Оценка видоизменения ткани с использованием оптоволоконного устройства - RU2445041C2
Код документа: RU2445041C2
Чертежи









Описание
Правительство Соединенных Штатов имеет права на настоящее изобретение в соответствии с Договором № W-7405-ENG-48 о работе Национальной Лаборатории Лоренса Ливермора между Министерством энергетики Соединенных Штатов и Университетом Калифорнии.
СВЯЗАННАЯ ЗАЯВКА
Настоящая заявка является частично продолжающейся заявкой № 10/260 141, озаглавленной "Fiber-Optic Evaluation of Cardiac Tissue Ablation", поданной 17 ноября 2005 г., которая притязает на приоритет по временной патентной заявке США № 60/629 166, также озаглавленной "Fiber-Optic Evaluation of Cardiac Tissue Ablation", поданной 17 ноября 2004 г., которые включены в настоящую заявку во всей своей полноте в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к медицинской диагностике. Более конкретно, настоящее изобретение относится к зондирующим конфигурациям для изучения видоизменений ткани в реальном времени во время проведения медицинских процедур.
Описание предшествующего уровня техники
Существует множество состояний, при которых для достижения для пациента положительного результата требуется разрушение областей ткани. Такое разрушение ткани обычно достигается, подвергая ткань условиям, выходящим за рамки набора параметров среды, необходимых для поддержания жизни ткани. Примером могут служить электродные катетеры для абляции сердечной ткани, которые могут быть введены чрескожно при местной анестезии в бедренную, плечевую, подключичную или внутреннюю яремную вену и вводиться в сердце, используя способы, разработанные специалистами в этой области техники, для лечения аритмии сердца, например, фибрилляции.
В целом, абляционные системы содержат абляционный катетер или аналогичный зонд, имеющие элемент, излучающий энергию. Элемент, излучающий энергию, обеспечивает энергию, производящую повреждение целевой ткани. К типичным элементам относятся абляционный микроволновый элемент, криогенный абляционный элемент, тепловой абляционный элемент, светоизлучающий абляционный элемент, ультразвуковой преобразователь и/или радиочастотный абляционный элемент. Абляционный катетер может быть выполнен с возможностью формирования множества повреждений типа линейных повреждений или круговых повреждений. Элемент соединяется с источником энергии, которая может меняться, чтобы управлять образованием повреждений.
Хотя в настоящее время существуют различные типы абляционных катетеров для различных терапевтических процедур, катетерная абляция сердечной ткани, в частности, обычно выполняется с использованием радиочастотной энергии, подаваемой в виде непрерывного, немодулированного, синусоидальной формы сигнала с частотой приблизительно 500 килогерц. Большинство таких систем используют температуру абляционного электрода, чтобы контролировать видоизменение ткани, такое как образование повреждения, и автоматически регулируют выходную мощность для достижения целевой температуры электрода. Знание температуры электрода на конкретном участке абляции полезно при определении, создает ли приложение радиочастотного сигнала желаемую абляцию или он недостаточен, чтобы точно прогнозировать размеры созданного повреждения, особенно, его глубину.
Термический ожог является основным механизмом разрушения ткани во время процедур радиочастотной катетерной абляции. Подъем температуры катетера может также приводить в результате к нежелательным состояниям, таким, как коагуляция крови. Образование сгустка, который может представлять опасность для пациента, (например, провоцируя внезапный приступ) ведет в результате к быстрому увеличению импеданса, что, в свою очередь, ведет к резкому уменьшению плотности тока, таким образом, дополнительно ограничивая, рост повреждения. Кроме того, процесс абляции также может вызывать нежелательное обугливание ткани и испарение воды в крови и в ткани, ведущее к появлению микропузырьков (то есть, пузырьков пара) во время процедуры абляции, что является результатом поглощения энергии с более высокой, чем желательно, скоростью. Как было показано, автоматическая регулировка выходной мощности, используя управление температурой в замкнутом контуре, уменьшает число случаев возникновения сгустков, пузырьков пара и нежелательного обугливания, что может также облегчить катетерную абляцию, например, уменьшая количество операций, когда катетер должен выниматься из тела, чтобы удалять сгустки крови и материал обугливания из наконечника электрода.
Несмотря на совершенствование существующих технологий, в настоящее время нет никакой системы с обратной связью в реальном времени и способа, учитывающего состояние (например, создание повреждения в боковых и осевых направлениях) участка обработки, в дополнение к формированию сгустка, пузырьков пара и обугливания во время катетерной абляции ткани внутри тела.
Соответственно, существует потребность в способах и инструментарии, чтобы, прежде всего, обеспечить обратную связь в реальном времени во время таких процедур для определения образования повреждения, физического размера, образования обугленной ткани, пузырьков пара и сгустков крови вокруг заранее определенного абляционного катетера или эндоскопического инструмента для любой заданной процедуры, медицинской или какой-либо иной. Настоящее изобретение направлено на удовлетворение такой потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение относится к спектроскопическому способу исследования биологической ткани в реальном времени, содержащему этапы, на которых размещают диагностический инструмент и/или инструмент для лечения на заранее определенном участке ткани, внутри или около такого участка, направляют диагностический инструмент и/или инструмент для лечения так, чтобы видоизменять один или более компонентов ткани, расположенных на участке ткани; обеспечивают один или более заранее определенных оптических каналов, выполненных с возможностью направления источника зондирующего излучения, на участок ткани, и один или более заранее определенных оптических каналов с возможностью приема индуцированного заранее определенного обратного рассеянного участком ткани излучения, являющегося результатом действия направленного зондирующего излучения; и измеряют до, во время или после этапа модификации один или более спектров длинноволнового инфракрасного излучения (NIR) упругого светового рассеяния, являющихся результатом индуцированного обратного рассеянного излучения NIR-диапазона, чтобы оценить в реальном времени образование повреждения, глубину проникновения повреждения, площадь поперечного сечения повреждения в ткани, распознавание обугливания, распознавание образования сгустка, дифференцировать подвергнутую абляции ткань от здоровой ткани и/или распознать испарение воды в крови и ткани, ведущее к появлению пузырьков пара.
Другая особенность настоящего изобретения обеспечивает инструмент для лечения и/или диагностический инструмент, который может быть выполнен с возможностью использования оптоволоконных устройств таким образом, чтобы обеспечить анализ в реальном времени образования повреждения, глубины проникновения повреждения, площади поперечного сечения повреждения в ткани, распознавания обугливания, распознавание формирования сгустка, дифференцирование подвергнутой абляции ткани от здоровой ткани и/или распознавание испарения воды в крови и ткани, ведущего к появлению пузырьков пара.
Соответственно, настоящее изобретение обеспечивает оптические устройства и способы, способные направлять излучение с заранее определенным спектром и способные обеспечивать прием и анализ спектральной информации для определения и количественной оценки нормальной или видоизмененной ткани. Заявки содержат оценку параметров ткани во время абляции сердечной ткани, а также оценку свойств ткани, таких как формирование бляшек, толщина артерии и рубцевание ткани.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Сопроводительные чертежи, которые содержатся в описании и составляют его часть, демонстрируют конкретные варианты осуществления изобретения и вместе с общим описанием изобретения, приведенным выше, и подробным описанием конкретных вариантов осуществления служат для объяснения принципов изобретения.
Фиг.1(a) - упрощенная схема оптоволоконной системы для оценки, соответствующей настоящему изобретению.
Фиг.1(b) - другой пример оптоволоконного устройства для оценки, соответствующего настоящему изобретению.
Фиг.1(c) - другое предпочтительное оптоволоконное устройство для оценки, соответствующее настоящему изобретению.
Фиг.2(a) - обобщенное осуществление оптоволоконного устройства внутри катетера для лечения.
Фиг.2(b) - предпочтительная модификация оптоволоконного устройства внутри катетера для лечения.
Фиг.3(a) - обнаружение в реальном времени изменений интенсивности во время лечения с помощью абляционного катетера.
Фиг.3(b) - спектр контроля в реальном времени для 5 различных глубин абляции.
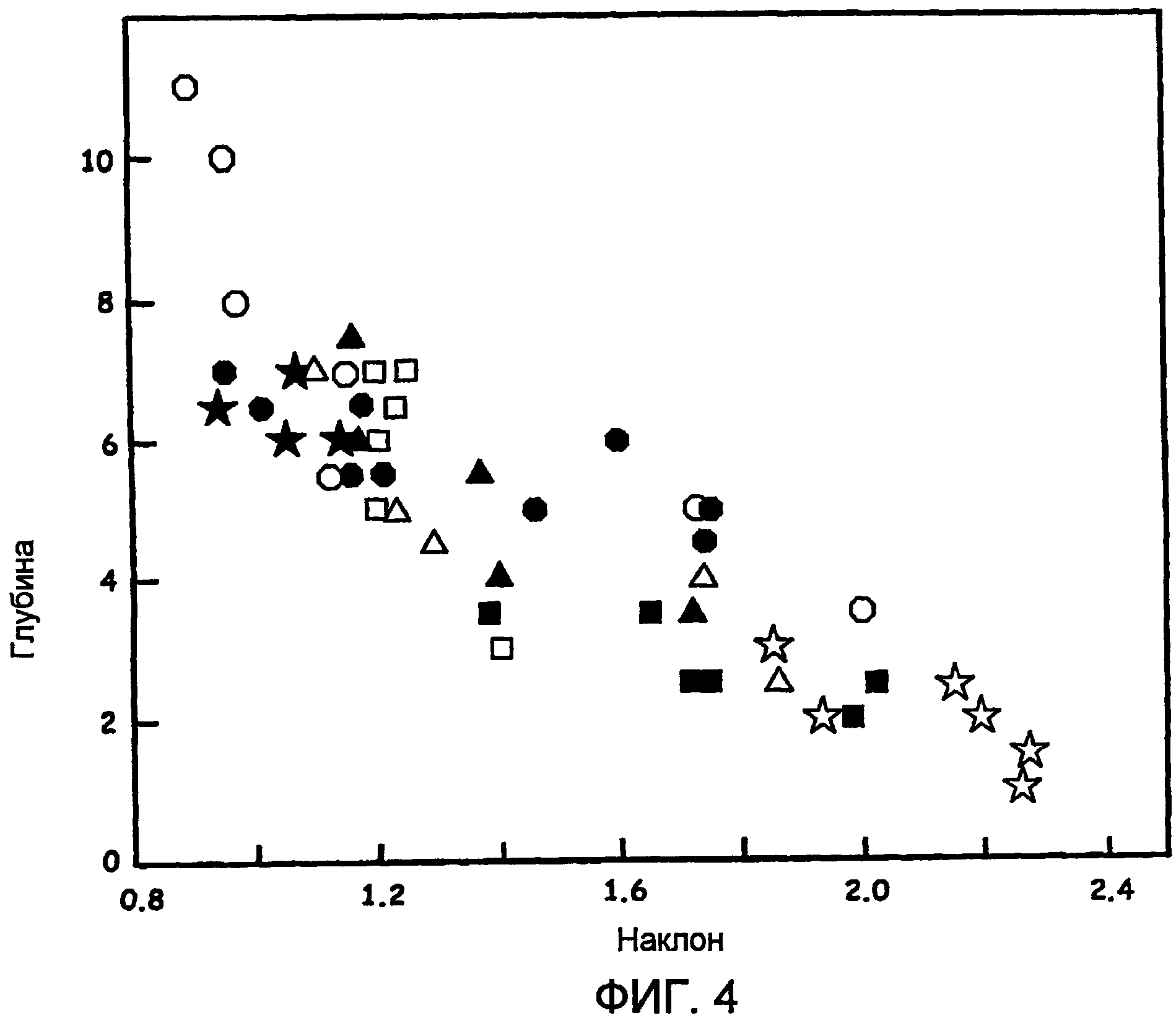
Фиг.4 - соотношения между глубиной и спектральным профилем, использующие в качестве маркера наклон профиля после линейной подгонки профиля в диапазоне между 730 нм и 900 нм.
Фиг.5(a) - обнаружение в реальном времени формирования сгустка во время лечения с помощью абляционного катетера по характерным изменениям в обнаруженном спектральном профиле.
Фиг.5(b) - обнаружение в реальном времени обугливания во время лечения с использованием абляционного катетера.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обратимся теперь к чертежам, на которых показаны конкретные варианты осуществления изобретения. Подробное описание конкретных вариантов осуществления вместе с общим описанием изобретения служит для объяснения принципов изобретения.
Если не указано как-либо иначе, числа, выражающие количество компонентов, составляющих элементов, условий реакции и т.д., используемых в описании и в формуле изобретения, должны пониматься как изменяемые, что может указываться термином "приблизительно". Соответственно, если не указано иное, числовые параметры, приведенные в описании и приложенной формуле изобретения, являются приближениями, которые могут изменяться в зависимости от желательных свойств, которые стремятся получить с помощью представленного здесь существа дела. По меньшей мере, и не как попытка ограничить применение доктрины эквивалентов к объему формулы изобретения, каждый числовой параметр должен истолковываться, по меньшей мере, в свете количества сообщенных значащих цифр и посредством применения обычных способов округления. Несмотря на то, что числовые диапазоны и параметры, устанавливающие широкий объем существа дела, представленного здесь, являются приближениями, числовые значения, приведенные в конкретных примерах, сообщаются настолько точно, насколько возможно. Любое числовое значение, однако, неотъемлемо содержит определенные ошибки, являющиеся обязательным результатом стандартного отклонения, обнаруженного в соответствующих результатах измерения соответствующих испытаний.
Общее описание
Устройство и способы, раскрытые в настоящем описании, позволяют проводить в реальном времени определение качества и количества компонентов ткани, часто во время лечения с помощью абляционного катетера заранее определенных компонентов ткани, таких как компоненты сердечной ткани. Используя раскрытые способы настоящего изобретения, можно с пользой определять образование повреждения, глубину проникновения повреждения, площадь поперечного сечения повреждения ткани, производить распознавание обугливания, распознавание формирования сгустка, дифференцирование подвергнутой абляции ткани от здоровой ткани и распознавание испарения воды в крови и ткани, ведущее к образованию микропузырьков (то есть, формирование пузырьков пара).
Предпочтительные варианты осуществления абляционных катетеров настоящего изобретения часто осуществляются с возможностью использования оптического канала, то есть, оптоволокон или жгутов оптоволокон, расположенных внутри катетера от проксимального до почти дистального конца. Система сбора и обнаружения может содержать любое оптическое средство для сбора, например, преломляющую и отражающую оптику, фильтрацию, например, с помощью узкополосных режекторных фильтров, полосовых фильтров, щелевых фильтров и т.д., и/или спектрально дисперсные (например, используя, для примера, заранее определенные спектрографы), принимающее поляризованные и часто неполяризованные индуцированные спектры, чтобы, таким образом, наилучшим образом количественно и качественно определять спектральную информацию о компонентах ткани, часто подвергающихся модификации. Детекторы, сами по себе, часто содержат устройства с зарядовой связью (CCD), (например, CCD с передней и задней подсветкой, CCD, охлаждаемые жидким азотом, CCD со встроенным в ту же микросхему усилителем), но могут также содержать фотодиоды, фотоумножители, многоканальные спектральные анализаторы, двухмерные детекторные решетки, многомерные детекторные решетки или любое эквивалентное средство для обеспечения приема, часто приема с оцифровкой одного или более спектров.
Во время видоизменения ткани, такого как, без ограничения, термическая или криогенная абляция ткани, оператор может получать информацию обратной связи в реальном времени об участке, подвергающемся видоизменению. Контролируя интенсивность (часто изменение пиковой интенсивности до двух или более раз), спектра принятого упругого рассеянного света в NIR-диапазоне между приблизительно 600 нм и приблизительно 1500 нм, оператор может обнаружить начало, а также проследить ход абляции ткани.
Кроме того, относительная интенсивность смещенного в красную область компонента спектрального профиля увеличивается как функция глубины абляции во времени и приложенной тепловой энергии. Таким образом, изменения в спектральном профиле могут использоваться для оценки глубины повреждения. При упрощенном способе анализа изменений в спектральном профиле оператор может использовать наклон принятых спектров (то есть, определяемый отношением заранее определенных спектральных диапазонов принятых спектров, таким как отношение части спектра на длине волны 730 нм к части спектра на длине волны 910 нм, для принятых смещенных в красную область спектров) для профилирования глубины, используя соответствующие способы калибровки, известные специалистам в данной области техники. Такой предпочтительный подход позволяет пользователю экстраполировать глубину абляции после точки определения глубины проникновения для данной длины волны падающего света. Другие особенности принятых спектров могут использоваться, чтобы контролировать обугливание, образование сгустков и/или образование пузырьков пара по наблюдаемым характеристическим изменениям, как показано ниже в настоящем изобретении.
Таким образом, исходя из такой информации, операторы сами или через команды, осуществляемые автоматическим программным обеспечением через работу замкнутого контура, могут определять время выдержки и/или прекращения процедуры или увеличение или уменьшение энергии, подаваемой к месту лечения, которая требуется для достижения желаемого эффекта (например, для образования большего повреждения на желаемой глубине), или обнаруживать образование обугливания, сгустка или пузырьков пара или определять, что применение энергии для абляции не достигло желательного видоизменения ткани.
Соответственно, настоящее изобретение обеспечивает способы и устройство для быстрого, выполняемого в живом организме обнаружения и оценки видоизмененных компонентов ткани. В частности, настоящее изобретение обеспечивает способы проверки упругого рассеяния света в длинноволновом инфракрасном диапазоне (NIR) (то есть, спектры упругого рассеяния света в диапазоне между приблизительно 600 нм и приблизительно 1500 нм) и оптические устройства, часто выполняемые с возможностью использования вариантов осуществления абляционного катетера, которые известны и используются специалистами в данной области техники, чтобы контролировать в реальном времени компоненты ткани человеческого тела, подвергающиеся видоизменению или для простого зондового анализа. Предпочтительные аспекты использования диапазона NIR как средства анализа в соединении зондами, как обсуждается здесь, содержат, в частности:
- глубины проникновения до приблизительно нескольких сантиметров внутрь целевых компонентов ткани;
- минимизированное влияние крови из-за низкого поглощения;
- недорогая используемая технология;
- отсутствие опасности для оператора или пациента;
- неинвазивно обеспечиваемая информация с поверхности, а также ниже поверхности ткани;
- оптоволоконные способы, которые могут легко использоваться в различных устройствах, чтобы направлять освещение в заранее определенных спектральных диапазонах, а также принимать сигнал обратной связи в реальном времени из удаленных мест, подвергающихся лечению.
Подробное описание
Обращаясь теперь к чертежам, на фиг.1(а)-1(с) показаны схемы, иллюстрирующие примеры основных вариантов осуществления систем, выполненных в соответствии с настоящим изобретением. Такие системы, обозначаемые в целом ссылочным номером 10, наиболее часто являются автоматизированными с использованием средства анализа, такого как программа 16, постоянно находящаяся на средстве 18 управления анализом (например, компьютер, программируемое оборудование (ПЗУ, EPROM) и интегрированные вычислительные, запоминающие и т.д. схемные устройства, такие как, в частности, большие интегральные схемы LSIC (LSIC), очень большие интегральные схемы (VLSIC) и программируемые пользователем матрицы логических элементов (FPGA), которые оперативно соединяются с каждым компонентом в системе 10 с помощью заранее определенных беспроводных и/или проводных линий связи (не показаны), таких как кабели USB или RS232. Такое средство программного обеспечения, микропрограммное средство и другое интегральное схемное средство могут обеспечивать фильтрацию, запоминание и вычислительные операции, желательные для настоящего применения. Такие линии связи могут быть сконструированы и выполнены, чтобы позволить ведение обмена информацией между средством 18 анализа и системой, компонентами, как показано на фиг.l(a)-l(c), чтобы осуществлять операции в предписанной последовательности по команде оператора или в соответствии с заранее определенным набором запрограммированных инструкций для передачи спектральной информации на средство 16 анализа для запоминания и непосредственного анализа во время рабочих процедур.
Система 10 также содержит источник 2 электромагнитного излучения, как показано на фиг.1(a) и фиг.1(b), для освещения целевых компонентов ткани. Поскольку настоящее изобретение использует способы с рассеянием света в NIR-диапазоне и, в некоторых устройствах, с рассеянием поляризованного света в NIR-диапазоне для определения качественного и количественного изменения ткани, например, подвергаемой абляции зоны сердца, такой источник излучения часто является источником излучения на длинах волн, больших, чем приблизительно 250 нм, часто монохроматическим лазерным источником излучения, работающим на длинах волны до приблизительно 1500 нм, но наиболее часто - на длинах волн от приблизительно 600 нм до приблизительно 970 нм, или любым некогерентным, широкополосным и/или когерентным источником, способным интегрироваться в настоящее изобретение, чтобы точно определять различия в поглощении и рассеянии компонентами человеческой ткани и обеспечивать определение средних глубин проникновения фотонов до приблизительно 1 см. В частности, такие источники могут содержать широкополосные источники (например, лампы накаливания, дуговые лампы, широкополосные светодиоды (LED), узкополосные спектрально стабильные светодиоды (LED), узкополосные флуоресцентные источники, перестраиваемые оптические источники (например, оптический параметрический генератор, лазеры на красителях или ксеноновый источник вместе с управляемым компьютером измерителем монохромности), узкополосные стабильные лазеры, тройные системы на иттрий-алюминиевом гранате, легированным неодимом (Nd:Yag) и т.д., каждый из которых способен излучать в заранее определенных, отфильтрованных или каких-либо иных спектральных диапазонах для взаимодействия с желательными компонентами ткани (не показаны), чтобы вызвать появление желательной спектральной информации о рассеянии в NIR-диапазоне.
Такие источники 2 излучения могут быть соединены с зондом/катетером 4 посредством одного или более подключаемых в процессе работы оптических каналов, например, посредством полых волноводов, световодов волокна (волокон) 8 и т.д., часто посредством оптоволокон с жилой большого диаметра) (то есть, многомодовых оптоволокон) или посредством оптоволокон, соответственно разработанных с заранее определенными индексами преломления оптоволокна и профилями распределения примесей, коническими окончаниями оптоволокна и/или специальными конфигурациями полостей (например, петли для компенсации потерь при изгибе) и т.д. для поддержания свойств поляризации для заранее определенных применений, таких, когда требуется информация об упругом дифференциальном рассеянии света от целевого компонента ткани.
Такие способы дифференциального рассеяния света, которые могут также использоваться в настоящем изобретении, подобным образом обсуждаются и раскрываются в патенте США № US7016717 B2, озаглавленном "Near-Infrared Spectroscopic Tissue Imaging In Medical Applications" Демоса и др., раскрытие которого включено в настоящую заявку путем ссылки во всей его полноте. Соответственно, анализ с использованием взаимной поляризации и нормализации в сочетании с межспектральными операциями, такими как, в частности, операция вычитания между одним или более заранее определенными полученными спектрами или разделение между заранее определенными спектральными диапазонами принятых спектров, обеспечивает информацию в отношении свойств ткани, являющуюся результатом освещения соответствующим зондом на одной или более длинах волн. Кроме того, сопутствующие измерения интенсивности упругого рассеяния света NIR-диапазона для видоизмененных компонентов ткани во время процедур лечения, часто во время лечения с использованием абляционного катетера, используя спектроскопию поперечно поляризованного света на заранее определенной длине волны, также могут обеспечить информацию для картографирования повреждения, определения образования повреждения и его количественного определения.
В качестве другого предпочтительного устройства, заказной источник (3) электромагнитного излучения, в общем виде показанный на фиг.1(c), может быть выполнен совместно с широкополосным источником или вместо него, как обсуждалось выше, чтобы обеспечить подачу желательных уровней направленной мощности, по меньшей мере, приблизительно 1 мкВт, в одной или более спектральных полосах/на одной или более длинах волн до приблизительно 1500 нм, но наиболее часто в диапазоне от приблизительно 600 нм до приблизительно 970 нм, до почти дистального конца зонда/катетера 4 через оптоволокно(-а) 8. Пример заказного источника(-ов) 3 электромагнитного излучения может содержать, в частности, один или более малогабаритных, по существу, когерентных коммерческих диодных лазеров, обладающих желаемой спектральной шириной полосы, уровнями мощности и геометрией для освещения заранее определенных компонент ткани, чтобы вызвать упругое рассеянное излучение в NIR-диапазоне длин волн от приблизительно 600 нм и до приблизительно 1500 нм. При освещении желательных компонентов ткани через приблизительно дистальный конец зонда/катетера 4, через оптоволокно(-а) 8, одно или более дополнительные оптоволокна 9 (например, одно или более многомодовые оптоволокна с основной жилой большого диаметра, оптоволокна, поддерживающие поляризацию и т.д.) дополнительно выполнены с возможностью сбора информации упругого обратного рассеяния NIR-диапазона около дистального конца зонда/катетера 4, наведенного источником света 2 или источником света 3, как показано на фиг.1(a)-(c).
Следует учесть, что варианты осуществления с использованием оптоволокна (то есть, оптоволокна, указанного ссылочными номерами 8 и 9, как показано на фиг.1(a)-(c) и как раскрыто в настоящей заявке) могут быть выполнены с возможностью использования любого зонда, такого как ручной зонд для местного исследования видоизменения ткани, и следует отметить, что такие варианты осуществления с использованием оптоволокон могут быть выполнены с возможностью улучшения оптических элементов в отношении их способности передавать и собирать свет, идущий к многочисленным местам или от них, чтобы проводить исследование ткани при положении катетера от приблизительно нормального (то есть, с расположением под углом 90 градусов) до приблизительно параллельного (то есть, с расположением под углом 90 градусов относительно нормали) относительно исследуемой ткани. Такие улучшенные оптические элементы могут содержать микролинзы, зеркала, линзы с переменным показателем преломления, дифракционные оптические элементы и другие улучшающие характеристики элементы, известные в этой области техники. В качестве другого предпочтительного устройства, конструкции с использованием оптоволокон могут быть выполнены вместе с зондом так, как, например, в любом из жестких оптических приборов, используемых во время эндоскопической хирургии, и/или в любом из гибких оптических приборов, обычно предназначаемых для диагностических исследований и биопсий трубчатых полостей тела и/или структур, например, верхнего кишечника, исследуемого с помощью гастроскопа. Хотя оптические устройства в соответствии с настоящим изобретением могут быть выполнены с возможностью использования любых инструментов для лечения и/или диагностических инструментов в настоящее время в данной области техники, наиболее часто, однако, варианты осуществления с использованием оптоволокна согласно настоящему изобретению влекут за собой соединение с любым из абляционных хирургических устройств, используемых для лечения компонентов ткани, таких как компоненты ткани сердца, простаты и печени. Примеры видоизменений таких хирургических устройств для удаления описаны в патенте США № 6 522 930, раскрытие которого содержится в настоящей заявке путем ссылки, и обсуждаются в заявке № 10/260 141 "Fiber-Optic Evaluation of Cardiac Tissue Ablation", также содержащейся в настоящей заявке путем ссылки во всей ее полноте.
Желательное рассеянное излучение от компонентов ткани, направляемое оптическими каналами (например, оптоволокнами 9), может фильтроваться с помощью одного или более оптических компонентов (не показаны), таких как щелевые фильтры, полосовые фильтры, поляризационные фильтры, призмы и/или узкополосные режекторные фильтры и т.д. Предпочтительные варианты осуществления, однако, могут просто содержать один спектрограф 12, как показано на фиг.1(a), или один или более спектрографов 12', как показано на фиг.1(b) (для простоты показаны три спектрографа), так чтобы при использовании вариантов осуществления с катетером, обеспечивать информацию на заранее определенные спектрографы для получения угловой подробной информации о месте лечения.
Такие спектрографы (замечание: названия "спектрографы", "спектрометры" и "спектроанализаторы" являются взаимозаменяемыми) часто содержат оптические спектроанализаторы, такие как двумерные спектроанализаторы, одиночные или одиночные развертывающиеся на плоскости линейчатые спектроанализаторы (то есть, многоканальный спектроанализатор 13), чтобы обеспечивать, например, отфильтрованную спектроскопическую информацию о поперечном сечении места лечения или предварительной обработке. Для диспергирования и анализа принятых спектров могут также использоваться видеоспектрометры с преобразованием Фурье или другие подобные устройства, чтобы обеспечить желаемые полосы и/или поляризованные компоненты электромагнитного излучения от компонент ткани (не показаны).
Детектор 14, как показано на фиг.1(a), или множество детекторов, как показано на фиг.1(b) (для простоты детектор на фиг.1(c) не показан) и как обсуждено выше, часто содержат приборы с зарядовой связью (CCD) (например, CCD с передней и задней подсветкой, CCD с охлаждением жидким азотом, CCD со встроенным в ту же микросхему усилителем), но могут также содержать фотодиоды, фотоумножители, двухмерные детекторные решетки, многомерные детекторные решетки или любое эквивалентное средство получения, часто в цифровом виде, одного или более спектров.
Программное обеспечение 16 системы управления, которая предпочтительно может быть автоматизированной, часто содержит графический интерфейс пользователя (GUI), выполненный с возможностью использования Visual Basic, MATLAB®, LabVIEW®, Visual C++ или любого языка программирования или специализированной среды программирования программного обеспечения, чтобы позволить упростить операцию выполнения зондового анализа, но чаще зондовый анализ применяют во время лечения с использованием абляционного катетера из заранее определенных мест, таких как заранее определенные участки сердца. LabVIEW® и/или MATLAB®, в частности, специально подгоняются под разработку приложений для управления измерительным прибором и облегчают быстрое создание интерфейса пользователя, и особенно предпочтительны в качестве приложения, которое, когда желательно, должно использоваться как специализированный вариант осуществления программного обеспечения. Принятый или один или более спектров затем записываются и запоминаются средством 18 анализа для хранения и непосредственного анализа во время рабочих процедур, что затем позволяет оператору вносить желаемые изменения, например, во время процедуры лечения.
На фиг.2(a) показан основной вариант осуществления настоящего изобретения с катетером, в целом обозначенный ссылочным номером 20, предназначенный для контроля в реальном времени, например, для абляции ткани во время лечения заранее определенных органов, таких как, в частности, печень, простата и сердце (например, абляционный катетер для сердечной ткани (например, варианты осуществления управляемого или направляемого катетера), вставленный, используя, например, транссептальный или ретроградный аортовый доступ в заранее определенные участки сердца для абляции, в некоторых случаях, добавочные проводящие пути. Оптические устройства, выполненные с возможностью осуществления такого варианта осуществления катетера или любых из устройств, раскрытых здесь, могут содержать коммерчески доступные оптические элементы, известные специалистам в данной области техники, или заказные оптические элементы для подачи и/или сбора света с заранее определенными спектрами из многочисленных положений относительно дистального конца таких катетеров.
При использовании вариантов осуществления с абляционным катетером, катетер 22 может продвигаться в намеченную для исследования область, в которой абляционный элемент катетера 22 (не показан) может получать энергию от средства, известного в технике, чтобы сформировать, например, повреждение 23 окружающей ткани 28. При таком использовании катетер 22 часто содержит одно или более освещающих оптоволокон 26 (для простоты показан один) и одно или более оптоволокон 24 для сбора (снова для простоты показан один), как показано на фиг.2(a), проходящих приблизительно от дистального конца до проксимального конца катетера 22, чтобы направлять излучение на длине волны освещения и собирать желаемое излучение (как показано стрелками) соответственно до, во время или после применения энергии для удаления.
Как предпочтительный вариант осуществления, заранее определенное излучение для освещения на длине волны, по меньшей мере, от приблизительно 250 нм и до приблизительно 1500 нм, но наиболее часто излучение на длине волны от приблизительно 600 нм до приблизительно 970 нм, с помощью одного или более освещающих оптоволокон 26, расположенных приблизительно около дистального конца катетера 22, направляется, по существу, по тому же самому направлению, что и катетер 22 (направление, обозначенное буквой Z и показанное стрелкой). Такое направленное излучение принимается компонентами ткани, такими как нормальная ткань, патологическая ткань, в дополнение к видоизмененным компонентам ткани, таким как повреждение 23 вдоль конусного угла излучения освещающего оптоволокна(-он) 26, или с интенсивностями излучения, создаваемыми адаптированными улучшающими оптическими элементами, такими как, в частности, микролинзы, зеркала, линзы с переменным показателем преломления, дифракционные оптические элементы и другие улучшающие характеристики элементы, известные в этой области техники, чтобы индуцировать упругий рассеянный свет NIR-диапазона в геометрии обратного излучения.
При создании такого обратно рассеянного излучения одно или более собирающих оптоволокон 24, выполненных с возможностью использования совместно с катетером 22, принимают заранее определенную часть индуцированного упругого светового рассеянного излучения NIR-диапазона от зондированной ткани в точке приема (обозначенной как P' на фиг.2(a)), расположенной сбоку от точки излучения одного или более освещающих оптоволокон 26 (обозначенной как P на фиг.2(a)). Такое индуцированное излучение затем направляется собирающим оптоволокном(-ами) 24 к устройствам спектрального анализа и детектора, как показано на фиг.1(a)-(c) и как подробно описано выше.
Детекторы, как показано и обсуждалось выше со ссылкой на фиг.1(a)-(c), преобразуют фотометрический сигнал в электрический сигнал. Электрический сигнал принимается электронной схемой (не показана) и преобразуется в цифровую форму обычными аналого-цифровыми преобразователями, как известно и понимается специалистами в этом виде техники. Цифровой сигнал затем предварительно обрабатывается в цифровой форме способами цифровой обработки сигналов, осуществляемыми, например, в устройстве 18 анализа, как показано на фиг.1(a)-(c), и информация запоминается в запоминающем устройстве. К информации может обращаться устройство 18 анализа или одно или более дополнительных внешних компьютерных устройств (не показаны) для дополнительного анализа и информация может предоставляться пользователям через графический интерфейс пользователя, используя специально разработанное или коммерческое программное обеспечение, как раскрыто здесь.
Удивительный и неожиданный результат во время абляционных процедур заключается в характеристических изменениях принятых спектров, которые позволяют обнаруживать и определять вредные термические эффекты (то есть, посредством изменений интенсивности и/или характеристических изменений в принятых спектрах), возникающие из-за обугливания, образования пузырьков пара и сгустков. Оператор может использовать такую информацию, чтобы увеличивать или уменьшать энергию, подаваемую на место, так чтобы управлять окончательной глубиной повреждения, в то же время предотвращая появление наблюдаемых вредных термических эффектов, или прекращать абляционную процедуру в целом.
Хотя такое устройство, как показано на фиг.2(a), обладает преимуществами, следует понимать, что возможны примеры оптоволокон (то есть, оптоволокон 24 и 26), используемых для направления желательных компонентов излучения, которые могут также присоединяться извне (не показано) к катетеру 22. В таком устройстве с присоединяемыми отдельно оптоволокнами, оптоволокна 24 и 26 не направляются непосредственно на ткань 28 под катетером 22 и, таким образом, такое устройство предназначается для регистрации присутствия на удаленной ткани (например, на повреждении 23), поскольку далее она расширяется наружу от точки контакта с элементом катетера 22, подающим энергию для абляции, и позволяет упрощать операции без необходимости полностью изменять существующие варианты осуществления катетера. В результате, имеется задержка во времени от точки начала абляции до времени, когда абляция будет обнаружена способами спектрального анализа, используемыми в настоящем изобретении с таким устройством.
На фиг.2(b) показано изменение варианта осуществления катетера, показанного на фиг.2(a), который, в целом, обозначается ссылочным номером 20'. Такое устройство также может содержать различные зонды, такие как, в частности, катетер 22, используемый для абляционных процедур и измененный в соответствии с представленными здесь описаниями. Как показано на чертеже, одно или более волокон 30 могут также использоваться для сбора, хотя одно или более волокон 26 могут использоваться для освещения. В этом новом варианте осуществления, однако, одно или более дополнительных волокон 27 могут быть выполнены для использования совместно с катетером 22, чтобы зондировать (то есть, освещать) ткань, такую, которая образовала или образует повреждение 23 в случае, когда катетер используется для абляции ткани под углом, отличным от нормали по отношению к поверхности ткани 28. Дополнительное собирающее оптоволокно 31, не соприкасающееся с тканью 28, может также быть добавлено посредством введения изменения, чтобы позволить получить варианты осуществления катетера, показанные в качестве примера на фиг.2(b), для зондирования образования сгустков, пузырьков пара и/или обугливания в зоне, окружающей катетер, который не имеет прямого контакта с тканью 28, и позволить оценивать ориентацию катетера относительно поверхности ткани. В дальнейшем примере устройства содержатся множество оптоволокон, чередующихся как освещающие и/или собирающие рассеянный свет в заранее определенной последовательности, чтобы позволить еще более точную оценку характеристик абляции и среды, окружающей катетер (образование сгустков, пузырьков пара, обугливания и т.д.).
На фиг.3(a) показаны экспериментальные данные для приблизительно двукратного увеличения (указано стрелкой) интенсивности обратного рассеяния света во время абляции ткани. Такой результат иллюстрируется спектрами для нормальной ткани 32, подвергнутой воздействию мощности 7 Вт, используемой для абляции в течение 20 секунд 34, и далее воздействию мощности 10 Вт в течение 120 секунд 36. Такое изменение интенсивности может использоваться, как пример для обнаружения образования пузырьков пара (микропузырьков) в результате нагревания жидкостей, окружающих ткань.
На фиг.3(a) также показан меняющийся наклон спектрального профиля в направлении более длинных длин волн (то есть, в диапазоне приблизительно 900 нм) (обозначенный более короткой стрелкой), благодаря изменению времени выдержки при абляции и приложенной тепловой энергии.
На фиг.3(b) показан наклон спектра для спектров повреждений разного размера, контролируемых во время образования повреждения после абляции с различными окончательными глубинами. Таким образом, на фиг.3(b) показана зависимость наклона относительно времени для 5 различных абляций, которые привели в результате к повреждениям глубиной приблизительно 1 мм (40), 2 мм (42), 4 мм (44), 6 мм (46) и 8 мм (48). Из этого набора экспериментальных данных должно быть понятно, что различные скорости, с которыми изменяется наклон, зависят от установки мощности катетера. Из этих данных можно получить данные о скорости абляции ткани, поскольку наклон связан с глубиной повреждения. Это может быть особенно важно для более глубоких повреждений, где невозможно прямое измерение глубины, используя волокна. Более конкретно, измерение наклона может обеспечивать точные результаты для глубины повреждений до приблизительно 10 мм в человеческой сердечной ткани. Однако, измеряя скорость удаления ткани в течение начальных 6 мм, можно экстраполировать время абляции, необходимое для создания повреждения любой глубины.
На фиг.4 показаны, по существу, линейные отношения между глубиной и спектральным профилем, используя в качестве маркера наклон профиля после линейной подгонки профиля между 730 нм и 900 нм. Чтобы определить измеренный наклон для данного примера, отношение спектральной интенсивности на длине волны 730 нм к спектральной интенсивности на длине волны 910 нм наносится на график, беря данные из заранее определенных спектров, полученных для ткани бычьего сердца во время абляционной процедуры для конкретно созданного повреждения. Затем дополнительные значения наклона для различных повреждений, созданных, используя различные времена абляции и установки мощности, приводящие в результате к различным глубинам повреждения, добавляются к общему графику, как показано на фиг.4. Соответственно, на фиг.4 обобщены экспериментальные результаты, показывающие глубину абляционной ткани и соответствующий наклон сопутствующего спектрального профиля. Эти результаты ясно указывают на почти линейные соотношения между этими двумя параметрами для глубин повреждения до приблизительно 6 мм.
На фиг.5(a) показано в реальном времени обнаружение образования сгустка во время лечения с использованием абляционного катетера по характерным изменениям в обнаруженном спектральном профиле, тогда как на фиг.5(b) показано обнаружение в реальном времени обугливания при лечении с использованием абляционного катетера. Таким образом, на фиг.5(a) показан обычный спектр 60 ткани и присутствие двух спектральных минимумов 66 в принятом спектре 62, указывающих на присутствие двух пиков поглощения, связанных с наличием сгустков. На фиг.5(b) показан спектр нормальной ткани 70 и последующий спектр 72 при наличии обугливания. Из результатов, показанных на фиг.5(b), в соответствии со способами и различными устройствами, используемыми в настоящем изобретении, обугливание имеет тенденцию демонстрировать интенсивности рассеянного света на длине волны 730 нм, которые ниже, чем на длине волны 910 нм (то есть, длины волны спектральной калибровки, используемой во время этого эксперимента). Это ведет к примеру значения оцененного наклона меньше 1. Абсолютные значения наклона, показанные выше, отчасти являются случайными. Это вытекает из того факта, что для записанных спектров не делалась поправка ни на характеристику прибора, ни на спектральный профиль белого света, использованного для освещения. Поэтому, хотя все тенденции и качественные поведения, описанные выше, имеют силу, в абсолютные значения наклонов и относительные интенсивности спектров на различных длинах волн должны быть внесены поправки, чтобы учесть характеристику прибора и спектр входного освещающего света.
Соответственно, настоящее изобретение использует, прежде всего, рассеяние света NIR-диапазона, чтобы обеспечить информацию о заранее определенных свойствах до, а также во время некоторых заранее определенных терапевтических процедур. В частности, что касается абляционных процедур, настоящее изобретение может позволить с пользой обеспечивать информацию о формировании повреждения, глубине проникновения при повреждении, площади поперечного сечения повреждения в ткани, распознавании обугливания, распознавании образования сгустка, проводить дифференцирование абляционной ткани от здоровой, больной и/или патологической ткани и распознавание испарения воды в крови и ткани, ведущего к появлению микропузырьков (то есть, к формированию пузырьков пара).
Заявители представляют настоящее описание, которое содержит чертежи и примеры конкретных вариантов осуществления, чтобы дать широкое представление изобретения. Различные изменения и модификации в пределах сущности и объема изобретения станут очевидны специалистам в данной области техники из настоящего описания и при практическом использовании изобретения. Объем изобретения не предназначен для ограничения конкретных раскрытых форм и изобретение охватывает все модификации, эквиваленты и альтернативы, попадающие в рамки сущности и объема изобретения, как определено формулой изобретения.
Реферат
Изобретение относится к медицине, а именно к спектроскопическому способу определения в реальном времени скорости абляции в сердечной ткани in-vivo. Для этого направляют зондирующее излучение с длинами волн ближневолнового инфракрасного диапазона (NIR) на сердечную ткань in-vivo так, что зондирующее излучение взаимодействует с сердечной тканью для формирования спектра обратного рассеянного излучения. Спектр содержит зависимость интенсивности от длины волны по упомянутому диапазону длин волн. Далее направляют излучение абляции на сердечную ткань. При этом измеряют наклон упомянутого спектра. Причем этап направления излучения абляции выполняют одновременно с этапом измерения наклона. Скорость абляции ткани определяют, исходя из упомянутого наклона. Использование изобретения позволит расширить арсенал технических средств, позволяющих в реальном времени определять скорость абляции спектроскопическим способом. 19 з.п. ф-лы, 5 ил.
Формула
направляют зондирующее излучение с длинами волн ближневолнового инфракрасного диапазона (NIR) на сердечную ткань in-vivo так, что упомянутое зондирующее излучение взаимодействует с упомянутой сердечной тканью для формирования спектра обратного рассеянного излучения, содержащего зависимость интенсивности от длины волны по упомянутому диапазону длин волн,
направляют излучение абляции на упомянутую сердечную ткань, измеряют наклон упомянутого спектра, причем этап направления излучения абляции выполняют одновременно с этапом измерения наклона, определяют скорость абляции ткани, исходя из упомянутого наклона.

Комментарии