Устройство анализа стенки кровеносного сосуда и способ анализа стенки кровеносного сосуда - RU2532296C2
Код документа: RU2532296C2
Чертежи








Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к устройству анализа стенки кровеносного сосуда, пригодному для анализа состава участка измерения внутри кровеносного сосуда, и к способу анализа стенки кровеносного сосуда.
Уровень техники
Бляшка в сонной артерии, как известно, является важным фактором, который вызывает церебральный инфаркт. Бляшка в сонной артерии является прикрепленной субстанцией, которая формируется на внутренних стенках сонных артерий из холестерина в крови, нейтральных жиров и т.п. Если эта прикрепленная субстанция отделяется от внутренней стенки сонной артерии и преграждает часть внутримозгового кровеносного сосуда, то это может вызвать серьезное нарушение, например церебральный инфаркт. Соответственно, известные способы, используемые для ранней диагностики состояния внутренних стенок кровеносных сосудов, включают в себя способы диагностики с использованием ультразвуковой эхокардиографии снаружи тела и способы диагностики, содержащие введение катетера с прикрепленным к нему измерительным зондом в кровеносный сосуд.
Существует несколько типов вышеупомянутых бляшек, включающих в себя бляшки, которые имеют липидное ядро, состоящее из холестерина и атеромы, формируемых из лейкоцитов и их остатков. Если атерома, которая представляет собой один из типов бляшек, разрывается под действием определенной формы давления или отделяется от внутренней стенки кровеносного сосуда, с высокой вероятностью могут быть вызваны известные серьезные нарушения, такие как церебральный инфаркт. Поэтому желательно идентифицировать тип бляшки, для того чтобы более точно диагностировать статус внутренних стенок кровеносного сосуда, и в соответствии с этим требованием были исследованы способы идентификации бляшек, например, такие, как описаны в Патентных документах 1 и 2. Например, в Патентном документе 1 раскрыт способ логического вывода состава бляшки по твердости бляшки, определенной на основе изменений формы, вызванных пульсациями при постоянном наблюдении бляшки с помощью измерительного зонда, вставленного в кровеносный сосуд. Кроме того, в Патентном документе 2 раскрыт способ логического вывода о составе бляшки путем излучения компонентов света, имеющих два или больше разных типа свойств, на участок измерения, приема отраженного/рассеянного света от участка измерения, формирования фантома каждой оптической бляшки и сравнения результатов измерения для бляшки, полученных с помощью ультразвукового исследования с фантомом.
Список литературы
Патентный документ
Патентный документ 1: Выложенная заявка № 2004-329550 на патент Японии
Патентный документ 2: Выложенная заявка № 2007-185242 на патент Японии
Непатентный документ
Непатентный документ 1: Chenan Xia, и др., "Mid-infrared supercontinuum generation to 4.5 µm in ZBLAN fluoride fibers by nanosecond diode pumping", Optics Letters, том. 31, No. 17, стр. 2553-2555, Сентябрь 1, 2006.
Сущность изобретения
Задачи, решаемые изобретением
Авторы настоящего изобретения исследовали обычные способы идентификации бляшки, описанные выше, и в результате обнаружили следующие проблемы.
А именно, в способе идентификации, описанном в вышеупомянутом Патентном документе 1, пациент подвергается значительной нагрузке обследования инвазивного характера в результате введения измерительного прибора в кровеносный сосуд. Кроме того, так как возможность повреждения внутренних стенок кровеносных сосудов и бляшки измерительным устройством, непосредственно введенным в кровеносный сосуд, не может быть исключена, то существует значительный риск, сопровождающий обследование. Кроме того, в способе идентификации, описанном в вышеупомянутом Патентном документе 2, не существует раскрытия относительно конкретного способа, посредством которого формируется фантом бляшки, и, следовательно, считается, что трудно создать фантом, соответствующий типу бляшки. Следовательно, считается, что трудно выполнить точную идентификацию типа субстанции, прикрепленной к стенке кровеносного сосуда, например бляшки, посредством способа идентификации, описанного в Патентном документе 2.
Настоящее изобретение разработано для устранения проблем, описанных выше. Целью настоящего изобретения является обеспечение устройства анализа стенки кровеносного сосуда, обеспеченного структурой для точного измерения компонента бляшки внутренних стенок кровеносных сосудов, в состоянии, которое уменьшает нагрузку на пациента, и способа анализа стенки кровеносного сосуда.
Средство решения задач
Для достижения вышеупомянутой цели используется устройство анализа стенки кровеносного сосуда согласно настоящему изобретению для анализа состава участка измерения внутри кровеносного сосуда, и, более конкретно, обеспечено средство излучения, средство обнаружения и средство анализа.
Средство излучения излучает, по меньшей мере, компонент света в измерительном диапазоне длин волн от 780 нм до 2750 нм на участок измерения внутри кровеносного сосуда. Кроме того, средство излучения включает в себя блок излучения света, установленный в месте на заданном расстоянии от кровеносного сосуда, и источник света, который подает компонент света, предназначенный для излучения, на участок измерения через блок излучения света. Средство обнаружения включает в себя блок ввода света, установленный в месте, на заданном расстоянии от кровеносного сосуда, куда доходит компонент света из участка измерения, и блок приема света, который обнаруживает компонент света, введенный через упомянутый блок ввода света. Средство анализа анализирует состав участка измерения на основе информации об интенсивности компонента света, обнаруживаемого средством обнаружения.
В частности, в устройстве анализа стенки кровеносного сосуда согласно настоящему изобретению, одно из: средства излучения и средства обнаружения содержит спектроскоп. А именно, в качестве одного аспекта устройства анализа стенки кровеносного сосуда, если средство излучения содержит спектроскоп, расположенный на световом пути между источником света и блоком излучения света, то спектроскоп отделяет от света, направленного из источника света в блок излучения света, компонент света в пределах диапазона длин волн обнаружения, который включен в измерительный диапазон длин волн и является более узким, чем измерительный диапазон длин волн. Кроме того, в средстве обнаружения в этом аспекте, блок ввода света совпадает с поверхностью приема света блока приема света. С другой стороны, в качестве другого аспекта устройства анализа стенки кровеносного сосуда, если средство обнаружения содержит спектроскоп, расположенный на световом пути между блоком ввода света и блоком приема света, то спектроскоп отделяет компонент света в пределах диапазона длин волн обнаружения, который включен в измерительный диапазон длин волн и является более узким, чем измерительный диапазон длин волн, от света (отражаемые компоненты или проходящие компоненты), введенного из участка измерения через блок ввода света.
В соответствии с устройством анализа стенки кровеносного сосуда со структурой, описанной выше, несмотря на то, что свет измерения излучается на участок измерения внутри кровеносного сосуда средством излучения, обеспечиваемым снаружи кровеносного сосуда, компонент света из участка измерения обнаруживается средством обнаружения, обеспечиваемым снаружи кровеносного сосуда. Соответственно, состояние стенки кровеносного сосуда можно анализировать без введения устройства, используемого в измерении, в кровеносный сосуд. А именно, анализ может быть выполнен в состоянии, которое уменьшает нагрузку на пациента. Кроме того, анализ для распознавания состава бляшки и т.п. может быть выполнен с использованием устройства анализа, обеспечиваемого снаружи кровеносного сосуда, посредством измерения, которое использует компонент света (свет измерения), содержащийся в измерительном диапазоне длин волн от 780 нм до 2750 нм, который демонстрирует разные свойства согласно составу субстанций, например бляшки, прикрепленной к внутренней части кровеносного сосуда.
Здесь, в качестве примера конкретной конфигурации, которая эффективно демонстрирует действие, описанное выше, в случае устройства анализа стенки кровеносного сосуда со структурой, в которой спектроскоп содержится в средстве излучения, один из: блока излучения света в средстве излучения и блока приема света в средстве обнаружения предпочтительно расположен на эпидерме шеи, в то время как другой предпочтительно расположен в пищеводе. Кроме того, в качестве другого примера конкретной конфигурации, которая эффективно демонстрирует действие, описанное выше, как блок излучения света в средстве излучения, так и блок приема света в средстве обнаружения могут быть расположены на эпидерме шеи. Кроме того, в качестве еще одного примера конкретной конфигурации, которая эффективно демонстрирует действие, описанное выше, как блок излучения света в средстве излучения, так и блок приема света в средстве обнаружения могут быть расположены в пищеводе.
С другой стороны, в случае устройства анализа стенки кровеносного сосуда со структурой, в которой спектроскоп включен в средство обнаружения, спектроскоп расположен на световом пути между блоком ввода света для ввода компонента света из участка измерения и частью приема света. В этом аспекте одна из части излучения света и части ввода света также расположена в пищеводе, в то время как другая расположена на эпидерме шеи. Кроме того, как часть излучения света, так и часть ввода света могут быть расположены на эпидерме шеи, или обе могут быть расположены в пищеводе.
В устройстве анализа стенки кровеносного сосуда согласно настоящему изобретению средство анализа может вычислять вторую производную согласно длине волны информации об интенсивности (например, спектр интенсивности в пределах каждого диапазона длин волн обнаружения) по компоненту света из участка измерения, обнаруженному средством обнаружения в пределах диапазона длин волн от 1400 нм до 1850 нм или от 1900 нм до 2700 нм, и может анализировать состав участка измерения на основе его результата.
Авторы настоящего изобретения обнаружили, что, в случае излучения компонента света в пределах диапазона длин волн от 1400 нм до 1850 нм или от 1900 нм до 2700 нм, компонент света, который проходит через бляшку и т.п., прикрепленную к стенке кровеносного сосуда, или отражается от нее, демонстрирует характерную интенсивность согласно ее составу. Соответственно, с вычислением второй производной согласно длине волны информации об интенсивности компонента света из участка измерения в пределах диапазона длин волн обнаружения от 1400 нм до 1850 нм или от 1900 нм до 2700 нм состав субстанции, прикрепленной к стенке кровеносного сосуда на участке измерения, могут быть проанализированы более точно.
Кроме того, в устройстве анализа стенки кровеносного сосуда согласно настоящему изобретению средство обнаружения может обнаруживать компонент света в диапазоне длин волн обнаружения, который продолжается на 15 нм как с короткой, так и с длинной сторон выбранной центральной длины волны, причем каждая из одной или более центральных длин волн выбирается из группы длин волн, состоящей из 1514, 1574, 1626, 1691, 1740, 1972, 2055, 2166, 2290, 2465 и 2544 нм. В этом случае средство анализа может анализировать присутствие или отсутствие тромбов в кровеносном сосуде для анализа состава участка измерения. Кроме того, средство обнаружения также может обнаруживать компонент света в диапазоне длин волн обнаружения, который продолжается на 15 нм как с короткой, так и с длинной сторон выбранной центральной длины волны, причем каждая из одной или более центральных длин волн выбираются из группы длин волн, состоящей из 1696, 1717, 2272 и 2629 нм. В этом случае средство анализа может анализировать присутствие или отсутствие атеромы в кровеносном сосуде для анализа состава участка измерения. Кроме того, средство обнаружения также может обнаруживать компонент света в диапазоне длин волн обнаружения, который продолжается на 15 нм как с короткой, так и с длинной сторон выбранной центральной длины волны, причем каждая из одной или более центральных длин волн выбирается из группы длин волн, состоящей из 1690, 2294 и 2372 нм. В результате средство анализа может анализировать присутствие или отсутствие липидного ядра в кровеносном сосуде для анализа состава участка измерения.
Кроме того, устройство анализа стенки кровеносного сосуда согласно настоящему изобретению может также содержать средство отображения, которое отображает результат анализа, полученный средством анализа.
Способом анализа стенки кровеносного сосуда согласно настоящему изобретению является способ анализа состава участка измерения в кровеносном сосуде с использованием устройства анализа стенки кровеносного сосуда с ранее описанной конфигурацией, и он используется в состоянии, в котором конец излучения света вводится так, чтобы быть расположенным около участка измерения, и конец ввода света устанавливается в заданное положение в кровеносном сосуде, куда доходит компонент света от участка измерения.
В конкретном процессе измерения, компонент света, по меньшей мере, в измерительном диапазоне длин волн 780 нм - 2713 нм излучают на участок измерения через конец излучения света, и компонент света, который вводится через конец ввода света, обнаруживается из положения измерения. Для идентификации состава участка измерения формируют данные анализа исходя из информации об интенсивности обнаруженного компонента света. Сформированные данные используются в различных обработках, например при анализе состава участка измерения или отображении на мониторе.
Конкретные данные анализа получают при вычислении второй производной согласно длине волны информации об интенсивности компонента света из участка измерения, обнаруживаемого средством обнаружения устройства анализа стенки кровеносного сосуда со структурой, аналогичной той, которая описана ранее, в пределах диапазона длин волн обнаружения, например от 1400 нм до 1850 нм или от 1900 нм до 2700 нм. Средство анализа анализирует состав участка измерения на основе этого результата.
Кроме того, в способе анализа стенки кровеносного сосуда согласно настоящему изобретению информация изображения, относящаяся к составу на участке измерения, накладывается на двумерное томографическое изображение кровеносного сосуда, и на мониторе отображается получающееся в результате двумерное изображение.
Технические результаты изобретения
В соответствии с устройством анализа стенки кровеносного сосуда и способом анализа стенки кровеносного сосуда согласно настоящему изобретению могут быть точно измерены компоненты бляшки внутренней стенки кровеносного сосуда в состоянии, которое уменьшает нагрузку на пациента.
Краткое описание чертежей
Фиг.1 - чертеж, изображающий конфигурацию варианта осуществления устройства анализа стенки кровеносного сосуда согласно настоящему изобретению.
Фиг.2 - чертеж, изображающий конфигурацию другого варианта осуществления устройства анализа стенки кровеносного сосуда согласно настоящему изобретению.
Фиг.3 - чертеж для раскрытия различных взаимных расположений блока излучения света в средстве излучения и блока приема света в средстве обнаружения.
Фиг.4 - чертеж для пояснения бляшки на внутренней стенке кровеносного сосуда.
Фиг.5 - чертеж, на котором изображены результаты оценки ослабления света, который прошел через свинину, с использованием моделирования.
Фиг.6 - чертеж, на котором изображены результаты измерения ослабления света, который прошел через свинину.
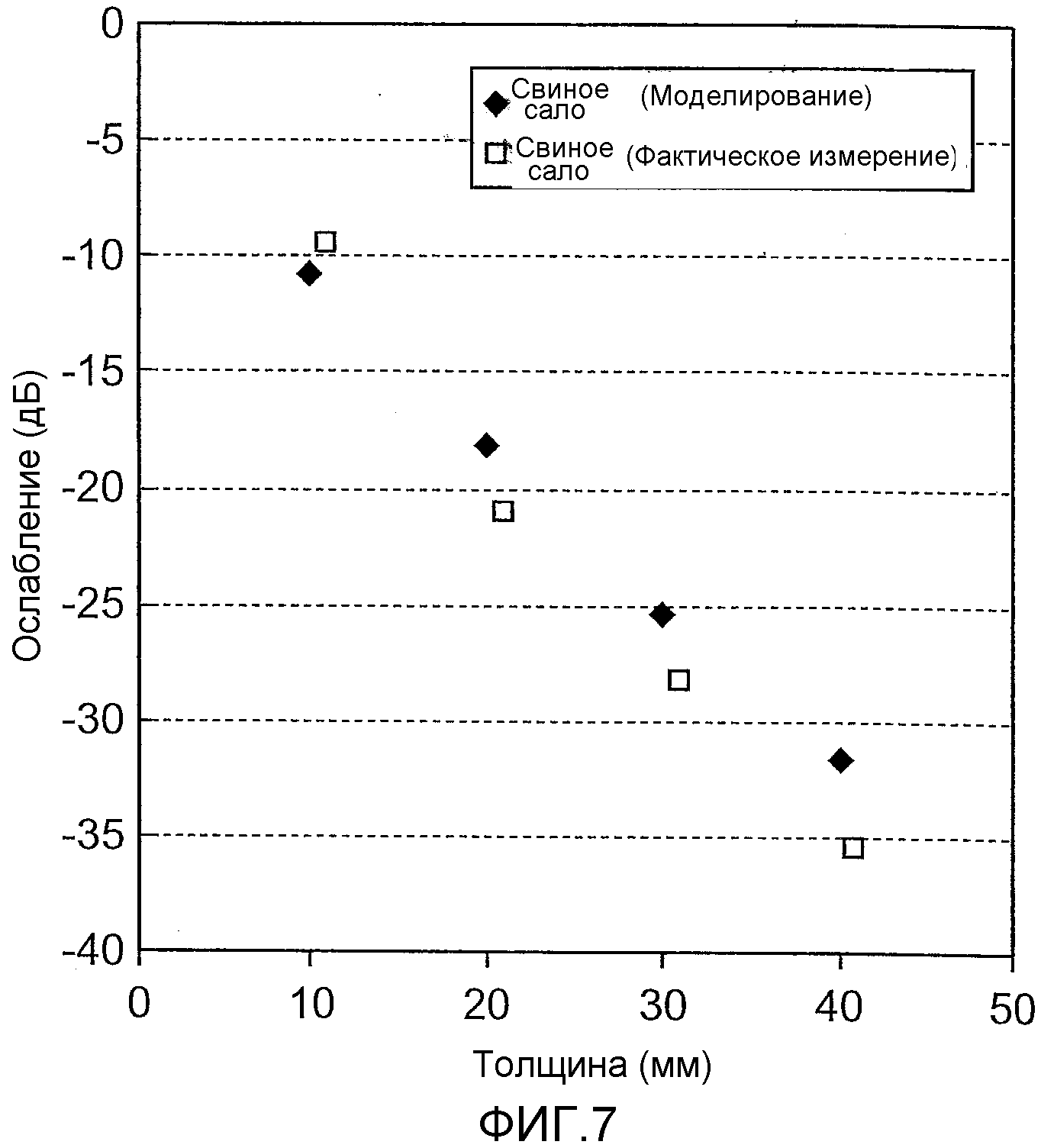
Фиг.7 - чертеж, на котором изображены результаты оценки и измерения ослабления света, который прошел через свиное сало, полученные с использованием моделирования.
Фиг.8 - чертеж для пояснения имитационной модели, используемой для измерения интенсивности света, когда свет ближней инфракрасной области спектра излучается на сонную артерию.
Фиг.9 - чертеж, изображающий результаты оценки ослабления света в случае перемещения положения блока приема света в моделировании.
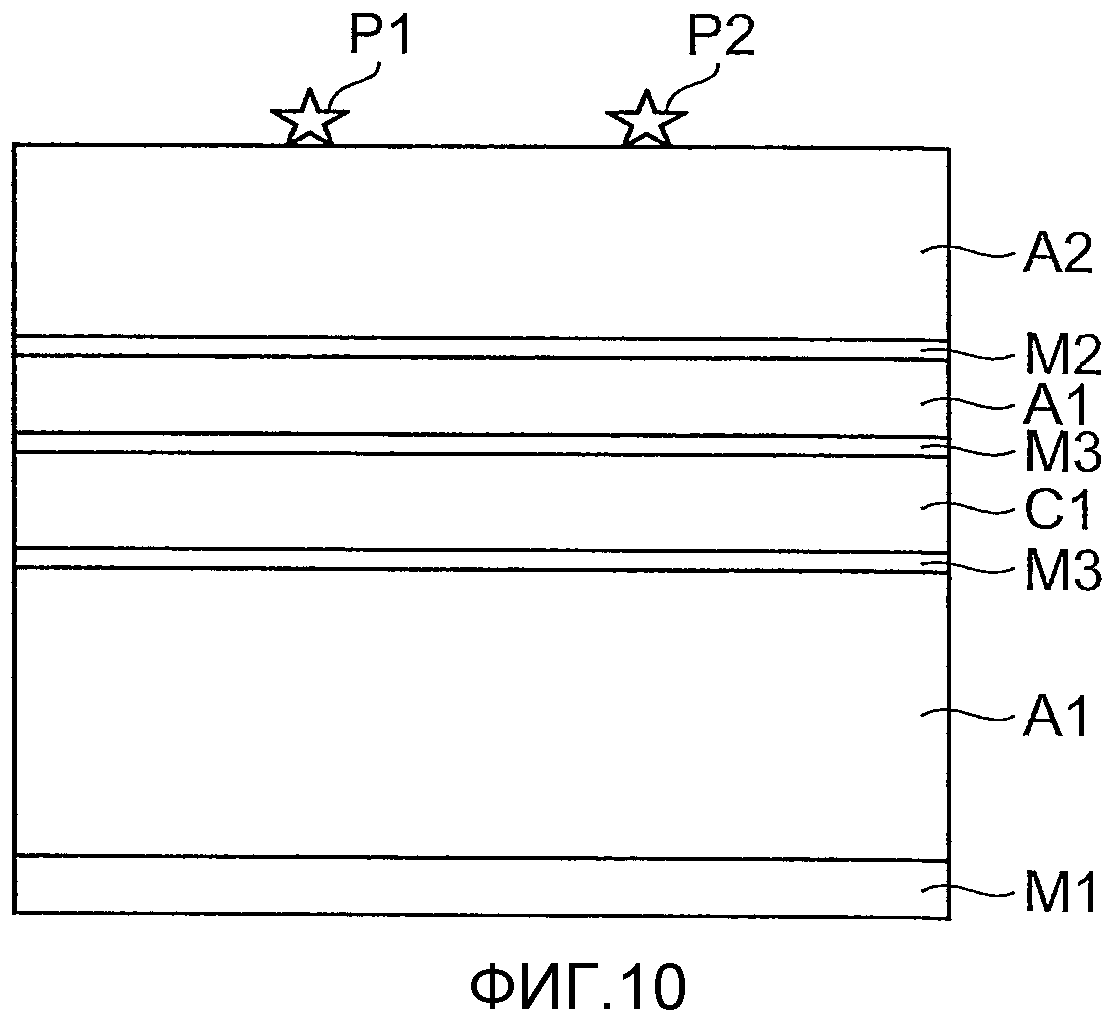
Фиг.10 - чертеж для пояснения имитационной модели, используемой для измерения интенсивности света, когда свет ближней инфракрасной области спектра излучается на сонную артерию.
На фиг.11 изображены спектры поглощения (вторая производная) бляшки (липидного ядра, атеромы) и жира.
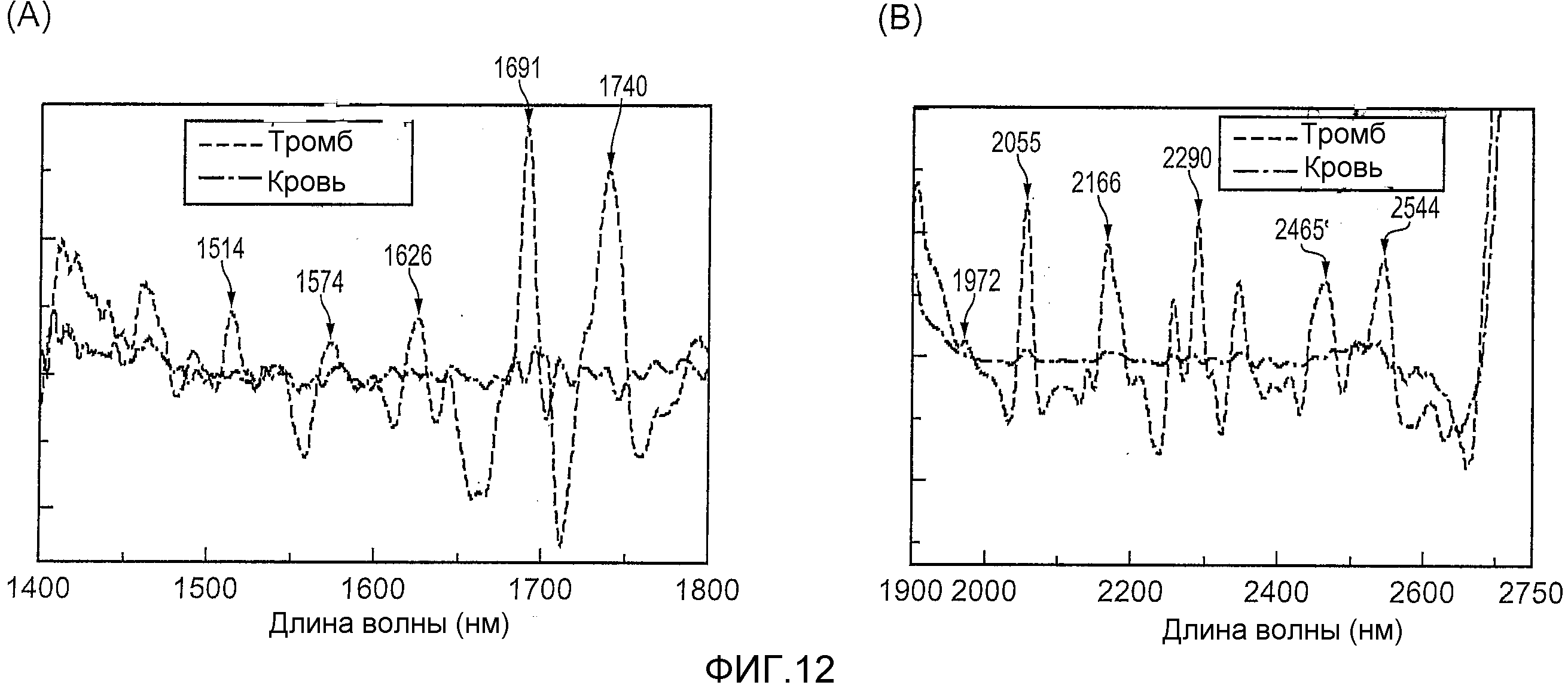
На фиг.12 изображены спектры поглощения (вторая производная) тромба и крови.
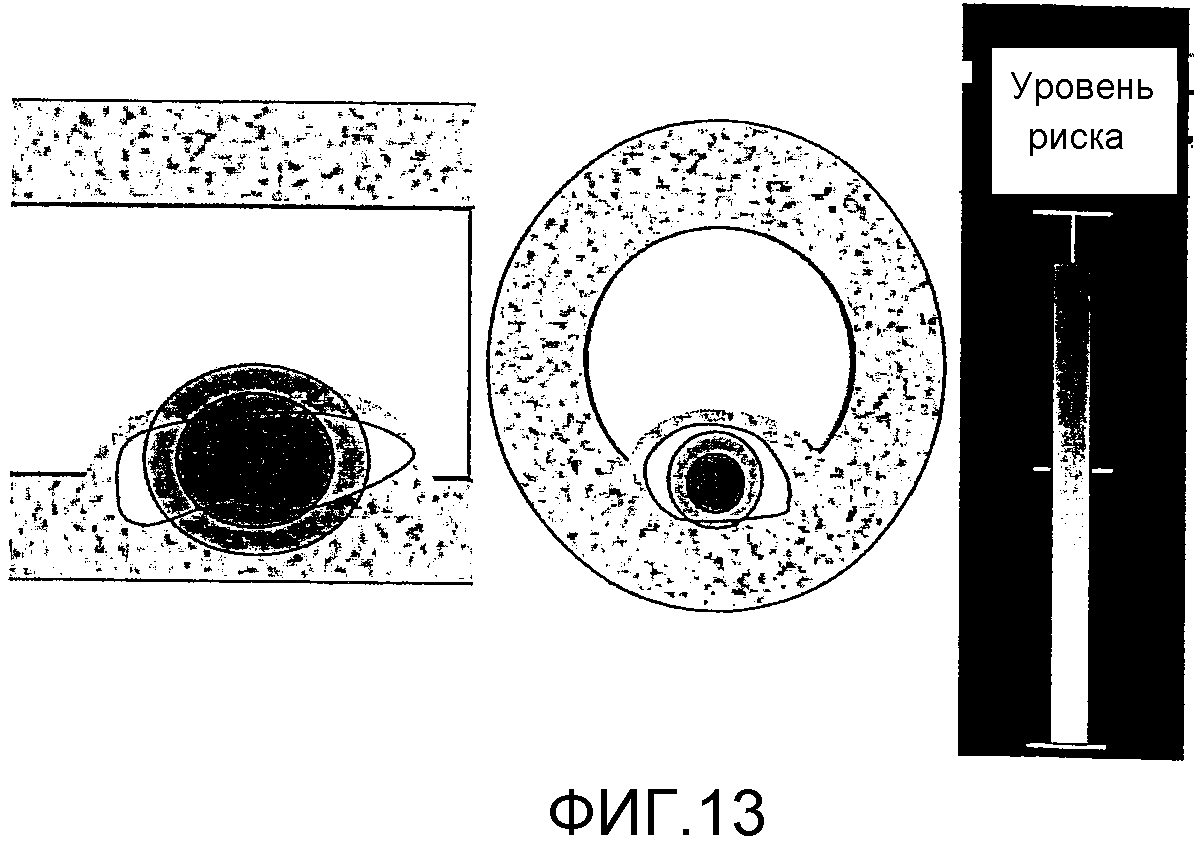
На фиг.13 изображен пример отображения на мониторе результатов анализа, полученных из устройства анализа стенки кровеносного сосуда.
Предпочтительные варианты осуществления изобретения
Ниже со ссылкой на фиг.1-фиг.13 подробно раскрыты варианты осуществления устройства анализа стенки кровеносного сосуда и способа анализа стенки кровеносного сосуда согласно настоящему изобретению. В описании чертежей используется сквозная нумерация и пересекающееся описание опущено.
(Конфигурация устройства анализа стенки кровеносного сосуда)
Фиг.1 является чертежом, на котором изображена конфигурация варианта осуществления устройства анализа стенки кровеносного сосуда согласно настоящему изобретению. Как изображено на фиг.1, устройство 1 анализа стенки кровеносного сосуда является устройством анализа, которое может быть использовано в одном варианте осуществления способа анализа стенки кровеносного сосуда согласно настоящему изобретению, и обеспечено источником 10 света, спектроскопом 20, блоком 30 излучения света, блоком 40 приема света и блоком 50 анализа. Кроме того, источник 10 света и спектроскоп 20, а также спектроскоп 20 и блок 30 излучения света соединены оптическими волокнами 15 и 25 соответственно. Блок 40 приема света и блок 50 анализа электрически соединены, и блок 50 анализа и спектроскоп 20 также электрически соединены. В устройстве 1 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления источник 10 света, спектроскоп 20 и блок 30 излучения света составляют средство излучения, которое излучает свет измерения на участок измерения с внешней стороны кровеносного сосуда. Блок 40 приема света и блок 50 анализа составляют средство обнаружения, которое обнаруживает компонент света из участка измерения. Блок 50 анализа функционирует как средство анализа для анализа состава участка измерения на основе света, обнаруженного средством обнаружения, и как средство отображения для отображения результатов анализа, полученных из средства анализа.
Источником 10 света является источник света, который выводит компонент света, который содержит измерительный диапазон длин волн света ближней инфракрасной области спектра от 780 нм до 2750 нм, и предпочтительно используется, например, лазерно-диодный (LD) источник света или источник сверхнепрерывного спектра (SC) света, как описано в вышеупомянутом Непатентном документе 1. Компонент света, выведенный из источника 10 света, проводится в спектроскоп 20 через оптическое волокно 15.
В спектроскоп 20 вводится компонент света из источника 10 света, который передан через оптическое волокно 15, и спектроскоп 20 выводит в оптическое волокно 25 только компонент света в пределах диапазона длин волн обнаружения с центром в конкретной длине волны на основе команд из блока 50 анализа. Для спектроскопа 20 используется дифракционная решетка или перестраиваемый фильтр длин волн и т.п. Кроме того, в случае использования дифракционной решетки для ввода света из источника 10 света на основе команд из блока 50 анализа с изменением наклона дифракционной решетки спектроскоп 20 выводит компонент света конкретной длины волны в пределах рабочего диапазона длин волн обнаружения в оптическое волокно 25. Компонент света, выведенный из спектроскопа 20, проводится в блок 30 излучения света через оптическое волокно 25.
Блок 30 излучения света вводится в пищевод E при анализе стенки кровеносного сосуда посредством устройства 1 анализа стенки кровеносного сосуда. Компонент света из спектроскопа 20, который передан через оптическое волокно 25, излучается как свет измерения на участок измерения внутри сонной артерии С из пищевода E.
Блок 40 приема света принимает свет, выводимый из блока 30 излучения света, который излучается на участок измерения внутри сонной артерии С и который прошел через участок измерения. Блок 40 приема света может использовать элемент приема света, например фотодиод, который преобразует свет из участка измерения в электрический ток и передает этот электрический ток в блок 50 анализа. Кроме того, свет также может быть преобразован в электрический ток путем обеспечения концевой поверхности ввода света оптического волокна для блока 40 приема света, распространения света, который был введен в эту концевую поверхность ввода света оптического волокна, и использования элемента приема света, обеспечиваемого в положении, отличном от блока 40 приема света.
Блок 50 анализа анализирует состав участка измерения на основе данных об интенсивности компонента света, принятого блоком 40 приема света, и отображает результат на мониторе и т.п. Более конкретно, блок 50 анализа состоит из персонального компьютера (PC) или рабочей станции (WS) и т.п. и, по меньшей мере, обеспечен средством отображения, например монитором, арифметическим средством обработки, средством ввода/вывода и средством записи. В качестве конкретного примера анализа, выполняемого блоком 50 анализа, блок 50 анализа вычисляет интенсивность света, принятого блоком 40 приема света, для каждой длины волны на основе величины электрического тока из элемента приема света блока 40 приема света. Блок 50 анализа после этого определяет спектр интенсивности компонента света в диапазоне длин волн обнаружения исходя из результата вычисления для каждой длины волны, выполняет взятие второй производной по спектру интенсивности для этой длины волны и анализирует состав участка измерения, например бляшки на основе величины пика, возникающего в составе участка измерения, например бляшки. Результат анализа (данные анализа) после этого сообщается пользователю, например субъекту, посредством PC или WS, отображающих результат на мониторе и т.п. Кроме того, PC или WS с функцией блока 50 анализа могут также быть обеспечены функцией для управления всем устройством 1 анализа стенки кровеносного сосуда. А именно, у PC или WS существует функция выбора длины волны компонента света, который должен быть расщеплен спектроскопом 20, (центральной длины волны диапазона длин волн обнаружения), и выдачи команды в спектроскоп 20.
Фиг.2 является чертежом, на котором изображен другой вариант осуществления устройства анализа стенки кровеносного сосуда согласно настоящему изобретению. Как изображено на фиг.2, устройство 2 анализа стенки кровеносного сосуда обеспечено источником 10 света, спектроскопом 20, блоком 30 излучения света, блоком 40 приема света и блоком 50 анализа аналогично устройству 1 анализа стенки кровеносного сосуда, показанному на фиг.1. Однако устройство 2 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления отличается от устройства 1 анализа стенки кровеносного сосуда, показанного на фиг.1, в котором спектроскоп 20 расположен на стороне средства излучения, тем, что спектроскоп 20 расположен на стороне средства обнаружения. В отношении других составов устройство 2 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления в основном имеет структуру, идентичную структуре устройства 1 анализа стенки кровеносного сосуда, показанного на фиг.1.
А именно, в устройстве 2 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления средство обнаружения состоит из блока 410 ввода света, спектроскопа 20 и блока 40 приема света. Средство излучения согласно настоящему варианту осуществления имеет структуру, идентичную структуре средства излучения в устройстве 1 анализа стенки кровеносного сосуда, показанном на фиг.1, за исключением того, что оно не содержит спектроскоп 20.
В устройстве 2 анализа внутренней части сосуда кровеносного сосуда компонент света из блока 30 излучения света, который прошел через участок измерения, достигает блока 410 ввода света. Блок 410 ввода света оптически соединен со спектроскопом 20 через оптическое волокно 411, и компонент света, который был подан через блок 410 ввода света, передается через оптическое волокно 411 и достигает спектроскопа 20. В спектроскопе 20 в соответствии с командой из анализатора 50 выводится только компонент света в пределах диапазона длин волн обнаружения с центром в конкретной длине волны. Спектроскоп 20 и блок 40 приема света оптически соединены через оптическое волокно 412, и выведенный свет из спектроскопа 20 передается через оптическое волокно 412 и достигает блока 40 приема света. Функционирование блока 40 приема света и блока 50 анализа является идентичным их функционированию в ранее описанном устройстве 1 анализа стенки кровеносного сосуда, показанном на фиг.1.
Кроме того, взаимное расположение между блоком 30 излучения света в средстве излучения и блоком 40 приема света в средстве обнаружения в устройстве 1 анализа стенки кровеносного сосуда, показанном на фиг.1, не ограничивается взаимным расположением, изображенным на фиг.1, наоборот, может использоваться противоположное расположение. Кроме того, как обозначено в области (A) на фиг.3, как блок 30 излучения света, так и блок 40 приема света могут быть расположены на эпидерме шеи. Как обозначено в области (В) на фиг.3, как блок 30 излучения света, так и блок 40 приема света могут также быть расположены в пищеводе. Однако, в случае устройства 2 анализа стенки кровеносного сосуда, показанного на фиг.2, блок 410 ввода света вместо блока 40 приема света расположен так, как описано выше в отношении взаимного расположения с блоком 30 излучения света.
Целевые объекты измерения устройства 1 анализа стенки кровеносного сосуда, изображенного на фиг.1, включают в себя бляшку, тромбы и гематомы, прикрепленные к внутренней стенке сонной артерии C. Четыре типичных примера бляшки, прикрепленной к внутренней стенке сонной артерии С, включают в себя липидные ядра, состоящие из холестерина, атеромы, сформированные из лейкоцитов и их остатков, камни, получающиеся в результате кальцификации подобных холестерину субстанций, и волокнистые слои, покрывающие поверхность бляшки, содержащей эти три компонента, упомянутые выше, и имеющей коллаген в качестве главного своего компонента. Кроме того, тромбы и гематомы, состоящие из кровяных сгустков внутри кровеносных сосудов, также могут влиять на заболевания головного мозга. Фиг.4 является чертежом, на котором схематично изображен пример случая бляшки S и тромба T, прикрепленных к внутренней стенке сонной артерии C. В случае бляшки S и тромба T, прикрепленных к внутренней стенке сонной артерии C, так как диаметр кровеносного сосуда в области сонной артерии С, через которую может протекать кровь, становится узким, как изображено на фиг.4, то, как известно, это вызывает стеноз и закупорку сонной артерии С, а также церебральный инфаркт или ишемию головного мозга и т.п. Среди обычных типов бляшки, описанных выше, как известно, у атером, в частности, существует самый высокий потенциал для вызова церебрального инфаркта, однако, с другой стороны, так как камни и липидные ядра редко отделяются от внутренней стенки сонной артерии C, то, как известно, существует низкий риск закупорки внутримозговых кровеносных сосудов и т.п. в случае бляшки, состоящей из этих компонентов. Следовательно, для более точного определения риска заболеваний, например церебрального инфаркта, считают, что необходимо идентифицировать состав бляшки, прикрепленной к внутренней стенке сонной артерии C.
То, прикреплена ли бляшка к внутренней стенке сонной артерии С, может быть определено посредством измерения с использованием способов диагностики, например диагностика посредством ультразвуковой эхокардиографии или внутрисосудистое ультразвуковое исследование (IVUS) снаружи шеи. Однако, в случае диагностики посредством ультразвуковой эхокардиографии или внутрисосудистого ультразвукового исследования, трудно получить информацию, отличную от информации, относящейся к форме бляшки внутри кровеносного сосуда, а именно идентифицировать состав бляшки. Кроме того, несмотря на то что тромбы и гематомы, прикрепленные к внутренней стенке сонной артерии С и содержащие кровяные сгустки внутри кровеносных сосудов, также являются целевыми объектами измерения устройства 1 анализа стенки кровеносного сосуда, так как они также могут влиять на заболевания головного мозга, их трудно обнаружить снаружи шеи с использованием ультразвуковой эхокардиографии или внутрисосудистого ультразвукового исследования.
Напротив, использование устройства 1 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления позволяет обнаруживать бляшку, тромбы и гематомы, сформированные в сонной артерии С, и идентифицировать их компоненты, и далее это раскрывается с использованием примеров измерения, приведенных ниже.
(Примеры измерения с использованием устройства анализа стенки кровеносного сосуда)
(Пример 1 измерения)
На фиг.5 изображены результаты вычисления ослабления проходящего света в случае излучения света ближней инфракрасной области спектра на свинину, используемую как целевой объект измерения при моделировании по методу Монте-Карло. Более конкретно, инфракрасный свет с длинами волны 1550 нм и 1640 нм излучался на свинину толщиной 6 мм при температуре 38°C с последующим измерением коэффициента поглощения и коэффициента рассеивания. Ослабление проходящего света, когда свет ближней инфракрасной области спектра излучается на свинину, вычислялось исходя из результатов моделирования по методу Монте-Карло. Кроме того, причиной для выбора толщины целевого объекта измерения равной 6 мм было то, что толщина, эквивалентная эпидерме на наружной стороне человеческого пищевода, и сонной артерии, и слоев мышц, содержащих стенки кровеносного сосуда, которая находится на световом пути, составляет приблизительно 6 мм. В результате моделирования ослабление проходящего света составило -42 дБ, в случае света с длиной волны 1550 нм, и -28 дБ в случае света с длиной волны 1640 нм.
(Пример 2 измерения)
С целью подтверждения результатов моделирования Примера 1 измерения было измерено ослабление проходящего света в случае излучения света ближней инфракрасной области спектра на реальную свинину. Результаты изображены на фиг.6. Условия измерения были аналогичными условиям Примера 1 измерения, и, несмотря на то, что свет ближней инфракрасной области спектра (параллельный свет) с диаметром 1 мм излучался на свинину толщиной 6 мм при температуре 38°C, проходящий свет принимался при расположении многомодового волокна с диаметром сердечника 400 мкм на стороне свинины, противоположной стороне, на которую излучался свет ближней инфракрасной области спектра. Далее было определено ослабление исходя из его интенсивности. В качестве света ближней инфракрасной области спектра излучались два типа света с длинами волн 1550 нм и 1640 нм. В результате было подтверждено, что свет ослабляется аналогично результатам моделирования, определенным в Примере 1 измерения.
(Пример 3 измерения)
Интенсивность света, который проходит через мышцу, была измерена с использованием слоя мышц свинины в вышеупомянутых Примерах 1 и 2 измерения. В Примерах 3 и 4 измерения с использованием слоя свиного жира была измерена интенсивность света, который проходит через жир.
На фиг.7 изображены результаты вычисления ослабления проходящего света в случае излучения света ближней инфракрасной области спектра на свиной жир (свиное сало), используемый в качестве целевого объекта измерения, при моделировании по методу Монте-Карло. Более конкретно, свет ближней инфракрасной области спектра с длинами волны 1550 нм излучался на свиное сало толщиной 40 мм при температуре 38°C с последующим измерением коэффициента поглощения и коэффициента рассеивания. После этого вычислялось ослабление проходящего света, когда инфракрасный свет излучался на свиное сало, исходя из результатов моделирования по методу Монте-Карло. Кроме того, причиной для выбора толщины сала, используемого для целевого объекта измерения, равной 40 мм, является то, что толщина, эквивалентная эпидерме на наружной стороне человеческого пищевода, и сонной артерии, и жирового слоя, находящихся на световом пути, составляет приблизительно 40 мм. В результате моделирования ослабление проходящего света было равно -32 дБ.
(Пример 4 измерения)
С целью подтверждения результатов моделирования Примера 3 измерения было измерено ослабление проходящего света в случае излучения света ближней инфракрасной области спектра на реальное свиное сало. Результаты изображены на фиг.7. Условия измерения были аналогичными условиям Примера 3 измерения, свет ближней инфракрасной области спектра (параллельный свет, длина волны: 1550 нм) с диаметром 1 мм излучался на свиное сало толщиной 40 мм при температуре 38°C, и проходящий свет принимался при расположении многомодового световода с диаметром сердечника 400 мкм на стороне сала, противоположной стороне, на которую излучался свет ближней инфракрасной области спектра. Далее было определено ослабление исходя из его интенсивности. В результате было подтверждено, что ослабление света происходит аналогично результатам моделирования, определенным в Примере 3 измерения.
С использованием существующих элементов обнаружения ближней инфракрасной области спектра в измерениях сигналы могут выводиться до -100 дБм. В данной работе, компонент света 1 мВт (0 дБм), который является интенсивностью, которая не оказывает вредное воздействие на человеческое тело, излучается из источника света внутри пищевода и обнаруживается элементом обнаружения ближней инфракрасной области спектра, расположенным на эпидерме шеи. В этом случае, на основе результатов Примеров 1-4 измерения, считается, что в эпидерме шеи обнаруживается свет интенсивности, в достаточной мере выше чем -100 дБм.
Однако, в случае использования источника света SC для источника 10 света, выход после расщепления луча, как правило, равен приблизительно от -10 дБ до -20 дБ. Кроме того, ослабление, относящееся к спектроскопу, как правило, составляет от -15 дБм до -25 дБм. Так как количество света, которое прошло через жир и мышцы шеи человека, равно -73 дБ при длине волны 1550 нм на основе результатов моделирования, когда в качестве источника света используются источник света SC или расщепитель, то величина проходящего света составляет от -83 дБм до -93 дБм, что заканчивает приближение к пределу обнаружения элементов обнаружения ближней инфракрасной области спектра. С другой стороны, ожидается, что величина проходящего света, в случае длины волны 1640 нм, увеличится на 14 дБм или больше по сравнению с количеством при длине волны 1550 нм, на основе результатов моделирования света, проходящего через мышцы, что позволяет получить выход, который выше, по меньшей мере, на один разряд, чем предел обнаружения элементов обнаружения ближней инфракрасной области спектра. Соответственно, в конфигурации, в которой блок излучения света или блок приема света расположен на эпидерме шеи, в то время как другой расположен в пищеводе, в случае использования источника SC света для источника света, устройство обнаружения, которое использует компонент света с длиной волны 1600 нм или больше, является более предпочтительным.
(Пример 5 измерения)
Создана имитационная модель, которая имитирует структуру шеи от эпидермы шеи до внутренней стенки пищевода E, с предположением случая, когда блок 30 излучения света устройства 1 анализа стенки кровеносного сосуда располагается внутри пищевода E, и блок 40 приема света располагается на эпидерме шеи. Моделирование интенсивности выхода света в эпидерму шеи при прохождении через сонную артерию С проводилась в случае, когда свет измерения подавался с внутренней стенки пищевода. Конкретная имитационная модель изображена на фиг.8. Как изображено на фиг. 8, источник P1 света расположен на внутренней стенке пищевода (нижняя часть чертежа), и блок P2 приема света расположен на эпидерме шеи (верхняя часть чертежа). Стенка M1 пищевода, содержащая мышцы толщиной 3 мм, жировой слой A1 толщиной 26 мм, мышечный слой M2 толщиной 1 мм и жировой слой A2 толщиной 10 мм, были разъединены на слои в порядке от внутренней стенки пищевода к эпидерме шеи, и источник P1 света и блок P2 приема света были расположены в направлении, перпендикулярном внутренней стенке пищевода и эпидерме шеи для вставки слоя C1 крови, имитирующего сонную артерию, обеспеченную внутри жирового слоя А1 напротив него, так, чтобы расстояние между внутренней стенкой пищевода и эпидермой шеи составляло 40 мм. Слой C1 крови был в форме круга с диаметром 5 мм, а его периферия была покрыта стенкой M3 сосуда, содержащей мышцы толщиной 1 мм. В это время расстояние между границей стенки М1 пищевода и жировым слоем А1 и границей стенки M3 сосуда и жировым слоем А1 на стороне источника P1 света было равно 15 мм, и расстояние между границей стенки M3 сосуда и жировым слоем А1 на стороне блока P2 приема света и блоком P2 приема света было равно 15 мм. Кроме того, диаметр блока P2 приема света был равен 2 мм.
В результате использования коэффициента поглощения и коэффициента рассеивания для имитации интенсивности света с длиной волны 1600 нм, принимаемого блоком P2 приема света после вывода из источника P1 света и прохождения через слой C1 крови, с использованием вышеупомянутой имитационной модели, ослабление принятого света составило -73 дБ. Соответственно, в случае приема света ближней инфракрасной области спектра в эпидерме после излучения на сонную артерию С изнутри пищевода E с использованием устройства 1 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления, посредством моделирования были получены результаты, указывающие на то, что проходящий свет может быть измерен при интенсивности, достаточной для измерения.
Далее, на фиг.9 изображены результаты определения зависимости между длиной смещения и ослаблением света в случае смещения блока P2 приема света в направлении X, изображенном на фиг.8, с целью более активного получения света, проходящего через стенку сосуда, из места блока P2 приема света по фиг.8. Соответственно, было подтверждено, что ослабление света, принимаемого блоком P2 приема света, уменьшается еще больше.
(Пример 6 измерения)
Интенсивность света была вычислена посредством моделирования в конфигурации, в которой свет, который был подан из эпидермы, возвращается снова в эпидерму после повторного многократного рассеивания с использованием имитационной модели, аналогичной имитационной модели, изображенной в Примере 5 измерения. Несмотря на то что имитационная модель, изображенная на фиг. 10, является идентичной имитационной модели, изображенной на фиг.8, в отличие от состояния, в котором слой C1 крови проходит в направлении, перпендикулярном листу бумаги, на фиг.8, на фиг.10 изображен случай, в котором слой C1 крови лежит в плоскости листа бумаги. Имитационная модель, изображенная на фиг.10, отличается от имитационной модели из Примера 5 измерения тем, что и источник P1 света, и блок P2 приема света расположены на стороне эпидермы шеи (верхняя часть чертежа), и оба находятся в положениях на расстоянии 30 мм друг от друга вдоль слоя C1 крови. В результате использования коэффициента поглощения и коэффициента рассеивания для имитации света, принимаемого блоком P2 приема света, с диаметром 2 мм, в случае излучения света с длиной волны 780 нм из источника P1 света в направлении слоя C1 крови, с использованием этой имитационной модели, ослабление принимаемого света составило -87 дБ. Соответственно, в случае приема света ближней инфракрасной области спектра в эпидерме после излучения на сонную артерию С из эпидермы шеи с использованием устройства 1 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления, посредством моделирования были получены результаты, указывающие на то, что проходящий свет может быть измерен при интенсивности, достаточной для измерения.
(Пример 7 измерения)
На фиг.11 изображены результаты измерения спектров поглощения в случае соответственного излучения света ближней инфракрасной области спектра на составные части бляшки, состоящие из атеромы и липидного ядра, и сравнивания со спектром поглощения жира. Более конкретно, свет ближней инфракрасной области спектра в пределах измерительного диапазона длин волн от 1600 нм до 2700 нм соответственно излучался на атерому, липидное ядро и жир с последующим измерением их спектров поглощения, определением второй производной согласно длине волны спектров поглощения в пределах каждого измерительного диапазона длин волн от 1600 нм до 1850 нм и от 1900 нм до 2700 нм и сравнением результатов. Кроме того, на фиг.11, в области (A) изображена вторая производная согласно длине волны спектров поглощения в пределах измерительного диапазона длин волн от 1600 нм до 1850 нм, в то время как в области (B) изображена вторая производная согласно длине волны спектров поглощения в пределах измерительного диапазона длин волн от 1900 нм до 2700 нм. Как изображено на фиг.11, было подтверждено присутствие множества характерных пиков, которые, как полагают, являются эффективными, чтобы отличить атерому и липидное ядро от жира (например пиков в точках 1690, 1696, 1705, 1717, 1729, 1762, 2272, 2294, 2308, 2348, 2372 и 2629 нм), в спектрах поглощения (вторая производная) атеромы и липидного ядра в каждом из вышеупомянутых измерительных диапазонов длин волн.
В частности, присутствие или отсутствие атеромы в кровеносном сосуде может быть проанализировано в случае использования компонента света в диапазоне длин волн обнаружения, который продолжается на 15 нм как с короткой, так и с длинной сторон выбранной центральной длины волны, причем каждая из одной или более центральных длин волн выбираются из группы длин волн, состоящей из пиковых длин волн 1696, 1717, 2272 и 2629 нм, для анализа состава участка измерения. Кроме того, присутствие или отсутствие липидного ядра в кровеносном сосуде может быть проанализировано в случае использования компонента света в диапазоне длин волн обнаружения, который продолжается на 15 нм как с короткой, так и с длинной сторон выбранной центральной длины волны, причем каждая из одной или более центральных длин волн выбираются из группы длин волн, состоящей из пиковых длин волн 1690, 2294 и 2372 нм, для анализа состава участка измерения. С учетом взаимосвязи между пиковыми длинами волн атеромы и пиковой длиной волны липидного ядра, как указано выше, использование пиковой длины волны 2629 нм, при которой пиковая длина волны липидного ядра и т.п. не присутствует в ее окрестности, является более предпочтительным для анализа присутствия или отсутствия атеромы. С другой стороны, пиковая длина волны 2294 нм липидного ядра перекрывается с пиковой длиной волны жира и т.п., в то время как устойчивые пиковые длины волн жира или атером присутствуют в пределах диапазона длин волн, продолжающегося на несколько нм как с короткой, так и с длинной сторон другой пиковой длины волны 1690 нм. С учетом этого пиковая длина волны 2372 нм является предпочтительной для анализа присутствия или отсутствия липидного ядра.
(Пример 8 измерения)
На фиг.12 изображены результаты измерения спектра поглощения в случае излучения света ближней инфракрасной области спектра на тромбы и сравнивания со спектром поглощения крови. Более конкретно, свет ближней инфракрасной области спектра в пределах измерительного диапазона длин волн от 1400 нм до 2700 нм соответственно излучался на тромбы и кровь с последующим измерением их спектров поглощения, определением второй производной согласно длине волны спектров поглощения в пределах каждого измерительного диапазона длин волн от 1400 нм до 1800 нм и от 1900 нм до 2700 нм и сравнением результатов. Кроме того, на фиг.12, в области (A) изображена вторая производная согласно длине волны спектров поглощения в пределах измерительного диапазона длин волн от 1400 нм до 1800 нм, в то время как в области (B) изображена вторая производная согласно длине волны спектров поглощения в пределах измерительного диапазона длин волн от 1900 нм до 2700 нм. Как изображено на фиг.12, было подтверждено присутствие множества характерных пиков, которые, как полагают, являются эффективными, чтобы отличить тромбы от крови (например, пиков в точках 1514, 1574, 1626, 1691, 1740, 1972, 2055, 2166, 2290, 2465 и 2544 нм), в спектрах поглощения (вторая производная) тромбов в каждом из вышеупомянутых измерительных диапазонов длин волн.
Соответственно, присутствие или отсутствие тромбов в кровеносном сосуде может быть проанализировано с использованием компонента света в диапазоне длин волн обнаружения, который продолжается на 15 нм как с короткой, так и с длинной сторон выбранной центральной длины волны, причем каждая из одной или более центральных длин волн выбирается из группы длин волн, состоящей из пиковых длин волн 1514, 1574, 1626, 1691, 1740, 1972, 2055, 2166, 2290, 2465 и 2544 нм, для анализа состава участка измерения. Кроме того, использование пиковых длин волн 1514, 1626, 1972 и 2465 нм, при которых пиковая длина волны крови не присутствует в их окрестности, является более предпочтительным для анализа присутствия или отсутствия тромбов, в то время как пиковые длины волн 1972 нм и 2465 нм являются особенно предпочтительными, так как существует небольшое влияние ослабления, вызванного рассеиванием после этого.
В примерах измерения, описанных выше, подтверждено то, что: (1) можно измерять свет ближней инфракрасной области спектра при прохождении между внутренней стенкой пищевода, состоящей из жира и крови внутри сонной артерии, и эпидермой шеи, (2) можно провести различие между жиром и бляшкой, а также идентифицировать тип бляшки (в частности, липидные ядра и атеромы) в случае излучения света в пределах диапазона длин волн света ближней инфракрасной области спектра и измерения спектров поглощения, и (3) можно провести различие между тромбами и кровью в случае излучения света в пределах диапазона длин волн света ближней инфракрасной области спектра и измерения спектров поглощения. Соответственно, при расположении блока 30 излучения света устройства 1 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления внутри пищевода E, при расположении блока 40 приема света на эпидерме шеи и при излучении света ближней инфракрасной области спектра из блока 30 излучения света в блок 40 приема света при приеме света, который прошел через участок измерения сонной артерии C, было подтверждено, что можно оценить состав субстанций, прикрепленных к внутренней стенке сонной артерии С.
Кроме того, в случае изменения направления расположения блока 30 излучения света и блока 40 приема света на обратное, а именно в случае расположения блока 30 излучения света на эпидерме шеи и расположения блока 40 приема света внутри пищевода E, состав субстанций, прикрепленных к внутренней стенке сонной артерии С, можно оценить способом, идентичным способу в вышеупомянутых примерах измерения.
Кроме того, в случае расположения блока 30 излучения света и блока 40 приема света на стороне эпидермы шеи, как изображено в вышеупомянутом Примере 6 измерения, подтверждено, что интенсивность света, выводимого из блока 30 излучения света, в конфигурации, в которой он снова возвращается в эпидерму после повторного прохождения многократного рассеивания, можно измерить в блоке 40 приема света. На основе этого, даже в случае измерения при расположении и блока 30 излучения света, и блока 40 приема света на стороне эпидермы шеи или в пищеводе E на фиксированном расстоянии друг от друга, можно оценить состав субстанций, прикрепленных к внутренней стенке сонной артерии С (см. фиг.3).
Несмотря на то что вышеупомянутые эффекты раскрыты для устройства 1 анализа стенки кровеносного сосуда по фиг.1, аналогичные эффекты также демонстрируются устройством 2 анализа стенки кровеносного сосуда по фиг.2.
(Пример использования устройства анализа стенки кровеносного сосуда)
В соответствии с устройствами 1 и 2 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления состав субстанций, прикрепленных к внутренней стенке сонной артерии С, можно проанализировать, как описано ранее. Кроме того, с объединением результатов анализа, полученных посредством устройств 1 и 2 анализа стенки кровеносного сосуда, с результатами измерения, полученными посредством других измерительных приборов, можно более точно определить состояние бляшки в сонной артерии. Например, несмотря на то что устройства 1 и 2 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления обеспечивают возможность анализа состава бляшки, прикрепленной к внутренней стенке сонной артерии C, трудно точно измерить форму бляшки. Соответственно, при объединении, например, с ультразвуковой эхокардиографией снаружи тела способность бляшки вызвать заболевание, например, можно более точно оценить на основе результатов измерения формы бляшки, полученных посредством ультразвуковой эхокардиографии и результатов анализа составных частей бляшки, полученных посредством устройств 1 и 2 анализа стенки кровеносного сосуда.
Кроме того, результаты анализа из устройств 1 и 2 анализа стенки кровеносного сосуда сообщаются пользователю, например субъекту, посредством отображения на мониторе, обеспеченном в блоке 50 анализа. В случае отображения результатов анализа на мониторе и т.п. также этим способом пользователь может быть уведомлен более простым и понятным способом при отображении этих результатов анализа в комбинации с результатами измерения, полученными с использованием другого способа измерения. Например, как изображено на фиг. 13, форма и уровень риска (способность вызвать заболевание) могут отображаться одновременно на основе формы бляшки, измеренной посредством ультразвуковой эхокардиографии снаружи тела, и на основе результатов анализа составных частей бляшки, полученных посредством устройства 1 анализа стенки кровеносного сосуда. Кроме того, устройство захвата изображения кровеносного сосуда, описанное в вышеупомянутом Патентном документе 3, является известным примером устройства, которое отображает томограммы кровеносного сосуда, включающие в себя томограммы бляшки, измеренной посредством ультразвуковой эхокардиографии.
Как описано ранее, согласно устройствам 1 и 2 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления, вместе с излучением света измерения на участок измерения, например на сонную артерию С, из блока 30 излучения света, обеспеченного снаружи кровеносного сосуда, так как свет от участка измерения обнаруживается в блоке 40 приема света, обеспеченном внутри кровеносного сосуда, то состояние стенки кровеносного сосуда может быть проанализировано без введения устройства, используемого в измерении, в кровеносный сосуд. В результате исследования могут быть выполнены в состоянии, которое уменьшает нагрузку на пациента. Кроме того, при выполнении измерений с использованием света ближней инфракрасной области спектра, который демонстрирует разные характеристики согласно составу прикрепленных субстанций, например бляшки внутри кровеносного сосуда (причем компонент света содержится в измерительном диапазоне длин волн от 780 нм до 2750 нм), могут быть выполнены исследования, которые различают составные части, например (бляшки), с использованием устройства анализа, обеспеченного снаружи кровеносного сосуда.
Кроме того, как указано в вышеупомянутых примерах измерения, в случае соответственного излучения компонентов света в пределах измерительного диапазона длин волн от 1400 нм до 1850 нм или от 1900 нм до 2700 нм, указывается характерная интенсивность при свете, который прошел через бляшку и т.п, прикрепленную к стенке кровеносного сосуда, или отражен ею. Соответственно, состав субстанций, прикрепленных к стенке кровеносного сосуда, на участке измерения можно проанализировать более точно при соответственном вычислении второй производной информации об интенсивности (например, спектр поглощения) света в пределах измерительного диапазона длин волн от 1400 нм до 1850 нм или от 1900 нм до 2700 нм.
Несмотря на то что выше обеспечено раскрытие устройств 1 и 2 анализа стенки кровеносного сосуда согласно настоящему варианту осуществления, устройство анализа стенки кровеносного сосуда согласно настоящему изобретению не ограничивается вышеупомянутым вариантом осуществления, наоборот, оно может быть изменено различными способами. Например, несмотря на то что в отношении ранее описанного варианта осуществления раскрыт случай, в котором целевой объект измерения устройства анализа стенки кровеносного сосуда является внутренней стенкой сонной артерии, кровеносный сосуд, предназначенный для измерения, не ограничивается сонной артерией.
Кроме того, в ранее описанных примерах измерения раскрыт способ исследования состава бляшки, который состоит из измерения спектра поглощения в пределах конкретного диапазона длин волн и взятия второй производной полученного результата согласно длине волны для обнаружения пика, возникающего в конкретном компоненте бляшки. Однако определение второй производной согласно длине волны не является существенным. Кроме того, может также быть применен вариант, в котором вместо измерения спектра поглощения для света ближней инфракрасной области спектра определяется пиковая интенсивность компонента света, который прошел через участок измерения или отражен им, посредством излучения света ближней инфракрасной области спектра с одной конкретной длиной волны или множеством конкретных длин волн на участок измерения, и на основе этого результата измеряется отношение компонентов, которые составляют бляшку на участке измерения.
Список номеров позиций
1, 2: устройство анализа стенки кровеносного сосуда, 10: источник света, 20: спектроскоп, 30: блок излучения света, 40: блок приема света и 50: блок анализа.
Реферат
Группа изобретений относится к медицинской технике. Устройство анализа стенки кровеносного сосуда обеспечено структурой, обеспечивающей возможность точного измерения компонентов бляшки на стенке кровеносного сосуда в состоянии, которое уменьшает нагрузку на пациента. При анализе стенки кровеносного сосуда свет измерения излучается на участок измерения внутри кровеносного сосуда, например на сонную артерию, из блока излучения света, обеспеченного снаружи кровеносного сосуда, в то время как свет от участка измерения обнаруживается в блоке приема света, обеспеченном снаружи кровеносного сосуда. Соответственно, так как состояние стенки кровеносного сосуда можно анализировать без введения устройства, используемого в измерении, в кровеносный сосуд, то нагрузка на пациента во время измерения уменьшается. Кроме того, в результате выполнения измерения с использованием света ближней инфракрасной области спектра (компонент света в диапазоне длин волн от 780 нм до 2750 нм), который демонстрирует характеристики, которые отличаются согласно составу субстанций, например бляшки, прикрепленной к внутренней части кровеносного сосуда, могут быть выполнены исследования, которые различают составные части, например бляшки, с использованием устройства анализа, обеспеченного снаружи кровеносного сосуда. 4 н. и 17 з.п. ф-лы, 13 ил.
Формула
средство излучения для излучения, по меньшей мере, компонента света в измерительном диапазоне длин волн от 780 нм до 2750 нм на участок измерения внутри кровеносного сосуда, причем средство излучения включает в себя блок излучения света, установленный в месте на заданном расстоянии от кровеносного сосуда и источника света, который подает компонент света, излучаемый на участок измерения через блок излучения света,
средство обнаружения для обнаружения упомянутого компонента света от участка измерения, причем средство обнаружения включает в себя блок ввода света, установленный в месте, на заданном расстоянии от кровеносного сосуда, куда доходит компонент света от участка измерения, и блок приема света, который обнаруживает компонент света, введенный через упомянутый блок ввода света, и
средство анализа для анализа состава участка измерения на основе информации об интенсивности компонента света, обнаруживаемого средством обнаружения,
причем одно из средства излучения и средства обнаружения содержит спектроскоп, который отделяет от света, выводимого из источника света, компонент света в пределах диапазона длин волн обнаружения, который включен в измерительный диапазон длин волн, и является более узким, чем измерительный диапазон длин волн, и спектроскоп расположен на одном из светового пути между источником света и блоком излучения света и светового пути между блоком ввода света и средством обнаружения; и
причем и блок излучения света в средстве излучения и блок ввода света в средстве обнаружения расположены на эпидерме шеи.
причем средство анализа выполнено с возможностью анализа присутствия или отсутствия тромбов в кровеносном сосуде для анализа состава участка измерения.
причем средство анализа выполнено с возможностью анализа присутствия или отсутствия атеромы в кровеносном сосуде для анализа состава участка измерения.
средство анализа выполнено с возможностью анализа присутствия или отсутствия липидного ядра в кровеносном сосуде для анализа состава участка измерения.
средство излучения для излучения, по меньшей мере, компонента света в измерительном диапазоне длин волн от 780 нм до 2750 нм на участок измерения внутри кровеносного сосуда, причем средство излучения включает в себя блок излучения света, установленный в месте на заданном расстоянии от кровеносного сосуда и источника света, который подает компонент света, излучаемый на участок измерения через блок излучения света,
средство обнаружения для обнаружения упомянутого компонента света от участка измерения, причем средство обнаружения включает в себя блок ввода света, установленный в месте, на заданном расстоянии от кровеносного сосуда, куда доходит компонент света от участка измерения, и блок приема света, который обнаруживает компонент света, введенный через упомянутый блок ввода света, и
средство анализа для анализа состава участка измерения на основе информации об интенсивности компонента света, обнаруживаемого средством обнаружения,
причем одно из средства излучения и средства обнаружения содержит спектроскоп, который отделяет от света, выводимого из источника света, компонент света в пределах диапазона длин волн обнаружения, который включен в измерительный диапазон длин волн, и является более узким, чем измерительный диапазон длин волн, и спектроскоп расположен на одном из светового пути между источником света и блоком излучения света и светового пути между блоком ввода света и средством обнаружения; и
в котором один из блока излучения света в средстве излучения и блока ввода света в средстве обнаружения расположен на эпидерме шеи, в то время как другой расположен в пищеводе.
причем средство анализа выполнено с возможностью анализа присутствия или отсутствия тромбов в кровеносном сосуде для анализа состава участка измерения.
причем средство анализа выполнено с возможностью анализа присутствия или отсутствия атеромы в кровеносном сосуде для анализа состава участка измерения.
средство анализа выполнено с возможностью анализа присутствия или отсутствия липидного ядра в кровеносном сосуде для анализа состава участка измерения.
средство излучения для излучения, по меньшей мере, компонента света в измерительном диапазоне длин волн от 780 нм до 2750 нм на участок измерения внутри кровеносного сосуда, причем средство излучения включает в себя блок излучения света, установленный в месте на заданном расстоянии от кровеносного сосуда и источника света, который подает компонент света, излучаемый на участок измерения через блок излучения света;
средство обнаружения для обнаружения упомянутого компонента света от участка измерения, причем средство обнаружения включает в себя блок ввода света, установленный в месте, на заданном расстоянии от кровеносного сосуда, куда доходит компонент света от участка измерения, и блок приема света, который обнаруживает компонент света, введенный через упомянутый блок ввода света;
средство анализа для анализа состава участка измерения на основе информации об интенсивности компонента света, обнаруживаемого средством обнаружения,
причем одно из средства излучения и средства обнаружения содержит спектроскоп, который отделяет от света, выводимого из источника света, компонент света в пределах диапазона длин волн обнаружения, который включен в измерительный диапазон длин волн, и является более узким, чем измерительный диапазон длин волн, и спектроскоп расположен на одном из светового пути между источником света и блоком излучения света и светового пути между блоком ввода света и средством обнаружения, и
в котором как блок излучения света средства излучения, так и блок ввода света средства обнаружения расположены в пищеводе.
причем средство анализа выполнено с возможностью анализа присутствия или отсутствия тромбов в кровеносном сосуде для анализа состава участка измерения.
причем средство анализа выполнено с возможностью анализа присутствия или отсутствия атеромы в кровеносном сосуде для анализа состава участка измерения.
средство анализа выполнено с возможностью анализа присутствия или отсутствия липидного ядра в кровеносном сосуде для анализа состава участка измерения.
вставляют конец излучения света так, чтобы расположить его около участка измерения,
устанавливают конец ввода света в заданном положении в кровеносном сосуде, куда доходит компонент света от участка измерения,
излучают, по меньшей мере, компонент света в измерительном диапазоне длин волн от 780 нм до 2713 нм на участок измерения через конец излучения света,
обнаруживают компонент света, входящий через конец ввода света, от участка измерения, и
генерируют данные анализа для идентификации состава участка измерения из информации об интенсивности обнаруживаемого компонента света.

Комментарии