Способы определения почечной функции - RU2734776C1
Код документа: RU2734776C1
Чертежи


















Описание
УРОВЕНЬ ТЕХНИКИ
[0001] Область данного раскрытия в общем относится к способам и фармацевтическим композициям, содержащим производные пиразина, для оценки почечной функции пациента, нуждающегося в этом.
[0002] Острая почечная недостаточность (ОПН) является распространенным заболеванием у пациентов, поступающих в общие медико–хирургические больницы. Приблизительно половина пациентов, у которых развивается ОПН, умирает либо непосредственно от ОПН, либо от осложнений, связанных с основным заболеванием, в то время как выжившие сталкиваются с заметным увеличением заболеваемости и длительной госпитализацией. Ранняя диагностика, как правило, считается важной, поскольку почечная недостаточность часто протекает бессимптомно и обычно требует тщательного отслеживания маркеров почечной функции в крови. Динамический контроль (мониторинг) почечных функций пациентов желателен, чтобы минимизировать риск острой почечной недостаточности, вызванной различными клиническими, физиологическими и патологическими состояниями. Такой динамический контроль имеет тенденцию быть особенно важным в случае критически больных или травмированных пациентов, поскольку большой процент таких пациентов склонен к риску полиорганной недостаточности (MOF), потенциально приводящей к смерти. MOF представляет собой последовательную недостаточность легких, печени и почек и вызывается одним или более острыми повреждениями легких (ОПЛ), респираторным дистресс–синдромом взрослых (РДСВ), гиперметаболизмом, гипотензией, персистирующим очагом воспаления и синдромом сепсиса. Общие гистологические признаки гипотензии и шока, приводящего к MOF, обычно включают некроз тканей, застой сосудов, интерстициальный и клеточный отек, кровоизлияние и микротромб. Эти изменения обычно затрагивают легкие, печень, почки, кишечник, надпочечники, мозг и поджелудочную железу в порядке убывания частоты. Переход от ранних стадий поражения к клинической MOF обычно соответствует определенной степени печеночной и почечной недостаточности, а также изменению риска смертности от примерно 30% до примерно 50%.
[0003] Традиционно почечная функция пациента определялась с помощью грубых измерений мочеиспускания пациента и уровней креатинина в плазме. Эти значения часто вводят в заблуждение, поскольку такие значения зависят от возраста, состояния гидратации, почечной перфузии, мышечной массы, потребления пищи и многих других клинических и антропометрических переменных. Кроме того, единственное значение, полученное через несколько часов после взятия пробы, может быть трудно соотнести с другими физиологическими событиями, такими как кровяное давление, сердечный выброс, состояние гидратации и другие конкретные клинические события (например, кровоизлияние, бактериемия, параметры ИВЛ и другие).
[0004] Хроническая болезнь почек (ХБП) является заболеванием, характеризующимся постепенной потерей функции почек с течением времени. Она включает состояния, которые повреждают почки и уменьшают их способность должным образом удалять ненужные продукты из крови человека. Осложнения ХБП включают высокое кровяное давление, анемию (малокровие), слабые кости, плохое алиментарное здоровье и повреждение нервов в дополнение к повышенному риску сердечного заболевания. По данным National Kidney Foundation, примерно две трети всех случаев ХБП вызваны диабетами или гипертонией. В дополнение к семейной истории болезни почек, другие факторы риска включают возраст, этническую принадлежность, гипертонию и диабеты. Скорость почечной клубочковой фильтрации (СКФ) является лучшим тестом для определения уровня функции почек и оценки стадии ХБП у пациента.
[0005] СКФ является важным тестом для определения уровня функции почек, который определяет стадию ХБП. Как показано в Таблице 1 и на Фигуре 28, чем ниже СКФ, тем серьезнее ХБП. СКФ можно оценить на основании анализа крови, измеряющего уровень креатинина в крови в сочетании с другими факторами. Более точные и, следовательно, более полезные способы требуют введения эндогенного вещества пациенту с последующим тщательным контролем выделения мочи в течение некоторого периода времени. Им часто являются контрастные вещества (СА), которые сами по себе могут вызывать почечные проблемы. Радиоизотопы или йодированные ароматические кольца являются двумя общими категориями СА, которые используются для определения СКФ.
[0006] Таблица 1
[0007] Контраст–индуцированная нефропатия (CIN) является серьезным осложнением, связанным с использованием радиоизотопов или йодированных CA. Считается, что CIN вызывается либо почечной вазоконстрикцией, либо повреждением канальцев, вызванным CA. Определение CIN варьируется от исследования к исследованию, но наиболее распространенное определение, основанное на симптомах, испытываемых пациентом, включает повышение креатинина в сыворотке на по меньшей мере 25% по сравнению с исходным уровнем, происходящее через два–пять дней после воздействия CA в отсутствие других причин острой почечной недостаточности. CIN может быть смертельной для вплоть до 20% пациентов, госпитализированных из–за этих осложнений. Чем тяжелее ХБП, тем выше риск развития CIN. Таким образом, пациенты, наиболее нуждающиеся в точных данных СКФ, подвергаются наибольшему риску развития иногда смертельных осложнений при получении этих данных.
[0008] Что касается традиционных процедур контроля почек, аппроксимация скорости клубочковой фильтрации (СКФ) пациента может быть получена с помощью 24–часовой процедуры сбора мочи, которая (как следует из названия) обычно требует около 24 часов для сбора мочи, еще несколько часов для анализа и тщательной техники сбора у кровати. К сожалению, нежелательно поздние сроки и значительная продолжительность этой традиционной процедуры могут снизить вероятность эффективного лечения пациента и/или спасения почки(почек). Еще одним недостатком процедуры такого типа является то, что получение повторных данных имеет тенденцию быть таким же трудоемким, что и получение исходных данных.
[0009] Время от времени изменения уровня креатинина в сыворотке пациента должны корректироваться на основе значений измерений, например, электролитов и осмолярности мочи пациента, а также производных вычислений, например, «индекса почечной недостаточности» и/или «фракционной экскреции натрия». Такие корректировки креатинина в сыворотке как правило нежелательно требуют одновременного сбора дополнительных проб сыворотки и/или мочи и, после некоторой задержки, дальнейших вычислений. Зачастую дозировка лекарственного средства корректируется с учетом почечной функции и, таким образом, может быть одинаково неточной, иметь аналогичную задержку и такую же трудную повторную оценку, что и значения измерения и вычисления, на которых такая дозировка основывается. Наконец, клинические решения в критически больных группах часто одинаково важны как по срокам, так и точности.
[0010] Известно, что гидрофильные, анионные вещества, как правило, могут выводиться почками. Почечный клиренс обычно происходит двумя путями: клубочковая фильтрация и канальцевая секреция. Канальцевая секреция может быть охарактеризована как активный транспортный процесс, и, следовательно, вещества, очищающиеся по этому пути, обычно проявляют специфические свойства в отношении размера, заряда и липофильности.
[0011] Большинство веществ, которые проходят через почки, фильтруются через клубочек (небольшую переплетенную группу капилляров в мальпигиевом тельце почки). Примеры экзогенных веществ, способных очищать почку с помощью клубочковой фильтрации (в дальнейшем называемых «агентами СКФ»), показаны на Фигуре 1 и включают креатинин (1), о–йодгиппуран (2) и99mTc–DTPA (3). Примеры экзогенных веществ, которые способны подвергаться почечному клиренсу посредством канальцевой секреции, включают99mTc–MAG3 (4) и другие вещества, известные в данной области.99mTc–MAG3 (4) также широко используется для оценки почечной функции с помощью гамма–сцинтиграфии, а также путем измерения почечного кровотока. В качестве одного из недостатков веществ, проиллюстрированных на Фигуре 1, o–йодгиппуран (2),99mTc–DTPA (3) и99mTc–MAG3 (4) включают радиоизотопы, позволяющие их обнаруживать. Даже если нерадиоактивные аналоги (например, такие как аналог o–йодгиппурана (2)) или другие нерадиоактивные вещества подлежали использованию для контроля почечной функции, такой контроль требовал использования нежелательного ультрафиолетового излучения для возбуждения этих веществ.
[0012] Производные пиразина известны в данной области для использования при контроле почек, в том числе те, которые описаны в US 8,155,000, US 8,664,392, US 8,697,033, US 8,722,685, US 8,778,309, US 9,005,581, US 9,114,160, US 9,283,288, US 9,376,399 и US 9,480,687, которые включены в данный документ во всей своей полноте по данной ссылке.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0013] В одном аспекте в данном документе раскрыто соединение Формулы I,

где каждый X1 и X2 независимо является –CO2R1, –CONR1R2, –CO(AA) или –CONH(PS); каждый из Y1 и Y2 независимо выбран из группы, состоящей из –NR1R2 и

Z1 представляет собой одинарную связь, –CR1R2–, –O–, –NR1–, –NCOR1–, –S–, –SO– или –SO2–; каждый из R1–R2 независимо выбран из группы, состоящей из H, –CH2(CHOH)aH, –CH2(CHOH)aCH3, –CH2(CHOH)aCO2H, –(CHCO2H)aCO2H, –(CH2CH2O)cH, –(CH2CH2O)cCH3, –(CH2)aSO3H, –(CH2)aSO3–, –(CH2)aSO2H, –(CH2)aSO2–, –(CH2)aNHSO3H, –(CH2)aNHSO3–, –(CH2)aNHSO2H, –(CH2)aNHSO2–,–(CH2)aPO4H3, –(CH2)aPO4H2–, –(CH2)aPO4H2–, –(CH2)aPO43–, –(CH2)aPO3H2, –(CH2)aPO3H–и –(CH2)aPO32–; AA представляет собой пептидную цепь, содержащую одну или более аминокислот, выбранных из группы, состоящей из природных и неприродных аминокислот, связанных вместе пептидными или амидными связями, и в каждом случае AA может быть таким же как каждый другой или отличаться от него; PS представляет собой сульфатированную или несульфатированную полисахаридную цепь, содержащую одно или более моносахаридных звеньев, связанных гликозидными связями; и ‘a’ представляет собой число от 1 до 10, ‘c’ представляет собой число от 1 до 100, и каждое из ‘m’ и ‘n’ независимо представляет собой число от 1 до 3.
[0014] В другом аспекте в данном документе раскрыта система для определения СКФ у пациента, нуждающегося в этом. Система содержит вычислительное устройство, устройство отображения, соединенное с возможностью связи с упомянутым вычислительным устройством, источник питания, который функционально связан с упомянутым вычислительным устройством и поддерживает электрическую изоляцию системы от внешних источников питания, одну или более головок датчика, функционально связанных с упомянутым вычислительным устройством, и по меньшей мере один индикаторный агент, выполненный с возможностью испускания спектральной энергии под воздействием электромагнитного излучения. Вычислительное устройство выполнено с возможностью работать и управлять упомянутыми головками датчика, регистрировать один или более замеров, отправленных с упомянутых головок датчика, и вычислять СКФ упомянутого пациента на основании упомянутых замеров. Одна или более головок датчика содержат по меньшей мере один источник электромагнитного излучения и выполнены с возможностью генерировать и доставлять электромагнитное излучение, обнаруживать и измерять спектральную энергию, испускаемую упомянутым индикаторным агентом, и передавать упомянутый замер, обеспеченный упомянутым индикаторным агентом, в упомянутое вычислительное устройство. Индикаторный агент предназначен для введения упомянутому пациенту и испускает спектральную энергию, которая является обнаруживаемой упомянутыми головками датчика, под воздействием электромагнитного излучения.
[0015] В еще одном аспекте в настоящем документе раскрыта система для трансдермального определения нормированной по размеру тела СКФ у пациента. Система содержит вычислительное устройство, устройство отображения, соединенное с возможностью связи с упомянутым вычислительным устройством, источник питания, который функционально связан с упомянутым вычислительным устройством и поддерживает электрическую изоляцию системы от внешних источников питания, одну или более головок датчика, функционально связанных с упомянутым вычислительным устройством, и по меньшей мере один индикаторный агент, выполненный с возможностью испускания спектральной энергии под воздействием электромагнитного излучения. Одна или более головок датчика содержат по меньшей мере один источник электромагнитного излучения и выполнены с возможностью генерировать и доставлять электромагнитное излучение, обнаруживать и измерять спектральную энергию, испускаемую упомянутым индикаторным агентом, и передавать упомянутый замер, обеспеченный упомянутым индикаторным агентом, в упомянутое вычислительное устройство. Индикаторный агент предназначен для введения упомянутому пациенту и испускает спектральную энергию, которая является обнаруживаемой упомянутыми головками датчика, под воздействием электромагнитного излучения. Вычислительное устройство выполнено с возможностью работать и управлять упомянутыми головками датчика, регистрировать один или более замеров, отправленных с упомянутых головок датчика, определять параметр затухания по измеренной спектральной энергии в течение временного интервала измерения, определять метрику качества, связанную с измеренной спектральной энергией в течение временного интервала измерения, использовать эту метрику качества, чтобы оценить, является ли определение параметра затухания достаточно точным, и если нет, увеличивать временной интервал измерения до тех пор, пока оценка метрики качества не будет указывать достаточную точность, преобразовать параметр затухания в замер СКФ, нормированный скорректированным по размеру тела индикаторным агентом или его объемом распределения (Vd), и сообщить результат на дисплее.

[0016] В еще одном другом аспекте в данном документе раскрыт способ для определения скорости клубочковой фильтрации (СКФ) у пациента, нуждающегося в этом. Данный способ содержит введение упомянутому пациенту соединения Формулы I или его фармацевтически приемлемой соли, измерение концентрации соединения Формулы I у упомянутого пациента в течение временного интервала измерения и определение СКФ у упомянутого пациента, при этом в соединении Формулы I
каждым из X1 и X2 независимо является –CO2R1, –CONR1R2, –CO(AA) или –CONH(PS); каждый из Y1 и Y2 независимо выбран из группы, состоящей из –NR1R2 и

Z1 представляет собой одинарную связь, –CR1R2–, –O–, –NR1–, –NCOR1–, –S–, –SO– или –SO2–; каждый из R1–R2 независимо выбран из группы, состоящей из H, –CH2(CHOH)aH, –CH2(CHOH)aCH3, –CH2(CHOH)aCO2H, –(CHCO2H)aCO2H, –(CH2CH2O)cH, –(CH2CH2O)cCH3, –(CH2)aSO3H, –(CH2)aSO3–, –(CH2)aSO2H, –(CH2)aSO2–, –(CH2)aNHSO3H, –(CH2)aNHSO3–, –(CH2)aNHSO2H, –(CH2)aNHSO2–,–(CH2)aPO4H3, –(CH2)aPO4H2–, –(CH2)aPO4H2–, –(CH2)aPO43–, –(CH2)aPO3H2, –(CH2)aPO3H–, and –(CH2)aPO32–; AA представляет собой пептидную цепь, содержащую одну или более аминокислот, выбранных из группы, состоящей из природных и неприродных аминокислот, связанных вместе пептидными или амидными связями, и в каждом случае AA может быть таким же как каждый другой или отличаться от него; PS представляет собой сульфатированную или несульфатированную полисахаридную цепь, содержащую одно или более моносахаридных звеньев, связанных гликозидными связями; и ‘a’ представляет собой число от 1 до 10, ‘c’ представляет собой число от 1 до 100, и каждое из ‘m’ и ‘n’ независимо представляет собой число от 1 до 3.
[0017] Еще одним аспектом, раскрытым в данном документе, является способ оценки почечной функции у пациента. Данный способ содержит введение флуоресцентного соединения или его фармацевтически приемлемой соли упомянутому пациенту; воздействие на упомянутое флуоресцентное соединение электромагнитным излучением, в результате чего спектральная энергия испускается от упомянутого флуоресцентного соединения; обнаружение спектральной энергии, испускаемой от упомянутого флуоресцентного соединения; и оценку почечной функции пациента на основе обнаруженной спектральной энергии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0018] Фигура 1 иллюстрирует несколько известных контрастных веществ для контроля почечной функции.
[0019] Фигура 2 является иллюстрацией системы контроля СКФ у пациента.
[0020] Фигуры 3A, 3B, 3D и 3D представляют собой графики клиренса MB–102, иллюстрирующие двухкамерную фармакокинетическую модель у четырех разных пациентов с разными значениями СКФ от 120 мл/мин (3A) до 25 мл/мин (3D).
[0021] Фигура 4 представляет собой график сравнения СКФ, определенной с использованием MB–102 в сравнении с Omnipaque®.
[0022] Фигура 5 представляет собой процент выведения MB–102 из мочи пациентов–людей через 12 часов.
[0023] Фигура 6 представляет собой гистограмму периода полувыведения концентрации MB–102 в плазме у пациентов.
[0024] Фигура 7 представляет собой график, показывающий корреляцию с течением времени между концентрацией MB–102 в плазме и интенсивностью трансдермальной флуоресценции у пациента с СКФ, равной 117 мл/мин/1,73 м2.
[0025] Фигура 8 представляет собой график, показывающий корреляцию с течением времени между концентрацией MB–102 в плазме и интенсивностью чрескожной флуоресценции у пациента с СКФ, равной 61 мл/мин/1,73 м2.
[0026] Фигура 9 представляет собой график, показывающий корреляцию с течением времени между концентрацией MB–102 в плазме и интенсивностью чрескожной флуоресценции у пациента с СКФ, равной 23 мл/мин/1,73 м2.
[0027] Фигура 10 представляет собой график, соотносящий трансдермально прогнозируемую СКФ с измеряемой в плазме СКФ, определяемой с использованием MB–102 и нормируемой по площади поверхности тела субъекта (способ 1 исключения выбросов; гибридный способ смещения).
[0028] Фигура 11 представляет собой график, соотносящий трансдермально прогнозируемую СКФ с измеряемой в плазме СКФ, определяемой с использованием MB–102 и нормируемой по объему распределения индикаторного агента в субъекте (способ 1 исключения выбросов; гибридный способ смещения).
[0029] Фигура 12 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: СКФ по Йогексолу, Ненормированная (Без исключения выбросов; способ аппроксимации с фиксированным смещением).
[0030] Фигура 13 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: СКФ по Йогексолу, Нормированная по BSA (Без исключения выбросов; способ аппроксимации с фиксированным смещением).
[0031] Фигура 14 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: СКФ по Йогексолу, Нормированная по Vd (Способ 1) (Без исключения выбросов; способ аппроксимации с фиксированным смещением).
[0032] Фигура 15 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: СКФ по MB–102, Ненормированная (Без исключения выбросов; способ аппроксимации с фиксированным смещением).
[0033] Фигура 16 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: СКФ по MB–102, Нормированная по BSA (Без исключения выбросов; способ аппроксимации с фиксированным смещением).
[0034] Фигура 17 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: СКФ по MB–102, Нормированная по Vd, Способ 1 (Без исключения выбросов; способ аппроксимации с фиксированным смещением).
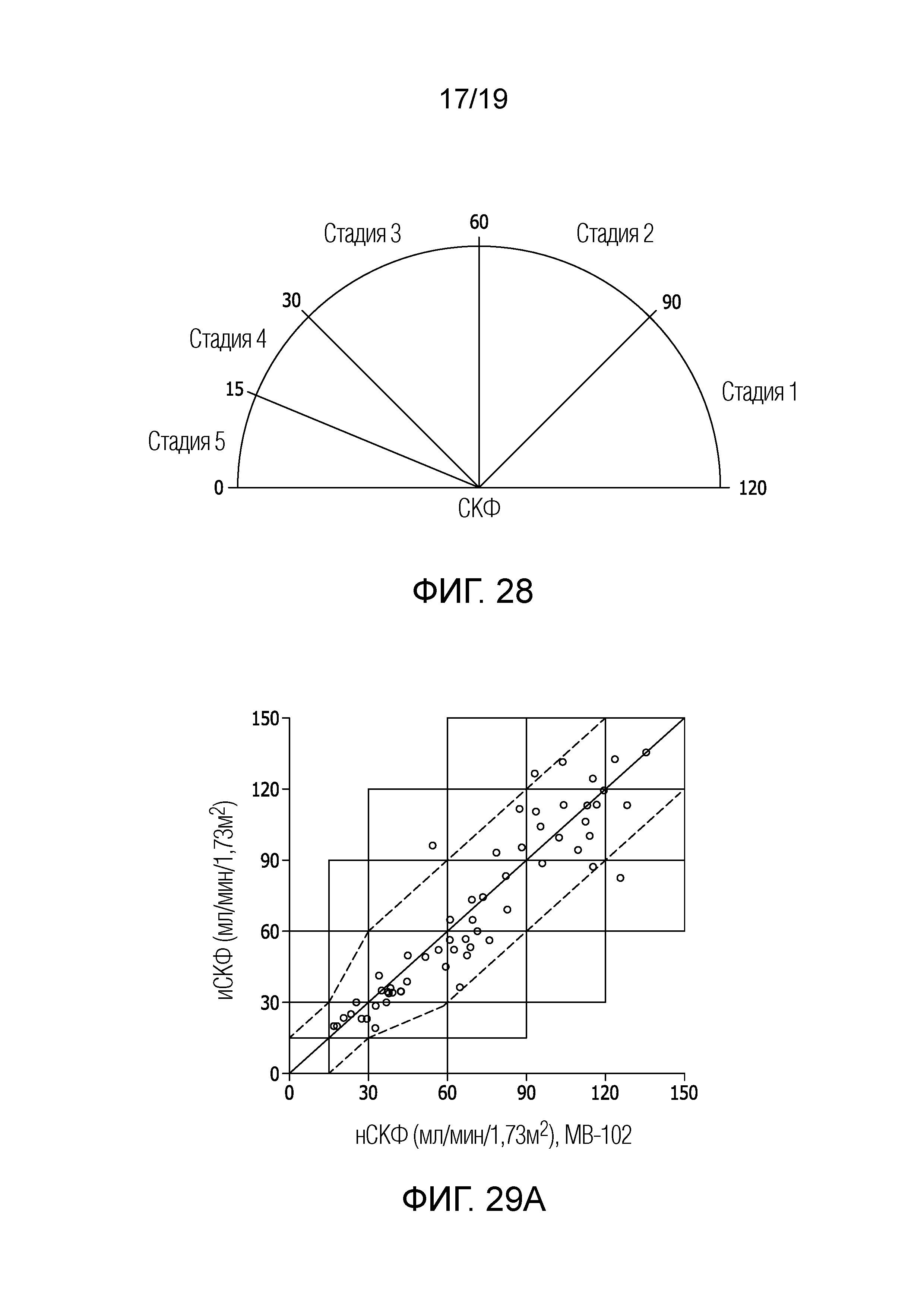
[0035] Фигура 18 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: СКФ по MB–102, Нормированная по Vd, Способ 2 (Без исключения выбросов; способ аппроксимации с фиксированным смещением).
[0036] Фигура 19 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: Способ с переменным смещением (Без исключения выбросов; Определение СКФ по MB–102 способом 2 нормирования по Vd).
[0037] Фигура 20 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: Способ с гибридным смещением (Без исключения выбросов; Определение СКФ по MB–102 способом 2 нормирования по Vd).
[0038] Фигура 21 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: Способ 1 исключения выбросов (Способ с гибридным смещением; Определение СКФ по MB–102, нормируемое по BSA).
[0039] Фигура 22 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: Способ 1 исключения выбросов (Способ с гибридным смещением; Определение СКФ по MB–102 способом 2 нормирования по Vd).
[0040] Фигура 23 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: Способ 2 исключения выбросов (Способ с гибридным смещением; Определение СКФ по MB–102, нормируемое по BSA).
[0041] Фигура 24 представляет собой график, соотносящий определяемую по плазме СКФ со скоростью клиренса чрескожной флуоресценции: Способ 2 исключения выбросов (Способ с гибридным смещением; Определение СКФ по MB–102 способом 2 нормирования по Vd).
[0042] Фигура 25 представляет собой график, обобщающий оптимизацию переходной RDTC для определения способа смещения, используемого при аппроксимации RDTC.
[0043] Фигура 26 представляет собой график, обобщающий оптимизацию порога ошибки выброса для постоянной скорости спада флуоресценции.
[0044] Фигура 27 представляет собой график, обобщающий оптимизацию порога ошибки выброса для определяемой по плазме СКФ.
[0045] Фигура 28 является графическим представлением 5 стадий хронической болезни почек по СКФ.
[0046] Фигура 29а представляет собой график сравнения оСКФ с определяемой по ФК в плазме СКФ, нормированной по площади поверхности тела субъекта (нСКФ). На данный график наложена сетка ошибок, указывающая точность диагностики, по числу стадий ХБП. Замеры, попадающие в ячейку только с зелеными сторонами, были бы правильно диагностированы по оСКФ. Замеры, попадающие в ячейку как с зелеными, так и с желтыми сторонами, были бы неправильно диагностированы по оСКФ на одну стадию ХБП. Замеры, попадающие в ячейку как с желтыми, так и с красными сторонами, были бы неправильно диагностированы по оСКФ на две стадии ХБП.
[0047] Фигура 29b представляет собой график сравнения трансдермально определяемого СКФ (чСКФ) с определяемой по ФК в плазме СКФ, нормированной по площади поверхности тела субъекта (нСКФ). На данный график наложена сетка ошибок, указывающая точность диагностики, по числу стадий ХБП. Замеры, попадающие в ячейку только с зелеными сторонами, были бы правильно диагностированы по чСКФ. Замеры, попадающие в ячейку как с зелеными, так и с желтыми сторонами, были бы неправильно диагностированы по чСКФ на одну стадию ХБП. Замеры, попадающие в ячейку как с желтыми, так и с красными сторонами, были бы неправильно диагностированы по чСКФ на две стадии ХБП.
[0048] Фигура 29c представляет собой график сравнения трансдермально определяемого СКФ (чСКФ) с определяемой по ФК в плазме СКФ, нормированной по объему распределения индикаторного агента в субъекте (нСКФ). На данный график наложена сетка ошибок, указывающая точность диагностики, по числу стадий ХБП. Замеры, попадающие в ячейку только с зелеными сторонами, были бы правильно диагностированы по чСКФ. Замеры, попадающие в ячейку как с зелеными, так и с желтыми сторонами, были бы неправильно диагностированы по чСКФ на одну стадию ХБП. Замеры, попадающие в ячейку как с желтыми, так и с красными сторонами, были бы неправильно диагностированы по чСКФ на две стадии ХБП.
[0049] Фигура 30 представляет собой график трансдермально измеряемой СКФ, автоматически определяемой на двух участках тела в режиме реального времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0050] Все ссылки на "пиразин", "производное пиразина", "молекулу пиразина", "соединение пиразина" или "аналог пиразина" применяются ко всем соединениям Формулы I. Кроме того, каждая ссылка на пиразин включает все его фармацевтически приемлемые соли, если иное не указано конкретно. Солевые формы могут быть заряжены или не заряжены и могут быть протонированы для формирования соответствующего катиона или депротонированы для формирования соответствующего аниона. Все аспекты и варианты осуществления, раскрытые в данном документе, применимы к соединениям Формулы I, а конкретные примеры являются лишь иллюстративными и не ограничивающими объем данного раскрытия.

[0051] В одном аспекте данного документа раскрыта производная пиразина Формулы I или его фармацевтически приемлемая соль,
при этом каждый из X1 и X2 независимо является –CO2R1, –CONR1R2, –CO(AA) или –CONH(PS); каждый из Y1 и Y2 независимо выбран из группы, состоящей из –NR1R2 и

Z1 представляет собой одинарную связь, –CR1R2–, –O–, –NR1–, –NCOR1–, –S–, –SO– или –SO2–; каждый из R1–R2 независимо выбран из группы, состоящей из H, –CH2(CHOH)aH, –CH2(CHOH)aCH3, –CH2(CHOH)aCO2H, –(CHCO2H)aCO2H, –(CH2CH2O)cH, –(CH2CH2O)cCH3, –(CH2)aSO3H, –(CH2)aSO3–, –(CH2)aSO2H, –(CH2)aSO2–, –(CH2)aNHSO3H, –(CH2)aNHSO3–, –(CH2)aNHSO2H, –(CH2)aNHSO2–,–(CH2)aPO4H3, –(CH2)aPO4H2–, –(CH2)aPO4H2–, –(CH2)aPO43–, –(CH2)aPO3H2, –(CH2)aPO3H– и –(CH2)aPO32–; AA представляет собой пептидную цепь, содержащую одну или более аминокислот, выбранных из группы, состоящей из природных и неприродных аминокислот, связанных вместе пептидными или амидными связями, и в каждом случае AA может быть таким же как каждый другой или отличаться от него; PS представляет собой сульфатированную или несульфатированную полисахаридную цепь, содержащую одно или более моносахаридных звеньев, связанных гликозидными связями; и ‘a’ представляет собой число от 0 до 10, ‘c’ представляет собой число от 1 до 100 и каждое из ‘m’ и ‘n’ независимо представляет собой число от 1 до 3. В другом аспекте, ‘a’ представляет собой число от 1 до 10. В еще одном аспекте, ‘a’ равно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
[0052] В некоторых аспектах по меньшей мере одним из X1 и X2 является –CO(PS) или –CO(AA). В еще одном аспекте, как X1, так и X2 являются –CO(AA).
[0053] (AA) представляет собой пептидную цепь, содержащую одну или более природных или неприродных аминокислот, связанных вместе пептидными или амидными связями. Пептидная цепь (АА) может быть одной аминокислотой, гомополипептидной цепью или гетерополипептидной цепью, и может быть любой соответствующей длины. В некоторых вариантах осуществления, природная или неприродная аминокислота является α–аминокислотой. В еще одном аспекте, α–аминокислота является D–α–аминокислотой или L–α–аминокислотой. В полипептидной цепи, состоящей из двух или более аминокислот, каждая аминокислота выбирается независимо от другой(их) во всех аспектах, включая, но без ограничения, структуру боковой цепи и стереохимию. Например, в некоторых вариантах осуществления пептидная цепь может включать от 1 аминокислоты до 100 аминокислот, от 1 аминокислоты до 90 аминокислот, от 1 аминокислоты до 80 аминокислот, от 1 аминокислоты до 70 аминокислот, от 1 аминокислоты до 60 аминокислот, от 1 аминокислоты до 50 аминокислот, от 1 аминокислоты до 40 аминокислот, от 1 аминокислоты до 30 аминокислот, от 1 аминокислоты до 20 аминокислот или даже от 1 аминокислоты до 10 аминокислот. В некоторых вариантах осуществления пептидная цепь может включать от 1 α–аминокислоты до 100 α–аминокислот, от 1 α–аминокислоты до 90 α–аминокислот, от 1 α–аминокислоты до 80 α–аминокислот, от 1 α–аминокислоты до 70 α–аминокислот, от 1 α–аминокислоты до 60 α–аминокислот, от 1 α–аминокислоты до 50 α–аминокислот, от 1 α–аминокислоты до 40 α–аминокислот, от 1 α–аминокислоты до 30 α–аминокислот, от 1 α–аминокислоты до 20 α–аминокислот или даже от 1 α–аминокислоты до 10 α–аминокислот. В некоторых вариантах осуществления аминокислоту выбирают из группы, состоящей из D–аланина, D–аргинина, D–аспарагина, D–аспарагиновой кислоты, D–цистеина, D–глутаминовой кислоты, D–глутамина, глицина, D–гистидина, D–гомосерина, D–изолейцина, D–лейцина, D–лизина, D–метионина, D–фенилаланина, D–пролина, D–серина, D–треонина, D–триптофана, D–тирозина и D–валина. В некоторых вариантах осуществления α–аминокислоты пептидной цепи (АА) выбирают из группы, состоящей из аргинина, аспарагина, аспарагиновой кислоты, глутаминовой кислоты, глутамина, гистидина, гомосерина, лизина и серина. В некоторых вариантах осуществления α–аминокислоты пептидной цепи (АА) выбирают из группы, состоящей из аспарагиновой кислоты, глутаминовой кислоты, гомосерина и серина. В некоторых вариантах осуществления пептидная цепь (АА) относится к одной аминокислоте (например, D–аспарагиновой кислоте или D–серину).
[0054] В некоторых вариантах осуществления (AA) является одной аминокислотой, выбранной из группы, состоящей из 21 незаменимой аминокислоты. В других аспектах AA выбирают из группы, состоящей из D–аргинина, D–аспарагина, D–аспарагиновой кислоты, D–глутаминовой кислоты, D–глутамина, D–гистидина, D–гомосерина, D–лизина и D–серина. Предпочтительно, АА является D–аспарагиновой кислотой, глицином, D–серином или D–тирозином. Наиболее предпочтительно АА является D–серином.
[0055] В некоторых вариантах осуществления, (AA) является β–аминокислотой. Примеры β–аминокислот включают, но не ограничиваются ими, β–фенилаланин, β–аланин, 3–амино–3–(3–бромфенил)пропионовую кислоту, 3–аминобутановую кислоту, цис–2–амино–3–циклопентан–1–карбоновую кислоту, транс–2–амино–3–циклопентан–1–карбоновую кислоту, 3–аминоизобутановую кислоту, 3–амино–2–фенилпропионовую кислоту, 3–амино–4–(4–бифенилил)бутановую кислоту, цис–3–амино–циклогексанкарбоновую кислоту, транс–3–амино–циклогексанкарбоновую кислоту, 3–амино–циклопентанкарбоновую кислоту, 3–амино–2–гидрокси–4–фенилбутировую кислоту, 2–(аминометил)фенилуксусную кислоту, 3–амино–2–метилпропионовую кислоту, 3–амино–4–(2–нафтил)бутановую кислоту, 3–амино–5–фенилпентановую кислоту, 3–амино–2–фенилпропионовую кислоту, 4–бром–β–Phe–OH, 4–хлор–β–Homophe–OH, 4–хлор–β–Phe–OH, 2–циано–β–Homophe–OH, 2–циано–β–Homophe–OH, 4–циано–β–Homophe–OH, 3–циано–β–Phe–OH, 4–циано–β–Phe–OH, 3,4–диметокси–β–Phe–OH, γ,γ–дифенил–β–Homoala–OH, 4–фтор–β–Phe–OH, β–Gln–OH, β–Homoala–OH, β–Homoarg–OH, β–Homogln–OH, β–Homoglu–OH, β–Homohyp–OH, β–Homoleu–ОН, β–Homolys–ОН, β–Homomet–ОН, β2–гомофенилаланин, β–Homophe–ОН, β3–Homopro–ОН, β–Homoser–ОН, β–Homothr–ОН, β–Homotrp–ОН, β–Homotrp–OMe, β–Homotyr–OH, β–Leu–OH, β–Leu–OH, β–Lys(Z)–OH, 3–метокси–β–Phe–OH, 3–метокси–β–Phe–OH, 4–метокси–β–Phe–OH, 4–метил–β–Homophe–OH, 2–метил–β–Phe–OH, 3–метил–β–Phe–OH, 4–метил–β–Phe–OH, β–Phe–OH, 4–(4–пиридил)–β–Homoala–OH, 2–(трифторметил)–β–Homophe–OH, 3–(трифторметил)–β–Homophe–OH, 4–(трифторметил)–β–Homophe–ОН, 2–(трифторметил)–β–Phe–OH, 3–(трифторметил)–β–Phe–OH, 4–(трифторметил)–β–Phe–OH, β–Tyr–OH, Этил-3–(бензиламино)пропионат, β–Ala–OH, 3–(амино)–5–гексеновую кислоту, 3–(амино)–2–метилпропионовую кислоту, 3–(амино)–2–метилпропионовую кислоту, 3–(амино)–4–(2–нафтил)бутановая кислота, 3,4–дифтор–β–Homophe–ОН, γ,γ–дифенил– β–Homoala–ОН, 4–фтор–β–Homophe–ОН, β–Gln–OH, β–Homoala–OH, β–Homoarg–OH, β–Homogln–OH, β–Homoglu–OH, β–Homohyp–OH, β–Homoile–OH, β–Homoleu–OH, β–Homolys–OH, β–Homomet–ОН, β–Homophe–ОН, β3–гомопролин, β–Homothr–OH, β–Homotrp–ОН, β–Homotyr–ОН, β–Leu–ОН, 2–метил–β–Homophe–ОН, 3–метил–β–Homophe–OH, β–Phe–OH, 4–(3–пиридил)–β–Homoala–OH, 3–(трифторметил)–β–Homophe–OH, β–глутаминовую кислоту, β–гомоаланин, β–Гомоглутаминовую кислоту, β–гомоглутамин, β–гомогидроксипролин, β–гомоизолейцин, β–гомолейцин, β–гомометионин, β–гомофенилаланин, β–гомопролин, ?–гомосерин, β–гомотреонин, β–гомотриптофан, β–гомотирозин, β–лейцин, β–фенилаланин, пирролидин–3–карбоновую кислоту и β–Dab–OH.
[0056] (PS) представляет собой сульфатированную или несульфатированную полисахаридную цепь, включающую одно или более моносахаридных звеньев, связанных гликозидными связями. Полисахаридная цепь (PS) может быть любой соответствующей длины. Например, в некоторых вариантах осуществления полисахаридная цепь может включать от 1 моносахаридного звена до 100 моносахаридных звеньев, от 1 моносахаридного звена до 90 моносахаридных звеньев, от 1 моносахаридного звена до 80 моносахаридных звеньев, от 1 моносахаридного звена до 70 моносахаридных звеньев, от 1 моносахаридного звена до 60 моносахаридных звеньев, от 1 моносахаридного звена до 50 моносахаридных звеньев, от 1 моносахаридного звена до 40 моносахаридных звеньев, от 1 моносахаридного звена до 30 моносахаридных звеньев, от 1 моносахаридного звена до 20 моносахаридных звеньев, или даже от 1 моносахаридного звена до 10 моносахаридных звеньев. В некоторых вариантах осуществления полисахаридная цепь (PS) представляет собой гомополисахаридную цепь, состоящую либо из пентозных, либо из гексозных моносахаридных звеньев. В некоторых вариантах осуществления полисахаридная цепь (PS) представляет собой гетерополисахаридную цепь, состоящую как из пентозных, так и из гексозных моносахаридных звеньев или лишь из пентозных или гексозных моносахаридных звеньев. В некоторых вариантах осуществления моносахаридные звенья полисахаридной цепи (PS) выбираются из группы, состоящей из глюкозы, фруктозы, маннозы, ксилозы и рибозы. В некоторых вариантах осуществления полисахаридная цепь (PS) относится к одному моносахаридному звену (например, глюкозе или фруктозе). В еще одном аспекте, полисахаридная цепь является аминосахаром, где одна или более гидроксильных групп этого сахара была заменена аминогруппой. Соединение с карбонильной группой может быть либо через аминную, либо через гидроксильную группу.
[0057] В некоторых вариантах осуществления, для производной пиразина Формулы I, по меньшей мере один из либо Y1, либо Y2 является

где Z1 представляет собой одинарную связь, –CR1R2–, –O–, –NR1–, –NCOR1–, –S–, –SO– или –SO2–; и каждый из R1–R2 независимо выбран из группы, состоящей из H, –CH2(CHOH)aH, –CH2(CHOH)aCH3, –CH2(CHOH)aCO2H, –(CHCO2H)aCO2H, –(CH2CH2O)cH, –(CH2CH2O)cCH3, –(CH2)aSO3H, –(CH2)aSO3–, –(CH2)aSO2H, –(CH2)aSO2–, –(CH2)aNHSO3H, –(CH2)aNHSO3–, –(CH2)aNHSO2H, –(CH2)aNHSO2–,–(CH2)aPO4H3, –(CH2)aPO4H2–, –(CH2)aPO4H2–, –(CH2)aPO43–, –(CH2)aPO3H2, –(CH2)aPO3H–, and –(CH2)aPO32–; a, c, m и n аналогичны таковым, описанным в любых других частях данного документа.
[0058] В еще одном аспекте по меньшей мере один из Y1 и Y2 является –NR1R2, а R1–R2 аналогичны таковым, описанным выше. В еще одном аспекте, как Y1, так и Y2 являются –NR1R2, а R1–R2 аналогичны таковым, описанным выше. В качестве альтернативы, оба R1 и R2 независимо выбраны из группы, состоящей из H, –CH2(CHOH)aCH3, –(CH2)aSO3H, –(CH2)aNHSO3H и –(CH2)aPO3H2. В еще одном аспекте оба R1 и R2 являются водородом.
[0059] В любом аспекте соединения пиразина один или более атомов могут альтернативно быть замещены изотопно–меченным атомом того же самого элемента. Например, атом водорода может быть изотопно помечен дейтерием или тритием; атом углерода может быть изотопно помечен с помощью13C или14C; атом азота может быть изотопно помечен с помощью14N или15N. Изотопная метка может быть стабильным изотопом или может быть нестабильным изотопом (т.е. радиоактивным). Молекула пиразина может содержать одну или более изотопных меток. Изотопная метка может быть частичной или полной. Например, молекула пиразина может быть помечена 50% дейтерия тем самым обеспечивая молекуле сигнатуру, которая может быть легко проконтролирована масс–спектроскопией или другой методикой. В качестве другого примера, молекула пиразина может быть помечена тритием, что обеспечивает молекуле радиоактивную сигнатуру, которая может быть проконтролирована как in vivo, так и ex vivo с использованием методик, известных в данной области.
[0060] Фармацевтически приемлемые соли известны в данной области. В любом аспекте в данном документе пиразин может иметь форму фармацевтически приемлемой соли. В качестве примера, а не ограничения, фармацевтически приемлемые соли включают соли, которые описаны Berge, et al. в J. Pharm. Sci., 66(1), 1 (1977), который включен в данный документ по этой ссылке во всей своей полноте. Соль может быть катионной или анионной. В некоторых вариантах осуществления противоион для фармацевтически приемлемой соли выбирают из группы, состоящей из ацетата, бензолсульфоната, бензоата, бесилата, бикарбоната, битартрата, бромида, эдетата кальция, камсилата, карбоната, хлорида, цитрата, дигидрохлорида, эдетата, эдисилата, эстолата, эзилата, фумарата, глюцептата, глюконата, глутамата, гликоллиларсанилата, гексилрезорцината, гидрабамина, гидробромида, гидрохлорида, гидроксинафтоата, йодида, изетионата, лактата, лактобионата, малата, малеата, манделата, мезилата, метилбромида, метилнитрата, метилсульфата, муката, напсилата, нитрата, памоата, пантотената, фосфата, дифосфата, полигалактуроната, салицилата, стеарата, субацетата, сукцината, сульфата, танната, тартрата, теоклата, триэтиодида, адипата, альгината, аминосалицилата, ангидрометиленцитрата, ареколина, аспартата, бисульфата, бутилбромида, камфората, диглюконата, дигидробромида, дисукцината, глицерофосфата, гемисульфата, фторгидрата, гидройодида, метиленбис(салицилата), нападисилата, оксалата, пектината, персульфата, фенилэтилбарбитурата, пикрата, пропионата, тиоцианата, тозилата, ундеканоата, бензатина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглюмина, прокаина, бенетамина, клемизола, диэтиламина, пиперазина, трометамина, алюминия, кальция, лития, магния, калия, натрия, цинка, бария и висмута. Любая функциональная группа в производном пиразина, способная образовывать соль, может необязательно образовывать ее с использованием способов, известных в данной области. В качестве примера, а не ограничения, соли гидрохлорида амина могут быть образованы путем добавления соляной кислоты к пиразину. Фосфатные соли могут быть образованы путем добавления фосфатного буфера к пиразину. Любая присутствующая кислотная функциональность, например, сульфоновой кислоты, карбоновой кислоты или фосфоновой кислоты, может быть депротонирована с помощью подходящего основания и образованной соли. Альтернативно, аминогруппа может быть протонирована соответствующей кислотой для образования аминной соли. Солевая форма может быть однозарядной, двузарядной или даже тризарядной, и когда присутствует более одного противоиона, каждый противоион может быть таким же как каждый из других или может отличаться от каждого из других.
[0061] В еще одном другом аспекте в данном документе раскрыт способ измерения почечной скорости клубочковой фильтрации (СКФ) у пациента, нуждающегося в этом. Способ содержит введение пациенту соединения пиразина или его фармацевтически приемлемой соли, измерения трансдермальной флуоресценции у упомянутого пациента в течение некоторого периода времени и определение СКФ у упомянутого пациента. Период времени, используемый для определения одного замера СКФ, именуется в данном документе временным интервалом измерения. Во многих ситуациях будет клинически полезно оценивать СКФ с течением времени в режиме реального времени. Следовательно, в некоторых аспектах раскрытия предусмотрены множественные последовательные оценки СКФ. В некоторых аспектах множественные последовательные оценки СКФ предусмотрены после однократного введения индикаторного агента. Общая продолжительность времени, в течение которого проводятся измерения СКФ после однократной инъекции, будет именоваться в данном документе как период сообщения по однократной инъекции. В некоторых аспектах существует временное перекрытие между временными интервалами измерения. В таких случаях интервал времени, в котором СКФ сообщается (интервал времени сообщения), не обязательно совпадает с временным интервалом измерения. Например, в одном варианте осуществления смежные временные интервалы измерения перекрываются на 50%, а интервал времени сообщения составляет половину временного интервала измерения. В некоторых аспектах временные интервалы измерения имеют переменную длину. В предпочтительном варианте осуществления, если смежные во времени временные интервалы измерения различаются по длине, то временной период перекрытия выбирают как 50% от меньшего из двух временных интервалов измерения. В некоторых аспектах СКФ пациента определяют с использованием системы, раскрытой в любых других частях данного документа.
[0062] В еще одном аспекте временной интервал измерения автоматически корректируют в соответствии с метрикой, связанной с качеством сигнала (в дальнейшем именуемой меткой качества). Метрика качества может быть основана на оценках отношения сигнал/шум (SNR), отношения сигнал/фон (SBR), метрик адекватности (good–of–fit), коэффициента корреляции или любой их комбинации для флуоресценции. В одном аспекте линия аппроксимируется под логарифм интенсивности флуоресценции в зависимости от времени в течение временного интервала измерения (или, что эквивалентно, одна экспонента аппроксимируется под интенсивность флуоресценции в зависимости от времени). Разность между аппроксимирующей линией и данными ("Остаток аппроксимации") используется для оценки "Шума". В одном аспекте, шум является среднеквадратичным значением (RMS) остатка аппроксимации. В другом аспекте шум является абсолютным отклонением медианы (MAD) остатка аппроксимации. "Сигнал" может быть определен как амплитуда единственной экспоненты, полученной исходя из аппроксимации. В другом аспекте сигнал выбирают как разность между аппроксимированной флуоресценцией в начале и конце временного интервала измерения. В другом аспекте уровень сигнала флуоресценции перед инъекцией используется для определения "фона", а SBR вычисляется путем деления фона на уровень сигнала. При использовании либо SNR, либо SBR в качестве метрики качества может быть определен минимальный порог, и только если метрика качества превышает этот порог, аппроксимация будет считаться достоверной для целей определения СКФ. В другом аспекте оценочная ошибка постоянной времени или скорости, определяемая посредством аппроксимации флуоресценции в зависимости от времени, используется в качестве метрики качества. В этом случае аппроксимация может считаться действительной, только если вычисленная метрика качества ниже предварительно определенного порогового значения. В некоторых других аспектах, аппроксимированная постоянная скорости или времени определяется как сигнал и оценочная ошибка от такой аппроксимации определяется как шум, и эта версия SNR используется в качестве метрики качества. В другом аспекте в качестве метрики качества используется коэффициент корреляции. Для вычисления коэффициента корреляции может использоваться любой из различных способов, известных в данной области, например, коэффициент корреляции Пирсона или коэффициент корреляции согласованности. В еще одном аспекте комбинация различных метрик качества объединяется в единую метрику, или аппроксимированный результат считается действительным только для цели определения СКФ, если все выбранные метрики качества пройдены.
[0063] В другом аспекте определен минимальный временной интервал измерения, а метрика качества используется для определения, следует ли сообщать СКФ, или для увеличения длины временного интервала измерения. В одном таком варианте осуществления длина временного интервала измерения автоматически увеличивается до тех пор, пока метрика качества не достигнет порога, после чего СКФ сообщается. В другом аспекте предварительные аппроксимации используются для постоянной скорости или времени, или для прогнозируемой СКФ и используются для установки временного интервала измерения равным предварительно определенной длине. В одном варианте осуществления минимальное время измерения устанавливается на 60 минут, после чего выполняется аппроксимация и делается предварительная оценка СКФ. Если предварительная оценка СКФ превышает или равна 75 мл/мин/1,73 м2, то результат сообщается пользователю, а временной интервал измерения сохраняется равным 60 минутам. Однако, если предварительная оценка СКФ ниже 75 мл/мин/1,73 м2, то результат не сообщается пользователю, а временной интервал измерения увеличивается до 120 минут.
[0064] В другом аспекте оставшийся период сообщения по однократной инъекции периодически оценивается и предоставляется пользователю. Основой для оценки оставшегося периода сообщения по однократной инъекции может быть SNR, SBR или оценочная ошибка аппроксимации, например, способы, описанные выше для определения метрики качества, но метрика качества, используемая для определения временного интервала измерения и метрика качества, используемая для определения оставшегося периода сообщения по однократной инъекции, могут быть одинаковыми или разными. В некоторых аспектах, в дополнение к метрике качества, постоянная скорости или времени затухания флуоресценции используется для оценки оставшегося периода сообщения по однократной инъекции. В одном варианте осуществления, аппроксимированная постоянная времени затухания флуоресценции и SNR объединяются для прогнозирования оставшегося периода сообщения по однократной инъекции. SNR масштабируется в диапазон между минимальным и максимальным значениями от 0 до 1 и умножается на постоянную времени затухания флуоресценции. Произведение затем масштабируется для прогнозирования периода сообщения по однократной инъекции. Масштабный коэффициент представляет собой калибровочный коэффициент, который определяется путем анализа данных, собранных ранее на людях, животных, исследованиях in vitro, моделированиях или любой их комбинации.
[0065] В еще одном аспекте фильтрация и/или отклонение выброса применяются к данным флуоресценции до аппроксимации во временном интервале измерения. Примеры надлежащих фильтров включают в себя: среднее по узкополосному фильтру, фильтр с функцией с бесконечной характеристикой, медианный фильтр, фильтр усеченного среднего. Примеры способов отклонения выбросов включают все вышеприведенные метрики качества, описанные выше, но применяемые к подмножеству временного интервала измерения.
[0066] В некоторых аспектах метрика качества вычисляется из измеренной энергии эмиссии индикаторного агента как функция времени в течение временного интервала измерения. Метрика качества может использоваться для определения того, следует ли сообщать вычисленную СКФ. В других аспектах, метрика качества используется для принятия решения о том, следует ли расширить временной интервал измерения. Например, временной интервал измерения может быть автоматически расширен до тех пор, пока метрика качества не пройдет предварительно определенный порог, после чего СКФ сообщается.
[0067] СКФ, нормированная по размеру тела пациента, определяется путем аппроксимации измеренной энергии эмиссии индикаторного агента как функции времени в течение временного интервала измерения к параметру затухания. В некоторых аспектах этот параметр затухания является постоянной скорости (или обратной ей величиной, именуемой постоянной времени) от одной экспоненциальной аппроксимации. В некоторых аспектах смещение аппроксимирующей функции фиксируется на нуле; в других аспектах смещение является переменным членом при аппроксимации; в других аспектах то, является ли смещение фиксированным или ему позволяют изменяться, зависит от предварительной оценки параметра затухания. Временной интервал измерения выбирается так, чтобы он начинался после того, как индикаторный агент уравновесится в теле, в течение периода, когда затухание интенсивности эмиссии происходит из–за почечного клиренса индикаторного агента. Аппроксимированная постоянная скорости умножается на калибровочный наклон, чтобы определить СКФ, нормированную по размеру тела пациента. Калибровочный наклон определяют путем анализа данных, собранных ранее на людях, животных, исследованиях in vitro, моделированиях или любой их комбинации.
[0068] Поскольку физический размер пациента может влиять на оценку функционирования почек, в некоторых аспектах метрика размера тела используется для нормализации вычисления СКФ для дальнейшего улучшения измерения. В некоторых аспектах метрика размера тела, используемая для нормирования СКФ, является площадью поверхности тела (BSA). В других аспектах метрикой размера тела является объем распределения (Vd) индикаторного агента.
[0069] Способы и системы, раскрытые в настоящем документе, также позволяют осуществлять контроль СКФ у пациента в режиме реального времени. Кроме того, многочисленные замеры или определения СКФ могут быть сделаны с помощью однократного введения индикаторного агента. В некоторых аспектах один замер СКФ определяется после введения индикаторного агента. В других аспектах многочисленные замеры СКФ определяются после введения индикаторного агента, обеспечивая тенденцию СКФ в режиме реального времени. В некоторых таких аспектах предусмотрена оценка оставшегося времени, в течение которого оставшейся концентрации индикаторного агента будет достаточно для продолжения определения СКФ.
[0070] В еще одном другом аспекте в данном документе раскрыт способ измерения почечной скорости клубочковой фильтрации (СКФ) у пациента, нуждающегося в этом. Способ содержит введение пациенту соединения пиразина или его фармацевтически приемлемой соли, измерение трансдермальной флуоресценции у упомянутого пациента в течение временного интервала измерения и определение СКФ у упомянутого пациента. В некоторых аспектах СКФ пациента определяют с использованием системы, раскрытой в любых других частях данного документа.
[0071] В еще одном другом аспекте в данном документе раскрыт способ определения СКФ у пациента, нуждающегося в этом. Способ содержит введение упомянутому пациенту соединения Формулы I или его фармацевтически приемлемой соли, или его фармацевтически приемлемого состава, измерение концентрации соединения Формулы I у упомянутого пациента в течение временного интервала измерения и определение СКФ у упомянутого пациента.
[0072] В некоторых аспектах и все еще со ссылкой на вышеупомянутый способ, измерение концентрации пиразина включает контроль трансдермальной флуоресценции у пациента. В еще одном аспекте измерение концентрации пиразина включает взятие аликвот крови у пациента и измерение концентрации пиразина с помощью ВЭЖХ или других способов, известных в данной области. Например, пиразин может включать радиоизотоп, который может быть определен количественно. В еще одном аспекте измерение концентрации пиразина может включать сбор мочи пациента в течение периода времени для определения скорости, с которой почки выводят это соединение из организма пациента.
[0073] В еще одном аспекте и все еще со ссылкой на вышеупомянутый способ, концентрация пиразина у пациента контролируется посредством трансдермальной флуоресценции. Это может включать обеспечение контакта медицинского устройства с кожей пациента, при этом упомянутое медицинское устройство выполнено с возможностью вызывать флуоресцентную реакцию в соединении Формулы 1 и обнаруживать упомянутую реакцию. Медицинское устройство может контактировать с кожей пациента в любом подходящем месте. Конкретные места, которые известны как подходящие, включают грудину, нижнюю часть грудины, большую грудную мышцу, затылочный треугольник, лоб, подбородок, верхнюю часть бедра и нижнюю часть бедра. Другие места на пациенте могут использоваться в зависимости от удобства, конструкции медицинского устройства и/или медицинской необходимости. В некоторых аспектах данный способ использует систему, раскрытую в данном документе.
[0074] В одном аспекте вышеупомянутого способа, дисплей используется, чтобы побудить пользователя прикрепить датчик на одном или более конкретных участках тела. В одном таком варианте осуществления используется интерфейс с сенсорным экраном и пользователь получает указание прикоснуться к изображению места на участке тела, в котором датчик был прикреплен, чтобы перейти к следующему этапу в процессе настройки измерения. Это обеспечивает преимущество, заключающееся в препятствовании размещению датчика на участках тела, которые не являются подходящими или оптимальными для определения СКФ.
[0075] В другом аспекте следующим этапом является установление выходных уровней источника света и уровней коэффициента усиления детектора. В одном таком аспекте как уровни коэффициента усиления детектора, так и уровни источника света первоначально устанавливаются в состояние низкого уровня, а затем уровни источника света последовательно увеличиваются до тех пор, пока целевой уровень сигнала не будет достигнут. В одном варианте осуществления источник света является источником возбуждения флуоресцентного агента СКФ, а ток возбуждения источника увеличивают до тех пор, пока не будет либо достигнут целевой флуоресцентный сигнал, либо достигнут предопределенный максимальный ток. В случае, когда максимальный ток источника достигается без получения желаемого уровня сигнала флуоресценции, тогда коэффициент усиления детектора последовательно увеличивают до тех пор, пока не будет достигнут либо целевой сигнал флуоресценции, либо не будет достигнута максимальная установка коэффициента усиления детектора.
[0076] В некоторых аспектах замер диффузного отражения кожи выполняют в дополнение к замеру флуоресценции кожи и агента СКФ. В таких аспектах сигнал диффузного отражения может использоваться для определения оптимального выходного сигнала источника и уровней коэффициентов усиления детектора. В других аспектах замеры диффузного отражения проводят в пределах диапазонов длин волн для возбуждения и излучения флуоресцентного агента СКФ. В таких аспектах установка уровней LED–источника и коэффициентов усиления детектора может быть выполнена с помощью диффузного отражения вместо уровней сигнала флуоресценции для управления настройками. В одном таком аспекте целевые уровни или сигналы диффузного отражения находятся в диапазоне между 15% и 35% уровня сигнала, при котором наблюдаются эффекты насыщения детектора или усилителя. Это обеспечивает пространство для колебаний сигнала, которые могут быть связаны с движением пациента или другими физиологическими изменениями. Описанные процедуры для оптимизации выходного сигнала источника света и/или коэффициентов усиления обнаружения обладают преимуществом в том, что они обеспечивают средство компенсации физиологических изменений у разных пациентов или в разных участках тела у одного и того же пациента. В одном аспекте основным фактором, который компенсируется, является содержание меланина в коже. Другие физиологические факторы, для которых может требоваться компенсация, включают содержание крови, водосодержание, а также рассеяние в объеме ткани, с которого датчик снимает показания оптически. В другом аспекте, если желаемые целевые значения сигнала не достигнуты, пользователю не разрешают продолжить измерение. Таким образом предотвращается сообщение неточных результатов.
[0077] В другом аспекте сигнал базовой линии (линии начала отсчета) регистрируется как только желаемые уровни сигнала были успешно достигнуты. В одном таком аспекте стабильность базовой линии оценивается, например, путем аппроксимации наклона к сигналу во времени, а базовая линия не принимается в качестве достоверной до тех пор, пока наклон во времени находится ниже предварительно определенного порога. В некоторых аспектах дисплей инструктирует пользователя не продолжать введение индикаторного агента до тех пор, пока не будет достигнута стабильная базовая линия. Таким образом измерение не допускается, если датчик не был правильно расположен или прикреплен. Кроме того, можно не позволять пользователю продолжать измерение, если индикаторный агент от предыдущей инъекции еще не выведен из организма до желаемой степени.
[0078] Как только стабильная базовая линия получена, в другом аспекте вышеупомянутого способа индикаторный агент вводят в сосудистое пространство пациента. Введение индикаторного агента автоматически обнаруживается как быстрое увеличение трансдермальной флуоресценции пациента, измеряемое одним или более датчиками. Для этой цели может использоваться заранее определенный порог для скорости изменения, абсолютного изменения сигнала или относительного изменения сигнала. Автоматическое обнаружение агента может сообщаться пользователю на устройстве отображения, таком как монитор с сенсорным экраном. В другом аспекте, как только индикаторный агент обнаружен, дополнительный порог используется для определения, присутствует ли достаточное количество индикаторного агента для инициирования измерения СКФ. В одном таком аспекте измерения флуоресценции (Fmeas) и диффузного отражения(DR) объединяются, чтобы уменьшить влияние физиологического изменения на объединенный результат (именуемый в настоящем документе собственной флуоресценцией или IF), так что влияние, например, цвета кожи на измерение компенсируется. Достаточность индикаторного агента затем оценивается путем сравнения IF сзаданным порогом. В некоторых аспектах IF определяют с помощью формулы следующей формы:

где нижние индексы в членах DR относятся к замерам, полученным в диапазонах длин волн возбуждения(ex) и эмиссии (em) индикаторного агента, как с фильтрованными, так и не фильтрованными детекторами, а верхние индексы в членах DR являются калибровочными коэффициентами, которые могут быть определены путем анализа данных, собранных ранее на людях, животных, исследованиях in vitro, моделированиях или любой их комбинации. Таким образом, если для точной оценки СКФ было введено недостаточно индикаторного агента, медицинскому специалисту, проводящему измерение, может быть предоставлена возможность ввести дополнительный индикаторный агент или прекратить измерение.
[0079] В другом аспекте как только индикаторный агент был введен, контролируется уравновешивание индикаторного агента во внеклеточном пространстве. В одном аспекте временной интервал измерения не начинается до тех пор, пока не будет установлено, что уравновешивание является достаточно завершенным. Для оценки прогресса уравновешивания может использоваться аппроксимация под экспоненциальную функцию. Например, изменение интенсивности флуоресценции во времени может быть подогнано под одну экспоненциальную функцию, и только после того, как аппроксимированная постоянная времени стабилизируется, уравновешивание считается завершенным. В одном таком аспекте пользователю предоставляется текущая оценка того, когда первое определение СКФ станет доступным. В другом аспекте пользователю запрещается переходить к фазе измерения до тех пор, пока достаточное уравновешивание не будет достигнуто. В одном таком аспекте время уравновешивания сравнивают с предварительно определенным порогом и, если время уравновешивания превышает этот порог, пользователю не разрешают перейти к определению СКФ. Таким образом, если датчик расположен на участке, который плохо взаимодействует с системой кровообращения, оценка СКФ не допускается.
[0080] В некоторых аспектах интервал времени сообщения, временной интервал измерения и/или период сообщения по однократной инъекции основаны на конкретной выполняемой медицинской оценке и могут изменяться надлежащим образом. Например, для пациентов с хронической почечной недостаточностью может быть достаточно одного определения СКФ. Тем не менее, для пациентов с острой почечной недостаточностью или с риском острой почечной недостаточности оценка в режиме реального времени или тенденция СКФ обеспечивает большую потенциальную выгоду. В некоторых аспектах упомянутый интервал времени сообщения составляет примерно 15 минут. В других аспектах упомянутый интервал времени сообщения составляет примерно 30 минут, примерно один час, примерно два часа, примерно три часа, примерно пять часов, примерно восемь часов, примерно 10 часов, примерно 12 часов, примерно 18 часов, примерно 24 часа, примерно 36 часов, примерно 48 часов, примерно 72 часа, примерно 96 часов или примерно 168 часов. В некоторых аспектах упомянутый интервал времени сообщения будет находится в диапазоне от 15 минут до 168 часов. В некоторых аспектах период сообщения по однократной инъекции будет основываться на периоде полувыведения из клиренса соединения пиразина. Упомянутый период полувыведения из клиренса может быть либо предварительно определен у упомянутого пациента, оценен на основании медицинского состояния упомянутого пациента, либо определен трансдермально с использованием способов, описанных в настоящем документе. В некоторых аспектах упомянутый период сообщения по однократной инъекции представляет собой один период полувыведения из клиренса, два периода полувыведения из клиренса, три периода полувыведения из клиренса, четыре периода полувыведения из клиренса, пять периодов полувыведения из клиренса, шесть периодов полувыведения из клиренса, восемь периодов полувыведения из клиренса или десять периодов полувыведения из клиренса. Максимальный период сообщения по однократной инъекции является таким, что пиразин больше не является обнаружимым в кровотоке упомянутого пациента. Термин «необнаружимый», используемый в данном документе, означает, что концентрация пиразина больше не обнаруживается способом, используемым для определения. В некоторых случаях, когда уровень обнаружения прибора делает его чрезвычайно длительным периодом времени (например, более одной недели), «необнаружимый» означает, что уровень концентрации упал ниже 0,39% (то есть восемь периодов полувыведения из клиренса). В еще одном аспекте интервал времени сообщения находится между примерно 1 часом и 168 часами и включает все последовательные увеличения на один час между ними.
[0081] Аналогично, временной интервал измерения может изменяться в зависимости от конкретных медицинских потребностей пациента и может изменяться надлежащим образом. В некоторых аспектах он будет составлять примерно 15 минут. В других аспектах упомянутый временной интервал измерения будет составлять примерно 30 минут, примерно один час, примерно два часа, примерно три часа, примерно пять часов, примерно восемь часов, примерно 10 часов, примерно 12 часов, примерно 18 часов, примерно 24 часа, примерно 36 часов, примерно 48 часов, примерно 72 часа, примерно 96 часов или примерно 168 часов. В некоторых аспектах временной интервал измерения будет находиться в диапазоне от 15 минут до 168 часов. В течение каждого периода сообщения по однократной инъекции может быть один или множество временных интервалов измерения. В некоторых аспектах период сообщения по однократной инъекции делится на многочисленные временные интервалы измерения, где каждый временной интервал измерения является одинаковым. В еще одном аспекте период сообщения по однократной инъекции делится на многочисленные временные интервалы измерения, причем каждый из временных интервалов измерения выбирается независимо от других и может быть таким же или отличаться от других временных интервалов измерения.
[0082] Способы и системы, раскрытые в данном документе, имеют преимущество автоматической регулировки под содержание меланина в коже, так что определение СКФ является точным для широкого диапазона типов кожи и уровней пигментации. Шкала Фицпатрика – это численная схема классификации цвета кожи человека. Она широко признана в качестве полезного инструмента для дерматологических исследований пигментации кожи человека. Оценки варьируются от типа I (очень светлая кожа с минимальной пигментацией) до типа VI (глубоко пигментированная и темно–коричневая). Система и способы, раскрытые в данном документе, подходят для использования со всеми шестью категориями пигментации кожи по шкале Фицпатрика. В частности, системы и способы, раскрытые в данном документе, подходят для использования с пигментацией кожи типа I, типа II, типа III, типа IV, типа V и типа VI.
[0083] В еще одном аспекте пиразин объединяют с по меньшей мере одним фармацевтически приемлемым вспомогательным веществом. Упомянутые фармацевтически приемлемые вспомогательные вещества выбирают из группы, состоящей из растворителей, регулирующих рН агентов, буферных агентов, антиоксидантов, модифицирующих тоничность агентов, регулирующих осмолярность агентов, консервантов, антибактериальных агентов, стабилизирующих агентов, регулирующих вязкость агентов, поверхностно–активных веществ и их комбинаций.
[0084] Фармацевтически приемлемые растворители могут представлять собой водные или неводные растворы, суспензии, эмульсии или их подходящие комбинации. Не ограничивающие примеры неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Примерами водных носителей являются вода, спиртовые/водные растворы, эмульсии или суспензии, в том числе физиологический раствор и забуференные среды.
[0085] В качестве примера, но не ограничения, фармацевтически приемлемые буферы включают ацетат, бензоат, карбонат, цитрат, дигидрофосфат, глюконат, глутамат, глицинат, гидрофосфат, лактат, фосфат, тартрат, Трис–HCl или их комбинации, имеющие рН от 4 до 9, предпочтительно от 5 до 8, еще предпочтительнее от 6 до 8, наиболее предпочтительно от 7,0 до 7,5. В еще одном аспекте pH составляет от 6,7 до 7,7. Другие буферы, как известно в данной области, могут быть выбраны на основании конкретной солевой формы полученного производного пиразина или конкретного медицинского применения. Предпочтительным буфером является забуференный фосфатом физиологический раствор при физиологическом pH (приблизительно 7,2).
[0086] Примерами модифицирующего тоничность агента являются глицерин, сорбит, сахароза или, предпочтительно, хлорид натрия и/или маннит. Примеры регулирующего вязкость агента включают бентонит, силикат кальция–магния и тому подобное. Примеры разбавителя включают этанол, метанол и тому подобное. Примеры противомикробного средства включают бензалкония хлорид, бензетония хлорид, этилпарабен, метилпарабен и тому подобное. Примеры регулирующих осмолярность агентов включают аминоэтанол, хлорид кальция, холин, декстрозу, диэтаноламин, раствор Рингера с лактатом, меглюмин, хлорид калия, раствор Рингера, бикарбонат натрия, хлорид натрия, лактат натрия, TRIS или их комбинации. Эти примеры приведены только для иллюстрации и не являются исчерпывающими или ограничивающими.
[0087] Также в данном документе раскрыт способ оценки почечной функции у пациента, нуждающегося в этом, причем упомянутый способ содержит введение соединения Формулы I или его фармацевтически приемлемой соли или его фармацевтически приемлемого состава упомянутому пациенту; воздействие на упомянутого пациента электромагнитным излучением, в результате чего спектральная энергия испускается от упомянутого соединения Формулы I; обнаружение спектральной энергии, испускаемой от упомянутого соединения и оценку почечной функции пациента на основе обнаруженной спектральной энергии.
[0088] В некоторых аспектах соединение Формулы I не метаболизируется пациентом; вместо этого оно полностью удаляется почечной экскрецией без метаболизма (например, без окисления, глюкуронизации или других конъюгаций). В некоторых аспектах по меньшей мере 95% соединения Формулы I не метаболизируется пациентом до почечной экскреции. В некоторых аспектах по меньшей мере 96% соединения Формулы I не метаболизируется пациентом до почечной экскреции. В некоторых аспектах по меньшей мере 97% соединения Формулы I не метаболизируется пациентом до почечной экскреции. В некоторых аспектах по меньшей мере 98% соединения Формулы I не метаболизируется пациентом до почечной экскреции. В некоторых аспектах по меньшей мере 99% соединения Формулы I не метаболизируется пациентом до почечной экскреции. В некоторых вариантах осуществления упомянутое соединение полностью удаляется упомянутым пациентом менее чем за предварительно определенный период времени. В некоторых аспектах оценка почечной функции у пациента может также включать определение СКФ у пациента.
[0089] Пиразин можно вводить любым подходящим способом. Способ будет основан на медицинских потребностях пациента и будет выбран медицинским работником, назначающим пиразин или проводящим процедуру. Примеры способов введения включают, но не ограничиваются ими, трансдермальное, пероральное, парентеральное, подкожное, энтеральное или внутривенное введение. Предпочтительно соединение пиразина будет вводиться с использованием внутривенных или трансдермальных способов. В некоторых вариантах осуществления пиразин вводят посредством одной болюсной внутривенной инъекции. В еще одном варианте осуществления пиразин вводят путем многократных болюсных внутривенных инъекций. Оба используемых в данном документе термина «чрескожный» и «трансдермальный» относятся к введению через кожу пациента и используются взаимозаменяемо.
[0090] Используемый в данном документе термин «энтеральное введение» относится к любому способу введения, который доставляет лекарственное средство непосредственно или опосредованно пациенту, используя желудочно–кишечный тракт. Примеры энтерального введения включают, но не ограничиваются ими, пероральное, сублингвальное, буккальное и ректальное. Используемый в данном документе термин «парентеральное введение» относится к любому способу введения, который доставляет лекарственное средство непосредственно или опосредованно пациенту путем инъекции или инфузии. Примеры парентерального введения включают, но не ограничиваются ими, внутривенное, внутриартериальное, внутрикожное, трансдермальное, подкожное и внутримышечное введение.
[0091] Также в данном документе раскрыта стабильная парентеральная композиция, содержащая производное пиразина Формулы I и фармацевтически приемлемый буферный агент. Композиция обладает тоничностью, подходящей для введения пациенту посредством парентерального введения. Тоничность парентеральной композиции можно регулировать с использованием регулирующего тоничность агента, как описано в любом другом месте данного документа. Композиция имеет рН, подходящий для введения нуждающемуся в этом пациенту, и его можно регулировать, используя буфер или другой регулирующий рН агент, как описано в любом другом месте данного документа. Композиция имеет осмолярность, подходящую для введения нуждающемуся в этом пациенту, и осмолярность композиции можно регулировать с использованием регулирующего осмолярность агента, как описано в любом другом месте данного документа. Композицию упаковывают в герметичный контейнер и подвергают терминальной стерилизации, чтобы уменьшить или устранить микробиологическую нагрузку состава. Композиция устойчива к деградации и другим неблагоприятным химическим реакциям и обладает фармацевтически приемлемым сроком годности.
[0092] «Стабильный», как используется в настоящем документе, означает остающийся в форме или состоянии, которое пригодно для введения пациенту. Обнаружено, что составы в соответствии с настоящим раскрытием стабильны при комнатной температуре в течение по меньшей мере 12 месяцев и обычно стабильны при комнатной температуре в течение 12–24 месяцев.
[0093] «Стерильная» композиция в том виде, как она используется в данном документе, означает композицию, которая была доведена до состояния стерильности и которая впоследствии не подвергалась микробиологическому загрязнению, т.е. контейнер, содержащий стерильную композицию, не был нарушен. Стерильные композиции обычно готовятся фармацевтическими производителями в соответствии с действующими правилами Надлежащей производственной практики («cGMP») Управления по контролю за продуктами и лекарствами США. В некоторых аспектах композиция упакована в стерилизованный нагреванием контейнер. Контейнер может быть любым контейнером, подходящим для использования в медицинских условиях, примеры включают, но не ограничиваются ими, флакон, ампулу, пакет, бутылку и шприц.
[0094] В некоторых вариантах осуществления композиция может принимать форму стерильного, готового к применению состава для парентерального введения. Это позволяет избежать неудобств, связанных с разбавлением концентрированного парентерального состава в инфузионных разбавителях перед инфузией или инъекцией, а также снизить риск микробиологического загрязнения во время асептического обращения и любой потенциальной ошибки расчета или разбавления. Альтернативно, состав может быть твердым составом, который разбавляют перед введением пациенту.
[0095] Раскрытая в данном документе водная стерильная фармацевтическая композиция подходит для парентерального введения нуждающемуся в этом пациенту. Например, композицию можно вводить в форме болюсной инъекции или внутривенной инфузии. Подходящие пути парентерального введения включают внутривенное, подкожное, внутрикожное, внутримышечное, внутрисуставное и интратекальное. Готовый к применению состав, раскрытый в данном документе, предпочтительно вводится путем болюсной инъекции. В некоторых вариантах осуществления композиция подходит для трансдермальной доставки в эпидермис или дерму пациента. Способы и устройства для чрескожной доставки известны в данной области и используют различные способы для доставки фармацевтической композиции пациенту.
[0096] Водный стерильный фармацевтический состав формируют в комбинации с одним или более фармацевтически приемлемыми вспомогательными веществами, что раскрыто в любом другом месте данного документа. Водный стерильный фармацевтический состав формируется таким образом, что он подходит для введения пациенту, нуждающемуся в этом. Тоничность, осмолярность, вязкость и другие параметры могут регулироваться с использованием агентов и способов, описанных в любом другом месте данного документа.
[0097] В еще одном аспекте в данном документе раскрыта водная стерильная фармацевтическая композиция для парентерального введения. Композиция содержит от около 0,1 до 50 мг/мл соединения пиразина Формулы I. Она также содержит от около 0,01 до 2 М буферного агента, как описано в любом другом месте данного документа. Она также содержит от 0 до 500 мг/мл регулирующего осмотичность агента и от 0 до 500 мг/мл регулирующего тоничность агента. Водная стерильная фармацевтическая композиция может также необязательно включать один или более дополнительных фармацевтически приемлемых вспомогательных веществ. Примеры фармацевтически приемлемых вспомогательных веществ могут быть выбраны из группы, состоящей из растворителей, регулирующих рН агентов, буферных агентов, антиоксидантов, модифицирующих тоничность агентов, регулирующих осмолярность агентов, консервантов, антибактериальных агентов, стабилизирующих агентов, регулирующих вязкость агентов, поверхностно–активных веществ и их комбинаций. Конкретные примеры вспомогательных веществ раскрыты в данном документе в другом месте.
[0098] Соединение пиразина, используемое в водной стерильной фармацевтической композиции, представляет собой любое соединение, раскрытое в данном документе. Конкретные примеры включают, но не ограничиваются ими, все соединения, полученные в Примерах. Одним предпочтительным примером является (2R,2'R)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(3–гидроксипропановая кислота), которая представляет собой молекулу, проиллюстрированную в Примере 12 (также идентифицируемая как MB–102 или 3,6–диамин–N2,N5–бис–(D–серин)–пиразин–2,5–дикарбоксамид).
[0099] рН водной стерильной фармацевтической композиции подходит для введения пациенту. В некоторых аспектах pH составляет от 4 до 9, предпочтительно от 5 до 8, еще предпочтительнее от 6 до 8, наиболее предпочтительно от 7,0 до 7,5. В еще одном аспекте pH составляет от 6,7 до 7,7. Еще более предпочтительно pH составляет приблизительно 7,2 в забуференном фосфатом физиологическом растворе.
[0100] В некоторых аспектах пиразин вводят пациенту, в отношении которого есть подозрения или известно, что у него имеется по меньшей мере одна медицинская проблема с почками, и способы, раскрытые в данном документе, используются для определения уровня нарушения почечной функции или почечной недостаточности, имеющейся у упомянутого пациента. В некоторых аспектах упомянутый пациент имеет оценочную СКФ (оСКФ) или ранее определенную СКФ менее 110, менее 90, менее 60, менее 30 или менее 15. СКФ пациента определяется с использованием стандартных медицинских способов, которые известны в данной области. В некоторых аспектах пациент не будет иметь или в отношении него будут отсутствовать подозрения наличия медицинских проблем с почками. Контроль СКФ может проводиться как часть общей или обычной оценки состояния здоровья пациента или в качестве меры предосторожности.
[0101] Как известно в данной области, скорость, с которой пациент удаляет отходы из своего кровотока (то есть период полувыведения из клиренса), зависит от здоровья и правильного функционирования его почечной системы. «Полностью удаленный», при использовании в данном контексте, означает, что уровень пиразина в крови снизился ниже 0,39% (т.е. восемь периодов полувыведения). Период полувыведения из клиренса будет зависеть от СКФ пациента и значительно замедляется по мере ухудшения функционирования почечной системы из–за болезни, возраста или других физиологических факторов. У пациента с неизвестными факторами риска, связанными с ХБП, с нормальной СКФ и/или нормальной оСКФ, период сообщения по однократной инъекции составляет 24 часа. В некоторых аспектах период сообщения по однократной инъекции для пациента с СКФ или оСКФ ниже 110 составляет 24 часа. Для пациента с СКФ или оСКФ ниже 90 период сообщения по однократной инъекции составляет 24 часа. Для пациента с СКФ или оСКФ ниже 60, период сообщения по однократной инъекции составляет 48 часов. Для пациента с СКФ или оСКФ ниже 30 период сообщения по однократной инъекции составляет 48 часов. В некоторых аспектах период сообщения по однократной инъекции для пациента с СКФ или оСКФ ниже 110 равен восьми периодам полувыведения из клиренса. Для пациента с СКФ или оСКФ ниже 90 период сообщения по однократной инъекции равен восьми периодам полувыведения из клиренса. Для пациента с СКФ или оСКФ ниже 60 период сообщения по однократной инъекции равен восьми периодам полувыведения из клиренса. Для пациента с СКФ или оСКФ ниже 30 период сообщения по однократной инъекции равен восьми периодам полувыведения из клиренса.
[0102] Поскольку повышение концентрации белка в моче пациента может свидетельствовать о каком–либо типе нарушения почечной функции или почечной недостаточности, способы, раскрытые в данном документе, подходят для пациентов, у которых при анализе мочи наблюдается повышение уровней белка. В некоторых аспектах у пациента повышен уровень белка в моче, что определяется стандартными медицинскими тестами (например, тест–полоской). В качестве примера, а не ограничения, анализ мочи пациента может показывать повышение альбумина, повышение креатинина, повышение азота мочевины в крови (то есть BUN–тест) или любую их комбинацию.
[0103] Все еще со ссылкой на вышеупомянутый способ, производное пиразина подвергают воздействию электромагнитного излучения, например, но не ограничиваясь упомянутым, видимого, ультрафиолетового и/или инфракрасного света. Это воздействие на пиразин со стороны электромагнитного излучения может происходить в любое подходящее время, но предпочтительно происходит, когда производное пиразина находится внутри тела пациента. Из–за этого воздействия на пиразин электромагнитным излучением пиразин испускает спектральную энергию (например, видимый, ультрафиолетовый и/или инфракрасный свет), которая может быть обнаружена соответствующим оборудованием обнаружения. Спектральная энергия, испускаемая производным пиразина, имеет тенденцию демонстрировать диапазон длин волн, превышающий диапазон длин волн поглощения. В качестве примера, но не ограничения, если вариант осуществления производного пиразина поглощает свет около 440 нм, производное пиразина может излучать свет около 560 нм.
[0104] Обнаружение пиразина (или, более конкретно, испускаемой им спектральной энергии) может быть достигнуто с помощью методов оптической флуоресценции, поглощения или рассеяния света. В некоторых аспектах спектральной энергией является флуоресценция. В некоторых вариантах осуществления обнаружение испущенной спектральной энергии может быть охарактеризовано как получение испускаемой спектральной энергии и формирование электрического сигнала, указывающего полученную спектральную энергию. Механизм(ы), используемый для обнаружения спектральной энергии от производного пиразина, присутствующего в теле пациента, может быть предназначен для обнаружения только выбранных длин волн (или диапазонов длин волн) и/или может включать в себя один или более подходящих спектральных фильтров. Различные катетеры, эндоскопы, ушные клипсы, браслеты, головные повязки, поверхностные катушки, пальцевые зонды и другие медицинские устройства могут быть использованы для воздействия на производное пиразина электромагнитным излучением и/или для обнаружения испускаемой им спектральной энергии. Устройство, которое подвергает пиразин электромагнитному излучению и обнаруживает испускаемую им спектральную энергию, может быть одним устройством или разными устройствами. То есть можно использовать одно или два устройства. Обнаружение спектральной энергии может быть выполнено один или более раз с перерывами или может быть по существу непрерывным.
[0105] Почечная функция или СКФ пациента определяется на основе обнаруженной спектральной энергии. Это достигается путем использования данных, указывающих обнаруженную спектральную энергию, и формирования профиля интенсивности/времени, указывающего клиренс производного пиразина из организма пациента. Этот профиль может быть связан с физиологическим или патологическим состоянием. Например, профили клиренса и/или скорости клиренса пациента могут сравниваться с известными профилями клиренса и/или скоростями клиренса для оценки почечной функции пациента и для диагностики физиологического состояния пациента. В случае анализа присутствия производного пиразина в жидкостях организма могут быть построены и проанализированы кривые концентрации/времени (предпочтительно в режиме реального времени) для оценки почечной функции. Альтернативно, профиль клиренса пациента можно сравнить с одним или более ранее измеренными профилями клиренса того же самого пациента, чтобы определить, изменилась ли функция почек упомянутого пациента с течением времени. В некоторых аспектах оценка почечной функции выполняется с использованием системы, раскрытой в любом другом месте данного документа.
[0106] Физиологическую функцию можно оценить путем: (1) сравнения различий в характерах вывода производного пиразина из кровотока нормальными и поврежденными клетками или органами; (2) измерения скорости выведения или накопления пиразина в органах или тканях пациента; и/или (3) получения томографических изображений органов или тканей, имеющих связанный с ними пиразин. Например, клиренс кровяного депо может быть измерен неинвазивно по поверхностным капиллярам, таким как в мочке уха или пальце, или он может быть измерен инвазивно с использованием соответствующего инструмента, такого как эндоваскулярный катетер. Трансдермальная флуоресценция также может контролироваться неинвазивно на теле упомянутого пациента. Многие участки эпидермиса пациента могут быть пригодны для неинвазивного контроля трансдермальной флуоресценции. Участком на пациенте предпочтительно является такой участок, где равновесие между сосудами и тканями происходит относительно быстро. Примеры подходящих участков на пациенте включают, но не ограничиваются ими, грудину, нижнюю часть грудины, большую грудную мышцу, затылочный треугольник, лоб, подбородок, верхнюю часть бедра и нижнюю часть бедра. Накопление производного пиразина в представляющих интерес клетках может быть оценено аналогичным образом.
[0107] Модифицированный катетер для легочной артерии также может быть использован, среди прочего, для проведения требуемых измерений спектральной энергии, испускаемой от производного пиразина. Возможность легочного катетера обнаруживать спектральную энергию, испускаемую от упомянутого пиразина, является явным улучшением по сравнению с существующими катетерами для легочной артерии, которые измеряют только внутрисосудистое давление, сердечный выброс и другие производные показатели кровотока. Традиционно тяжелобольных пациентов лечили, используя только вышеперечисленные параметры, и их лечение, как правило, зависело от периодического забора и исследования крови на предмет оценки почечной функции. Эти традиционные параметры обеспечивают прерывистые данные и часто вводят в заблуждение во многих группах пациентов.
[0108] Модификация стандартного катетера для легочной артерии требует лишь изготовления его волоконно–оптического датчика под определенную длину волны. В настоящее время существуют катетеры, в которых волоконно–оптическая технология используется для измерения насыщения смешанной венозной крови кислородом. В одной характеристике модифицированный катетер для легочной артерии включает оптический датчик определенной длины волны в наконечник стандартного катетера для легочной артерии. Этот оптический датчик определенной длины волны используется для контроля специфического для почечной функции удаления специально разработанного оптически обнаружимого химического объекта, такого как производные пиразина, раскрытые в данном документе. Таким образом, почечная функция в реальном времени может контролироваться посредством исчезновения/клиренса оптически детектируемого соединения.
[0109] В некоторых аспектах соединение пиразина вводят пациенту, у которого ранее была диагностирована ХБП по меньшей мере 1–й стадии. В других аспектах у упомянутого пациента ранее была диагностирована ХБП 2–й стадии, ХБП 3–й стадии, ХБП 4–й стадии или ХБП 5–й стадии. В еще одном аспекте у пациента еще не была диагностирована ХБП, но он имеет один или более факторов риска, связанных с ХБП. В еще одном аспекте пациент не имеет известных факторов риска ХБП.
[0110] Введение соединения пиразина осуществляется любым подходящим способом, основанным на проводимом медицинском исследовании и медицинских потребностях пациента. Подходящие способы раскрыты в любом другом месте данного документа. Предпочтительно пиразин вводят путем трансдермального или внутривенного введения.
[0111] Также в данном документе раскрыта система для определения СКФ или оценки почечной функции у пациента, нуждающегося в этом. Система содержит вычислительное устройство, устройство отображения, соединенное с возможностью связи с упомянутым вычислительным устройством, источник питания, который функционально связан с упомянутым вычислительным устройством и поддерживает электрическую изоляцию системы от внешних источников питания, одну или более головок датчика, функционально связанных с упомянутым вычислительным устройством, и по меньшей мере один индикаторный агент, выполненный с возможностью испускания света под воздействием электромагнитного излучения. Вычислительное устройство выполнено с возможностью работать и управлять упомянутыми головками датчика, регистрировать один или более замеров света, отправленных с упомянутых головок датчика, и вычислять СКФ упомянутого пациента на основании упомянутых замеров света.
[0112] В некоторых аспектах одна или более головок датчика содержат по меньшей мере один источник электромагнитного излучения, генерируют и доставляют электромагнитное излучение к коже упомянутого пациента, обнаруживают и замеряют электромагнитное излучение, испускаемое упомянутым индикаторным агентом, и передают упомянутый замер электромагнитного излучения, испускаемого упомянутым индикаторным агентом в упомянутое вычислительное устройство. В системе с более чем одной головкой датчика каждая головка датчика может быть одинаковой или разной, и излучаемое ею электромагнитное излучение может быть одинаковым или разным. В некоторых аспектах головки датчика выполнены с возможностью прикрепления к коже упомянутого пациента. В качестве примера, а не ограничения, в системе с двумя головками датчика одна головка датчика может излучать и контролировать одну длину волны электромагнитного излучения, тогда как вторая головка датчика может излучать и контролировать другую длину волны. Это позволило бы сравнивать данные для повышения точности определения СКФ и информации, доступной для медицинского работника, проводящего оценку. В еще одном не ограничивающем примере в системе с двумя головками датчика две головки датчика используются для отделения кинетики локального уравновешивания от кинетики терминальной фазы. Это позволяет медицинскому работнику определить, когда уравновешивание завершено, и уменьшает артефакты из–за локального перемещения датчиков.
[0113] В некоторых аспектах индикаторный агент выполнен с возможностью введения упомянутому пациенту посредством внутривенного или трансдермального введения, удаления только посредством клубочковой фильтрации в почках упомянутого пациента и испускания света, который может быть обнаружен упомянутыми головками датчика, под воздействием электромагнитного излучения. В некоторых аспектах индикаторный агент представляет собой соединение пиразина Формулы I, что раскрыто в любом другом месте данного документа. Предпочтительно, индикаторный агент представляет собой соединение, полученное в одном из Примеров. Наиболее предпочтительно, индикаторным агентом является (2R,2'R)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(3–гидроксипропановая кислота) (также именуемая MB–102 или 3,6–диамин–N2,N5–бис–(D–серин)–пиразин–2,5–дикарбоксамид). В некоторых аспектах индикаторный агент представляет собой производное пиразина в составе, подходящем для введения пациенту, нуждающемуся в этом. Такие составы описаны в любом другом месте данного документа.
[0114] Система для определения СКФ или оценки почечной функции у пациента может быть выполнена с возможностью осуществления способов, раскрытых в данном документе, для пациента, нуждающегося в этом. Вычислительное устройство в системе может быть любым стандартным компьютером, обладающим всеми связанными с ним возможностями, в частности, включая, помимо прочего, постоянную память, процессор, способный выполнять сложные математические вычисления, клавиатуру и/или мышь для взаимодействия с компьютер и дисплей, соединенный с возможностью связи с вычислительным устройством. Постоянная память вычислительного устройства как таковая может хранить любую информацию, программы и данные, необходимые для выполнения функций упомянутой системы для определения СКФ или оценки почечной функции у пациента. Такая информация, программы и данные могут быть стандартами и/или средствами управления, которые могут использоваться для сравнения значений трансдермальной флуоресценции, полученных одной или более головками датчика, с известными значениями. В некоторых аспектах вычислительное устройство может сохранять результаты предыдущей оценки или определения СКФ у пациента, чтобы их можно было сравнить с результатами, полученными позднее. Это позволяет медицинскому специалисту контролировать состояние почек пациента с течением времени. В некоторых аспектах вычислительное устройство представляет собой портативный компьютер. В некоторых аспектах устройство отображения включает в себя сенсорный экран.
[0115] Кроме того, вычислительное устройство выполнено с возможностью вычисления постоянной времени для почечного затухания в течение предварительно определенного периода времени. В одном аспекте данные трансдермальной флуоресценции у пациента собирают в течение заранее определенного периода времени и строят график зависимости времени (ось X) от флуоресценции (ось Y). Скорость затухания может быть изогнутой или линейной и для скорости затухания вычисляют постоянную времени. В одном аспекте скорость затухания является линейной для полулогарифмического(y) графика. Постоянная времени сравнивается с известными значениями, тем самым определяя СКФ у пациента. В некоторых аспектах скорость затухания соответствует стандартной кинетике первого порядка. В еще одном аспекте скорость затухания может демонстрировать многокамерную фармакокинетическую модель. Фигуры с 3А по 3D иллюстрируют двухкамерную фармакокинетику, с помощью которой стандартное фармакокинетическое программное обеспечение способно определять постоянную времени для почечного затухания.
[0116] Определение СКФ выполняется с использованием линейной регрессии, исключения выбросов, вычисления коэффициента корреляции (R2) и стандартной ошибки калибровки и более полно описано в Примерах.
[0117] В этом письменном описании используются примеры, раскрывающие изобретение, в том числе лучший вариант осуществления, а также позволяющие любому специалисту в данной области применять осуществить данное изобретение на практике, в том числе создать и использовать любые устройства или системы и выполнить любые включенные способы. Любой аспект или вариант осуществления, раскрытый в данном документе, может использоваться в сочетании с любым другим аспектом или вариантом осуществления, что будет понятно специалисту в данной области. Предполагается, что другие примеры находятся в рамках формулы изобретения, если они имеют структурные элементы, которые не отличаются от буквальной формулировки формулы изобретения, или если они включают эквивалентные структурные элементы с несущественными отличиями от буквальных формулировок формулы изобретения.
[0118] Пример 1
[0119] Получение 3,6–диамино–N2,N2,N5,N5–тетракис(2–метоксиэтил)пиразин–2,5–дикарбоксамида

[0120] Смесь из 3,6–диаминопиразин–2,5–дикарбоновой кислоты (200 мг, 1,01 ммоль), бис–2–(метоксиэтил)амина (372 μл, 335,5 мг, 2,52 ммоль), HOBt·H2O (459 мг, 3,00 ммоль) и EDC·HCl (575 мг, 3,00 ммоль) перемешивали вместе в DMF (20 мл) в течение 1 часа при комнатной температуре. Смесь концентрировали досуха, а остаток разделяли с помощью EtOAc и воды. Слои отделяли и раствор EtOAc промывали насыщенным NaHCO3 и раствором соли. Раствор сушили над безводным Na2SO4, фильтровали и концентрировали. Очистка с помощью радиальной флэш–хроматографии (SiO2, 10/1 CHCl3–MeOH) давала 228,7 мг (выход 53%) Примера 1 в форме оранжевой пены:1H ЯМР (300 МГц, CDCl3), δ 4,92 (с, 4 H), 3,76 (кажущийся т, J=5,4 Гц, 4 H), 3,70 (кажущийся т, J=5,6 Гц, 4 H), 3,64 (кажущийся т, J=5,4 Гц, 4 H), 3,565 (кажущийся т, J=5,4 Гц), 3,67 (с, 6 H), 3,28 (с, 6 H).13C ЯМР (75 МГц, CDCl3) δ 167,6 (с), 145,6 (с), 131,0 (с), 72,0 (т), 70,8 (т), 59,2 (кв), 49,7 (т), 47,1 (т). ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=3,14 мин на 30 мм колонке, (M+H)+ = 429. УФ/вид (100 μM в PBS) λabs=394 нм. Флуоресценция (100 нм) λex=394 нм, λem=550 нм.
[0121] Пример 2
[0122] 3,6–диамино–N2,N5–бис(2,3–дигидроксипропил)пиразин–2,5–дикарбоксамид


[0123] Стадия 1. Синтез 3,6–диамино–N2,N5–бис((2,2–диметил–1,3–диоксолан–4–ил)метил)пиразин–2,5–дикарбоксамида.
[0124] Смесь 3,6–диаминопиразин–2,5–дикарбоновой кислоты (350 мг, 1,77 ммоль), рацемат(2,2–диметил–1,3–диоксолан–4–ил)метанамина (933 μл, 944 мг, 7,20 ммоль), HOBt·H2O (812 мг, 5,3 ммоль) и EDC·HCl (1,02 г, 5,32 ммоль) перемешивали вместе в DMF (20 мл) в течение 16 часов при комнатной температуре. Смесь концентрировали досуха и остаток разделяли с помощью EtOAc и воды. Слои отделяли и раствор EtOAc промывали насыщенным NaHCO3 и раствором соли. Раствор сушили над безводным Na2SO4, фильтровали и концентрировали с получением 665 мг (выход 88%) бис–амидной диастереомерной пары в форме желтого твердого вещества:1ЯМР (300 МГц, CDCl3) δ 8,38 (т, J=5,8 Гц, 2 H), 6,55 (с, 4 H), 4,21 (квинтет, J=5,8 Гц, 2 H), 3,98 (дд, J=8,4 Гц, 6,3 Гц, 2 H), 3,65 (дд, J=8,4 Гц, J=5,8 Гц, 2 H), 3,39 (различимый квартет – диастереотопная смесь, J=5,9 Гц, 4 H), 1,35 (с, 6 H), 1,26 (с, 6 H).13C ЯМР (75 МГц, CDCl3) δ 165,7 (с), 146,8 (с), 126,8 (с), 109,2 (с), 74,8 (д), 67,2 (т), 42,2, 41,1 (т – диастереотопная пара), 27,6 (кв), 26,1 (кв).
[0125] Стадия 2. Полученный на Стадии 1 продукт растворяли в THF (100 мл) и обрабатывали 1,0 N HCl (2 мл). После завершения гидролиза смесь обрабатывали K2CO3 (1 г) и перемешивали в течение 1 часа и фильтровали через пробку C18 с использованием метанола. Фильтрат концентрировали досуха и остаток растирали с МеОН (50 мл). Твердые вещества отфильтровывали и выбрасывали, а остаток обрабатывали эфиром (50 мл). Осадок собирали фильтрацией и сушили при высоком вакууме. Этот материал очищали с помощью радиальной флэш–хроматографии с получением 221 мг (выход 36%) Примера 2 в форме оранжевого твердого вещества:1ЯМР (300 МГц, DMSO–d6) δ 8,00 (уш. м, 6 H), 5,39 (уш. с, 2 H), 4,88 (уш. с, 2 H), 3,63–3,71 (сложный м, 2 H), 3,40 (дд, J=11,1, 5,10 Гц, 2 H), 3,28 (дд, J=11,1, 6,60 Гц, 2 H), 2,92 (дд, J=12,6, 3,3 Гц, 2 H), 2,65 (дд, J=12,6, 8,4 Гц, 2 H). ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,13 мин на 30 мм колонке, (M+H)+ = 345. УФ/вид (100 μM в H2O) λabs=432 нм. Флуоресценция λex=432 нм, λem=558 нм.
[0126] Пример 3
[0127] (2S,2'S)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис (азанедиил))бис(3–гидроксипропановая кислота)


[0128] Стадия 1. Синтез диметил-2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))(2S,2'S)–бис(3–(бензилокси)пропаноата).
[0129] Смесь натрия 3,6–диаминопиразин–2,5–дикарбоксилата (300 мг, 1,24 ммоль), соли L–Ser(OBn)–OMe·HCl (647 мг, 2,64 ммоль), HOBt·H2O (570 мг, 3,72 ммоль) и EDC·HCl (690 мг, 3,60 ммоль) в DMF (25 мл) обрабатывали TEA (2 мл). Полученную смесь перемешивали в течение 16 часов и концентрировали. Обработка, как в Примере 1, давала 370 мг (выход 51%) бисамида в форме ярко–желтого порошка:1ЯМР (300 МГц, CDCl3): δ 8,47 (д, J=8,74 Гц, 2 H), 7,25–7,37 (сложный м, 10 H), 5,98 (уш. с, 4 H), 4,85 (дт, J=8,7, 3,3 Гц, 2 H), 4,56 (ABкв, J=12,6, Гц, Δν = 11,9 Гц, 4 H), 3,99 (одна половина ABкв из д, J=8,7, 3,3, Δν скрыта, 2 H), 3,76–3,80 (одна половина ABкв – скрыта, 2 H), 3,78 (с, 6 H).13C ЯМР (75 МГц, CDCl3) δ 170,5 (с), 165,1 (с), 146,8 (с), 138,7 (с) 128,6 (д), 128,1 (д), 127,8 (д), 126,9 (с), 73,5 (т), 69,8 (т), 53,0 (кв), 52,9 (кв). ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,93 мин на 30 мм колонке, (M+H)+ = 581.
[0130] Стадия 2. Синтез (2S,2'S)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(3–(бензилокси)пропановой кислоты.

[0131] Полученный на стадии 1 продукт (370 мг, 0,64 ммоль) в THF (10 мл) обрабатывали 1,0 N гидроксидом натрия (2,5 мл). После перемешивания при комнатной температуре в течение 30 минут реакцию определяли как завершенную с помощью TLC. pН регулировали до приблизительно 2 добавлением 1,0 N HCl, а полученный раствор экстрагировали (3х) с помощью EtOAc. Слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали, получая 353 мг (выход 100%) дикислоты в форме оранжевой пены: ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания=4,41 мин на 30 мм колонке, (M+H)+ = 553.
[0132] Стадия 3. К продукту, полученному на стадии 2 (353 мг, 0,64 ммоль), в метаноле (20 мл) добавляли 5% Pd/C (300 мг) и формиат аммония (600 мг). Полученную реакционную смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали через пробку из целита и концентрировали. Остаток перекристаллизовывали из смеси метанол–эфир с получением 191 мг (выход 80%) Примера 3 в форме желтой пены:1ЯМР (300 МГц, DMSO–d6) δ 8,48 (д, J=6,9 Гц, 2 Н), 6,72 (уш. с, 4 H), 3,95 (различимый квартет, J=5,1 Гц, 2 H), 3,60 (различимый ABкв дублетов; нижняя группа полей с центром в 3,71, J=9,9, 5,1 Гц, 2H; верхняя группа полей с центром в 3,48, J=9,9, 6,3 Гц, 2 H).13С ЯМР (75 МГц, CDCl3) δ 172,9 (с), 164,9 (с), 147,0 (с), 127,0 (с), 62,9 (д), 55,7 (т). ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=1,45 мин на 30 мм колонке, (M+H)+ = 373. УФ/вид (100 μM в PBS) λabs=434 нм. Флуоресценция λex=449 нм, λem=559 нм.
[0133] Пример 4
[0134] Соль 3,6–бис(бис(2–метоксиэтил)амино)–N2,N2,N5,N5–

тетракис(2–метоксиэтил)пиразин–2,5–дикарбоксамид бис (TFA)
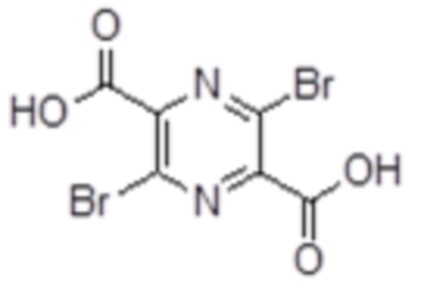
[0135] Стадия 1. Синтез 3,6–дибромпиразин–2,5–дикарбоновой кислоты.
[0136] 3,6–Диаминопиразин–2,5–дикарбоновую кислоту (499 мг, 2,52 ммоль) растворяли в 48% бромистоводородной кислоте (10 мл) и охлаждали до 0° C на бане с ледяной солью. К этой перемешиваемой смеси по каплям добавляли раствор нитрита натрия (695 мг, 10,1 ммоль) в воде (10 мл), чтобы температура оставалась ниже 5° С. Полученную смесь перемешивали в течение 3 ч при 5–15 °С, за это время красная смесь становилась желтым раствором. Желтый раствор выливали в раствор бромида меди (2,23 г, 10,1 ммоль) в воде (100 мл) и полученную смесь перемешивали при комнатной температуре. Еще через 3 часа водную смесь экстрагируют с помощью EtOAc (3х). Объединенные экстракты сушат (Na2SO4), фильтруют и концентрируют, получая 440 мг (выход 54%) 3,6–дибромпиразин–2,5–дикарбоновой кислоты в форме бледно–желтого твердого вещества:13C ЯМР (75 МГц, CDCl3) δ 164,3 (с), 148,8 (с), 134,9 (с). ВЭЖХ (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=2,95 мин на 250 мм колонке.

[0137] Стадия 2. Синтез 3–(бис(2–метоксиэтил)амино)–6–бром–N2,N2,N5,N5–тетракис(2–метоксиэтил)пиразин–2,5–дикарбоксамида.
[0138] Продукт, полученный на стадии 1 (440 мг, 1,36 ммоль), растворяли в DMF (25 мл), обрабатывали HOBt·H2O (624 мг, 4,08 ммоль) и EDC·HCl (786 мг, 4,10 ммоль) и перемешивали в течение 30 мин при комнатной температуре. Добавляли бис(2–метоксилэтил)амин (620 мл, 559 мг, 4,20 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 16 часов и концентрировали. Остаток разделяли с помощью воды и EtOAc. Слой EtOAc отделяли и воду снова экстрагировали с помощью EtOAc. Объединенные органические слои промывали 0,5 N HCl, насыщенным бикарбонатом натрия и раствором соли. Органический слой сушили (Na2SO4), фильтровали и концентрировали, получая 214 мг 3–(бис(2–метоксиэтил)амино)–6–бром–N2,N2,N5,N5–тетракис(2–метоксиэтил)пиразин–2,5–дикарбоксамида (выход 26%) в форме коричневого масла: ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=3,85 мин на 30 мм колонке, (M+H)+ = 608.
[0139] Стадия 3. К полученному на стадии 2 продукту (116 мг, 0,19 ммоль) добавляли бис(2–метоксилэтил)амин (3,0 мл, 2,71 г, 20,3 ммоль) и Pd(PPh3)4на «кончике шпателя». Полученную смесь нагревали до 140° С в течение 2 часов. Реакционную смесь охлаждали и концентрировали. Остаток очищали флэш–хроматографией (SiO2, 10/1 CHCl3–MeOH). Полученный материал снова очищали обращенно–фазовой хроматографией среднего давления (C18, 10–50% ручной градиент ацетонитрила в 0,1% TFA) с получением 12 мг (10% выход) Примера 4 в форме оранжево–коричневой пленки: ЖХ/МС (15–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=3,85 мин на 250 мм колонке, (M+H)+ = 661. УФ/вид (100 μM в PBS) λabs=434 нм. Флуоресценция λex=449 нм, λem=559 нм.
[0140] Пример 5

[0141] Соль 3,6–диамино–N2,N5–бис(2–аминоэтил)пиразин–2,5–дикарбоксамид–бис(TFA)
[0142] Стадия 1. Синтез 3,6–диамино–N2,N5–бис[2–(трет–бутоксикарбонил)аминоэтил]пиразин–2,5–дикарбоксамида.

[0143] Смесь 3,6–диаминопиразин–2,5–дикарбоксилата натрия (500 мг, 2,07 ммоль), трет–бутил–2–аминоэтилкарбамата (673 мг, 4,20 ммоль), HOBt·H2O (836 мг, 5,46) ммоль) и EDC·HCl (1,05 г, 5,48 ммоль) в DMF (25 мл) перемешивали в течение 16 часов и концентрировали. Обработка, как в примере 1, давала 770 мг (выход 76%) бисамида в форме оранжевой пены:1ЯМР (300 МГц, DMSO–d6) основной конформер, δ 8,44 (т, J=5,7 Гц, 2 Н), 6,90 (т, J=5,7 Гц, 2Н), 6,48 (уш. с, 4 Н), 2,93–3,16 (сложный м, 8 Н), 1,37 (с, 9 Н), 1,36 (с, 9 Н).13С ЯМР (75 МГц, DMSO–d6), конформационные изомеры δ 165,1 (с), 155,5 (уш. с), 155,4 (уш. с), 146,0 (с), 126,2 (с), 77,7 (уш. с), 77,5 (уш. с), 45,2 (уш. т), 44,5 (уш. т), 28,2 (кв).
[0144] Стадия 2. К полученному на стадии 1 продукту (770 мг, 1,60 ммоль) в метиленхлориде (100 мл) добавляли TFA (25 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Смесь концентрировали и остаток растворяли в метаноле (15 мл). Добавляли эфир (200 мл) и оранжевый твердый осадок выделяли фильтрованием и сушили при высоком вакууме с получением 627 мг (выход 77%) Примера 5 в форме оранжевого порошка:1ЯМР (300 МГц, DMSO–d6) δ 8,70 (т, J=6 Гц, 2 H), 7,86 (уш. с, 6 H), 6,50 (уш. с, 4 H), 3,46–3,58 (м, 4 H), 3,26–3,40 (м, 4 H).13С ЯМР (75 МГц, DMSO–d6) δ 166,4 (с), 146,8 (с), 127,0 (с), 39,4 (т), 37,4 (т). ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=3,62 мин на 30 мм колонке, (M+H)+ = 283. УФ/вид (100 μM в PBS) λabs=435 нм. Флуоресценция (100 нм) λex=449 нм, λem=562 нм.
[0145] Пример 6

[0146] 3,6–Диамино–N2,N5–бис(D–аспартат)пиразин–2,5–дикарбоксамид

[0147] Стадия 1. Синтез 3,6–диамино–N2,N5–бис(бензил-D–O–бензиласпартат)пиразин–2,5–дикарбоксамида
Смесь 3,6–диаминопиразин–2,5–дикарбоксилата натрия (600 мг, 2,48 ммоль), соли Asp(OBn)–OMe–p–TosH (2,43 г, 5,00 ммоль), HOBt·H2O (919 мг, 6,00 ммоль) и EDC·HCl (1,14 г, 5,95 ммоль) в DMF (50 мл) обрабатывали TEA (4 мл). Полученную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали и остаток разделяли с помощью воды и EtOAc. Слой EtOAc отделяли и последовательно промывали насыщенным бикарбонатом натрия, водой и раствором соли. Раствор EtOAc сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали флэш–хроматографией (SiO2, 50/1 CHCl3–MeOH до 10/1), получая 1,15 г бисамида (выход 58%) в форме желтой пены:1ЯМР (500 МГц, CDCl3) δ 8,61 (д, J=8,4 Гц, 2 Н), 7,29–7,39 (м, 20 Н), 5,85 (уш. с, 4 H), 5,22 (ABкв, J=10,0 Гц, Δν=17,3 Гц, 4 H), 5,10 (ABкв, J=12,2 Гц, Δν=34,3 Гц, 4 H), 5,06–5,09 (видимый м, 2 H), 3,11 (ABкв д, J=17,0, 5,14 Гц, Δν=77,9 Гц, 4 H).13С ЯМР (75 МГц, CDCl3) δ 170,7 (с), 170,7 (с), 165,4 (с), 147,0 (с), 135,7 (с), 135,6 (с), 129,0 (д), 128,9 (д) 128,8 (д), 128,75 (д), 128,7 (д), 126,9 (с), 68,0 (т), 67,3 (т), 49,1 (д), 37,0 (т). ЖХ/МС (50–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=5,97 мин на 250 мм колонке, (M+H)+ = 789.
[0148] Стадия 2. К полученному на стадии 1 продукту (510 мг, 0,65 ммоль) добавляли THF (20 мл) и воду (10 мл). К перемешиваемой смеси добавляли 10% Pd(C) (500 мг) и формиат аммония (1 г). Полученную смесь нагревали до 60° С в течение 2 ч и оставляли охлаждаться до комнатной температуры. Смесь фильтровали через целит и концентрировали. Полученный материал снова очищали обращенно–фазовой хроматографией среднего давления (C18, 10–70% ручной градиент ацетонитрила в 0,1% TFA) с получением 137,8 мг (выход 54%) Примера 6 в форме оранжевого твердого вещества:1ЯМР (300 МГц, DMSO–d6) δ 8,62 (д, J=8,4 Гц, 2 Н), 6,67 (уш. с, 4 Н), 4,725 (дт, J=8,4, 5,4 Гц, 2 Н), 2,74–2,88 (сложный м, 4 H).13С ЯМР (75 МГц, DMSO–d6) δ 172,6 (с), 165,2 (с), 147,0 (с), 126,6 (с), 60,8 (т), 49,1 (д). ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,01 мин на 250 мм колонке, (M+H)+ = 429. УФ/вид (100 μM в PBS) λabs=433 нм. Флуоресценция (100 нм) λex=449 нм, λem=558 нм.
[0149] Пример 7

[0150] 3,6–Диамино–N2,N5–бис(14–оксо–2,5,8,11–тетраокса–15–азагептадекан–17–ил)пиразин–2,5–дикарбоксамид
[0151] К раствору из примера 5 (77,4 мг, 0,15 ммоль) в DMF (5 мл) добавляли TEA (151 мг, 1,49 ммоль) и 2,5–диоксопирролидин–1–ил-2,5,8,11–тетраоксатетрадекан–14–оат (113 мг, 0,34 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь концентрировали и остаток очищали обращенно–фазовой хроматографией среднего давления (LiChroprep RP–18 Lobar (B) 25×310 мм – химические вещества EMD 40–63 μм, ~70 г, 90/10 до 80/20 0,1% TFA–ACN) с получением 37,4 мг (выход 35%) примера 7 в форме оранжевой пленки:1ЯМР (300 МГц, DMSO–d6) δ 8,47 (т, J=5,7 Гц, 2 Н), 7,96 (т, J=5,4 Гц, 2 Н), 3,20–3,60 (сложный м, 36 Н), 3,47 (с, 3 Н), 3,46 (с, 3 Н), 2,30 (т, J=6,3 Гц, 4 Н).13С ЯМР (75 МГц, DMSO–d6) δ 170,2 (с), 165,1 (с), 146,0 (с), 126,2 (с), 71,2 (т), 69,7 (т), 69,6 (т), 69,5 (т), 69,4 (т), 66,7 (т), 58,0 (кв), 38,2 (т), 36,2 (т). ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,01 мин на 250 мм колонке, (M+H)+ = 719, (M+Na)+ = 741. УФ/вид (100 μM в PBS) λabs=437 нм. Флуоресценция (100 нм) λex=437 нм, λem=558 нм.
[0152] Пример 8
[0153] 3,6–Диамино–N2,N5–бис(26–оксо–2,5,8,11,14,17,20,23–октаокса–27–азанонакозан–29–ил)пиразин–2,5–дикарбоксамид
[0154] К раствору из примера 5 (50,3 мг, 0,10 ммоль) в DMF (5 мл) добавляли TEA (109 мг, 1,08 ммоль) и 2,5–диоксопирролидин–1–ил-2,5,8,11,14,17,20,23–октаоксагексакозан–26–оат (128 мг, 0,25 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь концентрировали и остаток очищали обращенно–фазовой хроматографией среднего давления (LiChroprep RP–18 Lobar (B) 25×310 мм – химические вещества EMD 40–63 μм, ~70 г, 90/10 до 80/20 0,1% TFA–ACN) с получением 87,9 мг (выход 82%) Примера 8 в форме оранжевой пленки:1ЯМР (300 МГц, DMSO–d6) δ 8,46 (т, J=5,7 Гц, 2H), 7,96 (т, J=5,4 Гц, 2Н), 3,16–3,73 (сложный м, 74 Н), 2,28–2,32 (м, 2 Н).13С ЯМР (75 МГц, DMSO–d6) – множественные конформации – δ 170,1 (с), 169,9 (с) 169,8 (с), 165,1 (с), 146,0 (с), 126,2 (с). 71,2 (т), 69,7 (т), 69,6 (т), 69,5 (т), 66,7 (т), 58,0 (кв), 38,2 (т), 36,2 (т). ЖХ/МС (15–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=5,90 мин на 250 мм колонке, (M+H)+ = 1071, (M+2H)2+ = 536. УФ/вид (100 μM в PBS) λabs=438 нм. Флуоресценция (100 нм) λex=438 нм, λem=560 нм.
[0155] Пример 9

[0156] 3,6–Диамино–N2,N5–бис(38–оксо–2,5,8,11,14,17,20,23,26,29,32,35–додекаокса–39–азахентетраконтан –41–ил)пиразин–2,5–дикарбоксамид
[0157] К раствору из Примера 5 (53,1 мг, 0,10 ммоль) в DMF (5 мл) добавляли TEA (114 мг, 1,13 ммоль) и 2,5–диоксопирролидин–1–ил-2,5,8,11,14,17,20,23,26,29,32,35–додекаоксаоктатриаконтан–38–оат (144 мг, 0,21 ммоль) в DMF (2,0 мл) и полученную смесь затем перемешивали в течение 16 часов. Реакционную смесь концентрировали и остаток очищали обращенно–фазовой хроматографией среднего давления (LiChroprep RP–18 Lobar (B) 25×310 мм – химические вещества EMD 40–63 μм, ~70 г, 90/10 до 80/20 0,1% TFA–ACN) с получением 87,5 мг (выход 61%) Примера 9 в форме оранжевой пленки:1ЯМР (300 МГц, DMSO–d6) δ 8,48 (т, J=5,7 Гц, 2H), 7,96 (т, J=5,4 Гц, 2 Н), 7,80–7,86 (м, 2 Н), 5,94 (уш. м, 2 Н), 3,30–3,60 (сложный м, 106 Н), 2,26–2,33 (м, 4 Н).13С ЯМР (75 МГц, DMSO–d6) δ 170,2 (с), 165,1 (с), 146,0 (с), 126,2 (с), 71,2 (т), 69,7 (т), 69,6 (т), 69,5 (т), 66,7 (т), 58,0 (кв), 38,2 (т), 36,2 (т). ЖХ/МС (15–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=5,90 мин на 250 мм колонке, (M+2H)2+ = 712. УФ/вид (100 μM в PBS) λabs=449 нм. Флуоресценция (100 нм) λex=449 нм, λem=559 нм.
[0158] Пример 10

[0159] Бис(2–(PEG–5000)этил)6–(2–(3,6–диамино–5–(2–аминоэтилкарбамоил)пиразин–2–карбоксамидо)этиламино)–6–оксогексан–1,5–дилдикарбамат
[0160] Раствор из Примера 5 (25 мг, 0,049 ммоль) в DMF (30 мл) обрабатывали TEA (1 мл) и m–PEG2–NHS (1 г, 0,1 ммоль) и полученную смесь перемешивали в течение 48 часов при комнатной температуре. Смесь концентрировали и остаток частично очищали гель–фильтрационной хроматографией (смола G–25, вода). Продукт концентрировали и дополнительно очищали обращенно–фазовой хроматографией среднего давления (C18, 10–70% ручной градиент ацетонитрила в 0,1% TFA) с получением 137,8 мг (выход 54%) Примера 10 в форме твердого вещества желто–коричневого цвета: Maldi MS m/z=11393.
[0161] Пример 11

[0162] (R)–2–(6–(бис(2–метоксиэтил)амино)–5–циано–3–морфолинопиразин–2–карбоксамидо)янтарная кислота
[0163] Стадия 1. Синтез 2–амино–5–бром–3,6–дихлорпиразина
[0164] Раствор 2–амино–6–хлорпиразина (25 г, 193,1 ммоль) в МеОН (500 мл) обрабатывали NBS (34,3 г, 193,1 ммоль), порционно, в течение 1 часа. Полученную смесь перемешивали в течение 16 часов после этого. Анализ TLC в это время показывает небольшое количество оставшегося исходного материала. Добавляли еще 1,4 г NBS и реакционную смесь нагревали до 50°С в течение 2 часов. Затем смесь охлаждали до 38°С и обрабатывали NCS (25,8 г, 193,1 ммоль). После этого реакционную смесь нагревали до 50°С в течение 16 часов. Затем смесь охлаждали до комнатной температуры и обрабатывали водой (500 мл). Осадок собирали фильтрацией и сушили в вакуумном эксикаторе, получая 45,4 г (выход 97%) 2–амино–5–бром–3,6–дихлорпиразина в форме белого твердого вещества:13C ЯМР (75 МГц, CDCl3) δ 149,9 (с), 145,6 (с), 129,6 (с), 121,5 (с). ЖХ/МС (15–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,51 мин на 30 мм колонке, (M+H)+ = 244, (M+H+ACN)+ = 285.

[0165] Стадия 2. Синтез 5–амино–3,6–дихлорпиразин–2–карбонитрила
[0166] Смесь CuCN (8,62 г, 96,3 ммоль) и NaCN (4,72 г, 96,3 ммоль) нагревали в высоком вакууме до 90°C. Полученную смесь подвергали трем циклам аргон/вакуум и помещали под конечное положительное давление аргона. Смеси давали остыть до комнатной температуры и добавляли DMF (150 мл). Гетерогенную смесь нагревали до 130°С в течение 2,5 часов. К полученной гомогенной смеси дицианокупрата натрия добавляли раствор продукта со стадии 1 (15,6 г, 64,2 ммоль), растворенного в DMF (150 мл), по каплям в течение 1 часа. Температуру постепенно повышали до 150°С и полученную смесь перемешивали при этой температуре в течение 10 часов после этого. Затем реакционной смеси давали остыть до комнатной температуры и выливали в воду (1 л). Полученную смесь экстрагировали с помощью EtOAc (3х) и объединенные экстракты фильтровали для удаления хлопьевидного темного твердого вещества, промывали раствором соли, сушили (Na2SO4), снова фильтровали и концентрировали. Очистка колоночной флэш–хроматографией (SiO2, 10/1 гексаны–EtOAc до 3/1) дает 6,70 г (выход 55%) нитрильного продукта в форме рыжевато–коричневого твердого вещества:13С ЯМР (75 МГц, CDCl3) δ 153,9 (с), 149,1 (с), 131,7 (с), 115,4 (с), 111,0 (с). GCMS (Температура введ. = 280°C, скорость потока гелия 1,0 мл/мин, температурная программа: 100°C (выдержка 2 минуты), увеличение до 300°C при 10°C/мин (выдержка 2 минуты), время удерживания главного пика =16,556 мин, m/z (EI) = 188,190.

[0167] Стадия 3. Синтез 5–амино–3–(бис(2–метоксиэтил)амино)–6–хлорпиразин–2–карбонитрила.
[0168] К продукту, полученному на стадии 2 (1,00 г, 5,29 ммоль) в ACN (20 мл) добавляли бис(2–метоксиэтил)амин (3,0 мл, 2,71 г, 20,3 ммоль) и реакционную смесь нагревали до 70°С в течение 16 часов после этого. Реакционную смесь охлаждали и концентрировали. Остаток разделяли с помощью EtOAc и водой. Органический слой отделяли, а водный снова экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали раствором соли, сушили (Na2SO4), фильтровали и концентрировали. Очистка колоночной флэш–хроматографией (SiO2, 10/1 гексаны–EtOAc до 1/1) давала 950 мг (выход 63%) желаемого аддукта в форме желтого твердого вещества:1ЯМР (300 МГц, CDCl3) δ 7,47 (уш. с, 2 H), 3,77 (т, J=5,7 Гц, 4 H), 3,52 (т, J=5,4 Гц, 4 H), 3,25 (с, 6 H).13С ЯМР (75 МГц, CDCl3) δ 154,7 (с), 152,0 (с), 120,9 (с), 119,5 (с), 95,8 (с), 71,0 (т), 59,1 (кв), 50,0 (т). ЖХ/МС (50–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,91 мин на 250 мм колонке, (M+H)+ = 286, (M+Na)+ = 308, (M+Na+ACN)+ = 349.

[0169] Стадия 4. Синтез 3–(бис(2–метоксиэтил)амино)–5–бром–6–хлорпиразин–2–карбонитрила
[0170] К продукту со стадии 3 (1,39 г, 4,88 ммоль) в 48% бромистоводородной кислоте (20 мл) при 0°C (баня с ледяной солью) добавляли раствор нитрита натрия (673 мг, 9,75 ммоль) в воде (10 мл) по каплям в течение 30 мин. Полученную смесь перемешивали при 0~5°С в течение 1 часа и выливали в перемешиваемый раствор CuBr2 (1,64 г, 7,34 ммоль) в воде (100 мл). Затем полученную смесь перемешивали в течение 16 часов при комнатной температуре. Смесь экстрагировали с помощью EtOAc (3х). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали. Очистка колоночной флэш–хроматографией (SiO2, 50/1 CHCl3–MeOH) давала 1,00 г (58% выход) бромида в форме оранжево–коричневого твердого вещества:1ЯМР (300 МГц, CDCl3) δ 3,99 (т, J=5,4 Гц, 4 Н), 3,64 (т, J=5,4 Гц, 4 Н), 3,35 (с, 6 Н).13С ЯМР (75 МГц, CDCl3) δ 152,8 (с), 140,8 (с), 133,4 (с), 117,2 (с), 108,3 (с), 70,4 (т), 59,1 (т), 50,5 (кв). ЖХ/МС (50–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,55 мин на 250 мм колонке, (M+H)+ = 349,351.
[0171] Стадия 5. Синтез 3–(бис(2–метоксиэтил)амино)–6–хлор–5–(фуран–2–ил)пиразин–2–карбонитрила
[0172] Смесь продукта со стадии 4 (1,0 г, 2,87 ммоль), 2–фуранбороновой кислоты (643 мг, 5,75 ммоль), Cs2CO3 (3,31 г, 10,2 ммоль), TFP (35 мол.%, 236 мг, 1,02 ммоль) и Pd2dba3–CHCl3(5 мол.%, 10 мол.% Pd, 150 мг) подвергали 3 циклам вакуум/аргон и помещали под положительное давление аргона. Добавляли безводный диоксан (50 мл) и после этого реакционную смесь нагревали до 75°С в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (100 мл) и фильтровали через среднюю фритту. Концентрирование и очистка остатка флэш–хроматографией (SiO2, 50/1 CHCl3–MeOH) давало 757 мг фуранового аддукта (выход 78%) в форме желтовато–коричневого порошка: ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=6,41 мин на 250 мм колонке, (M+H)+ = 337.

[0173] Стадия 6. Синтез 6–(бис(2–метоксиэтил)амино)–3–хлор–5–цианопиразин–2–карбоновой кислоты
[0174] К хорошо перемешанной смеси ACN (11 мл), CCl4 (7 мл) и воды (11 мл) добавляли периодат натрия (1,07 г, 5,00 ммоль) и RuO2·H2O (13,3 мг, 0,10 ммоль), последовательно. Полученную смесь интенсивно перемешивали при комнатной температуре в течение 30 минут и обрабатывали бикарбонатом натрия (2,10 г, 25,0 ммоль), а затем водой (5 мл). За энергичным перемешиванием в течение еще 15 минут следовало добавление раствора продукта со стадии 5 (276 мг, 0,82 ммоль), растворенного в ACN (1 мл). Зеленую смесь перемешивали при комнатной температуре в течение 5,5 часов. Смесь переносили в делительную воронку и экстрагировали с помощью EtOAc. pН водного слоя регулировали до ~3,5 и снова экстрагировали с помощью EtOAc (2х). Объединенные экстракты промывали 20% бисульфитом натрия и раствором соли и сушили (Na2SO4). Фильтрация и концентрирование давали 140 мг (54% выход) карбоновой кислоты в форме бледно–желтого твердого вещества: ЖХ/МС (5–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=5,05 мин на 250 мм колонке, (M+H)+ = 315.

[0175] Стадия 7. Синтез (R)–дибензил-2–(6–(бис(2–метоксиэтил)амино)–3–хлор–5–цианопиразин–2–карбоксамидо)сукцината
[0176] Смесь продукта со стадии 6 (140 мг, 0,45 ммоль), EDC·HCl (128 мг, 0,67 ммоль) и HOBt·H2O (102 мг, 0,67 ммоль) в безводном DMF (25 мл) перемешивают вместе при комнатной температуре в течение 30 мин. К этой перемешанной смеси добавляли соль (R)–дибензил-2–аминосукцинат p–TsOH (213 мг, 0,44 ммоль) с последующим добавлением TEA (1 мл). Затем полученную смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали и разделяли с помощью EtOAc и раствора насыщенного бикарбоната натрия. Слой EtOAc отделяли и промывали насыщенным бикарбонатом натрия и раствором соли, сушили (Na2SO4), фильтровали и концентрировали, получая 240 мг (88% выход) пиразинамида в форме оранжевой пены: ЖХ/МС (15–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=8,76 мин на 250 мм колонке, (M+H)+ = 610, (M+Na)+ = 632.

[0177] Стадия 8. (R)–дибензил-2–(6–(бис(2–метоксиэтил)амино)–5–циано–3–морфолинопиразин–2–карбоксамидо)сукцинат

[0178] К продукту со стадии 7 (240 мг, 0,39 ммоль) добавляли морфолин (5 мл). Реакционную смесь нагревали до 70 ºC в течение 2 часов. Смесь охлаждали и концентрировали. Остаток распределяли с помощью EtOAc и воды. Слой EtOAc отделяли и промывали насыщенным бикарбонатом натрия и раствором соли. Слой EtOAc сушили (Na2SO4), фильтровали и концентрировали. Очистка колоночной флэш–хроматографией (SiO2, гексаны–EtOAc от 3:1 до 1:1) позволила получить 199 мг (75% выход) аддукта морфолина в форме оранжевой пены: ЖХ/МС (15–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=8,76 мин на 250 мм колонке, (M+H)+ = 661, (M+Na)+ = 683.
[0179] Стадия 9. Синтез Примера 11
[0180] К дибензиловому эфиру (115 мг, 0,17 ммоль) в THF (10 мл) добавляли 1,0 N гидроксид натрия (4 мл). Смесь перемешивали в течение 1 часа при комнатной температуре. pН регулировали до ~2 с помощью 1,0 N HCl и раствор концентрировали. Очистка остатка обращенно–фазовой хроматографией среднего давления (LiChroprep RP–18 Lobar (B) 25×310 мм – химические вещества EMD 40–63 μм, ~70 г, от 90/10 до 50/50 0,1% TFA–ACN) давала 32 мг (27% выход) Примера 11 в форме оранжевого твердого вещества: ЖХ/МС (15–95% градиент ацетонитрила в 0,1% TFA в течение 10 мин), время удерживания одного пика=4,47 мин на 250 мм колонке, (M+H)+ = 481. УФ/вид (100 μM в PBS) λabs=438 нм. Флуоресценция (100 нм) λex=449 нм, λem=570 нм.
[0181] Пример 12

[0182] (2R,2'R)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(3–гидроксипропановая кислота) («D–сериновый изомер» или «МВ–102»)
[0183] Стадия 1. Образование дибензил–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))(2R,2'R)–бис(3–гидроксипропаноата)
[0184] В круглодонную колбу объемом 500 мл, снабженную насадкой Кляйзена и капельной воронкой, загружали гидрохлорид бензилового эфира D–серина (24,33 г, 105,0 ммоль) и безводный DMF (300 мл) добавляли с помощью канюли. Раствор охлаждали на ледяной бане и перемешивали в течение 15 мин в атмосфере N2. DIPEA (19,16 мл, 110,0 ммоль) добавляли по каплям через капельную воронку в течение 30 минутного периода, а еще через 30 минут охлаждающую баню убирали и дикислоту (9,91 г, 50,0 ммоль) добавляли одной порцией. Суспензию кирпично–красного цвета перемешивали в течение 30 мин и HOBt·H2O (17,61 г, 115,0 ммоль) добавляли одной порцией. Через 15 минут реакционную колбу охлаждали на ледяной бане и порциями в течение 15 минут добавляли EDC·HCl (22,05 г, 115,0 ммоль). Полученной суспензии давали медленно нагреться до комнатной температуры и перемешивали в течение ночи (около 17 часов) в атмосфере N2.
[0185] Темный раствор концентрировали до сиропообразного остатка в высоком вакууме (температура бани 60°C), который разделяли между EtOAc и milli–Q H2O (по 400 мл каждого). Слои разделяли и водный слой экстрагировали с помощью EtOAc (3 × 200 мл). Объединенные EtOAc–экстракты последовательно промывали с помощью 0,50 М KHSO4, насыщенного NaHCO3, H2O и насыщенного раствора соли (по 250 мл каждого). Удаление растворителя при пониженном давлении давало 23,7 г оранжевого твердого вещества. Неочищенный продукт очищали с помощью флэш–хроматографии на силикагеле с использованием градиента CHCl3:MeOH с получением бисамида (19,6 г, 71%) в форме оранжевого твердого вещества: Rf 0,45 [CHCl3:MeOH(9:1, об/об)].1H ЯМР (DMSO–d6) δ 8,56 (д, J=8,0 Гц, 2 H, способный к обмену с D2O), 7,40–7,33 (м, 10 H), 6,76 (с, 4 H, способный к обмену с D2О), 5,37 (т, J=5,5 Гц, 2 Н), 5,20 (м, 4 Н), 4,66–4,63 (дт, J=8,0, 4,0 Гц, 2 Н), 3,97–3,93 (м, 2 Н) 3,81–3,77 (м, 2 Н).13C ЯМР (DMSO–d6) δ 170,1, 164,9, 146,4, 135,8, 128,4, 128,0, 127,6, 125,9, 66,2, 61,1, 54,4. RP–LC/MS (ESI) m/z 553,3 (М+Н)+(tR=4,44 мин, 5–95% В/6 мин). Анал. Вычислено для C26H28N6O8: C, 56,52; Н 5,11; N 15,21. Найдено: C 56,39; Н 5,11; N 14,99.
[0186] Стадия 2. Образование (2R,2'R)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(3–гидроксипропановой кислоты)
[0187] Бисамид (7,74 г, 14,0 ммоль) гидрогенизовали в присутствии 10% Pd/C (0,774 г) в EtOH:H2O (560 мл; 3:1, об./об.). Реакционную смесь продували аргоном и перемешивали в атмосфере водорода (медленное барботирование) при комнатной температуре в течение 5,5 часов. Реакционную смесь снова продували Ar и катализатор удаляли фильтрованием через Целит. Слой промывали с помощью EtOH:H2O (400 мл; 1:1, об./об.), а объединенные фильтраты концентрировали в вакууме. Продукт высушивали в высоком вакууме. Остаток растирали с CH3CN с получением изомера D–серина (4,89 г, 94%) в форме оранжевого порошка.1H ЯМР (DMSO–d6) δ 8,46 (д, J=8,3 Гц, 2 Н, способный к обмену с D2O), 6,78 (уш. с, 4 H, способный к обмену с D2O), 4,48–4,45 (дт, J=8,1, 3,9 Гц, 2 H), 3,88 (дд, J=11,1, 3,9 Гц, 2 H), 3,74 (дд, J=11,1, 3,7 Гц, 2 H).13C ЯМР (DMSO–d6) δ 171,6, 164,7, 146,4, 125,9, 61,2, 54,3. RP–LC/MS (ESI) m/z 373,2 (М+Н)+(tR=2,86 мин, 5,95% В/6 мин). Анал. Вычислено для C12H16N6O8: C 38,71; Н 4,33; N 22,57. Найдено: C, 38,44; Н 4,51: N, 22,33.
[0188] Пример 13
[0189] (2R,2'R)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил)) дипропионовая кислота («изомер D–Аланина»)

[0190] Стадия 1. Образование диэтил-2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))(2R,2'R)–дипропионата
[0191] В инертной атмосфере в высушенную пламенем круглодонную колбу (100 мл), снабженную магнитной мешалкой, загружали 3,6–диаминопиразин–2,5–дикарбоновую кислоту (1,0 г), гидрохлорид этилового эфира D–аланина (1,86 г), EDC·HCl (2,70 г), HOBt·H2O (2,65 г) и Et3N (2,0 мл) в DMF (безводном, 80 мл). Летучие вещества удаляли при пониженном давлении и температуре 50°С для образования темного полутвердого вещества. После охлаждения добавляли ацетонитрил (~100 мл) и раствору давали отстояться в течение примерно часа. Красный осадок выделяли центрифугированием, промывали с помощью EtOAc и сушили. Общий вес 1,30 г диэфира (3,06 ммоль, выход выделенного вещества 60,6%). Этот материал (1,3 г) использовался далее без дальнейшей очистки.
[0192] Стадия 2. Образование (2R,2'R)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил)) дипропионовой кислоты
[0193] Диэфир со стадии 1 (1,0 г) и LiOH (4 экв.) в THF/воде объединяли и перемешивали при температуре окружающей среды в течение нескольких часов. ВЭЖХ показала полный гидролиз. pH делали кислотным путем добавления TFA, и реакционную смесь оставляли отстояться в течение ночи при температуре окружающей среды. Дикислота была получена путем очистки реакционной смеси препаративной RPHPLC. Программа: 99:1 A:B в течение 5 минут, затем 5:95 A:B за 27 минут при 50 мл/мин. Лямбда УФ 264 нм и флуоресценция; λx=440 нм, λm=565 нм. Фракции, содержащие желаемый продукт, объединяли и лиофилизировали (–85°С, 15 мторр) с получением оранжевого твердого вещества (0,821 г, 2,41 ммоль, выход выделенного вещества 95,6%. M/z 341,13. Протонный и углеродный ЯМР согласовались с предложенной структурой.
[0194] Пример 14

[0195] 3,3'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))дипропионовая кислота ("Изомер β–аланина")
[0196] Стадия 1. Образование дибензил-3,3'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))дипропионата.
[0197] В инертной атмосфере в высушенную пламенем круглодонную колбу (100 мл) загружали 3,6–диаминопиразин–2,5–дикарбоновую кислоту (0,30 г), бензил-3–аминопропаноат р–толуолсульфонат (1,08 г), EDC·HCl (0,590 г), HOBt·H2O (0,582 г) и Et3N (1,50 г) в DMF (безводном, 40). Реакционную смесь перемешивали в течение ночи при температуре окружающей среды и концентрировали в вакууме до примерно 10 мл. Оставшийся DMF удаляли азеотропом толуола. Реакционную смесь разделяли между EtOAc (3 × 125 мл) и насыщенным NaHCO3 (3 × 100 мл). Органические слои объединяли и промывали лимонной кислотой (10% водной, 100 мл) и раствором соли (100 мл). Органический слой удаляли, сушили (безводным Na2SO4) и концентрировали в вакууме, получая кристаллическое твердое вещество, 0,58 г. TLC (силикагель на стекле, 1:1 EtOAc:гексаны) Rf=0,22. Продукт очищали с помощью флэш–хроматографии на силикагеле с получением 0,49 г продукта. Масс–спектр (ES+) 521,36 (100%), 522,42 (30%), 523,34 (приблиз. 6%). ЯМР,1Н (DMSO–d6), 400 МГц: 2,55 (4H, m), 3,41 (4H, m) 5,01 (4H, с), 6,44 (4H, с), 7,21 (10H, m), 8,41 (2Н, m);13C (DMSO–d6): 34,18, 35,33, 66,19, 126,74, 128,52, 128,92, 136,56, 146,75, 165,63, 171,90.
[0198] Стадия 2. Образование 3,3'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил)) дипропионовой кислоты.
[0199] Дибензиловый эфир со стадии 1 (0,92 г) объединяли с EtOH (абс., 75 мл) и переносили в сосуд под давлением Фишера–Портера (6 унций), снабженный впускным и выпускным клапанами, манометром (0–100 фунт/кв.дюйм) и магнитной мешалкой с тефлоновым покрытием. Добавляли воду (25 мл) и 10% Pd на углероде (0,2 г, Degussa/Aldrich wet), и реакционный сосуд герметизировали. После трех циклов вакуум/Ar, H2(g) вводили из баллона для отбора проб при 10 фунт/кв.дюйм в энергично перемешиваемый раствор. Через 3,5 часа реакционную смесь фильтровали через слой целита, и полученный слой целит/катализатор промывали с помощью примерно 500 мл 1:1 EtOH:H2O с получением раствора, который концентрировали в вакууме. Выделили 0,424 г твердого вещества (70,5% выход). ВЭЖХ/МС дала только один пик за 9,3 минуты. Масс–спектр (ES+) 341,32 (100%), 342,37 (30%), 344,29 (18%), 270,30 (62%). ЯМР,1Н (DMSO–d6), 400 МГц: 2,54 (2H, m), 3,42 (2H, m), 6,52 (2H, с), 7,21 (4H, m), 8,38 (2H, m), 11,9 (2H, уш. с);13C (DMSO–d6): 34,20, 35,33, 126,77, 146,75, 165,55, 173,57.
[0200] Пример 15

[0201] 2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис (азанедиил))диуксусная кислота («изомер глицина»)
[0202] Стадия 1. Образование диэтил-2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))диацетата
[0203] В круглодонную колбу (300 мл), снабженную магнитной мешалкой, загружали 3,6–диаминопиразин–2,5–дикарбоновую кислоту (5,0 г), гидрохлорид этилглицината (5,04 г), EDC·HCl (8,1 г), HOBt·H2O (8,0 г) и DIPEA (5,9 г) в DMF (безводном, 200 мл). В течение реакции поддерживалась атмосфера сухого аргона. Пиразин объединяли с глицинатом и при перемешивании добавляли DMF в инертной атмосфере. К упомянутому добавляли основание и HOBt. Примерно через 15 минут EDC добавляли порционно в течение 45 минут и реакционную смесь перемешивали при температуре окружающей среды в атмосфере Ar в течение ночи. Реакционную смесь концентрировали в вакууме до получения вязкого полутвердого вещества. Полутвердое вещество обрабатывали толуолом (примерно 30 мл) и летучие вещества удаляли в вакууме. После охлаждения образовывалось твердое вещество. Неочищенный продукт растворяли в 500 мл EtOAc и перемешивали до образования двух слоев. Раствор промывали раствором соли и насыщенным NaHCO3 и водный слой удаляли. Водный слой промывали (2х EtOAc, 150 мл) и органические слои объединяли. Органический слой промывали водным NaHSO4, насыщенным раствором соли, сушили над Na2SO4 и концентрировали, получая твердое вещество. Выход выделенного вещества: 5,46 г. ВЭЖХ анализ 96,9%. M/Z 369,2.1H и13C ЯМР согласовались с предложенной структурой. Этот продукт использовали далее без дальнейшей очистки.
[0204] Стадия 2. Образование 2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))диуксусной кислоты
[0205] Неочищенный продукт со стадии 1 (700 мг) растворяли в 40 мл THF с 10 мл воды (DI). Добавляли LiOH (4,2 эквивалента), и смесь перемешивали в течение ночи при температуре окружающей среды в инертной атмосфере. Анализ ВЭЖХ показал полное превращение в желаемую дикислоту (M/z=313,3). Реакционную смесь центрифугировали (3000 об/мин в течение 3 минут) и супернатант проверяли с помощью ВЭЖХ и выбрасывали. Оставшееся твердое вещество превращали в динатриевую соль путем обработки с помощью NaOH (6,25 N, 2 эквивалента) и полученный раствор фильтровали (0,22 микрона). Раствор лиофилизировали, получая твердое вещество, чистота которого была >95%, по данным ВЭЖХ. Динатриевую соль превращали в дикислоту, добавляя чуть более двух эквивалентов TFA с последующей препаративной колонкой с обращенной фазой. Протонный и углеродный ЯМР согласовались с предложенной структурой.
[0206] Пример 16
[0207] (2S,2'S)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))дипропионовая кислота («изомер L–аланина»)
[0208] Стадия 1. Образование диэтил-2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))(2S,2'S)–дипропионата
[0209] В инертной атмосфере в высушенную пламенем круглодонную колбу (100 мл) загружали 3,6–диаминопиразин–2,5–дикарбоновую кислоту (1,0 г), этил-L–аланинат гидрохлорид (1,86 г), EDC·HCl (2,70 г), HOBt·H2O (2,65 г) в DMF (безводном, 80 мл). Добавляли триэтиламин (1,50 г). Через 16 часов при температуре окружающей среды реакционные летучие вещества удаляли в вакууме. Полутвердое вещество было выделено. Добавляли воду (70 мл) и смесь оставляли отстояться в течение часа. В течение этого времени образовывался осадок, поэтому смесь центрифугировали и выделяли твердое вещество, которое сушили на воздухе в течение ночи. Этот материал растворяли в EtOAc и промывали водой, лимонной кислотой и насыщенным бикарбонатом натрия. Органический слой сушили (безводным сульфатом натрия) и концентрировали в вакууме с получением твердого продукта (1,38 г). ВЭЖХ чистота > 95% чистоты. Неочищенный продукт использовали на следующей стадии без дальнейшей очистки.
[0210] Стадия 2. Образование (2S,2'S)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))дипропионовой кислоты
[0211] Неочищенный продукт со стадии 1 (1,0 г) растворяли в THF (30 мл) и растворенный в воде (10 мл) LiOH·H2O (4 экв.) добавляли при температуре окружающей среды. Через час летучие вещества удаляли в вакууме. Продукт очищали препаративной ВЭЖХ с обращенной фазой и лиофилизировали, чтобы получить твердое вещество с чистотой > 95% желаемого дикислотного продукта. Протонный и углеродный ЯМР согласовались с предложенной структурой.
[0212] Пример 17

[0213] 2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(2–метилпропановая кислота) («изомер диметилглицина»)
[0214] Стадия 1. Образование диэтил-2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(2–метилпропаноата)
[0215] В инертной атмосфере в высушенную пламенем круглодонную колбу (100 мл) загружали 3,6–диаминопиразин–2,5–дикарбоновую кислоту (1,0 г), гидрохлорид этилгемдиметил-3–аминопропановой кислоты (1,86 г), EDC·HCl (2,70 г), HOBt·H2O (2,65 г) в DMF (безводном, 80 мл). Реакцию инициировали добавлением триэтиламина (1,50 г) и поддерживали при температуре окружающей среды в течение 72 часов. Летучие вещества удаляли в вакууме. Темную вязкую жидкость выделяли. После охлаждения ее растворяли в ацетонитриле (около 100 мл) и оставляли отстояться около часа. Образовавшийся осадок, который выделяли центрифугированием и сушили, являлся 1,30 г диэтилового эфира (61%) с чистотой по RPHPLC >95%. Этот неочищенный продукт был использован непосредственно на следующей стадии.
[0216] Стадия 2. Образование 2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(2–метилпропановой кислоты)
[0217] Неочищенный продукт со стадии 1 (1,0 г) растворяли в THF: вода (40 мл:5 мл). К полученному добавляли LiOH в воде (2,5 эквивалента в 0,5 мл DI воды). К реакционной смеси добавляли еще два эквивалента LiOH, и реакционной смеси давали протекать в течение ночи при температуре окружающей среды. По окончании реакционную смесь подкисляли с помощью TFA до достижения значения pH около 4. Продукт выделяли препаративной RPHPLC. M/Z 369,13. Протонный и углеродный ЯМР согласовались с предложенной структурой.
[0218] Пример 18

[0219] 3,6–диамино–N2,N5–бис((1R,2S,3R,4R)–1,2,3,4,5–пентагидроксипентил)пиразин–2,5–дикарбоксамид
[0220] В круглодонную колбу (100 мл), снабженную магнитной мешалкой, загружали 3,6–диаминопиразин–2,5–дикарбоновую кислоту (0,535 г, 2,70 ммоль), (1R,2S,3R,4R)–1–аминопентан–1,2,3,4,5–пентаол (0,978 г, 5,40 ммоль, 2,0 эквив.) и DMF (40 мл). К полученному добавляли триэтиламин (0,546 г, 0,76 мл, 5,40 ммоль, 2,0 эквив.) и PyBop (3,1 г, 5,94 ммоль, 2,2 эквив.). Через час реакция завершалась по данным ВЭЖХ анализа и реакционную смесь концентрировали в вакууме, поддерживая температуру ниже 40°C. Смесь растворяли в воде (10 мл), пропускали через колонку с Сефадексом G–10 и фракции, содержащие флуоресцентный продукт, собирали и лиофилизировали с получением неочищенного твердого вещества. Целевой продукт, 3,6–диамино–N2,N5–бис((1R,2S,3R,4R)–1,2,3,4,5–пентагидроксипентил)пиразин–2,5–дикарбоксамид, получали препаративной С–18 RPHPLC: 160 мг, HRMS (теоретическая), M+Na=547,1970; HRMS (наблюдаемая) M+Na=547,1969.
[0221] Пример 19
[0222] Протокол для оценки почечной функции
[0223] Пример установки 10 контроля почек in vivo показан на Фигуре 2 и включает в себя источник 12 света и систему 14 обработки данных. Источник 12 света, как правило, включает в себя или связан с соответствующим устройством для воздействия на по меньшей мере часть тела пациента его светом. Примеры соответствующих устройств, которые могут быть связаны или быть частью источника 12 света, включают в себя, но не ограничиваются ими, катетеры, эндоскопы, волоконную оптику, ушные клипсы, браслеты, головные повязки, налобные датчики, поверхностные катушки и пальцевые зонды. Действительно, любое из ряда устройств, способных излучать свет видимого и/или ближнего инфракрасного диапазона источника света, может использоваться в установке 10 контроля почек. В одном аспекте источники света представляют собой светодиоды, при этом один из этих светодиодов излучает свет вблизи максимума поглощения индикаторного агента, тогда как второй светодиод излучает свет вблизи максимума флуоресцентного излучения индикаторного агента. Например, один светодиод излучает свет при 450 нм, а второй светодиод излучает свет при 560 нм.
[0224] Все еще со ссылкой на Фигуру 2, система 14 обработки данных установки контроля почек может быть любой подходящей системой, способной обнаруживать спектральную энергию и обрабатывать данные, указывающие спектральную энергию. Например, система 14 обработки данных может включать в себя одну или более линз (например, для направления и/или фокусировки спектральной энергии), один или более фильтров (например, для отфильтрования нежелательных длин волн спектральной энергии), фотодиод или фотоумножитель (например, для получения спектральной энергии и преобразования ее в электрический сигнал, указывающий обнаруженную спектральную энергию), усилитель (например, для усиления электрического сигнала от фотодиода или фотоумножителя) и блок обработки (например, для обработки электрического сигнала от фотодиода или фотоумножителя). Система 14 обработки данных предпочтительно выполнена с возможностью манипулирования полученными спектральными данными и генерирования профиля интенсивности/времени и/или кривой концентрации/времени, указывающих почечный клиренс производного пиразина согласно настоящему изобретению у пациента 20. Действительно, система 14 обработки данных может быть выполнена с возможностью генерирования соответствующих данных о почечной функции путем сравнения различий в способах, которыми нормальные и поврежденные клетки удаляют производное пиразина из кровотока, чтобы определить скорость или накопление производного пиразина в органах или тканях пациента 20 и/или получить томографические изображения органов или тканей, имеющих связанное с ними производное пиразина.
[0225] В качестве примера, а не ограничения, в одном аспекте система содержит два кремниевых фотоумножителя. Первый фотоумножитель включает в себя фильтр длинных частот, тогда как второй фотоумножитель не фильтруется. Такая компоновка позволяет измерять как флуоресцентное излучение, так и диффузное отражение на длинах волн возбуждения и излучения. В одном таком варианте осуществления измерение флуоресценции и диффузного отражения объединяют в измерение собственной флуоресценцией, которое компенсирует различия в оптических свойствах ткани. Пример формулы для объединения измерений представлен в Уравнении 1.
[0226] В одном аспекте для определения функции почек, эффективное количество производного пиразина вводят пациентам, нуждающимся в этом (например, в форме его фармацевтически приемлемой композиции). По меньшей мере часть тела пациента 20 подвергают воздействию видимого и/или ближнего инфракрасного света от источника 12 света, что указано стрелкой 16. Например, свет от источника 12 света может быть доставлен через оптическое волокно, которое прикреплено к уху пациента 20. Пациент может подвергаться воздействию света от источника 12 света до или после введения этому пациенту 20 производного пиразина. В некоторых случаях может быть полезно генерировать фоновое или исходное показание света, испускаемого из тела пациента 20 (вследствие воздействия света от источника 12 света), до введения производного пиразина этому пациенту 20. Когда производное пиразина, которое находится в теле пациента 20, подвергается воздействию света от источника 12 света, производное пиразина испускает свет (указанный стрелкой 18), который обнаруживается/получается системой 14 обработки данных. Первоначально введение производного пиразина пациенту 20 обычно обеспечивает начальный спектральный сигнал, указывающий на начальное содержание производного пиразина в пациенте 20. Спектральный сигнал затем имеет тенденцию затухать в зависимости от времени по мере того, как производное пиразина выводится из пациента 20. Это затухание спектрального сигнала в зависимости от времени указывает почечную функцию пациента. Кроме того, если индикаторный агент вводят в сосудистое пространство пациента, начальная кинетика отражает равновесие индикаторного агента во всем внеклеточном пространстве пациента. В некоторых аспектах это равновесие становится полным менее чем за 2 часа.
[0227] Например, для первого пациента, у которого проявляется здоровая/нормальная почечная функция, спектральный сигнал может затухать обратно до базовой линии за период T. Тем не менее, спектральный сигнал для второго пациента, у которого проявляется недостаточность почечной функции, может затухать обратно до базовой линии за время Т+4 часа. Степень нарушения почечной функции или почечной недостаточности будет влиять на продолжительность времени, необходимого для обратного затухания сигнала до базовой линии. Большая степень почечной недостаточности потребует более длительного периода времени. По существу, пациент 20 может подвергаться воздействию света от источника 12 света в течение любого периода времени, подходящего для обеспечения желаемых данных о почечной функции. Аналогичным образом, системе 14 обработки данных может быть разрешено получать/обнаруживать спектральную энергию в течение любого периода времени, подходящего для обеспечения желаемых данных о почечной функции.
[0228] Кроме того, определение СКФ у пациента не ограничивается единственным определением, основанным на однократном введении индикаторного агента. Время между введением индикаторного агента и моментом, когда он становится необнаружимым в пациенте, может быть разделено на несколько меньших сегментов, а СКФ пациента вычислена для каждого меньшего сегмента. В некоторых аспектах временные сегменты могут перекрываться. В качестве примера, а не ограничения, если весь период времени до того момента, как индикаторный агент станет необнаружимым, составляет 24 часа, то период времени можно разделить на четыре равных сегмента по шесть часов; каждый новый временной сегмент начинается в конце предыдущего сегмента. В еще одном аспекте временные сегменты могут перекрываться. Например, каждый отдельный временной сегмент может длиться четыре часа, но новый временной сегмент может начинаться каждые два часа. Это создаст перекрывающиеся сегменты на всем протяжении измерения. Чтобы более полно проиллюстрировать этот неограничивающий пример, если индикаторный агент вводился в момент времени, равный 0, и стал необнаружимым в момент времени, равный 24 часам, то могут быть созданы следующие временные сегменты: 0–4 часа, 2–6 часов, 4–8 часов, 6–10 часов, 8–12 часов, 10–14 часов, 12–16 часов, 14–18 часов, 16–20 часов, 18–22 часа и 20–24 часа. СКФ пациента может быть вычислена в каждом временном сегменте индивидуально. Эти данные будут использованы для более полной оценки состояния почек пациента. Временной сегмент может быть любой продолжительности, которая позволяет определять СКФ, и может составлять 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 8 часов, 10 часов или 12 часов. Кроме того, временные сегменты не обязательно являются идентичными во время измерения. Продолжительность каждого временного сегмента подбирается индивидуально, без учета любого другого временного сегмента.
[0229] Результаты фармакокинетического исследования
[0230] В ходе клинического исследования 60 пациентам–людям внутривенно вводили MB–102 ((2R,2'R)–2,2'–((3,6–диаминопиразин–2,5–дикарбонил)бис(азанедиил))бис(3–гидроксипропановую кислоту)), полученную в Примере 12. Кровь и могу собирали в дополнение к способам и методикам, раскрытым в данном документе. Были собраны стандартные фармакокинетические данные, и было проведено сравнение способов и методик, описанных в данном документе, с Omnipaque® (Йогексолом), известным контрастным веществом, используемым для определения СКФ.
[0231] На Фигурах 3А–3D показаны данные, собранные у 60 пациентов–людей, протестированных с помощью МВ–102. Фармакокинетические данные плазмы собирали и анализировали с использованием способов, известных в данной области техники, и сравнивали с данными, измеренными с использованием способов и методик, раскрытых в данном документе.
[0232] Фигуры с 3А по 3D иллюстрируют двухкамерную фармакокинетическую модель для устранения MB–102. Данная модель совместима с пациентами независимо от их значений СКФ. Фигура 3А – для пациентов с нормальной функцией почек, у которых измеренная СКФ (иСКФ) составляет 120 мл/мин. Фигура 3B – для пациентов с иСКФ 81 мл/мин. Фигура 3C – для пациентов с иСКФ 28 мл/мин. Фигура 3D – для пациентов, имеющих иСКФ 25 мл/мин. Первая камера в модели с двумя камерами представляет собой равновесие между сосудами и тканью, тогда как вторая камера иллюстрирует лишь почечную экскрецию. В среднем время уравновешивания составляет около часа и зависит от субъекта.
[0233] На Фигуре 4 показаны сравнительные данные для СКФ, измеренной с использованием Omnipaque® с помощью традиционных способов, в сравнении с MB–102 с помощью способов, раскрытых в настоящем документе, для пациентов, имеющих иСКФ в диапазоне от около 20 до около 140. Данные демонстрируют коэффициент корреляции 0,97. Это указывает на то, что способ определения СКФ пациента, используемый в данном документе, дает аналогичные результаты по сравнению с известными способами.
[0234] В рамках клинического исследования 1 MB–102 у пациентов собирали мочу в течение 12 часов для определения выведенного объема и степени вторичного метаболизма. Как показано на Фигуре 5, для пациентов с иСКФ более 60, более 99% неметаболизированного МВ–102 было выведено через 12 часов. Для пациентов со значением иСКФ ниже 60, меньший процент MB–102 был выведен, но он также был неметаболизирован. Для пациентов, имеющих нормальную, стадии 1 и стадии 2 почечную функцию, 12–часовое время сбора было достаточным для более чем 99% выведения MB–102. Принимая во внимание фармакокинетические данные и определение периода полувыведения из плазмы, неполный сбор уже является понятным для пациентов с более серьезным нарушением функции почек.
[0235] На Фигуре 6 показан период полувыведения концентрации MB–102 в плазме для пациентов с нормальной функцией почек, почечной недостаточностью 1 стадии, почечной недостаточностью 2 стадии, почечной недостаточностью 3 стадии или почечной недостаточностью 4 стадии. На основе этих данных становится ясно, что в приведенном выше исследовании со сбором мочи потребуется более 24 часов, чтобы исключить весь MB–102 из кровотока пациента. Для группы с нормальной почечной функцией средний период полувыведения из плазмы составляет два часа, таким образом, 12–часовое время сбора составляет около 6 периодов полувыведения и является достаточным, чтобы вывести из организма большую часть введенной дозы. Для групп со стадиями 2 и 3 средний период полувыведения из плазмы составляет 2,5 часа, что приводит к приблизительно 5 периодам полувыведения для времени экскреции, что также является достаточным для сбора большей части введенной дозы. Однако 4–часовой период полувыведения для стадии 3 и 8–часовой период полувыведения для стадии 4 не позволяет собрать всю введенную дозу в 12–часовом окне для клинического исследования.
[0236] В клиническом исследовании фармакокинетика плазмы коррелировала как функция от времени (начиная с 2 часов после введения индикаторного агента и продолжая до конца 12–часового периода исследования) с фармакокинетикой трансдермальной флуоресценции, измеряемой по груди пациентов. Сильная корреляция между концентрациями в плазме и интенсивностью флуоресценции наблюдалась у пациентов с широким диапазоном значений СКФ. На Фигурах 7, 8 и 9 показаны три отдельных пациента со значениями СКФ от 23 мл/мин/1,73м2(почечная недостаточность стадии 3b) до 117 мл/мин/1,73м2(нормальная почечная функция). Таким образом, фармакокинетика плазмы коррелирует с трансдермальной флуоресценцией для MB–102 для пациентов с широким диапазоном СКФ.
[0237] Трансдермальное определение СКФ (соответствует полному набору данных)
[0238] Кинетический анализ проводился с использованием LabView, Matlab, WinNonlin и Microsoft Excel, версия 2010, следующим образом. Данные трансдермальной флуоресценции аппроксимировались под одну экспоненциальную функцию между 2 часами (относительно времени введения, что обеспечивало уравновешивание индикаторного агента во внеклеточном пространстве) и окончанием доступных данных (обычно около 12 часов). Для каждого субъекта были выполнены две аппроксимации: (1) со смещением, установленным на ноль, (2) со смещением, которому позволяли изменяться. Экспоненциальная постоянная времени, определяемая исходя из аппроксимаций, именуется постоянной времени почечного затухания (RDTC).
[0239] Линейная регрессия, исключение выбросов и вычисление коэффициента корреляции (R2) и стандартной ошибки калибровки (SEC) были выполнены в Microsoft Excel, версия 2010. Инверсию RDTC коррелировали с СКФ, используя 4 различных способа определения СКФ:
[0240] Ненормированная СКФ, определяемая исходя их PK–анализа в плазме как Йогексола, так и MB–102.
[0241] Нормированная по BSA – рост и вес использовались для оценки площади поверхности тела (BSA) каждого субъекта согласно способу Mosteller (N Engl J Med, 1987; 317(17)). СКФ, определенная с помощью PK–анализа в плазме, была разделена на отношение вычисленной BSA к 1,73 м2(BSA для пациента «стандартного» размера).
[0242] Нормированная по Vd (Способ 1) – СКФ, определяемая с помощью PK–анализа в плазме, была разделен на отношение объема распределения (Vd) (также определяемого исходя из PK–анализа) к 14,760 мл, Vd для пациента «стандартного» размера. Vd для пациента стандартного размера определяли путем обеспечения равной средней нСКФ у всех пациентов Группы 1 для способов нормирования по Vd и BSA. «нСКФ» используется здесь для обозначения обобщенных способов (в том числе как BSA, так и Vd), в которых СКФ нормируется по размеру тела.
[0243] Нормированный по Vd(способ 2) – единичная экспонента со смещением, установленным равным нулю, аппроксимировалась под концентрации MB–102 в плазме в зависимости от времени, от 2 до 12 часов (относительно времени введения индикаторного агента). Инверсию аппроксимированной постоянной времени умножали на 14,760 мл (Vd для пациента «стандартного» размера; см. выше), в результате чего СКФ нормировалась по объему распределения.
[0244] Коэффициенты корреляции (R2) и стандартные ошибки калибровки (SEC) для графиков полученной из плазмы СКФ в зависимости от чрескожной скорости клиренса почек приведены в Таблице 2 и на Фигурах с 12 по 18. В соответствии с предыдущими результатами Rabito (J Nucl Med, 1993; 34(2):199–207), нормирование СКФ по BSA увеличивает R2 и снижает SEC, подтверждая гипотезу о том, что скорость почечного клиренса MB–102 обеспечивает меру эффективности почек, которая не зависит от размера тела. Кроме того, эти результаты показывают, что объем распределения (Vd) индикаторного агента также эффективен для нормирования СКФ под стандартный размер тела. Как видно из Таблицы 2, способы нормирования по BSA и второму Vd, размеру тела были одинаково эффективны, когда способы исключения выбросов не применялись, а смещение для аппроксимаций RDTC было зафиксировано равным нулю.
[0245] Таблица 2
[0246] Способ смещения аппроксимации RDTC
[0247] Кинетику трансдермальной флуоресценции подбирали двумя различными способами смещения: (1) смещение фиксировано на нуле и (2) смещению позволено изменяться. На Фигурах 18 и 19 показаны результирующие графики корреляции для способов с фиксированным и переменным смещением, соответственно. Обратите внимание, что, когда смещение установлено на ноль (Фигура 18), данные кластеризуются более плотно в области низкой СКФ корреляционного графика, тогда как, когда смещению позволяют изменяться (Фигура 19), кластеризация данных становится более плотной в области высокой СКФ.
[0248] Это наблюдение указывает на нестабильность флуоресценции на базовой линии. У здоровых субъектов с высокой постоянной скорости почечного клиренса флуоресцентный агент был очищен до окончания 12–часового периода сбора данных. У этих субъектов было отмечено, что конечный уровень плато флуоресценции не всегда идеально совпадал с флуоресценцией на базовой линии перед введением. Разрешение смещению изменяться в аппроксимациях для этих здоровых субъектов позволило компенсировать эту неопределенность на базовой линии для таких аппроксимаций, тем самым повысив надежность извлекаемой постоянной скорости клиренса. Однако у многих субъектов с нарушенной функцией почек агент не был полностью очищен в течение 12–часового окна, в котором эти замеры собирали. Для этих субъектов было обнаружено, что включение переменного смещения в аппроксимации увеличивает неопределенность в аппроксимируемой постоянной скорости клиренса. За счет фиксации смещения на нуле надежность такой постоянной скорости повысилась.
[0249] На основании этих наблюдений был разработан гибридный способ смещения. В гибридном способе, если аппроксимация с фиксированным смещением указывает на то, что постоянная скорости высока (т.е. имеет место функция здоровых почек), тогда смещению позволяют изменяться; в противном случае (то есть когда имеет место нарушенная функция почек) смещение фиксируют. Оптимальная точка перехода была выбрана для максимизации R2 и минимизации SEC, как показано на Фигуре 25. Точка перехода, показанная на оси x, выражается как постоянная времени (в единицах часов), которая является обратной величиной постоянной скорости клиренса. Как видно на фигуре, оптимальная постоянная времени находилась в диапазоне от 3,5 до 4,5 часов. График корреляции с использованием способа гибридного смещения (с точкой перехода: 3,5 часа) показан на Фигуре 20. Сравнение способов фиксированного, переменного и гибридного смещений, представленное в Таблице 3, показывает, что способ гибридного смещения приводит к значительному увеличению R2 и снижению SEC по сравнению с другими способами.
[0250] Таблица 3
[0251] Исключения данных
[0252] Для некоторых клинических субъектов датчик не оставался полностью прикрепленным к коже в течение полных 12 часов исследования. Повторное присоединение датчика после инъекции часто приводило к значительному сдвигу уровня сигнала. Это могло быть из–за: (1) неоднородности в авто–флуоресценции кожи, (2) неоднородности в интерстициальной жидкостной фракции в коже, или (3) изменений в эффективности передачи света в и из кожи. Чтобы решить эту проблему в будущем, датчик был переработан таким образом, чтобы иметь меньшую площадь и быть более плотно прилегающим к пациенту. Чтобы использовать клинические данные, были применены некоторые исключения данных.
[0253] Пять из 60 клинических субъектов были полностью исключены из флуоресцентного кинетического анализа: (1) Субъект 1 был исключен из–за многократного перегрева датчика (у всех последующих субъектов максимально допустимый уровень мощности синего светодиода был снижен на 60%) (2) Субъекты 8, 37 и 49 были исключены, поскольку датчик полностью оторвался от кожи, и первоначальный уровень сигнала не мог быть восстановлен путем повторного прикрепления, (3) Субъект 46 был исключен, поскольку большая часть данных была исключена на этапе предварительной обработки (вероятной причиной было непреднамеренное изменение мощности светодиода или коэффициента усиления детектора после введения индикаторного агента).
[0254] Были протестированы различные метрики для дальнейшего исключения данных субъектов, в том числе: (1) коэффициент корреляции между IF и аппроксимацией; (2) среднеквадратичная ошибка (RMSE) IF относительно аппроксимации; (3) разность между RDTC, определенной исходя из одного экспоненциального и двух экспоненциальных приближений; (4) отношение сигнал/шум, вычисленное как амплитуда приближенного экспоненциального члена, деленная на RMSE; (5) коэффициент вариации (CV) постоянной скорости, когда его приближение получено по нескольким более коротким временным сегментам (например, 1–2 часа) в полном наборе данных за 12 часов; (6) оценочная ошибка постоянной скорости, аппроксимированной по IF; и (7) оцененная ошибка СКФ, определенная по данным плазмы. Ни одна из этих метрик не включает априорную информацию о коэффициенте корреляции или SEC.
[0255] В одном аспекте, используя вышеописанный способ (6) исключения данных, оценочная ошибка постоянной скорости, аппроксимированной по IF, деленная на постоянную скорости (выраженную как относительная ошибка), дала результаты, показанные на Фигуре 26. Исключая субъектов, у которых относительная погрешность ошибка постоянной скорости была больше 1,4–1,8%, наблюдались значительные улучшения в R2 и SEC. Выбрав 1,75% в качестве метрики отсечки, десять из 55 субъектов были исключены. Результирующие корреляционные графики показаны на Фигурах 21 и 22.
[0256] Этот способ далее применяли в качестве метрики исключения для проверки, вносит ли ошибка в извлекаемых по плазме определениях СКФ также вклад в разброс данных на корреляционных графиках. На Фигуре 27 показана оптимизация этой метрики. При выборе 5% в качестве отсечки для приемлемости СКФ наблюдалось небольшое улучшение R2 и SEC. Однако для этого потребовалось исключить еще 10 субъектов, в результате чего число оставшихся субъектов было доведено до 35. Полученные в результате корреляционные графики показаны на Фигурах 23 и 24. Численная сводка применения различных метрик исключения данных представлена в таблице 4.
Таблица 4
[0257] Калибровочный наклон, определенный исходя из вышеописанных способов, может применяться для генерации чрескожных замеров скорректированной по размеру тела СКФ (далее в данном документе упоминается как «чСКФ»). На Фигуре 10 показана корреляция между прогнозируемыми и определяемыми по плазме значениями СКФ с нормированием по BSA. Точность калибровки можно изобразить на графике чСКФ в сравнении с определением «золотого стандарта» скорректированной по размеру тела СКФ, получаемым из PK–анализа плазмы. На Фигуре 10 показана результирующая корреляция, когда определяемые по плазме значения СКФ были нормированы по площади поверхности тела (BSA) пациента, для которой коэффициент корреляции (R2) составляет 0,89. Использование объема распределения (Vd) для коррекции по размеру тела вместо BSA привело к существенно улучшенной корреляции 0,96 (Фигура 11).
[0258] По сравнению с наиболее часто используемым способом оценки СКФ в клинической практике, оСКФ, эти результаты чСКФ демонстрируют потенциал для значительно улучшенной точности. Высокая точность важна при принятии клинических решений. Фигура 28 и Таблица 1 иллюстрируют 5 стадий хронической болезни почек (ХБП). Ошибочный диагноз ХБП может повлиять на курс клинического лечения. График сетки ошибок был построен для визуализации ошибочного диагноза ХФП по замерам СКФ относительно золотого стандарта, как показано на Фигурах 29a–c. Измерения, попадающие в квадрат со всеми зелеными границами, правильно классифицируются по стадии ХБП. Измерения, содержащиеся в желтой и зеленой границах, являются неправильным на одну стадию ХБП диагнозом. Измерения, содержащиеся в красной и желтой границах, являются неправильным на две стадии ХБП диагнозом. На Фигуре 29а показана сетка ошибок оСКФ для той же самой группы субъектов, которая использовалась в вышеописанном анализе. В этом случае 2 из 60 субъектов был поставлен неправильный на 2 стадии ХБП диагноз, 16 субъектам был поставлен неправильный на 1 стадию ХБП диагноз; и 41 субъекту был поставлен правильный диагноз. В таблице 5 приведена сводка ошибок диагностики ХБП в процентах от общего объема измерений. На Фигурах 29b и c представлены графики сетки ошибок для трансдермального определения СКФ (чСКФ). Важно отметить, что сетки ошибок чСКФ не содержат неправильных на две стадии ХБП диагнозов. Кроме того, чСКФ, получаемая способом с нормированием по Vd, демонстрирует существенное снижение неправильных на одну стадию ХБП диагнозов по сравнению с оСКФ (см. Таблицу 5).
[0259] Таблица 5
[0260] Определение трансдермальной СКФ (интервальные аппроксимации)
[0261] В вышеприведенном примере для определения СКФ использовались полные доступные наборы данных (т.е. после введения индикаторного агента и уравновешивания, с 10 часовым затуханием флуоресценции). Это может быть уместным для пациентов со стабильной функцией почек, но для пациентов с острым поражением почек или с риском их возникновения требуется более быстрая и проходящая в режиме реального времени повторная оценка тенденции СКФ. Даже для пациентов со стабильной функцией почек ожидание определения СКФ в течение 12 часов может быть неудобным. В таблицах 6 и 7 показаны результаты изменения временного интервала измерения и периода сообщения по однократной инъекции для той же самой группы субъектов, которая была описана выше.
[0262] Временные интервалы измерения (столбец 1 в Таблицах 6 и 7) в этом примере не перекрывались, так что число интервалов (столбец 2 в Таблицах 6 и 7), умноженное на временные интервалы измерения, указывает общее количество часов после уравновешивания, в течение которых были сделаны оценки СКФ. Наилучшие результаты были получены, когда временной интервал измерения был достаточно длинным, так что интенсивность флуоресценции существенно снижалась. Время, необходимое для достижения той же доли затухания интенсивности флуоресценции, будет меняться в зависимости от состояния почек. Поэтому смещение было зафиксировано равным нулю, за исключением самых широких временных интервалов измерения для пациентов со здоровыми почками. Стандартная ошибка калибровки суммируется для всех субъектов (столбец 5 в Таблицах 6 и 7), а также для подгрупп пациентов с нСКФ ниже или выше 75 мл/мин.
[0263] С использованием нормированной по BSA СКФ в качестве эталонного сравнения (Таблица 6) для субъектов с нСКФ выше 75 временной интервал измерения, составляющий по меньшей мере около 1,5 часов, использовался для достижения точности калибровки нСКФ ниже 15 мл/мин. Для субъектов с нСКФ ниже 75 временной интервал измерения, составляющий по меньшей мере около 3 часов, использовался для достижения точности калибровки нСКФ ниже 10 мл/мин. С использованием нормированной по Vd СКФ в качестве эталонного сравнения (Таблица 7), эквивалентная точность калибровки нСКФ была достигнута временными интервалами измерения, составляющими 0,5 часа и 2 часа, соответственно. Как видно из Таблиц 6 и 7, целевые показатели точности калибровки, указанные выше, сохранялись по меньшей мере в двух неперекрывающихся временных интервалах измерения. Тем не менее, значительное увеличение SEC обычно наблюдалось, когда прогнозы распространялись на 3 или 4 временных интервала измерения. Увеличивая (например, удваивая или утраивая) временной интервал измерения относительно временного интервала измерения, который использовался для первых двух замеров СКФ, по меньшей мере третий замер СКФ обеспечивал эквивалентную точность. Эти результаты демонстрируют применимость предоставления автоматически регулируемого временного интервала измерения не только для учета различного SNR у разных пациентов, но также для учета уменьшающегося SNR с течением времени, так как индикаторный агент постепенно выводится почками.
Таблица 6
[0264] Таблица 7
[0265] Трансдермальное измерение СКФ в реальном времени
[0266] Способы, раскрытые в данном документе, позволяют осуществлять трансдермальное определение СКФ в режиме реального времени у пациентов. После внутрисосудистой инъекции индикаторного агента субъекту период ожидания, равный двум часам, использовался для обеспечения уравновешивания индикаторного агента во внесосудистом пространстве. Спустя два часа данные собирали в течение еще одного часа перед выполнением первой аппроксимации RDTC. Первая RDTC аппроксимация была выполнена с членом смещения, установленным в ноль. Если RDTC составляла менее 3,5 часов, аппроксимация повторялась, что позволяло изменять наклон, в противном случае исходная RDTC (с фиксированным смещением) сохранялась. Оценочная ошибка RDTC затем была разделена на RDTC. Если полученная относительная ошибка была менее 1,7%, RDTC преобразовывали в нормированную по BSA СКФ путем инвертирования RDTC и умножения на наклон, показанный на Фигуре 23; в противном случае СКФ не сообщалась. После первой RDTC–аппроксимации процедуру аппроксимации повторяли с интервалом приблизительно 3 секунды, при этом последующие аппроксимации включали все данные, которые были в первой аппроксимации, а также все данные, которые были впоследствии собраны (с интервалами времени около одной секунды). Аналогичная процедура применялась к данным, собираемым двумя датчиками: один был помещен над манубриумом грудины, а второй – над большой грудной мышцей. Результаты, полученные в замере в режиме реального времени, показаны на Фигуре 30. В течение всего исследования соответствие между чСКФ, сообщаемым двумя датчиками, и дисперсией в чСКФ, сообщаемой каждым датчиком, находилось в пределах 2 мл/мин/1,73 м2.
[0267] Проверка стабильности MB–102
[0268] Образцы МВ–102 готовили и хранили при 25°С и относительной влажности 60% в течение 24 месяцев. ВЭЖХ–оценку каждого образца проводили в различные моменты времени для оценки стабильности этих образцов. Результаты показаны в Таблице 8.
[0269] Таблица 8
[0270] При введении элементов настоящего раскрытия или его вариантов осуществления ссылки на единственное число, а также фразы типа «указанный» и «упомянутый», предназначены для обозначения того, что имеется один или более таких элементов. Термины «содержащий», «включающий» и «имеющий» являются инклюзивными и означают, что могут быть дополнительные элементы, отличные от перечисленных элементов.
[0271] Ввиду вышесказанного будет понятно, что некоторые преимущества раскрытия достигнуты, а другие полезные результаты получены. Поскольку в вышеупомянутые процессы и композиции могут быть внесены различные изменения, не выходящие за рамки объема данного раскрытия, предполагается, что все содержимое, приведенное выше в описании и показанное на прилагаемых чертежах, должно интерпретироваться как иллюстративное, а не ограничивающее.
Реферат
Изобретение относится к области медицины, а именно к способу определения скорости клубочковой фильтрации (СКФ) у пациента, нуждающегося в этом. Способ включает введение упомянутому пациенту соединения Формулы I или его фармацевтически приемлемой соли, измерение концентрации соединения Формулы I у упомянутого пациента в течение временного интервала измерения и определение СКФ у упомянутого пациента; где соединение Формулы I представляет собой:и где упомянутый пациент, нуждающийся в этом, имеет по меньшей мере стадию 1 ХБП. Изобретение обеспечивает расширение арсенала средств определения скорости клубочковой фильтрации, а также помогает в диагностике пациентов с ХБП за счет повышения точности. 12 з.п. ф-лы, 8 табл., 19 пр., 30 ил.
Формула


Комментарии