Определение местоположения и анализ перфорированных лоскутов для пластической и восстановительной хирургии - RU2506896C2
Код документа: RU2506896C2
Чертежи







Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет по предварительной заявке США №61/044779, зарегистрированной 14 апреля 2008 года, все содержание которой включено в настоящее описание посредством ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Пластическая и восстановительная хирургия часто влечет за собой определение местоположения и клиническую оценку лоскута кожи и подкожной ткани, который питается изолированными перфорантными сосудами и который потенциально пригоден для трансплантации в другую часть тела. Перфораторы проходят от их исходного сосуда к поверхности кожи через или между глубокими мышечными тканями. Хорошо васкуляризованные лоскуты являются хорошими кандидатами в трансплантаты.
Например, лоскуты брюшной полости с донорского участка стали стандартом для аутогенной реконструкции молочной железы с начала 1980-х годов. Внутри брюшной полости, места, свободные от жира, могут выбираться в диапазоне от полных кожно-мышечных лоскутов поперечной прямой мышцы живота (TRAM) до изолированных перфорированных лоскутов, таких как перфорированный лоскут глубокой нижней эпигастральной артерии (DIEA). Для перфорированных лоскутов разрешен перенос собственной кожи и жира пациента надежным способом также в другие области восстановления ткани с минимальной болезненностью для донорского участка. Лоскуты, которым был свойственен случайный характер кровоснабжения, были вскоре вытеснены лоскутами, имеющими ножку, с осевым характером кровоснабжения, которые позволяют надежно переносить большие количества ткани. Появление свободного переноса ткани предоставило еще больший диапазон возможностей, чтобы соответствующим образом согласовывать участки донора и реципиента. Повышенное использование перфорированных лоскутов обострило потребность в дооперационной совместимости конкретного анатомического признака DIEA пациента и его прободающих ветвей, в частности, учитывая значительное варьирование в этой анатомии кровоснабжения брюшной стенки.
Определение местоположения и оценка перфораторов кропотливый и отнимающий много времени процесс. Для определения местоположения часто выполняется дооперационное получение изображений с использованием компьютерной томографической ангиографии (СТА). Такой подход влечет за собой значительные затраты и обладает дополнительными сложностями, поскольку хирург должен мысленно коррелировать изображения, ранее полученные трехмерным способом, с текущим двумерным изображением пациента, в данный момент лежащего на операционном столе. Поиск более благоприятного способа получения изображения, таким образом, продолжается, и недавно возник интерес к использованию получения флуоресцентного изображения с помощью индоцианина зеленого (ICG), при котором кровообращение оценивается через кожу на основе флуоресцентного сигнала. Флюоресценция с использованием ICG с пиком эмиссии на длине волны приблизительно 830 нм происходит в результате возбуждения излучением в длинноволновой части инфракрасного спектрального диапазона. Возбуждающий свет с длиной волны приблизительно 800 нм может создаваться, например, диодным лазером, светодиодами (LED) или другими традиционными источниками света, такими как дуговые лампы, галогенные лампы с соответствующим полосовым фильтром. Для этой длины волны кожа прозрачна.
ICG прочно связан с белками крови и ранее использовался для измерения функционального состояния сердца, оценки печеночной функции и глазной ангиографии с небольшими побочными реакциями. Оценка флуоресцентных сигналов с использованием ICG может использоваться для определения местоположения перфораторов. Так как, когда вводится ICG, поверхность кожи вблизи перфоратора обычно накапливает больше крови и с более высокой скоростью, чем окружающая ткань, перфораторы имеют тенденцию флуоренсцировать более ярко и быстрее, чем окружающая ткань. Эта быстрая высокоинтенсивная флюоресценция позволяет визуальную локализацию перфоратора. Однако хирурга часто интересует не просто определение местоположения, но также оценка и сравнение, чтобы помочь правильному принятию клинического решения. Хирург должен определить, какие из нескольких перфораторов являются наилучшими кандидатами в трансплантаты. При этом простое визуальное наблюдение во время быстрого накопления и рассеивания флюоресценции недостаточно. Например, при проводимых одна за другой введениях тенденция остаточного ICG накапливаться в ткани и постепенно с каждой инжекцией повышать яркость фона дополнительно вносит затруднение в визуальное различение лучших кандидатов в перфораторы. Кроме того, ICG иногда перемещается чрезвычайно медленно, более чем несколько минут, делая такой экспресс-анализ очень проблематичным и субъективным. Хирург будет делать оценку, задаваясь следующими вопросами:
1) Сколько связанной с ICG крови находится в ткани?
2) Сколько времени он остается в ткани?
3) Как быстро он движется через ткань?
4) После того, как болюс введен, в каком порядке начинают светиться анатомические области?
На эти вопросы трудно ответить на субъективной основе. Соответственно, существует необходимость в более передовой обработке изображения и способах отображения, чтобы применять объективные стандарты для определения местоположения и оценки перфораторов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с одним вариантом изобретения, раскрывается способ дооперационной идентификации перфорантного сосуда для пластической и/или восстановительной хирургии, использующий получение изображения с помощью флюоресцентной ангиографии с индоцианином зеленым (ICG), который содержит этап обработки изображения с временным разрешением, чтобы выделить места расположения перфоратора и обеспечить визуальное различие между перфораторами-кандидатами посредством различных вычисленных метрик. Хирург имеет возможность выбрать и сравнить результаты алгоритмов, которые анализируют временные последовательности и дают в результате метрики, соответствующие, по меньшей мере, одному из следующих действий по обработке.
Определение интегрированной по времени флюоресценции на основе обработки пиксела за пикселом.
Вычисление средней флюоресценции путем деления интегрированной во времени флюоресценции на фактическую продолжительность времени.
Определение скорости увеличения/вымывания флюоресценции.
Определение фактической продолжительности времени до достижения пиковой флюоресценции.
Различные этапы обработки изображения независимо обрабатывают пикселы изображения и вычисляют уникальную числовую метрику для каждого пиксела во входной последовательности, наблюдаемой за все время получения или в выбранном временном субдиапазоне. Каждый вывод изображения, таким образом, является числовой матрицей, имеющей одни и те же размеры, то есть, количество и расстановку пикселов, как и кадр в последовательности входного изображения. Таким образом, обработанное изображение может отображаться, например, как трехмерное представление, например, контурная карта, вычисленных значений пикселов на отображаемой области, или как цветокодированное двумерное изображение или рельефная карта. Такие представления изображения облегчают быстрое понимание особенностей изображения и сравнение между отдельными областями на изображениях, в данном случае, между местами расположения перфораторов под кожей.
Эти и другие признаки и преимущества настоящего изобретения можно будет лучше и проще оценить, ознакомившись с подробным описанием изобретения, приведенным далее.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На перечисленных ниже чертежах представлены определенные пояснительные варианты осуществления изобретения, в которых схожие ссылочные позиции относятся к схожим элементам. Эти представленные варианты осуществления следует понимать как примеры изобретения, а не как ограничивающие его каким-либо образом.
Фиг.1 - схематичное изображение системы с камерой для наблюдения флюоресценции с использованием ICG;
Фиг.2 - флуоресцентное изображение с использованием ICG для участка кожи со значениями пикселов, интегрированными по времени;
Фиг.3 - интегрированное по времени флуоресцентное изображение с использованием ICG для участка кожи со значениями пикселов, инверсно взвешенными по фактической продолжительности времени;
Фиг.4 - флуоресцентное изображение с использованием ICG для участка кожи со значениями пикселов, определяемыми скоростью увеличения флюоресценции;
Фиг.5 - флуоресцентное изображение с использованием ICG для участка кожи со значениями пикселов, определяемыми фактической продолжительностью времени, отнесенными к максимальной флюоресценции; и
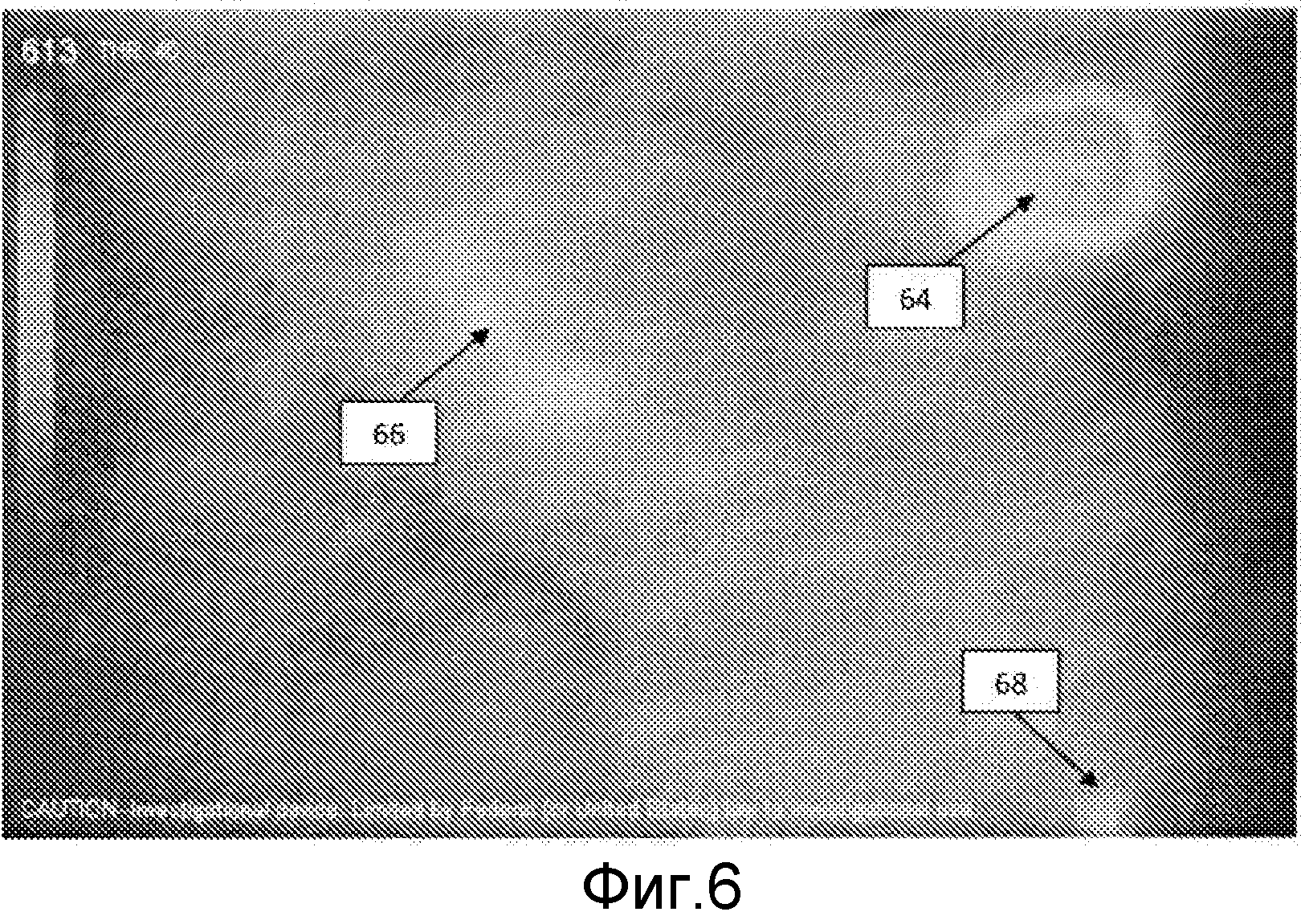
Фиг.6 - флуоресцентное изображение с использованием ICG для участка кожи со значениями пикселов, определяемыми пиковой флюоресценцией;
Фиг.7 - наложение флуоресцентного изображения, обработанного с помощью функции передачи с переменной контрастностью; и
Фиг.8 - наложение флуоресцентного изображения, обработанного другой функцией передачи с переменной контрастностью.
ПОДРОБНОЕ ОПИСАНИЕ
Изобретение направлено на дооперационное определение местоположения перфорантных сосудов в перфорированных лоскутах неинвазивным способом, прежде чем будет сделан какой-либо надрез.
На фиг.1 схематично представлено устройство для неинвазивного, чрескожного определения перфузии ткани в операционных, в частности, дооперационных применениях посредством флуоресцентного получения изображения с использованием ICG. Источник инфракрасного света, например, один или более диодных лазеров или светодиодов, с пиковым излучением на длине волны приблизительно 780-800 нм для возбуждения флюоресценции ICG, располагается в корпусе 1. Флуоресцентный сигнал обнаруживается камерой 2 на приборах с зарядовой связью (CCD), обладающей соответствующей чувствительностью в длинноволновой части инфракрасного спектра; такие камеры коммерчески доступны от нескольких продавцов (Hitachi, Hamamatsu и т.д.). CCD-камера 2 может иметь видоискатель 8, но изображение можно также видеть во время операции на внешнем мониторе, который может быть частью электронной системы 11 обработки и оценки изображений.
Пучок 3 света, который может быть рассеянным или сканирующим пучком, излучается из корпуса 1, чтобы осветить интересующую область 4, то есть область, где, как ожидается, будет расположен лоскут с соответствующими перфорантными сосудами. Интересующая область может охватывать площадь приблизительно 10 см ×10 см, но может изменяться, в зависимости от хирургических требований и доступной освещенности и чувствительности камеры.
Фильтр 6, как правило, располагается перед объективом 7 камеры, чтобы не пропускать возбуждающий свет к датчику камеры, в то же время разрешая прохождение флуоресцентного света. Фильтр 6 может быть длинноволновым пропускающим фильтром в длинноволновой области инфракрасного спектра (ограничивающим фильтром), который прозрачен только для длин волн, больших, чем приблизительно 815 нм или, предпочтительно, полосовым фильтром на пиковых длинах волн между 830 и 845 нм и имеющим полную ширину полосы по половине максимума (FWHM) окна пропускания приблизительно между 10 нм и 25 нм, то есть вне диапазона длин волн возбуждающего излучения. Камера 2 может также быть разработана для получения цветного изображения интересующей области, чтобы позволить корреляцию в реальном времени между флуоресцентным изображением и цветным изображением.
В контексте настоящего изобретения устройство, показанное на фиг.1, используется для идентификации/определения местоположения перфорантных сосудов до операции - это поможет хирургу в выборе наилучшего лоскута или зоны лоскута для использования во время реконструкции.
В других послеоперационных применениях устройство может использоваться для следующих целей.
Проверка правильности анастомотического раскрытого состояния и артериального и венозного кровотоков - это может потенциально улучшить результаты, чтобы устранить отторжение лоскута, которое может быть результатом плохого артериального кровотока и несоответствующей перфузии, а также плохого венозного оттока, приводящего к гиперемии.
Визуализация и подтверждение полной перфузии ткани, поскольку капиллярная перфузия во весь лоскут и собственную ткань критически важна для приживления лоскута.
С помощью изобретения места расположения перфораторов визуализируются посредством способа обработки и представления изображения, чтобы позволить легкое и объективное визуальное различение среди перфораторов-кандидатов. ICG вводится и вся флуоресцентная перфузия с использованием ICG и цикл вымывания фиксируются устройством получения изображения. После получения изображения вся последовательность или некоторый временной субдиапазон изображений обрабатываются алгоритмом обработки изображения, который может выбираться хирургом.
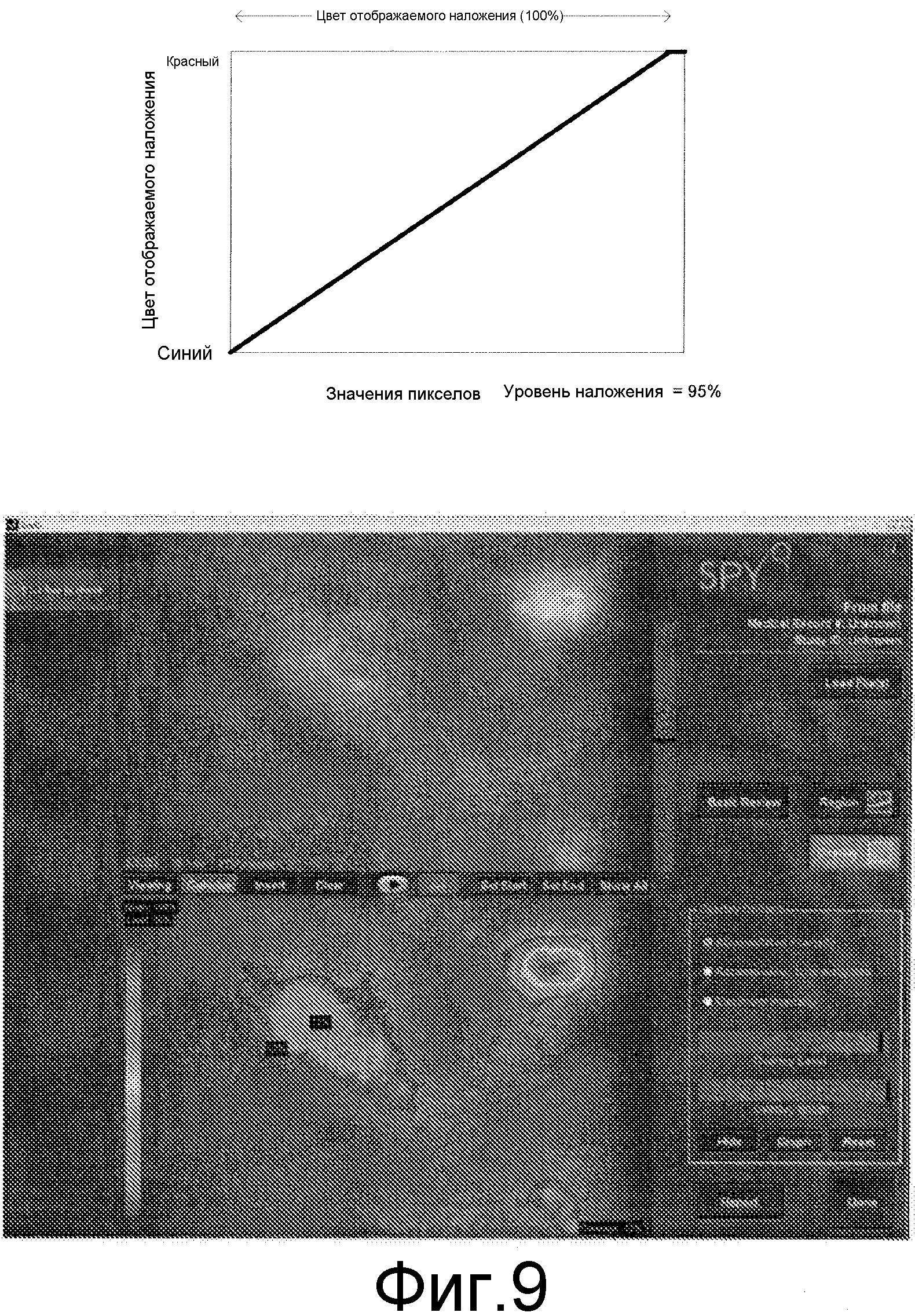
Обработанные результаты флуоресцентных измерений могут визуализироваться, например, как псевдоцветные изображения или как контурная карта, чтобы позволить быструю визуальную оценку, соответствующую примененной метрике алгоритма. Например, интенсивность флуоресценции для каждого пиксела может быть представлена как спектральный цвет, изменяющийся от синего ("холодные" точки или низкая интенсивность или скорость флуоресценции) до красного цвета ("горячие" точки или высокая интенсивность или скорость флюоресценции). Другие спектральные связи легко устанавливаются. Результат может быть представлен как полупрозрачное наложение на первоначальные анатомические изображения. Это позволяет выполнять визуальную корреляцию "горячих" точек с лежащей в их основе анатомией. Значение "горячих" точек меняется в зависимости от используемого алгоритма, и может быть таким, как интегральная интенсивность, взвешенная или невзвешенная, скорость увеличения или вымывания.
Пользователю предоставляется интерактивное управление цветовой картой от "горячего" до "холодного" и он может изменять ее в режиме реального времени, чтобы исследовать более тонкие или более грубые субдиапазоны динамического диапазона выходной метрики каждого алгоритма. По мере того, как цветовое окно расширяется, сначала на первый план выдвигаются самые горячие области, сопровождаемые более холодными областями. Этот вид регулирования может выполняться, изменяя картографию яркости или контраста между полученными пикселами и пикселами в отображаемом изображении. Такие функции картографии могут быть введены в стандартные программы получения изображения. Этот процесс взвешивания с помощью финитной функции, основанный на используемой в настоящее время метрике, помогает в различении перфораторов и усиливает восприятие и улучшает понимание хирургом примененной динамики с использованием ICG.
Изобретение также поддерживает одновременное отображение и оценку двух последовательностей из двух различных мест на коже пациента. Это позволяет сравнивать лоскуты-кандидаты, которые разделены на расстояние, большее, чем поле зрения системы получения изображения.
На фиг.2 показано изображение области кожи пациента, где должны быть идентифицированы соответствующие перфорантные сосуды. Каждый пиксел представляет интеграл по времени интенсивности флуоресценции за время экспозиции для последовательности изображений. Этот режим обычно упоминается как "режим интегрирования" при обработке изображения и многочисленные процессоры изображения предлагают этот режим как стандартную функцию. На практике интенсивности пикселов (накопленные заряды в CCD), полученные во время каждого кадра в последовательности изображений, складываются на основе "пиксел за пикселом", например, в процессоре изображения и делятся на количество кадров, после чего сумма может быть нормализована к фиксированному динамическому диапазону, например, от 1 до 255 (8-битовому). Следует понимать, что более яркие пикселы в изображении представляют участок кожи с притоком большего объема крови, несущей ICG, за заданный промежуток времени. На фиг.2 перфорантный сосуд 24 демонстрирует наивысшую интегральную интенсивность флуоресценции, а другой перфорантный сосуд, демонстрирующий более слабую интенсивность флуоресценции, показан как сосуд 26.
Заметим, что прозрачность изображения была установлена таким образом, что маркер 22 врача видим через прозрачное цветное наложение флуоресцентного изображения с использованием ICG в верхнем правом углу экрана.
На фиг.3 показано интегрированное по времени флуоресцентное изображение с использованием ICG для того же самого участка кожи со значениями пикселов, инверсно взвешенными за фактически прошедшее время. Этот алгоритм обработки изображения подобен ранее описанному интегрированию, но вместо сложения напрямую измеренных интенсивностей каждого пиксела, измеренные значения интенсивности перед сложением сначала делятся на время, фактически прошедшее после начала наблюдения флюоресценции с использованием ICG. Таким образом, более ранним сигналам флюоресценции придается большее значение, чем сигналам флуоресценции, полученным позже. "Самыми горячими" пикселами являются те пикселы, которые в последовательности кадров изображения флуоресцируют раньше, чем другие пикселы, которых болюс с ICG достигает в более позднее время. Тот же самый перфорантный сосуд 34 идентифицируется как на фиг.2, а другой сосуд 36 едва идентифицируется.
На фиг.4 показано флуоресцентное изображение с использованием ICG снова для того же самого участка кожи, со значениями пикселов в этом изображении, определяемыми скоростью увеличения интенсивности флуоресценции. В этом алгоритме обработки изображения зависимость крутизны интенсивности пиксела от фактически прошедшего времени вычисляется для каждого пиксела в изображении. Например, каждый пиксел может иметь назначенное нижнее значение интенсивности (линия отсчета) и назначенное верхнее значение интенсивности (или другое относительно высокое значение интенсивности). Для каждого пиксела отмечаются время, когда интенсивность пиксела пересекает линию отсчета, и время, когда интенсивность пиксела пересекает верхнее значение интенсивности. Из этой информации алгоритм обработки изображения вычисляет скорость увеличения для каждого пиксела в изображении, с "более горячими" пикселами, имеющими большую крутизну, то есть они достигают верхнего значения интенсивности быстрее, чем "более холодные" пикселы. Этот вариант осуществления алгоритма обработки изображения выдвигает, таким образом, на первый план скорость, с которой болюс с ICG достигает перфорантных сосудов. На фиг.4 прозрачность была выключена, так чтобы хирургический инструмент не был видим в изображении.
Ранее идентифицированный перфорантный сосуд, указанный здесь ссылочной позицией 44, определен намного лучше, чем сосуд 46 (ранее показанный как сосуды 26 и 36) и другой сосуд 48.
На фиг.5 показано флуоресцентное изображение с использованием ICG для того же самого участка кожи, со значениями пикселов, определенными за фактически прошедшее время, отнесенными к максимальной флюоресценции. В отличие от фиг.4, которая отображает скорость изменения во времени, алгоритм обработки изображения, представленный на фиг.5, показывает время, в которое пикселы достигают своей максимальной интенсивности, где "более горячие" пикселы достигают своей соответствующей пиковой интенсивности флуоресценции скорее, чем более холодные пикселы. Алгоритм, таким образом, выдвигает на первый план области изображения в том порядке, в котором перфораторы достигают своей пиковой интенсивности. В этом изображении ранее идентифицированные сосуды 24, 34, 44 перфоратора снова ясно различимы как сосуды 56 и 58, которые соответствуют сосудам 46 и 48 на фиг.4.
На фиг.6 показано флуоресцентное изображение с использованием ICG для того же самого участка кожи, со значениями пикселов, определенными пиковым значением флуоресценции в каждом пикселе. Более высокие ("горячие") значения 64 интенсивности флуоресценции могут указывать на более высокую концентрацию ICG или могут быть вызваны перфорантными сосудами, расположенными ближе к поверхности кожи, которая уменьшает поглощение реакции на возбуждающий свет/флуоресценцию. Сосуды 66, 68, которые были ясно видны на фиг.4 и 5, едва различимы от фона.
Хотя изображения, показанные, например, на фиг.2 и 6, представлены с линейной функцией передачи контрастности, обеспечивающей картографию 1:1 для значений пикселов, обработанных различными алгоритмами, описанными выше и примененными к интенсивности отображаемых пикселов, изображения могут также быть представлены (как контурные карты или псевдоцветные наложения) с переменной функцией передачи контрастности, чтобы увеличить визуальные различия в изображении. Кроме того, в наложенные изображения могут быть помещены метки, здесь далее упоминаемые как метки ACR (отношение суммарных или интегрированных по времени интенсивностей), которые облегчают количественное сравнение между двумя или более участками анатомии.
Поскольку абсолютные значения пикселов в изображении изменяются, когда изменяются динамический диапазон и крутизна переменной функции передачи контрастности, метки ACR позволяют пользователю сравнивать относительную перфузию в различных областях изображения, измеренную любым из выбранных способов наложения (например, суммарная/усредненная по времени интенсивность и т.д.).
Описанный ниже подход используется для вычисления значений меток ACR. Для ясности, мы предполагаем, что суммарная интенсивность выбирается в качестве способа наложения, хотя тот же самый подход может использоваться с любым из доступных способов наложения.
1) Суммарная интенсивность для всех пикселов всех изображений в последовательности изображений вычисляется по временному окну.
2) Суммарная интенсивность усредняется по области выбранной метки (например, квадратная матрица пикселов 5×5).
3) Усредненная интенсивность нормализуется к максимальному значению суммарной интенсивности во всем изображении.
4) Нормализованное среднее значение масштабируется, с максимальным значением функции передачи, представляющим 100%.
Следуя этому подходу, относительное отношение двух различных меток ACR остается неизменным даже при том, что крутизна функции передачи изменяется. На фиг.7 и 8 показано флуоресцентное изображение, полученное из последовательности изображений, которые были обработаны одним из упомянутых выше алгоритмов (верхняя часть полутонового изображения), и псевдоцветное наложенное изображение, представляющее суммарную интенсивность для последовательности в цвете (от синего цвета для низких значений до красного цвета для высоких значений) для двух разных функций контрастности. Значения пикселов на фиг.7 обрабатываются первой функцией передачи контрастности, давая две области с интенсивностью 52% и 72%, соответственно, что дает отношение 52/72=0,72 между двумя маркированными областями. Второе наложенное изображение на фиг.8 показывает те же самые значения пикселов, обработанные другой функцией передачи контрастности, с интенсивностью в этих двух областях обозначенных теперь как 99% и 71%, соответственно. Однако, их относительное отношение остается, по существу, неизменным и равным 71/99=0,72.
Пользователь может теперь изменить функцию передачи так, что область управления отмечается как 100% и все другие области могут теперь сравниваться с областью управления.
На фиг. 9 показано, что наложение прозрачно там, где пикселы с суммарной интенсивностью имеют значение, меньшее, чем точка, в которой нижняя часть падающей части функции передачи пересекает горизонтальную ось с величинами пикселов. Дополнительно здесь показано, что в этом примере 12% область изображения (показатель наложения внизу справа в нижнем окне) имеет суммарную интенсивность больше 52% от максимальной суммарной интенсивности. На фигуре показано несколько областей, ограниченных 52-процентными контурами.
Описанные варианты осуществления обнаруживают сигнал флуоресценции, излучаемый чрескожно с использованием ICG после возбуждения в длинноволновой части инфракрасного спектра. Однако специалисты в данной области должны понимать, что другие краски, которые могут возбуждаться и излучать флюоресценцию в спектральном диапазоне, в котором ткань пропускает свет, также могут использоваться.
Хотя настоящее изобретение было описано со ссылкой, например, артериального кровотока, то есть подачи крови к перфорантному(ым) сосуду(ам), способ может также обнаруживать отторжение трансплантата из-за венозного застоя, определяя количество и отображая скорость изменения от пиковой интенсивности обратно вниз до линии отсчета. Это будет указывать на венозный отток в области перфузии.
Хотя возможны различные изменения и альтернативные формы изобретения, его конкретные примеры были показаны на чертежах и здесь описываются подробно. Следует понимать, однако, что изобретение не ограничивается конкретными формами или раскрытыми способами, а, наоборот, изобретение предназначено охватывать все изменения, эквиваленты и альтернативы, соответствующие объему и сущности приложенной формулы изобретения.
Реферат
Изобретение относится к медицине, а именно к средствам оценки перфузии перфорантных сосудов. Способ заключается в обнаружении флуоресцентной реакции ткани после применения болюса с подачей индоцианина зеленого в кровоток, получении временной последовательности изображений флуоресцентной реакции, обработке последовательности изображений и отображении результатов обработки. В результате обработки изображения получают производную интенсивности по времени для значений пикселов в изображениях. Производную интенсивности по времени отображают как цветное или черно-белое изображение. Устройство содержит средства для осуществления этапов способа оценки перфузии перфорантных сосудов. Использование изобретения позволяет выделять места расположения перфоратора и обеспечивать визуальное различие между перфораторами-кандидатами, а также сравнивать лоскуты-кандидаты, которые разделены на расстояние, большее, чем поле зрения системы получения изображения. 2 н.и 5 з.п. ф-лы, 9 ил.
Формула
обнаруживают флуоресцентную реакцию ткани после применения болюса с подачей индоцианина зеленого (ICG) в кровоток,
получают временную последовательность изображений флуоресцентной реакции за заданное время,
обрабатывают последовательность изображений для получения в результате производной интенсивности по времени для значений пикселов в изображениях и
отображают производную интенсивности по времени как цветное или черно-белое изображение.
средство обнаружения флуоресцентной реакции ткани после введения болюса с ICG в кровоток,
средство получения временной последовательности изображений флуоресцентной реакции за заданное время,
средство обработки последовательности изображений для получения в результате производной интенсивности по времени для значений пикселов в изображениях и
средство отображения производной интенсивности по времени в виде цветного или черно-белого изображения.

Комментарии