Инактивация вируса при очистке антител - RU2551237C2
Код документа: RU2551237C2
Чертежи


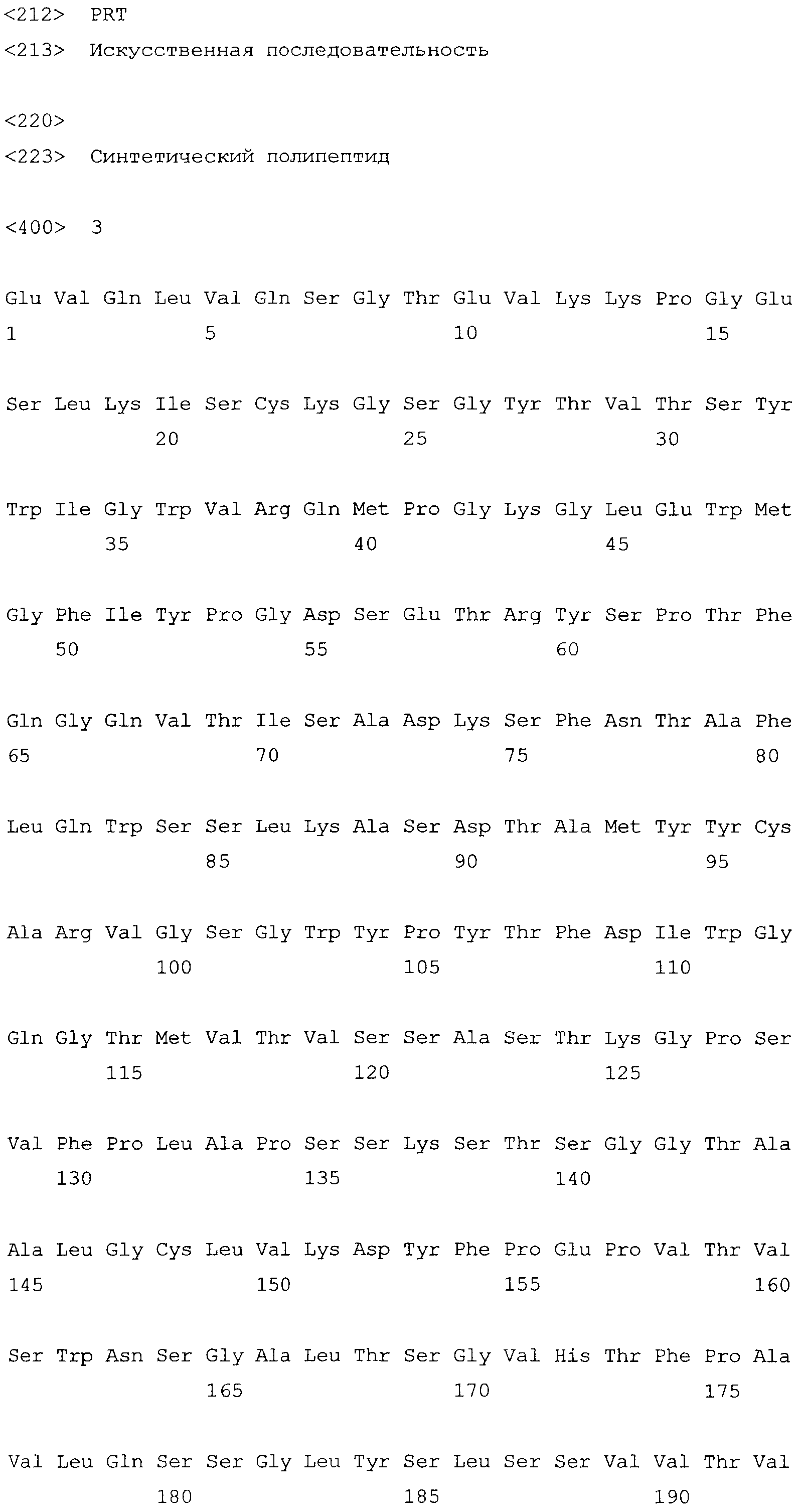








Описание
ИНАКТИВАЦИЯ ВИРУСА ПРИ ОЧИСТКЕ АНТИТЕЛ
Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки на патент США, серийный No. 61/196754, поданной 20 октября 2008 года, которая включена в настоящее описание полностью в качестве ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Процедуры очистки с целью получения моноклональных антител фармацевтической чистоты, образуемых в ферментационной культуре, в типичном случае охватывают четыре основных стадии. Указанные стадии включают: (1) сбор/осветление - выделение штамма-хозяина из ферментационной среды; (2) захват - отделение антитела от большей части компонентов в осветленной среде; (3) тонкую очистку - удаление оставшихся загрязнений в виде клеток-хозяев и агрегатов; и (4) создание композиции - внесение антитела в соответствующий носитель для достижения максимальной стабильности и максимального срока годности.
Однако, часто эти стадии, хотя и необязательно, оставляют некоторое вирусное загрязнение. Таким образом, в настоящее время имеется потребность в способах получения и очистки нужного антитела, подходящего для клинического применения, которые включают снижение и/или инактивацию загрязняющих вредных вирусов. Настоящее изобретение удовлетворяет эту потребность.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам выделения и очистки антител из матричного образца. В одном аспекте, настоящее изобретение относится к инактивации вируса в образцах, полученных на разных стадиях очистки антител. В одном конкретном аспекте, описываемые в настоящем изобретении способы включают стадию кислотной инактивации, за которой следуют одна или несколько стадий хроматографической очистки. Стадии хроматографической очистки могут включать одну или несколько указанных ниже хроматографических процедур, таких как ионообменная хроматография, аффинная хроматография и хроматография гидрофобного взаимодействия. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим одно или несколько антител, полученных и очищенных способом по настоящему изобретению.
В одном варианте, настоящее изобретение относится к способу очистки антитела и его антиген-связывающей части из матричного образца, так что полученная композиция антитела по существу не содержит белков клетки-хозяина (“HCP”). В одном аспекте, матричный образец (или просто «образец») включает собранные клетки из клеточной линии, где указанная клеточная линия используется для продукции специфических антител по настоящему изобретению. В конкретном аспекте, матричный образец получают из клеточной линии, используемой для продукции анти-IL-12 антител; в другом аспекте, матричный образец получают из клеточной линии, используемой для продукции анти-TNF антител; и еще в одном аспекте указанный матричный образец получают из клеточной линии, используемой для продукции анти-IL-18 антител.
Один способ осуществления настоящего изобретения относится к матричному образцу, включающему заданное нужное антитело или его антиген-связывающую часть, где указанное антитело или его часть подвергают коррекции по значению рН. В одном аспекте, значение рН доводят до кислого рН. Примером подходящего рН является значение рН от примерно 3 до примерно 5, предпочтительно примерно 3,5. Указанную обработку проводят, частично, для снижения или инактивации рН-чувствительных вирусов. Кроме снижения количества вирусов и/или их инактивации, создаваемые кислые условия облегчают удаление клеток и клеточных осколков, что приводит к формированию образца первичного извлечения. По прошествии некоторого периода времени, значение рН может быть доведено до более нейтрального или щелочного рН, и в некоторых вариантах, указанный образец подвергают одной или нескольким стадиям хроматографии, включающим, без ограничения, аффинную хроматографию, ионообменную хроматографию и хроматографию гидрофобного взаимодействия.
В одном варианте, стадия аффинной хроматографии включает нанесение образца первичного извлечения на колонку, которая включает подходящий для хроматографии аффинный носитель. Неограничивающие примеры таких хроматографических носителей включают, без ограничения, смолу с белком А, смолу с белком G, аффинные носители, включающие антиген, против которого образуется нужное антитело, и аффинные подложки, включающие Fc-связывающий белок. Смола с белком А используется для аффинной очистки и выделения антител (IgG). В одном аспекте, колонку с белком А уравновешивают подходящим буфером перед нанесением образца. Примером подходящего буфера является Tрис/NaCl буфер с рН примерно 7,2. После уравновешивания, образец может быть нанесен на колонку. После нанесения образца на колонку, колонку промывают один или несколько раз с использованием, например, уравновешивающего буфера. Другие промывки, включающие разные буферы, могут применяться до элюции образца с колонки. Колонка с белком А может быть подвергнута элюции с использованием подходящего элюирующего буфера. Примером подходящего элюирующего буфера является буфер на основе уксусной кислоты/NaCl, рН примерно 3,5. Полученный элюат далее анализируют с использованием методик, известных специалистам в данной области. Так, например, может определяться поглощение при длине волны 280. После элюции может быть получена одна или несколько представляющих интерес фракций, для дальнейшей обработки.
В некоторых вариантах осуществления настоящего изобретения, указанный образец подвергают одной или нескольким дополнительным процедурам хроматографического разделения. В одном аспекте, образец первичного извлечения подвергают ионообменной хроматографии. В рамках этого варианта, стадия ионного обмена может представлять собой хроматографию на основе катионного или анионного обмена или их сочетание. Указанная стадия может включать множество стадий ионного обмена, например, стадия катионного обмена может предшествовать стадии анионного обмена или наоборот. В одном аспекте, стадия ионного обмена включает двухстадийный ионообменный процесс. В конкретном аспекте, за первой стадией катионного обмена следует вторая стадия анионного обмена. Подходящая катионообменная колонка представляет собой колонку, в которой стационарная фаза включает анионные группы. Примером такой колонки является колонка с Fractogel SO3-. Указанная стадия хроматографии, включающая ионообменный захват, облегчает выделение представляющего интерес антитела из образца первичного извлечения. Подходящая анионообменная колонка представляет собой колонку, в которой стационарная фаза включает катионные группы. Примером такой колонки является колонка с Q-СефарозойТМ (SepharoseTM). Используемые для очистки одна или несколько ионообменных стадий позволяют улучшить выделение антител за счет снижения количества примесей, таких как белки и ДНК клетки-хозяина и, где это применимо, от белка аффинной матрицы. Указанная анионообменная процедура представляет собой способ проточной хроматографии (в отличие от процедуры катионного обмена), где антитела не взаимодействуют или не связываются с анионообменной смолой (или с твердой фазой). Однако, многие примеси взаимодействуют с анионообменной смолой и связываются с ней.
В другом варианте осуществления настоящего изобретения, образец, полученный после стадии ионного обмена, подвергают следующей процедуре хроматографии. В одном аспекте, следующая стадия хроматографии включает использование хроматографии гидрофобного взаимодействия (“HIC”). В этом случае, используется колонка, в которой стационарная фаза включает гидрофобные группы. Примером такой колонки является колонка с фенил-СефарозойТМ. Вполне возможно, что антитела содержат агрегаты, образованные в ходе выделения/очистки. И, в этой связи, стадия хроматографии гидрофобного взаимодействия облегчает удаление таких агрегатов. Она также помогает удалять примеси. В данной процедуре используется буфер с высоким содержанием соли, что облегчает взаимодействие антител (или их агрегатов) с гидрофобной колонкой. Элюцию с колонки проводят с использованием низких концентраций соли.
В одном варианте, первая и вторая стадии ионного обмена проводятся после первичного извлечения. В этом варианте, образец после ионного обмена подвергают промежуточной стадии фильтрования. В одном аспекте, стадия фильтрования включает захват в ходе ультрафильтрации/диафильтрации (“UF/DF”). Указанная стадия фильтрования облегчает очистку, в частности, за счет концентрирования антител и их антиген-связывающих частиц.
В другом варианте, элюат после очистки на стадии хроматографии гидрофобного взаимодействия (HIC) фильтруют через фильтр для удаления вирусов, такой как фильтр Ultipor DV50TM. Эта процедура позволяет отделить вирусные частицы от фенильного элюата для снижения количества вируса (если он присутствует) до безопасных уровней. Любые фильтры, известные специалистам в данной области, могут использоваться в этом варианте осуществления настоящего изобретения.
Чистота моноклональных антител в образце полученного продукта может быть проанализирована с использованием методов, известных специалистам в данной области, например, в рамках вестерн-блот-анализа.
В еще одном варианте, настоящее изобретение относится к одной или нескольким фармацевтическим композициям, содержащим выделенное моноклональное антитело или его антиген-связывающую часть и подходящий носитель. В другом аспекте, указанная композиция также включает один или несколько фармацевтических агентов.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг.1 приведены последовательности тяжелой и легкой цепи вариабельного участка для взятого в качестве неограничивающего примера анти-IL-12 антитела (АВТ-847).
На фиг.2 приведены последовательности тяжелой и легкой цепи для взятого в качестве неограничивающего примера анти-IL-18 антитела (АВТ-325).
На фиг.3 приведены последовательности тяжелой и легкой цепи для взятого в качестве неограничивающего примера анти-TNFα антитела (АВТ-847) (Adalimumab).
На фиг.4 приведена, в варианте неограничивающего примера, схема очистки по настоящему изобретению.
На фиг.5 показана фотография, иллюстрирующая электрофорез в полиакриламидном геле, где видно, что подлежащая очистке молекула антитела остается в растворе при снижении рН в осветленной культуральной среде.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам выделения и очистки антител из матричного образца. Один аспект настоящего изобретения относится к вирусной инактивации в образцах, полученных на различных стадиях очистки антитела. В конкретном аспекте, описываемые в настоящем изобретении способы включают стадию кислотной инактивации, за которой следует одна или несколько стадий хроматографии. Cтадии хроматографии могут включать одну или несколько приведенных ниже хроматографических процедур: ионообменную хроматографию, аффинную хроматографию и хроматографию гидрофобного взаимодействия. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим одно или несколько антител, полученных и очищенных способом по настоящему изобретению.
Для ясности, но не с целью ограничения, приведенное ниже подробное описание будет разделено на несколько подразделов:
1. Определения;
2. Образование антитела;
3. Продукция антитела;
4. Очистка антитела;
5. Способы оценки чистоты образца;
6. Дополнительные модификации;
7. Фармацевтические композиции; и
8. Применение антител.
1. Определения
Для лучшего пояснения настоящего изобретения ниже приводятся определения некоторых используемых в нем терминов.
Термин «антитело» включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, двух тяжелых (Н) и двух легких (L) цепей, связанных дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в описании как HCVR или VH) и константной области тяжелой цепи (СН). Константная область тяжелой цепи состоит из трех доменов, CH1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в описании как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH и VL области, в свою очередь, могут быть разделены на области гипервариабельности, так называемые определяющие комплементарность области (CDR), между которыми располагаются более консервативные зоны, известные как каркасные области (FR). Каждая из областей VH и VL состоит из трех CDR и четырех FR, сгруппированных в следующем порядке, начиная от амино-конца к карбоксильному концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин «антиген-связывающая часть» антитела (или просто «часть антитела») обозначает фрагмент антитела, который сохраняет способность специфически связываться с антигеном (например, hIL-12, hTNFa или hIL-18). Было показано, что антиген-связывающая функция антитела может осуществляться фрагментами антитела полной длины. Примеры связывающихся фрагментов, охватываемых термином «антиген-связывающая часть», включают (i) Fab фрагмент, одновалентный фрагмент, включающий VL, VH, CL и CH1 домены; (ii) F(ab')2, фрагмент, двухвалентный фрагмент, включающий два Fab фрагмента, соединенных дисульфидной связью в шарнирной области; (iii) Fd фрагмент, включающий VH и CH1 домены; (iv) Fv фрагмент, включающий VL и VH домены одного плеча антитела; (v) dAb фрагмент (Ward et al., (1989) Nature 341:544-546, где полное описание данной работы включено в настоящую заявку в качестве ссылки), который включает VH домен; и (vi) выделенная определяющая комплементарность область (CDR). Кроме того, несмотря на то, что два домена Fv фрагмента, VL и VH, кодируются разными генами, они могут быть соединены в рамках рекомбинантных методов через синтетический линкер, который позволяет получать из них одну белковую цепь, в которой VL и VH области спариваются с образованием одновалентных молекул (известных как одноцепочечной Fv (scFv); см. также. Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883, полное описание которых включено в настоящую работу в качестве ссылки). Такие одноцепочечные молекулы также охватываются термином «антиген-связывающая часть» антитела. Другие формы одноцепочечных антител, такие как диатела, также охватываются настоящим термином. Диатела представляют собой двухвалентные, биспецифические антитела, в которых VH и VL домены экспрессируются на одной полипептидной цепи, но с использованием линкера, который слишком короток для того, чтобы обеспечить спаривание между двумя доменами на одной цепи, что заставляет домены спариваться с комплементарными доменами на другой цепи с образованием двух антиген-связывающих сайтов (см., например,Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R. J., et al. (1994) Structure 2:1121-1123, полное описание которых включено в настоящую работу в качестве ссылки). Кроме того, антитело или его антиген-связывающая часть может представлять собой часть более крупной молекулы иммуноадгезии, образуемой за счет ковалентной или нековалентной ассоциации антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры использования таких молекул иммуноадгезии включают создание тетрамерной scFv молекулы с помощью ядерного участка стрептавидина (Kipriyanov, S. M., et al. (1995) Human Antibodies and Hybridomas 6:93-101, где полное описание данной работы включено в настоящую заявку в качестве ссылки) и использование цистеинового остатка, маркерного пептида и C-концевой полигистидиновой метки для создания бивалентных и биотинилированных scFv молекул (Kipriyanov, S. M., et al. (1994) Mol. Immunol. 31:1047-1058, где полное описание данной работы включено в настоящую заявку в качестве ссылки). Части антител, такие как Fab и F(ab')2, могут быть получены из полных антител с использованием стандартных методик, таких как расщепление полноразмерных антител папаином или пепсином, соответственно. Кроме того, антитела, части антител и молекулы иммуноадгезии могут быть получены с использованием стандартных методик рекомбинантных ДНК, приведенных в настоящем описании. В одном аспекте, антиген-связывающие части представляют собой полные домены или пары полных доменов.
Фраза «человеческий интерлейкин 12» (сокращенно обозначаемый как hIL-12 или IL-12) в контексте настоящего описания обозначает человеческий цитокин, который секретируется преимущественно макрофагами и дендритными клетками. Данный термин включает гетеродимерный белок, содержащий субъединицу размером 35 кДа (p35) и субъединицу размером 40 кДа (p40), которые соединены через дисульфидный мостик. Указанный гетеродимерный белок обозначается в настоящем описании как «субъединица р70». Структура человеческого IL-12 описана также в других работах, например, Kobayashi, et al. (1989) J. Exp Med. 170:827-845; Seder, et al. (1993) Proc. Natl. Acad. Sci. 90:10188-10192; Ling, et al. (1995) J. Exp Med. 154:116-127; Podlaski, et al. (1992) Arch. Biochem. Biophys. 294:230-237, полное описание которых включено в настоящую работу в качестве ссылки. Нуклеиновая кислота, кодирующая IL-12, доступна от GenBank с номером доступа No. NM_000882 и полипептидная последовательность доступна от GenBank с номером доступа No. NP_000873.2. Термин человеческий IL-12 в контексте настоящего описания включает рекомбинантный человеческий IL-12 (rh IL-12), который может быть получен стандартными методами рекомбинантной экспрессии.
Фраза «человеческий интерлейкин 18» (сокращенно обозначаемый в настоящем описании как hIL-18 или IL-18) в контексте настоящего описания обозначает человеческий цитокин, который вначале синтезируется как биологически неактивный белок-предшественник из 193 аминокислот, а также зрелый белок, состоящий из 156 аминокислот, образуемый, например, без ограничения, путем расщепления белка-предшественника, в частности, каспазой-1 или каспазой-4, которые обладает биологической активностью, включающей костимуляцию Т-клеточной пролиферации, усиление цитотоксической активности NK-клеток, индукцию образования IFN-γ Т-клетками и NK-клетками и потенцирование дифференцировки Т-хелперов типа 1 (Th1). Нуклеиновая кислота, кодирующая IL-18, доступна от GenBank с номером доступа No. NM_001562 и полипептидная последовательность доступна от GenBank с номером доступа No. NP_001553. Термин человеческий IL-18, в контексте настоящего описания, включает рекомбинантный человеческий IL-18 (rh IL-18), который может быть получен стандартными методами рекомбинантной экспрессии.
Фраза «человеческий фактор-α некроза опухолевых клеток» (обозначаемый в настоящем описании как hTNFα или TNFα) представляет собой полифункциональный провоспалительный цитокин, секретируемый преимущественно моноцитами/макрофагами, который оказывает эффект на липидный метаболизм, коагуляцию, инсулинорезистентность и функцию эндотелия. TNFα предсталяет собой растворимый гомотример, состоящий из белковых субъединиц размером 17 кДа. Существует также связанная с мембраной форма предшественника TNFα размером 26 кДа. Она была обнаружена в синовиальных клетках и макрофагах в тканях. Клетки, отличные от моноцитов или макрофагов, также продуцируют TNFα. Так, например, человеческие линии опухолевых клеток не моноцитарного типа продуцируют TNFα, а также CD4+ и CD8+ Т лимфоциты периферической крови и некоторые культуры Т- и В-клеточных линий продуцируют TNFα. Нуклеиновая кислота, кодирующая TNFα, доступна от GenBank с номером доступа No. X02910 и полипептидная последовательность доступна от GenBank с номером доступа No. CAA26669. Термин человеческий TNFα в контексте настоящего описания включает рекомбинантный человеческий TNFα (rh TNFa), который может быть получен стандартными методами рекомбинантной экспрессии.
Термины «нумерация по Кабату», «определение по Кабату» и «обозначение по Кабату» используются в настоящем описании взаимозаменяемо. Данные термины, известные в настоящей области, относятся в системе нумерации аминокислотных остатков, которые являются более вариабельными (в частности, гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепи антитела или его антиген-связывающей части (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 and, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, где полное описание данной работы включено в настоящую заявку в качестве ссылки). В случае вариабельной области тяжелой цепи, гипервариабельная область простирается на участке аминокислот 31-35 для CDR1, на участке аминокислот 50-65 для CDR2 и на участке аминокислот 95-102 для CDR3. В случае вариабельной области легкой цепи, гипервариабельная область располагается на участке аминокислот 24-34 в CDR1, на участке аминокислот 50-56 в CDR2 и на участке аминокислот 89-97 в CDR3.
Термин «человеческое антитело» включает антитела, содержащие вариабельные и константные области, которые соответствуют последовательностям человеческих зародышевых иммуноглобулинов, как это описано в работе Kabat et al. (см. Kabat, et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Человеческие антитела по настоящему изобретению могут включать аминокислотные остатки, которые не кодируются последовательностями иммуноглобулина человеческой зародышевой линии (т.е. имеются мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или за счет соматической мутации in vivo), например, в CDR и в перинуклеарных CDR3. Указанные мутации могут быть введены с использованием «стратегии селективного мутагенеза». Человеческое антитело может иметь, по меньшей мере, одно положение, замещенное аминокислотным остатком, например, аминокислотным остатком, повышающим активность, где указанный остаток не кодируется последовательностью иммуноглобулина зародышевой линии человека. Человеческое антитело может содержать до двадцати положений, замещенных аминокислотными остатками, которые не являются частью последовательности иммуноглобулина человеческой зародышевой линии. В других вариантах, может быть замещено до десяти, до пяти, до трех или до двух положений. В одном варианте, указанные замещения осуществляются в пределах областей CDR. Однако, термин «человеческое антитело» в контексте настоящего описания не включает те антитела, в которых CDR последовательности, полученные из зародышевой линии других материнского вида млекопитающего, такого как мышь, были перенесены на каркасные последовательности человеческой молекулы.
Фраза «стратегия селективного мутагенеза» включает способ повышения активности антитела за счет выбора и введения мутаций в отдельные аминокислоты в области CDR, по меньшей мере, в одном положении, подходящем для селективного мутагенеза, гипермутации, и/или в контактное положение. «Селективно мутированное» человеческое антитело представляет собой антитело, которое включает мутацию в положении, выбранном с использованием стратегии селективного мутагенеза. В другом аспекте, стратегия селективного мутагенеза представляет собой способ предпочтительного мутирования выбранных индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 в вариабельной области тяжелой цепи (далее обозначаемых как H1, H2 и H3, соответственно) или в CDR1, CDR2 или CDR3 в вариабельной области легкой цепи (далее обозначаемых как L1, L2 и L3, соответственно) антитела. Аминокислотные остатки могут быть выбраны из подходящих для селективного мутагенеза положений, контактных положений или гипермутированных положений. Индивидуальные аминокислоты выбирают на основании их положения в вариабельной области легкой или тяжелой цепи. Следует понимать, что положение гипермутации может также представлять собой контактное положение. В одном аспекте, стратегия селективного мутагенеза представляет собой «направленную стратегию». Термин «направленная стратегия» включает способ мутации индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 в вариабельной области тяжелой цепи или в CDR1, CDR2 или CDR3 в вариабельной области легкой цепи антитела заданным образом, т.е. представляет собой «стратегию групповой направленности» или «стратегию CDR-направленности». В рамках «стратегии групповой направленности» индивидуальные аминокислотные остатки в определенных группах являются мишенью для селективных мутаций, включающих группы 1 (включая L3 и H3), II (включая H2 и L1) и III (включая L2 и H1), где указанные группы были перечислены в порядке их предпочтительности для воздействия на них в качестве мишеней. В рамках «стратегии CDR-направленности», индивидуальные аминокислотные остатки в определенных CDR являются мишенью для селективных мутаций, где порядке их предпочтительности в качестве мишеней описан ниже: H3, L3, H2, L1, H1 и L2. В выбранные аминокислотные остатки вводят мутации, например, по меньшей мере, до двух других аминокислотных остатков, и определяют эффект созданной мутации на активность антитела. Активность оценивают как изменение в специфичности/аффинности связывания антитела и/или в нейтрализующей способности антитела. Следует понимать, что стратегия селективного мутагенеза может использоваться для оптимизации любого антитела, полученного из любого источника, включая фаговый дисплей, трансгенных животных с генами зародышевых линий человеческого IgG, человеческие антитела, выделенные из человеческих B-клеток. Стратегия селективного мутагенеза может использоваться применительно к антителам, которые не могут быть оптимизированы в достаточной мере с использованием методики фагового дисплея. Следует понимать, что антитела из любого источника, включая фаговый дисплей, трансгенных животных с генами зародышевой линии человеческого IgG, человеческие антитела, выделенные из B-клеток, могут быть подвергнуты обратной мутации (back-мутации) до или после осуществления стратегии селективного мутагенеза.
Фраза «рекомбинантное человеческое антитело» включает человеческие антитела, которые получают, экспрессируют, создают или выделяют методами рекомбинантной технологии, такие как антитела, экспрессированные с использованием вектора рекомбинантной экспрессии, трансфицированного в клетку-хозяин, антитела, выделенные из библиотеки рекомбинантных, комбинаторных человеческих антител, антитела, выделенные из животного (например, мыши), которые являются трансгенными для генов человеческого иммуноглобулина (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295, где полное описание работы включено в настоящую заявку в качестве ссылки), или антитела, полученные, экспрессированные, созданные или выделенные с использованием любых других способов, которые включают сплайсинг последовательностей гена человеческого иммуноглобулина с образованием других последовательностей ДНК. Такие рекомбинантные человеческие антитела содержат вариабельные и константные области, полученные из последовательностей зародышевой линии человеческого иммуноглобулина (см., Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). В некоторых вариантах осуществления настоящего изобретения, такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, в том случае, когда используют последовательности животного, трансгенные для последовательностей человеческого Ig, соматическому мутагенезу in vivo) и, в этой связи, аминокислотные последовательности VH и VL областей рекомбинантных антител представляют собой последовательности, которые, будучи полученными из зародышевой линии человеческих VH и VL или связанными с ними, могут в природных условиях не встречаться в репертуаре зародышевой линии человеческих антител in vivo. В некоторых вариантах осуществления настоящего изобретения, такие рекомбинантные антитела представляют собой результат селективного мутагенеза или back-мутации (обратной мутации) или обеих этих стратегий.
Термин «выделенное антитело» обозначает антитело, которое по существу не содержит других антител, обладающих другими антигенными специфичностями (например, выделенное антитело, которое специфически связывается с hIL-12, по существу не содержит антител, которые специфически связываются с антигенами, отличными от hIL-12). Выделенное антитело, которое специфически связывается с hIL-12, может связываться с молекулами IL-12 из другого вида. Кроме того, выделенное антитело может по существу не содержать другого клеточного материала и/или других химических веществ. Подходящие анти-IL-12, которые могут быть получены и очищены в рамках настоящего изобретения, описаны в патенте США No. 6914128 (который включен в настоящее описание полностью в качестве ссылки), где указанные антитела включают, без ограничения, анти-IL-12 антитело, которое было описано в указанном патенте как J695 и которое впоследствии было идентифицировано как ABT-874. Подходящие анти-IL-18 антитела, которые могут быть получены, очищены и выделены в рамках настоящего изобретения, описаны в патентах США NoNo. 09/780035 и 10/988360, которые включают антитело, впоследствии идентифицированное как ABT-325. Соответствующее анти-TNFα антитело представляет Адалимумаб (Adalimumab (Abbott Laboratories)).
Термин «нейтрализующее антитело» (или «антитело, которое нейтрализует активность hIL-12») обозначает антитело, которое, связываясь с hIL-12, приводит к ингибированию биологической активности hIL-12. Такое ингибирование биологической активности hIL-12 можно оценить при измерении одного или нескольких показателей биологической активности hIL-12, например, в тесте на ингибирование пролиферации человеческих бластных клеток, образующих фитогемагглютинин (PHA), или в тесте на ингибирование связывания рецептора в тесте на связывание рецептора человеческого IL-12. Указанные показатели биологической активности могут быть оценены с использованием одного или нескольких стандартных тестов in vitro или in vivo, известных в данной области.
Термин «нейтрализующее антитело» (или «антитело, которое нейтрализует активность hIL-18») обозначает антитело, которое, связываясь с hIL-18, приводит к ингибированию биологической активности hIL-18. Такое ингибирование биологической активности hIL-18 можно оценить при измерении одного или нескольких показателей биологической активности hIL-18, например, по индукции образования IFNγ T-клетками или NK-клетками или по ингибированию связывания рецептора IL-18 в тесте на связывание человеческого рецептора IL-18. Указанные показатели биологической активности hIL-18 могут быть оценены с использованием одного или нескольких стандартных тестов in vitro или in vivo, известных в данной области.
Термин «активность» обозначает активность, такую как специфичность/аффинность антитела в отношении антигена, например, анти-hIL-12 антитела, которое связывается с антигеном IL-12, и/или обозначает нейтрализующую способность антитела, например, анти-hIL-12 антитела, которое при связывании с hIL-12, ингибирует биологическую активность hIL-12, например, ингибирует бластную пролиферацию в РНА тесте или ингибирует связывание рецептора в тесте на связывание рецептора человеческого IL-12. Термин «активность» также обозначает активность, такую как специфичность /аффинность анти-IL-18 антитела в отношении своего антигена, например, анти-hIL-18 антитела, которое связывается с антигеном IL-18, и/или обозначает нейтрализующую способность антитела, такого как анти-hIL-18 антитело, которое при связывании с антигеном hIL-18 ингибирует биологическую активность hIL-18. Термин «активность» также обозначает другие виды активности, такие как специфичность/аффинность анти-TNFα антитела в отношении своего антигена, например, анти-TNFα антитела, которое связывается с антигеном TNFα, и/или обозначает нейтрализующую способность антитела, например, анти-TNFα антитела, которое, связываясь с hTNFα, ингибирует биологическую активность hTNFα.
Фраза «поверхностный плазмонный резонанс» обозначает оптическое явление, которое позволяет проводить анализ биоспецифических взаимодействий в масштабе реального времени путем выявления изменений в концентрации белка в биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.). Более подробное объяснение дано в работах Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19-20; Jonsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, В., el al. (1995) J. Mol. Recognit. 8:125-131; и Johnnson, В., et al. (1991) Anal. Biochem. 198:268-277, полное описание которых включено в настоящую заявку.
Термин «Koff» в контексте настоящего описания обозначает скорость диссоциации антитела из комплекса антитело/антиген.
Термин «Kd» в контексте настоящего описания обозначает константу диссоциации для случая конкретного взаимодействия антитело-антиген.
Фраза «молекула нуклеиновой кислоты» обозначает молекулу ДНК и молекулу РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но в одном аспекте это двухцепочечная ДНК.
Фраза «выделенная молекула нуклеиновой кислоты» в контексте настоящего описания относится к нуклеиновым кислотам, кодирующим антитела или части антител (например, VH, VL, CDR3), например, такие, которые связываются с hIL-12, hTNFa и hIL-18, и включают молекулу нуклеиновой кислоты, в которой нуклеотидная последовательность, кодирующая антитело или часть антитела, не содержит других нуклеотидных последовательностей, кодирующих антитела или части антител, которые связываются с антигенами, отличными от hIL-12, hTNFa или hIL-18, и где другие последовательности могут в природном состоянии фланкировать молекулу нуклеиновой кислоты в ДНК человеческого генома. Таким образом, например, выделенная нуклеиновая кислота по настоящему изобретению, кодирующая VH область анти-IL-12h, анти-TNFα или анти-hIL-18 антитела, не содержит других последовательностей, кодирующих другие VH области, которые связываются с антигенами, отличными, например, от IL-12, hTNFα или hIL-18. Фраза «выделенная молекула нуклеиновой кислоты» также обозначает последовательности, кодирующие бивалентные, биспецифические антитела, такие как антитела, в которых VH и VL области не содержат других последовательностей, отличных от последовательностей данного диатела.
Фраза «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») обозначает клетку, в которую был встроен рекомбинантный вектор экспрессии. Следует понимать, что такие термины относятся не только к конкретной рассматриваемой клетке, но и к потомству такой клетки. Поскольку в последующих поколениях могут возникать определенные модификации, связанные с мутацией или влиянием окружающей среды, то такое потомство фактически может быть неидентичным исходной клетке, но оно также охватывается термином «клетка-хозяин».
Термин «модификация» в контексте настоящего описания относится к изменению одной или нескольких аминокислот в антителах или их антиген-связывающих частях. Указанное изменение может быть получено за счет добавления, замещения или делеции аминокислоты в одном или нескольких положениях. Такое изменение может быть создано с использованием известных методик, таких как мутагенез в рамках ПЦР.
Термин «примерно» в контексте настоящего описания относится к диапазонам, который примерно на 10-20% больше или меньше указанного значения. В некоторых случаях, как это очевидно специалистам в данной области, в связи с природой указанного значения, термин «примерно» может означать большую или меньшую величину отклонения, чем 10-20% от приведенной величины.
Фраза «снижение/инактивация вируса» в контексте настоящего описания относится к снижению числа вирусных частиц в конкретном образце («снижение»), а также к снижению активности, в частности, без ограничения, к снижению инфекционности или способности к репликации вирусных частиц в конкретном образце («инактивация»). Такое снижение числа и/или активности вирусных частиц может достигать величин от примерно 1% до примерно 99%, предпочтительно от примерно 20% до примерно 99%, более предпочтительно от примерно 30% до примерно 99%, боле предпочтительно от примерно 40% до примерно 99%, еще более предпочтительно от примерно 50% до примерно 99%, еще более предпочтительно от примерно 60% до примерно 99%, и еще более предпочтительно от примерно 70% до примерно 99%, и еще более предпочтительно от примерно 80% до 99%, и еще более предпочтительно от примерно 90% до примерно 99%. В некоторых неограничивающих вариантах, количество вируса, если он присутствует, в очищенном антителе будет меньше, чем величина ID50 (количество вируса, которое будет инфицировать 50 процентов целевой популяции) для данного вируса, предпочтительно, по меньшей мере, в 10 раз меньше, чем показатель ID50 для данного вируса, более предпочтительно, по меньшей мере, в 100 раз меньше, чем показатель ID50 для данного вируса, и еще более предпочтительно, по меньшей мере, в 1000 раз меньше, чем показатель ID50 для данного вируса.
Фраза «контактное положение» относится к положению аминокислоты в CDR1, CDR2 или CDR3 в вариабельной области тяжелой цепи или в вариабельной области легкой цепи антитела, которое занимает аминокислота, контактирующая с антигеном в одной из двадцати шести известных структур антитело-антиген. Если аминокислота CDR в любой из двадцати шести известных структур комплексов антитело-антиген контактируют с антигеном, то такая аминокислота может рассматриваться как занимающая контактное положение. Контактное положение характеризуется повышенной вероятностью быть занятым аминокислотой, которая контактирует с антигеном, чем в неконтактном положении. В одном аспекте, контактное положение представляет собой CDR положение, которое содержит аминокислоту, которая контактирует с антигеном более чем в 3 из 26 структур (>1,5%). В другом аспекте, контактное положение представляет собой CDR положение, которое содержит аминокислоту, которая контактирует с антигеном более чем в 8 из 25 структур (>32%).
2. Образование антител
Термин «антитело» в контексте настоящего описания относится к интактному антителу или к его антиген-связывающему фрагменту.
Антитела по настоящему изобретению могут быть получены с использованием множества методик, включающих иммунизацию животного целевым антигеном с последующим получением моноклональных антител традиционным способом, например, гибридизацией соматических клеток согласно методике Колера и Мильштейна (Kohler and Milstein (1975) Nature 256: 495). Хотя некоторые процедуры гибридизации являются предпочтительными, в принципе могут использоваться другие методики для получения моноклонального антитела, например, основанные на вирусной или онкогенной трансформации В-лимфоцитов.
Одной предпочтительной животной системой для получения гибридом является система с использованием мышей. Продукция гибридом представляет собой хорошо установленную процедуру. Протокол иммунизации и методики выделения иммунизированных спленоцитов с целью их последующего слияния известны в данной области. Компоненты для проведения слияния (например, миеломные клетки мышей) и процедуры слияния также известны.
Антитело представляет собой предпочтительно человеческое, химерное или гуманизированное антитело. Химерные или гуманизированные антитела по настоящему изобретению могут быть получены на основе последовательности отличного от человеческого моноклонального антитела, полученного по описанной выше процедуре. ДНК, кодирующая тяжелую и легкую цепь иммуноглобулинов, может быть получена на основе соответствующей гибридомы, отличной от человеческой гибридомы, с последующим проведением процедур конструирования с целью создания немышиных (например, человеческих) иммуноглобулиновых последовательностей с использованием стандартных методик молекулярной биологии. Так, например, для получения химерного антитела вариабельные области мышиной молекулы могут быть соединены с константными областями человеческой молекулы с использованием известных методик (см., например, патент США No. 4816567, Cabilly et al.). Для получения гуманизированного антитела, мышиные области CDR могут быть встроены в рамку считывания человеческий молекулы с использованием известных методик (см, например, патент США No. 5225539, Winter и патенты США NoNo. 5530101; 5585089; 5693762 и 6180370, Queen et al.).
В одном неограничивающем варианте осуществления настоящего изобретения, рассматриваемые в нем антитела, представляют собой человеческие моноклональные антитела. Такие человеческие моноклональные антитела против IL-12, hTNFα или IL-18 могут быть получены с использованием трансгенных или трансхромосомных мышей, содержащих части иммунной системы человека, а не мышиной системы. Такие трансгенные и трансхромосомные мыши включают мышей, обозначенных в данном описании как HuMAb Mouse® (Medarex, Inc.), KM Mouse® (Medarex, Inc.) и XenoMouse® (Amgen).
Кроме того, в данной области доступны альтернативные трансхромосомные животные системы, экспрессирующие гены человеческого иммуноглобулина, и они могут быть использованы для получения антител по настоящему изобретению, таких как анти-IL-12, анти-TNFα или анти-IL-18 антитела. Так, например, могут использоваться мыши, содержащие как трансхромосомные молекулы с тяжелой цепью человека, так и трансхромосомные молекулы с легкой цепью человека, обозначаемые в настоящем описании как «TC мыши»; такие мыши описаны в работе Tomizuka et al. (2000) Proc. Natl. Acad. Sci. USA 97:722-727. Кроме того, были описаны коровы, содержащие трансхромосомные молекулы с тяжелой цепью и легкой цепью (например, Kuroiwa et al. (2002) Nature Biotechnology 20:889-894 и PCT заявка No. WO 2002/092812) и они могут использоваться для получения анти-IL-12, анти-TNFα или анти-IL-18 антител по настоящему описанию.
Рекомбинантные человеческие антитела по настоящему изобретению включают, без ограничения, анти-IL-12, анти-TNFα или анти-IL-18 антитела или их антиген-связывающую часть или антитела, родственные анти-IL-12, родственные анти-TNFα или родственные анти-IL-18 по настоящему изобретению, которые могут быть выделены при скрининге библиотеки рекомбинантных комбинаторных антител, например, библиотеки фагового дисплея scFv, полученной с использованием кДНК VL и VH человека, полученных на основе мРНК человеческих лимфоцитов. Методики получения и скрининга таких библиотек известны в данной области. Кроме коммерчески доступных наборов для получения библиотек фагового дисплея (например, Pharmacia Recombinant Phage Antibody System, No. по каталогу 27-9400-01; и набор фагового дисплея Stratagene SurfZAPXM, No. по каталогу 240612, полное описание которых включено в настоящую работу в качестве ссылки), примеры методик и реактивов, доступных для использования с целью получения и скрининга библиотек фагового дисплея, приведены, например, в Ladner et al. U.S. Patent No. 5223409; Kang et al. PCТ публикация No. WO 92/18619; Dower et al. PCТ публикация No. WO 91/17271; Winter et al. PCТ публикация No. WO 92/20791; Markland et al. PCТ публикация No. WO 92/15679; Breitling et al. PCТ публикация No. WO 93/01288; McCafferty et al. PCТ публикация No. WO 92/01047; Garrard et al. PCТ публикация No. WO 92/09690; Fuchs et al. (1991) Bio/Тechnology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrard et al. (1991) Bio/Тechnology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al. (1991) PNAS 88:7978-7982; полное описание которых включено в настоящую работу в качестве ссылки.
Человеческие моноклональные антитела по настоящему изобретению могут быть также получены с использованием SCID мышей, в которые были введены иммунные клетки человека, так что при иммунизации может быть получен ответ человеческих антител. Такие мыши описаны, например, в патентах США NoNo. 5476996 и 5698767 (Wilson et al.).
В некоторых вариантах, способы по настоящему изобретению включают анти-IL-12, анти-TNFα или анти-IL-18 антитела или части этих антител, антитела, родственные анти-IL-12, родственные анти-TNFα или родственные анти-IL-18, и части таких антител, а также человеческие антитела и части, эквивалентные по свойствам анти-IL-12, анти-TNFα или анти-IL-18 антителам, так что достигается высокая аффинность связывания с hIL-12, hТNFα или hIL-18 в сочетании с низкой кинетикой диссоциации и высокой нейтрализующей способностью. В одном аспекте, настоящее изобретение относится к лечению выделенным человеческим антителом или его антиген-связывающей частью, которое диссоциирует из hIL-12, hTNFα или hIL-18 с показателем Kd примерно 1×10-8 M и константой Koff, равной 1×10-3/сек или менее, по результатам определения обоих показателей по методу поверхностного плазмонного резонанса. В конкретных неограничивающих вариантах, анти-IL-12 антитело, полученное по настоящему изобретению, конкурентно ингибирует связывание ABT-874 с IL-12 в физиологических условиях. В конкретных неограничивающих вариантах, анти-IL-18 антитело, полученное и очищенное по настоящему изобретению, конкурентно ингибирует связывание по ABT-325 с IL-18 в физиологических условиях. В конкретных неограничивающих вариантах, анти-TNFα антитело, полученное и очищенное по настоящему изобретению, конкурентно ингибирует связывание Адалимумаба (Adalimumab) с TNFα в физиологических условиях.
В еще другом варианте осуществления настоящего изобретения, антитела или их фрагменты, такие как, без ограничения, анти-IL-12, анти-TNFα или анти-IL-18 антитела или их фрагменты, могут быть изменены, при этом константная область антитела модифицируется до ослабления по меньшей мере одной биологической эффекторной функции, определяемой константной областью, относительно немодифицированного антитела. Для модификации антитела по настоящему изобретению, так чтобы оно демонстрировало низкую способность к связыванию с Fc рецептором, в сегмент константной области иммуноглобулина данного антитела может быть введена мутация в определенных участках, необходимых для взаимодействий с Fc рецептором (FcR) (см., например, Canfield and Morrison (1991) J. Exp. Med. 173:1483-1491; и Lund et al. (1991) J. of Immunol. 147:2657-2662, полное описание работ включено в настоящее описание). Снижение FcR-связывающей аффинности для данного антитела может также приводить к снижению других эффекторных функций, определяемых FcR взаимодействиями, таких как опсонизация и фагоцитоз, а также антитело-обусловленная клеточная цитотоксичность.
3. Продукция антител
Для экспрессии антитела по настоящему изобретению, ДНК, кодирующие частичные или полноразмерные легкие и тяжелые цепи, встраивают в один или несколько векторов экспрессии, так чтобы гены были функционально связаны с контрольными последовательностями транскрипции и трансляции (см., например, патент США No. 6914128, полное описание которого включено в настоящую работу в качестве ссылки). В этом контексте, термин «функционально связанный» следует понимать как указание на то, что ген антитела лигирован в вектор, так что контрольные последовательности транскрипции и трансляции в данном векторе выполняют свою целевую функцию регуляции транскрипции и трансляции гена антитела. Вектор экспрессии и контрольные последовательности экспрессии выбирают таким образом, чтобы они были совместимы с используемой клеткой-хозяином, в которой осуществляется экспрессия. Ген легкой цепи антитела и ген тяжелой цепи антитела могут быть встроены в отдельный вектор или, что чаще, оба гена встраивают в один и тот же вектор экспрессии. Гены антитела встраивают в вектор экспрессии с использованием известных стандартных методов (таких как лигирование комплементарных сайтов рестрикции на фрагменте гена антитела и векторе или лигирование тупых концов, если нет сайтов рестрикции). Перед встраиванием антитела или связанных с антителом последовательностей легкой или тяжелой цепи, вектор экспрессии уже может содержать последовательность константной области. Так, например, один подход заключается в превращении VH и VL последовательностей анти-IL-12, анти-TNFα или анти-IL-18 антитела или родственных анти-IL-12, анти-TNFα или анти-IL-18 антител до полноразмерных генов антитела, так чтобы их можно было встроить в векторы экспрессии, которые уже будут кодировать константную область тяжелой цепи и константную область легкой цепи, соответственно, так что VH сегмент будет функционально связываться с одним или несколькими CH сегментами в векторе и VL сегмент будет функционально связываться с CL сегментом в векторе. Дополнительно или альтернативно, рекомбинантный вектор экспрессии может кодировать сигнальный пептид, облегчающий секрецию цепи антитела клетки-хозяина. Указанный ген цепи антитела может быть клонирован в векторе, так чтобы сигнальный пептид связывался в рамке считывания с амино-концом гена цепи антитела. Указанный сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (например, сигнальный пептид белка не иммуноглобулиновой природы).
Кроме генов цепи антитела, рекомбинантный вектор экспрессии по настоящему изобретению может содержать одну или несколько регуляторных последовательностей, которые контролируют экспрессию генов цепи антитела в клетке-хозяине. Термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию и трансляцию генов цепи антитела. Такие регуляторные последовательности описаны, например, в работе Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990), полное описание которой включено в настоящую работу в качестве ссылки. Для специалистов в данной области очевидно, что конструирование вектора экспрессии, включающее выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор трансформируемой клетки-хозяина, уровень экспрессии желательного белка и т.п. Подходящие регуляторные последовательности для экспрессии в клетке-хозяине млекопитающего включают вирусные элементы, которые направляют высокие уровни экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такой как промотор/энхансер CMV), обезьяньего вируса (SV40) (такой как промотор/энхансер SV40), аденовируса (например, крупный поздний промотор аденовируса (AdMLP)) и полиомный вирус. Дополнительное описание вирусных регуляторных элементов и их последовательностей содержится, например, в следующих работах: патент США No. 5168062 (Stinski), патент США No. 4510245 (Bell et al.) и патент США 4968615 (Schaffher et al.), полное описание которых включено в настоящую работу в качестве ссылки.
Кроме генов цепи антитела и регуляторных последовательностей, рекомбинантный вектор экспрессии по настоящему изобретению может содержать одну или несколько дополнительных последовательностей, таких как последовательность, которая регулирует репликацию вектора в клетке-хозяине (например, ориджины репликации), и/или селектируемый маркерный ген. Селектируемый маркерный ген облегчает отбор клеток-хозяев, в которую был встроен вектор (см., например,патенты США NoNo. 4399216, 4634665 и 5179017, все Axel et al., полное описание которых включено в настоящую работу в качестве ссылки). Например, в типичном случае, селектируемый маркерный ген придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую был встроен вектор. Подходящие селектируемые маркерные гены включают ген дигидрофолятредуктазы (DHFR) (при использовании в dhfr-клетках-хозяевах для селекции/амплификации с помощью метотрексата) и neo-ген (для селекции по G418).
Антитело или часть антитела по настоящему изобретению могут быть получены путем рекомбинантной экспрессии генов легкой и тяжелой цепи иммуноглобулинов. Для достижения рекомбинантной экспрессии антитела, клетку-хозяин трансфицируют одним или несколькими рекомбинантными векторами экспрессии, содержащими фрагменты ДНК, кодирующей легкую и тяжелую цепи иммуноглобулина, так что легкая и тяжелая цепи экспрессируются в клетке-хозяине и секретируются в среду, в которой проводится культивирование указанных клеток-хозяев, и из этой среды могут быть извлечены антитела. Получают стандартными методами рекомбинантных ДНК гены тяжелой и легкой цепей антитела, включают эти гены в рекомбинантные векторы экспрессии и вводят векторы в клетки-хозяева, такие как клетки, описанные в соответствующих руководствах: Sambrook, Fritsch and Maniatis (eds), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патентах США NoNo. 4816397 и 6914128, полное описание которых включено в настоящую работу в качестве ссылки.
Для экспрессии легкой и тяжелой цепей, один или несколько векторов экспрессии, кодирующих тяжелую и легкую цепи, трансфицируют в клетку-хозяина с использованием стандартных процедур. Различные формы термина «трансфекция» обозначают в контексте настоящего описания множество методик, используемых обычно для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, методами электропорации, осаждения с использованием фосфата кальция, трансфекции с использованием DEAE-декстрана и т.п. Хотя теоретически возможно использовать антитела по настоящему изобретению как в прокариотических, так и в эукариотических клетках-хозяевах, рассматривается как приемлемая экспрессия антител в эукариотических клетках, таких как клетки-хозяева млекопитающих, поскольку такие эукариотические клетки и, в частности, клетки млекопитающих, с большей вероятностью, чем прокариотические клетки, смогут осуществить сборку и секрецию иммунологически активного антитела с определенной складчатой структурой. Было сообщение о неэффективности прокариотической экспрессии генов антитела для целей получения высоких выходов активных антител (Boss and Wood (1985) Immunology Today 6:12-13, полное описание работы включено в настоящую заявку в качестве ссылки).
Подходящие клетки для клонирования или экспрессии ДНК в векторах по настоящему изобретению включают клетки прокариотов, дрожжей или высших эукариотов, указанные выше. Подходящие для этой цели прокариоты включают эубактерии, такие как Грам-отрицательные или Грам-положительные организмы, например, представители Enterobacteriaceae, такие как Escherichia, в частности, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, в частности., Salmonella typhimurium, Serratia, в частности, Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанный в DD 266710, опубликованном 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одним подходящим штаммом E. coli для клонирования в качестве хозяина является E. coli 294 (ATCC 31446), хотя применимы и другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Эти примеры являются иллюстративными, а не ограничивающими.
Кроме прокариотов, эукариотические микроорганизмы, такие как нитевидные грибы или дрожжи, применимы в качестве хозяев для клонирования или экспрессии векторов, кодирующих полипептиды. Saccharomyces cerevisiae, или обычные пекарские дрожжи, представляет собой наиболее часто используемого хозяина среди низших эукариотических микроорганизмов. Однако, известно и широко доступно множество других применимых для этой цели родов, видов и штаммов, такие как Schizosaccharomyces pombe; Kluyveromyces, в качестве клеток-хозяев, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. Thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus, в качемстве хозяев, такие как A. nidulans and A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированных антител получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы различные штаммы бакуловирусов и их варианты и соответствующие пермиссивные клетки-хозяева насекомых из таких организмов-хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. В настоящее время доступно множество вирусных штаммов для проведения трансфекции, например, L-1 вариант Autographa californica NPV и Bm-5 штамм Bombyx mori NPV, и такие вирусы могут использоваться в качестве вируса по настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. В качестве организмов-хозяев, могут также использоваться культуры клеток растений, таких как хлопок, кукуруза, картофель, соя, петунья, томаты и табак.
Подходящие клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по настоящему изобретению включают клетки яичника китайского хомячка (CHO клетки) (включающие dhfr-CHO клетки, описанные Urlaub and Chasin, (1980) PNAS USA 77:4216-4220, используемые в сочетании с DHFR-селектируемым маркером, например, как описано в работе Kaufman и Sharp (1982) Mol. Biol. 159:601-621, полное описание которой включено в настоящую заявку в качестве ссылки), клетки NS0 миеломы, COS клетки и SP2 клетки. В том случае, когда рекомбинантные векторы экспрессии, кодирующие гены антитела, встраивают в клетки-хозяева млекопитающих, антитела продуцируются культивируемыми клетками-хозяевами в течение периода времени, достаточного для экспрессии антитела в клетках-хозяевах или для секреции антитела в культуральную среду, где растут клетки-хозяева. Другие примеры используемых линий клеток-хозяев млекопитающих включают линию CV1 почки обезьяны, трансформированную SV40 (COS-7, ATCC CRL 1651); линию эмбриональных клеток почки человека (293 или 293 клетки, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мышей (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы buffalo (BRL 3А, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мышей (MMT 060562, ATCC CCL51); TR1 клетки (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); MRC 5 клетки; FS4 клетки; и клеточные линии гепатомы человека (Hep G2), полное описание которых включено в настоящую работу в качестве ссылки.
Клетки-хозяева трансформируют указанными выше векторами экспрессии или клонирования для получения антител и культивируют в традиционных питательных средах для достижения соответствующей модификации с целью индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желательные последовательности.
Клетки-хозяева, используемые для продукции антитела, могут культивироваться в большом числе сред. Для культивирования клеток-хозяев могут использоваться коммерчески доступные среды, такие как среда Хэмса F10™ (Sigma), минимальная эссенциальная средаТМ (Minimal Essential Medium™, MEM), (Sigma), RPMI-1640 (Sigma) и среда Игла в модификации Дульбекко (Dulbecco's Modified Eagle's Medium™, DMEM, Sigma). Кроме того, в качестве культуральных сред для культивирования клеток-хозяев может использоваться любая среда из описанных в следующих работах: Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патенты США NoNo. 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или патент США No. Re. 30985, полное описание которых включено в настоящую заявку в качестве ссылки. В любую из этих сред, при необходимости, могут быть внесены добавки, включая гормоны и/или другие ростовые факторы (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия, фосфат кальция, магния) буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как гентамицин), микроэлементы (определяемые как неорганические соединения, обычно используемые в конечной концентрации в микромолярном диапазоне) и глюкозу или эквивалентный источник энергии. Любые другие необходимые добавки могут быть также включены в соответствующих концентрациях, известных специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., не отличаются от тех, которые используют в случае выбранных для экспрессии клеток-хозяев, и которые очевидны специалистам в данной области.
Клетки-хозяева могут также использоваться для получения частей интактных антител, таких как Fab фрагменты или scFv молекулы. Следует понимать, что вариации в указанной выше процедуре также входят в область настоящего изобретения. Например, в некоторых вариантах может быть желательно провести трансфекцию клетки-хозяина с использованием ДНК, кодирующей легкую цепь или тяжелую цепь (но не обе) антитела по настоящему изобретению. Технология рекомбинантных ДНК может также использоваться для удаления некоторых или всех ДНК, кодирующих тяжелую и легкую цепи, одну или обе, необязательную(ые) для связывания с IL-12, в частности, hIL-12, в случае анти-IL-12 антител, или где указанная ДНК необязательна для связывания с IL-18, в частности, hIL-18, в случае анти-IL-18 антител, или где указанная ДНК не является обязательной для связывания с TNFα, в частности hTNFα, в случае анти-TNFα антител. Молекулы, экспрессируемые на основе таких усеченных молекул ДНК, также охватываются определением антител по настоящему изобретению. Кроме того, могут быть получены бифункциональные антитела, в которых одна тяжелая и одна легкая цепь представляют собой антитело по настоящему изобретению, а другая тяжелая и легкая цепь являются специфичными для антигена, отличного от IL-12, TNFα или IL-18, в зависимости от специфичности антитела по настоящему изобретению, что достигается при сшивке антитела по настоящему изобретению со вторым антителом с использованием стандартных методов химической сшивки.
В системе, подходящей для рекомбинантной экспрессии антитела или его антиген-связывающей части по настоящему изобретению, рекомбинантный вектор экспрессии, кодирующий и тяжелую цепь антитела, и легкую цепь антитела, встраивают в dhfr-CHO клетки с использованием трансфекции по методу, включающему использование фосфата кальция. В рекомбинантном векторе экспрессии, гены тяжелой и легкой цепи антитела функционально связаны с CMV энхансерными/AdMLP промоторными регуляторными элементами для достижения высоких уровней транскрипции генов. Рекомбинантный вектор экспрессии также содержит ген DHFR, который позволяет проводить селекцию CHO клеток, трансфицированных вектором, с использованием селекции/амплификации на основе метотрексата. Выбранные трансформированные клетки-хозяева культивируют с целью экспрессии тяжелой и легкой цепи антитела и интактное антитело восстанавливают из культуральной среды. Стандартные методы молекулярной биологии используют для получения рекомбинантного вектора экспрессии, трансфицируют в клетки-хозяев, выбирают трансформанты, культивируют клетки-хозяева, и извлекают антитело из культуральной среды.
При использовании рекомбинантных методик, антитело может быть получено внутри клетки, в периплазматическом пространстве или может секретироваться непосредственно в среду. В одном аспекте, если антитело образуется внутри клетки, то на первой стадии клеточные осколки, образуемые из клеток-хозяев или лизированных клеток (например, полученные после гомогенизации) могут быть удалены, например, центрифугированием или ультрафильтрацией. В том случае, когда антитело секретируется в среду, супернатанты от таких систем экспрессии могут быть вначале сконцентрированы с использованием коммерчески доступного фильтра для концентрирования белка, например, устройств для ультрафильтрации Amicon™ или Millipore Pellicon™.
До разработки способа по настоящему изобретению, процедуры очистки антител от клеточных осколков в основном определялись местом экспрессии антитела. Некоторые антитела могут секретироваться непосредственно из клетки в окружающую ростовую среду, другие создаются внутри клетки. В случае последних указанных антител, первая стадия процесса очистки в типичном случае включает лизис клетки, который может быть осуществлен с использованием множества методов, включающих механический сдвиг, осмотический шок или разные виды ферментативной обработки. Такие способы разрушения высвобождают полное содержимое клетки в гомогенат и дополнительно создают субклеточные фрагменты, которые трудно уладить из-за их малого размера. Такие фрагменты в основном удаляются в ходе дифференциального центрифугирования или путем фильтрации. В том случае, когда антитело секретируется, супернатанты от таких систем экспрессии вначале концентрируют, в основном с использованием коммерчески доступного фильтра для концентрирования белка, такого как, например, устройство для ультрафильтрации Amicon™ или Millipore Pellicon™. В том случае, когда антитело секретируется в среду, рекомбинантные клетки-хозяева могут быть также отделены от среды с культивированными клетками, например, путем тангенциальной поточной фильтрации. Антитела могут быть далее извлечены из культуральной среды с использованием способов очистки антител по настоящему изобретению.
4. Очистка антител
4.1 Основная стратегия очистки антител
Настоящее изобретение относится к способу получения очищенного (или «сниженного по НСР») препарата антитела из смеси, содержащей антитело и по меньшей мере один НСР. Способ очистки по настоящему изобретению начинается на стадии разделения, где антитело было получено с использованием описанных выше способов и стандартных, известных в настоящей области методик. В Таблице 1 приведен в обобщенном виде один вариант схемы очистки. Также рассматриваются и входят в область настоящего изобретения вариации этой схемы, включающие, без ограничения, вариации, согласно которым опускается стадия аффинной хроматографии на белке А или меняется порядок ионообменных стадий.

Как только получают осветленный раствор или смесь, содержащую антитело, проводят отделение антитела от других получаемых в клетке белков, таких как HCP, с использованием сочетания различных методов очистки, которые включают одну или несколько стадий ионообменного разделения и одну или несколько стадий разделения на основе гидрофобного взаимодействия. Указанные стадии позволяют разделить смеси белков на основе их заряда, степени гидрофобности или размера. В одном варианте осуществления настоящего изобретения, разделение проводится путем хроматографии, включающей катионные, анионные или гидрофобные взаимодействия. Для каждой из этих методик доступно несколько хроматографических смол, позволяющих точно проследить схему очистки для конкретного присутствующего в смеси белка. Основой каждого из методов очистки является то, что белки можно заставить либо двигаться с разной скоростью вниз по колонке, что приводит к достижению физического разделения, которое повышается по мере того, как они проходят все дальше вниз по колонке, или создают условия для их селективного прикрепления к разделяющей среде, что приводит к их дифференциальной элюции различными растворителями. В некоторых случаях, антитело отделяют от примесей, при этом примеси прикрепляют к колонке, а антитело не прикрепляется, т.е. антитело будет идти с протекающим потоком.
Как указывалось выше, приводимая схема очистки дается с целью очистки рассматриваемого белка. В некоторых вариантах, указанные стадии разделения используются для отделения антитела от одного или нескольких HCP. Антитела, которые можно успешно очистить с использованием способов по настоящему изобретению, включают, без ограничения, человеческие IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 и IgM антитела. В некоторых вариантах, стратегии очистки по настоящему изобретению исключают использование аффинной хроматографии с белком А, например, в случае очистки IgG3 антител, поскольку IgG3 антитела неэффективно связываются с белком А. Другие факторы, которые могут способствовать достижению специфичности в используемой схеме очистки, включают, без ограничения, присутствие или отсутствие Fc области (например, в случае полноразмерного антитела, в сравнении с его Fib фрагментом), поскольку белок А связывается с Fc областью; последовательности определенных зародышевых линий, используемые при создании представляющего интерес антитела, и аминокислотный состав антитела (например, первичная последовательность антитела, а также общий заряд/гидрофобность молекулы). Антитела, имеющие одну или несколько общих характеристик, могут быть очищены с использованием стратегий очистки, определяемых преимуществом таких общих характеристик.
4.2 Первичное извлечение
Начальные стадии способов очистки по настоящему изобретению включают первую фазу осветления и первичного извлечения антитела из матричного образца. Кроме того, стадия первичного извлечения может также представлять собой процесс, в ходе которого инактивируются вирусы, которые могут присутствовать в матричном образце. Например, на стадии первичного извлечения в рассматриваемой схеме очистки может использоваться один или несколько из множества имеющихся методов инактивации вируса, включая тепловую инактивацию (пастеризацию), инактивацию путем изменения рН, обработку растворителем/детергентом, УФ облучение и облучение гамма-лучами и добавление определенных инактивирующих химических агентов, таких как β-пропиолактон, или, например, фенантролин меди, как описано в патенте США. No. 4534972, полное описание которого включено в настоящую работу в качестве ссылки. В некоторых вариантах осуществления настоящего изобретения, матричный образец на стадии первичного извлечения подвергают обработке путем изменения рН для инактивации вируса.
Способы инактивции вирусов под действием рН включают, без ограничения, инкубацию смеси в течение определенного периода времени при низком рН с последующей нейтрализацией рН и удалением образовавшихся частиц фильтрованием. В некоторых вариантах, указанную смесь инкубируют при рН в диапазоне значений примерно от 2 до 5, предпочтительно, в диапазоне значений рН примерно от 3 до 4, и более предпочтительно, при рН примерно 3,5. В образце смеси рН может быть снижен с использованием любой подходящей кислоты, включающей, без ограничения, лимонную кислоту, уксусную кислоту, каприловую кислоту или другие приемлемые кислоты. Выбор уровня рН в основном зависит от профиля стабильности продукта антитела и присутствующих буферных компонентов. Известно, что качество целевого антитела, получаемого при инактивации вируса под действием низкого рН, определяется величиной такого рН и длительностью инкубации при низком рН. В некоторых вариантах осуществления настоящего изобретения, длительность инкубации при низком рН составляет от 0,5 часа до 2 часов, предпочтительно, от 0,5 часа до 1,5 часа, и более предпочтительно, длительность инкубации составляет 1 час. Инактивация вируса зависит от указанных параметров и дополнительно определяется концентрацией белка, которая может снижать инактивацию, в случае высоких концентраций. Таким образом, соответствующие параметры, такие как концентрация белка, рН и длительность инактивации, могут быть подобраны соответствующим образом для достижения желательного уровня инактивации вируса.
В некоторых вариантах осуществления настоящего изобретения, инактивация вируса может быть достигнута при использовании подходящих фильтров. Неограничивающий пример подходящих фильтров включает фильтр Ultipor DV50™ от компании Pall Corporation. Несмотря на то, что в некоторых вариантах настоящего изобретения используется такая фильтрация в ходе фазы первичного извлечения, в других вариантах указанное фильтрование используется на других фазах процесса очистки, включая либо предпоследнюю, либо последнюю стадию очистки. В некоторых вариантах, используются другие фильтры для инактивации вируса, такие как, без ограничения, фильтры Viresolve™ (Millipore, Billerica, Mass.); фильтры Zeta Plus VR™ (CUNO; Meriden, Conn.) и фильтры Planova™ (Asahi Kasei Pharma, Planova Division, Buffalo Grove, 111).
В тех вариантах, где проводится инактивация вируса, образец смеси может быть откорректирован, при необходимости, для проведения следующих стадий очистки. Так, например, после инактивации вируса при низком значении рН, далее рН образца смеси обычно доводят до более нейтрального значения рН, в частности, от примерно 4,5 до примерно 4,9, перед продолжением процесса очистки. Кроме того, через смесь может быть пропущен поток воды для инъекций (WFI) для достижения желательной проводимости.
В некоторых вариантах осуществления настоящего изобретения, первичное извлечение включает одну или несколько стадий центрифугирования для дальнейшего осветления матричного образца, что способствует очистке анти-IL-12, анти-TNFa, или анти-IL-18 антител. Цетрифугирование образца может проводиться, например, без ограничения, в диапазоне от примерно 7000×g до примерно 12750×g. В том, что касается крупномасштабной очистки, такое центрифугирование может проводиться на поточной линии со скоростью, установленной, например, без ограничения, до уровня мутности 150 нефелометрических единиц (NTU) в полученном супернатанте. Такой супернатант может быть затем собран для дальнейшей очистки.
В некоторых вариантах, указанное первичное извлечение будет включать использование одной или нескольких стадий глубокой фильтрации для большего осветления матричного образца и будет, таким образом, способствовать очистке анти-IL-12, анти-TNFa или анти-IL-18 антител. Фильтры глубокой очистки содержат фильтрующие среды, обладающие различной плотностью. Такая различная плотность позволяет захватывать более крупные частицы ближе к поверхности, тогда как более мелкие частицы проходят в более крупные открытые зоны на поверхности фильтра и захватываются в более мелких отверстиях ближе к центру фильтра. В некоторых вариантах, стадия глубокой фильтрации может представлять собой стадию глубокой делипидной фильтрации. Хотя в некоторых вариантах осуществления настоящего изобретения стадии глубокой фильтрации используются только в рамках фазы первичного извлечения, в других вариантах фильтры глубокой очистки, включая фильтры делипидной глубокой фильтрации, используются в ходе одной или нескольких дополнительных фаз очистки. Неограничивающие примеры фильтров глубокой фильтрации, которые могут использоваться в контексте настоящего изобретения, включают фильтры глубокой очистки Cuno™ модель 30/60ZA (3M Corp.) и двухслойные фильтрующие картриджи Sartopore™ с размером пор 0,45/0,2 мкм.
4.3 Аффинная хроматография
В некоторых вариантах осуществления настоящего изобретения, образец первичного извлечения подвергают аффинной хроматографии для дополнительной очистки представляющего интерес антитела HCP. В некоторых вариантах, материал в системе хроматографии способен селективно или специфически связываться с антителом, представляющим интерес. Неограничивающие примеры такого хроматографического материала включают белок A, белок G, хроматографический материал, включающий антиген, связанный с интересующим антителом, и хроматографический материал, включающий Fc-связывающий белок. В конкретных вариантах, стадия аффинной хроматографии включает нанесение образца первичного извлечения на колонку, включающую подходящую смолу с белком А. Смола с белком А используется для аффинной очистки и выделения антител множества изотипов, в частности, IgG1, IgG2 и IgG4. Белок А представляет собой белок клеточной стенки бактерий, который связывается с IgG млекопитающих, в основном через их Fc-области. В своем нативном состоянии, белок А содержит пять IgG-связывающих доменов, а также другие домены с неизвестной функцией.
Известно несколько коммерческих источников смолы с белком А. Одна подходящая смола представляет собой MabSelect™ от компании GE Healthcare. Неограничивающий пример подходящей колонки, наполненной МabSelect™, включает колонку с диаметром примерно 1,0 см и длиной примерно 21,6 см (объем слоя примерно 17 мл). Колонка такого размера может использоваться для маломасштабных процессов очистки и для масштабирования может использоваться в качестве варианта сравнения при подборе других колонок. Так, например, для более крупных систем очистки может использоваться колонка размером 20 см × 21 см, где объем слоя составляет примерно 6,6 л. Независимо от размера колонки, такая колонка должна быть заполнена подходящей смолой, такой как MabSelect™.
В некоторых вариантах осуществления настоящего изобретения, может быть полезно идентифицировать динамическую связывающую способность (DBC) смолы с белком А для того, чтобы улучшить очистку конкретного интересующего антитела. С этой целью, без ограничения, DBC колонки MabSelect™ может быть определена либо в варианте однопоточного введения, либо в варианте двухпоточного введения. В варианте однопоточного введения, оценка может быть проведена со скоростью примерно 300 см/час в ходе всего периода внесения препарата. В варианте двухпоточного введения, оценка может быть проведена при внесении на колонку примерно до 35 мг белка/мл смолы с линейной скоростью примерно 300 см/час, после чего снижают линейную скорость наполовину, с тем чтобы повысить время удерживания последней части вносимого препарата.
В некоторых вариантах, колонка с белком А может быть уравновешена подходящим буфером перед внесением образца. Неограничивающий пример подходящего буфера включает Трис /NaCl буфер, рН примерно 7,2. Неограничивающий пример подходящих условий уравновешивания включает использование 25 мM Tрис, 100 мM NaCl, pH примерно 7,2. После уравновешивания, образец может быть нанесен на колонку. После нанесения на колонку, колонка может быть промыта один или несколько раз с использованием, например, уравновешивающего буфера. Другие варианты промывки, включающие промывку с использованием разных буферов, могут использоваться перед элюцией с колонки. Так, например, колонка может быть промыта с использованием одного или нескольких объемов 20 мM лимонной кислоты/цитрата натрия, 0,5 M NaCl, при рН примерно 6,0. После промывки, необязательно может быть проведена еще одна или нескольких промывок с использованием уровновешивающего буфера. Далее может быть проведена элюция с колонки с белком А с использованием соответствующего элюирующего буфера. Неограничивающий пример подходящего элюирующего буфера включает буфер на основе уксусной кислоты/NaCl, pH примерно 3,5. Подходящие условия включают, например,0,1 M уксусную кислоту, pH примерно 3,5. Элюат далее анализируют с использованием методик, хорошо известных специалистам в данной области. Так, например, может определяться поглощение ОП280. Колоночный элюат может быть собран, начиная с исходных данных примерно 0,5 Ед. абсорбции до показателей 0,5 Ед. абсорбции в хвостовой части пика элюции. Одна или несколько интересующих фракций элюции могут быть приготовлена для дальнейшей обработки. Так, например, собранный образец может быть титрован до pH примерно 5,0 с использованием Tрис (например, 1,0 M) при рН примерно 10. Необязательно, такой титрованный образец может быть далее профильтрован и подвергнут обработке.
4.4 Ионнообменная хроматография
В некоторых вариантах, настоящее изобретение относится к способам получения препарата антитела со сниженным уровнем HCP из смеси, содержащей антитело и по меньшей мере один HCP, за счет проведения по меньшей мере одной стадии ионообменного разделения смеси, так что в результате получают элюат, содержащий указанное антитело. Разделение методом ионного обмена включает любой способ, посредством которого два вещества разделяются на основании их различий по ионному заряду, и в этом случае может использоваться либо материал катионообменника, либо материал аноионообменника.
Выбор материала катионообменника или анионообменника для использования по настоящему изобретению основан на оценке общего заряда белка. В этой связи, в область настоящего изобретения входит использование стадии анионного обмена перед стадией применения катионного обмена или использование стадии катионного обмена перед проведением стадии анионного обмена. Кроме того, в область настоящего изобретения входит использование только стадии катионного обмена, только стадии анионного обмена или любое серийное объединение обоих вариантов.
При проведении указанного разделения, исходная смесь с антителом может быть приведена в контакт с материалом ионообменника при использовании любой из числа известных и приемлемых для этого методик, например, с использованием методики периодической очистки или хроматографического разделения.
Например, в варианте периодической очистки подготавливают ионообменный материал или уравновешивают его до нужного состояния соответствующим исходным буфером. При подготовке или уравновешивании, получают взвесь материала ионообменника. Приводят в контакт раствор антитела с данной взвесью для абсорбции выделяемого антитела на материале ионообменника. Раствор, включающий НСР, которые не связываются с материалом ионообменника, отделяют от взвеси, например, путем осаждения взвеси и отбора супернатанта. Далее, указанная взвесь может быть подвергнута одной или нескольким стадиям обработки. При желании, указанную взвесь можно снова привести в контакт с раствором более высокой проводимости для десорбции НСР, которые связались с материалом ионообменника. Для элюции связанных полипептидов, концентрация буфера может быть повышена.
Ионообменная хроматография может также использоваться в методе ионообменного разделения. При ионообменной хроматографии молекулы разделяются на основании различий, существующих между суммарным зарядом молекул. Для очистки антитела, указанное антитело должно иметь заряд, противоположный заряду функциональной группы, присоединенной к материалу ионообменника, например, к смоле, для связывания. Например, антитела, которые в основном имеют общий положительный заряд в буфере с рН ниже их рI, будут хорошо связываться с материалом катионообменника, который содержит отрицательно заряженные функциональные группы.
При проведении ионообменной хроматографии, заряженные полосы на поверхности растворенного вещества притягиваются противоположно заряженными группами, присоединенными к хроматографической матрице, при условии низкой ионной силы окружающего буфера. Элюция достигается в основном путем повышения ионной силы (т.е. проводимости) буфера для конкуренции с растворенным веществом за заряженные сайты на матрице ионообменника. Изменение величины рН и, соответственно, изменение заряда растворенного вещества представляет собой другой вариант проведения элюции растворенного вещества. Изменение проводимости или рН может быть постепенным (градиентная элюция) или ступенчатым (ступенчатая элюция).
Анионные или катионные заместители могут быть присоединены к матрицам с целью формирования анионных или катионных носителей для хроматографии. Неограничивающие примеры заместителей для получения анионообменников включают диэтиламиноэтильные (DEAE), четвертичные аминоэтильные (QAE) и четвертичные аминные (Q) группы. Катионные заместители включают карбоксиметильные (СМ), сульфоэтильные (SE), сульфопропильные (SP), фосфатные (Р) и сульфонатные (S) группы. Ионообменные смолы на основе целлюлозы, такие как DE23™, DE32™, DE52™, CM-23™, CM-32™ и CM-52™, доступны от компании Whatman Ltd. Maidstone, Kent, U.K. Известны также ионообменники на основе Сефадекса® или кросс-формы Сефадекса®. Например, DEAE-, QAE-, CM- и SP- Сефадекс® и DEAE-, Q-, CM- и S-Сефароза® и легко текучая Сефароза® (SEPHAROSE® Fast Flow), все, доступны от компании Pharmacia AB. Кроме того, и DEAE-, и CM-производные этиленгликоль-метакрилатного сополимера, такие как TOYOPEARL™ DEAE-650S или M и TOYOPEARL™ CM-650S или M, доступны от компании Toso Haas Co., Philadelphia, Pa.
Смесь, содержащую антитело и примеси, например, HCP, наносят на ионообменную колонку, такую как катионообменная колонка. В частности, например, но не с целью ограничения, можно отметить, что указанная смесь может наноситься в количестве примерно 80 г белка/л смолы, в зависимости от используемой колонки. Примером подходящей катионообменной колонки является колонка с диаметром 80 см и длиной 23 см, в которой объем слоя составляет примерно 116 л. Нанесенную на колонку смесь можно затем промыть буфером (уравновешивающий буфер). Далее, антитело элюируют с колонки, получая первый элюат.
Указанная стадия ионного обмена позволяет осуществить захват нужного антитела, при сопутствующем снижении уровня примесей, таких как HCP. В некоторых вариантах осуществления настоящего изобретения, указанная ионообменная колонка представляет собой катионообменную колонку. В качестве примера, но не с целью ограничения, можно отметить смолу CM HyperDF, как подходящую смолу для применения в такой катионообменной колонке. Указанные смолы доступны из коммерческих источников, таких как компания Pall Corporation. Процедура катионного обмена может быть осуществлена при комнатной температуре или примерно при комнатной температуре.
4.5 Ультрафильтрация/Диафильтрация
В некоторых вариантах осуществления настоящего изобретения, используются стадии ультрафильтрации и/или диафильтрации для дальнейшей очистки и концентрирования образца антитела. Ультрафильтрация описана подробно в следующих работах: Principles and Applications, L. Zeman and A. Zydney (Marcel Dekker, Inc., New York, N.Y., 1996); и Ultrafiltration Handbook, Munir Cheryan (Technomic Publishing, 1986; ISBN No. 87762-456-9). Предпочтительным процессом фильтрации является тангенциальная поточная фильтрация, описанная в каталоге Миллипор (Millipore), озаглавленном: «Pharmaceutical Process Filtration Catalogue» pp. 177-202 (Bedford, Mass., 1995/96). Термин «ультрафильтрация» в основном используется для обозначения процесса фильтрации, проводимой с использованием фильтров, имеющих размер пор меньше, чем 0,1 мкм. При использовании фильтров с таким малым размером пор, объем образца может быть снижен за счет проникновения буфера для образца через фильтр, тогда как антитела остаются с другой стороны фильтра.
Ультрафильтрация представляет собой способ, в котором используются ультрафильтры для удаления и обмена солей, сахаров и неводных растворителей, для отделения свободных форм от связанных форм, для удаления низкомолекулярного материала и/или для того, чтобы быстро изменить ионную силу среды и/или pH среды. Растворенные микроколичества веществ удаляются наиболее эффективно при добавлении растворителя к раствору, подлежащему ультрафильтрации, со скоростью примерно равной скорости ультрафильтрации. Это приводит к вымыванию микрокомпонентов из раствора в постоянном объеме, что приводит к эффективной очистке задержанного антитела. В некоторых вариантах осуществления настоящего изобретения, стадия диафильтрации используется для обмена различных буферов, применяемых в рамках настоящего изобретения, необязательно перед проведением дальнейшей хроматографии и/или других стадий очистки, а также для удаления примесей из препаратов антитела.
4.6 Хроматография, основанная на гидрофобном взаимодействии
Настоящее изобретение также относится к получению препарата антитела со сниженным содержанием HCP из смеси, содержащей антитело и по меньшей мере один HCP, где дополнительно включается стадия разделения, основанного на гидрофобном взаимодействии. Так, например, первый элюат, полученный из ионообменной колонки, может быть далее подвергнут следующей стадии очистки, основанной на взаимодействии с гидрофобным материалом, таким образом, чтобы второй элюат имел сниженный уровень HCP. Стадии хроматографии, основанной на гидрофобном взаимодействии, описанные в настоящем изобретении, в основном проводятся для удаления белковых агрегатов, таких как агрегаты антител, и примесей, образованных в ходе обработки.
При проведении разделения, образец смеси приводят в контакт с материалом HIC, например, в процедуре периодической очистки или с использованием колонки. Перед очисткой с использованием HIC, может быть желательно удалить любые хаотропные агенты или очень гидрофобные вещества, например, путем пропускания смеси через предварительную колонку.
Например, в том, что касается периодической процедуры очистки, HIC материал получают или уравновешивают до желательного уровня уравновешивающим буфером. Получают взвесь HIC материала. Раствор антитела приводят в контакт с данной взвесью для адсорбции выделяемого антитела с HIC материалом. Раствор, включающий HCP, которые не связались с HIC материалом, отделяют от взвеси, например, путем осаждения взвеси и последующего отбора супернатанта. Затем взвесь может быть промыта в ходе одной или нескольких стадий промывки. При желании, указанная взвесь может быть приведена в контакт с раствором меньшей проводимости для десорбции антител, которые связались с HIC материалом. Для элюции связанных антител, может быть снижена концентрация соли.
Тогда как ионообменная хроматография, проводимая с целью выделения антител, основана на зарядах антител, в случае хроматографии на основе гидрофобного взаимодействия, используются гидрофобные свойства антител. Гидрофобные группы на антителе взаимодействуют с гиброфобными группами на колонке. Чем более гидрофобным является белок, тем сильнее он будет взаимодействовать с колонкой. Таким образом, стадия HIC позволяет удалить примеси из клеток-хозяев (например, ДНК и другие высоко- и низкомолекулярные продукты).
Гидрофобные взаимодействия являются наиболее сильными при высокой ионной силе, и, в этой связи, данная форма разделения обычно проводится после осаждения соли и/или процедур ионного обмена. Адсорбции антитела на HIC колонке будет способствовать высокая концентрация соли, хотя фактическая концентрация может варьировать в широком диапазоне, в зависимости от природы антитела и конкретного выбранного HIC лиганда. Различные ионы могут быть сгруппированы в так называемую солефобную серию, в зависимости от того, могут ли они усиливать гидрофобные взаимодействия (высаливающие эффекты) или разрушают структуру воды (хаотропный эффект), что ведет к ослаблению гидрофобного взаимодействия. Катионы можно расположить в направлении повышения их высаливающего эффекта следующим образом: Ba++; Ca++; Mg++; Li+; Cs+; Na+; K+; Rb+; NH4+, а анионы могут быть сгруппированы в плане возрастания хаотропного эффекта следующим образом PО---; S04--; СН3СО3-; Cl-; Br-; NО3-; ClО4; I-; SCN-.
В целом, сульфаты Na, K или NH4 эффективно усиливают взаимодействие по типу лиганд-белок в HIC. Могут быть получены соли, которые влияют на силу взаимодействия и они характеризуются следующей взаимосвязью: (NH4)2SО4>Na2SО4>NaCl>NH4Cl>NaBr>NaSCN. В основном, используют соли в концентрациях от примерно 0,75 до примерно 2М сульфата аммония или примерно от 1 до 4 М NaCl.
HIC колонки обычно содержат базовую матрицу (например, перекрестно-сшитую агарозу или синтетический сополимерный материал), к которой присоединяют гидрофобные лиганды (например, алкильные или арильные группы). Подходящая HIC колонка включает агарозную смолу, где указанная смола замещена фенильными группами (например, колонка с фенил-Сефарозой™). В настоящее время доступно множество HIC колонок. Примеры таких колонок включают, без ограничения, колонку с легко текучей фенил-Сефарозой™, которая характеризуется низким или высоким уровнем замещения (Pharmacia LKB Biotechnology, AB, Sweden); колонку для высокоэффективной хроматографии с фенил-Сефарозой™ (Phenyl Sepharose™) (Pharmacia LKB Biotechnology, AB, Sweden); колонку для высокоэффективной хроматографии с октил-Сефарозой™ (Octyl Sepharose™) (Pharmacia LKB Biotechnology, AB, Sweden); Fractogel™ EMD пропильные или Fractogel™ EMD фенильные колонки (E. Merck, Germany); колонки с Macro-Prep™ метильными или Macro-Prep™ т-бутильными носителями (Bio-Rad, California); колонки WP HI-пропильные (C3)™ (J. T. Baker, New Jersey); и колонки Toyopearl™ ether, phenyl или butyl Toyopearl™ (TosoHaas, PA).
4.7 Репрезентативная стратегия очистки
В некоторых вариантах осуществления настоящего изобретения, первичное извлечение может проводиться при последовательном использовании процедур снижения pH, центрифугирования и стадии фильтрации для удаления клеток и клеточных осколков (включая HCP) из собранного материала в биореакторе. Например, культура, содержащая антитела, среды и клетки, может быть подвергнута, без ограничения, процедуре, направленной на инактивацию вируса путем изменением pH, при использовании для этого кислого pH (около 3,5), в течение примерно одного часа. Снижение pH может быть достигнуто с использованием кислых препаратов, таких как лимонная кислота, например, 3М лимонная кислота. Воздействие кислого pH снижает, если не полностью устраняет, pH-чувствительные вирусные контаминанты и осаждает некоторые контаминанты среды/клеток. После данной стадии снижения уровня/инактивации вирусов, pH снова доводят до значений примерно 4,9 или 5,0 с использованием щелочи, такой как гидроксид натрия, например, 3М гидроксид натрия, в течение примерно двадцати-сорока минут. Такая коррекция может проводиться при температуре примерно 20ºС. В некоторых вариантах осуществления настоящего изобретения, культуру с откорректированным значением pH далее центрифугируют со скоростью от примерно 7000×g до примерно 11000×g. В некоторых вариантах осуществления настоящего изобретения, полученный супернатант с образцом затем пропускают через фильтрующее устройство, включающее фильтры для многократной глубокой очистки. В некоторых вариантах осуществления настоящего изобретения фильтрующее устройство включает примерно двенадцать 16-дюймовых фильтров для глубокой очистки Cuno™ модель 30/60ZA (3M Corp.) и примерно три круглых фильтровальных насадки, прикрепленных к трем 30-дюймовым фильтрующим картриджам Sartopore™ 2 с размером пор 0,45/0,2 мкм (Sartorius). Осветленный супернатант собирают в сосуд, такой как предварительно простерилизованный сосуд для сбора материала и выдерживают при температуре примерно 8ºС. Затем данный супернатант доводят до температуры примерно 20ºС перед проведением стадии хроматографии по методу захвата или нескольких таких стадий, как будет показано ниже. Следует отметить, что любой специалист в данной области может определить и выбрать условия из числа указанных выше, и все это будет соответствовать области настоящего изобретения.
В некоторых вариантах, первичное извлечение может быть проведено в рамках аффинной хроматографии с использованием смолы с белком А. Имеется несколько коммерческих источников смолы с белком А. Одной такой подходящей смолой является MabSelect™ от компании GE Healthcare. Примером подходящей колонки, наполненной смолой MabSelect™, является колонка с диаметром примерно 1,0 см и длиной примерно 21,6 см (объем слоя ~17 мл). Колонка такого размера может быть использована для процедур выделения, проводимых в лабораторных масштабах. Ее можно использовать в сочетании с другими колонками для масштабирования процесса. Так, например, колонка размером 20 см × 21 см с объемом слоя примерно 6,6 л может использоваться для масштабирования процесса. Независимо от варианта используемой колонки, колонка может быть заполнена подходящей смолы, такой как MabSelect™.
В других вариантах осуществления настоящего изобретения, осветленный супернатант подвергают очистке с использованием катионообменной колонки. В некоторых вариантах, используемый в катионообменной колонке уравновешивающий буфер представляет собой буфер с pH примерно 5,0. Примером подходящего буфера является ацетат калия с концентрацией примерно 210 мМ, pH 5,0. После уравновешивания, на колонку наносят образец, полученный из материала, который, в свою очередь, был получен на стадии первичного извлечения, описанной выше. Колонку заполняют катионообменной смолой, такой как легко текучая CM-Снфароза™ от компании GE Healthcare. Затем колонку промывают уравновешивающим буфером. Далее проводят стадию элюции с колонки с использованием буфера с большей ионной силой, чем уравновешивающий или промывочный буфер. Так, например, подходящим буфером для элюции может быть примерно 790 мМ ацетат натрия, pH 5,0. Антитела будут элюироваться и этот процесс можно отслеживать с использованием УФ-спектрофотометра по поглощению при длине волны 280 нм. В конкретном примере, получаемый при элюции материал может характеризоваться показателем ОП280 нм от 3 до 8. Следует понимать, что любой специалист в данной области может варьировать условия хроматографии, и эти условия также будут соответствовать области настоящего изобретения.
В некоторых вариантах осуществления настоящего изобретения, осветленный супернатант, полученный в ходе первичного извлечения, далее очищают с использованием анионообменной колонки. Неогранивающим примером подходящей для данной стадии колонки является колонка с диаметром 60 см и длиной 30 см, где объем слоя составляет примерно 85 л. Указанную колонку заполняют анионообменной смолой, такой как легко текучая Q-Сефароза™ от компании GE Healthcare. Далее колонка может быть уравновешена с использованием примерно семи объемов колонки соответствующим буфером, таким как Трис/хлорид натрия. Подходящие условия включают использование, в качестве репрезентативного примера, 25 мМ Трис, 50 мМ хлорида натрия, при pH 8,0. Любой специалист со средним уровнем знаний в данной области может варьировать эти условия для достижения наилучшего результата, и все это будет соответствовать области настоящего изобретения. Далее на колонку наносят образец, собранный после стадии первичного извлечения, как указывалось выше. В другом варианте, на колонку наносят образец элюата, собранного после хроматографии на катионнообменной смоле. После нанесения на колонку, указанную колонку промывают уравновешивающим буфером (например, Трис/хлорид натрия буфер). Протекающий поток материала, содержащий антитела, может отслеживаться с использованием УФ-спектрофотометра при длине волны 280 нм. Стадии ионного обмена снижают уровень примесей, связанных с процессом выделения, таких как нуклеиновые кислоты типа ДНК и белки клетки-хозяина. Разделение происходит благодаря тому, что нужные антитела существенным образом не взаимодействуют и не связываются с твердой фазой колонки, например, с Q-Сефарозой™, тогда как многие примеси взаимодействуют с материалом колонки и связываются с твердой фазой колонки. Анионный обмен может проводиться при температуре примерно 12°C.
В некоторых вариантах, элюат, полученный после катионного обмена или анионного обмена, смотря по тому, какой вариант ионного обмена используется на первой стадии очистки, затем фильтруют с использованием, например 16-дюймового делипидного фильтра Cuno™. После данной фильтрации проводимой с использованием делипидного фильтра, может проводиться фильтрование с использованием 30-дюймового бислойного фильтрующего картриджа Sartopore™ с размером пор 0,45/0,2 мкм. Может быть использован буфер, подходящий для ионного обмена для промыва имеющегося в фильтрах остаточного объема и подготовки к стадии ультрафильтрации/диафильтрации.
Для проведения стадии ультрафильтрации/диафильтрации, готовят фильтрующие среды в соответствующем буфере, например, в 20 мМ фосфата натрия, pH 7,0. Затем может быть добавлена соль, такая как хлорид натрия, для повышения ионной силы, например, это может быть 100 мМ хлорид натрия. Стадия ультрафильтрации/диафильтрации служит для концентрирования анти-IL-12, анти-ТNFα или анти-IL-18 антител, для удаления ацетата натрия и корректировки величины pH. Доступны коммерческие фильтры для проведения этой стадии. Например, компания Миллипор (Millipore) производит целлюлозные мембранные кассеты для ультрафильтрации с отсеканием молекул с молекулярной массой 30 кДа (MWCO). Данная процедура фильтрации может проводиться при комнатной температуре или приблизительно при комнатной температуре.
В некоторых вариантах осуществления настоящего изобретения, образец, полученный на стадии фильтрации по методу захвата, как было описано выше, подвергают второй стадии ионообменного разделения. Предпочтительно, указанное второе разделение путем ионного обмена включает метод разделения, основанный на наличии заряда, который противоположен тому заряду, который использовался на первой стадии ионообменного разделения. Например, если после первичного извлечения использовали стадию анионного обмена, то вторая ионообменная хроматография будет представлять собой стадию, основанную на катионном обмене. И наоборот, если стадия, следующая за первичным извлечением, представляла собой катионный обмен, то после нее будет проводиться анионообменная хроматография. В некоторых вариантах, элюат после первого ионного обмена, непосредственно подвергают ионообменной хроматографии на второй стадии, при этом элюат, полученный после первой стадии ионного обмена, доводят до нужного состояния соответствующим буфером. Подходящие материалы и условия для разделения методами анионного обмена и катионного обмена описаны выше.
В некоторых вариантах осуществления настоящего изобретения, образец содержащий антитела, будет далее обрабатываться на стадии разделения, основанной на гидрофобном взаимодействии. Неограничивающим примером подходящей колонки для проведения такой стадии является колонка с диаметром 80 см и длиной 15 см с объемом слоя примерно 75 л, которую наполняют подходящей смолой, используемой для HIC, такой как, без ограничения, фенил-HP Сефароза™ от компании Amersham Biosciences, Upsala, Sweden. Препарат, полученный на предыдущей стадии анионообменной хроматографии, который содержит нужные антитела, может быть разбавлен равным объемом примерно 1,7 М сульфата аммония, 50 мМ фосфата натрия, pH 7,0. Затем все это может быть профильтровано с использованием двухслойного фильтра Sartopore™ 2 размером пор 0,45/0,2 мкм или эквивалентного фильтра. В некоторых вариантах осуществления настоящего изобретения, процедура хроматографии гидрофобного взаимодействия включает два или более циклов.
В некоторых вариантах осуществления настоящего изобретения, HIC колонку вначале уравновешивают подходящим буфером. Неограничивающий пример подходящего буфера включает 0,85 М сульфата аммония, 50 мМ фосфата натрия, pH 7,0. Любой специалист со средним уровнем знаний в данной области может выбрать соответствующий буфер из числа доступных, и этот выбор будет соответствовать области настоящего изобретения, причем данный выбор может совершаться за счет изменений в концентрации буферных агентов и/или путем замещения эквивалентными буферами. В некоторых вариантах, на указанную колонку наносят образец для анионного разделения и несколько раз промывают, например, три раза, соответствующей буферной системой, такой как сульфат аммония/фосфат натрия. Примером подходящей буферной системы является система, которая включает 1,1 M сульфат аммония, 50 мМ натрий-фосфатный буфер, pH примерно 7,0. Необязательно, такая колонка может промываться в течение нескольких циклов. Например, второй цикл промывки может включать множественные промывки колонки, например, от одного до семи раз с использованием подходящей буферной системы. Неограничивающий пример подходящей буферной системы включает 0,85 М сульфата аммония, 50 мМ фосфата натрия, pH 7,0. В одном аспекте, заполненную колонку промывают третий раз с использованием подходящей буферной системы. Указанная колонка может промываться много раз, например, от одного до трех раз, с использованием буферной системы, такой как система, включающая 1,1 М сульфат аммония, 50 мМ фосфат натрия, pH примерно 7,0. И здесь также любой специалист в данной области может варьировать условия при использовании буферных систем, и этот выбор также будет соответствовать области настоящего изобретения.
Проводят элюцию с колонки с использованием подходящего элюирующего буфера. Репрезентативным примерном такого элюирующего буфера является буфер, включающий 0,5М сульфата аммония, 15 мМ фосфата натрия, pH примерно 7,0. Представляющие интерес антитела могут быть детектированы и собраны с использованием стандартного спектрофотометра при отборе фракций с показателями ОП280 нм от 3 в верхней до 3 в нижней части пика.
В некоторых аспектах осуществления настоящего изобретения, элюат, полученный при хроматографии гидрофобного взаимодействия, далее подвергают фильтрации для удаления вирусных частиц, включая интактные вирусы, если они присутствуют. Неограничивающий пример подходящего фильтра включает фильтр Ultipor DV50™ от компании Pall Corporation. Другие задерживающие вирусы фильтры, которые могут использоваться на данной стадии фильтрации, хорошо известны специалистам в данной области. Элюат HIC пропускают через предварительно увлажненный фильтр с размером пор примерно 0,1 мкм и 2 x 30-дюймовое фильтрующее устройство Ultipor DV50™ под давлением примерно 34 фунт/дюйм2. В некоторых вариантах осуществления настоящего изобретения, фильтр, после проведения фильтрации, промывают с использованием, например, элюирующего буфера HIC с целью удаления любых остаточных антител, который задержались на первом фильтре. Полученный фильтрат может храниться в стерилизованном контейнере при температуре примерно 12°C.
В некоторых вариантах, фильтрат, полученный на указанной выше стадии, вновь подвергают процедуре ультрафильтрации/ диафильтрации. Эта стадия важна, если конечной целью для специалиста является использование антитела, например, в составе фармацевтической композиции. Этот процесс, в случае его использования, может облегчить концентрирование антитела, а также способствовать удалению забуферивающих солей, которые использовались ранее, с замещением их соответствующим буфером, применяемым для получения композиции. В некоторых вариантах осуществления настоящего изобретения, проводится непрерывная диафильтрация множественными объемами, например, двумя объемами, буфера, используемого для создания композиций. Неограничивающим примером подходящего буфера для создания композиции является система, включающая 5 мМ метионина, 2% маннита, 0,5% сахарозы, pH 5,9 (без Твина). По завершению данной стадии буферных обменов в ходе дифафильтрации, антитела концентрируют. Как только достигается заданная концентрация антитела, то осуществляющий процедуру специалист может рассчитать количество 10% Твина, которое следует добавить, чтобы конечная концентрация Твина была 0,005 объем.%.
В некоторых вариантах осуществления настоящего изобретения используются дополнительные стадии очистки. Примеры дополнительных процедур очистки, которые могут проводиться до, во время или после стадии ионообменной хроматографии, включают осаждение этанолом, изоэлектрофокусирование, ВЭЖХ с обращением фазы, хроматографию на силикагеле, хроматографию на гепарин-Сефарозе™, еще дополнительную анионообменную хроматографию и/или дополнительную катионообменную хроматографию, хроматофокусирование, ДСН-ПААГ, осаждение сульфатом аммония, хроматографию на гидроксилапатите, гель-электрофорез, диализ и аффинную хроматографию (например, с использованием белка А, белка G, антитела, специфического субстрата, лиганда или антигена в качестве реагента, используемого для захвата исследуемого вещества).
В некоторых вариантах осуществления настоящего изобретения, анти-IL-12 антитело представляет собой антитело IgA1, IgA2, IgD, IgE, IgG1 IgG2, IgG3, IgG4 или IgM изотипа, включающее последовательности вариабельных областей тяжелой и легкой цепей, показанные на фиг.1. В предпочтительных вариантах, указанное анти-IL-12 антитело представляет собой антитело IgG1, IgG2, IgG3 или IgG4 изотипа, включающее последовательности вариабельных областей тяжелой и легкой цепей, показанные на фиг.1, более предпочтительно, анти-IL-12 антитело представляет собой IgG1 антитело, включающее последовательности вариабельных областей тяжелой и легкой цепей, показанные на фиг.1. В некоторых вариантах осуществления настоящего изобретения, анти-TNFα-антитело представляет собой антитело IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM изотипа, включающее последовательности вариабельных областей тяжелой и легкой цепей, показанные на фиг.3. В предпочтительных вариантах, анти-TNFα-антитело представляет собой антитело IgG1, IgG2, IgG3 или IgG4изотипа, включающее последовательности вариабельных областей тяжелой и легкой цепей, показанные на фиг.3, более предпочтительно, анти-TNFα-антитело представляет собой антитело IgG1, включающее последовательности вариабельных областей тяжелой и легкой цепей, показанные на фиг.3.
5. Способы анализа чистоты образца
5.1 Анализ белка клетки-хозяина
Настоящее изобретение также относится к способам определения остаточной концентрации белка клетки-хозяина (HCP) в выделенной/очищенной композиции антитела. Как было показано выше, HCP в желательном варианте должны быть исключены из готового целевого продукта, например, из анти-IL-12, анти-ТNFα или анти-IL-18 антитела. Примеры HCP включают белки из организма, который был источником для получения антитела. Неспособность идентифицировать и в достаточной степени удалить HCP из целевого антитела может приводить к сниженной эффективности и/или к неблагоприятным реакциям у субъекта.
В контексте настоящего описания, термин «HCP ELISA» относится к методу ELISA, в котором второе антитело, используемое в тесте, является специфическим для HCP, продуцируемых клетками, например, CHO клетками, которые использовались для получения антитела (например, анти-IL-12, анти-ТNFα или IL-18 антитела). Второе антитело может быть получено традиционными способами, известными специалистами в данной области. Так, например, второе антитело может быть получено с использованием HCP, полученных путем имитирующей продукции и очистки, то есть, используется та же клеточная линия, которая использовалась для получения интересующего антитела, но данную клеточную линию не трансфицировали специфичной для антитела ДНК. В репрезентативном варианте, второе антитело получают с использованием HCP аналогичным тем HCP, которые экспрессировались в выбранной системе экспрессии клетки, например, в системе экспрессии клетки, используемой для продукции целевого антитела.
В основном, методика HCP ELISA включает сэндвич-модификацию этого метода для анализа жидкого образца, в соответствии с которым HCP находится между двумя слоями антител, то есть, между первым антителом и вторым антителом. Указанный образец инкубируют в течение периода времени, необходимого для захвата HCP в образце первым антителом, например, без ограничения, козьим анти-CHO антителом, полученным после аффинной очистки (Cygnus). Добавляют второе меченое антитело или также содержащую метку смесь антител, специфичное(ых) для HCP, продуцируемых клетками, которые используются для получения антитела, например, биотинилированное анти-CHO HCP, которое связывается с имеющимся в образце HCP. В некоторых вариантах, первое и второе антитела представляют собой поликлональные антитела. В некоторых аспектах осуществления настоящего изобретения, первое и второе антитела представляют собой смеси поликлональных антител против HCP, например, без ограничения, смесь биотинилированных козьих антител против белка клетки-хозяина 599/626/748. Количество HCP, содержащихся в образце, определяют с использованием подходящего теста по метке второго антитела.
HCP ELISA может использоваться для определения уровня HCP в композиции антитела, например, в элюате или протекающем потоке с использованием описанного выше способа. Настоящее изобретение также относится к композиции, содержащей антитело, где указанная композиция не содержит выявляемых уровней HCP, определяемых по результатам иммуноферментного твердофазного анализа HCP («ELISA»).
5.2 Тестирование материала, применявшегося для аффинной хроматографии
В некоторых вариантах, настоящее изобретение также относится к способам определения остаточных количеств аффинного хроматографического материала в выделенной/очищенной композиции антитела. В некоторых вариантах, такого рода материалы в ходе очистки могут проходить в композицию антитела. В некоторых вариантах, используется тест для определения концентрации белка А в выделенной/очищенной композиции антитела. В контексте настоящего описания, термин «ELISA с белком А» относится к методу ELISA, где второе используемое в тесте антитело специфично для белка А, применяемого для очистки интересующего антитела, например, анти-IL-12, анти-ТNFα или анти-IL-18 антитела. Второе антитело может быть получено традиционными способами, известными специалистам в данной области. Так, например, второе антитело может быть получено с использованием природного или рекомбинантного белка А в рамках традиционных способов индукции и получения антитела.
В основном, процедура ELISA с белком А включает сэндвич-модификацию метода, используемого для анализа жидкого образца, включающую белок А (или возможно содержащую белок А) между двумя слоями антител против белка А, т.е. первого антитела против белка А и второго антитела против белка А. Образец приводят в контакт с первым слоем антитела против белка А, например, без ограничения, с поликлональными антителами или смесями поликлональных антител и инкубируют в течение периода времени, достаточного для захвата белка А в образце первым антителом. Затем добавляют второе меченое антитело, например, без ограничения, поликлональное антитело или смеси поликлональных антител, специфичных для белка А, для связывания с захваченным белком А в образце. Дополнительные неограничивающие примеры антител против белка А, применяемых по настоящему описанию, включает куриное антитело против белка А и биотинилированное антитело против белка А. Количество белка А, содержащегося в образце, определяют с использованием соответствующего теста по метке второго антитела. Аналогичные тесты могут использоваться для идентификации концентрации альтернативных материалов, применяемых для аффинной хроматографии.
Метод ELISA с белком А может использоваться для определения уровня белка А в композиции антитела, такой как элюат или протекающий поток, получаемой с использованием описанного выше способа. Настоящее изобретение также относится к композиции, содержащей антитело, где указанная композиция не содержит выявляемых количеств белка А, по результатам иммуноферментного твердофазного анализа с белком А («ELISA»).
6. Другие модификации
Антитела по настоящему изобретению могут быть модифицированы. В некоторых вариантах осуществления настоящего изобретения, антитела или их антиген-связывающие фрагменты химически модифицируют для достижения желательного эффекта. Так, например, может осуществляться ПЭГилирование антител или фрагментов антител по настоящему изобретению с использованием любых реакций ПЭГилирования, известных в данной области, например, описанных в приведенных ниже ссылках: Focus on Growth Factors 3:4-10 (1992); EP 0 154 316; и EP 0 401 384, где каждая из указанных работ включена в настоящее описание полностью. В одном аспекте, указанное ПЭГилирование проводят путем реакции ацилирования или реакции алкилирования с использованием реакционноспособной молекулы полиэтиленгликоля (или аналогичного реакционноспособного водорастворимого полимера). Подходящим водорастворимым полимером для проведения ПЭГилирования антител и фрагментов антител по настоящему изобретению является полиэтиленгликоль (ПЭГ). В контексте настоящего описания, термин «полиэтиленгликоль» обозначает любые формы ПЭГ, которые были использованы для дериватизации других белков, такие как моно (Cl-ClO) алкокси- или арилокси-полиэтиленгликоль.
Способы получения пэгилированных антител или фрагментов антител по настоящему изобретению в основном включают стадии (а) проведения реакции антитела или фрагмента антитела с полиэтиленгликолем, таким как реакционноспособное сложноэфирное или альдегидное производное ПЭГ, в подходящих условиях, в результате которой антитело или фрагмент антитела присоединяется к одной или нескольким группам ПЭГ, и (b) получения реакционных продуктов. Для любого специалиста со средним уровнем знаний в данной области понятно, как можно подобрать оптимальные условия для проведения реакции или каким образом провести реакцию ацилирования на основе известных параметров и с учетом желательного результата.
Пэгилированные антитела или фрагменты антител, специфичные для IL-12, ТNFα или IL-18, могут в основном использоваться для лечения связанных с IL-12, ТNFα или IL-18 расстройств по настоящему изобретению путем введения анти-IL-12 антитела, анти-ТNFα антитела или анти-IL-18 антитела и соответствующих фрагментов антител по настоящему описанию. В основном, пэгилированные антитела или фрагменты антител характеризуются увеличенным периодом полувыведения, в сравнении с непэгилированными антителами или фрагментами антител. Пэгилированные антитела или фрагменты антител могут использоваться по отдельности, совместно или в сочетании с другими фармацевтическими композициями.
Антитело или часть антитела по настоящему изобретению могут быть дериватизированы или присоединены к другой функциональной молекуле (например, к другому пептиду или белку). Соответственно, антитела и части антител по настоящему изобретению включают дериватизированные и иным образом модифицированные формы человеческих анти-hIL-12, анти-TNFa или анти-hIL-18 антител по настоящему изобретению, включая молекулы иммуноадгезии. Например, антитело или часть антитела по настоящему изобретению могут быть функционально присоединены (путем химического связывания, генетического слияния, нековалентной ассоциации или иным образом) к одной или нескольким молекулярным структурам, таким как другое антитело (например, биспецифическое антитело, или диатело), детектируемый агент, цитотоксическое средство, фармацевтический агент и/или белок или пептид, которые могут опосредовать ассоциацию антитела или части антитела с другой молекулой (такой как ядерная область стрептавидина или полигистидиновая метка).
Один тип дериватизированного антитела получают путем сшивки двух или более антител (одного или разных типов, например, для получения биспецифических антител). Подходящие сшивающие агенты включают такие агенты, которые обладают гетеробифункциональностью за счет наличия двух различных реакционных групп, разделенных соответствующим спейсером (например, м-малеимидобензоил-N-гидроксисукцинимидный сложный эфир) или которые могут быть гомобифункциональными (например, дисукцинимидилсуберат). Такие линкеры доступны от компании Pierce Chemical Company, Rockford, IL.
Подходящие детектируемые агенты, с которыми антитело или часть антитела по настоящему изобретению могут быть связаны для дериватизации, включают флуоресцентные соединения. Репрезентативные флуоресцентные детектируемые агенты включают флуоресцеин, изотиоцианат флуоресцеина, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и т.п. Антитело может быть также дериватизировано с использованием детектируемых ферментов, таких как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и т.п. В том случае, когда антитело дериватизируют с использованием детектируемого фермента, указанный фермент детектируют при добавлении соответствующих реагентов, которые данный фермент использует с образованием выявляемого реакционного продукта. Так, например, когда в качестве детектируемого агента присутствует пероксидаза хрена, добавление пероксида водорода и диаминобензидина приводит к получению окрашенного реакционного продукта, который далее детектируют. Антитело может быть также дериватизировано биотином и его детекция проводится за счет опосредованного измерения связывания авидина или стрептавидина.
7. Фармацевтическая композиция
Антитела и части антител по настоящему изобретению могут быть включены в состав фармацевтических композиций, подходящих для введения субъекту. В типичном случае, фармацевтическая композиция содержит антитело или часть антитела по настоящему изобретению и фармацевтически приемлемый носитель. В контексте настоящего описания, термин «фармацевтически приемлемый носитель» включает любой и все растворители, диспергирующие среды, материалы покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, задерживающие адсорбцию, а также другие физиологически совместимые агенты. Примеры фармацевтически приемлемых носителей включают один или несколько из приведенного списка: воду, физиологический раствор, фосфатно-буферный раствор, декстрозу, глицерин, этанол и т.п., а также их сочетания. Во многих случаях, в состав изготавливаемой композиции желательно включать изотонические средства, такие как сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. Фармацевтически приемлемые носителя могут также включать микроколичества вспомогательных веществ, таких как увлажнители или эмульгаторы, консерванты или буферы, которые повышают период полувыведения или эффективность антитела или части антитела.
Антитела и части антител по настоящему изобретению могут быть включены в состав фармацевтической композиции, приемлемой для парентерального введения. Антитело или части антитела могут быть изготовлены в виде инъецируемого раствора, который содержит, например, от 0,1 до 250 мг/мл антитела. Инъецируемый раствор может состоять из жидкости или лиофилизированной дозированной формы во флаконе из флинтгласа или желтого стекла, ампуле или шприце-тюбике. Указанный буфер может представлять собой L-гистидин в концентрации примерно 1-50 мМ (в оптимальном варианте 5-10 мМ), при pH 5,0-7,0 (оптимально pH 6,0). Другие подходящие буферы включают, без ограничения, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид натрия может использоваться для модификации токсичности раствора в концентрации 0-300 мМ (в оптимальном варианте 150 мМ для жидкой дозированной формы). В случае лиофилизированной дозированной формы, в состав могут быть включены криопротекторы, в основном 0-10% сахароза (в оптимальном варианте 0,5-1,0%). Другие подходящие криопротекторы включают трегалозу и лактозу. Объемные агенты также могут включаться в состав лиофилизированной дозированной формы, в основном, 10% маннит (в оптимальном варианте 24%). Стабилизаторы могут использоваться как в случае жидких, так и в случае лиофилизированных дозированных форм, в основном, это 1-50 мМ метионин (в оптимальном варианте 5-10 мМ). Другие подходящие объемные агенты включают глицин, аргинин, а также может вводиться полисорбат-80 в количестве 0-0,05% (оптимально 0,005-0,01%). Дополнительные поверхностно-активные вещества включают, без ограничения, полисорбат-20 и поверхностно-активные вещества на основе Бридж.
В одном аспекте, данная фармацевтическая композиция содержит антитело в количестве примерно от 0,01 мг/кг до 10 мг/кг. В другом аспекте, дозировки антитела включают примерно 1 мг/кг при введении через неделю или примерно 0,3 мг/кг для еженедельного введения. Любой специалист в данной области может определить соответствующую дозировку и режим ее введения субъекту.
Композиции по настоящему изобретению могут быть приготовлены в виде различных форм. Указанные формы включают, например, жидкие, полужидкие и твердые дозированные формы, такие как жидкие растворы (например, инъецируемые и инфузируемые растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Конкретная используемая форма зависит, например, от предполагаемого способа введения и от соответствующего терапевтического применения. Типичные композиции имеют форму инъецируемых или инфузируемых растворов, таких как композиции, аналогичные композициям, используемым для пассивной иммунизации людей другими антителами. Одним способом введения является парентеральный способ (например, это внутривенный, подкожный, внутрибрюшинный, внутримышечный способы). В одном аспекте указанное антитело вводят путем внутривенной инфузии или инъекции. В другом аспекте, указанное антитело вводят путем внутримышечной или подкожной инъекции.
В типичном случае терапевтические композиции должны быть стерильными и стабильными в условиях их производства и хранения. Указанные композиции могут быть изготовлены в виде раствора, микроэмульсий, дисперсий, липосомного препарата или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного вещества. Стерильные инъецируемые растворы могут быть получены путем включения активного соединения (например, антитела или части антитела) в требуемом количестве в соответствующий растворитель с одним ингредиентом или с сочетанием ингредиентов из числа указанных выше, как это необходимо, с последующей стерилизацией фильтрованием. В основном, дисперсию получают за счет включения активного соединения в стерильный наполнитель, который содержит основную диспергирующую среду и другие нужные ингредиенты из числа указанных выше. В случае стерильных лиофилизированных порошков, используемых для приготовления стерильных инъецируемых растворов, способы получения включают вакуумную сушку и распылительную сушку, что приводит к получению порошка активного ингредиента плюс любой дополнительный желательный ингредиент из его раствора, который был предварительно простерилизован фильтрованием. Соответствующая текучесть раствора может поддерживаться, например, при использовании покрытия, такого как покрытие из лецитина, за счет поддержания нужного размера частиц в случае дисперсии и использования поверхностно-активных веществ. Пролонгированная абсорбция инъецируемых композиций может быть достигнута за счет включения в состав композиции средства, задерживающего абсорбцию, например, солей моностеарата и желатина.
Антитела и части антител по настоящему изобретению могут вводиться с использованием большого числа известных в данной области способов, один вариант/способ введения включает подкожную инъекцию, внутривенную инъекцию или инфузию. Как это очевидно специалистам в данной области, указанный вариант и/или способ введения будет варьироваться, в зависимости от желательных результатов. В некоторых вариантах, указанное активное соединение может быть получено вместе с носителем, который будет защищать соединение от быстрого высвобождения, например, в виде композиции с пролонгированным высвобождением, которая может включать имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Могут использоваться биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Множество методов получения таких композиций запатентовано или в основном известно специалистам в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978, полное описание которой включено в настоящую работу в качестве ссылки.
В некоторых аспектах, антитело или часть антитела по настоящему изобретению может вводиться перорально, например, вместе с инертным разбавителем или с ассимилируемым пищевым носителем. Соединение (и другие ингредиенты, при желании) может включаться в состав твердой или мягкой желатиновой капсулы, может прессоваться с получением таблеток или может непосредственно включаться в пищу субъекта. Для случая перорального терапевтического введения, указанные соединения могут включаться в композицию вместе с эксципиентами и использоваться в форме принимаемых внутрь таблеток, трансбуккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, вафель и т.п. Для введения соединения по настоящему изобретению способом, отличным от парентерального введения, может быть необходимо нанести на соединение покрытие или вводить его совместно с другим соединением, материалом, препятствующим его инактивации.
Дополнительные активные соединения также могут включаться в состав композиции. В некоторых аспектах, антитело или часть антитела по настоящему изобретению вводят совместно в состав композиции и/или вводят в сочетании с одним или несколькими дополнительными терапевтическими агентами, которые используются для лечения заболеваний, в случае которых активность IL-12, TNF-α или IL-18 является неблагоприятной. Так, например, анти-hIL-12, анти-TNFα или анти-IL-18 антитело или часть антитела по настоящему изобретению может быть совместно введено в композицию и/или введено в сочетании с одним или несколькими дополнительными антителами, которые связываются с другими мишенями (например, с антителами, которые связываются с другими цитокинами или которые связываются с молекулами на клеточной поверхности). Кроме того, одно или несколько антител по настоящему изобретению могут использоваться в сочетании с двумя или более указанными выше терапевтическими средствами. В случае такой комбинированной терапии можно с успехом использовать более низкие дозировки вводимых терапевтических средств, что позволяет избежать возможных токсических реакций или осложнений, ассоциированных с разными вариантами монотерапии. Как это очевидно специалистам в данной области, когда антитела по настоящему изобретению используются в качестве части комбинированной терапии, может быть желательна более низкая дозировка антитела, в сравнении с вариантом введения субъекту одного антитела (например, может быть достигнут синергический терапевтический эффект при использовании комбинированной терапии, что, в свою очередь, позволяет использовать более низкую дозу антитела для достижения желательного терапевтического эффекта).
Следует понимать, что антитела по настоящему изобретению или их антиген-связыающая часть могут использоваться по отдельности или в сочетании с дополнительным средством, например, терапевтическим средством, и указанное дополнительное средство может быть выбрано специалистом в данной области с учетом цели введения. Так, например, дополнительное средство может представлять собой такое терапевтическое средство, которое известно как средство, используемое для лечения заболевания или состояния, которое подлежит лечению антителом по настоящему изобретению. Указанное дополнительное средство может также представлять собой средство, которое оказывает благоприятное воздействие на терапевтическую композицию, то есть это может быть средство, которое влияет на вязкость композиции.
Следует также понимать, что сочетания, которые входят в область настоящего изобретения, представляют собой такие сочетания, которые используются для данной поставленной цели. Указанные ниже средства даны только для иллюстрации, и их не следует рассматривать с точки зрения какого-либо ограничения. Сочетания, которые являются частью настоящего изобретения, могут представлять собой антитела по настоящему изобретению и по меньшей мере одно из дополнительных средств, выбранных из приведенного ниже перечня. Указанное сочетание может также включать более, чем одно дополнительное средство, например, это могут быть два или три дополнительных средства, если достигается такое сочетание, что созданная композиция может выполнять нужную функцию.
Некоторые сочетания представляют собой нестероидные противовоспалительные средства, одно или несколько, также обозначаемые как НСПВС, которые включают лекарственные средства типа ибупрофена. Другие сочетания включают кортикостероиды, включающие преднизолон, при этом известные побочные эффекты применения стероидов могут быть снижены или даже устранены при уменьшении необходимой дозы стероида, когда проводится лечение пациентов в сочетании с анти-IL-12 антителом по настоящему изобретению в составе комбинированной терапии. Неограничивающие примеры терапевтических средств, применяемых для лечения ревматоидного артрита, с которыми антитело или часть антитела по настоящему изобретению могут быть объединены, включают следующие: противовоспалительные средства, одно или несколько (НСПВС), подавляющие цитокин; антитела против других человеческих цитокинов или ростовых факторов или их антагонисты, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по настоящему изобретению или их антиген-связывающие части могут быть объединены с антителами к молекулам на клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90 или их лигандами, включающими CD 154 (gp39 или CD40L).
Некоторые сочетания терапевтических агентов могут в разных точках препятствовать развитию аутоиммунного и последующего воспалительного каскада; примеры таких сочетаний включают антагонисты TNF типа химерных, гуманизированных или человеческих анти-TNF антител, D2E7, (заявка на патент США серийный номер 08/599,226, зарегистрированная 9 февраля 1996, полное описание которой включено в настоящую работу в качестве ссылки), cA2 (Remicade™), CDP 571, фрагменты анти-TNF антитела (например, CDP870) и растворимые рецепторы p55 или p75 TNF, их производные (p75TNFRIgG (Enbrel™) или p55TNFRlgG (Lenercept), растворимый рецептор IL-13 (sIL-13), а также ингибиторы TNFα-превращающего фермента (TACE), аналогичные ингибиторам IL-1 (например, ингибиторы интерлейкин-1-превращающего фермента, такие как Vx740 или IL-1RA и т.п.), которые могут быть эффективны по той же причине. Другие сочетания включают интерлейкин-11, анти-P7s и лиганд гликопротеина (PSGL). Такого рода сочетания включают также другие ключевые агенты, участвующие в механизме аутоиммунного ответа, которые могут быть параллельными относительно функции IL-12, действовать в зависимости или в сочетании с функционированием IL-12; в особенности в их число входят антагонисты IL-18, включающие антитела IL-18 или растворимые рецепторы IL-18, а также IL-18-связывающие белки. Было показано, что IL-12 и IL-18 имеют, хотя и перекрывающиеся, но разные функции, так что сочетание этих антагонистов друг с другом может быть особенно эффективным. Еще другие сочетания включает не истощающие ингибиторы анти-CD4. Еще другие сочетания включают антагонисты костимилирующего пути CD80 (B7.1) или CD86 (B7.2), включающие антитела, растворимые рецепторы или лиганды антагонистов.
Антитела по настоящему изобретению или их антиген-связывающие части могут быть также объединены с агентами, такими как метотрексат, 6-MP, сульфасалазин, азатиоприн, месалазин, олсалазина хлорохинин/гидроксихлорокин, пеницилламин, ауротиомалат (внутримышечный и пероральный препараты), азатиоприн, кохицин, кортикостероиды (препараты пероральные, для ингаляции и для местной инъекции), агонисты β-2-адренорецептора (сальбутанол, тербуталин, салметерал), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропиум и окситропиум, циклоспорин, FK506, рапамицин, мофетил-микофенолят, лефлуномид, НСПВС, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические агенты, ингибиторы комплемента, адренергические средства, средства, которые препятствуют сигнальной функции провоспалительных цитокинов, таких как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента (например, Vx740), анти-P7s, лиганд гликопротеина р-селектина (PSGL), ингибиторы TNFα-превращающего фермента (TACE), ингибиторы сигнальной функции Т-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, рецепторы растворимых цитокинов и их производных (например, рецепторы растворимого p55 или p75 TNF и производные p75TNFRIgG (Enbrel.TM.) и p55TNFRIgG (Lenercept), sIL-1 RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительных цитокинов (например, IL-4, IL-10, IL-11, IL-13 и TGFP). Некоторые сочетания включают метотрексат или лефлуномид и, в случаях средней тяжести или тяжелого течения ревматоидного артрита, также циклоспорин.
Неограничивающие примеры терапевтических средств, применяемых для лечения воспалительных заболеваний кишечника, с которыми могут быть объединены антитело или часть антитела по настоящему изобретению, включают следующие: буденозид, эпидермальный фактор роста, кортикостероиды, циклоспорин, сульфасалазин, аминосалицилаты, 6-меркаптопурин, азатиоприн, метронидазол, ингибиторы липоксигеназы, мезаламин, олсалазин, балсалазид, антиоксиданты, ингибиторы тромбоксана, антагонисты рецептора IL-1, анти-IL-1α моноклональные антитела и анти-IL-6 моноклональные антитела, ростовые факторы, ингибиторы эластазы, пиридинил-имидазольные соединения, антитела против других человеческих цитокинов или факторов роста или их антагонисты, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по настоящему изобретению или их антиген-связывающие части могут быть объединены с антителами против молекул, локализованных на клеточных поверхностях, таких как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандами. Антитела по настоящему изобретению или их антиген-связывающие части могут быть также объединены с агентами, такими как метотрексат, циклосопорин, FK506, рапамицин, мофетил-микофенолят, лефлуномид, НСПВС (NSAID), такие как ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют сигнальной функции провоспалительных цитокинов, таких как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента (например, Vx740), анти-P7s, лиганд гликопротеина p-селектина (PSGL), ингибиторы TNFα-превращающего фермента ингибиторы сигнальной функции Т-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, рецепторы растворимых цитокинов и их производных (например, рецепторы растворимых p55 или p75 TNF, sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительных цитокинов (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Примеры терапевтических средств для лечения болезни Крона, с которыми могут быть объединены антитело или его антиген-связывающая часть, включают следующие: антагонисты TNF, например, анти-TNFα антитела, D2E7 (заявка на патент США, серийный номер 08/599 226, зарегистрированная 9 февраля 1996, полное описание которой включено в настоящую работу в качестве ссылки), cA2 (Remicade™), CDP 571, фрагменты анти-TNF антитела (например, CDP870), конструкции p75TNFRIgG (Enbrel™) и p55TNFRIgG (Lenercept)), анти-P7s, лиганд гликопротеина p-селектина (PSGL), растворимый рецептор IL-13 (sIL-13) и ингибиторы PDE4. Антитела по настоящему изобретению или их антиген-связывающие части могут быть объединены с кортикостероидами, такими как, например, буденозид и дексаметазон. Антитела по настоящему изобретению или их антиген-связывающие части могут быть объединены с такими средства, как сульфасалазин, 5-аминосалициловая кислота и олсалазин, и со средствами, которые препятствуют синтезу или активности провоспалительных цитокинов, такими как ингибиторы IL-1, например, ингибиторы IL-1-превращающего фермента (например, Vx740) и IL-1ra. Антитела по настоящему изобретению и их антиген-связывающие части могут также использоваться в сочетании с ингибиторами сигнальной функции Т-клеток, например, с 6-меркаптопуринами, в качестве ингибиторов трозинкиназы. Антитела по настоящему изобретению и их антиген-связывающие части могут быть объединены с IL-11.
Неограничивающие примеры терапевтических средств для лечения рассеянного склероза, с которыми могут быть объединены антитело или части антитела по настоящему изобретению, включают следующие: кортикостероиды, преднизолон, метилпреднизолон, азатиоприн, циклофосфамид, циклоспорин, метотрексат, 4-аминопиридин, тизанидин, IFNβ1а (Avonex; Biogen), IFNβ1b (Betaseron; Chiron/Berlex), сополимер 1 (Cop-1, Copaxone, Teva Pharmaceutical Industries, Inc.), гипербарический кислород, внутривенный иммуноглобулин, клабрибин, антитела против других человеческих цитокинов или факторов роста или их антагонисты, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по настоящему изобретению или их антиген-связывающие части могут быть объединены с антителами против молекул, локализованных на клеточной поверхности, такими как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лиганды. Антитела по настоящему изобретению или их антиген-связывающие части могут быть также объединены с такими средствами, как метотрексат, циклоспорин, FK506, рапамицин, мофетил-микофенолят, лефлуномид, НСПВС (NSAID), такие как ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические агенты, ингибиторы комплемента, адренергические средства, средства, которые препятствуют сигнальной функции провоспалительных цитокинов, таких как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента (например, Vx740), анти-P7, лиганд гликопротеина р-селектина (PSGL), ингибиторы TACE, ингибиторы сигнальной функции Т-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибитор ангиотензин-превращающего фермента, рецепторы растворимых цитокинов и их производных (например, рецепторы растворимого p55 или p75 TNF, sIL-1 RI, sIL-1 RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительных цитокинов (например, IL-4, IL-10, IL-13 и TGFβ).
Примеры терапевтических средств, применяемых для лечения рассеянного склероза, с которыми могут быть объединены антитела или их антиген-связывающие части, включают IFNβ, например, IFNβ1a и IFNβ1b, копаксон, кортикостероиды, ингибиторы IL-1, ингибиторы TNF и антитела против лиганда CD40 и CD80.
Фармацевтические композиции по настоящему изобретению могут включать «терапевтически эффективное количество» или «профилактически эффективное количество» антитела или части антитела по настоящему изобретению. «Терапевтически эффективное» количество относится к такому количеству, которое эффективно в дозировках и в течение необходимого периода времени для достижения желательного терапевтического результата. Терапевтически эффективное количество антитела или части антитела может варьировать в зависимости от таких факторов, как состояние заболевания, возраст пациента, его пол и вес, а также способность антитела или части антитела вызывать желательный ответ у индивидуума. Терапевтически эффективное количество представляет собой также такое количество, для которого любые токсические или неблагоприятные эффекты антитела или его части перевешиваются терапевтически благоприятными и значимыми эффектами. «Профилактически эффективное количество» относится к такому количеству, которое эффективно в дозировках и в течение необходимого периода времени для достижения желательного профилактического эффекта. В типичном случае, поскольку профилактическая доза применяется субъектом до начала заболевания или на ранних стадиях заболевания, то профилактически эффективное количество меньше, чем терапевтически эффективное количество.
Режимы дозировок могут быть откорректированы для достижения оптимального желательного ответа (например, терапевтического или профилактического ответа). Так, например, единичный болюс может быть введен в виде нескольких отдельных доз в течение определенного периода времени или доза может быть пропорционально снижена или повышена, в зависимости от потребностей той или иной терапевтической ситуации. В некоторых вариантах осуществления настоящего изобретения, особенно удобно изготавливать парентеральную композицию в стандартной дозированной форме, ввиду легкости ее введения и однородности получаемой дозировки. Стандартная дозированная форма, в контексте настоящего описания, относится к физически дискретным единицам, подходящим для введения в виде стандартных дозировок млекопитающим, подлежащим лечению; каждая единица в этих дозированных формах включает заданное количество активного соединения, которое, по расчетам, должно вызывать желательный терапевтический эффект в сочетании с требуемым фармацевтическим носителем. Спецификация на стандартные дозированные формы по настоящему изобретению диктуется и напрямую зависит от (а) уникальных характеристик активного соединения и конкретного терапевтического или профилактического ответа, который можно получить и (b) от ограничений, которые следует учитывать при создании композиции активного соединения, с тем чтобы она была приемлема для лечения чувствительных индивидуумов.
Неограничивающий диапазон терапевтически или профилактически эффективных количеств антитела или его части по настоящему изобретению включает: 0,01-20 мг/кг, или 1-10 мг/кг, или 0,3-1 мг/кг. Следует отметить, что уровни дозировок будут варьировать в зависимости от типа и тяжести состояния, которые предстоит облегчить. Следует также понимать, что специфичные для любого конкретного субъекта режимы дозировок следует с течением времени корректировать, в зависимости от потребностей индивидуума и решения лечащего врача или другого специалиста, ответственного за введение композиции и что диапазоны установленных дозировок являются лишь репрезентативными, и они ни в коей мере не ограничивают область или практический вариант применения заявленной композиции.
8. Применение антител по настоящему изобретению
8.1. Основная стратегия применения анти-IL-12 антитела
В связи со способностью связываться с IL-12, анти-IL-12 антитела или их части по настоящему изобретению могут использоваться для детекции IL-12, и в одном аспекте, hIL-12 (например, в матричном образце, и в одном аспекте, в биологическом образце, таком как сыворотка или плазма) в рамках стандартных иммунологических тестов, таких как иммуноферментный твердофазный анализ (ELISA), радиоиммуноанализ (RIA) или иммуногистохимический анализ ткани. Настоящее изобретение относится к способу детекции IL-12 в биологическом образце, включающему приведение в контакт образца с антителом или частью антитела по настоящему изобретению и детекцию антитела (или части антитела), связанного с IL-12, или, альтернативно, не связанного антитела (или его части), что позволяет выявлять IL-12 в образце. Антитело напрямую или опосредованно метят детектируемым веществом для облегчения детекции связанного или несвязанного антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры комплексов подходящих простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, флуоресцеин-дихлортриазиниламин, дансилхлорид или фикоэритрин; люминесцентные материалы включают люминол; и примеры подходящего радиоактивного материала включают125I,131I,35S или3H. Детекция IL-12 в образце может быть полезна с точки зрения диагностики, например, для диагноза состояния, ассоциированного с повышенным уровнем IL-12, и/или может быть полезна для целей идентификации субъекта, у которого может быть достигнут благоприятный эффект при лечении анти-IL-12 антителом.
В качестве альтернативы мечения антитела, IL-12 можно проанализировать в образце при использовании конкурентного иммунологического теста, в рамках которого, например, стандартные препараты rhIL-12 метят детектируемым веществом и используют немеченное анти-IL-12 антитело, такое как анти-hIL-12 антитело. Согласно этому тесту, объединяют образец, меченые rhIL-12 стандартные препараты и анти-hIL-12 антитело и определяют количество меченого стандартного препарата rhIL-12, связанного с немеченым антителом. Количество hIL-12 в образце обратно пропорционально количеству меченого стандартного препарата rhIL-12, связанного с анти-hIL-12 антителом.
Антитела и части антител по настоящему изобретению способны нейтрализовать активность IL-12 in vitro и in vivo, и в одном аспекте, активность hIL-12. Соответственно, антитела и части антител по настоящему изобретению могут использоваться для ингибирования активности IL-12, например, в культуре клеток, содержащей IL-12, у людей, а также у других млекопитающих, имеющих IL-12, с которым антитело по настоящему изобретению вступает в перекрестную реакцию (например, приматы, такие как павиан, яванский макак и макак-резус). В одном аспекте, настоящее изобретение относится к выделенному человеческому антителу или его антиген-связывающей части, которое/ая нейтрализует активность человеческого IL-12, и по меньшей мере активность IL-12 у одного дополнительного IL-12 примата, выбранного из группы, состоящей из IL-12 павиана, IL-12 игрунки, IL-12 обыкновенного шимпанзе, IL-12 яванского макак и IL-12 макака-резус, однако не нейтрализуют активность мышиного IL-12. В одном аспекте, указанный IL-12 представляет собой человеческий IL-12. Например, в случае культуры клеток, которые содержат или которые могут содержать hIL-12, антитело или часть антитела по настоящему изобретению могут быть добавлены в культуральную среду для ингибирования активности hIL-12 в культуре.
В другом аспекте, настоящее изобретение относится к способу ингибирования активности IL-12 у субъектов, имеющих расстройство, в развитие которого вовлекается активность IL-12. Было показано, что IL-12 вовлекается в патофизиологию большого числа расстройств (Windhagen et al., (1995) J. Exp. Med. 182: 1985-1996; Morita et al. (1998) Arthritis and Rheumatism. 41: 306-314; Bucht et al (1996) Clin. Exp. Immunol. 103: 347-367; Fais et al. (1994) J. Interferon Res. 14:235-238; Pyrronchi et al., (1997) Am. J. Path. 150:823-832; Monteleone et al., (1997) Gastroenterology. 112:1169-1178, и Berrebi et al (1998) Am. J. Path 152:667-672; Pyrronchi et al. (1997) Am. J. Path. 150:823-832, где полное описание указанных работ включено в настоящую заявку в качестве ссылок). Настоящее изобретение относится к способам ингибирования активности IL-12 у субъекта, имеющего такое расстройство, где указанный способ включает введение указанному субъекту антитела или части антитела по настоящему изобретению, так что достигается ингибирование активности IL-12 у субъекта. В одном аспекте, указанный IL-12 представляет собой человеческий IL-12 и субъектом является человек. Альтернативно, указанный субъект может представлять собой млекопитающее, экспрессирующее IL-12, с которым антитело по настоящему изобретению вступает в перекрестную реакцию. Еще другим субъектом может быть млекопитающее, в организм которого был встроен hIL-12 (например, путем введения IL-12 или при экспрессии трансгена hIL-12). Антитело по настоящему изобретению может вводиться человеку с терапевтической целью. Кроме того, антитело по настоящему изобретению может вводиться в ветеринарном аспекте млекопитающему, отличному от человека, которое экспрессирует IL-12 и с которым данное антитело вступает в перекрестную реакцию, или в том варианте, когда указанное животное можно использовать в качестве модели для изучения заболевания человека. Что касается последнего варианта, то такие модели животных могут использоваться для оценки терапевтической эффективности антител по настоящему изобретению (например, при тестировании дозировок и времени введения).
В контексте настоящего описания, фраза «расстройство, при котором активность IL-12 является неблагоприятной» относится к заболеваниям и другим расстройствам, при которых присутствие IL-12 у субъекта, имеющего это заболевание, как было показано, является или, предположительно, является ответственным за патофизиологию такого расстройства или является фактором, который вносит вклад в ухудшение указанного расстройства. Соответственно, расстройство, при котором активность IL-12 представляет собой неблагоприятный фактор, представляет собой такое расстройство, при котором ингибирование активности IL-12, как ожидается, будет облегчать симптомы и/или ослаблять прогрессирование расстройства. Такие расстройства могут проявляться, например, в виде повышения концентрации IL-12 в биологической жидкости у субъекта, имеющего такое расстройство (например, в виде повышения концентрации IL-12 в сыворотке, плазме, синовиальной жидкости и т.п. у субъекта), которое может быть обнаружено, например, с использованием анти-IL-12 антител, как было описано выше. Имеется множество примеров расстройств, при которых активность IL-12 является неблагоприятной. В одном аспекте, антитела или их антиген-связывающие части могут использоваться в курсе лечения заболеваний или расстройств по настоящему описанию. В другом аспекте, рассматриваемые антитела или их антиген-связывающие части могут использоваться для производства лекарственного средства, применяемого при лечении заболеваний или расстройств, описанных выше. Применение антител и частей антител по настоящему изобретению при лечении некоторых, без ограничения, специфических расстройств обсуждается ниже.
Интерлейкин 12 играет важную роль в патологии, ассоциированной с множеством заболеваний, включающих иммунные и воспалительные элементы. Указанные заболевания включают, без ограничения, ревматоидный артрит, остеоартрит, ювенильный хронический артрит, артрит Лайма, псориатический артрит, реактивный артрит, спондилоартропатию, красную волчанку, болезнь Крона, язвенный колит, воспалительную болезнь кишечника, инсулин-зависимый сахарный диабет, тиреоидит, астму, аллергические заболевания, псориаз, кожную склеродерму, атопический дерматит, болезнь «трансплантат против хозяина», реакцию отторжения трансплантата органа, острое или хроническое иммунное заболевание, ассоциированное с трансплантацией органа, саркоидоз, склероз, диссеминированное внутрисосудистое коагулирование, болезнь Кавасаки, болезнь Грейвса, нефротический синдром, синдром хронической усталости, гранулематоз Вегенера, пурпуру Геноха-Шенлейна, микроскопический васкулит почек, хронический активный гепатит, увеит, септический шок, синдром токсического шока, септический синдром, кахексию, инфекционные заболевания, паразитарные заболевания, синдром приобретенного иммунодефицита, острый поперечный миелит, хорею Хантингтона, болезнь Паркинсона, болезнь Альцгеймера, инсульт, первичный билиарный цирроз, гемолитическую анемию, злокачественное заболевание, сердечную недостаточность, инфаркт миокарда, болезнь Аддисона, спорадическую полигландулярную недостаточность типа I и полигландулярную недостаточность типа II, синдром Шмидта, респираторный дистрес-синдром взрослых (острый), алопецию, гнездную алопецию, серонегативную артропатию, болезнь Рейтера, псориатическую артропатию, язвенную артропатию, энтеропатический синовит, артропатию, ассоциированную с хламидиями, иерсиниями и сальмонеллами, спондиллоартропатию, атероматозное заболевание/артериосклероз, атопическую аллергию, аутоиммунное буллезное заболевание, пузырчатку вульгарную, листовидную пузырчатку, пемфигоид, IgA-зависимый линейный дерматоз, аутоиммунную гемолитическую анемию, позитивную гемолитическую анемию Кумбса, приобретенную пернициозную анемию, ювенильную пернициозную анемию, миалгический энцефалит/синдром хронической усталости, хронический кожно-слизистый кандидоз, гигантоклеточный артериит, первичный склерозирующий гепатит, криптогенный аутоиммунный гепатит, синдром приобретенного иммунодефицита, болезнь, родственную приобретенному иммунодефициту, гепатит С, вариабельный неклассифицируемый иммунодефицит (вариабельную неклассифицируемую гипогаммаглобулинемию), дилатированную кардиомиопатию, женскую инфертильность, угасание функции яичников, преждевременное угасание функции яичников, фиброз легкого, криптогенный фиброзирующий альвеолит, пост-воспалительную интерстициальную болезнь легкого, интерстициальный пневмонит, болезнь соединительной ткани, связанную с интерстициальной болезнью легкого, смешанную соединительнотканную болезнь, связанную с интерстициальной болезнью легкого, системный склероз, связанный с интерстициальной болезнью легкого, ревматоидный артрит, связанный с интерстициальной болезнью легкого, красную волчанку, связанную с интерстициальной болезнью легкого, дерматомиозит/полимиозит, связанный с болезнью легкого, болезнь Шегрена, связанную с болезнью легкого, анкилозирующий спондилит, связанный с болезнью легкого, васкулярную диффузную болезнь легкого, гемосидероз, связанный с болезнью легкого, интерстициальную болезнь легкого, вызванную лекарственными средствами, радиационный фиброз, облитерирующий бронхиолит, хроническую эозинофильную пневмонию, лимфоцитарную инфильтрирующую болезнь легкого, постинфекционную интерстинциальную болезнью легкого, подагрический артрит, аутоиммунный гепатит, аутоиммуный гепатит типа 1 (классический аутоиммунный или липоидный гепатит), аутоиммуный гепатит типа 2 (гепатит с анти-LKM антителом), аутоиммунное заболевание, опосредованное гипогликемией, инсулин-резистентность типа B с акантотическим дерматозом, гипопаратиреоз, острое иммунное заболевание, связанное с трансплантацией органа, хроническое иммунное заболевание, связанное с трансплантацией органа, остеоартроз, первичный склерозирующий холангит, идиопатическую лейкопению, аутоиммунную нейтропению, болезнь почек, без уточнения диагноза, гломерулонефрит, микроскопическую васкулит почек, болезнь Лайма, дискоидный волчаночный эритематоз, мужскую инфертильность, идиопатическую или без уточнения диагноза, аутоиммунность клеток спермы, рассеянный склероз (все подтипы), инсулин-зависимый сахарный диабет, симпатическую офтальмию, легочную гипертензию, вторичную относительно заболевания соединительной ткани, синдром Гудпасчера, легочное проявление полиартериита нодозного, острую ревматическую лихорадку, ревматоидный спондилит, болезнь Стилла, системный склероз, болезнь Такаясу/артериит, аутоиммунную тромбоцитопению, идиопатическую тромбоцитопению, аутоиммунную болезнь щитовидной железы, гипертиреоз, зобный аутоиммунный гипотиреоз (болезнь Хашимото), атрофический аутоиммунный гипотиреоз, первичную микседему, факогенный увеит, первичный васкулит и витилиго. Человеческие антитела и части антител по настоящему изобретению могут использоваться для лечения аутоиммунных заболеваний, в частности, таких заболеваний, которые ассоциированы с воспалением, включая ревматоидный спондилит, аллергию, аутоиммунный диабет и аутоиммунный увеит.
В некоторых аспектах, антитела или их антиген-связывающие части по настоящему изобретению используются для лечения ревматоидного артрита, болезни Крона, рассеянного склероза, инсулин-зависимого сахарного диабета и псориаза.
8.2 Применение анти-IL-12 антитела при ревматоидном артрите
Было показано, что интерлейкин-12 вовлекается в развитие воспалительных заболеваний, таких как ревматоидный артрит. Индуцируемый транскрипт IL-12p40 был выявлен в синовиальной жидкости от пациентов с ревматоидным артритом и было показано, что IL-12 присутствует в синовиальной жидкости у пациентов с ревматоидным артритом (см., например, Morita et al., (1998) Arthritis and Rheumatism 41: 306-314, полное описание работы включено в настоящую заявку в качестве ссылки). Было показано, что IL-12-положительные клетки присутствуют в выстилающем слое синовия при ревматоидном артрите. Человеческие антитела и части антител по настоящему изобретению могут применяться с целью лечения, например, ревматоидного артрита, ювенильного ревматоидного артрита, артрита Лайма, ревматоидного спондилита, остеоартрита и подагрического артрита. В типичном случае, указанное антитело и часть антитела вводят системно, хотя в случае некоторых расстройств может быть полезно локальное введение антитело или части антитела. Антитело или часть антитела по настоящему изобретению может также вводиться в сочетании с одним или несколькими дополнительными терапевтическими средствами, применяемыми при лечении аутоиммунных заболеваний.
На мышах с артритом, индуцированным коллагеном (CIA), используемых в качестве исследуемой модели ревматоидного артрита, лечение мышей, проводимое с использованием анти-IL-12 мАТ (моноклональное антитело крысы против IL-12, C17.15) до наступления артрита, заметно подавило начало его проявления и снизило частоту и тяжесть течения заболевания. Лечение с использованием анти-IL-12 мАТ сразу после начала артрита снижало тяжесть его течения, но применение анти-IL-12 мАТ, проводимое в более поздний период после начала заболевания, оказывало минимальный эффект на тяжесть заболевания.
8.3 Использование анти-IL-12 антитела при болезни Крона
Интерлейкин-12 также играет определенную роль в развитии воспалительного заболевания кишечника, болезни Крона. У пациентов с болезнью Крона происходит повышенная экспрессия IFN-γ и IL-12 в слизистой кишечника (см., например, Fais et al., (1994) J. Interferon Res. 14: 235-238; Pyrronchi et al., (1997) Amer. J. Pathol. 150: 823-832; Monteleone et al, (1997) Gastroenterology 112: 1169-1178; Berrebi et al., (1998) Amer. J. Pathol. 152: 667-672, где полное описание указанных работ включено в настоящую заявку в качестве ссылок). Было показано, что анти-IL-12 антитела подавляют заболевание на моделях мышей с колитом, например, у мышей с TNBS-индуцированным колитом с выключенным за счет knockout-мутации IL-12, и позже это было показано также на мышах с выключенным за счет knockout-мутации IL-10. Соответственно, антитела по настоящему изобретению и их части могут применяться при лечении воспалительных заболеваний кишечника.
8.4 Использование анти-IL-12 антитела при лечении рассеянного склероза
Интерлейкин-12 вовлекается в качестве ключевого медиатора в патологию рассеянного склероза. Экспрессия индуцируемого IL-12 p40 транскрипта или самого IL-12 была продемонстрирована в очагах повреждений у пациентов с рассеянным склерозом (см., например, Windhagen et al., (1995) J. Exp. Med 182: 1985-1996, Drulovic et al (1997) J. Neurol. Sci. 147:145-150, где полное описание указанных работ включено в настоящую заявку в качестве ссылки). Пациенты с хроническим прогрессирующим рассеянным склерозом характеризуются повышенными уровнями IL-12 в крови. Исследования, проведенные с Т-клетками и антиген-презентирующими клетками (APC) от пациентов с рассеянным склерозом, выявили наличие самопроизвольных серий иммунных взаимодействий в качестве основы прогрессирования рассеянного склероза, ведущих к появлению иммунного ответа Th1-типа. Усиленная секреция IFN-γ Т-клетками повышала продукцию IL-12 антигенпрезентирующими клеткаими, так что повторяющийся цикл приводил к хронической активации иммунного ответа Th1-типа, поддерживая заболевание (Balashov et al., (1997) Proc. Natl. Acad. Sci. 94: 599-603, где полное описание данной работы включено в настоящую заявку в качестве ссылки). Роль IL-12 в развитии рассеянного склероза исследовали на мышах и крысах с экспериментальным аллергическим энцефаломиелитом (EAE), взятых в качестве моделей рассеянного склероза. В условиях рецидивирующей-ремиттирующей модели EAE (рассеянного склероза) у мышей, предварительное лечение с использованием анти-IL-12 мАТ задерживало наступление паралича и снижало оценку тяжести заболевания по используемой клинической шкале. Лечение с использованием анти-IL-12 мАТ на пике проявления паралича или в ходе последующего периода ремиссии снижало оценку тяжести заболевания по клинической шкале. Соответственно, антитела или их антиген-связывающие части по настоящему изобретению могут служить для облегчения у людей симптомов, ассоциированных с рассеянным склерозом.
8.5 Использование анти-IL-12 антитела при инсулин-зависимом сахарном диабете
Было показано, что интерлейкин-12 вовлекается, в качестве важного медиатора процесса, в развитие инсулин-зависимого сахарного диабета (ИЗСД). ИЗСД индуцировали у NOD мышей путем введения IL-12 и анти-IL-12 антителa выполняли защитную функцию на адаптивной модели переноса ИЗСД. Раннее начало ИЗСД у пациентов зачастую проявляется так называемым периодом «медового месяца», в ходе которого еще сохраняются некоторые остаточные функции островковых клеток. Такие остаточные островковые клетки продуцируют инсулин и регулируют уровни глюкозы в крови лучше, чем вводимый инсулин. Лечение указанных пациентов на ранних стадиях заболевания с использованием анти-IL-12 антитела может препятствовать дальнейшему разрушения островковых клеток, позволяя поддерживать эндогенный источник инсулина.
8.6 Использование анти-IL-12 антитела при псориазе
Было показано, что интерлейкин-12 вовлекается, в качестве ключевого медиатора, в развитие псориаза. Псориаз приводит к острым и хроническим поражениям кожи, которые ассоциированы с профилем экспрессии цитокина TH 1-типа (см., например, Hamid ct al. (1996) J. Allergy Clin. Immunol. 1:225-231; Turka et al. (1995) Mol. Med. 1:690-699, где полное описание указанных работ включено в настоящую заявку в качестве ссылок). В образцах пораженной заболеванием кожи у людей с псориазом были выявлены мРНК для IL-12 p35 и p40. Соответственно, антитела и их антиген-связывающие части могут применяться для ослабления хронических кожных расстройств, таких как псориаз.
8.7 Основная стратегия применения анти-IL-18 антитела
В связи со способностью связываться с IL-18, анти-IL-18 антитела или их части по настоящему изобретению могут использоваться для детекции IL-18, и в одном аспекте, hIL-18 (например, в матричном образце, и в одном аспекте, в биологическом образце, таком как сыворотка или плазма) с использованием стандартных иммунологических тестов, таких как иммуноферментный твердофазный анализ (ELISA), радиоиммунный анализ (RIA) или иммуногистохимический анализ ткани. Настоящее изобретение относится к способу детекции IL-18 в биологическом образце, включающему контактирование образца с антителом или частью антитела по настоящему изобретению и выявление либо антитела (или части антитела), связавшегося с IL-18, либо антитела (или части антитела), которое осталось не связанным, что позволяет обнаруживать IL-18 в образце. Указанное антитело напрямую или опосредованно метят детектируемым веществом для облегчения детекции связанного или несвязанного антитела. Подходящие детектирующие вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, флуоресцеин-дихлортриазиниламин, дансилхлорид или фикоэритрин; примером люминесцентных материалов является люминол; и примеры подходящих радиоактивных материалов включают125I,131I,35S или3H. Детекция IL-18 в образце может использоваться с целью диагностики, например, при диагностике состояния, ассоциированного с повышенным уровнем IL-18, и/или может использоваться при идентификации субъекта, в случае которого может быть показано лечение с использованием анти-IL-18 антитело.
Альтернативно, меченое антитело IL-18 может быть проанализировано в образце с использованием конкурентного иммунологического анализа, в рамках которого, например, стандартные препараты rhIL-18 метят детектируемым веществом и используют немеченое анти-IL-18 антитело, такое как анти-hIL-18 антитело. В рамках данного теста, объединяют образец, меченые стандартные препараты rhIL-18 и анти-hIL-18 антитело, и определяют количество меченного стандартного препарата rhIL-18, связанного с немеченым антителом. Количество hIL-18 в образце обратно пропорционально количеству меченого стандартного препарата rhIL-18, связанного с анти-hIL-18 антителом.
Антитела и части антител по настоящему изобретению способны нейтрализовать активность IL-18 in vitro и in vivo, и в одном аспекте активность hIL-18. Соответственно, антитела и части антител по настоящему изобретению могут использоваться для ингибирования активности IL-18, например, в клеточной культуре, содержащей IL-18, у людей или у других млекопитающих, содержащих IL-18, с которым антитело по настоящему изобретению вступает в перекрестную реакцию (например, приматы, такие как павиан, яванский макак и макак- резус). В одном аспекте, настоящее изобретение относится к выделенному человеческому антителу или его антиген-связывающей части, которое/ая нейтрализует активность человеческого IL-18 и по меньшей мере активность IL-18 у еще одного представителя приматов, выбранного из группы, состоящей из IL-18 павиана, IL-18 игрунки, IL-18 обыкновенного шимпанзе, IL-18 яванского макака, IL-18 макака-резус, но не нейтрализуют активность мышиного IL-18. В одном аспекте, указанный IL-18 представляет собой человеческий IL-18. Например, в случае клеточной культуры, которая содержит или которая может содержать hIL-18, к указанной культуральной среде может быть добавлено/а антитело или часть антитела по настоящему изобретению для ингибирования активности по настоящему изобретению в культуре.
В другом аспекте, настоящее изобретение относится к способу ингибирования активности IL-18 у субъекта, имеющего расстройство, при котором активность IL-18 является неблагоприятной. Интерлейкин-18 играет решающую роль в патологиях, ассоциированных с множеством заболеваний, вовлекающих иммунные и воспалительные элементы.
В контексте настоящего описания, фраза «расстройство, при котором активность IL-18 является неблагоприятной» включает заболевания и другие расстройства, при которых, как было показано или как предполагается, присутствие IL-18 у субъекта с таким расстройством, определяет патофизиологию расстройства или представляет собой фактор, который вносит вклад в усиление расстройства. Соответственно, расстройство, при котором активность IL-18 является неблагоприятной, представляет собой такое расстройство, в случае которого ожидается, что ингибирование активности IL-18 будет облегчать симптомы и/или ослаблять прогрессирование расстройства. Такие расстройства могут проявляться, например, в виде повышения концентрации IL-18 в биологической жидкости у субъекта, имеющего такое расстройство (например, проявляться в виде повышения концентрации IL-18 в сыворотке, плазме, синовиальной жидкости и т.п. у субъекта), которое может быть детектировано, например, с использованием анти-IL-18 антитела, как было описано выше. Имеется множество примеров расстройств, при которых активность IL-18 является неблагоприятной. В одном аспекте, антитела или их антиген-связывающие части могут использоваться для лечения заболеваний или расстройств, приведенных в настоящем описании. В другом аспекте, антитела или их антиген-связывающие части могут использоваться в производстве лекарственного средства для лечения заболеваний или расстройств по настоящему описанию. Ниже приведен неограничивающий список вариантов применения антител и частей антител по настоящему изобретению для лечения ряда специфических расстройств.
Настоящее изобретение относится к фармацевтическим композициям, применяемым для лечения заболеваний или расстройств, при которых требуется модуляция активности IL-18. Указанные расстройства или состояния включают аутоиммунные заболевания, диабет типа I, ревматоидный артрит, реакции отторжения трансплантата, воспалительную болезнь кишечника, сепсис, рассеянный склероз, ишемическую болезнь сердца (включая сердечные приступы), ишемическое поражение головного мозга, хронический гепатит, псориаз, хронический панкреатит, острый панкреатит и т.п.
Соответственно, анти-IL-18 антитела или их антиген-связывающие части или векторы, экспрессирующие их in vivo, показаны для лечения аутоиммунных заболеваний, диабета типа I, ревматоидного артрита, реакций отторжения трансплантата, воспалительной болезни кишечника, сепсиса, рассеянного склероза, ишемической болезни сердца, включая острые сердечные приступы, ишемического поражения головного мозга, хронического гепатита, псориаза, хронического панкреатита, острого панкреатита и родственных заболеваний, при которых отмечается аберрантная экспрессия IL-18, приводящая к избыточным количествам IL-18, или в случаях осложнений, связанных с экзогенным введением IL-18.
8.8 Использование анти-IL-18 антитела при повреждении печени
Один аспект настоящего изобретения относится к разработке новых средств для лечения и/или профилактики повреждения печени. Было обнаружено, что ингибитор IL-18 эффективен в направлении предупреждения и лечения повреждения печени. В этой связи, настоящее изобретение относится к использованию ингибитора IL-18 в производстве лекарственного средства, применяемого для лечения и/или предупреждения повреждения печени. Более конкретно, настоящее изобретение относится к лечению и/или предупреждению повреждения печени, вызванного алкогольным гепатитом, вирусным гепатитом, иммунным гепатитом, молниеносным гепатитом, циррозом печени и первичным билиарным циррозом.
8.9 Использование анти-IL-18 антитела при артрите
Было показано, согласно настоящему изобретению, что ингибитор IL-18 эффективен при лечении артрита. Терапевтический эффект такого применения включает снижение тяжести заболевания, а также предупреждение распространения заболевания. В этой связи, настоящее изобретение относится к использованию ингибитора IL-18 для лечения и/или предупреждения артрита. Это открытие было неожиданным, поскольку на основе достигнутого в данной области уровня, как было описано выше, нельзя было сделать вывод о том, что блокада одного специфического фактора, вовлекаемого в развитие артрита, а именно: интерейлкина-18 (IL-18), приведет к ослаблению артрита или даже к излечиванию пораженного артритом сустава.
Термин «артрит» обозначает все различные типы артрита и артритных состояний, включая как острый, так и хронический артрит, согласно определению данному, например, в Руководстве Департамента Ортопедии при Университет Вашингтона по артриту (Homepage of the Department of Orthopaedics of the University of Washington on Arthritis). Примеры артритных состояний включают анкилозирующий спондилит, боль в пояснице, запястный синдром, синдром Элерса-Данлоса-Русакова, подагру, ювенильный артрит, красную волчанку, миозит, несовершенный остеогенез, остеопороз, полиартериит, полимиозит, псориатический артрит, синдром Рейтера, склеродерму, артрит в сочетании с болезнью кишечника, болезнь Бехчета, детский артрит, дегенеративное заболевание суставов, фибромиалгию, инфекционный артрит, болезнь Лайма, синдром Марфана, остеоартрит, остеонекроз, болезнь Педжета, ревматическую полимиалгию, псевдоподагру, рефлексную симпатическую дистрофию, ревматоидный артрит, ревматизм, синдром Шенгрена, семейный аденоматозный полипоз и т.п.
Ревматоидный артрит (РА) вызывает воспаление выстилки суставов (синовиальной мембраны, однослойного эпителия) и/или внутренних органов. Заболевание может персистировать в течение многих лет, поражая в типичном случае много разных суставов во всем теле, и в итоге может вызвать повреждение хряща, кости, сухожилий и связок. Суставы, которые могут поражаться ревматоидным артритом, включают суставы, локализованные на шее, плечах, локтях, бедрах, запястьях, руках, коленях, голеностопных областях и ногах, причем, например, при РА суставы зачастую воспаляются симметрично.
РА встречается примерно у 1% населения в Соединенный Штатах и распределяется в пределах всех этнических групп и возрастов. Это заболевание распространено по всему миру и количество женщин, больных ревматоидным артритом, превышает количество больных этим заболеванием мужчин в соотношении 3:1.
На мышиной модели артрита было показано, что введение ингибитора IL-18 значительно снижает эрозию хряща. Таким образом, настоящее изобретение, относится к использованию ингибитора IL-18 в производстве лекарственного средства для лечения и/или предупреждения деструкции хряща.
8.10 Основная стратегия использования анти-TNFα антитела
Фактор некроза опухолевой ткани TNFα представляет собой полифункциональный провоспалительный цитокин, секретируемый преимущественно моноцитами/макрофагами, и этот цитокин оказывает эффект на липидный метаболизм, процесс свертывания крови, инсулин-резистентность и функцию эндотелия. TNFα представляет собой растворимый гетеротример, состоящий из белковых субъединиц размером 17 кДа. Существует также связанный с мембраной предшественник TNFα размером 26 кДа. Он был обнаружен в синовиальных клетках и макрофагах в тканях. Клетки, отличные от моноцитов и макрофагов, также продуцируют TNFα. Например, человеческие не моноцитарные линии опухолевых клеток продуцируют TNFα, и, кроме того, CD4+ и CD8+ Т-лимфоциты периферической крови и некоторые Т- и B- клеточные линии также продуцируют TNFα. Он вовлекается, хотя это не уникальная его функция, в процесс ревматоидного артрита и присутствует при многих воспалительных заболеваниях. Рецепторы для TNFα находятся на некоторых мононуклеарных клетках, в синовиальной мембране, а также в периферической крови и синовиальной жидкости. TNFα представляет собой важнейший воспалительный медиатор при ревматоидном артрите и, в этой связи, может представлять собой полезную мишень для специфической иммунотерапии.
TNFα оказывает провоспалительное действие, которое приводит к повреждению ткани, такому как деградация хряща и кости, к индукции молекул адгезии, вызывающих прокоагулирующую активность в эндотелиальных клетках сосудов, что может привести к усилению процессов слипания нейтрофилов и лимфоцитов и к стимуляции высвобождения из макрофагов, нейтрофилов и эндотелиальных клеток сосудов фактора активации тромбоцитов. Результаты последних исследований выявили связь TNFα с инфекциями, иммунными расстройствами, с патологиями неопластического характера, с аутоиммунными патологиями и с патологиями, определяемыми реакцией «трансплантат против хозяина».
TNFα рассматривается как важнейший фактор, играющий центральную роль в сепсисе, вызванном Грам-отрицательными бактериями, и в эндотоксическом шоке, включая лихорадку, недомогание общего характера, анорексию и кахексию. Эндотоксин в значительной мере активирует продукцию моноцитами/макрофагами и далее секрецию TNFα и других цитокинов. TNFα и другие образуемые моноцитами цитокины вовлекаются в метаболические и нейрогормональные ответы на эндотоксин. Введение эндотоксина людям-волонтерам вызывает острое заболевание с гриппоподобными симптомами, включающими лихорадку, тахикардию, повышенный уровень метаболизма и высвобождение гормона стресса. Циркуляция TNFα возрастает у пациентов с сепсисом, вызванным Грам-отрицательными бактериями.
Таким образом, было показано, что TNFα вовлекается в воспалительные заболевания, аутоиммунные заболевания, вирусные, бактериальные и паразитарные инфекции, злокачественные заболевания и/или нейродегенеративные заболевания и представляет собой полезную мишень для специфически направленной биологической терапии при таких заболеваниях, как ревматоидный артрит и болезнь Крона. Благоприятные результаты испытаний с открытой меткой, проведенных с химерным моноклональным антителом против TNFα, продемонстрировали подавление воспаления и успешность его применения при повторном лечении рецидива ревматоидного артрита и болезни Крона.
Было показано, что нейтрализующая антисыворотка или мАТ против TNFα ослабляет у млекопитающих побочные физиологические изменения и при эндотоксемии и бактеремии в экспериментах с летальной провокацией препятствует гибели. Адалимумаб (Adalimumab) (также известный под торговой маркой HUMIRA®, доступный от компании Abbott Laboratories) представляет собой рекомбинантное человеческое моноклональное антитело, специфичное для TNFα. Это моноклональное антитело связывается с TNFα и блокирует взаимодействие с p55 и p75 рецепторами TNFα на клеточной поверхности. Указанное моноклональное антитело практически специфично для TNFα, поскольку оно, по всей видимости, не ингибирует активность TNFβ. В присутствии комплемента, адалимумаб лизирует поверхность клеток, экспрессирующих TNFα.
ПРИМЕРЫ
1. Уничтожение вируса в ходе очистки и выделения анти-IL-18 антител
Настоящее исследование было проведено для оценки эффективности методов уничтожения вируса в ходе очистки анти-IL-18 антител. В данном исследовании оценивали стадии: инактивации при низком pH, катионообменной хроматографии по методу захвата (Fractogel™ EMD S03-смола), анионообменной хроматографии (Q-Sepharose™ FF смола) и хроматографии гидрофобного взаимодействия (Phenyl Sepharose™ HP смола), использованной в качестве хроматографии, позволяющей провести более тонкую очистку. Данное исследование соответствовало руководству ICH относительно уничтожения вирусов ортогональными методами при производстве лекарственного вещества.
Данное исследование относилось к уничтожению двух вирусов, ксенотропного ретровируса лейкоза мышей (X-MuLV или X-MLV) и малого вируса мышей (MVM или MMV). Согласно руководствам ICH, оба этих вируса были выбраны с тем, чтобы «исследовать релевантные вирусы, которые могут загрязнять продукт и представить в исследовании широкий диапазон их физико-химических свойств, с тем чтобы протестировать способность системы устранять вирусы в целом» (см., «Q5A Viral Safety Evaluation of Biotechnology Products Derived From Cell Lines of Human or Animal Original,» published in Federal Register/Vol. 63, No. 185 /Thursday, September 24, 1998/Notices (http://www.fds.gove/cber/gdlns/virsafe.pdf, полное описание руководства включено в настоящую заявку в качестве ссылки). В таблице 2 указаны свойства двух исследованных вирусов. X-MLV представляет собой ретровирус, выбранный в качестве специфической модели вирусов, поскольку неинфекционные частицы типа ретровирусов часто обнаруживаются в линиях клеток грызунов, таких как клетки яичника китайского хомячка (CHO), включая клеточную линию CHO, используемую для получения антител, таких как анти-IL-18 антитела. MVM характеризуется высокой резистентностью к физико-химической инактивиции, и поэтому он может рассматриваться как релевантный вирус, поскольку в ряде сообщений есть указание на его присутствие в некоторых лотах супернатанта культуры CHO клеток ((R.L. Garnick, Dev. Biol. Stand., 88, pp. 49-56 (1996)). Термин MVM является синонимом малого мышиного вируса MMV.

1.1 Методы
Настоящее исследование проводилось по протоколу, представленному на фиг.4.
На каждой стадии данного процесса проводилась провокация концентрированным «спайком» вируса в подаваемом потоке (объемы «спайка» вируса 1-7,1 объемн %). Нагрузка, продукт и содержание в контрольных потоках оценивались по количеству вирусов и определяли log снижения для каждой стадии.
Каждую стадию процесса (см. фиг.4) проводили в двойном повторе. Хроматографические смолы оценивали путем провокации на менее масштабных моделях условий нормального процесса производства, как показано в таблице 4. Все колонки имели внутренний диаметр 1 см и соответствовали требуемым критериям по фактору асимметрии колонки (0,5-2,0). Разрешенный диапазон высоты слоя для каждой колонки в уменьшенном масштабе был таким же, как и в производственных колонках. В таблице 3 представлено краткое описание условий обработки.


1.2 Токсичность буфера/результаты оценки интерференции
В рамках исследования эффективности уничтожения вируса, тестировали образцы и буферы для выявления, имелась ли токсичность для клеточных линий, использованных в исследовании вирусов. Образцы и буферы оценивали по их потенциальному воздействию на способность выбранных вирусов инфицировать индикаторные клеточные линии. Не было выявлено значительного снижения инфекционности вирусов ни для одного из использованных буферов, при сравнении полученных результатов с релевантным положительным контролем. Таким образом, по данным проведенного тестирования, буферы, использованные в процессе очистки, были признаны пригодными для ресуспендирования вирусных препаратов после ультрацентрифугирования с целью использования в провокационных тестах на стадиях хроматографии и нанофильтрации.
1.3 Результаты оценки эффективности уничтожения вирусов
Эффективность каждой стадии процесса с точки зрения снижения титров вирусов оценивали путем вычисления log фактора снижения (LRF) по следующему уравнению:
LRF=log10 [Количество внесенного вируса/ Количество вируса в потоке продукта]
Данные по log снижению титров вирусов приведены в обобщенном виде в таблице 5. Результаты, представленные в виде нижних пределов (то есть, LRF≥4,54), показывают, что вирус присутствовал в количествах ниже предела определения.

Стадию инактивации при низком pH проводили только для вируса X-MLV, поскольку известно, что MMV высоко устойчив к инактивации при низком pH. В нулевой точке времени достигались высокие уровни снижения. К 15-минутной точке вообще не наблюдалось инфекционности вирусов. Для оценки образца в точке 60 минут, использовали объемную инокуляцию для повышения чувствительности теста и были получены факторы снижения ≥ 4,54 log10 и ≥ 5,07 log10 для двойных повторов. В случае X-MLV, наблюдалась быстрая инактивация вируса; независимо от того факта, что осветленный собранный материал содержал примерно 0,5% остаточных клеток после проведения процедуры осветления путем центрифугирования и имелись высокие концентрации белков из компонентов культуральной среды.
Стадию хроматографии на Fractogel™-SO3- проводили с использованием материала, нанесенного на Fractogel™-SO3- вместе с X-MLV или MMV в уравновешивающем буфере для Fractogel™-SO3-. Инфекционный вирус выявлялся в элюированных с колонок Fractogel™ фракциях в случае обоих исследованных вирусов. Факторы снижения для X-MLV составляли 5,78 log10 и 5,22 log10 для вариантов двойных повторов. В случае MMV, факторы снижения составляли ≥1,39 log10 и ≥ 1,33 log10.
Стадию хроматографии на Q-Сефарозе™ проводили с использованием нанесенного на колонку с Q-Сефарозой™ материала, при его объединении с X-MLV или MMV в уравновешивающем буфере для Q-Сефарозы™. В образцах из вытекающего элюата не выявлялся инфекционный вирус, ни для одного из исследуемых буферов, и в обоих случаях достигался минимальный предел для тестирования. Факторы снижения, наблюдаемые для X-MLV, составляли ≥ 5,51 log10 и ≥5,59 log10 для двойных повторов, а фактор снижения для MMV составлял 7,04 log10 в обоих повторах.
Стадию хроматографии на фенил-Сефарозе™ HP проводили с использованием нанесенного на колонку с фенил-Сефарозой™ материала, при его объединении с X-MLV или MMV в уравновешивающем буфере для фенил-Сефарозы™ НР. Инфекционный вирус выявлялся в элюируемых с колонок с фенил-Сефарозой™ фракциях, для обоих исследованных вирусов. Факторы снижения, наблюдаемые для X-MLV, составляли 2,45 log10 и 2,03 log10 для двойных повторов. Данная стадия очистки была менее жесткой для MMV, где факторы снижения составляли 0,49 log10 и 0,96 log10.
Нанофильтры Pall DV50™ использовали в экспериментах по вирусной провокации с использованием X-MLV. Для фильтрации в экспериментах с использованием MMV были взяты фильтры Pall DV20™. Оба исследованных вируса ресуспендировали в элюирующем буфере для фенил-Сефарозы™ HP перед добавлением элюированного материала к фенил-Сефарозе™ HP. Для проведения очистки MMV были выбраны фильтры DV20™. Не выявлялся инфекционный вирус в образцах фильтрата в случае X-MLV с использованием фильтра DV50. Факторы снижения, наблюдаемые для X-MLV, составляли ≥4,95 log10 и ≥4,61 log10 для двойных повторов. Инфекционный вирус обнаруживался в образцах фильтрата в случае очистки MMV с использованием фильтра DV20. Факторы снижения, наблюдаемые для MMV, составляли ≥2,98 log10 и ≥ 4,88 log10 для двойных повторов. Расхождение результатов между двумя вариантами оценки с использованием DV20 не удалось объяснить за счет различий в условиях проведения эксперимента для каждого фильтра или в титре «спайка», поскольку эти параметры соответствовали заданным ранее спецификациям. Однако, расхождение могло быть связано со сборкой фильтрующих устройств перед работой. Мембранные фильтры были предварительно смочены и подвергнуты автоклавированию, хотя фильтровальные отделения были отдельно простерилизованы паром. Непосредственно перед работой, фильтрующие разбирали и мембраны помещали в фильтровальные отделения и вновь собирали. Фиксация О-кольцевого конца перед повторной сборкой могло привести к менее, чем оптимальному поведению мембраны, помещенной в фильтровальное отделение.
Данные по инактивации/уничтожению вирусов (таблица 6) показывают, что рассматриваемый способ очистки антитела позволяет удалить минимум 21,91 log10 единиц X-MLV с использованием мембраны для нанофильтрации DV50. Общий фактор снижения для MMV, за исключением варианта использования мембраны DV50, составляет минимум 8,37 log10. А если в способ очистки антитела включали мембранный фильтр DV20, то общий фактор снижения для MMV возрастал минимум до 11,29 log10. Таким образом, приведенные данные показывают, что рассматриваемый способ очистки антител гарантирует вирусную безопасность лекарственного препарата, получаемого на основе антитела (например, анти-IL-18 антитела).

Материал, который был собран из клеточной культуры и который включал анти-IL-18 антитела, осветляли центрифугированием (3000 × g) с последующей фильтрацией через фильтр с размером пор 0,2 мкм. Собранный и осветленный материал корректировали по значению рН с использованием 1М лимонной кислоты и выдерживали при комнатной температуре. Осажденные белки отделяли от растворимых белков путем центрифугирования (16000 × g). Образцы растворимых и нерастворимых белков обрабатывали при нагревании при 60°C в течение 30 минут в присутствии ДСН и анализировали путем электрофореза в полиакриламидном геле.
Результаты проведенного гель-электрофореза (фиг.5) показывают, что молекула антитела остается в растворе при понижении pH в осветленной культуральной среде, где указанная среда также содержит белки клетки-хозяина и компоненты среды. При более низких значениях pH, белки клетки-хозяина дифференциально осаждаются и могут быть удалены путем центрифугирования. Максимальное осаждение достигается в диапазоне значений pH от 4 до 3,5.
В данном эксперименте оценивали влияние pH в ходе нанесения материала с анти-IL-18 антителом на колонку для катионообменной хроматографии (CEX) на связывающую способность (см. Таблица 7). Величину pH в отобранном материале клеточной культуры корректировали добавлением соответствующего количества лимонной кислоты. После выдерживания в течение 1 часа при комнатной температуре указанный материал центрифугировали и проводили фильтрацию через фильтр с размером пор 0,2 мкм. Далее корректировали проводимость путем добавления воды до показателя 10 мс. Исследуемый материал наносили на СЕХ колону с размером 0,5×5 см. Определяли динамическую связывающую способность в ходе нанесения материала на колонку с линейной скоростью 200 см/час. Использовали количественную аналитическую ВЭЖХ с белком A для определения титров антител в образцах вытекающего из колонки материала с целью оценки 5% уровня прорыва breakthrough в ходе нанесения.

Изоэлектрическая точка (pI) для анти-IL-18 антитела составляет 8,43. В растворе при pH 1, что ниже чем значение pI, молекула антитела должна быть положительно заряжена и, соответственно, должна связываться с отрицательно заряженной катионообменной смолой в условиях низкой проводимости. Однако, как видно на приведенной выше таблице 1, антитело совсем не связывалось при нейтральном pH 7,0, меньшем на целую единицу pH относительно pI, который равен 8,43, тогда как при снижении pH связывающая способность смолы повышалась. Титрование pH в собранном материале имеет другие последствия с точки зрении осаждения. Однако, это благоприятный эффект, поскольку происходит селективное осаждение белков и нуклеиновых кислот клетки-хозяина.
Жизнеспособность клеток. Отбирали аликвоту клеточной культуры из двухлитрового биореактора в конце стадии продукции при высокой жизнеспособности материала. Собранные культуры подкисляли с использованием 3 M лимонной кислоты, сначала до pH 5,0, затем до pH 3,5 и выдерживали в течение 1 часа при температуре окружающей среды. После одночасового периода выдерживания, pH культуры доводили до значения 4,8 с использованием 3 M NaOH. Образцы отбирали и определяли количество и жизнеспособность клеток в обработанной культуре. Результаты представлены в Таблице 8.

Отмечается умеренное, на уровне 19,6%, снижение жизнеспособности (92,8% против 74,6%) после 1-часовой экспозиции клеточной культуры при pH 3.5. Общая плотность клеток снижалась на 12,4% (5,6×106 против 4,77×106).
Выдерживание подкисленной культуры при pH 5 и при температуре 4°C в течение ночи привело к небольшому понижению жизнеспособности клеток (на 3% - 74,6% против 72,4%) и плотности клеток (на 10,5% - 4,77×106 против 4,27×106). Точное измерение плотности и жизнеспособности клеток было затруднено в связи с повышением мутности при осаждении белков и нуклеиновых кислот клетки-хозяина. Однако, не было признаков крупномасштабного лизиса клеток, которые должны было выявляться при макроскопическом обследовании.
Извлечение антител. Клеточные культуры получали после завершения ферментации в биореакторе. Клетки отбирали из одной из аликвот после их центрифугирования при 7000 × g. Образцы подкисляли с использованием 3 М лимонной кислоты и выдерживали в течение 1 часа при температуре окружающей среды. После 1-часового выдерживания, культуры корректировали до pH 4,9 с использованием 3 M NaOH. Подкисленные образцы осветляли центрифугированием при 11000 × g с последующей фильтрацией через фильтр с размером пор 0,2 мкм. Проводили количественный анализ по методу ВЭЖХ с белком А для определения титра антител. Полученные титры, после подкисления/осветления, сравнивали с исходными значениями контрольных титров для определения процентной характеристики процесса извлечения. Образцы анализировали и после нейтрализации до pH 5, и после дополнительного выдерживания их в течение ночи при температуре 4°C.
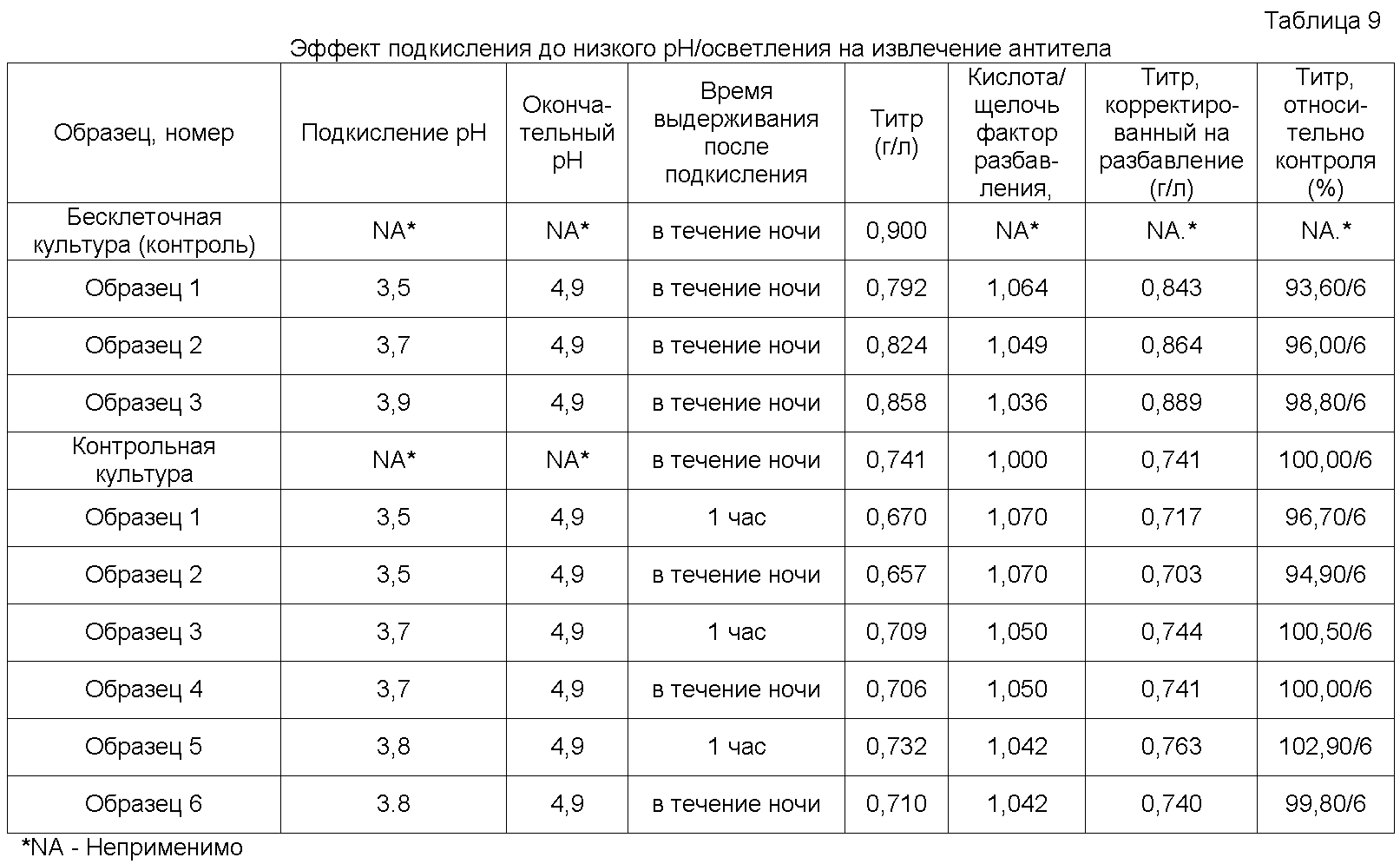
Как видно из данных, приведенных в таблице 9, оптимальное значение pH для извлечения титра антитела после подкисления/осветления собранного антитела, находилось в диапазоне значений pH от 3,7 до 3,9. При pH 3,5 наблюдалось небольшое снижение титра антител (от 5,1 до 6,4%). Такое небольшое снижение титра наблюдалось в подкисленных культурах, как при наличии клеток, так и в отсутствие клеток. Оптимальное значение pH различалось в зависимости от биохимических и физических свойств молекулы конкретного антитела.
Функция антитела. Культуру из биореактора подкисляли с использованием 3 М лимонной кислоты до pH 3,5 и выдерживали в течение 1 часа при температуре окружающей среды. Собранный и подкисленный материал далее титровали до pH 5 с использованием 3M NaOH и осветляли путем центрифугирования и фильтрования через фильтр с размером пор 0,2 мкм. Антитела из подкисленного/осветленного собранного материала далее очищали с использованием катионообменной хроматографии. Неподкисленную культуру из биореактора осветляли центрифугированием и фильтрованием через фильтр с размером пор 0,2 мкм, после чего антитело подвергали очистке на стадии аффинной хроматографии с белком А. С использованием целевого антигена, определяли кинетику связывания выделяемого антитела, взятого из подкисленного и неподкисленного материала. См. таблицу 10.

Приведенные данные показывают, что применительно к исследуемому антителу, подкисление материала из биореактора оказывало небольшой эффект на функциональность антитело после очистки.
Влияние типа используемой кислоты на извлечение антитела. Клеточные культуры получали из биореактора по завершению процесса ферментации. Образцы осторожно подкисляли с использованием 3М лимонной кислоты, 3М фосфорной кислоты или 3М хлористоводородной кислоты и выдерживали в течение 1 часа при температуре окружающей среды. После одночасового выдерживания культуры, корректировали pH до 5,0 с использованием 3M NaOH. Подкисленные образцы осветляли центрифугированием при 11000×g с последующим фильтрованием через фильтр с размером пор 0,2 мкм. Использовали количественный анализ по методу ВЭЖХ с белком А для определения титра антител. Титры, подсчитанные после подкисления/осветления, сравнивали с исходными титрами в контроле для определения процента извлечения. См. Таблицу 11.

Как видно из данных, приведенных в таблице 11, извлечение титра антител было оптимальным в случае использования лимонной или фосфорной кислоты для целей подкисления до низкого pH/осветления собранного материала антитела. Как было отмечено, перед использованием 3М лимонной кислоты, корректировка культуры до слегка более высокого pH улучшала извлечение антител. При pH 3,5 наблюдалось небольшое снижение титра антител (2,1% для 3M лимонной кислоты, 1% для 3M фосфорной кислоты и 7,7% для 3 M хлористоводородной кислоты).
2. Определение концентрации белка клетки-хозяина в композиции анти-IL-12 антитела
Данная процедура использовалась для определения остаточной концентрации белка клетки-хозяина в образцах анти-IL-12 антитела. Использовали иммуноферментный твердофазный анализ (ELISA) для сэндвич-тестирования белка клеток-хозяев (антигенов), помещенного между двумя слоями специфических антител. После этого казеином блокировали неспецифические сайты. Далее, белки клеток-хозяев инкубировали и в течение этого времени молекулы антигена связывались с первым антителом (покрывающее антитело). Затем добавляли второе антитело (биотинилированное антитело против белка клетки-хозяина), которое связывается с антигеном (белок клетки-хозяина). Добавляли нейтравидин, конъюгированный с пероксидазой хрена, который связывается с биотинилированным антителом против белка клетки-хозяина. После этого добавляли субстрат К blue. Хромогенный субстрат гидролизуется при связывании с антителом, конъюгированным с ферментом, образуя синее окрашивание. Реакцию останавливали добавлением 2M H3PO4, что сопровождалось изменением окрашивания на желтый цвет. Интенсивность окрашивания была прямо пропорциональна количеству антигена, связанного в лунке.
Получение 50 мМ бикарбоната натрия (покрывающий буфер), pH 9,4. В стакан на 1 литр добавляют: 900 мл воды Milli-Q; 4,20 г ± 0,01 г бикарбоната натрия. Хорошо перемешивают до полного растворения. Доводят pH до 9,4 с использованием 1н NaOH. Переносят в мерную колбу на 1 л и доводят объем до метки водой Milli-Q. Перемешивают до гомогенного состояния при переворачивании колбы. Фильтруют через устройство для стерильного фильтрования с размером пор 0,22 мкм. Хранят при температуре 4°C до 7 дней от даты приготовления.
Получение 0,104 M Na2HPO4×7H20, 1,37 M NaCl, 0,027 M KCl, 0,0176 M KH2PO4, pH 6,8-6,9(10×ФБР). Вносят примерно 400 мл воды Milli-Q в стеклянный стакан. Далее добавляют 13,94 г ± 0,01 г Na2HPO4 × 7H2O. Добавляют 40,0 г ±0,1 г NaCl. Добавляют 1,00 г ± 0,01 г KCl. Добавляют 1,20 г ± 0,01 г KH2P04. Перемешивают до гомогенного состояния. Переносят в мерную колбу на 500 мл. Доводят объем до метки 500 мл с использованием воды Milli-Q. Перемешивают путем переворачивания. Фильтруют через устройство для стерильного фильтрования с размером пор 0,2 мкм. Хранят при температуре 4°C до 7 дней от даты приготовления.
Получение 1×ФБР+0,1% Тритон X-100, pH 7,40: (промывочный буфер для планшета). В градуированном цилиндре на 4 л смешивают 400 мл 10×ФБР (стадия 5.2) с 3500 мл воды Milli-Q. Проверяют pH и, при необходимости, доводят до значения 7,40±0,05 с использованием 1н HCl или 1н NaOH. Доводят объем до метки водой Milli-Q. Плотно закрывают цилиндр парафином и перемешивают путем переворачивания до гомогенного состояния. Переносят в бутыль на 4 л. Отбирают 4 мл 1×ФБР и отбрасывают. Добавляют 4 мл Тритона Х-100 к 3996 мл 1×ФБР. Помещают на встряхиваемый планшет и перемешивают до полного растворения. Фильтруют буфер для промывания планшета в количестве, нужном для разбавления буфера, применяемого для получения препарата, через устройство для стерильного фильтрования с размером пор 0,22 мкм. Хранят при комнатной температуре до 7 дней от даты изготовления.
Получение покрывающей смеси антитела: козье анти-CHO антитело 599/626/748 (лот No. Gl 1201 @ 1,534 мг/мл), после аффинной очистки: Примечание: Концентрированный раствор хранят при номинальной температуре -80°C в ампулах. Отбирают аликвоты. Переносят одну аликвоту на планшет к моменту использования. Непосредственно перед использованием: разбавляют смесь антитела до конечной концентрации 4 мкг/мл с использованием 50 мМ бикарбоната натрия следующим образом: Например: добавляют 31 мкл покрывающей смеси антитела к 11969 мкл холодного покрывающего буфера. Осторожно перемешивают путем переворачивания.
Получение биотинилированного козьего антитела против белковой смеси клеток-хозяев 599/626/748 (лот No. Gl 1202 @ 0,822 мг/мл): Примечание: Концентрированный раствор хранят при номинальной температуре -80°C в ампулах. Отбирают аликвоты. Переносят одну аликвоту на планшет к моменту использования. Непосредственно перед использованием: разбавляют биотинилированную смесь антитела до конечной концентрации 1 мкг/мл при 37°C±2°С казеином следующим образом. Например: добавляют 14,6 мкл биотинилированной смеси антитела к 11985 мкл казеина при температуре 37°C±2°C. Осторожно перемешивают путем переворачивания.
Получение Нейтравидина-HRP, конъюгированного со щелочной фосфатазой хрена. Восстанавливают новые лоты (2 мг/флакон) до концентрации 1 мг/мл согласно указанной ниже процедуре: вносят во флакон 400 мкл воды Milli-Q, затем добавляют 1600 мкл 1×ФБР, получая общий объем 2 мл. Осторожно перемешивают на вихревом смесителе. Хранят при температуре -20°C. Отбирают аликвоты желательного объема, с тем чтобы использовать одну аликвоту на планшет. Указанную смесь готовят в полипропиленовой пробирке. Для новых лотов определяют рабочую концентрацию. Проверяют пригодность препарата, с учетом срока годности, составляющего 6 месяцев от даты производства. Например, если рабочая концентрация была определена в количестве 0,2 мкг/мл, то подготовку проводят следующим образом. Непосредственно перед использованием: оттаивают при комнатной температуре аликвоту нейтравидина-HRP. С использованием казеина разбавляют раствор нейтравидина с концентрацией 1 мг/мл до концентрации 0,1 мг/мл (100 мкг/мл) при температуре 37°C±2°C. Например: делают разбавление ×10, добавляя 50 мкл нейтравидина к 450 мкл казеина. Осторожно перемешивают в вихревом смесителе. Далее, указанный раствор с концентрацией 100 мкг/мл разбавляют до концентрации 0,2 мкг/мл казеином при температуре 37˚С±2°C. Например: делают разбавление ×500, добавляя 24 мкл нейтравидина (100 мкг/мл) к 11976 мкл казеина. Осторожно перемешивают в вихревом смесителе.
Приготовление 5,72 2М фосфорной кислоты (стоп-раствор). Готовят 2М раствор фосфорной кислоты из концентрированной фосфорной кислоты согласно следующей процедуре. С учетом процентного содержания фосфорной кислоты, указанного на этикетке, плотности (1,685 г/мл) и формульной массы (98 г/моль), рассчитывают объем концентрированной фосфорной кислоты, необходимой для получения 500 мл 2М фосфорной кислоты. Вносят в колбу рассчитанный выше объем концентрированной фосфорной кислоты. Доводят объем в колбе водой Milli-Q до метки и перемешивают содержимое до гомогенного состояния при переворачивании колбы. Хранят при температуре окружающей среды до 6 месяцев от даты изготовления.
Приготовление разбавляющего буфера (казеин, разбавленный х100 в 1×ФБР + 0,1% Тритон X100, pH 7,4). Делают разбавление казеина × 100 при температуре 37°C±2°C с использованием 1×ФБР+0,1% Тритона X100, pH 7,4, стерилизованного через фильтр с размером пор 0,22 мкм (как указано выше). Например: при температуре 37°C±2°C добавляют 1 мл казеина к 99 мл стерильно фильтрованного через фильтр с размером пор 0,22 мкм 1×ФБР+0,1% Тритон X100, pH 7,4. Хорошо перемешивают. Для каждого использования готовят новый раствор.
Приготовление стандартов. Стандарты белка клетки-хозяина (антигенные стандарты) (лот No. G11203 @ 1,218 мг/мл). Примечание: концентрированные растворы хранят при номинальной температуре -80°C в аликвотах по 70 мкл. Оттаивают аликвоту при комнатной температуре. Проводят серийное разведение в полипропиленовых пробирках с использованием буфера для элюции.
Приготовление образцов. В полипропиленовых пробирках разбавляют готовые объемные образцы до концентрации 24 мг/мл с использованием буфера для разбавления. Записывают полученную концентрацию. Примечание: используют указанные ниже растворы для получения «спайковых» образцов и для приготовления указанных ниже растворов с концентрацией 12 мг/мл. Далее, в полипропиленовых микропробирках разбавляют растворы с концентрацией 24 мг/мл до концентрации 12 мг/мл с использованием буфера для разбавления. Каждый из растворов с концентрацией 12 мг/мл вносят в трехкратном повторе в лунки планшета, используя всего 6 лунок.
Приготовление «спайка». В полипропиленовых микропробирках делают «спайк» белка клетки-хозяина с концентрацией 10 мг/мл из полученного выше стандарта с концентрацией 20 мг/мл при разбавлении в два раза буфером для разбавления. В три лунки планшета добавляют «спайковый» раствор с концентрацией 10 мг/мл. Для «спайковых» образцов используют стандартный раствор с концентрацией 20 мг/мл со стадии 6.1.
Приготовление «спайковых» образцов. В полипропиленовых микропробирках объединяют по 300 мкл каждого из готовых объемных растворов с концентрацией 24 мг/мл с 300 мкл «спайкового» раствора с концентрацией 20 мг/мл (6.1). Добавляют в лунки в тройном повторе каждый из растворов «спайкового» образца, получая всего 6 лунок.
Приготовление контроля. Должен быть установлен диапазон контрольных значений для каждого нового контрольного стандартного раствора перед его использованием для тестирования. Контрольный стандартный раствор: отбирают аликвоты по 150 мкл из партии концентрата лекарственного вещества ABT-874 и хранят их в замороженном состоянии при номинальной температуре -80°C до трех лет.
Приготовление рабочего контрольного раствора. Оттаивают аликвоту контрольного образца при комнатной температуре. С использованием разбавляющего буфера разбавляют указанный контроль до концентрации 24 мг/мл. Далее, с использованием буфера для разведения, в полипропиленовых микропробирках разбавляют контрольный раствор с концентрацией 24 мг/мл до концентрации 12 мг/мл. Получают одно разведение и вносят контрольный раствор в 3 лунки на планшете.
Процедура ELISA. Заполняют флакон для промывки планшетов соответствующим буфером для промывки планшетов (см. стадию 5.3, 1xФБР+0,1% Тритон X100). Подготавливают к работе промывающее устройство для планшетов, проверяя следующие параметры: параметры должны быть установлены следующим образом: тип планшета: 1 для каждого цикла (всего проводится 5 циклов); объем: 400 мкл; время промывания: 10 секунд; Asp. время: 4 секунды.
Процедура тестирования. Вносят в лунки планшета по 100 мкл/лунку наслаиваемую смесь антител с концентрацией 4 мг/мл в холодном 50 мМ бикарбонате натрия. Приподнимают сторону планшета, так чтобы наслаиваемый раствор равномерно покрывал низ лунки, закрывают пленкой и инкубируют при номинальной температуре 4°C при встряхивании на шейкере для планшетов (или эквивалентном устройстве) со скоростью 3 в течение 18 часов ± 1 час. После инкубации в течение ночи вынимают планшет из холодильника и выравнивают температуру до комнатной. Встряхивают нанесенный раствор. Переносят содержимое планшета на бумажные полотенца. Блокируют казеином, который добавляют по 300 мкл/лунку, при температуре 37°C±2°C, закрывают пленкой и инкубируют при температуре 37°C±2°C при встряхивании на лабораторном шейкере для планшетов (Lab-line Environ) (или эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 1 часа. Готовят стандарт, образец, контроль, «спайк» и «спайковые» образцы во время инкубации с блокирующим раствором. Промывают планшет 5 раз промывочным буфером. Переносят содержимое планшета на бумажные полотенца. Используя 8-канальную пипетку, в тройном повторе вносят в лунки планшета по 100 мкл/лунку стандарты, образцы, «спайки», «спайковые» образцы и контроли. Переносят пипеткой по 100 мкл/лунку разбавляющий буфер во все пустые лунки планшета, которые будут служить в качестве слепой пробы. Закрывают пленкой и инкубируют при температуре 37°C±2 °C при встряхивании на лабораторном шейкере для планшетов (Lab-line Environ) (или эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 1 часа. Заполняют матрицу, которая будет использоваться в качестве стандарта для оценки в ходе нанесения материалов на планшет.
Установка устройства изменения поглощения в содержимом планшетов. Устанавливают прибор, вводя концентрации для стандартов. Не вводят коэффициенты разбавления для образцов, контролей, «спайков» или «спайковых» образцов. Учитывают, что значения для лунок, содержащих разбавитель, используемых в качестве слепых проб, будут вычитаться из результатов для всех лунок. Промывают планшет 5 раз промывочным буфером. Переносят содержимое планшета на бумажные полотенца. Добавляют по 100 мкл/лунку биотинилированное козье антитело. Закрывают пленкой и инкубируют при температуре 37°C±2°C при встряхивании на лабораторном шейкере для планшетов (Lab-line Environ) (или эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 1 часа. Промывают планшет 5 раз промывочным буфером. Переносят содержимое планшета на бумажные полотенца. Добавляют по 100 мкл/лунку раствор конъюгата нейтравидина-HRP (конъюгат с пероксидазой хрена), закрывают пленкой и инкубируют при температуре 37°C±2°C при встряхивании на лабораторном шейкере для планшетов (Lab-line Environ) (или на эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 1 часа. Промывают планшет 5 раз промывочным буфером. Переносят содержимое планшета на бумажные полотенца. Добавляют по 100 мкл/лунку холодный K-blue субстрат, закрывают пленкой и инкубируют при комнатной температуре в течение 10 минут (устанавливают таймер сразу при добавлении субстрата в первый ряд), встряхивая со скоростью 3 на шейкере для планшетов Lab-line titer (или эквивалентном устройстве). Останавливают реакцию, добавляя по 100 мкл/лунку 2М фосфорную кислоту (стадия 5.7). Помещают планшет на шейкер для планшетов и встряхивают со скоростью 3 в течение 3-5 минут. Определяют поглощение содержимого планшета при длине волны 450 нм.
Анализ данных и расчеты. Примечание: обрабатывают данные только для тех образцов, «спайков», «спайковых» образцов и контролей, оптическая плотность которых укладывается в практически применимый предел количественного определения (2,5 нг/мл по стандарту) по стандартной кривой и соответствует указанным ниже значениям % КВ или % по критерию различий. Если показатели ОП для образца ниже 2,5 нг/мл по стандарту, то результат фиксируют как меньше, чем 2,5 нг/мл. Это значение затем следует разделить на концентрацию разбавленного образца (12 мг/мл) для получения значения в нг/мл. Если образец характеризуется высокой концентрацией клеток-хозяев, вследствие чего «неспайковые» и/или «спайковые» образцы попадают в область выше стандартной кривой, то результат описывают как >100 нг/мл. Это значение также следует разделить на концентрацию разбавленного образца (12 мг/мл), чтобы выразить результат в нг/мг. Считают, что образец имеет нулевое значение, по результатам расчета извлечения из «спайка», если показатель для образца падает ниже концентрации 2,5 нг/мл по стандарту.
Стандартная кривая. Стандартные концентрации должны быть введены в матричный протокол. Используют вариант квадратической кривой. Коэффициент смешанной корреляции должен составлять 0,99 и % КВ между показателями для исследуемых в тройном повторе лунок должен быть 20%. Если этот критерий не удовлетворяется, то: один стандарт (1 уровень, 3 лунки) можно не учитывать. Если опускают значение 1,25 нг/мл, то используют только значение для образцов и спайковых образцов с приемлемыми значениями оптической плотности в диапазоне от 2,5 нг/мл до 100 нг/мл (оставшиеся точки на стандартной кривой). Дополнительно, для тройных повторов, применительно к каждому стандартному уровню, следует отметить, что если одна лунка является явно контаминированной или демонстрирует низкое связывание, она должна быть пропущена. Если показатель в лунке опускается ниже стандартного уровня, то оставшиеся повторы должны иметь процент различий, равный 20%. Показатель % КВ для наименьшего стандарта, который демонстрирует показатель ОП, близкий к фоновому (слепые пробы) для планшета, должен быть равен 30%. Если показатель для одной лунке выпадает, то процент различий для оставшихся повторов должен составлять 35%. Если выпадает наименьший стандарт, то учитывают только образцы и спайковые образцы с оптическим плотностями, попадающими в оставшийся уровень оптических плотностей на стандартной кривой.
Образцы. Значение % КВ должно составлять 20% между результатами для исследуемых в тройном повторе лунок. Записывают % значение КВ между результатами оценки лунок в тройном повторе. Одна лунка для разбавления каждого образца, может быть пропущена. Оставшиеся повторы должны характеризоваться % различий, равным 20%. Следует отметить: если показатель ОП для «неспайкового» образца ниже значения 2,5 нг/мл на стандартной кривой, то % значение критерия различий неприменимо к «неспайковым» результатам. Следует вернуться к указанным выше расчетам.
Рассчитывают фактическую концентрацию клеток-хозяев в нг/мг относительно среднего значения (нг/мл) следующим образом: значение для белка клетки-хозяина CHO (нг/мг) = среднее значение для «результата для «неспайкового» образца (нг/мл)»_концентрация разбавленного образца (12 мг/мл).
«Спайк». %КВ должен составлять 20% между результатами для анализируемых в тройном повторе лунок. Записывают %КВ. Результат для одной лунки «спайка» может быть опущен. Оставшиеся точки должны характеризоваться % различий, равным 20%. Проводят указанные выше расчеты. Записывают концентрацию клеток-хозяев в нг/мл. Это результат будет использоваться в расчетах по определению уровня извлечения из «спайка». Полученная для «спайка» концентрация (нг/мл) должна составлять ±20% от теоретически ожидаемой концентрации в «спайке». Фиксируют результат и указывают, соответствует он или не соответствует требуемому значению. Если результат для «спайка» не укладывается в диапазон 20% от теоретически ожидаемого значения, то тест следует повторить. Среднее значение концентрации в «спайке» (нг/мл) x 100 = должно быть 100% ± 20%, 10 нг/мл.
«Спайковые» образцы. % КВ должен соответствовать 20% между результатами для анализируемых в тройном повторе лунок. Записывают % КВ между результатами для 3 лунок. Результат по одной лунке для каждого разведения «спайкового» образца может быть опущен. Оставшиеся результаты должны характеризоваться % различий, равным 20%. Проводят указанный выше расчет. Записывают «результат для спайкового образца», применительно к каждому разведению, в нг/мл. Записывают % различий между повторными разбавлениями. Процент различий между разбавлениями должен составлять 25%. Эти результаты далее будут использоваться в расчетах по извлечению из «спайкового» материала.
Рассчитывают процент извлечения из «спайка» для каждого разведения с использованием приведенной ниже формулы. % извлечения из спайка = (значение для «спайкового» образца - значение для «неспайкового» образца) × 100. Примечание: (1) Если значение ОП для «неспайкового» образца падает ниже 2,5 нг/мл относительно стандарта, то такое значение рассматривают как нулевое в расчетах % извлечения из «спайка». % извлечения из «спайка» должен составлять 100%±50% (50%-150%) для каждого разведения каждого образца. Записывают результаты и указывают, соответствует ли он критериям для данного теста (соответствует/ не соответствует).
Контроль. % КВ должен соответствовать 20% между результатами для анализируемых в тройном повторе лунок. Записывают процент КВ. Результат для одной лунки «спайка» может быть опущен. Оставшиеся результаты должны иметь процент различий, равный 20%. Проводят указанный выше расчет. Записывают концентрацию клеток-хозяев в контроле в нг/мл. Концентрацию клеток-хозяев в нг/мл рассчитывают следующим образом: концентрация белка клетки-хозяина (нг/мл) = результат оценки белка клетки-хозяина в контроле, в нг/мл.
3. Определение концентрации белка А в композициях анти-IL-12 антитела
При проведении процедуры ELISA, в лунки планшета добавляют антитело против куриного белка А и инкубируют. Неспецифические сайты блокируют казеином в ФБР. Планшеты промывают c использованием 1×ФБР+0,1% Тритон X-100 для удаления несвязанного материала. Образцы и стандарты на Cys-белок А разбавляют с использованием 1×ФБР+4,1% Тритона X + 10% казеина. Растворы денатурируют при нагревании при 95˚С ± 2°C, отделяют белок А от ABT-874. Затем указанные растворы добавляют к планшету и инкубируют. Несвязанный материал промывают с использованием 1 × ФБР + 0,1% Тритон X-100. Добавляют к лункам микротитрационного планшета биотинилированное антитело против куриного белка А и инкубируют. Планшет промывают для удаления несвязанного материала и добавляют конъюгат нейтравидина-пероксидазы.
Нейтравидин будет связываться с биотинилированным антителом против куриного белка А, которое не связалось с лунками. Планшет снова промывают для удаления несвязанного нейтравидина и к лункам планшета добавляют субстрат К-blue (тетраметилбензидин (TMB)). Субстрат гидролизуется связанным нейтравидином с образованием синего окрашивания. Реакцию останавливают добавлением фосфорной кислоты, которая меняет окрашивание на желтый. Интенсивность желтого окрашивания в лунках прямо пропорциональна концентрации белка А, имеющего в лунках.
Получение реагентов и растворов. Флаконы с казеином должны быть нагреты до температуры 37°C±2°C; далее их озвучивают в течение 2 минут и отбирают аликвоты. Аликвоты хранят при номинальной температуре 4°C. Во время тестирования, помещают нужное количество аликвот казеина в термостат с температурой 37°C±2°C. Буфер для наслаивания и субстрат используют в холодном виде (отбирают непосредственно перед использованием из холодильника, где они хранились при температуре 4°C.)
50 мМ бикарбонат натрия (буфер для наслаивания), pH 9,4. В химический стакан объемом 1 л добавляют: 900 мл воды Milli-Q и 4,20 г ± 0,01 г бикарбоната натрия. Перемешивают до полного растворения. Доводят значение pH до 9,4 с использованием 1 н NaOH. Переносят в мерную колбу на 1 л и доводят объем до метки водой Milli-Q. Перемешивают при переворачивании до гомогенного состояния. Фильтруют через устройство для стерильного фильтрования с размером пор 0,22 мкм. Хранят при номинальной температуре 4°C в течение 7 дней от даты приготовления.
104 M Na2HPО4 × 7H2O,1,37 M NaCl, 0,027 M KC1, 0,0176 M KH2PО4, pH 6,8-6,9. (10×ФБР): добавляют приблизительно 400 мл воды Milli-Q в стеклянный стакан. Добавляют 13,94 г ± 0,01 г Na2HPО4 × 7H2O. Добавляют 40,0 г ± 0,1 г NaCl. Добавляют 1,00 г ± 0,01 г KCl. Добавляют 1,20 г ± 0,01 г KH2PО4. Перемешивают до гомогенного состояния. Переносят в колбу объемом 500 мл. QS до объема 500 мл доводят водой Milli-Q. Перемешивают переворачиванием. Фильтруют через устройство для стерильного фильтрования 0,2 CA мкм. Хранят при комнатной температуре до 7 дней.
1×ФБР + 0,1% Тритон X-100, pH 7,40: (буфер для промывки планшета): в градуированном цилиндре на 4 л смешивают 400 мл 10 X ФБР (см. выше) с 3500 мл воды Milli-Q. Проверяют pH, и, при необходимости, доводят до 7,40±0,05 с использованием 1н HCl или 1н NaOH. Доводят объем до метки водой Milli-Q. Цилиндр плотно закрывают парафилмом и перемешивают путем переворачивания до гомогенного состояния. Переносят в колбу на 4 л. Отбирают 4 мл 1×ФБР и отбрасывают. Добавляют 4 мл Тритона X-100 к 3996 мл 1×ФБР. Помещают на перемешиваемый планшет и перемешивают до полного растворения. Хранят при комнатной температуре до 7 дней.
Наслаиваемое антитело против куриного белка А. К моменту использования отбирают одну аликвоту антитела в расчете на планшет. Для подтверждения качества новых лотов антитела против куриного белка А используют вместе с ним конъюгированное с биотином антитело против куриного белка А для подтверждения его качества (которое было получено из того же лота, что и наслаиваемое антитело). Непосредственно перед использованием: разбавляют смесь антитела холодным 50 мМ бикарбонатом натрия до концентрации, определенной в ходе пробных квалификационных тестов при наслаивании. Например: если в ходе квалификационного теста концентрация наслаиваемого антитела была определена на уровне 6 мкг/мл и если концентрация основного раствора составляет 3000 мкг/мл, то добавляют 24 мкл наслаиваемого антитела к 11976 мкл холодного буфера для внесения в лунки. Осторожно перемешивают путем переворачивания.
Биотинилированное антитело против куриного белка А. К моменту использования отбирают одну аликвоту антитела в расчете на планшет. Для подтверждения качества новых лотов конъюгированного с биотином антитела против куриного белка А, его используют и подтверждает его качество вместе с тем же лотом, из которого было получено антитело против куриного белка А. Непосредственно перед использованием: разбавляют биотинилированное антитело казеином при температуре 37°C±2°C до концентрации, определенной в ходе квалификационного пробного теста с биотинилированным антителом. Например: если в ходе пробного квалификационного теста концентрация вносимого биотинилированного антитела была определена как 4 мкг/мл и если концентрация основного раствора составляет 1000 мкг/мл, то добавляют 48 мкл биотинилированного антитела к 11952 казеина при температуре 37°C±2°C. Смесь осторожно перемешивают при переворачивании.
Нейтравидин-HRP. Восстанавливают новые лоты (2 мг/флакон) до концентрации 1 мг/мл следующим образом: добавляют 400 мкл воды Milli-Q во флакон, затем добавляют 1600 мкл 1×ФБР, получая общий объем 2 мл. Осторожно перемешивают на вихревом смесителе. Хранят при номинальной температуре -80°C. Отбирают аликвоты желаемого объема с учетом использования по одной аликвоте на планшет. Получение проводят в полипропиленовой пробирке. Подтверждают годность препарата, которая составляет 6 месяцев от даты изготовления. Например, если рабочая концентрация была определена на уровне 0,1 мкг/мл, то получение проводят следующим образом. Непосредственно перед использованием, оттаивают аликвоту нейтравидина-HRP при комнатной температуре. Разбавляют раствор нейтравидина с концентрацией 1 мг/мл до концентрации 0,01 мг/мл (10 мкг/мл) казеином при температуре 37°C±2°C. Например: для разбавления ×10, добавляют 50 мкл нейтравидина к 450 казеина. Осторожно перемешивают на вихревом смесителе, снова добавляют х10, добавляют 100 мкл ×10 нейтравидина к 900 мкл казеина. Осторожно перемешивают на вихревом смесителе. Далее разбавляют раствор с концентрацией 10 мкг/мл до концентрации 0,1 мкг/мл казеином при температуре 37°C±2°C. Например, для разбавления ×100, добавляют 120 мкл нейтравидина (10 мкг/мл) к 11880 мкл казеина. Осторожно переворачивают несколько раз для перемешивания.
Блокирующий раствор для остановки реакции (используют коммерческий препарат 1н фосфорной кислоты). Хранят при температуре окружающей среды в течение 1 года от момента получения. Буфер для разбавления (1×ФБР + 4,1% Тритон X-100 + 10% казеина, pH 7,4). В химический стакан или колбу добавляют 86 мл 1×ФБР + 0,1% Тритон Х-100, pH 7,4 (со стадии 5.3), затем добавляют 4 мл Тритона X-100 и 10 мл казеина в ФБР для блокирования реакции и перемешивают до растворения/полного перемешивания. Для растворения Тритона этот процесс может занять 20-30 минут. Получают 1×ФБР + 4,1% Тритона X-100 + 10% казеина, pH 7,4. Фильтруют через устройство для стерильного фильтрования 0,22 CA мкм. Получают свежий раствор для каждого использования. Этого количества достаточно на 1 планшет.
Стандарты на белок А (стандарты на антиген). Примечание: концентрированные растворы хранят при номинальной температуре -20°C в аликвотах по 70 мкл. Оттаивают аликвоту на льду. В пропиленовых пробирках с использованием буфера для разбавления (см. выше) и согласно концентрации, указанной производителями COA, делают серийные разведения с учетом данных, приведенных в таблице, в разделе примеров: например, если производитель COA указывает концентрацию основного раствора 2,1 мг/мл (2100000 нг/мл), то проводят следующую процедуру: оттаивают образцы на льду. Затем в пропиленовых микроцентрифужных пробирках с использованием буфера для разведения (см. выше) разбавляют образцы до конечной концентрации 20 мг/мл. Делают два отдельных разведения. Записывают концентрацию. Используют растворы, указанные ниже, для получения «спайковых» образцов и для приготовления растворов с концентрацией 10 мг/мл. Например: концентрация (мг/м), объем в мкл X мг/мл раствора, объем разбавителя (мкл) для серийного разведения из образца основного раствора 120. В полипропиленовых микроцентрифужных пробирках далее проводят разведение раствора с концентрацией 20 мг/мл до концентрации 10 мг/мл с использованием буфера для разведения.
Получение «спайка». В полипропиленовых микроцентрифужных пробирках готовят «спайк» белка А с концентрацией 0,296 нг/мл, исходя из стандарта с концентрацией 0,593 нг/мл, полученного выше на стадии 6.1, путем разведения его в 2 раза буфером для разведения. Делают 1 разведение. На лунки планшета вносят в трехкратном повторе «спайковый» раствор с концентрацией 0,296 нг/мл. Используют стандартный раствор с концентрацией 0,593 нг/мл со стадии 6.1 для получения «спайковых» образцов.
Получение «спайковых» образцов. В полипропиленовых микроцентрифужных пробирках объединяют по 500 мкл каждого из готовых объемных растворов с концентрацией 20 мг/мл с 500 мкл «спайкового» раствора с концентрацией 0,593 нг/мл. Оставляют для денатурации. Вносят на лунки планшета в тройном повторе растворы каждого из «спайковых» образцов, получают в целом 6 лунок.
Получение контроля. Получают лот лекарственного вещества ABT-874. Отбирают аликвоты по 150 мкл и хранят в замороженном состоянии при номинальной температуре -80°C в течение трех лет от даты отбора аликвот.
Рабочий контроль: оттаивают на льду аликвоту контроля. В полипропиленовой микроцентрифужной пробирке разбавляют контроль до концентрации 10 мг/мл с использованием буфера для разведения до конечного объема 1000 мкл. Делают однократное разведение. Оставляют для денатурации. В лунки планшета в тройном повторе вносят контроль.
Денатурация. Для получения слепых проб для планшетов, 1000 мкл буфера для разведения добавляют в микроцентрифужные пробирки, используя их в количестве, равном количеству слепых проб, которые будут исследоваться на планшете. Колпачки пробирок закрывают парафилмом для предупреждения открывания при нагревании, или сверху них может быть помещен второй ряд, с тем чтобы закрыть колпачки. Нагревают стандарты, «неспайковые» образцы, «спайковые» образцы, «спайк», слепые пробы и контроль при температуре 95°C±2°С в течение 15 минут. При охлаждении, снимают с пробирок парафилм если, он использовался. Охлаждают в течение 15 минут и центрифугируют в течение 5 минут со скоростью примерно 10000 об/мин. Переносят 700 мкл супернатанта в микропробирки для нанесения на планшет. Следует быть осторожным, с тем чтобы не взболтать осадок тритона/белка.
Инструкция по промывке планшета и установке водяной бани. Заполняют флакон для промывки планшета буфером для промывки планшета (см. стадия 5.3, 1×ФБР+0,1% Тритон X-100). Примируют устройство для промывки планшета. Проверяют следующие параметры: параметры должны быть установлены следующим образом: тип планшета: 1 для каждого цикла (всего проводится 4 цикла), скорость Asp.: 10 мм/с; объем: 400 мкл; время погружения: 5 секунд; время Asp.: 6 секунд. Включают водную баню и устанавливают на температуру 95°C. Оставляют водную баню по меньшей мере на 30 минут для уравновешивания температуры до уровня 95°С±2°С.
Процедура тестирования: может использоваться памятка в качестве руководства для проверки выполнения стадий. Дополнительно, отмечают все оборудование, необходимое для тестирования. Отбирают и хранят при температуре 37°C ± 2°C нужное количество аликвот казеина для ежедневного тестирования. Наслаиваемый буфер и субстрат используют в холодном виде. Подготавливают стандарт, образец, контроль, «спайк» и «спайковые» образцы до блокирования инкубации и в ее процессе. Процедура подготовки разведений, переноса в эппендорфовские пробирки, денатурации в течение 15 минут, охлаждения в течение 15 минут, центрифугирования в течение 5 минут и переноса в микропробирки может задержать более чем на 1 час блокирование инкубации. Выдерживают в течение по меньшей мере 40 минут перед блокированием планшетов. Образцы, «спайковые» образцы, стандарты, контроль, исследуемый «спайк» и слепые пробы вносят в лунки планшета горизонтально от ряда B к G с использованием 12-канальной пипетки. Стандарты вносят в направлении от высокой концентрации к низкой. Нанесение на лунки планшета, добавление биотина, добавление нейтравидина, добавление субстрата и добавление раствора, блокирующего инкубацию, проводят вертикально от колонки 2 к колонке 11.
Вносят в лунки планшетов по 100 мкл/лунку антитела в холодном 50 мМ бикарбонате натрия. Покачивают планшет за боковую сторону до тех пор, пока наслаиваемый раствор не покроет равномерно нижнюю часть лунок, плотно закрывают его пленкой и инкубируют при номинальной температуре 4°С при встряхивании на шейкере для планшетов (или эквивалентном устройстве) со скоростью 3.
После инкубации в течение ночи вынимают планшет из холодильника и оставляют для выравнивания температуры с комнатной температурой. Встряхивают содержимое. Переносят содержимое планшета на бумажные полотенца. Блокируют с казеином в количестве 300 мкл/лунку при 37°C ± 2°C, закрывают плотно пленкой и инкубируют при температуре 37°C ± 2°C, встряхивая на шейкере для планшетов (Lab-line Environ) (или эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 1 часа ±10 минут.
Получение стандарта, образца, контроля, «спайка» и «спайковых» образцов перед блокированием инкубации и во время нее. Промывают планшет 4 раза промывочным буфером. Переносят содержимое планшета на бумажные полотенца. С помощью 8-канальной пипетки переносят в лунки планшета в тройном повторе по 100 мкл/лунку денатурированные стандарты, образцы, «спайки», «спайковые» образцы, слепые пробы и контроль. Наружные лунки на планшете не используют, и в эти лунки добавляют необработанный разведенный буфер. Закрывают плотно пленкой и инкубируют при температуре 37°C ± 2°С при встряхивании в шейкере для планшетов (Lab-line Environ) (или эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 2 часов. Заполняют матрицу, которая будет служить в качестве эталона при нанесении на планшет.
Установка счетчика для планшетов. Промывают планшет 4 раза промывочным буфером. Переносят содержимое планшета на бумажные полотенца. Добавляют биотинилированное антитело в количестве 100 мкл/лунку. Закрывают плотно пленкой и инкубируют при температуре 37°C ± 2°C при встряхивании в шейкере для планшетов (Lab-line Environ) (или эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 1 часа.
Промывают планшет 4 раза промывочным буфером. Переносят содержимое планшета на бумажные полотенца. Добавляют раствор конъюгата нейтравидина-HRP в количестве 100 мкл/лунку. Запускают таймер с момента добавления нейтравидина к последнему ряду. Закрывают плотно пленкой и инкубируют при температуре 37°C ± 2°C при встряхивании в шейкере для планшетов (Lab-line Environ) (или эквивалентном устройстве) со скоростью 80 об/мин ± 5 об/мин в течение 30 минут. Промывают планшет 4 раза промывочным буфером. Переносят содержимое планшета на бумажные полотенца. Добавляют 100 мкл/лунку холодный субстрат K-Blue, закрывают плотно пленкой и инкубируют при комнатной температуре в течение 10 минут (запускают таймер, как только субстрат добавляют в первый рад) при встряхивании со скоростью 3 на шейкере для микротитрационных планшетов (Lab-line titer) (или эквивалентном устройстве). Останавливают реакцию добавлением 1 н фосфорной кислоты по 100 мкл/лунку. Помещают планшет на шейкер для планшетов и встряхивают со скоростью 3 в течение 3 минут. Определяют поглощение содержимого планшета при длине волны 450 нм.
Анализ данных и расчет. Примечание: принимаются к обработке только данные по тем образцам, «спайкам», «спайковым» образцам и контролю, где оптическая плотность попадает в практически значимый диапазон значений, до предела количественного определения по стандартной кривой и удовлетворяет критериям по проценту КВ или по проценту различий, как указано ниже. Если ОП образца имеет значение ниже стандартной кривой, то результат фиксируется как ниже, чем 0,18 нг/мл (LOQ для теста). Затем это значение делится на концентрацию разбавленного образца (10 мг/мл), с тем чтобы получить значение в нг/мг. Если образец имеет значение, которое превышает концентрацию белка А, так что данные для «неспайкового» и/или «спайкового» образцов находятся выше стандартной кривой (2 нг/мл), тогда делают дальнейшее разбавление, с тем чтобы уложиться в диапазон, соответствующий стандартной кривой. Это значение затем делят на концентрацию разбавленного образца, с тем чтобы выразить значение в нг/мг. При расчетах извлечения из «спайка», вычитают значение для «неспайкового» образца (нг/мл) из результата, полученного для «спайкового» образца (нг/мл), даже в том случае, когда результат для «неспайкового» образца (нг/мл) находится ниже стандартной кривой. Если получен отрицательный результат или так называемый «диапазон», то «неспайковый» образец рассматривают в качестве нулевого значения при расчетах извлечения из «спайка».
Стандартная кривая. Стандартные концентрации должны быть введены в протокольную матрицу. Используют квадратическую кривую. Коэффициент определения должен быть равен 0,99 и процент КВ между результатами для тройных повторов при анализе лунок должен составлять 20%. Если этот критерий не удовлетворяется, то: один стандарт (1 уровень, 3 лунки) может быть пропущены. Если опускают значение 0,18 нг/мл, то рассматривают значения только для образцов и «спайковых» образцов со значениями оптической плотности в диапазоне от 0,26 нг/мл до 2 нг/мл (оставшиеся точки на стандартной кривой). Дополнительно, для результатов тройных повторов при оценке каждого стандартного уровня, если в одной лунке выявлено явное загрязнение или низкое связывание, то результат по ней может быть опущен. Если отбрасывается результат по лунке для стандарта, то оставшиеся варианты должны характеризоваться процентом различий, равным 20%. % КВ для наименьшего стандарта, который имеет значение ОП, близкое к фону (слепые образцы) для планшета, должен иметь значение 30%. Если результат в одной лунке опускают, то процент различий для оставшихся повторов должен составлять 35%. Если опускают наименьший стандарт, то принимают к рассмотрению только данные по образцам и «спайковым» образцам, которые имеют оптические плотности в диапазоне оставшихся значений оптической плотности на стандартной кривой.
Рассчитывают % различий следующим образом. % различий = (абсолютное значение (результат разбавления 1 - результат разбавления 2)/среднее значение) × 100%. Тестирование должны быть проведено заново, если результаты для стандартов не удовлетворяют указанным критериям. Отмечают процент КВ и/или процент различий и коэффициент искажения стандартной кривой, применительно к результатам определения.
Образцы. Процентное значение КВ должен составлять 20% между результатами для лунок, анализируемых в тройном повторе. Фиксируют процент КВ между результатами для анализируемых в тройном повторе лунок. Значение по одной лунке для каждого разведения образца может быть опущено. Оставшиеся результаты должны иметь процент различий, равный 20%. Примечание: если ОП для «неспайкового» образца ниже наименьшего стандартного ОП, то критерий по проценту различий будет не применим к результатам, полученным для «неспайковых» образцов. Проводят указанный выше расчет.
Записывают «результат для «неспайкового» образца» применительно к каждому разведению в нг/мл. Эти значения будут далее использоваться в расчетах по извлечению из «спайка». Рассчитывают среднее значение «результата для «неспайкового» образца (нг/мл)» и процент различий между разведениями. Записывают результаты. % различий между разведениями должен составлять 25%. Рассчитывают фактическую концентрацию белка А в нг/мг относительно среднего значения (нг/мл) следующим образом: белок А (нг/мг) = (среднее значение «результата для «неспайкового» образца (нг/мл))»/концентрация разбавленного образца (10 мг/мл). Записывают результат.
«Спайки». Процент КВ должен составлять 20% между результатами для анализируемых в тройном повторе лунок. Записывают % КВ. Результат по одной лунке для «спайка» может быть опущен. Оставшиеся точки должны характеризоваться процентом различий, равным 20%. Проводят указанный выше расчет. Записывают концентрацию белка А в нг/мл. Этот результат будет далее использоваться в расчетах уровня извлечения из «спайка». Полученная для «спайка» концентрация (нг/мл) должна находиться в пределах ±20 % от теоретически ожидаемой концентрации «спайка». Записывают результат и указывают, соответствует ли он критериям для данного теста (соответствует/не соответствует). Если результат по «спайку» не вписывается в 20% значение от теоретически ожидаемого значения, то тест должен быть повторен заново. Среднее значение концентрации «спайка» (нг/мл) × 100 = должно составлять 100%±20%, т.е. 0,296 нг/мл.
«Спайковые» образцы. Процент КВ должен составлять 20% между результатами для анализируемых в тройном повторе лунок. Фиксируют процент КВ между тремя результатами для анализируемых в тройном повторе лунок. Один результат по лунке для каждого разведения «спайкового» образца может быть опущен. Оставшиеся результаты должны характеризоваться процентом различий, равным 20%. Проводят указанный выше расчет. Записывают «результат для «спайкового» образца» применительно к каждому разведению в нг/мл. Записывают % различий между повторными разведениями. % различий между результатами для повторных разведений должен составлять 25%. Эти результаты будут далее использоваться в расчетах уровня извлечения из «спайка». Рассчитывают % извлечения из «спайка» для каждого разведения с использованием приведенной ниже формулы: % извлечения из «спайка» = (значение для «спайкового» образца - значения для «неспайкового» образца) × 100. Значение для неспайкового образца. Примечание: в расчетах уровня извлечения из «спайка» вычитают значение для «неспайкового» образца (нг/мл) из значения для «спайкового» образца (нг/мл), даже в том случае, когда значение для «неспайкового» образца (нг/мл) находится ниже калибровочной кривой. Если указанный результат имеет отрицательное значение или описывается некоторым «диапазоном», то в расчетах извлечения из «спайка» полагают, что «неспайковый» образец имеет нулевое значение. Процент извлечения из «спайка» должен составлять 100% ± 50% (50% -150%) для каждого разведения каждого образца. Записывают результаты и указывают, соответствует ли он критериям для данного теста (соответствует/не соответствует).
Контроль. Процент КВ должен составлять 20% между результатами исследованных в тройном повторе лунок. Записывают результат в % КВ. Результат по одной лунке для контроля может быть опущен. Оставшиеся данные должны характеризоваться % различий, равным 20%.
В настоящей заявке приведены различные публикации, содержание которых включено полностью в качестве ссылок.
Реферат
Изобретение относится к области биотехнологии и иммунологии. Описывается способ получения препарата антитела или его антигенсвязывающей части со сниженным содержанием белка клетки-хозяина (HCP). Способ предусматривает снижение в образце значения рН до примерно 3,8 путем добавления лимонной или фосфорной кислоты, последующее ловедение рН до уровня 5.0, нанесение образца на ионообменную смолу, сбор образца после ионного обмена, нанесение образца на смолу для проведения хроматографии гидрофобного взаимодействия и сбор препарата антитела после хроматографии. Способ позволяет получать препарат антитела, который содержит сниженное число вирусных частиц или обладает сниженной вирусной активностью. Изобретение может быть использовано в медицине. 21 з.п.ф-лы, 5 ил., 11 табл.
Формула
(a) снижение в указанном образце смеси значения рН, где вирусная частица чувствительна к инактивации путем снижения рН, что приводит к получению образца первичного извлечения, где указанное снижение рН относится к значениям рН примерно 3,8, и указанное снижение достигается путем добавления лимонной или фосфорной кислоты;
(b) доведение указанного образца первичного извлечения по значению рН до уровня примерно 5,0, с последующим;
(c) нанесением указанного образца первичного извлечения на ионообменную смолу и сбор образца после ионного обмена;
(d) нанесение указанного полученного после ионного обмена образца на смолу для проведения хроматографии гидрофобного взаимодействия (HIC) и сбор образца со смолы HIC, где указанный образец после HIC включает указанный препарат антитела или его антигенсвязывающей части со сниженным содержанием НСР.

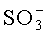

Комментарии