Разделение биспецифических антител и побочных продуктов процесса получения биспецифических антител с применением гидроксиапатитной хроматографии - RU2652911C2
Код документа: RU2652911C2
Чертежи

















Описание
Область изобретения
Данное изобретение относится к способам, включающим применение гидроксиапатитной хроматографии для выделения биспецифического антитела из раствора, который также содержит один или более чем один побочный продукт, характерный для получения биспецифического антитела. Побочные продукты, характерные для получения биспецифических антител (bispecific antibody specific byproducts, "BASB"), включают фрагменты биспецифического антитела и варианты антитела с большей молекулярной массой, где фрагмент и/или вариант содержит Fc-домен, но не проявляет аффинность к двум различным эпитопам и/или антигенам, которую проявляет нужное биспецифическое антитело. Таким образом, способы согласно данному изобретению включают отделение биспецифического антитела от одного или более чем одного из его BASB. Способы гидроксиапатитной хроматографии согласно данному изобретению могут быть использованы по отдельности или могут быть дополнительно объединены со стандартными способами очистки и технологическими операциями, которые известны в данной области, для достижения какого-либо уровня чистоты биспецифического антитела, необходимого, например, для терапевтических и/или диагностических применений.
Уровень техники
Терапевтический потенциал биспецифических антител уже давно является признанным. Биспецифические антитела предлагают IgG-подобную платформу, которая способна связываться с двумя антигенами или двумя эпитопами одновременно. Таким образом, биспецифические антитела предлагают потенциальный инструмент для модуляции взаимодействия по меньшей мере двух молекул и/или взаимодействия по меньшей мере двух систем, содержащих молекулы. Такая модуляция может представлять собой, например, модуляцию взаимодействия двух клеток, где распознаваемый антиген, антигены и/или эпитопы экспрессируются на поверхности клеток. Примеры терапевтического применения биспецифических антител включают, например, модуляцию клеточного сигналинга (например, путем усиления или нарушения взаимодействия нужных поверхностных рецепторов или лигандов) и терапию рака (например, помощь в нацеливании клеток иммунной системы на раковые клетки).
Несмотря на интерес к терапевтическому применению биспецифических антител их коммерческое производство оказалось проблематичным. Первые попытки были сосредоточены на слиянии двух гибридомных клеточных линий, каждая из которых экспрессирует моноспецифические двухвалентные антитела ("квадромная методика", см., например, Milstein and Cuello, Nature 305 (1983), 537-540). Хотя квадрома экспрессирует молекулы антитела, сразу стало очевидным, что экспрессированные молекулы содержали различные комбинации двух родительских тяжелых и двух родительских легких цепей. Одновременная экспрессия всех четырех родительских цепей приводит к смеси 10 различных вариантов почти идентичных молекул, где только один вариант из десяти (т.е. только незначительная часть всех экспрессированных молекул) содержал должным образом спаренные тяжелые и легкие цепи, необходимые для проявления нужной биспецифической активности (см., например, Suresh et al., Methods Enzymol. 121 (1986), 210-228). Соответственно, внимание было обращено на альтернативные конструкции на основе биспецифических антител в попытке устранить проблемы производства, например, одноцепочечные гибриды вариабельных доменов антител. Тем не менее, многие из этих форматов существенно отличаются от архетипической структуры антител, и было обнаружено, что они обладают терапевтическими недостатками, такими как плохие фармакокинетические свойства и/или потеря эффекторной активности (например, из-за отсутствия Fc-доменов). Кроме того, многие конструкции также демонстрировали тенденцию к агрегации и повышенный потенциал иммуногенности из-за наличия нечеловеческих или искусственных доменов, таких как линкерные области.
Ввиду ограниченности альтернативных биспецифических форматов и несмотря на производственные трудности сохраняется интерес к биспецифическим антителам, имеющим архетипическую архитектуру антитела (в частности, IgG-подобную архитектуру). Принципиально при производстве нужного биспецифического антитела, имеющего IgG-подобную архитектуру, возникают две проблемы. Поскольку такая молекула требует надлежащей ассоциации двух различных тяжелых цепей и двух различных легких цепей, необходимо (1) индуцировать гетеродимеризацию двух различных тяжелых цепей в качестве предпочтительной реакции над гомодимеризацией и (2) оптимизировать дискриминацию среди возможных комбинаций взаимодействий между легкой цепью и тяжелой цепью так, чтобы экспрессированная молекула содержала только нужные взаимодействия легкой цепи и тяжелой цепи. Эти два вопроса были эффективно решены.
Во-первых, было показано, что гетеродимеризация двух различных тяжелых цепей усиливается по сравнению с гомодимеризационными взаимодействиями с помощью методики "ключ в замке", или "KiH" ("knobs into holes"). В методике KiH в СН3-домен одной из тяжелых цепей вводятся большие аминокислотные боковые цепи, которые укладываются надлежащим образом в спроектированные полости в СН3-домене другой тяжелой цепи (см., например, Ridgeway et al., Protein Eng. 9 (1996), 617-621, и Atwell et al., J. Mol. Biol. 270 (1997), 677-681). Таким образом, гетеродимеры тяжелых цепей, как правило, более стабильны, чем любой из гомодимеров, и образуют большую долю экспрессируемых полипептидов.
Во-вторых, ассоциация нужных пар легкой цепи/тяжелой цепи может быть индуцирована изменением одного Fab биспецифического антитела (Fab-области) для "перемены мест" константных или константных и вариабельных областей между легкой и тяжелой цепями. Таким образом, в модифицированном Fab-домене тяжелая цепь будет содержать, например, домены CL-VH или CL-VL, а легкая цепь будет содержать домены CH1-VL или CH1-VH, соответственно. Это предотвращает взаимодействие тяжелой/легкой Fab-частей модифицированных цепей (т.е. модифицированной легкой или тяжелой цепи) с Fab-частями и тяжелой/легкой цепи стандартной/немодифицированной ветви. Для пояснения, тяжелая цепь в Fab-домене модифицированной ветви, содержащая домен CL, преимущественно не взаимодействует с легкой цепью немодифицированной ветви/Fab-домена, который также содержит CL-домен (предотвращая "неподходящее" или ненужное спаривание тяжелой/легкой цепей). Эта методика предотвращения ассоциации "неподходящих" легкой/тяжелой цепей называется методикой "CrossMab" и, в сочетании с методикой KiH, приводит к удивительно повышенной экспрессии нужных биспецифических молекул (см., например, Schaefer et al., PNAS 108(2011), 11187-11192). Альтернативно или дополнительно, одна ветвь антитела может быть модифицирована таким образом, что Fab-домен представляет собой scFab или scFv, оставляя только одну "свободную" легкую цепь в системе.
Несмотря на недавние успехи в экспрессии биспецифических антител применение молекул остается ограниченным из-за формирования побочных продуктов, характерным образом связанных с их производством (побочные продукты, характерные для производства биспецифических антител, "BASB"), и проблем, связанных с отделением BASB от нужных молекул. По сравнению с очисткой стандартных антител экономная очистка биспецифических антител от производственных сред представляет собой уникальную задачу. Производство стандартного антитела основано на димеризации идентичных субъединиц "тяжелая цепь/легкая цепь". Напротив, производство биспецифического антитела требует димеризации двух различных субъединиц "тяжелая цепь/легкая цепь", каждая из которых содержит отличающуюся тяжелую цепь, а также отличающуюся легкую цепь. Таким образом, производство биспецифического антитела требует надлежащего взаимодействия вплоть до четырех пептидных цепей. Соответственно, часто наблюдаются цепные неправильные спаривания (например, гомодимеризация пептидов идентичных тяжелых цепей или ненадлежащие ассоциации тяжелой цепи/легкой цепи), как и неполная сборка белка из-за несбалансированной экспрессии различных цепей антитела. Обычно наблюдаемые BASB включают


Кроме того, BASB могут демонстрировать конкретную невыгодную активность, которую они сохраняют в конечном очищенном продукте. Что касается стандартных антител, т.е. моноспецифических антител, можно видеть, что описанные выше побочные продукты содержат по меньшей мере один функциональный антигенсвязывающий сайт. Таким образом, такой побочный продукт в препарате моноспецифического антитела, вероятно, будет частично, если не полностью, терапевтически функциональным и, таким образом, он вызывает мало беспокойства при любой схеме очистки. Напротив, BASB представляют собой примеси, которые, в зависимости от биспецифического формата, могут отрицательно сказаться на активности нужного биспецифического препарата. Таким образом, их отделение от нужной молекулы в процессе очистки становится критическим. Например, функциональность биспецифической молекулы может зависеть от одной молекулы, проявляющей связывающую активность по отношению к двум различным антигенам. Если молекула проявляет связывающую активность по отношению только к одному целевому антигену (например, как в


К сожалению, большинство коммерческих схем производства и очистки антител непригодны или не способны отделить биспецифические антитела от вышеописанных специфических побочных продуктов. Стандартные схемы очистки антител, как правило, включают по меньшей мере два различных режима хроматографии, т.е., как правило, используют по меньшей мере два хроматографических механизма для отделения нужного иммуноглобулина(ов) от побочных продуктов/примесей. Первый режим, как правило, является хроматографией на основе аффинности, которая использует специфическое взаимодействие между белком, который нужно очистить (т.е. белком, представляющим интерес), и иммобилизованным реагентом захвата. Поскольку аффинные реагенты могут представлять собой самую дорогую часть схемы очистки, желательно снизить применение аффинных лигандов и/или максимизировать применимость конкретной схемы (и аффинного реагента) к целому ряду продуктов. Наиболее часто используемыми аффинными лигандами при очистке иммуноглобулина (и применимыми к широкому диапазону продуктов на основе иммуноглобулинов) являются Fc-связывающие агенты или агенты, связывающие константный домен, такие как белок А, белок G, белок L, KappaSelect™ и LambdaFabSelect™. Тем не менее, разделяющая активность этих агентов, связывающих Fc- или константный домен, основана на присутствии Fc-, κ-, и/или λ-доменов, которые, что немаловажно, являются общими как для биспецифических антител, так и для их характерных побочных продуктов (т.е. BASB). Соответственно, лиганды с аффинностью к Fc- или константному домену сами по себе не являются достаточными для очистки биспецифических антител от BASB, и проведение дополнительных очисток на основе аффинности и/или молекулоспецифической (т.е. антигенспецифической) очистки, вероятно, приведет к экономически невыгодным схемам.
Кроме того, на основании знаний в области данного изобретения также трудно поверить, что добавление других общих процессов очистки, используемых в коммерческих схемах обработки антитела, будет достаточным для удовлетворительного отделения биспецифических антител от BASB. Наиболее распространенными способами очистки, используемыми в сочетании с аффинной хроматографией для коммерческой очистки антитела, являются стандартные способы хроматографии, которые отделяют белок, представляющий интерес, от нежелательных побочных продуктов/примесей на основании различий в размерах, заряде (например, значении изоэлектрической точки, или "IEP"), растворимости и/или степени гидрофобности. Такие способы включают ионообменную хроматографию, эксклюзионную хроматографию, аффинную хроматографию на иммобилизованном металле и гидроксиапатитную хроматографию. Тем не менее, эти распространенные хроматографические процессы, использующие стандартные протоколы, непригодны для отделения биспецифического антитела от BASB: эксклюзионная хроматография является экономически нецелесообразной для крупномасштабных очисток, а различия в IEP между биспецифическим антителом и BASB считались слишком малыми для их разделения с помощью ионообменной хроматографии.
Поэтому известные способы выделения антител из растворов, содержащих побочные продукты, характерные для их производства (например, Fc-содержащие фрагменты антител), являются неэффективными для очистки биспецифических антител и/или могут быть нежелательными по экономическим причинам (например, применение дополнительных этапов аффинной хроматографии). Соответственно, существует потребность в новых и/или усовершенствованных схемах очистки биспецифических антител от производственных растворов (и, в частности, от BASB, содержащихся в них), где указанные схемы могут отвечать требованиям биотехнологической промышленности по производству диагностических и терапевтических продуктов (например, демонстрировать экономическую эффективность, пропускную способность и чистоту продукта).
Сущность изобретения
Данное изобретение относится к способам, использующим гидроксиапатитную хроматографию для выделения биспецифического антитела из раствора, содержащего биспецифическое антитело и один или более чем один побочный продукт, характерный для производства (например, рекомбинантного производства) биспецифического антитела. Побочные продукты, характерные для производства (например, рекомбинантного производства) биспецифических антител (также упоминаемые в данном документе как побочные продукты, характерные для биспецифических антител, "BASB"), являются полипептидными вариантами биспецифического антитела с большей или меньшей молекулярной массой, которые теряют нужную биспецифическую активность. Например, BASB могут проявлять специфичность в отношении только одного из двух эпитопов или антигенов, распознаваемых биспецифическим антителом, и/или могут обладать существенно сниженной аффинностью для одного или обоих эпитопов или антигенов, распознаваемых биспецифическим антителом. Типичные BASB включают (i) фрагменты биспецифического антитела (т.е. пептидные или полипептидные варианты с меньшей молекулярной массой), которые включают, но не ограничиваясь ими,


Авторы данного изобретения неожиданно обнаружили, что гидроксиапатитные хроматографические способы, описанные в данном документе, могут отделить нужное биспецифическое антитело, содержащее Fc-домен, от одного или более чем одного BASB, также содержащего Fc-домен, в потоке сырьевого продукта. Следовательно, способы данного изобретения могут быть особенно полезны в сочетании со стандартными схемами очистки антител, которые в противном случае содержат технологические операции, недостаточные для отделения биспецифического антитела от BASB. Способы, описанные в данном документе, также могут быть особенно полезны в сочетании со стандартными процессами очистки антител для доведения конечного потока продукта (содержащего биспецифическое антитело) до конечной композиции и/или чистоты.
Изобретение относится к способу выделения биспецифического антитела, содержащего Fc-домен, из раствора, содержащего указанное биспецифическое антитело, причем этот способ включает (а) контактирование раствора с гидроксиапатитной хроматографической средой, (b) адсорбцию биспецифического антитела на гидроксиапатитной хроматографической среде и (с) элюирование биспецифического антитела из гидроксиапатитной среды в присутствии хлорид-ионов, где раствор, содержащий биспецифическое антитело, также включает или содержит (i) один или более чем один фрагмент биспецифического антитела (где указанный фрагмент также содержит Fc-домен) и/или (ii) один или более чем один полипептид, имеющий молекулярную массу, большую, чем молекулярная масса биспецифического антитела, и содержащий по меньшей мере одну из двух тяжелых цепей указанного биспецифического антитела (где один или более чем один указанный полипептид также содержит Fc-домен). Как таковое, изобретение также охватывает применение гидроксиапатитной хроматографической среды для выделения биспецифического антитела, включающего Fc-домен, из раствора, содержащего биспецифическое антитело, где указанное применение включает (а) контактирование гидроксиапатитной хроматографической среды с указанным раствором, (b) адсорбцию биспецифического антитела на гидроксиапатитной хроматографической среде и (с) элюирование биспецифического антитела из гидроксиапатитной среды в присутствии хлорид-ионов, где раствор, содержащий биспецифическое антитело, также включает (i) один или более чем один фрагмент биспецифического антитела (где указанный фрагмент также содержит Fc-домен) и/или (ii) один или более чем один полипептид, имеющий молекулярную массу, превышающую молекулярную массу указанного биспецифического антитела, и содержащий по меньшей мере одну из двух тяжелых цепей указанного биспецифического антитела (где один или более чем один указанный полипептид также содержит Fc-домен).
Раствор, содержащий биспецифическое антитело и один или более чем один BASB, контактирует с гидроксиапатитной хроматографической средой в условиях, позволяющих связывание биспецифического антитела и/или биспецифического антитела и одного или более чем одного BASB с хроматографической средой. Предпочтительно, условия, подходящие для связывания биспецифического антитела и одного или более чем одного BASB, представляют собой условия, в которых раствор имеет низкое значение проводимости. Растворы с низкими значениями проводимости, подходящие для раскрытых в данном документе способов, как правило, имеют значения примерно или не более чем примерно 13 мСм/см. Растворы с низкими значениями проводимости, подходящие для раскрытых в данном документе способов, могут также иметь значения проводимости примерно или не более чем примерно 10,6 мСм/см, или примерно или не более чем примерно 8,5 мСм/см. Неограничивающие примеры растворов с низкими значениями проводимости включают буферные растворы с рН примерно от 6,5 до 8,0, содержащие концентрацию фосфат-ионов в диапазоне от примерно 1 мМ до примерно 20 мМ, предпочтительно примерно 10 мМ; концентрацию ионов кальция в диапазоне от примерно 0,001 мМ до примерно 0,5 мМ, предпочтительно примерно 0,1 мМ; и концентрацию хлорид-ионов в диапазоне от примерно 10 мМ до примерно 200 мМ, предпочтительно примерно 50 мМ. Раствор с низким значением проводимости для применения в способах согласно данному изобретению может иметь значение рН примерно от 6,5 до 7,5, концентрацию фосфат-ионов по меньшей мере 10 мМ, концентрацию ионов кальция по меньшей мере 0,1 мМ и концентрацию хлорид-ионов от примерно 50 мМ до примерно 500 мМ. Альтернативно или дополнительно, раствор с низким значением проводимости для применения в способах согласно данному изобретению, могут иметь значение рН от примерно 6,5 до 7,5, концентрацию ионов фосфата примерно 10 мМ, концентрацию ионов кальция примерно 0,1 мМ и концентрацию хлорид-ионов от примерно 50 мМ до примерно 500 мМ. Фосфат-ионы в растворе могут быть обеспечены с помощью любой подходящей фосфатной соли из известных в данной области и/или описанных в данном документе или с помощью их комбинации. Неограничивающие примеры фосфатных солей, пригодных для применения в растворе в соответствии со способами данного изобретения, включают NaH2PO4, Na2HPO4, KН2РO4 и K2НРO4. Ионы кальция в растворе могут быть обеспечены с помощью любой подходящей кальциевой соли из известных в данной области и/или описанных в данном документе или с помощью их комбинации. Неограничивающие примеры солей кальция, пригодных для применения в растворе в соответствии со способами данного изобретения, включают CaCl2. Хлорид-ионы в растворе могут быть обеспечены с помощью любой подходящей хлоридной соли из известных в данной области и/или описанных в данном документе, включая соли, используемые для обеспечения ионов кальция, или с помощью их комбинации, при условии, что концентрации ионов кальция поддерживаются в диапазонах, указанных в данном описании. Неограничивающие примеры хлоридных солей, пригодных для применения в растворе в соответствии со способами данного изобретения, включают NaCl и KCl. Иллюстративные комбинации солей, обеспечивающих хлорид-ионы, для применения в этих воплощениях включают NaCl, СаСl2 и KCl. В предпочтительных воплощениях раствор, содержащий биспецифическое антитело и один или более чем один BASB, в условиях, подходящих для их первоначального связывания с гидроксиапатитной хроматографической средой, представляет собой раствор, содержащий (в дополнение к биспецифическому антителу и одному или более чем одному BASB) примерно 10 мМ NaH2PO4, примерно 50 мМ NaCl, 20 мМ MES и примерно 0,1 мМ CaCl2 при рН примерно от 6,5 до 7,5. Как известно в данной области, связывающий буфер в одиночку (без биспецифического антитела и одного или более чем одного BASB), включая воплощения, конкретно перечисленные в этом параграфе, может быть использован в качестве уравновешивающего буфера для гидроксиапатитной хроматографической среды и/или в качестве промывочного буфера на одном или более чем одном этапе хроматографического процесса.
Элюирование биспецифического антитела достигается исключительно путем увеличения концентрации хлорид-ионов. Элюирование осуществляют с помощью элюирующего буфера, имеющего низкую исходную проводимость, где концентрация хлорид-ионов впоследствии неуклонно возрастает. Условия выбора связывающего раствора с низкой проводимостью, описанные непосредственно выше (т.е. раствора, содержащего биспецифическое антитело и один или более чем один BASB, в условиях, позволяющих их связывание с гидроксиапатитной хроматографической средой), в равной степени относятся к выбору исходного состава элюирующего буфера согласно данному изобретению (т.е. также имеющего низкую исходную проводимость). Соответственно, исходный состав элюирующего буфера может быть таким же или может отличаться от состава связывающего раствора/связывающего буфера, описанного непосредственно выше или в другой части данного документа. В некоторых воплощениях исходный состав элюирующего буфера является таким же, как состав связывающего раствора/связывающего буфера. В других воплощениях исходный состав элюирующего буфера отличается от состава связывающего раствора/связывающего буфера. Элюирующий буфер предпочтительно содержит как фосфат-, так и хлорид-ионоы. В некоторых воплощениях элюирующий буфер имеет исходный состав примерно 10 мМ NaH2PO4, примерно 50 мМ NaCl, примерно 20 мМ MES и примерно 0,1 мМ CaCl2при рН от примерно 6,5 до 7,5.
Данное изобретение относится к способам, включающим повышение концентрации хлорид-ионов в элюирующем буфере, чтобы элюировать биспецифическое антитело из хроматографической среды. Концентрация хлорид-ионов может увеличиваться в соответствии с линейным градиентом, выполненным ступенчатым градиентом (см., например, реализованный ступенчатый градиент увеличения хлорид-ионов, представленный на фиг. 6) или в соответствии с комбинацией этих двух градиентов. Оптимизация градиента для элюирования биспецифического антитела из хроматографической среды и/или для отделения биспецифического антитела от BASB (т.е. чтобы элюировать один, а другой оставить связанным со средой) находится в пределах возможностей специалиста в данной области благодаря знаниям, содержащимся в данном документе. Концентрация хлорид-ионов может быть увеличена в элюирующем буфере путем увеличения концентрации одной или более чем одной хлоридной соли. Неограничивающие примеры хлоридных солей, которые могут быть добавлены к элюирующему буферу для повышения концентрации хлорид-ионов, включают NaCl и KCl. Как известно в области хроматографии белка, относительные концентрации ионов кальция и фосфат-ионов нужно контролировать или оценивать, чтобы предотвратить осаждение кальция и фосфата из одного или более чем одного раствора в процессах согласно данному изобретению. В некоторых воплощениях концентрацию хлорид-ионов в элюирующем буфере повышают путем увеличения концентрации NaCl. В предпочтительных воплощениях исходная концентрация хлорид-ионов в элюирующем буфере составляет примерно 50 мМ (что может быть обеспечено одной или более чем одной хлоридной солью) и впоследствии увеличивается в ходе элюирования того биспецифического антитела, которое необходимо элюировать. Специалист в данной области сможет легко определить максимальную концентрацию хлорид-ионов, необходимую для элюирования адсорбированного биспецифического антитела, с помощью стандартных способов, известных в данной области и соответствующих знаниям и способам, описанным в данном документе. В некоторых воплощениях максимальная концентрация хлорид-ионов для элюирования биспецифического антитела и/или отделения биспецифического антитела от одного или более чем одного BASB составляет примерно 200 мМ, 250 мМ, 300 мМ, 350 мМ, 400 мМ или 500 мМ. Иллюстративный элюирующий буфера в соответствии со способами согласно данному изобретению имеет исходный состав примерно 10 мМ NaH2PO4, примерно 50 мМ NaCl, примерно 20 мМ MES и примерно 0,1 мМ CaCl2 при рН примерно от 6,5 до 7,5, где концентрация хлорид-ионов впоследствии повышается путем увеличения концентрации NaCl в соответствии с линейным, ступенчатым или линейно-ступенчатым градиентом до примерно 500 мМ в ходе этапа элюирования.
Элюирование биспецифического антитела предпочтительно достигается во фракции элюата, причем эта фракция содержит биспецифическое антитело, но не содержит по меньшей мере один из BASB, адсорбированых на гидроксиапатитной хроматографической среде. Способы согласно данному изобретению, в частности, позволяют отделить биспецифическое антитело по меньшей мере от одного BASB, где указанный по меньшей мере один BASB представляет собой




Способы согласно данному изобретению применимы к любому формату биспецифического антитела, известному в данной области и/или описанному в данном документе. Соответственно, биспецифическое антитело может содержать пептидные цепи антитела (например, тяжелую цепь и/или легкую цепь) или его антигенсвязывающие фрагменты из любого подходящего источника антитела, включая, но не ограничиваясь ими, антитела, полученные из животных источников (например, антитела мыши, крысы, хомяка, морской свинки, кролика, козы, овцы, собаки, лошади, коровы, обезьяны, примата и/или курицы), а также химерные, человеческие и гуманизированные антитела; может содержать пептидные цепи (например, тяжелую цепь и/или легкую цепь), имеющие константные домены (например, домен CL, СН1, СН2 и СН3) из антитела из любого подходящего источника, включая, но не ограничиваясь ими, подходящие животные источники, определенные в данном документе, и человеческие антитела; может содержать пептидные цепи (например, тяжелую цепь и/или легкую цепь), имеющие один или более чем один константный домен (например, один или более чем один из доменов CL, СН1, СН2 и СН3) из антитела из любого подходящего источника, рекомбинантно гибридного или химически конъюгированного с фрагментом антитела, который сохраняет свою антигенсвязывающую функцию, включая, но не ограничиваясь ими, scFv, scFab, Fd, dAb, одиночный вариабельный домен тяжелой цепи и одиночный вариабельный домен легкой цепи; и/или может содержать пептидные цепи (например, тяжелую и/или легкую цепь), имеющие человеческие или гуманизированные каркасные домены. В некоторых воплощениях биспецифическое антитело, содержащее Fc-домен согласно изобретению, представляет собой биспецифическое антитело типа "ключ в замке" ("KiH") (т.е. содержит две тяжелые цепи, разработанные в соответствии со способами KiH, известными в данной области, и/или как описано в данном документе). Методика KiH может быть объединена (или может не быть объединена) с другими методиками разработки биспецифического антитела. Неограничивающие примеры таких других методик разработки биспецифического антитела включают методики, применяемые к одному или более чем одному из вариабельных доменов биспецифического антитела, такие как методики CrossMab и/или слияние антигенсвязывающего фрагмента (например, scFab) с одним или более чем одним константным доменом тяжелой цепи. Изобретение также охватывает применение CrossMab и методик слияния тяжелой цепи антигенсвязывающего фрагмента (например, scFab), независимых от методик KiH. Соответственно, биспецифическое антитело согласно изобретению может включать применение только одной методики, выбранной среди методики KiH, методики CrossMab и методики слияния тяжелой цепи антигенсвязывающего фрагмента, или оно может включать применение более чем одной из этих методик. Для удобства используемые в данном описании антитела, разработанные в соответствии с методиками KiH, CrossMab и методикой слияния тяжелой цепи антигенсвязывающего фрагмента, указываются как "биспецифические KiH-антитела", "биспецифические CrossMab-антитела" и/или "гибридные антитела тяжелой цепи антигенсвязывающего фрагмента", соответственно. В некоторых воплощениях данного изобретения биспецифическое антитело является гибридным антителом тяжелой цепи антигенсвязывающего фрагмента, где одна тяжелая цепь биспецифического антитела содержит scFab, который рекомбинантно слит или химически конъюгирован с шарнирной СН2-СН3-областью тяжелой цепи антитела (т.е. "биспецифическое антитело scFab"). В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно изобретению представляет собой биспецифическое KiH-антитело, биспецифическое CrossMab-антитело, биспецифическое scFab-антитело, биспецифическое KiH-CrossMab-антитело или биспецифическое KiH-scFab-антитело. В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению представляет собой биспецифическое KiH-антитело, биспецифическое CrossMab-антитело, биспецифическое scFab-антитело, биспецифическое KiH-CrossMab-антитело или биспецифическое KiH-scFab-антитело, а способы согласно данному изобретению отделяют биспецифическое антитело от одного или более чем одного из их BASB.
Данное изобретение не ограничивается биспецифическими антителами, имеющими специфичность к любому конкретному эпитопу или антигену, но применимо к биспецифическим антителам в целом и, в частности, применимо к биспецифическим антителам, имеющим Fc-домен. Соответственно, антитела согласно данному изобретению могут иметь специфичность в отношении двух или более эпитопов (которые находятся на одном и том же или различных антигенах) и/или иметь специфичность в отношении двух или более антигенов. Неограничивающие примеры антигенов, в отношении которых биспецифическое антитело может проявлять специфичность, включают белки и полипептиды (включая, но не ограничиваясь ими, выделенные белки и полипептиды в нативной конформации; выделенные денатурированные белки и полипептиды; белки и полипептиды, экспрессированные на поверхности клетки (в том числе клеточные рецепторы и/или клеточные маркеры, известные в данной области или описанные в данном документе) и растворимые белки и полипептиды, которые могут быть найдены в биологических жидкостях (например, крови, сыворотке, моче и их фракциях), такие как секретированные белки, слущенные клеточные рецепторы и слущенные клеточные маркеры). В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению имеет специфичность к одному или более чем одному из EGFR, IGFR, Ang2, VEGF, TWEAK, IL17, CD3, TNF (TNF-альфа), белка активации фибробластов (fibroblast activation protein, FAP), рецептора смерти 5 (death receptor 5, DR5), CEA, хондроитинсульфатпротеогликана меланомы (melanoma-associated chondroitin sulfate proteoglycan, MCSP), фолатного рецептора 1 (FolR1), латентного мембранного белка 1/2 (latent membrane protein 1/2, LMP 1/2), или к другому антигену, описанному в подробном описании. В альтернативных или дополнительных воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению имеет специфичность в отношении любых двух из EGFR, IGFR, Ang2, VEGF, TWEAK, IL17, CD3, TNF (TNF-альфа), белка активации фибробластов (FAP), рецептора смерти 5 (DR5), СЕА, хондроитинсульфатпротеогликана меланомы (MCSP), фолатного рецептора 1 (FolR1), латентного мембранного белка 1/2 (latent membrane protein 1/2, LMP 1/2) или другого антигена, описанного в подробном описании. В других альтернативных или дополнительных воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению имеет специфичность в отношении EGFR и IGFR, Ang2 и VEGF или TWEAK и IL17.
В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению является биспецифическим KiH-CrossMab-антителом, обладающим специфичностью к EGFR и IGFR, где указанные способы согласно данному изобретению выделяют биспецифическое антитело из раствора, содержащего его и по меньшей мере один BASB, где по меньшей мере один BASB представляет собой




В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению является биспецифическим KiH-scFab-антителом, обладающим специфичностью к Ang2 и VEGF, где указанные способы согласно данному изобретению выделяют биспецифическое антитело из раствора, содержащего его и по меньшей мере один BASB, где по меньшей мере один BASB представляет собой




В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению является биспецифическим KiH-scFab-антителом, обладающим специфичностью к EGFR и IGFR, где указанные способы согласно данному изобретению выделяют биспецифическое антитело из раствора, содержащего его и по меньшей мере один BASB, где по меньшей мере один BASB представляет собой




В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению является биспецифическим KiH-scFab-антителом, обладающим специфичностью к TWEAK и IL17, где указанные способы согласно данному изобретению выделяют биспецифическое антитело из раствора, содержащего его и по меньшей мере один BASB, где по меньшей мере один BASB представляет собой 5/4 антитело, и где отделение представляет собой получение фракции элюата из гидроксиапатитной хроматографической среды, при этом указанная фракция элюата содержит биспецифическое TWEAK-IL17-антитело, но не содержит 5/4 антитело. В определенном аспекте этого воплощения биспецифическое антитело представляет собой биспецифическое KiH-scFab-антитело, обладающее специфичностью к TWEAK и IL17, где вариабельный домен, специфичный для TWEAK, представляет собой вариабельный scFab-домен. В предпочтительном аспекте этого воплощения биспецифическое антитело представляет собой биспецифическое KiH-scFab-антитело, обладающее специфичностью к TWEAK и IL17, где вариабельный домен, специфичный для TWEAK, является вариабельным scFab-доменом, где один или более чем один из BASB представляет собой 5/4 антитело, и где способы согласно изобретению включают получение фракции элюата из гидроксиапатитной хроматографической среды, где указанная фракция элюата содержит биспецифическое TWEAK-IL17-антитело, но не содержит 5/4 антитело.
В некоторых воплощениях биспецифическое антитело в соответствии со способами согласно данному изобретению является биспецифическим KiH-CrossMab-антителом, обладающим специфичностью к Ang2 и VEGF, где указанные способы согласно данному изобретению выделяют биспецифическое антитело из раствора, содержащего его и по меньшей мере один BASB, где по меньшей мере один BASB представляет собой 3/4 антитело, и где отделение представляет собой получение фракции элюата из гидроксиапатитной хроматографической среды, при этом указанная фракция элюата содержит биспецифическое Ang2-VEGF-антитело, но не содержит 3/4 антитело. В определенном аспекте этого воплощения биспецифическое антитело представляет собой биспецифическое KiH-CrossMab-антитело, обладающее специфичностью к Ang2 и VEGF, где вариабельный домен, специфичный для Ang2, представляет собой вариабельный CrossMab-домен. В предпочтительном аспекте этого воплощения биспецифическое антитело представляет собой биспецифическое KiH-CrossMab-антитело, обладающее специфичностью к Ang2 и VEGF, где вариабельный домен, специфичный для Ang2, является вариабельным CrossMab-доменом, где один или более чем один из BASB представляет собой 3/4 антитело, и где способы согласно изобретению включают получение фракции элюата из гидроксиапатитной хроматографической среды, где указанная фракция элюата содержит биспецифическое Ang2-VEGF-антитело, но не содержит 3/4 антитело.
Любой из гидроксиапатитных способов, раскрытых в данном документе, либо описанных в качестве аспекта и/или воплощения данного изобретения, либо описанных в качестве предпочтительного или нет, может быть объединен с предшествующими или последующими процессами очистки, описанными в данном документе и/или иным образом известными в данной области. Примеры таких процессов очистки, которые могут быть объединены с предшествующими или последующими гидроксиапатитными способами, раскрытыми в данном документе, включают, но не ограничиваясь ими, аффинную хроматографию, эксклюзионную хроматографию, ионообменную хроматографию (в том числе анионо- и катионообменную хроматографию), хроматографию гидрофобных взаимодействий, другие формы хроматографии смешанного режима и различные фильтрационные способы, известные в данной области. Специалист в данной области способен разработать соответствующие условия для интеграции с раскрытыми способами для достижения конкретной очистки биспецифического антитела. В неограничивающих примерах любой из гидроксиапатитных хроматографических способов, раскрытых в данном документе, может быть объединен с идущим ранее способом аффинной хроматографии, где аффинный лиганд имеет специфичность к домену антитела, такому как Fc-домен, домен каппа или домен лямбда (например, но не ограничиваясь ими, белок А, белок G, белок A/G, белок L, KappaSelect™ и LambdaFabSelect™ (GE Healthcare Life Sciences, Упсала, SE)). В некоторых воплощениях раствор, содержащий биспецифическое антитело и один или более чем один BASB, который контактирует с гидроксиапатитной хроматографической средой в соответствии со способами согласно данному изобретению, содержит объединенные фракции элюата, содержащие антитело, из аффинной хроматографической среды, имеющей специфичность в отношении Fc-домена антитела или домена каппа или лямбда легкой цепи антитела. В других неограничивающих примерах гидроксиапатитный хроматографический способ в соответствии с изобретением может быть объединен с предшествующими или последующими процессами очистки, включая, но не ограничиваясь ими, анионообменную хроматографию и катионообменную хроматографию. В качестве неограничивающего примера любой способ, аспект, воплощение или другой пример гидроксиапатитных хроматографических способов в соответствии с изобретением, раскрытых в данном документе, может быть объединен с предшествующей или последующей анион- или катионобменной хроматографией. В конкретном примере, который может быть объединен с любым способом, аспектом, воплощением или другим примером, рассмотренным в данном документе, гидроксиапатитные хроматографические способы согласно изобретению могут быть объединены с предшествующей или последующей катионобменной хроматографией, где указанная катионобменная хроматография может отделить биспецифическое антитело от одного или более чем одного загрязнителя, примеси и/или второго BASB. Используемые в данном документе термины "загрязнитель", "примесь" и аналогичные термины имеют их стандартное значение, известное в данной области и, в частности, указывают на нежелательные компоненты в растворе, содержащем биспецифическое антитело. Неограничивающие примеры таких нежелательных компонентов включают нежелательные белки (например, но не ограничиваясь ими, гомодимеры тяжелой цепи биспецифического антитела), нежелательные малые молекулы, один или более чем один фрагмент биспецифического антитела помимо BASB, описанного в данном документе, агрегаты биспецифического антитела и нежелательные белки/молекулы, продуцируемые клеткой (эндогенные или гетерологичные). Используемый в данном документе термин "второй BASB" и аналогичные термины относятся к BASB, который не является по меньшей мере одним BASB, который отделяется от биспецифического антитела путем гидроксиапатитных хроматографических способов, раскрытых в данном документе. Таким образом, в некоторых воплощениях гидроксиапатитные хроматографические способы, раскрытые в данном документе, выделяют биспецифическое антитело из раствора, содержащего биспецифическое антитело и по меньшей мере один BASB, где выделение представляет собой элюирование биспецифического антитела из гидроксиапатитной хроматографической среды в элюированную фракцию, содержащую биспецифическое антитело, но не содержащую по меньшей мере один BASB, причем эти способы объединены по меньшей мере с одним предшествующим или последующим катионообменным хроматографическим способом, который отделяет биспецифическое антитело по меньшей мере от одного загрязнителя, примеси и/или второго BASB. В конкретном примере, который может быть объединен с любым способом, воплощением, аспектом или другим примером, раскрытым в данном документе, гидроксиапатитный хроматографический способ в соответствии с изобретением может быть объединен с (1) предшествующим аффинным хроматографическим способом, где аффинный лиганд имеет специфичность к домену антитела, такому как Fc-домен, домен каппа или домен лямбда; и (2) предшествующим или последующим катионообменным хроматографическим способом, где указанная катионообменная хроматография отделяет биспецифическое антитело от одного или более чем одного загрязнителя, примеси и/или второго BASB.
Определения
Как правило, следующие слова или фразы имеют указанное определение при использовании в кратком изложении, описании, примерах и формуле изобретения.
Используемый в данном документе термин "примерно" в связи с числом обозначает ±5% от числа. При использовании в связи с измерением, выполняемым устройством (например, pH, который определяется с помощью рН-метра) или выполняемым в соответствии со стандартным способом, известным в данной области (например, концентрация белка в растворе, которая определяется путем HPLC (ВЭЖХ), UV(УФ)-адсорбции, ELISA (ИФА), с помощью стандартных наборов (например, колориметрического анализа)), "примерно" указывает на значение в пределах стандартной ошибки, известной для такого устройства, или в пределах одного стандартного отклонения определенного значения для такого способа.
Термин "антитело" используется в самом широком смысле и конкретно охватывает, например, одиночные моноклональные антитела (включая агонистические, антагонистические и нейтрализующие антитела; а также деиммунизированные, химерные, гуманизированные и человеческие антитела и/или антитела, полученные из любого подходящего животного источника (например, от мышей, крыс, хомяков, морских свинок, кроликов, коз, овец, собак, лошадей, коров, обезьян, приматов и/или кур)), иммуноконъюгаты, синтетические антитела, камелизированные антитела, одноцепочечные Fv (scFv), одноцепочечные антитела, Fab-фрагменты, F(аb')-фрагменты, F(аb')2-фрагменты, дисульфид-связанные Fv (sdFv), интратела и эпитопсвязывающие фрагменты любой из вышеперечисленных молекул. В частности, изобретение относится к биспецифическим антителам, которые, как понятно любому специалисту в данной области и в некоторых воплощениях, состоят из доменов по меньшей мере двух или более различных антител. Таким образом, биспецифическое антитело согласно изобретению может содержать две различные тяжелые цепи (полученные из различных антител) и две различные легкие цепи (полученные из различных антител) и/или может содержать тяжелые и легкие цепи, каждая из которых содержит фрагменты из двух или более различных антител. Таким образом, биспецифическое антитела согласно изобретению может содержать тяжелые и/или легкие цепи из деиммунизированных, мышиных, химерных, гуманизированных и человеческих антител, а также комбинацию тяжелой и/или легкой цепей из деиммунизированных, мышиных, химерных, гуманизированных и человеческих антител и их фрагментов (например, их вариабельных и/или константных доменов). Биспецифическое антитело согласно изобретению также может содержать эпитопсвязывающие фрагменты антител (например, но не ограничиваясь ими, одноцепочечные Fv (scFv), одноцепочечные антитела, Fab-фрагменты, F(аb')-фрагменты, F(аb')2-фрагменты и дисульфид-связанные Fv (sdFv)), в частности, связанные с одним или более чем одним константным доменом тяжелой или легкой цепи, например, scFv-связанные с доменами СН1/СН2/СН3 тяжелой цепи. В предпочтительных воплощениях биспецифическое антитело согласно изобретению содержит Fc-домен. Как понятно любому специалисту в данной области, наличие Fc-домена делает биспецифическое антитело поддающимся очистке с использованием Fc-связывающих группировок, таких как, но не ограничиваясь ими, белок А, белок G и/или белок A/G. Как хорошо известно в данной области, конкретная структура и аминокислотная последовательность доменов СН1-шарнир-СН2-СН3 тяжелых цепей определяет тип и подкласс иммуноглобулина. Биспецифические антитела согласно изобретению никоим образом не ограничены конкретной структурой или аминокислотной последовательностью тяжелой цепи; соответственно, биспецифические антитела согласно изобретению могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), любого класса (например, IgG1; IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
Термин "аффинный лиганд", используемый в данном документе, и особенно в отношении хроматографического процесса, относится к группировке, которая связывается селективно или предпочтительно с компонентом в сырьевом или загрузочном потоке процесса за счет специфического взаимодействия с сайтом связывания на группировках (например, лиганде) и/или компонентах. Иммуноглобулин-аффинный лиганд согласно данному изобретению селективно или предпочтительно связывает Fc- или другой константный домен иммуноглобулина (например, κ- или λ-домен легкой цепи антитела). Таким образом, "иммуноглобулин-аффинный лиганд", используемый в данном документе, селективно или предпочтительно связывается с компонентами в сырьевом или загрузочном потоке, имеющими Fc-, κ- и/или λ-домен(ы). Иммуноглобулин-аффинный лиганд обычно иммобилизован на твердой фазе, такой как полимерная подложка. Примеры иммуноглобулин-аффинных лигандов, которые могут связываться с полимерной подложкой в соответствии с данным изобретением, включают, но не ограничиваясь ими, Fc-аффинные лиганды, такие как, но не ограничиваясь ими, белок А, белок G и белок A/G, и их аналоги; а также аффинные лиганды, которые связываются с другими константными доменами иммуноглобулинов (такими как κ- и/или λ-домены), включая, но не ограничиваясь ими, KappaSelect™ и LambdaFabSelect™ (GE Healthcare Life Sciences, Упсала, SE) и их аналоги. Способы связывания аффинных лигандов с материалами твердой подложи хорошо известны в области очистки. См., например, Affinity Separations: A Practical Approach (Practical Approach Series), Paul Matejtschuk (Ed.), (Irl Pr: 1997); и Affinity Chromatography, Herbert Schott (Marcel Dekker, New York: 1997).
Используемый в данном документе термин "между" в связи с определением параметра в некотором диапазоне ясно включает конечные точки этого диапазона. Таким образом, если параметр определен в данном документе как "между X и Y", то ясно подразумевается, что параметр может иметь значение, равное X или превышающее X, при условии, что значение меньше или равно Y, т.е. не более Y. Другими словами, значения, определенные фразой "между X и Y" и аналогичными конструкциями, ясно включают значения X и Y.
Используемые в данном документе выражения "клетка", "клеточная линия" и "клеточная культура" используются взаимозаменяемо, и все такие определения включают потомство. В частности, данное изобретение охватывает разделение и/или очистку молекул, представляющих интерес, т.е. биспецифических антител, от продуктов клеток, клеточных линий и клеточных культур. Такие продукты, как правило, включают кондиционированные клеточные среды и/или лизированные и гомогенизированные клетки и клеточные культуры (например, гомогенизированные клетки и клеточные компоненты в кондиционированных клеточных средах). Способы согласно данному изобретению особенно подходят для обработки продуктов из трансгенных клеток, клеточных линий и клеточных культур, где указанные трансгенные клетки, клеточные линии и клеточные культуры экспрессируют молекулу, представляющую интерес.
Понятно, что способы согласно данному изобретению относятся к выделению, очистке и/или обработке молекулы, представляющей интерес, например, биспецифического антитела, из раствора, содержащего указанную молекулу. Раствор, содержащий молекулу, представляющую интерес, в соответствии со способами согласно данному изобретению, включает сырьевой поток или загрузочный поток хроматографического процесса, например, сырьевой или загрузочный поток, примененный в одной или более чем одной хроматографической технологической операции, например, в качестве части схемы очистки. По существу, если раствор, содержащий молекулу, представляющую интерес, представляет собой клеточные культуральные среды или фракционированную или осветленную часть клеточных культуральных сред, то следует понимать, что такие среды обязательно являются кондиционированными клеточными средами для культивирования клеток (таким образом, чтобы включать молекулу, представляющую интерес). Поэтому используемый в данном документе термин "клеточный культуральный раствор" и аналогичные термины относятся к любому раствору биологического процесса или системы, которая, как ожидается, содержит молекулу, представляющую интерес, включая, но не ограничиваясь ими, например, кондиционированный клеточный культуральный супернатант; осветленный кондиционированный клеточный культуральный супернатант; осветленные, гомогенизированные/лизированные клеточные культуры и т.д.
В некоторых воплощениях клеточные культуральные среды осветляют и/или стерилизуют перед осуществлением описанных в данном документе способов. Используемые в данном документе термины "осветленный" и "осветление" относятся к удалению твердых частиц из раствора, включая фильтрацию, стерилизацию и/или центрифугирование. Термин "стерилизованный", используемый в данном документе, следует понимать как используемый в связи с раствором, содержащим белки; соответственно, понимается, что "стерилизация" таких растворов предпочтительно осуществляется путем фильтрации и/или центрифугирования, но не под действием тепла, чтобы избежать денатурации белка и/или агрегации белка. Как правило, "осветленный"/"стерилизованный" раствор в отношении любой клеточной культуральной среды представляет собой раствор, который был профильтрован через мембрану с размером пор не более чем примерно 0,45 мкм и, предпочтительно, с размером пор не более чем примерно 0,22 мкм.
Термин "хроматографическая среда", используемый в данном документе, относится к твердофазному материалу, который способен селективно связывать один или более чем один компонент нанесенной загрузочной жидкости, как это хорошо известно в данной области. Изобретение охватывает, в частности, применение любой гидроксиапатитной хроматографической среды, известной в данной области и/или определенной в данном документе, для обработки молекулы, представляющей интерес, в частности, биспецифического антитела. Способы согласно данному изобретению также охватывают комбинацию гидроксиапатитной хроматографии с одним или более чем одним дополнительным хроматографическим процессом (например, ионообменной хроматографией) как части схемы очистки для отделения молекулы, представляющей интерес, т.е. биспецифического антитела, от одного или более чем одного побочного продукта, характерного для производства биспецифического антитела, т.е. "BASB". Примеры технологических хроматографических операций, с которыми может быть объединена гидроксиапатитная хроматография в соответствии со способами согласно изобретению, включают, но не ограничиваясь ими, технологические хроматографические операции, включающие применение твердых фаз (например, смол), которые селективно связываются с одним или более чем одним компонентом загрузочной жидкости за счет катионного обмена, анионного обмена, гидрофобных взаимодействий, гидрофильных взаимодействий, водородных связей, пи-пи-связывания, аффинности к металлу и/или специфического связывания с помощью биомолекул (например, аффинных смол, содержащих иммуноглобулины, фрагменты иммуноглобулинов и ферменты). Твердая фаза может представлять собой пористую частицу, непористую частицу, мембрану или сплошную подложку. Специалист в данной области способен разработать соответствующие условия для этих дополнительных технологических хроматографических операций и интегрировать их с изобретением, раскрытым в данном документе, чтобы достичь очистки конкретного биспецифического антитела.
Термины "Fc-домен", "Fc-область" и аналогичные термины, используемые в данном документе, относятся к С-концевой области антитела IgG, в частности, к С-концевой области тяжелой цепи (цепей) антитела IgG, содержащей домены СН2/СН3 тяжелой цепи IgG. Хотя границы Fc-области тяжелой цепи IgG могут слегка отличаться, Fc-домен, как правило, определяется как охватывающий область примерно от аминокислотного остатка Cys226 до карбоксильного конца тяжелой цепи (цепей) IgG. Как известно в данной области, Fc-область может быть использована независимо от остальной архитектуры антитела, например, может быть связана со вторым белком, чтобы функционировать в качестве белковой метки или для придания второму белка функциональности, обычно связанной с Fc-областью (например, комплемент-связывающей активности, FcRn-связывающей активности и т.д.). Такие вторые белки, связанные (например, но не ограничиваясь ими, химические конъюгаты и рекомбинантные гибриды) с Fc-доменом, включают фрагменты иммуноглобулина. Как известно в данной области, в белках, содержащих такие Fc-конъюгаты или гибриды, Fc-область не обязательно должна быть С-концевой областью белковой цепи или экспрессированной аминокислотной последовательностью.
Термин "побочный продукт" и аналогичные термины относятся к любой ненужной молекуле, присутствующей в загрузочном или сырьевом потоке, которая характерно образуется при производстве молекулы, представляющей интерес, т.е. биспецифического антитела, и которая должна быть отделена в ходе процесса хроматографической очистки. Что касается фразы "побочный продукт, характерный для биспецифического антитела", BASB", то этот термин относится к побочным продуктам, содержащим Fc-домен, которые характерны для рекомбинантной продукции биспецифических антител. Соответственно, BASB может быть фрагментом биспецифического антитела, который содержит Fc-домен, или может быть полипептидом, имеющим молекулярную массу, превышающую молекулярную массу биспецифического антитела, где указанный полипептид содержит по меньшей мере одну из двух тяжелых цепей биспецифического антитела, а также содержит Fc-домен. В зависимости от нужного формата биспецифического антитела, которое должно быть экспрессировано, типичные BASB, которые могут быть отделены от биспецифического антитела в соответствии со способами согласно изобретению, включают, но не ограничиваясь ими,


Способы согласно данному изобретению также охватывают выделение примесей и/или других загрязнителей, отличных от BASB, из растворов, содержащих биспецифическое антитело. Используемые в данном документе термины "примесь", "загрязнитель" и аналогичные термины относятся к любой чужеродной или ненужной молекуле, включая биологические макромолекулы, такие как ДНК, РНК или белок, отличающейся от молекулы, представляющей интерес, которая также присутствует в загрузочной жидкости, содержащей молекулу, представляющую интерес. Примеси включают, например, варианты белков (включая, но не ограничиваясь ими, BASB, особо указанные в данном описании, агрегированные белки, высокомолекулярные формы, низкомолекулярные формы и фрагменты и деамидированные формы); другие белки из клеток-хозяев, которые секретируют очищаемую молекулу, представляющую интерес (белки клетки-хозяина); белки, которые являются частью абсорбента, используемого для аффинной хроматографии, которые могут попадать в образец во время предшествующих этапов очистки (например, белок А); эндотоксины; и вирусы.
Краткое описание графических материалов
Фиг. 1 Анализ CE-SDS в невосстанавливающих условиях производственного культурального супернатанта биспецифического анти-ЕGFR/анти-IGFR-антитела KiH-CrossMab с последующей хроматографией на белке А.
Фиг. 2 Профиль элюирования из гидроксиапатитной хроматографической колонки (контролируемый по УФ-поглощению при 280 нм) композиции биспецифического антитела, анализируемой на фиг. 1. Элюирование достигается с помощью растущего градиента (линейный градиент) NaCl в элюирующем буфере, представленным наклонной линией.
Фиг. 3 Анализ CE-SDS в невосстанавливающих условиях первого пика элюирования из фиг. 2 (левый серый прямоугольник).
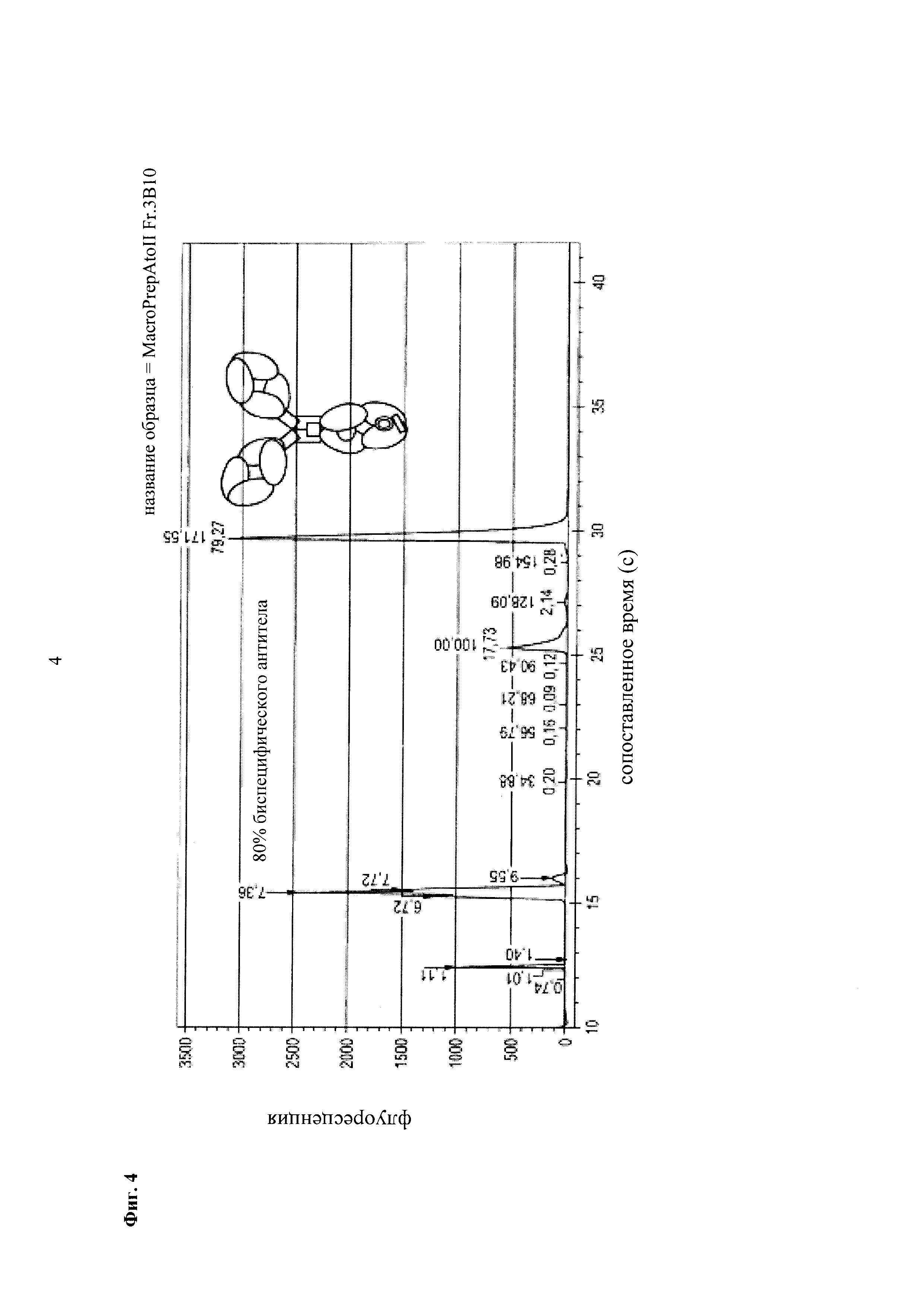
Фиг. 4 Анализ CE-SDS в невосстанавливающих условиях второго пика элюирования из фиг. 2 (правый серый прямоугольник).
Фиг. 5 Анализ CE-SDS в невосстанавливающих условиях производственного культурального супернатанта биспецифического анти-VEGF/анти-Ang2-антитела KiH/scFab с последующей хроматографией на белке А.
Фиг. 6 Профиль элюирования из гидроксиапатитной хроматографической колонки (контролируемый по УФ-поглощению при 280 нм) композиции биспецифического антитела, анализируемой на фиг. 5. Элюирование достигается с помощью растущего градиента (линейный градиент с внедренным этапом) NaCl в элюирующем буфере, представленного наклонной и ступенчатой линией.
Фиг. 7 Анализ CE-SDS в невосстанавливающих условиях первого пика элюирования и объединенных фракций слева от вертикальной черной линии на фиг. 6.
Фиг. 8 Анализ CE-SDS в невосстанавливающих условиях второго пика элюирования из фиг. 6 (первый пик элюирования справа от вертикальной черной линии на фиг. 6).
Фиг. 9 Профиль элюирования из гидроксиапатитной хроматографической колонки (контролируемый по УФ-поглощению при 280 нм) производственного культурального супернатанта биспецифического анти-VЕGF/анти-Ang2-антитела KiH/CrossMab, который был подвергнут хроматографии белка перед загрузкой на гидроксиапатитную колонку. Элюирование достигается с помощью растущего градиента (линейный градиент) NaCl в элюирующем буфере, представленного наклонной линией.
Фиг. 10 Анализ CE-SDS в невосстанавливающих условиях производственного культурального супернатанта биспецифического анти-EGFR/анти-IGFR-антитела KiH/scFab с последующей хроматографией на белке А.
Фиг. 11 Профиль элюирования из гидроксиапатитной хроматографической колонки (контролируемый по УФ-поглощению при 280 нм) композиции биспецифического антитела, анализируемого на фиг. 10. Элюирование достигается с помощью растущего градиента (линейный градиент с внедренным этапом) NaCl в элюирующем буфере, представленного наклонной и ступенчатой линией.
Фиг. 12 Анализ CE-SDS в невосстанавливающих условиях второго пика элюирования из фиг. 11.
Фиг. 13 Анализ CE-SDS в невосстанавливающих условиях производственного культурального супернатанта биспецифического анти-IL17/анти-TWEAK-антитела KiH/scFab с последующей хроматографией на белке А.
Фиг. 14 Профиль элюирования из гидроксиапатитной хроматографической колонки (контролируемый по УФ-поглощению при 280 нм) композиции биспецифического антитела, анализируемой на фиг. 13. Элюирование достигается при увеличении градиента (линейный градиент с внедренным этапом) NaCl в элюирующем буфере, представленного наклонной и ступенчатой линией. Черные стрелки в пределах первого, второго и третьего пиков элюирования показывает фракции, которые затем были проанализированы с помощью SDS-CE (представлены на фиг. 15 и 16; анализ фракции, указанной третьей стрелкой, не показан).
Фиг. 15 Анализ CE-SDS в невосстанавливающих условиях первого пика элюирования из фиг. 14 (первая/самая левая черная стрелка).
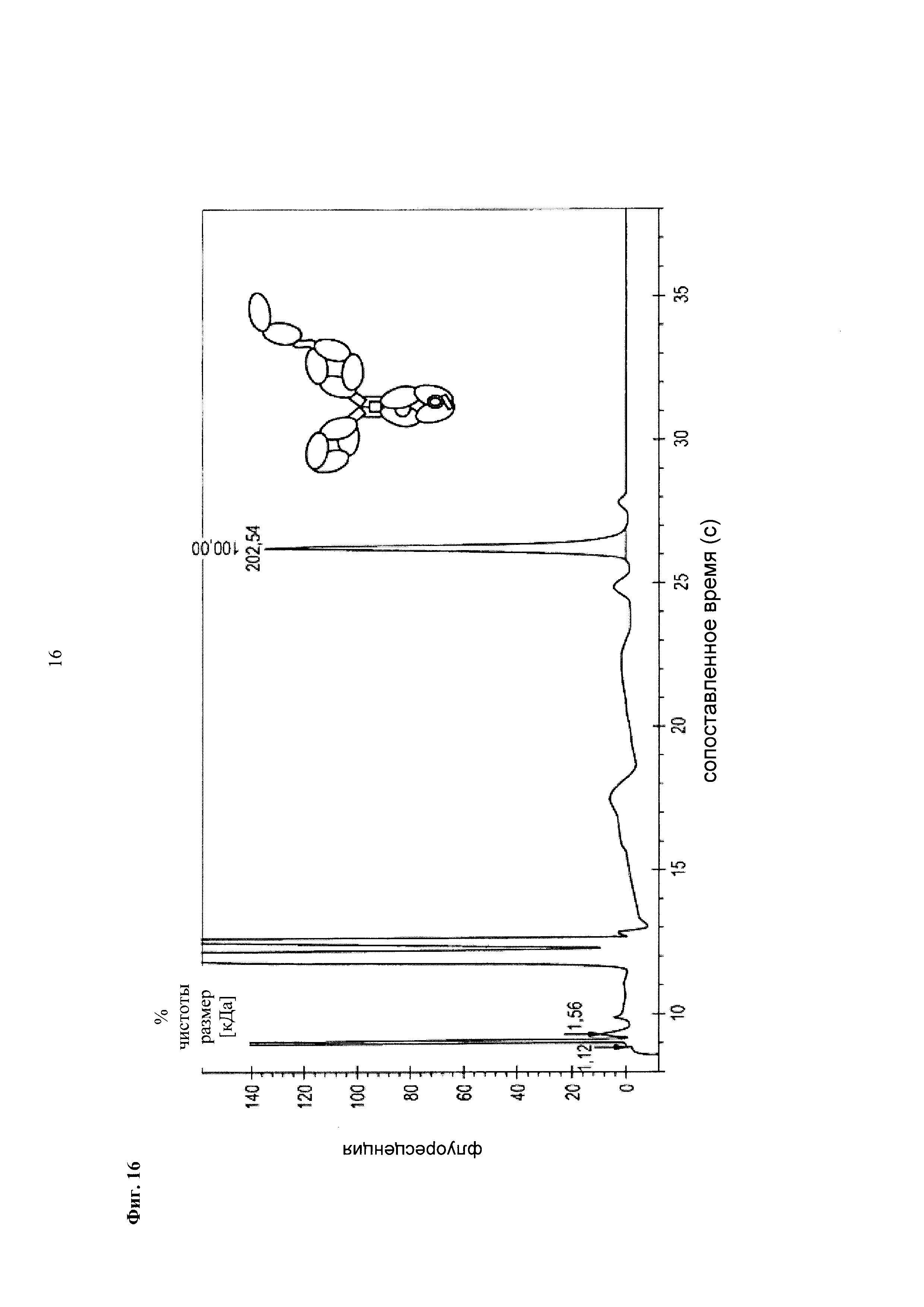
Фиг. 16 Анализ CE-SDS в невосстанавливающих условиях второго пика элюирования из фиг. 14 (вторая/средняя черная стрелка).
Фиг. 17 Профиль элюирования из катионообменной хроматографической колонки (контролируемый по УФ-поглощению при 280 нм) композиции биспецифического антитела, анализируемого на фиг. 13. Элюирование достигается при увеличении градиента (линейный градиент) NaCl в элюирующем буфере, представленного наклонной линией.
Фиг. 18 Анализ CE-SDS в невосстанавливающих условиях первого пика элюирования из фиг. 17.
Фиг. 19 Сокращение CE-SDS анализ второго пика элюирования из фиг. 17.
Подробное описание
Неожиданно было обнаружено, что гидроксиапатитная хроматография может быть использована для отделения биспецифических антител по меньшей мере от одного побочного продукта, характерного для производства биспецифического антитела (т.е. по меньшей мере одного "BASB"). Хотя было показано, что гидроксиапатитная хроматографии в процессах очистки белков дает высокую степень очистки от примесей, таких как агрегаты, ДНК и эндотоксины, не было продемонстрировано отделение молекул с IEP, которые отличаются лишь незначительно (см., например, Gagnon et al., Hydroxyapatite as a Capture Method for Purification of Monoclonal Antibodies, IВС World Conference and Exposition, San Francisco (2006)). Как правило, биспецифическое антитело и BASB будут отличаться по своим значениям IEP не более чем на 0,5 рН, что до настоящего изобретения и изучения было предположительно слишком близкими значениями для разделения путем ионнообменной хроматографии. Соответственно, попытки очистить биспецифические антитела, как правило, основаны на применении ряда дорогостоящих аффинных этапов для обеспечения очистки молекул с биспецифической активностью. Напротив, способы данного изобретения предлагают упрощенные и/или иным образом улучшенные протоколы очистки для разделения биспецифического антитела и по меньшей мере одного BASB.
BASB, определенные в данном документе, являются фрагментами биспецифического антитела, содержащими Fc-домен, и/или полипептидными вариантами биспецифического антитела, имеющими молекулярную массу, превышающую массу биспецифического антитела, где указанный полипептидный вариант содержит по меньшей мере одну из двух тяжелых цепей биспецифического антитела, а также содержит Fc-домен. Неограничивающие примеры BASB включают



























Гидроксиапатит [hydroxyapatite, НА] представляет собой кристаллический минерал фосфата кальция со структурной формулой Са10(РO4)6(ОН)2. Белок-реактивные сайты на НА включают пары положительно заряженных ионов кальция (С-сайты) и триплеты отрицательно заряженных фосфатных групп (Р-сайты). С-сайты взаимодействуют с белками (такими как биспецифические антитела и BASB) путем НА-кальций-комплексообразования через белковые карбоксильные кластеры. Комплексообразование и координацию с кальцием иногда называют аффинностью к кальцию. Р-сайты взаимодействуют с белками через фосфорильный катионный обмен с положительно заряженными аминокислотными остатками белка (см., например, US 2012/0077961). В промышленных и коммерческих установках НА наиболее часто используется в отделении нужного белка от побочных продуктов производства белка, таких как белковые агрегаты, белки клетки хозяина и ДНК клетки хозяина, с использованием фосфатных градиентов или, в некоторых обстоятельствах, хлоридных градиентов. Тем не менее, НА не был рассмотрен для очистки полноразмерных антител (например, содержащих Fc-домен) от Fc-содержащих побочных продуктов, потому что эти побочные продукты, как полагают, элюировались бы с нужным продуктом (т.е. полным антителом). Например, ранее считалось, что применение хлорида натрия в присутствии фосфата делает связывание IgG с НА менее сильным, что приводит к элюированию не только антитела, но и Fc-содержащих загрязнителей. Напротив, авторы данного изобретения обнаружили, что повышение концентрации хлорида натрия в присутствии фосфата неожиданно может отделить биспецифическое антитело от одного или более чем одного BASB.
Различные гидроксиапатитные хроматографические подложки являются коммерчески доступными и обычно используются в данной области, и любая из них может быть использована в осуществлении данного изобретения на практике. Они включают, но не ограничиваясь ими, керамический гидроксиапатит, гидроксиапатитные гели, гидроксиапатитные смолы и гидроксиапатитные порошки. Керамический гидроксиапатит относится к формам гидроксиапатита, в которых нанокристаллы агрегированы в частицы и расплавлены при высокой температуре, чтобы создать стабильные керамические микросферы, подходящие для хроматографических применений. Коммерческие примеры керамического гидроксиапатита включают, но не ограничиваясь ими, СНТ типа I и СНТ типа II (BioRad, США). Гидроксиапатитные микросферы обычно доступны в размерах частиц, включая, но не ограничиваясь этим, 10, 20, 40 и 80 микрон. Гидроксиапатитный гель относится к продуктам, содержащим некерамический гидроксиапатит, встроенный в гелевые подложки. Неограничивающим примером гидроксиапатитного геля является ULTROGEL™ (Pall Corp., США), который содержит микрофрагменты некерамического гидроксиапатита, встроенные в пористые агарозные микросферы. Выбор формы и/или типа гидроксиапатита, в том числе средний размер частиц, подходящий для способов согласно данному изобретению, находится в рамках квалификации специалиста в данной области и достигается с помощью общих знаний и/или проводится с помощью стандартных экспериментов.
Хроматографические способы могут быть осуществлены в соответствии с любыми настройками, известными в данной области и/или описанными в данном документе. Неограничивающие примеры хроматографических способов включают применение колонки с неподвижным слоем, колонки с псевдоожиженным/расширившимся слоем и/или операции в статическом режиме, когда хроматографическую среду смешивают с раствором, содержащим биспецифическое антитело. В предпочтительных воплощениях способы согласно данному изобретению осуществляют на практике с помощью гидроксиапатитной колонки с неподвижным слоем, работающей в режиме/условиях "связывание-элюирование".
Способы согласно данному изобретению выделяют биспецифическое антитело из растворов, содержащих биспецифическое антитело и по меньшей мере один BASB (т.е. "растворов биспецифического антитела"). Способы согласно данному изобретению применимы для растворов биспецифических антител, которые не очищены или частично очищены, и/или профильтрованы или не профильтрованы. Растворы биспецифических антител могут происходить из природных, синтетических или рекомбинантных источников. Неочищенные растворы биспецифических антител могут поступать из любого источника, известного в данной области и/или описанного в данном документе, включая, но не ограничиваясь ими, плазму, сыворотку, асцитную жидкость, молоко, растительные экстракты, бактериальные лизаты, дрожжевые лизаты, клеточные лизаты, рекомбинантные клеточные лизаты и кондиционированные клеточные культуральные среды. Используемый в данном документе термин "частично очищенный раствор" может относиться к растворам, включающим, но не ограничиваясь ими, растворы биспецифических антител, которые были подвергнуты по меньшей мере одному хроматографическому процессу, процессу фильтрации, процессу фракционирования, процессу осаждения или другим стандартным способам очистки, известным в данной области, или любой их комбинации. Данное изобретение охватывает комбинацию гидроксиапатитных хроматографических способов, описанных в данном документе, и любого другого хроматографического процесса или процессов, известных в данной области и/или описанных в данном документе, включая, но не ограничиваясь ими, эксклюзионную, аффинную, анионообменную, катионообменную, хроматографию гидрофобных взаимодействий, аффинную хроматографию на иммобилизованном металле и в смешанный режим хроматографии, а также их комбинации.
Гидроксиапатитные хроматографические способы, описанные в данном документе, могут быть объединены с одним или более чем одним аффинным хроматографическим способом, в частности, с использованием аффинной среды, обладающей специфичностью в отношении константного домена антитела, например, включая, но не ограничиваясь ими, Fc-домен антитела и/или κ- или λ-домен легкой цепи антитела (т.е. включают применение Fc-связывающего агента, κ-связывающего агента или λ-связывающего агента, соответственно). Аффинная хроматография для очистки антител (например, биспецифических антител) из различных растворов на основе агентов, связывающих константный домен (например, Fc-связывающих агентов), хорошо известна и стандартно применяется в данной области.
Используемый в данном документе термин "Fc-связывающий агент" и аналогичные термины относятся к молекуле, которая способна связываться с Fc-областью антитела (например, антитела IgG). Неограничивающие примеры стандартных Fc-связывающих агентов, которые могут быть использованы в соответствии со способами согласно данному изобретению, включают белок комплемента, Fc-рецептор, белки бактериального происхождения (такие как белок А и/или белок G) и их комбинации. Как правило, Fc-связывающие агенты связываются с антителами, например, IgG, в СН2/СН3-области тяжелой цепи. В предпочтительных воплощениях данное изобретение направлено на выделение биспецифических антител, содержащих Fc-домен/область, из раствора, содержащего биспецифическое антитело. В более предпочтительных воплощениях данное изобретение направлено на выделение биспецифических антител, содержащих Fc-домен/область, из раствора, содержащего биспецифическое антитело и по меньшей мере один BASB (который обязательно также содержит Fc-домен). Таким образом, в некоторых воплощениях раствор, который контактирует с гидроксиапатитной хроматографической средой в соответствии со способами согласно данному изобретению, содержит объединенные фракции, содержащие биспецифическое антитело и BASB, элюированные из аффинной колонки, содержащей Fc-связывающий агент.
Используемый в данном документе термин "агент, связывающий константный домен легкой цепи антитела" и аналогичные термины относятся к молекуле, которая способна связываться с легкой цепью антитела (например, антителом IgG), в частности, с константной областью легкой цепи антитела, например, с κ-константным доменом/областью легкой цепи или λ-константным доменом/областью легкой цепи. Неограничивающие примеры стандартных агентов, связывающих константный домен легкой цепи антитела, которые могут быть использованы в соответствии со способами данного изобретения, включают белки бактериального происхождения (такие как белок L) и одноцепочечные фрагменты антител, обладающие специфичностью к легкой цепи (например, коммерчески доступные продукты, такие как KappaSelect™ и LambdaFabSelect™ (GE Healthcare, США)), и комбинации таких агентов. Как правило, белок L, κ-связывающие агенты и λ-связывающие агенты связывают антитела, например, IgG, в пределах константной области легкой цепи. В некоторых воплощениях изобретение относится к выделению биспецифических антител, содержащих константный домен/область легкой цепи антитела, из раствора, содержащего биспецифическое антитело. В некоторых воплощениях раствор, который контактирует с гидроксиапатитной хроматографической средой в соответствии со способами согласно данному изобретению, включает объединенные фракции, содержащие биспецифическое антитело, элюированные из аффинной колонки, содержащей агент, связывающий константный домен легкой цепи антитела.
Для большинства очисток для коммерческих применений Fc-связывающий агент и/или агент, связывающий константный домен легкой цепи антитела (например, κ-связывающий агент и/или λ-связывающий агент), иммобилизирован на твердой фазе, чтобы сделать возможной упаковку колонки и/или облегчить выделение молекулы аффинного лиганда-мишени (например, биспецифического антитела и по меньшей мере одного BASB) из нанесенного раствора. Твердая фаза может содержать, например, но не ограничиваясь ими, шарики, агарозную матрицу, силикагель, а также их смесь.
Гидроксиапатитные хроматографические способы согласно данному изобретению могут быть объединены с другими известными способами, известными в данной области и/или описанными в данном документе для очистки белков, пептидов и/или полипептидов (например, антител и биспецифических антител). Способы очистки белков/пептидов/полипептидов, в частности, коммерческие способы очистки, обычно используют схемы очистки, включающие один или более чем один отдельный процесс/этап/способ, такой как фильтрация, осаждение и/или хроматография. Отдельные процессы/этапы/способы также могут называться "технологическими операциями", известными в данной области; соответственно, термины "процесс", "этап", "способ" и "технологическая операция", используемые в данном документе в связи с этапом очистки, например, хроматографическим способом и хроматографической технологической операцией, являются взаимозаменяемыми. Гидроксиапатитные хроматографические способы могут быть объединены с любым способом очистки/технологической операцией, известной в данной области или описанной в данном документе, включая, но не ограничиваясь ими, аффинную хроматографию с помощью белков микробного происхождения (например, аффинную хроматографию с белком А, белком G, белком A/G и/или белком L, как указано), ионообменную хроматографию (например катионообменную, анионообменную и обменную хроматографию смешанного режима), тиофильную адсорбцию (например, с бета-меркаптоэтанолом и другими SH-лигандами), хроматографию гидрофобных взаимодействий или ароматическую адсорбционную хроматографию (например, с бутил-сефарозой, фенил-сефарозой, аза-аренофильными смолами или м-аминофенилбороновой кислотой), металл-хелатную аффинную хроматографию (например, с Ni(II)-, Zn(II)- и Cu(II)-аффинным материалом), эксклюзионную хроматографию и препаративные электрофоретические способы (такие как гель-электрофорез, капиллярный электрофорез) (Vijayalakshmi, М.A., Appl. Biochem. Biotech. 75 (1998) 93-102). Дополнительные неограничивающие примеры этапов очистки или технологических операций, хорошо известных в данной области, включают диализ, хроматографию гидрофобных взаимодействий (hydrophobic interaction chromatography, HIC), гидрофобную хроматографию с индукцией заряда (hydrophobic charge interaction chromatography, HCIC), осаждение сульфатом аммония, анионо- или катионообменную хроматографию, осаждение этанолом; HPLC с обращенной фазой; хроматографию на силикагеле, хроматофокусирование и гель-фильтрацию. Гидроксиапатитные хроматографические способы и/или комбинации с другими способами/технологическими операциями по очистке, известными в данной области или описанными в данном документе, хорошо адаптированы для отделения биспецифического антитела от загрязнителей и/или примесей, включая, но не ограничиваясь ими, нуклеиновые кислоты клетки-хозяина, эндотоксины, вирусы и другие варианты биспецифического антитела, не охваченные явно термином "BASB", используемым в данном документе. Примером варианта биспецифического антитела, который будет рассматриваться как загрязнитель при производстве биспецифического антитела, но который не может быть охвачен термином "BASB", используемым в данном документе, является гомодимер, содержащий пару полипептидов тяжелой цепи/легкой цепи. Такой гомодимер имел бы молекулярную массу и архитектуру, подобную биспецифическому антителу (т.е. архитектуру, похожую на "стандартный" IgG), но все вариабельные домены были бы идентичны. Такие гомодимеры в данном документе называются гомодимерами






Хроматографические способы, описанные в данном документе, хорошо адаптированы для применения в промышленном масштабе. Способы могут быть запущены в виде периодических или непрерывных операций или в полунепрерывном режиме, например, основе постоянного тока раствора, содержащего нужные образцы, пропуская хроматографические технологические операции до тех пор, пока не будет профильтрована целая большая партия (например, с одним или более чем одним возможным этапом промывания, идущим между этапами фильтрации). Таким образом, может быть проведен непрерывный циклический процесс для получения большого выхода нужного продукта в приемлемо чистой форме в течение относительно коротких периодов времени.
Биспецифическое антитело согласно данному изобретению предпочтительно получают с помощью рекомбинантных средств. Стандартные способы рекомбинантной продукции антител, как правило, адаптированы к производству биспецифических антител. Такие стандартные способы хорошо известны в данной области и включают экспрессию белка в прокариотических или эукариотических клетках (см., например, следующие отчеты: Makrides, S.C., Protein Expr. Purif. 17, 183-202 (1999); Geisse, S., et al., Protein Expr. Purif. 8 (1996) 271-282; Kaufman, R.J., Mol. Biotechnol. 16 (2000) 151-160; Werner, R.G., Drug Res. 48 (1998) 870-880). Рекомбинантная продукция биспецифических антител охватывает дополнительные проблемы, которые необходимо решать в связи с производством стандартных антител, в частности, относящиеся к усилению гетеродимеризации двух разных тяжелых цепей и к усилению надлежащего спаривания вариабельного домена тяжелой цепи и вариабельного домена легкой цепи. Тем не менее, успешное производство биспецифических антител, например, усиление формирования надлежащего полипептида, было достигнуто в данной области. Например, было показано, что гетеродимеризация двух разных тяжелых цепей повышается за счет использования методики "ключ в замке" или "KiH". В методике KiH в СН3-домен одной тяжелой цепи вводятся большие аминокислотные боковые цепи, которые подходят для надлежащим образом спроектированных полостей в СН3-области другой тяжелой цепи (см., например, Ridgeway et al., Protein Eng. 9 (1996), 617-621, и Atwell et al., J. Mol. Biol. 270 (1997), 677-681). Таким образом, гетеродимеры тяжелых цепей, как правило, являются более стабильными, чем любой из гомодимеров, и образуют большую долю экспрессируемых полипептидов. Кроме того, объединение нужных пар легкой цепи/тяжелой цепи с образованием нужного Fab-домена можно индуцировать путем модификации одного вариабельного домена (или вариабельного домена-константной области в Fab-домене) биспецифического антитела (Fab-область), чтобы "поменять" константные или константные и вариабельные области между легкой и тяжелой цепями. Таким образом, в модифицированном Fab-домене тяжелая цепь будет содержать, например, домены CL-VH или CL-VL, а легкая цепь будет содержать домены CH1-VL или CH1-VH, соответственно. Это предотвращает взаимодействие легкой/тяжелой цепи модифицированной ветви и легкой/тяжелой цепи стандартной/немодифицированной ветви. Для пояснения, тяжелая цепь в Fab-домене модифицированной ветви, содержащая домен CL, не будет взаимодействовать с доменом CL в легкой цепи стандартной ветви (предотвращая "ненадлежащее" спаривание тяжелой/легкой цепей). Эта методика для предотвращения ассоциации ненадлежащих легкой/тяжелой цепей называется технологией "CrossMab" и, в сочетании с технологией KiH, приводит к значительному повышению экспрессии нужных биспецифических молекул (см., например, Schaefer et al., PNAS 108 (2011), 11187-11192). Альтернативно или дополнительно, одна ветвь антитела может быть модифицирована таким образом, что Fab-домен представляет собой scFab или scFv, оставляя только одну "свободную" легкую цепь в системе. Таким образом, данное изобретение охватывает биспецифические антитела, продуцируемые с помощью любых средств, известных в данной области или описанных в данном документе.
Способы согласно данному изобретению пригодны для выделения любого биспецифического антитела из раствора, содержащего его и по меньшей мере один BASB. Данные биспецифические антитела в соответствии с раскрытыми способами могут представлять собой рекомбинантные иммуноглобулины. Кроме того, биспецифические антитела в соответствии с изобретением могут содержать фрагменты гуманизированных иммуноглобулинов, химерных иммуноглобулинов, человеческих иммуноглобулинов и/или иммуноглобулиновых конъюгатов. Данные биспецифические антитела, выделенные и/или очищенные с помощью способов данного изобретения, могут быть терапевтическими или диагностическими биспецифическими антителами. В одном воплощении биспецифические антитела представляют собой терапевтические биспецифические антитела. Неограничивающие примеры терапевтических биспецифических антител включают биспецифическое антитело, имеющее специфичность по меньшей мере к одному или двум из EGFR, HER3, HER4, IGFR, Ер-САМ, СЕА, TRAIL, TRAIL-рецептора 1, TRAIL-рецептора 2, рецептора лимфотоксина бета, CCR4, CD3, CD19, CD20, CD22, CD28, CD33, CD40, CD80, CSF-1R, CTLA-4, рецептора смерти 5 (DR5), IL-17, белка активации фибробластов (FAP), фолатного рецептора 1 (FolR1), гепсина, латентного мембранного белка 1/2 (LMP 1/2), хондроитинсульфатпротеогликана меланомы (MCSP), простатспецифического мембранного антигена (PSMA), рецептора VEGF 1, рецептора VEGF 2, IGFI-R, TSLP-R, PDGF-R, TIE-I, TIE-2, TNF (TNF-альфа), TNF-подобного слабого индуктора апоптоза (TWEAK), IL-IR, VEGF, EGF, PDGF, HGF, ангиопоэтина 1 и/или 2 (Ang1 и/или Ang2) и опухолевого антигена, описанного в данном документе или известного в данной области (например, рецепторов факторов роста и факторов роста).
При подготовке к контактированию раствора, содержащего биспецифическое антитело и по меньшей мере один BASB, с гидроксиапатитной хроматографической средой, как правило, необходимо уравновесить химический состав среды. Это достигается путем контактирования среды с уравновешивающим буфером для установки соответствующего рН, проводимости и концентрации солей, чтобы обеспечить связывание биспецифического антитела со средой. Уравновешивающий буфер в соответствии с данным изобретением может включать фосфатные соли в концентрации примерно от 1 мМ до 20 мМ, хлоридные соли в концентрации примерно от 10 мМ до 200 мМ и кальциевые соли в концентрации от примерно 0,01 мМ до 0,5 мМ. В некоторых воплощениях уравновешивающий буфер в соответствии со способами согласно данному изобретению содержит фосфатную соль, кальциевую соль и хлоридную соль. Уравновешивающий буфер в соответствии со способом согласно данному изобретению может содержать фосфатную соль в концентрации примерно 10 мМ, кальциевую соль в концентрации примерно 0,1 мМ и хлоридную соль в концентрации примерно 50 мМ. Уравновешивающий буфер в соответствии со способом согласно данному изобретению может содержать NaH2PO4 в концентрации примерно 10 мМ, CaCl2 в концентрации примерно 0,1 мМ и NaCl в концентрации примерно 50 мМ.
Уравновешивающий буфер, возможно, также может включать буферное соединение для осуществления надлежащего контроля рН. Буферные соединения могут включать, но не ограничиваясь ими, MES, HEPES, бицин, имидазол и Tris. В неограничивающем воплощении уравновешивающий буфер в соответствии со способом согласно данному изобретению может содержать фосфатную соль в концентрации примерно 10 мМ, кальциевую соль в концентрации примерно 0,1 мМ и хлоридную соль в концентрации примерно 50 мМ в присутствии MES в концентрации примерно 20 мМ и при рН примерно от 6,5 до 7,5. В связанном или альтернативном неограничивающем воплощении уравновешивающий буфер в соответствии со способом согласно данному изобретению может содержать NaH2PO4 в концентрации примерно 10 мМ, CaCl2 в концентрации примерно 0,1 мМ и NaCl в концентрации примерно 50 мМ в присутствии MES в концентрации примерно 20 мМ и при рН примерно от 6,5 до 7,5.
После уравновешивания гидроксиапатитной среды она может быть введена в контакт с раствором, содержащим биспецифическое антитело и по меньшей мере один BASB. Биспецифическое антитело и по меньшей мере один BASB, как правило, находятся в растворе в таких условиях, которые позволяют им связываться с гидроксиапатитной хроматографической средой. Как известно в данной области, такой раствор может быть назван связывающим буфером. Связывающий буфер может иметь такой же состав, как у уравновешивающего буфера, определено в данном описании, или может отличаться от него. В некоторых воплощениях связывающий буфер выбран в соответствии с критериями, изложенными в данном документе для уравновешивающего буфера. Соответственно, в неограничивающем воплощении связывающий буфер в соответствии со способами согласно данному изобретению является таким же, как уравновешивающий буфер. В неограничивающих воплощениях связывающий буфер может содержать фосфатную соль в концентрации примерно 10 мМ, кальциевую соль в концентрации примерно 0,1 мМ и хлоридную соль в концентрации примерно 50 мМ в присутствии MES в концентрации примерно 20 мМ и при рН примерно от 6,5 до 7,5. В связанном или альтернативном неограничивающем воплощении связывающий буфер в соответствии со способом согласно данному изобретению может содержать NaH2PO4 в концентрации примерно 10 мМ, CaCl2 в концентрации примерно 0,1 мМ и NaCl в концентрации примерно 50 мМ в присутствии MES в концентрации примерно 20 мМ и при рН примерно от 6,5 до 7,5. В одном воплощении, включающем хроматографический способ связывания и элюирования, раствор, содержащий биспецифическое антитело и один или более чем один BASB, проходит через колонку, содержащую гидроксиапатитную среду, и биспецифическое антитело или биспецифическое антитело и один или более чем один BASB связываются с колонкой (т.е. с гидроксиапатитной средой). После раствора, содержащего биспецифическое антитело, может следовать или может не следовать промывочный буфер, обычно того же состава, что и уравновешивающий буфер и/или связывающий буфер. Промывочный буфер, если он используется, может удалить один или более чем один загрязнитель из колонки.
После связывания по меньшей мере биспецифического антитела и возможного промывания биспецифическое антитело элюируют из гидроксиапатитной хроматографической среды в условиях, которые оставляют один или более чем один BASB связанным со средой, и/или в условиях, в которых биспецифическое антитело и один или более чем один BASB элюируются из среды по отдельности. Буфер для элюирования выбирают так, чтобы он имел такой исходный состав, чтобы величина проводимости являлась низкой. Растворы с низкими значениями проводимости, подходящие для раскрытых в данном документе способов, как правило, имеют значения примерно или не более чем примерно 13 мСм/см. Растворы с низкими значениями проводимости, подходящие для раскрытых в данном документе способов, также могут иметь значения проводимости примерно или не более чем примерно 10,6 мСм/см или примерно или не более чем примерно 8,5 мСм/см. Неограничивающие примеры исходного состава элюирующего буфера с низким значением проводимости включают растворы, имеющие концентрацию фосфат-ионов в диапазоне от примерно 1 мМ до примерно 20 мМ, концентрацию кальция в диапазоне от примерно 0,01 мМ до примерно 0,5 мМ и концентрацию хлорида в диапазоне от примерно 10 мМ до примерно 200 мМ в присутствии буферного соединения (определенного в данном документе в связи со связывающим и/или уравновешивающим буфером) при рН от 6,5 до 8,0. Буфер для элюирования в соответствии со способами согласно данному изобретению может иметь исходный состав с концентрацией фосфат-ионов примерно 10 мМ, концентрацией кальция примерно 0,1 мМ и концентрацией хлорида примерно 50 мМ в присутствии буферного соединения (определенного в данном документе в отношении связывающего и/или уравновешивающего буфера) при рН примерно от 6,5 до 7,5. В конкретном воплощении элюирующий буфер в соответствии со способами согласно данному изобретению имеет исходный состав 10 мМ NaH2PO4, 0,1 мМ CaCl2 и 50 мМ NaCl в присутствии 20 мМ MES при рН от 6,5 до 7,5. Способы согласно данному изобретению элюируют биспецифическое антитело из гидроксиапатитной среды исключительно за счет увеличения концентрации хлорид-ионов в элюирующем буфере. Концентрация хлорид-ионов может быть увеличена в соответствии с линейным градиентом, внедренным ступенчатым градиентом (см., например, внедренный ступенчатый градиент увеличения хлорид-ионов, представленный на фиг. 6) или комбинацией этих двух градиентов. Оптимизация градиента для элюирования биспецифического антитела из хроматографической среды и/или для отделения биспецифического антитела от одного или более чем одного BASB (т.е. чтобы элюировать один, а другой оставить связанным со средой) находится в пределах возможностей специалиста в данной области благодаря знаниям, содержащимся в данном документе. Концентрация хлорид-ионов может быть увеличена в элюирующем буфере путем увеличения концентрации одной или более чем одной хлористой соли. Примеры хлористых солей, которые могут быть добавлены к элюирующему буферу для повышения концентрации хлорид-ионов, включают NaCl и KCl. В некоторых воплощениях концентрацию хлорид-ионов в элюирующем буфере повышают путем увеличения концентрации NaCl. В предпочтительных воплощениях исходная концентрация хлорид-ионов в элюирующем буфере составляет примерно 50 мМ (что может быть обеспечено одной или более чем одной хлористой солью) и впоследствии увеличивается в ходе элюирования того биспецифического антитела, которое необходимо элюировать. Специалист в данной области сможет легко определить максимальную концентрацию хлорид-ионов, необходимую для элюирования адсорбированного биспецифического антитела, с помощью стандартных способов, известных в данной области и соответствующих знаниям и способам, описанным в данном документе. В некоторых воплощениях максимальная концентрация хлорид-ионов для элюирования биспецифического антитела и/или отделения биспецифического антитела от одного или более чем одного BASB составляет примерно 200 мМ, примерно 250 мМ, примерно 300 мМ, примерно 350 мМ, примерно 400 мМ или примерно 500 мМ. Иллюстративный элюирующий буфер в соответствии со способами данного изобретения имеет начальный состав примерно 10 мМ NaH2PO4, примерно 50 мМ NaCl, примерно 20 мМ MES и примерно 0,1 мМ CaCl2при рН примерно от 6,5 до 7,5, где концентрация хлорид-ионов впоследствии повышается путем увеличения концентрации NaCl в соответствии с линейным, ступенчатым или линейно-ступенчатым градиентом до примерно 500 мМ в ходе этапа элюирования.
Все патенты и публикации, упомянутые в данном описании, указывают на уровень специалистов в данной области, к которой относится изобретение. Следует понимать, что хотя некоторые формы изобретения проиллюстрированы, они не должны быть ограничены конкретной формой или расположением частей, описанных и показанных в данном документе. Специалисту в данной области будет очевидно, что различные изменения могут быть сделаны без отхода от объема данного изобретения, и данное изобретение не следует рассматривать как ограниченное тем, что показано и описано в данном документе. Для более полного понимания описываемого в данном документе изобретения приведены следующие неограничивающие примеры.
Примеры Общие способы
Экспрессия антител
Антитела временно экспрессировали в клетках HEK293 (Invitrogen). Трансфекцию клеток проводили в соответствии с инструкциями поставщика клеток с использованием препаратов векторов антитела Maxiprep (Qiagen), среды Opti-MEM I (Invitrogen), 293fectin (Invitrogen) и с исходной плотностью клеток 1-2×106 жизнеспособных клеток/мл в бессывороточной экспрессионной среде FreeStyle 293 (Invitrogen). Через 7 дней культивирования в колбах или перемешиваемых биореакторах супернатанты клеточной культуры, содержащие антитело, собирали центрифугированием и фильтровали через стерильный фильтр (0,22 мкм). Супернатанты обрабатывали сразу после сбора или хранили при -80°С до очистки.
Аффинная хроматография на белке А
Молекулы, содержащие Fc-области/домен, очищали из стерильных профильтрованных культуральных супернатантов путем аффинной хроматографии с использованием колонки с сефарозой - белком А (MabSelectSure-Sepharose™ (GE Healthcare, Швеция)). Вкратце, культуральные супернатанты вначале наносили на колонку с белком А, уравновешенную PBS-буфером (10 мМ Na2HPO4, 1 мМ KН2РO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4). Затем колонку промывали уравновешивающим буфером и антитела элюировали 25 мМ цитратом натрия, рН 3,0. Фракции антител объединяли и готовили для гидроксиапатитной хроматографии путем обмена буфера до 10 мМ NaH2PO4, 50 мМ NaCl, 20 мМ MES, 0,1 мМ CaCl2, рН 6,5-7,5 с использованием обессоливающей колонки или экстенсивного диализа.
Гидроксиапатитная хроматография
Гидроксиапатитную хроматографию проводили с помощью гидроксиапатитной смолы MacroPrep СНТ типа II (BioRad, США). После уравновешивания гидроксиапатитной смолы с помощью 10 мМ NaH2PO4, 50 мМ NaCl, 20 мМ MES, 0,1 мМ CaCl2, рН 6,5-7,5, на колонку наносили загрузочную жидкость с антителом, полученную, как описано выше. Затем колонку промывали уравновешивающим буфером и элюировали связанный материал в линейном градиенте или линейном градиенте с внедренными этапами до 10 мМ NaH2PO4, 500 мМ NaCl, 20 мМ MES, 0,1 мМ CaCl2, рН 6,5-7,5. Концентрацию белка в элюате (элюированные фракции) контролировали по поглощению при 280 нм (представлены в виде хроматограмм, как указано в данном документе).
Анализ CE-SDS
Как до, так и после гидроксиапатитной хроматографии загрузочный и/или фракционный состав, включая определение процентной доли биспецифического антитела, фрагментов биспецифического антитела и/или побочного продукта, характерного для биспецифического антитела (включая предполагаемые молекулярные массы), анализировали с помощью капиллярного электрофореза с додецилсульфатом натрия (CE-SDS). CE-SDS проводили в соответствии с инструкциями производителя с использованием микрожидкостной технологии Labchip (PerkinElmer, США). Вкратце, 5 мкл загрузочной жидкости (предгидроксиапатитная хроматография; т.е. элюат (т.е. антитела), элюированный из аффинной колонки с белком А) и элюат из гидроксиапатитной колонки готовили для CE-SDS-анализа с использованием набора реагентов НТ Protein Express Reagent Kit в соответствии с инструкциями производителя и анализировали на системе LabChip GXII с помощью НТ Protein Express Chip. Данные анализировали с использованием программного обеспечения LabChip GX.
Пример 1: Разделение

Способы
Биспецифическое анти-EGFR/анти-IGFR-антитело было разработано в соответствии с CrossMab и методикой "ключ в замке" (KiH), описанной, например, в Schaefer et al., PNAS USA 108 (2011), 11187-11192. Биспецифическое антитело экспрессировали, очищали из культурального супернатанта с помощью аффинной хроматографии на белке А и анализировали с помощью CE-SDS, как описано выше в разделе "Общие способы".
Вслед за аффинной очисткой на белке А раствор, содержащий антитело, загружали на гидроксиапатитную колонку и элюировали в линейном солевом градиенте, как описано выше.
Результаты
Содержащие антитело фракции, элюированные из колонки с белком А, объединяли, получая загрузочную жидкость для гидроксиапатитной хроматографии, и анализировали на состав белков. CE-SDS-анализ показал, что загрузочная жидкость содержала два доминирующих вида белков. Примерно 43% от общего белка составлял белок, имеющий приблизительную молекулярную массу 94 кДа, и примерно 33% составлял белок, имеющий приблизительную молекулярную массу 160 кДа; эти две формы белка были идентифицированы как,

Загрузочную жидкость наносили на гидроксиапатитную колонку и элюировали линейным градиентом соли, который описан выше и представлен наклонной линией на фиг. 2. Фиг. 2 также показывает профиль элюирования из гидроксиапатитной колонки, который контролировали по УФ-поглощению при 280 нм. Формы


Полученные результаты показывают, что способы согласно данному изобретению позволяют отделить биспецифическое антитело по меньшей мере от побочного продукта/примесных

Пример 2: Разделение

Способы
Пример 2 следует методикам из примера 1 со следующими исключениями: биспецифическое антитело представляло собой биспецифическое анти-Ang2/анти-VEGF-антитело, разработанное с использованием методики KiH, но не методики CrossMab. Вместо этого, Ang2-специфический вариабельный домен был разработан как scFab, что предотвратило ненадлежащее спаривание различных вариабельных доменов легкой и тяжелой цепей, описанное в данном документе, например, в разделе "Уровень техники". Кроме того, после захвата на белке А раствор, содержащий антитело, элюировали из гидроксиапатитной колонки с использованием линейного градиента соли с внедренным этапом.
Результаты
CE-SDS-анализ объединенных фракций, содержащих антитело, после аффинной хроматографии на белке А показал, что загрузочная жидкость до гидроксиапатитной хроматографии содержала три доминирующих формы белка: примерно 16% составлял

Загрузочную жидкость наносили на гидроксиапатитную колонку и элюировали линейным градиентом соли с внедренным этапом, представленным ступенчатой и наклонной линией на фиг. 6. Фиг. 6 также показывает профиль элюирования из гидроксиапатитной колонки, контролируемый с помощью УФ-поглощения при 280 нм. Формы


Полученные результаты показывают, что способы согласно данному изобретению позволяют провести отделение биспецифического антитела по меньшей мере от побочного продукта/примесных

Пример 3: Разделение 3/4 фрагмента антитела и биспецифического CrossMab Ang2-VEGF
Способы
Повторяли пример 2, но с биспецифическим Ang2-VEGF-антителом, сконструированным согласно методике CrossMab. Опять же, после захвата на белке А раствор, содержащий антитело, элюировали из гидроксиапатитной колонки с использованием линейного градиента соли.
Результаты
CE-SDS-анализ объединенных фракций, содержащих антитело, после аффинной хроматографии на белке А показал, что загрузочная жидкость перед гидроксиапатитной хроматографией содержала примерно 7,8%

Загрузочную жидкость наносили на гидроксиапатитную колонку и элюировали линейным градиентом соли, представленным наклонной линией на фиг. 9.



Пример 4: Разделение

Способы
Пример 4 следует методике примера 2 со следующими исключениями: биспецифическое антитело представляло собой биспецифическое анти-EGFR/анти-IGFR-антитело. Как и в примере 2, биспецифическое антитело было разработано с использованием методики KiH, но не CrossMab, где IGFR-антигенсвязывающий домен представлял собой scFab. Фракции, содержащие антитело, элюировали из гидроксиапатитной колонки с использованием линейного градиента соли с внедренным этапом.
Результаты
CE-SDS-анализ объединенных фракций, содержащих антитело, после аффинной хроматографии на белке А показал, что загрузочная жидкость перед гидроксиапатитной хроматографией содержала три доминирующих формы белка, параллельно с тем, что наблюдалось в примере 2: примерно 25% составлял

Загрузочную жидкость наносили на гидроксиапатитную колонку и элюировали линейным градиентом соли с внедренным этапом, представленным ступенчатой и наклонной линией на фиг. 11. Формы



Пример 5: Разделение 5/4 антитела и биспецифического scFab TWEAK-IL17
Способы
Пример 5 следует методике примеров 2 и 3 со следующими исключениями: биспецифическое антитело представляло собой биспецифическое анти-TWEAK/анти-IL17-антитело. Как и в примерах 2 и 3, биспецифическое антитело было разработано с использованием методики KiH, но не CrossMab, где TWEAK-антигенсвязывающий домен представлял собой scFab. Фракции, содержащие антитело, элюировали с гидроксиапатитной колонки с использованием линейного градиента соли с внедренным этапом.
Результаты
CE-SDS-анализ объединенных фракций, содержащих антитело, после аффинной хроматографии на белке А показал, что загрузочная жидкость перед гидроксиапатитной хроматографией содержала две доминирующих формы белка: примерно 17% составляли 5/4 формы антитела (вероятно, содержащие дополнительную легкую цепь IL17), в то время как примерно 68% составляла фракция, имеющая кажущуюся молекулярную массу нужного биспецифического антитела (фиг. 13). Последующий анализ показал, что фракция, содержащая белок, имеющий кажущуюся молекулярную массу биспецифического белка, представляла собой смесь биспецифического белка и гомодимера пары тяжелой цепи/легкой цепи анти-IL17, т.е. эквивалента моноспецифического или "стандартного" анти-IL17-антитела (данные не представлены; подтверждено с помощью CE-SDS, проведенного в восстанавливающих условиях).
Загрузочную жидкость наносили на гидроксиапатитную колонку и элюировали линейным градиентом соли с внедренным этапом, представленным ступенчатой и наклонной линией на фиг. 14. Биспецифическое антитело и гомодимер совместно элюировались в виде единственного пика при более низкой концентрации соли (см. первый пик, фиг. 14 и фиг. 15). 5/4 антитела элюировали отдельно при более высокой концентрации соли (см. третий пик на фиг. 14; четвертый пик представляет собой агрегаты белка). Было определено, что объединенные фракции из первого пика элюирования содержат только биспецифическое антитело и гомодимер, без видимого загрязнения высокомолекулярными формами, например, 5/4 антитела (фиг. 15). Аналогичным образом, объединенные фракции пика элюирования, относящиеся к 5/4 антитела, показали, что эти формы элюировались без заметного загрязнения биспецифическим антителом или гомодимером (фиг. 16). Таким образом, линейный и ступенчатый градиент соли делает возможным быстрое отделение и очистку биспецифического антитела по меньшей мере от 5/4 антител и/или побочных продуктов, имеющих только минимальное превышение молекулярной массы по сравнению с молекулой, представляющей интерес.
Пример 6: Разделение гомодимера и биспецифического scFab TWEAK-IL17
Способы
Пример 5 показал, что гидроксиапатитная хроматография в соответствии со способами согласно данному изобретению была способна отделить биспецифическое антитело от примесных 5/4 антител; тем не менее, биспецифическое антитело совместно элюировалось с гомодимером спаренных тяжелой/легкой анти-IL17-цепей (т.е. с эквивалентом "стандартного" или моноспецифического анти-IL17-антитела). Разделение гомодимера и биспецифического антитела исследовали с использованием катионообменной хроматографии PorosHS50 с использованием линейного градиента соли.
Результаты
Как сообщалось для примера 5, загрузочная жидкость из производства биспецифического scFab TWEAK-IL17 с последующей аффинной хроматографией на белке А содержала три формы белка: биспецифическое антитело, анти-IL17-гомодимер и 5/4 антитела. Загрузочную жидкость подвергали катионообменной хроматографии и элюировали с использованием линейного градиента соли, как показано на фиг. 17. Белок из загрузочной жидкости элюировался в виде двух пиков (фиг. 17). CE-SDS-анализ объединенных фракций первого пика показал, что они содержали биспецифическое антитело и формы 5/4 антител (см. пример 5 и фиг. 18 (CE-SDS в невосстанавливающих условиях)). CE-SDS-анализ объединенных фракций второго пика показал, что они содержали исключительно IL-17-гомодимер (см. фиг. 19, CE-SDS в восстанавливающих условиях). Таким образом, применение катионообменной колонки позволяло легко отделить биспецифическое антитело и/или примесные формы 5/4 антител от гомодимерных молекул. Пример 5 показывает, что совместно элюированные биспецифическое антитело и примесные 5/4 антитела затем могут быть легко отделены с помощью гидроксиапатитной хроматографии, описанной в данном документе. Различия в результатах примеров 5 и 6 дают дополнительные свидетельства того, что гидроксиапатитные хроматографические способы, описанные в данном документе, предоставляют уникальный хроматографический инструмент, отличный от предыдущих способов, известных в данной области, например, ионообменной хроматографии. Соответственно, применение гидроксиапатитной хроматографии, описанной в данном документе, возможно, в сочетании с другими хроматографическими способами, позволяет отделить биспецифические антитела от побочных продуктов, характерных для продукции биспецифических антител.
Реферат
Данное изобретение относится к способам, включающим применение гидроксиапатитной хроматографии для выделения биспецифического антитела из раствора, который также содержит один или более чем один побочный продукт, характерный для производства биспецифических антител. Побочные продукты, характерные для производства биспецифических антител (bispecific antibody specific byproducts - BASB), включают фрагменты биспецифического антитела и варианты антитела с большей молекулярной массой, где указанный фрагмент и/или вариант содержит Fc-домен, но не проявляет аффинности к двум различным эпитопам и/или антигенам, к которым проявляет аффинность нужное биспецифическое антитело. Таким образом, способы согласно данному изобретению включают отделение биспецифического антитела от одного или более чем одного из его BASB. Гидроксиапатитные хроматографические способы согласно данному изобретению могут быть использованы по отдельности или также могут быть объединены со стандартными процессами очистки и технологическими операциями, известными в данной области, для достижения какого-либо уровня чистоты биспецифического антитела, необходимого, например, для терапевтических и/или диагностических применений. 11 з.п. ф-лы, 19 ил., 6 пр.

Комментарии