Система и способ определения места расположения и идентификации функциональных нервов, иннервирующих стенку артерий, и катетеры для них - RU2638438C2
Код документа: RU2638438C2
Чертежи























Описание
[0001] Заявка испрашивает преимущество по заявке на патент США 61/609,565, поданной 12 марта 2012 г., и заявке на патент США 61/527,893, поданной 26 августа 2011 г. Содержание предыдущих заявок включены в данное описание во всей своей полноте посредством ссылки. В данной заявке приводятся ссылки на различные публикации. Раскрытие этих публикаций во всей своей полноте включено в данное описание путем ссылки с тем, чтобы более полно описать положение дел в области техники, к которой относится данное изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к системе и способу точного определения места расположения и идентификации областей, иннервированных нервами, относящимися к симпатической и парасимпатической нервным системам, на стенке артерии во время и после обработки с подачей энергии. Это изобретение также относится к катетерным системам, предназначенным специально для использования при картировании почечных нервов и их абляции.
УРОВЕНЬ ТЕХНИКИ
[0003] Возникновение хронической сердечной недостаточности, гипертензии, диабета и хронической почечной недостаточности имеет много различных причин; однако все они имеют общий механизм развития, приводящий к терминальным стадиям заболеваний. Общим механизмом их развития является гиперактивность почечных симпатических нервов. Почечные симпатические нервы служат проводящими путями для подачи сигналов к высшим симпатическим центрам, расположенным в спинном и головном мозге, вследствие афферентной активности почечных нервов, с увеличением тонуса симпатической системы; при этом, вследствие эфферентной активности, почечные нервы и артерии принимают участие в симпатической гиперактивности в ответ на сигналы от головного мозга, что приводит к еще большему увеличению тонуса симпатической системы (ДиБона и Копп (DiBona and Корр), 1977). Первоначально симпатическая активность может иметь положительный эффект, но со временем она имеет отрицательный эффект. В состоянии симпатической гиперактивности могут возникать различные патологические явления: аномалии гормональной секреции, такие как повышенные уровни катехоламина, ренина и ангиотензина II, повышенное давление крови вследствие сужения периферических сосудов и/или удержания воды и натрия, почечная недостаточность вследствие нарушения клубочковой фильтрации и потери нефронов, сердечная дисфункция и сердечная недостаточность вследствие гипертрофии левого желудочка и потери миоцитов, инсульт и даже диабет. Следовательно, модуляция (сокращение/устранение) этой повышенной симпатической активности может замедлить или предотвратить развитие указанных заболеваний. В последнее время денервация почечных нервов с использованием радиочастот стала признанным способом лечения лекарственно устойчивой гипертензии (Эслер и др. (Esler et al.), 2010 и Крум и др. (Krum et al.), 2009) и аномалии метаболизма глюкозы (Мафо (Mahfoud), 2011). Однако некоторые методики, при которых проводят абляцию почечных нервов или их денервацию, либо являются неразвитыми, либо выполняются таким образом, что врачу-специалисту приходится работать, не зная достаточно точно место расположения почечных нервов, ответственных за развитие и проявление заболевания. Настоящее изобретение направлено на устранение некоторых из этих недостатков.
Гиперактивность почечных симпатических нервов и гипертензия
[0004] Было произведено систематическое исследование участия гиперактивности почечных симпатических нервов в развитии и закреплении гипертензии. Эта связь была выявлена в значительной степени благодаря тому факту, что несмотря на наличие различных фармацевтических препаратов и их сочетаний, а также возможностей для корректировки образа жизни пациентов, скорость лечения гипертензии осталась удивительно невысокой. В частности, примерно 1/3 пациентов, страдающих гипертензией, не поддается в полной мере даже оптимизированному лекарственному лечению, и диапазон измеренного давления крови для этой группы остается ненормальным. Это проявление называется лекарственно устойчивой гипертензией. Примерно у половины пациентов, страдающих гипертензией, давление крови остается выше, чем приемлемые целевые уровни лечения. Для таких пациентов с "эссенциальной" гипертензией (гипертонией) (т.е. устойчивым и патологически высоким давлением крови, для которого не может быть найдено определенной причины) было высказано предположение о существовании лежащих в ее основе патофизиологий, которые не восприимчивы к существующим схемам лечения. Кроме того, для таких пациентов было отмечено, что выход (outflow) эфферентных симпатических почечных нервов стимулирует выделение ренина, повышение канальцевой реабсорбции натрия и замедляет почечный кровоток, а сигналы афферентных нервов от почки изменяют выход центральной симпатической системы и, таким образом, способствуют регулированию натриевого и водного метаболизма, тонуса/сопротивления сосудов и давления крови.
[0005] Различные данные подтвердили положительное влияние блокирования почечных нервов на уменьшение гипертензии; данные также подтвердили связь между повышенной активностью симпатической нервной системы и гипертензией. В частности, исследования показали, что почечная дисфункция является механизмом повышенной активности симпатической нервной системы, приводящим к гипертензии (Кампезе (Campese), 2002; Ие (Ye), 2002), что блокирование активности почечных нервов приводит к контролированию гипертензии у животных с хронической почечной недостаточностью (Кампезе (Campese), 1995), и что хирургическая почечная денервация, выполняемая для устранения трудноизлечимой боли у пациентов с поликистозом почек также приводит к устранению гипертензии (Валенте (Valente) 2001). Дополнительными исследованиями было установлено, что поступление (spillover) норадреналина в почечную вену является причиной идиопатической гипертензии (Эслер и др. (Esler et al.), 1990), и было показано, что денервация посредством нефрэктомии приводит к устранению гипертензии у пациентов, находящихся на диализе, с резистенцией на лечение гипертензии несколькими лекарственными средствами (Конверсе (Converse) 1992). Почечная денервация также показала замедление или предотвращение развития многих форм гипертензии у экспериментальных животных (например, спонтанной гипертензии крыс (SHR), спонтанной гипертензии крыс, склонных к удару, спонтанной гипертензии новозеландских крыс, пограничной гипертензии крыс (BHR), синдрома Голдблатта 1К, 1С (крыса), синдрома Голдблатта 2К, 2С (крыса), коарктации аорты (собаки), рассечения в области аортального нерва (крыса), гипертензии дезоксикортикостерон-ацетатнатрий хлор (DOCA-NaCL) (крыса, свинья), Ангиотензин II (крыса, кролик), жирное кормление - ожирение (собака), почечное обертывание (renal wrap) (крыса)) (ДиБона и Копп (Dibona and Корр), 1997).
Гиперактивность почечных симпатических нервов, чувствительность к инсулину и метаболизм глюкозы
[0006] Также считается, что гиперактивность почечных нервов влияет на чувствительность к инсулину и метаболизм глюкозы. В частности, увеличение высвобождения норадреналина, сопровождающее гиперактивность почечных нервов, приводит к уменьшению кровотока, что, в свою очередь, связано со снижением потребления глюкозы. Это указывает на нарушение способности клеток перемещать глюкозу через свои мембраны. Гиперактивность почечных нервов связана с обусловленным неврально уменьшением количества открытых капилляров, поэтому инсулин должен пройти большее расстояние, чтобы достичь клеточной мембраны из внутрисосудистого пространства. В инсулинрезистентных состояниях обусловленное инсулином увеличение мышечной перфузии уменьшается примерно на 30%. Соответственно существует прямая связь между активностью симпатических нервов мышц и резистентностью к инсулину и обратная связь между резистентностью к инсулину и количеством открытых капилляров. (Мафо и др. (Mahfoud et al.), 2011). Гиперактивность почечных симпатических нервов таким образом связана с определенными аспектами сахарного диабета и/или метаболическим синдромом; симпатическая гиперактивность вызывает резистентность к инсулину и гиперинсулинемию, которая, в свою очередь, вызывает дополнительную симпатическую активность. Были проведены исследования с целью оценки влияния почечной денервации на диабетические критерии.
[0007] В исследовании Мафо и др. (Mahfoud et al.) (2011) рассмотрено влияние почечной денервации на пациентов со вторым типом сахарного диабета, а также имеющих верхние давление крови не менее 160 мм рт.ст. (или не менее 150 мм рт.ст. для пациентов со вторым типом сахарного диабета) несмотря на их лечение по меньшей мере тремя антигипертензическими препаратами (в том числе одним диуретиком). На исходном уровне и при последующих визитах, имевших место через один (1) и три (3) месяца после проведенной операции, был измерен химический состав крови и проведены анализы уровня глюкозы в крови натощак, инсулина, С-пептида и HbAlc, а теста на переносимость глюкозы (oral glucose tolerance test, OGTT) был проведен на исходном уровне и после трех месяцев. Через три месяца после денервации диабетические показатели существенно улучшились. После почечной денервации значительно увеличилась чувствительность к инсулину. После операции семь из двадцати пяти пациентов показали улучшения при тесте на переносимость глюкозы (OGTT). В исследовании Мафо и др. (Mahfoud et al.), таким образом, было доказательно продемонстрировано, что симпатическая нервная система почек является важным регулятором инсулинорезистентности и абляция почечных нервов по существу улучшает чувствительность к инсулину и метаболизм глюкозы. До появления противогипертензической терапии в 1950-х годах для лечения тяжелой гипертензии у людей применялась хирургическая симпатэктомия (Смитвик и Томпсон (Smithwick and Thompson), 1953). Однако такая хирургическая почечная денервация характеризовалась крайней инвазивностью и требовала проведения большой хирургической операции, поэтому в клинической практике она использовалась с большими ограничениями (DiBona, 2003).
[0008] В последнее время для создания селективной денервации в человеческой почке предпочтительно применяются эндоваскулярные катетерные технологии. Почечные нервы находятся прежде всего снаружи среды оболочки сосудов, внутри адвентициального пространства почечной артерии. Следовательно, радиочастотная энергия, лазерная энергия, сфокусированный ультразвук высокой интенсивности и алкоголь могут быть поданы к стенкам почечной артерии, а также для абляции симпатических почечных нервов через полости почечной артерии может быть проведена криоабляция на стенках почечной артерии. Первое исследование абляции почечных нервов у людей посредством катетерных методик было проведено на подвергаемых испытанию гипертониках в 2009 году. Под наблюдением находились пациенты, у которых давление крови в положении стоя (SBP) составляло более 160 мм рт.ст. или было равно 160 мм рт.ст. несмотря на лечение этих пациентов более чем тремя антигипертензическими препаратами (в том числе диуретиками), или которые имели подтвержденную непереносимость антигипертензических препаратов (Крум и др. (Krum et al.), 2009). В этом исследовании сорока пяти (45) пациентов их общий исходный уровень давления крови составил в целом 177/101±20/15 мм рт.ст.
[0009] Для оценивания эффективности проведенной почечной денервации, после абляции почечных нервов было проведено измерение поступления норадреналина в почечную систему для определения успешности симпатической денервации. Давление крови было измерено на исходном уровне и через 1 месяц, 3 месяца, 6 месяцев, 9 месяцев и 12 месяцев после проведенной операции. В каждый момент времени регистрировалось понижение как систолического, так и диастолического давления с понижением, продолжавшимся с течением времени. После операций общее уменьшение поступления норадреналина во всем теле на 28% (р=0,043) было зарегистрировано у 45 испытуемых, для которых примерно одна треть результатов была отнесена к симпатической почечной денервации.
Текущие протоколы при почечной денервации
[0010] Согласно работе Крума и др. (Krum et al.) были созданы определенные общепринятые методики для выполнения абляции почечных нервов с помощью катетерных средств, хотя эти методики имеют некоторые разновидности. Обычно абляция почечных нервов включает использование способов на основе катетеров, при которых пациента в течение четырех (4), шести (6) минут через почечную артерию подвергают воздействию радиочастотного излучения (RF), генерируемого радиочастотным (RF) генератором, который автоматизирован, имеет низкое энергопотребление и встроенные алгоритмы обеспечения безопасности. Радиочастотные сигналы, как правило 5-8 Вт, подают катетером в почечную артерию посредством дистального перемещения катетера к аорте и проксимально к аорте с подачей радиочастотных сигналов с пространственным приращением 5 мм или более.
[0011] В указанной выше работе Мафо и др. (Mahfoud et al.) по исследованию диабета был применен следующий конкретный протокол абляции: лечебный катетер был введен в каждую почечную артерию с применением почечного катетера с двумя искривлениями или левой внутренней грудной артерии для направляющего катетера для левой внутренней грудной артерии; были выполнены радиочастотные абляции длительностью до 2 минут каждая при низкой мощности 8 Вт для выполнения до 6 абляций с разделением в продольном направлении и в направлении вращения в каждой почечной артерии. Лечебное воздействие было осуществлено от первого дистального разветвления главной почечной артерии до входного отверстия в канал. Постоянно отслеживались полное сопротивление кончика катетера и температура, и регулировалась подача радиочастотной энергии согласно определенному алгоритму.
[0012] С функциональной точки зрения задача абляции почечных артерий состоит в выборочной блокировке симпатических (афферентных и эфферентных) почечных нервов без ухудшения прохождения симпатических сигналов к другим органам, и точной подаче энергии к тем местам, в которых распределены почечные симпатические нервы, в целях их денервации. В настоящее время абляцию почечных нервов выполняют "слепым" образом, т.е. перед радиочастотной абляцией врач, выполняющий операцию, не знает место распределения почечных симпатических нервов, поэтому почечная артерия подвергается абляции по всей своей длине; кроме этого, факт того, были почечные нервы действительно подвергнуты абляции или нет, может быть подтвержден только посредством измерения побочного эффекта - то есть выделения или поступления норадреналина (norepinephrine spillover) после завершения операции. В настоящее время, примерно 89% пациентов показывают реагирование на лечение почечной денервацией в небольшой и тщательно выбранной группе пациентов (Крум и др. (Krum et al.), 2009 и Эслер и др. (Esler et al.) 2010). Однако последние данные показали, что уровень реагирования на лечение также может быть менее 50% среди пациентов, подвергнутых этому лечению (Medical devices, стр. 1-2, 22 февраля 2012 года). В некоторых случаях неудачное лечение может быть следствием регенерации почечных нервов (Эслер и др. (Esler et al.), Lancet 2010, с. 1908), в других случаях неудачное лечение может быть следствием неправильного выбора цели и достаточно полной абляции почечных нервов. В связи с этим существует настоятельная необходимость в способах точного определения места распределения почечных нервов вдоль почечных артерий с тем, чтобы предоставить специалисту возможность получения информации о целевых участках, для отслеживания клинически значимых показателей (таких как давление крови, частота сердечных сокращений и активность симпатических нервов мышц), чтобы оценивать эффективность применения абляции. Как рассмотрено выше, система афферентных и эфферентных почечных нервов служит в качестве общего механизма развития симпатической гиперактивности, поэтому стимуляция почечных нервов может вызывать повышение давления крови и изменение частоты сердечных сокращений. Изменения частоты сердечных сокращений могут представлять собой либо повышение вследствие прямой стимуляции симпатических нервов или понижение давления крови вследствие косвенного регулирования рефлекса посредством барорефлекса.
[0013] Усовершенствованная методика могла бы включать в себя картирование почечных нервов, которое достигается посредством стимуляции отдельных сегментов почечной артерии электрическим током низкой мощности, с одновременным измерением давления крови, частоты сердечных сокращений и активности симпатических нервов мышц. При обнаружении измеряемых изменений давления крови, частоты сердечных сокращений и активности симпатических нервов мышц, таких как повышение давления крови или изменения частоты сердечных сокращений или понижение активности симпатических нервов мышц, можно обоснованно предположить необходимость проведения абляции на этом участке, с тем чтобы разрушить нервные волокна более точным способом и, соответственно, улучшить необходимые клинические показатели. Эти усовершенствованные методики картирования и катетеризации почечных нервов нацелены на минимизирование ненужной абляции при описанном типе операций денервации, задание направления для специалистов, выполняющих почечную абляцию, и улучшение клинических показателей абляции почечных нервов при лечении гипертензии, сердечной недостаточности, почечной недостаточности и диабета.
Анатомическое картирование и определение целевых участков при абляции почечных нервов
[0014] С анатомической точки зрения нервы, имеющие волокна, проходящие к почке или от нее, начинаются от чревного сплетения (также называемого солнечным сплетением) и его узлов, поясничных спланхнических нервов и брыжеечного сплетения (ДиБона и Копп (DiBona and Корр), 1997, с. 79). Чревное сплетение состоит из надпочечного ганглия (т.е. почечно-аортального ганглия), чревного ганглия и крупных спланхнических нервов. Чревный ганглий получает свои составляющие от грудного отдела симпатического ствола (грудных висцеральных нервов) и блуждающих нервов (ДиБона и Копп (Dibona and Корр), 1997, с. 79).
[0015] От надпочечного ганглия отходит множество ответвлений в направлении надпочечника, некоторые из которых проходят вдоль надпочечниковой артерии к периваскулярным нервным пучкам вокруг почечной артерии, входящей в почечные ворота; другие ответвления входят в почку за пределами области почечных ворот. Крупные спланхнические нервы на пути к чревной ганглии имеют ответвления в почку в точке над надпочечной ганглией. Чревный ганглий имеет ответвления в почку, которые проходят в периваскулярные нервные пучки вокруг почечной артерии, входящей в почечные ворота (ДиБона и Копп (Dibona and Корр), 1997, с. 79).
[0016] Поясничные и грудные спланхнические нервы берут свое начало из грудного и поясничного отделов паравертебрального симпатического ствола соответственно. Они обеспечивают почечную иннервацию через ответвления, которые проходят к чревной ганглии, а также через ответвления, которые проходят к периваскулярным нервным пучкам вокруг почечной артерии, входящей в почечные ворота. (ДиБона и Копп (Dibona and Корр), 1997, с. 79).
[0017] Брыжеечное сплетение, содержащее верхний брыжеечный ганглий, получает свои составляющие от поясничных висцеральных нервов и имеет ответвления, которые часто сопровождают артерии яичников или яичек до достижения почки (ДиБона и Копп (Dibona and Корр), 1997, с. 79). Почечные нервы входят в воротную область почки вместе с почечной артерией и веной (ДиБона и Копп (Dibona and Корр), 1997, с. 81). Затем они распределяются вдоль сосудистых сегментов почечных артерий в почечной коре и внешнем мозговом веществе, включая интерлобарные, дуговые и междольковые артерии и афферентные и эфферентные клубочковые артерии (ДиБона и Копп (Dibona and Корр), 1997, с. 81).
[0018] Несмотря на то, что перед возможным проведением абляции очень важно учитывать архитектуру почечных нервов, индивидуальные особенности почечной архитектуры должны тщательно учитываться перед принятием решения по катетеризации для денервации. Как отмечено в отношении работ Крума и др. (Krum et al.) и Эслера и др. (Esler et al.), возможность катетеризации определялась отчасти оценкой анатомии почечной артерии, стеноза почечной артерии, предыдущих почечных стентирования или ангиопластики и сдвоенных почечных артерий. Не только аномальная или необычная почечная архитектура усложняет проведение катетеризации, но и нормальные изменения почечной архитектуры могут оказаться проблематичными особенно в случае применения нештатной катетерной системы (т.е. катетера, не предназначенного по своей конструкции для абляции почечной артерии). Катетеризация почки катетерными системами, не приспособленными специально для этого, может привести к разрыву почечных артерий вследствие грубого или неровного воздействия кончиков такого катетера через нежные ткани, разрыву и/или повреждению стенки артерии или эндотелия почечной артерии вследствие подачи слишком большой энергии абляции и рассечения этой артерии. Поэтому существует потребность в катетерных системах, разработанных специально для почечной архитектуры и типичных отклонений ее архитектуры, чтобы обеспечивать возможность лечения широкого спектра резистентных пациентов.
Катетерные системы
[0019] Некоторые катетерные системы, разработанные для коронарных артериальных систем, сходны с катетерными системами, которые могут применяться для абляции почечных нервов; в частности, абляционные катетерные системы, разработанные для использования в коронарной артерии, специально предназначенные для лечения тахикардии, могут применяться для операций по абляции почечных нервов. Как таковые, эти системы обычно содержат электроды, которые разработаны для оценивания электричества уже существующего в сердечных тканях, через которые проходят катетерные электроды. В отличие от этого, идеальные катетерные системы для почечной денервации следует выполнить с возможностью реализации двух функций: картирования распределения почечных нервов и стимуляции активности почечных нервов посредством обеспечения электрической стимуляции, так чтобы врач, проводящий процедуру, мог иметь доступ в режиме реального времени к информации о физиологических изменениях, происходящих у пациента в результате указанной электрической стимуляции и почечной денервации. Однако ранее такие катетеры не были разработаны.
[0020] Известные катетерные системы часто выполнены с возможностью реализации многофункциональности при кардиологическом применении. Некоторые известные на рынке катетерные системы включают следующие:
Катетерная система Ardian Symplicity®
[0021] В настоящее время известна катетерная система Symplicity®, специально разработанная компанией Ardian (Mountain View, СА, США), которая применяется для почечной абляции и содержит абляционный катетер и радиочастотный генератор. Однако катетер Symplicity® не обладает функциями картирования, и абляция является его единственной функцией; и во-вторых, такие катетерные системы (так же как устройства для ангиопластики и защитные устройства для дистальной ангиопластики) были разработаны для коронарных и сонных артериальных систем - и поэтому, применение этих систем для абляции почечных нервов и их денервации для лечения гипертензии, сердечной недостаточности, почечной недостаточности и диабета будет являться "нештатным".
[0022] Тот факт, что в некоторых случаях гипертензия не поддается лечению только фармакологическими средствами, вновь привлек интерес к инвазивным методам лечения таких случаев. В течение долгого времени в прошлом хирургическая почечная денервация была очень популярна для лечения тяжелой гипертензии до перорального приема антигипертензических препаратов (Смитвик и Томпсон (Smithwick and Thompson), 1953). Такая общепринятая операция была, однако, исключительно инвазивной и подразумевала обширное хирургическое вмешательство, что значительно ограничивало ее применение на практике (ДиБона (DiBona, 2003). По меньшей мере два клинических исследования в некоторой степени обосновывают применение малоинвазивной радиочастотной (RF) абляции почечных нервов с помощью катетера при лечении устойчивой гипертензии (Крум и др. (Krum et al.), 2009; Эслер и др. (Esler et al.), 2009). Для этих исследований были отобраны пациенты с гипертензией, устойчивой к известным антигипертензическим препаратам, и эта хирургическая операция продемонстрировала свою успешность по снижению давления крови в 89% случаев в небольшой и тщательно выбранной группе пациентов.
[0023] Хотя интерес к применению таких малоинвазивных методов вмешательства для лечения гипертензии растет, все имеющиеся на рынке системы, включая катетерную систему Ardian Symplicity®, не обладают оптимальной конструкцией для решения указанной задачи. Даже в катетерной системе Ardian Symplicity® имеются очевидные недостатки, которые ограничивают уверенность в успешном результате такого вмешательства.
[0024] Существенным аспектом, который не учитывается в существующих интервенционных системах, является точность определения мест расположения и подачи эффективной дозы энергии к подходящей зоне абляции в стенке артерии. Существующие общепринятые процедуры выполнения абляции почечных нервов через катетеры обычно включают в себя этапы проведения в стенке артерии от 4 до 6 абляций, каждая из которых выполняется подачей радиочастотной энергии по 2 минуты, при этом катетеры размещают на расстоянии друг от друга в продольном направлении и в направлении вращения вдоль внутренней стенки каждой почечной артерии. Абляции по этой спиральной схеме должны быть проведены "вслепую", так как точное место расположения нервов, иннервирующих почечную артерию, относительно абляционного катетера остается неизвестным перед подачей энергии абляции и во время нее. Неточно направленная доза энергии не только вызывает ненужные повреждения здоровых тканей и несимпатических нервов, но, что более важно, не может обеспечить необходимое решение проблемы гипертензии, для которой предназначена указанная интервенционная операция. На самом деле, в определенных клинических условиях, отличающихся от условий, приведенных в двух указанных опубликованных работах, уровень успешности существующего "слепого" типа интервенционного вмешательства может снизиться до 50% (Medical devices, стр. 1-2, 22 февраля 2012 года).
[0025] Теоретически точная абляция нервов в стенке артерии может быть достигнута посредством картирования места расположения нервов, иннервирующих стенку артерии перед подачей дозы энергии. Путем отслеживания физиологических параметров, связанных с автономными нервными системами, таких как давление крови, частота сердечных сокращений и мышечная активность, при подаче стимулирующего раздражителя в выбранное место на стенке артерии, наличие автономных нервов в непосредственной близости от этого места отразится на изменении отслеживаемых физиологических параметров (Вонг (Wang), US 2011/0306851 A1).
[0026] Кроме того, симпатические и парасимпатические нервы автономной нервной системы часто вызывают в человеческом теле противоположные эффекты, включая их управление давлением крови и частотой сердечных сокращений. Хотя абляции симпатических нервов, иннервирующих стенки артерии, облегчат гипертензию, существует равная вероятность того, что другие ткани, такие как парасимпатические нервы, подвергаются абляции при интервенционном вмешательстве "слепого" типа. В результате уменьшения или устранения активности нервов вслепую гипертензия может ухудшиться, что можно заключить на основании нескольких исследований, проведенных на животных (Уеда и др. (Ueda et al.), 1967; Бичам и Кунце (Beacham and Kunze), 1969; Аарс и Акре (Aars and Акте), 1970; Ma и Хо (Ma and Но), 1990; Лю и др. (Lu et al.), 1995).
[0027] Причина неудачи текущего метода лечения была вызвана регенерацией нервов после абляции (Эслер и др. (Esler et al.), 2010), а также могла относиться к неспособности подать дозу энергии к целевому нерву и к дозе поданной энергии, недостаточной для эффективной абляции. В настоящее время успешность почечной денервации оценивается только измерением побочного эффекта, известного как поступление норадреналина (norepinephrine spillover), по меньшей мере через несколько дней после проведенного интервенционного вмешательства (Крум и др. (Krum et al.), 2009) при отсутствии способа немедленной послеоперационной оценки. Для увеличения количества успешных интервенционных операций важно не только определить место расположения подходящей зоны абляции на стенке артерии, но и обеспечить точность подачи энергии к целевому нерву во время процесса абляции и подтвердить непосредственно после абляции, что количество поданной энергии привело к эффективной абляции целевого нерва.
[0028] Учитывая недостатки существующих системы и способов абляции нервов, в настоящем изобретении представлены усовершенствованные системы и способы точного определения места подходящих зон абляции на стенке почечной артерии с обеспечением точного направления энергии абляции в достаточном количестве в целевой нерв и проведением немедленной послеоперационной оценки абляции нервов. Данное изобретение раскрывает также катетерную систему, оптимально приспособленную для картирования почечных нервов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
[0029] Настоящее изобретение было разработано с учетом устранения указанных выше проблем. Варианты реализации изобретения относятся к системе и способу точного определения места областей, иннервированных нервами на стенке артерии с обеспечением точного направления энергии в достаточном количестве в целевой нерв для получения необходимой реакции, такой как стимуляция и абляция, и проведением немедленной послеоперационной оценки достаточности абляции нервов. Кроме того, варианты реализации изобретения также относятся к обеспечению создания интерфейса для четкого представления места расположения и типа нервов, которые иннервируют зондируемое место на стенке артерии.
[0030] Настоящее изобретение обеспечивает создание способа идентификации наличия функциональных симпатических и парасимпатических нервов, иннервирующих стенки артерии в человеческом теле с учетом места приложения дозы энергии. Способ включает один или большее количество этапов, на которых подготавливают исходный уровень одного или большего количества физиологических параметров перед подачей дозы энергии к стенке артерии; подают дозу энергии к стенке артерии; обнаруживают физиологические изменения, произошедшие в результате подачи энергии; оценивают указанное изменение на основе набора значений, предварительно определенных эмпирическим путем; и определяют, находится ли область, в которую была подана энергия, в непосредственной близости от функциональных симпатических или парасимпатических нервов на основе полученных оценок.
[0031] В одном варианте реализации изобретения указанный способ применяют для определения мест расположения участков, подходящих для абляции нервов, в отношении барорефлекса, включая симпатическую и парасимпатическую системы в стенках артерии перед операцией абляции нервов. В некоторых вариантах реализации изобретения операция абляции нервов проводится для денервации почечной артерии. Еще в одном варианте реализации изобретения способ применяют для обеспечения точности подачи энергии абляции к целевому нерву в стенке артерии во время процесса абляции нервов. В дополнительном варианте реализации изобретения способ применяют для немедленной послеоперационной оценки абляции нервов, чтобы убедиться в том, что целевой нерв был подвергнут абляции энергией, поданной при абляции нервов.
[0032] В некоторых вариантах реализации изобретения энергию подают к стенке артерии в дозированном количестве, подходящем для стимуляции нервов. Еще в одних вариантах реализации изобретения энергию подают к стенке артерии в дозированном количестве, подходящем для абляции нервов.
[0033] В одном варианте реализации изобретения физиологические параметры содержат давление крови, частоту сердечных сокращений, биохимические уровни, электрическую активность сердца, мышечную активность, активность нервов, относящихся к скелету, биоэлектрический потенциал клеток или другие измеряемые реакции в качестве результата этих физиологических изменений, например реакция зрачков, электромиограмма и сужение сосудов.
[0034] В некоторых вариантах реализации изобретения область на стенке артерии, которая при стимуляции вызывает повышение давления крови и увеличение частоты сердечных сокращений, считается иннервированной симпатическими нервами, и наоборот, область на стенке артерии, которая при стимуляции вызывает понижение давления крови и уменьшение частоты сердечных сокращений, считается иннервированной парасимпатическими нервами.
[0035] В одном варианте реализации изобретения энергия для абляции считается точно поданной к целевому нерву, иннервирующему стенку артерии, когда физиологические параметры значительно отклоняются от исходного уровня во время процесса абляции.
[0036] В одном варианте реализации изобретения абляция нервов считается успешной, когда подтверждено, что область, иннервированная нервами, при указанном способе перед подачей энергии абляции, больше не имеет изменений физиологических параметров, таких как давление крови и частота сердечных сокращений, при подаче энергии стимуляции к этой зоне.
[0037] Настоящее изобретение также обеспечивает создание системы определения места расположения и идентификации нервов, иннервирующих стенку артерии. Система содержит одно или большее количество устройств, выполненных с возможностью подачи дозы энергии к стенке артерии; один или большее количество датчиков для приема сигналов физиологических параметров; одно или большее количество устройств для анализа сигналов от датчиков и один или большее количество индикаторов или приборных панелей, выполненных с возможностью отображения результатов анализа
[0038] В одном варианте реализации изобретения дозой энергии, поданной устройством для подачи энергии, можно управлять, чтобы выполнять либо стимуляцию нервов, либо их абляцию. Еще в одном варианте реализации изобретения используются два отдельных устройства для независимого выполнения стимуляции нервов и абляции нервов.
[0039] Еще в одном варианте реализации изобретения поданная энергия представляет собой одну или большее количество из следующих энергий: электрическая, механическая, ультразвуковая, лучистая энергия, энергия оптического излучения и тепловая энергия.
[0040] В некоторых вариантах реализации изобретения указанными датчиками обнаруживают физиологические параметры, которые включают в себя давление крови, частоту сердечных сокращений, биохимические уровни, электрическую активность сердца, мышечную активность, активность нервов, относящихся к скелету, биоэлектрический потенциал клеток и другие измеряемые реакции в качестве результата вышеуказанного, например, реакцию зрачков, электромиограмму и сужение сосудов. В некоторых вариантах реализации изобретения сигналы, соответствующие физиологическим параметрам обнаруживают с помощью коммерчески доступных методик, известных в данной области техники.
[0041] Еще в одном варианте реализации изобретения устройство для цифрового анализа физиологических сигналов представляет собой микроконтроллер или компьютер.
[0042] В одном варианте реализации изобретения результаты анализа отображают с использованием указателей различных цветов. Область, иннервированная симпатическими нервами, показана зеленым указателем, а область, иннервированная парасимпатическими нервами показана красным указателем. Еще в одном варианте реализации изобретения данные анализа отображают на цифровой приборной панели.
[0043] В одном варианте реализации изобретения совокупность указателей или приборных панелей может быть встроена в устройство системы, такое как устройство для подачи энергии. В некоторых вариантах реализации изобретения совокупность указателей или приборных панелей может быть выполнена в виде отдельного модуля системы.
[0044] Настоящее изобретение также обеспечивает создание имеющих специальную конструкцию катетеров с дистальным концом (т.е. кончиком катетера) с формами, приспособленными к почечной архитектуре, содержащими один или большее количество электродов для картирования распределения почечных нервов, для выполнения почечных абляций, для выполнения постабляционной оценки и для выполнения ангиографии. В некоторых вариантах реализации изобретения электроды таких катетеров размещены на расстоянии друг от друга и друг за другом вдоль длины кончика катетера, при этом поверхности электродов находятся в контакте с сегментированными участками полости почечной артерии. В некоторых вариантах реализации изобретения кончик катетера выполнен управляемым и имеет один электрод для излучения радиочастотной энергии. В некоторых вариантах реализации изобретения форма кончика катетера представляет собой одинарную спираль, в которой образованный витками компонент спирали выполнен по форме либо круглым, либо плоским. Еще в одних вариантах реализации изобретения кончик катетера представляет собой двойную спираль, в которой образованные витками компоненты спиралей выполнены по форме либо круглыми, либо плоскими. В дополнительных вариантах реализации изобретения кончик катетера может содержать баллон, вокруг которого обернут спиральный образованный витками компонент, в котором электроды размещены вдоль длины спирального образованного витками компонента на расстоянии друг от друга; в альтернативном варианте реализации изобретения кончик катетера может содержать баллон, вокруг которого выполнен зонтичный компонент, охватывающий баллон, и при этом электроды размещены вдоль зонтичного компонента на расстоянии друг от друга. В обоих вариантах реализации изобретения образованный витками или зонтичный компонент может быть выполнен по форме либо круглым, либо плоским; соответственно, электроды, размещенные на расстоянии друг от друга вдоль длины образованного витками или зонтичного компонента могут быть выполнены по форме круглыми или плоскими в зависимости формы образованного витками или зонтичного компонента, расположенного ниже.
[0045] В дополнительных вариантах реализации изобретения кончик катетера может содержать компонент зонтичной формы или каркас с закрытым концом или зонтичный компонент с открытым концом.
[0046] В некоторых вариантах реализации изобретения упомянутые выше кончики катетера могут быть введены в артериальную архитектуру для выполнения функций стента.
[0047] В одном варианте реализации изобретения диаметр этих кончиков катетера может варьироваться от 0,5 мм до 10 мм; длина кончика катетера может варьироваться от 20 мм до 80 мм; диаметры образованного витками компонента могут варьироваться от 3,0 мм до 7,5 мм; расстояния между каждым образованным витками компонентом могут варьироваться от 4 мм до 6 мм; и полностью развернутые длины образованных витками компонентов могут варьироваться от 31 мм до 471 мм.
[0048] Электроды катетеров выполнены с возможностью активирования независимо друг от друга или могут быть активированы в любом сочетании для испускания электрической стимуляции или радиочастотной энергии. Электроды каждый имеют двойные функции доставки электрической стимуляции или радиочастотной энергии. Электрическая стимуляция применяется для идентификации и картирования сегментов полости почечной артерии, ниже которой находятся важные почечные нервы. Указанные идентификация и картирование выполняют путем отслеживания физиологической реакции или физиологических реакций на осуществленную электрическую стимуляцию, таких как реакция изменения давления крови и частоты сердечных сокращений или активность симпатических нервов мышц (Шлейх и др. (Schlaich et al.), NEJM 2009), или поступление норадреналина в почки (Эслер и др. (Esler et al.) 2009 и Шлейх и др. (Schlaich et al.), J Htn. 2009), причем изменения в физиологической реакции указывают на наличие распределения расположенных ниже симпатических нервов в непосредственной близости от активируемого электрода. Еще в одном варианте реализации изобретения отдельные электроды катетеров выполнены с возможностью активирования в сочетаниях, выбранных врачом, проводящим операцию, чтобы оценивать максимальную физиологическую реакцию и, как следствие, определять места нахождения расположенных ниже почечных нервов. Электроды катетеров выполнены с возможностью выпуска не только электрического тока достаточной силы для стимуляции почечных нервов, но и тепловой энергии, такой как радиочастотная энергия, для абляции расположенной ниже ткани почечных нервов на основе результатов картирования почечных нервов. Еще в одних вариантах реализации изобретения отдельные электроды катетеров могут быть по выбору активированы для излучения энергии абляции, такой как радиочастотная энергия высокой частоты, при этом выбор активируемых электродов основан на результатах картирования нервов. В дополнительных вариантах реализации изобретения, основанных на картировании почечных нервов, абляция с использованием энергии других типов, такой как лазерная энергия, сфокусированный ультразвук высокой интенсивности, или криоабляция может быть использована на стенках почечной артерии, чтобы осуществить абляцию симпатических почечных нервов.
[0049] В некоторых вариантах реализации изобретения эти катетеры используются взаимозаменяемо с существующими радиочастотными генераторами, которые в настоящее время используются с существующими катетерными системами для сердца.
[0050] В одном варианте реализации изобретения вышеуказанные катетерные системы могут быть использованы с самыми разнообразными приемлемыми катетерными направителями, предварительно вставляемыми в тело пациента для направления кончика катетера к необходимому месту. Они также могут быть использованы с устройствами и другими инструментами, которые могут быть использованы для облегчения прохождения подобных устройств в сердечнососудистой и почечно-сосудистой системах, таких как оболочки и расширители. При необходимости вышеуказанные катетерные системы также могут быть использованы с толкательной проволокой для размещения кончика катетера.
[0051] Настоящее изобретение также обеспечивает создание способов применения катетеров, описанных в настоящем документе, для картирования распределения почечных нервов, включающих этапы применения электрической стимуляции при отслеживании изменения физиологических реакций, таких как давление крови и частота сердечных сокращений, для картирования распределения почечных нервов и идентификации зон абляции в почечных артериях для идеальной денервации почечных нервов. Эти способы включают активацию независимых электродов описанных катетеров для излучения электрического заряда, чтобы осуществлять стимуляцию расположенных ниже почечных нервов с отслеживанием физиологических реакций, таких как давление крови и частота сердечных сокращений; наличие изменений в физиологической реакции указывает на наличие расположенных ниже симпатических нервов в непосредственной близости от активируемого электрода и выше места абляции. Накапливание данных картирования может принять форму клинически полезного критерия относительно распределения почечных нервов, чтобы оказывать помощь лечащим специалистам при выполнении абляции.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
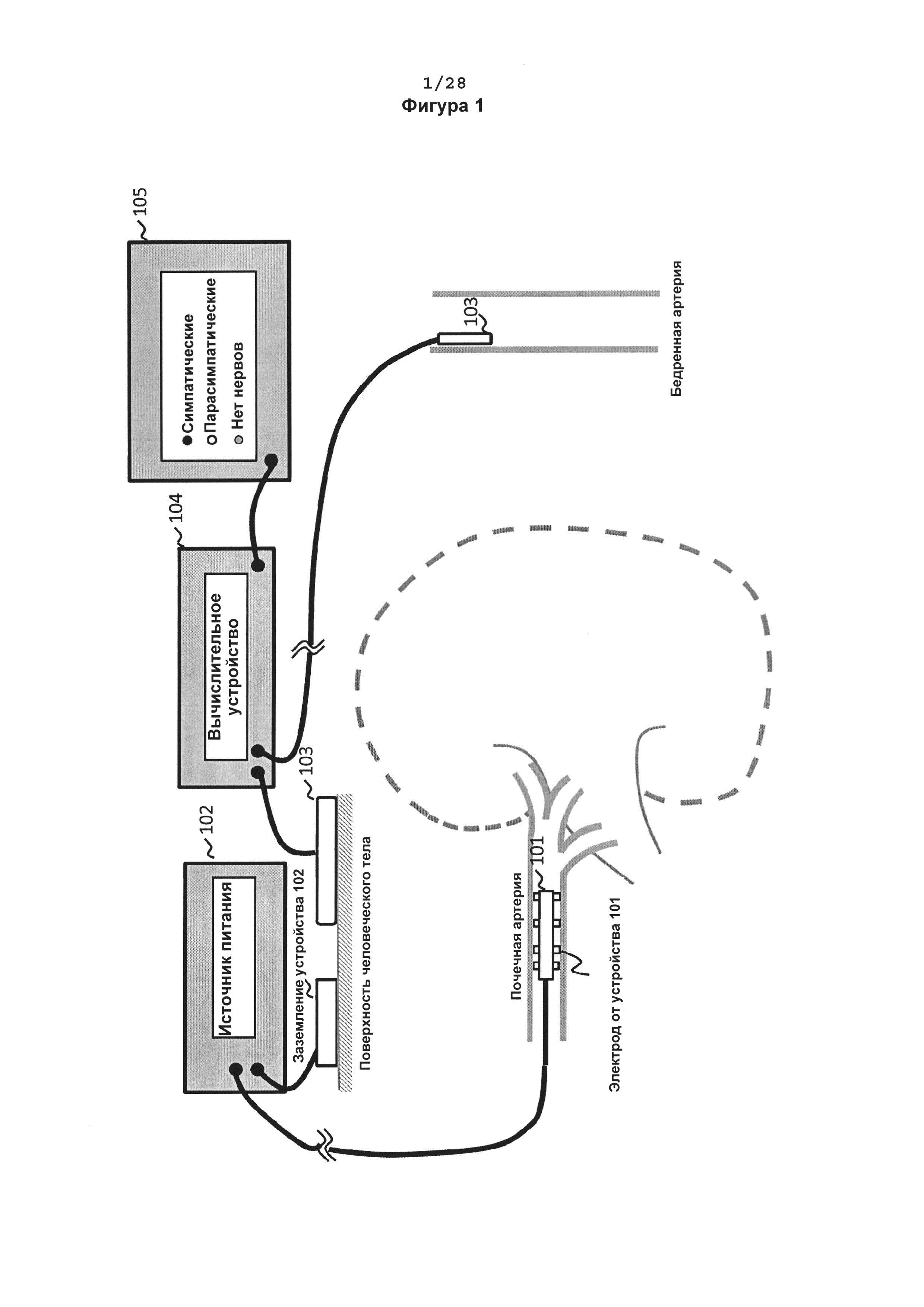
[0052] На фигуре 1 схематически показана система согласно настоящему изобретению для определения места расположения и идентификации функциональных нервов, иннервирующих стенку артерии. Система содержит устройство 101 для подачи энергии к стенке артерии; источник питания 102 для питания устройства 101; датчик 103 для обнаружения сигналов физиологических параметров; устройство 104 для анализа данных от датчика 103 и указатель 105 для отображения результатов от устройства 104.
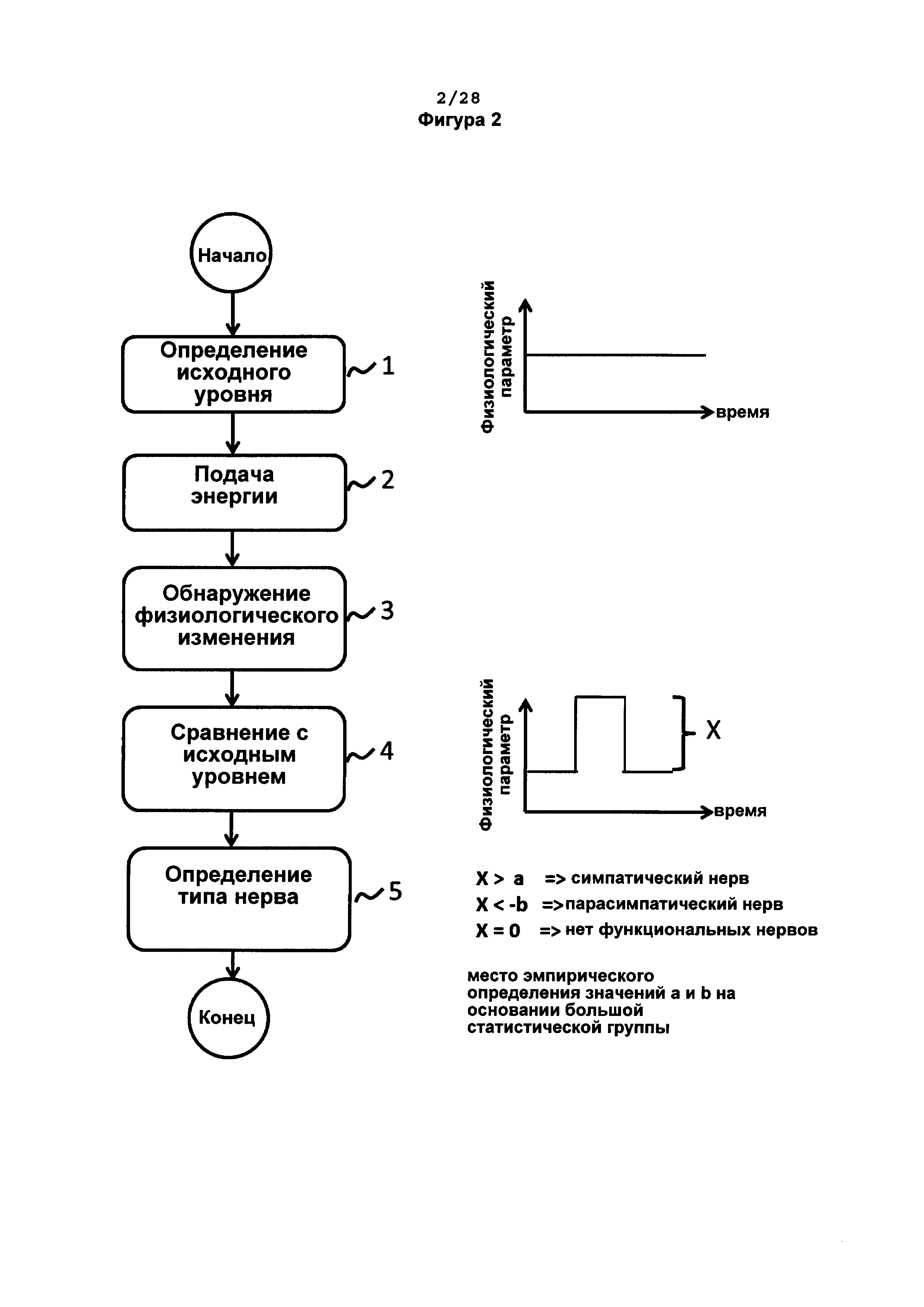
[0053] На фигуре 2 схематически показаны этапы одного варианта реализации способа определения, функционируют ли симпатические или парасимпатические нервы в непосредственной близости от места подачи дозы энергии к стенке артерии. Графики иллюстрируют возможные записанные физиологические сигналы.
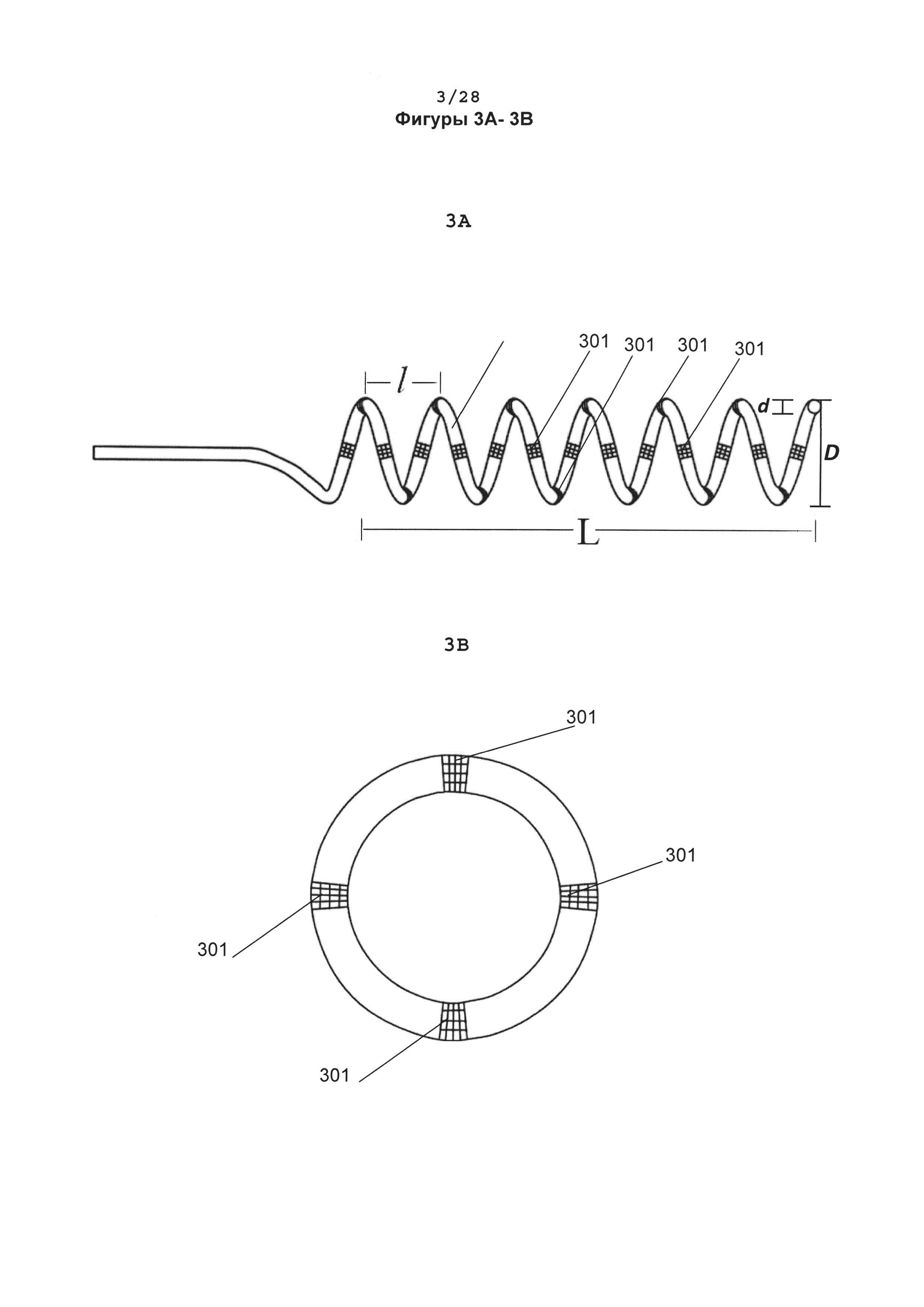
[0054] На фигуре 3А показана вертикальная проекция дистального участка (кончика катетера) одинарной спирали абляционного катетера в соответствии с одним вариантом реализации настоящего изобретения, причем электроды 301 расположены с интервалами 90° по длине спирали, а спиральный образованный витками компонент 303 выполнен круглым, и при этом "L" обозначает длину дистального участка, "l" обозначает длину одного витка цельного образованного витками компонента, "d" обозначает диаметр кончика катетера и "D" обозначает диаметр спирального образованного витками компонента.
[0055] На фигуре 3В показано распределение электродов 301 в одном цельном образованном витками компоненте в спирали абляционного катетера, показанного на фигуре 3А.
[0056] На фигуре 3С показан вид с конца дистального участка одинарной спирали абляционного катетера в соответствии с одним вариантом реализации, показанном на фигуре 3А, от направления подачи провода, показывающий только первый виток образованного витками компонента с электродами 301.
[0057] На фигуре 3D показана вертикальная проекция дистального участка одинарной спирали абляционного катетера в соответствии с вариантом реализации настоящего изобретения, причем электроды 305 расположены с интервалами 120° по длине спирали, и при этом спиральный образованный витками компонент 307 выполнен круглым.
[0058] На фигуре 3Е показано распределение электродов 305 в одном цельном образованном витками компоненте в спирали абляционного катетера, показанного на фигуре 3D.
[0059] На фигуре 3F показан вид с конца дистального участка одинарной спирали абляционного катетера в соответствии с одним вариантом реализации, показанном на фигуре 3D, от направления подачи провода, показывающий только первый виток образованного витками компонента с электродами 305.
[0060] На фигуре 3G показана вертикальная проекция дистального участка одинарной спирали абляционного катетера в соответствии с вариантом реализации настоящего изобретения, причем электроды 309 расположены с интервалами 90° по длине спирали, и при этом спиральный образованный витками компонент 311 выполнен имеющим плоскую форму.
[0061] На фигуре 3Н показано распределение электродов 309 в одном цельном образованном витками компоненте в спирали абляционного катетера, показанного на фигуре 3G.
[0062] На фигуре 31 показана вертикальная проекция дистального участка одинарной спирали абляционного катетера в соответствии с одним вариантом реализации настоящего изобретения, причем электроды 313 расположены с интервалами 120° по длине спирали, и при этом спиральный образованный витками компонент 315 выполнен имеющим плоскую форму.
[0063] На фигуре 3J показано распределение электродов 313 в одном цельном образованном витками компоненте в спирали абляционного катетера, показанного на фигуре 31.
[0064] На фигуре 4А показана вертикальная проекция дистального участка двойной спирали абляционного катетера в соответствии с вариантом реализации настоящего изобретения, причем электроды 417 расположены с интервалами 90° вдоль длины каждой отдельной спирали, а спиральные образованные витками компоненты 419 выполнены круглыми, и при этом "L" обозначает длину дистального участка, а "l" обозначает длину одного витка каждого спирального образованного витками компонента.
[0065] На фигуре 4В показан вид с конца дистального участка двойной спирали абляционного катетера в соответствии с одним вариантом реализации, показанном на фигуре 4А, от направления подачи провода, показывающий только первый виток каждого образованного витками компонента с электродами 417.
[0066] На фигуре 4С показана вертикальная проекция дистального участка двойной спирали абляционного катетера в соответствии с вариантом реализации настоящего изобретения, причем электроды 421 размещены на расстоянии друг от друга с интервалами 120° вдоль длины каждой отдельной спирали, а спиральные образованные витками компоненты 423 выполнены круглыми, и при этом "L" обозначает длину дистального участка, и "l" обозначает длину одного витка каждого спирального образованного витками компонента.
[0067] На фигуре 4D показан вид с конца дистального участка двойной спирали абляционного катетера в соответствии с одним вариантом реализации, показанном на фигуре 4С, от направления подачи провода, показывающий только первый виток каждого образованного витками компонента с электродами 421.
[0068] На фигуре 4Е показана вертикальная проекция дистального участка двойной спирали абляционного катетера в соответствии с вариантом реализации настоящего изобретения, причем электроды 425 размещены на расстоянии друг от друга с интервалами 90° вдоль длины каждой отдельной спирали, и при этом спиральные образованные витками компоненты 427 выполнены плоскими.
[0069] На фигуре 4F показана вертикальная проекция дистального участка двойной спирали абляционного катетера в соответствии с вариантом реализации настоящего изобретения, причем электроды 429 размещены на расстоянии друг от друга с интервалами 120° вдоль длины каждой отдельной спирали, и при этом спиральные образованные витками компоненты 431 выполнены плоскими.
[0070] На фигуре 5А показана вертикальная проекция дистального участка баллонного абляционного катетера в соответствии с вариантом реализации настоящего изобретения, при этом баллон 533 надут, а электроды 535 равномерно размещены на расстоянии друг от друга с интервалами вдоль спирального образованного витками компонента 537, который выполнен круглым по форме и обернутым вокруг баллона.
[0071] На фигуре 5В показана вертикальная проекция дистального участка баллонного абляционного катетера в соответствии с вариантом реализации настоящего изобретения, включающего в себя зонтообразный компонент 539, охватывающий баллон 541, который надут, и при этом электроды 543 размещены на расстоянии друг от друга с интервалами вдоль зонтичного компонента, охватывающего баллон.
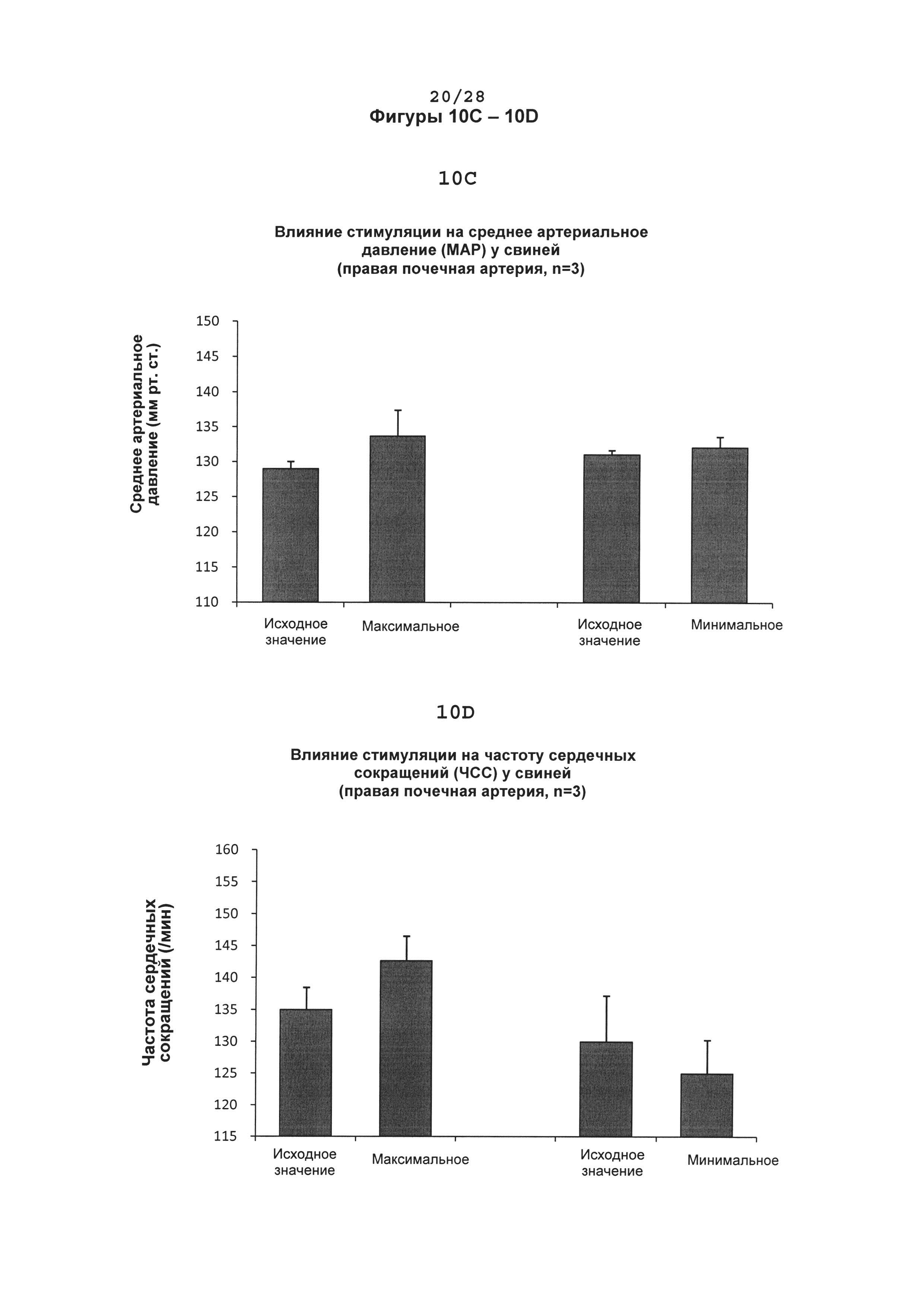
[0072] На фигуре 6А показана вертикальная проекция дистального участка абляционного катетера в соответствии с вариантом реализации настоящего изобретения, включающего в себя каркас 645 с закрытым концом наподобие зонтика, причем электроды 647 размещены на расстоянии друг от друга с интервалами вдоль зонтичного компонента наподобие каркасной конструкции.
[0073] На фигуре 6В показан вид с конца дистального участка абляционного катетера в соответствии с одним вариантом реализации, как показано на фигуре 6А, от направления подачи провода.
[0074] На фигуре 6С показана вертикальная проекция дистального участка абляционного катетера в соответствии с вариантом реализации настоящего изобретения, включающего в себя каркас 649 с открытым концом наподобие зонтика, причем электроды 651 размещены на расстоянии друг от друга с интервалами вдоль зонтичного каркаса.
[0075] На фигуре 6D показан вид с конца дистального участка абляционного катетера, от направления подачи провода.
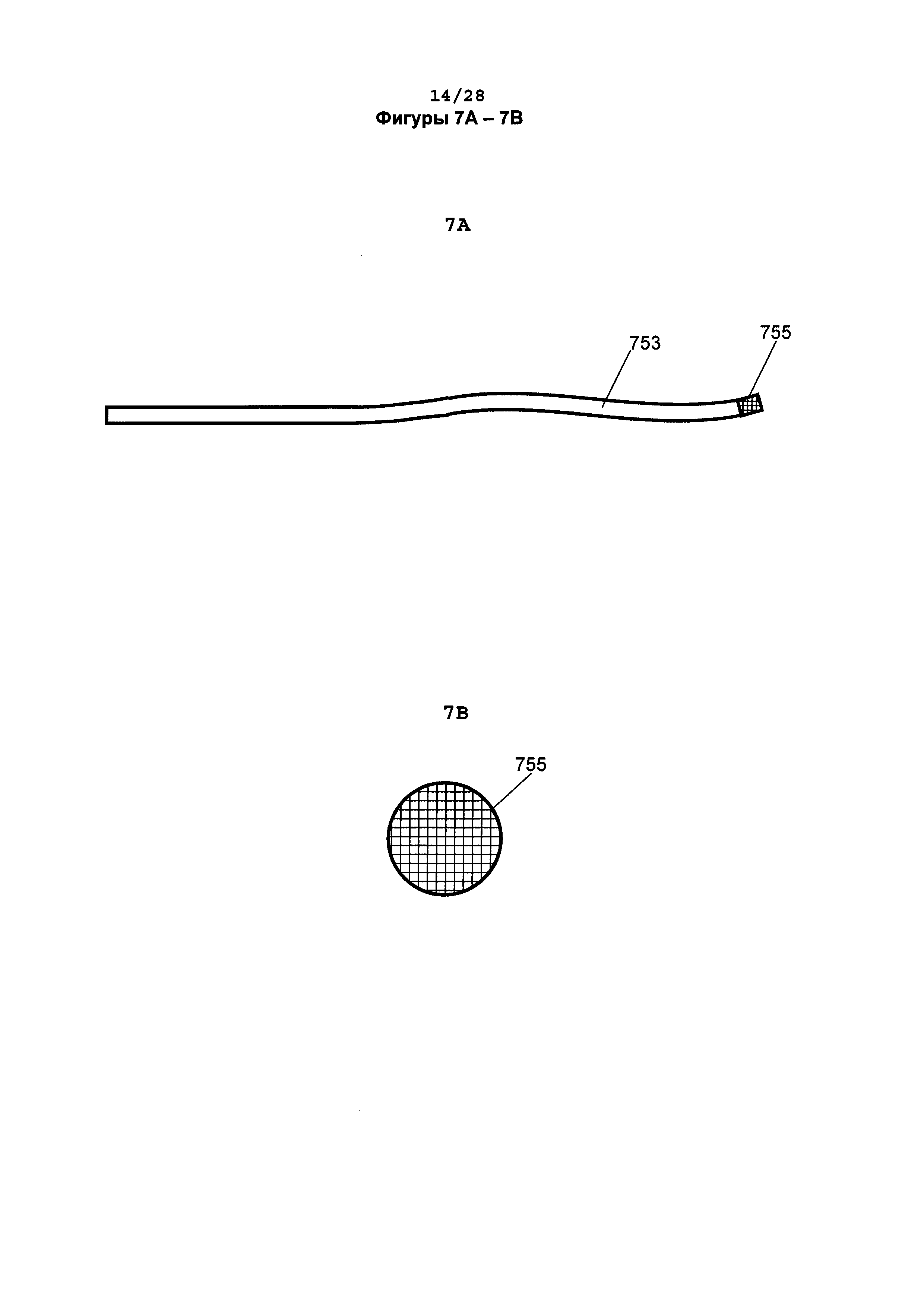
[0076] На фигуре 7А показана вертикальная проекция дистального участка абляционного катетера в соответствии с вариантом реализации настоящего изобретения, причем один электрод 755 расположен на управляемом кончике катетера 753.
[0077] На фигуре 7В показан вид с конца дистального участка абляционного катетера в соответствии с одним вариантом реализации, показанном на фигуре 7А, от направления подачи провода, показывающий электрод 755.
[0078] На фигуре 8 показана экспериментальная установка для проведения экспериментов над свиньями, использованная в экспериментах по картированию нервов.
[0079] На фигуре 9А показаны максимальные и минимальные результаты проведения стимуляции левой почечной артерии на артериальное систолическое давление (ASP). Показано артериальное систолическое давление (ASP, при измерении в миллиметрах рт.ст.) после электрической стимуляции в левой почечной артерии (LRA); показаны измерения исходного уровня, а также максимальные и минимальные реакции после стимуляции.
[0080] На фигуре 9В показаны максимальные и минимальные результаты проведения стимуляции левой почечной артерии на артериальное диастолическое давление (ADP). Показано артериальное диастолическое давление (ADP, при измерении в миллиметрах рт.ст.) после электрической стимуляции в левой почечной артерии (LRA); показаны измерения исходного уровня, а также максимальные и минимальные реакции после стимуляции.
[0081] На фигуре 9С показаны максимальные и минимальные результаты проведения стимуляции левой почечной артерии на среднее артериальное давление (MAP). Показано среднее артериальное давление (MAP, при измерении в миллиметрах рт.ст.) после электрической стимуляции в левой почечной артерии (LRA); показаны измерения исходного уровня, а также максимальные и минимальные реакции после стимуляции.
[0082] На фигуре 9D показаны максимальные и минимальные результаты проведения стимуляции левой почечной артерии на частоту сердечных сокращений (ЧСС). Показаны максимальные и минимальные изменения частоты сердечных сокращений после электрической стимуляции левой почечной артерии (LRA); показаны измерения исходного уровня, а также максимальные и минимальные частоты сердечных сокращений после стимуляции.
[0083] На фигуре 10А показаны максимальные и минимальные результаты проведения стимуляции правой почечной артерии на артериальное систолическое давление (ASP). Показано артериальное систолическое давление (ASP, при измерении в миллиметрах рт.ст.) после стимуляции в правой почечной артерии (RRA); показаны измерения исходного уровня, а также максимальные и минимальные реакции после электрической стимуляции.
[0084] На фигуре 10В показаны максимальные и минимальные результаты проведения стимуляции правой почечной артерии на артериальное диастолическое давление (ADP). Показано артериальное диастолическое давление (ADP, при измерении в миллиметрах рт.ст.) после электрической стимуляции в правой почечной артерии (RRA); показаны измерения исходного уровня, а также максимальные и минимальные реакции после стимуляции.
[0085] На фигуре 10С показано среднее артериальное давление (MAP, при измерении в миллиметрах рт.ст.) после электрической стимуляции в правой почечной артерии (LRA); показаны измерения исходного уровня, а также максимальные и минимальные реакции после стимуляции.
[0086] На фигуре 10D показаны максимальные и минимальные результаты проведения стимуляции правой почечной артерии на частоту сердечных сокращений (ЧСС). Показаны максимальные и минимальные изменения частоты сердечных сокращений после электрической стимуляции правой почечной артерии (RRA); показаны измерения исходного уровня, а также максимальные и минимальные частоты сердечных сокращений после стимуляции.
[0087] На фигуре 11 показано уменьшение частоты сердечных сокращений после стимуляции внутрипочечной артерии в некоторых местах почечной артерии.
[0088] На фигуре 12А показаны изменения в артериальном систолическом давлении (ASP) во время процесса четырех отдельных почечных абляций в левой почечной артерии. Показаны изменения в артериальном систолическом давлении (ASP, при измерении в миллиметрах рт.ст.) во время четырех отдельных почечных абляций в левой почечной артерии (LRA).
[0089] На фигуре 12 В показаны изменения в артериальном диастолическом давлении (ADP) во время четырех отдельных почечных абляций в левой почечной артерии. Показаны изменения в артериальном диастолическом давлении (ADP, при измерении в миллиметрах рт.ст.) во время четырех отдельных почечных абляций в левой почечной артерии (LRA).
[0090] На фигуре 12С показаны изменения среднего артериального давления (MAP) во время четырех отдельных почечных абляций в левой почечной артерии. Показаны изменения среднего артериального давления (MAP, при измерении в миллиметрах рт.ст.) во время четырех отдельных почечных абляций в левой почечной артерии (LRA).
[0091] На фигуре 12D показаны изменения частоты сердечных сокращений (ЧСС) во время четырех отдельных почечных абляций в левой почечной артерии. Показаны изменения частоты сердечных сокращений во время четырех отдельных почечных абляций в левой почечной артерии (LRA).
[0092] На фигуре 13А показаны изменения в артериальном систолическом давлении (ASP) во время четырех отдельных почечных абляций в правой почечной артерии. Показаны изменения в артериальном систолическом давлении (ASP, при измерении в миллиметрах рт.ст.) во время четырех отдельных почечных абляций в правой почечной артерии (RRA).
[0093] На фигуре 13В показаны изменения в артериальном диастолическом давлении (ADP) во время четырех отдельных почечных абляций в правой почечной артерии. Показаны изменения в артериальном диастолическом давлении (ADP, при измерении в миллиметрах рт.ст.) во время четырех отдельных почечных абляций в правой почечной артерии (RRA).
[0094] На фигуре 13С показаны изменения среднего артериального давления (MAP) во время четырех отдельных почечных абляций в правой почечной артерии. Показаны изменения среднего артериального давления (MAP, при измерении в миллиметрах рт.ст.) во время четырех отдельных почечных абляций в правой почечной артерии (RRA).
[0095] На фигуре 13D показаны изменения частоты сердечных сокращений (ЧСС) во время четырех отдельных почечных абляций в правой почечной артерии. Показаны изменения частоты сердечных сокращений во время четырех отдельных почечных абляций в правой почечной артерии (RRA).
[0096] На фигуре 14 показана экспериментальная установка для экспериментов по абляции хронических почечных нервов.
[0097] На фигуре 15 показана схема гистологических карт для сечений почечной артерии, выполненных в умерщвленных животных.
РЕАЛИЗАЦИЯ ИЗОБРЕТЕНИЯ
[0098] Следует отметить, что, как указано в данном описании, выражение "катетер" относится ко всей длине катетерного устройства от дистального участка, предназначенного для введения в необходимую целевую анатомию для абляции или другого действия, с проходом через место стыка, в котором катетер соединяется с кабелем, соединяющим катетер с радиочастотным генератором. Как указано в данном описании, выражение "кончик катетера" используется в отношении дистального участка катетера, который содержит электроды и реализует функции стимуляции, абляции и картирования в теле пациента на целевом участке воздействия. Выражение "кончик катетера" используется взаимозаменяемо с выражениями "дистальный участок" любого упоминаемого катетера.
[0099] Перед возможным проведением успешной абляции очень важно учитывать архитектуру почечных нервов; поэтому индивидуальная архитектура почечных нервов должна тщательно учитываться или картироваться перед катетеризацией для успешного осуществления денервации. Наличие отклонений или необычной почечной архитектуры, а также нормальных вариантов архитектуры почечных нервов у индивидуальных пациентов требует картирования почечных нервов перед абляцией. Иными словами, картирование почечных нервов требуется до катетерной денервации, поскольку наилучшие зоны для абляции размещены "случайным образом" в том смысле, что лучшие зоны для абляции отличаются у разных пациентов, и варьируются от одной артерии к другой. Оптимальная абляция, таким образом, требует идентификации или картирования почечных нервов перед проведением катетерной абляции.
[0100] Настоящее изобретение обеспечивает создание системы и способа определения мест расположения участков, иннервированных функциональными нервами в стенке артерий, в частности почечной артерии, хотя специалистам в данной области техники будет понятно, что с использованием настоящего изобретения могут быть определены места расположения нервов, иннервирующих другие артерии или сосуды в человеческом теле. Система содержит одно или большее количество устройств, выполненных с возможностью подачи дозы энергии к стенке артерии; один или большее количество датчиков для приема входящих физиологических сигналов; одно или большее количество устройств для анализа сигналов от датчиков; и один или большее количество индикаторов или приборных панелей, выполненных с возможностью отображения результатов анализа.
[0101] На фигуре 1 изображен пример системы в соответствии с аспектом настоящего изобретения, а именно системы почечной денервации с использованием давления крови и частоты сердечных сокращений в качестве физиологических параметров для идентификации реакции нервов. Система содержит одно или большее количество устройств 101 для подачи энергии к стенке артерии, которые имеют электрическую связь с источником питания 102. Система кроме того содержит датчики 103 для обнаружения физиологических сигналов, имеющие электрическую связь с устройством 104 для анализа физиологических сигналов. Указатель 105, имеющий электрическую связь с устройством 104, отображает результат анализа от устройства 104. В этом варианте реализации изобретения устройство 101, в форме катетера с двумя функциями, показано вставленным в почечную артерию путем минимального инвазивного интервенционного вмешательства. По меньшей мере один из электродов устройства 101 контактирует со стенкой почечной артерии в определенном месте и выполнен с возможностью подачи дозы энергии от источника питания 102 для стимуляции или абляции нервов, которые могут иннервировать область стенки артерии, с которой электрод находится в контакте. Датчики 103 обнаруживают изменения давления крови и/или частоты сердечных сокращений при подаче энергии, достаточной для стимуляции нервов или абляции, от электрода на устройстве 101 к зоне контакта электрода на стенке артерии. Сигналы от датчика 103 будут вводиться в устройство 104, которое будет цифровым образом определять факт появления этого сигнала благодаря симпатическим или парасимпатическим нервам или в результате их отсутствия. Затем указатель 105 отобразит результат анализа от устройства 104.
[0102] В одном варианте реализации изобретения устройство 101 представляет собой инвазивное устройство, введенное в артерию, выполненное с возможностью подачи энергии к нерву, иннервирующему артерию, что приводит к стимуляции нервов или их абляции. Еще в одном варианте реализации изобретения устройство 101 выполнено из двух отдельных модулей, один из которых служит для подачи энергии для стимуляции нервов, а другой для абляции нервов. Еще в одном варианте реализации устройство 101 представляет собой одноэлектродный катетер или многоэлектродный катетер.
[0103] В одном варианте реализации изобретения источник питания 102 подает энергию к стенке артерии посредством устройства 101. Еще в одном варианте реализации изобретения энергию подают удаленно через тело человека источником питания 102 в стенку артерии без использования устройства 101. В дополнительном варианте реализации изобретения источник питания 102 представляет собой многоканальный источник питания, выполненный с возможностью подачи отдельных доз энергии независимо для различения мест на стенке артерии. Еще в одних вариантах реализации изобретения источник питания 102 представляет собой одноканальный источник питания, выполненный с возможностью подачи только 1 дозы энергии каждый раз. Еще в одном варианте реализации изобретения дозирование энергии, которую необходимо подавать источником питания 102, является регулируемым, чтобы по-разному воздействовать на целевой нерв, например, выполнять стимуляцию или абляцию. В дополнительных вариантах реализации изобретения поданная источником питания 102 энергия представляет собой одну или большее количество из следующих энергий: электрическая, механическая, ультразвуковая, лучистая энергия, энергия оптического излучения и тепловая энергия.
[0104] В одном варианте реализации изобретения датчики 103 обнаруживают сигналы на основе физиологических параметров, включающих давление крови, частоту сердечных сокращений, биохимические уровни, электрическую активность сердца, мышечную активность, активность нервов, относящихся к скелету, биоэлектрический потенциал клеток и другие измеряемые реакции в качестве результата вышеуказанного, например, реакцию зрачков, электромиограмму и сужение сосудов. В дополнительном варианте реализации изобретения датчики 103 обнаруживают указанные сигналы снаружи при контактировании с любой частью человеческого тела или без такого контакта. Еще в одном варианте реализации изобретения датчики 103 обнаруживают указанные сигналы внутри человеческого тела путем размещения в контакте с необходимой полостью трубчатого органа, такого как почечная артерия или бедренная артерия или какая-либо иная артерия, или в непосредственной близости от этой полости. Еще в одном варианте реализации изобретения датчик 103 может представлять собой датчик из части другого оборудования, используемого в сочетании с настоящим изобретением во время интервенционного вмешательства.
[0105] В одном варианте реализации изобретения устройство 104 представляет собой один или большее количество микроконтроллеров или компьютеров, выполненных с возможностью цифрового анализа сигналов, поступающих непосредственно или косвенно от датчика 103.
[0106] В одном варианте реализации изобретения указатель 105 представляет собой один или большее количество цифровых приборных панелей, которые отображают результат анализа устройством 104. Еще в одном варианте реализации изобретения один или большее количество результатов указанного анализа от множества мест на стенке артерии одновременно отображаются на указателе 105. В дополнительном варианте реализации изобретения указатель 105 также отображает один или большее количество физиологических сигналов от датчика 103; информацию, относящуюся к энергии от источника питания 102, такую как ток, частота, напряжение; информацию, относящуюся к месту взаимодействия электрода с тканью, такую как полное сопротивление; и информацию, относящуюся к устройству 101, такую как температура. В некоторых вариантах реализации изобретения указатель 105 содержит совокупность разноцветных цветовых индикаторов, каждый из которых отчетливо представляет симпатический нерв, парасимпатический нерв или их отсутствие. Еще в одних вариантах реализации изобретения указатель 105 представляет результат, полученный на основании анализа устройства 104, в виде текстов, символов, цветов, звука или их комбинаций.
[0107] В некоторых вариантах реализации изобретения устройство 4 и указатель 5 выполнены за одно целое в виде одного устройств, а в дополнительных вариантах реализации изобретения устройство 4 и указатель 5 выполнены встроенными в источник питания 2.
[0108] Еще в одном варианте реализации изобретения датчик 103, устройство 104 и указатель 105 выполнены независимо от устройства 101 и источника питания 102, так что датчик 103, устройство 104 и указатель 105 могут быть использованы с другими способами внешней или инвазивной подачи энергии в стенку сосуда, такими как сфокусированный ультразвук высокой интенсивности.
[0109] Настоящее изобретение дополнительно обеспечивает создание способа идентификации наличия функциональных симпатических или парасимпатических нервов, иннервирующих выбранную область на стенке артерии, на основе изменений физиологических параметров, вызываемых дозой энергии. Способ включает один или большее количество этапов, на которых подготавливают исходный уровень физиологических параметров, подлежащих измерению, перед подачей дозы энергии к стенке артерии; подают дозу энергии к стенке артерии; обнаруживают физиологические изменения, произошедшие в результате подачи энергии; оценивают указанное изменение на основе набора значений, предварительно определенных эмпирическим путем; и на основе полученных оценок определяют, находятся ли функциональные симпатические или парасимпатические нервы в непосредственной близости от участка подачи энергии.
[0110] На фигуре 2 показана блок-схема, иллюстрирующая этапы способа определения наличия функционального симпатического или парасимпатического нерва, иннервирующего выбранную область стенки артерии.
[0111] На этапе 1 физиологические сигналы от датчика 103 постоянно регистрируют устройством 104 для получения надежного исходного уровня с отражением любых мгновенных изменений в указанных сигналах.
[0112] Затем одним из электродов в устройстве 101 к области на стенке артерии, с которой этот электрод контактирует, подают энергию (Этап 2). Датчик 103 обнаруживает любые физиологические изменения, вызываемые поданной энергией, и это изменение регистрируют в качестве сигналов, которые затем отправляют в устройство 104. (Этап 3)
[0113] На этапе 4 устройство 104 определяет отклонение физиологических сигналов от исходного уровня согласно этапу 1 и на этапе 5 определяет тип нервов, иннервирующих область на стенке артерии, на основе этого отклонения, базируясь на информации исходного уровня.
[0114] В одном варианте реализации изобретения физиологические сигналы, обнаруженные датчиком 103, содержат один или большее количество показателей из следующих: давление крови, частота сердечных сокращений, биохимические уровни, электрическую активность сердца, мышечную активность, активность нервов, относящихся к скелету, биоэлектрический потенциал клеток и другие наблюдаемые реакции организма в качестве результата вышеуказанного, например, реакцию зрачков и сужение сосудов.
[0115] В одном варианте реализации изобретения обеспечена возможность регулирования дозы энергии, подаваемой на этапе 2, чтобы вызвать различные взаимодействия с целевым нервом, такие как стимуляция или абляция нервов.
[0116] В некоторых вариантах реализации изобретения значения физиологических сигналов измеряют с использованием других внешних устройств и вводят в устройство 104 перед подачей энергии, чтобы заменить исходный уровень, сформированный устройством 104.
[0117] В одном варианте реализации изобретения изменения физиологических параметров обнаруживают во время или после процесса подачи энергии на этапе 2. Еще в одном варианте реализации изобретения изменения физиологических параметров представлены в форме числовых значений или волновых сигналов. В дополнительных вариантах реализации изобретения отклонение от исходного уровня согласно этапу 1 оцениваются путем вычитания из исходного уровня согласно этапу 1 из указанных сигналов.
[0118] В одном варианте реализации изобретения набор значений, предварительно определенных эмпирическим путем, может быть получен из наборов клинических данных или выведен из опыта клинических специалистов. В некоторых вариантах реализации изобретения область на стенке артерии считается иннервированной симпатическими нервами, когда энергия, подаваемая в эту область, вызывает увеличение частоты сердечных сокращений на 10 ударов в минуту и/или повышение давления крови на 6 мм рт. ст. Еще в одних вариантах реализации изобретения область на стенке артерии считается иннервированной парасимпатическими нервами, когда энергия, подаваемая в эту область, вызывает уменьшение частоты сердечных сокращений на 5 ударов в минуту и/или понижение давления крови на 2 мм рт. ст.
[0119] В дополнительном варианте реализации изобретения результаты этапа 5 будут отображены на указателе 105.
[0120] В одном варианте реализации изобретения способ применяют для идентификации участков, подходящих для абляции нервов в стенке артерии для прерывания пути прохождения барорефлекса, реализуемого через симпатическую и парасимпатическую нервные системы. Еще в одном варианте реализации изобретения способ обеспечивает индикацию точности подачи энергии абляции к целевым нервам в стенке артерии. В дополнительном варианте реализации изобретения способ применяют для немедленной послеоперационной оценки абляции нервов.
[0121] Настоящее изобретение также обеспечивает создание имеющих специальную конструкцию катетеров с управляемым дистальным концом (т.е. кончиком катетера) с формами, приспособленными к почечной архитектуре, содержащими один или большее количество электродов для картирования распределения почечных нервов, для выполнения почечных абляций и для выполнения ангиографии. В некоторых вариантах реализации изобретения электроды таких катетеров разнесены друг за другом вдоль длины кончика катетера, при этом поверхности электродов находятся в контакте с сегментированными участками полости почечной артерии. В некоторых вариантах реализации изобретения форма кончика катетера представляет собой одинарную спираль, в которой образованный витками компонент спирали выполнен по форме либо круглым, либо плоским (фигуры 3A-J). Еще в одних вариантах реализации изобретения кончик катетера представляет собой двойную спираль, в которой образованные витками компоненты спиралей выполнены по форме либо круглыми, либо плоскими (фигуры 4А-F). В дополнительных вариантах реализации изобретения кончик катетера может содержать баллон, вокруг которого обернут спиральный образованный витками компонент, в котором вдоль длины спиральных образованных витками компонентов на расстоянии друг от друга размещены электроды (фигура 5А); в альтернативном варианте реализации изобретения, кончик катетера может содержать баллон, вокруг которого выполнен зонтичный компонент, охватывающий баллон, и при этом вдоль зонтичного компонента на расстоянии друг от друга размещены электроды (фигура 5В). В разновидностях обоих вариантов реализации изобретения, показанных на фигуре 5А и 5В, образованный витками или зонтичный компонент могут быть выполнены по форме либо круглым, либо плоским; соответственно, электроды, размещенные на расстоянии друг от друга вдоль длины образованного витками или зонтичного компонента могут быть выполнены по форме круглыми или плоскими в зависимости формы образованного витками или зонтичного компонента, расположенного ниже.
[0122] В дополнительных вариантах реализации изобретения кончик катетера может содержать компонент зонтичной формы или каркас с закрытым концом (фигуры 6А-В) или зонтичный компонент с открытым концом (фигура 6C-D).
[0123] Еще в одном варианте реализации изобретения катетер имеет управляемый кончик катетера с одним электродом на его кончике (фигура 7А-В).
[0124] В некоторых вариантах реализации изобретения упомянутые выше кончики катетера могут быть введены в артериальную архитектуру для выполнения функций стента.
[0125] В одном варианте реализации изобретения диаметр этих кончиков катетера, d, может варьироваться от 0,5 мм до 10 мм; длина кончиков катетера, L, может варьироваться от 20 мм до 80 мм; диаметры образованного витками компонента, D, могут варьироваться от 3,0 мм до 7,5 мм; расстояния между каждым образованным витками компонентом, 1, могут варьироваться от 4 мм до 6 мм; количества образованных витками компонентов могут варьироваться от 3,3 до 20; и полностью развернутые длины образованных витками компонентов могут варьироваться от 31 мм до 471 мм.
[0126] Электроды катетеров выполнены с возможностью активирования независимо друг от друга или могут быть активированы в любом сочетании для испускания электрической стимуляции или радиочастотной энергии. Электроды каждый имеют двойные функции доставки электрической стимуляции или радиочастотной энергии. Электрическая стимуляция применяется для идентификации и картирования сегментов полости почечной артерии, ниже которой находятся важные почечные нервы. Указанные идентификация и картирование выполняют путем отслеживания физиологической реакции или физиологических реакций на осуществленную электрическую стимуляцию, таких как реакция изменения давления крови и частота сердечных сокращений или активность симпатических нервов мышц (Шлейх и др. (Schlaich et al.), NEJM 2009), или поступление норадреналина в почки (Эслер и др. (Esler et al.) 2009 и Шлейх и др. (Schlaich et al.), J Htn. 2009), причем изменения в физиологической реакции указывают на наличие распределения расположенных ниже симпатических нервов в непосредственной близости от активируемого электрода. Еще в одном варианте реализации изобретения отдельные электроды катетеров выполнены с возможностью активирования в сочетаниях, выбранных врачом, проводящим операцию, чтобы оценивать максимальную физиологическую реакцию и, как следствие, определять места нахождения расположенных ниже почечных нервов. Электроды катетеров выполнены с возможностью выпуска не только электрического тока достаточной силы для стимуляции почечных нервов, но и тепловой энергии, такой как радиочастотная энергия, для абляции расположенной ниже ткани почечных нервов на основе результатов картирования почечных нервов. Еще в одних вариантах реализации изобретения отдельные электроды катетеров могут быть по выбору активированы для излучения энергии абляции, такой как радиочастотная энергия высокой частоты, при этом выбор активируемых электродов основан на результатах картирования нервов. В дополнительных вариантах реализации изобретения, основанных на картировании почечных нервов, для абляции симпатических почечных нервов на стенках почечной артерии могут быть использованы иные методики проведения абляции с использованием энергии других типов, такой как лазерная энергия, сфокусированный ультразвук высокой интенсивности, или криоабляция.
[0127] В некоторых вариантах реализации изобретения эти катетеры используются взаимозаменяемо с существующими радиочастотными генераторами, которые в настоящее время используются с существующими катетерными системами для сердца.
[0128] В одном варианте реализации изобретения вышеуказанные катетерные системы могут быть использованы с самыми разнообразными приемлемыми катетерными направителями, предварительно вставляемыми в тело пациента для направления кончика катетера к необходимому месту. Они также могут быть использованы с устройствами и другими инструментами, которые могут быть использованы для облегчения прохождения подобных устройств в сердечнососудистой и почечно-сосудистой системах, таких как оболочки и расширители. При необходимости вышеуказанные катетерные системы также могут быть использованы с толкательной проволокой для размещения кончика катетера.
[0129] Настоящее изобретение также обеспечивает создание способов применения катетеров, описанных в настоящем документе, для картирования распределения почечных нервов, включающих этапы применения электрической стимуляции при отслеживании изменений физиологических реакций, таких как давление крови и частота сердечных сокращений, для картирования распределения почечных нервов и идентификации зон абляции в почечных артериях для идеальной денервации почечных нервов. Эти способы включают активацию независимых электродов описанных катетеров для излучения электрического заряда, чтобы осуществлять стимуляцию расположенных ниже почечных нервов с отслеживанием физиологических реакций, таких как давление крови и частота сердечных сокращений; наличие изменений в физиологической реакции указывает на наличие расположенных ниже симпатических нервов в непосредственной близости от активируемого электрода и выше места абляции. Накапливание данных картирования может принять форму клинически полезного критерия относительно распределения почечных нервов, чтобы оказывать помощь лечащим специалистам при выполнении абляции.
[0130] В одном варианте реализации изобретения кончик указанного катетера при необходимости перемещают в кровеносном сосуде в соответствии с частным протоколом с тем, чтобы установить контакт с необходимыми участками полости почечной артерии. В одном варианте реализации изобретения применяемый при необходимости протокол для перемещения кончика катетера в указанном выше способе включает перемещение стимулирующей или абляционной части кончика катетера от половины почечной артерии ближе к внутренней части почки к половине почечной артерии ближе к аорте и выполнение одной или большего количества электрических стимуляций в каждой из этих половин.
[0131] Еще в одном варианте реализации изобретения применяемый при необходимости протокол для перемещения кончика катетера включает поворот стимулирующей или абляционной части кончика катетера внутри почечной артерии в следующей последовательности: (а) поворот от передней стенки к задней стенке артерии; (b) поворот от задней стенки к верхней стенке артерии и (с) поворот от верхней стенки к нижней стенке артерии, причем каждый поворот составляет 90° или менее. В одном варианте реализации изобретения одну или большее количество электрических стимуляций проводят после каждого поворота кончика катетера внутри почечной артерии.
[0132] В одном варианте реализации изобретения электрическая стимуляция выполняется с параметрами в следующих диапазонах:
(а) напряжение между 2 и 30 В; (b) сопротивление между 100 и 1000 Ом; (с) ток между 5 и 40 мА; (d) время проведения между 0,1 и 20 мс.
[0133] Настоящее изобретение также обеспечивает создание способа абляции почечных нервов для лечения заболеваний, вызванных системной гиперактивностью почечных нервов, включающий этапы, на которых: (а) применяют способ картирования, описанный в настоящем документе, для картирования почечных нервов; (b) подают радиочастотную энергию через катетер к конкретным участкам полости почечной артерии для абляции картированных почечных нервов и (с) снова выполняют стимуляцию для оценивания эффективности абляции. В дополнительных вариантах реализации изобретения, основанных на картировании почечных нервов, для абляции симпатических почечных нервов на стенках почечной артерии могут быть использованы иные методики проведения абляции, известные в данной области техники, например абляция с использованием энергии других типов, такой как лазерная энергия, сфокусированный ультразвук высокой интенсивности, или криоабляция.
[0134] Настоящее изобретение обеспечивает создание катетера, выполненного с возможностью применения в способе определения места расположения или идентификации функционального нерва, иннервирующего стенку кровеносного сосуда в объекте воздействия, содержащего стержень, причем проксимальный конец указанного стержня выполнен с возможностью соединения с источником энергии, а дистальный конец (кончик катетера) указанного стержня выполнен в виде одинарной спирали, двойной спирали или множества выступов, имеющей или имеющих один или большее количество электродов.
[0135] В одном варианте реализации изобретения указанный катетер содержит один или большее количество электродов, которые выполнены с возможностью излучения энергии, достаточной для стимуляции или абляции нерва на указанном сосуде. В дополнительном варианте реализации изобретения указанные электроды выполнены с возможностью активирования независимо друг от друга.
[0136] В одном варианте реализации изобретения указанный катетер выполнен в длину 1 и 2 м, причем длина кончика катетера составляет 2 и 8 см, а диаметр между 0,5 мм и 10 мм.
[0137] В одном варианте реализации изобретения указанный катетер содержит спиральные образованные витками компоненты или выступы, выполненные по форме по существу круглыми или плоскими, а электроды размещены на расстоянии друг от друга вдоль длины указанных образованных витками компонентов или выступов, причем указанные электроды встроены в указанные образованные витками компоненты или выступы или расположены на поверхности указанных образованных витками компонентов или выступов. В одном варианте реализации изобретения выступы соединены на дистальном конце. Еще в одном варианте реализации изобретения электроды равномерно размещены на расстоянии друг от друга вдоль длины указанных образованных витками компонентов под углом 90° или 120° относительно друг друга.
[0138] В одном варианте реализации изобретения указанный катетер имеет кончик, который выполнен с возможностью удержания баллона, выполненного с возможностью надувания с заполнением пространства внутри образованных витками компонентов указанной спирали или выступов.
[0139] Настоящее изобретение также обеспечивает создание способа применения катетера для определения места расположения или идентификации функционального нерва, иннервирующего стенку кровеносного сосуда в объекте воздействия, включающий этапы, на которых: а) вставляют указанный катетер в указанный кровеносный сосуд и активируют на катетере электроды для подачи энергии к одному или большему количеству мест на стенке указанного сосуда, достаточной для изменения одного или большего количества физиологических параметров, связанных с иннервацией указанного сосуда симпатическим или парасимпатическим нервом; и b) измеряют указанные один или большее количество физиологических параметров после каждой подачи энергии и определяют изменения в отношении соответствующих параметров, полученных без подачи энергии к указанному сосуду; причем отсутствие изменений указанных физиологических параметров на этапе b указывает на отсутствие функционального нерва в месте подачи энергии, значительное изменение указанных физиологических параметров на этапе b указывает на наличие функционального нерва в месте подачи энергии, а направление изменения указанных физиологических параметров на этапе b определяет, является ли нерв в месте подачи энергии симпатическим или парасимпатическим. Следует отметить, что отсутствие изменения означает, что изменение будет считаться специалистом в данной области техники как незначительное или статистически незначимое, и значительное изменение означает, что изменение будет считаться специалистом как значительное или статистически значимое.
[0140] В одном варианте реализации изобретения указанный сосуд представляет собой артерию, включая почечную артерию. В одном варианте реализации изобретения функциональный нерв имеет отношение к барорефлексу. В одном варианте реализации изобретения местом подачи энергии является область, в которой нерв был подвергнут абляции, причем отсутствие изменения указанных физиологических параметров на этапе b подтверждает абляцию нервов. Еще в одном варианте реализации изобретения используемым объектом воздействия является человек или животное, не являющееся человеком, (non-human animal). Еще в одном варианте реализации изобретения описанные физиологические параметры выбирают из давления крови, частоты сердечных сокращений, электрической активности сердца, мышечной активности, активности нервов, относящихся к скелету, биоэлектрического потенциала клеток, реакции зрачков, электромиограммы, сужения сосудов и уровней биохимий, выбранных из адреналина, норадреналина, ренин-ангиотензина II и вазопрессина. Еще в одном варианте реализации изобретения указанная энергия является регулируемой и представляет собой одну или большее количество из следующих энергий: электрическая, механическая, ультразвуковая, лучистая энергия, энергия оптического излучения и тепловая энергия. В одном варианте реализации изобретения указанная энергия вызывает стимуляцию нервов или абляцию нервов. Еще в одном варианте реализации изобретения функциональный нерв является симпатическим или парасимпатическим нервом. Еще в одном варианте реализации изобретения поданная энергия находится в следующих диапазонах: а) напряжение между 2 и 30 В; b) сопротивление между 100 и 1000 Ом; с) ток между 5 и 40 мА; a d) время подачи между 0,1 и 20 мс.
[0141] В одном варианте реализации изобретения катетер, применяемый для вставки в кровеносный сосуд, перемещают в нем в следующей последовательности: а) поворачивают на 90° или менее от передней стенки к задней стенке артерии; b) поворачивают на 90° или менее от задней стенки к верхней стенке артерии и с) поворачивают на 90° или менее от верхней стенки к нижней стенке артерии.
[0142] Как будет понятно специалистам в данной области техники, система и способ, раскрытые в настоящем документе, могут применяться при абляции нервов почечной артерии для прерывания пути прохождения барорефлекса, реализуемого через симпатическую и парасимпатическую нервные системы, однако их применение может быть распространено на любые находящиеся в теле иннервированные сосуды.
[0143] Настоящее изобретение будет лучше понято со ссылкой на экспериментальные данные, приведенные ниже, но специалистам в данной области техники будет понятно, что указанные конкретные примеры даны здесь только в целях иллюстрации и не предназначены для ограничения объема изобретения, который определен формулой изобретения, приведенной ниже.
[0144] Также следует отметить, что переходное выражение "содержащий" (comprising), которое синонимично выражениям "включающий", "содержащий" (containing) или "характеризующийся" (characterized by), является включающим или открытым и не исключает дополнительных, не перечисленных элементов или этапов способа.
ПРИМЕР 1
Определение мест расположения нервов, иннервирующих стенку артерии
[0145] Был разработан и в экспериментах над свиньями реализован способ определения мест расположения нервов, иннервирующих стенку артерии, посредством исследования изменений физиологических параметров после подачи подходящей дозы энергии. Целью настоящих экспериментов является следующее:
1. Испытание существующих в настоящее время абляционных катетеров для сердца (управляемый катетер для абляции и диагностики CELSIUS® RMT, 7F,B-Type, с расстоянием между электродами 2-5-2 мм производства компании Biosense Webster, Даймонд Бар, Калифорния 91765, США) и радиочастотного генератора (радиочастотный генератор STOCKERT 70, Model Stockert GmbH ЕР-SHUTTLE ST-3205 производства компании STOCKERT GmbH, Фрайбург, Германия) для картирования почечных нервов и абляции.
2. Испытание картирования почечных нервов посредством исследования изменений давления крови и частоты сердечных сокращений во время излучения электрической стимуляции в различные участки в полости левой и правой почечных артерий.
3. Определение безопасного диапазона радиочастотной энергии высокой частоты, которую необходимо подавать в почечные артерии для абляции почечных нервов, посредством исследования видимых изменений в стенках почечной артерии и гистологии.
4. Использование изменений давления крови и частоты сердечных сокращений в качестве показателей эффективности абляции почечных нервов во время почечной абляции.
[0146] Три свиньи (с массой тела от 50-52 кг) были подвергнуты анестезии посредством внутривенной инъекции фенобарбитала натрия с дозой 15 мг/кг. Физиологические параметры: отслеживались систолическое давление крови, диастолическое давление крови, среднее артериальное давление и частота сердечных сокращений. Схема эксперимента и порядок его проведения показаны на фигуре 8.
[0147] Для этих экспериментов использовались такой абляционный катетер, как управляемый катетер для абляции и диагностики CELSIUS® RMT, 7F,B-Type, с расстоянием между электродами 2-5-2 мм (производства компании Biosense Webster, Даймонд Бар, Калифорния 91765, США), и радиочастотный генератор Celsius (радиочастотный генератор STOCKERT 70, Model Stockert GmbH ЕР-SHUTTLE ST-3205 производства компании STOCKERT GmbH, Фрайбург, Германия).
[0148] Исходные уровни систолического, диастолического и среднего артериального давления крови и частоты сердечных сокращений были измерены перед подачей электрической энергии к различным областям стенки почечной артерии. Среднее артериальное давление крови и частота сердечных сокращений затем была измерена в промежутке времени от 5 с до 2 мин после подачи энергии для определения эффектов воздействия. С учетом того, что значительное изменение давления крови и частоты сердечных сокращений должно быть связано с нервной стимуляцией, было установлено, что хотя иннервированный участок стенки артерии для каждого подопытного животного был разным, способ, описанный в настоящем документе, позволил правильно определить места расположения этих областей для каждого животного, что позволило получить карту иннервированных зон в почечной артерии.
ПРИМЕР 2
Взаимосвязь между физиологическими параметрами и нервами, иннервирующими стенку артерии
[0149] В целях демонстрации того, что энергия, поданная к различным местам на стенке артерии, может по-разному воздействовать на физиологические параметры, такие как давление крови и частота сердечных сокращений, и такие характеристики могут учитываться для идентификации типа нерва, иннервирующего стенку артерии, подавали электрическую энергию к иннервированным областям на стенках почечной артерии модели используемого животного согласно нескольким стратегиям. Подробно параметры электрической энергии, поданной для свиней №1, №2 и №3 приведены в Таблице 1, Таблице 2 и Таблице 3 соответственно.
[0150] Для свиньи №1 проводились четыре отдельные стимуляции в левой почечной артерии, и две отдельные стимуляции были выполнены в правой почечной артерии. В качестве подготовительных действий на брюшную сторону левой почечной артерии были поданы две отдельные дозы электрической энергии: одна к передней стенке и одна к задней стенке артерии. На почечную сторону левой почечной артерии были поданы две отдельные дозы электрической энергии: одна к передней стенке и одна к задней стенке артерии. Наблюдались различные воздействия этих доз энергии на давление крови и частоту сердечных сокращений. В правой почечной артерии одна доза электрической энергии была подана к почечной артерии на брюшной стороне и почечной стороне соответственно. Такой же порядок стимуляции была применен для свиньи №2 и свиньи №3.
[0151] Электрические энергии, поданные к различным местам в почечной артерии, у всех подопытных свиней по-разному влияли на систолическое давление крови, диастолическое давление крови, среднее давление крови и частоту сердечных сокращений. Например, в качестве реакции на электрическую энергию, поданную к левой почке, максимальное изменение в систолическом давлении крови составило соответственно 19,5 мм рт. ст. и 29 мм рт. ст. для свиньи №1 и свиньи №3; минимальное изменение систолического давления крови составило соответственно 2 мм рт. ст. и 1 мм рт. ст. для свиньи №1 и свиньи №3. При этом для свиньи №2 изменения в систолическом давлении крови были согласованными, когда подавали электрическую энергию либо к стороне брюшной аорты, либо к почечной стороне. Кроме того, место стимуляции, которое вызвало максимальное воздействие или минимальное воздействие, отличалось у каждого животного, что доказывало несогласованность распределения автономных почечных нервов для каждого животного. Эти показания систолического давления крови, диастолического давления крови, среднего артериального давления крови и частоты сердечных сокращений во время подачи электрической энергии к стенке левой почечной артерии наблюдались и далее сводились в Таблицы 4А, 4В, 4С и 4D соответственно. Подобные показания систолического давления крови, диастолического давления крови, среднего артериального давления крови и частоты сердечных сокращений во время электрической стимуляции в правой почечной артерии также наблюдались и далее сводились в Таблицы 5А, 5В, 5С и 5D соответственно.
[0152] Эти данные обеспечили доказательную базу для представления об определении места расположения и идентификации нервов, иннервирующих стенку артерии - в частности того, что существенная физиологическая реакция, в этом случае, максимальное повышение или понижение измеренного давления крови, была вызвана подачей электрической энергии посредством катетера, размещенного в таком определенном месте, в котором есть много ответвлений почечных нервов. Усредненные данные (среднее значение + стандартное отклонение), вычисленные из Таблицы 4A-D и Таблицы 5A-D, представлены графически на фигуре 9 и фигуре 10, включая все зависимые от них фигуры.
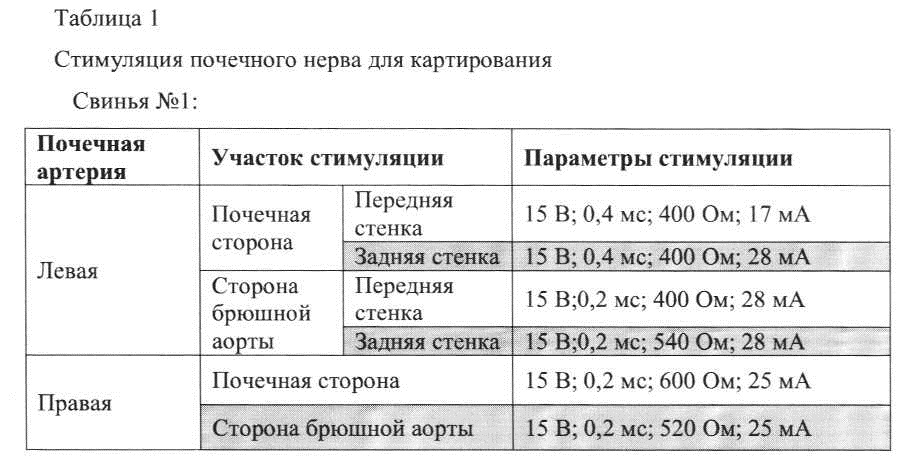









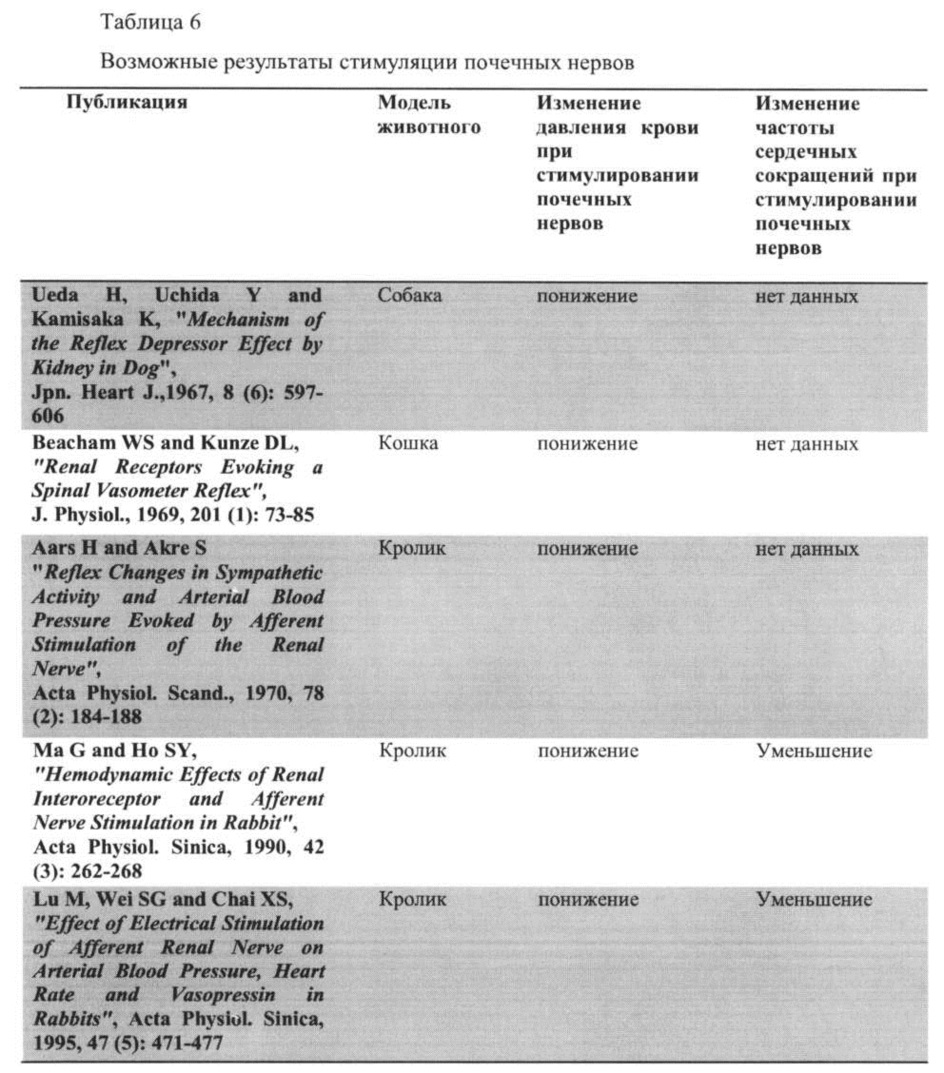
[0153] Во время всех этих экспериментов по стимуляции, проведенных на свиньях согласно описанному выше протоколу, определенные места в стенке почечной артерии обусловили значительное уменьшение частоты сердечных сокращений без изменений давления крови, или изменение давления крови было минимальным по сравнению с уменьшением частоты сердечных сокращений (фигура 11). Часто регистрировалось небольшое понижение давления крови, особенно диастолическое давление крови. Из 56 точек экспериментальных данных, включая все из 4 физиологических параметров, оцениваемых при проведении экспериментов, была по меньшей мере одна точка экспериментальных данных от каждого физиологического параметра, которая показывала реакцию на поданную дозу энергии падением или отсутствием/незначительным изменением значения; это относится более чем к 23% точкам данных этого эксперимента. Оказалось, что эти отличительные физиологические изменения в качестве реакции на стимуляцию указывают на парасимпатическую природу нервов, иннервирующих эти места, которые отличаются от изменений, вызываемых симпатическими нервами, иннервирующими эти места, что приводит к повышению давления крови и увеличению частоты сердечных сокращений при стимуляции. В Таблице 6 приведен общий результат подачи подходящей дозы энергии к афферентному почечному нерву при различных исследованиях, включающих модели на животных, таких как собаки, крысы и кролики. В сочетании с настоящим изобретением исследования согласно Таблице 6 показали, что вполне возможно вызывать эффекты наподобие парасимпатической активности, когда к нервам, иннервирующим почку, подается подходящая доза энергии. Иными словами, есть признаки того, что в схеме нервов почечной артерии существуют нервы, которые могут вызывать парасимпатическую активность, а не симпатическую активность и, следовательно, не должны быть подвергнуты абляции при лечений заболеваний, связанных с давлением крови.
ПРИМЕР 3
Обеспечение направления энергии к целевому нерву во время абляции
[0154] Согласно приведенным ниже исследованиям для определения места расположения и идентификации нервов в стенке артерии также была произведена подача энергии в дозированном количестве, подходящем для абляций, к иннервированным зонам в стенке почечной артерии тех же самых свиней. По четыре абляции было выполнено в левой и правой почечных артериях начиная от почечной стороны и с перемещением к стороне брюшной аорты, в порядке движения от передней, к задней, к верхней, а затем к нижней стенке; каждая абляция выполнялась на расстоянии не более 5 мм от места предыдущей абляции, и поворачивали головную часть электрода (кончик катетера) абляционного катетера на 90° после каждой абляции. Согласно опубликованным источникам (Крум (Krum) 2009, 2010) для почечной абляции необходимо было использовать небольшой уровень энергии (5-8 Вт); поэтому для почечной абляции было использовано 5 Вт и 8 Вт. Для абляции левой почечной артерии уровень подведенной энергии составил 5 Вт, а продолжительность абляции составила 120 с; для правой почечной артерии, уровень подведенной энергии абляции составил 8 Вт, а продолжительность составила 120 с. Измеренная температура на участке абляции составила от 40°C до 50°C. Физиологические параметры: во время абляций проверялись систолическое давление крови, диастолическое давление крови, среднее артериальное давление и частота сердечных сокращений. Полученные данные явно показали, что абляция в разных местах в почечной артерии привела к разным изменениям давления крови и частоты сердечных сокращений, а также продемонстрировали, что изменения физиологических параметров, таких как давление крови и частота сердечных сокращений, могут быть использованы в качестве индикаторов точки подачи энергии абляции к целевому нерву, и предоставили дополнительные доказательства того, что распределение нервов в стенке артерии меняется в зависимости от конкретного случая.
[0155] Суммарные показатели изменения систолического давления крови, диастолического давления крови, среднего артериального давления и частоты сердечных сокращений во время четырех отдельных почечных абляций в почечных артериях левой почки приведены на фигурах 12А, 12В, 12С и 12D соответственно. Суммарные показатели изменений систолического и диастолического артериального давления, среднего артериального давления и частоты сердечных сокращений во время четырех отдельных почечных абляций в почечных артериях правой почки приведены на фигурах 13А, 13В, 13С и 13D соответственно.
ПРИМЕР 4
Результаты экспериментальной абляции хронических почечных нервов
[0156] Эта совокупность экспериментов охватывает способы определения профиля безопасности уровней энергии, используемых в существующих абляционных катетерах для сердца при денервации почечных нервов. На фигуре 14 описаны детали этого эксперимента.
[0157] Для этих экспериментов использовались такой абляционный катетер, как управляемый катетер для абляции и диагностики CELSIUS® RMT, 7F,B-Type, с расстоянием между электродами 2-5-2 мм (производства компании Biosense Webster, Даймонд Бар, Калифорния 91765, США), и радиочастотный генератор Celsius (радиочастотный генератор STOCKERT 70, Model Stockert GmbH ЕР-SHUTTLE ST-3205 производства компании STOCKERT GmbH, Фрайбург, Германия). При исследовании было использовано четыре свиньи.
[0158] Уровни энергии, используемые для выполненных абляций, были следующими: Абляция правой почечной артерии, 8 Вт, 120 с; Абляция левой почечной артерии 16 Вт, 120 с (n=3). Абляция правой почечной артерии, 16 Вт, 120 с; Абляция левой почечной артерии, 8 Вт, 120 с (n=3).
[0159] Свиньям была выполнена анестезия, и были выполнены 4-5 почечных абляций для каждой почечной артерии (правой и левой) по отдельности. Была выполнена почечная ангиография до и после абляции, чтобы изучить проходимость почечных артерий. Была обеспечена возможность выздоровления свиней после проведенных операций. Для определения безопасных уровней энергии абляции одна свинья (правая почечная артерия, 16 Вт, 120 с; абляция левой почечной артерии, 8 Вт, 120 с) была предназначена для оценки острых повреждений вследствие двух различных уровней энергии абляции. Через двенадцать недель после операции абляции была выполнена ангиография в отношении животных для обеих почечных артерий. После этого животные были умерщвлены, и почечные артерии и почки исследовали на наличие видимых аномалий; были сделаны фотографии с целыми и разрезанными почечными артериями с обеими почками, разрезанными в продольном направлении. Образцы из обеих почечных артерий были собраны для последующих гистологических исследований согласно гистологическим картам, как показано на фигуре 15.
ПРИМЕР 5
Конструкции катетеров для почечного картирования
[0160] В настоящем документе раскрыты новые катетеры, выполненные имеющими функции стимуляции, картирования, абляции и ангиографии.
[0161] Катетерное устройство содержит удлиненный катетер, имеющий кончик на дистальном конце, который после вставки должен сохранять статическое положение в почечно-сосудистой архитектуре; проксимальный конец и множество абляционных электродов. В одном варианте реализации изобретения абляционные электроды равномерно размещены на расстоянии друг от друга по длине кончика удлиненного катетера. Множество этих абляционных электродов размещены на расстоянии друг от друга от проксимального конца и от дистального конца кончика удлиненного катетера посредством электрически непроводящих частей. В одном варианте реализации изобретения первый электрод на стороне кончика катетера или на концевой стороне катетера может быть использован в качестве контрольного средства стимуляции для любых других электродов при выполнении электрической стимуляции; в альтернативном варианте реализации изобретения любой из этих электродов может быть использован в качестве контрольного средства для других электродов.
[0162] В одном варианте реализации изобретения кончик удлиненного катетера имеет спиральную форму.
[0163] Еще в одном варианте реализации изобретения осуществляют подсоединение одного или большего количества соединительных проводов, и на указанное множество электродов подают постоянный или переменный электрический ток посредством одного или большего количества соединительных проводов. Управляющее устройство выполнено с возможностью управления электрическим током на множестве электродов независимым образом или одновременно, пока кончик катетера сохраняет в почечной артерии статическое положение.
[0164] Еще в одном варианте реализации изобретения осуществляют подсоединение одного или большего количества соединительных проводов, и на указанное множество электродов подают радиочастотную (RF) энергию, которая представляет собой однополярную радиочастотную энергию или биполярную радиочастотную энергию. Радиочастотный генератор подает энергию на указанное множество электродов посредством одного или большего количества соединительных проводов. Управляющее устройство выполнено с возможностью управления источником энергии для подачи энергии на указанное множество электродов независимым образом, в последовательном порядке или одновременно, пока кончик катетера сохраняет в почечной артерии статическое положение.
[0165] Управление радиочастотной энергией, подаваемой к электродам, может осуществляться таким образом, что электродами генерируются только низкоуровневые импульсы электрической энергии, чтобы осуществлять только стимулирование нижележащей нервной ткани и, в частности, тканей почечных нервов. В альтернативном варианте реализации изобретения управление радиочастотной энергией, подаваемой к электродам, может осуществляться таким образом, что электродами генерируются более мощные импульсы электрической энергии для абляции нижележащей нервной ткани и, в частности, тканей почечных нервов. Кончик катетера, а в частности электроды, разработаны с возможностью сохранения контакта с полостью почечной артерии, в одном и том же месте, на протяжении стимуляции и абляции.
[0166] Еще в одном варианте реализации изобретения катетер выполнен с возможностью использования с радиочастотными генераторами, применяющимися в настоящее время на практике при абляции сердечной ткани. Эти радиочастотные генераторы могут включать, помимо прочего, генераторы, производящиеся в настоящее время компаниями Medtronic, Cordis/Johnson & Johnson, St. Jude Medical и Biotronic.
[0167] Примерные варианты реализации данного изобретения, как подробно описано ниже, обеспечивают возможность создания устройств для денервации почечных нервов.
[0168] Фигуры 3-7 представляют собой примеры и иллюстрации этих абляционного катетера и электродов. Показаны вертикальная проекция, вид в разрезе и вид с конца дистального участка кончика абляционного катетера согласно различным вариантам реализации настоящего изобретения.
[0169] В одном варианте реализации изобретения катетер имеет удлиненный кончик спиральной формы. Множество электродов равномерно размещены на расстоянии друг от друга начиная от их размещения на проксимальном конце кончика катетера через дистальный конец кончика катетера посредством электрически непроводящих частей.
[0170] В некоторых вариантах реализации изобретения кончик абляционного катетера содержит одинарную спираль. В других вариантах реализации он состоит из двойной спирали. Образованный витками компонент или образованные витками компоненты спирали или спиралей кончика катетера может или могут быть либо круглым или круглыми, либо плоским или плоскими. Электроды могут быть размещены равномерно по длине образованных витками компонентов; например, они могут быть размещены на расстоянии друг от друга под углом 60°, 90° или 120°, но могут быть размещены по другой схеме или разделены под различными углами.
[0171] В одном варианте реализации изобретения электроды могут быть выполнены по форме либо плоскими и прямоугольными, либо квадратными, если образованный витками компонент спирали выполнен имеющим плоскую форму. В альтернативном варианте реализации изобретения электроды могут быть выполнены круглыми и/или образовывать спираль, если образованный витками компонент выполнен круглым. Еще в одном варианте реализации изобретения кончик катетера имеет длину от 2,0 см до 8,0 см и диаметр от 0,5 мм до 10,0 мм; диаметры образованного витками компонента могут варьироваться от 3,0 мм до 7,5 мм; расстояния от каждого образованного витками компонента могут варьироваться от 4 мм до 6 мм; и полностью развернутые длины образованных витками компонентов могут варьироваться от 31 мм до 471 мм; общая длина катетера составляет от 1 м до 2,0 мм.
[0172] Еще в одном варианте реализации изобретения кончик абляционного катетера содержит баллонную катетерную систему. В одном варианте реализации изобретения электроды равномерно размещены на расстоянии друг от друга с интервалами вдоль спирального образованного витками компонента, который выполнен по форме либо круглым, либо плоским и обернутым вокруг баллона; еще в одних вариантах реализации изобретения электроды размещены на расстоянии друг от друга вдоль устройства, реализованного в виде зонтичного каркаса, который выполнен по форме либо круглым, либо плоским и обернутым по длине баллона. В некоторых вариантах реализации изобретения устройство, реализованное в виде зонтичного каркаса, имеет открытый конец, а в других закрытый конец. Электроды будут вступать в контакт с почечной архитектурой при надувании баллонного устройства. В одном варианте реализации изобретения кончик катетера имеет длину от 2,0 см до 8,0 см и диаметр от 0,5 мм до 10,0 мм, когда баллон не надут; диаметры образованного витками компонента могут варьироваться от 3,0 мм до 8 мм; расстояния от каждого образованного витками компонента могут варьироваться от 4 мм до 6 мм; количество образованных витками компонентов могут варьироваться от 3,3 до 20; и полностью развернутые длины образованных витками компонентов могут варьироваться от 31 мм до 471 мм. общая длина катетера составляет от 1 м до 2,0 м.
[0173] В одном варианте реализации изобретения диаметр кончика катетера, когда баллон надут, может находиться в диапазоне от 0,5 мм до 10 мм. Диаметр образованного витками компонента вокруг баллона может находиться в диапазоне от 3 мм до 10 мм, а диаметр полностью надутого баллона составляет от 3 мм до 10 мм.
[0174] Изобретение также может содержать кончик катетера в форме трубки, цилиндрической формы и саморасширяющийся с регулируемыми размерами. Материалы, использованные для этих кончиков катетера, в некоторых вариантах реализации изобретения могут содержать сплав никеля и титана (нитинол).
[0175] В одном варианте реализации этого изобретения раскрыты процессы модуляции и абляции почечных нервов (либо на левой стороне почки, либо на правой стороне почки, либо на обеих сторонах) включают вставку одного из катетеров, описанных выше, либо в левую почечную артерию (LRA), либо в правую почечную артерию (RRA) после чего следует картирование почечных нервов, как по существу описано выше, и после этого проводится целевая абляция отдельными электродами.
[0176] В одном варианте реализации изобретения стимуляция нерва осуществляется при следующих параметрах: 0,1-20 мс, 2-30 В, 5-40 мА и 100-1000 Ом. В одном варианте реализации изобретения абляция нервов осуществляется при следующих параметрах: менее 12 В и 30-180 с.
ЛИТЕРАТУРА
1. Aars, Н. and Акте, S., (1970), Reflex Changes in Sympathetic Activity and Arterial Blood Pressure Evoked by Afferent Stimulation of the Renal Nerve, Acta Physiol. Scand., 78 (2): 184-188.
2. Beacham, W.S. and Kunze, D.L., (1969), Renal Receptors Evoking a Spinal Vasometer Reflex, J. Physiol., 201 (1): 73-85.
3. Campese, V.M., Kogosov, E., (April 1995), Renal afferent denervation prevents hypertension in rats with chronic renal failure, 25 (4 Pt. 2): 878-882.
4. Campese, V.M. and Krol, E., (June 2002), Neurogenic factors in renal hypertension, Current Hypertension Reports, 4 (3): 256-260.
5. Converse, R.L. Jr., Jacobsen, T.N., Toto, R.D., Jost, С.М., Cosentino, F., Fouad-Tarazi, F., Victor, R.G., (December 1992), Sympathetic overactivity in patients with chronic renal failure, New England Journal of Medicine, 327 (27): 1912-1918.
6. Dibona, Gerald F. and Ulla С.Kopp, (January 1997), Neural Control of Renal Function, Physiological Reviews, 77 (1): 75-197.
7. DiBona, G.F. (2003), Neural control of the kidney: past, present and future, Hypertension, 41: 621-624.
8. Esler, M., Jennings, G., Lambert, G., Meredith, I., Home, M., Eisenhofer, G., (October 1990), Overflow of catecholamine neurotransmitters to the circulation: source, fate, and functions, Physiological Reviews, 70 (4): 963-985.
9. Esler, M., Schlaich, M., Sobotka, P. et al., (2009), Catheter-based renal denervation reduces total body and renal noradrenaline spillover and blood pressure in resistant hypertension, Journal of Hypertension, 27(suppl 4): s167.
10. Esler, M. et al., (December 4, 2010), Renal sympathetic denervation in patients with treatment-resistant hypertension (The Symplicity HTN-2 Trial): a randomized controlled study, The Lancet, 376: 1903-1909.
11. Krum, H., Schlaich, M., Whitbourn, R., Sobotka, P.A., Sadowski, J., Krzysztof, Bartus, K., Kapelak, В., Walton, A., Sievert, H., Thambar, S., Abraham, W.T. and Esler, M., (April 2009), Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study, The Lancet, 373 (9671): 1275-1281.
12. Lu, M., Wei, S.G. and Chai, X.S., (1995), Effect of Electrical Stimulation of Afferent Renal Nerve on Arterial Blood Pressure, Heart Rate and Vasopressin in Rabbits, Acta Physiol. Sinica, 47 (5): 471-477.
13. Ma, G. and Ho, S.Y., (1990), Hemodynamic Effects of Renal Interoreceptor and Afferent Nerve Stimulation in Rabbit, Acta Physiol. Sinica, 42 (3): 262-268.
14. Mahfoud, F., Schlaich, M., Kindermann, I., Ukena, C, Cremers, В., Brandt, M.C., Hoppe, U.C., Vonend, O., Rump, L.C., Sobotka, P.A., Krum, H., Esler, M. and Böhm, M., (May 10, 2011), Effect of Renal Sympathetic Denervation on Glucose Metabolism in Patients With Resistant Hypertension: A Pilot Study, Circulation 123 (18): 1940-1946.
15. Medical devices: pg 1-2, February 22, 2012.
16. Schlaich, M.P., Sobotka, P.A., Krum, H., Lambert, E. and Esler, M.D., (August 27, 2009), New England Journal of Medicine, 36 (9): 932-934.
17. Schlaich, M.P., Krum, R, Whitbourn, R. et al., (2009), A novel catheter based approach to denervate the human kidney reduces blood pressure and muscle sympathetic nerve activity in a pateitn with end stage renal disease and hypertension. Journal of Hypertension, 27 (suppl 4): s154.
18. Smithwick, R.H. and Thompson, J.E., (August 15, 1953), Splanchnicectomy for essential hypertension; results in 1,266 cases. J Am Med Association, 152 (16): 1501-1504.
19. Talenfeld, A.D., Schwope, R.B., Alper, H.J., Cohen, E.I. and Lookstein, R.A., (June 2007), MDCT Angiography of the Renal Arteries in Patients with Atherosclerotic Renal Artery Stenosis: Implications for Renal Artery Stenting with Distal Projection, American Journal of Roentgenology, 188: 1652-1658.
20. Ueda, H., Uchida, Y. and Kamisaka, K., (1967), Mechanism of the Reflex Depressor Effect by Kidney in Dog, Jpn. Heart J., 8 (6): 597-606.
21. Valente, J.F., Dreyer, D.R., Breda, M.A., Bennett, W.M., (January 2001), Laparoscopic renal denervation for intractable ADPKD-related pain. Nephrology Dialysis Transplantation, 16 (1): 160.
22. Vigilance D.W., Mutrie C.J., Yi G.H., Yu K., Guo A., Gelfand M., Smith C.R., Oz M.C., Levin H., Wang J., (2005), A novel approach to increase total urine output in acute heart failure: unilateral renal nerve blockade. Journal of the American College of Cardiology Supplement 2005, 45 (3): 166A.
23. Wang, J., Mapping sympathetic nerve distribution for renal ablation and catheters for the same, US patent application no. 2011/0306851 Al, filed August 26, 2011.
24. Ye, S., Zhong, H., Yanamadala, V., Campese, V.M., (August 2002), Renal injury caused by intrarenal injection of phenol increases afferent and efferent sympathetic nerve activity, American Journal of Hypertension, 15 (8): 717-724.
Реферат
Группа изобретений относится к области медицины и медицинской техники. Система содержит: катетер, выполненный с возможностью подачи электрического тока на внутреннюю стенку почечной артерии для стимуляции нерва, иннервирующего почечную артерию; измерительное устройство для измерения физиологических параметров, связанных с иннервацией почечной артерии; вычислительное устройство, связанное с измерительными устройствами для вычисления значений физиологических параметров; отображающее устройство для идентификации парасимпатического или симпатического нерва, иннервирующего внутреннюю стенку почечной артерии. Для картирования нерва, иннервирующего стенку почечной артерии, катетер вводят в полость артерии таким образом, что кончик катетера контактирует с участком, расположенным на внутренней стенке почечной артерии. Измеряют значения физиологических параметров перед приложением электрического тока. Осуществляют стимуляцию. При этом управляют электрическим током таким образом, что он имеет значение, достаточное для выявления изменений физиологических параметров. Измеряют значения физиологических параметров в конкретный интервал времени и идентифицируют участок как имеющий симпатический нерв или участок как имеющий парасимпатический нерв. Изобретение позволяет повысить достоверность исследования, что достигается за счет идентификации участков с симпатической или парасимпатической иннервацией. 3 н. и 13 з.п. ф-лы, 15 ил., 6 табл., 5 пр.
Формула
Документы, цитированные в отчёте о поиске
Устройство для местного теплового лечения ткани

Комментарии