Способ диагностики состояния кожи пациента (варианты) - RU2466680C1
Код документа: RU2466680C1
Чертежи





Описание
Изобретение относится к области биофармакологии, биотехнологии, медицины и косметологии и может быть использовано в лечебно-профилактических учреждениях косметологического профиля.
Решение проблемы эффективной и безопасной коррекции возрастных изменений кожи является одной из важных задач современной дерматокосметологии. В настоящее время в практике эстетической медицины используют большой арсенал методов коррекции возрастных изменений кожи лица и тела - это мезотерапия, биоревитализация, пилинги, фракционный фототермолиз, радиоволновое воздействие, дермаабразия и другие методы. Основная цель применения этих методов - стимуляция функциональной активности фибробластов - главного клеточного компонента дермы, отвечающего за продукцию, организацию и обновление ее межклеточного матрикса.
Известно, что одной из причин старения кожи является уменьшение в ней содержания фибробластов и снижение их биосинтетической активности. Очевидно, что целенаправленное воздействие на дерму на клеточном уровне будет способствовать как ремоделированию ее межклеточного матрикса, так и эффективной коррекции визуальных дефектов кожи.
Практика использования современных косметологических процедур и методов, направленных на коррекцию морщин и других возрастных дефектов кожи, показывает, что их применение является эффективным, а в ряде случаев и безопасным, только при учете индивидуальных особенностей кожи пациента. Современные методы оценки состояния кожи, особенно на клеточном уровне, недостаточно эффективны и обладают малой практической значимостью.
Известен способ анализа процесса старения клеток путем идентификации изменений биологических параметров клеток, например характеристик клеточного метаболизма под действием факторов старения [патент GB 2395489, МПК C12N 5/06]. Этот способ включает протеомные, геномные или транскриптомные исследования или их комбинации с последующим сравнением полученных результатов таких исследований для «молодых» клеток, т.е. взятых у молодого донора с малым числом пассажей культивирования in vitro или клеток, полученных из ткани с минимальной экспозицией, УФ-облучения, и «старых» клеток, полученых от пожилых доноров или клеток с большим числом пассажей in vitro или клеток из ткани, подвергшейся высокой степени воздействия УФ-облучения и клеточных культур, помещенных в трехмерный матрикс, имитирующих биологическую ткань (соединительную, эпителиальную, эпидермальную и т.д.). Этот способ предлагается использовать для скрининговых исследований по поиску лекарственных средств, способных модулировать метаболические процессы в стареющих клетках.
К недостаткам данного способа относится сложность его выполнения, требующая высокой квалификации персонала и наличие специального дорогостоящего оборудования, что затрудняет рутинное применение метода, особенно в практике эстетической медицины. Кроме того, данное изобретение ограничивается исследованием только клеток in vitro и не может быть использовано для характеризации состояния клеточной популяции ткани in vivo, из которой данные клетки были выделены и, следовательно, не может быть использовано для диагностики ткани на клеточном уровне и прогноза последующей терапии.
Известен способ определения колониеобразующих единиц (KOE) эндотелиальных прогениторных клеток путем характеризации клеточного препарата для применения в регенеративной медицине или клинической трансплантологии [заявка WO 2008110570, МПК G01N 33/50, C12N 5/06]. В заявке описан метод анализа степени влияния веществ и условий проведения анализа на величину КОЕ эндотелиальных прогениторных клеток для его последующего использования в качестве скринингового теста на выявление позитивного или негативного влияния отдельных веществ на пролиферацию эндотелиальных прогениторных клеток. Этот способ включает эксплантацию исходных клеток в подходящей среде с плотностью, исключающей контактное ингибирование роста клеток, последующее инкубирование клеток в течение нескольких дней и проведение анализа образовавшихся колоний. Анализ колоний проводили путем их окрашивания, подсчета и ранжирования по размеру на две группы - колонии клеток с высоким пролиферативным потенциалом (колонии больше определенного порогового значения, равного, в зависимости от состава среды, 2 или 4 мм) и колонии с нормальным и низким пролиферативным потенциалом (равным или меньше порогового значения).
Недостатком данного способа является то, что способ ограничивается лишь анализом эндотелиальных прогениторных клеток: эндотелиальные клетки пупочного канатика человека (HUVEC); эндотелиальные клетки микрососудов человека. Также это изобретение ограничивается исследованием только клеток in vitro и не может быть использовано для характеризации состояния клеточной популяции ткани in vivo, из которой данные клетки были выделены и, следовательно, не может быть использовано для диагностики ткани на клеточном уровне и прогноза последующей терапии.
Известен способ анализа популяции фибробластов из кожно-мышечной ткани 7-8-недельных эмбрионов человека [патент RU 2017818, МПК C12N 5/02], включающий трипсинизацию клеток, их эксплантацию и инкубацию в питательной среде с последующим подсчетом веретеновидных, парусовидных и плеоморфных клеток.
В этом способе исследуют постнатальные культуры дермальных фибробластов на предмет митотической активности клеток путем подсчета колоний с определенным количеством и плотностью клеток.
К недостаткам данного способа следует отнести его трудоемкость, потребность в использовании специального инструментального обеспечения, субъективный и качественный характер получаемых результатов, затрудняющий их интерпретацию и ограничивающий их практическое применение.
Задачей, на решение которой направлено предлагаемое изобретение, является разработка универсального способа диагностики состояния популяции фибробластов кожи пациента и расширение диагностических возможностей определения состояния кожи для повышения эффективности и безопасности последующих косметических процедур.
Для решения поставленной задачи способ диагностики состояния кожи пациента характеризуется тем, что включает исследование параметров, характеризующих колонии фибробластов, заключающееся в определении эффективности колониеобразования в качестве параметра, определяющего регенераторный потенциал клеток и процентных долей плотных и диффузных колоний в клеточной культуре в качестве параметров, определяющих пролиферативный потенциал клеток, при этом среднее (нормальное) значение эффективности колониеобразования принимают для мужчин, равным 45-49%, а для женщин, равным 36-45%, среднее значение процентной доли плотных колоний принимают для мужчин, равным 44-54%, а для женщин, равным 40-50%, среднее значение процентной доли диффузных колоний принимают для мужчин, равным 20-25%, а для женщин, равным 30-40%, причем при значении эффективности колониеобразования ниже 45% для мужчин и ниже 36% для женщин диагностируют низкий регенераторный потенциал, при значении эффективности колониеобразования в интервале 45-49% для мужчин и 36-45% для женщин диагностируют нормальный регенераторный потенциал, а при значении эффективности колониеобразования выше 49% для мужчин и выше 45% для женщин диагностируют высокий, регенераторный потенциал, и при значении процентной доли плотных колоний ниже 44% и процентной доли диффузных колоний выше 25% для мужчин и процентной доли плотных колоний ниже 40% и процентной доли диффузных колоний выше 40% для женщин диагностируют низкий пролиферативный потенциал, при значении процентной доли плотных колоний в интервале 44-54% и процентной доли диффузных колоний в интервале 20-25% для мужчин и процентной доли плотных колоний в интервале 40-50% и процентной доли диффузных колоний в интервале 30-40% для женщин диагностируют нормальный пролиферативный потенциал, а при значении процентной доли плотных колоний выше 54% и процентной доли диффузных колоний ниже 20% для мужчин и процентной доли плотных колоний выше 50% и процентной доли диффузных колоний ниже 30% для женщин диагностируют высокий пролиферативный потенциал.
В частном варианте эффективность колониеобразования рассчитывают как процентное отношение образовавшихся колоний с числом клеток больше 20 к общему количеству эксплантированных клеток.
В другом частном варианте для получения объективной, статистически значимой информации значения параметров, характеризующих колонии фибробластов, определяют с использованием средств вычислительной техники, статистического анализа и математического моделирования.
Также для решения поставленной задачи способ диагностики состояния кожи пациента характеризуется тем, что включает исследование параметров, характеризующих колонии фибробластов, заключающееся в определении эффективности колониеобразования в качестве параметра, определяющего регенераторный потенциал клеток, процентных долей плотных, диффузных и смешанных колоний в культуре клеток и показателя пролиферации в качестве параметра, определяющего пролиферативный потенциал клеток, при этом среднее значение эффективности колониеобразования принимают для мужчин, равным 45-49%, а для женщин, равным 36-45%, среднее значение показателя пролиферации принимают для мужчин, равным 2,0-2,4, а для женщин, равным 1,8-2,0, причем при значении эффективности колониеобразования ниже 45% для мужчин и ниже 36% для женщин диагностируют низкий регенераторный потенциал, при значении эффективности колониеобразования в интервале 45-49% для мужчин и 36-45% для женщин диагностируют нормальный регенераторный потенциал, а при значении эффективности колониеобразования выше 49% для мужчин и выше 45% для женщин диагностируют высокий регенераторный потенциал, и при значении показателя пролиферации ниже 2,0 для мужчин и ниже 1,8 для женщин диагностируют низкий пролиферативный потенциал, при значении показателя пролиферации в интервале равным 2,0-2,4 для мужчин и 1,8-2,0 для женщин диагностируют нормальный пролиферативный потенциал, а при значении показателя пролиферации выше 2,4 для мужчин и выше 2,0 для женщин диагностируют высокий пролиферативный потенциал.
В частном варианте эффективность колониеобразования рассчитывают как процентное отношение образовавшихся колоний с числом клеток больше 20 к общему количеству эксплантированных клеток.
В другом частном варианте показатель пролиферации определяют по формуле
ПП=[1(ДД)+2(ДС)+3(ДП)]/100%,
где ПП - показатель пролиферации;
ДД - процентная доля диффузных колоний, (%);
ДС - процентная доля смешанных колоний, (%);
ДП - процентная доля плотных колоний, (%).
В другом частном варианте для получения объективной, статистически значимой информации значения параметров, характеризующих колонии фибробластов, определяют с использованием средств вычислительной техники, статистического анализа и математического моделирования.
Для проведения диагностики состояния популяции дермальных фибробластов кожи пациента были определены средние значения параметров колоний дермальных фибробластов пациентов.
В исследование была включена группа пациентов с признаками возрастных изменений кожи лица (наличие морщин, снижение упругости кожи), состоящая из 50 человек, из которых 35 женщин и 15 мужчин.
Исследование кожи лица для определения таких характеристик, как текстура кожи, количество и глубина морщин, уровень микрогемоциркуляции, проводили с помощью инструментальных методов исследования кожи:
- исследование гемомикроциркуляции кожи посредством лазерной допплеровской флоуметрии (лазерный анализатор кровотока ЛАКК-01, НПО «Лазма», Россия);
- исследование механических показателей кожи посредством вакуумного кутометра (Cutometer МРА 580, Courage + Khazaka electronic GmbH, Германия);
- общее исследование микрорельефа и визуальных показателей кожи посредством фотометрической системы (VISIA, Proctor&Gamble Со, США).
После применения инструментальных методов исследования кожи определяли параметры, характеризующие колонии дермальных фибробластов.
Для этого проводили забор биоптата и культивирование клеток.
Все процедуры проводили согласно разрешенной к применению Росздравнадзором РФ медицинской технологии «Забор, транспортировка, выделение, культивирование, криоконсервирование, хранение и использование аутологичных фибробластов для коррекции возрастных и рубцовых дефектов кожи» (разрешение ФС №2009/398).
Биопсию кожи размером 3-5 мм3 проводили при отсутствии у пациентов противопоказаний с помощью хирургического лезвия одноразового использования из-за ушной раковины под местной инфильтрационной анестезией 2%-ным раствором лидокаина. Выделенный фрагмент кожи немедленно помещали в промаркированный стерильный контейнер со средой для транспортировки (DMEM/F12).
После доставки биоматериала в лабораторию его стерильно переносили в культуральную чашку Петри, промывали раствором Хенкса с антибиотиком (гентамицин), затем трижды промывали раствором Версена. Материал измельчали с помощью стерильного скальпеля, добавляли дезагрегирующий 0,1% раствор коллагеназы и инкубировали 1-1,5 часа при температуре 37°C.
После инкубирования тканевую взвесь интенсивно пипетировали и центрифугировали в течение 10 минут при 300g, супернатант удаляли, а осадок разводили культуральной средой (DMEM/F12 1:1 с добавлением 10% сыворотки пуповинной крови человека (СПК) и 10% аутологичной сыворотки (АС), либо DMEM/F12 1:1 с добавлением 10% СПК и 10% сыворотки эмбрионов коров (СЭК) фирмы НПП "ПанЭко", Россия или FBS Defined фирмы HyClone, США, либо DMEM/F12 1:1 с добавлением 20% СЭК фирмы НПП "ПанЭко", Россия или FBS Defined фирмы HyClone, США и 40 мкг/мл гентамицина, ресуспендировали и переносили в культуральный флакон. Культуральный флакон помещали в CO2-инкубатор. Клетки культивировали при +37°C в атмосфере 5% CO2. Замену культуральной среды осуществляли каждые 3-4 дня.
После образования субконфлюэнтного монослоя клетки отмывали раствором Версена, затем снимали с поверхности культуральной посуды раствором Версена с 0,25% трипсина, ресуспендировали в культуральной среде и эксплантировали в культуральную посуду большего объема для последующего культивирования.
Затем осуществляли клональный анализ фибробластов.
По достижении клетками 2-го пассажа культуру клеток трехкратно отмывали раствором Версена и трипсинизировали при 37°C, 5% CO2 в течение 10 мин. Гомогенат центрифугировали в течение 10 мин при 300g об/мин. Надосадочную жидкость удаляли, клетки ресуспендировали в растворе Хэнкса и проводили подсчет клеток в камере Горяева до совпадения результатов не менее 95%.
Путем серии последовательных разбавлений готовили клеточную суспензию в концентрации 100 клеток/мл. В три чашки Петри диаметром 100 мм помещали культуральную среду (DMEM/F12 1:1 с добавлением 10% СПК и 10% АС, либо DMEM/F12 1:1 с добавлением 10% СПК и 10% СЭК фирмы НПП "ПанЭко", Россия или FBS Defined фирмы HyClone, США, либо DMEM/F12 1:1 с добавлением 20% эмбриональной сыворотки коров фирмы НПП "ПанЭко", Россия или FBS Defined фирмы HyClone, США и 40 мкг/мл гентамцина) и эксплантировали по 1 мл разбавленной клеточной суспензии для получения клональной плотности посева 1,5 клеток/см2.
Культуральные чашки инкубировали в CO2-инкубаторе в условиях насыщенной влажности при +37°C в атмосфере 5% CO2 в течение 14 дней. После чего чашки Петри с образовавшимися колониями трехкратно промывали фосфатно-солевым раствором (РН 7,2-7,4) и фиксировали 70% спиртом при комнатной температуре в течение 15 мин. Затем остатки спирта удаляли трехкратной промывкой дистиллированной водой и проводили окрашивание колоний красителем KaryoMAX® Giemsa Stain Stock Solution фирмы Gibco, США в течение 20 минут при 37°C. Чашки с окрашенными колониями тщательно отмывали от избытка красителя и сушили при комнатной температуре в течение 5-7 часов.
После этого осуществляли морфометрический анализ колоний с определением средней оптической плотности каждой исследуемой колонии.
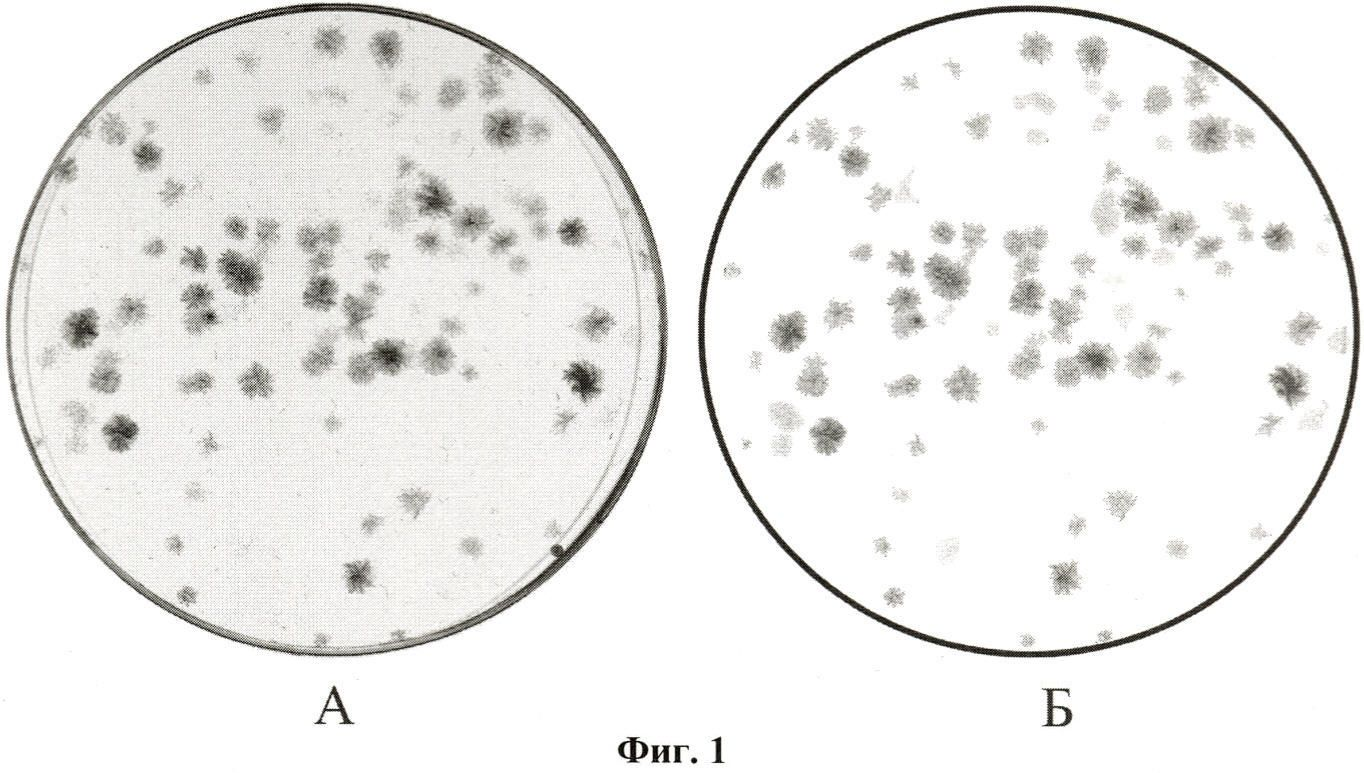
Культуральные чашки помещали в гель-документирующую систему ChemiDoc™ XRS Universalhood II фирмы BioRad Inc., США и проводили сканирование всей ее поверхности в видимом диапазоне света для получения электронного изображения колоний с разрешением не ниже 800 dpi.
На фиг.1А представлено электронное изображение типичных колоний пациента.
На фиг.1Б представлен результат компьютерной обработки типичных колоний пациента для проведения морфометрического анализа.
Полученное электронное изображение колоний обрабатывали при помощи морфометрической программы ImageJ согласно алгоритму, включающему удаление фонового окрашивания чашки Петри, нахождение границ индивидуальных клеточных колоний, удаление артефактов изображения, искажающих подсчет и анализ колоний и вычисление средней (по площади колонии) оптической плотности для каждой исследуемой колонии (фиг.1Б).
Подсчет колоний проводили следующим образом.
После выполнения морфометрического анализа полученные данные средней оптической плотности были перенесены в программу Микрософт Excel, где проводили общий подсчет колоний. Все колонии были проранжированы в зависимости от их средней оптической плотности (СОП) на три группы: плотные колонии (СОП≥46 отн. ед.), диффузные колонии (СОП≤25 отн. ед.) и смешанные колонии (25<СОП<46 отн. ед.).
Исследования этих колоний проводили по следующим параметрам.
Эффективность колониеобразования фибробластов, ЭКО-ф - отражает содержание клеток-предшественников фибробластов в коже пациента и служит количественным показателем регенераторного потенциала популяции дермальных фибробластов пациента. ЭКО-ф - это процентное отношение образовавшихся колоний с числом клеток больше 20 к общему количеству эксплантированных клеток. Клоны фибробластов, в состав которых входит меньшее количество клеток, колониями не считают и, соответственно, при подсчете не учитывают.
Линейные размеры колоний: диаметр круга (в мкм), включающий всю колонию (выполняется с помощью стандартной операции программы ImageJ).
Средняя площадь колоний (стандартная операция программы ImageJ) и ее распределение по числу колоний.
Количество плотных колоний и их доля от всех образовавшихся колоний с числом клеток более 20.
Количество диффузных колоний и их доля от всех образовавшихся колоний с числом клеток более 20.
Количество смешанных колоний и их доля от всех образовавшихся колоний с числом клеток более 20.
Средняя оптическая плотность колоний (стандартная операция программы ImageJ) и ее распределение по плотным, диффузным и смешанным колониям.
Средняя оптическая плотность плотных колоний, пропорциональная количеству составляющих колонию клеток (стандартная операция программы ImageJ).
Показатель пролиферации, ПП, определяемый по формуле [Владимирская Е.Б., Кошель И.В., Цуря В.М. и др. Стромальные фибробласты нормального костного мозга у детей. Гематология №1, 1990, стр.1-4]
ПП=[1(ДД)+2(ДС)+3(ДП)]/100%,
где: ПП - показатель пролиферации,
ДЦ - доля диффузных колоний, (%),
ДС - доля смешанных колоний, (%),
ДП - доля плотных колоний, (%).
Полученные параметры клеточных клонов, характеризующие популяцию дермальных фибробластов пациента, сопоставляли с параметрами инструментального исследования кожи пациента с использованием статистической программы BioStat при помощи корреляционного анализа для нахождения средних значений параметров (уровень статистической значимости α<0,05).
После установления устойчивой, статистически достоверной связи характеристик колоний дермальных фибробластов с характеристиками состояния кожи, полученными с помощью инструментальных методов исследования кожи посредством методов математической статистики, определяли средние значения наиболее статистически значимых параметров (с коэффициентом корреляции Пирсона больше 0,7): эффективность колониеобразования дермальных фибробластов (%), доля плотных колоний (%), доля диффузных колоний (%), показатель пролиферации.
Для получения объективной, статистически значимой информации на данной стадии использовали средства вычислительной техники, статистического анализа и математического моделирования.
Результаты клонального анализа представлены на фиг.2, фиг.3 и фиг.4, где показаны графики зависимостей параметров, выявленных с помощью корреляционного анализа Пирсона, где
на фиг.2 - зависимость доли диффузных колоний от инструментальной оценки глубины морщин (Visia, Proctor&Gamble Со, США);
на фиг.3 - зависимость доли плотных колоний от эластичности кожи пациента (Cutometer МРА 580, Courage + Khazaka electronic GmbH, Германия);
на фиг.4 - зависимость доли диффузных колоний от эластичности кожи пациента (Cutometer МРА 580, Courage +Khazaka electronic GmbH, Германия),
где R - коэффициент корреляции Пирсона (чем ближе к единице, тем сильнее зависимость исследуемых параметров) при уровне статистической значимости α.
В таблице 1 приведены средние значения вышеперечисленных статистически значимых параметров дермальных фибробластов в зависимости от пола пациента.
Данные значения параметров имеют относительную величину и применимы для сравнения и анализа клеток, полученных в определенных строго контролируемых условиях, таких как стандартные состав культуральной среды и условия культивирования.
В случае, когда сочетания величин ДД и ДП не позволяют сделать однозначный вывод о значении пролиферативного потенциала, например, для мужчин: ДД>25 и ДП>54, или ДЦ<20 и 44<ДП<54, или ДД<20 и ДП<44; для женщин: ДД>40 и ДП>50, или 30<ДД<40 и ДП<40, или ДД<30 и ДП<40, проводят расчет показателя пролиферации ПП, который, благодаря учету вклада всех видов колоний, позволяет сделать однозначное заключение о значении пролиферативного потенциала данной клеточной культуры.
Предложенный способ поясняется следующими примерами.
Пример 1.
Пациентка К. обратилась в клинику А по поводу коррекции возрастных изменений кожи лица (значительное истончение кожи, наличие множественных мелких статических морщин во всех зонах лица). Пациентке 56 лет, в течение последних 5 лет - менопауза. При менопаузе в значительной степени усугубляются наблюдающиеся с возрастом изменения кожи [Brincat М. Hormone replacement therapy and the skin. Maturitas. - 2000. - V.35. - N2. - p.107-117]. Для подбора адекватной состоянию кожи данной пациентки терапии была проведена оценка регенераторного и пролиферативного потенциала популяции ее дермальных фибробластов. Для этого были проведены биопсия кожи из заушной области и клональный анализ с определением параметров, характеризующих колонии фибробластов кожи пациентки согласно вышеописанной методике.
Полученное электронное изображение колоний представлено на фиг.5А и результат их компьютерной обработки для проведения морфометрического анализа представлен на фиг.5Б.
Результат обсчета размеров и средней оптической плотности колоний посредством программы ImageJ представлены в таблице 2.
Получены следующие величины:
ЭКО-ф=24/1,5=16,0%, где:
24 - количество образованных колоний из 150 эксплантированных клеток,
1,5 - коэффициент пересчета для вычисления % клоногенных клеток с учетом количества эксплантированных клеток (150 клеток/чашку).
Доля плотных колоний: [ДП]=7×100%/24=29,2%, где:
7 - количество плотных колоний;
24 - общее количество колоний.
Доля диффузных колоний: [ДД]=16×100%/24=66.6%, где:
16 - количество диффузных колоний;
24 - общее количество колоний.
Сопоставление полученных данных, характеризующих клеточные колонии, с ранее рассчитанными средними значениями (таблица 1), позволили сделать следующие выводы о состоянии популяции фибробластов кожи пациентки:
ЭКО-ф - значительно ниже среднего уровня, что свидетельствует о низком регенераторном потенциале фибробластов кожи пациентки;
доля плотных колоний ниже, а доля диффузных колоний выше нормы, что свидетельствует о низком пролиферативном потенциале популяции фибробластов в коже пациентки.
На основании анализа полученных данных для пациентки К. была разработана индивидуальная программа коррекции возрастных изменений кожи лица, которая включает: проведение курса терапии кожи аутологичными дермальными фибробластами, затем через 8-12 месяцев проведение поверхностного пилинга или фракционного фототермолиза (на уровне папиллярного слоя, не более 3-х процедур) и через 6 месяцев - повторный курс терапии кожи аутологичными дермальными фибробластами. В результате проведенного лечения наблюдалось значительное увеличение толщины кожи, особенно в параорбитальной области, увеличение эластичности и упругости кожи, уменьшение количества и глубины морщин.
Пример 2.
Пациентка Г. обратилась в клинику по поводу значительного истончения кожи в параорбитальной области после повторной блефаропластики. При визуальном осмотре: кожа в параорбитальной области истончена, тургор снижен, наличие множественных мелких морщин. Для подбора адекватной состоянию кожи данной пациентки терапии была проведена оценка регенераторного и пролиферативного потенциала популяции ее дермальных фибробластов. Для этого были выполнены биопсия кожи из заушной области и клональный анализ с определением параметров, характеризующих колонии фибробластов кожи пациентки согласно вышеописанной методике.
Получены вышеописанным методом параметры, характеризующие колонии фибробластов кожи пациента:
ЭКО-ф - 8,3%;
[ДД] - 19%;
[ДП] - 59%.
Выводы:
ЭКО-ф - значительно ниже среднего уровня, что свидетельствует о низком регенераторном потенциале фибробластов кожи пациентки,
доля плотных колоний ниже, а доля диффузных колоний выше нормы, что свидетельствует о низком пролиферативном потенциале популяции фибробластов в коже пациентки.
На основании анализа полученных данных пациентке было рекомендовано проведение 3-х курсов аутологичных дермальных фибробластов. После проведенной терапии в параорбитальной области наблюдалось увеличение толщины кожи, увеличение ее эластичности и упругости, значительное уменьшение количества морщин. Пациентке рекомендовано повторить курс клеточной терапии через 3 года в профилактических целях.
Пример 3.
Пациент Н. обратился в клинику А по поводу коррекции возрастных изменений кожи лица (наличие мимических морщин в области «улыбки», снижение тургора кожи).
Получены вышеописанным методом параметры, характеризующие колонии фибробластов кожи пациента:
ЭКО-ф - 60%;
[ДД] - 24%;
[ДП] - 46%.
Выводы:
ЭКО-ф - выше среднего уровня, что указывает на высокий регенераторный потенциал фибробластов кожи пациента;
доля плотных и доля диффузных колоний находятся в пределах нормы, что свидетельствует о хорошем пролиферативном потенциале фибробластов кожи пациента.
На основании анализа полученных данных пациенту было рекомендовано проведение любых методов эстетической медицины, имеющихся в арсенале клиники, для коррекции возрастных изменений кожи без ограничений согласно инструкции.
Пример 4.
Пациентка Д. обратилась в клинику А по поводу коррекции морщин и дряблости кожи. Пациентка, 36 лет, с нормальным эндокринным статусом, ухудшение состояния кожи произошло после применения процедуры «Thermage» в одной из московских клиник. Для выяснения причины данных изменений кожи было проведено исследование популяции дермальных фибробластов пациентки. Для этого были проведены биопсия кожи из заушной области и клональный анализ с определением параметров, характеризующих колонии фибробластов кожи пациентки согласно вышеописанной методике.
Полученное электронное изображение колоний представлено на фиг.6А, а результат их компьютерной обработки для проведения морфометрического анализа представлен на фиг.6Б. Результат обсчета размеров и средней оптической плотности колоний посредством программы ImageJ представлены в таблице 3.
Получены следующие величины:
ЭКО-ф=47/1,5=31,3%, где:
47 - количество образованных колоний из 150 эксплантированных клеток,
1,5 - коэффициент пересчета для вычисления % клоногенных клеток с учетом количества эксплантированных клеток (150 клеток/чашку).
Доля плотных колоний: [ДП]=5×100%/47=11%, где:
5 - количество плотных колоний;
47 - общее количество колоний.
Доля диффузных колоний: [ДД]=24×100%/47=51%, где:
24 - количество диффузных колоний;
47 - общее количество колоний.
Доля смешанных колоний: [ДС]=18×100%/47=38%, где:
18 - количество смешанных колоний;
47 - общее количество колоний.
Показатель пролиферации: [ПП]=(11×3+38×2+51×1)/100%=1,60.
Сопоставление полученных данных, характеризующих клеточные колонии, с ранее рассчитанными средними значениями (таблица 1), позволили сделать следующие выводы о состоянии популяции фибробластов кожи пациентки:
ЭКО-ф - ниже среднего уровня, что свидетельствует о низком регенераторном потенциале фибробластов кожи пациентки.
[ПП] - ниже среднего уровня, что свидетельствует о низком пролиферативном потенциале популяции фибробластов в коже пациентки.
На основании анализа полученных данных пациентке было рекомендовано проведение 2-х курсов клеточной терапии кожи (с интервалом 1 месяц) аутологичными дермальными фибробластами. Уже через месяц после проведенной терапии отмечалось увеличение эластичности, упругости и гидратации кожи, улучшение ее текстуры, уменьшение количества и глубины морщин. Эффект имел нарастающий характер и достигал максимума через 8 месяцев после трансплантации проведенной терапии.
Пример 5.
Пациент М. обратился в клинику А по поводу ухудшения состояния кожи лица после проведения в одной из клиник курса процедур фототермического термолиза на аппарате Palomar 1450 для коррекции возрастных изменений кожи лица. Так, после проведения 3-х процедур снизился тургор кожи, появились множественные очаги атрофии дермы диаметром до 0,4 мм в области щек, кожа приобрела нездоровый цвет. Получены вышеописанным методом параметры, характеризующие колонии фибробластов кожи пациента:
ЭКО-ф - 10%;
[ПП] - 1,49.
Выводы:
ЭКО-ф - значительно ниже среднего уровня, что указывает на низкий регенераторный потенциал фибробластов кожи пациента;
[ПП] - свидетельствует о низком пролиферативном потенциале фибробластов кожи пациента.
На основании анализа полученных данных пациенту было рекомендовано проведение 2-х курсов клеточной терапии кожи аутологичными дермальными фибробластами. После проведенной терапии аутологичными фибробластами наблюдалось увеличение упругости и эластичности кожи, улучшение цвета и контуров лица, значительное уменьшение размеров очагов атрофии дермы. В профилактических целях повторение курса клеточной терапии рекомендовано через 3-4 года.
Пример 6.
Пациентка Р. обратилась в клинику А по поводу коррекции возрастных изменений кожи лица (наличие мимических морщин в области глаз, выраженные носогубные складки).
В результате оценки параметров, характеризующих колонии фибробластов кожи пациентки, были получены следующие величины:
ЭКО-ф - 36%;
ДП - 35%;
ДД - 29%.
Ввиду невозможности сделать однозначный вывод о величине пролиферативного потенциала клеточной культуры данного пациента (доля диффузных колоний ДД заметно меньше среднего значения для женщин (30-40%) и доля плотных колоний ДП также меньше среднего значения (40-50%)), дополнительно было проведено измерение доли смешанных колоний ДС, которое составило 36%, и был рассчитан показатель пролиферации ПП, равный 2,06.
На основании полученных данных было сделано следующее заключение о состоянии популяции фибробластов в коже пациентки:
ЭКО-ф - практически равен среднему уровню, что указывает на нормальный регенераторный потенциал фибробластов кожи пациентки;
[ПП] - свидетельствует о высоком пролиферативном потенциале популяции дермальных фибробластов.
На основании анализа полученных данных для пациентки была разработана индивидуальная программа коррекции дефектов кожи, включающая: применение фракционного фототермолиза кожи всего лица (без ограничений согласно инструкции), через 6 месяцев - курс аутологичных дермальных фибробластов для коррекции морщин в параорбитальной области и области носогубных складок.
Таким образом, предлагаемое изобретение позволяет проводить диагностику состояния популяции фибробластов дермы пациента путем определения объективных количественных параметров, характеризующих регенераторный и пролиферативный потенциал составляющих их популяций фибробластов.
Предлагаемый способ позволяет получить уникальные данные, которые могут быть полезны для определения причины осложнений, вызванных неконтролируемым применением тех или иных косметологических методов путем оценки состояния популяции фибробластов кожи пациента. Данный способ может стать незаменимым для прогнозирования потенциальных осложнений при использовании различных косметологических методов и процедур, а также стать полезным инструментом врача как для понимания процессов, развивающихся в коже при тех или иных осложнениях, так и для разработки индивидуальной программы коррекции возрастных изменений кожи для каждого пациента.
Данный способ универсален и может быть применен для анализа любых колониеобразующих субстрат-зависимых клеток организма человека. Способ позволяет получить объективную количественную характеристику как пролиферативного, так и регенераторного потенциала клеток, что дает возможность оценить регенераторные возможности исходной ткани без проведения сложных и дорогостоящих инструментальных исследований ткани.
Реферат
Группа изобретений относится к области медицины, а именно к биофармакологии, биотехнологии и косметологии. Для диагностики состояния кожи пациента определяют эффективность колониеобразования фибробластов, в качестве параметра, определяющего регенераторный потенциал клеток и процентную долю плотных и диффузных колоний в культуре клеток в качестве параметров, определяющих пролиферативный потенциал клеток. Эффективность колониеобразования рассчитывают как процентное отношение образовавшихся колоний с числом клеток больше 20 к общему количеству эксплантированных клеток. В другом варианте дополнительно рассчитывают показатель пролиферации, определяющий пролиферативный потенциал клеток, по формуле ПП=[1(ДД)+2(ДС)+3(ДП)]/100(%), где ПП - показатель пролиферации; ДД - процентная доля диффузных колоний, (%); ДС - процентная доля смешанных колоний, (%); ДП - процентная доля плотных колоний, (%). Применение данной группы изобретений позволяет диагностировать состояние популяции фибробластов кожи пациента. 2 н. и 2 з.п. ф-лы, 6 ил., 6 пр., 3 табл.

Комментарии