Полностью масштабируемый способ производства raav на основе колонок - RU2754467C2
Код документа: RU2754467C2
Чертежи

Описание
ПРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет по предварительной патентной заявке США №62/316252, зарегистрированной 31 марта 2016 года. Полное содержание указанной выше заявки включено в настоящее описание в качестве ссылки, включая все тексты, таблицы, список последовательностей и чертежи.
ВВЕДЕНИЕ
[0002] Доставка генов является многообещающим способом лечения приобретенных и наследственных заболеваний. Описан ряд систем на основе вирусов для переноса генов, включая системы на основе аденоассоциированного вируса (AAV).
[0003] AAV является хелпер-зависимым ДНК-парвовирусом, принадлежащим к роду Dependovirus. В случае AAV для продуктивной инфекции необходимо функционирование хелперного вируса, например, аденовируса, вируса герпеса или вируса осповакцины. В отсутствие хелперного вируса AAV приводит к установлению латентного состояния благодаря встраиванию своего генома в хромосому клетки-хозяинка. Последующая инфекция хелперным вирусом высвобождает интегрированный вирусный геном, который затем может реплицироваться с образованием инфекционного потомства AAV.
[0004] AAV имеет широкий спектр хозяев и способен реплицироваться в клетках любого вида в присутствие подходящего хелперного вируса. Например, AAV человека будет реплицироваться в клетках собаки, конинфицированных аденовирусом собаки. AAV не ассоциирован с каким-либо заболеванием человека или животного и, по-видимому, не влияет неблагоприятно на биологические свойства клетки-хозяина после интеграции.
[0005] Можно конструировать векторы AAV так, чтобы они несли интересующую гетерологичную последовательность нуклеиновой кислоты (например, выбранный ген, кодирующий терапевтический белок, ингибиторную нуклеиновую кислоту, такую как антисмысловая молекула, рибозим, мкРНК и т.д.) посредством полной или частичной делеции внутренней части генома AAV и встраивания интересующей последовательности нуклеиновой кислоты между ITR. ITR остаются функциональными в таких векторах, что делает возможной репликацию и упаковку rAAV, содержащего интересующую гетерологичную последовательность нуклеиновой кислоты. Гетерологичная последовательность нуклеиновой кислоты, как правило, также связана с промоторной последовательностью, способной запускать экспрессию нуклеиновой кислоты в клетках-мишенях пациента. В вектор также можно включать сигналы терминации, такие как участки полиаденилирования.
[0006] Конструирование инфекционных рекомбинантных векторов AAV (rAAV) описано в ряде публикаций. См., например, патенты США №№5173414 и 5139941; международные публикации №№ WO 92/01070 и WO 93/03769; Lebkowski et al. (1988) Molec. Cell. Biol. 8:3988-3996; Vincent et al. (1990) Vaccines 90 (Cold Spring Harbor Laboratory Press); Carter, B. J. (1992) Current Opinion in Biotechnology 3:533-539; Muzyczka, N. (1992) Current Topics in Microbiol. и Immunol. 158:97-129; и Kotin, R. M. (1994) Human Gene Therapy 5:793-801.
[0007] Рекомбинантные векторы на основе аденоассоциированного вируса (AAV) демонстрируют исключительные терапевтические перспективы в нескольких клинических исследованиях ранней фазы на множестве групп. Разработка этого нового класса биологических продуктов для получения разрешения будет включать улучшение характеризации векторов и способы контроля качества, включая лучшее понимание того, как дизайн вектора и параметры способа производства будут влиять на профили примесей в векторах клинической категории.
[0008] Важной целью дизайна систем получения и очистки rAAV является осуществление стратегий минимизации/контроля получения связанных с производством примесей, таких как белки, нуклеиновые кислоты и относящиеся к вектору примеси, включая виды AAV дикого типа/псевдодикого типа (wtAAV) и инкапсидированные в AAV остаточные примеси ДНК. Удаление примесей в векторах AAV затруднено, что связано со способом получения векторов rAAV. В одном из способов получения векторы rAAV получают посредством транзиторной трансфекции с использованием трех плазмид. Значительные количества плазмидной ДНК встраивают в клетки для получения векторов rAAV. Кроме того, если векторы rAAV высвобождаются из продуцирующих клеток, совместно с ними высвобождаются клеточные белки и нуклеиновые кислоты. Учитывая, что вектор rAAV представляет лишь приблизительно 1% биомассы, очень трудно очищать векторы rAAV до уровня чистоты, при котором его можно использовать в качестве клинического продукта для генной терапии у человека. (Smith PH Wright JF. Qu G. et al 2003, Mo. Therapy, 7:8348; Chadeuf G. et al, Mo. Therapy 2005, 12:744. Report from the CHMP gene therapy expert group meeting. European Medicines Agency EMEA/2005 CHMP 183989/2004).
[0009] При разработке способов производства для очистки рекомбинантного AAV в качестве продукта для лечения заболевания человек необходимо достигать следующих целей: 1) единообразной чистоты, активности и безопасности вектора; 2) масштабируемости способа производства; и 3) приемлемой стоимости производства. При существующем "промышленном стандарте" масштабируемых способов очистки вектора AAV не достигают удаления примесей в достаточной мере, что важно для достижения первой цели, указанной выше (единообразной чистоты, активности и безопасности вектора). Кроме того, безуспешность достаточного удаления примесей с использованием существующего промышленного стандарта масштабируемых способов очистки имеет место из-за того, что: 1) разработка способов очистки вирусных продуктов, таких как рекомбинантный AAV, для иного использования, чем вакцины (в случае чего иммунного ответа, как правило, пытаются достичь, а не избегать) является относительно новой; 2) многие группы, участвующие в разработке масштабируемых способов очистки векторов AAV, не знают о высоких уровнях относящихся к вектору примесей и/или считают, что такие примеси не будут вносить свой вклад в клинически значимую иммуногенность вектора; и 3) технически сложно разработать масштабируемые способы очистки, подходящие для производства векторов rAAV промышленного масштаба.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0010] В некоторых аспектах настоящее изобретение относится к способу очистки частиц рекомбинантного вектора на основе аденоассоциированного вируса (rAAV), где способ включает стадии (a) сбора клеток и/или супернатанта культуры клеток, содержащего частицы вектора rAAV, для получения сбора; (b) необязательно, концентрирование сбора, полученного на стадии (a), для получения концентрированного сбора; (c) лизирование сбора, полученного на стадии (a), или концентрированного сбора, полученного на стадии (b), для получения лизата; (d) обработки лизата для снижения контаминирующей нуклеиновой кислоты в лизате и, таким образом, получения лизата со сниженным содержанием нуклеиновой кислоты; (e) фильтрации лизата со сниженным содержанием нуклеиновой кислоты, полученного на стадии (d), для получения очищенного лизата и, необязательно, разведения очищенного лизата для получения разведенного очищенного лизата; (f) подвергания очищенного лизата или разведенного очищенного лизата, полученного на стадии (e), анионо- или катионообменной хроматографии на колонках для получения колоночного элюата, состоящего из частиц вектора rAAV и, необязательно, концентрированию колоночного элюата для получения концентрированного колоночного элюата; (g) подвергания колоночного элюата или концентрированного колоночного элюата, полученного на стадии (f), эксклюзионной хроматографии на колонках для получения второго колоночного элюата, состоящего из частицы вектора rAAV, и, таким образом, отделения частицы вектора rAAV от белковых примесей и, необязательно, разведения второго колоночного элюата для получения разведенного второго колоночного элюата; (h) подвергания второго колоночного элюата или разведенного второго колоночного элюата, полученного на стадии (g), катионо- или анионообменной хроматографии на колонках для получения третьего колоночного элюата, состоящего из частиц вектора rAAV, и, таким образом, отделения частиц вектора rAAV от белковых или других производственных примесей и, необязательно, концентрирования третьего колоночного элюата для получения концентрированного третьего колоночного элюата; и (i) фильтрации третьего колоночного элюата или концентрированного третьего колоночного элюата, полученного на стадии (h), и, таким образом, получения очищенных частиц вектора rAAV. Следующие варианты осуществления и аспекты относятся к одной или нескольким стадиям (a)-(h), указанным выше.
[0011] В определенных вариантах осуществления стадия (f) включает подвергание очищенного лизата или разведенного очищенного лизата, полученного на стадии (e), анионообменной хроматографии, и/или стадия (h) включает подвергание второго колоночного элюата или разведенного второго колоночного элюата, полученного на стадии (g), катионообменной хроматографии на колонках. В определенных вариантах осуществления стадия (f) включает подвергание очищенного лизата или разведенного очищенного лизата, полученного на стадии (e), катионообменной хроматографии, и/или стадия (h) включает подвергание второго колоночного элюата или разведенного второго колоночного элюата, полученного на стадии (g), анионообменной хроматографии на колонках.
[0012] В некоторых аспектах концентрирование на стадии (b), и/или стадии (f), и/или стадии (h) осуществляют посредством ультрафильтрации/диафильтрации, необязательно, посредством фильтрации тангенциальным потоком. В некоторых вариантах осуществления посредством концентрирования на стадии (b) снижают объем собранных клеток и супернатанта культуры клеток приблизительно в 2-10 раз. В определенных вариантах осуществления посредством концентрирования на стадии (f) снижают объем колоночного элюата приблизительно в 5-20 раз. В некоторых аспектах лизирование сбора, полученного на стадии (a), или концентрированного сбора, полученного на стадии (b), осуществляют посредством микрофлюидизации.
[0013] В определенных вариантах осуществления после стадии (b) и до стадии (c) способ включает стадию (b)(i). В определенных вариантах осуществления стадия (b)(i) включает снижение контаминирующей нуклеиновой кислоты в лизате. В некоторых вариантах осуществления стадия (b)(i) включает обработку лизата нуклеазой и, таким образом, снижение контаминирующей нуклеиновой кислоты. В определенных вариантах осуществления нуклеаза включает бензоназу.
[0014] В некоторых вариантах осуществления фильтрацию очищенного лизата или разведенного очищенного лизата на стадии (e) осуществляют с помощью фильтра, имеющего диаметр пор приблизительно от 0,1 до 0,8 мкм включительно. В определенных вариантах осуществления разведение очищенного лизата или разведенного очищенного лизата на стадии (e) осуществляют с использованием водного забуференного раствора ацетата.
[0015] В некоторых вариантах осуществления разведение второго колоночного элюата на стадии (g) осуществляют с использованием водного забуференного раствора ацетата. В определенных вариантах осуществления водный забуференный раствор ацетата имеет pH приблизительно от 4,0 до 7,0 включительно.
[0016] В некоторых вариантах осуществления частицы вектора rAAV составляют с использованием поверхностно-активного вещества для получения состава вектора AAV. В определенных вариантах осуществления частицы вектора rAAV, полученные на стадии (i), составляют с использованием поверхностно-активного вещества для получения состава вектора AAV.
[0017] В некоторых вариантах осуществления катионо- или анионообменная хроматография на колонках на стадии (f) включает полиэтиленгликоль (PEG)-модулируемую хроматографию на колонках. В определенных вариантах осуществления катионо- или анионообменная хроматография на колонках на стадии (f) включает промывку колонки раствором PEG перед элюцией частиц вектора rAAV из колонки. В определенных вариантах осуществления PEG в растворе PEG имеет среднюю молекулярную массу в диапазоне приблизительно от 1000 до 50000 включительно. В некоторых вариантах осуществления катионо- или анионообменная хроматография на колонках на стадии (e) включает промывку колонки водным раствором поверхностно-активного вещества перед элюцией частиц вектора rAAV из колонки. В определенных вариантах осуществления катионо- или анионообменная хроматография на колонках на стадии (h) включает промывку колонки раствором поверхностно-активного вещества перед элюцией частиц вектора rAAV из колонки. В некоторых вариантах осуществления раствор PEG и/или раствор поверхностно-активного вещества содержит водный буфер Трис-Cl/NaCl или водный буфер фосфат/NaCl. В определенных вариантах осуществления буфер NaCl содержит приблизительно 20-250 мМ NaCl включительно или приблизительно 50-200 мМ NaCl включительно.
[0018] В некоторых вариантах осуществления частицы вектора rAAV элюируют из катионо- или анионообменной колонки на стадии (f) в водный буфер Трис-Cl/NaCl. В определенных вариантах осуществления буфер Трис-Cl/NaCl содержит 50-200 мМ NaCl. В определенных вариантах осуществления частицы вектора rAAV элюируют из катионо- или анионообменной колонки на стадии (h) в водный буфер фосфат/NaCl. В некоторых вариантах осуществления буфер фосфат/NaCl содержит приблизительно 100-500 мМ NaCl включительно. В определенных вариантах осуществления катионообменная колонка на стадии (f) содержит функциональную группу четвертичного аммония. В определенных вариантах осуществления функциональная группа четвертичного аммония содержит кватернизированный полиэтиленимин.
[0019] В определенных вариантах осуществления эксклюзионная колонка, например, на стадии (g) имеет диапазон разделения (по молекулярной массе) приблизительно от 10000 до 600000 включительно. В некоторых вариантах осуществления катионообменная колонка на стадии (h) содержит сульфоновую кислоту. В некоторых вариантах осуществления катионообменная колонка на стадии (h) содержит сульфопропил.
[0020] В определенных вариантах осуществления способы, представленные в настоящем описании, исключают стадию ультрацентрифугирования в градиенте хлорида цезия.
[0021] В определенных вариантах осуществления частицы вектора rAAV содержат трансген, кодирующий нуклеиновую кислоту, выбранную из группы, состоящей из миРНК, антисмысловой молекулы, мкРНК, рибозима и shRNA. В некоторых вариантах осуществления частицы вектора rAAV содержат трансген, кодирующий продукт гена, выбранный из группы, состоящей из инсулина, глюкагона, гормона роста (GH), паратиреоидного гормона (PTH), соматолиберина (GRF), фолликулостимулирующего гормона (FSH), лютеинизирующего гормона (LH), хорионического гонадотропина человека (hCG), фактора роста эндотелия сосудов (VEGF), ангиопоэтинов, ангиостатина, гранулоцитарного колониестимулирующего фактора (Г-КСФ), эритропоэтина (EPO), фактора роста соединительной ткани (CTGF), основного фактора роста фибробластов (bFGF), кислого фактора роста фибробластов (aFGF), эпидермального фактора роста (EGF), трансформирующего фактора роста α (ФНО), тромбоцитарного фактора роста (PDGF), инсулино-подобных факторов роста I и II (IGF-I и IGF-II), TGFβ, активинов, ингибинов, морфогенетического белка кости (BMP), фактора роста нервов (NGF), нейротрофического фактора головного мозга (BDNF), нейротрофинов NT-3 и NT4/5, цилиарного нейротрофического фактора (CNTF), нейротрофического фактора глиальных клеток (GDNF), нейртурина, агрина, нетрина-1 и нетрина-2, фактора роста гепатоцитов (HGF), эфринов, ноггина, Sonic Hedgehog и тирозингидроксилазы.
[0022] В некоторых вариантах осуществления частицы вектора rAAV содержат трансген, кодирующий продукт гена, выбранный из группы, состоящей из тромбопоэтина (TPO), интерлейкинов (ИЛ-1-ИЛ-17), моноцитарного белка-хемоаттрактанта, лейкоз-ингибирующего фактора, гранулоцитарно-макрофагального колониестимулирующего фактора, Fas-лиганда, факторов некроза опухоли α и β, интерферонов α, β и γ, фактора стволовых клеток, лиганда flk-2/flt3, IgG, IgM, IgA, IgD и IgE, химерных иммуноглобулинов, гуманизированных антител, одноцепочечных антител, T-клеточных рецепторов, химерных T-клеточных рецепторов, одноцепочечных T-клеточных рецепторов, молекул MHC класса I и класса II.
[0023] В определенных вариантах осуществления частицы вектора rAAV содержат трансген, кодирующий белок, применимый для коррекции врожденных нарушений метаболизма, выбранный из группы, состоящей из карбамоилсинтетазы I, орнитинтранскарбамилазы, аргиносукцинатсинтетазы, аргиносукцинатлиазы, аргиназы, фумариацетацетатгидролазы, фенилаланигидроксилазы, альфа-1-антитрипсина, глюкоза-6-фосфатазы, порфобилиногендезаминазы, фактора V, фактора VIII, фактора IX, цистатион бета-синтазы, декарбоксилазы разветвленных альфа-кетокислот, альбумина, изовалерил-КоА-дегидрогеназа, пропионил-КоА-карбоксилазы, метилмалонил-КоА-мутазы, глутарил-КоА-дегидрогеназы, инсулина, бета-глюкозидазы, пируваткарбоксилазы, печеночной фосфорилазы, фосфорилаза-киназы, глициндекарбоксилазы, RPE65, H-белок, T-белка, последовательности трансмембранного регулятора кистозного фиброза (CFTR) и последовательность кДНК дистрофина. В некоторых вариантах осуществления частицы вектора rAAV содержат трансген, кодирующий фактор VIII или фактор IX.
[0024] В определенных вариантах осуществления с помощью способа, представленного в настоящем описании, выделяют приблизительно 40-70% общего количества частиц вектора rAAV из сбора, полученного на стадии (a), или концентрированного сбора, полученного на стадии (b). В некоторых вариантах осуществления способом, представленным в настоящем описании, получают частицы вектора rAAV, имеющие более высокую чистоту, чем частицы вектора rAAV, полученные или очищенные посредством очистки с помощью AAV-аффинной колонки. В некоторых вариантах осуществления способом, представленным в настоящем описании, получают частицы вектора rAAV, имеющие более высокую чистоту, чем частицы вектора rAAV, полученные или очищенные посредством очистки с помощью AAV-аффинной колонки в комбинации с очисткой с помощью анионообменной колонки. В определенных вариантах осуществления способом, представленным в настоящем описании, получают частицы вектора rAAV, имеющие более высокую чистоту, чем частицы вектора rAAV, полученные или очищенные посредством очистки с помощью AAV-аффинной колонки в комбинации с очисткой с помощью анионообменной и катионообменной колонки.
[0025] В определенных аспектах частицы вектора rAAV (например, настоящие частицы вектора rAAV) получают из AAV, выбранного из группы, состоящей из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 и AAV10, AAV tyr-3, (3YAF, см., например, патент США № 8445267) капсида AAV с пептидными модификациями, такими как пептид, специфический в отношении клетки.
[0026] В некоторых аспектах настоящие частицы вектора rAAV присутствуют в последнем, например, третьем колоночном элюате на стадии (h) в концентрации приблизительно 100 мг/мл. В некоторых аспектах настоящие частицы вектора rAAV присутствуют в последнем, например, третьем колоночном элюате на стадии (h) в концентрации 1015 частиц на мл или более, 1016 частиц на мл или более или, например, 1017 частиц на мл или более.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
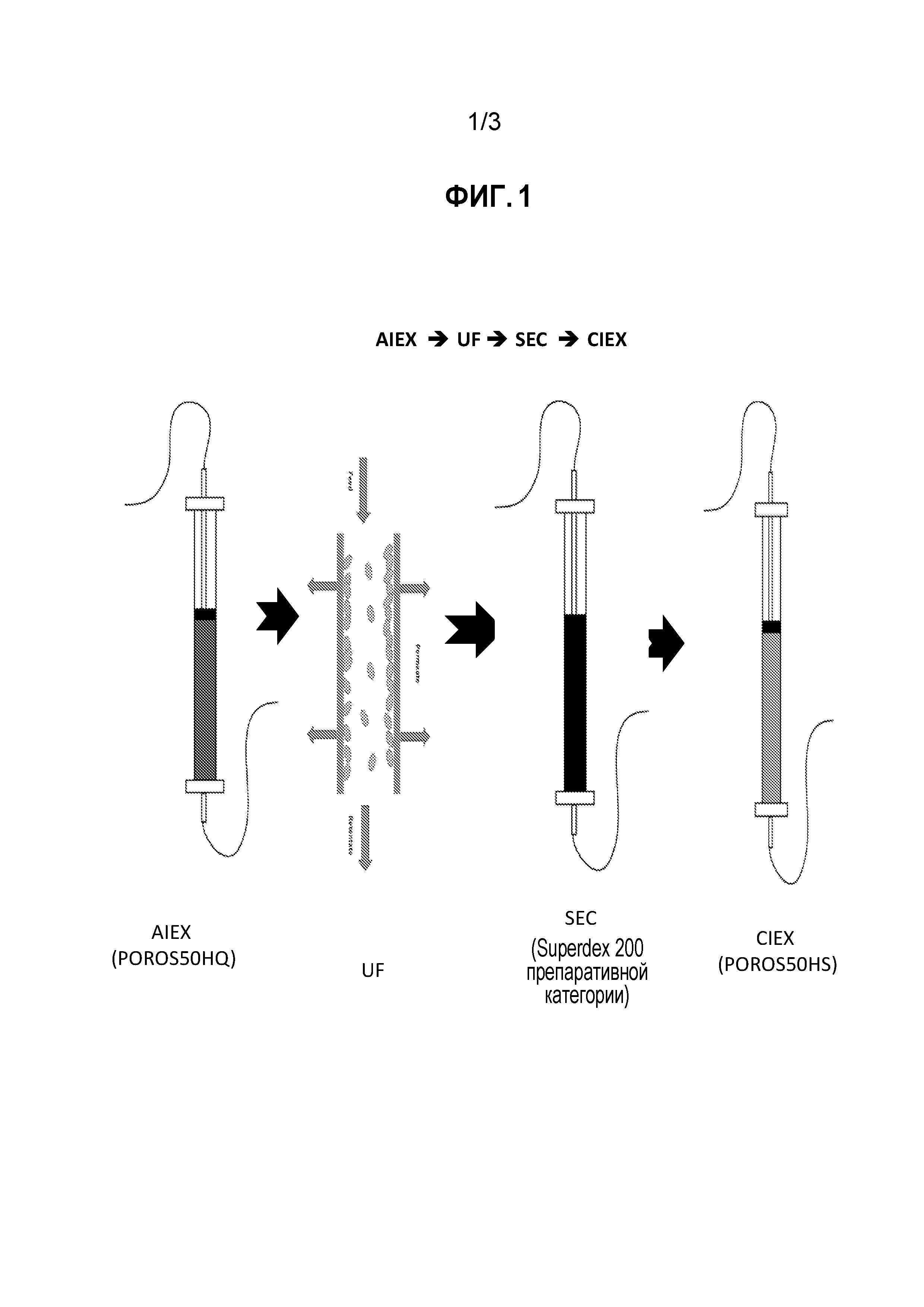
На фиг. 1 представлена типичная полностью колоночная схема очистки AAV с использованием анионообменной, гель-фильтрационной (эксклюзионной) и катионообменной хроматографических колонок. AIEX - анионообменная хроматография; UF/DF - ультрафильтрация/диафильтрация; SEC - эксклюзионная хроматография; и CIEX - катионообменная хроматография. Схему также можно осуществлять в обратном порядке.
На фиг. 2 представлены различные варианты дизайна для разработки способа очистки AAV с использованием колонок.
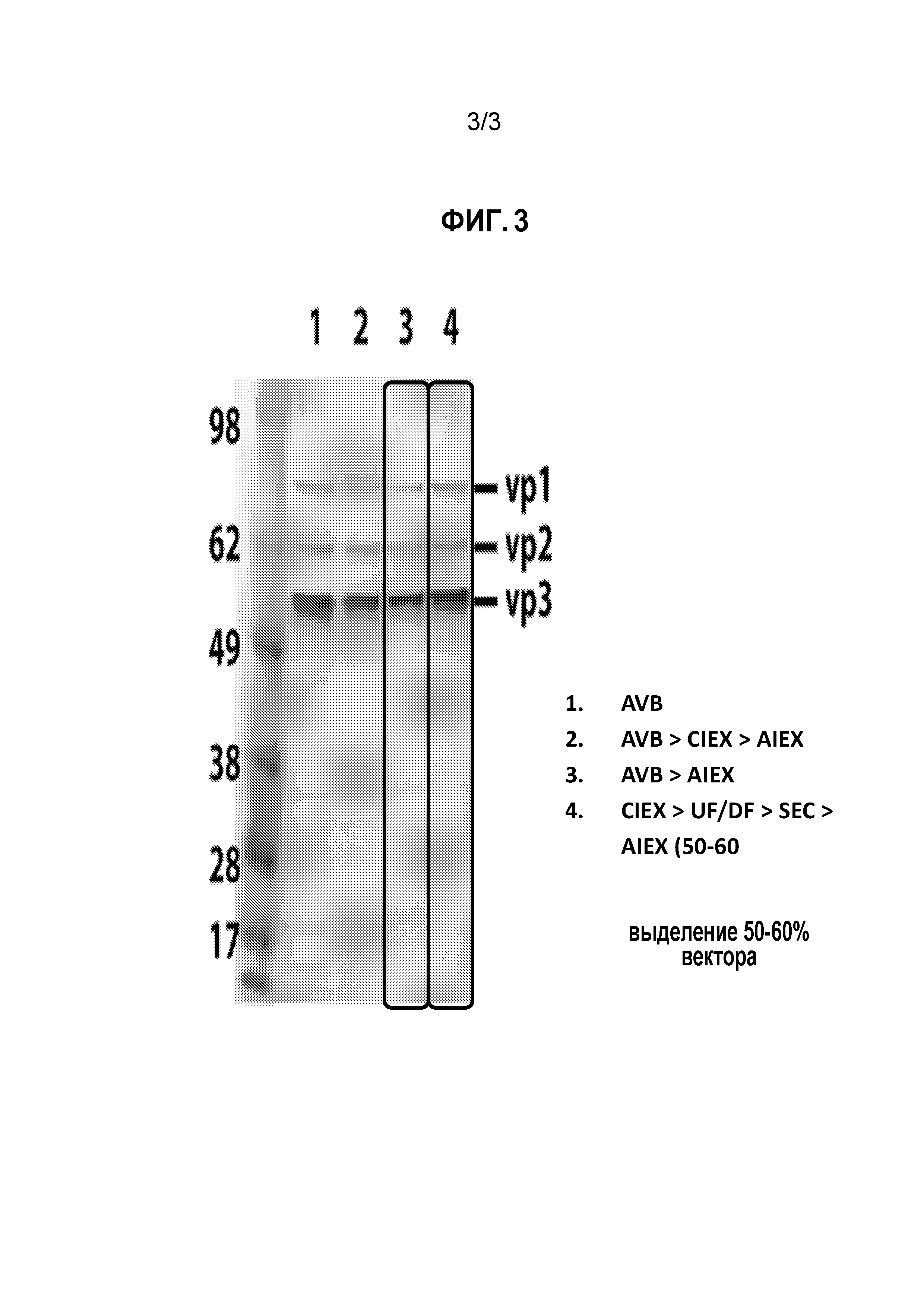
На фиг.3 представлены сравнительные результаты очистки AAV с использованием четырех (1-4) различных схем очистки: (1) AVB (AAV-аффинная колонка с антителами); и комбинации различных колонок, а именно (2) AVB (AAV-аффинная колонка) в комбинации с AIEX и CIEX; (3) AVB (AAV аффинная колонка) в комбинации с AIEX; и (4) AIEX в комбинации с хроматографией SEC (эксклюзионной) и CIEX. Результаты свидетельствуют о том, что примесей было меньше при схеме очистки (4), чем при схемах (1) и (2), а также, вероятно, меньше, чем при схеме (3). UF/DF (ультрафильтрацию/диафильтрацию) использовали для концентрирования, как представлено, но, необязательно, включали в схему очистки AAV на колонках.
ПОДРОБНОЕ ОПИСАНИЕ
[0027] Изобретение относится к платформе для очистки рекомбинантного вектора аденоассоциированного вируса (AAV) (rAAV), включающей уникальные признаки, отличающие ее от существующего "промышленного стандарта" масштабируемых способов очистки вектора AAV: 1) модульный платформенный способ, который можно использовать для очистки различных серотипов/вариантов капсида вектора AAV, включая удаление связанных со способом примесей и производственных примесей, 2) уникальная комбинация стадий хроматографии и стадий способа, придающих неожиданную масштабируемость для очистки множества различных серотипов/псевдотипов векторов rAAV.
[0028] Примеси включают примеси, связанные с производством вектора AAV, включающие белки, нуклеиновые кислоты (например, ДНК), клеточные компоненты, такие как внутриклеточные и мембранные компоненты, являющиеся примесями, отличающимися от векторов AAV. Термин "примеси, связанные с производством векторов" относится к любым компонентам, высвобождающимся при производстве AAV.
[0029] Термин "настоящие векторы AAV" относится к частицам векторов AAV, содержащим гетерологичную нуклеиновую кислоту (например, трансген), способную инфицировать клетки-мишени. Фраза включает пустые капсиды AAV, векторы AAV, в которых отсутствуют полные вставки в упакованном геноме, или векторы AAV, содержащие контаминирующие нуклеиновые кислоты клетки-хозяина. В определенных вариантах осуществления термин "настоящие векторы AAV" относится к частицам векторов AAV, в которых также отсутствуют контаминирующие плазмидные последовательности в упакованном геноме вектора.
[0030] Термин "пустые капсиды" и "пустые частицы" относится к частице или вириону AAV, включающему капсидную оболочку AAV, но в котором полностью или частично отсутствует геном, содержащий гетерологичную последовательность нуклеиновой кислоты, фланкированную ITR AAV на одной или обеих сторонах. Такие пустые капсиды не осуществляют перенос гетерологичной последовательности нуклеиновой кислоты в клетку-хозяина или клетки в организме.
[0031] Термин "вектор" относится к небольшой молекуле нуклеиновой кислоты-носителю, плазмиде, вирусу (например, вектору AAV) или другому носителю, на который можно воздействовать посредством инсерции или встраивания нуклеиновой кислоты. Векторы можно использовать для генетического воздействия (т.е. "клонирующие векторы"), для встраивания/переноса полинуклеотидов в клетки и для транскрипции или трансляции встроенного полинуклеотида в клетках. "Экспрессирующий вектор" является вектором, содержащим ген или последовательность нуклеиновой кислоты с необходимыми регуляторными областями, необходимыми для экспрессии в клетке-хозяине. Последовательность нуклеиновой кислоты вектора, как правило, содержит, по меньшей мере, участок начала репликации для размножения в клетке и, необязательно, дополнительные элементы, такие как гетерологичная последовательность нуклеиновой кислоты, элемент контроля экспрессии (например, промотор, энхансер), интрон, инвертированные концевые повторы (ITR), необязательный селективный маркер, сигнал полиаденилирования.
[0032] Вектор AAV получают из аденоассоциированного вируса. Векторы AAV применимы в качестве векторов для генной терапии, т.к. они могут проникать в клетки и встраивать нуклеиновую кислоту/генетический материал таким образом, что нуклеиновая кислота/генетический материал могут стабильно поддерживаться в клетках. Кроме того, с помощью этих вирусов можно встраивать нуклеиновую кислоту/генетический материал в конкретные участки, например, такие как конкретный участок на хромосоме 19. Т.к. AAV не ассоциированы с патогенным заболеванием у людей, с помощью векторов AAV можно доставлять гетерологичные последовательности нуклеиновой кислоты (например, терапевтические белки и средства) пациентам-людям, что не будет приводить к существенному патогенезу AAV или заболевания.
[0033] Термин "рекомбинантный", как определение вектора, такого как векторы rAAV, а также определение последовательностей, таких как рекомбинантные полинуклеотиды и полипептиды, означает, что композиции обрабатывали (т.е. конструировали) в таком виде, в котором они, как правило, не встречаются в природе. Конкретным примером рекомбинантного вектора AAV будет случай, когда нуклеиновую кислоту, как правило, не присутствующую в геноме AAV дикого типа, встраивают в вирусный геном. Примером является случай, когда нуклеиновую кислоту (например, ген), кодирующий терапевтический белок или полинуклеотидную последовательность, клонируют в вектор с 5'-, 3'- областями и/или областями интронов или без них, являющуюся геном, как правило, ассоциированным с геномом AAV. Хотя термин "рекомбинантный" не всегда используют в настоящем описании по отношению к векторам AAV, а также последовательностям, таким как полинуклеотиды, рекомбинантные формы, включающие векторы AAV, полинуклеотиды и т.д., конкретно включены в настоящее описание, несмотря на любое такое опущение.
[0034] "Вектор rAAV" получают из генома вируса дикого типа, такого как AAV, с использованием молекулярных способов для удаления генома дикого типа из генома AAV и замены ненативной (гетерологичной) нуклеиновой кислотой, такой как нуклеиновая кислота, кодирующая терапевтический белок или полинуклеотидную последовательность. Как правило, в случае AAV одну или обе последовательностей инвертированных концевых повторов (ITR) генома AAV сохраняют в векторе rAAV. rAAV отличается от генома AAV, т.к. весь или часть генома AAV заменяют ненативной последовательностью в отношении геномной нуклеиновой кислоты AAV, такой как гетерологичная нуклеиновая кислота, кодирующая терапевтический белок или полинуклеотидную последовательность. Встраивание ненативной последовательности, таким образом, определяет AAV в качестве "рекомбинантного" вектора AAV, который можно обозначать как "вектор rAAV".
[0035] Последовательность рекомбинантного вектора AAV может быть упакованной, в этом случае ее обозначают в настоящем описании как "частицу" для последующего инфицирования (трансдукции) клетки ex vivo, in vitro или in vivo. Если последовательность рекомбинантного вектора инкапсидирована или упакована в частицу AAV, частицу также можно обозначать как "rAAV", или "частица rAAV", или "вирион rAAV". Такие rAAV, частицы rAAV и вирионы rAAV включают белки, инкапсидирующие или упаковывающие геном вектора. Конкретные примеры в случае AAV включают белки капсида.
[0036] Термин "геном" вектора относится к части последовательности рекомбинантной плазмиды, в конечном итоге, упакованной или инкапсидированной с образованием частицы rAAV. В случаях, когда рекомбинантные плазмиды используют для конструирования или производства рекомбинантных векторов AAV, геном вектора AAV не включает часть "плазмиды", не соответствующую последовательности векторного генома рекомбинантной плазмиды. Эту часть рекомбинантной плазмиды, не относящуюся к геному вектора, обозначают как "остов плазмиды", важный для клонирования и амплификации плазмиды, что необходимо для размножения и производства рекомбинантного вируса, но она сама по себе не упакована или инкапсидирована в частицы rAAV. Таким образом, термин "геном" вектора относится к нуклеиновой кислоте, упакованной или инкапсидированной rAAV.
[0037] Термин "AAV-хелперные функции" относится к полученным из AAV кодирующим последовательностям (белкам), которые можно экспрессировать для получения продуктов генов AAV и векторов AAV, которые, в свою очередь, функционируют в транс-положении, обеспечивая продуктивную репликацию и упаковку AAV. Таким образом, AAV-хелперные функции включают обе из основных открытых рамок считывания AAV (ORF), rep и cap. Показано, что продукты экспрессии Rep обладают многими функциями, включая, среди прочего: распознавание, связывание и никирование точки начала репликации ДНК AAV; ДНК-хеликазную активность и модуляцию транскрипции с промоторов AAV (или других гетерологичных промоторов). Продукты экспрессии Cap (капсиды) выполняют необходимые функции упаковывания. AAV-хелперные функции используют для дополнения функций AAV в транс-положении, отсутствующие у геномов векторов AAV.
[0038] Термин "AAV-хелперная конструкция", как правило, относится к последовательности нуклеиновой кислоты, включающей нуклеотидные последовательности, обеспечивающие функции AAV, отсутствующие у вектора AAV, подлежащего использованию для получения трансдуцирующего вектора AVV для доставки интересующей последовательности нуклеиновой кислоты индивидууму, например, в ходе генной терапии. AAV-хелперные конструкции общеупотребительны для обеспечения транзиторной экспрессии генов rep и/или cap AAV для восполнения отсутствующих функций AAV, необходимых для репликации вектора AAV. В хелперных конструкциях, как правило, отсутствуют ITR AAV, и они не могут ни реплицироваться, ни упаковывать себя. AAV-хелперные конструкции могут находиться в форме плазмиды, фага, транспозона, космиды, вируса или вириона. Описан ряд AAV-хелперных конструкций, таких как плазмиды pAAV/Ad и pIM29+45, кодирующие продукты экспрессии Rep и Cap (см., например, Samulski et al. (1989) J. Virol. 63:3822-3828; и McCarty et al. (1991) J. Virol. 65:2936-2945). Описан ряд других векторов, кодирующих продукты экспрессии Rep и/или Cap (см., например, патенты США №№5139941 и 6376237).
[0039] Термин "вспомогательные функции" относится к не-AAV вирусным и/или клеточным функциям, от которых зависит репликация AAV. Термин включает белки и РНК, необходимые при репликации AAV, включая вещества, участвующие в активации транскрипции генов AAV, стадия-специфическом сплайсинге мРНК AAV, репликации ДНК AAV, синтезе продуктов экспрессии Cap и упаковке капсида AAV. Вирусные вспомогательные функции можно получать с помощью любых известных хелперных вирусов, таких как аденовирус, вирус герпеса (иной, чем вирус простого герпеса типа 1) и вирус осповакцины.
[0040] Термин "вектор вспомогательной функции", как правило, относится к молекуле нуклеиновой кислоты, включающей полинуклеотидные последовательности, выполняющие вспомогательные функции. Такие последовательности могут находиться на векторе вспомогательной функции, и их можно трансфицировать в подходящую клетку-хозяина. Вектор вспомогательной функции может поддерживать продукцию вирионов rAAV в клетке-хозяине. Векторы вспомогательной функции могут находиться в форме плазмиды, фага, транспозона или космиды. Кроме того, для вспомогательных функций не требуется полный комплемент генов аденовируса. Например, сообщают, что мутанты аденовируса, неспособные к репликации ДНК и синтезу поздних генов, необязательны для репликации AAV (Ito et al., (1970) J. Gen. Virol. 9:243; Ishibashi et al, (1971) Virology 45:317). Аналогично, показано, что мутанты по областям E2B и E3 поддерживают репликацию AAV, что свидетельствует о том, что области E2B и E3, вероятно, не участвуют, в осуществлении вспомогательных функций (Carter et al., (1983) Virology 126:505). Аденовирусы, дефектные по области E1 или имеющие делецию области E4, неспособны поддерживать репликацию AAV. Таким образом, области E1A и E4, по-видимому, необходимы для репликации AAV прямо или косвенно (Laughlin et al., (1982) J. Virol. 41:868; Janik et al., (1981) Proc. Natl. Acad. Sci. USA 78:1925; Carter et al., (1983) Virology 126:505). Другие охарактеризованные мутанты аденовируса включают: E1B (Laughlin et al. (1982), выше; Janik et al. (1981), выше; Ostrove et al., (1980) Virology 104:502); E2A (Handa et al., (1975) J. Gen. Virol. 29:239; Strauss et al., (1976) J. Virol. 17:140; Myers et al., (1980) J. Virol. 35:665; Jay et al., (1981) Proc. Natl. Acad. Sci. USA 78:2927; Myers et al., (1981) J. Biol. Chem. 256:567); E2B (Carter, Adeno-Associated Virus Helper Functions, в I CRC Handbook of Parvoviruses (P. Tijssen ed., 1990)); E3 (Carter et al. (1983), выше) и E4 (Carter et al.(1983), выше; Carter (1995)). В исследованиях вспомогательных функций, осуществляемых аденовирусами, имеющими мутации в кодирующей области E1B, получали противоречивые результаты, но E1B55k может быть необходимым для продукции вирионов AAV, а E1B19k - нет (Samulski et al., (1988) J. Virol. 62:206-210). Кроме того, в международной публикации № WO 97/17458 и Matshushita et al., (1998) Gene Therapy 5:938-945 описывают векторы вспомогательной функции, кодирующие различные гены аденовируса. Примеры векторов вспомогательной функции включают кодирующую область РНК VA аденовируса, кодирующую область ORF6 E4 аденовируса, кодирующую область E2A 72 кДа аденовируса, кодирующую область E1A аденовируса и область E1B аденовируса без интактной кодирующей области E1B55k. Такие векторы вспомогательной функции описаны, например, в международной публикации № WO 01/83797.
[0041] В рамках изобретения термин "серотип" представляет собой отличие, используемое для обозначения AAV, имеющего капсид, серологически отличающийся от других серотипов AAV. Серологическое отличие определяют с учетом отсутствия перекрестной реактивности между антителами в отношении одного AAV по сравнению с другим AAV. Отличия в перекрестной реактивности, как правило, являются результатом отличий в последовательностях/антигенных детерминантах белков капсида (например, по причине отличий последовательности VP1, VP2 и/или VP3 серотипов AAV).
[0042] В соответствии с общепринятым определением термин "серотип" означает, что интересующий вирус тестировали против сыворотки, специфической для всех существующих и охарактеризованных серотипов, на нейтрализующую активность и не обнаруживали антитела, нейтрализующие интересующий вирус. Т.к. обнаруживают все больше изолятов природного вируса и/или получают все больше мутантов по капсиду, могут иметь место или отсутствовать серологические отличия относительно любого существующего серотипа. Таким образом, в случаях, когда новый вирус (например, AAV) не имеет серологических отличий, этот новый вирус (например, AAV) будет подгруппой или вариантом соответствующего серотипа. Во многих случаях серологическое тестирование на нейтрализующую активность необходимо проводить на мутантных вирусах с модификациями последовательности капсида для определения того, относятся ли они к другому серотипу в соответствии с общепринятым определением серотипа. Таким образом, для удобства и во избежание повторения, термин "серотип" в широком смысле относится к серологически отличающимся вирусам (например, AAV), а также вирусам (например, AAV), серологически не отличающимся, которые могут относиться к одной подгруппе или варианту указанного серотипа.
[0043] Векторы rAAV включают любой вирусный штамм или серотип. В качестве неограничивающего примера, плазмида или геном вектора или частица (капсид) rAAV могут быть основаны на любом серотипе AAV, таком как, например, AAV-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11. Такие векторы могут быть основаны на одном и том же штамме или серотипе (или подгруппе или варианте) или могут отличаться друг от друга. В качестве неограничивающего примера, плазмида, или геном вектора, или частица (капсид) rAAV, основанные на одном геноме серотипа, могут быть идентичными одному или нескольким из белков капсида, упаковывающих вектор. Кроме того, плазмида или геном вектора rAAV могут быть основаны на геноме серотипа AAV (например, AAV2), отличающемся от одного или нескольких белков капсида, упаковывающих геном вектора, в случае чего по меньшей мере один из трех белков капсида может являться, например, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 или их вариантом. Таким образом, векторы rAAV включают последовательности гена/белка, идентичные последовательностям гена/белка, характерным для конкретного серотипа, а также смешанных серотипов.
[0044] В различных примерах вариантов осуществления вектор rAAV включает или состоит из последовательности капсида, по меньшей мере на 70% или более (например, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% и т.д.) идентичной одному или нескольким из белков капсида AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10 или AAV11. В различных примерах вариантов осуществления вектор rAAV включает или состоит из последовательности, по меньшей мере на 70% или более (например, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% и т.д.) идентичной одному или нескольким из ITR AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10 или AAV11.
[0045] rAAV, такие как AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 и их варианты, гибридные и химерные последовательности можно конструировать рекомбинантными способами, известными специалистам в этой области, так, чтобы они включали одну или несколько гетерологичных полинуклеотидных последовательностей (трансгенов), фланкированных одной или несколькими функциональными последовательностями ITR AAV. Такие векторы содержат один или несколько генов AAV дикого типа, делетированных полностью или частично, но сохраняющих по меньшей мере одну функциональную фланкирующую последовательность ITR, по мере необходимости, для спасения, репликации и упаковки рекомбинантного вектора в частицу вектора rAAV. Таким образом, геном вектора rAAV будет включать последовательности, необходимые в цис-положении для репликации и упаковки (например, функциональные последовательности ITR).
[0046] Термины "нуклеиновая кислота" и "полинуклеотид" в настоящем описании используют взаимозаменяемо для обозначения всех форм нуклеиновой кислоты, олигонуклеотидов, включая дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Нуклеиновые кислоты включают геномную ДНК, кДНК и антисмысловую ДНК, и сплайсированную или несплайсированную мРНК, рРНК, тРНК и ингибиторную ДНК или РНК (РНКи, например, малую или короткую шпилечную (sh)РНК, микроРНК (мкРНК), малую или короткую интерферирующую миРНК, транс-сплайсинговую РНК или антисмысловую РНК). Нуклеиновые кислоты включают природные, синтетические и преднамеренно модифицированные или измененные полинуклеотиды. Нуклеиновые кислоты могут являться одноцепочечными, двухцепочечными, или триплексными, линейными или кольцевыми и могут иметь любую длину. Что касается нуклеиновых кислот, последовательность или структура конкретного полинуклеотида может быть представлена в настоящем описании в соответствии с общепринятым представлением последовательности в 5'-3'-направлении.
[0047] Термин "гетерологичная" последовательность нуклеиновой кислоты относится к полинуклеотиду, встроенному в плазмиду или вектор AAV в целях вектор-опосредованного переноса/доставки полинуклеотида в клетку. Гетерологичные последовательности нуклеиновой кислоты отличаются от нуклеиновой кислоты AAV, т.е. являются ненативными в отношении нуклеиновой кислоты AAV. После переноса/доставки в клетку гетерологичную последовательность нуклеиновой кислоты, содержащуюся в векторе, можно экспрессировать (например, транскрибировать и транслировать, при необходимости). Альтернативно, перенесенный/доставленный гетерологичный полинуклеотид в клетке, содержащийся в векторе, можно не экспрессировать. Хотя термин "гетерологичный" не всегда используют в настоящем описании по отношению к последовательностям нуклеиновой кислоты и полинуклеотидам, упоминание последовательности нуклеиновой кислоты или полинуклеотида даже в отсутствие определения "гетерологичный" предназначено для включения гетерологичных последовательностей нуклеиновой кислоты и полинуклеотидов, несмотря на опущение.
[0048] "Полипептиды", "белки" и "пептиды", кодируемые "последовательностью нуклеиновой кислоты", включают полноразмерные нативные последовательности, как в природных белках, а также функциональные подпоследовательности, модифицированные формы или варианты последовательности при условии, что подпоследовательность, модифицированная форма или вариант сохраняют некоторую степень функциональности нативного полноразмерного белка. Такие полипептиды, белки и пептиды, кодируемые последовательностями нуклеиновой кислоты, необязательно, могут являться идентичными эндогенному белку, являющемуся дефектным, или экспрессия которого является недостаточной или дефектной у млекопитающего, подвергаемого лечению.
[0049] Термин "трансген" в настоящем описании используют в отношении нуклеиновой кислоты (например, гетерологичной), предназначенной для встраивания или встраиваемой в клетку или организм. Трансгены включают любую нуклеиновую кислоту, такую как гетерологичная нуклеиновая кислота, кодирующая терапевтический белок или полинуклеотидную последовательность.
[0050] В клетке, содержащей трансген, трансген встраивают/переносят с помощью плазмиды или вектора AAV, "трансдукции" или "трансфекции" клетки. Термины "трансдуцировать" и "трансфицировать" относятся к встраиванию молекулы, такой как нуклеиновая кислота, в клетку-хозяина (например, HEK293) или клетки организма. Трансген может интегрироваться или может не интегрироваться в геномную нуклеиновую кислоту клетки-реципиента. Если встраиваемая нуклеиновая кислота интегрируется в нуклеиновую кислоту (геномную ДНК) клетки- или организма-реципиента, ее можно стабильно поддерживать в этой клетке или организме, и она будет передаваться или наследоваться клетками- или организмами-потомками клетки-реципиента или клеток организма.
[0051] Термин "клетка-хозяин" означает, например, микроорганизмы, дрожжевые клетки, клетки насекомых и клетки млекопитающих, которые можно использовать в качестве реципиентов или используемые в качестве реципиентов плазмиды вектора AAV, AAV-хелперной конструкции, вектора вспомогательной функции или другой транспортной ДНК. Термин включает потомство исходной клетки, подвергнутой трансфекции. Таким образом, термин "клетка-хозяин", как правило, относится к клетке, трансфицированной с использованием экзогенной последовательности ДНК. Следует понимать, что потомство одной родительской клетки не обязательно может быть полностью идентичным исходному родителю по морфологии или в отношении геномной или тотальной ДНК по причине природной, случайной или преднамеренной мутации. Примеры клеток-хозяев включают эмбриональные клетки почки человека (HEK), такие как HEK293.
[0052] "Трансдуцированной клеткой" является клетка, в которую встраивают трансген. Таким образом, термин "трансдуцированная" клетка означает генетическое изменение в клетке после встраивания экзогенной молекулы, например, нуклеиновой кислоты (например, трансгена), в клетку. Таким образом, "трансдуцированная" клетка является клеткой, в которую или в потомство которой встроена экзогенная нуклеиновая кислота. Клетки можно выращивать (культивировать) и экспрессировать встроенный белок или транскрибировать нуклеиновую кислоту или вектор, такой как rAAV, продуцируемый клеткой. В случае применения и способов, касающихся генной терапии, трансдуцированная клетка может находиться в индивидууме.
[0053] В рамках изобретения термин "стабильный" по отношению к клетке или "стабильно интегрированный" означает, что последовательности нуклеиновой кислоты, такие как селективный маркер или гетерологичная последовательность нуклеиновой кислоты, или плазмиду или вектор встраивают в хромосому (например, посредством гомологичной рекомбинации, негомологичного соединения концов, трансфекции и т.д.) или поддерживают в клетке-реципиенте или организме-хозяине экстрахромосомно, и они остаются в хромосоме или поддерживаются экстрахромосомно в течение периода времени. В случае культуры клеток последовательности нуклеиновой кислоты, такие как гетерологичная последовательность нуклеиновой кислоты, или плазмиду или вектор, встроенные в хромосому, можно поддерживать в течение множества пассажей клеток.
[0054] Термин "линия клеток" относится к популяции клеток, способных к непрерывному или длительному росту и делению in vitro в подходящих условиях культивирования. Линии клеток, необязательно, могут являться клональными популяциями, полученными из одной клетки-предшественника. В линиях клеток могут возникать спонтанные или индуцированные изменения кариотипа при хранении или переносе таких клональных популяций, а также в течение длительного пассирования в культуре ткани. Таким образом, клетки-потомки, полученные из линии клеток, могут не являться в точности идентичными клеткам- или культурам-предшественникам. Примером линии клеток, применимой для способов очистки по изобретению, является HEK293.
[0055] Термин "элемент контроля экспрессии" относится к последовательностям нуклеиновой кислоты, влияющим на экспрессию функционально связанной нуклеиновой кислоты. Элементы контроля включают элементы контроля экспрессии, как указано в настоящем описании, такие как промоторы и энхансеры. Векторы rAAV могут включать один или несколько "элементов контроля экспрессии". Как правило, такие элементы включают для облегчения правильной транскрипции гетерологичного полинуклеотида и, при необходимости, трансляции (например, промотор, энхансер, сигнал сплайсинга для интронов, поддержание правильной рамки считывания гена, чтобы сделать возможной трансляцию мРНК в рамке считывания, стоп-кодоны и т.д.). Такие элементы, как правило, действуют в цис-положении, и их обозначают как "цис-действующий" элемент, но также могут действовать и в транс-положении.
[0056] На контроль экспрессии можно влиять на уровне транскрипции, трансляции, сплайсинга, стабильности мРНК и т.д. Как правило, элемент контроля экспрессии, модулирующий транскрипцию, расположен вблизи 5'-конца (т.е. "выше") транскрибируемой нуклеиновой кислоты. Элементы контроля экспрессии также могут располагаться на 3'-конце (т.е. "ниже") транскрибируемой последовательности или внутри транскрипта (например, в интроне). Элементы контроля экспрессии могут располагаться смежно или на расстоянии от транскрибируемой последовательности (например, в 1-10, 10-25, 25-50, 50-100, 100-500 или более нуклеотидов от полинуклеотида), даже на значительном расстоянии. Тем не менее, вследствие ограничения длины векторов rAAV, элементы контроля экспрессии будут, как правило, находиться в пределах от 1 до 1000 нуклеотидов от транскрибируемой нуклеиновой кислоты.
[0057] Функционально, экспрессия функционально связанной нуклеиновой кислоты, по меньшей мере, частично контролируется элементом (например, промотором) таким образом, что элемент модулирует транскрипцию нуклеиновой кислоты и, при необходимости, трансляцию транскрипта. Конкретным примером элемента контроля экспрессии является промотором, как правило, локализующийся в 5'-направлении от транскрибируемой последовательности. Промотор, как правило, повышает количество, экспрессирующееся с функционально связанной нуклеиновой кислоты, по сравнению с количеством, экспрессирующимся в отсутствие промотора.
[0058] В рамках изобретения термин "энхансер" может относиться к последовательности, локализующейся смежно с последовательностью нуклеиновой кислоты, такой как селективный маркер или гетерологичная последовательность нуклеиновой кислоты Энхансерные элементы, как правило, локализуются выше промоторного элемента, но также функционируют и могут локализоваться ниже последовательности или в ней. Таким образом, энхансерный элемент может локализоваться выше или ниже, например, в пределах 100 пар оснований, 200 пар оснований или 300 или более пар оснований от последовательности, такой как селективный маркер и/или гетерологичная нуклеиновая кислота, кодирующая терапевтический белок или полинуклеотидную последовательность. Энхансерные элементы, как правило, повышают экспрессию функционально связанной нуклеиновой кислоты относительно экспрессии, обеспечиваемой промоторным элементом.
[0059] Термин "функционально связанный" означает, что регуляторные последовательности, необходимые для экспрессии последовательности нуклеиновой кислоты, располагают в соответствующих положениях относительно последовательности так, чтобы влиять на экспрессию последовательности нуклеиновой кислоты. Это же определение иногда применимо к расположению последовательностей нуклеиновой кислоты и элементов транскрипционного контроля (например, промоторов, энхансеров и терминаторов) в экспрессирующем векторе, например, векторе rAAV.
[0060] В примере элемента контроля экспрессии, функционально связанного с нуклеиновой кислотой, взаимосвязь является такой, что элемент контроля модулирует экспрессию нуклеиновой кислоты. Более конкретно, например, то, что две последовательности ДНК функционально связаны, означает, что две ДНК расположены (в цис- или транс-положении) в такой взаимосвязи, что по меньшей мере одна из последовательностей ДНК способна проявлять физиологический эффект в отношении другой последовательности.
[0061] Таким образом, дополнительные элементы для векторов включают, в качестве неограничивающих примеров, элемент контроля экспрессии (например, промотор/энхансер), сигнал терминации транскрипции или стоп-кодон, 5'- или 3'-нетранслируемые области (например, последовательности полиаденилирования (полиА)), фланкирующие последовательность, такие как одна или несколько копий последовательности ITR AAV, или интрон.
[0062] Дополнительные элементы включают, например, филлерные или спейсерные полинуклеотидные последовательности, например, для улучшения упаковки и снижения наличия контаминирующей нуклеиновой кислоты. Векторы AAV, как правило, принимают вставки ДНК, имеющие диапазон размеров, составляющий, как правило, от приблизительно 4 т.п.н. до приблизительно 5,2 т.п.н. или немного больше. Таким образом, в случае более коротких последовательностей включение спейсера или филлера для корректировки длины до нормального размера вирусной геномной последовательности или близкого к нему, приемлемого для упаковки вектора в частицу rAAV. В различных вариантах осуществления филлерная/спейсерная последовательность нуклеиновой кислоты является нетранслируемым (некодирующим белок) сегментом нуклеиновой кислоты. В случае последовательности нуклеиновой кислоты менее чем 4,7 т.п.н. филлерная или спейсерная полинуклеотидная последовательность имеет длину, которая при комбинировании (например, вставке в вектор) с последовательностью имеет общую длину приблизительно 3,0-5,5 т.п.н., или приблизительно 4,0-5,0 т.п.н., или приблизительно 4,3-4,8 т.п.н.
[0063] В одном из вариантов осуществления "терапевтический белок" является пептидом или белком, который может облегчать или снижать симптомы, являющиеся результатом недостаточного количества, отсутствия или дефекта белка в клетке или индивидууме. "Терапевтический" белок, кодируемый трансгеном, может вызывать благоприятный эффект в отношении индивидуума, например, для коррекции генетического дефекта, для коррекции недостаточности гена (недостаточности экспрессии или функциональной недостаточности) и т.д.
[0064] Неограничивающие примеры гетерологичных нуклеиновых кислот, кодирующих продукты генов (например, терапевтические белки), применимых по изобретению, включают нуклеиновые кислоты, которые можно использовать в лечении заболевания или нарушения, включая, в качестве неограничивающих примеров, нарушения "гемостаза" или свертывания крови, такие как гемофилия A, гемофилия A у пациентов с ингибиторными антителами, гемофилия B, недостаточности факторов свертывания, VII, VIII, IX и X, XI, V, XII, II, фактора Виллебранда, комбинированная недостаточность FV/FVIII, талассемия, недостаточность витамин K-эпоксидредуктазы C1, недостаточность гамма-карбоксилазы; анемия, кровотечение, связанное с травмой, повреждение, тромбоз, тромбоцитопения, инсульт, коагулопатия, диссеминированное внутрисосудистое свертывание (DIC); гиперантикоагуляция, связанная с гепарином, низкомолекулярным гепарином, пентасахаридом, варфарином, низкомолекулярными антитромботическими средствами (т.е. ингибиторами FXa); и тромбоцитарные нарушения, такие как синдром Бернара-Сулье, тромбастения Гланцманна и недостаточность пула тромбоцитов.
[0065] Молекулы нуклеиновой кислоты, векторы, такие как клонирующие, экспрессирующие векторы (например, геномы векторов), и плазмиды можно получать с использованием способов рекомбинантных ДНК. Доступность информации о нуклеотидной последовательности делает возможным получение молекул нуклеиновой кислоты множеством способов. Например, гетерологичную нуклеиновую кислоту, кодирующую фактор IX (FIX), содержащую вектор или плазмиду, можно получать с использованием различных стандартных способов клонирования, технологии рекомбинантных ДНК, посредством экспрессии в клетке или трансляции in vitro и способами химического синтеза. Чистоту полинуклеотидов можно определять посредством секвенирования, электрофореза в геле и т.п. Например, нуклеиновые кислоты можно выделять с использованием гибридизации или компьютерных способов скрининга баз данных. Такие способы включают, в качестве неограничивающих примеров: (1) гибридизацию библиотек геномной ДНК или кДНК с использованием зондов для детекции гомологичных нуклеотидных последовательностей; (2) скрининг с использованием антител для детекции полипептидов, имеющих общие структурные признаки, например, с использованием экспрессионной библиотеки; (3) полимеразную цепную реакцию (ПЦР) с использованием геномной ДНК или кДНК и праймеров, способных отжигаться на интересующей последовательности нуклеиновой кислоты; (4) компьютеризированные поиски родственных последовательностей в базах данных последовательностей; и (5) дифференциальный скрининг библиотеки вычитаемых нуклеиновых кислот.
[0066] Термин "выделенный" при использовании в качестве определения композиции означает, что композиции получены руками человека или отделены полностью или, по меньшей мере, частично, от своего природного окружения in vivo. Как правило, выделенные композиции, по существу, не содержат один или несколько материалов, с которыми они, как правило, ассоциированы в природе, например, один или несколько белков, нуклеиновых кислот, липидов, углеводов, клеточных мембран.
[0067] Что касается белка, в настоящем описании иногда используют термин "выделенный белок" или "выделенный и очищенный белок". Этот термин относится, главным образом, к белку, получаемому посредством экспрессии молекулы нуклеиновой кислоты. Альтернативно, этот термин может относиться к белку, в достаточной степени отделенному от других белков, с которыми он был бы ассоциирован в природе, таким образом, что он существует в "по существу, чистой" форме.
[0068] Термин "выделенный" не исключает комбинации, полученные руками человека, например, рекомбинантный rAAV и фармацевтический состав. Термин "выделенный" также не исключает альтернативные физические формы композиции, такие как гибриды/химеры, мультимеры/олигомеры, модификации (например, фосфорилирование, гликозилирование, липидирование) или дериватизированные формы, или формы, экспрессируемые в клетках-хозяевах, полученных руками человека.
[0069] Термин "по существу, чистый" относится к препарату, содержащему по меньшей мере 50-60% по массе интересующего соединения (например, нуклеиновой кислоты, олигонуклеотида, белка и т.д.). Препарат может содержать по меньшей мере 75% по массе, или приблизительно 90-99% по массе интересующего соединения. Чистоту измеряют способами, подходящими для интересующего соединения (например, хроматографическими способами, посредством электрофореза в агарозном или полиакриламидном геле, анализа ВЭЖХ и т.п.).
[0070] Фраза "по существу, состоящий из" в отношении конкретной нуклеотидной последовательности или аминокислотной последовательности означает последовательность, имеющую свойства указанной последовательности. Например, при использовании в отношении аминокислотной последовательности фраза включает саму последовательность и молекулярные модификации, которые не будут влиять на основные и новые характеристики последовательности.
[0071] Способы, известные в этой области для получения вирионов rAAV: например, трансфекция с использованием вектора AAV и AAV-хелперных последовательностей в комбинации с коинфицированием с использованием одного из AAV-хелперных вирусов (например, аденовируса, вируса герпеса или вируса осповакцины) или трансфекция с использованием рекомбинантного вектора AAV, AAV-хелперного вектора и вектора вспомогательной функции. Неограничивающие способы получения вирионов rAAV описаны, например, в патентах США №№6001650 и 6004797. После получения рекомбинантного вектора rAAV (т.е. получения вектора в системах культур клеток) вирионы rAAV можно получать из клеток-хозяев и супернатанта культуры клеток и очищать, как указано в настоящем описании.
[0072] В качестве начальной стадии, как правило, клетки-хозяева, продуцирующие вирионы rAAV, можно собирать, необязательно, в комбинации со сбором супернатанта культуры клеток, в котором культивировали клетки-хозяева, продуцирующие вирионы rAAV. В способах, представленных в настоящем описании, собранные клетки и, необязательно, супернатант культуры клеток можно использовать как есть, при необходимости, или концентрировать их. Кроме того, если для осуществления вспомогательных функций используют инфицирование, можно инактивировать остаточный хелперный вирус. Например, аденовирус можно инактивировать посредством нагревания до температуры приблизительно 60°C в течение, например, 20 минут или более, что инактивирует только хелперный вирус, т.к. AAV является термически стабильным, в то время как хелперный аденовирус является термически лабильным.
[0073] Супернатант и клетки из сбора лизируют посредством разрушения клеток, например, посредством микрофлюидизации, для высвобождения частиц rAAV. Затем можно добавлять нуклеазу, такую как бензоназа, для деградации контаминирующей ДНК. Как правило, полученный лизат очищают для удаления клеточного детрита, например, посредством фильтрации, центрифугирования, для получения очищенного лизата клеток. В конкретном примере лизат фильтруют с использованием фильтра с микронным размером пор (например, фильтра 0,45 мкм и/или 0,2 мкм) для получения очищенного лизата.
[0074] Очищенный лизат содержит частицы AAV (настоящие векторы rAAV и пустые капсиды AAV) и связанные с производством вектора AAV примеси, такие как растворимые клеточные компоненты из клеток-хозяев, которые могут включать клеточные белки, липиды и/или нуклеиновые кислоты, и компоненты сред для культивирования клеток. Затем очищенный лизат подвергают дополнительным стадиям очистки для очистки частиц AAV (включая настоящие векторы rAAV) от примесей с использованием хроматографии. Очищенный лизат можно разводить подходящим буфером до первой стадии хроматографии.
[0075] Как правило, для очистки частиц rAAV используют множество последовательных стадий хроматографии. Такие способы, как правило, исключают стадию ультрацентрифугирования в градиенте хлорида цезия.
[0076] Как представлено в настоящем описании, первой стадией хроматографии может являться анионообменная хроматография или катионообменная хроматография. Если первой стадией хроматографии является анионообменная хроматография, третьей стадией хроматографии может являться катионообменная хроматография. Таким образом, в одном из способов очистки rAAV очистку осуществляют посредством анионообменной хроматографии с последующей очисткой посредством эксклюзионной хроматографии, а затем очисткой посредством катионообменной хроматографии.
[0077] Если первой стадией хроматографии является катионообменная хроматография, то третьей стадией хроматографии может являться анионообменная хроматография. Таким образом, в другом способе очистки rAAV очистку осуществляют посредством катионообменной хроматографии с последующей очисткой посредством эксклюзионной хроматографии, а затем очисткой посредством анионообменной хроматографии.
[0078] Анионообменную хроматографию используют для разделения частиц AAV и белков, клеточных и других компонентов, присутствующих в очищенном лизате и/или колоночном элюате, полученном посредством эксклюзионной хроматографии. Анионообменные смолы включают, в качестве неограничивающих примеров, смолы на основе полиаминных смол и другие смолы. Примеры сильных анионообменных смол включают смолы, как правило, на основе кватернизированного атома азота, включая, в качестве неограничивающих примеров, смолы с четвертичными солями аммония, такие как смолы триалкилбензиламмония. Подходящие материалы для ионообменной хроматографии включают, в качестве неограничивающих примеров, MACRO PREP Q (сильный анионообменник, доступный в BioRad, Hercules, Calif.); UNOSPHERE Q (сильный анионообменник, доступный в BioRad, Hercules, Calif.); POROS 50HQ (сильный анионообменник, доступный в Applied Biosystems, Foster City, Calif.); POROS 50D (слабый анионообменник, доступный в Applied Biosystems, Foster City, Calif.); POROS 50PI (слабый анионообменник, доступный в Applied Biosystems, Foster City, Calif.); SOURCE 30Q (сильный анионообменник, доступный в Amersham Biosciences, Piscataway, N.J.); DEAE SEPHAROSE (слабый анионообменник, доступный в Amersham Biosciences, Piscataway, N.J.); Q SEPHAROSE (сильный анионообменник, доступный в Amersham Biosciences, Piscataway, N.J.). Дополнительные примеры анионообменных смол включают аминоэтил (AE), диэтиламиноэтил (DEAE), диэтиламинопропил (DEPE) и четвертичный аминоэтил (QAE).
[0079] Катионообменную хроматографию используют для дальнейшего разделения частиц AAV и клеточных и других компонентов, присутствующих в очищенном лизате и/или колоночном элюате, полученном посредством эксклюзионной хроматографии. Неограничивающие примеры сильных катионообменных смол, способных связывать вирионы rAAV при широком диапазоне pH, включают любые смолы на основе сульфоновой кислоты, на что указывает наличие сульфонатной функциональной группы, включая арил- и алкил-замещенные сульфонаты, такие как сульфопропиловые или сульфоэтиловые смолы. Типичные матрицы включают, в качестве неограничивающих примеров, POROS HS, POROS HS 50, POROS SP, POROS S (сильные катионообменники, доступные в Applied Biosystems, Foster City, Calif.). Дополнительные примеры включают коммерческие семейства смол DOWEX®, AMBERLITE® и AMBERLYST®, доступные в Aldrich Chemical Company (Milliwaukee, WI). Слабые катионообменные смолы включают, в качестве неограничивающих примеров, любые смолы на основе карбоновых кислот. Примеры катионообменных смол включают карбоксиметиловые (CM), фосфатные (на основе фосфатной функциональной группы), метилсульфонатные (S) и сульфопропиловые (SP) смолы.
[0080] Хроматографическую среду, такую как катионообменная, анионообменная и эксклюзионная, можно уравновешивать, промывать и элюировать с использованием различных буферов в различных условиях, таких как pH и объем буфера. Следующее предназначено для описания конкретных неограничивающих примеров, а не для ограничения изобретения.
[0081] Катионообменную хроматографическую среду можно уравновешивать с использованием стандартных буферов по инструкциям производителя. Например, хроматографические среды можно уравновешивать ацетатным буфером в концентрации от 5 до 50 мМ или 10-40 мМ, такой как 10-30 мМ, и хлоридом натрия. После уравновешивания нагружают образец. Затем хроматографические среды промывают по меньшей мере один или более раз, например, 2-5 раз. Элюцию из хроматографических сред осуществляют с помощью высокосолевого буфера по меньшей мере один раз, но элюцию можно осуществлять 2 или более раз с использованием буфера с той же или более высокой концентрацией соли.
[0082] Типичные уравновешивающие буферы и растворы для промывок и элюций в случае катионообменной хроматографии имеют подходящий pH приблизительно от pH 3 до pH 8, более типично - приблизительно от pH 4 до pH 6, например, pH 4,1, 4,2, 4,3, 4,4. 4,5- 5,5, 5,6, 5,7, 5,8, 5,9, или 6,0 или любом pH в указанных диапазонах.
[0083] Подходящие уравновешивающие буферы и растворы для промывок и элюций в случае катионообменных колонок известны в этой области и, как правило, являются анионными. Такие буферы включают, в качестве неограничивающих примеров, буферы со следующими буферными ионами: фосфатом, ацетатом, цитратом, боратом или сульфатом.
[0084] В одном из вариантов осуществления катионообменные хроматографические среды сначала уравновешивают, наносят образец и промывают при низкой концентрации соли, например, 10-100 мМ NaCl, такой как 10, 20, 25, 30, 35, 40, 45, 50, 55, 60, 60-100 мМ, или любой концентрации или в этих диапазонах. После нанесения образца хроматографические среды можно обрабатывать при более высокой концентрации соли для элюции примесей, такой как более высокая концентрация NaCl, или с использованием другого буфера с более высокой ионной силой. Одним из примеров в случае использования в качестве второго буфера является ацетатный буфер с концентрацией NaCl 100-200 мМ или любой концентрацией в этих указанных диапазонах. После элюции дополнительных примесей из колонки, для элюции частиц AAV можно повышать ионную силу буфера с использованием соли, такой как NaCl, KCl, сульфат, формиат или ацетат, и выделять.
[0085] В промывочные растворы для анионообменных хроматографических сред можно включать полиэтиленгликоль(PEG). В этом случае хроматографию обозначают как полиэтиленгликоль (PEG)-модулируемую хроматографию на колонках. Промывочные растворы с PEG можно наносить на анионообменные хроматографические среды перед элюцией частиц вектора AAV.
[0086] Типичные уравновешивающие буферы и растворы для промывок и элюций в случае анионообменной хроматографии подходящие при pH приблизительно от pH 5 до pH 12, более типично - приблизительно от pH 6 до pH 10, и даже более типично - от pH 7 до pH 9,5, таком как pH 7,1, 7,2, 7,3, 7,4-8,0, 8,1, 8,2, 8,3, 8,4, 8,5-9,0, 9,1, 9,2, 9,3, 9,4, 9,5 или любом pH в указанных диапазонах.
[0087] Подходящие уравновешивающие буферы и растворы для промывок и элюций для анионообменных колонок известны в этой области и, как правило, являются катионными или цвиттерионными по своей природе. Такие буферы включают, в качестве неограничивающих примеров, буферы со следующими буферными ионами: N-метилпиперазином; пиперазином; бис-Трис; бис-Трис-пропаном; триэтаноламином; Трис; N-метилдиэтаноламином; 1,3-диаминопропаном; этаноламином; уксусной кислотой и т.п. Для элюции образца ионную силу начального буфера повышают с использованием соли, такой как NaCl, KCl, сульфат, формиат или ацетат.
[0088] В одном из вариантов осуществления анионообменные хроматографические среды сначала уравновешивают, наносят образец и промывают с использованием низкой концентрации соли, например, 10-100 мМ NaCl, такой как 10, 20, 25, 30, 35, 40, 45, 50, 55, 60, 60-100 мМ, или любой концентрации в этих диапазонах. После нанесения образца хроматографические среды можно обрабатывать с использованием более высокой концентрации соли для элюции примесей, такой как более высокая концентрация NaCl, или с использованием другого буфера с более высокой ионной силой. Одним из примеров использования в качестве второго буфера является буфер на основе Трис с концентрацией NaCl 100-200 мМ или любой концентрацией в этих указанных диапазонах. После элюции дополнительных примесей из колонки, частицы AAV можно выделять с использованием более высокой концентрации соли.
[0089] В промывочные растворы для анионообменных хроматографических сред можно включать полиэтиленгликоль(PEG). В этом случае хроматографию обозначают как полиэтиленгликоль (PEG)-модулируемую хроматографию на колонках. Промывочные растворы с PEG можно наносить на анионообменные хроматографические среды перед элюцией частиц вектора AAV.
[0090] Как правило, PEG в таких промывочных растворах имеет среднюю молекулярную массу в диапазоне приблизительно от 1000 до 50000 включительно. Типичные количества PEG в таких промывочных растворах находятся в диапазоне приблизительно от 0,1% до приблизительно 20% PEG, или являются любым количеством в этих указанных диапазонах, или составляют приблизительно от 1% до приблизительно 10% PEG или являются любым количеством в этих указанных диапазонах.
[0091] Эксклюзионные хроматографические среды можно уравновешивать с использованием стандартных буферов по инструкциям производителя. Например, хроматографические среды можно уравновешивать с использованием фосфатного буфера, например, в концентрации от 1 до 5 мМ, от 5 до 50 мМ или 5-25 мМ, и хлорида натрия, например, в концентрации от 25 до 50 мМ, от 50 до 100 мМ, 100-150 мМ или 125-175 мМ.
[0092] После уравновешивания нагружают образец. Затем выделяют элюат, содержащий частицы AAV. Для выделения частиц AAV можно добавлять дополнительные объемы буфера (например, фосфатного буфера) в зависимости от количества хроматографических сред и/или размера колонки.
[0093] В конкретных вариантах осуществления эксклюзионные хроматографические среды имеют диапазон разделения (по молекулярной массе) приблизительно от 10000 до 600000 включительно. Конкретные смолы (среды), подходящие для эксклюзионной хроматографии, включают, в качестве неограничивающих примеров, частицы или бусы пористой целлюлозы, перекрестно сшитой агарозы (Sepharose), перекрестно сшитого декстрана (Sephadex), стирол-дивинилбензола (Dianon HP-20), полиакриламида (Bio Gel), метакрила (Toyopearl) и стекла с контролируемым размером пор.
[0094] Объемы буфера для элюции могут зависеть от количества хроматографических сред и/или размера колонки для достижения выделения частиц AAV. Типичные объемы составляют 1-10 объемов колонки.
[0095] Колоночный элюат собирают после элюций на каждой из стадий хроматографии. AAV можно определять во фракциях стандартными способами, такими как мониторинг УФ-поглощения при 260 и 280 нм.
[0096] Использование катионо- или анионообменных хроматографических сред, природу используемых сред (т.е. сильных или слабых ионообменников) и условия концентрации соли, используемого буфера и pH можно варьировать в зависимости от капсида AAV (т.е. серотипа или псевдотипа капсида AAV). Хотя структура капсида AAV, как правило, обладает такими признаками, как размер и форма, капсиды могут иметь разные аминокислотные последовательности, что приводит к небольшим различиям в молекулярной топологии и распределении поверхностного заряда. Таким образом, ожидают, что варианты последовательности капсида будут поддаваться очистке способами по изобретению, и соответствующие способы можно определять систематически с использованием скрининговых исследований хроматографических сред и буферов для определения того, будут ли использовать другие условия для варианта капсида AAV в случае очистки частиц AAV.
[0097] Элюаты, содержащие частицы AAV, полученные посредством любой из стадий анионообменной, эксклюзионной или катионообменной хроматографии, как представлено в настоящем описании, при желании, можно эффективно концентрировать посредством ультрафильтрации/диафильтрации. Специалисты в этой области могут контролировать снижение объема. В конкретных неограничивающих примерах достигаемое снижение объема является 1-20-кратным включительно. Таким образом, 1-кратное снижение приводит к снижению объема наполовину, например, 1000 мл концентрируют до 500 мл. 10-кратное снижение приводит к снижению объема в 10 раз, например, 2000 мл концентрируют до 200 мл. 20-кратное снижение приводит к снижению объема в 20-раз, например, 2000 мл концентрируют до 100 мл.
[0098] Неограничивающим примером ультрафильтрации/диафильтрации является фильтрация тангенциальным потоком (TFF). Например, можно получать половолоконную мембрану с номинальным размером пор, соответствующим пороговому значению молекулярной массы 100 кДа, таким образом, что можно получать большие количества вектора AAV, если они присутствуют в более крупных объемах элюата.
[0099] Способами по изобретению достигают значительного выделения частиц AAV. Например, способами по изобретению достигают выделения частиц AAV в количестве приблизительно 40-70% от общего количества частиц вектора rAAV из клеток-хозяев и собранного супернатанта культур клеток-хозяев. В другом примере частицы AAV присутствуют в конечном (например, третьем колоночном) элюате в концентрации приблизительно 100 мг/мл. Частицы вектора AAV могут присутствовать в конечном (например, третьем колоночном) элюате в концентрации 1015 частиц на мл или более, 1016 частиц на мл, 1017частиц на мл.
[0100] Альтернативно, если концентрации частиц вектора AAV являются более низкими, очищенные частицы AAV можно концентрировать. Например, очищенные частицы AAV можно концентрировать до 1015 частиц на мл посредством ультрафильтрации/диафильтрации (например, TFF). Если желательны более высокие концентрации вектора, очищенные частицы AAV можно концентрировать до 1016 частиц на мл посредством ультрафильтрации/диафильтрации (например, TFF) или даже более высокой концентрации.
[0101] С помощью комбинации очистки частиц AAV из очищенных лизатов клеток посредством полностью колоночного способа хроматографии и концентрирования (при необходимости) очищенных частиц AAV посредством ультрафильтрации/диафильтрации (например, TFF) получают большие количества высокоочищенного рекомбинантного вектора rAAV.
[0102] В других вариантах осуществления вирионы rAAV с упакованными геномами (т.е. настоящие частицы вектора rAAV) "по существу, не содержат примеси AAV-инкапсидированных нуклеиновых кислот", если по меньшей мере приблизительно 60% или более присутствующих вирионов являются вирионами rAAV с упакованными геномами (т.е. настоящими частицами вектора rAAV). Количество получаемых вирионов rAAV с упакованными геномами (т.е. настоящих частиц вектора rAAV), по существу, не содержащих примеси AAV-инкапсидированных нуклеиновых кислот, может составлять от приблизительно 40% до приблизительно 20% или менее, от приблизительно 20% до приблизительно 10% или менее, от приблизительно 10% до приблизительно 5% или менее, от приблизительно 5% до приблизительно 1% или менее чем 1% или менее от продукта, содержащего примеси AAV-инкапсидированных нуклеиновых кислот.
[0103] В этой области известны способы определения инфекционного титра вектора AAV, содержащего трансген (см., например, Zhen et al., (2004) Hum. Gene Ther. (2004) 15:709). Известны способы анализа пустых капсидов и частиц вектора AAV с упакованными геномами (см., например, Grimm et al., Gene Therapy (1999) 6:1322-1330; Sommer et al., Molec. Ther. (2003) 7:122-128).
[0104] Для определения деградировавшего/денатурированного капсида очищенные AAV можно подвергать электрофорезу в полиакриламидном геле в присутствие SDS, состоящем из любого геля, с помощью которого можно разделять три белка капсида, например, градиентного геля, затем прогоняя гель до разделения образца и осуществляя блоттинг геля на нейлоновых или нитроцеллюлозных мембранах. Затем антитела против капсида AAV используют в качестве первичных антител, связывающихся с денатурированными белками капсида (см., например, Wobus et al., J. Virol. (2000) 74:9281-9293). Вторичное антитело, связывающееся с первичным антителом, содержит средства для детекции первичного антитела. Связывание между первичными и вторичными антителами определяют полуколичественно для определения количества капсидов.
[0105] Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обладают значением, общепринято понятным специалисту в области, к которой принадлежит изобретение. Хотя в практическом осуществлении или тестировании настоящего изобретения можно использовать способы и материалы, схожие или эквивалентные представленным в настоящем описании, подходящие способы и материалы представлены в настоящем описании.
[0106] Все заявки, публикации, патенты и другие ссылки, записи в GenBank и записи в ATCC, процитированные в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. В случае конфликта, описание, включая определение, будет обладать приоритетом.
[0107] Все признаки, представленные в настоящем описании, можно комбинировать в любой комбинации. Каждый признак, представленный в описании, можно заменять альтернативным признаком, служащим той же, эквивалентной или схожей цели. Таким образом, если не указано иначе, описанные признаки (например, последовательности нуклеиновой кислоты, векторы, векторы rAAV и т.д.) являются примером рода эквивалентных или схожих признаков.
[0108] В рамках изобретения формы в единственном числе включают ссылки на множественное число, если контекст четко не указывает на иное. Таким образом, например, ссылка на "вектор AAV" или "частицу AAV" включает множество таких векторов AAV и частиц AAV, и ссылка на "клетку" или "клетку-хозяина" включает множество клеток и клеток-хозяев.
[0109] В рамках изобретения термин "приблизительно" означает значения в пределах 10% (плюс или минус) от указанного значения.
[0110] В рамках изобретения все числовые значения или числовые диапазоны включают целые числа в пределах таких диапазонов и доли значений или целых чисел в пределах диапазонов, если контекст четко не указывает на иное. Таким образом, в качестве иллюстрации, ссылка на 80% идентичности или более, включает 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% и т.д., а также 81,1%, 81,2%, 81,3%, 81,4%, 81,5%, и т.д., 82,1%, 82,2%, 82,3%, 82,4%, 82,5% и т.д.
[0111] Ссылка на целое число с определением "более" или "менее" включает любое число больше или меньше указанного числа, соответственно. Таким образом, например, ссылка на "менее 100" включает 99, 98, 97 и т.д. вплоть до единицы (1); и "менее 10" включает 9, 8, 7 и т.д. вплоть до единицы (1).
[0112] В рамках изобретения все числовые значения или диапазоны являются включительными. Кроме того, все числовые значения или диапазоны включают доли значений и целые числа в таких диапазонах и доли целых чисел в таких диапазонах, если контекст четко не указывает на иное. Таким образом, в качестве иллюстрации, ссылка на числовой диапазон, такой как 1-10, включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, а также 1,1, 1,2, 1,3, 1,4, 1,5 и т.д. Ссылка на диапазон 1-50, таким образом, включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и т.д., до 50 и включая 50, а также 1,1, 1,2, 1,3, 1,4, 1,5, и т.д., 2,1, 2,2, 2,3, 2,4, 2,5 и т.д.
[0112] Ссылка на серию диапазонов включает диапазоны, в которых комбинируют значения границ различных диапазонов в пределах серии. Таким образом, в качестве иллюстрации, ссылка на серию диапазонов, например, 1-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-75, 75-100, 100-150, 150-200, 200-250, 250-300, 300-400, 400-500, 500-750, 750-1000, 1000-1500, 1500-2000, 2000-2500, 2500-3000, 3000-3500, 3500-4000, 4000-4500, 4500-5000, 5500-6000, 6000-7000, 7000-8000 или 8000-9000 включает диапазоны 10-50, 50-100, 100-1000, 1000-3000, 2000-4000 и т.д.
[0114] Изобретение, в целом, представлено в настоящем описании с использованием аффирмативного языка для описания многочисленных вариантов осуществления и аспектов. Изобретение также конкретно включает варианты осуществления, в которых полностью или частично исключен конкретный объект, такой как вещества или материалы, стадии и условия способа, протоколы или способы. Например, в определенных вариантах осуществления или аспектах изобретения исключены материалы и/или стадии способа. Таким образом, даже притом, что изобретение, в целом, не представлено в настоящем описании в терминах того, что оно не включает, аспекты, не исключенные конкретно из изобретения, все равно представлены в настоящем описании.
[0115] Описан ряд вариантов осуществления изобретения. Несмотря на это, специалист в этой области может осуществлять различные изменения и модификации изобретения без отклонения от сущности и объема изобретения для его адаптации к различному применению и условиям. Таким образом, следующие примеры представлены в иллюстративных целях, а не для ограничения объема изобретения.
Реферат
Изобретение относится к биохимии. Описан способ очистки частиц рекомбинантного вектора аденоассоциированного вируса (rAAV), включающий стадии: (a) сбора клеток и супернатанта культуры клеток, содержащего частицы вектора rAAV для получения сбора; (b) необязательно, концентрирования указанного сбора, полученного на стадии (а), для получения концентрированного сбора; (c) лизирования указанного сбора, полученного на стадии (а), или указанного концентрированного сбора, полученного на стадии (b), для получения лизата; (d) обработки лизата, полученного на стадии (с), для снижения содержания контаминирующей нуклеиновой кислоты в лизате и, таким образом, получения лизата со сниженным содержанием нуклеиновой кислоты; (e) фильтрации указанного лизата со сниженным содержанием нуклеиновой кислоты, полученного на стадии (d), для получения очищенного лизата и, необязательно, разведения указанного очищенного лизата для получения разведенного очищенного лизата; (f) подвергания указанного очищенного лизата или разведенного очищенного лизата, полученного на стадии (е), анионообменной хроматографии на колонках для получения колоночного элюата, состоящего из частиц вектора rAAV, и, необязательно, концентрирования указанного колоночного элюата для получения концентрированного колоночного элюата; (g) подвергания указанного колоночного элюата или указанного концентрированного колоночного элюата, полученного на стадии (f), эксклюзионной хроматографии на колонках для получения второго колоночного элюата, состоящего из частиц вектора rAAV, и, таким образом, разделения частиц вектора rAAV и белковых примесей и, необязательно, разведения указанного второго колоночного элюата для получения разведенного второго колоночного элюата; (h) подвергания указанного второго колоночного элюата или указанного разведенного второго колоночного элюата, полученного на стадии (g), катионообменной хроматографии на колонках для получения третьего колоночного элюата, состоящего из частиц вектора rAAV, и, таким образом, разделения частиц вектора rAAV и белковых или других производственных примеси и, необязательно, концентрирования указанного третьего колоночного элюата для получения концентрированного третьего колоночного элюата; и (i) фильтрации указанного третьего колоночного элюата или указанного концентрированного третьего колоночного элюата, полученного на стадии (h), и, таким образом, получения очищенных частиц вектора rAAV. Изобретение позволяет достигать значительного количества выхода частиц AAV. 2 н. и 72 з.п. ф-лы, 3 ил.
Формула
Документы, цитированные в отчёте о поиске
Система очистки вирусных векторов

Комментарии