Способы очистки полипептидов - RU2594163C2
Код документа: RU2594163C2
Чертежи


Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/348143, зарегистрированной 25 мая 2010, содержание которой включено в описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам очистки полипептида из композиции, содержащей полипептид и по меньшей мере одно загрязняющее вещество, и к препаратам, содержащим полипептид, очищенный указанными способами.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Крупномасштабное, экономичное очищение полипептидов становится все более важной проблемой в биотехнологии. Обычно полипептиды получают с помощью клеточной культуры с использованием клеточных линий млекопитающих или бактерий, сконструированных для получения интересующего полипептида путем введения рекомбинантной плазмиды, содержащей ген указанного полипептида. Поскольку используемые клеточные линии являются живыми организмами, они должны обеспечиваться комплексной питательной средой, содержащей сахара, аминокислоты и факторы роста, обычно получаемые из препаратов сыворотки животных. Желательно отделить интересующий полипептид от смеси соединений, продуцируемых клеткам, и от побочных продуктов самих клеток.
Отделение интересующего полипептида от других продуктов, продуцируемых клеткой обычно пытаются проводить путем комбинирования различных хроматографических методов. В указанных методах смеси полипептидов разделяют на основе их заряда, степени гидрофобности, размера или специфического взаимодействия интересующего полипептида и иммобилизованного захватывающего средства. Для каждого из указанных методов имеется несколько различных хроматографических смол, предусматривающих тщательную подгонку схемы очистки к определенному рассматриваемому полипептиду. Сущность каждого из указанных методов разделения заключается в том, что полипептиды можно заставить двигаться с разными скоростями вниз по длинной колонке, достигая физического разделения, которое увеличивается по мере того, как они проходят дальше вниз по колонке, или они селективно присоединяются к среде разделения, и затем дифференциально элюируются различными растворителями. В некоторых случаях интересующий полипептид отделяют от примесей, в то время как примеси специфически присоединяются к колонке, и интересующий полипептид не присоединяется, то есть интересующий полипептид представлен в элюате.
Крупномасштабное, рентабельное выделение полипептида с достаточной чистотой для применения в качестве лекарственного средства для человека остается сложной задачей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В описании раскрыты способы очистки полипептида из композиции, содержащей полипептид и по меньшей мере одно загрязняющее вещество, где способ включает либо (i), либо (ii): (i) последовательные стадии (a) загрузки катионообменного материала композицией с плотностью загрузки более чем 150 г/л катионообменного материала; и (b) загрузки материала смешанного типа композицией, выделенной с катионообменного материала; или (ii) последовательные стадии (a) загрузки композиции на материал смешанного типа; и (b) загрузки катионообменного материала композицией, извлеченной из смешанного материала, с плотностью загрузки более чем 150 г/л катионообменного материала.
В некоторых вариантах осуществления любого из способов полипептид характеризуется значением pI приблизительно от 6 до 10. В некоторых вариантах осуществления полипептид характеризуется значением pI приблизительно 7-9.
В некоторых вариантах осуществления любого из способов полипептид представляет собой антитело или иммуноадгезин. В некоторых вариантах осуществления полипептид представляет собой иммуноадгезин. В некоторых вариантах осуществления полипептид представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления моноклональное антитело представляет собой химерное антитело, гуманизированное антитело или антитело человека. В некоторых вариантах осуществления, моноклональное антитело представляет собой моноклональное антитело IgG. В некоторых вариантах осуществления антитело представляет собой антигенсвязывающий фрагмент. В некоторых вариантах осуществления антигенсвязывающий фрагмент выбирают из группы, состоящей из Fab-фрагмента, Fab'-фрагмента, F(ab')2 фрагмента, scFv, Fv и диатела.
В некоторых вариантах осуществления любого из способов по меньшей мере одно загрязняющее вещество представляет собой одно или более из перечисленного: белок яичника китайского хомячка (CHOP), смытый белок A, ДНК, агрегированный белок, компонент среды клеточной культуры, гентамицин и вирусный контаминант.
В некоторых вариантах осуществления любого из способов последовательные стадии в (i) и/или (ii) являются непрерывными. В некоторых вариантах осуществления любого из способов последовательные стадии в (i) и/или (ii) являются дискретными. В некоторых вариантах осуществления любого из способов способ представляет собой (i). В некоторых вариантах осуществления любого из способов способ представляет собой (ii).
В некоторых вариантах осуществления любого из способов плотность загрузки составляет приблизительно от 150 г/л до 2000 г/л. В некоторых вариантах осуществления плотность составляет приблизительно от 150 г/л до 1000 г/л. В некоторых вариантах осуществления плотность составляет приблизительно от 500 г/л до 700 г/л.
В некоторых вариантах осуществления любого из способов катионообменный материал содержит функциональную группу карбоновых кислот или функциональную группу сульфоновых кислот. В некоторых вариантах осуществления функциональная группа представляет собой сульфопропил, сульфоэтил, сульфоизобутил или карбоксил. В некоторых вариантах осуществления катионообменный материал представляет собой мембрану, монолит или частицы смолы. В некоторых вариантах осуществления катионообменный материал представляет собой смолу. В некоторых вариантах осуществления катионообменный материал представляет собой Mustang S, Sartobind S, SO3 Monolith, S Ceramic HyperD, Poros HS50, Poros HS20, sulfopropyl-Sepharose Fast Flow (SPSFF), SP-Sepharose XL (SPXL), CM Sepharose Fast Flow, Capto S, Fractogel Se HiCap, Fractogel SO3 или Fractogel COO. В некоторых вариантах осуществления катионообменный материал представляет собой Poros HS50.
В некоторых вариантах осуществления любого из способов материал смешанного типа содержит функциональные группы, способные к анионному обмену и гидрофобным взаимодействиям. В некоторых вариантах осуществления материал смешанного типа представляет собой смолу Capto-Adhere, смолу MEP HyperCel, смолу HEA HyperCel, смолу PPA HyperCel или мембрану ChromaSorb. В некоторых вариантах осуществления материал смешанного типа представляет собой смолу Capto-Adhere.
В некоторых вариантах осуществления любого из способов способ включает применение равновесного буфера, отмывочного буфера, и/или загрузочного буфера с катионообменным материалом и/или анионообменным материалом, и проводимость равновесного буфера, промывочного буфера, и/или загрузочного буфера составляет приблизительно от 2 мСм/см до 25 мСм/см. В некоторых вариантах осуществления проводимость равновесного буфера, промывочного буфера, и/или загрузочного буфера составляет приблизительно от 3 мСм/см до 8 мСм/см.
В некоторых вариантах осуществления любого из способов способ включает применение равновесного буфера, промывочного буфера и/или загрузочного буфера с катионообменным материалом, и/или анионообменным материалом, и значение pH равновесного буфера, промывочного буфера и/или загрузочного буфера составляет приблизительно 4,5-6,5.
В некоторых вариантах осуществления любого из способов равновесный буфер, промывочный буфер и/или загрузочный буфер с катионообменным материалом, и/или анионообменным материалом являются одинаковыми. В некоторых вариантах осуществления любого из способов равновесный буфер, промывочный буфер, и/или загрузочный буфер с катионообменным материалом и/или с анионообменным материалом являются разными.
В некоторых вариантах осуществления любого из способов, способ также включает воздействие на композицию, содержащую полипептид, одной или более дополнительных стадий очистки до или после стадий (a) и (b). В некоторых вариантах осуществления любого из способов способ также включает извлечение очищенного полипептида. В некоторых вариантах осуществления любого из способов способ также включает объединение очищенного полипептида с фармацевтически приемлемым носителем.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
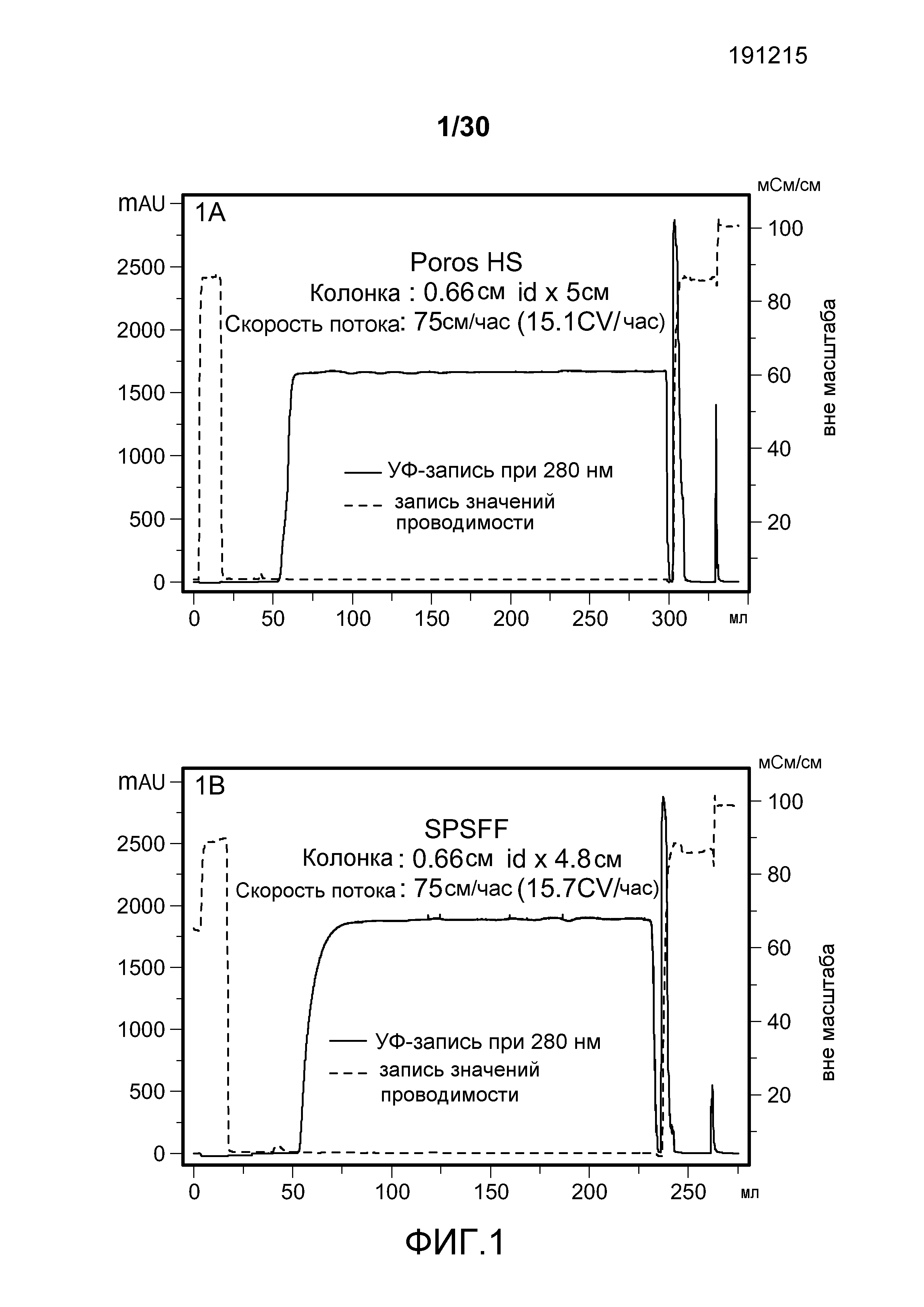
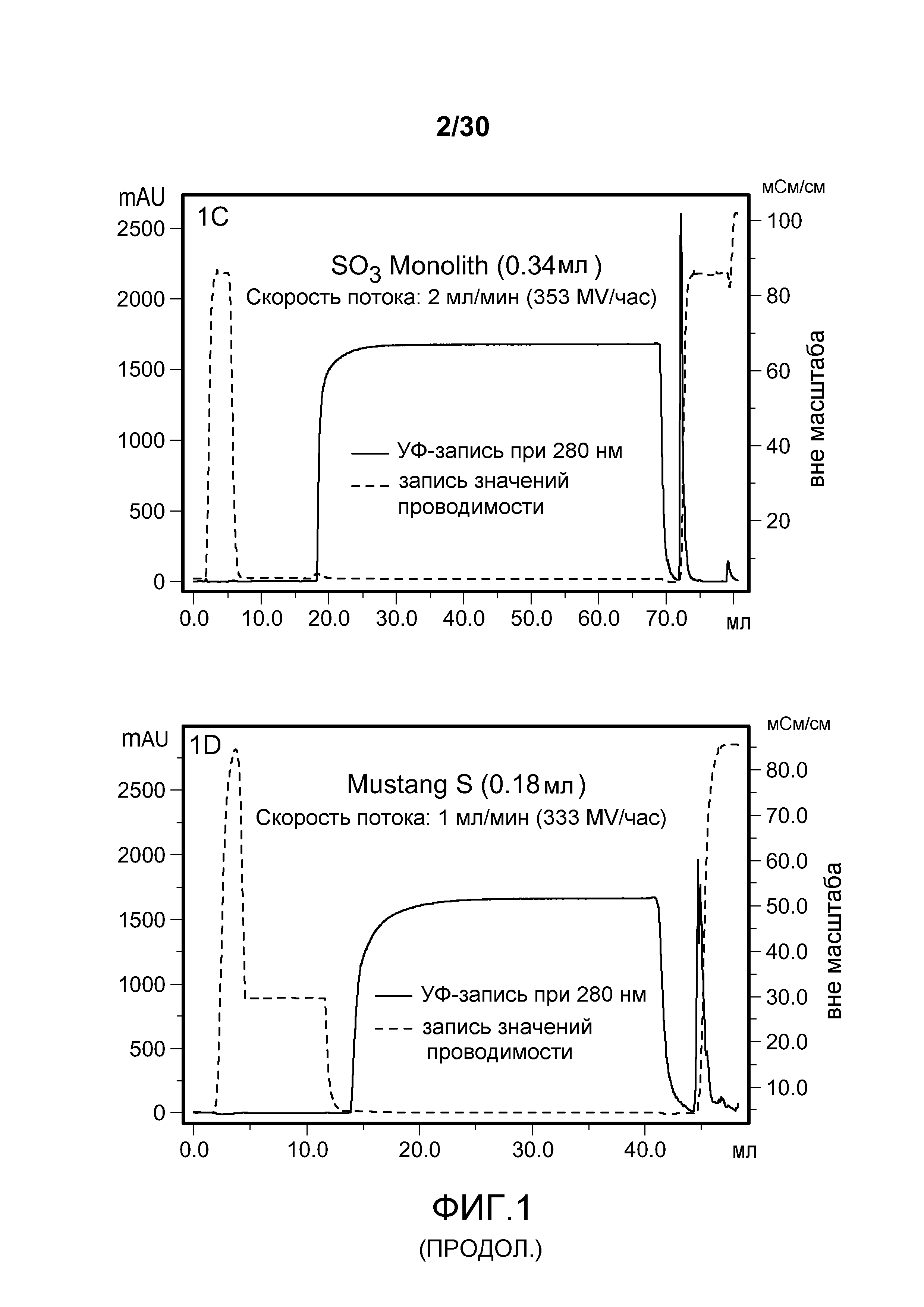
На фиг. 1A-D представлены хроматограммы, полученные с использованием Poros HS50, SPSFF, SO3 Monolith, и Mustang S при очистке антитела против CD11a.
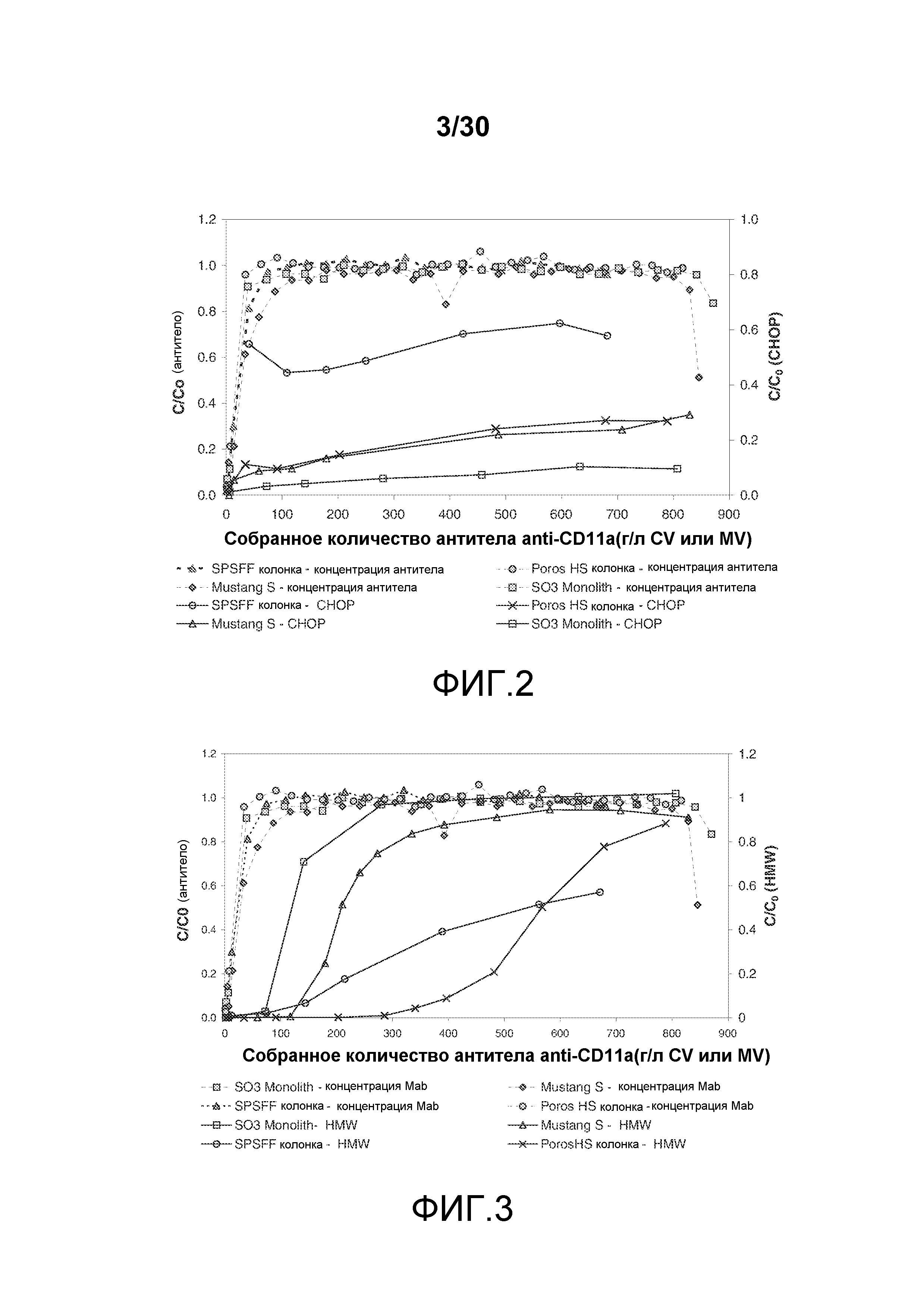
На фиг. 2 представлены C/C0 (концентрация Mab ("мономерное антитело")) и C/C0 (концентрация белка яичников китайского хомячка ("CHOP")) при изменяющемся количестве продукта, содержащего антитело против CD11a, полученное (г/л CV или MV) с применением SPSFF, Poros HS50, Mustang S, и SO3 monolith. C представляет собой концентрацию Mab или CHOP в собранной фракции, и C0 представляет собой концентрацию Mab или CHOP в загрузке.
На фиг. 3 показаны C/C0 (концентрация Mab) и C/C0 (концентрация высокомолекулярных соединений ("HMW")) при изменяющимся количестве продукта, содержащего антитело против CD11a, полученное (г/л CV или MV) с применением SO3 monolith, Mustang S, SPSFF, и Poros HS50. C представляет собой процентное содержание Mab или HMW в собранной фракции и C0 представляет собой процентное содержание Mab или HMW в загрузке.
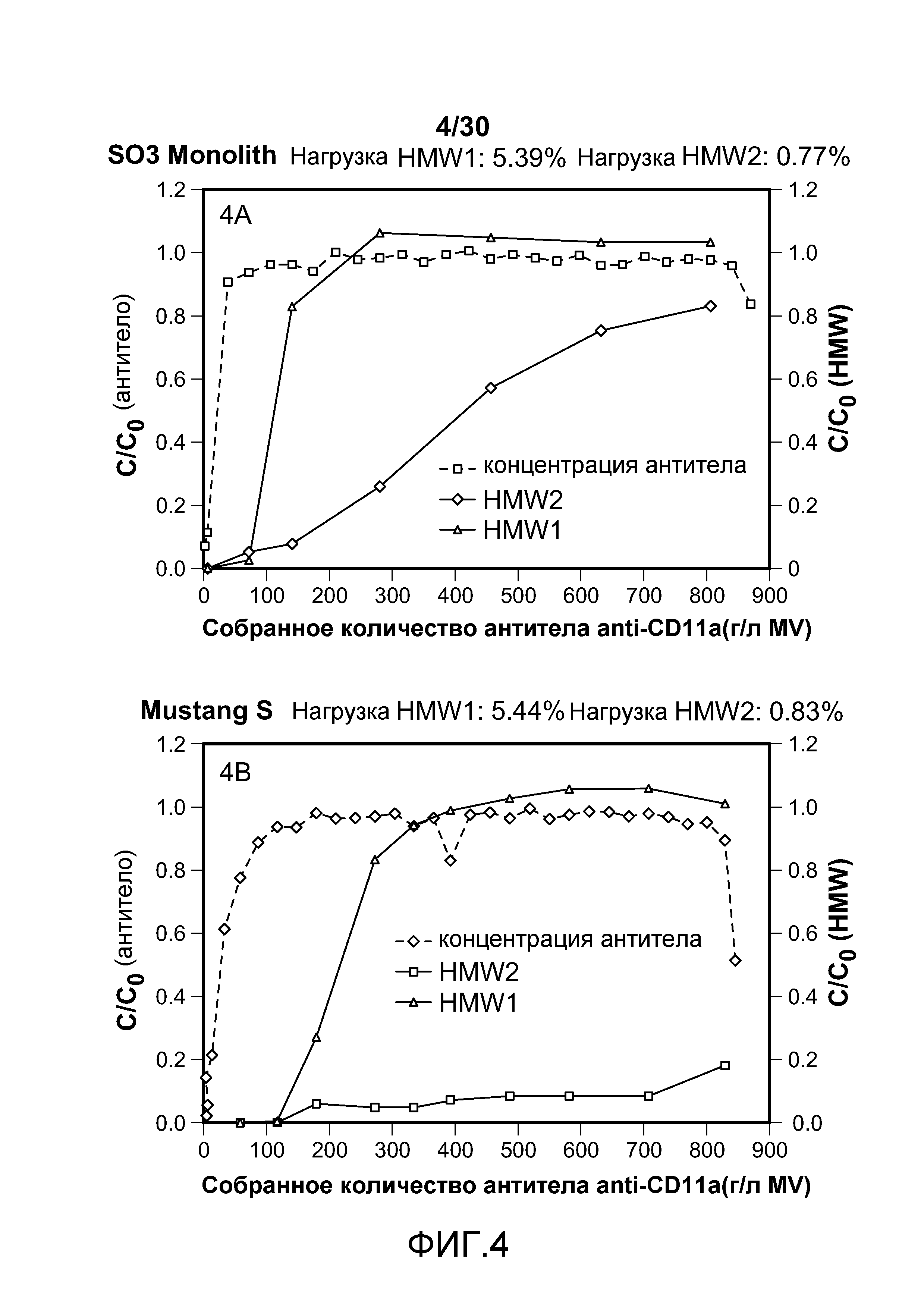
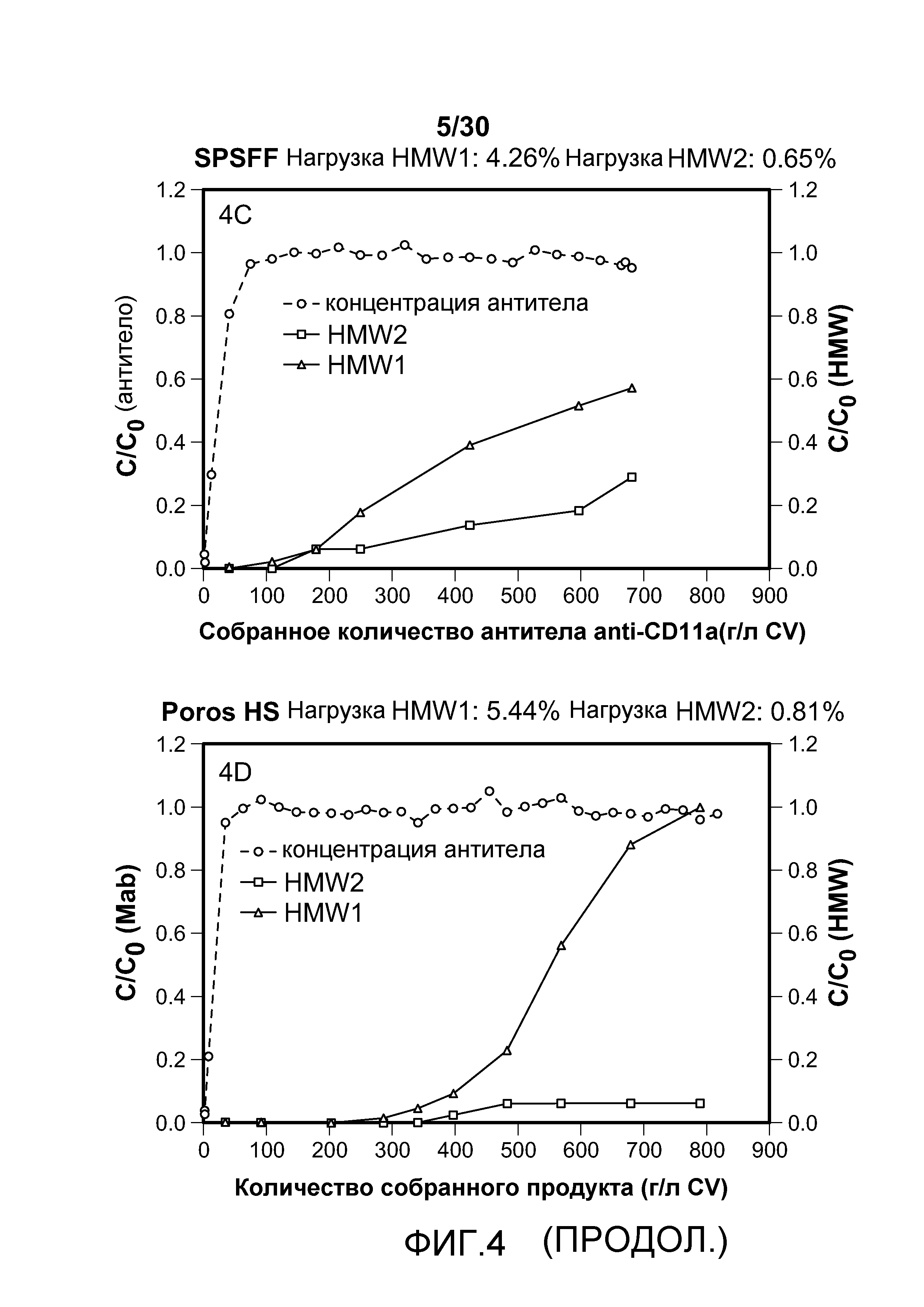
На фиг. 4A-D показаны C/C0 (концентрация Mab), C/C0 (концентрация HMW1) и C/C0 (концентрация HMW2) при изменяющемся количестве продукта, содержащего антитело против CD11a, собранного (г/л CV или MV) с применением SO3 monolith, Mustang S, SPSFF и Poros HS50.
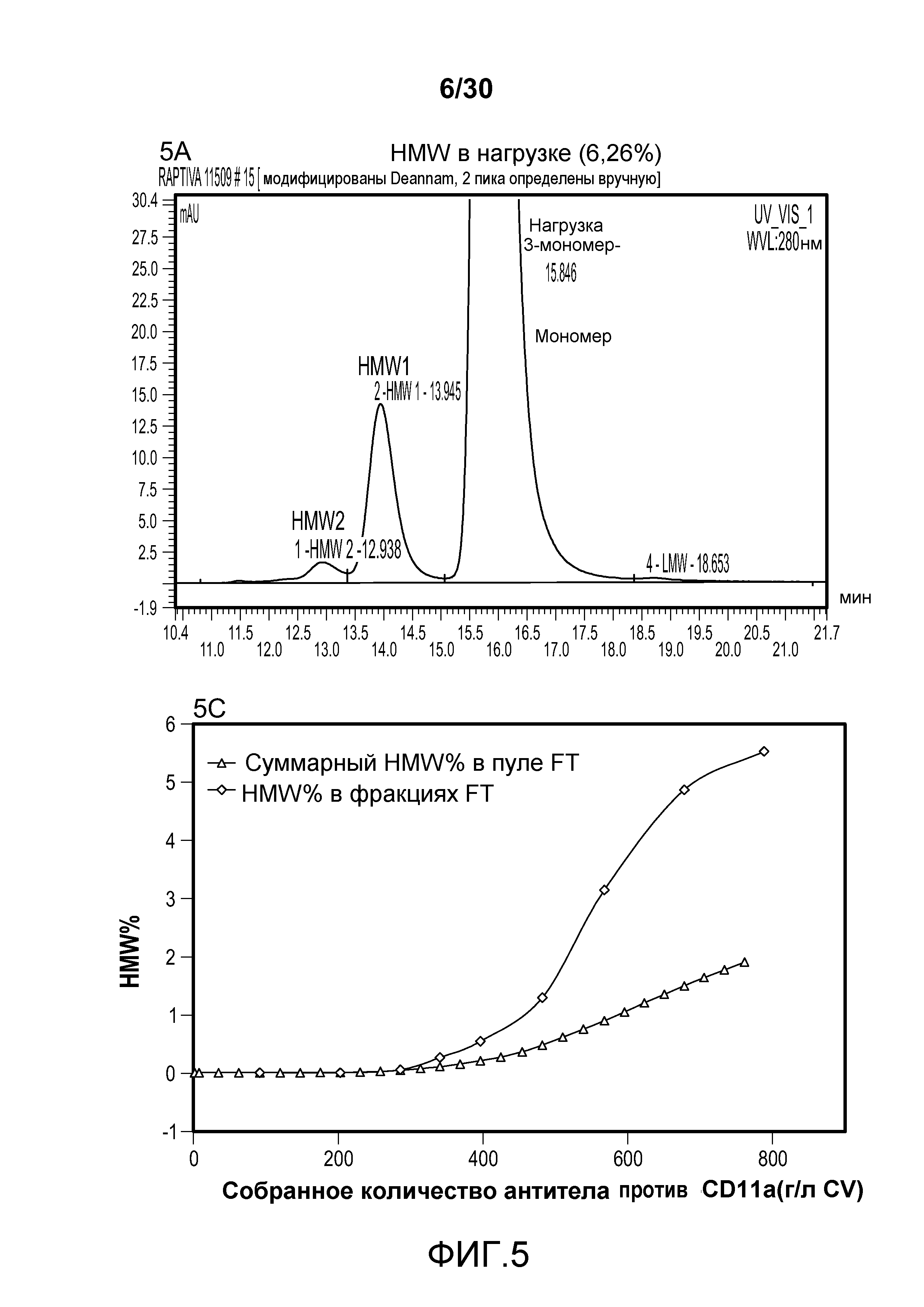
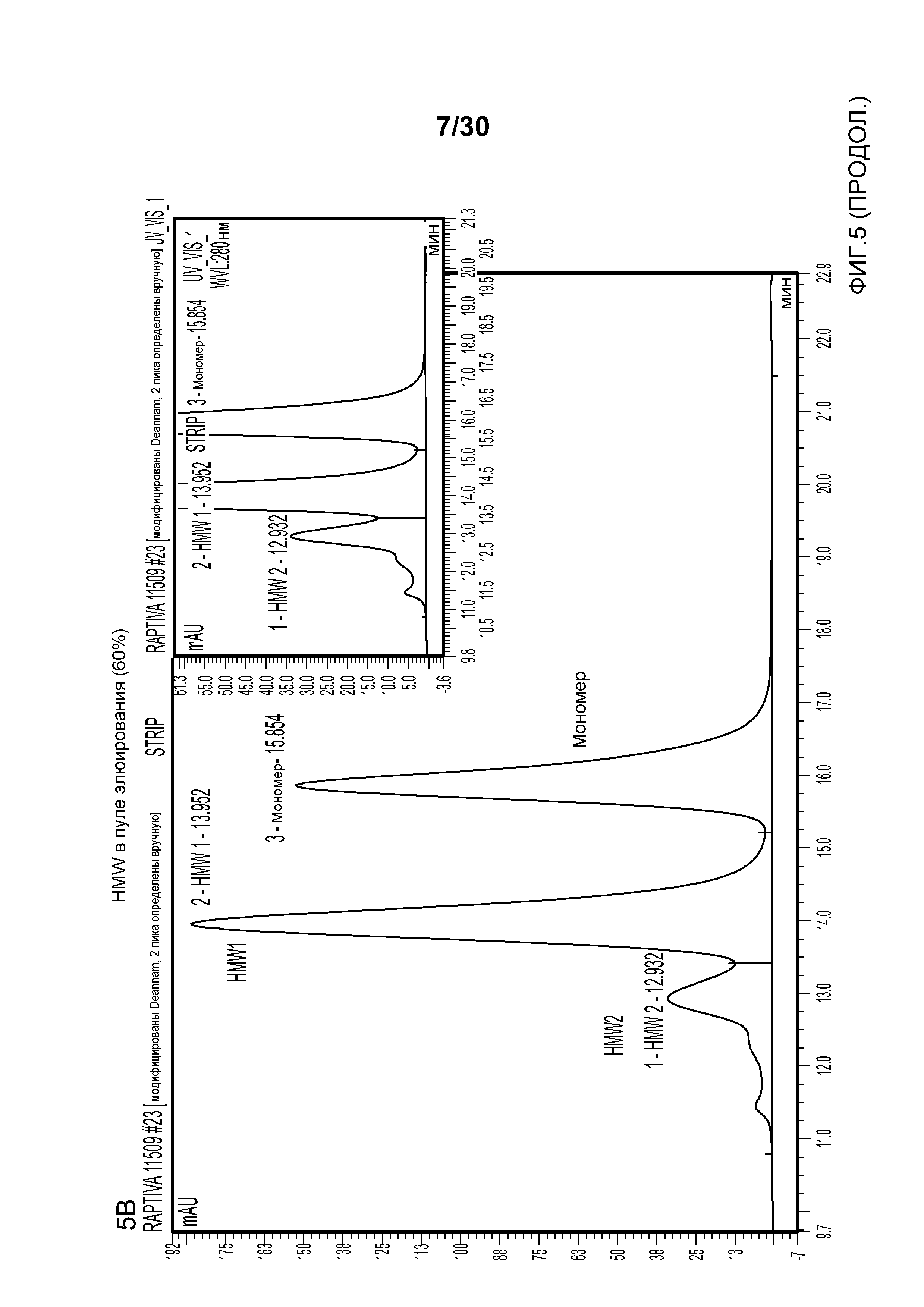
На фиг. 5A представлена хроматограмма HMW и Mab в продукте, содержащем антитело против CD11a, нагруженном на Poros HS50; на фиг. 5B представлена хроматограмма HMW и Mab в пуле элюирования с применением Poros HS50 (на расположенной внутри фигуре показан увеличенный участок пиков); на фиг. 5C показано суммарное значение HMW % в пуле непрерывного потока ("FT") и HMW % во фракциях FT при изменяющемся количестве продукта, содержащего антитело против CD11a, полученном (г/л CV) с использованием Poros HS50.
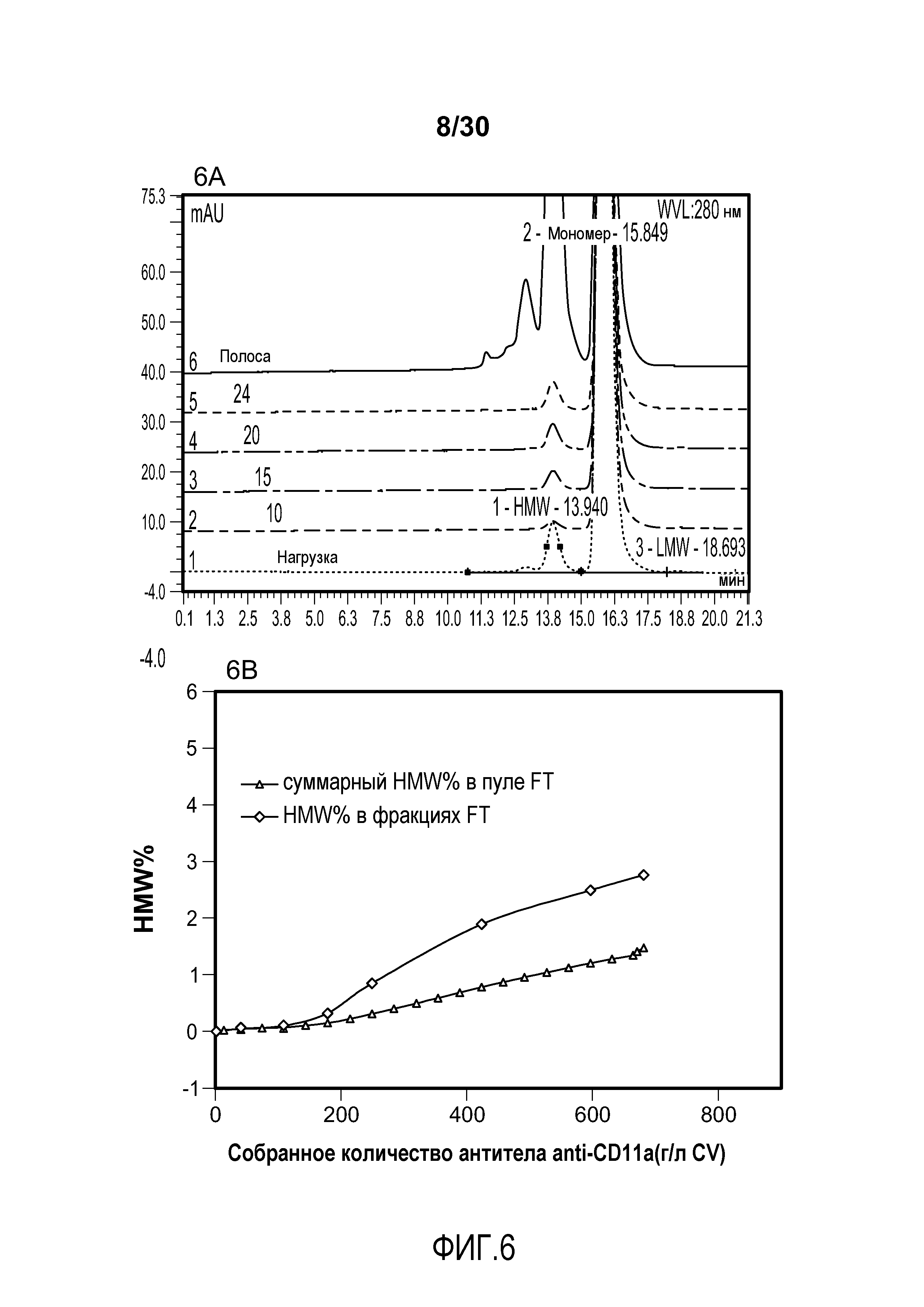
На фиг. 6A показаны хроматограммы пула FT при изменяющемся количестве продукта, содержащего антитело против CD11a, полученного с помощью колонки SPSFF; на фиг. 6B показано суммарное значение HMW% в пуле FT и HMW% во фракциях FT при изменяющемся количестве продукта, содержащего антитело против CD11a, полученного (мг/мл CV) с применением SPSFF; на фиг. 6C показаны HMW% при изменяющемся количестве продукта, содержащего антитело против CD11a, полученного (мг/мл) с применением SPSFF.
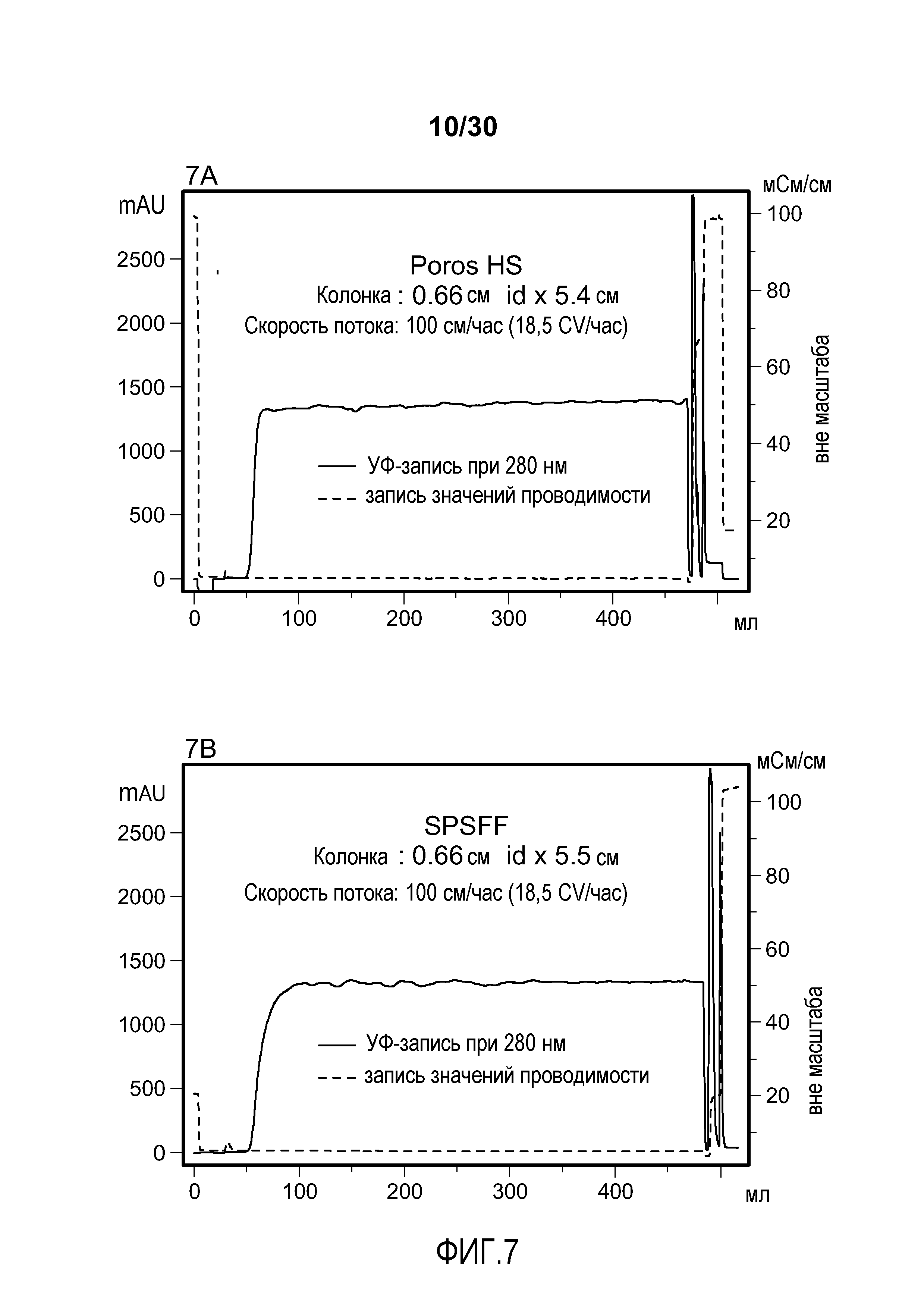
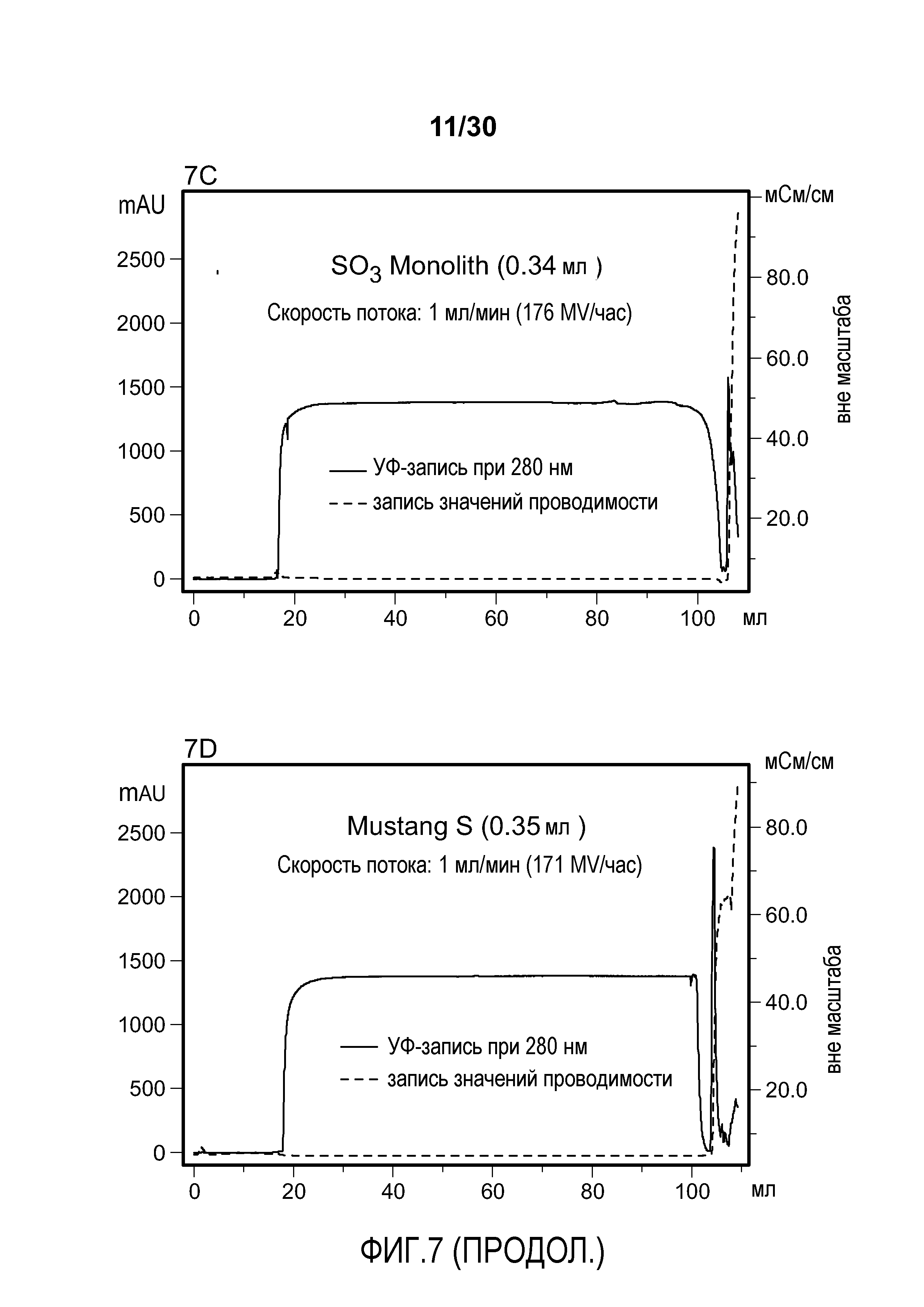
На фиг. 7A-D показаны хроматограммы, полученные при использовании Poros HS50, SPSFF, SO3 Monolith, и Mustang S для очистки антитела против VEGF.
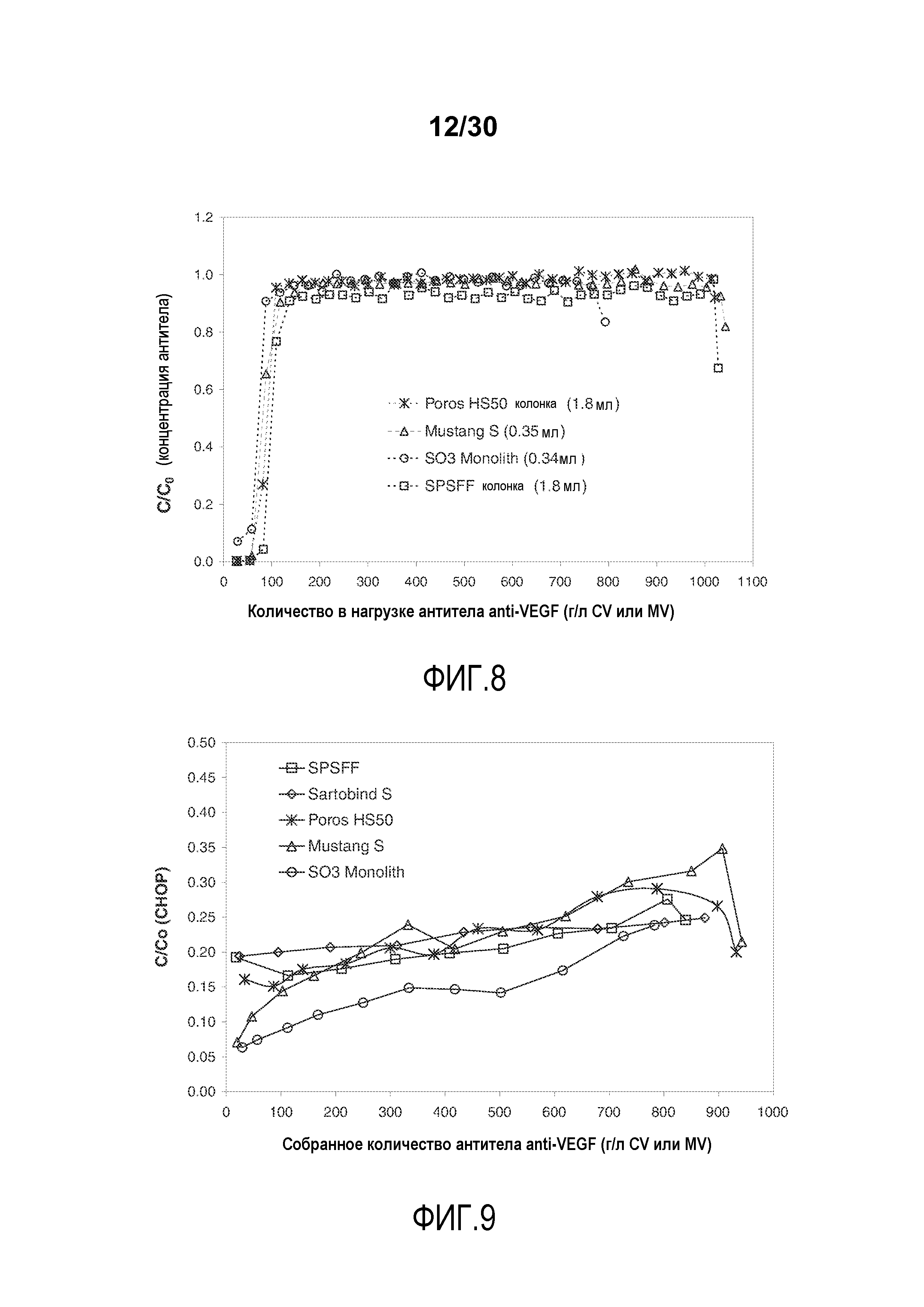
На фиг. 8 показано C/C0 (концентрация Mab) антитела против VEGF при изменяющемся количестве нагружаемого продукта (г/л CV или MV) с применением Poros HS50, Mustang S, SO3 monolith и SPSFF.
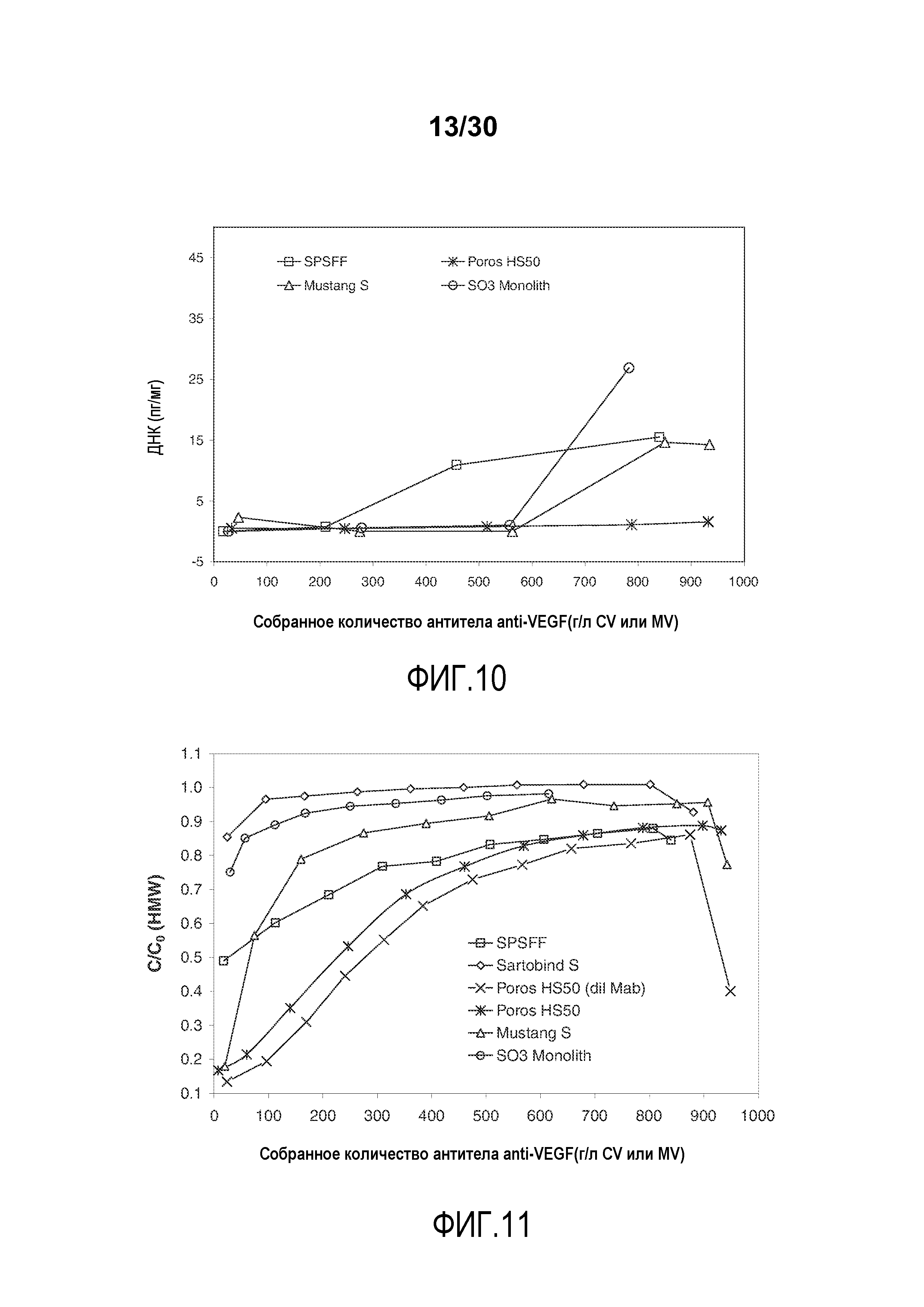
На фиг. 9 показаны C/C0 (концентрация CHOP) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV или MV) с применением SPSFF, Sartobind S, Poros HS50, Mustang S и SO3 monolith.
На фиг. 10 показано количество ДНК (пг/мг) при изменяющемся количестве продукта, содержащего антитело против VEGF, собранного (г/л CV или MV) при использовании SPSFF, Poros HS50, Mustang S, и SO3 monolith.
На фиг. 11 показаны C/C0 (концентрация HMW) при изменяющемся количестве продукта, содержащего антитело против VEGF, собранное (г/л CV or MV) с применением SPSFF, Sartobind S, Poros HS50 с разведенным Mab, Poros HS50, Mustang S и SO3 monolith.
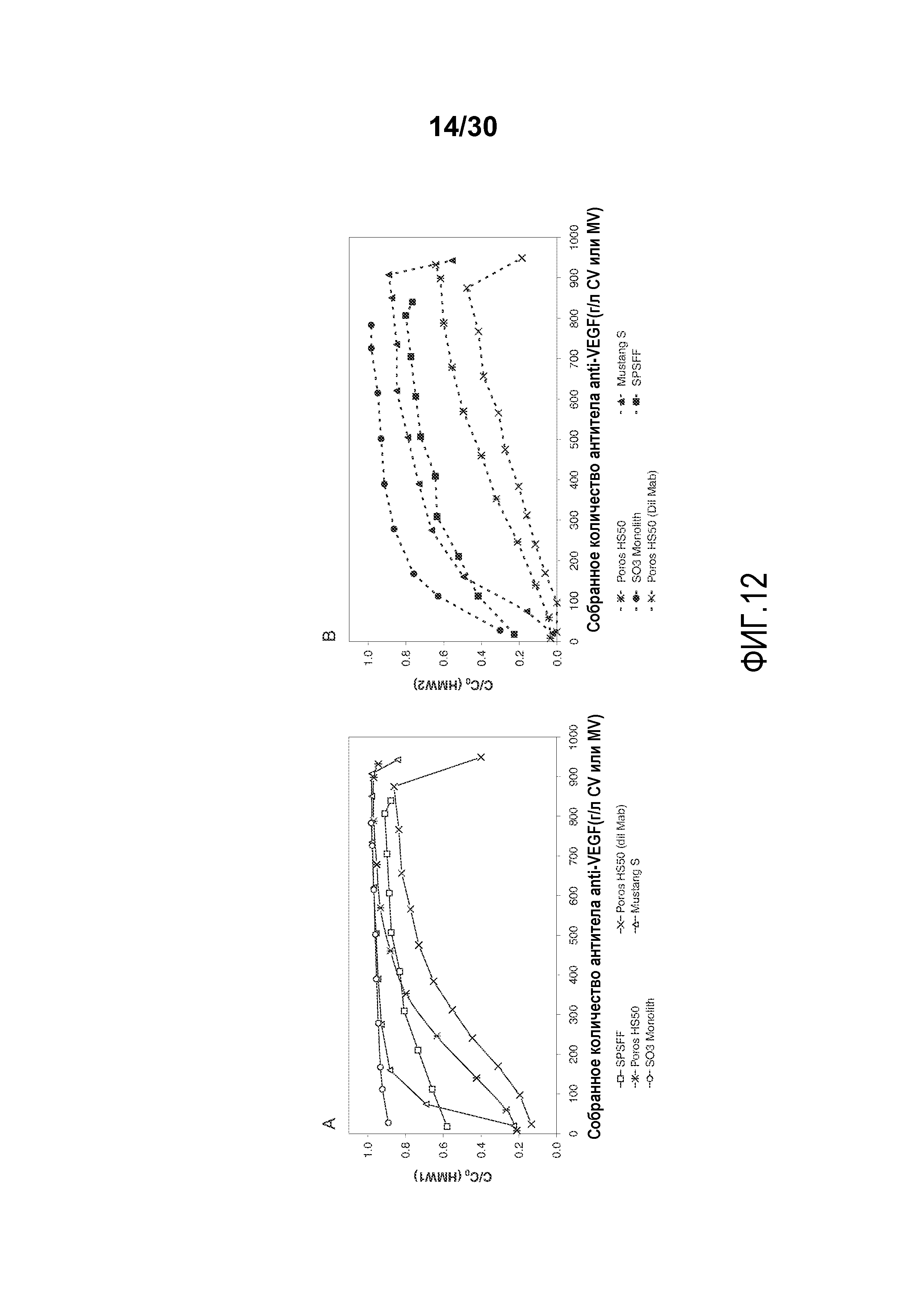
На фиг. 12A-B показаны C/C0 (концентрация HMW1) и C/C0 (концентрация HMW 2) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV или MV) с применением SPSFF, Poros HS50 с разведенным Mab, Poros HS50, Mustang S и SO3 monolith.
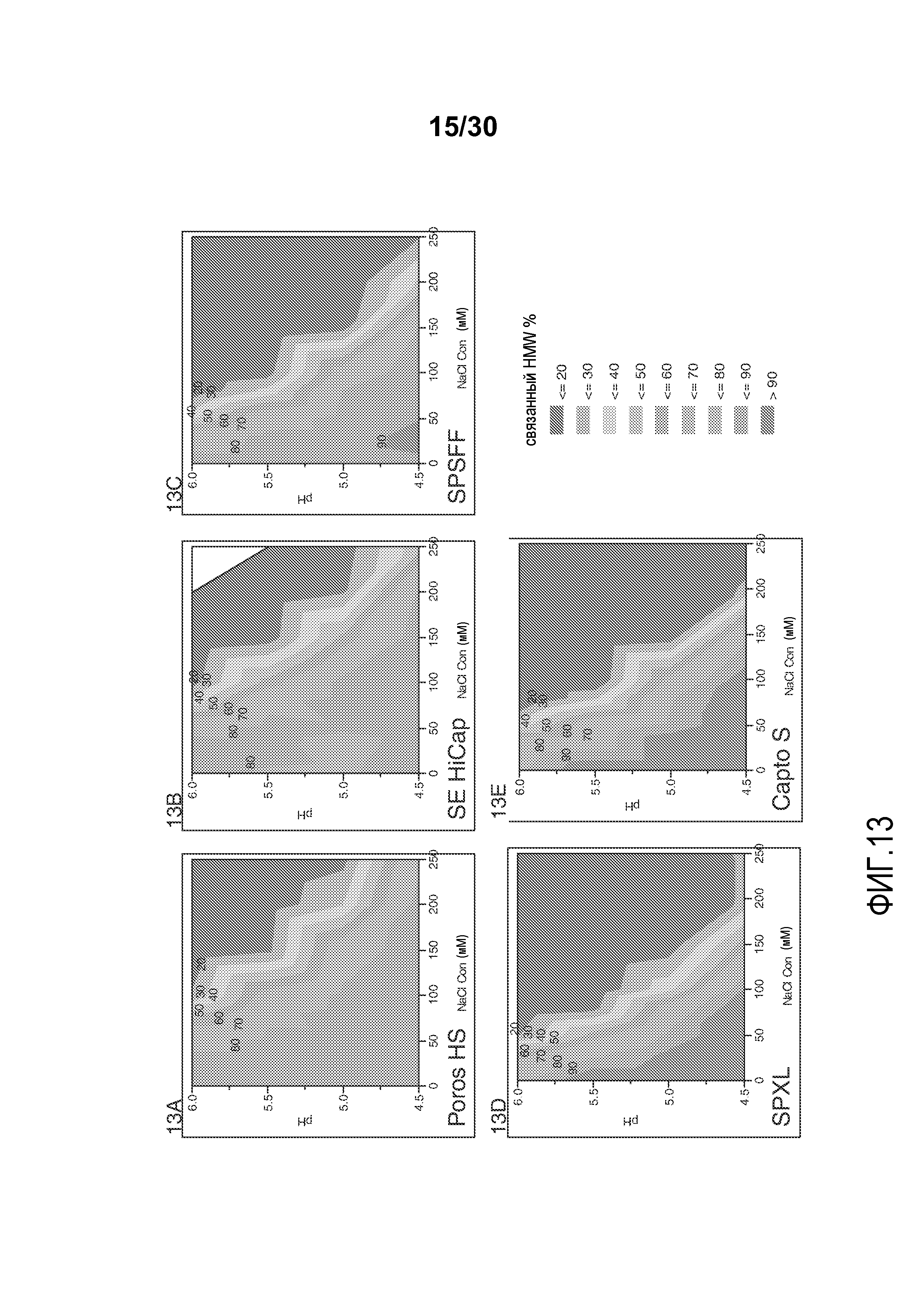
На фиг. 13A-E показано значение % HMW, связанного со смолой (Poros HS50, SE HiCap, SPSFF, SPXL, и Capto S), с применением продукта, содержащего антитело против CD20, при различных значениях pH и концентрациях солей.
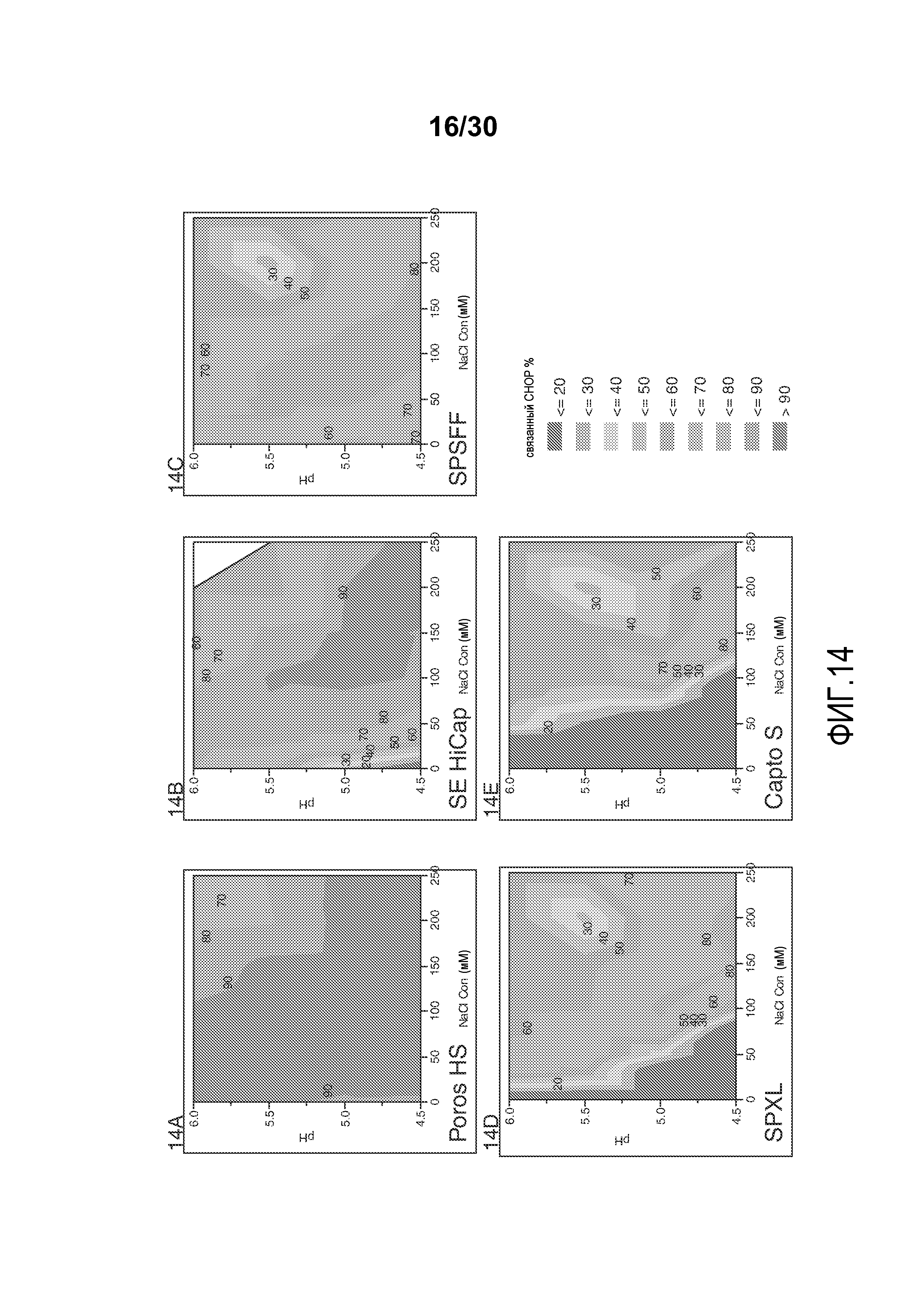
На фиг. 14A-E показано значение % CHOP, связанного со смолой (Poros HS50, SE HiCap, SPSFF, SPXL, и Capto S), с применением продукта, содержащего антитело против CD20, при различных значениях pH и концентрациях солей.
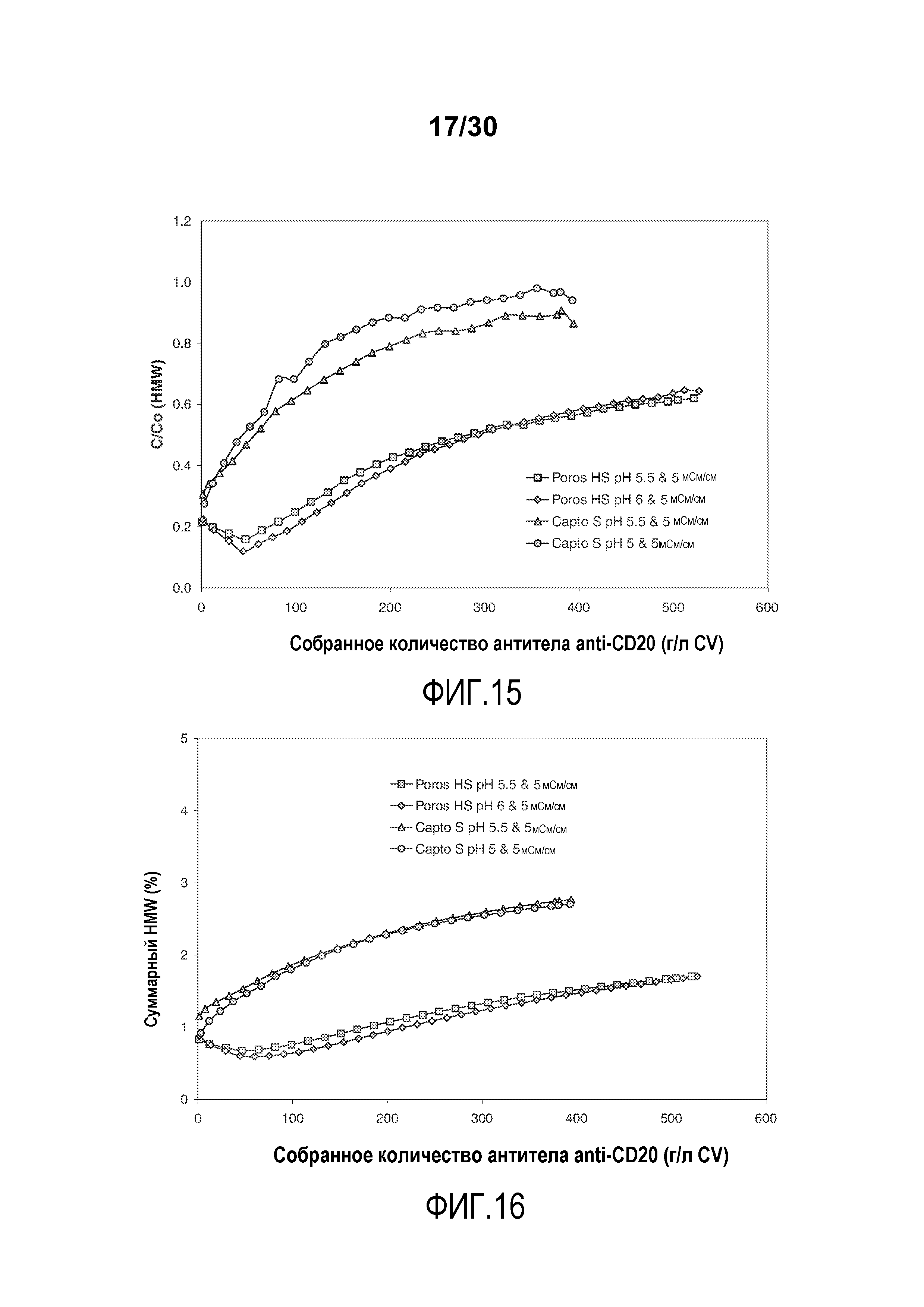
На фиг. 15 показано C/C0 (концентрация HMW%) при изменяющемся количестве продукта, содержащего антитело против CD20, полученного (г/л CV) с применением Poros HS50 и Capto S.
На фиг. 16 показано суммарное значение HMW(%) при изменяющемся количестве продукта, содержащего антитело против CD20, полученного (г/л CV) с применением Poros HS50 и Capto S.
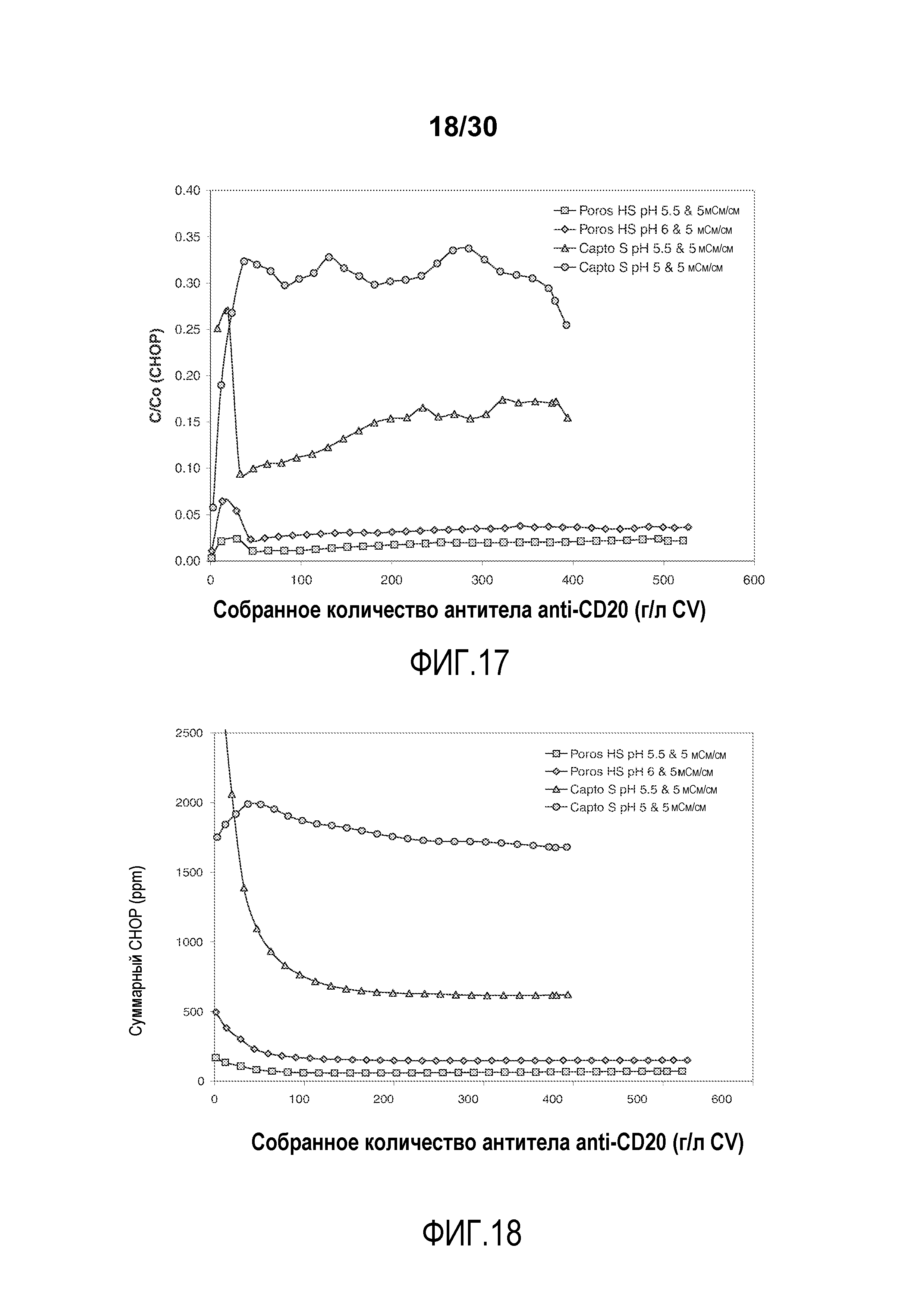
На фиг. 17 показано C/C0 (концентрация CHOP) при изменяющемся количестве продукта, содержащего антитело против CD20, полученное (г/л CV) с применением Poros HS50 и Capto S.
На фиг. 18 показано суммарное значение CHOP (ppm) при изменяющемся количестве продукта, содержащего антитело против CD20, полученное (г/л CV) с применением Poros HS50 и Capto S.
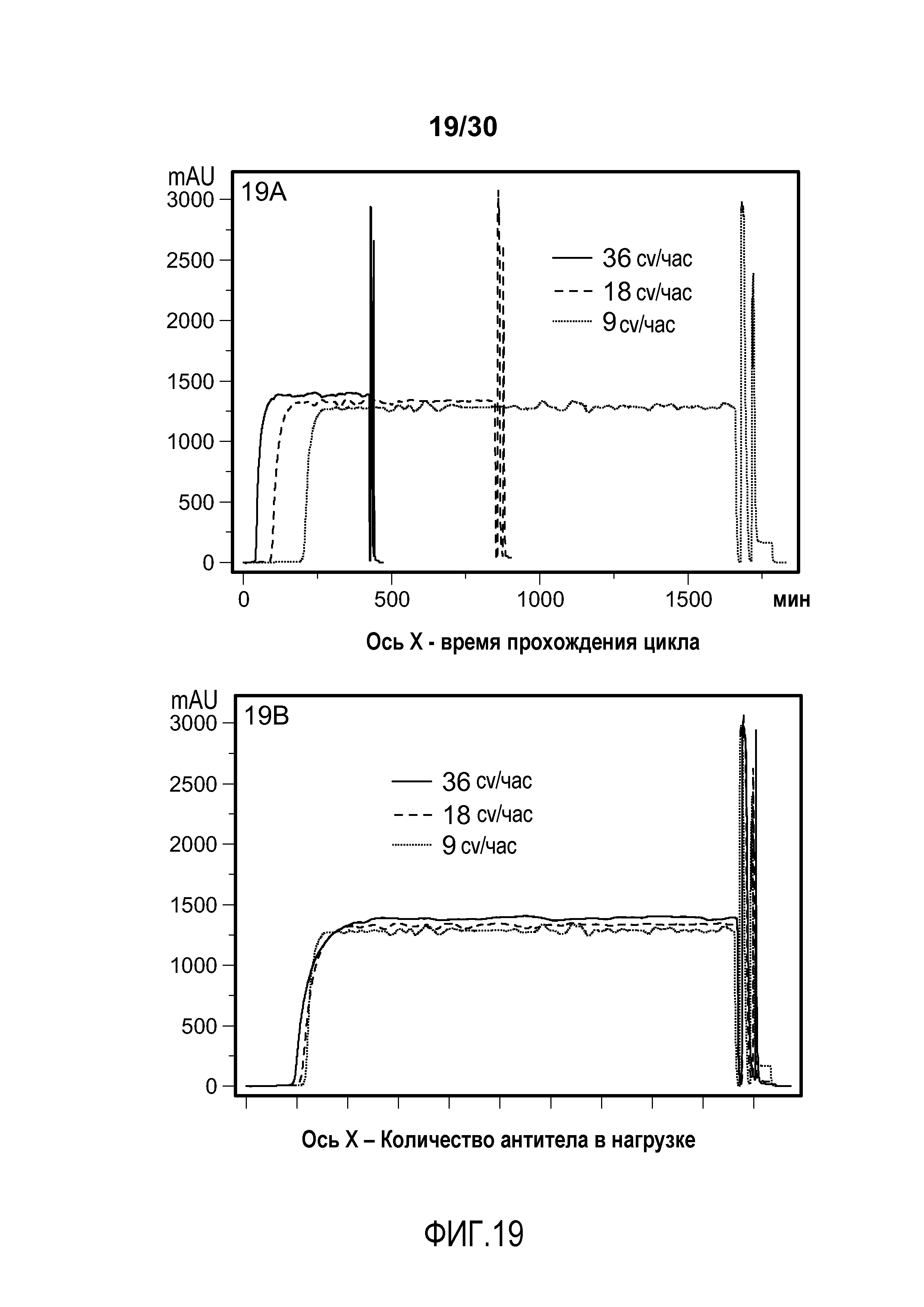
На фиг. 19A-B представлены хроматограммы с UV-кривой, полученной при 280 нм, нанесенной на график в течение времени цикла (фиг. 19A) и в пределах объема загрузки продуктом (фиг. 19B) с применением SPSFF при различных скоростях потока для очистки антитела против VEGF.
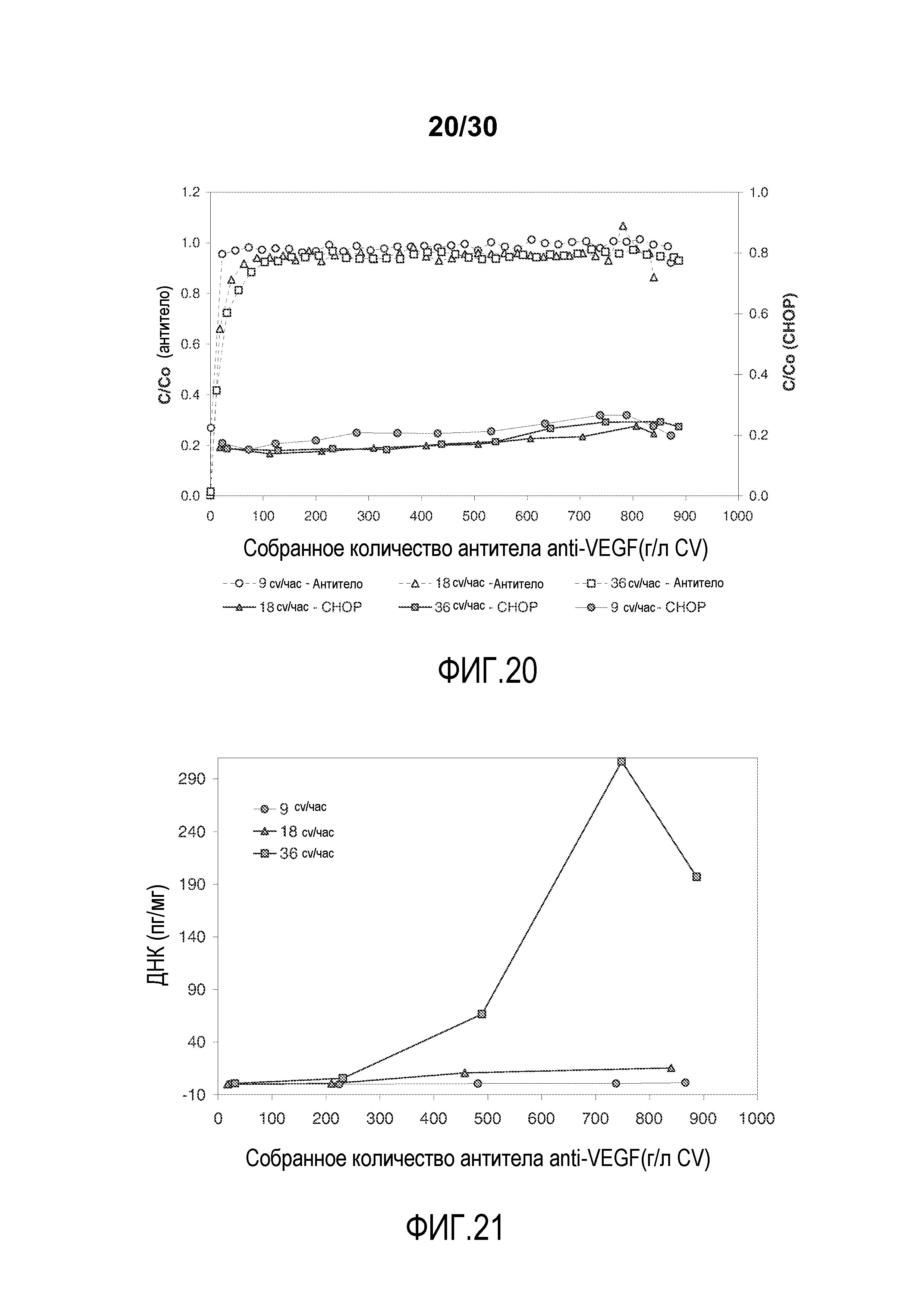
На фиг. 20 показано C/C0 (концентрация Mab) и C/C0 (концентрация CHOP) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением SPSFF при различных скоростях потока.
На фиг. 21 показано количество ДНК (пг/мг) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением SPSFF при различных скоростях потока.
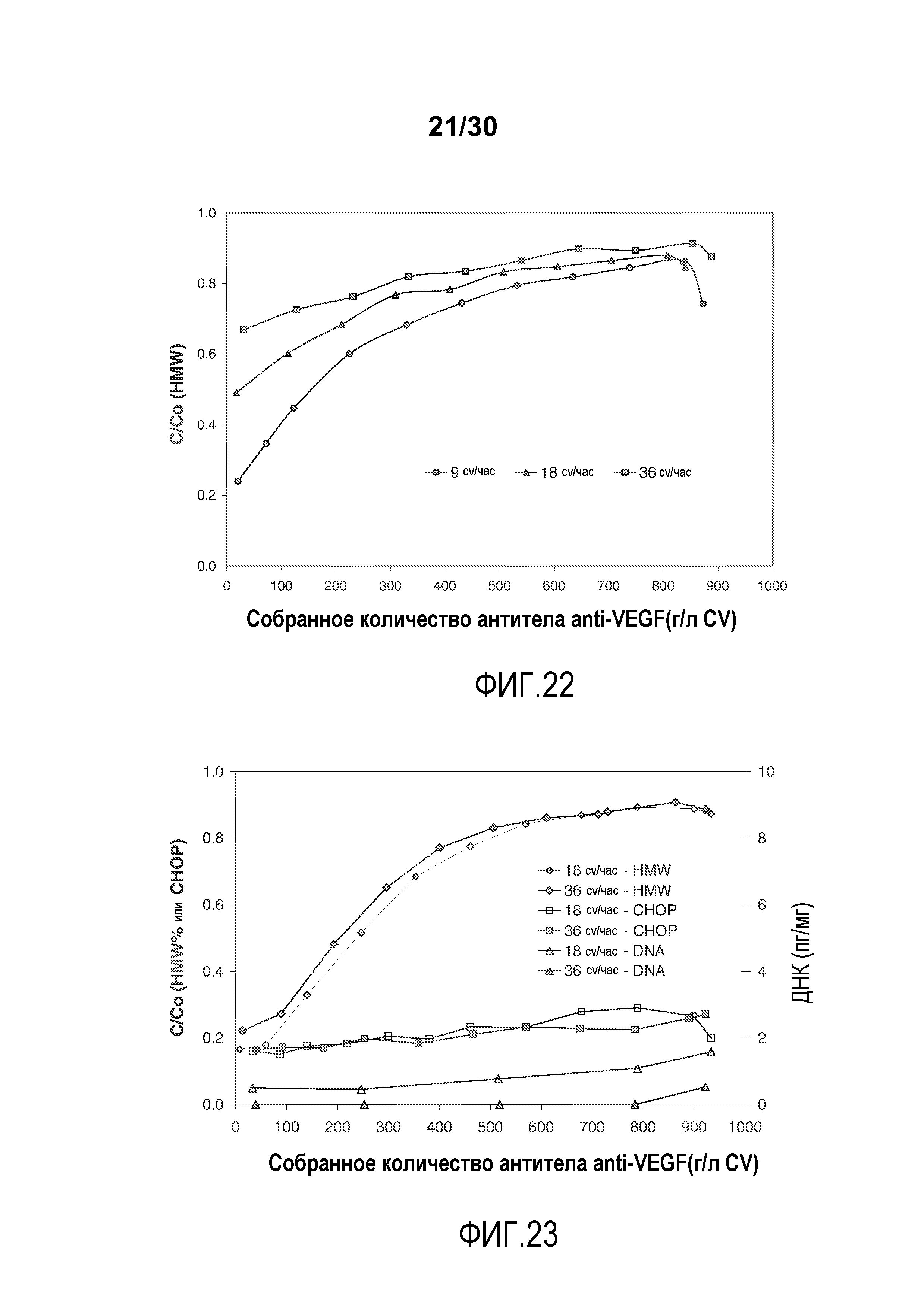
На фиг. 22 показано C/C0 (концентрация HMW) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV) с применением SPSFF при различных скоростях потока.
На фиг. 23 показано C/C0 (концентрация HMW (%)), C/C0 (Концентрация CHOP (ppm)), и количество ДНК (пг/мг) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV) с применением Poros HS50 при различных скоростях потока.
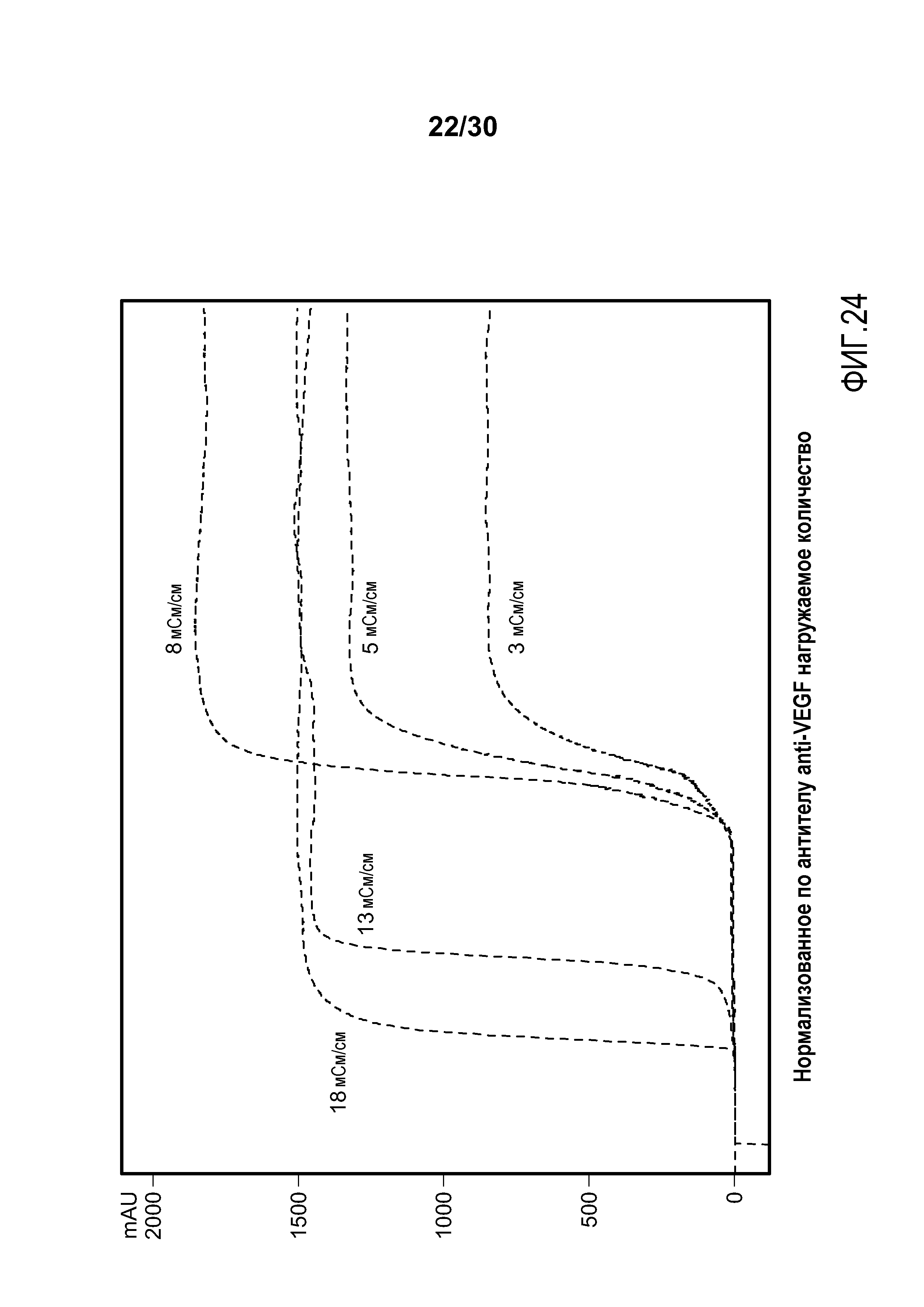
На фиг. 24 представлены хроматограммы, полученные с применением Poros HS50 при различных значениях проводимости в загрузке для очистки антитела против VEGF.
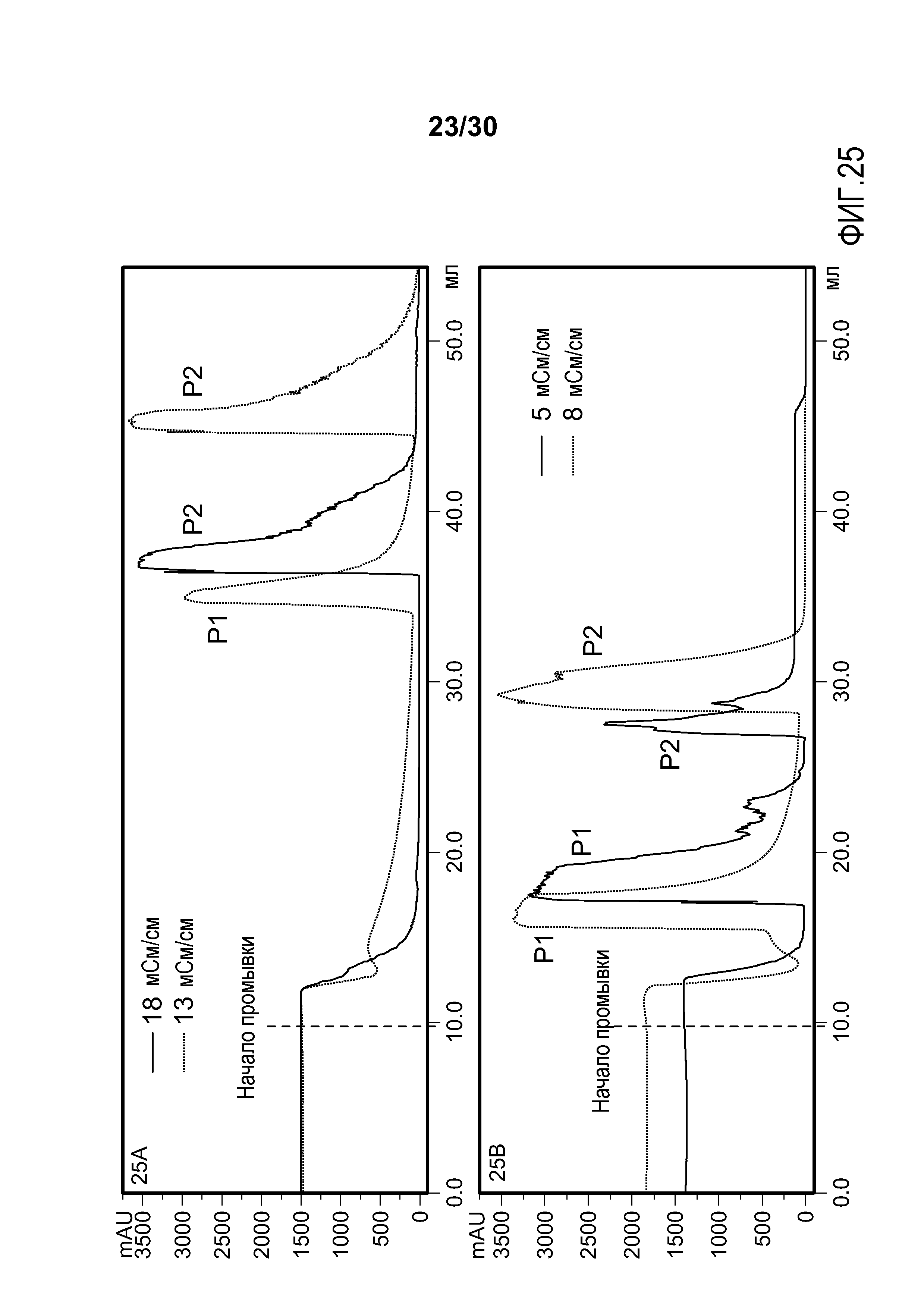
На фиг. 25A-B представлены хроматограммы элюата, полученного в результате элюции (пик P1), и элюата, полученного в результате очистки (пик P2) с применением колонки Poros HS50, нагруженной продуктом, содержащим антитело против VEGF, при различных значениях проводимости загрузки.
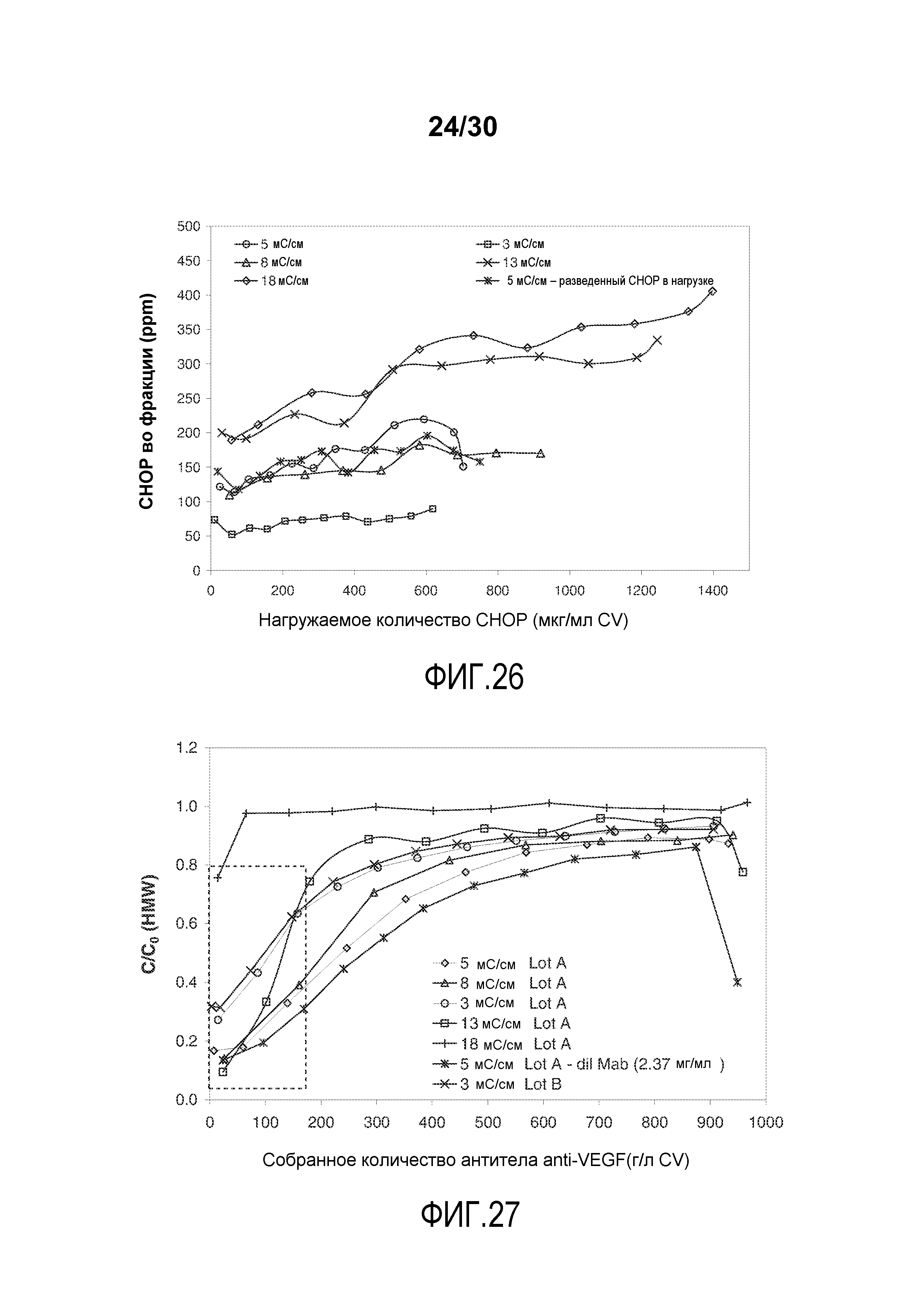
На фиг. 26 показано количество CHOP во фракции (ppm) при изменении количества нагружаемого CHOP (мг/мл CV) с применением Poros HS50 при различных значениях проводимости загрузки для очистки антитела против VEGF.
На фиг. 27 показано C/C0 (концентрация HMW) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением Poros HS50 при различных значениях проводимости загрузки.
На фиг. 28A-B показано количество ДНК (пг/мл) при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (г/л CV) при различных значениях проводимости в загрузке и различных скоростях потока (различное количество ДНК в загрузке (пг/мг) для различных значений проводимости в загрузке).
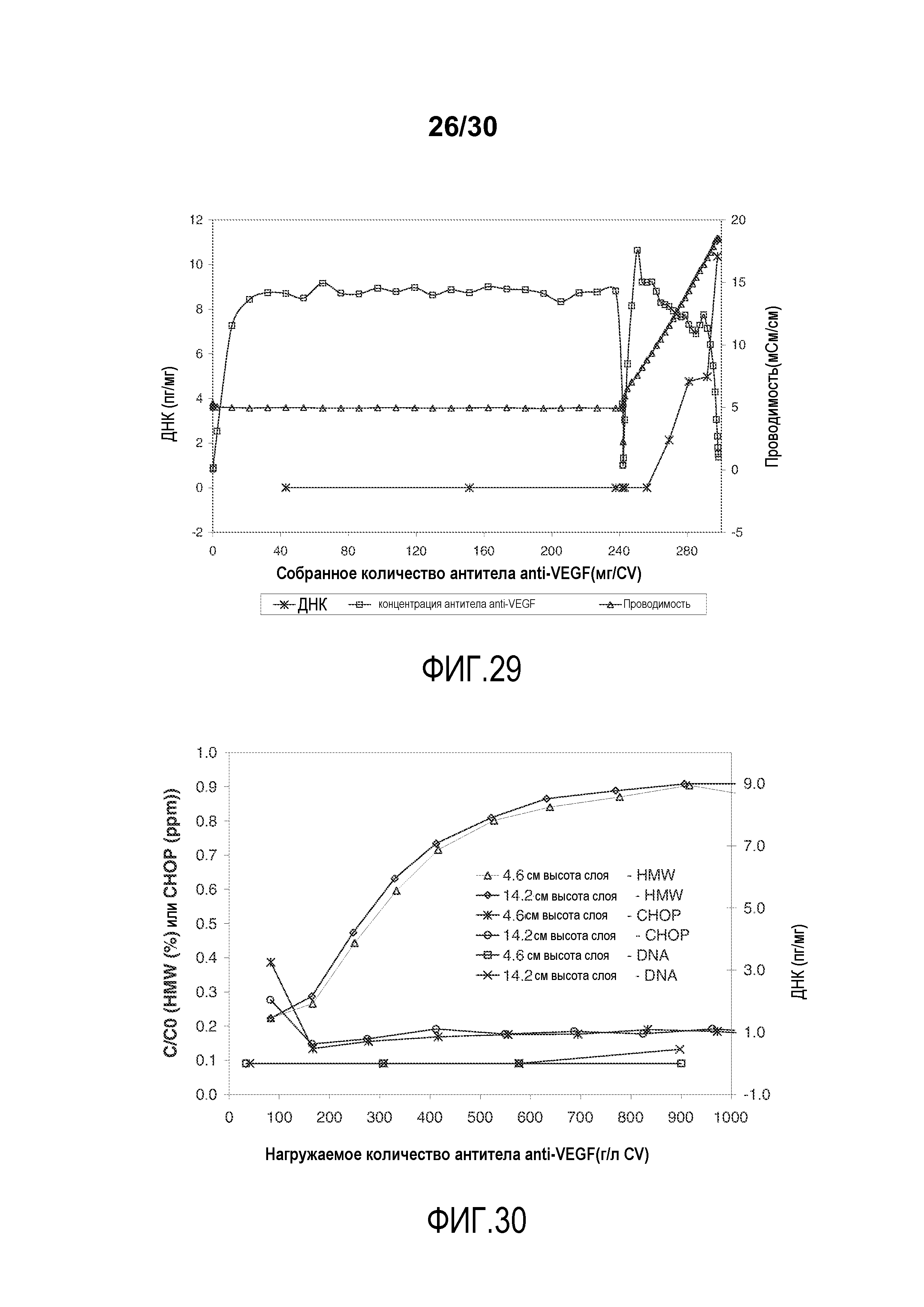
На фиг. 29 показано количество ДНК (пг/мл) и концентрация антитела при изменяющемся количестве продукта, содержащего антитело против VEGF, полученного (мг/мл CV) с применением Poros HS50, элюированного с элюцией линейного градиента соли.
На фиг. 30 показано C/C0 (концентрация HMW (%)), C/C0 (концентрация CHOP (ppm)), и количество ДНК (пг/мг) при изменяющемся количестве нагружаемого продукта, содержащего антитело против VEGF, (г/л CV) с применением Poros HS50 с высотой слоя 4,6 см или 14,2 см.
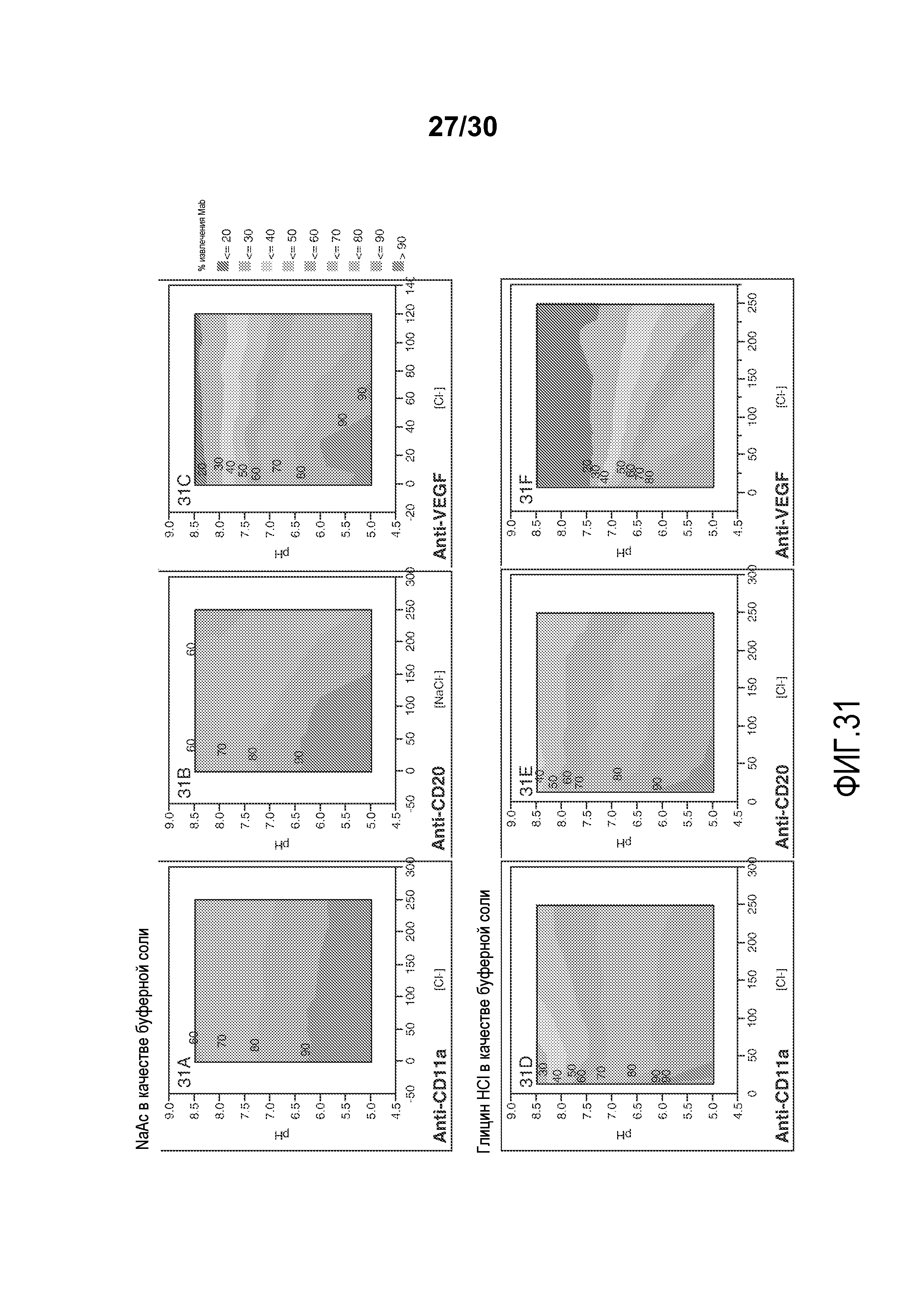
На фиг. 31A-F представлены значения % извлечения Mab для антитела против VEGF (во фракции FT), антитела против CD11a, и антитела против CD20, с применением смолы Capto Adhere при различных значениях pH и проводимости (с NaAC или глицин HCl в качестве буферной соли).
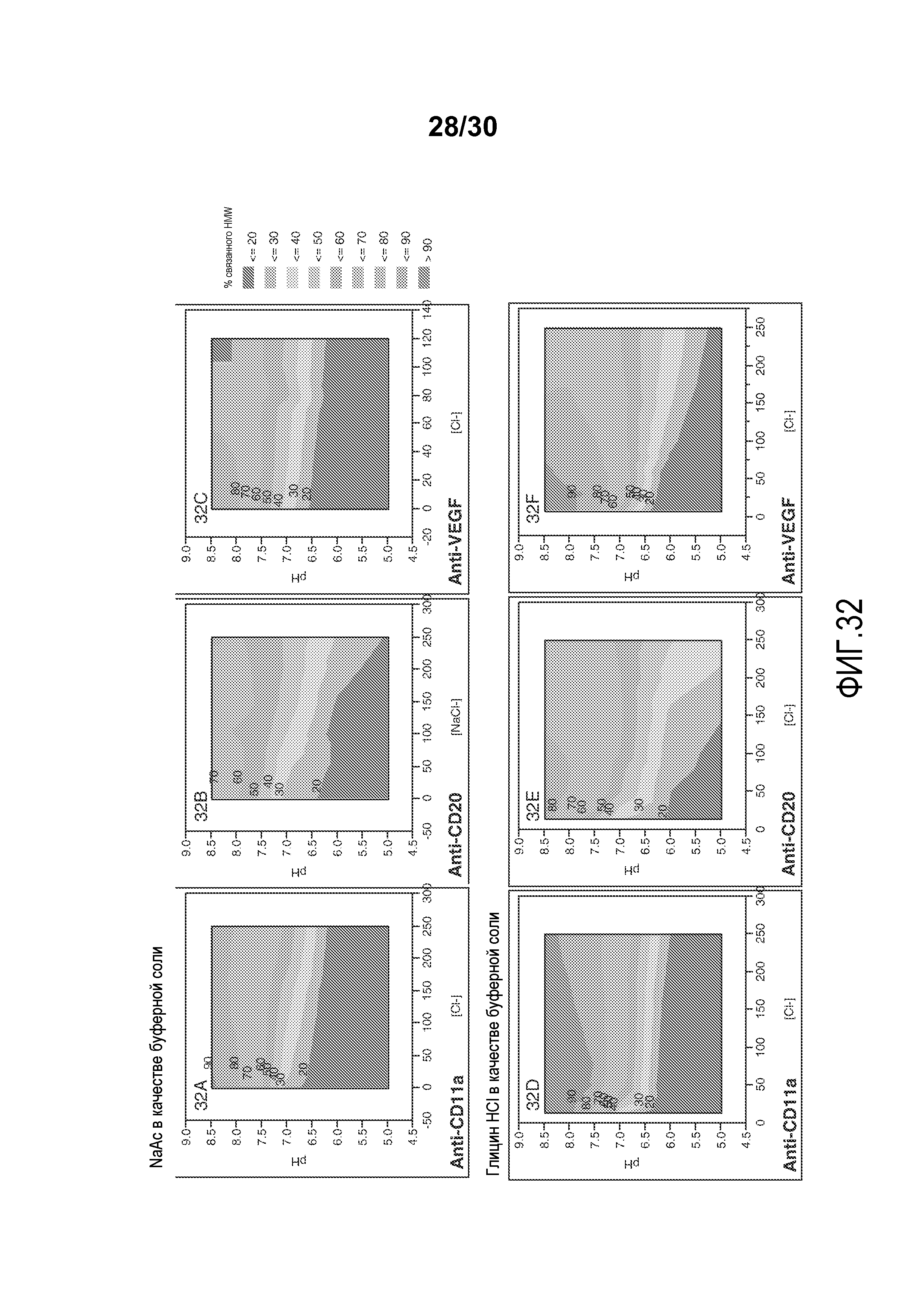
На фиг. 32A-F представлены значения связанного HMW % с применением смолы Capto Adhere resin при различных значениях pH и приводимости (с NaAC или глицин HC1 в качестве буферной соли) для антитела против VEGF, антитела против CD11a и антитела против CD20.
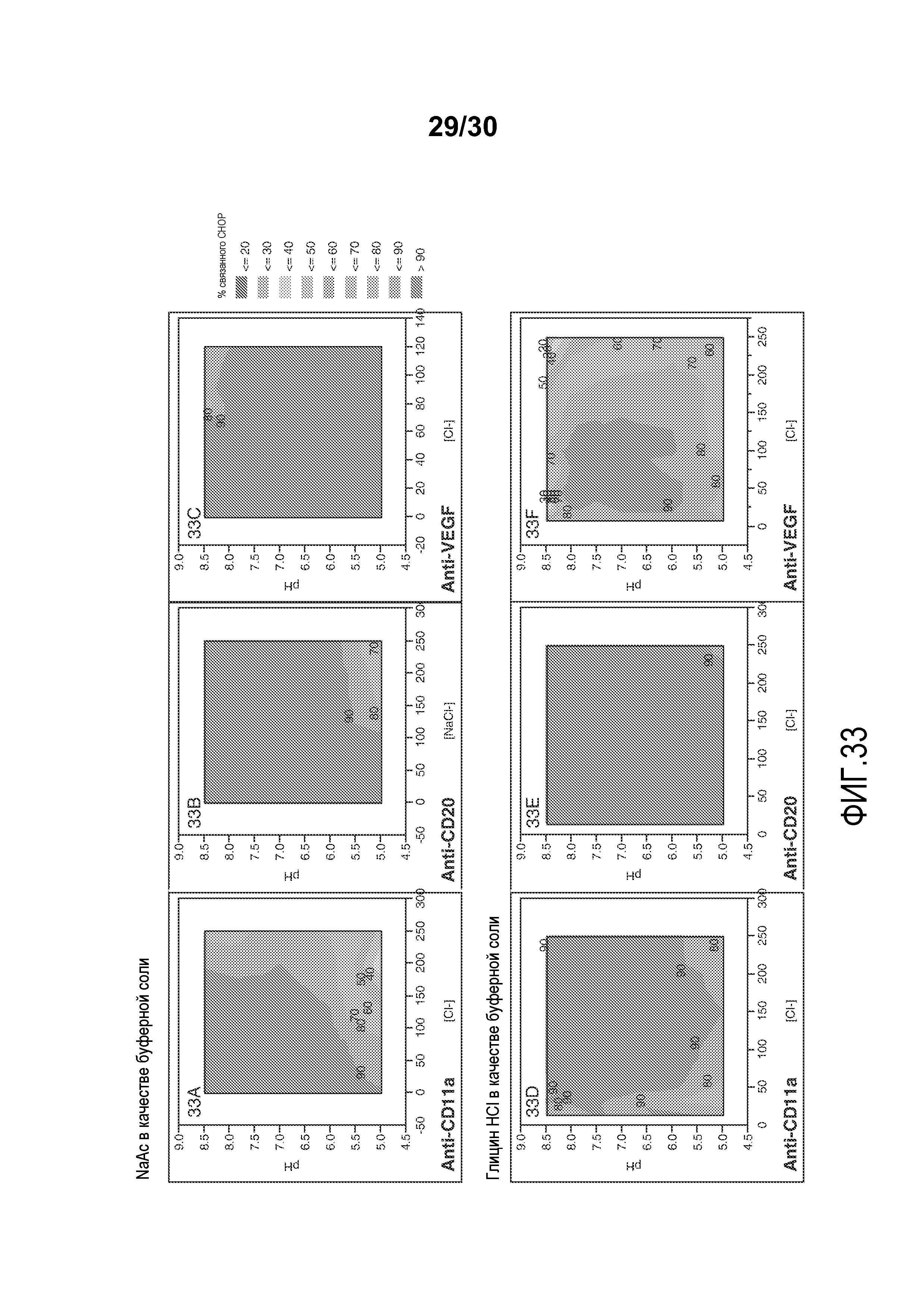
На фиг. 33A-F представлены значения связанного CHOP % с применением смолы Capto Adhere при различных значениях pH и приводимости (с NaAC или глицин HCl в качестве буферной соли) для антитела против VEGF, антитела против CD11a и антитела против CD20.
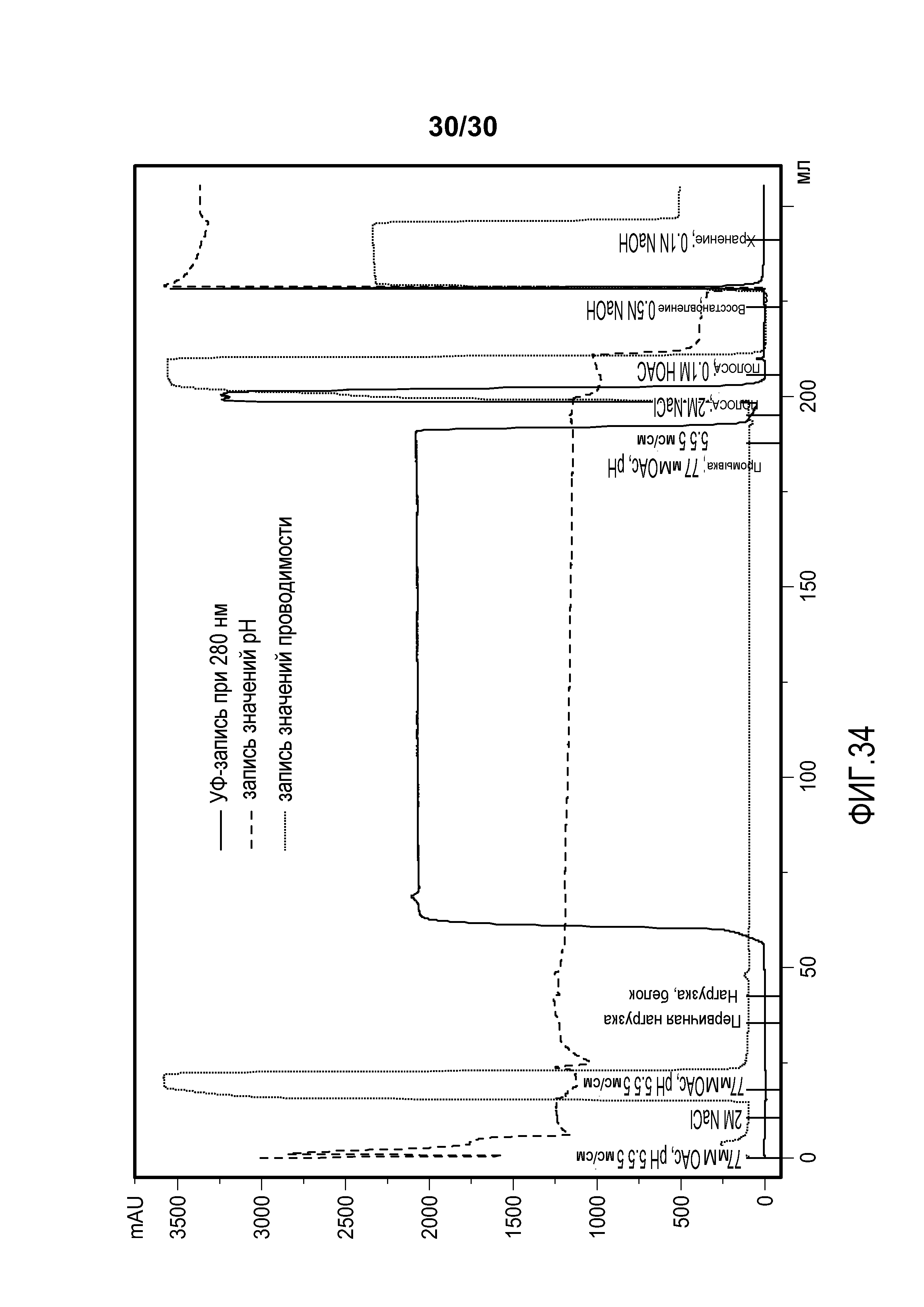
На фиг. 34 представлены хроматограммы, полученные при использовании колонки Capto Adhere, соединенной с колонкой Poros HS50 для очистки антитела против CD11a.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин "полипептид" или "белок" означает последовательность аминокислот с длиной цепи достаточной, чтобы создать более высокие уровни третичной и/или четвертичной структуры. Таким образом, белки отличаются от "пептидов", которые также являются молекулами на основе аминокислот, тем, что пептиды не обладают такой структурой. Обычно белок для применения будет характеризоваться молекулярным весом по меньшей мере приблизительно 5-20 кДа, альтернативно по меньшей мере приблизительно 15-20 кДа, предпочтительно, по меньшей мере приблизительно 20 кДа. "Пептид" обозначает последовательность аминокислот, которая обычно не проявляет более высокого уровня третичной и/или четвертичной структуры. Пептиды обычно имеют молекулярный вес меньше чем приблизительно 5 кДа.
Примеры полипептидов, охватываемые определением в настоящем описании, включают белки млекопитающих, такие как, например, ренин; гормон роста, включая гормон роста человека и гормон роста крупного рогатого скота; фактор, стимулирующий выделение гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор, и фактор Виллебранда; противосвертывающие факторы, такие как протеин C; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа или мочевина человека, или тканевой активатор плазминогена (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухоли альфа и бета; энкефалиназа; RANTES (регулирующий активацию нормальной Т-клеточной экспрессии и секреции); макрофагальный белок воспаления человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; мюллеров ингибирующий фактор; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный гонадотропин ассоциированный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген, связанный с цитотоксическими Т-лимфоцитами (CTLA), такой как CTLA-4; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы гормонов или факторов роста; протеин A или D; ревматоидные факторы; нейротрофический фактор, такой как нейротрофический фактор головного мозга (BDNF), нейротрофин-3, -4, -5, или -6 (NT-3, NT-4, NT-5 или NT-6), или ростовой фактор нервов, такой как NGF-b; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF) такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (brain IGF-I), белки, связывающие инсулиноподобный фактор роста (IGFBP); CD-белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета, и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF, и G-CSF; интерлейкины (IL), например, IL-1 - IL-10; супероксид-дисмутаза; T-клеточные рецепторы; белки мембранной поверхности; стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; хоминг-рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолеассоциированный антиген, такой как CA125 (антиген рака яичников) или рецептор HER2, HER3 или HER4; иммуноадгезины; и фрагменты и/или варианты любого из вышеперечисленных белков, а также антитела, включая фрагменты антител, связывающие белок, включая, например, любой из вышеперечисленных белков.
"Очищенный" полипептид (например, антитело) означает, что чистота полипептида увеличена, так что он представлен в форме боле чистой, чем форма, в которой он представлен в своем природном окружении и/или когда он исходно синтезирован и/или амплифицирован в лабораторных условиях. Термин “чистота” имеет относительное значение и не обязательно означает абсолютную чистоту.
Термин "меченный по эпитопу", когда используется в описании, обозначает химерный полипептид, включая полипептид, соединенный с "tag-полипептидом". Tag-полипептид содержит число остатков, достаточное, чтобы предоставить эпитоп, против которого может быть создано антитело, но в то же время является достаточно коротким, чтобы не влиять на активность полипептида с котором он соединен. Tag-полипептид, предпочтительно, также является достаточно уникальным так, чтобы антитело по существу не реагировало перекрестно с другими эпитопами. Подходящие tag полипептиды, как правило, имеют в своем составе по меньшей мере шесть аминокислотных остатков и обычно состоит приблизительно из 8-50 аминокислотных остатков (предпочтительно, приблизительно из 10-20 аминокислотных остатков).
"Активный" или "активность" в контексте настоящего документа относится к форме (формам) полипептида, которые сохраняют биологическую и/или иммунологическую активность нативного или природного полипептида, где "биологическая" активность обозначает биологическую функцию (ингибирующую или стимулирующую) обусловленную нативным или природным полипептидом, другую, чем способность вызывать продукцию антитела против антигенного эпитопа, принадлежащего нативному или природному полипептиду, и "иммунологическая" активность обозначает способность вызывать продукцию антитела против антигенного эпитопа, принадлежащего нативному или природному полипептиду.
Термин "антагонист" используется в самом широком смысле, и включает любую молекулу, которая частично или полностью блокирует, ингибирует, или нейтрализует биологическую активность нативного полипептида. Аналогичным образом термин "агонист" используется в самом широком смысле и включает любую молекулу, которая воспроизводит биологическую активность нативного полипептида. Подходящие молекулы агониста или антагониста, в частности, включают агонистические или антагонистические антитела или фрагменты антител, фрагменты или варианты аминокислотных последовательностей природных полипептидов и т.д. Способы определения агонистов или антагонистов полипептида могут включать взаимодействие полипептида с молекулой-кандидатом агониста или антагониста, и измерение обнаруживаемого изменения одной или более биологических активностей, обычно связанных с полипептидом.
"Комплементзависимая цитотоксичность" или "CDC" обозначает способность молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, полипептидом (например, антителом)), образующей комплекс с узнаваемым антигеном. Для оценки активации комплемента может быть проведен тест CDC, например, как описано в публикации Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Полипептид, "который связывает" интересующий антиген, например, опухоль-ассоциированный полипептидный антиген-мишень, представляет собой полипептид, который связывает антиген с достаточной аффинностью, так что полипептид полезен в качестве диагностического и/или терапевтического средства в определении клетки или ткани, экспрессирующей антиген, и что особенно важно, не реагирует перекрестно с другими полипептидами. В таких вариантах осуществления степень связывания полипептида с "нецелевым" полипептидом будет составлять меньше, чем приблизительно 10% от связывания полипептида с его специфическим полипептидом-мишенью, которую определяют с помощью анализа методом флуоресцентной сортировки клеток (FACS) или радиоиммунопреципитация (RIA).
Что касается связывания полипептида с молекулой-мишенью, термин "специфическое связывание" или "специфически связывается с" или является "специфичным для" определенного полипептида или эпитопа на определенном полипептиде-мишени означает связывание, которое в известной мере отличается от неспецифического взаимодействия. Специфическое связывание можно измерить, например, путем определения связывания молекулы по сравнению со связыванием контрольной молекулы, которая, обычно представляет собой молекулу сходной структуры, которая не обладает связывающей активностью. Например, специфическое связывание можно определить с помощью конкуренции с контрольной молекулой, которая похожа на мишень, например, избыток немеченной мишени. В этом случае специфическое связывание определяется, если связывание меченной мишени с зондом конкурентно ингибируется избытком немеченной мишени.
Полипептид, который "ингибирует рост опухолевых клеток" или "ингибирующий рост" полипептид представляет собой полипептид, который вызывает измеряемое ингибирование роста раковых клеток. В одном из вариантов осуществления ингибирование роста можно измерить при концентрации полипептида приблизительно 0,1-30 мкг/мл или приблизительно 0,5 нМ-200 нМ в клеточной культуре, где ингибирование роста определяют через 1-10 дней после воздействия полипептида на опухолевые клетки. Полипептид является ингибирующим рост in vivo, если введение полипептида в количестве приблизительно 1 мкг/кг-100 мг/кг веса тела приводит к уменьшению размера опухоли или пролиферации опухолевых клеток в течение приблизительно от 5 дней до 3 месяцев после первого введения полипептида, предпочтительно, в течение приблизительно 5-30 дней.
Полипептид, который "вызывает апоптоз" представляет собой полипептид, который вызывает программированную клеточную гибель, которую определяют по связыванию аннексина V, фрагментации ДНК, сморщиванию клетки, разрежение эндоплазматического ретикулума, фрагментации клетки, и/или образование мембранных везикул (называемых апоптотическими тельцами). Предпочтительно, клетка является опухолевой клеткой, например, клеткой предстательной железы, молочной железы, яичника, желудка, эндометрия, легкого, почки, толстой кишки, мочевого пузыря. Существуют различные методы оценки клеточных событий, ассоциированных с апоптозом. Например, транслокацию фосфатидилсерина (PS) можно измерить с помощью связывания аннексина; фрагментацию ДНК можно оценить по электрофоретическому расщеплению ДНК; и конденсацию ядра/хроматина наряду с фрагментацией ДНК можно оценить по увеличению гиподиплоидных клеток. Предпочтительно, полипептид, который вызывает апоптоз, представляет собой полипептид, который вызывает индукцию связывания аннексина приблизительно в 2-50 раз, предпочтительно, приблизительно в 5-50 раз и, наиболее предпочтительно, приблизительно 10-50 раз, выше по сравнению с необработанной клеткой в тесте связывания аннексина.
Полипептид, который "вызывает клеточную гибель" представляет собой полипептид, который является причиной того, что жизнеспособная клетка становится нежизнеспособной. Предпочтительно, клетка является раковой клеткой, например, клеткой молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. Гибель клеток in vitro можно определить в отсутствие комплемента и иммунных эффекторных клеток, чтобы различать клеточную гибель, вызванную антителозависимой клеточноопосредованной цитотоксичностью (ADCC) или комплементзависимой цитотоксичностью (CDC). Таким образом, анализ определения клеточной гибели можно осуществить с применением сыворотки, инактивированной нагреванием, (т.е., в отсутствие комплемента) и в отсутствие иммунных эффекторных клеток. Чтобы определить, способен ли полипептид вызвать клеточную гибель, можно оценить, в сравнении с необработанными клетками, потерю целостности мембраны клеток, которую определяют по захвату клетками пропидиум иодида (PI), трипанового синего (см. Moore et al. Cytotechnology 17: 1-11 (1995)) или 7AAD.
Термин "антитело" в описании используется в самом широком смысле и, в частности, предусматривает моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител, при условии что они проявляют желаемую биологическую активность. Термин "иммуноглобулин" (Ig) используется в описании взаимозаменяемо с термином “антитело”.
Антитела представляют собой природные молекулы иммуноглобулинов, которые характеризуются различными структурами на основе характерной для иммуноглобулинов укладки цепи. Например, антитела IgG имеют две "тяжелых" цепи и две "легких" цепи, которые соединяются дисульфидными связями с образованием функционального антитела. Каждая тяжелая и легкая цепь содержит "константную" (C) и "вариабельную" (V) область. V-области определяют антигенсвязывающую специфичность антитела, в то время как C-области обеспечивают структурную поддержку и функционирование в антиген-неспецифичных взаимодействиях с иммунными эффекторами. Антигенсвязывающая специфичность антитела или антигенсвязывающий фрагмент антитела заключается в способности антитела специфически связываться с определенным антигеном.
Антиген-связывающая специфичность антитела определяется структурными характеристиками V-области. Вариабельность распределена неравномерно в 110-аминокислотном промежутке вариабельных доменов. На самом деле, V-области состоят из относительно инвариантных участков, называемых каркасными областями (FR) длиной 15-30 аминокислот, разделенных короткими участками повышенной вариабельности, называемых "гипервариабельные участки", каждый из которых имеет длину 9-12 аминокислот. Вариабельные домены нативных тяжелой и легкой цепей, каждый, включают четыре FR, преимущественно принимающих конфигурацию β-листа, соединенных тремя гипервариабельными участками, которые образуют петли соединяющие, и в некоторых случаях формирующие часть структуры β-листа. Гипервариабельные участки в каждой цепи удерживаются вместе в непосредственной близости с помощью FR, и вместе с гипервариабельными участками из другой цепи участвуют в формировании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Каждая V-область обычно содержит три гипервариабельных участка ("CDR", каждый из которых содержит "гипервариабельную петлю"), и четыре каркасные области. Сайт связывания антитела, минимальная структурная единица, необходимая для связывания со значительной аффинностью с конкретным заданным антигеном, соответственно, будет содержать обычно три CDR, и по меньшей мере три, предпочтительно, четыре, каркасные области, расположенные между ними для удержания и представления CDR в соответствующей конформации. Классические четырехцепочечные антитела имеют антигенсвязывающие сайты, которые определяются доменами VH и VL при их кооперировании. Определенные антитела, такие как антитела верблюда и акулы, не имеют легких цепей и основаны на сайтах связывания, образованных только тяжелыми цепями. Можно создать однодоменные сконструированные иммуноглобулины, в которых сайты связывания образованы только тяжелыми цепями или легкими цепями, при отсутствии взаимодействия между VH и VL.
Термин "вариабельный" обозначает тот факт, что определенные части вариабельных доменов различаются в широких масштабах среди антител и используются при связывании и специфичности каждого конкретного антитела с его определенным антигеном. Однако вариабельность обычно неравномерно распределена на всем протяжении вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными областями, в вариабельных доменах легкой цепи и тяжелой цепи. Более высококонсервативные части вариабельных доменов называются каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей включают 4 области FR, главным образом принимающие конфигурацию β-листа, соединенного тремя CDR, которые образуют петли, соединяющие и в некоторых случаях формирующие часть структуры β-листа. Гипервариабельные области в каждой цепи удерживаются вместе в тесной близости областями FR и с CDR из другой цепи, участвуют в формировании антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Термин "гипервариабельная область", когда используется в описании, относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельная область может содержать аминокислотные остатки из "определяющей комплементарность области" или "CDR" (например, примерно вблизи остатков 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL, и примерно вблизи остатков 31-35B (H1), 50-65 (H2) и 95-102 (H3) в VH (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) и/или указанные остатки из "гипервариабельной петли " (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в VL, и 26-32 (H1), 52A-55 (H2) и 96-101 (H3) в VH (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)).
"Каркасные" или "FR" остатки представляют собой остатки вариабельного домена, за исключением остатков гипервариабельной области, которые определены в описании.
"Фрагменты антитела" содержат часть интактного антитела, предпочтительно, содержащую антигенсвязывающий участок. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2, и Fv; диатела; линейные антитела; одноцепочечные молекулы антител; и полиспецифические антитела, образованные из фрагментов антител.
Расщепление антител папаином приводит к образованию двух идентичных антиген-связывающих фрагментов, названных "Fab"-фрагментами, каждый с единственным антиген-связывающим сайтом, и остаточным "Fc"-фрагментом, наименование которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2-фрагмент, который обладает двумя антиген-связывающими сайтами и все еще способен перекрестно взаимодействовать с антигеном.
"Fv" является наименьшим фрагментом антитела, который содержит антиген-распознающий и -связывающий сайт. Данная область состоит из димера одной тяжелой и одной легкой цепи вариабельного домена, находящихся в тесной нековалентной связи. В данной конфигурации три гипервариабельных области каждого вариабельного домена взаимодействуют с определенным антиген-связывающим сайтом на поверхности VH-VL-димера. Совместно эти шесть гипевариабельных областей придают данному антителу антиген-связывающую специфичность. Однако даже одиночный вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью по сравнению с полным связывающим сайтом.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов из-за добавления нескольких остатков по карбоксиконцу тяжелой цепи CH1-домена, в том числе одного или более цистеинов шарнирной области антитела. Fab'-SH обозначает в настоящем описании Fab', в котором цистеиновый остаток(и) константных доменов несут по меньшей мере одну свободную тиольную группу. F(ab')2-фрагменты антитела исходно получают в виде пары Fab'-фрагментов, которые содержат между собой шарнирные цистеины. Известны также и другие химические соединения фрагментов антител.
"Легкие цепи" антител (иммуноглобулинов) любого вида позвоночных можно отнести к одному из двух отчетливо различимых типов, называемых “каппа” (κ) и “лямбда” (λ), на основе аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей иммуноглобулины можно отнести к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно еще разделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют разным классам антител, называют, соответственно, α, δ, ε, γ, и μ. Структура субъединиц и пространственная конфигурация разных классов иммуноглобулинов хорошо известны.
"Одноцепочечные Fv" или "scFv" фрагменты антител содержат VH- и VL-домены антител, которые представлены одиночной полипептидной цепью. В некоторых вариантах осуществления Fv-полипептид дополнительно содержит полипептидный линкер между VH- и VL-доменами, который позволяет scFv образовать требуемую структуру для связывания антигена. Обзор по scFv см. Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
Термин "диатела" относится к небольшим фрагментам антител с двумя антигенсвязывающими сайтами, которые содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). Путем использования линкера, который является настолько коротким, что допускает спаривание двух доменов в одной цепи, указанные домены вынуждают образовывать пару с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. Более подробно диатела описаны, например, в EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
Термин "моноклональное антитело" в данном контексте обозначает антитело, полученное из популяции по существу гомогенных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов, которые могут возникнуть при продукции моноклонального антитела, такие варианты, как правило, представлены в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Помимо специфичности моноклональные антитела выгодно отличаются тем, что они не имеют примесей других иммуноглобулинов. Определение "моноклональный" указывает на характер антитела, которое по существу получено из гомогенной популяции антител, и не должно истолковываться как необходимость получения антитела каким-либо определенным способом. Например, моноклональные антитела, которые используют согласно способам, предоставленным в описании, могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature 256:495 (1975), или могут быть получены методами рекомбинантной ДНК (см., например, патент США №4816567). "Моноклональные антитела" также могут быть выделены из фаговых библиотек антител с использованием методик, описанных, например, Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991).
Моноклональное антитела в настоящем описании включают в частности "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична, или гомологична соответствующим последовательностям антител, полученных из определенных видов или принадлежащих к определенному классу, или подклассу антител, тогда как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям антител, полученных из других видов или принадлежащих к другому классу, или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность (Патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Химерные антитела, представляющие интерес в настоящем описании, включают "приматизированные" антитела, содержащие антигенсвязывающие последовательности вариабельных доменов, полученные от нечеловекообразного примата (например, мартышковые, такие как павиан, макак-резус или яванский макак) и последовательности константных областей антител человека (Патент США № 5693780).
"Гуманизированные" формы нечеловеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. В большинстве, гуманизированное антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента замещаются остатками из гипервариабельной области нечеловекообразных видов (донорное антитело), таких как мышь, крыса, кролик или нечеловекообразный примат, обладающие желаемой специфичностью, аффинностью и антигенсвязывающей способностью. В отдельных случаях остатки из каркасной области (FR) иммуноглобулина человека замещают соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые отсутствуют в реципиентном антителе или в донорном антителе. Указанные модификации производят для дальнейшего улучшения характеристик антитела. В целом, гуманизированное антитело будет содержать по существу все, по меньшей мере один, и обычно два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют петлям нечеловеческого иммуноглобулина, и все или по существу все FR представляют собой FR из последовательности иммуноглобулина человека, за исключением замененного (замененных) FR, как уже отмечалось. Гуманизированное антитело также необязательно может содержать по меньшей мере часть константой области иммноглобулина, обычно иммуноглобулина человека. Для дополнительных подробностей см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); and Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
В рамках настоящего описания "интактное антитело" представляет собой антитело, содержащее вариабельные домены тяжелой и легкой цепи, а также Fc-область. Константные домены могут представлять собой константные домены с нативными последовательностями (например, константные домены человека с нативными последовательностями) или с вариантами аминокислотных последовательностей. Предпочтительно, интактное антитело обладает одной или более эффекторными функциями.
"Нативные антитела" представляют собой, как правило, гетеротетрамерные гликопротеины с молекулярной массой 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь соединяется с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных связей между тяжелыми цепями разных изотипов иммуноглобулинов варьирует. Каждая тяжелая и легкая цепь также имеет расположенные на равном расстоянии друг от друга внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следуют несколько константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце; константный домен легкой цепи находится на одной линии с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи находится на одной линии с вариабельным доменом тяжелой цепи. Полагают, что определенные аминокислотные остатки формируют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
"Голое антитело" представляет собой антитело (как определено в описании), которое не конъюгировано с гетерологичной молекулой, такой как цитотоксическая составляющая или радиоактивная метка.
В некоторых вариантах осуществления "эффекторные функции" антитела обозначают биологические активности, присущие Fc-области (нативная последовательность Fc-области или аминокислотная последовательность вариантной Fc-области) антитела, и изменяются вместе с изотипом антитела. Примеры эффекторных функций антитела включают: связывание Clq и комплементзависимая цитотоксичность; связывание Fc-рецептора; антителозависимая клеточноопосредованная цитотоксичность (ADCC); фагоцитоз; ингибирование рецепторов клеточной поверхности.
"Антителозависимая клеточноопосредованная цитотоксичность" и "ADCC" обозначают клеточно-опосредованную реакцию, в которой неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, естественные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Главные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные по экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Чтобы оценить активность ADCC интересующей молекулы, можно провести тест ADCC in vitro, такой как тест, описанный в патентах США № 5500362 или № 5821337. Полезные эффекторные клетки для таких тестов включают мононуклеарные клетки периферической крови (PBMC) и естественные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC интересующей молекулы можно оценить in vivo, например, в экспериментальной модели на животном, такой как модель, раскрытая в публикации Clynes et al., PNAS (USA) 95:652-656 (1998).
"Эффекторные клетки человека" представляют собой лейкоциты, которые экспрессируют один или более FcR и выполняют эффекторные функции. В некоторых вариантах осуществления клетки экспрессируют по меньшей мере FcγRIII и осуществляют ADCC эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), естественные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом PBMC и NK-клетки являются предпочтительными.
Термины "Fc-рецептор" или "FcR" используют для описания рецептора, который связывается с Fc-областью антитела. В некоторых вариантах осуществления FcR представляет собой нативную последовательность FcR человека. Кроме того, предпочтительный FcR представляет собой FcR, который связывает антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII, и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом по своим цитоплазматическим доменам. Активирующий рецептор FcγRIIA содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в своем цитоплазматическом домене (см. Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR рассматриваются в публикациях Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, включая те, которые могут быть определены в будущем, охватываются в описании термином "FcR". Термин также включает неонатальный рецептор, FcRn, который ответственен за передачу материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) and Kim et al., J. Immunol. 24:249 (1994)).
Термин "последовательный", как используется в настоящем описании, обозначает отсутствие стадии хроматографии между стадиями (a) и (b) способа.
Термин "непрерывный" в данном контексте относится к наличию катионообменного материала и материала смешанного типа, соединенных либо непосредственно, либо каким-любо другим механизмом, что предусматривает непрерывный поток между катионообменным материалом и материалом смешанного типа.
"Загрязняющие вещества" обозначают вещества, которые отличаются от желаемого полипептидного продукта. Загрязняющее вещество включает без ограничения: вещества клетки-хозяина, такие как CHOP; смытый протеин A; нуклеиновую кислоту; вариант, фрагмент, агрегат или производное желаемого полипептида; другой полипептид; эндотоксин; вирусный контаминант; компонент среды клеточной культуры и т.д.
Ссылка на "приблизительное" значение или параметр в описании включает (и описывает) варианты, которые относятся к указанному значению или параметру per se. Например, описание, относящееся к "приблизительно X" включает описание "X".
В данном контексте и в прилагаемых пунктах формулы патента формы единственного числа включают формы множественного числа объектов ссылки, если из контекста не следует другое. Следует понимать, что аспекты и вариации изобретения, описанного в настоящем документе, включают "состоящий из" и/или "по существу состоящий из” аспектов и вариаций.
II. Способы очистки
В настоящем описании раскрыты способы очистки полипептида из композиции, содержащее полипептид и по меньшей мере одно загрязняющее вещество. В частности способы включают применение катионообменного материала в условиях перегрузки. Например, способы включают загрузку на катионообменный материал с плотностью загрузки более чем 150 г/л катионообменного материала.
Способы очистки, раскрытые в описании, могут также включать загрузку на материал смешанного типа. Например, в некоторых вариантах осуществления способы включают последовательные стадии (a) загрузки катионообменного материала композицией с плотностью загрузки более чем 150 г/л катионообменного материала; и (b) загрузки материала смешанного типа композицией, извлеченной из катионообменного материала. В другом примере в некоторых вариантах осуществления способы включают последовательные стадии (a) загрузки материала смешанного типа композицией; и (b) загрузки катионообменного материала композицией, извлеченной из материала смешанного типа, с плотностью загрузки более чем 150 г/л катионообменного материала. В некоторых вариантах осуществления любого из способов, описанных в настоящем документе, последовательные стадии являются непрерывными. В некоторых вариантах осуществления любого из способов, описанных в настоящем документе, последовательные стадии являются дискретными. В некоторых вариантах осуществления при непрерывной очистке применяют такую же скорость потока, проводимость и/или значение pH.
Способы, описанные выше, также могут включать стадию загрузки на материал для аффинной хроматографии протеина А. Стадия загрузки на материал для аффинной хроматографии протеина А, как правило, но не обязательно осуществляют перед другой хроматографической стадией (стадиями). В некоторых вариантах осуществления стадия загрузки на материал для аффинной хроматографии протеина А может сочетаться с последовательными стадиями катионообменной хроматографии и хроматографии на носителях смешанного типа в условиях перегрузки колонки в любом порядке. В некоторых вариантах осуществления последовательные стадии являются непрерывными. В некоторых вариантах осуществления при непрерывной очистке применяют такую же скорость потока, проводимость и/или значение pH.
Катионообменный материал представляет собой твердую фазу, которая отрицательно заряжена и содержит свободные катионы для обмена с катионами в водном растворе, пропускаемом над или сквозь твердую фазу. В некоторых вариантах осуществления любого из способов, описанных в настоящем документе, катионообменный материал может представлять собой мембрану, монолит или смолу. В предпочтительном варианте осуществления катионообменный материал может представлять смолу. Катионообменный материал может содержать функциональную группу карбоксильных кислот или функциональную группу сульфоновых кислот такую как, но без ограничения сульфонат, карбоксильная группа, карбоксиметил, сульфоновая кислота, сульфоизобутил, сульфоэтил, карбоксил, сульфопропил, сульфонил, сульфоксиэтил или ортофосфат.
В некоторых вариантах осуществления любого из способов, описанных в изобретении, в качестве катионообменного материала может использоваться традиционный хроматографический материал или хроматографический материал смешанного типа. Традиционные хроматографические материалы включают, например, перфузионные материалы (например, смола поли(стирол-дивинилбензол)) и дифузионные материалы (например, сшитая агарозная смола). В некоторых вариантах осуществления смола поли(стирол-дивинилбензол) может представлять собой смолу Poros HS. Смола Poros HS может представлять собой Poros HS с частицами 50 мкм или частицы Poros HS с частицами 20 мкм. В некоторых вариантах осуществления сшитая агарозная смола может представлять собой смолу “sulfopropyl-Sepharose Fast Flow” ("SPSFF"). Хроматографический материал смешанного типа может представлять собой мембрану (например, полиэфирсульфон) или монолитный материал (например, сшитый полимер). Полиэфирсульфоновая мембрана может представлять собой Mustang S. Монолитный материал из сшитого полимера может представлять собой сшитый поли(глицидилметакрилат с этилендиметакрилатом), например, monolith SO3.
Примеры катионообменных материалов известны в данной области и включают, но без ограничения, Mustang S, Sartobind S, SO3 Monolith, S Ceramic HyperD, Poros HS50, Poros HS20, SPSFF, SP-Sepharose XL (SPXL), CM Sepharose Fast Flow, Capto S, Fractogel Se HiCap, Fractogel SO3, или Fractogel COO. В некоторых вариантах осуществления любого из способов, описанных в изобретении, катионообменный материал представляет собой Poros HS50. В некоторых вариантах осуществления смола Poros HS может представлять собой Poros HS 50 мкм или частицы Poros HS 20 мкм.
В некоторых вариантах осуществления любого из способов, описанных в изобретении, материал смешанного типа содержит функциональные группы, способные к одной или более из следующих функциональностей: анионный обмен, образование водородной связи и гидрофобные взаимодействия. В некоторых вариантах осуществления материал смешанного типа содержит функциональные группы, способные к анионному обмену и гидрофобным взаимодействиям. Материал смешанного типа может содержать N-бензил-N-метилэтаноламин, 4-меркапто-этил-пиридин, гексиламин или фенилпропиламин в качестве лиганда или может содержать сшитый полиаллиламин. Примеры материалов смешанного типа включают смолу Capto-Adhere, MEP HyperCel, HEA HyperCel или PPA HyperCel, или мембрану ChromaSorb. В некоторых вариантах осуществления материал смешанного типа представляет собой смолу Capto-Adhere.
В некоторых вариантах осуществления в описании предоставляются способы очистки полипептида из композиции, содержащей полипептид и по меньшей мере одно загрязняющее вещество, где способ включает либо (i), либо (ii): (i) последовательные стадии (a) загрузки композиции на Poros HS50 с плотностью загрузки более чем 150 г/л смолы; и (b) загрузки композиции, извлеченной из Poros HS50, на Capto-Adhere; или (ii) последовательные стадии (a) загрузки композиции на Capto-Adhere; и (b) загрузки композиции, извлеченной из Capto-Adhere, на Poros HS50 с плотностью загрузки более чем 150 г/л смолы.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, композицию загружают на катионообменный материал с плотностью загрузки более чем приблизительно 150 г/л, 200 г/л, 300 г/л, 400 г/л, 500 г/л, 550 г/л, 600 г/л, 650 г/л, 700 г/л, 800 г/л, 900 г/л или 1000 г/л катионообменного материала. Композиция может быть загружена на катионообменный материал с плотностью загрузки приблизительно от 150 г/л до 2000 г/л, от 150 г/л до 1500 г/л, от 150 г/л до 1000 г/л, от 200 г/л до 1500 г/л, от 300 г/л до 1500 г/л, от 400 г/л до 1000 г/л или от 500 г/л до 1000 г/л катионообменного материала. В некоторых вариантах осуществления композицию загружают на катионообменный материал с плотностью загрузки приблизительно 150 г/л, 300 г/л, 500 г/л, 550 г/л, 600 г/л, 650 г/л, 700 г/л, 800 г/л, 850 г/л, 900 г/л, 1000 г/л, 1500 г/л или 2000 г/л катионообменного материала.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, композицию загружают на материал смешанного типа с плотностью загрузки более чем 25 г/л, 50 г/л, 75 г/л, 100 г/л, 150 г/л, 200 г/л, 300 г/л, 400 г/л, 500 г/л или 550 г/л материала смешанного типа. Композицию загружают на материал смешанного типа с плотностью загрузки приблизительно от 25 г/л до 1000 г/л, от 25 г/л до 700 г/л, или от 25 г/л до 500 г/л материала смешанного типа.
Можно использовать различные буферы в зависимости, например, от желаемого значения pH буфера, желаемой проводимости буфера, характеристик интересующего белка и способа очистки. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, способы включают применение буфера. Буфер может представлять собой загрузочный буфер, равновесный буфер или промывочный буфер. В некоторых вариантах осуществления один или более из перечисленного: загрузочный буфер, равновесный буфер и/или промывочный буфер являются одинаковыми. В некоторых вариантах осуществления загрузочный буфер, равновесный буфер и/или промывочный буфер являются различными. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, буфер содержит соль. Буфер может содержать хлорид натрия, ацетат натрия или их смесь. В некоторых вариантах осуществления буфер представляет собой натрий-хлоридный буфер. В некоторых вариантах осуществления буфер представляет собой натрий-ацетатный буфер.
Загрузка в данном контексте представляет собой смесь, загружаемую на хроматографический материал. Загрузочный буфер представляет собой буфер, используемый для загрузки композиции, содержащей интересующий полипептид, на хроматографический материал. Хроматографический материал может быть уравновешен равновесным буфером перед загрузкой смеси, которую нужно очистить. Промывочный буфер используют после загрузки композиции на хроматографический материал, чтобы элюировать интересующий полипептид из твердой фазы.
“Проводимость” означает способность водного раствора проводить электрический ток между двух электродов. В растворе ток передается с помощью транспорта ионов. Следовательно, при увеличении количества ионов, представленных в водном растворе, раствор обладает более высокой проводимостью. Основной единицей измерения проводимости является сименс (или мо), мо (мСм/см), и проводимость можно измерить с помощью кондуктометра, такого как различные модели кондуктометров фирмы Orion. Поскольку электролитическая проводимость представляет собой способность ионов в растворе проводить электрический ток, проводимость раствора можно изменить путем изменения концентрации ионов в нем. Например, концентрацию буферного вещества и/или концентрацию соли (например, хлорида натрия, ацетата натрия или хлорида калия) в растворе можно изменить, чтобы обеспечить желаемую проводимость. Предпочтительно, концентрацию соли в различных буферах корректируют для достижения желаемой проводимости.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, проводимость характеризуется значением проводимости больше чем приблизительно 2 мСм/см, 5 мСм/см, 7,5 мСм/см, или 10 мСм/см. Проводимость может составлять приблизительно от 2 мСм/см до 25 мСм/см, от 2 мСм/см до 10 мСм/см, от 3 мСм/см до 8 мСм/см, от 2 мСм/см до 6 мСм/см, от 4 мСм/см до 6 мСм/см или от 2 мСм/см до 4 мСм/см. В некоторых вариантах осуществления проводимость составляет приблизительно 2 мСм/см, 3 мСм/см, 4 мСм/см, 5 мСм/см, 6 мСм/см, 8 мСм/см или 10 мСм/см. В одном из аспектов проводимость представляет собой проводимость загрузочного буфера, равновесного буфера и/или промывочного буфера. В некоторых вариантах осуществления проводимость одного или более из загрузочного буфера, равновесного буфера и промывочного буфера является одинаковой. В некоторых вариантах осуществления проводимость загрузочного буфера отличается от проводимости промывочного буфера и/или равновесного буфера.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, буфер характеризуется значением pH меньше чем приблизительно 10, 9, 8, 7 или 6. Буфер может иметь значение pH приблизительно 3-10, 4-8, 4-6 или 5-6. В некоторых вариантах осуществления значение pH составляет приблизительно 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5 или 8. Значение pH может представлять собой значение pH загрузочного буфера, равновесного буфера или промывочного буфера. В некоторых вариантах осуществления значение pH одного или более из загрузочного буфера, равновесного буфера, и/или промывочного буфера является одинаковым. В некоторых вариантах осуществления значение pH загрузочного буфера отличается от значения pH равновесного буфера и/или промывочного буфера.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, скорость потока составляет меньше, чем приблизительно 50 CV/час, 40 CV/час или 30 CV/час. Скорость потока может составлять приблизительно от 5 CV/час до 50 CV/час, от 10 CV/час до 40 CV/час или от 18 CV/час до 36 CV/час. В некоторых вариантах осуществления скорость потока составляет приблизительно 9 CV/час, 18 CV/час, 25 CV/час, 30 CV/час, 36 CV/час или 40 CV/час. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, скорость потока составляет меньше, чем приблизительно 100 см/час, 75 см/час или 50 см/час. Скорость потока может составлять приблизительно от 25 см/час до 150 см/час, от 25 см/час до 100 см/час, от 50 см/час до 100 см/час или от 65 см/час до 85 см/час. Скорость потока может представлять собой скорость потока через катионообменный материал или скорость потока через материал смешанного типа. В некоторых вариантах осуществления скорость потока через катионообменный материал является такой же, как скорость потока через материал смешанного типа. В некоторых вариантах осуществления скорость потока через катионообменный материал отличается от скорости потока через материал смешанного типа.
Высота слоя представляет собой высоту применяемого хроматографического материала. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, высота слоя составляет больше чем приблизительно 3 см, 10 см или 15 см. Высота слоя может составлять приблизительно от 3 см до 35 см, от 5 см до 15 см, от 3 см до 10 см или от 5 см до 8 см. В некоторых вариантах осуществления высота слоя составляет приблизительно 3 см, 5 см, 10 см или 15 см. В некоторых вариантах осуществления высота слоя катионообменного материала является такой же, как высота слоя материала смешанного типа. В некоторых вариантах осуществления высота слоя катионообменного материала отличается от высоты слоя материала смешанного типа.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, по меньшей мере одно загрязняющее вещество представляет собой одно или более из следующего: CHOP, смытый протеин A, ДНК, агрегированный белок, компонент среды клеточной культуры, гентамицин и вирусный контаминант.
CHOP представляет собой белки клеток-хозяев, т.е. белки клеток яичника китайского хомячка. Количество CHOP можно измерить с помощью твердофазного иммуноферментного анализа ("ELISA") или среднемасштабного скринингового исследования ("MSO"). В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, количество CHOP уменьшается больше чем приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95%. Количество CHOP может быть снижено приблизительно на 10%-99%, 30%-95%, 30%-99%, 50%-95%, 50%-99%, 75%-99%, или на 85%-99%. В некоторых вариантах осуществления количество CHOP уменьшается приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95% или 98%. В некоторых вариантах осуществления уменьшение определяют путем сравнения количества CHOP в композиции, полученной в результате стадии (стадий) очистки, с количеством CHOP в композиции перед стадией (стадиями) очистки.
Агрегированный полипептид может представлять собой высокомолекулярный (HMW) белок. В некоторых вариантах осуществления агрегированный полипептид представляет собой мультимеры интересующего полипептида. HMW может представлять собой димер вплоть до 8x мономера, или больше мономеров интересующего полипептида. Способы количественного определения агрегированного белка (например, HMW) известны в данной области техники и описаны в разделе “Примеры”. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, количество агрегированного белка снижается больше чем приблизительно на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95%. Количество агрегированного белка может уменьшаться приблизительно на 10%-99%, 30%-95%, 30%-99%, 50%-95%, 50%-99%, 75%-99% или 85%-99%. Количество агрегированного белка может уменьшаться приблизительно на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95%. В некоторых вариантах осуществления указанное уменьшение определяют путем сравнения количества агрегированного белка (например, HMW) в композиции, полученной в результате стадии (стадий) очистки, с количеством агрегированного белка (например, HMW) в композиции перед стадией (стадиями) очистки.
Смытый протеин А представляет собой протеин A, отделившийся или отмытый из твердой фазы, с которой он связывается. Например, смытый протеин А может быть смыт из хроматографической колонки с протеином A. Количество протеина A можно измерить, например, методом ELISA. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, количество смытого протеина A уменьшается больше чем приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%. Количество смытого протеина A может уменьшаться приблизительно на 10%-99%, 30%-95%, 30%-99%, 50%-95%, 50%-99%, 75%-99% или 85%-99%. В некоторых вариантах осуществления количество смытого протеина A уменьшается приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95%. В некоторых вариантах осуществления указанное уменьшение определяют путем сравнения количества смытого протеина A в композиции, полученной в результате стадии (стадий) очистки, с количеством смытого протеина A в композиции перед стадией (стадиями) очистки.
Способы измерения количества ДНК, такой как ДНК клеток CHO, известны в данной области техники и описаны в разделе Примеры. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, количество ДНК уменьшается больше чем приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, или 90%. Количество ДНК может уменьшаться приблизительно на 10%-99%, 30%-95%, 30%-99%, 50%-95%, 50%-99 %, 75%-99% или 85%-99%. Количество ДНК может уменьшаться приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99%. В некоторых вариантах осуществления уменьшение определяют путем сравнения количества ДНК в композиции, полученной в результате стадии (стадий) очистки, с количеством ДНК в композиции перед стадией (стадиями) очистки.
Компонент среды клеточной культуры обозначает компонент, представленный в клеточной культуральной среде. Клеточная культуральная среда может представлять собой клеточную культуральную среду во время получения клеток. В некоторых вариантах осуществления компонент среды клеточной культуры представляет собой гентамицин. Количество гентамицина можно определить методом ELISA. В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, количество компонента среды клеточной культуры уменьшается больше чем приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%. Количество компонента среды клеточной культуры может уменьшаться приблизительно на 10%-99%, 30%-95%, 30%-99%, 50%-95%, 50%-99%, 75%-99% или 85%-99%. В некоторых вариантах осуществления количество компонента среды клеточной культуры уменьшается приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 98%. В некоторых вариантах осуществления уменьшение определяют путем сравнения количества компонента среды клеточной культуры в композиции, полученной в результате стадии (стадий) очистки, с количеством компонента среды клеточной культуры в композиции перед стадией (стадиями) очистки.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, способы могут также включать одну или более стадий очистки до или после любой из стадий хроматографии, описанных в настоящем описании. В некоторых вариантах осуществления способы также включают воздействие на композицию, содержащую полипептид, одной или более дополнительных стадий очистки до или после стадий (a) и (b). Другие процедуры очистки включают, например, хроматографию с гидроксиапатитом; гельфильтрационную хроматографию; аффинную хроматографию; гель-электрофорез; диализ; осаждение этанолом; обращено-фазовая ВЭЖХ; хроматография на силикагеле; хроматофокусирование; SDS-PAGE; фракционирование сульфатом аммония; и колонки с металлохелатами для связывания меченных по эпитопу форм полипептида.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, способы также включают извлечение очищенного полипептида. В некоторых вариантах осуществления очищенный полипептид получают в результате любой из стадий очистки, описанных в настоящем описании. Стадия хроматографии может представлять собой катионообменную хроматографию, хроматографию на носителях смешанного типа или хроматография с протеином А.
В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, способы также включают объединение очищенного полипептида способов очистки с фармацевтически приемлемым носителем.
III. Полипептиды
Предоставляются полипептиды для применения по любому из способов очистки полипептидов и препараты, содержащие полипептиды, очищенные способами, описанными в настоящем описании.
В некоторых вариантах осуществления полипептид представляет собой терапевтический полипептид. Терапевтический полипептид может ингибировать рост опухолевых клеток, вызывать апоптоз и/или вызывать гибель клеток. В некоторых вариантах осуществления полипептид представляет собой антагонист. В некоторых вариантах осуществления полипептид представляет собой агонист. В некоторых вариантах осуществления полипептид представляет собой антитело.
В некоторых вариантах осуществления полипептид обладает молекулярным весом больше, чем приблизительно 5000 Дальтон, 10000 Дальтон, 15000 Дальтон, 25000 Дальтон, 50000 Дальтон, 75000 Дальтон, 100000 Дальтон, 125000 Дальтон или 150000 Дальтон. Полипептид может обладать молекулярным весом приблизительно от 50000 Дальтон до 200000 Дальтон или от 100000 Дальтон до 200000 Дальтон. Альтернативно, полипептид для применения в настоящем описании может обладать молекулярным весом приблизительно 120000 Дальтон или 25000 Дальтон.
pI обозначает изоэлектрическую точку и представляет собой значение pH, при котором определенная молекула или поверхность не несет суммарного электрического заряда. В некоторых вариантах осуществления любого из способов, описанных в настоящем документе, pI полипептида может составлять приблизительно 6-10, 7-9 или 8-9. В некоторых вариантах осуществления полипептид характеризуется значением pI приблизительно 6, 7, 7,5, 8, 8,5, 9, 9,5 или 10.
Полипептиды, которые очищают с применением описанных в настоящем документе способов, обычно получают с использованием рекомбинантных методов. Способы получения рекомбинантных белков описаны, например, в патентах США №5534615 и №4816567, которые включены в данное описание в качестве ссылки. В некоторых вариантах осуществления представляющий интерес белок получают в клетке CHO (см., например международный патент WO 94/11026). При использовании рекомбинантных методов полипептиды можно получить внутриклеточно, в периплазматическом пространстве или они могут секретироваться непосредственно в среду.
Полипептиды могут быть выделены из культуральной среды или из лизатов клеток-хозяев. Клетки, используемве для экспрессии полипептидов, могут быть разрушены различными физическими или химическими средствами, такими как циклы замораживания и оттаивания, сонификация, механическое разрушение, или применение реагентов, вызывающих лизис клеток. Если полипептид продуцируется внутриклеточно, то в качестве первой стадии удаляют клеточные фрагменты в виде частиц, или фрагменты клеток-хозяев, или лизированные фрагменты, например, центрифугированием или ультрафильтрацией. Carter et al., Bio/Technology 10: 163-167 (1992) описал процедуру выделения полипептидов, которые секретируются в периплазматическом пространстве клеток E. coli. Кратко, клеточную суспензию растапливают в присутствии ацетата натрия (pH 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 мин. Остатки клеток можно удалить центрифугированием. Если полипептид секретируется в среду, супернатанты из таких систем экспрессии обычно вначале концентрируют с применением коммерчески доступного фильтра для концентрации полипептида, например, производства Amicon или комплект для ультрафильтрации Millipore Pellicon. Ингибитор протеазы, такой как PMSF, можно включить в любую из указанных выше стадий для ингибирования протеолиза и можно включить антибиотики для предотвращения роста адвентиционных загрязняющих элементов.
(A) Антитела
В некоторых вариантах осуществления любого из способов, описанных в настоящем документе, полипептид для использования в любом из способов очистки, описанных в настоящем документе, представляет собой антитело.
Молекулярные мишени антител включают CD-белки и их лиганды, такие как, но без ограничения: (i) CD3, CD4, CD8, CD19, CD11a, CD20, CD22, CD34, CD40, CD79α (CD79a) и CD79β (CD79b); (ii) члены семейства рецептора ErbB, такие как рецептор EGF, рецептор HER2, HER3 или HER4; (iii) молекулы клеточной адгезии, такие как LFA-1, Mac1, p150,95, VLA-4, ICAM-1, VCAM и интегрин v/3, включая его субъединицы альфа или бета (например, антитела против CD11a, против CD18 или против CD11b); (iv) факторы роста, такие как VEGF; IgE; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl; CTLA-4; протеин C, BR3, c-met, тканевой фактор 7 и т.д.; и (v) поверхностные и трансмембранные опухольассоцированные антигены (TAA), такие как антигены, описанные в патенте США № 7521541.
Другие характерные антитела включают антитела, выбранные из, но без ограничения, таких как антитело против эстрогенового рецептора, антитело против прогестеронового рецептора, антитело против p53, антитело против HER-2/neu, антитело против EGFR, антитело против катепсин D, антитело против Bcl-2, антитело против E-кадгерин, антитело против CA125, антитело против CA15-3, против CA19-9, антитело против c-erbB-2, антитело против гликопротеина P, антитело против CEA, антитело против белка ретинобластомы, антитело против онкобелка ras, антитело против Lewis X, антитело против Ki-67, антитело против PCNA, антитело против CD3, антитело против CD4, антитело против CD5, антитело против CD7, антитело против CD8, антитело против CD9/p24, антитело против CD10, антитело против CD11a, антитело против CD11c, антитело против CD13, антитело против CD14, антитело против CD15, антитело против CD19, антитело против CD20, антитело против CD22, антитело против CD23, антитело против CD30, антитело против CD31, антитело против CD33, антитело против CD34, антитело против CD35, антитело против CD38, антитело против CD41, антитело против LCA/CD45, антитело против CD45RO, антитело против CD45RA, антитело против CD39, антитело против CD100, антитело против CD95/Fas, антитело против CD99, антитело против CD106, антитело против убиквитина, антитело против CD71, антитело против c-myc, антитело против цитокератинов, антитело против виментинов, антитело против белков HPV, антитело против легких цепей каппа, антитело против легких цепей лямбда, антитело потив меланосом, антитело против специфического антигена простаты, антитело против S-100, антитело против антигена тау, антитело против фибрина, антитело против кератинов и антитело против Tn-антигена.
(i) Поликлональные антитела
В некоторых вариантах осуществления антитела представляют собой поликлональные антитела. Образование поликлональных антител, предпочтительно, индуцируют у животных путем многократных подкожных (sc) или интраперитонеальных (ip) инъекций соответствующего антигена и адъюванта. Может быть полезным конъюгировать соответствующий антиген с полипептидом, который, является иммуногенным у иммунизированного млекопитающего, например, такого как гемоцианин лимфы улитки, сывороточный альбумин, бычий тиреоглобулин или ингибитор трипсина соевых бобов с применением бифункционального или дериватизирующего реагента, такого как например, сложный эфир малеимидобензоила и сульфосукцинимида (конъюгация по остаткам цистеина), N-гидроксисукцинимид (конъюгация по остаткам лизина), глутаровый альдегид, янтарный ангидрид, SOCl2, или R'N=C=NR, где R и R' являются различными алкильными группами.
Животных иммунизируют против антигена, иммунногенных конъюгатов или производных путем объединения, например, 100 мкг или 5 мкг полипептида или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и введения раствора внутрикожно в нескольких местах. Через один месяц животным стимулируют 1/5-1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда подкожной инъекцией в нескольких местах. Через 7-14 дней у животных берут кровь и оценивают титр антител в сыворотке. Животных стимулируют до достижения фазы плато титров антител. В некоторых вариантах осуществления животное стимулируют конъюгатом одного и того же антигена, но конъюгированного с другим полипептидом и/или с помощью другого сшивающего реагента. Конъюгаты также могут быть получены в рекомбинантной клеточной культуре в виде слияний полипептидов. Также используют подходящим образом агрегирующие реагенты, такие как алюминиевые квасцы, для усиления иммунного ответа.
(iii) Моноклональное антитела
В некоторых вариантах осуществления антитела представляют собой моноклональные антитела. Моноклональные антитела получают из популяции по существу гомогенных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп за исключением возможных вариантов, которые возникают во время продукции моноклонального антитела, такие варианты обычно представлены в незначительных количествах. Таким образом, определение "моноклональное" указывает на характер антитела, которое не является смесью отдельных или поликлональных антител.
Например, моноклональное антитела могут быть получены с помощью гибридомного метода, впервые описанного Kohler et al., Nature 256:495 (1975), или могут быть созданы методами рекомбинантной ДНК (Патент США № 4816567).
В гибридомном методе мышь или другое подходящее животное-хозяин, такое как хомячок, иммунизируют, как описано в настоящем документе, чтобы получить лимфоциты, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с полипептидом, применяемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с миеломными клетками с использованием подходящего средства, вызывающего слияние клеток, такого как полиэтиленгликоль, с образованием гибридомной клетки (Coding, Monoclonal Антитела: Principles and Practice, pp. 59-103 (Academic Press, 1986)).
Клетки гибридомы, полученные таким образом, высевают и выращивают в подходящей культуральной среде, которая, предпочтительно, содержит одно или несколько веществ, которые ингибируют рост или жизнеспособность неслитых родительских клеток миеломы. Например, в исходных клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), то культуральная среда для гибридом обычно будет содержать гипоксантин, аминоптерин и тимидин (“среда HAT”), и такие вещества предотвращают рост HGPRT-дефицитных клеток.
В некоторых вариантах осуществления клетками миеломы являются клетки, которые эффективно сливаются, поддерживают стабильный высокий уровень экспрессии антитела выбранными продуцирующими антитела клетками и являются чувствительными к такой среде, как среда HAT. Среди этого, в некоторых вариантах осуществления, клеточные линии миеломы являются линиями клеток миеломы мышей, такие как линии, полученные из клеток мышиных опухолей MOPC-21 и MPC-11, доступные в Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 или клетки X63-Ag8-653, доступные в Американской коллекции типов культур, Rockville, Maryland USA. Описаны линии клеток миеломы человека и гетеромиеломы мышь-человек также для получения моноклональных антител человека (Kozbor, J. Immunol. 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой культивируют клетки гибридомы, можно оценить в отношении присутствия моноклональных антител, направленных против антигена. В некоторых вариантах осуществления специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют иммунопреципитацией или используя анализ связывания in vitro, такой как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Связывающую способность моноклонального антитела можно определить, например, с использованием анализа Скэтчарда по Munson et al., Anal. Biochem. 107:220 (1980).
После того как идентифицируют гибридомные клетки, которые продуцируют антитела с желаемой специфичностью, аффинностью, и/или активностью, клоны можно субклонировать методами лимитирующих разведений и выращивать с помощью стандартных методов (Coding, Monoclonal Antibodies: Principles and Practice pp. 59-103 (Academic Press, 1986)). Культуральные среды, подходящие для данной цели, включают, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo в виде асцитных опухолей животного.
Моноклональные антитела, секретируемые субклонами, выделяют подходящим образом из культуральной среды, асцитической жидкости или сыворотки с помощью общепринятых методик очистки иммуноглобулинов, таких как, например, хроматография на протеин A-сефарозе, хроматография с гидроксилапатитом, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована с использованием обычных способов (например, с помощью олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). В некоторых вариантах осуществления клетки гибридомы служат в качестве предпочтительного источника такой ДНК. После выделения ДНК можно поместить в векторы экспрессии, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьян COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в других условиях не продуцируют белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи, посвященные рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al., Curr. Opinion in Immunol. 5:256-262 (1993) и Pluckthun, Immunol. Revs., 130: 151-188 (1992).
В другом варианте осуществления антитела или фрагменты антител могут быть выделены из фаговых библиотек антител, созданных с применением технологий, описанных McCafferty et al., Nature 348:552-554 (1990). Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991) описали выделение антител мыши и человека, соответственно, с использованием фаговых библиотек. В последующих публикациях описано получение высоко аффинных (в диапазоне нМ) антител человека с помощью “перетасовки цепей” (Marks et al., Bio/Technology 10:779-783 (1992)), а также комбинаторного инфицирования и рекомбинации in vivo в качестве стратегии для построения очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res. 21:2265-2266 (1993)). Таким образом, указанные технологии являются жизнеспособной альтернативой традиционным методикам гибридомных моноклональных антител для выделения моноклональных антител.
ДНК также может быть модифицирована, например, заменой кодирующей последовательностью для константных доменов тяжелой и легкой цепи человека вместо гомологичных мышиных последовательностей (Патент США № 4816567; Morrison et al., Proc. Natl Acad. Sci. USA 81:6851 (1984)), или ковалентным связыванием с последовательностью, кодирующей иммуноглобулин, всей или части последовательности, кодирующей неиммуноглобулиновый полипептид.
Обычно такими неиммуноглобулиновыми полипептидами можно заменить константные домены антитела или можно заменить вариабельные домены одного антигенсвязывающего центра антитела, чтобы создать химерное бивалентное антитело, содержащее один антигенсвязывающий центр, обладающий специфичностью к антигену, и другой антигенсвязывающий центр, обладающий специфичностью к другому антигену.
В некоторых вариантах осуществления любого из способов, описанных в настоящем документе, антитело представляет собой IgA, IgD, IgE, IgG, или IgM. В некоторых вариантах осуществления антитело представляет собой моноклональное антитело IgG.
(iv) Гуманизированные антитела
В некоторых вариантах осуществления антитело представляет собой гуманизированное антитело. Способы гуманизации нечеловеческих антител описаны в данной области. В некоторых вариантах осуществления гуманизированное антитело имеет один или более аминокислотные остатки, введенные в него, из организма, не являющегося организмом человека. Такие остатки часто обозначаются как “импортные” остатки, которые обычно взяты из “импортного” вариабельного домена. Гуманизацию по существу можно выполнить по способу Winter и соавтров (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al., Science 239:1534-1536 (1988)), замещением последовательностей в гипервариабельной области на соответствующие последовательности антитела человека. Соответственно, такие “гуманизированные” антитела представляют собой химерные антитела (патент США № 4816567) где по существу менее чем интактный вариабельный домен человека был замещен соответствующей последовательностью из нечеловеческого вида. На практике, гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки из гипервариабельных участков и, возможно, некоторые остатки FR замещены остатками из аналогичных участков в антителах грызунов.
Выбор вариабельных доменов человека, и легкого, и тяжелого, которые предстоит использовать при получении гуманизированных антител, очень важен для уменьшения антигенности. Руководствуясь методом “наилучшего соответствия” проводится скрининг последовательности вариабельного домена антитела грызунов по всей библиотеке известных последовательностей вариабельного домена человека. Затем человеческая последовательность, которая наиболее близка к последовательности грызуна, принимается в качестве каркасной области (FR) человека гуманизированного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol. 196:901 (1987)). В другом способе используется определенная каркасная область, полученная из консенсусной последовательности всех антител человека определенной подгруппы вариабельных областей легкой или тяжелой цепей. Один и тот же каркас может быть использован для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993)).
Важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других предпочтительных биологических свойств. Для достижения указанной цели в некоторых вариантах осуществления способов, гуманизированные антитела можно получать способом анализа исходных последовательностей и различных концептуальных гуманизированных продуктов, используя трехмерные модели исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и демонстрируют изображения возможных трехмерных конформационных структур, выбранных для исследования иммуноглобулиновых последовательностей. Просмотр таких изображений позволяет проводить анализ вероятной роли остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. анализ остатков, которые влияют на способность выбранного для исследования иммуноглобулина связывать его антиген. Таким образом, остатки FR могут быть выбраны и скомбинированы из консенсусной реципиентной и импортируемой последовательности так, чтобы получить требуемое свойство антитела, такое как повышенная аффинность по отношению к антигену-мишени. В целом, остатки из гипервариабельной области непосредственно и в наибольшей степени вовлечены в процесс, влияющий на связывание антигена.
(v) Антитела человека
В некоторых вариантах осуществления антитело представляет собой антитело человека. Как альтернатива гуманизации, могут быть произведены антитела человека. Например, в настоящее время возможно создать трансгенных животных (например, мышь), которые способны после иммунизации продуцировать полный репертуар антител человека при отсутствии продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена, кодирующего соединяющую область тяжелой цепи антигена (JH) у химерных и мутантных по зародошевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос набора генов иммуноглобулина человека зародышевой линии в таких мутантных по зародошевой линии мышей будет вызывать продукцию антител человека после антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggermann et al., Year in Immuno. 7:33 (1993); и патенты США №5591669, №5589369 и №5545807.
Альтернативно, можно использовать технологию фагового дисплея (McCafferty et al., Nature 348:552-553 (1990)) для получения антител и фрагментов антител in vitro, из генного репертуара вариабельных (V) доменов иммуноглобулинов неиммунизированных доноров. По данной технологии гены домена V антитела клонируют в пределах рамки считывания гена полипептида основного или минорного белка внешней оболочки нитевидного бактериофага, такого как M13 или fd, и представляют в виде функциональных фрагментов антител на поверхности фаговой частицы. Поскольку нитчатая частица содержит однонитевую копию ДНК фагового генома, то селекция, основанная на функциональных свойствах антитела, также приводит к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые свойства B-клетки. Фаговый дисплей может быть осуществлен в разных формах; см. обзор, например, Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового дисплея можно использовать несколько источников участков V-генов. Clackson et al., Nature 352:624-628 (1991) выделили ряд разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученных из селезенки иммунизированных мышей. Можно сконструировать репертуар V-генов неиммунизированных людей-доноров, и антитела к набору разнообразных антигенов (включая аутоантигены) могут быть выделены по существу согласно методикам, описанным в Marks et al., J. Mol. Biol. 222:581-597 (1991), или Griffith et al., EMBO J. 12:725-734 (1993). См. также патенты США №5565332 и №5573905.
Антитела человека также могут быть получены in vitro с помощью активированных B-клеток (см. патенты США № 5567610 и 5229275).
(vi) Фрагменты антител
В некоторых вариантах осуществления антитело представляет собой фрагмент антитела. Разработаны различные способы получения фрагментов антител. Обычно указанные фрагменты получают ферментативным расщеплением интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science 229:81 (1985)). Однако указанные фрагменты в настоящее время могут быть получены непосредственно с помощью рекомбинантных клеток-хозяев. Например, фрагменты антитела могут быть выделены из фаговых библиотек антител, которые обсуждались выше. Альтернативно, фрагменты Fab'-SH могут быть непосредственно выделены из E. coli и химически связаны с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology 10: 163-167 (1992)). Согласно другому подходу фрагменты F(ab')2 могут быть непосредственно выделены из культуры рекомбинантных клеток-хозяев. Другие методики получения фрагментов антител будут очевидны для специалиста в данной области. В других вариантах осуществления предпочтительное антитело представляет собой одноцепочечный фрагмент Fv (scFv). См. международный патент WO 93/16185; патент США №5571894; и патент США № 5587458. Фрагмент антитела ткже может быть "линейным антителом", например, как описано в патенте США №5641870. Такие линейные фрагменты антител могут быть моноспецифическими или биспецифическими.
В некоторых вариантах осуществления раскрыты фрагменты антител, описанных в настоящем документе. В некоторых вариантах осуществления фрагмент антитела представляет собой антигенсвязывающий фрагмент. В некоторых вариантах осуществления, антигенсвязывающий фрагмент выбирают из группы, состоящей из фрагмента Fab, фрагмента Fab', фрагмента F(ab')2, scFv, Fv и диатела.
(vii) Биспецифические антитела
В некоторых вариантах осуществления антитело представляет собой биспецифическое антитело. Биспецифические антитела представляют собой антитела, которые обладают специфичностями связывания по отношению, по меньшей мере, к двум разным эпитопам. Иллюстративные биспецифические антитела могут связываться с двумя различными эпитопами. Альтернативно, связывающее плечо биспецифического антитела можно соединить с плечом, которое связывается с закускающей молекулой на лейкоците, такой как T-клеточная рецепторная молекула (например, CD2 или CD3), или Fc-рецепторы для IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), для того чтобы направить механизмы клеточной защиты на клетку. Биспецифические антитела могут быть получены в виде полноразмерных антител или в виде фрагментов антител (например, F(ab')2-биспецифические антитела).
Способы получения биспецифических антител известны в данной области техники. Традиционное получение полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулинов, при этом две тяжелые цепи имеют разные специфичности (Millstein et al., Nature 305:537-539 (1983)). Ввиду случайного ассортимента тяжелой и легкой цепей иммуноглобулина эти гибридомы (квадромы) продуцируют потенциальную смесь 10 различных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы, которая обычно осуществляется стадиями аффинной хроматографии, является довольно трудоемкой, и выходы продукта являются низкими. Сходные процедуры раскрыты в международном патенте WO93/08829, и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
Согласно другому подходу вариабельные домены антитела с желаемыми специфичностями связывания (участки комбинирования антитела-антигена) сливают с последовательностями константного домена иммуноглобулина. В некоторых вариантах осуществления слияние, предпочтительно, происходит с последовательностями константного домена тяжелой цепи иммуноглобулина, включающего по меньшей мере часть шарнирной, СН2 и СН3 областей. В некоторых вариантах осуществления первая константная область тяжелой цепи (CH1), содержащая участок, необходимый для связывания легкой цепи, представлена по меньшей мере в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, при желании, легкой цепи иммуноглобулина, вставляются в отдельные векторы экспрессии и совместно трансфектируются в организм подходящего хозяина. Это обеспечивает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в тех вариантах, когда неравные соотношения трех полипептидных цепей, используемых при конструировании, обеспечивают оптимальные выходы. Однако можно встроить кодирующие последовательности для двух или всех трех полипептидных цепей в один вектор экспрессии, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или когда соотношения не имеют особого значения.
В некоторых вариантах осуществления такого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Обнаружено, что такая асимметричная структура с легкой цепью иммуноглобулина только в одной половине биспецифичной молекулы облегчает отделение требуемого биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулина. Указанный подход раскрывается в международном патенте WO 94/04690. Для дополнительных деталей создания биспецифических антител см., например, Suresh et al., Methods in Enzymology 121:210 (1986).
Согласно другому подходу, описанному в патенте США №573168, поверхность контакта между парой молекул антител может быть сконструирована для максимального увеличения процентного содержания гетеродимеров, которые получают из культуры рекомбинантных клеток. В некоторых вариантах осуществления поверхность контакта содержит по меньшей мере часть домена CH3 константного домена антитела. В данном способе одно или более небольших боковых цепей аминокислот на поверхности контакта молекулы первого антитела заменяют более крупными боковыми цепями (например, тирозином или триптофаном). Уравновешивающие "полости" идентичного или исходного размера для большой боковой цепи (цепей) создают на поверхности контакта молекулы второго антитела заменой крупных боковых цепей аминокислот цепями небольшого размера (например, аланином или треонином). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают перекрестно-сшитые или "гетероконъюгатные" антитела. Например, одно из антител в гетероконъюгате может быть соединено с авидином, другое с биотином. Такие антитела были, например, предложены для нацеливания клеток иммунной системы на нежелательные клетки (патент США №4676980), и для лечения ВИЧ инфекции (международные патенты WO91/00360, WO92/200373, и европейские патент EP03089). Гетероконъюгатные антитела могут быть получены с применением способов, связанных с использованием перекрестно-сшивающих средств. Подходящие перекрестно-сшивающие реагенты хорошо известны в данной области, и раскрываются в патенте США № 4676980, вместе с рядом способов, связанных с использованием перекрестно-сшивающих средств.
Технологии создания биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела могут быть получены с применением химической связи. Brennan et al., Science 229: 81 (1985) описывает процедуру, в которой интактные антитела протеолитически расщепляют с получением фрагментов F(ab')2. Указанные фрагменты восстанавливают в присутствии дитиолового комплексообразующего средства на основе арсенита натрия для стабилизации соседних дитиолов и предупреждения образования межмолекулярных дисульфидных связей. Полученные F(ab')2-фрагменты затем превращают в производные тионитробензоата (TNB). Затем одно из производных Fab'-TNB вновь превращают в Fab'-тиол восстановлением меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с образованием биспецифического антитела. Полученные биспецифические антитела можно использовать в качестве агентов для избирательной иммобилизации ферментов.
Также описаны различные методы получения и выделения фрагментов биспецифичных антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела получали с использованием лейциновой “застежки-молнии” Kostelny et al., J. Immunol. 148(5): 1547-1553 (1992). Лейциновые пептиды-“застежки-молнии” из белков Fos и Jun соединяли с Fab'-участками двух различных антител слиянием генов. Гомодимеры антител восстанавливали в шарнирной области с образованием мономеров и затем вновь окисляли с образованием гетеродимеров антител. Данный способ можно также использовать для получения гомодимеров антител. Технология получения «диатела», описанная Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993) предоставляет альтернативный механизм получения фрагментов биспецифических антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с помощью линкера, который является слишком коротким, чтобы обеспечить объединение двух доменов одной цепи. Таким образом, домены VH и VL одного фрагмента вынуждены образовывать пары с комплементарными доменами VL и VH другого фрагмента, формируя тем самым два антигенсвязывающих сайта. Также описана другая стратегия получения фрагментов биспецифических антител с применением димеров из одноцепочечных Fv (sFv). См. Gruber et al., J. Immunol. 152:5368 (1994).
Рассматриваются антитела с более чем двумя валентностями. Например, могут быть созданы триспецифические антитела. Tutt et al., J. Immunol. 147:60 (1991).
(viii) Поливалентные антитела
В некоторых вариантах осуществления антитела являются поливалентными антителами. Поливалентное антитело может интернализироваться (и/или катаболизироваться) быстрее, чем бивалентное антитело, клеткой, экспрессирующей антиген, с которым связываются антитела. Антитела, раскрытые в описании, могут быть поливалентными антителами (которые отличаются от антител класса IgM) с тремя или более участками связывания антигена (например, тетравалентные антитела), которые можно легко осуществить с помощью рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более участков связывания антигена. Предпочтительный домен димеризации содержит (или состоит из) Fc-область или шарнирную область. В такой ситуации антитело будет содержать Fc-область и три или более антигенсвязывающих участка, аминоконцевых для Fc-области. Предпочтительное поливалентное антитело содержит в настоящем описании (или состоит из) от трех до приблизительно восьми, но предпочтительно, четыре, антигенсвязывающих участка. Поливалентное антитело содержит по меньшей мере одну полипептидную цепь (и, предпочтительно, две полипептидных цепи), где полипептидная цепь (цепи) содержит два или более вариабельных домена. Например, полипептидная цепь (цепи) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-области, X1 и X2 представляют собой аминокислоту или полипептид, и n составляет 0 или 1. Например, полипептидная цепь (цепи) может содержать: VH-CH1-гибкий линкер-VH-CH1-цепь Fc-области; или VH-CH1-VH-CH1-цепь Fc-области. Поливалентное антитело в данном описании, предпочтительно, также содержит по меньшей мере два (и предпочтительно, четыре) полипептида вариабельных доменов легких цепей. Поливалентное антитело в данном описании, например, может содежать приблизительно от двух до восьми полипептидов вариабельных доменов легких цепей. Полипептиды вариабельных доменов легких цепей, рассматриваемые в описании, содержат вариабельный домен легкой цепи и, необязательно, также содержат домен CL.
(ix) Другие модификации антител
Может быть желательной модификация антитела по настоящему изобретению в отношении эффекторной функции, например, чтобы повысить антигензависимую клеточно-опосредуемую цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность (CDC) антитела. Этого можно достичь внесением одной или нескольких аминокислотных замен в Fc-область антитела. Альтернативно, или дополнительно, в Fc-область можно вводить остаток(и) цистеина, обеспечивая, таким образом, формирование дисульфидной связи между цепями в этом участке. Полученное таким образом гомодимерное антитело может обладать улучшенной способностью в отношении интернализации и/или повышенным комплементзависимым уничтожением клеток и повышенной антителозависимой клеточной цитотоксичностью (ADCC). См. Caron et al., J. Exp Med. 176: 1191-1195 (1992) и Shopes, B. J., Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также можно получать с использованием гетеробифункциональных поперечных линкеров, как описано в Wolff et al., Cancer Research 53:2560-2565 (1993). Альтернативно можно сконструировать антитело, которое обладает дублированными Fc-участками и, таким образом, может обладать повышенной способностью в отношении лизиса комплементом и ADCC. См. Stevenson et al., Anti-Cancer Drug Design 3:219-230 (1989).
Для увеличения периода полувыведения антитела из сыворотки, можно произвести в антителе аминокислотные перестройки, как описано в патенте США 2006/0067930, который включен в описание в качествсе ссылки в полном объеме.
(B) Полипептидные варианты и модификации
Модификация (модификации) аминокислотных последовательностей полипептидов, включая антитела, описанные в настоящем документе, могут быть использованы в способах очистки полипептидов (например, антител), описанных в настоящем документе.
(i) Вариантные полипептиды
"Полипептидный вариант" означает полипептид, предпочтительно, активный полипептид, указанный в описании, обладающий по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности с последовательностью полноразмерного нативного полипептида, полипептидную последовательность, лишенную сигнального пептида, внеклеточный домен полипептида с сигнальным пептидом или без него. Такие полипептидные варианты включают, например, полипептиды в которых добавлен или удален один или более аминокислотных остатков, на N- или C-конце полноразмерной нативной аминокислотной последовательности. Обычно, полипептидный вариант TAT будет обладать по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентичностью аминокислотной последовательности с последовательностью полноразмерного нативного полипептида, с полипептидной последовательностью, лишенной сигнального пептида, с последовательностью внеклеточного домена полипептида с сигнальным доменом или без него. Необязательно, вариантные полипептиды будут иметь не более чем одну консервативную аминокислотную замену по сравнению с последовательностью нативного полипептида, альтернативно не более чем приблизительно любыми из 2, 3, 4, 5, 6, 7, 8, 9, или 10 консервативных аминокислотных замен по сравнению с последовательностью нативного полипептида.
Вариантный полипептид может быть укорочен по N-концу или по C-концу, или может не иметь внутренних остатков, например, по сравнению с полноразмерным нативным пептидом. Определенные варианты полипептидов могут не иметь аминокислотных остатков которые не являются важными для желаемой биологической активности. Указанные варианты полипептидов с усечениями, делециями и вставками могут быть получены рядом общепринятых способов. Желаемые вариантные полипептиды можно синтезировать химически. Другая подходящая методика включает выделение и амплификацию фрагмента нуклеиновой кислоты, кодирующей желаемый вариант полипептида, с помощью полимеразной цепной реакции (ПЦР). Олигонуклеотиды, которые определяют желаемые концы фрагмента нуклеиновой кислоты, применяют в 5'- и 3'-праймерах в ПЦР. Предпочтительно, полипептидные варианты имеют по меньшей мере одну общую биологическую и/или иммунологическую активность с нативным полипептидом, раскрытым в описании.
Вставки аминокислотных последовательностей включают слияния амино- и/или карбоксиконцов, имеющие в длину от одного остатка до полипептида, содержащего сто и более остатков, а также вставки внутри последовательности одиночных или множественных аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком или данное антитело, слитое с цитотоксическим полипептидом. Другие инсерционные варианты молекулы антитела включают слияние N- или C-конца антитела с ферментом или полипептидом, который увеличивает время полужизни в сыворотке крови антитела.
Например, может возникнуть необходимость улучшить аффинность связывания и/или другие биологические свойства полипептида. Варианты аминокислотных последовательностей полипептида получают путем проведения соответствующих нуклеотидных изменений в нуклеиновой кислоте, кодирующей антитело, или с помощью пептидного синтеза. Такие модификации включают, например, делеции и/или вставки, и/или замены остатков в аминокислотных последовательностях полипептида. Для создания конечной конструкции осуществляют любое сочетание делеции, вставки и замены при условии, что конечная конструкция обладает требуемыми характеристиками. Аминокислотные замены могут также изменять посттрансляционные процессы полипептида (например, антитела), такие как изменение числа или положения сайтов гликозилирования.
Направление в определении, какой остаток аминокислоты можно вставить, заменить или удалить без негативного влияния на желаемую активность можно найти путем сравнения последовательности полипептида с последовательностью молекул известных гомологичных полипептидов и минимизации числа изменений аминокислотных последовательностей, проводимых в участках с высокой гомологией.
Полезный способ идентификации определенных остатков или областей полипептида (например, антитела), которые являются предпочтительными положениями для мутагенеза, называется "аланин-сканирующий мутагенез", который описан в Cunningham and Wells, Science 244: 1081-1085 (1989). При этом идентифицируют остаток или группу целевых остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys, и Glu) и замещают нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтителен аланин или полиаланин), которая влияет на взаимодействие аминокислот с антигеном. Затем уточняют местоположения аминокислот, демонстрирующих функциональную чувствительность к заменам, путем введения в участки замещения дополнительных или иных вариантов. Таким образом, несмотря на то что участок для введения разновидности аминокислотной последовательности установлен заранее, природа мутации как таковой не нуждается в предопределении. Например, для анализа проведения мутации по данному сайту, ala-сканирующий или случайный мутагенез осуществляют по целевому кодону или участку и экспрессируемые варианты антитела скринируют на нужную активность.
Другой тип варианта представляет собой вариант с аминокислотной заменой. Указанные варианты содержат по меньшей мере один аминокислотный остаток в молекуле антитела, замененный другим остатком. Участки, представляющие наибольший интерес для замещающего мутагенеза, включают гипервариабельные области, но также предполагаются изменения FR. Консервативные замены представлены в таблице 1 ниже, под заголовком "предпочтительные замены". Если такие замены приводят к желательному изменению биологической активности, тогда можно провести более значительные изменения, обозначенные в таблице 1 как "иллюстративные замены", или как дополнительно описано ниже в отношении классов аминокислот, и провести скрининг продуктов.
Важные модификации биологических свойств полипептида осуществляют путем избирательных замен, которые существенно отличаются своим влиянием на поддержание (а) структуры полипептидного скелета области замен, например, складчатая или спиральная конформация, (b) заряда или гидрофобности молекулы в данном мишеневом сайте, или (с) структуры боковой цепи. Аминокислоты можно сгруппировать по сходству свойств их боковых цепей (в A. L. Lehninger, Biochemistry second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислые: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His(H)
Альтернативно, природные остатки можно разделить по группам, исходя из общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию боковой цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены повлекут за собой замену члена одного из этих классов на представителя другого класса.
Любой цистеиновый остаток, не участвующий в поддержании надлежащей конформации антитела, также может быть заменен, обычно на серин, для улучшения окислительной стабильности его молекулы и предотвращения аберрантного сшивания. С другой стороны, к полипептиду можно добавить цистеиновую связь(и) для повышения его стабильности (особенно в том случае, когда антитело представляет собой антительный фрагмент, такой как Fv-фрагмент).
Особенно предпочтительный тип варианта замены включает замену одного или более остатков гипервариабельной области родительского антитела (например, гуманизированного антитела). Как правило, получаемый вариант(ы), выбранный для дальнейшего усовершенствования, должен обладать улучшенными биологическими характеристиками по сравнению с родительским антителом, от которого он происходит. Удобный способ для образования таких вариантов замены предусматривает созревание аффинности с использованием фагового дисплея. Вкратце, несколько участков гипервариабельной области (например, 6-7 участков) мутируют с образованием всех возможных аминокислотных замен в каждом участке. Получаемые таким образом варианты антител представлены в моновалентной форме на нитевидных фаговых частицах в виде слияний с продуктом гена III каждой частицы, упакованной в М13. Затем проводят скрининг вариантов фагового дисплея в отношении их биологической активности (например, аффинности связывания), как раскрыто в описании. Чтобы идентифицировать кандидатные сайты гипервариабельной области для модификации, осуществляют аланин-сканирующий мутагенез для идентификации остатков гипервариабельной области, существенно способствующих связыванию антигена. Альтернативно или дополнительно, может быть полезным проведение анализа кристаллической структуры комплекса антиген-антитело, для идентификации точек контактирования между антителом и мишенью. Такие контактирующие остатки и прилегающие остатки являются кандидатами для замены в соответствии с методами, разработанными в настоящем изобретении. После создания таких вариантов, полученную панель вариантов подвергают скринингу, как в настоящем изобретении описано, и можно выбрать антитела с наилучшими свойствами в одном или более соответствующих тестах для дальнейшей разработки.
Другой тип аминокислотного варианта полипептида изменяет исходный профиль гликозилирования антитела. Полипептид может содежать неаминокислотные составляющие. Например, полипептид может быть гликозилирован. Такое гликозилирование может происходить естественным образом во время экспрессии полипептида в клетке-хозяине или организме-хозяине, или может быть заранее подготовленной модификацией, обусловленной вмешательством человека. Под изменением подразумевается удаление одного или более углеводных остатков, обнаруживаемых в полипептиде, и/или добавление одного или более участков гликозилирования, которые не представлены в полипептиде.
Гликозилирование полипептида обычно является либо N-связанным, либо O-связанным. N-связанное относится к связыванию углеводного остатка с боковой цепью остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X означает любую аминокислоту за исключением пролина, представляют собой распознаваемые последовательности для ферментативного связывания углеводного остатка с боковой цепью аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к связыванию одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы с гидроксиаминокислотой, чаще всего серином или треонином, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к полипептиду обычно сопровождается изменением аминокислотной последовательности, так что она содержит одну или несколько описанных выше трипептидных последовательностей (в случае сайтов N-связанного гликозилирования). Изменение также можно осуществить добавлением или заменой, одного или нескольких остатков серина, или треонина к последовательности исходного антитела (в случае сайтов O-связанного гликозилирования).
Удаление углеводных остатков, представленных в полипептиде, можно осуществить химически или ферментативно или с помощью мутационной замены кодонов, кодирующих аминокислотные остатки, которые служат мишенями гликозилирования. Ферментативное расщепление углеводных остатков в полипептидах можно осуществить с применением ряда эндо- и экзо-гликозидаз.
Другие модификации включают дезамидирование остатков глутаминила и аспарагинила до соответствующих остатков глутамила и аспартила, соответственно, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серила или треонила, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина, ацетилирование N-концевого амина, и амидирование любой C-концевой карбоксильной группы.
(ii) Химерные полипептиды
Полипептид, описанный в настоящем описании, можно модифицировать в известной степени с образованием химерных молекул, содержащих полипептид, слитый с другим, гетерологичным полипептидом или аминокислотной последовательностью. В некоторых вариантах осуществления химерная молекула содержит слияние полипептида с меченым полипептидом, который предоставляет эпитоп, с которым может селективно связываться антитело против tag. Эпитопная метка обычно находится на амино- или карбоксильном конце полипептида. Наличие таких форм полипептида с эпитопной меткой можно обнаружить с помощью антитела против меченого полипептида. Также размещение эпитопной метки дает возможность легко очистить полипептид с помощью афинной очистки с использованием антитела против tag или другого типа аффинной матрицы, которая связывается с эпитопной меткой.
В альтернативном варианте осуществления химерная молекула может содержать слияние полипептида с иммуноглобулином или с оределенной областью иммуноглобулина. Бивалентная форма химерной молекулы обозначается как "иммуноадгезин."
В данном контексте термин "иммуноадгезин" обозначает антителоподобные молекулы, которые сочетают в себе специфичность связывания гетерологичного пептида с эффекторными функциями константных доменов иммуноглобулина. По своей структуре иммуноадгезины содержат слияние аминокислотной последовательности с желаемой специфичностью связывания, которая отличается от распознавания антигена, и участок связывания антитела (т.е., является "гетерологичной"), и последовательность константного домена иммуноглобулина. Адгезиновая часть молекулы иммуноадгезина обычно представляет собой смежную аминокислотную последовательность, содержащую по меньшей мере участок связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как подтипы IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM.
Слитый Ig, предпочтительно, включают замену растворимой формой (трансмембранный домен удален или инактивирован) полипептида по меньшей мере одной вариабельной области в молекуле Ig. В особенно предпочтительном варианте осуществления слитый иммуноглобулин включает шарнир, CH2 и CH3, или шарнир, CH1, CH2 и области CH3 молекулы IgG1.
(iii) Полипептидные конъюгаты
Полипептид для применения в полипептидных препаратах может быть конъюгирован с цитотоксическим средством, таким как химиотерапевтическое средство, ингибитор роста, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения, или их фрагменты), или радиоактивный изотоп (т.е. радиоконъюгат).
Могут быть использованы химиотерапевтические средства, подхоящие для создания указанных конъюгатов. Кроме того, токсины с ферментативной активностью и их фрагменты, которые можно использовать, включают цепь А токсина возбудителя дифтерии, несвязывающиеся активные фрагменты токсина возбудителя дифтерии, цепь эндотоксина А (из Pseudomonas aeruginosa), цепь рицина А, цепь абрина А, цепь модеццина А, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из момордика карантия, курцин, кротин, ингибитор из сапаонарии официналис, гелонин, метогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Для создания радиоконъюгированных полипептидов имеются различные радионуклиды. Примеры включают212Bi,131I,131In,90Y и186Re. Конъюгаты полипептида и цитотоксического средства можно получить с использованием различных бифункциональных реагентов для сочетания с белками, такими как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глютаральдегид), бис-азидопроизводные (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и производные бис-активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин можно получить, как описано в Vitetta et al., Science 238: 1098 (1987). Иллюстративным хелатирующим средством для конъюгации радионуклида с полипептидом является меченная по углероду-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA).
Также в настоящем документе рассматривают конъюгаты полипептида и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, трихотецен и CC1065, и производные этих токсинов, которые обладают токсической активностью.
Майтанзиноиды представляют собой ингибиторы митоза, которые действуют, ингибируя полимеризацию тубулина. Майтанзин впервые выделили из восточно-африканского кустарника Maytenus serrata. Впоследствии обнаружили, что определенные микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры майтанзинола по C-3. Также рассматриваются синтетический майтанзинол и его производные, и аналоги. Существует множество известных в данной области линкерных групп для получения конъюгатов полипептид-майтанзиноид, включающих, например, линкерные группы, раскрытые в патенте США №5208020. Линкерные группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидазолабильные группы или эстеразолабильные группы, как описано в указанных выше патентах, дисульфидные и тиоэфирные группы являются предпочтительными.
Линкер можно присоединять к молекуле майтанзиноида в различных положениях в зависимости от типа связи. Например, сложноэфирную связь можно формировать посредством реакции с гидроксильной группой с применением традиционных способов связывания. Реакция может проходить по положению C-3, в котором находится гидроксильная группа, по положению C-14, модифицированному гидроксиметилом, по положению C-15, модифицированному гидроксильной группой, и по положению C-20, в котором находится гидроксильная группа. В предпочтительном варианте осуществления связь формируют по положению C-3 майтанзинола или аналога майтанзинола.
Другой представляющий интерес иммуноконъюгат содержит полипептид, конъюгированный с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков способно к образованию двухцепочечных разрывов в ДНК в субпикомолярных концентрациях. Для получения конъюгатов калихеамицинового семейства см., например, патент США 5712374. Структурные аналоги калихеамицина, которые можно использовать, включают в качестве неограничивающих примеров γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θ1I. Другим противоопухолевым лекарственным средством, с которым можно конъюгировать антитело, является QFA, представляющее собой антифолат. И калихеамицин, и QFA содержат внутриклеточные участки действия и с трудом проходят через плазматическую мембрану. Таким образом, клеточный захват этих средств вследствие опосредованной полипептидом (например, антителом) интернализации значительно усиливает их цитотоксические эффекты действие.
Другие противоопухолевые средства, которые можно конъюгировать с полипептидами, описанными в настоящем описании, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство средств, в совокупности известных как комплекс LL-E33288, а также эсперамицины.
В некоторых вариантах осуществления полипептид может быть конъюгатом, образованным полипептидом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
В другом варианте осуществления полипептид (например, антитело) можно конъюгировать с "рецептором" (таким как стрептавидин) для применения в предварительном нацеливании на опухоль, где конъюгат полипептид-рецептор вводят пациенту с последующим удалением не связавшегося конъюгата из кровотока с использованием средства для выведения и с последующим введением "лиганда" (например, авидина), который конъюгирован с цитотоксическим средством (например, с радионуклидом).
В некоторых вариантах осуществления полипептид можно конъюгировать с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидное химиотерапевтическое средство) в активный противоопухолевый препарат. Ферментный компонент иммуноконъюгата включает любой фермент, способный воздействовать на пролекарство таким образом, что оно превращается в его более активную цитотоксическую форму.
Ферменты, которые подходят для применения в способе по изобретению, включают, но не ограничиваются этим, щелочную фосфатазу, которая является подходящей для преобразования фосфат-содержащих пролекарств в свободные препараты; арилсульфатазу, которая является подходящей для преобразования сульфат-содержащих пролекарств в свободные препараты; цитозиндеаминазу, которая является подходящей для преобразования не токсичного 5-фторцитозина в противоопухолевый препарат, 5-фторурацил; протеазы, такие как серратиа-протеаза, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины В и L), которые являются подходящими для преобразования пептид-содержащих пролекарств в свободные препараты; D-аланилкарбоксипептидазы, которые являются подходящими для преобразования пролекарств, содержащих заместители на основе D-аминокислоты; углевод-расщепляющие ферменты, такие как β-галактозидаза и нейраминидаза, который являются подходящими для преобразования гликозилированных пролекарств в свободные препараты; β-лактамазу, которая является подходящей для преобразования препаратов, дериватизированных β-лактамами, в свободные препараты; пенициллинамидазы, такие как пенициллин-V-амидаза или пенициллин-G-амидаза, который являются подходящими для преобразования препаратов, дериватизированных соответственно по атомам азота их аминогруппы феноксиацетильной или фенилацетильной группами, в свободные препараты. Альтернативно антитела с ферментативной активностью, также известные в данной области как "абзимы", можно использовать для преобразования пролекарств по изобретению в свободные активные препараты.
(iv) Другие модификации
Другой тип ковалентной модификации полипептида включает связывание полипептида с одним из различных небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Полипептид также может быть включен в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризацией (например, соответственно микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли(метилметакрилата)), и в коллоидные системы для доставки лекарственных препаратов (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или макроэмульсии. Такие методы раскрыты в Remington's Pharmaceutical Sciences, 18th edition, Gennaro, A.R., Ed., (1990).
IV. Получение полипептидов для применения в препаратах и методах
Полипептиды, использованные в способах очистки, описанных в настоящем описании, могут быть получены с использованием методов, хорошо известых в данной области, включая рекомбинантные методы. В следующих разделах предоставлены методические принципы указанных методов.
(A) Полинуклеотиды
"Полинуклеотид" или "нуклеиновая кислота", которые используются в описании взаимозаменяемо, обозначают полимеры нуклеотидов любой длины, и включают ДНК и РНК.
Полинуклеотиды, кодирующие полипептиды, можно получить из любого источника, включая, но без ограничения библиотеку кДНК, полученную из ткани, которая, как предполагают, содежит мРНК полипептида, и экспрессировать ее на обнаруживаемом уровне. Таким образом, полинуклеотиды, кодирующие полипептид, можно получить удобным образом из библиотеки кДНК, полученной из ткани человека. Ген, кодирющий полипептид, также можно получить из геномной библиотеки или с помощью известных методик синтеза (например, автоматизированный синтез нуклеиновой кислоты).
Например, полинуклеотид может кодировать целую цепь молекулы иммуноглобулина, такую как легкая цепь или тяжелая цепь. Полная тяжелая цепь включает не только вариабельную область тяжелой цепи (VH), но также константную область тяжелой цепи (CH), которая обычно будет содежать три константных домена: CH1, СН2 и CH3; и шарнирную область. В некоторых ситуациях желательно присутствие константной области.
Другие полипептиды, которые могут кодироваться полинуклеотидом, включают антигенсвязывающие фрагменты антител, такие как однодоменные антитела ("dAb"), Fv, scFv, Fab' и F(ab')2 и "минитела." Минитела представляют собой (обычно) бивалентные фрагменты антител, из которых удален домен CH1 и Cκ или CL. Поскольку минитела меньше, чем антитела обычного типа, они должны обеспечивать лучшее проникновение в ткани при клиническом/диагностическом использовании, но являясь бивалентными, они должны сохранять более высокую аффинность связывания, чем фрагменты моновалентного антитела, такие как dAb. Таким образом, если контекст не подразумевает другого, термин "антитело" в данном контексте включает не только молекулы полных антител, но также антигенсвязывающие фрагменты антител, рассмотренного выше типа. Предпочтительно, каждая каркасная область, представленная в кодированном полипептиде, будет содержать по меньшей мере одну аминокислотную замену, по сравнению с соответствующей акцепторной каркасной областью человека. Таким образом, например, каркасные области могут включать, в итоге, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, или пятнадцать аминокислотных замен по сравнению с акцепторными каркасными областями.
Соответственно, полинуклеотиды, описанные в настоящем описании, могут быть выделены и/или очищены. В некоторых вариантах осуществления, полинуклеотиды преставляют собой выделенные полинуклеотиды.
Термин "изолированный полинуклеотид" используют, чтобы показать, что молекула извлечена или выделена из обычного или природного окружения, или произведена таким способом, что она не представлена в своем обычном или природном окружении. В некоторых вариантах осуществления полинуклеотиды представляют собой очищенные полинуклеотиды. Термин “очищенный” используют, чтобы показать, что по меньшей мере некоторые загрязняющие молекулы или вещества были удалены.
Соответственно, полинуклеотиды по существу очищают, так что соответствующие полинуклеотиды составляют преобладающие (т.е. наиболее распространенные) полинуклеотиды, представленные в композиции.
Рекомбинантные нуклеиновые кислоты, содержащие вставку, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи, можно использовать в способах как описано в настоящем описании. По определению такие нуклеиновые кислоты включают кодирующие одноцепочечные нуклеиновые кислоты, двухцепочечные нуклеиновые кислоты, состоящие из указанных нуклеиновых кислот и из комплементарных им нуклеиновых кислот, или указанные комплементарные (одноцепочечные) нуклеиновые кислоты сами по себе.
Модификацию(и) также может быть осуществлена за пределами вариабельного домена тяжелой цепи и/или вариабельного домена легкой цепи антитела. Такая мутантная нуклеиновая кислота может быть молчащим мутантом, в котором один или более нуклеотидов заменены другими нуклеотидами, при этом новые кодоны кодиуют ту же самую аминокислоту(ы). Такая мутантная последовательность может быть вырожденной последовательностью. Вырожденные последовательности являются вырожденными в понимании генетического кода, в котором неограниченное число нуклеотидов заменяется другими нуклеотидами, не приводя к изменениям в исходно кодируемой аминокислотной последовательности. Такие вырожденные последовательности могут быть полезны благодаря своим различным сайтам рестрикции и/или частоте встречаемости определенных кодонов, которые являются предпочтительными для определенного хозяина, в особенности для дрожжевых, бактериальных клеток или клеток млекопитающих, для достижения наилучшей экспессии вариабельного домена тяжелой цепи и/или вариабельного домена легкой цепи.
Последовательности обладают степенью идентичности последовательности или гомологией последовательности с аминокислотной последовательностью(ми) полипептида, характеризующегося специфическими свойствами, определяемыми в настоящем описании, или с любой нуклеотидной последовательностью, кодирующей такой полипептид (в дальнейшем обозначаемые как "гомологичная последовательность(и)"). В описании термин "гомолог" обозначает частицу, обладающую определенной гомологией с рассматриваемыми аминокислотными последовательностями и рассматриваемыми нуклеотидными последовательностями. В описании термины "гомология" и "идентичность" иявляются взаимозаменяемыми.
В некоторых вариантах осуществления гомологичная аминокислотная последовательность и/или нуклеотидная последовательность кодиует полипептид, который сохраняет функциональную активность и/или усиливает активность антитела. В некоторых вариантах осуществления считают, что гомологичная последовательность включает аминокислотную последовательность, которая может быть по меньшей мере приблизительно на 75, 85 или 90% идентична, предпочтительно, по меньшей мере приблизительно на 95 или 98% идентична рассматриваемой последовательности. Обычно гомологи будут содержать такие же активные сайты и т.д. как и рассматриваемая аминокислотная последовательность. Хотя гомологию также можно рассматривать в терминах сходства (т.е., аминокислотные остатки обладают сходными химическими свойствами/функциями). В некоторых вариантах осуществления, предпочтительно, выражать гомологию в терминах идентичности последовательности.
В настоящем контексте считается, что гомологичная последовательность включает нуклеотидную последовательность, которая может быть по меньшей мере приблизительно на 75, 85 или 90% идентична, предпочтительно, по меньшей мере приблизительно на 95 или 98% идентична нуклеотидной последовательности, кодирующей полипептид, описанный в настоящем описании (рассматриваемая последовательность). Обычно гомологи будут включать такие же последовательности, которые кодируют активные сайты и т.п. как и рассматриваемая последовательность. Хотя гомологию также можно рассматривать в терминах сходства (т.е., аминокислотные остатки имеют сходные химические свойства/функции). В некоторых вариантах осуществления, предпочтительно, выражать гомологию в терминах идентичности последовательности.
Указанные способы включают, но без ограничения выделение из природного источника (в случае вариантов с природной аминокислотной последовательностью) или создание путем олигонуклеотид-опосредованного (или сайт-направленного) мутагенеза, мутагенеза с помощью ПЦР, и кассетного мутагенеза ранее полученного варианта или невариантной версии полипептида.
(B) Экспрессия полинуклеотидов
Нижеприведенное описание относится, главным образом, к получению полипептидов с помощью культивирования клеток, трансформированных или трансфицированных вектором, содержащим полинуклеотиды, кодирующие полипептиды. Предусматривается, что альтернативные методы, которые хорошо известны в данной области, можно использовать для получения полипептидов. Например, соответствующая аминокислотная последовательность, или ее части могут быть созданы прямым пептидным синтезом с использованием твердофазных методов анализа (см., например, Stewart et al., Solid-Phase Peptide Synthesis W.H. Freeman Co., San Francisco, Calif. (1969); Merrifield, J. Am. Chem. Soc. 85:2149-2154 (1963)). Синтез белка in vitro можно выполнить с использованием способов, выполняемых вручную, или с помощью автоматики. Автоматизированный синтез можно осуществить, например, с помощью синтезатора пептидов Applied Biosystems Peptide Synthesizer (Foster City, Calif.) с использованием инструкций производителя. Различные части полипептида можно химически синтезировать по отдельности и соединить с применением химических или ферментативных методов для получения нужного полипептида.
Полинуклеотиды, которые описаны в настоящем описании, помещают в вектор(ы) экспрессии для продукции полипептидов. Термин "контрольные последовательности" относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в определенном организме-хозяине. Контрольные последовательности включают, но без ограничения, промоторы (например, естественно-связанные или гетерологичные промоторы), сигнальные последовательности, энхансерные элементы и последовательности терминации транскрипции.
Полинуклеотид "функционально связан", если он находится в функциональных отношениях с другой полинуклеотидной последовательностью. Например, нуклеиновые кислоты предпоследовательности или секреторного лидера функционально связаны с нуклеиновыми кислотами полипептида, если он экспрессируется в виде препробелка, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания на рибосоме функционально связан с кодирующей последовательностью, если он расположен таким образом, что облегчает тансляцию. В целом, "функционально связанные" означает, что последовательности нуклеиновых кислот, которые связаны, являются соседними, и, в случае секреторного лидера, соседними и в фазе считывания. Однако энхансеры не должны быть соседними. Связывание выполняют путем сшивания в подходящих сайтах рестрикции. Если таких сайтов не существует, используют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепринятыми методиками.
В отношении антител, легкие и тяжелые цепи можно клонировать в одном и том же или разных векторах экспрессии. Сегменты нуклеиновой кислоты, кодирующие иммуноглобулиновые цепи, функционально связаны с контрольными последовательностями в векторе(ах) экспрессии, которые обеспечивают экспрессию иммуноглобулиновых полипептидов.
Компонент селективного гена
Обычно, векторы экспрессии содержат селективные маркеры (например, устойчивости к ампициллину, устойчивости к гигромицину, устойчивости к тетрациклину, устойчивости к канамицину или устойчивости к неомицину), чтобы обеспечить обнаружение тех клеток, которые трансформированы заданными последовательностями ДНК (см., например, патент США №4704362). В некоторых вариантах осуществления селективные гены кодируют белки, которые (a) обеспечивают устойчивость к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) компенсируют ауксотрофные дефициты или (c) предоставляют необходимые питательные элементы, недоступные из комплексной среды, например, ген, кодирующий D-аланинрацемазу для Bacilli.
В одном из примеров схемы селекции используют лекарственное средство для предотвращения роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, обеспечивающий устойчивость к лекарственному средству и, таким образом, переживают режим селекции. В примерах такой доминантной селекции применяют лекарственные средства неомицин, микофеноловая кислота и гигромицин.
Другим примером подходящих селективных маркеров для клетки млекопитающих являются те, которые обеспечивают идентификацию клеток, компетентных относительно захвата нуклеиновой кислоты антитела, например, DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно, гены металлотионеинов приматов, аденозиндезаминаза, орнитиндекарбоксилаза, и т.д.
Например, клетки, трансформированные селективным геном DHFR, вначале идентифицируют путем культивирования всех трансформированных клеток в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином, в которой используется DHFR дикого типа, является клеточная линия яичника китайского хомячка (CHO), дефицитная по активности DHFR (например, ATCC CRL-9096).
Альтернативно, клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или совместно трансформированные последовательностями ДНК, кодирующими полипептид, описанный в настоящем описании, белок DHFR дикого типа и другой селективный маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно подвергать селекции выращиванием в среде, содержащей средство селекции для селективного маркера, такое как антибиотик-аминогликозид, например, канамицин, неомицин или G418. См. патент США № 4965199.
Подходящим селективным геном для применения в дрожжах является ген trpl, представленный в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature 282:39 (1979)). Ген trpl предоставляет селективный маркер для мутантного штамма дрожжей, лишенного способности расти в присутствии триптофана, например, ATCC №44076 или PEP4-1. Jones, Genetics 85: 12 (1977). Наличие повреждения trpl в геноме дрожжевой клетки-хозяина в таком случае обеспечивает эффективное окружение для обнаружения трансформации при росте в отсутствии триптофана. Аналогичным образом, Leu2-дефицитные штаммы дрожжей (ATCC 20,622 или 38,626) дополняют известными плазмидами, несущими ген Leu2.
Кроме того, векторы, полученные из 1,6 мкм кольцевой плазмиды pKD1 можно использовать для трансформации дрожжей Kluyveromyces. Альтернативно, система экспрессии для крупномасштабного получения рекомбинантного химозина телят описана для K. lactis. Van den Berg, Bio/Technology 8: 135 (1990). Стабильные многокопийные векторы экспрессии для секреции зрелого рекомбинантного сывороточного альбумина человека с помощью промышленных штаммов Kluyveromyces также раскрыты. Fleer et al., Bio/Technology 9:968-975 (1991).
Компонент сигнальной последовательности
Полипептиды могут быть получены рекомбинантно не только непосредственно, но также в виде полипептида слияния с гетерологичным полипептидом, который, предпочтительно, является сигнальной последовательностью, или с другим полипептидом, содержащим специфический сайт расщепления на N-конце зрелого полипептида. Гетерологичная сигнальная последовательность может представлять собой последовательность, которая распознается и процессируется (т.е. расщепляется сигнальной пептидазой) в клетке-хозяине. Сигнальная последовательность может быть заменена прокариотической сигнальной последовательностью, выбранной, например, из группы, состоящей из щелочной фосфатазы, пенициллиназы, 1pp, или лидеров термостабильного энтеротоксина II. Для секреции дрожжей нативную сигнальную последовательность можно заменить, например, лидером инвертазы дрожжей, лидером α-фактора (включая лидеры α-фактора Saccharomyces и Kluyveromyces), или лидером щелочной фосфатазы, лидером глюкоамилазы C. albicans или сигнальной последовательностью, описанной в международном патенте WO 90/13646. Для экспрессии в клетке млекопитающего доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, сигнал вируса простого герпеса gD.
Последовательность нуклеиновой кислоты для такой области белка-предшественника лигируют в рамку считывания с последовательностью нуклеиновой кислоты, кодирующей полипептид, описанный в настоящем описании.
Точка начала репликации
Как вектор экспрессии, так и вектор клонирования содержат полинуклеотидную последовательность, которая дает возможность вектору реплицироваться в одной или более выбранных клетках-хозяевах. В целом, в векторах клонирования эта последовательность представляет собой последовательность, которая дает возможность вектору реплицироваться независимо от хромосомной ДНК хозяина, и включает точки начала репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для разнообразных бактерий, дрожжей и вирусов. Точка начала репликации из плазмиды pBR322 подходит для большинства грамотрицательных бактерий, точка начала репликации из плазмиды 2μ подходит для дрожжей, и различные вирусные точки начала репликации (SV40, полиомы, аденовирусы, VSV или BPV) можно использовать для клонирования векторов в клетках млекопитающих. В целом, компонент точки начала репликации не требуется для векторов экспрессии млекопитающих (происхождение из SV40 обычно можно использовать только потому, что он содержит ранний промотор).
Компонент промотора
Векторы экспрессии и клонирующие векторы, как правило, содержат промотор, который распознается организмом хозяина и функционально связан с нуклеиновой кислотой, кодирующей представляющий интерес полипептид. Промоторы, пригодные для использования в прокариотических хозяевах, включают промотор PhoA, промоторные системы β-галактамазы и лактозы, промотор щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. Однако также подходят другие известные промоторы. Промоторы для применения в бактериальных системах также будут содержать последовательность Шайна-Дальгарно (S.D.) функционально связанную с ДНК, кодирующей полипептид.
Соответственно, последовательности для контоля экспрессии представляют собой эукариотические промоторные системы в векторах, способных трансформировать или трансфицировать эукариотические клетки-хозяева (например, клетки COS - такие как клетки COS 7 - или клетки CHO). После того как вектор включен в подходящего хозяина, указанного хозяина содержат в условиях, подходящих для высокого уровня экспрессии нуклеотидных последовательностей, и сбора и очистки перекрестно реагирующих антител.
Известны промоторные последовательности эукариот. По существу, все эукариотические гены имеют AT-богатую область, расположенную приблизительно на 25-30 оснований выше участка инициации транскрипции. Другая последовательность, находящаяся на 70-80 оснований выше старта транскрипции многих генов, представляет собой область CNCAAT, в которой N может представлять собой любой нуклеотид. С 3'-конца большинства эукариотических генов находится последовательность AATAAA, которая может представлять собой сигнал добавления поли-A-хвоста к 3'-концу кодирующей последовательности. Все указанные последовательности можно встраивать в эукариотические векторы экспрессии подходящим образом.
Примеры подходящих промоторных последовательностей при использовании в качестве хозяина дрожжей включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, таких как енолаза, глицеральдегид-3-фосфат дегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкоизомераза и глюкокиназа.
Другие промоторы дрожжей, которые представляют собой индуцируемые промоторы, характеризующиеся дополнительным преимуществом транскрипции, контролируемой условиями роста, являются участками промоторов алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, деструктивные ферменты, связанные с метаболизмом азота, металлотионеин, глицеральдегид-3-фосфатдегидрогеназа, и ферменты, ответственные за использование мальтозы и галактозы. Подходящие векторы и промоторы для применения при экспрессии в дрожжах также описаны в европейском патенте EP 73657. Энхансеры дрожжей также успешно используются с дрожжевыми промоторами.
Транскрипция полипептидов, описанных в настоящем описании, с векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус оспы кур, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и, наиболее предпочтительно, вирус обезьян 40 (SV40), с гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, с промоторов белков теплового шока, при условии, что такие промоторы совместимы с системами клетки-хозяина.
Ранние и поздние промоторы вируса SV40 можно получить в виде рестрикционного фрагмента SV40, который также содержит точку начала репликации вируса SV40. Предранний промотор цитомегаловируса человека можно получить в виде рестрикционного фрагмента HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса папилломы крупного рогатого скота в качестве вектора раскрыта в патенте США №4419446. Модификация такой системы описана в патенте США №4601978. См. также Reyes et al., Nature 297:598-601 (1982), в отношении экспрессии кДНК β-интерферона человека в клетках мыши под контролем промотора тимидинкиназы вируса простого герпеса. Альтернативно, в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
Компонент энхансерного элемента
Транскрипция ДНК, кодирующей полипептид, описанный в настоящем описании, высшими эукариотами, часто увеличивается инсерцией последовательности энхансера в вектор. В настоящее время многие энхансерные последовательности известны из генов млекопитающих (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Однако обычно используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40 с поздней стороны точки начала репликации (bp 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомы с поздней стороны точки начала репликации и усилители аденовируса. См. также Yaniv, Nature 297: 17-18 (1982), где описаны энхансерные элементы для активации эукариотических промоторов. Энхансер может встраиваться в вектор в положении 5' или 3' относительно последовательности, кодирующей полипептид, но, как правило, он расположен в участке с 5'-конца от промотора.
Компонент терминации транскрипции
Векторы экспрессии, используемые в эукариотических клетках-хозяевах (дрожжевые, грибковые, насекомые, растительные, животные, человеческие или содержащие ядра клетки из других многоклеточных организмов), должны также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5'- и, иногда, 3'-концевых нетранслируемых областей эукариотической или вирусной ДНК, или кДНК. Один полезный компонент терминации транскрипции представляет собой область полиаденилирования коровьего гормона роста. См. международный патент WO 94/11026 и раскрытый в настоящем описании вектор экспрессии).
Векторы, содержащие полинуклеотидные последовательности (например, последовательности, кодирующие вариабельные участки тяжелых и/или легких цепей и необязательные последовательности контроля экспрессии), можно трансфицировать в клетку-хозяин хорошо известными способами, которые меняются в зависимости от типа клетки-хозяина. Например, трансфекцию с применением хлорида кальция обычно используют для прокариотических клеток, в то время как обработку фосфатом кальция, электропорацию, липофекцию, биолизис или трансфекцию на основе вирусов можно использовать для других клеток-хозяев. (См. в целом Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Press, 2nd ed., 1989). Другие способы, используемые для трансформации клеток млекопитающих, включают применение полибрена, слияние протопластов, применение липосом, электропорацию и микроинъекцию. Для получения трансгенных животных можно ввести микроиъекцией в оплодотворенные ооциты или можно ввести в геном эмбриональных стволовых клеток, и ядра таких клеток перенести в безъядерные клетки.
Если тяжелые и легкие цепи клонируют в отдельные векторы экспрессии, то векторы совместно трансфицируют для получения экспрессии и сборки интактных иммуноглобулинов. После экспрессии полные антитела, их димеры, отдельные легкие и тяжелые цепи или другие формы иммуноглобулинов можно очистить согласно стандартным методикам, принятым в данной области, которые включают фракционирование сульфатом аммония, очистку на колонках для аффинной хроматографии, хроматографию на колонках, очистку ВЭЖХ, гель-электрофорез и т.п. (см. в целом Scopes, Protein Purification (Springer-Verlag, N.Y., (1982)). По существу очищенные иммуноглобулины со значением гомогенности по меньшей мере приблизительно 90-95% являются предпочтительными, и наиболее предпочтительными со значением гомогенности приблизительно 98-99% или выше, для использования в фармацевтических целях.
(C) Конструкция
Обычно конструкция будет представлять собой вектор экспрессии, обеспечивающий экспрессию в подходящем хозяине полипептида(ов), кодируемого полинуклеотидом. Конструкция может содержать, например, одно или более из перечисленного ниже: промотор, активный в хозяине; одна или более регуляторных последовательностей, таких как энхансеры; точка начала репликации; и маркер, предпочтительно, селективный маркер. Хозяин может являться эукариотическим или прокариотическим хозяином, хотя эукариотические (и в особенности млекопитающие) хозяева могут быть предпочтительными. Выбор подходящих промоторов, очевидно, будет зависеть в известной мере от используемой клетки-хозяина, но может включать промоторы вирусов человека, таких как HSV, SV40, RSV и т.п. Многочисленные промоторы известны специалистам в данной области.
Конструкция может включать полинуклеотид, который кодирует полипептид, содержащий три гипервариабельных петли легкой цепи или три гипервариабельных петли тяжелой цепи. Альтернативно, полинуклеотид может кодировать полипептид, содержащий три гипервариабельных петли тяжелой цепи и три гипервариабельных петли легкой цепи, соединенные подходящим подвижным линкером соответствующей длины.
Другая возможность заключается в том, что отдельная конструкция может содержать полинуклеотид, кодирующий два отдельных полипептида - один, содержащий петли легкой цепи, и еще один, содержащий петли тяжелой цепи. Отдельные полипептиды могут экспрессироваться независимо или могут формировать часть одного общего оперона.
Конструкция может содержать один или более регуляторных элементов, таких как энхансер, точка начала репликации, и один или более маркеров (селективных или других). Конструкция может иметь форму плазмиды, искусственной хромосомы дрожжей, минихромосомы дрожжей или может быть интегрирована в полный геном или в часть генома вируса, в особенности ослабленного вируса или похожего вируса, который не является патогенным для человека.
Конструкцию можно удобным образом включить в состав для безопасного введения индивиду-млекопитающему, предпочтительно, человеку. Как правило, составы будут предоставляться в виде некоторого количества аликвот, каждая аликвота содержит достаточное количество конструкции для эффективной иммунизации по меньшей мере одного обычного взрослого индивида-человека.
Конструкция может предоставляться в жидкой или твердой форме, предпочтительно, в виде лиофилизированного порошка, который обычно восстанавливают стерильной водосодержащей жидкостью перед применением.
Конструкцию можно включить в состав с адъювантом или с другим компонентом, который обладает эффектом усиления иммунного ответа у индивида (например, который измеряют с помощью титра специфического антитела) в ответ на введение конструкции.
(D) Векторы
Термин "вектор" включает векторы экспрессии и тансформирующие векторы, и “челночные” векторы.
Термин "вектор экспрессии" обозначает конструкцию, способную к экспрессии in vivo или in vitro.
Термин "трансформирующий вектор" обозначает конструкцию, которую можно перенести из одного организма в другой организм - который принадлежит к тому же самому виду или к другому виду. Если конструкцию можно перенести из одного вида в другой - например, из плазмиды Escherichia coli в бактерию, например, рода Bacillus, то трансформирующий вектор иногда называют "челночный вектор". Также возможна конструкция, которую можно перенести из плазмиды E. coli в агробактерии, в растение.
Векторы можно трансфомировать в подходящую клетку-хозяина, как описано ниже, для обеспечения экспрессии полипептида. Различные векторы являются общедоступными. Вектор может быть, например, в форме плазмиды, космиды, вирусной частицы или фага. Подходящую последовательность нуклеиновой кислоты можно вставить в вектор различными способами. В целом, ДНК вставляют в подходящий сайт(ы) рестриктазы с применением методик, известных в данной области. При создании конструкций подходящих векторов, содержащих один или более из указанных компонентов, используют стандартные методики сшивания, которые известны специалисту в данной области.
Векторы могут представлять собой, например, плазмидные, вирусные или фаговые векторы, предоставляемые с точкой начала репликации, необязательно с промотором для экспрессии указанного полинуклеотида и необязательно с регулятором промотора. Векторы могут содержать один или более селективных маркерных генов, которые хорошо известны в данной области.
Указанные векторы экспрессии обычно являются реплицируемыми в оганизмах-хозяевах либо в виде эписом, либо в виде составляющей части хромосомной ДНК хозяина.
(E) Клетки-хозяева
Клетка-хозяин может представлять собой бактериальную, дрожжевую или другую грибковую клетку, клетку насекомого, растительную клетку, или, например, клетку млекопитающего.
Тансгенный многоклеточный организм-хозяин, который подвергался генетической обработке, можно использовать для получения полипептида. Организм может быть, например, трансгенным организмом млекопитающего (например, трансгенная линия козы или мыши).
Подходящие прокариоты включают, но без ограничения эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как E. coli. Различные штаммы E. coli являются общедоступными, такие как E. coli K12 штамм MM294 (ATCC 31,446); E. coli X1776 (ATCC 31,537); E. coli штамм W3110 (ATCC 27,325) и K5772 (ATCC 53,635). Другие подходящие прокариотические клетки-хозяева включают Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Указанные примеры являются скорее иллюстративными, чем ограничивающими. Штамм W3110 является особенно предпочтительным хозяином или исходным хозяином, поскольку он является общим штаммом-хозяином для ферментации рекомбинантных полинуклеотидных продуктов. Предпочтительно, клетка-хозяин секретирует минимальные количества протеолитических ферментов. Например, штамм W3110 можно модифицировать, чтобы осуществить генетическую мутацию в генах, кодирующих полипептиды, эндогенные для хозяина, примеры таких хозяев включают E. coli W3110 штамм 1A2, который имеет полный генотип tonA; E. coli W3110 штамм 9E4, который имеет полный генотип tonA ptr3; E. coli W3110 штамм 27C7 (ATCC 55,244), который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompTkan'; E. coli W3110 штамм 37D6, который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kan'; E. coli W3110 штамм 40B4, который является штаммом 37D6 с неканамициновой устойчивой делеционной мутацией degP; и штамм E. coli, содержащий мутантную периплазматическую протеазу. Альтернативно, можно использовать методы клонирования in vitro, например, ПЦР или другие реакции полимеразы нуклеиновой кислоты.
В указанных покариотических хозяевах можно использовать векторы экспрессии, которые обычно будут содержать последовательности для контроля экспрессии, совместимые с клеткой-хозяином (например, точка начала репликации). Кроме того, может быть представлено любое число хорошо известных промоторов, таких как промоторная система лактозы, промоторная система типтофана (trp), промоторная система бета-лактамазы или промоторная система фага лямбда. Промоторы обычно контролируют экспрессию, необязательно с последовательностью оператора, и имеют последовательности сайтов связывания рибосом и т.п. для инициации и завершения транскрипции, и трансляции.
Эукариотические микроорганизмы можно использовать для экспрессии. Эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи, являются подходящими хозяевами при клонировании или экспрессии для векторов, кодирующих полипептид. Saccharomyces cerevisiae является широко используемым низшим эукариотическим микроорганизмом-хозяином. Другие микрооганизмы включают Schizosaccharomyces pombe; хозяев, принадлежащих к роду Kluyveromyces, таких как, например, K. lactis (MW98-8C, CBS683, CBS4574), K. fragilis (ATCC 12,424), K. bulgaricus (ATCC 16,045), K. wickeramii (ATCC 24,178), K. waltii (ATCC 56,500), K. drosophilarum (ATCC 36,906), K. thermotolerans и K. marxianus; yarrowia (EP 402,226); Pichia pastoris; Candida; Trichoderma reesia; Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитчатые грибы, такие как например, Neurospora, Penicillium, Tolypocladium, и хозяева из рода Aspergillus, такие как A. nidulans, и A. niger. Применяются метилотрофные дрожжи, и они включают, но без ограничения дрожжи, способные расти на метанолселективной среде, принадлежащие к родам Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Saccharomyces являются предпочтительным дрожжевым хозяином, при этом подходящие векторы имеют последовательности для контроля экспрессии (например, промоторы), точку начала репликации, терминирующие последовательности и тому подобное, как описано. Типичные промоторы включают промоторы 3-фосфоглицераткиназы и других гликолитических ферментов. Индуцируемые промоторы дрожжей включают, в числе прочих, промоторы алкогольдегидрогеназы, изоцитохрома C, и ферментов, ответственных за использование мальтозы и галактозы.
Помимо микроорганизмов, тканевые клеточные культуры млекопитающих также могут быть использованы для экспрессии и получения полипептидов, которые описаны в настоящем описании, и в ряде они случаев являются предпочтительными (см. Winnacker, From Genes to Clones VCH Publishers, N.Y., N.Y. (1987). Для некотоых вариантов осуществления эукариотические клетки могут быть предпочтительными, в связи с тем, что несколько подходящих клеточных линий-хозяев, способных секретировать гетерологичные полипептиды (например, интактные иммуноглобулины) были разработаны в данной области, и они включают клеточные линии CHO, различные клеточные линии Cos, клетки HeLa, предпочтительно, миеломные клеточные линии или трансформированные B-клетки или гибридомы. В некоторых вариантах осуществления клетка-хозяин млекопитающего является клеткой CHO.
В некоторых вариантах осуществления клетка-хозяин представляет собой клетку-хозяина позвоночного. Примеры подходящих в качестве хозяина клеточных линий млекопитающего представляют собой, такие клетки как линия клеток почек обезьян CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия эмбриональных почечных клеток человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре); клетки почки новорожденного хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (линия CHO или CHO-DP-12); мышиные клетки Сертоли; почечные клетки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); почечные клетки собаки (MDCK, ATCC CCL 34); клетки печени крыс Буффало (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI; клетки MRC 5; клетки FS4; и клеточная линия гепатомы человека (Hep G2).
Альтернативно, последовательности, кодирующие полипептид, можно включить в трансгены для введения в геном трансгенного животного и последующей экспрессии в молоке тансгенного животного. Подходящие трансгены включают кодирующие последовательности легких и/или тяжелых цепей, функционально связанные с помотором или энхансером из специфического гена молочных желез, например, казеина или бета-лактоглобулина.
Альтернативно, продукция антител, описанных в настоящем описании, может быть осуществлена в трансгенных растениях (например, табак, кукуруза, соя и люцерна). Улучшенные векторы для "плантител" (Hendy et al., J. Immunol. Methods 231: 137-146 (1999)) и стратегии выделения в сочетании с увеличением числа тансформируемых агрокультур превращают такие способы в удобное и действенное средство получения рекомбинантных иммуноглобулинов не только для лечения человека и животных, но также и для промышленного применения (например, каталитические антитела). Кроме того, показано, что антитела, произведенные растениями, являются безопасными и эффективными и позволяют избежать применения материалов животного происхождения. Кроме того, различия профилей гликозилирования антител, произведенных растением и клеткой млекопитащюего оказывает незначительный эффект или не влияет на связывание антигена или специфичность. Кроме того, у пациентов, получавших местно внутриротовые компрессы секреторного димерного антитела IgA растительного происхождения, не наблюдали признаков токсичности или HAMA (см. Larrick et al., Res. Immunol. 149:603-608 (1998)).
Клетки-хозяева трансфицируют или трансформируют векторами экспрессии или клонирования, описанными в настоящем описании, для получения полипептида и культивируют в общепринятых питательных средах, модифицированных соответствующим образом для индукции промоторов, селекции трансформантов, или амплификации генов, кодорующих желаемые последовательности. Условия культивирования, такие как среда, температура, pH и т.п. могут быть выбраны специалистом в данной области без проведения излишних экспериментов. В целом, принципы, протоколы, и практические методики максимального увеличения продуктивности клеточных культур можно найти в публикации Mammalian Cell Biotechnology: a Practical Approach M. Butler, ed. (IRL Press, 1991).
Способы трансфекции эукариотических клеток и трансформации прокариотических клеток известны специалисту в данной области, например, с помощью CaCl2, CaPO4, липосомно-опосредованный способ и электропорация. В зависимости от используемой клетки-хозяина, трансформацию выполняют с применением стандартных методик, соответствующих таким клеткам. Обработка кальцием с применением хлорида кальция или электропорация, как правило, используется для прокариот. Инфицирование Agrobacterium tumefaciens используется для трансформации определенных растительных клеток, как описано Shaw et al., Gene 23:315 (1983) и в международном патенте WO 89/05859, опубликованном 29 июня 1989. Для клеток млекопитающих в отсутствие таких клеточных стенок, может быть применен метод преципитации фосфатом кальция по Graham and van der Eb, Virology 52:456-457 (1978). Общие аспекты трансфекций системы клетка-хозяин млекопитающих описаны в патенте США №4399216. Трансформации в дрожжах обычно осуществляют по методу Van Solingen et al., J. Bact. 130:946 (1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA) 76:3829 (1979). Однако могут быть использованы также другие методы введения ДНК в клетки, например, ядерная микроинъекция, электропорация, слияние бактериального протопласта с интактными клетками, или применение поликатионов, например, полибрена, полиорнитина. Для различных методик трансформации клеток млекопитающих см. Keown et al., Methods in Enzymology 185:527-537 (1990) и Mansour et al., Nature 336:348-352 (1988).
Полипептиды, например, антитела, можно получать в бактериях, в особенности, если гликозилирование и Fc-эффекторная функция не являются необходимыми, например, если терапевтическое антитело конъюгируют с цитотоксическим средством (например, токсином) и сам иммуноконъюгат проявляет эффективность в уничтожении опухолевых клеток. Полноразмерные антитела характеризуются более продолжительным времением полужизни в кровотоке. Продукция в E. coli поисходит быстрее и является более рентабельной. Для экспрессии полипептидов в бактериях см., например, патент США №5840523, который описывает область инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции, указанные патенты включены в описание посредством ссылки. После экспрессии антитело выделяют из клеточной суспензии E. coli в растворимой фракции и антитело можно очистить, например, с помощью колонки с протеином А или G в зависимости от изотипа. Заключительную очистку можно осуществить аналогично процессу очистки антитела экспрессированного, например, в клетках CHO.
Подходящие клетки-хозяева для экспрессии гликозилированных полипептидов, описанных в настоящем описании, получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и животных. Идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие чувствительные клетки-хозяева насекомых, полученные из хозяев, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Ряд вирусных штаммов для трансфекции находится в широком доступе, например, вариант L-l Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в качестве вируса в изобретении, в особенности для трансфекции клеток Spodoptera frugiperda.
Клетки-хозяева, используемые для получения полипептида, можно культивировать в разнообразных средах. Имеющиеся в продаже среды, такие как среда Ham F10 (Sigma), минимальная эссенциальная среда (МЕМ), (Sigma), RPMI-1640 (Sigma) и Модифицированная Дульбекко среда Игла (DMEM), (Sigma) подходят для культивирования клеток-хозяев. Любая из этих сред может дополняться по необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальные факторы роста), солями (такими как хлорид и фосфат натрия, кальция и магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как препарат GENTAMYCINTM), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Можно также включить любые другие необходимые добавки в соответствующих концентрациях, которые должны быть известны специалистам в данной области. Условия культивирования, такие как температура, рН и им подобные, представляют собой условия, ранее используемые с клетками-хозяевами, выбранными для экспрессии, и они очевидны для среднего специалиста в данной области.
V. Препараты и способы получения препаратов
В описании раскрыты также препараты и методы получения препаратов, содержащих полипептиды (например, антитела), очищенные способами, описанными в изобретении. Например, очищенный полипептид можно объединить с фармацевтически приемлемым носителем.
Препараты полипептида в некоторых вариантах осуществления можно составить для хранения путем смешивания полипептида, характеризующегося желаемой степень чистоты с произвольными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных препаратов или водных растворов.
"Носители" в данном контексте включают фамацевтически приемлемые носители, вспомогательные вещества или стабилизаторы, которые нетоксичны для клетки или для млекопитающего при воздействии в используемых дозах и концентрациях. Часто физиологически приемлемый носитель является водным pH-забуференным раствором.
Подходящие носители, вспомогательные вещества, или стабилизаторы не токсичны для реципиента в применяемых дозах и концентрациях, и включают буферы, например, фосфатный, цитратный и буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензетония хлорид; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и m-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; комплексообразующие реагенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-протеин) и/или неионогенные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (PEG).
В некоторых вариантах осуществления полипептид в препарате полипептида сохраняет функциональную активность.
Препараты, которые предназначены для введения in vivo, должны быть стерильными. Стерильность без труда достигается фильтрацией через мембраны для стерилизующего фильтрования.
Препараты в настоящем описании также могут содержать более чем одно активное соединение в соответствии с конкретным показанием, в связи с которым проводят лечение, предпочтительно, соединения с дополняющими активностями, которые не оказывают отрицательного влияния друг на друга. Например, помимо полипептида может быть желательным включить в состав дополнительный полипептид (например, антитело). Альтернативно или дополнительно, препарат может также содержать химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибитор роста, антигормональный препарат и/или кардиопротектор. Такие молекулы, соответственно, находятся в комбинации в количествах, эффективных для предназначенной цели. Такие молекулы представлены в комбинации подходящим образом в количествах, в которых они эффективны для предполагаемого использования.
V. Изделия
Полипептиды, очищенные способами, описанными в настоящем описании, и/или препараты, содежащие полипептиды, очищенные способами, описанными в настоящем описании, могут содержаться в изделии. Изделие может включать контейнер содержащий, полипептид и/или препарат полипептида. Предпочтительно, изделие включает: (a) контейнер, содержащий композицию, содежащую полипептид и/или препарат полипептида, описанный в настоящем описании, в контейнере; и (b) листок-вкладыш с инстукциями по введению препарата индивиду.
Изделие включает контейнер и этикетку или листок-вкладыш на контейнере или связанный с контейнером. Подходящие контейнеры включают, например, бутылочки, пузырьки, шприцы и т.д. Контейнеры можно сделать из различных материалов, например, из стекла или пластика. Контейнер содержит или заключает в себя препарат и может иметь стерильное отверстие (например, контейнер может представлять собой мешок с раствором для внутривенного введения или флакон, имеющий крышку, прокалываемую иглой для подкожной инъекции). По меньшей мере один активный реагент в комопзиции является полипептидом. Этикетка или листок-вкладыш указывает применение композиции у индивида с конкретными указаниями относительно дозировок и интервалов приема полипептида или любого другого лекарства, которое предоставляется. Изделие также может включать другие вещества, желательные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы. В некоторых вариантах осуществления контейнер педставляет собой шприц. В некоторых вариантах осуществления шприц также содержится в устройстве для инъекции. В некоторых вариантах осуществления устройство для инъекции представляет собой автоинжектор.
"Листок-вкладыш" используется для объяснения инструкций обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозах, пути введения, противопоказаниях, других терапевтических продуктах, которые можно совмещать с упакованным продуктом, и/или предупреждения относительно применения таких терапевтических продуктов.
Дополнительные детали изобретения проиллюстрированы следующими неограничивающими Примерами. Раскрытия всех ссылок в описании изобретения включены в явной форме посредством ссылки.
ПРИМЕРЫ
Приведенные ниже примеры предназначены исключительно для иллюстрации изобретения и, соответственно, не должны рассмативаться как ограничивающие изобретение каким-либо образом. Последующие примеры и подробное описание представлены в иллюстративных целях, и не для ограничения.
Пимер 1. Отбор катионообменного материала в условиях перегрузки
Данный пример описывает процесс катионообменной хроматографии для очистки рекомбинантного гуманизированного антитела против сосудистого эндотелиального фактора роста (VEGF), рекомбинантного гуманизированного антитела против CD11a, и рекомбинантного химерного антитела против CD20. Структуры антитела против VEGF, антитела против CD11a и антитела против CD20 раскрыты в патентах США № 7169901 и 6703018 и 5736137, соответственно, каждый из которых включен в оисание в качестве ссылки.
Материалы и методы
Способы очистки
Культуральную жидкость, содержащую моноклональное антитело, произведенное клетками яичников китайского хомячка, обрабатывали с помощью центрифуги непрерывного действия для удаления остатков клеток, и затем осветляли фильтрацией через объемные фильтры и 0,2 мкм фильтр. Собранные культуральные жидкости очищали хроматографией с протеином А. Условия загрузки и промывки соответствовали значениям pH в нейтральном диапазоне, и элюирование осуществляли при значениях pH низкого диапазона во время проведения хроматографии. Значения pH и проводимости белковых пулов, полученных с колонки с протеином А, доводили до условий загрузки, используемых при катионообменной хроматографии и затем фильтровали через фильтр 0,22 мкм. При катионообменной хроматографии использовали одинаковые значения pH и проводимости для условий загрузки, уравновешивания и начальной промывки. Отфильтрованные и уравновешенные белковые пулы использовали в качестве продукта для последующей катионообменной хроматографии. Концентрацию продукта (г/л) определяли по величине поглощения при 280 нм. Специфические условия катионообменной хроматографии осуществляли, как указано ниже в разделе Экспериментальные методы и результаты.
Количественные анализы
Количественные анализы во всех примерах осуществляли, как указано ниже.
Количественный анализ концентрации антитела
Концентрацию антитела в собранной культуральной жидкости (HCCF) определяли с использованием анализа ВЭЖХ на колонке Poros с протеином A (Applied Biosystems, Foster City, CA). Колонку использовали при скорости потока 2,0 мл/мин, причем колонку уравновешивали в буфере фосфат натрия/хлорид натрия при pH 6,3 и элюировали раствором уксусная кислота/глицин при pH 2,5. Контролировали значения оптической плотности при 280 нм и использовали площадь пика элюирования для количественного определения концентрации антитела на основании калибровочной кривой. Антитело в очищенных пулах, полученных с помощью аффинной хроматографии с протеином А или ионообменной хроматографии, определяли по оптической плотности при 280 нм (с вычитанием значения оптической плотности при 320 нм для коррекции светорассеяния), с применением спектрофотометра с длиной проточной кюветы 10 мм. Концентрацию антитела рассчитывали как [(поглощение при 280 нм - поглощение при 320 нм) × разведение]/ коэффициент экстинкции.
Количественный анализ CHOP
Использовали два анализа CHOP, твердофазный иммуноферментный анализ (ELISA) и анализ высокоэффективного скрининга для среднемасштабного выявления (Meso Scale Discovery, MSD).
Количественный анализ CHOP методом ELISA
Образцы из выбранных циклов вносили в группу для анализа, который выполняли стандартным и утвержденным методом ELISA для количественного определения уровней CHOP. Афинно очищенные козьи антитела против CHOP иммобилизовали в лунках микротитрационного планшета. Разведения образцов, содержащих CHOP, стандарты, и контроли инкубировали в лунках с последующей инкубацией с козьими антителами против CHOP, конъюгированными с пероксидазой хрена. Ферментную активность пероксидазы хрена обнаруживали с помощью дихлоргидрата o-фенилендиамина. Производили количественный анализ CHOP путем определения поглощения при 492 нм в устройстве для считывания микротитрационных планшетов. Компьютерную программу аппроксимации кривой по точкам использовали для построения стандартной кривой и автоматического расчета концентрации вещества в образце. Диапазон результатов количественного анализа теста ELISA обычно составляет 5 нг/мл - 320 нг/мл, и результаты стандартизировали по ppm для сравнения пулов.
Количественный анализ CHOP методом MSD
Образцы из выбранных циклов вносили в группу для анализа, который осуществляли стандартным и утвержденным методом MSD для количественного определения уровней CHOP. Афинно очищенные козьи антитела против CHOP иммобилизовали в лунках микротитрационного планшета. Разведения образцов, содержащих CHOP, стандарты и контроли, инкубировали в лунках, с последующей инкубацией с козьими антителами против CHOP, конъюгированными с MSD SULFO-TAG NHS-ESTER. NHS-ESTER имеет аминореактивный линкер, сложный эфир N-гидроксисукцинимида, который легко соединяется с первичными аминогруппами белков. Концентрацию CHOP измеряли после добавления буфера для считывания MSD и подведения электричества ко дну планшета. Меченые детекторные антитела взаимодействовали с буфером для считывания, содержащим трипропиламин, и испускали свет после электрохимической стимуляции, вызываемой на поверхности электродов микропланшетов Multi-Array при 620 нм, который измеряли с помощью камеры CCD. Затем получали значения концентрации методом обратной регрессии на стандартной кривой. Диапазон результатов данного анализа от 5 нг/мл до 1530 нг/мл, и результаты стандартизировали по ppm для сравнения пулов.
Количественный анализ протеина А
Измеряли смытый протеин А в образцах, где хроматографию с протеином А применяли для извлечения. Уровень протеина А определяли с помощью “сэндвич”-метода ELISA с протеином А. Антитела цыплят против стафилококкового протеина А иммобилизовали в лунках микротитрационного планшета. Процедура подготовки образцов включала разведение образцов и затем диссоциацию комплекса протеин A/IgG с использованием вспомогательного микроволнового нагревания в качестве подготовительной стадии перед применением образцов в “сэндвич”-методе ELISA. Протеин A, если представлен в образце, связывал антитело пленки. Связанный протеин A обнаруживали с помощью пероксидазы хрена, конъюгированной с антителами против протеина А. Ферментативную активность пероксидазы хрена определяли количественно с 2-компонентным раствором субстрата TMB, который продуцировал колориметрический сигнал.
Количественный анализ гентамицина
Использовали конкурентный метод ELISA для определения концентраций гентамицина во всех пулах. Козьи поликлональные антитела к гентамицину-БСА иммобилизовали в лунках микротитационного планшета. Гентамицин конкурировал с биотинилированным гентамицином за связывание с антителами. Количество связанного меченного биотином гентамицина определяли добавлением пероксидазы хрена-стрептавидина и субстрата o-фенилендиамина. Готовили серийные разведения образцов в разбавителе для проб, так чтобы считываемые показания оптической плотности находились в измеряемом диапазоне теста (0,37-90 нг/мл).
Эксклюзионная хроматография
Гетерогенность размеров моноклональных антител определяли с помощью количественного анализа высокоэффективной эксклюзионной хроматографии. Использовали колонку TSK-GEL G3000SWXL (7,8 мм x 300 мм, Tosoh Bioscience, Montgomeryville, PA) для разделения мономерных и более высокомолекулярных частиц (HMW). Колонку использовали при скорости потока 0,3 мл/мин с применением подвижной фазы 200 мМ фосфата калия, 250 мМ хлорида калия, pH 6,2. В каждую пробу вводили 20 мкг антитела. Оптическую плотность при 280 нм использовали для контроля разделения мономера и HMW. Процентные содержания мономера и HMW рассчитывали, исходя из площади их пиков.
Количественный анализ ДНК
В тесте ПЦР, осуществляемой методом TaqMan, для анализа ДНК клеток CHO используется ПЦР в режиме реального времени для обнаружения и количественного определения ДНК CHO в образцах продукта. ДНК образцов и контроли вначале экстрагируют с применением набора Virus Biorobot kit, Qiagen. Экстрагированные образцы, контроли, и стандарт ДНК подвергают полимеразной цепной реакции (PCR) TaqMan с применением праймеров ПЦР и зонда в 96-луночном планшете с системой детектирования последовательности производства ABI. Праймеры определяются по сегменту из 110 пар оснований из повторяющейся последовательности ДНК генома Cricetulus griseus. Зонд помечен флуоресцентным красителем-репортером на 5'-конце и тушителем флуоресценции на 3'-конце. В исходном состоянии зонда спектр излучения репортера подавляеся тушителем. Полимераза за счет своей 5'-нуклеазной активности гидролизует зонд, и репортер высвобождается, что приводит к увеличению флуоресценции. Детектор последовательности определяет количество амплифицированного продукта в виде прямой зависимости от увеличения флуоресценции, непрерывно измеряемой во время амплификации ДНК. Число циклов, при котором ДНК амплифицируется после прохождения порогового значения (CT), рассчитывают для стандартной кривой. Строят стандартную кривую в диапазоне 1 пг/мл - 10000 пг/мл, которую используют для определения количества ДНК в образцах.
Экспериментальные методы и результаты
Очистка антитела против CD11a
Три типа катионообменного материала оценивали в данном исследовании: смола, мембрана и монолит. Способы очистки с помощью катионообменной хроматографии в условиях перегрузки антитела против CD11a с применением указанных трех катионообменных материалов оценивали по показателям способа (например, удаление примесей, постадийный выход и качество продукта).
Хроматограммы для трех типов катионообменных материалов, смолы (Poros HS50 колонка (0,66 см внутренний диаметр ("i.d.") × 5 см, 15,1 CV/час) и колонка SP Sepharose FF ("SPSFF") (0,66 см i.d. × 4,8 см, 15,7 CV/час)), монолита (SO3 Monolith (0,34 мл, 353 MV/час)), и мембраны (Mustang S (0,18 мл, 333 MV/час)), с загрузкой продуктом до 1000 г/л CV (объем колонки) или MV (объем мембраны или монолита), получали при pH 5,5 и 3 мСм/см. См. фигуру 1.
Эффективность трех типов катионообменных материалов, смолы (колонка Poros HS50 (15,1 CV/час или 75 см/час) и колонка SPSFF (15,7 CV/час или 75 см/час)), мембраны (Mustang S (333 MV/час)), и монолита (SO3 Monolith (353 MV/час)) с изменением количества нагружаемого продукта до 1000 г/л CV или MV оценивали при pH 5,5 и 3 мСм/см. Как показано на фигуре 2, получали извлечение свыше 93% мономера антитела против CD11a на Mustang S, Monolith SO3, и Poros HS50 и приблизительно 88% извлечение мономера антитела против CD11a на SPSFF.
Способность трех типов катионообменных материалов, смолы (колонка Poros HS50 (15,1 CV/час или 75 см/час) и колонка SPSFF (15,7 CV/час или 75 см/час)), мембраны (Mustang S (333 MV/час)) и монолита (SO3 Monolith (353 MV/час)) с изменением количества нагружаемого продукта до 1000 г/л CV или MV удалять CHOP, оценивали при pH 5,5 и 3 мСм/см. Как показано на фигуре 2, монолитный материал, SO3 Monolith, лучше удалял CHOP, чем два других катионообменных материалов. Мембрана (Mustang S) и колонка Poros HS50 сходным образом и лучше, чем колонка SPSFF удаляли CHOP. См. фигуру 2.
Способность трех типов катионообменных материалов, смолы (колонка Poros HS50 (15,1 CV/час или 75 см/час) и колонка SPSFF (15,7 CV/час или 75 см/час)), мембраны (Mustang S (333 MV/час)), и монолита (SO3 Monolith (353 MV/час)) при изменении количества нагружаемого продукта до 1000 г/л CV или MV, удалять HMW оценивали при pH 5,5 и 3 мСм/см. Как показано на фигуре 3, катионообменный материал смола, Poros HS50, являлся наиболее эффективным в удалении HMW, с последующим SPSFF. Кроме того, Mustang S лучше, чем монолит SO3 удалял HMW. См. фигуру 3.
Способность катионообменных материалов, смолы (колонка Poros HS50 и колонка SPSFF), мембраны (Mustang S) и монолита (SO3 Monolith) с изменением количества нагружаемого продукта до 1000 г/л CV или MV удалять HMW1 и HMW2 также оценивали при pH 5,5 и 3 мСм/см. Как показано на фигуре 4, Poros HS50 и Mustang S более эффективно удаляли HMW2.
Способность Poros HS50 (15,1 CV/час или 75 см/час) удалять HMW1 и HMW2 с продуктом, нагруженным в разном количестве, вплоть до 1000 мг/мл CV, проверяли при pH 5,5 и 3 мСм/см. Количество HMW составляло 6,26% и 60% в загрузке и в элюированном пуле, соответственно. Как показано на фигуре 5, колонка Poros HS50 эффективно удаляла HMW1 и HMW2.
Способность SPSFF удалять HMW оценивали с продуктом, нагруженным в разном количестве, вплоть 800 г/л CV при pH 5,5 и 3 мСм/см. На фигуре 6 представлены хроматограммы и данные по удалению HMW.
Данные по эффективности трех типов катионообменных материалов, смолы (колонка Poros HS50 и колонка SPSFF), мембраны (Mustang S) и монолита (SO3 Monolith) представлены в обобщенном виде в таблице 2. В промышленном способе против CD11a использовали режим “связывание-элюирование” и плотность загрузки 15-44 мг/мл CV. Как показано в таблице 2, SO3 Monolith наиболее эффективно удалял CHOP, и смола Poros HS наиболее эффективно удаляла HMW. В способе с применением Poros HS в условиях перегрузки и в промышленном способе с применением SPSFF получали аналогичные результаты по удалению HMW и CHOP. См. таблицу 2.
Очистка антитела против VEGF
Три типа катионообменных материалов оценивали в данном исследовании: смолу, мембрану и монолит. Способы катионообменной очистки в условиях перегрузки антитела против VEGF с применением указанных трех катионообменных материалов оценивали по показателям способа (например, удаление примесей, постадийный выход и качество продукта).
Хроматограммы для трех типов катионообменных материалов, смолы (колонка Poros HS50 (0,66 см i.d. × 5,4 см, 18,5 CV/час) и колонка SPSFF (0,66 см i.d. × 5,5 см, 18,5 CV/час)), монолита (SO3 Monolith (0,34 мл, 176 MV/час)) и мембраны (Mustang S (0,35 мл, 171 MV/час)), нагруженных продуктом, приблизительно 1000 г/л CV или MV, получали при pH 5,5 и 5 мСм/см. См. фигуру 7.
Эффективность трех типов катионообменных материалов, смолы (колонка Poros HS50 (1,8 мл) и колонка SPSFF (1,8 мл)), мембраны (Mustang S (0,35 мл)), и монолита (SO3 Monolith (0,34 мл)), с изменяющимся количеством нагружаемого продукта 0-1000 г/л CV или MV оценивали при pH 5,5 и 5 мСм/см. При мембранной и монолитной хроматографии, используемая скорость потока составляла 100-400 MV/час. Для смол используемая скорость потока составляла 50-200 см/час (9-36 CV/час). Извлечение мономерного антитела против VEGF составляло свыше 90% при использовании всех катионообменных материалов, как показано на фигуре 8.
Способность трех типов катионообменных материалов, смолы (колонка Poros HS50 (18 CV/час и 1,7 мл) и колонка SPSFF (18 CV/час и 1,7 мл)), мембраны (Mustang S (171 MV/час) и Sartobind S (120 MV/час)), и монолита (SO3 Monolith (176 MV/час)), с изменяющимся количеством нагружаемого продукта от 0 до 1000 г/л CV или MV удалять CHOP оценивали при pH 5,5 и 5 мСм/см. Как показано на фигуре 9, монолит, SO3 Monolith, лучше удалял CHOP, чем два других катионообменных материала. Катионообменные материалы, смола (колонка Poros HS50 и колонка SPSFF) и мембраны (Mustang S и Sartobind S) имели сходные показатели по удалению CHOP. См. фигуру 9.
Способность трех типов катионообменных материалов, смолы (колонка Poros HS50 (18 CV/час) и колонка SPSFF (18 CV/час)), мембраны (Mustang S (171 CV/час)), и монолита (SO3 Monolith (176 CV/час)), с изменяющимся количеством нагружаемого продукта от 0 до 1000 г/л CV или MV удалять ДНК оценивали при pH 5,5 и 5 мСм/см. Катионообменный материал смола Poros HS50 наиболее эффективно удалял ДНК. См. фигуру 10.
Способность трех типов катионообменных материалов, смолы (Колонка Poros HS50 (18 CV/час), колонка Poros HS50 (18 CV/час) с 1:2 разведенным мономерным антителом ("Mab"), и колонка SPSFF (18 CV/час)), мембраны (Mustang S (176 MV/час) и Sartobind S (120 MV/час)), и монолита (SO3 Monolith (171 MV/час)), с изменяющимся количеством нагружаемого продукта от 0 до 1000 г/л CV или MV удалять HMW оценивали при pH 5,5 и 5 мСм/см. Как показано на фигуре 11, наиболее эффективным катионообменным материалом при удалении HMW, являлась смола на колонке Poros HS50, за ней следовала смола на колонке SPSFF. Кроме того, катионообменный материал Mustang S лучше, чем SO3 monolith удалял HMW. См. фигуру 11.
Способность катионообменных материалов, смолы (колонка Poros HS50 (18 CV/час), колонка Poros HS50 (18 CV/час) с разведенным Mab, и колонка SPSFF (18 CV/час)), мембраны (Mustang S (176 MV/час)) и монолита (SO3 Monolith (171 MV/час)) с изменяющимся количеством нагружаемого продукта от 0 до 1000 г/л CV или MV удалять HMW1 и HMW2 также оценивали при pH 5,5 и 5 мСм/см. Как показано на фигуре 12, удаление HMW2, в целом, происходило более эффективно, чем удаление HMW1. См. фигуру 12.
Оценивали емкость динамического связывания ("DBC") трех типов катионообменных материалов, смолы (колонка SPSFF (1,88 мл) и колонка Poros HS50 (1,85 мл)), мембраны (Mustang S coin (0,35 мл) и Mustang S (Acrodisc 0,18 мл)) и монолита (SO3 Monolith disk (0,34 мл - 1 диск) и SO3 Monolith disk (0,68 мл - 2 диска)) при pH 5,5 и 5 мСм/см с применением нескольких скоростей потока. Как описано и показано в таблице 3, катионообменная смола характеризовалась лучшими емкостями связывания Mab, чем мембрана и монолит. В целом, емкость связывания Mab катионообменных материалов коррелировала с их способностью к удалению HMW. См. фигуру 11 и таблицу 3. Колонка Poros HS50 показала лучшее значение переноса вещества, чем SPSFF. См. таблицу 3. Для Poros HS50 наблюдали более высокое значение DBC, чем для мембраны Mustang S и монолита SO3. См. таблицу 3.
Очистка антитела Против CD20
Способность различных типов катионообменной смолы (Poros HS50, SE HiCap, SPSFF, SPXL и Capto S) удалять HMW оценивали с применением 96-луночных планшетов для высокоэффективного скрининга и режима связывания партии, с продуктом, загруженным в количестве 70-90 мг/мл смолы при различных значениях pH и концентрациях солей для очистки антитела против CD20. Удаление HMW оценивали по значению % HMW, связанного на смоле. Как показано на фигуре 13, смола Poros HS50 наиболее эффективно удаляла HMW, после этого, второй по эффективности являлась SE HiCap. Затем, SPSFF лучше чем SPXL удаляла HMW. См. фигуру 13. Кроме того, SPXL и Capto S удаляли HMW со сходними результатами. См. фигуру 13.
Способность различных типов смолы (Poros HS50, SE HiCap, SPSFF, SPXL и Capto S) удалять CHOP оценивали с применением 96-луночных планшетов для высокоэффективного скрининга, с загрузкой продуктом 70-90 мг/мл смолы при различных значениях pH и концентрациях солей. Удаление CHOP оценивали по значению % CHOP, связанного на смоле. Как показано на фигуре 14, Смола Poros HS50 наиболее эффективно удаляла CHOP, после этого, второй по эффективности являлась SE HiCap. Кроме того, смола SPSFF лучше, чем смола SPXL удаляла CHOP. См. фигуру 14. Кроме того, смола SPXL лучше чем Capto S удаляла CHOP. См. фигуру 14.
Способность смол Poros HS50 и Capto S удалять HMW также проверяли с применением колоночной хроматографии с изменением количества нагружаемого продукта при 5 мСм/см и различных значениях pH (Poros HS50 при pH 5,5 и pH 6, и Capto S при pH 5 и pH 5,5). Как показано на фигуре 15, смола Poros HS50 лучше, чем Capto S связывала HMW. Суммарное значение HMW % было ниже в собранных пулах продукта, полученных в результате циклов на смоле Poros HS50, чем в собранных пулах продукта, полученных в результате циклов на смоле Capto S. См. фигуру 16.
Способность смол Poros HS50 и Capto S удалять CHOP также оценивали с применением колоночной хроматографии с изменяющимся количеством нагружаемого продукта при 5 мСм/см и различных значениях pH (Poros HS50 при pH 5,5 и pH 6, и Capto S при pH 5 и pH 5,5). Как показано на фигуре 17, CHOP лучше связывался на Poros HS50, чем на Capto S. Суммарное количество CHOP было ниже в собранных пулах продукта, полученных в результате циклов на смоле Poros HS50, чем в собранных пулах продукта, полученных в результате циклов на смоле Capto S. См. фигуру 18.
Пример 2. Катионообменная хроматография в условиях перегрузки с применением различных условий очистки
Данный пример описывает процесс катионообменной хроматографии в условиях перегрузки для очистки антител.
Материалы и методы
Способы очистки
Отфильтрованные и уравновешенные белковые пулы получали, как описано в Примере 1 и применяли в качестве продукта в катионообменной хроматографии.
Колонки заполняли смолой Poros HS50 или SPSFF или Capto S, соответственно. Размеры колонки составляли 0,66 см i.d. при 5 - 15 см высоте слоя. Значения используемой скорости потока составляли 50-200 см в час (9-36 объемов колонки (CV) в час). Процесс хроматографии постоянно отслеживали при 280 нм и осуществляли при комнатной температуре.
Для предотвращения вытеснения антитела из хроматографической смолы, например, оптимизированная проводимость загрузки составляет 4-6 мСм/см при pH 5-6, при которой можно достичь максимальной динамической емкости связывания. Использовали проводимость 5-6 мСм/см и pH 5,0-5,5 в услових загрузки на катионообменных колонках в исследовании первой группы.
Продукт, который определяли при 280 нм, нагружали до 1000 г/л объема колонки во время каждого цикла. Стадию промывки с применением равновесного буфера матрицы применяли непосредственно после стадии загрузки до тех пор, пока кривая регистрации UV не возвращалась к исходным значениям. Стадию элюирования с более концентрированным солевым раствором применяли, чтобы освободить связанные частицы из матрицы во время каждого хроматографического цикла. Связанные частицы содержали нежелательные частицы HMW, ДНК, CHOP и другие загрязняющие вещества. Колонки очищали раствором 0,5N NaOH после каждого цикла и хранили в растворе 0,1N NaOH.
Во время стадий загрузки и промывки фильтрат из каждого цикла разделяли на фракции и собирали в конические пробирки подходящего размера. Концентрацию белка в каждой фракции измеряли с применением спектрофотометра UV-Vis. Содержание примесей таких как белок клетки-хозяина, ДНК, смытый протеин А и гентамицин определяли в выбранных фракциях, чтобы полностью охватить стадии загрузки и промывки, как обсуждалось выше.
Экспериментальные методы и результаты
Очистка антитела против VEGF с использованием SPSFF
Хроматограммы SPSFF (0,66 см id × 5,5 см высота слоя) с нагружаемым количеством продукта до 1000 мг/мл CV получали при различных скоростях потока (9 CV/час, 8 CV/час и 36 CV/час) при pH 5,5, 5 мСм/см в NaAC. См. фигуру 19.
Эффекты различных скоростей потока (9 CV/час, 18 CV/час и 36 CV/час) на удаление CHOP, ДНК и HMW для смолы SPSFF с изменением количества нагружаемого продукта до 1000 г/л CV оценивали при pH 5,5 и 5 мСм/см. Как показано на фигуре 20, тестируемые скорости потока не влияли существенно на удаление CHOP. Однако, как показано на фигурах 21 и 22, тестируемые скорости потока влияли на удаление ДНК и HMW.
Очистка антитела против VEGF с применением Poros HS50
Эффекты различных скоростей потока (18 CV/час и 36 CV/час) на удаление CHOP, ДНК и HMW для Poros HS50 с изменением количества нагружаемого продукта до 1000 г/л CV оценивали при pH 5,5 и 5 мСм/см. Как показано на фигуре 23, тестиуемые скорости потока не влияли существенно на удаление HMW, CHOP и ДНК.
Способность Poros HS50 связывать Mab оценивали при различных значениях проводимости загрузки (3 мСм/см, 5 мСм/см, 8 мСм/см, 13 мСм/см, и 18 мСм/см) при pH 5,5 и 18 CV/час с применением разного количества нагружаемого продукта до 1000 мг/мл CV. Как показано на фигуре 24, более высокое значение проводимости в загрузке соответствовали более низкой емкости связывания Mab.
Хроматограммы Poros HS50 получали при различных значениях проводимости загрузки (5 мСм/см, 8 мСм/см, 13 мСм/см, и 18 мСм/см) при pH 5,5. P1 показывает пик элюирования с 350 мМ NaAC и P2 показывает пик очистки с 0,5 N NaOH. См. фигуру 25. Как показано на фигуре 25, наблюдали типичное связывание с Poros HS50 при значениях проводимости в загрузке 5 мСм/см и 8 мСм/см. Кроме того, частичное связывание происходило при 13 мСм/см. См. фигуру 25. При 18 мСм/см, наблюдали типичный непрерывный поток. См. фигуру 25.
Способность Poros HS50 удалять CHOP проверяли при pH 5,5 в различных условиях проводимости (3 мСм/см, 5 мСм/см, 5 мСм/см и при загрузке ~2 кратно разведенным CHOP, 8 мСм/см, 13 мСм/см, и 18 мСм/см) с изменением количества нагружаемого продукта до 1000 мг/мл CV при 18 CV/час. Как показано на фигуре 26, удаление CHOP происходило более эффективно при более низких значениях проводимости в загрузке.
Способность Poros HS50 удалять HMW оценивали при pH 5,5 при различных значениях проводимости загрузки (3 мСм/см, 5 мСм/см, 5 мСм/см и ~2 кратное разведение Mab при 2,37 мг/мл, 8 мСм/см, 13 мСм/см, и 18 мСм/см) с изменением количества нагружаемого продукта до 1000 г/л CV и 18 CV/час. Как показано на фигуре 27, при 3 мСм/см меньшее количество HMW связывалось с Poros HS50 в начале процесса. При 13 мСм/см большее количество HMW связывалось с Poros HS50 в начале процесса и количество связанного HMW снижалось с течением времени. См. фигуру 27.
Способность Poros HS50 удалять ДНК при изменении количества нагружаемого продукта до 1000 мг/мл CV оценивали при различных значениях проводимости загрузки и скоростях потока (3 мСм/см и 18 CV/час, 5 мСм/см и 18 CV/час, 5 мСм/см и 36 CV/час, 8 мСм/см и 18 CV/час, 13 мСм/см и 18 CV/час, и 18 мСм/см и 18 CV/час) при pH 5,5. Количества ДНК в загрузке составляли приблизительно 1000 пг/мг, 1000 пг/мг, 7000 пг/мг, 16821 пг/мг и 18566 пг/мг в условиях значений проводимости загрузки 3 мСм/см, 5 мСм/см, 8 мСм/см, 13 мСм/см, и 18 мСм/см, соответственно. Как показано на фигурах 28 (A) и (B), Poros HS50 связывала ДНК при тестируемых значениях проводимости загрузки.
Способность Poros HS50 связывать ДНК при загрузке продуктом 300 мг/мл CV также оценивали при pH 5,5 с градиентным элюированием. Как показано на фигуре 29, ДНК связывалась на колонке при pH 5,5 и 5 мСм/см и элюировалась с колонки во время элюирования в линейном градиенте концентрации соли.
Способность Poros HS50 (1,88 мл смолы) удалять гентамицин оценивали при pH 5,5, 5 мСм/см, и 18 CV/час с изменением количества нагружаемого продукта приблизительно до 990 г/л CV. Как показано в таблице 4, колонка Poros HS50 удаляла гентамицин при работе в условиях перегрузки.
Способность Poros HS50 (1,88 мл смолы) удалять протеин A оценивали при pH 5,5, 5 мСм/см, и 18 CV/час с изменением количества нагружаемого продукта приблизительно до 990 г/л CV. Как показано в таблице 5, смола Poros HS50 могла удалять смытый протеин А в условиях перегрузки. Протеин A выходил из колонки при значениях 727-860 г, собранных/л CV. См. таблицу 5.
Способность Poros HS50 удалять HMW, CHOP и ДНК при различных значениях высоты слоя в колонке (4,6 см высота слоя и 14,2 см высота слоя) оценивали при pH 5,5, 5 мСм/см, и 18 CV/час с изменением количества нагружаемого продукта до 1000 мг/мл CV. Как показано на фигуре 30, тестируемые значения высоты слоя в колонке (4,6 см и 14,2 см) не оказывали существенных эффектов на удаление HMW, CHOP или ДНК. Кроме того, при значениях высоты слоя в колонке 4,6 см и 14,2 см время удержания (3 минуты) оставалось одинаковым.
Распределение заряженных вариантов во фракциях, элюированных с колонки Poros HS50 (1,88 мл), оценивали при pH 5,5, 5 мСм/см, и 18 CV/час, с изменяющимся количеством нагружаемого продукта до 1000 г/л CV. Основные варианты обрабатывали CPB (карбоксипептидаза B) перед проведением анализа заряженных вариантов. Как показано в таблице 6, распределение заряженных вариантов (кислых и основных вариантов) и главные варианты в конечном пуле по существу не изменялись. Наблюдали более высокое процентное содержание кислого варианта в фильтрате при небольшом нагружаемом количестве. См. таблицу 6. Смола Poros HS50 могла связываться с каким-либо основным вариантом. См. таблицу 6.
Пример 3. Очистка полипептидов с использованием хроматографии на носителях смешанного типа
Данный пример описывает процесс хроматографии на носителях смешанного типа для очистки антитела против VEGF, антитела против CD11a, и антитела против CD20.
Материалы и способы
Способы очистки
Отфильтрованные и уравновешенные белковые пулы получали, как описано в Примере 1 для последующего проведения хроматографии на носителях смешанного типа. Пулы доводили до значений pH 5-8,5 с помощью 1,5 M основания Tris или 2 N ледяной уксусной кислоты. Концентрации хлорида устанавливали от 0 мМ до 250 мМ добавлением 3M NaCl. Конкретные условия, в которых проводили хроматографию на носителях смешанного типа, указаны ниже, в разделе “Экспериментальные методы и результаты”.
Экспериментальные методы и результаты
Эффективность смолы смешанного типа, например, Capto Adhere, оценивали с применением нескольких антител, таких как антитело против VEGF (70 мг/мл смолы), антитело против CD11a (90 мг/мл смолы) и антитело против CD20 (90 мг/мл смолы) при различных значениях pH и в разных солевых условиях в эксперименте высокопроизводительного скрининга. Количество CHOP (ppm) и % HMW в отфильтрованных и уравновешенных пулах, очищенных от протеина А, составляло 497 и 7,6 (для антитела против VEGF), 820 и 6,4 (для антитела против CD11a), и 4720 и 3,5 (для антитела против CD20). На фигурах 31, 32, и 33 представлены результаты по извлечению Mab, связыванию HMW на смоле, и связыванию CHOP на смоле, соответственно, при различных значениях pH и в разных солевых условиях. Как показано на фигуре 31, увеличение pH и проводимости повышало связывание Mab со смолой Capto Adhere в случае антитела против VEGF и антитела против CD20. Значение pH оказывало значительные эффекты на способность Capto Adhere связывать антитело против CD11a. См. фигуру 31. Повышение pH увеличивало процентное значение частиц HMW, связанных со смолой Capto Adhere в случае антитела против VEGF, антитела против CD11a, и антитела против CD20. См. фигуру 32. Значение pH оказывало более значительные эффекты, чем проводимость на способность Capto Adhere связывать HMW. См. фигуру 32. Смола Capto Adhere связывала CHOP в широком диапазоне значений pH и проводимости. Как показано на фигуре 33, на большинстве изображений в изолиниях свыше 80% CHOP связывалось со смолой в случае антитела против VEGF, антитела против CD11a и антитела против CD20.
Показатели эффективности Capto Adhere в эксперименте проведения высокопроизводительного скрининга и в колоночной хроматографии для очистки антитела против VEGF представлены в таблице 7. В целом, данные, полученные в эксперименте проведения высокопроизводительного скрининга, соответствовали результатам, полученным в эксперименте с колоночной хроматографией.
Способность Capto Adhere удалять CHOP и HMW также поверяли в колоночной хроматографии при очистке против CD11a при pH 5,5 и 5 мСм/см. Смола Capto Adhere способна уменьшать уровни CHOP ниже 20 ppm, если продукт нагружали в количестве приблизительно 700 мг/мл смолы; однако Capto Adhere не способна уменьшать % HMW. Данные не представлены.
Пример 4. Очистка антитела против CD11a с применением комбинации катионообменной хроматографии в условиях перегрузки и стандартной анионообменной хроматографии
Данный пример описывает процесс с использованием комбинации катионообменной хроматографии в условиях перегрузки и стандартной анионообменной хроматографии для очистки рекомбинантного гуманизированного антитела CD11a.
Материалы и методы
Культуральную жидкость, содержащую моноклональное антитело, произведенное клетками яичников китайского хомячка, обрабатывали с помощью центрифуги непрерывного действия для удаления клеточных остатков, и затем осветляли фильтацией через объемные фильтры и 0,2 мкм фильтр. Антитело против CD11a очищали a) экспериментальным проведением катионного обмена в условиях перегрузки: (i) очистка с применением протеина А (Prosep vA), (ii) очистка катионным обменом (CEX) (Poros HS50 в режиме перегрузки), и (ii) анионный обмен (AEX) (QSFF), или (b) помышленным способом (i) очистка с применением протеина А (Prosep vA), (ii) CEX (SPSFF), и (ii) AEX (QSFF). Условия проведения хроматографии перечислены в таблице 8.
Экспериментальные методы и результаты
Эффективность процесса, совмещающего CEX в условиях перегрузки с AEX, оценивали по удалению CHOP и выделению Mab. Результаты обобщены в таблице 9.
Способность Poros HS50 и QSFF удалять HMW, CHOP, гентамицин, ДНК, и смытый протеин А оценивали в двух различных условиях: (a) Poros HS50 при pH 5,5, 3,5 мСм/см и QSFF при pH 8,0, 3,5 мСм/см; и (b) Poros HS50 при pH 5,5, 5,0 мСм/см и QSFF при pH 8,0, 5,0 мСм/см. Результаты для условий (a) и (b) обобщены в таблице 10 и в таблице 11, соответственно. Гентамицин, ДНК, и смытый протеин А удаляли до значений ниже пределов обнаружения. Удаление CHOP лучше происходило в условиях (a), чем в условиях (b). Удаление HMW лучше происходило в условиях (b), чем в условиях (a). Выход продукта составлял по меньшей мере 90% для каждой стадии хроматографии.
Пример 5. Очистка с применением комбинации катионообменной хроматографии и хроматографии на носителях смешанного типа в условиях перегрузки
Данный пример описывает процесс применения комбинации катионообменной хроматографии в условиях перегрузки и хроматографии на носителях смешанного типа для очистки антитела против CD11a и антитела против CD20.
Материалы и методы
Отфильтрованные и уравновешенные белковые пулы получали, как описано в Примере 1 для последующей катионообменной хроматографии и/или хроматографии на носителях смешанного типа. Конкретные условия катионообменной хроматографии и/или хроматографии на носителях смешанного типа выполняли, как указано в разделе Экспериментальные методы и результаты, ниже.
Экспериментальные методы и результаты
Очистка антитела против CD11a
Эксперимент 1. Отфильтрованный и уравновешенный продукт, описанный выше, очищали с применением колонки Poros HS50 в условиях перегрузки и колонки Capto Adhere приблизительно с ~600 г/л CV нагружаемого продукта для Poros HS50 и приблизительно с ~100 г/л CV для Capto Adhere при pH 5,5, 5 мСм/см, и 100 см/час. Эксперимент проводили в двух различных последовательностях: a) последовательность A: (i) колонка Poros HS50 (0,66 см×5 см) и (ii) колонка Capto Adhere (1,5 см×20 см) или b) последовательность B (i) колонка Capto Adhere (0,66 см × 20 см) и (ii) колонка Poros HS50 (0,66 см × 5 см). В последовательности A плотности загрузки для колонки Poros HS50 и колонки Capto Adhere составляли 600 мг/мл смолы и 106 мг/мл смолы, соответственно. В последовательности B плотности загрузки для колонки Capto Adhere и колонки Poros HS50 составляли 100 мг/мл смолы и 569 мг/мл смолы, соответственно.
Результаты по удалению примесей обобщены в таблице 12 для последовательности A и в таблице 13 для последовательности B. Выходы по извлекаемому продукту и результаты по удалению примесей в случае обеих методик соответствовали требованиям к чистоте и выходу продукта коммерческого процесса.
Эксперимент 2. Отфильтрованный и уравновешенный продукт, описанный выше, очищали в непрерывном режиме с использованием колонки Capto Adhere (0,66 см × 5,2 см) и затем колонки Poros HS50 (0,66 см × 4,8 см) приблизительно с 566 г/л CV нагружаемого продукта для Poros HS50 и приблизительно 614 г/л CV для Capto Adhere при pH 5,5, 5 мСм/см, и 100 см/час в условиях, приведенных в таблице ниже.
Результаты хроматографии при непрерывном процессе обработки представлены на фигуре 34. Непрерывный процесс обработки давал в результате выход по извлекаемому Mab приблизительно 90%. Данные не представлены. Кроме того, в загрузке содержалось 617 ppm CHOP и только 3,4 ppm в пуле, в загрузке содержалось 6,37% HMW и только 0,6% в пуле (90% удаление HMW), и значения ДНК, смытого протеина А и гентамицина были ниже пределов обнаружения.
Очистка антитела против CD20
Эксперимент 1. Пул продуктов, полученных в результате хроматографии с протеином А, очищали с использованием колонки Poros HS50 (0,66 см × 5 см) приблизительно с 600 г/л CV нагружаемого продукта и колонки Capto Adhere (0,66 см × 8 см) приблизительно с 316 г/л CV для Capto Adhere при pH 5,5, 5 мСм/см, и 100 см/час.
Результаты представлены в таблице 15 ниже. В условиях перегрузки колонка Poros HS давала в результате ~50% уменьшение %HMW и 98% уменьшение CHOP. Poros HS50 представляла собой наилучшую смолу в сравнении с SE Hicap, SPFF, SPXL и Capto S по уменьшению % HMW (данные не представлены). Смола Capto Adhere не давала в результате дополнительного уменьшения %HMW, но вызывала 99% уменьшение CHOP (наблюдали разрыв CHOP на хроматограмме).
Эксперимент 2. Отфильтрованный и уравновешенный продукт, описанный выше, очищали в непрерывном режиме с использованием колонки Poros HS50 в условиях перегрузки (0,66 см × 4,8 см) и колонки Capto Adhere (0,66 см × 7 см) приблизительно с ~600 г/л CV нагружаемого продукта для Poros HS50 и около ~340 г/л CV для Capto Adhere при pH 5,5, 5 мСм/см, и 100 см/час. Эксперимент осуществляли в двух различных последовательностях: a) последовательность A: (i) колонка Poros HS50 и (ii) Capto Adhere или b) последовательность B (i) Capto Adhere и (ii) колонка Poros HS50, в условиях, перечисленных в таблице ниже.
Результаты представлены в таблице 17 ниже. Непрерывный процесс давал в результате выход по извлекаемому Mab приблизительно 90% (Poros HS50 затем Capto Adhere) и приблизительно 87% (Capto Adhere затем Poros HS50). В условиях перегрузки колонка Poros HS давала в результате ~59% уменьшение значения % HMW, содержание CHOP снижалось менее чем до 10 ppm, и значения ДНК, продукта смывания протеина А, гентамицина были ниже пределов обнаружения.
Реферат
Изобретение относится к способам очистки антитела или иммуноадгезина из композиции, содержащей антитело или иммуноадгезин и по меньшей мере одно загрязняющее вещество. Способы очистки включают очистку на катионообменном материале, представляющем собой частицы смолы, и материале смешанного типа, где плотность загрузки на катионообменном материале составляет более 150 г/л. Способ позволяет осуществлять очистку антитела или иммуноадгезина с высоким выходом. 28 з.п. ф-лы, 34 ил., 17 табл., 5 пр.
Формула
где способ включает (i) или (ii):
(i) последовательные стадии
(a) загрузки композиции на катионообменный материал с плотностью загрузки более чем 150 г/л катионообменного материала; и
(b) загрузки композиции, извлеченной из катионообменного материала, на материал смешанного типа; или
(ii) последовательные стадии
(a) загрузки композиции на материал смешанного типа; и
(b) загрузки композиции, извлеченной из материала смешанного типа, на катионообменный материал с плотностью загрузки более чем 150 г/л катионообменного материала;
где антитело связывается с катионообменным материалом и
где катионообменный материал представляет собой частицы смолы.
белок яичника китайского хомячка (CHOP),
смытый протеин А,
ДНК,
агрегированный белок,
компонент среды клеточной культуры,
гентамицин и
вирусный контаминант.

Комментарии