Антенна-аппликатор и устройство для определения температурных изменений внутренних тканей биологического объекта и способы определения температурных изменений и выявления риска рака - RU2407429C2
Код документа: RU2407429C2
Чертежи



















Описание
Область техники
Изобретение относится к области медицины и медицинской техники, а именно к методу радиотермографии, основанному на неинвазивном выявлении температурных изменений и тепловых аномалий внутренних тканей биологических объектов путем измерения интенсивности их собственного электромагнитного излучения.
Изобретение может быть использовано в медицинской аппаратуре для неинвазивного измерения температуры внутренних тканей, мониторинга за ее состоянием, выявления температурных изменений и тепловых аномалий внутренних тканей, в диагностических комплексах для ранней диагностики онкологических заболеваний и других патологий внутренних органов для выявления высокого риска рака, в частности для ранней диагностики рака молочной железы.
Уровень техники
Одной из важных задач современной медицины является разработка методов и приборов для неинвазивного выявления температурных аномалий внутренних тканей и ранней диагностики заболеваний внутренних органов.
В настоящее время для этих целей используется метод радиотермометрии, позволяющий, неинвазивно измерять яркостную температуру тканей человека путем измерения интенсивности их собственного электромагнитного излучения. Известно, что если прислонить микроволновую антенну к поверхности тела, то мощность СВЧ сигнала на выходе антенны будет прямо пропорционален усредненной температуре в объеме под антенной. Эту усредненную температуру обычно называют яркостной температурой, или радиометрической температурой. Таким образом, измеряя интенсивность сигнала на выходе антенны можно неинвазивно выявлять аномалии яркостной температуры. Поскольку яркостная температура представляет собой усредненную температуру под антенной, то, опираясь на данные о характере изменения яркостной температуры, можно судить о характере изменения температуры внутренних тканей. Такой подход широко применялся для неинвазивного выявления тепловых аномалий внутренних тканей с использованием одночастотного микроволнового радиотермометра.
Очевидный недостаток такого подхода состоит в том, что яркостная температура определяется не только температурой внутренних тканей, но и температурой кожи. Причем кожная температура вносит огромный вклад в яркостную температуру. В частности, в 10-сантиметровом диапазоне вклад кожной температуры в яркостную температуру составляет 30-50 процентов в зависимости от конструкции антенны, частотного диапазона и свойств тканей. Таким образом, выявляя аномалии яркостной температуры, нельзя быть уверенным, что они связаны именно с изменением температуры внутренних тканей, а во многих приложениях требуется определить характер изменения именно внутренней температуры.
Наиболее наглядно этот недостаток при оценке изменения температуры внутренних тканей с помощью измерения яркостной температуры проявляется при температурном мониторинге внутренних тканей с помощью одночастотного радиометра. Контактная антенна-аппликатор, которая используется в микроволновом радиотермометре для приема микроволнового сигнала, оказывает сильное влияние на температуру кожи в исследуемой точке, что, безусловно, сказывается на яркостной температуре, и она начинает сильно меняться, хотя реальная температура внутренних тканей практически не меняется.
Для того чтобы оценить характер изменения температуры по глубине, обычно применяют многочастотные микроволновые радиотермометры. Если измерить яркостную температуру на нескольких частотах, то опираясь на эти результаты можно оценить характер изменения по глубине. В J.W.Hand, G.M. J. Van Leeuwen, S.Mizushina, J.B.Van de Kamer, K.Maruyama, T.Sugiura, D.V.Azzopardi, A.D.Edwards, "Monitoring of deep brain temperature in infants using multi-frequency microwave radiometry and thermal modelling", Phys Med. Biol. (2001), pp.1885-1903 описан микроволновый радиотермометр, который состоит из 5 одночастотных микроволновых радиометров, принимающих сигнал в полосе 500 МГц. Центральная частота самого верхнего канала была равно 8 ГГц, а нижнего канала - 1,3 ГГц. Далее, анализируя 5 значений яркостной температуры на 5 частотах, в работе предложен алгоритм восстановления температуры внутри головного мозга. Недостатком такого подхода является, с одной стороны, сложность аппаратуры, так как один пятиканальный радиометр состоит из 5 одночастотных радиометров. Вторым недостатком многочастотного прибора является его слабая помехозащищенность. Для работы в диапазоне 1,3 ГГц необходима специальная экранировка помещений, что в подавляющем большинстве медицинских учреждений не существует.
Вместе с тем, если в одной точке, одновременно измерить яркостную температуру и температуру кожи, то вычитая из яркостной температуры вклад кожных слоев, можно определить температуру внутренних тканей. Но для этого необходимо в той же точке одновременно измерить и температуру кожи. Во многих случаях помимо выявления температурных аномалий внутренних тканей необходимо также измерять кожную температуру в тех же точках.
В работе A.H.Barrett & Ph. С.Myers, "Subcutaneous Temperature: A method of Noninvasive Sensing", Science, Nov.14, 1975, vol.190, pp.669-671, описан способ неинвазивного выявления у биологического объекта риска рака и показано, что при использованием одночастотного радиотермометра чувствительность диагностики рака молочной железы составляет 74%. Таким образом, число ложноположительных результатов составляет 26%.
Если дополнительно к измерению внутренней температуры с помощью микроволнового радиометра измерять температуру кожи с помощью датчика температуры, то можно в несколько раз снизить число ложноотрицательных результатов, доведя их до 10%, что сопоставимо с результатами маммографии.
Известно использование для диагностики рака молочной железы оснащенного компьютером диагностического комплекса РТМ-01-РЭС (Бурдина Л.М. и др., Радиотермометрия в алгоритме комплексного обследования молочных желез, Современная онкология, том 6, №1, 2005 г.), который включает в себя датчик внутренней температуры и выполненный в виде отдельного блока датчик температуры кожи, средства визуализации, обработки и оценки полученной информации.
Способ, который реализуется в диагностическом комплексе РТМ-01-РЭС и который может быть рассмотрен в качестве наиболее близкого аналога способов согласно заявленному изобретению, включает измерение сначала яркостной температуры в 22 точках молочной железы с помощью одночастотного микроволнового радиотермометра, а затем измерение температуры кожи в тех же самых 22 точках молочной железы с помощью отдельного инфракрасного датчика температуры. Опираясь на эти измерения, затем производится анализ полученных результатов, на основании которого делается заключение о патологических отклонениях.
Этот способ имеет несколько недостатков. Во-первых, последовательное измерение яркостной температуры, а затем измерение температуры кожи, выполненным в виде отдельного блока датчика, достаточно трудоемко и требует значительно больше времени, чем только одно измерение. Во-вторых, без специальной маркировки очень сложно обеспечить условие, чтобы яркостная температура и температура кожи измерялась в одних и тех же точках. Маркировка молочной железы красящими веществами не всегда приветствуются пациентками. В-третьих, измерение яркостной температуры в 22 точках молочной железы занимает около 10 минут, за это время кожа молочной железы охлаждается, т.е. яркостная температура и температура кожи измеряются в разное время.
Очевидно, что желательно одновременно измерять яркостную температуру и температуру кожи в одной и той же точке. Но для измерения яркостной температуры антенна-аппликатор должна плотно контактировать с поверхностью кожи, при этом известно, что в апертуре антенны нельзя размещать произвольным образом какие-либо дополнительные элементы, так как элемент, помещенный в апертуру антенны и поглощающий электромагнитные волны, будет влиять на измеряемую температуру, на коэффициент отражения антенны и на диаграмму направленности.
Наиболее широко в радиотермометрии используются контактные волноводные антенны-аппликаторы в виде прямоугольного волновода открытого с одного конца, контактирующего с пациентом. Например, в способе обнаружения опухолей молочной железы по патенту США №5779635 (К.Carr) используется матрица из нескольких антенн, включающих систему приема электромагнитного излучения, размещенную в частично заполненном диэлектриком прямоугольном волноводе, имеющем один закрытый конец и другой открытый, обращенный к пациенту, конец.
В многочастотной радиотермометрии используется антенна-аппликатор, имеющая открытый с одного конца прямоугольный волновод, заполненный диэлектриком, и размещенную в волноводе систему возбуждения электромагнитных волн, соединенную с входной частью радиотермометра (J.W.Hand, G.M. J.Van Leeuwen, S.Mizushina, J.B.Van de Kamer, K.Maruyama, T.Sugiura, D.V.Azzopardi, A.D.Edwards, "Monitoring of deep brain temperature in infants using multi-frequency microwave radiometry and thermal modelling", PhysMed. Biol. 2001), pp.1885-1903).
Наиболее близким аналогом заявленной антенны-аппликатора является разработанная автором настоящего изобретения антенна-аппликатор для неинвазивного измерения температуры внутренних тканей биологического объекта по патенту РФ 2306099, опубл. 20.09.2007 г., содержащая закрытый с одного конца отрезок волновода, частично или полностью заполненный диэлектриком, диэлектрическую пластину, расположенную на противоположном конце отрезка волновода, контактирующую с биологическим объектом, причем между диэлектрической пластиной и диэлектриком, заполняющим волновод, имеется зазор, заполненный воздухом или другим диэлектрическим материалом с низкой теплопроводностью и низкой диэлектрической проницаемостью, систему возбуждения электромагнитных волн, расположенную в волноводе между закрытым концом волновода и диэлектриком, соединенную с входной частью радиотермометра. Эта антенна обладает очень хорошими параметрами, но она также не позволяет одновременно измерять яркостную температуру и температуру кожи.
Сущность изобретения
Задачей изобретения является создание антенны-аппликатора, обеспечивающей одновременное измерение и яркостной температуры, и температуры кожи в одной и той же точке биологического объекта, и устройства для определения температурных изменений внутренних тканей, а также способов определения температурных изменений внутренних тканей и методов выявления пациентов группы риска рака, в частности риска рака молочной железы, с использованием предложенных устройств.
Решение указанной задачи обеспечивает возможность выявления температурных изменений именно внутренних тканей, возможность мониторинга температурных изменений внутренних тканей, повышает чувствительность метода при выявлении высокого риска рака, упрощает процесс измерения, снижает число ложноотрицательных результатов и сокращает время диагностики. Конструкция предложенной антенны-аппликатора также обеспечивает повышение ее помехозащищенности.
Одним объектом заявленного изобретения является антенна-аппликатор для определения температурных изменений внутренних тканей биологического объекта путем одновременного неинвазивного измерения яркостной температуры и температуры кожи биологического объекта, содержащая:
отрезок волновода, частично или полностью заполненный диэлектриком, имеющий один закрытый конец и противоположный открытый конец, контактирующий с биологическим объектом,
систему возбуждения электромагнитных волн, расположенную в волноводе между закрытым концом волновода и диэлектриком, соединенную с входной частью микроволнового радиотермометра,
датчик температуры кожи, расположенный у открытого конца волновода, выполненный с возможностью передачи информации на вычислительное устройство.
Датчик температуры кожи антенны-аппликатора может быть соединен с вычислительным устройством проводниками, расположенными ортогонально вектору электрического поля антенны-аппликатора.
В качестве датчика температуры антенна-аппликатор может содержать контактный экранированный датчик температуры, расположенный на открытом конце волновода, контактирующем с биологическим объектом, или инфракрасный экранированный датчик температуры кожи, расположенный внутри отрезка волновода на расстоянии от открытого конца волновода с зазором между инфракрасным датчиком температуры и биологическим объектом.
Антенна-аппликатор может дополнительно содержать разделительный фильтр нижних частот на выходе датчика температуры кожи.
Антенна-аппликатор может быть дополнительно снабжена металлизированным фланцем, расположенным на расстоянии от открытого конца волновода.
Антенна-аппликатор может содержать диэлектрическую пластину, частично или полностью выполненную из материала, пропускающего волны ближнего инфракрасного диапазона, расположенную на открытом конце отрезка волновода, причем между диэлектрической пластиной и диэлектриком, заполняющим волновод, имеется зазор, заполненный воздухом или другим диэлектрическим материалом с низкой теплопроводностью, низкой диэлектрической проницаемостью и пропускающим волны инфракрасного диапазона.
Антенна-аппликатор может быть снабжена системой подогрева.
Антенна-аппликатор может быть выполнена в виде одного или нескольких последовательно соединенных отрезков волновода, например круглого волновода, имеющих разное поперечное сечение.
Кроме того, антенна-аппликатор может содержать один или несколько последовательно соединенных отрезков внутреннего волновода и расположенных снаружи от внутреннего волновода одного или нескольких отрезков внешнего волновода, причем зазор между отрезками внутреннего и внешнего волноводов частично или полностью заполнен диэлектриком.
На диэлектрик со стороны открытого конца волновода путем металлизации может быть нанесен согласующий элемент, обеспечивающий использование антенны-аппликатора для тканей с различной диэлектрической проницаемостью.
Антенна-аппликатор может быть дополнительно снабжена датчиком температуры, измеряющим температуру антенны-аппликатора и передающим информацию на вычислительное устройство и/или датчиком для измерения температуры датчика температуры кожи, расположенным на корпусе датчика температуры кожи, измеряющим температуру корпуса датчика и передающим информацию на вычислительное устройство.
Другим объектом данного изобретения является устройство для определения температурных изменений внутренних тканей биологического объекта, включающее:
антенну-аппликатор, содержащую:
отрезок волновода, частично или полностью заполненный диэлектриком, имеющий один закрытый конец и противоположный открытый конец, контактирующий с биологическим объектом,
систему возбуждения электромагнитных волн, расположенную в волноводе между закрытым концом волновода и диэлектриком, соединенную с входной частью микроволнового радиотермометра,
датчик температуры кожи, расположенный у открытого конца волновода, выполненный с возможностью передачи информации на вычислительное устройство;
микроволновый радиотермометр, измеряющий интенсивность сигнала, поступающего с выхода антенны, который пропорционален яркостной температуре тканей биологического объекта; и
вычислительное устройство, выполненное с возможностью приема информации от датчика температуры кожи и от микроволнового радиотермометра и определения изменения температуры внутренних тканей.
В устройстве может быть использован любой из приведенных выше вариантов выполнения антенны-аппликатора.
Устройство может содержать средство визуализации и отображения.
Способ определения температурных изменений внутренних тканей согласно изобретению включает:
одновременное измерение яркостной температуры и температуры кожи в первой точке биологического объекта,
определение температуры внутренних тканей в первой точке по следующей формуле:

Tint1 - температура внутренних тканей в первой точке,
Tbr1 - яркостная температура в первой точке,
Tsk1 - температура кожи в первой точке,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
одновременное измерение яркостной температуры и температуры кожи во второй точке биологического объекта,
определение температуры внутренних тканей во второй точке по следующей формуле:
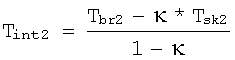
Tint2 - температура внутренних тканей во второй точке,
Tbr1 - яркостная температура во второй точке,
Tsk2 -температура кожи во второй точке,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
оценку изменения температуры внутренних тканей по формуле:
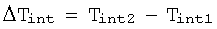
При этом согласно изобретению может быть также реализован способ определения температурных изменений внутренних тканей во времени, включающий:
одновременное измерение яркостной температуры и температуры кожи в заданной точке биологического объекта в первый момент времени,
определение температуры внутренних тканей в первый момент времени по следующей формуле:

Tint t1 - температура внутренних тканей в первой момент времени,
Tbr t1 - яркостная температура в первый момент времени,
Tskt1 - температура кожи в первый момент времени,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
одновременное измерение яркостной температуры и температуры кожи в той же точке биологического объекта в последующий второй момент времени,
определение температуры внутренних тканей во второй момент времени по следующей формуле:

Tintt2 - температура внутренних тканей во второй момент времени,
Tbrt2 - яркостная температура во второй момент времени,
Tskt2 - температура кожи во второй момент времени,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
оценку изменения температуры внутренних тканей во времени по следующей формуле:

Изобретение может быть использовано в способе выявления у биологического объекта высокого риска рака, включающем:
одновременное измерение яркостной температуры биологического объекта и температуры кожи биологического объекта в, по меньшей мере, одной опорной точке,
одновременное измерение яркостной температуры биологического объекта и температуры кожи биологического объекта в заданных точках,
определение температуры внутренних тканей в опорной и заданных точках по следующей формуле:

Tint - температура внутренних тканей в опорной точке Tonint или в заданной точке Tiint соответственно,
Tbr - яркостная температура в опорной или заданной точке,
Tsk - температура кожи в опорной или заданной точке,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
определение уровня тепловой активности тканей D, характеризующего тепловые изменения в тканях биологического объекта, согласно выражению:

D - уровень тепловой активности тканей,
С1 - весовой коэффициент, являющийся безразмерным постоянным множителем. На практике С1 часто равен 1, и формула будет иметь следующий вид:


Tiint - температура внутренних тканей в i-той заданной точке,
Tonint - температура внутренних тканей в опорной точке,
Tisk - температура кожи в i-той заданной точке,
Tonsk - температура кожи в опорной точке,
СС2 - весовой коэффициент, характеризующий вес температуры кожи по сравнению с температурой внутренних тканей. В большинстве случаев этот коэффициент принимают равным 1, и при СС2, равном 1, математическая формула для вычисления ΔTi будет иметь следующий вид:
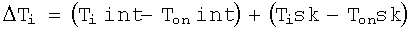
определение параметра W, характеризующего риск рака на основе уровня тепловой активности тканей D и соотношения между температурой внутренних тканей и температурой кожи, согласно выражению

W - параметр, характеризующий риск рака,
D - уровень тепловой активности тканей,
LL - параметр, характеризующий разницу между температурой внутренних тканей и температурой кожи биологического объекта, равный


и LD - параметр, характеризующий дисперсию разницы между температурой внутренних тканей и температурой кожи биологического объекта, равный


где U и UB - безразмерные коэффициенты, определяемые экспериментально, для приведенных примеров численное значение параметра U выбирается в диапазоне от 0.5 до 0.7, а численное значение параметра UB выбирается в диапазоне от 0.2 до 0.3,
и определение риска рака путем сравнения параметра W, характеризующего риск рака, с пороговым уровнем риска рака. Для приведенных примеров пороговый уровень риска рака находится в диапазоне от 0.7 до 1, более точное значение можно подобрать таким образом, чтобы на «обучающей выборке» все пациенты с раком имели значение W больше порового уровня, а пациенты, у которых нет рака, ниже порогового уровня.
Для парных органов биологического объекта при определении уровня тепловой активности тканей D дополнительно учитывают значение разницы температур в точках измерения правого и левого парного органа, определяемого по следующей формуле:

Tintiправ - температура внутренних тканей в i-той заданной точке правого парного органа,
Tintiлев - температура внутренних тканей в i-той заданной точке левого парного органа,
Tskiправ - температура кожи в i-той заданной точке правого парного органа,
Tskiлев - температура кожи в i-той заданной точке левого парного органа,
СС3 - безразмерный весовой коэффициент, который характеризует вес температуры кожи Tisk по сравнению с внутренней температурой и обычно принимается равным 1. Емли он равен 1, то формула примет следующий вид:

и уровень тепловой активности тканей D определяют как

C1, C2 - весовые коэффициенты, определяющие вклад указанных составляющих, которые также на практике равны 1, в результате чего формула будет иметь следующий вид:

В частности, изобретение может быть использовано в способе выявления у биологического объекта высокого риска рака молочной железы, включающем:
одновременное измерение яркостной температуры биологического объекта и температуры кожи биологического объекта в, по меньшей мере, одной опорной точке,
одновременное измерение яркостной температуры молочной железы биологического объекта и температуры кожи молочной железы биологического объекта в заданных точках,
определение температуры внутренних тканей в опорной и заданных точках молочной железы по следующей формуле:

Tint - температура внутренних тканей в опорной или заданной точке молочной железы,
Tbr - яркостная температура в опорной или заданной точке молочной железы,
Tsk - температура кожи в опорной или заданной точке молочной железы,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
определение уровня тепловой активности тканей D, характеризующего тепловые изменения в тканях молочной железы, согласно выражению:

D - уровень тепловой активности тканей молочной железы,
С1, С2 - весовые коэффициенты, определяющие вклад указанных составляющих, которые также на практике равны 1, в результате чего формула будет иметь следующий вид:

ΔTi - повышение температуры внутренних тканей в заданных точках молочной железы по сравнению с температурой в опорной точке, определяемое по следующей формуле:

Tiint- температура внутренних тканей в i-той заданной точке молочной железы,
Tonint - температура внутренних тканей в опорной точке молочной железы,
Tisk - температура кожи в i-той заданной точке молочной железы,
Tonsk - температура кожи в опорной точке молочной железы,
СС2 - безразмерный весовой коэффициент, характеризующий вклад разности температур кожи в заданных и опорной точке, на практике часто равен 1, и формула буде иметь следующий вид:

DTi - значение разницы температур между правой и левой молочной железой в заданных точках, определяемое по следующей формуле:

Tintiправ - температура внутренних тканей в i-той заданной точке правой молочной железы,
Tintiлев - температура внутренних тканей в i-той заданной точке левой молочной железы,
СС3 - безразмерный весовой коэффициент, характеризующий вес разности температур кожи в заданной точке правой и левой молочной железы, при его равенстве на практике 1, формула примет следующий вид:

Tskiправ - температура кожи в i-той заданной точке правой молочной железы,
Tskiлев - температура кожи в i-той заданной точке левой молочной железы,
определение параметра W, характеризующего риск рака на основе уровня тепловой активности тканей D и соотношения между температурой внутренних тканей и температурой кожи молочной железы, согласно выражению

W - параметр, характеризующий риск рака,
D - уровень тепловой активности тканей молочной железы,
LL - параметр, характеризующий разницу между температурой внутренних тканей и температурой кожи молочной железы, равный


и LD - параметр, характеризующий дисперсию разницы между температурой внутренних тканей и температурой кожи молочной железы, равный


где U и UD - экспериментальные коэффициенты, при этом численное значение параметра U экспериментально выбирается в диапазоне от 0.5 до 0.7, а численное значение параметра UB выбирается в диапазоне от 0.2 до 0.3,
и определение риска рака путем сравнения параметра W, характеризующего риск рака, с пороговым уровнем риска рака.
Краткое описание чертежей
На фиг.1 представлена антенна-аппликатор, известная из уровня техники.
На фиг.2 представлен вариант антенны-аппликатора с контактным экранированным датчиком температуры кожи.
На фиг.З представлен вариант антенны-аппликатора с инфракрасным экранированным датчиком температуры кожи.
На фиг.4 представлена антенна-аппликатор с инфракрасным экранированным датчиком температуры кожи и со скошенным диэлектриком, заполняющим волновод.
На фиг.5 представлен вариант антенны-аппликатора, с разделительным фильтром нижних частот, для повышения помехозащищенности.
На фиг.6 представлена антенна-аппликатор, которая на открытом конце отрезка волновода содержит диэлектрическую пластину, частично или полностью выполненную из материала, пропускающего волны ближнего инфракрасного и микроволнового диапазонов.
На фиг.7 представлена антенна-аппликатор, снабженная фланцем, для повышения помехозащищенности.
На фиг.8 представлена антенна-аппликатор, которая содержит систему подогрева антенны-аппликатора.
На фиг.9 представлен вариант антенны, которая содержит несколько последовательно соединенных отрезков волновода, имеющих разное поперечное сечение.
На фиг.10 представлен вариант антенны-аппликатора, в которой снаружи от внутреннего волновода расположен отрезок внешнего волновода, и зазор между отрезками внутреннего и внешнего волноводов частично заполнен диэлектриком.
На фиг.11 представлен вариант антенны-аппликатора и ее поперечное сечение по линии А-А, в которой между системой возбуждения и инфракрасным датчиком включен металлизированный согласующий элемент.
На фиг.12 представлен вариант антенны-аппликатора, которая дополнительно снабжена датчиком температуры, измеряющим температуру антенны-аппликатора и передающим информацию на вычислительное устройство.
На фиг.13 представлен вариант антенны-аппликатора, которая дополнительно снабжена датчиком температуры, расположенным на корпусе датчика температуры кожи, измеряющим температуру корпуса датчика и передающим информацию на вычислительное устройство.
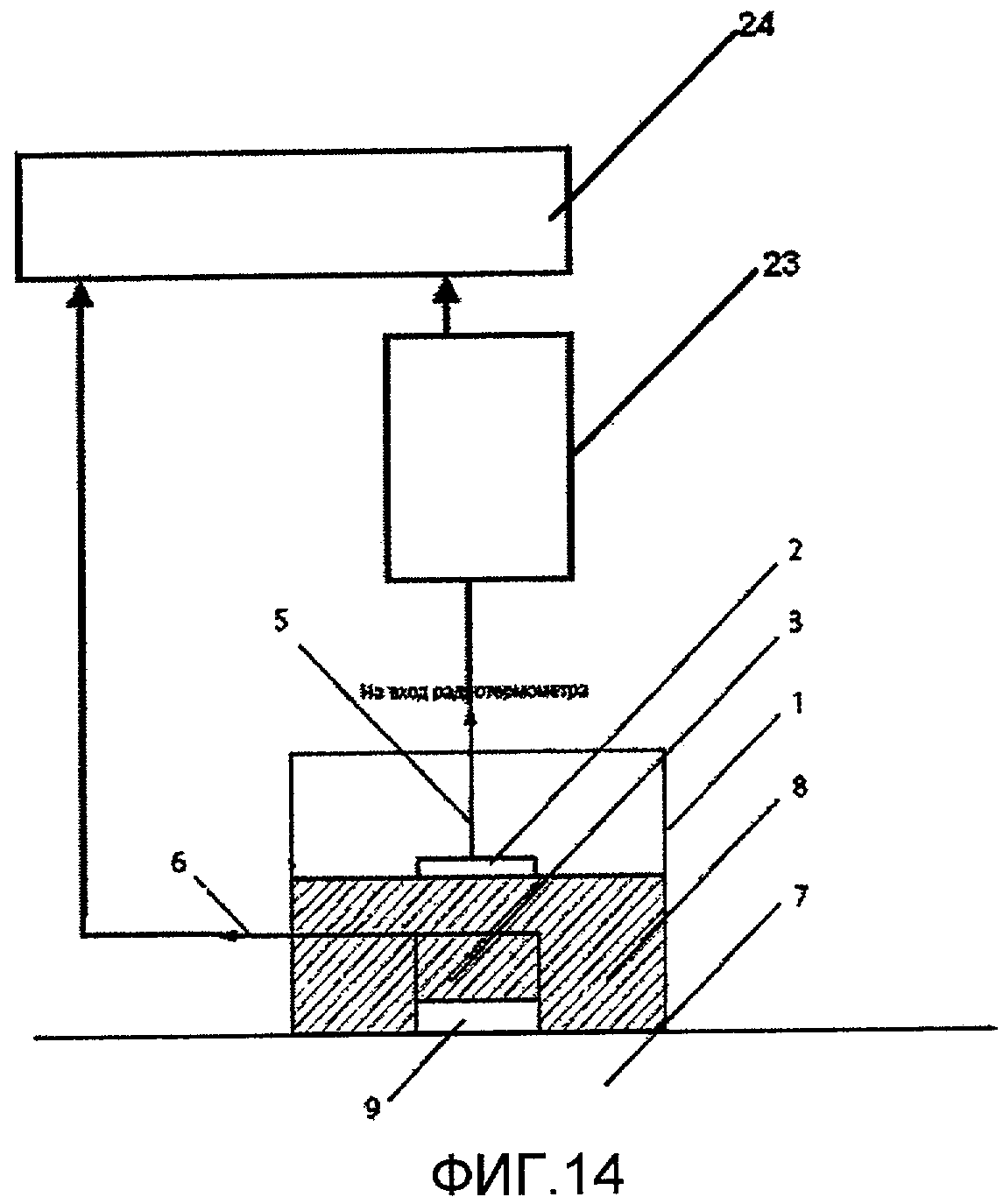
На фиг.14 представлено схематичное изображение устройства для определения температурных изменений внутренних тканей биологического объекта, содержащего антенну-аппликатор, микроволновый радиотермометр и вычислительное устройство.
На фиг.15 представлен другой вариант устройства для определения температурных изменений внутренних тканей, содержащего антенну-аппликатор, микроволновый радиотермометр, вычислительное устройство и дополнительно содержащего разделительный фильтр нижних частот на выходе датчика температуры кожи.
На фиг.16 представлен вариант устройства для определения температурных изменений внутренних тканей, содержащий антенну-аппликатор с системой подогрева.
На фиг.17 представлен вариант устройства для определения температурных изменений внутренних тканей, содержащий датчик касания.
На фиг.18 показан результат экспертной системы для Примера 1 клинического применения.
На фиг.19 показан результат экспертной системы для Примера 2 клинического применения.
На фиг.20 показан результата экспертной системы для Примера 3 клинического применения.
Подробное описание изобретения
На фиг.1 представлена антенна-аппликатор, известная из уровня техники (согласно патенту РФ 2306099), не содержащая датчика температуры кожи. На фиг.2-13 представлены варианты выполнения антенны-аппликатора согласно изобретению. Электромагнитная энергия микроволнового диапазона от биообъекта (7) через открытый конец волновода (1) поступает в волновод, частично заполненный диэлектриком (8), и далее электромагнитное излучение поступает в систему (2) возбуждения антенны-аппликатора и через коаксиальный кабель - на вход радиотермометра.
На фиг.2 показано общее схематичное изображение заявленной антенны-аппликатора, содержащей отрезок волновода (1), частично заполненный диэлектриком (8), имеющий один закрытый конец и противоположный открытый конец, контактирующий с биологическим объектом (7), систему (2) возбуждения электромагнитных волн, расположенную в волноводе между закрытым концом волновода и диэлектриком, соединенную проводниками (5) с входной частью микроволнового радиотермометра, и датчик (3) температуры кожи, расположенный у открытого конца волновода.
Информация с датчика (3) температуры по проводам (6) поступает в вычислительное устройство. Туда же поступает информация о яркостной температуре, измеренной микроволновым радиотермометром. В данном варианте выполнения в качестве датчика температуры использован контактный экранированный датчик температуры кожи, размещенный на поверхности диэлектрика и находящийся в прямом контакте с кожей.
На фиг.3 представлен вариант антенны-аппликатора с инфракрасным экранированным датчиком температуры кожи. Между инфракрасным датчиком (3) температуры и поверхностью кожи имеется зазор (9). Сигнал инфракрасного диапазона с поверхности биообъекта (7) через открытый конец волновода (1), через воздушный зазор (9), поступает на инфракрасный датчик (3) температуры.
Известно, что в апертуре антенны нельзя размещать произвольным образом каких-либо дополнительных элементов, так как элемент, помещенный в апертуру антенны и поглощающий электромагнитные волны, будет влиять на измеряемую температуру. Кроме этого, элементы, расположенные в апертуре влияют на коэффициент отражения антенны и на диаграмму направленности.
Вместе с тем, если между системой возбуждения и открытым концом волновода поместить металлизированный экран (10), имеющий только одну открытую поверхность, направленную в сторону биообъекта, то размеры металлического экрана можно подобрать таким образом, чтобы его влияние на измеренную яркостную температуру, на диаграмму направленности и на ее коэффициент отражения было минимальным. Влияние металлизированного экрана на измеренную яркостную температуру будет также минимальным, так как проводимость металла очень высокая.
Инфракрасный датчик (3) температуры, размещенный в экране, через открытую поверхность экрана и воздушный зазор (9) может измерять дистанционно и неинвазивно температуру кожи биообъекта (7). Расчетные и экспериментальные данные показывают, что в десятисантиметровом диапазоне длин волн экран диаметром 10 мм, расположенный между системой возбуждения и открытым концом волновода, заполненного диэлектриком, не оказывает отрицательного влияния на параметры антенны, и путем оптимизации размеров экрана и системы возбуждения можно получить низкий коэффициент отражения антенны в широком диапазоне частот.
Для снижения влияния температуры диэлектрика (8), заполняющего волновод (1), на результаты измерения температуры кожи биообъекта его можно срезать под углом (11), как показано на фиг.4, чтобы меньшая часть диэлектрика попадала в поле зрения инфракрасного датчика. Угол обзора инфракрасного датчика необходимо выбирать таким образом, чтобы диэлектрик, заполняющий волновод, не попадал в поле зрения инфракрасного датчика.
Очевидно, что проводники (6), идущие от датчиков температур (фиг.2-4), находятся в апертуре антенны и в общем случае оказывают сильное влияние на диаграмму направленности антенны и на погрешность измерения яркостной температуры. Но авторами данного изобретения было установлено, что предпочтительно располагать проводники ортогонально вектору электрического поля в волноводе, и в этом случае их влияние будет незначительно, и они не будут оказывать влияние на результаты измерения яркостной температуры.
При экранировании контактных датчиков температуры кожи (фиг.2) они также не оказывают влияние на измеряемую яркостную температуру и могут быть использованы для измерения температуры кожи.
Для того, чтобы проводники не ухудшали помехозащищенность антенны, можно на выходе проводника из волновода поставить разделительные фильтры (12) нижних частот, как показано на фиг.5, не позволяющие СВЧ колебаниям проникать внутрь волновода.
В качестве датчика инфракрасного излучения можно выбрать, например, датчики фирмы PerkinElmer Inc., имеющие диаметр 8 мм и высоту от 5 до 10 мм. Углы обзора этих датчиков варьируются в пределах от 7 до 100 градусов. Информация об измеренной температуре поступает с датчика в виде разности потенциалов на контактах датчика.
В качестве контактного датчика можно использовать датчик температуры, например, фирмы Honeywell International Inc.
На фиг.6 представлена антенна-аппликатор, которая на открытом конце отрезка волновода содержит диэлектрическую пластину, частично или полностью выполненную из материала, пропускающего волны ближнего инфракрасного диапазона и микроволнового диапазона, которая защищает датчик измерения температуры кожи и внутреннюю часть антенны от влаги и грязи и упрощает проведение дезинфекции антенны перед измерением.
Другой способ повышения помехозащищенности антенны представлен на фиг.7, где представлена антенна-аппликатор, имеющая металлизированный фланец (15), расположенный на расстоянии (16) от открытого конца волновода. Для обеспечения высокой помехозащищенности расстояние от фланца до поверхности кожи должно составлять от 1,5 до 2,5 мм. На фиг 8. представлена антенна-аппликатор, которая содержит систему (17) подогрева антенны-аппликатора, которая позволяет снизить влияние температуры антенны на погрешность измерения температуры кожи. В отсутствие подогрева температура антенны близка к температуре окружающей среды. Во время измерения яркостной температуры антенна-аппликатор контактирует с кожей и оказывает сильное влияние на измеряемую температуру. Следует отметить, что температура антенны также влияет и на погрешность измерения яркостной температуры. Для минимизации этого эффекта антенна-аппликатор подогревается до температуры, близкой к температуре кожи (примерно 33°С), и поддерживается на этом уровне во время измерения. Это позволяет снизить влияние температуры антенны на погрешность измерения температуры кожи и яркостной температуры.
На фиг.9 представлена антенна-аппликатор, которая содержит несколько последовательно соединенных отрезков волновода, имеющих разное поперечное сечение, позволяющих обеспечить хорошее согласование в широком диапазоне частот.
На фиг.10 представлена антенна-аппликатор, содержащая внутренний волновод (и расположенный снаружи от внутреннего волновода отрезок внешнего волновода (18), причем зазор между отрезками внутреннего и внешнего волноводов частично заполнен диэлектриком (19). Наличие дополнительных внешних волноводов (19) позволяет повысить помехозащищенность антенны.
На фиг.11 представлен вариант антенны-аппликатора и ее поперечное сечение по линии А-А, в которой между системой возбуждения и инфракрасным датчиком включен металлизированный согласующий элемент (20). Он позволяет проводить настройку коэффициента отражения антенны в широком диапазоне частот для использования антенны-аппликатора для тканей с различной диэлектрической проницаемостью.
Погрешность измерение температуры кожи, как правило, зависит от температуры датчиков, с помощью которых производится измерение. Вместе с тем, температура датчиков меняется при измерении температуры окружающей среды, в процессе нагрева датчика, энергией рассеиваемой в аппаратуре, и энергией, поступающей от пациента. Но если измерить температуру датчиков, измеряющих температуру кожи, и температуру антенны, то можно произвести компенсацию ошибок, возникающих в процессе измерения.
Поэтому антенна на фиг.12 дополнительно снабжена датчиком (21) температуры, измеряющим температуру антенны-аппликатора и передающим информацию на вычислительное устройство.
Антенна также может быть снабжена дополнительным датчиком (22) для измерения температуры датчика температуры кожи, который расположен на корпусе датчика температуры кожи, как показано на фиг.13. Этот датчик (22) измеряет температуру корпуса датчика температуры кожи и передает информацию о температуре инфракрасного или контактного датчика температуры кожи на вычислительное устройство. Эту информацию можно использовать в вычислительном устройстве для того, чтобы снизить влияние температуры окружающей среды на результаты измерения. Инфракрасные датчики, например, фирмы PerkinElmer Inc., помимо информации об измеряемой температуры дают информацию о температуре корпуса, что позволяет использовать эту информацию для снижения погрешности измерения температуры кожи.
На фиг.14 представлено схематичное изображение устройства для определения температурных изменений внутренних тканей биологического объекта, содержащего антенну-аппликатор (1), микроволновый радиотермометр (23) и вычислительное устройство (24).
На фиг.15 представлен другой вариант устройства для определения температурных изменений внутренних тканей, содержащего антенну-аппликатор (1), микроволновый радиотермометр (23), вычислительное устройство (24) и дополнительно содержащий разделительный фильтр (25) нижних частот на выходе датчика температуры кожи. Каждый проводник, идущий от датчика температуры кожи должен пройти через фильтр нижних частот, который препятствует СВЧ колебаниям попасть в апертуру антенны по проводникам, идущим к датчику температуры кожи. Фильтр должен располагаться как можно ближе к месту ввода проводников (6) в волновод.
На фиг.16 представлен вариант устройства для определения температурных изменений внутренних тканей, содержащий антенну-аппликатор (1) с системой (17) подогрева, который снижает влияние температуры антенны на погрешность измерения температуры кожи. Для нагрева антенны можно использовать либо резисторы, установленные на корпусе антенны, либо элементы Пельтье. Последние позволяют не только нагревать антенну, но и охлаждать ее. Но для работы элемента Пельтье требуется организация теплоотвода. При использовании резисторов теплоотвода не требуется, и охлаждение происходит за счет естественного охлаждения антенны.
На фиг.17 представлен вариант устройства для определения температурных изменений внутренних тканей, содержащий датчик (27) касания, который срабатывает, если антенна аппликатор касается кожи пациента и передает информацию о касании на вычислительное устройство. Вычислительное устройство обрабатывает информацию со всех датчиков (27) касания и, при наличии касания, позволяет программе сохранять результаты измерений в памяти компьютера. Это позволяет врачу быть уверенным, что антенна находится в контакте с кожей. Известно, что для обеспечения достоверных результатов измерений яркостной температуры, антенна-аппликатор должна плотно прилегать к коже. Для этого используется датчик касания, расположенный вблизи апертуры антенны или в апертуре антенны. Использование датчиков касания позволяет также прекращать измерения яркостной температуры, при отрыве антенны от кожи. В этом случае, датчики касания срабатывают и дают сигнал на вычислительное устройство об отсутствии контакта. В этом случае на индикаторе прибора отображается температура окружающей среды. Датчик касания может быть реализован различными способами: механический датчик касания, измерение емкости между датчиком и кожей, измерение электрических потенциалов и т.д. В данной конструкции используется оптический датчик касания. Вблизи апертуры антенны установлен оптический световод и датчик освещенности. В момент касания свет не поступает на датчик освещенности и происходит срабатывание.
Далее более подробно рассмотрены способы определения изменений температуры, в которых может быть использована антенна-аппликатор согласно изобретению, на примере реализации способа выявления у биологического объекта высокого риска рака.
Метод проведения измерений
Приложить рабочую поверхность аппликатора к первой (опорной) точке и произвести одновременное измерение температуры кожи и яркостной температуры в опорной точке и заданных точках согласно схеме измерения. Давление антенны-аппликатора на кожу не должно быть чрезмерно сильным, но, в то же время, аппликатор должен прилегать к коже всей рабочей поверхностью. Это необходимо контролировать визуально. В применении веществ, улучшающих контакт датчика с кожей, как это применяется при ультразвуковых исследованиях, нет необходимости. Ось антенны-аппликатора должна быть перпендикулярна поверхности кожи, т.к. результат исследования зависит от угла наклона антенны-аппликатора. Данные измерений сохраняются в компьютере.
Далее определяют температуры внутренних тканей в опорной и заданных точках по следующей формуле:

Tint - температура внутренних тканей в опорной или заданной точке,
Tbr - яркостная температура в опорной или заданной точке,
Tsk - температура кожи в опорной или заданной точке,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
и определяют уровень тепловой активности тканей D, характеризующий тепловые изменения в тканях биологического объекта, согласно выражению:

D - уровень тепловой активности тканей,
С1 - весовой коэффициент,
ΔTi - повышение температуры внутренних тканей в заданных точках измерения по сравнению с температурой внутренних тканей в опорной точке, определяемое по следующей формуле:

Tiint - температура внутренних тканей в i-той заданной точке,
Tonint - температура внутренних тканей в опорной точке,
Tisk - температура кожи в i-той заданной точке,
Tonsk - температура кожи в опорной точке,
СС2 - весовой коэффициент.
Параметр W, характеризующий риск рака, определяют на основе уровня тепловой активности D и соотношения между температурой внутренних тканей и температурой кожи, согласно выражению:

W - параметр, характеризующий риск рака,
D - уровень тепловой активности тканей,
LL - параметр, характеризующий разницу между температурой внутренних тканей и температурой кожи биологического объекта, равный


и LD - параметр, характеризующий дисперсию разницы между температурой внутренних тканей и температурой кожи биологического объекта, равный


где U и UB - экспериментальные коэффициенты,
и определение риска рака путем сравнения параметра W, характеризующего риск рака, с пороговым уровнем риска рака.
Экспериментальные коэффициенты U и UB выбирают таким образом, чтобы у пациентов с верифицированным раком значение параметра W было выше порогового уровня, а для пациентов, у которых нет рака, значение параметра W было ниже порогового уровня.
Для парных органов биологического объекта при определении уровня тепловой активности тканей D дополнительно учитывают значение разницы температур в точках измерения правого и левого парного органа, определяемого по следующей формуле:

Tintiправ - температура внутренних тканей в i-той заданной точке правого парного органа,
Tintiлев - температура внутренних тканей в i-той заданной точке левого парного органа,
Tskiправ - температура кожи в i-той заданной точке правого парного органа,
Tskiлев - температура кожи в i-той заданной точке левого парного органа,
СС3 - весовой коэффициент,
и уровень тепловой активности тканей D определяют как

C1, C2 - весовые коэффициенты.
При диагностике рака молочной железы обследование проводится с 6 по 12 день менструального цикла. Температура в помещении, где проводятся измерения, должна находиться в пределах 20-25°С. Перед началом обследований молочные железы пациентки в течение 7-10 минут должны адаптироваться к температуре окружающей среды. Обследование должно проводиться до проведения пальпаторного обследования, маммографии или УЗИ, поскольку последние оказывают сильное влияние на распределение температуры молочных желез. При проведении обследования пациентка лежит на спине с руками за головой.
Рабочими точками при обследовании молочной железы являются середины квадрантов, границы между квадрантами, область соска и аксилярные области (лимфатические узлы), и опорная точка. Опорная точка расположена в центре грудной клетки, на 5 сантиметров выше точки эпигастрия. Всего измерения обычно проводятся в 21 точках.
Яркостная температура, температура кожи и внутренняя температура отображаются в виде термограмм и в виде поля температур.
На термограмме по вертикальной оси отображается температура, по горизонтальной номера точек. Температура молочной железы может отображаться с использованием различных символов, например, кружком отображается температура правой молочной железы, крестиком - левой. На поле внутренняя температура и температура кожи могут отображаться с использованием цветовой палитры, например, красным цветом отображаются высокие температуры, синим цветом низкие температуры, желтым и зеленым цветом - средние значения температуры молочной железы.
Значение параметра тепловой активности ткани D, параметра W и границу области риска удобно отображать на графике отдельно для правой и отдельно для левой молочных желез.
Врач, глядя на этот график, видит насколько обследуемый пациент выше или ниже границы области риска для каждой из молочных желез.
Пороговый уровень риска рака может устанавливаться экспериментально. В одном из вариантов выполнения способа согласно изобретению пороговый уровень риска рака, например, определяется путем вычисления порогового уровня G на основе эмпирических данных по следующей формуле:

АА, b, СС - коэффициенты, которые зависят от диаметра молочной железы и представлены в таблице,
а X - это параметр, характеризующий повышение внутренней температуры по сравнению с «нормой», который может быть вычислен по следующей формуле

Величина разности Δ=W-G характеризует риск малигнизации. Положительные значения соответствуют высокому риску, отрицательные значения - низкому, и если для обследуемого пациента значение W выше порога, значит, обследуемый пациент находится в группе риска рака молочной железы.
Примеры клинических применений
Пример 1. Больная С. Возраст: 38 лет.
ЖАЛОБЫ ПРИ ПОСТУПЛЕНИИ: наличие уплотнения в правой молочной железе.
АНАМНЕЗ ЗАБОЛЕВАНИЯ: Уплотнение в правой молочной железе обнаружила самостоятельно в октябре с.г. обследовалась в поликлинике РНЦРР и с диагнозом фибросклероз правой молочной железы госпитализирована для хирургического лечения.
СОСТОЯНИЕ БОЛЬНОГО: Положение активное. Общее состояние удовлетворительное. Телосложение правильное. Питание удовлетворительное. Кожа и видимые слизистые чистые, нормальной окраски. Лимфатические узлы нормальных размеров. Костно-мышечный аппарат без патологии. Щитовидная железа не увеличена. Молочные железы на фоне умеренно выраженной мастопатии, справа в верхне-наружном квадранте определяется уплотнение с неровными, нечеткими контурами, округлой формы размерами до 2,0 см. Периферические л/узлы не увеличены.
ПРИ МАММОГРАФИИ: на фоне мастопатии средней степени выраженности справа в верхне-наружном квадранте отчетливых узловых образований не определяются, однако при УЗИ выявляется гипоэхогенное образование неоднородной структуры, размерами 13*11 мм, с анэхогенными включениями.
Клинический диагноз: ФИБРОСКЛЕРО3 ПРАВОЙ МОЛОЧНОЙ ЖЕЛЕЗЫ.
ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ: кубический эпителий с пролиферацией и атипической гиперплазией по типу Д-3.
Больной планируется хирургическое лечение в объеме секторальной резекции правой молочной железы со срочным гистологическим исследованием.
Результат экспертной системы для Примера 1 клинического применения показан на фиг.18.
По данным клинико-рентгенологического обследования у пациентки имеется доброкачественное образование молочной железы.
Вместе с тем экспертная система показала, что в правой молочной железе параметр W выше порогового уровня, что говорит о высоком риске рака молочной железы.
Срочное гистологическое исследование показало наличие инфильтративно-протокового рака.
Выводы: гистологическое исследование подтвердило правильность радиотермометрического заключения о высоком риске рака молочной железы.
Пример 2. Больная А. Возраст: 51 год.
ЖАЛОБЫ ПРИ ПОСТУПЛЕНИИ: образования правой молочной железы.
АНАМНЕЗ ЗАБОЛЕВАНИЯ: Уплотнение заметила сама около 2-х месяцев назад. Обратилась для обследования в РНЦРР, где при клинико-рентгенологическом обследовании был выявлен фибросклероз правой молочной железы.
СОСТОЯНИЕ БОЛЬНОГО: Положение активное. Общее состояние удовлетворительное. Телосложение правильное. Питание удовлетворительное. Кожа и видимые слизистые чистые, нормальной окраски. Лимфатические узлы нормальных размеров. Костно-мышечный аппарат без патологии. Щитовидная железа не увеличена. Молочные железы изменены: справа на границе верхних квадрантов пальпируется бугристое образование 3*4 см.
При маммографии справа на фоне жировой инволюции отрицательная динамика от 2003 г. в виде появления на границе верхних квадрантов участка тяжистости со скоплением микрокальцинатов.
При неоднократных пункциях, в том числе и под контролем "Цитогайта", цитологическое исследование: кубический эпителий.
Результат экспертной системы для Примера 2 клинического применения показан на фиг.19.
По данным цитологии клеток рака не обнаружено.
Результаты экспертной системы показали, что в правой молочной железе параметр W выше порогового уровня, что говорит о высоком риске рака молочной железы.
С предварительным диагнозом фибросклероз правой молочной железы больной проведено хирургическое лечение - секторальная резекция правой молочной железы. При срочном гистологическом исследовании - внутрипротоковый рак.
Далее была выполнена широкая секторальная резекция правой молочной железы с подмышечной лимфаденэктомией.
Гистологическое исследование:
МИКРОСКОПИЧЕСКОЕ ОПИСАНИЕ: В молочной железе (без сектора) в зоне операции фокусы внутрипротокового рака без признаков инвазивного роста. В лимфоузлах умеренный гистиоцитоз синусов, липоматоз, метастазов рака не обнаружено.
Послеоперационный период без особенности. В удовлетворительном состоянии выписывается под наблюдение районного онколога. Рекомендовано проведение ЛТ после полного заживления раны, решение вопроса о проведении гормональной терапии после консультации окулиста по месту жительства.
Вывод: результаты гистологического исследования подтвердили заключение радиотермометрического исследования о высоком риске рака молочной железы.
Пример 3. Больная Г. Возраст: 61 год.
ЖАЛОБЫ ПРИ ПОСТУПЛЕНИИ: на наличие уплотнения в левой молочной железе.
АНАМНЕЗ ЗАБОЛЕВАНИЯ: по м/ж наблюдается с 2002 г. по поводу мастопатии. Направлена в РНЦРР для консультации. При обследовании в РНЦРР выявлен узловой компонент с локальным скоплением микрокальцинатов. Госпитализирована для хирургического лечения.
Клинический диагноз: ФИБРОСКЛЕРО3 ЛЕВОЙ МОЛОЧНОЙ ЖЕЛЕЗЫ.
СОСТОЯНИЕ БОЛЬНОГО: Общее состояние удовлетворительное. Кожа и видимые слизистые чистые, нормальной окраски. Лимфатические узлы нормальных размеров. В верхне-наружном квадранте левой молочной железы пальпируется уплотнение с нечеткими контурами протяженностью до 3 см. Справа узловые образования не пальпируются.
При маммографии: на фоне фиброзной мастопатии справа на границе верхних квадрантов определяется участок перестройки структуры со скоплением микрокальцинатов. Результат прицельной биопсии: Фиброзно-жировая ткань.
ОПЕРАЦИЯ: секторальная резекция левой молочной железы.
Послеоперационный период без особенностей.
Гистологическое исследование: фиброз, простая протоковая гиперплазия, папилломатоз.
В удовлетворительном состоянии больная выписывается из хирургической клиники под наблюдение хирурга по месту жительства.
Результат экспертной системы для Примера 3 клинического применения показан на фиг.20.
Результаты экспертной системы показали, что параметр W ниже порога, что говорит о низком риске рака молочной железы. Это было подтверждено гистологическим заключением.
Выводы: Результаты гистологического заключения подтвердили выводы радиотермометрического заключения о доброкачественном характере образования.
Практическая реализация других заявленных способов аналогична описанному выше.
Таким образом, использование антенны-аппликатора согласно изобретению и различных способов с ее использованием, таких как способ определения температурных изменений внутренних тканей, способ определения температурных изменений внутренних тканей во времени, способ выявления у биологического объекта высокого риска рака, в частности высокого риска рака молочной железы, могут быть эффективно использованы для мониторинга и неинвазивной диагностики для раннего выявления онкологических заболеваний и других патологий внутренних органов, в частности для ранней диагностики рака молочной железы.
Реферат
Изобретение относится к области медицины, а именно к устройствам и способам для определения температурных изменений внутренних тканей биологического объекта, и может быть использовано для неинвазивного раннего выявления риска рака. Антенна-аппликатор содержит отрезок волновода, частично или полностью заполненный диэлектриком, имеющий один закрытый конец и противоположный открытый конец, контактирующий с биологическим объектом, систему возбуждения электромагнитных волн, расположенную в волноводе между закрытым концом волновода и диэлектриком, соединенную с входной частью микроволнового радиотермометра, и датчик температуры кожи, расположенный у открытого конца волновода, выполненный с возможностью передачи информации на вычислительное устройство. Устройство для определения температурных изменений помимо антенны-аппликатора включает микроволновый радиотермометр, измеряющий интенсивность сигнала, поступающего с выхода антенны, пропорционального яркостной температуре тканей биологического объекта, и вычислительное устройство, выполненное с возможностью приема информации от датчика температуры кожи и от микроволнового радиотермометра и определения изменения температуры внутренних тканей. Предложены также способ определения изменений внутренних тканей и способ определения изменений внутренних тканей во времени посредством одновременного измерения яркостной температуры и температуры кожи в первой и второй точках, в первый и второй момент времени, с учетом коэффициента вклада температуры кожи в яркостную температуру. Также предложены способы выявления у биологического объекта высоког
Формула
систему возбуждения электромагнитных волн, расположенную в волноводе между закрытым концом волновода и диэлектриком, соединенную с входной частью микроволнового радиотермометра, экранированный датчик температуры кожи, расположенный у открытого конца волновода, выполненный с возможностью передачи информации на вычислительное устройство.
антенну-аппликатор, содержащую:
отрезок волновода, частично или полностью заполненный диэлектриком, имеющий один закрытый конец и противоположный открытый конец, контактирующий с биологическим объектом,
систему возбуждения электромагнитных волн, расположенную в волноводе между закрытым концом волновода и диэлектриком, соединенную с входной частью микроволнового радиотермометра,
экранированный датчик температуры кожи, расположенный у открытого конца волновода, выполненный с возможностью передачи информации на вычислительное устройство;
микроволновый радиотермометр, измеряющий интенсивность сигнала, поступающего с выхода антенны, который пропорционален яркостной температуре тканей биологического объекта; и
вычислительное устройство, выполненное с возможностью приема информации от датчика температуры кожи и от микроволнового радиотермометра и определения изменения температуры внутренних тканей.
одновременное измерение яркостной температуры и температуры кожи в первой точке биологического объекта,
определение температуры внутренних тканей в первой точке по следующей формуле:

где Tintt1 - температура внутренних тканей в первой точке,
Tbr1 - яркостная температура в первой точке,
Tsk1 - температура кожи в первой точке,
К - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
одновременное измерение яркостной температуры и температуры кожи во второй точке биологического объекта,
определение температуры внутренних тканей во второй точке по следующей формуле:

где Tintt2 - температура внутренних тканей во второй точке,
Tbr2 - яркостная температура во второй точке,
Tsk2 - температура кожи во второй точке,
К - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
оценку изменения температуры внутренних тканей по формуле:
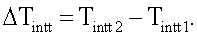
одновременное измерение яркостной температуры и температуры кожи в заданной точке биологического объекта в первый момент времени,
определение температуры внутренних тканей в первый момент времени по следующей формуле:

где Tintt1 - температура внутренних тканей в первой момент времени,
Tbrt1 - яркостная температура в первый момент времени,
Tskt1 - температура кожи в первый момент времени,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
одновременное измерение яркостной температуры и температуры кожи в той же точке биологического объекта в последующий второй момент времени,
определение температуры внутренних тканей во второй момент времени по следующей формуле:

где Tintt2 - температура внутренних тканей во второй момент времени,
Tbrt2 - яркостная температура во второй момент времени,
Tskt2 - температура кожи во второй момент времени,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
оценку изменения температуры внутренних тканей во времени по следующей формуле:

одновременное измерение яркостной температуры биологического объекта и температуры кожи биологического объекта в заданных точках,
определение температуры внутренних тканей в опорной и заданных точках по следующей формуле:

где Tintt- температура внутренних тканей в опорной или заданной точке,
Tbr - яркостная температура в опорной или заданной точке,
Tsk - температура кожи в опорной или заданной точке,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
определение уровня тепловой активности тканей D, характеризующего тепловые изменения в тканях биологического объекта, согласно выражению:

где D - уровень тепловой активности тканей,
ΔTi - повышение температуры внутренних тканей в заданных точках измерения по сравнению с температурой внутренних тканей в опорной точке, определяемое по следующей формуле:

где Tiint - температура внутренних тканей в i-й заданной точке,
Tonint - температура внутренних тканей в опорной точке,
Tisk - температура кожи в i-й заданной точке,
Tonsk - температура кожи в опорной точке,
определение параметра W, характеризующего риск рака на основе уровня тепловой активности тканей D и соотношения между температурой внутренних тканей и температурой кожи, согласно выражению

где W - параметр, характеризующий риск рака,
D - уровень тепловой активности тканей,
LL - параметр, характеризующий разницу между температурой внутренних тканей и температурой кожи биологического объекта, равный


и LD - параметр, характеризующий дисперсию разницы между температурой внутренних тканей и температурой кожи биологического объекта, равный


где U и UB - экспериментальные коэффициенты,
и определение риска рака путем сравнения параметра W, характеризующего риск рака, с пороговым уровнем риска рака.

где Tintiправ - температура внутренних тканей в i-й заданной точке правого парного органа,
Тintiлев - температура внутренних тканей в i-й заданной точке левого парного органа,
Tskiправ - температура кожи в i-й заданной точке правого парного органа,
Tskiлев - температура кожи в i-й заданной точке левого парного органа, и уровень тепловой активности тканей D определяют как
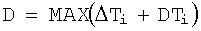
где ΔTi - повышение температуры внутренних тканей в заданных точках измерения по сравнению с температурой внутренних тканей в опорной точке,
DTi - значение разницы температур в точках измерения правого и левого парного органа.
одновременное измерение яркостной температуры биологического объекта и температуры кожи биологического объекта в, по меньшей мере, одной опорной точке,
одновременное измерение яркостной температуры молочной железы биологического объекта и температуры кожи молочной железы биологического объекта в заданных точках,
определение температуры внутренних тканей в опорной и заданных точках молочной железы по следующей формуле:

где Tint - температура внутренних тканей в опорной или заданной точке молочной железы,
Tbr - яркостная температура в опорной или заданной точке молочной железы,
Tsk - температура кожи в опорной или заданной точке молочной железы,
κ - безразмерный коэффициент, характеризующий вклад температуры кожи в яркостную температуру,
определение уровня тепловой активности тканей D, характеризующего тепловые изменения в тканях молочной железы, согласно выражению:
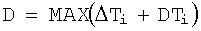
ΔTi - повышение температуры внутренних тканей в заданных точках молочной железы по сравнению с температурой в опорной точке, определяемое по следующей формуле:

где Tiint - температура внутренних тканей в i-й заданной точке молочной железы,
Tonint - температура внутренних тканей в опорной точке молочной железы,
Tisk - температура кожи в i-й заданной точке молочной железы,
Tonsk - температура кожи в опорной точке молочной железы,
DTi - значение разницы температур между правой и левой молочной железой в заданных точках, определяемое по следующей формуле:

где Tintiправ - температура внутренних тканей в i-й заданной точке правой молочной железы,
Tintiлев - температура внутренних тканей в i-й заданной точке левой молочной железы,
Tskiправ - температура кожи в i-й заданной точке правой молочной железы,
Tskiлев - температура кожи в i-й заданной точке левой молочной железы, определение параметра W, характеризующего риск рака на основе уровня тепловой активности тканей D и соотношения между температурой внутренних тканей и температурой кожи молочной железы, согласно выражению

где W - параметр, характеризующий риск рака,
D - уровень тепловой активности тканей молочной железы,
LL - параметр, характеризующий разницу между температурой внутренних тканей и температурой кожи молочной железы, равный


и LD - параметр, характеризующий дисперсию разницы между температурой внутренних тканей и температурой кожи молочной железы, равный
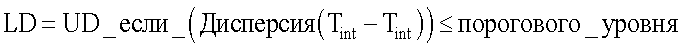

где U и UD - экспериментальные коэффициенты,
и определение риска рака путем сравнения параметра W, характеризующего риск рака, с пороговым уровнем риска рака.

Комментарии