Способ хроматографии в режиме слабого распределения - RU2457214C2
Код документа: RU2457214C2
Чертежи
















Описание
Область изобретения
[0001] Настоящее изобретение относится к способам выделения очищенного продукта из несущей жидкости (load fluid), содержащей одну или более примесь. Согласно некоторым вариантам реализации настоящего изобретения, указанный способ включает пропускание несущей жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере 1 мг продукта на 1 мл среды, и выделение очищенного продукта из элюата, выходящего из колонки в цикле загрузки а также на стадии любой по существу изократической промывки. В других вариантах реализации настоящего изобретения указанный способ включает пропускание несущей жидкости через среду при рабочих условиях, характеризуемых значением коэффициента распределения, по меньшей мере равным 0,1.
Уровень техники
[0002] В промышленной биотехнологии очистка белков в коммерческом масштабе является важной проблемой, препятствующей расширению применения рекомбинантных белков в терапевтических и диагностических целях. Развитие данного производственного сектора тормозят проблемы, связанные с выходом, чистотой и производительностью. С появлением технологии рекомбинантных белков появилась возможность получения нужного белка с использованием культур эукариотных или прокариотных клеток-хозяев, подвергнутых генетическим изменениям и способных экспрессировать ген, кодирующий данный белок. Однако при культивировании клеток-хозяев образуется смесь нужного белка с примесями, либо происходящими от самого белка, например, его изоформами, либо от клеток, например, белками клеток-хозяев. Применение подобных рекомбинантных белков в фармацевтических целях зависит от возможности качественного отделения существенных количеств белка от указанных примесей.
[0003] Известные способы очистки белков предполагают отделение целевого белка от примесей на основе различий в размере, заряде, растворимости и степени гидрофобности. Указанные способы включают хроматографические, в том числе аффинную, ионообменную, эксклюзионную хроматографию, хроматографию с гидрофобным взаимодействием, аффинную хроматографию с использованием иммобилизованных металлов и гидроксиапатитную хроматографию. В указанных способах разделение часто проводят на хроматографических средах, выбранных таким образом, чтобы обеспечить селективное удерживание целевого белка или примесей. В режиме связывания с последующим элюированием (или, для краткости, связывания-элюирования) целевой белок селективно связывается с разделяющей средой и затем его дифференциально элюируют из нее различными растворителями. В проточном режиме примеси специфически связываются с разделяющей средой при отсутствии связывания целевого белка, что позволяет получать целевой белок в выходящем потоке.
[0004] Существующие способы очистки белков, в том числе антител, включают по меньшей мере две хроматографические стадии. Например, первой стадией очистки белков часто является аффинная хроматография, использующая специфическое взаимодействие между целевым белком и иммобилизованным агентом, обеспечивающим специфическую сорбцию. Для аффинного связывания белков, таких как антитела, содержащих Fc-фрагменты, особенно полезны сорбенты на основе белка А. Однако недостатком использования хроматографии на белке А является смыв последнего, что приводит к загрязнению элюированного целевого белка. Кроме того, аффинное связывание не позволяет разделять изоформы целевого белка, в том числе агрегированные формы.
[0005] С тем, чтобы обеспечить извлечение белков, свободных от примесей, образующихся как на стадии культивирования, так и, возможно, на предыдующих стадиях очистки, различные исследователи использовали метод связывания-элюирования, проточный и вытеснительный методы хроматографии. В качестве примера можно назвать следующие группы исследователей, применявших стадию связывания-элюирования в качестве второй стадии очистки после стадии аффинного связывания: авторы патента США US 4,983,722, в котором предложен способ снижения содержания белка А в смеси путем использования ионообменной хроматографии в режиме связывания-элюирования; авторы патента США US 5,429,746, предложившие способ выделения антител IgG из смеси, загрязненной белком А, при помощи хроматографии с гидрофобным взаимодействием в режиме связывания-элюирования; авторы патента США US 5,644,036, предложившие трехстадийный способ выделения очищенных препаратов антител IgG, включающий стадии разделения на белке А, ионообменной хроматографии в режиме связывания-элюирования и эксклюзионной хроматографии. Другие группы исследователей после стадии аффинной хроматографии использовали очистку в проточном режиме. Например, в заявке РСТ WO 04/076485 предложен способ удаления примеси белка А из антител, очищенных хроматографией на белке А, с последующей стадией ионообменной хроматографии в проточном режиме. В заявке РСТ WO 03/059935 предложен способ очистки белков, включающий стадии хроматографии на гидроксиапатите в проточном режиме и последующей аффинной хроматографии.
[0006] В целях избежания проблем, связанных с предшествующими стадиями очистки, другие группы исследователей применяли одностадийные схемы полной очистки. Например, в патенте США US 6,177,548 предложен одностадийный способ удаления агрегатов из биологического образца, основанный на ионном обмене в проточном режиме, согласно которому рН образца доводят до значения, на 0,2 лог. ед. меньше изоэлектрической точки образца. В патенте США US 5,451,662 предложен одностадийный способ разделения смесей неочищенных белков путем ионного обмена в режиме связывания-элюирования, согласно которому рН смеси доводят до значения, лежащего между изоэлектрическими точками разделяемых фракций белков. В заявке РСТ WO 05/044856 предложен одностадийный вытеснительный способ удаления высокомолекулярных агрегатов из препаратов антител с использованием гидроксиапатитной хроматографии.
[0007] Ни один из известных способов, использующих режим связывания с последующим элюированием или проточный режим, однако, не способен удовлетворить всем требованиям биотехнологической промышленности, в том числе по производительности, выходу и чистоте продукта. Способы связывания с последующим элюированием и вытеснительный способ ограничены, помимо прочих факторов, предельной емкостью разделительной среды по целевому белку. С другой стороны, проточные способы способны обеспечивать разделение при более высоких нагрузках, но они ограничены емкостью разделительной среды по примесям. При использовании проточных способов не происходит существенного связывания целевого продукта с колонкой, и любое связывание продукта рассматривают как фактор, понижающий выход. До сих пор сохраняется потребность в способах высокопроизводительного получения очищенных белков, удовлетворяющих таким требованиям по чистоте и выходу, которые обеспечивают возможность их применения в терапии и диагностике. Кроме того, в процессах промышленного производства возникают потребности в надежных, мощных и экономически эффективных схемах очистки.
Описание изобретения
[0008] Настоящее изобретение относится к способам выделения очищенного продукта из несущей жидкости, содержащей по меньшей мере одну примесь, путем пропускания несущей жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере 1 мг продукта на 1 мл указанной среды, и выделения очищенного продукта в элюате, выходящем из колонки в цикле подачи нагрузки, а также при любой по существу изократической промывке. В других вариантах реализации настоящего изобретения указанные рабочие условия обеспечивают связывание по меньшей мере 5 мг продукта на 1 мл среды. В одном из вариантов реализации настоящего изобретения указанные рабочие условия обеспечивают связывание по меньшей мере 10 мг продукта на 1 мл среды. В других вариантах реализации настоящего изобретения указанные рабочие условия обеспечивают связывание по меньшей мере 20, 30, 40, 50 и 60 мг продукта на 1 мл среды.
[0009] Кроме того, настоящее изобретение относится к способам выделения очищенного продукта из несущей жидкости, содержащей по меньшей мере одну примесь, путем пропускания указанной несущей жидкости через среду при рабочих условиях, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1, и выделения очищенного продукта в элюате, выходящем из колонки в цикле подачи нагрузки и при любой по существу изократической промывке. Согласно одному из вариантов реализации настоящего изобретения коэффициент распределения составляет примерно от 0,2 до примерно 20,0. В другом варианте реализации настоящего изобретения коэффициент распределения составляет примерно от 0,2 до примерно 10,0. В других вариантах реализации настоящего изобретения коэффициент распределения составляет примерно от 1,0 до примерно 5,0. Еще в одном варианте реализации настоящего изобретения коэффициент распределения составляет примерно от 0,5 до примерно 5,0. В дополнительном варианте реализации настоящего изобретения коэффициент распределения составляет примерно от 0,5 до примерно 1,5.
[0010] Настоящее изобретение также относится к способам выделения очищенного продукта из несущей жидкости, которая содержит по меньшей мере одну примесь, путем пропускания указанной несущей жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере от 1 до порядка 70 мг продукта на 1 мл среды и характеризуемых значением коэффициента распределения от 0,3 до 20, и выделения очищенного продукта в элюате, выходящем из колонки в цикле нагрузки и при любой по существу изократической промывке.
[0011] Настоящее изобретение также относится к определению на стадии скрининга рабочих условий, обеспечивающих связывание по меньшей мере 1 мг продукта на 1 мл среды, или, в порядке альтернативы, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1. Стадия скрининга может включать исследование связывания в статическом режиме или на колонке, такие как изократическое или градиентное элюирование.
[0012] К рабочим условиям в зависимости от используемой среды относятся значение рН, ионная сила, концентрация солей, концентрация эксципиентов ((наполнителей) в том числе фосфатов, кальция, аргинина, глицина, N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (HEPES)) и количество противолигандов (например, концентрация имидазола).
[0013] В качестве среды используют любой тип сорбента (смолы) для хроматографии или разделительной среды, в том числе анионообменные и катионообменные заряженные ионообменные смолы, сорбенты для хроматографии с гидрофобным взаимодействием, гидроксиапатиты и сорбенты для аффинной хроматографии с иммобилизованными металлами.
[0014] Очищенные продукты, которые можно выделять с применением настоящего изобретения, включают гибридные белки, белки, содержащие Fc-фрагменты, иммуноконъюгаты, цитокины, интерлейкины, гормоны и терапевтические ферменты.
[0015] Примеси, удаляемые с использованием настоящего изобретения, включают белки клеток-хозяев, нуклеиновые кислоты, изоформы продукта, эндотоксины, белок А и вирусы.
[0016] Согласно одному из вариантов реализации настоящего изобретения, хроматографическая среда обеспечивает удаление из несущей жидкости по меньшей мере 99,9% примесей, в том числе белков клеток-хозяев, нуклеиновых кислот, изоформ продукта, эндотоксинов и белка А.
[0017] Согласно другому варианту реализации настоящего изобретения, концентрация изоформ продукта в очищенном продукте не превышает примерно 2%.
[0018] В дополнительных вариантах реализации настоящего изобретения величина нагрузки среды может составлять по меньшей мере 500 мг или по меньшей мере 1000 мг на 1 мл среды.
[0019] Согласно одному из аспектов настоящего изобретения, выделение очищенного продукта из несущей жидкости, содержащей по меньшей мере одну примесь, осуществляют посредством пропускания несущей жидкости через заряженную ионообменную среду при рабочих условиях, которые включают значения рН и ионной силы, обеспечивающие связывание по меньшей мере 1 мг продукта на 1 мл среды, или, в качестве альтернативы, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1.
[0020] Согласно другому аспекту настоящего изобретения, выделение очищенного продукта из несущей жидкости, содержащей по меньшей мере одну примесь, осуществляют при пропускании несущей жидкости через сорбент для хроматографии на основе гидрофобных взаимодействий при рабочих условиях, которые включают значения рН, ионной силы и концентрации солей, обеспечивающие связывание по меньшей мере 1 мг продукта на 1 мл среды, или, в качестве альтернативы, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1.
[0021] Согласно еще одному из аспектов настоящего изобретения, выделение очищенного продукта из несущей жидкости, содержащей по меньшей мере одну примесь, осуществляют при пропускании несущей жидкости через гидроксиапатитный сорбент при рабочих условиях, которые включают значения рН, ионной силы и концентраций фосфат-ионов, кальция, аргинина, глицина, буфера HEPES и имидазола, обеспечивающие связывание по меньшей мере 1 мг продукта на 1 мл среды, или, в качестве альтернативы, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1.
[0022] Согласно еще одному из аспектов настоящего изобретения, выделение очищенного продукта из несущей жидкости, содержащей по меньшей мере одну примесь, осуществляют при пропускании несущей жидкости через сорбент для аффинной хроматографии, содержащий иммобилизованные металлы, при рабочих условиях, которые включают уровень контрлиганда, значения рН и ионной силы, обеспечивающие связывание по меньшей мере 1 мг продукта на 1 мл среды, или, в качестве альтернативы, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1.
[0023] Возможно сочетание предложенных в настоящем изобретении способов по меньшей мере еще с одной стадией очистки. Дополнительные стадии очистки могут быть выполнены до или после применения предложенного в настоящем изобретении способа. Например, способы согласно настоящему изобретению можно комбинировать с хроматографией на белке А в качестве начальной стадии очистки.
[0024] Согласно одному из вариантов реализации настоящего изобретения, жидкость, содержащую продукт, элюируют из колонки с белком А с использованием буферного элюента с низкой ионной силой. рН и проводимость содержащей продукт жидкости регулируют с помощью нейтрализирующего буфера так, чтобы ионная сила содержащей продукт жидкости, которую далее используют в качестве нагрузки, не превышала 20 мМ. Полученную несущую жидкость пропускают через анионообменную среду при рабочих условиях, определенных согласно настоящему изобретению.
[0025] В некоторых вариантах реализации настоящего изобретения буферный раствор - элюент содержит молекулы с заряженными катионными группами, рКа которых составляет 6,5-10. В других вариантах реализации настоящего изобретения буферный раствор - элюент дополнительно содержит молекулы с заряженными анионными группами, рКа которых составляет 2-5. В некоторых вариантах реализации настоящего изобретения буферный раствор элюента содержит молекулы цвиттерионов с рН, равным 7-9.
[0026] Настоящее изобретение также обеспечивает очищенные продукты, в том числе белки и антитела, полученные способами, предложенными в настоящем изобретении.
[0027] Дополнительные задачи и преимущества настоящего изобретения будут описаны в следующем далее описании, частично очевидны из описания или могут быть определены при применении настоящего изобретения на практике. Задачи и преимущества настоящего изобретения реализуются и достигаются с использованием элементов и сочетаний, отдельно определенных в формуле настоящего изобретения.
[0028] Следует понимать, что как настоящее общее описание, так и последующее подробное описание приведены только в качестве примера и для пояснения и не являются ограничительными для объема настоящего изобретения.
[0029] Рисунки, сопровождающие настоящее изобретение, включены в настоящее описание, составляют его часть, и вместе с описанием данного изобретения служат для пояснения принципов настоящего изобретения.
Краткое описание фигур
[0030] На Фиг.1 показаны (А) отношение между коэффициентом распределения и изотермой адсорбции продукта и (В) изотермы адсорбции продукта на смоле в трех режимах: связывания-элюирования, слабого распределения и проточном режиме.
[0031] На Фиг.2 показаны (А) области значений коэффициента распределения для ионообменной хроматографии в трех режимах: связывания-элюирования, слабого распределения и проточного, и (В) области значений коэффициента распределения для трех режимов хроматографии на гидроксиапатите.
[0032] На Фиг.3 показаны схематические хроматограммы для трех режимов работы: связывания-элюирования, слабого распределения и проточного.
[0033] На Фиг.4 показаны для сравнения хроматограммы в режиме слабого распределения и в проточном режиме.
[0034] На Фиг.5 показаны (А) типичные профили удаления примесей в зависимости от значения Кр и (В) выход целевого продукта в зависимости от величины нагрузки и значения Кр.
[0035] На Фиг.6 показана типичная последовательность определения стадий хроматографии в режиме слабого распределения, включающая: 1) высокопроизводительный скрининг для определения значений Кр; 2) опыты с низкой величиной нагрузки; 3) опыты с высокой величиной нагрузки для определения емкости; 4) опыты с оптимальной для режима слабого распределения нагрузкой.
[0036] На Фиг.7 показана диаграмма значений Кр в зависимости от значений рН и общей концентрации хлоридов, определенных из набора данных, полученных при низкой концентрации, как описано в Эксперименте 1.1.
[0037] На Фиг.8 показано количество удаляемого белка А в зависимости от значения коэффициента распределения Кр согласно описанию Эксперимента 1.1. Логарифм количества удаляемого белка увеличивается с ростом Кр. Проточный режим обозначен в пунктирной рамке как FT, режим слабого распределения - как WP.
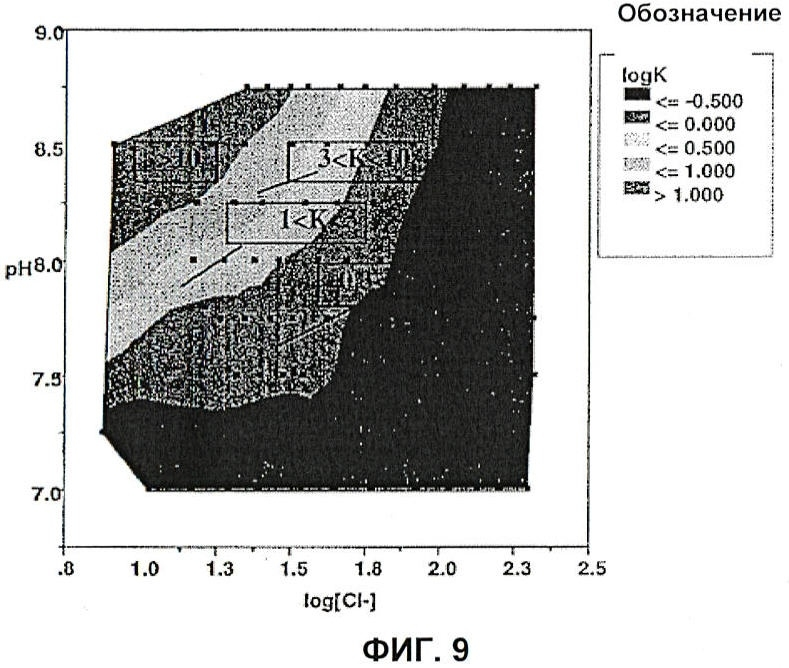
[0038] На Фиг.9 показана диаграмма значений IgКp в зависимости от значения рН и логарифма общей концентрации хлоридов согласно описанию в Эксперименте 2.1.
[0039] На Фиг.10 приведены профили прохождения через колонку (А) белков клеток-хозяев и (В) белка А в зависимости от значения Кр при ионообменной хроматографии антитела Маb-ААВ.
[0040] На Фиг.11 показан оптимальный ряд рабочих значений Кр при хроматографии антитела Mab-MYA на гидроксиапатите в режиме слабого распределения. Оптимальное значение Кр в данном примере находится в диапазоне 1,5-20.
[0041] На Фиг.12 приведен оптимальный ряд рабочих значений Кр при хроматографии антитела Маb-А5Т4 на гидроксиапатите в режиме слабого распределения. Оптимальное значение Кр в данном примере находится в диапазоне 2-20.
[0042] На Фиг.13 приведен оптимальный ряд рабочих значений Кр при хроматографии антитела Mab-MYO на гидроксиапатите в режиме слабого распределения. Оптимальное значение Кр в данном примере находится в диапазоне 5-20.
Подробное описание изобретения
А. Определения
[0043] С целью облегчения понимания настоящего изобретения вначале приводятся определения некоторых терминов. Дополнительные определения приведены в подробном описании настоящего изобретения.
[0044] Термин «Проточный режим» означает способ разделения препаратов продуктов, согласно которому по меньшей мере один продукт, содержащийся в препарате, проходит через хроматографический сорбент или хроматографическую среду, в то время как по меньшей мере одно потенциальное загрязнение или примесь связывается с сорбентом или средой. Обычно коэффициент распределения продукта в проточном режиме составляет менее 0,1, а концентрация связываемого продукта - менее 1 мг/мл. Проточный режим является изократической операцией.
[0045] Термин «Режим связывания с последующим элюированием» (или «Режим связывания-элюирования») означает способ разделения препаратов продуктов, согласно которому по меньшей мере один продукт, содержащийся в препарате, связывается с хроматографическим сорбентом или хроматографической средой. Коэффициент распределения продукта в режиме связывания-элюирования обычно превышает 20; концентрация связываемого продукта составляет 1-20 мг/мл. Связанный подобным образом продукт элюируют в ходе соответствующей стадии.
[0046] Термин «Режим слабого распределения» означает способ разделения препаратов продуктов, согласно которому по меньшей мере один продукт, содержащийся в препарате, и по меньшей мере одно загрязнение или одна примесь связываются с хроматографически сорбентом или хроматографической средой. Количество связываемого продукта в данном режиме составляет по меньшей мере 1 мг продукта на 1 мл сорбента или среды. Коэффициент распределения продукта при этом обычно составляет по меньшей мере 0,1. Режим слабого распределения представляет собой изократическую операцию.
[0047] Термин «Коэффициент распределения» (Кр) означает равновесное отношение концентрации продукта, поглощенного сорбентом (Q), к концентрации продукта в растворе (с) при определенных значениии рН и составе раствора. Коэффициент распределения Кр связан с изотермами адсорбции продукта (см. Фиг.1). Коэффициент распределения соответствует углу наклона изотермы адсорбции продукта при крайне низких концентрациях раствора. Он также связан с максимальной емкостью следующим уравнением:
Кр=Q/C=Qmax/kd,
где Qmax - максимальная емкость сорбента по отношению к продукту, kd - константа диссоциации для взаимодействия сорбента с продуктом. Коэффициент распределения обычно измеряют путем экспериментов в статическом режиме, однако возможно использование других способов, в том числе изократической хроматографии.
[0048] Термин «Связанный продукт» (Q) означает количество продукта, связывающегося с сорбентом в состоянии равновесия с потоком.
[0049] Термин «Антитело» означает любой иммуноглобулин или его фрагмент и охватывает любые полипептиды, содержащие фрагмент, связывающийся с антигенами. Данный термин включает поликлональные, моноклональные, моноспецифические, полиспецифические, неспецифические, гуманизированные, человеческие, одноцепочечные, химерные, синтетические, рекомбинантные, гибридные, мутантные, привитые и полученные in vitro антитела, но не ограничивается ими. Термин «антитела» также охватывает фрагменты антител, в том числе Fab, F(ab')2, Fv, scFv, Fd, dAb и другие фрагменты антител, сохраняющие способность связываться с антигенами. Обычно подобные фрагменты содержат домен, связывающийся с антигенами.
[0050] В некоторых вариантах реализации настоящего изобретения антитела содержат СH2/СH3-фрагмент и поэтому поддаются очистке хроматографией на белке А. Термин «СH2/СH3-фрагмент» относится к аминокислотным остаткам фрагмента Fc молекулы иммуноглобулина, взаимодействующим с белком А. В некоторых вариантах реализации настоящего изобретения СH2/СH3-фрагмент содержат неизмененный СH2-фрагмент и следующий за ним неизмененный СH3-фрагмент.В других вариантах реализации настоящего изобретения СH2/СH3-фрагмент содержит Fc-фрагмент иммуноглобулина. Примерами белков, содержащих СH2/СH3-фрагмент, являются антитела, иммуноадгезивы и гибридные белки, содержащие целевой белок, слитый или конъюгированный с СH2/СH3-фрагментом.
[0051] Термин «нагрузка» относится к любому загружаемому в колонку материалу, содержащему целевой продукт и полученному либо из осветленных клеточных культур, либо из кондиционированной ферментационной среды или из частично очищенного промежуточного продукта, полученного на стадии хроматографии. Термин «несущая жидкость» означает жидкость, содержащую материал нагрузки и пропускаемую через среду при рабочих условиях согласно настоящему изобретению.
[0052] Термин «примесь» означает любые чужеродные или нежелательные молекулы, в том числе биологические макромолекулы, такие как ДНК, РНК и белки, отличные от очищаемого целевого белка и присутствующие в образце, который подвергают очистке. К примесям относятся, например: изоформы белка, в том числе его агрегаты, фракции с высокой молекулярной массой, низкомолекулярные фракции и фрагменты и дезамидированные молекулы; белки, отличные от целевого и выделяемые клетками-хозяевами (белки клеток-хозяев); белки, являющиеся частью абсорбента, используемого при аффинной хроматографии и вымываемые вместе с образцом в ходе предшествующих стадий очистки, например, белок А; эндотоксины; вирусы.
[0053] Термин «по существу изократический раствор» означает раствор, состав и рН которого лишь незначительно отличаются от соответствующих величин для несущей жидкости.
[0054] Термин «колоночный элюат» (column effluent) означает жидкость, выходящую из среды или колонки в течение цикла подачи нагрузки или в период контакта с нагрузкой.
[0055] Термин «величина нагрузки» означает общее количество продукта, загруженного в колонку в цикле подачи нагрузки при проведении хроматографии или приводимого в контакт с сорбентом в ходе статического связывания, измеренное в единицах массы продукта на единицу объема сорбента.
[0056] Термин «Логарифмическая степень очистки (ЛСО)» означает десятичный логарифм отношения массы примесей в нагрузке перед стадией очистки к массе примесей в очищенной целевой фракции.
[0057] Термин «изократическая хроматография» означает работу хроматографической колонки с использованием растворителя, сила которого не меняется в ходе рабочего периода.
В. Описание способа
[0058] В настоящем изобретении предложены способы выделения очищенных продуктов из несущей жидкости, содержащей по меньшей мере одну примесь. Изобретение может быть использовано для широкомасштабного получения белков для терапевтических и диагностических целей.
1. Режим слабого распределения
[0059] Заявители неожиданно обнаружили, что в режиме хроматографии, промежуточном между известными режимами (связывания-элюирования и проточным), возможно достижение высокой степени удаления примесей и высокого выхода продукта, а также использование высоких величин нагрузок по продукту. Заявители назвали указанный промежуточный режим связывания «режимом слабого распределения».
[0060] В режиме слабого распределения несущую жидкость, содержащую целевой продукт и по меньшей мере одну примесь, пропускают через хроматографическую среду, с которой связываются как продукт, так и примеси. Однако примеси связываются со средой сильнее, чем продукт, и по мере продолжения подачи нагрузки, несвязанный продукт проходит через указанную среду и может быть выделен из элюата, выходящего из колонки. Дополнительно можно провести промывку хроматографической среды в изократических условиях для выделения дополнительных количеств слабо связанного со средой продукта, и затем объединить очищенный продукт, полученный при по существу изократической промывке, с очищенным продуктом из элюата, полученного в цикле подачи нагрузки.
[0061] В соответствии с настоящим изобретением режим слабого распределения характеризуется рабочими условиями, обеспечивающими связывание по меньшей мере 1 мг продукта на 1 мл среды. В одном варианте реализации настоящего изобретения рабочие условия обеспечивают связывание по меньшей мере 5 мг продукта на 1 мл среды. В другом варианте реализации настоящего изобретения рабочие условия обеспечивают связывание по меньшей мере 10 мг продукта на 1 мл среды. В еще одном варианте реализации настоящего изобретения рабочие условия обеспечивают связывание по меньшей мере 20 мг продукта на 1 мл среды.
[0062] Согласно некоторым вариантам реализации настоящего изобретения, общая масса продукта, которая оказывается связанной с указанной средой, составляет по меньшей мере 10% общей массы продукта, загруженного в среду. В некоторых других вариантах реализации настоящего изобретения общая масса продукта, которая оказалась связанной с указанной средой, составляет по меньшей мере 20% общей массы продукта, загруженного в среду. В других вариантах реализации настоящего изобретения общая масса продукта, связанного со средой, составляет по меньшей мере 30% общей массы продукта, загруженного в среду.
[0063] В соответствии с настоящим изобретением, режим слабого распределения также характеризуется значением коэффициента распределения, которое составляет по меньшей мере 0,1. В некоторых вариантах реализации настоящего изобретения работа в режиме слабого распределения подразумевает работу в условиях, характеризуемых значением коэффициента распределения, в диапазоне от примерно 0,2 до примерно 20,0. В других вариантах реализации настоящего изобретения работа в указанном режиме подразумевает работу в условиях, характеризуемых значением коэффициента распределения, которое находится в диапазоне от примерно 0,2 до примерно 10,0. В других вариантах реализации настоящего изобретения работа в данном режиме подразумевает работу в условиях, характеризуемых значением коэффициента распределения, которое находится в диапазоне от примерно 1,0 до примерно 5,0. В других вариантах реализации настоящего изобретения работа в режиме слабого распределения подразумевает работу в условиях, характеризуемых значением коэффициента распределения, которое находится в диапазоне от примерно 0,5 до примерно 5,0. В других вариантах реализации настоящего изобретения работа в данном режиме подразумевает работу в условиях, характеризуемых значением коэффициента распределения, которое находится в диапазоне от примерно 0,5 до примерно 1,5.
[0064] По меньшей мере один вариант реализации настоящего изобретения предусматривает рабочие условия режима слабого распределения, обеспечивающие связывание по меньшей мере от примерно 1 до примерно 70 мг продукта на 1 мл среды и характеризуемые значением коэффициента распределения, равным от 0,3 до 20.
[0065] На Фиг.1 приведены изотермы адсорбции продукта в режимах связывания-элюирования, слабого распределения и в проточном режиме. Видно, что связывание продукта в режиме слабого распределения является промежуточным по сравнению с режимом связывания-элюирования и проточным режимом. Поскольку значение коэффициента распределения продукта Кр является отношением концентрации адсорбированного продукта к концентрации продукта в растворе, значения Кр в режиме слабого распределения также являются промежуточными по сравнению с режимом связывания-элюирования и проточным режимом.
[0066] На Фиг.2А показаны области значений коэффициентов распределения для режимов связывания-элюирования и слабого распределения и проточного режима в зависимости от ионной силы. Оказывается, что коэффициент распределения примесей Kimp в режиме слабого распределения выше, чем в проточном режиме. В более жестких условиях режима слабого распределения повышение производительности способа в отношении выхода продукта достигается по сравнению с проточным режимом вследствие более сильного связывания примесей, а по сравнению с режимом связывания-элюирования вследствие очень слабого связывания продукта по сравнению с примесями и использования им малой части емкости сорбента. В более жестких условиях связывания коэффициент распределения примесей Kimp повышается, что обеспечивает снижение остаточных концентраций примесей в объединенных фракциях продукта в режиме слабого распределения по сравнению с целевой фракцией в проточном режиме. Области проточного режима и режимов слабого распределения и связывания-элюирования для гидроксиапатитной хроматографии в зависимости от концентраций фосфат-ионов и NaCl показаны на Фиг.2В.
[0067] В Таблице А обобщены различия характеристик трех режимов связывания: связывания-элюирования (В-Е), слабого распределения (WP) и проточного (FT).
[0068] Режим слабого распределения также отличается от режима связывания-элюирования и проточного режима по характеру хроматограмм, как показано на Фиг.3. На первый взгляд, хроматограммы, полученные в проточном режиме и режиме слабого распределения, кажутся почти одинаковыми, поскольку продукт выделяют из элюата и промывочных фракций в изократических условиях. Однако на хроматограммах существуют небольшие, но заметные отличия, по которым данные режимы можно отличить друг от друга. Как видно из Фиг.4, по сравнению с проточным режимом, в режиме слабого распределения в профиле начального проскока наблюдают появление продукта на выходе из колонки с запаздыванием при объеме элюата более 0,1 объема колонки. В режиме слабого распределения наблюдают также более медленное вымывание продукта из колонки. Также возможно появление небольшого десорбционного пика, который соответствует степени связывания сорбентом продукта в количестве 10-50% от концентрации продукта в подаваемой нагрузке. Данная часть продукта может быть выделена путем промывки сорбента изократическим раствором в количестве 1-5 объемов колонки после завершения цикла подачи нагрузки (load cycle) и выделения продукта с элюатом.
[0069] На Фиг.5А показаны общие тенденции величины ЛСО примесей для различных диапазонов значений коэффициента распределения продукта. При значениях Кр, соответствующих проточному режиму, величина ЛСО примесей относительно низка. Работа в условиях более высоких значений Кр значительно увеличивает ЛСО во фракциях элюата до выхода из колонки примесей. Как показано в примерах, работа при повышенных значениях Кр увеличивает ЛСО по меньшей мере на 2 лог. ед. по сравнению с обычными проточными условиями.
[0070] Повышение Кр обычно повышает связывание с сорбентом как продукта, так и примесей. Более сильное связывание примесей при более высоких значениях Кр ведет к более высокой ЛСО во фракциях элюата до момента проскока примесей на выходе из колонки. Однако величина нагрузки в точке проскока примесей при повышении Кр падает, поскольку продукт начинает конкурировать с примесями за связывающие центры сорбента, что схематически представлено на Фиг.5А верхней кривой Кр. Поэтому режим слабого распределения соответствует интервалу рабочих условий, в котором повышение ЛСО примесей и требования к емкости колонки для конкретного процесса разделения сбалансированы.
[0071] Верхний предел Кр для хроматографии в режиме слабого распределения также зависит от величины нагрузки на колонку, что показано на Фиг.5В. Коэффициент распределения не оказывает влияния на выход продукта, если его значения лежат вблизи границы интервала условий проточного режима. При больших значениях Кр выход продукта начинает падать, поскольку изократические условия промывки оказываются неэффективными для вымывания связанного с колонкой продукта при использовании приемлемых объемов промывочного раствора. Величина потери продукта, связанная с неэффективной промывкой, зависит от величины нагрузки наряду с природой и количеством примесей. Так, нижний предел интервала рабочих условий режима слабого распределения определяется требованиями к степени удаления примесей, тогда как верхний - ограничениями по выходу продукта или производительности при заданной величине нагрузки.
[0072] По меньшей мере в одном из вариантов реализации настоящего изобретения оптимальные условия режима слабого распределения могут быть определены с использованием следующей последовательности экспериментов, что показано на Фиг.6:
1) для определения коэффициентов распределения продукта Кр в зависимости от рабочих условий проводится высокопроизводительный скрининг (или стандартные эксперименты по статическому связыванию). По полученным данным определяют область слабого распределения (0,1<Кр<20);
2) после определения области слабого распределения предпочтительно проводят предварительные опыты на небольшой колонке при величине нагрузки, близкой к обычно используемой в проточном режиме (примерно 50 мг/мл). На основании значений степени очистки от примесей и выхода продукта, полученных в данных опытах, можно провести более точную оценку интервала, соответствующего режиму слабого распределения;
3) после этого, более предпочтительно, получают данные по проскоку примесей для нескольких значений Кр, лежащих в области слабого распределения. На основании указанных данных выбирают оптимальное значение коэффициента распределения, лежащее в области слабого распределения и обеспечивающее наиболее высокую степень удаления примесей и приемлемую величину нагрузки;
4) наконец, наиболее предпочтительно, проводят испытания в режиме хроматографии слабого распределения при оптимальных значениях Кр, и затем проводят отладку для определения точной величины нагрузки и объема промывного раствора для достижения оптимальных значений выхода и степени удаления примесей.
[0073] Специалист в данной области сможет с легкостью использовать вышеприведенные указания или модифицировать их так, чтобы определить параметры режима слабого распределения, обеспечивающие более высокую степень очистки от примесей при величинах нагрузки, сравнимых с обычными величинами нагрузки в проточном режиме или в режиме связывания-элюирования или превышающих их. Общая концепция, изложенная выше, с небольшими изменениями при наличии таковых, может быть применена для разработки схем очистки с использованием ионообменной хроматографии, хроматографии с гидрофобным взаимодействием, гидроксиапатитной хроматографии или хроматографической системы, сочетающей любые из указанных типов взаимодействий.
2. Техника разделения
[0074] Режим слабого распределения может быть использован с любым хроматографическим сорбентом или любой хроматографической средой, предназначенными для отделения продукта от примесей. В одном из вариантов реализации настоящего изобретения хроматографической средой является заряженная ионообменная смола. Ионный обмен является формой хроматографии, в которой разделение происходит в соответствии с суммарным зарядом. Разделение молекул является результатом конкуренции между заряженным целевым продуктом и противоионами за противоположно заряженные лигандные группы, содержащиеся в ионообменной среде. Взаимодействия, посредством которых происходит связывание продукта с ионообменной средой, зависят от суммарного заряда продукта. Последний зависит от рН и ионной силы среды, влияющих на различные зарядовые характеристики аминокислот и других компонентов на наружной поверхности молекул целевого продукта.
[0075] Ионообменные смолы, которые можно применять в настоящем изобретении, включают анионообменные и катионообменные смолы. Анионообменные смолы могут содержать такие заместители, как например диэтиламиноэтильные ((DEAE), триметиламиноэтильные (ТМАЕ), кватернизованные аминоэтильные (QAE) и кватернизованные аминные (Q) группы. Катионообменные смолы могут содержать такие заместители, как наподобие карбоксиметильные (СМ), сульфоэтильные (SE), сульфопропильные (SP), фосфатные (Р) и сульфонатные (S) группы. Ионообменные смолы на целлюлозной основе, например, DE23, DE32, DE52, СМ-23, СМ-32 и СМ-52, поставляются компанией Whatman Ltd., Мэдстоун (Maidstone), Кент, Великобритания. Также известны ионообменные смолы на основе сефадексов и сшитые ионообменные смолы. Например, компанией Amersham Biosciences, Пискатавэй (Piscataway), Нью-Джерси, США поставляются DEAE-, QAE-, СМ- и SP-сефадексы, DEAE-, Q-, СМ- и S-сефарозы и сефароза. Компания Toso Haas Co., Филадельфия, Пенсильвания, США поставляет смолы на основе сополимеров, содержащих этиленгликольметакрилат и модифицированных DEAE и СМ, например, TOYOPEARL™ DEAE-650S или М и TOYOPEARL™ СМ-650S или М.
[0076] В некоторых вариантах реализации настоящего изобретения для очистки продукта в режиме слабого распределения применяют хроматографию с гидрофобным взаимодействием. Данный вид хроматографии является техникой разделения молекул, основанной на их гидрофобности. При этом на сорбент обычно подают пробу, содержащую молекулы образца в солевом буфере высокой концентрации. Соли, содержащиеся в буфере, взаимодействуют с молекулами воды, что приводит к снижению сольватации молекул в растворе. При этом гидрофобные участки молекул образца открываются, и молекулы последовательно абсорбируются хроматографической средой. Количество соли, необходимое для того, чтобы вызвать связывание, снижается с ростом гидрофобности молекулы. Поэтому взаимодействия, которые обуславливают связывание молекул продукта с хроматографической средой, зависят от таких условий, как рН, ионная сила и концентрация соли в среде.
[0077] Коммерчески доступные сорбенты для хроматографии с гидрофробным взаимодействием, использование которых возможно в настоящем изобретении, включают сорбенты, на гелевой основе (например, сшитую агарозу или синтетический сополимер), к которой происоединены гидрофобные лиганды (например, алкильные или арильные группы). Примерами подобных сорбентов являются сорбенты Phenyl SEPHAROSE™ 6 FAST FLOW (компания Pharmacia LKB Biotechnology, AB, Швеция), Phenyl SEPHAROSE™ High Performance (компания Pharmacia LKB Biotechnology, AB, Швеция), Octyl SEPHAROSE™ High Performance (компания Pharmacia LKB Biotechnology, AB, Швеция), Fractogel™ EMD Propyl или FRACTOGEL™ EMD Phenyl (E.Merck, Германия), MACRO-PREP™ Methyl или MACRO-PREP™ t-butyl (компания Bio-Rad, Калифорния, США), WP HI-PropyI (С3)™ (компания J.T.Baker, Нью-Джерси, США) и TOYOPEARL™ ether, phenyl или butyl (компания TosoHaas, Пенсильвания, США).
[0078] В других вариантах реализации настоящего изобретения для очистки продукта в режиме слабого распределения используют хроматографию на гидроксиапатитах. Гидроксиапатитная хроматография представляет собой технику, в которой в качестве матрицы и лиганда используют нерастворимый основной фосфат кальция формулы [Са10(РO4)6(ОН)2]. Функциональные группы данной хроматографической среды состоят из пар положительно заряженных ионов кальция (С-участки) и скоплений отрицательно заряженных фосфат-ионов (Р-участки). Взаимодействия, связывающие продукт с гидроксиапатитной средой, зависят от таких условий, как рН, ионная сила и концентрации эксципиентов, в том числе фосфат-ионов, кальция, аргинина, глицина и HEPES в среде. В настоящем изобретении могут быть использованы различные коммерчески доступные гидроксиапатитные сорбенты.
[0079] В других вариантах реализации настоящего изобретения для очистки продукта в режиме слабого распределения применяют аффинную хроматографию с использованием иммобилизованных металлов. Данный вид хроматографии основан на взаимодействии между хелатированными переходными металлами, иммобилизованными на сорбенте, и имидазольными боковыми цепями гистидиновых остатков целевого продукта. Разделение молекул происходит за счет конкуренции между целевым продуктом и противолигандами металлсодержащих групп сорбента. Взаимодействия, связывающие продукт и металлсодержащую хроматографическую среду, зависят от таких условий, как содержание противолигандов, в том числе концентрации имидазола, и ионной силы среды. В настоящем изобретении могут быть использованы различные коммерчески доступные сорбенты для данного вида хроматографии.
3. Очищаемые продукты
[0080] Настоящее изобретение может быть использовано для очистки в коммерческом масштабе различных целевых продуктов, в том числе природных белков, гибридных белков, белков, содержащих Fc-фрагменты, иммуноконъюгатов, цитокинов, интерлейкинов, гормонов и ферментов для терапевтического применения. Согласно одному варианту реализации настоящего изобретения, подвергающийся очистке белок может содержать по меньшей мере один домен константной части иммуноглобулина. Согласно другому варианту реализации настоящего изобретения, белки также могут содержать единичные или множественные домены вариабельной части иммуноглобулина. В еще одном из вариантов реализации содержащий Fc-фрагмент белок, может содержать антитело. Белки могут происходить из различных источников, в том числе культур рекомбинантных линий прокариотических или эукариотических клеток-хозяев.
[0081] Препараты антител согласно настоящему изобретению могут быть выделены из многих источников, в том числе сыворотки вакцинированных животных, асцитной жидкости, супернатантов гибридом или миелом, кондиционированной среды, полученной при культивировании рекомбинантных линий клеток, экспрессирующих антитела, и из любых экстрактов клеток, продуцирующих антитела, но не ограничиваясь таковыми. В одном из вариантов реализации настоящего изобретения очистке подвергают антитела из кондиционированной среды культур клеток или различных рекомбинантных линий клеток, продуцирующих антитела. Хотя можно ожидать некоторые различия между разными линиями клеток и между разными антителами, приспособление настоящего изобретения к определенному сочетанию белкового антитела и культуры продуцирующих клеток является легко осуществимым для специалиста в данной области.
[0082] Исключительно в иллюстративных целях настоящее изобретение применили для очистки нескольких антител изотипа IgG. В частности, настоящее изобретение применили для очистки гуманизированных моноклональных антител против А-бета, антител против GDF8 и гуманизированных моноклональных антител против IL-13.
4. Условия и максимальная величина нагрузки
[0083] Перед нагружением среды жидкостью, содержащей продукт и примеси, может оказаться необходимым определить область слабого распределения путем нахождения рабочих условий, при которых на 1 мл среды связывается по меньшей мере 1 мг продукта. В одном из вариантов реализации настоящего изобретения при найденных условиях на 1 мл среды связывается по меньшей мере 5 мг продукта. В другом способе реализации при найденных рабочих условиях на 1 мл среды связывается по меньшей мере 10 мг продукта. В еще одном из вариантов реализации настоящего изобретения при найденных условиях на 1 мл среды связывается по меньшей мере 20 мг продукта. Другим вариантом реализации настоящего изобретения является определение области слабого распределения путем нахождения рабочих условий, при которых коэффициент распределения составляет по меньшей мере 0,1. В некоторых вариантах реализации настоящего изобретения подобные рабочие условия характеризуются значением коэффициента распределения, составляющим примерно от 0,2 до примерно 20,0. В других вариантах реализации настоящего изобретения указанные рабочие условия характеризуются значением коэффициента распределения, составляющим примерно от 0,2 до примерно 10,0. В некоторых других вариантах реализации настоящего изобретения указанные рабочие условия характеризуются значениями коэффициента распределения, составляющими соответственно примерно от 1,0 до примерно 5,0, примерно от 0,5 до примерно 5,0 или примерно от 0,5 до примерно 1,5. В дополнительных вариантах реализации настоящего изобретения область слабого распределения определяют посредством нахождения рабочих условий, при которых на 1 мл среды связывается по меньшей мере от 1 до примерно 70 мг продукта при коэффициенте распределения, равном 0,3-20.
[0084] Специалисту является понятным, что соответствующие рабочие условия зависят от выбора среды для очистки продукта. В некоторых вариантах реализации настоящего изобретения рабочие условия включают значения рН и ионной силы. В других вариантах реализации настоящего изобретения рабочие условия также включают значения концентраций солей. В некоторых других вариантах реализации настоящего изобретения рабочие условия также включают уровни содержания эксципиентов, например, концентрации фосфат-ионов и кальция. В некоторых других вариантах реализации настоящего изобретения рабочие условия включают содержание противолигандов, например, концентрацию имидазола, и значение рН.
[0085] Для определения рабочих условий режима слабого распределения можно использовать стадию скрининга. Указанная стадия может включать исследования связывания в статическом режиме и на колонке. При исследованиях связывания на колонке можно использовать градиентный или изократический режимы элюирования. Например, специалист в данной области может определить вид буферного раствора или соли, подходяющих для очистки конкретного белка в определяемых рабочих условиях. Далее определяется оптимальная концентрация буферного раствора или соли, например, путем пропускания градиента выбранного буферного раствора или соли через колонку, через которую была пропущена несущая жидкость, содержащая очищаемый продукт и примеси. Проводится отбор и анализ фракций элюата; определяется концентрация буферного раствора или соли, при которой на 1 мл среды связывается по меньшей мере 1 мг продукта, или при которой коэффициент распределения продукта составляет по меньшей мере 0,1. В некоторых вариантах реализации настоящего изобретения коэффициент распределения определяют в эксперименте по статическому связыванию при нагрузке 1-10 мг/мл с фазовым отношением (отношением объема жидкости к объему сорбента), равным 3-6.
[0086] После определения рабочих условий в соответствии с ними корректируют характеристики несущей жидкости и/или среды. Например, возможно уравновешивание среды путем ее промывки раствором, что приводит ее в состояние, необходимое для обеспечения рабочих условий режима слабого распределения. Несущая жидкость может также быть подвергнута буферному обмену с использованием подходящего буфера или буфера, используемого для нагрузки. Последний может быть идентичным уравновешивающему буферу или отличаться от него.
[0087] В одном из вариантов реализации настоящего изобретения ионная сила несущей жидкости не превышает 100 мМ. В другом вариантов реализации настоящего изобретения ионная сила несущей жидкости не превышает 50 мМ. В еще одном вариантов реализации ионная сила несущей жидкости не превышает 25 мМ. В еще одном из вариантов реализации ионная сила несущей жидкости не превышает 10 мМ.
[0088] Несущую жидкость пропускают через разделительную среду, упакованную в колонку с неподвижным, псевдоожиженным или разрыхленным слоем, содержащую твердую матрицу, или смешивают с разделительной средой в статическом режиме. В последнем случае твердую матрицу смешивают с жидкой нагрузкой в течение некоторого времени. После пропускания несущей жидкости через хроматографическую среду возможна промывка последней некоторым объемом по существу изократического раствора. Из по существу изократического раствора может быть выделен очищенный продукт, который объединяют с очищенным продуктом из элюата, получаемым в течение цикла нагрузки. После возможной стадии промывки можно провести десорбцию примесей с хроматографической среды и ее регенерацию. Последнюю процедуру выполняют регулярно с целью минимизации накопления примесей на поверхности твердой фазы и/или стерилизации среды с целью избежания заражения продукта микроорганизмами.
[0089] В режиме слабого распределения возможно использование высоких концентраций и объема нагрузки. В одном из вариантов реализации настоящего изобретения концентрация продукта в несущей жидкости составляет по меньшей мере 1 мг продукта на 1 мл, в другом исполнении - по меньшей мере 5 мг на 1 мл, в другом - по меньшей мере 50 мг на 1 мл, в еще одном из вариантов реализации настоящего изобретения - по меньшей мере 100 мг на 1 мл. Очищенный продукт получают при пропускании через хроматографическую среду несущей жидкости объемом до 50 объемов колонки.
[0090] В режиме слабого распределения также возможны высокие величины нагрузки. В одном из вариантов реализации настоящего изобретения величина нагрузки может составлять по меньшей мере 10 мг продукта на 1 мл среды. В других вариантах реализации настоящего изобретения нагрузка по продукту на среду составляет по меньшей мере 50 мг продукта на 1 мл среды. В некоторых вариантах реализации настоящего изобретения нагрузка по продукту на среду составляет по меньшей мере 100 мг продукта на 1 мл среды. В других вариантах реализации настоящего изобретения величина нагрузки может составлять по меньшей мере 500 мг продукта на 1 мл среды. В некоторых других вариантах реализации настоящего изобретения величина нагрузки может составлять по меньшей мере 1000 мг продукта на 1 мл среды.
5. Удаление примесей
[0091] Показано, что режим слабого распределения можно применять для удаления из препаратов продуктов всех типов примесей, в том числе белков клеток-хозяев, нуклеиновых кислот, изоформ продукта, включая агрегированные продукты и высокомолекулярные образцы, эндотоксинов, вирусов и белка А, попавшего в препарат на предшествующих стадиях очистки.
[0092] Согласно одному из вариантов реализации настоящего изобретения, концентрация белков клеток-хозяев в очищенном продукте не превышает 500 нг на 1 мг продукта. В других вариантах реализации настоящего изобретения концентрация белков клеток-хозяев может быть снижена до не более чем 250 нг на 1 мг продукта, в некоторых других - до не более чем 100 нг на 1 мг продукта. В некоторых вариантах реализации настоящего изобретения значение логарифмической степени очистки (ЛСО) от белков клеток-хозяев равно по меньшей мере 1,0, в других - по меньшей мере 2,0, в некоторых других - по меньшей мере 3,0.
[0093] В одном из вариантов реализации настоящего изобретения концентрация белка А в очищенном продукте составляет не более 100 нг на 1 мг продукта. В некоторых вариантах реализации настоящего изобретения концентрация белка А может быть снижена до не более чем 50 нг на 1 мг продукта, в других - до не более чем 10 нг на 1 мг продукта. В некоторых вариантах реализации логарифмическая степень очистки от белка А составляет по меньшей мере 1,0, в других - по меньшей мере 2,0, в некоторых других - по меньшей мере 3,0.
[0094] В другом варианте реализации настоящего изобретения из очищенного продукта удаляют примеси вирусов. В некоторых вариантах реализации значение логарифмической степени очистки от вирусов составляет более 1,0, в других - более 2,0, в некоторых других - более 3,0.
[0095] В некоторых вариантах реализации настоящего изобретения из очищенного продукта удаляют примеси нуклеиновых кислот. В некоторых вариантах реализации настоящего изобретения количество нуклеиновых кислот в очищаемом продукте понижают до не более чем 1 нг нуклеиновых кислот на 1 мг продукта.
[0096] В дополнительных вариантах реализации настоящего изобретения концентрация изоформ белка в очищенном продукте не превышает примерно 10%. В некоторых вариантах реализации настоящего изобретения концентрация изоформ белка может быть снижена до не более чем примерно 5%, в других - до не более чем примерно 2%, в некоторых других - до не более чем примерно 0,5%.
[0097] В жестких условиях связывания, соответствующих режиму слабого распределения, разделительной средой удаляется по меньшей мере 90% белков клеток-хозяев, нуклеиновых кислот, изоформ белка, эндотоксинов и белка А. В некоторых вариантах реализации настоящего изобретения разделительная среда удаляет по меньшей мере 99% примесей, в других вариантах реализации настоящего изобретения - по меньшей мере 99,9% примесей.
6. Возможные дополнительные стадии
[0098] Способ очистки, предложенный в настоящем изобретении, может быть использован в сочетании с другими стадиями очистки белка. В одном из вариантов реализации настоящего изобретения до очистки в режиме слабого распределения желательно проведение по меньшей мере еще одной стадии для снижения величины нагрузки. В другом вариантов реализации после очистки в режиме слабого распределения желательно проведение по меньшей мере еще одной стадии для удаления дополнительных количеств загрязнений или примесей.
[0099] Описанную процедуру очистки в режиме слабого распределения можно сочетать с другими стадиями очистки, в том числе хроматографией на белке А, аффинной хроматографией, хроматографией с гидрофобным взаимодействием, аффинной хроматографией с использованием иммобилизованных металлов, эксклюзионной хроматографией, диафильтрацией, ультрафильтрацией, фильтрацией с целью удаления вирусов и/или ионообменной хроматографией, но не ограничиваясь указанными способами. Возможные стадии очистки, предшествующие стадии очистки в режиме слабого распределения и/или следующие за ней, также могут проводиться в режиме слабого распределения или в других режимах, в том числе проточном режиме и режиме связывания-элюирования.
[0100] В одном из вариантов реализации настоящего изобретения перед стадией очистки в режиме слабого распределения возможна первоначальная очистка с применением хроматографии на белке А. Для этого можно применять, например, хроматографическую среду PROSEP-A™ (компания Millipore, Великобритания), состоящей из белка А, ковалентно связанного со стеклом с контролируемым размером пор. Среди других пригодных сред, содержащих белок А, следует указать колонки Protein A Sepharose FAST FLOW™ (компания Amersham Biosciences, Пискатавэй, Нью-Джерси, США), TOYOPEARL™ 650M Protein А (компания TosoHaas Co., Филадельфия, Пенсильвания, США) и MABSELECT™ (компания Amersham Biosciences, Пискатавэй, Нью-Джерси, США).
7. Цвиттерионные буферные растворы, используемые при последовательном проведении хроматографии на белке А и ионообменной хроматографии
[0101] В некоторых вариантах реализации настоящего изобретения продуктсодержащую жидкость элюируют из колонки с белком А с применением буфера с низкой ионной силой. После этого рН и проводимость продуктсодержащей жидкости регулируют нейтрализационным буфером с целью достижения значения ионной силы продуктсодержащей жидкости, не превышающего 20 мМ. Полученную несущую жидкость пропускают через анионообменную или гидроксиапатитную среду в режиме слабого распределения. В некоторых вариантах реализации несущую жидкость пропускают через анионообменную среду без диафильтрации. В других вариантах реализации настоящего изобретения рН и проводимость продуктсодержащей жидкости регулируют нейтрализационным буфером для достижения значения ионной силы продуктсодержащей жидкости, не превышающего 40 мМ, в некоторых других - не превышающего 60 мМ, в еще одной группе вариантов реализации - не превышающего 80 мМ.
[0102] Буферные растворы, используемые для элюирования из колонок с белком А, включают растворы, содержащие молекулы с заряженными анионными группами, значения рКа которых равны 2-5. Указанные растворы также могут содержать молекулы с заряженными катионными группами, рКа которых составляют 6,5-10. В одном из исполнений буферный раствор для элюирования содержит молекулы, являющиеся цвиттерионами при рН 4-9, в том числе глицин, 1,4-пиперазин-бис-этансульфоновую кислоту, глицилглицин, циклопентантетра-1,2,3,4-карбоновую кислоту, N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновую кислоту, 2-(N-морфолино)пропансульфоновую кислоту, N-трис(гидроксиметил)метил-2-аминоэтансульфоновую кислоту, N-2-гидроксиэтилпиперазин-N'-2-этансульфоновую кислоту, 4-(2-гидроксиэтил)-1-пиперазинпропансульфоновую кислоту, N-трис(гидроксиметил)метилглицин, глицинамид, N,N-бис(2-гидроксиэтил)глицин, N-трис(гидроксиметил)метил-2-аминопропансульфоновую кислоту и N-глицилглицин.
[0103] Преимуществом элюирования колонки с белком А цвиттерионным буферным раствором является низкая ионная сила при определенной степени нейтрализации. Низкая ионная сила не оказывает отрицательного влияния на работу ионообменных колонок, в том числе гидроксиапатитных. Высокая ионная сила приводит к снижению связывания примесей ионообменными колонками, что понижает общую эффективность очистки. Для нагружения ионообменных колонок предпочтительно использование растворов с пониженной ионной силой, так как ионную силу легко увеличить посредством добавления концентрированных растворов солей, но трудно понизить. Неожиданно обнаружили, что существуют буферные растворы с низким значением рКа, допускающим использование при низких рН, приемлемых при элюировании с белка А, обладающие при этом вторым значением рКа, допускающим использование при более высоких значениях рН, применяемых в ионообменной хроматографии. При использовании при соответствующем втором значении рН указанные буферные растворы в ходе стадии ионного обмена, следующего за очисткой на белке А, отличаются низким эффективным зарядом.
[0104] Использование цвиттерионных буферов с значением рКа, близким к рН элюента, предпочтительному для белка А (2-5, предпочтительно 2,5-4,0), дает возможность поддерживать рН, близкое к рl буфера, и при этом проводить элюирование. Цвиттерионные буферные растворы, обладающие вторым значением рКа, близким к значению рН, необходимому для работы ионообменных колонок (рН 5,5-11), обеспечивают поддержание рН как в указанном интервале, так и в интервале рН, применяемом при элюировании белка А. Применение одного и того же вещества как для элюирования колонки с белком А при низких значениях рН, также как и для поддержания высоких значений рН, необходимых в ионообменной хроматографии, упрощает проведение обеих стадий и делает менее сложным состав целевой фракции после нейтрализации.
[0105] В одном из вариантов реализации настоящего изобретения цвиттерионный буферный раствор, обладающий двумя значениями рКа (рКа1 и рКа2), можно применять для элюирования колонки с белком А при значениях рН, лежащих в интервале одной единицы рН от рКа1. Кроме того, в случае нейтрализации продукта, очищенного на белке А, основным цвиттерионным буферным раствором до второго значения рН, лежащего в пределах одной единицы от рКа2, цвиттерионный буфер оказывется способным поддерживать рН раствора. Если второе значение рН лежит ниже рКа2, буфер остается цвиттерионным и мало влияет на общую ионную силу раствора. Например, цвиттерионный буфер с концентрацией х при рН, равном рКа2, вносит вклад в общую ионную силу, равный х/2. При значении рН, на одну единицу меньшем рКа2 буфера, вносит соответствующий влкад величиной только 1/10x. Такое снижение ионной силы особенно полезно при использовании ионообменной хроматографии.
[0106] Существование буферных растворов, обладающих рКа1, пригодным для элюирования колонок с белком А, и рКа2, пригодным для использования в ионообменной хроматографии, не является очевидным, поскольку о значениях рКа1 подобных растворов сообщалось редко. Указанные растворы обычно применяют при значениях рН, близких к рКа2 и специалистам по хроматографии не было известно о возможности их применения для элюирования колонок с белком А. Кроме того, что свойства подобных растворов, полезные при элюировании колонок с белком А, обычно не использовали, не использовали также и дополнительную возможность применения подобных растворов в качестве буферов для ионообменных колонок после стадии хроматографии на белке А, поскольку они придают нейтрализованным фракциям, полученным при очистке на белке А, меньшую ионную силу.
С. Примеры
Следующие далее примеры приведены только в иллюстративных целях.
[0107] Примеры приводятся для трех видов хроматографии (анионообменной, с гидрофобным взаимодействием и гидроксиапатитной). При этом использовали три различных моноклональных антитела. Описаны четыре отдельных серии экспериментов, в которых представлены различные сочетания вида хроматографии и подвергаемого очистке моноклонального антитела. Вначале представлены результаты высокопроизводительного скрининга, служащие для определения коэффициента распределения и/или концентрации связанного продукта при различных составе и свойствах раствора и соответствующих интервалов режима слабого распределения (WP) и проточного режима (FT). Затем обобщаются несколько экспериментов на колонках; приводятся данные по выходу продукта и степени очистки от примесей. Выход продукта является исключительно высоким в экспериментах на колонках в режиме WP, при этом количество остаточных примесей является меньшим, чем в соответствующих экспериментах в режиме FT. Эксперименты в режиме WP проводили при больших величинах нагрузки, чем в режиме FT.
[0108] Количество остаточного белка А в исследуемых образцах определяли с использованием твердофазного иммуноферментного анализа (ИФА). Количество высокомолекулярных агрегатов измеряли с использованием аналитической стерической эксклюзионной хроматографии. Количество белков клеток-хозяев (БКХ) определяли с использованием ИФА. Все эксперименты по скринингу и эксперименты на колонках выполняли при комнатной температуре.
Серия 1. Анионообменная хроматография антител Mab-AAB с использованием среды TMAE-HiCap (М)
Эксперимент 1.1. Определение условий режимов WP и FT высокопроизводительным скринингом
[0109] Для определения условий режима слабого распределения и проточного режима при хроматографии антител Mab-AAB на среде TMAE-HiCap (М) был проведен высокопроизводительный скрининг. При этом для определения влияния на избыточное связывание Mab-AAB и производственных примесей (белка А и БКХ) со средой, содержащей ТМАЕ-группы, варьировали концентрацию хлорида натрия и рН.
[0110] В каждую лунку 96-луночного фильтр-планшета вносили по 50 мкл хроматографической среды ТМАЕ HiCap. Каждую лунку уравновешивали раствором, содержащим 50 мМ глицина и различные количества трис-буфера (в зависимости от количества, необходимого для доведения рН до уровня, указанного в Таблице 1.1.1) и хлорида натрия (количество указано в Таблице 1.1.2). Значение рН составляло 7,6-9,0, концентрация хлорида натрия - 0-80 мМ.
[0111] Буферные растворы, использованные в каждом ряду планшета, разбавляли при помощи автоматической пипеточной системы Tecan 100 RST. Исходные буферные растворы получали из 500 мМ раствора глицина, который подкисляли HCl до рН 3,0 и затем нейтрализовывали 2М трио-основанием до значений рН, указанных в Таблице 1.1.1. При нейтрализации достигалось содержание трис-основания, зависящее от рН буферного раствора. Последнее измеряли при 1-10-кратном разбавлении исходного буферного раствора в соответствии с разбавлением, производимым автоматической пипеточной системой. В результате подкисления глицина до рН 3,0 вклад буфера в ионную силу конечного раствора составлял примерно 10 мМ. Сорбент нагружали нагрузками величиной 5 мг/мл для определения коэффициента распределения К и 132 мг/мл для определения емкости сорбента по примесям и продукту Q в равновесии с раствором белка при концентрации последнего, приблизительно равной концентрации при нагружении колонки.
[0112] На первой стадии высокопроизводительного скрининга каждую лунку уравновешивали растворами, содержание NaCl и рН которых указаны в Таблицах 1.1.1 и 1.1.2, при объемном отношении фаз 6:1 (300 мкл раствора на 50 мкл сорбента). Планшет встряхивали в течение 20 мин до достижения равновесия. Затем раствор удаляли центрифугированием фильтр-планшета. Цикл приведения в равновесное состояние повторяли три раза.
[0113] На второй стадии сорбент в каждой лунке нагружали концентрированным раствором Маb-ААВ в количестве 5 мг антитела на 1 мл сорбента при объемном отношении 6:1 (300 мкл раствора на 50 мкл сорбента) и соответствующих концентрации NaCl и рН. В качестве исходного раствора использовали раствор Маb-ААВ в 1 мМ HEPES и 10 мМ NaCl концентрацией 36 мг/мл, в который вводили 300 м.д. белка А; рН раствора составляло 7,0. Нагруженный планшет встряхивали 20 мин до достижения равновесия между сорбентом и раствором. Супернатант удаляли центрифугированием и собирали в планшет. Концентрацию белка в супернатантах каждой лунки определяли по поглощению при 280 нм.
[0114] На третьей стадии сорбент промывали растворами, содержание NaCl и рН которых указаны в Табл.1.1.2. После встряхивания в течение 20 мин супернатант удаляли. На четвертой стадии для удаления связанного с сорбентом остаточного белка добавляли 2М NaCl. Для каждой лунки с использованием значений массы продукта, удаленного на третьей и четвертой стадиях, и концентрации продукта после второй стадии определяли коэффициент распределения. Полученные результаты представлены в Таблице 1.1.3. Диаграмма значений логарифма коэффициента распределения в зависимости от рН и концентрации хлорид-ионов показана на Фиг.7.
[0115] Из данных Табл.1.1.3 видно, что значение Кр может быть использовано для определения областей, в которых Маb-ААВ связывается с ТМАЕ-содержащей средой с различной силой. Указанные области более четко показаны на Фиг.7. Как в проточном (К≤,1) режиме, так и в режимах слабого распределения (0,1<К<20) и связывания-элюирования (K≥20) силу связывания Маb-ААВ с ТМАЕ-содержащей средой можно регулировать изменением рН и концентрации хлорид-ионов.
[0116] Супернатанты, полученные при нагружении каждой лунки каждой зоны, отбиради и анализировали на белок А. Результаты анализа указанных образцов представлены в Таблице 1.1.4. Из данной таблицы видно, что существует область рН и проводимости, при которых хроматография на ТМАЕ приводит к очень высокой степени очистки от белка А при органиченных потерях целевого белка на сорбенте. Найдено, что данная область близко коррелирует со значением коэффициента распределения Кр и не соответствует никаким особым значениям рН или концентрации хлорид-ионов (см. Фиг.8).
Эксперимент 1.2. Опыты на колонках в проточном режиме
[0117] Следующие эксперименты были выполены в проточном режиме (FT), в котором Маb-ААВ очень слабо взаимодействует с колонкой. Было проведено два анализа при величинах нагрузки, равных 110 и 200 мг/мл сорбента.
[0118] Для всех экспериментов по анионообменной хроматографии на ТМАЕ-HiCapM, описанных в Эксперименте 1, использовали следующие условия (исключения указаны в описаниях соответствующих экспериментов):
Рабочая скорость потока - 150-300 см/ч
Уравновешивающий буферный раствор №1 - 50 мМ трис-основания, 2,0 М NaCl, рН 7,5 (5 объемов колонки)
Уравновешивающий буферный раствор №2 - состав указан особо, рН и содержание хлорид-ионов примерно эквивалентны рН и содержанию хлорид-ионов в нагрузке
Промывочный буферный раствор - состав указан особо, рН и содержание хлорид-ионов примерно эквивалентны рН и содержанию хлорид-ионов в нагрузке
Десорбционный буферный раствор - 50 мМ трис-основания, 2,0 М NaCl, рН 7,5 (5 объемов колонки)
Хроматография на среде Mabselect Protein A
[0119] Очистку культуры, содержащей моноклональные антитела, в пилотном масштабе проводили на колонке MabSelect объемом 2389 мл, соединенной с хроматографической системой Millipore K-prime 400. Колонку Mabselect Protein A уравновешивали раствором, содержащим 50 мМ трис-основания и 150 мМ NaCl, в количестве 5 объемов колонки при скорости потока 300 см/ч. Затем колонку нагружали при величине нагрузки примерно 40 мг продукта на 1 мл сорбента. После нагружения колонку промывали раствором, содержащим 1 М NaCl и 50 мМ трис-основания при рН 7,5 в количестве 5 объемов колонки, затем раствором, содержащим 10 мМ трис-основания и 75 мМ NaCl при рН 7,5 в том же объеме. Затем колонку элюировали раствором, содержащим 50 мМ глицина и 75 мМ NaCl при рН 3,0. Полученный продукт нейтрализовали до рН 7,6 2М раствором трис-основания (рН 8,5). Концентрация хлорид-ионов в нейтрализованной целевой фракции составляла примерно 90 мМ.
Хроматография на среде ТМАЕ HiCap (М)
[0120] Нейтрализованную фракцию, полученную очисткой на белке А, подвергали дальнейшей очистке на среде, содержащей ТМАЕ. В качестве уравновешивающего раствора, подвижной фазы и промывочного раствора использовали раствор, содержащий 50 мМ трис-основания и 75 мМ хлорида натрия при рН 7,5. Объем промывки составлял 5 объемов колонки. Размеры колонки и величины нагрузки для двух указанных выше опытов составляли: опыт 1 - диаметр колонки 7,0 см, высота слоя хроматографической среды - 20,6 см (объем - 793 мл), концентрация продукта в нагрузке - 11,9 мг/мл; опыт 2 - диаметр колонки 7,0 см, высота слоя хроматографической среды - 13 см (объем 500 мл), концентрация продукта в нагрузке - 17,6 г/мл.
[0121] Указанные параметры находились в области проточного режима (FT) (см. Табл.1.2.1). Для измерения коэффициента распределения Кр проводили статические эксперименты; связывание продукта определяли по содержанию белка в растворе после десорбции с использованием УФ-поглощения. Данный способ определения связанного продукта обычно приводит к недооценке его общего количества вследствие изократического элюирования продукта при промывке. Также определяли уровни белка А, БКХ и высокомолекулярных фракций (ВМФ) в нагрузке и целевой фракции и рассчитывали значения степени очистки. Полученные результаты представлены в Таблице 1.2.1. Показано, что белок А и высокомолекулярные фракции удаляются плохо, а БКХ - удовлетворительно.
Количество примесей составляло 38,5 м.д. белка А и 51943 м.д. БКХ в анализе №1 и 8,8 м.д. белка А и 25398 м.д. БКХ в анализе №2.
Эксперимент 1.3. Опыты на колонках в условиях слабого распределения при высоких нагрузках по продукту
Анионообменная хроматография на среде ТМАЕ (HiCapM)
[0122] Для получения материала нагрузки для данных опытов использовали несколько стадий очистки на среде Mabselect Protein А согласно описанному в Эксперименте 1.2. Частично очищенную на белке А фракцию антител далее очищали на колонке, содержащей ТМАЕ. Нагрузку вводили в колонку в 50 мМ трио-буфере при рН 8,2. Диаметр колонки составлял 0,5 см, высота слоя хроматографической среды - 10 см, объем - 2,0 мл. Нагрузка на колонку составляла 500 мг/мл сорбента при концентрации продукта, равной 27,7 мг/мл.
[0123] Колонку уравновешивали раствором, содержащим 50 мМ трис-основания и 2М NaCl при рН 7,5 в количестве 5 объемов колонки с дополнительным уравновешиванием 50 мМ трио-буфером при рН 8,2. Затем колонку нагружали нейтрализованной целевой фракцией, полученной на стадии очистки на белке А, при величине нагрузки, равной 500 мг продукта на 1 мл сорбента. Продукт выделяли в виде элюата, полученного в цикле нагрузки, и фракции промывочного раствора, количество которого составляло несколько объемов колонки.
[0124] Указанные параметры находились в области слабого распределения. Для определения коэффициента распределения Кр и связывания продукта при высоких концентрациях белка проводили статические эксперименты. Путем интерполяции данных высокопроизводительного скрининга было оценено значение коэффициента распределения Кр при рН 8,2 и содержании хлорид-ионов, равном 12 мМ, составляющее 1,9.
[0125] В трех фракциях, отобранных в период нагружения при величинах нагрузки примерно в 250, 375 и 500 мг/мл сорбента, определяли содержание БКХ и белка А. Результаты эксперимента 1.3 представлены в Табл. 1.3.1. Из указанных результатов видно, что в режиме слабого распределения могут быть достигнуты очень большие нагрузки по продукту при отсутствии выхода примесей. Было достигнуто исключительно высокое снижение содержания БКХ и белка А при 50%-ном снижении содержания ВМФ. Из сравнения с результатами анализов в проточном режиме, представленными в Табл.1.2.1, видно, что в режиме слабого распределения примеси удаляются гораздо лучше.
Количество примесей в нагрузке составляло 25398 м.д. БКХ, 99,5 м.д. белка А и 2,3% ВМФ.
Эксперимент 1.4. Опыты на колонках в режиме слабого распределения (исследование надежности)
[0126] Для дальнейшего подтверждения эффективности колонок с ТМАЕ в области слабого распределения было выполнено несколько анализов при различных рН и концентрации NaCl в нагрузке с целью проверки надежности процесса. Все анализы выполняли при величине нагрузки в 250 мг/мл сорбента. Для получения материала нагрузки для данных анализов выполняли несколько стадий очистки на среде Mabselect Protein А согласно описанному в Эксперименте 1.2. Единственным переменным фактором при очистке являлась концентрация NaCl при элюировании с белка А, которую изменяли с целью достижения соответствия концентраций NaCl в полученном растворе и нагрузке, вводимой в колонку с ТМАЕ в конкретном эксперименте. Колонки уравновешивали буферным раствором №2 (см выше) и промывали промывочным буфером, рН и содержание NaCl в котором примерно соответствовали тем же величинам для нагрузки.
[0127] Указанные параметры находились в области слабого распределения. Для измерения коэффициента распределения Кр использовали статические эксперименты. Выход по значениям коэффициента распределения, указанным в Табл.1.4.1. Связывание продукта определяли по измерению содержания белка в десорбционном растворе с использованием УФ-поглощения; связывание составляло 7,8-25,3 мг/мл. Данные по удалению белка А, БКХ и ВМФ, полученные в указанных экспериментах, также представлены в Табл.1.4.1. Найдено, что удаление примесей является надежным в интервалах рабочих условий, ограниченных величиной общего содержания хлорид-ионов, равной 13,5-38,8 мМ, и рН 7,8-8,4.
Содержание примесей составляло: 38,5 м.д. белка А и 51943 м.д. БКХ (анализ №1); 8,8 м.д белка А и 25398 м.д. БКХ (анализ №2).
Содержание хлорид-ионов включает содержание в NaCl, буферных растворах и титрантах.
Выводы
[0128] Из данного исследования видно, что ЛСО для белка А сильно зависит от Кр, в то время как ЛСО БКХ является исключительно высокой при всех значениях Кр, не меньших 0,26, но значительно снижается при Кр=0,17 (в условиях проточного режима). В проточном режиме степень очистки от БКХ более чем на одну логарифмическую единицу ниже, чем в режиме слабого распределения даже при снижении величины нагрузки. Для данного сочетания сорбента и моноклонального антитела связывание продукта в условиях слабого распределения составляло 7,8-25 мг/мл. Оптимальным значением коэффициента распределения представляется область значений Кр, равных 0,41-5,4. Условия Эксперимента 1,2 (Кр=0,17 при связывании продукта, составляющем 1,4-3,3 мг/мл) не представляются оптимальными.
Серия 2. Анионообменная хроматография антител Mab-IMA с использованием среды TMAE-HiCap (М)
Эксперимент 2.1. Определение условий режимов WP и FT при помощи высокопроизводительного скрининга
[0129] Для определения условий режима слабого распределения и проточного режима при хроматографии Mab-IMA на среде TMAE-HiCap (М) был проведен высокопроизводительный скрининг. При скрининге изменяли концентрацию хлорида натрия и рН с целью определения их влияния на связывание Mab-IMA и производственных примесей (белка А и БКХ) с хроматографической средой. В каждую лунку 96-луночного фильтр-планшета вводили по 100 мкл хроматографической среды ТМАЕ HiCap. Каждую лунку уравновешивали растворами, приготовленными из 25 мМ буферного раствора, обладающего значениями рН, не более чем на одну единицу отличающимися от рКа последнего (Табл.2.1.1), и соответствующих количеств хлорида натрия (Табл.2.1.2). рН составляло 7,00-7,85, концентрация хлорида натрия - 1-190 мМ.
[0130] Все буферные растворы титровали до целевого значения рН с использованием 12 М HCl. Поскольку различные буферные растворы требовали различных количеств титранта, концентрация хлорида изменялась от лунки к лунке в зависимости от используемого буферного раствора. Количество Сl-, необходимое для титрования буфера до целевого значения рН, рассчитывали с использованием уравнения Хендерсона-Хассельбаха и прибавляли к общему количеству Сl-, которое содержалось в добавленном NaCl и в нагрузке.
Рассчитанные количества Сl- для каждой ячейки в эксперименте приведены в Табл.2.1.3.
[0131] На первой стадии высокопроизводительного скрининга каждую лунку уравновешивали при содержании NaCl и рН, представленных в Табл.2.1.1 и 2.1.2, и при объемном отношении фаз 3:1 (300 мкл раствора на 100 мкл сорбента). Планшет встряхивали 20 мин с целью установления равновесия. Затем раствор удаляли центрифугированием фильтр-планшета. Цикл приведения в состояние равновесия повторяли три раза.
[0132] На второй стадии сорбент в каждой лунке нагружали концентрированным раствором Mab-IMA при соответствующей концентрации NaCl и значении рН. Величина нагрузки составляла 3 мг/мл сорбента при объемном отношении 3:1 (300 мкл раствора на 100 мкл сорбента). В качестве исходного раствора использовали раствор Mab-IMA в 1 мМ Mes и 15 мМ NaCl концентрацией 30 мг/мл при рН 6,5, содержащий 300 м.д. белка А. Планшет с нагрузкой встряхивали 20 мин с целью установления равновесия сорбента с раствором. С фильтр-планшета центрифугированием удаляли супернатант, который собирали в другой планшет. Значения концентраций белка в супернатантах каждой лунки определяли с использованием поглощения при 280 нм. Уменьшение содержания белка А и/или БКХ рассматривалось как признак условий, благоприятствующих очистке.
[0133] На третьей стадии сорбент промывали растворами, содержание NaCl и рН которых приведены в Табл.2.1.2. После встряхивания в течение 20 мин супернатант удаляли. На четвертой стадии для удаления остаточного белка, связанного с сорбентом, добавляли 2 М NaCl. Для каждой лунки исходя из значений массы продукта, удаленного на третьей и четвертой стадиях, и концентрации продукта после стадии 2 определяли коэффициент распределения. Полученные значения представлены в Табл.2.1.4. Диаграмма значений логарифма Кр в зависимости от рН и содержания хлорид-ионов представлены на Фиг.9.
[0134] Как показано в Табл.2.1.4, значение Кр может быть использовано для определения областей, в которых Mab-IMA связывается с ТМАЕ-содержащей средой с различной силой. Указанные области более четко показаны на Фиг.9. Сила связывания Mab-IMA с ТМАЕ-содержащей средой может быть изменена путем изменения рН и концентрации хлорид-ионов как в области проточного режима (Кр≤0,1), так и в областях режимов слабого распределения (0,1<Кр<20) и связывания-элюирования (Кр≥20).
[0135] Супернатанты, полученные при нагружении нескольких лунок каждой зоны, отбирали и анализировали на содержание белка А. Нагрузка содержала 300 м.д. белка А. Результаты анализа указанных образцов представлены в Таблице 2.1.5. Показано, что существует область значений рН и проводимости, при которых хроматография на ТМАЕ-содержащей среде приводит к значительной степени очистки от белка А при ограниченных потерях целевого белка на сорбенте. Найдено, что данная область близко коррелирует со значением коэффициента распределения Кр и не соответствует никаким особым значениям рН или концентрации хлорид-ионов.
Прогноз значений Кр проводили на основе построения поверхности отклика для высокопроизводительного скрининга и последующего предсказания на основе полученной регрессионной модели, н.п.о. - ниже пределов обнаружения
Эксперимент 2.2. Опыты на колонках по очистке Mab-IMA на среде ТМАЕ-НiCарМ в проточном режиме (FT)
[0136] Следующие эксперименты были выполнены в проточном режиме (FT), в котором Mab-IMA очень слабо взаимодействует с колонкой. Было проведено четыре анализа при нагрузках по продукту, составляющих 109-275 мг/мл сорбента.
Анионообменная хроматография на среде ТМАЕ (HiCap М)
[0137] Для всех стадий анионообменной хроматографии на TMAE-HiCapM, описанных в Эксперименте 2, использовали следующие условия (исключения указаны в описаниях соответствующих экспериментов):
Рабочая скорость потока - 150-300 см/ч
Уравновешивающий буферный раствор №1 - 50 мМ трис-основания, 2,0 М NaCl, pH 7,5 или 8,0 (5 объемов колонки)
Уравновешивающий буферный раствор №2 - 75 мМ NaCl, 50 мМ трис-основания, pH 7,5 (в анализах №№3 и 4 раствор содержал 50 мМ глицина)
Промывочный буферный раствор - 75 мМ NaCl, 50 мМ трис-основания, pH 7,5 (в анализах №№3 и 4 раствор содержал 50 мМ глицина)
Десорбционный буферный раствор - 50 мМ трис-основания, 2,0 М NaCl, pH 7,5 или 8,0 (5 объемов колонки)
[0138] Для получения материала нагрузки для данных опытов использовали несколько стадий очистки на среде Mabselect Protein А согласно описанию Эксперимента 1.2. Частично очищенную на белке А целевую фракцию, содержащую антитела, подвергали дальнейшей очистке с использованием анионообменной хроматографии в проточном режиме (FT). Диаметр колонки составлял 1,0-3,2 см, высота - 7,2-8,5 см.
[0139] Колонки уравновешивали раствором, содержащим 50 мМ трис-основания и 2 М NaCl при рН 7,5, в количестве 5 объемов колонки с дополнительным уравновешиванием 50 мМ трио-основанием при рН 7,5. Затем колонки нагружали 109-275 мг/мл продуктсодержащей фракции, частично очищенной на белке А. Продукт выделяли в виде элюата, полученного во время цикла нагрузки, и фракции промывочного раствора, количество которого составляло несколько объемов колонки.
[0140] Указанные условия находились в области проточного режима (FT). Высокопроизводительный скрининг, описанный в Эксперименте 2.1, позволяет оценить значения коэффициента распределения Кр при указанных значениях рН и концентрации хлорид-ионов. Результаты анализа ранжировали по значениям коэффициента распределения, приведенным в Табл.2.2.1. Связанный продукт определяли по содержанию белка в десорбционном растворе с использованием УФ-поглощения. Данный способ определения связанного продукта обычно приводит к недооценке его общего количества вследствие изократического элюирования продукта при промывке. Значения степени очистки от белка А, БКХ, высокомолекулярных (ВМФ) и низкомолекулярных (НМФ) фракций, полученные в данных экспериментах, также представлены в Табл.2.2.1. Показано, что степень очистки от белка А является относительно низкой переменной величиной; очистки от белка А и изоформ продукта (ВМФ и НМФ) не наблюдается.
н.о. - не определено
Эксперимент 2.3. Опыты на колонках по очистке Mab-IMA в условиях слабого распределения
[0141] Следующие эксперименты на колонках были выполнены в режиме слабого распределения в условиях, определенных высокопроизводительным скринингом (Эксперимент 2.1). Было проведено семь анализов целевых фракций, частично очищенных на белке А, на колонках с ТМАЕ.
Хроматография на среде ТМАЕ HiCap(M)
[0142] Антитела, частично очищенные на белке А способом, в точности аналогичным вышеизложенному, подвергали дальнейшей очистке на ТМАЕ-содержащей среде согласно изложенному ниже при рН и содержании хлорид-ионов, соответствующим режиму слабого распределения (WP). Диаметр колонки составлял 0,5-3,2 см, высота - 9,4-9,5 см.
[0143] Колонки уравновешивали раствором, содержащим 50 мМ трис-основания и 2 М NaCl при рН 7,5 или 8,0, в количестве 5 объемов колонки с дополнительным уравновешиванием раствором, содержащим 50 мМ глицина и 50 мМ трис-основания при рН 7,5 или 8,0. Затем колонки нагружали фракцией, частично очищенной на белке А, при величине нагрузки, равной 124-303 мг/мл. Продукт выделяли в виде элюата, полученного во время цикла нагрузки, и фракции промывочного раствора, количество которого составляло несколько объемов колонки. Результаты проведенных экспериментов представлены в Табл.2.3.1.
[0144] Указанные условия находились в области слабого распределения (WP). Оценка коэффициента распределения Кр была проведена высокопроизводительным скринингом, описанным в Эксперименте 2.1. Выход по значениям коэффициента распределения, указанным в Табл.2.3.1. Связанный продукт определяли путем измерения количества белка в десорбционном растворе с использованиме УФ-поглощения. Данный способ определения связанного продукта обычно приводит к недооценке его общего количества вследствие изократического элюирования продукта при промывке. В Табл.2.3.1 также представлены данные по очистке от белка А, БКХ, ВМФ и НМФ, полученные в указанных экспериментах. Показано, что очистка от БКХ является стабильно высокой, очистка от белка А - исключительно высокой, очистка от изоформ продукта (ВМФ и НМФ) - существенной.
[0145] Сравнение данных Табл.2.2.1 и 2.3.1 подтверждает, что степень очистки от БКХ, белка А, ВМФ и НМФ в условиях проточного режима (Кр≤0,3) является гораздо более низкой, чем в режиме слабого распределения (Кр>0,3), даже в тех случаях, когда величина нагрузки превосходит 300 мг/мл.
н.о. - не определено
Эксперимент 2.4. Эксплуатационные характеристики колонок, работающих в режиме слабого распределения, в пилотном и клиническом масштабе
[0146] Очистка Mab-IMA на колонке с ТМАЕ в условиях слабого распределения была осуществлена на пилотной установке и в клиническом масштабе. Культуру, содержащую моноклональные антитела, вначале очищали на колонках MabSelect объемом 3 и 5 л в пилотном масштабе и объемом 28 л в клиническом масштабе. Рабочие условия колонок MabSelect в точности соответствовали описанным в Эксперименте 1.2. Нейтрализованные целевые фракции, полученные очисткой на белке А, подвергали дальнейшей очистке на колонках с ТМАЕ объемом 1,5 л в пилотном и 7 л в клиническом масштабе. Результаты трех пилотных и девяти клинических экспериментов представлены соответственно в Табл.2.4.1 и 2.4.2. Эксплуатационные характеристики оказались сопоставимыми во всех экспериментах, наблюдались исключительно высокое снижение содержания БКХ и белка А и хорошая степень очистки от ВМФ и НМФ. Выход продукта во всех экспериментах превышал 87%. Оценка связывания продукта с сорбентом в ходе пилотных экспериментов была проведена на основе содержания продукта в десорбционном растворе; соответствующая величина составляла 6-14 мг/мл сорбента.
н.о. - не определено
Выводы
[0147] Условия режимов FT и WP были найдены путем высокопроизводительного скрининга. Режим FT приводит к слабому снижению количеств БКХ и НМФ; снижения содержания остаточного белка А и ВМФ не наблюдается. Работа в режиме WP повышает степень очистки от всех исследованных примесей без снижения выхода продукта. Способ был осуществлен в пилотном масштабе; результаты трех экспериментов оказались сопоставимыми при очень высоких ЛСО БКХ и белка А и высоком снижении содержания ВМФ и НМФ.
Серия 3. Анионообменная хроматография Маb-ААВ на среде TMAE-HiCapM
Эксперимент 3.1. Определение условий режимов WP и FT путем высокопроизводительного скрининга
[0148] Эксперимент 3.1 выполняли тем же способом, что и Эксперимент 1.1.
Эксперимент 3.2. Определение максимальной нагрузки на колонку в условиях, соответствующих различным значениям коэффициента распределения
[0149] В условиях значений коэффициента распределения, установленных при высокопроизводительном скрининге (Эксперимент 3.1), было выполнено пять хроматографических экспериментов. Для того, чтобы особо подчеркнуть более высокие эксплутационные качества анионообменной хроматографии в режиме слабого распределения, колонки с ТМАЕ нагружали очень большими нагрузками (>1000 г/л).
[0150] В экспериментах по анионообменной хроматографии, выполненных в Серии 3, были использованы следующие условия (исключения указаны в описаниях соответствующих экспериментов):
Рабочая скорость потока - 150-300 см/ч
Уравновешивающий буферный раствор №1 - 50 мМ трис-основания, 2,0 М NaCl, pH 7,5 (5 объемов колонки)
Уравновешивающий буферный раствор №2 - состав указан особо, pH и содержание хлорид-ионов примерно эквивалентны pH и содержанию хлорид-ионов в нагрузке
Промывочный буферный раствор - состав указан особо, pH и содержание хлорид-ионов примерно эквивалентны pH и содержанию хлорид-ионов в нагрузке
Десорбционный буферный раствор - 50 мМ трис-основания, 2,0 М NaCl, pH 7,5 (5 объемов колонки)
[0151] Колонку последовательно уравновешивали буферным раствором №1 в количестве 5 объемов колонки и буферным раствором №2 в том же количестве. Затем колонку нагружали целевой фракцией, очищенной на белке А, с добавлением соответствующего количества буферного раствора №2. Величина нагрузки составляла 940-2144 мг продукта на 1 мл сорбента.
[0152] Фракции элюата собирали и анализировали на содержание БКХ и остаточного белка А. Условия нагрузки, использованные в данных экспериментах, соответствовали последовательно увеличивающимся значениям коэффициента распределения, охватывающим области проточного режима и режима слабого распределения. Оценка значений Кр была проведена высокопроизводительным скринингом согласно описанному в Эксперименте 3.1. Количество связанного продукта в данном примере рассчитывали на основе количества продукта, элюированного десорбционном раствором. Результаты данных экспериментов представлены в Табл.3.2.1 и на Фиг.10А и 10В.
[0153] Связывание продукта в эксперименте, в котором Кр состалял 0,1, было практически равно нулю, как и ожидалось для типичного случая проточного режима. Для всех экспериментов, выполненных в области слабого распределения, количество связанного продукта превышало 12,0 мг/мл. Связывание продукта в эксперименте, выполненном при Кр, равном 7, было высоким и составляло 71 мг/мл. Выход продукта в объединенных фракциях элюата и промывочного раствора, однако, во всех случаях составлял более 93%.
[0154] Зависимость степени очистки от БКХ и белка А в зависимости от величины нагрузки представлена на Фиг.10А и 10В. Как обсуждалось выше, при переходе условий от проточного режима к режиму слабого распределения степень очистки от БКХ значительно повышается. Работа в проточном режиме обеспечивает очистку от БКХ примерно на 1,5 лог. ед., в то время как логарифмическая степень очистки от БКХ при работе в области слабого распределения при величинах нагрузки менее 450 мг/мл сорбента и Кр, равном 7, составляет 3,8 лог. ед. При значении Кр, равном 0,8, в области слабого распределения при величинах нагрузки до 1000 мг/мл сорбента было достигнуто значение степени очистки от БКХ, равное 2,8 лог. ед., а при величине нагрузки до 800 мг/мл при Кр=2,7-3 лог. ед.
[0155] Как и в случае БКХ, степень очистки от белка А при переходе от проточного режима к режиму слабого распределения значительно повышается. Результаты, представленные на Фиг.10А и 10В, также подчеркивают тот факт, что увеличение Кр при переходе от проточного режима к режиму слабого распределения приводит к повышению логарифмической степени очистки как от БКХ, так и от белка А до выхода примесей, а также к повышению величин нагрузки, соответствующих точке выхода. При дальнейшем повышении Кр повышение ЛСО БКХ и белка А до выхода примесей продолжается. Однако выход происходит при относительно более низких величинах нагрузки, поскольку продукт связывается с сорбентом и начинает конкурировать за способные к связыванию участки с примесями. Несмотря на указанный факт, максимальная нагрузка на колонку в представленных экспериментах оставалась очень высокой даже при самом высоком Кр.
Выводы
[0156] В данном примере показано, что степень очистки от белка А может быть значительно повышена путем проведения анионообменной хроматографии в режиме слабого распределения при величинах нагрузки, превышающих 1000 мг/мл сорбента. Указанный пример подчеркивает одно из основных отличий между хроматографией в режиме слабого распределения и хроматографией в обычных условиях связывания. Предельное связывание продукта в условиях слабого распределения повышается до тех пор, пока повышается степень очистки от примесей, а выход продукта и величина нагрузки остаются высокими. Соответствующее значение Кр при анионообменной хроматографии превышает 20; при превышении указанного значения эффекты конкуренции между продуктом и примесями оказываются очень сильными, что снижает максимальную нагрузку по сравнению с режимом слабого распределения.
Серия 4. Хроматография Mab-AAB с гидрофобным взаимодействием на среде Phenyl Toyopearl
Эксперимент 4.1. Установление условий режимов WP и FT в статических экспериментах
[0157] Для определения условий режима слабого распределения и проточного режима при очистке Mab-AAB на хроматографической среде Phenyl Toyopearl компании Tosoh Biosciences были проведены исследования статического связывания. В качестве соли, изменяющей силу взаимодействия с сорбентом, использовали Na2S04, концентрацию которого изменяли от 0,20 до 0,90 М. В растворы вводили буфер до контрольного значения рН, равного 7,5. Для инкубирования сорбента жидкостью с последующим удалением супернатанта центрифугированием использовали 45 мкм фильтр-планшеты. Было приготовлено восемь трис / Nа2SO4-буферных растворов концентрацией Na2SO4, равной 0,2-0,9 М. Mab-AAB, частично очищенное хроматографией на белке А, разбавляли раствором трис-основания и Na2SO4 до конечной концентрации, равной 0,87 мг/мл. 50 мкл сорбента уравновешивали 300 мкл буферного раствора; затем буферный раствор при каждой концентрации трис-основания и Na2SO4 декантировали. Каждую операцию уравновешивания повторяли три раза. После уравновешивания и декантирования сорбент смешивали с продуктом при тех же концентрации соли и рН и инкубировали в течение 30 мин при осторожном встряхивании. Нагрузка во всех случаях составляла 5,2 мг продукта на 1 мл сорбента. Затем под фильтр-планшет помещали планшет для УФ-измерений и собирали супернатант путем центрифугирования. После этого сорбент промывали 300 мкл 50 мМ трис-основания при рН 7,5 для десорбции связанного продукта. После 20-минутного инкубирования десорбционный раствор отделяли центрифугированием и собирали в отдельный планшет для УФ-измерений. Концентрацию продукта в каждой фракции измеряли по УФ-поглощению с использованием значения коэффициента экстинкции для данного вида моноклонального антитела. Расчеты корректировали на постадийное проведение экспериментов с использованием значения объема в 29 мкл, определенного в отдельной серии экспериментов. Для каждой концентрации соли эксперимент повторяли четыре раза; значения коэффициентов распределения усредняли.
[0158] В Табл.4.2.1 представлены значения коэффициентов распределения, полученные в данном эксперименте. При наиболее высоких концентрациях Na2SO4 связывание продукта являлось сильным; интервал слабого распределения соответствовал значениям концентрации соли в интервале 0,40-0,55 М.
Эксперимент 4.2. Опыты на колонках в условиях проточного режима, слабого распределения и связывания при высоких нагрузках по продукту
[0159] Были проведены анализы на колонках в условиях проточного режима, слабого распределения и сильного связывания. Для всех анализов методом хроматографии с гидрофобным взаимодействием на среде Phenyl Toyopearl, описанных в Серии 4, использовались следующие условия (исключения указаны в описаниях соответствующих экспериментов):
Размер колонок: диаметр 0,5 см, высота слоя сорбента 9,5-10,5 см
Уравновешивающий буферный раствор - 50 мМ трис-основания, рН 7,5, концентрация Na2SO4 примерно эквивалентна концентрации в нагрузке
Концентрация Na2SO4 в нагрузке - указана ниже
Промывочный раствор - той же концентрацией по Na2SO4 (исключения указаны ниже)
Десорбционный раствор - 50 мМ трис-основания, рН 7,5
[0160] Использовали два вида нагрузок: 1) частично очищенные целевые фракции антител, очищенных на белке А в точности аналогично вышеизложенному; 2) целевые фракции, более глубоко очищенные на среде ТМАЕ Q Sepharose FF в проточном режиме.
Эксперимент 4.2.1. Опыты на колонках с использованием в качестве нагрузки целевой фракции, очищенной на белке А
[0161] Описанные ниже эксперименты проводили для того, чтобы показать улучшение рабочих характеристик хроматографии с гидрофобным взаимодействием в режиме слабого распределения. Анализы на колонках проводили при различной концентрации соли с тем, чтобы значения коэффициентов распределения охватывали области проточного режима, слабого распределения и сильного связывания. Значения коэффициента распределения Кр были оценены путем скрининга в условиях статического связывания, описанного в Эксперименте 4.1. Колонки уравновешивали раствором, содержащим 50 мМ трис-основания и Na2SO4 в соответствующей концентрации при рН 7,5 в количестве 5 объемов колонки. Целевую фракцию, очищенную на белке А, разбавляли в 10 раз, затем - до концентрации в 14,77 мг/мл при соответствующей концентрации соли. Количество БКХ и остаточного белка А в нагрузке составляло 30911 м.д. и 17,1 м.д. соответственно. Все анализы на колонках проводили при величине нагрузки, равной 100 мг/мл сорбента. Продукт собирали в элюате в ходе цикла нагрузки. После окончания элюирования продукта колонку нагружали промывочным буфером в количестве 10 объемов колонки при той же концентрации соли. Затем через колонку пропускали десорбционный буфер, содержащий 50 мМ трис-основания при рН 7,5, в количестве 5 объемов колонки. Содержание БКХ и белка А в элюате и промывочных фракциях определяли с использованием ИФА. Суммарное содержание примесей в элюате и промывочных фракциях приведено в Табл.4.2.1.
[0162] Выход по значениям коэффициента распределения. Связанный продукт определяли путем измерения количества белка в десорбционном растворе с использованием УФ-поглощения. Данный способ определения связанного продукта обычно приводит к недооценке количества продукта, связанного в ходе нагружения, вследствие постепенной десорбции продукта при промывке.
Коэффициенты распределения Кр рассчитывали с учетом объемного отношения фаз, равного 6 (50 мкл сорбента на 300 мкл раствора).
[0163] Из данных, представленных в Табл.4.2.1, очевидно, что степень очистки от примесей при хроматографии с гидрофобным взаимодействием значительно улучшается при переходе от условий проточного режима к условиям слабого распределения при сравнимых выходах продукта. Дальнейшее повышение концентрации соли приводит к тому, что значения коэффициента распределения переходят в область сильного связывания. Из данных Табл.4.2.1 также видно, что как степень очистки, так и выход продукта существенно ухудшаются при переходе от условий слабого распределения к условиям сильного связывания. Поэтому оптимальный интервал рабочих условий для подобного процесса соответствует условиям слабого распределения. Хроматография с гидрофобным взаимодействием в режиме слабого распределения приводит к очистке от БКХ на 1 лог. ед. и 3,4-кратному снижению содержания белка А. В данном примере количество связанного продукта в условиях слабого распределения составляло 2,8-5 мг/мл сорбента.
Эксперимент 4.2.2. Опыты на колонках с использованием в качестве нагрузки целевой фракции, очищенной на сорбенте Q-Sepharose
[0164] В данной серии экспериментов использовали целевые фракции, полученные очисткой на сорбенте Q Sepharose FF. Это было выполнено для того, чтобы подчеркнуть дальнейшее улучшение рабочих характеристик хроматографии с гидрофобным взаимодействием в условиях слабого распределения при использовании нагрузки с более высокой степенью очистки. Материал нагрузки, содержащий 2880 м.д. БКХ, был получен очисткой целевой фракции, очищенной на белке А, на колонке с сорбентом Q-Sepharose FF. Для сравнения степени очистки от примесей было проведено два эксперимента, в одном из которых соблюдались условия слабого распределения, в другом - типичные условия проточного режима. В первом случае целевую фракцию, очищенную на сорбенте Q-Sepharose, разбавляли до значения концентрации, равного 3,27 мг/мл, при концентрации Na2SO4, равной 550 мМ, и нагружали колонку при величине нагрузки в 100 мг/мл сорбента в режиме слабого распределения. Колонку последовательно промывали буферным раствором, содержащим соль в той же концентрации, что и в нагрузке, в количестве 10 объемов колонки и десорбировали 50 мМ трис-буфером при рН 7,5 в количестве 6 объемов колонки. Второй эксперимент проводили в условиях проточного режима. Нагрузку разбавляли 200 мМ Na2SO4 до значения концентрации, равного 3,03 мг/мл, и нагружали колонку при величине нагрузки в 90 мг/мл сорбента. Затем колонку промывали буферным раствором, содержащим соль в той же концентрации, что и в нагрузке, в количестве 6 объемов колонки и затем десорбировали 50 мМ трис-буфера при рН 7,5 в количестве 6 объемов колонки. В обоих экспериментах элюат и промывочные фракции собирали и анализировали на содержание продукта и примесей. Результаты данных экспериментов приведены в Табл.4.2.2.
[0165] Значения выхода подукта в условиях слабого распределения оказались сравнимыми с проточным режимом и не зависели от использованной нагрузки. Степень очистки от БКХ являлась значительно большей в условиях слабого распределения по сравнению с проточным режимом.
[0166] Значения ЛСО БКХ при хроматографии с гидрофобным взаимодействием в проточном режиме для обеих использованных нагрузок были сравнимыми (примерно 0,4-0,5 лог. ед.). Однако в условиях слабого распределения при переходе от нагрузки, очищенной на белке А, к нагрузке, очищенной на белке А и сорбенте Q Sepharose FF, ЛСО БКХ повышалась с 1 лог. ед. до более чем 2 лог. ед.
Выводы
[0167] Показано, что хроматография с гидрофобным взаимодействием успешно применима в режиме слабого распределения. Установлено, что характеристики хроматографии с гидрофобным взаимодействием в режиме слабого распределения, в частности выход продукта и степень очистки от БКХ и белка А, превосходят соответствующие характеристики как в проточном режиме, так и в режиме сильного связывания. В условиях слабого распределения была успешно очищена фракция при величине нагрузки, равной 100 мг/мл, причем количество связанного с сорбентом продукта составляло >3 мг/мл при концентрации продукта в нагрузке величиной 3,27 мг/мл. Значения коэффициентов распределения, соответствующие оптимальным условиям слабого распределения, видимо, немного превосходят соответствующие значения для анионообменной хроматографии.
Серия 5. Гидроксиапатитная хроматография Mab-MYA на керамическом гидроксиапатите I типа
Эксперимент 5.1. Определение условий режимов WP и FT путем высокопроизводительного скрининга
[0168] Для определения условий режима слабого распределения и проточного режима при хроматографии Mab-MYA на керамической гидроксиапатитной среде был проведен высокопроизводительный скрининг. Для определения влияния на связывание Mab-MYA гидроксиапатитной средой при скрининге варьировали концентрации хлорида натрия и фосфата натрия.
[0169] В 30 лунок 96-луночного фильтр-планшета вносили по 50 мкл керамической гидроксиапатитной среды. Каждую лунку уравновешивали растворами, полученными растворением соответствующих количеств хлорида натрия и фосфата натрия в 100 мМ HEPES-буфере, содержащем 100 мМ аргинина, при рН 7,2. Концентрации указанных солей в растворе приведены в Табл.5.1.1 и 5.1.2. Каждое сочетание условий исследовали дважды. Величина нагрузки по Mab-MYA в каждой лунке составляла 5,0 мг/мл сорбента.
[0170] На первой стадии высокопроизводительного скрининга лунки уравновешивали растворами, содержащими хлорид натрия и фосфат натрия в количествах, указанных в Табл.5.1.1 и 5.1.2, при объемном отношении фаз 6:1 (300 мкл раствора на 50 мкл сорбента). Планшет встряхивали в течение 20 мин до достижения равновесия. Затем раствор удаляли центрифугированием планшета. Цикл уравновешивания повторяли три раза.
[0171] На второй стадии сорбент в каждой лунке нагружали концентрированным раствором Mab-MYA при соответствующих величинах нагрузки и концентрациях хлорида натрия и фосфата натрия. Объемное отношение фаз составляло 6:1 (300 мкл раствора на 50 мкл сорбента). В качестве исходного раствора использовали раствор Mab-MYA в буферном растворе, содержащем 50 мМ NaCI, 100 мМ HEPES и 100 мМ аргинина (рН 7,2). Концентрация антитела в исходном растворе составляла 7,0 мг/мл. Планшет с нагрузкой встряхивали 20 мин для достижения равновесия между сорбентом и раствором. Затем из фильтр-планшета центрифугированием удаляли супернатант, который собирали в сборный планшет. Концентрацию белка в супарнатантах определяли по поглощению при 280 нм.
[0172] На третьей стадии сорбент промывали путем добавления растворов, содержащих хлорид натрия и фосфат натрия, в концентрациях, указанных в Табл.5.1.1 и 5.1.2. После 20-минутного встряхивания супернатант удаляли.
[0173] На четвертой стадии для удаления остаточного белка, связанного с сорбентом, к последнему добавляли буферный раствор, содержащий 100 мМ фосфата натрия и 1М NaCl при рН 7,2.
[0174] Для каждой лунки с использованием значений массы, элюированной на четвертой стадии, и концентраций продукта на второй стадии были рассчитаны коэффициенты распределения, приведенные в Табл.5.1.3.
[0175] Как видно из Табл.5.1.3, для определения областей, в которых Mab-MYA связывается с гидроксиапатитной средой с различной силой, может быть использовано значение Кр. Силу связывания Mab-MYA с гидроксиапатитной средой можно регулировать путем изменения концентраций хлорид- и фосфат-ионов в проточном режиме (Кр≤0,1) и режимах слабого распределения (0,1<Кр<20) и связывания (Кр≥20).
Эксперимент 5.2. Эксперименты на колонках в условиях слабого распределения
[0176] Описанные ниже эксперименты были выполнены для того, чтобы подчеркнуть улучшение характеристик гидроксиапатитной хроматографии в условиях слабого распределения. Эксперименты проводили в соответствующем интервале значений коэффициента распределения, определенном высокопроизводительным скринингом (Эксперимент 5.1). Было проведено 12 анализов при величине нагрузки по продукту, равной 100 мг/мл сорбента.
Хроматография на среде Mabselect Protein A
[0177] Была проведена очистка культуры, содержащей моноклональные антитела, на колонке с сорбентом MabSelect. Колонку уравновешивали раствором, содержащим 50 мМ трис-основания и 150 мМ NaCl при рН 7,5 и скорости потока 300 см/ч в количестве 5 объемов колонки. Затем колонку нагружали при величине нагрузки примерно в 40 мг продукта/мл сорбента. После нагрузки колонку промывали раствором, содержащим 1 М аргинина и 50 мМ трис-основания при рН 7,5, в количестве 10 объемов колонки и раствором, содержащим 10 мМ трис-основания и 75 мМ NaCl при рН 7,5, в количестве 5 объемов колонки. После этого колонку элюировали раствором, содержащим 100 мМ аргинина и 50 мМ NaCl при рН 3,0. Целевую продуктсодержащую фракцию нейтрализовали до рН 7,2 с использованием 2М HEPES (рН 8,0).
Хроматография на керамическом гидроксиапатите
[0178] Целевую фракцию антител, частично очищенную на белке А, подвергали дальнейшей очистке на гидроксиапатите. Диаметр колонки составлял 0,5 см, высота колонки - 10 см.
[0179] Для всех стадий гидроксиапатитной хроматографии, описанных в серии экспериментов №5, использовали следующие условия (исключения указаны в описаниях соответствующих экспериментов):
Рабочая скорость потока - 150-240 см/ч
Уравновешивающий буферный раствор №1 - 300 мМ фосфата натрия, 1,0 М NaCl, pH 6,8 (3 объема колонки)
Уравновешивающий буферный раствор №2 - 5-30 мМ фосфата натрия, 50-760 мМ NaCl, 100 мМ аргинина, 100 мМ HEPES, pH 7,2 (5 объемов колонки)
Промывочный раствор - 5-30 мМ фосфата натрия, 50-760 мМ NaCl, 100 мМ аргинина, 100 мМ HEPES, pH 7,2 (5-10 объемов колонки)
[0180] Колонку уравновешивали буферным раствором №1 в количестве 5 объемов колонки, затем - буферным раствором №2. После этого колонку нагружали целевой фракцией, полученной очисткой на белке А на предыдущей стадии, с добавлением соответствующего количества буферного раствора №2. Величина нагрузки составляла 100 мг продукта на 1 мл сорбента. Продукт выделяли в виде элюата, полученного в течение цикла нагрузки, и промывочной фракции, количество которой составляло несколько объемов колонки. Результаты данных экспериментов представлены в Табл.5.2.1 и на Фиг.11.
[0181] Условия нагружения соответствовали проточному режиму, режиму слабого распределения (WP) и области связывания. Оценка коэффициента распределения Кр и количества связанного продукта в мг/мл сорбента при указанной концентрации хлорид- и фосфат-ионов была проведена при высокопроизводительном скрининге, описанном в Эксперименте 5.1. Связанный продукт определяли по объему выхода продукта в колоночных экспериментах. Результаты по очистке от БКХ и белка А для данных экспериментов приведены в Табл.5.2.1 и на Фиг.11.
[0182] Из данных, представленных в Табл.5.2.1 и на Фиг.11, видно, что степень очистки от примесей путем гидроксиапатитной хроматографии значительно увеличивается при переходе от условий проточного режима к условиям слабого распределения при сравнимых выходах продукта. Работа в условиях, соответствующих дальнейшему повышению коэффициента распределения (т.е. в области связывания), не приводит к дополнительным преимуществам в очистке. При этом выход продукта в условиях сильного связывания начинает падать. Поэтому оптимальная область рабочих условий для данного процесса разделения соответствует области режима слабого распределения. В условиях слабого распределения при величине нагрузки, составляющей 100 мг продукта на 1 мл сорбента, достигается степень очистки от белка А величиной более 2 лог. ед, от БКХ - более 1,2 лог. ед. Количество связанного продукта в условиях слабого распределения в данном примере составляло 3,0-10,2 мг/мл сорбента.
Выводы
[0183] Показано, что еще один вид хроматографии (гидроксиапатитная хроматография) успешно применим в режиме слабого распределения. Белок А и БКХ сильнее связываются с керамическим сорбентом, чем целевые антитела, и в условиях слабого распределения сильно удерживаются на сорбенте. Наиболее высокое значение Кр для области слабого распределения в некоторых случаях лежит между 10 и 20, причем при столь высоком Кр удается достичь хорошего выхода продукта (более 90%). Более низкие значения Кр соответственно приводят к более высоким выходам.
[0184] В данном примере показано, что рабочие характеристики колонки могут быть вначале оптимизированы путем выбора рабочего значения коэффициента распределения. В гидроксиапатитной хроматографии указанный коэффициент является сложной функцией рН, состава и концентрации соли, фосфата и буферных компонентов. Каждая из указанных переменных в общем случае оказывает влияние на характеристики колоночной стадии. Представленный в настоящем изобретении подход обеспечивает простые средства для установления влияния изменения любой из этих переменных на характеристики колонки. Подход с использованием коэффициента распределения в качестве обобщенного параметра, представленный в настоящем примере, открывает возможность работы в более широком интервале рабочих условий для данного вида хроматографии по сравнению с использованными ранее. Условия слабого распределения, обеспечивающие оптимальные характеристики хроматографии, могут быть легко найдены методом высокопроизводительного скрининга, описанным выше.
Серия 6. Хроматография антител Mab-A5T на керамическом гидроксиапатите типа I
Эксперимент 6.1. Определение условий режимов WP и FT путем высокопроизводительного скрининга
[0185] Для определения условий режима слабого распределения и проточного режима при хроматографии Mab-A5T на керамической гидроксиапатитной среде был проведен высокопроизводительный скрининг. При скрининге варьировали рН и концентрации хлорида натрия и фосфата натрия с целью установления их влияния на связывание Mab-A5T с гидроксиапатитной средой.
[0186] В 36 лунок 96-луночного фильтр-планшета вносили по 50 мкл керамической гидроксиапатитной среды. Каждую лунку уравновешивали растворами хлорида натрия и фосфата натрия определенной концентрации в 50 мМ HEPES-буфере, содержащем 50 мМ аргинина при рН 7,0 или 8,0. Концентрации обеих солей в растворах указаны в Табл.6.1.1 и 6.1.2. Условия, приведенные в столбцах 1-3, соответствуют рН 7,0, в столбцах 4-6 - рН 8,0. Величина нагрузки по Mab-A5T в каждой лунке составляла 5,0 мг/мл сорбента.
[0187] На первой стадии высокопроизводительного скрининга каждую лунку уравновешивали растворами, содержание хлорида натрия, фосфата натрия и рН которых указаны в Табл.6.1.1 и 6.1.2. Объемное отношение фаз составляло 6:1 (300 мкл раствора на 50 мкл сорбента). Планшет встряхивали 20 мин для достижения равновесия. Затем раствор удаляли из фильтр-планшета центрифугированием. Цикл уравновешивания повторяли три раза.
[0188] На второй стадии сорбент в каждой лунке нагружали концентрированным раствором Маb-А5Т при определенных величине нагрузки по белку и концентрациях хлорида натрия и фосфата натрия. Объемное отношение составляло 6:1 (300 мкл раствора на 50 мкл сорбента). В качестве исходного раствора использовали раствор Маb-А5Т в 1 мМ HEPES и 100 мМ NaCl концентрацией 6,9 мг/мл при рН 7,0. Планшет с нагрузкой встряхивали 20 мин для достижения равновесия между сорбентом и раствором. Затем из фильтр-планшета центрифугированием удаляли супернатант, который собирали в сборный планшет. Концентрацию белка в супернатантах каждой ячейки определяли по поглощению при 280 нм.
[0189] На третьей стадии сорбент промывали раствором, концентрации хлорида натрия и фосфата натрия и рН которых указаны в Табл.6.1.1 и 6.1.2. После 20-минутного встряхивания супернатант удаляли.
[0190] На четвертой стадии для удаления остаточного белка, связанного с сорбентом, к последнему добавляли буферный раствор, содержащий 100 мМ фосфата натрия и 1 М NaCl при рН 7,2. Для каждой лунки с использованием значений массы, удаленной на четвертой стадии, и концентраций продукта на второй стадии были рассчитаны коэффициенты распределения, приведенные в Табл.6.1.3.
[0191] Как видно из Табл.6.1.3, для определения областей, в которых Маb-А5Т связывается с гидроксиапатитной средой с различной силой, может быть использовано значение Кр. Силу связывания Маb-А5Т с гидроксиапатитной средой можно регулировать путем изменения концентраций NaCl и фосфат-ионов и рН в проточном режиме и режимах слабого распределения и связывания.
Эксперимент 6.2. Эксперименты на колонках в условиях слабого распределения
[0192] Описанные ниже эксперименты были выполнены для того, чтобы подчеркнуть улучшение характеристик гидроксиапатитной хроматографии в условиях слабого распределения. Эксперименты проводили в соответствующем интервале значений коэффициента распределения, определенном высокопроизводительным скринингом (Эксперимент 6.1). Было проведено 8 анализов при величине нагрузки по продукту, равной 110 мг/мл сорбента.
Хроматография на среде Mabselect Protein A
[0193] Была проведена очистка культуры, содержащей моноклональные антитела, на колонке с сорбентом MabSelect. Колонку Mabselect Protein A уравновешивали раствором, содержащим 50 мМ трис-основания и 150 мМ NaCl при рН 7,5 и скорости потока 300 см/ч в количестве 5 объемов колонки. Затем колонку нагружали при величине нагрузки примерно в 40 мг продукта/мл сорбента. После нагружения колонку промывали раствором, содержащим 1М NaCl и 50 мМ трис-основания при рН 7,5 в количестве 5 объемов колонки и раствором, содержащим 10 мМ трис-основания и 75 мМ NaCl при рН 7,5 в том же количестве. Затем колонку элюировали раствором, содержащим 100 мМ аргинина и 50 мМ NaCl при рН 3,0. Целевую фракцию нейтрализовали до рН 7,2 с использованием 2М HEPES (рН 8,0).
Хроматография на керамическом гидроксиапатите
[0194] Целевые фракции антител, частично очищенные на белке А, подвергали дальнейшей очистке на гидроксиапатите. Диаметр колонки составлял 0,5 см, высота- 10 см.
Для всех стадий гидроксиапатитной хроматографии, описанных в серии экспериментов №6, использовали следующие условия (исключения указаны в описаниях соответствующих экспериментов):
Рабочая скорость потока - 150-240 см/ч
Уравновешивающий буферный раствор №1 - 300 мМ фосфата натрия, 1,0 М NaCl, рН 6,8 (3 объема колонки)
Уравновешивающий буферный раствор №2 - 2-32 мМ фосфата натрия, 50-400 мМ NaCl, 5 мМ имидазола, 50 мМ глицина, 10 мМ HEPES, рН 7,0 (5 объемов колонки)
Промывочный раствор - идентичен уравновешивающему буферному раствору №2.
[0195] Колонку уравновешивали буферным раствором №1 в количестве 5 объемов колонки, затем - буферным раствором №2. После этого колонку нагружали целевой фракцией, полученной очисткой на белке А, с добавлением определенного количества буферного раствора №2. Величина нагрузки составляла 110 мг продукта/мл сорбента. Продукт выделяли в виде элюата, полученного в течение цикла нагрузки, и промывочной фракции, количество которой составляло несколько объемов колонки. Результаты данных экспериментов представлены в Табл.6.2.1 и на Фиг.12.
[0196] Рабочие условия данных экспериментов соответствовали проточному режиму, режиму слабого распределения и режиму связывания. Оценка коэффициента распределения Кр при указанных рН и концентрации хлорид- и фосфат-ионов была проведена высокопроизводительным скринингом, описанным в Эксперименте 6.1. Эксперименты ранжировали в Табл.6.2.1 по значению коэффициента распределения. Связанный продукт определяли путем измерения количества белка в десорбционном растворе с использованием УФ-поглощения. Данный способ определения связанного продукта обычно приводит к недооценке количества продукта, связанного в ходе нагружения, вследствие постепенной десорбции продукта при промывке. Значения степени очистки от БКХ и ВМФ, а также выходов подукта, полученные в данных экспериментах, представлены на Фиг.12.
[0197] Из данных, представленных на Фиг.12, видно, что степень очистки от БКХ и ВМФ путем гидроксиапатитной хроматографии значительно повышается при переходе от условий проточного режима к условиям слабого распределения, при этом выход продукта превышает 80%. Работа в условиях, соответствующих дальнейшему повышению коэффициента распределения (т.е. в области связывания), не приводит к дополнительным преимуществам в очистке. При этом выход продукта в условиях сильного связывания начинает падать. Поэтому оптимальная область рабочих условий для данного процесса разделения соответствует области слабого распределения. В условиях слабого распределения при величине нагрузки, составляющей 110 мг продукта на 1 мл сорбента, достигается 4-кратное снижения содержания ВМФ и снижение количества БКХ на более чем 1,4 лог. ед. Количество связанного продукта в условиях слабого распределения в данном примере составляло 1,6-6,7 мг/мл сорбента.
Выводы
[0198] Второй пример гидроксиапатитной хроматографии в условиях слабого распределения показывает, что степень очистки от БКХ и ВМФ и выход продукта (>80%) в данных условиях повышаются. Как и в предыдущих экспериментах, рабочие условия данной стадии были предварительно оптимизированы путем выбора коэффициентов распределения, использованных при анализах. Подход, предложенный в настоящем изобретении, обеспечивает простые средства установления влияния любой из нескольких переменных (рН, концентрации солей, фосфат-ионов, имидазола, глицина, HEPES и др.) на характеристики колонки. Условия слабого распределения, обеспечивающие оптимальные рабочие характеристики, могут быть легко найдены с использованием высокопроизводительного скрининга, описанного в данном примере. Представленный подход открывает для данного вида хроматографии возможность работы в более широком интервале рабочих условий по сравнению с использованными ранее. Оптимальная область слабого распределения в данном примере соответствует значениям коэффициента распределения, составляющим 2-20.
Серия 7. Хроматография антител Mab-MYO на керамическом гидроксиапатите типа I
Эксперимент 7.1. Определение условий режимов WP и FT путем высокопроизводительного скрининга
[0199] Для определения условий режима слабого распределения и проточного режима при хроматографии Mab-MYO на керамической гидроксиапатитной среде был проведен высокопроизводительный скрининг. При скрининге варьировали рН и концентрации аргинина/глицина, HEPES, хлорида натрия и фосфата натрия с целью установления их влияния на связывание Mab-MYO с гидроксиапатитной средой.
[0200] Детали проведения процедуры высокопроизводительного скрининга, использованной в настоящем примере, идентичны описанным в Сериях 5 и 6 и не излагаются. Значения Кр, предсказанные на основе построения поверхности отклика по данным высокопроизводительного скрининга, были использованы для выбора условий колоночных экспериментов.
Эксперимент 7.2. Эксперименты на колонках в условиях слабого распределения
[0201] Изложенные ниже эксперименты проводили в условиях, соответствующих интервалу коэффициентов распределения, определенных высокопроизводительным скринингом. Данные эксперименты были выполнены для того, чтобы подчеркнуть улучшение характеристик гидроксиапатитной хроматографии, в частности, степени очистки от БКХ и ВМФ, в условиях слабого распределения. Было проведено 4 анализа при величине нагрузки, равной 55 мг/мл сорбента. Использованное значение нагрузки является низким для режима слабого распределения и типичным для проточного режима. Попытки оптимизировать величину нагрузки для работы в режиме слабого распределения в данных экспериментах сделано не было.
[0202] В экспериментах использовали целевые фракции антител, частично очищенные на белке А. Диаметр колонки составлял 0,5 см, высота - 10 см.
[0203] Для всех стадий гидроксиапатитной хроматографии, описанных в серии экспериментов №7, использовали следующие условия (исключения указаны в описаниях соответствующих экспериментов):
Рабочая скорость потока - 150-240 см/ч
Уравновешивающий буферный раствор №1 - 300 мМ фосфата натрия, 1,0 М NaCl, pH 6,8 (2-5 объемов колонки)
Уравновешивающий буферный раствор №2 - 1-8 мМ фосфата натрия, 50-1750 мМ NaCl, 12-50 мМ аргинина, 20-50 мМ HEPES, pH 7,0 (5 объемов колонки)
Промывочный раствор - идентичен уравновешивающему буферному раствору №2
[0204] Колонку уравновешивали буферным раствором №1 в количестве 2-5 объемов колонки, затем - буферным раствором №2 в количестве 5 объемов колонки. Затем колонку нагружали целевой фракцией, очищенной на белке А, с добавлением определенного количества буферного раствора №2. Величина нагрузки составляла 55 мг продукта/мл сорбента. Продукт выделяли в виде элюата, полученного в течение цикла нагрузки, и промывочной фракции, количество которой составляло несколько объемов колонки. Результаты данных экспериментов представлены в Табл.7.2.1 и на Фиг.13.
*Оптимальное значение Кр, см. Фиг.13
[0205] Рабочие условия данных экспериментов соответствовали проточному режиму, режиму слабого распределения и режиму связывания. Оценка коэффициента распределения Кр при указанных рН и концентрации хлорид- и фосфат-ионов, глицина/аргинина и HEPES была проведена при высокопроизводительном скрининге, описанном в Эксперименте 7.1. Эксперименты ранжировали в Табл.7.2.1 по значению коэффициента распределения. Связанный продукт определяли путем измерения количества белка в десорбционном растворе с использованием УФ-поглощения. Данный способ определения связанного продукта обычно приводит к недооценке количества продукта, связанного в ходе нагружения, вследствие постепенной десорбции продукта при промывке. Значения степени очистки от ВМФ, а также выходов подукта, полученные в данных экспериментах, представлены на Фиг.13.
Из данных, представленных на Фиг.13, видно, что степень очистки от ВМФ путем гидроксиапатитной хроматографии значительно повышается при переходе от условий проточного режима к условиям слабого распределения, при этом выход продукта превышает 80%. Работа в условиях, соответствующих дальнейшему повышению коэффициента распределения (т.е. в области связывания), не приводит к дополнительным преимуществам в очистке. При этом выход продукта в условиях сильного связывания начинает падать. Поэтому оптимальная область рабочих условий для данного процесса разделения соответствует области слабого распределения. В условиях слабого распределения было достигнуто 20-кратное снижения содержания ВМФ. Количество связанного продукта в условиях слабого распределения в данном примере составляло 5,1-9,5 мг/мл сорбента.
Выводы
[0206] Данный пример гидроксиапатитной хроматографии в условиях слабого распределения показывает, что степень очистки от ВМФ в данном режиме повышается при хорошем выходе продукта (>80%). Связывание ВМФ, в том числе происходящих от продукта, с керамическим сорбентом является более сильным, чем связывание антител, и остается сильным в условиях слабого распределения. Область слабого распределения в данном примере соответствует значениям коэффициента распределения, составляющим 8-20.
[0207] Вновь подтверждено, что рабочие условия колоночной стадии могут быть предварительно оптимизированы путем выбора значений коэффициентов распределения, используемых при анализах. Представленный подход обеспечивает простые средства для установления влияния изменения любой из нескольких переменных (рН, концентрации солей, фосфат-ионов, аргинина, HEPES и др.) на характеристики колонки. Условия слабого распределения, обеспечивающие оптимальные рабочие характеристики, могут быть легко найдены с использованием высокопроизводительного скрининга, описанного в данном примере. Представленный подход открывает для данного вида хроматографии возможность работы в более широком интервале рабочих условий по сравнению с использованными ранее.
[0208] Следует также отметить, что концепция хроматографии в режиме слабого распределения является работоспособной в системах, в которых распределение достигается не только путем взаимодействия зарядов. Общий подход, предлагаемый в настоящем изобретении, может успешно применяться к комплексным системам, например при сочетании хроматографии с гидрофобным взаимодействием с гидроксиапатитной хроматографией. При этом, например, на рабочие характеристики гидроксиапатитной хроматографии, помимо рабочего значения рН, могут влиять некоторые другие переменные, в том числе концентрация NaCl, фосфатов, аргинина/глицина, составляющих буферных растворов, а также тип сорбента. Однако интервал рабочих условий, соответствующих режиму слабого распределения, легко определяется путем простых экспериментов по статическому связыванию с использованием чистого целевого продукта.
Серия 8. Цвиттерионный буферный раствор для элюирования с белка А с последующей ионообменной хроматографией
[0209] Культуру, содержащую моноклональное антитело, подвергали очистке на сорбенте MabSelect. Колонку со средой Mabselect Protein А уравновешивали раствором, содержащим 50 мМ трис-основания и 150 мМ NaCl при рН 7,5, в количестве 5 объемов колонки. Затем колонку нагружали при величине нагрузки, примерно равной 40 мг продукта на 1 мл сорбента. После нагрузки колонку промывали раствором, содержащим 1М NaCl и 50 мМ трис-основания при рН 7,5 в количестве 5 объемов колонки и раствором, содержащим 10 мМ трис-основания и 75 мМ NaCl при рН 7,5, в том же количестве. После промывки колонку элюировали 30 мМ HEPES при рН 3,1. Целевую фракцию нейтрализовали до рН 7,2 с использованием 1М HEPES (рН 8,0). Общая концентрация HEPES составляла 55 мМ. При рН 7,2 доля ионной силы буферного раствора, отвечающая HEPES, составляла 17 мМ.
[0210] Все цитированные документы включены в описание настоящего изобретения посредством ссылки в полном виде и для любых целей, как если бы приложение каждой публикации, патента или заявки на патент в качестве ссылки в полном виде для любых целей было бы особо и отдельно оговорено. В тех случаях, когда публикации, патенты или заявки на патент, приложенные в качестве ссылки, противоречат раскрытию предмета настоящего изобретения в его описании, последнее лишает силы любой из указанных аспектов данных материалов или получает над ним преимущественную силу.
[0211] Все использованные в описании и формуле настоящего изобретения численные значения, выражающие количество составляющих, условия реакции и др., во всех случаях следует понимать как сопровождающиеся словом «примерно». В соответствии с данным замечанием, если не оговорено обратное, численные параметры, отраженные в описании и формуле настоящего изобретения, являются приблизительными и могут меняться в зависимости от целевых свойств, на достижение которых претендует настоящее изобретение. Как минимум, но не в качестве попытки ограничить применение теории эквивалентов к содержанию формулы изобретения, каждый численный параметр следует понимать с учетом числа значащих цифр и обычных операций округления.
[0212] Специалистам в области настоящего изобретения является понятным, что настоящее изобретение может быть подвергнуто множеству модификаций и изменений без отступления от его содержания и истинного смысла. Конкретные варианты реализации настоящего изобретения, изложенные в настоящем описании, приводятся только в качестве примеров и не органичивают настоящее изобретение никоим образом. Предполагается, что настоящие описание и примеры рассматриваются только в качестве иллюстрации и что истинные содержание и смысл настоящего изобретения переданы нижеследующей формулой.
Реферат
Изобретение относится к области биохимии. Предложены способы выделения очищенного белкового продукта (варианты) и способы выделения очищенного антитела (варианты) посредством хроматографии в режиме слабого распределения. Способы предусматривают пропускание загружаемой жидкости, содержащей белковый продукт или антитело, через среду при рабочих условиях, которые в одном варианте реализации способа обеспечивают связывание по меньшей мере 1 мг продукта на 1 мл среды. В другом варианте реализации способа рабочие условия характеризуются значением коэффициента распределения, равным по меньшей мере 0.1. Причем указанные рабочие условия определяют посредством скрининга. Указанную среду выбирают из группы, включающей заряженную ионообменную среду, смолу для хроматографии с гидрофобным взаимодействием, смолу для аффинной хроматографии с иммобилизованными металлами. Затем осуществляют выделение очищенного продукта из элюата, выходящего из колонки. Способы обеспечивают высокий выход очищенного белкового продукта или антитела при использовании высоких величин нагрузок 50-500 мг продукта/мл среды. 8 н. и 176 з.п. ф-лы, 13 ил., 30 табл., 8 пр.
Формула
- пропускание указанной загружаемой жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере 2.8 мг продукта на 1 мл среды, причем указанные рабочие условия определяют посредством скрининга, при этом указанная среда выбрана из группы, включающей: заряженную ионообменную среду, смолу для хроматографии с гидрофобным взаимодействием и смолу для аффинной хроматографии с иммобилизованными металлами;
- выделение очищенного продукта из элюата, выходящего из колонки.
- пропускание указанной загружаемой жидкости через среду при рабочих условиях, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1, причем указанные рабочие условия определяют посредством скрининга;
- выделение очищенного продукта из элюата, выходящего из колонки.
- пропускание указанной загружаемой жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере от примерно 2,8 до примерно 13 мг продукта на 1 мл среды, причем указанные рабочие условия определяют посредством скрининга;
- выделение очищенного продукта из элюата, выходящего из колонки.
фосфат, кальций, аргинин, глицин, HEPES и противолиганд.
- пропускание указанной загружаемой жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере 1 мг продукта на 1 мл среды, причем указанные рабочие условия определяют посредством скрининга, при этом указанная среда выбрана из группы, включающей: смолу для хроматографии с гидрофобным взаимодействием и смолу для аффинной хроматографии с иммобилизованными металлами;
- выделение очищенного продукта из элюата, выходящего из колонки.
- пропускание указанной загружаемой жидкости через заряженную анионообменную среду при рабочих условиях, обеспечивающих связывание по меньшей мере 2,8 мг антитела на 1 мл среды, причем указанные рабочие условия выбраны из группы, включающей: значения рН от 7,5 до 8,2 и концентрацию ионов хлора от 12 до 55 мМ; а указанная загружаемая жидкость представляет собой содержащую продукт жидкость, элюированную из колонки с белком А; и
- выделение очищенного антитела из элюата, выходящего из колонки.
- пропускание указанной загружаемой жидкости через заряженную анионообменную среду при рабочих условиях, характеризуемых значением коэффициента распределения, равным по меньшей мере 0,1, причем указанные рабочие условия выбраны из группы, включающей значения рН от 7,5 до 8,2 и концентрацию ионов хлора от 12 до 55 мМ, а указанная загружаемая жидкость представляет собой содержащую продукт жидкость, элюированную из колонки с белком А; и
- выделение очищенного антитела из элюата, выходящего из колонки в цикле нагрузки.
- пропускание указанной загружаемой жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере 1 мг продукта на 1 мл среды, причем указанные рабочие условия определяют посредством скрининга;
- выделение по меньшей мере 98% очищенного продукта из элюата, выходящего из колонки.
- пропускание указанной загружаемой жидкости через среду при рабочих условиях, обеспечивающих связывание по меньшей мере 3 мг продукта на 1 мл среды, причем указанные рабочие условия определяют посредством скрининга;
- выделение по меньшей мере 93% очищенного продукта из элюата, выходящего из колонки.

Комментарии