Стерильная хроматографическая смола и ее применение в способах производства - RU2679134C2
Код документа: RU2679134C2
Чертежи








Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕНННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной патентной заявке США № 61/928929, зарегистрированной 17 января 2014 года, и предварительной патентной заявке США № 62/001498, зарегистрированной 21 мая 2014 года, каждая из которых включена в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам биотехнологии и биологического производства рекомбинантных белков.
УРОВЕНЬ ТЕХНИКИ
Клетки млекопитающих, включающие нуклеиновую кислоту, кодирующую рекомбинантный белок, часто используют для получения терапевтически или коммерчески важных белков. В нынешних условиях конвейеров разнообразных продуктов биотехнологические компании вынуждены во все большей степени разрабатывать инновационные решения для крайне гибкого и рентабельного производства терапевтических белковых лекарственных веществ. Одной из стратегий эффективного выделения рекомбинантных белков является использование способов, включающих непрерывную хроматографию (например, с использованием замкнутой системы). Одним известным ограничением непрерывной хроматографии является наличие загрязнений в системе (например, повышенной бионагрузки), приводящее к получению загрязненного продукта, снижению выхода продукта и снижению скорости потока (или повышению давления) в системе. Например, повышенная бионагрузка в системе может приводить к полному прекращению работы системы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, по меньшей мере, частично, основано на том открытии, что гамма-облучение хроматографической смолы снижает связывающую способность хроматографической смолы. В свете этого открытия настоящее изобретение относится к способам снижения бионагрузки хроматографической смолы, включающим подвергание контейнера, включающего композицию, включающую хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы, где по меньшей мере один антиоксидант и/или хелатирующее средство присутствуют в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после воздействия дозы гамма-излучения. Также изобретение относится к способам снижения бионагрузки хроматографической смолы, включающим подвергание контейнера, включающего композицию, включающую хроматографическую смолу (и, необязательно, по меньшей мере один антиоксидант и/или хелатирующее средство в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после воздействия гаммы-облучения) гамма-облучению при мощности от приблизительно 0,1 кГр/ч до приблизительно 6 кГр/ч и/или при температуре от приблизительно 4°C до приблизительно 25°C для дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы. Также изобретение относится к хроматографическим колонкам со сниженной бионагрузкой, содержащей хроматографическую смолу со сниженной бионагрузкой, полученную любыми способами, представленными в настоящем описании, композициям, включающим хроматографическую смолу и по меньшей мере одно хелатирующее средство и/или антиоксидант, способам осуществления хроматографии на колонке со сниженной бионагрузкой с использованием по меньшей мере одной из этих хроматографических колонок со сниженной бионагрузкой и интегрированным, замкнутым или, по существу, замкнутым, и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим применение по меньшей мере одной из этих хроматографических колонок со сниженной бионагрузкой. Любые хроматографические смолы, получаемые любым из способов, представленных в настоящем описании, любые из наполненных хроматографических колонок, получаемых любым из способов, представленных в настоящем описании, любой из способов осуществления хроматографии на колонках и любой из способов, представленных в настоящем описании, могут являться стерильными, абсолютно стерильными, асептическими или со сниженной бионагрузкой. Любые хроматографические смолы, получаемые любым из способов, представленных в настоящем описании, любая из хроматографических колонок, получаемых любым из способов, представленных в настоящем описании, и любой из способов, представленных в настоящем описании, могут являться асептическими и стерильными, абсолютно стерильными, асептическими или со сниженной бионагрузкой.
Настоящее изобретение относится к способам снижения бионагрузки хроматографической смолы, включающим: подвергание контейнера, включающего композицию, включающую хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы, где по меньшей мере один антиоксидант и/или хелатирующее средство присутствует в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после воздействия дозы гамма-излучения. Некоторые варианты осуществления этих способов дополнительно включают помещение композиции перед воздействием в контейнер. В некоторых примерах облучение осуществляют при мощности от приблизительно 0,1 кГр/ч до приблизительно 6 кГр/ч и/или при температуре от приблизительно 4°C до приблизительно 25°C. В некоторых примерах любого из этих способов контейнер является сосудом для хранения, хроматографической колонкой или наполненной хроматографической колонкой. В некоторых примерах любого из способов, представленных в настоящем описании, композиция является суспензией седиментированной хроматографической смолы в жидкости, включающей по меньшей мере один антиоксидант и/или хелатирующее средство. В некоторых примерах жидкость содержит: (i) от 75 мМ до приблизительно 125 мМ (например, от 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) маннита; (ii) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) метионина (или, альтернативно, цистеина или глутатиона); (iii) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) аскорбата натрия; (iv) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) гистидина; (v) от 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ или от приблизительно 45 мМ до приблизительно 55 мМ) метионина (или, альтернативно, цистеина или глутатиона) и от приблизительно 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ или от приблизительно 45 мМ до приблизительно 55 мМ) гистидина; (vi) от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ о приблизительно 35 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) гистидина, и от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) аскорбата натрия; или (vii) от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) аскорбата натрия, от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) маннита и от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) гистидина. В некоторых примерах жидкость является буферным раствором (например, фосфатным буферным раствором, например, буферным раствором фосфата натрия, таким как 50 мМ фосфат натрия, pH 6,0).
В некоторых примерах любого из способов, представленных в настоящем описании, композиция является твердой смесью. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, композиция включает по меньшей мере один антиоксидант, выбранный из группы: восстановленного глутатиона, восстановленного тиоредоксина, восстановленного цистеина, каротиноида, мелатонина, ликопина, токоферола, восстановленного убихинона, аскорбата, билирубина, мочевой кислоты, липоевой кислоты, флавоноида, фенилпропионовой кислоты, лидокаина, нарингенина, фуллерена, глюкозы, маннита, 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксила и диметилметоксихроманола. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, композиция включает по меньшей мере один (один, два, три или четыре) антиоксидант, выбранный из маннита, аскорбата натрия, метионина (или, альтернативно, цистеина или глутатиона) и гистидина. В некоторых вариантах осуществления композиция включает маннит, аскорбат натрия, метионин (или, альтернативно, цистеин или глутатион) и гистидин. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, композиция включает по меньшей мере одно хелатирующее средство, выбранное из группы: этилендиаминтетрауксусной кислоты (ЭДТА), натриевой соли 2,3-димеркапто-1-пропансульфоновой кислоты (DMPS), димеркаптоянтарной кислоты (DMSA), металлотионеина и дефероксамина.
В некоторых примерах любого из способов, представленных в настоящем описании, композиция включает по меньшей мере одну хроматографическую смолу, выбранную из группы: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной или псевдоаффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы (или любой их комбинации). В некоторых примерах любого из способов, представленных в настоящем описании, хроматографическая смола может являться многомодальной (например, бимодальной) хроматографической смолой (например, хроматографической смолой, имеющей анионообменные группы и группы гидрофобных взаимодействий, или хроматографической смолой, имеющей катионообменные группы и группы гидрофобных взаимодействий). В некоторых примерах любого из способов, представленных в настоящем описании, композиция включает аффинную хроматографическую смолу, включающую белковый лиганд (например, протеин A или протеин G). В некоторых примерах любого из способов, представленных в настоящем описании, композиция включает анионообменную хроматографическую смолу (например, анионообменную хроматографическую смолу, включающую N-бензил-N-метил-этаноламиногруппы).
В некоторых примерах любого из способов, представленных в настоящем описании, доза составляет от приблизительно 2 кГр до приблизительно 45 кГр (например, от приблизительно 20 кГр до приблизительно 30 кГр, от приблизительно 23 кГр до приблизительно 27 кГр, от приблизительно 2 кГр до приблизительно 40 кГр, от приблизительно 2 кГр до приблизительно 35 кГр, от приблизительно 2 кГр до приблизительно 30 кГр, от приблизительно 2 кГр до приблизительно 25 кГр, от приблизительно 10 кГр до приблизительно 45 кГр, от приблизительно 10 кГр до приблизительно 40 кГр, от приблизительно 10 кГр до приблизительно 35 кГр, от приблизительно 10 кГр до приблизительно 30 кГр или от приблизительно 10 кГр до приблизительно 25 кГр). В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, воздействие осуществляют при температуре от приблизительно -25°C до приблизительно 0°C включительно или от приблизительно 0°C до приблизительно 25°C включительно (например, от приблизительно 4°C до приблизительно 25°C).
Также настоящее изобретение относится к хроматографической смоле со сниженной бионагрузкой, получаемой любым из способов, представленных в настоящем описании. В некоторых примерах любая из хроматографических смол со сниженной бионагрузкой, представленных в настоящем описании, имеет уровень гарантии стерильности (SAL) от приблизительно 1×10-8до приблизительно 1×10-5 (например, от приблизительно 1×10-7до приблизительно 1×10-6). Например, хроматографическая смола, получаемая любым из способов, представленных в настоящем описании, может иметь сниженную бионагрузку, являться стерильной, являться асептической или являться абсолютно стерильной. В некоторых вариантах осуществления хроматографическая смола, получаемая любым из способов, представленных в настоящем описании, может являться асептической и иметь сниженную бионагрузку, являться стерильной или являться абсолютно стерильной. Некоторые примеры любых хроматографических смол со сниженной бионагрузкой, представленных в настоящем описании, включают по меньшей мере одну смолу, выбранную из группы: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной или псевдоаффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы. В некоторых вариантах осуществления хроматографическая смола со сниженной бионагрузкой, представленная в настоящем описании, включает аффинную хроматографическую смолу, включающую белковый лиганд (например, протеин A или протеин G). В некоторых вариантах осуществления хроматографическая смола со сниженной бионагрузкой, представленная в настоящем описании, включает анионообменную хроматографическую смолу (например, анионообменную хроматографическую смолу, включающую N-бензил-N-метил-этаноламиногруппы). В некоторых вариантах осуществления хроматографическая смола со сниженной бионагрузкой, представленная в настоящем описании, является многомодальной хроматографической смолой (например, бимодальной хроматографической смолой).
Также настоящее изобретение относится к способам получения наполненной хроматографической колонки со сниженной бионагрузкой, включающим: получение любых хроматографических смол со сниженной бионагрузкой, получаемых любым из способов, представленных в настоящем описании; и наполнение хроматографической смолой колонки со сниженной бионагрузкой в асептических условиях. Также настоящее изобретение относится к наполненным хроматографическим колонкам со сниженной бионагрузкой, получаемым посредством гамма-облучения композиции, включающей хроматографическую смолу для наполненной колонки и по меньшей мере один антиоксидант и/или хелатирующее средство (например, любую из примеров композиций, представленных в настоящем описании), включенных в хроматографическую колонку. Любая из наполненных хроматографических колонок со сниженной бионагрузкой, представленных в настоящем описании, может иметь уровень гарантии стерильности (SAL) от приблизительно 1×10-8 до приблизительно 1×10-5 (например, от приблизительно 1×10-7до приблизительно 1×10-6). Любая из хроматографических колонок, получаемых любым из способов, представленных в настоящем описании, может иметь сниженную бионагрузку, являться стерильной, являться абсолютно стерильной или являться асептической. Например, любая из хроматографических колонок, получаемых любым из способов, представленных в настоящем описании, может являться асептической и может иметь сниженную бионагрузку, являться стерильной или являться абсолютно стерильной.
В некоторых вариантах осуществления любой из наполненных хроматографических колонок со сниженной бионагрузкой, представленных в настоящем описании, смола в наполненной колонке включает по меньшей мере одну смолу, выбранную из группы: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы. В некоторых вариантах осуществления любой из наполненных хроматографических колонок со сниженной бионагрузкой, представленных в настоящем описании, смола включает аффинную хроматографическую смолу, включающую белковый лиганд (например, протеин A или протеин G). В некоторых примерах любой из наполненных хроматографических колонок со сниженной бионагрузкой, представленных в настоящем описании, смола включает анионообменную хроматографическую смолу (например, анионообменная хроматографическая смола включает N-бензил-N-метил-этаноламиногруппы).
Также настоящее изобретение относится к композициям, включающим хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, где по меньшей мере один антиоксидант и/или хелатирующее средство присутствует в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после обработки дозой гамма-излучения, достаточной для снижения бионагрузки композиции. В некоторых примерах любой из композиций, представленных в настоящем описании, композиция является суспензией седиментированной хроматографической смолы в жидкости, включающей по меньшей мере один антиоксидант и/или хелатирующее средство. В некоторых примерах жидкость содержит: (i) от 75 мМ до приблизительно 125 мМ (например, от 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) маннита; (ii) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) метионина (или, альтернативно, цистеина или глутатиона); (iii) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ о приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) аскорбата натрия; (iv) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) гистидина; (v) от 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ или от приблизительно 45 мМ до приблизительно 55 мМ) метионина (или, альтернативно, цистеина или глутатиона) и от приблизительно 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ или от приблизительно 45 мМ до приблизительно 55 мМ) гистидина; (vi) от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ о приблизительно 45 мМ, от приблизительно 20 мМ о приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) гистидина, и от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) аскорбата натрия; или (vii) от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) аскорбата натрия, от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) маннита и от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ о приблизительно 40 мМ, от приблизительно 15 мМ о приблизительно 35 мМ, или от приблизительно 20 мМ до приблизительно 30 мМ) гистидина. В некоторых примерах, жидкость является буферным раствором (например, фосфатным буферным раствором, например, буферным раствором фосфата натрия, такого как 50 мМ фосфат натрия, pH 6,0).
В некоторых примерах любой из композиций, представленных в настоящем описании, композиция является твердой смесью.
Некоторые варианты осуществления любой из композиций, представленных в настоящем описании, могут включать по меньшей мере один антиоксидант, выбранный из группы: восстановленного глутатиона, восстановленного тиоредоксина, восстановленного цистеина, каротиноида, мелатонина, ликопина, токоферола, восстановленного убихинона, аскорбата, билирубина, мочевой кислоты, липоевой кислоты, флавоноида, фенилпропионовой кислоты, лидокаина, нарингенина, фуллерена, глюкозы, маннита, 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксила и диметилметоксихроманола. Некоторые варианты осуществления любой из композиций, представленных в настоящем описании, могут включать по меньшей мере один (один, два, три или четыре) антиоксидант, выбранный из маннита, аскорбата натрия, метионина (или, альтернативно, цистеина или глутатиона) и гистидина. Некоторые примеры любой из композиций, представленных в настоящем описании, включают маннит, аскорбат натрия, метионин (или, альтернативно, цистеин или глутатион) и гистидин. Некоторые примеры любой из композиций, представленных в настоящем описании, могут включать по меньшей мере одно хелатирующее средство, выбранное из группы: этилендиаминтетрауксусной кислоты (ЭДТА), натриевой соли 2,3-димеркапто-1-пропансульфоновой кислоты (DMPS), димеркаптоянтарной кислоты (DMSA), металлотионеина и дефероксамина. В некоторых примерах любой из композиций, представленных в настоящем описании, хроматографическая смола может включать по меньшей мере одну смолу, выбранную из группы: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы. В некоторых примерах любой из композиций, представленных в настоящем описании, смола включает аффинную хроматографическую смолу, включающую белковый лиганд (например, протеин A или протеин G).
Также настоящее изобретение относится к способам осуществления хроматографии на колонках со сниженной бионагрузкой, включающим: (a) получение любой из наполненных хроматографических колонок со сниженной бионагрузкой, получаемых любым из способов, представленных в настоящем описании; и (b) осуществление хроматографии на колонках с использованием наполненной хроматографической колонки со сниженной бионагрузкой и буфера со сниженной бионагрузкой в замкнутой системе. В некоторых примерах любого из способов, представленных в настоящем описании, хроматографию на колонках со сниженной бионагрузкой с использованием наполненной хроматографической колонки со сниженной бионагрузкой осуществляют непрерывно в течение периода по меньшей мере 4 дней (например, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 28 дней или по меньшей мере 60 дней). В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, смола в наполненной хроматографической колонке со сниженной бионагрузкой (a) имеет процентную долю связывающей способности от приблизительно 65% до приблизительно 100% (например, от приблизительно 75% до приблизительно 100%) по сравнению с той же смолой, не подвергнутой гамма-облучению. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, смола в наполненной хроматографической колонке со сниженной бионагрузкой включает по меньшей мере одну смолу, выбранную из группы: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной или псевдоаффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы. В некоторых примерах любого из способов, представленных в настоящем описании, смола включает аффинную хроматографическую смолу, включающую белковый лиганд (например, протеин A или протеин G). В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, смола включает анионообменную хроматографическую смолу.
Также настоящее изобретение относится к интегрированным, замкнутым, или, по существу, замкнутым, и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим: (a) получение жидкой среды для культивирования, включающей рекомбинантный белок, по существу, не содержащей клетки; и (b) непрерывный фидинг жидкой среды для культивирования в многоколоночную систему хроматографии (MCCS), включающей по меньшей мере одну из любых наполненных хроматографических колонок со сниженной бионагрузкой, получаемых любым из способов, представленных в настоящем описании; где в способе используют буфер со сниженной бионагрузкой, способ является интегрированным, и его осуществляют непрерывно от жидкой среды для культивирования до элюата из MCCS, являющегося очищенным рекомбинантным белком. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, посредством MCCS осуществляют по меньшей мере две разные типовые операции. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, способ включает переключение колонок. В некоторых примерах любого из способов, представленных в настоящем описании, посредством MCCS осуществляют типовые операции захвата рекомбинантного белка и инактивации вирусов или осуществляют типовые операции захвата и очистки рекомбинантного белка.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, MCCS включает по меньшей мере две наполненные хроматографические колонки со сниженной бионагрузкой. В некоторых примерах любого из способов, представленных в настоящем описании, MCCS является системой периодической противоточной хроматографии. В некоторых примерах любого из способов, представленных в настоящем описании, MCCS включает множество колонок для аффинной хроматографии, катионообменной хроматографии, анионообменной хроматографии, или эксклюзионной хроматография, или любой их комбинации. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, MCCS включает колонку для аффинной хроматографии, и аффинную хроматографию осуществляют способом с механизмом захвата, выбранным из группы: механизма захвата со связыванием протеина A, механизма захвата со связыванием субстрата, механизма захвата со связыванием антитела или фрагмента антитела, механизма захвата со связыванием аптамера и механизма захвата со связыванием кофактора. В некоторых примерах любого из способов, представленных в настоящем описании, аффинную хроматографию осуществляют способом с механизмом захвата со связыванием протеина A, и рекомбинантный белок является антителом или фрагментом антитела.
Также настоящее изобретение относится к интегрированным, замкнутым, или, по существу, замкнутым, и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим: (a) получение жидкой среды для культивирования, включающей рекомбинантный белок, по существу, не содержащей клетки; (b) непрерывный фидинг жидкой среды для культивирования в первую многоколоночную систему хроматографии (MCCS1); (c) захват рекомбинантного белка в жидкой среде для культивирования с использованием MCCS1; (d) получение элюата из MCCS1, включающего рекомбинантный белок, и непрерывный фидинг элюата во вторую многоколоночную систему хроматографии (MCCS2); (e) непрерывный фидинг рекомбинантного белка из элюата в MCCS2 и последующую элюцию рекомбинантного белка, чтобы, таким образом, получать очищенный рекомбинантный белок, где: в способе используют буфер со сниженной бионагрузкой, способ является интегрированным, и его осуществляют непрерывно от жидкой среды для культивирования до очищенного рекомбинантного белка, и по меньшей мере одна колонка в MCCS1 и/или MCCS2 включает по меньшей мере одну из любых из наполненных хроматографических колонок со сниженной бионагрузкой, получаемых любым из способов, представленных в настоящем описании. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, посредством MCCS1 и/или MCCS2 осуществляют по меньшей мере две разные типовые операции. Некоторые примеры любого из способов, представленных в настоящем описании, включают переключение колонок. В некоторых примерах любого из способов, представленных в настоящем описании, посредством MCCS1 осуществляют типовые операции захвата рекомбинантного терапевтического белка и инактивации вирусов. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, посредством MCCS2 осуществляют типовые операции очистки и тонкой очистки рекомбинантного белка. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, MCCS1 и/или MCCS2 включает по меньшей мере две хроматографические колонки. В некоторых примерах любого из способов, представленных в настоящем описании, MCCS1 является первой системой периодической противоточной хроматографии (PCCS1). В некоторых примерах любого из способов, представленных в настоящем описании, захват осуществляют с использованием аффинной хроматографии, катионообменной хроматографии, анионообменной хроматографии, или эксклюзионной хроматографии или любой их комбинации. В некоторых примерах любого из способов, представленных в настоящем описании, аффинную хроматографию осуществляют с использованием механизма захвата, выбранного из группы: механизма захвата со связыванием протеина A, механизма захвата со связыванием субстрата, механизма захвата со связыванием антитела или фрагмента антитела, механизма захвата со связыванием аптамера и механизма захвата со связыванием кофактора. В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, аффинную хроматографию осуществляют с использованием механизма захвата со связыванием протеина A, и рекомбинантный белок является антителом или фрагментом антитела.
В некоторых вариантах осуществления любого из способов, представленных в настоящем описании, MCCS2 является второй системой периодической противоточной хроматографии (PCCS2). В любом из способов, представленных в настоящем описании, рекомбинантный белок является терапевтическим рекомбинантным белком. Некоторые варианты осуществления любого из способов, представленных в настоящем описании, дополнительно включают составление очищенного терапевтического рекомбинантного белка в фармацевтической композиции. Некоторые варианты осуществления любого из способов, представленных в настоящем описании, можно осуществлять непрерывно в течение периода, по меньшей мере, 4 дней (например, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 14 дней или по меньшей мере 28 дней).
Также настоящее изобретение относится к способам снижения бионагрузки при хроматографии, включающим (a) подвергание контейнера, содержащего, по существу, сухую хроматографическую смолу, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы. Некоторые варианты осуществления этих способов дополнительно включают сушку хроматографической смолы перед этапом (a) для удаления жидкости из хроматографической смолы. В некоторых вариантах осуществления, по существу, сухая хроматографическая смола не содержит значительное количество антиоксиданта или значительное количество хелатирующего средства. В некоторых вариантах осуществления контейнер является сосудом для хранения. В некоторых вариантах осуществления хроматографическую смолу ковалентно присоединяют к поверхности предмета (например, чипа, мембраны или кассеты). В некоторых вариантах осуществления хроматографическая смола содержит белковый лиганд (например, протеин A или протеин G). В некоторых вариантах осуществления хроматографическая смола является анионообменной хроматографической смолой (например, хроматографической смолой, содержащей N-бензил-N-метил-этаноламиногруппы). В некоторых вариантах осуществления доза составляет от приблизительно 15 кГр до приблизительно 45 кГр (например, от приблизительно 20 кГр до приблизительно 30 кГр). Также настоящее изобретение относится к хроматографическим смолам со сниженной бионагрузкой, получаемым любым из способов, представленных в настоящем описании. В некоторых вариантах осуществления получаемая хроматографическая смола со сниженной бионагрузкой имеет уровень гарантии стерильности (SAL) от приблизительно 1×10-8 до приблизительно 1×10-5(например, SAL от приблизительно 1×10-7 до приблизительно 1×10-6). В некоторых вариантах осуществления хроматографическая смола со сниженной бионагрузкой содержит по меньшей мере одну смолу, выбранную из группы: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы. В некоторых вариантах осуществления хроматографическая смола со сниженной бионагрузкой содержит аффинную хроматографическую смолу, содержащую белковый лиганд (например, протеин A). В некоторых вариантах осуществления хроматографическая смола со сниженной бионагрузкой содержит анионообменную хроматографическую смолу (например, анионообменную хроматографическую смолу, содержащую N-бензил-N-метил-этаноламиногруппы). Также настоящее изобретение относится к способам получения наполненной хроматографической колонки со сниженной бионагрузкой, включающим получение хроматографической смолы со сниженной бионагрузкой, получаемой любым из способов, представленных в настоящем описании; и наполнение хроматографической смолой колонки со сниженной бионагрузкой в асептических условиях. Также настоящее изобретение относится к наполненным хроматографическим колонкам со сниженной бионагрузкой, получаемым любым из способов, представленных в настоящем описании.
Также настоящее изобретение относится к интегрированным, замкнутым и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим: (a) получение жидкой среды для культивирования, содержащей рекомбинантный белок, по существу, не содержащей клетки; и (b) непрерывный фидинг жидкой среды для культивирования в многоколоночную систему хроматографии (MCCS), содержащую по меньшей мере одну наполненную хроматографическую колонку со сниженной бионагрузкой, получаемую любым из способов, представленных в настоящем описании; где в способе используют буфер со сниженной бионагрузкой, способ является интегрированным, и его осуществляют непрерывно от жидкой среды для культивирования до элюата из MCCS, являющегося очищенным рекомбинантным белком. Также настоящее изобретение относится к интегрированным, замкнутым и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим: (a) получение жидкой среды для культивирования, содержащей рекомбинантный белок, по существу, не содержащий клетки; (b) непрерывный фидинг жидкой среды для культивирования в первую многоколоночную систему хроматографии (MCCS1); (c) захват рекомбинантного белка в жидкой среде для культивирования с использованием MCCS1; (d) получение элюата из MCCS1, содержащего рекомбинантный белок и непрерывный фидинг элюата во вторую многоколоночную систему хроматографии (MCCS2); (e) непрерывный фидинг рекомбинантного белка из элюата в MCCS2 и последующую элюцию рекомбинантного белка, чтобы, таким образом, получать очищенный рекомбинантный белок, где: в способе используют буфер со сниженной бионагрузкой, способ является интегрированным, и его осуществляют непрерывно от жидкой среды для культивирования до очищенного рекомбинантного белка, и по меньшей мере одна колонка в MCCS1 и/или MCCS2 включает наполненную хроматографическую колонку со сниженной бионагрузкой, получаемую любым из способов, представленных в настоящем описании.
Как применяют в настоящем описании, существительное в единственном числе представляет собой одно или несколько конкретных существительных. Например, фраза "хроматографическая колонка со сниженной бионагрузкой" представляет собой "одну или несколько хроматографических колонок со сниженной бионагрузкой".
Термин "бионагрузка" известен в этой области и относится к уровню самореплицирующихся биологических загрязнений, присутствующих в композиции (например, твердой или жидкой) и/или на поверхности (например, внешней и/или внутренней поверхности) предметов. Например, бионагрузка может относится к самореплицирующимся биологическим загрязнениям, присутствующим в композиции, содержащей хроматографическую смолу или хроматографическую смолу для наполненной колонки (например, самореплицирующиеся биологические загрязнения присутствуют в хроматографической смоле для наполненной колонки в наполненной хроматографической колонке). В других примерах бионагрузка может относится к самореплицирующимся биологическим загрязнениям на внутренней поверхности хроматографической колонки и/или в хроматографической смоле в хроматографической колонке (например, биологические загрязнения на внутренней поверхности хроматографической колонки и биологические загрязнения в хроматографической смоле для наполненной колонки в хроматографической колонке). Бионагрузка также может относится к самореплицирующимся биологическим загрязнениям, присутствующим в жидкости (например, буфере, используемом в любом из способов, представленных в настоящем описании). Неограничивающими примерами самореплицирующихся биологических загрязнений могут являться бактерии (например, грамположительные или грамотрицательные бактерии или бактериальные споры), микобактерии, вирусы (например, везивирус, вирус долины Кэш, парвовирус, вирус герпеса и буньявирус), паразиты, грибы, дрожжи и простейшие. Примеры способов определения бионагрузки представлены в настоящем описании. Дополнительные способы определения бионагрузки известны в этой области.
Термин "снижение бионагрузки" известно в этой области и относится к снижению (например, определяемому снижению) уровня самореплицирующихся биологических загрязнений, присутствующих в композиции (например, твердой или жидкой) и/или на поверхности (например, внешней и/или внутренней поверхности) предметов. Неограничивающие примеры способов снижения бионагрузки хроматографической смолы (например, хроматографической смолы для наполненной колонки), буфера и/или хроматографической колонки (например, наполненной хроматографической колонки) представлены в настоящем описании. Дополнительные способы снижения бионагрузки любой из композиций, представленных в настоящем описании, известны в этой области.
Термин "хроматографическая смола со сниженной бионагрузкой" означает хроматографическую смолу, обработанную для снижения уровня самореплицирующихся биологических загрязнений, присутствующих в хроматографической смоле (например, определяемого снижения уровня самореплицирующихся биологических загрязнений, присутствующих в композиции, содержащей хроматографическую смолу, например, суспензии). Например, хроматографическая смола со сниженной бионагрузкой может являться смолой, подвергнутой гамма-облучению в дозе, достаточной для снижения уровня самореплицирующихся биологических загрязнений в хроматографической смоле (например, композиции, содержащей хроматографическую смолу, подвергаемую гамма-облучению в дозе, достаточной для снижения уровня самореплицирующихся биологических загрязнений в хроматографической смоле). Например, хроматографическая смола со сниженной бионагрузкой может являться смолой, подвергнутой воздействию дозы от приблизительно 1 кГр до приблизительно 15 кГр, от приблизительно 1 кГр до приблизительно 20 кГр гамма-облучения, от приблизительно 1 кГр до приблизительно 25 кГр гамма-облучения, от приблизительно 1 кГр до приблизительно 30 кГр гамма-облучения или от приблизительно 1 кГр до приблизительно 35 кГр гамма-облучения. Примеры способов снижения бионагрузки хроматографической смолы представлены в настоящем описании. Дополнительные способы снижения бионагрузки хроматографической смолы известны в этой области.
Термин "хроматографическая колонка со сниженной бионагрузкой" означает хроматографическую колонку (например, наполненную хроматографическую колонку), включающую обработанную хроматографическую смолу (например, подвергнутую гамма-облучению хроматографическую смолу), имеющую уровень самореплицирующихся биологических загрязнений, меньший, чем уровень самореплицирующихся биологических загрязнений, присутствующих в идентичной хроматографической колонке, включающей необработанную хроматографическую смолу. Например, хроматографическая колонка со сниженной бионагрузкой может включать обработанную хроматографическую смолу, имеющую уровень гарантии стерильности по меньшей мере или приблизительно 1×10-6, 1×10-7, 1×10-8, 1×10-9 или 1×10-10.
Термин "буфер со сниженной бионагрузкой" известен в этой области и означает обработанную (например, фильтрованную, автоклавированную и/или подвергнутую гамма-облучению) жидкость (например, обработанный буферный раствор), имеющую уровень самореплицирующихся биологических загрязнений, меньший, чем уровень самореплицирующихся биологических загрязнений, обнаруживаемый в идентичной необработанной жидкости. Например, буфер со сниженной бионагрузкой может иметь уровень гарантии стерильности по меньшей мере или приблизительно 1×10-6, 1×10-7, 1×10-8, 1×10-9 или 1×10-10.
"Абсолютная стерильность" или "абсолютно стерильный" являются терминами, используемыми для описания композиции или способа, полностью не содержащего самореплицирующиеся биологические загрязнения. Например, термин можно использовать по отношению к гамма-облученной хроматографической смоле, внутренней поверхности и содержимому (например, хроматографической смоле) хроматографической колонки и/или буферу. Абсолютно стерильная композиция или способ могут являться чистыми (в том значении, в котором этот термин известен в этой области).
"Стерильный" или "стерильность" являются терминами, используемыми для описания композиции или способа, имеющего уровень гарантии стерильности приблизительно или менее 1,0×10-6 (например, приблизительно или менее 1,0×10-7, приблизительно или менее 1,0×10-8, приблизительно или менее 1,0×10-9 или 1×10-10). Определение того, являются ли композиция или способ стерильными, можно осуществлять с использованием ряда валидированных способов получения, известных в этой области. Например, стерильная композиция или способ могут являться полностью не содержащими жизнеспособные самореплицирующиеся биологические загрязнения (например, любые из самореплицирующихся биологических загрязнений, представленных в настоящем описании). Стерильная композиция или способ также могут являться чистыми (в том значении, в котором этот термин известен в этой области).
Термин "стерилизация" означает валидированный способ, используемый для того, чтобы сделать композицию стерильной (как определено в настоящем описании). Степень инактивации резистентных индикаторных самореплицирующихся биологических загрязнений (например, бактерий) в течение способа обработки можно измерять для определения того, достигнута ли стерильность (как определено в настоящем описании) композиции.
Термин "уровень гарантии стерильности" или "SAL" известен в этой области и означает доверительный уровень достижения абсолютной стерильности в партии обработанных единиц. Вероятность, как правило, вычисляют с учетом результатов исследований инактивации, осуществляемых в течение валидации и выражаемых в виде 1×10-n.
Термин "асептический" используют для описания композиции или способа, не содержащего вызывающие заболевание или симптом самореплицирующиеся биологические загрязнения (например, любые из самореплицирующихся биологических загрязнений, представленных в настоящем описании). Асептическая композиция или способ также могут являться чистыми (в том значении, в котором этот термин известен в этой области).
Термин "типовая операция" является термином, известным в этой области, и означает функциональный этап, который можно осуществлять в способе очистки рекомбинантного белка из жидкой среды для культивирования. Например, типовая операция может являться фильтрованием (например, удалением загрязнений бактериями, дрожжами, вирусами и/или микобактериями и/или твердых частиц из жидкости, включая рекомбинантный белок), захват, удаление эпитопной метки, очистку, хранение, тонкую очистку, инактивацию вирусов, коррекцию концентрации ионов и/или pH жидкости, включающей рекомбинантный белок, и удаление нежелательных солей.
Термин "захват" означает этап, осуществляемый для частичной очистки или выделения (например, для получения по меньшей мере или приблизительно 5%, например, по меньшей мере или приблизительно 10%, 15%, 20%, 25%, 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или по меньшей мере или приблизительно 95% чистого по массе) и концентрирования рекомбинантного белка (например, рекомбинантного терапевтического белка) из одного или нескольких других компонентов, присутствующих в жидкой среде для культивирования или разбавленной жидкой среде для культивирования (например, белков среды для культивирования или одного или нескольких других компонентов (например, ДНК, РНК или других белков), присутствующих или секретируемых клеткой млекопитающего). Как правило, захват осуществляют с использованием хроматографической смолы, связывающей рекомбинантный белок (например, посредством аффинной хроматографии). Неограничивающие способы захвата рекомбинантного белка из жидкой среды для культивирования или разбавленной жидкой среды для культивирования представлены в настоящем описании, а другие известны в этой области. Рекомбинантный белок можно захватывать из жидкой среды для культивирования с использованием по меньшей мере одной хроматографической колонки и/или хроматографической мембраны (например, любой из хроматографических колонок и/или хроматографических мембран, представленных в настоящем описании).
Термин "очистка" означает этап, осуществляемый для выделения рекомбинантного белка (например, рекомбинантного терапевтического белка) от одной или нескольких других примесей (например, объемных примесей) или компонентов, присутствующих в жидкости, включающей рекомбинантный белок (например, белков жидкой среды для культивирования или одного или нескольких других компонентов (например, ДНК, РНК, других белков, эндотоксинов, вирусов и т.д.) присутствующих или секретируемых клеткой млекопитающего). Например, очистку можно осуществлять в течение или после исходного этапа захвата. Очистку можно осуществлять с использованием хроматографической смолы, мембраны или любой другой твердой подложки, связывающей рекомбинантный белок или загрязнения (например, посредством аффинной хроматографии, хроматографии с гидрофобными взаимодействиями, анионо- или катионообменной хроматографии или хроматографии с молекулярным ситом). Рекомбинантный белок можно очищать от жидкости, включающей рекомбинантный белок, с использованием по меньшей мере одной хроматографической колонки и/или хроматографической мембраны (например, любой из хроматографических колонок или хроматографических мембран, представленных в настоящем описании).
Термин "тонкая очистка" является термином, известным в этой области, и означает этап, осуществляемый для удаления оставшихся следов или небольших количеств загрязнений или примесей из жидкости, включающей рекомбинантный белок (например, рекомбинантный терапевтический белок), близкой к конечной желаемой чистоте. Например, можно осуществлять тонкую очистку, пропуская жидкость, включающую рекомбинантный белок, через хроматографические колонки или мембранные абсорбенты, селективно связывающиеся с рекомбинантным белком-мишенью или небольшими количествами загрязнений или примесей, присутствующих в жидкости, включающей рекомбинантный белок. В таком примере элюат/фильтрат хроматографических колонок или мембранных абсорбентов включает рекомбинантный белок.
Термин "фильтрация" означает удаление, по меньшей мере, части (например, по меньшей мере 80%, 90%, 95%, 96%, 97%, 98% или 99%) нежелательных биологических загрязнений (например, клеток млекопитающего, бактерий, дрожжевых клеток, вирусов или микобактерий) и/или твердых частиц (например, осажденных белков) из жидкости (например, жидкой среды для культивирования или жидкости, присутствующей в любом из способов, представленных в настоящем описании).
Термин "элюат/фильтрат" является термином, известным в этой области, и означает жидкость, получаемую из хроматографической колонки или хроматографической мембраны, включающую определяемое количество рекомбинантного белка (например, рекомбинантного терапевтического белка).
Термин "интегрированный способ" означает способ, осуществляемый с использованием структурных элементов, функционирующих совместно для получения конкретного результата (например, очистки рекомбинантного белка из жидкой среды для культивирования).
Термин "непрерывный способ" означает способ, при котором жидкость непрерывно пропускают, по меньшей мере, через часть системы. Например, непрерывный способ является способом, при котором жидкую среду для культивирования, включающую рекомбинантный белок, из биореактора непрерывно пропускают через MCCS. Другим примером непрерывного способа является способ, при котором жидкую среду для культивирования, включающую рекомбинантный белок, из биореактора непрерывно пропускают через первую и вторую MCCS (MCCS1 и MCCS2). Дополнительные примеры включают способ, при котором жидкую среду для культивирования, включающую рекомбинантный белок, непрерывно пропускают через MCCS, способ, при котором жидкую среду для культивирования, включающую рекомбинантный белок, непрерывно пропускают через MCCS1 и MCCS2, или способ, при котором жидкость, включающую рекомбинантный белок, непрерывно пропускают через MCCS2.
Термин "замкнутый способ" является термином, известным в этой области, и означает способ, который осуществляют таким образом, что компоненты способа (например, хроматографические смолы и/или буферы), приводимые в контакт с рекомбинантным белком, или жидкости, включающие рекомбинантный белок, не подвергают преднамеренно воздействию загрязнений в течение значительного периода времени (например, не подвергают преднамеренно воздействию воздуха в течение значительного периода времени).
Термин "терапевтическое белковое лекарственное вещество" означает рекомбинантный белок (например, иммуноглобулин, фрагмент белка, сконструированный белок или фермент), достаточно очищенный или выделенный из загрязняющих белков, липидов и нуклеиновых кислот (например, загрязняющих белков, липидов и нуклеиновых кислот, присутствующих в жидкой среде для культивирования, или из клетки-хозяина (например, из клетки-хозяина млекопитающего, дрожжей или бактерий)) и биологических загрязнений (например, вирусных и бактериальных загрязнений), и его можно составлять в фармацевтическое средство без каких-либо дополнительных существенных этапов очистки и/или деконтаминации.
Термин "многоколоночная система хроматографии" или "MCCS" означает систему всего из двух или более взаимосвязанных или переключаемых хроматографических колонок и/или хроматографических мембран. Неограничивающим примером многоколоночной системы хроматографии является система периодической противоточной хроматографии (PCC), включающая всего две или более взаимосвязанных или переключаемых хроматографические колонки и/или хроматографические мембраны. Дополнительные примеры многоколоночных систем хроматографии представлены в настоящем описании и известны в этой области.
Термин "по существу, не содержащий" означает композицию (например, жидкую среду для культивирования), по меньшей мере или приблизительно на 90% не содержащую (например, по меньшей мере или приблизительно на 95%, 96%, 97%, 98%, или по меньшей мере или приблизительно на 99% не содержащую, или приблизительно на 100% не содержащую) конкретное вещество (например, клетку млекопитающего или загрязняющий белок, нуклеиновую кислоту, углевод или липид из клетки млекопитающего).
Термин "клетка млекопитающего" означает любую клетку из любого млекопитающего или полученную из любого млекопитающего (например, человека, хомяка, мыши, зеленой мартышки, крысы, свиньи, коровы или кролика). Например, клетка млекопитающего может являться иммортализованной клеткой. В некоторых вариантах осуществления клетка млекопитающего является дифференцированной клеткой. В некоторых вариантах осуществления клетка млекопитающего является недифференцированной клеткой. Неограничивающие примеры клеток млекопитающих представлены в настоящем описании. Дополнительные примеры клеток млекопитающих известны в этой области.
Термин "культивирование" или "культивирование клеток" означает поддержание или пролиферацию клеток млекопитающего в наборе контролируемых физических условий.
Термин "культура клеток млекопитающих" означает жидкую среду для культивирования, включающую множество клеток млекопитающих, поддерживаемых или пролиферирующих в наборе контролируемых физических условий.
Термин "жидкая среда для культивирования" означает жидкость, включающую достаточно питательных веществ, чтобы позволять клетке (например, клетке млекопитающего) расти или пролиферировать in vitro. Например, жидкая среда для культивирования может включать одно или несколько из: аминокислот (например, 20 аминокислот), пурина (например, гипоксантина), пиримидина (например, тимидина), холина, инозитола, тиамина, фолиевой кислоты, биотина, кальция, ниацинамида, пиридоксина, рибофлавина, тимидина, цианокобаламина, пирувата, липоевой кислоты, магния, глюкозы, натрия, калия, железа, меди, цинка и бикарбоната натрия. В некоторых вариантах осуществления жидкая среда для культивирования может включать сыворотку млекопитающего. В некоторых вариантах осуществления жидкая среда для культивирования не включает сыворотку или другой экстракт из млекопитающего (определенную жидкую среду для культивирования). В некоторых вариантах осуществления жидкая среда для культивирования может включать среды металлов, гормон роста млекопитающего и/или фактор роста млекопитающего. Другим примером жидкой среды для культивирования является минимальная среда (например, среда, включающая только неорганические соли, источник углерода и воду). Неограничивающие примеры жидкой среды для культивирования представлены в настоящем описании. Дополнительные примеры жидкой среды для культивирования известны в этой области и являются коммерчески доступными. Жидкая среда для культивирования может включать любую плотность клеток млекопитающих. Например, как применяют в настоящем описании, объем жидкой среды для культивирования, удаляемой из биореактора, может, по существу, не содержать клетки млекопитающих.
Термин "жидкая среда для культивирования, не содержащая компонент животного происхождения" означает жидкую среду для культивирования, не включающую любые компоненты (например, белки или сыворотку), полученные из млекопитающего.
Термин "жидкая среда для культивирования, не содержащая сыворотку" означает жидкую среду для культивирования, не включающую сыворотку млекопитающего.
Термин "жидкая среда для культивирования, содержащая сыворотку" означает жидкую среду для культивирования, включающую сыворотку млекопитающего.
Термин "химически определенная жидкая среда для культивирования" является термином, известным в этой области, и означает жидкую среду для культивирования, в которой известны все химические компоненты. Например, химически определенная жидкая среда для культивирования не включает эмбриональную телячью сыворотку, бычий сывороточный альбумин или сывороточный альбумин человека, т.к. эти препараты, как правило, включают сложную смесь альбуминов и липидов.
Термин "жидкая среда для культивирования, не содержащая белки" означает жидкую среду для культивирования, не включающую любой белок (например, любой определяемый белок).
Термин "иммуноглобулин" означает полипептид, включающий аминокислотную последовательность по меньшей мере из 15 аминокислот (например, по меньшей мере 20, 30, 40, 50, 60, 70, 80, 90 или 100 аминокислот) иммуноглобулинового белка (например, последовательность вариабельного домена, каркасную последовательность и/или последовательность константного домена). Иммуноглобулин, например, может включать по меньшей мере 15 аминокислот легкой цепи иммуноглобулина, например, по меньшей мере 15 аминокислот тяжелой цепи иммуноглобулин. Иммуноглобулин может являться выделенным антителом (например, IgG, IgE, IgD, IgA или IgM), например, подклассом IgG (например, IgG1, IgG2, IgG3 или IgG4). Иммуноглобулин может являться фрагментом антитела, например, Fab-фрагментом, F(ab′)2-фрагментом или scFv-фрагментом. Иммуноглобулин также может являться биспецифическим антителом или триспецифическим антителом, или димерным, тримерным или мультимерным антителом, или диателом, Affibody®, или Nanobody®. Иммуноглобулин также может являться сконструированным белком, включающим по меньшей мере один домен иммуноглобулина (например, слитый белок). Неограничивающие примеры иммуноглобулинов представлены в настоящем описании, и дополнительные примеры иммуноглобулинов известны в этой области.
Термин "фрагмент белка" или "полипептидный фрагмент" означает часть последовательности полипептида, составляющую по меньшей мере или приблизительно 4 аминокислоты, по меньшей мере или приблизительно 5 аминокислот, по меньшей мере или приблизительно 6 аминокислот, по меньшей мере или приблизительно 7 аминокислот, по меньшей мере или приблизительно 8 аминокислот, по меньшей мере или приблизительно 9 аминокислот, по меньшей мере или приблизительно 10 аминокислот, по меньшей мере или приблизительно 11 аминокислот, по меньшей мере или приблизительно 12 аминокислот, по меньшей мере или приблизительно 13 аминокислот, по меньшей мере или приблизительно 14 аминокислот, по меньшей мере или приблизительно 15 аминокислот, по меньшей мере или приблизительно 16 аминокислот, по меньшей мере или приблизительно 17 аминокислот, по меньшей мере или приблизительно 18 аминокислот, по меньшей мере или приблизительно 19 аминокислот, или по меньшей мере или приблизительно 20 аминокислот в длину, или более 20 аминокислот в длину. Фрагмент рекомбинантного белка можно получать любым из способов, представленных в настоящем описании.
Термин "сконструированный белок" означает полипептид, в природе не кодируемый эндогенной нуклеиновой кислотой, присутствующей в организме (например, млекопитающего). Примеры сконструированных белков включают ферменты (например, с одной или несколькими заменами аминокислот, делециями, инсерциями или добавлениями, приводящими к повышению стабильности и/или каталитической активности сконструированного фермента), слитые белки, антитела (например, бивалентные антитела, тривалентные антитела или диатело) и антигенсвязывающие белки, включающие по меньшей мере одну рекомбинантную каркасную последовательность.
Термин "секретируемый белок" или "секретируемый рекомбинантный белок" означает белок (например, рекомбинантный белок), исходно включающий по меньшей мере одну сигнальную последовательность секреции, когда он подвергается трансляции в клетке млекопитающего, и посредством, по меньшей мере, частично, ферментативного расщепления сигнальной последовательности секреции в клетке млекопитающего, секретируется, по меньшей мере, частично во внеклеточное пространство (например, жидкую среду для культивирования). Специалистам в этой области будет понятно, что "секретируемый" белок может не диссоциировать полностью из клетки, чтобы его считали секретируемым белком.
Термин "перфузионный биореактор" означает биореактор, включающий множество клеток (например, клеток млекопитающих) в первой жидкой среде для культивирования, где культивирование клеток, присутствующих в биореакторе, включает периодическое или непрерывное удаление первой жидкой среды для культивирования и одновременно или вскоре после этого добавление в биореактор, по существу, того же объема второй жидкой среды для культивирования. В некоторых примерах наблюдают пошаговое изменение (например, повышение или снижение) объема первой жидкой среды для культивирования, удаляемой и добавляемой через инкрементальные временные интервалы (например, приблизительно 24-часовой интервал, период от приблизительно 1 минуты до приблизительно 24 часов или период более 24 часов) в течение периода культивирования (например, при ежедневном повторном фидинге среды для культивирования). Фракция сред, удаляемая и заменяемая каждый день, может варьироваться в зависимости от конкретных культивируемых клеток, исходной плотности посева и плотности клеток в конкретным момент времени. "RV" или "объем реактора" означает объем среды для культивирования, присутствующий на начало культивирования (например, общий объем среды для культивирования, присутствующий после посева).
Термин "биореактор периодического действия" является термином, известным в этой области, и означает биореактор, включающий множество клеток (например, клеток млекопитающих) в первой жидкой среде для культивирования, где культивирование клеток, присутствующих в биореакторе, включает периодическое или непрерывное добавление второй жидкой среды для культивирования к первой жидкой среде для культивирования без существенного или значительного удаления первой жидкой среды для культивирования или второй жидкой среды для культивирования из культуры клеток. Вторая жидкая среда для культивирования может являться той же, что и первая жидкая среда для культивирования. В некоторых примерах периодической культуры вторая жидкая среда для культивирования является концентрированной формой первой жидкой среды для культивирования. В некоторых примерах периодической культуры вторую жидкую среду для культивирования добавляют в виде сухого порошка.
Термин "очищенная жидкая среда для культивирования" означает жидкую среду для культивирования, полученную из культуры бактериальных или дрожжевых клеток, по существу, не содержащую (например, по меньшей мере на 80%, 85%, 90%, 92%, 94%, 96%, 98% или 99% не содержащую) бактерии или дрожжевые клетки.
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, имеют то же значение, которое общепринято понятно специалисту в области, к которой относится настоящее изобретение. Способы и материалы представлены в настоящем описании для использования в настоящем изобретении; также можно использовать другие подходящие способы и материалы, известные в этой области. Материалы, способы и примеры являются исключительно иллюстративными и не предназначены для ограничения. Все публикации, патентные заявки, патенты, последовательности, записи баз данных и другие ссылки, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. В случае конфликта настоящее описание, включая определения, будет обладать приоритетом.
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания, фигур и формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 является графиком, на котором представлена кривая статического связывания смолы (мг/мл белка) для необработанной смолы GE Mab Select SuReTM, гамма-облученной в дозе 25 кГр смолы GE Mab Select SuReTM, гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203 и гамма-облученной в дозе 25 кГр смолы Kaneka KanCap A.
Фигура 2 является таблицей, в которой показано поглощение при 280 нм (поглощение протеина A) супернатанта из смолы GE Mab Select SuReTM после гамма-облучения в дозе 30 кГр и из смолы JSR LifeSciences Amsphere ProA JWT203 после гамма-облучения в дозе 30 кГр.
Фигура 3 является графиком, на котором представлено количество белка в элюате в течение нескольких циклов хроматографии, осуществляемой с использованием необработанной смолы JSR LifeSciences Amsphere ProA JWT203 (первого элюата) или гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203 (элюата из гамма-облученной смолы).
Фигура 4 является хроматограммой, на которой показан профиль элюции цикла 7 и цикла 11 при непрерывной хроматографии, осуществляемой с использованием необработанной смолы JSR LifeSciences Amsphere ProA JWT203.
Фигура 5 является хроматограммой, на которой показан профиль элюции цикла 7 и цикла 11 при непрерывной хроматографии, осуществляемой с использованием гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203.
Фигура 6 является графиком, на котором представлено количество белка в элюате в течение множества циклов непрерывной хроматографии, осуществляемой с использованием необработанной смолы JSR LifeSciences Amsphere ProA JWT203 (первой) или гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203 (гамма).
Фигура 7 является графиком белка, связавшегося в течение множества циклов хроматографии, осуществляемой с использованием необработанной смолы JSR LifeSciences Amsphere ProA JWT203 (первой) или гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203 (гамма).
Фигура 8 является графиком, на котором представлено количество белка в элюате в течение множества циклов хроматографии, осуществляемой с использованием необработанной смолы JSR LifeSciences Amsphere ProA JWT203 (первой) или гамма-облученной в дозе 29 кГр смолы JSR LifeSciences Amsphere ProA JWT203 (гамма).
Фигура 9 является графиком, на котором представлено количество белка (антитела против αβTCR (IgG1) или антитела против TGFβ (IgG4)) в элюате в течение множества циклов хроматографии, осуществляемой с использованием необработанной смолы JSR LifeSciences Amsphere ProA JWT203 (первой), гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203 (15 кГр) или гамма-облученной в дозе 29 кГр смолы JSR LifeSciences Amsphere ProA JWT203 (29 кГр).
Фигура 10 является списком примеров рекомбинантных белков, являющихся ферментами, которые можно использовать для лечения конкретных нарушений у людей.
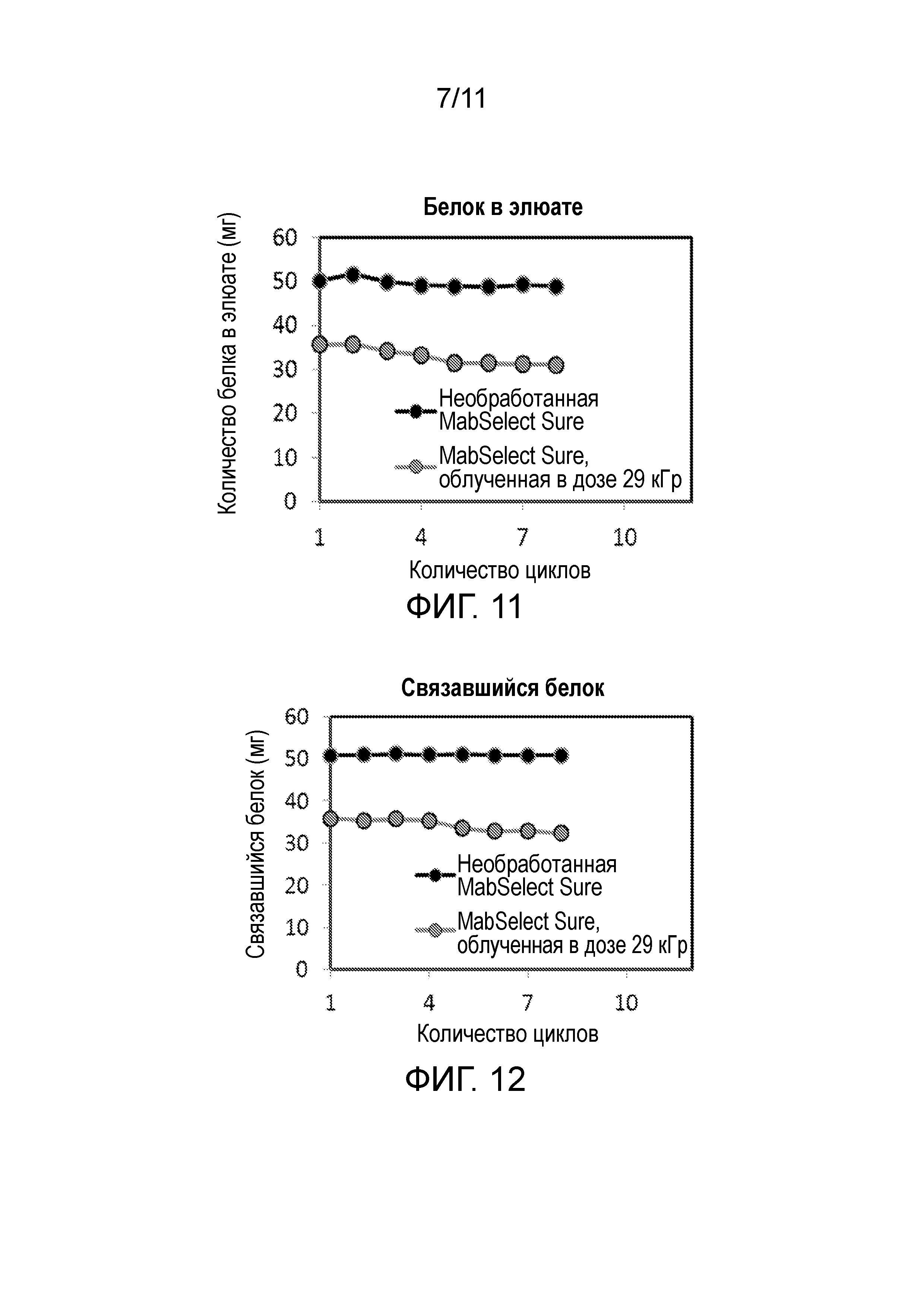
Фигура 11 является графиком белка в элюате необработанной (первой) и гамма-облученной в дозе 29 кГр смолы GE Mab Select SuReTM в течение множества циклов хроматографии, если для нагрузки каждой смолы использовали среду для культивирования, содержащую моноклональный IgG1.
Фигура 12 является графиком количества белка, связавшегося с необработанной (первой) и гамма-облученной в дозе 29 кГр смолы GE Mab Select SuReTM в течение множества циклов хроматографии, если для нагрузки каждой смолы использовали среду для культивирования, содержащую моноклональный IgG1.
Фигура 13 является графиком количества белка, связавшегося (мг связавшегося белка/мл смолы) с необработанной (первой) и гамма-облученной в дозе 29 кГр смолы GE Mab Select SuReTM LX после нагрузки различными равновесными концентрациями моноклонального антитела IgG4.
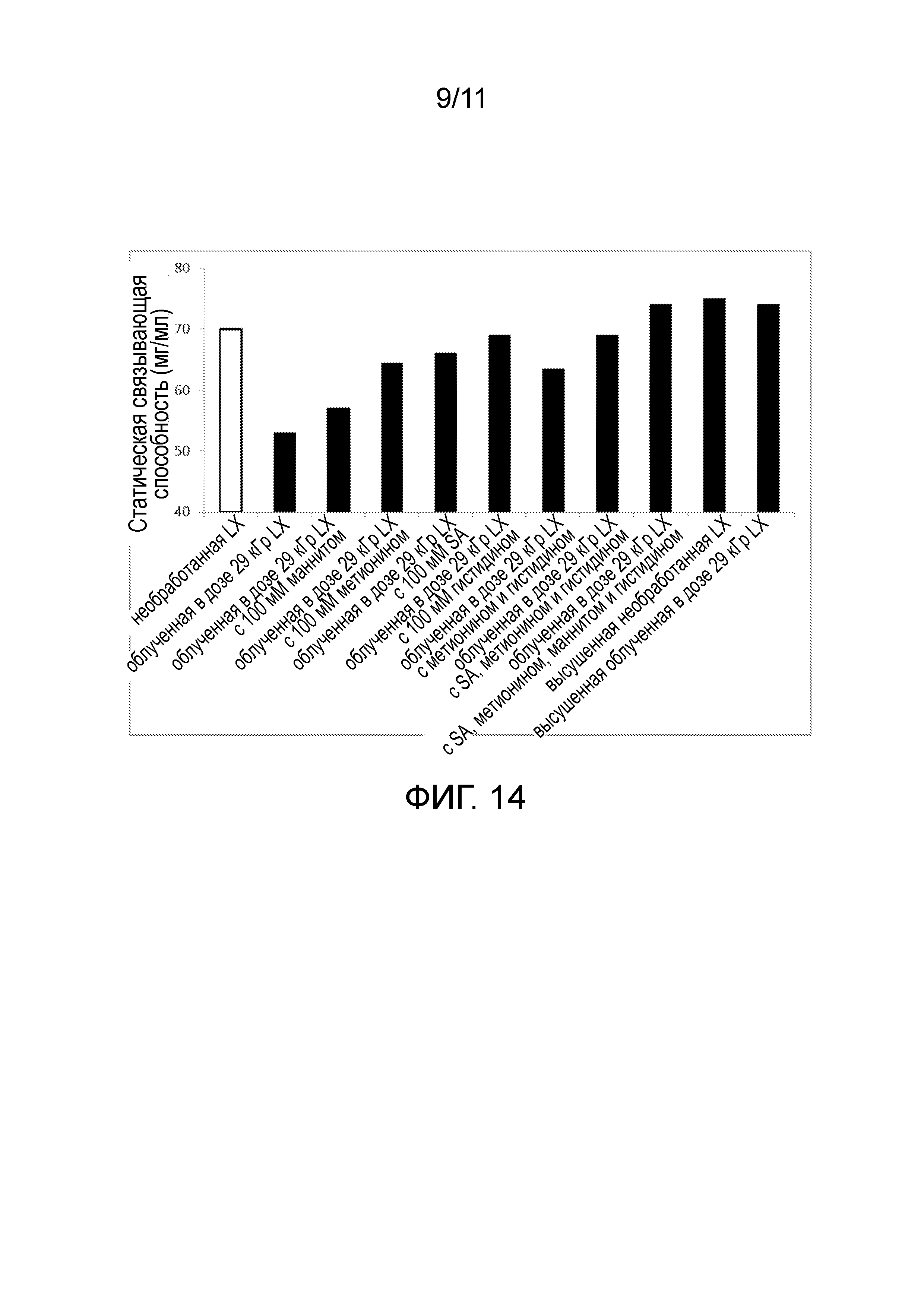
Фигура 14 является графиком способности к статическому связыванию (мг белка/мл смолы) при равновесной концентрации антитела IgG4 2 мг/мл необработанной смолы GE Mab Select SuReTM LX (первой LX), гамма-облученной в дозе 29 кГр смолы GE Mab Select SuReTM LX (29 кГр LX), сухой необработанной смолы GE Mab Select SuReTMLX, и сухой гамма-облученной в дозе 29 кГр смолы GE Mab Select SuReTM LX, и гамма-облученной в дозе 29 кГр смолы GE Mab Select SuReTM LX в присутствие одного из семи разных тестируемых буферов, содержащих по меньшей мере один антиоксидант.
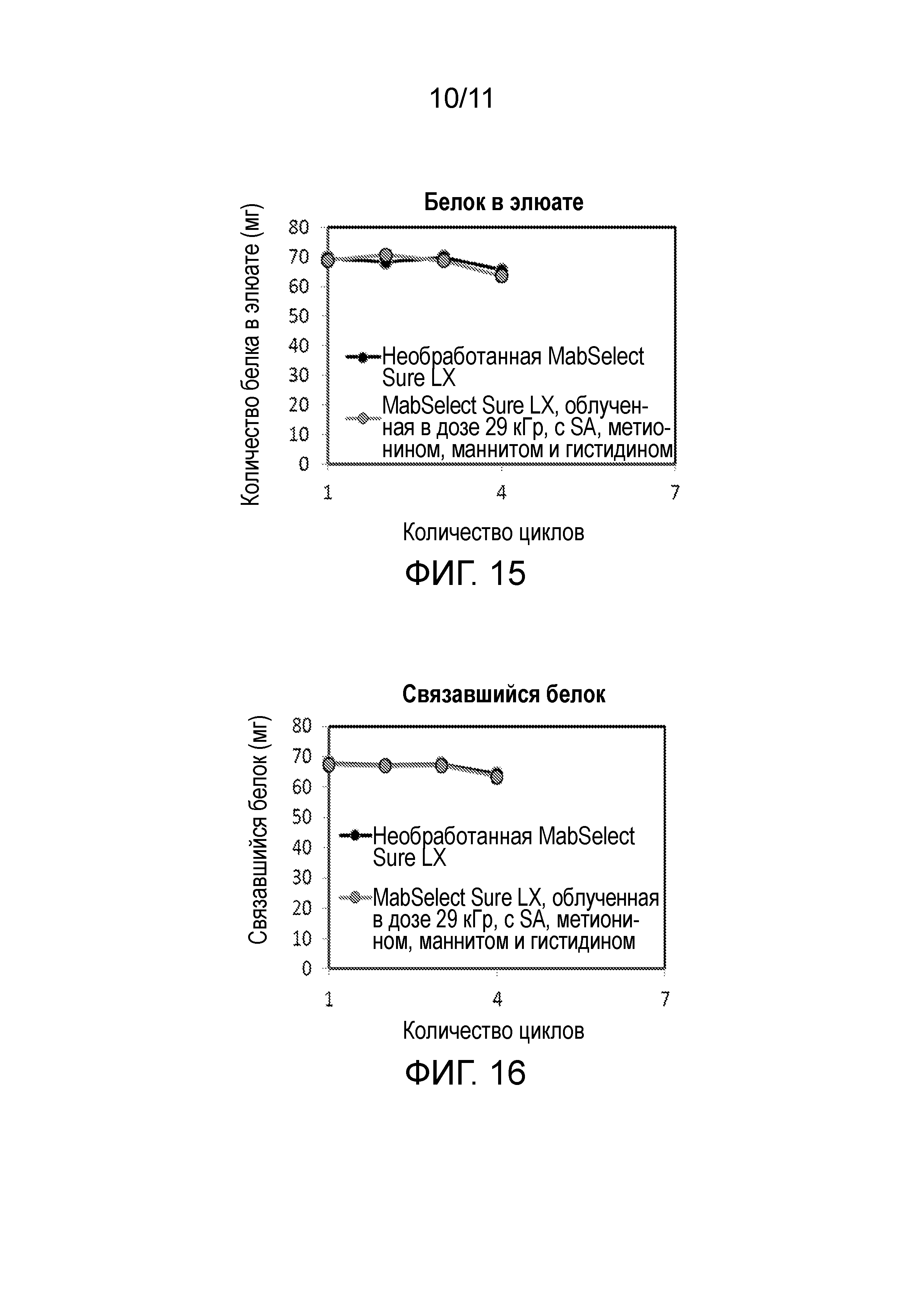
Фигура 15 является графиком количества белка в элюате в течение множества циклов хроматографии, осуществляемой с использованием необработанной смолы GE Mab Select SuReTM LX (первой) или смолы GE Mab Select SuReTM LX, гамма-облученной в дозе 29 кГр, в присутствие 25 мМ маннита, 25 мМ гистидина, 25 мМ аскорбата натрия, 25 мМ метионина, 50 мМ фосфата натрия, pH 6,0.
Фигура 16 является графиком количества белка, связавшегося в течение множества циклов хроматографии, осуществляемой с использованием необработанной смолы GE Mab Select SuReTM LX (первой) или смолы GE Mab Select SuReTM LX, гамма-облученной в дозе 29 кГр, в присутствие 25 мМ маннита, 25 мМ гистидина, 25 мМ аскорбата натрия, 25 мМ метионина, 50 мМ фосфата натрия, pH 6,0.
Фигура 17 представляет собой невосстановленный полиакриламидный гель с додецилсульфатом натрия, на котором показан элюат антитела IgG1 в течение множества циклов хроматографии с использованием необработанной смолы GE Mab Select SuReTM LX (первой LX) и смолы GE Mab Select SuReTM LX, гамма-облученной в дозе 29 кГр, в присутствие 25 мМ маннита, 25 мМ гистидина, 25 мМ аскорбата натрия, 25 мМ метионина, 50 мМ фосфата натрия, pH 6,0.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к способам снижения бионагрузки хроматографической смолы, включающим подвергание контейнера, включающего композицию, включающую хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы, где по меньшей мере один антиоксидант и/или хелатирующее средство присутствуют в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после воздействия дозы гамма-излучения. Также настоящее изобретение относится к хроматографическим колонкам со сниженной бионагрузкой, содержащим хроматографическую смолу со сниженной бионагрузкой, получаемую любым из способов, представленных в настоящем описании, композициям, включающим хроматографическую смолу и по меньшей мере одно хелатирующее средство и/или антиоксидант, способам осуществления хроматографии на колонках со сниженной бионагрузкой с использованием по меньшей мере одной из этих хроматографических колонок со сниженной бионагрузкой, и интегрированным, замкнутым, или, по существу, замкнутым, и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим применение по меньшей мере одной из этих хроматографических колонок со сниженной бионагрузкой. Неограничивающие аспекты этих способов описаны ниже. Как известно в этой области, различные аспекты, описываемые ниже, можно использовать в любой комбинации без ограничений.
Композиции, содержащие хроматографическую смолу и антиоксидант и/или хелатирующее средство
Настоящее изобретение относится к композициям, включающим хроматографическую смолу (например, любую из хроматографических смол, представленных в настоящем описании или известных в этой области) и по меньшей мере один антиоксидант и/или хелатирующее средство (например, любой из антиоксидантов и/или хелатирующих средств, представленных в настоящем описании или известных в этой области), где по меньшей мере один антиоксидант и/или хелатирующее средство присутствует в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после обработки дозой гамма-излучения, достаточной для снижения бионагрузки композиции. Например, хроматографическая смола может являться по меньшей мере одной из анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной или псевдоаффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями, и эксклюзионной хроматографической смолы, или любой их комбинации. В некоторых примерах, хроматографическая смола является смолой, включающей белковый или пептидный лиганд (например, аффинной хроматографической смолой с белковым или пептидным лигандом, например, хроматографической смолой с протеином A или протеином G).
Композиция, например, может являться суспензией седиментированной хроматографической смолы в жидкости, включающей по меньшей мере один антиоксидант и/или хелатирующее средство. Например, жидкость может содержать по меньшей мере один (например, один, два, три или четыре) из метионина (или, альтернативно, цистеина или глутатиона), аскорбата натрия, гистидина и маннита. В некоторых примерах жидкость содержит метионин (или, альтернативно, цистеин или глутатион), аскорбат натрия, гистидин и маннит. В некоторых примерах жидкость содержит: (i) от 75 мМ до приблизительно 125 мМ (например, от 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) маннита; (ii) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) метионина (или, альтернативно, цистеина или глутатиона); (iii) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) аскорбата натрия; (iv) от 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ или от приблизительно 95 мМ до приблизительно 105 мМ) гистидина; (v) от приблизительно 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ или от приблизительно 45 мМ до приблизительно 55 мМ) метионина (или, альтернативно, цистеина или глутатиона) и от приблизительно 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ или от приблизительно 45 мМ до приблизительно 55 мМ) гистидина; (vi) от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) гистидина, и от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ или от приблизительно 25 мМ до приблизительно 35 мМ) аскорбата натрия; или (vii) от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) аскорбата натрия, от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) маннита, и от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ или от приблизительно 20 мМ до приблизительно 30 мМ) гистидина. В некоторых примерах жидкость является буферным раствором (например, фосфатным буферным раствором, например, буферным раствором фосфата натрия, такого как 50 мМ фосфат натрия, pH 6,0). В некоторых примерах жидкость является буферным раствором (например, фосфатным буферным раствором, таким как буферный раствор фосфата натрия (например, 50 мМ фосфата натрия, pH 6,0).
В некоторых примерах композиция может являться твердой смесью (например, сухой твердой смесью или увлажненной или влажной твердой смесью). Твердая смесь может включать по меньшей мере один (например, один, два, три или четыре) из метионина (или, альтернативно, цистеина или глутатиона), аскорбата натрия, гистидина и маннита. В некоторых примерах твердая смесь содержит метионин (или, альтернативно, цистеин или глутатион), аскорбат натрия, гистидин и маннит. В некоторых примерах композиция является хроматографической смолой, наполненной в жидкости, включающей по меньшей мере один антиоксидант и/или хелатирующее средство. Неограничивающие примеры таких жидкостей представлены в настоящем описании.
Настоящее изобретение также относится к контейнеру (например, пластиковому контейнеру или хроматографической колонке), включающему хроматографическую смолу (например, любую из хроматографических смол, представленных в настоящем описании или известных в этой области) и по меньшей мере один антиоксидант и/или хелатирующее средство (например, любой из антиоксидантов и/или хелатирующих средств, представленных в настоящем описании или известных в этой области), где по меньшей мере один антиоксидант и/или хелатирующее средство присутствует в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после обработки дозой гамма-излучения, достаточной для снижения бионагрузки композиции. Например, контейнер (например, пластиковый контейнер или хроматографическая колонка) может иметь внутренний объем, например, по меньшей мере приблизительно 1 мл, 5 мл, по меньшей мере приблизительно 10 мл, по меньшей мере приблизительно 20 мл, по меньшей мере приблизительно 30 мл, по меньшей мере приблизительно 40 мл, по меньшей мере приблизительно 50 мл, по меньшей мере приблизительно 60 мл, по меньшей мере приблизительно 70 мл, по меньшей мере приблизительно 80 мл, по меньшей мере приблизительно 90 мл, по меньшей мере приблизительно 100 мл, по меньшей мере приблизительно 110 мл, по меньшей мере приблизительно 120 мл, по меньшей мере приблизительно 130 мл, по меньшей мере приблизительно 140 мл, по меньшей мере приблизительно 150 мл, по меньшей мере приблизительно 160 мл, по меньшей мере приблизительно 170 мл, по меньшей мере приблизительно 180 мл, по меньшей мере приблизительно 190 мл, по меньшей мере приблизительно 200 мл, по меньшей мере приблизительно 210 мл, по меньшей мере приблизительно 220 мл, по меньшей мере приблизительно 230 мл, по меньшей мере приблизительно 240 мл, по меньшей мере приблизительно 250 мл, по меньшей мере 300 мл, по меньшей мере 350 мл, по меньшей мере 400 мл или по меньшей мере 500 мл. Например, контейнер может иметь внутренний объем, например, от приблизительно 1 мл до приблизительно 500 мл, от приблизительно 1 мл до приблизительно 50 мл, от приблизительно 5 мл до приблизительно 500 мл, от приблизительно 5 мл до приблизительно 400 мл, от приблизительно 5 мл до приблизительно 350 мл, от приблизительно 5 мл до приблизительно 300 мл, от приблизительно 5 мл до приблизительно 250 мл, от приблизительно 5 мл до приблизительно 200 мл, от приблизительно 5 мл до приблизительно 150 мл, от приблизительно 5 мл до приблизительно 100 мл или от приблизительно 5 мл до приблизительно 50 мл. В некоторых примерах хроматографическая смола в контейнере является суспензией седиментированной хроматографической смолы в жидкости, включающей по меньшей мере один антиоксидант и/или хелатирующее средство. В некоторых примерах контейнер включает хроматографическую смолу для наполненной колонки (например, наполненной в жидкости, включающей по меньшей мере один антиоксидант и/или хелатирующее средство).
Любая из композиций, представленных в настоящем описании, может содержать по меньшей мере один (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) антиоксидант и/или по меньшей мере одно (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) хелатирующее средство. Любой из антиоксидантов, включенных в любую из композиций, представленных в настоящем описании, может иметь способность гасить одну или несколько из следующих активных форм кислорода и/или азота: гидроксил-радикал, карбонат-радикал, супероксид-анион, пероксид-радикал, пероксинитрит, диоксид азота и оксид азота. Неограничивающие примеры антиоксидантов, которые можно включать в любую из композиций, представленных в настоящем описании, включают: восстановленный глутатион, восстановленный тиоредоксин, восстановленный цистеин, каротиноид, мелатонин, ликопин, токоферол, восстановленный убихинон, аскорбат, билирубин, мочевую кислоту, липоевую кислоту, флавоноид, фенилпропионовую кислоту, лидокаин, нарингенин, фуллерен, глюкозу, маннит, 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксил и диметилметоксихроманол. Дополнительные неограничивающие примеры антиоксидантов включают антиоксидантные ферменты (например, супероксиддисмутазу, глутатионпероксидазу, глутатионредуктазу, каталазу и тиоредоксинредуктазу). Дополнительные примеры антиоксидантов, которые можно включать в любую из композиций, представленных в настоящем описании, включают маннит, аскорбат натрия, метионин и гистидин. Дополнительные примеры антиоксидантов включают цистеин, таурин, меркаптопропионилглицин, N-ацетилцистеин, чесночное масло, диаллилсульфид, дигидролипоевую кислоту и диаллилтрисульфид. Некоторые варианты осуществления, включающие антиоксидантный фермент в качестве антиоксиданта, могут дополнительно включать один или несколько субстратов для фермента. Антиоксидант можно идентифицировать рядом известных в этой области способов, включая, например, спиновую ловушку, редокс-чувствительные красители и анализы хемилюминесценции.
Любое из хелатирующих средств, включенных в любую из композиций, представленных в настоящем описании, может иметь способность связывать редокс-активный металл (например, Cu2+ и Fe2+) с высокой аффинностью (например, приблизительно или менее 1 ТМ, приблизительно или менее 800 нМ, приблизительно или менее 700 нМ, приблизительно или менее 600 нМ, приблизительно или менее 500 нМ, приблизительно или менее 400 нМ, приблизительно или менее 300 нМ, приблизительно или менее 250 нМ, приблизительно или менее 200 нМ, приблизительно или менее 150 нМ, приблизительно или менее 100 нМ, приблизительно или менее 80 нМ, приблизительно или менее 60 нМ, приблизительно или менее 40 нМ, приблизительно или менее 20 нМ или приблизительно или менее 1 нм). Неограничивающие примеры хелатирующих средств, которые можно включать в любую из композиций, представленных в настоящем описании, включают этилендиаминтетрауксусную кислоту (ЭДТА), натриевую соль 2,3-димеркапто-1-пропансульфоновой кислоты (DMPS), димеркаптоянтарную кислоту (DMSA), металлотионеин и дефероксамин.
Концентрация каждого из хелатирующих средств и/или антиоксидантов в любой из композиций, представленных в настоящем описании, может составлять от приблизительно 0,1 мМ до приблизительно 150 мМ (например, от приблизительно 0,1 мМ до приблизительно 150 мМ, от приблизительно 0,1 мМ до приблизительно 125 мМ, от приблизительно 0,1 мМ до приблизительно 100 мМ, от приблизительно 0,1 мМ до приблизительно 80 мМ, от приблизительно 0,1 мМ до приблизительно 60 мМ, от приблизительно 0,1 мМ до приблизительно 50 мМ, от приблизительно 0,1 мМ до приблизительно 40 мМ, от приблизительно 0,1 мМ до приблизительно 30 мМ, от приблизительно 0,1 мМ до приблизительно 25 мМ, от приблизительно 0,1 мМ до приблизительно 20 мМ, от приблизительно 0,1 мМ до приблизительно 10 мМ, от приблизительно 0,1 мМ до приблизительно 5,0 мМ, от приблизительно 0,5 мМ до приблизительно 150 мМ, от приблизительно 0,5 мМ до приблизительно 100 мМ, от приблизительно 0,5 мМ до приблизительно 50 мМ, от приблизительно 0,5 мМ до приблизительно 25 мМ, от приблизительно 0,5 мМ до приблизительно 15 мМ, от приблизительно 0,5 мМ до приблизительно 10 мМ, от приблизительно 0,5 мМ до приблизительно 5 мМ, от приблизительно 1 мМ до приблизительно 125 мМ, от приблизительно 1 мМ до приблизительно 120 мМ, от приблизительно 1 мМ до приблизительно 100 мМ, от приблизительно 1 мМ до приблизительно 80 мМ, от приблизительно 1 мМ до приблизительно 60 мМ, от приблизительно 1 мМ до приблизительно 50 мМ, от приблизительно 1 мМ до приблизительно 40 мМ, от приблизительно 1 мМ до приблизительно 30 мМ, от приблизительно 1 мМ до приблизительно 25 мМ, от приблизительно 5 мМ до приблизительно 150 мМ, от приблизительно 5 мМ до приблизительно 125 мМ, от приблизительно 5 мМ до приблизительно 100 мМ, от приблизительно 5 мМ до приблизительно 80 мМ, от приблизительно 5 мМ до приблизительно 60 мМ, от приблизительно 5 мМ до приблизительно 50 мМ, от приблизительно 5 мМ до приблизительно 40 мМ, от приблизительно 5 мМ до приблизительно 30 мМ, от приблизительно 5 мМ до приблизительно 25 мМ, от приблизительно 10 мМ до приблизительно 150 мМ, от приблизительно 10 мМ до приблизительно 125 мМ, от приблизительно 1 мМ до приблизительно 100 мМ, от приблизительно 10 мМ до приблизительно 80 мМ, от приблизительно 10 мМ до приблизительно 60 мМ, от приблизительно 10 мМ до приблизительно 50 мМ, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 10 мМ до приблизительно 30 мМ, от приблизительно 10 мМ до приблизительно 25 мМ, от приблизительно 20 мМ до приблизительно 150 мМ, от приблизительно 20 мМ до приблизительно 125 мМ, от приблизительно 20 мМ до приблизительно 100 мМ, от приблизительно 20 мМ до приблизительно 80 мМ, от приблизительно 20 мМ до приблизительно 60 мМ, от приблизительно 20 мМ до приблизительно 50 мМ, от приблизительно 20 мМ до приблизительно 40 мМ, от приблизительно 20 мМ до приблизительно 30 мМ, от приблизительно 30 мМ до приблизительно 150 мМ, от приблизительно 30 мМ до приблизительно 125 мМ, от приблизительно 30 мМ до приблизительно 100 мМ, от приблизительно 30 мМ до приблизительно 80 мМ, от приблизительно 30 мМ до приблизительно 60 мМ, от приблизительно 30 мМ до приблизительно 50 мМ, от приблизительно 30 мМ до приблизительно 40 мМ, от приблизительно 40 мМ до приблизительно 150 мМ, от приблизительно 40 мМ до приблизительно 125 мМ, от приблизительно 40 мМ до приблизительно 100 мМ, от приблизительно 40 мМ до приблизительно 90 мМ, от приблизительно 40 мМ до приблизительно 80 мМ, от приблизительно 40 мМ до приблизительно 70 мМ, от приблизительно 40 мМ до приблизительно 60 мМ, от приблизительно 50 мМ до приблизительно 150 мМ, от приблизительно 50 мМ до приблизительно 125 мМ, от приблизительно 50 мМ до приблизительно 100 мМ, от приблизительно 50 мМ до приблизительно 80 мМ, от приблизительно 50 мМ до приблизительно 60 мМ, от приблизительно 80 мМ до приблизительно 150 мМ, от приблизительно 80 мМ до приблизительно 125 мМ, от приблизительно 80 мМ до приблизительно 100 мМ, от приблизительно 100 мМ до приблизительно 150 мМ или от приблизительно 100 мМ до приблизительно 125 мМ).
В некоторых примерах композиции, представленные в настоящем описании, содержат один или несколько из от 5 мМ до приблизительно 150 мМ маннита (например, от приблизительно 10 мМ до приблизительно 150 мМ, от приблизительно 20 мМ до приблизительно 150 мМ, от приблизительно 30 мМ до приблизительно 150 мМ, от приблизительно 40 мМ до приблизительно 150 мМ, от приблизительно 50 мМ до приблизительно 150 мМ, от приблизительно 60 мМ до приблизительно 140 мМ, от приблизительно 70 мМ до приблизительно 130 мМ, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, от приблизительно 95 мМ до приблизительно 105 мМ, от приблизительно 5 мМ до приблизительно 50 мМ, от приблизительно 5 мМ до приблизительно 45 мМ, от приблизительно 5 мМ до приблизительно 40 мМ, от приблизительно 5 мМ до приблизительно 35 мМ, от приблизительно 10 мМ до приблизительно 35 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, или от приблизительно 20 мМ до приблизительно 30 мМ маннита); от 5 мМ до приблизительно 150 мМ (например, от приблизительно 10 мМ до приблизительно 150 мМ, от приблизительно 20 мМ до приблизительно 150 мМ, от приблизительно 30 мМ до приблизительно 150 мМ, от приблизительно 40 мМ до приблизительно 150 мМ, от приблизительно 50 мМ до приблизительно 150 мМ, от приблизительно 60 мМ до приблизительно 140 мМ, от приблизительно 70 мМ до приблизительно 130 мМ, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, от приблизительно 95 мМ до приблизительно 105 мМ, от приблизительно 30 мМ до приблизительно 70 мМ, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ, от приблизительно 45 мМ до приблизительно 55 мМ, от приблизительно 20 мМ до приблизительно 50 мМ, от приблизительно 25 мМ до приблизительно 45 мМ, от приблизительно 30 мМ до приблизительно 40 мМ, от приблизительно 30 мМ до приблизительно 35 мМ, от приблизительно 5 мМ до приблизительно 45 мМ, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ или от приблизительно 20 мМ до приблизительно 25 мМ) метионина (или, альтернативно, цистеина или глутатиона); от 5 мМ до 150 мМ аскорбата натрия (например, от приблизительно 10 мМ до приблизительно 150 мМ, от приблизительно 20 мМ до приблизительно 150 мМ, от приблизительно 30 мМ до приблизительно 150 мМ, от приблизительно 40 мМ до приблизительно 150 мМ, от приблизительно 50 мМ до приблизительно 150 мМ, от приблизительно 60 мМ до приблизительно 140 мМ, от приблизительно 70 мМ до приблизительно 130 мМ, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, от приблизительно 95 мМ до приблизительно 105 мМ, от приблизительно 10 мМ до приблизительно 50 мМ, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ, от приблизительно 25 мМ до приблизительно 35 мМ, от приблизительно 30 мМ до приблизительно 35 мМ, от приблизительно 5 мМ до приблизительно 45 мМ, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ, от приблизительно 20 мМ до приблизительно 25 мМ аскорбата натрия); и от 5 мМ до приблизительно 150 мМ (например, от приблизительно 10 мМ до приблизительно 150 мМ, от приблизительно 20 мМ до приблизительно 150 мМ, от приблизительно 30 мМ до приблизительно 150 мМ, от приблизительно 40 мМ до приблизительно 150 мМ, от приблизительно 50 мМ до приблизительно 150 мМ, от приблизительно 60 мМ до приблизительно 140 мМ, от приблизительно 70 мМ до приблизительно 130 мМ, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, от приблизительно 95 мМ до приблизительно 105 мМ, от приблизительно 30 мМ до приблизительно 70 мМ, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ, от приблизительно 45 мМ до приблизительно 55 мМ, от приблизительно 20 мМ до приблизительно 50 мМ, от приблизительно 25 мМ до приблизительно 45 мМ, от приблизительно 30 мМ до приблизительно 40 мМ, от приблизительно 30 мМ до приблизительно 35 мМ, от приблизительно 5 мМ до приблизительно 45 мМ, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ, или от приблизительно 20 мМ до приблизительно 25 мМ) гистидина.
Неограничивающие примеры любой из композиций содержат (i) от приблизительно 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, или от приблизительно 95 мМ до приблизительно 105 мМ) маннита (например, в буферном растворе, например, фосфатном буфере, таком как 50 мМ фосфат натрия, pH 6,0); (ii) от приблизительно 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, или от приблизительно 95 мМ до приблизительно 105 мМ) метионина (или, альтернативно, цистеина или глутатиона) (например, в буферном растворе, например, фосфатном буфере, таком как 50 мМ фосфат натрия, pH 6,0); (iii) от приблизительно 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, или от приблизительно 95 мМ до приблизительно 105 мМ) аскорбата натрия (например, в буферном растворе, например, фосфатном буфере, таком как 50 мМ фосфат натрия, pH 6,0); (iv) от приблизительно 75 мМ до приблизительно 125 мМ (например, от приблизительно 80 мМ до приблизительно 120 мМ, от приблизительно 85 мМ до приблизительно 115 мМ, от приблизительно 90 мМ до приблизительно 110 мМ, или от приблизительно 95 мМ до приблизительно 105 мМ) гистидина (например, в буферном растворе, например, фосфатном буфере, таком как 50 мМ фосфат натрия, pH 6,0); (v) от приблизительно 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ, или от приблизительно 45 мМ до приблизительно 55 мМ) метионина (или, альтернативно, цистеина или глутатиона) и от приблизительно 30 мМ до приблизительно 70 мМ (например, от приблизительно 35 мМ до приблизительно 65 мМ, от приблизительно 40 мМ до приблизительно 60 мМ, или от приблизительно 45 мМ до приблизительно 55 мМ) гистидин (например, в буферном растворе, например, фосфатном буфере, таком как 50 мМ фосфат натрия, pH 6,0); (vi) от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ, от приблизительно 25 мМ до приблизительно 35 мМ, или от приблизительно 30 мМ до приблизительно 35 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ, от приблизительно 25 мМ до приблизительно 35 мМ, или от приблизительно 30 мМ до приблизительно 35 мМ) гистидина, и от приблизительно 10 мМ до приблизительно 50 мМ (например, от приблизительно 15 мМ до приблизительно 45 мМ, от приблизительно 20 мМ до приблизительно 40 мМ, от приблизительно 25 мМ до приблизительно 35 мМ или от приблизительно 30 мМ до приблизительно 35 мМ) аскорбата натрия (например, в буферном растворе, например, фосфатном буфере, таком как 50 мМ фосфат натрия, pH 6,0); или (vii) от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ, или от приблизительно 23 мМ до приблизительно 27 мМ) аскорбата натрия, от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ, или от приблизительно 23 мМ до приблизительно 27 мМ) метионина (или, альтернативно, цистеина или глутатиона), от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ, или от приблизительно 23 мМ до приблизительно 27 мМ) маннита и от приблизительно 5 мМ до приблизительно 45 мМ (например, от приблизительно 10 мМ до приблизительно 40 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ или от приблизительно 23 мМ до приблизительно 27 мМ) гистидина (например, в буферном растворе, например, фосфатном буфере, таком как 50 мМ фосфат натрия, pH 6,0).
Неограничивающие дозы гамма-излучения, достаточные для снижения бионагрузки любой из композиций, представленных в настоящем описании, описаны ниже. Дополнительные дозы гамма-излучения, достаточные для снижения бионагрузки любой из композиций, представленных в настоящем описании, известны в этой области. Например, любую из композиций, представленных в настоящем описании, можно подвергать гамма-облучению в любой из доз, при любой из мощностей гамма-облучения и/или при любой из температур для осуществления гамма-облучения, представленного в настоящем описании (в любой комбинации). Бионагрузку композиции можно определять, например, получая образец из композиции, который будет содержать самореплицирующиеся биологические загрязнения, присутствующие в композиции, например, посредством расщепления, обработки ультразвуком, встряхивания, перемешивания на центрифуге типа вортекс, промывания, смешивания или получения мазка и качественного или количественного анализа уровня самореплицирующихся биологических загрязнений, присутствующих в образце (например, помещая образец в среду для выращивания, которая позволит биологическому загрязнению самореплицироваться, например, высевая образец на чашку Петри или пропуская образец через мембрану).
Количество по меньшей мере одного антиоксиданта и/или хелатирующего средства, достаточное для улучшения утраты связывающей способности хроматографической смолы после обработки дозой гамма-излучения, достаточной для снижения бионагрузки композиции, можно определять, например, способами, описываемыми в примерах. Например, уровень снижения связывающей способности хроматографической смолы, подвергнутой гамма-облучению в присутствие количества по меньшей мере одного антиоксиданта и/или хелатирующего средства, можно сравнивать с уровнем снижения связывающей способности хроматографической смолы, обработанной той же дозой гамма-излучения в отсутствие по меньшей мере одного антиоксиданта и/или хелатирующего средства, где снижение уровня снижения связывающей способности хроматографической смолы, гамма-облученной в присутствие по меньшей мере одного антиоксиданта и/или хелатирующего средства, по сравнению с хроматографической смолой, гамма-облученной в отсутствие по меньшей мере одного антиоксиданта и/или хелатирующего средства, свидетельствует о том, что по меньшей мере, один антиоксидант и/или хелатирующее средство присутствовало в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после гамма-облучения. Примеры способов определения связывающей способности хроматографической смолы описаны в примерах. Дополнительные примеры способов определения связывающей способности хроматографической смолы известны в этой области.
Способы снижения бионагрузки хроматографической смолы
Настоящее изобретение относится к способам снижения бионагрузки хроматографической смолы. Эти способы включают этап подвергания контейнера, включающего композицию, включающую хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы, где по меньшей мере один антиоксидант и/или хелатирующее средство присутствуют в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после воздействия дозы гамма-излучения.
Также настоящее изобретение относится к способам снижения бионагрузки хроматографической смолы, включающим подвергание контейнера, включающего композицию, включающую хроматографическую смолу (и необязательно по меньшей мере один антиоксидант и/или хелатирующее средство в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы после воздействия гамма-облучения) воздействию гамма-излучения при мощности от приблизительно 0,1 кГр/ч до приблизительно 6 кГр/ч (например, от приблизительно 0,1 кГр/ч до приблизительно 5,5 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 5,0 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 4,5 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 4,0 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 3,5 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 3,0 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 2,5 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 2,0 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 1,5 кГр/ч, от приблизительно 0,1 кГр/ч до приблизительно 1,0 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 6 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 5,5 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 5,0 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 4,5 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 4,0 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 3,5 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 3,0 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 2,5 кГр/ч, от приблизительно 0,5 кГр/ч до приблизительно 2,0 кГр/ч) и/или при температуре от приблизительно 4°C до приблизительно 25°C (например, от приблизительно 4°C до приблизительно 20°C, от приблизительно 4°C до приблизительно 15°C, от приблизительно 4°C до приблизительно 10°C, от приблизительно 10°C до приблизительно 25°C, от приблизительно 10°C до приблизительно 20°C, от приблизительно 10°C до приблизительно 15°C, или от приблизительно 15°C до приблизительно 25°C) в случае дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы. В способах, описываемых в этом параграфе, уровень связывающей способности гамма-облученной хроматографической смолы, получаемой этими способами, выше уровня связывающей способности гамма-облученной хроматографической смолы, гамма-облученной при мощностях выше 6,1 кГр/ч и/или при температуре выше 25°C, или и том, и другом.
Хроматографическую смолу можно подвергать гамма-облучению известными в этой области способами. Например, в качестве источника гамма-лучей можно использовать изотоп, такой как кобальт-60 или цезий-137. Хроматографическую смолу можно подвергать гамма-облучению при температуре приблизительно от приблизительно -25°C до приблизительно 0°C включительно или от приблизительно 0°C до приблизительно 25°C включительно. Хроматографическую смолу можно подвергать воздействию дозы гамма-излучения от приблизительно 0,1 кГр до приблизительно 100 кГр, от приблизительно 1 кГр до приблизительно 100 кГр, от приблизительно 1 кГр до приблизительно 90 кГр, от приблизительно 1 кГр до приблизительно 80 кГр, от приблизительно 1 кГр до приблизительно 70 кГр, от приблизительно 1 кГр до приблизительно 65 кГр, от приблизительно 5 кГр до приблизительно 65 кГр, от приблизительно 10 кГр до приблизительно 60 кГр, от приблизительно 10 кГр до приблизительно 55 кГр, от приблизительно 10 кГр до приблизительно 50 кГр, от приблизительно 10 кГр до приблизительно 45 кГр, от приблизительно 10 кГр до приблизительно 40 кГр, от приблизительно 10 кГр до приблизительно 35 кГр, от приблизительно 10 кГр до приблизительно 30 кГр, от приблизительно 15 кГр до приблизительно 50 кГр, от приблизительно 15 кГр до приблизительно 45 кГр, от приблизительно 15 кГр до приблизительно 40 кГр, от приблизительно 15 кГр до приблизительно 35 кГр, от приблизительно 20 кГр до приблизительно 30 кГр или от приблизительно 23 кГр до приблизительно 27 кГр. Хроматографическую смолу можно подвергать гамма-облучению в дозе, достаточной для получения уровня гарантии стерильности хроматографической смолы приблизительно или менее 1×10-6, приблизительно или менее 1×10-7, приблизительно или менее 10×10-8, приблизительно или менее 1×10-11, или приблизительно или менее 1×10-12, или от приблизительно 1×10-6 и приблизительно 1×10-12, от приблизительно 1×10-6и приблизительно 1×10-11, от приблизительно 1×10-6 и приблизительно 1×10-10, от приблизительно 1×10-6 и приблизительно 1×10-9, от приблизительно 1×10-6 и приблизительно 1×10-8, от 1×10-6 до приблизительно 1×10-7, от приблизительно 1×10-7и приблизительно 1×10-12, от приблизительно 1×10-7и приблизительно 1×10-11, от приблизительно 1×10-7 и приблизительно 1×10-10, от приблизительно 1×10-7 и приблизительно 1×10-9, от приблизительно 1×10-7и приблизительно 1×10-8, от приблизительно 1×10-8 и приблизительно 1×10-12, от приблизительно 1×10-8 и приблизительно 1×10-11, от приблизительно 1×10-8 и приблизительно 1×10-10 или от приблизительно 1×10-8 и приблизительно 1×10-9.
Дозу гамма-облучения, достаточную для снижения бионагрузки хроматографической смолы, можно определять известными в этой области способами. Например, уровень бионагрузки хроматографической смолы, обработанной дозой гамма-излучения, можно сравнивать с уровнем бионагрузки необработанной (например, контрольной, не-гамма-облученной) хроматографической смолы, и снижение уровня бионагрузки гамма-облученной хроматографической смолы по сравнению с необработанной хроматографической смолой свидетельствует о том, что доза гамма-излучения является достаточной для снижения бионагрузки хроматографической смолы. Примеры способов определения уровня бионагрузки композиции (например, хроматографической смолы) представлены в настоящем описании. Дополнительные способы определения уровня бионагрузки композиции (например, хроматографической смолы) известны в этой области.
Хроматографическая смола в любом из этих способов может являться анионообменной хроматографической смолой, катионообменной хроматографической смолой, эксклюзионной хроматографической смолой, смолой для хроматографии с гидрофобными взаимодействиями, или аффинной хроматографической смолой, или любой их комбинацией. Неограничивающие примеры аффинной хроматографической смолы могут включать белковый или пептидный лиганд (например, от приблизительно 5 аминокислот до приблизительно 100 аминокислот, от приблизительно 5 аминокислот до приблизительно 90 аминокислот, от приблизительно 5 аминокислот до приблизительно 80 аминокислот, от приблизительно 5 аминокислот до приблизительно 70 аминокислот, от приблизительно 5 аминокислот до приблизительно 60 аминокислот, от приблизительно 5 аминокислот до приблизительно 50 аминокислот, от приблизительно 5 аминокислот до приблизительно 40 аминокислот, от приблизительно 5 аминокислот до приблизительно 30 аминокислот, от приблизительно 5 аминокислот до приблизительно 25 аминокислот или от приблизительно 5 аминокислот до приблизительно 20 аминокислот), низкомолекулярным субстратом или кофактором фермента, аптамером, ингибитором (например, конкурентным ингибитором белка) или металлом. В некоторых вариантах осуществления аффинная хроматографическая смола включает белковый лиганд (например, протеин A). Дополнительные примеры аффинной хроматографической смолы включают кофакторный лиганд, субстрат-лиганд, металл-лиганд, продукт-лиганд или аптамер-лиганд. В некоторых примерах, хроматографическая смола является бимодальной хроматографической смолой (например, анионообменной хроматографической смолой и смолой для хроматографии с гидрофобными взаимодействиями). Хроматографическая смола может являться анионообменной хроматографической смолой (например, анионообменной хроматографической смолой, включающей N-бензил-N-метил-этаноламиногруппы).
Контейнер, включающий хроматографическую смолу может являться пластиковым контейнером (например, цилиндрической пробиркой, запаянной или закрепленной коробкой или запаянным мешком). Неограничивающие примеры контейнеров, используемых в этих способах, включают сосуд для хранения или хроматографическую колонку. Например, композиция, включающая хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, может находиться в запаянном контейнере (например, суспензия в запаянном контейнере или хроматографическая смола для наполненной колонки в запаянном контейнере (например, хроматографической колонке)). Контейнер, используемый в способах, представленных в настоящем описании, может являться одноразовой хроматографической колонкой. В некоторых вариантах осуществления контейнер, используемый в способах, представленных в настоящем описании, является одноразовой хроматографической колонкой, помещенной в блистерную упаковку. Контейнер (например, сосуд для хранения или хроматографическая колонка) может иметь общий внутренний объем от приблизительно 1 мл до приблизительно 1 л (например, от приблизительно 1 мл до приблизительно 900 мл, от приблизительно 1 мл до приблизительно 800 мл, от приблизительно 1 мл до приблизительно 700 мл, от приблизительно 1 мл до приблизительно 600 мл, от приблизительно 1 мл до приблизительно 500 мл, от приблизительно 1 мл до приблизительно 450 мл, от приблизительно 1 мл до приблизительно 400 мл, от приблизительно 1 мл до приблизительно 350 мл, от приблизительно 1 мл до приблизительно 300 мл, от приблизительно 1 мл до приблизительно 250 мл, от приблизительно 1 мл до приблизительно 200 мл, от приблизительно 1 мл до приблизительно 150 мл, от приблизительно 1 мл до приблизительно 100 мл, от приблизительно 1 мл до приблизительно 75 мл, от приблизительно 1 мл до приблизительно 50 мл, от приблизительно 1 мл до приблизительно 40 мл, от приблизительно 1 мл до приблизительно 30 мл или от приблизительно 1 мл до приблизительно 20 мл).
Композиция, содержащая хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, включенная в контейнер, может находиться в твердой смеси (например, сухой или увлажненной твердой смеси). Например, контейнер может включать суспензию седиментированной хроматографической смолы в жидкости (например, буферном растворе), содержащей по меньшей мере один антиоксидант и/или хелатирующее средство. В некоторых вариантах осуществления контейнер может включать хроматографическую смолу для наполненной колонки. Например, контейнер, включающий композицию, включающую хроматографическую смолу и по меньшей мере один антиоксидант и/или хроматографическую смолу, является наполненной хроматографической колонкой (например, в которой смолой наполняют жидкость (например, буферный раствор), содержащую по меньшей мере один антиоксидант и/или хроматографическую смолу). Некоторые варианты осуществления включают помещение композиции, содержащей хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, в контейнер перед воздействием.
Любой из антиоксидантов и/или хелатирующих средств, представленных в настоящем описании, можно использовать в любой комбинации, с использованием любой комбинации примеров концентраций, представленных в настоящем описании. Например, композиция может включать по меньшей мере один антиоксидант, выбранный из: восстановленного глутатиона, восстановленного тиоредоксина, восстановленного цистеина, каротиноида, мелатонина, ликопина, токоферола, восстановленного убихинона, аскорбата, билирубина, мочевой кислоты, липоевой кислоты, флавоноида, фенилпропионовой кислоты, лидокаина, нарингенина, фуллерена, глюкозы, маннита, 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксила и диметилметоксихроманола, и/или по меньшей мере одно хелатирующее средство, выбранное из: ЭДТА, DMPS, DMSA, металлотионеина и дефероксамина.
В настоящем описании представлены примеры способов определения/идентификации количеств по меньшей мере одного антиоксиданта и/или хелатирующего средства, достаточных для улучшения утраты связывающей способности хроматографической смолы после обработки дозой гамма-излучения, достаточной для снижения бионагрузки композиции. Дополнительные способы определения/идентификации количеств по меньшей мере одного антиоксиданта и/или хелатирующего средства, достаточных для улучшения утраты связывающей способности хроматографической смолы после обработки дозой гамма-излучения, достаточной для снижения бионагрузки композиции, известны в этой области.
Настоящее изобретение также относится к хроматографической смоле со сниженной бионагрузкой, получаемой любым из способов, представленных в настоящем описании (например, хроматографической смоле со сниженной бионагрузкой, предоставленной в контейнере для хранения, например, запаянном контейнере для хранения). Хроматографическая смола со сниженной бионагрузкой, получаемая любым из способов, представленных в настоящем описании, может иметь уровень гарантии стерильности приблизительно или менее 1×10-6, приблизительно или менее 1×10-7, приблизительно или менее 10×10-8, приблизительно или менее 1×10-11, или приблизительно или менее 1×10-12, или от приблизительно 1×10-6 до приблизительно 1×10-12, от приблизительно 1×10-6до приблизительно 1×10-11, от приблизительно 1×10-6 до приблизительно 1×10-10, от приблизительно 1×10-6 до приблизительно 1×10-9, от приблизительно 1×10-6 до приблизительно 1×10-8, от 1×10-6 до приблизительно 1×10-7, от приблизительно 1×10-7до приблизительно 1×10-12, от приблизительно 1×10-7до приблизительно 1×10-11, от приблизительно 1×10-7 до приблизительно 1×10-10, от приблизительно 1×10-7 до приблизительно 1×10-9, от приблизительно 1×10-7до приблизительно 1×10-8, от приблизительно 1×10-8 до приблизительно 1×10-12, от приблизительно 1×10-8 до приблизительно 1×10-11, от приблизительно 1×10-8 до приблизительно 1×10-10 или от приблизительно 1×10-8 до приблизительно 1×10-9. Хроматографическая смола со сниженной бионагрузкой, получаемая любым из способов, представленных в настоящем описании, может иметь связывающую способность, составляющую по меньшей мере 74% (например, по меньшей мере 76%, по меньшей мере 78%, по меньшей мере 80%, по меньшей мере 82%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100%) или от приблизительно 74% до 95%, от приблизительно 74% до приблизительно 95%, от приблизительно 76% до приблизительно 95%, по меньшей мере приблизительно 78% до приблизительно 95%, от приблизительно 80% до приблизительно 95%, или от приблизительно 74% до приблизительно 90%, от приблизительно 76% до приблизительно 90%, от приблизительно 78% до приблизительно 90%, или от приблизительно 80% до приблизительно 90% связывающей способности той же хроматографической смолы, не обработанной для снижения ее бионагрузки (например, не подвергнутой гамма-облучению), если тот же белок используют для тестирования связывающей способности хроматографической смолы, получаемой способами, представленными в настоящем описании, и контрольной, необработанной хроматографической смолой.
Способы получения наполненной хроматографической колонки со сниженной бионагрузкой
Настоящее изобретение также относится к способам получения наполненной хроматографической колонки со сниженной бионагрузкой, включающим получение хроматографической смолы со сниженной бионагрузкой, получаемой любым из способов, представленных в настоящем описании, и наполнение хроматографической смолой колонки со сниженной бионагрузки в асептических условиях или условиях сниженной бионагрузки. В некоторых вариантах осуществления наполненную хроматографическую колонку со сниженной бионагрузкой можно получать посредством подвергания колонки, включающей хроматографическую смолу для наполненной колонки и по меньшей мере один антиоксидант и/или хелатирующее средство, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки колонки и хроматографической смолы для наполненной колонки, где по меньшей мере один антиоксидант и/или хелатирующее средство присутствует в количестве, достаточном для улучшения утраты связывающей способности хроматографической смолы для наполненной колонки после воздействия дозы гамма-излучения.
Также настоящее изобретение относится к наполненным хроматографическим колонкам со сниженной бионагрузкой, получаемым способами, представленными в настоящем описании. Любая из наполненных хроматографических колонок со сниженной бионагрузкой, получаемых способами, представленными в настоящем описании, может иметь уровень гарантии стерильности приблизительно или менее 1×10-6, приблизительно или менее 1×10-7, приблизительно или менее 10×10-8, приблизительно или менее 1×10-11, или приблизительно или менее 1×10-12, или от приблизительно 1×10-6 до приблизительно 1×10-12, от приблизительно 1×10-6до приблизительно 1×10-11, от приблизительно 1×10-6 до приблизительно 1×10-10, от приблизительно 1×10-6 до приблизительно 1×10-9, от приблизительно 1×10-6 до приблизительно 1×10-8, от 1×10-6 до приблизительно 1×10-7, от приблизительно 1×10-7до приблизительно 1×10-12, от приблизительно 1×10-7до приблизительно 1×10-11, от приблизительно 1×10-7 до приблизительно 1×10-10, от приблизительно 1×10-7 до приблизительно 1×10-9, от приблизительно 1×10-7до приблизительно 1×10-8, от приблизительно 1×10-8 до приблизительно 1×10-12, от приблизительно 1×10-8 до приблизительно 1×10-11, от приблизительно 1×10-8 до приблизительно 1×10-10 или от приблизительно 1×10-8 до приблизительно 1×10-9. Любая из наполненных хроматографических колонок со сниженной бионагрузкой, получаемых способами, представленными в настоящем описании, может содержать по меньшей мере одну хроматографическую смолу, выбранную из группы: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной хроматографической смолы (например, любой из аффинных хроматографических смол, представленных в настоящем описании или известных в этой области), смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы. Например, любая из наполненных хроматографических колонок со сниженной бионагрузкой, представленных в настоящем описании, может включать аффинную хроматографическую смолу, включающую белковый лиганд (например, протеин A). Наполненная хроматографическая колонка со сниженной бионагрузкой, представленная в настоящем описании, может включать анионообменную хроматографическую смолу (например, анионообменную хроматографическую смолу, включающую N-бензил-N-метил-этаноламиногруппы).
Способы осуществления хроматографии со сниженной бионагрузкой
Способы, представленные в настоящем описании, включают применение наполненной хроматографической колонки со сниженной бионагрузкой, представленной в настоящем описании, и способы, представленные в настоящем описании, включают применение одной или двух MCCS, включающих по меньшей мере одну наполненную хроматографическую колонку со сниженной бионагрузкой, представленную в настоящем описании. Гамма-облученная хроматографическая смола может представлять собой любой тип смолы, представленной в настоящем описании (или любой тип хроматографической смолы, известный в этой области).
Наполненную хроматографическую колонку со сниженной бионагрузкой можно получать любым из способов, представленных в настоящем описании. Например, наполненную хроматографическую колонку со сниженной бионагрузкой можно получать посредством наполнения хроматографической колонки композицией, включающей хроматографические смолы и по меньшей мере один антиоксидант и/или хелатирующее средство (например, любой из таких композиций, представленных в настоящем описании), и подвергания наполненной колонки гамма-облучению (например, с использованием любого из воздействий и условий, представленных в настоящем описании). В других примерах можно получать наполненную хроматографическую колонку со сниженной бионагрузкой, подвергая контейнер, включающий хроматографическую смолу и по меньшей мере один антиоксидант и/или хелатирующее средство, воздействию дозы гамма-излучения и наполняя хроматографическую колонку полученной хроматографической смолой со сниженной бионагрузкой. В таких способах хроматографическая смола (присутствующая в контейнере при подвергании гамма-облучению) может находиться в виде суспензии в контейнере, и хроматографическую колонку наполняют в вытяжном шкафу со сниженной бионагрузкой. В других способах хроматографическую смолу, присутствующую в контейнере с по меньшей мере одним антиоксидантом и/или хелатирующим средством, можно подвергать гамма-облучению в виде твердой смеси в контейнере, и суспензию полученной хроматографической смолы со сниженной бионагрузкой можно получать с использованием буфера со сниженной бионагрузкой (например, получаемого в вытяжном шкафу со сниженной бионагрузкой), и получаемую суспензию используют для наполнения хроматографической колонки в вытяжном шкафу со сниженной бионагрузкой. В некоторых из этих примерах хроматографическую колонку перед наполнением можно обрабатывать для снижения бионагрузки (например, автоклавировать, подвергать гамма-облучению или воздействию этиленоксида).
Наполненная хроматографическая колонка со сниженной бионагрузкой, используемая в любом из способов, представленных в настоящем описании, может иметь уровень гарантии стерильности (SAL) от приблизительно 1×10-3до приблизительно 1×10-12, от приблизительно 1×10-4 до приблизительно 1×10-12, от 1×10-5 до приблизительно 1×10-11, от приблизительно 1×10-5до приблизительно 1×10-10, от приблизительно 1×10-5 до приблизительно 1×10-9, от приблизительно 1×10-6 до приблизительно 1×10-9 или от приблизительно 1×10-6 до приблизительно 1×10-8, включительно.
Буферы со сниженной бионагрузкой
Способы, представленные в настоящем описании, можно осуществлять с использованием одного или нескольких буферов со сниженной бионагрузкой. Как известно в этой области, буфер со сниженной бионагрузкой может представлять собой любой тип буфера, используемый в цикле хроматографии (например, буфер, используемый на любом из этапов цикла хроматографии или в любой из типовых операций, представленных в настоящем описании). Примеры способов снижения бионагрузки буфера включают фильтрацию (фильтрация при размере пор 0,2 мкм), автоклавирование и гамма-облучение. Дополнительные способы снижения бионагрузки буфера известны в этой области. Буфер со сниженной бионагрузкой может иметь уровень гарантии стерильности от приблизительно 1×10-3до приблизительно 1×10-12, от приблизительно 1×10-4 до приблизительно 1×10-12, от 1×10-5 до приблизительно 1×10-11, от приблизительно 1×10-5до приблизительно 1×10-10, от приблизительно 1×10-5 до приблизительно 1×10-9, от приблизительно 1×10-6 до приблизительно 1×10-9 или от приблизительно 1×10-6 до приблизительно 1×10-8, включительно.
Рекомбинантные терапевтические белки
Как представлено в настоящем описании, рекомбинантный белок может являться рекомбинантным терапевтическим белком. Неограничивающие примеры рекомбинантных терапевтических белков, которые можно получать способами, представленными в настоящем описании, включают иммуноглобулины (включая легкую и тяжелую цепь иммуноглобулинов, антитела или фрагменты антител (например, любые из фрагментов антител, представленных в настоящем описании), ферменты (например, галактозидазу (например, альфа-галактозидазу), Myozyme® или Cerezyme®), белки (например, эритропоэтин, фактор некроза опухоли (ФНО) или интерферон альфа или бета человека) или иммуногенные или антигенные белки или фрагменты белков (например, белки для использования в вакцине). Неограничивающие примеры рекомбинантных терапевтических ферментов, которые можно использовать для лечения множества лизосомальных болезней накопления, представлены на фигуре 10. Рекомбинантный терапевтический белок может являться сконструированным антигенсвязывающим полипептидом, включающим по меньшей мере один многофункциональный рекомбинантный белковый каркас (см., например, рекомбинантные антигенсвязывающие белки, описываемые в Gebauer et al., Current Opin. Chem. Biol. 13:245-255, 2009; и публикации патентной заявки США № 2012/0164066 (включенных в настоящее описание в качестве ссылок в полном объеме)). Неограничивающие примеры рекомбинантных терапевтических белков, являющихся антителами, включают: панитумумаб, омализумаб, абаговомаб, абциксимаб, актоксумаб, адалимумаб, адекатумумаб, афелимомаб, афутузумаб, алацизумаб, алацизумаб, алемтузумаб, алирокумаб, алтумомаб, аматуксимаб, анатумомаб, аполизумаб, атинумаб, тоцилизумаб, базиликсимаб, бектумомаб, белимумаб, бевацизумаб, бициромаб, канакинумаб, цетуксимаб, даклизумаб, денсумаб, экулизумаб, эдреколомаб, эфализумаб, эфунгумаб, эртумаксомаб, этарацизумаб, голимумаб, инфликсимаб, натализумаб, паливизумаб, панитумумаб, пертузумаб, ранибизумаб, ритуксимаб, тоцилизумаб и трастузумаб. Дополнительные примеры рекомбинантных терапевтических антител, которые можно получать способами, представленными в настоящем описании, известны в этой области. Дополнительные неограничивающие примеры рекомбинантных терапевтических белков, которые можно получать/очищать способами по настоящему изобретению, включают: алглюкозидазу альфа, ларонидазу, абатацепт, галсульфазу, лутропин альфа, антигемофильный фактор, агалзидазу бета, интерферон бета-1a, дарбэпоэтин альфа, тенектеплазу, этанерцепт, фактор свертывания IX, фолликулостимулирующий гормон, интерферон бета-1a, имиглюцеразу, дорназу альфа, эпоэтин альфа и альтеплазу.
Секретируемый, растворимый рекомбинантный терапевтический белок можно выделять из жидкой среды для культивирования (например, первой и/или второй жидкой среды для культивирования), удаляя или иным образом физически отделяя жидкую среду для культивирования от клеток (например, клеток млекопитающих). В этой области известно множество различных способов удаления жидкой среды для культивирования из клеток (например, клеток млекопитающих), включая, например, центрифугирование, фильтрацию, пипетирование и/или аспирацию. Затем секретируемый рекомбинантный терапевтический белок можно выделять и дополнительно очищать от жидкой среды для культивирования множеством биохимических способов, включая различные типы хроматографии (например, аффинной хроматографии, хроматографии с молекулярным ситом, катионообменной хроматографии, анионообменной хроматографии, или хроматографии с гидрофобными взаимодействиями, или любой их комбинации) и/или фильтрации (например, фильтрации с отсечкой по молекулярной массе).
Цикл хроматографии
Как хорошо известно в этой области, этапы цикла хроматографии могут отличаться в зависимости от хроматографической смолы, буферов, используемых для осуществления каждого этапа цикла, и биофизических характеристик рекомбинантного белка-мишени (например, рекомбинантного терапевтического белка). Например, аффинная хроматография на колонке может включать этапы нагрузки аффинной хроматографической колонки жидкостью, включающей рекомбинантный белок-мишень, промывания колонки для удаления нежелательного биологического материала (например, загрязняющих белков и/или низкомолекулярных соединений), элюции рекомбинантного белка-мишени, связавшегося с колонкой и повторного уравновешивания колонки. Цикл хроматографии с использованием катионообменной и/или анионообменной хроматографической колонки, где рекомбинантный белок-мишень связывается с хроматографической смолой на этапе нагрузки, может включать этапы нагрузки колонки жидкостью, включающей белок-мишень, промывания колонки для удаления нежелательного биологического материала, элюции рекомбинантного белка-мишени, связавшегося с колонкой, и повторного уравновешивания колонки. В других примерах цикл хроматографии с использованием катионообменной и/или анионообменной хроматографической колонки, где нежелательный биологический материал связывается с хроматографической смолой на этапе нагрузки, в то время как рекомбинантный белок-мишень не связывается, может включать этапы нагрузки колонки жидкостью, включающей белок-мишень, сбор рекомбинантного белка-мишени в элюате и повторное уравновешивание колонки. Как хорошо известно в этой области, любой из отдельных этапов цикла хроматографии может включать отдельный буфер или многочисленные буферы (например, два или более буферов), и один или несколько из любых из отдельных этапов цикла хроматографии может включать градиент буфера. Любую из комбинаций различных хорошо известных аспектов отдельного цикла хроматографии можно использовать в этих способах в любой комбинации, например, различные хроматографические смолы, элюаты, буферы, исключенные объемы колонки, объемы слоев колонки, объемы буфера, используемого на каждом этапе, объемы жидкости, включающей белок-мишень, и ряд и типы буферов, используемых на каждом этапе.
Способы осуществления хроматографии на колонках со сниженной бионагрузкой
Настоящее изобретение относится к способам осуществления хроматографии со сниженной бионагрузкой. Эти способы включают получение наполненной хроматографической колонки со сниженной бионагрузкой, получаемой любым из способов, представленных в настоящем описании, и осуществление хроматографии на колонках с использованием наполненной хроматографической колонки со сниженной бионагрузкой. Наполненная хроматографическая колонка со сниженной бионагрузкой может включать по меньшей мере одну из любых хроматографических смол, представленных в настоящем описании, в любой комбинации. Например, хроматографическая смола, присутствующая в наполненной хроматографической колонке со сниженной бионагрузкой, может являться аффинной смолой, включающей белковый лиганд (например, протеин A), или может включать анионообменную хроматографическую смолу. Наполненная хроматографическая колонка со сниженной бионагрузкой может иметь любой из примеров внутренних объемов, представленных в настоящем описании. Наполненная хроматографическая колонка со сниженной бионагрузкой может иметь любую форму (например, цилиндра, почти цилиндрическую форму или эллиптическую форму), представленную в настоящем описании или известную в этой области. Хроматографию на колонках, осуществляемую в любых способах, можно использовать для очистки или выделения рекомбинантного белка (например, любого из рекомбинантных терапевтических белков, представленных в настоящем описании или известных в этой области). В некоторых примерах наполненная хроматографическая колонка со сниженной бионагрузкой является частью многоколоночной системы хроматографии (MCCS), например, может являться частью системы периодической противоточной хроматографии (PCCS).
Осуществляемая хроматография на колонках может включать по меньшей мере один цикл хроматографии, представленной в настоящем описании или известной в этой области. Например, по меньшей мере один цикл хроматографии может включать этапы: захвата рекомбинантного белка посредством подвергания хроматографической смолы воздействию жидкости, включающей рекомбинантный белок; промывания хроматографической смолы посредством подвергания хроматографической смолы воздействию промывочного буфера, элюции рекомбинантного белка посредством подвергания хроматографической смолы воздействию элюирующего буфера; и регенерации хроматографической смолы посредством подвергания хроматографической смолы воздействию регенерационного буфера. В некоторых примерах жидкость, включающая рекомбинантный белок, является жидкой средой для культивирования (например, жидкой средой для культивирования, собранной из перфузионной или периодической культуры) или разбавленной жидкой средой для культивирования (например, средой для культивирования, разбавленной буфером).
Хроматографию на колонках можно осуществлять с использованием замкнутой и интегрированной системы (например, любой из примеров замкнутых и интегрированных систем, представленных в настоящем описании или известных в этой области). Например, хроматографию на колонках можно осуществлять с использованием замкнутой и интегрированной системы, где буфер является буфером со сниженной бионагрузкой. Как хорошо известно в этой области, буфер со сниженной бионагрузкой можно получать с использованием множества различных способов (например, получать посредством фильтрации, автоклавирования или температурной обработки).
Хроматография на колонках может включать два или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 20 или более, 25 или более, 30 или более, 35 или более, 40 или более, 45 или более, 50 или более, 55 или более, 60 или более, 65 или более, 70 или более, 75 или более, 80 или более, 85 или более, 90 или более, 95 или более, или 100 или более) циклов хроматографии. В некоторых примерах хроматографию на колонках осуществляют непрерывно в течение периода, по меньшей мере 3 дней (например, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 15 дней, по меньшей мере 16 дней, по меньшей мере 17 дней, по меньшей мере 18 дней, по меньшей мере 19 дней, по меньшей мере 20 дней, по меньшей мере 21 дней, по меньшей мере 22 дней, по меньшей мере 23 дней, по меньшей мере 24 дней, по меньшей мере 25 дней, по меньшей мере 30 дней, по меньшей мере 35 дней, по меньшей мере 40 дней, по меньшей мере 45 дней, по меньшей мере 50 дней, по меньшей мере 55 дней, по меньшей мере 60 дней, по меньшей мере 65 дней, по меньшей мере 70 дней, по меньшей мере 75 дней, по меньшей мере 80 дней, по меньшей мере 85 дней, по меньшей мере 90 дней, по меньшей мере 95 дней или по меньшей мере 100 дней).
В некоторых вариантах осуществления хроматографическая смола в наполненной хроматографической колонке со сниженной бионагрузкой имеет процентную долю связывающей способности от приблизительно 75% до приблизительно 100% (например, от приблизительно 76% до приблизительно 98%, от приблизительно 76% до приблизительно 96%, от приблизительно 76% до приблизительно 94%, от приблизительно 76% до приблизительно 92%, от приблизительно 76% до приблизительно 90%, от приблизительно 78% до приблизительно 100%, от приблизительно 78% до приблизительно 98%, от приблизительно 78% до приблизительно 96%, от приблизительно 78% до приблизительно 94%, от приблизительно 78% до приблизительно 92%, от приблизительно 78% до приблизительно 90%, от приблизительно 80% до приблизительно 100%, от приблизительно 80% до приблизительно 98%, от приблизительно 80% до приблизительно 96%, от приблизительно 80% до приблизительно 94%, от приблизительно 80% до приблизительно 92%, от приблизительно 80% до приблизительно 90%, от приблизительно 82% до приблизительно 100%, от приблизительно 82% до приблизительно 98%, от приблизительно 82% до приблизительно 96%, от приблизительно 82% до приблизительно 94%, от приблизительно 82% до приблизительно 92%, от приблизительно 82% до приблизительно 90%, от приблизительно 84% до приблизительно 100%, от приблизительно 84% до приблизительно 98%, от приблизительно 84% до приблизительно 96%, от приблизительно 84% до приблизительно 94%, от приблизительно 84% до приблизительно 92%, от приблизительно 84% до приблизительно 90%, от приблизительно 86% до приблизительно 100%, от приблизительно 86% до приблизительно 98%, от приблизительно 86% до приблизительно 96%, от приблизительно 86% до приблизительно 94%, от приблизительно 86% до приблизительно 92%, от приблизительно 88% до приблизительно 100%, от приблизительно 88% до приблизительно 98%, от приблизительно 88% до приблизительно 96%, от приблизительно 88% до приблизительно 94%, от приблизительно 90% до приблизительно 100%, от приблизительно 90% до приблизительно 98%, от приблизительно 90% до приблизительно 96%, от приблизительно 92% до приблизительно 100% или от приблизительно 92% до приблизительно 98%) по сравнению с той же смолой, не подвергнутой гамма-облучению (если один и тот же белок используют для тестирования связывающей способности обоих смол) (например, оцениваемых непосредственно после гамма-облучения).
Интегрированные, замкнутые, или, по существу, замкнутые, и непрерывные способы производства рекомбинантного белка
Настоящее изобретение относится к интегрированным, замкнутым, или, по существу, замкнутым, и непрерывным способам производства очищенного рекомбинантного белка (например, рекомбинантного терапевтического белка). Эти способы включают получение жидкой среды для культивирования, включающей рекомбинантный белок (например, рекомбинантный терапевтический белок), по существу, не содержащий клетки.
Некоторые способы включают непрерывный фидинг жидкой среды для культивирования в многоколоночную систему хроматографии (MCCS) включающую по меньшей мере одну наполненную хроматографическую колонку со сниженной бионагрузкой, представленную в настоящем описании, где в этих способах используют буфер со сниженной бионагрузкой, способы являются интегрированными, и их осуществляют непрерывно от жидкой среды для культивирования до элюата из MCCS, являющегося очищенным рекомбинантным белком (например, терапевтическим белковым лекарственным веществом).
Некоторые способы включают непрерывный фидинг жидкой среды для культивирования в первую MCCS (MCCS1), захват рекомбинантного белка из жидкой среды для культивирования с использованием MCCS1, получение элюата из MCCS,1 включающего рекомбинантный белок, и непрерывный фидинг элюата во вторую MCCS (MCCS2), и непрерывный фидинг рекомбинантного белка из элюата в MCCS2 и последующую элюцию рекомбинантного белка, чтобы, таким образом, получать очищенный рекомбинантный белок, где по меньшей мере одна колонка в MCCS1 и/или MCCS2 является наполненной хроматографической колонкой со сниженной бионагрузкой, представленной в настоящем описании, в способах используют буфер со сниженной бионагрузкой, способы являются интегрированными, и их осуществляют непрерывно от жидкой среды для культивирования до очищенного рекомбинантного белка.
В некоторых примерах каждая из хроматографических колонок, используемых в MCCS, MCCS1 и/или MCCS2, является наполненной хроматографической колонкой со сниженной бионагрузкой, представленной в настоящем описании. Некоторые варианты осуществления дополнительно включают этап составления очищенного рекомбинантного белка в фармацевтической композиции.
Способы, представленные в настоящем описании, представляют собой непрерывное и быстрое получение очищенного рекомбинантного белка из жидкой среды для культивирования, включающей рекомбинантный белок. Например, период времени между фидингом жидкой среды для культивирования, включающей терапевтический белок, в MCCS или MCCS1 и элюцией рекомбинантного белка из MCCS или MCCS2, соответственно, может составлять, например, от приблизительно 4 часов до приблизительно 48 часов включительно, например, от приблизительно 4 часов до приблизительно 40 часов, от приблизительно 4 часов до приблизительно 35 часов, от приблизительно 4 часов до приблизительно 30 часов, от приблизительно 4 часов до приблизительно 28 часов, от приблизительно 4 часов до приблизительно 26 часов, от приблизительно 4 часов до приблизительно 24 часов, от приблизительно 4 часов до приблизительно 22 часов, от приблизительно 4 часов до приблизительно 20 часов, от приблизительно 4 часов до приблизительно 18 часов, от приблизительно 4 часов до приблизительно 16 часов, от приблизительно 4 часов до приблизительно 14 часов, от приблизительно 4 часов до приблизительно 12 часов, от приблизительно 6 часов до приблизительно 12 часов, от приблизительно 8 часов до приблизительно 12 часов, от приблизительно 6 часов до приблизительно 20 часов, от приблизительно 6 часов до приблизительно 18 часов, от приблизительно 6 часов до приблизительно 14 часов, от приблизительно 8 часов до приблизительно 16 часов, от приблизительно 8 часов до приблизительно 14 часов, от приблизительно 8 часов до приблизительно 12 часов, от приблизительно 10 часов до 20 часов, от приблизительно 10 часов до 18 часов, от приблизительно 10 часов до 16 часов, от приблизительно 10 часов до 14 часов, от приблизительно 12 часов до приблизительно 14 часов, от приблизительно 10 часов до приблизительно 40 часов, от приблизительно 10 часов до приблизительно 35 часов, от приблизительно 10 часов до приблизительно 30 часов, от приблизительно 10 часов до приблизительно 25 часов, от приблизительно 15 часов до приблизительно 40 часов, от приблизительно 15 часов до приблизительно 35 часов, от приблизительно 15 часов до приблизительно 30 часов, от приблизительно 20 часов до приблизительно 40 часов, от приблизительно 20 часов до приблизительно 35 часов или от приблизительно 20 часов до приблизительно 30 часов, включительно. В других примерах, период времени между фидингом жидкой среды для культивирования, включающей рекомбинантный белок, в MCCS или MCCS1 и элюцией рекомбинантного белка из MCCS или MCCS2, соответственно, составляет, например, более приблизительно 4 часов и менее приблизительно 40 часов включительно, например, более приблизительно 4 часов и менее приблизительно 39 часов, приблизительно 38 часов, приблизительно 37 часов, приблизительно 36 часов, приблизительно 35 часов, приблизительно 34 часов, приблизительно 33 часов, приблизительно 32 часов, приблизительно 31 часов, приблизительно 30 часов, приблизительно 29 часов, приблизительно 28 часов, приблизительно 27 часов, приблизительно 26 часов, приблизительно 25 часов, приблизительно 24 часов, приблизительно 23 часов, приблизительно 22 часов, приблизительно 21 часов, приблизительно 20 часов, приблизительно 19 часов, приблизительно 18 часов, приблизительно 17 часов, приблизительно 16 часов, приблизительно 15 часов, приблизительно 14 часов, приблизительно 13 часов, приблизительно 12 часов, приблизительно 11 часов, приблизительно 10 часов, приблизительно 9 часов, приблизительно 8 часов, приблизительно 7 часов, приблизительно 6 часов, приблизительно 5 часов или приблизительно 4,5 часов, включительно.
Неограничивающие аспекты MCCS, которые можно использовать в любом из этих способов (MCCS, MCCS1 и/или MCCS2), описывают в предварительных патентных заявках США №№ 61/775060 и 61/856390 (каждая из которых включена в настоящее описание в качестве ссылки).
В некоторых примерах способов не используют этап хранения (например, не используют резервуар (например, бак) во всем способе). В других можно использовать максимально 1, 2, 3, 4 или 5 резервуаров (например, баков) во всем способе. В любом из способов, представленных в настоящем описании, можно использовать максимально 1, 2, 3, 4 или 5 резервуаров (например, баков) во всем способе, где каждый бак лишь удерживает рекомбинантный белок в течение общего периода времени, например, от приблизительно 5 минут до менее чем приблизительно 6 часов включительно, например, от приблизительно 5 минут до приблизительно 5 часов, приблизительно 4 часов, приблизительно 3 часов, приблизительно 2 часов, приблизительно 1 часа или приблизительно 30 минут, включительно.
В некоторых способах используют один, два, три, четыре, пять или шесть резервуаров (например, баков), и они могут иметь емкость, составляющую, например, от 1 мл до приблизительно 300 мл включительно, например, от 1 мл до приблизительно 280 мл, приблизительно 260 мл, приблизительно 240 мл, приблизительно 220 мл, приблизительно 200 мл, приблизительно 180 мл, приблизительно 160 мл, приблизительно 140 мл, приблизительно 120 мл, приблизительно 100 мл, приблизительно 80 мл, приблизительно 60 мл, приблизительно 40 мл, приблизительно 20 мл или приблизительно 10 мл (включительно). Любые резервуары (например, баки), используемые (в любом из способов, представленных в настоящем описании) для хранения жидкости до фидинга в MCCS или MCCS1, могут иметь емкость, составляющую, например, от 1 мл до приблизительно 100% включительно например, от 1 мл до приблизительно 90%, приблизительно 80%, приблизительно 70%, приблизительно 60%, приблизительно 50%, приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 10% или приблизительно 5% включительно нагрузочного объема первой колонки MCCS или MCCS1. Резервуары (например, баки) можно использовать для хранения элюата из MCCS1 до его попадания в MCCS2, и они могут иметь емкость, составляющую, например, от 1 мл до приблизительно 100% включительно, например, от 1 мл до приблизительно 90%, приблизительно 80%, приблизительно 70%, приблизительно 60%, приблизительно 50%, приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 10%, или приблизительно 5% включительно нагрузочного объема первой колонки MCCS2.
Различные дополнительные аспекты этих способов подробно описывают ниже, и их можно использовать в любой комбинации в способах, представленных в настоящем описании, без ограничения. Примеры аспектов представленных способов описаны ниже; однако специалисту в этой области будет понятно, что можно добавлять дополнительные этапы к способам, представленным в настоящем описании, и можно использовать другие материалы для осуществления любого из этапов способов, представленных в настоящем описании.
Жидкая среда для культивирования
Жидкую среду для культивирования, включающую рекомбинантный белок (например, рекомбинантный терапевтический белок), по существу, не содержащую клетки, можно получать из любого источника. Например, жидкую среду для культивирования можно получать из культуры рекомбинантных клеток (например, культуры рекомбинантных бактериальных, дрожжевых клеток или клеток млекопитающего). Жидкую среду для культивирования можно получать из периодической культуры клеток (например, клеток млекопитающего) (например, биореактора периодического действия, включающего культуру клеток млекопитающих, секретирующих рекомбинантный белок) или перфузионной культуры клеток (например, клеток млекопитающего) (например, перфузионного биореактора, включающего культуру клеток млекопитающих, секретирующих рекомбинантный белок). Жидкая среда для культивирования также может являться очищенной жидкой средой для культивирования из культуры бактериальных или дрожжевых клеток, секретирующих рекомбинантный белок.
Жидкую среду для культивирования, полученную из культуры рекомбинантных клеток, можно фильтровать или очищать для получения жидкой среды для культивирования, по существу, не содержащей клетки и/или вирусы. Способы фильтрации или очистки жидкой среды для культивирования для удаления клеток известны в этой области (например, фильтрация через фильтры с диаметром пор 0,2 мкм и фильтрация с использованием системы Alternating Tangential Flow (ATFTM)). Рекомбинантные клетки также можно удалять из жидкой среды для культивирования с использованием центрифугирования и удаления супернатанта, являющегося жидкой средой для культивирования, по существу, не содержащей клетки, или позволяя клеткам оседать под действием силы гравитации на дно контейнера (например, биореактора), включающего жидкую среду для культивирования, и удаляя жидкую среду для культивирования (жидкую среду для культивирования, по существу, не содержащую клетки), находящуюся далеко от осевших рекомбинантных клеток.
Жидкую среду для культивирования можно получать из культуры рекомбинантных клеток (например, рекомбинантных бактерий, дрожжей или клеток млекопитающих), продуцирующих любой из рекомбинантных белков (например, рекомбинантных терапевтических белков), представленных в настоящем описании или известных в этой области. Некоторые примеры любого из способов, представленных в настоящем описании, могут дополнительно включать этап культивирования рекомбинантных клеток (например, рекомбинантных бактерий, дрожжей или клеток млекопитающих), продуцирующих рекомбинантный белок (например, рекомбинантный терапевтический белок).
Жидкая среда для культивирования может представлять собой любой из типов жидкой среды для культивирования, представленных в настоящем описании или известных в этой области. Например, жидкую среду для культивирования можно выбирать из группы: жидкой среды для культивирования, не содержащей компонент животного происхождения, жидкой среды для культивирования, не содержащей сыворотку, жидкой среды для культивирования, содержащей сыворотку, химически-определенной жидкой среды для культивирования, и жидкой среды для культивирования, не содержащей белок. В любом из способов, представленных в настоящем описании, жидкую среду для культивирования, полученную из культуры, можно разбавлять, добавляя вторую жидкость (например, буфер), до ее фидинга в MCCS или MCCS1.
Жидкую среду для культивирования, включающую рекомбинантный белок, по существу, не содержащую клетки, можно хранить (например, при температуре ниже приблизительно 15°C (например, ниже приблизительно 10°C, ниже приблизительно 4°C, ниже приблизительно 0°C, ниже приблизительно -20°C, ниже приблизительно -50°C, ниже приблизительно -70 C° или ниже приблизительно -80°C) в течение по меньшей мере 1 дня (например, по меньшей мере приблизительно 2 дней, по меньшей мере приблизительно 5 дней, по меньшей мере приблизительно 10 дней, по меньшей мере приблизительно 15 дней, по меньшей мере приблизительно 20 дней или по меньшей мере приблизительно 30 дней) перед фидингом жидкой среды для культивирования в MCCS или MCCS1. Альтернативно, в некоторых примерах жидкую среду для культивирования подвергают фидингу в MCCS или MCCS1 непосредственно из биореактора (например, фидингу в MCCS или MCCS1 непосредственно из биореактора после этапа фильтрации или очистки).
Многоколоночные системы хроматографии
Способы, представленные в настоящем описании, включают применение MCCS или двух или более (например, двух, трех, четырех, пяти или шести) многоколоночных систем хроматографии (MCCS) (например, MCCS1 и MCCS2). MCCS может включать две или более хроматографических колонки, две или более хроматографических мембраны или комбинацию по меньшей мере одной хроматографической колонки и по меньшей мере одной хроматографической мембраны. В неограничивающих примерах MCCS (например, MCCS, MCCS1 и/или MCCS2 в любом из способов в настоящем описании) может включать четыре хроматографические колонки, три хроматографические колонки и хроматографическую мембрану, три хроматографические колонки, две хроматографические колонки, две хроматографические мембраны и две хроматографические колонки и одну хроматографическую мембрану. Можно предусматривать дополнительные примеры комбинаций хроматографических колонок и/или хроматографических мембран для использования специалистом в этой области в MCCS (например, MCCS, MCCS1 и/или MCCS2 в любом из способов, представленных в настоящем описании) без ограничения. Отдельные хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS, могут являться идентичными (например, иметь одну и ту же форму, объем, смолу, механизм захвата и типовую операцию) или разными (например, иметь одну или несколько разных форм, объемов, смол, механизмов захвата и/или типовых операций). Посредством отдельных хроматографических колонок и/или хроматографических мембран, присутствующих в MCCS (например, MCCS, MCCS1 и/или MCCS2 в любом из способов, представленных в настоящем описании) можно осуществлять одну и ту же типовую операцию (например, типовую операцию захвата, очистки или тонкой очистки) или разные типовые операции (например, разные типовые операции, выбранные, например, из группы захвата, очистки, тонкой очистки, инактивации вирусов, коррекции концентрации ионов и/или pH жидкости, включающей рекомбинантный белок, и фильтрации). Например, в примерах способов, представленных в настоящем описании, посредством по меньшей мере одной хроматографической колонки и/или хроматографической мембраны в MCCS или MCCS1 осуществляют типовую операцию захвата рекомбинантного белка.
Одна или несколько хроматографических колонок, которые могут находиться в MCCS (например, находиться MCCS, MCCS1 и/или MCCS2), могут иметь объем смолы, например, от приблизительно 1 мл до приблизительно 2 мл, приблизительно 5 мл, приблизительно 10 мл, приблизительно 15 мл, приблизительно 20 мл, приблизительно 25 мл, приблизительно 30 мл, приблизительно 35 мл, приблизительно 40 мл, приблизительно 45 мл, приблизительно 50 мл, приблизительно 55 мл, приблизительно 60 мл, приблизительно 65 мл, приблизительно 70 мл, приблизительно 75 мл, приблизительно 80 мл, приблизительно 85 мл, приблизительно 90 мл, приблизительно 95 мл, или приблизительно 100 мл, включительно. Одна или несколько хроматографических колонок, которые могут находиться в MCCS (например, находиться в MCCS, MCCS1 и/или MCCS2), могут иметь объем смолы от приблизительно 2 мл до приблизительно 100 мл, от приблизительно 2 мл до приблизительно 90 мл, от приблизительно 2 мл до приблизительно 80 мл, от приблизительно 2 мл до приблизительно 70 мл, от приблизительно 2 мл до приблизительно 60 мл, от приблизительно 2 мл до приблизительно 50 мл, от приблизительно 5 мл до приблизительно 50 мл, от приблизительно 2 мл до приблизительно 45 мл, от приблизительно 5 мл до приблизительно 45 мл, от приблизительно 2 мл до приблизительно 40 мл, от приблизительно 5 мл до приблизительно 40 мл, от приблизительно 2 мл до приблизительно 35 мл, от приблизительно 5 мл до приблизительно 35 мл, от приблизительно 2 мл до приблизительно 30 мл, от приблизительно 5 мл до приблизительно 30 мл, от приблизительно 2 мл до приблизительно 25 мл, от приблизительно 5 мл до приблизительно 25 мл, от приблизительно 15 мл до приблизительно 60 мл, от приблизительно 10 мл до приблизительно 60 мл, от приблизительно 10 мл до приблизительно 50 мл и от приблизительно 15 мл до приблизительно 50 мл. Одна или несколько хроматографических колонок в MCCS (например, MCCS, MCCS1 и/или MCCS2), используемых в любом из способов, представленных в настоящем описании, могут иметь, по существу, тот же объем смолы или могут иметь разные объемы смолы. Скорость потока, используемая для одной или нескольких хроматографических колонок в MCCS (например, MCCS, MCCS1 и/или MCCS2), может составлять, например, от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту).
Одна или несколько хроматографических колонок в MCCS (например, MCCS, MCCS1 и/или MCCS2) могут иметь, по существу, ту же форму или могут иметь, по существу, разные формы. Например, одна или несколько хроматографических колонок в MCCS (например, в MCCS, MCCS1 и/или MCCS2) могут иметь, по существу, форму цилиндра круглого сечения или могут иметь, по существу, форму цилиндра овального сечения.
Одна или несколько хроматографических мембран, которые могут находиться в MCCS (например, находиться в MCCS, MCCS1 и/или MCCS2), могут иметь объем слоя, например, от приблизительно 1 мл до приблизительно 500 мл (например, от приблизительно 1 мл до приблизительно 475 мл, от приблизительно 1 мл до приблизительно 450 мл, от приблизительно 1 мл до приблизительно 425 мл, от приблизительно 1 мл до приблизительно 400 мл, от приблизительно 1 мл до приблизительно 375 мл, от приблизительно 1 мл до приблизительно 350 мл, от приблизительно 1 мл до приблизительно 325 мл, от приблизительно 1 мл до приблизительно 300 мл, от приблизительно 1 мл до приблизительно 275 мл, от приблизительно 1 мл до приблизительно 250 мл, от приблизительно 1 мл до приблизительно 225 мл, от приблизительно 1 мл до приблизительно 200 мл, от приблизительно 1 мл до приблизительно 175 мл, от приблизительно 1 мл до приблизительно 150 мл, от приблизительно 1 мл до приблизительно 125 мл, от приблизительно 1 мл до приблизительно 100 мл, от приблизительно 2 мл до приблизительно 100 мл, от приблизительно 5 мл до приблизительно 100 мл, от приблизительно 1 мл до приблизительно 80 мл, от приблизительно 2 мл до приблизительно 80 мл, от приблизительно 5 мл до приблизительно 80 мл, от приблизительно 1 мл до приблизительно 60 мл, от приблизительно 2 мл до приблизительно 60 мл, от приблизительно 5 мл до приблизительно 60 мл, от приблизительно 1 мл до приблизительно 40 мл, от приблизительно 2 мл до приблизительно 40 мл, от приблизительно 5 мл до приблизительно 40 мл, от приблизительно 1 мл до приблизительно 30 мл, от приблизительно 2 мл до приблизительно 30 мл, от приблизительно 5 мл до приблизительно 30 мл, от приблизительно 1 мл до приблизительно 25 мл, от приблизительно 2 мл до приблизительно 25 мл, от приблизительно 1 мл до приблизительно 20 мл, от приблизительно 2 мл до приблизительно 20 мл, от приблизительно 1 мл до приблизительно 15 мл, от приблизительно 2 мл до приблизительно 15 мл, от приблизительно 1 мл до приблизительно 10 мл или от приблизительно 2 мл до приблизительно 10 мл).
В любом из способов, представленных в настоящем описании, при использовании MCCS, MCCS1 и/или MCCS2 можно использовать один или несколько (например, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два, двадцать три или двадцать четыре) разных типа буфера со сниженной бионагрузкой. Как известно в этой области, один или несколько типов буфера со сниженной бионагрузкой, используемых в MCCS, MCCS1 и/или MCCS2 в способах, представленных в настоящем описании, будет зависеть от смолы, присутствующей в хроматографических колонках и/или хроматографических мембранах MCCS, MCCS1 и/или MCCS2, биофизических свойств рекомбинантного белка и типовой операции (например, любой из примеров типовых операций, представленных в настоящем описании), осуществляемых посредством конкретных хроматографических колонок и/или хроматографических мембран MCCS, MCCS1 и/или MCCS2. Объем и тип буфера, используемого при использовании MCCS, MCCS1 и/или MCCS2 в любом из способов, представленных в настоящем описании, также может определять специалист в этой области (например, что более подробно описано ниже). Например, объем и типы буфера, используемого при использовании MCCS, MCCS1 и/или MCCS2 в любом из способов, представленных в настоящем описании, можно выбирать для оптимизации одного или нескольких из следующего в очищенном рекомбинантном белке (например, рекомбинантном белковом лекарственном продукте): общего выхода рекомбинантного белка, активности рекомбинантного белка, уровня чистоты рекомбинантного белка и удаления биологических загрязнений из жидкости, включающей рекомбинантный белок (например, жидкой среды для культивирования) (например, отсутствия активных вирусов, микобактерий, дрожжей, бактерий или клеток млекопитающих).
MCCS, MCCS1 и/или MCCS2 может являться системой периодической противоточной хроматографии (PCCS). PCCS, например, может включать две или более хроматографические колонки (например, три колонки или четыре колонки), переключаемые для непрерывной элюции рекомбинантного белка из двух или более хроматографических колонок. PCCS может включать две или более хроматографические колонки, две или более хроматографические мембраны, или по меньшей мере одну хроматографическую колонку и по меньшей мере одну хроматографическую мембрану. Операция на колонке (цикл), как правило, состоит из этапов нагрузки, промывания, элюции и регенерации. В PCCS используют множество колонок для осуществления тех же этапов по отдельности и непрерывно циклическим образом. Т.к. колонки используют в серии, элюат из одной колонки подвергают захвату на другой колонке. Эта уникальная черта PCCS делает возможной нагрузку смолы, близкую к ее способности к статическому связыванию вместо способности к динамическому связыванию, что является типичным при порционном способе хроматографии. В результате непрерывных циклов и элюции жидкость, поступающая в PCCS, обрабатывается непрерывно, и непрерывно получают элюат, включающий рекомбинантный белок.
Стратегию переключения колонок используют для продвижения от одного этапа к другому в цикле PCCS. Примеры переключения колонок, которые можно использовать в PCCS, описывают в предварительных патентных заявках США №№ 61/775060 и 61/856390. Например, в способе переключения колонок можно использовать две автоматизированные операции переключения на колонку: первая из которых связана с появлением исходного продукта, в то время как вторая соответствует насыщению колонки. Определение того, когда необходимо осуществлять операции переключения колонок, можно осуществлять посредством мониторинга концентрации рекомбинантного белка (например, мониторинга, осуществляемого посредством УФ-мониторинга) в элюате из каждой хроматографической колонки, находящейся в PCCS. Например, переключение колонок можно определять с помощью любого инструмента PAT, способного к линейному измерению концентрации рекомбинантного белка с регулированием с обратной связью. Инструмент PAT способен к линейному измерению концентрации рекомбинантного белка в реальном времени с регулированием с обратной связью. Как известно в этой области, переключение колонок также можно осуществлять с учетом времени или количества жидкости (например, буфера), пропускаемой через одну или несколько хроматографических колонок и/или хроматографических мембран в MCCS, MCCS1 и/или MCCS2.
В PCCS продолжительность обработки (RT) рекомбинантного белка на каждой хроматографической колонке и/или хроматографической мембране, находящейся в PCCS, можно снижать без повышения размера колонки/мембраны, т.к. появляющийся продукт из первой колонки/мембраны можно подвергать захвату на другой колонке/мембране в PCCS. Систему непрерывного способа можно конструировать для способа с жидкой средой для культивирования при любой скорости перфузии (D) посредством варьирования объема колонки/мембраны (V) и RT с использованием уравнения: V=D*RT.
Одна или несколько типовых операций, которые можно осуществлять посредством MCCS или MCC1 и/или MCCS2, используемых в представленных в настоящем описании способах, включают, например, захват рекомбинантного белка, инактивации вирусов, присутствующих в жидкости, включающей рекомбинантный белок, очистку рекомбинантного белка, тонкую очистку рекомбинантного белка, удержание жидкости, включающей рекомбинантный белок (например, с использованием любого из примеров баков, представленных в настоящем описании), фильтрации или удаления твердых частиц и/или клеток из жидкости, включающей рекомбинантный белок, и коррекцию концентрации ионов и/или pH жидкости, включающей рекомбинантный белок.
В некоторых вариантах осуществления MCCS или MCCS1 включает по меньшей мере одну хроматографическую колонку и/или хроматографическую мембрану, посредством которой осуществляют типовую операцию захвата рекомбинантного белка. Типовую операцию захвата можно осуществлять с использованием по меньшей мере одной хроматографической колонки и/или хроматографической смолы, например, в которой используют механизм захвата. Неограничивающие примеры механизмов захвата включают механизм захвата со связыванием протеина A, механизм захвата со связыванием антитела или фрагмента антитела, механизм захвата со связыванием субстрата, механизм захвата со связыванием аптамера, механизм захвата со связыванием метки (например, механизм захвата на основе полигистидиновой метки) и механизм захвата со связыванием кофактора. Захват также можно осуществлять с использованием смолы, которую можно использовать для осуществления катионообменной или анионообменной хроматографии, хроматографии с молекулярным ситом или хроматографии с гидрофобными взаимодействиями. Неограничивающие примеры смол, которые можно использовать для захвата рекомбинантного белка, представлены в настоящем описании. Дополнительные примеры смол, которые можно использовать для захвата рекомбинантного белка, известны в этой области.
Типовую операцию инактивации вирусов, присутствующих в жидкости, включающей рекомбинантный белок, можно осуществлять с использованием MCCS, MCCS1 и/или MCCS2 (например, включающих, например, хроматографическую колонку, хроматографическую мембрану или бак-накопитель, в котором можно инкубировать жидкость, включающую рекомбинантный белок при pH от приблизительно 3,0 до 5,0 (например, от приблизительно 3,5 до приблизительно 4,5, от приблизительно 3,5 до приблизительно 4,25, от приблизительно 3,5 до приблизительно 4,0, от приблизительно 3,5 до приблизительно 3,8 или приблизительно 3,75) в течение периода по меньшей мере 30 минут (например, периода от приблизительно 30 минут до 1,5 часов, периода от приблизительно 30 минут до 1,25 часов, периода от приблизительно 0,75 часов до 1,25 часов или периода приблизительно 1 час)).
Типовую операцию очистки рекомбинантного белка можно осуществлять с использованием одной или нескольких MCCS (например, MCCS, MCCS1 и/или MCCS2), включающих, например, хроматографическую колонку или хроматографическую мембрану, включающую смолу, например, в которой используют систему захвата. Неограничивающие примеры механизмов захвата включают механизм захвата со связыванием протеина A, механизм захвата со связыванием антитела или фрагмента антитела, механизм захвата со связыванием субстрата, механизм захвата со связыванием аптамера, механизм захвата со связыванием метки (например, механизм захвата на основе полигистидиновой метки) и механизм захвата со связыванием кофактора. Очистку также можно осуществлять с использованием смолы, которую можно использовать для осуществления катионообменной или анионообменной хроматографии, хроматографии с молекулярным ситом или хроматографии с гидрофобными взаимодействиями. Неограничивающие примеры смол, которые можно использовать для очистки рекомбинантного белка, представлены в настоящем описании. Дополнительные примеры смол, которые можно использовать для очистки рекомбинантного белка, известны в этой области.
Типовую операцию тонкой очистки рекомбинантного белка можно осуществлять с использованием одной или нескольких MCCS (например, MCCS, MCCS1 и/или MCCS), включающих, например, хроматографическую колонку или хроматографическую мембрану, включающую смолу, например, которую можно использовать для осуществления катионообменной, анионообменной хроматография, хроматографии с молекулярным ситом или хроматография с гидрофобными взаимодействиями. Неограничивающие примеры смол, которые можно использовать для тонкой очистки рекомбинантного белка, представлены в настоящем описании. Дополнительные примеры смол, которые можно использовать для тонкой очистки рекомбинантного белка, известны в этой области.
Типовую операцию хранения жидкости, включающей рекомбинантный белок, можно осуществлять с использованием MCCS (например, MCCS, MCCS1 и/или MCCS2), включающей по меньшей мере один резервуар (например, бак) или максимум 1, 2, 3, 4 или 5 резервуаров (например, баков) в MCCS или комбинации MCCS1 и MCCS2. Например, каждый из резервуаров (например, баков), которые можно использовать для осуществления этой типовой операции, может иметь объем от приблизительно 1 мл до приблизительно 1 л (например, от приблизительно 1 мл до приблизительно 800 мл, от приблизительно 1 мл до приблизительно 600 мл, от приблизительно 1 мл до приблизительно 500 мл, от приблизительно 1 мл до приблизительно 400 мл, от приблизительно 1 мл до приблизительно 350 мл, от приблизительно 1 мл до приблизительно 300 мл, от приблизительно 10 мл до приблизительно 250 мл, от приблизительно 10 мл до приблизительно 200 мл, от приблизительно 10 мл до приблизительно 150 мл, или от приблизительно 10 мл до приблизительно 100 мл). Резервуары (например, баки), используемые в способах, представленных в настоящем описании, могут иметь емкость, составляющую, например, от 1 мл до приблизительно 300 мл включительно, например, от 1 мл до приблизительно 280 мл, приблизительно 260 мл, приблизительно 240 мл, приблизительно 220 мл, приблизительно 200 мл, приблизительно 180 мл, приблизительно 160 мл, приблизительно 140 мл, приблизительно 120 мл, приблизительно 100 мл, приблизительно 80 мл, приблизительно 60 мл, приблизительно 40 мл, приблизительно 20 мл или приблизительно 10 мл, включительно. Любой из резервуаров (например, баков), используемых (в любом из способов, представленных в настоящем описании) для удержания жидкости перед ее поступлением в MCCS или MCCS1, может иметь емкость, составляющую, например, от 1 мл до приблизительно 100%включительно от приблизительно 1 мл до приблизительно 90%, приблизительно 80%, приблизительно 70%, приблизительно 60%, приблизительно 50%, приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 10%, или приблизительно 5% включительно нагрузочного объема первой колонки MCCS или MCCS1. Любой из резервуаров (например, баков), используемых для удержания элюата из MCCS1 (включающего рекомбинантный белок) перед его поступлением в MCCS2, может иметь емкость, составляющую, например, от 1 мл до приблизительно 100% включительно, например, от приблизительно 1 мл до приблизительно 90%, приблизительно 80%, приблизительно 70%, приблизительно 60%, приблизительно 50%, приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 10%, или приблизительно 5% включительно нагрузочного объема первой колонки MCCS2.
Каждый из резервуаров (например, баков) может удерживать жидкость, включающую рекомбинантный белок, в течение по меньшей мере 10 минут (например, по меньшей мере 20 минут, по меньшей мере 30 минут, по меньшей мере 1 часа, по меньшей мере 2 часов, по меньшей мере 4 часов или по меньшей мере 6 часов). В других примерах резервуары (например, баки) удерживают рекомбинантный белок лишь в течение общего периода времени, например, от приблизительно 5 минут до менее чем приблизительно 6 часов включительно, например, от приблизительно 5 минут до приблизительно 5 часов, приблизительно 4 часов, приблизительно 3 часов, приблизительно 2 часов, приблизительно 1 часа, или приблизительно 30 минут, включительно. Резервуары (например, баки) можно использовать для хранения и охлаждения (например, при температуре менее 25°C, менее 15°C или менее 10°C) жидкости, включающей рекомбинантный белок. Резервуар может иметь любую форму, включая цилиндр круглого сечения, цилиндр овального сечения, или приблизительно прямоугольный запаянный и непроницаемый мешок.
Типовые операции фильтрации жидкости, включающей рекомбинантный белок, можно осуществлять с использованием MCCS (например, MCCS, MCCS1 и/или MCCS2), включающей, например, фильтр, или хроматографическую колонку или хроматографическую мембрану, включающую смолу с молекулярным ситом. Как известно в этой области, в этой области доступен широкий спектр субмикронных фильтров (например, фильтра с размером пор менее 1 мкм, менее 0,5 мкм, менее 0,3 мкм, приблизительно 0,2 мкм, менее 0,2 мкм, менее 100 нм, менее 80 нм, менее 60 нм, менее 40 нм, менее 20 нм или менее 10 нм), с помощью которых удалять любой осажденный материал и/или клетки (например, осажденный несвернутый белок; осажденные нежелательные белки клетки-хозяина; осажденные липиды; бактерии; дрожжевые клетки; клетки грибов; микобактерии и/или клетки млекопитающих). Известно, что с помощью фильтров, имеющих размер пор приблизительно 0,2 мкм или менее 0,2 мкм, эффективно удаляют бактерии из жидкости, включающей рекомбинантный белок. Как известно в этой области, для осуществления типовой операции фильтрации жидкости, включающей рекомбинантный белок, в MCCS (например, MCCS, MCCS1 и/или MCCS2) также можно использовать хроматографическую колонку или хроматографическую мембрану, включающую смолу с молекулярным ситом.
Типовые операции коррекции концентрации ионов и/или pH жидкости, включающей рекомбинантный белок, можно осуществлять с использованием MCCS (например, MCCS, MCCS1 и/или MCCS2), включающей и использующей резервуар для коррекции буфера (например, резервуар для линейной коррекции буфера), с помощью которого добавляют новый буферный раствор в жидкость, включающую рекомбинантный белок (например, между колонками в MCCS, MCCS1 и/или MCCS2, или после последней колонки в предпоследней MCCS (например, MCCS1) и до фидинга жидкости, включающей рекомбинантный белок, в первую колонку следующей MCCS (например, MCCS2)). Как известно в этой области, резервуар для линейной коррекции буфера может быть любого размера (например, более 100 мл) и может включать любой буферный раствор (например, буферный раствор, имеющий один или несколько из: повышенного или сниженного pH по сравнению с жидкостью, включающей рекомбинантный белок, повышенной или пониженной концентрации ионов (например, солей) по сравнению с жидкостью, включающей рекомбинантный белок, и/или повышенной или пониженной концентрации средства, конкурирующего с рекомбинантным белком за связывание со смолой, присутствующей по меньшей мере в одной хроматографической колонке или по меньшей мере одной хроматографической мембране в MCCS (например, MCCS, MCCS1 и/или MCCS2)).
Посредством MCCS, MCCS1 и/или MCCS2 можно осуществлять две или более типовые операции. Например, посредством каждой из MCCS, MCCS1 и/или MCCS2 можно осуществлять, по меньшей мере, следующие типовые операции: захват рекомбинантного белка и инактивацию вирусов, присутствующих в жидкости, включающей рекомбинантный белок; захват рекомбинантного белка, инактивацию вирусов, присутствующих в жидкости, включающей рекомбинантный белок, и коррекцию концентраций ионов и/или pH жидкости, включающей рекомбинантный белок; очистку рекомбинантного белка и тонкую очистку рекомбинантного белка; очистку рекомбинантного белка, тонкую очистку рекомбинантного белка и фильтрацию жидкости, включающей рекомбинантный белок, или удаление осадков и/или твердых частиц из жидкости, включающей рекомбинантный белок; и очистку рекомбинантного белка, тонкую очистку рекомбинантного белка, фильтрацию жидкости, включающей рекомбинантный белок, или удаление осадков и/или твердых частиц из жидкости, включающей рекомбинантный белок, и коррекцию концентрации ионов и/или pH жидкости, включающей рекомбинантный белок.
Захват рекомбинантного белка
Способы по настоящему изобретению включают этап захвата рекомбинантного белка с использованием MCCS или MCCS1. Как известно в этой области, жидкую среду для культивирования, включающую рекомбинантный белок, можно подвергать непрерывному фидингу в MCCS или MCCS1 с использованием множества различных способов. Например, жидкую среду для культивирования можно активно закачивать в MCCS или MCCS1 или жидкую среду для культивирования можно подвергать фидингу в MCCS или MCCS1 с использованием силы гравитации. Жидкую среду для культивирования можно хранить в резервуаре (например, баке-накопителе) до ее фидинга в MCCS или MCCS1 или жидкую среду для культивирования можно активно выкачивать из биореактора, включающего культуру клеток (например, клеток млекопитающих, секретирующих рекомбинантный белок в среду для культивирования) в MCCS или MCCS1.
Жидкую среду для культивирования можно подвергать фидингу (нагружать) в MCCS или MCCS1 при скорости потока от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Жидкую среду для культивирования, включающую рекомбинантный белок, можно получать из любого из примеров источников, представленных в настоящем описании или известных в этой области.
Некоторые примеры дополнительно включают необязательный этап фильтрации жидкой среды для культивирования до ее фидинга в MCCS или MCCS1. Для фильтрации жидкой среды для культивирования, включающей рекомбинантный белок, до ее фидинга в MCCS или MCCS1 можно использовать любой из примеров способов фильтрации жидкой среды для культивирования или жидкости, включающей рекомбинантный белок, представленный в настоящем описании, или любые способы фильтрации, известные в этой области.
В способах, представленных в настоящем описании, захват рекомбинантного белка из жидкой среды для культивирования осуществляют с использованием MCCS или MCCS1. Как известно в этой области, для достижения захвата рекомбинантного белка по меньшей мере одна хроматографическая колонка или по меньшей мере одна хроматографическая мембрана в MCCS или MCCS1 должна включать смолу, в которой используют механизм захвата (например, любой из примеров механизмов захвата, представленных в настоящем описании), или включать смолу, с помощью которой можно осуществлять катионообменную, анионообменную хроматографию, хроматографию с молекулярным ситом или хроматографию с гидрофобными взаимодействиями. Например, если рекомбинантный белок является антителом или фрагментом антитела, система захвата может являться механизмом захвата со связыванием протеина A или механизмом захвата со связыванием антигена (где осуществляют захват антигена, специфически распознаваемого рекомбинантным антителом или фрагментом антитела). Если рекомбинантный белок является ферментом, в механизме захвата можно использовать антитело или фрагмент антитела, специфически связывающегося с ферментом для захвата рекомбинантного фермента, субстрат фермента для захвата рекомбинантного фермента, кофактор фермента для захвата рекомбинантного фермента, или, если рекомбинантный фермент включает метку, белок, хелат металла или антитело (или фрагмент антитела), специфически связывающееся с меткой, присутствующей в рекомбинантном ферменте. Неограничивающие примеры смол, которые можно использовать для захвата рекомбинантного белка, представлены в настоящем описании, и дополнительные смолы, которые можно использовать для захвата рекомбинантного белка, известны в этой области. Одним неограничивающим примером смолы, в которой используют механизм захвата со связыванием протеина A, является смола Mab Select SuReTM (GE Healthcare, Piscataway, NJ), JSR LifeSciences Amsphere ProA JWT203 (Sunnyvale, CA) и Kaneka KanCap A (Osaka, Japan).
Неограничивающие примеры размеров и форм хроматографических колонок или хроматографических мембран, находящихся в MCCS или MCCS1, которые можно использовать для захвата рекомбинантного белка, представлены в настоящем описании. Жидкая среда для культивирования, подвергаемая фидингу (нагружаемая) в MCCS или MCCS1, может включать, например, от приблизительно 0,05 мг/мл до приблизительно 100 мг/мл рекомбинантного белка (например, от приблизительно 0,1 мг/мл до приблизительно 90 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 80 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 70 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 60 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 50 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 40 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 30 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл, от 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл рекомбинантного белка). Среднее время, необходимое для связывания рекомбинантного белка со смолой, используемой для осуществления типовой операции захвата, может составлять, например, от приблизительно 5 секунд до приблизительно 10 минут (например, от приблизительно 10 секунд до приблизительно 8 минут, от приблизительно 10 секунд до приблизительно 7 минут, от приблизительно 10 секунд до приблизительно 6 минут, от приблизительно 10 секунд до приблизительно 5 минут, от приблизительно 30 секунд до приблизительно 5 минут, от приблизительно 1 минуты до приблизительно 5 минут, от приблизительно 10 секунд до приблизительно 4 минут, от приблизительно 30 секунд до приблизительно 4 минут, или от приблизительно 1 минуты до приблизительно 4 минут).
Как известно в этой области, для захвата рекомбинантного белка с использованием хроматографических колонок или хроматографических мембран, находящихся в MCCS или MCCS1, необходимо осуществлять последовательные хроматографические этапы нагрузки, промывания, элюции и регенерации хроматографических колонок или хроматографических мембран, находящихся в MCCS или MCCS1. Любой из примеров скоростей потока, объемов буферов и/или продолжительности времени, предназначенного для каждого последовательного хроматографического этапа, представленного в настоящем описании, можно использовать на одном или нескольких из этих разных последовательных хроматографических этапов (например, одном или нескольких из последовательных хроматографических этапов нагрузки, промывания, элюции и регенерации хроматографических колонок или хроматографических мембран, находящихся в MCCS или MCCS1, используемых для захвата рекомбинантного белка). Неограничивающие примеры скоростей потока, объемов буфера и/или продолжительности времени, предназначенного для каждого последовательного хроматографического этапа, который можно использовать для захвата хроматографических колонок и/или хроматографических мембран в MCCS или MCCS1 (например, PCCS или PCCS1), представлены ниже. Кроме того, примеры буферов, которые можно использовать в MCCS и/или MCCS1, описаны ниже.
MCCS или MCCS1, включающие по меньшей мере одну хроматографическую колонку и/или хроматографическую мембрану, включающую смолу, посредством которой можно осуществлять типовую операцию захвата (например, любую из примеров смол, которые можно использовать для захвата, представленных в настоящем описании) можно нагружать жидкой средой для культивирования, включающей рекомбинантный белок с использованием любой из нагрузочных скоростей потока (скоростей фидинга), описываемых выше. В некоторых примерах отдельную хроматографическую колонку или отдельную хроматографическую мембрану, включающую смолу, посредством которой можно осуществлять типовую операцию захвата, нагружают в течение, например, от приблизительно 10 минут до приблизительно 90 минут (например, от приблизительно 15 минут до приблизительно 90 минут, от приблизительно 20 минут и 80 минут, от приблизительно 30 минут и 80 минут, от приблизительно 40 минут до приблизительно 80 минут, от приблизительно 50 минут до приблизительно 80 минут и от приблизительно 60 минут и 80 минут). В некоторых примерах, где MCCS или MCCS1 включает по меньшей мере две хроматографические колонки, включающие смолу, посредством которой можно осуществлять типовую операцию захвата в серии, время, необходимое для нагрузки двух из хроматографических колонок в серии составляет, например, от приблизительно 50 минут до приблизительно 180 минут (например, от приблизительно 60 минут до приблизительно 180 минут, от приблизительно 70 минут до приблизительно 180 минут, от приблизительно 80 минут до приблизительно 180 минут, от приблизительно 90 минут до приблизительно 180 минут, от приблизительно 100 минут до приблизительно 180 минут, от приблизительно 110 минут до 150 минут и от приблизительно 125 минут до приблизительно 145 минут).
После нагрузки рекомбинантного белка по меньшей мере на одну хроматографическую колонку или хроматографическую мембрану в MCCS или MCCS1, включающую смолу, посредством которой можно осуществлять типовую операцию захвата, по меньшей мере одну хроматографическую колонку или хроматографическую мембрану промывают по меньшей мере одним промывочным буфером. Как известно в этой области, по меньшей мере один (например, два, три или четыре) промывочный буфер предназначен для элюции всех или большинства белков, не являющихся рекомбинантным белком, из по меньшей мере одной хроматографической колонки или хроматографической мембраны, в то же время не мешая взаимодействию рекомбинантного белка со смолой.
Промывочный буфер можно пропускать через по меньшей мере одну хроматографическую колонку или хроматографическую мембрану при скорости потока от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем используемого промывочного буфера (например, комбинированный общий объем используемого промывочного буфера при использовании нескольких промывочных буферов) может представлять собой, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 15-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, от приблизительно 1-кратного CV до приблизительно 13-кратного CV, от приблизительно 1-кратного CV до приблизительно 12-кратного CV, от приблизительно 1-кратного CV до приблизительно 11-кратного CV, от приблизительно 2-кратного CV до приблизительно 11-кратного CV, от приблизительно 3-кратного CV до приблизительно 11-кратного CV, от приблизительно 4-кратного CV до приблизительно 11-кратного CV, от приблизительно 5-кратного CV до приблизительно 11-кратного CV или от приблизительно 5-кратного CV до приблизительно 10-кратного CV). Общее время промывания может составлять, например, от приблизительно 2 минут до приблизительно 3 часов (например, от приблизительно 2 минут до приблизительно 2,5 часов, от приблизительно 2 минут до приблизительно 2,0 часов, от приблизительно 5 минут до приблизительно 1,5 часов, от приблизительно 10 минут до приблизительно 1,5 часов, от приблизительно 10 минут до приблизительно 1,25 часов, от приблизительно 20 минут до приблизительно 1,25 часов или от приблизительно 30 минут до приблизительно 1 часа).
После промывания по меньшей мере одной хроматографической колонки или хроматографической мембраны в MCCS или MCCS1, включающей смолу, посредством которой можно осуществлять типовую операцию захвата, рекомбинантный белок элюируют из по меньшей мере одной хроматографической колонки или хроматографической мембраны, пропуская элюирующий буфер по меньшей мере через одну хроматографическую колонку или хроматографическую мембрану в MCCS или MCCS1, включающей смолу, посредством которой можно осуществлять типовую операцию захвата. Элюирующий буфер можно пропускать по меньшей мере через одну хроматографическую колонку или хроматографическую мембрану, включающую смолу, посредством которой можно осуществлять типовую операцию захвата при скорости потока от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 6,0 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 5,0 мг/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем элюирующего буфера, используемого для элюции рекомбинантного белка из каждой из по меньшей мере одной хроматографической колонки или хроматографической мембраны, включающей смолу, посредством которой можно осуществлять типовую операцию очистки, можно представлять собой, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 15-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, приблизительно 1-кратного CV до приблизительно 13-кратного CV, приблизительно 1-кратного CV до приблизительно 12-кратного CV, приблизительно 1-кратного CV до приблизительно 11-кратного CV, приблизительно 2-кратного CV до приблизительно 11-кратного CV, приблизительно 3-кратного CV до приблизительно 11-кратного CV, приблизительно 4-кратного CV до приблизительно 11-кратного CV, приблизительно 5-кратного CV до приблизительно 11-кратного CV, или приблизительно 5-кратного CV до приблизительно 10-кратного CV). Общее время элюции может составлять, например, от приблизительно 2 минут до приблизительно 3 часов (например, от приблизительно 2 минут до приблизительно 2,5 часов, от приблизительно 2 минут до приблизительно 2,0 часов, от приблизительно 2 минут до приблизительно 1,5 часов, от приблизительно 2 минут до приблизительно 1,5 часов, от приблизительно 2 минут до приблизительно 1,25 часов, от приблизительно 2 минут до приблизительно 1,25 часов, от приблизительно 2 минут до приблизительно 1 часа, от приблизительно 2 минут до приблизительно 40 минут, от приблизительно 10 минут до приблизительно 40 минут или от приблизительно 20 минут до приблизительно 40 минут). Неограничивающие примеры элюирующих буферов, которые можно использовать в этих способах, будут зависеть от механизма захвата и/или рекомбинантного белка. Например, элюирующий буфер может включать различные концентрации солей (например, повышенную концентрацию соли), разный pH (например, повышенную или пониженную концентрацию соли) или молекулу, которая будет конкурировать с рекомбинантным белком за связывание со смолой, посредством которой можно осуществлять типовую операцию захвата. Примеры таких элюирующих буферов для каждого примера механизма захвата, представленного в настоящем описании, хорошо известны в этой области.
После элюции рекомбинантного белка по меньшей мере из одной хроматографической колонки или хроматографической мембраны в MCCS или MCCS1, включающей смолу, посредством которой можно осуществлять типовую операцию захвата, и до следующего объема жидкую среду для культивирования можно нагружать по меньшей мере на одну хроматографическую колонку или хроматографическую мембрану, по меньшей мере одну хроматографическую колонку или хроматографическую мембрану можно уравновешивать с использованием буфера для регенерации. Буфер для регенерации можно пропускать по меньшей мере через одну хроматографическую колонку или хроматографическую мембрану, включающую смолу, посредством которой можно осуществлять типовую операцию захвата при скорости потока, например, от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 6,0 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 5,0 мг/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту, от приблизительно 5,0 мл/минуту до приблизительно 15,0 мл/минуту, или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем буфера для регенерации, используемого для уравновешивания по меньшей мере одной хроматографической колонки или хроматографической мембраны, включающей смолу, посредством которой можно осуществлять типовую операцию захвата, может составлять, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 15-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, приблизительно 1-кратного CV до приблизительно 13-кратного CV, приблизительно 1-кратного CV до приблизительно 12-кратного CV, приблизительно 1-кратного CV до приблизительно 11-кратного CV, приблизительно 2-кратного CV до приблизительно 11-кратного CV, приблизительно 3-кратного CV до приблизительно 11-кратного CV, приблизительно 2-кратного CV до приблизительно 5-кратного CV, приблизительно 4-кратного CV до приблизительно 11-кратного CV, приблизительно 5-кратного CV до приблизительно 11-кратного CV, или приблизительно 5-кратного CV до приблизительно 10-кратного CV).
В некоторых из способов, представленных в настоящем описании, MCCS или MCCS1 включает резервуар, в котором хранят жидкость, включающую рекомбинантный белок, при низком pH (например, pH ниже 4,6, ниже 4,4, ниже 4,2, ниже 4,0, ниже 3,8, ниже 3,6, ниже 3,4, ниже 3,2 или ниже 3,0) в течение, например, от приблизительно 1 минуты до 1,5 часов (например, приблизительно 1 часа), и инактивируют вирусы, присутствующие в жидкости, включающей рекомбинантный белок. Примером резервуара, который можно использовать для осуществления типовой операции инактивации вирусов, является колба для встряхивания (например, колба для встряхивания емкостью 500 мл, например, колба для встряхивания емкостью 500 мл с программируемой плитой мешалки), в которой можно хранить жидкость, включающую рекомбинантный белок, в течение, например, от приблизительно 1 минуты до 1,5 часов, например, до фидинга жидкости, включающей рекомбинантный белок, в MCCS2. Резервуар, используемый для осуществления типовой операции инактивации вирусов, может являться колбой для встряхивания емкостью 500 мл с программируемой плитой мешалки (например, плитой мешалки, программируемой для перемешивания (например, периодического перемешивания) жидкости в резервуаре, например, каждые 4 часа). Другим примером резервуара, который можно использовать для осуществления типовой операции инактивации вирусов, является пластиковый мешок (например, пластиковый мешок емкостью 500 мл), в котором можно хранить жидкость, включающую рекомбинантный белок, в течение, например, от приблизительно 1 минуты до 1,5 часов, например, до фидинга жидкости, включающей рекомбинантный белок, в MCCS2. В некоторых примерах жидкость, включающая рекомбинантный белок, уже может иметь низкий pH (например, pH ниже 4,6, ниже 4,4, ниже 4,2, ниже 4,0, ниже 3,8, ниже 3,6, ниже 3,4, ниже 3,2 или ниже 3,0) при фидинге в резервуар, используемый для осуществления типовой операции инактивации вирусов. Как известно специалистам в этой области, для осуществления типовой операции инактивации вирусов можно использовать множество других способов. Например, для осуществления типовой операции инактивации вирусов также можно использовать УФ-облучение жидкости, включающей рекомбинантный белок. Неограничивающие примеры резервуаров, которые можно использовать для осуществления типовой операции инактивации вирусов, присутствующих в жидкости, включающей рекомбинантный белок, представлены в настоящем описании.
MCCS или MCCS1 может включать PCCS, включающую четыре хроматографические колонки, где посредством по меньшей мере трех из четырех хроматографических колонок осуществляют типовую операцию захвата рекомбинантного белка из жидкой среды для культивирования (например, с использованием MCCS, включающей любую из по меньшей мере одной хроматографической колонки, включающей смолу, посредством которой можно осуществлять типовую операцию захвата (например, любой из представленных в настоящем описании)). В этих примерах посредством четвертой колонки из PCC можно осуществлять типовую операцию инактивации вирусов в жидкости, включающей рекомбинантный белок (например, любой из примеров колонок, представленных в настоящем описании, которые можно использовать для достижения инактивации вирусов в жидкости, включающей рекомбинантный белок).
В некоторых примерах жидкость, включающую рекомбинантный белок, непрерывно элюируют из MCCS1 (например, PCCS1) и непрерывно подвергают фидингу в MCCS2 (например, PCCS2). Процент рекомбинантного белка, выделенного в элюате из MCCS или MCCS1 (например, PCCS или PCCS1), может составлять, например, по меньшей мере 70%, по меньшей мере 72%, по меньшей мере 74%, по меньшей мере 76%, по меньшей мере 78%, по меньшей мере 80%, по меньшей мере 82%, по меньшей мере 84%, по меньшей мере 86%, по меньшей мере 88%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 94%, по меньшей мере 96% или по меньшей мере 98%. Элюат из MCCS1 (например, PCCS1) можно подвергать фидингу в MCCS2 (например, PCCS2) с использованием множества средств, известных в этой области (например, трубок). Элюат из MCCS1 (например, PCCS1) можно подвергать фидингу в MCCS2 (например, PCCS2) при скорости потока, например, от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 6,0 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 5,0 мг/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту, от приблизительно 5,0 мл/минуту до приблизительно 15,0 мл/минуту, от приблизительно 15 мл/минуту до приблизительно 25 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту).
Некоторые способы, представленные в настоящем описании, могут дополнительно включать этап коррекции концентрации ионов и/или pH элюата из MCCS1 (например, PCCS1) до ее фидинга в MCCS2 (например, PCCS2). Как представлено в настоящем описании, концентрация ионов и/или pH элюата из MCCS1 (например, PCCS1) можно корректировать (до ее фидинга в MCCS2), добавляя буфер в элюат (например, используя резервуар для линейной коррекции буфера). Буфер можно добавлять в элюат из MCCS1 при скорости потока, например, от приблизительно 0,1 мл/минуту до приблизительно 15 мл/минуту (например, от приблизительно 0,1 мл/минуту до приблизительно 12,5 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 10,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 8,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 6 мл/минуту, от приблизительно 0,1 мл/минуту до 4 мл/минуту или от приблизительно 0,5 мл/минуту до приблизительно 5 мл/минуту).
Способы, представленные в настоящем описании, могут дополнительно включать этап хранения (и, необязательно, также охлаждения) элюата из MCCS1 до фидинга элюата из MCCS1 в MCCS2. Как представлено в настоящем описании, этот этап хранения можно осуществлять с использованием любого из резервуаров (например, резервных баков), представленных в настоящем описании.
Способы, представленные в настоящем описании, также могут включать этап фильтрации элюата из MCCS1 до фидинга элюата в MCCS2. Для фильтрации элюата из MCCS1 до фидинга элюата в MCCS2 можно использовать любой из примеров фильтров или способов фильтрации, представленных в настоящем описании.
Тонкая очистка и очистка рекомбинантного белка
MCCS, MCCS1 и/или MCCS2 можно использовать для осуществления типовой операции очистки и тонкой очистки рекомбинантного белка. Например, MCCS2 можно использовать для осуществления операции очистки и тонкой очистки рекомбинантного белка, и элюат из MCCS2 является белковым лекарственным веществом. MCCS, MCCS1 и/или MCCS2 может включать по меньшей мере одну (например, две, три или четыре) хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, и по меньшей мере одну (например, две, три или четыре) хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка.
По меньшей мере одна хроматографическая колонка или хроматографическая мембрана, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, может включать смолу, в которой используют механизм захвата (например, любой из механизмов захвата, представленных в настоящем описании или известных в этой области), или смолу, которую можно использовать для осуществления анионообменной, катионообменной хроматографии, хроматографии с молекулярным ситом или хроматографии с гидрофобными взаимодействиями. По меньшей мере одна хроматографическая колонка или хроматографическая мембрана, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может включать смолу, которую можно использовать для осуществления анионообменной, катионообменной хроматографии, хроматографии с молекулярным ситом или хроматографии с гидрофобными взаимодействиями (например, любую из примеров смол для осуществления анионообменной, катионообменной хроматографии, хроматографии с молекулярным ситом или хроматографии с гидрофобными взаимодействиями, представленных в настоящем описании или известных в этой области).
Размер, форма и объем по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, и/или размер и форма по меньшей мере одной хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может являться любой из комбинации примеров размеров, форм и объемов хроматографических колонок или хроматографических мембран, представленных в настоящем описании. Как известно специалисту в этой области, этап очистки или тонкой очистки рекомбинантного белка, например, может включать этапы нагрузки, промывания, элюции и уравновешивания по меньшей мере одной хроматографической колонки или хроматографической мембраны, используемой для осуществления типовой операции очистки или тонкой очистки рекомбинантного белка. Как правило, элюирующий буфер, выходящий из хроматографической колонки или хроматографической мембраны, используемой для осуществления типовой операции очистки, включает рекомбинантный белок. Как правило, буфер для внесения и/или промывочный буфер, выходящий из хроматографической колонки или хроматографической мембраны, используемой для осуществления типовой операции тонкой очистки, включает рекомбинантный белок.
Например, размер по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, может иметь объем, например, от приблизительно 2,0 мл до приблизительно 200 мл (например, от приблизительно 2,0 мл до приблизительно 180 мл, от приблизительно 2,0 мл до приблизительно 160 мл, от приблизительно 2,0 мл до приблизительно 140 мл, от приблизительно 2,0 мл до приблизительно 120 мл, от приблизительно 2,0 мл до приблизительно 100 мл, от приблизительно 2,0 мл до приблизительно 80 мл, от приблизительно 2,0 мл до приблизительно 60 мл, от приблизительно 2,0 мл до приблизительно 40 мл, от приблизительно 5,0 мл до приблизительно 40 мл, от приблизительно 2,0 мл до приблизительно 30 мл, от приблизительно 5,0 мл до приблизительно 30 мл или от приблизительно 2,0 мл до приблизительно 25 мл). Скорость потока жидкости, включающей рекомбинантный белок, нагружаемой на по меньшей мере одну хроматографическую колонку или по меньшей мере одну хроматографическую мембрану, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, может составлять, например, от приблизительно 0,1 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,1 мл/минуту до приблизительно 12,5 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 10,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 8,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 6 мл/минуту, от приблизительно 0,1 мл/минуту до 4 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 3 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 2 мл/минуту или приблизительно 0,2 мл/минуту до приблизительно 4 мл/минуту). Концентрация рекомбинантного белка в жидкости, нагружаемой на по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, может составлять, например, от приблизительно 0,05 мг/мл до приблизительно 100 мг/мл рекомбинантного белка (например, от приблизительно 0,1 мг/мл до приблизительно 90 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 80 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 70 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 60 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 50 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 40 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 30 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл, от 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл рекомбинантного белка). Смола в по меньшей мере одной хроматографической колонке или хроматографической мембране, используемой для осуществления типовой операции очистки, может являться смолой, которую можно использовать для осуществления анионообменной или катионообменной хроматографии. Смола в по меньшей мере одной хроматографической колонке или хроматографической мембране, используемой для осуществления типовой операции очистки, может являться катионообменной смолой (например, смолой Capto-S, GE Healthcare Life Sciences, Piscataway, NJ).
После нагрузки рекомбинантного белка на по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, по меньшей мере одну хроматографическую колонку или хроматографическую мембрану промывают по меньшей мере одним промывочным буфером. Как известно в этой области, по меньшей мере один (например, два, три или четыре) промывочный буфер предназначен для элюции всех белков, не являющихся рекомбинантным белком, из по меньшей мере одной хроматографической колонки или хроматографической мембраны, не мешая взаимодействию рекомбинантного белка со смолой или иной элюции рекомбинантного белка.
Промывочный буфер можно пропускать через по меньшей мере одну хроматографическую колонку или хроматографическую мембрану при скорости потока от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем используемого промывочного буфера (например, комбинированного общего объема используемого промывочного буфера при использовании нескольких промывочных буферов) может составлять, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 15-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, приблизительно 1-кратного CV до приблизительно 13-кратного CV, приблизительно 1-кратного CV до приблизительно 12-кратного CV, приблизительно 1-кратного CV до приблизительно 11-кратного CV, приблизительно 2-кратного CV до приблизительно 11-кратного CV, приблизительно 3-кратного CV до приблизительно 11-кратного CV, приблизительно 4-кратного CV до приблизительно 11-кратного CV, приблизительно 2,5-кратного CV до приблизительно 5,0-кратного CV, приблизительно 5-кратного CV до приблизительно 11-кратного CV или приблизительно 5-кратного CV до приблизительно 10-кратного CV). Общее время промывания может составлять, например, от приблизительно 2 минут до приблизительно 3 часов (например, от приблизительно 2 минут до приблизительно 2,5 часов, от приблизительно 2 минут до приблизительно 2,0 часов, от приблизительно 5 минут до приблизительно 1,5 часов, от приблизительно 10 минут до приблизительно 1,5 часов, от приблизительно 10 минут до приблизительно 1,25 часов, от приблизительно 20 минут до приблизительно 1,25 часов, от приблизительно 30 минут до приблизительно 1 часа, от приблизительно 2 минут до 10 минут, от приблизительно 2 минут до 15 минут или от приблизительно 2 минут до 30 минут).
После промывания по меньшей мере одной хроматографической колонки или хроматографической мембраны, используемой для осуществления типовой операции очистки рекомбинантного белка, рекомбинантный белок элюируют из по меньшей мере одной хроматографической колонки или хроматографической мембраны, пропуская элюирующий буфер через по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, используемую для осуществления типовой операции очистки рекомбинантного белка. Элюирующий буфер можно пропускать через по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, при скорости потока от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 6,0 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 5,0 мг/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем элюирующего буфера, используемого для элюции рекомбинантного белка из каждой по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, может составлять, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 25-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 20-кратного CV, от приблизительно 15-кратного CV и приблизительно 25-кратного CV, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, приблизительно 1-кратного CV до приблизительно 13-кратного CV, приблизительно 1-кратного CV до приблизительно 12-кратного CV, приблизительно 1-кратного CV до приблизительно 11-кратного CV, приблизительно 2-кратного CV до приблизительно 11-кратного CV, приблизительно 3-кратного CV до приблизительно 11-кратного CV, приблизительно 4-кратного CV до приблизительно 11-кратного CV, приблизительно 5-кратного CV до приблизительно 11-кратного CV или приблизительно 5-кратного CV до приблизительно 10-кратного CV). Общее время элюции может составлять, например, от приблизительно 2 минут до приблизительно 3 часов (например, от приблизительно 2 минут до приблизительно 2,5 часов, от приблизительно 2 минут до приблизительно 2,0 часов, от приблизительно 2 минут до приблизительно 1,5 часов, от приблизительно 2 минут до приблизительно 1,5 часов, от приблизительно 2 минут до приблизительно 1,25 часов, от приблизительно 2 минут до приблизительно 1,25 часов, от приблизительно 2 минут до приблизительно 1 часа, от приблизительно 2 минут до приблизительно 40 минут, от приблизительно 10 минут до приблизительно 40 минут, от приблизительно 20 минут до приблизительно 40 минут или от приблизительно 30 минут до 1,0 часа). Неограничивающие примеры элюирующих буферов, которые можно использовать в этих способах, будут зависеть от смолы и/или биофизических свойств рекомбинантного белка. Например, элюирующий буфер может включать разную концентрацию соли (например, повышенную концентрацию соли), разный pH (например, повышенную или сниженную концентрацию соли) или молекулу, которая будет конкурировать с рекомбинантным белком за связывание со смолой. Примеры таких элюирующих буферов для каждого из примеров механизмов захвата, представленных в настоящем описании, хорошо известны в этой области.
После элюции рекомбинантного белка из по меньшей мере одной хроматографической колонки или хроматографической мембраны, используемой для осуществления типовой операции очистки рекомбинантного белка, и до нагрузки следующего объема жидкости, включающей рекомбинантный белок, на по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, по меньшей мере одну хроматографическую колонку или хроматографическую мембрану необходимо уравновешивать с использованием буфера для регенерации. Буфер для регенерации можно пропускать через по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, используемую для осуществления типовой операции очистки рекомбинантного белка, при скорости потока, например, от приблизительно 0,2 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 6,0 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 5,0 мг/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту, от приблизительно 5,0 мл/минуту до приблизительно 15,0 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем буфера для регенерации, используемого для уравновешивания по меньшей мере одной хроматографической колонки или хроматографической мембраны, включающей смолу, которую можно использовать для осуществления типовой операции очистки рекомбинантного белка, может составлять, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 15-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, от приблизительно 1-кратного CV до приблизительно 13-кратного CV, от приблизительно 1-кратного CV до приблизительно 12-кратного CV, от приблизительно 1-кратного CV до приблизительно 11-кратного CV, от приблизительно 2-кратного CV до приблизительно 11-кратного CV, от приблизительно 3-кратного CV до приблизительно 11-кратного CV, от приблизительно 2-кратного CV до приблизительно 5-кратного CV, от приблизительно 2,5-кратного CV до приблизительно 7,5-кратного CV, от приблизительно 4-кратного CV до приблизительно 11-кратного CV, от приблизительно 5-кратного CV до приблизительно 11-кратного CV или от приблизительно 5-кратного CV до приблизительно 10-кратного CV). Концентрация рекомбинантного белка в элюате по меньшей мере одной хроматографической колонки или хроматографической мембраны, используемой для осуществления типовой операции очистки рекомбинантного белка, может составлять, например, от приблизительно 0,05 мг/мл до приблизительно 100 мг/мл рекомбинантного белка (например, от приблизительно 0,1 мг/мл до приблизительно 90 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 80 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 70 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 60 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 50 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 40 мг/мл, от приблизительно 2,5 мг/мл до приблизительно 7,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 30 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл, от 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл рекомбинантного белка).
По меньшей мере одна хроматографическая колонка или хроматографическая мембрана, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может включать смолу, которую можно использовать для осуществления катионообменной хроматографии, анионообменной хроматографии или хроматографии с молекулярным ситом. Как известно в этой области, тонкая очистка рекомбинантного белка с использованием по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может включать, например, этапы нагрузки, вытеснения и регенерации по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка. Например, если этапы нагрузки, вытеснения и регенерации используют для осуществления тонкой очистки, рекомбинантный белок не связывается со смолой по меньшей мере в одной хроматографической колонке или хроматографической мембране, используемой для осуществления типовой операции тонкой очистки рекомбинантного белка, и рекомбинантный белок элюируют из по меньшей мере одной хроматографической колонки или хроматографической мембраны на этапах нагрузки и вытеснения, и этап регенерации используют для удаления любых примесей по меньшей мере из одной хроматографической колонки или хроматографической мембраны до нагрузки дополнительной жидкости, включающей рекомбинантный белок, на по меньшей мере одну хроматографическую колонку или хроматографическую мембрану. Примеры скоростей потока и объемов буферов, предназначенные для использования на каждом из этапов нагрузки, вытеснения и регенерации, описаны ниже.
Размер, форма и объем по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, и/или размер и форма по меньшей мере одной хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может являться любой из комбинации примеров размеров, форм и объемов хроматографических колонок или хроматографических мембран, представленных в настоящем описании. Например, размер по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может иметь объем, например, от приблизительно 0,5 мл до приблизительно 200 мл (например, от приблизительно 0,5 мл до приблизительно 180 мл, от приблизительно 0,5 мл до приблизительно 160 мл, от приблизительно 0,5 мл до приблизительно 140 мл, от приблизительно 0,5 мл до приблизительно 120 мл, от приблизительно 0,5 мл до приблизительно 100 мл, от приблизительно 0,5 мл до приблизительно 80 мл, от приблизительно 0,5 мл до приблизительно 60 мл, от приблизительно 0,5 мл до приблизительно 40 мл, от приблизительно 5,0 мл до приблизительно 40 мл, от приблизительно 0,5 мл до приблизительно 30 мл, от приблизительно 5,0 мл до приблизительно 30 мл, от приблизительно 0,5 мл до приблизительно 25 мл, от приблизительно 0,2 мл до приблизительно 10 мл или от приблизительно 0,2 мл до приблизительно 5 мл). Скорость потока жидкости, включающей рекомбинантный белок, нагружаемый на по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может составлять, например, от приблизительно 0,1 мл/минуту до приблизительно 25 мл/минуту (например, от приблизительно 0,1 мл/минуту до приблизительно 12,5 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 10,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 8,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 6 мл/минуту, от приблизительно 0,1 мл/минуту to 4 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 3 мл/минуту, от приблизительно 2 мл/минуту до приблизительно 6 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 2 мл/минуту или приблизительно 0,2 мл/минуту до приблизительно 4 мл/минуту). Общий объем жидкости, включающей рекомбинантный белок, нагружаемый на по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, может составлять, например, от приблизительно 1,0 мл до приблизительно 250 мл (например, от приблизительно 1,0 мл до приблизительно 225 мл, от приблизительно 1,0 мл до приблизительно 200 мл, от приблизительно 1,0 мл до приблизительно 175 мл, от приблизительно 1,0 мл до приблизительно 150 мл, от приблизительно 100 мл до приблизительно 125 мл, от приблизительно 100 мл до приблизительно 150 мл, от приблизительно 1,0 мл до приблизительно 150 мл, от приблизительно 1,0 мл до приблизительно 125 мл, от приблизительно 1,0 мл до приблизительно 100 мл, от приблизительно 1,0 мл до приблизительно 75 мл, от приблизительно 1,0 мл до приблизительно 50 мл или от приблизительно 1,0 мл до приблизительно 25 мл). Смола по меньшей мере в одной хроматографической колонке или хроматографической мембране, используемой для осуществления тонкой очистки, может являться анионообменной или катионообменной смолой. Смола по меньшей мере в одной хроматографической колонке или хроматографической мембране, используемой для осуществления типовой операции тонкой очистки, может являться катионообменной смолой (например, Sartobind® Q смола, Sartorius, Goettingen, Germany).
После этапа нагрузки осуществляют этап вытеснения (например, вытесняющий буфер пропускают через по меньшей мере одну хроматографическую мембрану или хроматографическую мембрану для сбора рекомбинантного белка, по существу, не связывающегося с по меньшей мере одной хроматографической колонкой или хроматографической мембраной). В этих примерах, вытесняющий буфер можно пропускать через по меньшей мере одну хроматографическую колонку или хроматографическую мембрану при скорости потока от приблизительно 0,2 мл/минуту до приблизительно 50 мл/минуту (например, от приблизительно 1 мл/минуту до приблизительно 40 мл/минуту, от приблизительно 1 мл/минуту до приблизительно 30 мл/минуту, от приблизительно 5 мл/минуту до приблизительно 45 мл/минуту, от приблизительно 10 мл/минуту до приблизительно 40 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем используемого вытесняющего буфера может составлять, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 100-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 90-кратного CV, от приблизительно 1-кратного CV до приблизительно 80-кратного CV, от приблизительно 1-кратного CV до приблизительно 70-кратного CV, от приблизительно 1-кратного CV до приблизительно 60-кратного CV, от приблизительно 1-кратного CV до приблизительно 50-кратного CV, от приблизительно 1-кратного CV до приблизительно 40-кратного CV, от приблизительно 1-кратного CV до приблизительно 30-кратного CV, от приблизительно 1-кратного CV до приблизительно 20-кратного CV, от приблизительно 1-кратного CV до приблизительно 15-кратного CV, от приблизительно 5-кратного CV до приблизительно 20-кратного CV, от приблизительно 5 -кратного CV до приблизительно 30-кратного CV, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, приблизительно 1-кратного CV до приблизительно 13-кратного CV, приблизительно 1-кратного CV до приблизительно 12-кратного CV, приблизительно 1-кратного CV до приблизительно 11-кратного CV, приблизительно 2-кратного CV до приблизительно 11-кратного CV, приблизительно 3-кратного CV до приблизительно 11-кратного CV, приблизительно 4-кратного CV до приблизительно 11-кратного CV, приблизительно 2,5-кратного CV до приблизительно 5,0-кратного CV, приблизительно 5-кратного CV до приблизительно 11-кратного CV, или приблизительно 5-кратного CV до приблизительно 10-кратного CV). Общее время вытеснения может составлять, например, от приблизительно 1 минуты до приблизительно 3 часов (например, от приблизительно 1 минуты до приблизительно 2,5 часов, от приблизительно 1 минуты до приблизительно 2,0 часов, от приблизительно 1 минуты до приблизительно 1,5 часов, от приблизительно 2 минут до приблизительно 1,5 часов, от приблизительно 1 минуты до приблизительно 1,25 часов, от приблизительно 2 минут до приблизительно 1,25 часов, от приблизительно 1 минуты до приблизительно 5 минут, от приблизительно 1 минуты до приблизительно 10 минут, от приблизительно 2 минут до приблизительно 4 минут, от приблизительно 30 минут до приблизительно 1 часа, от приблизительно 2 минут до приблизительно 10 минут, от приблизительно 2 минут до приблизительно 15 минут или от приблизительно 2 минут до приблизительно 30 минут). Комбинированная концентрация рекомбинантного белка, присутствующего в элюате, пропускаемом через колонку на этапе нагрузки и этапе вытеснения, может составлять, например, от приблизительно 0,1 мг/мл до приблизительно 100 мг/мл рекомбинантного белка (например, от приблизительно 0,1 мг/мл до приблизительно 90 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 80 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 70 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 60 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 50 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 40 мг/мл, от приблизительно 2,5 мг/мл до приблизительно 7,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 30 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл, от 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, или от приблизительно 1 мг/мл до приблизительно 5 мг/мл рекомбинантного белка).
После этапа вытеснения и до нагрузки следующего объема жидкости, включающей рекомбинантный белок, на по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции тонкой очистки, по меньшей мере одну хроматографическую колонку или хроматографическую мембрану необходимо регенерировать с использованием буфера для регенерации. Буфер для регенерации можно пропускать через по меньшей мере одну хроматографическую колонку или хроматографическую мембрану, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка, при скорости потока, например, от приблизительно 0,2 мл/минуту до приблизительно 50 мл/минуту (например, от приблизительно 1 мл/минуту до приблизительно 40 мл/минуту, от приблизительно 1 мл/минуту до приблизительно 30 мл/минуту, от приблизительно 5 мл/минуту до приблизительно 45 мл/минуту, от приблизительно 10 мл/минуту до приблизительно 40 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 20 мл/минуту, от приблизительно 0,2 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 15 мл/минуту, от приблизительно 0,5 мл/минуту до приблизительно 10 мл/минуту, от приблизительно 0,5 мл/минуту и приблизительно 14 мл/минуту, от приблизительно 1,0 мл/минуту до приблизительно 25,0 мл/минуту или от приблизительно 1,0 мл/минуту до приблизительно 15,0 мл/минуту). Объем буфера для регенерации, используемого для регенерации по меньшей мере одной хроматографической колонки или хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки, может составлять, например, от приблизительно 1-кратного объема колонки (CV) до приблизительно 500-кратного CV (например, от приблизительно 1-кратного CV до приблизительно 450-кратного CV, от приблизительно 1-кратного CV до приблизительно 400-кратного CV, от приблизительно 1-кратного CV до приблизительно 350-кратного CV, от приблизительно 1-кратного CV до приблизительно 300-кратного CV, от приблизительно 1-кратного CV до приблизительно 250-кратного CV, от приблизительно 1-кратного CV до приблизительно 200-кратного CV, от приблизительно 1-кратного CV до приблизительно 150-кратного CV, от приблизительно 1-кратного CV до приблизительно 100-кратного CV, от приблизительно 1-кратного CV до приблизительно 90-кратного CV, от приблизительно 1-кратного CV до приблизительно 80-кратного CV, от приблизительно 1-кратного CV до приблизительно 70-кратного CV, от приблизительно 1-кратного CV до приблизительно 60-кратного CV, от приблизительно 1X до приблизительно 50-кратного CV, от приблизительно 1-кратного CV до приблизительно 40-кратного CV, от приблизительно 1-кратного CV до приблизительно 30-кратного CV, от приблизительно 1-кратного CV до приблизительно 20-кратного CV, от приблизительно 1-кратного CV до приблизительно 15-кратного CV, от приблизительно 5-кратного CV до приблизительно 20-кратного CV, от приблизительно 5 -кратного CV до приблизительно 30-кратного CV, от приблизительно 1-кратного CV до приблизительно 14-кратного CV, приблизительно 1-кратного CV до приблизительно 13-кратного CV, приблизительно 1-кратного CV до приблизительно 12-кратного CV, приблизительно 1-кратного CV до приблизительно 11-кратного CV, приблизительно 2-кратного CV до приблизительно 11-кратного CV, приблизительно 3-кратного CV до приблизительно 11-кратного CV, приблизительно 4-кратного CV до приблизительно 11-кратного CV, приблизительно 2,5-кратного CV до приблизительно 5,0-кратного CV, приблизительно 5-кратного CV до приблизительно 11-кратного CV или приблизительно 5-кратного CV до приблизительно 10-кратного CV).
В других примерах одна или несколько хроматографических колонок и/или хроматографических мембран, используемых для осуществления типовой операции тонкой очистки, включают смолу, селективно связывающую или удерживающую примеси, присутствующие в жидкости, включающей рекомбинантный белок, и вместо регенерации одной или нескольких колонок и/или мембран одну или несколько колонок и/или мембран заменяют (например, заменяют по существу схожими колонками и/или мембранами) после достижения или, по существу, достижения связывающей способности смолы в одной или нескольких колонках и/или мембранах.
В некоторых примерах этих способов, представленных в настоящем описании, MCCS2 включает PCCS, включающую три хроматографические колонки и одну хроматографическую мембрану, например, где посредством трех хроматографических колонок в PCCS осуществляют типовую операцию очистки рекомбинантного белка (например, с использованием по меньшей мере одной хроматографической колонки, которую можно использовать для осуществления типовой операции очистки белка), и посредством хроматографической мембраны в PCCS осуществляют типовую операцию тонкой очистки рекомбинантного белка. В этих примерах хроматографическая мембрана в PCCS, которую можно использовать для осуществления типовой операции тонкой очистки терапевтического белка, может являться любой из примеров хроматографических мембран, представленных в настоящем описании, которые можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка. Любой из способов переключения колонок, представленных в настоящем описании, можно использовать для определения того, когда можно переключать первые три хроматографические колонки и хроматографическую мембрану в PCCS в этом примере.
Некоторые варианты осуществления этого примера могут дополнительно включать этап коррекции концентрации ионов и/или pH элюата из трех хроматографических колонок в PCCS до фидинга элюата в хроматографическую мембрану в PCCS. Как представлено в настоящем описании, концентрацию ионов и/или pH элюата из трех хроматографических колонок в PCCS можно корректировать (до его фидинга в хроматографическую мембрану в PCCS в этом примере)), добавляя буфер в элюат из трех хроматографических колонок в PCCS (например, с использованием резервуара для линейной коррекции буфера). Буфер можно добавлять в элюат при скорости потока, например, от приблизительно 0,1 мл/минуту до приблизительно 15 мл/минуту (например, от приблизительно 0,1 мл/минуту до приблизительно 12,5 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 10,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 8,0 мл/минуту, от приблизительно 0,1 мл/минуту до приблизительно 6 мл/минуту, от приблизительно 0,1 мл/минуту до 4 мл/минуту или от приблизительно 0,5 мл/минуту до приблизительно 5 мл/минуту).
Эти примеры могут дополнительно включать этап хранения элюата из трех хроматографических колонок в PCCS в этом примере до фидинга элюата в хроматографическую мембрану (хроматографическую мембрану, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка). Как представлено в настоящем описании, этот этап хранения можно осуществлять с использованием любого из резервуаров (например, резервных баков), представленных в настоящем описании.
Эти примеры также могут включать этап фильтрации элюата из хроматографической мембраны в примере системе PCCS (элюата из хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка). Любой из примеров фильтров или способов фильтрации, представленных в настоящем описании, можно использовать для фильтрации элюата из хроматографической мембраны в примере PCCS (элюата из хроматографической мембраны, которую можно использовать для осуществления типовой операции тонкой очистки рекомбинантного белка).
Как известно специалистам в этой области, очищенный рекомбинантный белок можно периодически элюировать из MCCS или MCCS2 любым из способов, представленных в настоящем описании. Например, очищенный рекомбинантный белок можно элюировать любым из способов, представленных в настоящем описании, в течение, например, от приблизительно 30 секунд до приблизительно 5 часов (например, от приблизительно 1 минуты до приблизительно 4 часов, от приблизительно 1 минуты до приблизительно 3 часов, от приблизительно 1 минуты до приблизительно 2 часов, от приблизительно 1 минуты до приблизительно 1,5 часов, от приблизительно 1 минуты до приблизительно 1 часа или от приблизительно 1 минуты до приблизительно 30 минут) с частотой, например, от приблизительно 1 минуты до приблизительно 6 часов (например, от приблизительно 1 минуты до приблизительно 5 часов, от приблизительно 1 минуты до приблизительно 4 часов, от приблизительно 1 минуты до приблизительно 3 часов, от приблизительно 1 минуты до 2 часов, от приблизительно 1 минуты до 1 часа или от приблизительно 1 минуты до 30 минут), в зависимости от, например, хроматографических колонок и/или хроматографических мембран, используемых в MCCS или MCCS1 и MCCS2.
Способы культивирования
Некоторые из способов, представленных в настоящем описании, дополнительно включают этап культивирования клеток (например, рекомбинантных клеток млекопитающих), секретирующих рекомбинантный белок в биореакторе (например, перфузионном биореакторе или биореакторе периодического действия), включающем жидкую среду для культивирования, где объем жидкой среды для культивирования, по существу не содержащей клетки (например, клетки млекопитающих), непрерывно или периодически удаляют из биореактора (например, перфузионного биореактора) и подвергают фидингу в MCCS или MCCS1. Биореактор может иметь объем, например, от приблизительно 1 л до приблизительно 10000 л (например, от приблизительно 1 л до приблизительно 50 л, от приблизительно 50 л до приблизительно 500 л, от приблизительно 500 л до приблизительно 1000 л, от 500 л до приблизительно 5000L, от приблизительно 500 л до приблизительно 10000 л, от приблизительно 5000 л до приблизительно 10000 л, от приблизительно 1 л до приблизительно 10000 л, от приблизительно 1 л до приблизительно 8000 л, от приблизительно 1 л до приблизительно 6000 л, от приблизительно 1 л до приблизительно 5000 л, от приблизительно 100 л до приблизительно 5000 л, от приблизительно 10 л до приблизительно 100 л, от приблизительно 10 л до приблизительно 4000 л, от приблизительно 10 л до приблизительно 3000 л, от приблизительно 10 л до приблизительно 2000 л или от приблизительно 10 л до приблизительно 1000 л). Количество жидкой среды для культивирования, присутствующей в биореакторе, может составлять, например, от приблизительно от приблизительно 0,5 л до приблизительно 5000 л (например, от приблизительно 0,5 л до приблизительно 25 л, от приблизительно 25 л до приблизительно 250 л, от приблизительно 250 л до приблизительно 500 л, от 250 л до приблизительно 2500 л, от приблизительно 250 л до приблизительно 5000 л, от приблизительно 2500 л до приблизительно 5000 л, от приблизительно 0,5 л до приблизительно 5000 л, от приблизительно 0,5 л до приблизительно 4000 л, от приблизительно 0,5 л до приблизительно 3000 л, от приблизительно 0,5 л до приблизительно 2,500 л, от приблизительно 50 л до приблизительно 2,500 л, от приблизительно 5 л до приблизительно 50 л, от приблизительно 5 л до приблизительно 2000 л, от приблизительно 5 л до приблизительно 1,500 л, от приблизительно 5 л до приблизительно 1000 л или от приблизительно 5 л до приблизительно 500 л). Культивирование клеток можно осуществлять, например, с использованием биореактора периодического действия или перфузионного биореактора. Неограничивающие примеры и различные аспекты культивирования клеток (например, культивирования клеток млекопитающих) описаны ниже, и их можно использовать в любой комбинации.
Клетки
Клетки, культивируемые в некоторых из способов, представленных в настоящем описании, могут являться бактериями (например, грамотрицательными бактериями), дрожжами (например, Saccharomyces cerevisiae, Pichia pastoris, Hansenula polymorpha, Kluyveromyces lactis, Schizosaccharomyces pombe, Yarrowia lipolytica или Arxula adeninivorans) или клетками млекопитающих. Клетка млекопитающего может являться клеткой, растущей в суспензии, или адгезивной клеткой. Неограничивающие примеры клеток млекопитающих, которые можно культивировать в любом из способов, представленных в настоящем описании включают: клетки яичника китайского хомяка (CHO) (например, клетки CHO DG44 или клетки CHO-K1s), Sp2.0, миеломные клетки (например, NS/0), B-клетки, гибридомные клетки, T-клетки, клетки эмбриональной почки человека (HEK) (например, HEK 293E и HEK 293F), эпителиальные клетки почки африканской зеленой мартышки (Vero) и клетки Мадин-Дарби почек собак (коккер-спаниеля) (MDCK). В некоторых примерах, в которых культивируют адгезивные клетки, культура также может включать множество микроносителей (например, микроносителей, включающих одну или несколько пор). Дополнительные клетки млекопитающих, которые можно культивировать в любом из способов, представленных в настоящем описании, известны в этой области.
Клетка млекопитающего может включать рекомбинантную нуклеиновую кислоту (например, нуклеиновую кислоту, стабильно встроенную в геном клетки млекопитающего), кодирующую рекомбинантный белок (например, рекомбинантный белок). Неограничивающие примеры рекомбинантных нуклеиновых кислот, кодирующих примеры рекомбинантных белков, описаны ниже, т.е. рекомбинантные белки, которые можно получать способами, представленными в настоящем описании. В некоторых случаях клетку млекопитающего, культивируемую в биореакторе (например, любом из биореакторов, представленных в настоящем описании), получали из более крупной культуру.
Нуклеиновую кислоту, кодирующую рекомбинантный белок, можно встраивать в клетку млекопитающего с использованием широкого спектра способов, известных в молекулярной биологии и молекулярной генетике. Неограничивающие примеры включают трансфекцию (например, липофекцию), трансдукцию (например, лентивирусную, аденовирусную или ретровирусную инфекцию) и электропорацию. В некоторых случаях нуклеиновую кислоту, кодирующую рекомбинантный белок, не встраивают стабильно в хромосому клетки млекопитающего (транзиторная трансфекция), в то время как в других нуклеиновую кислоту встраивают. Альтернативно или дополнительно, нуклеиновая кислота, кодирующая рекомбинантный белок, может присутствовать в плазмиде и/или в искусственной хромосоме млекопитающего (например, искусственной хромосоме человека). Альтернативно или дополнительно, нуклеиновую кислоту можно встраивать в клетку с использованием вирусного вектора (например, лентивирусного, ретровирусного или аденовирусного вектора). Нуклеиновая кислота может являться функционально связанной с последовательностью промотора (например, сильного промотора, такого как промотор β-актина и промотор CMV, или индуцибельного промотора). Вектор, включающий нуклеиновую кислоту, при желании, также может включать селективный маркер (например, ген, придающий клетке млекопитающего резистентность к гигромицину, пуромицину или неомицину).
В некоторых случаях рекомбинантный белок является секретируемым белком и высвобождается клеткой млекопитающего во внеклеточную среду (например, первую и/или вторую жидкую среду для культивирования). Например, последовательность нуклеиновой кислоты, кодирующая растворимый рекомбинантный белок, может включать последовательность, кодирующую секреторный сигнальный пептид на N- или C-конце рекомбинантного белка, расщепляемого ферментом, присутствующим в клетке млекопитающего, и затем высвобождающегося во внеклеточную среду (например, первую и/или вторую жидкую среду для культивирования).
Среды для культивирования
Жидкие среды для культивирования известны в этой области. Жидкие среды для культивирования (например, первую и/или вторую среду для культивирования ткани) можно дополнять сывороткой млекопитающего (например, эмбриональной телячьей сывороткой и бычьей сывороткой) и/или гормоном роста или фактором роста (например, инсулином, трансферрином и эпидермальным фактором роста). Альтернативно или дополнительно, жидкие среды для культивирования (например, первая и/или вторая жидкая среда для культивирования) могут являться химически определенной жидкой средой для культивирования, жидкой средой для культивирования, не содержащей компонент животного происхождения, жидкой средой для культивирования, не содержащей сыворотку, или жидкой средой для культивирования, содержащей сыворотку. Неограничивающие примеры химически определенных жидких сред для культивирования, жидких сред для культивирования, не содержащих компонент животного происхождения, жидких сред для культивирования, не содержащих сыворотку, и жидких сред для культивирования, содержащей сыворотку, являются коммерчески доступными.
Жидкая среда для культивирования, как правило, включает источник энергии (например, углевод, такой как глюкоза), незаменимые аминокислоты (например, основной набор из двадцати аминокислот и цистеин), витамины и/или другие органические соединения, необходимые в низких концентрациях, свободные жирные кислоты и/или микроэлементы. Жидкие среды для культивирования (например, первую и/или вторую жидкую среду для культивирования), при желании, можно дополнять, например, гормоном или фактором роста млекопитающего (например, инсулином, трансферрином или эпидермальным фактором роста), солями и буферами (например, солями кальция, магния и фосфатными солями), нуклеозидами и основаниями (например, аденозином, тимидином и гипоксантином), гидролизатами белка и ткани и/или любой комбинацией этих добавок.
В этой области известен широкий спектр различных жидких сред для культивирования, которые можно использовать для культивирования клеток (например, клеток млекопитающих) в любом из способов, представленных в настоящем описании. Компоненты сред, которые также могут являться применимыми в способах по настоящему изобретению, включают, в качестве неограничивающих примеров, химически определенные (CD) гидролизаты, например, CD пептон, CD полипептиды (две или более аминокислот) и CD факторы роста. Дополнительные примеры жидкой среды для культивирования ткани и компоненты среды известны в этой области.
Специалистам в этой области будет понятно, что первая жидкая среда для культивирования и вторая жидкая среда для культивирования, представленные в настоящем описании, могут являться одним типом или разными средами.
Дополнительные признаки примеров биореакторов
Внутренняя поверхность любого из биореакторов, представленных в настоящем описании, может иметь по меньшей мере одно покрытие (например, по меньшей мере одно покрытие из желатина, коллагена, поли-L-орнитина, полистирола и ламинина), и, как известно в этой области, одно или несколько отверстий для барботирования O2, CO2 и N2в жидкую среду для культивирования, и механизм перемешивания для перемешивания жидкой среды для культивирования. В биореакторе можно инкубировать культуру клеток в контролируемой влажной атмосфере (например, при влажности выше 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% или влажности 100%). Биореактор также можно оборудовать механическим устройством, с помощью которого можно удалять объем жидкой среды для культивирования из биореактора, и, необязательно, фильтром в механическом устройстве, с помощью которого удаляют клетки из жидкой среды для культивирования при переносе жидкой среды для культивирования из биореактора (например, системы ATF или системы фильтрации клеток, описываемые в предварительной патентной заявке США № 61/878502).
Температура
Этап культивирования клеток млекопитающих можно осуществлять при температуре от приблизительно 31°C до приблизительно 40°C. Специалистам в этой области будет понятно, что температуру можно менять в конкретные моменты времени на этапе культивирования, например, ежечасно или ежедневно. Например, температуру можно менять (например, повышать или снижать) через приблизительно один день, два дня, три дня, четыре дня, пять дней, шесть дней, семь дней, восемь дней, девять дней, десять дней, одиннадцать дней, двенадцать дней, четырнадцать дней, пятнадцать дней, шестнадцать дней, семнадцать дней, восемнадцать дней, девятнадцать дней, или приблизительно двадцать дней или более после исходного посева клеток (например, клеток млекопитающего) в биореактор. Например, температуру можно повышать (например, изменять на до или приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или на до или приблизительно 20°C). Например, температуру можно снижать (например, изменять на до или приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или на до или приблизительно 20°C).
CO2
Этап культивирования, представленный в настоящем описании, может дополнительно включать подвергание жидкой среды для культивирования в биореакторе воздействию атмосферы, включая по большей части или приблизительно 15% CO2 (например, по большей части или приблизительно 14% CO2, 12% CO2, 10% CO2, 8% CO2, 6% CO2, 5% CO2, 4% CO2, 3% CO2, 2% CO2 или по большей части или приблизительно 1% CO2).
Перфузионный биореактор
Этап культивирования, представленный в настоящем описании, можно осуществлять с использованием перфузионного биореактора. Культивирование клеток (например, клеток млекопитающего) в перфузионном биореакторе включает удаление из биореактора первого объема первой жидкой среды для культивирования (например, включающей любую концентрацию клеток млекопитающих, например, первого объема первой жидкой среды для культивирования, по существу, не содержащей клетки) и добавления в первую жидкую среду для культивирования второго объема второй жидкой среды для культивирования. Удаление и добавление можно осуществлять одновременно или последовательно или комбинировать их. Кроме того, можно непрерывно осуществлять удаление и добавление (например, при скорости, при которой удаляют и заменяют объем от 0,1% до 800% (например, от 1% до 700%, от 1% до 600%, от 1% до 500%, от 1% до 400%, от 1% до 350%, от 1% до 300%, от 1% до 250%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% или от 4% до 30%) объема биореактора или объема первой жидкой среды для культивирования в течение любого указанного периода времени (например, в течение периода 24 часов, в течение инкрементального периода времени от приблизительно 1 часа до приблизительно 24 часов или в течение инкрементального периода времени более 24 часов)) или периодически (например, раз в три дня, через день, ежедневно, дважды в сутки, трижды в сутки, четыре раза в сутки или пять раз в сутки), или в любой их комбинации. При периодическом осуществлении удаляемый или заменяемый объем (например, в течение приблизительно периода 24 часов, в течение инкрементального периода времени от приблизительно 1 часа до приблизительно 24 часов или в течение инкрементального периода времени более 24 часов) может составлять, например, от 0,1% до 800% (например, от 1% до 700%, от 1% до 600%, от 1% до 500%, от 1% до 400%, от 1% до 300%, от 1% до 200%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% или от 4% до 30%) объема биореактора или объема первой жидкой среды для культивирования. Удаляемый первый объем первой жидкой среда для культивирования и добавляемый второй объем второй жидкой среды для культивирования в некоторых случаях можно поддерживать приблизительно одинаковыми в течение каждого периода 24 часов (или, альтернативно, инкрементального периода времени от приблизительно 1 часа до приблизительно 24 часов или инкрементального периода времени более 24 часов) в течение всего или части периода культивирования. Как известно в этой области, можно варьировать скорость, с которой удаляют первый объем первой жидкой среды для культивирования (объем/единицу времени), и скорость, с которой добавляют второй объем второй жидкой среды для культивирования (объем/единицу времени). Скорость, с которой удаляют первый объем первой жидкой среды для культивирования (объем/единицу времени), и скорость, с которой добавляют второй объем второй жидкой среды для культивирования (объем/единицу времени), могут являться приблизительно одинаковыми или могут отличаться.
Альтернативно, удаляемый и добавляемый объем можно менять (например, постепенно повышать) в течение каждого периода 24 часов (или, альтернативно, инкрементального периода времени от 1 часа до приблизительно 24 часов или инкрементального периода времени более 24 часов) в течение периода культивирования. Например, удаляемый объем первой жидкой среды для культивирования и добавляемый объем второй жидкой среды для культивирования в течение каждого периода 24 часов (или, альтернативно, инкрементального периода времени от приблизительно 1 часа до более 24 часов или инкрементального периода времени более 24 часов) в течение периода культивирования можно повышать (например, постепенно или с неравномерными приращениями) в течение периода культивирования из объема, составляющего от 0,5% до приблизительно 20% объема биореактора, или объема первой жидкой среды для культивирования до от приблизительно 25% до приблизительно 150% объема биореактор или объема первой жидкой среды для культивирования.
Специалистам в этой области будет понятно, что первая жидкая среда для культивирования и вторая жидкая среда для культивирования, могут являться одним типом сред. В других случаях первая жидкая среда для культивирования и вторая жидкая среда для культивирования могут отличаться.
Первый объем первой жидкой среды для культивирования можно удалять, например, с помощью механической системы, с помощью которой можно удалять первый объем первой жидкой среды для культивирования из биореактора (например, первый объем первой жидкой среды для культивирования, по существу не содержащей клетки из биореактора). Альтернативно или дополнительно, первый объем первой жидкой среды для культивирования можно удалять с помощью фильтрования или гравитационного течения первого объема первой жидкой среды для культивирования через стерильную мембрану с отсечкой по молекулярной массе, исключающей клетки (например, клетки млекопитающего).
Второй объем второй жидкой среды для культивирования можно добавлять в первую жидкую среду для культивирования в автоматическом режиме, например, с помощью перфузионного насоса.
В некоторых случаях, удаление первого объема первой жидкой среды для культивирования (например, первого объема первой жидкой среды для культивирования, по существу, не содержащей клетки млекопитающих) и добавление в первую жидкую среду для культивирования второго объема второй жидкой среды для культивирования не происходит в течение по меньшей мере 1 часа (например, в течение 2 часов, в течение 3 часов, в течение 4 часов, в течение 5 часов, в течение 6 часов, в течение 7 часов, в течение 8 часов, в течение 9 часов, в течение 10 часов, в течение 12 часов, в течение 14 часов, в течение 16 часов, в течение 18 часов, в течение 24 часов, в течение 36 часов, в течение 48 часов, в течение 72 часов, в течение 96 часов или через 96 часов) после посева клеток млекопитающего в биореактор.
Биореактор периодического действия
Этап культивирования, представленный в настоящем описании, можно осуществлять с использованием биореактора периодического действия. Культивирование клеток в биореакторе периодического действия включает, в течение большей части периода культивирования, добавление (например, периодическое или непрерывное добавление) в первую жидкую среду для культивирования второго объема второй жидкой среды для культивирования. Можно непрерывно осуществлять добавление второй жидкой среды для культивирования (например, со скоростью добавления объема от 0,1% до 300% (например, от 1% до 250%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% или от 4% до 30%) объема биореактора или объема первой жидкой среды для культивирования в течение любого указанного периода времени (например, в течение периода 24 часов, в течение инкрементального периода времени от приблизительно 1 часа до приблизительно 24 часов или в течение инкрементального периода времени более 24 часов)) или периодически (например, раз в три дня, через день, ежедневно, дважды в сутки, трижды в сутки, четыре раза в сутки или пять раз в сутки), или при любой их комбинация. При периодическом осуществлении добавляемый объем (например, в течение приблизительно периода 24 часов, в течение инкрементального периода времени от приблизительно 1 часа до приблизительно 24 часов или в течение инкрементального периода времени более 24 часов) может составлять, например, от 0,1% до 300% (например, от 1% до 200%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% или от 4% до 30%) объема биореактора или объема первой жидкой среды для культивирования. Добавляемый второй объем второй жидкой среды для культивирования в некоторых случаях можно поддерживать приблизительно одинаковым в течение каждого периода 24 часов (или, альтернативно, инкрементального периода времени от приблизительно 1 часа до приблизительно 24 часов или инкрементального периода времени более 24 часов) в течение всего или части периода культивирования. Как известно в этой области, скорость, с которой добавляют второй объем второй жидкой среды для культивирования (объем/единицу времени), можно варьировать в течение всего или части периода культивирования. Например, добавляемый объем второй жидкой среды для культивирования можно изменять (например, постепенно повышать) в течение каждого периода 24 часов (или альтернативно, инкрементального периода времени от 1 часа до приблизительно 24 часов или инкрементального периода времени более 24 часов) в течение периода культивирования. Например, добавляемый объем второй жидкой среды для культивирования в течение каждого периода 24 часов (или альтернативно, инкрементального периода времени от приблизительно 1 часа до более 24 часов или инкрементального периода времени более 24 часов) в течение периода культивирования можно повышать (например, постепенно или с неравными приращениями) в течение периода культивирования от объема, составляющего от 0,5% до приблизительно 20% объема биореактора или объема первой жидкой среды для культивирования, до от приблизительно 25% до приблизительно 150% объема биореактора или объема первой жидкой среды для культивирования. Скорость, с которой добавляют второй объем второй жидкой среды для культивирования, (объем/единицу времени) может являться приблизительно одинаковой в течение всего или части периода культивирования.
Специалистам в этой области будет понятно, что первая жидкая среда для культивирования и вторая жидкая среда для культивирования могут являться одним типом сред. В других случаях первая жидкая среда для культивирования и вторая жидкая среда для культивирования могут отличаться. Объем второй жидкой среды для культивирования можно добавлять в первую жидкую среду для культивирования в автоматизированном режиме, например, с помощью перфузионного насоса.
В некоторых случаях, добавление в первую жидкую среду для культивирования второго объема второй жидкой среды для культивирования не осуществляют в течение по меньшей мере 1 часа (например, в течение 2 часов, в течение 3 часов, в течение 4 часов, в течение 5 часов, в течение 6 часов, в течение 7 часов, в течение 8 часов, в течение 9 часов, в течение 10 часов, в течение 12 часов, в течение 14 часов, в течение 16 часов, в течение 18 часов, в течение 24 часов, в течение 36 часов, в течение 48 часов, в течение 72 часов, в течение 96 часов или через 96 часов) после посева клеток млекопитающего в биореактор. Среду для культивирования клеток в периодических культурах, как правило, собирают в конце периода культивирования и используют в любом из способов, представленных в настоящем описании, однако среду для культивирования клеток в периодических культурах также можно собирать в один или несколько моментов времени в течение периода культивирования и использовать в любом из способов, представленных в настоящем описании.
Специалистам в этой области будет понятно, что для осуществления эти способов можно использовать любой из различных параметров культивирования (например, контейнеры, объемы, скорости или частоты замены объемов культур, частоты перемешивания, температуры, среды и концентрации CO2) в любой комбинации. Кроме того, для получения рекомбинантного белка можно использовать любые из клеток млекопитающих, представленных в настоящем описании или известных в этой области.
Примеры биологических систем производства
Примеры биологических систем производства, применимых для осуществления способов, представленных в настоящем описании и включающих MCCS или MCCS1 и MCCS2, описывают в предварительных патентных заявках США №№ 61/775060 и 61/856390 (включенных в качестве ссылок). В этих примерах систем в MCCS или MCCS1 и/или MCCS2 присутствует по меньшей мере одна (например, по меньшей мере две, три, четыре, пять или шесть) наполненная хроматографическая колонка со сниженной бионагрузкой, представленная в настоящем описании. Например, целая система может включать всего две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать или двадцать наполненных хроматографических колонок со сниженной бионагрузкой, представленных в настоящем описании. Например, MCCS, MCCS1 и/или MCCS2 может включать (или каждая может включать) одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять наполненных хроматографических колонок со сниженной бионагрузкой, представленных в настоящем описании.
Например, применимые системы могут включать MCCS1, включающую впускное отверстие, и MCCS2, включающую выпускное отверстие, или MCCS, включающую впускное отверстие и выпускное отверстие. В некоторых вариантах осуществления MCCS1 и MCCS2 имеют между собой гидравлическое соединение. Эти системы также можно конфигурировать таким образом, что жидкость может поступать во впускное отверстие, через MCCS1 и MCCS2 и выходить из системы производства через выпускное отверстие. Эти системы обеспечивают непрерывное и быстрое получение терапевтического лекарственного вещества из жидкой среды для культивирования. Например, период времени между фидингом жидкости (например, жидкой среды для культивирования), включающей терапевтический белок, в MCCS1 и элюцией очищенного рекомбинантного белка (например, терапевтического белкового лекарственного вещества) из выпускного отверстия MCCS2 может составлять, например, от приблизительно 4 часов до приблизительно 48 часов, включительно.
Некоторые примеры систем не включают бак. В других система может включать максимум 1, 2, 3, 4 или 5 баков во всей системе (например, где в каждом баке хранят терапевтический белок всего в течение общего периода времени, например, от приблизительно 5 минут до приблизительно 6 часов, включительно). Баки могут иметь емкость, составляющую от 1 мл до приблизительно 300 мл, включительно. Любые баки, расположенные в системе таким образом, что жидкость поступает в баки перед поступлением в MCCS1 или MCCS, могут иметь емкость, составляющую от 1 мл до приблизительно 100% включительно нагрузочного объема первой колонки MCCS1 или MCCS, соответственно. Любые баки, расположенные в системе таким образом, что жидкость поступает в баки перед поступлением в MCCS2 (и после выхода из MCCS1), могут иметь емкость, составляющую, например, от 1 мл до приблизительно 100%включительно нагрузочного объема первой колонки MCCS2.
Дополнительные примеры структур и признаков системы
MCCS или MCCS1 может включать впускное отверстие, через которое жидкость (например, жидкая среда для культивирования, по существу не содержащей клетки) может поступать в MCCS или MCCS1, соответственно. Впускное отверстие может являться любой структурой, известной в этой области для таких целей. Оно может включать, например, резьбу, ребра жесткости или уплотняющую манжету, позволяющие вставлять жидкостный трубопровод, таким образом, что после вставки жидкостного трубопровода во впускное отверстие жидкость будет поступать в MCCS или MCCS1 через впускное отверстие без значительной утечки жидкости из впускного отверстия. Неограничивающие примеры впускных отверстий, которые можно использовать в системах по настоящему изобретению, известны и понятны специалистам в этой области.
MCCS или MCCS1 может включать по меньшей мере две хроматографические колонки, по меньшей мере две хроматографические мембраны, или по меньшей мере одну хроматографическую колонку и по меньшей мере одну хроматографическую мембрану и впускное отверстие. MCCS или MCCS1 может являться любой из примеров MCCS, представленных в настоящем описании, или иметь один или несколько из любых примеров признаков MCCS (в любой комбинации), представленных в настоящем описании. Хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS или MCCS1, могут иметь одну или несколько из любых примеров форм, размеров, объемов (объемов слоев) и/или типовых операций, представленных в настоящем описании.
Хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS или MCCS1 могут включать одну или несколько из любых примеров смол, представленных в настоящем описании или известных в этой области. Например, смола, включенная в одну или несколько хроматографических колонок и/или хроматографических мембран, присутствующих в MCCS или MCCS1, может являться смолой, в которой используют механизм захвата (например, механизм захвата со связыванием протеина A, протеин G-связывающий механизм захвата, механизм захвата со связыванием антитела или фрагмента антитела, механизм захвата со связыванием субстрата, механизм захвата со связыванием кофактора, механизм захвата со связыванием аптамера и/или механизм захвата со связыванием метки). Смола, включенная в одну или несколько хроматографических колонок и/или хроматографических мембран MCCS или MCCS1, может являться катионообменной смолой, анионообменной смолой, смолой с молекулярным ситом, или смолой для хроматографии с гидрофобными взаимодействиями, или любой их комбинацией. Дополнительные примеры смол, которые можно использовать для очистки рекомбинантного белка, известны в этой области, и их можно включать в одну или несколько хроматографических колонок и/или хроматографических мембран, присутствующих в MCCS или MCCS1. Хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS или MCCS1, могут включать одинаковые и/или разные смолы (например, любую из смол, представленных в настоящем описании или известных в этой области для применения в очистке рекомбинантного белка).
Посредством двух или более хроматографических колонок и/или хроматографических смол, присутствующих в MCCS или MCCS1, можно осуществлять одну или несколько типовых операций (например, захват рекомбинантного белка, очистку рекомбинантного белка, тонкую очистку рекомбинантного белка, инактивацию вирусов, коррекцию концентрации ионов и/или pH жидкости, включающей рекомбинантный белок, или фильтрацию жидкости, включающей рекомбинантный белок). В неограничивающих примерах посредством MCCS или MCCS1 можно осуществлять типовые операции захвата рекомбинантного белка из жидкости (например, жидкой среды для культивирования) и инактивации вирусов, присутствующих в жидкости, включающей рекомбинантный белок. Посредством MCCS или MCCS1 можно осуществлять любые комбинации двух или более типовых операций, представленных в настоящем описании или известных в этой области.
Хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS или MCCS1, можно соединять или перемещать относительно друг друга с помощью механизма переключения (например, механизма переключения колонок). MCCS или MCCS1 также может включать один или несколько (например, два, три, четыре или пять) насосов (например, автоматизированных, например, автоматизированных перистальтических насосов). Переключение колонок может запускать определение уровня рекомбинантного белка, определяемого посредством поглощения УФ, соответствующего конкретному уровню рекомбинантного белка в жидкости, пропускаемой через MCCS или MCCS1 (например, входящей жидкости и/или элюате из одной или нескольких хроматографических колонок и/или хроматографических мембран в MCCS или MCCS1), конкретного объема жидкости (например, буфера) или конкретного периода времени. Переключение колонок, как правило, означает механизм, посредством которого по меньшей мере двум разным хроматографическим колонкам и/или хроматографическим мембранам в MCCS или MCCS1 (например, двум или более разным хроматографическим колонкам и/или хроматографическим мембранам, присутствующим в MCCS1 или MCCS2) позволяют проходить через разные этапы (например, уравновешивания, нагрузки, элюции или промывания) за, по существу, одинаковое время в течение осуществления, по меньшей мере, части способа.
MCCS или MCCS1 может являться системой периодической противоточной хроматографии (PCCS). Например, PCCS, являющаяся MCCS или MCCS1 (т.е. PCCS или PCCS1, соответственно), может включать четыре хроматографические колонки, где посредством первых трех колонок осуществляют типовую операцию захвата рекомбинантного белка из жидкости (например, жидкой среды для культивирования) и посредством четвертой колонки PCCS осуществляют типовую операцию инактивации вирусов в жидкости, включающей рекомбинантный белок. В PCCS, являющейся MCCS или MCCS1, можно использовать механизм переключения колонок. В системе PCC можно использовать модифицированную систему ÄKTA (GE Healthcare, Piscataway, NJ), в которой можно использовать до, например, четырех, пяти, шести, семи или восьми колонки или более.
MCCS или MCCS1 можно оборудовать: одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) УФ-мониторами, одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) клапанами, одним или несколько (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) pH-метрами, и/или одним или несколько (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) кондуктометрами. MCCS или MCCS1 также можно оборудовать операционной системой, в которой используют программное обеспечение (например, программное обеспечение на основе Unicorn, GE Healthcare, Piscataway, NJ) для определения того, когда должно происходить переключение колонок (например, в зависимости от поглощения УФ, объема жидкости или периода времени), и влияния на переключение колонок (запуска).
MCCS или MCCS1 могут дополнительно включать один или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два, двадцать три или двадцать четыре) резервуара для линейной коррекции буфера и/или резервуара для буфера. В других примерах MCCS или MCCS1 могут включать один или несколько (например, два, три, четыре, пять или шесть) баков, в которых можно хранить жидкость, которая не может быстро поступать в одну или несколько хроматографических колонок и/или хроматографических мембран в MCCS или MCCS1. Системы, представленные в настоящем описании, могут включать один или несколько баков (например, бак, представленный в настоящем описании) в MCCS, MCCS1 и/или MCCS2. Другие примеры систем, представленных в настоящем описании, не включают бак в MCCS, MCCS1 или MCCS2 или не включают бак в целой системе. Другие примеры систем, представленных в настоящем описании, включают максимум один, два, три, четыре или пять баков (например, любые баки, представленные в настоящем описании) в целой системе.
Вторая MCCS
Вторая MCCS (MCCS2) в примерах систем включает по меньшей мере две хроматографические колонки, по меньшей мере две хроматографические мембраны, или по меньшей мере одну из хроматографических колонок, и по меньшей мере одну из хроматографических мембран и выпускное отверстие. MCCS2 может являться любой из примеров MCCS, представленных в настоящем описании, или может иметь один или несколько из любых примеров признаков MCCS (в любой комбинации), представленной в настоящем описании. Хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS2, могут иметь одно или несколько из: любых форм, размеров, объемов (объемов слоев) и/или типовых операций, представленных в настоящем описании. Хроматографические колонки и/или хроматографические мембраны могут включать любую из примеров смол, представленных в настоящем описании или известных в этой области. Например, смола, включенная в одну или несколько из хроматографических колонок и/или хроматографических мембран, присутствующих в MCCS2, может являться смолой, в которой используют механизм захвата (например, механизм захвата со связыванием протеина A, протеин G-связывающий механизм захвата, механизм захвата со связыванием антитела или фрагмента антитела, механизм захвата со связыванием субстрата, механизм захвата со связыванием кофактора, механизм захвата со связыванием метки и/или механизм захвата со связыванием аптамера). Применимые смолы включают, например, катионообменную смолу, анионообменную смолу, смолу с молекулярным ситом и смолу для хроматографии с гидрофобными взаимодействиями. Дополнительные примеры смол известны в этой области. Хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS2, могут включать одинаковые и/или разные смолы (например, любые из смол, представленных в настоящем описании или известных в этой области для применения в очистке рекомбинантного белка).
Посредством хроматографических колонок и/или хроматографических мембран, присутствующих в MCCS2, можно осуществлять одну или несколько типовых операций (например, любую из типовых операций, представленных в настоящем описании, или любую комбинацию типовых операций, представленных в настоящем описании). В неограничивающих примерах посредством MCCS2 можно осуществлять типовые операции очистки рекомбинантного белка из жидкости и тонкой очистки рекомбинантного белка, присутствующей в жидкости, включающей рекомбинантный белок. В других неограничивающих примерах посредством MCCS2 можно осуществлять типовые операции очистки рекомбинантного белка, присутствующего в жидкости, тонкой очистки рекомбинантного белка, присутствующего в жидкости, и фильтрации жидкости, включающей рекомбинантный белок. В другом примере посредством MCCS2 можно осуществлять типовые операции очистки рекомбинантного белка, присутствующего в жидкости, тонкой очистки рекомбинантного белка, присутствующего в жидкости, фильтрации жидкости, включающей рекомбинантный белок, и коррекции концентрации ионов и/или pH жидкости, включающей рекомбинантный белок. Посредством MCCS2 можно осуществлять любую комбинацию двух или более типовых операций, представленных в настоящем описании или известных в этой области.
Хроматографические колонки и/или хроматографические мембраны, присутствующие в MCCS2, можно соединять или перемещать относительно друг друга посредством механизма переключения (например, механизма переключения колонок). MCCS2 также может включать один или несколько (например, два, три, четыре или пять) насосов (например, автоматизированных, например, автоматизированных перистальтических насосов). Переключение колонок может запускать определение уровня рекомбинантного белка, определяемого по поглощению УФ, соответствующему конкретному уровню рекомбинантного белка в жидкости, пропускаемой через MCCS2 (например, входящей жидкости и/или элюате из одной или нескольких хроматографических колонок и/или хроматографических мембран в MCCS2), конкретного объема жидкости (например, буфера) или конкретного периода времени.
MCCS2 может являться системой периодической противоточной хроматографии (т.е. PCCS2). Например, PCCS2 может включать три колонки, посредством которых осуществляют типовую операцию очистки рекомбинантного белка из жидкости, и хроматографическую мембрану, посредством которой осуществляют типовую операцию тонкой очистки рекомбинантного белка, присутствующего в жидкости. Например, три колонки, посредством которых осуществляют типовую операцию очистки рекомбинантного белка из жидкости, могут включать, например, катионообменную смолу, и хроматографическая мембрана, посредством которой осуществляют типовую операцию тонкой очистки, может включать катионообменную смолу. В PCCS2 можно использовать механизм переключения колонок. В PCCS2 можно использовать модифицированную систему ÄKTA (GE Healthcare, Piscataway, NJ), в которой можно использовать до, например, четырех, пяти, шести, семи или восьми колонок, или более.
MCCS2 можно оборудовать: одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) УФ-мониторами, одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) клапанами, одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) pH-метрами и/или одним или несколькими (например, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью) кондуктометрами. MCCS2 также можно оборудовать операционной системой, в которой используют программное обеспечение (например, программное обеспечение на основе Unicorn, GE Healthcare, Piscataway, NJ) для определения того, когда должно происходить переключение колонок (например, в зависимости от поглощения УФ, объема жидкости или периода времени), и влияния на переключение колонок.
MCCS2 может дополнительно включать один или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два, двадцать три или двадцать четыре) резервуара для линейной коррекции буфера и/или резервуара для буферов. В других примерах MCCS2 может включать один или несколько (например, два, три, четыре, пять или шесть) баков (например, любой из баков, представленных в настоящем описании), в которых можно хранить жидкость, которая не может быстро поступать в одну или несколько из хроматографических колонок и/или хроматографических мембран в MCCS2.
MCCS2 включает выпускное отверстие, через которое терапевтическое белковое лекарственное вещество может покидать систему. Выпускное отверстие может включать, например, резьбу, ребра жесткости или уплотняющую манжету, позволяющие вставлять жидкостный трубопровод, или сосуд, предназначенный для хранения очищенного рекомбинантного белка (например, терапевтического белкового лекарственного вещества). Выпускное отверстие может включать поверхность, которую можно использовать для закрытия сосуда со сниженной бионагрузкой или другого такого контейнера для хранения на выпускном отверстии, чтобы позволить очищенному рекомбинантному белку (например, терапевтическому белковому лекарственному веществу) поступать непосредственно в сосуд или контейнер для хранения со сниженной бионагрузкой. Неограничивающие примеры выпускных отверстий, которые можно использовать в системах по настоящему изобретению, известны и понятны специалистам в этой области.
Системы, представленные в настоящем описании, также могут включать жидкостный трубопровод, расположенный между MCCS1 и MCCS2. Любой из жидкостных трубопроводов, представленных в настоящем описании, может являться, например, трубкой, сделанной, например, из полиэтилена, поликарбоната или пластика. Жидкостный трубопровод, расположенный между MCCS1 и MCCS2, может дополнительно включать один или несколько из следующего в любой комбинации: один или несколько резервуаров для линейной коррекции буфера, находящихся в гидравлическом соединении с жидкостным трубопроводом и расположенных таким образом, что буфер, хранящийся в резервуарах для линейной коррекции буфера, добавляют в жидкость, присутствующую в жидкостном трубопроводе; бак (например, любой из баков, представленных в настоящем описании), находящийся в гидравлическом соединении с жидкостным трубопроводом и расположенный таким образом, что в нем можно хранить любую избыточную жидкость, присутствующую в жидкостном трубопроводе, не способную быстро поступать в MCCS2; и один или несколько фильтров, расположенных в жидкостном трубопроводе таким образом, что с помощью них можно фильтровать (например, удалять бактерии) жидкость, присутствующую в жидкостном трубопроводе. Любой из резервуаров для линейной коррекции буфера может включать, например, объем от приблизительно 0,5 л до 50 л буфера (например, при температуре 25°C, 15°C или 10°C или ниже).
Системы, представленные в настоящем описании, необязательно, могут включать жидкостный трубопровод, расположенный между конечной хроматографической колонкой или хроматографической мембраной в MCCS2 и выпускным отверстием. Системы, представленные в настоящем описании, могут дополнительно включать один или несколько фильтров в гидравлическом соединении с жидкостным трубопроводом, расположенным между конечной хроматографической колонкой или хроматографической мембраной в MCCS2 и выпускным отверстием, таким образом, что посредством фильтра можно удалять, например, осажденный материал, твердые частицы или бактерии из жидкости, присутствующей в жидкостном трубопроводе, расположенном между конечной хроматографической колонкой или хроматографической мембраной в MCCS2 и выпускным отверстием.
Некоторые примеры систем, представленных в настоящем описании, также включают биореактор, находящийся в гидравлическом соединении с впускным отверстием MCCS или MCCS1. В системах по настоящему изобретению можно использовать любой из примеров биореакторов, представленных в настоящем описании или известных в этой области.
Некоторые примеры систем, представленных в настоящем описании, также включают насосную систему. Насосная система может включать одно или несколько из следующего: один или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять или десять) насосов (например, любой из насосов, представленных в настоящем описании или известных в этой области), один или несколько (например, два, три, четыре или пять) фильтров (например, любой из фильтров, представленных в настоящем описании или известных в этой области), один или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять или десять) УФ-детекторов и один или несколько (например, два, три, четыре или пять) баков (например, любой из баков, представленных в настоящем описании). Некоторые примеры систем, представленных в настоящем описании, дополнительно включают жидкостный трубопровод, расположенный между насосом и впускным отверстием MCCS или MCCS1 (например, любой из примеров жидкостных трубопроводов, представленных в настоящем описании или известных в этой области). В некоторых примерах этот конкретный жидкостный трубопровод может включать один или несколько (например, два, три или четыре) насосов (например, любой из насосов, представленных в настоящем описании или известных в этой области) и/или один или несколько (например, два, три или четыре) баков (например, любой из примеров баков, представленных в настоящем описании), где эти насосы и/или баки находятся в гидравлическом соединении с жидкостью, присутствующей в жидкостном трубопроводе.
Некоторые примеры систем, представленных в настоящем описании, дополнительно включают дополнительный жидкостный трубопровод, соединенный с жидкостным трубопроводом между насосом и впускным отверстием, где один конец дополнительного жидкостного трубопровода находится в гидравлическом соединении с биореактором, и другой конец находится в гидравлическом соединении с жидкостным трубопроводом между насосом и впускным отверстием. Этот дополнительный жидкостной трубопровод может включать фильтр, посредством которого можно удалять клетки из жидкой среды для культивирования, удаляемой из биореактора (например, системы удержания клеток ATF).
Системы, представленные в настоящем описании, делают возможным непрерывное получение очищенного рекомбинантного белка (например, терапевтического белкового лекарственного вещества). Как известно в этой области, системы могут обеспечивать периодическую элюцию очищенного рекомбинантного белка (например, терапевтического белкового лекарственного вещества). Системы, представленные в настоящем описании, также могут приводить к чистому выходу очищенного рекомбинантного белка (например, терапевтического белкового лекарственного вещества) по меньшей мере приблизительно 5 г/день, по меньшей мере приблизительно 10 г/день, по меньшей мере приблизительно 15 г/день, по меньшей мере приблизительно 20 г/день, по меньшей мере приблизительно 30 г/день или по меньшей мере приблизительно 40 г/день в течение непрерывного периода по меньшей мере приблизительно 5 дней, по меньшей мере приблизительно 10 дней, по меньшей мере приблизительно 15 дней, по меньшей мере приблизительно 20 дней, по меньшей мере приблизительно 25 дней, по меньшей мере приблизительно 30 дней, по меньшей мере приблизительно 40 дней, по меньшей мере приблизительно 50 дней, по меньшей мере приблизительно 60 дней, по меньшей мере приблизительно 70 дней, по меньшей мере приблизительно 80 дней, по меньшей мере приблизительно 90 дней или по меньшей мере приблизительно 100 дней.
Способы снижения бионагрузки хроматографической смолы, включающие применение, по существу, сухой хроматографической смолы
Настоящее изобретение также относится к способам снижения бионагрузки хроматографической смолы, включающим (a) подвергание контейнера, содержащего, по существу, сухую хроматографическую смолу, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и хроматографической смолы. Некоторые варианты осуществления этих способов дополнительно включают перед этапом (a) сушку хроматографической смолы для удаления жидкости из хроматографической смолы. Сушку хроматографической смолы можно осуществлять с использованием термической обработки (например, печи) или эксикатора. Дополнительные способы сушки хроматографической смолы известны в этой области.
В этих способах можно использовать любые из условий и доз гамма-облучения, представленных в настоящем описании. Например, доза гамма-облучения может составлять от приблизительно 15 кГр до приблизительно 45 кГр (например, от приблизительно 20 кГр до приблизительно 30 кГр). В этих способах можно использовать любой из контейнеров и хроматографических смол, представленных в настоящем описании. Например, контейнер может являться сосудом для хранения или хроматографической колонкой. Хроматографическая смола в этих способах может включать белковый лиганд (например, протеин A или протеин G). В некоторых примерах, хроматографическая смола может включать анионообменную хроматографическую смолу (например, хроматографическую смолу, включающую N-бензил-N-метил-этаноламиногруппы). В некоторых примерах хроматографическую смолу ковалентно присоединяют к поверхности предмета (например, чипа, мембраны или кассеты). В некоторых вариантах осуществления, по существу, сухая хроматографическая смола не содержит значительное количество антиоксиданта или значительное количество хелатирующего средства. Также настоящее изобретение относится к хроматографическим смолам со сниженной бионагрузкой, получаемым любым из способов, представленных в настоящем описании.
В некоторых примерах получаемая хроматографическая смола со сниженной бионагрузкой имеет уровень гарантии стерильности (SAL) от приблизительно 1×10-8 до приблизительно 1×10-5 (например, SAL от приблизительно 1×10-7 до приблизительно 1×10-6). Получаемая хроматографическая смола со сниженной бионагрузкой может включать по меньшей мере одну смолу, выбранную из группы, состоящей из: анионообменной хроматографической смолы, катионообменной хроматографической смолы, аффинной хроматографической смолы, смолы для хроматографии с гидрофобными взаимодействиями и эксклюзионной хроматографической смолы. В некоторых примерах получаемая хроматографическая смола со сниженной бионагрузкой включает аффинную хроматографическую смолу, содержащую белковый лиганд (например, протеин A). В некоторых примерах получаемая хроматографическая смола со сниженной бионагрузкой включает анионообменную хроматографическую смолу (например, анионообменную хроматографическую смолу, включающую N-бензил-N-метил-этаноламиногруппы). Также настоящее изобретение относится к способам получения наполненной хроматографической колонки со сниженной бионагрузкой, включающим получение хроматографической смолы со сниженной бионагрузкой, получаемой любым из способов, представленных в настоящем описании; и наполнение хроматографической смолой колонки со сниженной бионагрузкой в асептических условиях. Также настоящее изобретение относится к наполненным хроматографическим колонкам со сниженной бионагрузкой, получаемым любым из способов, представленных в настоящем описании.
Также настоящее изобретение относится к интегрированным, замкнутым и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим: (a) получение жидкой среды для культивирования, включающей рекомбинантный белок, по существу, не содержащей клетки; и (b) непрерывный фидинг жидкой среды для культивирования в многоколоночную систему хроматографии (MCCS), включающую по меньшей мере одну наполненную хроматографическую колонку со сниженной бионагрузкой, получаемую любым из способов, представленных в настоящем описании; где в способе используют буфер со сниженной бионагрузкой, способ является интегрированным, и его осуществляют непрерывно от жидкой среды для культивирования до элюата из MCCS являющегося очищенным рекомбинантным белком. Также настоящее изобретение относится к интегрированным, замкнутым и непрерывным способам производства очищенного рекомбинантного белка со сниженной бионагрузкой, включающим: (a) получение жидкой среды для культивирования, включающей рекомбинантный белок, по существу не содержащей клетки; (b) непрерывный фидинг жидкой среды для культивирования в первую многоколоночную систему хроматографии (MCCS1); (c) захват рекомбинантного белка в жидкой среде для культивирования с использованием MCCS1; (d) получение элюата из MCCS1, включающего рекомбинантный белок, и непрерывный фидинг элюата во вторую многоколоночную систему хроматографии (MCCS2); (e) непрерывный фидинг рекомбинантного белка из элюата в MCCS2 и последующую элюцию рекомбинантного белка, чтобы, таким образом, получать очищенный рекомбинантный белок, где: в способе используют буфер со сниженной бионагрузкой, способ является интегрированным, и его осуществляют непрерывно от жидкой среды для культивирования до очищенного рекомбинантного белка, и по меньшей мере одна колонка в MCCS1 и/или MCCS2 включает наполненную хроматографическую колонку со сниженной бионагрузкой, получаемую любым из способов, представленных в настоящем описании. В этих способах можно использовать любые из примеров аспектов интегрированных, замкнутых и непрерывных способов производства очищенного рекомбинантного белка со сниженной бионагрузкой, представленного в настоящем описании.
Способы получения мембран, смол, материалов с покрытием, чипов и кассет со сниженной бионагрузкой
Настоящее изобретение также относится к способам получения мембраны, смолы, материала с покрытием, чипа или кассеты со сниженной бионагрузкой, включающим: подвергание контейнера, включающего композицию, включающую мембрану, смолу, материал с покрытием, чип или кассету (например, мембрану, смолу, материал с покрытием, чип или кассету на основе целлюлозы, агарозы или сахара) и по меньшей мере один антиоксидант и/или хелатирующее средство, воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и мембраны, смолы, материала с покрытием, чипа или кассеты, где по меньшей мере один антиоксидант и/или хелатирующее средство присутствует в количестве, достаточном для улучшения повреждения мембраны, смолы, материала с покрытием, чипа и кассеты после воздействия дозы гамма-излучения. В некоторых примерах кассета является содержащей смолу кассетой (например, любой из примеров смол, представленных в настоящем описании или известных в этой области). В некоторых вариантах осуществления мембрана, смола, материал с покрытием, чип или кассета включает лиганд протеин A или протеин G, ковалентно присоединенный к по меньшей мере одной или части ее поверхности. В некоторых вариантах осуществления композиция включает мембрану, смолу, материал с покрытием, чип или кассету и жидкость, включающую по меньшей мере один антиоксидант и/или по меньшей мере одно хелатирующее средство. В любом из этих способов можно использовать любую из примеров комбинаций и концентраций антиоксидантов и/или хелатирующих средств, представленных в настоящем описании. В любом из этих способов можно использовать любую из примеров жидкостей, представленных в настоящем описании. В некоторых вариантах осуществления композиция является сухим материалом. Настоящее изобретение также относится к мембране, смоле, материалом с покрытием, чипом или кассетой со сниженной бионагрузкой, получаемым любым из способов, представленных в настоящем описании. В некоторых примерах контейнер является запаянным контейнером или сосудом для хранения.
Настоящее изобретение также относится к способам получения мембраны, смолы, материала с покрытием, чипа и кассеты со сниженной бионагрузкой, включающим: подвергание контейнера, включающего, по существу, сухую мембрану, смолу, материал с покрытием, чип или кассету (например, мембрану, смолу, материал с покрытием, чип или кассету на основе целлюлозы, агарозы или сахара) воздействию дозы гамма-излучения, достаточной для снижения бионагрузки контейнера и мембраны, смолы, материала с покрытием, чипа или кассеты. Некоторые примеры дополнительно включают этап сушки мембраны, смолы, материала с покрытием, чипа или кассеты до этапа воздействия. В некоторых вариантах осуществления мембрана, смола, материал с покрытием, чип или кассета включает лиганд протеин A или протеин G, ковалентно присоединенный к ее поверхности. В некоторых примерах кассета является содержащей смолу кассетой (например, любую из примеров смол, представленных в настоящем описании или известных в этой области). Настоящее изобретение также относится к мембране, смоле, материалу с покрытием, чипу или кассете со сниженной бионагрузкой, получаемым любым из способов, представленных в настоящем описании.
Изобретение дополнительно описано в следующих примерах, не ограничивающих объем изобретения, описываемый в формуле изобретения.
ПРИМЕРЫ
Пример 1. Эффект гамма-облучения в отношении способности различных хроматографических смол к статическому связыванию
Осуществляли ряд экспериментов для тестирования эффекта гамма-облучения в отношении способности к статическому связыванию трех разных смол для аффинной хроматографии с протеином A: GE Mab Select SuReTM (сильно перекрестно-сшитой агарозной смолы, имеющей размер частиц 85 мкм и функциональные эпоксигруппы, соединяющие протеин A с агарозой), JSR LifeSciences Amsphere ProA JWT203 (пористой полиметакрилатной смолы, имеющей размер частиц ~50 мкм и функциональные эпоксигруппы, соединяющие протеин A с полиметакрилатом) и Kaneka KanCap A (сильно перекрестно-сшитой целлюлозой, имеющей размер частиц 65-85 мкм с протеином A, соединенным с целлюлозой посредством восстановительного аминирования). Каждую из трех смол подвергали гамма-облучению в дозе 15 кГр, за исключением Mab Select SuReTM, обрабатываемой радиацией в дозе 25 кГр, и контрольный образец смолы GE Mab Select SuReTM оставляли необработанным, нагружали антителом против TGFβ (IgG4) и определяли уровень антитела против TGFβ в элюате. Гамма-облучение каждой смолы в этом примере осуществляли в 50 мМ фосфате, pH 7,0. Кривые статического связывания каждой из гамма-облученных смол и необработанной контрольной смолы представлены на фигуре 1. Эти данные свидетельствуют о том, что гамма-облучение снижает связывающую способность каждой из трех тестируемых хроматографических смол с протеином A, при этом смола JSR LifeSciences Amsphere ProA JWT203 демонстрировала наименьшее снижение связывающей способности в ответ на гамма-облучение в дозе 15 кГр.
Следующий эксперимент осуществляли для определения, приводит ли гамма-облучение смолы JSR LifeSciences Amsphere ProA JWT203 или смолы GE Mab Select SuReTM к отщеплению (и высвобождению) протеина A от хроматографической смолы. В этих экспериментах смолу JSR LifeSciences Amsphere ProA JWT203 или смолу GE Mab Select SuReTM подвергали гамма-облучению в дозе 30 кГр, а затем определяли уровень протеина A в супернатанте, измеряя поглощение при 280 нм. Данные этого эксперимента свидетельствуют о том, что после гамма-облучения из любой из этих двух тестируемых смол высвобождается мало протеина A (фигура 2).
Эти данные свидетельствуют о том, что гамма-облучение приводит к немедленному снижению связывающей способности аффинной хроматографической смолы, и что такая утрата связывающей способности не является результатом отщепления белкового лиганда от смолы.
Пример 2. Множественный эффект гамма-облучения в отношении связывающей способности смолы в течение множества циклов хроматографии
Ряд следующих экспериментов осуществляли для тестирования эффекта гамма-облучения в отношении связывающей способности хроматографической смолы в течение множества циклов хроматографии. Эти эксперименты осуществляли с использованием смолы JSR LifeSciences Amsphere ProA JWT203, т.к. эта смола демонстрировала наименьшую степень утраты связывающей способности в ответ на гамма-облучение в примере 1. Гамма-облучение каждой из смол в этом примере осуществляли в 50 мМ фосфате, pH 7,0.
Первый эксперимент осуществляли для тестирования эффекта гамма-облучения в дозе 15 кГр в отношении способности смоля JSR LifeSciences Amsphere ProA JWT203 связываться с антителом против TGFβ (IgG4) в течение множества циклов хроматографии. Необработанную смолу JSR LifeSciences Amsphere ProA JWT203 также использовали для осуществления множества циклов хроматографии в качестве положительного контроля. В конце каждого цикла смолы промывали 0,1 Н NaOH. Определяли количество антитела против TGFβ в элюате из каждого цикла. Данные свидетельствуют о том, что гамма-облучение в дозе 15 кГр приводит к немедленному снижению связывающей способности смолы JSR LifeSciences Amsphere ProA JWT203 на приблизительно 20%-25% (т.е. в первом цикле), но в течение множества дополнительных циклов хроматографии связывающая способность снижается лишь с очень медленной скоростью (т.е. со скоростью, сравнимой со скоростью снижения связывающей способности необработанной смолы) (фигуры 3, 6 и 7).
Минимальное снижение связывающей способности гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203 после исходного цикла хроматографии также очевидно из сравнения хроматограмм в цикле 7 и цикле 11 в этих экспериментах (фигуры 4 и 5). На этих фигурах показано, что и в случае необработанной, и в случае гамма-облученной в дозе 15 кГр смолы JSR LifeSciences Amsphere ProA JWT203 наблюдали лишь умеренное, если это и имело место, изменение связывающей способности этих смол в течение множества циклов хроматографии.
Дополнительные эксперименты осуществляли для тестирования изменения связывающей способности смолы JSR LifeSciences Amsphere ProA JWT203, необработанной или подвергнутой гамма-облучению в дозе 29 кГр в течение множества циклов хроматографии. В этих экспериментах смолы промывали 0,1 Н NaOH в конце каждого цикла и в начале каждого цикла смолы нагружали моноклональным антителом против αβTCR (IgG1). Полученные данные снова демонстрировали исходное снижение связывающей способности гамма-облученной в дозе 29 кГр смолы на приблизительно 20%-25% по сравнению с необработанной смолой (фигура 8). Связывающая способность необработанной и гамма-облученной в дозе 29 кГр смолы лишь умеренно снижалась в течение множества дополнительных циклов хроматографии (приблизительно с одинаковой скоростью в случае необработанной и гамма-облученной в дозе 29 кГр смолы) (фигура 8).
Ряд конечных экспериментов осуществляли для тестирования связывающей способности необработанной, гамма-облученной в дозе 15 кГр и гамма-облученной в дозе 29 кГр смолы JSR LifeSciences Amsphere ProA JWT203 в течение множества циклов хроматографии. В конце каждого цикла смолы промывали 0,1 Н NaOH и смолу нагружали моноклональным антителом против TGFβ (IgG4) или моноклональным антителом против αβTCR (IgG1) (abTCR). Данные свидетельствуют о том, что гамма-облучение в дозе 15 кГр и 29 кГр приводит к, по существу, одинаковому уровню снижения связывающей способности смолы JSR LifeSciences Amsphere ProA JWT203, и что уровень связывающей способности гамма-облученной в дозе 15 кГр и 29 кГр смолы JSR LifeSciences Amsphere ProA JWT203 умеренно снижался в течение множества циклов хроматографии с той же скоростью, что и в случае необработанной смолы (фигура 9).
Эти данные свидетельствуют о том, что гамма-облучение хроматографической смолы с белковым лигандом приводит к немедленному снижению связывающей способности, и что утрата связывающей способности остается относительно стабильной в течение множества раундов хроматографии. Эти данные позволяют предполагать, что гамма-облучение приводит к оксидативному повреждению хроматографической смолы (например, хроматографической смолы, содержащей белковый или пептидный лиганд, такой как аффинная хроматографическая смола) при гамма-облучении, и что утрата связывающей способности хроматографической смолы (например, хроматографической смолы, содержащей белковый или пептидный лиганд, такой как аффинная хроматографическая смола) при гамма-облучении можно предотвращать, улучшать или снижать посредством гамма-облучения хроматографической смолы в присутствие по меньшей мере одного хелатирующего средства и/или антиоксиданта.
Пример 3. Эффект гамма-облучения в отношении связывающей способности смолы GE Mab Select SuReTM
Ряд экспериментов осуществляли для определения эффекта гамма-облучения в отношении связывающей способности другой хроматографической смолы с белковым лигандом (смолы GE Mab Select SuReTM) в течение множества циклов хроматографии. Смолу подвергали замене буфера на 50 мМ фосфат натрия, pH 7,0, а затем подвергали гамма-облучению в дозе 29 кГр в бутыли Nalgene емкостью 30 мл. Затем смолой наполняли колонку диаметром 0,66 см с высотой слоя 3 см (колонка 1 мл). Затем эту колонку использовали для захвата моноклонального антитела IgG1 в среде для культивирования клеток в течение множества циклов хроматографии. Необработанную смолу GE Mab Select SuReTM также использовали для осуществления множества циклов хроматографии в качестве положительного контроля. В конце каждого цикла смолы промывали 0,1 Н NaOH. Определяли количество IgG1 в элюате из каждого цикла. Данные свидетельствуют о том, что гамма-облучение в дозе 29 кГр приводит к немедленному снижению связывающей способности смолы GE Mab Select SuReTM на приблизительно 25%-30% (т.е. в первом цикле) (фигуры 11 и 12). После первого цикла хроматографии гамма-облученная в дозе 29 кГр смола GE Mab Select SuReTM демонстрировала лишь очень низкую скорость снижения связывающей способности в течение множества дополнительных циклов хроматографии (т.е. скорость, сравнимую со скоростью снижения связывающей способности необработанной смолы в течение множества циклов хроматографии) (фигуры 11 и 12). Эти данные схожи с данными, полученными для смолы JSR с протеином A, описанной в примере 2, и механизм утраты связывающей способности смолы в результате гамма-облучение, по-видимому, является схожим.
Пример 4. Эффект гамма-облучения в отношении способности смолы MAb Select SuReTM LX к статическому связыванию
Данные, описываемые в примере 1, свидетельствуют о том, что гамма-облучение снижает способность к статическому связыванию трех разных хроматографических смол с протеином A (GE Mab Select SuReTM, JSR LifeSciences AmsphereTM ProA JWT203 и Kaneka KanCapATM). Гамма-облучение тестировали с другой хроматографической смолой с протеином A: GE Mab Select SuReTM LX. Смола GE Mab Select SuReTM LX имеет агарозный остов и тот же лиганд протеин A, что и смола Mab Select SuReTM, но имеет более высокую плотность лиганда по сравнению со смолой Mab Select SuReTM. Буфер смолы подвергали замене с 20% этанола на 50 мМ фосфат натрия, pH 6,0, и затем подвергали гамма-облучению в дозе 29 кГр. Статическое связывание смолы определяли, как описано в примере 1 (при этом способность к статическому связыванию смолы определяли до и после гамма-облучения). Данные свидетельствуют об аналогичном снижении способности смолы к статическому связыванию после гамма-облучения (фигура 13). Это индуцируемое гамма-облучением снижение способности смолы GE Mab Select SuReTM LX к статическому связыванию аналогично снижению способности к статическому связыванию, наблюдаемому в случае трех хроматографических смол с протеином A, тестируемых в примере 1 после гамма-облучения (фигура 1). Данные, представленные на фигуре 13, свидетельствуют о том, что гамма-облучение Mab Select SuReTM LX приводит к немедленному снижению способности смолы к статическому связыванию.
Пример 5. Снижение индуцируемого гамма-облучением снижения связывающей способности хроматографической смолы
Данные, представленные в предыдущих примерах, свидетельствуют о том, что гамма-облучение хроматографической смолы в дозе, снижающей бионагрузку смолы, также приводит к снижению связывающей способности смолы: снижению связывающей способности смолы на приблизительно 20%-40% по сравнению со связывающей способностью контрольной необработанной смолы. Степень снижения связывающей способности, вызываемого гамма-облучением, по-видимому, не зависит от лиганда протеина A, присоединенного к смоле, и/или химических свойств частиц смолы. Этот дополнительный ряд экспериментов осуществляли для идентификации буферных растворов, которые будут предотвращать утрату связывающей способности хроматографической смолы, происходящую при гамма-облучении. В этих экспериментах в качестве хроматографической смолы использовали GE Mab Select SuReTM LX. GE Mab Select SuReTM LX содержит протеин A, ковалентно иммобилизованный на пористой матрице каждой частицы. Смолу сначала подвергали замене буфера с 20% этанола на другой буфер, включающий один или несколько антиоксидантов, или контрольный буфер, не включающий какие-либо антиоксиданты. Тестируемые буферные растворы представлены в таблице 1 ниже. В контрольном эксперименте смолу подвергали гамма-облучению в виде сухой композиции в отсутствие антиоксидантов. Эти образцы смолы сушили в печи при 23°C в течение 2 дней таким образом, что при гамма-облучении минимизировали содержание воды. Каждый образец смолы, представленный в таблице 1, подвергали гамма-облучению в дозе 29 кГр в бутыли Nalgene емкостью 30 мл. Способность к статическому связыванию определяли для гамма-облученных образцов смолы и для необработанных (необлученных) образцов смолы способами, описываемыми в примере 1.
Таблица 1. Тестируемые образцы смолы GE Mab Select SuReTM LX и буферные растворы
Данные свидетельствуют о том, что гамма-облучение хроматографической смолы в присутствие одного или нескольких антиоксидантов снижало утрату связывающей способности, вызываемую гамма-облучением (фигура 14 и таблица 2). Буфер из 25 мМ аскорбата натрия, 25 мМ метионина, 25 мМ маннита, 25 мМ гистидина, 50 мМ фосфата натрия, pH 6,0 (далее обозначаемый как буфер "SMMH") полностью снижал индуцируемую гамма-облучением утрату связывающей способности смолы (т.е. не наблюдали утрату связывающей способности, наблюдаемую при сравнении необработанной контрольной смолы и смолы, подвергнутой гамма-облучению в дозе 29 кГр в присутствие буфера SMMH) (фигура 14 и таблица 2). Гамма-облученный в дозе 29 кГр высушенный образец смолы имел ту же связывающую способность, что необработанный образец смолы. Эти данные свидетельствуют о том, что гамма-облучение сухой хроматографической смолы является другим способом снижения степени индуцируемой гамма-облучением утраты связывающей способности смолы.
Таблица 2. Специфическая связывающая способность тестируемых образцов смолы GE Mab Select SuReTM LX
Осуществляли дополнительный эксперимент для тестирования свойств смолы, гамма-облученной в дозе 29 кГр в присутствие буфера SMMH, и необработанной смолы в течение множества циклов хроматографии. Каждой тестируемой смолой наполняли колонку диаметром 0,66 см и высотой 3 см. Колонки нагружали средой для культивирования клеток, содержащей моноклональное антитело IgG1. Как наблюдали в экспериментах, посвященных способности к статическому связыванию (фигура 14), способность к динамическому связыванию являлась сравнимой для необработанной смолы и смолы, гамма-облученной в дозе 29 кГр в присутствие буфера SMMH во всех циклах (фигуры 15 и 16). Кроме того, другие критические показатели качества и способа также являлись сравнимыми: процентная доля высокомолекулярных веществ, измеряемых с помощью эксклюзионной высокоэффективной жидкостной хроматографии (SEC-ВЭЖХ), и концентрация белка клетки-хозяина (HCP) в элюате (таблица 3). Фигура 17 представляет собой полиакриламидный гель после неденатурирующего электрофореза с додецилсульфатом натрия, на котором показана сравнимая чистота элюата в течение множества циклов с использованием необработанной смолы и смолы, гамма-облученной в дозе 29 кГр в присутствие буфера SMMH.
Таблица 3. Процентная доля высокомолекулярных веществ и белка клетки-хозяина в элюате необработанной смолы GE Mab Select SuReTM LX и смолы GE Mab Select SuReTM LX, гамма-облученной в присутствие буфера SMMH
Процентную долю высокомолекулярных веществ измеряли с помощью эксклюзионной высокоэффективной жидкостной хроматографии (SEC-ВЭЖХ) с использованием колонки Tosoh G3000 SWxl и концентрацию белка клетки-хозяина измеряли с использованием анализа ELISA.
Дополнительные буферные растворы тестировали на их способность снижать индуцируемую гамма-облучением утрату связывающей способности хроматографической смолы. В этих экспериментах осуществляли единственный цикл хроматографии для определения связывающей способности в динамическом режиме. Для каждого тестируемого буфера колонку, аналогичную описываемой выше (диаметр 0,66 см, высота 3 см), наполняли и нагружали средой для культивирования клеток, содержащей моноклональное IgG1. Как наблюдали в экспериментах, посвященных способности к статическому связыванию (фигура 14), каждый буфер, содержащий по меньшей мере один антиоксидант, снижал утрату связывающей способности смолы, вызываемую гамма-облучением (таблица 4). Эти данные свидетельствуют о том, что наличие по меньшей мере одного антиоксиданта может снижать утрату связывающей способности смолы, вызываемую гамма-облучением. Кроме того, эти данные также позволяют предполагать, что хелатирующие средства (связывающие и предотвращающие образование редокс-активными металлами активных форм кислорода и азота) также будут способны снижать утрату связывающей способности смолы, вызываемую гамма-облучением.
Таблица 4. Данные одного цикла хроматографии на смоле GE MabSelect SuRe LX (необработанной и подвергнутой облучению в дозе 29 кГр в присутствие или отсутствие гасителей) с культурой клеток, содержащей IgG1
В целом, эти данные позволяют предполагать, что гамма-облучение хроматографической смолы в присутствии по меньшей мере одного антиоксиданта и/или по меньшей мере одного хелатирующего средства может снижать утрату связывающей способности смолы, вызываемую гамма-облучением. Эти данные также позволяют предполагать, что наличие по меньшей мере одного антиоксиданта и/или по меньшей мере одного хелатирующего средства защищает иммобилизованный лиганд протеин A, а также основную матрицу смолы от повреждения, вызываемого свободными радикалами, образовавшимися при гамма-облучении. Наличие по меньшей мере одного антиоксиданта и/или по меньшей мере одного хелатирующего средства также можно использовать в другом биотехнологическом применении, включающем гамма-облучение материала в дозе, которая может вызывать повреждение матрицы и/или функциональных групп. Например, композиции, содержащие по меньшей мере один антиоксидант и/или по меньшей мере одно хелатирующее средство, можно использовать для предотвращения индуцируемого гамма-облучением повреждения целлюлозных мембран и других смол, мембран или материалов на основе целлюлозы, агарозы или сахара.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Следует понимать, что, хотя изобретение описано в комбинации с подробным описанием, изложенное выше описание предназначено для иллюстрирования, а не ограничения объема изобретения, определяемого объемом формулы изобретения. Другие аспекты, преимущества и модификации входят в объем представленной ниже формулы изобретения.
Реферат
Изобретение относится к способу снижения бионагрузки аффинной хроматографической смолы, включающему подвергание контейнера, включающего композицию, содержащую аффинную хроматографическую смолу и по меньшей мере один антиоксидант, воздействию дозы гамма-излучения между приблизительно 15 кГр и приблизительно 45 кГр, где по меньшей мере один антиоксидант присутствует в количестве, достаточном для снижения утраты связывающей способности хроматографической смолы после воздействия дозы гамма-излучения. Также настоящее изобретение относится к композиции, включающей хроматографическую смолу и по меньшей мере один антиоксидант. 2 н. и 34 з.п. ф-лы, 11 ил., 4 табл., 5 пр.

Комментарии