Способ очистки cys-связанных конъюгатов антитело-лекарственное средство - RU2680404C2
Код документа: RU2680404C2
Чертежи
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способ очистки смеси цистеин (Cys)-связанных конъюгатов антитело-лекарственное средство (ADC), в частности, смеси, которая содержит неконъюгированное антитело в количестве 10-40% по массе.
Такие Cys-связанные ADC могут играть важную роль в новых способах лечения рака. Следовательно, разработка способа очистки смеси Cys-связанных ADC в промышленном (препаративном) масштабе имеет большое значение для будущего коммерческого успеха таких ADC.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
В последние годы десятки ADC были приняты в доклинические и клинические разработки и два ADC были одобрены для продажи в последние пару лет. За исключением последних разработок по конъюгации линкер-лекарственных средств с (моноклональными) антителами (mAb), лекарственное средство, входящее в состав большинства ADC, участвующих в (пред)клинических исследованиях, и двух присутствующих в настоящее время на рынке ADC, присоединяют к антителу либо через N-атом остатка лизина, либо через S-атом остатка цистеина. Коммерческий продукт Kadcyla®, или адо-трастузумаба эмтансин (Roche/Genentech ImmunoGen), является примером лизин-связанного ADC, а Adcetris®, или брентуксимаба ведотин (Seattle Genetics/Takeda Millennium), является примером цистеин-связанного ADC. Одним из ADC, участвующих в настоящее время в (пред)клинических исследованиях, является цистеин-связанный ADC формулы (II), приведенной ниже, который содержит лекарственное средство дуокармицин, конъюгированное с трастузумабом через остаток цистеина.
Дуокармицины, впервые выделенные из культурального бульона видов Streptomyces, являются членами семейства противоопухолевых антибиотиков, которые включают дуокармицин A, дуокармицин SA и CC-1065. Биологическая активность этих чрезвычайно активных средств, по всей вероятности, обусловлена их способностью последовательность-специфически алкилировать ДНК по положению N3 аденина, присутствующего в малой бороздке, что инициирует каскад событий, заканчивающихся запуском механизма апоптотической гибели клеток.
Чтобы получить Cys-связанные ADC, антитело обычно частично восстанавливают, чтобы превратить одну или несколько межцепочечных дисульфидных связей в два или более свободных остатков цистеина. Тиольные или сульфгидрильные (SH) группы свободных остатков цистеина затем последовательно конъюгируют с молекулой линкер-лекарственное средство с получением Cys-связанного ADC. Как правило, данный процесс конъюгации дает случайную, гетерогенную смесь антител, нагруженных 0, 2, 4, 6 и 8 молекулами линкер-лекарственное средство. Чем ниже среднее отношение лекарственного средства к антителу (DAR), тем выше количество неконъюгированного антитела (DAR0) в реакционной смеси.
Известно, что нагрузка лекарственного средства оказывает влияние на противоопухолевую активность ADC, как описано, например, в K.J. Hamblett et al. in Clinical Cancer Research 10 (2004) 7063-7070. Нагрузка также влияет на CMC- (химия, производство и контроль) свойства, такие как агрегация.
WO2011/133039 тех же авторов, что и настоящая заявка, раскрывает ряд новых аналогов ДНК-алкилирующего средства CC-1065 и полученных на их основе конъюгатов антитело-лекарственное средство (ADC). В примере 15 описан способ получения ряда конъюгатов трастузумаб-дуокармицин с использованием 1,1-молярных эквивалентов восстановителя с получением 2 свободных тиольных групп на mAb. После гашения ADC очищают с помощью колонки, содержащей r-белок А, получая конъюгаты линкер-лекарственное средство со средним значением DAR примерно 2.
На предшествующем уровне техники описано применение хроматографии гидрофобного взаимодействия (HIC) в качестве стадии тонкой очистки, используемой во многих способах очистки моноклональных антител (mAb). Отмечено, что данный метод хроматографии особенно полезен для удаления агрегатов и обеспечивает хорошую очистку от других примесей, сопутствующих способу получения, таких как белок (белки) клетки-хозяина, ДНК, эндотоксины, выщелоченный белок А и эндогенные вирусы. HIC также представляет собой хорошо разработанный метод (аналитического) определения DAR и распределения нагрузки лекарственного средства в цистеин-связанных ADC (Laurent Ducry (ed.), Antibody-Drug Conjugates, Methods in Molecular Biology, 1045 (2013) 275-283). В главе 17 данной книги, под авторством Jun Ouyang, на фиг. 2, стр. 276, изображена типичная хроматограмма HIC Cys-связанного ADC (т.е. MC-VC-PABC-MMAE). Отмечено, что элюирование в градиенте уменьшающейся концентрации соли и повышающейся концентрации органического модификатора влияет на время удерживания на колонке молекул, нагруженных лекарственным средством, таким образом, что наименее гидрофобные, неконъюгированные формы (т.е. неконъюгированные антитела, DAR0), элюируются вначале, а наиболее гидрофобное антитело, нагруженное 8 молекулами линкер-лекарственное средство (DAR8), элюируется последним. Результаты, приведенные в таблице 2 на странице 279, показывают, что при средневзвешенном значении DAR 3,6 смесь Cys-связанных ADC содержит только 4,7% неконъюгированного антитела.
US4771128 описывает способ выделения и очистки конъюгатов токсинов с использованием HIC, в частности, в применении к иммуноглобулину (антителу), конъюгированному с токсическим инактивирующим рибосомы белком рицином А. Способ включает вначале удаление неконъюгированного рицина и агрегатов методом эксклюзионной хроматографии (т.е. гель-проникающей хроматографии, SEC), и затем разделение смеси конъюгатов методом гидрофобной гель-хроматографии (т.е. HIC, с использованием фенилсефарозы CL-4B в объеме 70 мл) путем элюирования растворами солей с уменьшением ионной силы. Неконъюгированный иммуноглобулин элюируется первым. И на стадии исключения по размерам, и на последующей стадии хроматографического разделения используют буфер, содержащий хлорид натрия (1 М), при скорости потока примерно 20-40 мл/ч, см. пример 1. В альтернативном варианте осуществления предлагают разделение и очистку методом хроматографии в "быстром потоке" (с использованием фенилсефарозы CL-4B и колонки диаметром 1 см, объем 3,14 мл), в котором неконъюгированный иммуноглобулин элюируется в первом объеме колонки раствором, содержащим фосфатный буфер/хлорид натрия (1,5 М), при скорости потока примерно 0,13 мл/ч, см. пример 2, а иммуноконъюгат элюируется во втором объеме колонки раствором, содержащим фосфатный буфер и 10-60 об.% органического растворителя (например, в примере 2 используют раствор, содержащий 60 об.% глицерина). Основным недостатком способов, описанных на предшествующем уровне техники, является применение органического растворителя, нежелательное и неприемлемое для способа, проводимого в промышленном масштабе.
Насколько известно заявителям, такая проблема, как масштабирование способа очистки ADC, не рассматривалась на предшествующем уровне техники.
Обзор предшествующего уровня техники со всей очевидностью демонстрирует, что существует потребность в новом способе очистки смесей Cys-связанных ADC. В частности, нужен способ очистки смесей Cys-связанных ADC со средним значением DAR примерно 2-3, которые, как правило, содержат относительно высокое количество неконъюгированных антител, иногда до 40% по массе, подходящий для проведения в промышленном препаративном масштабе и не требующий применения нескольких хроматографических стадий.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает новый способ очистки смеси цистеин-связанных конъюгатов антитело-лекарственное средство, в частности, смеси со средним значением DAR примерно 2-3, в которой количество неконъюгированных антител находится в диапазоне 10-40% по массе.
В первом аспекте настоящее изобретение предлагает способ очистки смеси цистеин-связанных конъюгатов антитело-лекарственное средство, в которой количество неконъюгированных антител находится в диапазоне 10-40% по массе, где способ включает:
a. растворение смеси в 0,2-1,5 М водном растворе соли;
b. загрузку полученного раствора на препаративную колонку для проведения хроматографии гидрофобного взаимодействия;
c. сбор проточной фракции, которая содержит неконъюгированное антитело;
d. промывание указанной колонки 0,2-1,5 М водным раствором соли с одновременным сбором проточной фракции; и
е. элюирование указанной колонки 0-100 мМ водным раствором соли с получением очищенной смеси цистеин-связанных конъюгатов антитело-лекарственное средство.
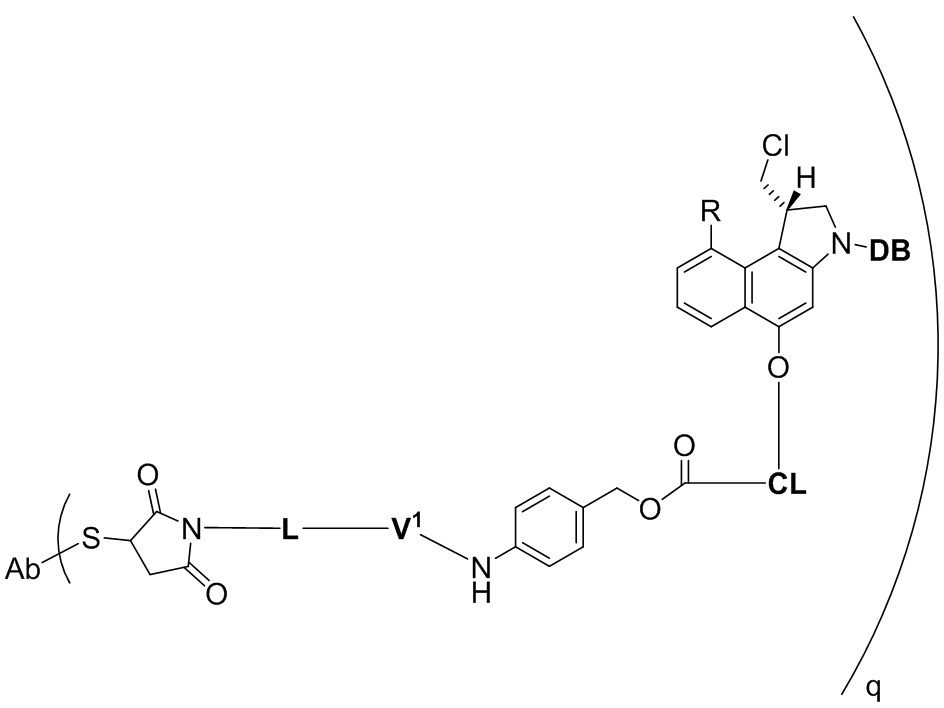
В особенно предпочтительном варианте осуществления настоящего изобретения смесь цистеин-связанных конъюгатов антитело-лекарственное средство имеет формулу (II)

где
Ab обозначает трастузумаб, а
q варьирует в диапазоне от 0 до 8.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
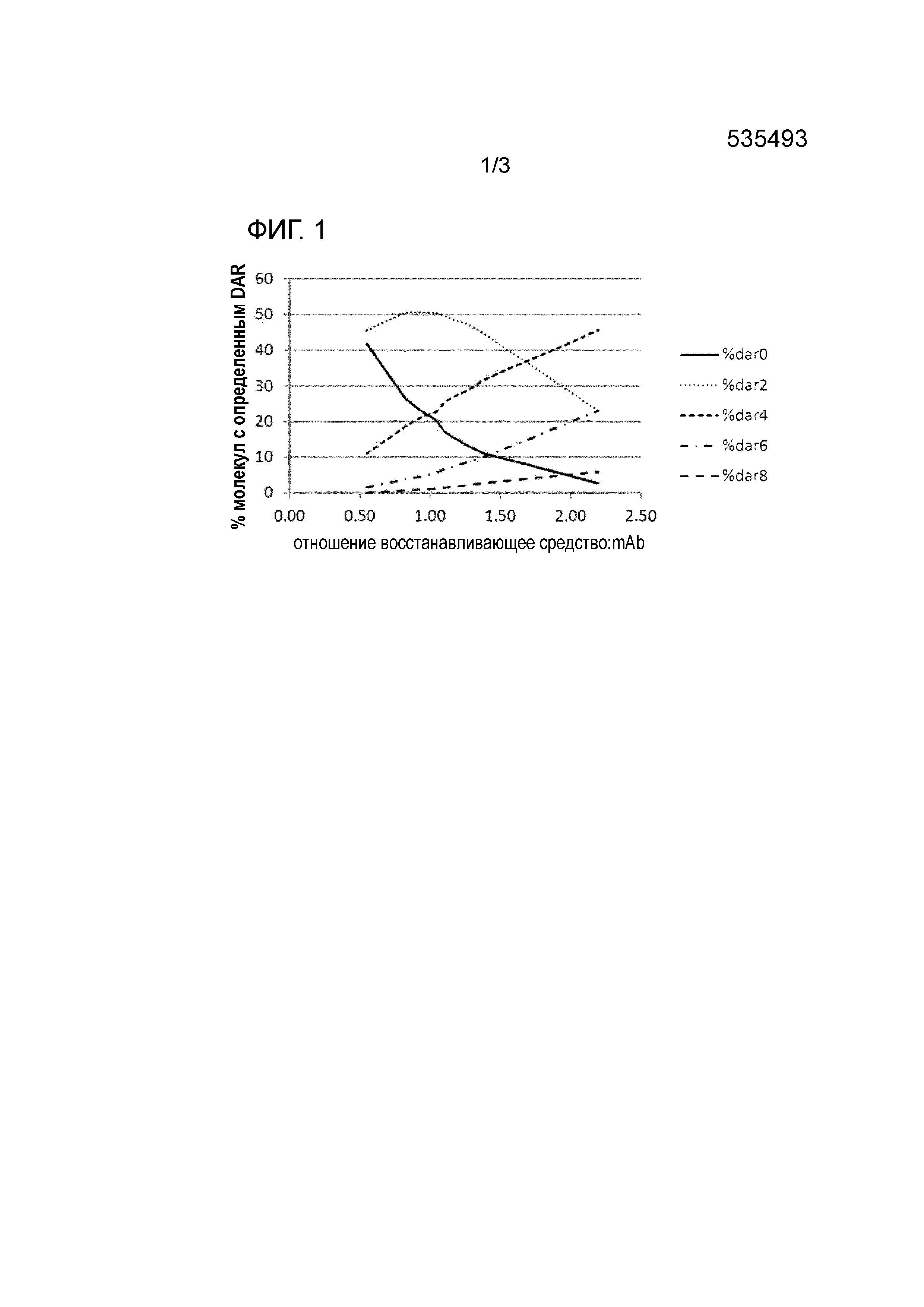
На фигуре 1 показан пример влияния количества восстанавливающего средства на распределение молекул DAR. При использовании 1,0 эквивалента восстанавливающего средства процент неконъюгированного антитела трастузумаба DAR0 составляет примерно 20% по массе.
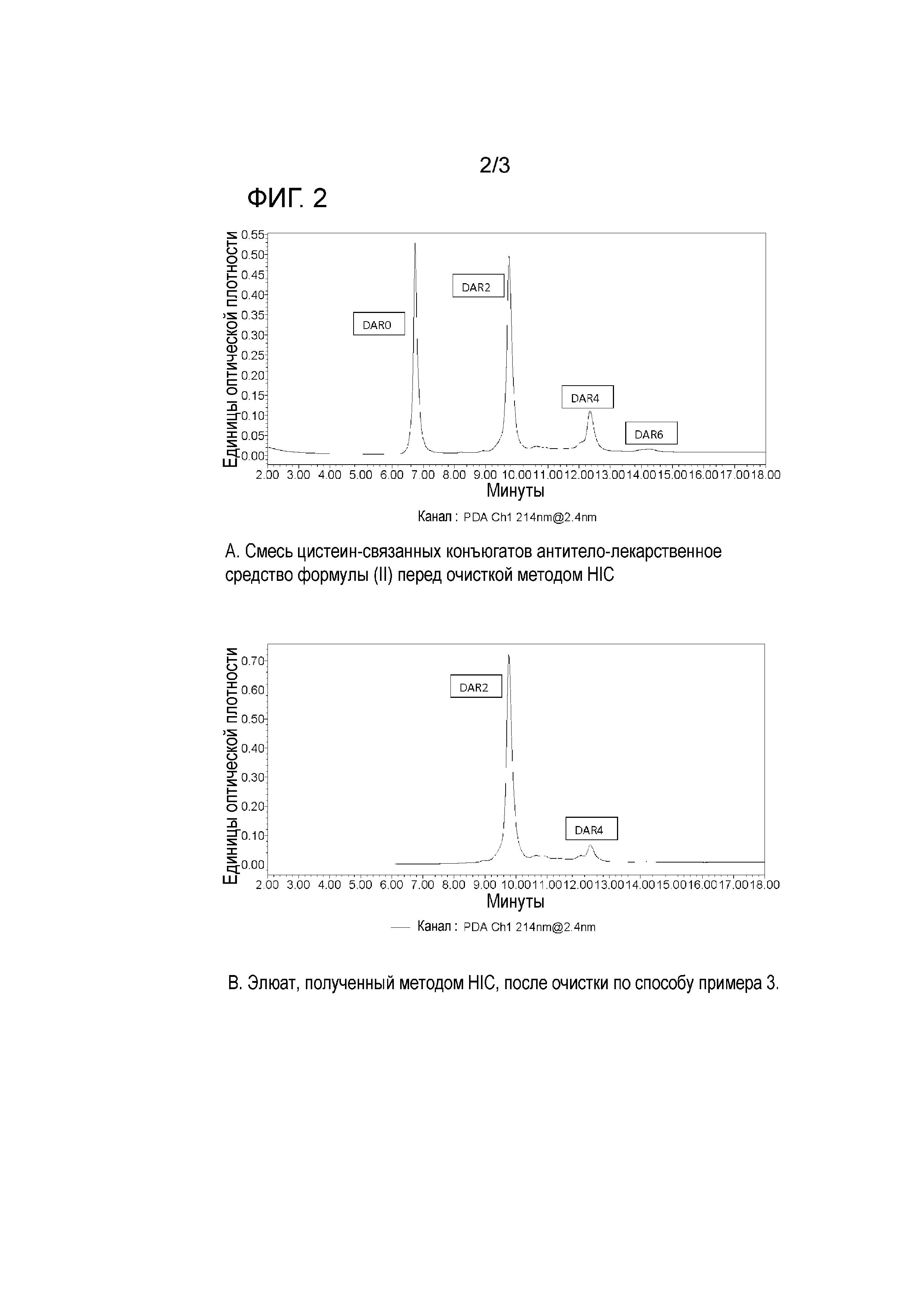
На фигуре 2 изображены аналитические хроматограммы, полученные методом HIC, смесей цистеин-связанных конъюгатов антитело-лекарственное средство формулы (II) до и после очистки HIC в препаративном масштабе по способу, описанному в примере 3.
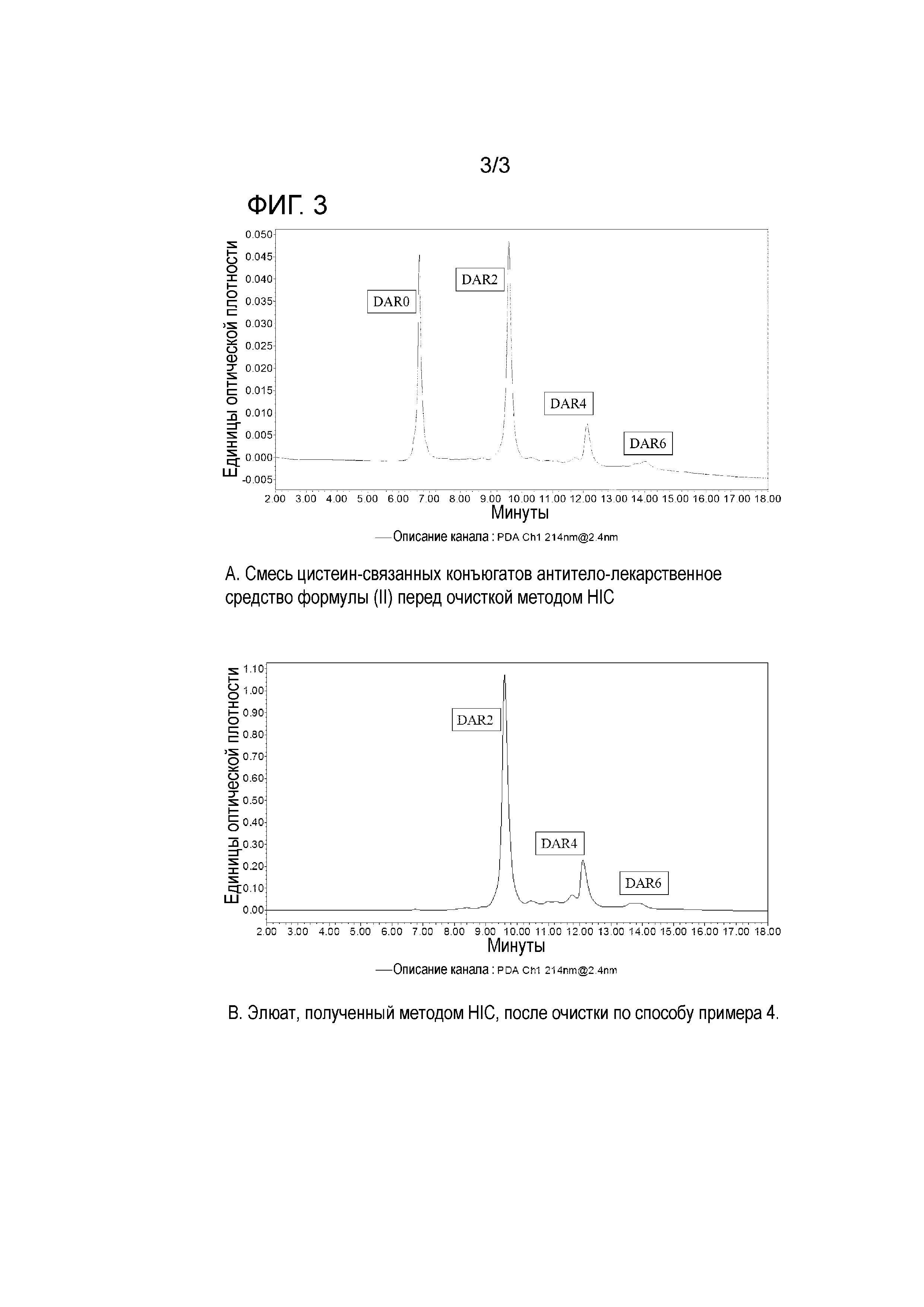
На фигуре 3 изображены аналитические хроматограммы, полученные методом HIC, смесей цистеин-связанных конъюгатов антитело-лекарственное средство формулы (II) до и после очистки HIC в препаративном масштабе по способу, описанному в примере 4.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В процессе разработки настоящего изобретения было обнаружено, что смесь цистеин-связанных конъюгатов антитело-лекарственное средство (Cys-связанные ADC), в которой количество неконъюгированного антитела находится в диапазоне 10-40% по массе, можно успешно очистить от неконъюгированного антитела (DAR0) и неконъюгированной молекулы линкер-лекарственное средство, которые обычно гасят после завершения реакции конъюгации, с помощью гидрофобной хроматографии. Способ в соответствии с настоящим изобретением включает:
a. растворение смеси в 0,2-1,5 М водном растворе соли;
b. загрузку полученного раствора на препаративную колонку для проведения хроматографии гидрофобного взаимодействия;
c. сбор проточной фракции, которая содержит неконъюгированное антитело;
d. промывание указанной колонки 0,2-1,5 М водным раствором соли с одновременным сбором проточной фракции; и
е. элюирование указанной колонки 0-100 мМ водным раствором соли с получением очищенной смеси цистеин-связанных конъюгатов антитело-лекарственное средство.
В контексте настоящего описания термин "соль" и термин "буфер" (солевой) имеют разные значения. Примеры солей и буферов, подходящих для применения в способе настоящего изобретения, приведены ниже. Предпочтительно в способе настоящего изобретения используют буферные водные растворы солей.
В способе настоящего изобретения используют только водные растворы, следовательно, ни на одной из стадий a, b, d или e не используют органический растворитель. Для ясности следует отметить, что стадию е можно проводить в отсутствии соли.
Заявленный способ включает приведение смеси Cys-связанных ADC в контакт с наполнителем колонки HIC в водном растворе соли в условиях загрузки колонки, в которых смесь антител, нагруженных 2-8 молекулами линкер-лекарственное средство, неконъюгированные молекулы линкер-лекарственное средство и примеси, как правило, агрегаты, связываются с наполнителем колонки, тогда как неконъюгированное антитело не связывается и сразу вымывается/протекает через колонку в условиях загрузки. Путем элюирования водным раствором соли с более низкой концентрацией можно отделить Cys-связанные ADC от неконъюгированной молекулы линкер-лекарственное средство и примесей, которые остаются связанными с наполнителем колонки/остаются на колонке.
Водные растворы соли, используемые для загрузки (стадия b) и промывания (стадия d) могут быть одинаковыми или разными. Предпочтительно для загрузки (стадия b) и промывания (стадия d) используют одинаковые водные растворы соли.
Как известно специалистам в данной области, и как описано в параграфе [0057] из US20100069617, оптимальные условия загрузки/связывания и элюирования для колонки HIC зависят от ряда факторов. Следовательно, изменение индивидуальных характеристик удерживания разных смесей ADC, например, вследствие изменений в антителе, линкере и лекарственном средстве, требует адаптации/оптимизации условий работы колонки HIC в соответствии с настоящим изобретением. Такая оптимизация, в первую очередь, включает определение гидрофобности смеси ADC, подлежащей очистки, например, путем определения (относительной) гидрофобности молекул DAR2 любого конкретного ADC и выбора (с учетом гидрофобности) наполнителя колонки. Кроме того, она включает выбор/оптимизацию концентрации водного раствора соли, используемого для загрузки/связывания, концентрации водного раствора соли, используемого для элюирования, концентрации забуферивающей соли и рН.
Смеси Cys-связанных ADC формул (I) и (II) в соответствии с настоящим изобретением содержат линкер-лекарственное средство, конъюгированное с антителом через атом S остатка цистеина, т.е. они представляют собой цистеин-связанные конъюгаты антитело-лекарственное средство. Как правило, остаток цистеина представляет собой природный остаток цистеина, который присутствует в тяжелой и/или легкой цепи антитела (Ab) и участвует в образовании межцепочечных дисульфидных связей. В частности, настоящее изобретение направлено на очистку соединений ADC, которые содержат линкер-лекарственное средство, конъюгированное посредством межцепочечных дисульфидных связей с Ab, более конкретно mAb. Например, антитела IgG1, как правило, содержат четыре межцепочечные дисульфидные связи, причем все четыре располагаются в шарнирном участке антитела, и после (частичного) восстановления дисульфидных связей молекула линкер-лекарственное средство случайным образом присоединяется к свободным тиольным группам.
Смеси Cys-связанных соединений ADC формул (I) и (II) настоящего изобретения можно получить с помощью методов и процедур, хорошо известных специалистам в данной области техники. Конъюгирование посредством межцепочечных дисульфидных связей можно осуществить после полного или частичного восстановления упомянутых дисульфидных связей. Подходящие способы получения таких соединений можно найти в описании и примерах WO2011/133039 авторов настоящей заявки. В частности, в примере 15 из WO2011/133039 описано частичное восстановление трастузумаба с получением 2 свободных тиольных групп на mAb и конъюгирование его с рядоммолекул линкер-лекарственное средство с получением ADC со средними значениями DAR примерно 2. В примерах 7 и 8 WO2005/084390 описано частичное восстановление, частичное восстановление/частичное повторное окисление и стратегии полного восстановления для (частичной) нагрузки антител молекулами линкер-лекарственное средство vcMMAE.
Смесь цистеин-связанных конъюгатов антитело-лекарственное средство (Cys-связанные ADC), подлежащая очистке с помощью способа настоящего изобретения, содержит неконъюгированное антитело, количество которого варьирует в диапазоне 10-40% по массе, более предпочтительно в диапазоне 10-35% по массе, еще более предпочтительно в диапазоне 15-35% по массе. В данной области техники хорошо известно, что количество неконъюгированного антитела, присутствующего после конъюгации, уменьшается с увеличением среднего отношения лекарственного средства к антителу (DAR). Например, авторы настоящего изобретения обнаружили, что при использовании более 1,5 эквивалентов восстанавливающего средства для восстановления межцепочных дисульфидных мостиков моноклонального антитела трастузумаба, в смеси конъюгатов присутствует менее 10% по массе неконъюгированного антитела (DAR0). При использовании 1,0 эквивалента восстанавливающего средства максимальное количество DAR2, присутствующего в смеси конъюгатов, составляет примерно 50% по массе, а процент неконъюгированного антитела (DAR0) трастузумаба составляет примерно 20% по массе (см. фигуру 1). Следует отметить, что распределение значений DAR, соответствующее отношению восстанавливающее средство:mAb, варьирует в зависимости от используемых реагентов и условий реакции.
Способ настоящего изобретения является особенно предпочтительным, если желательно, чтобы среднее значение DAR составляло примерно 2-3, более предпочтительно от 2,6 до 2,9, еще более предпочтительно от 2,7 до 2,9.
В способе настоящего изобретения можно использовать любую коммерчески доступную препаративную колонку HIC. Примеры поставщиков таких колонок и/или подходящих наполнителей для колонок включают Tosoh Bioscience, GE Healthcare, Bio-Rad и Merck Millipore.
В качестве наполнителя для указанной колонки HIC можно использовать пропил-Fractrogel EMD (Merck), фенил-Fractrogel EMD (Merck Millipore), бутил-S-сефарозу (GE Healthcare), октилсефарозу (GE Healthcare), октил-Capto (GE Healthcare), бутил-Capto (GE Healthcare), фенил-Capto Impres (GE Healthcare), бутил-Capto Impres (GE Healthcare), Toyopearl PPG-600M (Tosoh Bioscience), гексил-Toyopearl 650 (Tosoh Bioscience), бутил-Toyopearl 650 (Tosoh Bioscience), фенил-Toyopearl 650 (Tosoh Bioscience), Эфир Toyopearl 650 (Tosoh Bioscience), трет-бутил-MacroPrep (Bio-Rad), фенил-MacroPrep (Bio-Rad), бутил-Cellufine (JNC Corporation), фенил-Cellufine (JNC Corporation) или Poros НР2 (Applied Biosystems).
Предпочтительно указанную колонку HIC наполняют смолами, поставляемыми GE Healthcare, такими как быстропроточная (FF) бутил-S-сефароза 6, октил-Capto, быстропроточная октил-сефароза 4, быстропроточная фенил-сефароза 6, бутил-Capto, быстропроточная бутил-сефароза 4 или бутил-Capto Impres, или смолой Toyopearl PPG-600M, поставляемой Tosoh Bioscience. Сведения об относительной гидрофобности и многих других характеристиках разных наполнителей/смол для колонок можно найти в информационных брошюрах по упомянутым смолам, которые можно получить от поставщиков. В соответствии со способом настоящего изобретения колонку HIC предпочтительно наполняют бутил-S-сефарозой 6 FF, бутил-Capto, бутил-сефарозой 4 FF, бутил-Capto Impres или Toyopearl PPG-600М, более предпочтительно, бутил-сефарозой 4 FF, бутил-Capto Impres или Toyopearl PPG-600М, наиболее предпочтительно, бутил-сефарозой 4 FF или Toyopearl PPG-600M.
Как правило, в соответствии со способом настоящего изобретения, высота корпуса колонки составляет примерно 20-25 см, предпочтительно примерно 20 см, а давление на колонке поддерживают на уровне ниже 2 бар.
Размеры колонки определяются количеством материала, содержащего ADC, которое желательно или необходимо загрузить на колонку HIC. Как известно специалистам в данной области, с увеличением внутреннего диаметра и длины колонки увеличивается количество материала, содержащего ADC, которое можно загрузить на колонку.
Препаративная колонка HIC, подходящая для применения в способе настоящего изобретения, как правило, имеет диаметр в диапазоне 4,0-2000 мм, предпочтительно 15-2000 мм, более предпочтительно 80-2000 мм, наиболее предпочтительно 400-2000 мм. Чем больше диаметр колонки, тем больше материала, содержащего ADC, можно загрузить на верхнюю часть колонки. Предпочтительно условия загрузки и промывания колонки выбирают так, чтобы неконъюгированные антитела (DAR0) проходили через колонку, не задерживаясь, что обеспечивает повышение емкости колонки. Например, если количество неконъюгирванного антитела, присутствующего в смеси Cys-связанных ADC, составляет 30% по массе, способ очистки настоящего изобретения допускает увеличение загрузки указанной колонки на 30%.
Количество материала, содержащего ADC, которое загружают на препаративную колонку, используемую в способе настоящего изобретения, обычно находится в диапазоне 5-50 г/л, предпочтительно в диапазоне 5-40 г/л, более предпочтительно, оно составляет 10-40 г/л, еще более предпочтительно 30-40 г/л наполнителя для колонки. С помощью способа настоящего изобретения можно успешно очистить партию размером от 20 до 2000 г, то есть, заявляемый в настоящем документе способ очистки HIC подходит для очистки материала, содержащего ADC, в промышленном масштабе, в соответствии с GMP (надлежащая практика организации производства).
Помимо диаметра и длины колонки также имеет значение средний размер частиц (d50,объем, средний размер частиц на основании распределения частиц по размерам в суммарном объеме) наполнителя для колонки.
В соответствии со способом настоящего изобретения выбранный размер частиц обеспечивает хорошее разделение при минимальной скорости потока. Размер частиц используемого в способе настоящего изобретения наполнителя для колонки находится в диапазоне 30-180 мкм.
Предпочтительно размер частиц наполнителя для колонки находится в диапазоне 35-100 мкм; еще более предпочтительно, размер частиц наполнителя для колонки находится в диапазоне 45-90 мкм.
В соответствии со способом настоящего изобретения скорость потока находится в диапазоне 50-300 см/час. Предпочтительно скорость потока находится в диапазоне 80-250 см/ч, более предпочтительно, 100-220 см/ч, наиболее предпочтительно, примерно 100-110 см/час.
На стадии е способа настоящего изобретения элюирование проводят либо в обычном режиме (то есть, элюирующий поток имеет такое же направление, как и поток, используемый для загрузки и промывки), или в обратном режиме (то есть, элюирующий поток имеет направление, противоположное направлению потока, используемого для загрузки и промывки). Обратный режим элюирования очищаемой смеси Cys-связанных ADC является особенно предпочтительным в том случае, когда используют смесь ADC (полученную в результате реакции конъюгации), очищенную от неконъюгированных молекул линкер-лекарственное средство, например, путем подвергания указанной (полученной в результате реакции конъюгации) смеси фильтрации (например, на активированном угле), перед применением заявленного способа очистки.
Предпочтительно соль для приготовления водного раствора соли выбирают из группы, включающей тиоцианат калия, хлорид натрия, хлорид калия, хлорид аммония, сульфат натрия, сульфат калия и сульфат аммония. Предпочтительно соль представляет собой хлорид натрия или сульфат аммония. Более предпочтительно, соль представляет собой сульфат аммония.
В соответствии со способом настоящего изобретения, соль для приготовления водного раствора, используемого для загрузки (стадия b) и промывки (стадия d), может быть такой же, как и соль для приготовления водного раствора, используемого для элюирования (стадия e), или отличаться от нее. Предпочтительно на стадиях b, d и e используют одну и ту же соль.
В соответствии со способом настоящего изобретения, концентрация водного раствора соли, используемого для загрузки (стадия b) и промывания колонки (стадия d), находится в диапазоне 0,2-1,5 М. Предпочтительно концентрация водного раствора соли составляет 0,2-1,0 М, более предпочтительно 0,45-0,9 М, наиболее предпочтительно 0,55-0,9 М.
В соответствии со способом настоящего изобретения, концентрация водного раствора соли, используемого для элюирования колонки (стадии e), находится в диапазоне 0-100 мМ. Предпочтительно концентрация водного раствора соли составляет 0-90 мМ, более предпочтительно 0-80 мМ, еще более предпочтительно 0-70 мМ и наиболее предпочтительно 0-55 мМ.
В соответствии со способом настоящего изобретения, предпочтительно водный раствор соли дополнительно содержит буфер. Предпочтительно водный раствор соли имеет концентрацию 0 мМ (стадия е) и содержит буфер. Предпочтительно буфер выбран из группы, включающей фосфат натрия, фосфат калия, фосфат аммония, ацетат натрия, ацетат калия, цитрат натрия, цитрат калия, цитрат аммония и их смеси. Предпочтительно буфер представляет собой фосфатный, ацетатный или цитратный буфер, или их смесь, такую как цитратно-фосфатный буфер. Более предпочтительно буфер представляет собой фосфат натрия или ацетат натрия.
В соответствии со способом настоящего изобретения, буфер для загрузки (стадия b), промывания (стадия d) и элюирования колонки (стадия e) имеет концентрацию 0-100 мМ, предпочтительно 0-50 мМ, более предпочтительно 20-30 мм. Предпочтительно на всех стадиях (стадии от a до e) способа настоящего изобретения используют забуференный водный раствор соли.
Забуференный водный раствор соли, который предпочтительно используют в способе настоящего изобретения, предпочтительно имеет рН примерно от 4 до 8, более предпочтительно примерно от 5 до 7, наиболее предпочтительно примерно от 5,0 до 5,5.
Гидрофобная хроматография ADC в соответствии со способом настоящего изобретения основана на различиях в гидрофобных свойствах неконъюгированных антител, антител, несущих до 8 молекул линкер-лекарственное средство, неконъюгированных молекул линкер-лекарственное средство и примесей, т.е. агрегатов, позволяющих осуществить разделение и выделить очищенную смесь Cys-связанных ADC. Чем выше гидрофобность антитела, ADC, молекулы линкер-лекарственное средство или примеси, тем сильнее они будут взаимодействовать с наполнителем колонки.
В соответствии со способом настоящего изобретения гидрофобность целевых ADC, содержащихся в смеси цистеин-связанных конъюгатов антитело-лекарственное средство, измеряют путем определения времени удерживания на аналитической колонке HIC по сравнению со стандартом, то есть, временем удерживания коммерчески доступного mAb трастузумаба (Herceptin®, Roche/Genentech). Для измерения гидрофобности используют образец ADC с конечной концентрацией цистеин-связанных конъюгатов антитело-лекарственное средство 1 мг/мл в 0,8 М растворе сульфата аммония и аналитическую колонку HIC TSKgel бутил-NPR (Tosoh Bioscience). Образец ADC элюируют с использованием линейного градиента от 100% буфера С (25 мМ фосфат натрия, 1,5 М сульфат аммония, рН 6,95) до 100%буфера D (25 мМ фосфат натрия, рН 6,95, 20% изопропанол), со скоростью 0,4 мл/мин в течение 20 мин, время удерживания молекул DAR2, содержащихся в образце ADC, определяют путем измерения оптической плотности при 214 нм по сравнению с трастузумабом (Herceptin®).
В соответствии со способом настоящего изобретения, с использованием аналитической колонки HIC и способа, описанного в предыдущем параграфе, молекулы Cys-связанных ADC DAR2 имеют относительную гидрофобность в диапазоне 0,1-0,6, предпочтительно 0,2-0,5, более предпочтительно 0,2-0,45, трастузумаб (Herceptin®) имеет время удерживания (Rt): 6,7 мин.
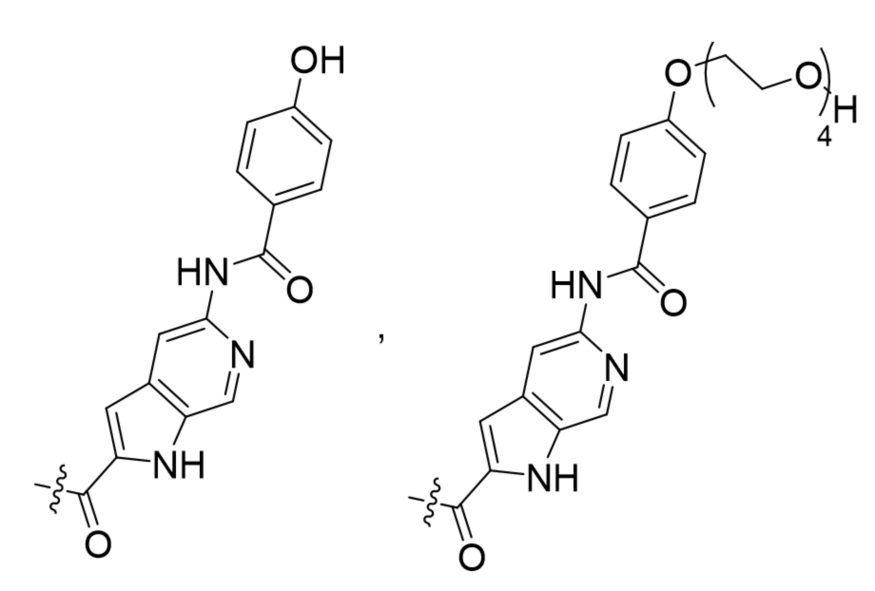
Способ настоящего изобретения особенно подходит для очистки смеси цистеин-связанных конъюгатов антитело-лекарственное средство формулы (I)

в которой
Ab обозначает антитело,
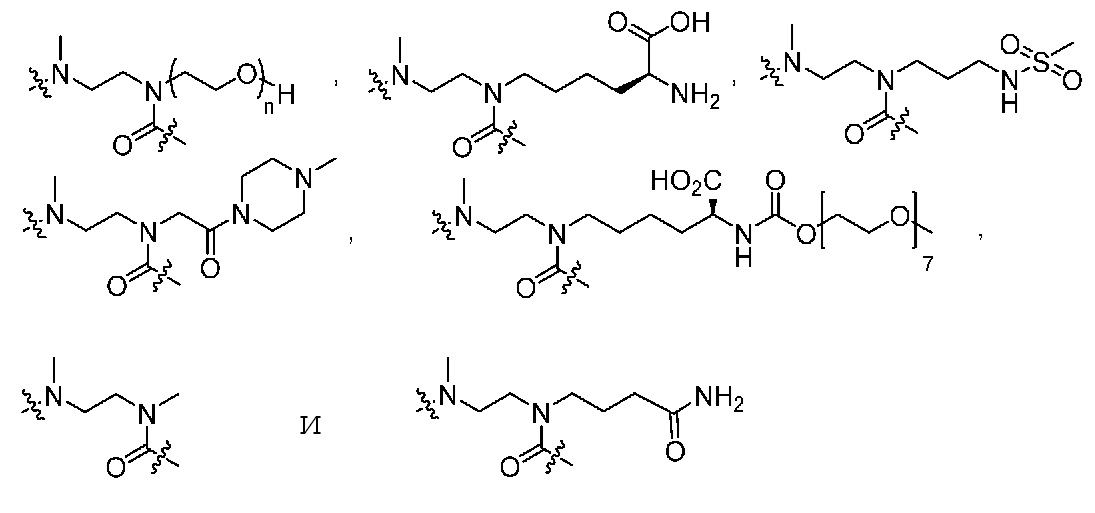
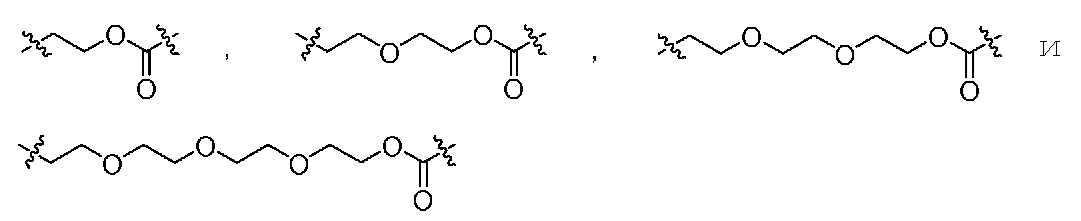
L обозначает связующую группу, выбранную из

V1 обозначает расщепляемый в определенных условиях дипептид, содержащий природные и/или неприродные аминокислоты,
CL обозначает циклизующий линкер, выбранный из
где n обозначает целое число в диапазоне от 1 до 16,
R выбран из Н, СН3, CH2CH3, OCH3, OCH2CH3, CF3, OCF3, Cl, F,
q варьирует от 0 до 8, и
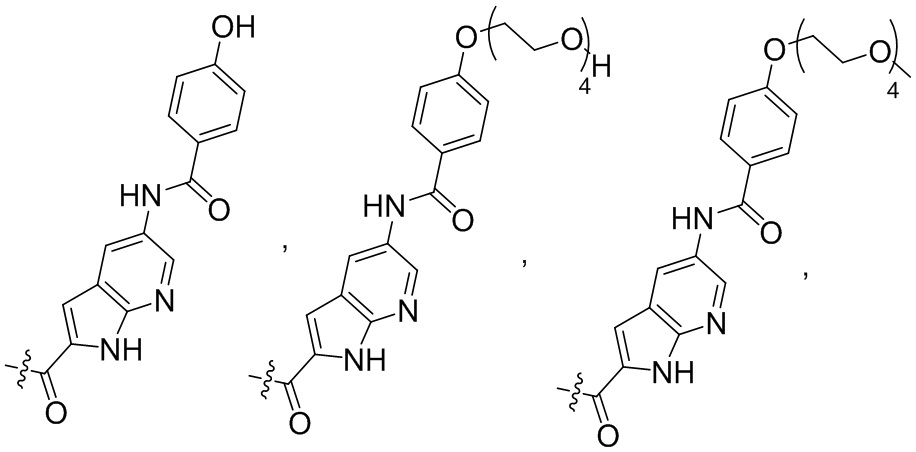
DB обозначает ДНК-связывающий фрагмент, выбранный из
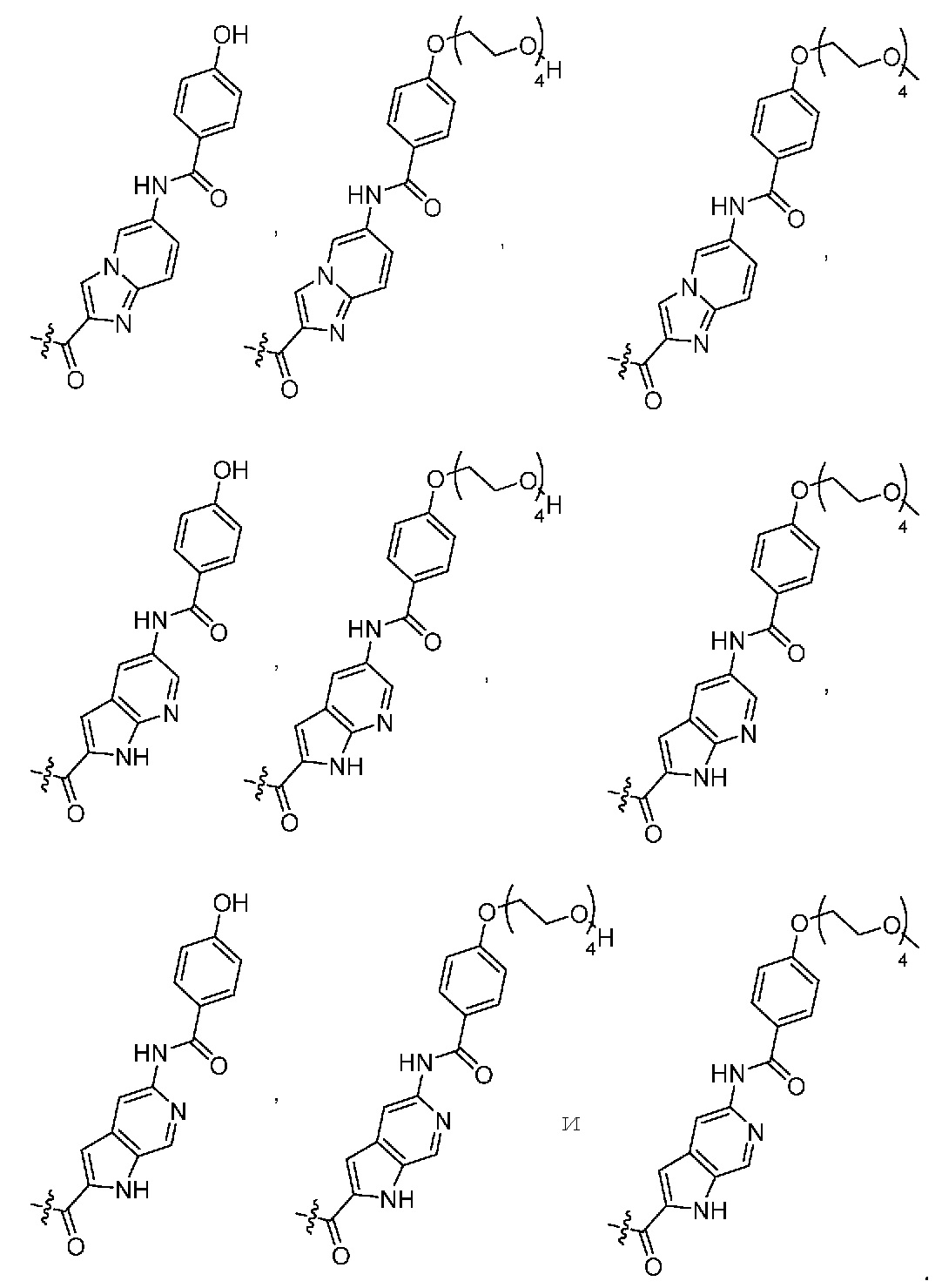
Такие смеси Cys-связанных ADC подробно описаны в WO2010/062171 и WO2011/133039 авторов настоящей заявки.
В соответствии со способом настоящего изобретения, расщепляемый в определенных условиях дипептид, содержащий природные и/или неприродные аминокислоты, предпочтительно выбран из группы, включающей фенилаланиллизин, валиллизин, валилаланин, аланиллизин, валилцитруллин, N-метилвалилцитруллин, фенилаланилцитруллин, изолейцилцитруллин, триптофаниллизин, триптофанилцитруллин, фенилаланиларгинин, фенилаланилаланин, фенилаланил-N9-тозиларгинин, фенилаланил-N9-нитроаргинин, лейциллизин, лейцилцитруллин и фенилаланил-O-бензоилтреонин. Предпочтительно дипептид представляет собой фенилаланиллизин, валиллизин или валилцитруллин.
В соответствии со способом настоящего изобретения, Ab выбрано из группы, включающей антитело против CD-19, антитело против CD22, антитело против CD30, антитело против CD33, антитело против CD56, антитело против CD70, антитело против CD74, антитело против CD-138, антитело против CLL-1, антитело против 5T4, антитело против CD303, антитело против Tag 72, антитело против углевода, подобного антигену Льюиса A, антитело против EphB3, антитело против HMW-MAA, антитело против CD38, антитело против Cripto, антитело против EphA2, антитело против GPNMB, антитело против интегрина, антитело против MN, антитело против HER2, антитело против PSMA, антитело против EGFR, антитело против CD203c, антитело против SLC44A4, антитело против нектина-4, антитело против мезотелина, антитело против CD44, антитело против CD79, антитело против FcRL5, антитело против MUC16, антитело против NaPi2b, анти-STEAP-1 антитело, антитело против ETBR, антитело против TF, антитело против MUC1, антитело против HGFR, антитело против CD37, антитело против FOLR1, антитело против CEACAM, антитело против TROP2, антитело против GCC, антитело против антигена Льюиса Y, антитело против LIV1, антитело против DLL3 и антитело против EPCAM. Антитело предпочтительно представляет собой моноклональное антитело (mAb).
В соответствии со способом настоящего изобретения, Ab, или предпочтительно mAb, представляет собой антитело против HER2. Более предпочтительно антитело представляет собой моноклональное антитело против HER2, такое как трастузумаб или биологически подобное ему антитело. В конкретном варианте осуществления способа настоящего изобретения смесь Cys-связанных ADC формулы (II) получают с использованием антитела трастузумаба или биологически подобного ему антитела, где указанное антитело восстанавливают трис(2-карбоксиэтил)фосфином (ТСЕР, 1,1 мольных эквивалентов на моль антитела) и подвергают взаимодействию с молекулой линкер-лекарственное средство формулы (III) (1,3 молярных эквивалентов на свободную тиольную группу). Конъюгирование обычно проводят в N,N-диметилацетамиде (DMAc) или диметилсульфоксиде (ДМСО), предпочтительно в DMAc.

В некоторых вариантах осуществления способа настоящего изобретения реакционную смесь после конъюгирования обрабатывают исходным раствором N-ацетилцистеина (1 молярный эквивалент на конъюгат линкер-лекарственное средство), чтобы блокировать реакционноспособные группы неконъюгированной молекулы линкер-лекарственное средство формулы (III).
В некоторых вариантах осуществления способа настоящего изобретения реакционную смесь после конъюгирования подвергают стадии фильтрования, чтобы удалить нерастворимый избыток молекулы линкер-лекарственное средство формулы (III). Удаление избытка молекулы линкер-лекарственное средство перед загрузкой реакционной смеси на колонку повышает емкость колонки. Можно использовать фильтры, хорошо известные специалистам в данной области техники.
Как правило, стадия фильтрации включает применение предфильтра и затем фильтра с допустимым значением абсолютного размера пор. Подходящие предфильтры включают объемные фильтры, содержащие активированный уголь. Предпочтительными являются такие фильтры, как ZetaCarbon SLP (3M).
Фильтры с подходящим абсолютным размером пор могут быть получены из полиэфирсульфона (PES), ацетата целлюлозы (CA) или поливинилиденфторида (PVDF). Предпочтительные фильтры включают фильтры из PVDF или PES, как правило, с абсолютным размером пор 0,2 мкм.
В некоторых вариантах осуществления способа настоящего изобретения реакционную смесь после конъюгирования готовят для очистки на колонке HIC с использованием фосфата натрия и сульфата аммония с конечной концентрацией фосфата натрия 20-30 мМ и сульфата аммония 0,55-0,65 М при рН 6,0-6,5 (буфер A).
В альтернативных вариантах осуществления способа настоящего изобретения реакционную смесь после конъюгирования готовят для очистки на колонке HIC с использованием ацетата натрия и сульфата аммония с конечной концентрацией ацетата натрия 20-30 мМ и 0,55-0,9 М сульфата аммония при рН 5,0-5,5 (буфер А).
В конкретном варианте осуществления способ настоящего изобретения включает использование колонки HIC (8 см ×20 см, быстропроточная бутил-сефароза 4), которую сначала уравновешивают буфером А (20-30 мМ фосфат натрия, 0,55-0,65 М сульфат аммония, рН 6,0-6,5) в объеме, равном трем объемам колонки, при скорости потока 100 см/ч, с последующим нанесением на колонку реакционной смеси, полученной после конъюгирования, в буфере А (стадия b) и сбором проточной фракции, содержащей неконъюгированное антитело (стадия c).
Стадия D включает промывание колонки HIC таким же буфером A (20-30 мМ фосфат натрия, 0,55-0,65 М сульфат аммония, рН 6,0-6,5), объем которого равен трем объемам колонки, при скорости потока 100 см/ч, и сбор проточной фракции, что позволяет удалить остаточные количества неконъюгированного антитела. Стадия е включает элюирование колонки HIC буфером В (20-30 мМ фосфат натрия, 45-55 мМ сульфат аммония, рН 6,0-6,5), объем которого равен трем объемам колонки, при скорости потока 100 см/ч, с получением очищенной смеси Cys-связанных ADC. Указанное элюирование можно проводить как в обычном режиме, или в реверсном режиме (как описано выше).
В другом конкретном варианте осуществления способ настоящего изобретения включает использование колонки HIC (1 см ×20 см, Toyopearl PPG-600M), которую сначала уравновешивают буфером А (20-30 мМ ацетат натрия, 0,55-0,9 М сульфат аммония, рН 5,0-5,5) в объеме, равном трем объемам колонки, при скорости потока 100 см/ч, с последующим нанесением на колонку реакционной смеси, полученной после конъюгирования, в буфере А (стадия b) и сбором проточной фракции, содержащей неконъюгированное антитело (стадия c).
После загрузки колонку HIC промывают таким же буфером А (20-30 мМ ацетат натрия, 0,55-0,9 М сульфат аммония, рН 5,0-5,5), объем которого равен трем объемам колонки, при скорости потока 100 см/ч, и собирают проточную фракцию, что позволяет удалить остаточные количества неконъюгированного антитела.
Стадия е включает элюирование колонки HIC буфером В (20-30 мМ ацетат натрия, рН 5,0-5,5), объем которого равен трем объемам колонки, при скорости потока 50-100 см/ч, с получением очищенной смеси Cys-связанных ADC. Указанное элюирование может проводить как в обычном режиме, так и в обратном режиме (как описано выше).
Полученная в результате очищенная смесь Cys-связанных ADC преимущественно содержит желательные молекулы DAR2 и DAR4. В указанных выше условиях большинство молекул DAR6 и DAR8, неконъюгированные молекулы линкер-лекарственное средство, а также любые агрегатные примеси остаются на колонке HIC. Промыванием колонки HIC водой для инъекций (WFI) можно элюировать молекулы DAR6 и DAR8, а также неконъюгированные молекулы линкер-лекарственное средство.
Способ настоящего изобретения особенно подходит для очистки смеси цистеин-связанных конъюгатов антитело-лекарственное средство формулы (II),

где
Ab обозначает трастузумаб, а
q варьирует от 0 до 8.
Удаление из указанной смеси ADC значительного количества неконъюгированных антител в результате применения способа очистки смеси Cys-связанных ADC настоящего изобретения приводит к увеличению среднего значения DAR. Например, как показано ниже в примере 3, среднее значение DAR для соединения Cys-связанного ADC формулы (II) увеличивается с 1,75 до 2,5 после очистки методом HIC.
После очистки методом HIC буфер, используемый для очистки Cys-связанного ADC, обычно заменяют на буфер для лиофилизации, после чего Cys-связанный ADC подвергают сушке из замороженного состояния с получением лиофилизированной массы, используя традиционные методы и традиционное оборудование.
ПРИМЕРЫ
Пример 1 - Получение раствора линкер-лекарственное средство, соединения формулы (III)
В защищенной среде изолятора (перчаточной камеры) достаточное количество твердого соединения формулы (III) отвешивают в бутылку. Твердое вещество растворяют в 100% DMAc до концентрации примерно 20 мМ. Затем бутылку вынимают из изолятора и хранят в вытяжном шкафу при комнатной температуре в защищенном от света месте. После определения точной концентрации раствор линкер-лекарственное средство разводят до 40 мМ.
Пример 2 - Конъюгирование молекулы линкер-лекарственное средство с трастузумабом
Моноклональное антитело (mAb) против HER2, трастузумаб, конъюгируют с молекулой линкер-лекарственное средство формулы (III), получая смесь цистеин-связанных конъюгатов антитело-лекарственное средство формулы (II).
Все операции проводят при непрерывном перемешивании в вытяжном шкафу.
Непосредственно перед конъюгированием раствор трастузумаба 60 мг/мл, также содержащий 4,2 мМ гистидина, 50 мМ трегалозы, 0,01% полисорбата 20, рН 6, смешивают в соотношении 2:1 с буфером для восстановления (4,2 мМ гистидина, 50 мМ трегалозы, 3 мМ ЭДТА (этилендиаминтетрауксусная кислота) и 1 мМ TCEP, рН 6). Чтобы получить 2 свободные тиольные группы на молекулу mAb, восстанавливающее средство ТСЕР добавляют в соотношении 1,15 мольных эквивалентов на 1 эквивалент трастузумаба. После инкубации при комнатной температуре в течение 60 мин добавляют раствор Ν,Ν-диметилацетамида (DMAc) (100%) и линкер-лекарственное средство формулы (III) (10 мМ в DMAc, 2,2 эквивалента по отношению к mAb) так, чтобы конечная концентрация DMAc составляла 2,5% об/об.
После конъюгирования в течение ночи смесь фильтруют через фильтр с активированным углем (ZetaCarbon SLP, 3М) и затем через полиэфирсульфоновый (PES) фильтр 0,2 мкм, чтобы удалить нерастворимый избыток молекулы линкер-лекарственное средство формулы (III).
На фигурах 2А и 3А показаны хроматограммы двух разных партий реакционной смеси, полученной после конъюгирования, на аналитической колонке HIC (описано ниже). DAR8 не обнаружены. Рассчитанное среднее значение DAR составляет 1,75.
Пример 3 - Очистка методом HIC
Все хроматографические стадии проводят при комнатной температуре. Реакционную смесь, полученную после конъюгирования, готовят для очистки на колонке HIC путем смешивания с буфером, содержащим фосфат натрия (84 мМ) и сульфат аммония (2,21 М), в соотношении 1 объем буфера на 2 объема реакционной смеси, полученной после конъюгирования, до конечной концентрации фосфата натрия (26 мМ) и сульфата аммония (0,62 М) при рН 6,5.
Препаративную колонку 8 см ×20 см наполняют быстропроточной бутил-сефарозой 4 (GE Healthcare). Колонку уравновешивают буфером А (26 мМ фосфат натрия, 0,62 М сульфат аммония, рН 6,5), объем которого равен 3 объемам колонки, при скорости потока 100 см/час. Реакционную смесь после конъюгирования загружают на колонку в количестве до 10 г/л наполнителя колонки/смолы. Скорость потока была устанавливают на уровне 100 см/ч. В этих условиях неконъюгированное антитело (трастузумаб) не связывается с колонкой/протекает через колонку, которую дополнительно промывают буфером А (26 мМ фосфат натрия, 0,62 М сульфат аммония, рН 6,5) в объеме, равном 3 объемам колонки, при скорости потока 100 см/час. Проточные фракции со стадий загрузки и промывания собирают и объединяют. Элюирование молекул DAR2 и DAR4 цистеин-связанных конъюгатов антитело-лекарственное средство проводят с использованием буфера В (25 мМ фосфат натрия, 50 мМ сульфат аммония, рН 6,2) в объеме, равном 3 объемам колонки, при скорости потока 100 см/ч. В этих условиях любая оставшаяся неконъюгированная молекула линкер-лекарственное средство и большая часть цистеин-связанных конъюгатов антитело-лекарственное средство DAR6 остается на колонке. Путем промывания колонки водой для инъекций (WFI) в объеме, равном 2 объемам колонки, при скорости потока 100 см/ч элюируют все оставшиеся неконъюгированные молекулы линкер-лекарственное средство и большую часть цистеин-связанных конъюгатов антитело-лекарственное средство DAR6.
На фигуре 2В показана хроматограмма реакционной смеси, полученной после конъюгирования, на аналитической колонке HIC (описано ниже) после очистки методом HIC в препаративном масштабе. DAR8 не обнаружены. Рассчитанное среднее значение DAR составляет 2,50.
Пример 4 - Альтернативная очистка методом HIC
Все хроматографические стадии проводят при комнатной температуре. Отдельную партию реакционной смеси, полученной после конъюгирования, как описано выше, готовят для очистки на колонке HIC путем смешивания с буфером, содержащим ацетат натрия (75 мМ) и сульфат аммония (2,4 М), в соотношении 1 объем буфера и 2 объема реакционной смеси, полученной после конъюгирования, до конечной концентрации ацетата натрия (25 мМ) и сульфата аммония (0,8 М) при рН 5,3.
Препаративную колонку 1 см ×20 см наполняют Toyopearl PPG-600M (Tosoh Bioscience). Колонку уравновешивают буфером А (25 мМ ацетат натрия, 0,8 М сульфат аммония, рН 5,3) в объеме, равном 3 объемам колонки, при скорости потока 100 см/час. Реакционную смесь, полученную после конъюгирования, загружают на колонку в количестве до 35 г/л наполнителя для колонки/смолы. Скорость потока устанавливают на уровне 100 см/ч. В этих условиях неконъюгированное антитело (трастузумаб) не связывается с колонкой/протекает через колонку, которую дополнительно промывают буфером А (25 мМ ацетат натрия, 0,8 М сульфат аммония, рН 5,3) в объеме, равном 3,5 объемам колонки, при скорости потока 100 см/час. Проточные фракции со стадий загрузки и промывания собирают и объединяют. Элюирование молекул DAR2 и DAR4 цистеин-связанных конъюгатов антитело-лекарственное средство проводят с использованием буфера В (25 мМ ацетат натрия, рН 5,3) в объеме, равном 3,5 объемам колонки, при скорости потока 100 см/ч. В этих условиях любая оставшаяся неконъюгированная молекула линкер-лекарственное средство и большая часть цистеин-связанных конъюгатов антитело-лекарственное средство DAR6 остается на колонке. Путем промывания колонки 40% изопропанолом в объеме, равном 2 объемам колонки, при скорости потока 100 см/ч элюируют все оставшиеся неконъюгированные молекулы линкер-лекарственное средство и большую часть цистеин-связанных конъюгатов антитело-лекарственное средство DAR6.
На фигуре 3В показана хроматограмма реакционной смеси, полученной после конъюгирования, на аналитической колонке HIC (описано ниже) после очистки методом HIC в препаративном масштабе. DAR0 не обнаружены. Рассчитанное среднее значение DAR составляет 2,80.
Пример 5 - Анализ методом аналитической HIC
Анализ цистеин-связанных конъюгатов антитело-лекарственное средство проводят методом аналитической хроматографии гидрофобного взаимодействия (HIC). Образец получают путем разведения 10 мкл цистеин-связанного конъюгата антитело-лекарственное средство 90 мкл 0,89 М водного раствора сульфата аммония с получением конечной концентрации цистеин-связанного конъюгата антитело-лекарственное средство 1 мг/мл в 0,8 М сульфате аммония. 10 мкл образца вводят на колонку с TSKgel бутил-NPR (Tosoh Bioscience). Способ элюирования включает линейный градиент от 100% буфера С (25 мМ фосфат натрия, 1,5 М сульфат аммония, рН 6,95) до 100% буфера D (25 мМ фосфат натрия, рН 6,95, 20% изопропиловый спирт) со скоростью 0,4 мл/мин в течение 20 минут. Используют систему UPLC Waters Acquity класса H, оборудованную PDA-детектором и программным обеспечением Empower. Измеряют оптическую плотность при 214 нм и определяют время удерживания цистеин-связанных конъюгатов антитело-лекарственное средство.
Такой же аналитический метод применяют к образцу трастузумаб/Herceptin®, полученному по описанному выше способу, для которого время удерживания определяют при длине волны 214 нм.
Пример 6 - Определение относительной гидрофобности
Относительную гидрофобность цистеин-связанных конъюгатов антитело-лекарственное средство DAR2 рассчитывают с использованием времени удерживания (Rt) указанных молекул DAR2, входящих в состав смеси Cys-связанных ADC, и времени удерживания трастузумаб/Herceptin® по следующей формуле:
[Rt(DAR2)-Rt(трастузумаб/Herceptin®)]/Rt(трастузумаб/Herceptin®).
В соответствии с результатами, полученными на описанной выше аналитической колонке HIC, молекулы цистеин-связанного конъюгата антитело-лекарственное средство формулы (II), характеризующиеся DAR2, имеют время удерживания 9,6 мин и относительную гидрофобность 0,4, тогда как время удерживания трастузумаб/Herceptin® составляет 6,7 минут.
Реферат
Изобретение относится к медицине и касается способа очистки смеси цистеин-связанных конъюгатов антитело-лекарственное средство, в которой количество неконъюгированного антитела находится в диапазоне от 10 до 40% по массе. Где способ включает получение смеси в водном солевом растворе, загрузку полученного раствора на препаративную колонку для проведения хроматографии гидрофобного взаимодействия, сбор проточной фракции, которая содержит неконъюгированное антитело, промывку указанной колонки водным солевым раствором с одновременным сбором проточной фракции, элюирование указанной колонки водным солевым раствором с получением очищенной смеси цистеин-связанных конъюгатов антитело-лекарственное средство. Причем ни на одной из стадий не используют органический растворитель. Изобретение обеспечивает увеличение емкости колонки в связывании конъюгатов антитело-лекарственное средство, подлежащих очистке. 17 з.п. ф-лы, 3 ил., 6 пр.
Формула





Комментарии