Система (варианты) и способ детектирования наличия аналита в жидком образце - RU2653451C2
Код документа: RU2653451C2
Чертежи



























Описание
Область техники
Настоящее изобретение относится к анализам и устройствам для детектирования аналитов и к их применению в лечении и диагностике заболевания.
Уровень техники
Настоящее изобретение относится к анализам и устройствам для детектирования аналитов и к их применению в лечении и диагностике заболевания.
Магнитные сенсоры были разработаны для детектирования молекулярных взаимодействий в различных средах, включая, помимо других сред, биологические жидкости, продукты питания и образцы почвы. При связывании с мишенью данные сенсоры вызывают изменения в свойствах соседних молекул воды (или любой молекулы растворителя со свободными атомами водорода) образца, которые могут быть обнаружены с помощью методов магнитного резонанса (ЯМР/МРТ). Таким образом, при использовании данных сенсоров в жидком образце можно детектировать присутствие аналита (небольших молекул, ДНК, РНК, белков, углеводов, организмов, метаболитов и патогенов (например, вирусов)) и, потенциально, определить его количество при очень низкой концентрации, используя магнитные сенсоры.
В целом, магнитные сенсоры представляют собой магнитные частицы, которые связываются или иным образом присоединяются к их предполагаемой молекулярной мишени с образованием кластеров (агрегатов). Считается, что когда магнитные частицы собираются в кластеры и эффективное поперечное сечение увеличивается (а число кластеров на единицу объема уменьшается), то взаимодействия с молекулами воды или другого растворителя изменяются, что приводит к изменениям таких измеряемых параметров, как времена релаксации (например, T2, T1, T2*), восприимчивость, частота прецессии, а также к другим физическим изменениям. Дополнительно образование кластеров может быть устроено так, чтобы быть обратимым (например, в ответ на сдвиг температуры, разрыв химических связей, сдвиг значения pH и т.д.), так что для детектирования специфических аналитов могут быть разработаны как ʺпрямойʺ, так и ʺобратныйʺ (основанные как на конкурентных реакциях, так и на использовании ингибиторов) тесты. Прямой (основанный на кластеризации) и обратный (основанный на декластеризации) виды анализов могут быть использованы для детектирования широкого спектра относящихся к биологическим материалов. Явление переключения магнитного резонанса (MPS (magnetic resonance switch)) было описано ранее (см. публикацию патента США №20090029392).
Многие диагностические тесты должны быть чувствительны в пикомолярном или субпикомолярном диапазонах концентраций. В настоящее время для выявления инфекционных агентов, нуклеиновых кислот, малых молекул, агентов и организмов, использующихся в качестве биологического оружия, а также молекулярных мишеней (биомаркеров) или комбинации молекулярных и иммунологических мишеней обычно требуется предварительная подготовка образцов, время для анализа образца и проведение одиночных анализов на каждый из отдельных аналитов. Существует необходимость в быстром, коммерчески реализуемом, базирующемся на ЯМР устройстве для детектирования аналитов, подходящем для применения с магнитными наносенсорами, которое обладает четырьмя уникальными признаками и качествами: 1) практически полное отсутствие необходимости приготовления проб, 2) возможность мультиплексного детектирования нескольких типов различных молекул, 3) быстрый сбор диагностической информации и 4) получение точной информации для принятия клинических решений в пунктах оказания медицинской помощи.
Сущность изобретения
Настоящее изобретение относится к системам и способам детектирования аналитов.
Настоящее изобретение относится к способу детектирования присутствия аналита в жидком образце, причем данный способ включает в себя: (a) контактирование раствора с магнитными частицами для получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 699 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 699 нм), значение релаксивности T2 (T2 relaxivity) на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии аналита или поливалентного связывающего агента; (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы, поливалентный связывающий агент и аналит, и имеет РЧ (радиочастотную) катушку (RF coil), расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; и (e) детектирование аналита на основании результата, полученного на стадии (d). В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Например, аналит может представлять собой креатинин, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты креатинина, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к креатинину. В другом варианте осуществления аналит может представлять собой такролимус, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты такролимуса, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к такролимусу. В определенных вариантах осуществления способа стадия (d) включает в себя измерение времени релаксации Т2 жидкого образца, причем увеличение агломерации в жидком образце приводит к увеличению наблюдаемой скорости релаксации T2 данного образца. В некоторых вариантах осуществления аналит представляет собой нуклеиновую кислоту-мишень (например, нуклеиновую кислоту-мишень, экстрагированную из лейкоцита или патогена). Настоящее изобретение относится к способу детектирования присутствия аналита в жидком образце, причем данный способ включает в себя: (a) контактирование раствора с магнитными частицами для получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×109 до 1×1012 ммоль-1сек-1 (например, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеют на своей поверхности связывающие остатки, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии аналита или поливалентного связывающего агента, (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы, поливалентный связывающий агент и аналит, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; и (e) определение аналита на основании результата, полученного на стадии (d). В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Например, аналит может представлять собой креатинин, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты креатинина, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к креатинину. В другом варианте осуществления аналит может представлять собой такролимус, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты такролимуса, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к такролимусу. В определенных вариантах осуществления способа стадия (d) включает в себя измерение релаксационного ответа T2 жидкого образца, и причем увеличение степени агрегирования в жидком образце приводит к увеличению наблюдаемой скорости релаксации T2 образца. В некоторых вариантах осуществления аналит представляет собой нуклеиновую кислоту-мишень (например, нуклеиновую кислоту-мишень, экстрагированную из лейкоцита или патогена). Настоящее изобретение дополнительно относится к способу детектирования наличия патогена в образце цельной крови, причем данный способ включает в себя: (a) предоставление образца цельной крови от испытуемого; (b) смешивание образца цельной крови с раствором агента лизиса эритроцитов для получения разрушенных красных кровяных клеток; (c) следующее за стадией (b) центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества супернатанта или всего супернатанта и ресуспендирование осадка с образованием экстракта, необязательно промывание осадка (например, ТЕ-буфером) до ресуспендирования осадка и необязательно повторение стадии (c); (d) лизис клеток экстракта для образования лизата; (e) помещение лизата со стадии (d) в детекционную пробирку и амплифицирование нуклеиновой кислоты-мишени в лизате для образования раствора подвергшегося амплифицированию лизата, включающего в себя нуклеиновую кислоту-мишень, в котором данная нуклеиновая кислота-мишень является характерной для патогена, который должен быть обнаружен; (f) следующее за стадией (e) добавление к детекционной пробирке от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм) и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (g) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (h) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (i) следующую за стадией (h) стадию измерения сигнала от детекционной пробирки; и (j) детектирование патогена на основании результата, полученного на стадии (i). В некоторых вариантах осуществления стадии от (a) до (i) завершаются за время, быстрее 4 часов (например, в течение 3,5 часов, 3,0 часов, 2,5 часов, 2 часов, 1,5 часов или 1 часа). В другом варианте осуществления стадию (i) проводят без предварительной очистки раствора подвергшегося амплифицированию лизата (например, раствор лизата не подвергается фракционированию после того, как он образуется). В определенных вариантах осуществления стадия (c) включает в себя промывание осадка до ресуспендирования осадка с целью образования экстракта. В определенных вариантах осуществления стадия (d) включает в себя объединение экстракта с шариками (beads) с целью образования смеси и перемешивание смеси для образования лизата. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, данный анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Лизат может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом.
Настоящее изобретение относится к способу детектирования присутствия нуклеиновой кислоты-мишени в образце цельной крови, причем данный способ включает в себя: (a) предоставление одной или более клеток из образца цельной крови от испытуемого; (b) лизис клеток с образованием лизата; (c) амплифицирование нуклеиновой кислоты-мишени в лизате для образования раствора подвергшегося амплифицированию лизата, содержащего нуклеиновую кислоту-мишень; (d) следующее за стадией (c) добавление к детекционной пробирке раствора подвергшегося амплифицированию лизата и от 1×106 до 1×1013 магнитных частиц на миллилитр раствора подвергшегося амплифицированию лизата, в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм и связывающие остатки на своей поверхности, причем связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (e) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (f) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (h) следующую за стадией (f) стадию измерения сигнала от детекционной пробирки; и (i) детектирование нуклеиновой кислоты-мишени на основании результата, полученного на стадии (h). В определенных вариантах осуществления нуклеиновую кислоту-мишень очищают до стадии (d). В определенных вариантах осуществления стадия (b) включает в себя объединение экстракта с шариками с целью образования смеси и перемешивание смеси для образования лизата. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы необязательно включают в себя поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Лизат может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом.
Настоящее изобретение дополнительно относится к способу детектирования присутствия нуклеиновой кислоты-мишени в образце цельной крови, причем данный способ включает в себя: (a) предоставление экстракта, получаемого лизисом красных кровяных клеток в образце цельной крови от испытуемого, центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества супернатанта или всего супернатанта и ресуспендирование осадка с образованием экстракта, необязательно промывание осадка (например, ТЕ-буфером) до ресуспендирования осадка и необязательно повторение центрифугирования, отбрасывания и промывания со стадии (a); (b) лизис клеток в экстракте для образования лизата; (c) размещение лизата со стадии (b) в детекционной пробирке и амплифицирование нуклеиновых кислот в ней для образования раствора подвергшегося амплифицированию лизата, включающего в себя от 40% (масс./масс.) до 95% (масс./масс.) нуклеиновой кислоты-мишени (например, от 40 до 60%, от 60 до 80% или от 85 до 95% (масс./масс.) нуклеиновой кислоты-мишени) и от 5% (масс./масс.) до 60% (масс./масс.) нецелевой нуклеиновой кислоты (например, от 5 до 20%, от 20 до 40% или от 40 до 60% (масс./масс.) нецелевой нуклеиновой кислоты); (d) следующее за стадией (c) добавление к детекционной пробирке раствора подвергшегося амплифицированию лизата и от 1×106 до 1×1013 магнитных частиц на миллилитр раствора подвергшегося амплифицированию лизата, в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм и связывающие остатки на своей поверхности, причем связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (e) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (f) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (g) следующая за стадией (f) стадия измерения сигнала от детекционной пробирки; и (h) детектирование нуклеиновой кислоты-мишени на основании результата, полученного на стадии (g), причем стадию (g) проводят без предварительной очистки раствора подвергшегося амплифицированию лизата. В определенных вариантах осуществления стадия (b) включает в себя объединение экстракта с шариками с целью образования смеси и перемешивание смеси для образования лизата. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления лизат дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Лизат может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом.
Настоящее изобретение относится к способу детектирования присутствия вида Candida в жидком образце, причем данный способ включает в себя: (a) лизис клеток Candida в жидком образце; (b) амплифицирование нуклеиновой кислоты, которая должна быть определена, в присутствии прямого праймера и обратного праймера, каждый из которых является универсальным для нескольких видов Candida, с целью образования раствора, включающего в себя ампликон Candida; (c) контактирование раствора с магнитными частицами с целью получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×109 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии ампликона Candida или поливалентного связывающего агента, (d) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы и ампликон Candida, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (e) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (f) следующую за стадией (e) стадию измерения сигнала; и (g) определение на основании результата, полученного на стадии (f), присутствия организмов вида Candida в образце. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Прямой праймер может включать в себя, например, последовательность


















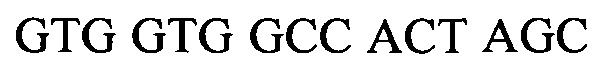




Настоящее изобретение относится к способу детектирования присутствия вида Candida в образце, представляющем собой образец цельной крови, причем данный способ включает в себя: (a) предоставление экстракта, произведенного лизисом красных кровяных клеток в образце цельной крови от пациента; (b) центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества или всего супернатанта; (c) промывание осадка (например, ТЕ-буфером) смешиванием осадка с буфером, перемешивание образца (например, на аппарате для встряхивания типа ʺВортексʺ), центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества супернатанта или всего супернатанта; (d) необязательно повторение стадий (b) и (c); (e) обработка осадка шариками с образованием лизата в присутствии буфера (например, ТЕ-буфера); (f) центрифугирование образца для образования супернатанта, содержащего лизат; (g) амплифицирование нуклеиновых кислот в лизате со стадии (f) для образования ампликона Candida; и (h) детектирование присутствия ампликона Candida, причем данным способом можно получить (i) по меньшей мере 95% правильного детектирования при количестве клеток, меньшем или равном 5 клеток/мл в образцах, вспрыснутых в 50 отдельных образцов крови нездоровых пациентов; (ii) по меньшей мере 95% правильного детектирования при количестве клеток, меньшем или равном 5 клеток/мл в образцах, вспрыснутых в 50 отдельных образцов крови нездоровых пациентов; и/или (iii) больше чем или эквивалентно 80% правильного детектирования в полученных от пациентов клинически позитивных образцах (например, в которых позитивный результат на Candida был получен с помощью другой методики, такой как анализ на клеточных культурах), начиная с 2 мл крови со стадии (a).
Настоящее изобретение относится к способу детектирования наличия патогена в образце цельной крови, причем данный способ включает в себя следующие стадии: (a) получение от 0,05 до 4,0 мл образца цельной крови (например, от 0,05 до 0,25, от 0,25 до 0,5, от 0,25 до 0,75, от 0,4 до 0,8, от 0,5 до 0,75, от 0,6 до 0,9, от 0,65 до 1,25, от 1,25 до 2,5, от 2,5 до 3,5 или от 3,0 до 4,0 мл цельной крови); (b) размещение аликвоты образца со стадии (a) в контейнер и амплифицирование нуклеиновой кислоты-мишени в образце для образования амплифицированного раствора, включающего в себя нуклеиновую кислоту-мишень, причем нуклеиновая кислота-мишень является характерной для патогена, который должен быть обнаружен, (c) размещение подвергшегося амплифицированию жидкого образца в детектирующем устройстве; (d) детектирование патогена на основе результата стадии (c), причем патоген выбран из бактерий и грибов, и где данным способом возможно детектировать патоген в концентрации 10 клеток/мл (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 клеток/мл) в образце цельной крови. Детектирующее устройство может детектировать патоген посредством измерения массы, плотности, оптического, флуоресцентного, магнитного, хроматографического и/или электрохимического измерения подвергшегося амплифицированию жидкого образца. В некоторых вариантах осуществления стадии от (a) до (d) завершаются в течение 3 часов (например, в течение 3,2; 2,9; 2,7; 2,5; 2,3; 2,2; 2,1; 2,0; 1,9; 1,8; 1,7; 1,6 или 1,5 часов или 1 часа). В других вариантах осуществления стадию (c) проводят без предварительной очистки амплифицированного раствора и/или жидкий образец со стадии (c) включает в себя белки цельной крови и нецелевые олигонуклеотиды. В некоторых вариантах осуществления патоген выбран из бактерий и грибов. Патоген может представлять собой любой бактериальный или грибковой патоген, описанный в данном документе.
Изобретение также относится к способу детектирования наличия патогена в образце цельной крови, причем данный способ включает в себя следующие стадии: (a) предоставление образца цельной крови от пациента; (b) смешивание от 0,05 до 4,0 мл образца цельной крови (например, от 0,05 до 0,25, от 0,25 до 0,5, от 0,25 до 0,75, от 0,4 до 0,8, от 0,5 до 0,75, от 0,6 до 0,9, от 0,65 до 1,25, от 1,25 до 2,5, от 2,5 до 3,5 или от 3,0 до 4,0 мл цельной крови) с раствором агента лизиса эритроцитов для получения разрушенных красных кровяных клеток; (c) следующее за стадией (b) центрифугирование образца с целью образования супернатанта и осадка, отбрасывание некоторого количества супернатанта или всего супернатанта и ресуспендирование осадка с образованием экстракта, необязательно промывание осадка (например, ТЕ-буфером) до ресуспендирования осадка и необязательно повторение стадии (c); (d) лизис клеток экстракта с целью образования лизата; (e) помещение лизата со стадии (d) в детекционную пробирку и амплифицирование нуклеиновой кислоты-мишени в лизате для образования раствора раствора подвергшегося амплифицированию лизата, включающего в себя нуклеиновую кислоту-мишень, причем данная нуклеиновая кислота-мишень является характерной для патогена, который должен быть обнаружен; (f) следующее за стадией (e) добавление к детекционной пробирке от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×109 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (g) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (h) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (i) следующее за стадией (h) измерение сигнала от детекционной пробирки; и (j) детектирование патогена на основании результата, полученного на стадии (i), причем патоген выбран из бактерий и грибов, и при этом данным способом возможно детектировать патоген в концентрации 10 клеток/мл (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 клеток/мл) в образце цельной крови. В некоторых вариантах осуществления стадии от (a) до (i) завершаются в течение 3 часов (например, в течение 3,2; 2,9; 2,7; 2,5; 2,3; 2,2; 2,1; 2,0; 1,9; 1,8; 1,7; 1,6 или 1,5 часов или 1 часа). В еще других вариантах осуществления стадию (i) проводят без предварительной очистки раствора подвергшегося амплифицированию лизата и/или жидкий образец со стадии (i) включает в себя белки цельной крови и нецелевые олигонуклеотиды. В некоторых вариантах осуществления патоген выбран из бактерий и грибов. Патоген может представлять собой любой бактериальный или грибковой патоген, описанный в данном документе. В определенных вариантах осуществления данный способ позволяет измерить в образце цельной крови концентрацию патогена, равную 10 клеток/мл, с коэффициентом вариации, составляющим менее 15% (например, 10 клеток/мл с коэффициентом вариации, составляющим менее 15%, 10%, 7,5% или 5%; или 25 клеток/мл с коэффициентом вариации, составляющим менее 15%, 10%, 7,5% или 5%; или 50 клеток/мл с коэффициентом вариации, составляющим менее 15%, 10%, 7,5% или 5%; или 100 клеток/мл с коэффициентом вариации, составляющим менее 15%, 10%, 7,5% или 5%). В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Способ мониторинга может включать в себя любой из способов агрегации, обусловленной магнитными взаимодействиями, описанный в данном документе. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени.
Настоящее изобретение дополнительно относится к способу детектирования присутствия вируса в образце цельной крови, причем данный способ включает в себя следующие стадии: (a) предоставление образца плазмы от пациента; (b) смешивание от 0,05 до 4,0 мл образца плазмы (например, от 0,05 до 0,25, от 0,25 до 0,5, от 0,25 до 0,75, от 0,4 до 0,8, от 0,5 до 0,75, от 0,6 до 0,9, от 0,65 до 1,25, от 1,25 до 2,5, от 2,5 до 3,5 или от 3,0 до 4,0 мл цельной крови) с агентом лизиса для получения смеси, содержащей разрушенные вирусы; (c) помещение смеси со стадии (b) в контейнер и амплифицирование нуклеиновой кислоты-мишени в фильтрате для образования раствора подвергшегося амплифицированию фильтрата, включающего в себя нуклеиновую кислоту-мишень, причем данная нуклеиновая кислота-мишень является характерной для вируса, который должен быть обнаружен; (d) следующее за стадией (c) смешивание раствора подвергшегося амплифицированию фильтрата с от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700 нм, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (e) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (f) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (g) следующее за стадией (f) измерение сигнала от детекционной пробирки; и (h) определение вируса на основании результата, полученного на стадии (g), причем данным способом возможно детектировать менее 100 копий вируса (например, менее 80, 70, 60, 50, 40, 30, 20 или 10 копий) в образце цельной крови. В некоторых вариантах осуществления стадии от (a) до (g) завершаются в течение 3 часов (например, в течение 3,2; 2,9; 2,7; 2,5; 2,3; 2,2; 2,1; 2,0; 1,9; 1,8; 1,7; 1,6 или 1,5 часов или 1 часа или менее). Патоген может представлять собой любой вирусный патоген, описанный в данном документе. В некоторых вариантах осуществления магнитные частицы являются по существу моно дисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Способ мониторинга может включать в себя любой из способов агрегации, обусловленной магнитными взаимодействиями, описанный в данном документе. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени.
В любой из систем и способов по изобретению, в которой(ом) выполняется ПЦР, метод ПЦР может представлять собой ПЦР в режиме реального времени для количественного определения количества нуклеиновой кислоты, присутствующей в образце.
Настоящее изобретение дополнительно относится к способу количественного определения молекулы нуклеиновой кислоты-мишени в образце путем амплифицирования молекулы нуклеиновой кислоты-мишени (например, с использованием ПЦР или изотермической амплификации) в реакционной смеси для проведения амплификации, помещенной в детекционную пробирку, в результате чего продуцируются ампликоны, соответствующие молекуле нуклеиновой кислоты-мишени В данном способе реакционная смесь для проведения амплификации включает в себя (1) молекулу нуклеиновой кислоты-мишени, (2) амплификационные праймеры, специфичные для данной молекулы нуклеиновой кислоты-мишени, и (3) суперпарамагнитные частицы. По данному способу амплификация выполняется в устройстве, включающем в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя суперпарамагнитные частицы и молекулу нуклеиновой кислоты-мишени, и имеющем РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов. Амплифицирование по данному способу включает в себя следующие стадии:
(a) выполнение одного или более циклов амплификации;
(b) помещение реакционной смеси для проведения амплификации или ее аликвоты в условия, позволяющие агрегацию или дезагрегацию суперпарамагнитных частиц,
(c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов;
(d) следующее за стадией (c) измерение сигнала от детекционной пробирки;
(e) повторение стадий от (a) до (d) до получения требуемого количества продукта амплификации; и
(f) на основе результата стадии (d) количественное определение ампликонов, присутствующих при соответствующем цикле амплификации.
При данном способе первоначальное количество молекулы нуклеиновой кислоты-мишени в образце определяется на основе количества ампликонов, определяемых в каждом цикле амплификации.
В любом из вышеуказанных способов количественного определения молекулы нуклеиновой кислоты-мишени детекционная пробирка может оставаться закрытой в ходе всей реакции амплификации. Суперпарамагнитные частицы по данным способам могут иметь диаметр, составляющий более или менее 100 нм (например, диаметр, равный 30 нм).
Кроме того, в любом из вышеуказанных способов количественного определения молекулы нуклеиновой кислоты-мишени способы могут дополнительно включать в себя наложение магнитного поля на детекционную пробирку после измерения сигнала от детекционной пробирки, приводящее к отложению суперпарамагнитных частиц на боковой части детекционной пробирки, и снятие магнитного поля после завершения одного или более дополнительных циклов амплификации.
Кроме того, в любом из вышеуказанных способов количественного определения молекулы нуклеиновой кислоты-мишени образец может, например, не включать в себя изолированные молекулы нуклеиновых кислот перед стадией (a) (например, данный образец может представлять собой цельную кровь или не содержать молекулу нуклеиновой кислоты-мишени перед стадией (a)).
Настоящее изобретение относится к способу мониторинга одного или более аналитов в жидком образце, происходящем от пациента, для диагностики, управления или лечения заболевания у пациента, причем данный способ включает в себя: (a) объединение с жидким образцом от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700 нм, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и в котором магнитные частицы имеют на поверхностях связывающие остатки, причем данные связывающие остатки действуют, изменяя специфическую агрегацию магнитных частиц в присутствии одного или более аналитов или поливалентного связывающего агента; (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы и один или более аналитов, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; (e) на основании результата, полученного на стадии (d) мониторинг одного или более аналитов; и (f) использование результата стадии (e) для диагностики, управления или лечения заболевания. В одном варианте осуществления один или более аналитов включают в себя креатинин. В другом варианте осуществления пациент имеет ослабленный иммунитет, и один или более аналитов включают в себя аналит, выбранный из ассоциированных с патогенами аналитов, антибиотиков, противогрибковых средств и противовирусных препаратов (например, один или более аналитов могут включать в себя Candida spp., такролимус, флуконазол и/или креатинин). В еще одном варианте осуществления у пациента имеется рак, и один или более аналитов выбраны из противоопухолевых агентов и генетических маркеров, присутствующих в раковой клетке. У пациента может иметься инфекция, или пациент может подвергаться риску инфекции, и один или более аналитов включают в себя аналит, выбранный из ассоциированных с патогенами аналитов, антибиотиков, противогрибковых средств и противовирусных препаратов. У пациента может иметься иммуновоспалительное заболевание, и один или более аналитов включают в себя аналит, выбранный из противовоспалительных средств и TNF-альфа. У пациента может иметься заболевание сердца, и один или более аналитов могут включать в себя сердечный маркер. Пациент может иметь диагноз ВИЧ/СПИД, и один или более аналитов могут включать в себя CD3, вирусный компонент и AZT. В некоторых вариантах осуществления данный способ используется, чтобы контролировать функцию печени пациента, и в котором один или более аналитов выбираются из альбумина, аспартат-трансаминазы, аланин-трансаминазы, щелочной фосфатазы, гамма-глутамилтранспептидазы, билирубина, альфа-фетопротеина, лактатдегидрогеназы, митохондриальных антител и цитохрома Р450. Например один или более аналитов включают в себя полиморфизмы цитохрома Р450, а также оценивается способность пациента к метаболизму лекарственного препарата. Данный способ может включать в себя выявление пациента как плохого метаболизатора, нормального метаболизатора, промежуточного метаболизатора или сверхбыстрого метаболизатора. Данный способ может быть использован для определения соответствующей дозы терапевтического средства у пациента посредством (i) введения пациенту терапевтического средства; (ii) следующего за стадией (i) получения от пациента образца, включающего в себя терапевтическое средство или его метаболит; (iii) контактирования данного образца с магнитными частицами и подвергания образца воздействию подмагничивающего поля и последовательности РЧ импульсов и детектдетектирования сигнала, испускаемого образцом; и (iv) определения концентрации терапевтического средства или его метаболита на основании результата, полученного на стадии (iii). Данное терапевтическое средство может представлять собой противораковое средство, антибиотик, противогрибковое средство или любое терапевтическое средство, описанное в данном документе. В любом из вышеперечисленных способов мониторинга мониторинг может осуществляться с перерывами (например, периодически) или быть непрерывным. В некоторых вариантах осуществления магнитные частицы являются по существу моно дисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Способ мониторинга может включать в себя любой из способов агрегации, обусловленной магнитными взаимодействиями, описанный в данном документе.
Настоящее изобретение относится к способу диагностики сепсиса у пациента, причем данный способ включает в себя: (a) получение жидкого образца, происходящего из крови пациента, (b) приготовление первого анализируемого образца объединением с порцией жидкого образца, содержащей от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700 нм, от 700 до 850, от 800 до 950, от 900 до 1050, или от 1000 до 1200 нм) и значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и в котором магнитные частицы имеют на поверхностях связывающие остатки, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии одного или более ассоциированных с патогенами аналитов, или поливалентного связывающего агента; (c) приготовление второго анализируемого образца объединением с порцией жидкого образца, содержащей от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700 нм, от 700 до 850, от 800 до 950, от 900 до 1050, или от 1000 до 1200 нм) и значение релаксивности Т2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и в котором магнитные частицы имеют на поверхностях связывающие остатки, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии одного или более характерных для сепсиса аналитов, выбранных из GRO-альфа, белка High mobility group-box 1 protein (HMBG-1), рецептора IL-1, антагониста рецептора IL-1, IL-1b, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-13, IL-18, макрофагального воспалительного белка (macrophage inflammatory protein (MIP-1)), фактора ингибирования миграции макрофагов (macrophage migration inhibitory factor (MIF)), остеопонтина, RANTES (регулируемого активацией, в норме экспрессируемого и секретируемого Т-клетками; или CCL5), TNF-α, C-реактивного белка (CRP), CD64, хемотаксического для моноцитов белка 1 (monocyte chemotactic protein 1 (MCP-1)), белка, связывающего аденозиндезаминазу (adenosine deaminase binding protein (ABP-26)), индуцируемой синтетазы оксида азота (inducible nitric oxide synthetase ((iNOS)), липополисахарид-связывающего белка и прокальцитонина, (d) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы и один или более аналитов, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (e) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (f) следующее за стадией (e) измерение сигнала, испускаемого первым анализируемым образцом, и сигнала, испускаемого вторым анализируемым образцом; (g) на основании результата, полученного на стадии (f) мониторинг одного или более аналитов первого анализируемого образца и мониторинг одного или более аналитов второго анализируемого образца; и (h) использование результатов со стадии (d) для постановки диагноза пациенту. В одном варианте осуществления один или более ассоциированных с патогенами аналитов первого анализируемого образца происходят от ассоциированного с сепсисом патогена, выбранного из Acinetobacter baumannii, Aspergillus fumigatis, Bacteroides fragilis, B. fragilis, blaSHV, Burkholderia cepacia, Campylobacter jejuni/coli, Candida guilliermondii, C. albicans, C. glabrata, C. krusei, C. lusitaniae, C. parapsilosis, C. tropicalis, Clostridium pefringens, Coagulase negative Staph, Enterobacter aeraogenes, Е. cloacae, Enterobacteriaceae, Enterococcus faecalis, Е. faecium, Escherichia coli, Haemophilus influenzae, Kingella Kingae, Klebsiella oxytoca, K. pneumoniae, Listeria monocytogenes, гена Mec A (MPSA), Morganella morgana, Neisseria meningitidis, Neisseria spp.non-meningitidis, Prevotella buccae, P. intermedia, P. melaninogenica, Propionibacterium acnes, Proteus mirabilis, P. vulgaris, Pseudomonas aeruginosa. Salmonella enterica, Serratia marcescens, Staphylococcus aureus, S. haemolyticus, S. maltophilia, S. saprophyticus, Stenotrophomonas maltophilia, S. maltophilia. Streptococcus agalactie, S. bovis, S. dysgalactie, S. mitis, S. mutans, S. pneumoniae, S. pyogenes и S. sanguinis. Один или более ассоциированных с патогенами аналитов могут происходить от резистентных к лечению штаммов бактерий, таких как пенициллин-резистентные, метициллин-резистентные, хинолон-резистентные, макролид-резистентные и/или ванкомицин-резистентные штаммы бактерий (например, метициллин-резистентный Staphylococcus aureus или ванкомицин-резистентный энтерококк). В некоторых вариантах осуществления один или более аналитов второго анализируемого образца выбраны из GRO-альфа, белка High mobility group-box 1 protein (HMBG-1), рецептора IL-1, антагониста рецептора IL-1, IL-1b, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-13, IL-18, макрофагального воспалительного белка (macrophage inflammatory protein (MIP-1)), фактора ингибирования миграции макрофагов (macrophage migration inhibitory factor (MIF)), остеопонтина, RANTES (регулируемого активацией, в норме экспрессируемого и секретируемого Т-клетками; или CCL5), TNF-α, C-реактивного белка (CRP), CD64 и хемотаксического для моноцитов белка 1 (monocyte chemotactic protein 1 (MCP-1)). В определенном варианте осуществления способ дополнительно включает в себя приготовление третьего анализируемого образца для мониторинга концентрации противовирусного средства, антибиотика или противогрибкового средства, циркулируемого в крови пациента. В некоторых вариантах осуществления пациент может являться пациентом с ослабленным иммунитетом или пациентом, подверженным риску стать пациентом с ослабленным иммунитетом. В любом из вышеперечисленных способов мониторинга мониторинг может осуществляться с перерывами (например, периодически) или быть непрерывным. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Способ мониторинга может включать в себя любой из способов агрегации, обусловленной магнитными взаимодействиями, описанный в данном документе.
Настоящее изобретение дополнительно относится к способу мониторинга одного или более аналитов в жидком образце, полученном от пациента для диагностики, управления или лечения сепсиса или синдрома системного воспалительного ответа (ССВО (SIRS)) у пациента, причем данный способ включает в себя: (a) объединение с жидким образцом от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700 нм, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности Т2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и в котором магнитные частицы имеют на поверхностях связывающие остатки, причем данные связывающие остатки действуют, изменяя специфическую агрегацию магнитных частиц в присутствии одного или более аналитов или поливалентного связывающего агента; (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы и один или более аналитов, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; (e) на основании результата, полученного на стадии (d) мониторинг одного или более аналитов; и (f) использование результата, полученного на стадии (e) для диагностики, управления или лечения сепсиса или ССВО. Данный способ может включать в себя (i) мониторинг ассоциированного с патогеном аналита и (ii) мониторинг второго характерного для сепсиса аналита, выбранного из GRO-альфа, белка High mobility group-box 1 protein (HMBG-1), рецептора IL-1, антагониста рецептора IL-1, IL-1b, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-13, IL-18, макрофагального воспалительного белка (macrophage inflammatory protein (MIP-1)), фактора ингибирования миграции макрофагов (macrophage migration inhibitory factor (MIF)), остеопонтина, RANTES (регулируемого активацией, в норме экспрессируемого и секретируемого T-клетками; или CCL5), TNF-α, C-реактивного белка (CRP), CD64, хемотаксического для моноцитов белка 1 (monocyte chemotactic protein 1 (MCP-1)), белка, связывающего аденозиндезаминазу (adenosine deaminase binding protein (ABP-26)), индуцируемой синтетазы оксида азота (inducible nitric oxide synthetase ((iNOS)), липополисахарид-связывающего белка и прокальцитонина. В некоторых вариантах осуществления ассоциированный с патогеном аналит происходит от ассоциированного с сепсисом патогена, выбранного из Acinetobacter baumannii, Aspergillus fumigatis, Bacteroides fragilis, B. fragilis, blaSHV, Burkholderia cepacia, Campylobacterjejuni/coli, Candida guilliermondii, C. albicans, C. glabrata, C. krusei, C. lusitaniae, C. parapsilosis, C. tropicalis, Clostridium pefringens, Coagulase negative Staph, Enterobacter aeraogenes, E. cloacae, Enterobacteriaceae, Enterococcus faecalis, E. faecium, Escherichia coli, Haemophilus influenzae, Kingella Kingae, Klebsiella oxytoca, K. pneumoniae, Listeria monocytogenes, гена Мес A (MPSA), Morganella morgana, Neisseria meningitidis, Neisseria spp. non-meningitidis, Prevotella buccae, P. intermedia, P. melaninogenica, Propionibacterium acnes, Proteus mirabilis, P. vulgaris, Pseudomonas aeruginosa, Salmonella enterica, Serratia marcescens, Staphylococcus aureus, S. haemolyticus, S. maltophilia, S. saprophyticus, Stenotrophomonas maltophilia, S. maltophilia, Streptococcus agalactie, S. bovis, S. dysgalactie, S. mitis, S. mutans, S. pneumoniae, S. pyogenes и S. sanguinis. Ассоциированный с патогеном аналит может происходить от резистентных к лечению штаммов бактерий, таких как пенициллин-резистентные, метициллин-резистентные, хинолон-резистентные, макролид-резистентные, и/или ванкомицин-резистентные штаммы бактерий (например, метициллин-резистентный Staphylococcus aureus или ванкомицин-резистентный энтерококк). В определенных вариантах осуществления второй аналит выбран из GRO-альфа, белка High mobility group-box 1 protein (HMBG-1), рецептора IL-1, антагониста рецептора IL-1, IL-1b, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-13, IL-18, макрофагального воспалительного белка (macrophage inflammatory protein (MIP-1)), фактора ингибирования миграции макрофагов (macrophage migration inhibitory factor (MIF)), остеопонтина, RANTES (регулируемого активацией, в норме экспрессируемого и секретируемого T-клетками; или CCL5), TNF-α, C-реактивного белка (CRP), CD64 и хемотаксического для моноцитов белка 1 (monocyte chemotactic protein 1 (MCP-1)). В определенном варианте осуществления способ дополнительно включает в себя приготовление третьего анализируемого образца для мониторинга концентрации противовирусного средства, антибиотика или противогрибкового средства, циркулируемого в крови пациента. В некоторых вариантах осуществления пациент может являться пациентом с ослабленным иммунитетом или пациентом, подверженным риску стать пациентом с ослабленным иммунитетом. В любом из вышеперечисленных способов мониторинга мониторинг может осуществляться с перерывами (например, периодически) или быть непрерывным. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Способ мониторинга может включать в себя любой из способов агрегации, обусловленной магнитными взаимодействиями, описанный в данном документе.
Настоящее изобретение дополнительно относится к системе для детектирования одного или более аналитов в жидком образце, причем данная система включает в себя: (a) первый блок, включающий в себя (a1) постоянный магнит, определяющий магнитное поле; (a2) подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы и один или более аналитов, и имеющую РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с помощью постоянного магнита, и последовательности РЧ импульсов; и (a3) один или более электрических элементов, связанных с РЧ катушкой, причем данные электрические элементы конфигурированы так, чтобы производить усиление, исправление, передачу и/или оцифровывание сигнала; и (b) второй блок, включающий в себя сменный картридж, который имеет размер, облегчающий введение в систему и удаление из системы, причем сменный картридж представляет собой модульный картридж, включающий в себя (i) реагентный модуль для удерживания одного или более реагентов для анализа; и (ii) детекторный модуль, включающий в себя детекторную камеру для удерживания жидкого образца, включающего в себя магнитные частицы и один или более аналитов, причем реагентный модуль и детекторный модуль могут быть собраны в модульный картридж перед применением, и причем детекторную камеру можно удалять из модульного картриджа. Модульный картридж может дополнительно включать в себя входной модуль, причем входной модуль, реагентный модуль и детекторный модуль могут быть собраны в модульный картридж до использования, и причем входной модуль может быть стерилизуемым. В некоторых вариантах осуществления система дополнительно включает в себя компьютер системы с процессором для осуществления протокола анализа и хранения данных анализа, и при этом сменный картридж дополнительно включает в себя (i) читаемую этикетку с указанием аналита, который должен быть обнаружен, (ii) читаемую этикетку с указанием протокола анализа, который должен быть реализован, (iii) читаемую этикетку с указанием идентификационного номера пациента, (iv) читаемую этикетку с указанием позиции реагентов для анализа, содержащихся в картридже, или (v) читаемую этикетку, включающую в себя инструкции для программируемого процессора. Данная система может включать в себя картриджный блок, блок для перемешивания, центрифугу или любой другой компонент системы, описанный в данном документе.
Настоящее изобретение дополнительно относится к системе для детектирования одного или более аналитов, причем данная система включает в себя: (a) одноразовый держатель образца, определяющий углубление для удерживания жидкого образца и имеющий РЧ катушку, содержащуюся внутри одноразового держателя образца и расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с помощью постоянного магнита, и последовательности РЧ импульсов, причем одноразовый держатель образца включает в себя одну или более плавкие перемычки; и (b) МР-ридер, включающий в себя (b1) постоянный магнит, определяющий магнитное поле; (b2) РЧ катушку для генерации последовательности импульсов и для детекции; (b3) один или более электрических элементов, связанных с РЧ катушкой, причем данные электрические элементы конфигурированы на усиление, исправление, передачу и/или оцифровывание сигнала; и (b4) один или более электрических элементов, связанных с плавкой перемычкой и конфигурированных так, чтобы подать избыточный ток на плавкую перемычку, вызывая разрыв перемычки и выведение катушки из строя после истечения заданного времени работы. В некоторых вариантах осуществления электрический элемент, связанный с РЧ катушкой, является индуктивно связанным с РЧ катушкой.
Настоящее изобретение относится к системе для детектирования креатинина, такролимуса и Candida, причем данная система включает в себя: (a) первый блок, включающий в себя (a1) постоянный магнит, определяющий магнитное поле; (a2) подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы и креатинин, такролимус и Candida, и имеющую РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с помощью постоянного магнита, и последовательности РЧ импульсов; и (a3) электрический элемент, связанный с РЧ катушкой, причем данный электрический элемент конфигурирован на усиление, исправление, передачу и/или оцифровывание сигнала; и (b) второй блок, включающий в себя сменный картридж, который имеет размер, облегчающий введение в систему и удаление из системы, причем сменный картридж представляет собой модульный картридж, включающий в себя (i) несколько реагентных модулей для удерживания одного или более реагентов для анализа; и (ii) несколько детекторных модулей, включающих в себя детекторную камеру для удерживания жидкого образца, включающего в себя магнитные частицы и креатинин, такролимус и Candida, причем несколько реагентных модулей включает в себя (i) первую популяцию магнитных частиц, имеющих средний диаметр в интервале от 150 нм до 699 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 699 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и антитела к креатинину, конъюгированные с их поверхностью; (ii) поливалентный связывающий агент, несущий многочисленные конъюгаты креатинина, предназначенный для образования агрегатов с первой популяцией магнитных частиц в отсутствие креатинина; (iii) вторую популяцию магнитных частиц, имеющих средний диаметр в интервале от 150 нм до 699 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 699 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и антитела к такролимусу, конъюгированные с их поверхностью; (iv) поливалентный связывающий агент, несущий многочисленные конъюгаты такролимуса, предназначенный для образования агрегатов с первой популяцией магнитных частиц в отсутствие такролимуса; (v) третью популяцию магнитных частиц, имеющих средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050, или от 1000 до 1200 нм), значение релаксивности Т2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и конъюгированные с их поверхностью первый зонд и второй зонд, выбранные для образования агрегатов в присутствии нуклеиновой кислоты Candida, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты Candida, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты Candida. В некоторых вариантах осуществления магнитные частицы являются по существу моно дисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные аналиты, конъюгированные с полимерным каркасом. В другом варианте осуществления жидкий образец включает в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр).
Настоящее изобретение относится к способу измерения концентрации креатинина в жидком образце, причем данный способ включает в себя: (a) контактирование раствора с (i) магнитными частицами для получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700 нм, от 700 до 850, от 800 до 950, от 900 до 1050, или от 1000 до 1200 нм), значение релаксивности Т2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и конъюгированные с их поверхностью антитела к креатинину, и с (ii) поливалентным связывающим агентом, несущим многочисленные конъюгаты креатинина, предназначенным для образования агрегатов с первой популяцией магнитных частиц в отсутствие креатинина; (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы, поливалентный связывающий агент и креатинин, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; и (e) на основании результата, полученного на стадии (d) определение концентрации креатинина в жидком образце. В некоторых вариантах осуществления магнитные частицы являются по существу моно дисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные аналиты, конъюгированные с полимерным каркасом.
Настоящее изобретение относится к поливалентному связывающему агенту, включающему в себя два или более остатка креатинина, ковалентно связанных со каркасом. В некоторых вариантах осуществления поливалентный связывающий агент представляет собой соединение формулы (I):

где (A) представляет собой

(B) представляет собой полимерный каркас, ковалентно присоединенный к каждому (A), m представляет собой целое число от 2 до 10, и n представляет собой целое число от 2 до 50.
Настоящее изобретение относится к раствору, включающему в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 600 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 600 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеют поверхность, несущую конъюгат креатинина (A), где (A) выбран из:

и m представляет собой целое число от 2 до 10.
Настоящее изобретение дополнительно относится к раствору, включающему в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 600 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 600 нм), значение релаксивности Т2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеют поверхность, несущую антитела, обладающие сродством к конъюгату креатинина (например, конъюгату креатинина, описанному в данном документе).
Настоящее изобретение дополнительно относится к способу измерения концентрации такролимуса в жидком образце, причем данный способ включает в себя: (a) контактирование раствора с (i) магнитными частицами для получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 1200 нм (например, от 150 до 250, 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650, от 500 до 700 нм, от 700 до 850, от 800 до 950, от 900 до 1050, или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеют антитела к такролимусу, конъюгированные с их поверхностью, и с (ii) поливалентным связывающим агентом, несущим многочисленные конъюгаты такролимуса, предназначенным для образования агрегатов с первой популяцией магнитных частиц в отсутствие такролимуса; (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы, поливалентный связывающий агент и такролимус, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; и (e) на основании результата, полученного на стадии (d) определение концентрации такролимуса в жидком образце. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные аналиты, конъюгированные с полимерным каркасом.
Настоящее изобретение относится к поливалентному связывающему агенту, включающему в себя два или более остатка такролимуса, включая метаболиты такролимуса, описанные в данном документе, или соединения с подобной структурой, к которым данное антитело имеет сродство, будучи ковалентно связанным со каркасом. В некоторых вариантах осуществления поливалентный связывающий агент представляет собой соединение формулы (II):

где (A) представляет собой

(B) представляет собой полимерный каркас, ковалентно присоединенный к каждому (А), и
n представляет собой целое число от 2 до 50.
Настоящее изобретение относится к раствору, включающему в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 600 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 600 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеют поверхность, несущую антитела, обладающие сродством к конъюгату такролимуса:

где (B) представляет собой полимерный каркас.
В варианте осуществления любого из вышеперечисленных растворов (i) магнитные частицы являются по существу монодисперсными; (ii) магнитные частицы проявляют неспецифическую обратимость в плазме; (iii) магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана); (iv) жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию; и/или (iv) магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Данные растворы могут быть использованы в любой из систем или способов, описанных в данном документе.
Настоящее изобретение относится к сменному картриджу, который имеет размер, облегчающий введение в систему и удаление из системы по изобретению, причем данный сменный картридж включает в себя одну или более камер для удерживания нескольких реагентных модулей для удерживания одного или более реагентов для анализа, причем реагентные модули включают в себя (i) камеру для удерживания от 1×106 до 1×1013 магнитных частиц (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц), имеющих средний диаметр в интервале от 100 нм до 699 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 699 нм), значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеющих на своих поверхностях связывающие остатки, причем данные связывающие остатки действуют, изменяя специфическую агрегацию магнитных частиц в присутствии одного или более аналитов или поливалентного связывающего агента; и (ii) камеру для удерживания буфера. Связанная с вышеизложенным задача изобретения относится к сменному картриджу, который имеет размер, облегчающий введение в систему и удаление из системы по изобретению, где данный сменный картридж включает в себя одну или более камер для удерживания нескольких реагентных модулей для удерживания одного или более реагентов для анализа, причем данные реагентные модули включают в себя (i) камеру для удерживания от 1×106 до 1×1013 магнитных частиц (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц), имеющих средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050, или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×109 до 1×1012 ммоль-1сек-1 (например, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеющих на своих поверхностях олигонуклеотидные связывающие остатки, причем данные олигонуклеотидные связывающие остатки действуют, изменяя специфическую агрегацию магнитных частиц в присутствии одного или более аналитов; и (ii) камеру для удерживания буфера. Магнитные частицы могут представлять собой любые частицы из описанных в данном документе, будучи покрытыми любыми связывающими остатками, описанными в данном документе, для детектирования любого аналита, описанного в данном документе. В определенных вариантах осуществления сменных картриджей магнитные частицы и буфер находятся вместе в одной камере внутри картриджа. В еще других вариантах осуществления буфер включает в себя от 0,1% до 3% (масс./масс.) альбумина, от 0,01% до 0,5% неионогенного сурфактанта, агент лизиса или их комбинацию. Сменный картридж может дополнительно включать в себя камеру, включающую в себя шарики для лизиса клеток; камеру, включающую в себя полимеразу, и/или камеру, включающую в себя праймер.
Настоящее изобретение относится к сменному картриджу, который имеет размер, облегчающий введение в систему и удаление из системы по изобретению, причем данный сменный картридж включает в себя одну или более камер для удерживания нескольких реагентных модулей для удерживания одного или более реагентов для анализа, причем данные реагентные модули включают в себя (i) камеру для удерживания от 1×108 до 1×1010 магнитных частиц, имеющих средний диаметр в интервале от 100 нм до 350 нм, значение релаксивности T2 на одну частицу, составляющее от 5×108 до 1×1010 ммоль-1сек-1, и имеющих на своих поверхностях связывающие остатки (например, антитела, конъюгированный аналит), причем данные связывающие остатки действуют, изменяя специфическую агрегацию магнитных частиц в присутствии одного или более аналитов или поливалентного связывающего агента; и (ii) камеру для удерживания буфера, включающего в себя от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В одном варианте осуществления магнитные частицы и буфер находятся вместе в одной камере внутри картриджа.
В любой(м) из систем, наборов, картриджей и способов по изобретению жидкий образец может включать в себя от 1×108 до 1×1010 магнитных частиц, имеющих средний диаметр в интервале от 100 нм до 350 нм, значение релаксивности T2 на одну частицу, составляющее от 1×108 до 1×1010 ммоль-1сек-1, и и имеющих на своих поверхностях связывающие остатки (например, антитела, конъюгированный аналит), причем данные связывающие остатки действуют, изменяя специфическую агрегацию магнитных частиц в присутствии одного или более аналитов или поливалентного связывающего агента.
В любой(м) из систем, наборов, картриджей и способов по изобретению для детектирования любого аналита в образце цельной крови разрушение красных кровяных клеток может быть осуществлено с использованием агента лизиса эритроцитов (например, буфер для лизиса или неионогенный детергент). Буферы для лизиса эритроцитов, которые можно использовать в способах по изобретению, включают в себя, без ограничения, изотонические растворы хлорида аммония (необязательно включающие в себя карбонатный буфер и/или EDTA) и гипотонические растворы. Альтернативно, агент лизиса эритроцитов может представлять собой водные растворы неионных детергентов (например, нонилфеноксиполиэтоксилэтанол (NP-40), 4-октилфенолполиэтоксилат (Triton-X100), Brij-58 или родственные неионные сурфактанты и их смеси). Агент лизиса эритроцитов разрушает, по меньшей мере, некоторые из красных кровяных клеток, что позволяет отделить большую фракцию некоторых компонентов цельной крови (например, некоторые белки цельной крови) (например, в виде супернатанта после центрифугирования) от белых кровяных клеток, дрожжевых клеток и/или бактериальных клеток, присутствующих в образце цельной крови. После лизиса эритроцитов и центрифугирования полученный осадок восстанавливают для образования экстракта.
Способы, наборы, картриджи и системы по изобретению могут быть подобраны для детектирования заданной панели ассоциированных с патогенами аналитов. Например, данная панель может представлять собой панель грибов Candida, подобранную для отдельного детектирования трех или более из Candida guilliermondii, С. albicans, С. glabrata, С. krusei, С. Lusitaniae, С. parapsilosis и С. tropicalis. В другом варианте осуществления данная панель может представлять собой бактериальную панель, подобранную для отдельного детектирования трех или более из коагулазоотрицательного Staphylococcus, Enterococcus faecalis, E. faecium, Pseudomonas aeruginosa, Staphylococcus aureus и Escherichia coli. В определенном варианте осуществления данная панель может представлять собой вирусную панель, подобранную для отдельного детектирования трех или более из Cytomegalovirus (CMV), вируса Epstein Ban, вируса ВК, вируса гепатита B, вируса гепатита C, Herpes simplex virus (HSV), HSV1, HSV2, Respiratory syncytial virus (RSV), Influenza; Influenza A, Influenza A subtype HI, Influenza A subtype H3, Influenza B, вируса герпеса человека 6-го типа (Human Herpes 6), вируса герпеса человека 8-го типа (Human Herpes 8), Human Metapneumovirus (hMPV), риновируса (Rhinovirus), Parainfluenza 1, Parainfluenza 2, Parainfluenza 3 и аденовируса (Adeno virus). Данная панель может представлять собой бактериальную панель, подобранную для отдельного детектирования трех или более из Е. coli, CoNS (коагулазоотрицательный стафилококк), Pseudomonas aeruginosa, S. aureus, Е. faecium, Е. faecalis и Klebsiella pneumonia. Данная панель может представлять собой бактериальную панель, подобранную для отдельного детектирования трех или более из A. fumigates и A. flavum. Данная панель может представлять собой бактериальную панель, подобранную для отдельного детектирования трех или более из Acinetobacter baumannii, Enterobacter aeraogenes, Enterobacter cloacae, Klebsiella oxytoca, Proteus mirabilis, Serratia marcescens, Staphylococcus haemolyticus, Stenotro-phomonas maltophilia. Streptococcus agalactie, Streptococcus mitis, Streptococcus pneumonia и Streptococcus pyogenes. Данная панель может представлять собой ʺменингитнуюʺ панель, подобранную для отдельного детектирования трех или более из Streptococcus pneumonia, Н. influenza, Neisseria Meningitis, HSV1, HSV2, Entero virus, Listeria, Е. coli, стрептококков группы В (Group В Streptococcus). Данная панель может быть подобрана для отдельного детектирования трех или более из N. gonnorrhoeae, S. aureus, S. pyogenes, CoNS и Borrelia burgdorferi. Данная панель может быть подобрана для отдельного детектирования трех или более из C. Difficile, токсина A и токсина B. Данная панель может представлять собой ʺпневмонийнуюʺ панель, подобранную для отдельного детектирования трех или более из Streptococcus pneumonia, MPSA, Legionella, C. pneumonia и Mycoplasma Pneumonia. Данная панель может быть подобрана для отдельного детектирования трех или более резистентных к лечению мутаций, выбранных из mecA, vanA, vanB, NDM-1, KPC VIM. Данная панель может быть подобрана для отдельного детектирования трех или более из Н. influenza, N. gonnorrhoeae, H. pylori, Campylobacter, Brucella, Legionella и Stenotrophomonas maltophilia. Данная панель может быть подобрана для детектирования общей вирусной нагрузки, вызванной CMV, EBV, вирусом ВК, HIV, HBV и HCV. Данная панель может быть подобрана для детектирования грибковой нагрузки и/или бактериальной нагрузки. Определение вирусной нагрузки можно проводить при помощи стандартной кривой и измерения образца в сравнении с данной стандартной кривой или каким-либо другим способом количественного определения патогена в образце. Количественный способ измерения может включать в себя ПЦР в режиме реального времени, конкурентную ПЦР (отношение двух конкурентных сигналов) или другие способы, упомянутые в данном документе. Данная панель может быть подобрана для детектирования иммунного ответа у пациента путем мониторинга РСТ, МСР-1, CRP, GRO-альфа, белка High mobility group-box 1 protein (HMBG-1), рецептора IL-1, антагониста рецептора IL-1, IL-1b, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-13, IL-18, макрофагального воспалительного белка (macrophage inflammatory protein (MIP-1)), фактора ингибирования миграции макрофагов (macrophage migration inhibitory factor (MIF)), остеопонтина, RANTES (регулируемого активацией, в норме экспрессируемого и секретируемого T-клетками; или CCL5), Th1, Th17 и/или TNF-a. Данная панель может быть подобрана для отдельного детектирования трех или более из Ehrlichea, Mycobacterium, Syphillis, Borrelia burgdorferi, Cryptococcus, Histoplasma и Blastomyces. Данная панель может представлять собой панель для детектирования возбудителей гриппа, подобранную для отдельного детектирования трех или более из Influenza A, Influenza В, RSV (ОРВИ), парагриппа (Parainfluenza), Meta-pneumovirus, риновируса (Rhino virus) и аденовируса (Adeno virus).
Способы, формы, картриджи и системы по изобретению могут быть подобраны так, чтобы уменьшить вариабельность образцов путем определения сигнала магнитного резонанса до и после гибридизации. Добавление дериватизированных наночастиц к образцу до применения способов увеличения кластеризации может обеспечить базовую линию, внутренний сигнал T2, который может быть либо вычтен, либо использован для коррекции сигнала T2 после связывания и кластеризации дериватизированных аналитами частиц. Данный способ также может быть использован для определения или учета вариабельности, обусловленной различиями между отдельными картриджами.
Понятия ʺагрегацияʺ, ʺагломерацияʺ и ʺкластеризацияʺ используются взаимозаменяемо по отношению к магнитным частицам, описанным в данном документе, и означают связывание двух или более магнитных частиц друг с другом, например, с помощью поливалентного аналита, мультимерной формы аналита, антитела, молекулы нуклеиновой кислоты или другой связывающей молекулы или субстанции. В некоторых случаях агломерация магнитных частиц является обратимой.
Под ʺаналитомʺ понимается вещество или составная часть образца, подлежащего анализу. Примеры аналитов включают в себя один или более видов одного или более из следующего: белок, пептид, полипептид, аминокислота, нуклеиновая кислота, олигонуклеотид, РНК, ДНК, антитело, углевод, полисахарид, глюкоза, липид, газ (например, кислород или углекислый газ), электролит (например, натрий, калий, хлорид, бикарбонат, азот мочевины крови (Blood Urea Nitrogen (BUN)), магний, фосфат, кальций, аммиак, молочная кислота), липопротеин, холестерин, жирная кислота, гликопротеин, протеогликан, липополисахарид, маркер клеточной поверхности (например, CD3, CD4, CD8, IL2R или CD35), цитоплазматический маркер (например, CD4/CD8 или CD4/вирусная нагрузка), терапевтическое средство, метаболит терапевтического средства, маркер для детектирования оружия (например, химического или биологического оружия), организм, патоген, побочный продукт патогена, паразит (например, простейшее или гельминт), протист, гриб (например, дрожжи или плесень), бактерия, актиномицет, клетка (например, целая клетка, опухолевая клетка, стволовая клетка, белая кровяная клетка, T-клетка (например, проявляющая CD3, CD4, CD8, IL2R, CD35 или другие поверхностные маркеры), или другая клетка, отождествляемая с одним или более специфическими маркерами), вирус, прион, растительный компонент, побочный продукт растения, водоросли, побочный продукт морских водорослей, гормон роста растений, инсектицид, техногенный токсин, экологический токсин, компонент масла и компоненты, происходящие из них. Для целей настоящего изобретения понятие ʺнебольшая молекулаʺ относится к лекарственному препарату, лекарству, медикаменту или другому химически синтезированному соединению, которое предусматривается для использования при терапии человека. Для целей настоящего изобретения понятие ʺбиологическийʺ относится к веществу, происходящему из биологического источника, которое не является синтезированным и предусматривается для использования при терапии человека. ʺБиомаркерʺ представляет собой биологическое вещество, которое может быть использовано как показатель определенного состояния заболевания или определенного физиологического состояния организма, как правило, биомаркер представляет собой белок или другое нативное соединение, содержание которого измеряется в биологической жидкости, и чья концентрация отражает наличие или тяжесть или постановку болезненного состояния или дисфункции, или он может быть использован для мониторинга терапевтического прогресса лечения заболевания или расстройства или дисфункции или может быть использован в качестве косвенного показателя клинического исхода или прогрессии. Для целей настоящего изобретения понятие ʺметаболический биомаркерʺ относится к веществу, молекуле или соединению, синтезируемому или биологически полученному, которое используется для определения состояния пациента или функции печени или почек субъекта. Для целей настоящего изобретения понятие ʺгенотипированиеʺ относится к способности определять генетические различия в специфических генах, которые могут или не могут повлиять на фенотип конкретного гена. Для целей настоящего изобретения понятие ʺфенотипʺ относится к конечному проявлению биологической экспрессии (метаболическому или физиологическому) белка, заданного генотипом. Для целей настоящего изобретения понятие ʺпрофилирование экспрессии генаʺ относится к способности определять временным или пространственным образом скорость или объем продукции продукта гена или активность транскрипции генов в специфической ткани. Для целей настоящего изобретения понятие ʺпротеомный анализʺ относится к паттерну или массиву белков, позволяющих идентифицировать основные различия в белках или пептидах в нормальной и пораженной тканях. Дополнительные примеры аналитов описаны в данном документе. Понятие ʺаналитʺ дополнительно включает в себя компоненты образца, которые являются прямым продуктом амплификации биохимическими способами исходного аналита-мишени, такие, как продукт реакции амплификации нуклеиновой кислоты.
Под ʺизолированнойʺ молекулой нуклеиновой кислоты понимают молекулу нуклеиновой кислоты, которая удалена из окружения, в котором она находится в природных условиях. Например, встречающаяся в природных условиях молекула нуклеиновой кислоты, присутствующая в геноме клетки или в составе генного банка, не является изолированной, но та же молекула, отделенная от остальной части генома, в результате, например, события клонирования, амплификации или обогащения, является ʺизолированнойʺ. Обычно в изолированной молекуле нуклеиновой кислоты отсутствуют области нуклеиновых кислот (например, кодирующие области), к которым она непосредственно примыкает на 5'- и 3'-концах в природном геноме. Такие изолированные молекулы нуклеиновой кислоты могут представлять собой часть вектора или композиции и по-прежнему считаться изолированными, поскольку такой вектор или композиция не является частью их природного окружения.
Для целей настоящего изобретения ʺсвязанныйʺ означает присоединенный или соединенный ковалентными связями, нековалентными связями и/или связанный посредством сил Ван-дер-Ваальса, водородных связей и/или других межмолекулярных сил.
Понятие ʺмагнитная частицаʺ относится к частицам, включающим в себя материалы с высокой положительной магнитной восприимчивостью, такие как парамагнитные соединения, суперпарамагнитные соединения и магнетит, оксид гамма-железа или металлическое железо.
Для целей настоящего изобретения понятие ʺнеспецифическая обратимостьʺ относится к коллоидной стабильности и надежности магнитных частиц по отношению к неспецифической агрегации в жидком образце и может быть определена подверганием частиц воздействию предполагаемых условий анализа в отсутствие конкретного агента, способствующего кластеризации (т.е., аналита или агента агломерации). Например, неспецифическая обратимость может быть определена измерением значений T2 раствора магнитных частиц до и после инкубации в однородном магнитном поле (определяется как менее 5000 м.д.) при 0.45 Тл в течение 3 минут при 37°C. Считается, что магнитные частицы обладают неспецифической обратимостью, если различие в значениях T2 до и после подвергания магнитных частиц воздействию предполагаемых условий анализа изменяется менее чем на 10% (например, изменяется менее чем на 9%, 8%, 6%, 4%, 3%, 2% или на 1%). Если различие составляет более 10%, то данные частицы проявляют необратимость в буфере, разбавителях и матриксе, для которых проводились испытания, так что может потребоваться видоизменение свойств частиц и матрикса (например, состава покрытия и буфера) с тем, чтобы создать систему, в которой частицы обладают неспецифической обратимостью. В другом примере тестирование может быть осуществлено путем измерения значений T2 раствора магнитных частиц до и после инкубации в градиенте магнитного поля в интервале от 1 Гаусс/мм до 1000 Гаусс/мм.
Для целей настоящего изобретения понятие ʺскорость ЯМР-релаксацииʺ относится к измерению в образце любого из следующих параметров: T1, T2, гибрид T1/T2, T1rho, T2rho и T2*. Системы и способы по изобретению предназначены для получения величины скорости ЯМР-релаксации, служащей характеристикой того, присутствует ли аналит в жидком образце. В некоторых случаях скорость ЯМР-релаксации характеризует количество аналита, присутствующего в жидком образце.
Для целей настоящего изобретения понятие ʺгибрид T1/T2ʺ (T1/T2 hybrid) относится к любому способу детектирования, который объединяет измерение значений T1 и T2. Например, величина ʺT1/T2 гибридаʺ может представлять собой композитный сигнал, полученный через объединение, соотношение или разницу между двумя или более различными измерениями значений T1 и T2. Величина ʺT1/T2 гибридаʺ может быть получена, например, с помощью последовательности импульсов, в которой значения T1 и T2 измеряются порознь или поочередно. Дополнительно T1/T2 гибридный сигнал может быть получен с помощью использования последовательности импульсов и регистрации сигнала, скорость релаксации которого обусловлена скоростями релаксации как T1, так и T2 или их механизмами.
ʺПатогенʺ означает агент, вызывающий заболевание или болезнь у хозяина, такой как организм или инфекционная частица, способный вызывать заболевание в другом организме, и включает, но не ограничивается ими, бактерии, вирусы, простейшие, прионы, дрожжи и грибы или побочные продукты патогена. ʺПобочные продукты патогенаʺ представляют собой такие биологические вещества, возникающие в связи с патогеном, которые могут быть вредны для хозяина или стимулировать чрезмерный иммунный ответ хозяина, например, антиген(ы) к патогену, метаболические вещества, ферменты, биологические вещества или токсины.
Под ʺассоциированным с патогеном аналитомʺ имеется в виду аналит, характеризующий присутствие патогена (например, бактерии, гриба или вируса) в образце. Ассоциированный с патогеном аналит может представлять собой определенное вещество, происходящее из патогена (например, белок, нуклеиновая кислота, липид, полисахарид или любой другой материал, произведенный патогеном) или смесь, происходящую из патогена (например, целые клетки или целые вирусы). В некоторых случаях ассоциированный с патогеном аналит выбирается так, чтобы характеризовать род, вид или конкретный штамм детектируемого патогена. Альтернативно, ассоциированный с патогеном аналит выбирается так, чтобы установить свойство патогена, такое как резистентность к определенной терапии. Например, ассоциированный с патогеном аналит может представлять собой ген, такой как ген Van A или ген Van B, обуславливающий резистентность к ванкомицину у ряда различных видов бактерий.
Под ʺпоследовательностью импульсовʺ или ʺпоследовательностью РЧ импульсовʺ имеется в виду один или более радиочастотных импульсов, которые должны быть поданы на образец и предназначены для измерения, например, некоторых скоростей ЯМР-релаксации, таких как последовательности спинового эха. Последовательность импульсов может также включать в себя регистрацию сигнала после одного или более импульсов, чтобы свести к минимуму шум и улучшить точность полученного значения сигнала.
Для целей настоящего изобретения понятие ʺсигналʺ относится к скорости ЯМР-релаксации, сдвигу частоты, измерению чувствительности, измерению диффузии или измерениям корреляции.
Для целей настоящего изобретения ссылка на ʺразмерʺ магнитной частицы относится к среднему диаметру для смеси магнитных частиц, определенному с помощью микроскопии, рассеяния света или другими способами.
Для целей настоящего изобретения понятие ʺпо существу монодисперсныйʺ относится к смеси магнитных частиц, обладающих полидисперсностью в распределении по размерам, определяемой формой кривой распределения частиц по размерам, полученной при измерениях рассеяния света. Считается, что величина параметра FWHM (full width half maximum (полная ширина на половине высоты)) кривой распределения частиц, составляющая менее 25% от позиции максимума, характеризует по существу монодисперсные частицы. В дополнение, в экспериментах по рассеянию света должен наблюдаться только один максимум, и данный максимум должен находиться в пределах одного стандартного отклонения от величины, полученной для популяции известных монодисперсных частиц.
Под ʺвеличиной T2 релаксивности на одну частицуʺ подразумевается средняя величина T2 релаксивности на одну частицу в популяции магнитных частиц.
Для целей настоящего изобретения ʺнефракционированныйʺ относится к анализу, в котором ни один из компонентов анализируемого образца не удаляется после добавления магнитных частиц к образцу и перед измерением ЯМР-релаксации.
Предполагается, что блоки, системы, способы и процессы по заявленному изобретению охватывают вариации и адаптации, разработанные с использованием информации из вариантов осуществления, описанных в настоящем документе. На протяжении данного описания, когда блоки и системы описываются как ʺимеющиеʺ, ʺвключающие в себяʺ или ʺвключающие в себя специфические компонентыʺ, или когда процессы и способы описываются как ʺимеющиеʺ, ʺвключающие в себяʺ или ʺвключающие в себя специфические стадииʺ, предполагается, что дополнительно существуют блоки и системы по настоящему изобретению, которые ʺсостоят в основном изʺ или ʺсостоят изʺ перечисленных компонентов, и что существуют процессы и способы в соответствии с настоящим изобретением, которые ʺсостоят в основном изʺ или ʺсостоят изʺ перечисленных стадий обработки. Следует иметь в виду, что порядок стадий или порядок выполнения некоторых действий не имеет значения, если не указано иное, до тех пор, пока настоящее изобретение остается действующим. Более того, во многих случаях две или более стадий или действий могут проводиться одновременно.
Другие признаки и преимущества данного изобретения будут очевидны из последующего подробного описания, чертежей и формулы изобретения.
Краткое описание чертежей
На фигуре 1A представлена блок-схема устройства ЯМР для детектирования ответа сигнала образца на последовательность РЧ-импульсов в соответствии с вариантом осуществления изобретения, приведенным в качестве наглядного примера.
На фигуре 1B представлено изображение типичной конфигурации катушки, окружающей пробирку с образцом для измерения релаксационного сигнала в образце объемом 20 мкл.
Фигуры 2A-2E иллюстрируют геометрические формы микрокатушек, которые могут быть использованы в ЯМР (для возбуждения и/или детектирования); конструкции включают, но не ограничиваются ими, намотанную соленоидальную катушку (фигура 2A), плоскую катушку (фигура 2B), MEMS (micro-electromechanical system (микроэлектромеханическая система))-соленоид (фигура 2C), MEMS-катушку Гельмгольца (фигура 2D) и седловидную катушку (фигура 2E), в соответствии с вариантом осуществления изобретения, приведенным в качестве наглядного примера. Изготовление катушек трехмерным литографическим способом для хорошо охарактеризованных катушек, используемых при МР-детектирования, также известно и может быть использовано для данных приложений, см. Demas et al. ʺElectronic characterization of lithographically patterned microcoils for high sensitivity NMP detectionʺ J Magn Reson 200:56 (2009).
На фигуре 3A представлен чертеж, изображающий принцип анализа на агрегацию по изобретению. Магнитные частицы (точки) покрыты связывающим агентом (т.е. антителом, олигонуклеотидом и т.д.), так что в присутствии аналита или поливалентного связывающего агента образуются агрегаты. Пунктирными кружками представлена область диффузии или часть от общего объема жидкости, которую молекула раствора может занимать благодаря ее диффузии во время измерения Т2 (точный путь, пройденный молекулой воды, является случайным и не соответствует шкале данного чертежа). В результате агрегации (см. чертеж с правой стороны) некоторые области образца оказываются лишенными микроскопических магнитных неоднородностей, что нарушает T2-сигнал воды, приводя к увеличению времени релаксации T2.
На фигуре 3B представлен график, изображающий полидисперсную модель, который показывает, что значение T2 должно изменяться, соответствуя переходу между двумя точками на данной кривой, когда частицы образуют кластеры определенных размеров. Зависимость ответа будет линейной относительно добавления аналита, но нелинейной относительно объемной доли кластеров, поскольку частицы переходят от состояния 1 к состоянию 2. Наклон зависимости является прямо пропорциональным чувствительности данного анализа.
На фигурах 4A-4C представлены чертежи, на которых изображены различные форматы анализов для анализов по изобретению. Фигура 4A представляет собой изображение схемы иммуноферментного сэндвич-анализа с использованием агломерации, в котором две популяции магнитных частиц предназначены для связывания с двуми различными эпитопами аналита. Фигура 4B представляет собой изображение схемы конкурентного иммуноферментного анализа, в котором аналит в жидком образце связывается с поливалентным связывающим агентом (поливалентным антителом), тем самым препятствуя агрегации. На фигуре 4C изображена схема анализа на опосредованную гибридизацией агломерацию, в котором две популяции частиц предназначены для связывания с первым и вторым участками нуклеиновой кислоты-мишени, соответственно.
Фигура 5 иллюстрирует концепцию модульного картриджа, состоящего из секций, которые могут быть упакованы и храниться отдельно. Это делается, например, таким образом, что входной модуль (показан на возвышении с присоединенным перевернутым вакутайнером) можно стерилизовать, в то время как модуль удержания реагентов в средней части можно не стерилизовать. Это позволяет охлаждать только компонент, содержащий реагенты.
На фигурах 6A-6F изображен входной модуль с вакутайнером. На фигуре 6A он показан в перевернутом положении после того, как пользователь удалил крышку с вакутайнера и надел на него сверху картридж. На фигуре 6B показан полученный формованием канал, по которому кровь будет следовать из вакутайнера в участок загрузки образца, как только картридж будет перевернут в «правильное» положение. При этом «нижней» стороной каналов может служить фольга, использующаяся для герметизации, образуя недорого формованную часть с закрытыми каналами. Фигура 6C представляют собой вид в разрезе, показывающий вентиляционную трубку, которая позволяет воздуху поступать в сосуд, когда кровь уходит и заполняет объем, предназначенный для образца. На фигурах 6D-6F изображен входной модуль для аликвотирования образца, предназначенный для взаимодействия с открытыми трубками вакутайнера и для аликвотирования двух объемов образца, что может быть использовано для выполнения, например, анализа на Candida. Входной модуль имеет две твердые пластиковые детали, которые соединяют вместе ультразвуковой сваркой и запечатывают фольгой с образованием сети каналов, чтобы позволить потоку из первой лунки переливаться во вторую лунку для образца. Мягкая часть пробки вакутайнера используется для обеспечения плотного соединения с вакутайнером. В ней имеются порт для потока образца и вентиляционный порт, позволяющий течь потоку.
На фигуре 7A представлен чертеж, на котором изображены компоненты конкурентного анализа на креатинин примера 6. Магнитная частица, покрытая креатинином, используется в комбинации с антителом к креатинину для образования системы агрегирования. Креатинин, присутствующий в жидком образце, конкурирует с магнитными частицами за антитело, что приводит к снижению агрегации с увеличением концентрации креатинина. Изменение в агрегации наблюдается как изменение скорости релаксации T2 ядер водорода в молекулах воды жидкого образца. Сравнивая наблюдаемую скорость релаксации T2 жидкого образца со стандартной кривой, определяют концентрацию креатинина.
На фигуре 7B представлен чертеж, изображающий схему конкурентного анализа на такролимус примера 9.
На фигуре 7C представлен чертеж, изображающий схему сэндвич-анализа на Candida с использованием агломерации примера 10.
Фигуры 8A-8C представляют собой серию графиков, на которых приведены кривые ответа для конкурентных анализов на креатинин. На фигуре 8A представлен график, на котором приведена стандартная кривая для конкурентного анализа на креатин примера 6, где наблюдаемое время релаксации T2 коррелирует с концентрацией креатинина в жидком образце. На фигуре 8B представлен T2-ответ покрытой креатинином частицы в присутствии 2-х различных препаратов антител. Препарат 1 представляет собой предварительный продукт (с агрегированным антителом), и препарат 2 представляет собой очищенный продукт (без присутствия агрегированного антитела). На фигуре 8C представлен T2-ответ покрытой креатинином частицы на неагрегированное антитело, биотинилированное антитело и преднамеренно мультимеризованное антитело, где подтверждается способность вызывать повышенную кластеризацию у поливалентных агентов, вызывающих агломерацию.
На фигуре 9 представлен график, на котором приведена стандартная кривая для конкурентного анализа на такролимус примера 9, где наблюдаемое время релаксации T2 коррелирует с концентрацией такролимуса в жидком образце.
На фигуре 10 представлен график, на котором изображена кривая ингибирования креатинина (см. пример 7) для использования покрытой антителами частицы и поливалентного связывающего агента аминодекстран-креатинин с целью индуцировать кластеризацию конкурированием с любым аналитом-мишенью (креатинин), присутствующим в образце, чтобы вызвать кластеризацию частиц. Используемый связывающий агент представляет собой декстран (40 kDa), с приблизительно 10 молекулами креатинина на одну молекулу декстрана.
На фигуре 11 представлен график, изображающий оценку способности конъюгатов Tac-декстрана к кластеризации (см. пример 8) проведением титрования. Наблюдения показали, что увеличение молекулярной массы конъюгата Tac-декстран приводит к улучшению T2 сигнала.
На фигуре 12 представлен график, изображающий оценку способности конъюгатов Tac-декстрана к кластеризации (см. пример 8) проведением титрования. Наблюдения показали, что более высокий уровень замещения улучшает T2 сигнал.
На фигуре 13 представлен график, изображающий оценку способности конъюгатов Тас-BSA к кластеризации (см. пример 8) при выполнении титрования, аналогичного тому, которое используется для конъюгатов Tac-декстран. Как было отмечено, эффективность кластеризации изменяется в зависимости от степени замещения такролимуса.
На фигуре 14 представлен график, на котором изображены результаты T2-анализов на выявление антитела против биотина в крови и в PBS матриксах с использованием полученных магнитных частиц, как описано в примере 1.
На фигуре 15 представлен график, на котором изображены результаты T2-анализов на выявление антитела против биотина с использованием полученных магнитных частиц с (открытый кружок) протеиновым блоком и без (заполненный кружок) протеинового блока, как описано в примерах 8 и 9.
На фигуре 16 представлен график, на котором изображены результаты T2-анализов на выявление антитела против биотина с использованием полученных магнитных частиц, имеющих BSA-блок (темные заполненные ромб, квадрат, треугольник) или FSG-блок (светло-серые Х и круг), как описано в примере 2.
На фигурах 17A и 17B представлены схематические изображения предоставляемых покрытий частиц.
На фигурах 18A-18B представлены результаты T2-анализов на выявление антитела против биотина в формате конкурентного анализа, описанного в примере 4.
На фигуре 18A изображены экспериментальные результаты, полученные в буфере, в то время на фигуре 18B изображены экспериментальные результаты, полученные в лизированной крови.
Фигура 19A представляет собой таблицу и 19B представляет собой график, где показана воспроизводимость измерений Candida способами по изобретению на протяжении восьми дней. Для определения воспроизводимости измерения T2 на цельной крови человека, инфицированной С. albicans, авторы провели восьмидневное исследование, в котором инфицированный и амплифицированный образец от того же донора каждый день гибридизовали с суперпарамагнитными частицами (n равно 3) и регистрировали конечные значения T2 (см. пример 13). Точность выполнения измерений охарактеризована на фигуре 19A и, в целом, является высокой, с относительным отклонением (CV) для всех измеряемых величин, составляющим менее 12%. Данные по воспроизводимости, полученные за восемь дней, представлены на фигуре 19B (средние значения T2 +/- 95%-ные доверительные интервалы, измеренные в инфицированных и амплифицированных образцах от того же донора на протяжении восьми дней), с CV, составляющими менее 10% во всем диапазоне концентраций Candida, и равными 6% для отрицательного контроля.
На фигуре 20 представлена схема с описанием последовательности действий для детектирования бактериального или грибкового патогена в образце цельной крови (см. примеры 14 и 17).
Фигуры 21A и 21B представляют собой графики, на которых изображены результаты, полученные при иследовании донорских образцов. На фигуре 21 представлен график, представляющий результаты, полученные в 16 экспериментах, разработанных для оценки эффективности анализа для шести различных образцов донорской крови, инфицированных клетками С. albicans в различных концентрациях (см. пример 13). Каждая точка на графике представляет собой среднее значение +/- 95%-ный доверительный интервал (n равно 48). При самой низкой испытываемой концентрации (10 клеток/мл) авторам не удалось обнаружить Candida albicans в 37% случаев (6 из 16 экспериментов), однако, клетки Candida albicans в концентрации, равной 100 клеток/мл, были выявлены в 100% случаев. Это дает основание предположить, что данный анализ позволяет надежно детектировать клетки С. albicans в концентрациях, превышающих или равных 100 клеток/мл, без существенного ингибирования эффективности компонентами донорской крови. На фигуре 21B представлен график, на котором изображены результаты, полученные из семи экспериментов, разработанных для оценки эффективности анализа для шести различных образцов донорской крови, инфицированных клетками С. krusei в различных концентрациях (см. пример 13). Каждая точка на графике представляет собой среднее значение +/- 95%-ный доверительный интервал (n равно 21). Ни в одном из опытов авторы не смогли выявить клетки в концентрации, равной 10 клеток/мл, но во всех опытах выявили клетки в концентрации, равной 100 клеток/мл. Это говорит о том, что LOD составляет от 10 до 100 клеток/мл.
Фигура 22 представляет собой точечную диаграмму, на которой представлены значения T2, измеренные для пяти клинических изолятов С. albicans, вспрыснутых в 400 мкл цельной крови в концентрациях, охватывающих от 0 до 1Е4 клеток/мл. Нанесенные результаты представляют собой среднее значение +/- 1 SD (standart deviation, стандартное отклонение). Настоящие данные указывают на то, что несмотря на разброс абсолютных значений T2, полученных для различных изолятов, все значения, полученные при концентрации клеток, равной 50 клеток/мл, лежат выше значения для не содержащего Candida контроля (3 повторных измерения из 20 независимых анализов, в общей сложности, 60 различных реакций кластеризации).
На фигурах 23A и 23B приведены графики ROC со значениями T2, полученными при концентрации клеток, равной 10 клеток/мл (фигура 23A) и 50 клеток/мл (фигура 23B). Площадь под кривой при концентрации клеток, равной 10 клеток/мл, составляет 0,72 (95CI (confidence interval, доверительный интервал) равно 0,56 к 0,88), в то время как при концентрации клеток, равной 50 клеток/мл, площадь под кривой составляет 0,98 (95CI равно 0,95 к 1,001). Площадь под кривой часто используется для количественной оценки диагностической точности; в данном случае она характеризует способность авторов отличать «кандидемического» пациента с содержанием инфекционных клеток, составляющим 10 клеток/мл или 50 клеток/мл, от пациента без кандидемии. При концентрации клеток, равной 10 клеток/мл, площадь под кривой составляет 0,72, что означает, что если T2-анализ был проведен на случайно выбранном пациенте с кандидемией с уровнем инфекции, составляющим 10 клеток/мл, то существует 72%-ная вероятность того, что у данного пациента значение T2 будет выше, чем у пациента без кандидемии. Клиническая точность анализа значительно выше при концентрации клеток, равной 50 клеток/мл, с площадью под кривой, равной 0,98. Это опять же указывает на то, что у пациента с кандидемией на данном уровне инфекции T2-анализ даст значение выше, чем образец от пациента без кандидемии, в 98% случаев. См. пример 13.
На фигуре 24 представлен график, иллюстрирующий чувствительность анализа при использовании стандартного термоцикла (время оборота составляет около 3 часов) и способа, который сочетает в себе стадии отжиг/удлинение (время оборота составляет около 2 часов, 13 минут). Объединение стадии отжига и удлинения в термоциклировании уменьшает общую продолжительность анализа ТАТ до 2,25 часов без ущерба для чувствительности анализа.
На фигуре 25 представлен график, показывающий изменение в сигнале T2 по ходу проведения циклов ПЦР (см. пример 14). Данные результаты демонстрируют, что способы и системы по изобретению могут быть использованы для выполнения ПЦР в режиме реального времени и для обеспечения количественной информацией о количестве нуклеиновой кислоты-мишени, присутствующей в образце.
На фигуре 26 представлена серия фотографий, на которых показана простая вставка в магнитный сепаратор/PCR блок.
Фигура 27 представляет собой изображение, на котором показано количество ДНК, произведенное амплификацией (1) 100 копий генома С. albicans, амплифицированного в присутствии наночастиц с одиночным 3'-5'-зондом С. albicans; во время проведения ПЦР частицы удерживались на боковой стенке с помощью магнитного поля, (2) 100 копий генома С. albicans, амплифицированного без наночастиц, и (3) 100 копий генома С. albicans, амплифицированного в присутствии наночастиц с одиночным 3'-5'-зондом С. albicans; без магнитного поля.
На фигурах 28A-28E представлены схематические изображения пробирки с образцом, содержащей иммобилизованную часть намагничивающейся металлической пены (затенено), магнитные частицы (кружки) и аналит (треугольники), Намагничивающаяся металлическая пена, например, сделанная из никеля, может быть введена в трубку и иммобилизована под воздействием нагревания, которое вызывает сжатие трубки вокруг металлической пены, в результате чего получается уплотнение. Образец, содержащий магнитные частицы и аналиты, затем вводится с одного конца трубки (фигура 28A). Далее трубка подвергается воздействию магнита (фигура 28B), и магнитные частицы притягиваются к металлической пене и оказываются в магнитной ловушке внутри пор или трещин в ней. Средний диаметр пор в металлической пене составляет, например, от 100 до 1000 мкмоль. Молекулы аналита могут быть доставлены к металлической пене через связывание с магнитной частицей, или жидкость может быть направлена сквозь металлическую пену, чтобы достичь захваченные магнитные частицы. Будучи захваченными металлической пеной, магнитные частицы больше взаимодействуют друг с другом, поскольку теперь они ограничены в пространстве и находятся ближе к другим магнитным частицам, и образование кластеров усиливается. Металлическую пену затем размагничивают (фигура 28C), т.е. магнитное поле металлической пены становится незначительным. Комплексы кластеров магнитных частиц и аналита в значительной степени остаются в металлической пене, поскольку диффузия кластеров магнитных частиц является относительно низкой, хотя происходит, в некоторой степени, природная диффузия аналита в металлическую пену и из металлической пены (фигура 28D). Альтернативно, намагничивающаяся металлическая пена (полый цилиндр) свободно плавает в пробирке с образцом, с магнитными частицами (кружки) и аналитом (звезды). Намагничивание и размагничивание свободно плавающей металлической пены используется для увеличения скорости образования агрегатов.
Фигура 29 представляет собой таблицу, показывающую Т2МР-результаты для 32 клинических образцов, в которой указан положительный результат на Candida в четырнадцати образцах. В тесте идентифицированы четыре образца, содержащие С. krusei или С. glabrata, семь образцов, содержащих С. albicans или С. tropicalis, и три образца, содержащие С. parapsilosis. Сплошная черная линия показывает пороговое значение решения (T2 равно 128 мсек) (см. пример 16).
Подробное описание
Настоящее изобретение относится к системам, устройствам и способам быстрого детектирования аналитов или определения концентрации аналита в образце. Системы и способы по изобретению используют магнитные частицы, ЯМР-блок, необязательно одну или более блоков инкубации при различных температурах, необязательно один или более аппаратов для встряхивания типа ʺВортексʺ, необязательно одну или более центрифугу, необязательно блок жидкостной манипуляции, необязательно роботизированную систему и необязательно один или более модульных картриджей. Системы, приборы и способы по изобретению могут быть использованы для анализа биологического образца (например, крови, пота, слез, мочи, слюны, спермы, сыворотки, плазмы, спинномозговой жидкости (cerebrospinal fluid (CSF)), кала, вагинальной жидкости или ткани, мокроты, аспирата или тампона из носоглотки, слезной жидкости, слизи или эпителиального тампона (защечного тампона), тканей, органов, костей, зубов или опухолей и др.). Альтернативно, системы, устройства и способы по изобретению используются для мониторинга состояния окружающей среды (например, гормона роста растений, инсектицидов, техногенных или экологических токсинов, последовательностей нуклеиновых кислот, которые являются важными для устойчивости/восприимчивости насекомых, водорослей и побочных продуктов водорослей), как часть программы биологической очистки, для применения в сельском хозяйстве растений или животных или для выявления экологической опасности. Подобным образом, системы, устройства и способы по изобретению используются для выявления и мониторинга биологического оружия или биологических отравляющих веществ, таких как рицин, Salmonella typhimurium, ботулинический токсин, афлатоксин, микотоксины, Francisella tularesis, оспа, сибирская язва или другие.
Магнитные частицы могут быть покрыты связывающим остатком (например, антителом, олигонуклеотидом, аптамером и т.д.), так что в присутствии аналита или поливалентного связывающего агента образуются агрегаты. В результате некоторые области образца оказываются лишенными микроскопических магнитных неоднородностей, что нарушает T2-сигнал воды, приводя к увеличению времени релаксации T2. (см. фигуру 3).
Измерение T2 представляет собой единую меру для всех спинов в ансамбле, причем измерения длятся обычно от 1 до 10 секунд, позволяя растворителю проходить расстояния в сотни микрон, что является большим расстоянием относительно микроскопических неоднородностей в жидком образце. Каждая молекула растворителя занимает объем в жидком образце, и сигнал T2 представляет собой среднее значение (чистый суммарный сигнал) всех (ядерных спинов) молекул растворителя в образце; другими словами, измерение T2 представляет собой чистое измерение всего окружения, с которым сталкивается молекула растворителя, и представляет собой среднее измерение всех микроскопических неоднородностей в образце.
Наблюдаемое время релаксации T2 для молекул растворителя в жидком образце определяется, в основном, магнитными частицами, которые в присутствии магнитного поля образуют сильные магнитные дипольные моменты. В отсутствие магнитных частиц наблюдаемые времена релаксации T2 для жидкого образца, как правило, являются длинными (т.е. T2 (воды) равно приблизительно 2000 мс, T2 (крови) равно приблизительно 1500 мс). По мере увеличения концентрации частиц микроскопические неоднородности в образце увеличиваются и диффузия растворителя через данные микроскопические неоднородности приводит к растущей спиновой декогеренции и уменьшению значения T2. Наблюдаемое значение T2 нелинейным образом зависит от концентрации частиц и от параметра ʺрелаксивность на одну частицуʺ.
В анализах на агрегацию по изобретению количество магнитных частиц, и если присутствуют агломерированные частицы, то их количество, остаются неизменными в течение анализа. Пространственное распределение частиц меняется, когда частицы образуют кластер. Агрегация изменяет средний ʺопытʺ молекулы растворителя, поскольку она способствует локализации частиц в кластеры, а не более равномерному распределению частиц. При высокой степени агрегации многие молекулы растворителя не испытывают воздействия со стороны микроскопических неоднородностей, создаваемых магнитными частицами, и значение T2 достигает значения T2 растворителя. Когда доля агрегированных магнитных частиц в жидком образце увеличивается, наблюдаемое значение T2 представляет собой среднее значение для неоднородной суспензии агрегированных и одиночных (неагрегированных) магнитных частиц. Тесты по изобретению предназначены для обеспечения максимального изменения в значении T2 в связи с агрегацией, чтобы увеличить чувствительность анализа к присутствию аналитов, а также к различиям в концентрации аналита.
Существуют два режима кластеризации частиц и эффектов Т2, базирующихся на размере частиц (см. фигуру 3B, граница соответствует обычно диаметру частиц, равному приблизительно 100 нм). Для любого данного анализа жидкого образца количество частиц в случае магнитных частиц размером 250 нм может составлять около 1×107 частиц, тогда как количество частиц в случае магнитных частиц размером 30 нм может составлять около 1×1013. Это происходит потому, что мелкие частицы обладают более низкой релаксивностью на одну частицу (для того же типа материала), что приводит к изначальному недостатку чувствительности. В обычном тесте по изобретению магнитные частицы выбирают так, что значение T2 возрастает с увеличением доли агрегированных частиц.
Анализ по изобретению могут быть предназначен для изменения направления T2 в присутствии аналита (см. фигуры 4A-4C). Например, анализ может представлять собой иммуноферментный сэндвич-анализ с использованием агломерации, в котором две популяции магнитных частиц связываются с различными эпитопами аналита (см. фигуру 4A); конкурентный тест, в котором аналит конкурирует с поливалентными связывающими агентами, чтобы ингибировать агрегацию магнитных частиц (см. фигуру 4B); или анализ на опосредованную гибридизацией агломерацию, в котором две популяции магнитных частиц связываются с первым и вторым участком олигонуклеотида (см. фигуру 4C). Дополнительный конкурентный формат может включать в себя связывание двух связывающих частицы остатков без агента агломерации (например, ДНК-олигонуклеотиды сконструированы таким образом, что две наночастицы имеют два различных олигонуклеотида, и они могут отжигаться вместе, и при нагревании аналит или ампликон или ДНК-мишень конкурирует с продуктом отжига или разрушает его).
Могут быть использованы другие форматы выполнения анализов по изобретению, такие как: (i) образец-мишень можно инкубировать в присутствии магнитной частицы, которая была покрыта связывающими остатками, специфическими для аналита-мишени и поливалентного связывающего агента, в тесте ингибирования связывание аналита с магнитными частицами блокирует агломерацию магнитных частиц с поливалентным связывающим агентом; (ii) образец-мишень можно инкубировать в присутствии магнитной частицы, которая была покрыта связывающими остатками, специфическими для аналита-мишени и поливалентного связывающего агента, в дезагрегирующем тесте аналит подвергается воздействию предварительно образованного агрегата поливалентного связывающего агента и магнитной частицы, и аналит вытесняет поливалентный связывающий агент, чтобы уменьшить агрегацию в жидком образце; или (iii) образец-мишень можно инкубировать в присутствии магнитной частицы, которая была покрыта связывающими остатками, специфическими для аналита-мишени, и самого аналита-мишени для образования самособирающейся одиночной популяции магнитных частиц, в тесте ингибирования или в дезагрегирующем тесте наличие связывания аналита с магнитными частицами блокирует агломерацию магнитных частиц друг с другом; или (iv) образец-мишень можно инкубировать в присутствии растворимого агента агломерации и магнитной частицы, покрытой аналитом или аналогом аналита, в тесте ингибирования присутствие аналита связывает растворимый агент агломерации, блокируя агломерацию частиц.
Когда используется поливалентный связывающий агент (агломерант), то несколько аналитов присоединяются к одному носителю (например, простой синтетический каркас или белок-носитель большего размера или полисахарид, такой как BSA, трансферрин или декстран).
Магнитные частицы
Магнитные частицы, описанные в данном документе, включают в себя магнитные частицы, описанные, например, в патенте США №7564245 и в публикации заявки на патент США №2003-0092029, каждый из которых включен в данный документ посредством ссылки. Магнитные частицы, как правило, представлены в виде конъюгатов, то есть магнитной частицы с присоединенными к ней одним или более связывающими остатками (например, олигонуклеотид, нуклеиновая кислота, полипептид или полисахарид). Связывающий остаток вызывает специфическое взаимодействие с аналитом-мишенью. Связывающий остаток специфически связывается с выбранным аналитом-мишенью, например, нуклеиновой кислотой, полипептидом или полисахаридом. В некоторых случаях связывание вызывает агрегацию конъюгатов, приводя к изменению, например, уменьшению (например, в случае магнитных частиц меньшего размера) или увеличению (например, в случае магнитных частиц большего размера) спин-спинового времени релаксации (T2) соседних протонов воды в водном растворе (или протонов в неводном растворителе). Альтернативно, аналит связывается с предварительно образованным агрегатом в конкурентном дезагрегирующем тесте (например, агрегат образуется из поливалентного связывающего агента и магнитных частиц) или конкурирует с поливалентным связывающим агентом за связывающие остатки на магнитных частицах в тесте ингибирования (т.е. образование агрегатов ингибируется в присутствии аналита).
Конъюгаты обладают высокой релаксивностью благодаря суперпарамагнетизму входящих в их состав железа, оксида металла или других ферро- или ферримагнитных наноматериалов. Соединения железа, кобальта и никеля и их сплавы, редкоземельные элементы, такие как гадолиний, и некоторые интерметаллиды, такие как золото и ванадий, которые являются ферромагнетиками, могут быть использованы для производства суперпарамагнитных частиц. Магнитные частицы могут быть монодисперсными (монокристалл из магнитного материала, например, оксида металла, такого как суперпарамагнитный оксид железа, на одну магнитную частицу) или полидисперсными (например, несколько кристаллов на одну магнитную частицу). Магнитный оксид металла может также включать в себя кобальт, магний, цинк или смеси данных металлов с железом. Важные признаки и элементы магнитных частиц, которые применяются для получения конъюгатов, включают в себя: (i) высокую релаксивность, т.е. сильное влияние на релаксацию воды (или другого растворителя), (ii) функциональную группу, к которой может быть ковалентно присоединен связывающий остаток, (iii) низкое неспецифическое связывание интерактивных остатков с магнитной частицей, и/или (iv) стабильность в растворе, т.е. магнитные частицы остаются взвешенными в растворе, не осаждаются и/или продукты отжига сохраняют способность к применению в описанном способе (т.е. продукты отжига имеют срок годности).
Магнитные частицы могут быть соединены со связывающими остатками с помощью функциональных групп. В некоторых вариантах осуществления магнитные частицы могут быть ассоциированы с полимером, который включает в себя функциональные группы, выбранные, в частности, для повышения неспецифической обратимости магнитных частиц. Данный полимер может представлять собой синтетический полимер, такой как, но не ограничиваясь ими, полиэтиленгликоль или силан, природные полимеры или производные либо синтетических, либо природных полимеров или их комбинацию. Данный полимер может быть гидрофильным. В некоторых вариантах осуществления полимерное ʺпокрытиеʺ представляет собой не сплошную пленку вокруг магнитного оксида металла, а ʺсеткуʺ или ʺоблакоʺ удлиненных полимерных цепей, прикрепленных к оксиду металла и окружающих его. Данный полимер может включать в себя полисахариды и их производные, включая декстран, пулланан, карбоксидекстран, карбоксиметилдекстран и/или восстановленный карбоксиметилдекстран. Оксид металла может представлять собой набор из одного или более кристаллов, которые контактируют друг с другом, или они отдельно захвачены или окружены полимером.
Альтернативно, магнитные частицы могут быть ассоциированы с композициями неполимерных функциональных групп. Способы синтеза стабилизированных, функционализированных магнитных частиц без ассоциированных полимеров описаны, например, в публикации Halbreich et al., Biochimie, 80:379 (1998).
Магнитные частицы обычно включают в себя монокристаллы и поликристаллы оксида металла, диаметр которых составляет от около 1 до около 25 нм, например, от около 3 до около 10 нм, или около 5 нм на кристалл. Магнитные частицы могут также включать в себя полимерный компонент в виде сердцевины и/или покрытия толщиной, например, от 5 до 20 нм и более. Общий размер магнитных частиц может составлять, например, от 20 до 50 нм, от 50 до 200 нм, от 100 до 300 нм, от 250 до 500 нм, от 400 до 600 нм, от 500 до 750 нм, от 700 до 1200 нм, от 1000 до 1500 нм или от 1500 до 2000 нм.
Магнитные частицы могут быть приготовлены различными способами. Предпочтительно, чтобы магнитные частицы имели функциональные группы, которые присоединяют магнитные частицы к связывающему остатку. Могут быть приготовлены магнитные частицы, функционализированные карбоксильными группами, например, в соответствии со способом Gorman (см. публикацию РСТ Publication No. WO 00/61191). Согласно данному способу восстановленный карбоксиметил(СМ)декстран синтезируется из коммерческого декстрана. СМ-декстран и соли железа смешивают вместе и затем нейтрализуют гидроксидом аммония. Готовые магнитные частицы, функционализированные карбоксильными группами, могут быть использованы для соединения функционализированных аминогруппами олигонуклеотидов. Магнитные частицы, функционализированные карбоксильными группами, могут быть также сделаны из покрытых полисахаридом магнитных частиц посредством реакции с бром- или хлоруксусной кислотой в сильном основании с целью присоединения карбоксильных групп. Кроме того, функционализированные карбоксильными группами частицы могут быть изготовлены из функционализированных аминогруппами магнитных частиц преобразованием аминогрупп в карбоксильные группы с помощью таких реагентов, как ангидрид янтарной кислоты или малеиновый ангидрид.
Размером магнитных частиц можно управлять, регулируя условия реакции, например, с помощью низкой температуры во время нейтрализации солей железа основанием, как описано в патенте США №5,262,176. Материалы с частицами одинакового размера также могут быть получены фракционированием частиц с использованием центрифугирования, ультрафильтрации или гель-фильтрации, как описано, например, в патенте США №5,492,814.
Магнитные частицы также могут быть синтезированы в соответствии со способом Molday (Molday, R.S. and D. MacKenzie, ʺImmunospecific ferromagnetic iron-dextran reagents for the labeling and magnetic separation of cells,ʺ J. Immunol. Methods, 52: 353 (1982)) и обработаны периодатом для образования альдегидных групп. Содержащие альдегидные группы магнитные частицы могут быть затем подвергнуты взаимодействию с диамином (например, этилендиамином или гександиамином), который образует основание Шиффа, с последующим восстановлением боргидридом натрия или цианоборгидридом натрия.
Покрытые декстраном магнитные частицы могут быть сделаны и сшиты с эпихлоргидрином. Добавление аммиака вызывает реакцию с эпоксидными группами с образованием аминогрупп, см. Hogemann, D., et al., Improvement of MPI probes to allow efficient detection of gene expression Bioconjug. Chem., 11: 941 (2000), и Josephson et al., ʺHigh-efficiency intracellular magnetic labeling with novel superparamagnetic-Tat peptide conjugates,ʺ Bioconjug. Chem., 10: 186 (1999). Данный материал известен как сшитый оксид железа или ʺCLIOʺ, и, будучи функционализированным аминогруппой, называется амин-CLIO или NH2-CLIO. Функционализированные карбоксильными группами магнитные частицы могут быть преобразованы в Функционализированные аминогруппами магнитные частицы с использованием водорастворимых карбодиимидов и диаминов, таких как этилендиамин или гександиамин.
Магнитные частицы могут быть образованы из феррожидкости (например, устойчивой коллоидной суспензии магнитных частиц). Например, магнитная частица может представлять собой композит, включающий в себя многочисленные кристаллы оксида металла, имеющие размер порядка нескольких десятков нанометров и диспергированные в жидкости, содержащей сурфактант, который адсорбируется на частицах и стабилизирует их, или полученный осаждением раствора ионов металлов в щелочной среде. Подходящие феррожидкости продаются компанией Liquids Research Ltd. по ссылкам: WHKS1S9 (A, B или C), которая представляет собой феррожидкость на водной основе, включающую в себя магнетит (Fe2O4) с частицами, имеющими диаметр 10 нм; WHJS1 (A, B или C), которая представляет собой феррожидкость на основе изопарафина, включающую в себя частицы магнетита (Fe3O4) диаметром 10 нм; и BKS25 декстран, которая представляет собой феррожидкость на водной основе, стабилизированную декстраном, включающую в себя частицы магнетита (Fe3O4) диаметром 9 нм. Другие феррожидкости, подходящие для применения в системах и способах по изобретению представляют собой стабилизированные олеиновой кислотой феррожидкости, доступные от Ademtech, которые включают в себя около 70% по массе частиц α-Fe2O3 (около 10 нм в диаметре), 15% по массе октана и 15% по массе олеиновой кислоты.
Магнитные частицы представляют собой, как правило, композит, включающий в себя многочисленные кристаллы оксида металла и органический матрикс, и имеющий поверхность, покрытую функциональными группами (например, аминогруппами или карбоксильными группами) для соединения связывающих остатков с поверхностью магнитной частицы. Например, магнитные частицы, применимые в способах по изобретению, включают в себя магнитные частицы, коммерчески доступные от Dynal, Seradyn, Kisker, Miltenyi Biotec, Chemicell, Anvil, Biopal, Estapor, Genovis, Thermo Fisher Scientific, JSR micro, Invitrogen и Ademtech, а также те частицы, которые описаны в патентах США №№4,101,435; 4,452,773; 5,204,457; 5.262,176; 5,424,419; 6,16,378; 6,866,838; 7,001,89 и 7,217,457, каждый из которых включен в данный документ посредством ссылки.
Авидин или стрептавидин может быть присоединен к магнитным частицам для применения с биотинилированным связывающим остатком, таким как олигонуклеотид или полипептид (см., например, Shen et aL, ʺMagnetically labeled secretin retains receptor affinity to pancreas acinar cells,ʺ Bioconjug. Chem., 7:31 1 (1996)). Сходным образом, биотин может быть присоединен к магнитной частице для применения с меченным авидином связывающим остатком. Альтернативно, связывающий остаток является ковалентно связанным с поверхностью магнитной частицы; частицы могут быть покрыты молекулами IgG, частицы могут быть покрыты антителами к гистидину (his), или частицы могут быть покрыты his-tagged FAb-фрагментами.
Перед использованием материалы с низкой молекулярной массой могут быть отделены от магнитных частиц ультра-фильтрацией, диализом, магнитной сепарацией или другим способом. Например, непрореагировавшие связывающие остатки и сшивающие агенты могут быть отделены от конъюгатов магнитных частиц магнитной сепарацией или хроматографией исключения по размеру. В некоторых случаях магнитные частицы могут быть фракционированы по размеру для получения смесей частиц с определенным диапазоном размеров и определенным средним диаметром.
В случае некоторых анализов, требующих высокой чувствительности, для детектирования аналита с использованием анализов, основанных на измерении времени релаксации Т2, может потребоваться выбор правильной частицы, позволяющей получить достаточно чувствительную индуцированную аналитом агломерацию. Более высокие чувствительности могут быть достигнуты с использованием частиц, которые содержат многочисленные сердцевины из суперпарамагнитного оксида железа (от 5 до 15 нм в диаметре) внутри одиночного большего полимерного матрикса, или ансамбля феррожидкости (с общим диаметром, составляющим от 100 нм до 1200 нм, таких как частицы, имеющие средний диаметр, равный 100 нм, 200 нм, 250 нм, 300 нм, 500 нм, 800 нм или 1000 нм), либо с использованием материалов с более сильным магнитным моментом или частиц с более высокой плотностью и/или частиц с более высоким содержанием железа. Не ограничиваясь теорией, постулируются данные типы частиц, обеспечивающие усиление чувствительности более чем в 100 раз благодаря гораздо большему числу атомов железа, приходящихся на одну частицу, что, как полагают, приводит к увеличению чувствительности за счет уменьшения числа частиц, присутствующих в анализируемом растворе, и, возможно, большего количества суперпарамагнитного железа, затронутого каждым событием кластеризации.
Релаксивность на одну частицу и размер частиц является одним применимым параметром для выбора оптимальной частицы для высокочувствительных анализов. В идеале, данный параметр должен быть как можно больше. Релаксивность на одну частицу представляет собой меру влияния каждой частицы на измеренное значение T2. Чем больше данное число, тем меньше число частиц, необходимых для выявления данного ответа T2. Дополнительно снижение концентрации частиц в реакционном растворе может улучшить аналитическую чувствительность анализа. Релаксивность на одну частицу может служить более применимым параметром, поскольку плотность железа и релаксивность могут варьировать от магнитной частицы к магнитной частице, в зависимости от компонентов, используемых для изготовления данных частиц (см. таблицу 1). Релаксивность на одну частицу пропорциональна намагниченности насыщения суперпарамагнитного материала.
Исходной частицей для применения в системах и способах по изобретению может быть любая из коммерчески доступных частиц, указанных в таблице 2.
Магнитные частицы для применения в системах и способах по изобретению могут иметь гидродинамический диаметр, равный от 10 нм до 1200 нм, и содержать в среднем от 8×102 до 1×1010 атомов металла на одну частицу и иметь значение релаксивности на одну частицу, равное от 1×104 до 1×1013 ммоль-1сек-1. Магнитные частицы, используемые в системах и способах по изобретению, могут быть любых конструкций, из любых композитов или источников, описанных выше, и могут быть дополнительно модифицированы, как описано в данном документе, для применения в качестве выключателя магнитного резонанса.
В дополнение к релаксивности на одну частицу, при выборе и разработке магнитных частиц для анализов с высокой аналитической чувствительностью должен быть решен ряд других практических вопросов.
Например, применение крупных частиц (например, размером, составляющим 1000 нм или более) может быть желательно для получения максимального содержания железа и релаксивности на одну частицу. Тем не менее, авторы наблюдали, что частицы такого размера, как правило, быстро осаждаются из раствора. Авторы наблюдали, что осаждение частиц обычно не мешает проведению анализа, если размеры магнитных частиц составляют менее 500 нм. При использовании в описанных анализах частиц с размерами более 500 нм или мелких частиц с высокой плотностью отслеживается осаждение и определяется эффект на измерение Т2. Авторы установили, что размер магнитной частицы, составляющий около 100-300 нм, является идеальным для стабильности с точки зрения осаждения, даже после функционализации (увеличение гидродинамического диаметра до 300 нм приблизительно на 50 нм), и позволяет достичь высокой чувствительности измерений благодаря высокой релаксивности на одну частицу. Плотность частиц, безусловно, играет важную роль в плавучести. Таким образом, относительная плотность раствора и частиц играет важную роль в осаждении частицы. Соответственно, одно из возможных решений данной проблемы заключается в применении плавучих магнитных частиц (например, полой частицы или частицы, содержащей как матрикс низкой плотности, так и оксид металла высокой плотности). Осаждение может повлиять на детектирование Т2, таким образом, для изменения соотношения частицы к плотности раствора могут быть использованы добавки к раствору. Осаждение может влиять на детектирование Т2, если в данном случае происходит потеря значительной части супермагнитного материала из измеренного объема жидкости. Осаждение может быть оценено путем разбавления частиц до такой концентрации, что UV-Vis-поглощение при длине волны 410 нм составляет от 0,6 до 0,8 единиц поглощения, с последующим мониторингом поглощения в течение 90 минут. Если происходит осаждение, различие между значениями поглощения в начале и в конце, деленное на величину начального поглощения, будет составлять более 5%. Если % осаждения составляет более 5%, то такая частица, как правило, не подходит для использования в анализах, требующих высокой аналитической чувствительности. Магнитные частицы, используемые в анализах по изобретению, могут быть, но не ограничиваются ими, неосаждающимися магнитными частицами. Высокая степень осаждения представляет трудности в обработке результатов и может привести к проблемам в воспроизводимости.
Для магнитных частиц, имеющих размер порядка 100 нм или больше, многочисленные кристаллы суперпарамагнитного оксида железа, которые обычно включают в себя сердцевину частицы, дают чистый дипольный момент в присутствии внешнего магнитного поля, т.е. дипольный момент является достаточной силой, чтобы преодолеть броуновское движение. Неспецифическая обратимость является мерой коллоидной стабильности и устойчивости к неспецифической агрегации. Неспецифическую обратимость оценивают измерением значений Т2 раствора частиц до и после инкубации в однородном магнитном поле (определяется как менее 5000 м.д.). Начальные значения Т2 составляют, как правило, 200 мс для частицы с концентрацией железа, равной 0,01 ммоль Fe. Если различие в значениях Т2 до и после инкубации в однородном магнитном поле составляет менее 20 мс, то образцы считаются обратимыми. Таким образом, 10% представляет собой пороговое значение, позволяющее начать измерения Т2 с учетом концентрации анализируемых частиц. Если различие составляет более 10%, то частицы обладают необратимостью в буфере, разбавителях и испытываемом матриксе. Неспецифическая обратимость магнитных частиц может быть изменена, как описано в данном документе. Например, на коллоидную стабильность и устойчивость к неспецифической агрегации могут влиять поверхностные свойства частиц, связывающие остатки, буфер, в котором проводится тестирование, матрикс и условия проведения анализа. Поддержание коллоидной стабильности и устойчивости к неспецифическому связыванию может быть изменено химическими способами конъюгации, способами блокирования, модификациями буфера и/или изменениями в условиях проведения анализа.
Авторы наблюдали, что очень важным атрибутом для надежных и воспроизводимых анализов является монодисперсность в распределении по размеру используемых магнитных частиц, различие наблюдается у полидисперсных частиц после покрытия в сравнении с монодисперсной частицей перед покрытием. При использовании партий полидисперсных магнитных частиц может отсутствовать воспроизводимость и уменьшаться чувствительность. Полидисперсные образцы могут также быть проблематичными в том, что касается равномерности покрытий. Для некоторых высокочувствительных анализов желательно, чтобы магнитные частицы были по существу монодисперсными в распределении по размеру (т.е. имели индекс полидисперсности, составляющий менее чем от около 0,8 до около 0,9). Альтернативно, тесты по изобретению могут быть спланированы так, чтобы использовать полидисперсные магнитные частицы.
Учитывая, что тесты по изобретению требуют мониторинга сдвига в состояних кластеризации при выполнении анализов на агломерацию и что для измерения изменения кластеризации, вероятно, требуется наличие значительной фракции кластеризованных частиц (например, считают, что она составляет более чем от 1 до 10%), для достижения высокой чувствительности общее число частиц в тесте должны быть сведено к минимуму. Тем не менее, должно присутствовать достаточное количество частиц, чтобы позволить использование динамического диапазона детектирования Т2. Авторы установили, что наибольшая чувствительность наблюдается, когда число магнитных частиц (или молярный эквивалент) составляет приблизительно тот же порядок величины количества (или молярного эквивалента) определяемого аналита, и величины количества (или молярного эквивалента) используемых поливалентных связывающих агентов (например, в тесте ингибирования).
Для белковых образцов может также потребоваться изменение поверхности магнитной частицы для уменьшения неспецифического связывания ʺфоновыхʺ белков с магнитными частицами. Неспецифическое связывание фоновых белков с частицами может индуцировать или препятствовать кластеризации частиц, приводя к ложным сигналам и/или ложному отсутствию сигналов. Например, в некоторых случаях поверхность магнитных частиц может включать в себя блокирующие агенты, ковалентно связанные с поверхностью магнитной частицы, которые снижают неспецифическое связывание фоновых белков. Имеется целый ряд агентов, которые можно было бы использовать для достижения желаемого эффекта, а в некоторых случаях оптимальной является комбинация агентов (см. таблицу 3; примеры частиц, покрытий и связывающих остатков).
Таким образом, авторы установили, что для достижения действенности и чувствительности анализа, особенно при работе с белковыми образцами (например, образцами плазмы или образцами цельной крови), сопоставимых с результатами, полученных для небелковых образцах с буфером, может потребоваться протеиновое блокирование. Некоторые часто используемые протеиновые блокаторы, которые могут быть использованы в предоставленных препаратах, включают в себя, например, бычий сывороточный альбумин (bovine serum albumin (BSA)), желатин рыбьей кожи (fish skin gelatin (FSG)), бычий гамма-глобулин (bovine gamma globulin (BGG)), лизоцим, казеин, пептидазу или сухое обезжиренное молоко. В некоторых вариантах осуществления покрытие магнитных частиц включает в себя BSA или FSG. В других вариантах осуществления комбинация покрытий представляет собой комбинации приведенных в качестве образцов покрытий, перечисленных в таблице 3.
Дополнительно неспецифическое связывание может быть обусловлено липидами или другими небелковыми молекулами в биологическом образце. В случае неспецифического связывания, не опосредованного белками, изменения величин pH и буферной ионной силы могут быть выбраны так, чтобы увеличить степень отталкивания частиц друг от друга, но не влиять на результаты исследуемых взаимодействий.
Реагенты для анализа
Тесты по изобретению могут включать в себя реагенты для уменьшения неспецифического связывания с магнитными частицами. Например, данный анализ может включать в себя один или более белков (например, альбумин (например, человеческий или бычий альбумин); желатин рыбьей кожи, лизоцим или трансферрин); низкомолекулярные (менее 500 дальтон) амины (например, аминокислоты, глицин, этиламин или меркаптоэтаноламин); и/или водорастворимые неионные поверхностно-активные вещества (например, полиэтиленгликоль, Tween® 20, Tween® 80, Pluronic® или Igepal®).
Сурфактант может быть выбран из широкого спектра растворимых неионных поверхностно-активных веществ, включая сурфактанты, которые обычно имеются в продаже под торговой маркой IGEPAL от компании GAF Company. Жидкие неионные сурфактанты IGEPAL представляют собой производные p-изооктилфенилового эфира полиэтиленгликоля и доступны с различными обозначениями молекулярной массы, например, IGEPAL CA720, IGEPAL CA630 и IGEPAL CA890. Другие подходящие неионные сурфактанты включают те, которые доступны под торговой маркой Tetronic 909 от компании BASF Wyandotte Corporation. Данный материал представляет собой тетрафункциональный блок-сополимерный сурфактант, на конце молекулы которого имеются первичные гидроксильные группы. Подходящие неионные сурфактанты также доступны под торговой маркой VISTA ALPHONIC от компании Vista Chemical Company, и такие материалы представляют собой этоксилаты, которые являются неионными биологически разлагаемыми материалами, происходящими от смесей линейных первичных спиртов различных молекулярных масс. Сурфактант также может быть выбран из полоксамеров, таких как блок-сополимеры полиоксиэтилена и полиоксипропилена, такие как полоксамеры, которые доступны под торговыми марками Synperonic РЕ series (ICI), Pluronic® series (BASF), Supronic, Monolan, Pluracare и Plurodac, полисорбатных сурфактантов, таких как Tween® 20 (PEG-20 сорбитанмонолаурат), и гликолей, таких как этиленгликоль и пропиленгликоль.
Такие неионные сурфактанты могут быть выбраны, чтобы обеспечить соответствующее количество детергентности для анализа без оказания вредного воздействия на реакции анализа. В частности, сурфактанты могут быть включены в реакционную смесь с целью подавления неспецифических взаимодействий между различными ингредиентами агрегационных анализов по изобретению. Неионные сурфактанты обычно добавляют в жидкий образец заранее в количестве от 0,01% (масс./масс.) до 5% (масс./масс.).
Неионные сурфактанты могут быть использованы в комбинации с одним или несколькими белками (например, альбумином, желатином рыбьей кожи, лизоцимом или трансферрином), также добавленными заранее в жидкий образец в количестве от 0,01% (масс./масс.) до 5% (масс./масс.).
Дополнительно тесты, способы и картриджные блоки по изобретению могут включать в себя дополнительные подходящие буферные компоненты (например, Трис-основание, выбранное для обеспечения в реакционной среде значения pH от около 7,8 до 8,2); а также хелатные агенты, чтобы удалять катионы (например, динатриевую соль ЭДТА, этилендиаминтетрауксусную кислоту (ЭДТА), лимонную кислоту, винную кислоту, глюкуроновую кислоту, сахарную кислоту или их подходящие соли).
Связывающие остатки
В целом, связывающий остаток представляет собой молекулу, синтетическую или натуральную, которая специфически связывается или связывается иным образом, например, ковалентно или нековалентно связывается или гибридизуется с молекулой-мишенью или с другим связывающим остатком (или, в некоторых вариантах осуществления, с вызывающей агрегацию молекулой). Например, данный связывающий остаток может представлять собой антитело, направленное против антигена или любого белок-белкового взаимодействия. Альтернативно, данный связывающий остаток может представлять собой полисахарид, который связывается с соответствующей мишенью, или синтетический олигонуклеотид, который гибридизуется со специфической комплементарной нуклеиновой кислотой-мишенью. В некоторых вариантах осуществления связывающие остатки могут быть разработаны или выбраны для того, чтобы служить, будучи связанными с другим связывающим остатком, в качестве субстратов для молекулы-мишени, такой как фермент в растворе.
Связывающие остатки включают в себя, например, олигонуклеотидные связывающие остатки (ДНК, РНК или замещенные или дериватизированные нуклеотидные замены), полипептидные связывающие остатки, антитела-связывающие остатки, аптамеры и полисахарид-связывающие остатки.
Олигонуклеотидные связывающие остатки
В некоторых вариантах осуществления связывающие остатки представляют собой олигонуклеотиды, прикрепленные/связанные с магнитными частицами с использованием любого из множества химических способов одиночной, например, ковалентной связью, например, на 3-' или 5'-конце, с функциональной группой на магнитной частице. Такие связывающие остатки могут быть использованы в системах, устройствах и способах по изобретению для детектирования мутаций (например, SNP, транслокаций, больших делеций, малых делеций, инсерций, замен) или для мониторинга экспрессии генов (например, наличия экспрессии или изменений в уровне экспрессии генов, контроля транскрипции РНК) или СНР-анализа, характеризующего наличие патогена, болезненное состояние или прогрессирование заболевания.
Олигонуклеотидный связывающий остаток может быть сконструирован с помощью химического синтеза. Связывающий двухцепочечную ДНК остаток может быть сконструирован реакциями ферментативного лигирования с использованием процедур, известных в данной области. Например, нуклеиновая кислота (например, олигонуклеотид) может быть химически синтезирована с использованием природных нуклеотидов или различным образом модифицированных нуклеотидов, разработанных для повышения биологической стабильности молекул или для увеличения физической стабильности дуплекса, образованного между комплементарными нитями, например, могут быть использованы фосфоротиоатные производные и замещенные акридином нуклеотиды. Данная нуклеиновая кислота также может быть получена биологическим путем с использованием вектора экспрессии, в который была субклонирована нуклеиновая кислота.
Один способ использует по меньшей мере две популяции магнитных частиц, несущих олигонуклеотиды, каждая из которых оказывает сильное воздействие на релаксацию воды (или другого растворителя). Поскольку конъюгаты олигонуклеотидов с магнитными частицами взаимодействуют с олигонуклеотидом-мишенью, они образуют агрегаты (например, кластеры магнитных частиц). При длительном стоянии, например, в течение ночи при комнатной температуре, агрегаты образуют крупные кластеры (кластеры микронного размера). Используя способы по изобретению, образование больших кластеров может быть достигнуто быстрее за счет использования большого количества циклов агломерации, достигаемой с помощью магнитных взаимодействий. Магнитный резонанс используется для определения релаксационных свойств растворителя, которые изменяются, когда смесь магнитных несущих олигонуклеотиды магнитных частиц взаимодействует с нуклеиновой кислотой с образованием агрегатов.
В некоторых вариантах осуществления используется смесь по меньшей мере двух типов магнитных частиц из магнитных оксидов металлов, каждый тип со специфической последовательностью олигонуклеотидов и каждый тип с более чем одной копией присоединенного олигонуклеотида, например, ковалентно, на одну магнитную частицу. Например, протокол анализа может включать в себя приготовление смеси популяций конъюгатов олигонуклеотидов с магнитными частицами и взаимодействие данной смеси с нуклеиновой кислотой-мишенью. Альтернативно, конъюгаты олигонуклеотидов с магнитными частицами могут быть подвергнуты взаимодействию с мишенью последовательным образом. Некоторые варианты осуществления относятся к применению магнитного резонанса для выявления взаимодействия олигонуклеотидов, конъюгированных с магнитными частицами, с нуклеиновой кислотой-мишенью. Когда мишень присутствует, диспергированные конъюгаты самостоятельно собираются с образованием мелких агрегатов.
Например, олигонуклеотидные связывающие остатки могут быть связаны с оксидом металла посредством ковалентного присоединения к функционализированному полимеру или к неполимерным оксидам металлов с функционализированной поверхностью. При последнем способе магнитные частицы могут быть синтезированы по способу Albrecht et al., Biochimie, 80:379 (1998). Димеркапто-янтарная кислота присоединяется к оксиду железа и обеспечивает карбоксильную функциональную группу.
В некоторых вариантах осуществления олигонуклеотиды прикрепляются к магнитным частицам через функционализированный полимер, ассоциированный с оксидом металла. В некоторых вариантах осуществления полимер является гидрофильным. В некоторых вариантах осуществления конъюгаты производятся, используя олигонуклеотиды, у которых имеются концевые амино-, сульфгидрильные или фосфатные группы, и магнитные частицы из суперпарамагнитного оксида железа, несущие амино- или карбоксильные группы на гидрофильном полимере. Существует несколько способов синтеза дериватизированных карбоксильными и аминогруппами магнитных частиц.
В одном варианте осуществления олигонуклеотиды прикрепляются к частице через связывающее взаимодействие лиганд-белок, такое как биотин-стрептавидин, когда лиганд ковалентно присоединен к олигонуклеотиду и белок к частице или наоборот. Такой подход может обеспечить более быстрое приготовление реагентов.
Могут быть использованы другие формы олигонуклеотидов. Например, аптамеры представляют собой олигонуклеотиды одноцепочечной РНК или ДНК олигонуклеотиды, имеющие от 15 до 60 оснований в длину, внутримолекулярные взаимодействия которых в растворе вызывают складывание данной линейной молекулы нуклеиновой кислоты в трехмерный комплекс, который затем может связываться с высоким сродством со специфическими молекулярными мишенями, часто с константами равновесия в диапазоне от 1 пМ до 1 нМ, что сходно со взаимодействиями некоторых моноклональных антител с антигенами. Аптамеры могут специфически связываться с другими молекулами нуклеиновых кислот, белками, небольшими органическими соединениями, небольшими молекулами и клетками (организмами или патогенами).
Полипептидные связывающие остатки
В некоторых вариантах осуществления связывающий остаток представляет собой полипептид (например, белок, полипептид или пептид), присоединенный, используя любой из различных химических способов, одиночной ковалентной связью таким образом, чтобы не влиять на биологическую активность данного полипептида. В одном варианте осуществления присоединение осуществляется посредством тиоловой группы одиночного реактивного цистеинового остатка, расположенного таким образом, что его модификация не влияет на биологическую активность данного полипептида. В связи с этим применение линейных полипептидов, с цистеином на C-конце или N-конце, предоставляет одиночную тиоловую группу в манере, подобно которой алкантиол поставляет тиоловую группу на 3'- или 5'-конце олигонуклеотида. Похожие бифункциональные реагенты для конъюгации, такие как SPDP, и взаимодействующие с аминогруппой магнитной частицы и тиоловой группой полипептида, могут быть использованы с любым связывающим остатком, несущим тиоловую группу. Типы полипептидов, используемых в качестве связывающих остатков, могут представлять собой антитела, фрагменты антител, природные и синтетические полипептидные последовательности. Пептидные связывающие остатки имеют партнера по связыванию, то есть молекулу, с которой они избирательно связываются.
Применение пептидов в качестве связывающих остатков обладает ряд преимуществ. Например, для прикрепления к магнитной частице могут быть разработаны полипептиды, имеющие уникальные реактивные остатки, удаленные от остатков, необходимых для биологической активности. Реактивный остаток может представлять собой тиоловую группу цистеина, N-концевую аминогруппу, C-концевую карбоксильную группу или карбоксильную группу аспартата и глутамата и т.д. Одиночный реактивный остаток на пептиде используется, чтобы обеспечить уникальное место прикрепления. Данные принципы проектирования можно проследить у пептидов, синтезируемых химическим путем, или полипептидов, производимых биологическим путем.
Связывающие остатки также могут содержать аминокислотные последовательности из встречающихся в природе (дикого типа) полипептидов или белков. Например, природный полипептид может представлять собой гормон (например, цитокин, фактор роста), сывороточный белок, вирусный белок (например, гемагглютинин), белок внеклеточного матрикса, лектин или эктодомен белка клеточной поверхности. Другим примером является лиганд-связывающий белок, такой как стрептавидин или авидин, которые связывают биотин. В целом, готовая магнитная частица, несущая связывающий остаток, используется для измерения наличия аналитов в испытуемой среде, взаимодействующих со связывающим остатком.
Дополнительно полипептидный связывающий остаток может быть использован в качестве универсального реагента, где мишень связывающего остатка (например, небольшая молекула, лиганд или партнер по связыванию) предварительно прикрепляется к аналиту-мишени для создания меченого аналита, который, в присутствие покрытых полипептидом частиц вызывает кластеризацию.
Примеры белковых гормонов, которые могут быть использованы в качестве связывающих остатков, включают в себя, без ограничения, тромбоцитарный фактор роста (platelet-derived growth factor (PDGF)), который связывает PDGF-рецептор; инсулин-подобный фактор роста-I и -II (insulin-like growth factor-I and -II (Igf)), который связывает Igf-рецептор; фактор роста нервов (nerve growth factor (NGF)), который связывает NGF-рецептор; фактор роста фибробластов (fibroblast growth factor (FGF)), который связывает FGF-рецептор (например, aFGF и bFGF); эпидермальный фактор роста (epidermal growth factor (EGF)), который связывает EGF-рецептор; трансформирующий фактор роста (TGF, например, TGF-α и TGF-β), которые связывают TGF-рецептор; эритропоэтин, который связывает рецептор эритропоэтина; гормон роста (например, человеческий гормон роста), который связывает рецептор гормона роста; и проинсулин, инсулин, A-цепь инсулина и B-цепь инсулина, которые все связываются с рецептором инсулина.
Рецепторные связывающие остатки применяются для детектирования и получения изображений рецепторов, кластеризованных на поверхности клетки. Применимые эктодомены включают в себя эктодомены белка Notch, белка Delta, интегринов, кадгеринов и других молекул клеточной адгезии.
Связывающие остатки антител
Другие полипептидные связывающие остатки включают в себя иммуноглобулиновые связывающие остатки, которые включают в себя по меньшей мере один домен иммуноглобулина, и обычно по меньшей мере два таких домена. ʺДомен иммуноглобулинаʺ означает домен молекулы антитела, например, вариабельный или константный домен. ʺДомен надсемейства иммуноглобулиновʺ означает домен, который имеет трехмерную структуру, родственную структуре иммуноглобулинового домена, но не из молекулы иммуноглобулина. Домены иммуноглобулина и домены надсемейств иммуноглобулинов обычно включают в себя два β-листа, образованные из около семи β-нитей, и консервативную дисульфидную связь (см., например, Williams and Barclay Ann. Rev Immunol., 6:381 (1988)). Белки, которые включают в себя домены доменов надсемейства Ig, включают в себя Т-клеточные рецепторы, CD4, происходящий из тромбоцитов рецептор фактора роста (platelet derived growth factor receptor (PDGFR)) и молекулу межклеточной адгезии (intercellular adhesion molecule (ICAM)).
Один вид иммуноглобулинового связывающего остатка представляет собой антитело. Понятие ʺантителоʺ для целей настоящего изобретения означает полноразмерную, двухцепочечную молекулу иммуноглобулина и антигенсвязывающий участок и ее фрагменты, включая синтетические варианты. Типичное антитело включает в себя вариабельные области двух тяжелых (heavy (H)) цепей (сокращено в данном документе как VH), и вариабельные области двух легких (light (L)) цепей (сокращено в данном документе как VL). VH- и VL-области могут быть дополнительно подразделены на гипервариабельные области, именуемые ʺобластями, определяющими комплементарностьʺ (complementarity determining regions (CDR)), чередующиеся с областями, которые являются более консервативными, именуемыми ʺкаркасными областямиʺ (framework regions (FR)). Протяженность каркасной области и CDR была точно определена (см., Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, и Chothia et al., J. Mol. Biol., 196:901 (1987)). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
Антитело также может включать в себя константную область как часть легкой или тяжелой цепи. Легкие цепи могут включать в себя константные области, кодируемые геном каппа- или лямбда-, на COOH-конце (именуемые CL). Тяжелые цепи могут включать в себя, например, гамма-константную область (IgG1, IgG2, IgG3, IgG4; кодирующую около 330 аминокислот). Гамма-константная область может включать в себя, например, сегменты CH1, CH2 и CH3. Понятие ʺполноразмерное антителоʺ относится к белку, который включает в себя один полипептид, который включает в себя VL и CL, и второй полипептид, который включает в себя VH, CH1, CH2 и CH3.
Понятие ʺантигенсвязывающий фрагментʺ антитела для целей настоящего изобретения относится к одному или более фрагментам полноразмерного антитела, которые сохраняют способность специфически связываться с мишенью. Примеры антигенсвязывающих фрагментов включают, но не ограничиваются ими: (i) Fab-фрагмент, одновалентный фрагмент, состоящий из VL-, VH-, CL- и CH1-доменов; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, включающий в себя два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iv) Fv-фрагмент, состоящий из VL- и VH-доменов одного плеча антитела, (v) фрагмент dAb (Ward et al., Nature 341:544 (1989)), который состоит из VH-домена и (vi) изолированную область, определяющую комплементарность (CDR). Дополнительно, хотя два домена Fv-фрагмента, VL и VH, кодируются разными генами, они могут быть объединены с помощью рекомбинантных способов синтетическим линкером, который позволяет получить одиночную белковую цепь, в которой VL- и VH-области спариваются с образованием одновалентных молекул (известна как одноцепочечный Fv-фрагмент (scFv); см., например, публикации Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также входят в определение понятия ʺантигенсвязывающий фрагментʺ.
Однодоменное антитело (sdAb, нанотело) представляет собой фрагмент антитела, состоящий из одного мономерного вариабельного домена антитела, и также может быть использовано в системах и способах по изобретению. Подобно целому антителу, sdAb способны селективно связываться с антигеном. С молекулярной массой, составляющей всего лишь от 12 до 15 кДа, одно доменные антитела намного меньше, чем обычные антитела (150-160 кДа), которые состоят из двух тяжелых белковых цепей и двух легких цепей, и даже меньше, чем Fab-фрагменты (около 50 кДа, одна легкая цепь и половина тяжелой цепи) и одноцепочечные вариабельные фрагменты (около 25 кДа, два вариабельные домена, один из легкой и один из тяжелой цепи).
Полисахаридные связывающие остатки
В некоторых вариантах осуществления связывающий остаток представляет собой полисахарид, связанный, например, используя любой из множества химических способов, простой связью, например, ковалентной связью, на одном из двух концов, с функциональной группой на магнитной частице. Полисахариды могут быть синтетическими или натуральными. Моно-, ди-, три- и полисахариды могут быть использованы в качестве связывающего остатка. К ним относятся, например, гликозиды, N-глюкозамины, O-ацил-производные, O-метилпроизводные, осазоны, спирты сахаров, кислоты сахаров, фосфаты сахаров при использовании соответствующих химических способов присоединения к магнитной частице.
Способ выполнения связывания заключается в присоединении авидина к магнитной частице и взаимодействию магнитной частицы, несущей авидин, с коммерчески доступными биотинилированными полисахаридами с целью получения конъюгатов полисахаридов с магнитными частицами. Например, полисахариды на основе антигена сиалил-Льюиса являются коммерчески доступными в качестве биотинилированных реагентов и будут взаимодействовать с авидин-CLIO (см. Syntesome, Gesellschaft für Medizinische Biochemie mbH.). Тетрасахарид сиалил-Льюис X (Slex) узнается белками, известными как селектины, которые присутствуют на поверхностях лейкоцитов и функционируют в рамках воспалительного каскада для привлечения лейкоцитов.
Другие нацеливающие остатки включают в себя небелковый элемент, например, гликозильную модификацию (такую как антиген Льюиса) или другую небелковую органическую молекулу. Другой способ представляет собой ковалентное связывание белка с магнитной частицей.
Еще один признак данных способов включает в себя идентификацию специфических типов клеток для гематологических или гистопаталогических исследований, например, подсчета количества CD4/CD3-клеток и циркулирующих опухолевых клеток с использованием любого из связывающих остатков, описанных выше.
Поливалентные связывающие агенты
Тесты по изобретению могут включать в себя поливалентный связывающий агент (i), несущий многочисленные аналиты, которые связаны с носителем (например, простой синтетический каркас или белок-носитель большего размера или полисахарид, такие как BSA, трансферрин или декстран), или несущий многочисленные эпигоны для связывания, например, с двумя или более популяциями магнитных частиц с образованием агрегата.
Когда используется поливалентный связывающий агент, то многочисленные аналиты могут быть связаны с носителем (например, простой синтетический каркас или белок-носитель большего размера или полисахарид, такие как BSA, трансферрин или декстран), Альтернативно, поливалентный связывающий агент может представлять собой нуклеиновую кислоту, предназначенную для связывания двух или более популяций магнитных частиц. Такие поливалентные связывающие агенты выступают в качестве агломерирующих средств, и построение анализа характеризуется конкуренцией между анализируемым аналитом и поливалентным связывающим агентом (например, в тесте ингибирования, конкурентном тесте или дезагрегирующем тесте).
Функциональная группа, присутствующая в аналите, может быть использована для образования ковалентной связи с носителем. Альтернативно, аналит может быть дериватизирован, чтобы обеспечить линкер (например, спейсер, отделяющий аналит от носителя в конъюгате), заканчивающийся функциональной группой (например, спиртовой группой, аминогруппой, карбоксильной группой, сульфгидрильной группой или фосфатной группой), которая используется для образования ковалентной связи с носителем.
Ковалентное связывание аналита и носителя может быть осуществлено с использованием линкера, который содержит реактивные остатки, способные к взаимодействию с такими функциональными группами, присутствующими в аналите и носителе. Например, гидроксильная группа аналита может взаимодействовать с карбоксильной группой линкера или его активированным производным, что приводит к образованию сложноэфирной связи между аналитом и носителем.
Примеры остатков, способных к взаимодействию с сульфгидрильными группами, включают в себя α-галогенацетильные соединения типа XCH2CO- (где X обозначает Br, Cl или I), которые проявляют особенную способность к взаимодействию с сульфгидрильными группами, но которые также могут быть использованы для модификации имидазолильной, тиоэфирной, фенольной групп и аминогруппы, как описано у Gurd, Methods Enzymol. 11:532 (1967). Производные N-малеимида также считаются селективными по отношению к сульфгидрильным группам, но дополнительно могут быть применимы для присоединения к аминогруппам при некоторых условиях. Такие реагенты, как 2-иминотиолан (Traut et al., Biochemistry 12:3266 (1973)), которые вводят тиоловую группу через преобразование аминогруппы, могут рассматриваться в качестве сульфгидрильных реагентов, если связывание происходит за счет образования дисульфидных мостиков.
Примеры реактивных остатков, способных к взаимодействию с аминогруппами, включают в себя, например, алкилирующие и ацилирующие агенты. Представители алкилирующих агентов включают в себя:
(i) α-галогенацетильные соединения, которые проявляют специфичность по отношению к аминогруппам в отсутствие реактивных тиоловых групп и относятся к типу XCH2CO- (где X обозначает Cl, Br или I), например, как описано в публикации Wong, Biochemistry 24:5337 (1979); (ii) производные N-малеимида, которые могут взаимодействовать с аминогруппами либо посредством реакции типа Михаэля или через ацилирование присоединением к карбонильной группе кольца, например, как описано в публикациях Smyth et al., J. Am. Chem. Soc. 82:4600 (1960) и Biochem. J. 91:589 (1964); (iii) арилгалогениды, такие как реактивные нитрогалоген-ароматические соединенияс; (iv) алкилгалогениды, описанные, например, в публикации McKenzie et al., J. Protein Chem. 7:581 (1988); (v), альдегиды и кетоны, способные образовывать основание Шиффа с аминогруппами, причем образовавшиеся аддукты обычно стабилизируются посредством восстановления, давая стабильный амин; (vi) эпоксидные производные, такие как эпихлоргидрин и бисоксираны, которые могут вступать в реакцию с аминогруппой, сульфгидрильной или фенольной гидроксильной группами; (vii) хлорсодержащие производные сим-триазинов, которые являются очень реакционноспособными по отношению к нуклеофилам, таким как аминогруппа, сульфгидрильная и гидроксильная группы; (viii) азиридины на основе соединений сим-триазина, подробно рассмотренных выше, например, как описано в публикации Ross, J. Adv. Cancer Res. 2:1 (1954), которые взаимодействуют с такими нуклеофилами, как аминогруппы, раскрытием кольца; (ix) диэтиловые сложные эфиры сквариковой кислоты, как описано в публикации Tietze, Chem. Ber. 124:1215 (1991); и (x) α-галогеналкиловые простые эфиры, которые являются более реакционноспособными алкилирующими агентами, чем обычные алкилгалогениды, из-за активации, вызываемой атомом кислорода простого эфира, как описано в публикации Benneche et al., Eur. J. Med. Chem. 28:463 (1993).
Представители реакционноспособных по отношению к аминогруппам ацилирующих агентов включают в себя (i) изоцианаты и изотиоцианаты, в частности, ароматические производные, которые образуют устойчивые производные мочевины и тиомочевины, соответственно; (ii) сульфонилхлориды, которые были описаны в публикации Herzig et al., Biopolymers 2:349 (1964); (iii) галоидангидриды; (iv) активные сложные эфиры, такие как нитрофенилэфиры или N-гидроксисукцинимидилэфиры; (v), ангидриды кислот, такие как смешанные, симметричные или N-карбоксиангидриды; (vi) другие применимые реагенты для образования амидной связи, например, как описано в публикации М. Bodansky, Principles of Peptide Synthesis, Springer-Verlag, 1984; (vii) ацилазиды, например, в которых азидная группа генерируется из предварительно образованного производного гидразида с использованием нитрита натрия, как описано в публикации Wetz et al., Anal. Biochem. 58:347 (1974); и (viii) имидоэфиры, которые образуют устойчивые амидины при реакции с аминогруппами, например, как описано в публикации Hunter and Ludwig, J. Am. Chem. Soc. 84:3491 (1962). Альдегиды и кетоны могут взаимодействовать с аминами с образованием оснований Шиффа, которые предпочтительно могут быть стабилизированы через восстановительное аминирование. Алкоксиламиновые остатки легко взаимодействуют с кетонами и альдегидами для получения стабильных алкоксиаминов, например, как описано в публикации Webb et al., Bioconjugate Chem. 1:96 (1990). Примеры реактивных остатков, способных к взаимодействию с карбоксильными группами, включают в себя диазосоединения, такие как диазоацетатные эфиры и диазоацетамиды, которые взаимодействуют с высокой специфичностью с получением эфирных групп, например, как описано в публикации Herriot, Adv. Protein Chem. 3: 169 (1947). Могут быть также использованы специфические к карбоксильной группе модифицирующие реагенты, такие как карбодиимиды, которые взаимодействуют через образование O-ацилмочевины с последующим образованием амидной связи.
Следует иметь в виду, что функциональные группы в аналите и/или носителе могут быть, по желанию, преобразованы перед реакцией в другие функциональные группы, например, для придания дополнительной реакционноспособности или селективности. Так называемые линкеры нулевой длины, включающие в себя прямое объединение реакционноспособной химической группы аналита с реакционноспособной химической группой носителя через ковалентную связь без введения дополнительного связывающего материала, могут быть использованы, по желанию, в соответствии с изобретением. Чаще всего, однако, данный линкер будет включать в себя два или более реакционноспособных остатков, как описано выше, соединенных спейсерным элементом. Наличие такого спейсера позволяет дифункциональным линкерам взаимодействовать со специфическими функциональными группами в аналите и в носителе, приводя к появлению ковалентной связи между ними. Реакционноспособные остатки в линкере могут быть одинаковыми (гомодифункциональный линкер) или различными (гетеродифункциональный линкер, или, если присутствуют несколько разнородных реакционноспособных остатков, гетерополифункциональный линкер), обеспечивая разнообразие потенциальных реагентов, которые могут привести к ковалентному присоединению аналита к носителю. Спейсерные элементы в линкере обычно состоят из линейных или разветвленных цепей и могут включать в себя (C1-C10)алкил, гетероалкил, состоящий из от 1 до 10 атомов, (C2-C10)алкен, (C2-C10)алкин, (C5-C10)арил, циклическую систему, состоящую из от 3 до 10 атомов, или -(CH2CH2O)nCH2CH2-, в котором n равен от 1 до 4. Как правило, поливалентный связывающий агент будет включать в себя 2, 3, 4, 5, 6, 7, 8, 15, 50 или 100 (например, от 3 до 100, от 3 до 30, от 4 до 25 или от 6 до 20) конъюгированных аналитов. Поливалентные связывающие агенты обычно имеют массу от 10 кДа до 200 кДа и могут быть приготовлены, как описано в примерах.
Аналиты
Варианты осуществления изобретения включают в себя устройства, системы и/или способы для детектирования и/или измерения концентрации одного или более аналитов в образце (например, белка, пептида, фермента, полипептида, аминокислоты, нуклеиновой кислоты, олигонуклеотида, терапевтического средства, метаболита терапевтического средства, РНК, ДНК, циркулирующих ДНК (например, из клетки, опухоли, патогена или плода), антитела, организма, вируса, бактерий, углевода, полисахарида, глюкозы, липида, газа (например, кислорода и/или диоксида углерода), электролита (например, натрия, калия, хлорида, бикарбоната, BUN, магния, фосфата, кальция, аммиака и/или лактата), распространных химических молекул (креатинина, глюкозы), липопротеина, холестерина, жирной кислоты, гликопротеина, протеогликана и/или липополисахарида). Аналиты могут включать в себя идентификаторы клеток или специфических типов клеток. Аналит(ы) могут включать в себя одно или более биологически активных веществ и/или метаболит(ы), маркер(ы) и/или другой(ие) индикатор(ы) биологически активных веществ. Биологически активное вещество может быть описано как единое целое или сочетание компонентов. Понятие ʺбиологически активное веществоʺ включает в себя, в частности, лекарства; витамины; минеральные добавки; вещества, используемые для лечения, профилактики, диагностики, санаторного лечения или смягчения последствий заболевания или болезни; или вещества, которые влияют на структуру или функцию организма; или пролекарства, которые становятся биологически активными или более активными после того, как они были размещены в заранее определенном физиологическом окружении; или такие биологически токсичные вещества, как те, которые используются в биологическом оружии, включая организмы, такие как сибирская язва, лихорадка Эбола, Salmonella typhimurium, вирус Марбург, чума, холера, Francisella tulariesis (туляремия), бруцеллез, Ку-лихорадка, боливийская геморрагическая лихорадка, Coccidioides mycosis, can, мелиоидоз, Shigella, пятнистая лихорадка Скалистых гор, сыпной тиф, орнитоз, желтая лихорадка, японский энцефалит В, лихорадка долины Рифт и оспа; природные токсины, которые могут быть использованы в качестве оружия, включая рицин, афлатоксин, SEB, ботулинический токсин, сакситоксин и многие микотоксины. Аналиты могут также включать в себя организмы, такие как Candida albicans, Candida glabrata, Candida krusei, Candida parapsilosis, Candida tropicalis, коагулазоотрицательный Staphalococcus, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, Klebsiella pneumonia, Pseudomonas aeruginosa, Staphylococcus aureus, Acinetobacter baumannii, Aspergillus fumigates, Bacteroides fragilis, Bacteroides fragilis, blaSHV, Burkholderia cepacia, Campylobacter jejuni/coli, Candida guilliermondii, Candida lusitaniae, Clostridium pefringens, Enterobacter aeraogenesi, Enterobacter cloacae, Enterobacteriaceae spp., Haemophilus influenza, Kingella kingae, Klebsiella oxytoca, Listeria monocytogenes, Mec A gene-bearing bacteria (MPSA), Morganella morgana, Neisseria meningitides, Neisseria spp., non-meningitidis, Prevotella buccae, Prevotella intermedia, Prevotella melaninogenica, Propionibacterium acnes, Proteus mirabilis, Proteus vulgaris, Salmonella enteric, Serratia marcescens, Staphylococcus haemolyticus, Staphylococcus maltophilia, Staphylococcus saprophyticus, Stenotrophomonas maltophilia, Stenotrophomonas maltophilia, Streptococcus agalactie, Streptococcus bovis, Streptococcus dysgalactie, Streptococcus mitis, Streptococcus mutans, Streptococcus pneumonia, Streptococcus pyogenes, Streptococcus sanguinis, ген Van А, ген Van В. Аналиты могут также включать в себя вирусные организмы, такие как dsnHK вирусы (содержащие двухцепочечную ДНК) (например, аденовирусы, вирусы герпеса, вирусы оспы); ssДHK вирусы (содержащие одноцепочечную ДНК) с (+) смысловой (положительной полярности) ДНК (например, парвовирусы); dsPHK вирусы (например, реовирусы); (+) ssRNA вирусы с (+) смысловой РНК (например, пикорнавирусы, тогавирусы); (-) ssRNA вирусы с (-) смысловой РНК (отрицательной полярности) (например, ортомиксовирусы, рабдовирусы); ssRNA-RT вирусы с (+) смысловой РНК с промежуточным продуктом ДНК в жизненном цикле (например, ретровирусы); и dsДHK-RT вирусы (например, гепаднавирусы).
Оппортунистические инфекции, которые могут быть детектированы с помощью систем и способов по изобретению, включают, в частности, грибковые, вирусные, бактериальные, протозойные инфекции, такие как: 1) грибковые инфекции, такие как инфекции, вызываемые Candida spp. (резистентные и нерезистентные к лекарственному препарату штаммы), С. albicans, С. krusei, С. glabrata и Aspergillus fumigates; 2) грамотрицательные инфекции, такие, как инфекции, вызываемые E. coli, Stenotrophomonas maltophilia, Klebsiella pneumonia/oxytoca и Pseudomonas aeruginosa; и 3) грамположительные инфекции, такие, как инфекции, вызываемые Staphylococcus spp., S. aureus, S. pneumonia, Enterococcus ssp. (E faecalis and E. faecium). Данная инфекция может быть вызвана коагулазоотрицательным стафилококком, Corynebacterium spp., Fusobacterium spp., Morganella morganii, Pneumocystis jirovecii (ранее известный как Pneumocystis carinii), F. hominis, S. pyogenes, Pseudomonas aeruginosa, polyomavirus JC polyomavirus (вирус, который вызывает прогрессивную мультифокальную лейкоэнцефалопатию), Acinetobacter baumanni, Toxoplasma gondii, цитомегаловирусом, Aspergillus spp., возбудителем саркомы Капоши, Cryptosporidium spp., Cryptococcus neoformans и Histoplasma capsulatum.
He ограничивающие примеры широких категорий аналитов, которые могут быть детектированы с помощью устройств, систем и способов по изобретению, включают, в частности, следующие терапевтические категории: анаболические средства, антациды, противоастматические средства, антихолестеринемические и антилипидные средства, антикоагулянты, противосудорожные средства, антидиарейные средства, противорвотные средства, противоинфекционные средства, противовоспалительные средства, антиманиакальные средства, противорвотные средства, противоопухолевые средства, средства для похудения, жаропонижающие средства и анальгетики, антиспазматические средства, антитромботические средства, антиурикемические средства, антиангинальные средства, антигистаминные препараты, противокашлевые препараты, препараты для подавления аппетита, биологические средства, церебральные расширители, ишемические расширители, противоотечные средства, мочегонные средства, диагностические средства, эритропоэтические средства, отхаркивающие средства, желудочно-кишечные седативные средства, гипергликемические средства, снотворные средства, сахароснижающие препараты, ионообменные смолы, слабительные средства, минеральные добавки, муколитические препараты, препараты нервно-мышечного действия, периферические вазодилататоры, психотропные средства, седативные средства, стимуляторы, тиреоидные и антитиреоидные препараты, маточные релаксанты, витамины и пролекарства.
Биологически активные вещества, которые могут быть детектированы с помощью устройств, систем и способов по изобретению, включают, в частности, лекарственные препараты для желудочно-кишечного тракта или пищеварительной системы, например, антациды, препараты подавления рефлюкса, препараты против метеоризма кишечника, антидопаминовые препараты, ингибиторы протонной помпы, антагонисты H2-рецепторов, цитопротектанты, аналоги простагландинов, слабительные средства, антиспазмолитики, противопоносные препараты, секвестранты желчных кислот и опиоиды; лекарственные препараты для сердечно-сосудистой системы, например, блокаторы бета-рецепторов, блокаторы кальциевых каналов, диуретики, сердечные гликозиды, антиаритмические средства, нитраты, антиангинальные препараты, сосудосуживающие средства, сосудорасширяющие средства, периферические активаторы, ингибиторы АСЕ, блокаторы рецепторов ангиотензина, альфа-блокаторы, антикоагулянты, гепарин, HSGAG, антиагреганты, фибринолитики, антигемофильные факторы, гемостатические препараты, гиполипемические агенты и статины; лекарственные препараты для центральной нервной системы, например, снотворные, обезболивающие средства, нейролептики, антидепрессанты, противорвотные средства, противосудорожные препараты, противоэпилептические средства, транквилизаторы, барбитураты, лекарственные препараты против двигательных расстройств, стимуляторы, бензодиазепины, циклопирролон, антагонисты допамина, антигистаминные препараты, холинергики, антихолинергические средства, рвотные средства, каннабиноиды, антагонисты 5-HT-рецепторов; лекарственные препараты для воздействия на боли и/или сознание, например, NSAID, опиоиды и орфаны, такие как парацетамол, трициклические антидепрессанты и противосудорожные препараты; препараты для лечения нарушений опорно-двигательного аппарата, например, NSAID, миорелаксанты и нервно-мышечный лекарственный препарат антихолинэстераза; лекарственные препараты для глаз, например, адренергические блокаторы нейронов, вяжущие средства, препараты для увлажнения роговицы глаза, местные анестетики, симпатомиметики, парасимпатолитики, мидриатики, препараты для расширения зрачка, антибиотики, местные антибиотики, сульфаниламидные препараты, аминогликозиды, фторхинолоны, антивирусные препараты, противогрибковые препараты, имидазолы, полиены, NSAID, кортикостероиды, ингибиторы тучных клеток, адренергические агонисты, бета-блокаторы, ингибиторы карбоангидразы/гиперосмотические препараты, холинергики, мистические препараты, парасимпатомиметики, простагландин, агонисты/ингибиторы простагландина; лекарственные препараты для уха, носа и ротовой части глотки, например, симпатомиметики, антигистаминные препараты, антихолинергические средства, NSAID, стероиды, антисептики, местные анестетики, противогрибковые препараты, серуменолитические препараты; лекарственные препараты для дыхательной системы, например, бронходилататоры, NSAID, антиаллергические препараты, противокашлевые средства, муколитики, противоотечные средства, кортикостероиды, антагонисты бета-рецепторов, антихолинергические средства, стероиды; лекарственные препараты для эндокринных проблем, например, андроген, антиандроген, гонадотропин, кортикостероиды, гормон роста, инсулин, противодиабетические препараты, гормоны щитовидной железы, антитиреоидные препараты, кальцитонин, дифоспонат и аналоги вазопрессина; лекарственные препараты для репродуктивной системы или мочевой системы, например, противогрибковые препараты, алкализирующие средства, хинолоны, антибиотики, холинергики, антихолинергики, антихолинэстераза, антиспазмолитики, ингибитор 5-альфа-редуктазы, селективные альфа-1-блокаторы и силденафил; лекарственные препараты для контрацепции, например, оральные контрацептивы, спермициды и депо-препараты контрацептивов; лекарственные препараты для акушерства и гинекологии, например, NSAID, антихолинергические средства, гемостатические препараты, антифибринолитики, заместительная гормональная терапия, регулятор костей, агонисты бета-рецепторов, фолликулостимулирующий гормон, лютеинизирующий гормон, LHRH гамоленовая кислота, ингибитор высвобождения гонадотропина, прогестоген, агонист дофамина, эстроген, простагландин, гонадорелин, кломифен, таммоксифен и диэтилстильбестрол; лекарственные препараты для кожи, например, смягчающие вещества, препараты против зуда, противогрибковые препараты, дезинфицирующие средства, средство от чесотки, педикулицид, продукты перегонки из смолы, производные витамина A, аналог витамина D, кератолитики, абразивы, системные антибиотики, местные антибиотики, гормоны, отшелушивающие средства, абсорбенты экссудата, фибринолитики, протеолитики, солнцезащитные кремы, дезодоранты и кортикостероиды; лекарственные препараты для лечения инфекций и заражений, например, антибиотики, противогрибковые препараты, антилепротики, противотуберкулезные препараты, противомалярийные препараты, антигельминтики, амебоцид, противовирусные препараты, противопротозойные средства и антисыворотка; лекарственные препараты для лечения иммунной системы, например, вакцины, иммуноглобулин, иммунодепрессанты, интерферон, моноклональные антитела, лекарства для аллергических расстройств, например, антиаллергические препараты, антигистаминные препараты и NSAID; лекарственные препараты для питания, например, тонизирующие средства, препараты железа, электролиты, витамины, лекарственные препараты против ожирения, анаболические препараты, кроветворные лекарственные препараты и лекарственные препараты пищевых продуктов; лекарственные препараты для опухолевых заболеваний, например, цитостатики, половые гормоны, ингибиторы ароматазы, ингибиторы соматостатина, рекомбинантные интерлейкины, G-CSF и эритропоэтин; лекарственные препараты для диагностики, например, контрастные вещества; и лекарственные препараты для рака (антираковые средства).
Биологически активные вещества, которые могут быть детектированы с помощью устройств, систем и способов по изобретению, включают, в частности, гематологические средства, такие как антианемические средства, кроветворные антианемические средства, средства для свертывания крови, антикоагулянты, гемостатические средства для свертывания крови, средства для свертывания крови с ингибитором тромбоцитов, средства для свертывания крови с тромболитическим ферментом и расширители объема плазмы; антикоагулянты, гепарин, HSGAG, антиагреганты, фибринолитики, антигемофильные факторы, гемостатические препараты. Примеры антитромботических препаратов (например, тромболитиков, антикоагулянтов и антиагрегантов), которые могут быть детектированы с помощью устройств, систем и способов по изобретению, включают в себя антагонисты витамина К, такие как аценокумарол, хлориндион, дикумарол, дифенадион, этиловый бискумацетат, фенпрокумон, фениндион, тиокломарол и варфарин, препараты гепариновой группы (ингибиторы агрегации тромбоцитов), такие как антитромбин III, бемипарин, дальтепарин, данапароид, эноксапарин, гепарин, надропарин, парнапарин, ревипарин, сулодексид и тинзапарин; другие ингибиторы агрегации тромбоцитов, такие как абциксимаб, ацетилсалициловая кислота (аспирин), алоксиприн, берапрост, дитазол, карбасалат кальция, клорикромен, клопидогрель, дипиридамол, эпопростенол, эптифибатид, индобуфен, илопрост, пикотамид, прасугрель, тиклопидин, тирофибан, трепростинил и трифлузал; ферменты, такие как альтеплаза, анкрод, анистреплаза, бриназа, дротрекогин альфа, фибринолизин, протеин C, ретеплаза, саруплаза, стрептокиназа, тенектеплаза и урокиназа; прямые ингибиторы тромбина, такие как аргатробан, бивалирудин, десирудин, лепирудин, мелагатран и ксимелагатран; другие антитромботические препараты, такие как дабигатран, дефибротид, дерматансульфат, фондапаринукс и ривароксабан; и другие, такие как цитрат, ЭДТА и оксалат.
Другие биологически активные вещества, которые могут быть детектированы с помощью устройств, систем и способов по изобретению, включают в себя таковые вещества, упомянутые в Basic and Clinical Pharmacology (LANGE Basic Science), Katzung and Katzung, ISBN 0071410929, McGraw-Hill Medical, 9th edition (2003).
Заболевания
Способы по изобретению могут быть использованы в процессе мониторинга одного или более аналитов в диагностике, управлении и/или лечении любого заболевания из широкого спектра заболеваний. Различные категории заболеваний включают в себя, например, нарушения, связанные с болью; изменениями в температуре тела (например, лихорадку); дисфункциями нервной системы (например, обмороки, миалгии, двигательные расстройства, онемение, потерю чувствительности, бред, слабоумие, потерю памяти или нарушения сна); заболевания глаз, ушей, носа и горла, заболевания кровообращения и/или дыхательной функции (например, дисплению, отек легких, кашель, кровохарканье, гипертонию, инфаркт миокарда, гипоксию, цианоз, сердечно-сосудистый коллапс, застойную сердечную недостаточность, отек или шок); нарушения желудочно-кишечной функции (например, дисфагию, диарею, запор, желудочно-кишечное кровотечение, желтуху, асцит, диспепсию, тошноту, рвоту); расстройства функции почек и мочевыводящих путей (например, ацидоз, алкалоз, дисбалансы жидкости и электролитов, азотемию или мочевые нарушения); расстройства половой и репродуктивной функции (например, эректильную дисфункцию, менструальные нарушения, гирсутизм, вирилизацию, бесплодие, расстройства, связанные с беременностью и стандартные измерения); заболевания кожи (например, экзему, псориаз, акне, розацеа, кожные инфекции, иммунологические заболевания кожи или фоточувствительность), заболевания крови (например, гематологию); заболевания генов (например, генетические нарушения); нарушения, связанные с ответом на лекарственный препарат (например, побочные реакции на лекарственный препарат) и расстройства, связанные с питанием (например, ожирение, расстройства, связанные с приемом пищи, или пищевая оценка). Другие области медицины, в которых варианты осуществления изобретения находят применение, включают в себя онкологию (например, опухоли, злокачественные опухоли, ангиогенез, паранеопластические синдромы или онкологические чрезвычайные ситуации); гематологию (например, анемию, гемоглобинопатию, мегалобластную анемию, гемолитическую анемию, апластическую анемию, миелодисплазию, недостаточность костного мозга, полицитемию, миелопролиферативные заболевания, острый миелобластный лейкоз, хронический миелолейкоз, лимфоидные злокачественные опухоли, нарушения плазматических клеток, биологию переливания или транспланты); гемостаз (например, нарушения свертывания крови и тромбоз или нарушения тромбоцитов и сосудистой стенки); и инфекционные заболевания (например, сепсис, септический шок, лихорадку неизвестного происхождения, эндокардит, укусы, ожоги, остеомиелит, абсцесс, пищевые отравления, воспалительные заболевания тазовых органов, бактериальные инфекции (например, грамположительные, грамотрицательные, разные (Nocardia, actimoyces, смешанные), микобактериальные, спирохетозные, риккетсии или микоплазмы); хламидиоз, вирусные (ДНК, РНК), грибковые и водорослевые инфекции; протозойные и глистные инфекции; эндокринные заболевания; болезни питания и нарушения обмена веществ.
Другие заболевания и/или области медицины, в которых варианты осуществления изобретения находят применение, включают в себя те, которые упомянуты в Harrison's Principles of Internal Medicine, Kasper et al., ISBN 0071402357, McGraw-Hill Professional, 16th edition (2004), а также те, которые упомянуты в Robbins Basic Pathology, Kumar, Cotran, and Robbins, eds., ISBN 1416025340, Elsevier, 7th edition (2005).
Медицинские тесты (например, тесты крови, тесты мочи и/или тесты других тканей человека или животного), которые могут быть выполнены с использованием различных вариантов осуществления изобретения, описанных в данном документе, включают в себя, например, общие химические тесты (например, аналиты включают в себя альбумин, азот мочевины крови, кальций, креатинин, магний, фосфор, общий белок и/или мочевую кислоту); электролитические тесты (например, аналиты включают в себя натрий, калий, хлор и/или диоксид углерода); диабетические тесты (например, аналиты включают в себя глюкозу, гемоглобин A1C и/или микроальбумин); липидные тесты (например, аналиты включают в себя аполипопротеин A1, аполипопротеин B, холестерин, триглицерид, холестерин липопротеинов низкой плотности и/или холестерин липопротеинов высокой плотности); оценку питания (например, аналиты включают в себя альбумин, преальбумин, трансферрин, ретинолсвязывающий белок, альфа-1-кислый гликопротеин и/или ферритин), тесты функции печени (например, аналиты включают в себя аланинтрансаминазу, альбумин, щелочную фосфатазу, аспартаттрансаминазу, прямой билирубин, гамма-глутамилтрансаминазу, лактатдегидрогеназу, иммуноглобулин A, иммуноглобулин G, иммуноглобулин M, преальбумин, общий билирубин и/или общий белок); тесты сердечной функции (например, аналиты включают в себя аполипопротеин A1, аполипопротеин B, сердечный тропонин-1, креатинкиназу, изофермент креатинкиназу MB, CRP высокой чувствительности, массовое соотношение изофермента креатинкиназы MB к миоглобину и/или N-терминальный про-мозговой натрийуретический пептид); тесты на анемию (например, аналиты включают в себя ферритин, фолиевую кислоту, гомоцистеин, гаптоглобин, железо, растворимый рецептор трансферрина, способность к связыванию всего железа, трансферрин и/или витамин B12); панкреатические тесты (например, аналиты включают в себя амилазу и/или липазу); нефропатии (например, аналиты включают в себя альбумин, альфа-1-микроглобулин, альфа-2-макроглобулин, бета-2-микроглобулин, цистатин C, ретинолсвязывающий белок и/или трансферрин); костные тесты (например, аналиты включают в себя щелочную фосфатазу, кальций и/или фосфор); мониторинг маркеров рака (например, аналиты включают в себя общий PSA); тиреоидные тесты (например, аналиты включают в себя свободный тироксин, свободный трийодтиронин, тироксин, тиреотропный гормон и/или трийодтиронин); тесты на рождаемость (например, аналиты включают в себя бета-хорионический гонадотропин человека); мониторинг терапевтических лекарственных препаратов (например, аналиты включают в себя карбамазепин, дигоксин, дигитоксин, гентамицин, лидокаин, литий, N-ацетилпрокаинамид, фенобарбитал, фенитоин, прокаинамид, теофиллин, тобрамицин, вальпроевую кислоту и/или ванкомицин); мониторинг иммуносупрессивных препаратов (например, аналиты включают в себя циклоспорин, сиролимус и/или такролимус); тесты на активность комплемента и/или аутоиммунное заболевание (например, аналиты включают в себя C3-комплемент, C4-комплемент, C1-ингибитор, C-реактивный белок и/или ревматоидный фактор); тесты на поликлональные/моноклональные гаммопатии (например, аналиты включают в себя иммуноглобулин A, иммуноглобулин G, иммуноглобулин M, 1 g легкие цепи типов каппа- и/или лямбда, подклассы 1, 2, 3 и/или 4 иммуноглобулина G); тесты на инфекционные заболевания (например, аналиты включают в себя антистрептолизин O); тесты на воспалительное заболевание (например, аналиты включают в себя альфа-1-кислый гликопротеин, альфа-1-антитрипсин, церулоплазмин, C-реактивный белок и/или гаптоглобин); тестирование аллергии (например, аналиты включают в себя иммуноглобулин E), тесты на белок в моче (например, аналиты включают в себя альфа-1-микроглобулин, иммуноглобулин G, 1 g легкие цепи типов каппа- и/или лямбда, микроальбумин и/или белок моче/спинномозговой жидкости); тесты на белок-CSF (например, аналиты включают в себя иммуноглобулин G и/или белок моче/спинномозговой жидкости); токсикологические тесты (например, аналиты включают в себя ацетаминофен в сыворотке, барбитураты в сыворотке, бензодиазепины в сыворотке, салицилат в сыворотке, трициклические антидепрессанты в сыворотке и/или этиловый спирт в моче); и/или тесты на наркотики (например, аналиты включают в себя амфетамин, кокаин, барбитураты, бензодиазепины, экстази, метадон, опиаты, фенциклидин, тетрагидроканнабиноиды, пропоксифен и/или метаквалон). Специальные маркеры рака, которые могут быть детектированы с помощью способов, устройств, картриджей и наборов по изобретению, включают в себя, без ограничения, 17-бета-гидроксистероиддегидрогеназу тип 1, Abl interactor 2, субъединицу 1A комплекса родственного актину белка 2/3 (Actin-related protein 2/3 complex subunit 1A), альбумин, альдолазу, щелочную фосфатазу, плацентарного типа, альфа-1-антитрипсин, альфа-1-кислый гликопротеин 1, альфа-2-HS-гликопротеин, альфа-лактальбумин, альфа-2-макроглобулин, альфа-фетопротеин (AFP), ангиогенин-рибонуклеазу семейства 5 РНКазы A (Angiogenin ribonuclease RNase A family 5), ангиопоэтин 1, ангиопоэтин 2, антиген, определяемый моноклональным антителом Ki-67, антилейкопротеиназу 1 (SLPI), аполипопротеин A1, ATP7B, β2-микроглобулин, B-cell CLL/lymphoma 2, ВСЕ2-связанный X белок, BRCA1, BRCA2, BrMSl, бутират-индуцируемый транскрипт 1 (Butyrate-induced transcript 1), CA15.3/CA27-29, раковый антиген 125, раковый антиген 15.3, раковый антиген 19.9, раковый антиген 602, раковый антиген 72-4/TAG-72, ассоциированный с раком антиген галактотрансферазы (Cancer associated galactotransferase antigen), ассоциированный с раком сывороточный антиген (Cancer associated serum antigen (CASA)), раково-эмбриональный антиген (РЭА (Carcinoembrionic Antigen, CEA)), катенин-бета-1, катепсин D, катепсин (Cathepsin member 8), CC хемокин 4 (HCC-4), CCL21 (малый индуцибельный цитокин А21), CCL5, CD15, CD24, CD34, CD44, протеинкиназу 5 деления клеток (Cell division protein kinase 5), церулоплазмин, протоонкогенный белок р40 рака шейки матки 1 (Cervical cancer 1 protooncogene protein p40), c-Etsl, шаперонин-со держащий ТСР1, субъединицу 3, Chemokine (c-c motif) ligand 4 small inducible cytokine A4 (CCL4, MIP-1-beta), лиганд 5 хемокина, хитиназа-3-подобный белок 1 (YKL-40), Chloride intracellular channel 4 (CLIC4), бета-цепь хориогонадотропина, клаудин-3, клаудин-4, кластерин, фактор свертывания крови II (протромбин), фактор свертывания крови III, а-цепь фактора свертывания крови XIII, b-цепь фактора свертывания крови XIII, C-терминальный пептид коллагена I типа, колониестимулирующий фактор 2, колониестимулирующий фактор 3, компонент С3 комплемента, C-реактивный белок, креатининкиназу мозга (Creatinine kinase brain (CKB)), CTD small phosphatase-like, циклин D1, циклин-зависимую киназу 6 (CDK 6), ингибитор циклин-зависимой киназы 1 (р21), циклооксигеназу-1, цитохром c-оксидазу Va, цитохром С-1, десмин, дистрогликан 1, эндоглин, эндотелии 1, рецептор эпидермального фактора роста (EGFR), эпидермальный фактор роста (EGF), эритропоэтин, E-селектин, EST транслокационный вариант 4 (EST translocation variant 4 (EST 4)), индуктор металлопротеиназы внеклеточного матрикса (Extracellular matrix metalloproteinase inducer (EMMPRIN)), ферритин H, ферритин L, фактор роста фибробластов 2, фибронектин, Fit-3 лиганд, фтордезоксиглюкозу-РЕТ (Fluorodeoxyglucose-PET (FDG-PET)) с СА125, Fms-родственную тирозинкиназу 1 (VEGFR-1), GADD45F, геминин, глифосат-N-ацетилтрансферазу, предшественник гранулин-эпителина (Granulin-epithelin precursor (GEP)), фактор 15 роста и дифференцировки, Гаптоглобин 1, Гаптоглобин-а-субъединица, человеческий эпидидимальный белок НЕ4 (human epididymis protein), Her2, HER2-neu, hK10, hK11, hK13, hk6, hk7, hK8, HLA класс II Doβ, hLMH1, hLMH2, HNF-1R, β-субъединицу хорионического гонадотропина человека, хорионический гонадотропин человека (hCG), IGFBP-2, IL-2R альфа (растворимый рецептор альфа интерлейкина-2), иммуноглобулины, иммуносупрессивный кислый белок (IAP), индоламин-2,3-диоксигеназу, связывающий инсулин-подобный фактор роста белок-1, связывающий инсулин-подобный фактор роста белок-2, связывающий инсулин-подобный фактор роста белок-3, интегрин α-V, интегрин ανβ6, молекулу межклеточной адгезии, интерферон альфа-1, интерлейкин 1 альфа, интерлейкин 1 бета, интерлейкин 10, интерлейкин 12A, интерлейкин 16, фрагмент интер-α-ингибитора трипсина, калликреин 8, кератин, кератин 18, кератин 19, тип I цитоскелетный (питокератин 19), лиганд Kit, KRAS, лактотрансферрин, ламинин-β3, лептил-селектин, рецептор гормона высвобождения лютеинизирующего гормона, Мас-2-связывающий белок 90k, макрофагальный колониестимулирующий фактор, фактор ингибирования миграции макрофагов, антиген к сыворотке молочной железы, маммоглобин B, М-САМ, MIR21, мезотелин, MMP3, антиген-гликопротеин муцинового типа, миозин X, фактор бета роста нервов, нетрин-1, нейроэндокринный секреторный белок-55, нейтрофильный дефенсин 1, нейтрофильный дефенсин 3, Nm23-H1, Nonmetallic cells protein 2, белок неметастатических клеток (Non-metastatic cells 1 protein (NM23A)), O-acyltransferase domain containing 2, OVX1, OX40, P53, параоксоназу 2, Pcaf, p-гликопротеин, фосфорибозиламиноимидазолкарбоксилазу, альфа-рецептор тромбоцитарного фактора роста, бета-рецептор тромбоцитарного фактора роста, тромбоцитарно-эндотелиальную молекулу клеточной адгезии (Platelet endothelial cell adhesion molecule (PECAM-1)), тромбоцитарный фактор 4, связанный с беременностью плазматический белок A, белок ʺзоны беременностиʺ, Procol-lys 1,2 oxoglute 5-digixyg 3, Procol-lys 1,2 oxoglute 5-digoxyg 1, рецептор прогестерона (Progesterone receptor (PR)), пролактин, простатический секреторный белок PSP94, простатический специфический антиген (ПСА (PSA)), простатин, протеинкиназу C-связывающий белок 1 (Protein kinase С binding protein 1), p-селектин, пирролин-5-карбоксилат-редуктазу 1, регулятор G-белок-сигнализации 12, ретикулокальбин, альфа-цепь S-100, S-аденозилгомоцистеингидролазу, белок сывороточный амилоид A, белок с семью трансмембранными доменами (Seven transmembrance domain protein), определяющий пол фактор Y-box-4, сиалил SSEA-1, малый индуцибельный цитокин A18 (CCL18, M1P-4), малый индуцибельный цитокин A2 (CCL2), малый индуцибельный цитокин A3 (CCL3), макрофаговый воспалительный белок-1 альфа, малый индуцибельный цитокин B5 (CXCL5), соматостатин, фактор роста соматотропин, фактор роста, антиген 1 плоскоклеточного рака, антиген 2 плоскоклеточного рака, рецепторы стероидных гормонов, сурвивин, синдекан-1, синуклеин гамма, тетранектин, тетраспанин 9, TGF-α, тимидинфосфорилазу (ТР), тиреоглобулин (ТГ), тканевый ингибитор металлопротеиназы 2, тканеспецифический трансплантационный антиген Р35В, тканевый активатор плазминогена (tPA), топоизомеразу II, трансферриновый рецептор CD71 p90, трансформирующий фактор роста альфа, трансформирующий фактор роста бета-1, транслоказу из внешней митохондриальной мембраны, транстиретин, фрагмент транстиретина (преальбумин), трофобластический гликопротеин, альфа-цепь тропомиозина 1 (альфа-тропомиозин), трипсин, тубулин β2, тубулин β3, член 5 надсемейства лигандов фактора некроза опухоли (CD 154), член 6 надсемейства лигандов фактора некроза опухоли (Fas ligand), фактор некроза опухоли альфа, рецептор p75/p55 фактора некроза опухоли, член 6 надсемейства рецепторов фактора некроза опухоли (fas), ассоциированный с рецептором фактора некроза опухоли протеин 1, опухолевый протеин p53, убиквитин-конъюгирующий фермент E2C (Ubiquitin cong enz), мочевой ангиостатин (Urinary angiostatin (uAS)), фактор роста эндотелия сосудов (Vascular endothelial growth factor (VEGF)), стимулятор роста гладких мышц сосудов (VSGPIF-Spondin), VEGF (165) b, V-erb-b2, витамин D-связывающий белок, витамин K-зависимый протеин C, витронектин, фактор фон Виллебранда, опухоль Вильмса 1 (Wilms tumor (WT-1)), WW домен-связывающий белок 11 (WW domain binding protein 11), X бокс-связывающий белок-1 (X box binding protein-1) и YKL-40. См. Polanski et al., Biomarker Insights, 1:1 (2006); Chemeva et al., Biotechnol. & Biotechnol. EQ. 21/2007/2:145 (2007); Alaoui-Jamali et al., J. Zhejiang Science В 7:411 (2006); Basil et al., Cancer Res. 66:2953 (2006); Suh et al., Expert Rev. Mol. Diagn. 10:1069 (2010); и Diamandis, E.P., Molecular and Cellular Proteomics 3:367 (2004).
Другие аналиты, которые могут быть детектированы с помощью устройств, систем и способов по изобретению, включают в себя упомянутые в учебнике Tietz Textbook of Clinical Chemistry and Molecular Diagnostics, Burtis, Ashwood, and Brans, ISBN 0721601898, Elsevier, 4th edition (2006).
Способы, наборы, картриджи и системы по изобретению могут быть подобраны для детектирования заданной комбинационной панели аналитов, что может быть использовано для определения состояния здоровья пациента. Например, комбинационная панель может включать в себя детекцию патогенов, терапевтических средств, используемых для лечения подозреваемого(ых) патогена/ов, и потенциального биомаркера для контроля за успешностью лечения данным фармакологическим препаратом (эффективность или фармакокинетика), или для мониторинга присутствия патогена или побочных продуктов патогена. Дополнительно можно представить себе панель для лечения болезни, подобранную для выявления заболевания или биомаркера заболевания, уровня или концентрации терапевтического препарата для применения при лечении подозреваемой болезни, потенциального биомаркера для контроля за успешностью лечения данным фармакологическим препаратом (эффективность или фармакокинетика) и общехимического биомаркера или другого физиологического маркера заболевания или эффективности лечения. Таким образом, панели детекции аналита могут быть использованы для получения информации, необходимой для принятия соответствующего медицинского решения.
Например, системы и способы по изобретению могут быть использованы для мониторинга пациентов с ослабленным иммунитетом после аллогенной трансплантации. Подвергшиеся трансплантации пациенты, которые получают цельный орган, костный мозг, гемопоэтические стволовые клетки или другие аллогенные трансплантанты, нуждаются в контроле иммунного статуса, функции органов и, при необходимости, в быстрой и точной идентификации оппортунистических инфекций. Например, необходимо следить за уровнями креатинина и такролимуса в одном и том же образце крови от пациента, поскольку мониторинг концентрации лекарственного препарата и функции почек может помогать врачам и способствовать выбору оптимальной терапии после трансплантации. Оптимизация терапии заключается в нахождении точного баланса между предотвращением отторжения и обеспечением иммунной функции для борьбы с оппортунистическими инфекциями и, в целом, приводит к повышению действенности иммуносупрессивной терапии. По большей части, реципиенты трансплантатов подвержены отторжению трансплантата, реакции трансплантат против хозяина или оппортунистическим инфекциям. В первых двух случаях иммуносупрессивные препараты могут аблировать или ингибировать данные реакции. Однако, если у пациента имеется скрытая инфекция, то проведение лечения представляет собой сложную задачу. В качестве конкретного примера, если у пациента, перенесшего пересадку сердца, легкого, появляется лихорадка неясного происхождения, то он госпитализируется. Данный пациент начинает принимать антибиотики широкого спектра действия и продолжает их прием до тех пор, пока не станут известны результаты культурального исследования. Если состояние ухудшается и в культуральном посеве выявляется конкретная инфекция, например Candida, то данному пациенту может быть назначен специфический противогрибковый препарат, флуконазол. Однако, такой противогрибковый препарат может изменить уровни иммунодепрессанта, даваемого почти всем реципиентам после аллогенной трансплантации, а именно, такролимуса. После тестирования уровней как такролимуса, так и креатинина в крови врач останавливает прием такролимуса, полагая, что флуконазол победит инфекцию, и быстро. При выполнении данного режима назначения состояние пациента может ухудшиться, если вид Candida устойчив к флуконазолу, и пациент вынужден начать затем прием соответствующего противогрибкового препарата. Однако, поскольку прием такролимуса может быть все еще приостановлен, иммуносупрессивная терапия может стать неуправляемой и пациент может перестать отвечать на любую дополнительную терапию, в результате чего может наступить смерть. Таким образом, если бы имелся анализ для одновременного мониторинга уровней креатинина (функция почек) и такролимуса в крови и для точной идентификации оппортунистических инфекций, вышеупомянутый пациент, возможно, был бы спасен.
Системы и способы по изобретению могут включать в себя мультиплексную, без приготовления образцов, со способом одиночной детекции, автоматизированную систему для определения уровня лекарственных препаратов, детерминанты токсичности или неблагоприятного эффекта, причем идентификация патогена играет критическую роль при лечении пациента с ослабленным иммунитетом. Например, картридж, имееющий порталы или углубления, содержащие 1) магнитные частицы, имеющие находящиеся на их поверхности специфические к креатинину антитела, 2) магнитные частицы, имеющие специфические к такролимусу антитела на своей поверхности, и 3) магнитные частицы, имеющие специфические нуклеиновокислотные зонды для выявления вида патогена, может быть использован для быстрого определения и предоставления значений для проведения лечения для данного пациента с трансплантом. Оппортунистические инфекции, которые можно контролировать у таких пациентов и у любых других групп пациентов, подверженных риску инфекции, включают в себя, без ограничения, грибковые; Candida (резистентные и нерезистентные штаммы); грамотрицательные бактериальные инфекции (например, Е. coli, Stenotrophomonas maltophilia, Klebsiella pneumonia/oxytoca или Pseudomonas aeruginosa); и грамположительные бактериальные инфекции (например, виды Staphylococcus: S. aureus, S. pneumonia, Е. faecalis и Е. faecium). Другие оппортунистические инфекции, которые можно контролировать, включают в себя коагулазоотрицательный стафилококк, Corynebacterium spp., Fusobacterium spp.и Morganella morganii, и вирусные организмы, такие как CMV, BKV, ЕВС, HHV-6, HIV, HCV, HBV и HAV.
Системы и способы по изобретению также могут быть использованы для мониторинга и диагностики онкологических больных в составе мультиплексного диагностического анализа. На одной из конкретных форм рака, колоректальном раке, были продемонстрированы положительные перспективы для персонализированного лечения специфической солидной опухоли.
Фармакогенетические маркеры могут быть использованы для оптимизации лечения колоректального и других видов рака. Существует значительная индивидуальная генетическая изменчивость лекарственного метаболизма 5FU, капецитабина, иринотекана и оксалиплатина, что влияет как на токсичность, так и на эффективность данных препаратов. Примеры генетических маркеров включают в себя UGT1Al*28, который приводит к уменьшению конъюгации SN-38, активного метаболита иринотекана, в результате чего ускоряется развитие побочных эффектов, особенно нейтропении. В меньшей степени, увеличение токсичности 5-FU предсказывается 2A*DPYD. Переменное число полиморфизма тандемных повторов в области гена-усилителя тимидилатсинтазы, в сочетании с одиночным нуклеотидным полиморфизмом C>G, может прогнозировать более слабый ответ на 5-FU. Эффективность оксалиплатина зависит от полиморфизмов в таких компонентах систем репарации ДНК, как ERCC1 и XRCC1. Полиморфные изменения в рецепторе фактора роста сосудистого эндотелия, возможно, предсказывают эффективность цетуксимаба. Дополнительно зависимый от антител клеточно-опосредованный цитотоксический эффект цетуксимаба может быть уменьшен полиморфизмами в рецепторах фрагмента C иммуноглобулина G. Также полагают, что полиморфные изменения в гене VEGF и в гене индуцируемого гипоксией фактора 1 альфа играют определенную роль в изменчивости исхода терапии. Таким образом, идентификация таких полиморфизмов у пациентов может быть использована для оказания помощи врачам при принятии решений относительно лечения. Например, были разработаны базирующиеся на ПЦР генетические тесты для оказания помощи врачам при принятии решений, касающихся терапевтического лечения пациентов с немелкоклеточным раком легкого (non-small cell lung cancer (NSCLC)), колоректальным раком (colorectal cancer (CRC)) и раком желудка. Экспрессия генов ERCC1, TS, EGFR, RRM1, VEGFR2, HER2 и определение мутаций в генах KRAS, EGFR и BRAF доступны для врачей с целью выявления оптимальной возможности терапевтического лечения. Однако такие ПЦР-тесты не доступны на месте, и, таким образом, образец должен быть доставлен во внешнюю лабораторию. Такие солидные опухоли часто подвергаются биопсии, и приготавливаются фиксированные в формалине и залитые в парафин (Formalin-Fixed, Paraffin-Embedded (FFPE)) (тканевые) образцы. Системы и способы по изобретению могут быть использованы без 5-7 дневного срока ожидания, чтобы получить данные и информацию, и без применения зафиксированных образцов, необходимого в существующих способов. Системы и способы по изобретению могут обеспечить единую платформу для анализа образцов, без приготовления образцов, для различных типов аналитов, как для химиотерапевтических препаратов в случае рака; генотипирование, маркеры токсичности и эффективности могут революционизировать практику персонализированной медицины и обеспечить быстрое и точное диагностическое тестирование.
Системы и способы по изобретению также могут быть использованы для мониторинга и диагностики неврологических заболеваний, таких как деменция (потеря познавательных способностей у ранее не имевшего подобного заболевания человека) и другие формы когнитивных нарушений. Заболевания деменцией можно разделить на две группы: корковые и подкорковые деменции. Корковые деменции включают в себя: болезнь Альцгеймера, сосудистую деменцию (также известную как мультиинфарктная деменция), включая болезнь Бинсвангера, деменцию с тельцами Леви (DLB), вызванную алкоголем и сохраняющуюся после его употребления деменцию, синдром Корсакова, энцефалопатию Вернике, вырождения лобно-височной доли (frontotemporal lobar degenerations (FTLD)), включая болезнь Пика, лобно-височную деменцию (или фронтальный вариант FTLD), семантическую деменцию (или временный вариант FTLD), прогрессивную номинальную афазию, болезнь Крейтцфельда-Якоба, «деменцию боксеров» (pugilistica), болезнь Моямоя (Moyamoya), thebestia (часто ошибочно принимают за рак), атрофию задних отделов коры головного мозга или синдром Бенсона. Подкорковые деменции включают в себя деменцию, обусловленную болезнью Хантингтона, деменцию, обусловленную гипотиреозом, деменцию, обусловленную болезнью Паркинсона, деменцию вследствие дефицита витамина B1, деменцию вследствие дефицита витамина B12, деменцию вследствие дефицита фолиевой кислоты, деменцию вследствие сифилиса, деменцию вследствие субдуральной гематомы, деменцию вследствие гиперкальциемии, деменцию, обусловленную гипогликемией, комплекс деменции при СПИДе, псевдодеменцию (большой депрессивный эпизод с проявляющимися когнитивными симптомами), вызванную абсентом и сохраняющуюся деменцию (связанную с употреблением психоактивных препаратов и ранее с абсентизмом), деменцию, обусловленную множественными этиологиями, деменцию, обусловленную другими общими заболеваниями (например, терминальной стадией почечной недостаточности, сердечно-сосудистыми заболеваниями и т.д.), или деменцию, не определенную другим образом (определение используется в тех случаях, когда не выполняются определенные критерии). Болезнь Альцгеймера представляет собой распространенную форму деменции. Поскольку деменция принципиально связана со многими нейродегенеративными заболеваниями, то возможность отслеживать на базе единой платформы соответствующие белки в качестве биомаркеров данных заболеваний, наряду с содержанием лекарственных препаратов или метаболитов лекарственных препаратов, может помочь врачу при регулировании дозировки, изменении режима или при проведении общего мониторинга прогрессирования данного заболевания. Такие тесты в настоящее время выполняются в лабораториях, удаленных от пациента и ухаживающего за ним медицинского работника. Таким образом, возможность следить на месте за содержанием лекарственных препаратов и за биомаркером в той же самой системе детектирования предоставит огромное преимущество при лечении данной изнурительной и разрушительной болезни. Способ по изобретению может представлять собой мультиплексную, без приготовления образцов, со способом одиночной детекции, автоматизированную систему для определения уровня лекарственных препаратов, детерминант токсичности или неблагоприятных эффектов и потенциального биомаркера прогрессирования данной болезни. Например, картридж, имеющий порталы или углубления, содержащие 1) магнитные частицы, имеющие находящиеся на их поверхности антитела, специфические к белковому биомаркеру деменции, 2) магнитные частицы, имеющие специфические антитела на своей поверхности, и 3) магнитные частицы, имеющие специфические нуклеиновокислотные зонды для выявления уровней белковой экспрессии, может быть использован для быстрого определения и предоставления значений, необходимых для проведения лечения данного пациента, имеющего деменцию.
Системы и способы по изобретению также могут быть использованы для мониторинга и диагностики инфекционного заболевания в мультиплексной, автоматизированной, не требующей приготовления образцов системе. Примеры патогенов, которые могут быть детектированы с помощью устройств, систем и способов по изобретению, включают в себя, например, Candida (резистентные и нерезистентные штаммы), например, С. albicans, С. glabrata, С. krusei, С. tropicalis и С. parapsilosis; A. fumigatus; E. coli, Stenotrophomonas maltophilia, Klebsiella pneumonia/oxytoca, P. aeruginosa; Staphylococcus spp.(например, S. aureus или S. pneumonia); E. faecalis, E. faecium, Coaglulase negative Staphylococcus spp., Corynebacterium spp., Fusobacterium spp., Morganella morganii, Pneumocystis jirovecii, ранее известный как Pneumocystis carinii, F. hominis, streptococcus pyogenes, Pseudomonas aeruginosa, Polyomavirus JC polyomavirus (вирус, который вызывает прогрессивную мультифокальную лейкоэнцефалопатию), Acinetobacter baumarmi, Toxoplasma gondii, Cytomegalovirus, Aspergillus spp., Kaposi's Sarcoma, Cryptosporidium, Cryptococcus neoformans и Histoplasma capsulatum, наряду с другими бактериями, дрожжами, грибковыми организмами, вирусами, прионами, плесневыми, актиномицетами, протозойными, паразитарными, простейшими и глистными инфекционными организмами. Системы и способы по изобретению могут быть использованы для выявления и мониторинга патогенеза заболевания у пациента, для выбора терапевтических вмешательств, а также для мониторинга эффективности выбранного лечения. Например, для пациента, имеющего вирусную инфекцию или подверженному риску вирусной инфекции, системы и способы по изобретению могут быть использованы для выявления инфекционного вируса, вирусной нагрузки, а также для мониторинга количества лейкоцитов и/или биомаркеров, указывающих на статус инфекции. Установление идентичности вируса может быть использовано для выбора соответствующей терапии. Можно контролировать терапевтическое вмешательство (например, конкретное противовирусное средство), а также соотнести режим лечения с циркулирующей концентрацией противовирусного средства и вирусной нагрузки для гарантии того, что пациент реагирует на лечение.
Системы и способы по изобретению могут быть использованы для мониторинга вирусной инфекции у пациента, например, используя вирусную панель, подобранную для детектирования цитомегаловируса (Cytomegalovirus (CMV)), вируса Эпштейна-Барра (Epstein Barr Virus), вируса ВК, вируса гепатита B, вируса гепатита C, вируса простого герпеса (Herpes simplex virus (HSV)), HSV1, HSV2, респираторно-синцитиального вируса (Respiratory syncytial virus (RSV)), гриппа (Influenza); гриппа A (Influenza A), гриппа A подтип H1 (Influenza A subtype H1), гриппа A подтип H3 (Influenza A subtype H3), гриппа B (Influenza B), вируса герпеса человека 6-го типа (Human Herpes 6), вируса герпеса человека 8-го типа (Human Herpes 8), Human Metapneumovirus (hMPV), риновируса (Rhinovirus), парагриппа 1 (Parainfluenza 1), парагриппа 2 (Parainfluenza 2), парагриппа 3 (Parainfluenza 3) и аденовируса (Adeno virus). Способы по изобретению могут быть использованы для мониторинга подходящего терапевтического препарата для пациента с вирусной инфекцией (например, Абакавир (Abacavir), Ацикловир (Aciclovir), Ацикловир (Acyclovir), Адефовир (Adefovir), амантадин (Amantadine), Ампренавир (Amprenavir), амприген (Ampligen), Арбидол (Arbidol), атацанавир (Atazanavir), Атрипла (Atripla), боцепревир (Boceprevir), цидофовир (Cidofovir), Комбивир (Combivir), Дарунавир (Darunavir), Делавирдин (Delavirdine), диданозин (Didanosine), докозанол (Docosanol), эдоксудин (Edoxudine), эфавиренц (Efavirenz), эмтрицитабин (Emtricitabine), Энфувиртид (Enfuvirtide), энтекавир (Entecavir), Фамцикловир (Famciclovir), фомиверсен (Fomivirsen), фосампренавир (Fosamprenavir), Фоскарнет (Foscamet), фосфонет (Fosfonet), ганцикловир (Ganciclovir), ибацитабин (Ibacitabine), имуновир (Imunovir), идоксуридин (Idoxuridine), имиквимод (Imiquimod), индинавир (Indinavir), инозин, ингибитор интегразы, интерферон типа III, интерферон типа II, интерферон типа I, интерферон α, интерферон β, Ламивудин (Lamivudine), Лопинавир (Lopinavir), ловирид (Loviride), Маравирок (Maraviroc), мороксидин (Moroxydine), метисазон (Methisazone), Нельфинавир (Nelfinavir), невирапин (Nevirapine), нексавир (Nexavir), аналоги нуклеозидов, Осельтамивир (Тамифлю) Oseltamivir (Tamiflu), Пегинтерферон альфа-2а (Peginterferon alfa-2a), пенцикловир (Penciclovir), перамивир (Peramivir), плеконарил (Pleconaril), подофиллотоксин (Podophyllotoxin), Ралтегравир (Raltegravir), ингибитор обратной транскриптазы, Рибавирин (Ribavirin), римантадин (Rimantadine), ритонавир (Ritonavir), пирамидин (Pyramidine), саквинавир (Saquinavir), ставудин (Stavudine), масло чайного дерева, Тенофовир (Tenofovir), дизопроксилфумарат (Tenofovir disoproxil), Типранавир (Tipranavir), Trifluridine, Тризивир (Trizivir), тромантадин (Tromantadine), Трувада (Truvada), валацикловир (Валтрекс) (Valaciclovir (Valtrex)), Валганцикловир (Valganciclovir), Викривирок (Vicriviroc), видарабин (Vidarabine), Вирамидин (Viramidine), Зальцитабин (Zaicitabine), занамивир (Zanamivir (Relenza)) или зидовудин (Zidovudine)), a также для мониторинга циркулирующей концентрации терапевтического препарата, вводимого пациенту.
Системы и способы по изобретению также могут быть использованы для мониторинга больных ВИЧ/СПИДом. Когда врачи подозревают острую инфекцию (например, у пациента с недавним рискованным поведением в связи с симптомами и признаками острого ретровирусного синдрома), то обычно выполняется анализ на РНК ВИЧ (HIV RNA). Высокие уровни РНК ВИЧ, детектируемые в плазме посредством использования чувствительных анализов амплификации (ПЦР, bДНК или NASBA), в сочетании с отрицательным или неопределенным результатом анализа на антитела к ВИЧ, поддерживают диагноз острой ВИЧ-инфекции. Мониторинг пациентов с диагнозом ВИЧ/СПИД с целью выявления вирусной нагрузки, уровней препаратов, количества клеток CD4 и моделей токсичности посредством диагностического способа на основе одной платформы обеспечивает явные преимущества для пациента. Системы и способы по изобретению могут быть использованы в мультиплексной, без приготовления образцов, со способом одиночной детекции, автоматизированной системе для определения уровня лекарственных препаратов, детерминант токсичности или неблагоприятных эффектов и потенциального биомаркера прогрессирования данного заболевания. Например, картридж, имеющий порталы или углубления, содержащие 1) магнитные частицы, имеющие находящиеся на их поверхности антитела, специфичные к клеткам CD4, 2) магнитные частицы, имеющие на поверхности специфичные антитела к биомаркерам токсичности, и 3) магнитные частицы, имеющие специфические нуклеиновокислотные зонды для выявления вирусного уровни нагрузки, могут быть использованы для быстрого определения и предоставления значений, необходимых для проведения лечения для данного пациента с диагнозом ВИЧ/СПИД.
Системы и способы по изобретению также могут быть использованы для мониторинга и диагностики иммунного заболевания у пациента (например, болезнь Крона, илеит, энтерит, воспалительное заболевание кишечника, синдром раздраженной толстой кишки, неспецифический язвенный колит, а также иммунное заболевание не желудочно-кишечного тракта). Относительно недавнее развитие генной инженерии обладает потенциалом для радикального изменения лечения иммунных заболеваний, и ремикейд (Remicade) (также известный как инфликсимаб (Infliximab), анти-TNF антитело) был введен в качестве нового класса терапевтических препаратов с высокой эффективностью, быстрым началом действия, пролонгированным эффектом и улучшенной толерантностью. Однако данные препараты стоят дорого, и, по меньшей мере, у одной трети подходящих пациентов не удалось обнаружить никакого полезного ответа. Поэтому очевидно, что поиск способа, позволяющего прогнозировать те препараты, которые будут вызывать ответ, и предвидеть рецидивы, имеет важное значение. Полиморфизмы генов TNF также, очевидно, влияют на характер и частоту внекишечных проявлений воспалительного заболевания кишечника (inflammatory bowel disease (IBD)). Несколько крупных контролируемых клинических исследований показывают, что ремикейд играет важную роль в лечении пациентов с болезнью Крона от умеренной до выраженной активной стадии и в лечении фистул при болезни Крона. Небольшие по охвату испытания показали возможные связи между слабым ответом на ремикейд и повышением содержания в слизистой оболочке активированного NF-kappaB, гомозиготностью для полиморфизма в экзоне 6 гена TNFR2 (генотип Arg196Arg), позитивностью для перинуклеарных антинейтрофильных цитоплазматических антител (permuclear antineutrophil cytoplasmic antibodies (ANCA)), а также с наличием увеличенного числа активированных клеток lamina propria (эффекторной зоны мукозальной иммунной системы), продуцирующих интерферон-гамма и TNF-альфа. Таким образом, мониторинг пациентов с болезнью Крона с целью выявления TNF-альфа и моделей токсичности посредством диагностического способа на основе одной платформы будет иметь явные преимущества. Способ по изобретению может представлять собой мультиплексную, без приготовления образцов, со способом одиночной детекции, автоматизированную систему для определения уровня лекарственных препаратов, токсичности или детерминант неблагоприятных эффектов и потенциального биомаркера прогрессирования данной болезни. Например, картридж, имеющий порталы или углубления, содержащие 1) магнитные частицы, имеющие находящиеся на их поверхности специфичные к TNF-альфа антитела, 2) магнитные частицы, имеющие на поверхности антитела, специфичные к биомаркерам токсичности, и 3) магнитные частицы, имеющие специфичные зонды для выявления биомаркеров прогрессирования болезни, может быть использован для быстрого определения и предоставления значений клинического управления для данного пациента с болезнью Крона или с IBD.
Системы и способы по изобретению также могут быть использованы для мониторинга и диагностики инфекционного заболевания и воспаления в мультиплексной, автоматизированной, не требующей приготовления образцов системе. Такие системы и способы могут быть использованы для мониторинга, например, бактериемии, сепсиса и/или синдрома системного воспалительного ответа (Systemic Inflammatory Response Syndrome (SIRS)). Ранняя диагностика является клинически значимой, поскольку данный тип инфекции, если его не лечить, может привести к дисфункции органов, гипоперфузии, артериальной гипотензии, рефракторному (септическому) шоку/SIRS-шоку и/или синдрому полиорганной недостаточности (Multiple Organ Dysfunction Syndrome (MODS)). Для типичного пациента многие бактериальные или грибковые инфекции являются результатом заражения во время приема в медицинское учреждение и называются инфекциями, связанными с оказанием медицинской помощи (healthcare-associated infections (HA1)), также известными как нозокомиальные, приобретенные в больнице или начавшиеся в больнице инфекции. К наиболее известным категориям бактерий, заражающих пациентов с ослабленным иммунитетом, относятся MPSA (резистентный к метициллину золотистый стафилококк (Methicillin resistant Staphylococcus aureus)), грамположительные бактерии и Helicobacter, которая является грамотрицательной бактерией. Хотя имеются антибиотики, которые могут лечить заболевания, вызванные грамположительными MPSA, в настоящее время существует немного эффективных лекарственных средств для лечения Acinetobacter. Распространенные возбудители инфекций, передающихся через кровь, представляют собой коагулазонегативные стафилококки, Enterococcus и Staphylococcus aureus. В дополнение, Candida albicans и возбудители пневмонии, такие как Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumoniae и Haemophilus influenza вызывают многие инфекции. Возбудители инфекций мочевыводящих путей включают в себя Escherichia coli, Candida albicans и Pseudomonnas aeruginosa. Дополнительно грамотрицательные микроорганизмы кишечной флоры также относятся к известным возбудителям инфекций мочевыводящих путей. Возбудители хирургических инфекций включают в себя Staphylococcus aureus, Pseudomonas aeruginosa и коагулазонегативные стафилококки. Инфекционный агент может быть выбран, без ограничения, из таких патогенов, связанных с сепсисом, как Acinetobacter baumannii, Aspergillus fumigatis, Bacteroides fragilis, B. fragilis, blaSHV, Burkholderia cepacia, Campylobacter jejuni/coli, Candida guilliermondii, C. albicans, C. glabrata, C. krusei, C. Lusitaniae, C. parapsilosis, C. tropicalis, Clostridium pefringens, Coagulase negative Staph, Enterobacter aeraogenes, E. cloacae, Enterobacteriaceae, Enterococcus faecalis, E. faecium, Escherichia coli, Haemophilus influenzae, Kingella Kingae, Klebsiella oxytoca, K. pneumoniae, Listeria monocytogenes, ген Мес A (MPSA), Morganella morgana, Neisseria meningitidis, Neisseria spp. non-meningitidis, Prevotella buccae, P. intermedia, P. melaninogenica, Propionibacterium acnes, Proteus mirabilis, P. vulgaris, Pseudomonas aeruginosa, Salmonella enterica, Serratia marcescens, Staphylococcus aureus, S. haemolyticus, S. maltophilia, S. saprophyticus, Stenotrophomonas maltophilia, S. maltophilia, Streptococcus agalactie, S. bovis, S. dysgalactie, S. mitis, S. mutans, S. pneumoniae, S. pyogenes и S. sanguinis; или любой другой инфекционный агент, описанный в данном документе. В некоторых случаях способ и система будут разработаны для выяснения, несет ли данный инфекционный агент ген Van А или ген Van В, характеризующий резистентность к ванкомицину; ген тесА резистентности к метициллину, гены NDM-1 и ESBL более общей резистентности к бета-лактамам.
Сепсис или септический шок представляют собой серьезные заболевания, которые характеризуются воспалительным состоянием всего тела (синдром системного воспалительного ответа (systemic inflammatory response syndrome) или SIRS) и наличием известной или предполагаемой инфекции. Сепсис определяют как SIRS в присутствии инфекции, септический шок определяется как сепсис с рефракторной артериальной гипотензией или гипоперфузией, несмотря на адекватную инфузионную терапию, и тяжелый сепсис определяется как сепсис с органной дисфункцией, гипоперфузией или гипотензией. В ряде исследований было изучено значение объединения доступных в настоящее время маркеров и, таким образом, описанная в данном документа платформа позволяет отдельное или одновременное определение уровней таких факторов, как GRO-альфа, белка High mobility group-box 1 protein (HMBG-1), рецептора IL-1, антагониста рецептора IL-1, IL-1b, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-13, IL-18, макрофагального воспалительного белка (macrophage inflammatory protein (MIP-1)), фактора ингибирования миграции макрофагов (macrophage migration inhibitory factor (MIF)), остеопонтина, RANTES (регулируемого активацией, в норме экспрессируемого и секретируемого Т-клетками; или CCL5), TNF-α, С-реактивного белка (CRP), CD64, хемотаксического для моноцитов белка 1 (monocyte chemotactic protein 1 (MCP-1)). Дополнительно могут быть разработаны системы и способы для мониторинга некоторых белков, характерных для сепсиса, таких как связывающий аденозиндезаминазу белок (АВР-26), индуцируемая синтаза оксида азота (inducible nitric oxide synthetase (iNOS)), липополисахарид-связывающий белок (LBP) и прокальцитонин (РСТ). Таким образом, данная платформа редуцирует эмпирические протоколы и/или применение неспецифических/общих противомикробных препаратов, которые могут быть или могут не быть направлены против специфического патогена и/или скрытой дисфункции системы в случае данного пациента. Данная платформа позволяет ставить быстрые и точные диагнозы, которые могут указывать на эффективную терапию, обеспечивая ключевой компонент для решения, принимаего врачом, и снижая заболеваемость и смертность.
Чтобы определить, имеется ли у пациента сепсис, необходимо выявить наличие патогена. Для наиболее эффективного лечения пациента решающее значение имеет возможно более раннее начало соответствующей терапии. Антимикробные и другие способы лечения сепсиса полагаются на классификацию патогенов на различных уровнях, включающую в себя определение агента как: 1) бактериальный, вирусный, грибковый, паразитарный или иным образом; 2) грамположительный, грамотрицательный, дрожжевой или плесневый, 3) по его видовой принадлежности и 4) по его восприимчивости.
Каждый из данных уровней специфичности ускоряет время начала соответствующей терапии, и «проход» на каждый последующий уровень должен приводить к сужению набора терапевтических препаратов до наиболее специфичного набора. Без данных по абсолютной восприимчивости эмпирические подходы к медицинскому уходу полагаются на имеющуюся информацию о патогене (в зависимости от уровня) и на особенности, связанные с встречаемостью патогена и чувствительности к нему в больнице или ином центре медицинской помощи. Таким образом, часто некоторые категории патогенов подозреваются в качестве причины инфекции до тех пор, пока будет получено достаточно уточняющих данных, позволяющих подобрать соотвествующую патогкну терапию. В частности, такие «мишение» относятся к категории ESCAPE (которая представляет собой ряд резистентных патогенов) и категории SPACE, представляющей собой набор высоковирулентных патогенов, которые требуют изоляции больных.
В дополнение к идентификации данных патогенов в различных типах образцов (крови, ткани, мочи и т.д.), другой способ отличить симптоматических пациентов, например, пациентов с синдромом системного воспалительного ответа или SIRS, от септических больных, заключается в использовании биомаркеров, которые коррелируют либо индивидуально, либо посредством индекса, для выявления пациентов с инфекцией. В тех случаях, когда инфекции не детектируются из-за вмешательства антимикробной терапии в диагностику, влияния иммунной системы на терапию, или, иных причин, подобные биомаркеры, которые могут представлять собой многочисленные типы аналитов (цитокины, метаболиты, ДНК, соотношение RNA/экспрессия генов и т.д.) будут указывать на инфекцию и, следовательно, на сепсис.
Для получения диагностической информации, необходимой как для определения наличия инфекции, так и для идентификации вида возбудителя до определенного уровня, одна панель может представлять собой: (i) грамположительные кластеры (например, S. aureus и CoNS (коагулазоотрицательный стафилококк)); (ii) грамположительные цепи/пары (например, Strep spp., mitis, pneumonia spp., agalactiae spp., pyogenes spp., Enterococcus spp. (E. faecium, E. fecalis); (iii) грамотрицательные палочки (например, Е. coli, Proteus spp., Klebsiella spp., Serratia spp., Acinetobacter spp., Stenotrophomonas spp.); (iv) SPACE (например, Serratia spp., Pseudomonas spp., Acinetobacter spp., Citrobacter spp., Enterobacter spp.); (v) Pseudomonas (например, Pseudomonas spp.); (vi) ESKAPE (E. faecium, Staphylococcus aureas, Klebsiella spp., Acinetobacter spp., Pseudomonas spp., Enterobacter spp.); и (vii) панбактериальную панель (все виды бактерий).
Данная панель должна использоваться в сочетании с тестом на грибковые патогены для полного охвата. Данные категории представляют информацию, необходимую для эффективного вмешательства с соответствующей терапией, учитывая, что у каждого центра медицинской помощи будет иметься эмпирический подход, основанный на положительном ответе на бактерии грамм (+), бактерии грамм (-) и т.д. Виды, выявленные в каждой категории, представляют те виды, которые подходят под каждое подобное определение, но не являются исчерпывающими. Дополнительно сочетание результатов также может указывать на вид, хотя и не полностью, если он включен, как описано выше.
Сравнительный анализ позитивных и негативных результатов по категориям позволяет провести (вероятностное) определение некоторых видов методом иключения.
Системы и способы по изобретению также могут быть использованы для мониторинга и диагностики у пациента заболевания сердца, такого как инфаркт миокарда. Сердечные маркеры или сердечные ферменты представляют собой белки, которые выходят из поврежденных клеток миокарда и используются для оценки повреждения сердца. Сердечные маркеры включают в себя, без ограничения, ферменты SGOT, LDH, подтип MB фермента креатинкиназы и сердечные тропонины (T и I). Таким образом, в острой ситуации, мониторинг тропонина I и T, а также других потенциальных биомаркеров ишемической болезни сердца, в дополнение к мониторингу лекарственной терапии и моделей токсичности в диагностическом способе, основанном на использовании единой платформы, будет иметь явные преимущества. Системы и способы по изобретению могут быть использованы для обеспечения мультиплексной, не требующей приготовления образцов, автоматизированной системы для детектирования уровня лекарственных препаратов, детерминант токсичности или неблагоприятных эффектов и потенциального биомаркера прогрессирования данного заболевания. Например, картридж, имеющий порталы или углубления, содержащие 1) магнитные частицы, имеющие находящиеся на их поверхности антитела, специфичные к анти-тропонину I или тропонину T, 2) магнитные частицы, имеющие на поверхности антитела, специфичные к биомаркерам токсичности, и 3) магнитные частицы, имеющие специфические зонды для выявления маркеров прогрессирования данного заболевания, могут быть использованы для быстрого определения и предоставления значений клинического управления для данного пациента с инфарктом миокарда.
Один или более мультилуночных картриджей могут быть подобраны для применения в системах и способах по изобретению и приготовлены по меньшей мере с одним образцом цельной крови от больного; магнитными частицами для детектирования каждого из аналитов, который должен быть определен (одной или более небольших молекул; одного или более метаболитов одной или более небольших молекул; метаболического биомаркера, такого как описано для панели ʺФункция печениʺ); а также с буферами разведения и промывки. Тесты на функции печени проводятся на образце сыворотки или плазмы пациента, и клинический анализ крови, выполненный в биохимической лаборатории, предоставляет важные данные о состоянии печени пациента. ʺПанель ʺФункция печениʺ представляет собой анализ крови, в котором низкий или высокий уровень одного или более ферментов может указывать на заболевания или повреждение печени. Например, панель ʺФункция печениʺ может включать в себя один или более из следующих способов детектирования аналита: детекцию одной или более небольших молекул; одного или более метаболитов одной или более небольших молекул; биологических, метаболических биомаркеров; генотипирование, профилирование экспрессии генов и протеомный анализ.
Панель ʺФункция печениʺ может включать в себя анализ одного или более из следующих белков в биологическом образце у пациента или субъекта: 1) альбумин (составляющий основную часть всего белка в печени, в то время как оставшаяся часть называется глобулином; альбумин должны быть представлен в количестве от 3,9 до 5,0 г/дл, гипоальбуминемия указывает на плохое питание, пониженный катаболизм белков, цирроз печени или нефротический синдром); 2) аспартаттрансаминаза (AST) (также известная как сывороточная глутамат-оксалоацетат-трансаминаза или аспартатаминотрансфераза, представляет собой фермент в паренхиматозных клетках печени и составляет обычно от 10 до 34 IU/L; повышенное содержание указывает на острое повреждение печени), 3) аланинтрансаминаза (ALT) (также известная как сывороточная глутамат-пируват-трансаминаза или аланинаминотрансфераза, представляет собой фермент, присутствующий в гепатоцитах на уровнях от 8 до 37 IU/L; повышенное содержание указывает на острое повреждение печени при вирусном гепатите или передозировке парацетамола, соотношение AST к ALT используется, чтобы различить причины поражения печени), 4) щелочная фосфатаза (ALP) (фермент, который присутствует в клетках, выстилающих желчные протоки печени; нормальный диапазон концентраций составляет от 44 до 147 IU/L, и уровень повышается в случае инфильтративных заболеваний печени, внутрипеченочного холестаза или высокой непроходимости желчных путей); 5) гамма-глутамилтранспептидаза (GGT) (более чувствительный маркер холестатического повреждения, чем ALP, является очень специфичным для печени; стандартный диапазон концентраций составляет от 0 до 51 IU/L; как острая, так и хроническая алкогольная токсичность вызывают повышение содержания GGT; причина отдельного повышения содержания ALP может быть определена посредством GGT), 6) общий билирубин (TBIL) (увеличение содержания общего билирубина может привести к желтухе и может быть отнесено к циррозу печени, вирусному гепатиту, гемолитической анемии или внутреннему кровотечению); 7) прямой билирубин; 8) протромбиновое время (РТТ) (повреждение клеток печени и непроходимость желчных протоков может привести к изменениям времени свертывания крови); 9) анализ на альфа-фетопротеин (повышенные уровни указывают на гепатит или рак); 10) лактатдегидрогеназа; и 11) митохондриальные антитела (их присутствие может свидетельствовать о хроническом активном гепатите, первичном билиарном циррозе печени или о других аутоиммунных заболеваниях). Белки, описанные выше, могут быть проанализированы в панели для оценки функций печени с помощью систем и способов по изобретению.
Дополнительная панель для оценки функции печени может включать в себя генотипирование ферментов цитохрома Р450. Тесты для генотипирования цитохрома Р450 используются для определения того, насколько хорошо пациент или субъект усваивает лекарственный препарат. По результатам тестирования цитохрома Р450 индивидуумы могут быть разделены на четыре основных типа:
(i) Медленные метаболизаторы. Некоторые лекарственные препараты метаболизируются медленнее, чем в норме, и лекарство имеет более длительный период полураспада и, возможно, увеличит вероятность проявления побочных эффектов.
(ii) Нормальные метаболизаторы. Лекарственные препараты будут метаболизироваться со средней скоростью, что, таким образом, свидетельствует о пользе от лечения и указывает на меньшее количество побочных эффектов, чем у других индивидуумов, которые не усваивают данные конкретные препараты так же хорошо.
(iii) Промежуточные метаболизаторы. Лекарственные препараты могут быть усвоены или могут не быть усвоены со средней скоростью. Подозревают, что, по меньшей мере, один ген, участвующий в метаболизме лекарств, работает неправильно. Тогда имеется предрасположенность к девиантному метаболизму некоторых лекарств.
(iv) Ультрабыстрые метаболизаторы. Лекарственные препараты метаболизируется быстрее и более эффективно, чем в среднем. Поскольку скорость обмена веществ выше, чем в среднем, некоторые лекарственные препараты инактивируются раньше или выводятся раньше, чем обычно, и лекарство может не обладать желаемой эффективностью.
В настоящее время генотипирование генов, ответственных за данные ферменты, у населения показало, что полиморфные различия в данных ферментах могут привести к изменениям эффективности и токсичности некоторых лекарственных препаратов. Для генотипирования требуется образец клеток, представляющих геном пациента или субъекта, и данный анализ направлен на выявление генетических различий в данных клинически важных генах.
Возможные ферменты печеночного метаболизма, которые могут входить в состав панели ʺФункция печениʺ, включают, но не ограничивается ими, CYP2C19, CYP2D6, CYP2C9, CYP2C19, CYP1A2, NAT2, DPD, UGT1A1, 5НТТ.
Настоящее изобретение относится к мультиплексному тесту одиночного образца крови (например, одиночной пробы крови или любого другого типа образца, описанного в данном документе, от пациента) от пациента, с целью определить a) ферментативный статус печени, а также b) генотип ключевых метаболических ферментов, чтобы потом быть в состоянии разрабатывать режимы фармакотерапии для оказания оптимальной терапевтической помощи с использованием систем и способов по изобретению.
Системы и способы по изобретению могут включать в себя один или более мультилуночных картриджей, подготовленных по меньшей мере с одним образцом цельной крови от больного; магнитными частицами для детектирования каждого из аналитов, который должен быть определен; антител к аналитам; поливалентных связывающих агентов; и/или буферов для разбавления и промывки для применения в мультиплексном тесте, как описано выше.
Нефротоксичность
Почечная токсичность является распространенным побочным эффектом применения ксенобиотиков, и раннее, быстрое выявление ранних стадий нефротоксичности может помочь в принятии решения о лечении. Ранние сообщения о выявлении почечной токсичности показывают, что увеличение экспрессии мРНК некоторых генов может быть отслежено. Тем не менее, в других сообщениях полагают, что маркеры почечной токсичности могут быть определены в моче. Данные маркеры включают в себя: kim-1, липокалин-2, желатиназа-ассоциированный липокалин нейтрофилов (neutrophil gelatinase-associated lipocalin (NGAL)), timp-1, кластерин, остеопонтин, виментин и гемоксигеназу 1 (НО-1). В более широком смысле, детекция ДНК, ионов тяжелых металлов или BUN в моче может представлять собой применимую клиническую информацию. Таким образом, способы и применимость настоящего изобретения также включают в себя возможность детектирования данных маркеров почечной токсичности. Необязательно панель ʺФункция печениʺ может также включать в себя один или два биомаркеров с отличительной чертой нефротоксичности или наоборот.
Амплификации и детекция нуклеиновых кислот из сложных образцов
Системы и способы по изобретению могут включать в себя основанные на амплификации анализы для детектирования нуклеиновых кислот, которые проводятся, непосредственно со сложными образцами (например, для диагностических, судебно-медицинских и экологических анализов).
При приготовлении образца также необходимо удалить обычные ингибиторы ПЦР, присутствующие в сложных образцах (например, биологические жидкости, почвы или другие сложные среды) или обеспечить устойчивость к ним. Обычные ингибиторы включают те ингибиторы, которые определены, в числе прочих, в публикации Wilson, Appl. Environ. MicrobioL, 63:3741 (1997). Ингибиторы обычно действуют, предотвращая лизис клеток, деградацию или выделение нуклеиновой кислоты и/или ингибируя полимеразную активность. Наиболее часто используемая полимераза, Taq, ингибируется наличием 0,1% крови в реакции. Совсем недавно были разработаны мутантные Taq-полимеразы, которые являются резистентными к обычным ингибиторам (например, гемоглобину и/или гуминовой кислоте), найденным в крови и почве (Kermekchiev et al., Nucl. Acid. Res., 37:e40 (2009)). В рекомендациях производителя указывается, что данные мутации позволяют проводить прямую амплификацию при наличии крови в количестве, составляющем до 20%. Несмотря на резистентность, обеспечиваемую мутациями, точная детекция посредством ПЦР в режиме реального времени затруднена из-за тушения флуоресценции, наблюдаемого в присутствии образца крови (Kermekchiev et al., Nucl. Acid. Res., 37:e40 (2009)).
Амплификация ДНК или кДНК полимеразной цепной реакцией является испытанной и проверенной методологией, однако, как уже говорилось выше, полимеразы ингибируются содержащимися в неочищенных образцах веществами, включающими в себя, но не ограничиваясь ими, обычно используемые антикоагулянты и гемоглобин. Не так давно были разработаны мутантные Taq-полимеразы, резистентные к обычным ингибиторам, найденным в крови и почве. Доступные в настоящее время полимеразы, например, HemoKlenTaq™ (New England BioLabs, Inc., Ipswich, MA)), а также OmniTaq™ и OmniKlenTaq™ (DNA Polymerase Technology, Inc., St. Louis, МО) представляют собой мутантные (например, N-концевое усечение и/или точечные мутации) Taq-полимеразы, что делает их способными к амплифицированию ДНК в присутствии цельной крови в количестве, составляющем до 10%, 20% или 25%, в зависимости от продукта и условий реакции (см., например, Kermekchiev et al. Nucl. Acids Res. 31:6139 (2003); и Kermekchiev et al., Nucl. Acid. Res., 37:e40 (2009); а также см. патент США №7,462,475). Дополнительно наборы Phusion® Blood Direct PCR Kits (Finnzymes Oy, Espoo, Finland) включают в себя уникальный слитый фермент ДНК-полимеразу, сконструированный так, что в него встроен связывающий двухцепочечную ДНК домен, который позволяет проводить амплификацию в условиях, обычно ингибирующих действие таких обычных полимераз, как Taq или Pfu, и позволяют проводить амплификацию ДНК в присутствии цельной крови в количестве, составляющем до около 40% при определенных условиях реакции. См. Wang et al., Nuc. Acids Res. 32:1197 (2004); и см. патенты США №№5,352,778 и 5,500,363. Дополнительно наборы Kapa Blood PCR Mixes (Kapa Biosystems, Wobum, MA) предоставляют генетически модифицированный фермент ДНК-полимеразу, которая позволяет прямую амплификацию в присутствии цельной крови в количестве, составляющем до около 20% от реакционного объема при определенных условиях реакции. Несмотря на данные достижения, прямое оптическое определение генерируемых ампликонов существующими способами не представляется возможным, поскольку флуоресценция, поглощение и другие способы, основанные на применении света, дают сигналы, которые гасятся при наличии крови. См. Kermekchiev et al., Nucl. Acid. Res, 37:e40 (2009).
Авторы установили, что такие сложные образцы, как цельная кровь, могут быть непосредственно подвергнуты амплифицикации, используя около 5%, около 10%, около 20%, около 25%, около 30%, около 25%, около 40% и около 45% или более цельной крови в реакциях амплификации, и что полученные ампликоны могут быть непосредственно детектированы из амплификационной реакционной смеси с использованием измерений магнитно-резонансной (МР) релаксации при добавлении конъюгированных магнитных частиц, связанных с олигонуклеотидами, комплементарными к последовательности нуклеиновой кислоты-мишени. Альтернативно, магнитные частицы могут быть добавлены к образцу до амплификации. Таким образом, предлагаются способы применения амплификации нуклеиновых кислот в сложном загрязненном образце, гибридизации полученного ампликона с парамагнитными частицами с последующей прямой детекцией гибридизированного конъюгата магнитных частиц и ампликонов-мишеней с использованием систем детектирования на основе магнитных частиц. В определенных вариантах осуществления прямая детекция гибридизированных конъюгатов магнитных частиц и ампликонов осуществляется посредством измерений МР релаксации (например, Т2, Т1, Т1/T2 гибрид, Т2* и т.д.). Дополнительно предлагаются способы, которые являются кинетическими, в целях количественного определения исходного количества копий нуклеиновой кислоты в образце (например, отбор проб и детекция нуклеиновой кислоты на заданных номерах цикла, сравнение эндогенной нуклеиновой кислоты, служащей внутренним контролем, применение экзогенно вспрыснутой гомологичной нуклеиновой кислоты, служащей конкурентным контролем).
Понятия ʺамплификацияʺ или ʺамплифицироватьʺ или их производные для целей настоящего изобретения означают один или более способов, известных в данной области для копирования целевой или матричной нуклеиновой кислоты, тем самым увеличивая количество копий выбранной последовательности нуклеиновой кислоты. Амплификация может быть экспоненциальной или линейной. Целевая или матричная нуклеиновая кислота может представлять собой либо ДНК, либо РНК. Последовательности, амплифицируемые таким образом, образуют ʺамплифицированную областьʺ или ʺампликонʺ. Первичные зонды могут быть легко разработаны специалистами в данной области для нацеливания на определенную последовательность матричной нуклеиновой кислоты. В некоторых предпочтительных вариантах осуществления готовые ампликоны являются короткими для обеспечения быстрого прохождения цикла и быстрой генерации копий. Размер ампликона может изменяться, если необходимо обеспечить способность отличать целевые нуклеиновые кислоты (мишени) от нецелевых нуклеиновых кислот. Например, ампликоны могут иметь длину, составляющую менее, чем около 1000 нуклеотидов. Желательно, ампликоны имеют длину, составляющую от 100 до 500 нуклеотидов (например, длину, составляющую от 100 до 200, от 150 до 250, от 300 до 400, от 350 до 450 или от 400 до 500 нуклеотидов).
В то время как приведенные в качестве примеров способы, описанные далее, относятся к амплификации с использованием полимеразной цепной реакции (ʺПЦРʺ (polymerase chain reaction (ʺPCRʺ)), в данной области известны и многочисленные другие способы амплификации нуклеиновых кислот (например, изотермические способы, способы круговой (rolling circle) амплификации и т.д.). При этом специалистам в данной области очевидно, что данные другие способы могут быть использованы либо вместо способов ПЦР, либо вместе с ними. См., например, Saiki, ʺAmplification of Genomic DNAʺ in PCR Protocols, Innis et al., Eds., Academic Press, San Diego, Calif., pp 13-20 (1990); Wharam et al., Nucleic Acids Res. 29:E54 (2001); Hafher et al., Biotechniques, 30:852 (2001). Дополнительные способы амплификации, подходящие для применения с настоящими способами, включают в себя, например, способ полимеразной цепной реакции (ПЦР (polymerase chain reaction (PCR))), ПЦР с обратной транскрипцией (reverse transcription PCR (RT-PCR)), лигазную цепную реакцию (ligase chain reaction (LCR)), систему амплификации на основе транскрипции (transcription based amplification system (TAS)), опосредованную транскрипцией амплификацию (transcription mediated amplification (TMA)), способ амплификации на основе последовательности нуклеиновых кислот (nucleic acid sequence based amplification (NASBA)), способ амплификации со смещением нити (strand displacement amplification (SDA)), способ loop-опосредованной изотермической амплификации (loop mediated isothermal amplification (LAMP)), способ изотермической и инициируемой химерным праймером амплификации нуклеиновых кислот (isothermal and chimeric primer-initiated amplification of nucleic acid (ICAN)) и способ с применением системы smart-амплификации (smart amplification system (SMAP)). Данные, а также другие способы хорошо известны в данной области и могут быть адаптированы для применения в сочетании с предлагаемыми способами детекции амплифицированной нуклеиновой кислоты.
Способ ПЦР является способом для создания множества копий специфической матричной последовательности ДНК. Способ ПЦР раскрыт в патентах США №4,683,195; 4,683,202; и 4,965,188, каждый из которых включен сюда посредством ссылки. Разрабатывается один набор праймеров, комплементарных матричной ДНК, и область, фланкируемая праймерами, амплифицируется ДНК-полимеразой в реакции, включающей в себя многочисленные циклы амплификации. Каждый цикл амплификации включает в себя начальную денатурацию и до 50 циклов отжига, удлинение нитей (или расширение) и разделение нитей (денатурация). В каждом цикле реакции последовательность ДНК между праймерами копируется. Праймеры могут связаться со скопированной ДНК, а также с исходной матричной последовательностью, так что общее количество копий возрастает экспоненциально с течением времени. ПЦР может быть выполнена в соответствии с публикацией Whelan, et al, Journal of Clinical Microbiology, 33:556 (1995). Различные модифицированные ПЦР-способы доступны и хорошо известны в данной области. Специалистам в данной области известны различные модификации, такие как способ ʺRT-PCRʺ, при котором ДНК синтезируется с РНК с помощью обратной транскриптазы перед выполнением ПЦР, и способ ʺTaqMan PCRʺ, при котором только определенный аллель амплифицируется и детектируется с использованием флуоресцентно меченного зонда TaqMan и Taq ДНК-полимеразы. RT-PCR и ее варианты были описаны, например, в патентах США №5,804,383; 5,407,800; 5,322,770; и 5,310,652 и в ссылках, описанных в них, которые включены сюда посредством ссылки; и TaqMan-PCR и относящиеся к данному способу реагенты для применения в данном способе были описаны, например, в патентах США №5210015; 5876930; 5538848; 6030787; и 6258569, которые включены сюда посредством ссылки.
LCR представляет собой способ амплификации ДНК, сходный с ПЦР, за исключением того, что в нем используется четыре праймера вместо двух и используется фермент лигаза для лигирования или соединения двух сегментов ДНК. Амплификация может быть выполнена в термоциклере (например, LCx из Abbott Labs, North Chicago, IL). LCR может выполняться, например, в соответствии с публикацией Moore et al., Journal of Clinical Microbiology 36:1028 (1998). Способы и варианты LCR были описаны, например, в Европейской заявке на патент №ЕР0320308 и в патенте США №5,427,930, каждый из которых включен в данное описание посредством ссылки.
Способ TAS представляет собой способ специфической амплифицирования РНК-мишени, при котором транскрипт получают из матричной РНК стадией синтеза кДНК и стадией транскрипции РНК. На стадии синтеза кДНК последовательность, узнаваемая ДНК-зависимой РНК-полимеразой (т.е. связывающая полимеразу последовательность или PBS (polymerase-binding sequence)), вставляется в копию кДНК по направлению транскрипции целевой или маркерной последовательности, которая должна быть амплифицирована, с использованием двухдоменного олигонуклеотидного праймера. На второй стадии РНК-полимераза используется для синтеза многочисленных копий РНК с матрицы кДНК. Для амплификации с использованием TAS требуется всего несколько циклов, поскольку в результате выполнения ДНК-зависимой РНК-транскрипции может быть получено от 10 до 1000 копий для каждой копии матрицы кДНК. TAS может выполняться в соответствии с публикацией Kwoh et al., PNAS 86:1173 (1989). Способ TAS был описан, например, в публикации Международной патентной заявки WO 198 8/010315, которая включена в данное описание посредством ссылки.
Опосредованная транскрипцией амплификация (ТМА) представляет собой реакцию изотермической амплификации на основе транскрипции, которая использует транскрипцию РНК, осуществляемую РНК-полимеразой, и транскрипцию ДНК, осуществляемую обратной транскриптазой, для получения ампликона РНК из нуклеиновой кислоты-мишени. Способы ТМА имеют преимущество, заключающееся в том, что они могут производить от 100 до 1000 копий ампликона за один цикл амплификации, в отличие от способов PCR или LCR, которые производят только 2 копии за один цикл. ТМА была описана, например, в патенте США №5,399,491, который включен в данное описание посредством ссылки. NASBA представляет собой основанный на транскрипции способ специфической амплификации РНК-мишени с матрицы либо РНК либо ДНК. NASBA представляет собой способ, используемый для непрерывной амплификации нуклеиновых кислот в одной смеси при одной температуре. Транскрипт получают из матричной РНК с помощью ДНК-зависимой РНК-полимеразы с использованием прямого праймера, имеющего последовательность, идентичную последовательности РНК-мишени, и обратного праймера, имеющего последовательность, комплементарную последовательности РНК-мишени, на 3'-стороне, и последовательность промотора, которая узнает РНК-полимеразу бактериофага Т7, на 5'-стороне. Транскрипт далее синтезируется с использованием полученного транскрипта в качестве матрицы. Данный способ может выполняться в соответствии с публикацией Heim, et al., Nucleic Acids Res., 26:2250 (1998). Способ NASBA был описан в патенте США №5,1302,38, который включен в данное описание посредством ссылки.
Способ SDA (амплификация с вытеснением цепи (Strand Displacement Amplification)) представляет собой способ изотермической амплификации нуклеиновых кислот, при котором ДНК-мишень амплифицируется с использованием нити ДНК, замещенной нитью, синтезированной вытесняющей рестрицированную цепь ДНК-полимеразой, лишенной 5'->3' экзонуклеазной активности, с помощью одноцепочечного разрыва (ника), генерированного ферментом рестрикции, в качестве матрицы следующей репликации. Праймер, содержащий сайт рестрикции, отжигают на матрице, и затем амплификационные праймеры отжигают на прилегающих к 5'-концу последовательностях (образуя ник). Амплификация начинается при фиксированной температуре. Заново синтезированные нити ДНК режутся ферментом рестрикции, и амплификация полимеразой начинается снова, приводя к вытеснению вновь синтезированных нитей. SDA может проводиться в соответствии с публикацией Walker et al., PNAS, 89:392 (1992). Способы SDA были описаны в патентах США №№5,455,166 и 5,457,027, каждый из которых включен сюда посредством ссылки.
Способ LAMP (Loop mediated isothermal amplification) представляет собой способ изотермической амплификации, при котором на 3'-конце синтезированной ДНК всегда образуется петля, праймеры отжигаются внутри петли, и специфическая амплификация ДНК-мишени проводится изотермически. LAMP может проводиться в соответствии с публикацией Nagamine et al., Clinical Chemistry. 47:1742 (2001). Способы LAMP были описаны в патентах США №№6410278, 6974670 и 7175985, каждый из которых включен сюда посредством ссылки.
Способ ICAN (primer-initiated amplification of nucleic acids) представляет собой способ изотермальной амплификации, при котором специфическая амплификация ДНК-мишени производится изотермически реакцией замещения нити, реакцией обмена матрицы и реакцией введения ника, с использованием химерного праймера, включающего в себя РНК-ДНК и ДНК-полимеразу, обладающую активностью замещения нити, и РНКазу Н. ICAN может проводиться в соответствии с публикацией Мукаи et al., J. Biochem. 142:273 (2007). Способ ICAN был описан в патенте США №6951722, который включен в данное описание посредством ссылки.
SMAP (smart-amplification process) (MITANI) представляет собой способ, при котором нуклеиновая кислота непрерывно синтезируется в изотермических условиях с использованием набора праймеров, включающего в себя два вида праймеров и ДНК или РНК в качестве матрицы. Первый праймер, включенный в набор праймеров, включает в себя, в его 3'-концевой области, последовательность (Ac'), гибридизующуюся с последовательностью (A) в 3'-концевой области последовательности нуклеиновой кислоты-мишени, а также, на 5'-стороне вышеупомянутой последовательности (Ac'), последовательность (B'), гибридизующуюся с последовательностью (Bc), комплементарной последовательности (B), существующей на 5'-стороне вышеупомянутой последовательности (A) в вышеупомянутой последовательности нуклеиновой кислоты-мишени. Второй праймер включает в себя, в его 3'-концевой области, последовательность (Cc'), гибридизующуюся с последовательностью (C) в 3'-концевой области последовательности, комплементарной вышеупомянутой последовательности нуклеиновой кислоты-мишени, а также замыкающуюся в кольцо последовательность (D-DC'), включающую в себя две последовательности нуклеиновых кислот, гибридизующихся друг с другом на идентичной нити на 5'-стороне вышеупомянутой последовательности (Cc'). SMAP может проводиться в соответствии с публикацией Mitani et al., Nat. Methods, 4(3):257 (2007). Способы SMAP были описаны в публикациях патентных заявок США №№2006/0160084, 2007/0190531 и 2009/0042197, каждая из которых включена в данное описание посредством ссылки.
Реакция амплификации может быть предназначена для получения конкретного вида такого амплифицированного продукта, как нуклеиновые кислоты, которые являются двухцепочечными; одноцепочечными; двухцепочечными с 3'- или 5'-выступами, или двухцепочечными с химическими лигандами на 5'- и 3'-концах. Амплифицированнный ПЦР-продукт может быть детектирован: (i) гибридизацией амплифицированного продукта с магнитной частицей, связывающей комплементарные олигонуклеотиды, когда используются два различных олигонуклеотида, которые гибридизуются с амплифицированным продуктом, так что нуклеиновые кислоты служат в качестве средства связывания частиц, содействуя агломерации частиц; (ii) опосредованной гибридизацией детекцией, где ДНК амплифицированного продукта сначала должна быть денатурирована; (iii) опосредованной гибридизацией детекцией, когда частицы гибридизуются с 5'- и 3'-выступами амплифицированного продукта; (iv) связыванием частиц с химическими или биохимическими лигандами на концах амплифицированного продукта, таких как стрептавидин-функционализированные частицы, связывающиеся с биотин-функционализированным амплифицированным продуктом.
Системы и способы по изобретению могут быть использованы для выполнения ПЦР в режиме реального времени и предоставляют количественную информацию о количестве нуклеиновой кислоты-мишени, присутствующей в образце (см. фигуру 25 и пример 14). Способы проведения количественной ПЦР в режиме реального времени представлены в литературе (см., например: RT-PCR Protocols. Methods in Molecular Biology, Vol.193. Joe O'Connell, ed. Totowa, NJ: Humana Press, 2002, 378 pp.ISBN 0-89603-875-0.). Пример 14 описывает применение способов по изобретению для анализа образца цельной крови способом ПЦР в режиме реального времени.
Системы и способы по изобретению могут быть использованы для выполнения ПЦР в режиме реального времени непосредственно в таких непрозрачных образцах, как цельная кровь, с использованием магнитных наночастиц, модифицированных зондами захвата, и магнитного разделения. Использование ПЦР в режиме реального времени позволяет проводить количественное определение нуклеиновой кислоты-мишени, не открывая реакционную пробирку после начала реакции ПЦР.
Предыдущая работа показала, что в некоторых случаях присутствие частиц в реакционной смеси ПЦР может ингибировать ПЦР. Для таких ингибирующих частиц предполагается, что частицы могут быть собраны на одной стороне пробирки (или в другом месте внутри контейнера), чтобы держать их вне раствора в процессе реакции ПЦР. Могут быть использованы способы, чтобы высвободить данные частицы обратно в суспензию, чтобы они могли гибридизоваться с ПЦР-продуктом, а затем удалить их обратно из раствора.
В некоторых вариантах осуществления настоящее изобретение относится к применению ферментов, совместимых с цельной кровью, например, NEB Hemoklentaq, DNAP Omniklentaq, Кара Biosystems whole blood enzyme, Thermo-Fisher Firmzymes Phusion enzyme.
Изобретение также относится к количественной асимметричной ПЦР. В любом из способов ПЦР в режиме реального времени по изобретению способ может включать в себя следующие стадии: (i) аликвотирование цельной крови в подготовленную для проведения ПЦР реакционную смесь Master-mix, содержащую суперпарамагнитные частицы; (ii) закрытие пробирки перед первым циклом ПЦР до завершения циклов ПЦР; (iii) загрузка пробирки в термоциклер; (iv) проведение ʺnʺ циклов стандартного ПЦР-термоциклирования; (v) проведение детекции Т2 (точная продолжительность времени и стадии данной задачи изменяются в зависимости от биохимического подхода и подхода к назначению частицы, описанных ниже); и (vi) повторение стадий (iv) и (v) до накопления количества замеров значений Т2, достаточного для точной количественной оценки начальной концентрации мишени.
Приведенные выше способы могут быть использованы с любой из следующих категорий детекции агрегации или дезагрегации, описанных в данном документе, включая в себя:
Различные примеси и компоненты цельной крови могут оказывать ингибирующее действие на полимеразы и отжиг праймеров. Такие ингибиторы могут привести к генерации ложнопозитивных результатов и низкой чувствительности. Чтобы уменьшить появление ложнопозитивных результатов и низкой чувствительности при амплифицировании и детектировании нуклеиновых кислот в сложных образцах, желательно применять стабильную термальную полимеразу, которая не ингибируется образцами цельной крови (см., например, патент США №7,462,475) и вводить один или более внутренних контролей ПЦР-анализа (см. Rosenstraus et al. J. din Microbiol. 36:191 (1998) and Hoofar et al., J. Clin. Microbiol. 42:1863 (2004)). Например, чтобы убедиться, что клинические образцы успешно амплифицируются и детектируются, анализ может включать в себя нуклеиновую кислоту для внутреннего контроля, которая содержит области связывания праймеров, идентичные таковым последовательности-мишени. Как показано на примерах, нуклеиновая кислота-мишень и нуклеиновая кислота для внутреннего контроля были выбраны так, что каждая обладает уникальной связывающей зонд областью, которая отличает нуклеиновую кислоту для внутреннего контроля от нуклеиновой кислоты-мишени.
Кинетика реакции
Взаимодействие магнитных частиц и специфических аналитов с образованием агрегатов может быть использовано для получения диагностического сигнала в анализах по изобретению. Во многих случаях инкубация реакционной смеси в течение определенного периода времени достаточно для образования агрегатов. Способы, наборы, картриджи и устройства по изобретению могут быть подобраны так, чтобы сократить количество времени, необходимое для захвата определенного аналита или для образования агрегатов магнитных частиц. В то время как изменение общей концентрации магнитных частиц, казалось бы, представляет собой простой и прямой подход для увеличения уровней агрегирования, такой подход осложняется (I) неспецифической агрегацией, которая может возникать при высокой концентрации магнитных частиц, и (II) необходимостью получить изменение наблюдаемого сигнала (например, изменение релаксационного сигнала) в ответ на агрегацию в присутствии низкой концентрации аналита. Кинетика реакции могут быть улучшена, например, посредством механически индуцированной агрегации, акустически индуцированной агрегации, индуцированной с помощью ультразвука агрегации, электростатически индуцированной агрегации, или посредством улавливания (например, подвергая наночастицы воздействию магнитного поля, с помощью пористой мембраны, используя подмагничивающуюся металлическую пену или центрифугирование) магнитных частиц в части жидкого образца.
ЯМР-блоки
Системы для выполнения способов по изобретению могут включать в себя один или более ЯМР-блоков. На фигуре 1 представлена принципиальная схема (100) системы ЯМР для детектирования ответа сигнала жидкого образца на соответствующую последовательность РЧ импульсов. Постоянный магнит (102) создает подмагничивающее поле Bb (104), направленное через образец (106). Магнитные частицы находятся в жидком или лиофилизированном состоянии в картридже до их введения в углубление для образца (понятие ʺуглублениеʺ для целей настоящего изобретения включает в себя любые выемку, сосуд, контейнер или подложку) (108) до введения жидкого образца (106) в углубление (108), или магнитные частицы могут быть добавлены к образцу (106) до введения жидкого образца в углубление (108). РЧ катушка (110) и РЧ генератор (112) обеспечивают РЧ возбуждение на ларморовской частоте, которая является линейной функцией подмагничивающего поля Bb. В одном варианте осуществления РЧ катушка (110) обернута вокруг углубления для образца (108). РЧ-возбуждение создает неравновесное распределение в спине протонов воды (или свободных протонов в неводном растворителе). При выключении РЧ возбуждения протоны «релаксируют», возвращаясь в исходное состояние, и испускают РЧ сигнал, который может быть использован для получения информации о наличии и концентрации аналита. Катушка (110) действует как РЧ антенна и детектирует сигнал, который, в зависимости от приложенной последовательности РЧ импульсов, зондирует различные свойства материала, например, время релаксации Т2. Сигнал, представляющий интерес для некоторых случаев данной технологии, представляет собой спин-спиновую релаксацию (как правило, составляющую от 10 до 2000 миллисекунд) и называется Т2-релаксацией. РЧ сигнал от катушки (110) усиливается в блоке (114) и обрабатываются для определения ответа Т2 (время затухания) в ответ на возбуждение в постоянном магнитном поле Bb. Углубление (108) может представлять собой небольшой капилляр или другую пробирку, содержащую образец, имеющий объем в интервале от нанолитров до микролитров, включающий в себя аналит, и катушку соответствующего размера, обмотанную вокруг данного углубления (см. фигуру 1В). Катушка, как правило, оборачивается вокруг образца и имеет размер, соответствующий объему образца. Например (и без ограничений), для образца, имеющего объем, составляющий около 10 мл, может быть использована соленоидальная катушка длиной около 50 мм и диаметром от 10 до 20 мм; для образца, имеющего объем, составляющий около 40 мкл, может быть использована соленоидальная катушка длиной от около 6 до около 7 мм и диаметром от 3,5 до 4 мм; и для образца, имеющего объем, составляющий около 0,1 нл, может быть использована соленоидальная катушка длиной около 20 мкмоль и диаметр длиной около 10 мкмоль. Альтернативно, катушка может находиться, как показано на любой из фигур 2А-2Е, около или в непосредственной близости от углубления. Система ЯМР может также содержать несколько РЧ катушек для детектирования мультиплексных целей. В некоторых вариантах осуществления РЧ катушка имеет коническую форму с размерами 6 мм × 6 мм × 2 мм.
На фигурах 2А-2Е представлены примеры конструкций ЯМР-микрокатушки (РЧ катушки). На фигуре 2А показана соленоидальная катушка (200), имеющая длину, равную около 100 мкм, однако можно представить себе катушку, имеющую длину, равную 200 мкм, 500 мкм или до 1000 мкм. На фигуре 2В показана ʺплоскаяʺ катушка (202) (катушка на самом деле не плоская, поскольку катушка имеет конечную толщину), имеющую диаметр, составляющий около 1000 мкм. На фигуре 2С показана соленоидальная MEMS-катушка (204), определяющая объем, составляющий около 0,02 мкл. На фигуре 2D показана схема конфигурации MEMS-катушки Гельмгольца (206), и на фигуре 2Е показана схема конфигурации седловидной катушки (220).
Соленоидальная микрокатушка (200), используемая для ЯМР-детекции традиционными способами, описана в публикации Seeber et al., ʺDesign and testing of high sensitivity micro-receiver coil apparatus for nuclear magnetic resonance and imaging,ʺ Ohio State University, Columbus, Ohio. Плоская микрокатушка (202), используемая для ЯМР-детекции традиционными способами, описана в публикации Massin et al., ʺHigh Q factor RF planar microcoil for micro-scale NMP spectroscopy,ʺ Sensors and Actuators A 97-98, 280-288 (2002). Катушка в конфигурации Гельмгольца (206) имеет углубление (208) для удерживания образца, верхний слой Si (210), нижний слой Si (212) и катушки из наплавленного металла (214). Пример конфигурации катушки Гельмгольца (206), используемой для ЯМР-детекции традиционными способами, описан в публикации Syms et al, ʺMEMS Helmholz Coils for Magnetic Resonance Spectroscopy,ʺ Journal of Micromechanics and Micromachining 15(2005) S1-S9.
ЯМР-блок включает в себя магнит (т.е. сверхпроводящий магнит, электромагнит или постоянный магнит). Конструкция магнита может быть открытой или частично закрытой, начиная с U- или C-образного магнита до магнитов с тремя и четырьмя штырями, до полностью закрытых магнитов с небольшими отверстиями для размещения образцов. Необходимо сочетание доступности к ʺсладкому пятнуʺ (sweet spot) магнита и его механическую стабильность (механическая стабильность может представлять собой проблему, когда желательна высокая однородность поля). Например, ЯМР-блок может включать в себя один или более постоянных магнитов, имеющих цилиндрическую форму и изготовленных из SmCo (самарий-кобальт), NdFeB (неодим-железо-бор), или другие постоянные магниты, создающие поля низкой интенсивности, которые обеспечивают магнитное поле в диапазоне от 0,5 до около 1,5 Тл (т.е. подходящие постоянные магниты из SmCo и NdFeB доступны от NeoMax, Осака, Япония). В целях иллюстрации, а не ограничения, такие постоянные магниты могут представлять собой сборку постоянных магнитов (permanent magnet (РМ)) в виде диполь/коробка или конфигурацию Hallbach (см. Demas et al., Concepts Magn Reson Part A 34A:48 (2009)). ЯМР-блоки могут включать в себя, без ограничения, постоянный магнит с полем, равным 0.5 Тл, с однородностью поля, составляющей около 20-30 м.д., и ʺсладким пятномʺ (sweet spot), равным 40 мкл, расположенным по центру. Такая однородность поля позволяет использовать более дешевый магнит (менее продолжительная тонкая настройка сборки/шиммирования) в системе, менее склонной к колебаниям (например, температурный дрейф, механическая стабильность во времени - практически любое влияние слишком мало, чтобы учитываться), терпимой к движению ферромагнитных или проводящих объектов в поле рассеяния (при их меньшем влиянии, соттветственно, требуется меньшее экранирование), без ущерба для качества аналитических измерений (релаксационные измерения и корреляционные измерения не требуют высокой однородности поля).
Конфигурация катушки может быть выбрана или приспособлена для конкретной реализации микро-ЯМР-MPS технологии, поскольку различные конфигурации катушки предлагают различные технические характеристики. Например, каждая из данных геометрических форм катушек характеризуется различной производительностью и направлением поля. Плоская катушка (202) создает РЧ поле, направленное перпендикулярно к плоскости катушки. Соленоидальная катушка (200) создает РЧ поле, направленное по оси катушки, и катушка Гельмгольца (206) создает РЧ поле, направленное поперек двух прямоугольных катушек (214). Катушка Гельмгольца (206) и седловидная катушка (220) создают поперечно направленные поля, которые позволят размещение поля, создаваемого постоянным магнитом, выше и ниже углубления для образца. Катушка Гельмгольца (206) и седловидная катушка (220) могут быть наиболее эффективными для чипов, в то время как соленоидальная катушка (200) может быть наиболее эффективной, когда образец и MPS-магнитные частицы удерживаются в микропробирке.
Микро-ЯМР-устройства могут быть изготовлены путем намотки или литографической печати катушек или с помощью технологий производства микроэлектромеханических систем (microelectromechanical system (MEMS)) по технологиям обработки полупроводников. Например, модуль ʺнамотанная или литографически отпечатанная катушка/углубление для образцаʺ может иметь диаметр, равный около 100 мкм или один сантиметр или более. MEMS-блок или чип (назван таким образом, поскольку он изготавливается по технологии производства полупроводников, штампованием пластины) может иметь катушку, характерный размер которой составляет, например, от около 10 мкм до около 1000 мкм. Конфигурация ʺнамотанная или литографически отпечатанная катушка/углубление для образцаʺ означает в настоящем документе модуль, и MEMS-версия означает в данном описании чип.Например, жидкий образец (108) может удерживаться в пробирке (например, капилляре, пипетке, или микропробирке) с катушкой, намотанной вокруг нее, или он может удерживаться в углублениях на чипе с РЧ катушкой, окружающей углубление. Альтернативно, образец размещается таким образом, что он протекает через пробирку, капилляр или полость в непосредственной близости от РЧ катушки.
Основные компоненты ЯМР-блока включают в себя электрические компоненты, такие как колебательный РЧ контур в магнитном поле, включая МР-сенсор, электронные приемное и передаточное устройства, которые могут включать в себя предусилители, усилители и схемы защиты, компоненты регистрации данных, программатор импульсов и генератор импульсов.
Системы, содержащие ЯМР-блоки с РЧ катушками и микроуглублениями, содержащими магнитные частицы-сенсоры, описанные в данном документе, могут быть предназначены для детектирования и/или измерения концентрации определенного(ых) аналита(ов), представляющего(их) интерес, путем разработки модели феномена агрегации частиц и разработки модели цепи сигнала РЧ-ЯМР. Например, с представляющими интерес системами аналит/магнитные частицы могут быть проведены эксперименты по характеристике физических эффектов, наблюдаемых при агрегации частиц, включая, например, эффекты, зависящие от аффинностей, соответствующих размеров и концентраций. Кроме того, могут проводиться эксперименты, чтобы охарактеризовать сигнал(ы) ЯМР (Т2, Т1 Т2*, T2rho, T1rho и/или другие характеристики сигнала(ов), такие как гибридные сигналы Т1/Т2 и могут также включать, но не ограничиваться ими, диффузию, восприимчивость, частоту) как функции агрегации или уменьшения количества частиц, а также характеристик магнитных частиц. Особенности сигналов, характерные для феномена MPS (переключение магнитного резонанса (magnetic resonance switch)) в данной системе, могут быть использованы для повышения чувствительности детектирования и/или улучшения эффективности иным образом.
Система ЯМР может включать в себя чип с РЧ катушкой(ми) и полученные по технологии микрообработки электронные структуры на нем. Например, чип может подвергнуться поверхностной микрообработке, так что структуры построены на верхней части подложки. Когда данные структуры построены на верхней части подложки, а не внутри нее, свойства подложки не так важны, как при объемной микрообработке, и дорогие кремниевые пластины, используемые при объемной микрообработке, могут быть заменены на менее дорогие материалы, такие как стекло или пластик. Альтернативные варианты осуществления, однако, могут включать в себя чипы, полученные по технологии объемной микромеханической обработки. При поверхностной микрообработке обычно происходит наращивание слоев, начиная с пластины или другой подложки. Данные слои подвергаются выборочному травлению с помощью фотолитографии и либо ʺмокромуʺ травлению с участием кислоты, либо ʺсухомуʺ травлению с участием ионизированного газа или плазмы. Сухое травление может объединять химическое травление с физическим травлением или ионной бомбардировкой материала. Поверхностная микрообработка может включать в себя столько слоев, сколько необходимо.
В некоторых случаях недорогая РЧ катушка может быть интегрирована в одноразовый картридж и может представлять собой одноразовый компонент.Данная катушка может быть размещена таким образом, чтобы осуществлялся электрический контакт со схемой на фиксированной ЯМР-установке, или возможно осуществление индуктивной связи с контуром.
При измерении времени релаксации Т2 достоверность и воспроизводимость (точность) будет зависеть от температурной стабильности образца, как имеющей отношение к калибровке, стабильности анализа, соотношения сигнал-шум (signal-to-noise ratio (S/N)), импульсной последовательности для переориентации (например, CPMG, BIRD, Tango и тому подобное), а также факторов, связанных с обработкой сигнала, таких как преобразование сигнала (например, усиление, исправление и/или оцифровка эхо-сигналов), преобразование домена время/частота и используемые алгоритмы обработки сигнала. Соотношение сигнал-шум представляет собой функцию постоянного магнитного поля (Bb), объема образца, коэффициента заполнения, геометрической формы катушки, Q-фактора катушки, пропускной способности электронного блока, шума усилителя и температуры.
Для того чтобы подобрать требуемую точность измерений Т2, необходимо изучить имеющуюся кривую ответа данного анализа и соотнести желаемую точность определения концентрации аналита с точностью измеряемого параметра, например, параметра Т2 для некоторых случаев. Таким образом, может быть подобрана допустимая величина ошибки.
Например, чтобы получить 10-кратное улучшение предела детекции концентрации для тропонина, составляющего 0,02 нг/мл (10-кратное увеличение чувствительности), было бы необходимо различить значение Т2, отличающееся на менее чем около 5,6 миллисекунд от традиционно измеренного (не путем MPS-измерений) значения Т2, равного около 100 миллисекунд. Минимальное соотношение сигнал-шум (S/N) должно составлять около 20, чтобы детектировать данное различие.
ЯМР-блоки для применения в системах и способах по изобретению могут представлять собой таковые, описанные в патенте США №7,564,245, который включен сюда посредством ссылки.
ЯМР-блоки по изобретению могут включать в себя небольшую головку зонда для применения в портативном релаксометре магнитного резонанса, как описано в публикации международной заявки РСТ № WO 09/061481, включенной в данное описание посредством ссылки.
Системы по изобретению могут быть имплантируемыми или частично имплантируемыми в субъекте. Например, ЯМР-блоки по изобретению могут включать в себя имплантируемые радиочастотные катушки и необязательно имплантируемые магниты, как описано в публикациях международных заявок РСТ №№ WO 09/085(214) и WO 08/057578, каждая из которых включена в данное описание посредством ссылки.
Системы по изобретению могут включать в себя полимерный контейнер для образца для уменьшения, частично или полностью, вклада сигнала ЯМР, связанного с контейнером для образца, в параметр ядерного магнитного резонанса жидкого образца, как описано в публикации международной заявки РСТ № WO 09/045354, включенной в данное описание посредством ссылки.
Системы по изобретению могут включать в себя одноразовый держатель образца для применения с МР-ридером, который конфигурирован так, чтобы позволить заданное количество измерений (то есть, предназначен для ограниченного числа применений). Одноразовый держатель образца может не включать в себя ни одного элемента, включать в себя часть элементов или все элементы катушки для детектирования РЧ сигнала (т.е. так, что у МР-ридера отсутствует катушка для детектирования). Например, одноразовый держатель образца может включать в себя ʺчитающуюʺ катушку для детектирования РЧ сигнала, которая индуктивно связана с ʺpickupʺ (датчиком)-катушкой, находящейся в МР-ридере. Когда контейнер с образцом находится внутри МР-ридера, он находится в непосредственной близости к ʺpickupʺ-катушке и может быть использован для измерения сигнала ЯМР. Альтернативно, одноразовый держатель образца включает в себя РЧ катушку для детектирования РЧ сигнала, которая электрически соединяется с МР-ридером при введении контейнера для образца. Таким образом, когда контейнер с образцом вводится в МР-ридер, устанавливается соответствующее электрическое соединение, позволяющее детектирование. Числом применений, доступных для каждого одноразового держателя образца, можно управлять с помощью отключения плавкой перемычки, включенной либо в электрическую цепь внутри одноразового держателя образца, либо между одноразовым держателем образца и МР-ридером. После использования одноразового держателя образца для детектирования ЯМР-релаксации в образце можно так настроить данный прибор, чтобы на плавкую перемычку подавался избыточный ток, вызывая разрыв перемычки и выведение катушки из строя. Необязательно может быть использовано несколько плавких перемычек, работающих параллельно, причем каждая подключена к ʺpickupʺ-катушке в системе и разрывается отдельно при каждом применении до тех пор, пока все они не будут прерваны и одноразовый держатель образца не будет выведен из строя.
Картриджные блоки
Системы для выполнения способов по изобретению могут включать в себя один или более картриджных блоков, чтобы обеспечить удобный способ для размещения всех реагентов для анализа и расходных материалов в системе. Например, система может быть подобрана для выполнения определенной функции или приспособлена для выполнения более чем одной функции, например, через сменные картриджные блоки, содержащие массивы микролунок с настраиваемыми магнитными частицами, содержащимися в них. Система может включать в себя сменный и/или несменный картридж, содержащий массив лунок, предварительно загруженных магнитными частицами, и предназначенных для детектирования и/или измерений концентрации определенного вещества. Альтернативно, может использоваться система с различными картриджами, каждый из которых предназначен для детектирования и/или измерения концентрации различных аналитов или конфигурирована для работы с отдельными картриджными модулями для реагента и детектирования для данного анализа. Картридж может иметь размер, облегчающий введение в корпус и удаление из корпуса для приготовления жидкого образца, который передается в другие блоки в системе (например, блок достигаемой с помощью магнитных взаимодействий агломерации или ЯМР-блок). Сам картриджный блок потенциально может взаимодействовать непосредственно с манипуляционными станциями, а также с МР-ридером(ами). Картриджный блок может представлять собой модульный картридж, имеющий входной модуль, который можно стерилизовать независимо от реагентного модуля.
Для работы с биологическими образцами, такими как образцы крови, имеются многочисленные конкурирующие требования к конструкции картриджей, включающие в себя необходимость стерильности для входного модуля, чтобы предотвратить перекрестную контаминацию и ложноположительные результаты анализов, а также необходимость заключать реагенты в упаковку, которая не может быть легко стерилизована с использованием таких стандартных способов окончательной стерилизации, как облучение. Входной модуль для аликвотирования образца может быть сконструирован для взаимодействия с незакрытыми пробирками типа ʺВакутайнерʺ и для аликвотирования двух объемов образца, что может быть использовано для выполнения, например, анализа на Candida (см. фигуры 6D-6F). Вакутайнер позволяет частичное или полное заполнение. Входной модуль имеет две твердые пластиковые части, которые соединяются друг с другом ультразвуковой сваркой и запечатываются фольгой с образованием сети каналов, чтобы позволить потоку из первого углубления перейти в углубление для второго образца. Мягкая часть пробки вакутайнера используется для обеспечения плотного соединения с вакутайнером и включает в себя порт для потока образца и вентиляционный порт. Чтобы преодолеть сопротивление потока после загрузки и переворачивания вакутайнера, требуется определенное гидростатическое давление. Каждый раз, когда образец удаляется из углубления для образца, углубление будет заполняться притоком из вакутайнера.
Модульный картридж может обеспечить простое средство для контроля перекрестной контаминации во время некоторых анализов, включая, но не ограничиваясь этим, распределение продуктов ПЦР на многочисленные аликвоты, подлежащие детектированию. В дополнение, модульный картридж может быть совместим с автоматизированной выдачей жидкости и предоставляет способ держать реагенты в очень малых объемах в течение длительного периода времени (более года). Наконец, предварительное дозирование данных реагентов позволяет, чтобы точность при соблюдении концентраций и объемов устанавливалась на стадии изготовления, тем самым предоставляя пункту медицинской помощи прибор, применение которого является более удобным, поскольку для работы с ним требуется гораздо менее точное пипетирование.
Модульный картридж по изобретению представляет собой картридж, который разделяется на модули, которые могут быть упакованы и, при необходимости, простерилизованы раздельно. Они также могут обрабатываться и храниться раздельно, если, например, охлаждение требуется для реагентного модуля, но не для детекторного модуля. На фигуре 5 показан типичный картридж с входным модулем, реагентным модулем и детекторным модулем, которые защелкиваются вместе. В данном варианте осуществления входной модуль будет упакован отдельно в стерильной упаковке, и реагентный и детекторный модули будут предварительно собраны и упакованы вместе.
В процессе хранения реагентный модуль можно хранить в холодильнике, в то время как входной модуль можно хранить в сухом помещении. Это дает дополнительное преимущество, заключающееся в том, что только очень небольшая часть объема холодильника или морозильника требуется для хранения наборов для многих анализов. В момент применения оператор должен получить детекторный модуль и открыть упаковку, возможно, используя стерильную технику для предотвращения контаминации кожной флорой, если это потребует анализ. Затем с пробирки-вакутайнера снимается колпачок и перевернутый входной модуль помещается на пробирку, как показано на фигуре 6А. Данный модуль был разработан так, чтобы он был легко формуемым одиночным прессованием, как показано на фигурах 6В и 6С, и верхняя и нижняя части картриджа запечатаны фольгой для предотвращения контаминации, а также, чтобы закрыть каналы. Как только пробирка герметично закрывается с помощью входного модуля, собранный элемент переворачивается и вставляется в оставшуюся часть картриджа. Входная секция включает в себя углубление с предотвращением переливания через край, что позволяет использовать пробирки для образца, содержащие от 2 до 6 мл крови, и при этом все еще обеспечивать постоянную глубокую границу раздела с автоматическими блоками системы. Это достигается путем переливания через край, когда избыточная переливающаяся кровь просто попадает в тело картриджа, предотвращая контаминацию.
Альтернативно, модульный картридж предназначен для мультиплексного анализа. Проблема мультиплексных анализов заключается в объединении многочисленных анализов, которые обладают несовместимыми требованиями к анализам (т.е. различные времена инкубации и/или температуры), на одном картридже. Картридж может быть представлен двумя основными компонентами: (i) реагентный модуль, который содержит все отдельные реагенты, необходимые для полной панели анализа, и (ii) детекторный модуль. Детекторные модули содержат только те части картриджа, которые проходят через инкубацию, и могут осуществлять одиночные анализы или несколько анализов, по мере необходимости. Детекторный модуль может включать в себя два детекторные камеры для одного анализа, первую детекторную камеру в качестве контрольной и вторую детекторную камеру для образца. Данный формат картриджа может быть расширяемым таким образом, что, включая в него реагенты и дополнительный детекторный модуль, к нему могут быть добавлены дополнительные анализы.
Работа модуля начинается, когда пользователь вставляет весь картридж или часть картриджа в прибор. Прибор начинает осуществлять анализ, аликвотируя пробы в отдельные детекторные камеры. Данные камеры индивидуального детектирования затем отсоединяются друг от друга и проходят через систему раздельно. Благодаря тому что реагентный модуль отделяется и отбрасывается, блок с образцом наименьшего возможного размера проходит через прибор, позволяя минимизировать внутренний объем прибора. Выделение каждого образца для анализа в отдельную единицу, возможно поддержание разных времен инкубации и различных температур, поскольку каждый образец для мультиплексного анализа физически удален от других и можно манипулировать каждым образцом индивидуально.
Картриджные блоки по изобретению могут включать в себя одну или более популяций магнитных частиц либо в виде жидкой суспензии, либо в виде сухих магнитных частиц, которые переводят в раствор перед применением. Например, картриджные блоки по изобретению могут включать в себя отделение, включающее в себя от 1×106 до 1×1013 магнитных частиц (например, от 1×106 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1х1011, от 1×1010 до 1×1012, от 1×1010 до 1×1013 или от 1×107 до 5×108 магнитных частиц) для анализа одного жидкого образца.
Системы
Системы для выполнения способов по изобретению могут включать в себя один или более ЯМР-блоков, картриджных блоков и блоков перемешивания (например, для разрушения неспецифических взаимодействий магнитных частиц и равномерного распределения магнитных частиц в жидком образце или для простого встряхивания пробирки с образцом, чтобы полностью смешать реагенты для анализа, например, обработкой ультразвуком, перемешиванием с помощью аппарата для встряхивания типа ʺВортексʺ, покачиванием или с применением ультразвуковой установки для перемешивания одного или более жидких образцов). Такие системы могут дополнительно включать в себя другие компоненты для проведения автоматизированного анализа по изобретению, такие как блок ПЦР для детектирования олигонуклеотидов; центрифуга, робот-манипулятор для доставки жидкого образца от блока к блоку в рамках системы; один или более инкубационных блоков; блок переноса жидкости (например, устройство для пипетирования) для объединения реагентов для анализа и биологического образца с образованием жидкого образца; компьютер с программируемым процессором для хранения данных, обработки данных, а также для управления включения и отключения различных блоков в соответствии с одним или несколькими заданными протоколами; и система для установки картриджей для доставки предварительно заполненных картриджей к системе, необязательно с инструкциями к компьютерному определению реагентов и с протоколом, который будет использоваться в сочетании с картриджем.
Системы по изобретению могут стать эффективным средством для высокопроизводительной и в режиме реального времени детекции аналитов, присутствующих в биологической жидкости, полученной от испытуемого. Способы детекции могут быть использованы при самых разнообразных обстоятельствах, включая в себя, без ограничений, идентификацию и/или количественную оценку аналитов, которые связаны с конкретными биологическими процессами, физиологическими состояниями, расстройствами или стадиями заболеваний. Таким образом, данные системы имеют широкий спектр применения, например, при скрининге лекарственных препаратов, диагностике заболеваний, филогенетической классификации, идентификации родителей и криминалистической идентификации, в начале заболевания и при рецидивах, при сравнении индивидуальной реакции на лечение с реакцией основной части населения и при мониторинге терапии. Устройства и системы по изобретению также особенно применимы для продвижения доклинической и клинической стадии развития терапевтических препаратов, улучшения соблюдения пациентом условий лечения, мониторинга побочных реакций (Adverse Drug Reaction (ADR)), связанных с предписанным лекарственным препаратом, разработки индивидуальных программ лечения, переноса тестирования крови из центральной лаборатории в домашние условия или на основе рецепта, а также мониторинга терапевтических препаратов после их официального одобрения. Данные приборы и системы могут обеспечить гибкую систему для персонализированной медицины. Элементы системы по изобретению могут быть заменяемыми или взаимозаменяемыми вместе с протоколом или инструкциями к программируемому процессору данной системы с целью выполнения широкого спектра анализов, как описано в данном документе. Системы по изобретению предоставляют много преимуществ, связанных с возможностью использования в лабораторных условиях автоматизированных настольных или меньшего размера приборов.
Системы по изобретению могут быть использованы для одновременного анализа аналитов, которые присутствуют в одном жидком образце в широком диапазоне концентраций, и могут быть использованы для мониторинга скорости изменения концентрации аналита и/или или концентрации маркеров PD или PK на протяжении определенного периода времени у одного пациента или использоваться для выполнения анализа тенденций изменения концентраций лекарственных препаратов или их метаболитов или маркеров PD или PK. Например, если глюкоза является аналитом, представляющим интерес, то определение концентрации глюкозы в образце в данный момент времени, а также скорости изменения концентрации глюкозы в течение определенного периода времени может быть весьма полезным для прогнозирования и предотвращения, например, гипогликемических событий. Таким образом, данные, полученные с применением установок и систем, тестирующих биологические жидкости субъекта, могут быть использованы для выполнения анализа тенденций изменений концентрации аналита у субъекта. Например, пациент может быть снабжен несколькими картриджными блоками, которые будут использоваться для детектирования различных аналитов в заданные моменты времени. Субъект может, например, использовать различные картриджные блоки в разные дни недели. В некоторых вариантах осуществления программное обеспечение системы предназначено для распознавания идентификатора на картридже, инструктирующего компьютер системы для осуществления определенного протокола выполнения и/или обработки данных. Протоколы системы могут быть обновлены через внешний интерфейс, такой как диск USB или соединение Ethernet, или в некоторых вариантах осуществления весь протокол может быть записан в штрих-коде, прикрепленном к картриджу. Данный протокол может быть оптимизирован по мере необходимости посредством запроса пользователя, касающегося различных исходных данных (например, изменения разведения образца, количества реагента, добавляемого в жидкий образец, изменения времени инкубации или времени достигаемой с помощью магнитных взаимодействий агломерации или изменения набора параметров ЯМР-релаксации). Когда для детектирования нуклеиновой кислоты-мишени конфигурируется мультиплексный массив, то анализ может включать в себя мультиплексную ПЦР для создания различных ампликонов и затем последовательное детектирование различных реакций. Мультиплексный анализ необязательно включает в себя логический массив, в котором мишени задаются бинарным поиском, чтобы уменьшить количество требуемых анализов (например, необходимость детектировать грамположительный или грамотрицательный микроорганизм приводит к базируемым на различных видах микроорганизмов анализам, которые будут проводиться только для одной группы или только для другой).
В системах по изобретению могут проводиться различные анализы, независимо от аналита, подлежащего детектированию в образце биологической жидкости. Протокол, зависимый от идентичности используемого картриджного блока, может быть сохранен в системе компьютера. В некоторых вариантах осуществления картриджный блок имеет идентификатор (ID), который определяется или читается компьютером системы, или штрих-код (1D или 2D) на карте, который затем поставляет относящуюся к определенному тесту или к определенному пациенту или к определенному субъекту информацию, которую необходимо отслеживать или необходимо оценить с помощью информации, относящейся к анализу (например, калибровочные кривые, протоколы, предыдущие концентрации или уровни аналита). При желании идентификатор картриджного блока используется для выбора протокола, хранящегося в системе компьютера, или для определения местоположения различных реагентов для анализа в картриджном блоке. Протокол, который будет работать в системе, может включать в себя инструкции к контроллеру системы для выполнения протокола, включая, но не ограничиваясь им, определенный анализ, который должен быть проведен, и способ детекции, который должен быть выполнен. После того, как системой проведен анализ, генерируются данные, указывающие на аналит в биологическом образце, которые передаются в собрание подобных сообщений, где они могут быть либо переданы на внешнее устройство для обработки, включающей в себя, без ограничения, расчет концентрации аналита в образце, либо обработаны компьютером системы, и результат представлен в виде показаний на дисплее.
Например, идентификатор может представлять собой идентификатор штрих-кода с набором черных и белых линий, которые могут быть считаны считывателем штрих-кода (или другим типом детектора) при вставке картриджного блока. Могут быть использованы другие идентификаторы, такие как набор буквенно-цифровых значений, цветов, рельефные формы, RFID или любой другой идентификатор, который может быть расположен на картриджном блоке и детектирован или считан компьютером системы. Детектор может также представлять собой светодиод, который излучает свет, который может взаимодействовать с идентификатором, который отражает свет и измеряется компьютером системы, чтобы определить идентичность определенного картриджного блока. В некоторых вариантах осуществления данная система включает в себя устройство хранения или запоминающее устройство с картриджным блоком или детектор для передачи информации в компьютер системы.
Таким образом, системы по изобретению могут включать в себя операционную программу для проведения различных анализов, и картриджи, закодированные для того, чтобы: (i) сообщить операционной программе, какой запрограммированный анализ используется в настоящее время; (ii) сообщить операционной программе конфигурацию картриджей; (iii) сообщить операционной программе порядок стадий для проведения анализа; (iv) сообщить системе, какой запрограммированный порядок выполнения операций надо использовать; (v) подсказать входные данные пользователя в отношении некоторых переменных анализа; (vi) записать идентификационный номер пациента (идентификационный номер пациента также может быть включен в вакутайнер, содержащий образец крови); (vii) записать некоторую информацию, касающуюся картриджа (например, № лота, данные калибровки, анализы, которые можно проводить с использованием данного картриджа, диапазон аналитических данных, срок годности, требования к хранению, приемлемые особенности образца); или (viii) сообщить операционной программе об обновлениях или изменениях анализа (т.е., так что анализ в его новых версиях будет проводиться с использованием только обновленного картриджа, а не в более крупной и дорогостоящей системе).
Системы по изобретению могут включать в себя один или более блоков переноса жидкости, конфигурированных так, чтобы присоединиться к роботу-манипулятору. Блок переноса жидкости может представлять собой пипетку, такую как пипетка объемного вытеснения, liquid backed или пипетка-шприц. Например, блок переноса жидкости может дополнительно включать в себя двигатель, связанный с программируемым процессором компьютера системы, и данный двигатель может перемещать несколько головок поршней на основании протокола из программируемого процессора. Таким образом, программируемый процессор системы может включать в себя инструкции или команды и может управлять блоком переноса жидкости в соответствии с инструкциями для переноса жидких образцов, выводя (для втягивания жидкости) поршень из замкнутого воздушного пространства или вводя (для вытеснения жидкости) поршень в замкнутое воздушное пространство. Как объем перемещаемого воздуха, так и скорость передвижения можно точно контролировать, например, с помощью программируемого процессора. Смешивание образцов (или реагентов) с разбавителями (или другими реагентами) может быть достигнуто аспирацией компонентов, которые должны быть смешаны, в общей пробирке и затем неоднократной аспирацией значительной доли совокупного объема жидкости вверх и вниз в наконечнике. Растворение сухих реагентов в пробирке может быть выполнено аналогичным способом.
Система может включать в себя один или более инкубационных блоков для нагрева жидкого образца и/или для контроля за температурой анализируемого образца. Нагрев может быть использован на стадии инкубации реакционной смеси анализа для ускорения реакции и сокращения времени, необходимого для стадии инкубации. Система может включать в себя термоблок, предназначенный для приема жидкого образца в течение заданного времени при заданной температуре. Термоблок может быть предназначен для приема многих образцов.
Температура системы может тщательно регулироваться. Например, система включает в себя корпус, выдерживемый при заданной температуре (например, 37°C) с помощью перемешиваемого воздуха с контролируемой температурой. Количество отработанного тепла от каждого из блоков будет превышать то количество, которое может быть пассивно рассеяно простым корпусом за счет теплопроводности и конвекции воздуха. Для устранения отработанного тепла система может включать в себя два отделения, разделенных изолированной перегородкой. Верхнее отделение включает в себя те части компонентов, которые необходимы для манипуляции и измерения жидких образцов, тогда как нижнее отделение включает в себя теплогенерирующие элементы отдельных блоков (например, двигатель для центрифуги, двигатели для блоков перемешивания, электронные компоненты для каждого из отдельных блоков, а также термоблоки для инкубационных блоков). Нижнее отделение вентилируется, и для отвода тепла от системы используется принудительное воздушное охлаждение.
Для МР-блока может потребоваться более тщательно контролируемая температура (например, ±0,1°C), и поэтому он может необязательно включать в себя отдельный корпус, в который продувается воздух, нагретый при заданной температуре. Корпус может включать в себя отверстие, через которое вводится и удаляется жидкий образец, и из которого может уходить нагретый воздух.
Следующие примеры представлены так, чтобы предоставить специалистам в данной области полное раскрытие и описание того, как выполняются, делаются и оцениваются устройства, системы и способы, описанные в данном документе, и предназначены служить только примерами настоящего изобретения и не предназначены для ограничения объема того, что авторы изобретения считают своим изобретением.
Пример 1. Приготовление покрытых частиц
Вкратце, 1 мг по существу монодисперсных карбоксилированных магнитных частиц промывали и ресуспендировали в 100 мкл активационного буфера, 10 ммоль MES. 30 мкл (10 мг/мл) аминодекстрана (10 kDa) (Invitrogen) добавляли к активационному буферу и инкубировали на ротаторе в течение 5 минут при комнатной температуре. Для связывания карбоксильных групп с аминогруппами декстрана добавляли 30 мкл раствора (10 мг/мл) гидрохлорида 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC) и инкубировали на ротаторе в течение 2 часов при комнатной температуре. Частицы трижды промывали от свободного декстрана в 1 мл PBS с использованием магнитной сепарации, затем ресуспендировали в 1 мл PBS. 100 мкл 100 ммоль раствора сульфо-КН8-биотина (Invitrogen) использовали для ʺнавешиванияʺ биотина на аминогруппы, находящиеся на поверхности декстрана. После 30 минут инкубации частицы трижды промывали в 1 мл активационного буфера. Далее вводили протеиновый блок из 100 мкл раствора (0,5 мг/мл) бычьего сывороточного альбумина (bovine serum albumin (BSA)) (Sigma) и 30 мкл раствора (10 мг/мл) EDC и инкубировали в течение ночи (Sigma). Полученные частицы трижды промывали в 1 мл PBS и ресуспендировали до требуемой концентрации.
Было показано, что полученные частицы, синтезированные с помощью данного протокола, дают близкие результаты в анализах детектирования аналита с помощью измерения времени релаксации Т2 (Т2-анализах), будь то образцы, включающие в себя буфер или 20% лизированной крови (см. фигуру 14). Вариации препаратов, в которых предварительно биотинилированный аминодекстран был конъюгирован непосредственно с частицами в одной стадии, также приводили к аналогичным показателям в Т2-анализах образцов, содержащих как кровь, так и буфер.
Пример 2. Оценка частиц, полученных с протеиновым блокированием и без протеинового блокирования
Вкратце, покрытые биотином аминодекстрановые магнитные частицы, полученные в соответствии со способом, описанным в примере 1, анализировали в PBS и в образцах, содержащих 20% лизированной крови, с помощью Т2-анализа при титровании антителами к биотину.
Анализ проводился с помощью следующей процедуры. 50 мкл матрикса, содержащего либо PBS, либо 20% лизированной крови образца, 50 мкл раствора антитела против биотина различной концентрации и 50 мкл раствора (1,0 мкг/мл) вторичного антитела добавляли в ЯМР-пробирку размером 5 мм. 150 мкл 0,02 ммоль частиц Fe затем добавляли в каждую пробирку (т.е. 2,7×108 частиц на одну пробирку). Затем образцы перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 4 секунд и инкубировали в термоблоке при 37°C в течение 2 минут. Каждый образец затем снова перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 4 секунд и инкубировали дополнительно еще одну минуту в термоблоке при 37°C. После инкубации каждый образец помещали в прибор Broker Minispec в течение 10 минут под действие магнитного поля. Через 10 минут образец удаляли от магнита, перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 4 секунд и инкубировали в термоблоке при 37°C в течение 5 минут. Через 5 минут каждый образец снова перемешивали на аппарате для встряхивания типа ʺВортексʺ и инкубировали в термоблоке при 37°C дополнительно еще одну минуту. Значения Т2 были получены с использованием программы Broker Minispec со следующими параметрами: Scans: I; Gain: 75; Tau: 0,25; Echo Train: 3500; Total Echo Train: 4500 и Dummy Echos: 2. Значения Δ Т2 были рассчитаны как: Т2-(Т2)0, и результаты представлены на фигуре 14.
Частицы, синтезированные с протеиновым блокированием, AXN4, давали почти равную эффективность в крови и буфере (фигура 14). На графике, изображенном на фигуре 15, сравниваются частицы, полученные со (открытый кружок) стадией протеинового блокирования и без (заполненный кружок) нее. Таким образом, авторы установили, что протеиновое блокирование может быть необходимо для достижения аналогичной функциональности в образцах, содержащих кровь.
Дополнительные протеиновые блокаторы, включающие, но не ограничиваясь этим, желатин рыбьей кожи, также были успешными. Частицы получали в соответствии со способом, описанным выше, с той разницей, что используемый в качестве протеинового блокатора BSA заменили желатином рыбьей кожи (fish skin gelatin (FSG)). На графике, изображенном на фигуре 16, приведены результаты Т2-анализа (как описано выше) с использованием титрования антителами для частиц, блокированных BSA, в сравнении с частицами, блокированными FSG. Представленные данные свидетельствуют о том, что между двумя способами протеинового блокирования не имеется или почти нет никакой разницы (см. фигуру 16). Тем не менее, оказалось, что BSA является более надежным блокатором.
Пример 3. Определение количества декстранового покрытия
Было установлено, что попытки увеличить плотность декстранового покрытия на частицах снижают функциональность полученных частиц в крови. При получении частиц, описываемых выше в примере 1, которые продемонстрировали почти эквивалентную эффективность в буфере/крови, использовали десятикратный избыток декстранового основания, исходяиз модели заполнения пространства, чтобы определить количество декстрана, требуемое для включения в эксперименты по покрытию. При попытке функционализации частиц с более высокой точностью, увеличение количества декстрана в покрытии при использовании от 1000-ного до 10000-ного избытка декстрана в экспериментах по покрытию приводило к появлению частиц, имеющих более толстое декстрановое покрытие, которые давали уменьшенный ответ в крови по сравнению с буфером. Авторы пришли к выводу, что умеренная плотность декстрана с протеиновым блокированием может быть желательна для получения покрытия частиц, которое хорошо работает в T2-анализах в присутствии образца крови (см. фигуры 17А и 17В).
Пример 4. Детекция небольшой молекулы аналита в образцах цельной крови
Приготовление буфера/аналита: 0,1% BSA, 0,1% Tween® в 1×PBS: готовили 10% по массе раствор Tween® 20. Вкратце, готовили Tween® в 1×PBS. 500 мл 0,2% раствора Tween® готовили добавлением 10 мл 10% раствора Tween® к 490 мл 1×PBS. 2% раствор BSA готовили в растворе 1×PBS по массе. 0,2% раствор раствора BSA готовили добавлением 50 мл 2% раствора BSA в PBS к 450 мл 1×PBS. Разведения объединяли, чтобы получить окончательный объем, равный 1 л, и конечную концентрацию буфера, равную 0,1% BSA, 0,1% Tween® в 1×PBS.
Аналит PEG-FITC-биотин: 100 мкл 0,5 ммоль раствора готовили из 1 ммоль Трис-HCl. 40 мкл PEG-FITC-биотина смешивали с 40 мкл 0,5 ммоль Трис-HCl и инкубировали в течение 15 минут при комнатной температуре. Через 15 минут 70 мкл раствора PEG-FITC-биотина в 0,5 ммоль Трис-HCl добавляли к 630 мкл 0,1% раствора Tween® для получения 100 мкМ основного раствора. Стоковый раствор энергично перемешивали на аппарате для встряхивания типа ʺВортексʺ. 200 мкл из 100 мкмоль раствора добавляли к 900 мкл 0,1% раствора Tween® для получения 20,000 нМ аналита. Готовили 10-кратные разведения до минимальной концентрации, равной 0,02 нМ.
Процедура:
25 мкл соответствующего аналита и 50 мкл из разведенного 1:5 лизированного матрикса крови пипетировали непосредственно в ЯМР-пробирку размером 5 мм. Образцы перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 4 секунд. Добавляли 25 мкл раствора первичного антитела против биотина (0,18 мкг/мл, разведенного в 0,1% Tween-20, 0,1% BSA, 1×PBS), после чего инкубировали при 37°C в течение 15 минут. Через 15 минут 50 мкл раствора (3,0 мкг/мл) вторичного антимышиного антитела (разведенного в 0,1% Tween, 0,1% BSA, 1×PBS) и 150 мкл 0,02 ммоль частиц Fe (2,7×108 частиц на одну пробирку) добавляли в ЯМР-пробирку. Затем образец перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 4 секунд и инкубировали в течение 5 минут при 37°C. Образец помещали в прибор Bruker Minispec в течение 10 минут под действие магнитного поля. Через 10 минут образец удаляли от магнита и инкубировали дополнительно в течение 5 минут. Образец снова перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 4 секунд и инкубировали дополнительно еще одну минуту. Значения Т2 были получены с использованием программы Bruker Minispec со следующими параметрами: Scans: I; Gain: 75; Tau: 0,25; Echo Train: 3500; Total Echo Train: 4500 и Dummy Echos: 2.
Пример 5: Синтез частиц, покрытых антителами
Покрытые аминодекстраном магнитные частицы, изготовленные, как описано в примере 1, могут быть дополнительно функционализированы антителами через связь SMCC-SATA (SMCC означает сукцинимидил 4-[N-малеимидометил]циклогексан-1-карбоксилат; SATA означает N-сукцинимидил-S-ацетилтиоацетат). Карбоксилированные магнитные частицы сначала подвергали конъюгированию с аминодекстраном (10 kDa), применяя химический подход с использованием EDC, как описано выше. Покрытые декстраном частицы дополнительно модифицировали избытком сульфо-SMCC, чтобы обеспечить малеимидную функциональную группу. Антитела модифицировали SATA-линкером, который, в первую очередь, связывается с аминогруппами на молекуле антитела. Образование SATA-связи контролируется, чтобы минимизировать чрезмерную функционализацию антитела, которая может привести к сшиванию частиц или снижению аффинности антитела. После деацетилирования SATA-линкер предоставляет тиоловую функциональную группу, которая может быть использована для непосредственного присоединения к функционализированным малеимидом частицам с образованием тиоэфирной связи. Число антител, конъюгированных с каждой частицей, может быть измерено с помощью тест-системы ВСА protein assay (Pierce). Были успешно использованы линкеры, которые выполняют функции, аналогичные SATA, такие как SPDP (N-сукцинимидил-3-[2-пиридилдитио]-пропионат).
Покрытые антителами магнитные частицы также могут быть получены с использованием химических подходов, описанных выше, но с прямым ковалентным связыванием исходной карбоксилированной частицы. В некоторых случаях может быть необходимо добавление дополнительного покрытия на поверхность частицы, такого как декстран, или блокирующего агента. Аналогичные химические подходы могут быть использованы с альтернативными аминодекстрану покрытиями, такими как PEG или BSA.
Пример 6. Анализ на креатинин
Вкратце, анализ включает в себя следующее: образец-мишень инкубируют в присутствии магнитной частицы, которая была покрыта креатинином, который связывается с поверхностью магнитных частиц. Покрытые креатинином магнитные частицы предназначены для агрегации в присутствии антитела к креатинину. Покрытые креатинином магнитные частицы и антитело к креатинину добавляют к жидкому образцу, содержащему креатинин, который конкурирует с магнитными частицами за антитело к креатинину. Таким образом, связывание креатинина с антителом блокирует агломерацию магнитных частиц, и низкие уровни креатинина отмечаются образованием агломератов. Данные агломераты изменяют скорости спин-спиновой релаксации образца при воздействии магнитного поля, и изменение времен релаксации Т2 (измерение изменения в сигнале магнитного резонанса от окружающих молекул воды) может непосредственно коррелировать с наличием и/или концентрацией аналита в образце-мишени.
Антитело к креатинину
При разработке программы создания антитела для креатинина была сконструирована модифицированная креатининовая молекула (COOH-креатинин) и конъюгирована с трансферрином для иммунизации мышей линии BALB-C и линии AJ.

Были получены тридцать четыре стабильных клона, продуцирующих антитела. Данные клоны происходили из клеток мышей либо линии BALB-C BALB-C (клетки селезенки) (n равно 7), либо линии AJ (n равно 17). Две генетически различные линии мышей были выбраны из-за известных генетических различий в их иммунных системах. Были разработаны критерии и процесс отбора для скрининга и выявления оптимального моноклонального антитела для применения в анализе. Процесс отбора антител включал в себя скрининг на связывание с BSA-креатинином с помощью способа твердофазного иммуноферментного анализа (enzyme linked immunosorbent assay (ELISA)), определение сродства/чувствительности/специфичности антитела конкурентными анализами ELISA с использованием свободного креатинина и потенциальных мешающих агентов, определение способности антитела конъюгироваться с магнитной частицей и определение функциональности в анализе, основанном на переключении магнитной Т2-релаксации.
Используя установленные критерии отбора антител, изложенные выше, семь моноклональных антител были выявлены и отобраны в качестве потенциальных кандидатов для применения в анализе.
Покрытые креатинином магнитные частицы
По существу монодисперсные карбоксилированные магнитные частицы промывали и ресуспендировали в 100 мкл связывающего буфера (50 ммоль MES, pH равен 4,75). Добавляли сульфо-NHS (55 мкмоль в 200 мкл MES-буфера) и смесь перемешивали на аппарате для встряхивания типа ʺВортексʺ. К смеси добавляли EDC (33,5 мкмоль в 200 мкл MES-буфера). Раствор быстро перемешивали на аппарате для встряхивания типа ʺВортексʺ и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ в течение 1 часа при комнатной температуре, давали частицам осесть и удаляли супернатант. К полученному твердому веществу добавляли 1 мл 1% BSA в PBS, смесь вновь перемешивали на аппарате для встряхивания типа ʺВортексʺ и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ в течение от 15 до 18 часов при комнатной температуре. Давали частицам осесть и удаляли супернатант.
Покрытые BSA частицы суспендировали в 0,5 мл раствора PBS-0,01% T20 (10 ммоль фосфатный буфер, pH 7,4, 150 ммоль NaCl, 0,01% Tween® 20). Непрореагировавшие карбоксильные группы подвергали воздействию метил-PEG4-амина (20 мкл 10% масс./масс. раствора в ДМСО) в качестве блокирующего агента. Смесь перемешивали на аппарате для встряхивания типа ʺВортексʺ и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ в течение 8 часов при комнатной температуре. Готовые покрытые BSA частицы многократно промывали 0,5 мл раствора PBS-0,01% T20.
COOH-креатинин (66 мкмоль), EDC (140 мкмоль) и NHS (260 мкмоль) объединяли с 300 мкл сухого ДМСО с образованием суспензии, которая становилась прозрачной, когда реакция достигала завершения. Покрытые BSA частицы суспендировали в 0,5 мл раствора PBS-0,01% T20 (pH равен 8) с последующим добавлением раствора активированного COOH-креатинина. Полученную смесь перемешивали на аппарате для встряхивания типа ʺВортексʺ и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ в течение 4 часов при комнатной температуре. Готовые частицы трижды промывали, сопровождая каждую промывку обработкой ультразвуком, используя соотношения 1:15 и 1:30 DMSO: PBS-0,01% T20 (масс./масс.). Частицы затем трижды промывали, сопровождая каждую промывку обработкой ультразвуком, с используя раствор PBS-0,01% T20. Частицы ресуспендировали в растворе PBS-T20 0,1% (pH равен 8) и добавляли 2 мг NHS-PEG 2K в 200 мкл раствора PBS-0,01% T20. Смесь помещали в смеситель с орбитальным вращением ʺend over end mixerʺ в течение от 12 до 20 часов при комнатной температуре. Частицы затем трижды промывали, сопровождая каждую промывку обработкой ультразвуком, используя раствор PBS-0,01% T20, чтобы получить креатинин-конъюгированные магнитные частицы с последовательными покрытием BSA, креатинином, PEG-ʺколпачкомʺ и блокированием.
Покрытые креатинином частицы ресуспендировали в буфере для анализа (100 ммоль глицина (pH равен 9,0), 150 ммоль NaCl, 1% BSA, 0,05% ProClin® и 0,05% Tween®).
Протокол анализа на креатинин выполняли, используя конъюгированные с креатинином частицы и растворимое антитело к креатинину, детекцией с использованием генерированного/завершенного Т2-сигнала. Схема конкурентного анализа на креатинин изображена на фигуре 7А.
Растворы магнитных частиц, антитело и жидкий образец разводили, когда указано, буфером, который включал в себя 100 ммоль Трис pH 7,0, 800 ммоль NaCl, 1% BSA, 0,1% Tween® и 0,05% ProClin®.
Покрытые креатинином магнитные частицы разбавляли до 0,4 ммоль Fe (5.48×109 частиц/мл) в буфере для анализа, тщательно перемешивали на аппарате для встряхивания типа ʺВортексʺ и оставляли для уравновешивания в течение 24 часов при температуре от 4 до 8°C.
Антикреатининовое мышиное моноклональное антитело (описанное выше) было использовано в качестве поливалентного связывающего агента для конъюгированных с креатинином магнитных частиц. Раствор антитела разбавляли до концентрации 0,8 мкг/мг в буфере для анализа и тщательно перемешивали на аппарате для встряхивания типа ʺВортексʺ.
Образцы и калибровочные образцы разводили, используя 1 часть образца и 3 части буфера для анализа. Верхний диапазон чувствительности анализа составлял около 4 мг/дл креатинина. Для образцов с ожидаемыми уровнями креатинина, превышающими 4 мг/дл, проводили дополнительное разбавление образцов, используя 1 часть исходного разведенного образца и 4 части буфера для анализа.
Предварительно разведенный образец, буфер для анализа, магнитные частицы и растворы антитела перемешивали каждый на аппарате для встряхивания типа ʺВортексʺ. 10 мкл каждого раствора добавляли в пробирку, и пробирку перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 5 секунд.
Пробирку затем подвергали в течение 12 минут с помощью агломерации, обусловленной магнитными взаимодействиями, инкубировали в течение 5 минут при 37°C, помещали в МР-ридер (MR Reader) (T2 МР, Reader with 2200 Fluke Temperature Controller, с программным обеспечением NDxIient software 0.9.14.1/ hardware Version 0.4.13 Build 2, Firmware Version 0.4.13 Build 0) для измерения скорости T2-релаксации образца, и скорость Т2-релаксации образца сравнивали со стандартной кривой (см. фигуру 8А), чтобы определить концентрацию креатинина в жидком образце.
Эффективность модифицированных антител к креатинину
Различные антитела к креатинину были протестированы в анализе, чтобы выяснить эффект антитела на агломерацию. Авторы заметили, что эффективность антител к креатинину изменялась при объединении данных антител с покрытыми креатинином магнитными частицами (см. фигуру 8В). Анализ способом электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) двух препаратов выявил значительное увеличение агрегации в препарате 1, что, как полагают, связано с повышением валентности связывания креатинина для данного антитела, которое агрегирует благодаря процессу его очистки. Для сравнения авторы мультимеризовали другое моноклональное антитело к креатинину (14H03) биотинилированием антитела и мультимеризацией антитела в присутствии стрептавидина. Мономерные, биотинилированные мономерные и мультимеризованные формы затем были протестированы с покрытыми креатинином магнитными частицами, чтобы оценить влияние повышения валентности на время Т2. Результаты приведены на фигуре 8С, показывая, что мультимеризованное антитело образует кластеры при гораздо более низких концентрациях, чем немультимеризованные антитела. Данное повышение валентности для кластеризации частиц также наблюдается при использовании IgM антител.
Пример 7. Покрытая антителом к креатинину магнитная частица
При использовании схемы альтернативного анализа анализ включает в себя следующее: образец-мишень инкубируется в присутствии (I) магнитной частицы, которая была покрыта антителами к креатинину; и (II) поливалентного связывающего агента, включающего в себя многочисленные конъюгаты креатинина. Магнитные частицы предназначены для агрегации в присутствии поливалентного связывающего агента, но агрегация ингибируется конкуренцией с креатинином в жидком образце. Таким образом, связывание креатинина с покрытой антителом частицей блокирует агломерацию магнитных частиц в присутствии поливалентного связывающего агента, так что низкие уровни креатинина соответствуют образованию агломератов. Данные агломераты изменяют скорости спин-спиновой релаксации образца при воздействии магнитного поля, и изменение времен Т2-релаксации (измерение изменения в сигнале магнитного резонанса от окружающих молекул воды) может быть непосредственно связано с наличием и/или концентрацией аналита в образце-мишени.
По существу монодисперсные карбоксилированные магнитные частицы промывали и ресуспендировали в 300 мкл связывающего буфера (50 ммоль MES, pH равен 4,75) и сульфо-NHS (46 мкмоль) и EDC (25 мкмоль) добавляли к частицам. Раствор быстро перемешивали на аппарате для встряхивания типа ʺВортексʺ и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ на 1 час при комнатной температуре. Активированные частицы промывали 1 мл PBS-0,01% T20 и ресуспендировали в 1 мл 10% масс./об. раствора амин-РЕО-амина в PBS-0,01% T20. Смесь перемешивали на аппарате для встряхивания типа ʺВортексʺ и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ на 2 часа при комнатной температуре, а затем трижды промывали раствором PBS-0,01% T20.
BSA может быть заменен амин-PEG-амином в качестве альтернативного химического агента. Покрытые BSA магнитные частицы получали, как описано в примере 6, в разделе, описывающем покрытые креатинином магнитные частицы.
Частицы ресуспендировали в 260 мкл раствора PBS-0,01% T20 и подвергали взаимодействию с 198 мкл сульфо-SMCC (5 мг/мл в PBS-0,01% T20). Раствор быстро перемешивали на аппарате для встряхивания типа ʺВортексʺ и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ на 1 час при комнатной температуре, а затем трижды промывали раствором PBS-0,01% T20 с 10 ммоль ЭДТА, чтобы получить покрытые SMCC частицы.
Антитело, меченое SATA, получали объединением SATA (30 нмоль в ДМСО) с антителом (2 нмоль в PBS, рН равен 7,4). Раствор помещали в смеситель с орбитальным вращением ʺend over end mixerʺ на 1 час при комнатной температуре. Заблокированные сульфгидрильные группы на антителе, меченом SATA, освобождали от защиты обработкой деацетилирующим буфером (0,5 М гидрохлорида гидроксиламина, pH 7,4, 10 ммоль фосфата, 150 ммоль хлорида натрия, 10 ммоль EDTA) в течение 1 часа и очищали перед использованием через обессоливающую колонку, используя PBS, содержащий 10 ммоль EDTA.
В качестве альтернативы SATA может быть использовано антитело, меченое SPDP. Антитело, меченое SPDP, получали добавлением SPDP (10 ммоль в ДМСО) к антителу (2 нмоль в PBS, pH 7,4). Раствор инкубировали в течение 1 часа при комнатной температуре и очищали через обессоливающую колонку. Дисульфидную связь SPDP на антителе, меченом SPDP, расщепляли в реакции с 5 ммоль меркаптоэтиламина и инкубировали в течение 10 минут при комнатной температуре. Меченое SPDP антитело с расщепленной дисульфидной связью очищали через обессоливающую колонку перед использованием.
Функционализированные SMCC частицы с PEG- или BSA-покрытием и деацетилированное антитело, модифицированное SATA, объединяли и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ на ночь при комнатной температуре, трижды промывали раствором PBS-0,05% Tween® 80 и ресуспендировали в растворе PBS-0,01% T20 с 10 ммоль EDTA. Добавляли блокирующий агент (m-PEG-SH 2K), раствор помещали в смеситель с орбитальным вращением ʺend over end mixerʺ на 2 часа, дважды промывали раствором PBS-0,05% Tween® 80 и ресуспендировали в растворе PBS-0,05% Tween® 80, 1% BSA и 0,05% ProClin® для получения покрытых антителами магнитных частиц.
Функционализированные SMCC частицы с BSA-покрытием и меченое SPDP антитело с расщепленной дисульфидной связью объединяли и помещали в смеситель с орбитальным вращением ʺend over end mixerʺ в на 2 часа при комнатной температуре, дважды промывали раствором PBS-0,01% Tween® 20, 10 ммоль ЭДТА и ресуспендировали в растворе PBS, 0,01% Т20 и 10 ммоль EDTA. Добавляли блокирующий агент, m-PEG-SH 2K (1 мкмоль), и раствор помещали в смеситель с орбитальным вращением ʺend over end mixerʺ на 2 часа. Добавляли второй блокирующий агент, N-этилмалеимид (5 мкмоль). Частицы перемешивали в течение 15 минут, дважды промывали раствором PBS-0,01% Tween® 20 и ресуспендировали в растворе 100 ммоль Трис, pH 9, 0,05% Tween® 80, 1% BSA и 0,05% ProClin® для получения покрытых антителами магнитных частиц. Описанная выше процедура может быть использована с антителами к креатинину, или антитела к креатинину могут быть соединены непосредственно с поверхностью карбоксилированных магнитных частиц через связь с EDC.
Связывающие креатинин поливалентные агенты
COOH-креатинин был подвергнут конъюгированию с соединениями 3-аминодекстрана (Invitrogen; молекулярная масса 10000, 40000 и 70000 с 6,5, 12 и 24 аминогруппами на молекулу декстрана, соответственно) и с BSA через связь с EDC. Готовые поливалентные связывающие агенты BSA-креатинин и аминодекстран-креатинин могут быть использованы в анализе конкурентного ингибирования, описанном выше. Были достигнуты степени замещения, составляющие от 2 до 30 остатков креатинина на один остаток декстрана. Один пример кривой ингибирования, обусловленной креатинином, приведен на фигуре 10. Используемый связывающий агент представляет собой декстран (40 kDa), содержащий около 10 остатков креатинина на одну молекулу декстрана.
Пример 8. Получение связывающих такролимус поливалентных агентов
Конъюгаты такролимуса были получены с использованием декстрана и BSA. FK-506 был подвергнут реакции обмена олефинов с использованием катализатора Граббса (Grubbs) второго поколения в присутствии 4-винилбензойной кислоты, как показано ниже на схеме.
1. Смесь неочищенных продуктов очищали нормально-фазовой хроматографией на силикагеле.
Схема 1

Конъюгаты декстрана
Были получены конъюгаты декстран-такролимус с использованием трех аминодекстранов с различными молекулярными массами, каждый с различным замещением аминокислотных групп.
2,78 мл раствора EDC (40 мг/мл гидрохлорида EDC) и 2,78 мл раствора сульфо-NHS (64 мг/мл сульфо-NHS) объединяли при перемешивании. К данной смеси добавляли 0,96 мл раствора кислого производного такролимуса (С21) (28,8 мг/мл в ДМСО) и содержимое перемешивали в течение 30 минут при комнатной температуре с целью образования активированного кислого производного такролимуса (активированный раствор такролимуса (Tac) с концентрацией 4,6 ммоль). Активированный такролимус использовали немедленно.
Различные аминодекстрановые полимеры растворяли в 100 ммоль натрий-фосфатного буфера (pH 8,0), чтобы сделать 9,5 мг/мл стокового раствора.
Раствор активированного Tac добавляли по каплям при перемешивании при комнатной температуре к стоковому раствору аминодекстрана в соотношениях, приведенных ниже в таблице. Каждую реакционную смесь энергично перемешивали в течение по меньшей мере 2 часов.
Готовые конъюгаты Tac-декстран очищали с помощью 5-стадийного последовательного диализа каждого продукта реакции (1-ая стадия - 15% (об./об.) водного ДМСО; 2-ая стадия - 10% (об./об.) водного метанола; от 3-й до 5-й стадии- вода высокой степени чистоты (high purity water); по меньшей мере 2 часа для каждой стадии, использование диализной мембраны 3,500 MWCO для аминодекстрана с молекулярной массой 10K и диализной мембраны 7К MWCO для аминодекстрана с молекулярной массой 40K и 70K).
После очистки каждый из образцов лиофилизировали и определяли сухой вес. Поливалентные связывающие агенты восстанавливали перед использованием.
После восстановления были оценены соотношения замещения такролимусом, основанные на поглощении при длине волны 254 нм.
Были проведены эксперименты с целью определения, декстран какого размера обеспечивает наиболее оптимальную агломерационную эффективность. Вкратце, 10 мкл раствора 10% метанола, 1% BSA в PBS-буфере pH 6,3, 20 мкл агента агломерации декстран-Tac с молекулярной массой 10K, 40K, 70K, при различных концентрациях, и 10 мкл покрытых антителами к такролимусу магнитных частиц с концентрацией Fe, равной 0,2 ммоль, добавляли в ПЦР-пробирку объемом 200 мкл (2,7×109 частиц на одну пробирку). Образец встряхивали с помощью прибора для перемешивания реагентов в планшетах при 2000 оборотах в минуту в течение 2 минут, предварительно нагревали в течение 15 минут при 37°C в инкубационном блоке, подвергали воздействию бокового и нижнего магнитов в течение 1 минуты для каждого, повторяли в течение 6 циклов, снова перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 2 минут при 2000 оборотах в минуту, инкубировали в течение 5 минут в инкубаторе при 37°C, содержащем предназначенный для ПЦР-пробирок термоблок, и значение Т2 считывалось на МР-ридере. Данные указывают на то, что повышение молекулярной массы/варьирующие степени замещения декстрана такролимусом (Tac) могут приводить к улучшению сигнала Т2 (см. фигуру 11). Кроме того, более высокая степень замещения также приводила к улучшению ответа (см. фигуру 12).
Конъюгаты BSA
Были получены конъюгаты BSA-такролимус с различными степенями замещения такролимусом.
34,5 мкл раствора NHS (66,664 мг/мл в ацетонитриле) и 552 мкл раствора EDC (6,481 мг/мл в 50 ммоль MES pH 4,7) объединяли при перемешивании. 515,2 мкл данной смеси EDC-NHS добавляли по каплям к 220,8 мкл раствора кислого производного такролимуса (C21) (33.33 мг/мл в ацетонитриле) и содержимое перемешивали в течение 1 часа при комнатной температуре с образованием активированного кислого производного такролимуса. Активированный такролимус использовали немедленно.
BSA растворяли в фосфатно-солевом буферном растворе и ацетонитриле с образованием раствора, содержащего 5 мг/мл BSA в 40% ацетонитриле.
Раствор активированного Tac добавляли по каплям при перемешивании при комнатной температуре в раствор BSA в соотношениях, приведенных ниже в таблице. Каждую реакционную смесь энергично перемешивали в течение по меньшей мере 2 часов.
Готовые конъюгаты Tac-BSA очищали с использованием эксклюзионной колонки PD10, предварительно уравновешенной 40% ацетонитрилом. Элюент собирали во фракции объемом 1 мл и контролировали поглощение при 280 нм для определения фракций, содержащих BSA.
Содержащие BSA фракции объединяли и удаляли ацетонитрил в вакууме.
Конъюгаты Тас-BSA были оценены на способность образовывать кластеры с помощью титрования, аналогичного тому, которое использовали для конъюгатов декстран-такролимус. Было обнаружено, что эффективность кластеризации зависит от соотношения, характеризующего степень замещения Tac (см. фигуру 13).
Пример 9. Протокол конкурентного анализа на такролимус (конструкция ʺантитело на частицеʺ)
Был разработан анализ на такролимус с использованием частиц, конъюгированных с антителом против такролимуса, и поливалентного связывающего агента BSA-такролимус, с использованием МР-ридера для детекции (см. пример 6). Данный анализ был разработан для тестирования образцов цельной крови, которые подвергались экстрагированию с тем, чтобы отделить такролимус от красных кровяных клеток и связывающих белков (экстракция гидрофобного аналита из образца может быть достигнута, например, с помощью методики, описанной в патенте США №5,1358,75). Схема конкурентного анализа на такролимус представлена на фигуре 7В.
Растворы магнитных частиц и поливалентного связывающего агента разбавляли, когда указано, буфером, который включал в себя 100 ммоль глицина pH 9, 0,05% Tween® 80, 1% BSA, 150 ммоль NaCl, 0,1% CHAPS.
Исходную частицу с функциональной группой COOH модифицировали последовательно аминированным покрытием (PEG или BSA), ковалентным присоединением антитела, PEG-колпачком и блокированием PEG/белок (как описано в примерах выше). Покрытые антителом магнитные частицы разбавляли до концентрации Fe, равной 0,4 ммоль (5,48×109 частиц/мл), в буфере для анализа и тщательно перемешивали на аппарате для встряхивания типа ʺВортексʺ.
Поливалентный связывающий агент образовывали из COOH-модифицированного такролимуса, ковалентно конъюгированного с BSA (как описано в примере 8).
Поливалентный связывающий агент разбавляли до концентрации, равной 0,02 мкг/мл, в буфере для анализа и тщательно перемешивали на аппарате для встряхивания типа ʺВортексʺ.
Раствор, содержащий экстрагированный образец (10 мкл), и раствор с магнитными частицами (10 мкл) объединяли и перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение пяти секунд и инкубировали при 37°C в течение 15 минут. К данной смеси добавляли 20 мкл поливалентного связывающего агента, и полученную смесь перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение пяти секунд и инкубировали при 37°C в течение 5 минут.
Несколько образцов были получено, как описано выше. Все образцы подвергали агломерации, обусловленной магнитными взаимодействиями, в течение 1 минуты. Все образцы затем помещали в лоток, удаляемый из магнитного поля. Каждый образец перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение не менее пяти секунд и возвращали в лоток. Все образцы вновь подвергали обусловленной магнитными взаимодействиями агломерации в течение 1 минуты, с последующим перемешиванием на аппарате для встряхивания типа ʺВортексʺ. Данный процесс повторяли двенадцать раз для каждого образца.
Образец инкубировали в течение 5 минут при 37°C, помещали в МР-ридер (см. пример 6) для измерения скорости Т2-релаксации образца и скорость Т2-релаксации образца сравнивали со стандартной кривой (см. фигуру 9) для определения концентрации трактолимуса в жидком образце.
Пример 10. Анализ на Candida
В анализе, использованном для определения Candida, две популяции магнитных частиц использовали для детектирования каждого вида Candida. В первой популяции видоспецифический олигонуклеотидный зонд захвата является конъюгированным с магнитными частицами. Во второй популяции дополнительный видоспецифический олигонуклеотидный зонд захвата является конъюгированным с магнитными частицами. При гибридизации две частицы будут гибридизоваться в пределах смысловой нити нуклеиновой кислоты-мишени с двумя различными видоспецифическими последовательностями, разделенными приблизительно от 10 до 100 нуклеотидами. (Альтернативно, два олигонуклеотида захвата могут быть конъюгированы с одним пулом частиц, в результате чего отдельные частицы будут иметь специфичность как для первой, так и для второй областей). Покрытые олигонуклеотидами магнитные частицы предназначены для агрегирования в присутствии молекул нуклеиновых кислот из определенного вида Candida. Таким образом, в отличие от анализов ингибирования, используемых для креатинина и такролимуса, особенностью анализа на Candida является увеличение агломерации в присутствии молекул-мишеней нуклеиновой кислоты Candida. Схема опосредованного гибридизацией агломерационного теста приведена на фигуре 7С. В анализах на Candida используются карбоксилированные магнитные частицы. Магнитные частицы были конъюгированы с олигонуклеотидными зондами захвата для создания конъюгатов олигонуклеотидов с частицами. Для каждого ампликона-мишени были получены две популяции конъюгатов олигонуклеотидов с частицами. Конъюгаты олигонуклеотидов с частицами были получены с использованием стандартного химического подхода посредством EDC-связывания между аминированными олигонуклеотидами и карбоксилированными частицами, или, необязательно, связыванием модифицированных биотин-TEG олигонуклеотидов с частицами, несущими стрептавидин. Реакции связывания, как правило, проводили при концентрации частиц, составляющей 1% твердого вещества.
Плотности функциональных олигонуклеотидов после конъюгации измерялись, гибридизуя Су5-меченные комплементы с частицами, промывая частицы три раза, чтобы удалить негибридизованные олигонуклеотиды; и элюируя нагреванием до 95°C в течение 5 минут. Количество Су5-меченного олигонуклеотида определяли количественно с помощью флуоресцентной спектроскопии.
Реакции связывания проводили при 37°C в течение ночи при непрерывном перемешивании, используя качалку или роллер. Готовые конъюгаты частиц дважды промывали водой, очищенной системой Millipore, в объеме реакционной смеси; дважды 0,1 М раствором имидазола (pH 6,0) в объеме реакционной смеси при 37°C в течение 5 минут; три раза 0,1 М раствором бикарбоната натрия в объеме реакционной смеси при температуре 37°C в течение 5 минут; затем дважды 0,1 М раствором бикарбоната натрия в объеме реакционной смеси при температуре 65°C в течение 30 минут. Готовые конъюгаты частиц хранились в виде 1% твердого вещества в ТЕ (pH 8,0), 0,1% Tween® 20.
Панель детектируемых видов Candida включает в себя С. albicans, С. glabrata, С. krusei, С. tropicalis и С. parapsilosis. Последовательности амплифицируются с использованием универсальных праймеров, узнающих последовательности с высоким уровнем консервативности в пределах рода Candida. Были разработаны олигонуклеотиды захвата для распознавания и гибридизации со видоспецифическими областями внутри ампликона.
Аликвоту образца крови сначала подвергали лизису следующим образом:
(i) Образец цельной крови смешивали с избыточным (1,25-кратным, 1,5-кратным или 2-кратным) объемом гипотонического лизисного раствора хлорида аммония. Добавление лизисного раствора разрушает все RBC (red blood cells, красные клетки крови), но не разрушает WBC (white blood cells, белые клетки крови), клетки дрожжей или бактерий. Клеточный материал центрифугировали при 9000 оборотах в минуту в течение 5 минут и удаляли лизат. К неповрежденным клеткам добавляли 100 мкл ТЕ (Трис-ЭДТА, pH равен 8) до конечного объема, равного около 100 мкл; и
(ii) к приблизительно 100 мкл образца добавляли 120 мг шариков диаметром 0,5 мм.
Образец перемешивали в течение 3 минут при около 3000 оборотах в минуту, тем самым образуя лизат.
Аликвоту, составляющую около 50 мкл лизата, затем подвергали ПЦР-амплификации добавлением лизата к реакционной смеси (master mix) ПЦР, включающей в себя нуклеотиды; буфер (5 ммоль (NH4)SO4, 3,5 ммоль MgCl2, 6% глицерина, 60 ммоль трицина, рН равен 8,7) при 25°С; праймеры (прямой праймер в 4-кратном избытке (300 ммоль прямого праймера; 0,75 ммоль обратного праймера), что позволяет получать асимметричные одиночные нити в конечном продукте); и термостабильную полимеразу (HemoKIenTaq (New England Biolabs)). После первоначальной инкубации при 95°C в течение 3 минут смесь подвергали циклам ПЦР: отжиг при 62°C; удлинение при 68°C; 95°С, в течение 40 циклов. Примечание: существует различие в температурах отжига и удлинения, составляющее 6°C; отжиг и удлинение могут быть объединены в одну стадию, чтобы уменьшить общее время оборота амплификации.
Полученный с помощью PCR ампликон, теперь готовый для детектирования, объединяется с двумя популяциями частиц в ʺсэндвичʺ-анализе.
ПЦР-праймеры и зонды захвата, которые могут быть использованы в анализе на Candida, приведены ниже в таблице 6.
Необязательно анализ проводится в присутствии контрольной последовательности, наряду с магнитными частицами, покрытыми зондами, для подтверждения наличия контрольной последовательности.
Пример 11. Неагломерационные способы
Данный способ был продемонстрирован с использованием обработанной аминосиланом никелевой металлической пены с покрытыми антикреатининовыми антителами порами диаметром 400 мкм, которые, как показано, специфически связывают дериватизированные креатинином магнитные частицы. Квадратный кусок никелевой металлической пены со стороной 1 см (Recemat RCM-Ni-4753.016) промывали, инкубируя при комнатной температуре в течение 1 часа в 2М HCL, тщательно промывали в деионизированной воде и сушили при 100°C в течение 2 часов. Никелевую пену затем обрабатывали 2% 3-аминопропилтриэтоксисиланом в ацетоне при комнатной температуре в течение ночи. Никелевую металлическую пену затем интенсивно промывали деионизированной водой и сушили в течение 2 часов при температуре 100°C. Обработанную аминосиланом никелевую металлическую пену обрабатывали 2% глютаровым альдегидом в воде в течение 2 часов при комнатной температуре и интенсивно промывали деионизированной водой. Далее, металлическую пену инкубировали с 100 мкг/мл антикреатининового антитела (14Н03) (см. пример 6) в PBS в течение ночи, интенсивно промывали PBS и обрабатывали Surmodics Stabilguard для стабилизации и блокирования неспецифического связывания. Квадратные куски дериватизированной металлической пены со стороной 2 мм осторожно нарезали, используя новое лезвие бритвы, чтобы не повредить структуру пены. Кусок дериватизированной металлической пены помещали в ПЦР-пробирку в 20 мкл буфере для анализа (100 ммоль глицина (pH равен 9,0), 150 ммоль NaCl, 1% BSA, 0,05% ProClin® и 0,05% Tween®). Двадцать микролитров частиц, служащих контролем (которые не должны связываться с металлической пеной АВХ1-11), при концентрации Fe, равной 0.2 ммоль, добавляли в пробирку, чтобы довести конечный объем до 40 мкл и конечную концентрацию частиц до 0.1 ммоль Fe (от 1×106 до 1×108 частиц/пробирка). Готовили также отдельную ПЦР-пробирку, содержащую столько же частиц и буфера, но без металлической пены. ПЦР-пробирку, содержащую дериватизированную металлическую пену и контрольные частицы, подвергали с обусловленной магнитными взаимодействиями агломерации в течение одной минуты, затем к образцу прикасались ручным размагничивателем и подвергали обусловленной магнитными взаимодействиями агломерации в течение еще одной минуты, после вынимания образца из магнитного поля к нему прикасались ручным размагничивателем и затем подвергали обусловленной магнитными взаимодействиями агломерации в течение еще одной минуты и перемешивали на аппарате для встряхивания типа ʺВортексʺ (три одноминутных магнитных воздействия). Тридцать мкл образца отбирали из обеих ПЦР-пробирок, нагревали до 37°C в нагревателе грантблока в течение 5 минут и считывали значение Т2 с помощью МР-ридера (см. пример 6). Значение Т2 для образца без пены составляло 39,2, а значение Т2 для образцов из ПЦР-пробирки, содержащей пену, составляло 45,1, что свидетельствует о незначительной убыли количества частиц, обусловленной NSB. Дериватизированную металлическую пену размагничивали, перемешивали на аппарате для встряхивания типа ʺВортексʺ и промывали в буфере для анализа. Ее помещали в новую ПЦР-пробирку с 20 мкл буфера для анализа и 20 мкл частиц AACr2-3-4, дериватизированных креатинином с конечной концентрацией частиц, равной 0.1 ммоль Fe. Дубликат ПЦР-пробирки, но без дериватизированной металлической пены, приготовлялся так же, как и в контрольном эксперименте. ПЦР-пробирку с металлической пеной подвергали дважды точно такому же циклу процедур обусловленной магнитными взаимодействиями агломерации, что и в контрольном эксперименте (3 одноминутных воздействия с размагничиванием после каждой экспозиции и окончательное перемешивание на аппарате для встряхивания типа ʺВортексʺ), Тридцать мкл образцов отбирали из обеих ПЦР-пробирок, нагревали до 37°C в течение 5 минут и считывали значение Т2 на МР-ридере. Значение Т2 для образца из ПЦР-пробирки с дериватизированной металлической пеной составляло 41,5, а значение Т2 для образца из ПЦР-пробирки с металлической пеной, дериватизированной антикреатининовым антителом, составляло 324,2, что свидетельствует о специфическом связывании/убыли количества соответствующих дериватизированных креатинином магнитных частиц из водного объема, анализируемого МР-ридером.
Пример 12. Детекция единичных нуклеотидных полиморфизмов
Существуют несколько способов, с помощью которых измерениями Т2 можно детектировать единичные нуклеотидные полиморфизмы.
Самое простое применение предполагает выявление несоответствий с помощью термофильной ДНК-лигазы (Tth лигазы). Данный анализ требует лизиса материала образца с последующей деградацией ДНК в результате гидродинамического сдвига (DNA shearing). Адаптеры могут быть лигированы на ДНК, деградированную в результате гидродинамических разрывов (sheared DNA), если необходима универсальная амплификация геномной ДНК. SNP можно детектировать с помощью суперпарамагнитной частицы, связывающей зонды захвата, которые фланкируют SNP, так что 5'-конец аминированного на 3'-конце зонда захвата будет полностью комплементарным к одному определенному аллелю SNP, и последующая обработка Tth лигазой приведет к лигированию двух связанных частицами зондов захвата. Поэтому благодаря лигированию частицы зафиксируются в агломерированном состоянии. Повторные циклы плавления и гибридизации могут обеспечивать амплификацию сигнала в тех случаях, когда амплификация геномной ДНК не желательна из-за риска неравномерной амплификации. Тот же самый зонд захвата, аминированный на 5'-конце, может быть использован в любом случае, в то время как зонд, аминированный на З'-конце, может быть создан для получения 4 различных пулов (A, G, C или T) на самом краю 5'-конца. Детекция потребует разделения образца на 4 пула, чтобы определить, какой(ие) нуклеотид(ы) присутствовал(и) в полиморфном сайте у данного определенного индивидуума. Например, сильный сдвиг значения Т2 в пробирке детектирования G-нуклеотида будет означать только, что индивидуум был гомозиготным по G-нуклеотиду в данном определенном месте последовательности, в то время как сдвиги значений в пробирках детектирования G-нуклеотида и A-нуклеотида будут означать, что индивидуум является гетерозиготным по G-нуклеотиду и A-нуклеотиду в данном определенном SNP-сайте. Преимущество данного способа заключается в том, что Tth полимераза, как было продемонстрировано, обладает превосходной возможностью распознавания, распознавая даже несоответствия G-T (наиболее допустимое несоответствие, а также наиболее распространенное) при соотношении 1:200 раз по сравнению с правильным комплементом. В то время как все реакции детекции с помощью лигазы, а также все олигонуклеотидные анализы с использованием лигазы, которые были использованы в прошлом для определения нуклеотидных последовательностей в известных полиморфных сайтах, требовали проведения амплификации либо до лигирования, либо после лигирования, в данном конкретном примере сигнал может быть усилен с помощью индуцированного лигированием увеличения в размере полученного агломерированного комплекса частиц и обусловленного этим увеличением измеренных времен релаксации (Т2).
Модификация данной процедуры может включать в себя гибридизацию связанного с частицей зонда захвата, фланкирующего гибридизацию биотинилированного зонда. Когда посредством гибридизации связанного с частицей зонда образуется полностью комплементарный дуплекс, лигаза сможет ковалентно связать биотиновый зонд с магнитной частицей. Заново повторяемые циклы тепловой денатурации с последующими отжигом и лигированием должны увеличить долю длинных биотинилированных олигонуклеотидов на поверхности магнитных частиц. Для удаления свободного зонда проводится промывка, после чего добавляется вторая суперпарамагнитная частица, меченная стрептавидином. Агломерация произойдет, только если биотинилированные зонды были лигированы на поверхности первой частицы.
Также может быть использован подход дискриминации гибридизации. В данном примере генерируют аминированные олигонуклеотидные комплементы, находящиеся рядом с известными SNP. Данные аминированные олигонуклеотиды будут использоваться для дериватизации поверхности 96-луночного планшета с реакцией детектирования одного SNP, проводимой в одной лунке. Геномную ДНК затем фрагментируют способом гидродинамических разрывов (sheared), лигируют с адаптерами и асимметрично амплифицируют. Данную амплифицированную геномную ДНК, так же как и короткий биотинилированный SNP-детектирующий зонд, наносят на массив. Амплифицированная геномная ДНК будет гибридизоваться со связанным с лункой зондом захвата, и SNP-детектирующий зонд будет затем связываться с привязанной геномной ДНК. Для удаления несвязанного SNP-детектирующего зонда проводится промывка. В каждую лунку будет затем добавляться магнитная частица, покрытая стрептавидином (SA). Для удаления частиц, не покрытых SA, снова потребуется промывка. Детекция Т2 будет проводиться непосредственно в лунках путем добавления биотинилированных суперпарамагнитных частиц для получения привязанных к поверхности агломерированных частиц, или магнитные частицы, покрытые SA, могут быть элюированы из каждой лунки на массиве и проинкубированы в условиях постановки реакций детектирования с биотинилированными магнитными частицами.
Наконец, реакция удлинения праймера может быть связана с детекцией Т2, с тем чтобы различить, какой нуклеотид присутствует в полиморфном сайте. В данном анализе будет использоваться пул дидеоксинуклеотидов с одним нуклеотидом в пуле, у которого имеется биотин (то есть, ddA, ddT, ddбиотин-C и/или ddG). Будет использоваться суперпарамагнитная частица, несущая зонд захвата, последнее основание которого при гибридизации находится рядом с SNP.
Фрагменты геномной ДНК, полученные гидродинамическим разрывом, будут разделены и будут инкубироваться в условиях постановки четырех отдельных реакций удлинения праймера. Экзо-ДНК-полимераза будет катализировать добавление дидезоксинуклеотида, комплементарного к нуклеотиду, присутствующему в SNP. Данная реакция снова может быть циклической, если для обеспечения того, чтобы большая часть зондов захвата на частице удлинялась, используется термофильная полимераза. После магнитной сепарации с последующим промыванием частиц будет проводиться инкубация с суперпарамагнитными частицами, покрытыми стрептавидином. Будет происходить кластеризация, степень которой пропорциональна длине биотинилированного зонда захвата на поверхности первой частицы. Если два пула дидеоксинуклеотидов дают увеличение значения сигнала Т2 (т.е. облегчают агломерацию частиц), то пациент является гетерозиготным. Если только один пул дал увеличение значения сигнала Т2, то пациент является гомозиготным.
В последнем способе выявления полиморфизмов SNP используются аллель-специфические ПЦР-праймеры, в которых 3'-конец праймера включает в себя SNP. Поскольку используются жесткие условия амплификации, если последовательность-мишень не является полностью комплементарной праймеру, ПЦР-амплификация не удастся, давая либо мало продукта либо вообще не давая продукта. В общем, будет разработано множество прямых праймеров (полностью комплементарных к каждому аллелю) вместе с одним обратным праймером. Ампликон будет детектироваться с помощью двух или более зондов захвата, связанных с суперпарамагнитными частицами, чтобы вызвать основанные на гибридизации реакции агломерации. Одно из преимуществ такого подхода заключается в том, что в нем используются результаты некоторых уже проведенных работ по определению Т2-сигнала в неочищенных образцах с использованием ПЦР, и настоящий подход влечет за собой только необходимость разработки праймеров, чтобы охватить известные SNP. Недостатком такого подхода является то, что с ним невозможно определить de novo местонахождения SNP.
Дополнительный способ, который может быть использован, основывается просто на возможностях различения способности частиц «сшиваться» благодаря гибридизации с короткой нуклеиновой кислотой-мишенью. Было показано, что несоответствия в парах оснований олигонуклеотидов резко влияют на степень агломерации частиц и измеряемый Т2-сигнал за счет снижения эффективностей гибридизации, обусловленных наличием несоответствия одного основания.
Пример 13. Панель диагностики Candida
Тестирование проводилось в течение 45 дней. Эталонные штаммы С. albicans и С. krusei, a также клинические изоляты С. albicans культивировали и поддерживали на протяжении всего исследования.
Материалы:
Наночастицы, содержащие С. albicans и С. krusei: для каждого вида были получены две популяции частиц, причем частицы были ковалентно конъюгированы с олигонуклеотидами, комплементарными к видоспецифическим последовательностям внутри области ITS2 (см. пример 10). Частицы хранили при температуре от 4 до 8°C в растворе ТЕ (pH 8), 0,1% Tween и разбавляли до концентрации Fe, равной 0,097 ммоль, в буфере для гибридизации ДНК непосредственно перед употреблением.
Штаммы Candida: панели проводились с использованием эталонного штамма С. albicans MYA 2876 (GenBank FN652297.1), эталонного штамма С. krusei 24210 (GenBank AY939808.1) и клинических изолятов С. albicans. Пять использованных изолятов С. albicans культивировали на среде YPD при комнатной температуре. Отдельные колонии отбирали, трижды промывали PBS и затем проводили количественное определение с помощью гемацитометра для получения образцов для инфицирования цельной крови. Образцы клеток хранили в виде замороженных запасов в глицерине при -80°C.
Цельная кровь человека: Цельную кровь собирали от здоровых доноров и обрабатывали К2ЭДТА и инфицировали промытыми, последовательно разбавленными клетками Candida в концентрациях, охватывающих диапазон от 1Е5 до 5 клеток/мл. Образцы инфицирующих клеток, приготовленные в свежей крови, хранили при -20°C.
Буфер для лизиса эритроцитов: гипотонический буфера для лизиса, содержащий 10 ммоль бикарбоната калия, 155 ммоль хлорида аммония и 0,1 ммоль ЭДТА, стерилизовали через фильтр и хранили до использования при комнатной температуре. Альтернативно, может быть использован агент лизиса эритроцитов, например, неионный детергент (например, смесь Triton-X100 и Igepal или Brij-8).
Реакционная смесь (master mix) ПЦР: готовили реакционную смесь, содержащую буфер, нуклеотиды, праймеры и фермент (20 мкл 5-кратного реакционного буфера, 22 мкл воды, 2 мкл 10 ммоль дНТФ, 3 мкл 10 мкмоль прямого праймера, 3 мкл 2,5 мкмоль обратного праймера, 10 мкл HemoKlenTaq и 40 мкл лизата, обработанного шариками) и хранили при комнатной температуре.
Реакционная смесь для гибридизации частиц: непосредственно перед применением готовили реакционную смесь, состоящую из конъюгатов наночастиц, солей, сурфактанта и формамида (78 мкл формамида, 78 мкл 20-кратного SSC, 88,3 мкл однократного ТЕ с 0,1% Tween, 7,5 мкл СР 1-3' и 8,2 мкл СР 3-5').
Стеклянные шарики (0,5 ммоль), используемые при механическом лизисе клеток Candida, промывали в кислоте, автоклавировали и хранили при комнатной температуре до использования.
Протокол ПЦР:
Общая схема рабочего процесса детекции патогена (например, Candida) в образце цельной крови представлена на фигуре 20. Протокол представлял собой следующее: (i) давали прогреться инфицированным образцам цельной крови человека до комнатной температуры (около 30 минут); (ii) 1 мл буфера для лизиса эритроциров аликвотировали в каждую пробирку; (iii) каждую пробирку центрифугировали при 9000 g в течение 5 минут и отбрасывали лизированную кровь; (iv) 100 мкл профильтрованного через фильтр с порами диаметром 0,2 микрон ТЕ аликвотировали в каждую пробирку; (v) 120 мг промытых кислотой стеклянных шариков добавляли в каждую пробирку; (vi), каждую пробирку перемешивали на аппарате для встряхивания типа ʺВортексʺ в течение 3 минут на максимальной скорости (около 3000 оборотов в минуту); (vii) 50 мкл лизированного образца аликвотировали в пробирку, содержащую реакционную смесь PCR; (viii) проводили цикл реакций ПЦР следующим образом: (начальная денатурация: 95°C, 3 минуты; 30-40 циклов при 95°C, 20 секунд; 30-40 циклов при 62°C, 30 секунд; 30-40 циклов при 68°C, 20 секунд; последнее удлинение: 68°C, 10 минут, остановка реакции при: 4°C); (ix) каждый из образцов быстро центрифугировали после термоциклирования с образованием осадка свернувшейся крови; (х) 5 мкл реакционной смеси для частиц аликвотировали в пробирку на каждые 10 мкл амплифицированного образца; (xi) полученную смесь хорошо перемешивали и образец денатурировали при 95°C в течение 3 минут; (xii) образец гибридизовали при 60°C в течение 1 часа при осторожном перемешивании; (xiii) образец разбавляли до 150 мкл буфером разбавления частиц и доводили до 37°C в термоблоке в течение 1 минуты; и (xiv) измеряли величину сигнала Т2 образца с помощью МР-ридера, считывающего значения Т2.
Результаты тестов
Воспроизводимость детекции клеток Candida albicans в цельной крови человека: Для определения воспроизводимости измерения T2 в инфицированной клетками С. albicans цельной крови человека авторы провели восьмидневное исследование, в котором инфицированный и амплифицированный образец одного и того же донора гибридизовали с суперпарамагнитными частицами (n равно 3) каждый день и фиксировали получаемые значения Т2.
Точность выполнения одного измерения представлена на фигуре 19А и, в общем, является высокой, с CV (коэффициент вариации, coefficient of variation) всех измеряемых величин, составляющими менее 12%. Данные по воспроизводимости, наблюдаемой на протяжении восьми дней, представлены на фигуре 19В, со значениями CV, составляющими менее 10% во всем диапазоне концентраций клеток Candida и 6% для отрицательного контроля. Двухвыборочный двусторонний t-тест Стьюдента применяли для определения того, являлось ли значимым различие между средними значениями, полученными для крови, (квази-)инфицированной клетками Candida, содержащей 10 клеток/мл, и для крови здоровых доноров. Полученное значение Р составляло менее 0,0001, подтверждая статистическую значимость данных различий.
Влияние матрикса образца на детекцию Candida albicans и Candida krusei и воспроизводимость: Здоровую кровь от 6 доноров инфицировали клетками С. albicans или С. krusei в различных концентрациях (от 1Е5 клеток/мл до 0 клеток/мл). С кровью, инфицированной клетками Candida albicans, было проведено шестнадцать независимых экспериментов. Каждый эксперимент состоял из ПЦР-амплификации крови, инфицированной клетками в концентрациях от 1Е5 до 0 клеток/мл, причем продукты каждой реакции амплификации подвергали трем одинаковым экспериментам по измерению значения Т2; таким образом, для С. albicans было зафиксировано в общей сложности 48 значений Т2 для каждой испытанной концентрации (см. фигуру 21А). При самой низкой испытываемой концентрации (10 клеток/мл) авторам не удалось выявить клетки Candida albicans в 37% случаев (6 из 16 экспериментов), однако, при концентрации, равной 100 клеток/мл, клетки Candida albicans были определены в 100% случаев. Это говорит о том, что LOD (порог детектирования) для С. albicans составляет более 10 клеток/мл, но менее 100 клеток/мл. Для более точного определения величины LOD будут поставлены опыты со значениями клеточных концентраций в диапазоне от 10 CFU (колониеобразующие единицы (colony-forming unit)) до 100 клеток/мл; однако, авторы не ожидают обнаружения сколь-либо значительного влияния матрикса на эффективность теста. Об этом свидетельствуют CV Т2-измерений, которые представляют собой следующие величины: 12,6% при концентрации, равной 1Е5 клеток/мл, в образцах крови от 6 доноров, 13,7% при концентрации, равной 1Е4 клеток/мл, 15% при концентрации, равной 1Е3 клеток/мл, 18% при концентрации, равной 1Е2 клеток/мл, и 6% при концентрации, равной 0 клеток/мл. Это говорит о том, что данный анализ обеспечивает надежное детектирование при концентрациях клеток С. albicans, превышающих или равных 100 клеток/мл, без серьезного ингибирования эффективности, обусловленного образцами донорской крови.
Такой же эксперимент был проведен с использованием эталонного штамма С. krusei. В данном случае было проведено 7 независимых экспериментов, поскольку остальная инфицированная кровь была зарезервирована для анализа крови на посев. Ни в одном из опытов авторы не смогли выявить клетки в концентрации, равной 10 клеток/мл, но во всех опытах детектировали клетки в концентрации, равной 100 клеток/мл. Это говорит о том, что величина LOD лежит в интервале от 10 до 100 клеток/мл. И в этом случае необходимо провести титрование с использованием концентраций клеток в диапазоне от 100 до 10 клеток/мл, чтобы точнее определить величину LOD. Значения CV измерений во всем диапазоне концентраций составляли: 10,5% при концентрации, равной 1Е5, 9% при концентрации, равной 1Е4, 12% при концентрации, равной 1Е3, 20% при концентрации, равной 1Е2, 6,4% при концентрации, равной 10 клеток/мл, и 5,2% при концентрации, равной 0 клеток/мл. Данные результаты представлены на фигуре 21В.
Предварительное определение предела детекции: Пять клинических изолятов клеток Candida albicans в концентрациях 1Е4, 1Е3, 5Е2, 1Е2, 50, 10, 5 и 0 клеток/мл вносили в 6 различных образцов донорской крови. Каждым изолятом инфицировали как минимум два различных образца донорской крови. Реакции амплификации детектировали с помощью Т2-измерений с результатами, приведенными в виде графика на фигуре 22. Важно отметить, что никакие из полученных данных не исключались из рассмотрения по какой-либо причине в рамках данного исследования. Авторы не выявили клетки С. albicans в 50% случаев при концентрации клеток, равной 5 клеток/мл или 10 клеток/мл; однако, при концентрации клеток, равной 50 клеток/мл, клетки С. albicans были выявлены в 95% случаев. Такие данные были получены с использованием различных клинических изолятов; каждый изолят содержит различное число повторов рДНК, и число данных повторов могло варьировать в 4 раза от штамма к штамму (т.е. от около 50 единиц до 200 единиц). Поскольку количество введенных копий-мишеней может незначительно изменяться от штамма к штамму и, безусловно, от вида к виду, то могут наблюдаться несущественные различия в абсолютных значениях Т2 при очень низких содержаниях клеток (то есть 10 клеток/мл). Авторы отмечают, что на основании весьма предварительных исследований настоящие данные позволяют предположить в качестве пороговой концентрации 10 клеток/мл; однако, окончательное определение порогового значения не может быть проведено в отсутствие окончательных составов реагентов, а также прибора/картриджа. Это позволяет предположить, что определение значения интервала от С5 до С95 будет трудным, поскольку при концентрации, равной 10 клеток/мл, в каждой реакционной смеси содержится только 4 клетки. Титрование при количестве клеток, меньшем, чем это, становится сложным, имея такой начальный объем крови. Использование распределения Пуассона для расчета числа реакционных смесей, которые содержат 0 клеток при концентрации, равной 10 клеток/мл, указывает на то, что только 2% реакционных смесей не будет содержать клеток; однако, при концентрации, равной 5 клеток/мл, 13% реакционных смесей не будет содержать клеток Candida, и при концентрации, равной 2 клеток/мл, около 37% реакционных смесей не будет содержать клеток Candida. Авторы отмечают, что повышению чувствительности анализа до 95% при концентрации, равной 10 клеток/мл, могло бы способствовать увеличение количества лизата, добавляемого в ПЦР-реакционные смеси, от 40 мкл до 50 мкл и увеличение количества крови пациента от 400 мкл до 800 мкл/реакционную смесь.
Предварительное определение чувствительности/специфичности: Изначально количественное определение начального количества колониеобразующих единиц Candida было проведено с использованием гемоцитометра; однако, в данном случае оператор считал почкующиеся дочерние клетки как отдельные клетки. Поскольку данные авторов приводятся в колониеобразующих единицах/мл, а не в клетках/мл, отпочковавшиеся клетки не должны были бы учитываться при количественном учете. Из-за данной ошибки в различных инфицирующих концентрациях присутствует меньшее количество клеток/мл Candida, и чувствительность детектирования авторами при концентрации, равной 10 клеток/мл, составляла только 90%, в то время как специфичность детектирования авторами составила 100%. При концентрации, равной 25 клеток/мл или выше, авторы наблюдали 100% чувствительности и 100% специфичности. Во всех случаях во флаконах с культурой крови, инокулированной клетками Candida, посев крови дал положительный результат на 8-й день. Следует отметить, что по умолчанию инкубационный период для посева крови равен 5 дням; однако авторы должны были удлинить данный инкубационный период, поскольку многим инокулятам потребовалось более 5 дней инкубации. В качестве примера в таблице 7 приведено время от инокуляции до получения положительного результата посева крови, зафиксированное для четырех различных клинических изолятов С. albicans, инокулированных в культуру крови.
Результаты Т2-измерений, проведенных на аликвотах объемом 800 мкл из данных инфицированных образцов цельной крови, представлены в таблице 8. Во всех случаях авторы смогли детектировать клетки в концентрации, равной 25 клеток/мл или выше, однако, авторы не смогли детектировать клинический изолят С3 в концентрации, равной 12 клеток/мл. Важно отметить, что значения CPU (colony-forming unit, колониеобразующая единица) определялись количественно с помощью гемоцитометра, а не счетчика Coulter, для данного определенного эксперимента по сравнению способов. Всего 51 сосуда с культурой крови были инокулированы клиническими изолятами Candida albicans, количественно охарактеризованными с помощью гемоцитометра, и 35 флаконов с «негативными» посевами крови были включены в эксперимент. Результаты для инокулятов, содержащих более 25 клеток/мл, приведены в таблице соответствия (Таблица 8).
Значения Т2 (в мс) представляют собой средние значения трех повторных измерений (n равно 3) с CV, составляющими менее 10% для повторных измерений
Рассчитанная чувствительность соответствует 100×[TP/(TP+FN)] и равна 100% (95% доверительный интервал от 93 до 100%)
Рассчитанная специфичность соответствует 100×[TN/(FP+T] и равна 100% (95% доверительный интервал от 90 до 100%)
Стандартизация количественного определения CFU улучшила чувствительность и воспроизводимость анализа, предложенного авторами. Предварительные результаты, полученные на 27 бутылках с культурой крови, представлены в таблице 10. Данные предварительные результаты указывают на то, что у авторы обеспечивают 100% чувствительности и специфичности при концентрации клеток, равной 10 клеток/мл или выше. Авторы начали дополнительно сравнение способов, используя С. krusei. Предварительные результаты (полученные на 36 флаконах) приведены в таблице 11. Данные результаты указывают на то, что обеспечивают чувствительность/специфичность, составляющую 88%/100% при концентрации клеток, равной 10 клеток/мл или выше, и 100% чувствительности/100% специфичности при концентрации клеток, равной 33 клеток/мл или выше, для Candida krusei. Еще одно важное изменение, осуществленное до достижения нового соглашения о проведении равнений посевов крови, заключалось в использовании частицы, несущей множество зондов. В данном случае определение Т2 при реакциях кластеризации с целью детектирования С. albicans проводили с использованием albicans/parapsilosis/tropicalis-мультифункциональных частиц, в то время как С. krusei детектировали, используя glabrata/krusei-мультифункциональные частицы.
Рассчитанная чувствительность соответствует 100×[TP/(TP+FN)] и равна 100% (95% доверительный интервал от 81,4 до 100%)
Рассчитанная специфичность соответствует 100×[TN/(FP+T] и равна 100% (95% доверительный интервал от 54 до 100%)
Рассчитанная чувствительность соответствует 100×[TP/(TP+FN)] и равна 89% (95% доверительный интервал от 71 до 98%)
Рассчитанная специфичность соответствует 100×[TN/(FP+T] и равна 100% (95% доверительный интервал от 66 до 100%)
Предварительная оценка клинической достоверности: Клиническая достоверность определяется как способность различать между двумя или более клиническими состояниями, например, кандидемия по сравнению с отсутствием кандидемии.
Графики Receiver Operator Characteristic (ROC) описывают эффективность анализа, иллюстрируя графически связь между чувствительностью (фракция с истинно положительным сигналом) и специфичностью (фракция с истинно отрицательным сигналом). Клиническая достоверность (пары чувствительность/специфичность) отображается для всего спектра уровней решений. Используя данные, полученные от образцов цельной крови, инфицированных клиническими изолятами с концентрациями 10 клеток/мл и 50 клеток/мл, были созданы два ROC-графика, представленные на фигурах 23А и 23В. Площадь под кривой часто используется для количественной оценки диагностической достоверности; в данном случае способности авторов различать кандидемического пациента с инфекцией на уровне, равном 10 клеток/мл или 50 клеток/мл, и пациента, не страдающего кандидемией. При концентрации клеток, равной 10 клеток/мл, площадь под кривой составляет 0,72, что означает, что если T2-анализ был проведен на случайно выбранном человеке с диагнозом кандидемия при инфекции на уровне, равном 10 клеток/мл, то существует 72%-ная вероятность того, что значение T2 будет выше, чем у человека, не болеющего кандидемией. Клиническая достоверность анализа значительно выше при концентрации клеток, равной 50 клеток/мл, с площадью под кривой, равной 0,98. Снова указывая на то, что у человека с диагнозом кандидемия с инфекцией на данном уровне Т2-анализ в 98% случаев даст значение выше, чем образец от пациента без диагноза кандидемия. Это отличная клиническая достоверность для уровней инфекции, составляющих 50 клеток/мл. ROC-графики не были построены для образцов, содержащих 100 клеток/мл или более, поскольку площадь будет переводиться в 100% клинической диагностической достоверности. Заключительная клиническая достоверность определяется с использованием образцов реальных пациентов на клинической базе.
Общее время анализа: Основные стадии анализа с рассчитанными временами представляют собой: (i) гипотонический лизис/центрифугирование/обработка шариками (8 мин); (ii) ПЦР (120 мин); (iii) гибридизация ампликона с частицами (30 мин); (iv) подвергание обусловленной магнитными взаимодействиями агломерации в однородном поле (10 мин); и (v) перенос данных и считывание (10 сек). Длительность проведения анализа оценивается как равное около 178 минут (около 3 часов), без учета подготовки реагентов и оборудования. Это соответствует процедуре, использованной при разработке способа, однако, авторы показали, что последующий модифицированный рабочий процесс с более короткими стадиями ПЦР и гибридизации дает такую же чувствительность детекции (см. фигуру 24) (хотя и с уменьшением количества ампликона, генерируемого для некоторых видов Candida (например, glabrata) и, следовательно, с меньшей разницей значений Т2 между показаниями от образцов, полученных от больных и от здоровых): (i) гипотонический лизис/центрифугирование/обработка шариками (8 мин); (ii) ПЦР (70 мин); (iii) гибридизация ампликона с частицами (30 мин); (iv) подвергание достигаемой с помощью магнитных взаимодействий агломерации в однородном поле (10 мин); и (v) перенос данных и считывание (10 сек). Данный модифицированный режим обеспечивает TAT (turnaround time, общее время (аналитического) цикла), равное 133 минут или 2 часа и 13 минут (и это без перехода к более быстрому термоциклеру).
Выводы
Данное способ тестирования обеспечивает современный, основанный на определении значения Т2 молекулярно-диагностический анализ на кандидемию со следующими показателями: (i) детекция Candida albicans в образце цельной крови в диапазоне, охватывающем от 5 до 1Е5 клеток/мл (5-log), (ii) детекция Candida krusei в образце цельной крови в диапазоне, охватывающем от 10 клеток/мл до 1Е5 клеток/мл; (iii) чувствительность/специфичность, равная 100%/100%, при концентрации клеток, составляющей более 25 клеток/мл; (iv), диагностическая достоверность, составляющая более 98% для концентраций клеток, составляющих более 50 клеток/мл; (v) совместимость анализа с цельной кровью (не наблюдалось сильных эффектов матрикса при использовании двенадцати различных образцов донорской крови); (vi) воспроизводимость Т2-измерений (отличие, составляющее менее 12% в тот же день и составляющее менее 13% через восемь дней) и (vii) сокращение общего времени проведения анализа до 2 часов 13 минут.
Авторы тестировали более высокие начальные объемы крови человека и установили, что эффективный гипотонический лизис достигался с такими большими объемами крови; впридачу это приводило к увеличению воспроизводимости детектирования при концентрации клеток, равной 10 клеток/мл.
Контаминация наблюдалась в 2 образцах из 50 титрований. Для уменьшения проблем контаминации ПЦР-стадии могут быть отделены от стадий детектирования. Дополнительно химические/биохимические способы могут быть использованы, чтобы сделать ампликоны неамплифицируемыми. Например, урацилы могут быть включены в ПЦР-продукт, и перед ПЦР может проводиться инкубация с урацил-N-гликозилазой.
Преимущества систем и способов по изобретению включают в себя возможность анализировать образцы цельной крови без отделения белков и нецелевых нуклеиновых кислот от образца. Поскольку при очистке ДНК не происходит потери нуклеиновых кислот-мишеней (например, использование колонки Qiagen после лизиса и до амплификации приводит к потери чувствительности более чам в 10 раз; а также применение цельной крови препятствует использованию способов оптической детекции при концентрациях выше 1%), то изменчивость и отклонения результатов измерений, наблюдаемые от образца к образцу (которые могут быть обусловлены очисткой ДНК) сведены к минимуму и чувствительность является максимальной.
Более 10% больных с септическим шоком являются носителями Candida, который является третьим наиболее распространенным возбудителем после S. aureus и Е. coli, и уровень смертности среди пациентов с септическим шоком, инфицированных Candida, составляет приблизительно 50%. Candida является четвертой по значимости причиной внутрибольничных инфекций. Быстрое выявление таких больных имеет решающее значение для выбора надлежащих схем лечения.
Пример 14. Вирусный анализ
Свободные от вируса CMV образцы крови здоровых доноров инфицировали геномной ДНК CMV, 40 мкл такой инфицированной крови аликвотировали в реакционную смесь ПЦР с общим объемом, равным 100 мкл. Амплификацию проводили с использованием совместимой с цельной кровью термофильной ДНК-полимеразой (Т2 Biosystems, Lexington, MA) и типичных универсальных праймеров, которые были разработаны следующим образом: 24-мерный конец - С6 линкер - специфическая последовательность CMV, точные последовательности выглядели следующим образом:




Праймеры были сконструированы таким образом, что зонды захвата (т.е. покрытая нуклеиновыми кислотами магнитная частица) будут отжигаться на области 10-мера (10-меры являются разными на 5'- или 3'-конце). Конечная концентрация праймеров в реакционной пробирке составляла 300 нм, и реакционная смесь ПЦР включала в себя 5 ммоль (NH4)2SO4, 3,5 ммоль MgCl2, 6% глицерина, 60 ммоль трицин (pH 8.7). Были подготовлены пять отдельных реакционных пробирок с образцами. За начальной денатурацией при 95°C в течение 3 минут следовали циклические ПЦР-реакции, и каждый цикл состоял из 95°C, 20 секунд; 55°C, 30 секунд; и 68°C, 20 секунд. На 30, 33, 36, 39, и 42 циклах реакционные пробирки вынимали и выдерживали при 4°C. После того как все образцы были готовы, 5 мкл реакционной смеси для частиц (6 × SSC, 30% формамид, 0,1% Tween) аликвотировали в пробирку на каждые 10 мкл амплифицированного образца; полученную смесь хорошо перемешивали и образец денатурировали при 95°C в течение 3 минут; образец гибридизовали при 45°C в течение 1 часа при осторожном перемешивании; образец разбавляли до 150 мкл разбавляющим буфером для частиц (PBS, 0,1% Tween, 0,1% BSA), подвергали обусловленной магнитными взаимодействиями агломерации в однородном поле в течение 10 минут и уравновешивали до 37°C в термоблоке в течение 1 минуты; и время релаксации Т2 для каждого из пяти отдельных образцов измеряли с помощью МР-ридера Т2 (см. фигуру 25).
Были разработаны праймеры, чтобы сделать возможным отжиг магнитных частиц, покрытых зондами захвата, на области 10-мера (10-меры являются разными на 5'- или 3'-конце), обеспечивая частицы с универсальной архитектурой для агрегации со специфическими амплификационными праймерами.
Результаты, представленные на фигуре 25, показывают, что способы и системы по изобретению могут быть использованы для выполнения ПЦР в режиме реального времени и предоставляют количественную информацию о количестве нуклеиновой кислоты-мишени, присутствующей в образце цельной крови.
Пример 15. ПЦР в режиме реального времени
Предыдущие результаты показали, что когда частицы находились в реакционной смеси ПЦР, то продукция ампликона была заингибирована. Авторы предполагают, что передвижение частиц к боковой стенке реакционной пробирки во время термоциклирования может обеспечить продуцирование ампликона. Был разработан простой, вставной магнитный сепаратор/ПЦР-блок (фигура 26) с тем, чтобы удерживать наночастицы на боковых стенках во время ПЦР-реакции, сводя к минимуму помехи и взаимодействие частиц с компонентами ПЦР-реакции. При удалении магнитного поля частицы могут быть полностью ресуспендированы в реакционной смеси.
В одном эксперименте авторы тестировали скорость, с которой частицы могут собираться на боковой стенке пробирки и возвращаться в раствор, соответственно. В данном эксперименте 100 мкл смеси частиц, покрытых С. albicans (3' и 5'), в однократном буфере ТЕ (около 150 мс для базовой линии, что соответствует значению T2 для некластеризованных частиц) подвергали три раза процессу кластеризации/декластеризации при 95°C. После этого осуществлялся следующий протокол: (i) перемешивание на аппарате для встряхивания типа ʺВортексʺ, инкубирование при 37°C в течение 1 мин, измерение Т2; (ii) нагревание при 95°C в течение 5 мин на магнитной ПЦР-вставке; (iii) инкубирование при 37°C в течение 1 мин, измерение Т2; (iv) перемешивание на аппарате для встряхивания типа ʺВортексʺ в течение 15 сек, инкубирование при 37°C в течение 1 мин, измерение Т2, и (v) переход к стадии (ii). Результаты данного эксперимента представлены ниже в таблице 12.
Как показано в таблице 12, полностью обратимая кластеризация наночастиц была продемонстрирована при 95°C при использовании испытываемого магнитного сепаратора. Частицы являются стабильными при 95°C в течение по меньшей мере 3 циклов кластеризации/декластеризации.
Авторы тестировали затем эффективность ПЦР в присутствии наночастиц в реакционном растворе. ПЦР проводили при двух условиях: (1) наночастицы полностью диспергированы в растворе; и (2) наночастицы концентрируются на боковых стенках ПЦР-пробирки с помощью вставного магнитного блока.
Три ПЦР-реакции (с наночастицами, сконцентрированными на стенке тестируемой пробирки; наночастицами, полностью диспергированными в растворе; и без наночастиц) создавали с использованием геномной ДНК С. albicans в качестве исходного материала.
Успех амплификации ДНК-мишени проверяли с помощью гель-электрофореза. Были использованы покрытые зондами захвата частицы Sera-Mag.
Асимметричные (4:1) ПЦР-реакции осуществляли с помощью готовой ПЦР-смеси и 100 копий геномной ДНК С. albicans в качестве исходного материала. Смесь частиц захвата С. albicans (3' и 5') в однократном растворе ТЕ добавляли к реакционным смесям (1) и (3) (базовая линия составляет около 150 мс). В контрольной реакционной смеси (2) не содержалось добавленных наночастиц (фигура 27).
Не наблюдалось никаких различий в образовании ПЦР-продукта в случаях, когда наночастицы присутствовали в растворе (диспергированные в растворе или сконцентрированные с помощью магнитного поля на боковых стенках анализируемой пробирки) в процессе ПЦР. Таким образом, наночастицы, модифицированные зондами захвата, не мешают ПЦР. Сопоставимые количества продукта были получены в реакциях с наночастицами, присутствующими в растворе, и без наночастиц в растворе, о чем свидетельствует гель-электрофорез. Кроме того, магнитная концентрация наночастиц на боковых стенках анализируемой пробирки в процессе ПЦР не оказывает влияния на ПЦР.
Пример 16. Анализ на Candida и клинические данные
Быстрый, точный и воспроизводимый молекулярно-диагностический анализ был разработан для детектирования пяти видов Candida непосредственно в образце цельной крови человека с пределом детектирования (LOD), составляющим 10 клеток/мл, и временем до получения результата, составляющим менее 2 часов. Клиническая эффективность анализа была определена с использованием 32 ʺслепыхʺ клинических образцов, и в данном исследовании авторы наблюдали 100% положительного и 100% отрицательного соответствия с посевом крови, тогда как являющиеся причиной инфекции виды Candida были точно идентифицированы в 100% образцов кандидемических пациентов. Авторы дополнительно применили анализ к образцам крови, взятым от пациентов с положительным результатом исследования на Candida, и наблюдали уменьшение в количестве детектируемых Candida, согласующееся с временным ходом противогрибкового лечения. Данный диагностический способ является быстрым, поддается автоматизации, а также предлагает врачам возможность детектировать несколько патогенов человека в сложных биологических образцах.
Магнитно-резонансный релаксометр
Компактная система для измерения магнитного резонанса (МР) была спроектирована и построена для точных измерений Т2-релаксации при выполнении необходимых тестов в описанных выше условиях. Температура данной системы может поддерживаться при 37°C с помощью системы контроля температуры; система содержит постоянный самарий-кобальтовый магнит с индукцией приблизительно 0,5 Тл, что соответствует протонной частоте, равной 22-24 МГц. Все стандартные МР-компоненты: радиочастотный зонд, предусилитель с низким уровнем шума и электронный преобразователь, плата спектрометра, а также аппарат температурного контроля - заключены в корпусе системы. В системе используется стандартный вход для переменного тока, и данная система подключается к внешнему компьютеру через Ethernet. Удобный для пользователя графический интерфейс позволяет пользователям настраивать экспериментальные параметры.
Система была разработана в расчете на прием образцов в стандартных ПЦР-пробирках объемом 0,2 мл. Электронные компоненты, а также катушка были оптимизированы для улучшения точности измерения применяемых объемов проб, что позволило авторам проводить анализ как один скан с получением значений Т2, характеризущихся значением CV, составляющим менее 0,1%. Инструментальный разброс составляет менее 2% в отсутствие калибровки и при минимальных требованиях к качеству используемых в системе компонентов.
Конъюгация и характеристика наночастицы-сенсора
Карбоксилированные суперпарамагнитные частицы размером 800 нм на основе оксида железа, состоящие из многочисленных нанокристаллов оксида железа, погруженных в полимерный матрикс, включая общий диаметр частицы, равный 800 нм (см. Demas et al., New J. Phys. 13:1 (2011)), конъюгировали с аминированными ДНК-олигонуклеотидами с применением стандартного химического карбодиимидного способа. ДНК-дериватизированные наночастицы хранили при 4°C в однократном Трис-ЭДТА (pH 8), 0,1% Tween-20. Концентрацию железа конъюгатов наночастиц определяли растворением частиц в 6М HCl с последующим добавлением гидрохлорида гидроксиламина и 1,10-O-фенантролина и последующим спектрофотометрическим детектированием, как описано в публикации Owen et al., J Immunol Methods, 73:41 (1984). Дериватизированные олигонуклеотидами частицы затем подвергали тесту на функциональную эффективность проведением реакций агломерации, индуцированной гибридизацией, с использованием разбавленных синтетических олигонуклеотидных мишеней, последовательности которых являются идентичными последовательностям ITS2 из пяти различных видов грибов Candida, в натрий-фосфатном гибридизационном буфере 4-кратным SSPE (600 ммоль NaCl, 40 ммоль фосфата натрия, 4 ммоль EDTA). Обратимость реакции агломерации была подтверждена при подвергании реакционных смесей для агломерации стадии тепловой денатурации при 95°C, проведении измерения Т2, и повторению гибридизации при 60°C с последующим вторым измерением Т2.
ПЦР-праймер и дизайн зонда захвата наночастиц
Были разработаны универсальные ПЦР-праймеры Pan Candida, комплементарные к 5,8S и 26S рРНК, которые амплифицировали область внутреннего транскрибируемого спейсера 2 (intervening transcribed spacer 2 (ITS2)) генома Candida. Была разработана пара олигонуклеотидных зондов захвата, комплементарных вложенным последовательностям на 5'- и 3'-конце относительно асимметрично амплифицируемого ПЦР-продукта. Зонд захвата, который гибридизуется с 5'-концом ампликона, был аминирован на 3'-конце, в то время как зонд захвата, который гибридизуется с 3'-концом ампликона, был аминирован на 5'-конце. Линкер поли-Т (n равен от 9 до 24) добавляется между аминогруппой и первым нуклеотидным основанием последовательности зонда захвата. Очищенные с помощью ВЭЖХ ПЦР-праймеры и зонды захвата были закуплены у IDT Technologies (Coralville, IA).
Дизайн контроля ингибирования
Контроль ингибирования ПЦР был разработан для совместного амплифицирования с видами семейства Candida и мониторинга в образцах цельной крови факторов, которые ингибируют ПЦР-амплификацию. Был разработана синтетическая матрица, которая содержит 30 нуклеотидных фланкирующих последовательностей, идентичных в последовательности областям 5,8S и 26S рРНК-оперона Candida. Внутренняя последовательность в данной матрице состоит из расположенных в случайном порядке нуклеотидов последовательности ампликона С. albicans. Были разработаны зонды захвата, комплементарные нити, амплифицируемой в избытке в рамках асимметричных ПЦР-реакций с Candida. Синтетические олигонуклеотиды, идентичные последовательности контроля ингибирования, были закуплены у IDT (Iowa City, IA). Олигонуклеотиды отжигали при концентрации 5 мкМ в 2-кратном SSC и клонировали в переваренную Hindll/EcoRV плазмиду pBR322 (NEB, Ipswich, MA) с использованием стандартных способов. Трансформацию проводили через электропорацию 1 мкл реакционной смеси для лигирования в электрокомпетентные клетки E.coli K12, и трансформанты высевали на чашки Петри с агаровой средой Луриа Бертани (Luria Bertani (LB)), содержащей 100 мкг/мл ампициллина. Два резистентные к ампициллину колонии отбирали и культивировали в 2 мл среды LB с ампициллином. Проводили очистки мини-проб плазмид с последующим картированием ферментом рестрикции, чтобы подтвердить наличие клонов, содержащих правильную вставку. После этого проводили дидезоксисеквенирование по методу Sanger (Seq Wright, Houston, TX), чтобы подтвердить успешное клонирование контроля, и проводили очистку больших количеств ДНК из клонов, несущих правильные вставки. Были проведены титрования контроля ингибирования в присутствии возрастающих концентраций всех 5 видов Candida для определения минимальной концентрации контроля ингибирования, которая могла бы быть воспроизводимо детектирована. Подтверждение функции контроля ингибирования было продемонстрировано проведением ПЦР-реакций в присутствии титрований известных мешающих ходу ПЦР агентов (SDS, гепарин, этанол) и демонстрацией того, что амплификация контроля была заингибирована.
Культивирование Candida и получение инфицированных in vitro образцов
MYA-2876, АТСС 2001, АТСС 24210, АТСС 66029 и АТСС 22019 представляли собой лабораторные эталонные штаммы С. albicans, С. glabrata, С. krusei, С. tropicalis и С. parapsilosis (АТСС, Manassas, VA), используемые для получения инфицированных in vitro образцов цельной крови. Дрожжи выращивали на чашках Петри с питательным агаром для культивирования дрожжей, содержащим пептон и декстрозу (yeast peptone dextrose agar (YPD)), и инкубировали при 25°C. Одиночные колонии отбирали и суспендировали в фосфатном буферном растворе (PBS). Виды были проверены через секвенирование последовательности ITS2 на приборе Accugenix (Newark, Delaware). Затем клетки подвергали центрифугированию с низкой скоростью (3000 g в течение 2 минут) и трижды промывали свежим PBS. Аликвоту промытых PBS клеток затем разбавляли в разбавителе ISOTON II (Beckman Coulter, Brea, CA) в кювете Accuvette объемом, равным 20 мкл, и определяли количество клеток на приборе Multisizer 4 Coulter Counter (Beckman Coulter, Brea, CA) в соответствии с инструкцией производителя. Клетки затем последовательно разбавляли до концентраций в диапазоне от 500 до 5 клеток/100 мкл PBS-буфера. Свежая человеческая кровь от здоровых доноров, отобранная в стерильных условиях в пробирки типа ʺвакутайнерʺ с K2EDTA (K2EDTA vacutainer tubes) (BD Diagnostics, Franklin Lakes, NJ) была получена от ProMedX. Обычно пять миллилитров крови человека инфицировали 100 мкл установленного количества клеток Candida. Инфицированные образцы цельной крови используются затем немедленно в тесте.
ПЦР цельной крови
Лизис эритроцитов проводили в 1 мл образца цельной крови с использованием ранее описанных способов (см. Bramley et al., Biochimica et Biophysica Acta (BBA) - Biomembranes, 241:752 (1971) и Wessels JM, Biochim Biophys Acta., 2:178 (1973)), затем проводили центрифугирование с низкой скоростью и супернатант удаляли и отбрасывали. Сто мкл буфера Трис-ЭДТА (ТЕ), pH 8,0, содержащего 1500 копий контроля ингибирования, затем добавляли к собранным осадкам и суспензию подвергали механическому лизису (см. Garver et al., Appl. Microbiol., 1959. 7:318 (1959); Hamilton et al., Appl. Microbiol., 10:577 (1962); и Ranhand, J.M., Appl. Microbiol., 28:66 (1974)). Пятьдесят мкл лизата затем добавляли к 50 мкл реакционной смеси для асимметричной ПЦР, содержащей дезоксинуклеотиды, ПЦР-праймеры и совместимую с цельной кровью термофильную ДНК-полимеразу (Т2 Biosystems, Lexington, МА). Термоциклирование проводили с использованием следующих параметров цикла: тепловая денатурация при 95°C в течение 5 мин, 40 циклов, состоящих из стадии тепловой денатурации при 95°C в течение 30 секунд, стадии отжига при 62°C в течение 20 секунд и стадии удлинения при 68°C в течение 30 секунд, и окончательное удлинение при 68°C в течение 10 минут.
Анализы на индуцированную гибридизацией агломерацию
Пятнадцать мкл готовой амплификационной реакционной смеси аликвотировали в тонкостенные ПЦР-пробирки с объемом, равным 0,2 мл, и инкубировали в натрий-фосфатном гибридизационном буфере (4-кратный SSPE) с парами дериватизированных олигонуклеотидами наночастиц при конечной концентрации железа, равной 0,2 ммоль железа на реакционную смесь. Гибридизационные реакционные смеси инкубировали в течение 3 минут при 95°C с последующей инкубацией при температуре 60°C в течение 30 минут в приборе-инкубаторе с покачиванием при перемешивании со скоростью 1000 оборотов в минуту (Vortemp, LabNet International). Гибридизированные образцы помещали в термоблок при 37°C в течение 3 минут, чтобы уравновесить температуру до температуры МР-ридера. Каждый образец затем подвергали стадии перемешивания на аппарате для встряхивания типа ʺВортексʺ в течение 5 секунд (3000 оборотов в минуту) и вставляли в МР-ридер для измерения значения Т2.
Протокол сбора образцов от пациентов с диагнозом Candida.
Отходы образцов крови, которые были помещены в вакутайнеры с K2EDTA (BD) в тот же день в качестве образцов, предназначенных для посева крови (Т равно 0), были получены из клинической лаборатории гематологии в Massachusetts General Hospital (MGH) или Houston University Hospital. Были собраны и каталогизированы образцы от пациентов, имеющих положительные результаты посева крови. Образцы хранились в оригинальном вакутайнере при -80°C, и отбор ʺслепыхʺ образцов был отправлен ночью в сухом льду в Т2 Biosystems. Протоколы отбора клинических образцов были рассмотрены соответствующими комитетами Human Research Committees.
Статистические анализы
Для каждого вида был определен предел детектирования с использованием пробит-моделей. Для каждого вида были рассчитаны уровень детектирования, составляющий 90%, и 95%-ые доверительные интервалы. Каждый необработанный Т2-сигнал был преобразован в Т2_мс с учетом фона анализа. Программа SAS v. 9.1.3 (Statistical Analysis Software версия 9.1.3 (Сагу, NC)) была использована в статистических расчетах для анализов предела детектирования, соответствия инфицированных образцов посеву, чувствительности и специфичности в клинических образцах и в серийных анализах для измерения клиренса Candida.
Соответствие детектирования Candida измерением Т2 с помощью МР (Т2МР-анализом) с посевом крови
В настоящее время золотым стандартом для диагностики Candida является посев крови. Инфицированные in vitro образцы цельной крови здоровых доноров были получены с использованием лабораторных эталонных штаммов С. albicans и С. krusei и клинических изолятов С. albicans в концентрациях, равных 0,33 и 100 клеток/мл. Педиатрические флаконы ВАСТЕС для культивирования крови (ВАСТЕС Peds Plus/F vials, Beckton Dickenson) инокулировали аликвотой инфицированных in vitro образцов, оцениваемых Т2МР-анализом. Флаконы с культурой крови, инокулированной клетками Candida, давали положительный результат посева крови на 8-й день во всех случаях. В общей сложности 133 бутылей с культурой крови были инокулированы 90 образцами крови, инфицированными клетками Candida (инокулят из 33 клеток/мл), или 43 образцами крови с отрицательным результатом. Девяносто восемь процентов положительного соответствия и 100% отрицательного соответствия наблюдалось между Т2МР-анализом и посевом крови.
Данные по клиническим образцам
Образцы цельной крови пациентов (с К2 EDTA) были получены для проверки клинической эффективности Т2МР-анализа на Candida. У пациентов проявлялись симптомы септицемии, и кровь была взята для посева. Сохраняемые образцы крови хранили при 4°C в лаборатории гематологии и отбирали для Т2МР-анализа, если посев крови давал положительный результат на Candida, если посев крови давал положительный результат на бактериемию или если посев крови давал отрицательный результат с тем, чтобы иметь широкий спектр образцов, которые будут испытываться на платформе. Четырнадцать образцов были от кандидемических пациентов, восемь были от пациентов с бактериемией и десять были от пациентов с посевом крови, давшим отрицательный результат.На фигуре 29 представлены измеренные значения Т2 для всех 32 образцов от пациентов. Одну ПЦР-реакцию проводили с использованием 1 мл каждого образца. 750 копий внутреннего контроля ингибирования добавляли к каждой реакционной смеси ПЦР. Для образцов, для которых анализ на Candida дал отрицательный ответ, величина среднего сигнала внутреннего контроля (IC) составляла 279 мс; значение CV составляло 25% для 18 образцов с отрицательным ответом анализа на Candida. Ни в одном из случаев сигнал IC не находился ниже порогового значения (128 мс, 5 стандартных отклонений, добавленных к среднему значению Т2, измеряемому в реакциях детекции Candida с отрицательным результатом), что дает основание предполагать, что все отрицательные результаты являлись истинно отрицательными результатами и в образцах цельной крови не присутствовали ингибирующие вещества. Реакции детектирования были мультиплексными, базируясь на руководящих документах Американского общества инфекционных болезней (IDSA), так, что три результата были доложены следующим образом: положительный ответ на С. albicans или С tropicalis; положительный ответ на С.krusei или С.glabrata; и положительный ответ на С.parapsilosis. Среднее значение Т2, измеряемое в образцах с отрицательным результатом анализа на Candida, составляет 114 мс, CV для данных измерений составляло 2,4%, и пороговое значение (рассчитанное добавлением пять раз стандартного отклонения, измеряемого в реакциях детекции Candida с отрицательным результатом, плюс среднее значение Т2, измеряемое в образцах с отрицательным результатом анализа на Candida) составляло 128 мс. В образцах с положительным результатом анализа на Candida сигнал IC был подавлен из-за конкуренции за амплификационные реагенты. В случаях высокого содержания С. albicans некоторая перекрестная реактивность наблюдалась для детекции частиц с С. parapsilosis (например, образец от пациента №3), однако, величина данного сигнала существенно не превышает величину отсечения (20 мс) и не приводит к различию в противогрибковой терапии, поскольку как С. albicans, так и С. parapsilosis являются восприимчивыми к флуконазолу.
С помощью Т2МР-анализа были успешно идентифицированы четырнадцать образцов С. albicans, С. parapsilosis или С. krusei, причем положительный результат данных анализов был подтвержден посевом кровью с последующей исследованием с помощью биохимической карты анализатора Vitek 2. Дополнительно детекция была специфической для Candida spp. поскольку образцы бактериемических пациентов с Escherichia coli, Enterococcus sp., Staphylococcus aureus, Klebsiella pneumoniae, коагулазоотрицательным стафилококком или альфа-гемолитическим стрептококком давали отрицательный результат.
Для демонстрации применимости анализа при мониторинге клиренса Candida, были протестированы образцы, взятые для серийных посевов от двух пациентов, которые проявляли такие симптомы, указывающие на кандидемию, как постоянная лихорадка после приема антибиотиков. Заборы крови для Т2МР-анализа происходили в тот же день, что и заборы крови для посева крови. Пробы для высевания наблюдаемых культур отбирались затем на протяжении девяти дней у пациента А и на протяжении пяти дней у пациента B. На фигуре 3 представлены результаты, полученные Т2МР-способом для обоих пациентов. У пациента A отбирали кровь для посева (t равно 0), ему был поставлен диагноз кандидемии и введен внутривенно микафунгин (С. glabrata) на следующий день через культуру крови (t равно 1). Образцы цельной крови были проверены с помощью Т2МР-анализа при t, равном 0 дней, t, равном 3 дня, t, равном 7 дней, t, равном 8 дней, t, равном 9 дней. Полученные значения Т2МР составили 320 мс при t, равном 0, 467 мс при t, равном 3, 284 мс при t, равном 7, 245 мс при t, равном 8, и 117 мс (ниже отсечения) при t, равном 9. Последующие заборы крови на 3-й день и 8-й день дали положительный результат посева через 24 и 48 часов, соответственно. Наборы образцов для серийных посевов были получены от пациента B. Наличие C. albicans было правильно детектировано с помощью Т2МР-анализа в день 0 (Т2 равно 426 мс). Посев крови дал положительный результат на 2-й день с последующей идентификацией С. albicans. На следующий день пациенту ввели микафунгин, было очевидно резкое снижение измеряемой в Т2МР-анализе величины для С. albicans (Т2 равно 169 мс), и через три или более дней после начала противогрибкового лечения не наблюдалось детектируемого С. albicans. Все тесты были завершены за общее время проведения анализа, равное двум часам, с использованием ПЦР-термоциклера с быстрым блоком и трехстадийной процедуры термоциклирования, которая не была оптимизирована по скорости.
Выводы
Авторы разработали и обосновали Т2МР-анализ цельной крови на Candida, способный детектировать пять клинически значимых видов Candida, который использует преимущества неоптической детекции, не требуя очистки аналита, что позволяет обеспечить более короткие общие времена анализа и более воспроизводимые результаты. Асимметричная ПЦР была использована для амплификации области ITS2 генома Candida непосредственно в образце цельной крови для достижения клинически значимых чувствительностей детектирования. Был разработан способ детекции Т2, при котором два пула дериватизированных олигонуклеотидами наночастиц гибридизуются с каждым концом одноцепочечного ампликона. Ампликоны служат, таким образом, для связывания между частицами и индуцируют агломерацию наночастиц, которая дает измеримое и воспроизводимое изменение в спин-спиновой релаксометрии (Т2) протонов в молекулах воды. Дополнительно авторы сконструировали и осуществили внутренний контроль ингибирования для мониторинга ингибиторов ПЦР, которые могут присутствовать в образцах пациентов.
Система анализа была испытана с использованием эталонных штаммов и клинических изолятов, количественно охарактеризованных счетчиком Coulter Counter и вспрыснутых в цельную кровь здоровых доноров. Воспроизводимость анализа измеряли с помощью инфицированной С. albicans крови (тот же образец, тот же оператор, тот же прибор) на протяжении 10 дней, и авторы наблюдали CV менее 12,8% (п равно 30) во всем динамическом диапазоне ответа (от 0 до 1Е5 клеток/мл). Аналитическая чувствительность и предел детектирования, составляющий не более 10 клеток/мл, были измерены для С. albicans, С. tropicalis, С. krusei и С. parapsilosis, и составляющий более 10 клеток/мл с 92,5% случаев, детектируемых в концентрации, равной 10 клеток/мл, для С. glabrata. Хотя это и не доказано, возможная причина более высокого LOD, наблюдаемого для С. glabrata, может заключаться в том, что число копий оперона рДНК уменьшается в С. glabrata по сравнению с другими запрашиваемыми Candida spp, поскольку известно, что С. glabrata существует в природе как гаплоид, в то время как другие виды Candida представляют собой диплоиды. Согласованность с методом, использующимся в качестве ʺзолотого стандартаʺ при диагностике Candida было очень хорошим с соответствием, составляющим 98% для положительных результатов и 100% для отрицательных результатов, наблюдаемым для 133 образцов, in vitro инфицированных С. albicans и С. krusei. Следует отметить, что время до получения результата составляло 2 часа для Т2-теста на Candida, тогда как время до получения положительного результата посева крови составляло обычно 2 дня для С. albicans и около 1 дня (от 18 до 24 часов) для Candida krusei.
Результаты, полученные для 32 клинических образцов, были аналогичны результатам посева крови. Измеренные значения Т2 превышали значение отсечения, установленное равным пяти стандартным отклонениям от значения Т2, измеренных в образцах с отрицательным результатом анализа на Candida, добавленным добавлены к их среднему значению. В данном случае порог составлял 128 мс (n равно 54). Ни в одном из случаев авторы не наблюдали ингибирование ПЦР-реакции, поскольку внутренний контроль детектировали во всех 32 реакциях с уменьшенным сигналом IC, наблюдавшимся у пациентов с положительным результатом анализа на Candida, и CV, равным 25% (среднее значение Т2, равное 279 мс) у образцов с отрицательным результатом анализа на Candida (n равно 18). Анализ является высоко специфичным для детекции Candida, поскольку не наблюдалось перекрестной реактивности с образцами, зараженными бактериями (n равно 8). Образцы с положительным результатом анализа на Candida были достоверно определены, Candida spp., являющийся причиной инфекции, был достоверно определен до вида, причем для получения ответа требовалось всего 2 часа.
Были также продемонстрированы возможности данного анализа в обеспечении быстрой детекции клиренса Candida после введения противогрибковой терапии. Два набора образцов от пациентов были взяты и подвергнуты Т2МР-анализу (фигура 3). У пациента А наблюдали Т2-сигналы для С. glabrata в диапазоне от умеренных до сильных в день 0 и на 3-й день, с введением противогрибковых препаратов в 1-й день. Снижение сигнала от С. glabrata наблюдали в течение последующих дней, и после восьми дней противогрибкового лечения сигнал вообще не детектировался. Сильный сигнал для С. albicans была измерен для пациента B в день 0, и резкое снижение (дельта Т2, равная 306 мс) Т2-сигнала наблюдалось на следующий день после введения противогрибкового препарата, и после двух дней противогрибкового лечения сигнал вообще не детектировался. Хотя и будучи предварительными, такие данные позволяют предположить, что настоящий анализ может быть использован для мониторинга эффективности лечения и клиренса Candida в режиме реального времени.
В заключение, авторы разработали чувствительный и специфичный анализ для диагностики кандидемии, вызванной пятью наиболее часто встречающимися видами Candida. Ранние клинические результаты были обнадеживающими и показали, что экспресс-диагностика и идентификация видов являются достижимьми и могут не только способствовать раннему лечению соответствующим противогрибковым препаратом, но и обеспечить средство для мониторинга клиренса Candida. Авторы ожидают, что данный базирующийся на наночастицах Т2МР-способ может найти широкое применение для диагностики инфекционных заболеваний для различных типов образцов и патогенов.
Пример 17. Анализ на такролимус использованием Fab
Анализ на такролимус представляет собой гомогенный конкурентный иммуноанализ, осуществляемый с помощью образца цельной крови с EDTA, который был подвергнут экстракции с тем, чтобы освободить такролимус от красных кровяных клеток и связывающих белков. Ключевыми компонентами анализа является антитело с высоким сродством к такролимусу, надежный способ экстракции и улучшение буферных систем, выбираемых для способствования специфической агрегации и минимизации неспецифической агрегации. В данной версии анализа используется рекомбинантный одновалентный Fab (участок связывания антигена, fragment antigen binding) с высоким сродством к такролимусу.
Анализ на такролимус оценивали с помощью калибраторов цельной крови, коммерческих контролей цельной крови, инфицированных образцов и образцов от пациентов.
Реагенты для анализа включали в себя: (a) частицу размером 244 нм, конъюгированную последовательно с BSA и моновалентным Fab-антителом, и блокированную mPEG-тиолом плюс NEM (частицы разбавляли до концентрации Fe, равной 0,2 ммоль, в буфере для анализа), (b) C22-модифицированный такролимус, конъюгированный с BSA при начальном соотношении такролимуса и BSA, равном 10:1 (разбавленный до 600 нг/мл в буфере для анализа); (c) буфер для анализа: 100 ммоль глицин, pH 9,0, 1% BSA, 0,05% Tween 80, 150 ммоль NaCl и 0,05% ProClin и (d) экстракционный реагент: 70% метанол, 60 ммоль ZnSO4 в dH2O.
Калибраторы цельной крови были получены с использованием 1 мг/мл раствора Sigma FK506 Stock в 100% МеОН. В цельную кровь с EDTA добавляли различные дозы раствора такролимуса. Кровь с добавкой такролимуса инкубировали при 37°C при осторожном перемешивании и затем хранили в течение ночи при 4°C до аликвотирования и замораживания. Целевые уровни составляли 0, 1, 2, 5, 10, 20, 50, 100 и 250 нг/мл такролимуса. Калибраторы были предоставлены внешней лаборатории для присвоения значений с помощью анализа Architect Tacrolimus. Образцы анализировали масс-спектрометрией. Результаты показывают корреляцию, равную 0,9998, при сравнении теоретического и фактического значений.
Контроли качества (QC) состояли из 3 уровней контролей UTAK Immunosuppressant Matrix Controls. Образцы от пациентов были получены от пациентов после трансплантации, получающих препараты такролимуса.
Протокол тестирования выглядел следующим образом:
(i) Инкубировать все образцы, Калибраторы, QC и реагенты до достижения ими комнатной температуры, перемешать, осторожно переворачивая.
(ii) Пипетировать 200 мкл образца, калибратора или материала QC в микроцентрифужную пробирку объемом 1,5 мл. Добавить 200 мкл экстракционного реагента и перемешивать на аппарате для встряхивания типа ʺВортексʺ в течение 30 с. Инкубировать образец в течение 2 минут при комнатной температуре и центрифугировать в течение 5 минут при 10000 оборотах в минуту. Перенести чистый супернатант в чистую пробирку и приготовить разбавление в 2,5 раза с использованием буфера для анализа.
(iii) Пипетировать 10 мкл разбавленного экстракта и 10 мкл разбавленных частиц в реакционную пробирку, перемешать на аппарате для встряхивания типа ʺВортексʺ и инкубировать в течение 15 минут при 37°C. Пипетировать 20 мкл конъюгата BSA-tac в реакционную пробирку, перемешать на аппарате для встряхивания типа ʺВортексʺ и инкубировать в течение 15 минут при 37°C. Образец подвергали 6 циклам (12 мин) с помощью обусловленной магнитными взаимодействиями агломерации. Образец, перемешанный на аппарате для встряхивания типа ʺВортексʺ, инкубировали в течение 5 минут при 37°C и считывали в Т2-ридере при 37°C.
Калибраторы были протестированы в трех параллелях для каждого выполнения теста (всего 6 опытов). Данные отдельного опыта фитовали моделью 5PL с использованием программного обеспечения GraphPad Prism 5 for Windows, version 5.02, GraphPad Software, San Diego California USA. Калибратор 0 был введен как 0,01 нг/мл и использовался в модели зависимости. Полученные калибровочные кривые (Run Calibration) были использованы для обратного вычисления концентрации такролимуса для всех калибраторов, образцов цельной крови с добавкой такролимуса, QC и образцов от пациентов, анализировавшихся при данном осуществлении теста.
В дополнение, фитованием данных по всему 3-дневному исследованию (n равно 18) для каждого калибратора были получена калибровочная кривая Master Curve. Концентрации во всех образцах были пересчитаны с использованием кривой Master Curve, и полученные уровни содержания такролимуса сравнивали с таковыми, полученными с использованием калибровочной кривой Run Calibration.
Воспроизводимость панели, состоящей из 13 образцов (9 калибраторов, 3 контроля и 1 образец цельной крови с добавкой такролимуса) была испытана на трех параллелях в течение 3 дней с 2 выполнениями теста в один день, в общей сложности, для 18 повторов. Калибраторы хранили при -80°C, в то время как контроли и инфицированные образцы цельной крови хранили при температуре от 4 до 8°C в течение всего срока исследования.
Концентрации образцов были определены, используя калибровочную кривую Run Calibration, а также кривую Master Curve в GraphPrism. Точности определения для одного выполнения теста, для одного дня, при сравнении результатов, полученных в разные дни, а также общая точность определения были рассчитаны при помощи дисперсионного анализа (ANOVA) с использованием программы Mini Tab 15.
Данные, полученные с использованием способа Run Calibration, показали, что общая погрешность во всем диапазоне концентраций такролимуса от около 3 до 210 нг/мл составляет менее 25% CV.
Аналитическая чувствительность рассчитывалась методом 2SD. Было определено стандартное отклонение 18-ти повторов калибратора 0. Затем было рассчитано содержание такролимуса при максимальном значении Т2 (верхняя асимптота фитованной кривой) - 2SD и предсказана концентрация с использованием кривой Master Calibration Curve. Аналитическая чувствительность составляет 0,8 нг/мл.
Во время разработки антитела против такролимуса и процедуры скрининга специфичность антител оценивали по пяти метаболитам такролимуса. С каждым из 5 метаболитов проводили анализ ELISA на ингибирование и сравнивали перекрестным клонированием со свободным такролимусом для пяти клонов со зрелой аффинностью и для семи клонов с дополнительным созреванием аффинности. Данные для двух перекрестных клонов и имеющегося в наличии мышиного моноклонального антитела RUO приведены ниже. Единственная наблюдаемая перекрестная реактивность представляла собой небольшую реактивность по отношению к 15-O-десметиловому метаболиту.
Обобщенные результаты эффективности анализа на такролимус представлены в таблице ниже.
Пример 18. Получение наночастиц для детектирования нуклеиновокислотных аналитов
Получение частиц с одним зондом: Карбоксилированные суперпарамагнитные частицы размером 800 нм на основе оксида железа, состоящие из многочисленных нанокристаллов оксида железа, погруженных в полимерный матрикс, включая общий диаметр частицы, равный 800 нм (см. Demas et al., New J. Phys. 13:1 (2011)), промывали при помощи магнитной стойки перед применением. Магнитные частицы ресуспендировали в 66 мкл свободной от нуклеаз воды, 20 мкл 250 ммоль MES-буфера, pH 6, и 4 мкл аминированного зонда (полученного от IDT), чтобы приготовить концентрацию 1 ммоль на мг частиц. Были получены частица с зондом, аминированным на 3'-конце, и частица с зондом, аминированным на 5'-конце (например, зонд для С. parapsilosis). Зонд добавляли к частице и суспензию перемешивали, используя аппарат для встряхивания типа ʺВортексʺ, оснащенный держателем из пенопласта для удерживания пробирки. Аппарат для встряхивания типа ʺВортексʺ был установлен на скорости, обеспечивающей хорошее суспендирование частиц без разбрызгивания. N-этил-N-(3-диметиламинопропил)карбодиимид (EDC) растворяли затем в воде и сразу же добавляли во встряхиваемую смесь частицы и зонда. Затем пробирку закрывали и инкубировали с вращением в инкубаторе при 37°C в течение 2 часов. Затем пробирку помещали в магнитную стойку и удаляли реакционную жидкость. Частицы промывали серией промывок (125 мкл/мг частиц) следующим образом: вода, вода, 0,1 М имидазол, pH 6,0, с 5-минутной инкубацией с вращением при 37°C, воды, 0,1 М бикарбонат натрия, pH 8,0, с 5-минутной инкубацией с вращением при 37°C, вода. Затем частицы подвергали тепловому стрессу в течение 1 часа при температуре от 60°C до 65°C в 0,1 М бикарбонате натрия pH 8,0 при перемешивании. После теплового стресса раствор бикарбоната удаляли, помещая пробирку в магнитную стойку. Частицы затем ресуспендировали в буфере для хранения (Трис-ЭДТА, 0,1% Tween 20) и перемешивали на аппарате для встряхивания типа ʺВортексʺ. Буфер для хранения удаляли и к полученным частицам добавляли окончательные 100 мкл буфера для хранения. Частицы хранили при температуре от 2°C до 8°C, в частицах проводилось определение концентрации железа частиц с помощью количественного теста, на содержание ионов железа и их тестировали относительно нуклеиновой кислоты-мишени (например, титрование олигонуклеотидом ITS2 С. paraplsilosis). В тесте на Candida частицы разводили в 8-кратном SSPE с добавленным 0,09% азидом натрия в качестве консерванта.
Получение частиц с двойным зондом: Для получения частицы с двойным зондом применяется такая же процедура, что и выше, кроме того, что равные объемы второго зонда (например, аминированного на 3'-конце С. albicans) и первого зонда (например, аминированного на 5'-конце С. tropicalis) смешивали перед добавлением к магнитным частицам. Аналогично, равные объемы зондов, аминированных на 5'-конце, смешивали перед добавлением к магнитным частицам.
Пример 19. Улучшения анализа на Candida
Предел детектирования для анализа на Candida из примера 16 была улучшен промыванием осадка. 2,0 мл цельной крови объединяли с 100 мкл TRAX-буфера для лизиса эритроцитов (например, смесь нонилфенокси-полиэтоксиэтанола (NP-40) и 4-октилфенолполиэтоксилата (Triton-X100)) и инкубировали в течение около 5 минут.Образец центрифугировали в течение 5 минут при 6000 g и полученный супернатант удаляли и выбрасывали. Чтобы промыть осадок, осадок смешивали с 200 мкл буфера трис-ЭДТА (ТЕ) pH 8,0 и перемешивали на аппарате для встряхивания типа ʺВортексʺ. Образец вновь центрифугировали в течение 5 минут при 6000 g и полученный супернатант удаляли и отбрасывали. После стадии промывания осадок смешивали с 100 мкл ТЕ-буфера и подвергали обработке шариками (например, такими как 0,5 ммоль стеклянных шариков, 0,1 ммоль шариков из диоксида кремния, 0,7 ммоль шариков из диоксида кремния или смесь из шариков разного размера) при интенсивном перемешивании. Образец снова центрифугировали. Пятьдесят мкл полученного лизата затем добавляли к 50 мкл реакционной смеси для асимметричной ПЦР, содержащей дезоксинуклеотиды, ПЦР-праймеры и совместимую с цельной кровью термофильную ДНК-полимеразу (Т2 Biosystems, Lexington, MA). Термоциклирование и анализы на индуцированную гибридизацией агломерацию были проведены, как описано в примере 16, чтобы получить значения Т2, характерные для присутствия Candida в образце крови. Используя данный тест, можно получить (i) степень вариации значения Т2 менее 20%, на образцах с положительным результатом на Candida; (ii) по меньшей мере 95% правильного детектирования при концентрации клеток, менее или равной 5 клеток/мл, в образцах, вспрыснутых в 50 индивидуальных образцов крови здоровых пациентов; (iii) по меньшей мере 95% правильного детектирования при концентрации клеток, менее или равной 5 клеток/мл в образцах, вспрыснутых в 50 индивидуальных образцов крови нездоровых пациентов, и/или (iv) более чем или равного 80% правильного детектирования в полученных от пациентов клинически позитивных образцах (например, в которых позитивный результат на Candida был получен с помощью другой методики, такой как анализ на клеточных культурах), начиная с 2 мл крови.
Данная заявка испрашивает приоритет заявки США серийный №12/910,594, поданной 22 октября 2010 года, и испрашивает приоритет предварительной заявки на патент США №61/414,141, поданной 16 ноября 2010 года, предварительной заявки на патент США №61/418,465, поданной 1 декабря 2010 года, и предварительной заявки на патент США 61/497,374, поданной 15 июня 2011, каждая из которых включена в данное описание посредством ссылки.
Другие варианты осуществления
Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены в данный документ посредством ссылки в той же степени, как если бы каждая независимая публикация или патентная заявка была определенно и отдельно указана, чтобы быть включенной в данное описание посредством ссылки.
Хотя настоящее изобретение было описано в связи с определенными вариантами его осуществления, следует понимать, что оно может в дальнейшем модифицироваться, и что данная заявка предназначена для покрытия любых вариаций, применений или адаптации изобретения, следующих, в целом, принципам данного изобретения, и включающих в себя такие отклонения от настоящего раскрытия, которые входят в известную или обычную практику в области техники, к которой относится изобретение, и могут быть приложены к существенным признакам, изложенным выше, и соотвествуют объему формулы изобретения.
Другие варианты осуществления приведены в формуле изобретения.
Реферат
Представленные изобретения касаются способа детектирования наличия аналита в жидком образце, способа детектирования наличия патогена в образце цельной крови, способа детектирования наличия вируса в образце цельной крови, способа детектирования присутствия нуклеиновой кислоты-мишени в образце цельной крови, способа детектирования наличия организмов, относящихся к видам Candida в жидком образце, системы для детектирования одного или более аналитов нуклеиновой кислоты в жидком образце и сменного картриджа для размещения реагентов для анализа и расходных материалов в указанной системе. Представленные изобретения характеризуются тем, что при своем осуществлении используют магнитные частицы, имеющие средний диаметр в интервале от 700 нм до 950 нм, значение релаксивности Тна одну частицу, составляющее от 1х10до 1х10ммольсек, и имеют связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии аналита. Изобретения обеспечивают мультиплексное детектирование нескольких типов различных молекул и могут быть использованы в клинической практике. 9 н. и 22 з.п. ф-лы, 29 ил., 13 табл., 19 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ и соединения для магниторелаксометрического обнаружения аналитов и их применение











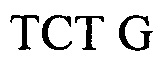




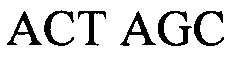


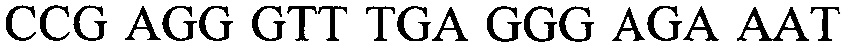





Комментарии