Способ очистки белка - RU2737539C2
Код документа: RU2737539C2
Чертежи



Описание
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
В области терапевтических препаратов использование белков, и в частности, антител и образованных из антител молекул, постоянно набирает силу и значимость, и соответственно, параллельно развивается необходимость в контролируемых производственных процессах. Коммерческое внедрение терапевтических белков требует их производства в больших количествах. C этой целью белок часто экспрессируется в клетке-хозяине и затем должен быть выделен и очищен до его приготовления в виде вводимой формы. Примеси, которые удаляются во время указанной очистки, обычно классифицируются как связанные с процессом примеси, включая обломки клеток-хозяев, белки клеток-хозяев, следы культуральных сред и т. д., и связанные с продуктом примеси, образующиеся в результате модификации, разрушения или агрегирования целевого продукта.
Наиболее распространенным классом молекул антител является иммуноглобулин G (IgG), гетеротетрамер, состоящий из двух тяжелых цепей и двух легких цепей. Молекула IgG может подразделяться на две функциональные субъединицы: (1) кристаллизующийся фрагмент (Fc), который образует «хвост» антитела и взаимодействует с рецепторами клеточной поверхности для активации иммунного ответа, и (2) антигенсвязывающий фрагмент (Fab), который опосредует распознавание антигена. Fc-область содержит две пары константных доменов (CH2 и CH3) из двух парных тяжелых цепей, тогда как Fab-область состоит из вариабельного домена, за которым следует константный домен из тяжелой цепи (VH и CH1, соответственно), которые соединяются с вариабельным и константным доменом из легкой цепи (VL и CL, соответственно). Fc- и Fab-области разграничены шарнирной областью, которая содержит дисульфидную связь, удерживающую две тяжелые цепи вместе; дополнительные дисульфидные мостики в доменах CH1 и CL соединяют тяжелую и легкую цепи вместе.
Полноразмерные антитела класса IgG обычно очищают с помощью способов, которые включают стадию захвата аффинной хроматографии с использованием белка А, полученного из Staphylococcus aureus. Высокая специфичность связывания между белком А и Fc-областью антител позволяет этому методу хроматографии удалять более 98% примесей в одну стадию, начиная непосредственно из сложных растворов, таких как собранные клеточные культуральные среды. Большой коэффициент очистки, получаемый на этой стадии процесса, помогает упростить весь последующий процесс очистки. Как правило, только следовые примеси, такие как высокомолекулярные агрегаты, остаточные белки клеток-хозяев, остаточная ДНК или вымываемый белок A, остается удалить после этой стадии очистки, и это обычно может быть достигнуто за одну-две последующие стадии хроматографии.
Несмотря на тот факт, что очистка антител на основе белка А использовалась и развивалась в течение последних десятилетий, производство рекомбинантных антител в промышленном масштабе с уровнем чистоты, подходящим для введения препарата, остается сложной проблемой. В частности, белки, такие как антитела и их фрагменты, содержат межцепочечные дисульфидные связи, которые обычно нуждаются в защите и сохранении в процессе производства и очистки для получения антител в их нативной конформации, соответственно, сохраняющих свою биологическую активность.
Когда эти межцепочечные дисульфидные связи подвергаются воздействию окружающей среды и становятся восстановленными, различные полипептидные цепи будут разделяться, приводя к появлению примесей, состоящих из неполных молекул антител, которые должны быть удалены из конечного препарата антитела. По мере того, как среда становится окисляющей в дальнейшем во время процесса очистки, эти связанные с восстановлением примеси могут некорректно преобразовываться, что приводит к увеличению концентраций связанных с продуктом высоко- и низкомолекулярных соединений. Очистка образующихся дополнительных примесей приводит к снижению выхода способа и повышению уровней примесей в конечном лекарственном веществе. Кроме того, должна обеспечиваться воспроизводимость между производственными партиями, и поэтому регулирование наличия и относительного содержания таких примесей имеет важное значение для исключения брака конкретных производственных партий. Брак в партии может быть вызван или повышенными уровнями примесей в лекарственном веществе, или несоблюдением внутрипроизводственного контроля. Повышенный уровень примесей в лекарственном веществе также может снижать срок хранения лекарственного продукта.
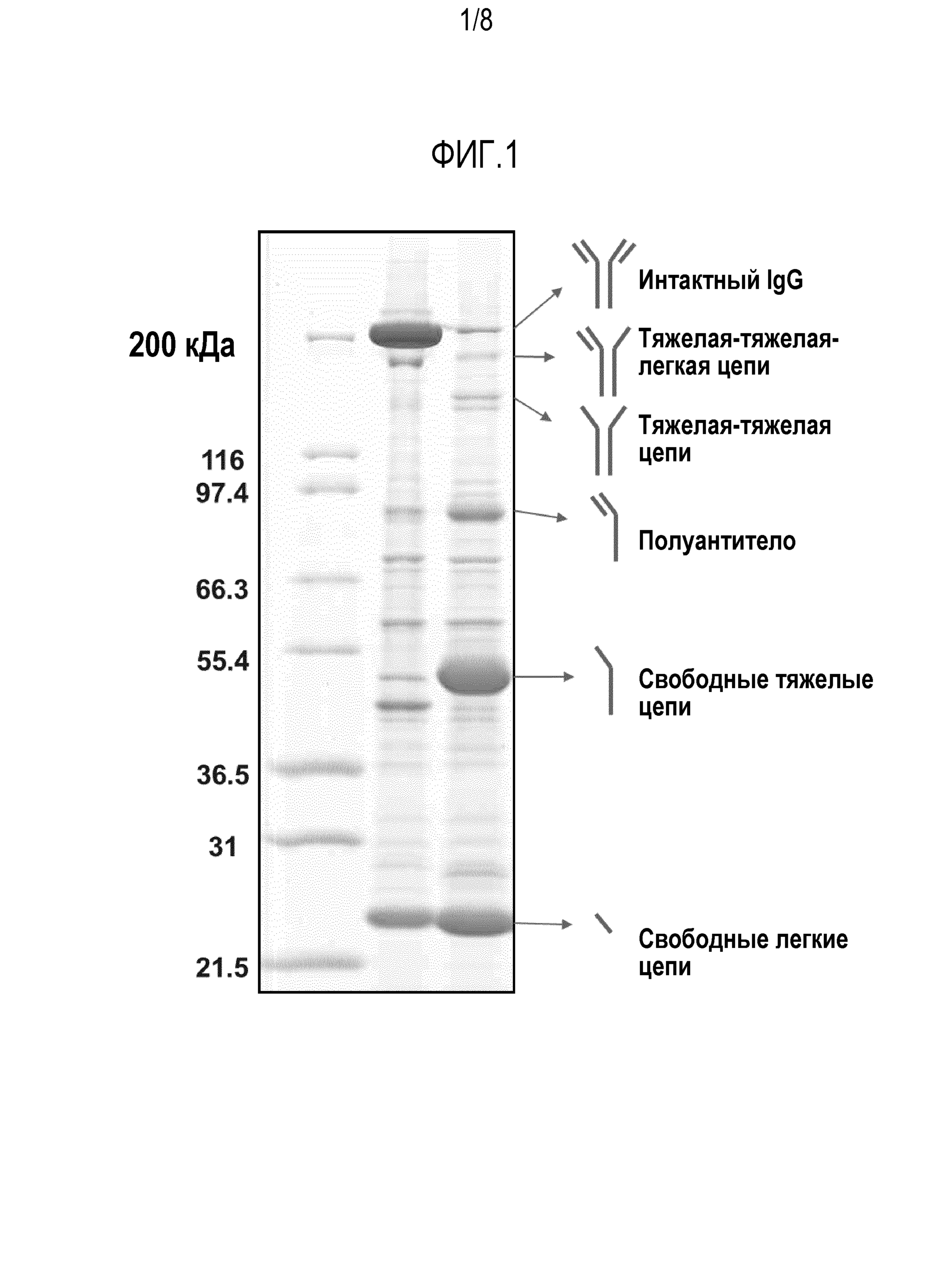
В ходе получения антител появление примесей, связанных с продуктом, таких как свободные тяжелые и легкие цепи, полумономеры (одна тяжелая цепь и одна легкая цепь) или изоформы, частично лишенные дисульфидных связей, благодаря восстановлению межцепочечных дисульфидных связей, наблюдалось после стадии хроматографии на белке А. Следует избегать появления этих примесей во время процесса очистки и удалять примеси в ходе указанного процесса. Возможные связанные с продуктом примеси могут быть проанализированы с помощью невосстановительного электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) и показаны на фиг.1.
В этом отношении в US 8574869 описан способ предотвращения восстановления дисульфидной связи при сборе рекомбинантных белков из культур клеток-хозяев.
Соответственно, сохраняется потребность в воспроизводимых способах получения белка, которые позволяют осуществлять очистку белков в их нативной конформации с постоянной степенью чистоты в различных партиях.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Невосстановительный гель-электрофорез с окраской кумасси, показывающий возможные связанные с продуктом примеси, выделенные из образца антитела после проведения очистки.
Фигура 2: Невосстановительный биоанализ образцов элюата с белка А соединения А. Образцы представляют собой образцы элюата белка A из партии 1 и партии 2 производственного цикла 2 (C2B1 и C2B2, соответственно), без использования угольного фильтра, и партии 1 цикла 3 (C3B1), где угольный фильтр использовался. Полумономер, отмечающийся в образцах партии 2, не наблюдается в образце партии 3.
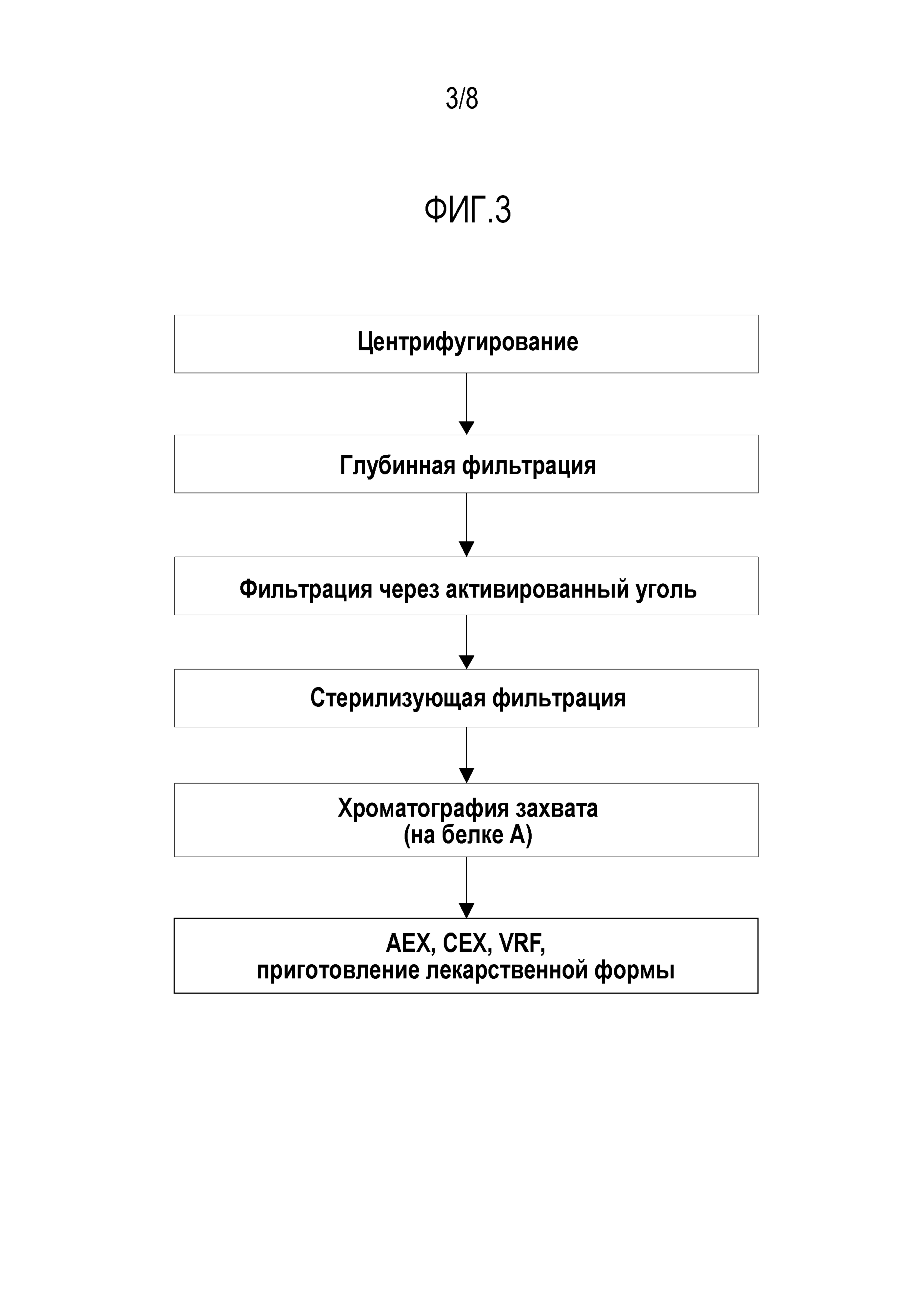
Фигура 3: Блок-схема процесса очистки, включающего фильтрацию через уголь. Стадию фильтрации через фильтр с активированным углем выполняли в одном потоке между глубинной фильтрацией и фильтрацией через стерилизующий фильтр. Затем следовала стадия захвата с использованием белка A и последующие стадии очистки: анионообменная хроматография (AEX), катионообменная хроматография (CEX), снижение вирусной нагрузки фильтрацией (VRF) и приготовление лекарственной формы.
Фигура 4: Невосстановительный биоанализ производственных образцов соединения В IgG. Показанные образцы представляют собой осветленную клеточную культуральную жидкость и элюат захвата (после хроматографии на белке А) для партии 1, в которой антитело восстанавливается, образуя полумономер и свободную тяжелую цепь. Также показан элюат захвата для партии 3, в которой фильтр с активированным углем использовался при первичном извлечении, и молекула антитела была все еще мономерной после стадии захвата на белке А.
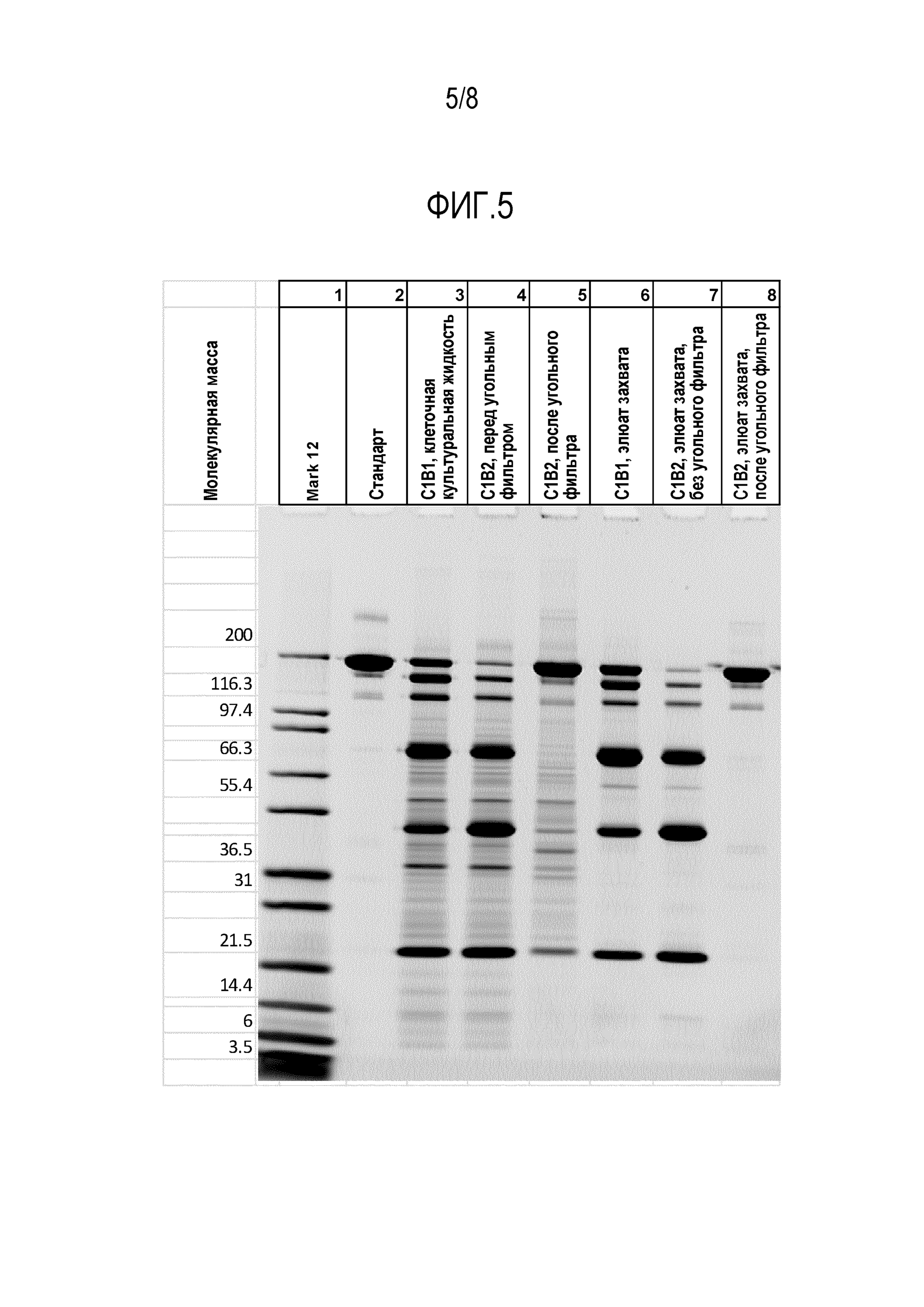
Фигура 5: Невосстановительный SDS-PAGE анализ с окрашиванием Sypro производственных образцов соединения В. Дорожка 1: стандарт молекулярной массы, Дорожка 2: эталонный стандарт соединения 1, Дорожка 3: клеточная культуральная жидкость партии 1 цикла 1, Дорожка 4: партия 2 цикла 1 до угольного фильтра, Дорожка 5: партия 2 цикла 1 после угольного фильтра, Дорожка 6: элюат захвата для партии 1 цикла 1, Дорожка 7: элюат захвата без угольного фильтра для партии 2 цикла 1, Дорожка 8: элюат захвата после угольного фильтра для партии 2 цикла 1.
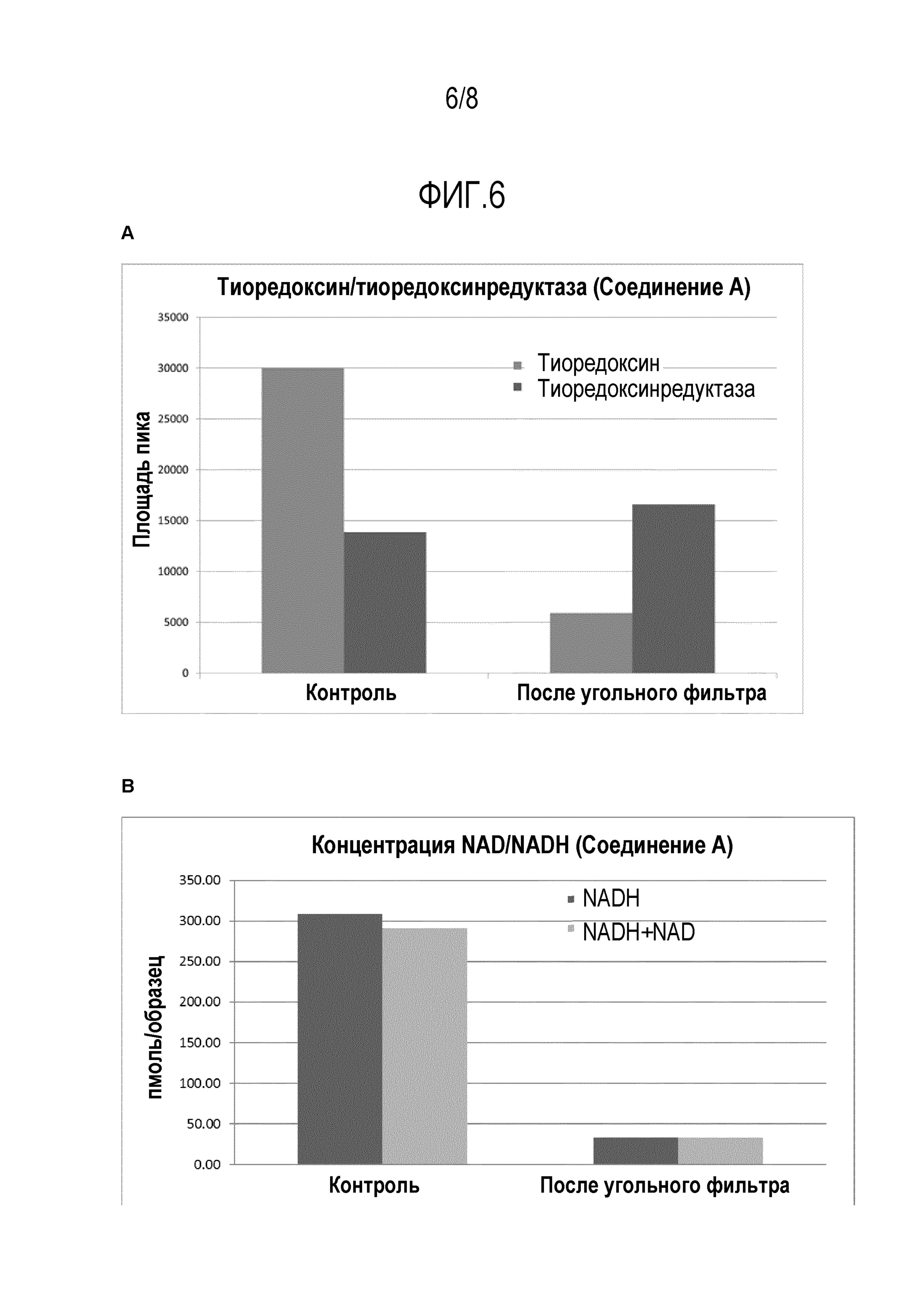
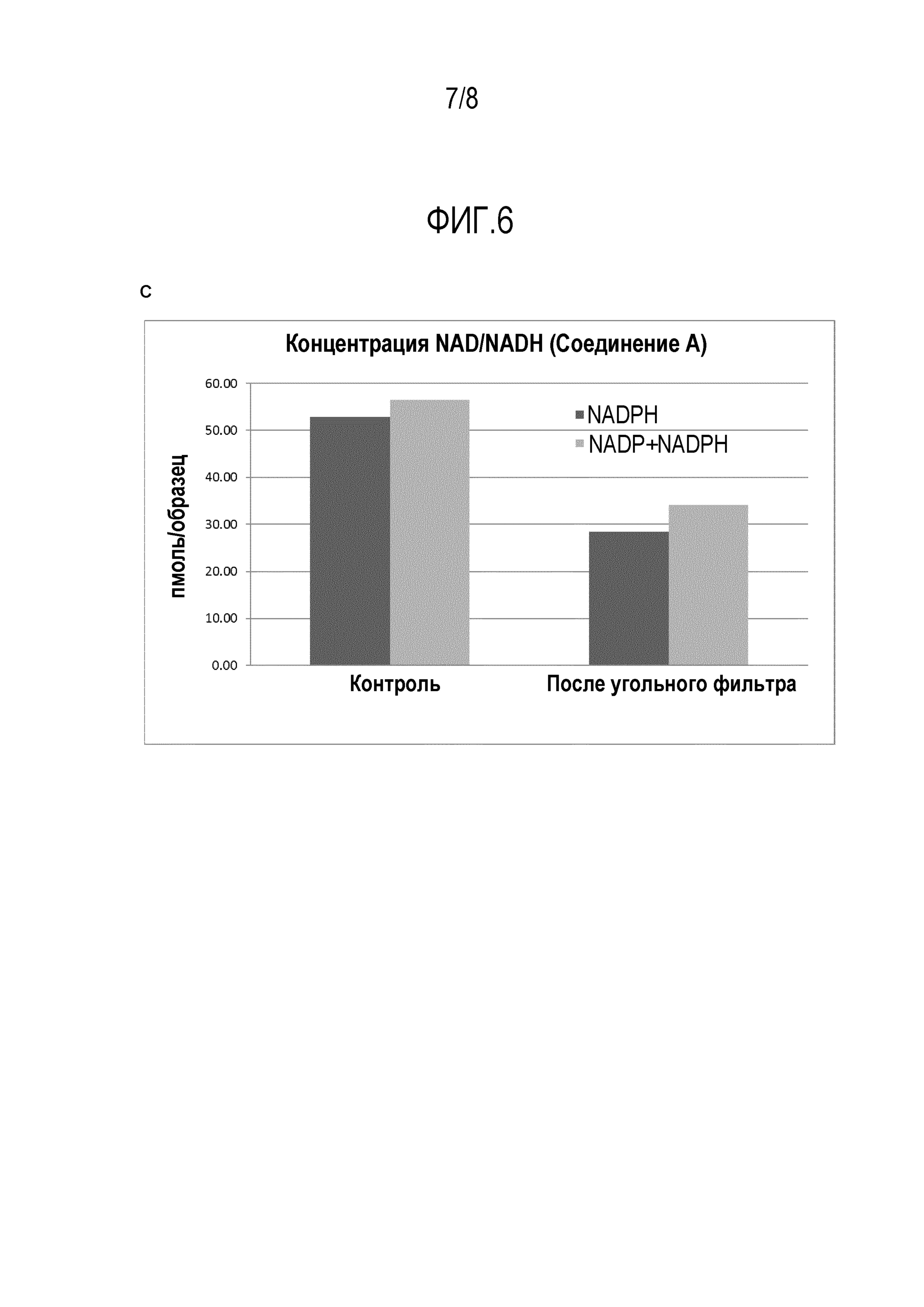
Фигура 6: Осветленная клеточная культуральная жидкость (CCCF) соединения А с глубинной и стерилизующей фильтрацией (контроль) и после введения угольного фильтра между глубинным и стерилизующим фильтрами, анализируемая на восстанавливающие агенты тиоредоксин (А), NAD/NADH (B) и NADP/NADPH (C).
Фигура 7: Осветленная клеточная культуральная жидкость (CCCF) соединения B из партии 1 (до введения угольного фильтра, контроль) и партии 2 (после введения угольного фильтра), анализируемая на восстанавливающие агенты NAD/NADH и NADP/NADPH.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение решает указанную выше потребность, предлагая новый способ получения антител, который позволяет выделять антитело с нативными дисульфидными связями, соответственно повышая выход процесса и гарантируя стабильность между партиями.
Таким образом, в первом аспекте изобретение относится к способу получения антитела или его фрагмента, включающему:
- экспрессию указанного антитела или его фрагмента в клетке-хозяине;
- выделение смеси, содержащей антитело или его фрагмент, обломки клеток-хозяев и примеси; и
- очистку указанного антитела или его фрагмента от смеси, при этом указанная очистка включает:
- фильтрацию через активированный уголь, за которой следует
- хроматография на белке А.
Во втором аспекте изобретение относится к способу предотвращения восстановления дисульфидной связи во время очистки антитела или его фрагмента, экспрессированного в клетке-хозяине, ему
- фильтрацию через активированный уголь, за которой следует
- хроматография на белке А.
В третьем аспекте изобретение относится к способу очистки антитела или его фрагмента, включающему:
- фильтрацию через активированный уголь, за которой следует
- хроматография на белке А.
В четвертом аспекте изобретение относится к способу уменьшения количества восстанавливающих агентов во время очистки антитела или его фрагмента, включающему:
- фильтрацию через активированный уголь, за которой следует
- хроматография на белке А.
Восстанавливающий агент, также называемый в данной области восстановителем или редуцирующим агентом, представляет собой элемент или соединение, которое теряет (или отдает) электрон другим химическим соединениям в окислительно-восстановительной химической реакции. Поскольку восстанавливающий агент теряет электроны, считается, что он окисляется. Некоторые восстанавливающие агенты, такие как, например, кальций, могут присутствовать в клеточной культуральной среде, дополнительные восстанавливающие агенты могут быть секретированы в клеточную культуральную жидкость в результате метаболизма клеток-хозяев. Кроме того, во время получения рекомбинантного белка восстанавливающие агенты могут дополнительно высвобождаться в среде из-за усилий сдвига и последующего повреждения клеток и возможного лизиса и/или апоптоза, выделяющих клеточные компоненты в среду. Количество и мощность восстанавливающих агентов высвобожденного содержимого клеток зависит от клеточной линии и процесса; примеры таких восстанавливающих агентов включают, без ограничения, глутатион, цистеинилглицинат, цистеинилсульфонат, тиоредоксин, NADP, NADPH, NAD, NADH.
В частном варианте осуществления четвертого аспекта изобретения способ по изобретению снижает количество тиоредоксина, NADP, NADPH, NAD и/или NADH.
В еще одном частном варианте осуществления четвертого аспекта изобретения способ по изобретению снижает количество тиоредоксина, NADP, NADPH, NAD и/или NADH.
Как правило, хроматографию на белке А проводят в режиме связывания и элюирования, в котором связывание представляющего интерес белка с твердой фазой позволяет примесям, таким как белки клеток-хозяев, протекать через хроматографическую среду, в то время как представляющий интерес белок остается связанным с твердой фазой. Представляющий интерес связанный белок затем извлекают из твердой фазы элюирующим буфером, который разрушает механизм, с помощью которого представляющий интерес белок связывается с указанной твердой фазой.
В еще одном варианте осуществления способа по изобретению первый раствор добавляют к хроматографическому материалу белка А после нанесения смеси, содержащей антитело или его фрагмент, благодаря чему несвязанный материал удаляется в раствор.
В еще одном варианте осуществления способа по изобретению элюирующий буфер наносят на хроматографический материал белка А, благодаря чему связанное антитело или его фрагмент высвобождаются.
В частном варианте осуществления способа по изобретению связанное антитело высвобождается из хроматографического материала белка А путем нанесения элюирующего буфера с рН, подходящим для нарушения связывания антитела. Указанный рН зависит от конкретного соединения и обычно определяется эмпирически специалистом и корректируется для достижения желаемого конечного показателя, т.е. может быть желательно извлечение наибольшего возможного количества мономера из нанесенной смеси, или может быть желательно получить мономер с максимально возможной чистотой. В конкретном варианте осуществления способа по изобретению элюирующий буфер имеет pH от 3 до 4,5, предпочтительно от 3,2 до 4,3, от 3,5 до 4, предпочтительно от 3,6 до 3,9.
Буферы, пригодные для использования в качестве промывочных и элюирующих буферов в хроматографии на белке А, легко доступны в данной области, и могут быть выбраны, в качестве неограничивающих примеров, среди прочего, из фосфатно-солевого буферного раствора (PBS), Трис, гистидиновых, ацетатных, цитратных буферов или буферов MES (2-(N-морфолин)этансульфоновой кислоты-имидазола), BES (N,N-(бис-2-гидроксиэтил)-2-аминоэтансульфоновой кислоты), MOPS (3- (N-морфолин)пропансульфоновой кислоты) или HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты).
Во втором варианте осуществления изобретение относится к способу в соответствии с первым, вторым, третьим или четвертым аспектом, где указанная очистка включает по меньшей мере одну дополнительную стадию хроматографии. Указанные дополнительные стадии хроматографии выбирают из анионообменной или катионообменной хроматографии, хроматографии гидрофобного взаимодействия, хроматографии со смешанным режимом, такой как хроматография на гидроксиапатите, хиральная хроматография или диэлектрическая хроматография. Эти стадии хроматографии могут применяться по отдельности или, в качестве альтернативы, в сочетании с еще одной стадией хроматографии. Кроме того, эти стадии хроматографии могут работать в режиме связывания и элюирования или в проточном режиме. В проточном режиме примеси связываются или имеют пониженную подвижность в твердой фазе, тогда как целевой белок выделяют в элюате или проточной фракции. В еще одном конкретном варианте осуществления указанные дополнительные стадии хроматографии проводят после хроматографии на белке А.
В третьем варианте осуществления изобретение относится к способу в соответствии со вторым вариантом осуществления, при этом указанные дополнительные стадии хроматографии включают катионообменную хроматографию и/или анионообменную хроматографию.
В частном варианте осуществления изобретения указанная первая дополнительная стадия хроматографии представляет собой стадию анионообменной хроматографии для захвата примесей и образования проточной фракции, содержащей белок.
В одном конкретном варианте осуществления изобретения за первой дополнительной стадией хроматографии следует стадия катионообменной хроматографии, на которой представляющий интерес белок связывается с хроматографической средой и затем элюируется в элюат, содержащий белок. В качестве альтернативы, указанную стадию катионообменной хроматографии осуществляют таким образом, чтобы захватить примеси и получить проточную фракцию, содержащую белок.
В еще одном варианте осуществления изобретение относится к способу в соответствии со вторым или третьим вариантом осуществления, в котором указанные дополнительные стадии хроматографии включают первую стадию анионообменной хроматографии и вторую стадию катионообменной хроматографии.
В альтернативном варианте осуществления изобретение относится к способу в соответствии со вторым или третьим вариантом осуществления, в котором указанные дополнительные стадии хроматографии включают первую стадию катионообменной хроматографии и вторую стадию анионообменной хроматографии.
В других вариантах осуществления одна или более стадий ультрафильтрации или диафильтрации (UF/DF) осуществляются между стадиями хроматографии. В промышленном производстве белков это обычно осуществляют с использованием стадии тангенциальной поточной фильтрации на основе мембраны, выполняемой с целью концентрирования продукта и замены буфера. Эти мембраны обычно характеризуются низким связыванием белка и имеют определенное номинальное отсечение по молекулярной массе для предотвращения потери продукта, например, они включают мембраны из простого полиэфирсульфона (PES) с номинальным отсечением по молекулярной массе 30 кДа (мембрана T-series Omega PES от Pall Life Sciences) или регенерированную целлюлозу с номинальным отсечением по молекулярной массе 30 кДа (Delta Regenerated Cellulose Membrane от Pall Life Sciences). В качестве альтернативы используют мембраны с отсечением по молекулярной массе 30 кДа, такие как Pellicon 3 от Millipore или Hydrosart от Sartorius.
Методика очистки может включать любую из этих стадий в различных комбинациях для соответствия физико-химическим свойствам целевого белка.
В еще одном конкретном варианте осуществления способа по изобретению стадия очистки белка от смеси включает первую дополнительную стадию хроматографии, которая представляет собой анионообменную хроматографию, на которой получают первую проточную фракцию, содержащую белок, вторую дополнительную стадию хроматографии, которая представляет собой катионообменную хроматографию, на которой элюируется элюат, содержащий белок; и вторую стадию ультрафильтрации или диафильтрации, проведенную на элюате.
В еще одном конкретном варианте осуществления способа по изобретению стадия очистки белка от смеси включает первую дополнительную стадию хроматографии, которая представляет собой катионообменную хроматографию, на которой элюируется первый элюат, содержащий белок, первую стадию ультрафильтрации или диафильтрации, проведенную на первом элюате, вторую дополнительную стадию хроматографии, которая представляет собой анионообменную хроматографию с получением проточной фракции, содержащей белок; и вторую стадию ультрафильтрации или диафильтрации, проведенную на проточной фракции.
В еще одном конкретном варианте осуществления способа по изобретению процесс очистки также включает стадию ультрафильтрации или диафильтрации после хроматографии на белке А и перед дополнительными стадиями хроматографии.
В четвертом варианте осуществления изобретение относится к способу в соответствии с любым из предшествующих вариантов осуществления, в котором выделенное антитело или его фрагмент содержит нативные дисульфидные связи.
В пятом варианте осуществления изобретение относится к способу в соответствии с любым из предшествующих вариантов осуществления, в котором выделенное антитело или его фрагмент содержит нативные межцепочечные дисульфидные связи.
В еще одном варианте осуществления, в соответствии с любым из аспектов изобретения, изобретение относится к способу в соответствии с любым из предшествующих вариантов осуществления, в котором антитело или фрагмент, выделенные в результате хроматографии на белке A, содержат менее 10%, менее 5%, менее 4%, менее 3%, менее 2% или менее 1% связанных с восстановлением антитела примесей.
В другом дополнительном варианте осуществления, в соответствии с любым из аспектов изобретения, изобретение относится к способу в соответствии с любым из предшествующих вариантов осуществления, в котором антитело или его фрагмент, выделенные в результате хроматографии на белке A, содержит меньше связанных с восстановлением антитела примесей, чем антитело или фрагмент, выделенные в результате этого же процесса без использования стадии фильтрации через активированный уголь.
В еще одном альтернативном варианте осуществления, в соответствии с любым из аспектов изобретения, изобретение относится к способу в соответствии с любым из предшествующих вариантов осуществления, в котором очищенное антитело или его фрагмент имеет пониженный уровень связанных с восстановлением антитела примесей.
В еще одном альтернативном варианте осуществления, в соответствии с любым из аспектов изобретения, изобретение относится к способу в соответствии с любым из предшествующих вариантов осуществления, в котором очищенное антитело или его фрагмент имеет пониженный уровень связанных с восстановлением антитела примесей после стадии хроматографии на белке А.
В шестом варианте осуществления изобретение относится к способу в соответствии с любым из предшествующих вариантов осуществления, в котором указанная клетка-хозяин является клеткой-хозяином млекопитающего, и смесь, содержащая антитело, является супернатантом клеточной культуры.
В седьмом варианте осуществления изобретение относится к способу согласно пятому варианту осуществления, в котором указанный процесс очистки дополнительно включает глубинную фильтрацию супернатанта клеточной культуры перед фильтрацией через активированный уголь.
В дополнительном возможном варианте осуществления изобретения указанная последовательность фильтрации может включать дополнительные фильтры, доступные специалисту, такие как, например, стерилизующий фильтр.
Последовательные стадии фильтрации во время очистки белка могут быть осуществлены как отдельные стадии, при этом фильтруемую смесь пропускают через один фильтр, фильтрат извлекают и затем пропускают через второй фильтр, из которого извлекается второй фильтрат. В качестве альтернативы, указанные стадии фильтрации могут осуществляться однопоточно, когда один фильтр примыкает к следующему, благодаря чему фильтруемая среда последовательно пропускается через оба фильтра, и после этой стадии извлекается один фильтрат; указанная однопоточная установка обычно называется последовательностью фильтров.
В восьмом варианте осуществления изобретение относится к способу согласно седьмому варианту осуществления, в котором глубинная фильтрация и фильтрация через активированный уголь осуществляются однопоточно.
В качестве альтернативы, в другом конкретном варианте осуществления седьмого варианта осуществления способа по изобретению, глубинная фильтрация и фильтрация через активированный уголь представляют собой отдельные стадии.
Клетки-хозяева согласно вариантам осуществления изобретения представляют собой, например, к прокариотические клетки, дрожжевые клетки (например, без ограничения Candida boidinii, Hansenula polymorpha, Pichia methanolica, Pichia pastoris, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyveromyces lactis и другие Kluyveromyces spp., Yarrowia lipolytica), клетки миксомицет (например, без ограничения, Dictyostelium discoideum), мицелиальных грибов (например, без ограничения, Trichoderma reesei и другие Trichoderma spp., Aspergillus niger и другие Aspergillus spp.), мха (например, без ограничения, Physcomitrella patens, Atrichum undulatum), насекомых или млекопитающих. Клетки-хозяева млекопитающих представляют собой, например, без ограничения NSO, SP2.0, клетки 3Т3, клетки COS, клетки остеосаркомы человека, клетки MRC-5, клетки почки новорожденного хомяка (BHK), клетки VERO, клетки СНО, клетки rCHO-tPA, клетки rCHO-поверхностного антигена гепатита В, клетки CHO-S, клетки HEK 293, клетки rHEK 293, клетки C127, клетки rC127-поверхностного антигена гепатита В, клетки фибробластов человека, стромальные клетки, клетки гепатоцитов или клетки PER.C6.
Клетки-хозяева предпочтительно представляют собой эукариотические клетки-хозяева, предпочтительно клетки-хозяева млекопитающих, более предпочтительно клетки яичника китайского хомячка (CHO), например, штамма DG44.
Для эукариотических клеток-хозяев (например, дрожжей, клеток насекомых или млекопитающих) могут использоваться различные транскрипционные и трансляционные регуляторные последовательности, в зависимости от природы хозяина. Они могут быть получены из вирусных источников, таких как аденовирус, вирус папилломы крупного рогатого скота, вирус обезьяны или тому подобное, где регуляторные сигналы связаны с определенным геном, который имеет высокий уровень экспрессии. Примерами являются промотор TK вируса герпеса, ранний промотор SV40, промотор гена gal4 дрожжей, и т.д. Могут быть выбраны регуляторные сигналы инициации транскрипции, которые обеспечивают репрессию и активацию, благодаря чему экспрессию генов можно модулировать. Клетки, которые были стабильно трансформированы введенной ДНК, могут быть выбраны путем введения одного или более маркеров, которые обеспечивают отбор клеток-хозяев, которые содержат вектор экспрессии. Маркер может также обеспечивать фототрофию у ауксотропного хозяина, резистентность к биоцидам, например, без ограничения, к антибиотикам или тяжелым металлам, таким как медь, или тому подобное. Селектируемый маркерный ген может быть или непосредственно связан с экспрессируемой последовательностью гена ДНК или же введен в эту же клетку с помощью котрансфекции. Дополнительные элементы также могут быть необходимы для оптимального синтеза белков по изобретению.
Эукариотические клетки-хозяева трансфицируют одним или несколькими векторами экспрессии, кодирующими представляющий интерес белок, и затем культивируют в любой среде, которая будет поддерживать их рост и экспрессию представляющего интерес белка. Среда представляет собой химически определенную среду, не содержащую продуктов животного происхождения, таких как животная сыворотка и пептон. Существуют различные клеточные культуральные среды, доступные специалисту в данной области, содержащие различные комбинации витаминов, аминокислот, гормонов, факторов роста, ионов, буферов, нуклеозидов, глюкозы или эквивалентного источника энергии, присутствующие в соответствующих концентрациях, чтобы обеспечить рост клеток и получение белка. Дополнительные компоненты клеточных культуральных сред могут быть включены в клеточную культуральную среду в соответствующих концентрациях в разное время цикла культивирования клеток, что известно специалистам в данной области.
Культивирование клеток млекопитающих может происходить в любом подходящем контейнере, таком как встряхивая колба или биореактор, который может работать или может и не работать в режиме с подпиткой, в зависимости от требуемого масштаба производства. Эти биореакторы могут представлять собой реакторы с мешалкой или эрлифтные реакторы. Доступны различные крупномасштабные биореакторы емкостью более 400 л, от 1000 л до 50000 л или до 100000 л, предпочтительно от 5000 л до 20000 л или до 10000 л. В качестве альтернативы, биореакторы меньшего масштаба, такие как от 2 л до 80 л и 100 л, также можно использовать для получения антитела в соответствии со способом по изобретению.
Представляющий интерес белок, такой как антитело или антигенсвязывающий фрагмент, продуцируемый в эукариотической клетке-хозяине, такой как клетка СНО, в соответствии с процессом и способами настоящего изобретения обычно находится в супернатанте клеточной культуры. В одном из вариантов осуществления изобретения указанный супернатант представляет собой смесь, очищенную в способе изобретения.
Поэтому в конкретном варианте осуществления изобретения процесс и способы по изобретению включают стадию центрифугирования клеточной культуральной жидкости и извлечения жидкой фазы после центрифугирования, для получения смеси, содержащей антитело или его фрагмент, для дальнейшей очистки в соответствии со способом по изобретению.
В качестве альтернативы или дополнительно, указанный супернатант может быть извлечен с использованием методик осветления, известных специалисту в данной области, таких как, например, глубинная фильтрация. Поэтому в конкретном варианте осуществления изобретения способ включает стадию глубинной фильтрации для получения смеси, содержащей антитело или его фрагмент, для дальнейшей очистки в соответствии со способом по изобретению.
В качестве альтернативы, клетки-хозяева представляют собой прокариотические клетки, предпочтительно грамотрицательных бактерий, предпочтительно клетки E. coli. Прокариотические клетки-хозяева для экспрессии белка хорошо известны в данной области (Terpe, 2006; Appl Microbiol Biotechnol 72, 211-222.). Клетки-хозяева представляют собой рекомбинантные клетки, которые были образованы генетическими методами для получения представляющего интерес белка, такого как фрагмент антитела. Рекомбинантные клетки-хозяева E. coli могут быть получены из любого подходящего штамма E. coli, включая MC4100, TG1, TG2, DHB4, DH5α, DH1, BL21, K12, XL1Blue и JM109. Одним из примеров является штамм E.coli W3110 (АТСС 27325), обычно используемый штамм-хозяин для ферментации рекомбинантных белков. Фрагменты антител также могут быть получены путем культивирования модифицированных штаммов E. coli, например, метаболических мутантов или дефицитных по протеазе штаммов E. coli.
Фрагмент антитела, который может быть очищен в соответствии со способами согласно настоящему изобретению, обычно находится либо в периплазме клетки-хозяина E. coli, либо в супернатанте культуры клеток-хозяина, в зависимости от природы белка, масштаба производства и используемого штамма E. coli. Способы направления белков в эти области хорошо известны в области техники (Makrides, 1996; Microbiol Rev 60, 512-538). Примеры подходящих сигнальных последовательностей для направления белков в периплазму E. coli включают сигнальные последовательности E. coli PhoA, OmpA, OmpT, LamB и OmpF. Белки могут быть направлены в супернатант, опираясь на естественные секреторные пути, или путем индукции ограниченной проницаемости наружной мембраны, чтобы вызвать секрецию белка, примерами которой являются использование pelB-лидера, лидера белка А, коэкспрессия белка высвобождения бактериоцинов, митомицин-индуцированного белка высвобождения бактериоцинов, наряду с добавлением глицина к культуральной среде и коэкспрессией гена kil для пермеабилизации мембраны. Наиболее предпочтительно в способах изобретения рекомбинантный белок экспрессируется в периплазме хозяина E. coli.
Экспрессия рекомбинантного белка в клетках-хозяевах E.coli также может находиться под контролем индуцибельной системы, при этом экспрессия рекомбинантного антитела в E. coli находится под контролем индуцибельного промотора. Многие индуцибельные промоторы, подходящие для использования в E. coli, хорошо известны в данной области и зависят от промотора; экспрессия рекомбинантного белка может быть индуцирована различными факторами, такими как температура или концентрация конкретного вещества в питательной среде. Примеры индуцибельных промоторов включают промоторы lac, tac и trc E.coli, которые индуцируются лактозой или негидролизуемым аналогом лактозы, изопропил-бета-D-1-тиогалактопиранозид (IPTG) и phoA, trp и araBAD промоторы, которые индуцируются фосфатом, триптофаном и L-арабинозой, соответственно. Экспрессия может быть индуцирована, например, добавлением индуктора или изменением температуры, если индукция зависит от температуры. Если индукция экспрессии рекомбинантного белка достигается добавлением индуктора в культуру, - индуктор может быть добавлен любым подходящим способом в зависимости от системы ферментации и индуктора, например, путем однократной или многократных дробных добавок или путем постепенного добавления индуктора через питательное вещество. Следует отметить, что может быть задержка между добавлением индуктора и фактической индукцией экспрессии белка, например, когда индуктор представляет собой лактозу, может быть задержка перед индукцией экспрессии белка, в то время как любой уже существующий источник углерода утилизируется перед лактозой.
Культуры клеток-хозяев E. coli (ферментации) можно культивировать в любой среде, которая будет поддерживать рост E. coli и экспрессию рекомбинантного белка. Среда может быть любой химически определенной средой, такой как, например, описанная Durany O, 2004, в Process Biochem 39, p.1677-1684.
Культивирование клеток-хозяев E. coli может происходить в любом подходящем контейнере, таком как встряхивая колба или ферментер, в зависимости от требуемого масштаба производства. Доступны различные крупномасштабные ферментеры емкостью более 1000 л, до 100000 л. Предпочтительно используют ферментеры от 1000 л до 50000 л, более предпочтительно от 1000 л до 10000 л или 12000 л. Также могут быть использованы ферментеры меньшего масштаба, с емкостью от 0,5 л до 1000 л.
Ферментация клеток-хозяев, таких как СНО или E. coli, может быть осуществлена в любой подходящей системе, например, работающей в непрерывном, периодическом режиме или режиме с подпиткой, в зависимости от белка и требуемого выхода. Может использоваться периодический режим с дробными добавками питательных веществ или индукторов, где это необходимо. В качестве альтернативы, можно использовать культуру с подпиткой и культуры, выращенные в периодическом режиме преиндукции при максимальной удельной скорости роста, которые могут поддерживаться с помощью питательных веществ, изначально присутствующих в ферментере, и один или более режимов подачи питательных веществ, используемых для регулирования скорости роста до завершения ферментации.
В одном варианте осуществления способ по настоящему изобретению включает, перед загрузкой на хроматографическую матрицу белка А, стадию центрифугирования сбора клеточной культуры, за которой следует суспендирование клеток-хозяев с помощью добавления экстрагирующего буфера.
Для процессов ферментации E. coli, в которых представляющий интерес белок, такой как фрагмент антитела, находится в периплазматическом пространстве клетки-хозяина, необходимо высвободить белок из клетки-хозяина. Высвобождение может быть достигнуто любым подходящим способом, таким как лизис клеток путем механической обработки или обработки давлением, способом замораживания-оттаивания, осмотического шока, использованием экстрагирующих агентов или тепловой обработкой. Такие способы экстракции для высвобождения белка хорошо известны в данной области.
Используемый здесь термин «активированный уголь» относится к форме углерода, который был обработан с образованием миллионов крошечных пор между атомами углерода, что приводит к значительному увеличению площади поверхности. Площадь поверхности активированного угля делает материал подходящим для адсорбции, процесса, с помощью которого примеси удаляются из текучих сред, паров или газа. Активированный уголь также известен как активный древесный уголь. Коммерчески доступные фильтры с активированным углем включают, без ограничения, Millipore Millistak+ CR series, Pall Activated Carbon Filters Incorporating Seitz® AKS Filter Media, и 3M Zeta Plus™ Activated Carbon Filters.
Термин «анионообменная хроматография», используемый в рамках изобретения, относится к хроматографии, в которой твердая фаза является положительно заряженной, например, имеет один или более положительно заряженных лигандов, таких как присоединенные к ней четвертичные аминогруппы. Коммерчески доступные анионообменные матрицы включают DEAE-целлюлозу, QAE SEPHADEXTM, FAST Q SEPHAROSETM Capto Q, Capto Adhere и Capto Q Impres (GE Healthcare), Unosphere и Nuvia Q (BioRad), GigaCap Q (Tosoh), Mustang Q XT (Pall), Fractogel Q и Eshmuno Q (Merck Millipore), Poros XQ (Thermo Fisher) и анионообменные мембранные адсорберы, такие как SartoBind Q (Sartorius) и монолитные адсорберы, такие как монолиты QA (Bia Separations).
Термин «антитело» или «антитела», используемый в рамках изобретения, относится к моноклональным или поликлональным тетрамерным полноразмерным антителам, содержащим две тяжелые и две легкие цепи. Термин «иммуноглобулин» или «иммуноглобулины» используется как синоним «антитела» или «антител», соответственно. Используемый здесь термин «антитело» или «антитела» включает, без ограничения, рекомбинантные антитела, которые вырабатывают с помощью рекомбинантных технологий, как известно в данной области. «Антитело» или «антитела» могут быть любого происхождения, в том числе от таких видов млекопитающих, как человек, отличные от человека приматы (например, человекообразные, такие как шимпанзе, бабуин, макак-резус или макак-крабоед), грызуны (например, от мыши, крысы, кролика, хомяка или морской свинки), козы, крупный рогатый скот или лошади. Антитело здесь направлено против представляющего интерес «антигена». Предпочтительно антиген представляет собой биологически важный полипептид, и введение антитела млекопитающему, страдающему заболеванием или нарушением, может вызвать терапевтический эффект у этого млекопитающего. Однако рассматриваются также антитела, направленные против неполипептидных антигенов. Если антиген представляет собой полипептид, он может представлять собой трансмембранную молекулу (например, рецептор) или лиганд, такой как фактор роста или цитокин. Предпочтительные молекулярные мишени для антител, охватываемых настоящим изобретением, включают полипептиды CD, такие как CD3, CD4, CD8, CD19, CD20, CD22, CD34, CD38, CD40 и CD40-L; FcRN; OX40; члены семейства рецепторов HER, такие как рецептор EGF, рецептор HER2, HER3 или HER4; молекулы клеточной адгезии, такие как LFA-1, Mac1, p150,95, VLA-4, ICAM-1, VCAM и av/b3-интегрин, включая их α или β субъединицы (например, антитела анти-CD11a, анти-CD18 или анти-CD11b); хемокины и цитокины или их рецепторы, такие как IL-1 α и β, IL-2, рецептор IL-6, IL-12, IL-13, IL-17A и/или IL-17F, IL-18, IL-21, IL-23, TNFα и TNFβ; факторы роста, такие как VEGF; IgE; антигены группы крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl; CTLA-4; полипептид С; PD1, PD-L1, PCSK9; склеростин и т.д.
Термин «фрагмент антитела» или «фрагменты антител», используемый в рамках изобретения, относится к части антитела, обычно к его антигенсвязывающей или вариабельной области. Примеры фрагментов антител включают любое антитело, которое не содержит или не имеет Fc-части. Примеры фрагментов антител включают также такие фрагменты, как Fab, Fab', F(ab')2 и Fv, и scFv; а также диатела, включая такие форматы, как BiTE® (биспецифичные активаторы T-клеток) и DART™ (технология переориентирующегося антитела с двойной аффинностью), триатела, тетратела, минитела, доменные антитела (dAbs), такие как sdAbs, VHH и VNAR фрагменты, одноцепочечные антитела, биспецифические, триспецифические, тетраспецифические или мультиспецифические антитела, образованные из фрагментов антител или антител, включая, без ограничения,, Fab-Fv, Fab-scFv, Fab(Fv)2 или Fab-(scFv)2 конструкции. Определенные выше фрагменты антител известны в данной области техники. Для ясности следует понимать, что Fab-Fv относится к конструкции, содержащей одну Fv-область и одну Fab-область, соединенные в любом порядке, т.е. Fab-Fv, или Fv-Fab, при этом за последними аминокислотами в одной области следуют первые аминокислоты в следующей области или наоборот. Аналогичным образом, следует понимать, что Fab-scFv относится к конструкции, содержащей одну scFv-область и одну Fab-область, соединенные в любом порядке, и в случае Fab с каждой полипептидной цепью, т.е. Fab-scFv или scFv-Fab, при этом за последней аминокислотой в одной области следует первая аминокислота в следующей области или наоборот. Аналогичным образом, следует понимать, что Fab-(Fv)2 относится к конструкции, содержащей две Fv-области и одну Fab-область, соединенные в любом порядке, т.е. Fab-Fv-Fv, Fv-Fab-Fv или Fv-Fv-Fab, при этом за последними аминокислотами в одной области следуют первые аминокислоты в следующей области или наоборот. Аналогичным образом, следует понимать, что Fab-(scFv)2 относится к конструкции, содержащей две scFv-области и одну Fab-область, соединенные в любом порядке, и в случае Fab с каждой полипептидной цепью, что приводит к 20 возможным перестановкам. Обычно эти конструкции включают пептидный линкер между первой областью (например, Fab) и второй областью (например, Fv). Такие линкеры хорошо известны в данной области техники и могут быть одной или несколькими аминокислотами, обычно оптимизированными по длине и составу специалистом. В качестве альтернативы, указанные области могут быть связаны непосредственно, т.е. без пептидного линкера. Примеры подходящих линкерных областей для связывания вариабельного домена с Fab или Fab' описаны в WO 2013/068571, включенном в настоящее описание посредством ссылки, и включают, без ограничения, гибкие линкерные последовательности и жесткие линкерные последовательности. Гибкие линкерные последовательности включают последовательности, описанные в Huston et al., 1988, 10 PNAS 85:5879-5883; Wright & Deonarain, Mol. Immunol., 2007, 44(11):2860-2869; Alfthan et al., Prot. Eng., 1995, 8(7):725-731; Luo et al., J. Biochem., 1995, 118(4):825-831; Tang et al., 1996, J. Biol. Chern. 271(26): 15682-15686; и Turner et al., 1997, JIMM 205, 42-54. Фрагменты антител могут быть агликозилированными или гликозилированными.
Термин «связанные с восстановлением антитела примеси», используемый в рамках изобретения, относится к примесям, таким как свободные тяжелые и легкие цепи, полумономеры (одна тяжелая цепь и одна легкая цепь) или изоформы, частично лишенные дисульфидных связей, благодаря восстановлению межцепочечных дисульфидных связей.
Термин «катионообменная хроматография», используемый в рамках изобретения, относится к хроматографии, в которой твердая фаза, которая отрицательно заряжена, например, имеет один или более отрицательно заряженных лигандов, таких как, например, карбоксилатная или сульфонатная группа. Коммерчески доступные катионообменные матрицы включают карбоксиметилцеллюлозу, сульфопропил (SP), иммобилизованный на агарозе и сульфонил, иммобилизованный на агарозе, такие как Capto S и Capto S Impres (GE Healthcare), Unosphere S и Nuvia S (BioRad), GigaCap S (Tosoh), Fractogel S и Eshmuno S (Merck Millipore), Poros S и Poros XS (Thermo Fisher), или катионообменные мембранные адсорберы, такие как SartoBind Q (Sartorius) и монолитные адсорберы, такие как монолиты SO3 (Bia Separations).
Термин «белок А», используемый в рамках изобретения, охватывает белок А, выделенный из своего нативного источника, белок А, полученный синтетическим путем (например, пептидным синтезом или рекомбинантными способами), и его варианты, которые сохраняют способность связывать белки, которые имеют CH2/CH3-область, такую как Fc-область. Белок А может быть коммерчески приобретен у Repligen, GE Healthcare и Fermatech. Белок A обычно иммобилизуют на твердофазном материале носителя, таком как мембрана или смола. Термин «белок А» также относится к смоле или колонке афинной хроматографии, содержащей твердую хроматографическую матрицу-носитель, к которой ковалентно присоединен белок А. Коммерчески доступные матрицы белка А включают MabSelect, MabSelect SuRe, MabSelect SuRe LX от GE Healthcare; Amsphere Protein A (JSR Life Sciences), KanCapA (Kaneka), AbSolute® High Cap (NovaSep), UNOsphere SUPrA (BioRad), Toyopearl (Toso BioScience), Prosep Ultra plus, Eshmuno A, ProSep®-vA, ProSep®-vA Ultra от Millipore, Poros Mab-Capture A (Life Technologies) и Praesto AC (Purolite).
Термин «глубинный фильтр», используемый в рамках изобретения, относится к множеству фильтров, которые используют пористую фильтрующую среду для удерживания частиц во всей среде, а не только на поверхности среды. Они обычно используются для текучих сред, которые имеют высокую концентрацию частиц, поскольку они могут удерживать большую массу частиц до своего насыщения.
ПРИМЕРЫ
Пример 1: Предотвращение восстановления антител в процессе с биореактором масштаба 2000 л
В настоящем примере производство соединения A в масштабе 2000 л продемонстрировало значительное восстановление антител в цикле 2 после стадии захватывающей хроматографии на белке A. В последующем производственном цикле (цикл 3) была реализована стадия фильтрации через активированный уголь (Millistak+CR40, Millipore) в процессе первичного извлечения, как показано на фиг.3. В этом цикле не было обнаружено никакого восстановления антител.
Соединение А представляет собой гуманизированное моноклональное антитело IgG4P, экспрессированное в клеточной линии CHO DG44 в процессе с биореактором с периодической подпиткой, и очищаемое с помощью способа трехстадийной хроматографии. Определено, что теоретическая интактная масса полной гликозилированной молекулы составляла 147460 Да. На фиг.3 подробно описан процесс очистки соединения А с подаваемым материалом из 2000 л биореактора, выращиваемом в течение 14 суток. Материал центрифугировали с помощью тарельчатой центрифуги, используя оптимизированные настройки для извлечения и очистки продукта. В цикле 2 центрифугат (или супернатант) далее отфильтровывали с помощью фильтров Pall PDE2 и PDD1 (или эквивалентных), за чем следовала стерилизующая фильтрация. Затем следовала стадия захвата с использованием белка A (MabSelect SuRe LX, GE Healthcare), и последующие стадии очистки: анионный обмен (AEX с использованием Capto Q, GE Healthcare), катионный обмен (CEX с использованием Capto SP ImpRes), снижение вирусной нагрузки фильтрацией (VRF) и приготовление лекарственной формы. В цикле 3 стадию фильтрации через фильтр с активированным углем выполняли в потоке между глубинной фильтрацией и фильтрацией через стерилизующий фильтр (с диаметром пор 0,2 мкм).
Стадия очистки захватывающей хроматографией снижает уровни примесей клеток-хозяев и компонентов клеточной культуральной среды, которые не связываются со смолой. Продукт связывается с колонкой при нейтральном рН. Связанный продукт элюируют из колонки с использованием 30 мМ ацетата натрия, рН 3,7.
Восстановление антител определяли в образцах элюата захвата, проанализированных с помощью невосстанавливающего биоанализатора, см. фиг.2. Аналитический метод использовали для определения чистоты образцов и присутствия примесей, образующихся при восстановлении антител в невосстанавливающих условиях, с помощью анализа чип-электрофореза. Анализ включает две основные стадии: ковалентное связывание белка с флуоресцентным красителем (мечение) и выделение и обнаружение меченных белков с помощью чип-электрофореза.
Чип-анализ состоит из взаимосвязанного набора заполненных гель-полимером микроканалов, которые просеивают белки по размеру, когда они проходят через них под действием электрофореза. Использованным оборудованием был биоанализатор 2100 с программным обеспечением 2100 Expert (поставляется Agilent, каталожный номер G2940CA) и набор для высокочувствительного анализа белков (поставляемый Agilent technologies, каталожный номер 5067-1575).
Образцами были образцы элюата белка A из партии 1 и партии 2 производственного цикла 2 (C2B1 и C2B2, соответственно), в котором угольный фильтр не использовался во время первичного извлечения, и партии 1 цикла 3 (C3B1), в котором угольный фильтр использовался. Продукты восстановления антител (полумономер и свободные цепи), наблюдаемые в образцах цикла 2, не отмечались в образце цикла 3.
На фиг.6 показаны образцы осветленной клеточной культуральной жидкости (CCCF) для соединения А, с глубинной и стерилизующей фильтрацией (цикл 2 процесса, контроль), и после введения угольного фильтра между глубинным и стерилизующим фильтрами (цикл 3 процесса), анализируемые на восстанавливающие агенты тиоредоксин, NAD/NADH и NADP/NADPH. Более низкие уровни этих восстанавливающих агентов обнаруживаются после введения угольного фильтра. Тиоредоксинредуктаза, однако, не удаляется с помощью фильтрации через уголь.
Никотинамидадениндинуклеотид (NAD) является ферментным кофактором, участвующим во многих окислительно-восстановительных реакциях. NAD функционирует как носитель электронов, циклически переходящий между окисленными (NAD) и восстановленными (NADH) формами. Набор MAK037 от Sigma Aldrich для количественного определения NAD/NADH служит для определения NAD и NADH и их соотношения без предварительной очистки от образца. Этот анализ специфичен для NAD и NADH и не обнаруживает NADP или NADPH. NAD общий (NAD и NADH) или NADH количественно определяют в колориметрическом анализе (450 нм).
Никотинамидадениндинуклеотидфосфат (NADP) является ферментным кофактором, участвующим во многих окислительно-восстановительных реакциях, где он циклически переходит между восстановленной (NADPH) и окисленной (NADP) формами.
Набор MAK038 от Sigma Aldrich для количественного определения NADP/NADPH служит для определения NADP и NADPH и их соотношения без предварительной очистки от образца. Этот анализ специфичен для NADP и NADPH и не обнаруживает NAD или NADH. NADP общий (NADP и NADPH) или NADPH количественно определяют в колориметрическом анализе (450 нм).
Тиоредоксин и тиоредоксинредуктазу определяют с помощью Simon Simple Western анализа. Образцы обрабатывают SDS/DTT и денатурируют нагреванием. Затем образцы загружают в капилляры, разделяют по размеру и иммобилизуют на капиллярной стенке с помощью запатентованного способа УФ-захвата. Целевые белки иммунозондируют антителом (антитиоредоксиновый путь/антиглутаредоксин) с последующим HRP-усиленным хемилюминесцентным детектированием (кроличий анти-козий HRP конъюгат).
Пониженный уровень примесей в цикле 3 по сравнению с циклом 2 привел к более высокому выходу продукта на последующей стадии катионообменной хроматографии, предназначенной для удаления низкомолекулярных соединений и высокомолекулярных соединений. Срок хранения материала из цикла 3 также был больше, чем для материала из цикла 2.
Пример 2: Предотвращение восстановления антител в процессе с биореактором масштаба 400 л
В настоящем примере производство соединения В в масштабе 400 л продемонстрировало значительное восстановление антител в партии 1 цикла 1 после стадии захватывающей хроматографии на белке A. В последующих производственных партиях была реализована стадия фильтрации через активированный уголь (Millistak+CR40, Millipore) в процессе первичного извлечения, как показано на фиг.3. В этих партиях не было обнаружено никакого восстановления антител.
Соединение В представляет собой гуманизированное моноклональное антитело IgG4P. Оно экспрессируется в клеточной линии CHO DG44 в процессе с биореактором с периодической подпиткой и очищается с помощью процесса трехстадийной хроматографии. Определено, что теоретическая интактная масса полной гликозилированной молекулы IgG составляла 146372 Да (с точностью до целых Дальтон).
Процесс очистки был очень похож на процесс для соединения А в примере 1. Разница заключалась в том, что элюирующий буфер из колонки для хроматографии на белке А был 100 мМ ацетатом натрия, рН 3,7. Результаты невосстанавливающего биоанализа производственных образцов IgG соединения B, представленные на фиг.4, показывают образцы осветленной клеточной культуральной жидкости и элюата захвата (после хроматографии на белке A) для партии 1, в которой мономер восстанавливается, образуя полумономер и тяжелую цепь. Также показан образец элюата захвата для партии 3, в которой фильтр с активированным углем был использован при первичном извлечении, и молекула была все еще мономерной после стадии захвата на белке А.
На фиг.7 показана осветленная клеточная культуральная жидкость (CCCF) для соединения B из партии 1 (перед введением угольного фильтра, контроль) и партии 2 (после применения угольного фильтра), проанализированная на восстанавливающие агенты NAD/NADH и NADP/NADPH. Более низкие уровни этих восстанавливающих агентов обнаруживаются после введения угольного фильтра.
Пример 3
Образцы были отобраны из производственного цикла соединения B после фильтрации (с фильтрацией через угольный фильтр и без нее), но затем очищались в условиях низкого содержания кислорода, с использованием менее масштабной модели производственного процесса. Данная модель включала продувку образцов газообразным азотом в течение по меньшей мере 30 мин, которые затем хранили в этих условиях в течение ночи.
Результаты этого процесса, которые были проанализированы с использованием невосстановительного SDS-PAGE анализа с окрашиванием Sypro, можно увидеть на фиг.5. Аналитический метод использовали для определения чистоты образцов и присутствия примесей, образующихся при восстановлении антител в невосстанавливающих условиях. Используемыми гелями были NuPAGE 4-20% трис-глицин, 10×15 лунок 1,5 мм от Thermo Fisher (кат. № EС6028). Показан стандарт молекулярной массы Mark 12 (Thermo Fisher, каталожный номер LC5677). Гель пропускали при постоянном напряжении 125 В. Окрашивание проводили с использованием рубиново-красного флуоресцентного красителя SYPRO (Bio-Rad, кат. № 170-3125).
Образцы до стадии захвата, дорожки 3, 4 и 5, были затем заморожены (≤ -60°С) и размораживались непосредственно перед анализом. Образцы на дорожках 6, 7 и 8 очищали на белке А в емкости, продуваемой газообразным азотом, и образцы элюата затем замораживали и размораживали непосредственно перед анализом.
Образцы культуральной жидкости и элюата захвата партии 1 цикла 1 содержали низкие уровни мономера и высокие уровни примесей, образующихся при восстановлении антител. Образец партии 2 цикла 1, отобранный перед угольным фильтром, и элюат захвата из этого образца содержали высокие уровни примесей, связанных с восстановлением антител. Образец, отобранный после угольного фильтра, и элюат захвата из этого образца содержали высокие уровни мономера и низкие/нулевые уровни примесей, связанных с восстановлением антител. Таким образом, фильтрация через угольный фильтр препятствует образованию восстановленных продуктов антител, наблюдаемых после хроматографии на белке А.
Реферат
Группа изобретений относится к области биотехнологии. Предложены способ получения антитела или его фрагмента, способ предотвращения восстановления дисульфидной связи во время очистки антитела или его фрагмента, способ очистки антитела или его фрагмента от жидкой смеси, а также способ уменьшения количества восстанавливающих агентов во время очистки антитела или его фрагмента. Вышеуказанные способы включают введение смеси, содержащей антитело или его фрагмент, обломки клеток-хозяев и примеси, на стадию фильтрации через активированный уголь, а далее хроматографию на белке А. Изобретения обеспечивают очистку белков в их нативной конформации с постоянной степенью чистоты в различных партиях. 4 н. и 11 з.п. ф-лы, 3 пр., 7 ил.
Формула
Документы, цитированные в отчёте о поиске
Выделение и очистка антител с использованием аффинной хроматографии на основе белка а

Комментарии