Использование пвдф-мембраны для очистки конъюгатов клеточно-связывающий агент - цитотоксический агент - RU2661083C2
Код документа: RU2661083C2
Чертежи






Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая патентная заявка заявляет приоритет по временной патентной заявке США №61/709891, поданной 4 октября 2012 г., которая включена в данный документ посредством ссылки.
[002] ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ МАТЕРИАЛОВ, ПОДАННЫХ В ЭЛЕКТРОННОМ ВИДЕ
Данный документ посредством ссылки включает в полном объеме машинно-считываемый перечень нуклеотидных/аминокислотных последовательностей, поданный совместно с данным документом и идентифицируемый следующим образом: один файл в формате ASCII (текстовом) размером 8259 байт, названный "714287SequenceListing.TXT," созданный 3 октября 2013 г.
УРОВЕНЬ ТЕХНИКИ
[003] Конъюгаты антитело-лекарственное средство, пригодные для лечения рака и других болезней, обычно состоят из трех отдельных элементов: клеточно-связывающего агента, линкера и цитотоксического агента. Один из обычно используемых способов получения включает стадию модификации, на которой клеточно-связывающий агент приводят в контакт с бифункциональным линкером для получения клеточно-связывающего агента, ковалентно присоединенного к линкеру, имеющему реакционноспособную группу, стадию очистки, на которой модифицированное антитело очищают от других компонентов реакции модификации, стадию конъюгации, на которой модифицированный клеточно-связывающий агент приводят в контакт с цитотоксическим агентом для образования ковалентной химической связи между линкером (с использованием реакционноспособной группы) и цитотоксическим агентом, и вторую стадию очистки, на которой конъюгат очищают от других компонентов реакции конъюгации.
[004] Недавно проведенные клинические испытания показали многообещающую роль конъюгатов антитело-лекарственное средство в лечении многих различных типов рака. Таким образом, существует потребность в получении конъюгатов с высокой степенью очистки и высокой стабильностью, которые могут быть использованы для лечения пациентов. Несмотря на достижения в получении конъюгатов антитело-лекарственное средство, современные методы ограничены несколькими факторами. Например, конъюгаты, полученные этими способами, содержат повышенное количество примесей, включая свободный цитотоксический агент (например, частицы, производные от димеров цитотоксического агента) и/или высокомолекулярные частицы (например, димеры и другие агрегаты более высокого порядка). Современные способы очистки, используемые в технике, такие как тангенциальная поточная фильтрация и адсорбционная хроматография, не позволяют эффективно удалять такие примеси без значительного снижения выхода и/или являются обременительными для крупномасштабных производственных процессов.
[005] Таким образом, сохраняется потребность в усовершенствованных способах получения конъюгатов антитело-лекарственное средство, которые бы являлись более стабильными и имели более высокую степень очистки, чем конъюгаты антитело-лекарственное средство, полученные с помощью способов, используемых в настоящее время. Данное изобретение предлагает такой способ. Это и другие преимущества изобретения, а также дополнительные признаки изобретения, будут понятны из описания изобретения, приведенного в данном документе.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
(006) Изобретение предлагает способы получения очищенных конъюгатов клеточно-связывающий агент-цитотоксический агент, включающие приведение в контакт смесина смесь, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с поливинилдифторидной (ПВДФ) мембраной для удаления по меньшей мере части примесей из смеси, тем самым обеспечивая очищенный конъюгат клеточно-связывающий агент-цитотоксический агент. Настоящее изобретение также включает конъюгат, содержащий клеточно-связывающий агент, химически связанный с цитотоксическим агентом, полученный в соответствии со способами, описанными в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[007] Фигуры 1А-В представляют собой хроматограммы, показывающие химические вещества, присутствующие в реакционной смеси конъюгата антитело-SMCC-DM1 до (Фигура 1А) и после (Фигура 1В) ПВДФ-фильтрации.
[0081 Фигура 2 представляет собой линейный график, изображающий процентное содержание частиц димера DM1 (ось Y), присутствующих в реакционной смеси конъюгата антитело-SMCC-DM1 до и после фильтрации через множество ПВДФ-мембран (ось X).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[009] Специалисту в данной области техники будет понятно, что конъюгаты, содержащие клеточно-связывающий агент, такой как антитело, химически связанный с цитотоксическим агентом ("конъюгаты антитело-цитотоксический агент"), как правило, получают путем модификации антитела бифункциональным сшивающим реагентом при низком pH (т.е., pH 7,0 или ниже), очистки антитела, имеющего связанные с ним линкеры, конъюгации цитотоксического агента с антителом, имеющим связанные с ним линкеры, и очистки конъюгата антитело-цитотоксический агент. Недавно были разработаны способы получения конъюгатов с повышенной стабильностью путем максимизирования количества линкера, стабильно связанного с клеточно-связывающим агентом и минимизации нежелательных побочных реакций, приводящих к нестабильности конъюгата. Например, были разработаны способы, в которых процесс получения конъюгата проводят в одну стадию (см., например, процессы, описанные в публикации патентной заявки США №2012/0253021) и/или при высоком pH (например, pH 7 или выше) (см., например, процессы, описанные в публикации международной патентной заявки № WO 2012/135522) для увеличения уровня содержания целевых соединений клеточно-связывающих агентов, имеющих линкер, стабильно связанный с ними, и снижения уровня содержания нежелательных продуктов реакции (например, клеточно-связывающих агентов, имеющих линкер, нестабильно связанный с ними). Хотя такие процессы дают конъюгаты с повышенной стабильностью, было обнаружено, что такие процессы приводят к получению конъюгатов, имеющих повышенные уровни содержания примесей, таких как свободный цитотоксический агент (например, веществ, связанных с димером цитотоксического агента) и/или высокомолекулярных соединений (например, димеров и других агрегатов более высокого порядка). Современные способы очистки, используемые в данной области техники, такие как тангенциальная поточная фильтрация и адсорбционная хроматография, не позволяют эффективно удалять эти примеси без значительного снижения выхода и/или являются обременительными для крупномасштабных производственных процессов.
[0010] Неожиданно было обнаружено, что поливинилдифторидная (ПВДФ) мембрана может быть использована для удаления по меньшей мере части примесей из смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент. В частности, было неожиданно обнаружено, что свободный цитотоксический агент (например, вещества, связанные с димером цитотоксического агента) могут быть действенно и эффективно удалены из смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент, путем приведения в контакт смеси с ПВДФ-мембраной. Соответственно, изобретение предлагает способы производства конъюгатов клеточно-связывающий агент-цитотоксический агент с повышенной чистотой и стабильностью, включающие приведения в контакт смесей, содержащих конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной.
[0011] Изобретение предлагает способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной для удаления по меньшей мере части примесей из смеси, тем самым обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент. ПВДФ-мембрана может быть использована для удаления различных примесей, обычно присутствующих в смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент. Например, ПВДФ-мембрана может быть использована для удаления одной или нескольких примесей, выбранных из группы димеров цитотоксического агента, агрегатов конъюгата клеточно-связывающий агент-цитотоксический агент, свободного цитотоксического агента, неконъюгированного линкера и их смесей.
[0012] В одном варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент, содержит димеры цитотоксического агента в качестве примеси, и ПВДФ-мембрана удаляет некоторую часть димеров цитотоксического агента из смеси, обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент. В другом варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент, содержит агрегаты конъюгата клеточно-связывающий агент-цитотоксический агент в качестве примеси, и ПВДФ-мембрана удаляет некоторую часть агрегатов клеточно-связывающий агент-цитотоксический агент из смеси, обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.В другом варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент, содержит свободный цитотоксический агент в качестве примеси, и ПВДФ-мембрана удаляет некоторую часть свободного цитотоксического агента из смеси, обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент. В другом варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент, содержит неконъюгированный линкер в качестве примеси, и ПВДФ-мембрана удаляет некоторую часть неконъюгированного линкера из смеси, обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[0013] В предпочтительном варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент, содержит димеры цитотоксического агента, химически связанные друг с другом с помощью линкера (например, DM1-MCC-DM1, DM1-SPP-DM1 или DM1-CX1-1-DM1), в качестве примеси, и ПВДФ-мембрана удаляет некоторую часть димеров цитотоксического агента, химически связанных друг с другом с помощью линкера (например, DM1-MCC-DM1, DM1-SPP-DM1 или DM1-CX1-1-DM1), из смеси, обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент. В другом предпочтительном варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент, содержит димеры цитотоксического агента, не связанные химически друг с другом с помощью линкера (например, DM1-DM1), в качестве примеси, и ПВДФ-мембрана удаляет некоторую часть димеров цитотоксического агента, не связанных химически друг с другом с помощью линкера (например, DM1-DM1), из смеси, обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[0014] Когда смесь, содержащую конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, приводят в контакт с ПВДФ-мембраной, полученный очищенный конъюгат клеточно-связывающий агент-цитотоксический агент содержит пониженный уровень по меньшей мере одной или нескольких примесей по сравнению с уровнем содержания одной или нескольких примесей в смеси перед приведением в контакт смеси с ПВДФ-мембраной. Например, ПВДФ-мембрана удаляет по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, или даже 100% одной или нескольких примесей в смеси по сравнению с уровнем содержания одной или нескольких примесей в смеси перед проведением воздействия на смесь с помощью ПВДФ-мембраны. В одном варианте реализации изобретения ПВДФ-мембрана удаляет от примерно 10% до примерно 100%, от примерно 10% до примерно 90%, от примерно 20% до примерно 100%, от примерно 20% до примерно 90%, от примерно 20% до примерно 80%, от примерно 30% до примерно 100%, от примерно 30% до примерно 90%, от примерно 30% до примерно 80%, от примерно 40% до примерно 80%, от примерно 40% до примерно 90%, от примерно 40% до примерно 100%, от примерно 50% до примерно 80%, от примерно 50% до примерно 90%, от примерно 50% до примерно 100% (например, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%), от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 90% до примерно 100%, или от примерно 95% до примерно 100% (например, от примерно 96% до примерно 100%, от примерно 97% до примерно 100%, от примерно 98% до примерно 100%, от примерно 99% до примерно 100%, от примерно 95% до примерно 96%, от примерно 95% до примерно 97%, от примерно 95% до примерно 98%, или от примерно 95% до примерно 99%) одной или нескольких примесей в смеси по сравнению с уровнем содержания одной или нескольких примесей в смеси перед приведением в контакт смеси с ПВДФ-мембраной.
[0015] В одном варианте реализации изобретения величину pH смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, регулируют перед приведением в контакт смеси с ПВДФ-мембраной. Величина pH смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, предпочтительно составляет от примерно 4 до примерно 9 (например, pH от примерно 4,5 до примерно 8,5, от примерно 5 до примерно 8, от примерно 5,5 до примерно 7,5, от примерно 6 до примерно 7, от примерно 6,5 до примерно 7,5, от примерно 7 до примерно 8, от примерно 8 до примерно 9, от примерно 4,5 до примерно 6, или от примерно 4,5 до примерно 5). В некоторых вариантах реализации изобретения pH смеси составляет от примерно 6 до примерно 6,5 (например, pH от 5,5 до 7, pH от 5,7 до 6,8, pH от 5,8 до 6,7, pH от 5,9 до 6,6, или pH от 6 до 6,5), pH примерно 6 или ниже (например, pH от примерно 4 до 6, от примерно 4 до примерно 5,5, от примерно 4 до примерно 4,5, от примерно 4 до примерно 5, от примерно 5 до 6), или pH примерно 6,5 или выше (например, pH от 6,5 до примерно 9, от примерно 6,5 до примерно 7, от примерно 7 до примерно 9, от примерно 7,5 до примерно 9, или от 6,5 до примерно 8). В одном варианте реализации изобретения pH смеси имеет значение выше 7,5 (например, pH от 7,6 до примерно 9, от 7,7 до примерно 9, от примерно 7,8 до примерно 9, от примерно 7,9 до примерно 9, от 7,6 до примерно 8,5, от 7,6 до примерно 8, от 7,7 до примерно 8,5, от 7,7 до примерно 8, от примерно 7,8 до примерно 8,4, от примерно 7,8 до примерно 8,2, от примерно 8 до примерно 9, или от примерно 8 до примерно 8,5). Например, величина pH смеси может быть равна pH 7,6; 7,7; 7,8; 7,9; 8; 8,1; 8,2; 8,3; 8,4; 8,5; 8,6; 8,7; 8,8; 8, 9 или 9. В другом варианте реализации изобретения pH смеси составляет примерно 4,8 (например, от примерно 4,5 до примерно 5, от примерно 4,6 до примерно 5, или от примерно 4,7 до примерно 4,9).
[0016] Различные ПВДФ-мембраны известны специалистам в данной области техники и могут быть использованы в соответствии с изобретением, описанным в данном документе. В одном варианте реализации изобретения ПВДФ-мембрана имеет размер пор 0,22 микрон. В другом варианте реализации изобретения ПВДФ-мембрана имеет размер пор 0,45 микрон. В другом варианте реализации изобретения ПВДФ-мембрана представляет собой двухслойную мембрану, имеющую размеры пор 0,45 и 0,22 микрон (т.е., двухслойную мембрану с размерами пор 0,45/0,22 микрон).
[0017] В некоторых вариантах реализации изобретения ПВДФ-мембрану подвергают гамма-облучению. В других вариантах реализации изобретения ПВДФ-мембрану не подвергают гамма-облучению.
[0018] Был описан ряд способов получения конъюгатов клеточно-связывающий агент-цитотоксический агент (см., например, публикацию патентной заявки США №2012/0253021; публикацию международной патентной заявки № WO 2012/135522; патент США 5208020; патент США 6441163; патент США 7811572; публикацию патентной заявки США №2006/0182750; публикацию патентной заявки США №2008/0145374; и публикацию патентной заявки США №2011/0003969).
[0019] В одном варианте реализации изобретения изобретение предлагает способ получения конъюгата, содержащего клеточно-связывающий агент, химически связанный с цитотоксическим агентом, в котором реакция модификации и реакция конъюгации объединены в одну стадию, с последующей стадией очистки (т.е., одностадийный процесс, описанный в публикации патентной заявки США №2012/0253021), и в котором процесс включает приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной до или после стадии очистки. Одностадийный процесс включает приведение в контакт клеточно-связывающего агента (например, антитела) с цитотоксическим агентом с образованием первой смеси, содержащей клеточно-связывающий агент и цитотоксический агент, и затем приведение в контакт первой смеси, содержащей клеточно-связывающий агент и цитотоксический агент, бифункциональным сшивающим реагентом, содержащим линкер, в растворе, имеющем pH от примерно 4 до примерно 9, для получения второй смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей (например, свободный цитотоксический агент и побочные продукты реакции), где клеточно-связывающий агент химически связан с помощью линкера с цитотоксическим агентом. Вторую смесь затем подвергают очистке для получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент. Вторую смесь, содержащую конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, приводят в контакт с ПВДФ-мембраной перед стадией очистки, после стадии очистки, или в обоих случаях.
[0020] Одностадийную реакцию предпочтительно проводят при pH от примерно 4 до примерно pH 9 (например, pH от примерно 4,5 до примерно 8,5, от примерно 5 до примерно 8, от примерно 5,5 до примерно 7,5, от примерно 6 до примерно 7, от примерно 6 до примерно 8, от примерно 6 до примерно 9, или от примерно 6,5 до примерно 7,5). В некоторых вариантах реализации изобретения реакцию проводят при pH от примерно 6 до примерно 8 (например, pH примерно 6, примерно 6,5, примерно 7, примерно 7,5 или примерно 8).
[0021] В одном варианте реализации изобретения реакцию проводят при pH примерно 7,1, примерно 7,2, примерно 7,3, примерно 7,4, примерно 7,5, примерно 7,6, примерно 7,7, примерно 7,8, примерно 7,9, примерно 8, примерно 8,1, примерно 8,2, примерно 8,3, примерно 8,4, примерно 8,5, примерно 8,6, примерно 8,7, примерно 8,8, примерно 8,9 или примерно 9. В другом варианте реализации изобретения реакцию проводят при pH от примерно 7,5 до примерно 9, от примерно 7,5 до примерно 8,5, от примерно 7,5 до примерно 8, от примерно 7,8 до примерно 9, от примерно 7,8 до примерно 8,5, от примерно 7,8 до примерно 8, от примерно 8 до примерно 9, от примерно 8 до примерно 8,5, или от примерно 8,5 до примерно 9. В другом варианте реализации изобретения реакцию проводят при pH примерно 7,8 (например, pH от 7,6 до 8,0 или pH от 7,7 до 7,9). В другом варианте реализации изобретения реакцию модификации проводят при pH примерно 8 (например, pH от 7,8 до 8,2 или pH от 7,9 до 8,1).
[0022] В другом варианте реализации изобретения реакцию проводят при pH выше 7,5 (например, pH от 7,6 до примерно 9, от 7,7 до примерно 9, от примерно 7,8 до примерно 9, от примерно 7,9 до примерно 9, от 7,6 до примерно 8,5, от 7,6 до примерно 8, от 7,7 до примерно 8,5, от 7,7 до примерно 8, от примерно 7,8 до примерно 8,4, от примерно 7,8 до примерно 8,2, от примерно 8 до примерно 9, или от примерно 8 до примерно 8,5).
[0023] В одном варианте реализации изобретения приведение в контакт осуществляют путем обеспечения клеточно-связывающего агента, затем приведение в контакт клеточно-связывающего агента с цитотоксическим агентом с образованием первой смеси, содержащей клеточно-связывающий агент и цитотоксический агент, и затем приведение в контакт первой смеси, содержащей клеточно-связывающий агент и цитотоксический агент, с бифункциональным сшивающим реагентом. Например, в одном варианте реализации изобретения обеспечивают клеточно-связывающий агент в реакционном сосуде, цитотоксический агент прибавляют в реакционный сосуд (тем самым приводя в контакт с клеточно-связывающим агентом), и затем бифункциональный сшивающий реагент прибавляют к смеси, содержащей клеточно-связывающий агент и цитотоксический агент (тем самым приводя в контакт со смесью, содержащей клеточно-связывающий агент и цитотоксический агент). В одном варианте реализации изобретения обеспечивают клеточно-связывающий агент в реакционном сосуде, и цитотоксический агент прибавляют в реакционный сосуд немедленно после обеспечения клеточно-связывающего агента в сосуде. В другом варианте реализации изобретения обеспечивают клеточно-связывающий агент в реакционном сосуде, и цитотоксический агент прибавляют в реакционный сосуд через некоторое время после обеспечения клеточно-связывающего агента в сосуде (например, примерно 5 минут, примерно 10 минут, примерно 20 минут, примерно 30 минут, примерно 40 минут, примерно 50 минут, примерно 1 час, примерно 1 день или больше после обеспечения клеточно-связывающего агента в сосуде). Цитотоксический агент может быть добавлен быстро (т.е., за короткий промежуток времени, такой как примерно 5 минут, примерно 10 минут) или медленно (например, с помощью насоса).
[0024] Смесь, содержащая клеточно-связывающий агент и цитотоксический агент, может быть затем введена в контакт с бифункциональным сшивающим реагентом или немедленно после введения в контакт клеточно-связывающего агента с цитотоксическим агентом или в какой-то более поздний момент времени (например, от примерно 5 минут до примерно 8 часов или больше) после введения в контакт клеточно-связывающего агента с цитотоксическим агентом. Например, в одном варианте реализации изобретения бифункциональный сшивающий реагент прибавляют к смеси, содержащей клеточно-связывающий агент и цитотоксический агент, немедленно после прибавления цитотоксического агента в реакционный сосуд, содержащий клеточно-связывающий агент. Альтернативно, смесь, содержащая клеточно-связывающий агент и цитотоксический агент, может быть введена в контакт с бифункциональным сшивающим реагентом через примерно 5 минут, примерно 10 минут, примерно 20 минут, примерно 30 минут, примерно 1 час, примерно 2 часа, примерно 3 часа, примерно 4 часа, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов или больше, после введения в контакт клеточно-связывающего агента с цитотоксическим агентом.
[0025] В другом варианте реализации изобретения цитотоксический агент и бифункциональный агент прибавляют на протяжении множества циклов (например, 1, 2, 3, 4, 5 или больше циклов). Например, изобретение предлагает способ, включающий стадии: а) приведения в контакт клеточно-связывающего агента с цитотоксическим агентом с образованием первой смеси, содержащей клеточно-связывающий агент и цитотоксический агент; и затем введения в контакт первой смеси с бифункциональным сшивающим реагентом, содержащим линкер, в растворе, имеющем pH от примерно 4 до примерно 9, для получения второй смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей (например, свободный цитотоксический агент и побочные продукты реакции), где клеточно-связывающий агент химически связан с помощью линкера с цитотоксическим агентом; b) приведения в контакт второй смеси с цитотоксическим агентом с образованием третьей смеси; и затем приведения в контакт третьей смеси с бифункциональным сшивающим реагентом при pH от примерно 4 до примерно 9 для получения четвертой смеси; и с) очистки четвертой смеси для получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент. В одном варианте реализации изобретения стадию b) проводят через некоторый период времени (например, примерно 1 час, примерно 2 часа, примерно 3 часа или больше) после стадии а). В другом варианте реализации изобретения стадия b) может быть повторена несколько раз (например, 1, 2, 3, 4 или больше раз) до проведения стадии с). Дополнительная стадия b) может быть проведена через некоторый период времени (например, примерно 1 час, примерно 2 часа, примерно 3 часа или больше) после начальной стадии b).
[0026] В другом варианте реализации изобретения бифункциональный сшивающий реагент прибавляют до завершения прибавления цитотоксического агента. Например, в одном варианте реализации изобретения цитотоксический агент прибавляют к клеточно-связывающему агенту непрерывно на протяжении периода времени (например, на протяжении примерно 5 минут, примерно 10 минут, примерно 30 минут, примерно 1 часа, примерно 2 часов, примерно 3 часов или больше) с образованием смеси, содержащей клеточно-связывающий агент и цитотоксический агент. Бифункциональный сшивающий реагент прибавляют к смеси, содержащей клеточно-связывающий агент и цитотоксический агент, до завершения прибавления цитотоксического агента, при условии, что в любой момент времени цитотоксический агент имеет молярный избыток по отношению к бифункциональному сшивающему реагенту. В одном варианте реализации изобретения бифункциональный сшивающий реагент прибавляют непрерывно на протяжении периода времени (например, на протяжении примерно 5 минут, примерно 10 минут, примерно 30 минут, примерно 1 часа, примерно 2 часов, примерно 3 часов или больше).
[0027] После введения в контакт смеси, содержащей клеточно-связывающий агент и цитотоксический агент, с бифункциональным сшивающим реагентом, реакции позволяют протекать в течение примерно 1 часа, примерно 2 часов, примерно 3 часов, примерно 4 часов, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов, примерно 9 часов, примерно 10 часов, примерно 11 часов, примерно 12 часов, примерно 13 часов, примерно 14 часов, примерно 15 часов, примерно 16 часов, примерно 17 часов, примерно 18 часов, примерно 19 часов, примерно 20 часов, примерно 21 часов, примерно 22 часов, примерно 23 часов, примерно 24 часов или больше (например, примерно 30 часов, примерно 35 часов, примерно 40 часов, примерно 45 часов или примерно 48 часов).
[0028] Таким образом, в одном варианте реализации изобретения изобретение предлагает способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт клеточно-связывающего агента с цитотоксическим агентом с образованием первой смеси, содержащей клеточно-связывающий агент и цитотоксический агент, затем приведение в контакт первой смеси с бифункциональным сшивающим реагентом, содержащим линкер, в растворе, имеющем pH от примерно 4 до примерно 9, для получения второй смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент, которая содержит клеточно-связывающий агент, химически связанный посредством линкера с цитотоксическим агентом, и одну или несколько примесей; (b) приведение в контакт второй смеси с поливинилдифторидной (ПВДФ) мембраной для удаления по меньшей мере части примесей, тем самым обеспечивая получение очищенной второй смеси конъюгата клеточно-связывающий агент-цитотоксический агент; и (с) обработку второй смеси после стадии (b) методом тангенциальной поточной фильтрации, селективного осаждения, неадсорбционной хроматографии, адсорбционной фильтрации, адсорбционной хроматографии или их комбинации, для дополнительной очистки конъюгата клеточно-связывающий агент-цитотоксический агент от примесей и тем самым получения очищенной третьей смеси конъюгата клеточно-связывающий агент-цитотоксический агент, где очищенная третья смесь содержит пониженное количество примесей по сравнению с очищенной второй смесью. В способе по изобретению может быть использован любой способ очистки, описанный в данном документе. В предпочтительном варианте реализации изобретения в качестве стадии очистки используют тангенциальную поточную фильтрацию, адсорбционную хроматографию или неадсорбционную хроматографию.
[0029] В одном варианте реализации изобретения приведение клеточно-связывающего агента в контакт с бифункциональным сшивающим реагентом (т.е., реакция модификации) дает первую смесь, содержащую клеточно-связывающий агент, имеющий связанные с ним линкеры и одну или несколько примесей (например, реагенты и другие побочные продукты). В некоторых вариантах реализации изобретения первая смесь содержит клеточно-связывающий агент, имеющий линкеры, стабильно и нестабильно связанные с ним, и одну или несколько примесей (например, реагенты и другие побочные продукты). Линкер "стабильно" соединен с клеточно-связывающим агентом, если ковалентная связь между линкером и клеточно-связывающим агентом не подвергается существенному ослаблению или разрыву в нормальных условиях хранения в течение периода времени, который может составлять от нескольких месяцев до нескольких лет. В отличие от этого, линкер является "нестабильно" связанным с клеточно-связывающим агентом, если ковалентная связь между линкером и клеточно-связывающим агентом существенно ослабевает или разрывается в нормальных условиях хранения в течение периода времени, который может составлять от нескольких месяцев до нескольких лет.
[0030] Реакцию модификации предпочтительно проводят при pH от примерно 4 до примерно pH 9 (например, pH от примерно 4,5 до примерно 8,5, от примерно 5 до примерно 8, от примерно 5,5 до примерно 7,5, от примерно 6 до примерно 7, от примерно 6 до примерно 8, от примерно 6 до примерно 9 или от примерно 6,5 до примерно 7,5). В некоторых вариантах реализации изобретения реакцию модификации проводят при pH от примерно 6 до примерно 8 (например, pH примерно 6, примерно 6,5, примерно 7, примерно 7,5 или примерно 8).
[0031] В одном варианте реализации изобретения реакцию модификации проводят при pH примерно 7,1, примерно 7,2, примерно 7,3, примерно 7,4, примерно 7,5, примерно 7,6, примерно 7,7, примерно 7,8, примерно 7,9, примерно 8, примерно 8,1, примерно 8,2, примерно 8,3, примерно 8,4, примерно 8,5, примерно 8,6, примерно 8,7, примерно 8,8, примерно 8,9 или примерно 9. В другом варианте реализации изобретения реакцию модификации проводят при pH от примерно 7,5 до примерно 9, от примерно 7,5 до примерно 8,5, от примерно 7,5 до примерно 8, от примерно 7,8 до примерно 9, от примерно 7,8 до примерно 8,5, от примерно 7,8 до примерно 8, от примерно 8 до примерно 9, от примерно 8 до примерно 8,5 или примерно 8,5 до примерно 9. В другом варианте реализации изобретения реакцию модификации проводят при pH примерно 7,8 (например, pH от 7,6 до 8,0 или pH от 7,7 до 7,9). В другом варианте реализации изобретения реакцию модификации проводят при pH примерно 8 (например, pH от 7,8 до 8,2 или pH от 7,9 до 8,1).
[0032] В другом варианте реализации изобретения реакцию модификации проводят при pH выше 7,5 (например, pH от 7,6 до примерно 9, от 7,7 до примерно 9, от примерно 7,8 до примерно 9, от примерно 7,9 до примерно 9, от 7,6 до примерно 8,5, от 7,6 до примерно 8, от 7,7 до примерно 8,5, от 7,7 до примерно 8, от примерно 7,8 до примерно 8,4, от примерно 7,8 до примерно 8,2, от примерно 8 до примерно 9 или от примерно 8 до примерно 8,5). Например, способ по изобретению включает приведение в контакт клеточно-связывающего агента с бифункциональным сшивающим реагентом в растворе, имеющем pH 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9 или 9.
[0033] В одном варианте реализации изобретения очистку модифицированного клеточно-связывающего агента от примесей, образующихся в ходе реакции модификации (например, реагентов и побочных продуктов) проводят путем проведения процесса очистки смеси, полученной в результате реакции модификации (т.е., первой смеси). При этом первая смесь может быть очищена с использованием тангенциальной поточной фильтрации (TFF), например, способа мембранной тангенциальной поточной фильтрации, неадсорбционной хроматографии, адсорбционной хроматографии, адсорбционной фильтрации или селективного осаждения или любого другого пригодного способа очистки, а также их комбинаций. Такая первая стадия очистки дает очищенную первую смесь, т.е., с повышенной концентрацией клеточно-связывающих агентов, имеющих связанные с ними линкеры, и пониженным количеством несвязанного бифункционального сшивающего реагента, по сравнению с первой смесью до очистки в соответствии с изобретением. Предпочтительно, первую смесь очищают с использованием тангенциальной поточной фильтрации или адсорбционной хроматографии (например, ионообменной хроматографии, такой как на керамическом гидроксиапатите).
[0034] После очистки первой смеси для получения очищенной первой смеси клеточно-связывающих агентов, имеющих связанные с ними линкеры, цитотоксический агент конъюгируют с клеточно-связывающими агентами, имеющими связанные с ними линкеры, в первой очищенной смеси путем проведения реакции клеточно-связывающих агентов, имеющих связанные с ними линкеры, с цитотоксическим агентом в растворе, имеющем pH от примерно 4 до примерно 9, с образованием второй смеси, в результате которой получают вторую смесь, содержащую клеточно-связывающий агент, химически связанный посредством линкера с цитотоксическим агентом, и одну или несколько примесей (например, свободный цитотоксический агент и побочные продукты реакции).
[0035] Необязательно, очистка модифицированного клеточно-связывающего агента может быть опущена. Таким образом, в одном варианте реализации изобретения первую смесь, содержащую клеточно-связывающий агент, имеющий связанные с ним линкеры, а также реагенты и другие побочные продукты, не подвергают процессу очистки. В данном случае, цитотоксический агент может быть добавлен одновременно со сшивающим реагентом или в какой-то более поздний момент времени, например, через 1, 2, 3 или больше часов после прибавления сшивающего реагента к клеточно-связывающему агенту. Модифицированный клеточно-связывающий агент конъюгируют с цитотоксическим агентом (например, майтанзиноидом) путем проведения реакции модифицированного клеточно-связывающего агента с цитотоксическим агентом в растворе, имеющем pH от примерно 4 до примерно 9, где стадия конъюгации приводит к образованию смеси стабильных конъюгатов клеточно-связывающий агент-цитотоксический агент, нестабильных конъюгатов клеточно-связывающий агент-цитотоксический агент, неконъюгированного цитотоксического агента (т.е., "свободного" цитотоксического агента), реагентов и побочных продуктов.
[0036] Реакцию конъюгации предпочтительно проводят при pH от примерно 4 до примерно pH 9 (например, pH от примерно 4,5 до примерно 8,5, от примерно 5 до примерно 8, от примерно 5,5 до примерно 7,5, от примерно 6,0 до примерно 7 или от примерно 6,5 до примерно 7,5). В некоторых вариантах реализации изобретения реакцию конъюгации проводят при pH от примерно 6 до примерно 6,5 (например, pH от 5,5 до 7, pH от 5,7 до 6,8, pH от 5,8 до 6,7, pH от 5,9 до 6,6 или pH от 6 до 6,5), pH примерно 6 или ниже (например, pH от примерно 4 до 6, от примерно 4 до примерно 5,5, от примерно 5 до 6), или при pH примерно 6,5 или выше (например, pH от 6,5 до примерно 9, от примерно 6,5 до примерно 7, от примерно 7 до примерно 9, от примерно 7,5 до примерно 9 или от 6,5 до примерно 8). В одном варианте реализации изобретения реакцию конъюгации проводят при pH от примерно 4 до pH ниже 6 или при pH от выше 6,5 до 9. В тех случаях, когда стадию конъюгации проводят при pH примерно 6,5 или выше, некоторые сульфгидрил-содержащие цитотоксические агенты могут иметь склонность димеризоваться путем образования дисульфидной связи. В одном варианте реализации изобретения удаление следов металлов и/или кислорода из реакционной смеси, а также необязательное добавление антиоксидантов или использование линкеров с более реакционноспособными отходящими группами или добавление цитотоксического агента в количестве более одной аликвоты, может быть необходимо для обеспечения эффективной реакции в такой ситуации.
[0037] После стадии конъюгации смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, подвергают обработке на стадии очистки. В данном случае, смесь со стадии конъюгации может быть очищена с использованием тангенциальной поточной фильтрации (TFF), например, способа мембранной тангенциальной поточной фильтрации, неадсорбционной хроматографии, адсорбционной хроматографии, адсорбционной фильтрации или селективного осаждения или любого другого пригодного способа очистки, а также их комбинаций. Специалисту в данной области техники будет понятно, что очистка после стадии конъюгации позволяет выделить очищенный конъюгат, содержащий клеточно-связывающий агент, химически связанный с цитотоксическим агентом, причем конъюгат имеет пониженное количество примесей по сравнению с конъюгатом до стадии очистки. В одном варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, приводят в контакт с ПВДФ-мембраной после стадии конъюгации и до стадии очистки для удаления по меньшей мере части примесей из смеси до очистки. В другом варианте реализации изобретения смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, приводят в контакт с ПВДФ-мембраной после стадии очистки для удаления по меньшей мере части примесей, остающихся в смеси после очистки.
[0038] Таким образом, в одном варианте реализации изобретения изобретение предлагает способ получения конъюгата, содержащего клеточно-связывающий агент, химически связанный с цитотоксическим агентом, включающий первую стадию очистки после стадии модификации и вторую стадию очистки после стадии конъюгации, причем способ включает приведения в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной до или после второй стадии очистки для удаления по меньшей мере части примесей из смеси. В одном варианте реализации изобретения изобретение предлагает способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт клеточно-связывающего агента с бифункциональным сшивающим реагентом для ковалентного присоединения линкера к клеточно-связывающему агенту и, тем самым, получения первой смеси, содержащей клеточно-связывающие агенты, имеющие связанные с ними линкеры, (b) обработку первой смеси методом тангенциальной поточной фильтрации, селективного осаждения, неадсорбционной хроматографии, адсорбционной фильтрации, адсорбционной хроматографии или их комбинации и, тем самым, получения очищенной первой смеси клеточно-связывающих агентов, имеющих связанные с ними линкеры, (с) конъюгацию цитотоксического агента с клеточно-связывающими агентами, имеющими связанные с ними линкеры в очищенной первой смеси путем проведения реакции клеточно-связывающих агентов, имеющих связанные с ними линкеры, с цитотоксическим агентом в растворе, имеющем pH от примерно 4 до примерно 9, для получения второй смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент, которая содержит клеточно-связывающий агент, химически связанный с цитотоксическим агентом посредством линкера, и одну или несколько примесей, (d) приведение в контакт второй смеси с поливинилдифторидной (ПВДФ) мембраной для удаления по меньшей мере части примесей, тем самым обеспечивая получение очищенной второй смеси конъюгата клеточно-связывающий агент-цитотоксический агент; и (е) обработку второй смеси после стадии (d) методом тангенциальной поточной фильтрации, селективного осаждения, неадсорбционной хроматографии, адсорбционной фильтрации, адсорбционной хроматографии или их комбинацией, для дополнительной очистки конъюгата клеточно-связывающий агент-цитотоксический агент от примесей и, тем самым, получения очищенной третьей смеси конъюгата клеточно-связывающий агент-цитотоксический агент, где очищенная третья смесь содержит пониженное количество примесей по сравнению с очищенной второй смесью.
[0039] Любой способ очистки, описанный в данном документе, может быть использован в способе по изобретению. В одном варианте реализации изобретения на стадиях очистки используют тангенциальную поточную фильтрацию (TFF, также известная как фильтрация в тангенциальном потоке, ультрафильтрация и диафильтрация) и/или смолы для адсорбционной хроматографии. Например, способ по изобретению может включать первую стадию очистки с использованием TFF после стадии модификации и вторую стадию очистки с использованием TFF после стадии конъюгации. Альтернативно, способ по изобретению может включать первую стадию очистки с использованием адсорбционной хроматографии после стадии модификации и вторую стадию очистки с использованием адсорбционной хроматографии после стадии конъюгации. Способ по изобретению может также включать первую стадию очистки с использованием адсорбционной хроматографии после стадии модификации и вторую стадию очистки с использованием TFF после стадии конъюгации или первую стадию очистки с использованием TFF после стадии модификации и вторую стадию очистки с использованием адсорбционной хроматографии после стадии конъюгации.
[0040] В одном варианте реализации изобретения на стадии очистки используют неадсорбционную хроматографию. Например, способ по изобретению может включать первую стадию очистки с использованием неадсорбционной хроматографии после стадии модификации и вторую стадию очистки с использованием неадсорбционной хроматографии после стадии конъюгации.
[0041] В другом варианте реализации изобретения изобретение предлагает способ получения конъюгата, содержащего клеточно-связывающий агент, химически связанный с цитотоксическим агентом, в котором первую смесь, содержащую клеточно-связывающие агенты, имеющие связанные с ними линкеры, не подвергают очистке после реакции модификации и перед реакцией конъюгации, и в котором способ включает приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной. В тех случаях, когда очистка модифицированного клеточно-связывающего агента не проводится, изобретение предлагает способ получения конъюгата, содержащего клеточно-связывающий агент, химически связанный с цитотоксическим агентом, включающий стадию модификации, стадию конъюгации и первую стадию очистки после стадии конъюгации, в котором способ включает приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной, до или после первой стадии очистки для удаления по меньшей мере части примесей из смеси. В одном варианте реализации изобретения изобретение предлагает способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт клеточно-связывающего агента с бифункциональным сшивающим реагентом для ковалентного присоединения линкера к клеточно-связывающему агенту и, тем самым, получения первой смеси, содержащей клеточно-связывающие агенты, имеющие связанные с ними линкеры, (b) конъюгацию цитотоксического агента с клеточно-связывающими агентами, имеющими связанные с ними линкеры, в первой смеси путем проведения реакции клеточно-связывающих агентов, имеющих связанные с ними линкеры, с цитотоксическим агентом для получения второй смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент, которая содержит клеточно-связывающий агент, химически связанный посредством линкера с цитотоксическим агентом и одну или несколько примесей, (с) приведение в контакт второй смеси с поливинилдифторидной (ПВДФ) мембраной для удаления по меньшей мере части примесей, тем самым обеспечивая получение очищенной второй смеси конъюгата клеточно-связывающий агент-цитотоксический агент; и (d) обработку второй смеси после стадии (с) методом тангенциальной поточной фильтрации, селективного осаждения, неадсорбционной хроматографии, адсорбционной фильтрации, адсорбционной хроматографии или их комбинации, для дополнительной очистки конъюгата клеточно-связывающий агент-цитотоксический агент от примесей и, тем самым, получения очищенной третьей смеси конъюгата клеточно-связывающий агент-цитотоксический агент, где очищенная третья смесь содержит пониженное количество примесей по сравнению с очищенной второй смесью, и где первую смесь, содержащую клеточно-связывающий агент, имеющий связанные с ним линкеры (а также реагенты и другие побочные продукты), полученную на стадии (а), не подвергают очистке перед стадией (b). Любой способ очистки, описанный в данном документе, может быть использован на стадии очистки после реакции конъюгации. В предпочтительном варианте реализации изобретения на стадии очистки после реакции конъюгации используют тангенциальную поточную фильтрацию, адсорбционную хроматографию или неадсорбционную хроматографию.
[0042] В одном варианте реализации изобретения изобретение предлагает способ получения конъюгата, содержащего клеточно-связывающий агент, химически связанный с цитотоксическим агентом, включающий конъюгацию предварительно сформированного соединения цитотоксический агент-линкер с клеточно-связывающим агентом, как описано в патенте США 6441163 и публикациях патентных заявок США №2011/0003969 и 2008/0145374, с последующей стадией очистки, и включающий приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной до или после стадии очистки. Любой способ очистки, описанный в данном документе, может быть использован в способе по изобретению. В предпочтительном варианте реализации изобретения на стадии очистки используют тангенциальную поточную фильтрацию, адсорбционную хроматографию или неадсорбционную хроматографию.
[0043] В одном варианте реализации изобретения соединение цитотоксический агент-линкер получают путем введения в контакт цитотоксического агента с бифункциональным сшивающим реагентом, содержащим линкер, для ковалентного присоединения цитотоксического агента к линкеру. Соединение цитотоксический агент-линкер необязательно подвергают очистке перед введением в контакт соединения цитотоксический агент-линкер с клеточно-связывающим агентом.
[0044] В одном варианте реализации изобретения способ по изобретению, описанный в данном документе (например, одностадийный процесс) включает две раздельные стадии очистки после стадии конъюгации. В тех случаях, когда способ по изобретению включает две раздельные стадии очистки после стадии конъюгации, смесь, содержащая конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, может быть приведен в контакт с ПВДФ-мембраной перед любой из или обоими стадиями очистки или после стадий очистки для удаления по меньшей мере части примесей из смеси. Любой способ очистки, описанный в данном документе, может быть использован на стадиях очистки после реакции конъюгации. В предпочтительном варианте реализации изобретения используют тангенциальную поточную фильтрацию, адсорбционную хроматографию, неадсорбционную хроматографию или их комбинацию на стадии очистки после реакции конъюгации.
[0045] Любые пригодные TFF-системы могут быть использованы для очистки, включая систему типа Pellicon (Millipore, Billerica, MA), систему Sartocon Cassette (Sartorius AG, Edgewood, NY) и систему типа Centrasette (Pall Corp., East Hills, NY).
[0046] Любая пригодная смола для адсорбционной хроматографии может быть использована для очистки. Предпочтительные смолы для адсорбционной хроматографии включают гидроксиапатитную хроматографию, гидрофобную хроматографию с индуцированием заряда (HCIC), хроматографию гидрофобных взаимодействий (HIC), ионообменную хроматографию, ионообменную хроматографию в смешанном режиме, металл-аффинную хроматографию (IMAC), хроматографию на сорбентах, содержащих биоспецифические красители, аффинную хроматографию, обращенно-фазовую хроматографию и их комбинации. Примеры пригодных гидроксиапатитных смол включают керамический гидроксиапатит (СНТ типа I и типа II, Bio-Rad Laboratories, Hercules, СА), гидроксиапатит НА Ultrogel (Pall Corp., East Hills, NY) и керамический фторапатит (CFT типа I и типа II, Bio-Rad Laboratories, Hercules, СА). Примером пригодной смолы HCIC является смола МЕР Hypercel (Pall Corp., East Hills, NY). Примеры пригодных смол HIC включают бутилсефарозную, гексилсефарозную, фенилсефарозную и октилсефарозную смолы (все производства GE Healthcare, Piscataway, NJ), а также смолы Macro-prep Methyl и Macro-Prep t-Butyl (Biorad Laboratories, Hercules, СА). Примеры пригодных ионообменных смол включают SP-сефарозную, СМ-сефарозную и Q-сефарозную смолы (все производства GE Healthcare, Piscataway, NJ) и смолу Unosphere S (Bio-Rad Laboratories, Hercules, СА). Примеры пригодных ионообменников для смешанного режима включают смолу Bakerbond АВх (JT Baker, Phillipsburg NJ). Примеры пригодных смол IMAC включают хелатообразующую сефарозную смолу Chelating Sepharose (GE Healthcare, Piscataway, NJ) и смолу Profinity IMAC (Bio-Rad Laboratories, Hercules, СА). Примеры пригодных смол, содержащих биоспецифические красители, включают смолу Blue Sepharose (GE Healthcare, Piscataway, NJ) и смолу Affi-gel Blue (Bio-Rad Laboratories, Hercules, СА). Примеры пригодных аффинных смол включают смолу Protein A Sepharose (например, MabSelect, GE Healthcare, Piscataway, NJ), у которой клеточно-связывающий агент представляет собой антитело, и лектин-аффинные смолы, например, смолу Lentil Lectin Sepharose (GE Healthcare, Piscataway, NJ), где клеточно-связывающий агент несет соответствующие лектинсвязывающие сайты. Альтернативно, может быть использовано антитело, специфическое по отношению к клеточно-связывающему агенту. Такое антитело может быть иммобилизовано, например, на смоле Sepharose 4 Fast Flow (GE Healthcare, Piscataway, NJ). Примеры пригодных обращенно-фазовых смол включают смолы С4, С8 и C18 (Grace Vydac, Hesperia, CA).
[0047] Для очистки может быть использована любая пригодная смола для неадсорбционной хроматографии. Примеры пригодных смол для неадсорбционной хроматографии включают, без ограничения, SEPHADEX™ G-25, G-50, G-100, смолы SEPHACRYL™ (например, S-200 и S-300), смолы SUPERDEX™ (например, SUPERDEX™ 75 и SUPERDEX™ 200), смолы BIO-GEL® (например, Р-6, Р-10, Р-30, Р-60 и Р-100) и другие, известные специалистам в данной области техники.
[0048] В одном варианте реализации изобретения способ, описанный в данном документе, дополнительно включает приведение смеси с ионообменной хроматографической мембраной для удаления по меньшей мере части примесей из смеси. Ионообменная хроматографическая мембрана может быть анионообменной мембраной, такой как Q-мембрана, или катионообменной мембраной, такой как S-мембрана. В одном варианте ионообменная хроматографическая мембранареализации изобретения мембрана представляет собой обменную мембрану для удаления эндотоксина. В предпочтительном варианте ионообменная хроматографическая мембранареализации изобретения мембрана представляет собой анионообменную мембрану (например, Q-мембрану).
[0049] Анионообменная мембрана представляет собой положительно заряженную микропористую мембрану. В одном варианте реализации изобретения положительно заряженный анионообменный фрагмент представлет собой четвертичную аммониевую группу. В одном варианте реализации изобретения положительно заряженная микропористая мембрана содержит пористую основу и сшитое покрытие, имеющее боковые катионные группы (см., например, описанные в патентах США №№6780327, 6851561, 7094347, 7223341, 7396465). В одном варианте реализации изобретения пористая основа является гидрофильной (например, полиэфирсульфоновой или сшитой целлюлозной матрицей). В другом варианте реализации изобретения катионная группа представляет собой четвертичную аммониевую группу. В другом варианте реализации изобретения анионообменная мембрана представляет собой положительно заряженную микропористую мембрану, содержащую пористую полиэфирсульфоновую основу и сшитое покрытие, имеющее боковые четвертичные аммониевые группы.
[0050] В одном варианте реализации изобретения смесь приводят в контакт с ПВДФ-мембраной перед приведением в контакт смеси с ионообменной хроматографической мембраной (например, Q-мембраны или S-мембраны). В другом варианте реализации изобретения смесь приводят в контакт с ионообменной хроматографической мембраной перед приведением в контакт смеси с ПВДФ-мембраной. В еще одном варианте реализации изобретения смесь приводят в контакт с ионообменной хроматографической мембраной до приведения в контакт смеси с ПВДФ-мембраной. В другом варианте реализации изобретения смесь приводят в контакт с ПВДФ-мембраной до приведения в контакт с ионообменной хроматографической мембраной.
[0051] Способ по изобретению включает проведение реакций, описанных в данном документе (например, реакция модификации, реакция конъюгации или одностадийная реакция) при любой пригодной температуре, известной в данной области техники. Например, реакция может протекать при примерно 20°С или ниже (например, от примерно -10°С (при условии, что не допускается замерзание раствора, например, вследствие присутствия органического растворителя, используемого для растворения цитотоксического агента и бифункционального сшивающего реагента) до примерно 20°С, от примерно 0°С до примерно 18°С, от примерно 4°С до примерно 16°С), при комнатной температуре (например, от примерно 20°С до примерно 30°С или от примерно 20°С до примерно 25°С) или при повышенной температуре (например, от примерно 30°С до примерно 37°С). В одном варианте реализации изобретения реакция проходит при температуре от примерно 16°С до примерно 24°С (например, примерно 16°С, примерно 17°С, примерно 18°С, примерно 19°С, примерно 20°С, примерно 21°С, примерно 22°С, примерно 23°С, примерно 24°С или примерно 25°С).
[0052] В одном варианте реализации изобретения способ по изобретению, описанный в данном документе, дополнительно включает стадию гашения для гашения какого-либо непрореагировавшего цитотоксического агента и/или непрореагировавшего бифункционального сшивающего реагента. Стадию гашения проводят до очистки клеточно-связывающего агента-цитотоксического агента. Альтернативно, стадию гашения проводят после очистки клеточно-связывающего агента-цитотоксического агента. В одном варианте реализации изобретения способ по изобретению включает (а) приведение в контакт клеточно-связывающего агента с цитотоксическим агентом с образованием смеси, содержащей клеточно-связывающий агент и цитотоксический агент, и затем приведение в контакт смеси, содержащей клеточно-связывающий агент и цитотоксический агент, с бифункциональным сшивающим реагентом, содержащим линкер, в растворе, имеющем pH от примерно 4 до примерно 9, для получения смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент, где клеточно-связывающий агент химически связан с помощью линкера с цитотоксическим агентом, и примеси (например, свободный цитотоксический агент и побочные продукты реакции), (b) приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной, (с) гашение смеси после стадии (b) для гашения какого-либо непрореагировавшего цитотоксического агента и/или непрореагировавшего бифункционального сшивающего реагента, (d) приведение в контакт погашенной смеси с ПВДФ-мембраной, (е) необязательно, выдерживание смеси, (f) необязательно, приведение в контакт смеси с ПВДФ-мембраной, и (g) очистку смеси для получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент. В другом варианте реализации изобретения способ по изобретению включает (а) приведение клеточно-связывающего агента в контакт с цитотоксическим агентом с образованием смеси, содержащей клеточно-связывающий агент и цитотоксический агент, и затем приведение в контакт смеси, содержащей клеточно-связывающий агент и цитотоксический агент, с бифункциональным сшивающим реагентом, содержащим линкер, в растворе, имеющем pH от примерно 4 до примерно 9, для получения смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент, где клеточно-связывающий агент химически связан с помощью линкера с цитотоксическим агентом, и примеси (например, свободный цитотоксический агент и побочные продукты реакции), (b) приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной, (с) необязательно, гашение смеси после стадии (b) для гашения какого-либо непрореагировавшего цитотоксического агента и/или непрореагировавшего бифункционального сшивающего реагента, (d) необязательно, приведение в контакт погашенной смеси с ПВДФ-мембраной, (е) выдерживание смеси, (f) приведение в контакт смеси с ПВДФ-мембраной, и (g) очистки смесь для получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[0053] В одном варианте реализации изобретения смесь гасят путем введения в контакт смеси с реагентом-гасителем. Как используется в данном документе, "реагент-гаситель" относится к реагенту, который вступает в реакцию со свободным цитотоксическим агентом и/или бифункциональным сшивающим реагентом.
[0054] В одном варианте реализации изобретения малеимидные или галоидацетамидные реагенты-гасители, такие как 4-малеимидомасляная кислота, 3-малеимидопропионовая кислота, N-этилмалеимид, йодацетамид или йодацетамидопропионовая кислота, могут быть использованы для обеспечения гашения каких-либо непрореагировавших групп (таких как тиольные) в цитотоксическом агенте. Стадия гашения может помогать предотвратить димеризацию цитотоксического агента, в частности, цитотоксического агента, имеющего непрореагировавшую тиольную группу (такого как DM1). Димеризованный цитотоксический агент может быть трудно удалить. Стадия гашения может также минимизировать какие-либо нежелательные реакции обмена тиол-дисульфида с нативными дисульфидными группами антитела. При гашении полярными заряженными реагентами-гасителями тиольных групп (такими как 4-малеимидомасляная кислота или 3-малеимидопропионовая кислота), избыточный непрореагировавший цитотоксический агент превращается в полярный заряженный водорастворимый аддукт, который может быть легко отделен от ковалентно-связанного конъюгата на стадии очистки. Также может быть использовано гашение неполярными и нейтральными реагентами-гасителями тиольных групп.
[0055] В одном варианте реализации изобретения смесь гасят путем введения в контакт смеси с реагентом-гасителем, который вступает в реакцию с непрореагировавшим бифункциональным сшивающим реагентом. Например, нуклеофилы могут быть добавлены в смесь для гашения какого-либо непрореагировавшего бифункционального сшивающего реагента. Нуклеофил предпочтительно представляет собой нуклеофил, содержащий аминогруппу, такой как лизин, таурин и гидроксиламин.
[0056] Альтернативно, смесь гасят путем понижения pH смеси до примерно 5,0 (например, 4,8; 4,9; 5,0; 5,1 или 5,2). В другом варианте реализации изобретения смесь гасят путем понижения pH до менее 6,0; менее 5,5; менее 5,0; менее 4,8; менее 4,6; менее 4,4; менее 4,2; менее 4,0. Альтернативно, pH снижают до примерно 4,0 (например, 3,8; 3,9; 4,0; 4,1 или 4,2) до примерно 6,0 (например, 5,8; 5,9; 6,0; 6,1 или 6,2), от примерно 4,0 до примерно 5,0, от примерно 4,5 (например, 4,3; 4,4; 4,5; 4,6 или 4,7) до примерно 5,0. В одном варианте реализации изобретения смесь гасят путем понижения pH смеси до 4,8.
[0057] В предпочтительном варианте реализации изобретения реакции (например, стадии модификации, стадии конъюгации или одностадийной реакции) позволяют протекать до завершения до введения в контакт смеси с реагентом-гасителем. При этом реагент-гаситель прибавляют к смеси через от примерно 1 часа до примерно 48 часов (например, от примерно 1 часа, примерно 2 часов, примерно 3 часов, примерно 4 часов, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов, примерно 9 часов, примерно 10 часов, примерно 11 часов, примерно 12 часов, примерно 13 часов, примерно 14 часов, примерно 15 часов, примерно 16 часов, примерно 17 часов, примерно 18 часов, примерно 19 часов, примерно 20 часов, примерно 21 часов, примерно 22 часов, примерно 23 часов, примерно 24 часов или примерно 25 часов, до примерно 48 часов) после введения в контакт смеси, содержащей клеточно-связывающий агент и цитотоксический агент, с бифункциональным сшивающим реагентом.
[0058] Способ по изобретению может необязательно включать прибавление сахарозы к стадии реакции (например, стадии модификации, стадии конъюгации или одностадийной реакции) для увеличения растворимости и выхода конъюгатов клеточно-связывающий агент-цитотоксический агент. Желательно, сахарозу прибавляют в концентрации от примерно 0,1% (мас./об.) до примерно 20% (мас./об.) (например, примерно 0,1% (мас./об.), 1% (мас./об.), 5% (мас./об.), 10% (мас./об.), 15% (мас./об.) или 20% (мас./об.)). Предпочтительно, сахарозу прибавляют в концентрации от примерно 1% (мас./об.) до примерно 10% (мас./об.) (например, примерно 0,5% (мас./об.), примерно 1% (мас./об.), примерно 1,5% (мас./об.), примерно 2% (мас./об.), примерно 3% (мас./об.), примерно 4% (мас./об.), примерно 5% (мас./об.), примерно 6% (мас./об.), примерно 7% (мас./об.), примерно 8% (мас./об.), примерно 9% (мас./об.), примерно 10%) (мас./об.) или примерно 11% (мас./об.)). Кроме того, стадия реакции может также включать прибавление буферного агента. Могут быть использованы любые пригодные буферные агенты, известные в данной области техники. Пригодные буферные агенты включают, например, цитратный буфер, ацетатный буфер, сукцинатный буфер и фосфатный буфер. В одном варианте реализации изобретения буферный агент выбирают из группы, состоящей из HEPPSO (N-(2-гидроксиэтил)пиперазин-N'-(2-гидроксипропансульфоновая кислота)), POPSO (пиперазин-1,4-бис-(2-гидроксипропансульфоновой кислоты) дегидрат), HEPES (4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота), HEPPS (EPPS) (4-(2-гидроксиэтил)пиперазин-1-пропансульфоновая кислота), TES (N-[трис(гидроксиметил)метил]-2-аминоэтансульфоновая кислота) и их комбинаций.
[0059] В одном варианте реализации изобретения способ по изобретению дополнительно включает одну или несколько (например, одну, две или три) стадии выдерживания для высвобождения нестабильно связанных линкеров из клеточно-связывающего агента. Стадия выдерживания включает выдерживание смеси после модификации клеточно-связывающего агента бифункциональным сшивающим реагентом, после конъюгации цитотоксического агента с клеточно-связывающими агентами, имеющими связанные с ними линкеры, и/или после стадии очистки. В тех случаях, когда стадия выдерживания включает выдерживание смеси после конъюгации цитотоксического агента с клеточно-связывающими агентами, имеющими связанные с ними линкеры, и/или после стадии очистки после стадии конъюгации, смесь может быть приведена в контакт с ПВДФ-мембраной до или после стадии выдерживания или в обоих этих случаях. В одном варианте реализации изобретения способ включает приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с помощью стадии выдерживания после стадии конъюгации, с ПВДФ-мембраной после стадии выдерживания и до стадии очистки. В другом варианте реализации изобретения способ включает проведение воздействия на смесь, содержащую конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с помощью стадии выдерживания после стадии конъюгации, причем смесь подвергают обработке на стадии очистки после стадии выдерживания, с последующим проведением воздействия на смесь с помощью ПВДФ-мембраны. Смесь, необязательно, может быть подвергнута второй стадии выдерживания перед приведением в контакт смеси с ПВДФ-мембраной.
[0060] Стадия выдерживания включает выдерживание раствора при пригодной температуре (например, от примерно 2°С до примерно 37°С) на протяжении пригодного периода времени (например, от примерно 1 часа до примерно 1 недели) для высвобождения нестабильно связанных линкеров из клеточно-связывающего агента, без существенного высвобождения стабильно связанных линкеров из клеточно-связывающего агента. В одном варианте реализации изобретения стадия выдерживания включает выдерживание раствора при низкой температуре (например, от примерно 2°С до примерно 10°С или примерно 4°С), при комнатной температуре (например, от примерно 20°С до примерно 30°С или от примерно 20°С до примерно 25°С) или при повышенной температуре (например, от примерно 30°С до примерно 37°С).
[0061] Продолжительность стадии выдерживания зависит от температуры, при которой проводят стадию выдерживания. Например, продолжительность стадии выдерживания может быть существенно уменьшена путем проведения стадии выдерживания при повышенной температуре, причем максимальная температура ограничена стабильностью конъюгата клеточно-связывающий агент-цитотоксический агент. Стадия выдерживания может включать выдерживание раствора от примерно 1 часа до примерно 1 дня (например, примерно 1 час, примерно 2 часа, примерно 3 часа, примерно 4 часа, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов, примерно 9 часов, примерно 10 часов, примерно 12 часов, примерно 14 часов, примерно 16 часов, примерно 18 часов, примерно 20 часов, примерно 22 часа или примерно 24 часа), от примерно 5 часов до примерно 1 недели, от примерно 12 часов до примерно 1 недели (например, примерно 12 часов, примерно 16 часов, примерно 20 часов, примерно 24 часов, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней или примерно 7 дней), от примерно 12 часов до примерно 1 недели (например, примерно 12 часов, примерно 16 часов, примерно 20 часов, примерно 24 часов, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней или примерно 7 дней) или от примерно 1 дня до примерно 1 недели.
[0062] В одном варианте реализации изобретения стадия выдерживания включает выдерживание раствора при температуре от примерно 2°С до примерно 8°С в течение периода от по меньшей мере примерно 12 часов до 1 дня.
[0063] Значение pH для стадии выдерживания предпочтительно составляет от примерно 4 до примерно 9 (например, от примерно 4,5 до примерно 8,5 или от примерно 5 до примерно 8). В одном варианте реализации изобретения значения pH для стадии выдерживания находятся в диапазоне от примерно 5 до примерно 7,5 (например, от примерно 5,5 до примерно 7,5, от примерно 6 до примерно 7,5, от примерно 6,5 до примерно 7,5, от примерно 7 до примерно 7,5, от примерно 5 до примерно 7, от примерно 5 до примерно 6,5, от примерно 5 до примерно 5,5, от примерно 5,5 до примерно 7, от примерно 6 до примерно 6,5 или примерно 6 до примерно 7). Например, значения pH для стадии выдерживания могут составлять примерно 4, примерно 4,5, примерно 5, примерно 5,5, примерно 6, примерно 6,5, примерно 7, примерно 7,5, примерно 8, примерно 8,5 или примерно 9.
[0064] Стадия выдерживания может быть проведена до или после конъюгирования клеточно-связывающего агента с цитотоксическим агентом. В одном варианте реализации изобретения стадию выдерживания проводят сразу после модификации клеточно-связывающего агента бифункциональным сшивающим реагентом. Например, способ по изобретению включает стадию выдерживания после модификации клеточно-связывающего агента бифункциональным сшивающим реагентом и перед конъюгацией. После модификации клеточно-связывающего агента, стадия очистки может быть проведена перед стадией выдерживания и/или после стадии выдерживания, но до стадии конъюгации. В другом варианте реализации изобретения стадию выдерживания проводят сразу после конъюгации цитотоксического агента с клеточно-связывающим агентом, имеющим связанные с ним линкеры, и до стадии очистки. В другом варианте реализации изобретения стадию выдерживания проводят после конъюгации и стадии очистки, с последующим проведением дополнительной стадии очистки.
[0065] В конкретных вариантах реализации изобретения стадия выдерживания может включать инкубирование смеси при pH примерно 5-7,5 или примерно 6,5-7,5 в течение от примерно 1 часа до примерно 1 недели при температуре от примерно 2°С до примерно комнатной температуры.
[0066] В одном варианте реализации изобретения изобретение предлагает способ получения конъюгата клеточно-связывающий агент-цитотоксический агент, включающий прибавление экзогенного NHS. "Экзогенный NHS", как используется в данном документе, относится к NHS, который прибавляют во время проведения процесса из внешнего источника и не относится к NHS, который образуется в ходе реакции модификации в результате гидролиза/аминолиза бифункционального линкера.
[0067] В одном варианте реализации изобретения изобретение предлагает способ получения конъюгата клеточно-связывающий агент-цитотоксический агент, включающий прибавление от примерно 0,1 мМ до примерно 300 мМ экзогенного NHS. Например, способ по изобретению включает прибавление примерно 0,1 мМ, примерно 0,2 мМ, примерно 0,3 мМ, примерно 0,4 мМ, примерно 0,5 мМ, примерно 0,6 мМ, примерно 0,7 мМ, примерно 0,8 мМ, примерно 0,9 мМ, примерно 1,0 мМ, примерно 1,1 мМ, примерно 1,3 мМ, примерно 1,5 мМ, примерно 1,7 мМ, примерно 1,9 мМ, примерно 2,0 мМ, примерно 2,1 мМ, примерно 2,3 мМ, примерно 2,5 мМ, примерно 2,7 мМ, примерно 2,9 мМ, примерно 3,0 мМ, примерно 3,1 мМ, примерно 3,3 мМ, примерно 3,5 мМ, примерно 3,7 мМ, примерно 3,9 мМ, примерно 4,0 мМ, примерно 4,1 мМ, примерно 4,3 мМ, примерно 4,5 мМ, примерно 4,7 мМ, примерно 4,9 мМ, примерно 5,0 мМ, примерно 5,1 мМ, примерно 5,3 мМ, примерно 5,5 мМ, примерно 5,7 мМ, примерно 5,9 мМ, примерно 6,0 мМ, примерно 6,1 мМ, примерно 6,3 мМ, примерно 6,5 мМ, примерно 6,7 мМ, примерно 6,9 мМ, примерно 7,0 мМ, примерно 7,1 мМ, примерно 7,3 мМ, примерно 7,5 мМ, примерно 7,7 мМ, примерно 7,9 мМ, примерно 8,0 мМ, примерно 8,1 мМ, примерно 8,3 мМ, примерно 8,5 мМ, примерно 8,7 мМ, примерно 8,9 мМ, примерно 9,0 мМ, примерно 9,1 мМ, примерно 9,3 мМ, примерно 9,5 мМ, примерно 9,7 мМ, примерно 9,9 мМ, примерно 10 мМ, примерно 11 мМ, примерно 12 мМ, примерно 13 мМ, примерно 14 мМ, примерно 15 мМ, примерно 16 мМ, примерно 17 мМ, примерно 18 мМ, примерно 19 мМ, примерно 20 мМ, примерно 25 мМ, примерно 30 мМ, примерно 35 мМ, примерно 40 мМ, примерно 45 мМ, примерно 50 мМ, примерно 55 мМ, примерно 60 мМ, примерно 65 мМ, примерно 70 мМ, примерно 75 мМ, примерно 80 мМ, примерно 85 мМ, примерно 90 мМ, примерно 95 мМ, примерно 100 мМ, примерно 110 мМ, примерно 120 мМ, примерно 130 мМ, примерно 140 мМ, примерно 150 мМ, примерно 160 мМ, примерно 170 мМ, примерно 180 мМ, примерно 190 мМ, примерно 200 мМ, примерно 210 мМ, примерно 220 мМ, примерно 230 мМ, примерно 240 мМ, примерно 250 мМ, примерно 260 мМ, примерно 270 мМ, примерно 280 мМ, примерно 290 мМ или примерно 300 мМ экзогенного NHS. В одном варианте реализации изобретения способ по изобретению включает прибавление от примерно 0,1 мМ до примерно 5 мМ, от примерно 0,1 мМ до примерно 10 мМ, от примерно 1,0 мМ до примерно 5 мМ, от примерно 1,0 мМ до примерно 10 мМ, от примерно 5,0 мМ до примерно 10 мМ, от примерно 10 мМ до примерно 20 мМ, от примерно 20 мМ до примерно 30 мМ, от примерно 30 мМ до примерно 40 мМ, от примерно 40 мМ до примерно 50 мМ, от примерно 50 мМ до примерно 60 мМ, от примерно 60 мМ до примерно 70 мМ, от примерно 70 мМ до примерно 80 мМ, от примерно 80 мМ до примерно 90 мМ, от примерно 90 мМ до примерно 100 мМ, от примерно 100 мМ до примерно 110 мМ, от примерно 110 мМ до примерно 120 мМ, от примерно 120 мМ до примерно 130 мМ, от примерно 130 мМ до примерно 140 мМ, от примерно 140 мМ до примерно 150 мМ, от примерно 150 мМ до примерно 160 мМ, от примерно 160 мМ до примерно 170 мМ, от примерно 170 мМ до примерно 180 мМ, от примерно 180 мМ до примерно 190 мМ, от примерно 190 мМ до примерно 200 мМ, от примерно 200 мМ до примерно 220 мМ, от примерно 220 мМ до примерно 240 мМ, от примерно 240 мМ до примерно 260 мМ, от примерно 260 мМ до примерно 280 мМ или от примерно 280 мМ до примерно 300 мМ экзогенного NHS. В другом варианте реализации изобретения способ по изобретению включает прибавление от примерно 10 мМ до примерно 200 мМ, от примерно 20 до примерно 150 мМ, от примерно 50 до примерно 150 мМ или от примерно 20 до примерно 100 мМ экзогенного NHS.
[0068] В некоторых вариантах реализации изобретения способ по изобретению включает прибавление экзогенного NHS в определенном молярном соотношении по отношению к количеству NHS, образующегося в ходе реакции модификации в результате гидролиза/аминолиза бифункционального линкера. Специалист в данной области техники может определить количество NHS, образующегося в ходе конкретной модификации, поскольку количество образующегося NHS является по существу таким же, как и количество использованного бифункционального линкера. Квалифицированный специалист может затем прибавить к реакционной смеси экзогенный NHS в молярной концентрации, определенной по отношению к количеству NHS, образующегося в ходе реакции модификации. В одном варианте реализации изобретения экзогенный NHS прибавляют в количестве от примерно 2-до примерно 200-кратного по отношению к количеству NHS, образующегося в ходе реакции модификации. Например, способ по изобретению включает прибавление экзогенного NHS примерно в 2-, примерно 5-, примерно 10-, примерно 15-, примерно 20-, примерно 25-, примерно 50-, примерно 100- или примерно 200-кратном количестве по отношению к количеству NHS, образующегося в ходе реакции модификации.
[0069] В некоторых вариантах реализации изобретения способ по изобретению включает прибавление экзогенного NHS в определенном молярном соотношении по отношению к количеству бифункционального линкера. В одном варианте реализации изобретения молярное отношение экзогенного NHS к бифункциональному сшивающему агенту составляет от примерно 0,5 до примерно 1000 (например, от примерно 1 до примерно 900, от примерно 5 до примерно 750, от примерно 50 до примерно 500, от примерно 100 до примерно 500, от примерно 0,5 до примерно 500 или от примерно 100 до примерно 1000). Например, способ по изобретению включает NHS в примерно 0,5-, примерно 1-, примерно 2-, примерно 5-, примерно 10-, примерно 15-, примерно 20-, примерно 25-, примерно 50-, примерно 100-, примерно 200-, примерно 300-, примерно 400-, примерно 500-, примерно 600-, примерно 700-, примерно 800-, примерно 900- или примерно 1000-кратном количестве по отношению к количеству бифункционального линкера.
[0070] Способ по изобретению включает прибавление экзогенного NHS в какой-либо точке в ходе процесса получения конъюгата клеточно-связывающий агент-цитотоксический агент. Например, способ по изобретению включает прибавление экзогенного NHS на стадии модификации (т.е., стадии, на которой клеточно-связывающий агент приводят в контакт с бифункциональным линкером), на стадии конъюгации (т.е., стадии, на которой модифицированный клеточно-связывающий агент приводят в контакт с цитотоксическим агентом), на стадии очистки или на стадии выдерживания между какмим-либо из вышеуказанных стадий. В одном варианте реализации изобретения способ по изобретению включает прибавление экзогенного NHS на стадии модификации (т.е., NHS прибавляют к реакции модификации), на стадии выдерживания между стадией модификации и стадией очистки, на стадии выдерживания между стадией модификации и стадией конъюгации, на стадии очистки, на стадии конъюгации, на стадии выдерживания между стадией конъюгации и стадией очистки, и/или на стадии выдерживания между двумя стадиями очистки.
[0071] В одном варианте реализации изобретения изобретение предлагает способ получения клеточно-связывающего агента, имеющего связанный с ним линкер, включающий приведение в контакт клеточно-связывающего агента с бифункциональным сшивающим реагентом в присутствии экзогенного NHS для ковалентного присоединения линкера к клеточно-связывающему агенту и, тем самым, получения смеси, содержащей клеточно-связывающий агенты, имеющие связанные с ним линкеры.
[0072] Изобретение предлагает способ получения композиций стабильных конъюгатов, содержащих клеточно-связывающий агент, химически связанный с цитотоксическим агентом, причем композиции по существу не содержат нестабильных конъюгатов. При этом изобретение предлагает способ получения конъюгата клеточно-связывающий агент-цитотоксический агент с существенно высокой степенью очистки и стабильности. Такие композиции могут быть использованы для лечения болезней благодаря высокой степени очистки и стабильности конъюгатов. Композиции, содержащие клеточно-связывающий агент, такой как антитело, химически связанный с цитотоксическим агентом, таким как а майтанзиноид, описаны, например, в патенте США 7374762. В одном аспекте изобретения, конъюгат клеточно-связывающий агент-цитотоксический агент с существенно высокой степенью очистки имеет один или несколько из следующих признаков: (а) более примерно 90% (например, количество, большее или равное примерно 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%), предпочтительно, более примерно 95%, частиц конъюгата являются мономерными, (b) уровень содержания неконъюгированного линкера в препарате конъюгата или очищенном конъюгате составляет менее примерно 10% (например, количество, меньшее или равное примерно 9%, 8%, 1%, 6%, 5%, 4%, 3%, 2%, 1% или 0%) (по отношению к общему количеству линкера), (с) менее 10% частиц конъюгата являются сшитыми (например, количество, меньшее или равное примерно 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или 0%), (d) уровень содержания свободного цитотоксического агента в препарате конъюгата или очищенном конъюгате составляет менее примерно 5%, менее примерно 3%, менее примерно 2% (например, количество, меньшее или равное примерно 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1,0%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) (по отношению к общему количеству цитотоксического агента), (f) уровень содержания цитотоксических димерных частиц в препарате конъюгата или очищенном конъюгате составляет менее примерно 5%, менее примерно 3%, менее примерно 2% (например, количество, меньшее или равное примерно 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1,0%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) (по отношению к общему количеству цитотоксического агента), и/или (е) отсутствие существенного увеличения уровня содержания свободного цитотоксического агента при хранении (например, через примерно 1 неделю, примерно 2 недели, примерно 3 недели, примерно 1 месяц, примерно 2 месяца, примерно 3 месяца, примерно 4 месяца, примерно 5 месяцев, примерно 6 месяцев, примерно 1 год, примерно 2 года или примерно 5 лет). "Существенное увеличение" уровня содержания свободного цитотоксического агента означает, что после определенного времени хранения, увеличение уровня содержания свободного цитотоксического агента составляет менее примерно 0,1%, примерно 0,2%, примерно 0,3%, примерно 0,4%, примерно 0,5%, примерно 0,6%, примерно 0,7%, примерно 0,8%, примерно 0,9%, примерно 1,0%, примерно 1,1%, примерно 1,2%, примерно 1,3%, примерно 1,4%, примерно 1,5%, примерно 1,6%, примерно 1,7%, примерно 1,8%, примерно 1,9%, примерно 2,0%, примерно 2,2%, примерно 2,5%, примерно 2,7%, примерно 3,0%, примерно 3,2%, примерно 3,5%, примерно 3,7% или примерно 4,0%.
[0073] Как используется в данном документе, термин "неконъюгированный линкер" относится к клеточно-связывающему агенту, который ковалентно связан с бифункциональным сшивающим реагентом, причем клеточно-связывающий агент не является ковалентно связанным с цитотоксическим агентом через линкер бифункционального сшивающего реагента (т.е., "неконъюгированный линкер" может быть представлен как CBA-L, где СВА обозначает клеточно-связывающий агент и L обозначает бифункциональный сшивающий реагент. В отличие от этого, конъюгат клеточно-связывающий агент-цитотоксический агент может быть представлен как CBA-L-D, где D обозначает цитотоксический агент).
[0074] Как используется в данном документе, термин "димеры цитотоксического агента" относится к димерам, содержащим свободный цитотоксический агент, где цитотоксический агент не является химически связанным с клеточно-связывающим агентом через линкер. В одном варианте реализации изобретения димеры цитотоксического агента химически связаны друг с другом с помощью линкера (т.е., "димеры цитотоксического агента" могут быть представлены как D-L-D, где D обозначает цитотоксический агент и L обозначает бифункциональный сшивающий реагент.В отличие от этого, конъюгат клеточно-связывающий агент-цитотоксический агент может быть представлен как CBA-L-D, где СВА обозначает клеточно-связывающий агент). В другом варианте реализации изобретения димеры цитотоксического агента химически не связаны друг с другом с помощью линкера (т.е., "димеры цитотоксического агента" могут быть представлены как D-D, где D обозначает цитотоксический агент. В отличие от этого, конъюгат клеточно-связывающий агент-цитотоксический агент может быть представлен как CBA-L-D, где СВА обозначает клеточно-связывающий агент и L обозначает бифункциональный сшивающий реагент). В одном варианте реализации изобретения некоторые димеры цитотоксического агента химически связаны друг с другом с помощью линкера и некоторые димеры цитотоксического агента химически не связаны друг с другом с помощью линкера (т.е., "димеры цитотоксического агента" могут быть представлены как D-L-D и D-D, где D обозначает цитотоксический агент и L обозначает бифункциональный сшивающий реагент). В одном варианте реализации изобретения димерами цитотоксического агента являются димер DM1-DM1 и димер DM1-MCC-DM1, где линкер представляет собой SMCC и цитотоксический агент представляет собой DM1.


[0075] В другом варианте реализации изобретения димерами цитотоксического агента
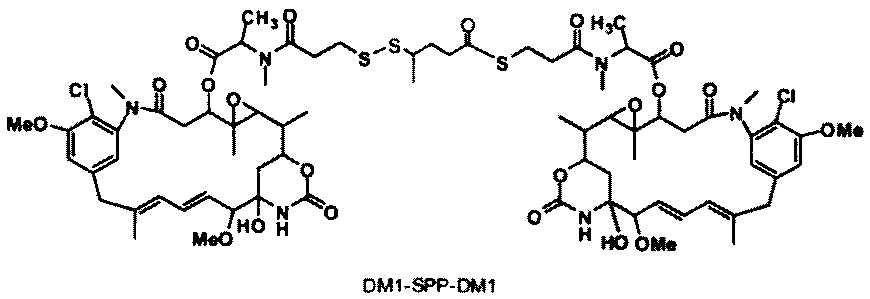
являются димеры DM1-DM1 и димеры DM1-SPP-DM1, где линкер представляет собой SPP и цитотоксический агент представляет собой DM1.
[0076] В другом варианте реализации изобретения димерами цитотоксического агента являются димеры DM1-DM1 и димеры DM1-CXI-1-DM1, где линкер представляет собой СХ1-1 и цитотоксический агент представляет собой DM1.

[0077] Как используется в данном документе, термин "свободный цитотоксический агент" относится к какой-либо форме цитотоксического агента, который не является химически связанным с клеточно-связывающим агентом через линкер (т.е., "свободный цитотоксический агент" может включать, без ограничений, собственно цитотоксический агент, представленный как D, цитотоксический агент, связанный с линкером или производными линкера (например, гидролизованные производные), представленный как D-L, и димеры цитотоксического агента, представленные как D-D и D-L-D, описанные выше).
[0078] В одном варианте реализации изобретения свободный цитотоксический агент включает DM1, MCC-DM1, гидро-SMCC-DM1, SMCC-DM1, DM1-SPP, DM1-TPA, DM1-DM1, DM1-MCC-DM1 и DM1-SPP-DM1.

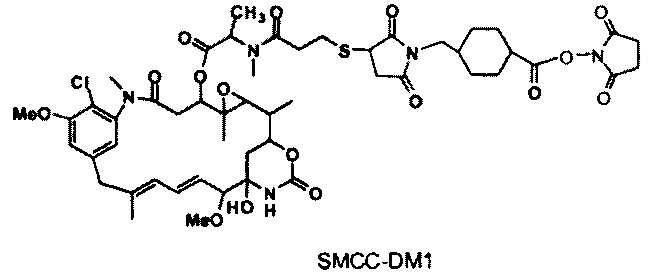
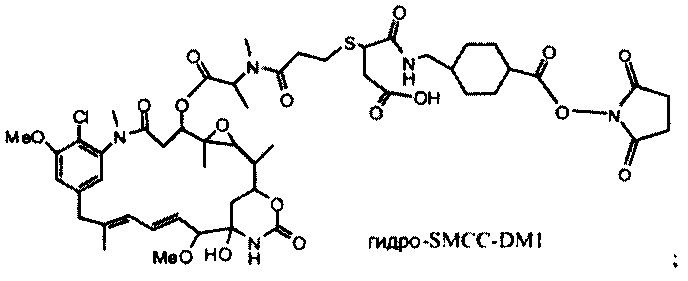
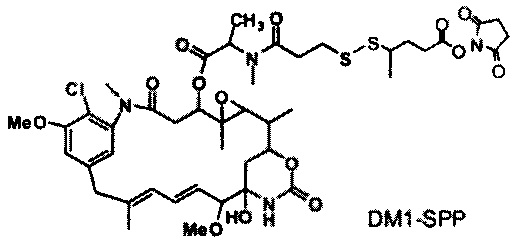
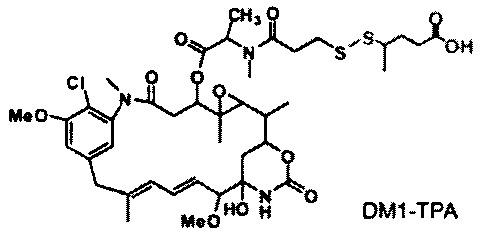
[0079] Как используется в данном документе, термин "агрегаты конъюгата клеточно-связывающий агент-цитотоксический агент" относится к двум или больше конъюгатам клеточно-связывающий агент-цитотоксический агент, ковалентно или нековалентно связанным друг с другом (например, два или больше конъюгатов клеточно-связывающий агент-цитотоксический агент, ковалентно связанные через линкер).
[0080] В одном варианте реализации изобретения среднее молярное отношение цитотоксического агента к клеточно-связывающему агенту в конъюгате клеточно-связывающий агент-цитотоксический агент составляет от примерно 1 до примерно 10, от примерно 2 до примерно 7, от примерно 3 до примерно 5, от примерно 2,5 до примерно 4,5 (например, примерно 2,5, примерно 2,6, примерно 2,7, примерно 2,8, примерно 2,9, примерно 3,0, примерно 3,1, примерно 3,3, примерно 3,4, примерно 3,5, примерно 3,6, примерно 3,7, примерно 3,8, примерно 3,9, примерно 4,0, примерно 4,1, примерно 4,2, примерно 4,3, примерно 4,4, примерно 4,5), от примерно 3,0 до примерно 4,0, от примерно 3,2 до примерно 4,2, от примерно 4,5 to 5,5 (например, примерно 4,5, примерно 4,6, примерно 4,7, примерно 4,8, примерно 4,9, примерно 5,0, примерно 5,1, примерно 5,2, примерно 5,3, примерно 5,4, примерно 5,5).
[0081] Клеточно-связывающий агент может быть любым пригодным агентом, который связывается с клеткой, в типичном и предпочтительном случае животной клеткой (например, клеткой человека). Клеточно-связывающий агент предпочтительно представляет собой пептид или полипептид или гликотоп.Пригодные клеточно-связывающие агенты включают, например, антитела (например, моноклональные антитела и их фрагменты), интерфероны (например, альфа, бета, гамма), лимфокины (например, интерлейкин 2 (IL-2), интерлейкин 3 (IL-3), интерлейкин 4 (IL-4), интерлейкин 6 (IL-6), гормоны (например, инсулин, TRH (тиреотропин-рилизинг гормон), MSH (меланоцит-стимулирующий гормон), стероидные гормоны, такие как андрогены и эстрогены), факторы роста и колониестимулирующие факторы, такие как эпидермальный фактор роста (EGF), трансформирующий фактор роста альфа (TGF-альфа), фактор роста фибробластов (FGF), фактор роста сосудистого эндотелия (VEGF), колониестимулирующие факторы (CSF), такие как G-CSF, M-CSF и GM-CSF (Burgess, Immunology Today 5:155-158 (1984)), молекулы, транспортирующие питательные вещества (например, трансферрин), витамины (например, фолат) и любые другие агенты или молекулы, которые специфически связывают молекулу-мишень на поверхности клетки.
[0082] В тех случаях, когда клеточно-связывающий агент представляет собой антитело, он связывается с антигеном, который является полипептидом и может быть трансмембранной молекулой (например, рецептором) или лигандом, таким как фактор роста. Типичные примеры антигенов включают молекулы, такие как ренин; гормон роста, включая человеческий гормон роста и бычий гормон роста; рилизинг-гормон гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор vmc, фактор IX, тканевой фактор (TF) и фактор фон Виллебранда; факторы, препятствующие свертыванию крови, такие как белок С; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназный активатор плазминогена или активатор плазминогена мочи человека или активатор плазминогена тканевого типа (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухоли-альфа и -бета; энкефалиназа; RANTES (фактор регуляции экспрессии и секреции нормальных Т-лимфоцитов); макрофагальный воспалительный белок человека (MIP-1-альфа); сывороточный альбумин, такой как человеческий сывороточный альбумин; ингибирующая субстанция Мюллера; A-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; цитотоксический Т-лимфоцит-ассоциированный антиген (CTLA), такой как CTLA-4; ингибин; активин; фактор роста сосудистого эндотелия (VEGF); рецепторы гормонов или факторов роста; белок А или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT4, NT-5 или NT-6) или фактор роста нервов, такой как NGF-β; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов (FGF), такой как aFGF и bFGF; рецептор фактора роста фибробластов, такой как FGFR2/4 и FGFR3, эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозговой IGF-I), белки, связывающие инсулиноподобный фактор роста, рецепторы ЕрСАМ, GD3, FLT3, PSMA, PSCA, MUC1, MUC16, STEAP, CEA, TENB2, рецепторы EphA, рецепторы EphB, фолатный рецептор, FOLR1, мезотелин, крипто, альфаvбета6, интегрины, VEGF, VEGFR, EGFR, рецептор трансферрина, IRTA1, IRTA2, IRTA3, IRTA4, IRTA5; CD-белки, такие как CD2, CD3, CD4, CD5, CD6, CD8, CD11, CD 14, CD 19, CD20, CD21, CD22, CD25, CD26, CD28, CD30, CD33, CD36, CD37, CD38, CD40, CD44, CD52, CD55, CD56, CD59, CD70, CD79, CD80. CD81, CD103, CD105, CD134, CD137, CD138, CD152, или антитело, которое связывается с одним или несколькими ассоциированными с опухолью антигенами или рецепторами клеточной поверхности, раскрытые в публикации патентной заявки США №2008/0171040 или публикации патентной заявки США №2008/0305044, целиком включенных в данный документ посредством ссылок; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; морфогенетический протеин кости (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1 - IL-10; супероксиддисмутаза; Т-клеточные рецепторы; поверхностные мембранные белки; диссоциацию; вирусный антиген, такой как, например, часть оболочки ВИЧ; транспортные белки; хоминг-рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухоль-ассоциированный антиген, такой как рецептор HER2, HER3 или HER4; эндоглин, c-Met, IGF1R, антигены простаты, такие как РСА3, PSA, PSGR, NGEP, PSMA, PSCA, TMEFF2 и STEAP1; LGR5, В7Н4 и фрагменты любого из вышеперечисленных полипептидов.
[0083] Дополнительно, GM-CSF, который связывается с миелоидными клетками, может быть использован в качестве клеточно-связывающего агента для клеток, пораженных при остром миелогенном лейкозе. IL-2, который связывается с активированными Т-клетками, может быть использован для предотвращения отторжения трансплантата, для лечения и профилактики реакции "трансплантат против хозяина" и для лечения острого Т-клеточного лейкоза. MSH, связывающийся с меланоцитами, может быть использован для лечения меланомы, как и антитела, направленные против меланом. Фолиевая кислота может быть использована для нацеливания на фолатный рецептор, экспрессируемый на овариальных и других опухолях. Эпидермальный фактор роста может быть использован для нацеливания на плоскоклеточный рак, такой как рак легкого, головы и шеи. Соматостатин может быть использован для нацеливания на нейробластомы и другие типы опухолей.
[0084] Нацеливание на рак молочной железы и рак яичка можно успешно осуществлять путем использования в качестве клеточно-связывающих агентов эстрогена (или аналогов эстрогена) или андрогена (или аналогов андрогена), соответственно.
[0085] Термин "антитело", как используется в данном документе, относится к любому иммуноглобулину, любому фрагменту иммуноглобулина, такому как Fab, Fab', F(ab')2, dsFv, sFv, минителам, диателам, трителам, тетрателам (Parham, J. Immunol. 131:2895-2902 (1983); Spring et al. J. Immunol. 113:470-478 (1974); Nisonoff et al. Arch. Biochem. Biophys. 89:230-244 (1960), Kim et al., Mol. Cancer Ther., 7:2486-2497 (2008), Carter, Nature Revs., 6:343-357 (2006)) или иммуноглобулиновой химере, которая может связываться с антигеном на поверхности клетки (например, содержащей гипервариабельный участок (CDR)). Любое пригодное антитело может быть использовано в качестве клеточно-связывающего агента. Специалисту в данной области техники будет понятно, что выбор соответствующего антитела будет зависеть от клеточной популяции, на которую проводится нацеливание. При этом тип и число молекул клеточной поверхности (т.е., антигенов), селективно экспрессируемых в конкретной клеточной популяции (в типичном и предпочтительном случае популяции больных клеток) будут обуславливать выбор антитела, пригодного для использования в композиции по изобретению. Профили экспрессии клеточной поверхности известны для широкого спектра типов клеток, включая типы опухолевых клеток, или, если они неизвестны, то могут быть определены с использованием стандартных методов молекулярной биологии и гистохимии.
[0086] Антитело может быть поликлональным или моноклональным, но наиболее предпочтительно является моноклональным антителом. Как используется в данном документе, "поликлональные" антитела относятся к гетерогенным популяциям молекул антител, как правило, присутствующим в сыворотках иммунизированных животных. "Моноклональные" антитела относятся к гомогенным популяциям молекул антител, которые являются специфическими по отношению к конкретному антигену. Моноклональные антитела, как правило, продуцируются одним клоном В-лимфоцитов ("В-клетки"). Моноклональные антитела могут быть получены с использованием различных методик, известных квалифицированным специалистам в данной области техники, включая стандартную гибридомную технологию (см., например, Köhler and Milstein, Eur. J. Immunol., 5:511-519 (1976), Harlow and Lane (eds.), Antibodies: A Laboratory Manual, CSH Press (1988), и C.A. Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)). Вкратце, гибридомный способ продуцирования моноклональных антител, как правило, включает инъекцию любому пригодному животному, в типичном и предпочтительном случае мыши, антигена (т.е., "иммуногена"). Животное затем умерщвляют и проводят слияние В-клеток, выделенных из его селезенки, с клетками миеломы человека. Получают гибридную клетку (т.е., "гибридому"), которая бесконечно пролиферирует и непрерывно секретирует in vitro высокий титр антитела с желательной специфичностью. Любой пригодный способ, известный в данной области техники, может быть использован для идентификации гибридомных клеток, продуцирующих антитело с желательной специфичностью. Такие способы включают, например, твердофазный иммуноферментный анализ (ELISA), анализ методом вестерн-блоттинга и радиоиммунологический анализ. Популяцию гибридом подвергают скринингу для выделения индивидуальных клонов, каждый из которых секретирует один вид антител к антигену. Поскольку каждая гибридома представляет собой клон, полученный в результате слияния с одной В-клеткой, все продуцируемые ей молекулы антитела имеют идентичную структуру, включая антигенсвязывающий участок, и изотип. Моноклональные антитела также могут быть получены с использованием других пригодных методик, включая EBV-гибридомную технологию (см., например, Haskard and Archer, J. Immunol. Methods, 74(2): 361-67 (1984) и Roder et al., Methods Enzymol, 121: 140-67 (1986)), системы экспрессии на основе бюактериофагальных векторов (см., например, Huse et al., Science, 246: 1275-81 (1989)) или библиотеки фагового дисплея, содержащие фрагменты антитела, такие как Fab и scFv (одноцепочечный вариабельный участок) (см., например, патенты США 5885793 и 5969108 и публикации международных патентных заявок WO 92/01047 и WO 99/06587).
[0087] Моноклональное антитело может быть выделено из или продуцироваться в любом пригодном животном, но предпочтительно продуцируется в млекопитающем, более предпочтительно, мыши или человеке, и наиболее предпочтительно, человеке. Способы продуцирования антитела в мышах хорошо известны квалифицированным специалистам в данной области техники и описаны в данном документе. В случае человеческих антител, специалисту в данной области техники будет понятно, что поликлональные антитела могут быть выделены из сывороток людей, вакцинированных или иммунизированных пригодным антигеном. Альтернативно, человеческие антитела могут быть получены путем адаптации известных методик продуцирования человеческих антител в животных кроме человека, таких как мыши (см., например, патенты США 5545806, 5569825 и 5714352 и публикацию патентной заявки США №2002/0197266 A1).
[0088] Однако, будучи идеальным выбором для терапевтического применения на людях, человеческие антитела, особенно моноклональные человеческие антитела, как правило, более сложны в получении, чем мышиные моноклональные антитела. Мышиные моноклональные антитела, однако, индуцируют быстрый гуморальный иммунный ответ организма-хозяина при введении людям, который может снижать терапевтический или диагностический потенциал конъюгата антитело-цитотоксический агент. Во избежание таких осложнений, моноклональное антитело предпочтительно не распознается как "чужое" иммунной системой человека.
[0089] В связи с этим, для получения антитела может быть использован фаговый дисплей. При этом фаговые библиотеки, кодирующие антиген-связывающие вариабельные (V) домены антител, могут быть сгенерированы с использованием стандартных методов молекулярной биологии и рекомбинантных ДНК (см., например, Sambrook et al. (eds.), Molecular Cloning, A Laboratory Manual, 3rd Edition, Cold Spring Harbor Laboratory Press, New York (2001)). Фаги, кодирующие вариабельный участок с желательной специфичностью, выбирают по специфическому связыванию с целевым антигеном и реконструируют полное человеческое антитело, содержащее выбранный вариабельный домен. Последовательности нуклеиновой кислоты, кодирующие реконструированное антитело, вводят в пригодную клеточную линию, такую как миеломные клетки, используемые для получения гибридомы, так чтобы клетка секретировала человеческие антитела с характеристиками моноклональных антител (см., например, Janeway et al., supra, Huse et al., supra, и патент США 6265150). Альтернативно, моноклональные антитела могут быть получены из мышей, являющихся трансгенными по специфическим генам тяжелой и легкой цепей иммуноглобулина человека. Такие способы известны специалистам и описаны, например, в патентах США 5545806 и 5569825 и Janeway et al., supra.
[0090] Наиболее предпочтительно, антитело представляет собой гуманизированное антитело. Как используется в данном документе, "гуманизированное" антитело представляет собой антитело, в котором гипервариабельные участки (CDR) мышиного моноклонального антитела, образующие антигенсвязывающие петли антитела, прививаются на каркас молекулы человеческого антитела. В данной области техники считается общепризнаным, что, благодаря сходству каркасов мышиного и человеческого антител, такой подход позволяет получить моноклональное антитело, которое является антигенно идентичным человеческому антителу, но связывает тот же самый антиген, что и мышиное моноклональное антитело, из которого были выделены CDR-последовательности. Способы получения гуманизированных антител хорошо известны в данной области техники и детально описаны, например, в Janeway et al., supra, патентах США 5225539, 5585089 и 5693761, европейском патенте №0239400 В1 и патенте Великобритании №2188638. Гуманизированные антитела также могут быть получены с использованием технологии перекладки антитела, описанной в патенте США 5639641 и у Pedersen et al., J. Mol. Biol., 235: 959-973 (1994). Хотя антитело, используемое в конъюгате композиции по изобретению, наиболее предпочтительно является гуманизированным моноклональным антителом, человеческое моноклональное антитело и мышиное моноклональное антитело, как описано выше, также входят в объем изобретения.
[0091] Фрагменты антитела, которые имеют по меньшей мере один антигенсвязывающий участок и, таким образом, распознают и связываются с по меньшей мере одним антигеном или рецептором, присутствующим на поверхности клетки-мишени, также входят в объем изобретения. При этом протеолитическое расщепление интактной молекулы антитела может давать различные фрагменты антитела, сохраняющие способность к распознаванию и связыванию антигенов. Например, ограниченный гидролиз молекулы антитела протеазой папаином, как правило, дает три фрагмента, два из которых являются идентичными и называются Fab-фрагментами, поскольку они сохраняют антигенсвязывающую активность молекулы исходного антитела. Расщепление молекулы антитела ферментом пепсином нормально дает два фрагмента антитела, один из которых сохраняет обе антиген-связывающие цепи молекулы антитела и поэтому называется фрагментом F(ab')2. Восстановление фрагмента F(ab')2 дитиотреитол или меркаптоэтиламином дает фрагмент, называемый фрагментом Fab'. Одноцепочечный фрагмент вариабельного участка (sFv) фрагмент антитела, который состоит из укороченного фрагмента Fab, содержащего вариабельный (V) домен тяжелой цепи антитела, связанный с V-доменом легкой цепи антитела через синтетический пептид, может быть получен с использованием обычных методов технологии рекомбинантной ДНК (см., например, Janeway et al., supra). Аналогично, стабилизированных дисульфидными связями фрагменты вариабельного участка (dsFv) могут быть получены по технологии рекомбинантной ДНК (см., например, Reiter et al., Protein Engineering, 7: 697-704 (1994)). Фрагменты антитела в контексте изобретения, однако, не ограничены этими иллюстративными типами фрагментов антитела. Может быть использован любой пригодный фрагмент антитела, который распознает и связывается с целевым рецептором клеточной поверхности или антигеном. Фрагменты антитела дополнительно описаны, например, в Parham, J. Immunol., 131: 2895-2902 (1983), Spring et al., J. Immunol, 113: 470-478 (1974) и Nisonoff et al., Arch. Biochem. Biophys., 89: 230-244 (1960). Анализ связывания антитело-антиген может быть проведен с использованием любого пригодного способа, известного в данной области техники, такого как, например, радиоиммунологический анализ (RIA), ELISA, вестерн-блоттинг, иммунопреципитация и анализы конкурентного ингибирования (см., например, Janeway et al., supra, и публикацию патентной заявки США №2002/0197266 A1).
[92] Кроме того, антитело может быть химерным антителом или его антигенсвязывающим фрагментом. Под "химерным" подразумевается, что антитело содержит по меньшей мере два иммуноглобулина или их фрагменты, полученные или выделенные из по меньшей мере двух разных видов (например, два разные иммуноглобулина, такие как константная область человеческого иммуноглобулина, объединенная с вариабельным участком мышиного иммуноглобулина). Антитело также может быть доменным антителом (dAb) или его антигенсвязывающим фрагментом, таким как, например, верблюжьим антителом (см., например, Desmyter et al., Nature Struct. Biol, 3: 752, (1996)) или акульим антителом, таким как, например, новый антигенный рецептор (IgNAR) (см., например, Greenberg et al., Nature, 374: 168 (1995) и Stanfield et al., Science, 305: 1770-1773 (2004)).
[93] В контексте изобретения может быть использовано любое пригодное антитело. Например, моноклональное антитело J5 представляет собой мышиное антитело IgG2a, специфическое по отношению к антигену острого лимфобластного лейкоза общего типа (CALLA) (Ritz et al., Nature, 283: 583-585 (1980)) и может быть использовано для нацеливания на клетки, экспрессирующие CALLA (например, клетки острого лимфобластного лейкоза). Моноклональное антитело MY9 представляет собой мышиное антитело IgG1, которое специфически связывается с антигеном CD33 (Griffin et al., Leukemia Res., 8: 521 (1984)) и может быть использовано для нацеливания на клетки, экспрессирующие CD33 (например, клетки острого миелогенного лейкоза (AML)). Аналогично, моноклональное антитело анти-В4 (также называемое В4) представляет собой мышиное антитело IgG1, которое связывается с антигеном CD19 В-клеток (Nadler et al., J. Immunol., 131: 244-250 (1983)) и может быть использовано для нацеливания на В-клетки или больные клетки, экспрессирующие CD19 (например, клетки неходжкинской лимфомы и клетки хронического лимфобластного лейкоза). N901 представляет собой мышиное моноклональное антитело, которое связывается с антигеном CD56 (нейтральная молекула клеточной адгезия), присутствующим на клетках нейроэндокринного происхождения, включая мелкоклеточную опухоль легкого, которые могут быть использованы в конъюгате для нацеливания лекарственных средств на клетки нейроэндокринного происхождения. Антитела J5, MY9 и В4, предпочтительно, подвергают перекладке или гуманизации перед их использованием в качестве компонента конъюгата. Перекладка или гуманизация антител описана, например, в Roguska et al., Proc. Natl. Acad. Sci. USA, 91: 969-73 (1994). В одном варианте реализации изобретения анти-В4 антитело представляет собой huB4. В другом варианте реализации изобретения анти-В4 антитело содержит тяжелую цепь и легкую цепь, где тяжелая цепь имеет следующую последовательность

и дегкая цепь имеет следующую последовательность

[94] Кроме того, моноклональное антитело С242 связывается с антигеном CanAg (см., например, патент США 5552293) и может быть использовано для нацеливания конъюгата на опухоли, экспрессирующие CanAg, такие как колоректальный, панкреатический рак, немелкоклеточный рак легкого и рак желудка. HuC242 представляет собой гуманизированную форму моноклонального антитела С242 (см., например, патент США 5552293). Гибридома, из которой продуцируют HuC242, депонирована в ЕСАСС под идентификационным номером 90012601. HuC242 может быть получен с использованием методологии CDR-прививки (см., например, патенты США 5585089, 5693761 и 5693762) или технологии перекладки (см., например, патент США 5639641). HuC242 может быть использован для нацеливания конъюгата на опухолевые клетки, экспрессирующие антиген CanAg, такие как, например, клетки колоректального, панкреатического, немелкоклеточного рака легкого и рака желудка.
[95] Для нацеливания на клетки рака яичников и рака простаты, анти-MUCl антитело может быть использовано в качестве клеточно-связывающего агента в конъюгате. Анти-MUCl антитела включают, например, анти-HMFG-2 (см., например, Taylor-Papadimitriou et al., Int. J. Cancer, 28: 17-21 (1981)), hCTM01 (см., например, van Hof et al., Cancer Res., 56: 5179-5185 (1996)) и DS6. Нацеливание на клетки рака простаты также может быть осуществлено с помощью конъюгата путем использования анти-простатического специфического мембранного антигена (PSMA) в качестве клеточно-связывающего агента, такого как J591 (см., например, Liu et al., Cancer Res., 57: 3629-3634 (1997)). Кроме того, нацеливание на раковые клетки, экспрессирующие антиген Her2, таких как рака молочной железы, простаты и яичника, может быть осущестьвлено с помощью конъюгата путем использования анти-HER2 антитела, например, трастузумаба, в качестве клеточно-связывающего агента. Нацеливание на клетки, экспрессирующие рецептор эпидермального фактора роста (EGFR) и его варианты, такие как делеционный мутант типа III, EGFRvIII, может быть осуществлено с помощью конъюгата путем использования анти-EGFR антитела. Анти-EGFR антитела описаны в международных патентных заявках № PCT/US11/058385 и PCT/US11/058378. Анти-EGFRvIII антитела описаны в патентах США 7736644 и 7628986 и публикациях патентных заявок США 2010/0111979; 2009/0240038; 2009/0175887; 2009/0156790; и 2009/0155282. Анти-IGF-IR антитела, которые связываются с рецептором инсулиноподобного фактора роста, такие как описанные в патенте США 7982024, также могут быть использованы в конъюгате. Антитела, которые связываются с CD27L, Крипто, CD138, CD38, EphA2, интегринами, CD37, фолатом, CD20, PSGR, NGEP, PSCA, TMEFF2, STEAP1, эндоглином и Her3, также могут быть использованы в конъюгате.
[96] В одном варианте реализации изобретения антитело выбирают из группы, состоящей из huN901, анти-CD33 антитела (например, huMy9-6), huB4, huC242, анти-HER2 антитела (например, трастузумаба), биватузумаба, сибротузумаба, ритуксимаба, huDS6, анти-мезотелиновых антител, описанных в публикации международной патентной заявки WO 2010/124797 (таких как MF-T), анти-крипто-антител, описанных в публикации патентной заявки США 2010/0093980 (таких как huB3F6), анти-СВ138 антител, описанных в публикации патентной заявки США 2007/0183971 (таких как В-В4 или гуманизированное В-В4 или nBT062), анти-EGFR антител, описанных в публикации международных патентных заявок WO 2012/058592 и WO 2012/058588 (таких как EGFR-7), анти-EGFRvIII антител, описанных в патентах США 7736644 и 7628986 и публикациях патентных заявок США 2010/0111979, 2009/0240038, 2009/0175887, 2009/0156790 и 2009/0155282, гуманизированных EphA2 антител, описанных в публикациях международных патентных заявок WO 2011/039721 и WO 2011/039724 (таких как 2H11R35R74); анти-CD38 антител, описанных в публикации международной патентной заявки WO 2008/047242 (таких как hu38SB19), антител против фолатного рецептора, описанных в публикации международной патентной заявки WO 2011/106528 и публикации патентной заявки США 2012/0009181 (например, huMovl9 версии 1.0 или 1.6); анти-IGFIR антител, описанных в патентах США 5958872, 6596743 и 7982024; анти-CD37 антител, описанных в публикации патентной заявки США 2011/0256153 (например, huCD37-3 версии 1.0); анти-интегриновых αvβ6 антител, описанных в публикации патентной заявки США 2006/0127407 (например, CNT095); и анти-Her3 антител, описанных в публикации международной патентной заявки WO 2012/019024. В одном варианте реализации изобретения изобретения, антитело не является huN901 или CNT095. В одном варианте реализации изобретения анти-CD37 антитело представляет собой huCD37-3, где антитело содержит вариабельную тяжелую цепь и вариабельную легкую цепь, причем вариабельная тяжелая цепь имеет следующую последовательность

и вариабельная легкая цепь имеет следующую последовательность

[97] Хотя клеточно-связывающий агент предпочтительно является антителом, клеточно-связывающий агент может также представлять собой молекулу, не являющуюся антителом. Пригодные молекулы, не являющиеся антителами, включают, например, интерфероны (например, альфа-, бета- или гамма-интерферон), лимфокины (например, интерлейкин 2 (IL-2), IL-3, IL-4 или IL-6), гормоны (например, инсулин), факторы роста (например, EGF, TGF-альфа, FGF и VEGF), колониестимулирующие факторы (например, G-CSF, M-CSF и GM-CSF (см., например, Burgess, Immunology Today, 5: 155-158 (1984)), соматостатин и трансферрин (см., например, O'Keefe et al., J. Biol. Chem., 260: 932-937 (1985)). Например, GM-CSF, который связывается с миелоидными клетками, может быть использован в качестве клеточно-связывающего агента для нацеливания на клетки острого миелогенного лейкоза. Кроме того, IL-2, который связывается с активированными Т-клетками, может быть использован для предотвращения отторжения трансплантата, для лечения и профилактики реакции "трансплантат против хозяина" и для лечения острого Т-клеточного лейкоза. Эпидермальный фактор роста (EGF) может быть использован для нацеливания на йплоскоклеточный рак, такой как рак легкого и рак головы и шеи. Соматостатин может быть использован для нацеливания на клетки нейробластомы и другие типы опухолевых клеток.
[98] Конъюгат может включать любой пригодный цитотоксический агент. "Цитотоксический агент", как используется в данном документе, относится к любому соединению, приводящему к гибели клетки, индуцирующему гибель клеток или уменьшающему жизнеспособность клеток. Пригодные цитотоксические агенты включают, например, майтанзиноиды и аналоги майтанзиноида, таксоиды, СС-1065 и аналоги СС-1065, и доластатин и аналоги доластатина. В предпочтительном варианте реализации изобретения цитотоксический агент представляет собой майтанзиноид, включая майтанзинол и аналоги майтанзинола. Майтанзиноиды представляют собой соединения, которые ингибируют образование микротрубочек и являются высокотоксичными для клеток млекопитающих. Примеры пригодных аналогов майтанзинола включают соединения, имеющие модифицированное ароматическое кольцо и имеющие модификации в других положениях. Такие майтанзиноиды описаны, например, в патентах США 4256746, 4294757, 4307016, 4313946, 4315929, 4322348, 4331598, 4361650, 4362663, 4364866, 4424219, 4371533, 4450254, 5475092, 5585499, 5846545 и 6333410.
[99] Примеры аналогов майтанзинола, имеющих модифицированное ароматическое кольцо, включают: (1) C-19-дехлор (патент США 4256746) (полученный путем восстановления ансамитоцина Р2 с помощью LAH), (2) C-20-гидрокси (или C-20-деметил)+/- C-19-дехлор (патенты США 4361650 и 4307016) (полученный путем деметилирования с использованием Streptomyces или Actinomyces или путем дехлорирования с использованием LAH) и (3) C-20-деметокси, C-20-ацилокси (-OCOR), +/- дехлор (патент США 4294757) (полученный путем ацилирования с использованием ацилхлоридов).
[100] Примеры аналогов майтанзинола, имеющих модификации в положениях, отличных от ароматического кольца, включают: (1) C-9-SH (патент США 4424219) (полученный путем реакции майтанзинола с H2S или P2S5), (2) C-14-алкоксиметил (деметокси/CH2OR) (патент США 4331598), (3) C-14-гидроксиметил или ацилоксиметил (СН2ОН или СН2ОАс) (патент США 4450254) (с использованием Nocardia), (4) C-15-гидрокси/ацилокси (патент США 4364866) (получены путем конверсии майтанзинола с помощью Streptomyces), (5) C-15-метокси (патенты США 4313946 и 4315929) (выделен из Trewia nudiflora), (6) С-18-N-деметил (патенты США 4362663 и 4322348) (получен путем деметилирования майтанзинола с помощью Streptomyces) и (7) 4,5-дезокси (патент США 4371533) (получен путем восстановления майтанзинола трихлоридом титана/LAH).
[101] В предпочтительном варианте реализации изобретения в конъюгате используется тиолсодержащий майтанзиноид DM1, также известный как N2'-деацетил-N2'-(3-меркапто-1-оксопропил)майтанзин, в качестве цитотоксического агента. Строение DM1 представлено в виде формулы (I):

[102] В другом предпочтительном варианте реализации изобретения в конъюгате используется тиолсодержащий майтанзиноид DM4, также известный как N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)майтанзин, в качестве цитотоксического агента. Строение DM4 представлено в виде формулы (II):
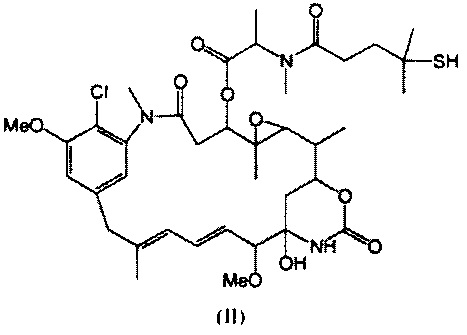
[103] Другие майтанзины могут быть использованы в контексте изобретения, включая, например, тиол- и дисульфид-содержащие майтанзиноиды, несущие моно- или диалкильное замещение на атоме углерода, несущем атом серы. Особенно предпочтительным является майтанзиноид, имеющий в С-3 положении (а) С-14 гидроксиметильную, С-15 гидрокси или С-20 десметильную функциональность, и (b) ацилированную аминокислотную боковую цепь с ацильной группой, несущей затрудненную сульфгидрильную группу, в которой атом углерода ацильной группы, несущей тиольную функциональность, имеет один или два заместителя, причем указанные заместители представляют собой СН3, С2Н5, линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал и в которой дополнительно один из заместителей может быть Н и в которой ацильная группа имеет длину линейной цепи, равную по меньшей мере трем атомам углерода между карбонильной функциональностью и атомом серы.
[104] Дополнительные майтанзины для использования в контексте изобретения включают соединения представленные как формула (III):
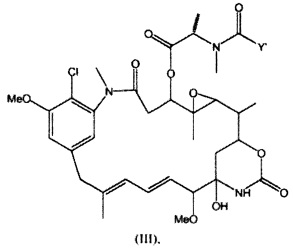
в которой Y' обозначает
(CR7R8)l(CR9=CR10)p(C≡C)qAo(CR5R6)mDu(CR11=CR12)r(C≡C)sBt(CR3R4)nCR1R2SZ, где R1 и R2 каждый независимо обозначают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и где R2 также может быть Н,
где А, В, D обозначают циклоалкил или циклоалкенил, содержащий 3-10 атомов углерода, простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал,
где R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 каждый независимо обозначают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,
где l, m, n, о, p, q, r, s и t каждый независимо обозначают нуль или целое число от 1 до 5, при условии, что по меньшей мере два из l, m, n, o, p, q, r, s и t не равны нулю одновременно, и где Ζ обозначает H, SR или COR, где R обозначает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода или простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал.
[105] Предпочтительные варианты реализации изобретения формулы (III) включают соединения формулы (III), в которой (a) R1 обозначает H, R2 обозначает метил и Z обозначает H, (b) R1 и R2 обозначают метил и Z обозначает Н, (с) R1 обозначает Н, R2 обозначает метил и Z обозначает -SCH3 и (d) R1 и R2 обозначают метил и Z обозначает -SCH3.
[106] Такие дополнительные майтанзины также включают соединения, представленные формулами (IV-L), (IV-D) или (IV-D,L):
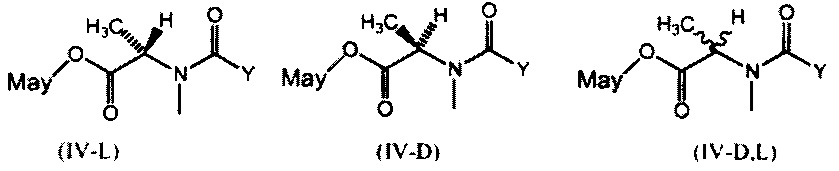
где Y обозначает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2SZ,
где R1 и R2 каждый независимо обозначают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и где R2 также может быть Н,
где R3, R4, R5, R6, R7 и R8 каждый независимо обозначают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,
где l, m и n каждый независимо обозначают целое число от 1 до 5 и, кроме того, n может быть нулем,
где Z обозначает Н, SR или COR, где R обозначает линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода или простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал, и где May обозначает майтанзиноид, несущий боковую цепь в положении С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 десметил.
[107] Предпочтительные варианты реализации формул (IV-L), (IV-D) и (IV-D,L) включают соединения формул (IV-L), (IV-D) и (IV-D,L), в которых (a) R1 обозначает Н, R2 обозначает метил, R5, R6, R7 и R8 каждый обозначают Н, l и m каждый равны l, n равен 0 и Z обозначает Н, (b) R1 и R2 обозначают метил, R5, R6, R7, R8 каждый обозначают Н, l и m равны l, n равен 0 и Z обозначает Н, (с) R1 обозначает Н, R2 обозначает метил, R5, R6, R7 и R8 каждый обозначают Н, l и m каждый равны l, n равен 0 и Z обозначает -SCH3, или (d) R1 и R2 обозначают метил, R5, R6, R7, R8 каждый обозначают Н, l и m равны l, n равен 0 и Z обозначает -SCH3.
[108] Предпочтительно, цитотоксический агент представлен формулой (IV-L).
[109| Дополнительные предпочтительные майтанзины также включают соединения, представленные формулой (V):
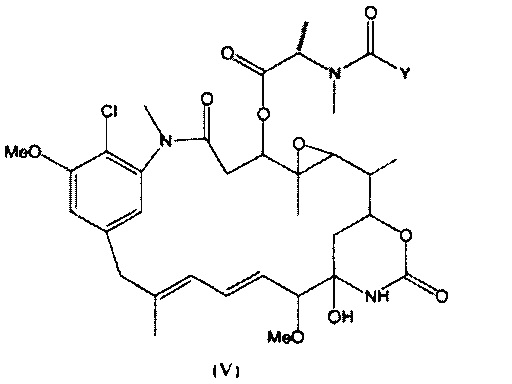
где Y обозначает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2SZ,
где R1 и R2 каждый независимо обозначают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и где R2 также может быть Н,
где R3, R4, R5, R6, R7 и R8 каждый независимо обозначают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,
где l, m и n каждый независимо обозначают целое число от 1 до 5 и, кроме того, n может быть нулем, и
где Z обозначает Н, SR или COR, где R обозначает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, или простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал.
[110] Предпочтительные варианты реализации формулы (V) включают соединения формулы (V), в которой (a) R1 обозначает Н, R2 обозначает метил, R5, R6, R7 и R8 каждый обозначают Н; l и m каждый равны l; n равен 0; и Z обозначает Н, (b) R1 и R2 обозначают метил; R5, R6, R7, R8 каждый обозначают Н, l и m равны l; n равен 0; и Z обозначает Н, (с) R1 обозначает Н, R2 обозначает метил, R5, R6, R7 и R8 каждый обозначают Н, l и m каждый равны l, n равен 0 и Z обозначает -SCH3, или (d) R1 и R2 обозначают метил, R5, R6, R7, R8 каждый обозначают Н, l и m равны l, n равен 0 и Z обозначает -SCH3.
[111] Другие дополнительные предпочтительные майтанзины включают соединения, представленные формулами (VI-L), (VI-D) или (VI-D,L):

где Y2 обозначает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2SZ2,
где R1 и R2 каждый независимо обозначают СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и где R2 также может быть Н,
где R3, R4, R5, R6, R7 и R8 каждый независимо обозначают Н, СН3, С2Н5, линейный циклический алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,
где l, m и n каждый независимо обозначают целое число от 1 до 5 и, кроме того, n может быть нулем,
где Z2 обозначает SR или COR, где R обозначает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода или простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал, и где May обозначает майтанзиноид.
[112] Дополнительные предпочтительные майтанзины включают соединения, представленные формулой (VII):

где Y2' обозначает
(CR7R8)l(CR9=CR10)p(C≡C)qAo(CR5R6)mDu(CR11=CR12)r(C≡C)sBt(CR3R4)nCR1R2SZ2, где R1 и R2 каждый независимо обозначают СН3, С2Н5, линейный разветвленный или алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал и, кроме того, R2 может быть Н,
где А, В и D каждый независимо обозначают циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал, где R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 каждый независимо обозначают Н, СН3, С2Н5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,
где l, m, n, о, p, q, r, s и t каждый независимо обозначают нуль или целое число от 1 до 5, при условии, что по меньшей мере два из l, m, n, о, p, q, r, s и t не равны нулю одновременно, и где Z2 обозначает SR или -COR, где R обозначает линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, или простой или замещенный арил, или гетероциклический ароматический или гетероциклоалкильный радикал.
[113] Предпочтительные варианты реализации формулы (VII) включают соединения формулы (VII), в которой R1 обозначает Н и R2 обозначает метил.
[114| Помимо майтанзиноидов, цитотоксический агент, используемый в конъюгате, может быть таксаном или его производным. Таксаны представляют собой семейство соединений, которое включает паклитаксел (Taxol®), цитотоксический природный продукт и доцетаксел (Taxotere®), полусинтетическое производное, которые оба широко используются для лечения рака. Таксаны являются ядами митотического веретена, которые ингибируют деполимеризацию тубулина, приводя к гибели клеток. Хотя доцетаксел и паклитаксел являются агентами, пригодными для лечения рака, их противоопухолевая активность ограничена вследствие их неспецифической токсичности по отношению к нормальным клеткам. Кроме того, такие соединения, как паклитаксел и доцетаксел, сами по себе являются недостаточно сильнодействующими для использования в конъюгатах клеточно-связывающих агентов.
[115] Предпочтительным таксаном для использования в приготовлении цитотоксического конъюгата является таксан формулы (VIII):
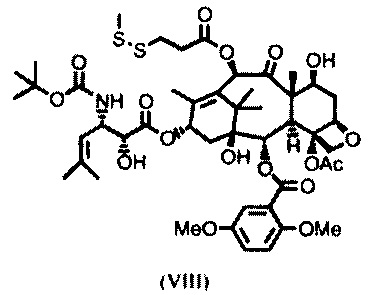
[116] Способы синтеза таксанов, которые могут быть использованы в контексте изобретения, вместе со способами конъюгации таксанов с клеточно-связывающими агентами, такими как антитела, детально описаны в патентах США 5416064, 5475092, 6340701, 6372738, 6436931, 6596757, 6706708, 6716821 и 7390898.
[117] Цитотоксический агент также может представлять собой СС-1065 или его производное. СС-1065 является сильнодействующим противоопухолевым антибиотиком, выделенным из культуральной жидкости Streptomyces zelensis. СС-1065 является примерно в 1000 раз более сильнодействующим in vitro, чем обычно используемые противораковые лекарственные средства, такие как доксорубицин, метотрексат и винкристин (Bhuyan et al., Cancer Res., 42: 3532-3537 (1982)). СС-1065 и его аналоги раскрыты в патентах США 5585499, 5846545, 6340701 и 6372738. Цитотоксическая активность СС-1065 коррелируете его алкилирующей активностью и его ДНК-связывающей или ДНК-интеркалирующей активностью. Эти две активности присущи разным частям молекулы. При этом алкилирующая активность присуща циклопропапирролоиндольной (CPI) субъединице, а ДНК-связывающая активность присуща двум пирролоиндольным субъединицам СС-1065.
[118] Несколько аналогов СС-1065 известны специалистам и также могут быть использованы в качестве цитотоксического агента в конъюгате (см., например, Warpehoski et al., J. Med. Chern., 31: 590-603 (1988)). Был разработан ряд аналогов СС-1065, в которых фрагмент CPI замещен на фрагмент циклопропабензиндола (CBI) (Boger et al., J. Org. Chern., 55: 5823-5833 (1990) и Boger et al., Bioorg. Med. Chem. Lett., 1: 115-120 (1991)). Такие аналоги CC-1065 сохраняют высокую in vitro активность исходного лекарственного средства, не вызывая замедленной токсичности у мышей. Как и СС-1065, такие соединения являются алкилирующими агентами, которые ковалентно связываются с малой бороздкой ДНК, вызывая гибель клеток.
[119] Терапевтическая эффективность аналогов СС-1065 может быть значительно улучшена путем изменения in vivo распределения посредством целевой доставки к месту локализации опухоли, приводя к сниженной токсичности для нецелевых тканей и, таким образом, сниженной системной токсичности. Для этого были получены конъюгаты аналогов и производных СС-1065 с клеточно-связывающими агентами, которые специфически нацелены на опухолевые клетки (см., например, патенты США 5475092, 5585499 и 5846545). Эти конъюгаты, как правило, демонстрируют высокую мишень-специфическую цитотоксичность in vitro и противоопухолевую активность в моделях ксенотрансплантатов человеческой опухоли у мышей (см., например, Chari et al., Cancer Res., 55: 4079-4084 (1995)).
[120] Способы синтеза аналогов СС-1065 детально описаны в патентах США 5475092, 5585499, 5846545, 6534660, 6586618, 6756397 и 7329760.
[121] Лекарственные средства, такие как метотрексат, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С, хлорамбуцил, калихеамицин, тубулизин и аналоги тубулизина, дуокармицин и аналоги дуокармицина, доластатин и аналоги доластатина, также могут быть использованы в качестве цитотоксических агентов по изобретению. Соединения доксарубицина и даунорубицина (см., например, патент США 6630579) также могут быть использованы в качестве цитотоксического агента.
[122] Конъюгаты клеточно-связывающий агент-цитотоксический агент могут быть получены с помощью in vitro способов. Для связывания цитотоксического агента с антителом используется связующая группа. Пригодные связующие группы хорошо известны в данной области техники и включают дисульфидные группы, кислотно-лабильные группы, фотолабильные группы, пептидаза-лабильные группы и эстераза-лабильные группы, а также нерасщепляемые связующие группы.
[123] В соответствии с изобретением, клеточно-связывающий агент модифицируют путем проведения реакции бифункционального сшивающего реагента с клеточно-связывающим агентом, приводящей к ковалентному присоединению молекулы линкера к клеточно-связывающему агенту. Как используется в данном документе, "бифункциональный сшивающий реагент" относится к реагенту, обладающему двумя реакционноспособными группами; одна из которых способна реагировать с клеточно-связывающим агентом, а другая - способна реагировать с цитотоксическим агентом для связывания клеточно-связывающего агента с цитотоксическим агентом, тем самым образуя конъюгат.
[124] Любой пригодный бифункциональный сшивающий реагент может быть использован в связи с изобретением, при условии, что линкерный реагент обеспечивает сохранение терапевтических характеристик, например, цитотоксичности, и характеристик нацеливания цитотоксического агента и клеточно-связывающего агента, соответственно, обеспечивая в то же время приемлемый профиль токсичности. Предпочтительно, линкерная молекула связывает цитотоксический агент с клеточно-связывающим агентом с помощью химических связей (как описано выше), так чтобы цитотоксический агент и клеточно-связывающий агент были химически связаны (например, ковалентно связаны) друг с другом.
[125] В одном варианте реализации изобретения клеточно-связывающий агент химически связан с цитотоксическим агентом с помощью химических связей, выбранных из группы, состоящей из дисульфидных связей, кислотно-лабильных связей, фотолабильных связей, пептидаза-лабильных связей и эстераза-лабильных связей.
[126] В одном варианте реализации изобретения бифункциональный сшивающий реагент содержит нерасщепляемые линкеры. Нерасщепляемый линкер представляет собой любой химический фрагмент, способный связывать цитотоксический агент, такой как майтанзиноид, таксан или аналог СС-1065, с клеточно-связывающим агентом с помощью стабильной ковалентной связи. Таким образом, нерасщепляемые линкеры являются по сути устойчивыми к кислотно-индуцируемому расщеплению, светоиндуцируемому расщеплению, пептидаза-индуцируемому расщеплению, эстераза-индуцируемому расщеплению и расщеплению дисульфидной связи, в условиях, при которых цитотоксический агент или клеточно-связывающий агент сохраняет активность.
[127] Пригодные сшивающие реагенты, которые образуют нерасщепляемые линкеры между цитотоксическим агентом и клеточно-связывающим агентом, хорошо известны в данной области техники. В одном варианте реализации изобретения цитотоксический агент химически связан с клеточно-связывающим агентом посредством тиоэфирной связи. В другом варианте реализации изобретения цитотоксический агент связан с клеточно-связывающим агентом посредством амидной связи. Примеры нерасщепляемых линкеров включают линкеры, содержащие малеимидный фрагмент галоидацетильный фрагмент для реакции с цитотоксическим агентом. Такие бифункциональные сшивающие агенты хорошо известны в данной области техники (см. публикации патентных заявок США №2010/0129314, 2009/0274713, 2008/0050310, 2005/0169933 и Pierce Biotechnology Inc. P.O. Box 117, Rockland, IL 61105, USA) и включают, без ограничений, N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилат (SMCC), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбокси-(6-амидокапроат), представляющий собой "длинноцепочечный" аналог SMCC (LC-SMCC), κ-малеимидоундекановой кислоты N-сукцинимидильный сложный эфир (KMUA), γ-малеимидомасляной кислоты N-сукцинимидильный сложный эфир (GMBS), ε-малеимидокапроновой кислоты N-гидроксисукцинимидный сложный эфир (EMCS), м-малеимидобензоил-N-гидроксисукцинимидный сложный эфир (MBS), N-(α-малеимидоацетокси)сукцинимидный сложный эфир (AMAS), сукцинимидил-6-(β-малеимидопропионамидо)гексаноат (SMPH), N-сукцинимидил-4-(п-малеимидофенил)бутират (SMPB) и N-(п-малеимидофенил)изоцианат (PMPI). Сшивающие реагенты, содержащи галоидацетильный фрагмент, включают N-сукцинимидил-4-(йодацетил)аминобензоат (SIAB), N-сукцинимидил йодацетат (SIA), N-сукцинимидилбромацетат (SBA), N-сукцинимидил-3-(бромацетамидо)пропионат (SBAP), бис-малеимидополиэтиленгликоль (ВМРЕО), ВМ(РЕО)2, ВМ(PEO)3, N-(β-малеимидопропилокси)сукцинимидный сложный эфир (BMPS), 5-малеимидовалериановой кислоты NHS, HBVS, 4-(4-N-малеимидофенил)масляной кислоты гидразид⋅HCl (МРВН), сукцинимидил-(4-винилсульфонил)бензоат (SVSB), дитиобисмалеимидоэтан (DTME), 1,4-бис-малеимидобутан (BMB), 1,4-бисмалеимидил-2,3-дигидроксибутан (BMDB), бис-малеимидогексан (ВМН), бис-малеимидоэтан (ВМОЕ), сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (сульфо-SMCC), сульфосукцинимидил-(4-йодацетил)аминобензоат (сульфо-SIAB), м-малеимидобензоил-N-гидроксисульфосукцинимидный сложный эфир (сульфо-MBS), N-(γ-малеимидобутирилокси)сульфосукцинимидный сложный эфир (сульфо-GMBS), N-(ε-малеимидокапроилокси)сульфосукцинимидо сложный эфир (сульфо-EMCS), N-(κ-малеимидоундеканоилокси)сульфосукцинимидный сложный эфир (сульфо-KMUS), сульфосукцинимидил-4-(п-малеимидофенил)бутират (сульфо-SMPB), СХ1-1, сульфо-Mal и PEGn-Mal. Предпочтительно, бифункциональный сшивающий реагент представляет собой SMCC.

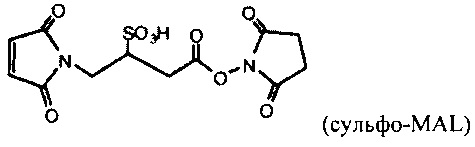

[128] В одном варианте реализации изобретения связующий реагент представляет собой расщепляемый линкер. Примеры пригодных расщепляемых линкеров включают дисульфид-содержащие линкеры, кислотно-лабильные линкеры, фотолабильные линкеры, пептидаза-лабильные линкеры и эстераза-лабильные линкеры. Дисульфид-содержащие линкеры представляют собой линкеры, расщепляемые посредством дисульфидного обмена, который может происходить в физиологических условиях. Кислотно-лабильные линкеры представляют собой линкеры, расщепляемые при кислотных pH. Например, определенные внутриклеточные компартменты, такие как эндосомы и лизосомы, имеют кислотный pH (pH 4-5) и обеспечивают условия, пригодные для расщепления кислотно-лабильных линкеров. Фотолабильные линкеры пригодны для использования на поверхности тела и во многих полостях тела, доступных для воздействия света. Кроме того, инфракрасный свет может проникать в ткани. Пептидаза-лабильные линкеры могут быть использованы для расщепления определенных пептидов внутри или вне клеток (см. например, Trouet et al., Proc. Natl. Acad. Sci. USA, 79: 626-629 (1982) и Umemoto et al., Int. J. Cancer, 43: 677-684 (1989)). В одном варианте реализации изобретения расщепляемый линкер расщепляется в мягких условиях, т.е., условиях внутри клетки, при которых активность цитотоксического агента не изменяется.
[129] В одном варианте реализации изобретения цитотоксический агент связан с клеточно-связывающим агентом посредством дисульфидной связи. Линкерная молекула содержит реакционноспособную химическую группу, которая может реагировать с клеточно-связывающим агентом. В одном варианте реализации изобретения бифункциональный сшивающий реагент содержит реакционноспособный фрагмент, который может образовывать амидную связь с остатком лизина клеточно-связывающего агента. Примеры реакционноспособных фрагментов, которые могут образовывать амидную связь с остатком лизинв клеточно-связывающего агента, включают фрагменты карбоновых кислот и реакционноспособные сложнорэфирные фрагменты, такие как N-сукцинимидильный сложный эфир, N-сульфосукцинимидильный сложный эфир, нитрофенильный (например, 2- или 4-нитрофенильный) сложный эфир, динитрофенильный (например, 2,4-динитрофенильный) сложный эфир, сульфотетрафторфенильный (например, 4-сульфо-2,3,5,6-тетрафторфенильный) сложный эфир и пентафторфенильный сложный эфир.
[130] Предпочтительными реакционноспособными химическими группами для реакции с клеточно-связывающим агентом являются N-сукцинимидильные сложные эфиры и N-сульфосукцинимидильные сложные эфиры. Дополнительно, линкерная молекула содержит реакционноспособную химическую группу, предпочтительно дитиопиридильную группу, которая может реагировать с цитотоксическим агентом с образованием дисульфидной связи. Бифункциональные сшивающие реагенты, обеспечивающие возможность связывания клеточно-связывающего агента с цитотоксическим агентом посредством дисульфидных связей, известны специалистам и включают, например, N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (см., например, Carlsson et al., Biochem. J., 173: 723-737 (1978)), N-сукцинимидил-4-(2-пиридилдитио)бутаноат (SPDB) (см., например, патент США 4563304), N-сукцинимидил-4-(2- пиридилдитио)пентаноат (SPP) (см., например, CAS Registry number 341498-08-6) и N-сукцинимидил-4-(2-пиридилдитио)2-сульфобутаноат (сульфо-SPDB) (см., например, публикацию патентной заявки США №2009/0274713). Другие бифункциональные сшивающие реагенты, которые могут быть использованы для введения дисульфидных групп, известны специалистам и описаны в патентах США 6913748, 6716821 и публикациях патентных заявок США №2009/0274713 и 2010/0129314, которые все в полном объеме включены в данный документ посредством ссылок.
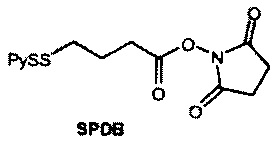


[131] Другие сшивающие реагенты, не содержащие атома серы, которые образуют нерасщепляемые линкеры, также могут быть использованы в способе по изобретению. Такие линкеры могут быть получены из фрагментов на основе дикарбоновых кислот. Пригодные фрагменты на основе дикарбоновых кислот включают, без ограничения, α,ω-дикарбоновые кислоты общей формулы (IX):

где X обознаачет линейную или разветвленную алкильную, алкенильную или алкинильную группу, имеющую от 2 до 20 атомов углерода, Y обозначает циклоалкильную или циклоалкенильную группу, несущую от 3 до 10 атомов углерода, Z обозначает замещенную или незамещенную ароматическую группу, несущую от 6 до 10 атомов углерода или замещенную или незамещенную гетероциклическую группу, где гетероатом выбирают из N, О или S, и где l, m и n каждый равны 0 или 1, при условии, что l, m и n не равны нулю одновременно.
[132] Многие нерасщепляемые линкеры, раскрытые в данном документе, описаны детально в публикации патентной заявки США №2005/0169933 A1.
[133] Готовые очищенные конъюгаты клеточно-связывающий агент-цитотоксический агент, полученные способом по изобретению, содержат цитотоксический агент, бифункциональный сшивающий агент и клеточно-связывающий агент. В предпочтительном варианте реализации изобретения цитотоксический агент представляет собой DM1, бифункциональный сшивающий агент представляет собой SMCC и клеточно-связывающий агент представляет собой антитело huCD37-3. В другом предпочтительном варианте реализации изобретения цитотоксический агент представляет собой DM1, бифункциональный сшивающий агент представляет собой SMCC и клеточно-связывающий агент представляет собой антитело EGFR-7R. В предпочтительном варианте реализации изобретения цитотоксический агент представляет собой DM1, бифункциональный сшивающий агент представляет собой SMCC и клеточно-связывающий агент представляет собой антитело анти-EFGRvIII. В предпочтительном варианте реализации изобретения цитотоксический агент представляет собой DM1, бифункциональный сшивающий агент представляет собой SMCC и клеточно-связывающий агент представляет собой антитело анти-CD27L. В предпочтительном варианте реализации изобретения цитотоксический агент представляет собой DM1, бифункциональный сшивающий агент представляет собой SMCC и клеточно-связывающий агент представляет собой трастузумаб.
[134] Приведенные далее примеры дополнительно иллюстрируют изобретение, но, конечно, не должны каким-либо образом ограничивать его объем.
ПРИМЕР 1
[135] Данный пример демонстрирует способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной для удаления по меньшей мере части примесей из смеси, тем самым обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[136] Конъюгат антитело-SMCC-DM1 был получен с помощью одностадийного процесса (как описано в публикации патентной заявки США №2012/0253021). Реакционную смесь непрерывно прокачивали насосом через ПВДФ-фильтр и фильтрат собирали и анализировали на димерные частицы DM1. Как показано на Фигуре 1, Димерные частицы DM1, включая DM1-DM1 и DM1-MCC-DM1, присутствовашие до ПВДФ-фильтрации (см. Фиг. 1А), эффективно удалялись путем ПВДФ-фильтрация (см. Фиг. 1В).
[137] Результаты экспериментов, описанных в данном примере, демонстрируют, что ПВДФ-фильтрация может эффективно удалять свободный цитотоксический агент, такой как димеры цитотоксического агента, из смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей.
ПРИМЕР 2
[138] Данный пример демонстрирует способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с отдельно взятой ПВДФ-мембраной и в комбинации с ионообменной хроматографической мембраной, для удаления по меньшей мере части примесей из смеси, тем самым обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[139] Конъюгат антитело-SMCC-DM1 был получен с помощью одностадийного процесса (как описано в публикации патентной заявки США №2012/0253021). Реакционную смесь фильтруют через ПВДФ-мембранный фильтр или комбинацию ПВДФ-мембранного фильтра и Q-мембраны (мембрана для ионообменной хроматографии). Как показано в Таблице 1 ниже, комбинация ПВДФ-мембранного фильтра и Q-мембраны удаляет больше димерных частиц DM1, чем отдельно взятый ПВДФ-мембранный фильтр.

[140] Результаты экспериментов, описанных в данном примере, демонстрируют, что ПВДФ-фильтрация, при использовании отдельно или в комбинации с Q-мембраной, может эффективно удалять свободный цитотоксический агент, такой как димеры цитотоксического агента, из смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей.
ПРИМЕР 3
[141] Данный пример демонстрирует способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий повторное приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной для удаления по меньшей мере части примесей из смеси, тем самым обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[142] Конъюгат антитело-SMCC-DM1 был получен с помощью одностадийного процесса (как описано в публикации патентной заявки США №2012/0253021). Реакционную смесь фильтруют через ПВДФ-мембранный фильтр два или три раза. Процентное содержание димеров DM1 (DM1-DM1 и DM1-MCC-DM1) измеряют до и после каждой фильтрации. Как показано на Фигуре 2, дополнительная ПВДФ-мембранная фильтрация может удалять дополнительное количество димерных частиц DM1.
[143] Результаты экспериментов, описанных в данном примере, демонстрируют, что ПВДФ-фильтрация может эффективно удалять свободный цитотоксический агент, такой как димеры цитотоксического агента, из смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей.
ПРИМЕР 4
[144] Данный пример демонстрирует способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной для удаления по меньшей мере части примесей из смеси, тем самым обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[145] Конъюгат huN901-SPP-DM1 был получен с помощью одностадийного процесса (как описано в публикации патентной заявки США №2012/0253021). Вкратце, антитело huN901 подвергают диафильтрации в буфере для модификации (50 мМ фосфата калия, 2 мМ EDTA, pH 7,5) и затем конъюгируют с 2,5 мг/мл DM1 с молярным избытком 1,55 по отношению к линкеру и 7 молями SPP линкера по отношению к антителу, при температуре окружающей среды в течение 24-28 часов в буфере 50 мМ фосфата калия, 2 мМ EDTA, pH 7,5, содержащем 10% (об./об.) DMA.
[146] Реакционную смесь затем фильтруют через 0,22 мкм ПВДФ-фильтр Dura роге. Количество свободного цитотоксического агента, присутствующего в реакционной смеси до и после ПВДФ-фильтрации, измеряют методом ВЭЖХ. Результаты приведены в Таблице 3 ниже.

[147] Как показано в Таблице 3, количество всех измеряемых свободных частиц цитотоксического агента (т.е., DM1, DM1-TPA, DM1-SPP, DM1-DM1 и DM1-SPP-DM1) уменьшалось в результате ПВДФ-фильтрации. В частности, содержание обоих видов димерных частиц цитотоксического агента, DM1-DM1 и DM1-SPP-DM1, значительно снижалось в результате ПВДФ-фильтрации.
[148] Результаты экспериментов, описанных в данном примере, демонстрируют, что ПВДФ-фильтрация может эффективно удалять свободный цитотоксический агент из смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей.
ПРИМЕР 5
[149] Данный пример демонстрирует способ получения очищенного конъюгата клеточно-связывающий агент-цитотоксический агент, включающий приведение в контакт смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей, с ПВДФ-мембраной для удаления по меньшей мере части примесей из смеси, тем самым обеспечивая получение очищенного конъюгата клеточно-связывающий агент-цитотоксический агент.
[150] Антитело HuN901 модифицируют SPP при концентрации 16,0 мг/мл при соотношении 11,0 мг/г антитела (молярное отношение 4,7×) в буфере 50 мМ KPi, 50 мМ KCl, 2 мМ EDTA, pH 7,5 с 5% (об./об.) DMA на протяжении в общей сложности 180 минут при 23°С при постоянном перемешивании. Модифицированное антитело затем конъюгируют при концентрации 2,5 мг/мл с использованием 1,8-кратного молярного избытка DM1 по отношению к исходному SPP-линкеру в буфере 15 мМ KPi с 2 мМ EDTA, 7,7 мМ лимонной кислоты и 5% DMA при pH 5,3 в течение 23 ч при 23°С при постоянном перемешивании. Затем реакционную смесь фильтруют через 0,22 мкм ПВДФ-фильтр Dura pore. Количество свободного цитотоксического агента, присутствующего в реакционной смеси до и после ПВДФ-фильтрации, измеряют методом ВЭЖХ. Результаты приведены в Таблице 4 ниже.

[151] Как показано в Таблице 4, количество всех измеряемых свободных частиц цитотоксического агента (т.е., DM1-TPA, DM1, DM1-DM1 и DM1-SPP-DM1) уменьшается при ПВДФ-фильтрации. В частности, содержание обоих видов частиц димера цитотоксического агента, DM1-DM1 и DM1-SPP-DM1, значительно снижается в результате ПВДФ-фильтрации.
[152] Результаты экспериментов, описанных в данном примере, демонстрируют, что ПВДФ-фильтрация может эффективно удалять свободный цитотоксический агент из смеси, содержащей конъюгат клеточно-связывающий агент-цитотоксический агент и одну или несколько примесей.
[153] Все ссылки, включая публикации, патентные заявки и патенты, указанные в данном документе, настоящим включены посредством ссылок в такой же степени, как если бы для каждой ссылки было индивидуально и конкретно указано, что она включена посредством ссылки, и она была приведена в полном объеме в данном документе.
[154] Следует понимать, что использование терминов в единственном числе (в английском тексте - с артиклями "а" и "an" и "the" и подобными указаниями в контексте описания изобретения (особенно в контексте приведенной далее формулы изобретения) должно охватывать как формы единственного числа, так и формы множественного числа, если иное не указано в данном документе или если это четко не противоречит контексту. Термины "содержащий", "имеющий", "включающий" и "входящий в состав" следует понимать как открытые конструкции (т.е., означающие "включая, без ограничений"), если не указано иное. Указание диапазонов значений в данном документе используется просто как способ сокращенного указания каждого индивидуального значения, попадающего в данный интервал, если иное не указано в данном документе, и каждое отдельное значение включено в описание изобретения, как если бы оно было индивидуально указано в данном документе. Все способы, описанные в данном документе, могут быть проведены в любом пригодном порядке, если иное не указано в данном документе или если это четко не противоречит контексту. Использование каких-либо и всех примеров или иллюстративных описаний (например, "такой как"), приведенных в данном документе, предназначено только для лучшего освещения изобретения и не должно накладывать ограничения на объем изобретения, если не будет указано иное. Ничто в данном документе не должно истолковываться в качестве указания на какой-либо незаявленный элемент как существенный для практической реализации изобретения.
[155] Предпочтительные варианты реализации изобретения описаны в данном документе, включая наилучший способ осуществления изобретения, известный авторам изобретения. Варианты таких предпочтительных вариантов реализации изобретения могут быть очевидными специалистам в данной области техники после прочтения приведенного выше описания. Авторы изобретения ожидают, что квалифицированные специалисты будут использовать такие варианты при необходимости, и авторы изобретения предусматривают, что изобретение может быть реализовано иначе, чем конкретно описано в данном документе. Соответственно, настоящее изобретение включает все модификации и эквиваленты предмета изобретения, описанные в приложенной формуле изобретения, насколько это разрешено применяемым законодательством. Кроме того, любая комбинация вышеописанных элементов во всех их возможных вариантах входит в объем изобретения, если иное не указано в данном документе или если это четко не противоречит контексту.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ImmunoGen, Inc.
<120> ИСПОЛЬЗОВАНИЕ ПВДФ-МЕМБРАНЫ ДЛЯ ОЧИСТКИ КОНЪЮГАТОВ КЛЕТОЧНО-
СВЯЗЫВАЮЩИЙ АГЕНТ-ЦИТОТОКСИЧЕСКИЙ АГЕНТ
<130> 714287
<150> 61/709,891
<151> 2012-10-04
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 1
Gln Val Gln Leu Val Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Ser Asn
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Asn Phe
50 55 60
Gln Gly Lys Ala Lys Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Asn Pro Tyr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 2
<211> 211
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 2
Glu Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Ser Ala Ser Ser Gly Val Asn Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Arg Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Ser Met Glu Pro Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Gly Ser Tyr Thr Phe Gly
85 90 95
Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
100 105 110
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
115 120 125
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
130 135 140
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
145 150 155 160
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
165 170 175
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
180 185 190
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
195 200 205
Gly Glu Cys
210
<210> 3
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 3
Gln Val Gln Val Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Ser
20 25 30
Gly Val Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Asp Gly Ser Thr Asn Tyr His Pro Ser Leu Lys
50 55 60
Ser Arg Leu Ser Ile Lys Lys Asp His Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Leu Asn Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Lys Gly Gly Tyr Ser Leu Ala His Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 4
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Val Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Arg Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Val
35 40 45
Asn Val Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Gln His Tyr Trp Gly Thr Thr Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
Реферат
Группа изобретений относится к области биохимии. Предложен способ получения очищенного конъюгата клеточно-связывающий агент - цитотоксический агент (варианты). В первом варианте способ включает приведение клеточно-связывающего агента в контакт с цитотоксическим агентом с образованием первой смеси, приведение первой смеси в контакт с содержащим линкер бифункциональным сшивающим реагентом для получения второй смеси, приведение второй смеси в контакт с поливинилдифторидной мембраной и обработку второй смеси для получения очищенной смеси конъюгата клеточно-связывающий агент - цитотоксический агент. Во втором варианте способ включает приведение клеточно-связывающего агента в контакт с содержащим линкер бифункциональным сшивающим реагентом для получения первой смеси, обработку первой смеси для получения очищенной первой смеси, конъюгацию цитотоксического агента с имеющими связанные линкеры клеточно-связывающими агентами с получением второй смеси, приведение второй смеси в контакт с поливинилдифторидной мембраной и обработку второй смеси для получения очищенной смеси конъюгата клеточно-связывающий агент - цитотоксический агент. В третьем варианте способ включает приведение клеточно-связывающего агента в контакт с содержащим линкер бифункциональным сшивающим реагентом для получения первой смеси, конъюгацию цитотоксического агента с имеющими связанные линкеры клеточно-связывающими агентами для получения второй смеси, приведение второй смеси в контакт с поливинилдифторидной мембраной и обработку очищенной второй смеси для получения очищенной смеси конъюгата клеточно-связывающий агент - цитотоксический агент. Изобретения обеспечивают получение конъюгата клеточно-связывающий агент – цитотоксический агент с повышенной чистотой и стабильностью. 3 н. и 175 з.п. ф-лы, 2 ил., 3 табл., 5 пр.
Формула
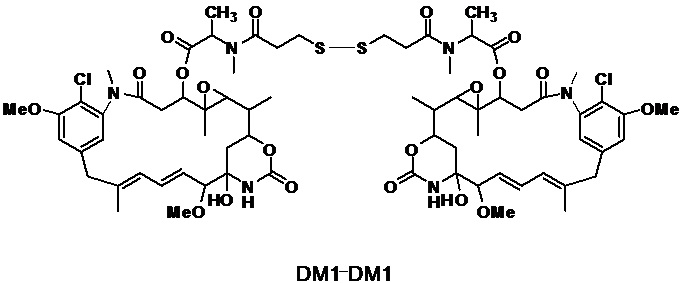











Документы, цитированные в отчёте о поиске
Усиление действия противораковых агентов

Комментарии