Способ прогнозирования послеоперационного положения интраокулярной линзы (иол) и применения таких способов - RU2596720C2
Код документа: RU2596720C2
Чертежи









Описание
Настоящее изобретение относится к области офтальмологических систем и процедур. В частности, настоящее изобретение относится к определению послеоперационного положения интраокулярной линзы (называемой "ИОЛ"; intraocular lens (IOL)) в глазу пациента, перенесшего операцию по замене хрусталика, которое включает в себя определение положения наличествующего хрусталика в предоперационном глазу пациента и использование данной информации и одной численной константы для прогнозирования послеоперационного положения интраокулярной линзы. Раскрыты также относящиеся к изобретению способы и компьютерные программы для осуществления способов согласно изобретению.
Операция по замене хрусталика включает в себя удаление из глаза наличествующего биологического хрусталика и имплантацию искусственной интраокулярной линзы (ИОЛ). Как правило, ИОЛ имплантируют в пустую хрусталиковую капсулу (иногда называемую "мешок, сумка" (the bag)), которая остается после удаления биологического материала хрусталика.
ИОЛ обычно состоит из небольшой пластиковой линзы с пластиковыми боковыми ножками (называемыми гаптическими элементами) для удерживания линзы на месте внутри капсульного мешка внутри глаза. ИОЛ традиционно изготавливали из негибкого материала (например, полиметилметакрилат (ПММА); polymethylmethacrylate (PMMA)), хотя это в значительной степени было заменено применением гибких материалов. Большинство ИОЛ, устанавливаемых в настоящее время, представляет собой монофокальные линзы, которые обеспечивают фиксированную фокальную точку, подобранную для зрения вдаль, но доступны и другие типы, такие, как мультифокальные ИОЛ (которые обеспечивают несколько фокальных точек, что дает возможность видеть как на дальние расстояния, так и вблизи), адаптивные ИОЛ (которые обеспечивают ограниченную визуальную аккомодацию) и торические ИОЛ (которые обеспечивают коррекцию астигматизма).
Операция по замене хрусталика может проводиться в силу ряда причин.
Катаракта (помутнение хрусталика, которое препятствует прохождению света через глаза и затемняет видение) представляет собой одну из основных причин слепоты, и операция по удалению катаракты и имплантации интраокулярной линзы является одной из наиболее часто выполняемых хирургических процедур по всему миру. Однако общее улучшение безопасности и эффективности операции по замене хрусталика и разработка новых конструкций ИОЛ в последние годы расширило показания к операции по замене хрусталика, чтобы охватить не только пациентов с катарактой, но и пациентов с рефракционными проблемами, такими как миопия (близорукость), гиперметропия (сильная близорукость), а также пресбиопия (возрастная дальнозоркость при чтении) и астигматизм (очковая коррекция с цилиндрической составляющей).
Глаз представляет собой не простую физическую систему линз, а биологический орган, в котором различные внутренние поверхности и границы раздела фаз (такие как передняя и задняя поверхности роговицы и передняя и задняя поверхности хрусталика) способствуют отклонению света и формированию изображения на сетчатке, где оно воспринимается (см. фигуры 1 и 2).
Поскольку точные оптические свойства и размеры глаза отличаются у разных пациентов, выбор ИОЛ с соответствующими оптическими свойствами (такими как оптическая сила как сферического, так и цилиндрического компонента, асферичность, а также аберрации высших порядков) имеет решающее значение с тем, чтобы данный глаз видел четко. Если оптические свойства имплантата ИОЛ соответствуют оптическим свойствам и размерам глаза, у пациента имеются хорошие шансы на то, что после операции зрение будет хорошим и что очки не потребуются, независимо от того, были ли необходимы очки перед операцией.
Поскольку небольшую искусственную интраокулярную линзу имплантируют в пустую капсулу биологического хрусталика большего размера, и в связи тем, что капсула сжимается в результате процесса заживления после операции, точное физическое положение, которое ИОЛ будет занимать внутри глаза, часто становится известно только после имплантации. Более того, поскольку положение интраокулярной линзы может быть фактически измерено только после операции, необходимо уметь оценивать ее вероятное положение перед операцией.
Очевидно, что физическое положение ИОЛ может значительно влиять на то, как свет преломляется внутри глаза, например, ИОЛ, расположенная ближе к роговице, будет фокусировать свет в более передней плоскости, чем ИОЛ, которая находится дальше от роговицы, причем в каждом случае будет необходима особая очковая коррекция перед глазом, для того чтобы перевести фокус на сетчатку. Более того, влияние аберраций высшего порядка, обусловленных ИОЛ, на общие оптические характеристики глаза, будет также зависеть от более переднего или более заднего расположения ИОЛ внутри глаза. Таким образом, важным моментом при выборе имплантата ИОЛ является прогноз физического положения имплантированной ИОЛ в данном глазу.
Были описаны многие подходы и математические формулы для расчета оптической силы ИОЛ, которая должна быть использована при операции. Однако, поскольку все имеющиеся в настоящее время формулы используют упрощенные модели для оптических свойств глаза, они требуют проведения расчета ряда эмпирических корректирующих условий и параметров персонализации, основанных на наблюдаемых ранее данных, для того, чтобы приспособить формулу к реальным клиническим условиям. Примеры таких "подгоночных (fudge)" параметров включают в себя "константу A" (A-constant (формула SRK (Sanders-Retzlaff-Kraff)), "фактор хирурга" (Surgical Factor) (Holladay) или "эффективное ELP" (эффективное положение линзы (effective lens position) или эффективную глубину передней камеры (Anterior Chamber Depth ("ACD")) (формула Hoffer или Binkhorst). В то время как данные параметры обеспечивают точность прогнозов, сделанных с применением конкретной формулы, в усредненном случае, они не всегда могут обеспечить точный прогноз в каждом отдельном случае. Одна из причин неточности существующих способов заключается в недостаточной способности точно прогнозировать положение ИОЛ в каждом отдельном случае.
Соответственно, в то время как современные подходы и формулы были использованы с некоторым успехом на протяжении многих лет, ни один из них еще не является идеальным инструментом, позволяющим прогнозировать послеоперационное положение ИОЛ для каждого пациента, соответственно, даже при использовании современных подходов и формул пациент все еще может остаться с несовершенным зрением после операции из-за имплантации ИОЛ, которая не обладает подходящими оптическими свойствами для данного глаза.
Настоящее изобретение направлено на решение проблем предшествующего уровня техники.
Первый объект настоящего изобретения относится к способу прогнозирования послеоперационного положения заменяющей хрусталик интраокулярной линзы в глазу пациента, причем данный способ содержит следующие стадии:
(i) определение положения наличествующего хрусталика в предоперационном глазу пациента;
(ii) определение толщины хрусталика в предоперационном глазу пациента; а также
(iii) прогноз послеоперационного положения интраокулярной линзы по отношению к положению хрусталика в предоперационном глазу пациента в виде отношения к толщине хрусталика в предоперационном глазу пациента,
в котором данное отношение определяется единственной численной константой (C), которая определяется типом интраокулярной линзы.
Как обсуждается более подробно ниже и в прилагаемых примерах, настоящее изобретение предлагает более точный способ прогнозирования перед операцией послеоперационного положения заменяющей хрусталик ИОЛ в глазу пациента.
Данное изобретение основано на открытии авторов, заключающемся в том, что ИОЛ сама разместит себя в определенном положении в послеоперационном глазу после того, как она была вставлена в пустую капсулу. Данное положение может быть описано в виде отношения к толщине хрусталика в предоперационном глазу пациента. Соответственно, послеоперационное положение ИОЛ связано с некоторыми определенными анатомическими и физическими характеристиками предоперационного глаза: в частности, с положением и толщиной хрусталика в предоперационном глазу пациента. Таким образом, в свете открытия авторов, измерение некоторых физических параметров в предоперационном глазу пациента (в частности, положения и толщины хрусталика) может быть использовано для прогноза конкретного послеоперационного положения, которое имплантированная ИОЛ будет занимать в глазу данного пациента.
Как объясняется в прилагаемых примерах, открытие авторов возникло из подробных, проведенных до и после операции исследований прооперированных на глазу индивидуумов с актуальным имплантатом ИОЛ, у которых были измерены различные физические параметры, которые могут повлиять на положение ИОЛ. Статистический анализ таких данных выявил связь между данными параметрами и позволил разработать удивительно простую формулу, описывающую связь между измеряемыми параметрами. Данный анализ показал, что послеоперационное положение имплантированной ИОЛ может быть точно прогнозируемо, исходя из данной формулы и физических параметров глаза, измеренных перед операцией.
После прогнозирования послеоперационного положения ИОЛ может быть произведен точный расчет (и прогноз) наиболее подходящих оптических свойств ИОЛ (например, преломляющей способности линзы и других оптических свойств), которая должна быть имплантирована в ходе операции. Такие расчеты и прогнозы выполняются на основе создания модели глаза и преломления света в нем. Способы обеспечения подробной и правильной модели глаза и имплантата ИОЛ требуют правильной интерпретации различных измеримых физических параметров глаза и оптических и физических свойств множества межфазных границ и поверхностей в глазу. Такие способы включают в себя способы трассировки параксиальных лучей в случае так называемой "толстой линзы" и способы трассировки реальных лучей, как описано здесь, и они также известны в данной области техники (как обсуждается, например, в WO 2010/028654).
Таким образом, настоящее изобретение отличается от предыдущих систем и способов, в том, что:
(1) В настоящем изобретении прогнозирование положения ИОЛ после операции отделено от оптической формулы, описанной в предшествующем уровне техники, и вместо этого базируется на истинном, физически определенном послеоперационном положении ИОЛ (предпочтительно с использованием послеоперационного измерения глубины передней камеры), а не на виртуальном послеоперационном положении (таком как виртуальное эффективное положение линзы или "ELP"); и
(2) В настоящем изобретении прогнозирование послеоперационного положения ИОЛ может быть выполнено, исходя из точного измерения положения и толщины хрусталика пациента перед операцией, и
(3) В настоящем изобретении физическое прогнозирование положения ИОЛ может быть использовано в реальной модели оптической трассировки лучей для точного отражения оптических свойств глаза на основе измеренных и предсказанных данных. Таким образом могут быть получены наиболее подходящие оптические свойства ИОЛ, которая должна быть имплантирована.
Следует иметь в виду, что положение хрусталика на стадии (i) может быть определено рядом способов, основанных на одном или нескольких измерениях, выполненных на предоперационном глазу. Предпочтительно производится определение осевого положения хрусталика в предоперационном глазу пациента, которое может быть точно выполнено с использованием (например) частичной когерентной интерферометрии, что осуществляется с помощью лазера (например, с использованием прибора Lenstar LS900 компании Haag-Streit, Швейцария).
Следует также иметь в виду, что толщина хрусталика в предоперационном глазу пациента может быть определена несколькими способами на основе одного или нескольких измерений, выполненных на предоперационном глазу. Например, толщина хрусталика может быть определена измерением относительного положения его передней и задней поверхности в глазу, например, при помощи ультразвука, лазерной интерферометрии или лазерной биометрии.
В понятие "предоперационный глаз пациента" авторы включают глаз перед удалением его естественного, биологического хрусталика. В предыдущем уровне техники такой глаз часто называется "факичный" (phakic) глаз.
В понятие "послеоперационный глаз пациента" авторы включают глаз после удаления естественного, биологического хрусталика и после имплантации ИОЛ. В предыдущем уровне техники такой глаз часто называется "артифакичный" (pseudophakic) глаз.
В понятие "хрусталик" авторы включают естественный, биологический хрусталик, находящийся в глазу.
Как известно, хрусталик не является равномерным по толщине, но имеет эллипсоидную или двояковыпуклую форму. В понятие "толщина хрусталика" авторы включают осевое расстояние (вдоль луча зрения) от передней поверхности до задней поверхности хрусталика, когда он находится в расслабленном состоянии. Расслабленное состояние представляет собой неаккомодирующее состояние, когда глаз фокусируется вдаль; однако, данное состояние становится менее важным с возрастом пациента, потому что способность к аккомодации постепенно теряется в течение жизни, например, у людей в возрасте от 45 лет и более она становится очень мала и не может влиять на толщину линзы.
В понятие "интраокулярная линза" или "ИОЛ" авторы включают искусственный хрусталик для имплантации в капсульный мешок в глазу. ИОЛ обычно содержат пластиковую линзу с пластиковыми боковыми ножками (называемыми гаптическими элементами) для удержания линзы на месте внутри капсульного мешка. ИОЛ может быть выполнена из негибких материалов (таких как ПММА) или гибких материалов (например силикона или акр иловых материалов). ИОЛ различаются по своим оптическим свойствам (таким как их сферическая и цилиндрическая оптическая сила, асферичность и другие высшие порядки аберраций), и ИОЛ может представлять собой фиксированную монофокальную линзу (соответствующую зрению вдаль), мультифокальную линзу (которая обеспечивает несколько фокальных точек, что дает возможность видеть как на дальние расстояния, так и вблизи) или адаптивную линзу (которая обеспечивает ограниченную визуальную аккомодацию).
Ключевым объектом настоящего изобретения является одна численная константа, называемая "C".
Настоящее изобретение широко применимо и может быть использовано для различных типов пациентов, включая людей (всех рас и национальностей) и других млекопитающих (таких как млекопитающее, имеющее сельскохозяйственную или коммерческую ценность, включая лошадь, корову, свинью, овцу, собаку, кошку и кролика). Следует иметь в виду, что размеры и оптические характеристики глаза будут варьировать у различных видов животных, родов и, в случае людей, у представителей различных национальностей или рас. Соответственно, численная константа (C) определяется не только типом ИОЛ, но и типом пациента и подходом, используемым для имплантации ИОЛ в глазу.
Предпочтительно, численная константа (C) определяет связь между послеоперационным положением интраокулярной линзы в глазу одного или более прооперированных на глазу индивидуумов по отношению к положению и толщине хрусталика в предоперационном глазу одного или более прооперированных на глазу индивидуумов.
Более предпочтительно, что численная константа (C) вычисляется с использованием данных, полученных от двух или более прооперированных на глазу индивидуумов, которым данный тип ИОЛ был имплантирован в глазу с использованием такого же имплантационного подхода.
Следует иметь в виду, что численная константа (C) должна быть рассчитана с использованием данных, полученных от прооперированных на глазу индивидуумов, причем такие данные соответствуют конкретному типу пациента, который подвергается операции по замене хрусталика. Как обсуждалось выше, размеры и оптические характеристики глаза будут варьировать у различных видов животных, родов и, в случае людей, у представителей разных рас. Например, в случае людей, глаза представителей азиатской расы имеют другое соотношение между передним и задним сегментами глаза по сравнению с представителями кавказской расы - то есть, глаз представителя азиатской расы будет иметь относительно более короткий передний сегмент и более длинный задний сегмент по сравнению с глазом представителя кавказской расы.
В свете таких различий, при расчете численной константы (C) должны использоваться данные, полученные от соответствующих прооперированных на глазу индивидуумов. Например, если пациентом является собака, то прооперированные на глазу индивидуумы, чьи данные используются для расчета численной константы (C), также должны являться собаками (и, предпочтительно, собаками того же вида). Если пациентом является человек, то прооперированные на глазу индивидуумы, чьи данные используются для расчета численной константы (C), должны быть предпочтительно той же расы. Специалисты в данной области техники осведомлены о значимых различиях в размерах глаз и оптических характеристиках и смогут отобрать соответствующие прооперированные на глазу индивидуумы для расчета численной константы (C).
Как показано в прилагаемых примерах, для того, чтобы точно вычислить численную константу, C, необходимо получить данные только от очень небольшого числа прооперированных на глазу пациентов. Предпочтительно, количество прооперированных на глазу индивидуумов, от которых получают данные, составляет: 2 или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 20, или 30, или 40, или 50, или 60, или 70, или 80, или 90, или 100, или 200, или более прооперированных на глазу индивидуумов.
Обычно, численная константа (C) определяет соотношение с толщиной хрусталика в предоперационном глазу двух или более прооперированных на глазу индивидуумов.
В одном варианте осуществления настоящее изобретение относится к способу, в котором тип ИОЛ приспособлен для имплантации в капсульный мешок в глазу. Такие ИОЛ хорошо известны специалистам в данной области техники.
Компании, производящие ИОЛ, хорошо известны и включают в себя Alcon Laboratories (которая производит акриловые цельные складные ИОЛ, называемые Acrysof и Restor и др.); Rayner Intraocular Lenses (которая производит ряд складных имплантатов, называемых Superflex и T-flex и др.); Abbott Medical Optics (которая производит акриловые цельные складные ИОЛ, такие как Tecnis® Aspheric IOL, Tecnis® Multifocal IOL, ReZoom® Multifocal IOL); Carl Zeiss Meditec (которая производит ряд монофокальных, мультифокальных и торических ИОЛ, относящихся к серии Acri.Lisa); Bausch & Lomb; Corneal; Hoya; Topcon.
Предпочтительно, ИОЛ имплантируют в капсульный мешок в глазу. Как известно, стандартный подход для выполнения таких операций заключается в том, чтобы открыть переднюю часть капсулы хрусталика способом, называемым "капсулорексис" (capsulorhexis), который обеспечивает круглое отверстие, через которое удаляют хрусталиковое вещество и через которое вставляют ИОЛ. Капсула может быть открыта различными способами (путем отрыва, разрезанием, прожиганием, лазером), но предпочтительным размещением ИОЛ является всегда "в мешке" (in-the-bag). Хрусталиковое вещество часто удаляют с помощью "факоэмульсификации", при которой используется ультразвук для разрушения и аспирации хрусталикового вещества через небольшой разрез; альтернативно, хрусталиковое вещество может быть разрушено мануально или с помощью фемтосекундного лазера. После удаления хрусталикового вещества ИОЛ имплантируют через отверстие в передней части капсулы и помещают в пустой мешок. Такой способ представляет собой принятый в настоящее время во всем мире способ выполнения операции по замене хрусталика.
Следует иметь в виду, что положение ИОЛ внутри послеоперационного глаза (и, следовательно, численная константа, C) может зависеть от геометрии ИОЛ, которая имплантируется, особенно потому, что диаметр, форма и механические свойства гаптических элементов могут влиять на то, как ИОЛ будет выталкиваться вперед или назад в результате постепенного сокращения капсулы после операции. Однако, как показано в прилагаемых примерах, изменение величины C, полученное с использованием двух различных типов ИОЛ, является на удивление небольшим. Соответственно, способ по настоящему изобретению может быть осуществлен с использованием любой ИОЛ, которая приспособлена для имплантации в капсульный мешок в глазу и которую имплантируют в капсульный мешок в глазу.
Способы по настоящему изобретению не применяются со способами имплантации или типами ИОЛ, которые не включают в себя имплантацию in-the-bag. Такие способы имплантации и типы ИОЛ могут быть использованы, когда капсула хрусталика не является интактной или отсутствует.
Как обсуждается в прилагаемых примерах, в предпочтительном варианте осуществления численная константа (C) рассчитывается по данным, полученным от двух или более прооперированных на глазу индивидуумов, с использованием следующей формулы:
C=(IOLmeasured-ACDpre)/LT
где:
IOLmeasured - измеренное положение интраокулярной линзы в глазу прооперированного на глазу индивидуума после операции, которое может быть определено, например, глубиной передней камеры глаза прооперированного на глазу индивидуума. В предпочтительном варианте осуществления IOLmeasured - измеренное положение до центра интраокулярной линзы, которое может быть вычислено сложением измеренного значения глубины передней камеры в глазу прооперированного на глазу индивидуума и значения, равного половине толщины ИОЛ.
ACDpre - положение передней поверхности хрусталика относительно поверхности роговицы в глазу прооперированных на глазу индивидуумов перед операцией; данное положение может быть определено, например, измерением глубины передней камеры (Anterior Chamber Depth) глаза прооперированного на глазу индивидуума перед операцией;
LT (Lens Thickness) - толщина хрусталика в глазу прооперированного на глазу индивидуума перед операцией;
Таким образом, численная константа (C) может быть рассчитана способом, содержащим следующие стадии: измерение положения и толщины хрусталика у глазу двух или более индивидуумов перед операцией на глазу; измерение положения ИОЛ в глазу двух или более индивидуумов после операции (т.е. прооперированных на глазу индивидуумов); и вычисление численной константы (C) по формуле, описанной выше, т.е.
C=(IOLmeasured-ACDpre)/LT
Предпочтительно, измерение положения хрусталика в глазу двух или более индивидуумов перед операцией на глазу выполняют, измеряя глубину передней камеры глаза перед операцией (т.е. предоперационное измерение ACD); и измерение положения интраокулярной линзы в глазу прооперированного на глазу индивидуума после операции проводят измерением глубины передней камеры глаза после операции (т.е. послеоперационное измерение ACD). Способы проведения таких измерений известны в данной области техники и описаны в данном документе.
Как обсуждалось выше, предоперационное измерение ACD представляет собой измерение расстояния от поверхности роговицы глаза до передней поверхности хрусталика. Следует иметь в виду, что положение хрусталика могло быть определено другими способами, на основе других измерений глаза, которые все еще позволили бы рассчитать константу (C). Например, положение хрусталика может быть определено измерением расстояния от поверхности роговицы глаза до задней поверхности хрусталика (т.е. предоперационное измерение ACD). Альтернативно, положение хрусталика могло быть определено измерением расстояния от поверхности сетчатки до передней или задней поверхности хрусталика. В качестве примера, в котором положение хрусталика определяется измерением расстояния от поверхности сетчатки до задней поверхности хрусталика, численная константа (C) вычисляется с помощью следующей формулы:
C=(LPant-IOLpost)/LT
где:
LPant - измеренное расстояние от сетчатки до передней поверхности хрусталика в глазу;
IOLpos - измеренное расстояние от сетчатки до центра интраокулярной линзы;
LT - толщина хрусталика в глазу перед операцией.
Как обсуждалось выше, предпочтительно численная константа (C) рассчитывается по формуле: C=(IOLmeasured-ACDpre)/LT
Более предпочтительно, численная константа (C) представляет собой в среднем (т.е. среднее) значение, полученное из расчета значений, полученных от двух или более прооперированных на глазу индивидуумов с использованием описанного выше подхода и предпочтительной формулы (т.е. C=(IOLmeasured-ACDpre)/LT).
Численная константа (C) может составлять от 0,0 до 1,0 (что, будучи выражено в процентах, будет составлять от 0 до 100%). Данные крайние значения описывают чрезвычайные ситуации с ИОЛ бесконечной толщины, которая фиксируется на передней поверхности капсулы или на задней поверхности капсулы, соответственно, не вызывая вторичного сжатия пустой капсулы после операции; хотя такие случаи являются маловероятными, способ по настоящему изобретению будет по-прежнему работать, потому что он все равно будет правильно описывать взаимоотношение ИОЛ с анатомическим строением глаза.
Соответственно, предпочтительно, что численная константа (C) равна или составляет около: 0,1 или 0,2, или 0,3, или 0,4, или 0,5, или 0,6, или 0,7, или 0,8, или 0,9, или 1,0 (что, будучи выражено в процентах, составляет: 10% или 20%, или 30%, или 40%, или 50%, или 60%, или 70%, или 80%, или 90%, или 100%).
Особенно предпочтительно, что численная константа (C) составляет от 0,3 до 0,6; например 0,3 или 0,4, или 0,5, или 0,6. Еще более предпочтительно, численная константа (C) составляет или составляет около 0,4 (что, будучи выражено в процентах, составляет или составляет около 40%). Например, как показано в прилагаемых примерах, численная константа C может составлять 0,387 (т.е. 38,7%).
Следует иметь в виду, что, когда конструкции ИОЛ изменяется в результате новых разработок, и/или когда изменяется хирургический способ имплантирования интраокулярных линз, это может изменить среднее послеоперационное положение ИОЛ в глазу после операции. В таких случаях может потребоваться изучение результата операций многих прооперированных на глазу индивидуумов, чтобы иметь статистически достоверную оценку среднего положения интраокулярной линзы.
В таких случаях численную константу (C) можно постоянно корректировать для отражения любых изменений в конструкции интраокулярных линз и/или в хирургических способах с использованием приведенной выше предпочтительной формулы (т.е. C=(IOLmeasured-ACDpre)/LT). При наличии достаточного количества прооперированных на глазу индивидуумов, скорректированная величина "C" может быть определена с достаточной точностью для перспективного использования в случае новой конструкции интраокулярной линзы и/или хирургического способа.
Предпочтительно данное изобретение относится к способу, в котором стадия (i) содержит измерение глубины передней камеры предоперационного глаза пациента.
В понятие "глубина передней камеры (Anterior Chamber Depth)" или "ACD" авторы включают расстояние от поверхности роговицы до передней поверхности линзы, будь то естественная или искусственная интраокулярная линза. В целях настоящего изобретения понятие "ACDpre" относится к глубине передней камеры предоперационного глаза, как определено в данном документе, в то время как понятие "ACDpost" относится к глубине передней камеры послеоперационного глаза, как определено в данном документе. Способы измерения ACD хорошо известны в данной области техники и включают в себя: лазерную интерферометрию; ультразвуковое А-сканирование; ультразвуковое В-сканирование; рентгеновское сканирование; КТ-сканирование (компьютерная томография); МРТ-сканирование (магнитно-резонансная томография).
В предпочтительном варианте осуществления измерение глубины передней камеры предоперационного глаза пациента часто производится с применением ультразвука. С помощью ультразвука при этом измеряется время прохождения, за которое ультразвуковой сигнал проходит от поверхности роговицы до передней поверхности хрусталика, где: отражается луч. Как и в случае измерения осевой длины (обсуждается ниже), данный способ имеет некоторые недостатки, включая возможное вдавливание роговицы во время измерения и неопределенность в отношении скорости прохождения ультразвука, принимаемой при преобразовании времени прохождения в расстояние.
В другом варианте осуществления измерение глубины передней камеры предоперационного глаза пациента содержит применение оптического способа, выбранного из группы, содержащей или состоящей из: измерения видимой глубины; оптической когерентной томографии; интерферометрии; частичной интерферометрии; низкокогерентной интерферометрии; получения изображений Шаймпфлюга (Scheimpflug); лазерной интерферометрии; лазерной биометрии.
Оптические способы включают в себя измерение видимой глубины передней камеры с помощью щелевой лампы (общепринятое средство для выполнения биомикроскопии глаза), а в последнее время измерения с помощью интерферометрии (прибор LS900 Lenstar© компании Haag-Streit) или получения изображений Шаймпфлюга переднего сегмента глаза (на примере производителей: Pentacam© производитель Oculus Inc, Германия, Galilei© производитель Ziemer Inc, Швейцария или Sirius© производитель CSO, Италия). Данные способы можно рассматривать как более надежные, чем ультразвуковые измерения, поскольку для них не требуется прикосновение к глазу и они используют оптические принципы для измерения расстояния.
На стадии (ii) способа по первому объекту данного изобретения необходимо определение толщины хрусталика предоперационного глаза пациента, и несколько способов такого определения известны в данной области техники.
В одном варианте осуществления определение толщины хрусталика основано на применении ультразвука. Способы определения толщины хрусталика с помощью ультразвука хорошо известны специалистам в данной области техники. Используя данную технику, измеряют время прохождения, за которое ультразвуковой сигнал проходит от передней поверхности хрусталика до задней поверхности хрусталика. Данный способ имеет некоторые ограничения и недостатки, которые необходимо учитывать - например, катарактный хрусталик не может представлять собой акустически однородную среду, и появление внутрихрусталикового эхо-сигнала, вызванного помутнением хрусталика, может размыть сигнал от задней капсулы хрусталика. Другая неопределенность связана с предполагаемой скоростью прохождения ультразвука, используемой при преобразовании времени прохождения в расстояние.
В альтернативном варианте осуществления толщину хрусталика в предоперационном глазу пациента на стадии (ii) определяют с помощью лазерной интерферометрии или лазерной биометрии.
В последнее время для измерения толщины хрусталика используется лазерная интерферометрия (например, с помощью прибора LS900 Lenstar© компании Haag-Streit). Данный способ кажется существенно более точным, чем ультразвуковые измерения, и представляется менее подверженным ошибкам, связанным с неоднородностью хрусталикового вещества.
Особенно предпочтительно, что прогноз послеоперационного положения интраокулярной линзы на стадии (iii) содержит применение формулы:
IOLpredicted=ACDpre+С×LT
где:
IOLpredicted - прогнозируемое послеоперационное положение интраокулярной линзы в глазу пациента;
ACDpre - предоперационная глубина передней камеры глаза пациента;
C - численная константа, как обсуждалось выше, и
LT - толщина хрусталика в предоперационном глазу пациента.
Таким образом, особенно предпочтительный вариант осуществления способа по первому объекту данного изобретения содержит: способ прогнозирования послеоперационного положения заменяющей хрусталик ИОЛ в глазу пациента, содержащий следующие стадии:
(i) определение положения наличествующего хрусталика в предоперационном глазу пациента;
(ii) определение толщины хрусталика в предоперационном глазу пациента; и (iii) прогноз послеоперационного положения ИОЛ с использованием формулы:
IOLpredicted=ACDpre+С×LT
где:
IOLpredicted - прогнозируемое послеоперационное положение ИОЛ в глазу пациента;
ACDpre - предоперационная глубина передней камеры глаза пациента;
C - численная константа, как обсуждалось выше, и
LT - толщина хрусталика в предоперационном глазу пациента.
Предпочтительно, чтобы IOLmeasured соответствовало бы положению в центре интраокулярной линзы.
Второй объект настоящего изобретения относится к способу выбора заменяющей хрусталик ИОЛ, требуемой для обеспечения желаемого оптического свойства в послеоперационном глазу пациента, причем данный способ содержит следующие стадии:
(a) прогнозирование послеоперационного положения заменяющей хрусталик ИОЛ в глазу пациента с помощью способа в соответствии с первым объектом настоящего изобретения;
(b) прогноз оптических свойств послеоперационного глаза пациента, в котором ИОЛ известной оптической силы и геометрии позиционируется, как прогнозировано на стадии (a); и
(c) выбор ИОЛ, обладающей силой и геометрией, необходимыми для обеспечения желаемого оптического свойства в послеоперационном глазу пациента.
Конечно, желаемым результатом операции на глазу является обеспечение пациента безаберрационной оптической системой, которая дает лучший фокус с минимальной степенью размытия изображения.
Как известно в данной области техники, большинство "дефектов глаза", которые могут быть исправлены ИОЛ, включают в себя сферическую и цилиндрическую оптическую силу ИОЛ, которая непосредственно коррелирует со сферической и цилиндрической коррекцией, используемой в очках. В случае мультифокальной ИОЛ также имеется "добавленная" сила, связанная с дополнительной силой, необходимой для зрения вблизи ("добавка для чтения").
Данные основные оптические дефекты глаза описываются сферической и цилиндрической очковой коррекцией, требуемой для обеспечения лучшей остроты зрения. Соответствующее обследование представляет собой рутинное обследование, выполняемое оптиком, оптометристом или окулистом. Острота зрения соответствует самому высокому визуальному разрешению, которое может быть воспринято, то есть представляет собой "наименьшие различимые буквы". В физической оптике это соотносится с "функцией рассеяния точки" (point-spread function) или "функцией передачи модуляции" (modulation transfer function), которые характеризует оптический прибор. В идеальном случае, точка должна быть отображена в виде точки, но часто это не так, и тогда будет наблюдаться некоторый разброс вокруг максимального сигнала.
Как известно в данной области техники, остальные оптические "дефекты глаза" называются "аберрации высших порядков", такие как: кома, наклон, кривизна поверхности Петцваля (Petzval), искажение и хроматическая аберрация. Как описано в учебниках по физической оптике (например, Born & Wolf; "Principles of Optics", 6th edition, Pergamon Press, New York, 1980; и Bennett & Rabbetts; Clinical Visual Optics, Butter-worth, London), для описания оптических аберраций доступны многие теоретические модели, включая метод волнового фронта, полиномы Цернике и преобразование Фурье.
Полиномы Цернике используют многочисленные коэффициенты для характеристики индивидуальных "дефектов" оптической системы целиком.
Оптические дефекты роговицы можно измерить такими измерительными способами, как топографирование роговицы или томография. Оптический дефект глаза в целом может быть измерен клиническими измерительными приборами с использованием аберрометрии - анализа волнового фронта, который задает номера порядков для всех аберраций высших порядков в соответствии с моделью Цернике или другими моделями. Оптические дефекты хрусталика могут быть измерены путем вычитания дефектов роговицы из дефектов глаза в целом. Таким образом, можно измерять аберрации ИОЛ внутри глаза.
После того как у пациента были определены желаемые оптические свойства, может быть выбрана подходящая интраокулярная линза. Следует иметь в виду, что интраокулярная линза может обладать определенным диапазоном свойств. Большинство производителей выпускают ИОЛ со знаком, указывающим на "оптическую силу" интраокулярной линзы. По определению стандарта Американского Национального Института Стандартов (American National Standards Institute, ANSII) это относится к толщине, показателю преломления и кривизне центральной части ИОЛ.
Как обсуждалось выше, большинство глазных дефектов, которые могут быть исправлены ИОЛ, включают в себя сферическую и цилиндрическую оптическую силу ИОЛ, которая непосредственно коррелирует со сферической и цилиндрической коррекцией, используемой в очках. В случае мультифокальной ИОЛ также имеется "добавленная" сила, связанная с дополнительной силой, необходимой для близкого зрения ("добавка для чтения").
Однако оптические свойства содержат не только оптическую силу параксиальной области ИОЛ. В течение последнего десятилетия были также получены многие ИОЛ с коррекцией сферической аберрации, найденной в глазу человека, в частности, это относится к уравнению Z(4) полинома Цернике, который известен в данной области техники. Величина коррекции часто указывается в микрометрах (мкм) - например, 0.21 мкм - со ссылкой на коррекцию волнового фронта для заданного размера зрачка. Степень асферичности, однако, варьирует. Некоторые ИОЛ были произведены в попытке устранить все природные сферические аберрации, в то время как другие ИОЛ пытались исправить только их часть. Измерительные способы выполнения анализа "волнового фронта" глаза с целью обеспечить анализ оптических свойств глаза согласно модели, использующей полиномные функции Цернике, известны в данной области техники.
Таким образом, особенно предпочтительный вариант осуществления способа по второму объекту изобретения содержит: способ выбора заменяющей хрусталик ИОЛ, требуемой для обеспечения желаемого оптического свойства в послеоперационном глазу пациента, причем данный способ содержит следующие стадии:
(a) прогнозирование послеоперационного положения заменяющей хрусталик ИОЛ в глазу пациента способом, содержащим следующие стадии:
(i) определение положения наличествующего хрусталика в предоперационном глазу пациента;
(ii) определение толщины хрусталика в предоперационном глазу пациента; и
(iii) прогнозирование послеоперационного положения ИОЛ с использованием формулы:
IOLpredicted=ACDpre+С×LT
где:
IOLpredicted - прогнозируемое послеоперационное положение ИОЛ в глазу пациента;
ACDpre - предоперационная глубина передней камеры глаза пациента;
C - численная константа, как обсуждалось выше, и
LT - толщина хрусталика в предоперационном глазу пациента.
(b) прогноз оптических свойств послеоперационного глаза пациента, в котором ИОЛ известной оптической силы и геометрии позиционируется, как прогнозировано на стадии (a), и
(c) выбор ИОЛ, обладающей силой и геометрией, необходимыми для обеспечения желаемого оптического свойства в послеоперационном глазу пациента.
Стадия (b) способа по второму объекту изобретения содержит прогноз оптических свойств послеоперационного глаза пациента, в котором ИОЛ известной оптической силы и геометрии позиционируется, как прогнозировано на стадии (a).
Предпочтительно, предсказание оптических свойств послеоперационного глаза пациента содержит создание оптической модели послеоперационного глаза пациента. Способы моделирования оптической системы известны в данной области техники и обычно включают в себя создание модели глаза пациента на основе измерений его оптических свойств и размеров (которые для удобства выполняются перед операцией). В данной области техники известны многочисленные подходы для создания и анализа таких моделей, как обсуждается более подробно ниже.
В предпочтительном варианте осуществления оптическая модель послеоперационного глаза пациента содержит измерение кривизны роговицы предоперационного глаза пациента (например, кератометрией, топографированием или томографией, как обсуждалось в данном документе) и осевой длины предоперационного глаза пациента (например, ультразвуком или лазерной биометрией, как обсуждалось в данном документе).
Как только модель для глаза пациента создана, может быть проанализировано преломление света внутри данного глаза и сделан прогноз относительно оптических свойств после позиционирования интраокулярной линзы известной оптической силы и геометрии внутри него. Такие моделирование и прогнозы позволяют выбрать интраокулярную линзу, которая имеет требуемые сферическую и цилиндрическую оптическую силу и другое оптическое свойство, которые требуются для обеспечения желаемого оптического свойства в послеоперационном глазу пациента.
Как обсуждалось выше, когда свет проходит через глазную среду, он отклоняется на нескольких межфазных границах, следуя физическим принципам преломления, таким как закон Снеллиуса (Snellius). Однако для того чтобы правильно применять физические принципы к биологической структуре, очень важно, чтобы клинические измерения точно отражали физические размеры и, кроме того, чтобы восприятие изображения было тесно связано с формированием изображения на сетчатке.
Предпочтительно, чтобы модель глаза пациента, используемая в способах по изобретению (например, на стадиях (b) и (c) способа по второму объекту изобретения) содержала по меньшей мере одну из следующих поверхностей и/или межфазных границах: переднюю поверхность роговицы; заднюю поверхность роговицы; переднюю поверхность линзы биологического хрусталика; заднюю поверхность линзы биологического хрусталика; переднюю поверхность ИОЛ, заднюю поверхность ИОЛ; сетчатку.
Осевая длина
Как известно, важнейшим параметром для правильной модели глаза служит осевая длина глаза. Осевая длина должна быть измерена с высокой точностью - ошибка только в 1 мм в осевой длине приводит к ошибке в 2,5 дптр. в очковую плоскость в случае усредненного глаза.
Для измерения осевой длины существуют различные клинические способы, такие как ультразвук и частичная когерентная интерферометрия.
Осевая длина традиционно измеряется ультразвуком с использованием так называемого "А-сканирования". По сути, измеряется время прохождения ультразвукового сигнала при его прохождении через глазную среду и отражении на внутренних пограничных поверхностях глаза. Если предположить, что скорость прохождения ультразвука в различных глазных компартментах (роговице, передней камере, хрусталике и стекловидном компартменте) известна, то представляется возможным вычислить расстояние от роговицы до акустически отражающей мембраны в задней части глаза.
Как известно, существует ряд неопределенностей в измерении осевой длины с помощью ультразвука. Во-первых, все измерения скорости ультразвука должны быть точными для различных глазных сред, что может быть не всегда так, учитывая обусловленную наличием катаракты различную плотность, наблюдаемую в клинической практике. Во-вторых, во многих ультразвуковых способах используется уплощение роговицы при передаче ультразвукового сигнала в глаз, и это может приводить к вдавливанию роговицы во время измерения и ухудшению показания. В-третьих, ультразвук измеряет расстояние до отражающей мембраны на задней поверхности глаза (предположительно, внутренней ограничивающей мембраны, составляющей границу между полостью стекловидного тела и слоем нервных волокон сетчатки), которое не совпадает с положением фоторецепторов сетчатки глаза, поглощающих свет.
Существование погрешности ультразвукового измерения, обусловленной различием между точкой измерения и положением эффективной фокальной плоскости на сетчатке (соответствующим положению фоторецепторов), привело к тому, что во многие формулы расчета оптической силы интраокулярной линзы включен корректирующий параметр, называемый "толщина сетчатки", составляющий обычно около 0,25 мм.
В последние годы введение лазерной биометрии с использованием частичной когерентной интерферометрии (называемой "partial coherence interferometry; PCI") (Drexler et al., 1998) значительно повысило точность, с которой может быть измерена осевая длина. Оборудование для проведения измерений по способу PCI производится для продажи в виде прибора IOLMaster© instrument, производитель Carl Zeiss Meditec©, Йена, Германия.
Длина световой волны намного короче, чем длина звуковой волны, что значительно улучшает физическое разрешение. В то время как типичные значения точности измерений в случае хороших ультразвуковых измерений находятся в пределах ±0,1 мм, утверждается, что точность измерений способом PCI приблизительно в десять раз лучше (то есть находится в пределах ±0,01 мм), и это не зависит от наблюдателя (Connors, III et al., 2002; Findl et al., 2003; Haigis, 2001; Kiss et al., 2002; Packer et al., 2002; Vogel et al., 2001). Дополнительно, тот факт, что пигментный эпителий сетчатки является конечной точкой оптического измерения, делает измерения способом PCI оптически более правильными (и длительнее, чем ультразвуковые измерения).
Однако, так же, как измерения с помощью ультразвука зависят от предполагаемой скорости ультразвука, оптическая биометрия зависит от предполагаемых групповых показателей преломления факичного глаза. Показатели преломления, используемые IOLMaster© Zeiss, были рассчитаны Haigis (Haigis, 2001), частично на основе экстраполированных данных. Однако, как было показано впоследствии, калибровка показателя преломления факичного глаза может нуждаться в корректировке, чтобы обеспечить достоверность для предоперационных и послеоперационных показаний (Olsen and Thorwest, 2005a).
Для точной интерпретации показания осевой длины прибора IOLMaster© Zeiss следует понимать, что выходной сигнал (показание) данного прибора не представляет собой истинную длину оптического пути глаза - то есть, он не соответствует истинной осевой длине. Для того, чтобы не менять константы A и другие константы в формулах, используемых в течение многих лет при ультразвуковых измерениях, показания, которые дает коммерческая версия прибора IOLMaster© Zeiss, были откалиброваны на основании данных ультразвуковой иммерсионной биометрии в соответствии со следующими формулами (Haigis et al., 2000; Haigis, 2001):
AxZeiss=(OPL/1,3549-1,3033)/0,9571
где:
AxZeiss - выходной сигнал (показание) прибора Zeiss; и
OPL - оптическая длина пути, измеряемая по способу PCI.
Таким образом:
OPL=(A×Zeiss*0,9571+1,3033)*1,3549
В предположении, что показатель преломления составляет 1,3574 для факичного глаза (Haigis, 2001):
Axtrue=(AxZeiss*0,9571+1,3033)*1,3549/1,3574
Согласно Olsen (Olsen and 2005b), показатель преломления, составляющий 1,3574 для факичного глаза, может быть не самым лучшим выбором. Возможно, лучше использовать более высокое значение показателя преломления, такое как 1,3616, чтобы получить достоверные пред- и послеоперационные показания. Таким образом, истинная осевая длина из показания прибора Zeiss может быть вычислена как:
Axtrue=(AxZeiss*0,9571+1,3033)*1,3549/1,3616
Такое преобразование предпочтительно используется в способах по настоящему изобретению. (Тем не менее возможно, что калибровка показателя преломления может быть в будущем скорректирована по мере накопления нами опыта в лазерной биометрии).
Предпочтительно, осевую длину глаза измеряют с помощью интерферометрии, предпочтительно посредством прибора, работающего на принципе низкокогерентной интерферометрии, или прибора, работающего на принципе частичной когерентной интерферометрии (например, MeditecIOLMaster производителя Carl Zeiss или LS900 Lenstar производителя Haag-Streit).
Оптические свойства роговицы
Радиус передней поверхности роговицы предпочтительно измеряют посредством кератометрии и/или посредством топографирования роговицы. Дополнительно предполагается, что радиус задней поверхности роговицы находится в фиксированном соотношении с радиусом передней поверхности роговицы. Предпочтительно предполагается, что радиус задней поверхности роговицы составляет 0,84 от радиуса передней поверхности роговицы.
Правильную модель глаза получают только при условии учета асферичности поверхности роговицы. Предпочтительно предполагается, что асферичность задней поверхности роговицы линейно зависит от передней поверхности, и предпочтительно предполагается, что асферичности задней и передней поверхности роговицы зависят от возраста пациента. Согласно Dubbelman et al., 2006, предпочтительно предполагается, что асферичность передней поверхности роговицы составляет 0,76 плюс 0,003 раза от возраста пациента; и предпочтительно предполагается, что асферичность задней поверхности роговицы составляет 0,76 плюс 0,325 раза от асферичности передней поверхности роговицы минус 0,0072 раза от возраста пациента.
Сферическая аберрация представляет собой явление, свойственное многим линзам, включая роговицу и не асферические ИОЛ, и заключается в том, что проходящие через периферийную часть линзы лучи и проходящие через центральную часть линзы лучи преломляются по-разному. Глаз человека имеет некоторое количество положительных сферических аберраций, обуславливающих "ночную миопию", которую многие люди испытывают в мезопических (при слабом освещении) условиях, когда зрачок становится большим.
Сферическая аберрация корректируется до некоторой степени за счет так называемого эффекта Stiles-Crawford, в силу которого чувствительность сетчатки зависит от угла, под которым лучи попадают на сетчатку. Эффект Stiles-Crawford прогнозирует, что чувствительность сетчатки является максимальной для лучей, попадающих в центр зрачка, и является менее эффективной для лучей, попадающих на края зрачка. Следствие эффекта Stiles-Crawford заключается в том, что он обеспечивает корректировку сферической аберрации, когда зрачок становится большим (Olsen, 1993).
Предпочтительно, оптическую силу ИОЛ корректируют в отношении сферической аберрации, предпочтительно посредством эффекта Stiles-Crawford, описываемого уравнением I=I0exp(-С*γ2), где: C - численный коэффициент и γ - расстояние от центра зрачка. C составляет предпочтительно 0,108, когда γ измеряется в миллиметрах (мм).
Преломляющую способность роговицы обычно получают измерением кривизны передней поверхности роговицы с помощью прибора, называемого "кератометр". При этом фактически измеряется увеличение, производимое выпуклым зеркалом, образованным передней отражающей поверхностью глаза. Данную величину преобразуют в радиус, предполагая, что центральный участок роговицы имеет сферическую форму. Когда кератометр регистрирует оптическую "силу" роговицы, это делается в предположении, что роговица представляет собой "тонкую линзу" с одной преломляющей поверхностью следующей оптической силы:
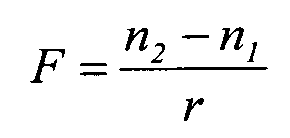
где:
F - рефрактивная сила поверхности в диоптриях;
r = радиус кривизны в метрах;
n1 = показатель преломления первой среды (воздуха); и
n2 = показатель преломления второй среды (роговицы).
Для стандартной калибровки клинических кератометров предполагается, что показатель преломления роговицы с одной поверхностью составляет 1,3375, давая уравнение:
D=337,5/r
где:
D - сила роговицы в диоптриях, и
r - радиус кривизны в миллиметрах.
Как показано Olsen, 1986a, калибровка с показателем преломления, равным 1,3375, не является точной с точки зрения более физиологической теории "толстой линзы", которая прогнозирует, что величина оптической силы роговицы ниже на около 0,75 дптр. в среднем случае, в зависимости от модели роговицы. Данная "врожденная ошибка" общего показания кератометра важна с физической точки зрения, потому что если ее не исправить, это вызовет ошибку во всех последующих расчетах и в конечном итоге потребует внесения коррекции в формулу оптической силы интраокулярной линзы.
Другая проблема касается топографического изменения радиуса роговицы, которое может быть наблюдаться не только в нормальной роговице, но особенно в роговицах, которые перед этим подвергались рефракционной операции (PRK (Photorefractive keratectomy), LASIK (Laser Assisted in-situ Keratomileusis), LASEK (Laser-Assisted Sub-Epithelial Keratectomy) и другим процедурам лазерной абляции с целью исправления рефракции изменением кривизны передней поверхности). В таких роговицах, подвергавшихся LASIK, форма передней поверхности далека от сферической, и возможно, должна быть оценена с помощью топографирования роговицы измерением кривизны в различных точках всей поверхности роговицы.
Чтобы рассматривать роговицу в виде "толстой линзы", толщина роговицы и кривизна задней поверхности также должны быть приняты во внимание. В большинстве моделей роговицы предполагается, что задняя кривизна фиксировано соотносится с кривизной передней поверхности при условии стандартной формы роговицы. На протяжении многих лет было принято, что стандартная форма и, следовательно, радиус задней поверхности соответствуют предположению по Gullstrand (Gullstrand, 1924). Тем не менее, не так давно более современные исследования предоставили подробную информацию относительно не только кривизны обеих поверхностей роговицы, но и их асферичности (Dunne et al., 1992; Dubbelman et al., 2002; Dubbelman et al., 2006). Данные результаты позволили улучшить условия для создания более реалистичных моделей оптических свойств роговицы и, следовательно, оптических свойств глаза в целом.
Предполагается, что показатель преломления роговицы имеет постоянное значение, равное 1,376, и предполагается, что толщина роговицы имеет постоянное значение, равное 0,5 мм. Предполагается, что кривизна передней поверхности измеряется с помощью общепринятой кератометрии и/или топографированием роговицы. Вместо показания, дающего диоптрии, используется показание, дающее радиусы, чтобы избежать путаницы связанной с показателем преломления при кератометрии.
Когда задняя кривизна роговицы не измеряется непосредственно, как правило, предполагается, что задняя поверхность роговицы фиксировано соотносится с передней поверхностью. Согласно модели, описанной Dubbelman (Dubbelman et al., 2002), данное соотношение представляет собой:
R2=0.84*R1
где:
R2 - радиус задней поверхности роговицы; и
R1 - радиус передней поверхности роговицы.
Кроме того, из работы Dubbelman (Dubbelman et al., 2002) предполагается, что асферичность поверхностей роговицы зависит от возраста пациента в соответствии со следующими уравнениями:
Ка=0,76+0,003 * Возраст
Кp=0,76+0,325 * Ка - 0,0072 * Возраст
где:
Ка - асферичность передней поверхности роговицы;
Кр - асферичность задней поверхности роговицы;
Возраст - возраст пациента в годах.
Модель Dubbelman, используемая в данном документе, прогнозирует, что кривизна центральной части задней поверхности роговицы составляет 84% от кривизны передней поверхности, что несколько отличается от предыдущего Gullstrand, равного 6,8/7,7 (88,3%), которое используется Olsen в исходной формуле "толстой линзы". Если бы не асферичность, это означало бы, что оптическая сила роговицы ниже, чем предполагалось ранее. Однако с учетом асферичности роговицы (трассировкой реальных лучей) было показано, что эффективная оптическая сила роговицы несколько больше, чем прогнозируемая соотношением по Gullstrand (Olsen, 2007).
Способы измерения глубины передней камеры в предоперационном и послеоперационном глазу и толщин естественного, биологического хрусталика и искусственной линзы обсуждаются выше.
Свойства интраокулярной линзы
Для того чтобы прогнозировать оптическое поведение интраокулярной линзы, которую предстоит имплантировать, очень важно знать оптическую силу и геометрию интраокулярной линзы. Производители интраокулярных линз обычно предоставляют данные для показателя преломления и толщины и кривизны передней и задней поверхности интраокулярной линзы, и оптическую силу и геометрию предпочтительно рассчитывают из таких данных.
Физическое описание интраокулярной линзы, изученной в прилагаемых примерах, было основано на данных производителя для показателя преломления, толщины и кривизны передней и задней поверхностей интраокулярной линзы. Кривизны поверхностей изменялись в зависимости от оптической силы имплантата, так что было необходимо использовать табличные значения физических данных в зависимости от указанной (labelled) оптической силы.
По определению (стандарт ANSI), указанная сила интраокулярной линзы относится к кривизнам в параксиальной области линзы, ее толщине и показателю преломления. В случае сферической интраокулярной линзы кривизна постоянна по всей площади. В случае асферической интраокулярной линзы кривизна зависит от асферичности и изменяется от центральной к периферийным частям линзы.
Для того чтобы оценить результат анализа методом трассировки лучей и, таким образом, оценить оптические свойства глаза, по меньшей мере одна функция точки рассеяния предпочтительно вычисляется и оценивается на сетчатке глаза и/или в точке наилучшего фокуса.
Примеры моделирования, которое возможно с помощью способов и средств, обсуждаемых выше, представлены на фигурах 3 и 4.
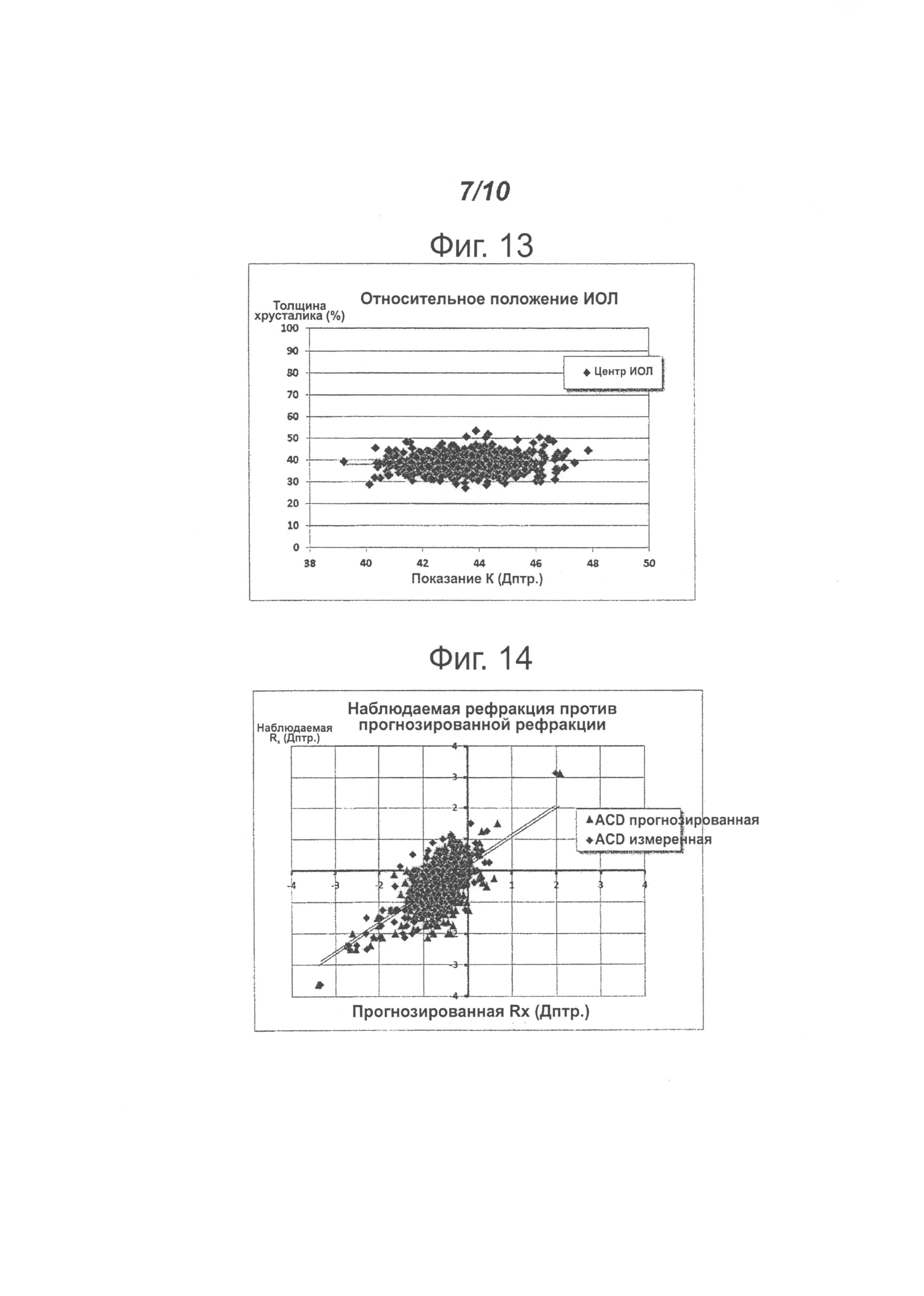
На фигуре 3 представлен пример оптического сканирования факичного глаза, выполненного с использованием биометра Lenstar производителя Haag-Streit, которое демонстрирует точность в определении различных параметров факичного глаза, включая толщину линзы (знак "указывающие руки" на фигуре). Обычно выполняют серию измерений, каждое из которых показывает интраокулярные размеры (слева направо на фигуре) толщины роговицы в центральной области (central corneal thickness - "CCT" на фигуре), глубину передней камеры (anterior chamber depth - "AD" на фигуре), толщину линзы (lens thickness - "LT" на фигуре) и общую осевую длину (axial length - "AL" на фигуре). В нижней части фигуры показаны различия между отдельными показаниями. Поскольку используется способ интерферометрии, стандартное отклонение, как правило, очень мало, что означает высокую точность данных измерений.
На фигуре 4 представлен пример послеоперационного сканирования того же глаза, который был показан на фигуре 3, на следующий день после операции. Естественный хрусталик была заменен интраокулярной линзой, помещенной в капсульный мешок. Положение интраокулярной линзы легко определить и измерить (знак "указывающие руки" на фигуре).
Следует иметь в виду, что для того, чтобы выбрать соответствующую ИОЛ для имплантации в глаз пациента, требуется реалистичная оптическая модель глаза.
Предпочтительно, второй объект настоящего изобретения относится к способу, в котором создание оптической модели послеоперационного глаза пациента содержит измерение одного или более свойства предоперационного глаз глаза пациента, выбранного из группы, состоящей из: оптических свойств роговицы; радиуса роговицы; длины глаза; осевой длины; глубины передней камеры; толщины хрусталика.
Наиболее предпочтительно, измеряют осевую длину глаза и кривизну передней поверхности роговицы глаза. Такие данные используются для введения в формулы расчета оптической силы ИОЛ, которые известны в данной области техники.
Следует иметь в виду, что в некоторых случаях может потребоваться применение дополнительного анализа для изучения формы роговицы. Например, если пациент перенес операцию LASIK до операции на хрусталике, передняя поверхность роговицы у такого пациента изменяется, что нарушает стандартные модели для расчета оптической силы роговицы, исходя только из данных о передней поверхности. В таких случаях также может потребоваться измерение кривизны задней поверхности роговицы, и это может быть сделано с использованием современных способов сканирования высокого разрешения.
Предпочтительно, стадия (b) способа по второму объекту изобретения дополнительно содержит анализ оптических свойств оптической модели послеоперационного глаза пациента.
В течение многих лет использовалась "формула Olsena", которая представляет собой формулу так называемой "толстой линзы" для расчета оптической силы ИОЛ, использующую известную теорию из Гауссовой оптики, которая представляет собой так называемую трассировку параксиальных лучей. Преимущество использования модели "толстой линзы" заключается в том, что она позволяет использовать расстояния, как если бы они могли быть измерены в предположении отсутствия аберраций высших порядков. В этом состоит отличие от модели "тонкой линзы", где: эффективные плоскости линзы (ELP) сводятся к мнимым плоскостям, которые близки, но не идентичны измеренным положениям.
В последнее время была описана более сложная модель с использованием трассировки реальных лучей (в WO 2010/028654), и такая модель имеет то преимущество, что она использует по возможности мало предположений, и это позволяет применить оптическую теорию из физического мира к человеческому глазу. С помощью такого подхода можно анализировать аберрации высших порядков (например, сферические аберрации) и другие свойства, которые не объясняются моделью "толстой линзы".
В особенно предпочтительном варианте осуществления анализ оптических свойств оптической модели послеоперационного глаза пациента содержит применение анализа трассировки реальных лучей. Такие подходы обсуждаются в данном описании и известны в данной области техники (как описано, например, в WO 2010/028654).
В альтернативном варианте осуществления анализ оптических свойств оптической модели послеоперационного глаза пациента содержит применение анализа трассировки параксиальных лучей. Такие подходы обсуждаются в данном описании и известны в данной области техники (как описано, например, в WO 2010/028654).
Трассировка лучей хорошо известна в данной области техники как способ моделирования оптических свойств глаза, который основан на законе преломления Снеллиуса:
Sinθ1/Sinθ2=n2/n1
где:
θ1 - угол падения входящего света в первой среде;
θ2 - угол преломления света во второй среде;
n1 - коэффициент преломления первой среды; и
n2 - коэффициент преломления второй среды.
Коротко, зная кривизну каждой поверхности заданной оптической системы, возможно имитировать изображение "стрельбой" большого количества лучей через систему и наблюдать распределение лучей в плоскости изображения. Для целей настоящего изобретения, где: используется анализ методом трассировки лучей, предполагается наличие вращательной симметрии отдельных поверхностей и принимается, что лучи равномерно распределены по площади входной апертуры. Математические подходы, задействованные в методологии трассировки луча, хорошо известны из оптической техники и включают в себя описание эллипсов и плоских сечений поверхностей второго порядка (Baker, 1943). Пример того, как может быть выполнена трассировка лучей, описан в прилагаемых примерах.
Следует иметь в виду, что улучшенные прогнозы послеоперационного положения ИОЛ, предлагаемые настоящим изобретением, означают, что могут быть выявлены пациенты, для которых ИОЛ с соответствующими оптическими свойствами не доступна. В данных случаях необходимо, чтобы для таких пациентов была специально разработана и изготовлена ИОЛ с оптическими свойствами, подходящими для их глаз.
Соответственно, третий объект изобретения относится к способу конструирования заменяющей хрусталик интраокулярной линзы, которая требуется, чтобы обеспечить желаемое оптическое свойство в послеоперационном глазу пациента, причем данный способ содержит следующие стадии:
(a1) прогнозирование послеоперационного положения заменяющей хрусталик интраокулярной линзы в глазу пациента с помощью способа в соответствии с первым объектом настоящего изобретения;
(b1) прогнозы оптических свойств послеоперационного глаза пациента, в котором интраокулярная линза известной оптической силы и геометрии позиционируется, как прогнозировано на стадии (a);
(c1) проектирование интраокулярной линзы, имеющей оптическую силу и геометрию, необходимые для обеспечения желаемого оптического свойства в послеоперационном глазу пациента;
(d1) необязательно, изготовление интраокулярной линзы, разработанной на стадии (c1).
Таким образом, особенно предпочтительный вариант осуществления способа по третьему объекту настоящего изобретения содержит: способ конструирования заменяющей хрусталик интраокулярной линзы, которая требуется, чтобы обеспечить желаемое оптическое свойство в послеоперационном глазу пациента, причем данный способ содержит следующие стадии:
(a1) прогнозирование послеоперационного положения заменяющей хрусталик интраокулярной линзы в глазу пациента с помощью способа, содержащего следующие стадии
(i) определение положения наличествующего хрусталика в предоперативном глазу пациента
(ii) определение толщины хрусталика в предоперативном глазу пациента; и
(iii) прогнозирование послеоперационного положения ИОЛ с использованием формулы:
IOLpredicted=ACDpre+C×LT
где:
IOLpredicted - прогнозируемое послеоперационное положение интраокулярной линзы в глазу пациента;
ACDpre - предоперационная глубина передней камеры глаза пациента;
C - численная константа, как обсуждалось выше, и
LT - толщина хрусталика в предоперационном глазу пациента;
(b1) прогноз оптических свойств послеоперационного глаза пациента, в котором интраокулярная линза известной оптической силы и геометрии позиционируется, как прогнозировано на стадии (a1);
(c1) проектирование интраокулярной линзы, имеющей оптическую силу и геометрию, необходимые для обеспечения желаемого оптического свойства в послеоперационном глазу пациента;
(d1) необязательно, изготовление интраокулярной линзы, разработанной на стадии (c1).
Предпочтительно, стадию (b1) способа по третьему объекту настоящего изобретения осуществляют, как обсуждалось выше в связи со вторым объектом настоящего изобретения.
Таким образом, предпочтительно стадия (b1) содержит создание оптической модели послеоперационного глаза пациента. Способы моделирования оптических систем известны в данной области техники и обычно включают в себя создание модели глаза пациента на основе измерений его оптических свойств и размеров (которые могут для удобства проводиться перед операцией). Как только модель для глаза пациента была создана, может быть проанализировано преломление света внутри данного глаза и сделан прогноз, касающийся оптических свойств, когда интраокулярная линза известной оптической силы и геометрии располагается внутри него. Такие моделирование и прогнозы позволяют выбрать интраокулярную линзу, которая обладает необходимой силой и геометрией, которые необходимы для обеспечения желаемого оптического свойства в послеоперационном глазу пациента.
Предпочтительно, создание оптической модели послеоперационного глаза пациента содержит измерение одного или более свойства предоперационного глаз глаза пациента, выбранного из группы, состоящей из: оптических свойств роговицы; радиуса роговицы; длины глаза; осевой длины; глубины передней камеры; толщины хрусталика.
Для удобства, стадия (b1) дополнительно содержит анализ оптических свойств оптической модели послеоперационного глаза пациента - предпочтительно, такой анализ содержит применение анализа точной трассировки лучей или анализа трассировки параксиальных лучей. Такие подходы обсуждаются выше в связи со вторым объектом настоящего изобретения.
Способы проектирования и изготовления ИОЛ хорошо известны специалистам в данной области техники и обсуждаются, например, у Born & Wolf ("Principles of Optics", 6th edition, Pergamon Press, New York, 1980) и Bennett & Rabbetts (Clinical Visual Optics, Butterworth, London).
ИОЛ изготавливаются из материалов, которые, как было доказано на протяжении многих лет, переносятся глазом, и производятся в соответствии с действующими стандартами оптического производства (в пределах определенных допусков). Имеются стандарты ANSII, относящиеся к принятым допускам на оптическую силу. В промышленности оптические свойства ИОЛ часто определяются на "оптической скамье" с целью измерения заднего фокусного расстояния и так называемой функции рассеяния точки или так называемой функции передачи модуляции (modulation transfer function (MTF)). Широко используемой программой в оптической технике является ZEMAX, которая может выполнять подробный оптический анализ любой оптической структуры (в том числе, глаза) с учетом физической информации.
Предпочтительно, разработанная на стадии (c1) и/или изготовленная на стадии (d1) ИОЛ приспособлена для имплантации в капсульный мешок глаза пациента. Признаки таких ИОЛ и способы выполнения имплантации в капсульный мешок обсуждаются выше и известны в данной области техники.
Четвертый объект данного изобретения относится к способу имплантации заменяющей хрусталик интраокулярной линзы в глазу пациента, причем данный способ содержит следующие стадии:
(a2) прогнозирование послеоперационного положения заменяющей хрусталик интраокулярной линзы в глазу пациента с помощью способа в соответствии с первым объектом настоящего изобретения;
(b2) необязательно, удаление наличествующего хрусталика из предоперационного глаза пациента;
(c2) предоставление интраокулярной линзы;
(d2) имплантация интраокулярной линзы в глаз пациента.
Таким образом, особенно предпочтительный вариант осуществления способа по четвертому объекту настоящего изобретения содержит: способ имплантации заменяющей хрусталик интраокулярной линзы в глазу пациента, причем данный способ содержит следующие стадии:
(a2) прогнозирование послеоперационного положения замены хрусталика интраокулярного в глазу пациента с помощью способа, содержащего следующие стадии:
(i) определение положения наличествующего хрусталика в предоперационном глазу пациента;
(ii) определение толщины хрусталика в предоперационном глазу пациента; и
(iii) прогнозирование послеоперационного положения ИОЛ с использованием формулы:
IOLpredicted=ACDpre+С×LT
где:
IOLpredicted - прогнозируемое послеоперационное положение интраокулярной линзы в глазу пациента;
ACDpre - предоперационная глубина передней камеры глаза пациента;
C - численная константа, как обсуждалось выше, и
LT - толщина хрусталика в предоперационном глазу пациента;
(b2) необязательно, удаление хрусталика из предоперационного глаза пациента;
(c2) предоставление интраокулярной линзы;
(d2) имплантация интраокулярной линзы в глазу пациента.
Следует иметь в виду, что в удалении хрусталика из предоперационного глаза пациента на стадии (b2) не будет необходимости, если хрусталика нет (например, вследствие повреждения или разрушения вследствие заболевания или расстройства).
В одном варианте осуществления интраокулярную линзу, предоставленную на стадии (c2) способа по четвертому объекту изобретения, выбирают с использованием способа в соответствии со вторым объектом настоящего изобретения.
В альтернативном варианте осуществления интраокулярную линзу, предоставленную на стадии (c2) способа по четвертому объекту изобретения, разрабатывают и необязательно изготавливают с использованием способа в соответствии с третьим объектом настоящего изобретения.
Предпочтительно, ИОЛ, предоставленная на стадии (c2), приспособлена для имплантации в капсульный мешок глаза пациента. Предпочтительно, стадия (d2) содержит имплантацию интраокулярной линзы в капсульный мешок глаза пациента. Способы, подходящие для имплантации интраокулярной линзы в глаз пациента, хорошо известны в данной области техники и описаны в данном документе.
Следует иметь в виду, что способы по настоящему изобретению могут быть использованы при имплантации ИОЛ в глазу пациента, который страдает от расстройства и/или заболевания глаза, и что имплантации ИОЛ приводит к лечению и/или профилактике и/или снижению такого заболевания или расстройства.
Таким образом, пятый объект настоящего изобретения относится к способу лечения и/или предотвращения и/или уменьшения заболевания или расстройства в глазу пациента, причем данный способ содержит следующие стадии:
(a3) прогнозирование послеоперационного положения заменяющей хрусталик интраокулярной линзы в глазу пациента с помощью способа в соответствии с первым объектом настоящего изобретения;
(b3) необязательно, удаление наличествующего хрусталика из предоперационного глаза пациента;
(c3) предоставление интраокулярной линзы;
(d3) имплантация интраокулярной линзы в глаз пациента.
Следует иметь в виду, что в удалении хрусталика из предоперационного глаза пациента на стадии (b3) не будет необходимости, если хрусталика нет (например, вследствие повреждения или разрушения вследствие заболевания или расстройства).
Таким образом, особенно предпочтительный вариант осуществления способа по пятому объекту настоящего изобретения содержит: способ лечения и/или предотвращения и/или уменьшения заболевания или расстройства в глазу пациента, причем данный способ содержит следующие стадии:
(a3) прогнозирование послеоперационного положения заменяющей хрусталик интраокулярной линзы в глазу пациента с помощью способа, содержащего следующие стадии
(i) определение положения наличествующего хрусталика в предоперационном глазу пациента;
(ii) определение толщины хрусталика в предоперационном глазу пациента; и
(iii) прогнозирование послеоперационного положения ИОЛ с использованием формулы:
IOLpredicted=ACDpre+C×LT
где:
IOLpredicted - прогнозируемое послеоперационное положение интраокулярной линзы в глазу пациента;
ACDpre - предоперационная глубина передней камеры глаза пациента;
C - численная константа, как обсуждалось выше, и
LT - толщина хрусталика в предоперационном глазу пациента;
(b3) необязательно, удаление хрусталика из предоперационного глаза пациента;
(c3) предоставление интраокулярной линзы;
(d3) имплантация интраокулярной линзы в глаз пациента.
Следует иметь в виду, что в удалении хрусталика из предоперационного глаза пациента на стадии (b3) не будет необходимости, если хрусталика нет (например, вследствие повреждения или разрушения вследствие заболевания или расстройства).
В одном варианте осуществления интраокулярную линзу, предоставленную на стадии (c3) способа по четвертому объекту изобретения, выбирают с использованием способа в соответствии со вторым объектом настоящего изобретения.
В альтернативном варианте осуществления интраокулярную линзу, предоставленную на стадии (c3) способа по пятому объекту изобретения, разрабатывают и необязательно изготавливают с использованием способа в соответствии с третьим объектом настоящего изобретения.
Предпочтительно, ИОЛ, предоставленная на стадии (c3), приспособлена для имплантации в капсульный мешок глаза пациента. Предпочтительно, стадия (d3) содержит имплантацию интраокулярной линзы в капсульный мешок глаза пациента. Способы, подходящие для имплантации интраокулярной линзы в глаз пациента, хорошо известны в данной области техники и описаны в данном документе.
Предпочтительно, заболевание или нарушение в глазу пациента выбрано из группы, состоящей из: миопии (т.е. близорукости), гиперопии (то есть дальнозоркости), пресбиопии, астигматизма; рефракционных ошибок; катаракты; непрозрачности; Brunescence (т.е. помутнения хрусталика). Такие заболевания и расстройства хорошо известны, и специалисты в данной области техники знают, как определить такие заболевания и расстройства.
Предпочтительно пациент в способе по первому объекту настоящего изобретения и/или по второму объекту настоящего изобретения и/или по третьему объекту настоящего изобретения и/или по четвертому объекту изобретения и/или по пятому объекту настоящего изобретения представляет собой млекопитающее, например, человека, или млекопитающее, имеющее сельскохозяйственную или коммерческую ценность, такое как млекопитающее, выбранное из группы, состоящей из: лошади, коровы, свиньи, овцы, собаки, кошки, кролика. В предпочтительном варианте осуществления пациент представляет собой человека.
Шестой объект данного изобретения относится к компьютерной программе для передаче инструкций компьютеру о выполнении способа по первому объекту настоящего изобретения и/или по второму объекту настоящего изобретения и/или по третьему объекту настоящего изобретения и/или по четвертому объекту изобретения и/или по пятому объекту настоящего изобретения.
Таким образом, настоящее изобретение направлено на решение проблем, связанных с предшествующим уровнем техники и предлагает улучшенный способ для прогнозирования послеоперационного положения интраокулярной линзы в глазу пациента. Как обсуждалось выше, настоящее изобретение является особенно предпочтительным, поскольку оно относится к способу прогнозирования, который основан на истинном, физически определенном послеоперационном положении интраокулярной линзы, а не на виртуальном послеоперационном положении.
Способы, используемые для прогнозирования положения интраокулярной линзы перед операцией и/или для расчета оптической силы интраокулярной линзы, которые использовались до появления настоящего изобретения, обсуждаются ниже:
Способы предшествующего уровня техники
Цель любой формулы расчета оптической силы интраокулярной линзы состоит в контроле оптического результата операции на хрусталике с имплантацией интраокулярной линзы.
Многие формулы были описаны для расчета оптической силы интраокулярной линзы для использования в операциях по удалению катаракты (для обзора см. Olsen 2007 и раздел "Ранние формулы" ниже). Большинство из данных формул было получено следующим образом: основываясь на модели простой "тонкой линзы" оптических свойств глаза, конечный рефракционный результат был проанализирован у большого количества пациентов, и в каждом отдельном случае получалось обратное решение для эффективной плоскости линзы (ELP).
ELP можно рассматривать как виртуальное расстояние, которое - при использовании в конкретной формуле с полученными при измерениях параметрами - даст наблюдаемый рефракционный результат. Взяв среднее число случаев, выводится среднее значение ELP (или константа A в подходе SRK), давая среднее по популяции значение для заданного типа интраокулярной линзы.
Поскольку все доступные в настоящее время формулы используют очень упрощенные модели для оптических свойств глаза, они требуют использования ряда корректирующих параметров, ретроспективно рассчитанных из полученных данных, для того, чтобы работать точно. Примеры таких "подгоночных (fudge)" параметров включают в себя "константу A" (A-constant (формула SRK), "параметр хирурга" (Surgical Factor) (Holladay) или "эффективное ELP или ACD")) (формула Hoffer или Binkhorst). "Подгоночная" процедура гарантирует, что прогнозы, сделанные с помощью конкретной формулы, оказываются, в среднем, точными. При этом, однако, нет гарантий, что прогнозы будут точны в каждом отдельном случае.
В большинстве из вышеупомянутых формул использовались только два важных входных параметра, измеренных до операции:
(1) Кератометрия (показание K) роговицы, которая является по существу измерением кривизны передней поверхности роговицы; и
(2) Длина глаза - известная как осевая длина, которая измеряется с помощью ультразвука или лазерной интерферометрии.
Исходя из данных двух переменных, формула включает в себя математическую модель для определения эффективного положения интраокулярной линзы (ELP). Точный способ, которым показание K и осевая длина преобразуются в каждом отдельном случае в значение ELP, встроен в формулу, отличаясь, однако, для разных формул.
Общепринятые формулы расчета оптической силы ИОЛ
Первая имплантация искусственного хрусталика была выполнена Гарольдом Ридли (Harold Ridley) в 1949 году. Тем не менее, лишь с 1970-х имплантация искусственного хрусталика вошла в общую клиническую практику, и с тех пор было описано несколько способов для расчета оптической силы имплантированной интраокулярной линзы.
Первые способы использовали оптические формулы, известные из оптико-физической теории "тонкой линзы". Данные способы представляли собой простые формулы, основанные на предположениях, что:
(1) роговица представляет собой "тонкую линзу", оптическая сила которой может быть измерена;
(2) интраокулярная линза представляет собой также "тонкую линзу" известной эффективной оптической силы;
(3) положение интраокулярной линзы предполагается фиксированным; и
(4) расстояние от поверхности глаза (роговицы) до задней поверхности глаза (сетчатки) представляет собой расстояние, которое может быть измерено клиническими способами.
С некоторыми вариациями формат данных ранних, основанных на модели "тонкой линзы" формул для расчета оптической силы интраокулярной линзы может быть описан как (Olsen, 2007):

где:
K - оптическая сила роговицы в диоптриях;
d - расстояние от роговицы до плоскости линзы интраокулярной линзы (иногда называемое глубиной передней камеры (Anterior Chamber Depth; "ACD"), но которое более правильно называют эффективной плоскостью линзы (effective lens plane "ELP"), поскольку "ACD", строго говоря, представляет собой расстояние до передней поверхности линзы, каковая отсутствует при использовании подходов, основанных на модели "тонкой линзы");
n1 - показатель преломления для водянистой жидкости (ACD),
Ax - осевая длина глаза (расстояние от поверхности роговицы до сетчатки);
n2 - показатель преломления среды за интраокулярной линзой (полость стекловидного тела); и
P0 - оптическая сила в диоптриях интраокулярной линзы, необходимая для получения эмметропии (остроты зрения на расстоянии) после операции.
Примеры формул "тонкой линзы" включают в себя: Colenbrander (Colenbrander, 1973), Fyodorov (Fyodorov et al., 1975); Binkhorst (Binkhorst, 1975; Binkhorst, 1979); Gernet (Gernet, 1990); Hoffer (Hoffer, 1993a; Hoffer, 2000); Holladay (Holladay et al., 1988).
Простой формат вышеуказанного уравнения "тонкой линзы" для расчета оптической силы интраокулярной линзы скрывает, однако, несколько неизвестных параметров, которые должны быть учтены с тем, чтобы формула работала в клинической практике. В частности, остается неизвестным, какой показатель преломления надо использовать, как точно рассчитать оптическую силу роговицы, точность измерений осевой длины, как преобразовать измерения расстояний в оптически значимые расстояния и как бороться с аберрациями высших порядков. Самым важным неизвестным параметром, однако, является точная величина "d" (ELP), которая не является фиксированным значением, как предполагает формула, но подвержена большим индивидуальным различиям. Следовательно, для того, чтобы формула работала во всех случаях, необходимо прогнозировать отдельные значения ELP в каждом отдельном случае.
В связи с большим числом неизвестных параметров, все имеющиеся формулы требуют использования корректирующих членов и персонализированных параметров с тем, чтобы приспособить каждую из данных формул формулу к реальной клинической жизни.
Эмпирические формулы
Вскоре после введения первых теоретических формул, клинический опыт показал, однако, что точность данных формул ниже точности так называемых "эмпирических формул". Последние формулы использовали статистический (линейная множественная регрессия) подход для описания линейной зависимости между клиническими измерениями и оптической силой интраокулярной линзы, необходимой для эмметропии (термин, используемый для характеристики глаза, который не нуждается в очках для зрения вдаль).
Наиболее важным примером способов регрессии являются так называемые формулы SRK (Sanders - Retzlaff-Kraff) (Retzlaff, 1980; Sanders et al., 1981; Sanders et al., 1988; Retzlaff et al., 1990; Sanders et al., 1990), которые были основаны на статистическом анализе большого количества случаев с предоперационными измерениями оптической силы роговицы ("показание K"), осевой длины глаза, определенной ультразвуком ("A-сканирование"), фактической силы имплантата и наблюдаемой рефракции (очковой коррекции).
Оригинальная формула SRK I представляла собой следующее простое линейное уравнение регрессии (Retzlaff, 1980):
P0=A-0.9K-2.5Ax
где:
P0 - оптическая сила имплантата для достижения остроты зрения на расстоянии ("эмметропия");
K - показание кератометра в диоптриях (с использованием показателя преломления, равного 1,3375);
Ax - осевая длина глаза, измеренная с помощью ультразвука; и
A - “константа A”, зависящая от типа интраокулярной линзы и способа проведения операции.
Идея "константы A" заключалась в том, что данная константа действовала как константа типа "черный ящик", способная "поглощать" любые ошибки смещения в системе, включая различия в типе интраокулярной линзы, хирургических и измерительных способах, а также размещения в глазу. Для преодоления систематических ошибок смещения было рекомендовано "персонализировать" "константу A" в соответствии с собственной техникой хирурга.
Успех исходной формулы SRK I и более поздних версий (SRK II, SRK/T) был связан с тем, что она базировалась на эмпирических данных и, следовательно, могла, в среднем, срабатывать без систематических ошибок. Однако, поскольку данная формула была основана на статистическом анализе, было показано, что точность прогноза оказывалась ниже в случаях необычных глаз, таких как длинные и короткие глаза, глаза с крутой или плоской роговицей, а также глаза с аметропией (Olsen, 1987с; Olsen, 1987b; Olsen et al., 1990b;. Olsen et al., 1991). Более того, поскольку она зависела только от эмпирических данных, включая способ измерения, было нелегко применять ее в различных клинических условиях с различиями (и возможными усовершенствованиями) в способе проведения операции или способе измерений, в первую очередь, измерения осевой длины.
Дополнительно, как видно из математических подходов, задействованных в различных формулах "тонкой линзы" для расчета оптической силы интраокулярной линзы, оценка ELP, основанная только на показании K и осевой длине, встроена в формулу и не всегда видима для пользователя.
Ранние теоретические формулы
Во время появления ранних теоретических формул было известно очень немного о фактическом положении имплантата после операции.
Например, в формуле Binkhorst I (Binkhorst, 1979) использовалось фиксированное значение ELP для прогноза эффективного положения имплантата в каждом случае. В настоящее время накапливаются доказательства в пользу того, что ELP (или ACD) не является фиксированной величиной, но зависит от размеров глаз. Среди прочих параметров учитываются предоперационная длина глаза (x), предоперационная глубина передней камеры (ACDpre), толщина хрусталика и радиус роговицы.
На фигуре 5 показаны связанные со зрением компоненты глаза до операции ("факичный глаз" - в верхней части) и после операции ("псевдофакичный глаз" - в нижней части) с важными переменными, используемыми в прогнозировании положения имплантата. "Ax" - осевая длина, "ACDpre" - предоперационное значение ACD, "LT" - толщина хрусталика, "CR" - передний радиус роговицы, "H" - высота роговицы, "ACDpost" - послеоперационная глубина передней камеры.
Сферическая аберрация и коррекция Stiles-Crawford
В предшествующем разделе оптическая система глаза была описана как система комбинированных линз в предположении, что все лучи имеют одинаковую значимость для изображения, попадаемого на сетчатку. Однако, это не обязательно так. В связи с существованием так называемого эффекта Stiles-Crawford (Stiles & Crawford, 1933), чувствительность сетчатки зависит от угла, под которым лучи попадают на сетчатку. Эффект Stiles-Crawford прогнозирует, что чувствительность сетчатки является максимальной для лучей, попадающих в центр зрачка, и является менее эффективной для лучей, попадающих в края зрачка. Данные эффекты описываются следующей математической формулой:
I=I0exp(-0.108*γ2)
где:
γ - расстояние от центра зрачка в мм.
Фигура 6 иллюстрирует эффект Stiles-Crawford, показывая чувствительность сетчатки в виде функции от расстояния от центральной оси (оси x на данной фигуре, но оси y на схеме трассировки лучей).
Влияние эффекта Stiles-Crawford на воспринимаемое изображение заключается в том, что он стремится корректировать сферическую аберрацию, когда зрачок становится большим (Olsen, 1993). Сферическая аберрация представляет собой явление, свойственное многим линзам, включая роговицу и не асферические ИОЛ, когда проходящие через периферийную часть линзы лучи преломляются больше и фокусируются на более коротком фокусном расстоянии, чем лучи, проходящие через центральную часть линзы. Сферическая аберрация человеческого глаза является реальностью, и ею обусловлена "ночная миопия", которую многие люди испытывают в мезопических (при недостаточном освещении) условиях, когда зрачок становится большим.
Сферическая аберрация не учитывается, когда оптические системы описываются в соответствии с теорией "тонкой линзы" или "толстой линзы", но ее легко продемонстрировать, используя трассировку лучей. Еще одно преимущество способа трассировки лучей заключается в том, что эффект Stiles-Crawford может учитываться за счет присвоения каждому лучу весового значения в соответствии с функцией Stiles-Crawford.
Недавние разработки
Одним из наиболее важных компонентов любой оптической формулы, связанной с имплантатами интраокулярной линзы, является индивидуальный прогноз положения имплантата после операции.
За исключением формулы Olsen (Olsen, 1987a; Olsen, 1987с; Olsen et al., 1990b;. Olsen et al., 1991;. Olsen and Corydon, 1993; Olsen and Gimbel, 1993; Olsen, 2004), все современные способы разработки формул для расчета оптической силы интраокулярной линзы используют виртуальные модели для положения интраокулярной линзы после операции, в которых положение интраокулярной линзы описывается не как физическое, измеряемое расстояние, а скорее как "эффективное положение линзы" (ELP), определяемое как расстояние от поверхности роговицы до эффективной плоскости линзы интраокулярной линзы, в предположении, что расчеты основаны на теории "тонкой линзы".
На протяжении многих лет формула Olsen была единственной формулой, использующей подход "толстой линзы", который означает, что роговицу и интраокулярную линзу рассматривали как "толстую линзу" конечной толщины с точной коррекцией главных плоскостей. Идея расчета "толстой линзы", которая была впервые выдвинута Olsen (Olsen, 1987a), заключалась в том, что положение интраокулярной линзы было определено как физическое измеряемое расстояние, которое в конечном счете могло быть проверено клиническими способами. Множество улучшений в формуле расчета оптической силы интраокулярной линзы имеет дело с улучшенными алгоритмами для прогнозирования послеоперационной глубины передней камеры (называемой "ACDpost") (Olsen, 1986b; Holladay et al., 1988; Olsen et al., 1990a; Olsen et al., 1992; Hoffer, 1993b; Olsen et al., 1995; Haigis, 2004; Olsen, 2006).
Однако, хотя модель "толстой линзы" превосходит модель "тонкой линзы" в отношении более реалистичного представления положения интраокулярной линзы в глазу, в модели "толстой линзы" все еще предполагается, что поверхности оптической системы являются сферическими. Поскольку ни роговица, ни интраокулярная линза не являются обязательно сферическими, более совершенная модель могла бы базироваться на трассировке реальных лучей с тем, чтобы работать для любого типа поверхности.
Упоминание или обсуждение в данной спецификации очевидно уже опубликованного документа не обязательно должно рассматриваться как подтверждение того, что данный документ является частью уровня техники или общеизвестных знаний.
Теперь будут описаны предпочтительные, не ограничивающие примеры, которые воплощают некоторые объекты настоящего изобретения, со ссылкой на следующие фигуры:
Фигура 1 - схема человеческого глаза, на которой обозначены различные анатомические части и структуры.
Фигура 2 - модель глаза, показывающая преломление света и формирование изображения. Преломление света в глазу происходит в роговице (1) и хрусталике (2) с тем, чтобы сфокусировать свет на сетчатке (3) в задней части глаза. Если между любым из окулярных компонентов имеется несоответствие, то необходима очковая коррекция глаза, чтобы видеть четко.
Фигура 3 - пример оптического сканирования нормального, факичного глаза, выполняемого биометром Lenstar компании Haag-Streit. Положение нормального хрусталика обозначено знаком "указывающие руки".
Фигура 4 - пример послеоперационного сканирования того же самого глаза, который показан на фигуре 3, через одну неделю после операции с установленной ИОЛ. Положение ИОЛ обозначено знаком "указывающие руки".
Фигура 5 - иллюстрация окулярных компонентов глаза до и после операции.
Фигура 6 - иллюстрация эффекта Stiles-Crawford.
Фигура 7 - пример трассировки реальных лучей в «схематическом глазе» по Gullstrand.
Фигура 8 - распределение пересечений лучей с осью x (число лучей равно 1000) для глаза по Gullstrand, в предположении, что диаметр зрачка составляет 3 мм. Следует отметить, что все лучи фокусируются за сетчаткой на расстоянии, равном 24,0 мм. Поэтому глаз является незначительно дальнозорким (гиперметропичным).
На фигуре 9 представлена функция рассеяния точки для глаза по Gullstrand на сетчатке (темные столбцы) и при наилучшем фокусном расстоянии, равном 0,194 мм, за сетчаткой (светлые столбцы).
Фигура 10 иллюстрирует влияние размера зрачка на показатель преломления, прогнозируемый для нормального глаза среднего размера с имплантатом сферической интраокулярной линзы.
На фигуре 11 представлен график, на котором измеренное положение интраокулярной линзы (квадраты) относительно положения передней (треугольники) и задней капсулы (ромбы) отложено против осевой длины (ось x).
На фигуре 12 представлен график, на котором положение интраокулярной линзы, выраженное как процентная доля от толщины хрусталика, отложено против осевой длины.
На фигуре 13 представлен график, на котором положение интраокулярной линзы, выраженное как процентная доля от толщины хрусталика, отложено против оптической силы роговицы, измеренной кератометрией.
На фигуре 14 представлен график, на котором наблюдаемое преломление отложено против ожидаемого (прогнозируемого) преломления для двух способов с использованием значений "ACD измеренное" и "ACD прогнозируемое" для положения имплантата интраокулярной линзы.
На фигуре 15 представлена средняя абсолютная ошибка расчета ожидаемого преломления для трех способов расчета оптической силы интраокулярной линзы.
На фигуре 16 представлен график, на котором величина ошибки прогноза (наблюдаемое преломление минус ожидаемое преломление) в соответствии с формулой SRK/T отложена против размера переднего сегмента (глубина передней камеры плюс толщина хрусталика равно положению задней поверхности хрусталика). Наблюдалось значительное отклонение (r=0,32, p<0,0001).
На фигуре 17 представлен график, на котором величина ошибки прогноза (наблюдаемое преломление минус ожидаемое преломление) в соответствии с формулой по настоящему изобретению отложена против размера переднего сегмента (глубина передней камеры плюс толщина хрусталика равно положению задней поверхности хрусталика). Наблюдаемая корреляция не является значимой, что указывает на отсутствие систематической ошибки (r=0,001, p>0,5).
На фигуре 18 представлена средняя ошибка прогноза (наблюдаемое преломление минус ожидаемое преломление), подразделенная на показатели для группы женщин (n равно 274) и группы мужчин (n равно 181) в соответствии с формулой SRK/T и формулой по настоящему изобретению, соответственно. Среднюю ошибку прогноза поддерживалась равной нулю для всей группы (n равно 455), включая женщин и мужчин, постоянной оптимизацией ИОЛ. Значительное смещение, связанное с полом, видно для способа SRK/T, но не для способа по настоящему изобретению (p<0,05). Столбики указывают на стандартную ошибку (SE).
На фигуре 19 представлено сравнение константы C с константой A.
Примеры
Пример 1. Анализ методом трассировки лучей глаза по Gullstrand
Модель реального «схематического глаза» по Gullstrand (Gullstrand, 1909, Gullstrand, 1924) была использована в качестве примера анализа методом трассировки лучей. В течение многих лет модель реального «схематического глаза» по Gullstrand использовалась для моделирования оптических свойств человеческого глаза. Помимо плоскости объекта и плоскости изображения структура «схематического глаза» представляет собой модель из шести поверхностей, как показано в таблице 1.


Для глаза по Gullstrand предполагается, что осевая длина глаза равна 24,00 мм, что соответствует расположению сетчатки, где: воспринимается изображение. Пример трассировки лучей для такого глаза, структура которого приведена в таблице 1, представлен на фигуре 7 для ширины входного пучка, равной 3 мм, с ограниченным числом входящих параллельных лучей. Предполагается, что лучи имеют происхождение в бесконечности и преломляются на каждой поверхности в соответствии с законом преломления Снеллиуса до тех пор, пока они не попадают на заднюю поверхность глаза (сетчатку).
При использовании достаточного количества лучей (более 1000 или больше) может быть изучено распределение пересечений лучей с осью x, чтобы оценить эффективный фокус вдоль зрительной оси. Аналогично может быть изучено распределение пересечений лучей с сетчаткой (которую можно рассматривать как незначительно изогнутую ось y). Такое распределение известно в оптике как функция рассеяния точки (point-spread function "PSF"), которая является мерой качества изображения. Вычисление среднеквадратического (root-mean-square, "RMS") расстояний от осевого фокуса в качестве меры рассеяния является обычной практикой.
На фигуре 8 приведено распределение пересечений лучей с осью x (число лучей равно 1000) для глаза по Gullstrand, в предположении, что диаметр зрачка равен 3 мм. Следует отметить, что все лучи фокусируются за сетчаткой на расстоянии, равном 24,0 мм. Поэтому глаз является незначительно дальнозорким (гиперметропичным).
Анализ функции рассеяния точки в направлении у был выполнен в двух плоскостях: 1) на сетчатке и 2) в точке наилучшего фокуса, которая, как было установлено компьютерной итерацией, находится на расстоянии, составляющем около 0,194 мм, за сетчаткой. Фигура 9 иллюстрирует функцию рассеяния точки для глаза по Gullstrand на сетчатке (темные столбцы) и в точке наилучшего фокуса, находящейся на расстоянии 0,194 мм за сетчаткой (светлые столбцы). Было обнаружено, что соответствующие RMS составляют 0,256 и 0,109 на сетчатке и в точке наилучшего фокуса, соответственно.
В заключение, данный эксперимент показал, что качество изображения, дающее наименьшее размытие, будет повышено, если осевая длина глаза будет составлять на 0,194 мм больше, или, наоборот, если небольшая очковая коррекция с оптической силой, составляющей около +0,5 диоптрий (эквивалентное значение сдвига осевой длины) будет помещена перед глазом.
Пример 2. Анализ способом трассировки лучей глаза с имплантатом ИОЛ
Следующий пример трассировки лучей показывает глаз среднего размера, со сферической ИОЛ, имплантированной для восстановления хорошей остроты зрения при незначительном размере зрачка. Эффективное преломление рассчитывают относительно диаметра зрачка и без поправки на эффект Stiles-Crawford.
Фигура 10 иллюстрирует влияние размера зрачка на преломление, прогнозируемое для нормального глаза среднего размера с имплантатом сферической ИОЛ. Как только зрачок расширяется, глаз становится близоруким в результате сферической аберрации. Данный эффект компенсируется эффектом Stiles-Crawford ("SC").
На основании фигуры 10 можно сделать два наблюдения:
(1) эффективное преломление зависит от размера зрачка даже в пределах нормы (составляющего менее чем от 3 до 4 мм); и
(2) Эффект Stiles-Crawford компенсирует сферическую аберрацию при больших размерах зрачка.
Данные ИОЛ
Предполагаемые физические характеристики ИОЛ (толщина, показатель преломления, кривизна передней и задней поверхности) были получены из "схемы разреза" (cutting chart), предоставленной Alcon). Пример "схемы разреза" приведен в таблице 2.

По определению ANSI, оптическая сила ИОЛ может быть рассчитана как параксиальная оптическая сила "толстой линзы"
D12=D1-(T/n)D1D2
где:
D12 - общая оптическая сила линзы;
D1 - оптическая сила передней поверхности;
D2 - оптическая сила задней поверхности;
T - толщина линзы (в метрах); и
n - показатель преломления.
D1 и D2 можно выразить как:
D1=(n-1.336)/r1
и
D2=(1.336-n)/r2
где:
r1 - радиус кривизны передней поверхности (м);
r2 - радиус кривизны задней поверхности (с соответствующим знаком); и
n - показатель преломления линзы.
Таким образом можно определить точные значения кривизны ИОЛ, зная оптическую силу в соответствии со схемой в таблице 2.
Пример 3. Клинические данные: определение константы, С
Краткое изложение
Как обсуждалось в прилагаемом описании, настоящее изобретение основано на открытии авторов, которое заключается в том, что послеоперационное положение интраокулярной линзы связано с некоторыми определенными анатомическими и физическими характеристиками предоперационного глаза - в частности, с положением и толщиной нормального, биологического хрусталика в предоперационном глазу пациента. Таким образом, в свете открытия авторов, измерение некоторых физических параметров в предоперационном глазу пациента (в частности, положение хрусталика и толщины) может быть использовано для прогнозирования конкретного послеоперационного положения, которое имплантированная интраокулярная линза будет занимать в глазу данного пациента.
Данное открытие возникло из исследований, обсуждаемых ниже. В немногих словах, данные исследования включали в себя следующие стадии:
(1) статистический анализ результатов операции у большого количества пациентов, перенесших операцию по замене хрусталика;
(2) измерение следующих предоперационных параметров глаза пациента: радиус роговицы, осевая длина, предоперационная глубина передней камеры и толщина хрусталика;
(3) измерение следующих послеоперационных параметров глаза: окончательная рефракция (очковая коррекция) и положение ИОЛ;
(4) демонстрирование того, что измеренное положение ИОЛ может быть использовано в оптической модели артифакичного (ИОЛ) глаза;
(5) генерирование удивительно простой формулы прогнозирования послеоперационного положения ИОЛ на основе постоянной доли от толщины биологического хрусталика, зависящей от модели ИОЛ и способа проведения операции.
Материалы и способы
В настоящее исследование было включено, в общей сложности, 590 случаев (250 мужчин и 340 женщин в возрасте от 20 до 94 лет, в среднем 70,1 лет). Они охватывали последовательную серию больных, направленных на операцию по удалению катаракты или операцию по замене хрусталика в University Eye Clinic, Aarhus Hospital с неосложненной имплантацией ИОЛ аналогичной конструкции (Alcon Acrysof SA60AT) в капсульный мешок.
Перед операцией передний радиус роговицы измеряли по двум меридианам автоматическим кераторефрактометром (ARK700; Nidek, Hiroishi, Япония) и усредняли два показания, что является общепринятой процедурой при работе со сферическими эквивалентами. Осевую длину измеряли с помощью оптической интерферометрии (Zeiss IOLMaster (Zeiss Meditec, Jena, Германия). Глубину передней камеры (называемую "ACDpre") и толщину хрусталика (называемую "LT") предоперационного глаза пациентов измеряли с помощью оптической интерферометрии (Haag-Streit LS900 Lenstar).
Критериями исключения были глаза с осложнениями во время операции, с имплантацией ИОЛ за пределами капсульного мешка, с дислоцированной линзой, с предыдущей операцией на переднем (т.е. LASIK), или заднем сегменте, с отрицательной оптической силой ИОЛ и с предоперационном или послеоперационном астигматизмом, составлявшим более 4 дптр. В настоящее исследование были включены только случаи с наилучшей исправленной послеоперационной четкостью зрения, составляющей 20/50 или более, для того, чтобы иметь надежную оценку окончательной очковой коррекции (рефракции).
Послеоперационный период наблюдения было установлен в диапазоне от 1 недели до 3 месяцев. В это время регистрировали остроту зрения и рефракцию. Послеоперационную глубину передней камеры (называемую "ACDpost") измеряли с помощью оптической интерферометрии (Haag-Streit LS900 Lenstar).
Краткое изложение клинических данных приведено в таблице 3.

Результаты
Измерение послеоперационной глубины передней камеры
Среднее положение (центр) ИОЛ после операции составило 4,90 мм +0,35 (+SD) (диапазон от 3,30 до 5,78 мм). Оно было определено как измеренная глубина передней камеры плюс половина от известной толщины ИОЛ. Из графика, на котором величина, соответствующая центральной точке среднего положения ИОЛ, отложена против осевой длины и предоперационного положения биологического хрусталика, видно, что величина, соответствующая положению ИОЛ, составляет постоянную долю толщины хрусталика ("размер мешка" (bag size)) (фигура 11).
Выраженное в виде доли толщины хрусталика, положение ИОЛ показало небольшую положительную корреляцию с осевой длиной, которая была едва значимой (r=0,13, p<0,01, фигура 12).
Как показано на фигуре 13, положение ИОЛ показало незначительную корреляцию с кератометрией (r=0,04, p>0,2).
Наличие очень слабой или незначительной корреляции с осевой длиной и кератометрией является важным наблюдением, так как это означает, что прогноз положения ИОЛ может быть сделано независимо как от показания K, так и от осевой длины, вопреки тому, что предполагается во всех существующих формулах на сегодняшний день.
Формула для прогноза положения ИОЛ
На основе наблюдения, что величина, соответствующая положению ИОЛ, составляет постоянную долю толщины хрусталика, может быть выведена следующая формула для прогноза положения ИОЛ в каждом отдельном случае:
IOLpredicted=ACDpre+C*LT
где:
IOLpredicted - прогнозируемое послеоперационное (центральное) положение ИОЛ;
ACDpre - предоперационная глубина передней камеры глаза;
LT - толщина хрусталика;
C - численная константа, связанная с типом ИОЛ (равную 38,7% в текущем наборе данных).
Результаты расчета оптической силы ИОЛ
Для проверки гипотезы о том, что данный способ может использоваться при расчете оптической силы ИОЛ в каждом отдельном случае, было проведено несколько экспериментов:
Эксперимент 1. Используя наблюдаемое (измеренное) значение ACD, ожидаемая послеоперационная рефракция была рассчитана с использованием формулы трассировки лучей, как описано в предыдущих разделах. Данный эксперимент следует рассматривать как эксперимент, который показывает предельную точность в результате применения идеального способа, не дающего никакой погрешности в прогнозе положения ИОЛ.
Эксперимент 2. Используя новую формулу ACD (т.е. IOLpredicted=ACDpre+C*LT), ожидаемая послеоперационная рефракция была рассчитана с использованием формулы трассировки лучей, как описано в предыдущих разделах.
Эксперимент 3. В качестве эталона сравнения, оптическая сила ИОЛ была рассчитана с использованием известного способа SRK/T, который является одним из самых известных способов расчета оптической силы ИОЛ, используемых на сегодняшний день.
Во всех данных опытах прогнозы были проанализированы на среднюю вычислительную погрешность, стандартное отклонение и диапазон погрешности. В случае формулы SRK/T прогнозы были оптимизированы в соответствии с рекомендациями авторов, так что используемая константа А была точной в среднем случае. Как и в случае оценки точности формулы при расчете оптической силы ИОЛ в клинических условиях, все способы были оптимизированы для небольших погрешностей смещения, сводя среднюю вычислительную погрешность к нулю. При этом можно оценить эффективность формулы сравнением стандартного отклонения погрешности, или, альтернативно, - как это обычно имеет место в области исследований расчета оптической силы ИОЛ - сравнением абсолютной погрешности для каждого способа.
В таблице 4 представлены результаты трех экспериментов. Как можно заметить, самая низкая погрешность (самое низкое стандартное отклонение, самая низкая средняя абсолютная погрешность, наименьший диапазон погрешностей и самый высокий процент случаев в пределах ±1,0 дптр.) была найдена у способа, использующего наблюдаемое (измеренное) значение ACD после операции.

Сравнение экспериментов 1 и 2
Данные два эксперимента хорошо согласовывались друг с другом, что можно увидеть на фигуре 14, на которой графически представлена наблюдаемая рефракция, величины которой отложены против ожидаемой (прогнозируемой) рефракции для данных двух способов. Коэффициенты корреляции составляли 0,88 и 0,82 для опыта 1 и 2, соответственно (p<0,001).
Общая погрешность 3-х экспериментов
На фигуре 15 представлено графическое сравнение средней абсолютной погрешности 3-х способов. Имелось статистически значимое различие в точности между всеми 3-я способами (p<0,05)
Дополнительные результаты, показывающие улучшение по сравнению с существующими способами
Систематическая ошибка, связанная с размером переднего сегмента
Как описано в предыдущих разделах, одним из преимуществ настоящего изобретения является то, что оно использует предоперационную глубину передней камеры и толщину хрусталика как параметры для прогноза положения ИОЛ. В этом состоит отличие настоящего изобретения от других формул расчета оптической силы ИОЛ, которые используют показание К и осевую длину для всех расчетов, включая как оптические вычисления, так и прогноз положения ИОЛ.
Тот факт, что положение ИОЛ зависит от предоперационной глубины передней камеры и толщины хрусталика, как показано в настоящем изобретении, позволяет предположить, что другие формулы расчета оптической силы ИОЛ, такие как наиболее популярная формула SRK/T, могут давать систематическую ошибку, связанную с не учетом размера переднего сегмента (размер переднего сегмента равен глубине передней камеры плюс толщина хрусталика).
Как показано на фигуре 16, подобная систематическая ошибка имела место в серии из 455 случаев, когда погрешность прогнозирования формулы SRK/T графически откладывали относительно предоперационного размера переднего сегмента (r равно 0,32, p<0,001). Подобная систематическая ошибка, которая является нежелательной, не наблюдалась при использовании настоящего подхода (фигура 17).
Систематическая ошибка, связанная с полом
Еще одно усовершенствование касается систематической ошибки, связанной с полом. Из популяционных исследований хорошо известно, что глаза женщин и мужчин незначительно отличаются во многих отношениях. Примерами служат радиус роговицы, глубина передней камеры и осевая длина, которые меньше у женщин, чем у мужчин. Кроме того, незначительно отличается среднее положение ИОЛ, что может быть продемонстрировано в достаточно большой выборке (неопубликованные данные автора). Это может создавать проблемы при использовании одних и тех же констант ИОЛ как для женщин, так и для мужчин.
Однако, благодаря концепции константы "C" по настоящему изобретению, которая прогнозирует положение ИОЛ по отношению к отдельным анатомическим особенностям хрусталика, можно предположить, что данный способ не столь подвержен систематическим ошибкам, связанным с полом, как способ с использованием константы A способа SRK, который основан на средней оптической силе ИОЛ, действительной для случая смешанной группы, включающей как женщин, так и мужчин.
Как показано на фигуре 18, было установлено, что это действительно так, когда вся серия испытуемых была разделена по половому признаку. Вся серия участников включала 455 человек (274 женщин и 181 мужчин), причем прогнозирования относительно рефракции были скорректированы для среднего значения погрешности смещения оптимизацией константы ИОЛ для группы в целом. В случае формулы SRK/T средняя погрешность прогноза оказалась равной -0,10 дптр. и +0,15 дптр., для женщин и мужчин, соответственно, что значительно отличается от нуля (p<0,05). Для настоящего способа было обнаружено, что средняя погрешность прогноза составляет -0,04 дптр. и +0,05 дптр. для женщин и мужчин, соответственно, что существенно не отличалось от нуля (p>0,05). Следовательно, настоящий способ не дает систематической ошибки, связанной с полом.
Выводы
1. Настоящее изобретение прогнозирует положение ИОЛ, имплантированной в капсульный мешок, в соответствии с точными измерениями положения и толщины естественного хрусталика.
2. Формула прогнозирует, что положение центра ИОЛ соответствует величине, составляющей постоянную долю "C" толщины хрусталика ("размер мешка"), в зависимости от типа ИОЛ и способа проведения операции. Как только среднее положение ИОЛ было определено в достаточном количестве случаев, величина "C" может быть рассчитана для конкретной ИОЛ.
3. Прогноз положения ИОЛ делается независимо от измерений оптической силы роговицы ("показание K") и осевой длины, которые традиционно используются в других формулах.
4. В оптической модели глаза, используемой в настоящем подходе, может использоваться информация из измерений положения ИОЛ (а также прогнозируемые значения) с тем, чтобы делать точные прогнозы.
5. Полученная точность расчета оптической силы ИОЛ выше, чем у существующих способов, таких как формула SRK/T, и прогнозы не характеризуются систематическими ошибками, связанными с осевой длиной, передним размером сегмента и полом.
6. Поскольку настоящий способ специфически относится к анатомии хрусталика, который должен быть оперирован, данный способ должен работать для любого типа глаза, включая глаза, которые претерпели изменения в анатомии роговицы, подобно изменениям после рефракционной операции (LASIK, LASEK, PRK, RK и т.д.) у пациентов, перенесших операцию на роговице, вызванную рефракционными ошибками.
Пример 4. Изменения константы C
Положение ИОЛ внутри послеоперационного глаза (и, следовательно, численная константа, C) может зависеть от геометрии ИОЛ, которая имплантируется, особенно потому, что диаметр, форма и механические свойства гаптических элементов могут влиять на то, как ИОЛ будет сдвинута вперед или назад в результате постепенного сокращения капсулы после операции.
Однако, как обсуждается ниже, изменение величины C, полученное при использовании двух различных типов ИОЛ, является, на удивление, небольшим.
В таблице 5 приведены данные, полученные для двух различных ИОЛ, которые имеют различные геометрию и конструкцию. Как можно заметить, значение константы C отличается лишь на 0,06 между двумя ИОЛ, что соответствует только 0,29 мм, исходя из усредненных данных.
Таблица 5

Пример 5. Сравнение константы C с константой A
Способ по настоящему изобретению выполняется с использованием численной константы, C, которая определяет связь между послеоперационным положением ИОЛ в глазу двух или более прооперированных на глазу индивидуумов, по отношению к толщине хрусталика в предоперационном глазу двух или более прооперированных на глазу индивидуумов.
Константа C может быть определена с использованием данных, полученных от относительно небольшого числа прооперированных на глазу пациентов, что делает настоящий способ выгодным по сравнению с предыдущими способами (например, с использованием константы A), которые требуют данных из больших массивов данных.
Минимальное число прооперированных на глазу пациентов, требуемое для выполнения настоящего способа, может быть выведено из статистического анализа данных, которые были уже получены с использованием настоящего изобретения. Например, типичный результат представляет собой среднее значение C, равное 39%, при стандартном отклонении, составляющем только 4%. Небольшое стандартное отклонение означает, что требуется очень мало случаев для получения статистически значимой оценки константы, C.
В этом состоит отличие от (всех) других формул, использующих " подгоночные (fudged)" константы (т.е. константу A), полученные из наблюдаемой окончательной очковой коррекции.
Фигура 16 - численный пример, иллюстрирующий преимущество константы C по сравнению с константой A при анализе агрегированных данных. Фигура 16 была построена для случайной выборки клинических данных вычислением наблюдаемого среднего значения новой константы C по сравнению со старой константой A и преобразованием отклонения от окончательного среднего значения в погрешность в очковой коррекции (Rx). Как можно видеть, значение константы C быстро достигает достаточной точности в пределах 0,1 дптр., тогда как в случае константы A требуется по меньшей мере 25 случаев для достижения того же результата.
Фигура 19 - численный пример, иллюстрирующий преимущество константы C по сравнению с константой A при анализе агрегированных данных. Фигура 16 была построена из случайной выборки клинических данных путем вычисления наблюдаемого среднего значения новой константы C по сравнению со старой константой A, и преобразованием отклонения от окончательного среднего значения в погрешность в очковой коррекции (Rx). Как можно видеть, значение константы C быстро достигает достаточной точности (в пределах 0,1 дптр.) внутри выборки из первых 25 случаев, тогда как в случае константы A требуется по меньшей мере от 50 до 100 случаев для стабилизации кривой.
Ссылки
Baker T Y. Ray-tracing trough non-spherical surfaces. Proc Physical Soc (UK) 1943; (24): 361-364.
Binkhorst R D. The optical design of intraocular lens implants. Ophthalmic Surg 1975; (6): 17-31.
Binkhorst R D. Intraocular lens power calculation. Int Ophthalmol Clin 1979; (19): 237-252.
Colenbrander M С. Calculation of the power of an iris clip lens for distant vision. Br J Ophthalmol 1973; (57): 735-740.
Connors R, III, Boseman P, III, Olson R J. Accuracy and reproducibility of biometry using partial coherence interferometry. J Cataract Refract Surg 2002; (28): 235-238.
Drexler W, Findl O, Menapace R, Rainer G, Vass C, Hitzenberger С K, Fercher A F. Partial coherence interferometry: a novel approach to biometry in cataract surgery. Am J Ophthalmol 1998; (126): 524-534.
Dubbelman M, Sicam V A, van der Heijde G L. The shape of the anterior and posterior surface of the aging human cornea. Vision Res 2006; (46): 993-1001.
Dubbelman M, Weeber H A, van der Heijde R G, Volker-Dieben H J. Radius and asphericity of the posterior corneal surface determined by corrected Scheimpflug photography. Acta Ophthalmol Scand 2002; (80): 379-383.
Dunne M С, Royston J M, Barnes D A. Normal variations of the posterior corneal surface. Acta Ophthalmol (Copenh) 1992; (70): 255-261.
Findl O, Kriechbaum K, Sacu S, Kiss B, Polak K, Nepp J, Schild G, Rainer G, Maca S, Petternel V, Lackner B, Drexler W. Influence of operator experience on the performance of ultrasound biometry compared to optical biometry before cataract surgery. J Cataract Refract Surg 2003; (29): 1950-1955.
Fyodorov S N, Galin M A, Linksz A. Calculation of the optical power of intraocular lenses. Invest Ophthalmol 1975; (14): 625-628.
Gernet H. [Intraocular lens planning. Geometric-optical and Sanders-Retzlaff-Kraff I and II formulas]. Ophtalmologie 1990; (4): 96-101.
Gullstrand A. Die Dioptrik des Auges. In: Handbuch der physiologischen Optik. (Ed. Helmholz H). Hamburg: L Voss, 1909; 3: 41-375.
Gullstrand A. The dioptrics of the eye. In: Helmholtz′s Treatise on Physiological Optics. (Ed. Southall JPC). Optical Society of America, 1924; 351-352.
Haigis W. Pseudophakic correction factors for optical biometry. Graefes Arch Clin Exp Ophthalmol 2001; (239): 589-598.
Haigis W. The Haigis formula. In: Intraocular lens power calculations. (Ed. Shammas HJ). Slack Inc, 2004; 5-57.
Haigis W, Lege B, Miller N, Schneider B. Comparison of immersion ultrasound biometry and partial coherence interferometry for intraocular lens calculation according to Haigis. Graefes Arch Clin Exp Ophthalmol 2000; (238): 765-773.
Hoffer K J. The Hoffer Q formula: a comparison of theoretic and regression formulas. J Cataract Refract Surg 1993b; (19): 700-712.
Hoffer K J. The Hoffer Q formula: a comparison of theoretic and regression formulas. J Cataract Refract Surg 1993a; (19): 700-712.
Hoffer K J. Clinical results using the Holladay 2 intraocular lens power formula. J Cataract Refract Surg 2000; (26): 1233-1237.
Holladay J Т, Prager Т С, Chandler Т Y, Musgrove K H, Lewis J W, Ruiz R S. A three-part system for refining intraocular lens power calculations. J Cataract Refract Surg 1988; (14): 17-24.
Jansson F, Kock E. Determination of the velocity of ultrasound in the human lens and vitreous. Acta Ophthalmol (Copenh) 1962; (40): 420-433.
Kiss B, Findl O, Menapace R, Wirtitsch M, Petternel V, Drexler W, Rainer G, Georgopoulos M, Hitzenberger C K, Fercher A F. Refractive outcome of cataract surgery using partial coherence interferometry and ultrasound biometry: clinical feasibility study of a commercial prototype II. J Cataract Refract Surg 2002; (28): 230-234.
Olsen Т. On the calculation of power from curvature of the cornea. Br J Ophthalmol 1986a;(70): 152-154.
Olsen T. Prediction of intraocular lens position after cataract extraction. J Cataract Refract Surg 1986b; (12): 376-379.
Olsen T. Theoretical approach to intraocular lens calculation using Gaussian optics. J Cataract Refract Surg 1987a; (13): 141-145.
Olsen T. Theoretical vs empirical prediction of aphakic refraction. Arch Ophthalmol 1987b;(105): 1042-1045.
Olsen T. Theoretical, computer-assisted prediction versus SRK prediction of postoperative refraction after intraocular lens implantation. J Cataract Refract Surg 1987с; (13): 146-150.
Olsen T. On the Stiles-Crawford effect and ocular imagery. Acta Ophthalmol (Copenh) 1993; (71): 85-88.
Olsen T. The Olsen formula. In: Intraocular lens calculations. (Ed. Shammas HJ). Thorofare, NJ: Slack Inc. 2004; 27-40.
Olsen T. Prediction of the effective post-operative (intraocular lens) anterior chamber depth. J Cataract Refract Surg 2006; (32): 419-424.
Olsen T. Calculation of intraocular lens power: a review. Acta Ophthalmol Scand 2007; (85): 472-485.
Olsen T, Corydon L. We don′t need fudge factors in IOL power calculation. Eur J Implant Refract Surg 1993; (5): 51-54.
Olsen T, Corydon L, Gimbel H. Intraocular lens power calculation with an improved anterior chamber depth prediction algorithm. J Cataract Refract Surg 1995; (21): 313-319.
Olsen T, Funding M. Ray-tracing analysis of intraocular lens power in situ. J Cataract Refract Surg 2012, in press.
Olsen T, Gimbel H. Phacoemulsification, capsulorhexis, and intraocular lens power prediction accuracy. J Cataract Refract Surg 1993; (19): 695-699.
Olsen T, Olesen H, Thim K, Corydon L. Prediction of post-operative intraocular lens chamber depth. J Cataract Refract Surg 1990a; (16): 587-590.
Olsen T, Olesen H, Thim K, Corydon L. Prediction of pseudophakic anterior chamber depth with the newer IOL calculation formulas. J Cataract Refract Surg 1992; (18): 280-285.
Olsen T, Thim K, Corydon L. Theoretical versus SRK I and SRK II calculation of intraocular lens power. J Cataract Refract Surg 1990b; (16): 217-225.
Olsen T, Thim K, Corydon L. Accuracy of the newer generation intraocular lens power calculation formulas in long and short eyes. J Cataract Refract Surg 1991; (17): 187-193.
Olsen T, Thorwest M. Calibration of axial length measurements with the Zeiss IOLMaster. J Cataract Refract Surg 2005a; (31): 1345-1350.
Olsen T, Thorwest M. Calibration of axial length measurements with the Zeiss IOLMaster. J Cataract Refract Surg 2005b; (31): 1345-1350.
Packer M, Fine I H, Hoffman R S, Coffman P G, Brown L K. Immersion A-scan compared with partial coherence interferometry: outcomes analysis. J Cataract Refract Surg 2002; (28): 239-242.
Retzlaff J. A new intraocular lens calculation formula. J Am Intraocul Implant Soc 1980; (6): 148-152.
Retzlaff J A, Sanders D R, Kraff M C. Development of the SRK/T intraocular lens implant power calculation formula. J Cataract Refract Surg 1990; (16): 333-340.
Sanders D, Retzlaff J, Kraff M, Kratz R, Gills J, Levine R, Colvard M, Weisel J, Loyd T. Comparison of the accuracy of the Binkhorst, Colenbrander, and SRK implant power prediction formulas. J Am Intraocul Implant Soc 1981; (7): 337-340.
Sanders D R, Retzlaff J, Kraff M C. Comparison of the SRK II formula and other second generation formulas. J Cataract Refract Surg 1988; (14): 136-141.
Sanders D R, Retzlaff J A, Kraff M C, Gimbel H V, Raanan M G. Comparison of the SRK/T formula and other theoretical and regression formulas. J Cataract Refract Surg 1990; (16): 341-346.
Stiles WS, Crawford BH. The luminous efficiency of rays entering the eye pupil at different points. Proc Roy Soc (London) В 1933; (112): 428-450.
Vogel A, Dick H В, Krummenauer F. Reproducibility of optical biometry using partial coherence interferometry: intraobserver and interobserver reliability. J Cataract Refract Surg 2001; (27): 1961-1968.
Реферат
Группа изобретений относится к области офтальмологических систем и процедур. Изобретения основаны на определении послеоперационного положения интраокулярной линзы в глазу пациента, перенесшего операцию по замене хрусталика, которое включает в себя определение положения наличествующего хрусталика в предоперационном глазу пациента и использование данной информации и одной численной константы для прогнозирования послеоперационного положения интраокулярной линзы. Описаны также связанные способы и компьютерные программы для осуществления способов согласно изобретению. Группа изобретений позволяет повысить точность прогноза положения, сделать более точным расчет оптической силы линзы и, соответственно, повысить эффективность лечения заболеваний у пациентов, требующих такого лечения. 6 н. и 35 з.п. ф-лы, 5 табл., 19 ил., 5 пр.
Формула
(i) определение положения наличествующего хрусталика в предоперационном глазу пациента;
(ii) определение толщины хрусталика в предоперационном глазу пациента; и
(iii) прогнозирование послеоперационного положения интраокулярной линзы, при этом величина послеоперационного положения интраокулярной линзы относительно положения хрусталика в предоперационном глазу пациента составляет долю толщины хрусталика в предоперационном глазу пациента, причем указанная доля определяется единственной численной константой (С), которая определяется типом интраокулярной линзы,
при этом численная константа (С) определяет взаимосвязь между послеоперационным положением интраокулярной линзы в глазу одного или более прооперированных на глазу пациентов и положением и толщиной хрусталика в предоперационном глазу указанных одного или более прооперированных на глазу пациентов,
тип интраокулярной линзы приспособлен для имплантации в капсульный мешок в глазу, и
имплантационный подход представляет собой имплантацию интраокулярной линзы в капсульный мешок в глазу.
С=(IOLmeasured - ACDpre)/LT,
где:
IOLmeasured - измеренное положение интраокулярной линзы у прооперированного на глазу пациента после операции;
ACDpre - положение хрусталика в глазу пациента, прооперированного на глазу, перед операцией; и
LT - толщина хрусталика в глазу прооперированного на глазу пациента перед операцией.
IOLpredicted = ACDpre + С × LT,
где:
IOLpredicted - прогнозируемое послеоперационное положение интраокулярной линзы в глазу пациента;
ACDpre - предоперационная глубина передней камеры глаза пациента;
С - численная константа, как обсуждалось выше; и
LT - толщина хрусталика в предоперационном глазу пациента.
(a) прогнозирование послеоперационного положения заменяющей интраокулярной линзы в глазу пациента с использованием способа по любому из пп. 1-18;
(b) прогнозирование оптических свойств послеоперационного глаза пациента, в котором интраокулярная линза известной оптической силы и геометрии позиционирована, как прогнозировано на стадии (а); и
(c) выбор интраокулярной линзы, имеющей оптическую силу и геометрию, необходимые для обеспечения желаемого оптического свойства в послеоперационном глазу пациента.
(a1) прогнозирование послеоперационного положения интраокулярной линзы в глазу пациента с использованием способа по любому из пп. 1-18;
(b1) прогнозирование оптических свойств послеоперационного глаза пациента, в котором интраокулярная линза известной оптической силы и геометрии позиционирована, как прогнозировано на стадии (а);
(c1) конструирование интраокулярной линзы, имеющей оптическую силу и геометрию, необходимые для обеспечения желаемого оптического свойства в послеоперационном глазу пациента.
(a2) прогнозирование послеоперационного положения интраокулярной линзы в глазу пациента с использованием способа по любому из пп. 1-18;
(b2) необязательно, удаление хрусталика из предоперационного глаза пациента;
(с2) предоставление интраокулярной линзы;
(d2) имплантация интраокулярной линзы в глазу пациента.
(а3) прогнозирование послеоперационного положения интраокулярной линзы в глазу пациента с использованием способа по любому из пп. 1-18;
(b3) необязательно, удаление хрусталика из предоперационного глаза пациента;
(с3) предоставление интраокулярной линзы;
(d3) имплантация интраокулярной линзы в глазу пациента.

Комментарии