Уменьшение объема ткани - RU2308967C2
Код документа: RU2308967C2
Чертежи



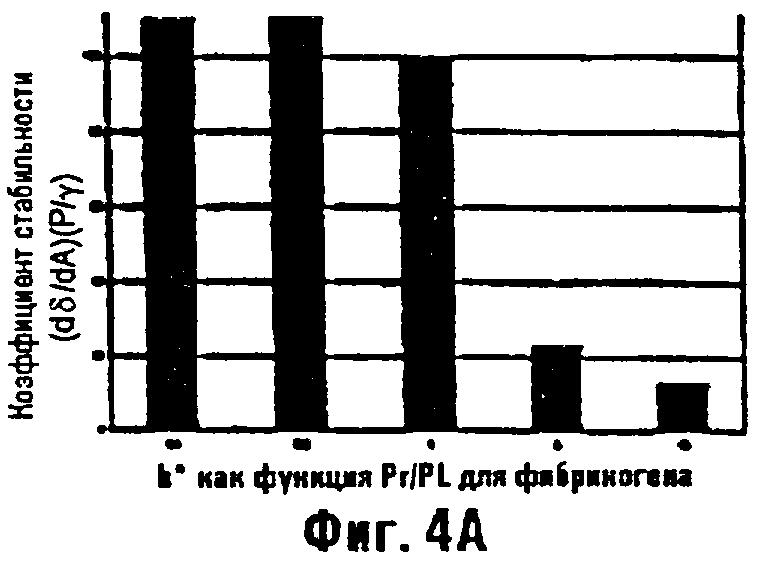









Описание
Предпосылки изобретения
Областью данного изобретения являются репарация и уменьшение объема ткани, например, репарация и уменьшение объема легких.
Конечная стадия эмфиземы может лечиться хирургией для уменьшения объема ткани (LVRS) (см., например. Cooper et al., J. Thorac. Cardiovasc. Surg. 109:106-116, 1995). Хотя кажется противоречащим здравому смыслу, что дыхательная функция могла бы быть улучшена удалением части легкого, иссечение перерастянувшейся ткани (что наблюдается в пациентах с гетерогенной эмфиземой) позволяет соседним участкам легкого, которые являются более нормальными, расширяться (увеличиваться в размерах). В свою очередь, это расширение делает возможными улучшенную эластическую тягу и улучшенный газообмен легкого. Даже пациенты с гомогенной эмфиземой легкого получают пользу от LVRS, поскольку резекция отклоняющегося от нормы легкого приводит к общему уменьшению в объемах легких, увеличению давлений эластической тяги и смещению к норме кривой статической эластичности (ткани без нагрузки) (Hoppin, Am. J. Resp.Crit. Care Med. 155:520-525, 1997).
Хотя многие пациенты, которые были подвергнуты LVRS, испытывают значительное улучшение (Cooper et al., J. Thorac. Cardiovasc. Surg. 112:1319-1329, 1996), они подвергаются значительному риску. LVRS проводят хирургическим удалением части больного легкого, доступ к которому осуществлялся введением торакоскопа через грудную стенку или посредством более радикального разреза вдоль грудины (Katloff et al., Chest 110:1399-1406, 1996). Таким образом, получение доступа к легкому является травматическим, и последующие процедуры, которые могут включать в себя использование сшивающего аппарата (ушивателя) хрупкой ткани легкого, могут вызывать серьезные послеоперационные осложнения.
Сущность изобретения
Данное изобретение описывает устройства, композиции и способы для репарации ткани и для достижения нехирургического уменьшения объема ткани (например, легкого). В одном аспекте, эти способы проводят на ткани легкого с использованием бронхоскопа. Этот способ полностью исключает необходимость хирургического вмешательства, так как он делает возможной выполнение процедуры уменьшения ткани через трахею и более мелкие дыхательные пути пациента. В этом подходе бронхоскопическое уменьшение объема легкого (BLVR) выполняют спадением (коллапсом) участка легкого, плотным прикреплением одной части спавшегося участка с другой и стимуляцией фиброза в прикрепленной ткани. Композицией, используемой для достижения коллапса легкого, может быть, но необязательно, та же самая композиция, которую используют для образования адгезий (слипаний) в этой ткани. Предпочтительные варианты могут включать в себя один или более следующих признаков.
Имеются многочисленные пути для индуцирования коллапса легкого. Например, материал, который увеличивает поверхностное натяжение жидкостей, выстилающих альвеолы (т.е. материал, который может действовать как антисурфактант), может быть введен через бронхоскоп (предпочтительно через катетер, находящийся внутри бронхоскопа). Этот материал может включать в себя фибриноген, фибрин или их биологически активные фрагменты. Коллапс легкого может быть также индуцирован блокированием потока воздуха в участок или из участка легкого, который намечен для коллапса. Это достигается введением баллонного катетера через бронхоскоп и раздуванием этого баллона таким образом, что он закупоривает бронх или бронхиолу, в которые он был помещен. Перед индуцированием коллапса легкого легкое может быть наполнено кислородом, так чтобы сохранившийся газ мог быть абсорбирован в кровь.
Подобным образом, имеются многочисленные способы для стимуляции адгезий между одной частью спавшегося легкого и другой. Если в качестве антисурфактанта выбран фибриноген, адгезию активируют подверганием фибриногена действию активатора фибриногена, такого как тромбин, который расщепляет фибриноген и полимеризует образующийся фибрин. Другие вещества, в том числе агонисты рецептора тромбина и батроксобин, могут быть также использованы для активации фибриногена. Если в качестве антисурфактанта выбран фибрин, нет необходимости введения дополнительного вещества или соединения; фибрин может полимеризоваться спонтанно, прикрепляя посредством этого одну часть спавшейся ткани к другой.
Фиброз активируется обеспечением одного или более полипептидных факторов роста вместе с одним или более антисурфактантами или активаторными веществами, описанными выше. Факторы роста могут быть выбраны из семейства факторов роста фибробластов (FGF) или могут быть полипептидами, подобными трансформирующему фактору роста бета (TGFβ).
Композиции, описанные выше, могут также содержать один или более антибиотиков для содействия профилактике инфекции. Альтернативно или в дополнение, могут быть использованы другие пути для введения антибиотика (например, они могут вводиться перорально или внутримышечно).
Другие аспекты данного изобретения включают в себя композиции, описанные выше, для стимуляции коллапса и/или адгезии, а также устройства для введения композиции в тело. Например, в одном аспекте, данное изобретение описывает физиологически приемлемые композиции, которые включают в себя полипептидный фактор роста или его биологически активный фрагмент (например, тромбоцитарный фактор роста, фибробластный фактор роста (FGF) или полипептид, подобный трансформирующему фактору роста бета) и фибриноген или мономер фибрина (например, мономер фибрина I, мономер фибрина II, мономер фибрина des BB, или их любую смесь или комбинацию) или активатор фибриногена (например, тромбин). Фибриноген, мономеры фибрина и активаторы фибриногена, применимые в BLVR, могут быть биологически активными мутантами (например, фрагментами) этих полипептидов.
В другом аспекте данное изобретение описывает устройства для проведения нехирургического уменьшения объема легкого. Например, данное изобретение описывает устройство, которое включает в себя бронхоскоп, имеющий рабочий канал, и катетер, который может быть вставлен в этот рабочий канал. Катетер может содержать множественные просветы и может включать в себя раздуваемый баллон. Другое устройство для выполнения уменьшения объема легкого включает в себя катетер, имеющий множество просветов (например, два или более), и контейнер для материала, имеющий множество камер (например, две или более), причем камеры контейнера могут соединяться с просветами этого катетера. Эти устройства могут также включать в себя инъектор для облегчения перемещения материала из контейнера в катетер.
BLVR имеет несколько преимуществ над стандартным хирургическим уменьшением объема легкого (LVRS). BLVR должно снижать болезненность и смертность, которые, как известно, связаны с LVRS (Swanson et al., J. Am. Coil. Surg. 185:25-32, 1997). Предсердные аритмии и пролонгированные утечки воздуха, которые являются наиболее часто сообщаемыми осложнениями LVRS, являются менее вероятно встречающимися в случае BLVR, поскольку BLVR не требует использования сшивающего устройства (ушивателя) хрупкой легочной ткани или хирургических манипуляций, которые раздражают перикард. BLVR может быть также значительно менее дорогостоящим, чем LVRS, которая в настоящее время стоит между приблизительно 18000 и 26000 долларов США для одного применения. Экономия могла бы быть значительной, поскольку известно, что эмфизема поражает два - шесть миллионов пациентов только в Америке. Кроме того, некоторые пациенты, которые не могли бы быть кандидатами для LVRS (например, вследствие их преклонного возраста), могут подвергаться BLVR. Кроме того, в случае необходимости, BLVR предоставляет пациентам возможность подвергаться более, чем одной процедуре уменьшения объема легкого. Хотя повторяемое хирургическое вмешательство не является обязательным предметом выбора (вследствие плевральных спаек, которые образуются после первоначальной процедуры), подобные недостатки не должны существовать для пациентов, которые были подвергнуты BLVR.
Другие признаки и преимущества данного изобретения будут очевидными из следующего подробного описания и из формулы изобретения.
Краткое описание чертежей
Фиг.1 является схематическим представлением BLVR.
Фиг.2а иллюстрирует катетер, который может быть введен через бронхоскоп.
Фиг.2b является видом в поперечном разрезе через стержень катетера, иллюстрируемого на фиг.2а.
Фиг.2с иллюстрирует картридж, который может быть присоединен к катетеру, иллюстрируемому на фиг.2а.
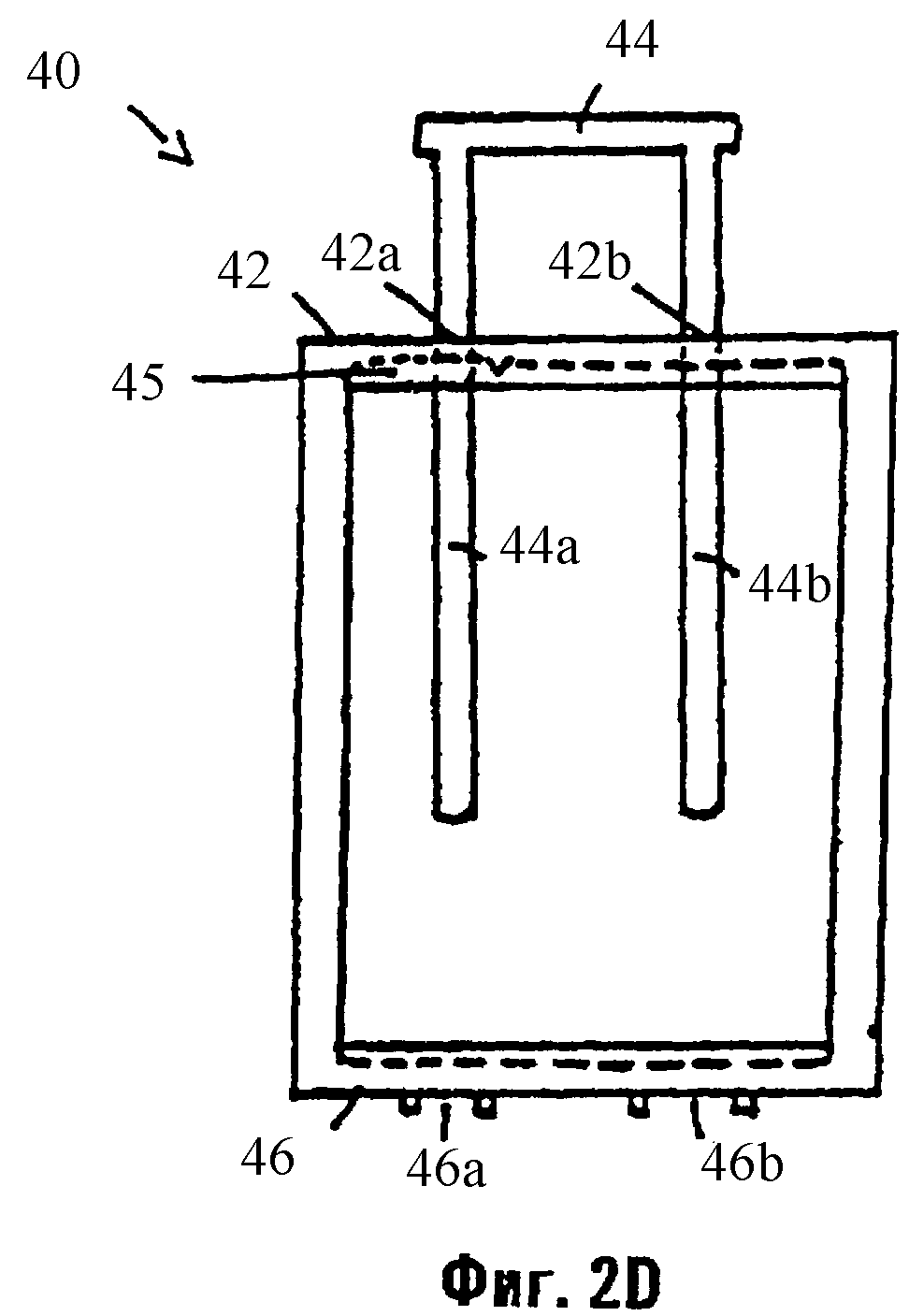
Фиг.2d иллюстрирует инъектор, который может быть использован для выталкивания материала из картриджа, иллюстрируемого на фиг.2с.
Фиг.2е иллюстрирует катетер фиг.2а, собранный в одно целое с картриджем фиг.2с, инъектором фиг.2d и имеющий защелку Люэра, заполненный воздухом шприц.
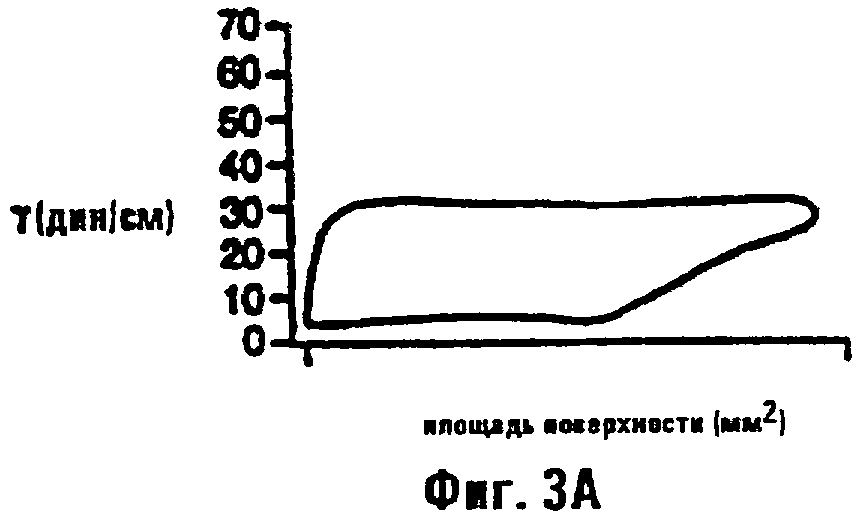
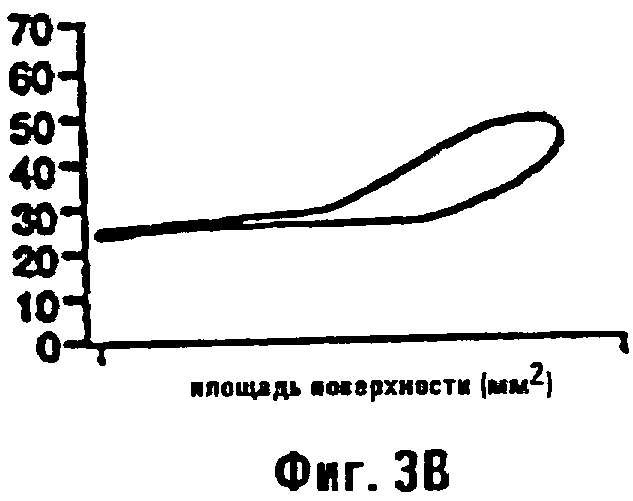
Фиг.3а и 3b являются графиками, изображающими поверхностное натяжение в зависимости от площади поверхности пленок сурфактанта из контрольной морской свинки (фиг.3а) и морской свинки, подвергнутой действию LPS (фиг.3b).
Фиг.4а и 4b являются диаграммами в виде столбцов, изображающими параметр стабильности поверхностных пленок (Gy/dA)1(А/у) в виде функции концентрации белок/липид для смесей сурфактантов фибриногена и альбумина.
Фиг.5а и 5b являются диаграммами в виде столбцов, изображающими динамическую (фиг.5а) и квазистатическую (фиг.5b) эластичность, спустя 3 месяца после того, как овцы были подвергнуты действию папаина, n=6.
Фиг.6а и 6b являются графиками, изображающими зависимость между физиологией (Cdyn, в виде % от фона, показан на фиг.6а, a rl, также в виде % от фона, показан на фиг.6b) и оценкой тяжести эмфиземы.
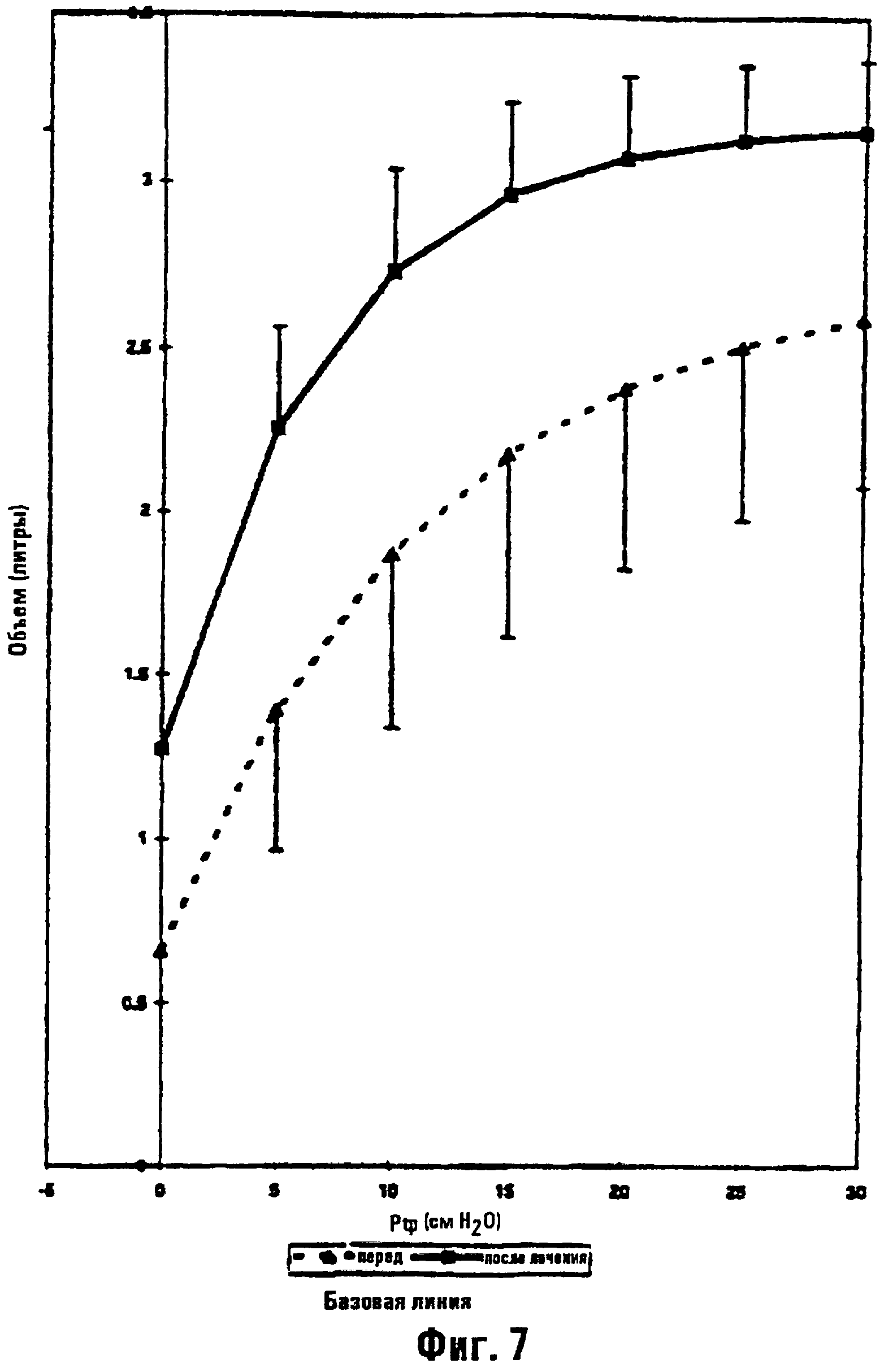
Фиг.7 является графиком, иллюстрирующим статическую эластичность легкого (объем в литрах в зависимости от Ptp в см Н2О) при базовой линии (фоне) (т.е. перед началом лечения) и при шести неделях после терапии папаином у овец.
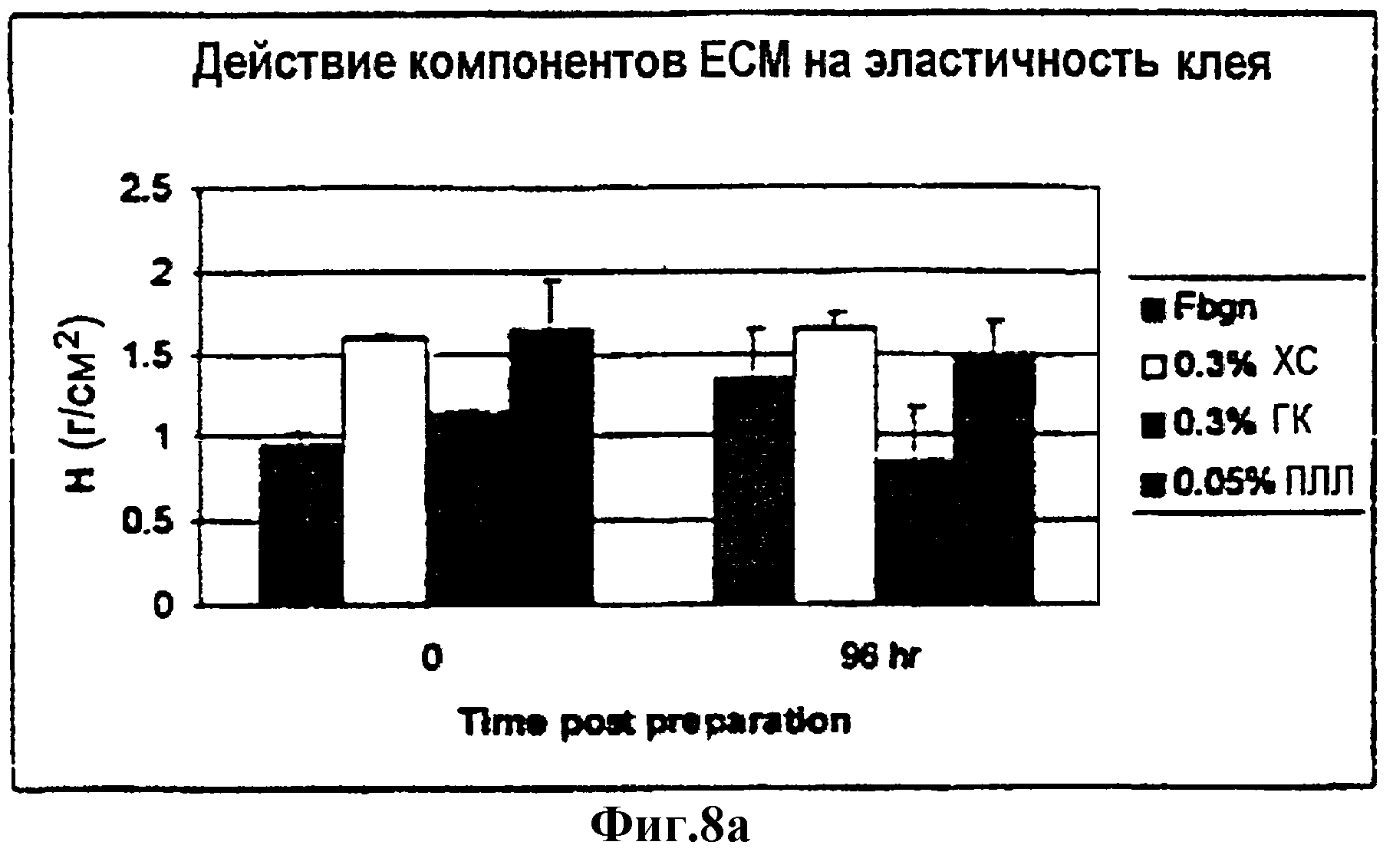
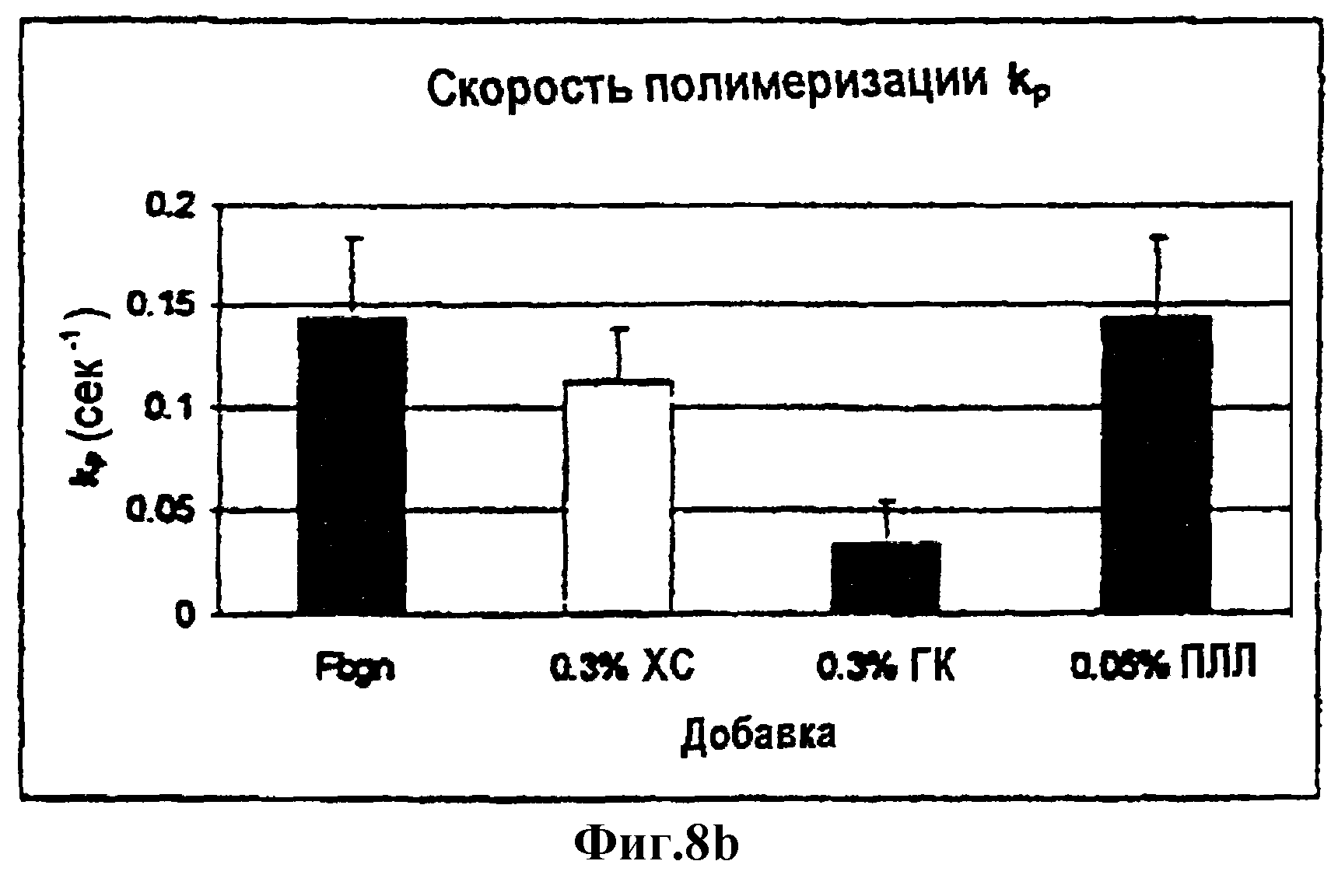
Фиг.8а и 8b являются диаграммами в виде столбцов, суммирующими модули упругости полосок геля, содержащих компоненты ЕСМ (фиг.8а), и скорости полимеризации геля (фиг.8b).
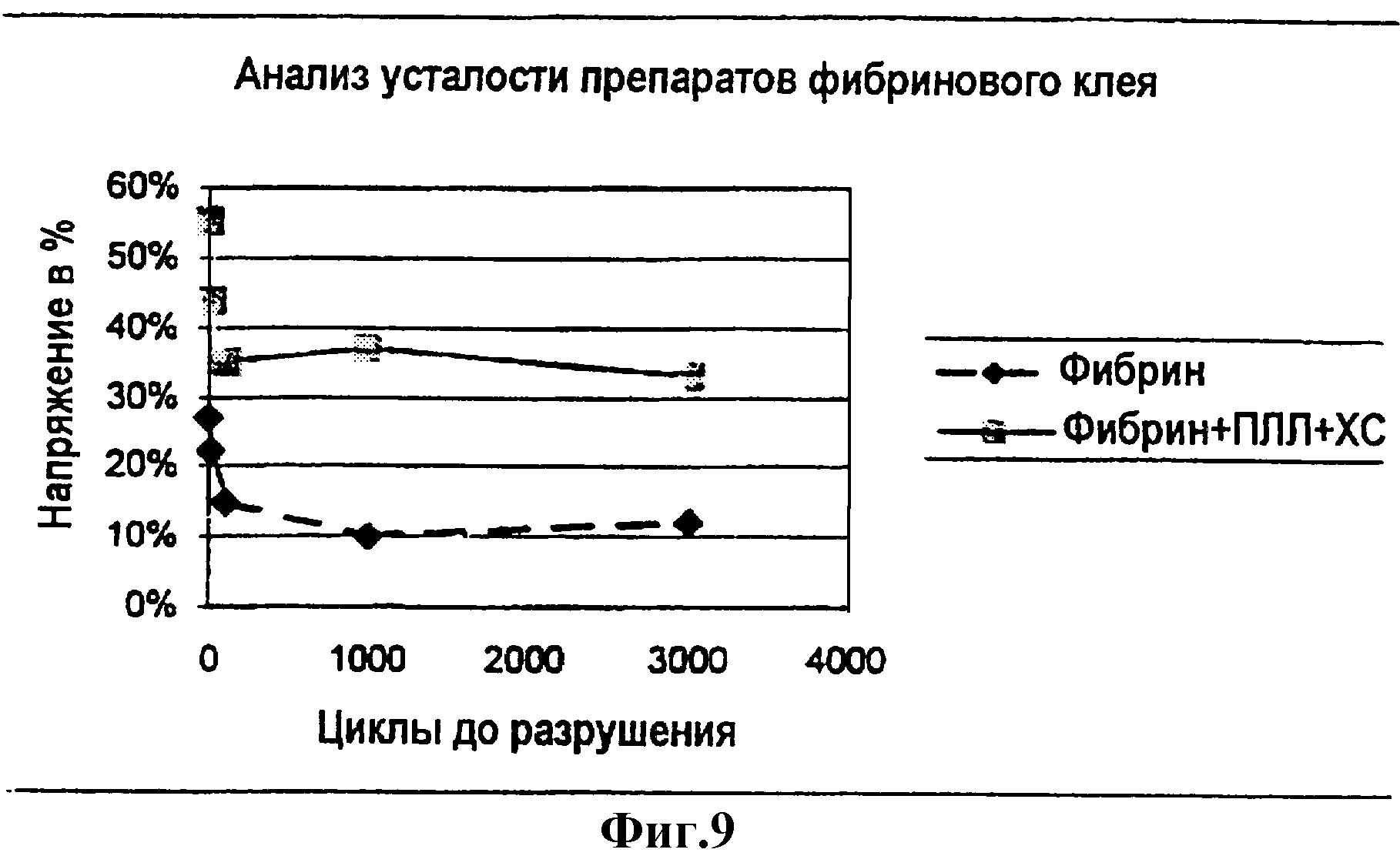
Фиг.9 является линейным графиком процентного напряжения в зависимости от циклов до разрушения для полосок геля, состоящих только из фибрина или из смеси фибрин + ПЛЛ + ХС.
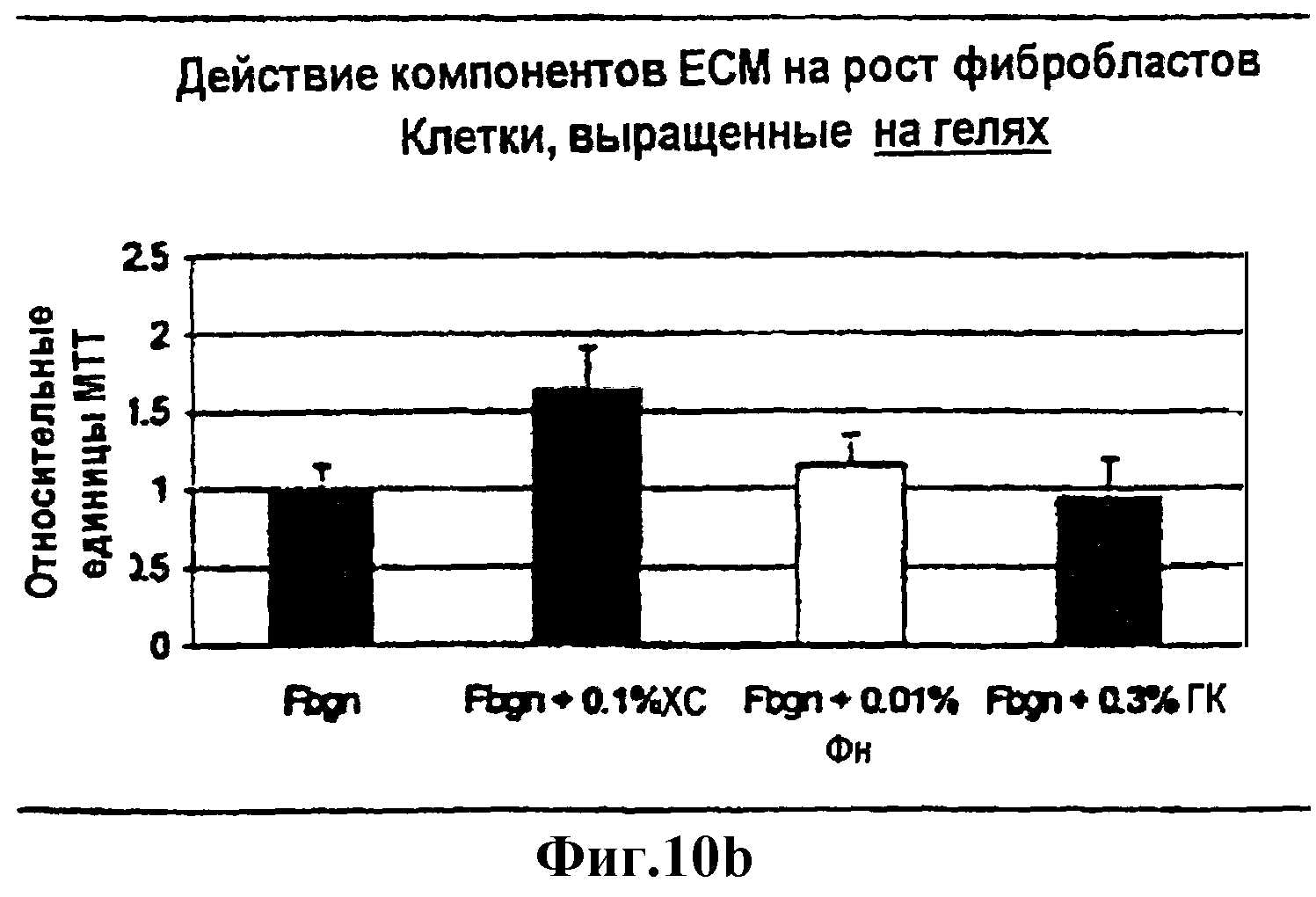
Фиг.10а и 10b являются диаграммами в виде столбцов пролиферации фибробластов человека на фибриновых гелях, содержащих компоненты ЕСМ.
Фиг.11 является диаграммой в виде столбцов, изображающей действия модифицированных промывочных растворов и клеев на физиологию легкого в овцах.
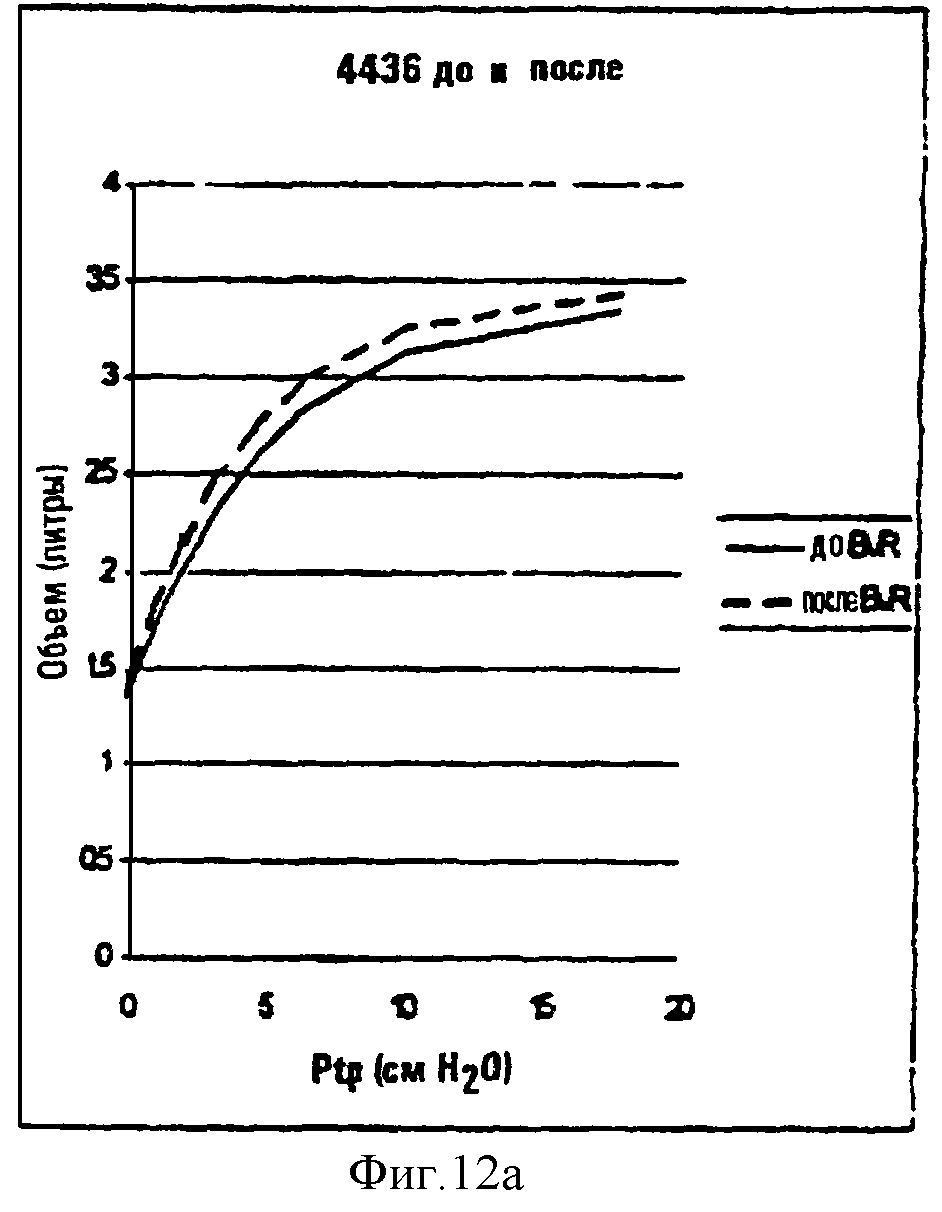
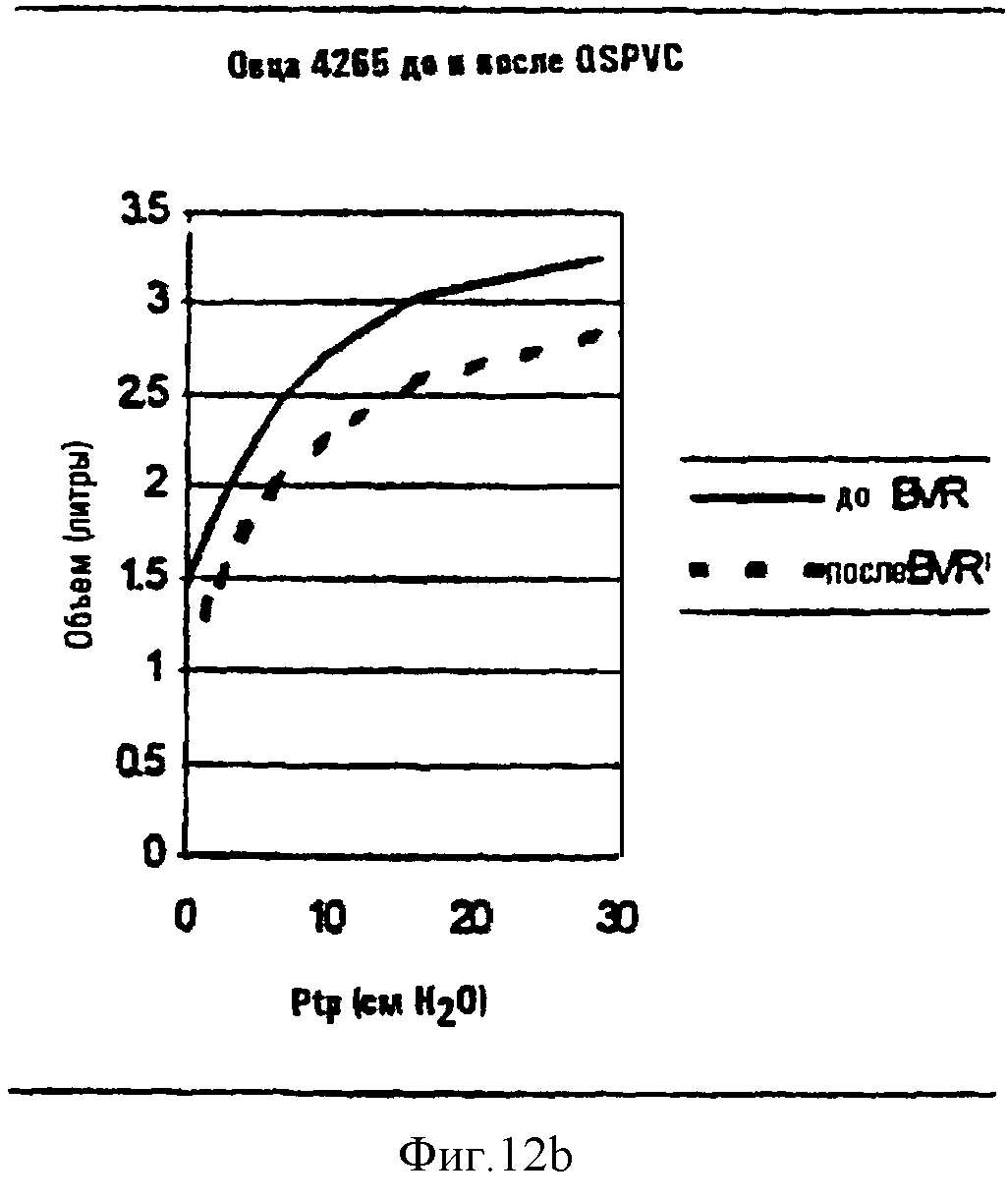
Фиг.12а и 12b являются линейными графиками, показывающими зависимости между квазистатическими давлением и объемом для овцы, обработанной 4×10 мл промывочного раствора для субсегментов легкого плюс фибриновый клей (результаты после двух недель показаны на фиг.12а), и овцы, обработанной промывочным раствором, содержащим компоненты ЕСМ (фиг.12b).
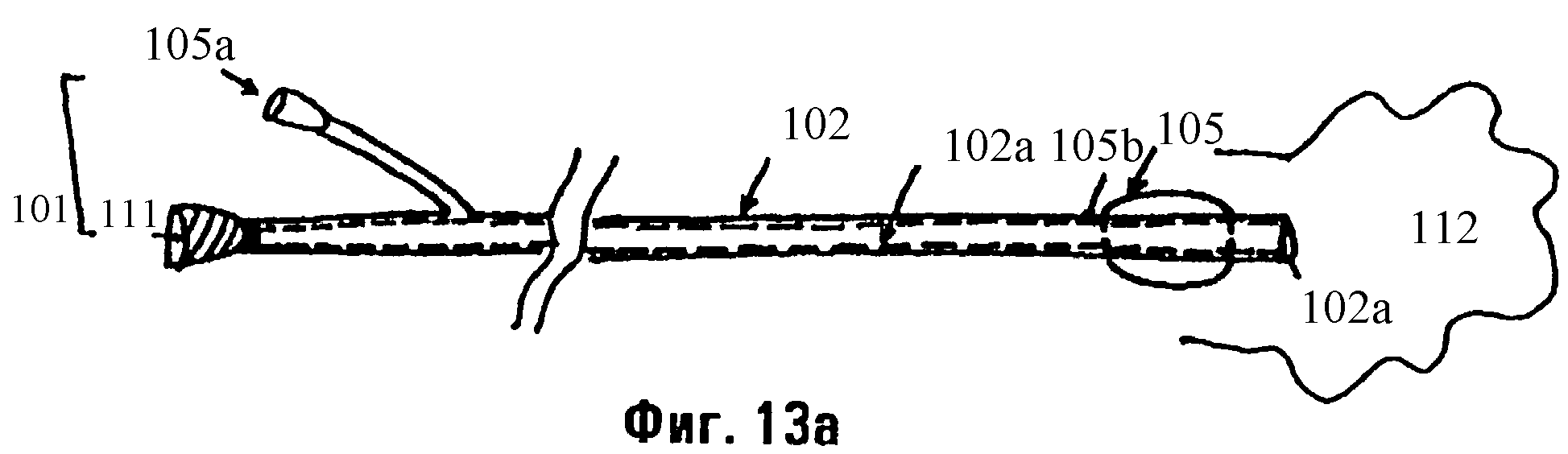
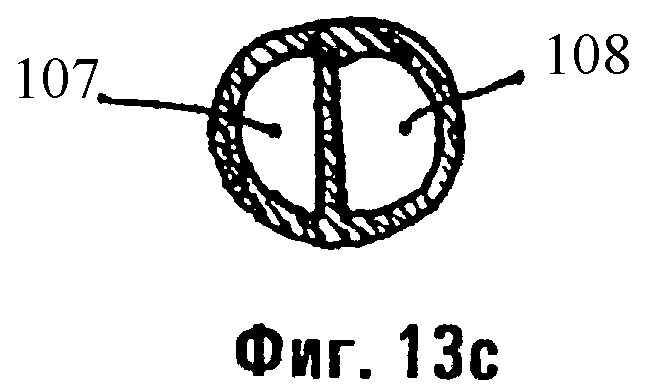
Фиг.13а, 13b и 13с являются схемами катетерной системы с двумя просветами.
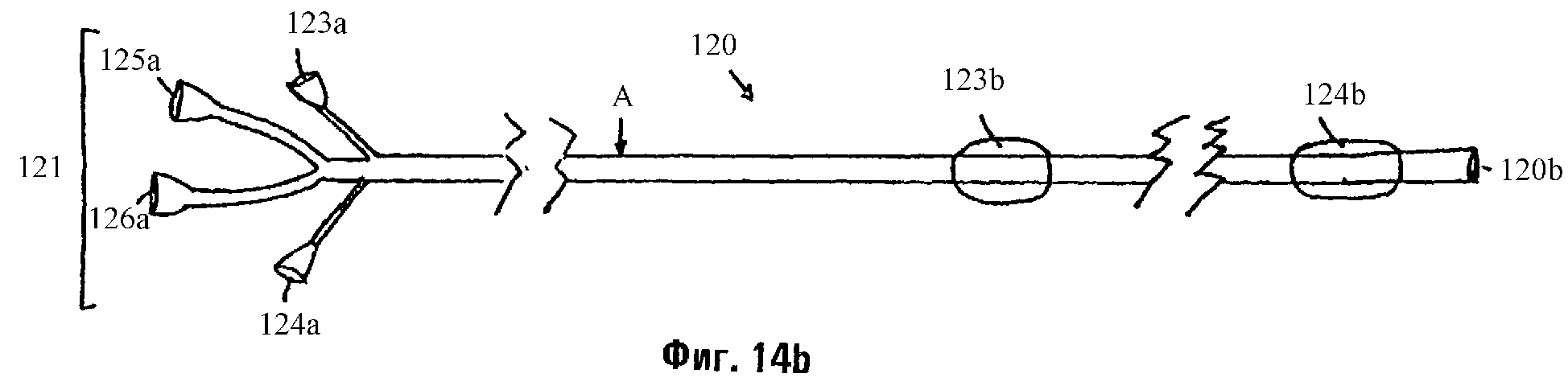
Фиг.14а м 14b являются схемами катетерной системы, которая может быть использована для закрытия бронхоплевральных фистул.
Подробное описание изобретения
Устройства, композиции и способы, описанные здесь, могут быть использованы для репарации повреждений тканей или утечек в тканях, таких как легкое, которые могут быть вызваны травмой, заболеванием или хирургическими процедурами, а также для уменьшения объема ткани, которой присуще свойство спадания (коллапса). Например, объем легкого может быть уменьшен с использованием бронхоскопа (бронхоскопическое уменьшение объема легкого называют здесь в виде аббревиатуры BLVR). Как видно на фиг.1, гибкий бронхоскоп 10 вводят через трахею 12 пациента в участок-мишень 20а легкого 20, и баллонный катетер 50 с дистальным отверстием (портом) 60 просвета (фиг.2) вводят через канал в бронхоскопе. Участок-мишень 20а будет спадаться либо когда воздушный проход 14 к участку-мишени 20а является закупоренным, либо когда антисурфактант вводят через баллонный катетер 50 к участку-мишени 20а. Независимо от причины коллапса одна часть спавшегося участка-мишени будет слипаться с другой при воздействии одной или более композиций, описанных ниже. Эти композиции включают в себя вещества, которые могут полимеризоваться либо спонтанно (например, фибрин), либо в ответ на активатор (например, фибриноген). Кроме того, одна или более композиций содержат полипептидный фактор роста, который стимулирует фиброз, и может содержать антибиотик для содействия профилактике инфекции или дополнительный фактор (такой как трансглутаминаза фактора XI На) для активации полимеризации. После применения этой композиции (композиций) бронхоскоп удаляют.
Пациенты, которые имеют хроническую обструктивную болезнь легкого, могут получать пользу от BLVR. Эти пациенты включают в себя, но не ограничиваются ими, пациентов, которые имеют эмфизему, хроническую астму, хронический бронхит и бронхоэктаз. BLVR может также выполняться, когда легкое пациента повреждено травмой или в случае спонтанного пневмоторакса. Хотя композиции данного изобретения (которые могут называться далее различно: растворами, клеями и гелями) могут применяться с новыми устройствами данного изобретения, они могут также применяться независимо. Например, эти композиции могут применяться во время хирургического LVR или во время любой хирургической процедуры, которая ставит пациента в положение риска повреждения легкого, других тканей в дыхательных путях, других органов или других систем органов. Некоторые из этих применений для композиций данного изобретения описаны более конкретно под заголовком "Другие варианты".
Идентификация участка-мишени и получение доступа к участку-мишени легкого
Как только пациент определен в качестве кандидата для BLVR, участок-мишень 20а легкого может быть идентифицирован с использованием радиологических исследований (например, рентгена грудной клетки) и сканограмм компьютерной томографии. Когда эта процедура выполнена, пациента анестезируют и интубируют, и он может быть помещен на абсорбируемый газ (например, по меньшей мере 90% кислород и до 100% кислорода) на определенный период времени (например, на приблизительно 30 минут). Участок (участки) легкого, который был сначала идентифицирован радиологически, затем идентифицируют бронхоскопически.
Подходящие бронхоскопы включают в себя бронхоскопы, изготавливаемые Pentax, Olympus и Fujinon, которые позволяют визуализировать освещенное поле. Врач направляет бронхоскоп 10 в трахею 12 и через бронхиальное дерево таким образом, что открытый кончик 60 бронхоскопа 10 располагается у входа в участок-мишень 20а (т.е. в участок легкого, который должен быть уменьшен в объеме). Бронхоскоп 10 может направляться через прогрессивно сужающиеся ветви бронхиального дерева для достижения различных субсегментов любого легкого 20. Например, как показано на фиг.1, бронхоскоп может быть направлен к субсегменту в нижней доле левого легкого пациента.
Баллонный катетер 50, упомянутый выше (и описанный более полно ниже), направляют затем через бронхоскоп 10 к участку-мишени 20а легкого 20. Когда катетер 50 расположен в бронхоскопе 10, баллон 58 раздувают таким образом, что материал, проходящий через катетер, будет содержаться в участках легкого, дистальных относительно баллона. Участок-мишень может быть подвергнут лаважу (промыванию) солевым раствором для уменьшения количества сурфактанта, который природно присутствует, и физиологически совместимую композицию, содержащую антисурфактант (т.е. агент, который увеличивает поверхностное натяжение жидкостей, выстилающих альвеолы), наносят в участок-мишень легкого через этот катетер. Предпочтительно, эту композицию готовят в виде раствора или суспензии, и она включает в себя фибрин или фибриноген. Преимущество введения этих веществ заключается в том, что каждое из них не только может действовать как антисурфактант, но и может участвовать также в адгезивном процессе.
Растворы на основе фибриногена
Фибриноген может функционировать в качестве антисурфактанта, так как он увеличивает поверхностное натяжение жидкостей, выстилающих альвеолы, и он может функционировать в качестве герметика или адгезива, так как он может участвовать в каскаде коагуляции, в котором он превращается в мономер фибрина, который затем полимеризуется и перекрестно сшивается с образованием стабильной сетки. Фибриноген, который был также назван фактором I, представляет приблизительно 2-4 г/л белка плазмы крови и является мономером, который состоит из трех пар связанных дисульфидными связями полипептидных цепей, названных (Aα)2, (Вβ)2 и γ2. Цепи "А" и "В" представляют два небольших N-концевых пептида и известны так же как фибринопептиды А и В, соответственно. Расщепление фибриногена тромбином приводит к получению соединения, называемого фибрином I, а последующее расщепление фибринопептида В приводит к получению фибрина II. Хотя эти расщепления уменьшают лишь незначительно молекулярную массу фибриногена, они тем не менее обнажают сайты полимеризации. В процессе нормального образования сгустков этот каскад инициируется, когда фибриноген подвергается действию тромбина, и этот процесс может точно копироваться в связи с уменьшением объема легкого, когда фибриноген подвергается действию активатора, такого как тромбин, или агониста рецептора тромбина, в водном растворе, содержащем кальций (например, 1,5-5,0 мМ кальций).
Фибриногенсодержащая композиция может включать в себя 3-12% фибриногена и предпочтительно включает в себя приблизительно 10% фибриноген в солевом растворе (например, 0,9% солевом растворе) или другом физиологически приемлемом водном растворе. Объем вводимого антисурфактанта будет варьироваться в зависимости от размера участка легкого, оцененного из просмотра сканов компьютерной томографии грудной клетки. Например, участок-мишень может быть промыт 10-100 мл (например, 50 мл) раствора фибриногена (10 мг/мл). Для облегчения коллапса легкого участок-мишень может быть подвергнут действию (например, ополоснут или подвергнут лаважу) неполимеризованного раствора фибриногена и затем подвергнут действию второго раствора фибриногена, который затем полимеризуют с активатором фибриногена (например, тромбином или агонистом рецептора тромбина).
Антисурфактант может содержать фибриноген, который был получен из пациента перед началом нехирургической процедуры уменьшения легкого (т.е. антисурфактантная или адгезивная композиция может включать в себя аутологичный фибриноген). Применение аутологичного вещества является предпочтительным, так как это уменьшает риск, что пациент будет заражен какой-либо формой гепатита (например, гепатита В или гепатита не А, не В), синдромом приобретенного иммунодефицита (СПИДа) или другой передаваемой кровью инфекцией. Этими инфекциями можно, более вероятно, заразиться, когда фибриногеновый компонент экстрагируют из объединенной плазмы человека (см., например, Silberstein et al., Transfusion 28:319-321, 1988). Фибриноген человека является коммерчески доступным через поставщиков, известных специалистам в данной области, или может быть получен из банков крови или подобных депозитариев.
Полимеризация антисурфактантов на основе фибриногена может быть получена добавлением активатора фибриногена. Эти активаторы известны в данной области и включают в себя тромбин, батроксобин (такой как батроксобин из В. Moojeni, В. Maranhao, В. atrox, В. Ancrod или A. Rhodostoma) и агонисты рецептора тромбина. При объединении фибриноген и активаторы фибриногена реагируют подобно реакции в конечных стадиях природного процесса свертывания крови, с образованием фибринового матрикса. Более конкретно, полимеризация может быть достигнута добавлением тромбина (например, 1-10 единиц тромбина на нг фибриногена). Если желательно, 1-5% (например, 3%) трансглутаминаза фактора XI На может быть добавлена для стимуляции перекрестного сшивания.
Кроме того, для усиления фиброза (или образования рубцов) в месте, где один участок спавшегося легкого прилипает к другому, одна или более композиций, применяемых для получения уменьшения объема легкого (например, композиция, содержащая фибриноген), может содержать полипептидный фактор роста. Могут быть включены многочисленные факторы роста. Предпочтительными являются тромбоцитарный фактор роста (PDGF) и факторы роста из семейств фибробластных факторов роста и трансформирующих факторов роста бета.
Например, полипептидым фактором роста, включенным в композицию, вводимую для уменьшения объема легкого (например, описанные здесь композиции на основе фибриногена, активатора фибриногена или фибрина), может быть основной FGF (bFGF), кислый FGF (aFGF), генный продукт hst/Kfgf, FGF-5, FGF-10 или int-2. Номенклатура в области полипептидных факторов роста является сложной, прежде всего потому, что многие факторы были выделены независимо разными исследователями и, исторически, названы по типу ткани, используемой в качестве теста во время очистки данного фактора. Эта сложность иллюстрируется основным FGF, который называли, по меньшей мере, 23 различными названиями (в том числе лейкозный фактор роста, макрофагальный фактор роста, полученный из почек эмбриона фактор ангиогенеза 2, фактор роста предстательной железы, астроглиальный фактор роста 2, эндотелиальный фактор роста, фактор ангиогенеза опухолей, фактор роста гепатомы, фактор роста хондросаркомы, полученный из хряща фактор роста 1, полученный из глаз фактор роста 1, гепаринсвязывающие факторы роста класса II, миогенный фактор роста, фактор, очищенный из плаценты человека, полученный из матки фактор роста, фактор роста, полученный из эмбрионального рака, фактор роста гипофиза человека, полученный из гипофиза фактор роста хондроцитов, фактор роста адипоцитов, остеобластный фактор предстательной железы и полученный из опухоли молочной железы фактор). Таким образом, любой фактор, называемый одним из вышеуказанных названий, находится в рамках данного изобретения.
Композиции могут также включать в себя "функциональные полипептидные факторы роста", т.е. факторы роста, которые, несмотря на присутствие мутации (будь то замена, деления или добавление аминокислотных остатков), сохраняют способность стимулировать фиброз в связи с уменьшением объема легких. Таким образом, альтернативные молекулярные формы полипептидных факторов роста (такие как формы bFGF, имеющие молекулярные массы 17,8, 22,5, 23,1 и 24,2 кД) находятся в объеме данного изобретения (формы с более высокой молекулярной массой являются колинеарными N-концевыми удлинениями bFGF 17,8 кД (Florkiewicz et al., Proc. Natl. Acad. Sci. USA 86:3978-3981, 1989)).
Вполне в рамках квалификации специалиста в данной области находится определение, сохраняет ли по существу полипептидный фактор роста, независимо от мутаций, которые влияют на его содержание аминокислот или размер, способность активировать фиброз, как и полноразмерный, полипептидный фактор роста дикого типа (т.е. усиливает ли мутантный полипептид фиброз на, по меньшей мере, 40%, предпочтительно, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 70% и наиболее предпочтительно, по меньшей мере, 90% так же эффективно, как соответствующий фактор роста дикого типа). Например, можно исследовать отложение коллагена в культивируемых фибробластах после подвергания действию полноразмерных факторов и мутантных факторов роста. Мутантный фактор роста по существу сохраняет способность активировать фиброз, когда он активирует на, по меньшей мере, 40%, предпочтительно, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 70% и наиболее предпочтительно, по меньшей мере, 90% отложение коллагена в сравнении с соответствующим фактором дикого типа. Количество отложения коллагена может быть измерено различными путями. Например, экспрессия коллагена может быть определена иммуноанализом. Альтернативно, экспрессия коллагена может быть определена экстракцией коллагена из фибробластов (например, культивируемых фибробластов или фибробластов вблизи уменьшенной ткани легкого) и измерением гидроксипролина.
Полипептидные факторы роста, применимые в данном изобретении, могут быть природно встречающимися, синтетическими или рекомбинантными молекулами и могут состоять из гибридного или химерного полипептида, в котором, например, одна часть является bFGF или TGFβ, а вторая часть является отличающимся полипептидом. Эти факторы могут быть очищены из биологической пробы, химически синтезированы или получены рекомбинантно стандартными способами (см., например, Ausubel et al. Current Protocols in Molecular Biology, New York, John Wiley and Sons, 1993; Powels et al. Cloning Vectors: A Laboratory Manual, 1985, Suppl. 1987).
Конечно, различные стимулирующие фиброз факторы роста могут быть использованы в комбинации.
Специалист в данной области вполне сможет определить дозу полипептидного фактора роста, требуемую для стимуляции фиброза в связи с BLVR. Требуемая доза может варьироваться и может находиться в диапазоне от 1 до 100 нМ.
Кроме того, любые из композиций или растворов, описанных здесь для уменьшения объема легкого (например, описанная выше композиция на основе фибриногена), могут содержать один или более антибиотиков (например, ампициллин, гентамицин, цефотаксим, небацетин, пенициллин или сискомицин). Включение антибиотиков в терапевтически применяемые композиции хорошо известно специалистам в данной области.
Растворы на основе фибрина
Фибрин может также функционировать в качестве антисурфактанта, а также в качестве герметика или адгезива. Однако, в противоположность фибриногену, фибрин может быть превращен в полимер без применения активатора (такого как тромбин или фактор XI На). В самом деле, мономеры фибрина I могут спонтанно образовывать полимер фибрина I, который действует как сгусток, независимо от того, были ли они перекрестно сшиты, и независимо от того, превращается ли фибрин I далее в полимер фибрина II. Без ограничения данного изобретения соединениями, которые функционируют по какому-либо конкретному механизму, следует отметить, что, когда мономеры фибрина I приходят в контакт с кровью пациента, собственный тромбин и фактор XIII пациента могут превращать полимер фибрина I в структурированный (сшитый) полимер фибрина II.
Любая форма мономера фибрина, которая может быть превращена в полимер фибрина, может быть приготовлена в виде раствора и использована для уменьшения объема легкого. Например, композиции на основе фибрина могут содержать мономеры фибрина I, мономеры фибрина II, мономеры фибрина des ВВ или любую их смесь или комбинацию. Предпочтительно, эти мономеры фибрина не являются перекрестно сшитыми.
Фибрин может быть также получен из любого источника, пока его получают в форме, которая может быть превращена в полимер фибрина (подобным образом, несшитый фибрин может быть получен из любого источника, пока он может быть превращен в сшитый фибрин). Например, фибрин может быть получен из крови млекопитающего, такого как человек, и его предпочтительно получают от пациента, которому его впоследствии должны вводить (т.е. этот фибрин является аутологичным фибрином). Альтернативно, фибрин может быть получен из клеток, которые, в культуре, секретируют фибриноген.
Композиции на основе фибрина могут быть получены, как описано в патенте США 5739288 (который таким образом включен в качестве его полной ссылки), и могут содержать мономеры фибрина, имеющие концентрацию не менее, чем приблизительно 10 мг/мл. Например, мономеры фибрина могут присутствовать в концентрациях от приблизительно 20 мг/мл до приблизительно 200 мг/мл от приблизительно 20 мг/мл до приблизительно 100 мг/мл и от приблизительно 25 мг/мл до приблизительно 50 мг/мл.
Спонтанное превращение мономера фибрина в полимер фибрина может быть облегчено контактированием мономера фибрина с ионами кальция (как обнаружено, например, в хлориде кальция, например, 3-30 мМ растворе CaCl2). За исключением первых двух стадий в свойственном организму пути свертывания крови, ионы кальция необходимы для стимуляции превращения одного фактора коагуляции в другой. Таким образом, кровь не будет свертываться в отсутствие ионов кальция (но в живом организме концентрации ионов кальция никогда не падают достаточно низко, чтобы значимо влиять на кинетику свертывания крови; человек умер бы от мышечной тетании до того, как кальций снизится до этого уровня). Содержащие кальций растворы (например, стерильный 10%-ный CaCl2) может быть легко приготовлен или куплен у коммерческого поставщика.
Композиции на основе фибрина, описанные здесь, могут также включать в себя один или более полипептидных факторов роста, которые усиливают фиброз (или образование рубцов) в месте, где один участок спавшегося легкого слипается с другим. Многочисленные факторы могут быть включены, и предпочтительными являются факторы из семейств фибробластных факторов роста и трансформирующих факторов роста бета. Полипептидные факторы роста, пригодные для включения с композициями на основе фибрина, включают в себя все те факторы (описанные выше), которые пригодны для включения с композициями на основе фибриногена.
Растворы, которые включают в себя компоненты внеклеточного матрикса
Как описано здесь, эффективным способом получения безопасного, нехирургического уменьшения объема ткани является применение растворов, содержащих агенты, которые действуют не только механически, склеивая одну часть ткани с другой, но также биологически модулируют ответные реакции клеток в зонах, намеченных для уменьшения объема. Так, растворы на основе фибрина и фибриногена, описанные выше, могут содержать также один или более агентов, которые усиливают механические и биологические свойства этих растворов. Как описано выше, такие растворы могут быть использованы для лаважа (т.е. промывания) ткани или для приклеивания одной части этой ткани к другой.
Применимые агенты включают в себя агенты, которые: (1) стимулируют хемотаксис фибробластных и мононуклеарных клеток и отложение коллагена самоограничивающим и локализованным образом; (2) подавляют активность альвеолярных эпителиальных клеток, либо ингибированием их способности экспрессировать сурфактант, что стимулирует повторное открывание участков-мишеней, либо стимуляцией апоптоза эпителиальных клеткок, что вызывает воспаление; (3) стимулируют сжатие эпителиальных клеток, что уменьшает кровоток к участкам-мишеням, минимизируя тем самым несовпадение между вентиляцией и перфузией и любое получение отклонений от нормы газообмена. Более конкретно, могут быть использованы растворы, содержащие компоненты внеклеточного матрикса (ЕСМ), эндотелин-1 и/или проапоптотические реагенты. Подходящие проапоптотические агенты включают в себя белки в семействе Вс1-2 (например, Вах, Bid, Bik, Bad и Bim и их биологически активные фрагменты или варианты), белки в семействе каспаз (например, каспазу-3, каспазу-8, каспазу-9 и их биологически активные фрагменты и варианты) и белки в семействе аннексинов (например, аннексии V или его биологически активный фрагмент или вариант). Как описано дополнительно в примерах ниже, растворы, содержащие несколько из этих агентов, тестировали. Первые агенты для тестирования отбирали на основании их биологических признаков, их биофизических действий на поведение геля, их растворимости в водных растворах (при физиологических условиях) и стоимости. Специалисты в данной области смогут выбрать и использовать сравнимые агенты без обращения к чрезмерному экспериментированию.
Выбранными для применения агентами были первоначально ходроитинсульфат А, гиалуроновая кислота с низкой и высокой молекулярной массой, фибронектин, поли-L-лизин со средней и длинной цепью и дипептид коллагена пролин-гидроксипролин.
Хондроитинсульфат (ХС) является компонентом ЕСМ из семейства гликозаминогликанов (ГАГ). Он представляет собой сульфатированный углеводный полимер, состоящий из повторяющихся дисахаридных единиц галактозамина, связанных с глюкуроновой кислотой через связь бета-1-4-углерод. ХС не обнаруживается в виде свободной углеводной части in vivo, a скорее связан с коровыми (центральными) белками различных типов. Как таковой, он является компонентом нескольких важных протеогликанов ЕСМ, в том числе членов семейства синдеканов (синдекана 1-4), богатого лейцином семейства (десортина, бигликана) и гиалуронатсвязывающего семейства (CD44, аггрекана, версикана, нейронкана). Эти ХС-содержащие протеогликаны функционируют в связывании интегринов клеточной поверхности и факторов роста. ХС-содержащие протеогликаны могут функционировать в легком в качестве каркаса для депонирования коллагена фибробластами. Таким образом, компоненты ЕСМ в семействе гликозаминогликанов, в частности, углеводные полимеры, применимы в достижении уменьшения объема ткани (например, уменьшения объема легкого, проводимого бронхоскопически). Например, добавление хондроитинсульфата А или С при концентрациях в диапазоне от 0,05 до 3,00% оказывает специфическое и благоприятное действие как на механические, так и на биологические свойства фибриновых гелей. Подобным образом растворы, применимые для лаважа и склеивания ткани, могут содержать сравнимые количества одного или более протеогликанов, таких как синдекан 1-4, декортин, бигликан, CD44, аггрекан, версикан и нейронкан. В одном варианте композиция данного изобретения включает в себя этанол (например, 1-20%), фибриноген (например, 0,01-5,00%), ГК (например, 0,01-3,00%), ФН (например, 0,001-0,1%) и ХС (например, 0,01-1,0%). Например, применимая композиция данного изобретения включает в себя 10% этанол, 0,5% фибриноген, 0,3% ГК, 0,01% ФН и 0,1% ХС.
Гиалуроновая кислота (ГК), подобно ХС, является полисахаридом, состоящим из повторяющихся единиц глюкуроновой кислоты и N-ацетилглюкозамина, соединенных связью бета-1-3. Однако, в противоположность ХС и ГАГ, ГК действует in vivo в виде свободного углевода и не является компонентом какого-либо семейства протеогликанов. ГК является большой полианионной молекулой, которая предполагает случайно скрученную структуру в растворе и, вследствие ее самоагрегирующих свойств, придает высокую вязкость водным растворам. Она поддерживает как прикрепление, так и пролиферацию клеток. Кроме того, считают, что ГК усиливает хемотаксис моноцитов/макрофагов и стимулирует секрецию ингибитора активатора цитокина и плазмина из этих клеток. Таким образом, полисахариды, которые включают в себя повторяющиеся единицы, например, глукуроновую кислоту и N-ацетилглюкозамин, применимы в достижении уменьшения объема ткани (например, уменьшения объема легкого, проводимого бронхоскопически). Например, добавление ГК с высокой или низкой молекулярной массой при концентрациях в диапазоне от 0,05 до 3,00% будет оказывать специфическое и благоприятное действие как на механические, так и на биологические свойства фибриновых гелей.
Фибронектин (Фн) является широкораспространенным гликопротеином, присутствующим в ЕСМ. Он присутствует в тканях в виде гетеродимера, в котором субъединицы ковалентно связаны парой дисульфидных связей вблизи карбокси-конца. Фн разделен на несколько доменов, каждый из которых имеет отличающуюся функцию. Амино-концевой участок имеет сайты связывания для фибрина, гепарина, фактора XIIIa и коллагена. Фн имеет центральный клеточносвязывающий домен, который узнается интегринами клеточной поверхности макрофагов, а также фибробластами, миофибробластами и недифференцированными интерстициальными клетками. Первичной функцией Фн in vivo является его функционирование в качестве регулятора заживления ран, клеточного роста и дифференцировки. Фн может усиливать связывание и хемотаксис фибробластов. Он может также действовать в качестве фактора компетентности клеточного цикла, позволяя фибробластам размножаться более быстро при подвергании действию подходящих "сигналов прогрессирования". In vitro, Фн усиливает миграцию фибробластов в сгустки плазмы. Кроме того, Фн стимулирует изменения в фенотипе альвеолярных клеток, которые приводят к снижению экспрессии сурфактанта. Таким образом, молекулы Фн, которые активируют коллапс ткани и образование рубцов, применимы в достижении уменьшения объема ткани (например, уменьшения объема легкого, проводимого бронхоскопически). Применимы изоформы Фн, генерируемые альтернативным сплайсингом, и лизофосфатидная кислота или ее соль могут быть добавлены к содержащим Фн растворам для усиления связывания Фн. Например, добавление Фн в концентрации в диапазоне 0,05%-3,00% оказывает специфическое и благоприятное действие как на механические, так и на биологические свойства фибриновых гелей, например, в BLVR.
Поли-L-лизин (ПЛЛ) обычно используют в экспериментах с клеточной культурой для стимуляции прикрепления клеток к поверхности, и он является сильно положительно заряженным. Несмотря на его большой размер, он легко растворяется в присутствии анионных полисахаридов, в том числе ГК и ХС.Таким образом, ПЛЛ, ГК и ХС могут быть использованы в комбинации в растворах для лаважа, дестабилизации и прикрепления одной части ткани к другой. Описанные ниже исследования исследуют возможность, что ПЛЛ в фибриновой сетке, содержащей длинноцепочечные полисахариды, генерирует ионные взаимодействия, которые делают фибриновые гели более эластичными и менее склонными к разрушению во время повторяющегося растягивания. ПЛЛ может также стимулировать гидратацию и набухание после образования матриксов. Таким образом, конкретным преимуществом использования растворов, содержащих ПЛЛ, для уменьшения объема легкого, является то, что такие растворы делают еще менее вероятным удаление образующихся матриксов из дыхательных путей. ПЛЛ, имеющие молекулярную массу между 3000 и 10000, могут быть использованы в концентрациях 0, 1%-5,0%.
Дипептид пролин-гидроксипролин (ПГП) является обычным в последовательности интерстициальных коллагенов (типа I и типа II). Полученные из коллагена пептиды могут действовать в качестве сигналов для стимуляции врастания фибробластов и репарации во время процесса заживления ран. Дипептид ПГП в концентрациях в диапазоне от 2,5 до 10,0 мМ является таким же эффективным, как и фрагменты коллагена типа I и типа II, в стимуляции хемотаксиса фибробластов in vitro. Таким образом, дипептиды ПГП применимы в достижении уменьшения объема ткани (например, уменьшения объема легкого, проводимого бронхоскопически). Например, добавление ПГП в концентрации в диапазоне 0,05%-3,00% оказывает специфическое и благоприятное действие как на механические, так и на биологические свойства фибриновых гелей.
Добавление компонентов ЕСМ к промывочным растворам и фибриновым гелям может стимулировать коллапс ткани и образование рубцов посредством модуляции активности интерстициальных фибробластов и легочных макрофагов. Разрыв интактного эпителия имеет тенденцию к стимуляции перманентных ателектаза и образования рубцов. Таким образом, может быть полезным обнажение альвеолярных компонентов для агентов, которые вызывают воспаление и запускают "подобную СПИДу" реакцию. Конечно, введение таких агентов должно тщательным образом контролироваться и подвергаться мониторингу, так чтобы величина продуцируемого воспаления не была опасной. Альтернативно, репарация ткани и уменьшение объема могут быть облегчены добавлением агентов, которые стимулируют апоптоз эпителиальных клеток, "запрограммированную гибель клеток", без интенсивного некроза и воспаления. Эти агенты вызывали бы потерю функции альвеолярных клеток без воспаления. Одним способом для получения такой реакции является введение сфингомиелина (СГМ), липидного соединения, которое поглощается определенными типами клеток и ферментативно превращается сфингомиелиназой и церамидкиназой в церамид-1-фосфат, ключевой модулятор запрограммированной гибели клеток. Применение СГМ, вероятно, также ингибирует сурфактант, так как СГМ имеет антисурфактантную активность in vitro. СГМ мог бы вводиться в промывочном растворе для сурфактанта, где он мог бы действовать специфически на поверхность эпителия для дестабилизации локальной поверхностной пленки и вызывать гибель эпителиальных клеток без воспаления. Растворы, применимые для репарации утечек воздуха в легочной ткани или для проведения BLVR, могут содержать СГМ или его биологически активный вариант в концентрациях в диапазоне 0,05-15,00% (например, 0,1, 0,5, 1,0, 2,0, 2,5, 5,0, 7,5, 10,0, 12,0, 13,0, 14,0 или 14,5).
Эффективность BLVR может быть также повышена модуляцией реакции эндотелиальных клеток. Например, временное сужение сосудов может быть достигнуто включением в промывочный раствор эпинефрина или норэпинефрина. Длительная эндотелиальная модуляция могла бы быть достигнута включением одного из эндотелинов, из семейства цитокинов, который стимулирует сужение сосудов и действует как профибротический агент. Эндотелин-1, эндотелин-2 или эндотелин-3 могут быть использованы отдельно или в комбинации. Таким образом, растворы данного изобретения могут также включать в себя вазоактивное вещество, такое как эндотелии, эпинефрин или норэпинефрин (в концентрациях от 0,01 до 5,00%) или их комбинации. Преимущество включения одного или более вазоактивных веществ заключается в том, что они благоприятным образом модулируют сосудистый ответ в ткани-мишени, а это, в свою очередь, уменьшает несоответствие вентиляции/перфузии, улучшает газообмен и, одновременно, стимулирует образование рубцов.
Применение композиций на основе фибрина, на основе фибриногена и композиций, содержащих ЕСМ, после коллапса легкого
Хотя участок-мишень легкого может быть подвергнут коллапсу действием одного из описанных здесь веществ, эти вещества могут также применяться для прикрепления одного участка легкого к другому (и для стимуляции фиброза), когда коллапс был индуцирован другими способами. Например, описанные выше вещества могут применяться после коллапса легкого, возникающего вследствие блокирования тока воздуха в участок-мишень или из участка-мишени. Такая блокада может быть легко индуцирована, например, введением бронхоскопа в трахею анестезированного пациента, введением баллонного катетера через этот бронхоскоп и раздуванием баллона таким образом, что малое количество воздуха проходит или воздух вообще не проходит в участок-мишень легкого. Коллапс закупоренного участка после того, как легкое заполняется абсорбируемым газом, будет происходить на протяжении приблизительно 5-15 минут в зависимости от размера закупоренного участка. Альтернативно, раствор на основе фибриногена или на основе фибрина (например, раствор на основе фибриногена или на основе фибрина, который содержит полипептидный фактор роста), а также растворы, которые содержат компоненты ЕСМ (такие, как описанные здесь), ЕСМ-подобные агенты (такие как ПЛЛ и ПГП), вазоактивные вещества (т.е. вещества, вызывающие сужение сосудов) и про-апоптотические факторы (например, белки из семейств Вс1-2, каспазы и аннексина) могут применяться после того, как легкое было подвергнуто действию антисурфактанта другого типа (например, нетоксичного детергента).
Конечно, описанные здесь композиции применимы не только в ходе выполнения BLVR, но также служат для заделки разрывов в легком, которые возникают в результате травмы или в ходе любой хирургической процедуры.
Катетеры для внесения материала в легкое
Как видно на фиг.2а, любой из описанных выше растворов может быть введен в легкое баллонным катетером 50, имеющим множественные входные порты (отверстия) 52, через которые материалы (такие как растворы или суспензии) или газы (например, воздух) могут инъецироваться через соответствующее число просветов.
Входные порты катетера 50 размещены следующим образом. Первый входной порт 54, имеющий проксимальный конец 54а, приспособленный для соединения с подачей газа (например, шприцом с защелкой Люэра, содержащим воздух), соединен с внутренним просветом 56 катетера 50, который заканчивается раздуваемым баллоном 58 вблизи дистального кончика 60 катетера 50. Второй входной порт 64, имеющий проксимальный конец 64а, приспособленный для соединения с источником одного или более материалов (например, картриджем для лекарственных средств 80, описанным ниже), соединен с внутренним просветом 66, который заканчивается на открытом дистальном кончике 60 катетера 50. Третий входной порт 74, имеющий проксимальный конец 74а, приспособленный для соединения с источником одного или более материалов (например, картриджем для лекарственных средств 80), соединен с внутренним просветом 76, который также заканчивается на открытом дистальном кончике 60 катетера 50.
Таким образом, газ, инъецируемый через входной порт 54, перемещается через внутренний просвет 56 к раздутому баллону 58, а материал, инъецируемый через входной порт 64 и/или входной порт 74, перемещается через внутренние просветы 66 и 76, соответственно, к дистальному кончику 60 катетера 50. По достижении дистального кончика 60 катетера 50, материалы, ранее разделенные внутри просветов 66 и 76, могли бы смешиваться друг с другом.
Как видно на фиг.2b, внутренний просвет 54, внутренний просвет 64 и внутренний просвет 74 показаны в виде поперечного сечения стержня 51 катетера 50. В другом варианте, просветы 66 и 76 могут отличаться по размеру, причем диаметр просвета, через который подается раствор на основе фибриногена, является приблизительно в два раза большим, чем диаметр просвета, через который подается раствор, содержащий активатор фибриногена.
Как показано на фиг.2с, картридж 80 может быть подсоединен к катетеру 50 для инъекции материала через входные порты 64, 74 и просветы 66, 76. Картридж 80 включает в себя первую камеру 82 и вторую камеру 92, любая или обе из которых могут содержать материал, применимый в BLVR (например, камера 82 может содержать смесь фибриногена, TGF-β и гентамицина, а камера 92 может содержать тромбин в забуференном кальцием растворе). Материал в картридже 80 может вводиться в легкое посредством катетера 20 следующим образом. Верхняя стенка 84 камеры 82 имеет отверстие 84а, через которое может подаваться давление для опускания поршня 86. Опускание поршня 86 проталкивает материал внутри камеры 82 в направлении нижней стенки 88 камеры 82, через отверстие 88а и, когда картридж 80 подсоединен к катетеру 50, во входной порт 64 катетера 50. Подобным образом, верхняя стенка 94 камеры 92 имеет отверстие 94а, через которое может подаваться давление для опускания поршня 96. Опускание поршня 96 проталкивает материал внутри камеры 92 в направлении нижней стенки 98 камеры 92, через отверстие 98а и, когда картридж 80 подсоединен к катетеру 50, во входной порт 74 катетера 50.
Как показано на фиг.2d, для содействия переносу материала из картриджа 80 в катетер 50, картридж 80 может быть помещен в выемку 45, имеющую форму рамы инъектора 40. Инъектор 40 включает в себя верхнюю стенку 42, имеющую отверстия 42а и 42b, через которые вставляется рукоятка 44. Выступ 44а рукоятки 44 входит в инъектор 40 через отверстие 42а, а выступ 44b рукоятки 44 входит в инъектор 40 через отверстие 42b. Когда картридж 80 помещают в инъектор 40 и рукоятку 44 опускают, выступы 44а и 44b давят на поршни 86 и 96, соответственно, выталкивая тем самым материалы в камерах 82 и 92 через отверстия 88а и 98а, соответственно, картриджа 80 и отверстия 46а и 46b, соответственно, нижней стенки 46 инъектора 40.
Фиг.2е иллюстрирует катетер 50, собранный с картриджем 80, инъектором 40 и шприцом 30 с защелкой Люэра, заполненным воздухом.
Как показано на фиг.13а-13с, любые описанные здесь растворы могут вводиться в легкое баллонным катетером 100, имеющим множественные входные порты (отверстия) 101, через которые материалы (например, растворы или суспензии) или газы (например, воздух) могут инъецироваться через соответствующее число просветов. Катетер 100 представляет собой двойной кожух для доставки композиций данного изобретения. Наружный кожух 102 окружает внутренний канал 102а, через который проходит внутренний кожух 110. Наружный кожух 102 поддерживает баллон 105. Воздух (или другой газ или вещество), инъецируемый через проксимальный порт для раздувания баллона 105а, проходит через просвет 105b к баллону 105, закупоривая таким образом участок 112. Когда внутренний кожух 110 находится во внутреннем канале 102а и баллон 105 является раздутым, композиции (например, растворы антисурфактанта) могут быть доставлены через дистальный входной порт 111 к закупоренному участку 112. Закупоренный участок 112 может быть подвергнут действию раствора (например, раствора антисурфактанта или промывочного раствора) в течение короткого времени (например, 60 секунд). Затем этот раствор может быть удален через дистальный входной порт 111 при непрерывном отсасывании. Обычно, отсасывание продолжается в течение 3-5 минут. Затем внутренний кожух 110 пропускают через внутренний канал 102а наружного кожуха 102. Благодаря тому факту, что внутренний кожух 110 длиннее, чем наружный кожух 102, дистальный кончик 110а внутреннего кожуха 110 останавливается глубже в закупоренном участке 112, чем дистальный кончик 102а наружного кожуха 102. Затем раствор на основе фибрина или на основе фибриногена может быть введен через один из множественных портов 101. Альтернативно, раствор на основе фибрина может вводиться через проксимальный входной порт 101а, а полимеризующий агент (например, тромбин) может вводиться через проксимальный входной порт 101b. Преимущество системы катетера с двойным просветом, представленной на фиг.13а и 13b, заключается в том, что внутренний кожух 110 может вручную вытягиваться через внутренний канал 102а, когда растворы инъецируются через проксимальные входные порты 101а и 101b. Таким образом, раствор (растворы) может быть распределен (т.е. распространен) от наиболее дистальных пределов досягаемости дистального кончика 110а до точки, где внутренний кожух 110 вытаскивается через дистальный кончик 102а. Как показано на фиг.13с, виде в поперечном разрезе через внутренний кожух 110 в точке А, двойные просветы 107 и 108 удерживают растворы, инъецированные через проксимальные входные порты 101а и 101b, отдельно, пока они не выйдут через дистальный кончик 110а в закупоренный участок 112.
Таким образом, данное изобретение описывает систему респираторного катетера, которая включает в себя наружный кожух, определяющий первый просвет, причем этот наружный кожух включает в себя фиксирующий член (например, баллон) для помещения наружного кожуха в бронхиальное дерево, и внутренний кожух, определяемый парой просветов, каждый из которых служит для принятия одного из первого и второго компонентов клея.
Как показано на фиг.14а и 14b, любые из описанных здесь растворов могут вводиться в легкое катетером с двумя баллонами 120, имеющим множественные входные порты (отверстия) 121, через которые материалы (такие как растворы или суспензии) или газы (такой как воздух) могут инъецироваться через соответствующее число просветов. Катетер 120 имеет четыре канала. Эти каналы показаны на фиг.14а в поперечном сечении, взятом в точке А фиг.14b. Канал 123 соединяет балонный порт 123а с баллоном 123b. Канал 124 соединяет баллонный порт 124а с дистальным баллоном 124b. Канал 125 соединяет порт инъекции 125а с дистальным кончиком 120b, а канал 126 соединяет порт инъекции 126а с дистальным кончиком 120b. Преимуществом этого катетера является то, что он уменьшает период времени, необходимый для выполнения BLVR, позволяя врачу более быстро определять, достиг ли дистальный концик 120b подходящего участка легкого (например, участка, который дает утечку воздуха). Бронхи и бронхиолы интенсивно разветвляются (см. фиг.1), и желательно помещать катетер как можно более точно в бронхиальном дереве. Обычно, врач будет знать, что утечка воздуха была закупорена, наблюдая за движением воздуха из трубки, помещенной в груди пациента перед BLVR. Если катетер 120 введен (например, через бронхоскоп) в одну из ветвей бронхиального дерева и если движение воздуха через грудную трубку прекращается при раздувании баллона 123b, врач будет знать, что поврежденный участок легкого расположен дистально относительно баллона 123b. Если затем воздух из баллона 123b выпущен, баллон 124b раздут и движение воздуха через грудную трубку прекращается, врач будет знать, что дистальный кончик 120b также находится в подходящем участке легкого. Однако, если движение через грудную трубку продолжается (когда из баллона 123b выпущен воздух, а баллон 124b является раздутым), то дистальный кончик 120b не был продвинут в участок легкого, который дает утечку и нуждается в репарации.
Таким образом, данное изобретение описывает систему респираторного катетера, которая включает в себя кожух, определяющий четыре просвета, где первый и второй просветы принимают первый и второй компоненты клея и простираются от проксимального конца катетера до дистального кончика катетера, а третий и четвертый просветы простираются от проксимального конца катетера до фиксирующих членов (например, баллонов), расположенных вдоль стержня катетера, причем один фиксирующий член расположен ближе к дистальному кончику катетера, чем другой.
Предпочтительные способы, материалы и примеры, которые будут теперь описаны, являются только иллюстративными и не предназначены для ограничения; материалы и способы, подобные или эквивалентные описанным здесь, могут быть использованы в практике или испытании данного изобретения.
Пример 1: BLVR в выделенном легком теленка
Выделенные легкие теленка являются превосходной моделью для BLVR, так как с ними легко работать и они анатомически подобны легким человека. Легкие теленка, имеющие общую емкость легких 4-5 литров, покупали из Arena and Sons′ Slaughter House (Hopkinton, MA), и они были доставлены на льду в лабораторию в пределах 3 часов после приобретения. Легкие трахеально канюлировали трубчатым соединителем №22 и подвешивали из кольцевого зажима с диафрагмальной поверхностью, лежащей в большой тефлоновой чашке, содержащей 2-3 мм забуференного фосфатом солевого раствора (ЗФР). Висцеральную плевральную поверхность поддерживали во влажном состоянии, опрыскиванием ее аэрозолем 0,15 М NaCl при регулярных интервалах. Утечки плевры идентифицировали по появлению пузырьков на плевральной поверхности и оценкой способности легкого поддерживать постоянное давление 20 см Н2О давления раздувания. Утечки закупоривали аутологичной поддерживающей хирургической пликацией (образованием складок). Любые неблагоприятно поврежденные секции легких скручивали и сшивали подобно способу, используемому в LVRS у человека (Swanson et al., J. Am. Coil. Surg, 185:25-32, 1997).
Абсолютные объемы легких измеряли разведением газа с использованием азота в качестве газа-метки (Conrad et al., Pulmonary Function Testing - Principles and Practice, Churchill Livingston Publishers, New York, NY, 1984). Измерения проводили при 0 см H2O транслегочного давления следующим образом. Шприц на 3 литра заполняли 1,5 литрами 100% кислорода из резервуарного мешка. Затем выделенное легкое, содержащее неизвестный объем комнатного воздуха (79% азота), подсоединяли к системе со шприцом, содержащим 0% азота, через трехходовой клапан. Газ тщательно смешивали опусканием поршня шприца 60-100 раз и затем определяли равновесную концентрацию азота с использованием азотомера (Medtronics, Model 830 Nitrogen meter). Неизвестный исходный объем комнатного воздуха легкого рассчитывали затем в соответствии со следующим уравнением сохранения массы:
VL={FN2f/(0,79-FN2f)}·1,5 л,
где FN2f является фракцией азота, измеренной в стационарном состоянии после смешивания с 1,5 литрами кислорода из шприца. Это измерение определяет единый абсолютный объем легкого, который требуется для характеристики статической механики легкого.
Затем регистрировали кривые взаимосвязи давления и объема при квазистатическом выпускании давления (QSPVC) во время ступенчатого выпускания газа от 20 см H2O до 0 см H2O транслегочного давления следующим образом. Легкие заполняли воздухом до транслегочного давления 20 см H2O, а затем трахею закупоривали вручную. Транслегочное давление регистрировали с использованием датчика давления 50 см H2O, помещенного в отверстие воздушного пути. Выдыхаемый объем легкого измеряли с использованием пневмотахографа (Hans Rudolf Inc, Kansas City, МО), соединенного последовательно с трахеальной канюлей. Давление как функцию выдыхаемого объема легких (в сравнении с исходным объемом при 20 см Н2О) определяли, периодически закупоривая трахею. Закупорки поддерживали достаточно долго, чтобы позволить уравновеситься трахеальному и альвеолярному давлениям (когда нет изменения в трахеальном давлении на протяжении трех секунд). Посредством объединения измерения единого абсолютного объема легкого, сделанного посредством азотного разведения при нулевом транслегочном давлении, с данными QSPVC, определяли взаимосвязи между давлением полной статической эластической тяги и объемом легкого. Эти взаимосвязи могут быть описаны в виде экспоненциальной функции в соответствии с уравнением Salazar et al. (J. Appl. Physiol. 19:97-104, 1964):
V(P)=Vmax-Ae-kp,
где V обозначает объем легкого как функцию транслегочного давления; Р обозначает транслегочное давление; Vmax обозначает экстраполированный объем легкого при конечном давлении (приблизительно равном TLC); А является разностью между Vmax и объемом газа, улавливаемым в легком при нулевом транслегочном давлении (приблизительно равном жизненной емкости легких, ЖЕЛ); и k обозначает коэффициент формы, который описывает кривизну экспоненциальной взаимосвязи (зависимости) между давлением и объемом, независимую от абсолютного объема легкого. Параметры Vmax, А и k определяли из линейного регрессионного анализа наилучшего соответствия, а давление тяги легкого при общей емкости легкого (PTLC) определяли прямым измерением.
Можно выражать зависимость между давлением и объемом в виде параметров, описанных выше, поскольку известно, что каждый параметр изменяется характерным образом в случае эмфиземы. Таким образом, можно предвидеть конкретные изменения после вмешательств, предназначенных либо для получения эмфиземы (например, при воздействии папаином в модели животного), либо для коррекции отклонений от нормы, связанных с эмфиземой (например, уменьшение объема легкого; см. Gibson et al. Am. Rev. Resp. Dis. 120:799-811, 1979). Например, Vmax увеличивается в случае эмфиземы вследствие гиперрасширения легких (это отражает увеличение в общей емкости легких); k, коэффициент формы, также увеличивается вследствие уменьшения наклона кривой зависимости между давлением и объемом при низких объемах легких; и А, разность между максимальным объемом легких и уловленным газом легких при нулевом транслегочном давлении, уменьшается, так как уловленный газ увеличивается чрезмерно, несоизмеримо с общей емкостью легких.
После завершения измерений объема легкого и QSPVC, функцию легкого оценивают во время имитированной "приливно-отливной" (с попеременным наполнением и опустошением) вентиляции. Для этой цели был разработан запускаемый соленоидом регулируемый компьютером пневматический аппарат искусственной вентиляции легких. Это устройство позволяет измерять сопротивление легкого и динамическую эластичность во время колебательной вентиляции при мониторинге и поддержании константного указанного пользователем среднего давления дыхательных путей. Ток газа (V) в легкое и из легкого измеряли с использованием пневмотахометра, объем (V) определяли интегрированием сигнала тока газа, а транслегочное давление (Ptp) регистрировали в виде давления отверстия дыхательных путей в сравнении с атмосферным давлением.
Параметры тока газа, выбранные для измерения функции легких, являлись параметрами оптимальной формы волны вентиляции (OVW), разработанной Lutchen et al, (J. Appl. Physiol. 75:478-488, 1993). Эти параметры представляют сумму ряда синусоид, выбранных для обеспечения "приливно-отливной" (с попеременным наполнением и опустошением) вентиляции при одновременной минимизации искажения сигнала вследствие нелинейных эффектов дыхательной системы (Suki et al., J. Appl. Physiol. 79:660-671, 1995). Функцию легкого оценивали определением реактивного сопротивления отношения давления к объемной скорости тока газа, в области частот, с использованием анализа Фурье. Реальная и воображаемая части сигнала реактивного сопротивления представляют сопротивление легкого и реактивное сопротивление легкого, соответственно. Сопротивление легкого, в свою очередь, равно сумме сопротивления ткани (Rti) и сопротивления дыхательных путей (Raw), тогда как реактивное сопротивление легкого определяют комбинированием эффектов эластичности и коэффициента инерции газа. Таким образом, в противоположность стандартной синусоидальной или имеющей константную объемную скорость тока газа вентиляции, измерения OVW позволяют определять сопротивление дыхательных путей, сопротивление ткани и динамическую эластичность (Edyn) на протяжении диапазона частот из одного измерения. Эта подробная информация является полезной по нескольким причинам. Уменьшение объема является процедурой, которая имеет потенциал действия на все три из этих параметров функции легкого. В случае эмфиземы, уменьшение объема должно снижать Raw посредством улучшения связи дыхательных путей, растягивая тем самым дыхательные пути для большей доступности. Однако, поскольку уменьшение объема увеличивает растяжение ткани, она будет иметь тенденцию к увеличению сопротивления ткани. Общее сопротивление легкого, сумма Raw и Rti может, следовательно, подвергаться вариабельному воздействию в зависимости от того, каким образом LVR индивидуально влияет на Raw и Rt1. В большинстве случаев, должен быть некоторый оптимальный диапазон резекции ткани, который может производить существенное уменьшение Raw, но лишь небольшое увеличение Rti. Подход OVW помогает определить этот оптимум. Дополнительным преимуществом подхода OVW является то, что он обеспечивает неинвазивную оценку гетерогенности функции легкого. Присутствие гетерогенности, которая физиологически производит положительную зависимость от частоты в эластичности легкого, может быть обнаружено с использованием способа OVW (Lutchen et al., J. Appl. Physiol. 75:478-488, 1993). В нормальном легком, эластичность является относительно независимой от частоты, так как большинство участков имеют сходные механические свойства, приводящие к однородному распределению газового потока. В больном легком, различия реактивного сопротивления току газа в разных участках существуют, и эластичность легкого увеличивается с увеличением частоты. В эмфиземе зависимость эластичности от частоты является характерным обнаруживаемым явлением и отражает различия тяжести заболевания в разных участках. Успешное уменьшение объема, нацеленное на патологический участок, должно уменьшать гетерогенность и зависимость эластичности легкого от частоты. Таким образом, уменьшение зависимости эластичности от частоты может быть использовано как показатель успешной процедуры BLVR и может быть легко определено из измерения OVW. Ожидается, что любое измерение, сделанное сразу же после BLVR, может давать заниженные результаты улучшения, что станет очевидным, как только образуется зрелый рубец. В это время можно было наблюдать 25-50% улучшения в скоростях тока выдыхаемого газа. Таким образом, любая описанная выше композиция на основе фибрина или на основе фибриногена находится в рамках данного изобретения, если, при применении в процедуре BLVR она дает 25-50%-ное улучшение в скоростях тока выдыхаемого газа.
Измерения объемов легких, квазистатических зависимостей между давлением и объемом и сопротивления легкого и динамической эластичности легкого как функции частоты производили в трех выделенных, не подвергнутых какому-либо воздействию легких теленка до и после уменьшения объема пликацией (образованием складки). Регистрации в динамике производили при среднем транслегочном давлении расширения 9-10 см Н2O (PEEP = 5 см H2O) посредством способа OVW при «приливно-отливных» объемах 10% измеренного Vmax. Небольшие утечки, присутствующие после пликации, герметизировали цианоакрилатным клеем. Приближенно определенное время между начальной записью и записями после уменьшения объема было между 60 и 90 минутами.
Записи физиологии легких до и после уменьшения объемов в выделенных легких теленка суммированы в таблице 1.
Эти результаты показывают, что в нормальных легких теленка 10-15% уменьшение объема (среднее 11,1%) не производит значимого изменения в динамической эластичности, сопротивлении дыхательных путей или сопротивлении ткани. Они показывают также, что подробное функционирование легких может быть измерено в выделенных легких с использованием системы измерений, описанной здесь, и что успешное уменьшение объема легких пликацией может проводиться на выделенных легких, которые служат в качестве контролей для BLVR-экспериментов.
Пример 2: Антисурфактанты на основе фибриногена
Механическое равновесие по всем альвеолам и малым дыхательным путям определяется балансом между силами растяжения, которые проявляются транслегочным давлением газа, выталкивающим наружу, и силами эластической тяги легкого, которая развивается структурами паренхимной ткани и поверхностной пленкой, выстилающей межфазную поверхность раздела воздух-жидкость, причем обе эти составляющие (ткань и пленка) тянут вовнутрь и стимулируют коллапс легкого. Для того чтобы альвеолы и малые дыхательные пути оставались проходимыми (раскрытыми) во время нормального дыхания, дестабилизирующие пертурбации сил должны быть сбалансированы внутренними стабилизирующими силами. Тенденция легких сопротивляться дестабилизации и ателектазу может быть выражена в виде двух биомеханических свойств: модуля объемного сжатия (К) и модуля сдвига (р). Величина К пропорциональна способности легкого сопротивляться деформации, возникающей из сил, направленных перпендикулярно (или нормально) участку ткани (Martinez et al., Am. J. Resp. Crit. Care Med, 155: 1984-1990, 1997), а величина р пропорциональна способности легкого сопротивляться деформации, возникающей из сил сдвига, налагаемых на участок ткани (Stamenovic, Physiol Rev. 70:1117-1134, 1990). Чем больше величины К и р, тем больше тенденция внутренних сил внутри легкого противостоять (сопротивляться) наружным пертурбациям и ателектазу. Напротив, любые факторы, которые понижают К и р, имеют тенденцию стимулировать альвеолярную нестабильность и коллапс, приводящие к ателектазу. Величины модуля сдвига и модуля объемного сжатия зависят как от ткани, так и от свойств поверхностной пленки и могут быть количественно выражены как (Stamenovic, Physiol Rev. 70:1117-1134, 1990):
К=1/3{(B-2)·Ptis}+1/3{(3b-1)·Pγ},
μ=(0,4+0,1B)-Ptis+0,4-Pγ,
где В является нормализованной эластичностью для компонентов ткани (эластина, коллагена и интерстициальных клеток) легкого; Ptis является давлением эластической тяги компонентов ткани в отсутствие эластичности поверхностной пленки; b является нормализованной эластичностью для поверхностной пленки при поверхности раздела воздух-жидкость; и Рγ является давлением эластической тяги поверхностной пленки в отсутствие эластической тяги ткани. В здоровом легком поверхностные силы ответственны за две трети - три четверти эластической тяги легкого, и, следовательно, вклад Рγ в модули объемного сжатия и модули сдвига является прежде всего ответственным за определение стабильности. В эмфиземе, где элементы ткани разрушены и проявляют меньшую эластическую тягу, роль поверхностных сил в определении паренхимной стабильности имеет даже еще большее значение.
Первичной задачей этих экспериментов была разработка биосовместимого реагента, который мог бы быть введен бронхоскопически для получения сайт-специфических изменений в поведении поверхностной пленки, например, для стимуляции нестабильности и коллапса альвеол (т.е. для получения антисурфактанта). Это может быть достигнуто, если выстилка пленкой жидкости альвеол и малых дыхательных путей подвергается уменьшению в модуле объемного сжатия и модуле сдвига в результате химической модификации. По существу, это требует раствора, который может изменять поверхностное натяжение, понижая свойства нативного легочного сурфактанта без продуцирования других нежелательных эффектов. С точки зрения биомедицинской перспективы, характерным параметром поверхностной пленки, на который можно легко повлиять такой наружной химической манипуляцией, является безразмерный параметр эластичности пленки, b, который равен b′·(δγ/δА)(V/A), где γ является поверхностным натяжением пленки; А является площадью поверхности, на которой распределена эта пленка, а b′ является константой пропорциональности, которая варьируется в зависимости от геометрии рассматриваемого участка. Для сурфактанта нормального легкого b′ ·(δγ/δА) (V/A) (определенного в виде b*=b/b′) предполагает величины приблизительно 100-110. По мере уменьшения b (т.е. δγ/δ А становится меньше или у становится больше) в конкретном участке, локальные силы натяжения действуют в большей степени для дестабилизации, а не для стабилизации альвеол. Таким образом, пленки с низкой эластичностью (с относительно однообразным поверхностным натяжением в сравнении с профилями площади поверхности) или повышенными поверхностными натяжениями имеют тенденцию к стимулированию дестабилизации.
Примеры стабильных и нестабильных поверхностных пленок, обнаруживающих эти параметры поведения, показаны на фиг.3а и 3b. Фиг.3а показывает профиль поверхностного натяжения - площадей поверхности, измеренный сурфактометрией с пульсирующими пузырьками (PBS), для нормального сурфактанта при концентрации 1 мг/мл, выделенного из легкого нормальной морской свинки. Он демонстрирует как положительную эластичность пленки (δγ/δА>0), так и минимальное поверхностное натяжение (γmin<3 дин/см). Такая пленка обладает положительными величинами для биофизических параметров b, К и р и, следовательно, могла бы стимулировать стабильность in vivo. В противоположность нормальному сурфактанту, проба, выделенная из животного с острым повреждением легкого и ателектазом после инфузии эндотоксина, показывает почти нулевую эластичность и повышенное минимальное поверхностное натяжение (фиг.3b). Эта пленка имеет модуль объемного сжатия менее нуля и, следовательно, стимулирует альвеолярную нестабильность и коллапс. Хотя эти биофизические признаки являются вредными в условиях острого легочного повреждения, способность придавать такие признаки пленке контролируемым образом является, очевидно, желательной в проведении данных экспериментов.
Поскольку дисфункция, наблюдаемая выше, встречается in vivo, характеристика биохимических изменений в сурфактанте, которые сопровождают эту дисфункцию, будет предполагать биосовместимые реагенты, которые применимы в BLVR. Пробы сурфактанта, выделенные из животных, обработанных липополисахаридом (ЛПС), являются в большей части дисфункциональными в результате изменений граничных свойств вследствие смешивания с сывороточными белками, которые входят в альвеолярный компартмент через поврежденную базальную мембрану (Kennedy et al., Exp.Lung Res. 23:171-189, 1997).
Для определения, могут ли растворы фибриногена добавляться к нативному сурфактанту для получения значимой дисфункции поверхностной пленки, сурфактант теленка выделяли лаважем и центрифугированием из легких теленка, полученных в свежем виде из местной бойни. Бычий фибриноген покупали из фирмы (Sigma Chemical Co., St. Louis, МО). Исходные растворы каждого реагента готовили в обычном солевом растворе и смешивали при соотношениях в мг (фибриноген к содержанию фосфолипидов сурфактанта) 0,1:1, 0,5:1, 1,0:1, 5,0:1 и 10,0:1. Результаты сравнивали со смесью сурфактанта легкого теленка и бычьего сывороточного альбумина.
Регистрации поверхностного натяжения производили сурфактометрией с пульсирующими пузырьками при 37°С, с частотой пульсации 20 циклов/мин и коэффициентом амплитуды площади 72%, непрерывно, в течение 5 минут (Enhorning J. Appl. Physiol. 43:198-203, 1977). На основании измерений поверхностного натяжения в зависимости от площади поверхности, величины для параметра стабильности пленки, (γδ/δА)/(А/γ), определяли и выражали как функцию отношения концентрации белка к концентрации фосфолипида. Эти результаты суммированы на фиг.4а и 4b. Эти результаты предполагают, что фибриноген является более сильным ингибитором функции сурфактанта, чем альбумин, и способен генерировать заметную нестабильность поверхностной пленки (выраженную в виде критерия стабильности пленки b*, при отношениях концентрации белка к концентрации липида менее 5:1). Эти отношения концентраций являются легко достигаемыми in vivo с использованием концентрированных растворов фибриногена.
Для испытания растворов фибриногена в выделенных легких теленка готовили исходные растворы бычьего фибриногена (Sigma Chemical, St. Louis, МО) в 5 мМ Трис-HCl (рН 7,4) и частично очищенного тромбина в 5 мМ Трис-HCl, содержащем 5 мМ CaCl2. Исследования со смешиванием показали, что отношения фибриногена к тромбину между 10:1 и 3:1 (мг:мг) приводили к полимеризации в пределах 3-5 минут. Отношение 10:1 было выбрано для испытания на целых легких. Выделенные легкие теленка канюлировали, подвешивали из кольцевого зажима и подвергали измерениям фонового объема легких и QSPVC, как описано выше. При нулевом транслегочном давлении при прямой бронхоскопической визуализации, бронхоскоп продвигали в дистальный субсегмент с диаметром приблизительно 5 мм. Затем противолежащую поверхность промывали 50 мл раствора фибриногена (10 мг/мл), инъецируемого через полипропиленовый катетер Р-240, проходящий через порт для отсасывания. Раствор фибриногена окрашивали несколькими каплями концентрированного красителя Evans blue для облегчения идентификации участка-мишени. Затем этот катетер удаляли и применяли отсасывание непосредственно через отверстие (порт) для отсасывания бронхоскопа для завершения процедуры промывания. Возврат лаважа был в среднем 28 мл в 4 проведенных процедурах лаважа (возврат 56%). Затем этот катетер перемещали в пораженный участок и вводили инстилляцией 4 мл тромбина в содержащем кальций буфере. Затем проводили вторую процедуру лаважа и полимеризации в другом субсегменте. Затем регистрировали повторные объемы легкого и профили объемов при квазистатическом давлении. Эти результаты суммированы в таблице 2.
Эти данные указывают на то, что даже без добавления фактора XI На для стимуляции стабилизации сгустков достигались уменьшения объема легких, которые значимо превышали удержанный объем полимеризующего раствора, что свидетельствует о достижении длительного коллапса.
Пример 3: Растворы на основе фибриногена и на основе фибрина, содержащие факторы роста
Любой потенциальный антисурфактант мог оцениваться в описанном выше тесте, что показало, что растворы фибриногена обладают многими из признаков, желательных для антисурфактанта. Кроме описанного выше раствора фибриногена, можно использовать растворы, которые придают дополнительные свойства композициям, которые могут быть использованы для проведения BLVR in vivo. Например, раствор фибриногена мог быть модифицирован для поддержания роста фибробластов и для функционирования в качестве резервуара для антибиотиков. Любой модифицированный раствор фибриногена может быть использован в сочетании с факторами, которые усиливают фиброз, пока фибриноген поддерживает способность ингибировать сурфактант и подвергаться полимеризации.
Основной фактор роста фибробластов (bFGF) и/или трансформирующий фактор роста бета (TGFβ) могут быть добавлены к растворам фибриногена, как и антибиотическая смесь ампициллина и гентамицина, которые могут быть добавлены в количествах, достаточных для превышения минимальной ингибирующей концентрации для большинства бактерий.
Исследования in vitro могут проводиться для определения подходящих концентраций фактора XI На относительно фибриногена и тромбина, и оценки, как факторы роста и антибиотики влияют на конечную стадию перекрестного сшивания. Поверхностное натяжение сурфактантных смесей фибриногена может быть измерено in vitro с использованием коммерчески доступного модуля сурфактометра с пульсирующими пузырьками (PBS). Измерения поверхностного натяжения как функции площади поверхности могут проводиться при 37°С, частоте пульсаций 20 циклов/мин и относительном изменении площади поверхности, которое приближается к изменению дыхания с попеременным наполнением и опустошением (5А/А=20-30%).
Могут проводиться регистрации равновесного и динамического поверхностного натяжения. Регистрации могут проводиться при 30 секундах, 5 минутах и 15 минутах для гарантии того, что любая дисфункция поверхностной пленки, наблюдаемая первоначально, удерживается на протяжении всего периода измерений. Стабильность каждого препарата пленки может быть выражена в виде b*, безразмерной эластичности поверхностной пленки (δγ/dA·А/γ), описанной выше, нормализованной относительно величин b*, измеренных для нативного сурфактанта легкого теленка. Смеси, обнаруживающие нормализованные величины b*<0,2, будут приемлемыми для дополнительного испытания в качестве антисурфактантов.
Сурфактант легкого теленка может быть выделен из целых легких теленка, как описано ранее (Kennedy et al., Exp. Lung Res. 23:171-189, 1997), а бычий фибриноген, bFGF, трансглутаминаза фактора XI На и TGFβ могут быть куплены из коммерческих фирм-поставщиков (например, Sigma Chemical Co., St. Louis, МО).
Поведение поверхностного натяжения для проб с отношениями фибриноген:сурфактант в диапазоне между 0,01-10 (мг белка:мг липида) может быть получено в забуференном фосфатом солевом растворе (0,15 М, рН 7,3). Были выбраны следующие шесть смесей, так как они являются характерными смесями, которые могут быть применимы in vivo, и они содержат компоненты частично полимеризованного фибрина, которые могут существовать в легком во время процесса полимеризации. Таким образом, они представляют поведение частично полимеризованных смесей in vivo и могут быть оценены для определения, способен ли фибриноген ингибировать изменения функции сурфактанта, когда он подвергается полимеризации.
Испытуемые смеси (тест-смеси) будут включать в себя сурфактант (при 1 мг/мл) с подходящими количествами: (1) только мономера фибрина; (2) мономера фибрина с FGF и TGFβ; (3) мономера фибрина с FGF, TGFβ, ампициллином и гентамицином (4) фибриногена с FGF и TGFp; (5) фибриногена с FGF, TGFβ, ампициллином и гентамицином и (6) фибриногена с FGF, TGFβ, ампициллином, гентамицином и тромбином. Регистрации данных будут прекращаться для проб, которые подвергаются полимеризации во время измерений поверхностной пленки (что делает невозможными измерения зависимости у от А), и будет отмечаться время, прошедшее до полимеризации.
Стабильность сгустков может быть испытана in vitro на растворах смесей сурфактанта-фибриногена, содержащих антибиотики и факторы роста, которые демонстрируют длительные отклонения от нормы в граничных свойствах при PBS-измерениях. К этим пробам может быть добавлен фактор XI На для стимуляции перекрестного сшивания сгустков. Стабильность сгустков при различных концентрациях добавленного фактора XI На может быть испытана анализом растворения сгустков в 8 М мочевине (время лизиса сгустка плазмы).
Как мономеры фибрина, так и фибриноген должны вызывать значимые изменения в поведении поверхностной пленки (нормализованные величины b*<0,2) при соотношениях белок:фосфолипид >4). Кроме того, добавление тромбина, антибиотиков или факторов роста не должно заметно изменять способность соединений фибрина ингибировать функцию сурфактанта при концентрациях, требующихся для этих реагентов для действия in vivo. Если эти добавки действительно изменяют биофизику взаимодействия между сурфактантом и смесью фибриноген/фибрин, могут быть легко рассмотрены альтернативные реагенты (или альтернативные концентрации реагентов).
Стабильное долгосрочное состояние ателектаза с образованием рубцов в участке-мишени является необходимым для предотвращения частичного или полного повторного растяжения после BLVR. Это состояние может быть достигнуто с использованием биополимера, который стимулирует врастание фибробластов из соседних участков в легком и вызывает депонирование компонентов внеклеточного матрикса (ЕСМ). Процедуры, описанные ниже, могут быть использованы для испытания способности полимеров фибрина, содержащих различные концентрации факторов роста, стимулировать врастание фибробластов. Более конкретно, они могут быть использованы для испытания способности полимеров с варьирующимися концентрациями факторов роста стимулировать как первоначальное прикрепление клеток, так и последующий рост клеток.
Чашки для культуры клеток покрывают смесью фибриногена, антибиотиков, FGF (как с TGFβ, так и без него), и эту смесь полимеризуют добавлением небольшого количества тромбина. Затем чашки промывают стерильной минимальной необходимой средой Игла для удаления избытка реагентов и тромбина и стерилизуют в течение ночи при облучении ультрафиолетом. Первоначально обследуют шесть типов чашек: первая и вторая покрыты полимером фибрина, антибиотиками и FGF при низкой или при высокой концентрации; третья и четвертая покрыты полимером фибрина, антибиотиками и TGFβ при низкой или высокой концентрации; и пятая и шестая покрыты таким же образом, но содержат оба фактора роста при низкой или высокой концентрациях.
Штамм IMR-90 (диплоидные фибробласты человека, доступные из Американской коллекции типовых культур, Manassas, VA) культивируют в минимальной необходимой культуральной среде, содержащей 10% фетальную телячью сыворотку. Клетки доводят до 80%-ной конфлюентности после первоначального засева, затем собирают и пассируют дважды в бессывороточных средах (MCDB-104, Gibco 82-5006ЕА, Grand Island, NY). Затем сформированные культуры субкультивируют на покрытые 6-луночные чашки при исходной плотности 104 клеток/мл. Эффективность прикрепления (АЕ) для каждой смеси покрытия оценивают при 4 часах после высева удалением избытка среды, промыванием лунок в не содержащей культуры среде и фиксацией каждой лунки 70% этанолом гистологической чистоты (Fisher Scientific, Pittsburg, PA). Лунки окрашивают Geimsa и среднее число прикрепленных клеток на поле зрения микроскопа с большим увеличением (hpf) определяют при помощи светового микроскопа. Двадцать полей зрения на лунку оценивают в слепом исследовании. Шесть лунок на одно покрытие берут для определения среднего для конечных чисел клеток и результаты сравнивают с результатами контрольных проб, посеянных на пластиковые чашки для культуры ткани. Эффективность прикрепления выражают в виде индекса (AEI), равного отношению числа клеток/hpf в экспериментальных пробах к числу клеток/hpf в контрольных пробах. Рост клеток на каждой из шести смесей биополимеров оценивают определением общего числа клеток, присутствующих при 48 часах после посева. Рост клеток выражают в виде индекса эффективности роста (GEI), равного общему числу клеток при 48 часах для каждой пробы, нормализованному относительно общего числа клеток при 48 часах роста на пластиковых чашках для культуры ткани. Клетки собирают и считают удалением среды из каждой лунки и промыванием лунок не содержащим кальция/магния раствором Хенка. Среды сохраняют для повторного суспендирования клеток. Один мл 0,2% трипсина добавляют в каждую лунку и клетки инкубируют в течение 2 минут. Затем трипсин удаляют и прикрепленные клетки вымывают из чашки с использованием ранее собранной среды, которая действует для дополнительного ингибирования активности трипсина. Степень остаточной адгезии клеток оценивают прямой визуализацией с использованием инвертированного микроскопа. Оставшиеся прикрепленные клетки удаляют второй трипсинизацией и общие числа клеток получают с использованием гемоцитометра.
Прикрепление клеток к фибриновому полимеру должно быть эквивалентно, или лучше, чем прикрепление, наблюдаемое на пластике для культуры ткани. Если прикрепление клеток является слабым при применении только фибрина, фибриноген смешивают с 3-5% фибронектином и полимеризуют. Фибронектин имеет сайты связывания фибрина как на его амино-, так и на его карбокси-концах, причем центральный связывающий клетки домен, который узнается большинством прикрепленных клеток, экспрессирует β1-интегрины. Добавление фибриногена должно приводить к улучшенной адгезии клеток.
GEI должен также увеличиваться в препаратах, содержащих bFGF при низкой и высокой концентрациях, но может быть пониженным в препаратах, содержащих TGFβ, вследствие супрессирующих действий TGFp на пролиферацию клеток. Однако, должно быть возможным преодоление любых супрессирующих действий, наблюдаемых с использованием TGFp, при помощи комбинации bFGF и TGFR. Эта комбинация имеет потенциал для стимуляции клеточного врастания и для увеличения депонирований коллагена и фибронектина с образованием рубцов. Если bFGF не способен преодолеть антипролиферативные действия TGFp, может быть использован тромбоцитарный фактор роста (PDGF).
Пример 4: Модель эмфиземы на овцах
Исследование на живых животных может помочь установить эффективность, безопасность и продолжительность действия BLVR. Модель эмфиземы на овцах, описанная здесь, проявляет многие физиологические, гистологические и радиографические признаки эмфиземы. В предварительных исследованиях, шесть взрослых овец (весом 27-41 кг) обрабатывали ингаляцией распыленного папаина, коммерчески доступной смеси эластазы и коллагеназы, вводимых через маску-респиратор, использующую две системы распылителей с высокой скоростью потока, соединенные параллельно. Эта система генерирует частицы с диаметром 1-5 мкм. Каждое животное получало 7000 единиц фермента в солевом растворе на протяжении периода 90 минут при 0,3 мл/мин. Приблизительно 30-40% общей дозы, вводимой таким образом, депонировалась на альвеолярном уровне. Одно животное, которое получало солевой раствор в соответствии с таким же протоколом, служило в качестве контроля.
Все животные подвергались подробным измерениям функции легких до и при месячных интервалах после ингаляционных обработок. Оценку после обработки продолжали в течение 3 месяцев. Записи показателей производили после введения анестезии во время регулируемой вентиляции легких. Транслегочное давление регистрировали с использованием датчика давления, который регистрировал разность давления между входным отверстием дыхательных путей и интраторакальным (внутригрудным) давлением, измеренным с использованием пищеводного баллона. Скорость тока при полости рта измеряли при помощи пневмотахографа, присоединенного к проксимальному концу эндотрахеальной трубки. Проводили измерения сопротивления легкого, статической эластичности легкого и динамической эластичности легкого. Через 3 месяца всех животных умерщвляли и готовили срезы легких для гистопатологической оценки.
Результаты статической и динамической эластичности легких, измеренные до подвергания действию папаина и в течение 3 месяцев после обработки папаином, суммированы на фигурах 5а и 5b. Статическая эластичность легкого увеличивалась значимо с 0,13±0,02 до 0,18±0,03 л/см Н2О (р=0,012, n=6), что указывало на гетерогенность заболевания и улавливание газа.
Физиологические изменения, коррелированные с полуколичественной оценкой эмфиземы, оценивали также гистологически. В слепом исследовании, восемь срезов (по одному на долю легкого) из каждого животного оценивали в баллах следующим образом: 0 = нет эмфиземы; 1 = слабая эмфизема; 2 = умеренная эмфизема; 3 = тяжелая эмфизема. Общий балл определяли как среднее из восьми срезов, полученных из каждого животного. Общее сопротивление легкого имело тенденцию увеличиваться с баллом тяжести эмфиземы, хотя эта корреляция не была статистически значимой вследствие присутствия одного выброса (резко отличающегося значения) и малого числа исследованных животных. Динамическая эластичность не показала значимой обратной корреляции с баллом тяжести эмфиземы (фиг.6а и 6b).
Пример 5: Применение BLVR in vivo
Индукция эмфиземы у овец, как описано выше, обеспечивает превосходную модель, в которой можно испытывать как безопасность, так и эффективность BLVR. В описанных ниже исследованиях анализировали восемь овец, имеющих эмфизему; четырех не обрабатывали, а четыре обрабатывали BLVR. Измерения проводили: (1) на фоновой линии до подвергания действию папаина; (2) спустя восемь недель после подвергания действию папаина (в это время у всех животных развивалась эмфизема) и (3) спустя шесть недель после либо симулированной (ложной) бронхоскопии без уменьшения объема легких (контроль), либо после BLVR, проводимого с композицией на основе фибриногена (эксперимент). Более конкретно, экспериментальных животных обрабатывали раствором на основе фибриногена, содержащим 5% фибриноген, который затем полимеризовали 1000 единицами тромбина в 5 мМ растворе кальция.
У всех животных проявлялись физиологические признаки эмфиземы с увеличенным сопротивлением легких, увеличенной динамической эластичностью, увеличенными общими объемами легких и изменениями в статических взаимосвязях между давлением и объемом, согласующихся с мягкой или умеренной эмфиземой. Таким образом, терапия с использованием папаина, вводимого через распылитель, как описано выше, вызывала эмфизему.
Спустя шесть недель, животные с индуцированной папаином эмфиземой, которые не получали никакого лечения, имели стойкие увеличения сопротивления легких (125% при нормальной частоте дыхания в сравнении с базовым уровнем перед обработкой) и динамическую эластичность (31% при нормальной частоте дыхания в сравнении с базовым уровнем перед обработкой). Статическое поведение легких оставалось заметно патологическим в сравнении с базовым уровнем, причем объемы легких увеличивались на 33% в сравнении с базовым уровнем перед обработкой. Эти результаты суммированы ниже в таблице 3 и показаны на фиг.7.
В противоположность этому, после шести недель животные, обработанные BLVR, испытывали значимое уменьшение сопротивления дыхательных путей, общего легочного сопротивления при нормальной частоте дыхания, общей емкости легких и объемов легких в покое. Эти результаты, суммированные в таблице 4, указывают на значимое улучшение в физиологии легких в сравнении с состоянием перед уменьшением объема и значимое улучшение в сравнении с необработанными животными.
Кроме того, все животные, обработанные BLVR, хорошо переносили эту процедуру. Они были способны дышать без поддержки аппарата искусственной вентиляции легких в пределах одного часа завершения процедуры, и все животные ели и пили нормально в пределах 24 часов. Одно из четырех животных развило лихорадочное состояние, которое длилось два дня и было легко снято пятью днями внутримышечной терапии антибиотиками. Другие осложнения не встречались. Таким образом, физиологическая реакция на BLVR была очень положительной.
Пример 6: Действие компонентов ЕСМ на свойства фибриновых гелей
Исследовали действия ХС, ГК, ФН и ПЛЛ на: механические свойства растворов, которые стимулируют коллапс ткани или адгезию ткани; скорость, при которой растворы полимеризуются; и способность таких растворов поддерживать рост фибробластов. Для характеристики механических свойств образовывали круговые гели в чашках с 12 лунками для культуры клеток, вырезали полоски гелей (4×4×10 мм) при помощи лезвия бритвы и модуль упругости (Н) и диссипативный модуль (G) этих полосок при их растяжении с использованием серворегулируемой компьютеризованной системы исполнительного механизма для определения длины и связанного с ней устройства датчика силы. Кроме того, измеряли предел текучести (Ys) для каждого препарата для оценки прочности и стойкости в условиях одноосного натяжения, и усталость испытывали с раствором, содержащим ХС и ПЛЛ (см. ниже). Этот раствор проявлял желательные механические свойства. Скорости полимеризации (kp) оценивали с использованием секундомера и определяли как обратную величину времени, требующегося для ингибирования вращения маленького стержня магнитной мешалки в растворе при 4 л радиан/сек при времени начала полимеризации. Исследования культуры клеток проводили выращиванием фибробластов (WS-1, трансформированной линии фибробластных клеток человека) на предварительно приготовленных гелях, а также внутри гелей, полимеризуемых после смешивания фибриногеновых реагентов со свежими клеточными суспензиями. Для оценки пролиферации клеток число клеток, присутствующих на 10 полей зрения с высоким увеличением, считали после посева при одной концентрации клеток и проводили тест пролиферации клеток с МТТ.
Все испытанные компоненты ЕСМ были растворимы в фибриногене, растворенном в забуференном солевом растворе при рН 7,4, хотя этот раствор требовал нагревания для растворения ГК. Фибриновые гели готовили с использованием водного бычьего фибриногена (фракции VII, Sigma Chemical Co., St. Louis, МО) при конечной концентрации 3%, 2 мМ CaCl2 и 0,025 мМ дипальмитоилфосфатидилхолина (DPPC). Концентрации кальция и DPPC определяли в предварительном исследовании, проводимом для оптимизации скоростей полимеризации фибриногена. Полимеризацию выполняли с использованием тромбина при 100 единиц/мл раствора фибриногена (3,3 единицы тромбина/мг фибриногена). ХС, ПЛЛ и ГК испытывали при 0,01, 0,1 и 0,3% (относительно фибриногена) по весу. Фн испытывали при 0,001 и 0,01%. Результаты сравнивали с гелями фибрина без добавок и с коммерчески доступным фибриновым клеем, продаваемым в качестве герметика тканей (Baxter Pharmaceutical, Tisseal™ ). Пробы испытывали в пределах 30 минут гелеобразования и при 24, 48 и 168 часах после образования геля при поддержании в водном растворе при комнатной температуре.
Действия на механические свойства добавления компонентов внеклеточного матрикса к фибриновым гелям суммированы на фиг.8а и 8b. Добавление низкомолекулярного ГК значимо снижало kp(замедляло полимеризацию), тогда как ХС, ПЛЛ и Фн не влияли на скорости полимеризации. Добавление ХС (при 0,1 и 0,3%) и ПЛЛ (0,05%) увеличивало эластичность геля (Н) на приблизительно 55% и 50%, соответственно, тогда как добавление ГК не оказывало влияния. Изменения в диссипативном поведении (G) полосок геля были параллельными поведению эластичности, так что отношение диссипативного модуля к модулю упругости, эта (η=G/H), остается относительно постоянным для всех препаратов (диапазон (0,1-0,15 для всех проб). Предел текучести геля заметно улучшался добавлением 0,05% ПЛЛ, но добавление других компонентов не оказывало значимого влияния.
Скорости полимеризации и механические свойства фибриновых гелей, содержащих отдельные добавки, использовали для разработки комбинаций геля, которые содержали агенты, которые теоретически должны были бы стимулировать хемотаксис макрофагов и фибробластов и депонирование коллагена. Конечная комбинация геля, содержащая 0,1% ХС, 0,1% ПЛЛ, 0,1% ГК и 0,01% Фн, полимеризовалась быстро, сохраняла ее механические свойства после одной недели в солевом растворе, противостояла разрыву во время повторяемых натяжения и деформации. Кроме того, эти свойства придавались агентами, которые модулируют поведение клеток в зоне коллапса ткани.
Фиг.9 суммирует тесты на усталость, в которых стандартный фибриновый гель сравнивали с фибриновым гелем, содержащим 0,05% ПЛЛ и 0,1% ХС. Модифицированный фибриновый гель демонстрирует более высокий предел текучести и большую способность противостоять связанной с усталостью ошибке при испытании во время повторяемого синусоидального циклического напряжения на протяжении диапазона амплитуд напряжения. Как показано на фиг.9, полоски геля, состоящего только из фибрина, показали тягучий разрыв при гораздо меньших процентных напряжениях, чем раствор фибрина, содержащий ПЛЛ и ХС. "Бесконечная" долговечность препарата модифицированного фибринового клея, представленная напряжением в процентах, ниже которой не происходит отказ действия, является значимо большей (32% напряжение), чем долговечность стандартного фибринового клея (10% напряжение).
Препараты фибринового геля испытывали на их способность поддерживать рост фибробластов не только на их поверхности, но также внутри полимерной смеси при времени полимеризации. Пролиферацию клеток анализировали путем подсчета числа клеток в 10 полях зрения при высоком увеличении и проведением анализа пролиферации с красителем МТТ (3,4,5-диметилтиазол-2-ил-2,5-дифенилтетразолийбромидом). Анализы проводили спустя 96 часов после инициации культуры при исходной плотности посева 2×106 клеток на лунку. Анализы проводили с использованием фибробластов WS-1 человека, а также мышиных фибробластов ЗТЗ, полученных из Американской Коллекции Типовых культур клеток (АТСС; Manassas, VA). Подсчеты нормализовали относительно подсчетов, измеренных на стандартных пластиковых чашках для культуры ткани. Результаты, полученные этими двумя анализами (подсчетом клеток и с МТТ), были сходными (фиг.10а и 10b). В сравнении с ростом на пластиковых чашках для культуры ткани, пролиферация клеток ускорялась как для WS-1, так и для ЗТЗ при выращивании на фибриновых гелях (сверху). ХС (0,1% и 0,3%), Фн (0,001 и 0,01%) и ГК (0,1 и 0,3%) не оказывали дополнительного влияния на скорости роста клеток, большего, чем наблюдаемое на гелях, содержащих только фибрин (фиг.10а, левая панель). Напротив, ни одна из этих добавок не оказывала вредного действия на пролиферацию клеток. Исследования в гелях (фиг.10b) показали, что ХС (0,1%) и Фн (0,01%) стимулируют пролиферацию фибробластов, в сравнении с фибриновыми гелями без добавок и в сравнении с фибриновыми гелями, содержащими ГК. Комбинация ХС и Фн оказывала наиболее серьезное действие. Гистомикрографии фибробластов WS-1 в гелях показывают, что ХС совместно с Фн стимулируют пролиферацию фибробластов и органотипическую организацию. Таким образом, добавление этой комбинации компонентов ЕСМ стимулирует пролиферацию фибробластов и клеточную организацию в линейную и перекресносшитую стрктуры, предполагаемые для характера органотипического роста. Таким образом, фибриновые гели, содержащие ХС (0,1%) и Фн (0,01%), стимулируют пролиферацию фибробластов и картины органотипической организации и роста. ПЛЛ значимо улучшает механические свойства фибриновых гелей посредством увеличения эластичности и сопротивления разрыву. Поскольку ГК замедляет скорости полимеризации без явного улучшения механических свойств гелей на основе фибрина или усиления хемотаксиса in vitro, ГК может быть лучшей добавкой для "антисурфактантного" промывочного раствора, чем сам фибриновый клей. Исследования in vivo, представленные ниже, подтверждают этот вывод.
Пример 7: "Живые" биополимеры
Исследования, описанные выше, которые демонстрируют, что фибробласты легких могут культивироваться в модифицированных фибриновых гелях, показывают, что гели, содержащие клетки, собранные из ткани-мишени пациента, других тканей пациента, другого человека (например, родственника или донора органа) или зародыша (например, фетальной легочной ткани), могут быть использованы для достижения уменьшения объема легкого-мишени. Таким образом, для пациента-человека с эмфиземой, фибробласты, собранные из кожной биопсии, подвергнутые in vitro действию специфических факторов роста и введенные в это легкое с использованием клеев на основе фибрина данного изобретения (которые могут содержать или могут не содержать агенты, описанные выше, например, компоненты ЕСМ), могли бы использоваться для эффективного получения уменьшения объема ткани и стимуляции очагового образования рубцов. Типы используемых клеток могут варьироваться в зависимости от цели, которая должна быть достигнута. Например, комбинация собственных клеток легкого пациента и стволовых клеток (возможно, полученных из фетальной ткани) могла бы использоваться для уменьшения объема легкого и стимуляции роста или возобновления роста тканей легкого.
Пример 8: Исследования in vivo с использованием растворов на основе фибрина
Многие описанные здесь растворы испытывали на безопасность, биосовместимость и применимость в уменьшении объема легких в интактных животных. Безопасность и биосовместимость испытывали на овцах, которые не имели легочного заболевания (т.е. овцах, не подвергнутых действию папаина, который вызывает состояние, подобное эмфиземе). Базовый уровень функции легких животного (в том числе объемы легких и кривые статического раздувания объема в зависимости от давления) измеряли при времени 0 (т.е. до обработки) и во время недель после обработки. Всех животных анестезировали кетамином и Валиумом и поддерживали внутривенным Пропофолом. Пищеводный баллон помещали для измерения интраторакального давления. Животных поддерживали на механическом аппарате для искусственной вентиляции легких во время периодов измерений. Между тестами животных возвращали в их клетки и давали им есть и пить без ограничений.
Описанные здесь эксперименты на целых животных были модифицированы следующим образом. Ранее использовали 50 мл фибринового клея для герметизации каждого субсегмента участка-мишени, но в данном исследовании в каждом участке использовали только 10 мл раствора фибрина (со сосредоточением на биологии, а не в биомеханике, причем целью было ограничение образования абсцесса). Солевой промывочный раствор, объединенный с немодифицированным фибриновым клеем (n=2), сравнивали с модифицированным промывочным раствором (10% этанол, 0,5% фибриноген, 0,3% низкомолекулярная гиалуроновая кислота и 0,01% фибронектин), объединенным с фибриновым клеем, содержащим 0,1% ХС, 0,1% ПЛЛ и 0,05% ГК (n=4). Результаты суммированы на фиг.11, где взаимосвязь между давлением и объемом выражается в соответствии с экспоненциальным уравнением Salazar и Knowles:
V(P)=Vmax-(Vmax-Vmin)e-kP,
где Vmax обозначает общую емкость легкого при максимальном расширяющем давлении; Vmin обозначает остаточный объем легкого при нулевом расширяющем давлении; и k обозначает коэффициент формы (кривой), описывающий форму экспоненциальной взаимосвязи между давлением и объемом. Показаны сравнения Vmax/Vmin и k до обработки и после обработки для обработанных комбинацией солевой раствор+фибриновый клей животных и животных, обработанных комбинацией модифицированный промывочной раствор+модифицированный клей. В животных, обработанных комбинацией солевой раствор+фибриновый клей, не наблюдали различий в максимальных объемах легких (Vmax=3,6±0,28 л до и 3,49±0,62 л после), минимальных объемах легких (Vmin=1/22±0,18 л до и 1,28±0,21 л после) или коэффициенте формы (k=0,19±0,02 до и 0,19±0,05 после). В животных, обработанных промывочными растворами и клеем, как описано выше, для стимуляции роста фибробластов, хемотаксиса и депонирования коллагена, были замечены уменьшения в Vmax (3, 61±0,31 л до и 3,15±0,22 л после; р=0,11 согласно парному t-тесту) и Vmin (1,69±0,31 л до и 1,22±0,23 л после; р=0,007), но k (0,14±0,02 до и 0,15± 0,04 после) оставался неизмененным.
Примеры отдельных взаимосвязей между квазистатическими давлением и объемом из обработанного комбинацией промывочный солевой раствор+фибрин животного и обработанного комбинацией модифицированный промывочной раствор + модифицированный клей животного показаны на фиг.12а и 12b. Животные, обработанные только комбинацией солевой раствор + фибрин, не показали уменьшения в объемах легких в результате терапии. В противоположность этому, животные, обработанные комбинацией модифицированный промывочной раствор + клей, показали заметное уменьшение как Vmax, так и Vmin и смещение вправо всей взаимосвязи между давлением и объемом, что указывает на общее уменьшение объема легкого.
В противоположность исследованию, в котором все животные, обрабатанные 50 мл фибринового клея, нуждались в кислороде после этой процедуры, а 2 из 4 животных нуждались в антибиотиках для устранения лихорадочного состояния, ни одно из животных в группах с обработкой комбинацией солевой промывки или модифицированной промывки + клей не нуждались в кислороде или в антибиотиках. Кроме того, исследования аутопсии на обработанных легких не обнаружили доказательства образования абсцесса.
Эти данные показывают, что модифицированные сурфактантные промывочные растворы и фибриновые клеи, описанные здесь, могут быть использованы для получения безопасной и эффективной терапии с уменьшением объема ткани. Они подтверждают исследования, показывающие, что эффективная терапия с уменьшением объема ткани в легком может быть достигнута без хирургии с использованием биосовместимых клеев, а также устанавливают перспективность подходов с использованием агентов, которые модулируют специфические аспекты биологии фибробластов легкого, альвеолярных клеток, макрофагов и эндотелиальных клеток.
Пример 9: Модифицированные клеи на основе фибрина могут герметизировать утечки воздуха в легком.
Исследования, описываемые далее, показывают, что растворы данного изобретения могут эффективно герметизировать (закупоривать) утечки воздуха в легком. Механические свойства описанных здесь растворов лучше свойств других препаратов на основе фибрина и позволяют новым растворам данного изобретения противостоять разрывам во время повторяемой деформации (фиг.9). Пациенты, подвергающиеся хирургии грудной клетки, будут испытывать благоприятное действие при применении модифицированных клеев на основе фибрина для герметизации воздушных утечек. Хирургия грудной клетки является обычной. Более четверти миллиона пациентов подвергаются этому типу хирургии каждый день по поводу, например, резекции узелков и раков легкого, резекции ткани для подтверждения диагноза неизвестного заболевания легких и резекции хронических инфекций, не поддающихся лечению общепринятыми лекарственными способами терапии. Поскольку легочная ткань является хрупкой, утечки, образующиеся из разрывания ткани, являются обычными после хирургии. Сообщаемая частота встречаемости составляет 25-40%. Разрывы в легких требуют длительных периодов для заживления, особенно в пациентах с тяжелым лежащим в основе заболеванием легких, и продолжительные утечки воздуха способствуют в значительной степени болезненности и смертности.
Применение описанных здесь фибриновых клеев, в частности, клеев, которые модифицированы таким образом, что они содержат компоненты внеклеточного матрикса (ЕСМ), может быть использовано либо в качестве первичной терапии для профилактики утечек в случаях общей торакальной хирургии, либо вторично для заделки существующих или стойких утечек, независимо от того, возникли ли вследствие имевшей место операции или вследствие внутреннего заболевания.
Участок утечки может быть идентифицирован с использованием системы баллонного искатель-инъекционного катетера (фиг.14а и 14b). Как только этот участок был идентифицирован и выделен, могут быть инъецированы растворы дистально для выполнения заделки (герметизации). Эти растворы могут быть идентичными растворам, используемым для выполнения уменьшения объема, так как одни и те же свойства полимеризации, биосовместимости, механические и биологические свойства являются желательными в обоих случаях.
Исследования проводили на выделенных легких теленка с использованием баллонного искателя-инъектора и модифицированных фибриновых клеев для идентификации, локализации и заделки плевральных утечек. Как описано выше и показано на фиг.8а, 8b и 9, добавление биосовместимых полимеров в фибриновых матриксах заметно усиливает образующийся гель-полимер и уменьшает разрывание геля во время циклической усталости (которая имитирует связанное с дыхательными путями напряжение). Эти препараты являются значительно более прочными и более долговечными in vitro, чем общепринятые фибриновые клеи. Модификации, необходимые для увеличения механической прочности этих клеев, не влияют вредным образом на скорости полимеризации гелей. Таким образом, сохраняется точная своевременная доставка.
В трех отдельных экспериментах на выделенных бычьих легких эти клеи полностью заделывали 13 из 17 воздушных утечек после введения через систему искатель-инъекторного катетера. Утечки герметизировались до расширяющих давлений 50 см Н2О. Введение клея во всех случаях уменьшало степень подтекания, как было оценено по уменьшению вытекания через место утечки при фиксированном расширяющем давлении (50 см Н2О).
Другие варианты
Хотя композиции и способы данного изобретения особенно пригодны для применения в человеке, они могут быть также использованы для лечения любого млекопитающего (например, сельскохозяйственных животных, таких как лошади, коровы и свиньи, и домашних животных, такие как собаки и кошки).
Кроме того, описанные здесь композиции могут успешно применяться к различным тканям, иным, чем легкое. Например, они могут применяться для заделки утечек цереброспинальной жидкости; для заделки анастомозов нативных и протезных васкулярных трансплантатов (в том числе трансплантатов, связанных с имплантацией протезных клапанов, таких как митральные клапаны); в диагностических или требующих вмешательства процедурах или эндоскопических или ортопедических процедурах, включающих в себя преднамеренную или случайную пункцию (прокол) стенки сосуда; в пластической хирургии и в случае ткани с очень высоким количеством сосудов (например, почек, печени и селезенки). Описанные выше композиции применимы также для ускорения заживления у диабетических пациентов и для лечения септических ран с длительно сохраняющейся устойчивостью к стандартным подходам, в том числе устойчивых к антибиотикам бактериальных инфекций.
Реферат
Изобретение относится к медицине, а именно к пульмонологии, и может быть использовано при заболеваниях легких, требующих уменьшения объема поврежденной ткани легкого или герметизации его в случае спонтанного пневмоторакса. Для этого через бронхоскоп, подведенный к участку-мишени, по катетеру вводят определенный материал. Количество и природа материала должны быть достаточными для стимуляции адгезии между одной спавшейся частью участка-мишени легкого и другой и фиброза участка-мишени легкого или вокруг участка-мишени легкого, в котором произошел коллапс. Данный материал на основе фармацевтических композиций содержит в своем составе полипептидный фактор роста, компонент внеклеточного матрикса, вазоактивное вещество, про-апоптотический агент. При этом композиции дополнительно включают фибриноген или мономер фибрина, или активатор фибриногена. Изобретение позволяет достичь направленной стимуляции адгезии участка-мишени, фиброза самого участка-мишени или вокруг участка, в котором возник коллапс, что обеспечивает повышение эффективности лечения таких заболеваний легких. 8 н. и 62 з.п. ф-лы, 14 ил., 4 табл.
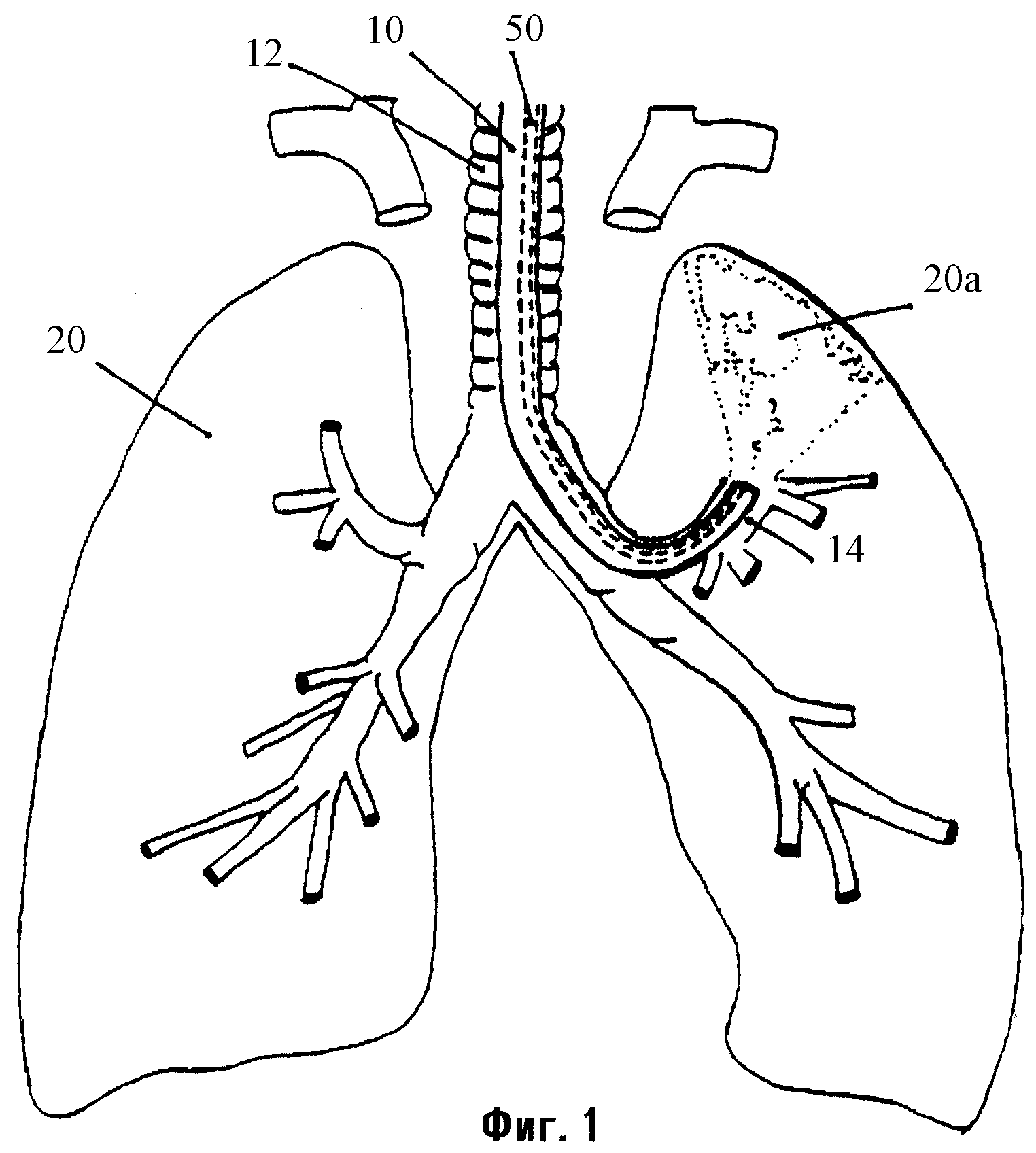
Формула
Документы, цитированные в отчёте о поиске
Способ получения биологического клея, изготовленного из концентрированных коагулирующих факторов посредством "высаливания"

Комментарии