Биопсийная игла с большим межволоконным расстоянием на наконечнике - RU2639037C2
Код документа: RU2639037C2
Чертежи



Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится, в общем, к игле с встроенными волокнами. В частности, изобретение относится к биопсийной игле с боковым углублением для взятия биопсии и встроенными волокнами. Кроме того, изобретение относится к системе, включающей в себя упомянутую иглу, для контроля тканей на основании измерений диффузного отражения и автофлуоресценции, чтобы диагностировать, является ли ткань раковой или нет, перед отбором ткани.
Патентная заявка US 2002/128570A1 раскрывает метод количественного определения перфузии и взятия биопсийной пробы на участке живого тела, при этом прибор, содержащий датчик перфузии, вводят на участке, подлежащем исследованию, чтобы обследовать ткань на данном участке. Образец для биопсии отбирают, когда датчик перфузии выдает сигнал, указывающий на перфузируемую здоровую ткань.
Патентная заявка US 2011/218445A1 раскрывает иглы, оснащенные волокнами для предоставления возможности исследования ткани на основе оптической спектроскопии, чтобы диагностировать, является ли ткань раковой или нет. Предлагается изготавливать иглы, состоящие из четырех частей: внутренней цилиндрической трубки, внешней полой цилиндрической трубки, оконечной части иглы с выходом для встроенного волокна и части держателя, при этом пустое расстояние между внутренним и внешним цилиндрами больше или равно внешнему диаметру волокон, внутренний и внешний цилиндры закреплены в части держателя и причем оконечная часть закреплена на двух цилиндрах.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Чтобы точнее позиционировать биопсийную иглу с контролем по изображениям в подозрительной ткани, требуется зондирование ткани около наконечника устройства. Современная биопсийная игла не располагает подобными возможностями обратной связи с тканью. В последнее время сообщалось об удлиненных интервенционных устройствах, подобных тому, которое показано на фиг. 1, с оптическими волокнами 110, встроенными в устройство 100, допускающее обратную связь с тканями около наконечника устройства. Чтобы допускать распознавание тканей, упомянутые устройства использовали спектроскопию диффузного отражения. Для зондирования хромофоров в ткани, имеющих низкие концентрации, межволоконное расстояние 120 между подводящим и приемным волокнами рассчитывают сделать как можно большим. Обычно игла, подобная устройству 100, имеет лишь ограниченный диаметр. Чтобы сделать расстояние между подводящим и приемным волокнами большим, концы волокна располагают на наклоненной поверхности наконечника иглы, допускающей межволоконные расстояния большие, чем диаметр иглы.
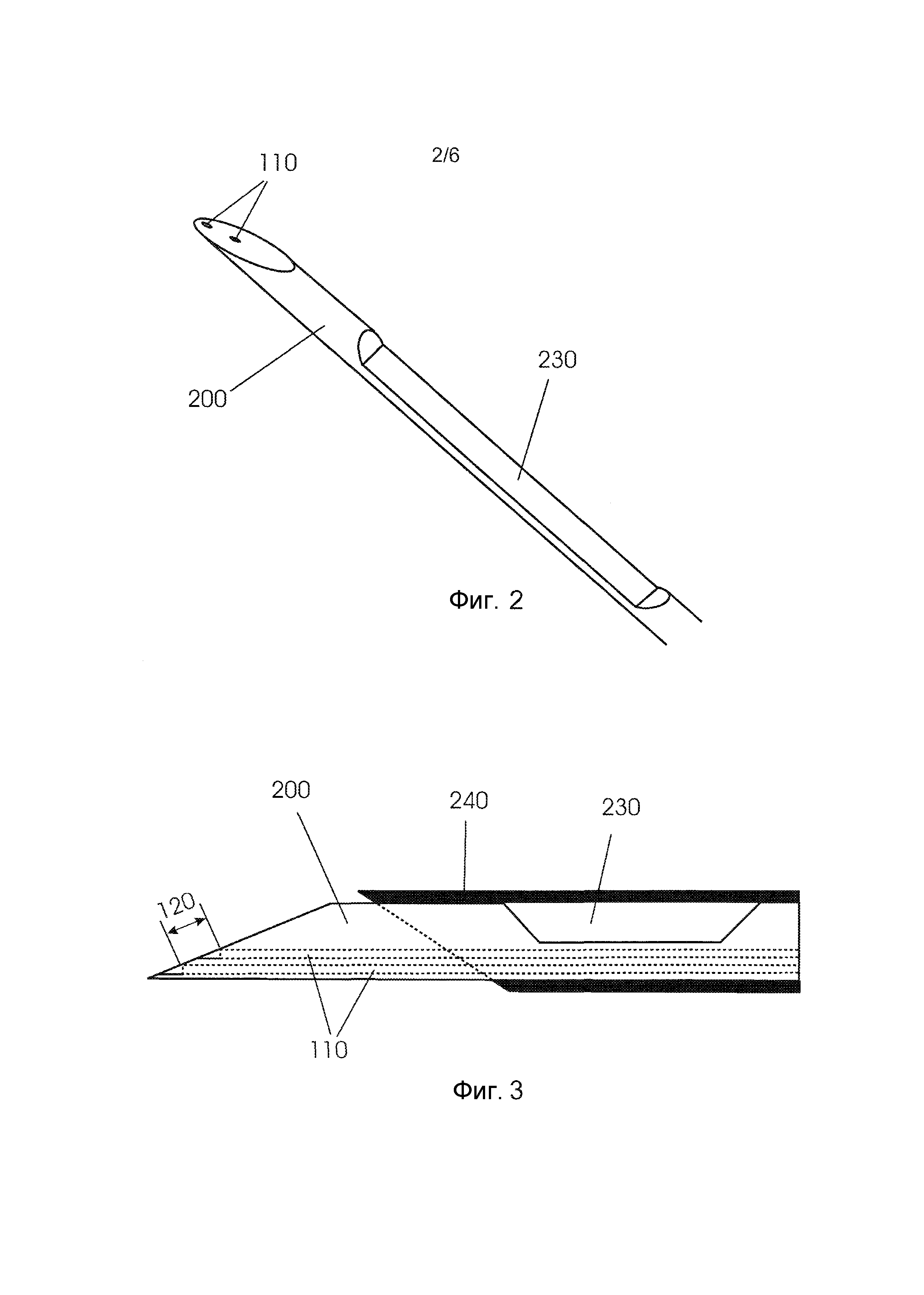
Фиг. 2 и 3 представляют разные виды другого традиционного биопсийного устройства 200 с вырезом 230 на окружности стержня и трубчатым элементом 240 для селективного укрытия выреза. Однако при встраивании волокон 110 в устройство 200 нельзя реализовать большое расстояние между подводящим и приемным волокнами.
Причиной этому является вырез, который необходим для того, чтобы иметь возможность взятия биопсий. В результате этого, при встраивании волокон 110 в биопсийное устройство, и поскольку волокна не должны находиться в вырезе биопсийной иглы, межволоконное расстояние 120, которое можно обеспечить, является лишь небольшим.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью изобретения является создание биопсийной иглы, содержащей вырез или выемку для взятия биопсии, с улучшенными средствами для обследования тканей. Приведенная и другие цели достигаются посредством объекта независимого пункта формулы изобретения. Дополнительные варианты осуществления описаны в зависимых пунктах формулы изобретения.
В общем, биопсийное устройство в соответствии с вариантом осуществления может содержать сплошной стержень и трубчатый элемент. Стержень может размещаться с возможностью перемещения внутри трубчатого элемента и может иметь продольную ось и дистальный конец со скосом. По меньшей мере два канала сформированы внутри стержня в продольном направлении стержня, при этом каждый канал формирует отверстие в скошенной поверхности, причем по меньшей мере одно оптическое волокно размещается внутри каждого из каналов. Кроме того, углубление для вмещения ткани, подлежащей отбору, может быть сформировано в стержне рядом с дистальным концом стержня.
«Скос» является геометрической конструкцией, допускающей введение иглы в ткань. Обычно стержень иглы содержит круглое поперечное сечение. Дистальный конец стержня иглы срезан так, что сформирована овальная поверхность, которая наклонена относительно продольной оси стержня. Скос формирует заостренный наконечник на крайнем дистальном конце иглы. Следует отметить, что скос может формировать острый угол со стержнем таким образом, что игла содержит заостренный наконечник. В предпочтительном варианте, острый угол может составлять, приблизительно, 20°.
В соответствии с вариантом осуществления, скос обращен вверх, а углубление обращено в боковом направлении.
Ниже будут даны определения геометрических аспектов для лучшего понимания. Прежде всего, игла содержит продольную главную ось, обычно центральную ось осесимметричного стержня. Кроме того, участок наконечника иглы срезан под углом к главной оси с формированием скоса. Наблюдение в направлении поверхности скоса, а также стержня означает наблюдение «сверху». Следовательно, наблюдение в противоположном направлении означает наблюдение «вверх». Соответственно, «под» иглой означает противоположно «над». Заостренный наконечник скоса направлен «вперед» от иглы. В результате, при наблюдении «сбоку» можно определить угол между скосом и главной осью и дополнительно можно смотреть на и в углубление, сформированное на боковой стороне. Следовательно, наблюдение в противоположном направлении означает наблюдение «в боковом направлении».
Хотя скошенная поверхность не ориентирована параллельно продольной оси стержня, т.е. вектор нормали скошенной поверхности не ориентирован перпендикулярно продольной оси стержня, данную поверхность следует считать обращенной вверх. Соответственно, хотя вектор нормали бокового углубления может быть наклонен, т.е. может определять угол между направлениями вверх и вбок, следует понимать, что углубление обращено в боковом направлении. Другими словами, пока векторная составляющая вектора нормали скоса ориентирована перпендикулярно продольной оси стержня, скос следует считать обращенным вверх. Соответственно, пока векторная составляющая вектора нормали углубления ориентирована перпендикулярно плоскости, содержащей как продольную ось стержня, так и вектор нормали скоса, углубление следует считать обращенным в боковом направлении.
В соответствии с вариантом осуществления, углубление в стержне биопсийного устройства сформировано так, что вектор нормали углубления ориентирован относительно плоскости, содержащей ось стержня и вектор нормали скоса под углом больше чем 30 градусов, предпочтительно больше чем 45 градусов и более предпочтительно больше чем 70 градусов. Другими словами, углубление расположено относительно скоса со смещением в окружном направлении стержня.
В соответствии с дополнительным вариантом осуществления, вектор нормали углубления ориентирован перпендикулярно относительно плоскости с осью стержня и вектором нормали скоса.
В соответствии с вариантом осуществления, расстояние между двумя отверстиями в скошенной поверхности стержня биопсийного устройства больше, чем диаметр стержня.
В случае двух волокон, в котором оба волокна способны передавать свет, торцевая поверхность одного из волокон может располагаться в верхней части скоса, и другое волокно из волокон может располагаться в нижней части скоса.
Формулировка «верхняя часть скоса» должна указывать на участок, являющийся частью поверхности скоса, при этом данный участок расположен рядом с дистальной кромкой между скосом и стержнем. То есть волокно, которое расположено в верхней части скоса, может располагаться на овальной поверхности скоса, вблизи дистальной кромки, т.е. заостренного наконечника.
С другой стороны, «нижняя часть скоса» означает участок, являющийся частью поверхности скоса, при этом данный участок расположен диаметрально противоположно верхней части скоса. То есть волокно, которое расположено в нижней части скоса, может быть на или вблизи, или около длинной оси овальной поверхности скоса, вблизи проксимальной кромки между скосом и стержнем.
Следует отметить, что торцевая поверхность волокна в отверстии в скосе может иметь круглую форму или овальную форму в случае, по существу, круглого поперечного сечения волокна. В зависимости от угла, под которым волокно будет заканчиваться на скошенной поверхности, будет обеспечиваться форма торцевой поверхности волокна и, следовательно, направление испускания или приема света.
Стержень иглы имеет внешний диаметр, и торцевые поверхности волокон расположены на расстоянии друг от друга. В предпочтительном варианте, расстояние между торцами волокон больше, чем диаметр стержня. Например, расстояние является более чем в 1,1 раза больше, чем диаметр. В частности, расстояние может быть более чем в 1,25 раза больше, чем диаметр. В предпочтительном варианте, расстояние может быть более чем в 1,5 раза больше, чем диаметр. Другими словами, расстояние между торцами волокон в оконечной части иглы должно быть насколько возможно большим. Упомянутые расстояния измеряют от центральной оси одного из волокон до центральной оси другого из волокон.
В соответствии с дополнительным вариантом осуществления, стержень допускает перемещение между первым положением, в котором углубление укрыто трубчатым элементом, и вторым положением, в котором углубление не укрыто трубчатым элементом. Трубчатый элемент может содержать заостренную дистальную кромку.
В соответствии с другим вариантом осуществления, биопсийное устройство дополнительно содержит консоль, содержащую источник света, приемник света и процессорный блок для обработки сигналов, обеспечиваемых приемником света, при этом одно из источника света и приемника света может обеспечивать селективность по длинам волн. Источник света может быть одним из лазера, светоизлучающего диода или источника света с фильтром, и консоль может дополнительно содержать одно из переключателя волокна, светоделителя или дихроичного устройства сведения пучков. Кроме того, устройство может быть выполнено с возможностью выполнения по меньшей мере одного из группы, состоящей из спектроскопии диффузного отражения, диффузной оптической томографии, спектроскопии дифференциальной длины пробега и рамановской спектроскопии.
Вышеописанные аспекты и дополнительные аспекты, признаки и преимущества настоящего изобретения могут быть также получены из примеров вариантов осуществления, описанных в дальнейшем, и поясняются со ссылками на примеры вариантов осуществления. Изобретение подробно описано в дальнейшем со ссылкой на примеры вариантов осуществления, но которыми изобретение не ограничено.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 - изображение известной иглы, содержащей два оптических волокна.
Фиг. 2 - изометрическое изображение известной иглы с вырезом.
Фиг. 3 - вид сбоку иглы, показанной на фиг. 2.
Фиг. 4 - изометрическое изображение биопсийной иглы с углублением сбоку.
Фиг. 5 - вид сверху иглы с углублением сбоку.
Фиг. 6 - вид сбоку иглы с углублением сбоку.
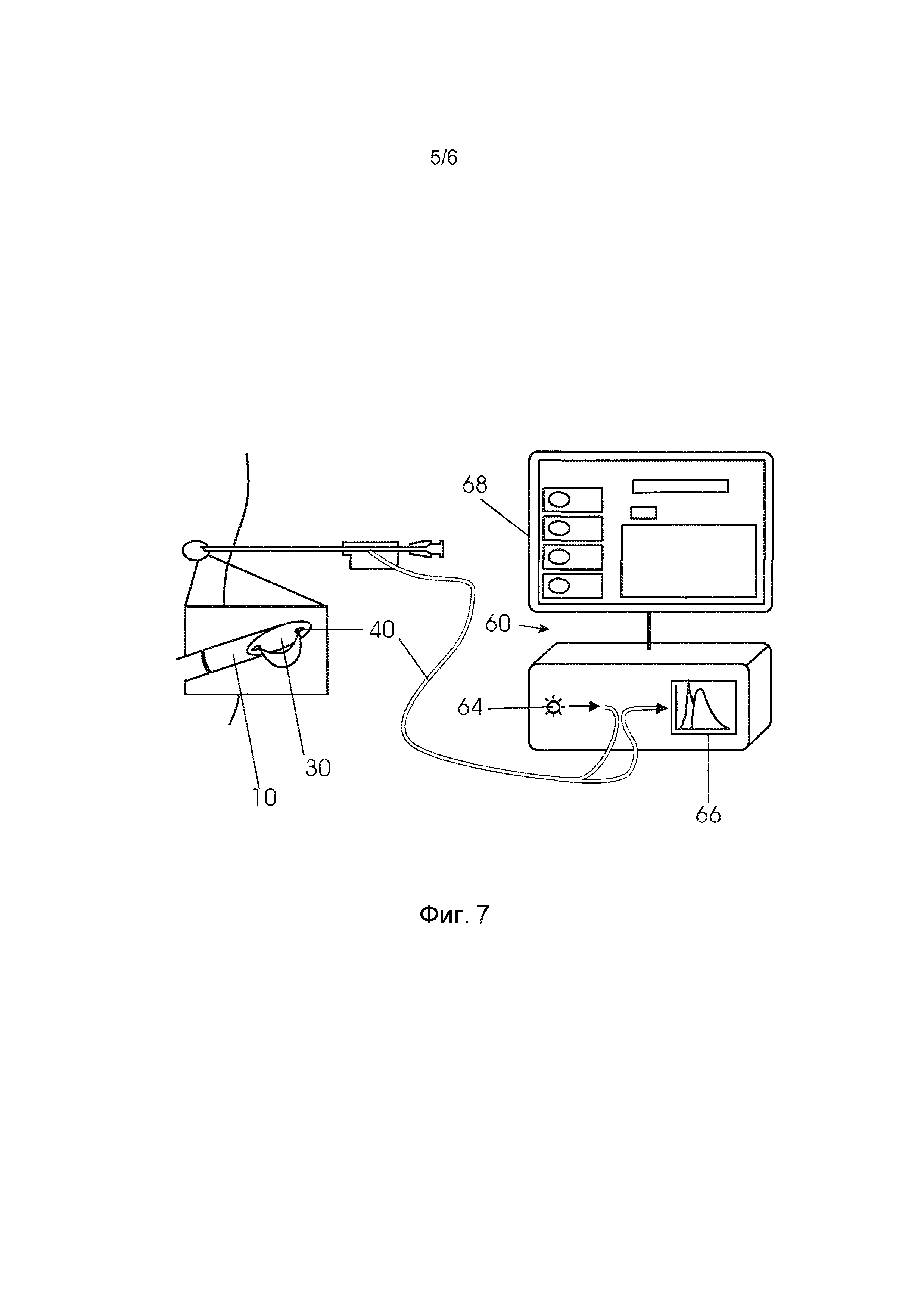
Фиг. 7 - система, содержащая иглу и консоль.
Фиг. 8 - график в логарифмическом масштабе коэффициента поглощения крови, воды и жира.
Изображение на чертежах является всего лишь схематическим и выполнено не в масштабе. Следует отметить, что сходные элементы снабжены одинаковыми позициями на разных чертежах, при необходимости.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
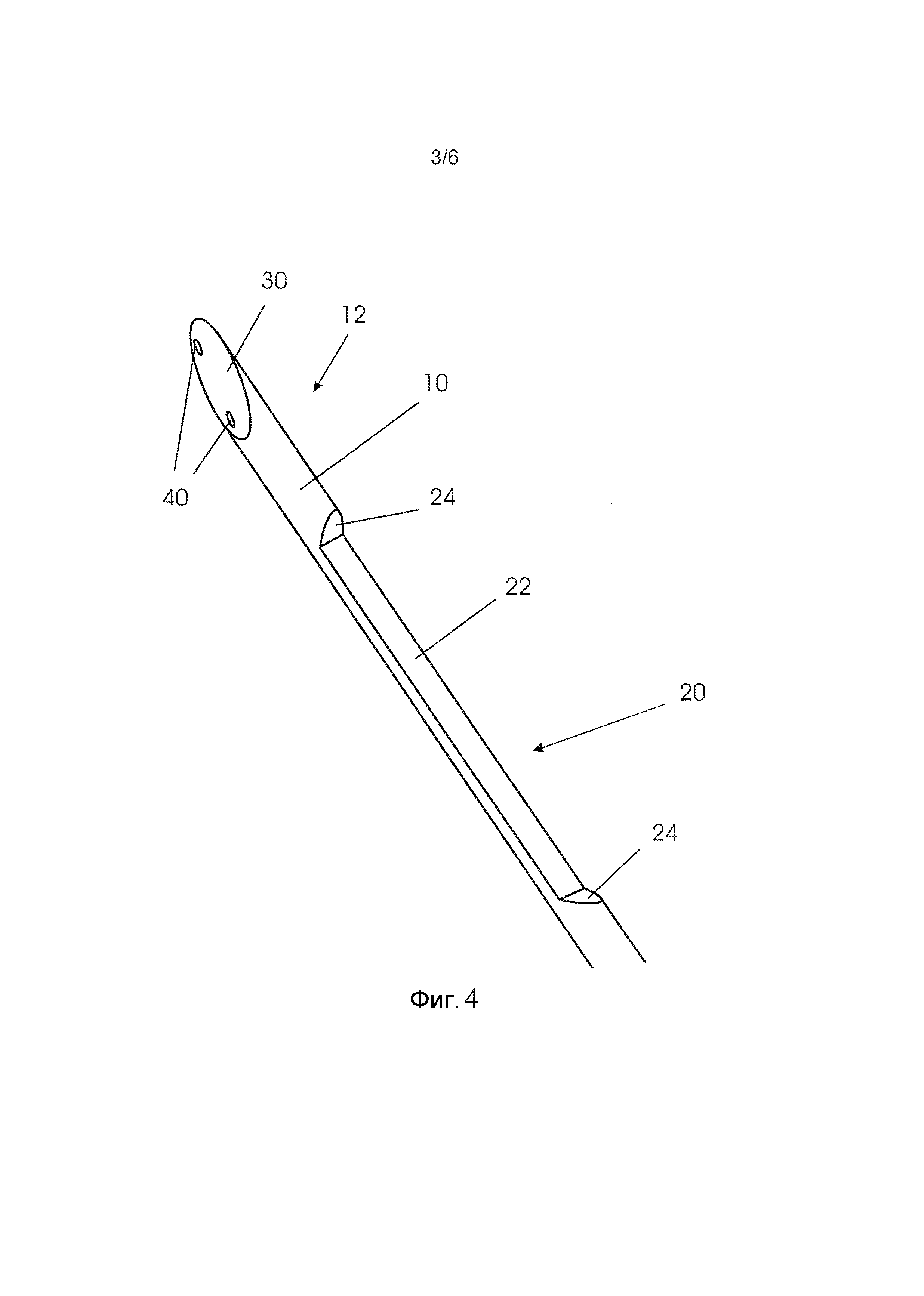
На фиг. 4-6 представлен вариант осуществления биопсийного устройства, которое содержит стержень 10, вырез или углубление 20 рядом с дистальным концом 15, скос 30 на дистальном конце 15, два оптических волокна 40, размещенных в продольном направлении внутри стержня 10, и внешний трубчатый элемент 50, который допускает перемещение относительно стержня.
Как показано на изометрическом изображении на фиг. 4, углубление 20 повернуто в окружном направлении относительно поверхности скоса 30, т.е. сформировано относительно скоса со смещением в окружном направлении. Углубление 20 содержит плоскую нижнюю поверхность 22 и скошенные края 24 на соответствующих концах нижней поверхности. Следует понимать, что углубление может также иметь любую другую подходящую форму, подобную, например, пониженной нижней поверхности с приподнятыми кромками, сформированными в продольном направлении.
Как показано на фиг. 5 и 6, трубчатый элемент 50 имеет такой размер, что сплошной стержень 10 входит в полый трубчатый элемент 50 с тем, чтобы размещаться с возможностью перемещения внутри трубчатого элемента. Во время использования трубчатый элемент 50 будет располагаться относительно стержня подобно тому, как он показан на фиг. 5 и 6, когда биопсийное устройство вводят в ткань. Как только, например, раковая ткань обнаруживается посредством спектроскопии, использующей оптические волокна 40, только стержень 10 можно продвинуть вперед, пока углубление 20 уже не укрывается трубчатым элементом 50. В данной ситуации мягкая ткань может проникнуть в углубление. Затем, трубчатый элемент 50 можно продвинуть вперед с тем, чтобы отрезать ткань посредством заостренной дистальной кромки 55 трубчатого элемента, и поэтому проба ткани может оставаться внутри углубления, будучи, таким образом, надежно огражденной для извлечения из ткани посредством вытягивания биопсийного устройства из ткани.
Внутри стержня в продольном направлении стержня сформированы два канала для вмещения оптических волокон 40. Каналы и, следовательно, оптические волокна расположены в материале стержня, который остается около углубления, как можно видеть с первого направления на фиг. 5, и расположены на максимальном расстоянии друг от друга, как можно видеть со второго направления на фиг. 6. В результате, концы волокон 40, расположенные на поверхности скоса 30, могут иметь расстояние 45 друг от друга, которое может быть больше, чем диаметр 16 стержня 10.
Как показано на фиг. 5, каналы с оптическими волокнами 40 могут быть обеспечены с поперечным смещением относительно оси 14 стержня. В частности, плоскость, содержащая два волоконных канала, может располагаться параллельно и на ненулевом расстоянии от плоскости, содержащей ось стержня и вектор нормали скоса. С данной целью углубление 20 может иметь максимальную глубину, приблизительно половину диаметра стержня.
Следует отметить, что «скос» может также иметь другую форму или конструкцию на наконечнике иглы, пригодную для введения иглы в ткань. Например, скос может быть выпуклой или вогнутой поверхностью, или скос может быть сочетанием нескольких небольших поверхностей, при этом данные поверхности соединены друг с другом ступеньками или кромками. Кроме того, возможно, что сечение стержня срезается скосом не полностью так, что остается участок, который является тупым, т.е., например, ориентированным перпендикулярно относительно продольной оси стержня. Данный «тупой» конец может содержать скругленные кромки или может также формировать скругленную рабочую кромку. В другом примере острый край может быть сформирован двумя или более скошенными поверхностями, симметрично или асимметрично расположенными для формирования наконечника иглы.
Как изложено выше, вектор нормали углубления должен быть, по меньшей мере, наклонен, имея, тем самым, векторную составляющую, перпендикулярную относительно плоскости, содержащей ось стержня и вектор нормали скошенной поверхности. На фиг. 5 показан вектор N1 нормали, при этом данный вектор задан перпендикулярно плоской нижней поверхности 22 углубления 20. Вектор N1 на фиг. 5 перпендикулярен плоскости, содержащей ось 14 стержня и вектор N2 нормали скошенной поверхности.
Вектор N2 нормали показан на фиг. 6, при этом данный вектор задан поверхностью скоса 30. На фиг. 6 дополнительно показаны векторные составляющие N2x и N2y, при этом векторная составляющая N2x продолжается параллельно продольной оси 14 стержня, и векторная составляющая N2y продолжается перпендикулярно продольной оси стержня. Следует понимать, что вектор N1 нормали также можно разложить на векторные составляющие, например, в варианте осуществления, в котором вектор нормали углубления наклонен относительно плоскости, содержащей ось 14 стержня и вектор N2 нормали скошенной поверхности.
Как показано на фиг. 7, волокна 40 интервенционного устройства соединены с оптической консолью 60. Оптические волокна можно представлять как световоды или оптические волноводы. В варианте осуществления, консоль 60 содержит источник 64 света в форме галогенного широкополосного источника света со встроенным обтюратором и фотоприемник 66. Фотоприемник 66 может разрешать свет с длиной волны, по существу, в видимой и инфракрасной областях волнового спектра, например, от 400 нм до 1700 нм. Сочетание источника 64 света и приемника 66 допускает измерения диффузного отражения. Подробное описание измерений диффузного отражения смотри в работе R. Nachabe, B.H.W. Hendriks, A.E. Desjardins, M. van der Voort, M.B. van der Mark, and H.J. CM. Sterenborg, «Estimation of lipid and water concentrations in scattering media with diffuse optical spectroscopy from 900 to 1600nm», J. Biomed. Opt. 15, 037015 (2010).
С другой стороны, можно предположить также другие оптические способы, подобные диффузной оптической томографии, при использовании множества оптических волокон, спектроскопии дифференциальной длины пробега, флуоресценции и рамановской спектроскопии, для выделения свойств тканей.
Процессор преобразует измеренный спектр в физиологические параметры, которые служат признаком состояния ткани, и монитор 68 можно использовать для визуализации результатов.
Компьютерная программа, выполняемая в процессоре, может обеспечиваться на подходящем носителе, например оптическом носителе информации или твердотельном носителе, поставляемом совместно или в составе процессора, но может также распространяться в других формах, например по сети Internet или в других проводных или беспроводных системах связи.
Для флуоресцентных измерений консоль должна быть способна обеспечивать возбуждающий свет в по меньшей мере одно подводящее волокно, при одновременном обнаружении флуоресценции, генерируемой тканью, по одному или более приемным волокнам. Источник возбуждающего света может быть лазером (например, полупроводниковым лазером), светоизлучающим диодом (СД) или источником света с фильтром, например ртутной лампой с фильтром. В общем, длины волн, испускаемые источником возбуждающего света, короче, чем диапазон длин волн флуоресценции, которая подлежит обнаружению. Возбуждающий свет предпочтительно отфильтровывать с использованием приемного фильтра во избежание возможной перегрузки приемника возбуждающим светом. Когда присутствует несколько флуоресцентных объектов, которые необходимо различать друг от друга, требуется приемник с селекцией по длине волны, например спектрометр.
В случае, если измерения флуоресценции планируется сочетать с измерениями диффузного отражения, возбуждающий свет для измерения флуоресценции может обеспечивать такое же подводящее волокно, как свет для диффузного отражения. Этого можно добиться посредством, например, использования переключателя волокна или светоделителя, или дихроичного устройства сведения пучков с фокусирующей оптикой. В качестве альтернативы можно использовать отдельные волокна для обеспечения возбуждающего света для флуоресценции и света для измерений диффузного отражения.
Для выполнения спектроскопии собранные спектры можно аппроксимировать с использованием специально разработанного алгоритма Matlab 7.9.0 (Mathworks, Natick, MA). В данном алгоритме реализована общепринятая аналитическая модель, а именно модель, примененная в работе T.J. Farrel, M.S. Patterson and B.C.Wilson, «A diffusion theory model of spatially resolved, steady-state diffuse reflectance for the non-invasive determination of tissue optical properties», Med.Phys. 19 (1992) p.879-888, которая в полном объеме включена в настоящую заявку посредством ссылки. Входными параметрами для модели в данной ссылке являются коэффициент μa(λ) поглощения, коэффициент μ'a(λ) приведенного рассеяния и межцентровое расстояние между испускающим и собирающим волокнами на наконечнике зонда.
В последующей части приведено краткое пояснение модели. Используемые формулы основаны, главным образом, на работе Nachabe и др. и, следовательно, приводится ссылка на работу R. Nachabe, B.H.W. Hendriks, M. van der Voort, A.E., and H.J.C.M. Sterenborg «Estimation of biological chromophores using diffuse optical spectroscopy: benefit of extending the UV-VIS wavelength range to include 1000 to 1600 nm», Optics Express, vol. 18, 2010, pp. 1432-1442, которая в полном объеме включена в настоящую заявку посредством ссылки, и дополнительно приводится ссылка на работу R. Nachabe, B.H.W. Hendriks, A.E. Desjardins, M. van der Voort, M.B. van der Mark, and H.J.C.M. Sterenborg, «Estimation of lipid and water concentrations in scattering media with diffuse optical spectroscopy from 900 to 1600nm», J. Biomed. Opt. 15, 037015 (2010), которая также в полном объеме включена в настоящую заявку посредством ссылки.
Для описания зависимости приведенного сканирования от длины волны можно использовать двойную степенную функцию, в которой длина волны λ выражена в нм и нормирована по значению λ0=800 нм длины волны. параметр α соответствует амплитуде приведенного рассеяния на данной конкретной длине волны.
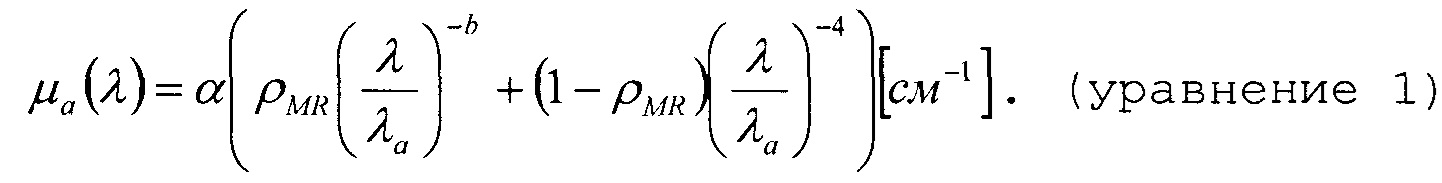
В приведенном уравнении коэффициент приведенного рассеяния выражен в виде суммы рассеяния Ми и Релея, где ρMR означает долю рассеяния Ми в общем приведенном рассеянии. Крутизна приведенного рассеяния для рассеяния Ми обозначена b и связана с размером частиц. Для гомогенного распределения поглотителей коэффициент суммарного поглощения света можно вычислить как произведения коэффициентов экстинкции и объемной доли поглотителей (см. фиг. 8)

Вместо моделирования коэффициента μa(λ) поглощения в виде суммы коэффициентов поглощения, взвешенных по соответствующим концентрациям четырех представляющих интерес хромофоров, было принято решение выражать коэффициент поглощения ткани в виде
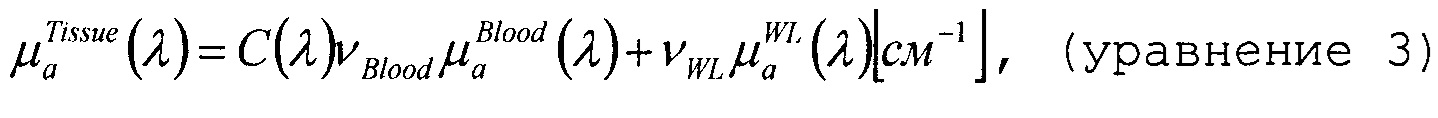
где

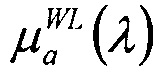
Коэффициент C является поправочным коэффициентом, зависящим от длины волны, который учитывает влияние упаковки пигмента и изменяется для формы спектра поглощения. Упомянутое влияние можно объяснить тем, что кровь в ткани ограничена очень небольшой долей общего объема, а именно кровеносными сосудами. Поэтому эритроциты вблизи центра сосуда поглощают меньше света, чем эритроциты на периферии. Фактически, при гомогенном распределении внутри ткани, меньшее число эритроцитов будет производить такое же поглощение, как фактическое число эритроцитов в отдельных сосудах. Поправочный коэффициент можно описать в виде
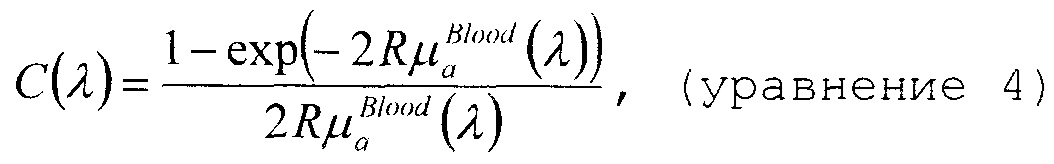
где R означает средний радиус сосуда, выраженный в см. Коэффициент поглощения, зависящий от крови, имеет вид

где


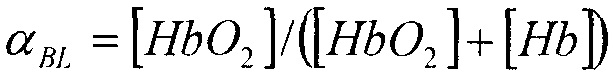
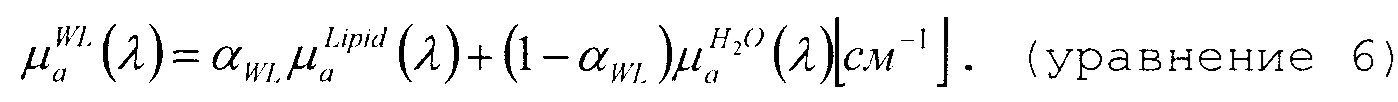
В данном случае, концентрацию липида относительно суммарной концентрации совместно липида и воды можно записать в виде

Приведенный метод установления связи между параметрами воды и липида в выражении коэффициента поглощения, определенном уравнением 6, вместо оценки по отдельности объемной доли воды и липида, соответствует минимизации ковариантности основных функций для аппроксимации, приводящей к более стабильной аппроксимации, сравните со ссылкой R. Nachabe, B.H.W. Hendriks, M. van der Voort, A.E., and H.J.C.M. Sterenborg «Estimation of biological chromophores using diffuse optical spectroscopy: benefit of extending the UV-VIS wavelength range to include 1000 to 1600 nm», Optics Express, vol. 18, 2010, pp. 1432-1442. Дополнительное разъяснение и проверка правильности данной теоремы сделаны в работе R. Nachabe, B.H.W. Hendriks, A.E. Desjardins, M. van der Voort, M.B. van der Mark, and H.J.C.M. Sterenborg, «Estimation of lipid and water concentrations in scattering media with diffuse optical spectroscopy from 900 to 1600nm», J. Biomed. Opt. 15, 037015 (2010).
Например, с помощью описанного алгоритма могут быть получены такие оптические свойства ткани, как коэффициент рассеяния и коэффициент поглощения разных тканевых хромофоров: например гемоглобина, оксигемоглобина, воды, жира и т.п. Данные свойства различаются между нормальной здоровой тканью и больной (раковой) тканью.
Основными поглощающими составными частями в нормальной ткани, преобладающими в поглощении в видимом и ближнем инфракрасном диапазонах, являются кровь (т.е. гемоглобин), вода и жир. На фиг. 8 представлен коэффициент поглощения данных хромофоров в виде функции длины волны. Следует отметить, что кровь преобладает в поглощении в видимом диапазоне, а вода и жир преобладают в ближнем инфракрасном диапазоне.
Суммарный коэффициент поглощения является линейной комбинацией коэффициентов поглощения, например, крови, воды и жира (следовательно, для каждой составляющей значение, показанное на фиг. 8, умножается на ее объемную долю). Посредством аппроксимации модели к измерению, при одновременном использовании степенного правила для рассеяния, можно определить объемные доли крови, воды и жира, а также коэффициент рассеяния.
Иглы в соответствии с изобретением можно применять при минимально инвазивных вмешательствах иглой, например болезненных вмешательствах в зоне поясницы или взятии биопсий в области диагностики рака, где требуется определение характеристик ткани вокруг иглы.
Ниже описаны примерные иглы в соответствии с изобретением, по их внешнему диаметру, длине их введения и их предпочтительному применению.
Биопсийная игла может иметь внешний диаметр от 1,27 мм до 2,108 мм, может быть введена в ткань на от 100 мм до 150 мм ее длины и может применяться при толстоигольной биопсии мягкой ткани в шее, голове, молочной железе, предстательной железе и печени.
Аспирационная тонкая игла для мягкой ткани может иметь внешний диаметр от 0,711 мм до 2,108 мм, может быть введена в мягкую ткань на от 100 мм до 150 мм ее длины и может применяться для аспирации мягкой ткани.
Биопсийная игла для головного мозга может иметь внешний диаметр 2,108 мм, может быть введена в ткань на от 150 мм до 250 мм ее длины и может применяться для диагностических биопсий головного мозга.
Наконец, устройство может содержать игольчатый электрод, имеющий внешний диаметр 2,108 мм и меньше, при этом электрод можно вводить в ткань на вплоть до 250 мм его длины и можно применять для радиочастотной абляции, например, опухолей.
Хотя изобретение подробно представлено на чертежах и охарактеризовано выше в описании, упомянутые чертежи и описание следует считать наглядными или примерными, а не ограничивающими; изобретение не ограничено раскрытыми вариантами осуществления. Специалистами в данной области техники, в ходе практического применения заявленного изобретения, после изучения чертежей, описания и прилагаемой формулы изобретения, могут быть разработаны и реализованы другие изменения раскрытых вариантов осуществления.
В формуле изобретения формулировка «содержащий» не исключает других элементов или этапов, и признак в единственном числе не исключает множества. Очевидное обстоятельство, что некоторые признаки упомянуты во взаимно различающихся зависимых пунктах формулы изобретения, не означает невозможность применения комбинации упомянутых признаков в подходящем случае. Никакие позиции в формуле изобретения нельзя считать ограничивающими объем изобретения.
СПИСОК ПОЗИЦИЙ
10 стержень
20 углубление
30 скос
40 оптическое волокно
45 межволоконное расстояние
50 трубчатый элемент
55 дистальная кромка
60 консоль
64 источник света
66 приемник света
68 монитор
100 игла
110 оптическое волокно
120 межволоконное расстояние
200 игла
230 вырез
N1, N2 вектор нормали
Реферат
Изобретение относится к медицинской технике, а именно к биопсийным устройствам. Устройство содержит стержень и трубчатый элемент. При этом стержень размещается с возможностью перемещения внутри трубчатого элемента. Причем стержень имеет продольную ось и дистальный конец, причем на дистальном конце стержня сформирован скос, который обращен вверх. Причем по меньшей мере два канала сформированы внутри стержня в продольном направлении стержня. Каждый канал формирует отверстие в скошенной поверхности, причем оптическое волокно размещается внутри каждого из каналов для оптического контроля ткани в контакте со скосом. Причем углубление сформировано в стержне рядом с дистальным концом стержня и обращено в боковом направлении. Причем направление вверх и боковое направление являются направлениями, которые взаимно смещены в окружном направлении вокруг продольной оси стержня. 12 з.п. ф-лы, 8 ил.

Комментарии