Способ извлечения чистого 225ac получаемого из облученных 226ra-мишеней - RU2432632C2
Код документа: RU2432632C2
Чертежи


Описание
Настоящее изобретение относится к способу извлечения чистого225Ас, получаемого из облученных226Ra-мишеней, нанесенных на подложку, в соответствии с пп.1-3 Формулы изобретения. Кроме того, в соответствии с п.21 Формулы изобретения, настоящее изобретение относится к радиоизотопному составу, содержащему225Ас.
В частности, радионуклид225Ас, связанный с опухолеспецифическими антителами, может быть с успехом использован в медицинской радиологии, в различных клинических испытаниях и при лечении раковых заболеваний, в частности, в виде своего дочернего нуклида213Bi.
Критерии выбора радионуклидов для иммунотерапии с использованием α-излучателей и β-излучателей впервые были предложены еще в 1993 году (Geerlings, M.W. (1993): Int. J. Biol. Markers, 8, 180-186: "Radionuclides for radioimmunotherapy: criteria for selection"); при этом оказалось, что из-за разницы в энергиях радиоактивность используемых α-излучателей может быть более чем в 1000 раз ниже радиоактивности соответствующих β-излучателей при условии достижения одинакового эффекта.
Кроме того, в вышеуказанной литературе отмечалось, что α-излучающий радионуклид225Ас и его дочерний изотоп213Bi являются весьма перспективными объектами для радиоиммунотерапии наряду с такими α-излучателями, как211At,255Fm,212Bi/212Pb,224Ra,233Ra, которые могут быть в принципе использованы для указанных целей, однако либо являются труднодоступными, либо образуют нестабильные конъюгаты с антителами.
Одно из фундаментальных исследований, давших начало использованию α-излучателей в радиоиммунотерапии, опубликовано в работе Geerlings, M.W., Kaspersen, F.M., Apostolidis; С, Van Der Hout, R. (1993): Nuclear Medicine Communications 14, 121-125, "The feasibility of225Ac as a source of α-particles in radioimmunotherapy". В указанной работе описано, что225Ас, получаемый из229Th, и его (225Ас) дочерний изотоп, а именно213Bi, пригодны для использования в радиоиммунотерапии совместно с α-излучателями. В подтверждение этому, в частности, описано лечение рака и микрометастаз, злокачественных опухолей с использованием опухолеспецифических моноклональных антител в качестве переносчиков α-излучателей.
Дальнейшие исследования Kaspersen, F.М., Bos, Е., Doornmalen, A.V., Geerlings, M.W., Apostolidis, С., Molinet, R., опубликованные в журнале (1995): Nuclear Medicine Communications, 16, 468-476: "Cytotoxicity of213Bi- and225Ac-immunoconjugates", подтвердили и выявили количественную оценку цитотоксического эффекта213Bi и225Ас в испытаниях in vitro с использованием клеточной линии А431 эпидермоидных опухолей человека.
Кроме того, было предложено использование213Bi для лечения злокачественных заболеваний кровеносной системы.
Кроме того, в публикации Kaspersen et al. 1995 был описан способ, в соответствии с которым антитела могут быть химически связаны с хелатирующим агентом, пригодным для связывания213Bi и225Ас.Было показано, что особенно пригодным для этой цели является, например, п-изотиоцианатобензил-диэтилентриамин-пентаацетат (бензил-DTPA).
Другой хелатирующий агент, а именно циклогексил-DTPA, описан, например, в публикации Nikula, Т.К., McDevitt, M.R., Finn, R.D., Wu, С., Kozak, R.W., Garmestani, К., Brechbiel, M.W., Curcio, M.J., Pippin, C.G., Tiffany-Jones, L., Geerlings, M.W., Sr., Apostolidis, C., Molinet, R., Geerlings, M.W., Jr., Gansow, OA, Scheinberg, D.A. (1999): J. Nucl. Med., 40, 166-176: "Alpha-Emitting Bismuth Cyclohexylbenzyl DTPA Constructs of Recombinant Humanized Anti-CD33 Antibodies: Pharmacokinetics, Bioactivity, Toxicity and Chemistry".
Обзор химических свойств хелатирующих агентов можно найти, например, в публикации Hassfjell, S. und Brechbiel, W. (2001): Chem. Rev., 101, 2019-2036: "The Development of the α-Particle Emitting Radionuclides212Bi and213Bi, and Their Decay Chain Related Radionuclides, For Therapeutic Applications".
В настоящее время различные радиоиммунотерапевтические способы применения225Ас и213Bi для лечения раковых заболеваний находятся в различных стадиях клинических испытаний.
Далее рассмотрены два перспективных терапевтических подхода, которые могут в качестве примера способствовать пониманию медико-клинической важности настоящего изобретения.
В одной работе, Jurcic, J.G., Larson, S.M., Sgouros, G., McDevitt, M.R., Finn, R.D., Divgi, C.R. Ase, M.B., Hamacher, K.A., Dangshe, M., Humm, J.L, Brechbiel, M.W., Molinet, R., Scheinberg, D.A. (2002) в журнале Blood, 100, 1233-1239, сообщают о значительном успехе, достигнутом в лечении пациентов, страдающих острой миелогенной лейкемией (AML) и хронической миелогенной лейкемией (CML), благодаря применению213Bi, который связывается с HuM195, моноклональным антителом связывающим CD33-антиген, которое было разработано для лечения людей. Указанное исследование было первым решающим экспериментом, в котором человека подвергали лечению посредством систематической радиоиммунотерапии, включающей использование α-излучателя, который транспортировался к опухолеспецифической клеточной мишени.
В другой работе, в публикации Huber, R., Seidl, С., Schmid, Е., Seidenschwang, S., Becker, K.-F., Schumacher, C., Apostolidis, C., Nikula, Т., Kremmer, E., Schwaiger, M., Senekowitsch-Schmidtke, R. (2003): Clinical Cancer Research (Suppl.) 9, 1s-6s: "Locoregional α-Radioimmunotherapy of Intraperitoneal Tumor Cell Dissemination Using a Tumor-specific Monoclonal Antibody", сообщают о терапевтической эффективности213Bi-d9MAB в сочетании с низкой токсичностью по отношению к костному мозгу и о возможном применении локорегионарной терапии к пациентам, страдающим желудочной карциномой с выраженным d9-E-кадгерином.
Более подробно результаты аналогичных исследований и некоторые их аспекты изложены в докторской диссертации Roswitha Huber, Факультет ветеринарной медицины Университета Людвига Максимилиана в Мюнхене (Ludwig-Maximilians-University of Munich), защищенной 18 июля 2003 года: "Bewertung der lokoregionalen Radioimmuntherapie disseminierter Tumorzellen des diffusen Magenkarzinoms mit einem213Bi gekoppelten tumorspezifischen Antikδrper im Mausmodell" (Оценка локорегионарной радиоиммунотерапии рассеянных опухолевых клеток диффузной желудочной карциномы при действии связанного с213Bi опухолеспецифического антитела у мышей).
Эта диссертация была выполнена в клиниках Nuklearmedizinische Klinik и Poliklinik Технического Университета Мюнхена, университетской больницы "Klinikum rechts der Isar", декан: проф., др. М.Schwaiger. Диссертация была подготовлена под руководством профессора, доктора медицины Reingard Senekowitsch-Schmidtke и была представлена на ветеринарном факультете под руководством профессора, доктора ветеринарной медицины К. Tempel в Институте Фармакологии, Токсикологии и Фармацевтики, на Факультете ветеринарной медицины Университета Людвига Максимилиана в Мюнхене, директор: профессор, доктор ветеринарной медицины R. Schulz.
По данным Huber 2003, каждый год у 18 из 100000 жителей Германии обнаруживают карциному желудка. В Японии этим заболеванием страдают каждые 126 из 100000 человек. Таким образом, только в Японии каждый год заболевают приблизительно 156000 человек. В Японии, так же как и в Китае, Тайване и Корее, желудочная карцинома является одной из наиболее частых причин смерти в результате развития опухоли. При обнаружении перитонеального карциноматоза, развившегося в результате диффузного разрастания опухолевых клеток в брюшной полости, ожидаемая продолжительность жизни пациента после постановки диагноза в настоящее время составляет около 12 месяцев. Даже при наличии операбельной желудочной карциномы, т.е. недиссеминированной карциномы в отсутствие отрицательных симптомов, связанных с лимфатическими узлами, процент безрецидивного существования в течение трех лет составляет приблизительно лишь 45%.
До настоящего времени наиболее перспективным способом лечения оказывалось применение цитостатической терапии в сочетании с химиотерапией.
Тем не менее, побочные эффекты такого лечения включают целый ряд заболеваний, начиная от ослабления иммунитета, коагулопатии, метаболической гипоксии, воспаления слизистых оболочек и гиперурикемии до риска возникновения вторичных опухолей, вызываемых цитостатической терапией. В особенности часто поражаются пролиферативные ткани, например костный мозг и эпителий желудочно-кишечного тракта, а также слизистая оболочка ротовой полости.
Напротив, для связывания цитотоксически активных веществ при помощи переносчика (носителя) в радиоиммунотерапии применяют белковые структуры, находящиеся в мембранах, переносимые клеточными линиями опухоли. В большинстве случаев перенос связывающей молекулы к клетке опухоли является центральным фактором радиоиммунотерапии. Таким образом, целевая молекула для опухолеспецифических антител также находится, но в меньшей степени, в физиологических клетках организма. Это говорит о том, что любой терапевтический агент, пригодный для радиотерапии, также связывается с данными клетками.
В частности, настоящее изобретение эффективно при лечении острой или хронической миеловидной лейкемии, главным образом, для приготовления подходящего α-излучателя, а именно225Ас, который при реакции радиоактивного распада образует агент, способный связываться, например, с опухолеспецифическим антителом.
Атом213Bi в результате β-распада образует213Ро, который, в свою очередь, в результате α-распада с периодом полураспада, равным 4 мкс, и свободным пробегом в тканях, равным 80 мкм, высвобождает энергию, равную 8,4 МэВ, и, таким образом, благодаря высокому линейному переносу энергии, эффективно убивает клетки в своем непосредственном окружении.
Так называемое локорегиональное применение позволяет использовать быстрое связывание опухолеспецифического антитела, связанного с213Bi, с антигенами опухоли с максимальным терапевтическим эффектом и минимальной токсичностью.
Изотопная пара213Bi/213Po, излучающая α-частицы, была введена в радиоиммунотерапию только в конце 1980х годов. Тем не менее, в стандартном учебнике Schicha, Schober, 1997 "Nuklearmedizin - Basiswissen und khnische Anwendung" (Медицинская радиология - основные понятия и клиническое применение) имеется следующая фраза: "Линейная передача энергии α-лучей так велика, что вероятность возникновения радиационного поражения превышает терапевтический эффект.По этой причине нуклиды, излучающие α-частицы, не применимы в медицинской радиологии…". ("Der lineare Energietransfer ist bei α-Strahlen so gropβ, daβ die Wahrscheinlichkeit fur die Erzeugung von Strahlenschaden gro'βer ist als ein therapeutischer Effekt. Aus diesem Grunde werden Nuklide, die α-Strahlen emittieren, in der Nuklearmedizin…nicht eingesetzt.")
Тем не менее, клиническое применение подобных α-излучателей в сочетании с опухолеспецифическими антителами доказывает обратное (см. Jurcic et al. 2002). Соответственно, возникает вопрос: какой изотоп лучше использовать и как можно осуществить его приготовление непрерывным и надежным способом?
Более сотни доступных α-излучателей можно смело исключить из рассмотрения на предмет применения in vivo по практическим соображениям (см. Geerlings 1993). Потенциальные α-излучатели должны соответствовать определенным требованиям, таким как достаточная химическая и физическая чистота, экономическая доступность и приемлемый период полураспада. Период полураспада должен быть достаточно большим для формирования связи с антителами и локализации в биологическом объекте и в то же время достаточно коротким, чтобы свести к минимуму риск чрезмерного облучения пациента.
Одним из α-излучателей, которые соответствуют указанным критериям, является изотопная пара213Bi/213Po, период полураспада которой составляет 45,6 минут (213Bi). Эмиссия фотона с энергией 440 кэВ, испускаемого атомом213Bi, позволяет дополнительно производить сцинтиграфическое исследование пациента in vivo, а также легко определять радиоактивность при помощи счетчика α-излучения.
Кроме того, при защите от излучения важно, чтобы излучение было легко определяемым. Кроме того, при помощи современных способов измерения можно обнаружить следовые количества дочерних изотопов пары225Ас/213Bi, например221Fr или209Pb, и наряду с качественным контролем может быть оценен их вклад в суммарную дозу облучения.
В настоящее время изотоп213Bi доступен благодаря тому, что разработан способ получения225Ас, например, в соответствии с заявками ЕР 0752709 В1 и ЕР 0962942А1, и, в частности, способом, называемым «ториевая корова» ("thorium cow"), в соответствии с патентом США 5,355,394. Тем не менее, способ «ториевой коровы» требует очень серьезных затрат, поскольку он включает облучение226Ra нейтронами в течение нескольких лет, в результате чего среди прочих накапливается смесь изотопов228Th и229Th, в которой изотоп229Th, распадаясь до225Ra, вновь образует225Ас, который, в свою очередь, распадается до213Bi.
Таким образом, получение пары материнский-дочерний изотоп225Ас/213Bi становится доступным в принципе, но при этом ни их количество, ни непрерывность способа получения, ни цена не являются удовлетворительными; тем не менее, как уже было отмечено выше, первые клинические исследования конъюгата225Ac/213Bi с HuM195, очеловеченным анти-CD33 моноклональным антителом, являются весьма успешными при лечении миелоидной лейкемии. Первая клиническая фаза I испытаний конъюгата213Bi-HuM195 на пациентах, страдающих лейкемией, была проведена в Центре раковых заболеваний Memorial Sloan-Kettering Cancer Center в Нью-Йорке и дала прекрасные терапевтические результаты (Juricic et al. 2002).
В циклотронах, впервые разработанных в 1931 году, электрически заряженные частицы движутся по спиральным орбитам по линиям магнитной индукции.
В частности, в циклотроне при действии достаточно высоких токов протоны могут быть разогнаны до таких высоких скоростей, при которых они могут быть использованы в экспериментальной и прикладной ядерной физике для получения изотопов в количественном масштабе.
Например, в заявке ЕР 0752709 В1 описан способ получения актиния-225 из радия-226, в соответствии с которым ускоренные протоны при помощи циклотрона направляют в мишень из радия-226; способ отличается тем, что протоны, ускоренные в циклотроне, направляют в мишень из радия-226, установленную в циклотроне, так что нестабильное составное ядро227Ас, испуская два нейтрона, превращается в актиний-225 (p, 2n-реакция), при этом спустя некоторый период, во время которого актиний-226, образующийся одновременно в результате испускания только одного нейтрона, разлагается, в основном благодаря тому, что имеет гораздо более короткий период полураспада, актиний отделяется химически, в результате чего получают относительно чистый изотоп Ас-225.
Тем не менее, конечный продукт содержит недопревращенный226Ra и другие изотопы Ra. В дополнение, встречаются различные продукты распада актиния, наряду с ядерными превращениями элементов, загрязняющих алюминий.
Особенно важно минимизировать содержание Sr и Ва, присутствие которых ведет к получению радиоизотопов Y и La соответственно.
Ядерные реакции типа (p, n) или (p, 2n) на основных примесях, таких как Ва, Fe, Zn, Sr, Pt, V, Ti, Cr и Сu, присутствующих в Al подложке (фольга, сетка) и/или Ra-материале, приводят к получению нескольких радиоизотопов. Кроме226Ra и его дочерних изотопов, основной вклад в суммарное гамма-излучение обычно вносят следующие изотопы:135La,55Со,56Со,67Ga,57Ni,135mBa,133mBa,131Ba,129Cs,51Cr,48V,52Mn,54Mn,65Zn.
Кроме того, мешающими радиохимическими примесями являются210Ро и210Pb, получающиеся в результате следующей цепочки радиоактивных распадов:
Ra-226 (альфа) → Rn-222 (альфа) → Po-218 (альфа) → Pb-214 (бета) → Bi-214 (бета) → Po-214 (альфа) → Pb-210 (бета) → Bi-210 (бета) → Po-210 (альфа) → Pb-206 (стабильный).
Мишень из226Ra, применяемая в соответствии с процедурой, описанной в заявке ЕР 0752709 В1, в настоящем описании подробно не рассматривается.
В заявке ЕР 0962942А1 также описан способ получения Ас-225 облучением226Ra протонами, ускоренными в циклотроне и имеющими энергию от 10 до 20 МэВ.
В соответствии с существующим уровнем техники, описанным в заявке ЕР 0962942А1, нуклид226Ra мишени используют в виде RaCl2, который получают, например, осаждением под действием концентрированной HCl, или в виде карбоната радия (RaCO3). Указанные соединения радия затем прессуют в виде таблеток для мишени. Для удаления кристаллизованной воды перед началом облучения солей радия протонами таблетки нагревают приблизительно до 150°С, а затем запаивают в серебряные капсулы. Капсулы затем закрепляют на рамке держателя и соединяют с контуром с охлаждающей водой. В мишени имеется окно, расположенное таким образом, что пучок протонов достигает мишени, проходя сквозь это окно. В соответствии с заявкой ЕР 0962942А1 поверхность мишени составляет приблизительно 1 см2.
Несмотря на то что в настоящее время уже можно получать хорошие выходы актиния-225 на мишенях, предлагаемых согласно ЕР 0962942А1, на практике оказалось, что предлагаемые мишени в определенных условиях под действием пучка протонов могут разогреваться до такой степени, что разрушается серебряная капсула, в результате чего может происходить как разрушение всей мишени, так и загрязнение периферийных материалов.
Для решения вышеуказанных проблем, связанных с конструкцией мишеней, а также для получения радионуклидов под действием ускоренных протонов создатели настоящего изобретения разработали две разные усовершенствованные мишени из радия на основании существующего уровня техники, описанного в ЕР 0962942А1.
Приготовление одной из мишеней производят способом электроосаждения материала226Ra, описанным в заявке DE 10347459 В3, поданной Заявителем настоящего изобретения; вторую мишень получают при помощи испарительно-дозаторной системы, описанной в заявке DE 102004022200А1, поданной Заявителем настоящего изобретения. Содержание обеих заявок полностью включено в настоящее описание по ссылке.
Способы изготовления мишеней, предложенные Заявителем, обеспечивают получение целевого225Ас в смеси с различными радионуклидами на поверхности из алюминия.
Предпочтительно в качестве подложек для мишеней, содержащих Ra, применяют мишени, изготовленные из алюминиевых сеток.
Преимуществом мишеней, изготовленных из алюминиевых сеток, является высокий выход, достигаемый при электроосаждении. Если при электроосаждении диск из алюминиевой сетки используют как катод, а затем - как подложку для радия в мишени, то количество радия, которое осаждают на диске, может быть увеличено. В то время как количество радия, осажденного на диске из алюминиевой фольги (эксперименты проводились в масштабе миллиграммов для бария и микрограммов для Ra-226), составляло менее 10 мг (2-3 мм по краю одного диска), в случае диска, изготовленного из сетки, количество радия достигает приблизительно 70 мг (в зависимости от толщины осадка и других параметров - осажденный материал большей толщины на мишени не удерживался). Таким образом, количество сетчатых дисков, изготовленных из Ra/Al, которые нужно поместить в оболочку мишени, было снижено до пяти или шести, вместо 10 или более, которые требовались при работе с дисками, изготовленными из алюминиевой фольги. Более высокий выход электроосаждения на алюминиевой сетке по сравнению с алюминиевой фольгой определяется более высокой площадью поверхности сетки. Кроме того, большее количество радия, осажденного на алюминии, обеспечивает большую вероятность попадания пучка протонов в атомы радия, а не в атомы алюминия, т.е. обеспечивает меньшие потери пучка.
Использование алюминиевой сетки в процессе электроосаждения позволяет упростить и усовершенствовать автоматизацию всего процесса.
Предпочтительно используют алюминий с чистотой 99%, предоставляемый компанией Good Fellow. Результаты активации мишени нейтронами, проведенной в Институте, приведены ниже:
Примеси в алюминиевой сетке, определенные при помощи отклоняющего инструментального нейтронно-активационного анализа (Ko-INAA), указаны в Таблице 1.
Результаты обработки Ra/Al-мишеней, изготовленных из сетчатых дисков, с остаточной активностью несколько сотен микроКюри, показали, что, как и в случае мишеней из алюминиевой фольги, может быть выполнено селективное выщелачивание Ra и Ас из Al сетки (способом, разработанным для мишеней, изготовленных из алюминиевых дисков). Уже во время растворения мишени возможно отделить большую часть Al и примесей от Ас.
Особое преимущество радиевых мишеней, описанных в заявках DE 10347459 В3 и DE 102004022200 А1, состоит в том, что получаемое радиевое покрытие состоит из почти чистого радия. Таким образом, получаемые мишени не содержат носителей или других дополнительных компонентов, например солей бария, которые необходимо добавлять в традиционные радиевые мишени, изготовляемые в соответствии с существующим уровнем техники, для гомогенизации радийсодержащего материала. Благодаря возможности изготовления мишеней без таких материалов-носителей, как соединения бария, химическое выделение и очистка вырабатываемого225Ас становятся гораздо более простыми и приводят к оптимизации выходов облучения, поскольку исключают возможность протекания конкурирующих ядерных реакций, например трансформаций ядер бария.
Однако в заключение следует сказать, что несмотря на оптимизированную систему мишени, предоставляемую в соответствии с заявками DE 10347459 ВЗ и DE 102004022200А1, поданными Заявителем настоящего изобретения, конечный продукт -225Ас - все же содержит значительные количества неорганических, радиоизотопных и органических примесей, которые делают получаемый225Ас непригодным для непосредственного применения в медицинских или фармацевтических целях.
Другими словами, получаемый продукт не может быть немедленно использован для приготовления фармацевтически чистого продукта, содержащего225Ас, пригодного для изготовления радиофармацевтических агентов, описанных во вводной части настоящего документа и применяемых в лечении раковых заболеваний.
Таким образом, задачей настоящего изобретения является предоставление чистого и фармацевтически приемлемого радиоизотопного состава, содержащего225Ас, предназначенного для дальнейшей обработки с целью изготовления терапевтических агентов, содержащих225Ас.
В отношении способа вышеуказанная задача может быть независимо решена в соответствии с отличительными признаками пп.1, 2 и 3 Формулы изобретения.
Вышеуказанная задача может быть решена при помощи фармацевтически приемлемого радиоизотопного состава, содержащего225Ac, по п.21 Формулы изобретения.
В частности, в соответствии с настоящим изобретением предложен способ извлечения чистого225Ас из облученных226Ra-мишеней, нанесенных на подложку, включающий следующие операции:
а) по меньшей мере одну обработку226Ra-мишеней выщелачиванием с осуществлением по существу полного выщелачивания225Ас и226Ra под действием азотной или соляной кислоты в условиях дефлегмации;
b) удаление HCl, если растворитель, применяемый на стадии a), представляет собой соляную кислоту, и последующее растворение полученного материала в азотной кислоте;
c) концентрирование экстрактов, содержащих225Ас и226Ra;
d) отделение225Ас от226Ra и других изотопов радия посредством по меньшей мере одного первого этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее первой системой экстрагентов, включающих по меньшей мере одно соединение, отвечающее общей формуле I, в по меньшей мере одном соединении, отвечающем общей формуле II,
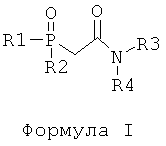
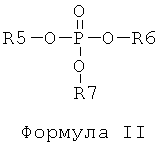
где в Формуле I:
R1, R2 независимо представляют собой октил, н-октил, фенил или фенил, замещенный С1-С3-алкилом;
R3, R4 независимо представляют собой пропил, изопропил, бутил или изобутил;
и в Формуле II:
R5, R6 и R7 независимо представляют собой С2-С5-алкил, в частности бутил или изобутил;
e) элюирование из неподвижной фазы при помощи разбавленной азотной или соляной кислоты225Ас, удержанного на твердой подложке в отсутствие удерживания226Ra;
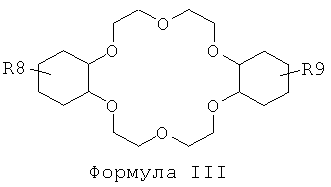
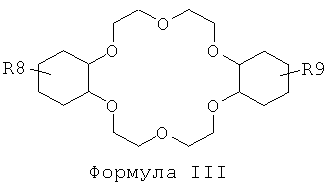
f) отделение225Ас от210Ро и210Pb посредством по меньшей мере одного второго этапа экстракционной хроматографии с использованием твердой подложки, с нанесенной на нее второй системой экстрагентов, включающих по меньшей мере одно вещество, отвечающее общей формуле III, в по меньшей мере одном веществе, отвечающем общей формуле IV,
R10-ОН
Формула IV
где в Формуле III:
R8 и R9 независимо представляют собой Н, C1-С6-алкил или трет-бутил; и
в Формуле IV:
R10 представляет собой С4-С12 алкил;
g) использование в качестве подвижной фазы 2М HCl; и
h) извлечение225Ас из элюата, в то время как210Ро и210Pb удерживаются в твердой фазе на стадии f).
В альтернативном случае способ извлечения чистого225Ас из облученных226Ra-мишеней, нанесенных на подложку, предлагаемый согласно настоящему изобретению, включает следующие стадии:
a) по меньшей мере одну обработку226Ra-мишеней выщелачиванием с осуществлением по существу полного выщелачивания225Ас и226Ra под действием азотной или соляной кислоты в условиях дефлегмации;
b) удаление HCl, если растворитель, применяемый на стадии, а) представляет собой соляную кислоту, и последующее растворение полученного материала в азотной кислоте;
c) концентрирование экстрактов, содержащих225Ас и226Ra;
d) отделение225Ас от226Ra и других изотопов радия посредством по меньшей мере одного первого этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее первой системой экстрагентов, включающих по меньшей мере одно соединение, отвечающее общей формуле IA,
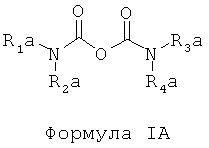
где в Формуле IA:
R1a, R2a, R3a, R4a независимо представляют собой октил или 2-этилгексил;
e) элюирование из неподвижной фазы при помощи азотной кислоты концентрацией от 0,3М до 0,01М или соляной кислоты концентрацией от 1М до 0.05М225Ас, удержанного на твердой подложке в отсутствие удерживания226Ra;
f) отделение225Ас от210Ро и210Pb посредством по меньшей мере одного второго этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее второй системой экстрагентов, включающих по меньшей мере одно вещество, отвечающее общей формуле III, в по меньшей мере одном веществе, отвечающем общей формуле IV,

R10-ОН
Формула IV
где в Формуле III:
R8 и R9 независимо представляют собой Н, C1-С6-алкил или трет-бутил; и
в Формуле IV:
R10 представляет собой С4-С12 алкил;
g) использование в качестве подвижной фазы 2М HCl; и
h) извлечение225Ас из элюата, в то время как210Ро и210Pb удерживаются в твердой фазе на стадии f).
Еще один альтернативный способ извлечения чистого225Ас из облученных226Ra-мишеней, нанесенных на подложку, включает следующие стадии:
a) по меньшей мере одну обработку226Ra-мишеней выщелачиванием с осуществлением по существу полного выщелачивания225Ас и226Ra под действием азотной или соляной кислоты в условиях дефлегмации;
b) удаление HCl, если растворитель, применяемый на стадии а), представляет собой соляную кислоту, и последующее растворение полученного материала в азотной кислоте;
c) концентрирование экстрактов, содержащих225Ас и226Ra;
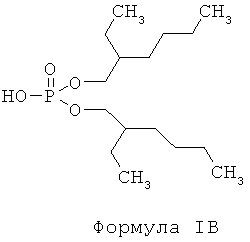
d) отделение225Ас от226Ra и других изотопов радия посредством по меньшей мере одного первого этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее первой системой экстрагентов, включающих по меньшей мере одно соединение, отвечающее общей формуле IB,
e) элюирование из неподвижной фазы при помощи азотной кислоты, концентрация которой составляет от примерно 0.02М до примерно 0,1М,225Ас, удержанного на твердой подложке в отсутствие удерживания226Ra;
f) отделение225Ас от210Po и210Pb посредством по меньшей мере одного второго этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее второй системой экстрагентов, включающих по меньшей мере одно вещество, отвечающее общей формуле III, в по меньшей мере одном веществе, отвечающем общей формуле IV,

R10-ОН
Формула IV
где в Формуле III:
R8 и R9 независимо представляют собой Н, C1-С6-алкил или трет-бутил; и
в Формуле IV:
R10 представляет собой С4-С12 алкил;
g) использование в качестве подвижной фазы 2М HCl; и
h) извлечение225Ас из элюата, в то время как210Ро и210Pb удерживаются в твердой фазе на стадии f).
В предпочтительном способе, предлагаемом согласно настоящему изобретению, концентрация указанной азотной кислоты, применяемой на стадии а), находится в диапазоне приблизительно от 0,001 до 2М, предпочтительно около 0,1М, и концентрация указанной соляной кислоты находится в диапазоне приблизительно от 0,001 до 2М, и/или указанные кислоты применяют при повышенных температурах, в частности приблизительно от 30 до 90°С.
Предпочтительно экстракты, полученные при обработке выщелачиванием, объединяют и используют в дальнейшем..
Обычно при проведении концентрирования на стадии с) конечная концентрация азотной кислоты достигает значения 1,5-10М.
В предпочтительном примере реализации настоящего изобретения первая система экстрагентов представляет собой октил(фенил)-N,N-диизобутилкарбамоилфосфиноксид [СМРО] в трибутилфосфате [ТВР].
Очень эффективной второй системой экстрагентов является краун-эфир, отвечающий Формуле V:
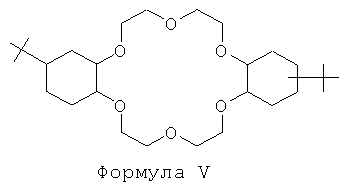
Предпочтительно краун-эфир, отвечающий Формуле V, применяют в 1-октаноле.
В особенно предпочтительном способе, предлагаемом согласно настоящему изобретению, вторая система экстрагентов представляет собой 4,4'-бис(трет-бутилциклогексано)-18-краун-6 в 1-октаноле.
Альтернативная вторая система экстрагентов представляет собой 4,5'-бис(трет-бутилциклогексано)-18-краун-6 в 1-октаноле.
Для усовершенствования способа окончательной очистки первый этап экстракционной хроматографии, который проводят на стадии а), можно повторить несколько раз, в зависимости от желаемой чистоты225Ас, для удаления следовых количеств изотопов радия.
Аналогично, в зависимости от желаемой чистоты225Ас, второй этап экстракционной хроматографии, который проводят на стадии f), можно повторить несколько раз.
При необходимости, для достижения лучшей степени очистки первый и второй этапы экстракционной хроматографии можно проводить несколько раз.
В соответствии со способом, предлагаемым согласно настоящему изобретению, радон, содержащийся в алюминиевой подложке и/или продуктах распада нуклидов, получаемых из225Ас и алюминиевой подложки, предпочтительно удаляют при проведении выщелачивания при помощи подходящих ловушек.
Радон может быть легко удален, например, если его направить в первую щелочную ловушку, в которой нейтрализуют кислотные пары, затем в следующую ловушку, содержащую оксид кремния, в которой происходит поглощение воды, и в последнюю ловушку, содержащую уголь, которая, кроме того, может быть охлаждаемой.
Из-за высокой стоимости и потенциальной опасности непрореагировавший исходный материал, содержащий226Ra, извлекают из элюата, получаемого на стадии е).
Примеси210Ро и210Pb элюируют из твердой фазы, использованной на втором этапе экстракционной хроматографии, проводимом на стадии h), при помощи концентрированной азотной кислоты или соляной кислоты.
Предпочтительно при осуществлении способа, предлагаемого согласно настоящему изобретению, производят α- и/или γ-спектроскопический анализ после каждой стадии очистки и/или каждой получаемой фракции.
Соответствующие фракции, содержащие:
a)225Ас; или
b) изотопы Ra; или
c)210Po и
d)210Pb,
испаряют до получения влажных или сухих остатков и при необходимости вновь растворяют.
Для удаления органических примесей предварительно очищенные растворы225Ас предпочтительно пропускают через фильтр из смолы, который содержит неионогенный полимер на основе эфира акриловой кислоты.
Конечным продуктом, получаемым посредством способа, предлагаемого согласно настоящему изобретению, является фармацевтически приемлемый радиоизотопный состав, содержащий225Ас, который может быть использован для приготовления радиофармацевтических препаратов, содержащих225Ас, описанных во вводной части настоящего документа.
Настоящее изобретение также включает все сочетания каждой из отдельных особенностей, независимо от связывающих их отношений И или ИЛИ.
Другие преимущества и особенности настоящего изобретения рассмотрены в нижеследующих примерах, сопровождаемых чертежами.
На Фиг.1 показана общая схема экстракции225Ас из облученных мишеней226Ra/Al;
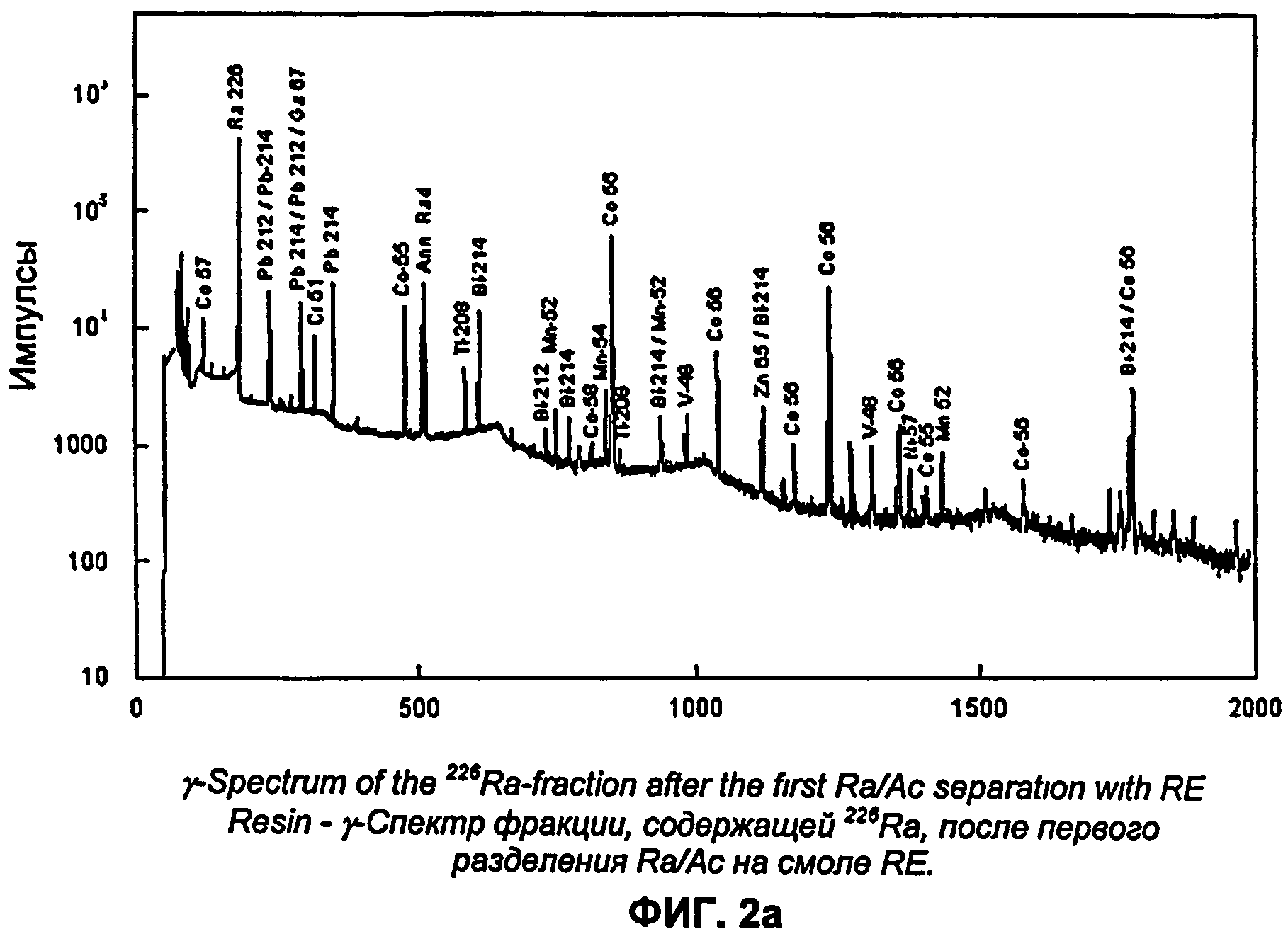
На Фиг.2а показан γ-спектр фракции226Ra после первого разделения Ra/Ac на смоле RE;
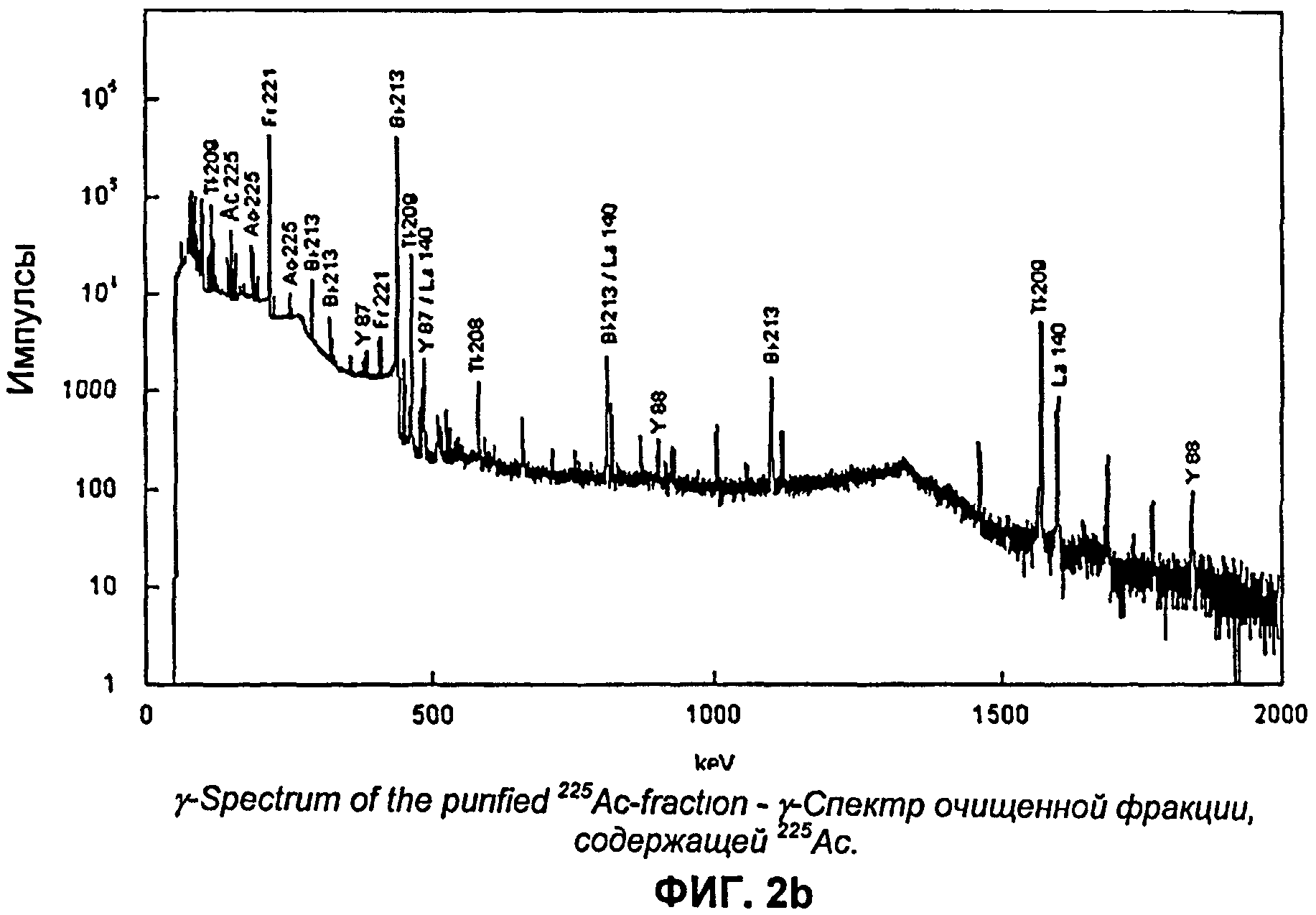
На Фиг.2b показан γ-спектр очищенной фракции225Ас;
На Фиг.3a показан γ-спектр225Ас до отделения Po и Pb; и
На Фиг.3b показан γ-спектр225Ас после отделения Po и Pb.
1. Приготовление очищенного материала, содержащего226Ra, предназначенного для изготовления мишени
Проводят γ-спектрометрическую проверку герметично закрытой навески Ra, содержащей источник226Ra, и ампулу разбивают. Соединения или соли радия растворяют и осколки стекла отделяют фильтрованием. Фильтр и осколки подвергают выщелачиванию 0,5М HNO3 и объединяют с жидкостью, содержащей226Ra. Полученный раствор подвергают по меньшей мере одному этапу экстракционной хроматографии, в результате которой получают очищенную фракцию, содержащую Ra.
Полученную фракцию после проведения стадии концентрирования используют для приготовления226Ra-мишеней.
Более подробно очистка226Ra, предназначенного для изготовления мишеней для циклотрона, применяемых для получения225Ас, описана в патенте DE 102005043012 от 9 сентября 2005 года (без предварительной публикации). Содержание этого патента полностью включено в настоящее описание по ссылке.
2. Изготовление226Ra-мишени способом электроосаждения с использованием фиксированного алюминиевого диска в качестве катода
Данное изобретение будет проиллюстрировано неограничивающим примером приготовления мишени способом электроосаждения в соответствии с заявкой DE 10347459 В3, озаглавленной "Radium-Target sowie Verfahren zu seiner Herstellung".
Средний специалист в данной области техники должен понимать, что в соответствии с настоящим изобретением можно также использовать мишени, приготовленные способом испарения в соответствии с заявкой DE 102004022200 А1 «Способ изготовления226Ra-мишеней, предназначенных для облучения в циклотроне, способами капельного испарения» ("Method for producing226Ra targets by the droplet-evaporation methods for irradiation in the cyclotron").
Для приготовления226Ra-мишени из алюминия с минимальной чистотой 99% вырезают диски толщиной 0,015 мм и диаметром приблизительно 5 см и закрепляют их на держателе из нержавеющей стали. Держатель обеспечивает легкость обращения с алюминиевой фольгой, и его удаляют после проведения электроосаждения, перед введением фольги, покрытой радием, в мишень.
Для проведения электроосаждения на алюминиевой фольге применяют раствор нитрата радия-226, в частности, предварительно приготовленный из хлорида радия-226 или карбоната радия-226 растворением в HNO3 концентрацией приблизительно 0.05М.
Затем взвешивают держатель из нержавеющей стали, на котором после закрепляют алюминиевую фольгу, и вычисляют точную массу алюминиевой фольги.
В ячейку для электроосаждения помещают 150 мл (если осаждение производят на алюминиевой фольге диаметром до 15 см) или от 10 до 11 мл изопропанола (если осаждение производят на дисках из алюминиевой фольги диаметром до 2 см).
Затем в электролитическую ячейку помещают требуемое количество раствора радия-226 и добавляют 1-2 мл 0.05М HNO3. Общий объем раствора радия и 0.05М HNO3 не должен превышать приблизительно 2 мл, если диаметр алюминиевых дисков составляет до 2 см, и не более 20 мл, если диаметр алюминиевых дисков составляет до 15 см. При использовании высоких концентраций радия могут образовываться белые осадки. Если это происходит, то в ячейку добавляют такое количество 0.05М HNO3, чтобы произошло растворение осадка. Предпочтительно значение рН раствора для электроосаждения должно составлять от 4 до 5.
Для проведения электроосаждения материала, содержащего226Ra, из раствора для электроосаждения подают электрический ток, равный приблизительно 60 мА, и напряжение, равное приблизительно 200 В, выдерживают указанные параметры в течение некоторого времени и при необходимости их регулируют.
По завершении электроосаждения раствора226Ra раствор для электроосаждения выливают, держатель промывают 2-3 мл изопропанола, ячейку разбирают и алюминиевую фольгу дополнительно промывают приблизительно 1-2 мл изопропанола.
После этого держатель с алюминиевой фольгой с нанесенным Ra сушат под ИК лампой до постоянной массы, получая безводное покрытие, содержащее радий.
После этого держатель из нержавеющей стали с закрепленной на нем алюминиевой фольгой, на которую нанесено покрытие, взвешивают и определяют точную массу алюминиевой фольги с покрытием. Выход определяют, исходя из определенной массы слоя, содержащего226Ra.
Вместо взвешивания можно применить альтернативный способ определения выхода электроосаждения, т.е. измерить γ-активность226Ra при помощи γ-спектрометра высокого разрешения.
После этого держатель из нержавеющей стали и алюминиевую фольгу отделяют друг от друга.
Сухую алюминиевую фольгу с покрытием из соединений радия тщательно накрывают свежей алюминиевой фольгой и обрезают те края несущей активный слой алюминиевой фольги, которыми она закреплена, сводя, таким образом, к минимуму количество алюминия в самой мишени.
Для получения радиевой мишени, пригодной для облучения пучком протонов в циклотроне, несколько круглых дисков из алюминиевой фольги с кольцеобразно нанесенным на них радийсодержащим материалом, приготовленных в соответствии с вышеуказанными примерами, соединяют в виде так называемой гильзы-мишени.
Для получения складчатой мишени одну или несколько алюминиевых фольг, в случае рассматриваемого примера, с одной из сторон полностью покрытых226Ra-материалом, накрывают другой алюминиевой фольгой так, что пленка, содержащая радий, оказывается закрытой полностью. Затем алюминиевую фольгу несколько раз складывают до тех пор, пока не получают полоски шириной приблизительно 2 мм. Сложенную алюминиевую фольгу, включающую слои радийсодержащего материала, в частности оксида радия, затем помещают в мишень, предназначенную для облучения протонами в циклотроне или линейном ускорителе.
В соответствии с вышеизложенными способами, описанными в заявках DE 10347459 ВЗ и DE 102004022200 А1 можно получить высокоэффективные226Ra-мишени на алюминиевой фольге различной толщины, содержащие разные количества226Ra.
Предложенный способ, в частности, обеспечивает осаждение пленок с высокой гомогенностью на алюминий226Ra - мишени. Это особенно важно при облучении мишеней в циклотроне, поскольку атомные ядра радия равномерно подвергаются воздействию потока протонов.
Использование алюминия в качестве подложки для226Ra создает несколько преимуществ для облучения в циклотроне и при последующей радиохимической обработке облученной мишени. Преимущества использования алюминия обусловлены ядерными, физическими и химическими свойствами этого элемента.
Ядерные свойства: Алюминий имеет только один стабильный изотоп. При активации алюминий образует чрезвычайно короткоживущие продукты. Образование алюминием исключительно короткоживущих радиоизотопов облегчает радиохимическую очистку Ас-225 и уменьшает время охлаждения мишени после облучения. Поскольку потеря энергии протонами в материале алюминия очень невелика, то использование нескольких тонких пленок из алюминия не приводит к значительным потерям энергии протонов.
Физические свойства: Алюминий - легкий металл с хорошей термической и электрической проводимостью, он легок в обращении и может быть легко приведен к нужной геометрической форме.
Химические свойства: Алюминий легко растворяется в минеральных кислотах, и он может быть легко оделен от получаемого актиния. Алюминиевую фольгу можно получать с высокой степенью чистоты и по приемлемой цене.
Осаждение226Ra, например, в виде оксида или пероксида позволяет получить слой с высоким содержанием радия, в частности приблизительно 70% осажденного материала на см2. Выход при электроосаждении оказывается высоким.
На практике оказывается, что на алюминиевую фольгу может быть осаждено приблизительно от 4 до 5 г/см2 226Ra, обладающего хорошими адгезионными свойствами.
3. Очистка225Ас, полученного при облучении226Ra протонами в циклотроне
А. Селективное выщелачивание Ac и Ra из облученных Ra/Al-мишеней, изготовленных способом электроосаждения
После облучения в циклотроне мишень, содержащую Ас и Ra, переносят в защитный перчаточный бокс и подготавливают для проведения разборки и растворения. Для выщелачивания Ra и Ас из облученных алюминиевых колец или дисков применяют установку для перегонки с дефлегматором. Такая установка позволяет сконденсировать горячую воду и пары кислот, осуществлять их конденсацию в сосуд с растворенными веществами и по мере надобности собирать конденсаты. Такая установка позволяет улавливать радон, который может все еще присутствовать в облученных алюминиевых дисках, при помощи ряда ловушек. Ловушки располагают в следующей последовательности: емкость с NaOH для нейтрализации кислотных паров, ловушка, заполненная силикагелем, для поглощения водяных паров и, наконец, охлаждаемая ловушка, заполненная углем, для улавливания радона.
Установка, применяемая для выщелачивания Ra и Ас из облученных дисковых мишеней, представляет собой установку для перегонки с дефлегматором. Обычно диски или кольца помещают в колбу, где их сначала обрабатывают 30 мл горячей 0,1-0,2М HNO3, а затем 30 мл кипящей 2М HNO3 или HCl. Операцию выщелачивания повторяют два-три раза для вымывания остаточной радиоактивности, создаваемой Ra или Ac, закрепившихся на диске или стенках стеклянного сосуда. Растворы, полученные при выщелачивании, сначала подвергают гамма-спектрометрии, а затем, при необходимости, объединяют.
В результате выщелачивания получают по меньшей мере две фракции: первая фракция содержит Ac, Ra и часть продуктов активации (0,1-0,2М HNO3), а вторая содержит большую часть матрицы (Al) и часть продуктов активации (2М HNO3 или концентрированная HCl). Для проведения экстракции Ас работают с фракцией с 0,1-0,2М HNO3. Этот раствор доводят до концентрации 2М по HNO3; во время этого процесса любые частицы, которые могут оставаться в растворе во взвешенном состоянии, должны раствориться. Обычно объем этой фракции делают равным 30 мл.
Результаты указывают на то, что эта фракция содержит более чем 99% Ас и Ra. Во втором выщелачивающем растворе, т.е. в 2М HNO3, содержащем большую часть Al из алюминиевых дисков, найдены лишь следовые количества Ас и Ra. Обнаружено, что продукты активации почти поровну распределены между обоими растворами. Указанная процедура облегчает очистку и повторное использование радия, поскольку при экстракции Ас и Ra из фольги или сетки не происходит полного растворения алюминия. Кроме того, низкие уровни бета- и гамма-излучений, продуктов активации, находящихся в растворах выщелачивания Ac/Ra, уменьшают риск радиационного разрушения используемых смол, в частности, смолы RE.
В. Селективное выщелачивание Ас и Ra из облученных Ra-мишеней, изготовленных способом капельного испарения
Ra и Ас извлекают из алюминиевой гильзы промыванием гильзы 0,1 М раствором HNO3 в ультразвуковой ванне. После облучения в циклотроне и разборки мишени в защитном перчаточном боксе алюминиевую гильзу-мишень, имеющую высокую остаточную радиацию, переносят и помещают в 250-мл стеклянный химический стакан (выбранный для конкретной гильзы-мишени). Стакан помещают в ультразвуковую ванну. Как только мишень помещена в стакан или контейнер, в алюминиевую гильзу добавляют 100 мл 0,1 М HNO3. Объем, равный 100 мл, выбран для того, чтобы мишень была полностью погружена в раствор для выщелачивания (объем зависит от геометрии и размера гильзы-мишени). Затем активируют ультразвуковую ванну; во время обработки температуру воды в ванне поддерживают равной приблизительно 80°С. Стадию выщелачивания проводят дважды в ультразвуковой ванне в течение короткого времени (не более 20-30 минут). Все жидкие фракции, содержащие Ra и Ас, объединяют в стеклянном химическом стакане и испаряют до получения влажного остатка. Ранее проведенные эксперименты с нитратом бария показали, что в этих условиях (установка, объем раствора выщелачивания, продолжительность ультразвукового воздействия) барий полностью извлекается. Эксперименты, проведенные с барием, также показали, что из гильзы-мишени также выщелачивается некоторая фракция, содержащая оксид алюминия. Таким образом, до начала разделения эта фракция должна быть растворена либо в горячей 2М HNO3 или, при необходимости, в 6М HCl, а затем переведена в 2М HNO3. Этот раствор используют для радиохимического разделения. В соответствии с указанным способом выход Ra и Ас из облученной мишени всегда составляет более 90%. В настоящее время проводятся эксперименты с целью минимизировать объем 0,1 М раствора HNO3, необходимого для количественного извлечения Ra и Ас высокой химической чистоты из гильзы-мишени. В этих исследованиях также используется другой дизайн мишени. Использование такой мишени позволит производить выщелачивание Ас и Ra из гильзы-мишени, не разбирая мишень. Возможность повторного использования радия и сложность способа очистки при таком подходе будет определяться химической чистотой раствора выщелачивания, и, следовательно, химически чистый раствор радия нужно будет получать уже на этом этапе.
С. Отделение Ас от Ra и большинства продуктов активации экстракционной хроматографией с применением в качестве первой системы экстрагентов смолы RE
Разделение Ac/Ra основано на использовании экстракционной хроматографии на смоле RE (EiChrom). Неподвижная фаза в смоле RE состоит из октил(фенил)-N,N-диизобутилкарбамоилфосфиноксида в трибутилфосфате. Этот экстрагент способен извлекать трехвалентные актиноиды и лантаноиды из растворов азотной кислоты (например, 2М HNO3). Актиний можно элюировать с неподвижной фазы промыванием колонки разбавленными растворами азотной или соляной кислоты (например, 0.05М HNO3).
Дополнительная информация
В США и бывшем СССР проводились широкомасштабные исследования экстракции трехвалентных актиноидов, в особенности трансплутониевых элементов бидентатными фосфорорганическими соединениями. Например, в США Horwftz et al. (1984, 1993) исследовал экстракцию америция и других элементов большим количеством карбамоилфосфонатов и карбамоилфосфиноксидов. Было установлено, что оба типа экстрагентов образуют с лантаноидами и трехвалентными актиноидами трисольваты. Высокий коэффициент извлечения из сред, содержащих азотную кислоту, объясняли бидентатной координацией и модификациями циклической хроматографии для экстракционной системы СМРO/ТВР (например, смола TRU или смола RE, поставляемая EICHROM). На обеих смолах четырехвалентные актиноиды хорошо удерживаются из растворов азотной кислоты, показывая, например, для смолы TRU коэффициенты заполнения (CF) из 2-3М HNO3 в диапазоне 104-106. В том же диапазоне концентраций коэффициенты заполнения лантаноидов составляют порядка 100 на смоле TRU и 100-200 на смоле RE. Для RE коэффициенты заполнения выше для всех рассматриваемых элементов. Низкая степень улавливания трехвалентных актиноидов из растворов HCl и из разбавленных растворов азотной кислоты является основой для их селективного элюирования. По данным Horwitz (1993) Ca, Fe (II) и обычно встречающиеся многоатомные анионы не оказывают значительного воздействия на улавливание америция из HNO3. Учитывая эти свойства, для отделения Am от Sr, Ca и Ba, находящихся в природных образцах, применяли смолу TRU (например, Burnett et al., 1995; Moreno et al., 1997, 1998). Для объединенного определения очень малых количеств226Ra and228Ra в природных образцах Burnett et al. (1995) применяли смолу RE.
В соответствии с настоящим изобретением изобретатели использовали абсолютно новый подход, применив смолу RE для отделения Ас от226Ra, Al и большинства продуктов активации, получаемых в циклотроне, при помощи селективной экстракции Ас из 2М HNO3. Актиний элюировали с неподвижной фазы, используя 0,03-0,05М HNO3.
Отделение Ас от Ra, Al и продуктов активации после облучения Ra/Al-мишеней в циклотроне
На Фиг.1 показана схема последовательности операций способа экстракции актиния из облученных мишеней. Выбор размера колонок (объем слоя - 8 мл) обеспечивает максимальное улавливание Ас на смоле RE из загружаемого раствора большого объема и позволяет значительно снизить проскок Ас во фракцию, содержащую Ra. Предполагая, что в 2М растворе HNO3 для выщелачивания/загрузки в колонку может присутствовать максимум 0,5 г Ra и 0,5 г Al (крайние условия), для полного растворения Ra и Al необходим общий объем, составляющий до 70-80 мл. Результаты экспериментов, проведенных с синтетическими растворами и с облученными мишенями (мг Ra и сотни мкКюри225Ас), указывают на то, что при равных условиях большая часть радия может быть удалена промыванием колонки приблизительно 50 мл 2М HNO3 и при этом не происходит значительного проскока Ас. В то же время большая часть актиния может быть элюирована 50 мл 0.05М HNO3. Было показано, что обычно коэффициент очистки Df(Ac/Ra) имеет порядок 104 (для одной стадии).
D. Очистка Ас
D1. Очистка от следовых количеств Ra повторной колоночной экстракционной хроматографией на смоле RE
После отделения основной части Ra, Al и продуктов активации во фракции, содержащей актиний, еще остаются210Ро (Фиг.3a) и небольшие количества Ra и изотопов переходных элементов. Таким образом, необходимо проводить второе отделение Ас от этих остаточных примесей. Как показано на Фиг.1, способ очистки включает две операции: первая представляет собой повторение разделения Ac/Ra с использованием смолы RE, обеспечивающее дополнительную очистку Ас от Ra. Эксперименты показали, что при двукратном разделении Ac/Ra на смоле RE в описанных выше условиях общий коэффициент очистки Ac/Ra составляет приблизительно 106-107.
Последующая стадия очистки позволяет отделять Ас/Po, Ас/Pb и Ac/Rn при помощи второй системы экстрагентов, смолы Sr (Eichrom), и этот способ описан в разделе D2.
D2. Очистка от изотопов Po и Pb с использованием в качестве второй системы экстрагентов смолы Sr
Дополнительная информация
В смоле Sr, применяемой согласно настоящему примеру, экстрагент неподвижной фазы представляет собой краун-эфир 4,4'(5')-бис(трет-бутилциклогексанено)-18-краун-6 в 1-октаноле. Horwitz (1991, 1992) предложил использовать этот краун-эфир в 1-октаноле для селективной экстракции Sr из концентрированных растворов азотной кислоты. Система для экстракционной хроматографии коммерчески доступна под маркой Смолы Sr (Eichrom), и ее применяют для определения очень низких радиоактивностей210Pb в природных образцах (Vajda et al.; 1995). В самом деле, эту смолу также часто используют для очистки и отделения90Sr от Ca, Mg и Ba при радиохимическом анализе природных образцов (Vajda N. et al., 1992; Moreno et al. 1997, 1998). В соответствии с настоящим изобретением изобретатели использовали Смолу Sr в качестве второй системы экстрагентов для отделения Ас от Po, Pb, а также Rn, находящихся в растворах 2М HCl: в то время как Pb и Po сорбируются в неподвижной фазе из 2М HCl, Ас проходит через систему.
Отделение Ас от Po и Pb в схеме очистки
Присутствие Po в Ас (Фиг.3a) обнаруживают по альфа-спектру актиния, полученного после очистки на смоле RE. Присутствие Pb и Po в Ас может быть подтверждено измерением общей альфа-бета-радиоактивности аликвот, отобранных от фракции, содержащей актиний. Без очистки этот параметр (общая альфа-бета-радиоактивность) оказывается гораздо выше ожидаемой общей радиоактивности, обусловленной актинием и продуктами его распада. Эксперименты, проведенные в динамических условиях, показали, что, в то время как актиний проходит через колонку, полоний и свинец улавливаются из 2М соляной кислоты. Фракция 2М HCl (загрузка и промывка 2М растворами HCI) содержит Ac (Фиг.3b), в то время как Po и Pb остаются в неподвижной фазе.
Е. Окончательная очистка и предварительное концентрирование очищенной фракции, содержащей Ас
Перед проведением последней стадии предварительного концентрирования, фракцию 2М HCl, содержащую актиний, полученную после промывания Смолы Sr, подвергают качественному контролю. Обычно на этом этапе радиохимическая чистота очень высока и в основном зависит от присутствия короткоживущего135La. Таким образом, после окончания обработки чистота быстро возрастает, достигая спустя несколько суток 99,7%. Определяют коэффициент радиоактивности226Ra/225Ac (а также коэффициент радиоактивности по отношению к другим долгоживущим изотопам), и во фракции, содержащей актиний, этот коэффициент обычно составляет менее 5·10-4.
Если не выполнены условия достижения радиохимической чистоты, то требуется проведение дополнительной очистки актиния от радия и других соответствующих компонентов. Для этой цели фракцию, содержащую актиний и полученную после концентрирования 2М раствора HCl, подвергают быстрой очистке от Ra, используя колонку с объемом слоя 2 мл, заполненную смолой RE. Обычно также приходится очищать актиний от растворенных или диспергированных органических материалов. Для отделения органических материалов раствор пропускают через фильтр предварительной очистки, объемом 2 мл, состоящий из смолы (Eichrom), которая содержит неионогенный полимер на основе эфира акриловой кислоты. Результаты показывают, что при этом содержание растворимых органических веществ снижается на порядок величины, и при фильтровании через слой указанной смолы актиний не улавливается.
Результаты, полученные при ручной обработке облученных Ra/Al-мишеней, показывают, что выходы извлечения Ас и Ra (исключая рециркуляцию и дальнейшую очистку) превышают 98 и 96% соответственно. Для обработки 2-3 мг радия и225Ас радиоактивностью в несколько сотен мкКюри полностью автоматизированным способом коэффициент извлечения Ra немного ниже, но обычно превышает 90-92%. Этот коэффициент может быть увеличен при оптимизации параметров автоматизированного способа (например, массопередачи в жидкости, «мертвых объемов» и т.д.).
F. Радиоизотопные примеси, определяемые γ-спектрометрическим анализом
Радиоизотопная чистота и химическая чистота актиния зависят от применяемых радиохимических способов, а также от чистоты материалов (подложки сетки, ТС и т.д.) и реактивов (растворов радия, кислот и т.д). В частности, необходимо снизить содержания Sr и Ba, которые трансформируются с образованием изотопов Y и La соответственно, которые во время разделения ведут себя аналогично Ас.
Во вводной части уже было указано, что в результате ядерных реакций типа (p, n) или (p, 2n), протекающих на основных примесях, например Ba, Fe, Zn, Sr, Pt, V, Ti, Cr и Сu, присутствующих в алюминиевой подложке (фольга, сетка) и/или осадке радия, образуется некоторое количество радиоизотопов. В качестве примера на Фиг.2а показан γ-спектр фракции, содержащей Ra. Кроме226Ra и его дочерних изотопов, основной вклад в общую гамма-ативность вносят следующие радиоизотопы:135La,55Со,56Со,67Ga,57Ni,135mBa,133mBa,131Ba,129Cs,51Cr,48V,52Mn,54Mn,65Zn. За исключением редкоземельных изотопов большую часть указанных радионуклидов можно отделить от актиния. Обычно радиоизотопная чистота фракции, содержащей актиний, превышает 99,8% (см. Таблицу 2). γ-Спектрометрические определения очищенной фракции, содержащей актиний (Фиг.3b), показывают присутствие небольших количеств редкоземельных радиоизотопов, а именно:87Y,88Y,139Се. Иногда, если мишень была изготовлена способом электроосаждения, наблюдают небольшие количества194Au (Pt анод).
Радиоизотопные примеси, определяемые γ-спектрометрическим анализом
Результаты γ-спектрометрического анализа после радиохимического отделения Ra в аликвоте образца показывают, что суммарный коэффициент очистки225Ас относительно226Ra (Df) составляет 106-107. Этот коэффициент может быть существенно улучшен за счет оптимизации соответствующих параметров способа очистки.
На Фиг.3b показан спектр очищенного актиния, извлеченного из облученной мишени. На спектре ясно видны пики225Ас и продуктов распада. Видно отсутствие примесей210Ро, что указывает на высокую степень очистки225Ас от210Ро, обеспечиваемую предлагаемой схемой радиохимической очистки (см. Фиг.3a).
Содержание примесей может быть уменьшено за счет правильного подбора реактивов и материалов высокой чистоты (например, более чистой фольги/сетки из алюминия). Кроме того, при элюировании Bi из Ac/Bi-генератора радиоизотопы редкоземельных элементов Се, Ln, Y и226Ra остаются в неподвижной фазе вместе с Ас (Ac/Bi-генератор), что обеспечивает дополнительную очистку от213Bi.

За исключением226Ra, все результаты были получены на гамма-спектрометре высокого разрешения.
Примечания:
a) α-спектрометрический анализ после радиохимического отделения Ra (два независимых анализа),
b) al/аAc - отношение радиоактивностей примесь/актиний,
c) al,t/аAc - отношение радиоактивностей всех примесей к радиоактивности225Ас.
55Со,56Со,57Со,58Со,67Ga,194Au,206Bi,205Bi,51Cr,87Y,48V,54Mn,65Zn,226Ra,214Pb и214Bi не могут быть определены γ-спектрометрическим анализом.
Химические примеси, обнаруженные в очищенной фракции, содержащей актиний
Обычно общее содержание всех неорганических примесей в очищенной фракции, содержащей актиний, составляет менее 100 мг. Во фракции, содержащей актиний, были обнаружены и подвергнуты количественному анализу следующие элементы: Al, Ва, Са, Сr, Сu, К, La, Mg, Mn, Na, P, Rb, Si, Sr, Ti, Zr, Zn и Zr.
Таким образом, в соответствии со способом, предлагаемым согласно настоящему изобретению, может быть приготовлен фармацевтически приемлемый препарат, содержащий225Ас, и225Ас может быть использован для приготовления радиоизотопных медикаментов, пригодных для лечения раковых заболеваний, описанных во вводной части настоящего документа.
Реферат
Группа изобретений относится к способу извлечения чистого 225Ас из облученных 226Ra-мишеней, нанесенных на подложку. Способ включает обработку Ra-мишеней выщелачиванием с осуществлением по существу полного выщелачивания 225Ac и 226Ra под действием азотной или соляной кислоты с проведением последующего первого этапа экстракционной хроматографии для отделения 225Ac от 226Ra и других изотопов радия и второго этапа экстракционной хроматографии для отделения 225Ac от 210Ро и 210Pb. Имеются также два варианта осуществления способа извлечения чистого 225Ас из облученных 226Ra-мишеней, а также фармацевтически приемлемый радиоизотопный состав. Группа изобретений направлена на получение очищенного 225Ас, который может быть использован для приготовления составов, пригодных для фармацевтических целей. 4 н. и 46 з.п. ф-лы, 5 ил., 2 табл.
Формула
a) по меньшей мере одну обработку226Ra-мишеней выщелачиванием с осуществлением, по существу, полного выщелачивания225Ас и226Ra под действием азотной или соляной кислоты в условиях дефлегмации;
b) удаление НCl, если растворитель, применяемый на стадии а) представляет собой соляную кислоту, и последующее растворение полученного материала в азотной кислоте;
c) концентрирование экстрактов, содержащих225Ас и226Ra;
d) отделение225Ас от226Ra и других изотопов радия посредством по меньшей мере одного первого этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее первой системой экстрагентов, включающих по меньшей мере одно соединение, отвечающее общей Формуле I, в по меньшей мере одном соединении, отвечающем общей Формуле II,
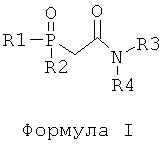

где в Формуле I:
R1, R2 независимо представляют собой октил, н-октил, фенил или фенил, замещенный C1-С3-алкилом;
R3, R4 независимо представляют собой пропил, изопропил, бутил или изобутил;
и в Формуле II:
R5, R6 и R7 независимо представляют собой С2-С5-алкил, в частности бутил или изобутил;
e) элюирование из неподвижной фазы при помощи разбавленной азотной или соляной кислоты225Ас, удержанного на твердой подложке в отсутствие удерживания226Ra;
f) отделение225Ас от210Ро и210Pb посредством по меньшей мере одного второго этапа экстракционной хроматографии с использованием твердой подложки, с нанесенной на нее второй системой экстрагентов, включающих по меньшей мере одно вещество, отвечающее общей Формуле III, в по меньшей мере одном веществе, отвечающем общей Формуле IV,
R10-OH
Формула IV,
где в Формуле III:
R8 и R9 независимо представляют собой Н, C1-С6-алкил или трет-бутил; и в Формуле IV:
R10 представляет собой С4-С12 алкил;
g) использование в качестве подвижной фазы 2М НСl; и
h) извлечение225Ас из элюата, в то время как210Po и210Рb удерживаются в твердой фазе на стадии f).
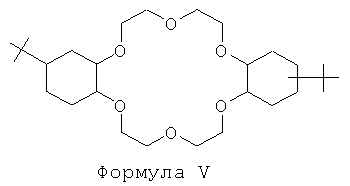
в 1-октаноле.
a.225Ас; или
b. изотопы Ra; или
c.210Ро; и
d.210Pb
испаряют до получения влажных или сухих остатков и при необходимости вновь растворяют.
a) по меньшей мере одну обработку226Ra-мишеней выщелачиванием с осуществлением, по существу, полного выщелачивания225Ас и226Ra под действием азотной или соляной кислоты в условиях дефлегмации;
b) удаление НСl, если растворитель, применяемый в операции а) представляет собой соляную кислоту, и последующее растворение полученного материала в азотной кислоте;
c) концентрирование экстрактов, содержащих225Ас и226Ra;
d) отделение225Ас от226Ra и других изотопов радия посредством по меньшей мере одного первого этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее первой системой экстрагентов, включающих по меньшей мере одно соединение, отвечающее общей Формуле IA,
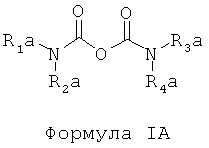
где в Формуле IA:
R1a, R2a, R3a, R4a независимо представляют собой октил или 2-этилгексил;
e) элюирование из неподвижной фазы при помощи азотной кислоты концентрацией от 0,3М до 0,01М или соляной кислоты концентрацией от 1М до 0,05М225Ас, удержанного на твердой подложке в отсутствие удерживания226Ra;
f) отделение225Ас от210Ро и210Рb посредством по меньшей мере одного второго этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее второй системой экстрагентов, включающих по меньшей мере одно вещество, отвечающее общей Формуле III, в по меньшей мере одном веществе, отвечающем общей Формуле IV,

R10-OH
Формула IV,
где в Формуле III:
R8 и R9 независимо представляют собой Н, C1-С6-алкил или трет-бутил; и
в Формуле IV:
R10 представляет собой С4-С12 алкил;
g) использование в качестве подвижной фазы 2М НСl; и
h) извлечение225Ас из элюата, в то время как210Ро и210Рb удерживаются в твердой фазе на стадии f).

в 1-октаноле.
a.225Ас; или
b. изотопы Ra; или
c.210Ро; и
d.210Рb
испаряют до получения влажных или сухих остатков и при необходимости вновь растворяют.
a) по меньшей мере одну обработку226Ra-мишеней выщелачиванием с осуществлением, по существу, полного выщелачивания225Ас и226Ra под действием азотной или соляной кислоты в условиях дефлегмации;
b) удаление НСl, если растворитель, применяемый на стадии а) представляет собой соляную кислоту, и последующее растворение полученного материала в азотной кислоте;
c) концентрирование экстрактов, содержащих225Ас и226Ra;
d) отделение225Ас от226Ra и других изотопов радия посредством по меньшей мере одного первого этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее первой системой экстрагентов, включающих по меньшей мере одно соединение, отвечающее общей формуле IB,
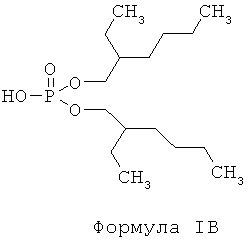
e) элюирование из неподвижной фазы при помощи азотной кислоты, концентрация которой составляет от примерно 0,02М до примерно 0,1М,225Ас, удержанного на твердой подложке в отсутствие удерживания226Ra;
f) отделение225Ас от210Po и210Рb посредством по меньшей мере одного второго этапа экстракционной хроматографии с использованием твердой подложки с нанесенной на нее второй системой экстрагентов, включающих по меньшей мере одно вещество, отвечающее общей формуле III, в по меньшей мере одном веществе, отвечающем общей формуле IV,

R10-OH
Формула IV,
где в Формуле III:
R8 и R9 независимо представляют собой Н, С1-С6-алкил или трет-бутил; и
в Формуле IV:
R10 представляет собой С4-С12 алкил;
g) использование в качестве подвижной фазы 2М НСl; и
h) извлечение225Ас из элюата, в то время как210Ро и210Рb удерживаются в твердой фазе на стадии f).

в 1-октаноле.
а.225Ас; или
b. изотопы Ra; или
c.210Ро; и
d.210Рb
испаряют до получения влажных или сухих остатков и при необходимости вновь растворяют.
Документы, цитированные в отчёте о поиске
Способ получения актиния-225 и его дочерних элементов

Комментарии