Комбинированный хирургический эндозонд для оптической когерентной томографии, подсветки или фотокоагуляции - RU2603427C2
Код документа: RU2603427C2
Чертежи


Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет по предварительной патентной заявке US 61/435031, поданной 21 января 2011 г.
УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Описанные здесь варианты реализации относятся к области микрохирургических зондов. Более конкретно, описанные здесь варианты реализации относятся к области хирургических эндозондов, сочетающих оптическую когерентную томографию с подсветкой или фотокоагуляцией.
2. ОПИСАНИЕ МАТЕРИАЛОВ, ИСПОЛЬЗОВАННЫХ ПРИ ЭКСПЕРТИЗЕ
Область микрохирургических процедур быстро развивается. Обычно эти процедуры включают в себя использование зондов, которые способны достигать ткани, подлежащей обработке или диагностированию. Такие процедуры выполняются с использованием эндоскопических хирургических инструментов, имеющих зонд, соединенный с управляющим устройством на удаленном пульте оператора. Зонды, относящиеся к текущему состоянию техники, довольно сложны в эксплуатации, часто требуя подвижных частей, которые приводятся в действие с использованием сложных механических систем. Во многих случаях электродвигатель включен в состав зонда. Большинство из устройств предшествующего уровня техники имеют стоимость, при которой становится трудно их выбрасывать после одной или всего лишь нескольких хирургических процедур. Кроме того, сложность устройств предшествующего уровня техники приводит в общем случае к тому, что зонды имеют сечение в несколько миллиметров. Такие зонды находят небольшое практическое применение для глазных микрохирургических операций. В глазной хирургии предпочтительными являются размеры в один (1) миллиметр или меньше, чтобы достичь зон, не нанося повреждений посторонним тканям. Сканирующие механизмы, которые обеспечивают зависящее от времени направление света для диагностических или терапевтических целей, были использованы в эндоскопических хирургических инструментах. В этих инструментах обычно используются зонды, которые обеспечивают формирование изображения, лечение, или и то и другое, по протяженной области ткани, не требуя перемещения эндоскопа по отношению к окружающей его среде. Однако обычно существует несколько зондов для каждой функции, и используются разные источники света для разных применений.
Поэтому остается необходимость в хирургических эндозондах, сочетающих разные функции с обеспечением синергического эффекта.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно конкретным вариантам реализации настоящего изобретения хирургическая система включает в себя хирургический лазерный источник, выполненный с возможностью излучения луча хирургического лазера, и модуль оптической когерентной томографии (ОКТ), выполненный с возможностью излучения луча ОКТ. Хирургическая система также включает в себя эндозонд, оптически соединенный с хирургическим лазерным источником и модулем ОКТ. Эндозонд включает в себя оптоволокно ОКТ для передачи луча ОКТ, оптоволокно хирургического лазера для передачи луча хирургического лазера и сканирующую оптику, оптически соединенную с оптоволокном ОКТ и с оптоволокном хирургического лазера, причем сканирующая оптика выполнена с возможностью одновременного сканирования как луча ОКТ, так и луча хирургического лазера. Хирургическая система дополнительно включает в себя процессор, запрограммированный на управление сканирующей оптикой для сканирования луча ОКТ и луча хирургического лазера по области целевой ткани и обнаружения сигнала ОКТ от области целевой ткани.
Различные варианты реализации настоящего изобретения будут также распространяться на способы работы, соответствующие приведенному описанию, и этапы, выполняемые различными элементами хирургической системы. Подобным образом варианты реализации настоящего изобретения могут распространяться на программное обеспечение, находящееся на машиночитаемом носителе, используемое для управления хирургической системой описанным образом. Это будет также распространяться на любые подходящие изменения, очевидные для специалистов в данной области техники, которые должны сделать подобные изменения способов и программного обеспечения также очевидными.
Эти и другие варианты реализации настоящего изобретения будут подробно описаны ниже со ссылками на прилагаемые чертежи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 - блок-схема хирургической системы согласно конкретному варианту реализации настоящего изобретения;
Фиг. 2 - изображение эндозонда согласно конкретному варианту реализации настоящего изобретения;
Фиг. 3 - изображение дистального конца эндозонда согласно конкретному варианту реализации настоящего изобретения; и
Фиг. 4 - изображение дистального конца эндозонда согласно другому конкретному варианту реализации настоящего изобретения.
На фигурах элементы, имеющие одинаковые номера позиций, имеют одинаковые или подобные функции.
ПОДРОБНОЕ ОПИСАНИЕ
Различные варианты реализации настоящего изобретения представляют эндозонд с ОКТ сканированием в сочетании с применениями в качестве хирургического лазера и подсветкой. Зонд может быть ручным зондом для непосредственных манипуляций специализированным персоналом. В некоторых вариантах реализации зонд может быть выполнен с возможностью управления роботизированной рукой или устройством под управлением компьютера. Зонды имеют проксимальный конец, ближе к операционному органу управления (которым может быть специалист или устройство), и дистальный конец, ближе к ткани или находящийся с ней в контакте. Зонды, соответствующие описываемым здесь вариантам реализации, могут иметь малые размеры, быть легко управляемыми с проксимального конца и минимально инвазивными для окружающей ткани. На дистальном конце зонд заканчивается наконечником, откуда зонд выполняет определенное действие с целевой тканью, расположенной вблизи наконечника. Например, зонд может доставлять свет из своего наконечника и принимать свет, отраженный или рассеянный от ткани, подводимый через наконечник. Наконечник зонда может включать в себя подвижные элементы, которые позволяют наконечнику выполнять действие.
На фиг. 1 показана блок-схема хирургической системы 10 согласно конкретному варианту реализации настоящего изобретения. В представленном варианте реализации хирургическая система 10 включает в себя источник 20 подсветки для генерации видимого света, пригодного для визуализации хирургического поля, и модуль 30 ОКТ. Хирургический лазерный источник 40 обеспечивает лазерную энергию, имеющую подходящие свойства, чтобы осуществить модификацию целевой ткани, такую как фотокоагуляция ткани сетчатки глаза. Когда эти элементы будут обсуждаться подробно ниже, станет понятно, что хирургическая система 10 может также включать в себя другие хирургические источники света, такие как лазерный источник для фотокоагуляции, трабекулэктомии или других хирургических применений. Следующее описание может быть соответствующим образом адаптировано, чтобы включить в него множество приемлемых способов по доставке света, известных в технике. Источник 20 подсветки, модуль 30 ОКТ и хирургический лазерный источник 40 соединены с хирургическим зондом 100, используя соответствующую соединительную оптику, которая может быть выбрана, основываясь на выходном луче, имеющем желаемые свойства света, доставляемого для конкретного применения, такие как энергия, длина волны или числовая апертура. Хирургическая система 10 дополнительно включает в себя пользовательский интерфейс 50, который позволяет пользователю управлять работой хирургической системы 10, которая может содержать любые подходящие входные или выходные устройства, включая, но не ограничиваясь перечисленным, клавиатуру, ручной пульт управления, мышь, сенсорный экран, педальный переключатель, микрофон для голосовых команд или любое из многочисленных таких устройств, известных в традиционных хирургических системах.
Источник 20 подсветки может быть любым из многочисленных хирургических источников подсветки, таких как ксеноновая лампа, комплект светодиодов, лазер или другой подходящий источник света для генерации света, находящегося в пределах видимой области спектра. Модуль 30 ОКТ является интерферометрическим аппаратом для измерения интерференции между опорным лучом, генерируемым путем использования хирургического света, и светом, отраженным от ткани, освещаемой хирургическим светом. В конкретных вариантах реализации модуль 30 ОКТ может включать в себя основанный на спектрометре интерферометр, известный также как “ОКТ в спектральной области”. Это относится к системе ОКТ, которая использует относительно широкий спектральный диапазон света и измеряет интерференцию дискретных длин волн в пределах спектральной полосы, чтобы воссоздать информацию о целевой ткани.
Модуль 30 ОКТ также включает в себя процессор 32, который может быть одним или несколькими подходящими электронными компонентами для обработки информации, включая, но не ограничиваясь перечисленным, микропроцессор, микроконтроллер, специализированную интегральную схему (ASIC) или другое программируемое устройство. Процессор 32 обрабатывает информацию об интерференции, производимой светом, отраженным от ткани, чтобы создать математическое представление сканируемой ткани, которое может быть в свою очередь использовано для создания электронного изображения ткани. Модуль 30 ОКТ также включает в себя память 34, которая может иметь любую подходящую форму устройства хранения информации, включая электронные, магнитные или оптические запоминающие устройства, которые могут быть либо энергозависимыми, либо энергонезависимыми. Наконец, модуль 30 ОКТ включает в себя контроллер 36 сканирования. Контроллер 36 сканирования может быть любым подходящим сочетанием аппаратного обеспечения, программного обеспечения и/или аппаратно-программных средств и механических компонентов, которое может включать в себя процессор 32 и память 34, пригодным для управления перемещением оптических компонентов с целью изменения направления хирургического света, используемого модулем 30 ОКТ. Например, в вариантах реализации, где зонд 100 включает в себя сканирующую оптику для луча ОКТ, контроллер 36 сканирования может быть соединен со сканирующей оптикой, чтобы управлять сканирующим механизмом.
В одном примере ОКТ технологии формирования изображений световой луч, имеющий интервал когерентности, может быть направлен в определенное пятно в целевой ткани, используя зонд. Интервал когерентности обеспечивает глубину разрешения, которая при изменении у дистального конца зонда может быть восстановлена из свертки для образования углубленного изображения освещенного участка ткани (А-сканирование). Двухмерное изображение ткани может быть получено через В-сканирование. В некоторых вариантах реализации В-сканирования являются прямыми линиями вдоль сечения ткани. Кроме того, выполняя повторные циклы В-сканирования вдоль разных линий в ткани, можно получить трехмерное (3D) изображение ткани. В некоторых вариантах реализации В-сканирования могут быть рядом линий, имеющих одну и ту же длину и расположенных по радиусу от общей точки пересечения. Таким образом, множество В-сканирований обеспечивают изображение круговой области в ткани, имеющее глубину.
В некоторых вариантах реализации ОКТ технология использует процедуры опережающего сканирования. В этом случае оптическая подсветка обеспечивается в прямом направлении от продольной оси зонда. При опережающем сканировании целевая ткань может находиться впереди зонда в плоскости, перпендикулярной к продольной оси зонда. Таким образом, свет, проходящий от наконечника зонда к ткани и обратно от ткани к зонду, может проходить в направлении, по существу параллельном продольной оси зонда. В некоторых вариантах реализации, использующих опережающее сканирование, целевая ткань может быть приближенно, но не точно, перпендикулярна продольной оси зонда. Кроме того, в некоторых вариантах реализации свет, проходящий к ткани от зонда и от ткани к зонду, может не быть параллельным продольной оси зонда, но образовывать симметричный паттерн относительно продольной оси зонда. Например, свет, подсвечивающий целевую ткань при опережающем сканировании, может формировать сплошной конус или часть его вокруг продольной оси зонда. Подобным образом свет, собираемый эндозондом при опережающем сканировании, может поступать от целевой ткани в 3D зону, включающую в себя участок с коническим сечением вокруг продольной оси зонда.
На фиг. 2 показан микрохирургический эндозонд 100, который включает в себя узел канюли 110 и манипулятор 150. Узел канюли 110 включает в себя дистальный конец эндозонда 100, который может быть вытянут вдоль продольной оси зонда и иметь ограниченное сечение. Например, в некоторых вариантах реализации узел канюли 110 может иметь диаметр (D2) около 0,5 мм, тогда как манипулятор 150 может иметь по существу цилиндрическую форму с диаметром (D1) в несколько миллиметров, например 12-18 мм. Соединительный кабель 195 включает в себя световоды, передающие свет от соединительной оптики 50 широкополосного источника 20 света. В альтернативных вариантах реализации отдельные зонды 100 могут быть соединены в общий источник света, или же как хирургический свет, так и подсвечивающий свет могут быть соединены в общем световоде.
В некоторых вариантах реализации сборный узел 110 может находиться в контакте с тканью, включающей в себя целевую ткань для микрохирургической процедуры. При этом сборный узел 110 может быть покрыт материалами, которые предотвращают заражение или загрязнение ткани. Кроме того, хирургические процедуры и протоколы могут устанавливать гигиенические стандарты для сборного узла 110, которые все полностью включены в настоящее описание путем ссылки. Например, может оказаться желательным, чтобы собранный узел 110 выбрасывался после одного использования. В некоторых ситуациях сборный узел 110 может выбрасываться по меньшей мере каждый раз, когда процедура выполняется на другом пациенте или в другой части тела.
Манипулятор 150 может находиться ближе к проксимальному концу зонда и может иметь большее сечение по сравнению с элементом 110. Элемент 150 может быть выполнен с возможностью оперирования вручную эндозондом 100 в соответствии с некоторыми вариантами реализации. Элемент 150 может быть выполнен с возможностью проведения робототехнического действия или же удержания автоматизированного устройства или дистанционно управляемого устройства. Тогда как сборный узел 110 может находиться в контакте с целевой тканью, элемент 150 может не находиться в непосредственном контакте с живой тканью. Таким образом, даже хотя элемент 150 может соответствовать гигиеническим стандартам, они могут быть до некоторой степени смягчены по сравнению с теми, которые используются применительно к сборному узлу 110. Например, элемент 150 может включать в себя части и компоненты эндозонда 100, которые могут быть использованы повторно перед их выбрасыванием.
Таким образом, некоторые варианты реализации эндозонда 100, описываемые здесь, могут включать сложные компоненты в состав элемента 150, и менее дорогие сменные компоненты могут включаться в состав сборного узла 110. Некоторые варианты реализации могут иметь сменный элемент 110, который выбрасывается, тогда как манипулятор 150 может использоваться более одного раза. Манипулятор 150 может герметизироваться, для того чтобы исключить загрязнение ткани частицами или газами, выделяемыми внутренними элементами манипулятора 150. В некоторых вариантах реализации узел канюли 110 может быть прикреплен к манипулятору 150 клеевым соединением. Согласно другим вариантам реализации сборный узел 110 может отделяться от манипулятора 150, чтобы обеспечить легкую замену эндозонда 100 для повторных процедур. Некоторые варианты реализации, соответствующие фиг. 2, могут иметь выбрасываемый элемент 150 и выбрасываемый сборный узел 110.
В некоторых вариантах реализации технология ОКТ может использовать боковое формирование изображений. Например, при боковом формировании изображений целевая ткань может быть параллельной плоскости, содержащей продольную ось зонда. В ситуации, подобной этой, может оказаться желательным перемещать освещаемое пятно по круговой траектории вокруг продольной оси зонда, чтобы создать замкнутое изображение целевой ткани. Такая ситуация может возникнуть в микрохирургии, включающей в себя эндоваскулярные процедуры. Например, в коронароангиографии внутренняя стенка коронарной артерии может быть полностью просканирована в цилиндрических сечениях вдоль артериальной полости, используя описываемые здесь варианты реализации.
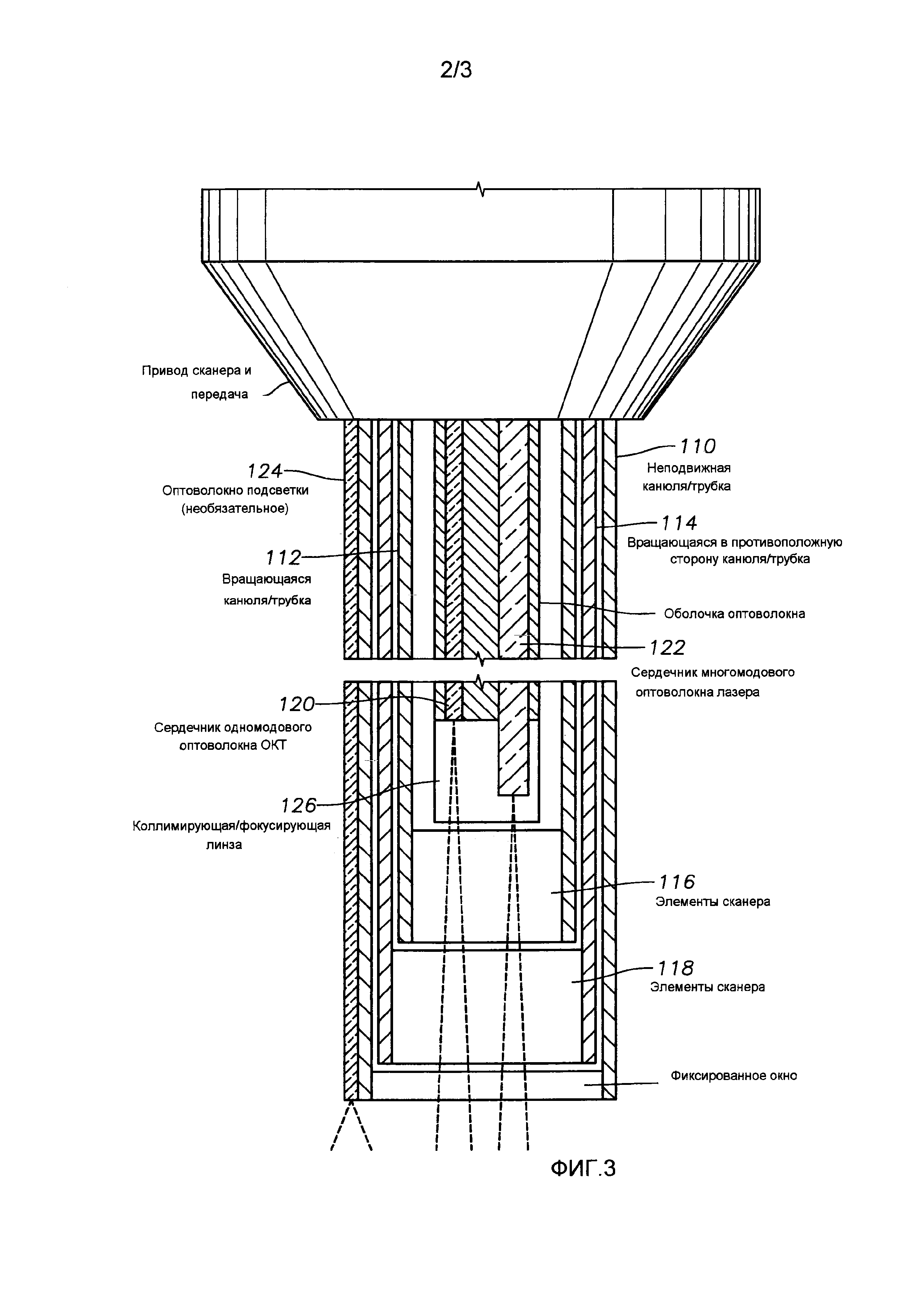
На фиг. 3 схематически представлены конкретные компоненты узла канюли 110 типового эндозонда 100 согласно конкретным вариантам реализации настоящего изобретения. В представленном варианте реализации узла канюля 110 включает в себя две вращающиеся в противоположные стороны внутренние канюли 112 и 114, имеющие соответствующие элементы 116 и 118 сканера, которые могут быть градиентными (GRIN) линзами. Элементы 116 и 118 сканера вращаются относительно друг друга, чтобы обеспечить сканирующий луч. Работа этих элементов описана более подробно в одновременно находящейся на рассмотрении заявке, озаглавленной “Приводной механизм офтальмологического сканера с противоположным вращением” (“Counter-rotating Ophthalmic Scanner Drive Mechanism”), которая подана 21 января 2011 г. как заявка номер 61/434942 и включена в настоящее описание путем ссылки. В более общем смысле может быть использовано любое сочетание подвижных оптических элементов, пригодное для сканирования светового луча и в целом именуемое “сканирующей оптикой”.
Канюля 110 также включает в себя оптоволокно 120 ОКТ, оптоволокно 122 хирургического лазера и оптоволокно 124 подсветки внутри стенки канюли 110. Оптоволокно 124 подсветки доставляет свет видимого диапазона от источника 20 подсветки, тогда как оптоволокно 120 ОКТ доставляет свет соответствующего спектра от модуля 30 ОКТ и возвращает свет, отраженный от ткани, для интерферометрических измерений. Волокно 122 хирургического лазера подобным образом доставляет лазерную энергию от хирургического лазерного источника 40. В представленном варианте реализации оптоволокно 120 ОКТ и оптоволокно 122 хирургического лазера могут использовать общую оболочку, но послойное размещение отдельных оптических волокон также может быть использовано.
Согласно требованиям к длине волны, обязательным для ОКТ измерений, одномодовое оптоволокно может быть подходящим для оптоволокна 120 ОКТ, тогда как оптоволокно 122 хирургического лазера может быть многомодовым, чтобы доставлять достаточную энергию для модификации ткани с относительно высокой эффективностью. Коллимирующая и/или фокусирующая линза 126 может быть пригодна для обеспечения того, чтобы свет, излученный от оптоволокна 120 ОКТ и оптоволокна 122 хирургического лазера, фокусировался в общей плоскости, с тем чтобы ОКТ сканирование происходило в непосредственной близости к лучу хирургического лазера. Как показано, луч ОКТ и луч хирургического лазера могут затем совместно сканироваться элементами 116 и 118 сканера. Это позволяет успешно контролировать модификацию ткани хирургическим лазером.
Отдельные оптические элементы также могут быть использованы вместо линз 126 и/или элементов 116 и 118 сканера для каждого оптоволокна, что позволяет сканировать лучи в разных диапазонах или с разными частотами. В конкретных вариантах реализации линза 126, связанная с оптоволокном хирургического лазера, создает паттерн с несколькими пятнами от луча хирургического лазера, используя подходящую оптическую конфигурацию, которая может быть в свою очередь просканирована элементами 118 и 118 сканера. В других вариантах реализации хирургический лазерный источник 4 0 может использовать один или более элементов для излучения нескольких лучей, объединенных в нескольких волокнах 122 хирургического лазера, которые создают несколько пятен от хирургического лазера.
Процессор 32 модуля 30 ОКТ может быть запрограммирован на обнаружение характеристики конфигураций ткани в конкретных условиях, таких как когда модификация ткани была успешно достигнута в целевой зоне. Процессор 32 может быть также запрограммирован на обнаружение случая доставки избыточной энергии, например, когда была обожжена ткань, и на принятие корректирующего действия. Например, хирургический лазерный источник 40 может получить сигнал на выключение, или элементы 116 и 118 сканера могут управляться для более быстрого перемещения луча в новую зону целевой ткани. В общем случае сканирование фотокоагуляционного луча может быть автоматизировано на основе мониторинга сигнала ОКТ для обеспечения эффективной и равномерной модификации ткани.
Хотя был представлен пример фотокоагуляции, любое другое применение оптической энергии для модификации ткани может также подобным образом контролироваться. Кроме того, хотя в качестве примера была приведена конфигурация с процессором 32 модуля 30 ОКТ, любая подходящая структура управляющей электроники для хирургической системы, включающая в себя любое число отдельных процессоров для управления различными подсистемами хирургической системы 10, также может быть использована. Следовательно, термин “процессор” может относиться в общем случае к любому компоненту или сочетанию компонентов, включающему в себя любую подходящую энергозависимую или энергонезависимую память для хранения информации, которое способно руководить операциями различных элементов хирургической системы 10.
На фиг. 4 показан другой вариант реализации канюли 110 зонда 100. В варианте реализации на фиг. 4 свет от оптоволокна 124 подсветки может также подлежать сканированию. Преимущество сканирования луча подсветки, такого как в варианте реализации на фиг. 4, заключается в том, что луч может развертываться, чтобы покрыть большую зону, эффективно увеличивая числовую аппретуру освещающего света и напрямую связывая визуализацию ткани со сканированием лучом хирургического лазера и/или лучом ОКТ. Умеренно высокая частота сканирования, пригодная для ОКТ, такая как 60 Гц, обычно также пригодна для того, чтобы сделать подсветку постоянной и равномерной в пределах поля наблюдения.
Различные варианты реализации могут также с успехом регулировать рабочий цикл источника 20 подсветки, модуля 30 ОКТ и/или хирургического лазерного источника 40, чтобы обеспечить желаемые паттерны сканирования. Например, хирургический лазерный источник 4 0 может приводиться в действие в выбранных точках, в то время как луч ОКТ и луч подсветки продолжают сканирование, для обеспечения желаемого распределения лазерного излучения на целевой ткани. Подобным образом относительный размер паттерна распределения пятен для хирургического лазера по отношению к полю подсветки также может выбираться.
В практических вариантах реализации паттерн сканирования может также программироваться или выбираться из числа вариантов, используя пользовательский интерфейс 50. Таким образом, например, хирург, который хочет отрегулировать размер паттерна распределения пятен относительно поля подсветки или расширить поле подсветки, может обеспечить соответствующий ввод, чтобы сделать это. В одном таком примере паттерн распределения пятен и поле подсветки могут воспроизводиться на сенсорном экране, чтобы изменить форму или размер элементов этого паттерна. Могут быть также установлены ограничения на возможные паттерны распределения, чтобы предотвратить ситуации, в которых такие пятна окажутся слишком близко друг к другу, и тем самым повысить правдоподобие повреждения ткани. Процессор 32 может быть также запрограммирован на определение ожидаемой скорости модификации ткани и регулировку времени выдержки конкретных пятен, основываясь на рабочем цикле и/или частоте сканирования, и управление лазерной хирургией может также осуществляться на основе обратной связи ОКТ. Ряд других возможных адаптаций к конкретным потребностям исходя из хирургических требований, подходящего освещения и соображений безопасности будет очевиден для специалистов в данной области техники.
Хотя вышеизложенное описание было сосредоточено на хирургической системе и устройстве зонда, должно быть понятно, что различные варианты реализации настоящего изобретения будут распространяться на способы работы, соответствующие приведенному выше описанию, и этапы, выполняемые различными элементами хирургической системы. Подобным образом варианты реализации настоящего изобретения могут распространяться на программное обеспечение, вложенное в машиночитаемый носитель, используемый для управления хирургической системой описанным образом. Это будет также распространяться на любые подходящие изменения, очевидные для специалистов в данной области техники, которые должны сделать подобные изменения способов и программного обеспечения также очевидными.
Различные варианты реализации настоящего изобретения представляют эндозонд с ОКТ сканированием в сочетании с хирургическими лазерными применениями и/или подсветкой. Варианты реализации изобретения, описанные выше, являются только примерами. Специалисты в данной области техники могут осознать различные альтернативные варианты реализации на основе тех, которые были конкретно описаны. Такие альтернативные варианты реализации также должны укладываться в объем настоящего описания. Как таковое, изобретение ограничивается только прилагаемой формулой изобретения.
Реферат
Изобретение относится к медицинской технике. Хирургическая система включает в себя хирургический лазерный источник, выполненный с возможностью излучения луча хирургического лазера; модуль оптической когерентной томографии (ОКТ), выполненный с возможностью излучения луча ОКТ; эндозонд, оптически соединенный с хирургическим лазерным источником и модулем ОКТ. Причем эндозонд содержит оптоволокно ОКТ для передачи луча ОКТ; оптоволокно хирургического лазера для передачи луча хирургического лазера; причем луч хирургического лазера проходит через по меньшей мере один оптический элемент, создавая множество пятен от луча хирургического лазера; и узел канюли, содержащий первую канюлю, имеющую первую сканирующую оптику, и вращающуюся в противоположную сторону вторую канюлю, имеющую вторую сканирующую оптику, оптоволокно ОКТ и оптоволокно хирургического лазера, оптически соединенные с первой и второй сканирующей оптикой, так что луч ОКТ и луч хирургического лазера каждый проходят через первую и вторую сканирующую оптику, и вращение в противоположную сторону первой и второй сканирующей оптикой приводит к одновременному сканированию и лучом ОКТ, и лучом хирургического лазера; и процессор, запрограммированный на управление сканирующей оптикой с целью сканирования лучом ОКТ и лучом хирургического лазера по области целевой ткани и обнаружения сигнала ОКТ от области целевой ткани. Применение данного изобретения позволит расширить арсенал технических средств, а именно хирургических систем. 9 з.п. ф-лы, 4 ил.
Формула
хирургический лазерный источник, выполненный с возможностью излучения луча хирургического лазера;
модуль оптической когерентной томографии (ОКТ), выполненный с возможностью излучения луча ОКТ;
эндозонд, оптически соединенный с хирургическим лазерным источником и модулем ОКТ, причем эндозонд содержит:
оптоволокно ОКТ для передачи луча ОКТ;
оптоволокно хирургического лазера для передачи луча хирургического лазера;
причем луч хирургического лазера проходит через по меньшей мере один оптический элемент, создавая множество пятен от луча хирургического лазера; и
узел канюли, содержащий первую канюлю, имеющую первую сканирующую оптику, и вращающуюся в противоположную сторону вторую канюлю, имеющую вторую сканирующую оптику, оптоволокно ОКТ и оптоволокно хирургического лазера, оптически соединенные с первой и второй сканирующей оптикой, так что луч ОКТ и луч хирургического лазера каждый проходят через первую и вторую сканирующую оптики, и вращение в противоположную сторону первой и второй сканирующей оптикой приводит к одновременному сканированию и лучом ОКТ, и лучом хирургического лазера; и
процессор, запрограммированный на управление сканирующей оптикой с целью сканирования лучом ОКТ и лучом хирургического лазера по области целевой ткани и обнаружения сигнала ОКТ от области целевой ткани.
Документы, цитированные в отчёте о поиске
Способ и системы для определения параметров и картографирования поражений ткани

Комментарии