Эндовазальный мини-робот - RU2218191C2
Код документа: RU2218191C2
Чертежи



Описание
Изобретение относится к области медицинской техники, преимущественно используется при реканализации кровеносных сосудов методами дезоблитерации и ангиопластики при облитерации сосудистого просвета атеросклеротическими отложениями и тромбами различной консистенции.
Изобретение может быть использовано для диагностики и лечения заболеваний других трубчатых органов, например кишечника, мочеточника, дыхательных путей.
Изобретение позволяет осуществлять перемещение диагностических, хирургических и терапевтических технических средств внутри трубчатых органов различной протяженности, поперечных размеров и конфигурации в максимально щадящем для пациента режиме, используя физиологический принцип движения - перистальтический.
В последние годы наблюдается увеличение числа тромбоэмболических заболеваний, что обуславливает необходимость разработок методов и систем для внутрисосудистых операций. Следует отметить, что многие из этих методов ангиопластики проходят в настоящее время экспериментально-клинические испытания, а другие, такие как баллонная ангиопластика, широко применяются на практике. К основным группам методов внутрисосудистых операций относятся дилатация, экстракция, деструкция.
К дилатационной группе относятся такие методы, как стентирование, вибрационная, ультразвуковая и балонная дилатация. Простейший вариант дилатации - многократное бужирование инструментами все большего диаметра, пока не будет достигнута требуемая величина просвета сосуда.
Одним из самых распространенных методов в данной группе является балонная дилатация. Устройства для осуществления этого способа содержат сдутый баллон, вводимый в сосуд с помощью катетера. Затем для открытия просвета сосуда баллон раздувают. При раздувании баллон стремится уплотнить стеноз. Материал стеноза из сосуда не удаляется, поэтому существует высокая вероятность реокклюзий сосуда на том же участке. Требуется повторная, иногда многократная обработка.
Это оборудование не дает положительных результатов при обработке кальцинированных и твердых окклюзий, эксцентрических окклюзий (баллон стремится растянуть непораженную стенку сосуда, а не сжать твердый материал стеноза), длинных участков окклюзий. Сосуд в процессе обработки полностью закупорен баллоном. Баллон во время раздувания может нанести сосуду неконтролируемую глубокую травму, в том числе с образованием лоскутов, находящихся в просвете сосуда, с последующим его перекрытием или рестенозом.
Еще одним методом из дилатационной группы является ультразвуковая дилатация, позволяющая уплотнять и изменять структуру внутрисосудистых отложений в крупных и средних артериях путем контактного воздействия на них рабочими окончаниями специальных ультразвуковых инструментов.
Вибрационная ангиопластика использует энергию механических колебаний металлического проводника с частотой 100-400 Гц для обработки канала внутри полых окклюзий и для изменения свойств отложений.
Стентирование заключается в использовании металлических сетчатых трубок (стентов) для расширения просвета сосуда и прижатия фрагментов эндотелия к поверхности интимы.
К экстракционной группе относятся методы эндарэктомии, вакуумная и механическая экстракция. Эндарэктомия в простейшем случае состоит в отделении внутрисосудистых отложений вместе с пораженными слоями сосуда от здоровой части стенки при помощи металлической или проволочной петли. Развитием этих методик стало создание газовой эндарэктомии, при которой выходящий углекислый газ ускоряет процессы разделения тканей, и ультразвуковой эндарэктомии, использующей энергию ультразвуковых колебаний инструментов с рабочим окончанием в форме кольца.
Неизбежная травма, связанная с удалением интимы, ограничивает область их применения.
К методам, основанным на деструкции, относятся ультразвуковая, искровая и лазерная деструкция и другие (в том числе устройства типа Rotoblator и т. п. ). Главной отличительной чертой этих методов является разрушение окклюзирующего субстрата без его эвакуации из сосудистого русла.
Один из путей реканализации - атерэктомия, состоит в механическом иссечении материала, который полностью или частично закупоривает сосуд. Устройства для атерэктомии (напр., см. патент США 4445509) включают вращающийся бор с рифленой или абразивной поверхностью. В месте локализации стеноза бор приводится во вращение с высокой скоростью, стирая или срезая материал. Бор вводится с катетером, как правило, через бедренную артерию и дистанционно приводится во вращение.
Такие устройства позволяют практически полностью удалить стеноз, оставляя стенки сосуда относительно гладкими, исключая образование лоскутов ткани. Эффективно уделяются эксцентрические стенозы, относительно длинные окклюзии, а также срезаются плотные и/или кальцинированные окклюзии.
Главный недостаток устройств для атерэктомии - фиксированный рабочий диаметр. В больших сосудах требуется применять бор большого диаметра, что представляет опасность для пациента. Чтобы подвести бор большого диаметра к стенозу, используют катетеры большого диаметра, которые часто причиняют тканям сосудов в месте введения тяжелые травматические повреждения. Большие абразивные головки имеют тенденцию наносить сосудистым тканям травматические повреждения повышенной тяжести во время прохождения по сосудам. Большие боры на пути к окклюзированному участку сосуда, который необходимо обработать, могут задеть другие окклюзированные участки, которым обработка не показана.
В последнее время получила развитие аппаратура для реканализации трубчатых органов после тотальной окклюзии, применяющая ультразвуковые (УЗ) средства разрушения (см. , например, описание к европейскому патенту ЕР 0582766 А1, 16.02.94 и международную заявку WО 99/25257 А1, 27.05.99).
Однако и в этих системах средства УЗ воздействия вводятся в сосуд катетером, что не гарантирует от перечисленных выше осложнений и травм.
Одним из наиболее развиваемых направлений в последнее время является ангиопластика /1/, использующая эффекты лазерного излучения, передаваемого к месту патологии через тонкие световоды (диаметром до 0,5 мм), которые вводятся в просвет сосуда посредством ангиографических катетеров.
Искровая эрозия внутрисосудистых отложений вызывается акустическими и тепловыми эффектами, сопровождающими искровой разряд.
Общим недостатком всех известных технических средств реканализации кровеносных сосудов при минимально-инвазивной хирургии является то, что не обеспечивается полная безопасность и быстрота продвижения инструмента по сосудистому руслу, а также сложность определения точного местоположения патологического очага.
Таким образом, в медицине существует очевидная потребность в создании устройства для реканализации кровеносных сосудов, которое обладало бы преимуществами известных атерэктомических и УЗ устройств, но могло бы быть введено в тело пациента и перемещалось бы в сосудах с минимальной травмой тканей, могло бы свободно проходить через не подлежащие обработке стенозы. Такое устройство должно иметь возможность проходить через сосуды с изменяющимся в определенных пределах диаметром в процессе одного введения. Оно должно снизить стоимость лечения и исключить опасения врачей по поводу ротационного бора.
Устройство должно быть универсальным и обеспечивать возможность использования хирургом различных способов разрушения стенозов, включая баллонную ангиопластику, атерэктомию и ультразвуковое воздействие. Это даст возможность совместить преимущества перечисленных методов. В некоторых случаях целесообразно использовать несколько методов воздействия на внутреннюю полость сосудов за одно введение устройства. Например, при диссекции тканей с образованием лоскута, который невозможно удалить с помощью абразивного наконечника. Для восстановления сосудов в таких случаях целесообразно применить баллоноангиопластику.
Устройство должно быть безопасным для пациента и допускать свободное извлечение из тела пациента в случае возникновения непредвиденных ситуаций.
Очевидно, что использование относительно автономного устройства, способного перемещаться внутри тела пациента, требует использования соответствующих информационно-сенсорных систем, контролирующих как собственное движение устройства, так и обстановку в рабочей зоне. При этом необходимость обработки информации в реальном масштабе времени и представления ее хирургу-оператору в легко воспринимаемой им форме требует применения современных информационных технологий. Таким образом, рассматриваемое устройство является частью медицинской робототехнической системы и может квалифицироваться как медицинский мини-робот.
В последнее время появились публикации о создании медицинских мини-роботов различного применения, являющихся близкими аналогами заявляемого устройства. В работе /2/ (M. C.Carroza etc.) рассматривается медицинский мини-робот для колоноскопии. Движитель мини-робота пневматического типа; он представляет собой три камеры. Две крайние могут присасываться к стенкам трубчатого органа. Средняя представляет собой сильфон, который может изменять длину за счет изменения давления со стороны источника энергии. Крайние камеры последовательно присасываются к стенкам, а за счет сокращения средней камеры происходит поступательное движение мини-робота внутри трубчатого органа. Управление роботом осуществляется с поста оператора, оснащенного ПЭВМ для обработки поступающей информации и формирования управляющих сигналов. Предусмотрена визуальная, тактильная и силовая обратная связь. Мини-робот снабжается аппаратурой для визуального наблюдения за состоянием внутренней полости органа, датчиками сил, датчиками проскальзывания, а также рабочим инструментом в виде микросхвата, аппаратом радиотерапии. Данный мини-робот принят как ближайший аналог заявляемого изобретения. Проект финансируется по программе Европейской комиссии БИОМЕД-2 и, насколько можно судить по публикации, не вышел за рамки лабораторных исследований.
Отметим, что данное устройство обладает определенными недостатками при использовании внутри кровеносных сосудов. Главным из них является полная закупорка сосуда при работе микроробота. Применение пневматического движителя, а также пневматических фиксаторов создает риск попадания пузырьков воздуха в русло крови с возможностью последующей эмболии.
Еще одно близкое решение /3/ (A.Rovetta, etc.) представляет собой телеуправляемый робот-эндоскоп, предназначенный для диагностики трубчатых органов, в том числе пищевода, а также для колоноскопии. В отличие от первого аналога для перемещения устройства внутри трубчатого органа здесь используется пьезоэлектрический движитель. Устройство состоит из нескольких пьезоэлектрических колец, соединенных с центральным стержнем из того же материала. Попарно расширяющиеся за счет пьезоэффекта кольца играют роль фиксаторов; при этом за счет удлинения центрального стержня осуществляется поступательное перемещение конструкции внутри трубчатого органа. Трансформация элементов движителя происходит с высокой частотой (19 Гц-10 МГц), поэтому, несмотря на микроперемещения на каждой фазе, движение осуществляется с приемлемой скоростью. Устройство представляет собой капсулу длиной 5 см и диаметром 1,3 см; оно способно перемещаться вперед и назад, а также вращаться внутри трубчатого органа. Оно подключается микрокабелем к внешнему источнику электроэнергии и может нести аппаратуру для диагностики внутренней полости трубчатого органа различного типа (микровидеокамеру, лазер и др.). В перспективе предполагается использовать это устройство и для минимально-инвазивной хирургии трубчатых органов. Работа находится в стадии исследований, в которых участвуют ученые нескольких итальянских университетов, Литвы, а также специалисты компании "Филипс".
Недостатком проекта применительно к использованию в кровеносных сосудах является, как и в предыдущем случае, полное перекрытие русла сосуда. Другим недостатком является возможность перемещения только в трубчатом канале с определенным диаметром, т. е. полное отсутствие адаптации к изменению диаметра трубчатого органа. Недостатками являются также жесткость конструкции и характер высокочастотного вибрационного механического воздействия на внутреннюю стенку сосуда, что может неблагоприятно отразиться на структуре интимы.
Отметим, что принцип, заложенный в основу последнего аналога, тщательно проработан с точки зрения процедуры управления, определены наиболее эффективные алгоритмы управления мини-роботом /4/ (I-Ming Chen, etc.). Тем не менее, он не может быть использован для решения задач, поставленных в данном проекте.
Еще одно оригинальное решение проблемы перемещения внутри трубчатого канала использует в качестве материала для транспортного модуля сплав с памятью формы /5/ (C.Libersa, etc.). Устройство при этом состоит из последовательно соединенных одинаковых модулей, каждый из которых может находиться в двух состояниях. За счет последовательного изменения формы модулей осуществляется поступательное перемещение конструкции.
Применительно к нашей проблеме устройство обладает теми же недостатками, что и предыдущий аналог. Правда, элементы обладают определенной гибкостью, так как они выполняются в виде тонкостенных оболочек. Однако эти оболочки выполняются в виде куба и при перемещении они отталкиваются от внутренней поверхности органа своими гранями, что может сильно травмировать внутреннюю поверхность органа.
Обратим внимание на то, что существует большое количество разработок роботов, в том числе и миниатюрных, для задач технической диагностики трубопроводов различного диаметра.
Однако они, как правило, используют для перемещения значительно более простые конструкции, содержащие вращающиеся опорные элементы. Конструкции такого рода совершенно неприемлемы для перемещения внутри сосудов и трубчатых органов.
Таким образом, в качестве прототипа может быть рассмотрено только устройство, предложенное в работе /2/.
Объектом настоящего изобретения является робототехническая система для выполнения диагностики, терапии и хирургии внутренних полостей трубчатых органов, включающая мини-робот, являющийся исполнительной частью системы, и движитель мини-робота.
Изобретение направлено на решение задачи реканализации сосудов с минимально возможными осложнениями и травматическими последствиями.
Технический результат, достигаемый при использовании настоящего изобретения, заключается в повышении степени атравматичности таких процедур на трубчатых органах любой конфигурации, и любой удаленности от места введения. При реканализации сосудов хирург получает возможность за один проход обеспечить диагностику сосуда, обработку стеноза методами атерэктомии с изменяемым диаметром обрабатывающего инструмента, ультразвукового воздействия и баллоноангиопластики, причем выбор технологии и конкретного инструмента остается за хирургом в каждом конкретном случае.
Технический результат достигается за счет использования в медицинском мини-роботе модульного принципа построения его конструкции, включающей модули различного типа - транспортные, измерительные, инструментальные и вспомогательные, установленные с возможностью соединения в требуемом порядке и разъема. Медицинский мини-робот содержит по меньшей мере один измерительный модуль, на котором размещены средства контроля, включающие в себя видеодатчик и тактильные датчики для контроля за состоянием внутренней полости трубчатого органа, по меньшей мере один воздействующий модуль, на котором установлены средства воздействия; по меньшей мере три транспортных модуля, которые представляют собой тонкостенные конструкции, содержащие оболочечные деформируемые и упругие деформируемые элементы. К числу инструментальных модулей относится шнековая обрабатывающая головка с переменным диаметром, ангиопластический модуль, выполняющий роль баллона при ангиопластической процедуре, а также иные модули. Состав модулей может компоноваться в зависимости от решаемых задач и назначенной хирургом процедуры. Таким образом, модульный принцип построения мини-робота обеспечивает универсальность его применения.
Для перемещения мини-робота используется принцип перистальтики, как и в близких аналогах, рассмотренных выше. Отличие состоит в способе реализации этого принципа. Движитель мини-робота включает не менее трех раздельных, последовательно соединенных, одинаковых по конструкции транспортных модулей. Каждый модуль представляет собой сильфон, к торцам которого прикреплена упругая оболочка. Диаметр сильфона значительно меньше диаметра сосуда или трубчатого органа, в который вводится мини-робот. При создании разрежения в сильфоне он сокращается. При этом оболочка расширяется и соприкасается с внутренней поверхностью сосуда. Оболочка не является сплошной, и через имеющиеся в ней просветы обеспечивается ток крови. Оболочка имеет выпуклые площадки, прижимающиеся к внутренней полости трубчатого органа в четырех ортогональных направлениях, чем обеспечивается центрирование мини-робота внутри органа. Последовательно создавая разрежение внутри трех модулей, из которых по крайней мере один всегда удерживает конструкцию внутри трубчатого органа, можно обеспечить поступательное перемещение мини-робота.
Движитель мини-робота может быть как пневматическим, так и гидравлическим, в зависимости от назначения устройства. В последнем случае рабочим телом является физиологический раствор, чем обеспечивается безопасность устройства для пациента в случае утечки рабочего тела.
Конструкция и размеры упругих деформируемых элементов таковы, что при сокращении сильфона и деформации упругих элементов последние не перекрывают канал трубчатого органа, в том числе русло кровеносного сосуда, обеспечивая ток крови в процессе перемещения мини-робота.
Безопасность обеспечивается также и тем, что деформация оболочечных и связанных с ними упругих деформируемых элементов происходит при снижении давления относительно нормального. Поэтому при отказе системы управления, нарушении герметичности трубопроводов и сильфонов, или при возникновении иных непредвиденных ситуаций во всех камерах движителя восстанавливается нормальное давление; при этом сильфоны выпрямляются, а упругие оболочки "складываются", после чего мини-робот может быть свободно извлечен из трубчатого канала.
Для того чтобы исключить механические повреждения стенок трубчатого канала при соприкосновении с элементами конструкции мини-робота, последний помещен в сетчатую оболочку (чехол), обеспечивающую свободный проход и фильтрацию жидкости.
При работе в кровеносных сосудах мини-робот вводится в сосуд через минимальный хирургический доступ, чем обеспечивается минимальный травматизм, связанный с введением устройства в тело пациента. Снижение травматизма, главным образом, достигается за счет отсутствия жесткого катетера, с помощью которого хирург обычно вводит инструмент в сосуды, полагаясь, прежде всего, на собственную интуицию. В данном случае хирург-оператор управляет движением мини-робота с использованием текущей информации о внутренней поверхности сосуда, что существенно снижает риск травматизма при перемещении в нем мини-робота. Возможность наблюдения обеспечивается с использованием средств визуализации (микровидеокамеры, волоконной оптики), а также тактильных и силовых датчиков, размещенных на мини-роботе (см. фиг.1). Получаемая с датчиков информация позволяет восстановить на экране монитора ПЭВМ рельеф внутренней поверхности органа.
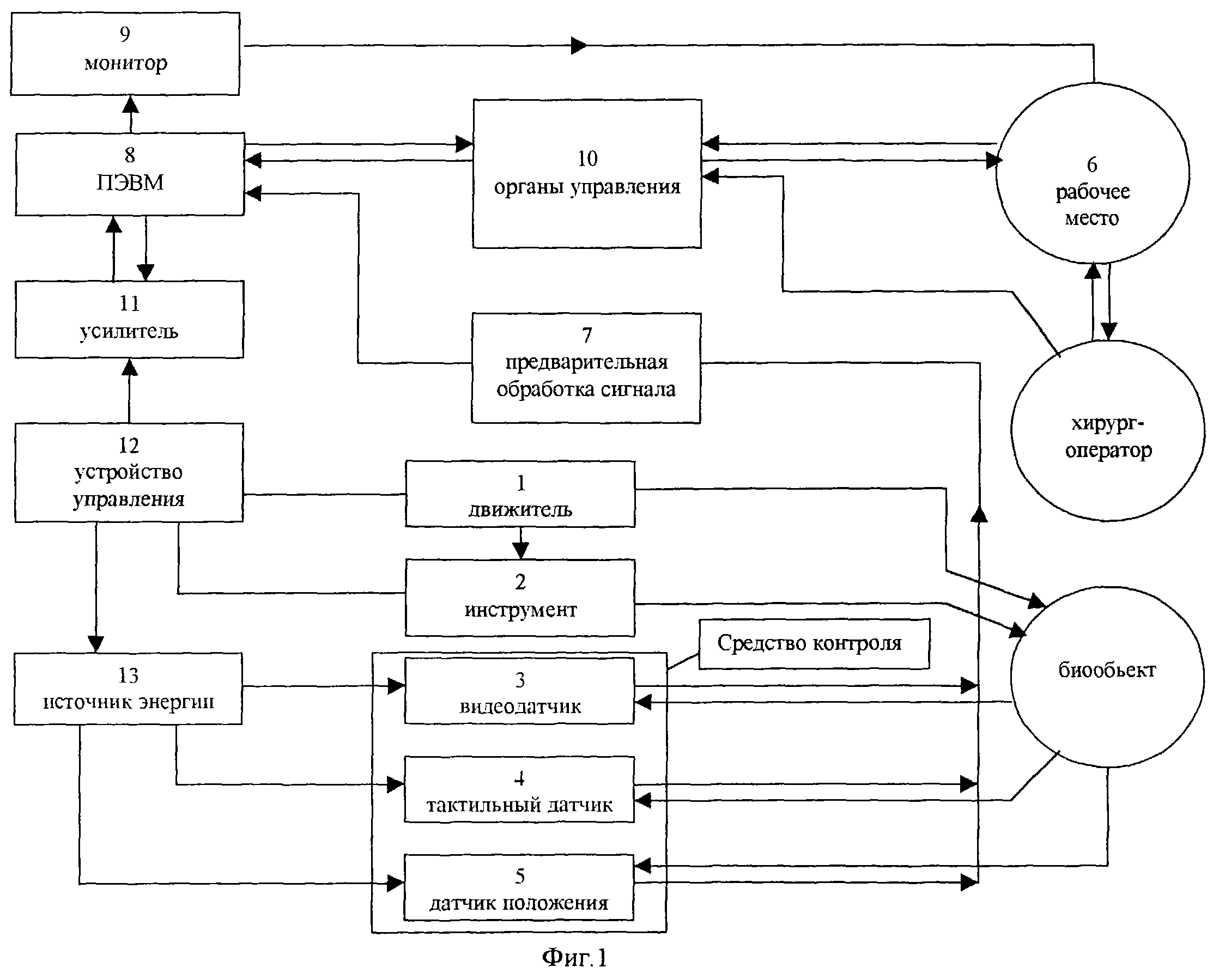
На фиг.1 представлена структурно-функциональная схема робототехнической системы, включающей мини-робот в качестве исполнительного устройства.
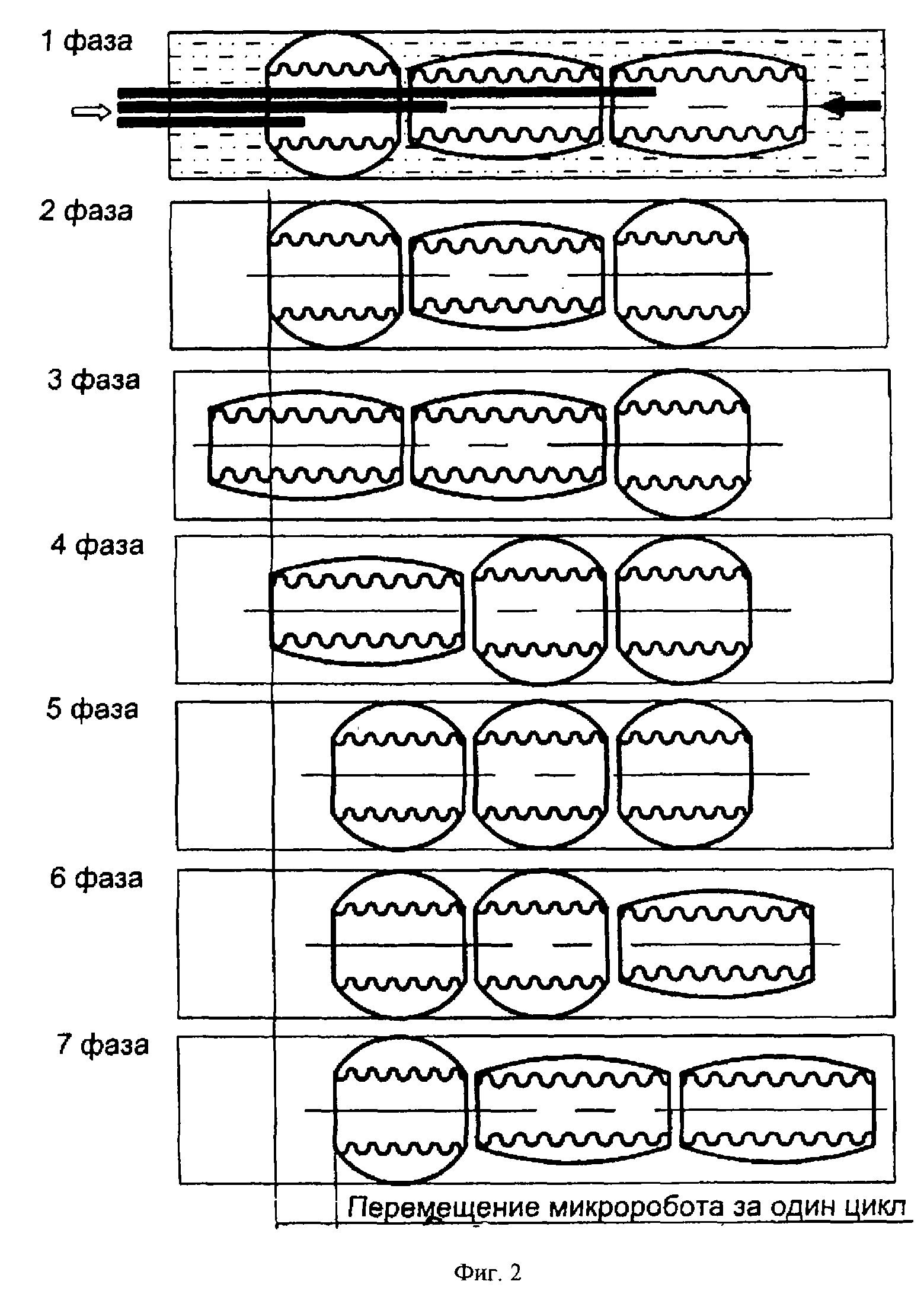
На фиг. 2 иллюстрируется перистальтический принцип движения мини-робота внутри трубчатого органа.
На фиг. 3 показан общий вид транспортного модуля, являющегося основной составной частью движителя мини-робота.
На фиг. 4 дается возможная компоновка мини-робота для выполнения комплекса диагностических и хирургических операций внутри канала трубчатого органа.
На фиг.5 приводится схема воздействующего инструмента.
Робототехническая система, функциональная схема которой представлена на фиг. 1, включает в себя мини-робот, являющийся исполнительным устройством системы, пост оператора, с которого ведется управление мини-роботом и контроль за его действиями, устройство управления и внешний источник энергии.
Мини-робот оснащен перистальтическим движителем 1, сменным рабочим (в том числе, хирургическим) инструментом 2, средствами контроля (видеодатчиком 3, тактильными и силоизмерительными датчиками 4, а также датчиками положения 5), позволяющими регистрировать текущее положение мини-робота внутри трубчатого органа с помощью внешних средств наблюдения.
Пост оператора представляет собой автоматизированное рабочее место оператора-хирурга 6. Информация с датчиков поступает на устройство предварительной обработки сигналов 7, обеспечивающее их фильтрацию, усиление и преобразование в цифровую форму. Полученная информация поступает на ПЭВМ 8 и с помощью средств машинной графики воспроизводится на экране монитора 9 в форме, удобной для восприятия ситуации оператором. Пост оператора оборудован активными органами управления миинироботом 10, позволяющими воспроизводить в определенном масштабе силы, действующие на мини-робот и на его рабочий инструмент в процессе движения и выполнения механических операций. Восприятие оператором этих сил значительно повышает надежность и эффективность его работы.
По сигналам оператора и с учетом текущих измерений датчиков ПЭВМ вырабатывает сигналы управления мини-роботом. Эти сигналы преобразуются в форму, необходимую для управления мини-роботом и его отдельными модулями, усиливаются в усилительно-преобразующем устройстве 11 и поступают на вход устройства управления 12. Блок управления формирует в соответствии с сигналами управления давление в рабочих полостях модулей мини-робота, что и приводит их в движение. При управлении давлением рабочего тела в полостях транспортных модулей движителя 1 осуществляется поступательное движение мини-робота. Аналогично может быть выполнено управление движением специализированного хирургического (воздействующего), диагностического и терапевтического инструмента 2, установленного на мини-роботе.
Источник энергии 13 находится вне тела пациента и обеспечивает работу устройства управления, а также датчиков, установленных на мини-роботе.
Перемещение мини-робота в канале трубчатого органа обеспечивается его движителем. Принцип перемещения поясняется на фиг.2, где схематически показан движитель, состоящий из трех транспортных модулей 14, 15, 16, а также отдельные фазы движения. На первой фазе создается разряжение внутри сильфона 17 третьего от головной части движителя модуля 14, который фиксируется внутри канала. На второй фазе фиксируется первый модуль 16. На третьей фазе перемещения освобождается модуль 14 (путем создания в полости соответствующего сильфона исходного давления). На 4-ой, 5-ой фазах последовательно сокращаются второй и третий модули, подтягивая конструкцию к первому. Далее роль фиксатора опять передается третьему модулю, и на двух последующих фазах освобождаются первый и второй модули устройства. Начиная с седьмой фазы цикл движения повторяется. Конструкция перемещается поступательно слева направо; аналогично движение осуществляется и в противоположную сторону.
Отметим, что при использовании мини-робота в кровеносном сосуде движитель позволяет перемещаться как по току крови, так и против тока крови. Это обеспечивается путем расчета соответствующих сил прижима контактных площадок деформируемых элементов к внутренним стенкам сосудов. Кроме того, при сжатии сильфона происходит одновременный поворот его свободного конца на известный угол. Таким образом, конструкция робота одновременно с поступательным движением поворачивается вокруг собственной оси. Это обстоятельство позволяет организовать при необходимости вращательное движение робота внутри трубчатого канала.
Движитель мини-робота состоит из нескольких (не менее трех) одинаковых по конструкции транспортных модулей, соединенных между собой. Внешний вид транспортного модуля мини-робота в свободном состоянии (а) и в сжатом состоянии (б) показан на фиг.3. Сильфон 17 закреплен внутри упругой конструкции, включающей несколько (не менее трех) упругих деформируемых элементов 18, соединенных с торцами 19 сильфона. Каждый элемент имеет контактную площадку 20, выполненную из специального материала, пригодного для контакта с внутренней поверхностью трубчатого органа. Через одно из отверстий 21 в торцах сильфона в его полость поступает рабочее тело. Два других отверстия используются для подводки жидкости к другим модулям движителя. Схематически такая подводка показана на фиг.2, из которого видно, что число отверстий зависит от номера модуля в схеме движителя, а также от стороны, с которой подводится рабочее тело.
При сокращении сильфона 17 (фиг.3б) упругие элементы 18 деформируются и прижимаются контактными площадками 20 к внутренней поверхности трубчатого органа. Поскольку диаметр сильфона 17 меньше диаметра внутренней полости органа, устройство в таком положении не мешает току крови.
Из последнего чертежа видно, что для центрирования мини-робота внутри сосуда необходимо не менее трех контактных площадок 20 и, следовательно, не менее трех упругих деформируемых элементов 18. В этом случае упругие элементы должны располагаться под 120 град. в поперечном сечении модуля. Если выбирается четыре опорных площадки, то упругие элементы располагаются под 90 град. Число этих элементов определяется диаметром канала и величиной внешних сил, приложенных к мини-роботу как за счет тока крови, так и за счет сил реакции, возникающих при движении и, особенно, при механической обработке внутренней поверхности трубчатого канала.
Мини-робот представляет собой модульную конструкцию, которая компонуется из отдельных модулей, имеющих различное функциональное назначение, в зависимости от технологии процесса, определенной хирургом-оператором. Возможная компоновка мини-робота представлена на фиг.4.
Мини-робот представляет собой совокупность соединенных в определенном порядке модулей, среди которых можно выделить транспортные 14, 15, 16 (их число должно быть не менее трех), измерительный 22, воздействующий 25, улавливающий 26, коммутатор 27.
Транспортные модули 14, 15, 16 в совокупности образуют движитель мини-робота, описанный в предыдущих разделах.
Измерительный модуль 22 оснащен видеодатчиком 3 и системой тактильных датчиков 24. Этот модуль может быть выполнен как сильфон с деформируемыми элементами, подобно транспортному модулю. При деформации упругих элементов, образующих оболочку модуля, тактильные датчики 24 приходят в соприкосновение с внутренней поверхностью канала. По измерениям возникающих контактных сил можно составить представление о внутреннем рельефе канала. В совокупности с видеосигналом эти измерения позволяют описать рельеф математически и записать его в память ПЭВМ, а также воспроизвести на экране монитора на посту оператора.
Воздействующий модуль 25 представляет собой режущий инструмент переменного диаметра. Конструкция этого модуля рассмотрена ниже. Управление обрабатывающим модулем осуществляется от ПЭВМ через устройство управления (см. фиг.2). В процессе обработки мини-робот фиксируется внутри трубчатого органа с помощью транспортных модулей 14, 15, 16.
Улавливающий модуль 26 предназначен для улавливания и удаления мелких частиц, возникающих при механической обработке стенозов и других образований на внутренней поверхности трубчатого органа. Он также выполнен на базе сильфона и размещенной на нем конструкции из стержневых элементов. Последние удерживают сетку, которая раскрывается при сокращении сильфона и складывается, прижимаясь к корпусу модуля, при освобождении сильфона. В этом положении захваченные частицы удерживаются в соответствующей полости модуля и извлекаются вместе с ним наружу.
Коммутатор 27 предназначен для подключения рабочих полостей модулей к управляющему устройству, которое последовательно, в соответствии с сигналами управления, выработанными ПЭВМ, формирует в этих полостях давление рабочего тела. В каждый момент времени происходит управление только одним из модулей мини-робота, т.е. все модули работают последовательно и параллельная работа исключена. Это обстоятельство делает возможным использование только одного канала для доставки рабочего тела 28. Для передачи управляющих сигналов и снятия информации с датчиков робота используется электрический кабель малого диаметра 29. По этому каналу сигналы проходят в форме импульсной модуляции с разделением времени, что предполагает наличие электронного коммутатора в составе модуля 27.
Возможна иная компоновка мини-робота в случае необходимости прохождения канала, закупоренного стенозом полностью, или настолько, что канал становится непроходимым для мини-робота. В этом случае обрабатывающий модуль 25 становится первым.
В составе мини-робота могут находиться и другие модули. Например, баллон для ангиопластики, выполненный как один из модулей мини-робота и совместимый с остальными элементами конструкции. Или контейнер, содержащий лекарственный препарат, либо устройство для терапевтического воздействия на внутреннюю полость трубчатого органа.
Модульный принцип построения мини-робота обеспечивает многофункциональность его применения в медицинской практике.
Схема воздействующего модуля, оснащенного средствами воздействия, приведена на фиг. 5. Фиг.5,а соответствует исходному (транспортному) положению рабочей головки, а фиг.5,б - рабочему положению.
Воздействующий модуль состоит из камеры гидропривода 30, режущего инструмента 31 и гидросистемы 32, представляющей собой трубку Вентурри.
В камере гидропривода расположен гидроцилиндр 33, содержащий гибкий вал 34, соединенный с поршнем 35. Поршень соединен с гидротурбиной 36 и режущим инструментом 31. Он может совершать поступательное и вращательное движения.
Режущий инструмент 31 представляет собой набор проволочных элементов, каждый из которых имеет режущие грани. Такая конструкция позволяет режущему инструменту изменять свою форму и максимальный наружный диаметр в зависимости от положения поршня 35.
При подаче жидкости в камеру 30 через канал В поршень 35 вместе с режущим инструментом перемещается вправо и открывает доступ жидкости к каналу А. Жидкость по этому каналу поступает в правую часть камеры 30, приводит в движение гидротурбину 36 и выходит в канал Б.
При этом вращающийся с большой скоростью и увеличивающийся за счет центробежных сил в диаметре режущий инструмент 31 разрушает плотные атеросклеротические бляшки и тромбы. Продукты разрушения поступают в гидросистему, где происходит их дальнейшее диспергирование и эвакуация из кровеносного сосуда.
К конкретному применению изобретения относится примеры в медицинской практике сосудистых отделений.
Пример. Больной Г., 57 лет, поступил на лечение с симптомами перемежающейся хромоты, возникающей при ходьбе на расстоянии 100-150 м. При осмотре выявлена едва ощутимая пульсация левой бедренной артерии. Дистальный пульс отсутствует. Во время транслюмбальной артериографии обнаружен выраженный стеноз левой подвздошной артерии. Лодыжечно-плечевой индекс составил 0,5.
Предпринята попытка лечения с использованием мини-робота, с помощью которого осуществлена управляема артериотомия из левой подвздошной артерии, следствием которой была нормализация гемодинамики в левой конечности. Через артериотомический доступ в бедренной артерии на уровне отхождения глубокой бедренной артерии осуществлен запуск мини-робота в сосудистое русло в проксимальном направлении. Контроль за перемещением в автоматическом режиме мини-робота по сосуду осуществлялся с помощью силовых датчиков.
При достижении роботом стеноза в подвздошной артерии выполнена артерэктомия с помощью воздействующего модуля 25. Наличие в воздействующей системе рабочего окончания с меняющимся диаметром обеспечивает максимальное удаление атероматозного материала и восстановления просвета артерии, создавая тем самым благоприятные условия для наиболее полного восстановление гемодинамики и профилактики рестеноза.
После завершения артерэктомии мини-робот был удален из просвета артерии вручную с помощью фала, прикрепленного к заднему модулю мини-робота. Лодыжечно-плечевой индекс достиг 1,0, перемежающая хромота исчезла. Патоморфологическим субстратом стеноза послужила фиброзная бляшка с тромботическими наложениями, в препарате имелись также элементы медиа и внутренней эластической мембраны. Элементы неизменненой и адвентиции не обнаружены, что свидетельствует о целенаправленном контролируемом удалении атеросклеротических бляшек. Через 6 мес. стабильный положительный эффект сохраняется. Лодыжечно-плечевой индекс составляет 1, 0, симптомы перемежающейся хромоты отсутствуют.
Список использованной
литературы
1. Саврасов Г. В. , Скворцов С.П. Современные технические средства хирургического лечения
тромбозов: состояние и перспективы. - "Медицинская техника", июль-август, 2000.
2. Carrozza M.C., Granieri G.C., D'Attanasio S., Lazzarini R., Lencioni L., Dario P. A Sensorised Robotic Systems for Computer-Assisted Colonoscopy. - Proc. of MH, 1'96, Nagoy, Japan, Oct. 1996.
3. Rovetta A. Prototype of a new tele-robotic endoscope. Proceedings of the Tenth World Congress on the Theory of Machines and Mechanisms. - Oulu, Finland, June, 1999.
4. I-Ming Chen, Song Huat Yeo, Yan Gao. Locomotion Gait Generation for Multi-segment Inchworm Robots. Proceedings of the Tenth World Congress on the Theory of Machines and Mechanisms. - Oulu, Finland, June, 1999.
5. Libersa C., Arsicault M., Lallemand J.-P. Characterisation of a New Locomotion System for In-tube Exploration Microrobots. Proceedings of the Tenth World Congress on the Theory of Machines and Mechanisms. - Oulu, Finland, June, 1999.
Реферат
Изобретение относится к медицинской технике, преимущественно используется при реканализации кровеносных сосудов при облитерации сосудистого просвета атеросклеротическими отложениями и тромбами различной консистенции. Изобретение может быть использовано для диагностики и лечения заболеваний других трубчатых органов. В эндовазальном мини-роботе модульного принципа построения его конструкции, включающей модули различного типа - транспортные, измерительные, инструментальные и вспомогательные, установленные с возможностью соединения и разъема. Эндовазальный мини-робот содержит по меньшей мере один измерительный модуль, на котором размещены средства контроля, по меньшей мере один воздействующий модуль, на котором установлены средства воздействия; по меньшей мере три транспортных модуля, которые представляют собой тонкостенные конструкции, содержащие оболочечные и упругие деформируемые элементы. Состав модулей может компоноваться в зависимости от решаемых задач и назначенной хирургом процедуры. Изобретение позволяет осуществлять перемещение диагностических, хирургических и терапевтических технических средств внутри трубчатых органов различной протяженности, поперечных размеров и конфигурации с помощью робота, использующего перистальтический принцип движения. 11 з.п. ф-лы, 5 ил.

Комментарии