Роботизированное управление эндоскопом по изображениям сети кровеносных сосудов - RU2594813C2
Код документа: RU2594813C2
Чертежи

Описание
Изобретение в целом относится к роботизированному управлению эндоскопом во время минимально инвазивной хирургической процедуры (например, минимально инвазивной хирургической операции по трансплантации коронарного шунта). Настоящее изобретение, в частности, относится к сопоставлению графического представления дооперационного трехмерного («3D») изображения сети кровеносных сосудов с графическим представлением интраоперационного эндоскопического изображения сети кровеносных сосудов в качестве основы для роботизированного направления эндоскопа.
Трансплантация шунта коронарных артерий («CABG») представляет собой хирургическую процедуру для реваскуляризации коронарных артерий с обструкцией. В Соединенных Штатах ежегодно осуществляют приблизительно 500000 операций. В стандартной CABG раскрывают грудину пациента и сердце пациента полностью обнажают для хирурга. Несмотря на обнажение сердца, некоторые артерии могут быть частично не видны в связи со слоем жировой ткани над ними. Для таких артерий хирург может осуществлять пальпацию поверхности сердца и чувствовать как кровь, пульсирующую из артерий, так и стеноз артерий. Однако эти данные рассеяны могут быть недостаточными для переноса хирургического плана на место хирургического вмешательства.
В минимально инвазивной CABG указанная выше проблема стандартной CABG усилена, поскольку хирург не может пальпировать поверхность сердца. Дополнительно, длина хирургических инструментов, используемых в минимально инвазивной CABG, препятствует какой-либо тактильной обратной связи с проксимальным концом инструмента.
Один известный способ для решения проблем со стандартной CABG состоит в совмещении интраоперационного участка с дооперационной трехмерной сетью коронарных артерий. В частности, оптически отслеживаемый указатель используют для того, чтобы преобразовать в цифровую форму положение артерий в условиях открытого сердца, и данные о положении совмещают с дооперационной сетью с использованием итеративного алгоритма ближайших точек («ICP»), известного в уровне техники. Однако этот способ, как и любой связанный подход, сопоставляющий оцифрованные артерии и дооперационные данные, не практичен при минимально инвазивной CABG по причине пространственных ограничений, налагаемых доступом через минипорт. Также этот способ требует, чтобы большинство артерий было видно или поддавалось пальпации хирургом, что невозможно при минимально инвазивной CABG.
Один известный способ, направленный на проблемы с минимально инвазивной CABG, состоит в реализации способа совмещения, в котором поверхность сердца реконструируют с использованием оптически отслеживаемого эндоскопа и сопоставляют с данными дооперационной компьютерной томографии («CT») той же поверхности. Однако этот способ, как и любой связанный подход, предлагающий сопоставление на основе поверхности, может терпеть неудачу, если эндоскопический вид, используемый для получения поверхности, слишком мал. Кроме того, поскольку поверхность сердца является относительно гладкой без конкретных признаков поверхности, алгоритм этого способа большей частью работает в субоптимальном локальном максимуме алгоритма.
Другой известный способ, направленный на проблемы с минимально инвазивной CABG, состоит в мечении коронарной сети, полученной у нового пациента, с использованием базы данных предварительно меченных случаев и сопоставления на основе графов. Однако этот способ работает, только если доступна вся сеть, и его цель состоит в мечении сети, а не в сопоставлении геометрии.
Дополнительная проблема минимально инвазивной CABG заключается в ориентации и направлении эндоскопа после того, как достигают глобальное расположение по отношению к дооперационным трехмерным изображениям. Цель совмещения состоит в том, чтобы облегчить локализацию места анастомоза и стеноза. В стандартной установке ассистент держит эндоскоп, пока хирург держит два инструмента. Хирург дает команды ассистенту, и ассистент перемещает эндоскоп соответствующим образом. Этот тип установки мешает зрительной координации движений рук хирурга, поскольку ассистент должен интуитивно транслировать команды хирурга, типично даваемые в системе ориентиров хирурга, в систему ориентиров ассистента и систему ориентиров эндоскопа. Множество систем координат может вызывать различные ошибки обращения, увеличивать длительность хирургического вмешательства или вызывать ошибки идентификации коронарных артерий.
Ассистент, работающий с хирургическим эндоскопом, предназначенный для того, чтобы позволить хирургу непосредственно контролировать эндоскоп через воспринимаемое перемещение головы хирурга, может решить некоторые из этих проблем посредством устранения ассистента из контура управления, но сохраняется проблема преобразования между системой ориентиров хирурга и системой ориентиров эндоскопа.
Настоящее изобретение относится к способам сопоставления графических представлений сети кровеносных сосудов (например, разветвления артерий, капилляров или вен), как показано на дооперационном трехмерном изображении (например, КТ изображении, изображении КТ с коническим пучком, трехмерных рентгеновских изображениях или МРТ изображении) и на интраоперационном эндоскопическом изображении, наложения сети кровеносных сосудов с дооперационного трехмерного изображения на интраоперационное эндоскопическое изображение и использования результата наложения для того, чтобы направлять робота, держащего эндоскоп, в направлении местоположения, как определено на дооперационном трехмерном изображении.
Согласно одному аспекту настоящего изобретения представлена роботизированная направляющая система, в которой используют роботизированный блок и блок управления.
В роботизированной направляющей системе используют роботизированный блок и блок управления. Роботизированный блок содержит эндоскоп для генерации интраоперационного эндоскопического изображения сети кровеносных сосудов в пределах анатомической области и робота для перемещения эндоскопа в пределах анатомической области. Блок управления содержит контроллер эндоскопа для генерации траектории движения эндоскопа в пределах анатомической области, причем траекторию движения эндоскопа извлекают из сопоставления графического представления интраоперационного эндоскопического изображения сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения сети кровеносных сосудов. Блок управления дополнительно содержит контроллер робота для выдачи команды роботу на перемещение эндоскопа в пределах анатомической области в соответствии с траекторией движения эндоскопа.
Вторая форма настоящего изобретения заключается в способе направления робота, включающем генерацию интраоперационного эндоскопического изображения сети кровеносных сосудов в пределах анатомической области и генерацию траектории движения эндоскопа в пределах анатомической области, причем траекторию движения эндоскопа извлекают из сопоставления графического представления интраоперационного эндоскопического изображения сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения сети кровеносных сосудов. Способ направления робота дополнительно включает передачу команд роботу на перемещение эндоскопа в пределах анатомической области в соответствии с траекторией движения эндоскопа.
Термин «дооперационный», как используют в настоящем описании, определен широко для того, чтобы описывать какую-либо активность, выполняемую до, во время или после эндоскопической визуализации анатомической области для целей получения трехмерного изображения анатомической области, и термин «интраоперационный», как используют в настоящем описании, определен широко для того, чтобы описывать какую-либо активность, выполняемую посредством роботизированного блока и блока управления во время эндоскопической визуализации анатомической области. Примеры эндоскопической визуализации анатомической области включают, но без ограничения, CABG, бронхоскопию, колоноскопию, лапароскопию и эндоскопию головного мозга.
Указанные выше формы и другие формы настоящего изобретения, а также различные признаки и преимущества настоящего изобретения станут более понятны из следующего подробного описания различных вариантов осуществления настоящего изобретения, прочитанных в сочетании с сопроводительными чертежами. Подробное описание и чертежи представлены в качестве иллюстрации настоящего изобретения, а не ограничения объема настоящего изобретения, определяемого приложенной формулой изобретения и ее эквивалентами.
На фиг.1 проиллюстрирован пример варианта осуществления роботизированной направляющей системы в соответствии с настоящим изобретением.
На фиг.2 проиллюстрирована блок-схема, представляющая пример варианта осуществления способа роботизированного направления в соответствии с настоящим изобретением.
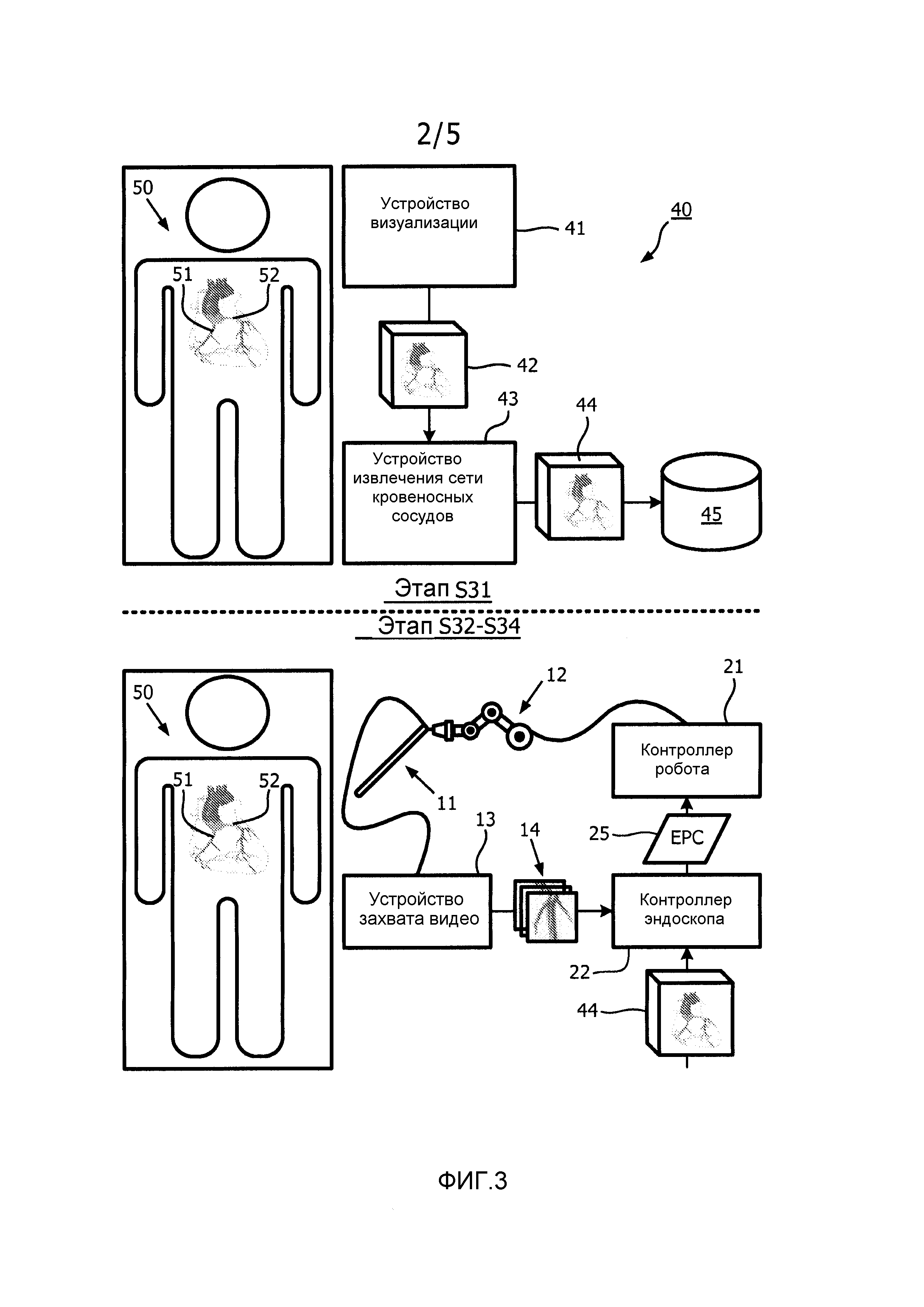
На фиг.3 проиллюстрирован пример хирургической реализации блок-схемы, представленной на фиг.2.
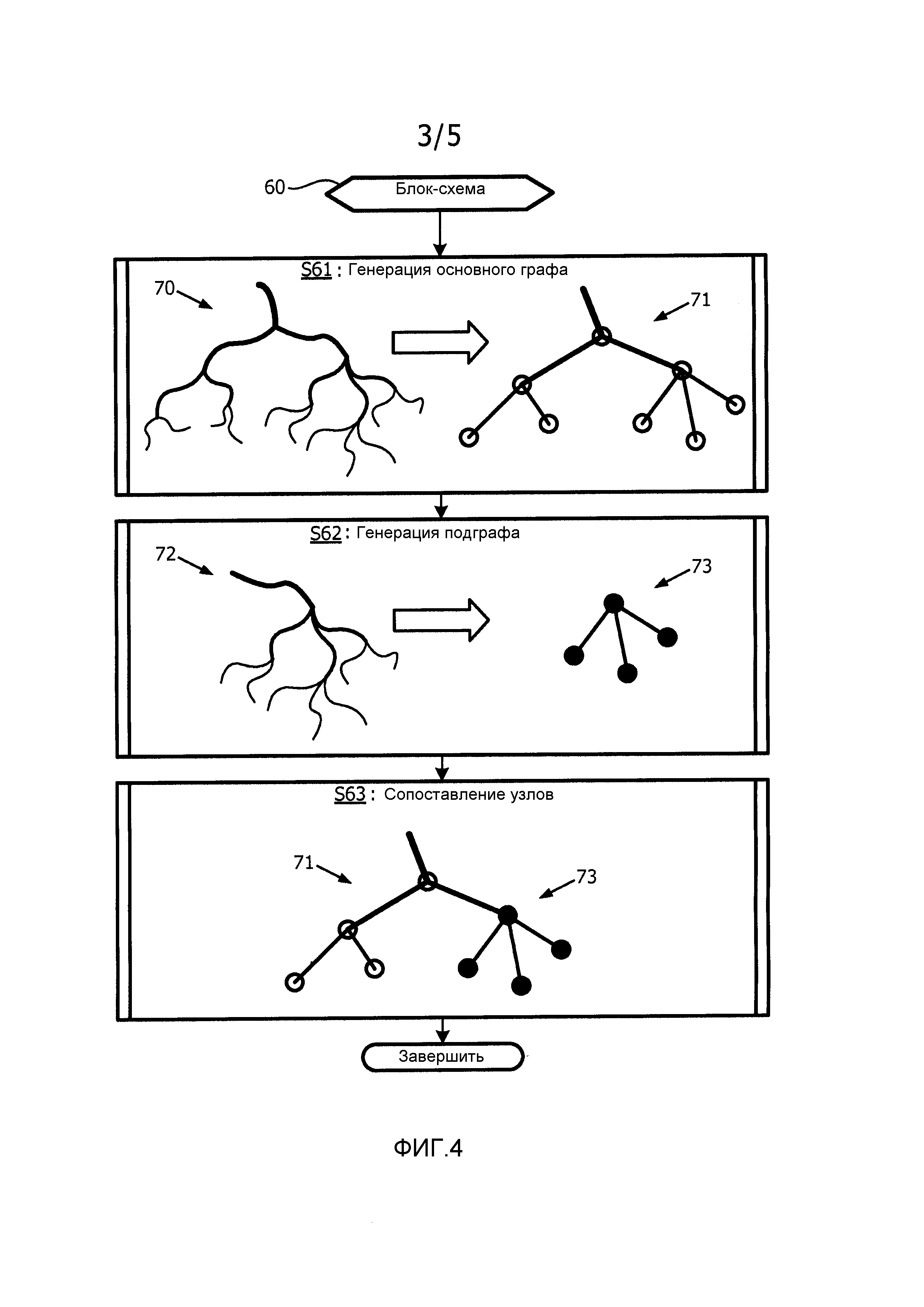
На фиг.4 проиллюстрирована блок-схема, представляющая пример варианта осуществления способа сопоставления графов в соответствии с настоящим изобретением.
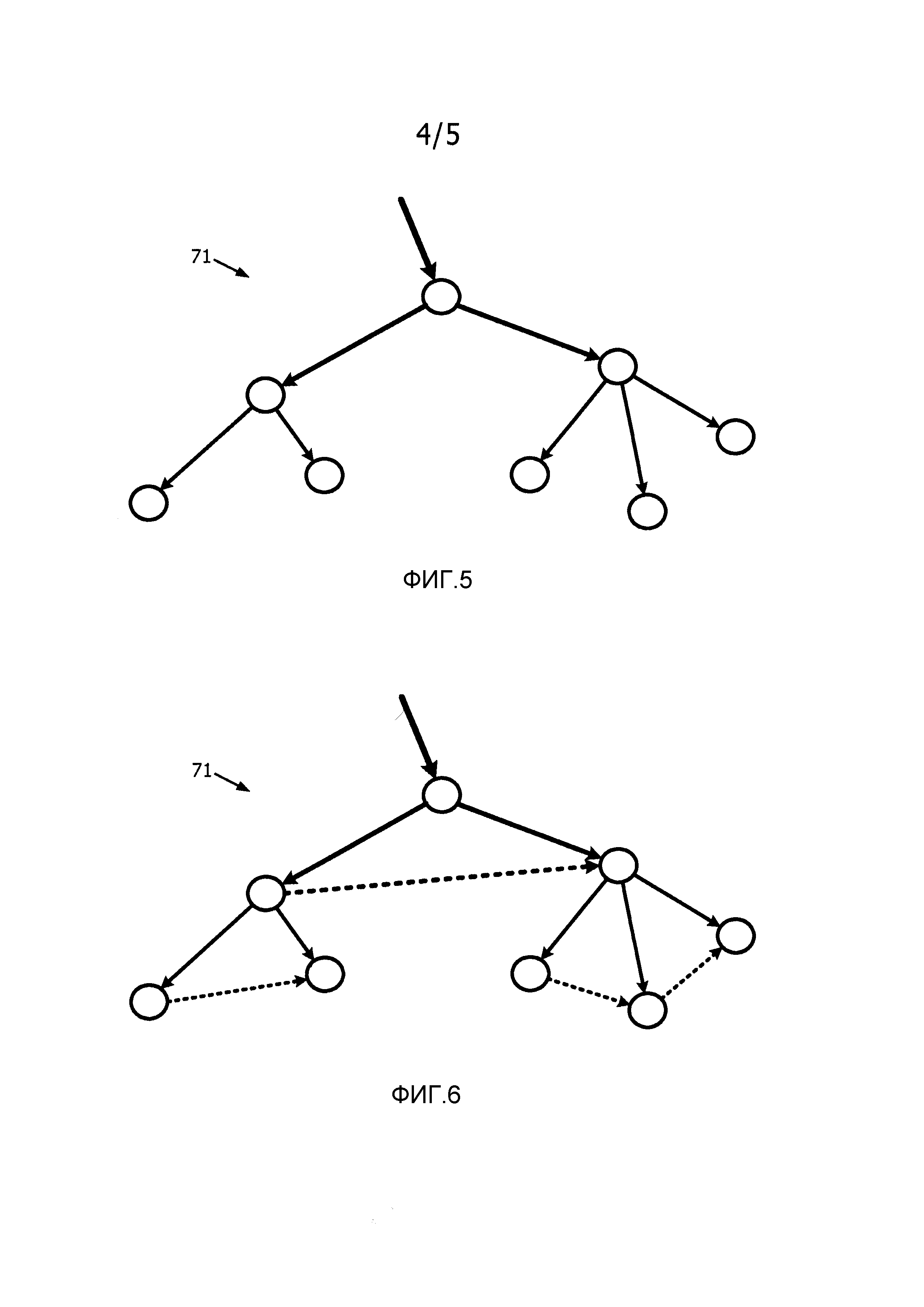
На фиг.5 и 6 проиллюстрирован пример упорядочения основных графов сети кровеносных сосудов в соответствии с настоящим изобретением.
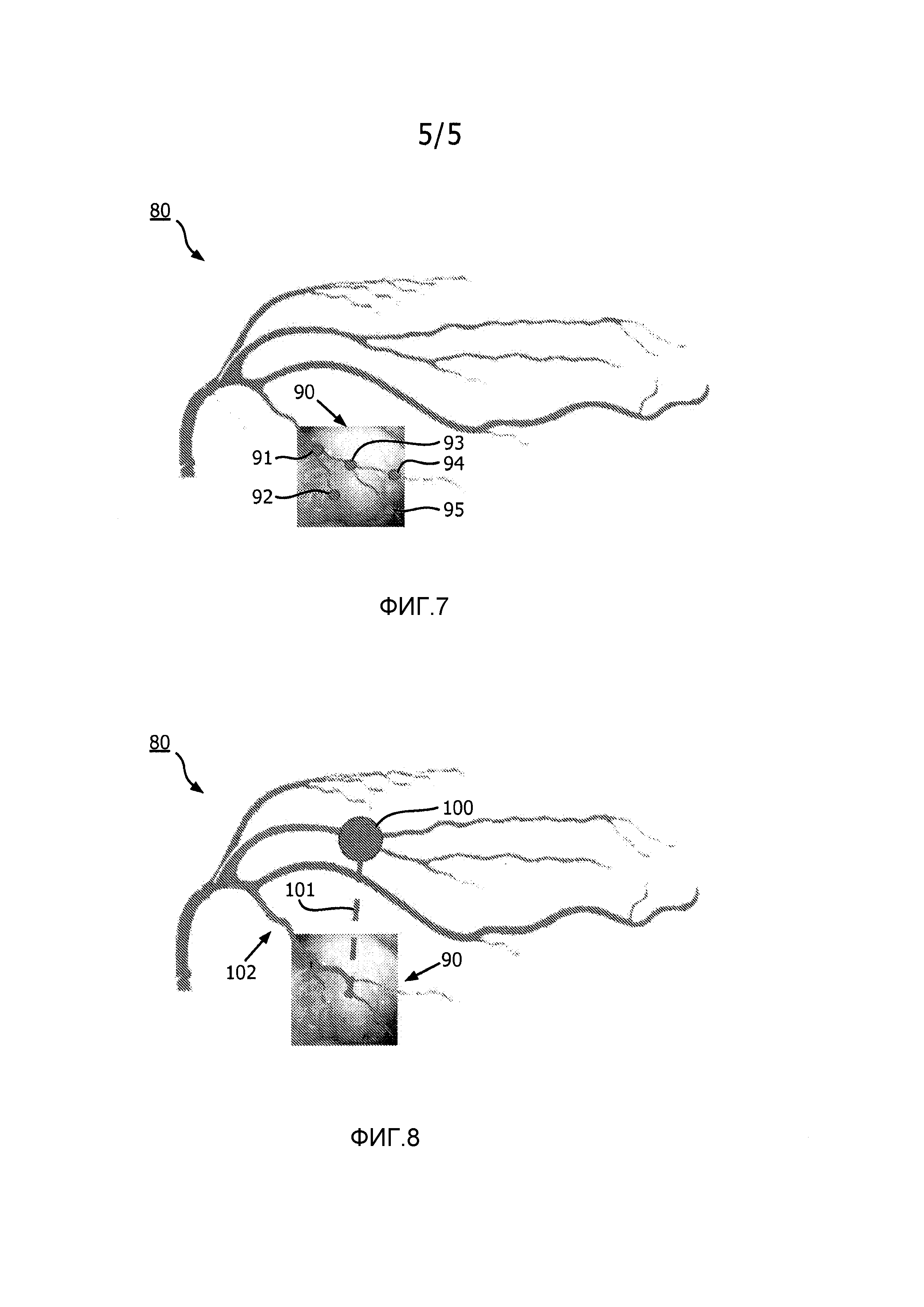
На фиг.7 проиллюстрирован пример результата наложения геометрического представления на эндоскопическое изображение в соответствии с настоящим изобретением.
На фиг.8 проиллюстрирован пример траектории движения робота в пределах результата наложения, представленного на фиг.7, в соответствии с настоящим изобретением.
Как показано на фиг.1, в роботизированной направляющей системе используют роботизированный блок 10 и блок 20 управления для какой-либо эндоскопической процедуры, включающей эндоскопическую визуализацию сети кровеносных сосудов, имеющей одно или несколько разветвлений (т.е. ветвей). Примеры таких эндоскопических процедур включают, но без ограничения, минимально инвазивное кардиологическое хирургическое вмешательство (например, трансплантацию шунта коронарных артерий или замену митрального клапана).
Роботизированный блок 10 содержит робота 11, эндоскоп 12, жестко прикрепленный к роботу 11, и устройство 13 захвата видео, прикрепленное к эндоскопу 12.
Робот 11 широко определен в настоящем описании в качестве какого-либо роботизированного устройства, структурно сконфигурированного с механическим приводным управлением одним или несколькими сочленениями для манипулирования рабочим органом, по желанию, для конкретной эндоскопической процедуры. На практике робот 11 может иметь четыре (4) степени свободы, такой как, например, последовательный робот, имеющий сочленения, последовательно соединенные с жесткими сегментами, параллельный робот, имеющий сочленения и жесткие сегменты, установленные в параллельном порядке (например, платформа Стюарта, известная в данной области техники), или какая-либо гибридная комбинация последовательных и параллельных кинематических схем.
Эндоскоп 12 широко определен в настоящем описании в качестве какого-либо устройства, структурно сконфигурированного с возможностью визуализации изнутри организма. Примеры эндоскопа 12 для целей настоящего изобретения включают, но без ограничения, оптический прибор какого-либо типа, гибкий или жесткий (например, эндоскоп, артроскоп, бронхоскоп, холедохоскоп, колоноскоп, цистоскоп, дуоденоскоп, гастроскоп, гистероскоп, лапароскоп, ларингоскоп, нейроскоп, отоскоп, нажимной энтероскоп, риноларингоскоп, сигмоидоскоп, синускоп, тораскоп и т.д.) и какое-либо устройство, похоженее на оптическое устройство, которое оборудовано системой визуализации (например, вложенная канюля со средством визуализации). Визуализация является локальной, и поверхностные изображения можно получать оптически с использованием волоконной оптики, линз и миниатюризированных (например, на основе CCD) систем визуализации.
На практике эндоскоп 12 устанавливают на концевом рабочем органе робота 11. Позиция концевого рабочего органа робота 11 представляет собой положение и ориентацию рабочего органа в системе координат приводов робота 11. С эндоскопом 12, установленным на рабочем органе робота 11, какая-либо заданная позиция поля обзора эндоскопа 12 в пределах анатомической области соответствует четкой позиции рабочего органа робота 11 в системе координат робота. Следовательно, каждое отдельное эндоскопическое изображение сети кровеносных сосудов, генерируемое посредством эндоскопа 12, можно связать с соответствующей позицией эндоскопа 12 в пределах анатомической области.
Устройство 13 захвата видео широко определено в настоящем описании в качестве какого-либо устройства, структурно сконфигурированного с возможностью преобразования интраоперационного эндоскопического видеосигнала от эндоскопа 12 в машиночитаемую временную последовательность интраоперационного эндоскопического изображения («IOEI») 14. На практике, в устройстве 13 захвата видео можно использовать устройство захвата кадра какого-либо типа для захвата отдельных цифровых неподвижных кадров из интраоперационного эндоскопического видеосигнала.
Также со ссылкой на фиг.1, блок 20 управления содержит контроллер 21 робота и контроллер 22 эндоскопа.
Контроллер 21 робота широко определен в настоящем описании в качестве какого-либо контроллера, структурно сконфигурированного с возможностью предоставления одной или нескольких команд 26 привода робота («RAC») роботу 11 для управления позицией рабочего органа робота 11 по желанию для эндоскопической процедуры. Более конкретно, контроллер 21 робота преобразует команды 25 положения эндоскопа («EPC») от контроллера 22 эндоскопа в команды 26 привода робота. Например, команды 25 положения эндоскопа могут указывать траектории движения эндоскопа, ведущие к желаемому трехмерному положению поля обзора эндоскопа 12 в пределах анатомической области, в соответствии с чем контроллер 21 робота преобразует команду 25 в команды 26, включая ток срабатывания для каждого двигателя робота 11 при необходимости для перемещения эндоскопа 12 в желаемое трехмерное положение.
Контроллер 22 эндоскопа широко определен в настоящем описании в качестве какого-либо контроллера, структурно сконфигурированного для реализации способа роботизированного направления в соответствии с настоящим изобретением и показанного для примера на фиг.2. С этой целью, контроллер 22 эндоскопа может включать модуль 23 обработки изображения («IPM»), который широко определен в настоящем описании в качестве какого-либо модуля, структурно сконфигурированного для исполнения совмещения изображения анатомического объекта по настоящему изобретению. В частности, совмещение изображения сети кровеносных сосудов реализовано в качестве примера посредством этапов S32 и S33 блок-схемы 30, представленной на фиг.2. Контроллер 22 эндоскопа дополнительно может содержать визуальный сервомодуль («VSM») 24, который широко определен в настоящем описании в качестве какого-либо модуля, структурно сконфигурированного для генерации команд 25 положения эндоскопа, указывающих траекторию движения эндоскопа, который ведет к желаемому трехмерному положению поля обзора эндоскопа 12 в пределах анатомической области. В частности, команды 25 положения эндоскопа получают из совмещения изображения сети кровеносных сосудов, как реализовано в качестве примера посредством этапа S34 блок-схемы 30, представленной на фиг.2.
Далее в настоящем описании предоставлено описание блок-схемы 30 для того, чтобы облегчить дальнейшее понимание контроллера 22 эндоскопа.
Со ссылкой на фиг.2, этап S31 блок-схемы 30 включает извлечение геометрического представления сети кровеносных сосудов из дооперационного трехмерного изображения. Например, как показано на фиг.3, устройство трехмерной визуализации (например, КТ устройство, рентгеновское устройство или МРТ устройство) генерирует дооперационное трехмерное изображение 42 грудной области пациента 50, которое иллюстрирует левую и правую коронарные артерии 51 и 52 пациента 50. После этого устройство 43 извлечения сети кровеносных сосудов извлекает геометрическое представление 44 сети коронарных артерий из изображения 42, которое можно хранить в базе 45 данных. На практике, сканер Brilliance iCT, поставляемый Philips, можно использовать для того, чтобы генерировать изображение 42, и для того, чтобы извлекать трехмерный массив данных сети коронарных артерий из изображения 42.
Также со ссылкой на фиг.2, этап S32 блок-схемы 30 включает модуль 23 обработки изображения, сопоставляющий графическое представление одного или нескольких интраоперационных эндоскопических изображений 14 (фиг.1) сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения 44 (фиг.1) сети кровеносных сосудов. Например, как показано на фиг.3, эндоскоп 12 генерирует интраоперационное эндоскопическое видео грудной области пациента 50, которое захватывают посредством устройства 13 захвата видео и преобразуют в интраоперационные эндоскопические изображения 14, в соответствии с чем модуль 23 обработки изображения контроллера 22 эндоскопа сопоставляет графическое представление интраоперационного эндоскопического изображения(й) 14 сети коронарных артерий с графическим представлением дооперационного трехмерного изображения 44 сети коронарных артерий. В одном примере варианта осуществления, модуль 23 обработки изображения исполняет способ сопоставления изображения сети кровеносных сосудов по настоящему изобретению, как представлено для примера блок-схемой 60, показанной на фиг.4, которая описана в настоящем описании в контексте сети кровеносных сосудов, представляющей собой сеть коронарных артерий.
Со ссылкой на фиг.4, этап S61 блок-схемы 60 включает модуль 23 обработки изображения, генерирующий основной граф сети коронарных артерий по геометрическому представлению сети коронарных артерий в соответствии с каким-либо способом представления, известным в данной области техники. Например, как показано на этапе S61, геометрическое представление 70 сети коронарных артерий преобразуют в основной граф 71, имеющий узлы, представляющие каждое разветвление (например, бифуркация или трифуркация) геометрического представления 70 сети коронарных артерий, и дополнительно имеющий соединения ветвей между узлами. Этап S61 можно осуществлять до операции (например, за несколько суток до эндоскопического хирургического вмешательства или за какое-либо время до введения эндоскопа 12 в пациента 50) или во время операции посредством ангиографии с манипулятором C-типа или другой подходящей системы.
Этап S62 блок-схемы 60 включает в себя модуль 23 обработки изображения, генерирующий подграф сети коронарных артерий из части сети коронарных артерий, видимой на интраоперационном эндоскопическом изображении 14 в соответствии с каким-либо способом графического представления, известным в данной области техники. В частности, эндоскоп 12 вводят внутрь пациента 50, в соответствии с чем модуль 23 обработки изображения осуществляет обнаружение структуры коронарных артерий в пределах интраоперационного эндоскопического изображения 14. На практике, некоторые артериальные структуры могут быть видны, тогда как другие артериальные структуры могут быть скрыты слоем жировой ткани. По существу, модуль 23 обработки изображения может реализовать автоматическое обнаружение видимой структуры(р) коронарных артерий посредством известных операций обработки изображения (например, пороговое обнаружение по отчетливому красному цвету видимой структуры(р) коронарных артерий), или хирург может вручную использовать устройство ввода для того, чтобы очертить видимую структуру(ры) коронарных артерий на дисплее компьютера. После обнаружения артериальной структуры(р), модуль 23 обработки изображения генерирует граф сети коронарных артерий образом, схожим с генерацией основного графа сети коронарных артерий. Например, как показано на этапе S62, геометрическое представление 72 структуры(р) коронарных артерий преобразуют в граф 73, имеющий узлы, представленные для каждого разветвления (например, бифуркации или трифуркации) геометрического представления 72 сети коронарных артерий, и дополнительно имеющий соединения ветвей между узлами. Поскольку обе сети происходят от одного и того же человека, понятно, что граф, полученный из эндоскопических изображений, представляет собой подграф графа, полученного из трехмерных изображений.
Этап S63 блок-схемы 60 включает в себя модуль 23 обработки изображения, сопоставляющий подграф с основным графом в соответствии с каким-либо известным способом сопоставления графов (например, максимально общий подграф или общий подграф Макгрегора). Например, как показано на этапе S63, узлы подграфа 73 сопоставляют с поднабором узлов основного графа 71.
На практике, подграф 73 может быть только частично обнаружен на интраоперационном эндоскопическом изображении 14, или некоторые узлы/соединения подграфа 73 могут отсутствовать на интраоперационном эндоскопическом изображении 14. Чтобы после сопоставления усовершенствовать точность этапа S62, можно реализовать дополнительное упорядочение основного графа 71 и подграфа 73.
В одном из вариантов осуществления вертикальное упорядочение узлов основного графа 71 реализуют, основываясь на известной ориентации пациента 50 во время сканирования изображения на этапе S61. В частности, узлы основного графа могут быть направленно связаны для сохранения порядка сверху вниз, как показано для примера на фиг.5 сплошными стрелками. Для подграфа 73 ориентация пациента 50 относительно эндоскопа 12 может быть не известна. Однако зная, что диаметр ветвей сети коронарных артерий уменьшается по мере их хода сверху вниз, варьирующие размеры артерий для ветвей артерий на интраоперационном эндоскопическом изображении 14 могут указывать ориентацию.
В другом варианте осуществления горизонтальное упорядочение узлов основного графа 70 можно реализовать, основываясь на известной ориентации пациента 50 во время сканирования изображения на этапе S61. В частности, узлы основного графа могут быть направленно связаны для сохранения упорядочения узлов слева направо, как показано для примера на фиг.6 пунктирными стрелками. Для подграфа 73, скорее всего при неизвестной ориентации пациента 50 относительно эндоскопа 12, горизонтальное упорядочение узлов подграфа 73 может задать оперирующий хирург или ассистент через графический пользовательский интерфейс.
Несмотря на то что использование упорядочения может уменьшать время сопоставления графов и снижать число возможных сопоставлений, теоретически множественные сопоставления между графами все еще можно получать с помощью алгоритма сопоставления. На такой случай множественных сопоставлений направлен этап S33 блок-схемы 30.
Снова со ссылкой на фиг.2, основываясь на сопоставлении графов, этап S33 блок-схемы включает результат наложения геометрического представления дооперационного трехмерного изображения 44 (фиг.1) сети кровеносных сосудов на интраоперационное эндоскопическое изображение 14 сети кровеносных сосудов. Это выполняют посредством использования геометрического представления, однозначно ассоциированного с основным графом. Таким образом, всю геометрию можно непосредственно перевести в интраоперационное эндоскопическое изображение 14 с использованием перспективного преобразования. Перспективное преобразование можно обнаруживать по интраоперационному эндоскопическому изображению 14 и узлам в дооперационном трехмерном изображении 44 с использованием алгоритмов сопоставления, известных в данной области, таких как, например, гомографическое сопоставление.
Например, на фиг.7 проиллюстрировано геометрическое представление 80 сети коронарных артерий, которое имеет узлы, сопоставленные с узлами 91-95 с использованием интраоперационного эндоскопического изображения 90. Расстояние между каждой парой узлов среди узлов 91-95 можно использовать для того, чтобы определять коэффициент пересчета для геометрического представления 80, чтобы тем самым сделать возможным наложение геометрического представления 80 на интраоперационное эндоскопическое изображение 90, как показано.
На практике, если сопоставление графов на этапе S32 (фиг.2) приносит множество результатов, то все возможные результаты наложения можно отображать хирургу, в соответствии с чем хирург может выбирать результат сопоставления, который хирург полагает наиболее вероятным сопоставлением, через графический пользовательский интерфейс. При условии что хирург знает положение эндоскопа 12 относительно по меньшей мере некоторых структур на интраоперационном эндоскопическом изображении 14, выбор может быть относительно простым.
Также со ссылкой на фиг.2, этап S34 блок-схемы 30 включает генерацию траектории движения эндоскопа визуальным сервомодулем 32 в пределах результата наложения геометрического представления дооперационного трехмерного изображения 44 (фиг.1) сети кровеносных сосудов на интраоперационное эндоскопическое изображение 14 (фиг.1) сети кровеносных сосудов. Основываясь на траектории движения эндоскопа, визуальный сервомодуль 32 генерирует команды 25 положения эндоскопа для контроллера 21 робота, чтобы тем самым направлять эндоскоп 12 (фиг.1) вдоль траектории движения эндоскопа в желаемое положение в пределах анатомической области. В частности, после того как находят точный результат наложения, роботу 11 можно давать команду направлять эндоскоп 12 в положения, которые хирург выбирает на дооперационном трехмерном изображении 44. Хирург или ассистент может выбирать точку сети кровеносных сосудов, и робот 11 может направлять эндоскоп 12 в это желаемое положение вдоль какой-либо подходящей траектории движения. Например, как показано на фиг.9, робот 11 может перемещать эндоскоп 12 вдоль кратчайшей траектории 101 движения в желаемое положение 100 или вдоль траектории движения по коронарным артериям 102 в желаемое положение 100. Траектория движения по коронарным артериям 102 представляет собой предпочтительный вариант осуществления, поскольку траектория движения по коронарным артериям 102 позволяет хирургу наблюдать видимые артерии по мере перемещения эндоскопа 12 роботом 11. Вдобавок, это может помогать хирургу принимать решение, если сопоставление было успешным. Траекторию движения по коронарным артериям 102 можно определять с использованием способов, известных в области техники (например, алгоритм кратчайшей траектории движения Дейкстры).
На практике, перемещением робота 11 можно командовать с использованием некалиброванного визуального сервоуправления с удаленным центром движения, и поле обзора эндоскопа 12 можно расширять для того, чтобы дать возможность для большего подграфа во время этапа сопоставления S32.
Также со ссылкой на фиг.2, этапы S32-S34 можно исполнять или за один раз или на периодической основе до тех пор, пока робот 11 не переместит эндоскоп 12 в желаемое положение в пределах анатомической области, или множество раз, как определяет хирург.
На практике, модули 23 и 24 (фиг.1) можно реализовать посредством аппаратного обеспечения, программного обеспечения и/или встроенного программного обеспечения, интегрированного в контроллер 22 эндоскопа, как показано.
По описанию фиг. 1-8 в настоящем описании средние специалисты в данной области оценят множество преимуществ настоящего изобретения, включая в качестве неограничивающих примеров применение по настоящему изобретению к эндоскопическому хирургическому вмешательству какого-либо типа, осуществляемому на кровеносных сосудах какого-либо типа.
Несмотря на то что настоящее изобретение описано со ссылкой на представленные в качестве примера аспекты, признаки и реализации, раскрытые системы и способы не ограничены такими представленными в качестве примера аспектами, признаками и/или реализациями. Скорее, как будет очевидно специалистам в данной области из предоставленного описания, раскрытые системы и способы допускают модификации, изменения и расширения, не отступая от сущности или объема настоящего изобретения. Соответственно, настоящее изобретение в явной форме включает такие модификации, изменения и расширения в свой объем.
Реферат
Группа изобретений относится к медицине. В роботизированной направляющей системе используют роботизированный блок и блок управления. Роботизированный блок содержит эндоскоп для генерации интраоперационного эндоскопического изображения сети кровеносных сосудов в пределах анатомической области и робота для перемещения эндоскопа в пределах анатомической области. Блок управления содержит контроллер эндоскопа для генерации траектории движения эндоскопа в пределах анатомической области, причем траекторию движения эндоскопа извлекают из сопоставления графического представления интраоперационного эндоскопического изображения сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения сети кровеносных сосудов. Блок управления дополнительно содержит контроллер робота для того, чтобы давать команды роботу на перемещение эндоскопа в пределах анатомической области в соответствии с траекторией движения эндоскопа. 3 н. и 17 з.п. ф-лы, 8 ил.
Формула
роботизированный блок (10), содержащий эндоскоп (12), выполненный с возможностью генерации интраоперационного эндоскопического изображения (14) сети кровеносных сосудов в пределах анатомической области, и робота (11), выполненного с возможностью перемещения эндоскопа (12) в пределах анатомической области; и
блок (20) управления, содержащий контроллер (22) эндоскопа, выполненный с возможностью генерации траектории движения эндоскопа в пределах анатомической области, причем траекторию движения эндоскопа извлекают из сопоставления графического представления интраоперационного эндоскопического изображения (14) сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения (44) сети кровеносных сосудов, и контроллер (21) робота, выполненный с возможностью выдачи команды роботу (11) на перемещение эндоскопа (12) в пределах анатомической области в соответствии с траекторией движения эндоскопа.
генерацию основного графа, получаемого из геометрического представления дооперационного трехмерного изображения (44) сети кровеносных сосудов;
генерацию подграфа, получаемого из геометрического представления интраоперационного эндоскопического изображения (14) сети кровеносных сосудов; и
сопоставление подграфа с основным графом.
в которой основной граф содержит основной набор узлов, представляющих каждое разветвление сети кровеносных сосудов в пределах дооперационного трехмерного изображения (44) сети кровеносных сосудов; и
подграф содержит поднабор основного набора узлов, причем поднабор узлов представляет каждое разветвление сети кровеносных сосудов в пределах интраоперационного эндоскопического изображения (14) сети кровеносных сосудов.
установление по меньшей мере одного из вертикального упорядочения и горизонтального упорядочения узлов в основном графе.
в которой сопоставление подграфа с основным графом включает множество результатов сопоставления поднабора узлов с основным набором узлов; и
один из множества результатов сопоставления выбирается в качестве сопоставления подграфа с основным графом.
контроллер (22) эндоскопа, выполненный с возможностью генерации траектории движения эндоскопа в пределах анатомической области, причем траекторию движения эндоскопа извлекают из сопоставления графического представления интраоперационного эндоскопического изображения (14) сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения (44) сети кровеносных сосудов; и
контроллер (21) робота, выполненный с возможностью выдачи команды роботу (11) на перемещение эндоскопа (12) в пределах анатомической области в соответствии с траекторией движения эндоскопа.
генерацию основного графа, получаемого из геометрического представления дооперационного трехмерного изображения (44) сети кровеносных сосудов;
генерацию подграфа, получаемого из геометрического представления интраоперационного эндоскопического изображения (14) сети кровеносных сосудов; и
сопоставление подграфа с основным графом.
в котором основной граф содержит основной набор узлов, представляющих каждое разветвление сети кровеносных сосудов в пределах дооперационного трехмерного изображения (44) сети кровеносных сосудов; и
подграф содержит поднабор основного набора узлов, причем поднабор узлов представляет каждое разветвление сети кровеносных сосудов в пределах интраоперационного эндоскопического изображения (14) сети кровеносных сосудов.
установление по меньшей мере одного из вертикального упорядочения и горизонтального упорядочения узлов в основном графе.
в котором сопоставление подграфа с основным графом включает множество результатов сопоставления поднабора узлов с основным набором узлов; и
один из множества результатов сопоставления выбирают в качестве сопоставления подграфа с основным графом.
генерируют интраоперационное эндоскопическое изображение (14) сети кровеносных сосудов в пределах анатомической области;
генерируют траекторию движения эндоскопа в пределах анатомической области, причем траекторию движения эндоскопа извлекают из сопоставления графического представления интраоперационного эндоскопического изображения (14) сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения (44) сети кровеносных сосудов; и
выдают команду роботу (11) на перемещение эндоскопа (12) в пределах анатомической области в соответствии с траекторией движения эндоскопа.
генерируют основной граф, полученный из геометрического представления дооперационного трехмерного изображения (44) сети кровеносных сосудов;
генерируют подграф, полученный из геометрического представления интраоперационного эндоскопического изображения (14) сети кровеносных сосудов; и
сопоставляют подграф с основным графом.
в котором основной граф содержит основной набор узлов, представляющих каждое разветвление сети кровеносных сосудов в пределах дооперационного трехмерного изображения (44) сети кровеносных сосудов; и
подграф содержит поднабор основного набора узлов, причем поднабор узлов представляет каждое разветвление сети кровеносных сосудов в пределах интраоперационного эндоскопического изображения (14) сети кровеносных сосудов.
накладывают геометрическое представление дооперационного трехмерного изображения (44) сети кровеносных сосудов на интраоперационное эндоскопическое изображение (14) сети кровеносных сосудов в соответствии с сопоставлением графического представления интраоперационного эндоскопического изображения (14) сети кровеносных сосудов с графическим представлением дооперационного трехмерного изображения (44) сети кровеносных сосудов.

Комментарии