Способ очистки нейтрального олигосахарида грудного молока с применением хроматографии с симулированным движением неподвижной фазы - RU2685537C2
Код документа: RU2685537C2
Чертежи







Описание
В настоящей заявке описывают способ очистки нейтрального олигосахарида грудного молока (нейтрального ОГМ). В способе применяют хроматографию с симулированным движением неподвижной фазы (SMB), которая обеспечивает непрерывную очистку больших количеств ОГМ с высокой степенью чистоты. В отличие от способов химического синтеза нейтральных ОГМ и их последующей очистки, представленный способ позволяет получить ОГМ, не содержащие ядовитых химикатов, таких, например, как следовые количества тяжелых металлов или органических растворителей. Нейтральный ОГМ в виде индивидуального продукта можно получить в форме твердого вещества путем сушки распылением или в виде концентрированного сиропа. Полученный нейтральный ОГМ очень хорошо подходит для применения в пищевых производствах.
Грудное молоко представляет собой сложную смесь углеводов, жиров, белков, витаминов, минералов и микроэлементов. Безусловно, наибольшая фракция представлена углеводами, которые можно дополнительно разделить на лактозу и более сложные олигосахариды. В то время как лактозу используют в качестве источника энергии, сложные олигосахариды не участвуют в обмене веществ ребенка. На фракцию сложных олигосахаридов приходится вплоть до 1/10 всей углеводной фракции, которая состоит возможно из более чем 150 различных олигосахаридов. Наличие и концентрация этих сложных олигосахаридов являются специфичными для людей и, таким образом, не могут быть обнаружены в больших количествах в молоке других млекопитающих, таких, например, как домашние молочные животные.
Наличие таких сложных олигосахаридов в грудном молоке уже давно известно, а физиологические функции этих олигосахаридов в течение многих десятилетий изучались в медицинских исследованиях. Для некоторых из наиболее распространенных в грудном молоке олигосахаридов конкретные функции уже были установлены.
Ограниченный источник и сложности получения чистых фракций индивидуальных ОГМ привели к разработке химических методов получения некоторых из этих сложных молекул. Однако оказалось, что синтез ОГМ посредством химического синтеза, ферментативного синтеза или ферментации представляет сложности. По меньшей мере крупномасштабные количества, а также количества, соответствующие применению в пищевых производствах, до настоящего времени нельзя было получить. В этой связи, в частности методы химического синтеза конкретных ОГМ (например, ОГМ 2'-фукозиллактоза, см. WO 2010/115935 А1) включают несколько ядовитых химикатов, что влечет за собой риск загрязнения конечного продукта.
Из-за сложностей, имеющих место в химическом синтезе олигосахаридов грудного молока, было разработано несколько ферментативных способов и ферментативных подходов. Однако эти способы приводят к образованию сложных смесей олигосахаридов, то есть целевой продукт загрязнен исходным материалом, таким как лактоза, биосинтетическими промежуточными соединениями и субстратами, такими как индивидуальные моносахариды и полипептиды и т.п.
Способы уровня техники по очистке индивидуальных олигосахаридных продуктов из этих сложных смесей являются технологически сложными, а также неэкономичными для применения в пищевых производствах. Для очистки дисахаридов лактозы или сахарозы из сложных смесей, таких как молочная сыворотка или патока, были разработаны способы промышленного масштаба, которые включают множественные кристаллизации. Недостатком указанных способов является то, что они сложно организованы и дают низкие выходы.
Для очистки сложных олигосахаридов, таких как некоторые ОГМ, до сих пор предпочтительным способом была гельфильтрационная хроматография. Недостаток гельфильтрационной хроматографии состоит в том, что она не может быть эффективно масштабирована и не подходит для непрерывных процессов. Таким образом, гельфильтрационная хроматография не является экономичной и это делает невозможным ее применение для получения конкретных ОГМ - подобных ОГМ 2'-фукозиллактозе - в разумном количестве и при соблюдении качества, пригодного для использования их в продуктах питания, предназначенных для человека.
Хроматография с симулированным движением неподвижной фазы (SMB) берет начало из нефтехимической и горнодобывающей промышленностей. В настоящее время SMB-хроматографию применяют в фармацевтической промышленности для выделения энантиомеров из рацемических смесей. SMB-хроматография уже использовалась для крупномасштабного выделения моносахарида фруктозы из растворов фруктозы и глюкозы и для выделения дисахарида сахарозы из сиропов сахарной свеклы или сахарного тростника. Однако SMB-хроматография еще не применялась для очистки ОГМ или других сложных олигосахаридов из продуктов ферментации.
Хроматография с симулированным движением неподвижной фазы (SMB) была разработана как непрерывной способ разделения, аналогичный непрерывным способам химического разделения, таким как ректификация. В ректификации устанавливают противоток жидкой и газовых фаз, что обеспечивает затем непрерывное применение подачи и извлечения продукта(ов). Кроме того, при хроматографических операциях в противотоке теоретически должны достигать степени разделения, превосходящей результат традиционных операций в поперечном потоке. Однако для хроматографических операций в противотоке нужно, чтобы движение подвижной и неподвижной фаз проходило в противоположных направлениях. Таким образом, SMB-хроматографию разработали в качестве практического решение проблем, связанных с принципом движения твердого хроматографического материала в непрерывном хроматографическом способе разделения.
Стандартный SMB принцип включает четыре различные зоны с четырьмя применяемыми внешними потоками: поток подаваемого сырья, содержащий подлежащие разделению компоненты, десорбент или поток подвижной фазы, экстракт и поток рафината (под потоком рафината подразумевают в менеьшей степени удерживаемый(ые) компонент(ы)). Эти жидкие потоки делят с помощью SMB-системы на четыре различные зоны (каждая зона или секция может содержать одну или более колонок) со следующими задачами: зона I требуется для регенерации твердой фазы, целью зоны II является десорбция менее сильно десорбируемого материала, задачей зоны III является адсорбция сильно адсорбируемого материала и, наконец, задачей зоны IV является адсорбция менее адсорбирующегося материала. Таким образом, более сильно адсорбирующиеся компоненты формируют концентрированную волну в зоне II и переносятся ко входу экстракции, в то время как менее сильно адсорбирующиеся компоненты перемещаются по направлению ко входу рафината.
В принципе, зоны I и IV служат для регенерации твердой фазы (зоны регенерации), в то время как зоны II и III можно назвать зонами системы действительного разделения (зонами разделения). Кроме четырех жидких потоков и получающихся зон, система содержит (для действия в замкнутом контуре) циркуляционный насос для подвижной фазы (десорбента), пропускающий подвижную фазу через фиксированные зоны в одном направлении. Затем в системе обеспечивают противоток путем периодического сдвига и непрерывной подачи или извлечения сырья, десорбента и продуктов последовательно из одной колонки в следующую.
Помимо стандартной 4-зонной SMB-системы с замкнутым контуром также можно использовать 3-зонные системы с открытым контуром. 3-зонные системы с открытым контуром являются экономичными в случае, когда свежий растворитель является довольно недорогим, например, когда в качестве подвижной фазы используют воду или воду/этанол. При использовании 3-зонной конфигурации с открытым контуром более не требуется регенерация жидкой фазы, что делает зону IV неактуальной.
Помимо стандартных SMB-систем для разделения двухкомпонентной смеси, также были разработаны 8-зонные SMB-системы с замкнутым контуром или 5-зонные SMB-системы с открытым контуром для разделения более 2 компонентов.
В силу непрерывного режима работы, а также из-за возможности использования колонок с несколько большим размером и рециклирования подвижной фазы, SMB-систему можно, в принципе, масштабировать до объемов производства, составляющих сотни тонн.
Исходя из этого предшествующего уровня техники, техническая задача состоит в обеспечении нового способа получения нейтрального ОГМ в больших количествах с высокой степенью чистоты и не содержащего ядовитых химикатов.
Техническую задачу решают с помощью способа по пункту 1 формулы изобретения, нейтрального ОГМ по пункту 14 формулы изобретения и применения нейтрального ОГМ по пункту 18 формулы изобретения. В зависимых пунктах формулы изобретения показаны преимущественные воплощения.
В настоящем изобретении обеспечивают способ очистки нейтрального ОГМ (например, 2'-фукозиллактозы) в непрерывной хроматографии (или в непрерывном режиме) из неочищенного раствора, содержащего нейтральный ОГМ (например, 2'-фукозиллактозу) и загрязняющие вещества, причем неочищенный раствор, содержащий нейтральный ОГМ (например, 2'-фукозиллактозу) и загрязняющие вещества, содержит раствор или состоит из раствора, который выбран из группы, состоящей из экстракта микробиологической ферментации, реакционного раствора биокатализа, раствора химического синтеза и их сочетаний, где чистота нейтрального ОГМ (например, 2'-фукозиллактозы) в растворе составляет <80%. Способ отличается тем, что неочищенный раствор подвергают по меньшей мере одной стадии очистки с использованием хроматографии с симулированным движением неподвижной фазы. Этим способом получают очищенный раствор, содержащий целевой нейтральный ОГМ (например, 2'-фукозиллактозу) со степенью чистоты ≥80%.
Способ очистки нейтрального ОГМ в непрерывной хроматографии может быть способом очистки нейтрального ОГМ в непрерывном режиме. В этой связи, нейтральный ОГМ может быть 2'-фукозиллактозой или лакто-N-тетраозой.
Заявитель обнаружил, что с помощью разработанного способа, включающего стадию очистки с применением хроматографии с симулированным движением неподвижной фазы, можно обеспечить ОГМ высокой степени чистоты, без загрязнения тяжелыми металлами и в непрерывном режиме. Таким образом, можно обеспечить большие количества высококачественных ОГМ очень удобным и экономичным способом, например, из неочищенного раствора из процесса микробиологической ферментации. Способ по изобретению также оказался высоконадежным даже без стадии регенерации материала колонки (например, катионного материала колонки), используемого на стадии хроматографии с симулированным движением неподвижной фазы. Фактически, весь способ может работать в стабильном и непрерывном режиме в течение нескольких месяцев.
В предпочтительном воплощении чистота нейтрального ОГМ в неочищенном растворе составляет ≤70%, ≤60%, ≤50%, ≤40%, ≤30%, ≤20%, ≤10% или ≤5% и/или очищенный раствор содержит ОГМ с чистотой ≥80%, предпочтительно ≥90%. Термин «неочищенный раствор» относится к раствору, содержащему ОГМ перед стадией хроматографической очистки с симулированным движением неподвижной фазы, «очищенный раствор» относится к раствору после стадии хроматографии с симулированным движением неподвижной фазы.
По меньшей мере одна стадия хроматографии с симулированным движением неподвижной фазы может включать
i) по меньшей мере 4 колонки, предпочтительно по меньшей мере 8 колонок, более предпочтительно по меньшей мере 12 колонок, где по меньшей мере одна колонка содержит слабую или сильную катионообменную смолу, предпочтительно катионообменную смолу в Н+ форме или Са2+ форме, и/или
ii) четыре зоны I, II, III и IV с различными скоростями потока, и/или
iii) элюент, содержащий воду или состоящий из воды, предпочтительно этанола и воды, более предпочтительно 5-15% (об.) этанола и 85-95% (об.) воды, наиболее предпочтительно 9-11% (об.) этанола и 89-91% (об.) воды, где элюент возможно дополнительно содержит серную кислоту, предпочтительно ≤10 мМ серной кислоты, более предпочтительно ≤2-5 мМ серной кислоты, и/или
iv) рабочую температуру от 15°C до 60°C, предпочтительно от 20°C до 55°C, более предпочтительно от 25°C до 50°C.
Если подлежащий очистке ОГМ является 2-фукозиллактозой, по меньшей мере одна стадия хроматографии с симулированным движением неподвижной фазы может включать
i) четыре зоны I, II, III и IV с различными скоростями потока, где скорости потока предпочтительно составляют: 28-32 мл/мин в зоне I, 19-23 мл/мин в зоне II, 21-25 мл/мин в зоне III и/или 16-20 мл/мин в зоне IV, и/или
ii) скорость подачи 2-4 мл/мин, предпочтительно 3 мл/мин, и/или
iii) скорость потока элюента 10-13 мл/мин, предпочтительно 11,5 мл/мин, и/или
iv) время переключения колонок 16-20 мин, предпочтительно 17-19 мин, более предпочтительно 18 мин.
Предпочтительно по меньшей мере одна из колонок содержит от 0,1 до 5000 кг катионообменной смолы, предпочтительно от 0,2 до 500 кг катионообменной смолы, более предпочтительно от 0,5 до 50 кг катионообменной смолы, наиболее предпочтительно от 1,0 до 20 кг катионообменной смолы.
Важно, что возможно масштабирование количества катионообменного материала, скорости потока в различных зонах, скорости подачи, скорости потока элюента и/или времени переключения колонок. Масштабирование можно осуществлять в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 1000 раз или в любое возможное количество раз между указанными величинами.
В колонках сильную катионообменную смолу можно использовать в качестве неподвижной фазы. Предпочтительно катионообменная смола представляет собой смолу сульфоновой кислоты, более предпочтительно смолу Purolite® PCR833H (Purolite, Ратинген, Германия), Lewatit MDS 2368 и/или Lewatit MDS 1368. Если катионообменную смолу применяют в колонках, ее можно регенерировать серной кислотой. Серную кислоту можно применять в элюенте, предпочтительно с концентрацией 10 мМ серной кислоты или менее. (Сильная) катионообменная смола может присутствовать в Н+ форме или в Са2+ форме.
Рабочие температуры выше 60°C не являются предпочтительными в процессе хроматографии с симулированным движением неподвижной фазы. Было обнаружено, что, особенно в присутствии сильной катионообменной смолы (в Н+ форме или в Са2+ форме) в качестве неподвижной фазы, применяемые нейтральные олигосахариды были значительно дестабилизированы, то есть деполимеризованы, что ухудшало конечный выход нейтрального ОГМ.
В своем преимущественном воплощении изобретение отличается тем, что к очищенный раствор подвергают по меньшей мере одной дополнительной стадии очистки с применением хроматографии с симулированным движением неподвижной фазы, в результате которой получают очищенный раствор, содержащий нейтральный олигосахарид грудного молока со степенью чистоты ≥90%, предпочтительно ≥92%, более предпочтительно ≥93%. В частности, изобретение дает продукт ОГМ, не содержащий рекомбинантной ДНК и штамм-акцепторных белков.
Дополнительная стадия хроматографии с симулированным движением неподвижной фазы может включать
i) по меньшей мере 4 колонки, предпочтительно по меньшей мере 8 колонок, более предпочтительно по меньшей мере 12 колонок, где по меньшей мере одна колонка содержит слабую или сильную катионообменную смолу, предпочтительно катионообменную смолу в Н+ форме или Са2+ форме, и/или
ii) четыре зоны I, II, III и IV с различными скоростями потока, и/или
iii) элюент, содержащий или состоящий из воды, предпочтительно этанола и воды, более предпочтительно 5-15% (об.) этанола и 85-95% (об.) воды, наиболее предпочтительно 9-11% (об.) этанола и 89-91% (об.) воды, где элюент возможно дополнительно содержит серную кислоту, предпочтительно ≤10 мМ серной кислоты, более предпочтительно ≤2-5 мМ серной кислоты, и/или
iv) рабочую температуру от 15°C до 60°C, предпочтительно от 20°C до 55°C, более предпочтительно от 25°C до 50°C.
Если подлежащий очистке ОГМ является 2'-фукозиллактозой, дополнительная стадия хроматографии с симулированным движением неподвижной фазы может включать
i) четыре зоны I, II, III и IV с различными скоростями потока, где скорости потока предпочтительно составляют: 28-32 мл/мин в зоне I, 19-23 мл/мин в зоне II, 21-25 мл/мин в зоне III и/или 16-20 мл/мин в зоне IV, и/или
ii) скорость подачи 2-4 мл/мин, предпочтительно 3 мл/мин, и/или
iii) скорость потока элюента 10-13 мл/мин, предпочтительно 11,5 мл/мин, и/или
iv) время переключения колонок 16-20 мин, предпочтительно 17-19 мин, более предпочтительно 18 мин.
В частности, по меньшей мере одна из колонок содержит от 0,1 до 5000 кг катионообменной смолы, предпочтительно от 0,2 до 500 кг катионообменной смолы, более предпочтительно от 0,5 до 50 кг катионообменной смолы, наиболее предпочтительно от 1,0 до 20 кг катионообменной смолы.
Важно, что возможно масштабирование количества катионообменного материала, скорости потока в различных зонах, скорости подачи, скорости потока элюента и/или времени переключения колонок. Масштабирование можно осуществлять в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 1000 раз или в любое возможное количество раз между указанными величинами.
После стадии очистки с применением хроматографии с симулированным движением неподвижной фазы, рН очищенного раствора можно установить на уровне рН 7, предпочтительно путем добавления основания, более предпочтительно путем добавления NaOH (например, 0,2 М NaOH).
Согласно изобретению, неочищенный раствор, содержащий нейтральный ОГМ и загрязняющие вещества, содержит раствор или состоит из раствора, который выбран из группы, состоящей из микробиологической ферментации, экстракта микробиологической ферментации, реакционного раствора биокатализа, раствора химического синтеза и их сочетаний. Ферментация в качестве источника нейтрального ОГМ обладает тем преимуществом, что она является более экономичной, чем химический синтез или биокатализ, то есть ферментативный синтез. Таким образом, экстракт микробиологической ферментации является предпочтительным.
Предпочтительно перед тем, как подвергнуть раствор по меньшей мере одной стадии хроматографии с симулированным движением неподвижной фазы, раствор (предпочтительно раствор микробиологической ферментации), содержащий нейтральный ОГМ,
i) фильтруют или центрифугируют для удаления биомассы и/или нерастворимого материала, предпочтительно фильтруют с помощью активированного угля, древесного угля, целита и/или путем поперечноточной фильтрации для удаления любого нерастворимого материала и органических загрязняющих веществ, более предпочтительно фильтруют путем поперечноточной фильтрации, наиболее предпочтительно фильтруют с использованием микрофильтрационной мембраны, и/или
ii) применяют по меньшей мере одну стадию очистки с использованием катионообменной и/или анионообменной хроматографии, предпочтительно сначала по меньшей мере одну стадию катионообменной хроматографии и затем по меньшей мере одну стадию анионообменной хроматографии.
В дополнительном предпочтительном воплощении перед тем, как подвергнуть раствор по меньшей мере одной стадии очистки с применением хроматографии с симулированным движением неподвижной фазы или после стадии очистки с применением хроматографии с симулированным движением неподвижной фазы раствор, содержащий нейтральный ОГМ, подвергают электродиализу и/или диафильтрации, предпочтительно диафильтрации с использованием нанофильтрационной мембраны, более предпочтительно диафильтрации с использованием нанофильтрационной мембраны, имеющей размер эксклюзионного предела ≤20 Ǻ. Наиболее предпочтительно раствор подвергают диализу до проводимости ≤15 мСм/см, предпочтительно ≤10 мСм/см, более предпочтительно ≤5 мСм/см.
Если неочищенный раствор подвергают диализу перед тем, как подвергнуть раствор по меньшей мере одной стадии очистки с применением хроматографии с симулированным движением неподвижной фазы, большая часть загрязняющих веществ зависит от происхождения фракций нейтрального ОГМ (то есть химического синтеза, биокатализа или ферментации). Обычные загрязняющие вещества представляют собой моносахариды (например, глюкозу, галактозу, фукозу и т.п.), дисахариды (например, лактозу) и побочные продукты (например, лактулозу). В случае, когда ферментацию использовали в качестве источника нейтрального ОГМ, неочищенный раствор обычно содержит в качестве загрязняющих веществ применяемый источник углерода (например, глицерин, сахарозу и/или глюкозу), а также побочные продукты применяемых микроорганизмов (например, олигосахариды с более высокими молекулярными массами). В качестве дополнительных загрязняющих веществ также могут присутствовать олигосахариды, которые образуются из-за разнородности применяемых гликозилтрансфераз (например, гликозилтрансфераз в ячейке для синтеза, которые превращают целевой продукт, субстрат или промежуточное соединение в загрязняющий олигосахарид). Указанные загрязняющие вещества можно эффективно удалять с помощью стадии очистки с применением хроматографии с симулированным движением неподвижной фазы (SMB).
После диализа, предпочтительно после электродиализа и/или диафильтрации (возможно перед тем, как подвергнуть раствор способу SMB-хроматографии), раствор, содержащий ОГМ, можно концентрировать, в частности
i) до концентрации ≥50 г/л, ≥100 г/л, предпочтительно ≥200 г/л, более предпочтительно ≥300 г/л, и/или
ii) применяя вакуумный концентратор, и/или
iii) путем нанофильтрации, и/или
iv) при температуре от 4°C до 50°C, предпочтительно от 10°C до 45°C, возможно от 20°C до 40°C или от 30°C до 35°C.
Более предпочтительно содержащую ОГМ фракцию концентрируют с применением нанофильтрации. Стадию нанофильтрации можно дополнительно использовать для удаления с помощью диализа загрязняющих солей. В данном случае фракцию ОГМ можно сначала концентрировать путем нанофильтрации, и получившуюся концентрированную фракцию ОГМ затем разбавить водой, предпочтительно бидистиллированной H2O (бдH2O) или деионизированной водой, а затем разбавленную фракцию ОГМ можно снова концентрировать, используя нанофильтрационную мембрану.
Концентрация с помощью нанофильтрации особенно предпочтительна, потому что можно обойтись без воздействия на нейтральные ОГМ посредством высоких температур. Таким образом, указанный способ концентрации является менее разрушающим структуру ОГМ, чем тепловая обработка, то есть он не вызывает теплового повреждения нейтральных ОГМ в процессе концентрирования. Дополнительное преимущество нанофильтрации состоит в том, что ее можно применять как для концентрирования, так и для диализа (диафильтрации) нейтральных ОГМ. Другими словами, мембрану, используемую в нанофильтрации, не нужно заменять, если в способе по изобретению последовательно применяют стадию концентрирования и стадию диализа. Помимо этого, можно значительно понизить концентрацию соли в растворе, содержащем нейтральные ОГМ. Это экономит материал и время и делает весь способ более экономичным. Предпочтительно нанофильтрацию объединяют с электродиализом. Оказывается, что такое объединение дает превосходные результаты при концентрировании и обессоливании.
В предпочтительном воплощении изобретения очищенный раствор подвергают стерилизующему фильтрованию и/или подвергают удалению эндотоксинов, предпочтительно путем фильтрации очищенного раствора через 3 кДа фильтр.
Очищенный раствор можно высушить распылением, в частности высушить распылением при концентрации нейтрального ОГМ, составляющей 20-60% (масс./об.), предпочтительно 30-50% (масс./об.), более предпочтительно 35-45% (масс./об.), температуре на входе 110°C-150°C, предпочтительно 120°C-140°C, более предпочтительно 125°C-135°C и/или температуре на выходе 60°C-80°C, предпочтительно 65°C-70°C.
В предпочтительном воплощении способа по изобретению нейтральный ОГМ, который подлежит очистке, представляет собой нейтральный ОГМ, содержащий более 3-х моносахаридных звеньев, предпочтительно нейтральный трисахарид, тетрасахаридм, пентасахаридм или гексасахаридм грудного молока. Более предпочтительно нейтральный ОГМ выбирают из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, 2',3-дифукозиллактозы, лакто-N-триозы II, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-неофукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-неофукопентаозы V, лакто-N-дифукогексаозы I, лакто-N-дифукогексаозы II, 6'-галактозиллактозы, 3'-галактозиллактозы, лакто-N-гексаозы, лакто-N-неогексаозы, пара-лакто-N-гексаозы, пара-лакто-N-неогексаозы и дифокузил-лакто-N-неогексаозы. Наиболее предпочтительно нейтральный ОГМ является 2'-фукозиллактозой или лакто-N-неотетраозой.
Факультативно также возможно, чтобы нейтральный ОГМ не являлся 2'-фукозиллактозой.
В преимущественном воплощении изобретения способ по изобретению отличается тем, что неочищенный раствор, содержащий нейтральный олигосахарид грудного молока и загрязняющие вещества, содержит или состоит из экстракта микробиологической ферментации, где экстракт микробиологической ферментации получают в по меньшей мере одной стадии микробиологической ферментации, за которой предпочтительно следует по меньшей мере одна стадия
а) фильтрации раствора, предпочтительно неочищенного раствора, для отделения растворимого материала от нерастворимого материала после микробиологической ферментации, и/или
б) ионообменной хроматографии, предпочтительно катионообменной хроматографии, более предпочтительно катионообменной хроматографии, за которой следует анионообменная хроматография раствора, предпочтительно раствора, полученного на стадии а), и/или
в) концентрирования раствора, предпочтительно раствора, полученного на стадии б), более предпочтительно путем испарения воды и/или путем нанофильтрации, возможно путем концентрирования более одного раза, и/или
г) диализа раствора, предпочтительно раствора, полученного на стадии в), более предпочтительно путем электродиализа и/или диафильтрации, наиболее предпочтительно диафильтрации с помощью нанофильтрационной мембраны, возможно путем диализа более одного раза, и/или
д) хроматографии раствора с применением хроматографии с симулированным движением неподвижной фазы, предпочтительно раствора, полученного на стадии г), и/или
е) фильтрации раствора, предпочтительно раствора, полученного на стадии д), для отделения нейтрального олигосахарида грудного молока от окрашенных загрязнителей, более предпочтительно путем фильтрации через активированный уголь, и/или
ж) сушки распылением очищенного раствора, содержащего нейтральный олигосахарид грудного молока, предпочтительно очищенного раствора, полученного на стадии е).
Наиболее предпочтительно все стадии от а) до ж) применяют последовательно. Было обнаружено, что последовательное применение всех стадий от а) до ж) является наиболее преимущественным воплощением способа по изобретению. Указанный способ является эффективным по затратам и по времени и делает возможным обеспечение больших количеств высокочистых, высушенных распылением (то есть аморфных) нейтральных ОГМ из (экстрактов) микробиологической ферментации. В частности, стадии концентрирования и обессоливания раствора ОГМ с использованием нанофильтрации представляют собой чрезвычайно экономичные и щадящие технологические стадии, препятствующие образованию нежелательных побочных продуктов.
Таким образом, в изобретении предложен нейтральный ОГМ, который можно получить с помощью способа по изобретению. Нейтральный ОГМ (например, 2'-фукозиллактозу или лакто-N-тетраозу) предпочтительно сушат распылением. Очищенный нейтральный ОГМ обладает тем преимуществом, что он является высокочистым и не содержит загрязнений в виде тяжелых металлов и/или органических растворителей.
Нейтральный ОГМ по изобретению может иметь
i) форму твердых гранул, и/или
ii) температуру стеклования от 60°C до 90°C, предпочтительно от 62°C до 88°С, более предпочтительно 64°C до 86°C, определенную с помощью дифференциальной сканирующей калориметрии, и/или
iii) размер частиц от 5 до 500 мкм, предпочтительно от 10 до 300 мкм, определенный с помощью лазерной дифракции, и/или
iv) средний размер частиц от 10 до 100 мкм, предпочтительно от 20 до 90 мкм, более предпочтительно от 30 до 80 мкм, наиболее предпочтительно от 40 до 70 мкм, определенный с помощью лазерной дифракции, и/или
v) аморфное состояние, предпочтительно аморфное состояние без каких-либо характеристических пиков кристаллического вещества в методе порошковой рентгеновской дифракции, и/или
vi) влажность ≤10%, предпочтительно ≤8%, более предпочтительно ≤5%.
Нейтральный ОГМ можно использовать в медицине, предпочтительно при профилактике или в терапии нарушений работы желудочно-кишечного тракта. Его также можно использовать в питании, предпочтительно лечебном питании или молочном питании (например, в зерновых продуктах).
В предпочтительном воплощении изобретения нейтральный олигосахарид грудного молока является нейтральным ОГМ, содержащим более 3-х моносахаридных звеньев, предпочтительно нейтральным трисахаридом, тетрасахаридом, пентасахаридом или гексасахаридом грудного молока. Более предпочтительно нейтральный ОГМ выбирают из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, 2',3-дифукозиллактозы, лакто-N-триозы II, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-неофукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-неофукопентаозы V, лакто-N-дифукогексаозы I, лакто-N-дифукогексаозы II, 6'-галактозиллактозы, 3'-галактозиллактозы, лакто-N-гексаозы, лакто-N-неогексаозы, пара-лакто-N-гексаозы, пара-пакто-N-неогексаозы и дифукозил-лакто-N-неогексаозы. Наиболее предпочтительно нейтральный ОГМ является 2'-фукозиллактозой или лакто-N-неотетраозой.
Факультативно также возможно, чтобы нейтральный ОГМ не являлся 2'-фукозиллактозой.
Более того, предполагают применение нейтрального ОГМ по изобретению в качестве добавки в пищу, предпочтительно в качестве добавки в продукты питания, предназначенные для человека, и/или продукты питания для домашних животных, более предпочтительно в качестве добавки в детские продукты питания.
Со ссылкой на следующие чертежи и примеры предмет данного изобретения предполагают объяснить более подробно, не желая ограничить указанный предмет показанными здесь конкретными воплощениями.
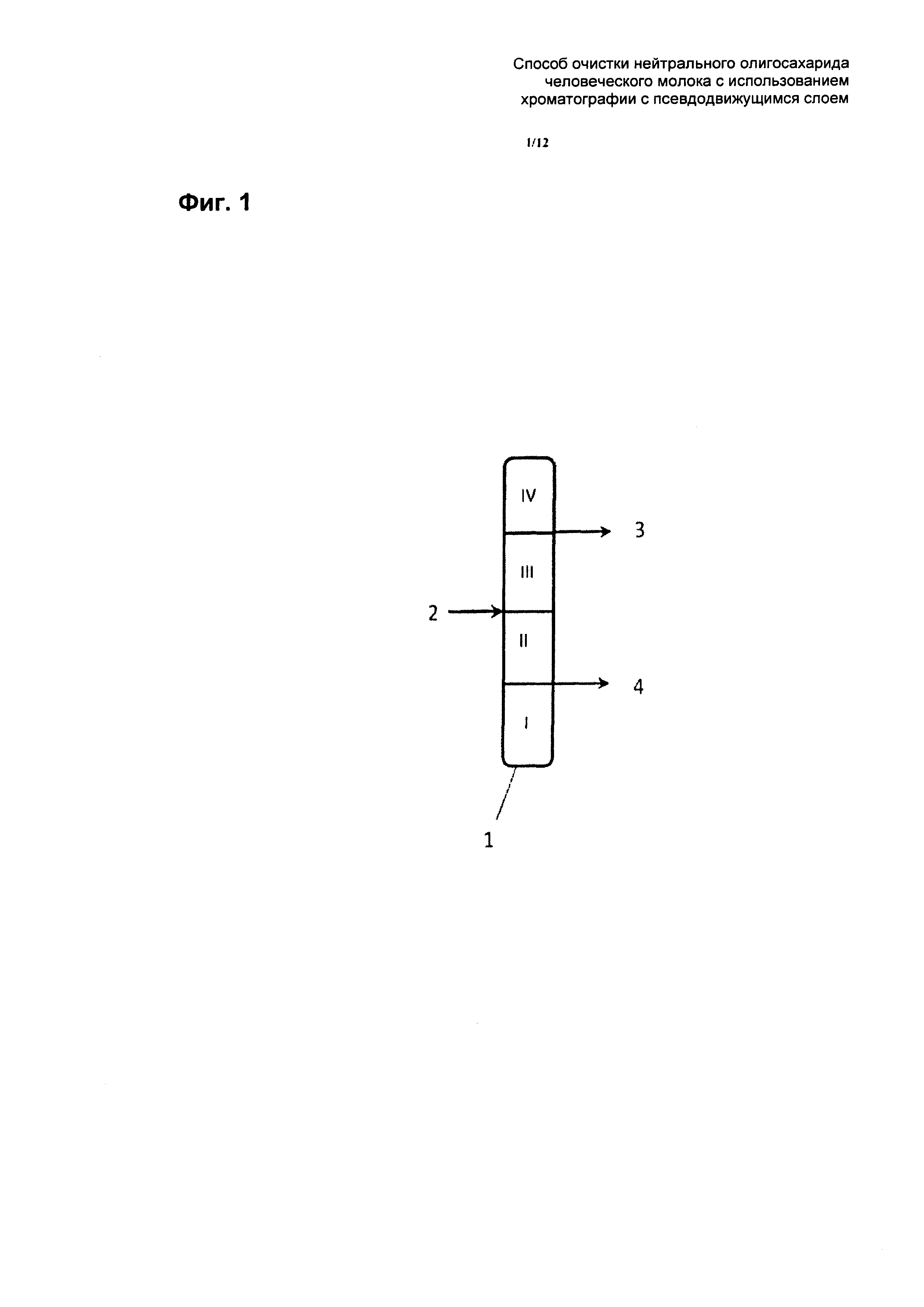
На Фиг. 1 схематически показана одна стадия очистки с применением хроматографии с симулированным движением неподвижной фазы. Хроматография с симулированным движением неподвижной фазы может иметь, например, 12 колонок в последовательном расположении 1, где расположение разделено на четыре различные зоны I, II, III и IV. Неочищенный раствор, содержащий нейтральный ОГМ 2'-фукозиллактозу и загрязняющие вещества, применяют между зоной II и зоной III на входе 2 подачи. Экстракт удаляют из выхода 4 между зоной I и зоной II, тогда как рафинат удаляют на выходе 3 между зоной III и зоной IV. Рафинат на выходе 3 содержит очищенную ОГМ 2-фукозиллактозу, тогда как экстракт на выходе 4 содержит загрязняющие вещества с низкой молекулярной массой (например, моносахариды и дисахариды).
На Фиг. 2 схематически показаны две последовательные стадии очистки с применением хроматографии с симулированным движением неподвижной фазы. Каждая стадия хроматографии с симулированным движением неподвижной фазы может иметь, например, 12 колонок в последовательном расположении 1, 1', где каждое расположение разделено на четыре различных зоны Ia, IIa, IIIa и IVa или зоны Ib, IIb, IIIb и IVb, соответственно. Неочищенный раствор, содержащий нейтральный ОГМ 2'-фукозиллактозу и загрязняющие вещества, применяют между зоной IIa и зоной IIIa первого расположения 1 на входе 2 подачи. Экстракт удаляют из выхода 4 между зоной Ia и зоной IIa, тогда как рафинат покидает первое последовательное расположение 1 на выходе 3 между зоной IIIa и зоной IVa и его применяют во втором последовательном расположении 1' между зоной IIb и зоной IIIb. Во втором последовательном расположении 1' экстракт удаляют на выходе 6, тогда как рафинат удаляют на выходе 5 между зоной IIIb и зоной IVb. Рафинат на выходе 5 содержит хорошо очищенную 2'-фукозиллактозу, тогда как экстракт на выходе 6 содержит загрязняющие вещества с высокой молекулярной массой (например, высшие олигосахариды).
На Фиг. 3 схематически показана предпочтительная схема очистки по настоящему изобретению. Сначала на раствор 7, содержащий нейтральный ОГМ 2'-фукозиллактозу и загрязняющие вещества, воздействуют с помощью стадии 8 электродиализа до тех пор, пока не достигнут проводимости ≤0,5 мСм/см. Указанный раствор концентрируют до тех пор, пока раствор не достигнет концентрации 2'-фукозиллактозы, составляющей приблизительно 40% (масс./об.). Затем указанный раствор подвергают по меньшей мере одной стадии очистки с применением хроматографии 9 с симулированным движением неподвижной фазы. После стадии хроматографии с симулированным движением неподвижной фазы получают очищенный раствор, содержащий 2'-фукозиллактозу высокой степени чистоты. Указанный чистый раствор подвергают стерилизующему фильтрованию 11 (предпочтительно также для удаления эндотоксинов). Перед стадией стерилизующего фильтрования 11 можно факультативно осуществить дополнительную стадию электродиализа 10 с последующим концентрированием. После стерилизующего фильтрования 11 очищенный раствор, содержащий 2'-фукозиллактозу, подвергают сушке 12 распылением и получают чистую, высушенную распылением 2'-фукозиллактозу 13 в форме твердых гранул.
На Фиг. 4 показан результат анализа методом порошковой рентгеновской дифракции двух образцов высушенной распылением 2'-фукозиллактозы по настоящему изобретению (образец №1 и образец №2). Две полученные дифрактограммы обнаруживают, что как образец №1, так и образец №2 находятся в полностью аморфном состоянии (никаких характеристических пиков кристаллического вещества).
На Фиг. 5 показано распределение по размеру частиц высушенной распылением 2'-фукозиллактозы по настоящему изобретению (образец №1 и образец №2), определенное методом лазерной дифракции. Для образца №1 был определен средний размер частиц, составляющий приблизительно 68 мкм. Образец №2 имел средний размер частиц приблизительно 44 мкм. Оба значения считаются высокими для высушенного распылением продукта.
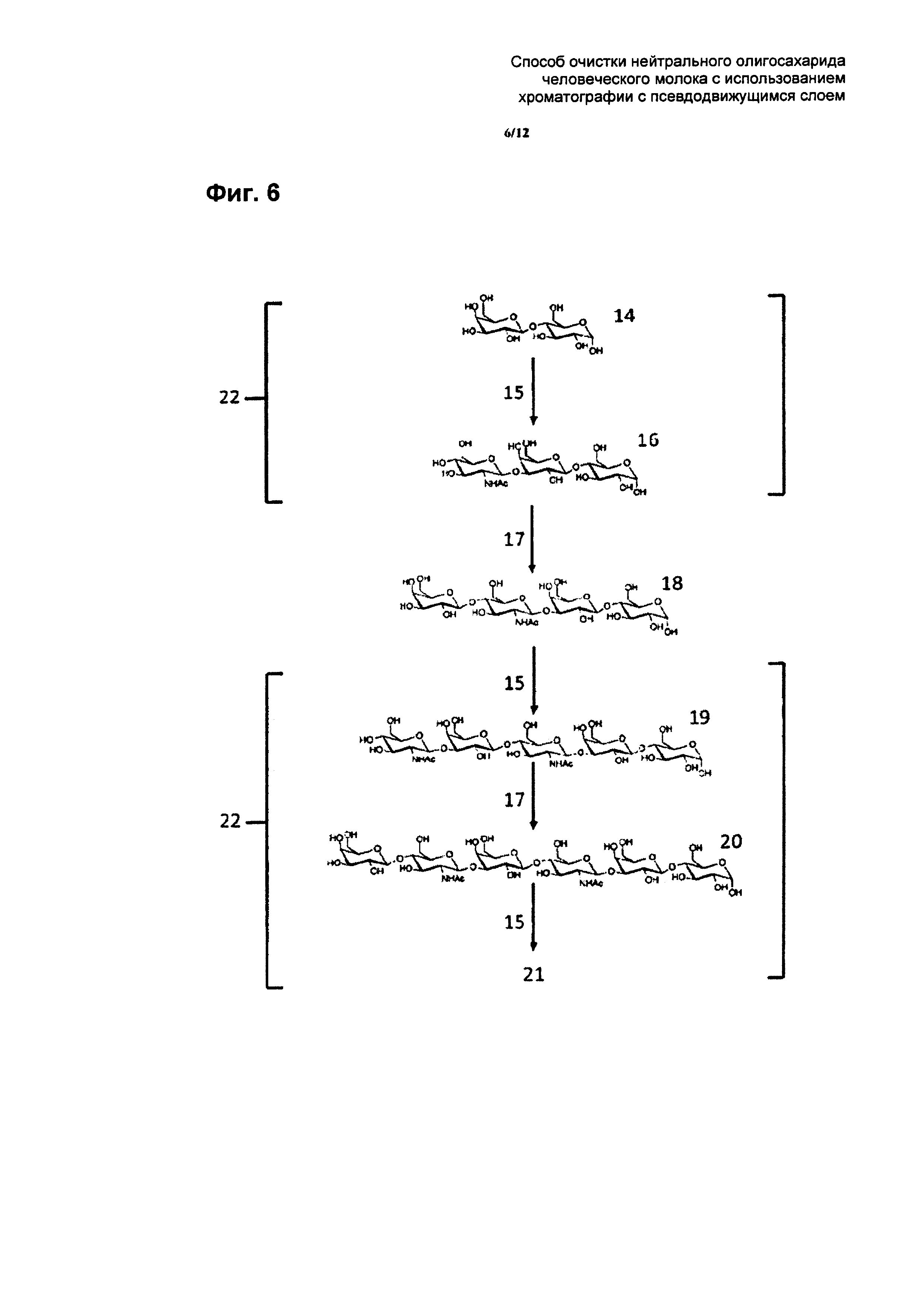
На Фиг. 6 показан биосинтез нейтрального тетрасахарида грудного молока лакто-N-неотетраозы 18. Биосинтез начинается с дисахарида лактозы 14, которую превращают с помощью β-1,3-N-ацетил-глюкозаминтрансферазы 15 в трисахарид лакто-N-триозу 16. Трисахарид лакто-N-триозу 16 затем превращают в тетрасахарид лакто-N-неотетраозу 18 с помощью фермента 1,4-галактозилтрансферазы 17. В живом организме некоторая процентная доля лакто-N-неотетраозы 18 дополнительно превращается в более крупные олигосахариды 19, 20, 21 с помощью ферментов β-1,3-N-ацетил-глюкозаминтрансферазы 15 и 1,4-галактозилтрансферазы 17. Если целью способа по изобретению является очистка лакто-N-неотетраозы 18, более крупные олигонуклеотиды, а также более мелкие олигонуклеотиды (предшественники) лактозы 14 и лакто-N-триозы 16 могут присутствовать в качестве загрязняющих веществ 22 в неочищенном растворе, содержащем лакто-N-неотетраозу 18. Способ по изобретению обеспечивает эффективное удаление указанных загрязняющих веществ 22.
На Фиг. 7 показано сравнение двух различных нанофильтрационных мембран для концентрирования содержащего 2'-фукозиллактозу раствора путем нанофильтрации (ПОК: показатель объемной концентрации, поток: выражает скорость, с которой вода проникает через нанофильтрационную мембрану). В качестве нанофильтрационной мембраны использовали нанофильтрационную мембрану Alfa Laval типа NF99 (NF) и нанофильтрационную мембрану Alfa Laval типа NF99HF. Можно видеть, что при ПОК ≤6, нанофильтрационная мембрана NF99HF обеспечивает более высокий поток, то есть более быстрое концентрирование раствора.
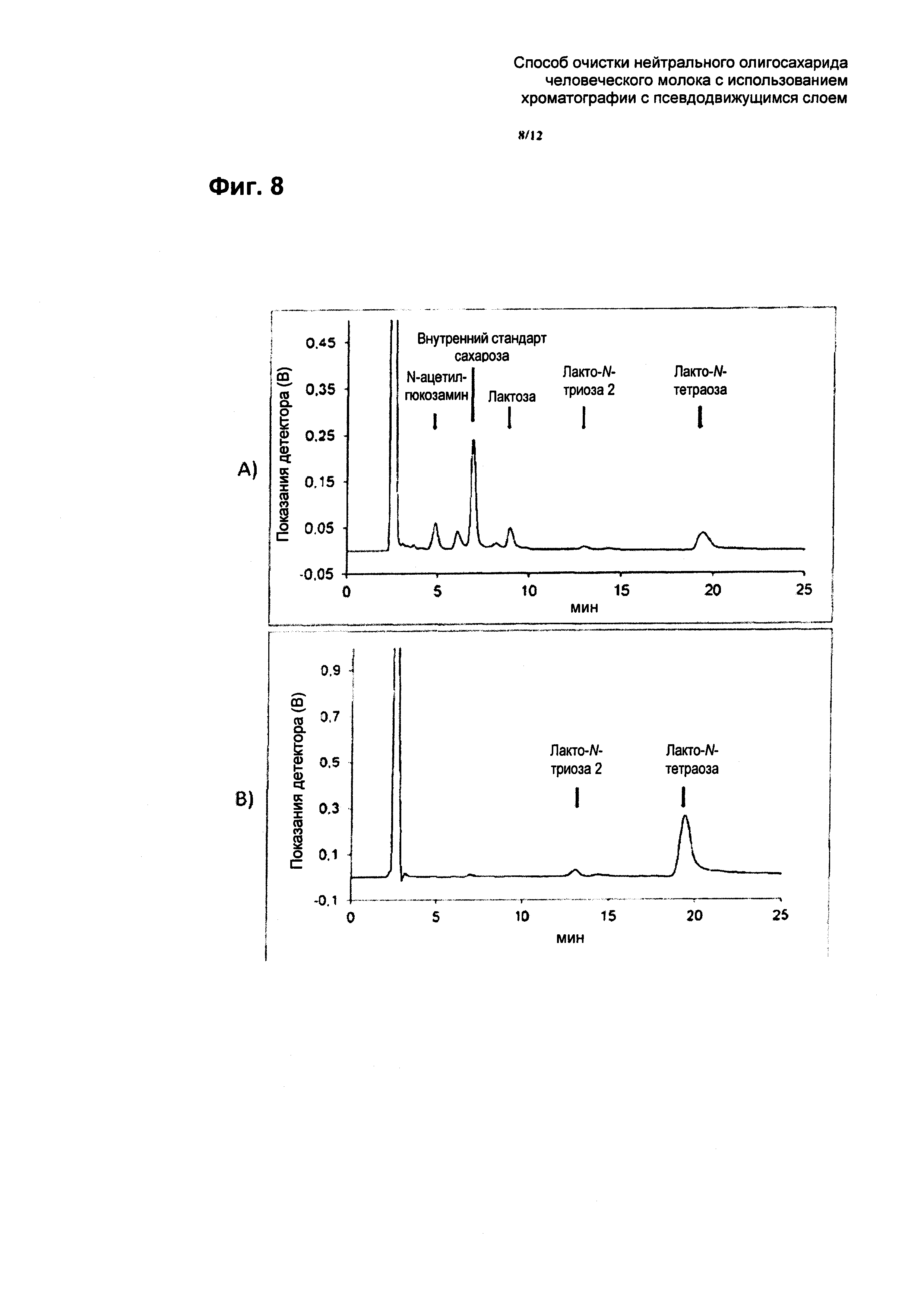
На Фиг. 8 приведены результаты ВЭЖХ (высокоэффективной жидкостной хроматографии) анализа сырья (Фиг. 8А) и рафината (Фиг. 8B) SMB хроматографии примера 6 (сахарозу использовали в качестве внутреннего стандарта, см. Фиг. 8А). В качестве аналитической колонки применяли колонку ReproSil Carbohydrate (аминофункционализированная капиллярная колонка с силикагелем, 5 мкм, 250×4,6 мм, производства Dr. Maisch GmBH, Ammerbuch) со скоростью потока 1,4 мл/мин. В качестве элюента использовали смесь ацетонитрила и воды (68% (об.):32% (об.)). Элюирование проводили в изократическом режиме. Объем вводимой пробы составлял 20 мкл. Температура нагревателя составляла 35°C. В SMB хроматографии использовали сильную катионообменную смолу, которая присутствовала в Н+ форме.
На Фиг. 9 приведены результаты ВЭЖХ анализа экстракта SMB хроматографии из примера 6. В качестве аналитической колонки использовали колонку ReproSil Carbohydrate (аминофункционализированная капиллярная колонка с силикагелем, 5 мкм, 250×4,6 мм, производства Dr. Maisch GmBH, Ammerbuch) со скоростью потока 1,4 мл/мин. В качестве элюента использовали смесь ацетонитрила и воды (68% (об.):32% (об.)). Элюирование проводили в изократическом режиме. Объем вводимой пробы составлял 20 мкл. Температура нагревателя составляла 35°C. В SMB хроматографии использовали сильную катионообменную смолу, которая присутствовала в Н+ форме.
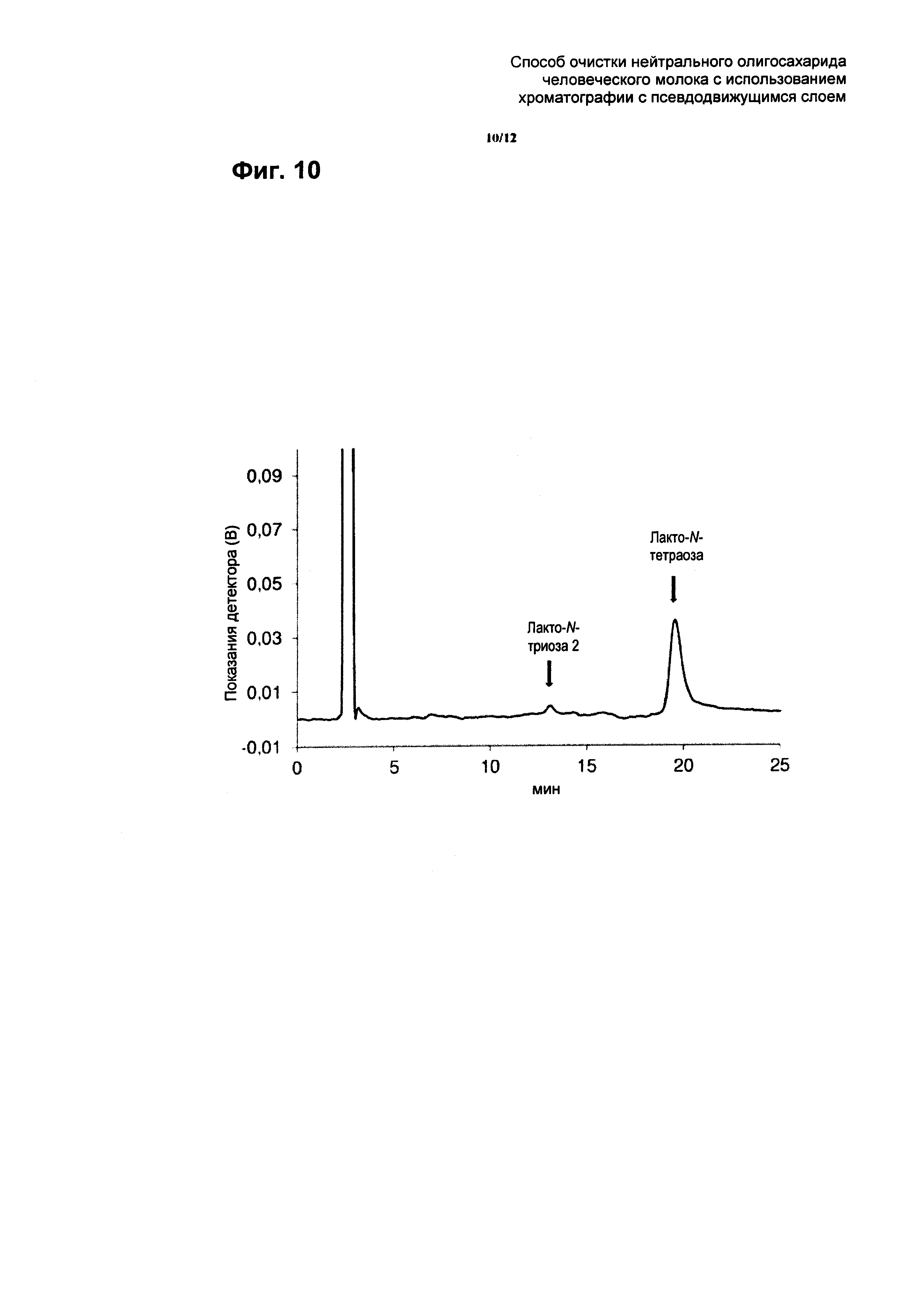
На Фиг. 10 приведены результаты ВЭЖХ анализа экстракта второй стадии SMB хроматографии (дополнительной стадии SMB хроматографии по изобретению) из примера 6. В качестве аналитической колонки применяли колонку ReproSil Carbohydrate (аминофункционализированная капиллярная колонка с силикагелем, 5 мкм, 250×4,6 мм, производства Dr. Maisch GmBH, Ammerbuch) со скоростью потока 1,4 мл/мин. В качестве элюента использовали смесь ацетонитрила и воды (68% (об.):32% (об.)). Элюирование проводили в изократическом режиме. Объем вводимой пробы составлял 20 мкл. Температура нагревателя составляла 35°C. В SMB хроматографии использовали сильную катионообменную смолу, которая присутствовала в Н+ форме.
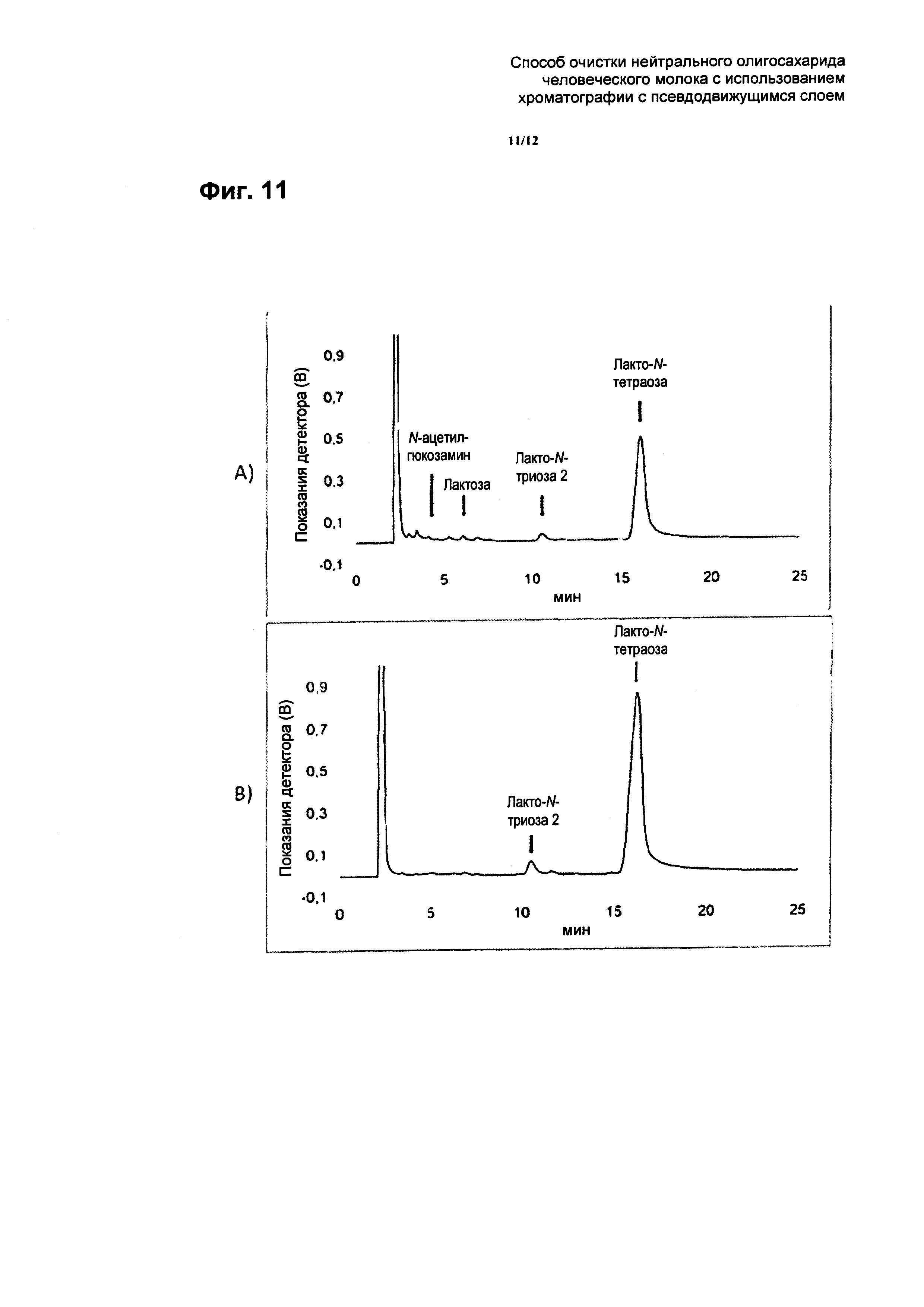
На Фиг. 11 приведены результаты ВЭЖХ анализа сырья (Фиг. 11A) и рафината (Фиг. 11B) SMB хроматографии из примера 7. В качестве аналитической колонки использовали колонку ReproSil Carbohydrate (аминофункционализированная капиллярная колонка с силикагелем, 5 мкм, 250×4,6 мм, производства Dr. Maisch GmBH, Ammerbuch) со скоростью потока 1,4 мл/мин. В качестве элюента использовали смесь ацетонитрила и воды (68% (об.):32% (об.)). Элюирование проводили в изократическом режиме. Объем вводимой пробы составлял 20 мкл. Температура печи составляла 35°C. В данном опыте SMB хроматографии использовали сильную катионообменную смолу, которая присутствовала в Са2+ форме.
На Фиг. 12 приведены результаты ВЭЖХ анализа экстракта SMB хроматографии из примера 7. В качестве аналитической колонки применяли колонку ReproSil Carbohydrate (аминофункционализированная капиллярная колонка с силикагелем, 5 мкм, 250×4,6 мм, производства Dr. Maisch GmBH, Ammerbuch) со скоростью потока 1,4 мл/мин. В качестве элюента использовали смесь ацетонитрила и воды (68% (об.):32% (об.)). Элюирование проводили в изократическом режиме. Объем вводимой пробы составлял 20 мкл. Температура нагревателя составляла 35°C. В данном опыте SMB хроматографии использовали сильную катионообменную смолу, которая присутствовала в Са2+ форме.
Пример 1. Очистка 2'-фукозиллактозы с применением хроматографии с симулированным движением неподвижной фазы (SMB хроматографии)
Прозрачный, не содержащий частиц раствор, содержащий 2'-фукозиллактозу с концентрацией 250 г/л подвергали электродиализу до 0,5 мСм/см с применением установки электродиализа PC-Cell BED 1-3 (производства PC-Cell, Heusweiler, Германия), оборудованной мембранным пакетом PC-Cell Е200. Указанный пакет содержал следующие мембраны: катионообменную мембрану КОМ: PC SK и анионообменную мембрану АОМ: PcAcid60, имеющие размер эксклюзионного предела, составляющий 60 Да.
Для SMB очистки раствор 2'-фукозиллактозы концентрировали до 300 г/л, применяя вакуумный концентратор при 40°C. Для SMB хроматографии применяли SMB систему с замкнутым контуром, оборудованную 12 колонками (колонки Prosep® размером 40 мм × 740 мм (производства Lartek, Eppelheim, Германия)), расположенными в 4-х зонах. Каждая колонка содержала 760 г сильной катионообменной смолы Purolite® PCR833H+ (производства Purolite, Ratingen, Германия).
Систему эксплуатировали при температуре 25°C со следующими характеристиками потока: скорость потока в зоне I составлял 30,00 мл/мин, скорость потока в зоне II устанавливали на уровне 21,00 мл/мин, скорость потока в зоне III составлял 21,48 мл/мин, скорость потока в зоне IV устанавливали на уровне 18,44 мл/мин, подачу устанавливали на уровне 3,00 мл/мин, поток элюента устанавливали на уровне 11,56 мл/мин и время переключения колонок устанавливали на уровне 17,92 мин. В качестве элюента использовали воду с 10% (об.) пищевого этанола.
Основные загрязняющие вещества, такие как лактоза, моносахариды, такие как фукоза, глюкоза, галактоза и глицерин, фракционировали в экстракт. 2'-фукозиллактозу и загрязняющие большие олигосахариды (например, дифукозиллактозу) фракционировали в рафинат.
2'-фукозиллактоза немного разбавлялась в процессе стадии SMB очистки - концентрация 2'-фукозиллактозы в рафинате определяли на уровне 200 г/л. рН рафината регулировали до уровня рН 7, используя 0,2 н-ную NaOH. При указанных настройках системы SMB системы могут непрерывно эксплуатироваться в течение по меньшей мере 3 месяцев.
Затем полученный раствор снова подвергали электродиализу до тех пор, пока не получали проводимость менее 0,5 мСм/см, и концентрировали, чтобы получить 40%-ный (масс./об.) раствор 2'-фукозиллактозы.
Раствор затем подвергали стерилизующему фильтрованию и удалению эндотоксинов путем пропускания раствора через фильтр 3 кДа (Pall Microza ультрафильтрационный модуль с полыми волокнами SEP-2013, Pall Corporation, Dreieich).
Используя этот алгоритм действий можно было получить 2'-фукозиллактозу со степенью чистоты 90,4%. Основными загрязняющими веществами были 3'-фукозиллактоза (2,6%), дифукозиллактоза (1,5%) и лактоза (1,4%). Выход со стадии очистки составлял приблизительно 80%.
Пример 2. Очистка 2'-фукозиллактозы с применением многокомпонентного SMB хроматографического разделения
Прозрачный, не содержащий частиц раствор 2'-фукозиллактозы с концентрацией 250 г/л подвергали электродиализу до 0,5 мСм/см с применением установки электродиализа PC-Cell BED 1-3 (производства PC-Cell, Heusweiler, Германия), оборудованной мембранным пакетом PC-Cell Е200. Указанный пакет содержал следующие мембраны: катионообменную мембрану КОМ: Рс SK и анионообменную мембрану АОМ: Рс Acid 60, которые обладают размером эксклюзионного предела, составляющим 60 Да.
Для стадии SMB очистки раствор 2'-фукозиллактозы концентрировали до 300 г/л, применяя вакуумный концентратор при 40°C. Для SMB-хроматографии применяли SMB-систему с замкнутым контуром, оборудованную 24 колонками (колонки Prosep® размером 40 мм × 740 мм (производства Lartek, Eppelheim, Германия)), расположенными в 2×4 зонах. Каждая колонка содержала 760 г сильной катионообменной смолы Purolite® PCR833H+ (Purolite, Ratingen, Германия).
Система эксплуатировалась при температуре 25°C со следующими характеристиками потока: скорость потока в зоне Ia составлял 30,00 мл/мин, скорость потока в зоне IIa устанавливали на уровне 21,00 мл/мин, скорость потока в зоне IIIa устанавливали на уровне 21,48 мл/мин, скорость потока в зоне IVa устанавливали на уровне 18,44 мл/мин, подачу устанавливали на уровне 3,00 мл/мин, поток элюента устанавливали на уровне 11,56 мл/мин и время переключения колонок устанавливали на уровне 17,92 мин.
Рафинат из первого разделения пропускали со скоростью потока 3,04 мл/мин во вторую стадию разделения. Скорость потока в зоне Ib поддерживали на уровне 30,00 мл/мин, скорость потока в зоне IIb устанавливали на уровне 19,61 мл/мин, скорость потока в зоне IIIb устанавливали на уровне 21,63 мл/мин, скорость потока в зоне IVb устанавливали на уровне 18,46 мл/мин, поток элюента устанавливали на аналогичном уровне 11,56 мл/мин и время переключения колонок в зонах Ib-IVb составляло 10,46 мин.
В качестве элюента использовали воду с 10% (об.) пищевого этанола. При многокомпонентном разделении загрязняющие вещества, такие как лактоза, моносахариды, такие как фукоза, глюкоза, галактоза и глицерин, были обнаружены в экстракте первой стадии разделения, а загрязнители в виде более крупных олигосахаридов (например, дифукозиллактозу), фракционировали в рафинат второй стадии разделения.
2'-фукозиллактозу фракционировали в рафинат первой стадии разделения и экстракт второй сади разделения и, таким образом, она не содержала загрязняющих веществ с низкой и высокой молекулярной массой. 2'-фукозиллактоза только немного разбавлялась в процессе стадии SMB очистки - концентрация 2'-фукозиллактозы в экстракте второй стадии очистки определяли на уровне 200 г/л.
рН рафината после первой стадии очистки регулировали до уровня рН 7, используя 0,2 н-ный NaOH.
Применяя этот алгоритм действий можно было получить 2-фукозиллактозу со степенью чистоты 93,0%. Основными загрязняющими веществами были 3'-фукозиллактоза (1,1%), дифукозиллактоза (0,9%) и лактоза (1,0%).
Пример 3. Получение 2'-фукозиллактозы в твердой форме путем сушки распылением
Фракции 2'-фукозиллактозы, полученные методом SMB хроматографии, снова подвергали электродиализу до тех пор, пока не получали проводимость менее 0,5 мСм/см. Фракции затем концентрировали под вакуумом для получения фракций 2'-фукозиллактозы, содержащих 40% (масс./об.) 2'-фукозиллактозы. Растворы последовательно подвергали стерилизующему фильтрованию и удалению эндотоксинов путем пропускания раствора через фильтр 3 кДа (Pall Microza ультрафильтрационный модуль с полыми волокнами SEP-2013, производства Pall Corporation, Dreieich, Германия).
Полученные таким образом стерильные растворы 2'-фукозиллактозы затем сушили распылением, используя распылительную сушилку NUBILOSA LTC-GMP (NUBILOSA, Konstanz, Германия). Для сушки распылением 40%-ный (масс./об.) раствор 2'-фукозиллактозы пропускали под давлением через форсунки распылительной сушилки с температурой на входе, установленной на уровне 130°C. Поток настраивали так, чтобы поддерживать температуру на выходе от 66°C до 67°C.
Применяя эти настройки можно было получить высушенный распылением порошок с влажностью менее 5%. Содержание влаги определяли с помощью титрования по методу Карла-Фишера.
Пример 4. Получение характеристик высушенной распылением 2'-фукозиллактозы
1. Дифференциальная сканирующая калориметрия (ДСК)
Mettler Toledo 821е (производства Mettler Toledo, Giessen, Германия) использовали для определения термических потоков в двух образцах (образец №1 и образец №2) высушенной распылением 2'-фукозиллактозы.
Приблизительно 25 мг высушенного распылением образца анализировали в гофрированных AI ячейках (производства Mettler Toledo, Giessen, Германия). Образцы охлаждали до 0°C со скоростью 10°K/мин и повторно нагревали до 100°C со скоростью сканирования 10°K/мин. После охлаждения образцов до 0°C, во втором цикле нагревания образцы нагревали до 150°C. Среднюю точку эндотермического сдвига базовой линии в процессе нагревающего сканирования принимали за Tg. Экзотермические и эндотермические пики описывают посредством максимальной температуры и нормированной энергии потока. Результаты ДСК анализа образцов собраны в таблице 1.

При анализе методом ДСК образца №1 обнаружили основной переход в стеклообразное состояние при температуре (Tg) 67,4°C при втором нагревающем сканировании. Небольшой второй переход в стеклообразное состояние также регистрировали при Tg 122,6°C при втором нагревающем сканировании. Основной переход в стеклообразное состояние регистрировали при первом нагревающем сканировании, за которым следовал экзо- и эндотермический поток при температуре выше Tg. Эти потоки относят к эффектам релаксации в образце.
Анализ образца №2 методом ДСК показал значительно более высокий переход в стеклообразное состояние (Tg) при 84,6°C во втором нагревающем сканировании, что также регистрировали при первом нагревающем сканировании. Это может указывать на более низкое содержание остаточной воды в образце №2 по сравнению с образцом №1. Так как переход в стеклообразное состояние регистрировали близко к конечной температуре первого нагревающего сканирования, нельзя было зарегистрировать возможные явления релаксации. В этом образце нельзя было зарегистрировать второй переход в стеклообразное состояние, хотя был виден небольшой экзотермический пик при 125,9°C во втором нагревающем сканировании.
2. Порошковая рентгеновская дифракция
Широкоугольную порошковую рентгеновскую дифракцию (XRD) использовали для изучения морфологии образцов №1 и №2. Использовали рентгеновский дифрактометр Empyrean (производства Panalytical, Almelo, Нидерланды), оборудованный медным анодом (45 кВ, 40 мА, Kα1 эмиссия при длине волны 0,154 нм), и датчик PIXcel3D. Приблизительно 100 мг высушенных распылением образцов анализировали в режиме отражения в угловом диапазоне 5-45° 2θ, с шагом 0,04° 2θ и со временем регистрации импульсов, составляющим 100 секунд на шаг.
При XRD анализе образцов №1 и №2 обнаружили полностью аморфное состояние обоих образцов и отсутствие каких бы то ни было характеристических пиков кристаллического вещества (см. Фиг. 4 для наложения обеих дифрактограмм).
3. Лазерная дифракция
Измерения методом лазерной дифракции выполняли, используя лазерный дифракционный анализатор распределения по размеру частиц Partica LA-950 (производства Horiba, Kyoto, Япония), оборудованный 605 нм-овым лазерным диодом для регистрации частиц >500 нм и 405 нм-овым светодиодом голубого свечения (LED) для регистрации частиц <500 нм. Изооктан использовали в качестве диспергирующей среды (показатель преломления 1,391). Так как показатель преломления образцов неизвестен, использовали показатель преломления частиц сахара (дисахарида) (1,530). Образцы диспергировали в изооктане с помощью воздействия ультразвука в течение времени, не превышающего 5 минут. Перед измерением систему очищали изооктаном. Дисперсию каждого образца измеряли 3 раза и приводили средние значения величин и стандартное отклонение.
Регистрировали средний размер частиц (средневзвешенное размера частиц по объему) и модальный размер частиц (пик распределения). Помимо распределения частиц по объему (q%) результат регистрировали в виде:
d(v, 10): диаметр частиц, соответствующий 10% совокупного распределения размеров частиц по объему,
d(v, 50): диаметр частиц, соответствующий 50% совокупного распределения размеров частиц по объему,
d(v, 90): диаметр частиц, соответствующий 90% совокупного распределения размеров частиц по объему.
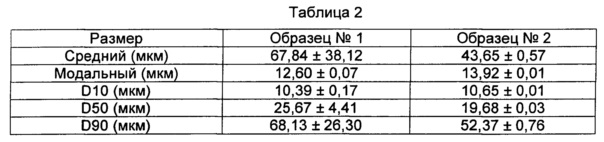
Распределение размеров частиц для образца №1 и образца №2 показано на Фиг. 5. Модальный размер, который представляет размер частиц с наивысшей интенсивностью, сравним для обоих образцов. В целом, средний размер частиц, составляющий 67,85 мкм (образец №1) и 43,65 мкм (образец №2), соответственно, считают необычно высоким для высушенных распылением частиц. Фракция, зарегистрированная при более высоких диаметрах частиц, возможно, вызвана агломерированными порошковыми частицами.
В таблице 2 суммированы характеристики размеров частиц образца №1 и образца №2.
Пример 5. Уменьшение объема и обессоливание содержащего 2'-фукозиллактозу супернатанта с применением нанофильтрации
Для концентрирования и обессоливания супернатанта культуры, содержащей 2'-фукозиллактозу, применяли мембранный фильтрационный модуль Alfa Laval М-20, оборудованный либо NF99 (Alfa Laval NF99), либо NF99HF (Alfa Laval NF99HF) нанофильтрационной мембраной. Используемый супернатант культуры, содержащей 2'-фукозиллактозу (содержащий 25 г/л 2'-фукозиллактозы), отделяли от ферментационной микробиологической биомассы, используя поперечноточную фильтрацию. Молекулярное пороговое значение поперечноточной фильтрационной мембраны составляло 150 кДа (StrassBurger Filter Micro Cross Module® FS10LFC-FUS1582).
He содержащий клеток фильтрат затем обрабатывали с помощью катионообменной установки (Lewatit S2568 в протонной форме (Lanxess)) и анионообменной установки (Lewatit S6368 в карбонатной форме (Lanxess)) перед тем, как подвергнуть его нанофильтрации. Раствор нейтрализовывали после каждой стадии ионного обмена, используя раствор гидроксида натрия или соляную кислоту, соответственно. Давление на входе мембранного модуля составляло 4,2 МПа (42 бар) и давление на выходе составляло 4 МПа (40 бар), скорость потока сырья внутри мембранного модуля составлял 8 л/мин. Фильтрат удаляли из способа, тогда как концентрат подавали обратно в резервуар и мембранный модуль. Объем резервуара, соединенного с мембранным пакетом, составлял 6 литров. В процессе концентрирования содержащего 2'-фукозиллактозу раствора резервуар непрерывно заполняли раствором супернатанта культуры, содержащей 2'-фукозиллактозу, до тех пор, пока не получали 8-кратно концентрированный раствор.
На Фиг. 7 показан полученный поток (л/м2/ч), приведенный в зависимости от показателя объемной концентрации (ПОК) для двух применяемых мембран. Имея 8-кратно концентрированную 2'-фукозиллактозу с концентрацией приблизительно 200 г/л 2'-фукозиллактозы, концентрированный раствор подвергали диафильтрации для обессоливания путем добавления деионизированной воды с той же скоростью, с которой фильтрат получали из мембранного модуля. Применяя стадию диафильтрации, проводимость концентрата 2'-фукозиллактозы можно уменьшить от 25 мСм до менее 7 мСм при использовании NF99HF мембраны.
Применяя этот нанофильтрационный подход, раствор 2'-фукозиллактозы можно 8-кратно концентрировать до концентрации 2'-фукозиллактозы, составляющей ≥200 г/л в щадящих условиях (избегая теплового воздействия), с помощью стадии диафильтрации можно удалить большую часть доли солей. Концентрат 2'-фукозиллактозы подвергали электродиализу для дальнейшего уменьшения содержания солей.
Пример 6. Очистка лакто-N-тетраозы с применением двух стадий хроматографии с симулированным движением неподвижной фазы и ионообменной смолы в Н+ форме
Прозрачный, не содержащий частиц раствор лакто-N-тетраозы (30 г/л), полученный из процесса микробиологической ферментации, подвергали электродиализу до проводимости 0,5 мСм/см, используя установку электродиализа PC-Cell (см. выше). Для SMB хроматографии раствор лакто-N-тетраозы концентрировали до 50 г/л в вакууме при 40°C. Альтернативно, содержащий лакто-N-тетраозу раствор можно обессолить и концентрировать, используя нанофильтрационную мембрану (например, нанофильтрационную мембрану NF99HF производства Alfa Laval).
Для SMB хроматографии применяли SMB систему с замкнутым контуром, оборудованную 12 колонками (стеклянные колонки Prosep® размером 40 мм × 740 мм (Lartek, Eppelheim, Германия)), расположенными в 4-х зонах. Каждая стеклянная колонка содержала 760 г сильной катионообменной смолы Purolite® PCR833H+. Сильная катионообменная смола присутствовала в Н+ форме.
Система эксплуатировалась при температуре 25°C со следующим установочными параметров: скорость потока в зоне I устанавливали на уровне 30,00 мл/мин, скорость потока в зоне II устанавливали на уровне 19,07 мл/мин, скорость потока в зоне IV устанавливали на уровне 18,44 мл/мин. Подачу поддерживали на уровне 1 мл/мин и поток элюента устанавливали на уровне 11,56 мл/мин со временем переключения колонок 17,92 мин. В качестве элюента использовали воду с 10% (об.) пищевого этанола.
При этих параметрах лакто-N-тетраозу и более крупные нейтральные олигосахариды фракционировали в рафинат. Чистота лакто-N-тетраозы составляла 86,3% вместо 33,4% в сырье для SMB стадии (см. Фиг. 7А для ВЭЖХ анализа сырья для SMB стадии и Фиг. 7В для ВЭЖХ анализа рафината с SMB стадии). Загрязняющие вещества, такие как лактоза, моносахариды и глицерин обнаруживали во фракции экстракта cSMB стадии (см. Фиг. 8 для ВЭЖХ анализа фракции экстракта с SMB стадии). Рафинат, содержащий лакто-N-тетраозу, доводили до нейтрального рН, используя раствор 0,2 н-ного NaOH.
рН полученного экстракта, содержащего лакто-N-тетраозу, доводили до рН 7, используя 0,2 н-ный NaOH. Затем полученный раствор подвергали электродиализу до тех пор, пока снова не получали проводимость менее 0,5 мСм. Раствор затем концентрировали в вакууме до приблизительно 50 г/л лакто-N-тетраозы и затем подвергали стерилизующему фильтрованию путем прохождения через 3 кДа поперечноточный фильтр (Pall Microza ультрафильтрационный модуль с полыми волокнами SEP-2013, Pall Corporation, Dreieich).
Чтобы отделить загрязнители в виде более крупных олигосахаридов от лакто-N-тетраозы, выполняли второе разделение с помощью SMB хроматографии. При использовании той же SMB системы параметры изменяли следующим образом: скорость потока в зоне I 30 мл/мин, скорость потока в зоне II 19,27 мл/мин, скорость потока в зоне IV 17,30 мл/мин. Подачу устанавливали на уровне 2,08 мл/мин и поток элюента устанавливали на уровне 12,70 мл/мин. Поток рафината составлял 4,04 мл/мин и поток экстракта составлял 10,73 мл/мин. Время переключения колонок SMB разделения устанавливали на уровне 10,46 мин. В качестве элюента снова применяли смесь воды и этанола 9:1 (об./об.). ВЭЖХ анализ экстракта второго отделения лакто-N-тетраозы путем SMB хроматографии показан на Фиг. 10.
При этих условиях лакто-N-тетраозу фракционировали в экстракт и от 5 до 10% от общего количества более крупных нейтральных олигосахаридов обнаруживали в рафинате. Применяя этот алгоритм действий (аминофункционализированная капиллярная колонка с силикагелем после второй стадии SMB), можно было получить лакто-N-тетраозу с чистотой 93,1%.
Пример 7. Очистка лакто-N-тетраозы с применением хроматографии с симулированным движением неподвижной фазы с ионообменной смолой в Са2+ форме
Прозрачный, не содержащий частиц раствор лакто-N-тетраозы (30 г/л), полученный из микробиологической ферментации, подвергали электродиализу до проводимости 0,5 мСм/см, используя установку электродиализа PC-Cell (см. выше).
Для SMB хроматографии с кальцием в качестве противоиона раствор лакто-N-тетраозы концентрировали до 50 г/л в вакууме при 40°C. Для SMB хроматографии применяли SMB систему с замкнутым контуром, оборудованную 12 колонками (стеклянные колонки Prosep® размером 40 мм × 740 мм (Lartek, Eppelheim, Германия)), расположенными в 4-х зонах.
Каждая колонка содержала 760 г сильной катионообменной смолы Purolite® PCR833H+. Катионообменную смолу промывали 50 литрами 200 мМ СаС1 г для обмена ионов Н+ на ионы Са2+. Таким образом, сильная катионообменная смола присутствовала в Са2+ форме.
Система эксплуатировалась при температуре 25°C со следующим установочными параметрами: скорость потока в зоне I устанавливали на уровне 30,00 мл/мин, скорость потока в зоне II устанавливали на уровне 20,07 мл/мин, скорость потока в зоне IV устанавливали на уровне 17,04 мл/мин. Подачу поддерживали на уровне 2,5 мл/мин и поток элюента устанавливали на уровне 11,56 мл/мин со временем переключения колонок 17,92 мин. В качестве элюента использовали воду с 10% (об.) пищевого этанола.
Пример 8. Получение лакто-N-тетраозы в твердой форме путем сушки распылением
Фракции, содержащие лакто-N-тетраозу, концентрировали в вакууме для получения концентрации лакто-N-тетраозы, составляющей 25% (масс./об.). Затем растворы для стерилизующего фильтрования и для удаления эндотоксинов пропускали через фильтр 3 кДа (Pall Microza ультрафильтрационный модуль с полыми волокнами SEP-1013, Pall Corporation, Dreieich, Германия).
Полученный таким образом стерильный раствор лакто-N-тетраозы затем сушили распылением с использованием Mini Spray Dryer В-290 (Buchi Labortechnik GmbH, Essen, Германия). Для сушки распылением лакто-N-тетраозы раствор проводили под давлением через форсунки распылительной сушилки с температурой на входе от 120°C до 130°C и поток настраивали так, чтобы поддерживать температуру на выходе от 66°C до 67°C. Используя эти настройки можно было получить высушенный распылением порошок с влажностью 7-9% и выходом 72% высушенной лакто-N-тетраозы. Содержание влаги определяли с помощью титрования по методу Карла-Фишера.
Реферат
Изобретение относится к способу очистки нейтрального олигосахарида грудного молока и может быть использовано в пищевой промышленности. Способ заключается в очистке нейтрального олигосахарида грудного молока от загрязняющих веществ в неочищенном растворе, содержащем загрязняющие вещества и нейтральный олигосахарид грудного молока с чистотой <80%, методом непрерывной хроматографии, при этом загрязняющие вещества представляют собой олигосахариды, которые образуются из-за разнородности гликозилтрансферазы, которая превращает целевой продукт, субстрат или промежуточный продукт в загрязняющий олигосахарид, при этом неочищенный раствор выбран из группы, состоящей из экстракта микробиологической ферментации и реакционного раствора биокатализа, и при этом к неочищенному раствору применяют по меньшей мере одну стадию очистки с использованием хроматографии с симулированным движением неподвижной фазы, при этом способ обеспечивает очищенный раствор, в котором нейтральный олигосахарид грудного молока имеет чистоту ≥80%. Предложен новый эффективный способ очистки нейтрального олигосахарида грудного молока. 12 з.п. ф-лы, 7 пр., 12 ил., 2 табл.
Формула

Документы, цитированные в отчёте о поиске
Детское питание, стимулирующее иммунитет

Комментарии