Очистка антител с помощью хроматографии с псевдодвижущимся слоем - RU2608499C2
Код документа: RU2608499C2
Чертежи








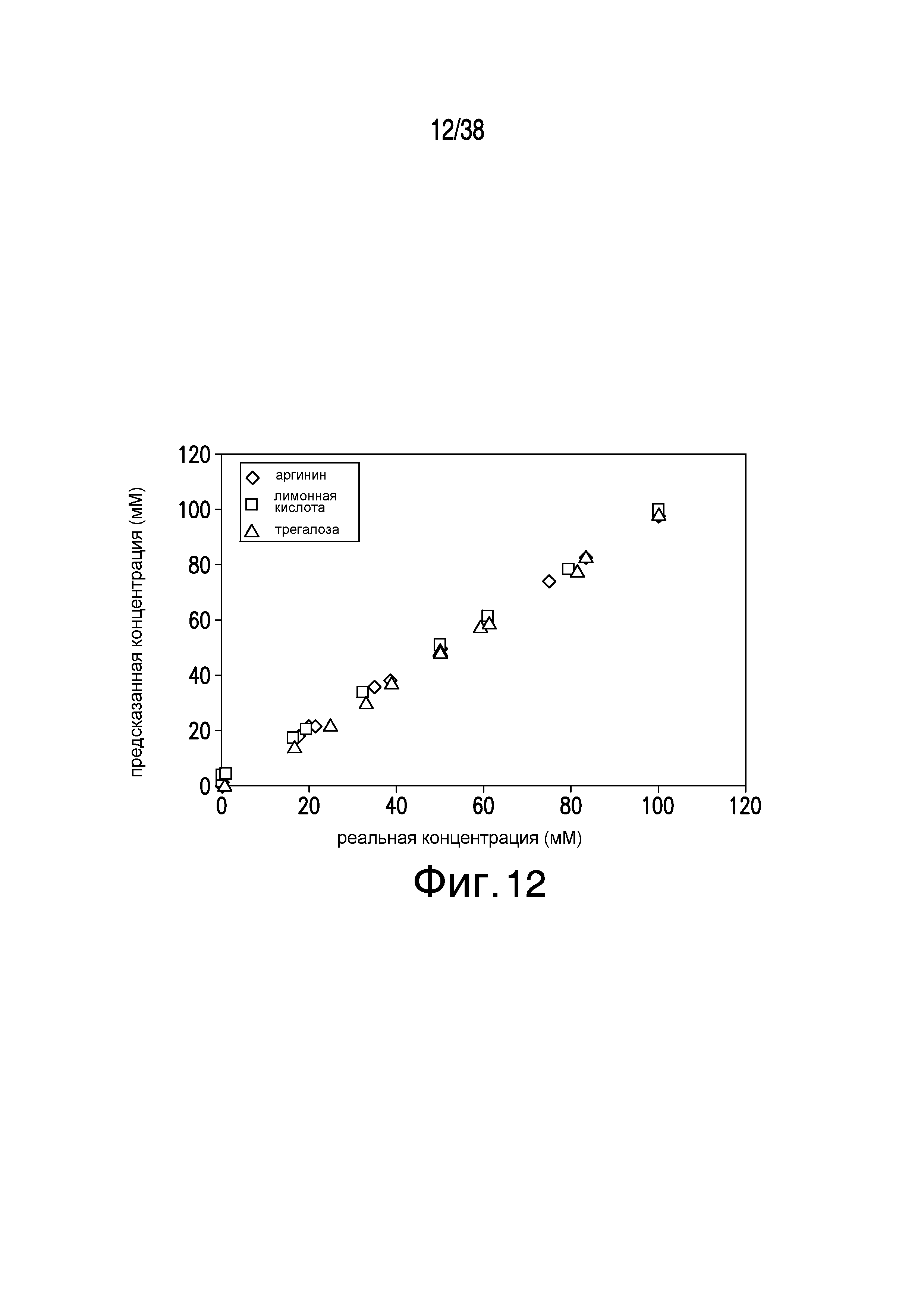























Описание
Данная заявка претендует на преимущества даты подачи заявки U.S.S.N. 61/384,620, поданной 20 сентября 2011 г., содержание которой включено в настоящее описание путем ссылки во всей своей полноте.
1. ВВЕДЕНИЕ
Данное изобретение относится к композициям и способам хроматографической очистки антител, таких как моноклональные антитела («mAb»), использующим стратегии разделения в псевдодвижущемся слое («SMB») и, в определенных вариантах осуществления, спектроскопию комбинационного рассеяния света (рамановскую спектроскопию).
2. УРОВЕНЬ ТЕХНИКИ В ОБЛАСТИ ИЗОБРЕТЕНИЯ
Стратегии очистки белка обычно используют одну или более стадий хроматографического разделения, чтобы исключить белки клеток-хозяев («HCP») из финального препарата очищенного белка. Такие стадии хроматографического разделения обычно выполняются в «периодическом режиме», при котором единственная колонка, заполненная какой-то хроматографической твердой фазой, последовательно уравновешивается, нагружается, отмывается, элюируется и затем регенерируется. Поскольку периодический режим хроматографии зависит по нагрузке колонки только от динамической емкости колонки, а не от емкости насыщения, каждый цикл нагрузки и разделения использует только 30-50% реальной связывающей емкости колонки. Таким образом, разделение в периодическом режиме требует использования колонки, имеющей в два-три раза больший объем, чем был бы необходим, если бы колонки работали при емкости насыщения. Вследствие использования только 30-50% реальной связывающей емкости колонки, следовательно, хроматография в периодическом режиме вовлекает использование существенно больших количеств твердой фазы хроматографического разделения и превышает время, необходимое для завершения каждого цикла нагрузки и разделения, что существенно увеличивает расходы, связанные с очисткой белка. Кроме того, использование колонок, имеющих объем, в два-три раза превышающий тот, который требовался бы, если бы разделение проводилось при насыщении, приводит к существенному увеличению количества буферов уравновешивания, отмывки и элюции, используемых в единичном цикле разделения, что приводит к дополнительным расходам и неэффективности по времени.
В свете изложенного выше, в данной области техники существует необходимость в улучшении способов более эффективной очистки белков, включая терапевтические антитела. Данное изобретение отвечает этой необходимости путем включения в очистку белков улучшенной стратегии разделения с псевдодвижущимся слоем.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В определенных вариантах осуществления данное изобретение направлено на способы продуцирования желаемого препарата белка с уменьшенным содержанием белка клеток-хозяев (HCP) из образца смеси, содержащей белок, являющийся целью выделения, и, по меньшей мере, один HCP. В определенных вариантах осуществления способы по данному изобретению содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой таким образом, что смола нагружается до приблизительно 50%-100%, включая нагрузку более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP. В некоторых из таких вариантов осуществления применяется Рамановская спектроскопия, чтобы контролировать и/или определять композицию одной или более из многокомпонентных смесей, участвующих в производстве таких препаратов, являющихся целью выделения, с уменьшенными HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которая содержит приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой так, что смола загружена между приблизительно 50-100%, включая более чем на приблизительно 50%, более чем на приблизительно 60%, более чем на приблизительно 70%, более чем на приблизительно 80% и более чем на приблизительно 90% насыщения ее связывающей емкости, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP, и хроматографическую смолу, выбранную из группы, содержащей смолу для аффинной хроматографии, смолу для ионообменной хроматографии и смолу для хроматографии с гидрофобным взаимодействием. В некоторых из таких вариантов осуществления Рамановская спектроскопия использовалась, чтобы контролировать и/или определять композицию одной или более многокомпонентной смеси, вовлеченной в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которые содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP, а препарат, являющийся целью выделения, выбран из группы, состоящей из: ферментов; пептидных гормонов; поликлональных антител; моноклональных антител человека; гуманизированных моноклональных антител; одноцепочечных антител; антител к антигенсвязывающему домену (антител к Fab-фрагментам); антител к F(ab’)2-фрагментам; антител к Fd-фрагментам; антител к Fv-фрагменту; выделенным CDR; диател; DVD и иммуноадгезивных веществ. В некоторых из таких вариантов осуществления Рамановская спектроскопия использовалась, чтобы контролировать и/или определять композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которая содержит приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, такой как смола, нагруженная до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP и хроматографическую смолу, загруженные в серию жидкостно соединенных колонок, разделенных жидкостными трубопроводами, причем число жидкостно соединенных колонок выбрано из группы, состоящей из: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 и 12 индивидуальных колонок. В некоторых из таких вариантов осуществления Рамановская спектроскопия используется, чтобы контролировать и/или определять композицию одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которые содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP и хроматографическую смолу, которые упакованы в серию из по меньшей мере 2-х жидкостно соединенных колонок, разделенных жидкостными трубопроводами, причем колонки разделены жидкостными трубопроводами, которые позволяют введение буферов, таких как буферы уравновешивания, отмывки и элюции, а также удаление элюатов. В некоторых из таких вариантов осуществления используется Рамановская спектроскопия, чтобы контролировать и/или определять композицию одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющихся целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, и содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, таким образом, что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат, являющийся целью выделения, с уменьшенным HCP, и образец смеси приводят в контакт с хроматографической смолой, чтобы получить время удерживания, выбранное в диапазоне от приблизительно 0,5 до приблизительно 12 минут, в одном из вариантов осуществления оно может быть выбрано из группы, состоящей из: до приблизительно 0,5, до приблизительно 1, до приблизительно 2, до приблизительно 3, до приблизительно 4, до приблизительно 5, до приблизительно 6, до приблизительно 7, до приблизительно 8, до приблизительно 9, до приблизительно 10, до приблизительно 11 и до приблизительно 12 минут. В некоторых из таких вариантов осуществления Рамановская спектроскопия используется для контроля и/или определения композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP и содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат, являющийся целью выделения, с уменьшенным HCP, а способ также содержит стадии уравновешивания хроматографической смолы перед приведением в контакт с образцом смеси и отмывки хроматографической смолы после приведения в контакт с образцом смеси, где буферы уравновешивания и отмывки являются идентичными буферами. В некоторых из таких вариантов осуществления, Рамановская спектроскопия используется для контроля и/или определения композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которая содержит приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат, являющийся целью выделения, с уменьшенным HCP, а способ также содержит отмывку хроматографической смолы и стадию регенерации, в котором эти стадии могут быть рассчитаны и запрограммированы, чтобы поддерживать стадию приведения образца в контакт с хроматографической смолой от приблизительно 20% до приблизительно 80% времени обработки, в одном конкретном варианте осуществления оно составляет приблизительно 50%. В некоторых из таких вариантов осуществления Рамановская спектроскопия используется для контроля и/или определения композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
4. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
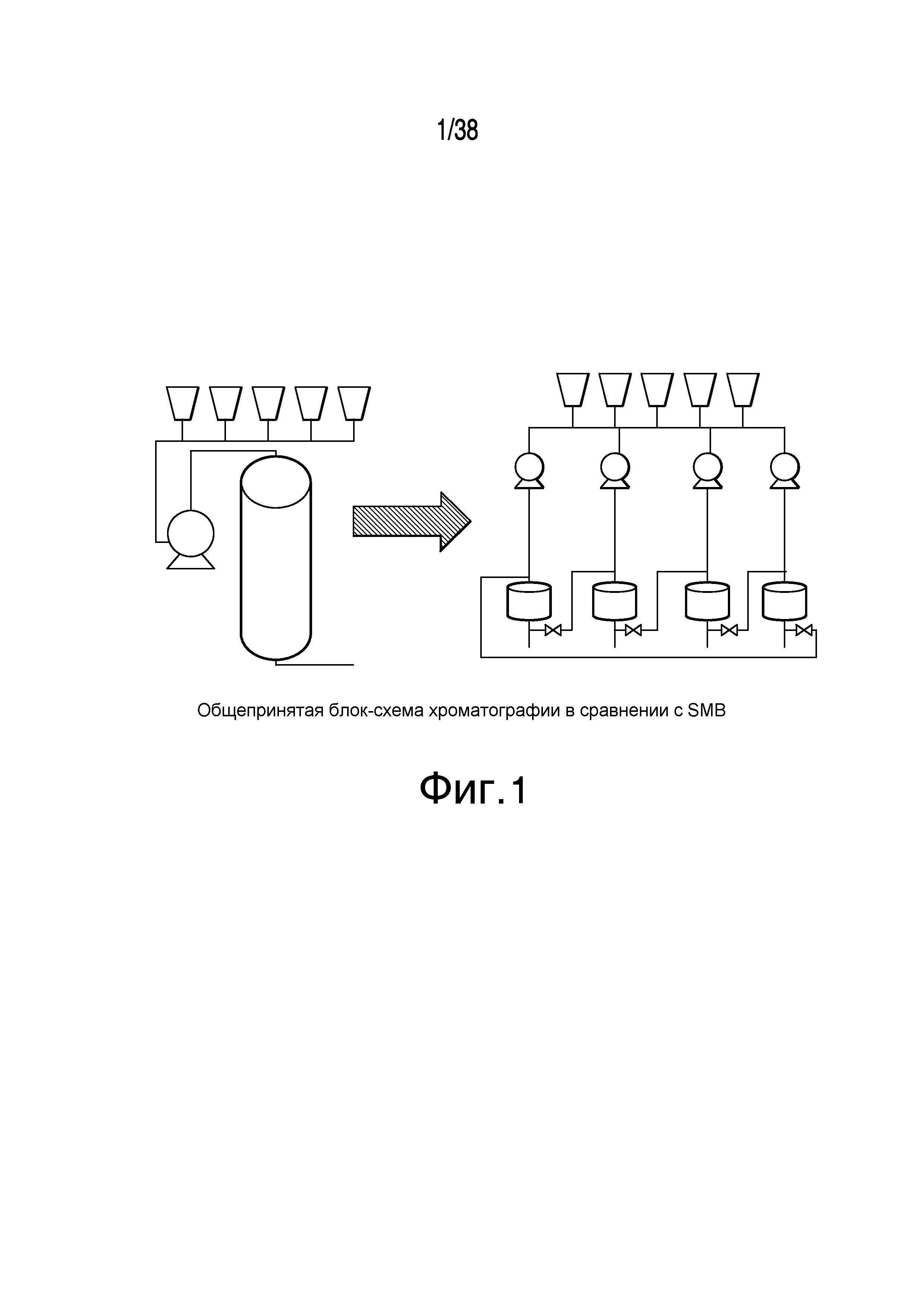
Фиг.1 описывает сравнение блок-схемы общепринятой хроматографии с блок-схемой хроматографии с псевдодвижущимся слоем.
Фиг.2 описывает блок-схему общепринятой хроматографии.
Фиг.3 описывает блок-схему хроматографии с псевдодвижущимся слоем.
Фиг.4 описывает хроматограмму, отражающую результат исследования хроматографии с псевдодвижущимся слоем на примере mAb.
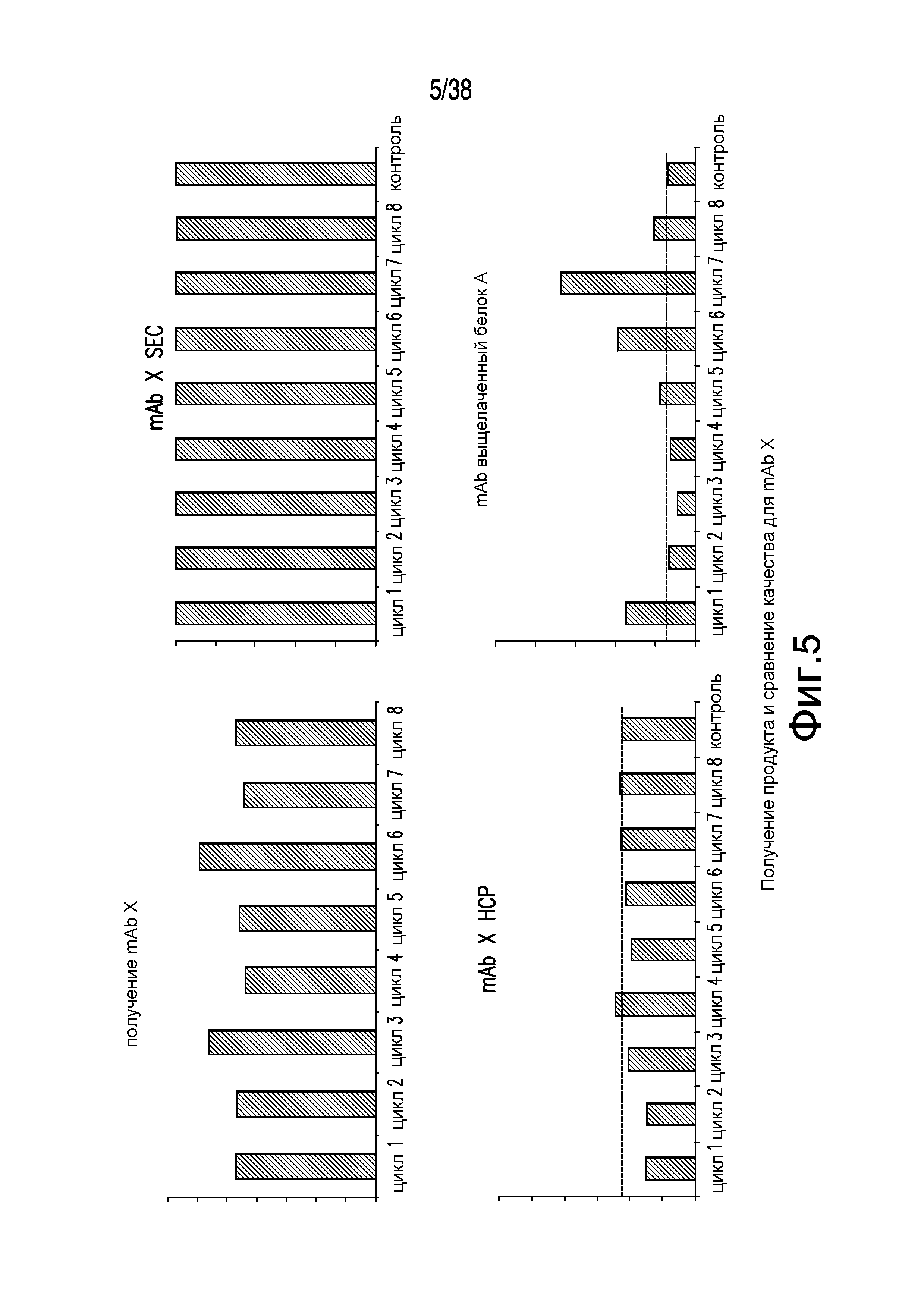
Фиг.5 описывает выделение продукта и анализ качества продукта на примере хроматографии с псевдодвижущимся слоем mAb X.
Фиг.6 описывает хроматограмму, отражающую результат хроматографии с псевдодвижущимся слоем на примере mAb Y.
Фиг.7 описывает выделение продукта и анализ качества продукта на примере хроматографии с псевдодвижущимся слоем mAb Y.
Фиг.8 описывает анализ % выхода mAb X на примере хроматографии с псевдодвижущимся слоем mAb X.
Фиг.9 описывает анализ % выхода mAb Y на примере хроматографии с псевдодвижущимся слоем mAb Y.
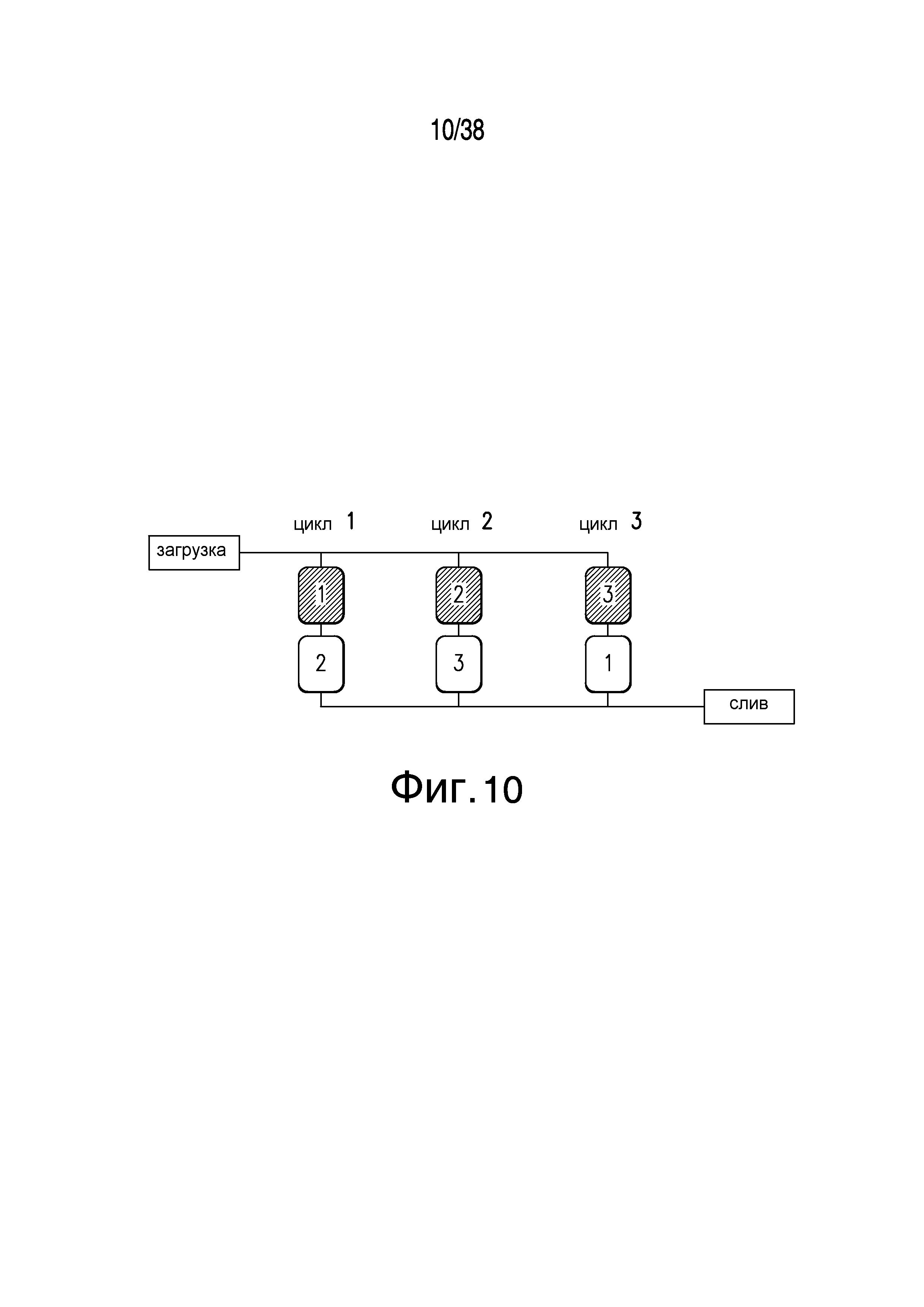
Фиг.10 описывает блок-схему полупромышленной хроматографии с псевдодвижущимся слоем.
Фиг.11 описывает рамановский спектр 3 компонентов (аргинин/лимонная кислота/трегалоза) буферной системы, которая включает аминокислоту, вид pH-буфера и сахар. Данный график сгенерирован с помощью Umetrics SIMCA P+ V 12.0.1.0. По оси X даны измеренные величины. Каждая величина представляет собой волновое число смещения частоты за счет рамановского рассеяния. Они могут быть представлены иначе с волновым числом смещения частоты за счет рамановского рассеяния (см-1) по оси X. Данные начинаются с волнового числа 1800 (=Num 0) до 800 (=Num 1000). Исходные данные рамановских спектров представлены в единицах интенсивности (связанной с числом рассеянных фотонов). Данный чертеж показывает спектры трех отдельных компонентов (в воде), отложенные от средних значений. Среднее значение спектров составляет 0. Прочие значения, относящиеся к ним, вероятно, находятся в пределах стандартного отклонения от среднего.
Фиг.12 описывает сравнение реальной и предсказанной концентраций для 3 компонентов буферной системы (аргинин/лимонная кислота/трегалоза) со случайными значениями. Этот чертеж выполнен с использованием существующей модели предсказания концентраций новых растворов. По осям x и y даны концентрации (мМ).
Фиг.13 описывает сравнение реальной и предсказанной концентраций для 3 компонентов буферной системы (аргинин/лимонная кислота/трегалоза) по отдельным компонентам.
Фиг.14 описывает общие спектры чистых компонентов - 4 компонентов буферной системы (маннитол/метионин/гистидин/Tween™). По оси «y» представлены спектральные интенсивности, по оси «x» - величина волнового числа (см-1).
Фиг.15 описывает общие спектры чистых компонентов - 4 компонентов буферной системы (маннитол/метионин/гистидин/Tween™). По оси «y» - спектральная интенсивность, по оси «x» - величина волнового числа (см-1). Фиг.5 представляет собой более детальный вид спектра, показанного на Фиг.4, характеристическая область увеличена.
Фиг.16 описывает спектры (отложенные от среднего значения/SNV/DYDX чистых компонентов 4-компонентной буферной системы (маннитол/метионин/гистидин/Tween™). Данные, показанные на Фиг.6, основаны на тех же данных, что показаны на Фиг.4-5, после всей предобработки: стандартное отклонение случайной величины с нормальным распределением (SNV) для нормализации интенсивности, первая производная для нормализации базовой линии и расположение средних в центре для нанесения графика.
Фиг.17 описывает сравнение реальной и предсказанной концентраций для 4-компонентной буферной системы (маннитол/метионин/гистидин/Tween™) со случайными значениями. Это было выполнено с помощью существующей модели для предсказания концентраций новых растворов.
Фиг.18 описывает сравнение реальной и предсказанной концентраций для 3-компонентной буферной системы (маннитол/метионин/гистидин/Tween™) по отдельным компонентам.
Фиг.19 описывает общие спектры чистых компонентов для 3-компонентной буферной системы с белком (маннитол/метионин/гистидин/адалимумаб). Общие спектры показывают рамановскую интенсивность.
Фиг.20 описывает общие спектры чистых компонентов для 3-компонентной буферной системы с белком (маннитол/метионин/гистидин/адалимумаб), с характеристической областью (800-1700 см-1), показанной детально.
Фиг.21 описывает спектры (отложенные от среднего значения/SNV/DYDX чистого компонента для 3-компонентной буферной системы с белком). Данные, показанные на Фиг.11, основаны на тех же данных, что показаны на Фиг.9-10, после всей предобработки: стандартное отклонение случайной величины с нормальным распределением (SNV) для нормализации интенсивности, 1-я производная для нормализации базовой линии и расположение средних в центре для нанесения графика.
Фиг.22 описывает сравнение реальных и предсказанных концентраций для 3-компонентной буферной системы с белком по отдельным компонентам.
Фиг.23 описывает процесс очистки адалимумаба, который использует Рамановскую спектроскопию как часть процесса и/или контроля качества.
Фиг.24 описывает предсказание он-лайн рамановских концентраций процесса диафильтрации, вовлекающий трехкомпонентную смесь буфера, сахара и аминокислоты (метионин/маннитол/гистидин).
Фиг.25 описывает процесс многократной диафильтрации, вовлекающий трехкомпонентную смесь буфера, сахара и аминокислоты (метионин/маннитол/гистидин). Дополнительные точки данных включены для увеличения разрешения.
Фиг.26 описывает рамановскую калибровку раствора сахар (маннитол)/белок (адалимумаб).
Фиг.27 описывает рамановское он-лайн предсказание концентрирования в процессе обмена буфера диафильтрации, в котором антитело в воде замещается раствором маннитола для получения раствора сахар/белок (маннитол/адалимумаб). За обменом буфера следует концентрирование белка.
Фиг.28. описывает повтор эксперимента, описанного на Фиг.27, где фаза концентрирования белка доведена до 180 г/л.
Фиг.29 описывает рамановскую калибровку растворов гистидина и адалимумаба.
Фиг.30 описывает рамановские предсказания концентрирования в процессе обмена буфера диафильтрации, в котором белок в воде замещается раствором гистидина. За обменом гистидина следует концентрирование адалимумаба.
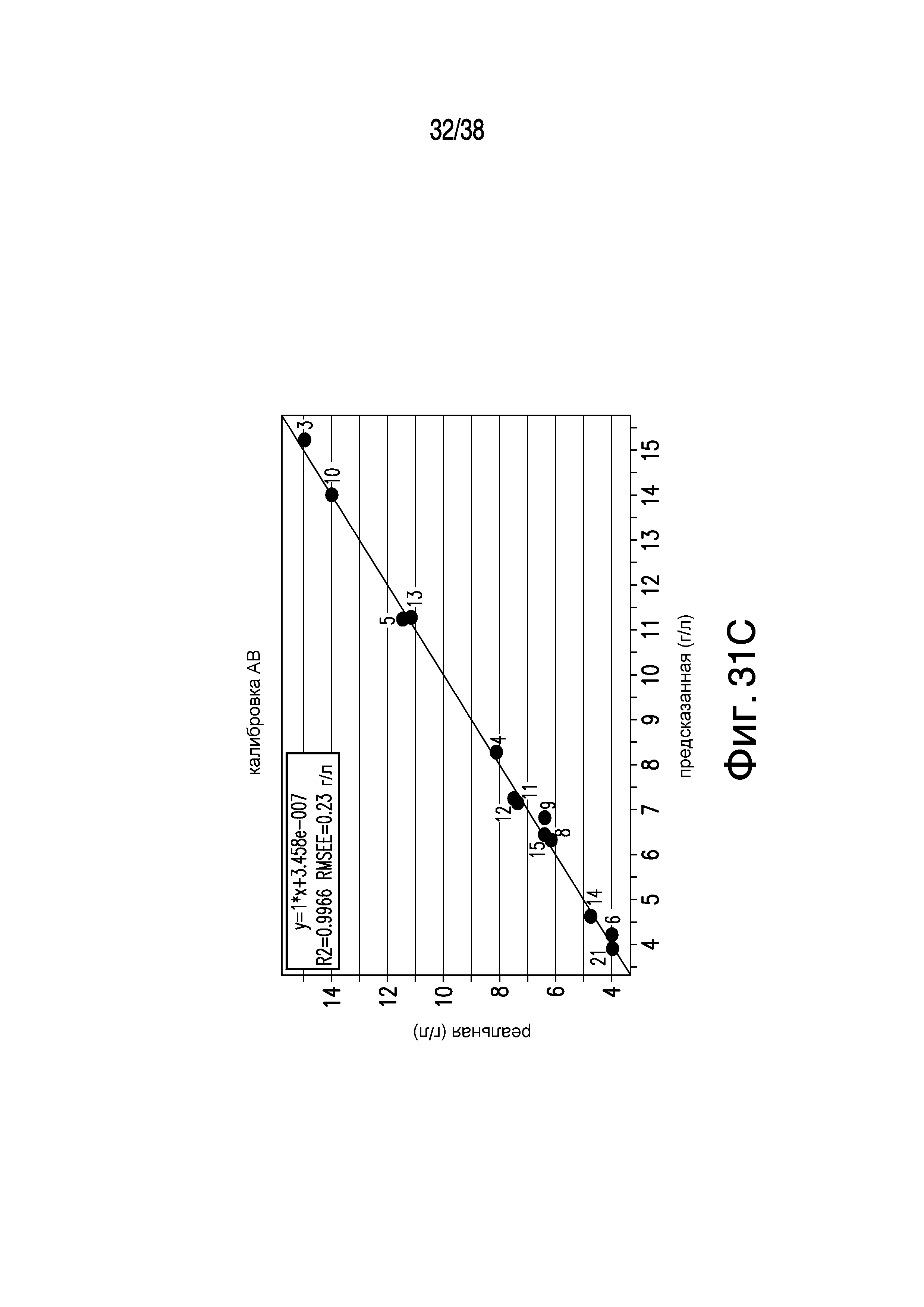
Фиг.31A-C описывает сравнение реальной и предсказанной концентраций 2-компонентной буферной системы с белком по отдельным компонентам: A. Концентрация Трис; B. Концентрация ацетата; и C. Концентрация адалимумаба.
Фиг.32A-B описывает сравнение реальной и предсказанной концентраций для 1-компонентной буферной системы с белком по отдельным компонентам: A. Концентрация Tween™; и B. Концентрация адалимумаба.
Фиг.33 описывает условия, использованные, когда два антитела (D2E7 и ABT-874) были отдельно агрегированы с помощью фотоиндуцированной сшивки немодифицированных белков (PICUP). Антитела подвергались воздействию вызывающего агрегацию источника света от 0-4 часов.
Фиг.34 описывает результаты гель-хроматографии сшивки, показанной на Фиг.33.
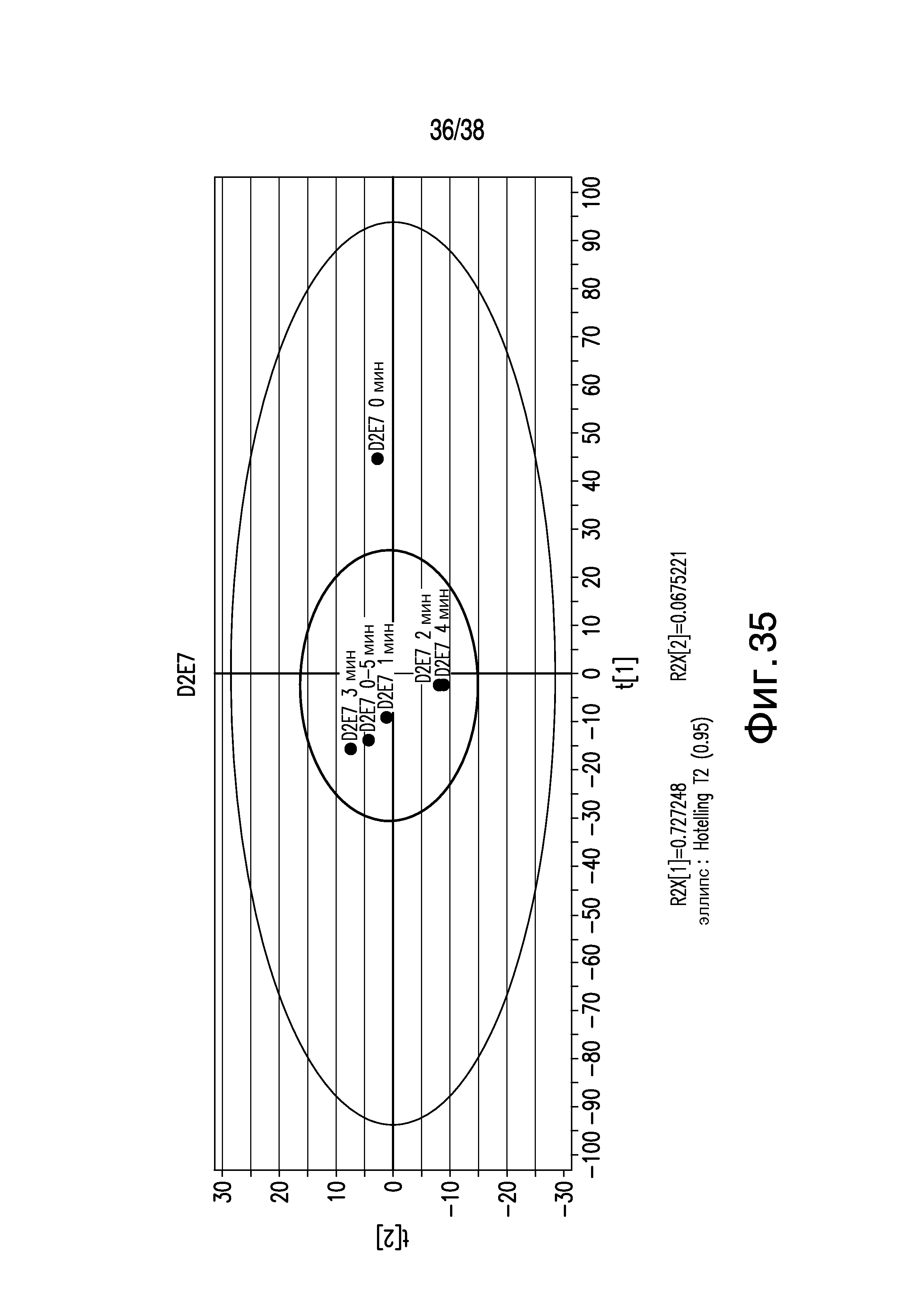
Фиг.35 описывает Рамановскую спектроскопию и спектры, смоделированные с помощью анализа основных компонентов образцов D2E7, показывающие, что агрегированные образцы имеют отличные значения для основных компонентов и могут быть различены от агрегатов с помощью Рамановской спектроскопии.
Фиг.36 описывает Рамановскую спектроскопию и спектры, смоделированные с помощью анализа основных компонентов образцов ABT-874, показывающие, что агрегированные образцы имеют отличные значения для основных компонентов и могут быть различены от агрегатов с помощью Рамановской спектроскопии.
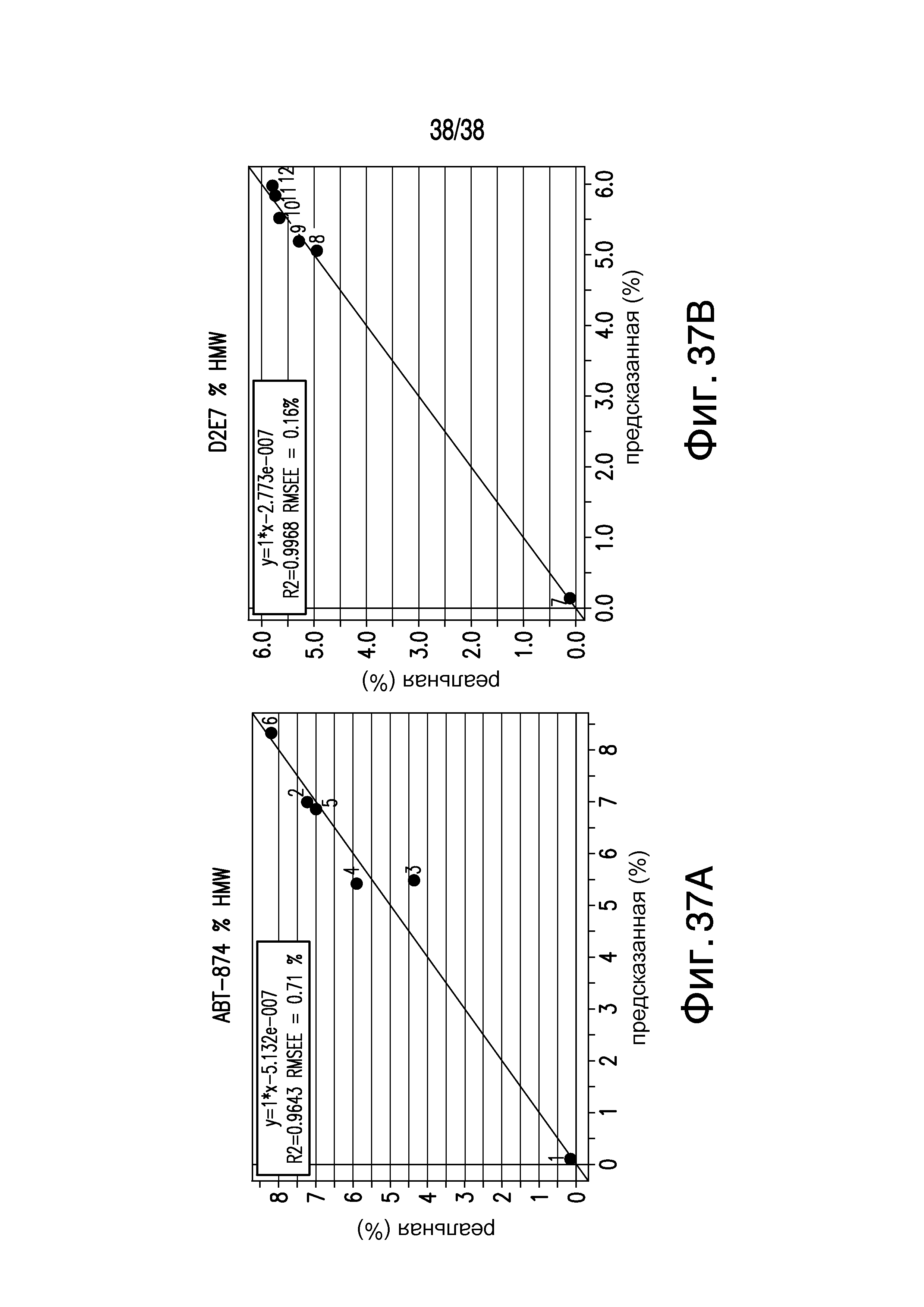
Фиг.37A-B описывает Рамановскую спектроскопию и спектры, смоделированные с помощью анализа частных наименьших квадратов (A) образцов D2E7 и (B) образцов ABT-974, показывающие некоторую корреляцию между результатами Рамановской спектроскопии и изменениями SEC.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к композициям и способам хроматографической очистки антител, таких как моноклональные антитела, использующим улучшенные стратегии разделения с псевдодвижущимся слоем. Для ясности и не путем ограничений, данное подробное описание разделено на нижеследующие подразделы:
5.1. Определения;
5.2. Генерация антитела;
5.3. Продукция антитела;
5.4. Очистка антитела;
5.5. Типовые стратегии очистки; и
5.6. Рамановская спектроскопия.
Термин «антитело» включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, связанных дисульфидными связями. Каждая из тяжелых цепей содержит вариабельную область тяжелой цепи (сокращаемую в настоящем описании как HCVR или VH) и константную область тяжелой цепи (CH). Константный участок тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая из легких цепей содержит вариабельную область легкой цепи (сокращаемую в настоящем описании как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть далее подразделены на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), которые перемежаются более консервативными, называемые каркасными областями (FR). Каждый из VH и VL состоит из трех CDR и четырех FR, выстроенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин «антигенсвязывающий участок» антитела (или «участок антитела») включает фрагменты антитела, которые обладают способностью специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может быть выполнена фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающий участок» антитела, включают (i) фрагмент Fab, моновалентный фрагмент, содержащий домены VL, VH, CL и CH1; (ii) фрагмент F(ab’)2, бивалентный фрагмент, содержащий два фрагмента Fab, связанные дисульфидным мостиком в шарнире; (iii) фрагмент Fd, содержащий домены VH и CH1; (iv) фрагмент Fv, содержащий домены VL и VH единственного участка антитела, (v) фрагмент dAb (Ward et al. (1989) Nature 341:544-546, полное изучение которого включено в настоящее описание путем ссылки), который содержит домен VH; и (vi) выделенный участок, определяющий комплементарность (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH кодируются разными генами, они могут быть соединены рекомбинантными способами синтетическим линкером, который делает для них возможным образовать единую белковую цепь, в которой участки VL и VH соединяются с образованием моновалентных молекул (известных как единая цепь Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883, все идеи которого включены в настоящее описание путем ссылки). Предполагается, что такие одноцепочечные антитела также охватываются термином «антигенсвязывающий участок» антитела. Также охватываются другие формы одноцепочечных антител, такие как диатела. Диатела являются бивалентными биспецифическими антителами, в которых домены VH и VL экспрессируются в единственной полипептидной цепи, но с линкером, который слишком короток, чтобы допустить объединение между двумя доменами одной и той же цепи, вынуждая, таким образом, домены взаимодействовать с комплементарными доменами другой цепи и создавая два сайта связывания антигенов (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R. J., et al. (1994) Structure 2:1121-U23, все идеи которого включены в настоящее описание путем ссылки). Также антитело или его антигенсвязывающий участок может быть частью большей иммуноадгезивной молекулы, образованной ковалентной или нековалентной связью антитела или участка антитела с одним или более другими белками или пептидами. Примеры таких иммуноадгезивных молекул включают использование корового участка стрептавидина с образованием тетрамерной молекулы scFv (Kipriyanov, S. M., et al. (1995) Human Антитела and Hybridomas 6:93-101, идеи которого полностью включены в настоящее описание путем ссылки) и использование остатка цистеина, маркерного пептида и C-концевой полигистидиновой метки для получения бивалентных и биотинилированных молекул scFv (Kipriyanov, S. M., et al. (1994) Mol. Immunol. 31:1047-1058, все идеи которого включены в настоящее описание путем ссылки). Участки антитела, такие как фрагменты Fab и F(ab’)2, могут быть получены из целых антител с помощью общепринятых технологий, таких как расщепление целых антител папаином или пепсином, соответственно. Далее, антитела, участки антитела и иммуноадгезивные молекулы могут быть получены с помощью стандартных технологий рекомбинации ДНК, как описано в настоящем описании. В одном аспекте антигенсвязывающие участки представляют собой полные домены или пары полных доменов.
Термины «номенклатура Кэбота», «определения Кэбота» и «обозначения Кэбота» в настоящем описании используются взаимозаменяемо. Эти термины, которые признаны в данной области техники, относятся к системе обозначения аминокислотных остатков, которые более вариабельны (т.е. гипервариабельны), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепей антитела или его антигенсвязывающего участка (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 and, Kabat, E. A„ et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NTH Publication No. 91-3242, все идеи которого включены в настоящее описание путем ссылки). В случае вариабельной области тяжелой цепи, гипервариабельная область находится в диапазоне положений аминокислот с 31 по 35 для CDR1, положений аминокислот 50-65 для CDR2 и положений аминокислот 95-102 для CDR3. В случае вариабельной области легкой цепи гипервариабельная область находится в диапазоне положений аминокислот с 24 по 34 для CDR1, положений аминокислот с 50 по 56 для CDR2 и положений аминокислот с 89 по 97 для CDR3.
Термин «антитело человека» включает антитела, имеющие вариабельную и константную области, соответствующие эмбриональным последовательностям иммуноглобулинов человека, как описано Kabat et al. (см. Kabat, et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Антитела человека по данному изобретению могут включать аминокислотные остатки, не кодируемые эмбриональными последовательностями иммуноглобулинов человека (например, мутации, внесенные случайным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo), например, в CDR, и в частности, в CDR3. Мутации могут быть внесены с помощью подхода, называемого селективным мутагенезом. Антитело человека может иметь, по меньшей мере, в одном положении замещение аминокислотным остатком, например усиливающим активность аминокислотным остатком, который не кодируется эмбриональными последовательностями иммуноглобулинов человека. Антитело человека может иметь до двадцати положений, замещенных аминокислотными остатками, которые не являются частью эмбриональных последовательностей иммуноглобулинов человека. В других вариантах осуществления замещены до десяти, до пяти, до трех или до двух положений. В одном из вариантов осуществления эти замещения расположены в областях CDR. Однако термин «антитело человека», так, как это используется в настоящем описании, не направлен на то, чтобы включать антитела, в которых последовательности CDR, происходящие из эмбриональных линий других видов млекопитающих, таких как мышь, встроены в каркас последовательности человека.
Выражение «рекомбинантное антитело человека» включает антитела человека, которые получены, экспрессированы, созданы или выделены средствами рекомбинации, такие как антитела, экспрессированные с помощью рекомбинантной экспрессии вектора, трансфицированного в клетку-хозяина, антитела, выделенные из библиотеки рекомбинантных комбинаторных антител человека, антитела, выделенные из животных (например, мышей), которые являются трансгенными в отношении генов иммуноглобулина человека (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295, все идеи которого включены в настоящее описание путем ссылки), или антитела, полученные, экспрессированные, созданные или выделенные каким-либо из иных средств, которые вовлекают сплайсинг последовательностей гена иммуноглобулина человека в другие последовательности ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области, происходящие из эмбриональных последовательностей иммуноглобулина человека (см., Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). В определенных вариантах осуществления, однако, такие рекомбинантные антитела человека подвергаются мутагенезу vitro (или, когда используются последовательности животных, трансгенные для последовательностей Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител являются последовательностями, которые, хотя и происходят из и связаны с эмбриональными зародышевыми линиями человека VH и VL последовательностей, не могут существовать в естественных условиях в антителах из набора эмбриональных линий in vivo. В определенных вариантах осуществления, однако, такие рекомбинантные антитела являются результатом подхода с помощью селективного мутагенеза или обратных мутаций или их обоих.
«Выделенное антитело» включает антитело, которое в основном свободно от других антител, имеющих иные антигенные специфичности (например, выделенное антитело, которое специфически связывается с конкретной мишенью, в основном свободно от антител, которые специфически связываются с антигенами, иными, чем специфическая мишень). Выделенное антитело, которое специфически связывается с конкретной мишенью в организме человека, может связываться с такой же мишенью в других видах. Далее, выделенное антитело может быть в основном свободно от других клеточных материалов и/или химических веществ.
Термин «Koff», так, как он используется в настоящем описании, предназначен обозначить скорость диссоциации комплекса антитело/антиген.
Термин «Kd», так, как он используется в настоящем описании, предназначен обозначить константу диссоциации конкретного взаимодействия антитело-антиген.
Выражение «молекула нуклеиновой кислоты» включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но в одном из объектов данного изобретения представляет собой двухцепочечную ДНК.
Выражение «выделенная молекула нуклеиновой кислоты», используется в настоящем описании в отношении нуклеиновых кислот, кодирующих антитела или участки антител (например, VH, VL, CDR3), например такие, которые связываются с конкретной мишенью и включают молекулу нуклеиновой кислоты, в которой последовательности нуклеотидов, кодирующие антитело или участок антитела, свободны от других последовательностей нуклеотидов, кодирующих антитела или участки антител, которые связываются с антигенами, иными, чем данная мишень, которые могут фланкировать нуклеиновую кислоту в геномной ДНК. Выражение «выделенная молекула нуклеиновой кислоты» также направлено на то, чтобы включать последовательности, кодирующие бивалентные, биспецифические антитела, такие как диатела, в которых участки VH и VL не содержат других последовательностей, отличающихся от последовательности диатела.
Выражение «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») включает клетки, в которые введен рекомбинантный вектор экспрессии. Следует понимать, что такие термины направлены на обозначение не только конкретных клеток-объектов, но и потомство таких клеток. Поскольку могут встречаться определенные модификации в следующих одно за другим поколениях вследствие либо мутации, либо воздействия окружающей среды, такое потомство может быть фактически не идентичным родительским клеткам, но все же включается в сферу термина «клетка-хозяин», так, как он используется в настоящем описании.
Термин «приблизительно», так, как он используется в настоящем описании, направлен на обозначение диапазонов приблизительно в 10-20% более чем или менее чем рассматриваемое. При определенных обстоятельствах специалистам в данной области техники понятно, что вследствие природы рассматриваемой величины термин «приблизительно» может означать большее или меньшее отклонение, чем 10-20% значения.
Термин «хроматография», так, как он используется в настоящем описании, обозначает аналитические технологии, используемые для разделения молекул-мишеней, представляющих интерес, из смеси молекул, и основывается на селективном сродстве компонентов смеси к твердой фазе. Примеры включают аффинную хроматографию, ионообменную хроматографию, гель-хроматографию и хроматографию гидрофобного взаимодействия.
Термин «очищенный», когда он относится к молекуле-мишени, представляющей интерес в смеси, показывает, что ее относительная концентрация (вес мишени, деленный на вес всех компонентов или фракций в смеси) увеличена, по меньшей мере, на 20%. В одной из серий вариантов осуществления относительная концентрация увеличена на, по меньшей мере, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 75%, приблизительно 100%, приблизительно 150% или приблизительно 200%. Молекула-мишень, представляющая интерес, может также быть названа очищенной, когда относительная концентрация компонентов, из которых она очищена (вес компонента или фракции, из которой проводится очистка, деленная на вес всех компонентов или фракций в смеси), уменьшена на, по меньшей мере, приблизительно 20%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 75%, приблизительно 85%, приблизительно 95%, приблизительно 98% или приблизительно 100%. В другой группе вариантов осуществления молекула-мишень, представляющая интерес, очищена до относительной концентрации в, по меньшей мере, приблизительно 50%, приблизительно 65%, приблизительно 75%, приблизительно 85%, приблизительно 90%, приблизительно 97%, приблизительно 98% или приблизительно 99%. Когда молекула-мишень, представляющая интерес в одном из вариантов осуществления, «разделена» от других компонентов или фракций, следует понимать, что в других вариантах осуществления компонент или фракция «очищен» до уровня, представленного в настоящем описании.
5.2. Генерация антитела
Термин «антитело», так, как он используется в данном разделе, обозначает интактное антитело или его антигенсвязывающий фрагмент.
Антитела по данному описанию могут быть сгенерированы с помощью различных технологий, включая иммунизацию животных антигеном, представляющим интерес, за которой следуют общепринятые методологии моноклональных антител, например стандартная техника соматической гибридизации по Kohler and Milstein (1975) Nature 256: 495. Хотя процедуры гибридизации соматических клеток являются типичными, в принципе, могут быть использованы другие технологии продуцирования моноклональных антител, например вирусная или онкогенная трансформация B-лимфоцитов.
Одной из типичных систем на животных для получения гибридом является система на мышах. Продукция гибридом является очень прочно установившейся процедурой. Протоколы и технологии иммунизации для выделения иммунизированных спленоцитов для слияния клеток известны в данной области техники. Партнеры для слияния (например, клетки миеломы мыши) и процедуры слияния также известны.
Обычно антитело может быть антителом человека, химерным или гуманизированным антителом. Химерные или гуманизированные антитела по данному описанию могут быть получены на основе последовательности моноклонального антитела, не являющегося антителом человека, полученным, как описано выше. ДНК, кодирующая тяжелую и легкую цепь иммуноглобулинов, может быть получена из гибридомы, представляющей интерес и не являющейся гибридомой человека и сконструированной так, чтобы содержать последовательности иммуноглобулина, не относящихся к последовательностям мыши (например, человека), с использованием стандартных молекулярно-биологических технологий. Например, чтобы создать химерное антитело, вариабельные участки мыши могут быть соединены с константными участками человека с помощью способов, известных в данной области техники (см., например, патент США № 4816567, выданный Cabilly et al). Чтобы создать гуманизированное антитело, участки CDR мыши могут быть встроены в каркас человека с помощью способов, используемых в данной области техники (см., например, патент США № 5,225,539, выданный Winter, и патенты США №№ 5530101; 5585089; 5693762 и 6180370, выданные Queen et al.).
В одном из неограничивающих вариантов осуществления антитела по данному описанию являются моноклональными антителами человека. Такие моноклональные антитела человека могут быть сгенерированы с помощью трансгенных или трансхромосомных мышей, несущих части иммунной системы человека вместо системы мыши. Эти трансгенные и трансхромосомные мыши включают мышей, обозначенных в настоящем описании как HuMAb Mouse® (фирма Medarex, Inc.), KM Mouse® (фирма Medarex, Inc.) и XenoMouse® (фирма Amgen).
Далее, альтернативные трансхромосомные системы на животных, экспрессирующие гены иммуноглобулинов человека, доступны в данной области техники и могут быть использованы для индуцирования антител по данному описанию. Например, может быть использована мышь, несущая и тяжелую цепь трансхромосомы человека, и легкую цепь трансхромосомы человека, обозначаемая как «мышь TC»; такая мышь описана в Tomizuka et al, (2000) Proc. Natl. Acad. Sci. USA 97:722-727. Кроме того, в данной области техники описаны коровы, несущие тяжелую и легкую цепи трансхромосом человека (например, Kuroiwa et al. (2002) Nature Biotechnology 20:889-894 и заявка PCT № WO 2002/092812), и могут быть использованы для получения антител по данному описанию.
Рекомбинантные антитела человека по данному изобретению могут быть выделены путем скрининга библиотеки рекомбинантных комбинаторных антител, например библиотеки фагового дисплея scFv, изготовленной с использованием кДНК VL и VH человека, полученных из мРНК, происходящей из лимфоцитов человека. Методологии получения и скрининга таких библиотек известны в данной области техники, помимо коммерчески доступных наборов для генерации библиотек фагового дисплея (например, Pharmacia Recombinant Phage Antibody System, каталожный № 27-9400-01; и набор для фагового дисплея фирмы Stratagene SurfZAPTM, каталожный № 240612, все идеи которых включены в настоящее описание), примеры способов и реагентов, особенно пригодных для использования в генерации и скрининге библиотек дисплеев антител, можно найти в, например, Ladner et al. патент США № 5,223,409; Kang et al. PCT публикация № WO 92/18619; Dower et al. PCT публикация № WO 91/17271; Winter et al. PCT публикация № WO 92/20791; Markland et al. PCT публикация № WO 92/15679; Breitling et al. PCT публикация № WO 93/01288; McCafferty et al. PCT публикация № WO 92/01047; Garrard et al. PCT публикация № WO 92/09690; Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrard et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al. (1991) PNAS 88:7978-7982; все идеи которых включены в настоящее описание.
Моноклональные антитела человека по данному описанию могут быть также получены с помощью мыши SCID, у которой восстановлены иммунные клетки человека, так что при иммунизации может быть сгенерирован ответ антителами человека. Такая мышь описана, например, в патентах США №№ 5476996 и 5698767, выданных Wilson et al.
В еще одном варианте осуществления данного изобретения антитела или их фрагменты могут быть изменены, причем константный участок антитела модифицирован так, чтобы редуцировать, по меньшей мере, одну опосредованную константным участком биологическую эффекторную функцию, характерную для немодифицированного антитела. Чтобы модифицировать антитело по данному изобретению так, что оно будет демонстрировать уменьшение связывания с рецептором Fc, сегмент константного участка иммуноглобулина антитела может быть мутирован в конкретных участках, важных для взаимодействий рецептора Fc (FcR) (см., например, Canfield and Morrison (1991) J. Exp. Med. 173:1483-1491; и Lund et al. (1991) J. of Immunol. 147:2657-2662, все идеи которых включены в настоящее описание). Редукция связывающей способности FcR антитела может также редуцировать другие эффекторные функции, которые относятся к взаимодействиям FcR, такие как опсонизация и фагоцитоз, а также антигензависимая клеточная цитотоксичность.
5.3. Продукция антитела
Чтобы экспрессировать антитело по данному изобретению, ДНК, кодирующие части или полноразмерные легкие и тяжелые цепи, встраивали в один или более векторов экспрессии, так что гены функционально связывались с последовательностями контроля транскрипции и трансляции последовательности (См., например, патент США № 6,914,128, все идеи которого включены в настоящее описание путем ссылки). В данном контексте термин «функционально связанный» направлен на обозначение того, что ген антитела связан в векторе так, что последовательности контроля транскрипции и трансляции в векторе служат своей функции регуляции транскрипции и трансляции гена антитела. Вектор экспрессии и последовательности контроля экспрессии выбирают так, чтобы они были совместимы с используемыми для экспрессии клетками-хозяевами. Ген легкой цепи антитела и ген тяжелой цепи антитела могут быть встроены в отдельный вектор каждый, или, более обычно, оба гена встраивают в один и тот же вектор экспрессии. Гены антитела встроены в вектор экспрессии стандартными способами (например, сшивка комплементарных сайтов рестрикции во фрагменте гена антитела и в векторе или сшивка «тупых концов», если сайты рестрикции отсутствуют). Перед встраиванием последовательностей антитела или связанных с антителом легкой или тяжелой цепей вектор экспрессии может уже нести последовательности константного участка антитела. Например, один из подходов к преобразованию конкретных последовательностей VH и VL в полноразмерные гены антитела состоит во встраивании их в векторы экспрессии, уже кодирующие константную область тяжелой цепи и константную область легкой цепи, соответственно, так что сегмент VH функционально связан в векторе с сегментом (сегментами) CH, а сегмент VL функционально связан в векторе с сегментом CL. Дополнительно или в качестве альтернативы, рекомбинантный вектор экспрессии может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела может быть клонирован в вектор, так что сигнальный пептид будет связан с сохранением рамки считывания с аминоконцом гена цепи антитела. Сигнальный пептид может представлять собой иммуноглобулиновый сигнальный пептид или гетерологический сигнальный пептид (т.е. сигнальный пептид из неиммуноглобулинового белка).
В дополнение к генам цепи антитела, рекомбинантный вектор экспрессии по данному изобретению может нести одну или более регуляторных последовательностей, которые контролируют экспрессию генов цепи антитела в клетке-хозяине. Термин «регуляторная последовательность» предназначен, чтобы включать промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию или трансляцию генов цепи антитела. Такие регуляторные последовательности описаны, например, в Goeddel; Gene Экспрессия Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990), все идеи которого включены в настоящее описание путем ссылки. Специалистам в данной области техники ясно, что дизайн вектора экспрессии, включая выбор регуляторной последовательности, может зависеть от таких факторов, как выбор клетки-хозяина, которая подвергается трансформации, желаемого уровня экспрессии белка и т.д. Подходящие регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают вирусные элементы, которые контролируют высокий уровень экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, основной поздний промотор аденовируса (AdMLP)) и полиомы. Для дальнейшего описания вирусных регуляторных элементов и их последовательностей, см., например, патент США № 5168062, выданный Stinski, патент США № 4510245, выданный Bell et al., и патент США № 4968615, выданный Schaffher et al., все идеи которых включены в настоящее описание путем ссылки.
В дополнение к генам цепи антитела и регуляторной последовательности рекомбинантный вектор экспрессии по данному изобретению может нести одну или более дополнительных последовательностей, таких как последовательность, которая регулирует репликацию вектора в клетках-хозяевах (например, начало репликации) и/или селектируемый маркерный ген. Селектируемый маркерный ген облегчает отбор клеток-хозяев, в которые введен вектор (см., например, патенты США №№ 4399216, 4634665 и 5179017, все выданы Axel et al, все идеи которых включены в настоящее описание путем ссылки). Например, обычно селектируемый маркерный ген придает устойчивость клеткам-хозяевам, в которые введен вектор, к лекарственным препаратам, таким как G418, гигромицин или метотрексат. Подходящие маркерные гены включают ген дигидрофолат редуктазы (DHFR) (для использования в клетках-хозяевах dhfr с селекцией/амплификацией по метотрексату) и ген neo (для селекции по G418).
Антитело или часть антитела по данному изобретению может быть получено путем рекомбинантной экспрессии генов легкой и тяжелой цепей иммуноглобулина в клетке-хозяине. Чтобы рекомбинантно экспрессировать антитело, клетку-хозяина трансфицируют одним или более рекомбинантными векторами экспрессии, несущими фрагменты ДНК, кодирующие легкую и тяжелую цепи иммуноглобулина антитела, так, что легкая и тяжелая цепи экспрессируются в клетке-хозяине и секретируются в среду, в которой клетки-хозяева культивируются, из каковой среды антитела могут быть извлечены. Стандартные рекомбинантные ДНК-методологии используются для получения генов тяжелой и легкой цепи антитела, встраивая эти гены в рекомбинантные векторы экспрессии и вводя векторы в клетки-хозяева, так, как это описано в Sambrook, Fritsch and Maniatis (eds), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патентах США №№ 4816397 и 6914128, все идеи которых включены в настоящее описание.
Для экспрессии легкой и тяжелой цепей вектор(-ы) экспрессии, кодирующий тяжелую и легкую цепи, трансфицируется в клетку-хозяина с помощью стандартных технологий. Различные формы термина «трансфекция» направлены на охват широкого разнообразия технологий, обычно используемых для введения экзогенной ДНК в прокариотические и эукариотические клетки-хозяева, например, путем электропробоя мембраны, осаждения фосфата кальция, DEAE-декстрановой трансфекции и им подобных. Хотя теоретически возможно экспрессировать антитела по данному изобретению либо в прокариотических, либо в эукариотических клетках-хозяевах, экспрессия антител в эукариотических клетках, таких как клетки-хозяева млекопитающих, являются пригодными, поскольку такие эукариотические клетки, и в частности, клетки млекопитающих, более вероятно, чем прокариотические клетки, способны сформировать и секретировать антитело с надлежащей конформацией и иммунологической активностью. Сообщалось, что прокариотическая экспрессия генов антитела неэффективна для продукции активного антитела с высоким выходом (Boss and Wood (1985) Immunology Today 6:12-13, все идеи которого включены в настоящее описание путем ссылки).
Клетки-хозяева, пригодные для клонирования или экспрессии ДНК в векторах по настоящему описанию, являются прокариотическими, дрожжевыми или клетками высших эукариот, описанными выше. Подходящие прокариоты для этой цели включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, напримерSerratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанная в DD 266,710, опубликованной 12 апреля 1989 .), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одним из пригодных клонов хозяев E. coli является E. coli 294 (ATCC 31,446), хотя другие линии, такие как E. coli B, E. coli X1776 (ATCC 31,537), и E. coli W3110 (ATCC 27,325), являются подходящими. Эти примеры являются иллюстративными, а не ограничивающими.
В дополнение к прокариотическим эукариотические микробы, такие как гифомицеты или дрожжи, пригодны для того, чтобы быть хозяевами для клонирования или экспрессии векторов, кодирующих полипептид. Saccharomyces cerevisiae, или обычные пекарские дрожжи, являются наиболее обычно используемыми среди низших эукариотических микроорганизмов-хозяев. Однако множество других родов, видов и штаммов обычно доступны и пригодны по данному документу, такие как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12,424), K. bulgaricus (ATCC 16,045), K. wickeramii (ATCC 24,178), K. waltii (ATCC 56,500), K. drosophilarum (ATCC 36,906), K. thermotolerans и K. marxianus; [дрожжи] yarrowia (EP 402,226); Pichia pastoris (EP 183,070); Candida; Trichoderma reesia (EP 244,234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и гифомицеты, такие как, например, Neurospora, Penicillium, Tolypocladium, и хозяева Aspergillus, такие как A. nidulans и A. niger.
Пригодные клетки-хозяева для экспрессии гликозилированных антител происходят из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты, а также соответствующие пермиссивные клетки-хозяева насекомых, такие как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Множество вирусных штаммов для трансфекции имеются в открытом доступе, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в качестве вируса согласно настоящему описанию по данному изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. Культуры растительных клеток хлопка, кукурузы, картофеля, соевых бобов, петунии, томата и табака также могут быть использованы в качестве хозяев.
Подходящие клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по данному изобретению включают клетки яичника китайского хомячка (клетки CHO) (включая клетки dhfr-CHO, описанные в Urlaub and Chasin, (1980) PNAS USA 77:4216-4220, используемые с селектируемым маркером DHFR, например, как описано в Kaufman and Sharp (1982) Mol. Biol. 159:601-621, все идеи которых включены в настоящее описание путем ссылки), клетки миеломы NS0, клетки COS и клетки SP2. Когда рекомбинантные векторы экспрессии, кодирующие гены антитела, вводятся в клетки-хозяева млекопитающих, антитела продуцируются путем культивирования клеток-хозяев в течение периода времени, достаточного для того, чтобы позволить экспрессию антитела в клетках-хозяевах или секрецию антитела в культуральную среду, в которой растут клетки-хозяева. Другими примерами подходящих линий клеток-хозяев млекопитающих являются линии CV1 из почек обезьян, трансформированные SV40 (COS-7, ATCC CRL 1651); эмбриональная почечная линия человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почек новорожденных хомячков (BHK, ATCC CCL 10); клетки из яичников китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек обезьян (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собаки (MDCK, ATCC CCL 34); клетки печени крыс buffalo (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мышей (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2), все идеи которых включены в настоящее описание путем ссылки.
Клетки-хозяева для продукции антитела трансформируются с помощью описанной выше экспрессии или клонирования векторов и культивируются в общепринятой питательной среде, модифицированной подходящим образом для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
Клетки-хозяева, используемые для продукции антитела, могут культивироваться в различных средах. Коммерчески доступные среды, такие как Ham’s F10™ (фирма Sigma), минимальная питательная среда (Minimal Essential Medium™, MEM), (фирма Sigma), RPMI-1640 (фирма Sigma) и модифицированная по Дульбекко среда Игла (Dulbecco’s Modified Eagle’s Medium™, DMEM), (фирма Sigma) являются подходящими для культивирования клеток-хозяев. Кроме того, какие-либо среды, описанные в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al, Anal. Biochem. 102:255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или патенте США No. Re, 30985, все идеи которых включены в настоящее описание путем ссылки, могут быть использованы в качестве культуральной среды для клеток-хозяев. Какие-либо из этих сред могут быть дополнены, если требуется, гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлористый натрий, кальций, магний и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как гентамициновые препараты), следовыми элементами (определяемыми как неорганические соединения, обычно присутствующие в финальных концентрациях микромолярного диапазона) и глюкоза или эквивалентный источник энергии. Какие-либо другие необходимые дополнения, известные специалистам в данной области техники, могут также быть включены в подходящих концентрациях. Условия культивирования, такие как температура, pH и им подобные, таковы же, как были использованы для клеток-хозяев, выбранных для экспрессии, и являются очевидными для обычных специалистов в данной области техники.
Клетки-хозяева могут быть также использованы для продукции частей интактных антител, таких как Fab-фрагменты или молекулы scFv. Следует понимать, что вариации в вышеописанной процедуре находятся в сфере данного изобретения. Например, в определенных вариантах осуществления может быть желательно трансфицировать клетку-хозяина ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе) антитела по данному изобретению. Технология рекомбинантной ДНК может также быть использована для устранения некоторых или всех ДНК, кодирующих или какую-либо, или обе легкую и тяжелую цепи, которые не требуются для связывания антигена. Молекулы, экспрессируемые из таких процессированных форм ДНК, также охватывают антитела по данному изобретению. В дополнение, бифункциональные антитела могут быть продуцированы так, что в них одна тяжелая и одна легкая цепь представляют собой антитело по данному изобретению, а другая тяжелая и легкая цепь являются специфичными для антигена, иного, чем оригинальный антиген, путем сшивки антитела по данному изобретению со вторым антителом с помощью способов стандартной химической сшивки.
В подходящей системе для рекомбинантной экспрессии антитела или его антиген-связывающей части по данному изобретению рекомбинантный вектор экспрессии, кодирующий и тяжелую цепь, и легкую цепь антитела, вводится в клетки dhfr-CHO с помощью трансфекции, опосредованной фосфатом кальция. Внутри рекомбинантного вектора экспрессии каждый из генов тяжелой и легкой цепи антитела функционально связан с регуляторными элементами, энхансером CMV/промотором AdMLP, для обеспечения высокого уровня транскрипции генов. Рекомбинантный вектор экспрессии также несет ген DHFR, который позволяет отбор клеток CHO, которые были трансфицированы вектором, с помощью метотрексатного отбора/амплификации. Отобранные трансформированные клетки-хозяева культивировали, чтобы позволить экспрессию тяжелой и легкой цепи антитела и выделение интактного антитела из культуральной среды. Стандартные молекулярно-биологические технологии использовали для получения рекомбинантного вектора экспрессии, трансфекции клеток-хозяев, отбора трансформированных клеток, культивирования клеток-хозяев и выделения антитела из культуральной среды.
При использовании рекомбинантных технологий антитело может быть продуцировано внутриклеточно, в периплазматическом пространстве или непосредственно секретироваться в среду. В одном аспекте, если антитело продуцируется внутриклеточно, как первая стадия, частицы остатков либо клеток-хозяев, либо лизированных клеток (возникшие, например, в результате гомогенизации) могут быть удалены, например, путем центрифугирования или ультрафильтрации. Когда антитело секретируется в среду, супернатанты из таких систем экспрессии могут быть сначала сконцентрированы с помощью коммерчески доступных фильтров для концентрирования белков, например ультрафильтрационных устройств Amicon™ или Millipore Pellicon™.
Перед процессом по данному изобретению процедуры очистки антител от клеточных остатков исходно зависят от места экспрессии антитела. Некоторые антитела могут быть секретированы непосредственно из клеток в окружающую среду роста; другие образуются внутриклеточно. В последнем случае первая стадия процесса очистки антитела обычно вовлекает: лизис клетки, который может быть выполнен множеством способов, включая механическое размельчение, осмотический шок или ферментативную обработку. Такое разрушение высвобождает все содержимое клетки в гомогенат и к тому же образует субклеточные фрагменты, которые трудно устранить вследствие их малого размера. Они в целом устраняются с помощью дифференцированного центрифугирования или путем фильтрации. Когда антитело секретировано, супернатанты из таких систем экспрессии обычно сначала концентрируются с помощью коммерчески доступных фильтров для концентрирования белка, например, устройств ультрафильтрации Amicon™ или Millipore Pellicon™. Когда антитело секретируется в среду, рекомбинантные клетки-хозяева также могут быть отделены от среды клеточной культуры, например путем тангенциальной поточной фильтрации. Антитела могут быть затем выделены из культуральной среды с помощью способов очистки антитела по данному изобретению.
5.4. Очистка антитела
5.4.1 Очистка антитела в целом
Данное изобретение предоставляет способ продукции препарата очищенного (или «с уменьшенным HCP») антитела из смеси, содержащей антитело и, по меньшей мере, один HCP. Процесс очистки по данному изобретению начинается на стадии разделения, когда антитело, продуцируется с помощью способов, описанных выше, и общепринятых способов, известных в данной области техники. В таблице 1 суммирован один из вариантов осуществления схемы очистки. Вариации этой схемы, включая, но не ограничиваясь ими, вариации, в которых порядок стадий ионообмена обращен, предусмотрены и находятся в объеме данного изобретения.
После получения очищенного раствора или смеси, содержащей антитело, разделение антитела и других белков, продуцируемых клеткой, таких как HCP, выполняли с помощью комбинации различных технологий очистки, включая стадию(-и) аффинного разделения, стадию(-и) ионообменного разделения и стадию(-и) разделения с гидрофобным взаимодействием. Стадии разделения разделяют смеси белков на основе их характеристик связывания, заряда, степени гидрофобности или размера. В одном аспекте разделение выполняют с помощью хроматографии, включая аффинную, катионную, анионную и с гидрофобным взаимодействием. Несколько различных хроматографических смол доступны для каждой из этих технологий, позволяющих точную подстройку схемы очистки под конкретный интересующий белок. Сущность каждого из способов разделения состоит в том, что белки можно заставить или перемещаться с различными скоростями по колонке, достигая физического разделения, которое усиливается по мере продвижения по колонке, или селективно адгезировать к среде разделения с последующей дифференциальной элюцией различными растворителями. В некоторых случаях антитело отделяется от загрязнений, когда загрязнения специфически адгезируют к колонке, а антитело не адгезирует, т.е. антитело находится в потоке.
Как отмечалось выше, точная подстройка схемы очистки руководствуется характеристиками очищаемого белка. В определенных вариантах осуществления используются стадии разделения по данному изобретению для разделения антитела от одного или более HCP. Поскольку данное изобретение направлено в целом на очистку белка, оно может быть конкретно адаптировано для очистки антител. Например, антитела, которые могут быть успешно очищены с помощью способов, описанных в настоящем описании, включают, но не ограничиваются ими, антитела человека IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 и IgM. В определенных вариантах осуществления стратегии очистки по данному изобретению исключают использование аффинной хроматографии с белком A, например, в контексте очистки антитела IgG3, поскольку антитела IgG3 связываются с белком А неэффективно. Другие факторы, которые позволяют специфическую подстройку схемы очистки, включают, но не ограничиваются ими: присутствие или отсутствие участка Fc (например, в контексте полноразмерного антитела по сравнению с его фрагментом Fab), поскольку белок A связывается с участком Fc; конкретные эмбриональные последовательности, участвующие в генерации антитела, представляющего интерес; и аминокислотную композицию антитела (например, первичную последовательность антитела, а также общий заряд/гидрофобность молекулы). Антитела, обладающие одной или более характеристиками, могут быть очищены с помощью стратегий очистки, подстроенных для извлечения преимуществ из этих характеристик.
5.4.2. Хроматография с псевдодвижущимся слоем
Как изложено выше, очистка антитела обычно включает одну или более стадий хроматографического разделения. Поскольку такие стадии хроматографического разделения традиционно выполняются в периодическом режиме, такой периодический режим разделения может вносить существенную неэффективность в процесс очистки. Например, поскольку использование хроматографических колонок в периодическом режиме требует, чтобы колонки были загружены только до их динамической емкости, периодический режим требует в два-три раза больше смолы, чем если бы колонки были загружены до своей емкости насыщения. Эта неэффективность может значительно увеличивать общую стоимость, поскольку хроматографические смолы для белка часто очень дорогостоящи. Дополнительно, процессы отмывки и элюции в колонках в периодическом режиме требуют существенных объемов жидкости, которые не только повышают стоимость процесса очистки, но также существенно увеличивают время, требуемое для завершения такого разделения.
В определенных вариантах осуществления данное изобретение направлено на использование одного или более хроматографических разделений в псевдодвижущемся слое (SMB). В определенных вариантах осуществления такие разделения в SMB являются дополнением одного или более традиционных разделений в периодическом режиме или замещают их. Поскольку хроматографические разделения в SMB вовлекают использование колонок, которые загружены близко к их емкости насыщения, они требуют меньших объемов хроматографической смолы. Кроме того, поскольку разделения в SMB позволяют более эффективные процессы отмывки и элюции, использование разделений в SMB ведет к существенному уменьшению потребления буферов и более эффективным процессам очистки по времени.
В определенных вариантах осуществления система SMB включает один или более модулей, заполненных твердофазным хроматографическим носителем. Такие носители включают, но не ограничиваются ими, аффинные хроматографические смолы, ионообменные хроматографические смолы и хроматографические смолы с гидрофобным взаимодействием. В определенных вариантах осуществления конкретный модуль может включать одну или множество хроматографических колонок, при том что система содержит, по меньшей мере, две хроматографические колонки. В определенных вариантах осуществления каждый из модулей в различных вариантах, а также каждый модуль в многомодульной системе, находится в жидкостной коммуникации с каждым из остальных. В определенных вариантах осуществления такая жидкостная коммуникация достигается через соединение жидкостными трубопроводами. В определенных вариантах осуществления такие трубопроводы разделены клапанами или другими средствами, позволяющим введение и/или выведение жидкости.
В определенных вариантах осуществления данного изобретения жидкостные трубопроводы соединяют верхние и нижние концы системы SMB с образованием петли, через которую постоянно циркулирует жидкая смесь. В определенных точках может быть введен поток жидкости, а в других точках может быть выведен. В определенных вариантах осуществления может быть устроена множественная система труб и клапанов для выбранного расположения входа питающего материала, входа для буфера элюции и выхода для разделенного компонента, а также выхода для неразделенного (или менее соединенного) компонента. В определенных вариантах осуществления каждая точка входа и выхода соединены с отдельным модулем или колонкой. Например, в определенных вариантах осуществления питающий материал подается в систему в предназначенной точке и двигается через твердую фазу по непрерывному внутреннему рециркулирующему потоку. Такой подвижный контакт приводит к хроматографическому разделению компонентов питающего материала. Диссоциированные компоненты, которые протекают со сравнительно большей скоростью, удаляются через выход для неассоциированных компонентов, как при удалении первого слива выходящего потока. Буфер, который диссоциирует и ассоциирует соединения от твердой фазы, добавляется через его входной клапан между соответствующими положениями выходных клапанов ассоциированного и неассоциированного компонентов.
В определенных вариантах осуществления предназначенные положения входного и выходного клапанов смещены дальше по ходу на одну позицию на множественной системе к следующей твердофазной колонке. Время протекания стадии выбирают так, что расположение клапанов должным образом синхронизировано с внутренним потоком рециркуляции. В таких условиях система, в конечном счете, достигает устойчивого состояния со специфическими характеристиками продукта, последовательно появляющегося в предварительно обусловленные интервалы в каждой позиции клапанов. Этот тип системы имитирует клапаны, расположенные в единственном положении, тогда как твердая фаза движется с постоянной и непрерывной скоростью по петле рециркуляции, давая продукт с постоянным качеством в каждом клапане. В определенных вариантах осуществления может быть применен альтернативный аппарат, где колонки физически двигаются либо вручную, либо механической каруселью, тогда как расположение клапанов остается фиксированным.
С точки зрения процессов разделения в SMB система реально движущегося слоя характеризуется как увеличение множества модулей и положений клапанов. В определенных вариантах осуществления число модулей доходит до 2, 3, 4, 5, 6, 7, 8, 9 или 10, где каждый модуль содержит одну или более хроматографических колонок. В конкретных вариантах осуществления система SMB включает 4 или 8 хроматографических колонок.
В определенных вариантах осуществления процесс с псевдодвижущимся слоем используется в контексте аффинной хроматографии. В определенных вариантах осуществления хроматографический материал способен к селективности или специфическому связыванию с антителом, представляющим интерес. Неограничивающие примеры такого хроматографического материала включают: белок A, белок G, хроматографический материал, содержащий антиген, связанный с антителом, представляющим интерес, и хроматографический материал, содержащий Fc-связывающий белок. В специфических вариантах осуществления стадия аффинной хроматографии вовлекает помещение первичного собранного образца на колонку, содержащую подходящую смолу с белком А. Смола с белком А пригодна для аффинной очистки и выделения различных изотипов антител, в частности IgG1, IgG2 и IgG4. Белок A представляет собой бактериальный белок клеточной стенки, который связывается с IgG млекопитающих первично через их участки Fc. В нативном состоянии белок A имеет пять IgG-связывающих доменов, а также другие домены неизвестных функций.
В определенных вариантах осуществления процесс с псевдодвижущимся слоем используется в контексте ионообменной хроматографии. Ионообменное разделение включает какие-либо способы, с помощью которых два вещества разделяются на основе различия в их относительном ионном заряде, и может использовать либо катионный обменный материал, либо анионный обменный материал.
Использование катионообменного материала или анионообменного материала основывается на общем заряде белка. Следовательно, использование анионообменной стадии перед использованием катионообменной стадии или катионообменной стадии до использования анионообменной стадии находится в сфере данного изобретения. Кроме того, в объеме данного изобретения находится использование только катионообменной стадии, только анионообменной стадии или несколько серийных комбинаций этих двух стадий.
Ионообменная хроматография может также быть использована в качестве ионообменной технологии разделения. Ионообменная хроматография разделяет молекулы на основе различий между общим зарядом молекул. Для очистки антитела антитело должно иметь заряд, противоположный таковому функциональной группы, присоединенной к ионообменному материалу, например смоле, чтобы оно могло связаться с ним. Например, антитела, которые, в целом, имеют общий положительный заряд в буфере с рН ниже его pI, хорошо связываются с катионообменным материалом, который содержит отрицательно заряженные функциональные группы.
В ионообменной хроматографии заряженные участки на поверхности жидкой фазы притягиваются противоположным зарядом к хроматографической фазе, учитывая, что ионная сила окружающего буфера низка. Элюция, в целом, достигается повышением ионной силы (т.е. проводимости) буфера для конкуренции за заряженные сайты ионообменной фазы. Изменение pH и, таким образом, изменение заряда жидкой фазы представляет собой другой путь достижения элюции жидкой фазы. Изменение проводимости или pH может быть градуальным (градуальная элюция) или ступенчатым (ступенчатая элюция).
Анионные и катионные заместители могут быть присоединены к твердой фазе, чтобы образовать анионный или катионный носители для хроматографии. Неограничивающие примеры анионообменных заместителей включают диэтиламиноэтильную (DEAE), четвертичную аминоэтильную (QAE) и четвертичную амино (Q) группы. Катионные заместители включают карбоксиметил (CM), сульфоэтил (SE), сульфопропил (SP), фосфат (P) и сульфонат (S). Целлюлозные ионообменные смолы, такие как DE23™, DE32™, DE52™, CM-23™, CM-32™ и CM-52™ доступны от фирмы Whatman Ltd. Maidstone, Kent, U.K. Известны также ионообменники, основанные на SEPHADEX® и сшитые. Например, DEAE-, QAE-, CM- и SP- SEPHADEX® и DEAE-, Q-, CM- и S-SEPHAHOSE® и SEPHAROSE® Fast Flow, все доступны от фирмы Pharmacia AB. Также, дериватизированные этиленгликоль-метакрилатные сополимеры и DEAE, и CM, такие как TOYOPEAJRL™ DEAE-650S или M и TOYOPEARL™ CM-650S или M, доступны на фирме Toso Haas Co., Philadelphia, Pa.
Ионообменная стадия облегчает захват антитела, представляющего интерес, при уменьшении загрязнений, таких как HCP. В определенных аспектах ионообменная колонка представляет собой катионообменную колонку. Например, но не ограничиваясь этим, подходящая смола для такой катионообменной колонки представляет собой смолу CM HyperDF™. Такие смолы доступны из коммерческих источников, таких как Pall Corporation. Эта катионообменная процедура может быть выполнена при комнатной температуре или близко к ней.
В определенных вариантах осуществления процесс с псевдодвижущимся слоем используется в контексте хроматографии гидрофобного взаимодействия («HIC»). Тогда как ионообменная хроматография основывается на заряде антитела как основе его выделения, хроматография гидрофобного взаимодействия использует гиброфобные свойства антител. Гиброфобные группы антитела взаимодействуют с гидрофобными группами на колонке. Чем более гидрофобным является белок, тем сильнее он взаимодействует с колонкой. Таким образом, на стадии HIC удаляются загрязнения, связанные с клеткой-хозяином (например, ДНК и другие, относящиеся к продукту высоко- и низкомолекулярные виды).
Гидрофобные взаимодействия являются наиболее сильными при высокой ионной силе, следовательно, эту форму разделения целесообразно проводить перед осаждением солей или ионообменных процедур. Адсорбции антитела на колонке HIC благоприятствуют высокие концентрации солей, но конкретные концентрации могут варьировать в широком диапазоне в зависимости от природы антитела и конкретного выбранного лиганда HIC. Различные ионы могут быть скомпонованы в так называемые солюфобные серии в зависимости от того, способствуют ли они гидрофобным взаимодействиям (эффекты высаливания) или нарушают структуру воды (хаотропный эффект) и приводят ли к ослаблению гидрофобного взаимодействия. Катионы в отношении эффекта высаливания располагаются так: Ba++; Ca++; Mg++; Li+ ; Cs+ ; Na+ ; K+; Rb+ ; NH4+, тогда как анионы могут выстраиваться в отношении возрастания хаотропного эффекта так: PO---; SO4--; CH3CO3 -; Cl-; Br-; NO3-; ClO4-; I-; SCN-.
В целом, сульфаты Na, K или NH4 эффективно способствуют взаимодействию лиганда и белка в HIC. Соли могут быть подобраны, чтобы влиять на силу взаимодействия, как дано в нижеследующем соотношении: (NH4)2SO4>Na2SO4>NaCl>NH4Cl>NaBr>NaSCN. В целом, пригодны концентрации солей между приблизительно 0,75 и приблизительно 2 M сульфата аммония или между приблизительно 1 и 4 M NaCl.
Колонки HIC обычно содержат основной носитель (например, сшитую агарозу или синтетический сополимерный материал), к которому присоединены гидрофобные лиганды (например, алкильные или арильные группы). Подходящая колонка HIC содержит агарозную смолу, замещенную фенильными группами (например, колонка Phenyl Sepharose™). Многие колонки HIC коммерчески доступны. Примеры включают, но не ограничиваются ими, колонку Phenyl Sepharose™ 6 Fast Flow с низким или высоким уровнем замещения (фирма Pharmacia LKB Biotechnology, AB, Швеция); колонку Phenyl Sepharose™ High Performance (фирма Pharmacia LKB Biotechnology, AB, Швеция); колонку Octyl Sepharose™ High Performance (фирма Pharmacia LKB Biotechnology, AB, Швеция); колонки Fractogel™ EMD Propyl или Fractogel™ EMD Phenyl (фирма E. Merck, Германия); колонку Macro-Prep™ Mehyl или Macro-Prep™ t-Butyl Supports (фирма Bio-Rad, Калифорния); колонку WP Hl-Propyl (C3)™ (фирма J. T. Baker, Нью-Джерси); и колонки либо фенильные, либо бутильные Toyopearl™ (TosoHaas, PA).
5.5. Стратегии очистки, приводимые в качестве примеров
В определенных вариантах осуществления процесс разделения в SMB использует серию колонок с белком A. В частности, в качестве неограничивающего примера, процесс разделения в SMB использует четыре колонки с белком А. В конкретных вариантах осуществления четыре колонки с белком A имеют диаметр 1,6 см и длину 5 см и упакованы смолой с белком А MabSelect. В альтернативных вариантах осуществления могут быть использованы дополнительные колонки, например, 5, 6, 7, 8, 9 или 10 колонок, а колонки могут быть существенно большего диаметра и высоты, что доводит объемы упакованных колонок до приблизительно 2, до приблизительно 3, до приблизительно 4, до приблизительно 5, до приблизительно 6, до приблизительно 7, до приблизительно 8, до приблизительно 9, до приблизительно 10, до приблизительно 11, до приблизительно 12, до приблизительно 13, до приблизительно 14, до приблизительно 15, до приблизительно 16, до приблизительно 17, до приблизительно 18, до приблизительно 19, до приблизительно 20, до приблизительно 25, до приблизительно 30, до приблизительно 40, до приблизительно 50, до приблизительно 60, до приблизительно 70, до приблизительно 80, до приблизительно 90, до приблизительно 100 или более литров.
В определенных вариантах осуществления каждая колонка с белком A, используемая в конкретной схеме разделения в SMB, может быть уравновешена подходящим буфером перед загрузкой образца. Неограничивающий пример подходящего буфера представляет собой Трис-буфер с pH приблизительно 7,2. Неограничивающий пример подходящих условий уравновешивания представляет собой 350 мМ Трис, pH приблизительно 7,2. Вслед за этим уравновешиванием образец может быть загружен на колонку. Вслед за загрузкой колонки, колонка может быть отмыта один или более раз с использованием, например, буфера для уравновешивания. Другие отмывки, включая отмывки с использованием других буферов, могут быть использованы перед элюцией колонки. Например, колонка может быть отмыта с использованием одного или более объемов колонки 25 мМ Трисом при pH приблизительно 7,2. За этой отмывкой, если требуется, могут следовать одна или более отмывок с помощью буфера для уравновешивания. Колонка с белком A может затем элюироваться с помощью подходящего буфера элюции. Неограничивающим примером подходящего буфера элюции является буфер уксусная кислота/NaCl, pH приблизительно 3,5. Подходящие условия состоят, например, в 0,1 M уксусной кислоты, pH приблизительно 3,5. Элюат может быть проконтролирован с помощью технологий, хорошо известных специалистам в данной области техники. Например, может быть отслежена адсорбция при OD280. Элюат с колонки может быть собран, начиная с первоначального отклонения приблизительно 0,5 AU до значения приблизительно 0,5 AU хвоста пика элюции. Фракция(-и) элюции, представляющие интерес, могут быть получены для дальнейшей обработки. Например, собранный образец может быть оттитрован до pH приблизительно 5,0 с помощью Триса (например, 1,0 M) при pH приблизительно 10. Если требуется, этот оттитрованный образец может быть отфильтрован и подвергнут дальнейшей обработке.
В определенных вариантах осуществления загрузка образца рассчитана так, чтобы получить конкретное время удерживания фракции-мишени. В конкретных вариантах осуществления загрузка образца рассчитана так, чтобы время удерживания фракции-мишени находилось в диапазоне от приблизительно 0,5 до приблизительно 12 минут, в определенных вариантах осуществления оно выбирается из группы, состоящей из: до приблизительно 0,5, до приблизительно 1, до приблизительно 2, до приблизительно 3, до приблизительно 4, до приблизительно 5, до приблизительно 6, до приблизительно 7, до приблизительно 8, до приблизительно 9 или до приблизительно 10 минут. В определенных вариантах осуществления время удерживания фракции-мишени составляет 3 минуты. В определенных вариантах осуществления загрузка образца также рассчитана, чтобы она составила до приблизительно 50, до приблизительно 60, до приблизительно 70, до приблизительно 80, до приблизительно 90 или до приблизительно 100% насыщения связывающей способности колонки.
В определенных вариантах осуществления процесс разделения в SMB вовлекает особую программу буферов уравновешивания, загрузки, отмывки, элюции, регенерации и хранения. В определенных вариантах осуществления программа состоит из трех частей: 1-е хроматографирование, хроматографирование с 2-го до (n-1)-го и последнее хроматографирование. Неограничивающий пример такой программы представлен ниже:
В определенных вариантах осуществления первая стадия отмывки использует буфер, идентичный буферу уравновешивания. В определенных вариантах осуществления первая стадия отмывки может быть объединена со стадией загрузки образца. В определенных вариантах осуществления стадии отмывки, элюции и регенерации могут быть рассчитаны и запрограммированы так, чтобы удержать время загрузки приблизительно 50% от времени хроматографирования.
5.5. Рамановская спектроскопия
Рамановская спектроскопия основывается на том принципе, что монохроматическое излучение, падающее на материал, отражается, поглощается или рассеивается специфическим образом, который зависит от конкретной молекулы или белка, которые получают облучение. Тогда как большая часть энергии рассеивается при той же длине волны (Рэлеевское рассеяние), малое количество излучения (например, 10-7) рассеивается на несколько иной длине волны (стоксово и антистоксово рассеяние). Это рассеивание связано с вращательными, колебательными и электронными переходами. Изменение длины волны рассеянного фотона дает химическую и структурную информацию.
В определенных вариантах осуществления Рамановская спектроскопия может быть выполнена на многокомпонентных смесях, таких как используются в контексте технологий с SMB, описанных в настоящем описании, для получения высокоспецифичных характеристик компонентов. Спектральная характеристика, получаемая с помощью анализа Рамановской спектроскопии смеси, представляет собой наложение всех индивидуальных компонентов. Относительные интенсивности полос коррелируют с относительными концентрациями конкретных компонентов. Соответственно, в определенных вариантах осуществления Рамановская спектроскопия может быть использована для качественной и количественной характеристики смеси компонентов. Таким образом, В некоторых из таких вариантов осуществления Рамановская спектроскопия может быть использована для контроля и/или определения композиции одной или более многокомпонентных смесей, вовлеченных в продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP по данному изобретению.
Рамановская спектроскопия может быть использована для характеристики большинства образцов, включающих твердые вещества, жидкости, суспензии, гели, пленки, порошки и некоторые газы, с очень коротким временем обнаружения сигнала. В целом, образцы могут быть взяты непосредственно из биопроцесса, о котором идет речь, без необходимости в специальных технологиях приготовления. Также, проходящий и отраженный свет может быть передан на длинные дистанции, что позволяет дистанционный контроль. Кроме того, поскольку вода дает только слабое рамановское рассеяние, водные образцы могут быть охарактеризованы без значительного влияния, исходящего от воды.
Подходящие процессы и композиции, описанные в настоящем описании, могут быть проанализированы на основе коммерчески доступных анализаторов Рамановской спектроскопии. Например, могут быть использованы анализатор RamanRX2™ или другие анализаторы, коммерчески доступные от фирмы Kaiser Optical Systems, Inc. (Ann Arbor, MI). В качестве альтернативы, Рамановские анализаторы коммерчески доступны, например, от фирм PerkinElmer (Waltham, MA), Renishaw (Gloucestershire, UK) и Princeton Instruments (Trenton, NJ). Технические детали и рабочие параметры коммерчески доступных анализаторов Рамановской спектроскопии могут быть получены от соответствующих фирм.
Подходящие времена экспозиции, размеры образца и частоты отбора образцов могут быть определены на основе, например, анализатора Рамановской спектроскопии и процесса, который используется (например, в процессах, обеспечивающих контроль управления биопроцессом UF/DF (ультрафильтрации/диафильтрации) в реальном времени). Сходным образом, соответствующее расположение зонда также может быть определено исходя из анализатора и процесса, для которого анализатор используется. Например, размер образца для погружного зонда для получения адекватного сигнала может быть менее чем 20 мл или менее чем 10 мл (например, 8 мл или менее). Время экспозиции для получения адекватного сигнала может составлять менее чем 2 минуты или менее чем 1 минуту (например, 30 секунд).
Для компонентов, для которых желательна количественная оценка и которые существуют в более чем одной pH-зависимой ионизированной форме (например, гистидин), калибровка рамановской спектроскопии может быть проведена при варьирующих концентрациях и/или при различных pH, чтобы предсказать концентрацию в заданном диапазоне pH так, чтобы измерение компонента (например, гистидина) не было pH-зависимым. Например, калибровочные модели для гистидина в различных pH-зависимых формах могут быть использованы для измерения и количественной оценки гистидина в различных ионизированных формах, так что могут быть определены свойства раствора. Может быть выполнена обработка сигнала, который может включать коррекцию интенсивности (например, стандартное отклонение (SNV)) и/или коррекцию базовой линии (например, первая производная).
Время экспозиции может быть определено измерением насыщения CCD по репрезентативным тестовым растворам, чтобы убедиться, что они находятся в приемлемом инструментальном диапазоне (например, 40-80%).
В некоторых вариантах осуществления контроль pH или моделирование диапазона pH используется для конкретных компонентов (например, буферов, таких как гистидин). В некоторых вариантах осуществления проходящий свет минимизируется, что может быть достигнуто, например, использованием светоизоляции, чтобы блокировать влияние источников света в окружающей среде на спектроскопию (например, с помощью алюминиевой фольги).
В определенных вариантах осуществления, в которых, например, белок (такой как антитело) концентрируется с незаряженными частицами, белок занимает значительный объем раствора, исключая существенное количество растворителя. Это приводит к чистому снижению концентрации незаряженных частиц. Этот эффект обозначается как «эксклюзия объема», которая пропорциональна концентрации белка.
В определенных вариантах осуществления, таких как те варианты осуществления, которые вовлекают анализ заряженных компонентов, возникает доннановский эффект, поскольку при более высоких концентрациях белка заряд начинает вносить существенный вклад в общий заряд частиц в растворе. Поскольку ожидается, что равновесие устанавливается по обе стороны мембраны, требование электронейтральности приводит к чистому снижению положительно заряженных частиц (например, частиц буфера) на той стороне мембраны, где концентрация выше. Этот феномен называется доннановским эффектом.
В соответствии с определенными вариантами осуществления данной заявки используется анализатор RamanRX2™. Этот анализатор, так же как и другие коммерчески доступные рамановские анализаторы, дает возможность контроля вплоть до четырех каналов при одновременном покрытии всего спектра. В определенных вариантах осуществления стандартное лазерное возбуждение в близкой инфракрасной области (NIR) использовали для максимизации пригодности образца. Могут быть использованы программируемые последовательные форматы контроля, например, анализатора RamanRX2™, и совместимый с оптикой процесса аппарат, дающий возможность использовать один тип анализатора, начиная с фазы обнаружения до фазы продукции. Портативный кожух и волоконно-оптический интерфейс получения данных позволяют использовать анализатор в множестве положений.
В определенных вариантах осуществления описываемого в настоящем описании предмета, по меньшей мере, одна многокомпонентная смесь стандарта, содержащая предварительно определенные количества известных компонентов (т.е. многокомпонентные стандартные смеси), охарактеризована Рамановской спектроскопией, чтобы получить модель для использования со смесями с неизвестными компонентами и/или неизвестными концентрациями известных или неизвестных компонентов (например, калибровочная кривая). Предпочтительно, серия многокомпонентных стандартных смесей с предварительно определенными количествами известных компонентов охарактеризовывается путем Рамановской спектроскопии с целью получения модели.
Методологии получения модели для использования со смесями неизвестных компонентов и/или неизвестными концентрациями известных или неизвестных компонентов могут быть определены специалистами в данной области техники. Например, анализ регрессии частных наименьших квадратов, основанный на основных компонентах, которые, как ожидается, присутствуют в многокомпонентных тестовых смесях. Также доступное от поставщиков Рамановской спектроскопии программное обеспечение может быть использовано для получения стандартов многокомпонентной смеси, которые, в свою очередь, могут быть использованы для разработки модели для использования с многокомпонентными тестовыми смесями.
Ясно, что ссылка на «получение стандарта многокомпонентной смеси с предварительно определенными количествами известных компонентов» и «выполнение анализа Рамановской спектроскопии на стандарте многокомпонентной смеси» и, в более общем виде, разработка модели для характеризации многокомпонентных смесей с неизвестными компонентами или неизвестными концентрациями компонентов, включает и параллельный анализ (т.е. данные, полученные «на месте»), и ссылку на ранее полученные или ранее зарегистрированные результаты (например, характеристики Рамановского спектра) для стандартов многокомпонентной смеси, т.е. многокомпонентных смесей с известными компонентами с известными концентрациями. Например, ссылка на результаты Рамановских спектров, полученных из литературы от источника продукта, охватывает «получение стандарта многокомпонентной смеси с предварительно определенным количеством известных компонентов» и «выполнение анализа Рамановской спектроскопии на стандарте многокомпонентной смеси».
Определенные варианты осуществления данной заявки используют технологии Рамановской спектроскопии для характеризации компонентов (например, многокомпонентной смеси), используемых в управлении биопроцессом, включая, но не ограничиваясь ими, операции с SMB. Например, в определенных вариантах осуществления Рамановская спектроскопия может быть использована для характеристики форм, которые предназначены быть скомбинированными с биологически активным агентом (например, моноклональным антителом) в контексте разделения в SMB. Эти формы, иногда обозначаемые как «буферы формы», обычно представляют собой многокомпонентные смеси, которые определяют уровень носителя в биологических препаратах. Например, такие формы, в целом, включают одно или более из нижеследующего: буфер pH (например, цитрат, Трис, ацетат или соединение гистидина), поверхностно-активное вещество (например, полисорбат 80), сахар или сахароспирт (например, маннитол) и/или аминокислоту (например, L-аргинин или метионин). Ошибки в формуле буферов часто приводят к получению бракованных партий, что, в свою очередь, приводит к существенным потерям. Использование технологий, описанных в настоящем описании, может уменьшить или устранить такую неэффективность.
В определенных вариантах осуществления технологии Рамановской спектроскопии могут быть использованы для идентификации белковых агрегатов, таких как, но не ограничиваясь ими, те, которые могут сформироваться в ходе операций в SMB. Например, но не путем ограничения, технологии Рамановской спектроскопии по данному изобретению могут, в определенных вариантах осуществления, идентифицировать агрегаты белка в образцах действующего вещества и готовых лекарственных форм (Drug Substance and Drug Product), включая, но не ограничиваясь ими, образцы действующего вещества антитела (Drug Substance) и образцы готовой лекарственной формы антитела (Drug Product).
В определенных вариантах осуществления Рамановская спектроскопия может быть использована для тестирования и характеризации формы, присутствующей в операциях фильтрации (например, процессы ультрафильтрации/диафильтрации), таких как операции фильтрации, в которых биологически активный агент, такой как моноклональное антитело, очищен, включая, но не ограничиваясь ими, операции, выполненные в связи с операцией в SMB. Например, но не ограничиваясь этим, технологии Рамановской спектроскопии по данному изобретению могут быть использованы для получения образцов, полученных в реальном времени или автономно, чтобы уточнить и идентичность, и количество компонентов, присутствующих в единичном измерении. В определенных вариантах осуществления концентрации белка могут быть определены в дополнение к концентрациям носителя. В определенных вариантах осуществления могут быть проанализированы концентрации белка в диапазоне 0-150 мг/мл.
В определенных вариантах осуществления Рамановская спектроскопия может быть использована для контроля, проверки, тестирования и, таким образом, контроля операций биопроцесса, таких как, но не ограничиваясь ими, те, которые выполняются в связи с операциями в SMB. Отдельные операции, которые используются в управлении биопроцессом, например хроматография, фильтрация, изменения pH, изменения композиции путем добавления компонентов или разбавления растворов, все это приводит к образованию смесей, состоящих из органических и неорганических компонентов и биологических молекул. Соответственно, быстрое и точное измерение композиции промежуточных продуктов, например, путем использования Рамановской спектроскопии, дает возможность для улучшения и поддержания стабильности и качества операций, а также биологического продукта.
В определенных вариантах осуществления измерение композиции отдельных компонентов в смеси с помощью Рамановской спектроскопии позволяет точное приготовление таких смесей, в присутствии и в отсутствие биологической молекулы. Например, в определенных вариантах осуществления, такое измерение полезно в получении растворов буферов, широко используемых в управлении биопроцессом с преимуществами, вытекающими из улучшенной стабильности препарата, или предоставлении буферных растворов практически в реальном времени. В определенных вариантах осуществления это устраняет необходимость в разработке оборудования для приготовления, содержания и доставки буферных растворов. В определенных вариантах осуществления применение Рамановской спектроскопии позволяет тестирование и получение буферных растворов так, что потенциальные ошибки в формах буфера (например, в концентрациях химических компонентов, ошибочных химических препаратах и т.д.) могут быть обнаружены в реальном времени с помощью простого инструментария. Формы, которые могут быть протестированы, включают, но не ограничиваются ими, безбелковые трехкомпонентные формы (буфер+сахар+аминокислота), формы белка и сахара, формы белка и поверхностно-активного вещества и формы белка и буфера.
В определенных вариантах осуществления точное измерение композиции раствора позволяет корректировать биологические растворы так, что может быть достигнута правильная целевая композиция добавок (анион, катион, гидрофобные вещества, растворители и т.д.). В настоящее время такие измерения являются трудоемкими и требуют сложных аналитических способов, которые неприменимы для использования в реальном времени. Использование Рамановской спектроскопии позволяет измерения, которые дают очень высокую степень надежности и документированности, что является потребностью для стабильного промышленного производства.
В определенных вариантах осуществления технологии по данному изобретению дают возможность отслеживать и контролировать реакции между белками, реакции между белком и малыми молекулами и/или модификации белка, которые достигнуты химическими, физическими или биологическими средствами. В некоторых из таких вариантов осуществления уникальная биохимическая характеристика вещества, участвующего в реакции (биологического в своем исходном состоянии,) и продукта (биологического в его финальном состоянии), а также других веществ, участвующих в реакции/катализаторов, которые являются по своей природе химическими или биологическими, отслеживаются с помощью Рамановской спектроскопии. Отслеживание вещества (веществ), участвующих в реакции, и продукта(-ов) таким образом позволяет, помимо прочего, контроль с обратной связью условий и количества вещества, участвующего в реакции. Также возможно в определенных вариантах осуществления организовать систему так, чтобы устранять побочные продукты реакции и/или непрерывную оптимизацию, улучшение или поддержание качества продукта или показателей процесса такой системы.
В определенных вариантах осуществления Рамановская спектроскопия также позволяет выделение биологического продукта и его очистку в ходе хроматографических операций, включая, но не ограничиваясь ими, операции в SMB. В некоторых из таких вариантов осуществления элюция продукта/вариантов продукта/изоформ продукта или загрязнений может быть отслежена, и фракционирование элюента колонки может быть выполнено с желаемым качеством продукта или показателями процесса. В определенных вариантах осуществления также возможно применение Рамановской спектроскопии для выделения/обогащения фракций в порядке отдельных операций, таких как, но не ограничиваясь ими, фильтрация и нехроматографические разделения.
В определенных вариантах осуществления Рамановская спектроскопия может быть применена в качестве неинвазивного инструмента. Например, но не путем ограничения, измерения Рамановской спектроскопии могут быть выполнены через материал, который не влияет на сигнал. Это дает дополнительные уникальные преимущества в управлении биопроцессами, когда поддержание целостности контейнера/сосуда, содержащего эти смеси, критично.
В определенных вариантах осуществления, Рамановская спектроскопия может быть крайне ценным средством в детектировании «загрязнений» раствора другими компонентами. В некоторых из таких вариантов осуществления может быть обнаружено загрязнение хроматографического носителя или его части от одной стадии очистки к другой. В определенных вариантах осуществления такие загрязнения включают, но не ограничиваются ими, белок A, вымытый из хроматографического носителя, связанного с белком А. В некоторых из таких вариантов осуществления данные Рамановской спектроскопии, полученные по загрязненным растворам, сравнивали с ожидаемыми спектрами с использованием статистических или спектральных технологий сравнения, и, если они отличались, это могло позволить быстрое обнаружение ошибок в форме этих растворов, прежде чем они будут использованы в биопроцессах.
В определенных вариантах осуществления, как продемонстрировано ниже в примере в подтверждение концепции, концентрация антитела в смеси, содержащей загрязнения из собранного материала культуры клеток, включая белки клетки-хозяина, ДНК, липиды и т.д., может быть измерена количественно с помощью Рамановской спектроскопии. В таких вариантах осуществления указанный способ может быть использован для отслеживания входящих и выходящих из операций биопроцесса компонентов, содержащих неочищенные смеси. Примеры могут включать, но не ограничиваться ими, операции загрузки и элюции колонок, фильтров и устройств нехроматографического разделения (расширяющийся слой, псевдожидкий слой, двухфазная экстракция и т.д.). Представленный пример демонстрирует, что концентрация антитела от 0,1 до 1 г/л может быть определена количественно в матриксе, который содержит несвязанную фракцию с аффинной хроматографической колонки с белком А, которая была загружена собранным очищенным раствором, приготовленным из химически определенной среды, основанной на процессе культуры клеток. Если Рамановская спектроскопия включена в процесс непосредственно, тогда такие измерения делают возможным отслеживание и контроль загрузки колонки, затем такие измерения делают возможным подходящую и оптимальную загрузку колонок либо при предварительно определенной связывающей емкости, которая представляет или процент динамической связывающей емкости, или статической (равновесной) емкости. Специалистам в данной области техники ясно, что такая технология может быть применена к различным другим операциям, как упоминалось выше.
В определенных вариантах осуществления Рамановская спектроскопия может быть использована для контроля качества и/или контроля с обратной связью в операциях по очистке в биопроцессе (например, для контроля в реальном времени разбавления буфера для процесса очистки терапевтического антитела). В некоторых из таких вариантов осуществления Рамановская спектроскопия может быть использована для контроля качества и/или контроля с обратной связью в процессах, вовлекающих реакции конъюгации белков или другие химические реакции (например, жидкофазная реакция Хека), как описано в Anal. Chem., 77:1228-1236 (2005), таким образом включенный путем ссылки во всей своей полноте.
6. ПРИМЕРЫ
6.1. Практический анализ: mAb X
Практический анализ был выполнен с использованием промежуточных продуктов процесса получения mAb X в качестве проточного материала и типичной хроматографической среды для основанной на агарозе аффинной хроматографии с белком А в качестве аффинной хроматографической смолы. Всего выполнено восемь циклов на четырех колонках. Каждая из колонок была загружена до насыщения, и Фиг.4 показывает получившуюся хроматограмму. УФ-пики с четными номерами показывают элюцию, а УФ-пики с нечетными номерами показывают Отмывку 1 непосредственно после загрузки.
Нижеследующие буферы были использованы для всех опытов по SMB:
Нижеследующие таблицы показывают программу очистки в SMB для mAb X. Существует три части программы: 1-е хроматографирование, 2-е-(n-1)-е хроматографирование и последнее хроматографирование. Остановку Загрузки 2 рассчитывали по анализу площади под кривой (AUC) насыщения связывающей способности (SBC) (см. ниже). Следует отметить, нижеследующие процессы разделения выполняли при загрузке, на 20% меньшей, чем реальное SBC. Первый процесс разделения выполняли при времени удерживания 1 минута, а второй выполняли при времени удерживания 3 минуты.
Данные на Фиг.8 иллюстрируют исследование насыщения связывающей способности (SBC) для mAb X. Поток через колонку анализировали с помощью анализа Poros A HPLC (жидкостная хроматография высокого разрешения), чтобы определить количество продукта, не связанного на колонке. Площадь под кривой (AUC) до насыщения связывающей способности, составляющей 73 г/л, показывает улучшение, достигнутое с помощью SMB, по сравнению с обычным связыванием («динамическое связывание») в 40 г/л. AUC вычитали из насыщения связывающей способности, чтобы рассчитать загружаемое количество для 2-го цикла вплоть до последнего цикла (см. Фиг.8).
6.2. Практический анализ mAb Y
Практический анализ был выполнен с использованием промежуточного продукта процесса очистки mAb Y в качестве проточного материала и обычной, основанной на агарозе, аффинной хроматографической среде с белком А в качестве аффинной хроматографической смолы. Всего проведено восемь циклов на четырех колонках. Каждая из колонок была загружена до насыщения, и Фиг.6 показывает получившуюся хроматограмму. Четные УФ-пики показывают элюцию, а нечетные УФ-пики показывают отмывку 1, непосредственно после загрузки. Эти буферы были использованы при всех хроматографированиях SMB:
Нижеследующие таблицы показывают программу очистки в SMB для mAb Y. Существует три части программы: 1-е хроматографирование, хроматографирование со 2-го по (n-1)-е и последнее хроматографирование. Остановку Загрузки 2 рассчитывали анализу площади под кривой (AUC) насыщения связывающей способности (SBC) (см. ниже). Стадии отмывки 1, отмывки 2 и регенерации рассчитывали так, чтобы поддерживать время загрузки на уровне 50% от длительности хроматографирования, и стадию загрузки рассчитывали, чтобы время удерживания составило 3 минуты. Следует отметить, что нижеследующие процессы разделения выполнялись при загрузке на 20% меньшей, чем реальная SBC.
Данные на Фиг.8 иллюстрируют исследование насыщения связывающей способности (SBC) для mAb Y. Поток через колонку анализировали с помощью анализа Poros A HPLC, чтобы определить количество продукта, не связанного на колонке. AUC до насыщения связывающей способности в 86 г/л показывает улучшенную связывающую способность, достигнутую благодаря SMB, по сравнению с обычным связыванием («динамическое связывание») в 45 г/л. Эту AUC вычитали из насыщения связывающей способности, чтобы рассчитать загружаемое количество во 2-м цикле до последнего цикла (см. Фиг.9).
6.3. Практический анализ mAb X, обнаружение избыточного загрязнения
Второе разделение в SMB было выполнено с помощью mAb X. В этом разделении mAb X присутствовало в химически определенной среде. Всего восемь циклов выполнено на четырех колонках. Каждая из колонок была загружена до насыщения. Нижеследующие буферы были использованы во всех хроматографированиях SMB:
Нижеследующая таблица показывает программу очистки в SMB для mAb X. Существует три части программы: 1-е хроматографирование, хроматографирование со 2-го по (n-1)-е и последнее хроматографирование. Остановку загрузки 2 рассчитывали по анализу площади под кривой (AUC) насыщения связывающей способности (SBC). Следует отметить, что нижеследующие процессы разделения выполнялись при загрузке, на 20% меньшей, чем реальное SBC. Первый процесс разделения выполняли при времени удерживания 1 минута, а второй выполняли при времени удерживания 3 минуты.
Общий выход разделения в SMB составил 85%. Выполненные аналитические тесты включали анализ Poros A для определения концентрации mAb и твердофазный иммуноферментный анализ (ELISA) вымываемого белка A, чтобы определить присутствие загрязнение белком А после каждой хроматографии элюата. Последний показывает, что вымываемый белок А выше во втором цикле (хроматографии элюата 5-8), чем в первом цикле (хроматографии элюата 1-4), показывающий некоторый эффект загрязнения по этой примеси.
6.4. Практический анализ mAb Z в полупромышленном масштабе
Процессы с использованием белка A, описанные выше, были расширены до полупромышленного масштаба и использованы в контексте разделения mAb Z. Три колонки (каждая 10 см в диаметре × 8 см высота, 785 мл) были упакованы хроматографическим носителем с белком А. Сходно с разделениями в лабораторном масштабе, описанными выше, включение колонок проводилось вручную. Всего на трех колонках рабочий поток может быть налажен, как описано на Фиг.10.
Выход mAb Z с клеточной культуры закисляли, чтобы осадить клетки и клеточные остатки. Осаждение таких загрязнений улучшает эффективность последующего центрифугирования и увеличивает емкость объемных фильтров и мембранных фильтров. Очистка выхода клеточной культуры делает возможным загрузку образца на колонку с белком А со стадией простой отмывки и упрощенными процедурами очистки. Встроенный фильтр добавляли перед колонкой, чтобы предохранить ее от остатков клеток, а воздухоулавливатель добавляли перед колонкой, чтобы защитить ее от воздуха.
Упрощенная буферная система была использована на всех стадиях обработки. Буферы уравновешивания, всех отмывок и элюции были составлены только из двух компонентов: Триса и уксусной кислоты. При определенном количестве каждого компонента pH может контролироваться молярностью каждого из компонентов. Таким образом, регулировка pH не требуется для всех буферов, экономя существенное время на получение буфера. Ниже следуют буферы, использованные в полупромышленном процессе.
Все три колонки были соединены в серию в ходе очистки, что экономит количество используемых очищающих агентов. Скорость потока была уменьшена до 200 см/час, чтобы скомпенсировать повышенное падение давления на трех колонках.
Общий выход для этого процесса составил 91%, демонстрируя, что выход с клеточной культуры mAb Z может быть очищен путем закисления, за которым следуют центрифугирование/объемная фильтрация и захват с помощью аффинной хроматографии с белком А, дающие простой процесс захвата mAb.
6.5. Тестирование 3-компонентного состава буферов
Составы буферов, содержащих предварительно определенные смеси аргинина, лимонной кислоты и трегалозы, получали на воде в качестве растворителя. Компоненты варьировали от 0 до 100 мМ.
Рамановские спектры в диапазоне 800-1700 см-1 были получены для аликвот в 15 мл каждой смеси с использованием анализатора RAMANRXN2™ Analyzer (2 спектра/смесь). Параметры спектрального фильтра были установлены как стандартное отклонение (SNV) нормализации интенсивности, коррекция исходной линии первой производной (диапазон) с 15 процентным сглаживанием, и средней разностью центров при среднем значении интенсивности = 0. Это рассматривается как масштабирование данных, а не фильтр спектра. Спектры получали с помощью иммерсионного зонда с временем экспозиции 30 секунд на образец.
Методологию основных компонентов использовали для разработки модели. Модель PLS (проекция частных наименьших квадратов на латентные структуры) были применены к каждому из трех компонентов для определения корреляций между компонентами. Это дает линейную модель, которая переводит спектральную интенсивность (например, от 1700-800 см-1) в концентрацию (a×1+b×2+….+z×900=концентрация). Программным обеспечением, использованным для калибровки результатов, показанных здесь, является GRAMS/AIV 7.02 с дополнением PLSplus/IQ от Thermo Galactic. SIMCA P+ было использовано для многих графиков и создания экспериментальной модели. Образцы были перекрестно валидированы путем устранения двух образцов. Анализ данных проводили так, чтобы стадии тестирования корреляций и перекрестной валидации итерировались, пока межкомпонентные корреляции не оказывались ниже порога ошибки в 2%. Точное количественное определение компонентов буфера (например, в пределах 2%) может быть получено в результате единственного определения.
Калибровочные кривые могут быть получены с помощью Random Mixture Design. 3-компонентная модель, разработанная выше, была использована для генерации предсказаний спектров случайных смесей аргинина, лимонной кислоты и трегалозы (Фиг.11). Эти предсказания сравнивали с реальными спектрами, чтобы подтвердить, что модель находится в пределах допустимого отклонения в ±2%. Эти результаты показаны на Фиг.12 и 13. Независимые измерения были получены на случайных смесях, чтобы подтвердить, что модель может быть использована для проведения измерений.
6.6 Тестирование 4-компонентного состава буферов
Методология Примера 6.5 была применена к составу буферов, содержащих 4 компонента, причем компоненты представляют собой маннитол, метионин, гистидин и Tween™ (полисорбат 80). Спектры, измеренные на предварительно определенных смесях, показаны на Фиг.14-16. Пики находятся в диапазоне от дальней инфракрасной части спектра до средней инфракрасной части. Вследствие ограничений сапфирового покрытия диапазон от 100-800 см-1 может быть в данном конкретном примере не принят во внимание, и калибровка проводилась от 800-1800 см-1.
Модель для 4-компонентной буферной системы была получена таким же образом, как для 3-компонентной модели, полученной в Примере 6.5. Предсказания, основанные на полученной модели, сравнивали с реальными спектрами случайных смесей, чтобы подтвердить, что модель достаточно точна. Результаты показаны на Фиг.17 и 18.
6.7 Тестирование 3-компонентного состава буфера с белком
Методология Примера 6.6 была применена к составу буфера, содержащего 3 компонента вместе с белком в концентрации в диапазоне 0-100 мг/мл. Компоненты представляли собой маннитол, метионин, гистидин и D2E7 (адалимумаб). Измеренные спектры предварительно определенных смесей показаны на Фиг.19-21.
Модель для 3-компонентной буферной системы с белком была получена таким же путем, как для 4-компонентной модели, полученной в Примере 6.6. Предсказания, основанные на полученной модели, сравнивали с реальными спектрами случайных смесей, чтобы подтвердить, что модель достаточно точна. Результаты показаны на Фиг.22. Значения коэффициента смешанной корреляции (R2) и стандартной ошибки перекрестной валидации (SECV) сравнения реальных спектров с предсказанными показаны в Таблице 2 ниже.
6.8 Процесс UF/DF Адалимумаба
Процесс ультрафильтрации/диафильтрации (UF/DF), предназначенный для введения носителя в раствор адалимумаба, показан на Фиг.23. Питающий насос (100) подает пересекающий поток через мембрану тангенциальной поточной фильтрации, переносящий раствор, содержащий адалимумаб, в резервуар за мембраной. Буфер диафильтрации (состав буфера, содержащий метионин, маннитол и гистидин) перекачивается в резервуар так, чтобы соответствовать скорости фильтрации через мембрану (поток жидкости через проницаемую сторону мембраны) (110). Поток материала (120), покидающий питающую емкость, направляется насосом (130) в мембранный модуль (140). Проникающий поток (150), содержащий воду, компоненты буфера и подобное, имеющее сравнительно малый размер молекул, проходит через мембранный модуль. Поток концентрата (160), содержащий концентрированный адалимумаб, направляется в питающую емкость, что контролируется клапаном концентратора (170).
Рамановский зонд (180), совместимый с анализатором RamanRX2™ (190) от фирмы Kaiser Opticals, помещен в питающую емкость, чтобы дать возможность периодически характеризовать содержимое емкости. Полученные спектры, преобразуются в значения концентраций компонентов с помощью калибровочных файлов, и, таким образом, прохождение процесса диафильтрации может быть отслежено. Кроме того, изменения концентраций носителя, которые происходят вследствие повышения концентрации белка (вызванные доннановским эффектом и эксклюзионным эффектом заряда) могут быть отслежены и необязательно проконтролированы. Другие рамановские системы, помимо анализатора RamanRX2™, также могут быть использованы, чтобы охарактеризовать в реальном времени образцы из процесса ультрафильтрации/диафильтрации на регулярной основе как часть контроля качества процесса очистки адалимумаба. Например, результаты рамановского анализа могут быть использованы, чтобы определить завершение процесса диафильтрации и финальные концентрации носителя.
Смесь гистидина, маннитола и метионина была диафильтрована через UF/DF мембрану. Рамановский зонд был помещен в резервуар концентрата. Рамановские спектры получали через определенные интервалы, причем каждая точка состояла из 30-секундной экспозиции, повторенной 10 раз (10 сканирований). Фиг.24-25 показывают изменение концентрации в ходе диафильтрации. Как ожидалось, концентрации индивидуальных компонентов повышались в ходе диафильтрации, достигая плато.
Фиг.24-25 показывают результаты отслеживания в реальном времени процесса диафильтрации. На Фиг.24 концентрации сахара, буфера и аминокислоты даны для различных времен диафильтрации. Как показано на Фиг.24 и 25, аминокислота представляет собой метионин, а концентрация (мМ) нанесена по оси «y», сахар представляет собой маннитол, вес/объем % нанесен по оси «y», а буфер представляет собой гистидин, и его концентрация (мМ) нанесена по оси «y». По оси «x» для каждого из графиков на Фиг.24-25 нанесено время удерживания, на которых концентрации с 0 до 81 минуты были измерены и нанесены по оси «x».
Далее, адалимумаб, присутствующий в воде в концентрации приблизительно 40 мг/мл, был диафильтрован в растворе сахара в 7 объемах диафильтрации через мембрану UF/DF на 5 килодальтон (0,1 кв. м). Рамановский зонд был помещен в резервуар концентрата. Рамановские спектры были получены через определенные интервалы, причем каждая точка состоит из 30-секундного времени экспозиции, повторенного 10 раз (10 сканирований). Затем белок был сконцентрирован до 140 г/л.
Фиг.26 дает данные калибровки, полученные на системе сахар/белок (маннитол/адалимумаб), которые были использованы в системе UF/DF и измерены, как описано выше. Калибровочная кривая на Фиг.26 была использована, чтобы определить концентрации маннитола и адалимумаба на Фиг.27 и 28. Фиг.27 и 28 показывают изменения концентрации сахара в ходе диафильтрации. График справа показывает концентрацию белка в ходе диафильтрации и последующей ультрафильтрации. На Фиг.27 и 28 концентрация сахара (%) нанесена по отношению к объемам удерживания (от нуля до 6), и концентрация адалимумаба (г/л) нанесена по отношению к объемам удерживания (от нуля до 6).
Как и ожидалось, концентрация сахара нарастает в ходе диафильтрации, достигая плато. Белок достигает целевой концентрации. На Фиг.27 использована модель, откалиброванная на 50 г/л. Фиг.28 показывает концентрации сахара и белка, рассчитанные с помощью калибровок, полученных с 120 г/л смесями белка и сахара.
Адалимумаб, присутствующий в воде в концентрации приблизительно 20 мг/мл, был диафильтрован в раствор гистидина (50 мМ) в 7 объемах диафильтрации через UF/DF мембрану на 5 килодальтон (0,1 кв. м). Рамановский зонд был помещен в резервуар концентрата. Рамановские спектры были получены через определенные интервалы, каждая точка состояла из 30-секундной экспозиции, повторенной 10 раз (10 сканирований). Затем белок концентрировали до 50 г/л. Фиг.29 дает калибровочные данные, полученные на системе буфер (гистидин)/белок (адалимумаб). Это представляет собой калибровочную модель для смеси гистидин/адалимумаб до 50 г/л белка. Фиг.30 дает график объемов диафильтрации (от 0 до 6 объемов диафильтрации) по отношению к концентрациям гистидина (нМ) и адалимумаба (г/л) для низких концентраций буфера и белка в системе буфер/белок.
Графики показывают изменения концентрации в ходе диафильтрации гистидина (нМ). График справа показывает концентрацию белка (г/л) в ходе диафильтрации, а затем последующей ультрафильтрации. Как и ожидалось, концентрация сахара возрастала в ходе диафильтрации, достигая плато. Белок достигал целевой концентрации. На этом графике (Фиг.29) использована модель, откалиброванная на 50 г/л. Концентрация на графике были ниже, чем ожидалось, вследствие ограничений модели, которые впоследствии были определены как относящиеся к ионизации гистидина. Модели могут коррелировать ионизированное состояние гистидина с реальной общей концентрацией гистидина и свойствами раствора.
Данные демонстрируют возможность отслеживать низкие и высокие концентрации при операциях UF/DF с белком и единственным дополнительным компонентом. Концентрации могут считываться каждые 3 минуты, давая, таким образом, способность отслеживать концентрации в реальном масштабе времени (или близко к реальному масштабу времени). В системе сахар/белок была получена очень высокая точность в отношении сахара при всех концентрациях белка. В системе буфер/белок высокая точность в отношении буфера была получена при высоких концентрациях буфера и низких концентрациях белка. Способность детектировать и измерять объемно-эксклюзионные эффекты и доннановские эффекты также обеспечена в реальном времени (или близко к реальному времени). Таким образом, Рамановская спектроскопия пригодна в качестве инструмента для измерений концентрации носителя в растворах белка и также дает возможность измерять концентрации белка в дополнение к концентрациям носителя, чтобы обеспечить контроль процесса.
6.9 Тестирование 2-компонентного состава буферов с белком
Методология Примера 6.5 была применена к составу буферов, содержащих 2 компонента, Трис и ацетат, а также белок Адалимумаб. Компоненты были включены в нижеследующих диапазонах: Трис 50-160 мМ; ацетат 30-130 мМ; и Адалимумаб 4-15 г/л.
Калибровочные кривые могут быть получены, как описано в Примере 6.5. Модели, разработанные выше, были использованы для получения предсказаний спектров смесей Триса, ацетата и Адалимумаба в образцах, полученных в соответствии с концентрациями из Таблицы 3:
Эти предсказания сравнивали с реальными спектрами, чтобы подтвердить, что модель находится в пределах допустимых погрешностей. Результаты показаны на Фиг.31 A-C.
6.10 Тестирование выхода белка с клеточной культуры
Методология Примера 6.5 была применена к химически определенной среде, собранной с культуры клеток, содержащей компоненты Tween™ и белок адалимумаб. Среда клеточной культуры была собрана с партии клеточной культуры, отфильтрована и загружена на колонку с белком А. Элюат с колонки с белком А собирали, а затем фильтровали в стерильных условиях перед хранением и тестированием.
Эта методология должна использоваться, чтобы определить момент окончания загрузки колонки с белком А. Отфильтрованный выход с клеточной культуры должен быть нанесен на захватывающую колонку (обычно с белком А). Современный способ отслеживания выхода с загруженной колонки использует поглощение на A280. Выход с клеточной культуры, однако, содержит множество компонентов, которые поглощают свет на длине волны 280 нм. Поглощение A280 обычно интенсивно, что указывает на то, что способ не дает возможности измерить выход антитела в фазе загрузки колонки.
Рамановский спектрометр дает возможность специфического измерения антитела в выходящем потоке из загружаемой колонки (элюат колонки). Этот тест имитирует предлагаемое измерение антитела в реальном времени путем введения различных концентраций очищенного антитела являющегося активным фармакологическим ингредиентом (API) лекарственного средства (например, Адалимумаб) в объем элюата белка А. Образец API, использованный для экспериментов по введению, содержал 0,1% Tween™. В ходе прямых экспериментов по введению концентрация Tween™ должна меняться прямопропорционально с антителом и может быть ошибочно принята за антитело при рамановской спектральной калибровке. Чтобы устранить это, Tween™ рассматривали как дополнительный компонент и вводили независимо от концентраций антитела. Компоненты были, следовательно, включены в нижеследующих диапазонах: Tween™ 0,1-1,0% и Адалимумаб 0,1-1,0 г/л.
Калибровочные кривые могут быть получены, как описано в Примере 6.5. Модели, разработанные выше, были использованы для получения предсказаний спектров смесей Tween™ и Адалимумаба в образцах, полученных в соответствии с концентрациями в Таблице 4:
Эти предсказания сравнивали с реальными спектрами, чтобы подтвердить, что модель укладывается в предварительно определенные допустимые погрешности. Результаты показаны на Фиг.32A-B.
6.11 Тестирование детектирования агрегации антител
Два антитела (D2E7 и ABT-874) агрегировали отдельно друг от друга с помощью фотоиндуцированной сшивки немодифицированных белков (PICUP). Антитела подвергались воздействию агрегирующего источника света 0-4 часа (Фиг.33 и 34), и агрегацию количественно определяли с помощью эксклюзионной хроматографии (SEC). Образцы были измерены с помощью Рамановской спектроскопии, и спектры смоделированы с помощью способа главных компонент (PCA) (Фиг.35 и 36) и анализа частных наименьших квадратов PLS (Фиг.37A и 37B). Фиг.35 и 36 показывают, что агрегировавшие образцы имеют разные значения главных компонентов и могут быть различены от агрегатов с помощью Рамановской спектроскопии. Фиг.37A и 37B показывают некоторую корреляцию между результатами Рамановской спектроскопии и измерениями SEC.
В настоящем описании процитированы различные публикации, содержание которых таким образом включено в настоящее описание во всей своей полноте.
Реферат
Изобретение относится к области биохимии. Описан способ получения препарата белка из образца смеси, содержащей белок, являющийся целью выделения, и по меньшей мере один НСР. Способ включает в себя стадии проведения анализа Рамановской спектроскопии указанного образца смеси; приведение указанного образца смеси в контакт с аффинной хроматографической смолой в хроматографическом разделении с псевдодвижущимся слоем; сбор хроматографического образца; и проведение анализа Рамановской спектроскопии указанного хроматографического образца для идентификации его как препарата, являющегося целью выделения, с уменьшенным НСР, где указанный белок, являющийся целью выделения, представляет собой антитело или его антигенсвязывающую часть. Изобретение расширяет арсенал средств для очистки белков. 8 з.п. ф-лы, 41 ил., 4 табл., 11 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ очистки антител

Комментарии