Аффинная хроматография с применением fc-рецепторов - RU2624128C2
Код документа: RU2624128C2
Чертежи


















Описание
В данном документе описано применение колонки для аффинной хроматографии с иммобилизованным человеческим неонатальным Fc-рецептором в качестве лиганда для аффинной хроматографии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Иммуноглобулин обычно содержит два так называемых полипептида легкой цепи (две легкие цепи) и два так называемых полипептида тяжелой цепи (две тяжелые цепи). В состав каждого из полипептидов тяжелой и легкой цепи входит вариабельный домен (вариабельный участок) (как правило, N-концевая область полипептидной цепи), содержащий связывающие участки, способные взаимодействовать с антигеном. Каждый из полипептидов легкой и тяжелой цепи содержит константный участок (как правило, в С-концевой области). Константный участок тяжелой цепи опосредует связывание антитела i) с клетками, несущими рецептор для Fc-фрагмента IgG (Fc-гамма рецептор, или FcγR), например, фагоцитами, или ii) с клетками, несущими неонатальный Fc-рецептор (FcRn), также известный как рецептор Брамбелла. Он также опосредует связывание с некоторыми факторами, в т.ч. с факторами классического пути активации комплемента, например, с компонентом C1q.
Неонатальный Fc-рецептор (FcRn) также известен как рецептор, подобный молекулам главного комплекса гистосовместимости (ГКГС) класса I (см. обзор Ward, E.S. and Ober, R.J., Advances in Immunology 103 (2009) 77-115). Исследования показали, что этот рецептор служит для регуляции уровней IgG и его распределения в организме на протяжении взрослой жизни (Ghetie, V., et al., Nat. Biotechnol. 15 (1997) 637-640; Israel, E.J., Immunology 89 (1996) 573-578; Junghans, R.P. and Anderson, C.L., Proc. Natl. Acad. Sci. USA 93 (1996) 5512-5516), а также выполняет множество других функций в различных типах клеток и тканей (см., например, Akilesh, S., et al., Proc. Natl. Acad. Sci. USA 105 (2008) 967-972; Dickinson, B.L., et al., J. Clin. Invest. 104 (1999) 903-911; Kim, H., et al., Invest. Ophthalmol. Vis. Sci. 49 (2008) 2025-2029; Spiekermann, G.M., et al., J. Exp. Med. 196 (2002) 303-310; Zhu, X., et al., J. Immunol. 166 (2001) 3266-3276). Ортологи FcRn выделены у многих биологических видов, включая мышь, крысу, человека, овцу, корову, поссума, свинью и верблюда (Adamski, F.M., et al., Mol. Immunol. 37 (2000) 435-444; Ahouse, J.J., et al., J. Immunol. 151 (1993) 6076-6088; Kacskovics, I., et al., J. Immunol. 164 (2000) 1889-1897; Kacskovics, I., et al., Dev. Comp. Immunol. 30 (2006) 1203-1215; Kandil, E., et al., J. Immunol. 154 (1995) 5907-5918; Mayer, В., et al., Immunology 107 (2002) 288-296; Schnulle, P.M. and Hurley, W.L., Vet. Immunol. Immunopathol. 91 (2003) 227-231; Simister, N.E. and Mostov, K.E., Nature 337 (1989) 184-187; Story, С.М., et al., J. Exp. Med. 180 (1994) 2377-2381), что свидетельствует о том, что данный рецептор присутствует практически у всех видов млекопитающих. Многочисленные функции FcRn обусловлены его способностью «сортировать» IgG, предотвращая его деградацию в лизосомах клеток, и высвобождать связанный IgG после переноса через плазматическую мембрану в процессе экзоцитоза (Ober, R.J., et al., Proc. Natl. Acad. Sci. USA 101 (2004) 11076-11081; Ober, R.J., et al., J. Immunol. 172 (2004) 2021-2029; Prabhat, P., et al., Proc. Natl. Acad. Sci. USA 104 (2007) 5889-5894). Кроме того, благодаря возможности регулировать оборот и поведение IgG in vivo вначале появились сообщения о конструировании антител с увеличенным временем полужизни в организме мышей (Ghetie et al., см. выше), которые придали импульс для развития целой области биофармацевтической индустрии, представляющей особый интерес (DallʹAcqua, W.F., et al., J. Biol. Chem. 281 (2006) 23514-23524; Hinton, P.R., et al., J. Biol. Chem. 279 (2004) 6213-6216; Hinton, P.R., et al., J. Immunol. 176 (2006) 346-356; Shields, R.L., et al., J. Biol. Chem. 276 (2001) 6591-6604).
В WO 2005/047327 описаны варианты полипептидов, связывающихся с неонатальным Fc-рецептором (FcRn), димерные белки, связывающие Fc и способы, относящиеся к ним. Варианты полипептидов с измененной эффекторной функцией описаны в WO 2006/031370. В WO 2009/041643 описан способ изменения изоэлектрической точки антитела вследствие аминокислотной замены в CDR. В WO 2010/048313 описан рекомбинантный FcRn и его варианты для очистки гибридных белков, содержащих Fc. Magistrelli, G., et al. описали надежный способ получения рекомбинантного FcRn в клетках млекопитающих, обеспечивающий его упорядоченную иммобилизацию для исследований связывания IgG (J. Immunol. Meth. in press, available online 12.09.2011).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из аспектов данного описания представляет собой применение иммобилизованного нековалентного комплекса неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) в качестве лиганда для аффинной хроматографии.
Обнаружили, что способы/применения, описанные в данном документе, позволяют разделить, выделить близкородственные виды антител, т.е. различающиеся по одному или по небольшому количеству аминокислотных остатков, и охарактеризовать их свойства in vivo.
Таким образом, различные виды антител, т.е. различающиеся на один аминокислотный остаток, выделенные с помощью описанного здесь способа, можно применять для определения/идентификации аминокислотных остатков, задействованных в связывании FcRn, которые влияют на время полужизни.
Таким образом, способ, описанный в данном документе, позволяет разделять различные варианты одного родительского антитела и определять точное соотношение между такими вариантами, в отличие от известных в настоящее время способов, которые лишь дают информацию о сумме модификаций, а не о каждом виде в отдельности (т.е. для смеси родительского антитела, варианта 1, варианта 2 и варианта 1/2 масс-спектрометрия позволяет определить общее количество молекул, содержащих вариант 1, т.е. вариантов, содержащих единственную модификацию (1), а также вариантов, содержащих обе модификации (1/2)).
Этого можно достичь благодаря i) иммобилизации на хроматографическом носителе полученного рекомбинантным способом FcRn человека вместе с полученным рекомбинантным способом бета-2-микроглобулином человека в сочетании с ii) линейным градиентом pH.
Было обнаружено, что в заданных условиях время удерживания антитела IgG1 дикого типа составляет приблизительно от 42 до 49 минут. В одном воплощении время удерживания антитела или гибридизованного с Fc белка, содержащего Fc-участок подкласса IgG1 дикого типа, составляет приблизительно 45 минут.
Антитело, имеющее модифицированный Fc-участок, слабее связывающийся с FcRn, характеризуется меньшим временем удерживания, тогда как антитело, имеющее модифицированный Fc-участок, прочнее связывающийся с FcRn, характеризуется большим временем удерживания. В одном воплощении нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) связан с твердой фазой. В одном воплощении твердая фаза представляет собой хроматографический материал. В одном воплощении нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) биотинилирован, а твердая фаза покрыта стрептавидином.
В одном воплощении применяют аффинную хроматографию с градиентом pH. В одном воплощении градиент pH представляет собой изменение pH от первого значения до второго значения, где первое значение pH составляет приблизительно от pH 3,5 приблизительно до pH 7,5, а второе значение pH составляет приблизительно от pH 6,0 приблизительно до pH 9,5. В одном воплощении градиент pH представляет собой градиент с увеличением значения pH или градиент с уменьшением значения pH. В одном воплощении первое значение pH составляет приблизительно pH 5,5, а второе значение pH составляет приблизительно pH 8,8, или первое значение pH составляет приблизительно pH 7,4, а второе значение pH составляет приблизительно pH 6,0.
В одном воплощении бета-2-микроглобулин происходит из того же биологического вида, что и FcRn.
В одном воплощении применение представляет собой определение времени полужизни анитела in vivo путем определения соотношения времени удерживания антитела и референтного антитела.
В одном воплощении применение представляет собой разделение антител или химерных полипептидов, по меньшей мере содержащих Fc-участок.
В одном воплощении применение представляет собой определение окисленного метионина в составе антитела.
В одном воплощении применение представляет собой определение степени олигомеризации антитела.
В одном воплощении применение представляет собой скрининг библиотеки модифицированных антител или модифицированных химерных полипептидов родительского антитела или родительского химерного полипептида, содержащего по меньшей мере связывающую FcRn часть Fc-участка, на модифицированные антитела или модифицированные химерные полипептиды, у которых аффинность связывания с FcRn изменена по сравнению с родительским антителом или родительским химерным полипептидом.
В одном воплощении применение представляет собой выявление антител или химерных полипептидов, содержащих по меньшей мере связывающую FcRn часть Fc-участка, демонстрирующих измененное связывание неонатального Fc-рецептора.
В одном воплощении антитело представляет собой моноспецифическое антитело или фрагмент антитела или химерный полипептид, или биспецифическое антитело или антительный фрагмент химерного полипептида, или триспецифическое антитело или антительный фрагмент химерного полипептида, или тетраспецифическое антитело или антительный фрагмент химерного полипептида.
В одном воплощении применение представляет собой удаление половинных молекул антител из препарата IgG.
В одном воплощении применение представляет собой удаление агрегатов антител и олигомеров антител из препаратов IgG.
Один аспект данного описания представляет собой вариант с модификацией Fc-участка иммуноглобулина человека изотипа IgG1, в котором в позиции 252 произведена замена аминокислоты метионина на гистидин, а в позиции 428 произведена заменена аминокислоты метионина на глутаминовую кислоту.
Один аспект данного описания представляет собой способ отбора антитела с заданным временем полужизни in vivo, в котором проводят хроматографирование и отбирают антитело, у которого время удерживания находится в заданном диапазоне относительно IgG1 дикого типа.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
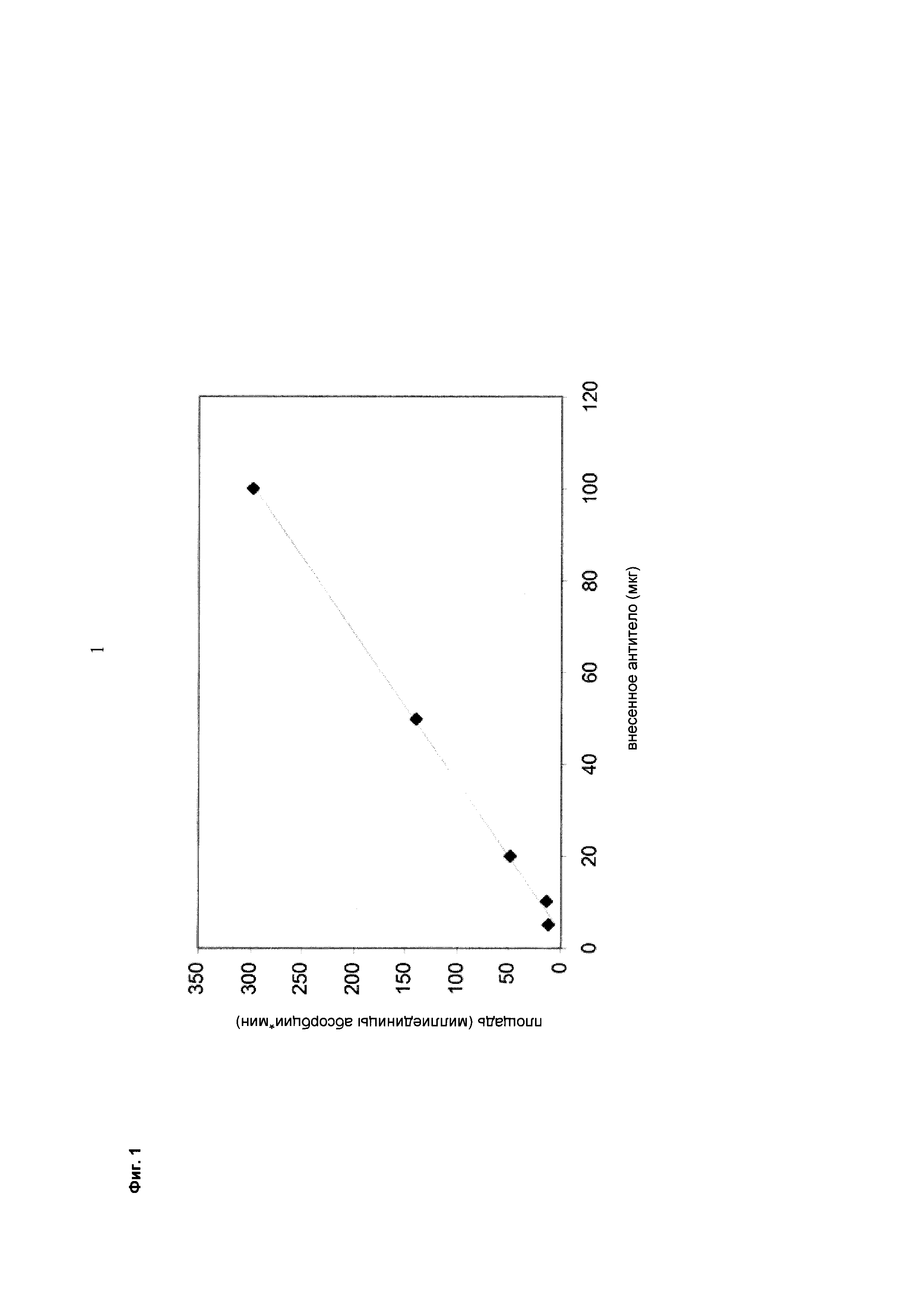
Фиг. 1 Линейная зависимость площади под кривой от внесенного количества антитела при хроматографии с использованием колонки с иммобилизованным FcRn согласно данному описанию.
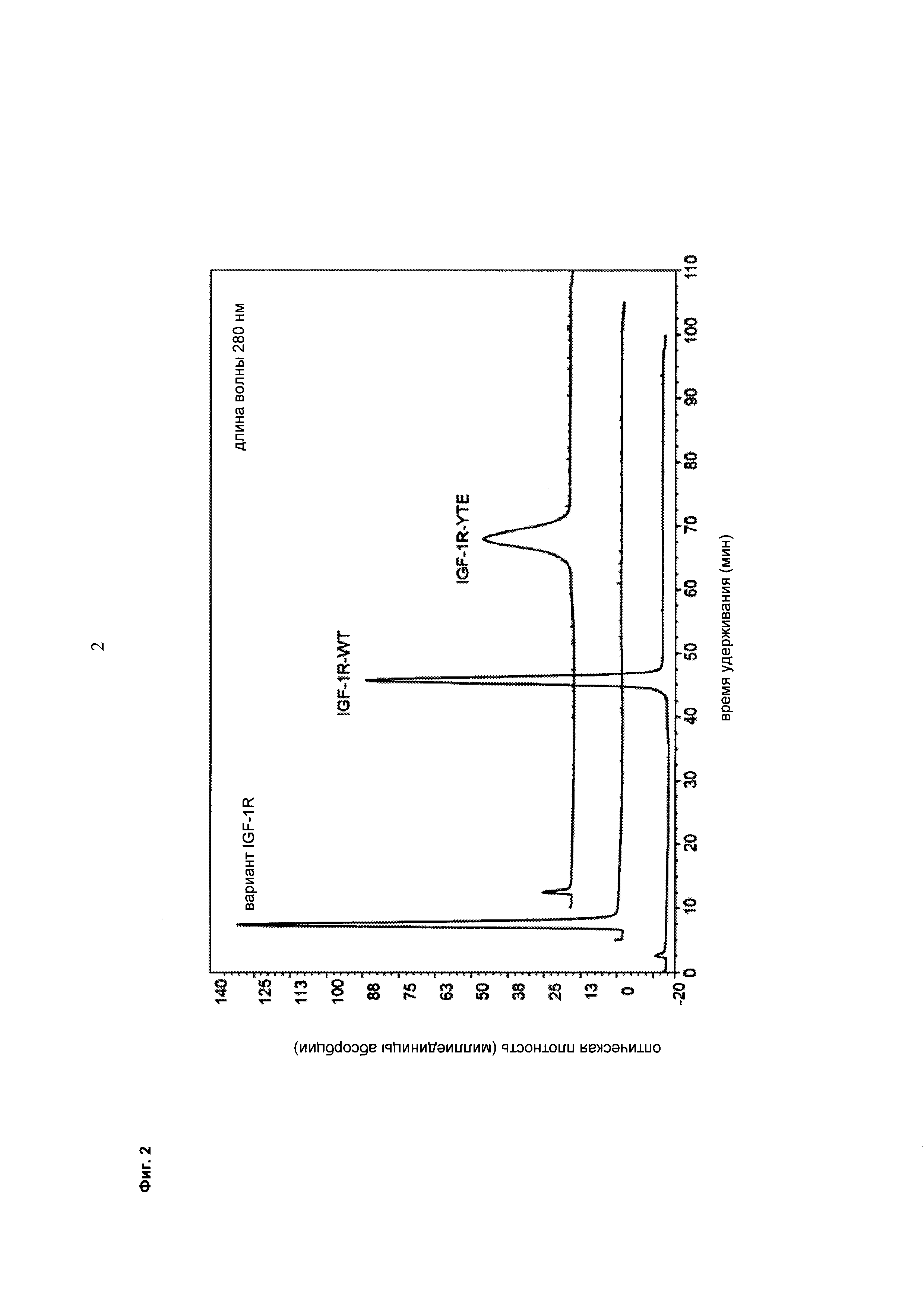
Фиг. 2 Хроматография анти-IGF-1R антитела дикого типа и с мутацией YTE на колонке с иммобилизованным FcRn согласно данному описанию.
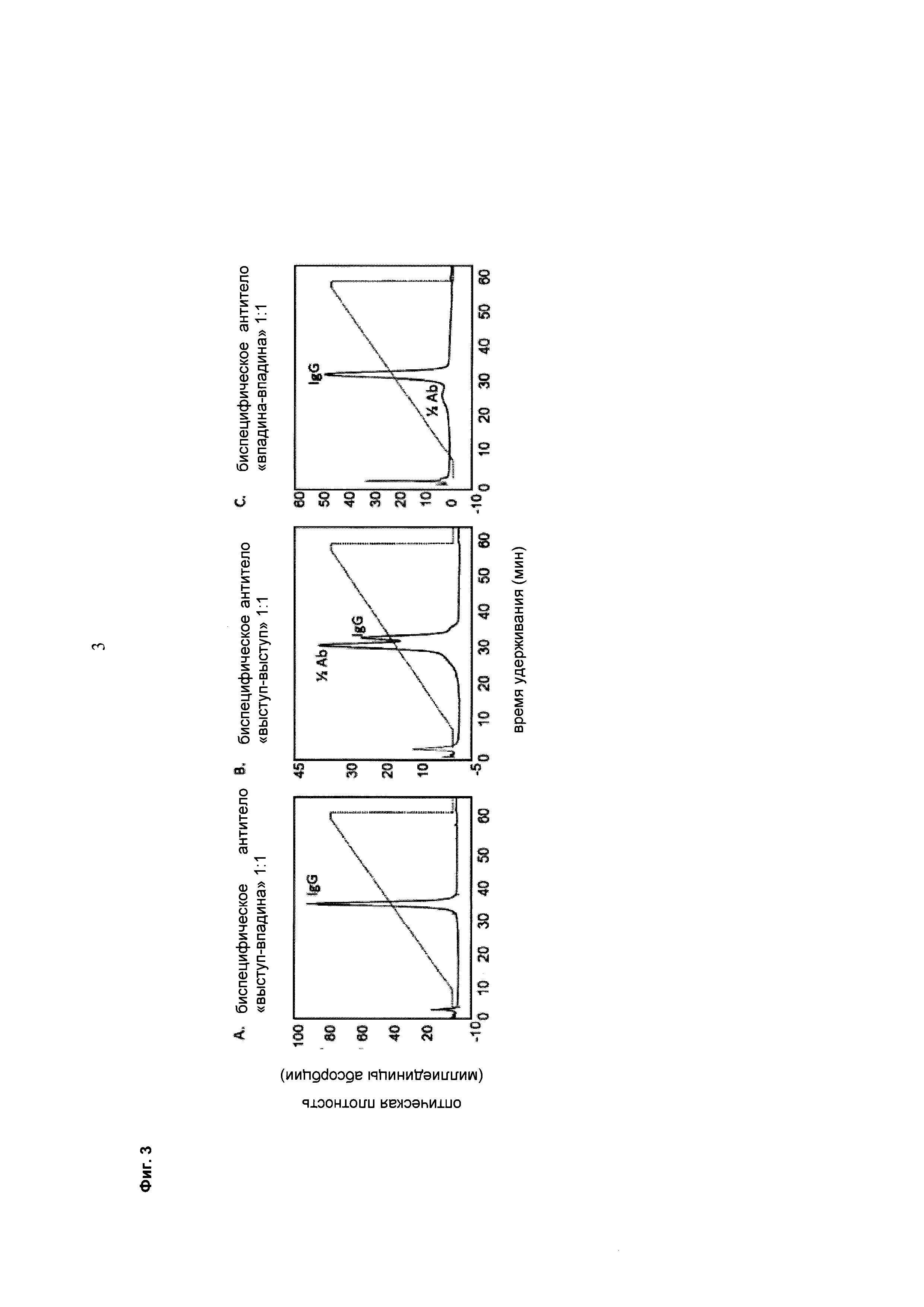
Фиг. 3 Хроматография с применением FcRn (А/В/С верхний ряд) различных препаратов антител с различным содержанием половинных молекул антител, о котором свидетельствуют результаты капиллярного электрофореза в присутствии додецил-сульфата натрия (CE-SDS) (А/В/С нижний ряд).
Фиг. 4 Хроматография с применением FcRn различных препаратов антител с различным содержанием мономеров и агрегатов антител.
Фиг. 5 Зависимость времени удерживания при хроматографии с применением FcRn от количества Fc-участков в молекуле, которая подвергается хроматографическому анализу.
Фиг. 6 Влияние окисления антитела на время удерживания при хроматографии с применением FcRn.
Фиг. 7 Хроматография антитела дикого типа и антитела с мутацией НЕ, распознающих бета-амилоидный белок, на колонке с иммобилизованным FcRn согласно данному описанию.
Фиг. 8 Влияние окисления Met252 и Met428 на взаимодействие с FcRn. При загрузке образца антитела IgG1, хранившегося в течение 2 мес при 40°C (кривая 2), в колонку с иммобилизованным FcRn элюирование происходит быстрее и наблюдается два пика, что указывает на присутствие окисленных форм антитела IgG1, тогда как при загрузке образцов антитела IgG1, хранившихся в течение 2 мес при 25°C (кривая 1) и при -80°C (кривая 3), в колонку с иммобилизованным FcRn элюирование происходит медленнее, при этом пики по существу перекрываются. Условия хроматографии: буфер А (20 мМ MES, 150 мМ NaCl, pH 5,5), буфер В (20 мМ HEPES, 150 мМ NaCl, pH 8,2), скорость 0,5 мл/мин, градиент буфер А→буфер В: 60 мин (стандартные условия).
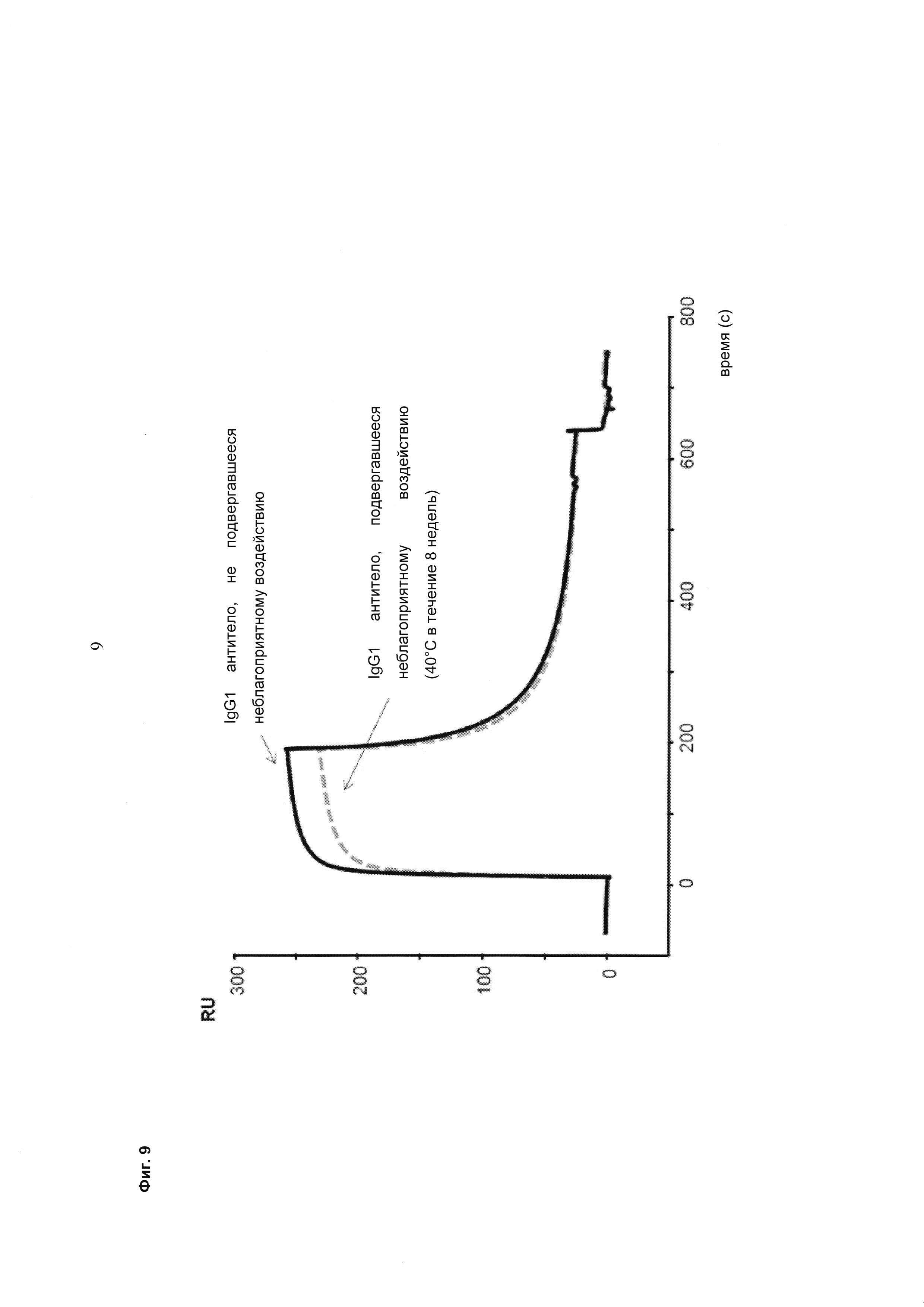
Фиг. 9 Исследование IgG1 антитела, подвергшегося неблагоприятному воздействию, методом поверхностного плазмонного резонанса (SPR, от англ. Surface plasmon resonance). При внесении образца антитела IgG1, хранившегося в течение 2 мес при 40°C, в биосенсор BIAcore для анализа методом SPR получали различные сенсограммы для антител IgG1 дикого типа и с окисленными Met252 и Met428.
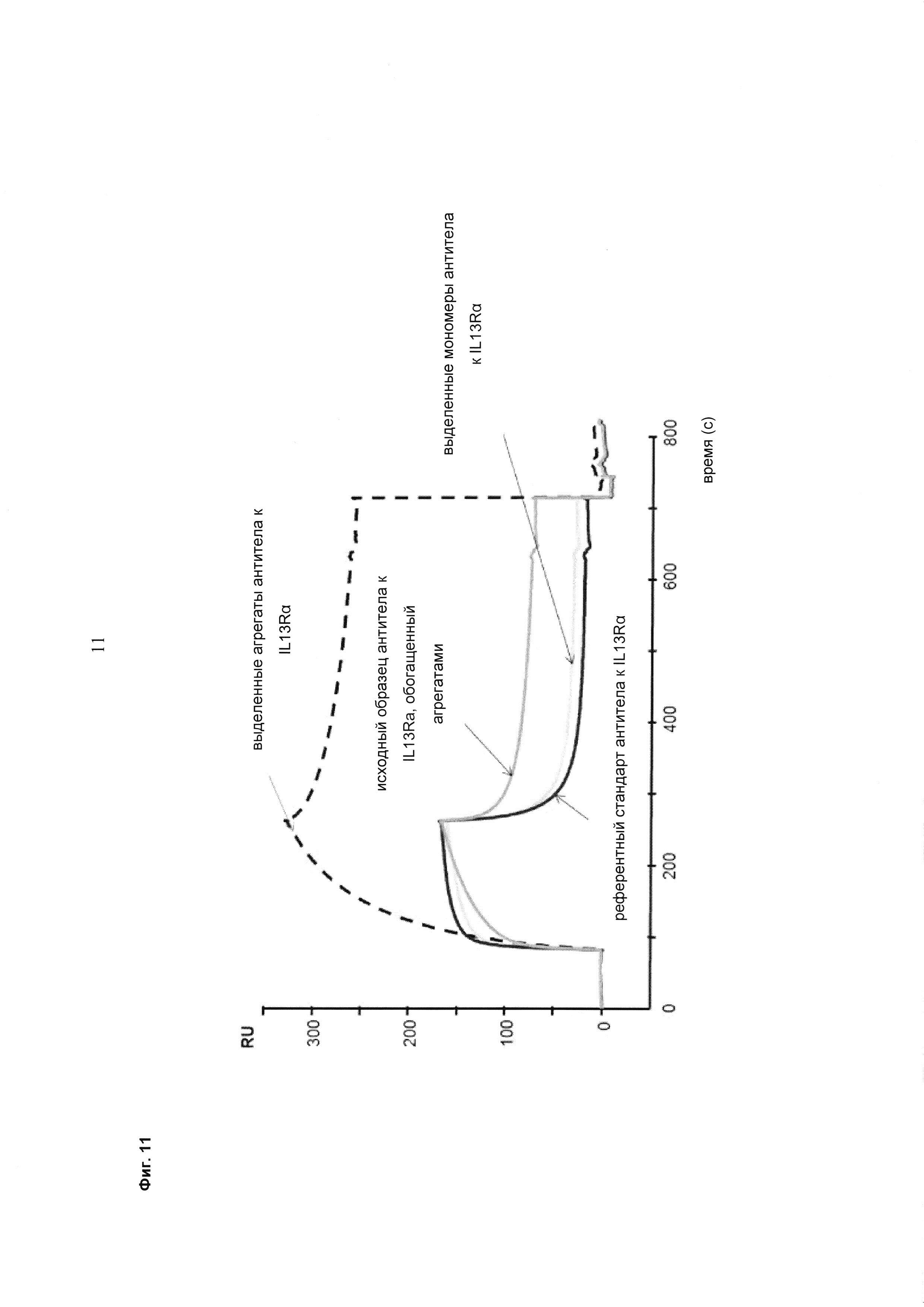
Фиг. 10 Влияние агрегатов антител на взаимодействие с FcRn. Анализ исходного образца антитела к IL13Rα, его выделенных мономеров и выделенных агрегатов с помощью хроматографии с применением FcRn. Условия хроматографии: буфер А (20 мМ MES, 150 мМ NaCl, pH 5,5), буфер В (20 мМ Tris/HCl, 150 мМ NaCl, pH 8,8), скорость потока 0,5 мл/мин, градиент буфер А→буфер В: 50 мин (стандартные условия).
Фиг. 11 Исследование агрегатов антитела к IL13Rα методом SPR. Сенсограммы референтного стандарта антитела к IL13Rα, (кривая 1), исходного образца (3), выделенных мономеров антитела к IL13Rα (кривая 2) и выделенных агрегатов антитела к IL13Rα (кривая 4).
Фиг. 12 Влияние мутаций Fc на фармакокинетику у мышей, трансгенных по FcRn. Группы, в каждую из которых входило по 8 животных, получали антитело дикого типа или его вариант с тройной мутацией YTE однократно в виде внутривенной болюсной инъекции в дозе 10 мг/кг. Результаты представлены как среднее ± стандартное отклонение (SD), значимость различий с антителом дикого типа исследовали методом дисперсионного анализа (+++, р<0,001). А: площадь под кривой зависимости сывороточной концентрации от времени в интервале от 0 до 672 ч (AUC(0-672)). В: время полужизни.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Неонатальный Fc-рецептор (FcRn) играет важную роль в метаболизме антител IgG in vivo.
Аффинная хроматография с применением FcRn позволяет разделить образцы IgG по площади их пиков и профилю времени удерживания. С ее помощью можно исследовать взаимодействие между FcRn и IgG in vitro и получить представление о структурных и функциональных особенностях IgG, используемых в терапевтических целях, влияющих на их фармакокинетику in vivo.
Таким образом, аффинную хроматографию с применением FcRn можно использовать как полуколичественный анализ, позволяющий прогнозировать фармакокинетику IgG дикого типа и его мутантных форм in vivo. Кроме того, аффинную хроматографию с применением FcRn можно использовать для изучения взаимодействия между FcRn и IgG, например, для изучения характеристик партий IgG или для проведения сравнительных исследований.
Найдены условия стандартизованного метода жидкостной аффинной хроматографии с применением FcRn и градиента pH, позволяющие воспроизвести механизм взаимодействия между IgG и FcRn in vivo. Человеческий FcRn иммобилизуют на колонке в качестве аффинного лиганда и создают линейный градиент pH, например от pH 5,5 до 8,8.
Например, аналитическая аффинная хроматография с применением FcRn позволяет выявить и охарактеризовать образцы IgG и варианты по паттернам пиков и профилю времени удерживания. Способ позволяет различить 1) одинаковые IgG с различными Fab фрагментами, 2) окисленные и неокисленные формы IgG, 3) агрегаты и мономеры, а также 4) антитела с различиями в области Fc-участка.
Было обнаружено, что при аффинной хроматографии с применением FcRn изменение профиля элюирования вариантов IgG (вариантов с модификациями Fc-участка) относительно профиля IgG дикого типа позволяет спрогнозировать фармакокинетический профиль in vivo. Эти результаты указывают, что аффинная хроматография с применением FcRn является новым способом, который может найти применение в исследовании взаимодействия FcRn-IgG, целостности IgG и главным образом IgG как таковых.
I. Определения
Термин "приблизительно" обозначает диапазон +/-20% от указанного далее численного значения. В одном воплощении термин "приблизительно" обозначает диапазон +/-10% от указанного далее численного значения. В одном воплощении термин "приблизительно" обозначает диапазон +/-5% от указанного далее численного значения.
Термин "модификация" обозначает замену, добавление или делецию одного или нескольких аминокислотных остатков родительского антитела или химерного полипептида, содержащего по меньшей мере связывающую FcRn часть Fc-участка с получением модифицированного антитела или химерного полипептида.
Термин "аминокислотная замена" обозначает замещение по меньшей мере одного существующего аминокислотного остатка другим отличающимся аминокислотным остатком (замещающим аминокислотным остатком). Замещающий аминокислотный остаток может представлять собой "протеиногенный аминокислотный остаток" и быть выбранным из группы, состоящей из аланина (трехбуквенный код: ala, однобуквенный код: А), аргинина (arg, R), аспарагина (asn, N), аспарагиновой кислоты (asp, D), цистеина (cys, С), глутамина (gin, Q), глутаминовой кислоты (glu, Е), глицина (gly, G), гистидина (his, Н), изолейцина (ile, I), лейцина (leu, L), лизина (lys, К), метионина (met, М), фенилаланина (phe, F), пролина (pro, Р), серина (ser, S), треонина (thr, Т), триптофана (trp, W), тирозина (tyr, Y) и валина (val, V).
Термин "вставка аминокислоты" обозначает включение по меньшей мере одного аминокислотного остатка в заданной позиции аминокислотной последовательности. В одном воплощении вставка представляет собой вставку одного или двух аминокислотных остатков. Вставленный(е) аминокислотный(е) остаток (остатки) может (могут) быть протеиногенным(и) и непротеиногенным(и).
Термин "делеция аминокислоты" обозначает удаление по меньшей мере одного аминокислотного остатка в заданной позиции аминокислотной последовательности.
Термин "антитело" в данном описании используется в широком смысле и включает антитела с различной структурой, включая моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют способность связывать FcRn.
Термин "буферное вещество" обозначает вещество, которое, будучи в растворе, способно препятствовать изменениям значения pH раствора, например, при добавлении или высвобождении веществ с кислотными или основными свойствами.
Термин "CH2 домен" обозначает часть полипептида тяжелой цепи антитела, которая находится приблизительно между позициями 231 и 340 (нумерация по системе EU согласно Kabat). В одном воплощении CH2 домен имеет аминокислотную последовательность SEQ ID NO: 1: APELLGG PSVFLFPPKP KDTLMISRTP EVTCVWDVS HEDPEVKFNW YVDGVEVHNA KTKPREEQE STYRWSVLT VLHQDWLNGK EYKCKVSNKA LPAPIEKTIS KAK.
Термин "CH3 домен" обозначает часть полипептида тяжелой цепи антитела, которая находится приблизительно между позициями 341 и 446 (нумерация по системе EU). В одном воплощении CH3 домен имеет аминокислотную последовательность SEQ ID NO: 2: GQPREPQ VYTLPPSRDE LTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW QQGNVFSCSV MHEALHNHYT QKSLSLSPG.
Термин "класс" антитела обозначает тип константного домена или константного участка его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, обозначаются α, δ, ε, γ и μ, соответственно.
Термин "Fc-участок человеческого происхождения" обозначает С-концевую область тяжелой цепи иммуноглобулина человека, имеющую в своем составе по меньшей мере часть шарнирного участка, СН2 домен и СНЗ домен. В одном воплощении Fc-участок тяжелой цепи IgG человека располагается между Cys226 или Pro230 и карбокси-концом тяжелой цепи. В одном воплощении Fc-участок имеет аминокислотную последовательность SEQ ID NO: 10. При этом С-концевой лизин (Lys447) Fc-участка может присутствовать или отсутствовать. Если не указано иначе, нумерация аминокислотных остатков Fc-участка или константного участка приведена в соответствии с системой нумерации EU, также обозначаемой EU индекс, согласно описанию Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
Термин "FcRn" обозначает неонатальный Fc-рецептор человеческого происхождения. Функция FcRn заключается в защите IgG от деградации в лизосомах, в результате приводящей к уменьшению его клиренса и увеличению времени полужизни. FcRn представляет собой гетеродимерный белок, состоящий из двух полипептидов: белка с молекулярной массой 50 кДа, подобного молекулам главного комплекса гистосовместимости класса I (α-FcRn), и β2-микроглобулина (β2m) с молекулярной массой 15 кДа. FcRn связывается с высокой аффинностью с CH2-CH3 частью Fc домена IgG. Взаимодействие между IgG и FcRn строго зависит от pH и характеризуется стехиометрическим соотношением 1:2, при этом одна молекула IgG при помощи двух тяжелых цепей связывается с двумя молекулами FcRn (Huber, А.Н., et al., J. Mol. Biol. 230 (1993) 1077-1083). Связывание FcRn происходит в эндосомах при кислых значениях pH (pH<6,5), а высвобождение IgG происходит на поверхности клеток, обладающих нейтральным значением pH (приблизительно 7,4). pH-зависимая природа взаимодействия способствует защите IgG, проникающих в клетку путем пиноцитоза, от внутриклеточной деградации при связывании с рецептором FcRn в кислой среде эндосом. Затем FcRn способствует возврату IgG на клеточную поверхность и последующему высвобождению в кровоток при экспозиции комплекса FcRn-IgG в окружающую клетку среду с нейтральными значениями pH.
Термин "связывающая FcRn часть Fc-участка" обозначает часть полипептида тяжелой цепи антитела, которая находится приблизительно между позициями EU 243 и EU 261, приблизительно между позициями EU 275 и EU 293, приблизительно между позициями EU 302 и EU 319, приблизительно между позициями EU 336 и EU 348, приблизительно между позициями EU 367 и EU 393, приблизительно в позиции EU 408 и приблизительно между позициями EU 424 и EU 440. В одном воплощении модифицированы один или несколько следующих аминокислотных остатков согласно нумерации EU по Kabat: F243, Р244, Р245 Р, К246, Р247, К248, D249, Т250, L251, М252, I253, S254, R255, Т256, Р257, Е258, V259, Т260, С261, F275, N276, W277, Y278, V279, D280, V282, Е283, V284, Н285, N286, А287, К288, Т289, К290, Р291, R292, Е293, V302, V303, S304, V305, L306, Т307, V308, L309, Н310, Q311, D312, W313, L314, N315, G316, К317, Е318, Y319, I336, S337, К338, А339, К340, G341, Q342, Р343, R344, Е345, Р346, Q347, V348, С367, V369, F372, Y373, Р374, S375, D376, I377, А378, V379, Е380, W381, Е382, S383, N384, G385, Q386, Р387, Е388, N389, Y391, Т393, S408, S424, С425, S426, V427, М428, Н429, Е430, А431, L432, Н433, N434, Н435, Y436, Т437, Q438, К439 и S440 (нумерация EU).
Термин "полноразмерное антитело" обозначает антитело, структура которого по существу схожа со структурой нативного антитела или у которого тяжелые цепи содержат Fc-участок, как описано в данном документе.
Термин "шарнирный участок" обозначает часть полипептида тяжелой цепи антитела, которая связывает CH1 домен и CH2 домен, например, приблизительно от позиции 216 до позиции 230, согласно системе нумерации EU по Kabat. Шарнирный участок обычно представляет собой димер, состоящий из двух полипептидов с идентичной аминокислотной последовательностью. Шарнирный участок обычно содержит приблизительно 25 аминокислотных остатков и обладает подвижностью, что позволяет антигенсвязывающим участкам двигаться независимо. В шарнирном участке можно выделить три домена: верхний, средний и нижний шарнирный домены (Roux, et al., J. Immunol. 161 (1998) 4083).
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" используются взаимозаменяемо и обозначают клетки, в которые была внедрена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают "трансформанты" и "трансформированные клетки", включающие первично трансформированные клетки и их потомков, независимо от числа пассажей. Потомство может быть не полностью идентично родительской клетке по содержанию нуклеиновой кислоты, но может иметь мутации. Сюда также включаются мутантные потомки, обладающие такими же функциями или биологической активностью при скрининге или отборе, как и исходные трансформированные клетки.
"Гуманизированное" антитело обозначает химерное антитело, содержащее аминокислотные остатки гипервариабельных участков (HVR, от англ. hypervariable regions) и аминокислотные остатки каркасных участков (FR, от англ. framework regions). В некоторых воплощениях гуманизированное антитело содержит по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные участки (например, CDR) соответствуют участкам антитела, не являющегося человеческим, и все или по существу все каркасные участки соответствуют участкам человеческого антитела. Гуманизированное антитело может содержать по меньшей мере часть константного участка антитела, полученного из антитела человека. "Гуманизированная форма" антитела, например, антитела не являющегося человеческим, обозначает антитело, прошедшее гуманизацию.
Термин "гипервариабельный участок" или "HVR", используемый в данном описании, обозначает каждый из участков вариабельного домена антитела, имеющих гипервариабельную последовательность и/или формирующих петли определенной структуры ("гипервариабельные петли"). Как правило, нативные антитела, состоящие из четырех цепей, имеют 6 HVR; три в VH (Н1, Н2, H3), и три в VL (L1, L2, L3). Как правило, HVR содержат аминокислотные остатки гипервариабельных петель и/или "участков определяющих комплементаность" (CDR), последние характеризуются наибольшей вариабельностью последовательности и/или задействованы в распознавании антигена. Приведенные в качестве примера гипервариабельные петли находятся между аминокислотными остатками 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (H3). (Chothia, С. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917). Приведенные в качестве примера CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) находятся между аминокислотными остатками 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35В в Н1, 50-65 в Н2 и 95-102 в Н3. (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242). Как правило, CDR содержат аминокислотные остатки, образующие гипервариабельные петли, за исключением CDR1 в составе VH. CDR также включают "остатки, определяющие специфичность" или "SDR," которые представляют собой остатки, контактирующие с антигеном. SDR находятся в составе участков CDR, обозначаемых "укороченными CDR", или a-CDR (от англ. abbreviated-CDRs). Приведенные в качестве примера a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) образованы аминокислотными остатками в положениях 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35В в Н1, 50-58 в Н2 и 95-102 в Н3 (см. Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633). Если не указано иначе, остатки HVR и иные остатки вариабельного домена (например, остатки каркасного участка) в данном документе пронумерованы в соответствии с Kabat et al., см. выше.
"Индивид" или "субъект" является млекопитающим. Млекопитающие включают одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и не относящихся к человеку приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс), но не ограничиваются ими. В определенных воплощениях индивидом или субъектом является человек.
Термин "моноклональное антитело" обозначает антитело, полученное из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны и/или связывают один эпитоп, за исключением возможных вариантов антител, например, содержащих мутации, которые возникают естественным путем или в ходе получения препарата моноклонального антитела, при этом подобные варианты, как правило, присутствуют в минорных количествах. В противоположность препаратам поликлональных антител, обычно содержащим различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против единственной детерминанты или антигена. Таким образом, определение "моноклональное" указывает на характер антитела, полученного из по существу гомогенной популяции антител, и не должно рассматриваться как необходимость получения антитела определенным способом. Например, моноклональные антитела, предназначенные для применения в соответствии с настоящим изобретением, могут быть произведены с помощью различных технологий, включая гибридомную технологию, технологию рекомбинантной ДНК, технологию фагового дисплея и технологии с использованием трансгенных животных, имеющих все локусы человеческих иммуноглобулинов или их часть, но не ограничиваясь ими; данные способы и другие приведенные в качестве примера способы производства моноклональных антител описаны в данном документе.
"Нативные антитела" обозначают молекулы иммуноглобулинов естественного происхождения с различной структурой. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой приблизительно 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидными связями. В направлении от N- к С-концу в каждой тяжелой цепи расположен вариабельный участок (VH), также обозначаемый тяжелым вариабельным доменом или вариабельным доменом тяжелой цепи, за которым следуют три константных домена (СН1, СН2 и CH3). Аналогично, в направлении от N- к С-концу в каждой легкой цепи расположен вариабельный участок (VL), также обозначаемый легким вариабельным доменом или вариабельным доменом легкой цепи, за которым следует легкий константный домен (CL). Легкая цепь антитела может относиться к двум типам, обозначаемым каппа (κ) и лямбда (λ), в зависимости от аминокислотной последовательности ее константного домена.
Термин "непротеиногенный аминокислотный остаток" обозначает аминокислотный остаток, отличный от перечисленных выше протеиногенных аминокислотных остатков, который может быть ковалентно связан с граничащими аминокислотными остатками в полипептидной цепи. Примерами непротеиногенных аминокислотных остатков являются норлейцин, орнитин, норвалин, гомосерин. Другие примеры приведены в публикации Ellman, et al., Meth. Enzym. 202 (1991) 301-336. Примеры способов синтеза непротеиногенных аминокислотных остатков описаны, например, в публикации Noren, et al., Science 244 (1989) 182 и Ellman et al., см. выше.
"Показатель идентичности аминокислотной последовательности (выраженный в процентах)" относительно референтной полипептидной последовательности определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в референтной полипептидной последовательности после выравнивания последовательностей и расстановки пропусков (гэпов), если это необходимо для достижения наибольшего процента идентичности последовательностей, и без принятия каких-либо консервативных замен за часть идентичной последовательности. Выравнивание в целях определения процента идентичности аминокислотной последовательности может выполняться различными способами, известными в данной области техники, например, с помощью общедоступных компьютерных программ, таких как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить надлежащие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей настоящего описания, значения % идентичности аминокислотной последовательности получены при помощи компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была разработана в компании Genentech, Inc., исходный код был представлен вместе с пользовательской документацией в бюро по охране авторских прав США, Washington D.C., 20559, где было зарегистрировано авторское право под номером TXU510087. Доступ к программе ALIGN-2 можно получить в компании Genentech, Inc., South San Francisco, California, или код программы может быть скомпилирован на основе исходного кода. Программа ALIGN-2 должна быть скомпилирована для работы на платформе UNIX, включая платформу digital UNIX V4.0D. Все параметры для сравнения последовательностей заданы программой ALIGN-2 и остаются неизменными.
В случаях, когда для сравнения аминокислотных последовательностей используется ALIGN-2, процент идентичности заданной аминокислотной последовательности А к последовательности В, с последовательностью В, или по сравнению с заданной аминокислотной последовательностью В (что можно также сформулировать как заданная аминокислотная последовательность А, имеющая или содержащая определенный процент идентичной аминокислотной последовательности к последовательности В, с последовательностью В, или по сравнению с заданной аминокислотной последовательностью В) рассчитывается по формуле:
X/Y×100,
где X это число аминокислотных остатков, которые были расценены программой для выравнивания последовательностей ALIGN-2 как абсолютные совпадения при выравнивании А и В в рамках этой программы, и где Y это общее число аминокислотных остатков в В. Следует принимать во внимание, что когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, процент идентичности аминокислотной последовательности А с последовательностью В не будет равен проценту идентичности аминокислотной последовательности В с последовательностью А. Если не указано иначе, все значения % идентичности аминокислотных последовательностей, приведенные в данном документе, получены согласно описанию в предыдущем параграфе о применении компьютерной программы ALIGN-2.
Термин "фармацевтический препарат" относится к препарату, который находится в такой форме, которая обеспечивает эффективное проявление биологической активности содержащегося в нем активного ингредиента, и не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет вводиться препарат.
"Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтическом препарате, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает, буфер, эксципиент, стабилизатор или консервант, но не ограничивается ими.
Термин "восходящий линейный градиент pH" обозначает градиент pH, начальная точка которого находится в области низких (т.е. более кислых) значений pH, а конечная точка которого находится в области более высоких (т.е. менее кислых, нейтральных или щелочных) значений pH. В одном воплощении начальная точка восходящего линейного градиента pH соответствует значению pH приблизительно 5,5, а конечная точка соответствует значению pH приблизительно 8,8.
Термин "нисходящий линейный градиент pH" обозначает градиент pH, начальная точка которого находится в области высоких (т.е. нейтральных или щелочных) значений pH, а конечная точка которого находится в области низких (т.е. нейтральных или кислых) значений pH. В одном воплощении начальная точка нисходящего линейного градиента pH соответствует значению pH приблизительно 7,4, а конечная точка соответствует значению pH приблизительно 6,0.
Используемый в данном документе термин "лечение" (и его грамматические производные, такие как "лечить" или "проводить лечение") обозначает клиническое вмешательство в попытке изменить естественный ход заболевания у индивида, получающего лечение, и могут осуществляться как для профилактики, так и при наличии патологического состояния. Желательные эффекты от лечения включают предупреждение возникновения или повторного проявления заболевания, смягчение симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, предупреждение метастазирования, снижение скорости прогрессирования заболевания, улучшение или временное облегчение состояния, а также ремиссию или улучшение прогноза, но не ограничиваются ими. В некоторых воплощениях антитела по изобретению применяют, чтобы отсрочить развитие заболевания или чтобы замедлить прогрессирование заболевания.
Термин "вариабельный участок" или "вариабельный домен" обозначает домен легкой или тяжелой цепи антитела, задействованный в связывании антитела с антигеном. Вариабельные домены тяжелой и легкой цепей нативного антитела (VH и VL, соответственно), как правило, имеют схожую структуру, каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). (См., например, Kindt, T.J., et al., Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), page 91). Для обеспечения специфичности связывания антигена может быть достаточно одного VH или VL домена. Кроме того, антитела, связывающиеся с конкретным антигеном, можно выделить с использованием VH или VL домена антитела, связывающегося с антигеном, при скрининге библиотеки комплементарных доменов VL или VH, соответственно. См., например, Portolano, S., et al., J. Immunol. 150 (1993) 880-887; Clackson, Т., et al., Nature 352 (1991) 624-628).
Термины "вариант", "модифицированное антитело" и "модифицированный химерный полипептид" обозначают молекулы, у которых аминокислотная последовательность отличается от аминокислотной последовательности родительской молекулы. Как правило, такие молекулы имеют одну или несколько модификаций, вставок или делеций. В одном воплощении модифицированное антитело или модифицированный химерный полипептид содержит аминокислотную последовательность, содержащую по меньшей мере часть Fc-участка, не имеющую естественного происхождения. Идентичность последовательностей таких молекул и родительского антитела или родительского химерного полипептида составляет менее 100%. В одном воплощении идентичность аминокислотной последовательности варианта антитела или варианта химерного полипептида и аминокислотной последовательности родительского антитела или родительского химерного полипептида составляет приблизительно от 75% до менее чем 100%, в частности приблизительно от 80% до менее чем 100%, в частности приблизительно от 85% до менее чем 100%, в частности приблизительно от 90% менее чем до 100%, и в частности приблизительно от 95% до менее чем 100%. В одном воплощении родительское антитело или родительский химерный полипептид и вариант антитела или вариант химерного полипептида различаются по одному (единственному), двум или трем аминокислотному(ым) остатку(ам).
II. Композиции и способы
Человеческий неонатальный Fc-рецептор (FcRn) играет важную роль в катаболизме IgG. Способность/свойство IgG связывать FcRn in vitro указывают на его фармакокинетические свойства in vivo. Такие in vitro методы будут иметь важное значение при создании антител, т.к. позволят избежать многочисленных исследований in vivo (сократить эксперименты на животных, время и расходы). До настоящего времени подобные анализы обычно проводили с использованием поверхностного плазмонного резонанса (SPR, от англ. surface plasmon resonance) (Wang, W., et al., Drug Metab. Disp. 39 (2011) 1469-1477; Datta-Mannan, A., et al., Drug Metab. Disp. 40 (2012) 1545-1555; Vaughn, D.E. and Bjorkman, P.J., Biochemistry 36 (1997) 9374-9380; Raghavan, M., et al., Proc. Natl. Acad. Sci. USA 92 (1995) 11200-11204; Martin, W.L. and Bjorkman, P.J., Biochemistry 38 (1999) 12639-12647). Также для исследования аффинности связывания IgG и FcRn использовали калориметрические методы и методы фракционирования в асимметричных потоках под действием поля (Huber, А.Н., et al., J. Mol. Biol. 230 (1993) 1077-1083; Pollastrini, J., et al., Anal. Biochem. 414 (2011) 88-98). Помимо того, что эти методы сложны в исполнении, в нескольких исследованиях, направленных на установление корреляции между показателями связывания FcRn при оценке методом SPR in vitro и временем полужизни антител в сыворотке in vivo, не удалось продемонстрировать такую корреляцию, несмотря на оптимизацию условий проведения реакций связывания и построение адекватных моделей (Gurbaxani, В., et al., Mol. Immunol. 43 (2006) 1462-1473; Gurbaxani, B.M. and Morrison, S.L, Mol. Immunol. 43 (2006) 1379-1389; Gurbaxani, В., Clin. Immunol. 122 (2007) 121-124). Модификация Fc-участка IgG1, приводящая к улучшению аффинности IgG1 к FcRn при pH 6 и нейтральных значениях pH, зарегистрированному методом SPR, не сопровождалась улучшением фармакокинетических показателей у яванского макака (Yeung, Y.A., et al., J. Immunol. 182 (2009) 7663-7671). При этом умеренное увеличение аффинности к FcRn при pH 6 у варианта IgG1 N434A, не сопровождающееся выраженным связыванием с FcRn при pH 7,4, приводило к улучшению фармакокинетических показателей у приматов, что свидетельствовало о важности высвобождения FcRn при pH 7,4 (см. Yeung, Y.A., выше).
Комбинация известных методов позволит получить аналитические данные, сравнимые с теми, что дает аффинная хроматография с применением FcRn, но при этом процесс будет более сложным и трудоемким.
Существующие в настоящее время стандартные методы не могут адекватно отразить зависимость связывания FcRn от физиологических значений pH, когда для связывания в эндосомах требуются кислые значения pH, а для высвобождения IgG на клеточной поверхности - нейтральные значения pH. Значение pH среды влияет на способность молекулы FcRn к самосборке. Используемые в настоящее время методы применяются в стандартных условиях с постоянным значением pH и, следовательно, позволяют получить статичное изображение сложного взаимодействия FcRn-IgG, при этом невозможно полноценно охарактеризовать динамический процесс взаимодействия между IgG и FcRn. Это также может быть одной из причин отсутствия корреляции между аффинностью к FcRn при исследовании in vitro и фармакокинетическими параметрами in vivo в нескольких исследованиях (см. выше).
Метод SPR дает качественную оценку взаимодействия IgG-FcRn, выявляет прогнозируемые или аномальные связывающие свойства образца, но не позволяет ни установить причину, лежащую в основе аномального связывания, ни провести количественное определение антитела, демонстрирующего аномальное связывание. Масс-спектрометрия тоже позволяет лишь качественно оценить целостность молекулы IgG. Напротив, аффинная хроматография с применением FcRn позволяет проводить анализ образцов в условиях, соответствующих физиологическим, при преобладании стехиометрического соотношения 2:1 над стехиометрическими соотношениями 1:2, 1:1 и 2:2, при оптимизации градиента pH для лучшего разделения отдельных пиков, выявленных в образце. Различные пики можно количественно охарактеризовать по величине их площади под кривой, а элюат, соответствующий каждому пику, подвергнуть вторичном анализу, например, провести функциональные исследования, повторную хроматографию или масс-спектрометрический анализ.
Кроме того, для лечения различных заболеваний, известных на сегодняшний день, а также тех, которые станут известны в будущем, существует необходимость в создании антител и полипептидов, имеющих в своем составе Fc-часть, которые бы обладали заданными характеристиками.
Для получения антител или химерных полипептидов, имеющих в своем составе Fc-часть, с заданной способностью связывать FcRn, в них модифицируют остатки Fc-части, которые задействованы в обеспечении эффекторных функций, и затем исследуют полученные модифицированные антитела и химерные полипептиды. Если необходимые характеристики не достигнуты, тот же процесс повторяют заново.
В одном воплощении Fc-часть представляет собой область Fc-участка, которая опосредует связывание с FcRn.
Таким образом, целесообразно разработать способ, позволяющий прогнозировать изменение свойств модифицированного антитела, используя простой хроматографический метод, и не требующий проведения исследований in vivo для анализа изменений в свойствах модифицированного антитела.
В некоторых случаях требуются антитела с увеличенным временем полужизни. Например, лекарства с увеличенным временем полужизни в кровотоке пациента, нуждающегося в лечении, позволят уменьшить дозировку или увеличить интервал между приемами препарата. Преимуществом таких антител также является увеличение продолжительности воздействия на очаг поражения, например, опухоль.
Одним аспектом данного описания является применение иммобилизованного нековалентного комплекса неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина в качестве лиганда для аффинной хроматографии.
Обнаружили, что колонка для аффинной хроматографии, содержащая иммобилизованный нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина в качестве лиганда для аффинной хроматографии, обладает необычайной стабильностью. Ее можно использовать по меньшей мере более чем в 100 хроматографических циклах, вплоть до 200 хроматографических циклов (уравновешивание - разделение - регенерация) без потери рабочих характеристик (селективности и/или связывающей способности).
Кроме того, предложена колонка для аффинной хроматографии, содержащая матрицу и связанные с матрицей функциональные группы для проведения хроматографии, отличающаяся тем, что связанные с матрицей функциональные группы для проведения хроматографии представляют собой нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулин.
Один аспект данного описания представляет собой применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для определения времени полужизни антитела in vivo путем определения соотношения времени удерживания антитела и референтного антитела. В одном воплощении референтное антитело представляет собой полноразмерное человеческое антитело IgG1.
В данном документе также описан способ определения времени полужизни антитела in vivo относительно референтного антитела путем определения соотношения времени удерживания антитела и референтного антитела, установленного с использованием колонки для аффинной хроматографии с применением FcRn, согласно данному описанию.
Один аспект данного описания представляет собой применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для разделения антител или химерных полипептидов, содержащих по меньшей мере Fc-часть.
В данном документе также описан способ разделения антител или химерных полипептидов, содержащих по меньшей мере Fc-часть.
В одном воплощении разделение выбрано из очистки, получения и анализа.
Один аспект данного описания представляет собой применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для отделения антител подкласса IgG1 от антител подкласса IgG3.
Один аспект данного описания представляет собой применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для определения окисленного метионина в составе антитела.
В данном документе описан способ определения влияния окисленных остатков метионина в Fc-части антитела на связывание FcRn с помощью метода аффинной хроматографии, согласно данному описанию.
Один аспект данного описания представляет собой применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для определения степени олигомеризации антитела.
В данном документе описан способ определения степени олигомеризации антитела с помощью метода аффинной хроматографии, согласно данному описанию.
Как правило, в способе, описанном в данном документе, за основу берется родительское антитело или родительский химерный полипептид, отличающиеся способностью связываться с FcRn.
Один аспект данного описания представляет собой применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для скрининга библиотеки модифицированных антител или модифицированных химерных полипептидов родительского антитела или родительского химерного полипептида, содержащих по меньше мере связывающую FcRn часть Fc-участка, на модифицированные антитела или модифицированные химерные полипептиды, у которых аффинность связывания FcRn изменена по сравнению с родительским антителом или родительским химерным полипептидом.
В данном документе описан способ скрининга библиотеки модифицированных антител или модифицированных химерных полипептидов родительского антитела или родительского химерного полипептида, содержащих по меньше мере связывающую FcRn часть Fc-участка, на модифицированные антитела или модифицированные химерные полипептиды, у которых аффинность связывания FcRn изменена по сравнению с родительским антителом или родительским химерным полипептидом, при этом способ включает следующие этапы:
(a) внесение отдельных представителей библиотеки и родительского антитела или родительского химерного полипептида в колонку для аффинной хроматографии с иммобилизованным FcRn, описанную в данном документе;
(b) выделение отдельных представителей библиотеки с использованием градиента рН и определение их времени удерживания; и
(c) отбор антител или химерных полипептидов, у которых аффинность связывания FcRn изменена по сравнению с родительским антителом или родительским химерным полипептидом.
В данном документе описан способ очистки антитела или химерного полипептида, содержащего по меньшей мере связывающую FcRn часть Fc-участка из смеси полипептидов, при этом способ включает внесение смеси в колонку для аффинной хроматографии с иммобилизованным FcRn, описанную в данном документе, и элюирование антител или химерного полипептида, содержащего по меньшей мере связывающую FcRn часть Fc-участка, с помощью градиента pH и таким образом выделение антитела или химерного полипептида. В одном воплощении связывающая FcRn часть Fc-участка представляет собой часть человеческого Fc-участка или мышиного Fc-участка или Fc-участка яванского макака или кроличьего Fc-участка или Fc-участка хомячка.
Термины в единственном числе обозначают один или два или три или четыре или пять или шесть вплоть до 109.
В одном воплощении реакционную смесь/продуцируемую смесь или неочищенную или частично очищенную культуральную надосадочную жидкость наносят на колонку для аффинной хроматографии с применением FcRn при первом значении pH, а антитело или химерный полипептид элюируют с колонки для аффинной хроматографии с применением FcRn при втором значении pH.
В одном воплощении первое значение pH составляет приблизительно от 3,5 приблизительно до 7,5. В одном воплощении первое значение pH составляет приблизительно от 4 приблизительно до 7. В одном воплощении первое значение pH составляет приблизительно от 4,5 приблизительно до 6,5. В одном воплощении первое значение pH составляет приблизительно от 5 приблизительно до 6. В одном воплощении первое значение pH составляет приблизительно 5 или приблизительно 5,5 или приблизительно 6.
В одном воплощении первое значение pH выбрано из приблизительно pH 3,5, приблизительно pH 3,6, приблизительно pH 3,7, приблизительно pH 3,8, приблизительно pH 3,9, приблизительно pH 4,0, приблизительно pH 4,1, приблизительно pH 4,2, приблизительно pH 4,3, приблизительно pH 4,4, приблизительно pH 4,5, приблизительно pH 4,6, приблизительно pH 4,7, приблизительно pH 4,8, приблизительно pH 4,9, приблизительно pH 5,0, приблизительно pH 5,1, приблизительно pH 5,2, приблизительно pH 5,3, приблизительно pH 5,4, приблизительно pH 5,5, приблизительно pH 5,6, приблизительно pH 5,7, приблизительно pH 5,8, приблизительно pH 5,9, приблизительно pH 6,0, приблизительно pH 6,1, приблизительно pH 6,2, приблизительно pH 6,3, приблизительно pH 6,4, приблизительно pH 6,5, приблизительно pH 6,6, приблизительно pH 6,7, приблизительно pH 6,8, приблизительно pH 6,9, приблизительно pH 7,0, приблизительно pH 7,1, приблизительно pH 7,2, приблизительно pH 7,3, приблизительно pH 7,4, and приблизительно pH 7,5.
В одном воплощении второе значение pH составляет приблизительно от pH 8 приблизительно до pH 9,5. В одном воплощении второе значение pH составляет приблизительно от pH 8,5 приблизительно до pH 9. В одном воплощении второе значение pH составляет приблизительно pH 8,8.
В одном воплощении второе значение pH выбрано из приблизительно pH 8,0, приблизительно pH 8,1, приблизительно pH 8,2, приблизительно pH 8,3, приблизительно pH 8,4, приблизительно pH 8,5, приблизительно pH 8,6, приблизительно pH 8,7, приблизительно pH 8,8, приблизительно pH 8,9, приблизительно pH 9,0, приблизительно pH 9,1, приблизительно pH 9,2, приблизительно pH 9,3, приблизительно pH 9,4 и приблизительно pH 9,5.
В одном воплощении каждое из заданных первых значений pH, составляющих приблизительно pH 3,5, приблизительно pH 3,6, приблизительно pH 3,7, приблизительно pH 3,8, приблизительно pH 3,9, приблизительно pH 4,0, приблизительно pH 4,1, приблизительно pH 4,2, приблизительно pH 4,3, приблизительно pH 4,4, приблизительно pH 4,5, приблизительно pH 4,6, приблизительно pH 4,7, приблизительно pH 4,8, приблизительно pH 4,9, приблизительно pH 5,0, приблизительно pH 5,1, приблизительно pH 5,2, приблизительно pH 5,3, приблизительно pH 5,4, приблизительно pH 5,5, приблизительно pH 5,6, приблизительно pH 5,7, приблизительно pH 5,8, приблизительно pH 5,9, приблизительно pH 6,0, приблизительно pH 6,1, приблизительно pH 6,2, приблизительно pH 6,3, приблизительно pH 6,4, приблизительно pH 6,5, приблизительно pH 6,6, приблизительно pH 6,7, приблизительно pH 6,8, приблизительно pH 6,9, приблизительно pH 7,0, приблизительно pH 7,1, приблизительно pH 7,2, приблизительно pH 7,3, приблизительно pH 7,4 и приблизительно pH 7,5 сочетается с каждым из заданных вторых значений pH, составляющих приблизительно pH 8,0, приблизительно pH 8,1, приблизительно pH 8,2, приблизительно pH 8,3, приблизительно pH 8,4, приблизительно pH 8,5, приблизительно pH 8,6, приблизительно pH 8,7, приблизительно pH 8,8, приблизительно pH 8,9, приблизительно pH 9,0, приблизительно pH 9,1, приблизительно pH 9,2, приблизительно pH 9,3, приблизительно pH 9,4 и приблизительно pH 9,5.
Одним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для выявления антител или химерных полипептидов, содержащих по меньшей мере связывающую FcRn часть Fc-участка (например, константный домен иммуноглобулина, такого как IgG1), демонстрирующих измененное связывание с неонатальным Fc-рецептором (FcRn).
В данном документе предложен способ выявления антител или химерных полипептидов, содержащих по меньшей мере связывающую FcRn часть Fc-участка (например, константный домен иммуноглобулина, такого как IgG1), демонстрирующих измененное связывание с неонатальным Fc-рецептором (FcRn).
Такие модифицированные антитела или химерные полипептиды демонстрируют усиленное или ослабленное связывание с FcRn при сравнении с родительским антителом или химерным полипептидом или при сравнении с референтным антителом или референтным химерным белком и, следовательно, их время полужизни в сыворотке, соответственно, увеличено или уменьшено.
Предполагают, что у вариантов с модификацией Fc-участка, обладающих повышенной аффинностью к FcRn (т.е. их время удерживания на колонке с иммобилизованным FcRn увеличено по сравнению с родительским антителом или референтным антителом, но элюирование происходит при значениях pH ниже pH 7,4, согласно данному описанию), время полужизни в сыворотке больше, чем у вариантов с пониженной аффинностью к FcRn. Варианты с модификацией Fc-участка, обладающие повышенной аффинностью к FcRn применяют в способах лечения млекопитающих, в частности людей, где требуется увеличение времени полужизни вводимого антитела или химерного полипептида, например, при лечении хронических заболеваний или нарушений. Варианты с модификацией Fc-участка, обладающие пониженной аффинностью к FcRn, применяют в способах лечения млекопитающих, в частности людей, где требуется уменьшение времени полужизни вводимого антитела или химерного полипептида, например при визуализирующих методах диагностики in vivo.
Существует очень большая вероятность, что варианты с модификацией Fc-уастка, обладающие пониженной аффинностью связывания FcRn, будут способны проходить через плаценту и, следовательно, смогут применяться в лечении заболеваний или нарушений у беременных женщин, в частности, нерожденных детей. Кроме того, пониженная аффинность связывания FcRn может требоваться для лекарств, предназначенных для применения/доставки в мозг, почки и/или печень.
Одним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для выявления антител или химерных полипептидов, которым характерен затрудненный транспорт из сосудистого русла через эпителий почечных клубочков.
В одном воплощении для антитела или химерного полипептида, содержащего модифицированный Fc-участок согласно данному описанию, характерен затрудненный транспорт из сосудистого русла через эпителий почечных клубочков.
Одним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для выявления антител или химерных полипептидов, которым характерен затрудненный транспорт через гематоэнцефалический барьер из мозга в сосудистое русло.
В одном воплощении для антитела или химерного полипептида, содержащего модифицированный Fc-участок согласно данному описанию, характерен затрудненный транспорт через гематоэнцефалический барьер (ГЭБ) из мозга в сосудистое русло.
В данном документе описаны способы получения таких модифицированных антител и химерных полипептидов, содержащих по меньшей мере связывающую FcRn часть Fc-участка, и способы применения таких модифицированных антител и химерных полипептидов.
В одном воплощении антитело или химерный полипептид по данному описанию содержат по меньшей мере один сайт связывания (например, по меньшей мере один антигенсвязывающий сайт или по меньшей мере один сайт связывания рецептора или по меньшей мере один сайт связывания лиганда). В одном воплощении антитело или химерный полипептид по данному описанию содержат по меньшей мере два сайта связывания (например, по меньшей мере два антигенсвязывающих сайта или по меньшей мере два сайта связывания рецепторов, или по меньшей мере два сайта связывания лигандов, или по меньшей мере один антигенсвязывающий сайт и по меньшей мере один сайт связывания рецептора, или по меньшей мере один антигенсвязывающий сайт и по меньшей мере один сайт связывания лиганда, или по меньшей мере один сайт связывания рецептора и по меньшей мере один сайт связывания лиганда). В одном воплощении антитело или химерный полипептид по данному описанию содержат три сайта связывания (например, по меньшей мере три антигенсвязывающих сайта или по меньшей мере три сайта связывания рецепторов, или по меньшей мере три сайта связывания лигандов, или любые комбинации по меньшей мере трех сайтов связывания, описанных выше). В одном воплощении антитело или химерный полипептид согласно данному описанию содержат четыре сайта связывания.
В одном воплощении всех аспектов данного описания по меньшей мере часть Fc-участка представляет собой по меньшей мере часть Fc-участка человеческого происхождения. В одном воплощении всех аспектов данного описания FcRn выбран из FcRn человека, FcRn яванского макака, FcRn мыши, FcRn крысы, FcRn овцы, FcRn собаки и FcRn кролика.
В одном воплощении всех аспектов данного описания бета-2-микроглобулин происходит из того же биологического вида, что и FcRn.
В одном воплощении всех аспектов данного описания бета-2-микроглобулин и FcRn происходят из разных биологических видов.
В одном воплощении Fc-участки или связывающие FcRn части Fc-участка получены из тяжелых цепей любого изотипа.
В одном воплощении по меньшей мере часть Fc-участка содержит по меньшей мере аминокислотные остатки 282-340 CH2 домена человеческого происхождения (SEQ ID NO: 01, нумерация согласно Kabat). В одном воплощении по меньшей мере часть Fc-участка содержит весь CH2 домен (приблизительно аминокислотные остатки 231-340 полипептида Fc-участка тяжелой цепи антитела человека, в соответствии с системой нумерации EU по Kabat). В одном воплощении по меньшей мере часть Fc-участка содержит по меньшей мере CH2 домен и по меньшей мере один шарнирный участок (приблизительно аминокислотные остатки 216-230 полипептида Fc-участка цепи антитела человека, в соответствии с системой нумерации EU) или CH3 домен (приблизительно аминокислотные остатки 341-446 полипептида Fc-участка тяжелой цепи антитела человека, в соответствии с системой нумерации EU). В одном воплощении по меньшей мере часть Fc-участка содержит CH2 и CH3 домены тяжелой цепи антитела человека. В одном воплощении по меньшей мере часть Fc-участка содержит шарнирный участок, CH2 домен и CH3 домен Fc-участка тяжелой цепи антитела человека. Fc-участки человеческого происхождения или связывающие FcRn части Fc-участка человеческого происхождения могут быть получены из тяжелых цепей любого изотипа, например IgG1 (SEQ ID NO: 03), IgG2 (SEQ ID NO: 04), IgG3 (SEQ ID NO: 05) и IgG4 (SEQ ID NO: 06). В одном воплощении человеческое антитело имеет изотип IgG1.
Fc-участок родительского антитела или входящий в состав химерного полипептида может быть получен из молекул различных иммуноглобулинов и/или из иммуноглобулинов с различным изотипом. Например, родительское антитело или родительский химерный полипептид могут содержать CH2 домен, полученный из иммуноглобулина с изотипом IgG1, и шарнирный участок, полученный из иммуноглобулина с изотипом IgG3. Также, например, родительское антитело или родительский химерный полипептид могут содержать шарнирный участок, полученный частично из иммуноглобулина подтипа IgG1 и, частично, из иммуноглобулина подтипа IgG3, поскольку оба они имеют человеческое происхождение. Например, родительское антитело или родительский химерный полипептид могут содержать химерный шарнирный участок, полученный частично из иммуноглобулина с изотипом IgG1 и, частично, из иммуноглобулина с изотипом IgG4.
Родительское антитело или родительский химерный полипептид согласно данному описанию содержат по меньшей мере один Fc-участок или один его связывающий FcRn участок. В одном воплощении родительское антитело или родительский полипептид дополнительно содержат по меньшей мере один связывающий домен (в одном воплощении выбранный из антигенсвязывающего домена, связывающего рецептор домена или связывающего лиганд домена). В одном воплощении родительское антитело или родительский химерный полипептид содержат по меньшей мере один связывающий домен и по меньшей мере один Fc-участок или один его связывающий FcRn участок. В одном воплощении родительское антитело или родительский химерный полипептид содержат два связывающих домена и два Fc-участка или две их связывающих FcRn части.
В одном воплощении родительское антитело или родительский химерный полипептид согласно данному описанию содержат по меньшей мере один связывающий домен, который специфически связывается с мишенью, опосредующей биологический эффект (в одном воплощении лиганд, способный связываться с рецептором клеточной поверхности, или рецептор клеточной поверхности, способный связываться с лигандом) и опосредует передачу в клетку активирующего или ингибирующего сигнала совместно с по меньшей мере одним Fc-участком или его связывающей FcRn частью. В одном воплощении биологический эффект опосредуется при значении pH приблизительно 7,4. В одном воплощении родительское антитело или родительский химерный полипептид содержат по меньшей мере один связывающий домен, специфический в отношении антигена, количество которого необходимо уменьшить или от которого нужно избавиться (в одном воплощении антиген клеточной поверхности или растворимый антиген) и по меньшей мере один Fc-участок или одну его связывающую FcRn часть.
Антитела, специфически связывающиеся с мишенью, могут вырабатываться в организме млекопитающих при многократных подкожных или внутрибрюшинных инъекциях соответствующего антигена (например, очищенного антигена, клеток или клеточных экстрактов, содержащих такие антигены, или ДНК, кодирующей такие антигены) и возможно, адъюванта.
В одном воплощении антитело представляет собой моноклональное антитело.
В одном воплощении химерный полипептид по данному описанию содержит фрагмент антитела (например, молекулу scFv, миниантитело, тетравалентное миниантитело или диатело), функционально связанный со связывающей FcRn частью. В одном воплощении связывающая FcRn часть представляет собой всю Fc-область тяжелой цепи антитела.
В одном воплощении родительское антитело представляет собой биспецифическое антитело или родительский химерный полипептид содержит биспецифическое антитело или фрагмент биспецифического антитела.
В одном воплощении родительское антитело представляет собой химерное антитело.
В одном воплощении родительский химерный полипептид содержит по меньшей мере связывающую FcRn часть Fc-участка. В одном воплощении родительский химерный полипептид согласно данному описанию содержит один или несколько связывающих доменов, каждый из которых в свою очередь содержит один сайт связывания. Родительский химерный полипептид может быть биспецифическим (иметь один сайт связывания, специфически связывающийся с первой мишенью, и второй сайт связывания, специфически связывающийся со второй мишенью) или мультивалентным (иметь два сайта связывания, специфически связывающиеся с одной и той же мишенью).
В одном воплощении всех предыдущих аспектов градиент pH представляет собой градиент приблизительно от pH 5,5 приблизительно до pH 8,8.
В одном воплощении градиент pH представляет собой градиент приблизительно от pH 5 до pH 6, или приблизительно от pH 6 приблизительно до pH 7, или приблизительно от pH 7 приблизительно до pH 8.
Как правило, связывающий домен объединен с С-концом или N-концом по меньшей мере связывающей FcRn части Fc-участка.
Одним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для отбора антител, связывающих FcRn при значении pH 7,4 для (совместного) направленного взаимодействия in vivo. В одном воплощении совместное направленное взаимодействие представляет собой интернализацию.
Так, в одном воплощении первое значение pH составляет приблизительно pH 7,4. В одном воплощении второе значение pH составляет приблизительно pH 6,0.
Как правило, растворимый внеклеточный домен FcRn (SEQ ID NO: 07 для человеческого FcRn) с С-концевым эпитопом His-Avi Tag (SEQ ID NO: 08) совместно экспрессируют с β2-микроглобулином (SEQ ID NO: 09 для человеческого бета-2-микроглобулина) в клетках млекопитающих. Нековалентный комплекс FcRn-микроглобулин биотинилируют и наносят на покрытую стрептавидином сефарозу.
В одном воплощении всех аспектов данного описания нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина связан с твердой фазой.
"Твердая фаза" обозначает нетекучую субстанцию и включает частицы (включая микрочастицы и гранулы), сделанные из такого материала, как полимер, металл (парамагнитные, ферромагнитные частицы), стекло и керамика; гелевые субстанции, такие как силикагель, алюмогель и полимерные гели; капилляры, которые могут быть сделаны из полимера, металла, стекла и/или керамики; цеолиты и другие пористые субстанции; электроды; планшеты для микротитрования; твердые стрипы; а также кюветы, пробирки или другие контейнеры для образцов, применяемые в спектрометрии. Компонент, представляющий собой твердую фазу, отличается от инертной твердой поверхности тем, что на поверхности "твердого носителя" имеется по меньшей мере одна функциональная группа, предназначенная для химического взаимодействия с молекулой. Твердая фаза может быть неподвижным элементом, таким как пробирка, стрип, кювета или планшет для микротитрования, или может быть подвижным элементом, таким как гранулы или микрочастицы. В качестве твердого носителя в гомогенных аналитических системах можно также использовать микрочастицы. Можно применять разнообразные микрочастицы, которые обеспечивают как нековалентное, так и ковалентное присоединение белков и других субстанций. Такие частицы включают частицы полимеров, такие как полистирен и поли-(метилметакрилат); частицы золота, такие как наночастицы золота и коллоидные частицы золота; а также керамические частицы, такие как частицы кремния, стекла и оксидов металлов. См., например, публикацию Martin, C.R., et al., Analytical Chemistry-News & Features, May 1 (1998) 322A-327A, включенную сюда путем ссылки. В одном воплощении твердым носителем является сефароза.
В одном воплощении конъюгацию нековалентного комплекса с твердой фазой осуществляют путем химического связывания по N-концевым и/или ε-аминогруппам (лизин), ε-аминогруппам различных лизинов, по карбоксильным, сульфгидрильным, гидроксильным и/или фенольным функциональным группам аминокислотного остова антитела и/или спиртовым группам углеводного компонента антитела.
В одном воплощении нековалентный комплекс конъюгирован с твердой фазой при помощи специфически связывающейся пары. В одном воплощении нековалентный комплекс конъюгирован с биотином, а иммобилизацию на твердом носителе осуществляют при помощи авидина или стрептавидина, иммобилизованного на твердой фазе.
Специфически связывающаяся пара (первый компонент/второй компонент) в одном воплощении выбрана из стрептавидина или авидина/биотина, антитела/антигена (см., например, Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press (1996)), лектина/полисахарида, стероида/стероид-связывающего белка, гормона/рецептора гормона, фермента/субстрата, IgG/белка А и/или G и т.д.
Выделение антитела, связанного с колонкой для аффинной хроматографии с иммобилизованным FcRn, согласно описанию в данном документе, для применений и способов, описанных в данном документе, осуществляют путем элюирования линейным градиентом. В одном воплощении линейный градиент представляет собой градиент pH или градиент проводимости.
В принципе, в способах по данному описанию можно использовать любое буферное вещество.
Остатки Fc-участка, критически важные для взаимодействия мышиного Fc и мышиного FcRn, были идентифицированы при помощи сайт-специфического мутагенеза (см., например DallʹAcqua, W.F., et al. J. Immunol 169 (2002) 5171-5180). Остатки I253, H310, H433, N434 и Н435 (в соответствии с нумерацией по системе EU согласно Kabat) вовлечены во взаимодействие (Medesan, С., et al., Eur. J. Immunol. 26 (1996) 2533; Firan, M., et al., Int. Immunol. 13 (2001) 993; Kim, J.K., et al., Eur. J. Immunol. 24 (1994) 542). Было обнаружено, что остатки I253, Н310 и Н435 критически важны для взаимодействия человеческого Fc с мышиным FcRn (Kim, J.К., et al., Eur. J. Immunol. 29 (1999) 2819). DallʹAcqua et al., исследуя белок-белковые взаимодействия, показали, что остатки M252Y, S254T, Т256Е улучшают связывание FcRn (DallʹAcqua, W.F., et al. J. Biol. Chem. 281 (2006) 23514-23524). Исследования комплекса человеческого Fc с человеческим FcRn показали, что остатки I253, S254, Н435 и Y436 играют решающую роль при взаимодействии (Firan, М., et al., Int. Immunol. 13 (2001) 993; Shields, R.L., et al., J. Biol. Chem. 276 (2001) 6591-6604). Yeung, Y.A., et al. (J. Immunol. 182 (2009) 7667-7671) исследовали и описали различные мутации остатков 248-259, 301-317, 376-382 и 424-437.
Время удерживания различных антител, полученные при использовании различных элюирующих буферов, приведено в следующей Таблице.


Термин мутация YTE обозначает тройную мутацию M252Y/S254T/T256E.
В одном воплощении используют фармацевтически приемлемое буферное вещество, например, фосфорную кислоту или ее соли, уксусную кислоту или ее соли, лимонную кислоту или ее соли, морфолин, 2-(N-морфолино)-этансульфоновую кислоту (MES) или ее соли, гистидин или его соли, глицин или его соли, трис-(гидроксиметил)-аминометан (TRIS) или его соли, (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES) или ее соли.
В одном воплощении буферное вещество выбрано из фосфорной кислоты или ее солей или уксусной кислоты или ее солей, или лимонной кислоты или ее солей, или гистидина или его солей.
В одном воплощении буферное вещество имеет концентрацию от 10 мМ до 500 мМ. В одном воплощении буферное вещество имеет концентрацию от 10 мМ до 300 мМ. В одном воплощении буферное вещество имеет концентрацию от 10 мМ до 250 мМ. В одном воплощении буферное вещество имеет концентрацию от 10 мМ до 100 мМ. В одном воплощении, буферное вещество имеет концентрацию от 15 мМ до 50 мМ. В одном воплощении буферное вещество имеет концентрацию приблизительно 20 мМ.
В одном воплощении буферное вещество в первом растворе и буферное вещество во втором растворе представляют собой одно и то же буферное вещество.
В одном воплощении буферное вещество в первом растворе и буферное вещество во втором растворе являются различными буферными веществами.
В одном воплощении первый раствор имеет значение pH приблизительно от pH 3,5 приблизительно до pH 7,5. В одном воплощении первый раствор имеет значение pH приблизительно от pH 5 приблизительно до pH 6. В одном воплощении первый раствор имеет значение pH приблизительно pH 5,5.
В одном воплощении второй раствор имеет значение pH приблизительно от pH 7,0 приблизительно до pH 9,5. В одном воплощении второй раствор имеет значение pH приблизительно от pH 8 приблизительно до pH 9. В одном воплощении второй раствор имеет значение pH приблизительно от pH 8,2 приблизительно до pH 8,8.
Приведенный в качестве примера первый раствор содержит 20 мМ MES и 150 мМ NaCl, pH 5,5.
Приведенный в качестве примера второй раствор содержит 20 мМ TRIS и 150 мМ NaCl, pH 8,8
Приведенный в качестве примера второй раствор содержит 20 мМ HEPES, pH 8,6.
Приведенный в качестве примера второй раствор содержит 20 мМ TRIS, pH 8,2.
В одном воплощении буферный раствор содержит добавленную соль. В одном воплощении добавленная соль выбрана из хлорида натрия, сульфата натрия, хлорида калия, сульфата калия, цитрата натрия или цитрата калия. В одном воплощении буферный раствор содержит приблизительно от 50 мМ до 1000 мМ добавленной соли. В одном воплощении буферный раствор содержит приблизительно от 50 мМ до 750 мМ добавленной соли. В одном воплощении буферный раствор содержит приблизительно от 50 мМ до 500 мМ добавленной соли. В одном воплощении буферный раствор содержит приблизительно от 50 мМ до 750 мМ добавленной соли. В одном воплощении буферный раствор содержит приблизительно от 50 мМ приблизительно до 300 мМ добавленной соли.
В одном воплощении первый и/или второй раствор содержит хлорид натрия. В одном воплощении первый и/или второй раствор содержит приблизительно от 50 мМ приблизительно до 300 мМ хлорида натрия.
Обнаружили, что тип соли и буферного вещества влияет на время удерживания и разделение. Можно найти концентрацию соли, оптимальную для связывания антител с FcRn (150 мМ NaCl). Если концентрация соли выше (300 мМ), связывание с FcRn ослабевает/время удерживания укорачивается. То же самое справедливо и для более низкой концентрации соли (50 мМ). Использование 20 мМ HEPES, pH 8,6 вызывало увеличение времени удерживания для всех протестированных антител.
Как видно из Фиг. 1, между количеством вносимого антитела и площадью под кривой пика элюирования существует линейная корреляция.
Было проанализировано 8 антител в виде целых антител и после расщепления ферментом IDES. Эффективность расщепления контролировали при помощи электрофореза в полиакриламидном геле в присутствии ДСН и аналитической эксклюзионной хроматографии (SEC, от англ. size exclusion chromatography). Fc-фрагмент и Fab-фрагмент антитела разделяли при помощи препаративной SEC. В следующей Таблице приведено время удерживания целых антител, Fab-частей и Fc-частей.
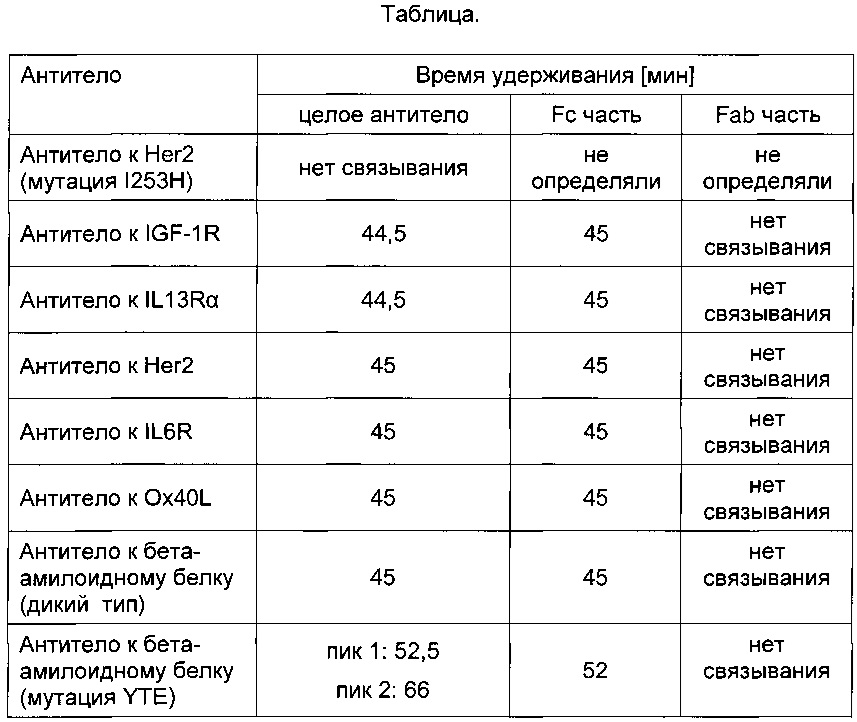
Термин мутация YTE обозначает тройную мутацию M252Y/S254T/T256E.
Как правило, время удерживания антител, содержащих Fc-часть дикого типа (IgG1 или IgG2 или IgG4), варьируется от 45 до 49 мин (проверено на 35 терапевтически активных антителах, направленных против 36 антигенов, данные не приведены).
В следующей Таблице показано время удерживания в зависимости от количества иммобилизованного рецептора FcRn, приходящегося на грамм набивочного материала для колонки.

Термин мутация YTE обозначает тройную мутацию M252Y/S254T/T256E.
FAB-фрагмент антитела к бета-амилоидному белку содержит сайт гликозилирования.
Таким образом, одним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для выявления модификаций FAB. В одном воплощении модификация представляет собой гликозилирование или распределение заряда.
Как правило, время удерживания в способах и применениях, описанных в данном документе, зависит от плавности градиента pH и используемой концентрации соли. Антитело дикого типа применяют в качестве референтного, а на более слабое связывание указывает укороченное время удерживания (=более раннее элюирование), тогда как на более прочное связывание указывает удлиненное время удерживания (=более позднее элюирование), до достижения значения pH 7,4.
Обнаружили, что IgG с различными мутациями в Fc части ведут себя различным образом при хроматографии на колонке с иммобилизованным FcRn и демонстрируют различное время удерживания.
Например, время удерживания антитела к бета-амилоидному белку, несущего мутацию YTE, увеличено. Второй пик обусловлен введением дополнительного сайта гликозилирования в Fab части антитела к бета-амилоидному белку, несущего мутацию YTE.
Например, антитело к IGF-1R, несущее мутацию YTE, характеризуется увеличенным временем удерживания (см. Фиг. 2).

Термин мутация YTE обозначает тройную мутацию M252Y/S254T/T256E.
Было обнаружено, что с помощью колонки с иммобилизованным FcRn, описанной в данном документе, можно идентифицировать аминокислоты, задействованные в связывании с FcRn, и проранжировать мутанты, сравнивая их с немодифицированным антителом дикого типа.
Аспектами данного описания являются применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для идентификации аминокислот, задействованных в связывании с FcRn, и ранжирования мутантов по сравнению с немодифицированным антителом дикого типа.
Результаты, полученные для антитела к Her2, приведены в следующей Таблице (для справки см., например WO 2006/031370).

Обнаружили, что у антител, которые поздно элюируются с колонки с иммобилизованным FcRn, т.е. у которых увеличено время удерживания на колонке с иммобилизованным FcRn, время полужизни in vivo также увеличено. Данные in vivo приведены в следующей ниже Таблице.
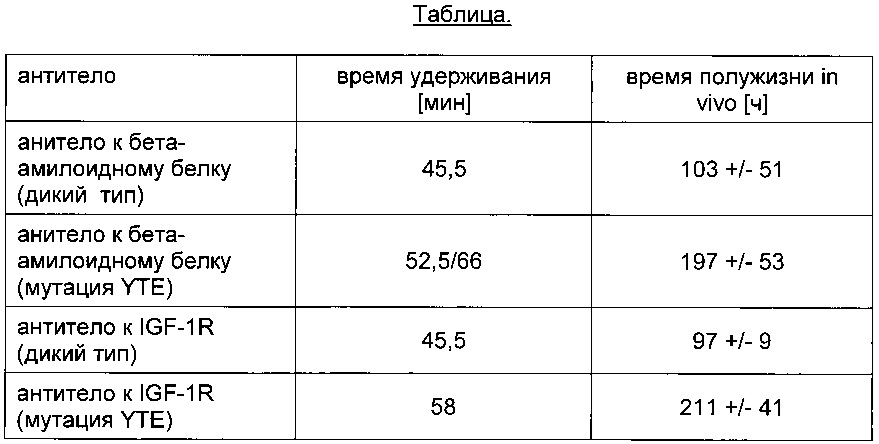
Термин мутация YTE обозначает тройную мутацию M252Y/S254T/T256E.
Одним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для определения времени полужизни антитела in vivo.
Ряд экспериментов, проведенных in vitro и in vivo с IgG дикого типа и с вариантами IgG, имеющими мутацию YTE в Fc части, позволил обнаружить полуколичественную корреляцию между результатами аффинной хроматографии с применением FcRn и результатами фармакокинетических исследований in vivo на трансгенных мышах, имеющих человеческий FcRn (Spiekerman, G.M., et al. J. Exp. Med. 196 (2002) 303-310; DallʹAcqua, W.F., et al., J. Biol. Chem. 281 (2006) 23514-23524). Мутация YTE существенно увеличивает время полужизни и замедляет клиренс из плазмы. Увеличенное время полужизни in vivo соответствует большему времени удерживания при хроматографии с применением FcRn. Недавно было показано, что вариант трастузумаба с модифицированным Fc и увеличенным временем полужизни демонстрирует повышенное связывание с FcRn in vitro, зарегистрированное методом проточной цитометрии (Petkova, S.B., et al., Int. Immunol. 18 (2006) 1759-1769). Было показано, что у варианта IgG1 антитела к VEGF под названием бевацизумаб с 11-кратно повышенной аффинностью к FcRn время полужизни в организме трансгенных мышей с человеческим FcRn увеличено в 5 раз, а время полужизни в организме яванского макака увеличено в три раза (Zalevsky, J., et al., Nat. Biotechnol. 28 (2010) 157-159).
Было обнаружено, что анализ и удаление половинных молекул антител из препаратов IgG можно осуществлять с помощью колонок с иммобилизованным FcRn, описанных в данном документе. Пример хроматографии с использованием колонки с применением FcRn показан на Фиг. 3.
Оним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для удаления половинных молекул антител из препаратов IgG.
Обнаружили, что олигомеры и агрегаты можно отделять при помощи хроматографии с применением FcRn, согласно данному описанию (см. Фиг. 4).
Оним аспектом данного описания является применение хроматографического материала, содержащего в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, для удаления агрегатов антител и олигомеров антител из препаратов IgG.
Обнаружили, что время удерживания зависит от количества Fc частей, содержащихся в молекуле аналита. Это было показано с применением конструкций, содержащих одну или две Fc части (см. Фиг. 5).
Было обнаружено, что окисление влияет на связывание FcRn и выявляется с применением колонок с иммобилизованным FcRn (см. Фиг. 6).
Было показано, что формат антитела не влияет на связывание с колонкой с иммобилизованным FcRn. Это было показано для формата «выступы-во-впадины» (knob-into-hole) и нескольких форматов биспецифических антител. Таким образом, колонки с иммобилизованным FcRn можно применять для исследования антител новых форматов.
В одном воплощении комплекс является монобиотинилированным.
В одном воплощении хроматографический материал, содержащий в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, демонстрирует стабильность по меньшей мере на протяжении 100 циклов в способах и применениях, описанных в данном документе. Циклом является изменение pH (градиент) от первого значения pH до второго значения pH в соответствующем способе или применении, причем для регенерации материала не требуется дальнейшего изменения условий, кроме достижения конечного состояния, описанного для способа или применения. Так, в одном воплощении цикл представляет собой изменение pH (градиент) приблизительно от значения pH 5,5 приблизительно до значения pH 8,8.
Было обнаружено, что аминокислотная замена М на Н в позиции 252 в комбинации с аминокислотной заменой М на Е в позиции 428 приводит к укорочению времени удерживания (см. Фиг. 7).
Различия между методикой SPR и аффинной хроматографией с применением FcRn можно проиллюстрировать на образце антитела с окисленными формами Met252 и Met428. Хотя SPR анализ образцов позволил выявить относительные различия между связыванием образца и референтного стандарта, составившие приблизительно 20%, он не дал представление о гетерогенности данного образца. Напротив, аффинная хроматография с применением FcRn выявила в образце два отдельных пика, один из которых соответствовал времени удерживания референтного стандарта, а другой был значительно сдвинут влево, что указывало на более слабое взаимодействие антитела в образце, подвергшемся неблагоприятному воздействию, с материалом колонки с иммобилизованным FcRn при более низких значениях pH.
Описанный в данном документе хроматографический материал, содержащий нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина в качестве лиганда, можно применять для выделения/разделения фрагментов антитела, что будет альтернативой обычной аффинной хроматографии с применением белка А. Кроме того, с применением хроматографического материала, описанного в данном документе, разделение можно проводить в условиях (например, значениях pH), более близких к физиологическим по сравнению с обычной аффинной хроматографией с применением белка А.
Хроматографический материал, содержащий в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, можно применять для определения/разделения/обогащения формами антитела, содержащими модификации, например, вариантами с различным зарядом, окисленными, гликозилированными и дезаминированными вариантами. Хроматографический материал, содержащий в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, можно применять в зависимости от выбранного градиента pH (начального/конечного значения pH) для обогащения некоторыми формами антител.
Хроматографический материал, содержащий в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, можно применять для выделения/обогащения формами антител с вариациями/различиями по молекулярной массе.
Хроматографический материал, содержащий в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, можно применять для выделения/обогащения антителами с различным количеством сайтов связывания FcRn в молекуле.
Хроматографический материал, содержащий в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, можно применять для выявления аминокислотных модификаций. Хроматографический материал, содержащий в качестве лиганда нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина, можно применять для выделения/разделения ошибочно спаренных биспецифических антител, таких как димеры с двумя «впадинами» (hole-hole dimers) и половинные молекулы антител.
Специфические воплощения
1. Применение иммобилизованного нековалентного комплекса неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) в качестве лиганда для аффинной хроматографии при аффинной хроматографии с восходящим линейным градиентом pH.
2. Применение согласно п. 1, отличающееся тем, что аффинную хроматографию с восходящим линейным градиентом pH применяют для разделения антител или химерных полипептидов, содержащих по меньшей мере один Fc-участок.
3. Применение согласно любому из пп. 1-2, отличающееся тем, что неонатальный Fc-рецептор и бета-2-микроглобулин независимо друг от друга могут иметь человеческое происхождение или мышиное происхождение или происходить от яванского макака, крысы или кролика.
4. Применение согласно любому из пп. 1-3, отличающееся тем, что бета-2-микроглобулин происходит из того же биологического вида, что и неонатальный Fc-рецептор.
5. Применение согласно любому из пп. 1-4, отличающееся тем, что неонатальный Fc-рецептор и бета-2-микроглобулин представляют собой человеческий неонатальный Fc-рецептор дикого типа и человеческий бета-2-микроглобулин дикого типа независимо друг от друга имеющие от 0 до 10 аминокислотных модификаций.
6. Применение согласно любому из пп. 1-5, отличающееся тем, что нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) связан с твердой фазой.
7. Применение согласно п.6, отличающееся тем, что твердая фаза представляет собой хроматографический материал.
8. Применение согласно любому из пп. 6-7, отличающееся тем, что нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) биотинилирован, а твердая фаза модифицирована стрептавидином.
9. Применение согласно любому из пп. 1-8, отличающееся тем, что градиент pH представляет собой изменение pH от первого значения до второго значения, где первое значение pH составляет приблизительно от 3,5 приблизительно до 7,5, а второе значение pH составляет приблизительно от 6,0 приблизительно до pH 9,5.
10. Применение согласно любому из пп. 1-9, отличающееся тем, что первое значение pH составляет приблизительно pH 5,5, а второе значение pH составляет приблизительно pH 8,8.
11. Применение согласно любому из пп. 1-10, отличающееся тем, что применение предназначено для определения времени полужизни антитела in vivo путем определения соотношения времени удерживания антитела и референтного антитела.
12. Применение согласно любому из пп. 1-10, отличающееся тем, что применение предназначено для определения окисленного метионина в составе антитела.
13. Применение согласно любому из пп. 1-10, отличающееся тем, что применение предназначено для определения степени олигомеризации антитела.
14. Применение согласно любому из пп. 1-10, отличающееся тем, что применение предназначено для скрининга библиотеки модифицированных антител или модифицированных химерных полипептидов родительского антитела или родительского химерного полипептида, содержащих по меньшей мере связывающую FcRn область Fc-участка, на такие модифицированные антитела или модифицированные химерные полипептиды, у которых аффинность связывания с FcRn изменена по сравнению с родительским антителом или родительским химерным полипептидом.
15. Применение согласно любому из пп. 1-10, отличающееся тем, что применение предназначено для идентификации антител или химерных полипептидов, которые содержат по меньшей мере связывающую FcRn область Fc-участка, демонстрирующих измененное связывание с неонатальным Fc-рецептором.
16. Применение согласно любому из пп. 1-10, отличающееся тем, что применение предназначено для удаления половинных молекул антител из препаратов IgG.
17. Применение согласно любому из пп. 1-10, отличающееся тем, что применение предназначено для удаления агрегатов антител и олигомерных форм антител из препаратов IgG.
18. Применение согласно любому из пп. 1-17, отличающееся тем, что антитело представляет собой моноспецифическое антитело или фрагмент антитела или химерный полипептид, или биспецифическое антитело или антительный фрагмент химерного полипептида, или триспецифическое антитело или антительный фрагмент химерного полипептида, или тетраспецифическое антитело или антительный фрагмент химерного полипептида.
19. Применение иммобилизованного нековалентного комплекса неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) в качестве лиганда для аффинной хроматографии при аффинной хроматографии с нисходящим линейным градиентом pH.
20. Применение согласно п. 19, отличающееся тем, что аффинную хроматографию с нисходящим линейным градиентом pH применяют для разделения антител или химерных полипептидов, содержащих по меньшей мере один Fc-участок.
21. Применение согласно любому из пп. 19-20, отличающееся тем, что неонатальный Fc-рецептор и бета-2-микроглобулин независимо друг от друга могут иметь человеческое происхождение или мышиное происхождение или происходить от яванского макака или крысы или кролика.
22. Применение согласно любому из пп. 19-21, отличающееся тем, что бета-2-микроглобулин происходит из того же биологического вида, что и неонатальный Fc-рецептор.
23. Применение согласно любому из пп. 19-22, отличающееся тем, что неонатальный Fc-рецептор и бета-2-микроглобулин представляют собой человеческий неонатальный Fc-рецептор дикого типа и человеческий бета-2-микроглобулин дикого типа, независимо друг от друга имеющие от 0 до 10 аминокислотных модификаций.
24. Применение согласно любому из пп. 19-23, отличающееся тем, что нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) связан с твердой фазой.
25. Применение согласно п. 24, отличающееся тем, что твердая фаза представляет собой хроматографический материал.
26. Применение согласно любому из пп. 24-25, отличающееся тем, что нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) биотинилирован, а твердая фаза модифицирована стрептавидином.
27. Применение согласно любому из пп. 19-26, отличающееся тем, что градиент pH представляет собой изменение pH от первого значения до второго значения, где первое значение pH составляет приблизительно от pH 7,0 приблизительно до pH 8,5, а второе значение pH составляет приблизительно от pH 5,5 приблизительно до pH 6,9.
28. Применение согласно любому из пп. 19-27, отличающееся тем, что первое значение pH составляет приблизительно pH 7,4, а второе значение pH составляет приблизительно pH 6,0.
29. Применение согласно любому из пп. 19-28, отличающееся тем, что применение предназначено для определения времени полужизни антитела in vivo путем определения соотношения времени удерживания антитела и референтного антитела.
30. Применение согласно любому из пп. 19-28, отличающееся тем, что применение предназначено для определения окисленного метионина в составе антитела.
31. Применение согласно любому из пп. 19-28, отличающееся тем, что применение предназначено для определения степени олигомеризации антитела.
32. Применение согласно любому из пп. 19-28, отличающееся тем, что применение предназначено для скрининга библиотеки модифицированных антител или модифицированных химерных полипептидов родительского антитела или родительского химерного полипептида, содержащих по меньшей мере связывающую FcRn область Fc-участка, на такие модифицированные антитела или модифицированные химерные полипептиды, у которых аффинность связывания с FcRn изменена по сравнению с родительским антителом или родительским химерным полипептидом.
33. Применение согласно любому из пп. 19-28, отличающееся тем, что применение предназначено для идентификации антител или химерных полипептидов, которые содержат по меньшей мере связывающую FcRn область Fc-участка, демонстрирующих измененное связывание с неонатальным Fc-рецептором.
34. Применение согласно любому из пп. 19-28, отличающееся тем, что применение предназначено для удаления половинных молекул антител из препаратов IgG.
35. Применение согласно любому из пп. 19-28, отличающееся тем, что применение предназначено для удаления агрегатов антител и олигомерных форм антител из препаратов IgG.
36. Применение согласно любому из пп. 19-35, отличающееся тем, что антитело представляет собой моноспецифическое антитело или фрагмент антитела или химерный полипептид, или биспецифическое антитело или антительный фрагмент химерного полипептида, или триспецифическое антитело или антительный фрагмент химерного полипептида, или тетраспецифическое антитело или антительный фрагмент химерного полипептида.
37. Применение согласно любому из пп. 1-10, 18, 19-28 и 35, отличающееся тем, что применение предназначено для разделения антител подкласса IgG1 и антител подкласса IgG3.
38. Вариант человеческого IgG1 с модификацией Fc-участка, у которого в позиции 252 произведена аминокислотная замена метионина на гистидин, а в позиции 428 произведена аминокислотная замена метионина на глутаминовую кислоту.
1. Фрагменты антител
В некоторых воплощениях химерный полипептид, описанный в данном документе, содержит фрагмент антитела. Фрагменты антител включают фрагменты Fab, Fabʹ, Fabʹ-SH, F(abʹ)2, Fv, и scFv, а также другие фрагменты, описанные ниже, но не ограничиваются ими. Обзор некоторых фрагментов антител представлен в публикации Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134. Обзор scFv фрагментов представлен, например, в публикации Plueckthun, A., In: The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp. 269-315; см. также WO 93/16185 и US 5,571,894 и US 5,587,458. В патенте США 5,869,046 обсуждаются Fab и F(abʹ)2 фрагменты, содержащие аминокислотные остатки эпитопа, связывающего «рецептор спасения» (salvage receptor), и имеющие повышенное время полужизни in vivo.
Диатела являются фрагментами антител с двумя антигенсвязывающими сайтами, которые могут быть бивалентными или биспецифическими. См., например, EP 0404097; WO 1993/01161; Hudson, P.J., et al., Nat. Med. 9 (2003) 129-134 и Holliger, P., et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448. Триатела и тетратела также описаны в публикации Hudson, P.J., et al., Nat. Med. 9 (2003) 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи антитела или его часть. В некоторых воплощениях однодоменные антитела представляют собой однодоменные антитела человека (Domantis, Inc., Waltham, MA; см., например патент США US 6,248,516 В1).
Фрагменты антител могут быть получены при помощи различных методик, описанных в данном документе, включая протеолитическое расщепление интактного антитела, а также продукцию в рекомбинантных клетках-хозяевах (например, Е.coli или фагах), но не ограничиваясь ими.
2. Химерные и гуманизированные антитела
В некоторых воплощениях антитело, предложенное в данном описании, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в патенте США US 4,816,567 и Morrison, S.L., et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855). В одном примере химерное антитело содержит вариабельный участок, не являющийся человеческим (например, вариабельный участок, происходящий из организма мыши, крысы, хомяка, кролика или не являющегося человеком примата, например, обезьяны), и константный участок человеческого происхождения. В следующем примере химерное антитело представляет собой антитело "с переключенным классом", у которого класс или подкласс были изменены по сравнению с родительским антителом. Химерные антитела включают также их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Как правило, антитело, не являющееся человеческим, подвергают гуманизации, чтобы снизить иммуногенность для человека, при этом сохраняя специфичность и аффинность родительского антитела, не являющегося человеческим. Как правило, гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, например, CDR, (или их части) получены из антитела, не являющегося человеческим, а каркасные участки FR (или их части) получены на основе последовательностей антитела человека. Возможно гуманизированное антитело также содержит по меньшей мере часть константного участка человеческого антитела. В некоторых воплощениях некоторые остатки FR в гуманизированном антителе заменены соответствующими остатками антитела, не являющегося человеческим (например, антитела из которого получены аминокислотные остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения представлены, например, в обзоре Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633, и более подробно описаны, например, Riechmann, I., et al., Nature 332 (1988) 323-329; Queen, C., et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; US 5,821,337, US 7,527,791, US 6,982,321, and US 7,087,409; Kashmiri, S.V., et al., Methods 36 (2005) 25-34 (описание пересадки SDR (a-CDR)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описание "изменения поверхности"); DallʹAcqua, W.F., et al., Methods 36 (2005) 43-60 (описание "комбинирования каркасных участков" ("FR shuffling")) и Osbourn, J., et al., Methods 36 (2005) 61-68 and Klimka, A., et al., Br. J. Cancer 83 (2000) 252-260 (описание "направленного отбора" для комбинирования каркасных участков).
Каркасные участки человека, которые могут быть использованы для гуманизации, включают: каркасные участки, выбранные при помощи метода "максимального соответствия" (см., например, Sims, M.J., et al., J. Immunol. 151 (1993) 2296-2308; каркасные участки, полученные из консенсусных последовательностей человеческих антител с вариабельными участками легкой или тяжелой цепей определенной подгруппы (см., например, Carter, P., et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; and Presta, L.G., et al., J. Immunol. 151 (1993) 2623-2632); зрелые каркасные участки человека (с соматическими мутациями) или каркасные участки зародышевой линии (неперестроенные) (см., например, Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633) и каркасные участки, полученные при скрининге библиотек FR (см., например, Baca, М., et al., J. Biol. Chem. 272 (1997) 10678-10684 and Rosok, M.J., et al., J. Biol. Chem. 271 (1996) 22611-22618).
3. Человеческие антитела
В некоторых воплощениях предложенное в данном документе антитело представляет собой человеческое антитело. Человеческие антитела могут быть получены при помощи различных способов, известных в данной области техники. Человеческие антитела описаны van Dijk, М.А. and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374 и Lonberg, N., Curr. Opin. Immunol. 20 (2008) 450-459.
Человеческие антитела могут быть получены путем введения иммуногена трансгенному животному, модифицированному для получения интактных человеческих антител или интактных антител с вариабельными участками человека в ответ на введение антигена. Такие животные обычно имеют все или часть локусов иммуноглобулинов человека, заменяющие локусы эндогенных иммуноглобулинов, находящиеся вне хромосом или случайным образом интегрированные в хромосомы животных. У таких трансгенных мышей локусы эндогенных иммуноглобулинов обычно бывают инактивированы. Обзор способов получения человеческих антител в трансгенных животных представлен Lonberg, N., Nat. Biotech. 23 (2005) 1117-1125. См. также, например, US 6,075,181 и US 6,150,584 описывающие технологию XENOMOUSE™; US 5,770,429 описывающий технологию HuMab®; US 7,041,870 описывающий технологию К-М MOUSE®, и US 2007/0061900, описывающий технологию VelociMouse®). Вариабельные участки человеческого происхождения в интактных антителах, полученных в таких животных, могут быть далее модифицированы, например, путем комбинации с различными константными участками человеческого происхождения.
Антитела человека могут также быть получены при помощи гибридомной технологии. Описаны клеточные линии миеломы человека и гетеромиеломы мышь-человек для продукции моноклональных человеческих антител (см., например, Kozbor, D., J. Immunol. 133 (1984) 3001-3005; Brodeur, B.R., et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York (1987), pp. 51-63 и Boerner, P., et al., J. Immunol. 147 (1991) 86-95). Также описаны человеческие антитела, полученные с применением гибридомной технологии с использованием В-клеток человека Li, J., et al., Proc. Natl. Acad. Sci. USA 103 (2006) 3557-3562. Дополнительные способы включают те, что описаны, например, в US 7,189,826 (описание получения моноклональных антител человека класса IgM из гибридомных клеточных линий) и в публикации Ni, J., Xiandai Mianyixue 26 (2006) 265-268 (описание гибридом человек-человек). Технология человеческих гибридом (технология триом) также описана в публикациях Vollmers, Н.Р. and Brandlein, S., Histology and Histopathology 20 (2005) 927-937 и Vollmers, H.P. and Brandlein, S., Methods and Findings in Experimental and Clinical Pharmacology 27 (2005) 185-191.
Человеческие антитела могут быть получены путем выделения последовательностей вариабельных доменов Fv клонов, отобранных из библиотек фагового дисплея, созданных на основе генов человека. Такие последовательности вариабельных доменов затем могут быть объединены с необходимым константным доменом человека. Технологии для отбора человеческих антител из библиотек антител описаны ниже.
4. Антитела, полученные из библиотек
Антитела по изобретению могут быть выделены путем скрининга комбинаторных библиотек на антитела с желаемой активностью или активностями. Например, в данной области техники известно большое количество способов создания библиотек фагового дисплея и скрининга таких библиотек на антитела, обладающие желаемыми характеристиками связывания. Такие способы рассматриваются, например, в обзоре Hoogenboom, H.R., et al., Methods in Molecular Biology 178 (2002) 1-37 and further described, например, in the McCafferty, J., et al., Nature 348 (1990) 552-554; Clackson, Т., et al., Nature 352 (1991) 624-628; Marks, J.D., et al., J. Mol. Biol. 222 (1992) 581-597; Marks, J.D. and Bradbury, A., Methods in Molecular Biology 248 (2003) 161-175; Sidhu, S.S., et al., J. Mol. Biol. 338 (2004) 299-310; Lee, C.V., et al., J. Mol. Biol. 340 (2004) 1073-1093; Fellouse, F.A., Proc. Natl. Acad. Sci. USA 101 (2004) 12467-12472 и Lee, C.V., et al., J. Immunol. Methods 284 (2004) 119-132.
В некоторых способах фагового дисплея спектры генов VH и VL клонируют отдельно при помощи полимеразной цепной реакции (PCR) и рекомбинируют случайным образом в библиотеках фагового дисплея, и затем проводят их скрининг на связывание фаговой частицы с антигеном, согласно описанию Winter, G., et al., Ann. Rev. Immunol. 12 (1994) 433-455. Как правило, фаги экспонируют фрагменты антител либо в виде одноцепочечных Fv (scFv) фрагментов, либо в виде Fab фрагментов. Библиотеки на основе генов, полученных из иммунизированных доноров, позволяют получить высокоаффинные антитела к иммуногену без необходимости создания гибридом. В альтернативном случае, для получения единого источника антител к широкому спектру "чужих" и "своих" антигенов можно клонировать репертуар генов первичных антител (например, человеческих), согласно описанию Griffiths, A.D., et al., EMBO J. 12 (1993) 725-734. Наконец, "наивные" или первичные библиотеки также могут быть синтезированы путем клонирования неперестроенных сегментов, включающих V-гены стволовых клеток, и использования праймеров PCR, содержащих случайные последовательности, которые кодируют высоковариабельные участки CDR3 и обеспечивают перестройку in vitro, согласно описанию Hoogenboom, H.R. and Winter, G., J. Mol. Biol. 227 (1992) 381-388. Публикации, в которых описаны фаговые библиотеки человеческих антител, включают, например, US 5,750,373, US 2005/0079574, US 2005/0119455, US 2005/0266000, US 2007/0117126, US 2007/0160598, US 2007/0237764, US 2007/0292936 и US 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, в данном описании считаются человеческими антителами или фрагментами человеческих антител.
5. Мультиспецифические антитела
В некоторых воплощениях предложенное в данном документе антитело представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, имеющие связывающие детерминанты по меньшей мере для двух различных сайтов. В некоторых воплощениях биспецифические антитела могут связывать два различных эпитопа одного и того же антигена. Биспецифические антитела также можно применять для размещения цитотоксических агентов на клетках, экспрессирующих антиген. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
Способы получения мультиспецифических антител включают рекомбинантную ко-экспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулинов, имеющих разную специфичность (см. Milstein, С. and Cuello, А.С., Nature 305 (1983) 537-540, WO 93/08829 и Traunecker, A., et al., EMBO J. 10 (1991) 3655-3659), а также технологию "выступы-во-впадины" ("knob-in-hole") (см., например, US 5,731,168). Мультиспецифические антитела также могут быть получены за счет наведения электростатических зарядов для получения молекул антител с гетеродимерными Fc-фрагментами (WO 2009/089004); сшивания двух или более антител или фрагментов (см., например, патент США US 4,676,980 и Brennan, М., et al., Science 229 (1985) 81-83); использования «лейциновых застежек» для получения биспецифических антител (см., например, Kostelny, S.A., et al., J. Immunol. 148 (1992) 1547-1553; с помощью технологии "диател" для получения фрагментов биспецифических антител (см., например, Holliger, P., et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448) и использования одноцепочечных Fv (sFv) димеров (см., например, Gruber, М., et al., J. Immunol. 152 (1994) 5368-5374), а также получения триспецифических антител, например, согласно описанию в публикации Tutt, A., et al., J. Immunol. 147 (1991) 60-69).
Рекомбинантные антитела с тремя или более функциональными сайтами связывания антигенов, включая антитела типа "Octopus antibodies," также включены в данное описание (см., например, US 2006/0025576).
Антитело или фрагмент в данном документе также включает "FAb двойного действия" или "DAF" (от англ. "Dual Acting FAb"), содержащий антигенсвязывающий сайт, связывающий специфический антиген, а также другой отличный антиген (см., например, US 2008/0069820).
Антитело или фрагмент в данном документе также включает мультиспецифические антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
6. Варианты антител
В некоторых воплощениях рассматриваются варианты аминокислотных последовательностей предложенных в данном документе антител. Например, может требоваться улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антитела могут быть получены путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки и/или замены остатков в составе аминокислотной последовательности антитела. Для получения конечной конструкции можно осуществлять любые комбинации делеций, вставок и замен, при условии, что конечная конструкция будет обладать желаемыми характеристиками, например, связыванием антигена.
а) Варианты с заменами, вставками и делециями
В некоторых воплощениях предложены варианты антитела, имеющие одну или более аминокислотных замен. Сайты, представляющие интерес для проведения замещающего мутагенеза включают HVR и FR. Примеры модификаций приведены в Таблице 1 под заголовком "примеры замен" и подробнее описаны далее, со ссылкой на классы боковых цепей аминокислот. Консервативные замены представлены в Таблице 1 под заголовком "предпочтительные замены". Аминокислотные замены можно вводить в антитело, представляющее интерес, и проводить скрининг полученных продуктов на предмет желаемой активности, например, сохранения/улучшения связывания антигена, понижения иммуногенности или улучшения ADCC или CDC.

Аминокислотные остатки можно сгруппировать в соответствии общими свойствами боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gin;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены влекут за собой замещение представителя одного из этих классов представителем другого класса.
Один вид замен включает замену одного или нескольких остатков гипервариабельного участка родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный(е) вариант(ы), отбираемые для дальнейшего изучения, будут иметь модификации (например, улучшение) определенных биологических свойств (например, повышенную аффинность, пониженную иммуногенность) по отношению к родительскому антителу и/или в значительной степени сохраняют определенные биологические свойства родительского антитела. Примером варианта с заменами является антитело, подвергнутое аффинному созреванию, которое может быть легко получено, например, при помощи подробно описанной технологии увеличения аффинности с использованием фагового дисплея. Вкратце, один или более остатков HVR подвергают мутации и проводят скрининг вариантов антитела, экспрессируемых фагом, по определенной биологической активности (например, аффинности связывания).
Изменения (например, замены) могут осуществляться внутри HVR, например, для увеличения аффинности антитела. Такие изменения можно проводить в "горячих точках" HVR, т.е. в остатках, кодируемых кодонами, которые в процессе соматического созревания с высокой частотой подвергаются мутациям (см., например, Chowdhury, P.S., Methods Mol. Biol. 207 (2008) 179-196), и/или SDR (a-CDR), а у полученных вариантов VH или VL исследовать аффинность связывания. Повышение аффинности путем конструирования и повторного отбора из вторичных библиотек было описано, например, Hoogenboom, H.R., et al., in Methods in Molecular Biology 178 (2002) 1-37. В некоторых воплощениях для повышения аффинности повышают изменчивость вариабельных генов, выбранных для повышения аффинности при помощи любого из существующих разнообразных методов (например, ПЦР пониженной точности, перестройки цепей или олигонуклеотид-направленного мутагенеза). После этого создается вторичная библиотека. Затем проводят скрининг библиотеки для выявления любых вариантов антител с необходимой аффинностью. Другой способ повышения изменчивости включает методы, нацеленные на изменение HVR, при которых рандомизируют несколько остатков HVR (например, 4-6 остатков одновременно). HVR остатки, задействованные в связывании антигена, могут быть специально идентифицированы, например, при помощи аланин-сканирующего мутагенеза или моделирования. В частности, изменениям часто подвергаются CDR-H3 и CDR-L3.
В некоторых воплощениях замены, вставки или делеции могут возникать в составе одного или нескольких HVR, при условии, что такие изменения существенным образом не снижают способность антитела связывать антиген. Например, могут быть выполнены консервативные замены в HVR (например, консервативные замены, описанные в данном документе), которые существенным образом не снижают аффинность связывания. Такие замены могут располагаться за пределами "горячих точек" HVR или SDR. В некоторых воплощениях, каждый HVR либо остается без изменений, либо содержит не более одной, двух или трех аминокислотных замен в составе вариантов последовательностей VH и VL, приведенных выше.
Полезный способ определения остатков или участков антитела, которые могут быть мишенями направленного мутагенеза, называется "аланин-сканирующий мутагенез", описанный Cunningham, B.C. and Wells, J.A., Science 244 (1989) 1081-1085. В этом способе выявляют аминокислотный остаток или группу таргетных остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и замещают нейтральным или отрицательно заряженными аминокислотами (например, аланином или полиаланином), чтобы выяснить, изменится ли взаимодействие антитела с антигеном. Если при первоначальной замене аминокислот происходят изменения функциональных свойств молекулы, в этих позициях можно проводить дальнейшие замены. Дополнительно или альтернативно, может оказаться полезным провести анализ кристаллической структуры комплекса антиген-антитело для выявления точек контакта между антителом и антигеном. Такие остатки, задействованные в контактах, а также соседние с ними остатки могут быть выбраны в качестве кандидатов для замен. Можно проводить скрининг вариантов с целью выявления у них наличия желаемых свойств.
Вставки в аминокислотных последовательностях добавления на амино- и/или карбокси-концах, составляющие по длине от одного остатка до полипептидов, содержащих сотни или более остатков, а также вставки одного или нескольких аминокислотных остатков внутри последовательности. Примеры вставок в концевых участках включают антитела с N-концевым остатком метионила. Другие варианты молекулы антитела с вставками включают объединение N- или С-конца антитела с ферментом (например, ADEPT) или полипептидом, приводящее к увеличению времени полужизни антитела в сыворотке.
b) варианты с измененным гликозилированием
В некоторых воплощениях предложенное антитело модифицировано для повышения или понижения степени гликозилирования антитела. Добавление или удаление сайтов гликозилирования антитела может легко достигаться за счет изменения аминокислотной последовательности таким образом, что создаются или удаляются один или несколько сайтов гликозилирования.
В случае когда антитело содержит Fc-область, присоединенные к ней углеводы могут быть изменены. Нативные антитела, продуцируемые в клетках млекопитающих, обычно содержат разветвленные двухантенные олигосахариды, которые как правило присоединены посредством N-гликозидной связи к Asn297 CH2 домена Fc-области. См., например, Wright, et al., TIBTECH 15 (1997) 26-32. Олигосахариды могут включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стволе» двухантенной олигосахаридной структуры. В некоторых воплощениях для создания вариантов антитела с некоторыми улучшенными свойствами могут производиться модификации олигосахаридов в составе антитела по изобретению.
В одном воплощении предложены варианты антител, имеющие углеводную структуру, в которой отсутствует фукоза, присоединенную (напрямую или опосредовано) к Fc-участку. Например, содержание фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют путем расчета среднего содержания фукозы в составе углеводной цепи, присоединенной к Asn297, относительно суммы всех гликоструктур, присоединенных к Asn297 (например, комплексных, гибридных структур и структур с высоким содержанием маннозы), при определении методом масс-спектрометрии MALDI-TOF, например, согласно описанию WO 2008/077546. Asn297 обозначает остаток аспарагина, находящийся приблизительно в положении 297 в области Fc (нумерация остатков в области Fc согласно системе EU); однако, Asn297 может также находиться на расстоянии ±3 аминокислот в восходящем или нисходящем направлении от позиции 297, т.е., между позициями 294 и 300, вследствие незначительных вариаций в последовательности антител. Такие варианты с модифицированным фукозилированием могут проявлять повышенную ADCC. См, например, US 2003/0157108; US 2004/0093621. Примеры публикаций, относящихся к "дефукозилированным" или "лишенным фукозы" вариантам антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki, A., et al., J. Mol. Biol. 336 (2004) 1239-1249; Yamane-Ohnuki, N., et al., Biotech. Bioeng. 87 (2004) 614-622. Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 CHO с нарушением фукозилирования белков (Ripka, J., et al., Arch. Biochem. Biophys. 249 (1986) 533-545; US 2003/0157108 и WO 2004/056312, в частности, Пример 11) и клеточные линии с выключенными генами, например, с выключенным геном α-1,6-фукозилтрансферазы, FUT8, клетки CHO с выключенными генами (см., например, Yamane-Ohnuki, N., et al., Biotech. Bioeng. 87 (2004) 614-622; Kanda, Y., et al., Biotechnol. Bioeng. 94 (2006) 680-688 и WO 2003/085107).
Также известны варианты антител с бисекционными (разветвленными) олигосахаридами, например, в которых двухантенный олигосахарид, присоединенный к Fc-области антитела, разделен пополам GlcNAc. Такие варианты антител могут иметь пониженное содержание фукозы и/или повышенную ADCC. Примеры таких вариантов антител описаны, например, в WO 2003/011878; US 6,602,684 и US 2005/0123546. Также предложены варианты антител по меньшей мере с одним остатком галактозы в составе олигосахарида, присоединенного к Fc-области. Такие варианты антител могут обладать улучшенной CDC функцией. Такие варианты антител описаны, например, в WO 1997/30087; WO 1998/58964 и WO 1999/22764.
с) варианты с модификациями Fc-области
В некоторых воплощениях в Fc-область антитела, описанного в данном документе, могут быть введены одна или две аминокислотные модификации, и таким образом получены варианты Fc-области. Вариант с модификацией Fc-области может содержать последовательность Fc-области человеческого происхождения (например, Fc-области IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одной или нескольких аминокислотных позициях.
В некоторых воплощениях изобретение относится к варианту антитела, обладающему некоторыми, но не всеми эффекторными функциями, которые делают его подходящим кандидатом для применений, в которых время полужизни антитела in vivo имеет важное значение, однако некоторые эффекторные функции (например, комплемент- и антитело-зависимая клеточная цитотоксичность) являются необязательными или нежелательными. Для подтверждения снижения/устранения CDC и/или ADCC активностей можно проводить исследование цитотоксичности in vitro и/или in vivo. Например, исследование связывания Fc-рецептора (FcR) можно проводить для подтверждения того, что антитело не связывается с FcγR (следовательно, по всей вероятности не обладает ADCC активностью), но сохраняет способность связывать FcRn. Первичные клетки, опосредующие ADCC, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγIII. Данные, касающиеся экспрессии FcR на гемопоэтических клетках, кратко изложены в Таблице 3 на стр. 464 в публикации Ravetch, J.V. and Kinet, J.P., Annu. Rev. Immunol. 9 (1991) 457-492. He являющиеся исчерпывающими примеры исследований in vitro, позволяющих оценить ADCC активность молекулы, представляющей интерес, описаны в патенте США US 5,500,362 (см., например, Hellstrom, I., et al., Proc. Natl. Acad. Sci. USA 83 (1986) 7059-7063 и Hellstrom, I., et al., Proc. Natl. Acad. Sci. USA 82 (1985) 1499-1502); US 5,821,337 (см. Bruggemann, M., et al., J. Exp. Med. 166 (1987) 1351-1361). В альтернативном случае можно использовать нерадиоактивные методы исследования (см, например, нерадиоактивный метод исследования цитотоксичности для проточной цитометрии ACTI™ (CellTechnology, Inc. Mountain View, CA; и нерадиоактивный метод исследования цитотоксичности CytoTox 96® (Promega, Madison, WI). Подходящие эффекторные клетки для таких исследований включают мононуклеарные клетки периферической крови (PBMC) и естественные киллерные клетки (NK). В альтернативном случае или дополнительно ADCC активность молекулы, представляющей интерес, можно оценить in vivo, например, в модели на животных, такой как описанная Clynes, R., et al., Proc. Natl. Acad. Sci. USA 95 (1998) 652-656. Исследования связывания C1q можно также проводить для подтверждения того, что антитело не способно связывать C1q и, следовательно, не обладает CDC активностью. См., например, определение связывания C1q и C3c методом ИФА в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно выполнять исследование CDC (см., например, Gazzano-Santoro, Н., et al., J. Immunol. Methods 202 (1996) 163-171; Cragg, M.S., et al., Blood 101 (2003) 1045-1052; and Cragg, M.S. and M.J. Glennie, Blood 103 (2004) 2738-2743). Связывание FcRn и исследование клиренса/времени полужизни in vivo можно также выполнять при помощи способов, известных в области техники (см., например, Petkova, S.B., et al., Int. Immunol. 18 (2006) 1759-1769).
Антитела со сниженной эффекторной функцией включают антитела с заменой одного или нескольких остатков в позициях 238, 265, 269, 270, 297, 327 и 329 в Fc-области (US 6,737,056). Такие Fc мутанты включают Fc мутанты с заменами двух или нескольких аминокислот в позициях 265, 269, 270, 297 и 327, включая так называемые Fc мутанты "DANA" с заменой остатков в позициях 265 и 297 на аланин (US 7,332,581).
Описаны некоторые варианты антител с улучшенным или пониженным связыванием с FcR (см., например, US 6,737,056; WO 2004/056312 и Shields, R.L., et al., J. Biol. Chem. 276 (2001) 6591-6604).
В некоторых воплощениях вариант антитела содержит Fc-область с одной или несколькими аминокислотными заменами, которые улучшают ADCC, например, заменами в позициях 298, 333 и/или 334 в Fc-области (нумерация остатков в соответствии с системой EU).
В некоторых воплощениях изменения затрагивают Fc-область и вызывают изменение (т.е. улучшение или нарушение) связывания C1q и/или комплемент-зависимой цитотоксичности (CDC, от англ. Complement Dependent Cytotoxicity), например, как описано в US 6,194,551, WO 99/51642 и Idusogie, Е.Е., et al., J. Immunol. 164 (2000) 4178-4184.
Антитела с увеличенным временем полужизни и улучшенным связыванием с неонатальным рецептором FcRn, отвечающим за транспорт материнских IgG к плоду (Guyer, R.L., et al., J. Immunol. 117 (1976) 587-593, and Kim, J.K., et al., J. Immunol. 24 (1994) 2429-2434), описаны в US 2005/0014934. Эти антитела содержат Fc-область с одной или несколькими заменами, которые улучшают связывание Fc-области с FcRn. Такие варианты с модификациями Fc-включают варианты с заменами одного или нескольких остатков Fc-области в позициях: 238, 252, 253, 254, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замены остатка в позиции 434 в Fc-области (US 7,371,826).
См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; US 5,648,260; US 5,624,821 и WO 94/29351, касающиеся других примеров вариантов с модификациями Fc-области.
d) модифицированные цистеином варианты антител
В некоторых воплощениях, может быть целесообразным создание модифицированных цистеином антител, например, "thioMAbs," в которых один или несколько остатков антитела заменены остатками цистеина. В конкретных воплощениях замененные остатки располагаются в доступных сайтах антитела. При замене этих остатков на цистеин реакционно-способные тиоловые группы размещаются в доступных сайтах антитела и могут использоваться для конъюгирования антитела с другими компонентами, например, компонентами лекарств или фрагментами линкер-лекарство, для создания конъюгата антитела, согласно описанию ниже. В некоторых воплощениях один или несколько из следующих остатков могут быть заменены на цистеин: V205 легкой цепи (нумерация по Кабат); А118 тяжелой цепи (нумерация EU) и S400 (нумерация EU) Fc-фрагмента тяжелой цепи. Модифицированные цистеином антитела могут быть получены, как описано, например, в патенте США US 7,521,541.
e) производные антител
В некоторых воплощениях предложенное в данном документе антитело может быть также модифицировано с целью введения дополнительных небелковых компонентов, известных в данной области техники и легко доступных. Компоненты, подходящие для получения производных антитела, включают водорастворимые полимеры, но не ограничиваются ими. Не являющиеся исчерпывающими примеры водорастворимых полимеров включают полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена и малеинового ангидрида, полиаминокислоты (как гомополимеры, так и случайные сополимеры) и декстран или поли(n-винил пирролидон)полиэтиленгликоль, гомополимеры пропропиленгликоля, сополимеры пролипропиленоксида и этилен оксида, полиоксиэтилированные полиолы (например, глицерол), поливиниловый спирт и их смеси, но не ограничиваются ими. Пропиональдегид полиэтиленгликоля может иметь преимущества при производстве благодаря своей стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать и в случае присоединения более одного полимера, их молекулы могут быть идентичными или различаться. Как правило, число и/или тип полимеров, применяемых для получения производных, может определяться исходя из того, какие конкретные свойства или функции антитела, нуждаются в улучшении, и того, будет ли производное антитела применяться в терапии при определенных условиях, и т.д., но не ограничиваться данными соображениями.
В другом воплощении предложены конъюгаты антитела и небелковые компоненты, которые могут быть избирательно нагреты под воздействием излучения. В одном воплощении, небелковый компонент представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Излучение может иметь любую длину волны, включая, но не ограничиваясь длинами волн, не повреждающими обычные клетки, но нагревающими небелковый компонент до температуры, которая вызывает гибель клеток, расположенных вблизи небелкового компонента антитела.
III. Рекомбинантные способы и композиции
Способы получения моноклональных антител впервые описали Kohler and Milstein (Nature 256 (1975) 495-497). Затем было описано получение рекомбинантных антител с помощью стабильного введения нуклеиновой кислоты, кодирующей антитело (ДНК), в клетки миеломы (см. Oi, et al., Proc. Natl. Acad. Sci. USA 80 (1983) 6351-6355).
Нуклеиновую кислоту, кодирующую антитело (полное антитело или вариабельные домены), можно выделить из клетки, продуцирующей антитело, и секвенировать с помощью стандартных методов. После выделения кодирующую нуклеиновую кислоту можно встроить в один или несколько векторов экспрессии. Если выделяют нуклеиновую кислоту, кодирующую только вариабельный домен, вектор экспрессии также содержит нуклеиновую кислоту, кодирующую константный участок тяжелой цепи и/или легкой цепи, соответственно (см., например US 5,658,570). Вектором экспрессии можно трансфецировать прокариотическую (Е.coli) или эукариотическую клетку-хозяина (CHO, HEK, BHK, SP2/0), которая без этого не секретирует антитела.
Если кодирующая нуклеиновая кислота получена из библиотеки, например, библиотеки фагового дисплея, библиотеки дрожжевого дисплея или в принципе библиотеки клеточного дисплея, ее можно клонировать непосредственно в вектор экспрессии.
Антитела могут быть получены с применением рекомбинантных способов и композиций, например, описанных в патенте США 4,816,567. В одном воплощении предложена выделенная нуклеиновая кислота, кодирующая антитело, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В следующем воплощении предложены один или более векторов (например, экспрессирующие векторы), содержащие такую нуклеиновую кислоту. В следующем воплощении предложены клетки-хозяева, содержащие такую нуклеиновую кислоту. В одном из таких воплощений клетка-хозяин содержит (например, была трансформирована): (1) вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VL антитела и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VL антитела и второй вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (CHO) или лимфоидную клетку (например, Y0, NS0, Sp20). В одном воплощении предложен способ получения антитела, описанного в данном документе, где способ включает культивирование клеток-хозяев, содержащих нуклеиновую кислоту, кодирующую антитело, согласно описанию выше, при условиях, подходящих для экспрессии антитела, и возможно, выделение антитела из клеток-хозяев (или среды культивирования клеток-хозяев).
Для получения антитела, описанного в данном документе, рекомбинантным способом нуклеиновую кислоту, кодирующую антитело, например, согласно описанию выше, выделяют и вставляют в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетках-хозяевах. Такую нуклеиновую кислоту можно легко выделить и секвенировать при помощи стандартных методов (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Клетки-хозяева, подходящие для клонирования или экспрессии векторов, кодирующих антитело, включают клетки прокариот или эукариот, описанные в данном документе. Например, антитела могут производиться в бактериях, в частности, когда гликозилирование и эффекторные функции Fc не являются необходимыми. Для экспрессии фрагментов антител и полипептидов в бактериях см., например, патенты США US 5,648,237, US 5,789,199 и US 5,840,523. (См. также Charlton, К.А., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, описывающие экспрессию фрагментов антител в Е.coli.). После экспрессии антитело можно выделить из бактериальной массы в виде растворимой фракции и затем очистить.
Кроме прокариот в качестве хозяев для клонирования или экспрессии векторов, кодирующих антитела, подходят микроорганизмы-эукариоты, такие как мицелиальные грибы или дрожжи, включая штаммы грибов и дрожжей, у которых пути гликозилирования были "гуманизированы" для обеспечения продукции антитела с частично или полностью человеческим профилем гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414 и Li, Н., et al., Nat. Biotech. 24 (2006) 210-215.
Клетки-хозяева, подходящие для экспрессии гликозилированных антител также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Также были найдены многочисленные штаммы бакуловирусов, которые могут использоваться совместно с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также можно использовать культуры клеток растений. См., например, патенты США US 5,959,177, US 6,040,498, US 6,420,548, US 7,125,978 и US 6,417,429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев можно также использовать клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, адаптированные для роста в суспензии. Другими примерами клеточных линий млекопитающих, используемых в качестве хозяев, являются линия клеток почки обезьяны CV1, трансформированная SV40 (COS-7); линия человеческих эмбриональных клеток почки (293 или клетки 293, например, согласно описанию Graham, F.L., et al., J. Gen Virol. 36 (1977) 59-74); клетки почки новорожденного хомяка (BHK); мышиные клетки сертоли (клетки TM4, например, согласно описанию Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени крысы буффало (BRL 3A); клетки легких человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (MMT 060562); клетки TRI (например, согласно описанию Mather, J.P., et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68); клетки MRC 5; и клетки FS4. Другие клеточные линии млекопитающих, используемые в качестве хозяев, включают клетки яичников китайского хомячка (CHO), включая клетки DHFR" CHO (Urlaub, G., et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220) и линии клеток миеломы, такие как Y0, NS0 и Sp2/0. Обзор некоторых клеточных линий млекопитающих, подходящих в качестве хозяев для получения антител, представлен, например, Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
III. Иммуноконъюгаты
В изобретении также предложены иммуноконъюгаты, содержащие антитело по изобретению, конъюгированное с одним или несколькими цитотоксическими агентами, например, химиотерапевтическими агентами или лекарствами, подавляющими рост агентами, токсинами (например, белковыми токсинами, энзиматически активными токсинами бактериального, грибкового, растительного или животного происхождения и их фрагментами) или радиоактивными изотопами.
В одном воплощении иммуноконгъюгат представляет собой конъюгат антитело-лекарство (ADC), в составе которого антитело конъюгировано с одним или несколькими лекарствами, включая майтансиноид (см. US 5,208,020, US 5,416,064 и EP 0425235 В1); ауристатин, например, лекарственные фрагменты DE и DF монометилауристатина (MMAE и MMAF) (см. US 5,635,483, US 5,780,588 и US 7,498,298); доластатин, калихеамицин или их производные (см. US 5,712,374, US 5,714,586, US 5,739,116, US 5,767,285, US 5,770,701, US 5,770,710, US 5,773,001 и US 5,877,296; Hinman, L.M., et al., Cancer Res. 53 (1993) 3336-3342 и Lode, H.N., et al., Cancer Res. 58 (1998) 2925-2928); антрациклин, например, дауномицин или доксорубицин (см. Kratz, F., et al., Curr. Med. Chem. 13 (2006) 477-523; Jeffrey, S.C., et al., Bioorg. Med. Chem. Lett. 16 (2006) 358-362; Torgov, M.Y., et al., Bioconjug. Chem. 16 (2005) 717-721; Nagy, A., et al., Proc. Natl. Acad. Sci. USA 97 (2000) 829-834; Dubowchik, G.M., et al., Bioorg. & Med. Chem. Letters 12 (2002) 1529-1532; King, H.D., et al., J. Med. Chem. 45 (2002) 4336-4343 и патент США US 6,630,579); метотрексат; виндезин; таксан, например, доцетаксел, паклитаксел, ларотаксел, тезетаксел, ортатаксел; трихотецен; и CC1065, но не ограничиваясь ими.
В другом воплощении иммуноконъюгат содержит описанное в данном документе антитело, конъюгированное с энзиматически активным токсином или его фрагментом, включая А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курицин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, ретстриктоцин, феномицин, эномицин и трихотецены, но не ограничиваясь ими.
В другом воплощении иммуноконъюгат содержит описанное в данном документе антитело, конъюгированное с радиоактивным изотопом и формирующее "радиоконъюгат". Для получения радиоактивных конъюгатов существует большое разнообразие радиоактивных изотопов. Примеры их включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Если для детекции применяется радиоконъюгат, он может содержать радиоактивный изотоп для проведения сцинтиграфического исследования, например, TC99m или I123, или спиновую метку для проведения исследования методом ядерного магнитного резонанса (ЯМР) (также известного под названием магнитного резонансного исследования), например, иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела с цитотоксическим агентом могут быть получены с применением различных бифункциональных сшивающих агентов для присоединения белков, таких как N-сукцинимидил-3-(2-пиридилдитио)-пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональных производных имидоэфиров (таких как диметил адипимидат HCl), активных эфиров (таких как дисукцинимидил суберат), альдегидов (таких как глутаральдегид), бис-азидо соединений (таких как бис(р-азидобензоил)гександиамин), производных бисдиазония (таких как бис-(р-диазоний-бензоил)-этилендиамин), диизоцианатов (таких как толуол 2,6-диизоцианат) и соединений с двумя активными атомами фтора (таких как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицина может быть получен согласно описанию Vitetta, E.S., et al., Science 238 (1987) 1098-1104. Меченая углеродом-14 1-изотиоцианатобензил-3-метилдиэтилен триаминопентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгирования меченого радиоактивным изотопом нуклеотида с антителом. См. WO 94/11026. Линкер может быть "расщепляемым линкером", способствующим высвобождению цитотоксического лекарства в клетках. Например, можно применять кислотолабильный линкер, чувствительный к пептидазам линкер, фотолабильный линкер, диметиловый линкер или дисульфид-содержащий линкер (Chari, R.V., et al., Cancer Res. 52 (1992) 127-131; US 5,208,020).
Иммуноконъюгаты или конъюгаты антитело-лекарство в данном документе явным образом предусматривают но не ограничиваются конъюгатами, полученными с помощью образующих поперечные связи реагентов, включающих, но не ограничивающихся BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)-бензоат), которые поставляются на рынок (например, компанией Pierce Biotechnology, Inc., Rockford, IL., U.S.A).
IV. Способы и композиции для диагностики и детекции
В некоторых воплощениях любое из предложенных здесь антител можно применять для определения наличия его антигена в биологическом образце. Термин "определение", используемый в данном документе, включает количественное или качественное определение. В некоторых воплощениях биологический образец включает клетку или ткань.
В одном воплощении предложено антитело, которое может найти применение в способах диагностики или детекции. В следующем аспекте предложен способ детекции наличия антигена в биологическом образце. В некоторых воплощениях способ включает приведение в контакт биологического образца с антителом по данному описанию в условиях, обеспечивающих связывание антитела с его антигеном, и определение, сформировался ли комплекс между антителом и антигеном. Такой способ может представлять собой способ для применения in vitro или in vivo.
В некоторых воплощениях предложены меченные антитела, описанные в данном документе. Метки включают детектируемые напрямую метки или компоненты (например, флуоресцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также компоненты, например, ферменты или лиганды, которые детектируют опосредовано, например, при помощи ферментативной реакции или молекулярного взаимодействия, но не ограничиваются ими. Примеры меток включают радиоизотопы32Р,14С,125I,3Н и131I, флуорофоры, например, редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светлячка и бактериальную люциферазу (US 4,737,456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (ПХ), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфат дегидрогеназу, оксидазы гетероциклических соединений, такие как уриказа и ксантин-оксидаза, связанные с ферментом, использующим пероксид водорода для окисления хромогена, таким как пероксидаза хрена, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы, и им подобные, но не ограничиваются ими.
V. Фармацевтические препараты
Фармацевтические препараты антитела по данному описанию изготавливают путем смешивания такого антитела, имеющего необходимую степень чистоты, с одним или несколькими возможными фармацевтически приемлемыми носителями (Remingtonʹs Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированного препарата или водного раствора. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозировках и концентрациях и включают: буферы, например, фосфатный, цитратный и содержащие другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензил аммоний хлорид; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкил парабены, такие как метил или пропил парабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (содержащие менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины, гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; углеводы, такие как сахароза, маннитол, трегалоза или сорбитол; солеобразующие противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ), но не ограничиваются ими. Примеры фармацевтически приемлемых носителей в данном документе также включают диспергирующие агенты, такие как активные в нейтральных условиях растворимые гликопротеины гиалуронидазы (sHASEGP), например, растворимые гликопротеины гиалуронидазы PH-20 человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Примеры некоторых sHASEGP и способов их применения, включая rHuPH20, описаны в публикациях US 2005/0260186 и 2006/0104968. В одном аспекте sHASEGP дополнительно комбинирован с одним или более гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных препаратов антител описаны в US 6,267,958. Водные препараты антител включают описанные US 6,171,586 и WO 2006/044908, последние включают гистидин-ацетатный буфер.
Препараты могут также содержать несколько активных ингредиентов, предпочтительно имеющих комплементарную активность и не оказывающих друг на друга отрицательного влияния. Такие активные ингредиенты соответственно находятся в комбинации в количествах, эффективных для намеченного использования.
Активные ингредиенты могут быть заключены в микрокапсулы, приготовленные, например, с помощью технологии коацервации или полимеризации на границе раздела фаз, например, в микрокапсулы гидроксиметилцеллюлозы или желатина и микрокапсулы поли-(метилметакрилата), соответственно, в коллоидные системы доставки лекарственных препаратов (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики описаны в Remingtonʹs Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980).
Можно изготавливать препараты с пролонгированным высвобождением. Примеры подходящих препаратов с пролонгированным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, в которых матрицы находятся в форме профилированных изделий, например, в виде пленок или микрокапсул.
Препараты, применяющиеся для введения in vivo, как правило, стерильны. Стерильность может быть достигнута, например, путем фильтрации через стерильные фильтрующие мембраны.
VI. Изделия
В другом аспекте изобретения предложены изделия, содержащие материалы, которые могут найти применение в лечении, предупреждении и/или диагностике нарушений, описанных выше. Изделия включают контейнер и этикетку или листовку-вкладыш на контейнере или внутри него. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, пакеты с раствором для внутривенного введения и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая самостоятельно или в комбинации с другой композицией является эффективной при лечении, предупреждении и/или диагностике патологических состояний, и может иметь отверстие для стерильного доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон с пробкой, которую можно проткнуть иглой для подкожных инъекций). По меньшей мере один активный агент в композиции представляет собой антитело по изобретению. На этикетке или листовке-вкладыше указано, что композицию применяют для лечения предпочтительного патологического состояния. Кроме того, изделие может содержать (а) первый контейнер с содержащейся в нем композицией, где композиция содержит антитело по изобретению и (б) второй контейнер с содержащейся в нем композицией, где композиция содержит цитотоксический или иной терапевтический агент. Изделие в данном воплощении изобретения может также содержать листовку-вкладыш, с указанием, что композиции могут применяться в лечении конкретного патологического состояния. Альтернативно или дополнительно изделие может также содержать второй (или третий) контейнер, содержащий фармацевтически-приемлемый буфер, например бактериостатическую воду для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Оно может также содержать другие материалы, привлекательные с коммерческой и с потребительской точки зрения, включая другие буферы, растворители, фильтры, иглы и шприцы.
Очевидно, что любое из вышеупомянутых изделий может содержать иммуноконъюгат по изобретению вместо или в дополнение к антителу по изобретению.
Следующие Примеры, графические материалы и последовательности позволяют лучше понять данное изобретение, объем которого ограничен прилагаемой формулой. Следует понимать, что указанные методики могут быть модифицированы, но при этом суть изобретения сохранится.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Методы
Масс-спектрометрия с ионизацией электрораспылением (МС-ИЭР)
Аликвоты белка (50 мкг) дегликозилировали путем добавления 0,5 мкл N-гликаназы плюс (Roche) и натрий-фосфатного буфера (0,1 М, pH 7,1) до конечного объема образца 115 мкл. Смесь инкубировали при 37°C в течение 18 ч. Затем для восстановления и денатурации добавляли 60 мкл 0,5 М TCEP (Pierce) в 4 М растворе гуанидин * HCl (Pierce) и 50 мкл 8 М раствора гуанидин * HCl. Смесь инкубировали при 37°C в течение 30 мин. Образцы обессоливали при помощи эксклюзионной хроматографии (Sepharose G-25, изократический режим, 40% ацетонитрил с 2% муравьиной кислотой). Масс-спектры ИЭР (+ve) регистрировали с помощью инструмента Q-TOF (maXis, Bruker), оборудованного источником наноэлектроспрейной ионизации (TriVersa NanoMate, Advion). Параметры настроек масс-спектрометра были следующими: перенос ионов: радиочастотное (РЧ) напряжение конуса (воронки) 400 Vpp; энергия ISCID 0 эВ; РЧ напряжение мультиполя 400 Vpp; квадруполь: энергия ионизации 4,0 эВ; нижний предел 600 m/z; источник: поток осушающего газа 8 л/мин; температура осушающего газа 160°C; камера столкновений: энергия столкновения 10 эВ; РЧ напряжение в камере столкновений: 2000 Vpp; охлаждение ионов: РЧ напряжение в ячейке охлаждения ионов 300 Vpp; время переноса: 120 мкс; накопление ионов перед подачей импульса 10 мкс; диапазон сканирования m/z 600-2000. Для анализа данных использовали разработанное в стенах компании программное обеспечение (MassAnalyzer).
Исследование связывания FcRn методом поверхностного плазмонного резонанса
Способность антитела дикого типа и мутантов связывать FcRn исследовали методом поверхностного плазмонного резонанса (SPR, от англ. surface plasmon resonance) с использованием инструмента BIAcore Т100 (BIAcore AB, Uppsala, Sweden). Данная система хорошо подходит для исследования молекулярных взаимодействий. Она позволяет непрерывно отслеживать в реальном времени связывание лиганд/аналит и таким образом определять кинетические параметры в различных экспериментальных условиях. Технология SPR основана на измерении показателя преломления в поверхностном слое покрытого золотом чипа биосенсора. Изменения показателя преломления указывают на изменения массы на поверхности, вызванные взаимодействием иммобилизованного лиганда с аналитом в инжектируемом растворе. Если молекулы связываются с иммобилизованным лигандом на поверхности, масса увеличивается, в случае диссоциации масса уменьшается. В данном исследовании рецептор FcRn иммобилизовали на поверхности чипа CM5 биосенсора BIAcore (GE Healthcare Bioscience, Uppsala, Sweden) при помощи связывания через аминогруппы до уровня 400 RU (от англ. Response units, единицы ответа). Исследование проводили при комнатной температуре, в качестве проточного и разводящего буфера использовали PBS, 0,05% Tween20, pH 6,0 (GE Healthcare Bioscience). Нативные или окисленные образцы антител в количестве 200 нМ инжектировали при скорости потока 50 мкл/мин при комнатной температуре. Время ассоциации составляло 180 с, фаза диссоциации - 360 с. Для регенерации поверхности чипа выполняли короткие инъекции HBS-P, pH 8,0. Анализ данных SPR осуществляли путем сравнения амплитуды сигналов, характеризующих биологический ответ, регистрируемых через 180 с после инъекции и через 300 с после инъекции. Соответствующими параметрами являлись максимальный уровень сигнала (через 180 с после инъекции) и уровень сигнала в конце фазы диссоциации (через 300 с после окончания инъекции), выраженные в RU.
Пример 1. Подготовка колонки для аффинной хроматографии с применением FcRn
Экспрессия FcRn в клетках HEK293
FcRn транзиторно экспрессировали в клетках HEK293 при трансфекции двумя плазмидами, содержащими кодирующую последовательность FcRn и бета-2-микроглобулина. Трансфецированные клетки культивировали во встряхиваемых флаконах при 6,5°C, при перемешивании на шейкере со скоростью 120 об/мин и амплитудой 5 см, при влажности 80% и содержании CO2 в атмосфере 7%. Клетки разводили каждые 2-3 дня до плотности 3-4*105 клеток/мл.
Для транзиторной экспрессии в биореактор из нержавеющей стали объемом 14 л загружали 8 л питательной среды и посевного материала и осуществляли культивирование при 36,5°C, pH 7,0±0,2, pO2 35% (при подаче смеси N2 и воздуха с суммарной скоростью газового потока 200 мл мин-1) и перемешивании со скоростью 100-400 об/мин. Когда клеточная плотность достигала 20*105 клеток/мл, 10 мг плазмидной ДНК (обе плазмиды в эквимолярном соотношении) разводили в 400 мл среды Opti-MEM (Invitrogen). К этой смеси добавляли 20 мл реагента 293fectin (Invitrogen), которую затем инкубировали в течение 15 минут при комнатной температуре и затем переносили в ферментер. Со следующего дня к клеткам добавляли питательную среду в непрерывном режиме: питательную среду добавляли по 500 мл в сутки, а глюкозу по мере необходимости, поддерживая ее уровень выше 2 г/л. Надосадочную жидкость собирали через 7 дней после трансфекции центрифугированием при 4000 об/мин в течение 90 мин в центрифуге с ротором-крестовиной со свободно подвешенными стаканами объемом 1 л. Для просветления надосадочной жидкости (13 л) ее пропускали через фильтр Sartobran Р (0,45 мкм+0,2 мкм, Sartorius) и выделяли из нее комплекс FcRn бета-2-микроглобулин.
Биотинилирование неонатального Fc-рецептора
После совместной экспрессии растворимого внеклеточного домена FcRn, несущего His-Avi Tag, и β2-микроглобулина в клетках HEK293 и очистки осуществляли его биотинилирование следующим образом.
Для биотинилирования комплекса FcRn/β2-микроглобулин в количестве от 1,2 мг до 12 мг в 5 мл 20 мМ натрий-цитратного буфера, pH 5,5, содержащего 150 мМ KCl, 250 мкл PBS и 1 таблетку коктейля ингибитора протеаз (Roche Diagnostics GmbH, Mannheim, Germany), использовали набор для биотинилирования Avidity согласно инструкциям производителя (Bulk BIRA). Реакцию биотинилирования проводили при комнатной температуре в течение ночи. Модифицированный белок диализировали против 20 мМ натрий-фосфатного буфера, содержащего 150 мМ NaCl, pH 7,5 при 4°C в течение ночи для удаления избытка биотина.
Связывание со стрептавидин-сефарозой
К стрептавидин-сефарозе (GE Healthcare) в количестве 1 г добавляли раствор биотинилированного рецептора, подвергнутого диализу (количество FcRn/β2-микроглобулина составляло от 1,2 до 12 мг, для стандартного аналитического применения использовали 3 мг) и инкубировали в течение 2 ч при перемешивании. Модифицированной сефарозой, после присоединения к ней рецептора, заполняли колонку XK объемом 1 мл (GE Healthcare).
Пример 2. Аффинная хроматография с применением колонки с иммобилизованным FcRn
Модифицированной сефарозой, после присоединения к ней рецептора, заполняли колонку XK объемом 1 мл (GE Healthcare), затем колонку с иммобилизованным FcRn уравновешивали буферным раствором 20 мМ 2-(N-морфолино)-этансульфоновой кислоты (MES), содержащим 150 мМ NaCl, pH 5,5.
Условия:
размер колонки: 50 мм×5 мм
высота слоя сорбента: 5 см
загрузка: 50 мкг образца
уравновешивающий буфер: 20 мМ MES, 150 мМ NaCl, pH 5,5
элюирующий буфер: 20 мМ Tris/HCl, 150 мМ NaCl, pH 8,8
элюирование: 7,5 объемов колонки (CV, от англ. column volume) уравновешивающего буфера; градиент 0-100% - 30 CV элюирующего буфера; 10 CV элюирующего буфера
pH образцов антитела или химерного белка, содержащих от 50 до 100 мкг белка, доводили до pH 5,5 и загружали их в колонку с иммобилизованным FcRn, подключенную к хроматографической системе ÄKTA explorer 10 XT или Dionex Summit (Dionex, Idstein, Germany). Колонку с высотой слоя сорбента 5 см затем промывали 5-10 объемами колонки уравновешивающего буфера 20 мМ MES, 150 мМ NaCl, pH 5,5. Аффинно-связанные белки, содержащие Fc, элюировали градиентом pH, пропуская раствор 20 мМ Tris/HCl, 150 мМ NaCl, pH 8,8, в объеме 30 CV. Для полного элюирования модифицированных антител формировали градиент pH, с конечным значением pH 8,8. Эксперименты проводили при комнатной температуре. Профиль элюирования получали при непрерывном измерении поглощения при 280 нм. Время X, проходившее от инжектирования образца до появления детектируемого пика аналита, обозначали временем удерживания.
Пример 3. Корреляция между временем удерживания на колонке с иммобилизованным FcRn и временем полужизни in vivo
Время полужизни in vivo определяли на трансгенных мышах C57BL/6J, несущих человеческий FcRn, после однократного внутривенного введения 10 мг/кг (n=8) и сопоставляли с временем удерживания на колонке с иммобилизованным FcRn (см. Таблицу). Обнаружили, что у антител, которые медленно элюировались с колонки с иммобилизованным FcRn, время полужизни в организме трансгенных по FcRn мышей было увеличено.
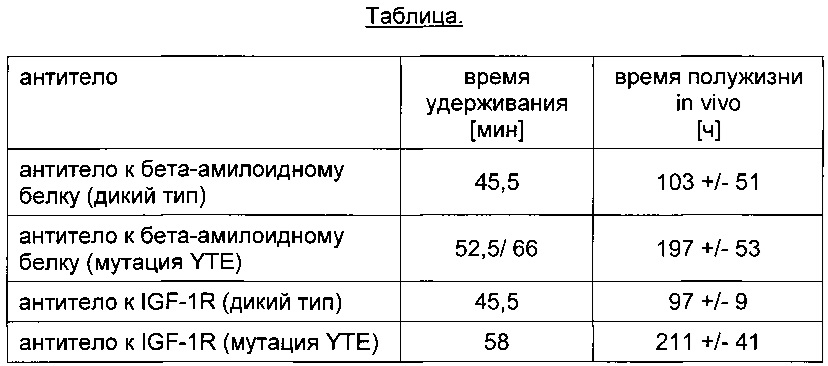
Пример 4. Очистка человеческого FcRn, мышиного FcRn и FcRn яванского макака
Профильтрованную надосадочную жидкость, содержащую белки, несущие гексагистидиновый мотив, загружали в хроматографическую колонку с аффинным сорбентом, модифицированным никель-нитрилотриацетатом (Ni-NTA) (Qiagen, Hanbrechtikon, Switzerland) при 4°C. После этапов отмывки 20 мМ натрий-фосфатным буфером, содержащим 500 мМ NaCl при pH 7,4 и содержащим 20 мМ соответственно 100 мМ имидазола, белки элюировали при скорости 2 мл/мин в периодическом режиме тем же буфером, содержащим 300 мМ имидазол, с применением хроматографической системы ÄKTA Prime (Amersham Pharmacia Biotech, Uppsala, Sweden). Фракции объединяли и далее очищали при помощи эксклюзионной хроматографии (SuperdexTM 200, GE Healthcare, Zurich, Switzerland) в натрий-фосфатном буфере, содержащем 500 мМ NaCl. Количественное определение очищенных белков проводили с помощью спектрофотометра Nanodrop (Nanodrop Technologies, Wilmington, DE) и анализировали при помощи денатурирующего электрофореза в полиакриламидном геле NuPAGE 4-12% Bis-Tris в буфере MES в восстанавливающих условиях.
Пример 5. Аффинная хроматография на колонках с мышиным FcRn и FcRn яванского макака
В следующей Таблице указано время удерживания приведенных в качестве примера человеческих антител на колонках для аффинной хроматографии, содержащих FcRn яванского макака. Результаты были получены в следующих условиях: элюирующий буфер: 20 мМ TRIS/HCl, 150 мМ NaCl, pH 8,5. Более подробное описание: см. Пример 2. Термин мутация YTE обозначает тройную мутацию M252Y/S254T/T256E.

В следующей Таблице в качестве примера приведено время удерживания человеческих антител на FcRn мыши. Результаты были получены в следующих условиях: рецептор (1,2 мг) иммобилизовали на сефарозе (1 мл). Элюирующий буфер: 20 мМ TRIS/HCl, 150 мМ NaCl, pH 8,5. Более подробное описание: см. Пример 2. Мутанты YTE не включены в данную Таблицу, т.к. их элюирование было невозможно без доведения pH элюирующего буфера до значения 9,5.

Колонка для аффинной хроматографии с иммобилизованным FcRn яванского макака, по связыванию гуманизированных антител сопоставима с аффинной колонкой, несущей человеческий FcRn. С другой стороны, связывание гуманизированных антител с колонкой, на которой иммобилизован FcRn мыши, более прочное по сравнению с колонкой для аффинной хроматографии, на которой иммобилизован FcRn человека, о чем свидетельствует увеличение времени удерживания.
Пример 6. Получение фрагментов антител
F(abʹ)2 фрагмент и фрагмент Fc-участка получали путем расщепления полноразмерного антитела, разведенного 1:1 в 100 мМ Tris, pH 8,0, при добавлении 1 мкг цистеиновой протеазы IdeS на 50 мкг антитела и инкубации в течение 2 ч при 37°C. Полученные продукты расщепления F(abʹ)2 и Fc разделяли на колонке для эксклюзионной хроматографии (SEC) (Superdex 200, GE Healthcare, Zurich, Switzerland) с использованием хроматографической системы ÄKTA Explorer (GE Healthcare, Uppsala, Sweden), пиковые фракции объединяли. Для идентификации двух продуктов расщепления по времени удерживания на той же в колонке хроматографировали стандарты молекулярной массы.
Время удерживания полноразмерных антител существенно варьировало. Напротив, время удерживания соответствующих Fc частей всех протестированных антител по существу не отличалось друг от друга (<1%).
При использовании плазмина для расщепления полноразмерных антител были получены аналогичные результаты (данные не приведены).
Пример 7. Корреляция между временем удерживания на колонке с иммобилизованным FcRn и состоянием окисления
Исследовали влияние окисления антитела на время удерживания при аффинной хроматографии с применением FcRn. Окисление IgG1 антитела (1 мг/мл) исследовали при хранении антитела при 40°C в течение 2 месяцев. Образцы немодифицированного и окисленного антитела исследовали при помощи аффинной хроматографии с применением FcRn и поверхностного плазмонного резонанса с применением FcRn (SPR). Окисление антитела анализировали при помощи пептидного картирования и масс-спектрометрии с ионизацией электрораспылением (МС-ИЭР).
Результаты ESI-MS показали, что обращенные к растворителю остатки Met252 и Met428 окислены приблизительно у 50% тяжелых цепей антитела IgG1 после хранения в буфере (20 мМ His/His*HCl, 240 мМ трегалоза, 0,02% полисорбат 20) в условиях ускоренной деградации при 40°C в течение двух месяцев. При внесении образцов, выдерживавшихся при 40°C, содержащих окисленную форму антитела, и образцов, хранившихся при -80°C и при 25°C, в колонку для аффинной хроматографии с предварительно иммобилизованным FcRn выделялись два основных пика (Фиг. 8). Второй пик на Фиг. 8, состоящий из двух по существу перекрывающихся кривых с большим временем удерживания, соответствовал времени элюирования немодифицированного антитела в образцах, хранившихся при 25°C и при -80°C, тогда как пик, элюирующийся раньше, представлял антитело с окисленными Met252 и Met428. О наличии окисленного Met252 и Met428 свидетельствовал сдвиг массы на 16 Да в образце, выдерживавшемся в неблагоприятных условиях, зарегистрированный МС-ИЭР. Анализ образца антитела, выдерживавшегося в неблагоприятных условиях (40°C), методом SPR на биосенсоре BIAcore показал аналогичный характер ответа на сенсограмме, что и при хроматографическом разделении двух видов антител на колонке с иммобилизованным FcRn, т.е. антитела дикого типа и антитела с окисленным Met252 и Met428 (Фиг. 9).
Пример 8. Корреляция между временем удерживания на колонке с иммобилизованным FcRn и формированием агрегатов
Влияние образования агрегатов антитела на взаимодействие с FcRn в ходе аффинной хроматографии изучали на примере антитела к IL13Rα. Фракции мономеров и агрегатов антитела выделяли при помощи эксклюзионной хроматографии (SEC, от англ. size exclusion chromatography) и соответствующие пики объединяли. Взаимодействие фракций с FcRn анализировали при помощи аффинной хроматографии и технологии SPR.
Для выделения трех фракций антитела к IL13Rα, содержащих мономеры антитела к IL13Rα и мультимерные агрегаты, использовали эксклюзионную хроматографию (SEC), полученные фракции хроматографировали на колонках, с иммобилизованным FcRn. Согласно площади пиков на хроматограмме, образцы антитела к IL13Rα, использовавшегося при аффинной хроматографии с применением FcRn, содержали 57% мономеров и 43% агрегатов антитела к IL13Rα. Анализ нефракционированных образцов при аффинной хроматографии с применением FcRn позволил выявить два главных пика, характеризовавшихся различным временем удерживания (Фиг. 10). Меньший пик с большим временем удерживания соответствовал фракции агрегатов, тогда как основная часть пика, элюирующегося быстрее, соответствовала фракции мономеров.
При анализе методом поверхностного плазмонного резонанса (SPR) антитело к IL13Rα, служившее референтным стандартом, сравнивали с двумя различными объединенными фракциями, обогащенными агрегатами (пул 1) и мономерами (пул 2), и с нативным пулом. Точный состав нативного материала и пулированных фракций описан в следующей Таблице.

Сенсограмма пулированного образца 2, обогащенного мономерами, в большей степени была схожа с сенсограммой антитела к IL13Rα, служившего референтным стандартом, и в меньшей степени с сенсограммой образца, обогащенного агрегатами. Напротив, по данным SPR-анализа обогащенный агрегатами пул 1 связывался с FcRn почти в два раза прочнее (Фиг. 11).
Пример 9. Фармакокинетические исследования на мышах, несущих FcRn человека
Все процедуры проводили в соответствии с рекомендациями Ассоциации по аттестации и аккредитации содержания лабораторных животных (www.aaalac.org). Исследования были одобрены региональным комитетом Верхней Баварии, Германия.
Фармакокинетическое исследование проводили на самцах и самках гемизиготных трансгенных мышей линии C57BL/6J с врожденным отсутствием мышиного FcRn, несущих человеческий FcRn (huFcRn (276)-/tg (30, 31).
Перед введением вес животных составлял от 17 до 25 г. Соответствующее антитело вводили в виде однократной болюсной инъекции в хвостовую вену. Поскольку мыши имеют небольшой объем циркулирующей крови, чтобы осуществить отбор проб в 9 временных точках животных поделили на три группы, в каждую из которых вошли четыре самца и четыре самки, и у каждого животного пробы отбирали в 3 временных точках. Образцы крови в группе 1 брали через 5 мин, 24 часа и 336 часов, в группе 2 через 2 часа, 168 часов и 504 часа, а в группе 3 через 8 часов, 48 часов и 672 часа после введения. Образцы крови приблизительно по 100 мкл забирали из ретроорбитального синуса и оставляли при комнатной температуре на 60 мин для свертывания. Образцы сыворотки объемом по меньшей мере 40 мкл получали путем центрифугирования при 9,300 xg при 4°C в течение 3 мин и немедленно замораживали и хранили при -20°C до исследования.
Концентрацию человеческих терапевтически активных антител в сыворотке мышей определяли при помощи иммуноферментного анализа с иммобилизацией антигена (ELISA), специфического в отношении антигенсвязывающей области (Fab) введенного антитела и его вариантов. Все реагенты или образцы инкубировали при комнатной температуре на шейкере при 400 об/мин. Каждый этап отмывки включал три цикла. Вкратце, в планшеты для микротитрования, покрытые стрептавидином, вносили биотинилированное антитело, разведенное в буфере для анализа. После отмывания фосфатным буфером, содержащим полисорбат 20 (Tween 20), добавляли образцы сыворотки в различных разведениях и инкубировали в течение 1 ч. После отмывки связанные человеческие терапевтически активные антитела детектировали при последующей инкубации с Fab-фрагментами моноклонального антитела, специфического к Fcγ человека, конъюгированными с дигоксигенином, не дающими перекрестной реакции с IgG мыши. После отмывки добавляли антитело к дигоксигенину, конъюгированное с пероксидазой хрена (ПХ) и инкубировали в течение 1 ч. После отмывки добавляли ABTS (2,2ʹ-азино-ди[3-этилбензтиазолин сульфонат; Roche Diagnostics, Germany) в качестве субстрата для ПХ для образования окрашенного продукта реакции. Оптическую плотность полученного продукта реакции измеряли при 405 нм при референтной длине волны 490 нм. Все образцы сыворотки и положительные или отрицательные контрольные образцы анализировали в повторностях, для калибровки использовали референтный стандарт.
Для расчета фармакокинетических параметров с помощью пограммы для оценки фармакокинетики WinNonlin™ (Pharsight, St. Louis, MO, USA) версии 5.2.1 использовали некомпартментный подход. Вкратце, площадь под кривой концентрация/время (0-672) рассчитывали методом трапеций (с линейной интерполяцией) от временной точки 0 до бесконечности. Кажущееся время полужизни (Т1/2) рассчитывали по формуле: Т1/2=In2/λz. Общий клиренс (CL) рассчитывали как частное от деления дозы на площадь под кривой. Статистически достоверные различия в фармакокинетических параметрах антитела дикого типа и его вариантов определяли методом дисперсионного анализа.
Фармакокинетические исследования у гемизиготных трансгенных мышей C57BL/6J с врожденным отсутствием мышиного FcRn, несущих человеческий FcRn (huFcRn (276)-/tg), показали, что мутация YTE улучшает фармакокинетику антитела (Фиг. 12). При наличии мутации YTE площадь под кривой (0-672) увеличивалась в 1,74 раза, клиренс снижался в 1,95 раз, а время полужизни возрастало в 2,2 раза по сравнению с антителом дикого типа (Таблица), различия были статистически достоверными.

Фармакокинетические параметры, полученные для антитела дикого типа и антитела с тройной мутацией YTE с использованием некомпартментного подхода к анализу сывороточных концентраций, измеренных методом ИФА, после однократной внутривенной болюсной инъекции 10 мг/кг трансгенным мышам, несущим человеческий FcRn. Среднее ± станд. откл., в каждой группе n=8, статистическую достоверность различий с антителом дикого типа определяли с помощью дисперсионного анализа (+++, p<0,001). Площадь под кривой (0-672) - площадь под кривой зависимости концентрации в сыворотке от времени в интервале от 0 до 672 ч.
Реферат
Изобретение относится к области биохимии. Описано изобретение, включающее применение иммобилизованного нековалентного комплекса неонатального Fc-рецептора и бета-2-микроглобулина (b2m), связанного с хроматографическим материалом, в качестве лиганда для аффинной хромотографии при аффинной хромотографии с восходящим линейным градиентом рН, где нековалентный комплекс неонатального Fc-рецептора (FcRn) и бета-2-микроглобулина (b2m) биотинилирован, а хроматографический материал модифицирован стрептавидином. В одном варианте аффинную хроматографию с восходящим линейным градиентом рН применяют для разделения антител или химерных полипептидов, содержащих, по меньшей мере, Fc-участок. Изобретение расширяет арсенал средств, применяемых в качестве лигандов в аффинной хромотографии с восходящим линейным градиентом рН. 13 з.п. ф-лы, 12 ил., 12 табл., 9 пр.

Комментарии