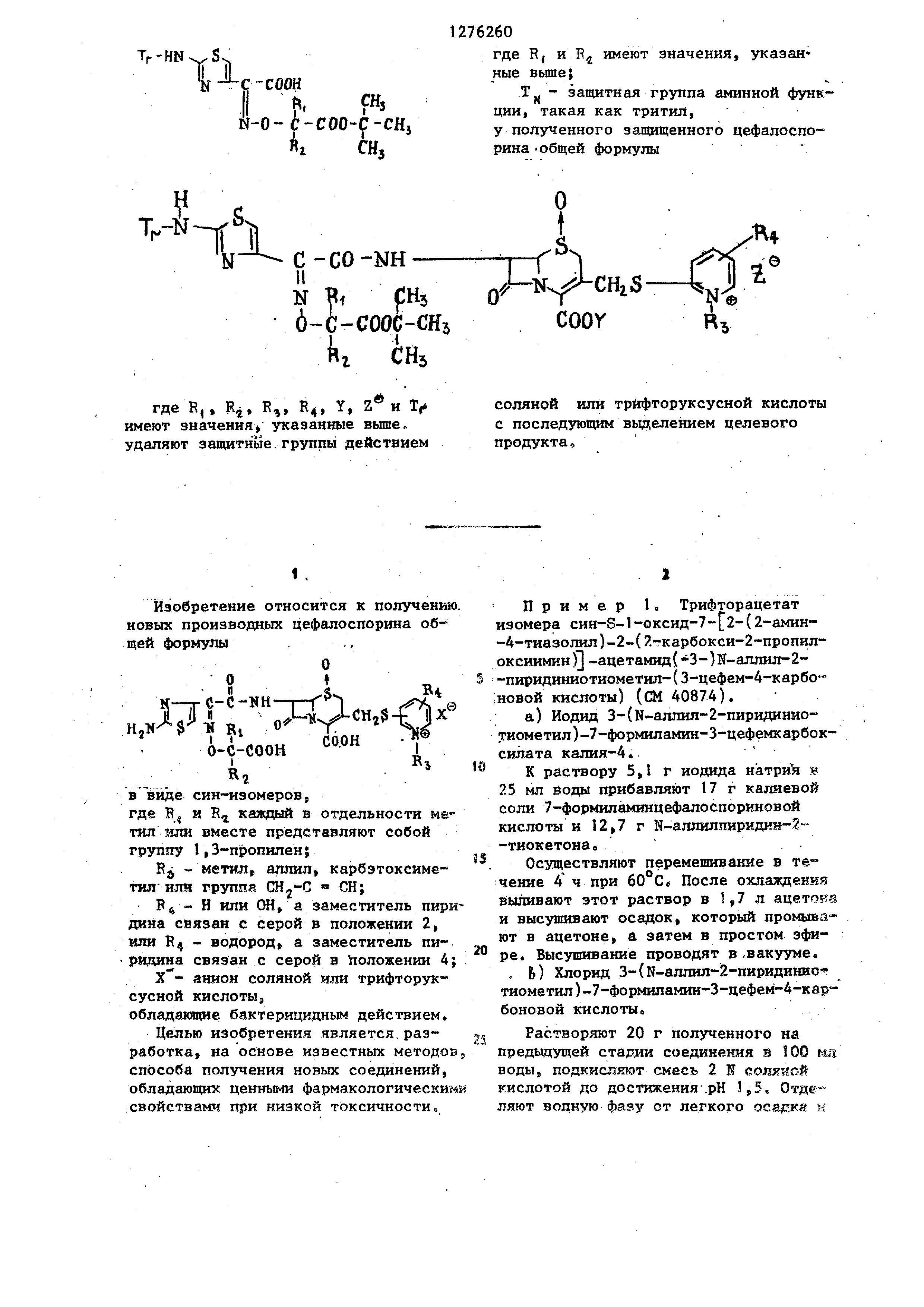
Изобретение относится к получени новых производных цефалоспорина о6
щей формулы О t C-C-NH-i-f K-jC-CO Hy CHjS Ri i-fcOOH CO.OH
R, в виде син-изомеров, где R, и R каждый в отдельности ме
тил шш вместе представляют собой группу I,З-пропилен 5
RJ - метилf аллил, карбэтоксиметилшш группа CHj-C СН;
РФ - Н или ОН, а заместитель пир дина связан с серой в положении 2,
или R - водород, а заместитель пиридина связан с серой в
положении 4 анион соляной или трйфторуксусной кислоты,
обладающие бактерицидным действием. Целью изобретения является.раз
работка, на основе известных методо способа получения новых
соединений, обладающих ценными фармакологически свойствами при
низкой токсичности. Пример 1 о Трифторацетат из омера син-S-1-оксид-7- 2-(2-амин-4-тиазолил )-2-(
.ткарбокси-2-пропилоксииминУ -ацетамид(-3-)Н-аллш1-2-пиридиниотиометил- (3-цефем-4-карбо новой кислоты) (см 40874).
а) Иодид 3-(Н-аллип-2-пиридиниотиометил )-7-формиламин-З-цефемкарбоксилата калия-4. К раствору 5,1 г иодида натрий в
.5 мл Воды прибавляют 17 г калиевой соли 7-формш1аминцефалоспориновой кислоты и 12,7 г М-аллилпиридин-З-тиокетокао
Осуществляют перемешивание в течение 4 ч при После охлаждения
выпивают этот раствор в 1,7 л ацетона и высушивают осадок, который промыва ют в ацетоне, а затем в простом эфире . Высушивание проводят в -вакуз ме. , Ь) Хлорид 3-{Н-аллил-2-пиридиниог тиометил)-7-формш1амин-3-цефем-4-карбоновой кислотыо Растворяют 20 г полученного на предыдущей стад1та соединения в 100 ш воды, подкисляют смесь 2 N соляйс-й кислотой до достижения .рН 1,5, Отделяют водную фазу от легкого ocapKg к вьшивают ее в колонку с ионообменной
смолой Амберлит 1 R А 68 взятой в виде хлоргидрата. Промьюание ведут
водойо Воду затем вьшаривают насухо в вакууме, а остаток растворяют
в аб солютном этанолео Снова вьтаривают досуха и снова растворяют
остаток в простом эфире. Отжимают твердое веще ство и сушат его в
вакууме. С.) Хлорид 5-оксид-1-3(К-аллил-2-пиридиниотиометил-
)-7-формиламин-3-цефем-А-карбоновой кислоты. Растворяют 6 г
соединения, полученного на стадии Ь), в 30 мл муравьиной кислоты.
Прибавляют 30 мл метанола и охлаждают раствор до 5 С. В течение 5
мин прибавляют к этому раствору 2,7 г метахлорнадбензойной кислоты
Оставляют смесь для того, чтобы ее температзфа поднялась до 20 С,
-после чего при этой температуре (20°С) проводят перемешивание в течение 30 мин. Отфильтровывают нерастворимую
часть, а полученный раствор выливают в 600 мл простого эфира Отжимают твердую часть и промьгаают ее в простом эфире, затем высушивают в вакуг уме, d-) Хлорид Б-оксид-1-3-(Ш-аллил-2-пиридиниотиометил )-7-формиламин-3 -цефемкарбоксилат-4-дифенилметила. Растворяют 4,5 г соединения, полученного на стадии с), в 45 мл воды затем прибавляют 130 MJX раствора дифенилдиазометана в метиленхлориде Осуществляют интенсивное перемешивание , после чего прибавляют 90 мл абсолютного этанола и поддерживают рН 2 путем присоединения
концентрированной соляной кислоты. ,Через 45 мин раствор
обесцвечива- ется. Органический слой декантируют снова
экстрагируют водную фазу с помощью метиленхлорида. Органически
экстракты объединяют и концентрируют их досуха. Остаток растворяют в абсолютном этаноле и выпаривают досзгка Остаток растворяют в простом эфире, отжимают твердую часть и сушат ее в вакууме.
е) Хлоридгидратхлорид 8-Ьксил-1- (Н-аллил-2-пиридиниотиометил)-7-амин-З-цефемкарбоксил&тдифенилметила . Растворяют 3 г соединения, полученного выше, в 10 мл метанола в инертной атмосфере. Раствор охлаждают до 10 С и прибавляют в него в течение 5 мин
0,8 мл тионилхлорида, поддерживая температуру ниже 20 С Затей
смесь перемешивают в течение 30 мин при 20°С и выливают ее в 300 мл простого эфира./Твердую часть отжимают и промьшают в простом эфире. Осуществляют высушивание в вакууме на фосфорном ангидриде f) Хлорид изомера син Б-оксид-1 -7- 2-(2-тритиламин-4-тиазолил)-N-аллил-2-пиридиниотиометил
-3-цефемкарбоксилат-4-дифенилметила . Хлорид изомера син
2-(2-тритилaмин-4-тиaзoлил )-2-(2-t-бyтoкcикapбонил-2-пропилоксиимин
)-уксусной кислоты Поддерживают в виде суспензии в
атмосфере азота 3,4 г изомера син 2-
(2-тритиламин-4-тиазолил)-2-(2-t-бутоксикарбонил-2-пропилоксиимин )-уксусной кислоты в 20 мл метиленхлорида . Прибавляют 1,4 г пентахлорида фосфора и перемешивают в течение 30 мин, поддерживая температуру смеси ниже 0°С. Затем смесь выливают в 200 мл гексана. Твердое вещество отжимают и сушат в вакууме на фосфорном ангидриде Хлорид кислоты
используют в том.в1вде, как он есть Поддерживают в виде
суспензии в атмосфере азота 3,3 г производного полученного на
стадии ie, в 30 мл метиленхлорида Проводят охлаждение до 5 С и
прибавляют 1,7 мл диметиланилина , а затем хлорид кислоты, полученный на предыдущей стадии, оставляя подниматься температуру до 20 С. После одночасового перемеЩивання промывают раствор в 30 мл О,,5 N растворе соляной кислоты. Органический раствор сушат и концентрируют в вакууме растворители до объема 10-15 мл. Этот раствор выливают в 150 мл
изопропилового эфира„ Твердую часть отжимают , промывают в
изопропиловом эфире и сушат в вакууме. , -1 Таким образом
полученный неочищенный продукт подвергают хроматографии на
колонке с силикareлем (120 г). Используя в качестве элюента смесь метиленхлорид-метанол 85-15 объем/объем , получают искомое соединение. Растворяют 1 г защищенного соединения в 2 мл анизола и охлаждают полученную смесь до 5 С, затем добавляют 10 мл трифторуксусной кислоты. Выдерживают образовавшуюся смесь для того, чтобы ее температура поднялась до 20 С, и выдерживают смесь при этой
температуре в течение 2 ч Трифторуксусную кислоту вьшаривают
в вакууме, а искомое Соединение переводят в осадок путем
присоединения простого эфира. Отжимают это соединение , промьшают его
в простом эфире и сушат. Пример 2. Хлоргидрат,
хлорид изомера син 8-оксил-1-7- 2-(2-амин-4-тиазолил
)-2-(2-карбокси-2-пропилоксиимин )-ацетамид -3-(N-аллил-2-пиридинотиометил )-3-цефем-4-карбоновой кислоты. Действуют
аналогично примеру 1 до стадии включительно, затем обрабатывают
таким образом полученное защищенное соединение концентрированной
соляной кислотой в муравьиной ки- 20ие техники, а именно изомер син Sслоте так, чтобы образовать
хлоргид--оксид-1-7- 2-(2-амин-4-тиазолил)-2рат ,-карбоксиметоксииминацетамид -3-(2Полученное соединение выделяют,-пиридилтиометил)-3-цефем-4-карбонодействуя аналогично указанному в при-вой кислоты
(соединение А)
С-СО-11ГН- -т -Г
- $
(KJHgCOOHСООН
грифторацетат изомера син (2- 35 -амин-4-тиазолил)-2-(2-карбокси-2-пропилоксиимин )-ацетамидЗ-3-(метилПолученные результаты приведены в табЛо 3,
Эти результаты показьгоают особо интересную активность соединений, полученных в изобретении, в отношении штаммов, обычно мало чувствительных в изобретении, в отношении штаммов , обычно мало чувствительных к антибиотикам ряда цефалоспоринов, а именно Enterobacteries и Pseudomonas . 1 0 Ц СН2$Л«
При сравнении с соединением А данные соединения показывают
активность в отношении следующих штаммов Citrobacter,
Buterobacter, Serratia и Pseudomonas, сохраняя при этом
активность по меньшей мере аналогичную той, что проявляют соединения А на штаммы Klebsiel1а и Protens ,
По срэяненню с создинаняем В обладают много превышаияцей актив 606 мерах 1 и 2, однако изменяют реаген-ты и
получают различные производные, которые показаны в табл. 1 и 2.
Полученные соединения изучены в отношении их фармакологических
свойств, а более тщательно изучено бактериостатическое действие этих соединений . Бактериостатическое действие in vitro
определено в твердой среде с помощью метода разбавлений. Полученные
результаты вьфажены в минимальных тормозящих концентрациях (СМ1|Ц
г/мл) и касаются различных штаммов Enterobacteries и Psendomonas.
Для сравнения приведены результаты , полученные при использовании двух соединений, близких описанным в уров 2-пиридиниотиометш1)-3-цефем-4-карбоновой кислоты (соединение В). ностью по отношению к Citrobacter. Protens и Enterobacter, сохраняя по отношению к другим штаммам активность того же порядка , а иногда и повышенную актив ность .
Таблица 2762608 Кроме того, опыты, приведенные на животных, не выявили токсичности CO-J единений, полученных согласно предлагаемому способуо Их токсичность
срав5 ;нима с токсичностью соединений, принадлежащих к классу
цефалоспоринов.
Вид штамма
Citrobacter 49. Proteus 1510 Serratia Ri 72 Klebsiella
30
Enteroba.cter Rg 46
Enterobacter P 99 Pseudomohas A 22 IP
Pseudomonas Rl 112
4 20,5
60,125iO,1250,25
0,25 0,252
0,,1250,5
0,25бО,1251
0,5 0,52
2 2. 4 4Соединение квд
40874 Г40914 40763 140876 1 40800
4
2
2Ч
0,125
40,125
0,1250,25
0,25
0,250,25
2
0,2540,125
0,
125
0,25
0,
25
0,50,25 0,25
0,1 . 1
1 4
0,:
8
16 8
2
8
4
4
Продолжение табл.3
8 4 2









Комментарии