Композиции и способы wt1-специфичной иммунотерапии - RU2237674C2
Код документа: RU2237674C2
Чертежи


























Описание
Изобретение в целом относится к иммунотерапии злокачественных заболеваний, таких как лейкоз и рак. Более конкретно изобретение относится к композициям для индукции или усиления иммунного ответа на WT1 и к применению таких композиций для предупреждения и лечения злокачественных заболеваний.
Рак и лейкоз являются серьезными проблемами здравоохранения в Соединенных Штатах и во всем мире. Несмотря на достижения в диагностике и лечении таких заболеваний, в настоящее время не существует вакцины или другого универсального успешного способа предупреждения или лечения рака и лейкоза. Сейчас контроль над этими заболеваниями основан на сочетании ранней диагностики и активного лечения, которое может включать в себя одно или более различных лечебных воздействий, таких как хирургическое вмешательство, облучение, химиотерапия и гормонотерапия. Курс лечения для конкретной формы рака часто выбирают на основе множества прогностических параметров, включая анализ специфических опухолевых маркеров. Однако применение установленных маркеров часто ведет к результату, который трудно интерпретировать, и у больных многими формами рака продолжает наблюдаться высокая смертность.
Иммунотерапия обладает определенным потенциалом для существенного усовершенствования лечения рака и лейкоза и роста выживаемости. Последние данные показывают, что лейкоз может быть излечен с помощью иммунотерапии, под которой подразумевается трансплантация костного мозга (например, инфузия лимфоцитов доноров). Такая терапия может включать в себя индукцию или усиление иммунного ответа на ассоциированный с опухолью антиген (ТАА). Однако к настоящему времени известно относительно мало ТАА, и индукция иммунного ответа против таких антигенов, как показано, за редким исключением, не дает терапевтического преимущества.
Следовательно, в этой области есть потребность в усовершенствовании способов предотвращения и лечения рака и лейкоза. В настоящем изобретении эта потребность реализуется и дополнительно обеспечиваются другие связанные с этим преимущества.
В кратком изложении в настоящем изобретении предлагаются композиции и способы диагностики и терапии таких заболеваний, как рак и лейкоз. В одном варианте в изобретении предлагаются полипептиды, включающие в себя иммуногенную часть природного WT1 или ее вариант, который отличается одной или более заменами, делениями, добавками и/или вставками, такими, что способность варианта взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами существенно не снижается. В определенных вариантах осуществления полипептид включает в себя последовательность из не более 16 аминокислотных остатков природного полипептида WT1. В других вариантах осуществления полипептид включает в себя иммуногенную часть из аминокислотных остатков 1-174 природного полипептида WT1 или его варианта, где полипептид включает в себя последовательность не более чем из 16 аминокислотных остатков, представленных аминокислотами с 175 по 449 природного полипептида WT1. Иммуногенная часть предпочтительно взаимодействует с молекулой класса I и/или II МНС. В определенных вариантах осуществлениях полипептид включает в себя последовательность, выбираемую из группы, состоящей из (а) последовательностей, представленных в любой одной или более из таблиц II-XLVI, (b) вариантов упомянутых выше последовательностей, которые отличаются одной или более заменами, делениями, добавками и/или вставками, такими, что способность варианта взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами существенно не снижается, и (с) миметиков полипептидов, упомянутых выше, таких, что способность миметика взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами существенно не снижается.
В других вариантах осуществления полипептид включает в себя последовательность, выбираемую из группы, состоящей из (a) ALLPAVPSL (SEQ ID NO:34), GATLKGVAA (SEQ ID NO:88), CMTWNQMNL (SEQ ID NOs:49 и 258), SCLESQPTI (SEQ ID NOs:199 и 296), SCLESQPAI (SEQ ID NO:198), NLYQMTSQL (SEQ ID NOs:147 и 284) ALLPAVSSL (SEQ ID NOs:35 и 255), RMFPNAPYL (SEQ ID NOs:185 и 293), (b) вариантов упомянутых выше последовательностей, которые отличаются одной или более заменами, делениями, добавками и/или вставками, такими, что способность варианта взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами существенно не снижается, и (с) миметиков полипептидов, упомянутых выше, таких, что способность миметика взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами существенно не снижается. Миметики могут включать в себя аминокислоты в сочетании с одним или более аминокислотными миметиками или могут представлять собой полностью непептидные миметики.
В дополнительных вариантах в настоящем изобретении предлагаются полипептиды, включающие в себя вариант иммуногенной части белка WT1, причем этот вариант отличается от иммуногенной части за счет замен аминокислот в положениях между 1 и 3 аминокислотами иммуногенной части так, что способность варианта взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами увеличивается по сравнению с природным белком WT1.
В настоящем изобретении дополнительно предлагаются полинуклеотиды WT1, которые кодируют полипептид WT1, как описано выше.
В других вариантах в настоящем изобретении предлагаются фармацевтические композиции и вакцины. Фармацевтические композиции могут включать в себя полипептид или миметик, как описано выше, и/или один или более из (i) полинуклеотида WT1; (ii) антитела или его антигенсвязывающего фрагмента, которые специфически связывают полипептид WT1; (iii) Т-клетку, которая специфически взаимодействует с полипептидом WT1 или (iv) антигенпредставляющую клетку, которая экспрессирует полипептид WT1, в сочетании с фармацевтически приемлемым носителем или наполнителем. Вакцины включают в себя полипептид, как описано выше, и/или один или более из следующих компонентов: (i) полинуклеотид WT1, (ii) антигенпредставляющую клетку, которая экспрессирует полипептид WT1, или (iii) антиидиотипическое антитело и усилитель неспецифического иммунного ответа. В определенных вариантах осуществления в полипептиде WT1 присутствует последовательность менее чем из 23 аминокислотных остатков, предпочтительно менее чем из 17 аминокислотных остатков природного полипептида WT1, применяемая в таких фармацевтических композициях и вакцинах. Усилителем иммунного ответа может быть адъювант. Предпочтительно, чтобы усилитель иммунного ответа усиливал Т-клеточный ответ.
В настоящем изобретении дополнительно предлагаются способы увеличения или индукции иммунного ответа у больного, включающие в себя введение больному фармацевтической композиции или вакцины, как описано выше. В определенных вариантах осуществления больным является человек.
В настоящем изобретении дополнительно предлагаются способы торможения развития злокачественного заболевания у больного, включающие в себя введение больному фармацевтической композиции или вакцины, как описано выше. Злокачественные заболевания включают в себя, не ограничиваясь ими, лейкозы (например, острую миелому, острую лимфоцитарную и хроническую миелому) и рак (например, рак молочной железы, легких, щитовидной железы, или рак желудочно-кишечного тракта, или меланому). Больной может, но необязательно, страдать от злокачественного заболевания, и введение фармацевтической композиции или вакцины может тормозить начало такой болезни или может тормозить прогрессирование и/или метастазирование существующей болезни.
В настоящем изобретении дополнительно предлагаются среди других вариантов способы удаления клеток, экспрессирующих WT1, из костного мозга и/или периферической крови или их фракций, включающие в себя контактирование костного мозга, периферической крови или фракции костного мозга с Т-клетками, которые специфически взаимодействуют с полипептидом WT1, причем стадию контактирования выполняют в условиях и временных интервалах, достаточных для возможности удаления WT1-позитивных клеток до количества, составляющего менее 10%, предпочтительно менее 5% и более предпочтительно менее 1% от числа миелоидных или лимфатических клеток в костном мозге, периферической крови или фракции. Костный мозг, периферическая кровь и фракции могут быть получены у больного, страдающего от заболевания, ассоциированного с экспрессией WT1, или могут быть получены от человека или млекопитающего, не являющегося человеком, не страдающего от такого заболевания.
В связанных с этим вариантах в настоящем изобретении предлагаются способы торможения развития злокачественного заболевания у больного, включающие в себя введение больному костного мозга, периферической крови или фракции костного мозга или периферической крови, полученных, как описано выше. Такие костный мозг, периферическая кровь или фракции могут быть аутологичными или могут происходить от родственного или неродственного человека или животного, не являющегося человеком (например, сингенного или аллогенного).
В других вариантах в настоящем изобретении предлагаются способы стимуляции (или прайминга) и/или экспансии Т-клеток, включающие в себя контактирование Т-клеток с полипептидом WT1 в условиях и временных интервалах, достаточных для разрешения стимуляции и/или экспансии Т-клеток. Такие Т-клетки могут быть аутологичными, аллогенными, сингенными или не относящимися к ним WT1-специфичными Т-клетками и могут быть стимулированы in vitro и in vivo. Распространяющиеся Т-клетки в определенных вариантах осуществления могут быть представлены в костном мозге, периферической крови или фракции костного мозга, или периферической крови и могут быть (но необязательно) клональными. В определенных вариантах осуществления Т-клетки могут быть представлены у млекопитающего при стимуляции и/или экспансии. WT1-специфичные Т-клетки могут быть использованы, например, при инфузиях донорских лимфоцитов.
В связанных с этим вариантах предлагаются способы торможения развития злокачественного заболевания у больного, включающие в себя введение больному Т-клеток, полученных, как описано выше. Такие Т-клетки могут быть в определенных случаях осуществления аутологичными, сингенными или аллогенными.
В настоящем изобретении дополнительно предлагаются, среди прочих вариантов, способы мониторинга эффективности иммунизации или терапии злокачественного заболевания, связанного с экспрессией у больного WT1. Такие способы основаны на мониторинге у больного антитела, CD4+ Т-клеточного и/или CD8+ Т-клеточного ответов. В некоторых из этих вариантов способ может включать в себя стадии: (а) инкубации первичного биологического образца с одним или более из следующих компонентов: (i) полипептидом WT1; (ii) полинуклеотидом, кодирующим полипептид WT1; или (iii) антигенпредставляющей клеткой, которая экспрессирует полипептид WT1, причем первичный биологический образец получают у больного до терапии или иммунизации, и инкубацию проводят в условиях и во временных интервалах, достаточных для образования иммунокомплексов; (b) определения иммунокомплексов, образованных между полипептидом WT1 и антителами в биологическом образце, который специфически связывается с полипептидом WT1; (с) повторения стадий (а) и (b) с применением второго биологического образца, полученного от того же больного после терапии или иммунизации; (d) сравнения числа иммунокомплексов, определяемых в первом и втором биологических образцах, и в результате этого мониторинга эффективности терапии или иммунизации у больного.
В определенных вариантах указанных выше способов стадия определения включает в себя (а) инкубацию иммунокомплексов с выявляющим агентом, который способен связываться с иммунокомплексами, где выявляющий агент содержит репортерную группу, (b) удаление несвязавшегося выявляющего агента, (c) определение присутствия или отсутствия репортерной группы. Выявляющий агент может содержать, например, вторичное антитело или его антигенсвязывающий фрагмент, способные связываться с антителами, которые специфически связывают полипептид WT1 или такую молекулу, как протеин А. В других вариантах репортерная группа связывается с полипептидом WT1, и стадия определения включает в себя удаление несвязавшегося полипептида WT1 и последующее определение присутствия или отсутствия репортерной группы.
В дополнительных вариантах способы мониторинга эффективности иммунизации или терапии злокачественного заболевания, ассоциированного с экспрессией WT1 у больного, могут включать в себя стадии (а) инкубации первого биологического образца с одним или более из следующих компонентов: (i) полипептидом WT1; (ii) полинуклеотидом, кодирующим полипептид WT1; или (iii) антигенпредставляющей клеткой, которая экспрессирует полипептид WT1, причем биологический образец содержит Т-клетки CD4+ и/или CD8+, и его получают у больного до терапии или иммунизации, и инкубацию проводят в условиях и во временных интервалах, достаточных для осуществления специфической активации, пролиферации и/или лизиса Т-клеток; (b) определения количества активированных, пролиферирующих и/или лизированных Т-клеток; (с) повторения стадий (а) и (b) с применением второго биологического образца, содержащего CD4+ и/или CD8+ Т-клетки, причем второй биологический образец получают у того же больного после терапии или иммунизации; (d) сравнения числа активированных, пролиферирующих и/или лизированных Т-клеток в первом и втором биологических образцах, и в результате этого - мониторинга эффективности терапии или иммунизации у больного.
В настоящем изобретении дополнительно предлагаются способы торможения развития злокачественного заболевания, ассоциированного с экспрессией WT1 у больного, включающие в себя стадии (а) инкубации CD4+ и/или CD8+ Т-клеток, выделенных у больного, с одним или более из следующих компонентов: (i) полипептидом WT1; (ii) полинуклеотидом, кодирующим полипептид WT1; или (iii) антигенпредставляющей клеткой, которая экспрессирует полипептид WT1, так, чтобы Т-клетки пролиферировали; и (b) введения больному эффективного количества пролиферирующих Т-клеток и торможения, таким образом, развития злокачественного заболевания у больного. В определенных случаях стадию инкубации Т-клеток можно повторять один или более раз.
В других вариантах в настоящем изобретении предлагаются способы торможения развития злокачественного заболевания, ассоциированного с экспрессией WT1 у больного, включающие в себя стадии (а) инкубации CD4+ и/или CD8+ Т-клеток, выделенных у больного, с одним или более из следующих компонентов: (i) полипептидом WT1; (ii) полинуклеотидом, кодирующим полипептид WT1; или (iii) антигенпредставляющей клеткой, которая экспрессирует полипептид WT1, так, чтобы Т-клетки пролиферировали; (b) клонирования одной или более клеток, которые пролиферируют; с) введения больному эффективного количества клонированных Т-клеток.
В других вариантах предлагаются способы определения наличия или отсутствия злокачественного заболевания, ассоциированного с экспрессией WT1 у больного, включающие в себя стадии (а) инкубации CD4+ и/или CD8+ Т-клеток, выделенных у больного, с одним или более из следующих компонентов: (i) полипептидом WT1; (ii) полинуклеотидом, кодирующим полипептид WT1; или (iii) антигенпредставляющей клеткой, которая экспрессирует полипептид WT1; (b) определения присутствия или отсутствия специфической активации Т-клеток, в результате чего определяют наличие или отсутствие злокачественного заболевания, ассоциированного с экспрессией WT1. В определенных случаях стадия определения включает в себя определение наличия или отсутствия пролиферации Т-клеток.
В дополнительных вариантах в настоящем изобретении предлагаются способы определения наличия или отсутствия злокачественного заболевания, связанного с экспрессией у больного WT1, включающие в себя стадии (а) инкубации биологического образца, полученного у больного, с одним или более из следующих компонентов: (i) полипептидом WT1; (ii) полинуклеотидом, кодирующим полипептид WT1; или (iii) антигенпредставляющей клеткой, которая экспрессирует полипептид WT1, причем инкубацию проводят в условиях и во временных интервалах, достаточных для образования иммунокомплексов; (b) определения иммунокомплексов, образованных между полипептидом WT1 и антителами в биологическом образце, который специфически связывается с полипептидом WT1; и в результате этого определения наличия или отсутствия злокачественного заболевания, связанного с экспрессией WT1.
Эти и другие варианты настоящего изобретения будут ясны при отсылке к последующему подробному описанию и прилагаемым чертежам. Все раскрытые в данном описании ссылки включены для сравнения во всей их полноте, так, как если бы каждую включали индивидуально.
Краткое описание чертежей
На фигуре 1 представлено сравнение последовательностей белка WT1 мыши (МО) и человека (HU) (SEQ ID NOS:320 и 319 соответственно).
Фигура 2 представляет собой иммуноблоттинг, иллюстрирующий определение WT1-специфичных антител у больных злокачественным заболеванием крови (AML). На дорожке 1 показаны маркеры молекулярного веса; на дорожке 2 показан позитивный контроль (WT1-позитивная линия лейкемических клеток человека, иммунопреципитированная WT1-специфичным антителом); на дорожке 3 показан негативный контроль (WT1-позитивная линия клеток, иммунопреципитированная мышиной сывороткой); на дорожке 4 показана WT1-позитивная линия клеток, иммунопреципитированная сывороткой больного AML. Для дорожек 2-4 иммунопреципитат отделяли гель-электрофорезом и анализировали с помощью WT1-специфичного антитела.
Фигура 3 представляет собой иммуноблоттинг, иллюстрирующий определение WT1-специфичного антитела у мышей В6, иммунизированных TRAMP-C, WT1-позитивной линией опухолевых клеток. На дорожках 1, 3 и 5 показаны маркеры молекулярного веса, и на дорожках 2, 4 и 6 показан WT1-специфический позитивный контроль (N180, Santa Cruz. Biotechnology, полипептид, содержащий 180 аминокислот N-концевого участка белка WT1, с подвижностью при иммуноблоттинге, соответствующей 52 кДа). Применяемое первичное антитело представляло собой WT180 на дорожке 2, сыворотку неиммунизированных мышей В6 на дорожке 4 и сыворотку иммунизированных мышей В6 на дорожке 6.
Фигура 4 представляет собой иммуноблоттинг, иллюстрирующий определение WT1-специфичных антител у мышей, иммунизированных представленными WT1-пептидами. На дорожках 1, 3 и 5 показаны маркеры молекулярного веса и на дорожках 2, 4 и 6 показан WT1-специфичный позитивный контроль (N180, Santa Cruz Biotechnology, полипептид, содержащий 180 аминокислот N-концевого участка белка WT1, с подвижностью при иммуноблоттинге, соответствующей 52 кДа). Применяемое первичное антитело представляло собой WT180 на дорожке 2, сыворотку неиммунизированных мышей В6 на дорожке 4 и сыворотку иммунизированных мышей В6 на дорожке 6.
Фигуры с 5А до 5С представляют собой графики, иллюстрирующие стимуляцию пролиферативных ответов Т-клеток у мышей, иммунизированных представленными пептидами WT1. Тестирование включения тимидина выполняли, применяя одну Т-клеточную линию и два различных клона, как указано, и результаты представляли в имп/мин. Контроли указаны по оси x, где нет антигена (нет АГ) и В6-среды; применяемые антигены представляли собой р6-22 человека (р1), р117-139 (р2) или р244-262 человека (р3).
Фигуры 6А и 6В представляют собой гистограммы, иллюстрирующие стимуляцию пролиферативных ответов Т-клеток у мышей, иммунизированных представленными пептидами WT1. Через три недели после третьей иммунизации клетки селезенки мышей, которые были инокулированы вакциной А или вакциной В, культивировали только со средой (среда) или с клетками селезенки и средой (В6/без антигена), с клетками селезенки от В6, обработанными в импульсном режиме пептидами р6-22 (р6), р117-139 (р117), р244-262 (р244) (Вакцина А; фигура 6А) или р287-301 (р287), р299-313 (р299), р421-435 (р421) (Вакцина В; фигура 6В) и с клетками селезенки, обработанными в импульсном режиме неродственным контрольным пептидом (неродственный пептид) в концентрации 25 мкг/мл, и определяли пролиферацию по включению (3H)-тимидина через 96 часов. Столбики представляют собой индекс стимуляции (SI), который рассчитывают как среднее экспериментальных лунок, разделенное на среднее контрольных (клетки селезенки от В6 без антигена).
Фигуры 7A-7D представляют собой гистограммы, иллюстрирующие генерацию пролиферирующих Т-клеточных линий и клонов, специфичных в отношении р117-139 и р6-22. После иммунизации in vivo были выполнены три исходных стимуляции in vitro (IVS)c применением всех трех пептидов вакцины А или В соответственно. Последующую IVS выполняли в виде стимуляций одним пептидом с применением только двух используемых пептидов р117-139 и p6-22. Источником клонов были, как указано, специфичные Т-клеточные линии как p6-22, так и р117-139. Т-клетки культивировали только со средой (среда) или с клетками селезенки и средой (В6/без антигена), с клетками селезенки от В6, обработанными в импульсном режиме пептидами p6-22 (р6), р117-139 (р117) или с неродственным контрольным пептидом (неродственный пептид) в концентрации 25 мкг/мл, и определяли пролиферацию по включению (3H)-тимидина через 96 часов. Столбики представляют собой индекс стимуляции (SI), который рассчитывают как среднее экспериментальных лунок, разделенное на среднее контрольных (клетки селезенки от В6 без антигена).
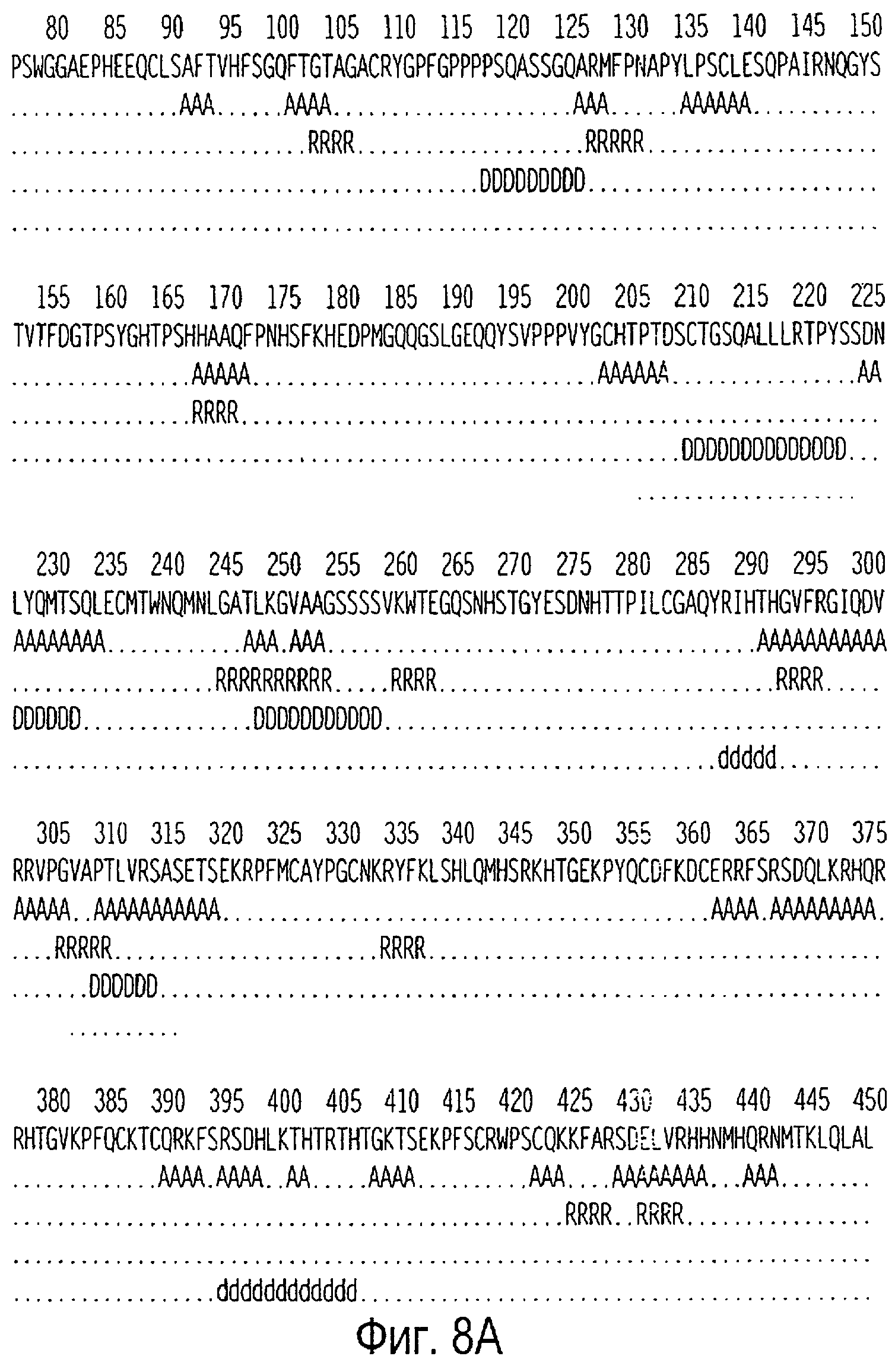
Фигуры 8А и 8В представляют собой результат TSITES анализа WT1 человека (SEQ ID NO:319) для пептидов, которые обладают потенциалом в отношении индукции ответов Th. Области, обозначенные как "А", представляют собой средние точки блоков AMPHI, "R" указывает на остатки, совпадающие с мотивом Rothbard/Taylor, "D" указывает на остатки, совпадающие с мотивом IAd, и "d" указывает на остатки, совпадающие с мотивом IEd.
Фигуры 9А и 9В представляют собой графики, иллюстрирующие лизис специфичных для пептида WT1 CTL (цитотоксических Т-лимфоцитов) у мышей, иммунизированных пептидами WT1. На фигуре 9А проиллюстрирован лизис клеток-мишеней аллогенными клеточными линиями, а на фигуре 9В показан лизис клеточных линий, покрытых пептидом. В каждом случае % лизиса (определяемый по стандартным тестам высвобождения хрома) показан при трех указанных соотношениях эффектор:мишень. Результаты представлены для клеток лимфомы (LSTRA и Е10), а также для Е10+р235-243 (Е10+Р235). Клетки Е10 обозначаются здесь так же, как клетки EL-4.
Фигуры 10A-10D представляют собой графики, иллюстрирующие лизис WT1-специфичных CTL, при котором уничтожаются WT1-позитивные линии опухолевых клеток, но не уничтожаются WT1-негативные линии клеток, после вакцинации мышей В6 WT1-пептидом Р117. На фигуре 10А проиллюстрировано, что Т-клетки неиммунизированных мышей В6 не уничтожают WT1-позитивные линии опухолевых клеток. На фигуре 10В проиллюстрирован лизис клеток-мишеней аллогенными клеточными линиями. На фигурах 10С и 10D продемонстрирован лизис WT1-позитивных линий опухолевых клеток в сравнении с WT1-негативными линиями клеток в двух различных экспериментах. Кроме того, на фигурах 10С и 10D показан лизис клеточных линий, покрытых пептидом (WT1-негативная линия клеток Е10, покрытая пептидом Р117, родственным WT1). В каждом случае % лизиса (определяемый по стандартным тестам высвобождения хрома) показан при трех указанных соотношениях эффектор: мишень. Результаты представлены для клеток лимфомы (Е10), клеток рака простаты (TRAMP-C), клеточной линии трансформированных фибробластов (BLK-SV40), а также для Е10+р117.
Фигуры 11А и 11В представляют собой гистограммы, иллюстрирующие способность CTL, специфичных для представленного пептида Р117-139, лизировать WT1-позитивные линии опухолевых клеток. Через три недели после третьей иммунизации клетки селезенки мышей, которые были инокулированы пептидами р235-243 или р117-139, стимулировали in vitro с помощью родственного пептида и тестировали на способность лизировать мишени, проинкубированные с пептидом WT1, а также опухолевые клетки, позитивные и негативные в отношении WT1. Столбики представляют собой % специфического лизиса в тестах по высвобождению хрома в трех параллельных определениях при соотношении Е:Т 25:1. На фигуре 11А, как указано, показана цитотоксическая активность линии Т-клеток, специфичной в отношении р235-243, в сравнении с WT1-негативной клеточной линией EL-4 (EL-4, WT1-негативная); EL-4, обработанная в импульсном режиме родственным (применяемым для иммунизации, а также для повторной стимуляции) пептидом р235-243 (EL-4+p235); EL-4, обработанная в импульсном режиме неродственными пептидами р117-139 (EL-4+p117), p126-134 (EL-4+р126) или р130-138 (EL-4+p130), и в отношении WT1-позитивных опухолевых клеток BLK-SV40 (BLK-SV40, WT1-позитивная) и TRAMP-C (TRAMP-C, WT1-позитивная). На фигуре 11В, как указано, показана цитотоксическая активность линии Т-клеток, специфичной в отношении р117-139, в сравнении с линией EL-4; EL-4, обработанная в импульсном режиме родственным пептидом Р117-139 (EL-4+p117) и EL-4, обработанная в импульсном режиме неродственными пептидами р123-131 (EL-4+p123) или р128-136 (EL-4+p128); BLK-SV40 и TRAMP-C.
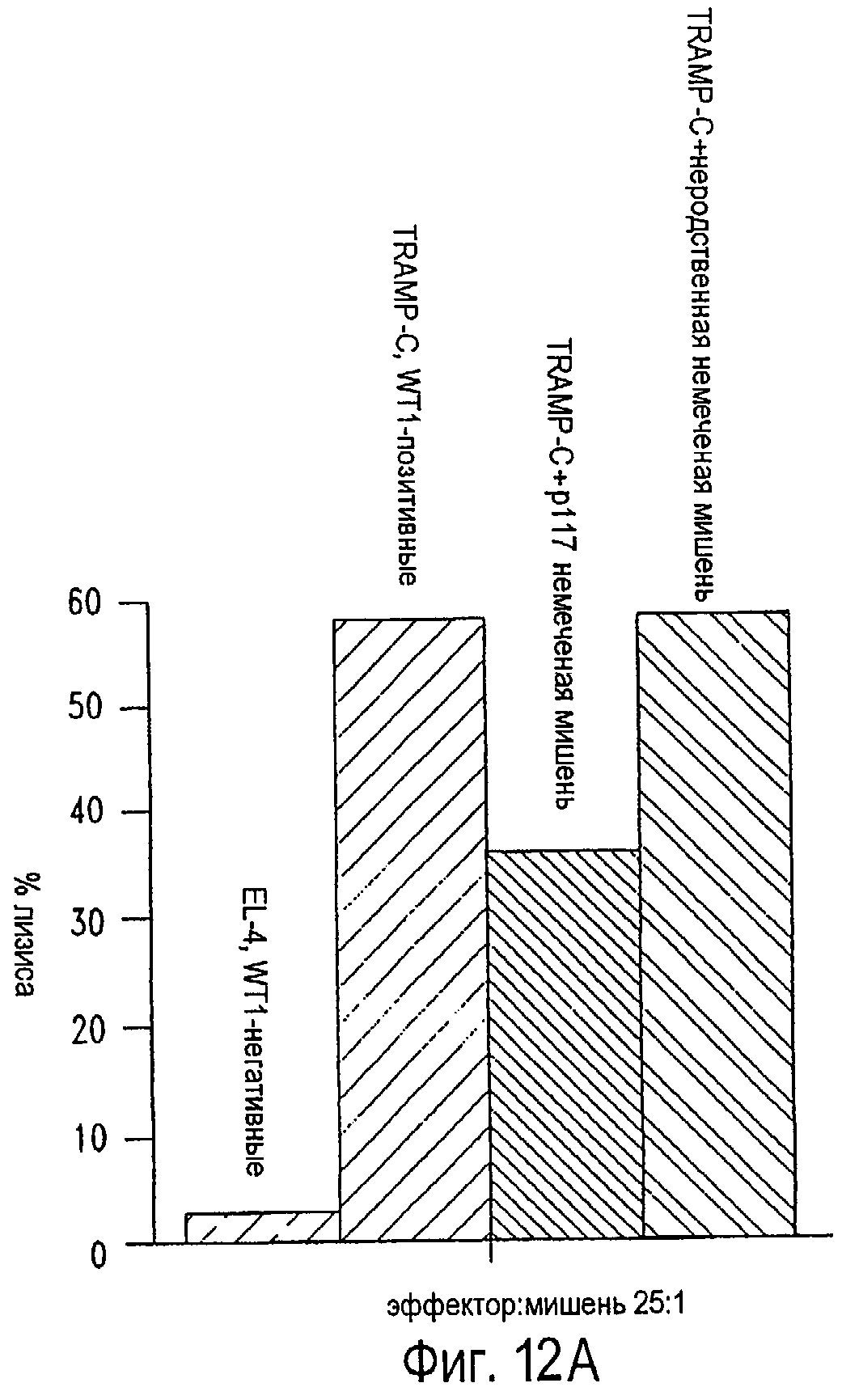
Фигуры 12А и 12В представляют собой гистограммы, иллюстрирующие специфичность лизиса WT1-позитивных опухолевых клеток, как продемонстрировано с помощью торможения лизиса немечеными мишенями. Столбики представляют собой средний % специфического лизиса в тестах высвобождения хрома, определенный в трех параллельных пробах при соотношении Е:Т 25:1. На фигуре 12А, как указано, представлена цитотоксическая активность р117-139-специфичной Т-клеточной линии в сравнении с WT1-негативной клеточной линией EL-4 (EL-4, WT1-негативная); WT1-позитивная опухолевая клеточная линия TRAMP-C (TRAMP-C, WT1-позитивная); TRAMP-C клетки, проинкубированные с 10-кратным избытком (по сравнению с меченой мишенью) EL-4 клеток, обработанных в импульсном режиме родственным пептидом р117-139 (TRAMP-C+p117 немеченая мишень) без промечивания51Сr, и TRAMP-C клетки, проинкубированные с EL-4, обработанными в импульсном режиме неродственным пептидом без промечивания51Cr (TRAMP-C+неродственная немеченая мишень). На фигуре 12В, как указано, представлена цитотоксическая активность р117-139-специфичной Т-клеточной линии в сравнении с WT1-негативной клеточной линией EL-4 (EL-4, WT1-негативная); WT1-позитивная линия опухолевых клеток BLK-SV40 (BLK-SV40, WT1-позитивная); BLK-SV40-клетки, проинкубированные с родственной немеченой мишенью (BLK-SV40+p117 немеченая мишень) и BLK-SV40 клетки, проинкубированные с неродственной немеченой мишенью (BLK-SV40+неродственная немеченая мишень). Фигуры 13А-13С представляют собой гистограммы, отображающие оценку 9-членного эпитопа CTL в пределах р117-139. р117-139 специфичную опухолевую линию CTL тестировали в сравнении с пептидами в пределах аминокислот 117-139, в которых присутствует или отсутствует подходящий H-2bсвязывающий мотив класса I, с последующей повторной стимуляцией пептидами р126-134 или р130-138. Столбики представляют собой средний % специфического лизиса в тестах высвобождения хрома, определяемый в трех параллельных пробах при соотношении Е:Т 25:1. На фигуре 13А представлена цитотоксическая активность р117-139-специфичной Т-клеточной линии в сравнении с WT1-негативной клеточной линией EL-4 (EL-4, WT1-негативная) и EL-4 клетками, обработанными в импульсном режиме пептидами р117-139 (EL-4+p117), p119-127 (EL-4+p119), p120-128 (EL-4+p120), p123-131 (EL-4+p123), р126-134 (EL-4+p126), p128-136(EL-4+p128) и р130-138 (EL-4+р130). На фигуре 13В представлена цитотоксическая активность линии CTL после повторной стимуляции р126-134 в сравнении с WT1-негативной клеточной линией EL-4, клетки EL-4, обработанные в импульсном режиме р117-139 (EL-4+p117), р126-134 (EL-4+p126) и WT1-позитивная линия опухолевых клеток TRAMP-C. На фигуре 13С представлена цитотоксическая активность линии CTL после повторной стимуляции р130-138 в сравнении с EL-4, клетки EL-4, обработанные в импульсном режиме р117-139 (EL-4+p117), р130-138 (EL-4+p130) и WT1-позитивная линия опухолевых клеток TRAMP-C.
Как указано выше, настоящее изобретение в целом направлено на композиции и способы иммунотерапии и диагностики злокачественных заболеваний. Описанные здесь композиции могут включать в себя полипептиды WT1, полинуклеотиды WT1, антигенпредставляющие клетки (АРС, например, дендритные клетки), которые экспрессируют полипептид WT1, такие агенты как антитела, которые связывают полипептид WT1, и/или клетки иммунной системы (например, Т-клетки), специфичные в отношении WT1. Полипептиды WT1 настоящего изобретения обычно включают в себя по меньшей мере часть продукта гена Wilms Tumor (WT1) или его варианта. Нуклеотидные последовательности, являющиеся предметом настоящего изобретения, обычно содержат последовательности ДНК или РНК, которые кодируют весь такой полипептид или его часть, или те из них, которые комплементарны таким последовательностям. Антитела представляют собой обычно белки иммунной системы или их антигенсвязывающие фрагменты, которые способны связывать часть полипептида WT1. Т-клетки, которые могут применяться в таких композициях, обычно представляют собой Т-клетки (например, CD4- и/или CD8+), которые специфичны в отношении полипептида WT1. В определенных описанных здесь способах, как здесь предусмотрено, дополнительно применяются антигенпредставляющие клетки, которые экспрессируют полипептид WT1.
Настоящее изобретение основано на открытии того, что иммунный ответ, возникающий в отношении продукта гена Wilms Tumor (WT) (например, WT1), может создавать профилактические и/или терапевтические преимущества для больных, страдающих злокачественными заболеваниями, характеризующимися повышенной экспрессией гена WT1. Такие заболевания включают в себя, не ограничиваясь ими, лейкозы (например, острый миелоидный лейкоз (AML), хронический миелоидный лейкоз (CML), острый лимфоцитарный лейкоз (ALL) и детский ALL), a также многие типы рака, такие как рак легких, молочной железы, щитовидной железы и рак желудочно-кишечного тракта и меланомы). Ген WT1 был первоначально идентифицирован и выделен на основе цитогенетической делеции в хромосоме 11р13 у больных с опухолью Wilms (смотри Call et al., патент США №5350840). Ген состоит из 10 экзонов и кодирует транскрипционный фактор с цинковыми пальцами, последовательности белков WT1 мыши и человека представлены на фигуре 1 и SEQ ID NOs:319 и 320.
Полипептиды WT1
В контексте настоящего изобретения полипептид WT1 представляет собой полипептид, который содержит по меньшей мере иммуногенную часть природного WT1 (т.е. генетически неизмененного белка WT1, экспрессируемого организмом) или его варианта, как здесь описано. Полипептид WT1 может быть любой длины, при условии, что он содержит по меньшей мере иммуногенную часть природного WT1 или его варианта. Другими словами, полипептид WT1 может быть олигопептидом (т.е. состоять из относительно небольшого числа аминокислотных остатков, например 8-10 остатков, соединенных пептидными связями), полноразмерным белком WT1 (например, присутствующим у человека или животного, не являющегося человеком, такого как мышь) или полипептидом промежуточного размера. В определенных вариантах осуществления предпочтительно применение полипептидов WT1, которые содержат небольшое число аминокислотных остатков последовательности природного полипептида WT1. Такие полипептиды предпочтительны для определенных целей, для которых желательна индукция Т-клеточного ответа. Например, такой полипептид WT1 может содержать менее 23, предпочтительно не более 18 и более предпочтительно не более 15 аминокислотных остатков последовательности природного полипептида WT1. Обычно для таких целей подходят полипептиды, содержащие девять аминокислотных остатков последовательности природного полипептида WT1. В любом полипептиде WT1 могут присутствовать дополнительные последовательности, происходящие из природного белка, и/или гетерологичные последовательности, и такие последовательности могут (но не обязательно) обладать дополнительными иммуногенными или антигенными свойствами. Предлагаемые здесь полипептиды могут дополнительно (ковалентно или нековалентно) связываться с другими пептидными или непептидными соединениями.
Применяемый здесь термин ″иммуногенная часть″ представляет собой часть полипептида, которая узнается (т.е. специфически связывается) рецепторами антигенов поверхности В-клеток и/или Т-клеток. Конкретные предпочтительные иммуногенные части взаимодействуют с молекулой МНС класса I или класса II. В применяемом здесь смысле говорится, что иммуногенные части "взаимодействуют с" молекулой МНС класса I или класса II, если такое взаимодействие выявляется с помощью любого способа, известного в данной области. Например, способность полипептида взаимодействовать с классом I МНС может быть оценена непрямым способом с помощью мониторинга способности стимулировать включение меченного125I β2-микроглобулина (β2m) в гетерогримерные комплексы - класс I МНС/β2m/пептид (смотри Parker et al., J. Immunol. 152:163, 1994). В противоположном варианте могут быть применены известные науке тесты оценки функциональной конкуренции пептида. Конкретные иммуногенные части имеют одну или более последовательностей, представленных в одной или более таблиц II-XIV. Примеры иммуногенных частей включают в себя, не ограничиваясь этим, RDLNALLPAVPSLGGGG (остатки WT1 человека 6-22; SEQ ID NO:1), PSQASSGQARMFPNAPYLPSCLE (остатки WT1 человека и мыши 117-139; SEQ ID NOs:2 и 3 соответственно), GATLKGVAAGSSSSVKWTE (остатки WT1 человека 244-262; SEQ ID NO:4), GATLKGVAA (остатки WT1 человека 244-252; SEQ ID NO:88), CMTWNQMNL (остатки WT1 человека и мыши 235-243; SEQ ID NOs:49 и 258 соответственно), SCLESQPTI (остатки WT1 мыши 136-144; SEQ ID NO:296), SCLESQPAI (остатки WT1 человека 136-144; SEQ ID NO:198), NLYQMTSQL (остатки WT1 человека и мыши 225-233; SEQ ID NOs:147 и 284 соответственно); ALLPAVSSL (остатки WT1 мыши 10-18; SEQ ID NO:255); или RMFPNAPYL (остатки WT1 человека и мыши 126-134; SEQ ID NOs:185 и 293 соответственно). Предлагаемые здесь дополнительные иммуногенные части и другие могут обычно идентифицироваться с помощью хорошо известной техники, такой как обобщенная у Paul, Fundamental Immunology, 3rd ed., 243-247 (Raven Press, 1993) и в цитированных здесь ссылках. Примеры способов идентификации иммуногенных частей включают в себя скрининг полипептидов на способность взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами. Иммуногенная часть природного полипептида WT1 представляет собой часть, которая взаимодействует с такими антисыворотками и/или Т-клетками на уровне, который не является существенно более низким, чем уровень взаимодействия полноразмерного WT1 (например, в ТИФА тесте и/или тесте Т-клеточной реактивности). Другими словами, в таких тестах иммуногенная часть может взаимодействовать на уровне, сходном или более высоком, чем взаимодействие полноразмерного пептида. Такие скрининги обычно могут быть выполнены с помощью способов, хорошо известных специалистам в этой области, таких как описанные у Наrlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988.
В противоположном варианте иммуногенные части могут быть идентифицированы с применением компьютерного анализа, такого как программа Tsites (смотри Rothbard and Taylor, EMBO J. 7:93-100, 1988; Deavin et al., Mol. Immunol. 33:145-155, 1996), с помощью которого проводят поиск пептидных мотивов, которые обладают потенциалом в отношении индукции Тh-ответов. Пептиды CTL с мотивами, подходящими для связывания с МНС класса I или класса II человека или мыши, могут быть идентифицированы в соответствии с BIMAS (Parker et al., J. Immunol. 152:163, 1994) и другими системами анализа для предсказания связывания пептидов HLA. Для подтверждения иммуногенности пептид может быть протестирован с применением модели HLA A2 трансгенной мыши и/или с помощью теста стимуляции in vitro с использованием дендритных клеток, фибробластов или клеток периферической крови.
Как отмечено выше, композиция может включать в себя вариант природного белка WT1. Применяемый здесь термин "вариант полипептида" означает полипептид, который отличается от природного полипептида по одной или более замен, делений, добавок и/или вставок, таких, что иммуногенность полипептида сохраняется (т.е. способность варианта взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами существенно не снижается по отношению к природному полипептиду). Другими словами, способность варианта взаимодействовать с антигенспецифичными антисыворотками и/или Т-клеточными линиями или клонами может быть увеличенной или не измененной по отношению к природному полипептиду, или может быть сниженной менее чем на 50%, и предпочтительно менее чем на 20% по отношению к природному полипептиду. Такие варианты обычно могут быть идентифицированы по модификации одной из указанных выше полипептидных последовательностей и оценке взаимодействия модифицированного пептида с антисыворотками и/или Т-клетками, как здесь описано. В контексте настоящего изобретения было обнаружено, что для увеличения способности полипептида индуцировать иммунный ответ можно использовать относительно небольшое количество замен (например, от 1 до 3) в иммуногенной части полипептида WT1. Подходящие замены в целом могут быть определены с помощью компьютерных программ, как описано выше, с подтверждением эффекта на основе способности модифицированного полипептида взаимодействовать с антисывороткой и/или Т-клетками, как описано здесь выше. Соответственно, в некоторых предпочтительных вариантах осуществления полипептид WT-1 включает в себя вариант, в котором от 1 до 3 аминокислотных остатков иммуногенной части заменены, в результате чего способность реагировать с антигенспецифичной антисывороткой и/или линиями или клонами Т-клеток оказывается статистически значимо более высокой по сравнению с немодифицированным полипептидом. Такие замены предпочтительно локализованы в сайте связывания МНС полипептида, который может быть определен, как описано выше. Предпочтительные замены обеспечивают повышенное связывание с молекулами МНС класса I или II.
Определенные варианты содержат консервативные замены. "Консервативная замена" представляет собой такую, в которой одна аминокислота заменена на другую аминокислоту, которая имеет сходные свойства, такие, что специалист по химии пептидов мог бы ожидать, что вторичная структура и гидропатическая природа полипептида останутся без существенных изменений. Аминокислотные замены в целом могут производиться на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков. Например, отрицательно заряженные аминокислоты включают в себя аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают в себя лизин и аргинин; аминокислоты с незаряженными полярными головными группами, имеющие сходные величины гидрофильности, включают в себя лейцин, изолейцин и валин; глицин и аланин; аспарагин и глутамин; и серин, треонин, фенилаланин и тирозин. Другие группы аминокислот, которые могут представлять консервативные замены, включают; (1) ala, pro, gly, glu, asp, gln, asn, ser, thr; (2) cys, ser, tyr, thr; (3) val, ile, leu, met, ala, phe; (4) lys, arg, his; и (5) phe, tyr, trp, his. Вариант может также или альтернативно содержать неконсервативные замены. Варианты могут также (или альтернативно) модифицироваться с помощью, например, делении или вставки аминокислот, которые оказывают минимальное влияние на иммуногенность, вторичную структуру и гидропатическую природу полипептида.
Как отмечалось выше, полипептиды WT1 могут быть присоединены по N-концу белка к сигнальной (или лидирующей) последовательности, которая одновременно с трансляцией или посттрансляционно направляет транспорт белка. Полипептид может также или альтернативно быть присоединен к линкеру или другой последовательности для облегчения синтеза, очистки или идентификации полипептида (например, поли-His) или для повышения связывания полипептида с твердым матриксом. Например, полипептид может быть конъюгирован с Fc-областью иммуноглобулина.
Полипептиды WT1 могут быть получены с помощью множества хорошо известных способов. Рекомбинантные полипептиды, кодируемые полинуклеотидом WT1, как здесь описано, могут быть легко получены из полинуклеотида. В целом для экспрессии рекомбинантных полипептидов WT1 может быть применен любой из множества известных специалисту экспрессионных векторов. Экспрессия может быть достигнута в любой подходящей клетке-хозяине, трансформированной или трансфицированной экспрессионным вектором, содержащим молекулу ДНК, которая кодирует рекомбинантный полипептид. Подходящие клетки-хозяева включают в себя прокариотические и дрожжевые клетки и клетки высших эукариот. Предпочтительными применяемыми клетками-хозяевами являются Е. coli, дрожжи или линии клеток млекопитающих, такие как COS или СНО. Супернатанты подходящих систем хозяин/вектор, которые секретируют рекомбинантный белок или полипептид в культуральную среду, могут быть сначала сконцентрированы с помощью имеющегося в продаже фильтра. Концентрат может быть затем нанесен на подходящий матрикс для очистки, такой как аффинный матрикс или ионообменная смола. Наконец, для последующей очистки рекомбинантного полипептида может быть использована одно- или более стадийная ВЭЖХ с обращенной фазой. Такие способы техники могут быть применены для получения природных полипептидов или их вариантов. Например, полинуклеотиды, которые кодируют вариант природного полипептида, обычно могут быть получены с помощью стандартных способов мутагенеза, таких как направляемый олигонуклеотидом сайтспецифический мутагенез, и для обеспечения получения укороченных полипептидов могут быть удалены блоки последовательностей ДНК.
Некоторые части и другие варианты могут быть также получены с помощью способов синтеза, с применением методов, хорошо известных специалистам. Например, могут быть синтезированы полипептиды, содержащие приблизительно менее 500 аминокислот, предпочтительно приблизительно менее 100 аминокислот и более предпочтительно приблизительно менее 50 аминокислот. Полипептиды могут быть синтезированы с применением любых имеющихся в продаже твердофазных способов, таких как метод твердофазного синтеза Merrifield, в котором аминокислоты последовательно присоединяют к растущей аминокислотной цепи. Смотри Merrifield, J. Am. Chem. Soc. 85:2149-2146, 1963. Аппаратура для автоматизированного синтеза полипептидов имеется в продаже от таких поставщиков, как Applied BioSysteias, Inc. (Foster City, CA), и ее можно использовать в соответствии с инструкциями производителя.
В целом выделяют описанные здесь полипептиды и полинуклеотиды. "Выделенный" полипептид или полинуклеотид представляет собой удаленный из исходной среды. Например, природный белок является выделенным, если он отделен от части или всех имеющихся вместе с ним в природной системе материалов. Предпочтительно чтобы такие полипептиды имели чистоту по меньшей мере приблизительно 90%, более предпочтительна чистота по меньшей мере приблизительно 95% и наиболее предпочтительна чистота по меньшей мере приблизительно 99%. Полипептид считается выделенным, если он, например, клонирован в вектор, который не является частью природного окружения.
В дополнительных вариантах в настоящем изобретении предлагаются миметики полипептидов WT1. Такие миметики могут включать в себя аминокислоты, присоединенные к миметикам из одной или более аминокислот (т.е. одна или более аминокислот в белке WT1 может быть заменена аминокислотным миметиком) или они могут представлять собой полностью непептидные миметики. Аминокислотный миметик представляет собой соединение, которое конформационно сходно с аминокислотой, таким образом, что он может заменить аминокислоту в полипептиде WT1 без существенного снижения способности реагировать с антигенспецифичными антисыворотками и/или линями или клонами Т-клеток. Непептидный миметик представляет собой соединение, которое не содержит аминокислот и которое обладает общей конформацией, сходной с таковой полипептида WT1, таким образом, что способность миметика реагировать с WT1-специфичными антисыворотками и/или линиями или клонами Т-клеток существенно не снижается по сравнению со способностью полипептида WT1. Такие миметики могут быть разработаны с помощью стандартных способов (например, ядерного магнитного резонанса и вычислительной техники), при которых оценивается трехмерная структура пептидной последовательности. Миметики могут быть разработаны, когда одна или более функциональных групп боковых цепей полипептида WT1 заменены группами, которые необязательно обладают тем же размером или объемом, но которые обладают сходными химическими и/или физическими свойствами, которые вызывают сходные биологические ответы. Следует понимать, что в описанных здесь вариантах осуществления миметик может быть заменен полипептидом WT1.
Полинуклеотиды WT1
Любой полинуклеотид, который кодирует полипептид WT1, как здесь описано, представляет собой полинуклеотид WT1, охватываемый настоящим изобретением. Такие полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут быть представлены молекулами ДНК (геномной, кДНК или синтетической) или РНК. В полинуклеотиде настоящего изобретения могут находиться, но необязательно, дополнительные кодирующие или некодирующие последовательности, и полинуклеотид может быть, но не обязательно, присоединен к другим молекулам и/или поддерживающим материалам.
Полинуклеотиды WT1 могут кодировать природный белок WT1 или могут кодировать вариант WT1, как здесь описано. Полинуклеотидные варианты могут содержать одну или более замен, добавок, делеций и/или вставок, таких, что иммуногенность кодируемого полипептида не снижается по сравнению с природным белком WT1. Действие кодируемого полипептида на иммуногенность может быть в целом оценена, как здесь описано. Предпочтительные варианты содержат замены, делении, вставки и/или добавки, составляющие не более 20%, предпочтительно не более 10% положений нуклеотидов, которые кодируют иммуногенную часть природной последовательности WT1. Некоторые варианты в значительной мере гомологичны природному гену или его части. Такие полинуклеотидные варианты способны гибридизоваться в умеренно жестких условиях с природно существующей последовательностью ДНК, кодирующей полипептид WT1 (или с комплементарной последовательностью). Подходящие умеренно жесткие условия включают в себя предварительную промывку в растворе 5 Х SSC, 0,5% ДCН, 1,0 мМ ЭДТА (рН 8,0); гибридизацию при 50°С-65°С, 5 Х SSC, в течение ночи; с последующей промывкой дважды при 65°С в течение 20 минут каждым из 2 X, 0,5 X и 0,2 X SSC, содержащим 0,1% ДСН). Такие гибридизуемые последовательности ДНК также включаются в сферу этого изобретения.
Специалисты должны принимать во внимание, что в результате вырожденности генетического кода имеется много нуклеотидных последовательностей, которые кодируют полипептид WT1. Некоторые из этих полинуклеотидов обладают минимальной гомологией с нуклеотидной последовательностью любого природного гена. Тем не менее полинуклеотиды, варьирующие из-за различий в применяемом кодоне, особо охватываются настоящим изобретением.
После того как определена иммуногенная часть WT1, как описано выше, полинуклеотид WT1 может быть получен с помощью любого из множества способов. Например, полинуклеотид WT1 может быть амплифицирован с кДНК, полученной из клеток, экспрессирующих WT1. Такие полинуклеотиды могут быть амплифицированы с помощью полимеразной цепной реакции (ПЦР). Для такого подхода могут быть созданы специфичные для последовательности праймеры на основе последовательности иммуногенной части и они могут быть приобретены или синтезированы. Например, подходящие праймеры для амплификации с помощью ПЦР гена WT1 человека включают в себя следующее: первая стадия - Р118: 1434-1414: 5’ GAG AGT CAG ACT TGA AAG CAGT 3’ (SEQ ID NO:5) и P135: 5’ CTG AGC CTC AGC AAA TGG GC 3’ (SEQ ID NO:6); вторая стадия - P136: 5’ GAG CAT GCA TGG GCT CCG ACG TGC GGG 3’ (SEQ ID NO:7) и P137: 5’ GGG GTA CCC ACT GAA CGG TCC CCG A 3’ (SEQ ID NO:8). Праймеры для ПЦР-амплификации мышиного гена WT1 включают в себя следующее: первая стадия - Р138: 5’ TCC GAG CCG CAC CTC ATG 3’(SEQ ID NO:9) и Р139: 5’GCC TGG GAT GCT GGA CTG 3’ (SEQ ID NO:10), вторая стадия - P140: 5’ GAG CAT GCG ATG GGT TCC GAC GTG CGG 3’ (SEQ ID NO:11) и Р141: 5’ GGG GTA CCT CAA AGC GCC ACG TGG AGT TT 3’(SEQ ID NO:12).
Амплифицированная часть может быть затем применена для выделения полноразмерного гена из библиотеки геномной ДНК человека или из подходящей библиотеки кДНК с помощью хорошо известных способов. В другом варианте полноразмерный ген может быть сконструирован из множества фрагментов ПЦР. Полинуклеотиды WT1 можно также получить с помощью синтеза олигонуклеотидных компонентов и совместного лигирования компонентов для создания полного полинуклеотида.
Полинуклеотиды WT1 можно также синтезировать с помощью любого известного в науке способа, включая химический синтез (например, твердофазный фосфорамидитный химический синтез). Модификации в последовательности полинуклеотида могут быть также введены с помощью стандартных способов мутагенеза, таких как направляемый олигонуклеотидом сайтспецифичный мутагенез (смотри Adelman et al., DNA 2:183, 1983). В другом варианте можно получать молекулы РНК с помощью in vitro или in vivo транскрипции последовательностей ДНК, кодирующих полипептид WT1, осуществляемой так, что ДНК включают в вектор с помощью подходящего промотора для РНК-полимеразы (такой как Т7 или SP6). Некоторые части могут быть применены для получения кодируемого полипептида, как здесь описано. Кроме того, или в другом варианте, часть может быть введена больному таким образом, что кодируемый полипептид образуется in vivo (например, путем трансфекции в антигенпредставляющие клетки, такие как дендритные клетки, конструкции кДНК, кодирующей полипептид WT1, и введения трансфицированных клеток больному).
Полинуклеотиды, которые кодируют полипептид WT1, в целом можно применять для получения полипептида in vitro или in vivo. Полинуклеотиды WT1, которые комплементарны кодирующей последовательности (т.е. антисмысловые полинуклеотиды), также можно применять в качестве зонда или для торможения экспрессии WT1. Конструкции кДНК, которые могут быть транскрибированы в антисмысловую РНК, также могут быть введены в клетки или ткани для облегчения получения антисмысловой РНК.
Любой полинуклеотид может быть дополнительно модифицирован для повышения стабильности in vivo. Возможные модификации включают в себя, не ограничиваясь этим, добавление фланкирующих последовательностей по 5’- и/или 3’-концам; применение фосфоротиоата или 2’ O-метила вместо фосфодиэстеразных связей в скелете; и/или включение необычных оснований, таких как инозин, квеозин и вибутозин, а также ацетил-, метил-, тио- и других модифицированных форм аденина, цитидина, гуанина, тимина и уридина.
Нуклеотидные последовательности, как здесь описано, могут быть присоединены к множеству других нуклеотидных последовательностей с помощью общепринятых способов рекомбинантной ДНК. Например, полинуклеотид может быть клонирован в любой из множества векторов клонирования, включая плазмиды, фагемиды, производные фага лямбда и космиды. Особенно интересные векторы включают в себя экспрессионные векторы, репликативные векторы, векторы для получения зондов и секвенирующие векторы. В целом вектор должен содержать точку начала репликации, способную функционировать по меньшей мере в одном организме, удобные сайты рестрикции эндонуклеазами и один или более пригодных для селекции маркеров. Другие элементы будут зависеть от желаемого применения и должны быть очевидны для специалистов.
В некоторых осуществлениях полинуклеотиды могут быть составлены таким образом, чтобы обеспечить их вхождение в клетку млекопитающего и экспрессию в ней. Такие составы особенно пригодны для терапевтических целей, как описано ниже. Специалистам должно быть ясно, что имеется много путей достижения экспрессии полинуклеотида в клетке-мишени, и может быть применен любой подходящий способ. Например, полинуклеотид может быть включен в вирусный вектор, такой как, но не ограничиваясь этим, аденовирус, вирус, ассоциированный с аденовирусом, ретровирус или вирус коровьей оспы или другой вирус оспы (например, вирус оспы птиц). Техника включения ДНК в такие векторы хорошо известна специалистам в этой области. Ретровирусный вектор может дополнительно переносить или включать в себя ген маркера селекции (для идентификации или селекции трансдуцированных клеток) и/или часть для направленной доставки, такую как ген, который кодирует лиганд для рецептора конкретной клетки-мишени, для обеспечения специфичной доставки вектора. Специфичная доставка может быть также достигнута с помощью антитела с использованием способов, известных специалистам в этой области. Конструкции кДНК в таком векторе могут быть применены, например, для трансфекции линий клеток человека или животного при применении для создания WT1-позитивных моделей опухолей, которые могут быть применены для проведения экспериментов по защите от опухоли и по чувствительности к иммунотерапии для демонстрации торможения опухолевого или лейкозного роста или лизиса таких клеток.
Другие терапевтические составы для полинуклеотидов включают в себя коллоидные дисперсные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, шарики и системы на основе липидов, включая эмульсии типа масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой для применения в качестве носителя для доставки in vitro и in vivo является липосома (т.е. искусственный мембранный пузырек). Получение и применение таких систем хорошо известно в данной области.
Антитела и их фрагменты
В настоящем изобретении далее предлагаются связывающие агенты, такие как антитела и их антигенсвязывающие фрагменты, которые специфически связываются с полипептидом WT1. Здесь агент называют "специфически связывающимся" с полипептидом WT1, если он реагирует на определяемом уровне (например, при ТИФА) с полипептидом WT1 и не реагирует на определяемом уровне с неродственными белками при сходных условиях. Применяемый здесь термин "связывание" относится к нековалентной ассоциации двух отдельных молекул, в результате которой образуется "комплекс". Способность к связыванию можно оценить, например, определением константы связывания для образования комплекса. Константа связывания представляет собой величину, получаемую делением концентрации комплекса на результирующие концентрации компонентов. В целом два компонента называют "связывающимися" в контексте настоящего изобретения, когда константа связывания для образования комплекса превышает приблизительно 103 л/моль. Константа связывания может быть определена с помощью способов, хорошо известных в данной области.
Любой агент, который удовлетворяет указанным выше требованиям, может быть связывающим агентом. В предпочтительном осуществлении связывающий агент представляет собой антитело или его антигенсвязывающий фрагмент. Некоторые антитела поступают в продажу от, например, Santa Cruz Biotechnology (Santa Cruz CA). В другом варианте антитела можно получить любым из множества способов, известных специалистам. Смотри, например, Наrlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988. В целом антитела можно получать с помощью методов культуры клеток, включая получение моноклональных антител, как здесь описано, или путем трансфекции генов антител в подходящие бактериальные клетки-хозяева или клетки-хозяева млекопитающих для обеспечения получения рекомбинантных антител. В одном из способов иммуноген, включающий в себя полипептид, исходно вводят любому из широкого множества млекопитающих (например, мышам, крысам, кроликам, овцам или козам). На этой стадии полипептиды настоящего изобретения могут служить в качестве иммуногена без модификации. Альтернативно, особенно для относительно коротких пептидов, сильный иммунный ответ может быть вызван, если полипептид присоединен к белку-носителю, такому как бычий сывороточный альбумин или гемоцианин моллюска фиссурелии. Иммуноген вводят животному-хозяину предпочтительно в соответствии с предварительно определенной схемой, включающей в себя одну или более поддерживающих иммунизации, и у животных периодически берут кровь. Специфичные в отношении полипептида поликлональные антитела можно затем очищать из таких антисывороток, например, с помощью аффинной хроматографии с применением полипептида, присоединенного к подходящей твердой основе.
Моноклональные антитела, специфичные в отношении интересующего антигенного полипептида, могут быть получены, например, с помощью способа Kohler and Milstein, Eur. J. Immunol. 6: 511-519, 1976 и его усовершенствований. Вкратце, эти способы включают в себя получение бессмертных линий клеток, способных продуцировать антитела, обладающие желаемой специфичностью (т.е. способностью к реакции с интересующим полипептидом). Такие линии клеток могут быть получены, например, из клеток селезенки, полученных от животного, иммунизированного, как описано выше. Клетки селезенки затем делают бессмертными с помощью, например, слияния с миеломной клеткой, партнером по слиянию, предпочтительно такой, которая является сингенной с иммунизированным животным. Можно использовать множество способов слияния. Например, клетки селезенки и миеломные клетки можно соединять с помощью неионного детергента в течение нескольких минут и затем помещать при низкой плотности в селективную среду, которая поддерживает рост гибридных клеток, но не миеломных клеток. В предпочтительном способе селекции используется HAT (гипоксантин, аминоптерин, тимидин) селекция. Спустя достаточное время, обычно приблизительно от 1 до 2 недель, наблюдаются колонии гибридов. Отбирают одиночные колонии и тестируют их культуральные супернатанты на связывающую активность против полипептида. Предпочтительны гибридомы, обладающие высокой реактивностью и специфичностью.
Моноклональные антитела можно выделить из супернатанта растущих колоний гибридом. Кроме того, можно использовать различные способы для повышения выхода, такие как введение гибридомной линии клеток в брюшную полость подходящего хозяина-позвоночного, такого как мышь. Затем моноклональные антитела можно собрать из асцитной жидкости или крови. Загрязнения могут быть удалены из антител с помощью традиционных способов, таких как хроматография, гель-фильтрация, осаждение и экстракция. Полипептиды настоящего изобретения могут быть применены в процессе очистки, например, на стадии аффинной хроматографии.
В некоторых аспектах применение антигенсвязывающих фрагментов антител может быть предпочтительным. Такие фрагменты включают Fab фрагменты, которые могут быть получены с помощью стандартных способов. Вкратце, иммуноглобулины могут быть очищены из сыворотки кролика с помощью аффинной хроматографии на колонках с иммобилизованным протеином A (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988) и переваривания папаином для получения Fab- и Fc- фрагментов. Fab- и Fc-фрагменты могут быть разделены с помощью аффинной хроматографии на колонках с иммобилизованным протеином А.
Моноклональные антитела и их фрагменты могут быть присоединены к одному или более терапевтическим агентам. Подходящие в этом отношении агенты включают в себя радиоактивные метки и химиотерапевтические агенты, которые могут быть применены, например, для очистки аутологичного костного мозга in vitro). Характерные терапевтические агенты содержат радионуклиды, индукторы дифференцировки, лекарства, токсины и их производные. Предпочтительные радионуклиды включают в себя90Y,123I,125I,131I,186Re,188Re,211At и212Bi. Предпочтительные лекарства включают в себя метотрексат и аналоги пиримидина и пурина. Предпочтительные индукторы дифференцировки включают в себя форболовые эфиры и масляную кислоту. Предпочтительные токсины включают в себя рицин, абрин, токсин дифтерии, холерный токсин, гелонин, экзотоксин Pseudomonas, токсин Shigella и антивирусный белок лаконоса. Для диагностических целей может быть применено присоединение радиоактивных агентов для облегчения промечивания метастазов или для определения локализации WT1-позитивных опухолей.
Терапевтический агент может быть присоединен (например, ковалентно привязан) к подходящему моноклональному антителу прямо или непрямо (например, через линкерную группу). Прямая реакция между агентом и антителом возможна, если каждый из них содержит заместитель, способный реагировать с другим. Например, нуклеофильная группа, такая как амино- или сульфгидрильная группа, на одном может обладать способностью реагировать с карбонилсодержащей группой, такой как ангидрид или кислотный галоген, или с алкильной группой, содержащей хорошую уходящую группу (например, галоген), на другом.
В другом варианте может быть желательным соединение терапевтического агента и антитела через линкерную группу.
Линкерная группа может функционировать как спейсер для отдаления антитела от агента для того, чтобы избежать влияния на связывающие характеристики. Линкерная группа может также служить для повышения химической реакционной способности заместителя в агенте или антителе и, тем самым, для повышения эффективности присоединения. Повышение химической реакционной способности может также облегчать применение агентов или функциональных групп агентов, которое в другом случае было бы невозможно.
Для специалиста должно быть очевидным, что в качестве линкерной группы может быть использовано множество бифункциональных или полифункциональных реагентов, как гомо-, так и гетерофункциональных (таких, как описанные в каталоге Pierce Chemical Co., Rockford, IL). Присоединение может быть осуществлено, например, через аминогруппы, карбоксильные группы, сульфгидрильные группы или окисленные углеводные остатки. Имеется множество источников, в которых описана такая методология, например, патент США №4671958, принадлежащий Rodwell et al.
Когда терапевтический агент более активен, находясь в свободной от антительной части иммуноконъюгатов настоящего изобретения, может быть желательным применение линкерной группы, разрушаемой во время или после интернализации в клетку. Был описан ряд разрушаемых линкерных групп. Механизмы внутриклеточного отделения агента от этих линкерных групп включают в себя разрушение путем восстановления дисульфидной связи (например, патент США №4489710, принадлежащий Spitler), путем облучения фотолабильной связи (например, патент США №4625014, принадлежащий Senter et al.), путем гидролиза производных боковых цепей аминокислот (например, патент США №4638045, принадлежащий Kohn et al.), путем опосредуемого сывороточным комплементом гидролиза (например, патент США №4671958, принадлежащий Rodwell et al.) и путем кислотокатализируемого гидролиза (например, патент США №4569789, принадлежащий Blattler et al.).
Может быть желательным присоединение к антителу более одного агента. В одном из аспектов к одной молекуле антитела присоединяют много молекул агента. В другом к одному антителу присоединяют агенты более, чем одного типа. Независимо от конкретного варианта осуществления, иммуноконъюгаты с более чем одним агентом могут быть получены множеством способов. Например, более чем один агент может быть присоединен прямо к молекуле антитела, или могут быть применены линкеры, которые обеспечивают множество сайтов для присоединения. В другом варианте может быть применен носитель. Носитель может переносить агенты с помощью различных способов, включая ковалентное присоединение либо прямо, либо через линкерную группу. Подходящие носители включают в себя белки, такие как альбумины (например, патент США №4507234, принадлежащий Kato et al.), пептиды и полисахариды, такие как аминодекстран (например, патент США №4699784, принадлежащий Shin et al.). Носитель может также переносить агент путем нековалентного связывания или инкапсулирования, такого как в пузырьке липосомы (например, патенты США №№4429008 и 4873088). Носители, специфичные для радионуклидных агентов, включают в себя радиогалогенизированные малые молекулы и хелатирующие соединения. Например, в патенте США №4735792 раскрыты примеры радиогалогенизированных малых молекул и их синтез. Радионуклидный хелат может быть образован из хелатирующих соединений, которые включают в себя такие, которые содержат атомы азота и серы в качестве донорных атомов для связывания металлического или оксиметаллического радионуклида. Например, в патенте США №4673562, принадлежащем Davison et al., раскрыты примеры хелатирующих соединений и их синтез.
Может быть применено множество путей введения антител и иммуноконъюгатов. Обычно введение бывает внутривенным, внутримышечным, подкожным или в место удаленной опухоли. Должно быть ясным, что точная доза антитело/иммуноконъюгат должна варьировать в зависимости от применяемого антитела, плотности антигена на опухоли и скорости клиренса антитела.
Здесь также предлагаются антиидиотипические антитела, которые имитируют иммуногенную часть WT1. Такие антитела могут быть выработаны с помощью хорошо известных способов против антитела или его антигенсвязывающего фрагмента, которые специфически связываются с иммуногенной частью WT1.
Антиидиотипические антитела, которые имитируют иммуногенную часть WT1, являются антителами, которые связываются с антителом или его антигенсвязывающим фрагментом, которое специфически связывается с иммуногенной частью WT1, как здесь описано.
Т-клетки
Иммунотерапевтические композиции могут также или в другом варианте включать в себя специфичные в отношении WT1 Т-клетки. В целом такие клетки могут быть получены in vitro или ex vivo с помощью стандартных способов. Например, Т-клетки могут присутствовать в костном мозге, периферической крови или фракции костного мозга или периферической крови (или быть выделены из них) млекопитающего, например человека, с помощью имеющейся в продаже системы разделения клеток, такой как система CEPRATE™ от CellPro Inc., Bothell WA (смотри также патент США №5240856; патент США №5215926; WO 89/06280; WO 91/16116 и WO 92/07243). В другом варианте Т-клетки могут происходить от родственных или неродственных людей, животных, клеточных линий или культур.
Т-клетки могут быть стимулированы полипептидом WT1, полинуклеотидом, кодирующим полипептид WT1, и/или клеткой, представляющей антиген (АРС), которая экспрессирует полипептид WT1. Такую стимуляцию проводят при условиях и в течение времени, достаточных для обеспечения образования Т-клеток, специфичных в отношении полипептида WT1. Предпочтительно чтобы полипептид WT1 или полинуклеотид находились в средстве доставки, таком как микросфера, для облегчения образования антигенспецифичных Т-клеток. Вкратце, Т-клетки, которые могут быть выделены из больного или родственного или неродственного донора с помощью обычных способов (таких как центрифугирование лимфоцитов периферической крови в градиенте плотности Ficoll/Hypaque), инкубируют с полипептидом WT1. Например, Т-клетки можно инкубировать in vitro в течение 2-9 дней (обычно 4 дней) при 37°С с полипептидом WT1 (например, от 5 до 25 мкг/мл) или клетками, синтезирующими сопоставимое количество полипептида WT1. Может оказаться желательным инкубировать отдельную аликвоту образца Т-клеток в отсутствие полипептида WT1 для использования в качестве контроля.
Т-клетки рассматривают как специфичные в отношении полипептида WT1, если Т-клетки вызывают гибель клеток-мишеней, покрытых полипептидом WT1 или экспрессирующих ген, кодирующий такой полипептид. Специфичность Т-клеток может быть оценена с помощью любого из многочисленных стандартных способов. Например, при анализе выделения хрома или анализе пролиферации на специфичность Т-клеток указывает индекс стимуляции более чем двукратного повышения лизиса и/или пролиферации относительно негативных контролей. Такие анализы могут быть выполнены, например, как описано Chen et al., Cancer Res. 54:1065-1070, 1994. В другом варианте выявление пролиферации Т-клеток проводят с помощью множества известных способов. Например, пролиферацию Т-клеток можно выявлять путем измерения повышенной скорости синтеза ДНК (например, с помощью разовой обработки культур Т-клеток меченным по тритию тимидином и измерения количества меченного по тритию тимидина, включенного в ДНК). Другие способы определения пролиферации Т-клеток включают в себя измерение повышения образования интерлейкина-2 (IL-2), притока Са2+ или захвата красителя, такого как 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия. В другом варианте может быть измерен синтез лимфокинов (таких как интерферон-гамма) или может быть определено относительное количество Т-клеток, которые могут отвечать на полипептид WT1. Контактирование с полипептидом WT1 (200 нг/мл 100 мкг/мл, предпочтительно 100 нг/мл 25 мкг/мл) в течение 3-7 дней должно вызывать по меньшей мере двукратное повышение пролиферации Т-клеток и/или контактирование, как описано выше, в течение 2-3 часов должно приводить к активации Т-клеток, измеренной с помощью стандартных анализов цитокинов, когда двукратное увеличение уровня выделения цитокина (например, TNF или IFN-y) служит показателем активации Т-клеток (смотри Coligan et. al., Curren Protocols in Immunology, vol. 1, Wiley Interscience (Greene 1998). Можно осуществлять экспансию клеток, специфичных в отношении WT1, с использованием стандартных способов. В предпочтительных осуществлениях Т-клетки получают у больного или родственного или неродственного донора, и их вводят больному после их стимуляции и экспансии.
Т-клетки, которые проактивировались в ответ на полипептид WT1, полинуклеотид или WT1-экспрессирующие АРС, могут быть CD4+ или CD8+. Специфическая активация CD4+ или CD8+ Т-клеток может быть определена множеством способов. Способы определения специфической активации Т-клеток включают в себя определение пролиферации Т-клеток, продукции цитокинов (например, лимфокинов) или генерации цитолитической активности (т.е. генерации цитотоксических Т-клеток, специфичных для WT1). Для CD4+ Т-клеток предпочтительным способом определения специфичной активации Т-клеток является определение пролиферации Т-клеток. Для CD8+ Т-клеток предпочтительным способом определения специфичной активации Т-клеток является определение генерации цитолитической активности.
Для терапевтических целей число CD4+ или CD8+ Т-клеток, которые пролиферируют в ответ на полипептид WT1, полинуклеотид или АРС, может быть увеличено либо in vitro, либо in vivo. Пролиферация таких Т-клеток in vitro может осуществляться множеством способов. Например, Т-клетки можно повторно подвергать воздействию WT1 полипептида с добавлением или без добавления ростовых факторов Т-клеток, таких как интерлейкин-2, и/или клеток-стимуляторов, которые синтезируют полипептид WT1. Добавление клеток-стимуляторов предпочтительно, когда индуцируются ответы CD8+ Т-клеток. Количество Т-клеток может возрастать до большой величины in vitro с сохранением специфичности ответа на прерывистую повторную стимуляцию полипептидом WT1. Вкратце, для первичной стимуляции in vitro (IVS) во флаконы со средой, содержащей сыворотку человека, можно поместить большое число лимфоцитов (например, большее чем 4×107). Полипептид WT1 (например, пептид в концентрации 10 мкг/мл) может быть добавлен непосредственно вместе с анатоксином столбняка (например, в концентрации 5 мкг/мл). Сосуды можно затем проинкубировать (например, при 37°С в течение 7 дней). Для повторной IVS Т-клетки затем собирают и помещают в новые флаконы с 2-3×107облученных мононуклеарных клеток периферической крови. Полипептид WT1 (например, в концентрации 10 мкг/мл) добавляют непосредственно. Сосуды инкубируют при 37°С в течение 7 дней. На 2-й день и на 4-й день после повторной IVS добавляют 2-5 единиц интерлейкина-2 (ИЛ-2). Для третьей IVS Т-клетки могут быть помещены в лунки и простимулированы своими собственными индивидуальными EBV-трансформированными В-клетками, покрытыми пептидом. ИЛ-2 можно добавлять на 2-й и 4-й дни каждого цикла. Как только демонстрируется, что клетки стали специфичными цитотоксичными Т-клетками, их количество может быть увеличено с применением 10-дневного цикла стимуляции более высоким количеством ИЛ-2 (20 единиц) на 2-й, 4-й и 6-й дни.
В противоположном варианте одну или более Т-клеток, которые пролиферируют в присутствии полипептида WT1, можно клонировать, за счет чего увеличивается их число. Способы клонирования клеток хорошо известны науке и включают в себя ограниченное разведение. Реагирующие Т-клетки могут быть выделены из периферической крови сенсибилизированных больных с помощью центрифугирования в градиенте плотности и образования розеток с эритроцитами барана и размножены в культуре путем стимуляции номинальным антигеном в присутствии облученных аутологичных клеток-носителей. Для создания CD4+ Т-клеточных линий WT1 полипептид применяют в качестве антигенного стимула, а в качестве антиген-представляющих клеток применяют аутологичные лимфоциты периферической крови (PBL) или клеточные линии лимфобластом (LCL), иммортализованные с помощью инфицирования вирусом Эпштейна-Барр. Для создания CD8+ Т-клеточных линий в качестве клеток-стимуляторов могут быть использованы аутологичные антигенпредставляющие клетки, трансфицированные экспрессионным вектором, который продуцирует WT1 полипептид. Созданные Т-клеточные линии могут быть клонированы через 2-4 дня после стимуляции антигеном путем рассаживания стимулированных Т-клеток в количестве 0,5 клеток на лунку в 96-луночные плоскодонные планшеты с 1×106 облученных PBL или LCL клеток и рекомбинантного интерлейкина-2 (рИЛ2) (50 Ед/мл). Приблизительно через 2-3 недели после первоначального рассаживания лунки с индукцией клонального роста могут быть идентифицированы и повторно стимулированы соответствующим антигеном в присутствии аутологичных антигенпредставляющих клеток, затем размножены с помощью добавления низких доз рИЛ2 (10 Ед/мл) через 2-3 дня после стимуляции антигеном. Клоны Т-клеток могут поддерживаться в 24-луночных планшетах путем периодической повторной стимуляции антигеном и рИЛ2 приблизительно каждые две недели.
В определенных вариантах аллогенные Т-клетки могут быть подвергнуты первичной стимуляции (т.е. сенсибилизации к WT1) in vivo и/или in vitro. Такая первичная стимуляция может быть достигнута путем контакта Т-клеток с полипептидом WT1, полинуклеотидом, кодирующим такой полипептид, или с клеткой, продуцирующей такой полипептид, в условиях и в течение времени, достаточных для осуществления первичной стимуляции Т-клеток. В целом считается, что первичная стимуляция Т-клеток осуществлена, если, например, результатом контакта с полипептидом WT1 стала пролиферация и/или активация Т-клеток, измеренные стандартными способами оценки пролиферации, тестами высвобождения хрома и/или секреции цитокинов, как здесь описано. Индекс стимуляции, оцениваемый по более чем двукратному повышению пролиферации или лизиса и более чем трехкратному повышению уровня цитокинов по отношению к негативным контролям, указывает на Т-клеточную специфичность. Клетки, подвергнутые первичной стимуляции in vitro, могут быть применены, например, при трансплантации костного мозга или для инфузии донорских лимфоцитов.
Фармацевтические композиции и вакцины
В определенных вариантах полипептиды, полинуклеотиды, антитела и/или Т-клетки могут быть включены в фармацевтические композиции или вакцины. В другом варианте фармацевтическая композиция может включать в себя антигенпредставляющую клетку (например, дендритную клетку), трансфицированную полинуклеотидом WT1, таким, чтобы антигенпредставляющая клетка экспрессировала полипептид WT1. Фармацевтические композиции включают в себя одно или более соединений или клеток и физиологически приемлемый носитель или наполнитель. Конкретные вакцины могут включать в себя одно или более таких соединений или клеток и усилитель неспецифического иммунного ответа, такой как адъювант или липосома (в которую включено соединение). Фармацевтические композиции и вакцины могут дополнительно содержать систему доставки, такую как биологически деградируемые микросферы, которые раскрыты, например, в патентах США №№4897268 и 5075109. В объеме настоящего изобретения фармацевтические композиции и вакцины могут также содержать другие соединения, которые могут быть биологически активными или неактивными.
В определенных вариантах фармацевтические композиции и вакцины предназначены для индукции Т-клеточных ответов, специфичных для полипептида WT1 у больного, например, человека. В целом Т-клеточные ответы могут быть преимущественными при использовании относительно коротких пептидов (например, содержащих последовательность менее чем из 23 аминокислотных остатков природного полипептида WT1, предпочтительно последовательность из 4-16 остатков, более предпочтительно последовательность из 8-16 остатков и еще более предпочтительно последовательность из 8-10 остатков. В противоположном варианте или в дополнение вакцина может включать в себя усилитель неспецифического иммунного ответа, который предпочтительно увеличивает Т-клеточный ответ. Другими словами, усилитель иммунного ответа может усиливать уровень Т-клеточного ответа на полипептид WT1 на такую величину, которая пропорционально выше, чем величина, на которую увеличен ответ антител. Например, по сравнению со стандартным адъювантом на основе масла, таким как CFA (полный адъювант Фрейнда), усилитель иммунного ответа, который преимущественно увеличивает ответ Т-клеток, может увеличивать пролиферативный Т-клеточный ответ - по меньшей мере в два раза, литический ответ - по меньшей мере на 10% и/или активацию Т-клеток по меньшей мере в два раза по сравнению с WT1-негативными контрольными линиями клеток, заметно не увеличивая в то же время антительного ответа. Величина, на которую увеличен ответ на полипептид WT1 Т-клеток или антител, может обычно определяться с применением характерной техники, известной науке, такой как предлагаемая здесь техника.
Фармацевтическая композиция или вакцина может содержать ДНК, кодирующую один или более полипептидов, как описано выше, так, чтобы такой полипептид вырабатывался in situ. Как отмечалось выше, ДНК может быть представлена в любой из множества систем доставки, известных специалистам в этой области, включая экспрессионные системы для нуклеиновых кислот, бактериальные и вирусные экспрессионные системы и экспрессионные системы млекопитающих. Подходящие экспрессионные системы для нуклеиновых кислот содержат необходимые последовательности ДНК, кДНК или РНК для экспрессии у больного (такие как подходящий промотор и сигнал терминации). Бактериальные системы доставки включают в себя введение бактерий (такой как Bacillus-Calmette-Guerrin), которая экспрессирует иммуногенную часть полипептида на своей клеточной поверхности. В предпочтительном осуществлении ДНК может быть введена с применением экспрессионной системы вируса (например, вируса коровьей оспы или другого вируса оспы, ретровируса или аденовируса), что может включать в себя применение непатогенного (дефектного) вируса, способного к репликации. Техника включения ДНК в такие экспрессионные системы хорошо известна специалистам в этой области. ДНК может быть также "незащищенной", как описано, например, в Ulmer et al., Science 259:1745-1749, 1993 и в обзоре Cohen, Science 259:1691-1692, 1993. Захват незащищенной ДНК может быть увеличен покрытием ДНК биологически деградируемым материалом, который эффективно транспортируется в клетки.
Как отмечалось выше, фармацевтическая композиция или вакцина может включать в себя антигенпредставляющую клетку, которая экспрессирует полипептид WT1. Для терапевтических целей, как здесь описано, антигенпредставляющая клетка представляет собой аутологичную дендритную клетку. Такие клетки могут быть получены и трансфицированы с применением стандартной техники, такой как описанная Reeves et al., Cancer Res. 56:5672-5677, 1996; Tuting et al., J. Immunol. 160:1139-1147, 1998; и Nair et al., Nature Biotechnol. 16:364-369, 1998). Экспрессия полипептида WT1 на поверхности антигенпредставляющей клетки может быть подтверждена путем стимуляции in vitro и стандартной пролиферации, а также, как здесь описано, тестами с использованием высвобождения хрома.
Несмотря на то, что в фармацевтических композициях настоящего изобретения может быть применен любой носитель, известный специалистам в этой области, тип носителя должен варьировать в зависимости от способа введения. Композиции настоящего изобретения могут быть составлены для любого подходящего способа введения, включая, например, местное, пероральное, интраназальное, внутривенное, внутричерепное, внутрибрюшинное, подкожное или внутримышечное введение. Для парентерального введения, такого как подкожное введение, носитель предпочтительно включает в себя воду, физиологический раствор, спирт, масло, воск или буфер. Для перорального введения может быть применен любой из указанных выше носителей или твердый носитель, такой как маннит, лактоза, крахмал, стеарат магния, натриевая соль сахарина, тальк, целлюлоза, глюкоза, сахароза и карбонат магния. В качестве носителей фармацевтических композиций настоящего изобретения могут быть также применены биологически деградируемые микросферы (например, полилактат, полигликолат). Для определенных местных применений предпочтителен такой состав, как крем или примочка с использованием хорошо известных компонентов.
Такие композиции могут также включать в себя буферы (например, нейтральный забуференный физиологический раствор или физиологический раствор на основе фосфатного буфера), углеводы (например, глюкозу, маннозу, сахарозу или декстраны), маннит, белки, полипептиды или аминокислоты, такие как глицин, антиоксиданты, халатирующие агенты, такие как ЭДТА или глутатион, адъюванты (например, гидроокись алюминия) и/или консерванты. В противоположном варианте композиции настоящего изобретения могут быть составлены как лиофилизированный состав. Соединения могут также быть инкапсулированными в липосомы с применением хорошо известной технологии.
В вакцинах настоящего изобретения может быть применен любой из множества усилителей неспецифического иммунного ответа, таких как адъюванты. Большинство адъювантов содержит вещество, предназначенное для защиты антигена от быстрого катаболизма, такое как гидроокись алюминия или минеральное масло, и стимулятор иммунных ответов, такой как липид А, белки из Bortadella pertussis или Mycobacterium tuberculosis. Подходящие усилители неспецифического иммунного ответа включают в себя адъюванты на основе алюминия (например, Alhydrogel, Rehydragel, фосфат алюминия, Algammulin, гидроокись алюминия); адъюванты на основе масла (адъювант Фрейнда (FA), Specol, RIBI, TiterMax, Montanide ISA50 или Seppic MONTANIDE ISA 720; цитокины (например, GM-CSF (гранулоцит-макрофаг-колониестимулирующий фактор) или Falt3-лиганд); микросферы; адъюванты на основе неионных блоков сополимеров; адъюванты на основе бромида диметилдиоктадециламмония (DDA) AS-1, AS-2 (Smith Kline Beecham); адъюванты на основе адъювантной системы Ribi; QS21 (Aquila); адъюванты на основе сапонина (неочищенный сапонин, сапонин Quil A); адъюванты на основе мюрамилдипептида (MDP), такие как SAF (адъювант Syntex в своей микродисперсной форме (SAF-m)); бромид диметилдиоктадециламмония (DDA); адъюванты на основе комплемента человека m. vaccae и производные; адъюванты на основе иммуностимуляторного комплекса (iscom); инактивированные токсины; ослабленные инфекционные агенты (такие как М. tuberculosis).
Как отмечено выше, в определенных случаях усилители иммунного ответа выбирают по их способности предпочтительно вызывать или увеличивать Т-клеточный ответ (например, CD4+и/или CD8+) на полипептид WT1. Такие усилители иммунного ответа хорошо известны науке и включают в себя (но не ограничиваются этим) Montanide ISA50, Seppic MONTANIDE ISA 720, цитокины (например, GM-CSF, Falt3-лиганд), микросферы, адъюванты на основе бромида диметилдиоктадециламмония (DDA), AS-1 (Smith Kline Beecham), AS-2 (Smith Kline Beecham), адъюванты на основе адъювантной системы Ribi, QS21 (Aquila), адъюванты на основе сапонина (неочищенный сапонин, сапонин Quil А), адъювант Syntex в своей микродисперсной форме (SAF-m), MV, ddMV (Genesis), адъюванты на основе иммуностимуляторного комплекса (iscom) и инактивированные токсины.
Описанные здесь композиции и вакцины можно вводить как часть состава с постоянным высвобождением (т.е. такого состава как капсула или губка, который определяет медленное высвобождение соединения после введения). Такие составы обычно могут быть получены с применением хорошо известной технологии и могут вводиться с помощью, например, пероральной, ректальной или подкожной имплантации или путем имплантации в желаемое место направленного действия. Составы с постоянным высвобождением могут содержать полипептид, полинуклеотид, антитело или клетку, диспергированные в матриксе носителя и/или содержащиеся в резервуаре, окруженном мембраной, контролирующей скорость высвобождения. Носители для применения в таких составах являются биологически совместимыми и могут также быть биологически деградируемыми; предпочтительно состав дает относительно постоянный уровень высвобождения активного компонента. Количество активного компонента, содержащееся в составе с постоянным высвобождением, зависит от места имплантации, скорости и предполагаемой продолжительности высвобождения, а также от природы состояния, которое планируется лечить или предотвратить.
Лечение злокачественных заболеваний
В дополнительных вариантах настоящего изобретения описанные здесь композиции и вакцины можно применять для торможения развития злокачественных заболеваний (например, прогрессирующих или метастазирующих заболеваний или заболеваний, характеризующихся малым размером опухоли, таких как заболевание с минимальной остаточной опухолевой тканью). В целом такие способы могут быть применены для профилактики, сдерживания развития или лечения заболевания, связанного с экспрессией WT1. Другими словами, предлагаемые здесь терапевтические способы могут быть применены для лечения существующего заболевания, связанного с экспрессией WT1, или могут быть применены для профилактики или сдерживания развития такого заболевания у пациента, который не страдает от заболевания или который страдает от заболевания, которое пока не связано с экспрессией WT1.
Здесь понимается, что заболевание является “связанным с экспрессией WT1, если больные клетки (например, опухолевые клетки) в определенный период в процессе болезни производят измеримо большее количество полипептида WT1 по сравнению с нормальными клетками той же ткани. Для связи экспрессии WT1 со злокачественным заболеванием не требуется присутствие WT1 на опухоли. Например, гиперэкспрессия WT1 может принимать участие в инициации опухоли, но впоследствии экспрессия белка может быть утрачена. В другом варианте злокачественное заболевание, для которого не характерна повышенная экспрессия WT1, может с течением времени развиваться в заболевание, для которого характерна повышенная экспрессия WT1. Соответственно, любое злокачественное заболевание рассматривается как “связанное с экспрессией WT1”, когда больные клетки ранее экспрессировали, экспрессируют в настоящее время или, как ожидается, будут экспрессировать впоследствии повышенное количество WT1.
Иммунотерапия может проводиться с применением любого из множества способов, при котором предлагаемые здесь соединения или клетки действуют в направлении удаления экспрессирующих WT1 клеток из организма больного. Такое удаление может иметь место в результате усиления или индукции иммунного ответа, специфичного в отношении WT1 или экспрессирующей WT1 клетки, у больного. В другом варианте экспрессирующие WT1 клетки могут быть удалены ex vivo (например, обработкой аутологичного костного мозга, периферической крови или фракции костного мозга или периферической крови). Фракции костного мозга или периферической крови могут быть получены стандартным для науки способом.
В рамках таких способов больному могут вводиться фармацевтические композиции и вакцины. Как это применяется здесь, термин “больной” относится к любому теплокровному животному, предпочтительно к человеку. Больной может страдать, но может и не страдать злокачественным заболеванием. Соответственно, указанные выше фармацевтические композиции и вакцины могут применяться для предотвращения наступления заболевания (т.е. профилактически) или для лечения больного, страдающего заболеванием (например, для предотвращения или отсрочки развития и/или метастазирования существующего заболевания). У страдающего заболеванием больного может быть минимальное остаточное заболевание (например, при малом размере опухоли у больного лейкемией при полной или частичной ремиссии или у больного раком после снижения размера опухоли после хирургической радиотерапии и/или химиотерапии). Такого больного можно иммунизировать для торможения рецидива (т.е. предотвращения или отсрочки рецидива или снижения тяжести рецидива). К предпочтительным вариантам относятся такие, когда больной страдает лейкозом (например, AML, CML, ALL или детским ALL), миелодисплазическим синдромом (MDS) или раком (например, раком желудочно-кишечного тракта, легкого, щитовидной или молочной железы или меланомой), когда рак или лейкоз являются WT1-позитивными (т.е. измеримо реагируют с антителом против WT1, как предлагается здесь, или экспрессируют мРНК WT1 на уровне, определяемом с помощью ОТ-ПЦР, как описано здесь) или страдает аутоиммунным заболеванием, направленным против экспрессирующих WT1 клеток.
Предлагаемые здесь композиции могут применяться самостоятельно или в сочетании с традиционными формами лечения, такими как хирургия, облучение, химиотерапия и/или трансплантация костного мозга (аутологичная, сингенная, аллогенная или неродственная). Как это обсуждается подробнее ниже, предлагаемые здесь связывающие агенты и Т-клетки могут применяться для очистки аутологичных стволовых клеток. Такая очистка может быть полезной, например, перед трансплантацией костного мозга или трансфузией крови или ее компонентов. Предлагаемые здесь связывающие агенты, Т-клетки, антигенпредставляющие клетки (АРС) и композиции могут быть также применены для экспансии и стимуляции (или прайминга) аутологичных, аллогенных, сингенных или неродственных специфичных в отношении WT1 Т-клеток in vitro и/или in vivo. Такие специфичные в отношении WT1 Т-клетки можно применять, например, при инфузии донорских лимфоцитов.
Пути и частота введения, а также дозировка должны варьировать от индивидуума к индивидуума и могут быть легко определены с помощью стандартных способов. В целом фармацевтические композиции и вакцины можно вводить с помощью инъекции (например, внутрикожной, внутримышечной, внутривенной или подкожной), интраназально (например, путем вдыхания) или перорально. В случае некоторых опухолей фармацевтические композиции или вакцины можно вводить местно (с помощью, например, ректоколоскопии, гастроскопии, видеоэндоскопии, ангиографии или других известных в данной области способов). Предпочтительно на протяжении 52-недельного периода можно вводить от 1 до 10 доз. Предпочтительно, чтобы вводилось 6 доз с интервалами 1 месяц, и после этого могут периодически делаться поддерживающие вакцинации. Для отдельных больных могут быть подходящими другие схемы. Подходящей дозой является количество соединения, которое при описанном выше введении способно вызывать противоопухолевый иммунный ответ, который по меньшей мере на 10-50% превышает базальный (т.е. без лечения) уровень. Такой ответ может быть отслежен с помощью измерения противоопухолевых антител у больного или образования зависимых от вакцины цитолитических эффекторных клеток, способных вызывать гибель опухолевых клеток больного in vitro. Такие вакцины должны быть также способны вызывать иммунный ответ, ведущий к улучшенному клиническому результату (например, более частым полным или частичным ремиссиям или более длительной безболезненной или общей продолжительности жизни) у вакцинированных больных по сравнению с невакцинированными больными. В целом для фармацевтических композиций и вакцин, включающих в себя один или более полипептидов, количество каждого полипептида в дозе варьирует приблизительно от 100 мкг до 5 мг. Подходящие размеры доз должны варьировать в зависимости от размера больного, но обычно должны находиться в диапазоне приблизительно от 0,1 мл до 5 мл.
В целом подходящая дозировка и схема лечения обеспечивает активное (активные) соединение (соединения) в количестве, достаточном для обеспечения терапевтического и/или профилактического благоприятного действия. Такой ответ может быть отслежен путем установления улучшенного клинического результата (например, более частые полные или частичные ремиссии или более длительная безболезненная или общая продолжительность жизни) у подвергнутых лечению больных по сравнению с больными без лечения. Повышение предсуществующих иммунных ответов на WT1 в целом коррелирует с улучшенным клиническим исходом. Такие иммунные ответы в целом могут быть оценены с помощью стандартных способов определения пролиферации, цитотоксичности или цитокинов, которые могут быть проведены с использованием образцов, полученных у больного до и после лечения.
В других вариантах способы торможения развития злокачественного заболевания, ассоциированного с экспрессией WT1, включают в себя введение аутологичных Т-клеток, активированных в ответ на полипептид WT1 или АРС, экспрессирующие WT1, как описано выше. Такие клетки могут быть CD4+ и/или CD8+, и их пролиферацию можно вызвать, как описано выше. Т-клетки могут быть введены индивидууму в количестве, эффективном для торможения развития злокачественного заболевания. Обычно вводят внутривенно, внутриполостно или в ложе удаленной опухоли приблизительно от 1×109 до 1×1011 Т-клеток/М2. Специалистам должно быть ясно, что количество клеток и частота введения должны зависеть от реакции больного.
В некоторых случаях осуществления перед аутологичной трансплантацией костного мозга Т-клетки могут быть стимулированы. Такая стимуляция может иметь место in vivo или in vitro. Для стимуляции in vitro костный мозг и/или периферическая кровь (или фракция костного мозга или периферической крови), полученные у больного, могут быть введены в контакт с полипептидом WT1, полинуклеотидом, кодирующим полипептид WT1, и/или АРС, которые экспрессируют полипептид WT1, в условиях и в течение периода времени, достаточных для обеспечения стимуляции Т-клеток, как описано выше. Костный мозг, стволовые клетки периферической крови и/или специфичные в отношении WT1 Т-клетки могут быть затем введены больному с помощью стандартных способов.
В сходных вариантах осуществления Т-клетки от родственного или неродственного донора могут быть стимулированы перед трансплантацией сингенного или аллогенного (родственного или неродственного) костного мозга. Такая стимуляция может иметь место in vivo или in vitro. Для стимуляции in vitro костный мозг и/или периферическая кровь (или фракция костного мозга или периферической крови), полученные у родственного или неродственного донора, могут быть введены в контакт с полипептидом WT1, полинуклеотидом WT1 и/или АРС, которые экспрессируют полипептид WT1, в условиях и в течение периода времени, достаточных для обеспечения стимуляции Т-клеток, как описано выше. Костный мозг, стволовые клетки периферической крови и/или специфичные в отношении WT1 Т-клетки могут быть затем введены больному с помощью стандартных способов.
В других вариантах осуществления описанные здесь Т-клетки, специфичные в отношении WT1, могут быть применены для удаления экспрессирующих WT1 клеток из аутологичного костного мозга, периферической крови или фракции костного мозга или периферической крови (например, обогащенной CD34+ периферической крови (ПК) перед введением больному). Такие способы проводятся путем введения в контакт костного мозга или ПК с такими Т-клетками в условиях и в течение периода времени, достаточных для обеспечения снижения экспрессирующих WT1 клеток менее чем до 10%, предпочтительно менее чем до 5% и еще более предпочтительно менее чем до 1% от общего количества миелоидных или лимфатических клеток в костном мозге или периферической крови. Степень, до которой такие клетки были удалены, может быть легко определена с помощью стандартных способов, таких, например, как качественный и количественный анализ ПЦР, морфологический, иммуногистохимический и FACS-анализ. Костный мозг или ПК (или их фракции) могут быть затем введены больному с помощью стандартных способов.
Способы диагностики
В настоящем изобретении далее предлагаются способы определения злокачественного заболевания, ассоциированного с экспрессией WT1, и мониторинга эффективности иммунизации или лечения такого заболевания. Такие способы основываются на открытии данного изобретения, что иммунный ответ, специфичный в отношении белка WT1, может быть обнаружен у больных, страдающих такими заболеваниями, и что способы, которые повышают иммунный ответ, могут оказывать предохраняющее или терапевтическое благоприятное действие.
Для определения наличия или отсутствия у больного злокачественного заболевания, ассоциированного с экспрессией WT1, можно определять уровень специфичных в отношении WT1 Т-клеток. В определенных способах биологический образец, включающий в себя CD4+ и/или CD8+ Т-клетки, выделенный у больного, инкубируют с полипептидом WT1, полинуклеотидом, кодирующим полипептид WT1, и/или экспрессирующими полипептид WT1 АРС, и определяют наличие или отсутствие специфической активации Т-клеток, как здесь описано. Подходящие биологические образцы включают в себя, не ограничиваясь этим, выделенные Т-клетки. Например, Т-клетки могут быть выделены у больного с помощью традиционных способов (таких как центрифугирование лимфоцитов периферической крови в градиенте концентрации фиколл/Hypaque). Т-клетки можно инкубировать in vitro в течение 2-9 дней (обычно 4 дня) при 37°С с полипептидом WT1 (например, 5-25 мкг/мл). Может оказаться желательным инкубировать другую аликвоту образца Т-клеток в отсутствие полипептида WT1 в качестве контроля. Для CD4- Т-клеток активацию предпочтительно определяют с помощью оценки пролиферации Т-клеток. Для CD8+ Т-клеток активацию предпочтительно определяют с помощью оценки цитолитической активности. Уровень пролиферации, который по меньшей мере в два раза выше, и/или уровень цитолитической активности, которая по меньшей мере на 20% выше, чем у пациентов без заболевания, указывает на наличие злокачественного заболевания, ассоциированного с экспрессией WT1. С помощью способов, известных в науке, может быть определена дополнительная корреляция между уровнем пролиферации и/или цитолитической активности и предсказываемым ответом на лечение. В частности, у больных с более выраженным ответом антител, пролиферативным и/или литическим ответом можно ожидать более выраженный ответ на лечение.
В других способах в биологическом образце, полученном у больного, определяют уровень специфичного в отношении WT1 антитела. Биологический образец инкубируют с полипептидом WT1, полинуклеотидом, кодирующим полипептид WT1, и/или экспрессирующими полипептид WT1 АРС, в условиях и в течение периода времени, достаточных для образования иммунных комплексов. Затем определяют иммунные комплексы, образованные между полипептидом WT1 и антителами в биологическом образце, которые специфически связываются с полипептидом WT1. Биологический образец для применения в таких способах может быть любым образцом, полученным у больного, который, как можно было бы ожидать, содержит антитела. Подходящие биологические образцы включают в себя кровь, сыворотки, асциты, костный мозг, плевральную жидкость и спинномозговую жидкость.
Биологический образец инкубируют с полипептидом WT1 в реакционной смеси, в условиях и в течение периода времени, достаточных для обеспечения образования иммунных комплексов между полипептидом и специфичными в отношении WT1 антителами. Например, биологический образец и полипептид WT1 можно инкубировать при 4°С в течение 24-48 часов.
После инкубации в реакционной смеси определяют наличие иммунных комплексов. Определение иммунных комплексов, образованных между полипептидом WT1 и антителами, присутствующими в биологическом образце, может быть осуществлено с помощью множества известных способов, таких как радиоиммунологические анализы (РИА) и твердофазный иммуно ферментный анализ (ТИФА). Подходящие способы хорошо известны в науке и подробно описаны в научной и патентной литературе (например, Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988). Анализы, которые могут быть применены, включают в себя, не ограничиваясь этим, иммунотестирование с помощью двуслойного сэндвич-метода с применением моноклональных антител по David et al. (патент США 4376110); сэндвич-метод с применением моноклональных-поликлональных антител (Wide et al., in Kirkham and Hunter, eds., Radioimmunoassay Methods, E. And S. Livingstone, Edinburgh, 1970); способ “иммуноблоттинга” Gordon et al. (патент США 4452901); иммунопреципитацию меченого лиганда (Brown et al., J. Biol. Chem. 255:4980-4983, 1980); твердофазные иммуноферментные анализы, как описано, например, Raines and Ross (J. Biol. Chem. 257:5154-5160, 1982); иммуноцитохимические способы, включающие в себя применение флуорохромов (Brooks et al., Clin. Exp. Immunol. 39: 477, 1980); и нейтрализацию активности (Bowen-Pope et al., Proc. Natl. Acad. Sci:2396-2400, 1984). Другие иммунологические анализы включают в себя, не ограничиваясь этим, те, которые описаны в патентах США №№3817827; 3850752; 3901654; 3935074; 3984533; 3996345; 4034074 и 4098876.
Для целей определения полипептид WT1 может быть меченым или немеченым. Немеченый полипептид WT1 может быть применен в анализах агглютинации или в сочетании с мечеными выявляющими реагентами, которые связываются с иммунными комплексами (например, антииммуноглобулином, протеином G, протеином А, лектином или вторичными антителами или их антигенсвязывающими фрагментами, способными связываться с антителами, которые специфически связываются с полипептидом WT1). Если полипептид WT1 является меченым, репортерной группой может быть любая известная в данной области репортерная группа, включая радиоизотопы, флуоресцентные группы, люминесцентные группы, ферменты, биотин и красящие частицы.
В некоторых анализах полипептид WT1 иммобилизуют на твердой основе. Твердая основа может быть любым материалом, известным специалистам, к которому может быть присоединен полипептид. Например, твердой основой может служить лунка для тестирования в планшете для микротитрования, или нитроцеллюлоза, или другая подходящая мембрана. В другом варианте основа может иметь форму шарика или диска, из такого материала, как стекло, стекловолокно, латекс или пластмасса, такая как полистирол или поливинилхлорид. Основой может быть также магнитная частица или волоконный оптический сенсор, такой как те, которые раскрыты, например, в патенте США №5359681. Полипептид может быть иммобилизован на твердой основе с применением множества известных специалистам способов, которые подробно описаны в патентной и научной литературе. В контексте настоящего изобретения термин “иммобилизация” относится как к нековалентному связыванию, такому как адсорбция, так и к ковалентному присоединению (которое может быть прямой связью между антигеном и функциональными группами основы или может быть связью с помощью перекрестно-сшивающего агента). Предпочтительна иммобилизация путем адсорбции на лунку в планшете для микротитрования или на мембрану. В таких случаях адсорбция может быть достигнута путем введения в контакт полипептида WT1 в подходящем буфере с твердой основой в течение подходящего периода времени. Время контакта варьируется в зависимости от температуры, но обычно находится между приблизительно 1 часом и приблизительно 1 днем. В целом для иммобилизации адекватного количества полипептида достаточно контактирования лунки пластикового планшета для микротитрования (такого, как полистироловый или поливинилхлоридный) с количеством полипептида, варьирующим приблизительно от 10 нг до 10 мкг и предпочтительно приблизительно от 100 нг до 1 мкг.
После иммобилизации оставшиеся на подложке связывающие участки белка обычно блокируют. Пригодны любые блокирующие агенты, известные специалистам, такие как бычий сывороточный альбумин, Твин 20ТМ (Sigma Chemical Co., St. Louis, МО), инактивированная температурой нормальная сыворотка козы (NGS) или BLOTTO (забуференный раствор обезжиренного сухого молока, который также содержит консервант, соли и противопенный агент). Основу затем инкубируют с биологическим образцом, в котором подозревают наличие специфического антитела. Образец может быть нанесен неразбавленным или, чаще, он может быть разбавлен, обычно забуференным раствором, который содержит небольшое количество (0,1%-5,0% по весу) белка, такого как БСА, NGS или BLOTTO. В целом подходящее время контакта (т.е. время инкубации) является периодом времени, который достаточен для определения наличия антитела, которое специфически связывает WT1 в образце, содержащем такое антитело. Предпочтительно, чтобы время контакта было достаточным для достижения уровня связывания, который составляет по меньшей мере приблизительно 95% от достигаемого при равновесии между связанным и несвязанным антителом. Специалисты должны понимать, что время, необходимое для достижения равновесия, может быть легко определено путем анализа уровня связывания, которое происходит с течением времени. При комнатной температуре обычно достаточным является время инкубации приблизительно 30 минут.
Несвязавшийся образец затем может быть удален промывкой основы подходящим буфером, таким как ЗФР, содержащим 0,1% Твина 20ТМ. Затем может быть добавлен выявляющий реагент, который связывается с иммунными комплексами и который содержит репортерную группу. Выявляющий реагент инкубируют с иммунным комплексом в течение периода времени, достаточного для определения связанного антитела. В целом подходящий период времени может быть определен с помощью анализа уровня связывания в зависимости от времени. Несвязанный выявляющий реагент затем удаляют, а связанный выявляющий реагент определяют с помощью репортерной группы. Способ, применяемый для определения репортерной группы, зависит от природы репортерной группы. Для радиоактивных групп обычно пригодны способы сцинтилляционного счета или авторадиографии. Для определения красителей, люминесцентных групп и флуоресцентных групп могут быть применены спектроскопические способы. Биотин может быть определен с помощью авидина, соединенного с различными репортерными группами (обычно с радиоактивной или флуоресцентной группой или ферментом). Ферментные репортерные группы (например, пероксидазу хрена, бета-галактозидазу, щелочную фосфатазу и глюкозооксидазу) можно обычно определить с помощью добавления субстрата (обычно в течение определенного периода времени) с последующим спектроскопическим или другим типом анализа продуктов реакции. Независимо от конкретного применяемого способа уровень связанного выявляющего реагента, который по меньшей мере в два раза превышает фон (т.е. уровень, наблюдаемый в биологическом образце, полученном не у больного индивидуума), указывает на наличие злокачественного заболевания, ассоциированного с экспрессией WT1.
В целом способы мониторинга эффективности иммунизации или терапии включают в себя контролируемые изменения у больного в уровне антител или Т-клеток, специфичных в отношении WT1. Способы, с помощью которых осуществляется мониторинг уровня антител, могут включать в себя стадии (а) инкубации первого биологического образца, полученного у больного до лечения или иммунизации, с полипептидом WT1, когда инкубацию проводят в условиях и в течение периода времени, достаточных для образования иммунных комплексов; (b) определения иммунных комплексов, образованных между полипептидом WT1 и антителами, в биологическом образце, который специфически связывается с полипептидом WT1; (с) повторения стадий (а) и (b) с применением второго биологического образца, полученного у больного после лечения или иммунизации; (d) сравнения количества иммунных комплексов, определяемых в первом и втором биологических образцах. В другом варианте вместо полипептида WT1 могут быть использованы полинуклеотид, кодирующий полипептид WT1, или экспрессирующие полипептид WT1 АРС. В таких способах определяют иммунные комплексы между полипептидом WT1, кодируемым полинуклеотидом, или экспрессируемым АРС и антителами в биологическом образце.
Способы, при которых оценивается активация Т-клеток и/или количество специфичных в отношении WT1 предшественников, могут включать в себя стадии (а) инкубации первого биологического образца, содержащего клетки CD4+ и/или CD8+ (например, костного мозга, периферической крови или их фракции), полученного у больного до лечения или иммунизации, с полипептидом WT1, когда инкубацию проводят в условиях и в течение периода времени, достаточных для обеспечения специфической активации, пролиферации и/или лизиса Т-клеток; (b) определения степени активации, пролиферации и/или лизиса Т-клеток; (с) повторения стадий (а) и (b) с применением второго биологического образца, включающего в себя CD4+ и/или CD8+ Т-клетки, взятого у того же больного после лечения или иммунизации; (d) сравнения уровня активации, пролиферации и/или лизиса Т-клеток в первом и втором биологических образцах. В другом варианте вместо полипептида WT1 могут быть использованы полинуклеотид, кодирующий полипептид WT1, или экспрессирующие полипептид WT1 АРС.
Биологическим образцом для применения в таких способах может быть любой образец, взятый у больного, в котором можно было бы ожидать наличие антител, CD4+ Т-клеток и/или CD8+ Т-клеток. Подходящие биологические образцы включают в себя кровь, сыворотки, асциты, костный мозг, плевральную жидкость и спинномозговую жидкость. Первый биологический образец может быть получен перед началом лечения или иммунизации или в процессе реализации схемы лечения или вакцинации. Второй биологический образец следует получать сходным образом, но после дополнительного лечения или иммунизации. Второй биологический образец может быть получен по завершении или в процессе лечения или иммунизации, таким способом, что в промежутке между получением первого и второго биологических образцов проходит по меньшей мере часть лечения или иммунизации.
Стадии инкубации и определения для обоих образцов обычно можно проводить, как описано выше. Статистически значимое повышение количества иммунных комплексов во втором образце по сравнению с первым образцом отражает успешность лечения или иммунизации.
Следующие примеры предлагаются для иллюстрации, но не служат ограничением изобретения.
Примеры
Пример 1
Выявление иммунного ответа на WT1 у больных со злокачественными заболеваниями крови
Этот пример иллюстрирует выявление реального иммунного ответа у больных со злокачественным заболеванием крови.
Для оценки наличия у больных предсуществующих ответов в виде специфичных в отношении WT1 антител сыворотки больных AML, ALL, CML и тяжелой апластической анемией анализировали с помощью иммуноблоттинга. Сыворотки анализировали на способность иммунопреципитировать WT1 из линии лейкемических клеток человека К562 (American Type Culture Collection, Manassas, VA). В каждом случае иммунопреципитаты отделяли с помощью электрофореза в геле, переносили на мембрану и тестировали с помощью антитела WT180 против WT-1 (Santa Cruz Biotechnology, Inc., Santa Cruz, CA). Этот анализ иммуноблоттингом выявил потенциальные специфичные в отношении WT1 антитела у больных со злокачественным заболеванием крови. Показательная картина иммуноблоттинга, показывающая результаты для больного с AML, представлена на фигуре 2. Белок 52 кДа в иммунопреципитате, образующемся с использованием сывороток больных, узнавался специфичным в отношении WT1 антителом. Подвижность белка 52 кДа была такой же, что и в позитивном контроле.
Пример 2
Индукция антител против WT1 у мышей, иммунизированных линиями клеток, экспрессирующих WT1
Этот пример иллюстрирует применение клеток, экспрессирующих WT1, для индукции in vivo ответа на WT1 в виде специфичных антител.
Выявление наличия антител против WT1 у больных лейкемией служит важным указанием на то, что возможна иммунизация к белку WT1 для стимуляции иммунности к WT1. Для проверки того, действительно ли иммунность к WT1 может быть вызвана вакцинацией, мышам вводили TRAMP-С, WT1-позитивную линию опухолевых клеток, происходящих от В6. Вкратце, мышей В6 иммунизировали 5×106 клетками TRAMP-C подкожно с двумя поддерживающими введениями по 5×106 клеток с трехнедельными интервалами. Через три недели после последней иммунизации собирали сыворотки и получали суспензии одиночных клеток из селезенки в среде RPMI 1640 (GIBCO) с 25 мкМ β-2-меркаптоэтанола, 200 единицами пенициллина на мл, 10 мМ L-глутамина и 10% эмбриональной сывороткой телят.
После иммунизации TRAMP-C ответ специфичных в отношении WT1 антител у иммунизированных животных становился определимым. Показательная картина иммуноблоттинга представлена на фигуре 3. Эти результаты показывают, что иммунизация против белка WT1 может вызывать иммунный ответ в отношении белка WT1.
Пример 3
Индукция Th и ответов антител у мышей, иммунизированных пептидами WT1
Этот пример иллюстрирует способность иммунизации пептидами WT1 вызывать иммунный ответ, специфичный в отношении WT1.
Пептиды, пригодные для индукции AT и пролиферативных ответов Т-клеток, выявляли в соответствии с программой Tsites (Rothbard and Taylor, EMBO J. 7:93-100, 1988; Deavin et al., Mol. Immunol. 33:145-155/1996), обеспечивающей поиск пептидных мотивов, обладающих способностью вызывать Th ответы. Представленные в таблице I пептиды были синтезированы и секвенированы.

Для иммунизации пептиды группировали следующим образом:
Группа А: p6-22 человека: 10,9 мг в 1 мл (10 мкл = 100 мкг)
р117-139 человека/мыши: 7,6 мг в 1 мл (14 мкл = 100 мкг)
р244-262 человека: 4,6 мг в 1 мл (22 мкл = 100 мкг)
Группа В: р287-301 человека/мыши: 7,2 мг в 1 мл (14 мкл = 100 мкг)
р299-313 мыши: 6,6 мг в 1 мл (15 мкл = 100 мкг)
р421-435 человека/мыши: 3/3 мг в 1 мл (30 мкл = 100 мкг)
Контроль: (пептид FBL 100 мкг) + CFA/IFA
Контроль: (пептид CD45 100 мкг) + CFA/IFA
Группа А содержала пептиды, присутствующие в аминоконцевой части WT1 (экзон 1), а группа В содержала пептиды, присутствующие в карбоксиконцевой части, которая содержит область четырех цинковых пальцев с последовательностью, гомологичной другим ДНК-связывающим белкам. В пределах группы В р287-301 и р299-313 получены из экзона 7, цинковый палец I, а р421-435 получен из экзон 10, цинковый палец IV.
Мышей В6 иммунизировали пептидами группы WT1 или контрольным пептидом. Пептиды растворяли в 1 мл стерильной воды для инъекций, и мышей В6 иммунизировали 3 раза с интервалами в три недели. В качестве адъювантов применяли CFA/IFA, GM-CSF и Montinide. Наличие антител, специфичных в отношении WT1, определяли, как описано в примерах 1 и 2, а пролиферативные ответы Т-клеток оценивали с помощью стандартного анализа включения тимидина, при котором клетки культивировали в присутствии антигена и пролиферацию оценивали измерением включенной радиоактивности (Chen et al., Cancer Res. 54:1065-1070, 1994). Конкретно, лимфоциты культивировали в 96-луночных планшетах в количестве 2×105клеток на лунку с 4×105 облученных (3000 рад) (30 Дж/кг) сингенных клеток селезенки и соответствующим пептидом.
Иммунизация мышей группой пептидов, обозначенных как группа А, вызывала ответ антител на WT1 (фигура 4). Антитела не были обнаружены после иммунизации вакциной В, что соответствует отсутствию ответа хелперных Т-клеток на иммунизацию вакциной В. Пептид р117-139 вызывал пролиферативные ответы Т-клеток (фигуры 5А-5С). Индексы стимуляции (SI) варьировали между 8 и 72. Было показано, что и другие пептиды (Р6-22 и Р299-313) также вызывают пролиферативные ответы Т-клеток. Иммунизация Р6-22 приводила к индексу стимуляции (SI) 2,3, а иммунизация Р299-313 приводила к SI 3,3. Позитивные контроли включали в себя Т-клетки, стимулированные СоnА, а также Т-клетки, стимулированные известными антигенами, такими как CD45 и FBL, и аллогенные линии Т-клеток (DeBruijn et al., J. Immunol. 21:2963-2970, 1991).
На фигурах 6А и 6В показан пролиферативный ответ, наблюдавшийся для каждого из трех пептидов из вакцины А (фигура 6А) или вакцины В (фигура 6В). Вакцина А вызывала пролиферативные ответы Т-клеток на пептиды иммунизации p6-22 и р117-139 с индексами стимуляции (SI), варьирующими между 3 и 8 (наиболее высокие столбики). Не обнаружено пролиферативного ответа на р244-262 (фигура 6А).
Последующую стимуляцию in vitro проводили отдельными пептидами с применением только p6-22 и р117-139. Стимуляция специфичной в отношении вакцины А линии Т-клеток пептидом р117-139 приводила к пролиферации в ответ на р117-139, тогда как ответа на p6-22 не было (фигура 7А). Клоны, полученные из этой линии клеток, были специфичны в отношении р117-139 (фигура 7В). Напротив, стимуляция специфичной в отношении вакцины А линии Т-клеток пептидом p6-22 приводила к пролиферации в ответ на p6-22 при отсутствии ответа на р117-139 (фигура 7С). Клоны, полученные из этой линии клеток, были специфичны в отношении p6-22 (фигура 7D).
Эти результаты показывают, что вакцинация пептидами WT1 может вызывать ответы антител против белка WT1 и пролиферативные ответы Т-клеток на пептиды для иммунизации.
Пример 4
Индукция ответов CTL у мышей, иммунизированных пептидами WT1
В этом примере иллюстрируется способность пептидов WT1 вызывать иммунность CTL.
Пептиды (9-членные) с мотивами, подходящими для связывания с МНС класса I, идентифицировали с помощью BIMAS HLA анализа предсказания связывания пептидов (Parker et al., J. Immunol. 152:163, 1994). Идентифицированные с помощью такого анализа пептиды показаны в таблицах II-XLIV. В каждой из эти таблиц оценка отражает теоретическое сродство связывания (период полудиссоциации) пептида с указанной молекулой МНС.
Пептиды, идентифицированные с помощью программы Tsites (Rothbard and Taylor, EMBO J. 7:93-100, 1988; Deavin et al., Mol. Immunol. 33:145-155, 1996), обеспечивающей поиск пептидных мотивов, обладающих способностью вызывать Тh ответы, показаны далее на фигурах 8А и 8В и в таблице XLV.
























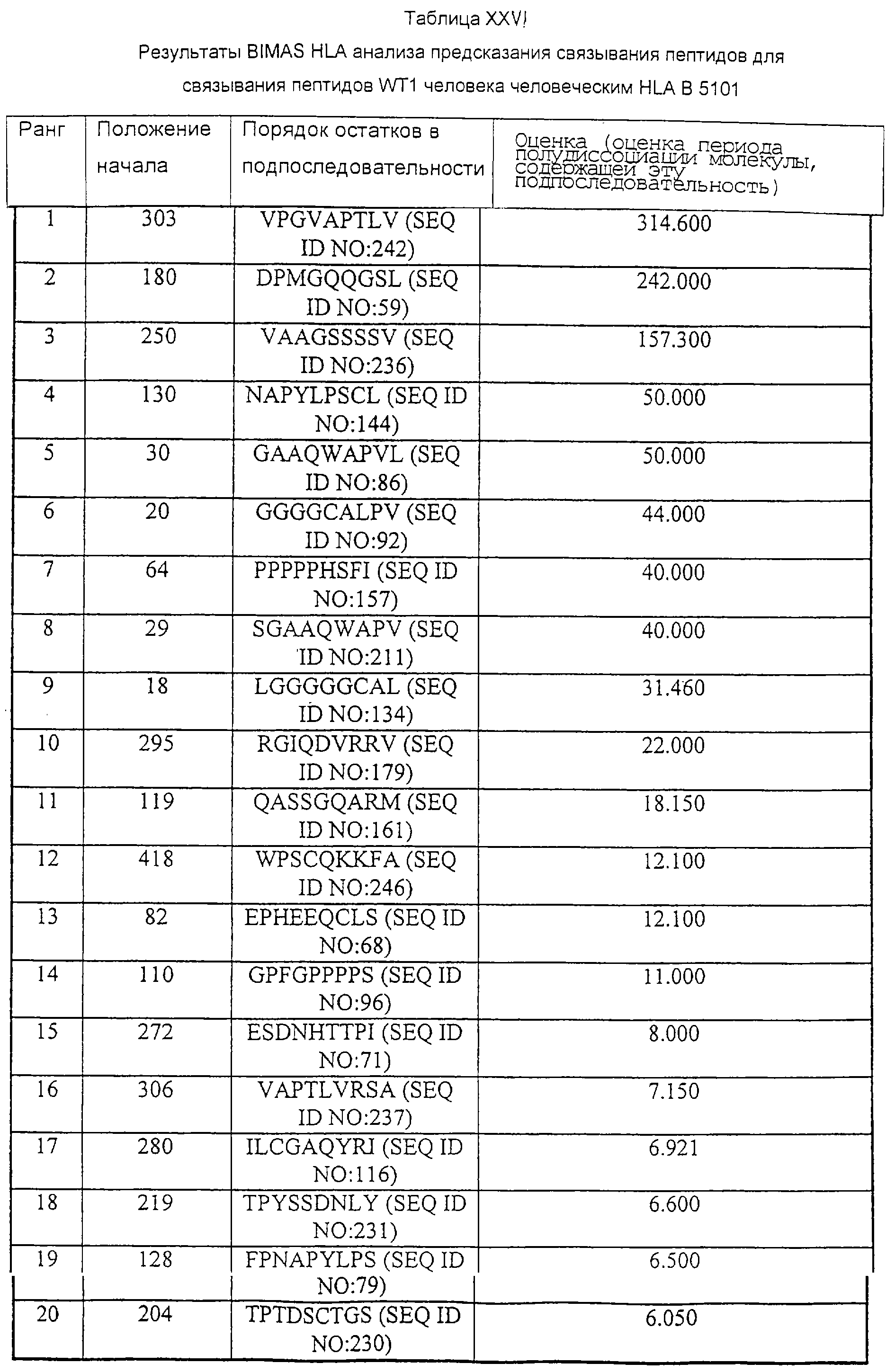










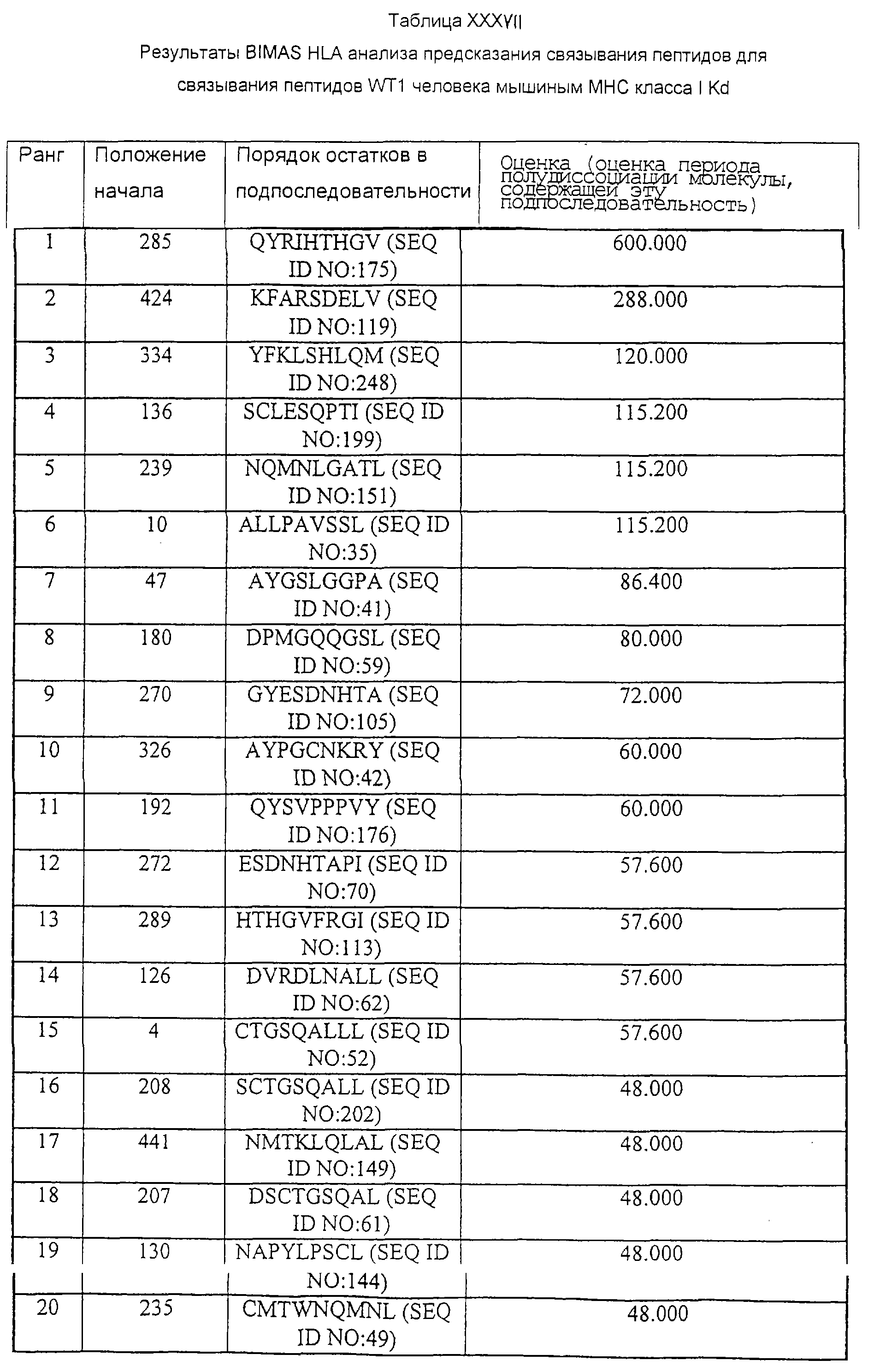








Для дальнейшего изучения были отобраны некоторые из пептидов CTL (показанные в таблице XLVI). Для каждого из пептидов в таблице XLVI представлены оценки, полученные с помощью BIMAS HLA анализа предсказания связывания пептидов.

Связывание пептидов МНС мышей С57В1/6 было подтверждено с помощью линии лейкозных клеток RMA-S, как описано Ljunggren et al., Nature 346:476-480, 1990. Вкратце, клетки RMA-S культивировали в течение 7 часов при 26°С в полной среде с добавкой 1% FCS (сыворотки плодов телят, СПТ). В каждую лунку 24-луночного планшета добавляли 106 клеток RMA-S и инкубировали в отсутствие или в присутствии выбранного пептида (25 мкг/мл) в течение 16 часов при 26°С и дополнительно 3 часа при 37°С в полной среде. Клетки затем промывали трижды и окрашивали конъюгированным с флуоресцеинизотиоцианатом анти-Db или анти-Kb антителом (PharMingen, San Diego, CA). Меченые клетки дважды промывали, ресуспендировали, фиксировали в 500 мкл PBS с 1% параформальдегида и анализировали на интенсивность флуоресценции в проточном цитометре (Becton-Dickinson FACSCalibur®). Процент повышения молекул Db или Kb на поверхности клеток RMA-S измеряли по увеличению средней интенсивности флуоресценции клеток, инкубированных с пептидом, по сравнению с таковой клеток, инкубированных только со средой.
Мышей иммунизировали пептидами, способными связываться МНС класса I мышей. После иммунизации клетки селезенки стимулировали in vitro и тестировали на способность лизировать мишени, инкубированные с пептидами WT1. CTL оценивали с помощью стандартного анализа выделения хрома (Chen et al., Cancer Res 54:1065-1070, 1994)· 106 Клеток-мишеней инкубировали при 37°С с 150 мкКи натрий51Сr в течение 90 минут в присутствии или в отсутствие специфических пептидов. Клетки трижды промывали и ресуспендировали в RPMI с 5% фетальной сыворотки телят. Для анализа 104 меченых51Сr клеток-мишеней инкубировали с различными концентрациями эффекторных клеток в конечном объеме 200 мкл в 96-луночных планшетах с U-образным дном. Супернатанты удаляли спустя 4-7 часов при 37°С и определяли процент специфического лизиса по формуле:
% специфического лизиса = 100 × (экспериментальное выделение спонтанное выделение)/(максимальное выделение - спонтанное выделение).
Результаты, представленные в таблице XLVII, показывают, что некоторые пептиды WT1 могут связываться молекулами МНС класса I, что важно для генерации CTL. Более того, некоторые из пептидов были способны индуцировать специфичные в отношении пептида CTL (Фигуры 9А и 9В), по данным, полученным с помощью анализа выделения хрома. После иммунизации против пептидов CTL р10-18 человека, р136-144 человека, р136-144 мыши и р235-243 были основаны специфичные в отношении пептидов линии CTL и созданы клоны. Эти результаты показывают, что специфичные в отношении пептида CTL могут вызывать гибель злокачественных клеток, экспрессирующих WT1.

Пример 5 Применение полипептида WT1 для индукции специфичных в отношении WT1 CTL у мышей
Этот пример иллюстрирует способность характерного полипептида WT1 вызывать иммунный ответ, обеспечивающий гибель WT1-позитивных линий опухолевых клеток.
Пептид р 117-139, содержащий мотивы, подходящие для связывания с МНС класса I и класса II, идентифицировали, как описано выше, с помощью TSITES и BIMAS анализа предсказания связывания пептидов HLA. Мышей иммунизировали, как описано в примере 3. После иммунизации клетки селезенки стимулировали in vitro и тестировали на способность лизировать мишени, инкубированные с пептидами WT1, а также WT1-позитивные и негативные опухолевые клетки. CTL оценивали с помощью стандартного анализа выделения хрома. Представленные на фигурах 10A-10D результаты показывают, что Р117 способен индуцировать специфичные в отношении WT1 CTL, способные вызывать гибель WT1-позитивных опухолевых клеток, в то время как гибели WT1-негативных клеток не наблюдалось. Эти результаты показывают, что CTL, специфичные в отношении пептидов, действительно вызывают гибель злокачественных клеток, экспрессирующих WT1, и что вакцина и Т-клеточная терапия эффективны в борьбе со злокачественными новообразованиями, экспрессирующими WT1.
Сходные иммунизации проводили с помощью 9-членных пептидов р136-144, р225-233, р235-243, связываемых МНС класса I, а также 23-членным пептидом р117-139. После иммунизации клетки селезенки стимулировали in vitro каждым из 4 пептидов и тестировали на способность лизировать мишени, инкубированные с пептидами WT1. Были генерированы CTL, специфичные в отношении р136-144, р235-243 и р117-139, но не р225-233. Данные по CTL для р235-243 и р117-139 представлены на фигурах 11А и 11В. Данные для пептидов р136-144 и р225-233 не показаны.
Для лизиса CTL требуется, чтобы пептиды WT1 подвергались эндогенному процессингу и представлялись в связи с молекулами МНС класса I опухолевых клеток. Указанные выше CTL, специфичные в отношении пептидов WT1, тестировали на способность лизировать WT1-позитивные линии опухолевых клеток по сравнению с негативными. CTL, специфичные в отношении р235-243 лизировали мишени, инкубированные с р235-243 пептидами, но не вызывали лизиса линий клеток, экспрессирующих белки WT1 (фигура 11А). Совершенно противоположным образом, специфичные в отношении р117-139 CTL лизировали мишени, инкубированные с р117-139 пептидами, и вызывали также лизис злокачественных клеток, экспрессирующих WT1 (фигура 11В). В качестве негативного контроля служат данные о том, что специфичные в отношении р117-139 CTL не лизировали WT1-негативные клетки EL-4 (обозначаемые здесь также как Е10).
Специфичность WT1-специфического лизиса была подтверждена торможением немечеными мишенями (фигуры 12А-12В). Эффекторные клетки рассаживали при различных соотношениях эффектор:мишень в 96-луночные планшеты с U-образным дном. Добавляли десятикратный избыток (по отношению к меченой мишени) указанной покрытой пептидом мишени без промечивания51Сr. Наконец, добавляли 104 меченых51Сr клеток мишеней на лунку, и планшеты инкубировали при 37°С в течение 4 часов. Общий объем на лунку составлял 200 мкл.
Лизис клеток TRAMP-C р117-139-специфичными CTL тормозился до от 58% до 36% клетками EL-4, инкубированными с соответствующим пептидом р117-139, но не клетками EL-4, инкубированными с посторонним пептидом (фигура 12А). Сходным образом, лизис клеток BLK-SV40 тормозился до от 18% до 0% клетками EL-4, инкубированными с соответствующим пептидом р117-139 (фигура 12В). Эти результаты подтверждают, что специфичные в отношении пептида WT1 CTL специфически вызывают гибель злокачественных клеток за счет узнавания прошедшего процессинг WT1.
В р117-139 содержится несколько сегментов с предполагаемыми мотивами CTL. Для определения точной последовательности эпитопа CTL были синтезированы все потенциальные 9-членные пептиды в пределах р117-139 (Таблица XLVIII). Было показано, что два из этих пептидов (р126-134 и р130-138) связываются с молекулами H-2b класса I (Таблица XLVIII). Индуцированные иммунизацией р117-139 CTL лизировали мишени, инкубированные с р126-134 и р130-138, но не с другими 9-членными пептидами в пределах р117-139 (фигура 13А).
Специфичную в отношении р117-139 линию CTL повторно стимулировали либо р126-134, либо р130-138. После повторной стимуляции р126-134 или р130-138 обе линии Т-клеток продемонстрировали специфичный в отношении пептида лизис, но лишь р130-138-специфичные CTL вызвали лизис WT1-позитивной линии опухолевых клеток (фигуры 13В и 13С). Таким образом, похоже, что р130-138 является эпитопом с природным процессингом.

Пример 6
Идентификация специфичной для WT1 мРНК в линиях опухолевых клеток мыши
Этот пример иллюстрирует применение ОТ-ПЦР для определения специфичной для WT1 мРНК в клетках и клеточных линиях.
Одноядерные клетки выделяли с помощью центрифугирования в градиенте плотности и немедленно замораживали и хранили при -80°С до анализа с помощью ОТ-ПЦР на наличие специфичной для WT1 мРНК. ОТ-ПЦР обычно проводили как описано Fraizer et al., Blood 86:4704-4706, 1995. Суммарную РНК экстрагировали из 107 клеток в соответствии со стандартными процедурами. Осадки РНК ресуспендировали в 25 мкл обработанной диэтилпирокарбонатом воды и непосредственно использовали для обратной транскрипции. Область цинковых пальцев (экзоны с 7 по 10) амплифицировали с помощью ПЦР с получением кДНК мыши размером 330 п.о. Амплификацию проводили в аппарате с циклически изменяемой температурой с использованием одного или, при необходимости, двух циклов ПЦР. Применяли AmpliTaq ДНК-полимеразу (Perkin Elmer Cetus, Norwalk, CT), 2,5 мМ MgCl2 и 20 пмоль каждого из праймеров при суммарном объеме реакционной смеси 50 мкл. Двадцать мкл продуктов ПЦР подвергали электрофорезу в 2% агарозных гелях и окрашивали бромистым этидидием. Гели фотографировали на пленке Polaroid (Polaroid 667, Polaroid Ltd., Hertfordshire, Англия). В соответствии с рекомендациями Kwok and Higuchi, Nature 339:237-238, 1989, были предприняты предосторожности от перекрестного загрязнения. Отрицательные контроли в каждом эксперименте включали смеси реагентов кДНК и ПЦР с водой вместо кДНК. Для исключения ложных негативных результатов наличие интактной РНК и образование соответствующей кДНК оценивали в каждом образце с помощью контрольной ПЦР с применением праймеров β -актина. Образцы, в которых не наблюдалась амплификация с этими праймерами, исключали из анализа.
Праймерами для амплификации WT1 в линиях клеток мыши служили: Р115: 1458-1478: 5’ CCC AGG CTG CAA TAA GAG ATA 3’ (прямой праймер; SEQ ID NO:21); и Р116: 1767-1787: 5’ ATG TTG TGA TGG CGG ACC AAT 3’ (обратный праймер; SEQ ID NO:22) (смотри Inoue et al., Blood 88:2267-2278, 1996; Fraizer et al., Blood 86:4704-4706, 1995).
Праймерами бета-актина, применявшегося в контрольных реакциях, служили: 5’ GTG GGG CGC CCC AGG САС СА 3’ (смысловой праймер; SEQ ID NO:23); и 5’ GTC CTT AAT GTC ACG CAC GAT TTC 3’ (антисмысловой праймер; SEQ ID NO:24)
Праймеры, применяемые для амплификации WT1 человека включают: Р117: 954-974: 5’ GGC ATC TGA GAC CAG TGA GAA 3’ (SEQ ID NO:25); и Р118: 1434-1414: 5’ GAG AGT CAG ACT TGA AAG CAGT 3’ (SEQ ID NO:5). Для групповой ОТ-ПЦР праймерами могут служить: Р119: 1023-1043: 5’ GCT GTC CCA CTT АСА GAT GCA 3’ (SEQ ID NO:26); и Р120: 1345-1365: 5’ TCA AAG CGC CAG CTG GAG TTT 3’ (SEQ ID NO:27).
В таблице XLVIII представлены результаты анализа WT1 в линиях опухолевых клеток с помощью ПЦР. В таблице IV (+++) обозначает сильно амплифицированный продукт WT1 ПЦР на первой стадии ОТ ПЦР, (++) обозначает продукт амплифицикации WT1, определяемый на первой стадии ОТ ПЦР WT1, (+) обозначает продукт, определяемый только на второй стадии ОТ ПЦР WT1, а (-) означает негативную ПЦР WT1.

На основании приведенного выше должно быть ясно, что хотя для целей иллюстрации здесь были описаны конкретные осуществления изобретения, могут вноситься различные модификации без отступления от духа и объема изобретения. Соответственно, изобретение ограничивается лишь прилагаемой формулой изобретения.


















































Реферат
Описан полипептид, представляющий собой последовательность, раскрытую в описании, выбранную из SEQ ID No.: 15-20, 28-312, 315 и 316, содержащий иммуногенную часть природного WT1, определяемого последовательностью SEQ ID No.: 319, или его вариант, в котором от 1 до 3 аминокислотных остатков иммуногенной части заменены так, что способность варианта взаимодействовать с WT1-специфичными антисыворотками и/или Т-клеточными линиями или клонами существенно не снижается, причем полипептид содержит последовательность не более чем 16 следующих друг за другом аминокислотных остатков, присутствующих в природном полипептиде WT1. Соединения по изобретению усиливают или индуцируют иммунный ответ на WT1 и могут использоваться для лечения лейкоза и рака. 7 з.п. ф-лы, 28 ил., 49 табл.

Комментарии