Саморегулируемый апоптоз воспалительных клеток с помощью генной терапии - RU2198683C2
Код документа: RU2198683C2
Чертежи


























Описание
Изобретение касается лечебного индуцирования апоптоза в воспалительных клетках путем введения в эти клетки гена, который индуцирует в этих клетках апоптоз (запрограмированное отмирание клетки или ненекротическое отмирание клетки). Ген, индуцирующий апоптоз (который иногда здесь будет обозначаться как AIG), регулируется промотором TNFα (TNFp) или другим индуцибельным геном, активизирующимся при воспалении.
В одном из воплощений изобретения апоптоз селективно индуцируется в тех клетках, которые способны продуцировать TNFα. TNFp-AIG или другой химерный ген можно обычным путем вводить in vitro, используя традиционные терапевтические методы. Преимущественно в том варианте, когда химерным геном является TNFp-AIG, он экспрессируется только в тех клетках, которые продуцируют воспалительный цитокин TNFα. Кроме того, поскольку химерный ген TNFp-AIG содержит элементы промотора TNFα, он также удаляет индуцибельные TNFp-селективные факторы транскрипции. Такое удаление приводит к уменьшению эндогенного продуцирования TNFα. Настоящее изобретение касается, в частности, конструкций TNFp-AIG или подобных генных конструкций, клеток, содержащих химерные гены, способов индуцирования апоптоза в клетках, трансфицированных химерными генами, фармацевтических композиций, содержащих химерные гены, способов отбора in vitro соматических клеток, не продуцирующих TNFα, среди популяции клеток, продуцирующих TNFα, или тому подобных клеток, способа идентификации доминант-негативных/доминант-супрессивных генов, ответственных за ингибирование продуцирования TNFα, и терапевтических способов, использующих химерные гены.
Во многих воспалительных процессах происходит избыточное продуцирование цитокинов, таких как IL-1, IL-10, GM-CMF и TNFα как результат массового агрегирования и аккумуляции воспалительных клеток (см. статью Brennan F.M. и др. в журнале British Medical Bulletin, 1995, 51/2, с.368-384). Повышающая регуляция и снижающая регуляция цитокинов в воспаленной ткани могут быть прямо или косвенно ответственны за обострение хронических воспалительных заболеваний. Например, наиболее заметно патология при ревматоидном артрите (RA) выражена в локальной области воспаления (т.е. в синовиальных точках). Поэтому является вероятным, что цитокины, продуцируемые в синовиальных точках у пациента, страдающего RA, играют важную роль в процессе болезни. Представляется, что среди этих цитокинов за разложение хрящей и эрозию костей, которые характерны для RA, ответственны IL-1 и TNFα (см. статью Dayer J.M. и др. в журнале J.Exp.Med., 1985, 162, с.1208-1215; статью Gowen M. и др. в журнале Nature, 1983, 306, с.378-380). Наличие избыточных количеств TNFα и IL-1 в синовиальных точках, как было показано на грызунах, ускоряет развитие коллаген-индуцированного артрита (см. статью Brennan F.M. и др. в журнале Clin.Expt.Immunol., 1994, 97/1, с.1-3). Избыточные количества TNFα и IL-1 продуцировались в синовиальной ткани с помощью множества типов клеток в местах соединения хрящ-паннус, включая клетки, происходящие от макрофагов, макрофаг-подобные синовиоциты, активированные Т-клетки и, возможно, фибробласт-подобные синовиоциты (см. статью Chu C.Q. и др. в журнале Arthritis & Rheumatism, 1991, 34, с.1125-1132; статью Deletfran B.W. и др. в журнале Arthritis & Rheumatism, 1992, 35, с.1170-1178).
В дополнение к вышеописанным воспалительным эффектам TNFα играет всеобъемлющую и ключевую роль во многих провоспалительных явлениях, таких как индуцирование активности IL-1 в моноцитах. Действительно, было показано, что анти-TNFα нейтрализующие антитела уменьшают продуцирование IL-1 в целом (см. статью Portillo и др. в журнале Immunol. , 1989, 66, с.170-175; статью Brennan F. M. и др. в журнале British Medical Bulletin, 1995, 51/2, с.368-384). Таким образом, дополнительной пользой от блокирования действия воспалительного цитокина TNFα является уменьшение продуцирования в равной степени разрушительного провоспалительного медиатора IL-1. Более того, хорошо известно, что TNFα является транскрипционным активатором других генов, имеющих отношение к развитию воспаления. Например, присутствие TNFα стимулирует продуцирование других цитокинов (таких как GM-CSF) и рецепторов клеточной поверхности, включая антигены HLA класса II и молекулы адгезии (см. статью Alvaro-Garcia J.M. и др. в журнале J.Exp.Med., 1989, 146, с.865-875), что приводит к непрерывному привлечению активированных Т-клеток и нейтрофилов и, в результате, к синовиальному воспалению и гиперплазии, а в конечном итоге к возрастающему разрушению хрящей и костей (см. статью Alien и др. в журнале J.Exp.Med., 1990, 171, с.231).
Обычное терапевтическое лечение воспалительных заболеваний, как правило, направлено против симптоматичного воспаления. Такие способы лечения дают только временное облегчение без заметного торможения развития болезни. В противоположность этому терапия направленная против таких мишеней, как TNFα и других факторов, индуцируемых в воспалительном процессе, явно являются более предпочтительными. Например, у образцов животных с коллагениндуцируемым артритом антитела к TNFα и растворимая химерная конструкция "рецептор TNFα-IgG" эффективно снижают опухание лап, суставные поражения и разрушение хрящей и костей (см. статью Williams R.O. в журнале Proc.Natl.Acad.Sci., 1992, 89, с.9784-9788). Пробы от человека, применяющего как гуманизированные антитела к TNFα, так и химерные молекулы "рецептор TNFα-IgG", дают удивительные результаты (см. статью Elliott M.J. и др. в журнале Arthritis & Rheumatism, 1993, 36, с.1681-1690; статью Elliott M.J. и др. в журнале Lancet, 343, с.1105-1110). Хотя лечение с применением таких антагонистов TNFα оказалось очень легко переносимым, оно также приводит к продуцированию антител к рекомбинантным белкам. Таким образом, эти терапевтические способы могут не подходить для долговременного лечения и могут не дать подлинного ослабления заболевания. Для того чтобы действенно смягчить развитие болезни, TNFα нужно избирать мишенью непрерывно, применяя терапию, специфическую для TNFα. Такой терапевтический протокол для этих биологических агентов невыполним и сопряжен с трудностями при введении их в течение долгого времени.
В качестве альтернативного метода можно удалить воспаленный синовиум хирургически (см. статью Herold H.A. в журнале Acta Orthop.Scand., 1995, 66, с.252-254; статью Ogilivie-Harris D.J. и Weisleder L. в журнале Arthroscopy, 1995, 11, с.91-95), химическим путем (см. статью Cruz-Esteban С. и Wilke W. S. в журнале Bailliere's Clinical Rheumatol., 1995, c.787-801) или синовэктомией под воздействием радиации (см. статью Cruz-Esteban С. и Wilke W.S. в журнале Bailliere's Clinical Rheumatol.1995, c.787-801). Результаты артроскопической хирургической синовэктомии хорошие и демонстрируют улучшение, если сравнивать предоперационное и послеоперационное состояние. Нехирургическая синовэктомия осуществляется с применением различных химических агентов, таких как осмиевая кислота, алкилирующие агенты, например, азотистый иприт и тиотепа, метотрексат. К сожалению, нехирургическая синовэктомия (включая химическую и радиационную) представляет собой сложную процедуру, дает только кратковременное облегчение и обнаруживает лишь переменное уменьшение синовиальной гиперплазии. Более того, большинство нехирургических альтернативных методов являются потенциально тератогенными. Кроме того, химическое воздействие на больную ткань при нехирургической синовэктомии часто само по себе вызывает воспалительную ответную реакцию. Наконец, следует отметить, что такие воздействия являются рискованными и чреваты побочными эффектами, связанными с обычным лекарственным лечением и травмирующими хирургическими процедурами, включая стоимость и неудобства госпитализации и реабилитации.
Следовательно, существует нужда в эффективном терапевтическом способе лечения воспалительных заболеваний вообще и RA, в частности.
Изобретение позволяет устранить недостатки ранее известных способов лечения воспалительных заболеваний путем применения нового терапевтического подхода. В соответствии с одним воплощением изобретения, в клетках воспаления, продуцирующих TNFα, селективно индуцируется апоптоз, вызывая деструкцию этих клеток, без сопутствующей воспалительной ответной реакции.
Одним объектом
настоящего изобретения является создание терапевтического способа, предусматривающего стадию введения в клетки воспаления млекопитающих или клетки в области воспаления химерного гена, содержащего
саморегулируемый ген, индуцирующий апоптоз (AIG). AIG регулируется промотором, таким как промотор TNFα (TNFp, см. фиг.1 и 2), и, предпочтительно, энхансером промотора. Таким образом, он
экспрессируется вообще и только в тех клетках, которые могут продуцировать TNFα.
Другим объектом настоящего изобретения является создание TNFp-AIG и подобных ему химерных генных
конструкций, способы их изготовления, способы их применения и препараты, содержащие их.
Еще одним объектом настоящего изобретения является создание способа индуцирования апоптоза в клетках, трансфицированных химерным геном TNFp-AIG, способ отбора в популяции in vitro вариантов соматических клеток, не продуцирующих TNFα, способ распознавания доминант/негативных генов, ответственных за генезис популяции, не продуцирующей TNFα, и способ распознавания продуктов, ответственных за регулирование продуцирования TNFα (фиг.10).
Эти и другие объекты будут легко поняты обычными специалистами в данной области знаний на основании следующего детального описания изобретения.
Фиг. 1 схематично представляет химерные гены TNFp-AIG данного изобретения. Ген, индуцирующий апоптоз (AIG), может быть любым из списка, в частности, каспазы с 1 по 10, Гранзим В, Fas-лиганд и так далее, но не ограничиваясь этим перечнем.
Фиг.2 схематически показывает результаты генной терапии с использованием химерных генов TNFp-AIG по настоящему изобретению.
Фиг.3 представляет совокупность делеционных конструкций, применяемых для распознавания индуцибельных cis-элементов промотора TNFα, использующего экспрессию гена люциферазы (Luc) как репортерной системы.
Фиг. 4 (а и b) представляет совокупность результатов, полученных с использованием конструкций, раскрытых на фиг.3. Временная экспрессия конструкций оценивалась в двух различных TNFα-продуцирующих клеточных линиях, в частности, Jurkat (фиг.4а) или ТНР-1 (фиг.4b). Гистограммы на каждой Фигуре показывают индекс стимулирования как результат измерения индуцибельности с помощью активирующих агентов, таких как РМА (фиг.4а) или LPS (фиг.4b), в индивидуальных экспериментах. Наложенная линия на каждой фигуре отображает среднюю индуцибельность, выведенную из 4-6 экспериментов.
Фиг.5 показывает схему получения TNFp-AIG с применением отобранных нативных элементов промотора TNFα и продомен-делетированных AIG (использованными AIG являются каспаза и каспаза 4/5).
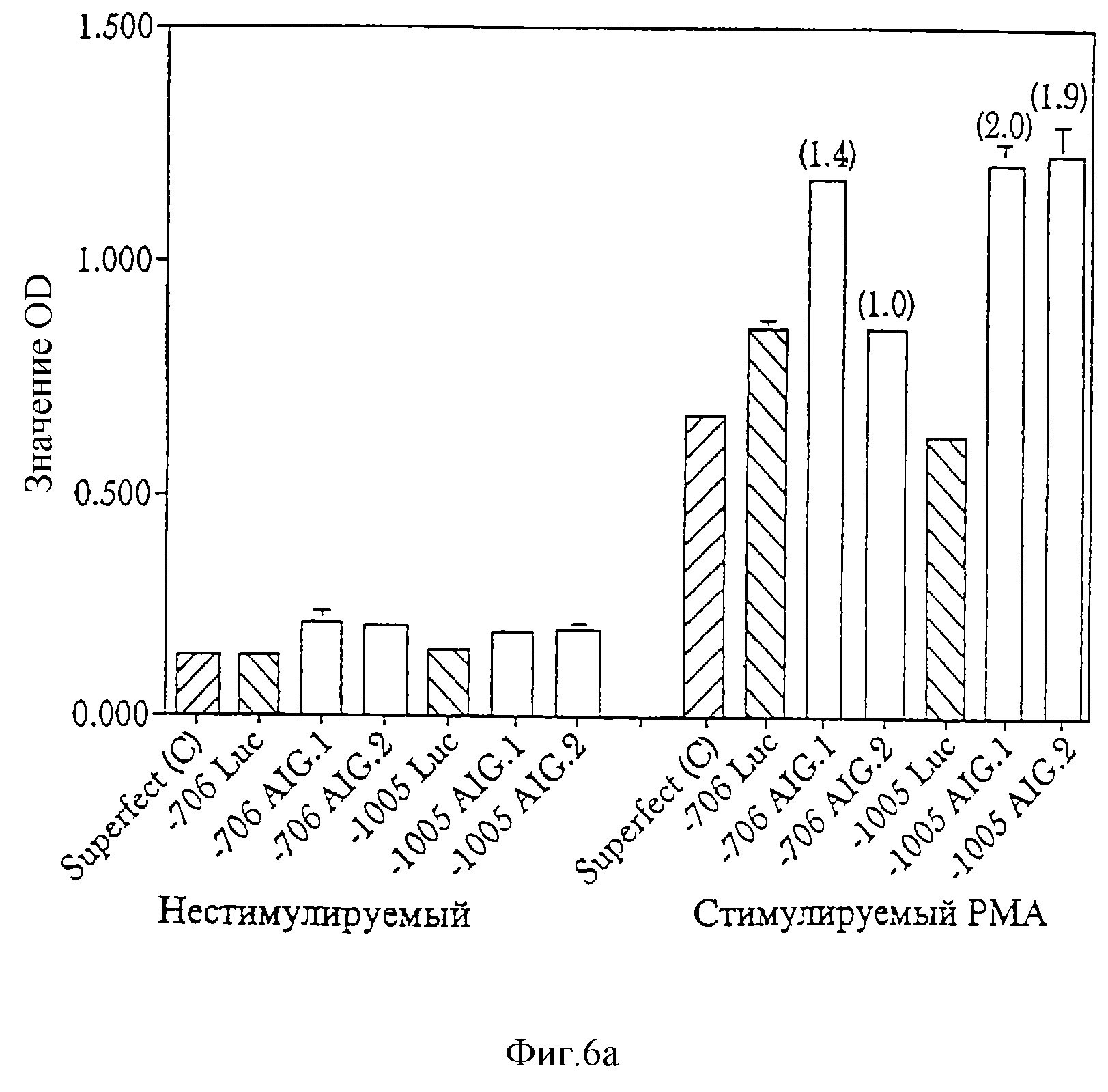
Фиг. 6 (а, b, с) представляет совокупность результатов репрезентативных экспериментов, выполненных с целью наблюдения экспрессии химерных конструкций TNFp-AIG. Апоптоз в транзиентно-трансфицированных клетках Jurkat (фиг.6а и фиг.6b) и клетках ТНР-1 (фиг.6с) наблюдали с использованием твердофазного иммуноферментного анализа гибели клеток (Cell Death Elisa, метод CDE). На всех трех фигурах гистограммы, заштрихованные слева направо вниз, представляют контроль трансфекции, где клетки обработаны трансфицирующим агентом без ДНК. Гистограммы, заштрихованные слева направо вверх, представляют экспрессию гена люциферазы, регулируемую элементами TNFp, а сплошные гистограммы представляют экспрессию или AIG. 1, или AIG.2, регулируемую такими же элементами TNFp. Цифры в скобках над сплошными гистограммами представляют фактор обогащения (отношение апоптоза, индуцируемого TNFp-AIG, к контрольному вектору TNFpLuc).
На Фиг. 7 (а и b) показано схематическое изображение конструкции химерного гена TNFp-AIG, содержащего множественные копии индуцибельных cis-элементов промотора TNFα, который, в свою очередь, регулирует экспрессию AIG (фиг. 7а). Схематическое изображение конструкции химерного гена TNFp-AIG, содержащего множественные копии индуцибельных cis-элементов промотора TNFα, регулирующих экспрессию AIG, за которыми находится 3'-нетранслируемый участок гена TNFα (TNF3'UTR) (фиг.7b). 3'UTR гена TNFα вовлечен в регуляцию индуцируемой экспрессии TNFα (см. статью Han, J., и др. в журнале Immunology, 1991, 146, с.1843-1848, и статью Crawford, E.K. и др. в журнале J.Biol.Chem. , 1997, 272, стр. 21120-21137, и фиг.9).
На фиг. 8 (а и b) представлены схемы получения химерных конструктов TNFα-суперпромотор AIG.
Фиг. 9 показывает суммарные результаты двух экспериментов, отражающих регуляторное влияние TNF3'UTR на индуцибельную экспрессию гена-репортера люциферазы. Транзиентная трансфекция выполнялась в линии клеток фибробластов. Точечные гистограммы отражают индуцибельность TNF3'UTR в отсутствие TNFpLuc, а сплошные гистограммы представляют индyцибeльнocть TNF3'UTR в присутствии TNFpLuc. Подобные же результаты получены в клетках Jurkat.
На фиг.10 показано схематическое изображение отбора вариантов соматических клеток, не продуцирующих TNFα, среди
популяции клеток, продуцирующих TNFα, и распознавания доминант-негативных супрессивных генов, ответственных за ингибирование продуцирования TNFα.
Настоящее изобретение основано
на очевидности того факта, что при некоторых воспалительных заболеваниях с терапевтической точки зрения является полезным апоптоз в воспалительных клетках. Изобретение, в частности, касается
саморегулируемого апоптоза, обеспечиваемого с помощью генной терапии. В основном, при практическом воплощении изобретения, химерный ген, содержащий по меньшей мере один энхансер промотора, присоединен
по меньшей мере к одной функциональной копии минимального промотора, причем промотор, являющийся геном или комбинацией генов, активированных в воспалительных клетках или в клетках в области воспаления,
присоединен, по меньшей мере, к одной копии гена, индуцирующего апоптоз (AIG), так, что экспрессия гена, индуцирующего апоптоз, регулируется промотором, и, таким образом, воспалительные клетки
становятся мишенью. Примерами промоторов индуцибельных генов, активируемых при воспалении (но не ограничиваясь этим), служат цитокины, интерлейкины и их рецепторы, молекулы клеточной адгезии и их
лиганды, хемокины и их рецепторы, провоспалительные ферменты и тому подобные. Химерные гены согласно данному изобретению включают энхансер, промотор и АIG-элементы в прямом, дистальном или
проксимальном соединении или их комбинации. Как упомянуто выше и будет подробно обсуждено далее, для максимальной эффективности в некоторых воплощениях изобретения используются множественные копии
энхансера, промотора и AIG.
Для более полного понимания раскрываемого здесь изобретения следует детальное описание с акцентом на химерные гены, содержащие по меньшей мере один энхансер промотора TNFα, присоединенный по меньшей мере к одной функциональной копии минимального промотора TNFα, а также присоединенный по меньшей мере к одной копии AIG, но только с целью иллюстрации. Хотя в нижеследующих примерах также использованы такие типы конструкций, специалисты в данной области знаний поймут, что описанные здесь основные конструкции могут быть изменены в других воплощениях изобретения, что для нацеливания на клетки в инфицированной области, кроме перечисленных выше, можно применить продукты, способы, методы и составы согласно изобретению с другими промоторами, содержащими активирующиеся при воспалении индуцибельные гены, которые обнаруживают такие же свойства.
Например, цитокины и интерлейкины, используемые в качестве промоторов в конструкции химерных генов согласно изобретению, включают (но не ограничиваются этим): TNFα, TNFβ, IL-1α, IL-lβ, IL-2, IL-6, IL-9, GM-CMF, интерферон γ, их функциональные фрагменты и варианты и смеси. Молекулы клеточной адгезии включают (но не ограничиваются этим) селектины, интегрины и члены суперсемейства иммуноглобулинов, такие как ICAM-1, V-CAM и тому подобные, их функциональные фрагменты и варианты и смеси. Хемокины и их рецепторы включают (но не ограничиваются этим) членов семейства С-Х-С и С-С, таких как MIP-lα, MIP-lβ, MCP1-4, RANTES, Mig, NAP2, IP10, Groα-γ и тому подобные, их функциональные фрагменты и варианты и смеси. К провоспалительным ферментам относятся (но не ограничиваются этим) COX-2, 1NOS, фосфолипазы, протеазы (включая матричные металлопротеазы), их функциональные фрагменты и их смеси.
Для ясности понимания химерных генов TNFp-AIG настоящего изобретения показаны
следующие последовательности:
SEQ ID No:l, представляет собой нуклеотидную последовательность, соответствующую полноразмерной последовательности промотора TNFα человека, как
опубликовано в статье Takashiba S. и др. в журнале Gene, 1993, 131, с.307-308). Номера нуклеотидов, используемые здесь, соответствуют нумерации этой последовательности.
SEQ ID No: 2 представляет собой нативную последовательность промотора TNFα гена, который используется в настоящем изобретении (-1077 нуклеотидов от участка начала транскрипции, TSS). Имеются некоторые различия в последовательности TNFp у SEQ ID No:l и SEQ ID No:2. Такие различия в нуклеотидных последовательностях SEQ ID No:l и SEQ ID No:2 описаны (см. статью Takashiba S. и др. в журнале Gene, 1993, 131, с.307-308).
SEQ ID No:3 представляет собой нативную минимальную промоторную последовательность TNFα (нуклеотид -120 через -TSS, который включает по меньшей мере один энхансерный элемент (сайт k1; см. статью Pauli, U., Crit.Rev. in Eucaryotic Gene Expression, 1994, 4, с.323-344; статью Rhades K.L. в журнале J.Biol.Chem., 1992, 267, с.22102-22107; и статью Takashiba S. и др. в журнале Gene, 1993, 131, с.307-308).
SEQ ID No:4 представляет собой химерный ген TNFp 120 AIG.1 (содержащий - 120 TNFp, регулирующий экспрессию продомен-делецированного варианта гена СРР 32 (каспаза 3, описанная в статье Tewari М. и др. в журнале Се11. 1995, 81(5), с.801-809, с вариацией, представляющей собой V239A).
SEQ ID No:5 представляет собой химерный ген TNFp706 AIG.1 (содержащий - 706 TNFp, регулирующий экспрессию продомен-делецированного гена СРР 32).
SEQ ID No:6 представляет собой химерный ген TNFpl005 AIG.1 (содержащий - 1005 TNFp, регулирующий экспрессию продомен-делецированного гена СРР-32).
SEQ ID No:7 представляет собой химерный ген TNFp120 AIG.2 (содержащий - 120 TNFp, регулирующий экспрессию продомен-делецированного гена Ту/х). (Последовательности генов Ту (каспаза 5) и Тх (каспаза 4) раскрыты в публикациях Faucheu, С. и др. в журнале Eur.J.Biochem.,136, с. 207-213,1996; Faucheu, С. и др. EMBO J., 14, c.1914-1922, 1995).
SEQ ID No:8 представляет собой химерный ген TNFp706 AIG.2 (содержащий - 706 TNFp, регулирующий экспрессию продомен-делецированного гена Ту/х).
SEQ ID No:9 представляет собой химерный ген TNFpl005 AIG.2 (содержащий - 1005 TNFp, регулирующий экспрессию продомен-делецированного гена Ту/х).
SEQ ID No: 10 представляет собой энхансерный участок 1 (ER1) промотора TNFα, охватывающий нуклеотиды от -1005 до -905.
SEQ ID No: 11 представляет собой энхансерный участок 2 (ER2) промотора TNFα, охватывающий нуклеотиды от -706 до -517.
SEQ ID No: 12 представляет собой дополнительные сайты множественного клонирования(MCS), встроенные с помощью методов генной инженерии выше минимального промотора TNFα-120 в конструкцию -120pGL3.
SEQ ID No:13 представляет собой 3' нетранслируемый участок (3'UTR) гена TNFα (см. статью Nedwin. G.T. в журнале Nucleic Acid Research, 1985,13, с. 6361-6373).
Элементы промотора TNFα для получения конструкций химерных генов согласно настоящему изобретению выбирают из элементов, которые
способны индуцировать экспрессию терапевтически активного гена, регулируемого промотором TNFα. Эти промоторные элементы будут обозначены как "индуцибельные cis-элементы", "cis-индуцибельные
элементы" или " энхансерные элементы" промотора TNFα.
Энхансерные элементы могут быть физически связаны с минимальной промоторной последовательностью промотора линкерной
последовательностью, имеющей или не имеющей уникальные сайты рестрикции. Таким образом, суммируя вышесказанное, энхансерные элементы могут быть присоединены к химерным генам согласно данному
изобретению путем непосредственного присоединения, или дистального присоединения, или проксимального присоединения или любой их комбинации. Обычно они встроены выше промотора. Энхансерные элементы
TNFα расположены в последовательностях SEQ ID No:10 и SEQ ID No:11; могут быть также использованы их функциональные фрагменты или их варианты и их комбинации. Некоторые предпочтительные генные
конструкции в соответствии с настоящим изобретением включают такие, которые имеют множественные копии энхансерные элементы, то есть по меньшей мере 2 копии. В отдельных воплощениях изобретения имеется
от 2 до 25, в частности от 2 до 10, а еще более узкий предел - от 2 до 5 копий.
Термины "промотор TNFα", "промотор TNFa" и "TNFp" используются здесь как равноценные. До тех пор, пока не будет отмечено что-либо иное, эти термины обозначают полноразмерную нуклеотидную последовательность, соответствующую нативной минимальной промоторной последовательности TNFα, присоединенной как минимум к одному из вышерасположенных энхансерных элементов (как имеющихся от природы, то есть нативных, так и полученных в лаборатории методами генной инженерии). Примеры включают, но не ограничиваются этим, последовательности SEQ ID No:l, SEQ ID No:2, SEQ ID No:3, их функциональные фрагменты, варианты и любые их смеси. Многие функциональные фрагменты и варианты этих и других последовательностей TNFα, описанных здесь, обнаруживают гомологию не менее 80%, а в некоторых случаях более 90%, с их нативными и полученными методами генной инженерией последовательностями, но они известны специалистам в данной области знаний и определены в цитируемых здесь ссылочных материалах.
Любой ген, индуцирующий апоптоз, может быть применен в описываемых здесь химерных генах и способах. Ген, индуцирующий апоптоз и применяемый в терапевтически активных химерных генах согласно данному изобретению, может быть такого же вида, как апоптозиндуцирующий ген в нативной последовательности клеток воспаления, продуцирующих TNFα (если эти клетки от природы содержат ген апоптоза), или отличаться от него. Предпочтительные AIG включают, но не ограничиваясь этим, семейство апоптозиндуцирующих протеаз ICE/CED3, (таких как ген каспазы-1 (ICE), hIСЕ, ICE-LAP45, Mch2α), ген каспазы-2 (ICH1), ген каспазы-3 (СРР32, Yama, Apopain), ген каспазы-4 (ТХ, ICH2, ICE rel II), ген каспазы-5 (ICE rel III, TY), ген каспазы-6 (Mch-2), ген каспазы-7 (Mch-3, ICE-LAP3, СМН-1), ген каспазы-8 (VFCH, FLICE, Mch-5), ген каспазы-9 (ICE-LAP6, Mch6) и ген каспазы-10 (Mch4), членов семейства грэнзимов (таких как Гранзим А и Гранзим В), Fas-лиганд (FasL), их функциональные фрагменты, варианты и любые их смеси. Некоторые воплощения изобретения предусматривают использование генов каспазы-3, каспазы-4, каспазы-5, Гранзима В, их функциональных фрагментов, вариантов и их смесей. Эти гены, за исключением FasL, когда происходит их сверхэкспрессия в результате трансфекции, индуцируют апоптоз в трансфицированных клетках (см. статью Miura М. и др. в журнале Cell. , 1993, 75, с.653-660; статью Chinnayan A.M. и др. в журнале Cell., 1995, 81, с. 505-512, статью Los. и др. в журнале Nature, 1995, 375, с.81, Muzio и др. в журнале Cell., 1996, 85, с.817-827).
В случае применения FasL апоптоз индуцируется (как с помощью аутокринного, так и с помощью паракринного эффекта) только в тех клетках, которые экспрессируют Fas. Поэтому конструкция химерного гена TNFp-FasL дает второй уровень селективности. Другим преимуществом химерного гена TNFp-FasL является селективное нацеливание в те вызывающие болезнь клетки синовиума, которые не экспрессируют TNFα (из-за чего утрачивается регулирование экспрессии гена, индуцирующего апоптоз), но экспрессируют Fas на поверхности. В этом случае FasL будут экспрессироваться клетками, способными продуцировать TNFα, такими как активированные макрофаги и Т-клетки. Эти клетки затем индуцируют апоптоз в клетках, экспрессирующих Fas, в частности, в опасно активированных клетках и экспрессирующих Fas синовиоцитах.
Изобретение предлагает новый терапевтический способ,
предусматривающий стадию введения в клетки млекопитающих химерного гена, содержащего ген, индуцирующий апоптоз (AIG), регулируемый промотором TNFα (TNFp). Примерами химерных генов являются те,
которые имеют последовательности SEQ ID NOs 4, 5, 6, 7, 8 и 9; можно использовать также их функциональные фрагменты или варианты. Не вдаваясь в теорию, в результате регулирования
посредством TNFp AIG экспрессируется только теми клетками, которые продуцируют воспалительный цитокин TNFα. Поэтому любые клетки, экспрессирующие TNFα, будут саморазрушаться, в то время
как клетки, не экспрессирующие TNFα, не будут затронуты. Выгодным является то, что этот метод делает мишенью любые клетки, продуцирующие TNFα (такие как активированные
макрофаги,
активированные Т-клетки и клетки, подобные макрофагам, а также синовиоциты, подобные фибробластам) без различия типа клеток. Действительно, продуцирующая TNFα клетка-мишень может быть лишь
такой, которая обычно несет, или не несет, или экспрессирует ген апоптоза в своей природной, не измененной форме. Поэтому, применяя химерные гены и способы по настоящему изобретению, можно с высокой
селективностью разрушать клеточные источники TNFα.
Другим преимуществом использования химерного гена TNFp-AIG по настоящему изобретению является то, что TNFp удаляет факторы
транскрипции, в которых нуждается эндогенный TNFp, что ведет к уменьшению продуцирования эндогенного TNFα. В одном из предпочтительных воплощений изобретения TNFp наличествует в клетках,
подвергшихся терапевтическому нацеливанию, в большом избытке. Это может быть достигнуто введением в клетку множественных копий трансфицированного гена. С другой стороны, химерный ген TNFp-AIG по
настоящему изобретению может содержать множественные копии индуцибельных cis-элементов промотора TNFα. Как упомянуто выше, эти множественные копии "индуцибельных энхансерных элементов" TNFp
присутствуют в некоторых вариантах конструкций химерного гена TNFp-AIG согласно настоящему изобретению. Включая множественные копии индуцибельных cis-элементов конструкции TNFp, факторы транскрипции,
в которых нуждаются трансфицированные клетки для продуцирования TNFα, удаляются экзогенно введенной последовательностью. Эта предпочтительная конструкция химерного гена TNFp-AIG характеризуется
повышенной эффективностью в отношении TNFp-специфичных факторов транскрипции по сравнению с химерными генами согласно данному изобретению, содержащими только один энхансерный элемент, связанный с
TNFp. "Индуцибельный
супер-промотор", сконструированный таким образом, способен: (1) быть более эффективным в отношении TNFp-специфичных факторов транскрипции и (2) регулировать экспрессию гена,
индуцирующего апоптоз, в сторону увеличения за счет множественных энхансерных элементов.
Например, известно, что для пациентов с ревматоидным артритом, клинически полезной является синовэктомия, т.е. удаление синовиальной ткани. В отличие от традиционных и хирургических методов лечения, описываемый здесь терапевтический способ избирает мишенями лишь клетки, продуцирующие TNFα. Таким образом, преимуществом введения и экспрессии химерного гена TNFp-AIG с последующим индуцированном апоптоза является то, что не индуцируется ответная воспалительная реакция. Соответственно, способы по настоящему изобретению сравнительно селективны и в результате минимально травмируют ткани и уменьшают воспаление.
Продукты и способы, описанные здесь, являются также полезными при лечении других воспалительных заболеваний. Такие воспалительные заболевания включают, но не ограничиваясь этим, множественный склероз, синдром Гийена-Барре, болезнь Крона, язвенный колит, псориаз, болезнь, вызванную реакцией организма-хозяина на пересаженную ткань, волчанку, инсулинзависимый сахарный диабет, псориазный артрит, саркоидоз, гиперсенситивный пневмонит, алкилозирующий спондилит и связанную с ним спондилартропатию, синдром Рейтера и системный склероз. Кроме того, настоящее изобретение распространяется на способы лечения воспалительных заболеваний у пациента путем индуцирования апоптоза в клетках воспаления или клетках в области воспаления путем введения в клетки пациента по меньшей мере одного химерного гена согласно данному изобретению. Обычно это достигается приготовлением фармацевтической композиции, содержащей по меньшей мере один химерный ген согласно данному изобретению и фармацевтически приемлемый носитель, и введения состава пациенту с помощью стандартных средств. В некоторых воплощениях изобретения лекарственный состав подается непосредственно в область воспаления с применением локальных топических, внутривенных, внутрибрюшинных и тому подобных методов. Ниже методология будет обсуждена дополнительно.
Кроме лечебных показаний, гены и клетки по настоящему изобретению можно применять в различных известных способах скрининга и селекции. В одном из таких способов можно отобрать в популяции т vitro варианты соматических клеток, не продуцирующих TNFα, путем введения химерного гена TNFp-AIG в популяцию клеток, продуцирующих TNFα. Клетки, продуцирующие TNFα, подвергаются апоптозу. Клетки, не продуцирующие TNFα, остаются живыми. Отбор вариантов клеток, обладающих фенотипом выживания, является легким способом распознавания клеток, не продуцирующих TNFα. Такой способ селекции можно применять для того, чтобы определять экспрессию генов, обеспечивающих транс-действие для регулирования активности промотора TNFα, посредством чего уменьшается продуцирование TNFα. Такие гены в других системах характеризуются как доминант-негативные (DN)/доминант-супрессивные гены (см. статьи Behrends и др. в журнале "J.Biol.Chem.", 1995, 270, с. 21109-2113; Zhang и др. в журнале "J. Biol. Chem.", c. 23934-23936; Watowich и др. в журнале "Mol. Cell.Biol", 1994, 14/6, с. 3535-3549).
Еще в одном способе in vitro химерный ген TNFp-AIG согласно данному изобретению можно применять для распознавания доминант-негативных генов, ответственных за генезис популяции клеток, не продуцирующих TNFα. В соответствии с этим способом химерный ген TNFp-AIG по настоящему изобретению вводят в клетки, продуцирующие TNFα. Эти клетки, за исключением тех, где присутствует доминант-негативный ген, подвергаются апоптозу при активации. Из этого можно заключить, что живые варианты обладают доминант-негативным геном, способным регулировать продуцирование TNFα в сторону уменьшения. Доминант-негативный ген можно легко распознать продуцированием библиотеки кДНК и трансфицированием клеточных линий (например, Jurkat и ТНР-1). Эти клетки являются стабильными трансфектантами индуцибельного химерного гена TNFp-AIG или TNFp-люциферазным геном. Клетки, трансфицированные конструкцией TNFp-AIG, могут быть отобраны по их фенотипу выживания, вслед за чем следует активирование in vitro; фенотип выживания является показателем эффекта DN-генов. В клетках, трансфицированных TNFp-люциферазным геном, показателем эффекта DN-генов будет снижение активности люциферазы. Доминант-негативные гены, распознанные с использованием этого протокола, сами по себе можно применять в дальнейшем в качестве терапевтически активных агентов. Такие гены являются кандидатами на применение в генной терапии, когда требуется уменьшить продуцирование TNFα.
Способы, используемые для передачи гена, образуют две
больших группы:
1. Прямая подача: введение гена с терапевтическим действием in situ в клетки-мишени, такие как синовиоциты, с использованием подходящего вектора в качестве носителя для гена.
Вектор, содержащий ген с терапевтическим эффектом, вводят непосредственно в пораженную болезнью область (например, артритный сустав).
2. Косвенная подача: трансфекция гена с терапевтическим действием ex-vivo в клетки-мишени, такие как синовиоциты. При такой подаче синовиум удаляют из сустава, синовиоциты изолируют и культивируют in vitro. Культивированные in vitro клетки трансфицируют геном с терапевтическим действием и генетически модифицированные синовиоциты трансплантируют обратно в синовиум.
С целью передачи in vivo несколько векторов оценивались по эффективности их при доставке гена (см. статью Nita и др. в журнале Arthritis & Rheumatism, 1996, 39/5, с. 820-828). Среди векторов, используемых в генной терапии, намного лучше всех разработаны векторы, полученные из ретровирусов. Они способны встроить генетический материал в геном хозяина и продуцировать стабильные трансфектанты. Однако эти векторы не могут инфицировать неделящиеся клетки и после того как они введены в геном-хозяин не исключена возможность мутагенеза в месте прикрепления. В сравнении с этим векторы, полученные из аденовирусов, поражают как делящиеся, так и неделящиеся клетки и вводят ДНК эписомальным образом. Недостатком векторов на основе аденовирусов является то, что эти векторы продолжают продуцировать вирусные белки в пораженных клетках, делая их потенциально антигенными. Третий тип векторов на вирусной основе получают из вирусов простого герпеса (HSV), которые также способны поражать как делящиеся, так и неделящиеся клетки.
Среди невирусных векторных систем оценивались катионные липосомы и депротеинизированная плазмидная ДНК. Липосомы находятся на наиболее прогрессивной стадии разработки, хотя определенные типы клеток, такие как клетки мышц и кожи, принимают, поддерживают и экспрессируют депротеинизированную плазмидную ДНК.
Также обладает таким свойством и является многообещающей система доставки гена, опосредуемая частицами (см. статью Rakhmilevich и др. в журнале PNAS, 1996, 93, c. 629l).
Для доставки химерных генов по настоящему изобретению можно использовать следующие
протоколы доставки in vivo:
(1) Nita и др., Arthritis & Rheumatism, 1996, 39, с. 820-823
эксперименты in vivo на кроликах:
Каждый вектор вводят внутрисуставно в
коленный сустав 1. В случае вирусных векторов вспрыскивают 0,5 мл равновесного солевого раствора, в котором суспендировано от 108 до 106 частиц, из расчета на колено.
Вспрыскивают также комплексы липосома-ДНК (200 нмолей DC-Chol в комплексе с 20 мкг ДНК/мл) в 1 мл равновесного солевого раствора из расчета на колено.
(2) Methods in Molecular Medicine: Gene Therapy Protocols, изд. Paul Robbins, 1997, Barr и др., с. 205-212.
Доставка с помощью вектора на основе аденовируса к гепатоцитам: гепатоциты крысы 1• l011 PFU на 100 г массы животного.
У собак (масса 12-17 кг) в воротную вену залили около 1,5•1011 PFU/кг, передав 1 копию генома аденовируса на диплоидную копию ДНК хозяина.
У кроликов (массой 2-4 кг. 1,5•1013 вирусных частиц (около 1,5•1011 PFU) дают 100% гепатоцитную трансдукцию; 4•1012 вирусных частиц дают 50-75% трансдукцию. Yang N-S, и др, с. 281-296.
Доставка гена, опосредуемая частицами золота: трансфекция кожной ткани млекопитающих - 0,1, 0,5, 1,0 и 2,5 мкг ДНК/мг частицы дает линейное соотношение с уровнями трансгенной экспрессии.
Nabel и др., с. 297-305
Доставка гена, опосредуемая липосомами, у человека:
Протокол
1: 15 нмолей липосом DC-Chol/Dope комбинировали с 1 мкг ДНК в 0,7 мл. 0,2 мл этой смеси вспрыскивали в меланомный узел пациента. При катетерной доставке в артерию вводили 0,6 мл.
Протокол 2:15 нмолей липосом DMRIE/Dope комбинировали с 5 мкг ДНК в 1,0 мл.
Для прямых инъекций внутрь опухоли, диапазон концентраций ДНК составлял от 3 мкг в комплексе с 4,5 нМ DMRIE/Dope до 300 мкг в комплексе с 450 нМ DMRIE/Dope.
(3) Roessler и др., с. 369-374
Передача гена к синовиуму:
Использовали диапазон доз 109-1012 аденовирусных частиц, содержащих ген с терапевтическим действием, на сустав. Однако оптимальную дозу для любых частных серий экспериментов нужно было определять эмпирически, и она зависела
как от свойств используемой рекомбинантной аденовирусной геномной основы, так и от экспрессируемого трансгена.
Для косвенной подачи уже созданы разнообразные методы, включая использование катионного липида, или трансфекцию на основе катионного полимера, или электропорацию.
Любая из приведенных выше технологий для того чтобы соответствовать конкретным требованиям, может быть изменена обычным специалистом в данной области. Такие модификации известны из уровня знаний, которыми обладают обычные специалисты, и не требуют оригинальных экспериментов. Эти традиционные варианты находятся в рамках данного изобретения.
Примеры
Для того чтобы изобретение было понято более полно, приводятся следующие примеры. Эти примеры
иллюстрируют некоторые предпочтительные воплощения настоящего изобретения, но ни в коем случае не должны быть истолкованы как ограничение рамок изобретения.
Пример 1
Получение
конструкций TNFp-AIG
Для того чтобы сконструировать химерный AIG, регулируемый энхансерными cis-элементами промотора TNF, в одной или множественных копиях одинакового или различных участков
проводят распознавание участков, которые представляют интерес как ответственные за оптимальную индуцибельную экспрессию.
Отбор промоторных элементов TNFα для конструирования химерного гена. Участки промотора TNFα амплифицируют путем полимеразной цепной реакции (PCR), используя праймеры, окружающие различные делеционные конструкции промотора TNFα, (фиг. 3). В качестве ссылки используются участки, идентифицированные другими исследователями в различных других клеточных системах (см. статьи: Rhoades и др. в журнале J.Biol.Chem., 1992, 267, с. 22102-22107; Leithman и др. в журнале Mol.Cell Biol., 1992, 12, с.1352-1356; Pauli U. в журнале Crit. Reviews Eucaryotic Gene Expression, 1994, 4, с. 323-344). PCR-амплифицированные гены затем клонировали выше репортерного гена, такого как ген люциферазы (Luc), в коммерчески доступный вектор, не содержащий промотора. Эти конструкции тестировали на их конститутивную и индуцибельную экспрессию в различных клеточных линиях, таких как Jurkat (Т-лимфобластоиды), U973 (миеломоноциты, ТНР-1 (моноциты), фибробласты и культивированные in vitro синовиоциты человека. Распознавание участков, ответственных за индуцибельную экспрессию репортерного гена, в первую очередь основано на результатах, полученных при использовании двух клеточных линий, продуцирующих TNFα, в частности клеток Jurkat (с последующей стимуляцией РМА) и ТНР-1 (с последующей стимуляцией LPS) (фиг.4, а и b). Эти клетки транзиентно трансфицировали, применяя хорошо известные методы и коммерчески доступные реагенты, например декстран DEAE и Superfect. Cis-элементы промотора TNFα, которые ответственны за индуцируемую экспрессию репортерного гена, затем использовали для конструирования химерных генов TNFp-AIG.
Конструирование химерных генов TNFp-AIG. Из описываемых здесь генов, индуцирующих апоптоз, предпочтительными являются следующие гены:
i) ген цистеиновой протеазы - СРР32 (также
известный как Yama, апопаин или каспаза 3) и
ii) ген цистеиновой протеазы - Тх/Ту (каспаза 4/каспаза 5).
AIG используются как "продомен-делецированные" усечения, чтобы потенциально увеличить автокатализ каспаз. Это существенно для перевода каспазы из неактивной в активную форму.
Продомен-делецированную СРР32 амплифицируют, применяя праймеры, соответствующие кодонам 29-36 и 271-278 (278 является стоп-кодоном). Усеченная форма СРР32 обозначена здесь как "αСРР32" или "AIG. 1".
Для PCR-амплификации с получением
продомен-делецированной Ту синтезировали праймеры, соответствующие этим последовательностям в Ту-гене. Все открытые каспазы гомологичны другим членам семейства каспаз. 3' праймер, соответствующий
кодонам 359-365 (кодон 365 является стоп-кодоном), обнаруживает 100% гомологии последовательности с кодонами 372-378 (кодон 378 является стоп-кодоном) в Тх-гене. Однако 5' праймер, соответствующий
кодонам 81-87 в Ту-гене не обнаруживает 100% гомологии с соответствующим участком Тх-гена (Тх-кодоны 94-100). Остаток 87 (аланин) в Ту-гене отличается от остатка 100 (глицин) в Тх-гене.
PCR-амплифицированный продукт, полученный на основе кДНК, выделенной из активированных лимфоцитов периферической крови человека, имеет последовательность Тх, вследствие очевидного избытка транскриптов
Тх. Поэтому усеченная форма AIG, полученная с применением синтетических олигонуклеотидных праймеров, соответствующих последовательностям в Ту, действительно совпадает с последовательностями в Тх, хотя
фланкирована Ту-последовательностями праймеров. Ту-последовательности используемых праймеров также совпадают с последовательностью Тх, за исключением одного кодона. Таким образом, используемый
согласно изобретению ген совпадает с Тх-геном. Этот ген здесь обозначен как "ΔТу/х" или "AIG.2"
AIG. 1 и AIG.2 встраивают ниже промотора TNFα путем замены репортерного гена
люциферазы в делеционных конструкциях (-120, -706 и -1005) промотора TNFα (фиг. 5). Эти конструкции тестировали на индуцирование апоптоза с последующей стимуляцией транзиентно-инфицированных
клеток Jurkat и клеток ТНР-1 (фиг.6, a, b и с).
Конструирование химерных генов суперпромотора TNFα-AIG. Два основных предпочтительных участка, в частности ER1(-1005 до -905) (SEQ ID No:10) и ER2(-706 до -517) (SEQ ID No:11), промотора TNFα, содержащие элементы, ответственные за индуцибельную экспрессию репортерного гена, описанного выше (фиг.4, а и b), PCR-амплифицировали и лигировали выше минимального нативного промотора (-120 через TSS, SEQ ID No:3) как единственную копию или как множественные копии. Еще два участка (-234 до -120) и (-234 до -65) промотора TNFα также идентифицировали как потенциально энхансерный участок 3 (ER3) и энхансерный участок 4 (ER4) соответственно, которые можно использовать в химерных конструкциях с применением технологий, описанных ниже. Суперпромотор содержит несколько (2-10) кассет вышеупомянутых участков, в которых имеются индуцибельные элементы промотора (фиг.7). Это достигается путем PCR-амплификации интересующих участков с использованием праймеров, синтезированных с сайтами рестрикции, встроенными в 5'-конец каждого из праймеров. Эти уникальные сайты рестрикции фланкируют представляющий интерес амплифицированный генный продукт. Предпочтительно клонировать PCR-амплифицированный AIG ниже суперпромотора TNF, заменившего репортерный ген люциферазы в исходной конструции, как это описано для нативного промотора TNFα (фиг.5).
Ниже приведены на фиг.8 схемы конструирования суперпромотора TNFα и линкерных последовательностей, имеющих уникальные сайты рестрикции (такие сайты рестрикции отсутствуют в отобранных элементах промотора TNFα и AIG, о которых идет речь) для эффективного направленного встраивания.
Схема 1
СТАДИЯ 1.
Встраивание минимального промотора TNFα (-120 до TSS) в основной (не содержащий промотора) вектор люциферазы pGL3 (Promega):
Элементы основных векторов pGL3, которые используют для
конструирования химерного гена TNFp-AIG, показаны ниже.
_KpnI.SacI.MluI.SmaI.XhoI.BglII.HindIII.[люцифераза].XbaI_
Минимальный промотор PCR-амплифицируют, используя праймеры,
содержащие сайты XhoI. BglII. HindIII, так, что Xhol. находится на 5'-конце, а сайты BglII. HindIII - на 3'-конце амплифицированного продукта. Этот фрагмент встраивают в полилинкер основного вектора
pGL3, применяя такие же сайты рестрикции. Эта конструкция обозначена как "Конструкция А1" и выглядит следующим образом:
_ KpnI.SacI.MluI.NheI.SmaI.XhoI.(-120 дo TSSBglII). HindIII._
[люцифepaзa]. XbaI
СТАДИЯ 2. Фрагмент энхансера (ER1 или ER2) PCR-амплифицируют, используя праймер, содержащий несколько сайтов рестрикции. Полученный фрагмент будет иметь сайты рестрикции
KpnI. AatII.BssHII на 5'-конце и NsiI.SpeI.MluI на 3'-конце и выглядеть следующим образом: 5' KpnI.AatII.BssHII. (ER1 или ER2). NsiI.SpeI.MluI 3'. Фрагмент встраивают в " Конструкт А1", полученный на
СТАДИИ 1, используя сайты рестрикции KpnI. или MluI. Эта конструкция обозначена как "Конструкция В1" и выглядит следующим образом:
_ KpnI. AatII. BasHII.(ERl или ER2). NsiI. SpeI. MluI. NheI.
SmaI. XhoI. (-120 до TSSBgIII). HindIII. (люцифераза). XbaI_
СТАДИЯ 3. Фрагмент энхансера TNFα (ER1 или ER2) PCR-амплифицируют, используя праймеры, содержащие сайты рестрикции AatII. и
BasHII., для получения PCR-продукта, который выглядит следующим образом:
5'AatII. (ER1 или ER2). BssHII. Этот фрагмент клонируют в "Конструкцию В1", используя такие же сайты рестрикции. Эта
конструкция обозначена как "Конструкция С1" и выглядит следующим образом:
_ KpnI. AatII. (ER1 или ER2). BasHII (ER1 или ER2). NsiI. SpeI. MluI. -NheI. SmaI. XhoI. (-120 до TSSBgIII). HindIII.
{люцифераза}. XbaI_
СТАДИЯ 4. Фрагмент энхансера TNFα (ER1 или ER2) PCR-амплифицируют, используя праймеры, содержащие сайты рестрикции NsiI и SpeI для производства PCR-продукта,
который выглядит следующим образом:
5'NsiI. (ER1 или ER2). SpeI.3'. Этот фрагмент клонируют в "Конструкцию С1", используя такие же сайты рестрикции. Эта конструкция обозначена как
"Конструкция D1" и выглядит следующим образом:
_ KpnI. AatII. (ERl или ER2). BasHII (ER1 или ER2). NsiI. (ER1 или ER2) SpeI. MluI. NheI. SmaI. XhoI. (-120 дo TSSBgIII). HindIII. {люцифepaзa}.
XbaI_
СТАДИЯ 5. Кодирующие участки AIG.1 или AIG.2 (предпочтительно, но не ограничиваясь AIG. 1 и AIG.2; можно применить любую AIG из перечня) PCR-амплифицируют, используя праймеры,
содержащие сайты рестрикции BglII и Xbal, с получением фрагмента, который выглядит следующим образом: 5'BglII.(AIG.l или AIG.2). Xbal 3'. Этот фрагмент встраивают в "Конструкцию D1", используя такие
же сайты рестрикции. Полученная конструкция обозначена как "Конструкция Е1" и выглядит следующим образом:
_ KpnI. AatII. (ERl или ER2). BasHII (ER1 или ER2). NsiI. (ER1 или ER2) SpeI. MluI.
NheI. SmaI. XhoI. (-120 до TSSBglII). HindIII. {AIG.1 или AIG.2} . XbaI_
Альтернативная схема 2 выглядит таким образом.
Схема 2
СТАДИЯ 1. Такая же, как в схеме 1,
давая начало "Конструкции А1", которая выглядит следующим образом:
КpnI. SacI. MluI. NheI. SmaI. XhoI. (-120 до TSSBglII). HindIII. {люцифераза}. ХbaI
СТАДИЯ 2. Встраивание
дополнительно MCS.
Два комплементарных олигонуклеотида (5'-фосфорилированных), дающих _ Nhel. SacII. EcorV. AflII. AatII. AvrII. Spel. PvuII. XhoI_, синтезируют из коммерчески
доступных источников. Эти олигонуклеотиды отжигают и затем клонируют в сайты Nhel и XhoI "Конструкта А1". Полученная конструкция обозначена как "Конструкция В2" и выглядит следующим образом:
_KpnI. SacI. MluI. Nhel. SacII. EcorV. AfIII. AatII. AvrII. Spel. PvuII. XhoI. (-120 до TSS ВgIII). HindIII. {люцифераза}Хbа1_
СТАДИЯ 3. Фрагмент энхансера промотора TNFα (ER1 или ER2)
PCR-амплифицируют, используя праймеры, содержащие сайты рестрикции Spel.PvuII на 5'-конце и XhoI на 3'-конце для получения PCR-продукта, который выглядит следующим образом: 5' Spel.PvuII. (ER1 или
ER2). XhoI.3'. Этот фрагмент клонируют в "Конструкцию В2", используя сайты рестрикции Spel и XhoI. Такая конструкция обозначена как "Конструкция С2" и выглядит следующим образом:
_KpnI. SacI.
MluI. Nhel. SacII. EcorV. AfflI. AatII. AvrII. Spel. PvuII. (ER1 или ER2). XhoI. (-120 до TSS BglII). HindIII. {люцифераза} Xbal_
СТАДИЯ 4. Фрагмент энхансера промотора TNFα (ER1 или
ER2) PCR-амплифицируют, используя праймеры, содержащие сайты рестрикции AvrII.Spel на 5'-конце и PvuII на 3'-конце для получения PCR-продукта, который выглядит следующим образом: 5' AvrII.Spel. (ER1
или ER2). PvuII.3'. Этот фрагмент клонируют в "Конструкцию С2", используя сайты рестрикции Spel и XhoI. Такая конструкция обозначена как "Конструкция D2" и выглядит следующим образом:
_ KpnI.
SacI. MluI. Nhel. SacII. EcorV. AfIII. AatII. AvrII. Spel. (ERl или ER2). PvuII. (ER1 или ER2). XhoI. (-120 до TSS ВglII). HindIII. {люцифераза} Хbа1_
Таким образом, применяя этот метод,
можно добавить по одному по меньшей мере семь копий энхансерных участков (El, E2 или Е3, по отдельности или в комбинации), используя следующий сайт рестрикции выше предыдущего при PCR-амплификации
энхансерных участков по выбору.
Когда желаемое количество копий энхансерных участков добавлено, встраивают AIG ниже суперпромотора, как это описано на СТАДИИ 5 схемы 1.
Индуцибельную экспрессию химерного гена TNFp-AIG тестируют путем транзиентной трансфекции вышеупомянутых клеточных линий. Экспрессию гена TNFp-AIG измеряют регистрацией апоптоза трансфицированных клеток, оценивая экспрессируемые AIG протеины путем Вестерн-блоттинга с использованием коммерчески доступных, хорошо описанных специфических синтетических тетрапептидных субстратов.
Индуцибельную экспрессию химерного гена TNFp-FasL тестируют путем транзиентной трансфекции таких же клеточных линий. Экспрессию FasL на поверхности трансфицированных клеток подсчитывают, применяя связывание антитела анти-FasL, определенное непрямым иммунофлюоресцентным анализом, и при посредством измерения индуцирования апоптоза Fas-позитивных клеток.
Регуляция экспрессии репортерного гена, управляемого TNFp. 3'-нетранслируемый участок гена TNFα играет важную роль в регуляции биосинтеза TNFα. Он вовлечен в трансляционную экспрессию гена TNFα в нормальном, неактивированном состоянии. Существенным является то, что эти элементы обеспечивают дерепрессию, когда клетки, продуцирующие TNFα, активируются под воздействием внешних стимулов (см. статьи Han J. и др. в журнале J.Immunology, 1991, 146, с. 1843-1848; Crawford F. K. и др. в журнале J.Biol.Chem., 1996, 271, с. 22383-22390).
Генетические конструкции выполнены таким образом, чтобы полный 3'-нетранслируемый участок (SEQ ID No:13) встраивают ниже гена люциферазы, регулируемого делеционными фрагментами, в частности, -120, -706 и -1005, промотора TNFα. Результаты транзиентной экспрессии таких конструкций в совокупности даны на фиг.9.
ПРИМЕР 2
Протоколы тестирования
Методы in vitro
Анализ люциферазы:
активность люциферазы определяют, применяя коммерчески доступные реагенты (Promega).
Экспрессия генов AIG1 и АIG2:
a) Вестерн-блоты лизатов трансфицированных клеток
обрабатывали, используя антитело анти-СРР32, а также антитело анти-PRAP. Антитело анти-PRAP обнаруживает как гидролизованные, так и негидролизованные продукты PRAP, а также ферментное действие
СРР32.
b) Анализ фермента СРР32: этот анализ показывает ферментную реакцию СРР32 и разложение колориметрического и флюорогенного субстрата. Для этого анализа применяют коммерчески доступный набор (Clonotech, Pharmingen).
с) Апоптоз трансфицированных клеток: апоптоз трансфицированных клеток, обусловленный AIG1 и AIG2, определяют путем окрашивания ядер иодидом пропидия (см. статью Krishan А. в журнале J.Cell Biol., 66, 1994, с.188-193) и с помощью коммерчески доступного набора для твердофазного иммуноферментного анализа гибели клеток (Cell Death Elisa) (Boehringer Mannheim).
Моделирование на животных
Моделирование у кролика артрита, индуцируемого IL-1, (см. статью Pettipher E. R. в журнале Proc. Natl. Acad.Sci. 1986, 83, с.
8749-8753): IL-1 вспрыскивают в коленные суставы кроликов породы "новозеландская белая". Внутрисуставная инъекция IL-1 вызывает зависящую от дозировки инфильтрацию лейкоцитов в суставной области и
потерю протеогликана из суставного хряща.
Артрит, индуцированный антигеном: Внутрисуставная инъекция антигена (овальбумина) в коленные суставы индуцирует накопление лейкоцитов и разрушение хряща, которые очень похожи на ревматоидный артрит у человека. Опухание сустава вслед за инъекцией держится в течение 14 дней.
Модели синовиоцитов "человек-мышь scid"(cм. статьи Houri J.M. и др. в журнале Current Opinions in Rheumatol., 1995, 7, с. 201-205; Sack U. в журнале J.Autoimmunity, 1995, 9, с. 51-58; Geiler Т. и др. в журнале Arthritis & Rheumatism, 1994, 37, с.1664-1671): они представляют собой недавно разработанные модели для изучения артрита, в которых свежая синовиальная ткань от пациентов, страдающих RA, и нормальный хрящ человека имплантированы в мышь scid подкожно ниже почечной капсулы (см. статью Geiler Т. и др. в журнале Arthritis & Rheumatism, 1994, 37, с.1664-1671) или в коленные суставы (см. статью Sack U. в журнале J.Autoimmunity, l995, 9, с. 51-58). Имплантанты развиваются с симптомами, свойственными артриту, включая формирование ткани паннуса с высокой клеточной плотностью, эрозию кости и хряща и поражение хряща синовиальными фибробластами.
Непрямой метод: синовиоциты трансфицируют in vitro генами с терапевтической активностью и трансплантируют обратно в кроликов. Артрит у этих кроликов индуцируют инъекцией IL-1, в результате чего происходит экспрессия гена с терапевтическим действием вслед за активацией. Индуцируемая активацией экспрессия химерного гена индуцирует апоптоз в имплантированных клетках.
Прямой метод: внутрисуставная инъекция химерных генов. Может быть использован любой из вышеописанных методов доставки гена, включая депротеинизированную ДНК-плазмиду и доставку, опосредуемую катионными липосомами. Для осуществления доставки на основе вирусного вектора, химерные гены должны быть клонированы в подходящие векторы. Затем векторы модифицируют с помощью делеционного эукариотического промотора, присутствующего в этих векторах. Для оценки как терапевтической, так и профилактической эффективности затем можно сделать внутрисуставную инъекцию генов с терапевтическим действием, вставленных в соответствующие векторы.
ПРИМЕР 3
Отбор вариантов соматических клеток, не продуцирующих TNFα
Клетки (ТНР, Jurkat) стабильно трансфицируют in vitro химерным геном TNFp-AIG. После нескольких циклов стимуляции, которая индуцирует апоптоз в клетках, экспрессирующих ген TNFp-AIG,
собирают выжившие клетки. Из этих клеток конструируют библиотеку кДНК, которую используют для функционального клонирования (см. статьи Legerski и Peterson в журнале Nature, 1992, 359, с. 70-73;
Jaattela и др. в журнале Oncogene, 1995, 10, с. 2297-2305).
ПРИМЕР 4
Распознавание и характеристика доминант-негативных генов (DN)
Клетки ТНР-1 и Jurkat, стабильно
трансфицированные TNFp-AIG, подвергают нескольким циклам стимуляции, чтобы активировать экспрессию TNFp-AIG. Клетки, которые не экспрессируют негативных регуляторных генов, подвергаются апоптозу, в то
время как те, которые экспрессируют негативные регуляторные гены, выживают. В этих выживших клетках продукты DN-гена действуют in-trans с промотором TNFα, благодаря чему ингибируется его
активность в обеспечении транскрипции AIG, результатом чего является фенотип выживания. Конструируют библиотеку кДНК, используя полиаденилированные мРНК из этих клеток. DN-гены, которые защищают
клетки ТНР-1 и Jurkat, трансфицированные TNFp-AIG, от апоптоза, распознают с помощью функционального клонирования, как описано для других генов (см. статьи Legerski и Peterson в журнале Nature, 1992,
359, с. 70-73; Jaattela и др. в журнале Oncogene, 1995, 10, с. 2297-2305).
Данное выше описание предназначено для пояснения обычному специалисту в данной области знаний, как на практике осуществить данное изобретение, и оно не имеет целью детализировать те общепринятые модификации и варианты его, которые будут ясны знающему специалисту при чтении описания. Оно, однако, предусматривает, что все такие общепринятые модификации и варианты должны быть включены в объем настоящего изобретения, которое определено нижеследующими пунктами формулы. Формула предназначена для схватывания заявленных компонентов и стадий, применяемых в любом порядке, который будет целесообразен для целей, поставленных здесь, до тех пор, пока в контексте не будет специально оговорено другое.
Упоминаемые здесь документы специально приводятся в виде ссылки.
Реферат
Изобретение касается терапевтического индуцирования апоптоза в активированных воспалительных клетках или клетках в области воспаления путем введения в эти клетки химерного гена, содержащего ген, индуцирующий апоптоз (AIG), который регулируется промотором индуцибельного гена, активирующимся в процессе воспаления, и энхансер промотора, в результате чего клетки становятся мишенями. В одном из воплощений изобретения химерный ген содержит по меньшей мере один энхансер промотора TNFα, присоединенный к функциональной копии минимального промотора TNFα и также присоединенный по меньшей мере к одной копии гена, индуцирующего апоптоз, причем экспрессия гена регулируется промотором TNFα. Присоединение может быть непосредственным, дистальным или проксимальным или их комбинацией. Примерами гена, индуцирующего апоптоз, являются ген каспазы-3, ген каспазы-4, ген каспазы-5, Гранзим В. Предпочтительно, чтобы химерный ген TNFp-AIG был экспрессирован только в тех клетках, которые продуцируют воспалительный цитокин TNFα. Кроме того, химерный ген TNFp- AIG также изолирует индуцибельные факторы TNFp-транскрипции, благодаря чему уменьшается эндогенное продуцирование TNFα. Изобретение также касается способов получения и применения саморегулируемых химерных генов, индуцирующих апоптоз, и фармацевтических композиций, содержащих их и предназначенных для лечения воспалительных заболеваний. Преимущество изобретения заключается в разработке средств, применяемых для длительного лечения, связанных со снижением побочного действия. 10 с. и 20 з.п. ф-лы, 10 ил.

Формула
2. Химерный ген по п.1, в котором присоединение энхансера к промотору и промотора к гену, индуцирующему апоптоз, осуществляется путем непосредственного присоединения, или дистального присоединения, или проксимального присоединения, или их комбинации.
4. Химерный ген по п.1, в котором энхансер промотора TNFα представляет собой последовательность SEQ ID : 10, или SEQ ID : 11, или их функциональные фрагменты, или их варианты.
15. Фармацевтическая композиция для индуцирования апоптоза в воспалительных клетках, продуцирующих TNFα, содержащая ген по п.14.

Комментарии