Пептиды, полученные из р16, для профилактики и лечения впч-ассоциированных опухолей и других опухолей, экспрессирующих р16 - RU2626542C2
Код документа: RU2626542C2
Чертежи




Описание
Настоящее изобретение относится к определенным фрагментам ингибитора циклин-зависимой киназы pl6INK4a и применению указанных фрагментов для вакцинации индивидуума против опухолей, экспрессирующих pl6INK4a.
Ежегодно несколько миллионов человек в мире заболевают и умирают от карциномы. Эти показатели смертности остаются неизменными на протяжении многих лет, несмотря на интенсивные поиски лечения. Многие пациенты, страдающие от карциномы, до сих пор вынуждены прибегать к хирургическому удалению карциномы, к химиотерапии или лучевой терапии. Однако это сопровождается тяжелыми побочными эффектами, которые затем вносят вклад в показатели смертности пациентов, страдающих от карциномы. Интересно, что вирус папилломы человека (ВПЧ) ассоциирован с развитием более 5% всех типов рака (Parkin and Bray, 2006). Профилактическая вакцинация против ВПЧ уже доступна, но не оказывает терапевтического эффекта на уже инфицированных людей (Hildesheim et al., 2007). Поэтому существует необходимость в разработке новых способов лечения.
Таким образом, задачей настоящего изобретения является предложение средств для лечения и профилактики ВПЧ-ассоциированных опухолей и других опухолей, экспрессирующих pl6INK4a.
Согласно изобретению решение этой задачи достигается с помощью объектов изобретения, определенных в формуле изобретения. Исследования, приведшие к данному изобретению, исходили из того, что клеточный белок pl6INK4a экспрессируется в инфицированных ВПЧ клетках, когда они вследствие нарушения отрицательной обратной связи посредством продукта онкогена Е7 ВПЧ приобретают трансформированный и, возможно, злокачественный фенотип (Sano et al., 1998; Klaes et al., 2001).
Таким образом, pl6INK4a сильно экспрессирован практически во всех ВПЧ-индуцированных карциномах и пренеоплазиях высокой степени, включая цервикальные, вульварные, вагинальные, пенильные, анальные опухоли, а также опухоли головы и шеи (Ishikawa et al., 2006; Samama et al., 2006; issaoui et al., 2006; Santos et al., 2006; Roma et al., 2008; Hafkamp et al., 2003). В физиологических условиях pl6INK4a экспрессируется только в клетках, которые претерпевают последующее старение и, таким образом, экспрессия pl6INK4a практически не обнаруживается в нормальных тканях (Beausejour et al., 2007). Помимо экспрессии pl6INK4a в ВПЧ-ассоциированых опухолях, индуцированной онкогенными ВПЧ, сверхэкспрессия pl6INK4a обнаружена в различных опухолях, не связанных с ВПЧ инфекцией, или в опухолях, инфицированных ВПЧ, но без проявления вирусного канцерогенеза, включая часть видов меланомных и немеланомных раков кожи (Nindl et al., 2004; Busch et al., 2010), рака легких (Leversha et al., 2003; Esposito et al., 2004), пищевода и желудка, колоректального рака (Ding et al., 2010; Kim et al., 2005), рака почек, мочевого пузыря, яичников, эндометрия и молочной железы (Ikuerowo et al. 2007; Buza et al., 2010; Giordano et al., 2008; Giordano et al., 2007; di Vinci et al., 2005). Известно, что мутации гена ретинобластомы, являющегося опухолевым супрессором, приводят к активации экспрессии pl6INK4a (Okamoto et al., 1994). Однако в этом случае основные механизмы увеличения экспрессии pl6INK4a не изучены до конца и скорее всего, являются гетерогенными.
Сверхэкспрессия эндогенных генных продуктов в раковых клетках давно признана ценным источником опухолевых антигенов. Иммунный ответ на такие антигены был обнаружен у различных раковых больных и возрастал в иммунотерапевтических испытаниях (Jager et al., 2003; Finn, 2008; Rescigno et al., 2007).
В ходе экспериментов, приведших к настоящему изобретению, может быть продемонстрировано, что Т-лимфоциты, выделенные из периферической крови здоровых людей, могут быть особым образом стимулированы in vitro с помощью пептидов, полученных из pl6INK4a (pl6INK4a-пептидов). Также можно продемонстрировать, что спонтанную реактивность против таких пептидов показывают CD4+ и CD8+ Т-клетки у пациентов, больных цервикальным раком. Такие клетки дают начало росту Т-клеток цитотоксической линии, которые способны атаковать и убивать HLA-совместимые pl6INK4a клетки и цервикальные раковые клетки. Другими словами, фрагменты pl6INK4a являются высоко иммуногенными, так как индуцируют очень сильный иммунный ответ. Более того, был обнаружен гуморальный иммунный ответ на pl6INK4a.
Описанный паттерн экспрессии pl6INK4a и обнаруженный спонтанный иммунный ответ против pl6INK4a, не связанный с какими-либо аутоиммунными заболеваниями, делают pl6INK4a перспективным кандидатом для иммунизации пациентов, страдающих от рака, экспрессирующего pl6INK4a. Активно индуцированный сильный иммунный ответ против pl6INK4a может специфически разрушить ВПЧ-трансформированные клетки и другие раковые клетки, экспрессирующие pl6INK4a. Вакцинация донорских Т-клеток этими pl6INK4a пептидами была выполнена в экспериментах на клеточных культурах. Дополнительные эксперименты с использованием pl6INK4a пептидов, показали спонтанный Т-клеточный ответ у пациентов, страдающих цервикальным раком, что доказывает иммуногенность этих пептидов in vivo. Таким образом, профилактика или лечение рака на основе иммунизации с использованием pl6INK4a пептидов могут иметь несколько преимуществ для пациента. Белок pl6INK4a сильно экспрессируется при многих типах рака, в том числе всех ВПЧ-ассоциированных, независимо от типа ВПЧ. При иммунизации с помощью pl6INK4a исключены тяжелые побочные эффекты, так как экспрессия pl6INK4a слабо выражена в нормальных тканях и никаких аутоиммунных реакций не было выявлено у лиц со спонтанным иммунным ответом против pl6INK4a. Наконец, иммунное уклонение, вызванное потерей антигена, маловероятно, поскольку экспрессия pl6INK4a неразрывно связана со злокачественным фенотипом опухолевой клетки.
Краткое описание чертежей
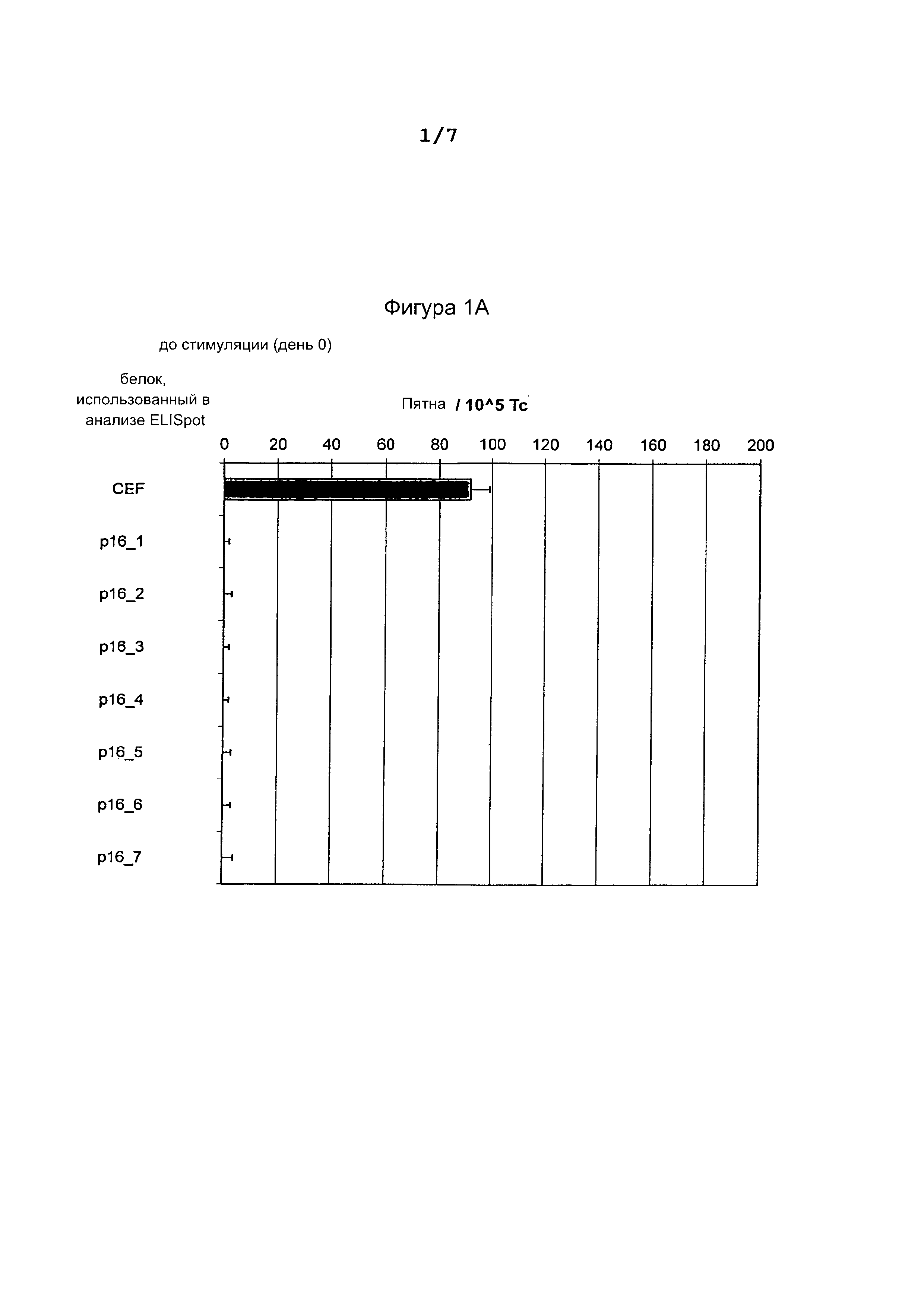
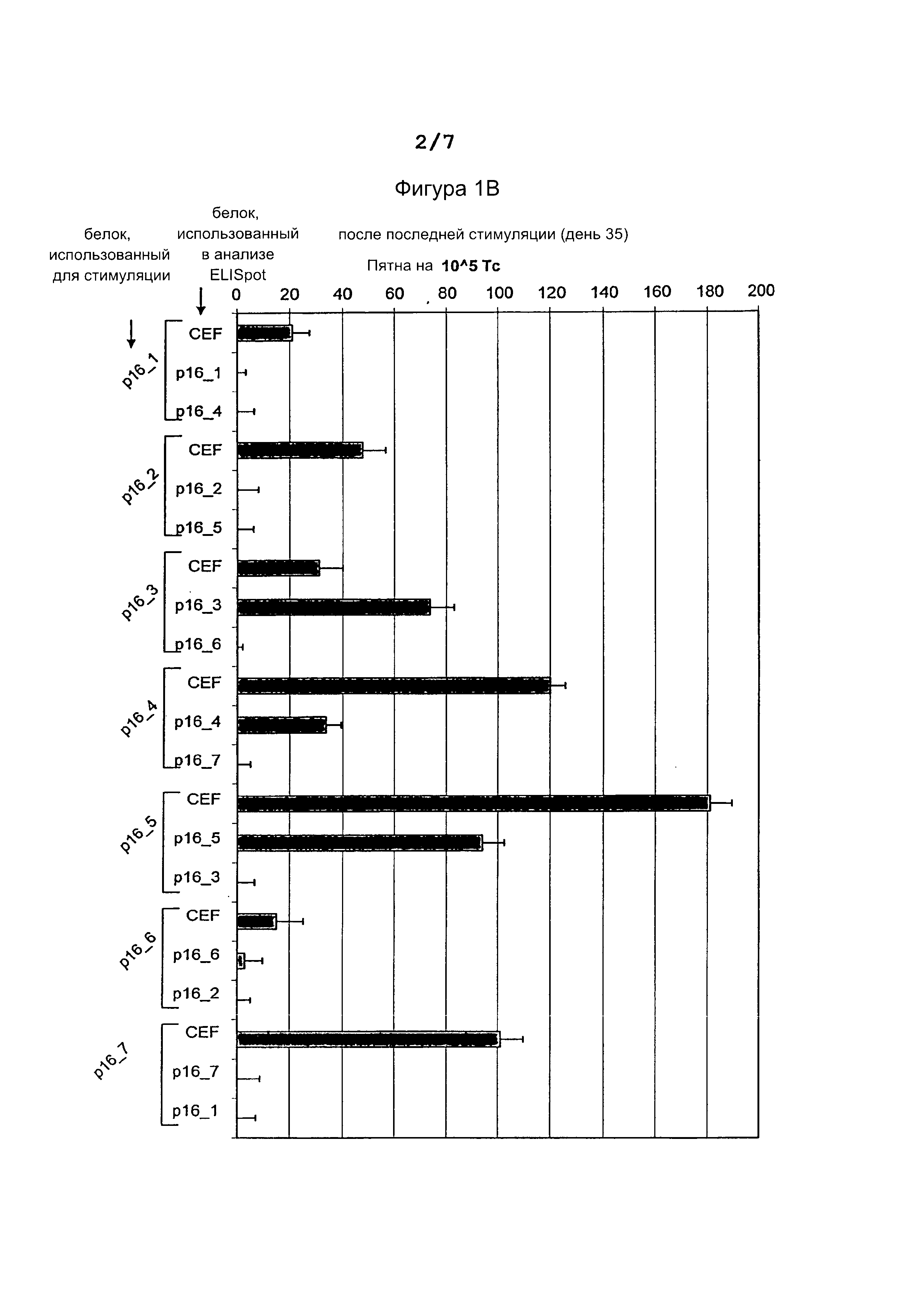
Фигура 1: Результаты ELISpot (интерферон-гамма) теста до (А) и после (В) стимуляции донорских Т-клеток pl6INK4a пептидами.
Количество пятен нормализовано путем вычитания фонового количества пятен в лунках без пептидов. Из (В) очевидно увеличение количества пятен в клетках при стимуляции пептидами pl6INK4a_37-63, pl6INK4a_51-80 и pl6INK4a_73-104, по сравнению с днем 0. CEF = смесь пептидов CMV, EBV, вируса гриппа использована в качестве положительного контроля.
Фигура 2: Результаты теста ELISpot (интерферон-гамма) в группе из 23 пациентов (Тх и Fx) и в контрольной группе из 15 человек (ВСх) против вирусной смеси как положительного контроля (CEF) и против семи 30-мерных pl6INK4a пептидов (Таблица 1). Результаты скорректированы по фону и учитываются только пятна выше порога значения (двукратная сумма количества пятен в лунке отрицательного контроля и стандартного отклонения реактивности против соответствующего pl6INK4a пептида). Два человека имели CD4+ ответ, остальные имели CD8+ ответ, na = не анализировали.
Фигура 3: Тест с радиоактивным хромом
CD8 Т-клетки от пациентов с цервикальным раком (HLA А2 A3 В7 В15 Cw3 Cw7) индуцируют лизис HLA-совместимых В-клеток, содержащих pl6INK4a_37-63 (черные квадраты), и не индуцируют лизис HLA-совместимых В-клеток, не содержащих pl6INK4a пептид (открытые треугольники). Линии цервикальных раковых HeLa клеток (pl6INK4a+, HLA А68, В15, В95, Cw7 Cwl2) и Caski клеток (pl6INK4a+, HLA А2, A3, В7, В37, Cw5, Cw7) подвергаются лизису, в то время как лизиса клеток МЕ180 и К562 не обнаружено.
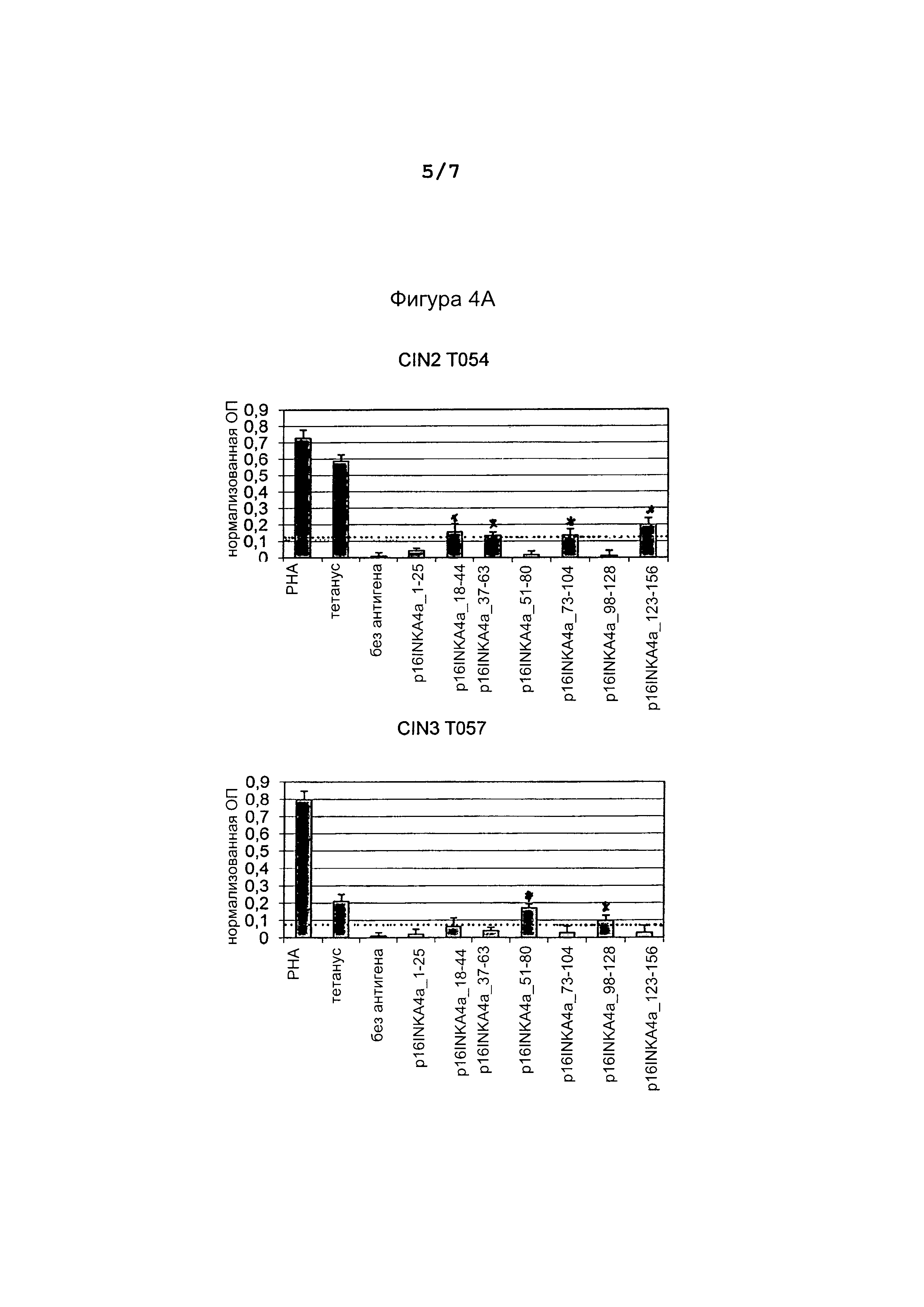
Фигура 4: Пролиферация мононуклеарных клеток периферической крови у женщин с цервикальными дисплазиями после стимуляции семью pl6INK4a пептидов (Таблица 1).
Показаны оптические плотности анализа пролиферации BrdU, проведенного после инкубации мононуклеарных клеток периферической крови (РВМС клеток) с pl6INK4a пептидами, положительные контроли (митоген РНА и столбнячный токсин) и отрицательные контроли (без антигена). Пунктирными линиями показаны пороговые значения для положительного ответа. Звездочки показывают индуцирующие пролиферацию pl6INK4a пептиды. Показаны результаты для трех пациентов с положительной реакцией и одного пациента с отрицательной реакцией.
Фигура 5: Вестерн-блот анализ серологической реактивности pl6INK4a.
(a) (1) Серебряная окраска очищенного pl6INK4a, меченного гистидином. (2) Вестерн-блот анализ очищенного pl6INK4a, меченного гистидином, с использованием моноклональных pl6INK4a антител Е6Н4
(b) Показано 6 проб положительной сыворотки. Размер белка соответствует реакции моноклональных антител (Е6Н4) против рекомбинантного белка.
(c) Примеры отрицательных сывороток (1 и 2).
(d) Реактивность pl6INK4a сыворотки до (1) и после (2) предварительной инкубации с рекомбинантным pl6INK4a. (3) Выявление белка pl6INK4a преципититированного в сыворотке, полученной от пациента с цервикальным раком, и белка pl6INK4a обнаруженного с помощью прямого HRP-мечения моноклональными pl6INK4a -антителами (из Reuschenbach et al., 2008).
Таким образом, настоящее изобретение относится к определенным фрагментам ингибитора циклин-зависимой киназы pl6INK4a, способным индуцировать иммунный ответ против pl6INK4a. Иммунный ответ определяется как состояние, удовлетворяющее по меньшей мере одному из следующих критериев: 1. Индукция CD8-позитивных Т-клеток, определяемая с помощью анализов цитотоксичности или секреции IFN-гамма, или экспрессии перфорина, или экспрессии гранзима В, или других цитокинов, которые могут продуцироваться СВ8-позитивными Т-клетками. Такие клетки выявляемы анализом ELISpot выше неспецифического фона, окрашиванием внутриклеточных цитокинов, детекцией цитокинов методом ELISA или эквивалентными методами. 2. Индукция CD4-позитивных Т-клеток, определяемая по секреции цитокинов, выявляемых анализом ELISpot выше неспецифического фона, окрашиванием внутриклеточных цитокинов, детекцией цитокинов методом ELISA или эквивалентными методами. Цитокины, включая IFN-альфа, IFN-гамма, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12, IL-13, IL-17, TNF-альфа, TGF-бета и другие, могут быть произведены CD4-позитивными Т-клетками. 3. Индукция антител, обнаруживаемая методом Вестерн-блот, методом ELISA и похожими или эквивалентными ему методами. 4. Индукция любого вида клеточного иммунного ответа, не опосредованного CD8-позитивными или CD4-позитивными Т-клетками, как описано в 1 и 2.
Фрагменты pl6INK4a состоят из
(a) любой из следующих аминокислотных последовательностей:
(a1) MEPAAGSSMEPSADWLATAAARGRV;
(а2) TAAARGRVEEVRALLEAGALPNAPNSY;
(а3) LPNAPNSYGRRPIQVMMMGSARVAELL;
(a4) VMMMGSARVAELLLLHGAEPNCADPATLTR;
(а5) ADPATLTRPVHDAAREGFLDTLWLHRAGARL;
(a6) HRAGARLDVRDAWGRLPVDLAEELGHRDVAR;
(a7) GHRDVARYLRAAAGGTRGSNHARIDAAEGPSDIPD;
(b) функционального эквивалента фрагмента (а), который так же способен индуцировать иммунный ответ против pl6INK4a; или
(c) комбинации фрагментов (а) и/или (b).
Термин "функциональный эквивалент", использованный в настоящей заявке, относится к, например, вариантам или фрагментам (а), которые так же способны индуцировать иммунный ответ против pl6INK4a, таким образом, являются подходящими для эффективной вакцинации. Эти варианты характеризуются аминокислотными делениями, заменами и/или вставками. Желательно, чтобы аминокислотные различия обуславливались одной или несколькими заменами консервативных аминокислот. Термин "замена консервативных аминокислот" включает в себя замену алифатических или гидрофобных аминокислот Ala, Val, Leu и Ile; замену гидроксильных остатков Ser и Thr; замену кислотных остатков Asp и Glu;, замену амидных остатков Asn и Gin; замену основных остатков Lys, Arg, и His; замену ароматических остатков Phe, Tyr и Trp; и замену аминокислот малого размера Ala, Ser, Thr, Met и Gly.
Для производства пептидов, показывающих определенную степень идентичности, и определения критических для функции пептида областей может быть использована, например, генная инженерия, позволяющая изменять аминокислотный состав части пептида посредством изменений клонированной последовательности ДНК. Например, может быть использован сайт-направленный мутагенез или аланин-сканирующий мутагенез (целенаправленная замена отдельных аминокислот полипептидной цепи на аланин) (Cunningham и Wells, 1989). Полученные мутантные молекулы могут быть затем проверены на иммуногенность с использованием анализов, описанных в примерах. Предпочтительны короткие аминокислотные замены, делеции и вставки длинной не более 8 аа, 6 аа и, еще лучше, 4 аа.
В результате от исходной аминокислотной последовательности фрагмента pl6INK4a остается непрерывная последовательность длинной по меньшей мере 5 аа, предпочтительно, по меньшей мере 10 аа, более предпочтительно, по меньшей мере 15 аа и, еще более предпочтительно, по меньшей мере 20 аа. Такой фрагмент все еще способен индуцировать иммунный ответ против pl6INK4a и, таким образом, так же является полезным в качестве эффективной вакцины.
Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей фрагмент согласно изобретению, или вектору, содержащему такую нуклеиновую кислоту. Прямое введение генетического материала в клетки хозяина приводит к тому, что небольшое количество из них продуцирует продукты введенного гена. Экспрессия этого гена в клетках хозяина аномальна и имеет важные иммунологические последствия, приводя к специфическому иммунному ответу на антиген, кодируемый доставленным геном. Прямое введение «голой» плазмидной ДНК индуцирует сильный иммунный ответ на данный антиген, кодируемый генной вакциной. После того, как конструкция плазмидной ДНК введена, клетка хозяин захватывает чужеродную ДНК, экспрессируя вирусный ген и продуцируя pl6INK4a внутри клетки. Эта форма презентации и процессинга антигена индуцирует оба класса молекул МНС (I и II) и ограниченные клеточные и гуморальные иммунные реакции. ДНК вакцины состоят из векторов, как правило, содержащих две части: части, экспрессирующей антиген, которая состоит из промоторной/энхансерной последовательности, и следующую за ней части из (FSP)-кодирующие последовательности, последовательности полиаденилирования и производственной единицы, которая необходима для амплификации и селекции вектора. Конструирование векторов со вставками вакцины осуществляется квалифицированным специалистом с использованием технологии рекомбинантной ДНК. Эффективность ДНК-иммунизации может быть улучшена путем стабилизации ДНК против деградации и повышения эффективности ее доставки в антигенпрезентирующие клетки. Это было продемонстрировано путем нанесения ДНК на биоразлагаемые катионные микрочастицы (например, сополимер лактида с гликолидом, комбинированный с бромидом цетилтриметиламмония). Такие микрочастицы, покрытые ДНК, могут быть эффективны как при повышении цитотоксических Т-лимфоцитов (CTL), так и при рекомбинантных вирусах коровьей оспы, особенно при смешивании с квасцами. Частицы 300 нм в диаметре представляются наиболее эффективными для захвата антигенпрезентирующими клетками.
Разнообразные экспрессионные векторы, например, плазмиды или вирусные векторы, могут быть использованы для вставки и экспрессии нуклеотидных последовательностей, кодирующих фрагмент настоящего изобретения.
Наиболее подходящими вирусными векторами являются: поксвирус, аденовирус, ретровирус, вирус герпеса или адено-ассоциированный вирус (AAV). Наиболее подходящими поксвирусами являются: вирус коровьей оспы, NYVAG, вирус рода Avipox, вирус оспы канареек, ALVAC, ALVAC (2), вирус куриной оспы или TROVAC.
Рекомбинантные векторы на основе альфавируса также были использованы для повышения эффективности ДНК вакцинации. Ген, кодирующий фрагмент согласно изобретению, вводят в репликон альфавируса, заменяя структурные гены, но оставляя интактными неструктурные гены репликазы. Вирус Синдбис и вирус леса Семлики были использованы для создания рекомбинантных альфавирусных репликонов. Однако в отличие от консервативной ДНК вакцинации, альфавирусные векторы экспрессируются только временно. Альфавирусные репликоны повышают иммунную реакцию вследствие высокой экспрессии кодируемых вектором белков, репликон-индуцированных реакций цитокинов или репликон-индуцированного апоптоза, приводящего к повышенному захвату антигена дендритными клетками.
Настоящее изобретение также относится к фармацевтической композиции, содержащей фрагмент, последовательность нуклеиновой кислоты или вектор согласно настоящему изобретению в количестве, подходящем для иммунизации индивидуума; и, желательно, один или более общих вспомогательных агентов. Такой фрагмент, последовательность нуклеиновой кислоты или вектор, могут присутствовать отдельно, или в комбинации с носителями. Для индивидуума благоприятными являются неиммуногенные носители. Такими носителями могут быть собственные белки индивидуума или чужеродные белки или их фрагменты. Предпочтительны такие носители, как сывороточный альбумин, фибриноген или трансферрин или его фрагмент. Фрагменты содержат эпитопы, которые распознаются цитотоксическими Т-клетками, например, CD8+ Т-клетками или CD4 Т-клетками, и могут индуцировать иммунный ответ. Такие эпитопы регуляторных белков клеточного цикла могут быть определены методами, известными специалисту в данной области техники. Также благоприятным может быть одновременное присутствие нескольких фрагментов. Далее приведена ссылка на метод получения указанных фрагментов путем рекомбинации, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2 edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor N.Y. (1989).
Настоящее изобретение также относится к применению фрагмента, последовательности нуклеиновой кислоты или вектора по настоящему изобретению для производства вакцины, и для профилактики или лечения экспрессирующей pl6INK4a пренеоплазии, неоплазии или карциномы (включая запущенную карциному).
Например, это могут быть ВПЧ-индуцированные, pl6INK4a-экспрессирующие аногенитальные карциномы, в частности цервикальная карцинома, рак головы или шеи и pl6INK4a-экспрессирующие опухоли, не индуцированные ВПЧ. Также сюда можно включить доброкачественные модификации, такие как папилломы, аденомы, гиперплазии или аналогичные пролиферации (разрастания) эпителиальных, мезенхимальных и гемопоэтических клеток.
Используемый в настоящей заявке термин "индивидуум" означает индивидуума любого рода, способного заболеть раком. Примерами таких индивидуумов являются люди и животные, а также их клетки.
Используемый в настоящей заявке термин "количество, пригодное для иммунизации индивидуума" обозначает любое количество фрагмента согласно изобретению, к которому применимы описанные выше пояснения, и, соответственно, количество которым может быть иммунизирован индивидуум. Например, количество зависит от предназначения иммунизации: для профилактического или для терапевтического лечения. Кроме того, при определении количества играют роль возраст, пол и вес индивидуума. Подходящая для индивидуума доза инъекции составляет от 100 мкг до 1 г фрагмента pl6INK4a. Инъекция индивидууму может быть выполнена различными путями: внутримышечно, подкожно, внутрикожно или в любой другой форме. Также может быть благоприятным проведение одной или более инъекций бустерной дозы, имеющей примерно одинаковое количество фрагмента. В этом случае, может быть особенно благоприятно использование различных фрагментов соответствующих регуляторных белков клеточного цикла для индивидуальных инъекций.
Используемый в настоящей заявке термин "общие вспомогательные агенты" включает любые вспомогательные агенты, пригодные для изготовления фармацевтической композиции для вакцинации индивидуума. Такими вспомогательными агентами являются, например, иммунологические адъюванты, такие как GM-CSF или адъювант Фрейнда, буферные растворы поваренной соли, вода, эмульсии, такие как масляно-водные эмульсии, увлажняющие агенты, стерильные растворы и т.д.
С помощью настоящего изобретения можно иммунизировать индивидуумов, в частности человека и животных. Иммунизация происходит как путем индукции антител, так и стимуляции Т-клеток. Таким образом, возможно принять профилактические и терапевтические меры против (пре)неоплазий, неоплазий и карцином.
Изобретение поясняется примерами, приведенными ниже.
Пример 1
Реактивность Т-клеток против pl6INK4a-пептидов у больных с ВПЧ-ассоциированными неоплазиями
Для того, чтобы оценить, насколько и в какой степени повышается Т-клеточный ответ на сильную сверхэкспрессию pl6INK4a у пациентов с ВПЧ-ассоциированными опухолями, были применены различные методы, позволяющие детально охарактеризовать иммунные реакции против pl6INK4a-антигена. Обнаружение спонтанных иммунных реакций против pl6INK4a у больных цервикальным раком доказывает иммуногенность определенных фрагментов pl6INK4a и антигена в целом, и обеспечивает основу для иммунизации фрагментами pl6INK4a пациентов с опухолями экспрессирующими pl6INK4a. Мононуклеарные клетки периферической крови (Peripheral Blood Mononuclear Cells, PBMCs) от 13 женщин с экспрессирующей pl6INK4a цервикальной дисплазией высокой степени (CIN2/3), инкубировали с pl6INK4a пептидами (Таблица 1), чтобы определить пролиферативную активность иммунных клеток. Для глобального измерения лимфопролиферативного потенциала после заражения pl6INK4a пептидами применялся BrdU анализ. Этот анализ представляет собой колориметрический иммуноанализ, применяемый для количественной оценки пролиферации клеток, основанный на измерении включения тимидинового аналога 5-бром-2-'дезоксиуридина в процессе синтеза ДНК. PBMCs в среде IMDM с добавлением 10% сыворотки человека высевали на 96-луночные микротитровальные планшеты (с плоским дном) с плотностью 150.000 клеток/50 мкл/лунку. Клетки в каждых 4 повторных лунках инкубировали в присутствии семи pl6INK4a пептидов (Таблица 1), столбнячного анатоксина (20 нг/мл, Calbiochem, La Jolla, СА) и митогена PHA-L (5 мкг/мл, Roche, Mannheim, Germany) в качестве положительных контролей, и без антигена в качестве отрицательного контроля, в течение 6 дней при 37°С, 5% CO2. На 6-й день, 10 мкл/лунку окрашивающего раствора BrdU (все реагенты для BrdU анализа были из набора Proliferation ELISA, BrdU (colorimetric) компании Roche, Mannheim, Germany) в каждой лунке разбавляли 1:100 средой IMDM с 10% человеческой сывороткой и дополнительно инкубировали в течение 18 часов при 37°С, 5% СО2. На 7-й день, планшет центрифугировали при 1200 оборотах в минуту в течение 10 мин, удаляли 50 мкл супернатанта и переносили в новый планшет с V-образным дном для хранения при -80°С для анализа цитокинов. Оставшиеся клетки сушили с помощью фена в течение примерно 15 минут и добавляли к клеткам 150 мкл/лунку раствора FixDenat и инкубировали 30 минут при комнатной температуре, после чего удаляли FixDenat, встряхиванием и аккуратным постукиванием. Добавляли 100 мкл/лунку рабочего раствора анти-BrdU-POD и инкубировали в течение 90 минут при комнатной температуре, затем удаляли и заменяли на 100 мкл субстрата ТМВ, с которым инкубировали в течение 30 минут при комнатной температуре. Ферментативную реакцию останавливали добавлением 25 мкл/лунка 1N H2SO4 и измеряли оптическую плотность (OD) при 450 нм (эталонная длина волны 620 нм). Пороговое значение для положительных реакций определено как три стандартных отклонения OD в лунках негативного контроля без антигена. PBMCs у 3-х из 13 обследованных женщин показали пролиферативную активность в ответ на pl6INK4a пептиды, демонстрируя, что инкубация с пептидами инициировала пролиферативную память Т-клеточных ответов. В целом структура пептидов, индуцирующих ответ, была гетерогенна, указывая на различные эпитопы для Т-клеток в р16 антигене. Один пациент показал ответ на пептиды pl6INK4a_18-44, pl6INK4a_37-63, pl6INK4a_73-107 и pl6INK4a_123-156, один пациент отреагировал на пептиды pl6INK4a_51-80 и pl6INK4a _98-128 и один на пептиды pl6INK4a_1-25 и pl6INK4a_37-63 (Фигура 4).
Для того чтобы доказать, что определенные фрагменты pl6 способны индуцировать секрецию IFN-гамма как один из признаков ответа Th1 клеток, Т-клетки от 23 пациентов с инвазивным цервикальным раком и предраковыми патологическими изменениями высокой степени (CIN2/3) с сильной сверхэкспрессией pl6INK4a, испытывали против семи pl6INK4a пептидов (Таблица 1) в интерферон-гамма ELISpot анализе. Т-клетки выделяли из гепаринизированной крови с использованием Ficoll-центрифугирования, адгезии к пластику и магнитных гранул с антителами (CD11, CD 16, CD 19, CD36, CD56, набор «Pan Т cell isolation», ilteny, Bergisch Gladbach, Germany). Дендритные клетки были получены путем культивирования адгерентных к пластику клеток в течение 7 дней с IL-4 и GM-SCF (каждый 1000 ед./мл) и использованы в качестве антигенпрезентирующих клеток в ELIspot анализе. Каждые 105 Т-клеток были испытаны после короткой (от 2 до 5 дней) предсенсибилизации in vitro с соответствующим пептидом, представленным 2×104 дендритными клетками.
При вычитании фона (определенного как 2 кратное число пятен в лунке с отрицательным контролем + 2 стандартных отклонения реактивности против соответствующего pl6INK4a-пептида) у 7 больных цервикальным раком могли быть выявлены Т-клетки (CD4 или CD8), реагирующие против pl6INK4a_37- 63 пептида (фиг. 2).
Пример 2
In vitro примирование Т-клеток здорового донора pl6INK4a пептидами
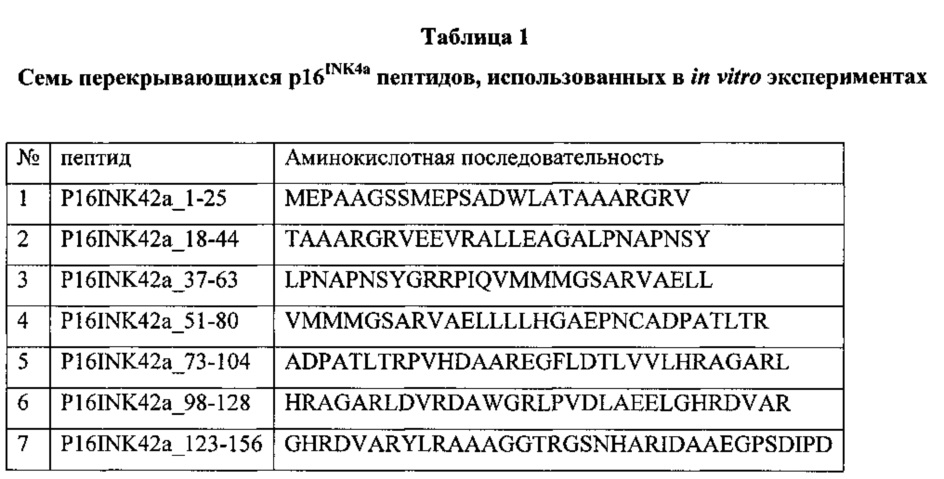
Семь длинных 25-35-мерных пептидов, охватывающих всю аминокислотную последовательность pl6INK4a, каждый с перекрыванием 7-13 аминокислот, были испытаны для определения фрагментов pl6INK4a, способных индуцировать in vitro интерферон-гамма секретирующие Т-клетки у здоровых доноров. (Таблица 1).
Для того чтобы показать, что фрагменты pl6INK4a, могут стимулировать in vitro секрецию интерферона-гамма в Т-клетках здоровых доноров и определить наиболее иммуногенные эпитопы, полученные из pl6INK4a, была проверена возможность in vitro стимуляции Т-клетк, выделенных из периферической крови здоровых доноров, с помощью таких pl6INK4a пептидов. В клеточных культурах Т-клетки секретируют цитокины при введении соответствующего pl6INK4a пептида в так называемых ELISpot экспериментах, если этот пептид способен индуцировать специфический Т-клеточный ответ. В ELISpot анализе цитокины (интерферон-гамма) могут быть обнаружены с помощью специфических антител с последующей цветной реакцией.
Мононуклеарные клетки периферической крови (PBMCs) были выделены из гепаринизированной крови (100 мл) одного здорового донора с помощью фиколл-пак центрифугирования в градиенте плотности. От 5 до 10×107 РВМС были разделены на моноциты и Т-клетки с помощью адгезии к пластику и магнитных гранул с антителами (CD11, CD16, CD19, CD36, CD56, Pan Т cell isolation Kit, Milteny, Bergisch Gladbach, Germany). Моноциты культивировали в течение 7 дней с GM-CSF и IL-4 (1000 ед/мл каждого), чтобы получить антигенпрезентирующие дендритные клетки.
Т-клетки (2×107) инкубировали с дендритными клетками (2×106), которые были предварительно культивированы с pl6INK4a пептидами (10 мкг/мл) в течение 4 часов для достижения презентации антигенов. Для каждого из семи pl6INK4a пептидов была проведена отдельная стимуляция.
Т-клетки повторно стимулировали дендритными клетками, культивированными в присутсвии pl6INK4a пептидов, и обрабатывали IL-2 и IL-7 (10 Ед/мл) каждые 7 дней в течение 5 недель.
Специфический Т-клеточный ответ на pl6INK4a пептиды измеряли посредством интерферон-гамма ELISpot анализа до стимуляций (день 0) и после последней стимуляции (день 35). Для ELISpot анализа использовали 96-луночные нитроцеллюлозные планшеты (МАНА N4550 Millipore) покрытые анти-интерферон-гамма антителами 1-D1K (Mabtech, Nacka Strand, Sweden) в концентрации 0.75 мкг/лунку. Каждые 105 Т-клеток были испытаны с соответствующим пептидом, представленным дендритными клетками (2×104). После 12 часов инкубации при 37°С, был обнаружен секретированный интерферон-гамма, за счет детекции с вторичным биотинилированным анти-интерферон-гамма антителом 7BG-1 (Mabtech), коньюгатом стрептавидин-щелочная фосфатаза и раствором субстрата BCIP/NBT (Sigma Aldrich, St. Louis, USA).
В то время как вначале (день 0) ни на один из семи pl6INK4a пептидов не было обнаружено никакой реактивности, кроме реактивности против смеси вирусных пептидов (CEF = CMV, EBV и flu), использованных в качестве положительного контроля. На 35-й день, Т-клетки, стимулированные пептидами pl6INK4a_37-63, pl6INK4a_51-80 и pl6INK4a_73-104, в ELISpot анализе показали повышенную секрецию интерферон-гамма в испытании против клеток-мишеней, культивированных с этими пептидами, но не в испытании против клеток, культивированных с остальными pl6INK4a пептидами (фиг. 1).
Пример 3
Лизис в клеточной линии цервикального рака стимулированный pl6INK4a реактивированными Т-клетками
Способность активированных Т-клеток лизировать клетки цервикального рака, экспрессирующие pl6INK4a, была проверена анализом с радиоактивным хромом как на различных клеточных линиях цервикального рака, также и на HLA-совместимых В-клетках, содержащих pl6INK4a пептиды в качестве мишеней. 10×6 клеток-мишеней (HLA-совместимых В-клеток, содержащих пептид, и В-клеток без пептида) инкубировали в течение 1 часа с51Cr (100 μCi), а затем, в разных соотношениях, с Т-клетками одного пациента, страдающего цервикальным раком, который по результатам ELISpot анализа реагировал на клетки-мишени, содержащие пептид pl6INK4a_37-63. Специфический лизис клеток-мишеней, вызванный Т-клетками, может быть измерен путем определения испускаемой радиоактивности.
Показано, что CD8+ Т-клетки пациента больного цервикальным раком, которые в ELISpot анализе реагируют на клетки-мишени, содержащие пептид pl6INK4a_37-63, способны лизировать HLA-совместимые В-клетки, содержащие пептид pl6INK4a_37-63, а также линии клеток цервикального рака HeLa и CaSki (ВПЧ и pl6INK4a положительные).
Однако лизис не обнаружен в тех же HLA-совместимых В-клетках, не содержащих пептид pl6INK4a_37-63, и в других ВПЧ- и pl6INK4a негативных клеточных линиях (фиг. 3). Эти результаты показывают цитотоксическую активность pl6INK4a-пептид-специфических Т-клеток, и демонстрируют, что эпитопы pl6INK4a представлены на поверхности цервикальных раковых клеток и распознаются клонами pl6INK4a -реактивных Т-клеток пациента.
Пример 4
Гуморальный иммунный ответ против pl6INK4a
Анализ более 900 сывороток дополнительно показал, что часть индивидуумов вырабатывает антитела, которые специфически связываются с эпитопами, полученными из pl6INK4a (фиг. 4) (Reuschenbach et al., 2008). Это показывает способность pl6INK4a индуцировать гуморальный иммунный ответ. Дополнительно было продемонстрировано, что в сыворотках также могут быть обнаружены антитела к пептиду pl6INK4a_37-63 который, как оказалось, индуцирует in vitro сильнейшую секрецию интерферона-гамма в Т-клетках. В общей сложности 374 сывороток от пациентов с цервикальным раком, мелкоклеточным раком легких, раком головы и шеи, и сывороток здоровых людей были испытаны пептидным ELISA методом. Пептид (20 мкг/мл) наносили на 96-луночные планшеты для микротитрования (Maxisorp, Nunc, Roskilde, Denmark) в течение ночи при 4°С, неспецифические сайты связывания блокировали 0,5% казеином. Сыворотку тестировали антителами против пептида в соотношении 1:100. Связанные сывороткой антитела были обнаружены с помощью конъюгированных HRP анти-человеческих IgG антител (Jackson Iramuno, West Grove, USA and TMB substrate (Sigma Aldrich, St. Louis, USA). На пороговом значении 0,03 нормированной оптической плотности, 15% (56/374) тестируемых сывороток имели антитела против pl6INK4a_37-63.
В целом эти наблюдения показывают, что у пациентов, страдающих от дисплазии, индуцированной ВПЧ высокого онкогенного риска, или неоплазии вырабатывается иммунный ответ на pl6INK4a. Если этот иммунный ответ будет способен устранить клетки, инфицированные ВПЧ высокого риска, pl6INK4a антиген может быть очень привлекательным кандидатом будущей вакцины для предотвращения и/или лечения pl6INK4a-экспрессирующих (пре)неоплазий, в частности опухолей, ассоциированных с ВПЧ высокого риска.
Источники информации
Beausejour, СМ., Krtolica, A., Galimi, F., Narita, M., Lowe, S.W., Yaswen, P., and Campisi, J. (2003). Reversal of human cellular senescence: roles of the p53 and pl6 pathways. EMBO J 22, 4212.
Cunningham and Wells, Science 244 (1989), 1081-1085.
Finn, O.J. (2008). Cancer immunology. N. Engl. J. Med. 358, 2704-2715.
Hildesheim, A., Herrero, R., Wacholder, S., Rodriguez, А.С., Solomon, D., Bratti, M.C, Schiller, J.T., Gonzalez, P., Dubin, G., Porras, C, Jimenez, S.E., and Lowy, D.R. (2007). Effect of human papillomavirus 16/18 LI viruslike particle vaccine among young women with preexisting infection: a randomized trial. JAMA 298, 743-753.
Jager, E., Jager, D., and Knuth, A. (2003). Antigen-specific immunotherapy and cancer va_ccines. Int J Cancer 106, 817-20.
Klaes, R., Friedrich, T., Spitkovsky, D., Ridder,R., Rudy,., Petry,U., Dallenbach-Hellweg, G., Schmidt, D., and Knebel Doeberitz, M. (2001). Overexpression of pl6(INK4A) as a specific marker for dysplastic and neoplastic epithelial cells of the cervix uteri. Int J Cancer 92, 276.
Parkin, D.M. and Bray, F. (2006). Chapter 2: The burden of HPV-related cancers. Vaccine 24 Suppl 3, S11-S25.
Rescigno, M., Avogadri, F., and Curigliano, G. (2007). Challenges and prospects of immunotherapy as cancer treatment. Biochim. Biophys. Acta 1776, 108-123.
Reuschenbach, M., Waterboer,., Wallin, K.L., Einenkel, J., Dillner, J., Hamsikova, E., Eschenbach, D., Zimmer, H., Heilig, B., Kopitz, J., Pawlita, M., Doeberitz, M.K., and entzensen, N. (2008). Characterization of humoral immune responses against pl6, p53, HPV16 E6 and HPV16 E7 in patients with HPV-associated cancers. Int. J. Cancer 123, 2626-2631.
Sano, T., Oyama, T., Kashiwabara, K., Fukuda, T., and Nakajima, T. (1998). Expression status of pl6 protein is associated with human papillomavirus oncogenic potential in cervical and genital lesions. Am. J. Pathol. 153, 1741-1748.
Schadlich, L., Senger, T., Gerlach, B., Mucke, N., Klein, C, Bravo, I.G., Muller, M., and Gissmann,L. (2009)-. Analysis of modified human papillomavirus type 16 L1 capsomeres: the ability to assemble into larger particles correlates with higher immunogenicity. J. Virol. 83, 7690-7705.
Ishikawa M, Fujii T, Saito M, Nindl I, Ono A, Kubushiro K et al. Overexpression of pl6 INK4a as an indicator for human papillomavirus oncogenic activity in cervical squamous neoplasia. Int J Gynecol Cancer 2006; 16 (1): 347-353.
Samama B, Lipsker D, Boehm N. pl6 expression in relation to human papillomavirus in anogenital lesions. Hum Pathol 2006; 37 (5): 513-519.
Missaoui N, Hmissa S, Frappart L, Trabelsi A, Ben Abdelkader A, Traore С et al. pl6INK4A overexpression and HPV infection in uterine cervix adenocarcinoma. Virchows Arch 2006; 448(5):597-603.
Santos M, Landolfi S, Olivella A, Lloveras B, Klaustermeier J, Suarez H et al. pl6 overexpression identifies HPV-positive vulvar squamous cell carcinomas. Am J Surg Pathol 2006; 30(11): 1347-1356.
Roma AA, Goldblum JR, Fazio V, Yang B. Expression of 14-3-3sigma, pl6 and p53 proteins in anal squamous intraepithelial neoplasm and squamous cell carcinoma. Int J Clin Exp Pathol 2008; 1(5). 419-425.
Hafkamp HC, Speel EJM, Haesevoets A, Bot FJ, Dinjens WNM, Ramaekers FCS et al. A subset of head and neck squamous cell carcinomas exhibits integration of HPV 16/18 DNA and overexpression of pl61NK4A and p53 in the absence of mutations in p53 exons 5-8. Int J Cancer 2003; 107 (3): 394.
Nindl I, Meyer T, Schmook T, Ulrich C, Ridder R, Audring H et al. Human papillomavirus and overexpression of Pl61NK4a in nonmelanoma skin cancer. Dermatol Surg 2004; 30 (3): 09-414. Busch C, Geisler J, nappskog S, Lillehaug JR, L0nning PE. Alterations in the p53 pathway and pl61NK4a expression predict overall survival in metastatic melanoma patients treated with dacarbazine. J Invest Dermatol. 2010 Oct; 130 (10): 2514-6.
Giordano G, Azzoni C, D'Adda T, Rocco A, Gnetti L, Froio E et al. Human papilloma virus (HPV) status, pl6INK4a, and p53 overexpression in epithelial malignant and borderline ovarian neoplasms. Pathol Res Pract 2008; 204 (3): 163-174.
Giordano G, Azzoni C, D'Adda T, Merisio C. Pl6(iNK4a) overexpression independent of Human Papilloma Virus (HPV) infection in rare subtypes of endometrial carcinomas. Pathol Res Pract. 2007; 203 (7): 533-8.
Di Vinci A, Perdelli L, Banelli B, Salvi S, Casciano I, Gelvi I, Allemanni G, Margallo E, Gatteschi B, Romani M. pl6(INK4a) promoter methylation and protein expression in breast fibroadenoma and carcinoma. Int J Cancer. 2005 Apr 10/114 (3).-414-21.
Buza N, Cohen PJ, Pei Hui, Parkash V. Inverse pl6 and p63 expression in small cell carcinoma and high-grade urothelial cell carcinoma of the urinary bladder. Int J Surg Pathol. 2010 Apr; 18 (2): 94-102.
Esposito V, Baldi A, Tonini G, Vincenzi B, Santini M, Ambrogi V, Mineo TC, Persichetti P, Liuzzi G, Montesarchio V, Wolner E, Baldi F, Groeger AM. Analysis of cell cycle regulator proteins in non-small cell lung cancer. J Clin Pathol. 2004 Jan; 57 (1): 58-63.
Ikuerowo SO, Kuczyk MA, von asielewski R, Shittu OB, Jonas U, Machtens S, Serth J. pl6INK4a expression and clinicopathologic parameters in renal cell carcinoma. Eur Urol. 2007 Mar; 51 (3):732-7; discussion 738. Epub 2006 Aug 23.
Leversha MA, Fielding P, Watson S, Gosney JR, Field JK. Expression of p53, pRB, and pl6 in lung tumours: a validation study on tissue microarrays. J Pathol. 2003 Aug; 200 (5): 610-9.
Ding GC, Ren JL, Chang FB, Li JL, Yuan L, Song X, Zhou SL, Guo T, Fan ZM, Zeng Y, Wang LD. Human papillomavirus DNA and P16(INK4A) expression in concurrent esophageal and gastric cardia cancers. World J Gastroenterol. 2010 Dec 14; 16 (46): 5901-6.
Kim BN, Yamamoto H, Ikeda K, Damdinsuren B, Sugita Y, Ngan CY, Fujie Y, Ogawa M, Hata T, Ikeda M, Ohue M, Sekimoto M, Monden T, Matsuura N, Monden M. Methylation and expression of pl6INK4 tumor suppressor gene in primary colorectal cancer tissues. Int J Oncol. 2005 May; 26 (5): 1217-26.
Okamoto A, Demetrick DJ, Spillare EA, Hagiwara K, Hussain SP, Bennett WP, Forrester K, Gerwin B, Greenblatt MS, Serrano M. pl6INK4 mutations and altered expression in human tumors and cell lines. Cold Spring Harb Symp Quant Biol 1994; 59:49-57.
Реферат
Изобретение относится к области биохимии. Изобретение представляет собой фрагмент ингибитора циклин-зависимой киназы p16, способный индуцировать иммунный ответ против p16, молекулу нуклеиновой кислоты, вектор, содержащий молекулу нуклеиновой кислоты, вирусный вектор, а также их применение. Изобретение позволяет повышать секрецию интерферона-гамма Т-клетками или индуцировать пролиферацию Т-клеток, и применять указанные фрагменты для иммунизации индивидуума против ВПЧ-ассоциированных или других типов рака, экспрессирующих pl6, предпочтительно запущенных типов рака. 4 н. и 11 з.п. ф-лы, 5 ил., 1 табл., 5 пр.

Комментарии