Генотерапевтический днк-вектор на основе генотерапевтического днк-вектора vtvaf17, несущий целевой ген cftr, или nos1, или aq1, или aq3, или aq5, для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов, способ ег - RU2705252C1
Код документа: RU2705252C1
Чертежи















Описание
Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. То есть созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки организма животных и человека, характеризующихся сниженной или недостаточной экспрессией данного гена, обеспечивая таким образом достижение терапевтического эффекта.
Уровень техники
Генная терапия - это современный медицинский подход, направленный на лечение наследственных и приобретенных заболеваний путем введения нового генетического материала в клетки пациента с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта.
Переносчики генетического материала (генотерапевтические векторы) разделяют на вирусные и невирусные. В последнее время в генной терапии все большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы.
Плазмидные векторы лишены недостатков, присущих вирусным векторам. В клетке-мишени они существуют в эписомальной форме, не интегрируясь в геном, производство их достаточно дешево, отсутствие иммунного ответа и побочных реакций на введение плазмидного вектора делают их удобным инструментом генной терапии и генетической профилактики (ДНК-вакцины) (Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines. 2016; 15(3):313-29).
Тем не менее, ограничениями для использования плазмидных векторов для генной терапии являются: 1) наличие генов устойчивости к антибиотикам для наработки в штаммах-носителях, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов, 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies).
Кроме того, это же агентство рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), являющихся нуклеотидными последовательности геномов различных вирусов (Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_quideline/2015/05/WC500187020.pdf).
Также существенным моментом является размер терапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (Mairhofer J, Grabherr R. Rational vector design for efficient non-viral gene delivery: challenges facing the use of plasmid DNA. Mol Biotechnol. 2008.39(2):97-104).
Известен способ накопления плазмидных векторов в штаммах Escherichia coli без использования антибиотиков (Cranenburgh RM, Hanak JA, Williams SG, Sherratt DJ. Escherichia coli strains that allow antibiotic-free plasmid selection and maintenance by repressor titration. Nucleic Acids Res. 2001. 29(5):E26). Были созданы штаммы Escherichia coli DH1lacdapD и DH1lacP2dapD, в которых ген dapD, кодирующий фермент 2,3,4,5-тетрагидропиридин-2,6-дикарбоксилат-N-сукцинилтрансферазу, участвующий в биосинтезе L-лизина, находится под контролем lac-промотора. В отсутствие индуктора IPTG (изопропил-(β-D-1-тиогалактопиранозид) эти штаммы подвержены лизису. Однако при введении мультикопийного вектора pORT, содержащего lac-оператор, индуцируется экспрессия гена dapD и, таким образом, трансформированные клоны могут быть отобраны и размножены. Однако, эти штаммы характеризуются низким уровнем трансформации и ее нестабильностью.
Известно решение по патентной заявке US 2011152377/10, описывающей получение экспрессионного плазмидного вектора без устойчивости к антибиотику, которая содержит полинуклеотидную последовательность, кодирующую белок-репрессор. Экспрессия указанного белка-репрессора регулирует экспрессию токсичного генного продукта, встроенного в участок генома E.coli. Однако, как и все методы селекции, основанные на использовании белков-репрессоров, данный метод отличается нестабильностью трансформации и ее низкой эффективностью.
Известен патент (US 9,644,211), описывающий получение минимального по размеру вектора. Данный вектор не содержит бактериальных геномных последовательностей и продуцируется путем parA-опосредованной рекомбинации, проходящей в специально полученном штамме E.coli. Недостатком данного метода получения минимального по размеру вектора является невозможность его использования при масштабировании производства.
Прототипом настоящего изобретения в части использования рекомбинантных ДНК-векторов для генной терапии является способ получения рекомбинантного вектора для генетической иммунизации (US 9,550,998). Плазмидный вектор представляет собой суперскученный плазмидный ДНК-вектор и предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из ориджина репликации, регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека.
Накопление вектора производят в специальном штамме E.coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Ограничением использования данного ДНК -вектора для генетической терапии является наличие в его составе регуляторных элементов, представляющих собой последовательности вирусных геномов.
Раскрытие изобретения
Задачей изобретения является конструирование генотерапевтических ДНК-векторов для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов, оптимально сочетающих в себе:
I) возможность безопасного использования для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности;
II) длину, обеспечивающую эффективное проникновение в клетку-мишень;
III) наличие регуляторных элементов, обеспечивающих эффективную экспрессию целевых генов и, в то же время, не представляющих собой нуклеотидные последовательности вирусных геномов;
IV) технологичность получения и возможность наработки в промышленных масштабах.
Пункты I и III являются обязательными и предусмотрены в данном техническом решении в соответствии с требованиями государственных регуляторов к лекарственным средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам касательно отказа от введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011, EMA/CAT/GTWP/44236/2009 Committee for advanced therapies) и касательно отказа от введения в разрабатываемые плазмидные векторы для генной терапии элементов вирусных геномов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Задачей изобретения также является конструирование штаммов, несущих эти генотерапевтические ДНК-вектора для производства в промышленных масштабах этих генотерапевтических ДНК-векторов.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, CFTR или NOS1 или AQ1 или AQ3 или AQ5 для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов, представляющий собой группу генотерапевтических ДНК-векторов, каждый из которых содержит кодирующую часть по крайней мере одного целевого гена, выбранного из CFTR или NOS1, или AQ1, или AQ3, или AQ5, клонированную в генотерапевтический ДНК-вектор VTvaf17, при этом группу генотерапевтических ДНК-векторов составляют генотерапевтический ДНК-вектор VTvaf17-CFTR, размером 7606 п.н., или VTvaf17-NOS1, размером 7468 п.н., или VTvaf17-AQ1 размером 3982 п.н., или VTvaf17-AQ3, размером 4024 п.н., или VTvaf17-AQ5, размером 3943 п.н., с нуклеотидной последовательностью SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно или их сочетание. Создан способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CFTR или NOS1 или AQ1 или AQ3 или AQ5, заключающийся в том, что каждый из группы генотерапевтических ДНК-векторов: ДНК-вектор VTvaf17-CFTR, или VTvaf17-NOS1, или VTvaf17-AQ1, или VTvaf17-AQ3, или VTvaf17-AQ5 получают следующим образом: кодирующую часть целевого гена CFTR, или NOS1, или AQ1, или AQ3, или AQ5 клонируют в генотерапевтический ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-CFTR, SEQ ID №1, или VTvaf17-NOS1, SEQ ID №2 или VTvaf17-AQ1, SEQ ID №3, или VTvaf17-AQ3, SEQ ID №4, или VTvaf17-AQ5, SEQ ID №5, соответственно, при этом кодирующую часть целевого гена CFTR или NOS1, или AQ1, или AQ3, или AQ5 получают путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных оли гону клеотидов и расщеплением продукта амплификации соответствующими эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводят по сайтам рестрикции SalI и KpnI, или по сайтам рестрикции BamHI и EcoRI, а селекцию проводят без антибиотиков, при этом при получении генотерапевтического ДНК-вектора VTvaf17-CFTR, SEQ ID №1, для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
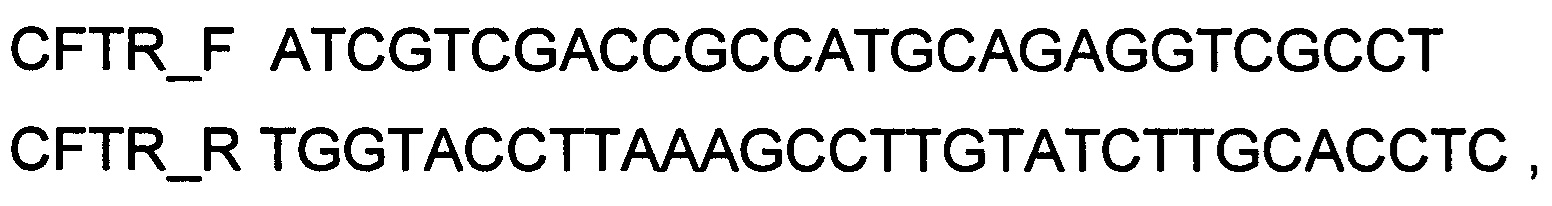
а расщепление продукта амплификации и клонирование кодирующей части гена CFTR в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI.
При получении генотерапевтического ДНК-вектора VTvaf17-NOS1, SEQ ID №2, для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
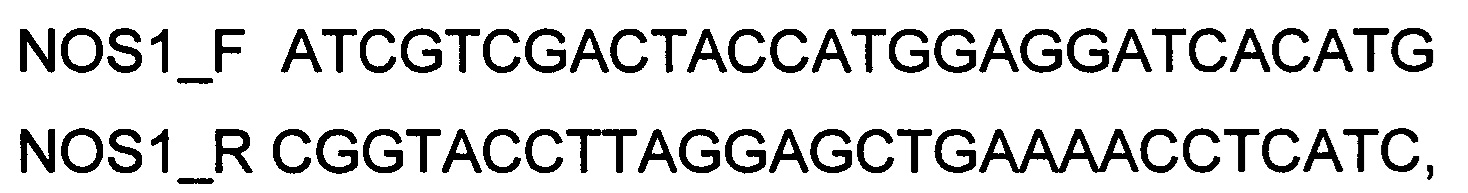
а расщепление продукта амплификации и клонирование кодирующей части гена NOS1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI.
При получении генотерапевтического ДНК-вектора VTvaf17-AQ1, SEQ ID №3 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
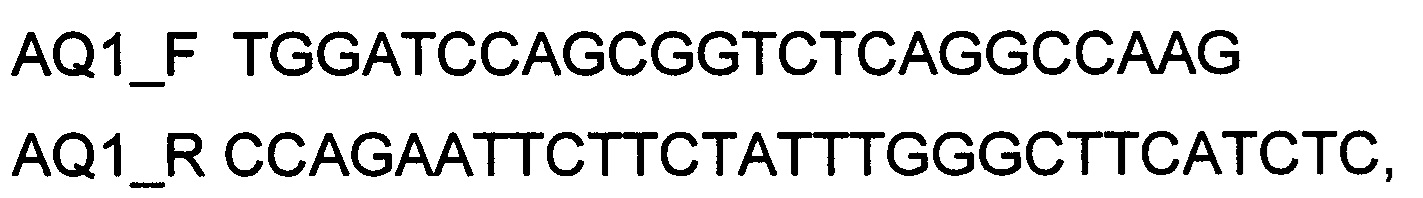
а расщепление продукта амплификации и клонирование кодирующей части гена AQ1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI.
При получении генотерапевтического ДНК-вектора VTvaf17-AQ3, SEQ ID №4 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
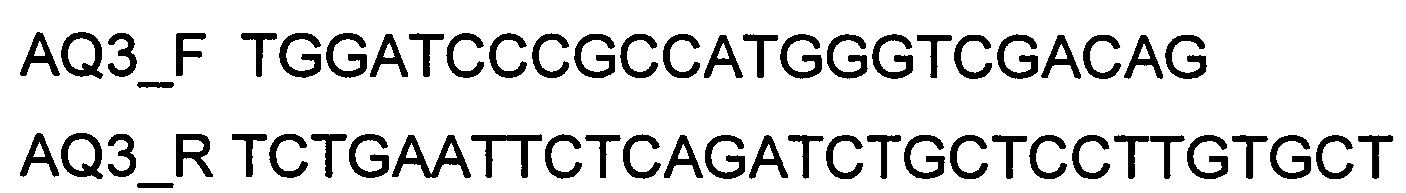
а расщепление продукта амплификации и клонирование кодирующей части гена AQ3 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI.
При получении генотерапевтического ДНК-вектора VTvaf17-AQ5, SEQ ID №5 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
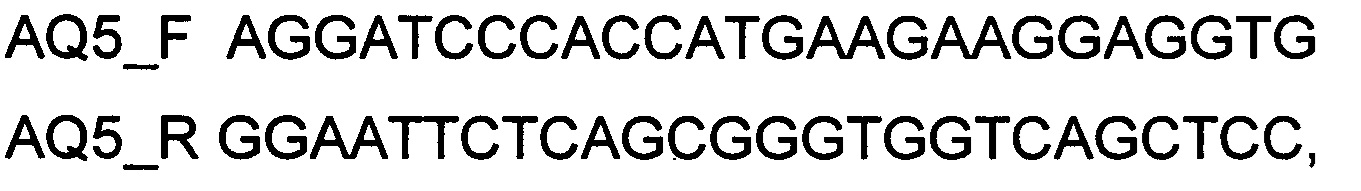
а расщепление продукта амплификации и клонирование кодирующей части гена AQ5 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и HindIII. При этом способ использования генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CFTR или NOS1 или AQ1 или AQ3 или AQ5 генотерапевтического ДНК-вектора VTvaf17-CFTR, или генотерапевтического ДНК-вектора VTvaf17-NOS1, или генотерапевтического ДНК-вектора VTvaf17-AQ1, или генотерапевтического ДНК-вектора VTvaf17-AQ3, или генотерапевтического ДНК-вектора VTvaf17-AQ5 для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов, заключается в трансфекции выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17, или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из группы созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, клеток органов и тканей пациента или животного, и/или во введении в органы и ткани пациента или животного аутологичных клеток этого пациента или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из группы созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17 и/или во введении в органы и ткани пациента или животного выбранного генотерапевтического ДНК-вектора, несущего целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или нескольких выбранных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17 из группы созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, или в сочетании обозначенных способов. Причем способ получения штамма Escherichia coli SCS110-AF/VTvaf17-CFTR или штамма Escherichia coli SCS110-AF/VTvaf17-NOS1, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ1, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ3, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ5, заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-CFTR, или ДНК-вектором VTvaf17-NOS1, или ДНК-вектором VTvaf17-AQ1, или ДНК-вектором VTvaf17-AQ3, или ДНК-вектором VTvaf17-AQ5, после чего клетки высеивают на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. Получен штамм Escherichia coli SCS110-AF/VTvaf17-CFTR, или штамм Escherichia coli SCSI 10-AF/VTvaf17-NOS1, или штамм Escherichia coli SCS110-AF/VTvaf17-AQ1, или штамм Escherichia coli SCS110-AF/VTvaf17-AQ3, или штамм Escherichia coli SCS110-AF/VTvaf17-AQ5, несущий генотерапевтический ДНК-вектор VTvaf17-CFTR или VTvaf17-NOS1 или VTvaf17-AQ1 или VTvaf17-AQ3 или VTvaf17-AQ5 для его наработки с возможностью селекции без использования антибиотиков. Создан также способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CFTR или NOS1 или AQ1 или AQ3 или AQ5, заключающийся в том, что генотерапевтический ДНК-вектор VTvaf17-CFTR, или генотерапевтический ДНК-вектор VTvaf17-NOS1, или генотерапевтический ДНК-вектор VTvaf17-AQ1, или генотерапевтический ДНК-вектор VTvaf17-AQ3, или генотерапевтический ДНК-вектора VTvaf17-AQ5 получают путем того, что засевают в колбу с приготовленной средой затравочную культуру, выбранную из штамма Escherichia coli SCS110-AF/VTvaf17-CFTR, или штамма Escherichia coli SCS110-AF/VTvaf17-NOS1, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ1, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ3, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ5, затем инкубируют затравочную среду в шейкере-инкубаторе и переносят ее в промышленный ферментер, после чего растят до достижения стационарной фазы, затем выделяют фракцию, содержащую целевой ДНК-продукт, многостадийно фильтруют и очищают хроматографическими методами.
Изобретение поясняется чертежами, где:
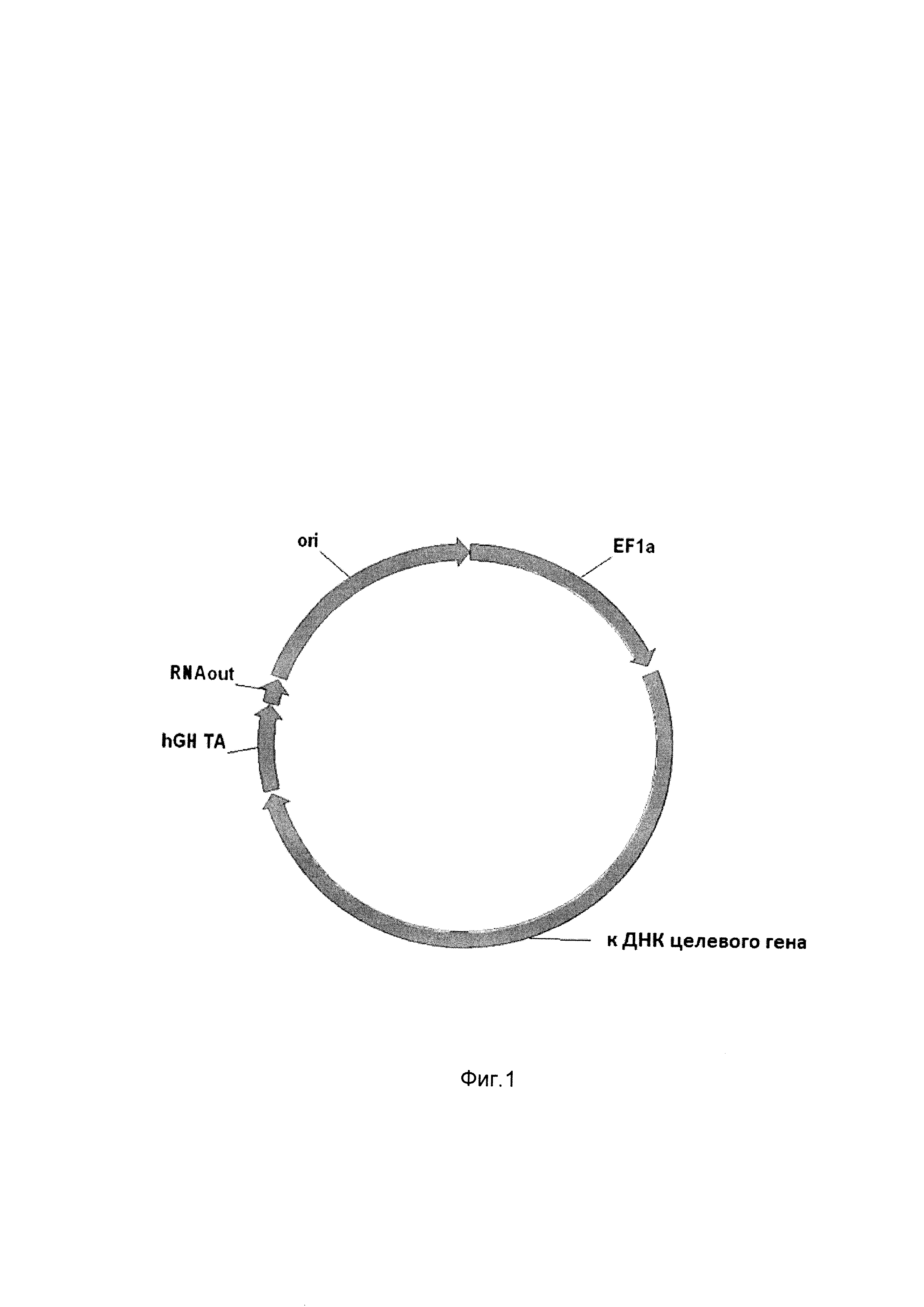
На фиг. 1
приведена схема генотерапевтического ДНК-вектора VTvaf17, несущего кДНК целевого гена человека, выбранный из CFTR, или NOS1, или AQ1, или AQ3, или AQ5, который представляет собой кольцевую двухцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Eshcerichia coli.
На фиг. 1 отмечены следующие структурные элементы вектора:
(1) EF1a - промоторная область гена человеческого фактора элонгации EF1A с собственным энхансером, содержащимся в первом интроне гена. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей человека.
(2) кДНК целевого гена
(3) hGH-TA - терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
(4) RNA-out - регуляторный элемент РНК-оиггранспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Eshcerichia coli SCS 110;
(5) ori - ориджин репликации, служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов Eshcerichia coli.
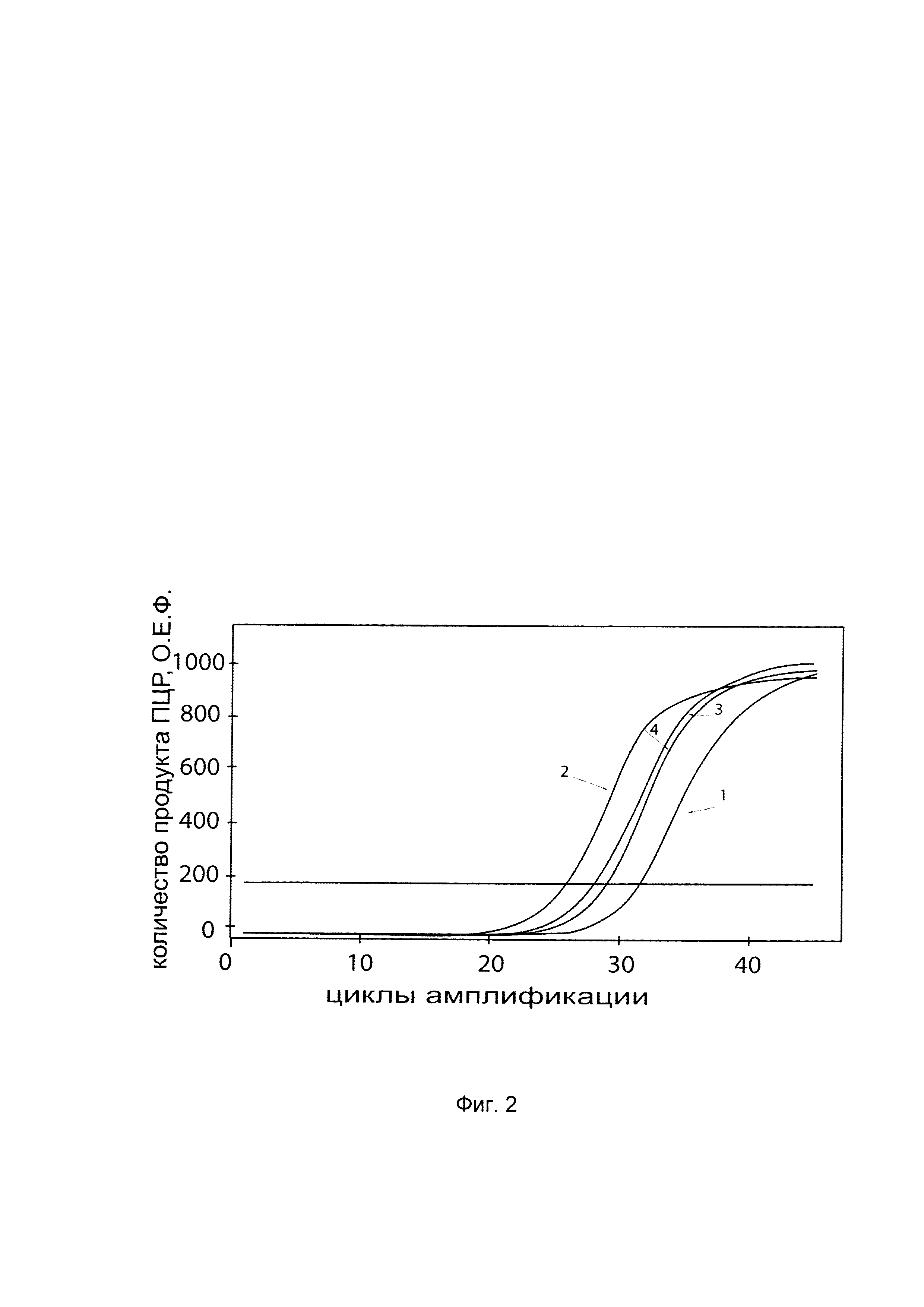
На фиг. 2
показаны графики накопления мРНК целевого гена, а именно, гена CFTR, в клетках трахеального эпителия человека линии CFTE 29о- до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-CFTR, несущим участок, гена CFTR человека с целью оценки изменения накопления мРНК гена CFTR в клетках трахеального эпителия до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-CFTR, несущим участок, кодирующий ген CFTR, где:
1 - кДНК гена CFTR в клетках трахеального эпителия человека линии CFTE 29о- до трансфекции ДНК-вектором VTvaf17-CFTR;
2 - кДНК гена CFTR в клетках трахеального эпителия человека линии CFTE 29о- после трансфекции ДНК-вектором VTvaf17-CFTR;
3 - кДНК гена В2М в клетках трахеального эпителия человека линии CFTE 29о- до трансфекции ДНК-вектором VTvaf17-CFTR;
4 - кДНК гена В2М в клетках трахеального эпителия человека линии CFTE 29о- после трансфекции ДНК-вектором VTvaf17-CFTR.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин), приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 3
показаны графики накопления мРНК целевого гена, а именно гена NOS1, в клетках нейробластомы человека SH-SY5Y до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-NOS1, несущим участок, гена NOS1 человека с целью оценки изменения накопления мРНК гена NOS1 в клетках SH-SY5Y до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-NOS1, несущим участок, кодирующий ген NOS1, где:
1 - кДНК гена NOS1 в клетках нейробластомы человека SH-SY5Y до трансфекции ДНК-вектором VTvaf17-NOS1;
2 - кДНК гена NOS1 в клетках нейробластомы человека SH-SY5Y после трансфекции ДНК-вектором VTvaf17-NOS1;
3 - кДНК гена В2М в клетках нейробластомы человека SH-SY5Y до трансфекции ДНК-вектором VTvaf17-NOS1;
4 - кДНК гена В2М в клетках нейробластомы человека SH-SY5Y после трансфекции ДНК-вектором VTvaf17-NOS1.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
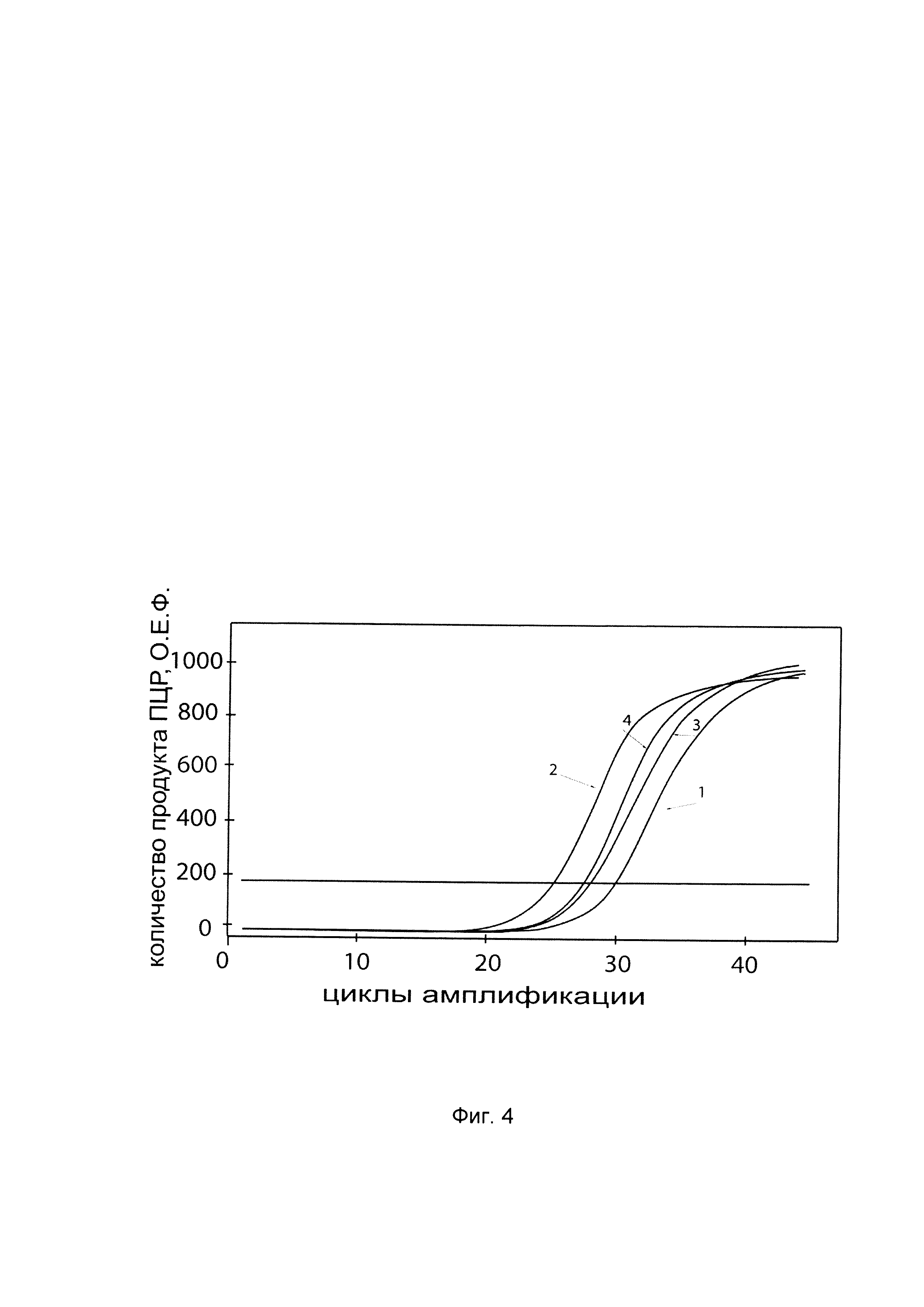
На фиг. 4
показаны графики накопления мРНК целевого гена, а именно гена AQ1 в клетках трахеального эпителия человека линии CFTE 29о- до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-AQ1, несущим участок, гена AQ1 человека с целью оценки изменения накопления мРНК гена AQ1 в клетках CFTE 29о- до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-AQ1, несущим участок, кодирующий ген AQ1, где:
1 - кДНК гена AQ1 в клетках трахеального эпителия человека линии CFTE 29о- до трансфекции ДНК-вектором VTvaf17-AQ1;
2 - кДНК гена AQ1 в клетках трахеального эпителия человека линии CFTE 29о- после трансфекции ДНК-вектором VTvaf17-AQ1;
3 - кДНК гена В2М в клетках трахеального эпителия человека линии CFTE 29о- до трансфекции ДНК-вектором VTvaf17-AQ1;
4 - кДНК гена В2М в клетках трахеального эпителия человека линии CFTE 29о- после трансфекции ДНК-вектором VTvafl 7-AQ1.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 5
показаны графики накопления мРНК целевого гена, а именно гена AQ3, в первичной культуре эпителиальных клеток периферических дыхательных путей человека HSAEC до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-AQ3, несущим участок, гена AQ3 человека с целью оценки изменения накопления мРНК гена AQ3 в клетках до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-AQ3, несущим участок, кодирующий ген AQ3, где:
1 - кДНК гена AQ3 в первичной культуре эпителиальных клеток периферических дыхательных путей человека до трансфекции ДНК-вектором VTvaf17-AQ3;
2 - кДНК гена AQ3 в первичной культуре эпителиальных клеток периферических дыхательных путей человека после трансфекции ДНК-вектором VTvaf17-AQ3;
3 - кДНК гена в первичной культуре эпителиальных клеток периферических дыхательных путей человека до трансфекции ДНК-вектором VTvaf17-AQ3;
4 - кДНК гена В2М в первичной культуре эпителиальных клеток периферических дыхательных путей человека после трансфекции ДНК-вектором VTvaf17-AQ3.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
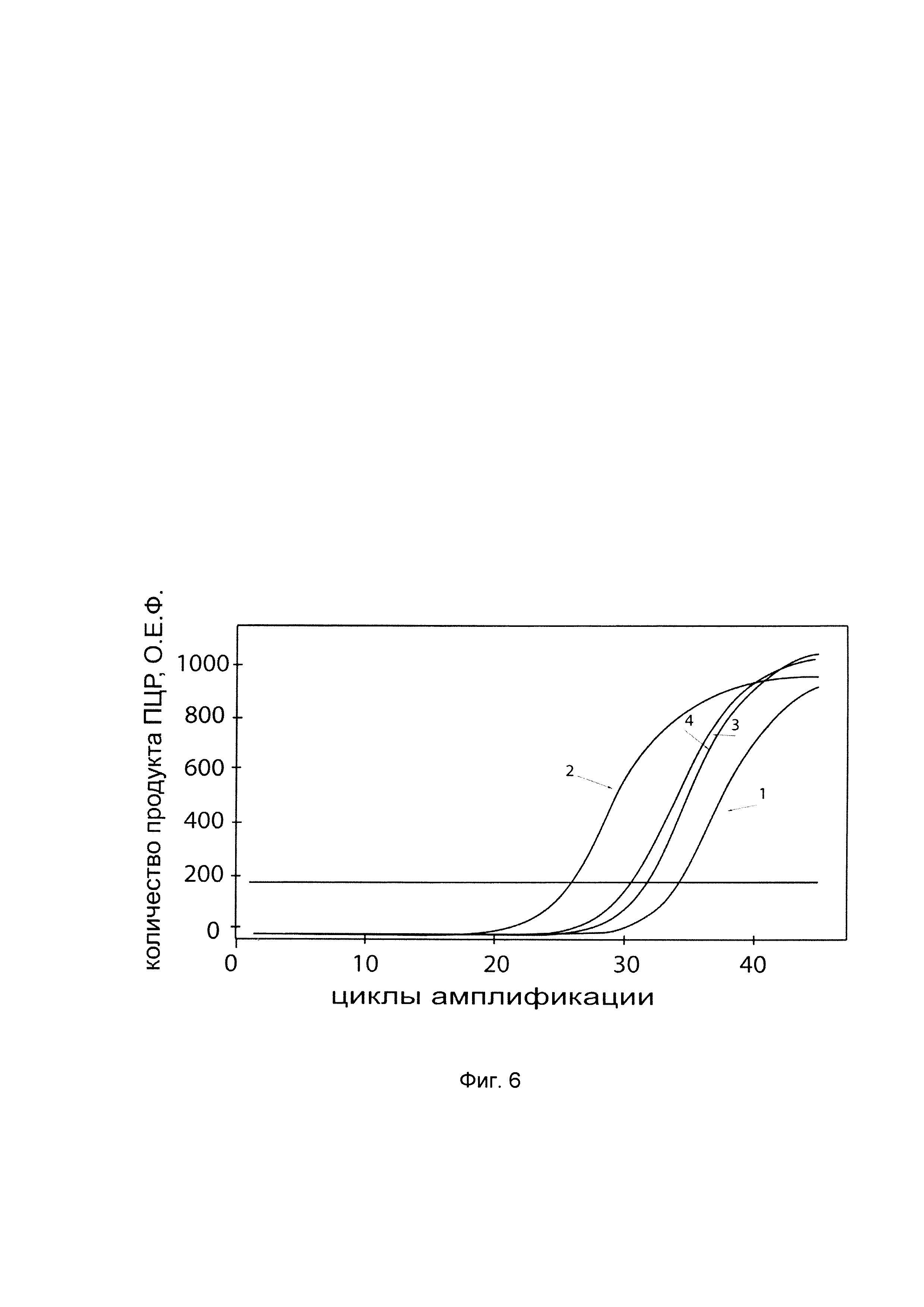
На фиг. 6
показаны графики накопления мРНК целевого гена, а именно гена AQ5, в клетках первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (АТСС PCS-420-012) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-AQ5, несущим участок, гена AQ5 человека с целью оценки изменения накопления мРНК гена AQ5 в клетках HBdSMC до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-AQ5, несущим участок, кодирующий ген AQ5, где:
1 - кДНК гена AQ5 в гладкомышечных клетках мочевого пузыря человека до трансфекции ДНК-вектором VTvafl 7-AQ5;
2 - кДНК гена AQ5 в гладкомышечных клетках мочевого пузыря человека после трансфекции ДНК-вектором VTvaf17-AQ5;
3 - кДНК гена В2М в гладкомышечных клетках мочевого пузыря человека до трансфекции ДНК-вектором VTvaf17-AQ5;
4 - кДНК гена В2М в гладкомышечных клетках мочевого пузыря человека после трансфекции ДНК-вектором VTvaf17-AQ5.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
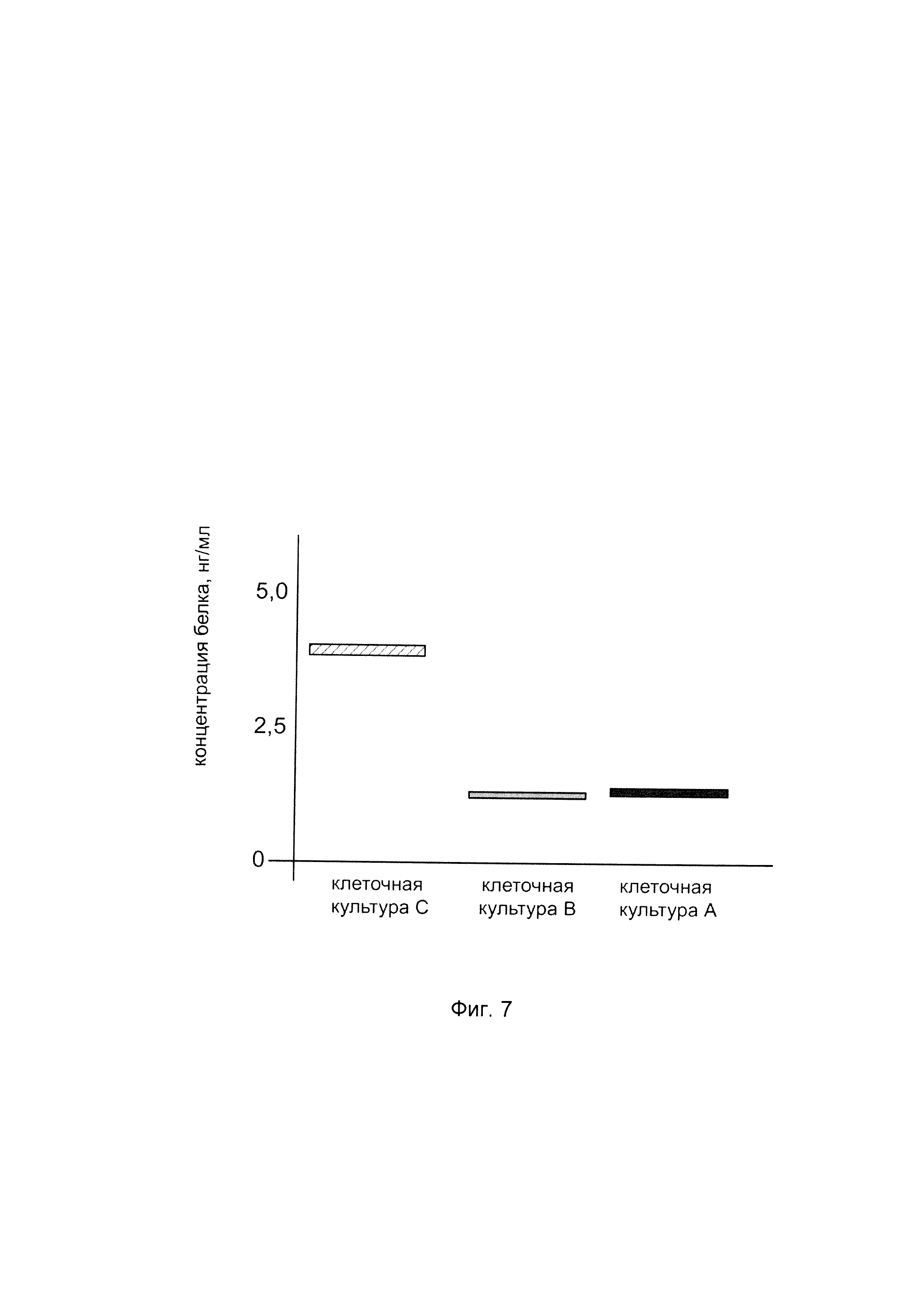
На фиг. 7
показана диаграмма концентрации белка трансмембранный регулятор кистозного фиброза в клеточном лизате клеток трахеального эпителия человека линии CFTE 29о- после трансфекции этих клеток ДНК-вектором VTvaf17-CFTR, несущим участок, гена CFTR человека с целью оценки изменения количества белка трансмембранный регулятор кистозного фиброза в клеточном лизате клеток трахеального эпителия человека линии CFTE 29о- человека при трансфекции этих клеток ДНК-вектором VTvaf17-CFTR, несущим участок, кодирующий ген CFTR, где:
культура А - культура клеток трахеального эпителия человека линии CFTE 29о- трансфицированных водным раствором дендримеров без ДНК-вектора (контроль);
культура В - культура клеток трахеального эпителия человека линии CFTE 29о- трансфицированных ДНК-вектором VTvaf17;
культура С - культура клеток трахеального эпителия человека линии CFTE 29о- трансфицированных ДНК-вектором VTvaf17-CFTR, несущим участок гена CFTR.
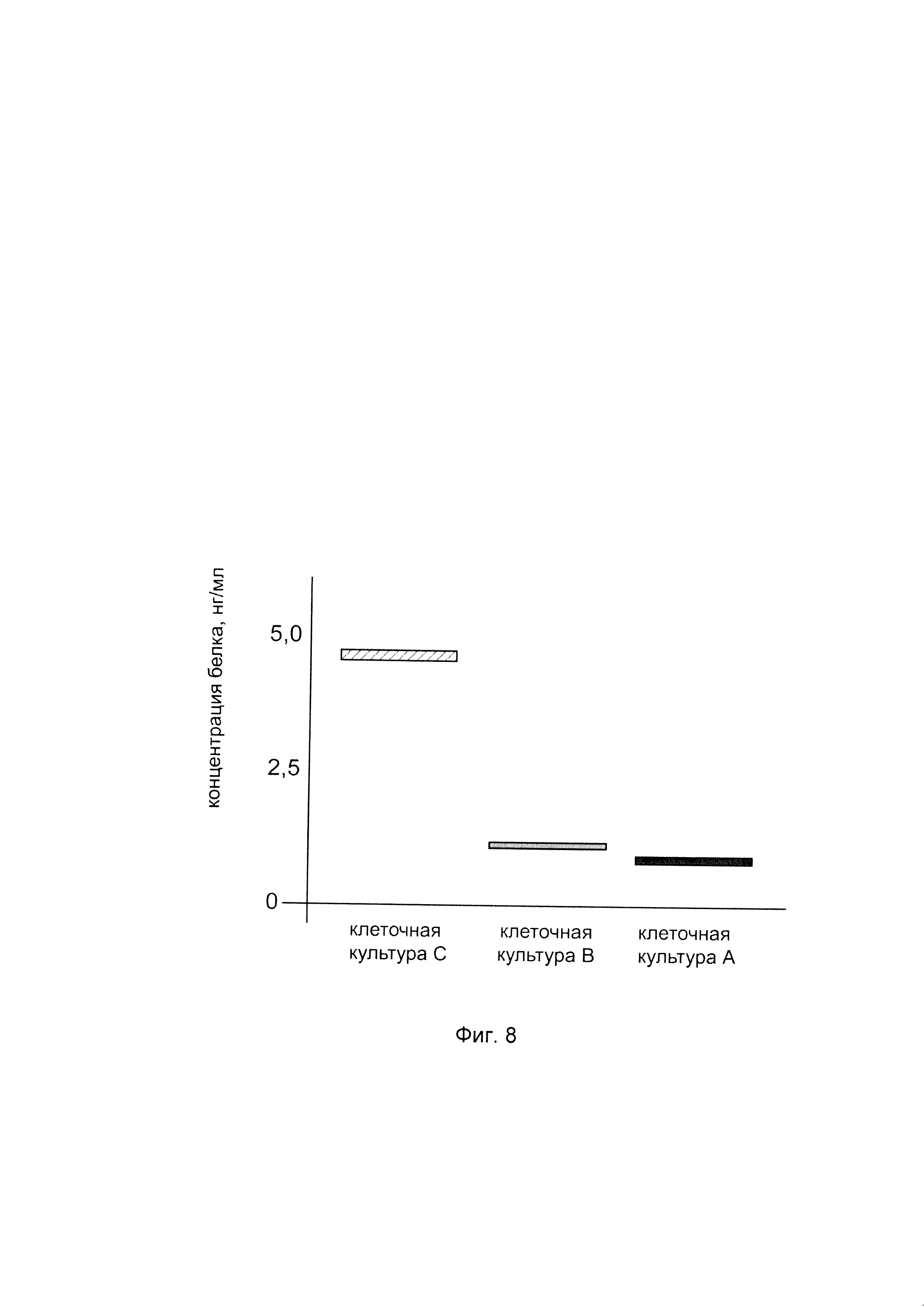
На фиг. 8
показана диаграмма концентрации белка нейрональная синтаза оксида азота 1 типа в лизате клеток нейробластомы человека SH-SY5Y после трансфекции этих клеток ДНК-вектором VTvaf17-NOS1, несущим участок, гена NOS1 человека с целью оценки изменения количества белка нейрональная синтаза оксида азота 1 типа в лизате клеток нейробластомы человека SH-SY5Y при трансфекции этих клеток ДНК-вектором VTvaf17-NOS1, несущим участок, кодирующий ген NOS1, где:
культура А - клетки SH-SY5Y, трансфицированные водным раствором дендримеров без плазмидной ДНК (контроль);
культура В - клетки SH-SY5Y, трансфицированные ДНК-вектором VTvaf17;
культура С - клетки SH-SY5Y, трансфицированные ДНК-вектором VTvaf17-NOS1, несущим участок гена NOS1.
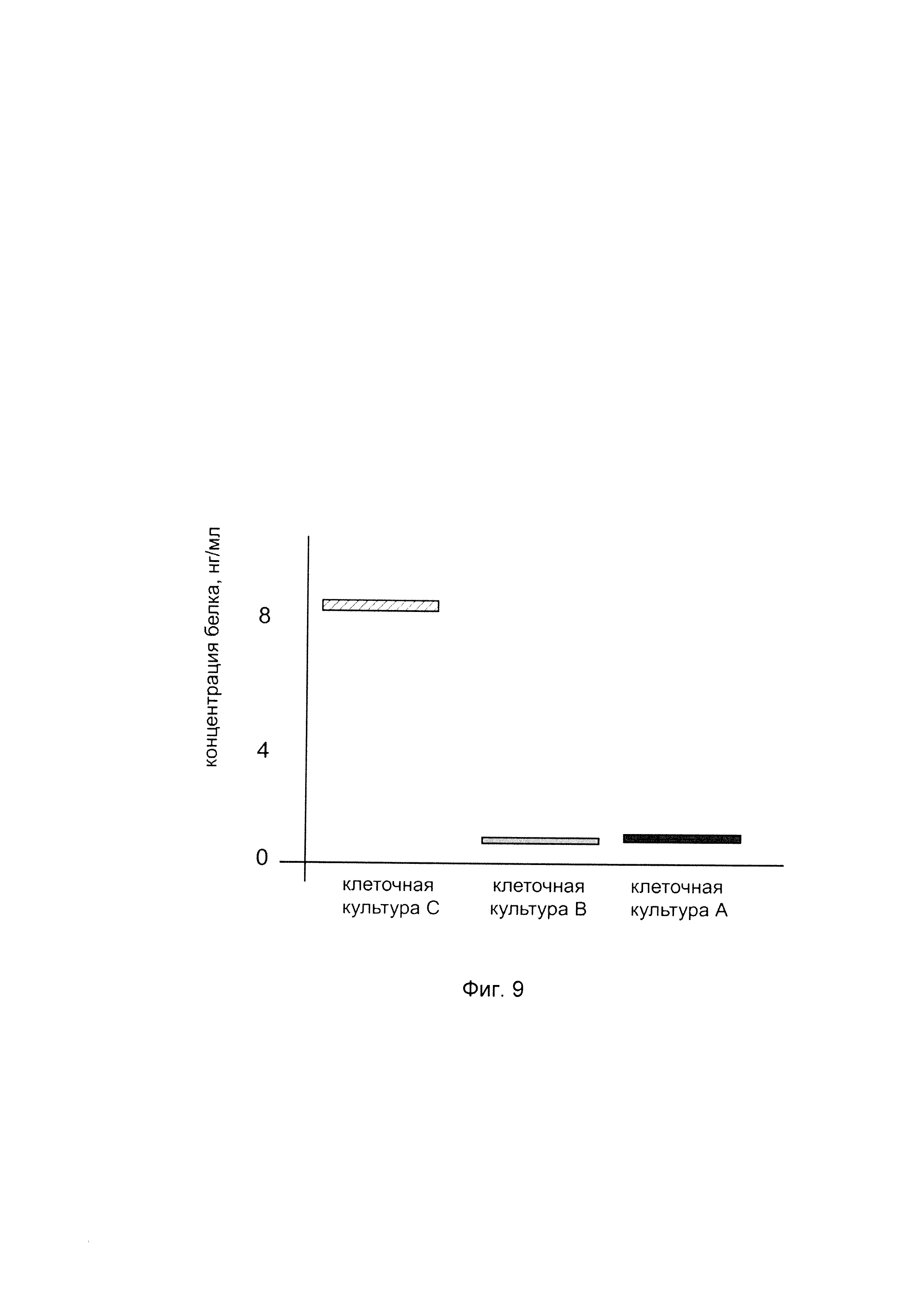
На фиг. 9
показана диаграмма концентрации белка аквапорин 1 в клеточном лизате клеток трахеального эпителия человека линии CFTE 29о- после трансфекции этих клеток ДНК-вектором VTvaf17-AQ1, несущим участок, гена AQ1 человека с целью оценки изменения количества белка аквапорин 1 в клеточном лизате клеток трахеального эпителия человека при трансфекции этих клеток ДНК-вектором VTvaf17-AQ1, несущим участок, кодирующий ген AQ1, где:
культура А - культура клеток трахеального эпителия человека линии CFTE 29о-, трансфицированных водным раствором дендримеров без ДНК-вектора (контроль);
культура В - культура клеток трахеального эпителия человека линии CFTE 29о-, трансфицированных ДНК-вектором VTvaf17;
культура С - культура клеток трахеального эпителия человека линии CFTE 29о-, трансфицированных ДНК-вектором VTvaf17-AQ1, несущим участок гена AQ1.
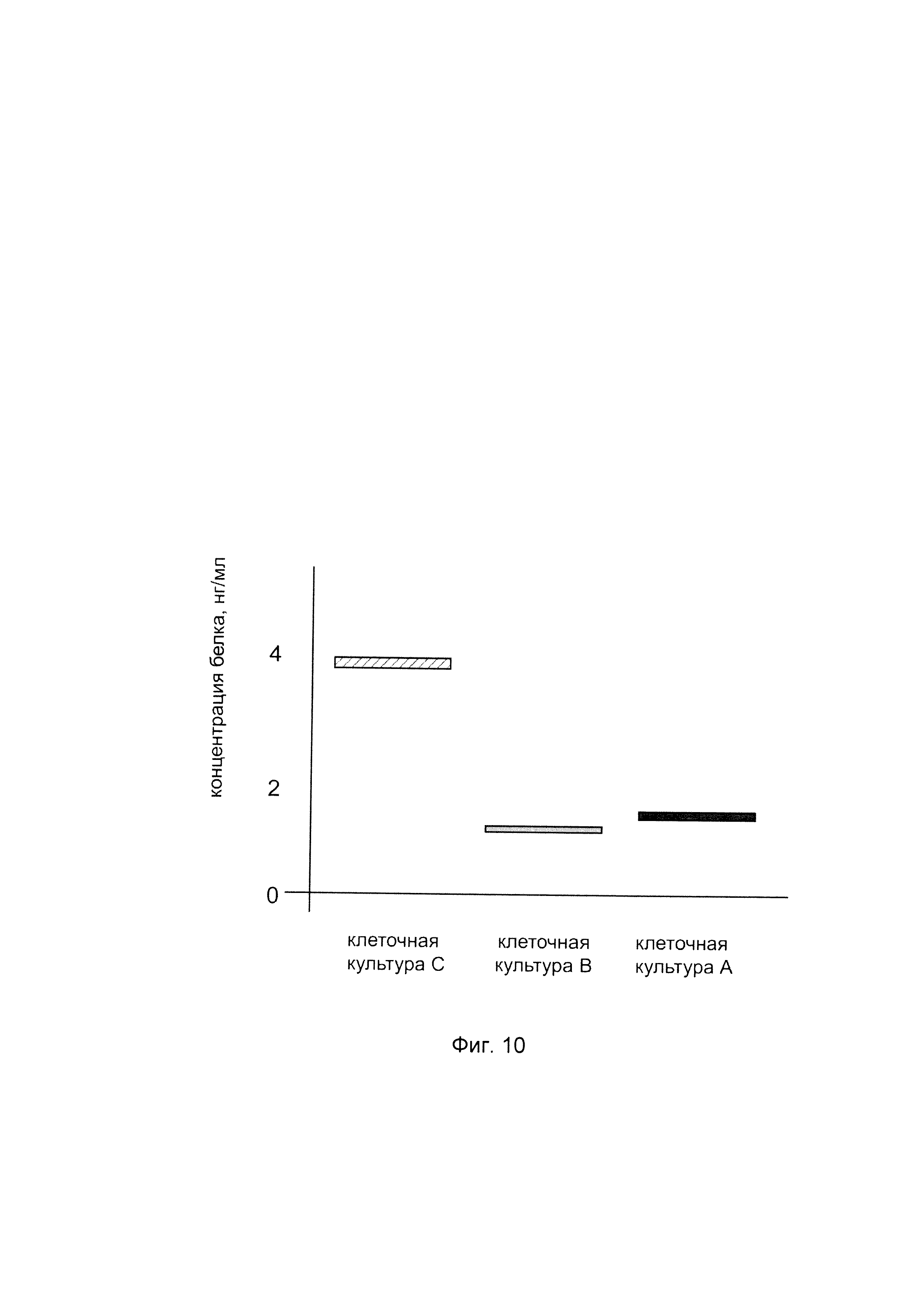
На фиг. 10
показана диаграмма концентрации белка аквапорин 5 в клеточном лизате первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC после трансфекции этих клеток ДНК-вектором VTvaf17-AQ5, несущим участок, гена AQ5 человека с целью оценки изменения количества белка аквапорин 5 в клеточном лизате первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC при трансфекции этих клеток ДНК-вектором VTvaf17-AQ5, несущим участок, кодирующий ген AQ5, где:
культура А - первичная культура гладкомышечных клеток мочевого пузыря человека трансфицированных водным раствором дендримеров без ДНК-вектора (контроль);
культура В - первичная культура гладкомышечных клеток мочевого пузыря человека трансфицированных ДНК-вектором VTvaf17;
культура С - первичная культура гладкомышечных клеток мочевого пузыря человека трансфицированных ДНК-вектором VTvaf17-AQ5, несущим участок гена AQ5.
На фиг. 11
показана диаграмма концентрации белка аквапорин 3 в лизате культуры клеток трахеального эпителия человека линии CFTE 29о-, после трансфекции этих клеток ДНК-вектором VTvaf17-AQ3, несущим участок, гена AQ3 человека с целью оценки изменения количества белка аквапорин 3 в лизате культуры клеток трахеального эпителия человека линии CFTE 29о-, при трансфекции этих клеток ДНК-вектором VTvaf17-AQ3, несущим участок, кодирующий ген AQ3, где:
культура А - культура клеток трахеального эпителия человека линии CFTE 29о-, трансфицированных водным раствором дендримеров без ДНК-вектора (контроль);
культура В - культура клеток трахеального эпителия человека линии CFTE 29о-, трансфицированных ДНК-вектором VTvaf17;
культура С - культура клеток трахеального эпителия человека линии CFTE 29о-, трансфицированных ДНК-вектором VTvaf17-AQ3, несущим участок гена AQ3.
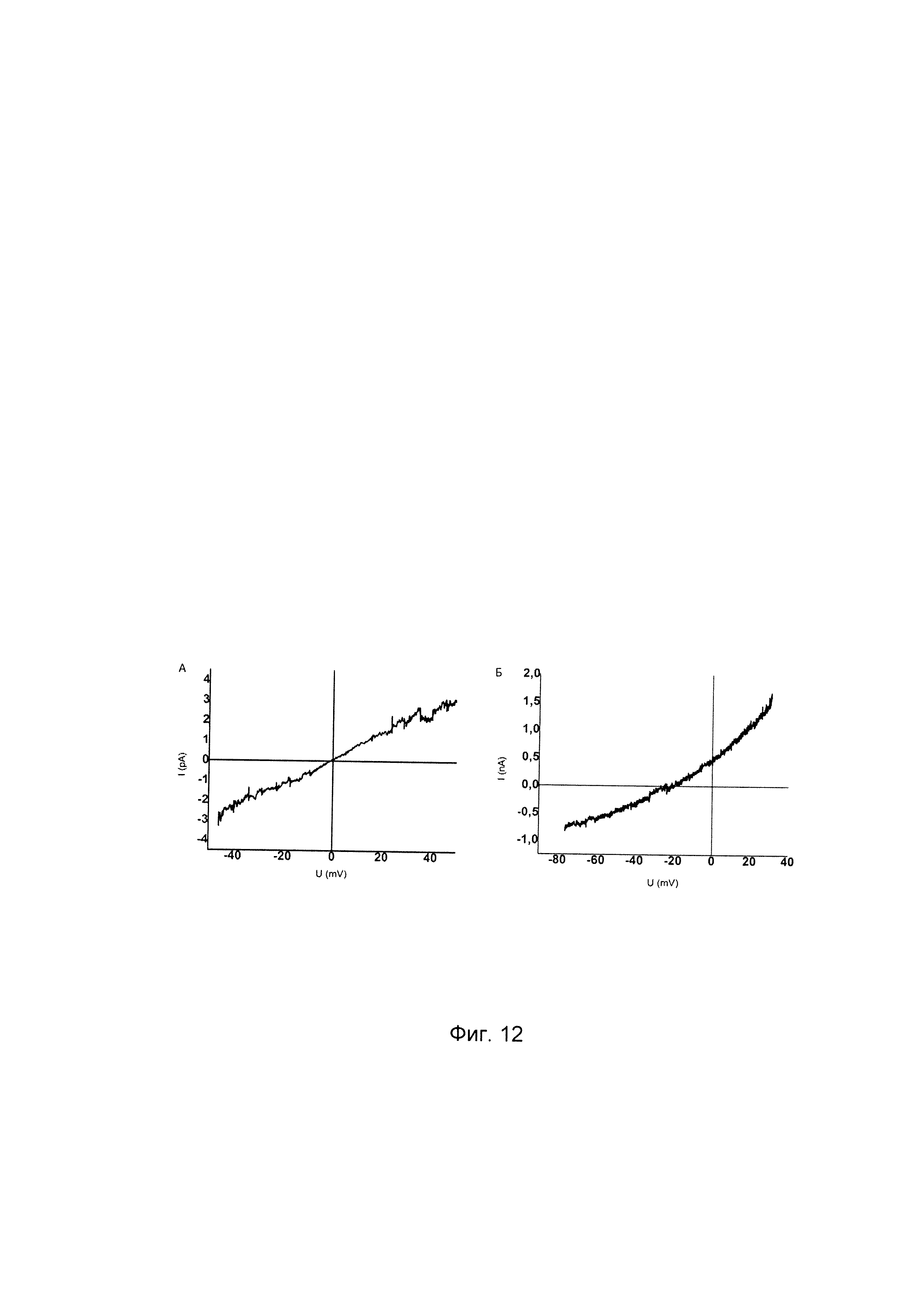
На фиг. 12
показаны вольт-амперные характеристики нетрансфицированных клеток CFTE29o- (А) и клеток CFTE29o-, трансфицированных вектором VTvaf17-CFTR, экспрессирующим ген CFTR (Б), при отсутствии Na+и К+ токов.
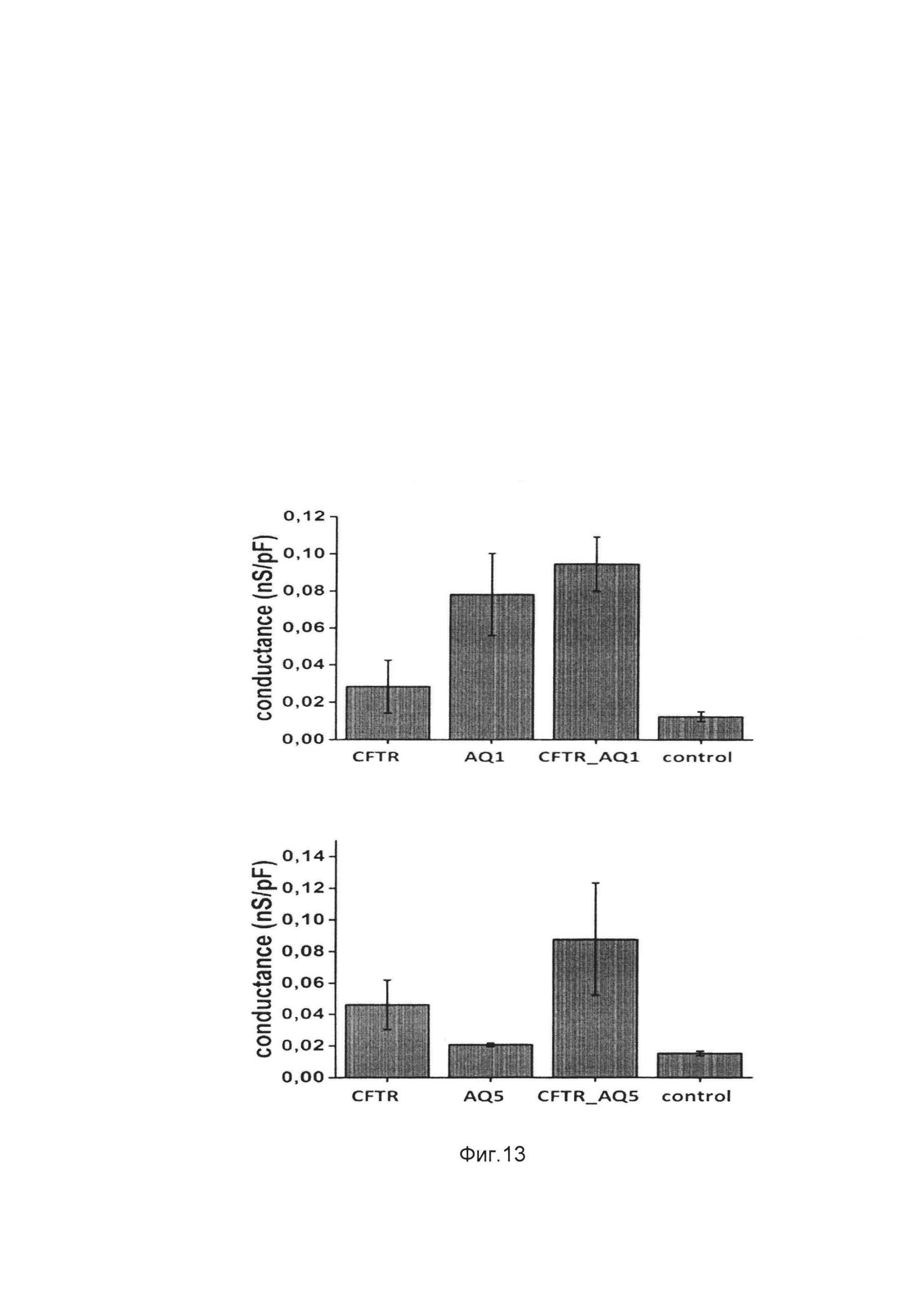
На фиг. 13
показаны средние значения проводимости клеточной мембраны, нормированные на электрическую емкость мембраны клетки (G/C=I/(UC) клеток CFTE29o- после трансфекции их ДНК-векторами VTvaf17-CFTR, VTvaf17-AQ1, (экспрессирующими гены CFTR и AQ1), а также при котрансфекции клеток CFTE29o- ДНК-векторами VTvaf17-CFTR и VTvaf17-AQ1 (А) и средние значения потенциала покоя клеток CFTE29o- после трансфекции их ДНК-векторами VTvaf17-CFTR, VTvaf17-AQ5, (экспрессирующими гены CFTR и AQ5), а также при котрансфекции клеток CFTE29o- ДНК-векторами VTvaf17-CFTR и VTvaf17-AQ5 (Б), где:
control - клетки, трансфицированные ДНК-вектором VTvaf17;
CFTR - клетки CFTE29o-, трансфицированные ДНК-вектором VTvaf17-CFTR;
AQ1 - клетки CFTE29o-, трансфицированные ДНК-вектором VTvaf17-AQ1;
AQ5 - клетки CFTE29o-, трансфицированные ДНК-вектором VTvaf17-AQ5;
CFTR_AQ1 - клетки CFTE29o-, котрансфицированные ДНК-векторами VTvaf17-CFTR и VTvaf17-AQ1;
CFTR_AQ5 - клетки CFTE29o-, котрансфицированные ДНК-векторами VTvaf17-CFTR и VTvaf17-AQ5.
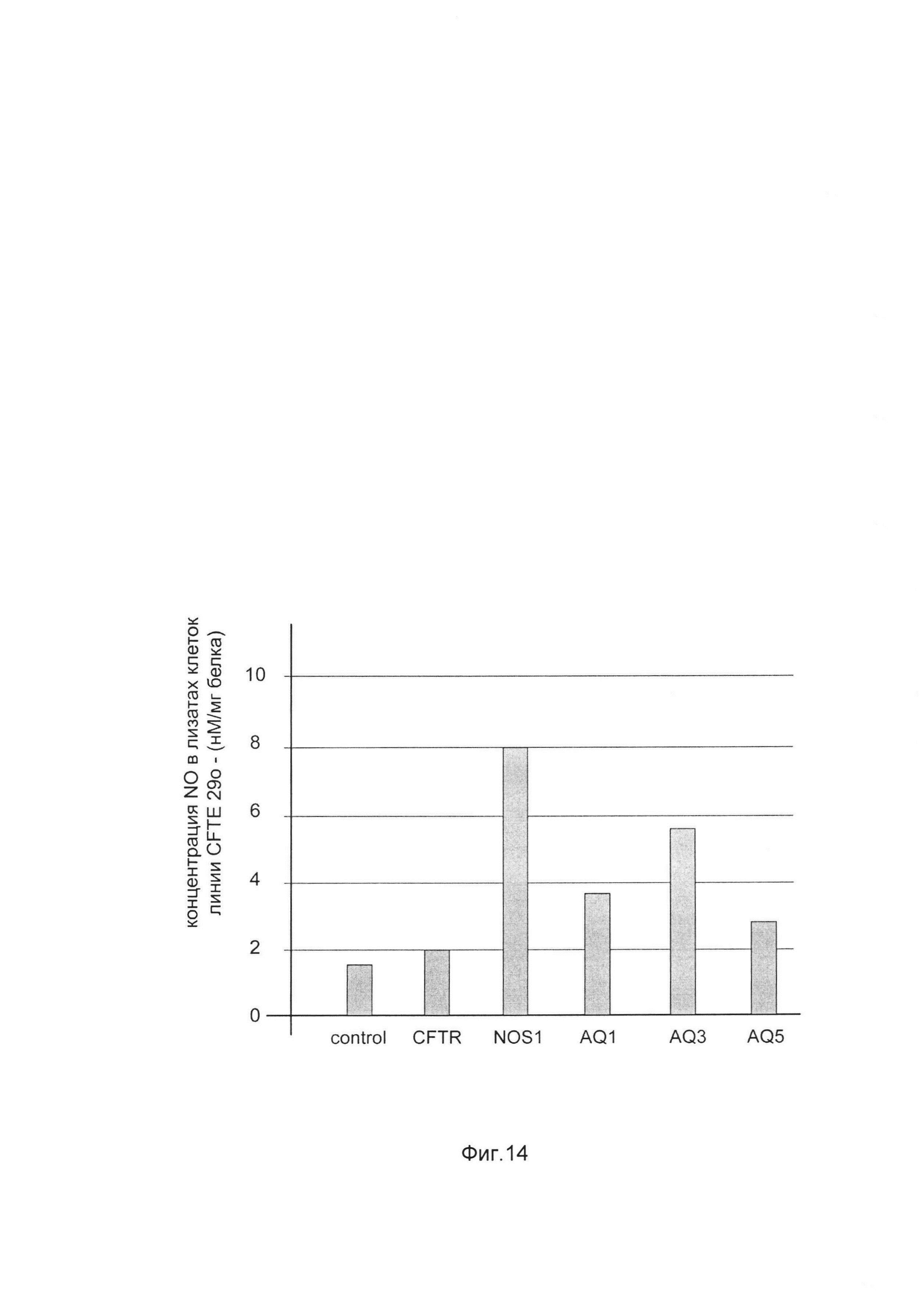
На фиг. 14
показана диаграмма концентрации оксида азота в клеточных лизатах линии CFTE29o- после трансфекции и ко-трансфекции этих клеток ДНК-векторами, VTvaf17-CFTR, VTvaf17-NOS1, VTvaf17-AQ1, VTvaf17-AQ3, VTvaf17-AQ5 каждый из которых несет целевой ген, а именно, ген CFTR, NOS1, AQ1, AQ3, AQ5, где:
control - клетки CFTE29o, трансфицированные ДНК-вектором VTvaf17 с транспортной системой Jet-Pei;
CFTR - клетки CFTE29o, трансфицированные ДНК-вектором VTvaf17-CFTR с транспортной системой Jet-Pei;
NOS1 - клетки CFTE29o, трансфицированные ДНК-вектором VTvaf17-NOS1 с транспортной системой Jet-Pei;
AQ1 - клетки CFTE29o, трансфицированные ДНК-вектором VTvaf17-AQ1 с транспортной системой Jet-Pei;
AQ3 - клетки CFTE29o, трансфицированные ДНК-вектором VTvaf17-AQ3 с транспортной системой Jet-Pei;
AQ5 - клетки CFTE29o, трансфицированные ДНК-вектором VTvaf17-AQ5 с транспортной системой Jet-Pei.
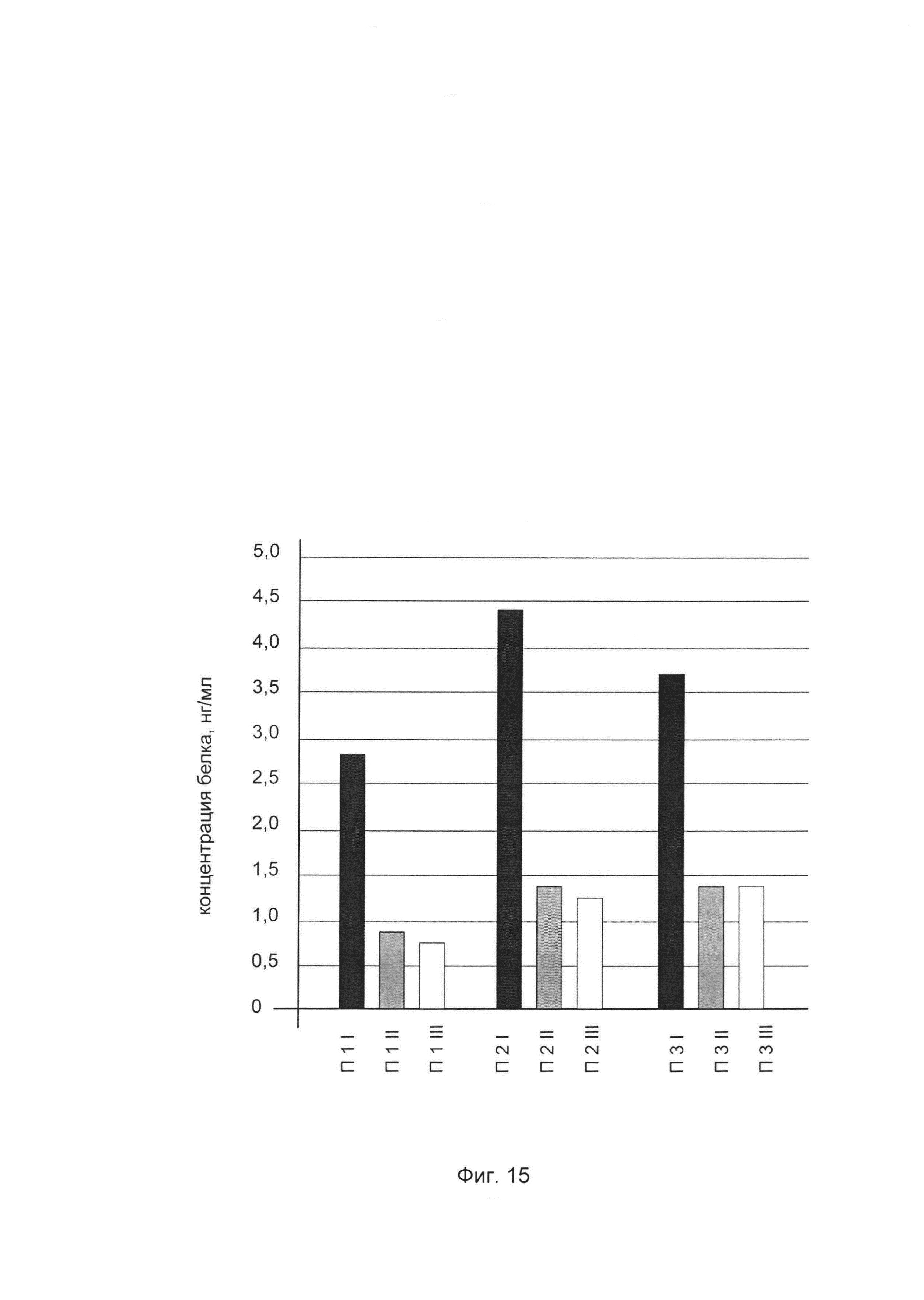
На фиг. 15
показана диаграмма концентрации белка аквапорин 1 в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего участок целевого гена, а именно, гена AQ1 человека для оценки изменения количества белка аквапорин 1 в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего ген AQ1 человека, где:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-AQ1, несущего участок гена AQ1;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17, не несущего участок гена AQ1 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка;
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-AQ1, несущего участок гена AQ1;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора AQ1, не несущего участок гена AQ1 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-AQ1, несущего участок гена AQ1;
ПI3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17, не несущего участок гена AQ1 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
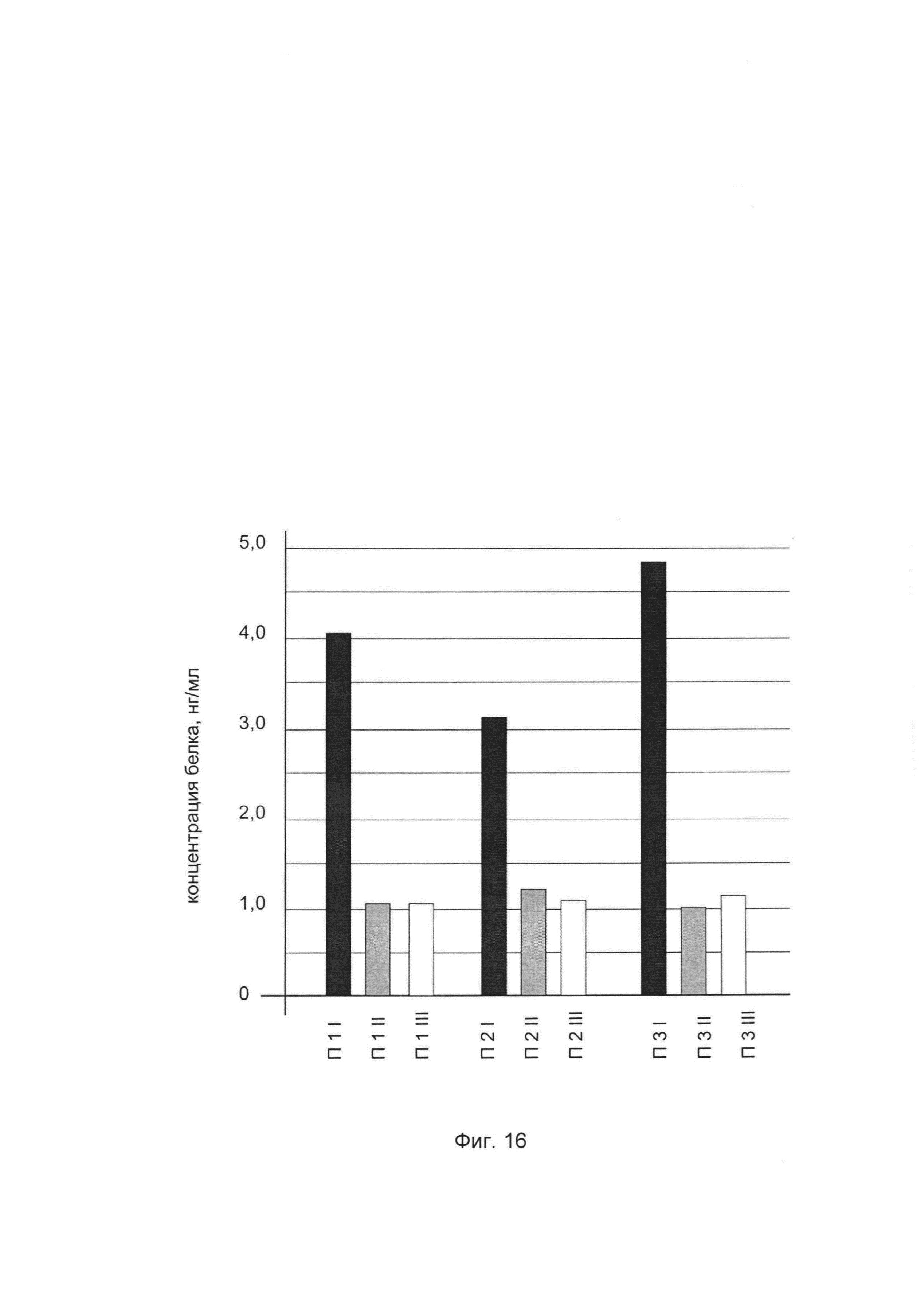
На фиг. 16
показана диаграмма концентрации белка нейрональная синтаза оксида азота 1 типа в биоптатах икроножной мышцы трех пациентов после введения в икроножную мышцу этих пациентов генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего участок целевого гена, а именно, гена NOS1 человека для оценки изменения количества белка нейрональная синтаза оксида азота 1 типа в икроножной мышце человека при введении в икроножную мышцу человека генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего ген NOS1 человека, где:
П1I - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS1, несущего участок гена NOS1;
П1II - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17, не несущего участок гена NOS1 (плацебо);
П1III - биоптат икроножной мышцы пациента П1 из интактного участка;
П2I - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS1, несущего участок гена NOS1;
П2II - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора NOS1, не несущего участок гена NOS1 (плацебо);
П2III - биоптат икроножной мышцы пациента П2 из интактного участка;
П3I - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS1, несущего участок гена NOS1;
ПI3I - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17, не несущего участок гена NOS1 (плацебо);
П3III - биоптат икроножной мышцы пациента П3 из интактного участка.
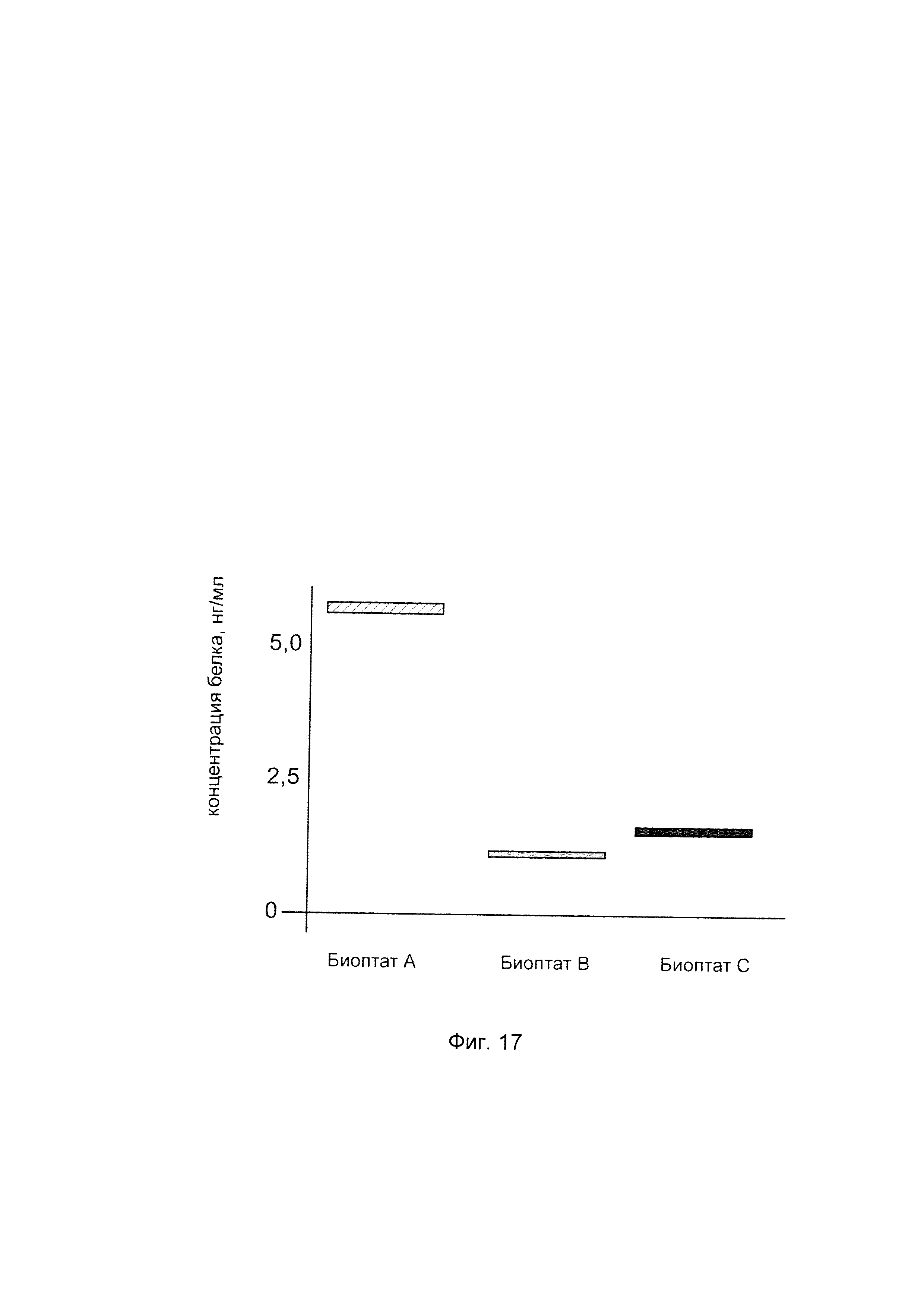
На фиг. 17
показана диаграмма концентрации белка трансмембранный регулятор кистозного фиброза в биоптатах легких и бронхов крысы линии Sprague-Dawley после ингаляционного введения в полость легких и бронхов крысы генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего участок целевого гена, а именно, гена CFTR человека для оценки изменения количества белка трансмембранный регулятор кистозного фиброза в легких и бронхах крысы при введении в полость легких и бронхов группы крыс генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего ген CFTR человека, где:
А - биоптат легкого крысы контрольной группы (ингаляция физиологического раствора);
В - биоптат легкого крысы контрольной группы (ингаляция ДНК-вектором VTvaf17, не несущим кДНК гена CFTR);
С - биоптат легкого крысы контрольной группы (ингаляция ДНК-вектором VTvaf17, несущим кДНК гена CFTR).
На фиг. 18
показана диаграмма концентрации белка аквапорин 3 в биоптатах кожи человека после введения в кожу культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3, для оценки изменения количества белка аквапорин 3 в коже в сравнении с количеством белка аквапорин 3 в области введения в кожу пациента культуры аутогенных фибробластов, нетрансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 (плацебо), где:
П1А - биоптат кожи пациента П1 в зоне введения культуры аутогенных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим ген AQ3;
П1В - биоптат кожи пациента П1 в зоне введения культуры аутогенных фибробластов пациента, нетрансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим ген AQ3
П1С - биоптат кожи пациента П1 из участка интактной кожи.
Реализация изобретения
На основе генотерапевтического ДНК-вектора VTvaf17 (Cell and Gene Therapy LLC, PIT Ltd.) размером 3165 п.н. созданы генотерапевтические ДНК-векторы, несущие целевые гены человека предназначенные для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов. При этом способ получения каждого генотерапевтического ДНК-вектора, несущего целевые гены человека заключается в том, что, в полилинкер генотерапевтического ДНК-вектора VTvaf17 клонируют целевой ген, а именно, CFTR (ген трансмембранного регулятора проводимости муковисцидоза, или трансмембранный регулятор кистозного фиброза), NOS1 (ген нейрональной синтазы оксида азота 1 типа), AQ1 (ген аквапорина 1), AQ3 (ген аквапорина 3), AQ5 (ген аквапорина 5) человека.
Возникновение мутаций и нарушение экспрессии генов CFTR, NOS1, AQ1, AQ3, AQ5 приводит к развитию различных заболеваний человека.
Белок CFTR, кодируемый одноименным геном трансмембранного регулятора проводимости муковисцидоза, является мембранным каналом для активной секреции ионов хлора из клетки в просвет выводных протоков экзокринных желез и выполняет роль переключателя, регулирующего абсорбцию ионов натрия, участвует в регуляции функции других ионных каналов в клеточной мембране. Следствием мутации гена является нарушение синтеза, структуры и функции этого белка, в результате чего хлорные каналы становятся непроницаемыми для ионов хлора при гиперабсорбции натрия и одновременном поступлении в клетку воды. Это приводит к дегидратации апикальной поверхности секреторного эпителия и, соответственно, к увеличению вязкости слизи. Заболевание, обусловленное наличием мутаций в гене CFTR получило название муковисцидоз. Это наследственное мультисистемное заболевание, поражающее дыхательные пути, желудочно-кишечный тракт, печень, поджелудочную железу, слюнные, потовые железы, репродуктивную систему. При этом патология дыхательных путей является главной причиной осложнений и летальности (Национальный консенсус «Муковисцидоз: определение, диагностические критерии, терапия» Под редакцией Е.И. Кондратьевой, Н.Ю. Каширской, Н.И. Капранова. Москва. 2016).
Показано, что введение нормальной копии гена CFTR в составе невирусного вектора путем небулизации в дыхательные пути пациентов с муковисцидозом приводило к хотя и небольшому, но выраженному терапевтическому эффекту в течение 12 месяцев по сравнению с контрольной группой (Alton Е. et al. Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis: a randomised, double-blind, placebo-controlled, phase 2b trial. Lancet Respir Med. 2015 Sep; 3(9):684-691).
Белок нейрональная синтаза оксида азота 1 типа, кодируемый геном NOS1, является ферментом, катализирующим образование оксида азота и цитруллина из аргинина, кислорода и NADPH. У млекопитающих имеются три изоформы NO-синтазы: эндотелиальная eNOS (также NOS3), нейрональная nNOS (также NOS1) и индуцибельной iNOS (также NOS2). Нейрональная синтаза оксида азота 1 типа экспрессируется не только в клетках нервной ткани, но и в мышцах. Функции нейронального оксида азота чрезвычайно разнообразны: он контролирует осцилляторную активность нейронов, является медиатором ноцицепции, термочувствительности, регулирует выход нейромедиаторов. Оксид азота, продуцируемый в мозге, является одним из важнейших рычагов, с помощью которых нервная система управляет тонусом сосудов, снабжающих кровью все системы организма.
В настоящее время в исследовательских работах, а также в клинике определена целая группа заболеваний, в развитии которых наблюдаются выраженные изменения в обмене оксида азота. Прежде всего, это заболевания сердечно-сосудистой системы, такие как гипертония, инфаркт миокарда, атеросклероз, инсульты. Изменения активности синтаз оксида азота наблюдаются при диабете, нейродегенеративных и онкологических заболеваниях, остром и хроническом воспалении различных органов и тканей. Установлена чрезвычайно важная роль оксида азота в регуляции сосудистого тонуса. (Пожилова Е.В., Новиков В.Е. Синтаза оксида азота и эндогенный оксид азота в физиологии и патологии клетки // Вестник Смоленской государственной медицинской академии. 2015, №4, С. 35-41).
Недавние исследования указывают на связь активности гена NOS1 и тяжестью протекания муковисцидоза. Показано, что оксид азота, синтезируемый с помощью гена NOS1, так называемого «гена-модификатора», влияет на трансэпителиальный транспорт ионов, иммунный ответ и на развитие неспецифического воспаления дыхательных путей при муковисцидозе (Texereau J, Marullo S, Hubert D, Coste J, Dusser DJ, Dall'Ava-Santucci J, Dinh-Xuan AT. Nitric oxide synthase 1 as a potential modifier gene of decline in lung function in patients with cystic fibrosis. Thorax. 2004. 59(2): 156-158).
Аквапорины - семейство аллостерически регулируемых белков, формирующих ионные каналы цитоплазматической мембраны, которые пропускают воду. Это семейство содержит 11 членов, локализованных в разных органах. Пространственная структура этих белков напоминает цилиндрический канал, по которому движутся молекулы воды, но не ионы. Благодаря аквапоринам клетки не только регулируют свой объем и внутреннее давление, но и выполняют такие важные функции, как всасывание воды в почках и другие. Предполагается, что аквапорины участвуют в развитии ряда наследственных и приобретенных заболеваний, в том числе таких, как отек мозга, цирроз, сердечная недостаточность, глаукома.
Кроме того, показана тесная взаимосвязь аквапоринов типов 1, 3 и 5 с трансмембранным регулятором проводимости муковисцидоза. Так, аквапорин 3 активирует CFTR в эпителиальных клетках дыхательных путей (Schreiber R, Nitschke R, Greger R, Kunzelmann K. The cystic fibrosis transmembrane conductance regulator activates aquaporin 3 in airway epithelial cells. J Biol Chem. 1999. 274(17): 11811-11816.). Гены AQ3 и AQ5 участвуют в регуляции водного балланса в эпителиальных клетках у пациентов с муковисцидозом (Levin МН, Sullivan S, Nielson D, Yang В, Finkbeiner WE, Verkman AS. Hypertonic saline therapy in cystic fibrosis: Evidence against the proposed mechanism involving aquaporins. J Biol Chem. 2006/ 281(35):25803-25812).
Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CFTR или NOS1 или AQ1 или AQ3 или AQ5 заключается в том, что каждый из группы генотерапевтических ДНК-векторов: ДНК-вектор VTvaf17-CFTR, или VTvaf17-NOS1, или VTvaf17-AQ1, или VTvaf17-AQ3, или VTvaf17-AQ5 получали следующим образом: кодирующую часть целевого гена CFTR, или NOS1, или AQ1, или AQ3, или AQ5 клонировали в генотерапевтический ДНК-вектор VTvaf17 и получали генотерапевтический ДНК-вектор VTvaf17-CFTR, SEQ ID №1, или VTvaf17-NOS1, SEQ ID №2 или VTvaf17-AQ1, SEQ ID №3, или VTvaf17-AQ3, SEQ ID №4, или VTvaf17-AQ5, SEQ ID №5, соответственно, при этом кодирующую часть целевого гена CFTR или NOS1, или AQ1, или AQ3, или AQ5 получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщеплением продукта амплификации соответствующими эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводили по сайтам рестрикции SalI и KpnI, или по сайтам рестрикции BamHI и EcoRI, а селекцию проводили без антибиотиков.
Кодирующую часть гена CFTR размером 4459 п. н., или гена NOS1 размером 4321 п.н., или гена AQ1 размером 853 п. н., или гена AQ3 размером 895, или гена AQ5 размером 814 п.н. получали путем выделения суммарной РНК из биологического образца ткани здорового человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации, с использованием созданных для этого методом химического синтеза олигонуклеотидов.
Для получения первой цепи кДНК генов CFTR, NOS1, AQ1, AQ3, AQ5 человека использовали обратную транскриптазу Mint (Евроген, Россия). К 6 мкл суммарной РНК добавляли 4 мкл буфера Mint, 2 мкл дитиотреитола, 2 мкл ревертазы Mint 2 мкл смеси dNTP, и по 2 мкл созданных олигонуклеотидов:
для гена CFTR - CFTR_F и CFTR_R (перечень последовательностей олигонуклеотидов (1) и (2);
для гена NOS1 - NOS1_F и NOS1_R (перечень последовательностей олигонуклеотидов (5) и (6);
для гена AQ1 - AQ1_F и AQ1_R (перечень последовательностей олигонуклеотидов (9) и (10);
для гена AQ3 - AQ3_F и AQ3_R (перечень последовательностей олигонуклеотидов (13) и (14);
для гена AQ5 - AQ5_F и AQ5_R (перечень последовательностей олигонуклеотидов (17) и (18).
Данную смесь для каждого гена инкубировали при 42°С в течении 2 часов. Полученную кДНК каждого гена использовали как матрицу при ПЦР-амплификации с использованием этих же олигонуклеотидов при условиях:
95°С - 1 мин; 30 циклов: 95°С - 30 сек, 60°С - 30 сек и 72°С - 2 мин, с финальной элонгацией 72°С - 3 мин.
Для подтверждения эффективности созданного генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR, генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1, генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3, генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего целевой ген, а именно, ген AQ5 оценивали:
A) изменение накопления мРНК целевых генов в клеточном лизате, после трансфекции различных клеточных линий генотерапевтическими ДНК-векторами;
B) изменение количественного уровня целевых белков в клеточном лизате, после трансфекции различных клеточных линий генотерапевтическими ДНК-векторами;
C) изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани генотерапевтических ДНК-векторов;
D) изменение количественного уровня целевых белков в супернатанте биоптатов тканей животного (крысы), после введения в эти ткани генотерапевтических ДНК-векторов;
E) изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани аутологичных клеток этого человека, трансфицированных генотерапевтическими ДНК-векторами;
F) изменение равновесного потенциала клеток, наличие и уровень токов ионов хлора через клеточную мембрану после трансфекции клеточных линий генотерапевтическими ДНК-векторами;
G) зависимость ионного тока, текущего через мембрану клетки от величины приложенного к ней потенциала путем измерения проводимости мембран клеток котрансфицированных генотерапевтическими ДНК-векторами;
H) изменение концентрации оксида азота в клетках после их трансфекции и ко-трансфекции генотерапевтическими ДНК-векторами.
Для подтверждения реализуемости способа использования созданного генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR, генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1, генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3, генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего целевой ген, а именно, ген AQ5 выполняли:
I) трансфекцию генотерапевтическими ДНК-векторами различных клеточных линий человека;
J) введение генотерапевтических ДНК-векторов в различные ткани человека и животного;
K) введение в ткани человека аутологичных клеток, трансфицированных генотерапевтическими ДНК-векторами.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR, генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1, генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3, генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего целевой ген, а именно, ген AQ5 выполняли:
L) ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17-CFTR или штамма Escherichia coli SCS110-AF/VTvaf17-NOS1 или штамма Escherichia coli SCS110-AF/VTvaf17-AQ1, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ3, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ5, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий участок целевого гена, а именно CFTR, или NOS1, или AQ1, или AQ3, или AQ5.
Пример 1
Получение генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего участок целевого гена, а именно, гена CFTR.
Генотерапевтический ДНК-вектор VTvaf17-CFTR
конструировали клонированием кодирующей части гена CFTR в ДНК-вектор VTvaf17 по сайтам рестрикции SalI и KpnI. Кодирующую часть гена CFTR размером 4459 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщепления продукта амплификации соответствующими эндонуклеазами рестрикции. В качестве созданных для этого олигонуклеотидов использовали олигонуклеотиды
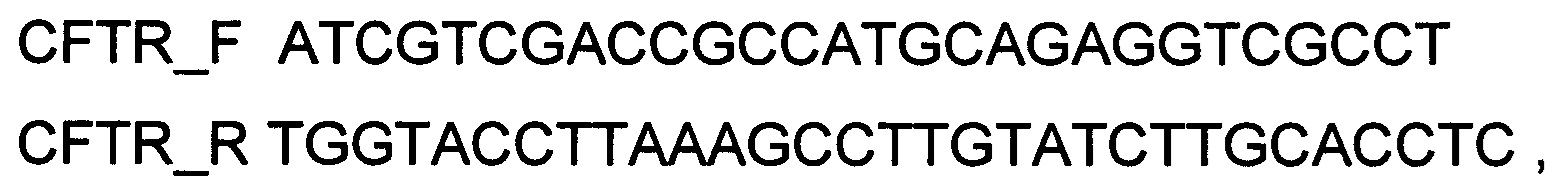
В результате получали ДНК-вектор VTvaf17-CFTR размером 7606 п.н. с нуклеотидной последовательностью SEQ ID №1, несущий участок целевого гена, а именно, гена CFTR, размером 4459 п.н. с возможностью селекции без антибиотиков. При этом генотерапевтический ДНК-вектор VTvaf17 конструировали объединением шести фрагментов ДНК, полученных из разных источников:
(а) ориджин репликации получали путем ПЦР-амплификации участка коммерческой плазмиды pBR322 с внесением точечной мутации;
(б) промоторный регион EF1a получали путем ПЦР-амплификации участка геномной ДНК человека;
(в) терминатор транскрипции hGH-TA получали путем ПЦР-амплификации участка геномной ДНК человека;
(г) регуляторный участок транспозона Tn10 PHK-out получали путем синтеза из олигонуклеотидов;
(д) ген устойчивости к канамицину получали путем ПЦР-амплификации участка коммерческой плазмиды рЕТ-28 человека;
(е) полилинкер получали отжигом двух синтетических олигонуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs) в соответствии с инструкцией производителя. Фрагменты имеют перекрывающиеся области для возможности их объединения с последующей ПЦР-амплификацией. Объединяли фрагменты (а) и (б) с использованием олигонуклеотидов Ori-F и EF1-R, а так же фрагменты (в), (г) и (д) с использованием олигонуклеотидов hGH-F и Kan-R Далее, полученные участки объединяли путем рестрикции с последующим лигированием по сайтам BamHI и Ncol. В результате получали плазмиду, пока еще не содержащую полилинкер. Для его введения проводили расщепление плазмиды по сайтам BamHI и EcoRI и лигирование с фрагментом (е). Таким образом, получали вектор размером 4182 п.н., несущий ген устойчивости к канамицину, который фланкирован сайтами рестрикции Spel. Далее этот участок выщепляли по сайтам рестрикции Spel, после чего оставшийся фрагмент лигировали сам на себя. Таким образом получали генотерапевтический ДНК-вектор VTvaf17 размером 3165 п.н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Пример 2
Получение генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего участок целевого гена, а именно, гена NOS1.
Генотерапевтический ДНК-вектор VTvaf17-NOS1 конструировали клонированием кодирующей части гена NOS1 в ДНК-вектор VTvaf17 по сайтам рестрикции SalI и KpnI. Кодирующую часть гена NOS1 размером 4321 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщепления продукта амплификации соответствующими эндонуклеазами рестрикции. В качестве созданных для этого олигонуклеотидов использовали олигонуклеотиды
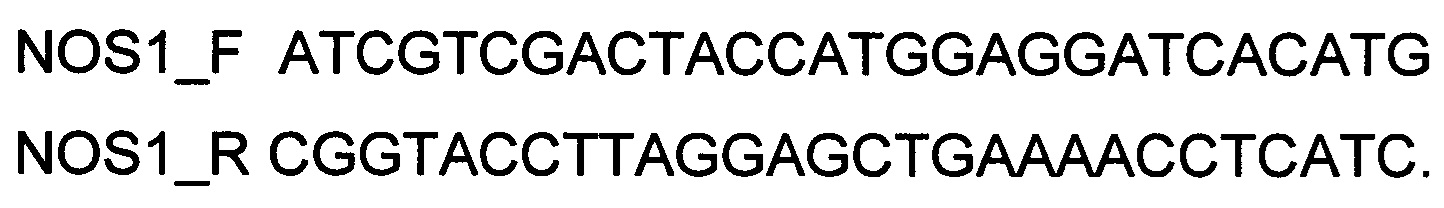
В результате получили ДНК-вектор VTvaf17-NOS1 размером 7468 п.н. с нуклеотидной последовательностью SEQ ID №2, несущий участок, целевого гена, а именно, гена NOS1, размером 4321 п.н. с возможностью селекции без антибиотиков. При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 3
Получение ДНК-вектора VTvaf17-AQ1, несущего участок, целевого гена, а именно, гена AQ1 человека.
Генотерапевтический ДНК-вектор VTvaf17-AQ1 конструировали клонированием кодирующей части гена AQ1 в ДНК-вектор VTvaf17 по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена AQ1 размером 853 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщепления продукта амплификации соответствующими эндонуклеазами рестрикции. В качестве созданных для этого олигонуклеотидов использовали олигонуклеотиды
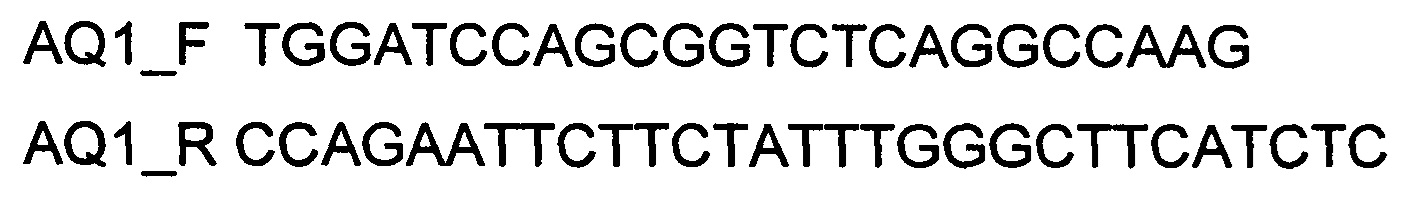
В результате получили генотерапевтический ДНК-вектор VTvaf17-AQ1 размером 3982 п.н. с нуклеотидной последовательностью SEQ ID №3 несущий участок гена AQ1, размером 853 п.н. с возможностью селекции без антибиотиков. При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 4
Получение генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего участок целевого гена, а именно, гена AQ3.
Генотерапевтический ДНК-вектор VTvaf17-AQ3 конструировали клонированием кодирующей части гена AQ3 в ДНК-вектор VTvaf17 по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена AQ3 размером 895 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщепления продукта амплификации соответствующими эндонуклеазами рестрикции. В качестве созданных для этого олигонуклеотидов использовали олигонуклеотиды

В результате получили ДНК-вектор VTvaf17-AQ3 размером 4024 п.н. с нуклеотидной последовательностью SEQ ID №4, несущий участок целевого гена, а именно, гена AQ3, размером 895 п.н. с возможностью селекции без антибиотиков. При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 5
Получение генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего участок целевого гена, а именно, гена AQ5.
Генотерапевтический ДНК-вектор VTvaf17-AQ5 конструировали клонированием кодирующей части гена AQ5 в ДНК-вектор VTvaf17 по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена AQ5 размером 814 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщепления продукта амплификации соответствующими эндонуклеазами рестрикции. В качестве созданных для этого олигонуклеотидов использовали олигонуклеотиды

В результате получили ДНК-вектор VTvaf17-AQ5 размером 3943 п.н. с нуклеотидной последовательностью SEQ ID №5, несущий участок, целевого гена, а именно, гена AQ5, размером 814 п.н. с возможностью селекции без антибиотиков. При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 6
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования оценивали изменения накопления мРНК целевого гена CFTR, в клетках линии CFTE 29о- («Коллекция культур клеток позвоночных» ИНЦ РАН), представляющие собой иммортализованные клетки трахеального эпителия человека, гомозиготные по мутации AF508 через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-CFTR, несущим участок, гена CFTR человека.
Клетки трахеального эпителия линии CFTE 29о- выращивали на чашках Петри при 37°С в атмосфере, содержащей 5% CO2, в среде DMEM (Gibco) с 10% фетальной телячьей сывороткой и гентамицином 10 мкг/мл. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-CFTR, экспрессирующим ген CFTR человека, проводили следующим образом. В пробирке №1 к 25 мкл среды Opti-MEM (Gibco) добавляли 1 мкл раствора ДНК-вектора VTvaf17-CFTR (концентрация 500 нг/мкл) и 1 мкл реагента Р3000. Аккуратно перемешивали легким встряхиванием. В пробирке №2 к 25 мкл среды Opti-MEM (Gibco) добавляли 1 мкл раствора Lipofectamine 3000. Аккуратно перемешивали легким встряхиванием. Добавляли содержимое пробирки №1 к содержимому пробирки №2, инкубировали 5 мин при комнатной температуре. Полученный раствор по каплям добавляли к клеткам в объеме 40 мкл.
В качестве контроля использовали клетки трахеального эпителия CFTE 29о-, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена. Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано выше.
Суммарную РНК из трансфицированных клеток выделяли следующим образом. В лунку с клетками добавляли 1 мл Trizol Reagent (ThermoFisher Scientific) и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14000 g в течении 10 мин и снова прогревали в течении 10 мин при 65°С. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14000 g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°С в течении 10 мин с последующим центрифугированием при 14000 g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Для определения уровня экспрессии мРНК гена CFTR после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена CFTR человека, использовали олигонуклеотиды CFTR_SF и CFTR_SR (перечень последовательностей олигонуклеотидов, (3), (4)). Длина продукта амплификации - 328 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) или другого набора для ПЦР в режиме реального времени в 20 мкл амплификационной смеси, содержащей: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 mM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл суммарной РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, USA) при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С -15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов CFTR и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов CFTR и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена CFTR в клетках трахеального эпителия линии CFTE 29о - после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17-CFTR, несущим участок, гена CFTR, на фиг. 2 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена CFTR после трансфекции генотерапевтическим вектором VTvaf17;
2 - кДНК гена CFTR после трансфекции генотерапевтическим вектором VTvaf17-CFTR, несущим участок гена CFTR;
3 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17;
4 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17-CFTR, несущим участок гена CFTR.
Из фигуры следует, что в результате трансфекции клеток трахеального эпителия линии CFTE 29о- генотерапевтическим ДНК-вектором VTvaf17-CFTR, уровень специфической мРНК гена CFTR человека вырос многократно, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR и подтверждает реализуемость способа его использования.
Пример 7
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 и реализуемости способа его использования оценивали изменения накопления мРНК целевого гена NOS1, в клетках нейробластомы человека SH-SY5Y (АТСС CRL-2266) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOS1, несущим участок гена NOS1 человека.
Клетки нейробластомы человека выращивали в среде DMEM, содержащей 4.5 г/л глюкозы и 10% эмбриональной телячьей сыворотки (Gibco) в атмосфере 5% CO2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-NOS1, экспрессирующим ген NOS1 человека, проводили как описано в примере 6. Суммарную РНК из трансфицированных клеток и построение первой цепи кДНК проводили как описано в примере 6. Для определения уровня экспрессии мРНК гена NOS1 после трансфекции использовли метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена NOS1 человека, использовали олигонуклеотиды NOS1_SF и NOS1_SR (перечень последовательностей олигонуклеотидов, (7), (8)). Длина продукта амплификации - 818 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) или другого набора для ПЦР в режиме реального времени в 20 мкл амплификационной смеси, содержащей: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 mM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл суммарной РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, USA) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов NOS1 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов NOS1 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена NOS1 в клетках нейробластомы человека SH-SY5Y (АТСС CRL-2266) после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17-NOS1, несущим участок, гена NOS1 на фиг. 3 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена NOS1 после трансфекции генотерапевтическим вектором VTvaf17;
2 - кДНК гена NOS1 после трансфекции генотерапевтическим вектором VTvaf17-NOS1, несущим участок гена NOS1;
3 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17;
4 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17-NOS1, несущим участок гена NOS1.
Из фигуры следует, что в результате трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOS1, несущим целевой ген, а именно, ген NOS1 человека, уровень специфической мРНК гена NOS1 человека вырос многократно, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1 и подтверждает реализуемость способа его использования.
Пример 8
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 и реализуемости способа его использования оценивали изменения накопления мРНК целевого гена AQ1, в клетках трахеального эпителия человека линии CFTE 29о- через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-AQ1, несущим участок гена AQ1 человека.
Клетки трахеального эпителия человека линии CFTE 29о-выращивали по примеру 6. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-AQ1, экспрессирующим ген AQ1 человека, проводили как описано в примере 6. В качестве контроля использовали клетки CFTE 29о-, трансфицированные генотерапевтическим ДНК-вектором VTvaf17. Суммарную РНК из трансфицированных клеток и построение первой цепи кДНК проводили как описано в примере 6. Для определения уровня экспрессии мРНК гена AQ1 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена AQ1 человека, использовали олигонуклеотиды AQ1_SF и AQ1_SR (перечень последовательностей олигонуклеотидов (11)), (12). Длина продукта амплификации - 357 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) или другого набора для ПЦР в режиме реального времени в 20 мкл амплификационной смеси, содержащей: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 mM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл суммарной РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, USA) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 30 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов AQ1 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов AQ1 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена AQ1 в клетках CFTE 29о- человека после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17-AQ1, несущим участок, гена AQ1 на фиг. 4 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена AQ1 после трансфекции генотерапевтическим вектором VTvaf17;
2 - кДНК гена AQ1 после трансфекции генотерапевтическим вектором VTvaf17-AQ1, несущим участок гена AQ1;
3 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17;
4 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17-AQ1, несущим участок гена AQ1.
Из фигуры следует, что в результате трансфекции клеток трахеального эпителия человека линии CFTE 29о- генотерапевтическим ДНК-вектором VTvaf17-AQ1, несущим целевой ген, а именно, ген AQ1 человека, уровень специфической мРНК гена AQ1 человека вырос многократно, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1 и подтверждает реализуемость способа его использования.
Пример 9
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3 и реализуемости способа его использования оценивали изменения накопления мРНК целевого гена AQ3, в первичной культуры клеток эпителия малых дыхательных путей человека HSAEC (АТСС PCS-301-01) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим участок, гена AQ3 человека.
Клетки линии первичной культуры эпителия малых дыхательных путей человека выращивали с использованием культуральной среды, входящий в набор Bronchial Epithelial Growth Kit (АТСС PCS-300-040) согласно инструкции фирмы производителя. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-AQ3, экспрессирующим ген AQ3 человека, проводили как описано в примере 6. В качестве контроля использовали клетки эпителия малых дыхательных путей человека HSAEC, трансфицированные генотерапевтическим ДНК-вектором VTvaf17. Суммарную РНК из трансфицированных клеток и построение первой цепи кДНК проводили как описано в примере 6. Для определения уровня экспрессии мРНК гена AQ3 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена AQ3 человека, использовали олигонуклеотиды AQ3_SF и AQ3_SR (перечень последовательностей олигонуклеотидов, (15), (16)). Длина продукта амплификации - 350 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) или другого набора для ПЦР в режиме реального времени в 20 мкл амплификационной смеси, содержащей: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 mM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл суммарной РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, USA) при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 30 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов AQ3 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов AQ3 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена AQ3 в клетках эпителия малых дыхательных путей человека после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим участок, гена AQ3 на фиг. 5 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена AQ3 после трансфекции генотерапевтическим вектором VTvaf17;
2 - кДНК гена AQ3 после трансфекции генотерапевтическим вектором VTvaf17-AQ3, несущим участок гена AQ3;
3 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17;
4 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17-AQ3, несущим участок гена AQ3.
Из фигуры следует, что в результате трансфекции первичной культуры клеток эпителия малых дыхательных путей человека генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 человека, уровень специфической мРНК гена AQ3 человека вырос многократно, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3 и подтверждает реализуемость способа его использования.
Пример 10
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего целевой ген, а именно, ген AQ5 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего целевой ген, а именно, ген AQ5 и реализуемости способа его использования оценивали изменения накопления мРНК целевого гена AQ5, в клетках первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (АТСС PCS-420-012) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-AQ5, несущим участок, гена AQ5 человека.
Клетки первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (АТСС PCS-420-012) выращивали в среде, входящей в состав Vascular Smooth Muscle Cell Growth Kit (ATCC® PCS-100-042™) в атмосфере 5% CO2 при 37°C. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-AQ5, экспрессирующим ген AQ5 человека, проводили как описано в примере 6. В качестве контроля использовали клетки HBdSMC трансфицированные генотерапевтическим ДНК-вектором VTvaf17. Суммарную РНК из трансфицированных клеток и построение первой цепи кДНК проводили как описано в примере 6. Для определения уровня экспрессии мРНК гена AQ5 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена AQ5 человека, использовали олигонуклеотиды AQ5_SF и AQ5_SR (перечень последовательностей олигонуклеотидов, (19), (20)). Длина продукта амплификации - 477 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) или другого набора для ПЦР в режиме реального времени в 20 мкл амплификационной смеси, содержащей: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 mM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл суммарной РНК. Реакцию осуществляют на амплификаторе CFX96 (Bio-Rad, USA) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С -15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 30 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов AQ5 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов AQ5 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена AQ5 в клетках HBdSMC после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17-AQ5, несущим участок, гена AQ5 на фиг. 6 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена AQ5 после трансфекции генотерапевтическим вектором VTvaf17;
2 - кДНК гена AQ5 после трансфекции генотерапевтическим вектором VTvaf17-AQ5, несущим участок гена AQ5;
3 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17;
4 - кДНК гена В2М после трансфекции генотерапевтическим вектором VTvaf17-AQ5, несущим участок гена AQ5.
Из фигуры следует, что в результате трансфекции клеток HBdSMC генотерапевтическим ДНК-вектором VTvaf17-AQ5, несущим целевой ген, а именно, ген AQ5 человека, уровень специфической мРНК гена AQ5 человека вырос многократно, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ5 и подтверждает реализуемость способа его использования.
Пример 11
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования оценивали изменение количества белка трансмембранный регулятор кистозного фиброза в лизате клеток трахеального эпителия человека линии CFTE 29о- после трансфекции этих клеток ДНК-вектором VTvaf17-CFTR, несущим ген CFTR человека.
Для оценки изменения количества белка трансмембранный регулятор кистозного фиброза, использовали клетки трахеального эпителия человека линии CFTE 29о-. Клетки трахеального эпителия человека линии CFTE 29о- выращивали по примеру 6.
В качестве транспортной молекулы использовали дендримеры SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия), в качестве контроля - водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена CFTR (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-CFTR, несущий участок гена CFTR человека. Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли среду DMEM не содержащую антибиотиков, до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл полной среды DMEM, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% CO2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли полную среду DMEM, содержащую 10 мкг/мл гентамицина и инкубировали 24-48 часов при 37°С в атмосфере 5% CO2.
После трансфекции к 0,5 мл культуральной жидкости приливали 0,1 мл 1N HCI, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2N NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение продукта гена CFTR проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) (SEC425Hu Cloud -Clone Corp., США). Чувствительность метода составляла 0.059 нг/мл, диапазон измерения - 0.156-10 нг/мл.
В наборе использованы высоко специфичные антитела к белку трансмембранный регулятор кистозного фиброза, адсорбированные в лунках микропланшета. В лунки добавляли по 100 мкл разведенных стандартных образцов и тестируемых образцов и инкубировали 2 часа при 37°С. Затем добавляли 100 мкл реагента А, закрывали планшет клейкой лентой и инкубировали 1 час при 37°С. Далее лунки промывали трехкратно 350 мкл промывочного буфера и добавляли 100 мкл реагента В с последующей инкубацией в течение 30 мин при 37°С. После инкубации проводили пятикратную отмывку 350 мкл промывочного буфера, затем добавляли 90 мкл раствора субстрата и инкубировали 20-25 мин при 37°С. Реакцию останавливали добавлением 50 мкл стоп-раствора и измеряли оптическую плотность при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США). Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка трансмембранный регулятор кистозного фиброза, входящим в состав набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Показано, что трансфекция клеток трахеального эпителия человека линии CFTE 29о- ДНК-вектором, несущим кДНК гена CFTR, приводит к увеличению количества белка трансмембранный регулятор кистозного фиброза в клетках трахеального эпителия человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR и подтверждает реализуемость способа его использования. Результаты показаны на фигуре 7.
Пример 12
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 и реализуемости способа его использования оценивали изменение количества белка нейрональная синтаза оксида азота 1 типа в лизате клеток нейробластомы человека SH-SY5Y (АТСС CRL-2266) после трансфекции этих клеток ДНК-вектором VTvaf17-NOS1, несущим ген NOS1 человека.
Для оценки изменения количества белка нейрональная синтаза оксида азота 1 типа использовали культуру клеток нейробластомы человека SH-SY5Y (АТСС CRL-2266). Клетки выращивали как описано в примере 7. В качестве транспортной молекулы использовали дендримеры SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия), в качестве контроля - водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена NOS1 (В), в качестве трансфицирующих агентов - ДНК-вектор VTvaf17-NOS1, несущий участок, гена NOS1 человека SEQ ID No: 2(C). Приготовление комплекса ДНК-дендример и трансфекцию клеток SH-SY5Y проводили как описано в примере 11.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15000 об/мин в течении 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта гена NOS1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Nitric Oxide Synthase 1, Neuronal (NOS1) (SEA815Hu, Cloud -Clone Corp., США). Чувствительность метода составила 0.065 нг/мл, диапазон измерения - 0.156-10 нг/мл.
Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили как описано в примере 11.
Показано, что трансфекция клеток культуры нейробластомы человека SH-SY5Y ДНК-вектором, несущим кДНК гена NOS1, приводит к увеличению количества белка нейрональная синтаза оксида азота 1 типа, в клетках SH-SY5Y, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1 и подтверждает реализуемость способа его использования. Результаты показаны на фигуре 8.
Пример 13
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген AQ1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген AQ1 и реализуемости способа его использования оценивали изменение количества белка аквапорин 1 в лизате клеток трахеального эпителия линии CFTE 29о- после трансфекции этих клеток ДНК-вектором VTvaf17-AQ1, несущим ген AQ1 человека.
Для оценки изменения количества белка аквапорин 1, использовали первичную культуру клеток трахеального эпителия линии CFTE 29о- по Примеру 6, в качестве транспортной молекулы - дендримеры SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия), в качестве контроля - водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена AQ1 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-AQ1, несущий участок гена AQ1 человека SEQ ID No: 3 (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток трахеального эпителия человека проводили согласно Примеру 11.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15000 об/мин в течении 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена AQ1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Aquaporin 1, Colton Blood Group (AQP1) (SEA579Hu, Cloud -Clone Corp., США). Чувствительность метода составила 0.09 нг/мл, диапазон измерения - 0.25-16 нг/мл.
Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили по примеру 11.
Показано, что трансфекция клеток трахеального эпителия линии CFTE 29о- человека ДНК-вектором, несущим кДНК гена AQ1, приводит к увеличению количества белка аквапорин 1 в клетках трахеального эпителия линии CFTE 29о- человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1 и подтверждает реализуемость способа его использования. Результаты показаны на фигуре 9.
Пример 14
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего целевой ген AQ5 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ5, несущего целевой ген AQ5 и реализуемости способа его использования, оценивали изменения количества белка аквапорин 5 в лизате клеток первичной культуры гладкомышечных клеток мочевого пузыря человека HBdSMC (АТСС PCS-420-012) после трансфекции этих клеток ДНК-вектором VTvaf17-AQ5, несущим участок гена AQ5 человека.
Для оценки изменения количества белка аквапорин 5, использовали первичную культуру гладкомышечных клеток мочевого пузыря человека HBdSMC (АТСС PCS-420-012) по примеру 10, в качестве транспортной молекулы - дендримеры SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия), в качестве контроля - водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена AQ5 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-AQ5, несущий участок гена AQ5 человека, SEQ ID No: 5 (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток мочевого пузыря человека проводили согласно примеру 11.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15000 об/мин в течении 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена AQ5 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Aquaporin 5 (AQP5) (SEA583Hu, Cloud -Clone Corp., США). Чувствительность метода составляла 0.055 нг/мл, диапазон измерения - 0.156-10 нг/мл.
Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили по примеру 11.
Показано, что трансфекция первичной культуры гладкомышечных клеток мочевого пузыря человека ДНК-вектором, несущим кДНК гена AQ5, приводит к увеличению количества белка аквапорин 5 в клетках мочевого пузыря человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ5 и подтверждает реализуемость способа его использования. Результаты показаны на фигуре 10.
Пример 15
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3 и реализуемости способа его использования оценивали изменения количества белка аквапорин 3 в лизате клеток эпителия малых дыхательных путей человека HSAEC (АТСС PCS-301-01) после трансфекции этих клеток ДНК-вектором VTvaf17-AQ3, несущим участок, гена AQ3 человека.
Для оценки изменения количества белка аквапорин 3, использовали клетки эпителия малых дыхательных путей человека HSAEC (АТСС PCS-301-01) по примеру 10, в качестве транспортной молекулы - дендримеры SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия), в качестве контроля - водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена AQ3 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-AQ3, несущий участок, гена AQ3 человека, SEQ ID No: 4 (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток эпителия малых дыхательных путей человека HSAEC (АТСС PCS-301-01) проводили согласно Примеру 11.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляют 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15000 об/мин в течении 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена AQ3 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Aquaporin 3, Gill Blood Group (AQP3) (SEA581Hu, Cloud -Clone Corp., США). Чувствительность метода составила 0.058 нг/мл, диапазон измерения - 0.156-10 нг/мл.
Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили по примеру 11.
Показано, что трансфекция клеток эпителия малых дыхательных путей человека HSAEC (АТСС PCS-301-01) ДНК-вектором, несущим кДНК гена AQ3, приводит к увеличению количества белка аквапорин 3 в клетках эпителия малых дыхательных путей человека HSAEC (АТСС PCS-301-01), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3 и подтверждает реализуемость способа его использования. Результаты показаны на фигуре 11.
Пример 16
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования оценивали изменение равновесного потенциала клеток CFTE 29о-, трансфицированных ДНК-вектором VTvaf17-CFTR, экспрессирующим ген CFTR.
Для этого готовили серию буферных растворов.
Внешний буфер А: 145 мМ NaCl; 10 мМ HEPES; 10 мМ D-глюкоза, рН7.4
Внутренний буфер А: 145 мМ KCI; 10 мМ HEPES, рН7.2
Внешний буфер Б: 140 мМ NMDG (N-methyl-d-glucamine), 140 мМ HCI, 2 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES, рН 7.4
Внутренний буфер Б: 140 мМ NMDG, 40 мМ HCI, 100 мМ L-глутаминовой кислоты, 0.2 мМ CaCl2, 2 MgCl2, 1 мМ EGTA, 10 мМ HEPES, рН 7.2.
За день до трансфекции клетки CFTE 29о- пересевали в 6-луночные планшеты в соотношении 6.5×105 клеток на лунку (90% конфлюэнтный монослой) в объеме 2 мл. В пробирку №1 к 125 мкл мл среды Opti-MEM (Gibco) добавляли 5 мкг вектора VTvaf17-CFTR (в качестве контроля использовали вектор VTvaf17, не содержащий кДНК целевого гена CFRT), 10 мкл реагента Р3000, перемешивали аккуратно пипетированием. В пробирку №2 к 125 мкл мл среды Opti-MEM (Gibco) добавляли 7.5 мкл Lipofectamine3000 Reagent, аккуратно перемешивали легким встряхиванием (без использования вортекса). Далее к содержимому пробирки №2 по каплям добавляли содержимое пробирки №1, перемешивали пипетированием 2 раза. Смесь инкубировали при комнатной температуре 5-10 мин, затем по каплям добавляли к клеткам. Через 18 часов производили замену среды на свежую. Инкубировали клетки в течении 30 часов.
За 2 часа до начала измерения клетки CFTE 29о- пересевали на чашки Петри с целью получения одиночных клеток. Для этого, проводили аспирацию среды и промывали клетки HBSS (Thermo scientific, США). Клетки снимали 200 мкл трипсина-ЭДТА (Thermo scientific, США), а затем инактивировали трипсин средой DMEM (Invitrogen) с 10% сыворотки плодов коров (Gibco) и гентамицином (Gibco), доведя объем до 2 мл. Далее, клетки пересевали в 35 мм чашки Петри с разведением 1:10-1:20.
Через 2 часа после пересева, когда 80-90% клеток прикрепилось, клетки промывали 3 раза внешним буфером А после этого среду заменяли на 2 мл внешнего буфера А.
Измерение равновесного потенциала клетки проводили с помощью стандартной пэтч-кламп методики. Для этого в растворе электролита, омывающем клетки, закрепленные на дне чашки Петри, располагали хлорсеребряный электрод сравнения, измерительный хлорсеребряный электрод помещали внутрь микро-пипетки, заполненной внутренним буфером А. Ионный состав внешнего буфера соответствовал внеклеточному раствору, а ионный состав электролита внутри пипетки соответствовал внутриклеточному составу. Радиус кончика пэтч-пипетки составлял 0.3-1 мкм. Далее между электродами прикладывали тестовую разность потенциалов и с помощью пэтч-кламп усилителя Axopatch 200 В (Molecular Devices, USA) измеряли текущий в системе ионный ток в режиме фиксации потенциала. Подаваемое к электродам напряжение и регистрируемый ток оцифровывали и записывали на электронный носитель с помощью карты сбора данных DigitData 1550 (Molecular Devices, USA). Пэтч-пипетку плавно подводили к поверхности клетки с помощью нано-позиционеров (Sensapex, Finland) до образования плотного электрического контакта между кончиком пипетки и цитоплазматической мембраны клетки. Для этого в пипетке создавали небольшое отрицательное гидростатическое давление в момент ее касания клеточной мембраны. Измерения проводили только в тех случаях, когда электрическое сопротивление контакта более 1 ГОм. После образования контакта компенсировали вклад электрической емкости пипетки в измеряемый ток и скачком гидростатического давления разрушали участок мембраны внутри пипетки. Резкое увеличение емкостного тока свидетельствовало о наличии электрического доступа к клетке. Затем компенсировали емкость самой клеточной мембраны и измеряли напряжение, которое требовалось приложить к клетке, чтобы обратить в ноль текущий через ее мембрану ток. Данное напряжение соответствовало потенциалу покоя клетки.
Поскольку белок CFTR участвует в транспорте ионов хлора, для регистрации токов хлора через мембрану клетки использовали внешний и внутренний буферы Б, в которых положительно заряженные ионы Na+ и K+ заменяли на NMDG, при этом в качестве источника иона хлора использовали соляную кислоту (Ettorre, М., et al., Electrophysiological evaluation of cystic fibrosis conductance transmembrane regulator (CFTR) expression in human monocytes. Biochim Biophys Acta, 2014. 1840(10): p. 3088-95).
Проводили измерения равновесных потенциалов нетрансфицированных клеток CFTE 29о- (1-я группа) и клеток, трансфицированных вектором VTvaf17-CFTR, несущим кДНК целевого гена CFTR (2-я группа) и трансфицированных вектором VTvaf17, не несущим кДНК целевого гена CFTR (3-я группа) в нормальных ионных условиях (NaCI снаружи, KCI внутри). На ограниченной выборке клеток (по 5 из каждой группы) видно, что в данных условиях не наблюдается статистически достоверной разницы между 1-й и 3-й группами клеток (контрольные группы), так средний потенциал покоя составлял -20±6 мВ. Потенциал покоя для второй группы клеток составлял -14±7 мВ.
Проводили аналогичные эксперименты по измерению потенциала покоя клеток при замене положительно заряженных ионов на NMDG, при этом в качестве источника иона хлора использовали соляную кислоту. В этом случае клетки 1-й и 3-й группы имели потенциал покоя равный 0 мВ, в то время как потенциал 2-й группы клеток равен -30 мВ, что соответствует ожидаемому равновесному потенциалу Нернста для ионов хлора (140 мМ снаружи и 40 мМ внутри клетки).
На фиг. 12 приводится график, подтверждающий, что трансфекция клеток CFTE 29о- вектором, экспрессирующим ген CFTR, приводит к появлению токов ионов хлора через клеточную мембрану, при отсутствии таковых в нетрансфицированной линии клеток, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR и подтверждает реализуемость способа его использования.
Пример 17
Подтверждение эффективности генотерапевтических ДНК-векторов VTvaf17-CFTR, VTvaf17-AQ1, VTvaf17-AQ5 каждый из которых несет целевой ген, а именно, ген CFTR, AQ1, AQ5 и реализуемости способа их использования.
Для подтверждения эффективности генотерапевтических ДНК-векторов VTvaf17-CFTR, VTvaf17-AQ1, VTvaf17-AQ5 каждый из которых несет целевой ген, а именно, ген CFTR, AQ1, AQ5 и реализуемости способа их использования оценивали зависимость ионного тока, текущего через мембрану клетки (линия клеток CFTE 29о-), от величины приложенного к ней потенциала. Проводили измерение проводимости мембран клеток CFTE 29о- котрансфицированных ДНК-векторами VTvaf17-CFTR и VTvaf17-AQ1 (экспрессирующими гены CFTR и AQ1), VTvaf17-CFTR и VTvaf17-AQ5, (экспрессирующими гены CFTR и AQ5), а также контрольным вектором VTvaf17, не несущим кДНК целевого гена CFTR.
Для этого проводили измерения равновесных потенциалов нетрансфицированных клеток CFTE 29о- (группа control), клеток CFTE 29о-, ко-трансфицированных ДНК-векторами VTvaf17-CFTR и VTvaf17 (группа CFTR), клеток CFTE 29о-, ко-трансфицированных ДНК-векторами VTvaf17-AQ1 и VTvaf17 (группа AQ1), клеток CFTE 29о-, ко-трансфицированных ДНК-векторами VTvaf17-AQ5 и VTvaf17 (группа AQ5), клеток CFTE 29о-, ко-трансфицированных ДНК-векторами VTvaf17-CFTR и VTvaf17-AQ1 (группа CFTR_AQ1), клеток CFTE 29о-, ко-трансфицированных ДНК-векторами VTvaf17-CFTR и VTvaf17-AQ5 (группа CFTR_AQ5) в условиях замены положительно заряженных ионов на NMDG, при этом в качестве источника иона хлора использовали соляную кислоту. Трансфекцию клеток CFTE 29о- и измерение их вольт-амперных характеристик проводили по примеру 16.
На фиг. 13 приводится гистограмма средних значений проводимости клеточной мембраны, нормированное на электрическую емкость мембраны клетки (G/C=I/(UC)) для четырех групп клеток.
Показано, что совместная трансфекция генов CFTR и аквапоринов (AQ1 или AQ5) приводит к усилению токов ионов хлора через клеточную мембрану клеток трахеального эпителия человека CFTE 29о- (кумулятивный эффект), что свидетельствует об эффективности генотерапевтических ДНК-векторов VTvaf17-CFTR, VTvaf17-AQ1 и VTvaf17-AQ5 и подтверждает реализуемость способа их использования. Наибольшая эффективность наблюдается при совместной трансфекции клеток ДНК-векторами, экспрессирующими ген CFTR и ген AQ1.
Пример 18
Подтверждение эффективности генотерапевтических ДНК-векторов VTvaf17-CFTR, VTvaf17-NOS1, VTvaf17-AQ1, VTvaf17-AQ3, VTvaf17-AQ5, каждый из которых несет целевой ген, а именно, ген CFTR, NOS1, AQ1, AQ3, AQ5 и реализуемости способа их использования.
Для подтверждения эффективности генотерапевтических ДНК-векторов VTvaf17-CFTR, VTvaf17-NOS1, VTvaf17-AQ1, VTvaf17-AQ3, VTvaf17-AQ5, каждый из которых несет целевой ген, а именно, ген CFTR, NOS1, AQ1, AQ3, AQ5 и реализуемости способа их использования оценивали концентрации оксида азота в клетках линии CFTE29o- после трансфекции и ко-трансфекции ДНК-векторами, содержащими гены CFTR, NOS1, AQ1, AQ3, AQ5.
За 24 часа до постановки реакции трансфекции клетки трахеального эпителия линии CFTE29o-, гомозиготные по мутации F508del высевали в три 6-луночных планшета в концентрации 105 клеток/лунка (конечный объем культуральной среды в лунке составлял 4 мл).
Полная среда: DMEM/F12 (Gibco) + 10% heat-inactivated FBS (Gibco) + 1× Антибиотик-Антимикотик (Стрептомицин-Пенициллин (Gibco)).
Условия культивирования: 37°C, 5% CO2. В качестве транспортных систем использовали Lipofectamine 3000 (Invitrogen) и JET-Pei (Polyplus transfection, France). Комплексы ДНК/транспортная система готовили по примеру 6 и 11. Трансфекцию осуществляли по примеру 6. Через 48 часов после трансфекции клетки линии CFTE29o- снимали с подложки путем интенсивного пипетирования в растворе 1xDPBS (Gibco). Полученную клеточную суспензию переносили в пробирки типа эппендорф на 2 мл. Клетки осаждали центрифугированием в течение 10 минут при 150 rcm, отбирали супернатант, осадки ресуспендировали в 250 мкл деионизованной воды.
Для получения клеточного лизата, клетки разрушали с помощью замораживания-оттаивания: суспензии замораживали на -70°С (примерно 30 минут), а затем быстро размораживали в твердотельном термостате при +37°С и перемешивали на Vortex. Процедуру замораживания-оттаивания повторяли три раза. Далее гомогенат разрушенных клеток осаждали центрифугированием на 13000 об/мин в течение 15 минут. В полученных супернатантах исследовали уровень NO методом иммуноферментного анализа. Концентрацию NO в клеточных лизатах определяли с помощью тест-системы ИФА (Biosource, MBS044841, 48T/Kit) согласно рекомендациям производителя. Чувствительность метода - 1 мкМ/л; диапазон концентраций - 10-320 1 мкМ/л.
Полученные значения концентрации NO нормировали по уровню белка в клеточных лизатах. Концентрацию белка в пробах оценивали колористическим методом по Бредфорд. В качестве красителя использовали краситель Coomassie Brilliant Blue R-250 (на 1 л: 100 мг Coomassie R-250 растворяли в 50 мл спирта и добавляли 100 мл ортофосфорной кислоты, доводили до 1 л водой и фильтровали через бумажный фильтр). Перед тестированием лизаты клеток разводили в 50 раз. Для построения калибровочной кривой использовали серийные разведения человеческого сывороточного альбумина, 1 мг/мл, от 100 до 2,5 мкг/мл. Тестирование осуществляли в 96-л планшете, пробы и калибровочные образцы вносили в объеме 50 мкл/л, реагент Бредфорд - 200 мкл/л. Для каждой точки калибровки и для каждого образца осуществляли постановку трех технических повторов.
На фиг. 14 приводится диаграмма концентрации NO в клетках линии CFTE29o- после их трансфекции и ко-трансфекции генотерапевтическими ДНК-векторами, содержащими гены CFTR, NOS1, AQ1, AQ3, AQ5. Полученные результаты показывают, что при использовании в качестве системы доставки JET-Pei трансфекция и ко-трансфекция клеток линии трахеального эпителия CFTE29o- ДНК-вектором, содержащим NOS1, приводит к существенному повышению концентрации NO в клеточных лизатах, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1. В то же время трансфекция данных клеток ДНК-вектором, содержащим ген CFTR не влияла на уровень NO. Умеренное повышение концентрации NO было также обнаружено в клетках линии CFTE29o, трансфицированных ДНК-векторами, содержащими AQ1, AQ3 и AQ5, что также свидетельствует об эффективности генотерапевтических ДНК-векторов VTvaf17-AQ1, VTvaf17-AQ3, VTvaf17-AQ5. Пример также подтверждает реализуемость способа использования генотерапевтических ДНК-векторов VTvaf17-NOS1, VTvaf17-AQ1, VTvaf17-AQ3, VTvaf17-AQ5.
Пример 19
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 и реализуемости способа его использования оценивали изменения количества белка аквапорин 1 в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 человека.
С целью анализа изменения количества белка аквапорин 1 трем пациентам вводили в кожу генотерапевтический ДНК-вектор VTvaf17-AQ1, несущий участок гена AQ1 с транспортной молекулой и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена AQ1 с транспортной молекулой. Пациент 1, мужчина 47 лет, (П1); пациент 2, женщина 48 лет, П2); пациент 3, мужчина, 53 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, France-USA). Генотерапевтический ДНК-вектор VTvaf17-AQ1, который содержит кДНК гена AQ1 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена AQ1, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-AQ1, несущий участок гена AQ1 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 5 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-AQ1, несущего участок, гена AQ1 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-AQ1, несущего участок гена AQ1 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена AQ1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Aquaporin 1, Colton Blood Group (AQP1) (SEA579Hu, Cloud -Clone Corp., США). Чувствительность метода составила 0.09 нг/мл, диапазон измерения - 0.25-16 нг/мл. Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили по примеру 11.
Показано, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-AQ1, несущего целевой ген, а именно, ген AQ1 человека, произошло увеличение количества белка аквапорин 1 в сравнении с количеством белка аквапорин 1 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего участок, гена AQ1 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ1 и подтверждает реализуемость способа его использования.
Результаты измерений концентрации белка аквапорин 1 в биоптате кожи пациентов П1, П2, П3 отражены на фиг. 15.
Пример 20
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 и реализуемости способа его использования оценивали изменение количества белка нейрональная синтаза оксида азота 1 типа в икроножной мышце человека при введении в икроножную мышцу человека генотерапевтического ДНК-вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 человека.
С целью анализа изменения количества белка нейрональная синтаза оксида азота 1 типа трем пациентам вводят в икроножную мышцу генотерапевтический ДНК-вектор VTvaf17-NOS1, несущий участок гена NOS1 с транспортной молекулой, и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена NOS1 с транспортной молекулой. Пациент 1, женщина 60 лет, (П1); пациент 2, мужчина 42 года, (П2); пациент 3, мужчина, 63 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, France- USA) по Примеру 19.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-NOS1, несущий участок гена NOS1 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 10 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-NOS1, несущего участок, гена NOS1 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагали медиально на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков икроножной мышцы пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-NOS1, несущего участок гена NOS1 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактного участка мышцы (III), используя устройство для взятия биопсии MAGNUM (компания BARD, USA). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 20 куб. мм, масса - около 22 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена NOS1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Nitric Oxide Synthase 1, Neuronal (NOS1) (SEA815Hu, Cloud -Clone Corp., США). Чувствительность метода составила 0.065 нг/мл, диапазон измерения - 0.156-10 нг/мл. Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили по примеру 11.
Показано, что в икроножной мышце всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-NOS1, несущего целевой ген, а именно, ген NOS1 человека, произошло увеличение количества белка нейрональная синтаза оксида азота 1 типа сравнении с количеством белка нейрональная синтаза оксида азота 1 типа в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего участок, гена NOS1 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1 и подтверждает реализуемость способа его использования.
Результаты измерений концентрации белка нейрональная синтаза оксида азота 1 типа в биоптатах икроножной мышцы пациентов П1, П2, П3 отражены на фиг. 16.
Пример 21
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR и реализуемости способа его использования оценивали изменения количества белка трансмембранный регулятор кистозного фиброза в биоптатах легких и бронхов крысы при введении в полость легких и бронхов группы крыс генотерапевтического ДНК-вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR человека.
С целью анализа изменения количества белка трансмембранный регулятор кистозного фиброза десяти самцам крыс линии Sprague-Dawley (группа А) ингаляционно вводили в полость легких и бронхов генотерапевтический ДНК-вектор VTvaf17-CFTR, несущий участок гена CFTR с транспортной молекулой. Контрольной группе самцов крыс линии Sprague-Dawley в количестве 5 животных (группа В) ингаляционно вводили в полость легких и бронхов плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена CFTR с транспортной молекулой. Другой контрольной группе самцов крыс линии Sprague-Dawley в количестве 5 животных (группа С) в полость легких и бронхов никаких внешних агентов не вводили. В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, France- USA) по примеру 19.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-CFTR, несущий участок гена CFTR вводили ингаляционно в полость легких и бронхов животного в количестве 50 мкг мг для каждой генетической конструкции. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-CFTR, несущего участок, гена CFTR - 0,3 мл для каждой генетической конструкции.
Биопсийные образцы отбирали после некропсии животных на 3-й сутки после введения генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков бронхов и легких крыс целевой группы при введении генотерапевтического ДНК вектора VTvaf17-CFTR, несущего участок гена CFTR (группа А), и контрольных групп при введении генотерапевтического ДНК-вектора VTvaf17 (плацебо) (группа В) и интактных животных (группа С). Размер биопсийного образца составлял около 10 куб. мм, масса - около 12 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена CFTR проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) (SEC425Hu Cloud -Clone Corp., США). Чувствительность метода составила 0.059 нг/мл, диапазон измерения - 0.156-10 нг/мл.
Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили по примеру 11.
Показано, что в биоптатах бронхов и легких всех животных целевой группы при введении генотерапевтического ДНК вектора VTvaf17-CFTR, несущего целевой ген, а именно, ген CFTR человека, зафиксировано появление существенного количества белка трансмембранный регулятор кистозного фиброза в сравнении с количеством белка трансмембранный регулятор кистозного фиброза в биоптатах бронхов и легких крыс контрольной группы при введении генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего участок, гена CFTR человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOS1 и подтверждает реализуемость способа его использования.
Результаты измерений концентрации белка трансмембранный регулятор кистозного фиброза в биоптатах бронхов и легких крыс отражены на фиг. 17.
Пример 22
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3, несущего целевой ген, а именно, ген AQ3 и реализуемости способа его использования оценивали изменения количества белка аквапорин 3 в коже человека при введении в кожу пациента культуры аутогенных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3. С целью анализа изменения количества белка аквапорин 3 пациенту вводили в кожу предплечья соответствующую культуру аутогенных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 и параллельно вводили плацебо, представляющее собой культуру аутогенных фибробластов пациента, нетрансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3.
Первичную культуру фибробластов человека выращивали из биоптатов кожи пациентов. Используя устройство для взятия биопсии кожи Epitheasy 3.5 (MedaxSRL) брали образец биоптата кожи из зоны, защищенной от действия ультрафиолета, а именно за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 10 кв. мм, массой - около 11 мг. Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Выращивание первичной культуры клеток осуществляли на чашках Петри при 37°С в атмосфере, содержащей 5% CO2 в среде DMEM с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Трипсинизацию и пересев производили каждые 5 дней, для трипсинизации клетки промывали раствором PBS и инкубировали 30 минут при 37°С в растворе, содержащем 0.05% трипсина и 1 мМ ЭДТА. Для нейтрализации трипсина к клеткам добавляли 5 мл культуральной среды и центрифугировали суспензию при 600 об/мин 5 минут. Рост культуры фибробластов после 4-5 пассажей осуществляли в культуральных флаконах емкостью 75 мл в среде, содержащей 10 г/л DMEM, 3.7 г/л Na2CO3, 2.4 г/л HEPES, 10% фетальной сыворотки и 100 Ед/мл ампициллина. Смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 5×104 клеток. Культуру фибробластов пациента трансфицировали генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3.
Трансфекцию осуществляли с помощью катионного полимера полиэтиленимина JETPEI (Polyplus transfection, Франция), согласно инструкции фирмы-производителя. Клетки культивировали 72 часа и затем вводили пациенту. Введение пациенту культуры аутогенных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 и плацебо, представляющее собой культуру аутогенных фибробластов пациента, нетрансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 осуществляли туннельным методом в область кожи предплечья иглой 30G длиной 13 мм на глубину 3 мм. Концентрация модифицированных аутогенных фибробластов в вводимой суспензии составляла примерно 5 млн клеток на 1 мл суспензии, доза вводимых клеток не превышала 15 млн. Очаги введения культуры аутогенных фибробластов трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 и плацебо, представляющее собой культуру аутогенных фибробластов, нетрансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 4-е сутки после введения культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 и плацебо. Взятие биопсии осуществляли из участков кожи пациента в зоне введения культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 (I), культуры аутогенных фибробластов, нетрансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген AQ3 (плацебо) (II), а также из участков интактной кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL). Кожу в зоне отбора биоптата пациентов предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена AQ3 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ELISA Kit for Aquaporin 3, Gill Blood Group (AQP3) (SEA581Hu, Cloud -Clone Corp., США). Чувствительность метода составляла 0.058 нг/мл, диапазон измерения - 0.156-10 нг/мл. Подготовку тестируемых и стандартных образцов, измерение и обработку результатов проводили по примеру 11.
Показано, что в коже пациента в области введения культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3, произошло увеличение количества белка аквапорин 3 в сравнении с количеством белка аквапорин 3 в области введения культуры аутогенных фибробластов, нетрансфицированных генотерапевтическим ДНК-вектором VTvaf17-AQ3, несущим целевой ген, а именно, ген AQ3 (плацебо), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-AQ3 и подтверждает реализуемость способа его использования. Результаты измерений концентрации белка аквапорин 3 в биоптатах кожи пациента отражены на фиг. 18.
Пример 23
Штамм Escherichia coli SCS110-AF/VTvaf17-CFTR или штамм Escherichia coli SCS110-AF/VTvaf17-NOS1 или штамм Escherichia coli SCS110-AF/VTvaf17-AQ1 или штамм Escherichia coli SCS110-AF/VTvaf17-AQ3, или штамм Escherichia coli SCS110-AF/VTvaf17-AQ5, несущий генотерапевтический ДНК-вектор, способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CFTR или NOS1 или AQ1 или AQ3 или AQ5: а именно штамма Escherichia coli SCS110-AF/VTvaf17-CFTR, или штамма Escherichia coli SCS110-AF/VTvaf17-NOS1, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ1, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ3, или штамма Escherichia coli SCS110-AF/VTvaf17-AQ5, несущего генотерапевтический ДНК-вектор VTvaf17-CFTR, или VTvaf17-NOS1, или VTvaf17-AQ1, или VTvaf17-AQ3, или VTvaf17-AQ5 соответственно для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-CFTR, или ДНК-вектором VTvaf17-NOS1, или ДНК-вектором VTvaf17-AQ1, или ДНК-вектором VTvaf17-AQ3, или ДНК-вектором VTvaf17-AQ5, после чего клетки высеивали на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coli SCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п.н., ген устойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола.
Пример 24
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CFTR или NOS1 или AQ1 или AQ3 или AQ5.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-CFTR (SEQ ID №1), или VTvaf17-NOS1 (SEQ ID №2), или VTvaf17-AQ1 (SEQ ID №3), или VTvaf17-AQ3 (SEQ ID №4), или VTvaf17-AQ5 (SEQ ID №5), каждый из которых несет участок целевого гена, а именно, CFTR, или NOS1, или AQ1, или AQ3, или AQ5 проводили масштабную ферментацию штамма Escherichia coli SCS110-AF/VTvaf17-CFTR (регистрационный № ВКПМ B-13169, INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43038 или штамма Escherichia coli SCS110-AF/VTvaf17-NOS1 (регистрационный № ВКПМ B-13168, INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43037 или штамма Escherichia coli SCS110-AF/VTvaf17-AQ1 (регистрационный № ВКПМ B-13172, INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43041), или штамма Escherichia coli SCS110-AF/VTvaf17-AQ3 (регистрационный № ВКПМ B-13171, INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43040), или штамма Escherichia coli SCS110-AF/VTvaf17-AQ5 (регистрационный № ВКПМ B-13170, INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43039), каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий участок целевого гена, а именно CFTR, или NOS1, или AQ1, или AQ3, или AQ5. Каждый штамм Escherichia coli SCS110-AF/VTvaf17-CFTR, или Escherichia coli SCS110-AF/VTvaf17-NOS1, или Escherichia coli SCS110-AF/VTvaf17-AQ1, или Escherichia coli SCS110-AF/VTvaf17-AQ3, или Escherichia coli SCS110-AF/VTvaf17-AQ5 получали на базе штамма Escherichia coli SCS110-AF (Cell and Gene Therapy LLC, PIT Ltd) по примеру 23 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17-CFTR, или VTvaf17-NOS1, или VTvaf17-AQ1, или VTvaf17-AQ3, или VTvaf17-AQ5, несущим участок целевого гена, а именно, CFTR, или NOS1, или AQ1, или AQ3, или AQ3 с последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма Escherichia coli SCS110-AFA/Tvaf 17-CFTR, несущего генотерапевтический ДНК-вектор VTvaf17-CFTR проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-CFTR.
Для ферментации штамма Escherichia coli SCS110-AF/VTvaf17-CFTR готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (Becton Dickinson), доводили водой до 8800 мл и автоклавировали при 121°С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-CFTR в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С. Переносили затравочную культуру в ферментер Techfors S (Infors НТ, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000 g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, рН 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100 мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3М ацетат натрия, 2М уксусная кислота, рН 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу A (Sigma) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000 g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore). Далее проводили ультрафильтрацию через мембрану размером отсечения 100 кДа (Millipore) и разбавляли до начального объема буфером 25 мМ TrisCl, рН 7.0. Операцию повторяли три -четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAE sepharose HP (GE, США), уравновешенную раствором 25 мМ TrisCl, рН 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-CFTR линейным градиентом от раствора 25 мМ TrisCl, рН 7.0 до раствора 25 мМ TrisCl, рН 7.0, 1М NaCI в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-CFTR, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-CFTR объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно. Все технологические операции для штаммов Escherichia coli SCS110-AF/VTvaf17-NOS1, или Escherichia coli SCS110-AF/VTvaf17-AQ1, или Escherichia coli SCS110-AF/VTvaf17-AQ3, или Escherichia coli SCS110-AF/VTvaf17-AQ5 проводили аналогичным образом.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-CFTR, или VTvaf17-NOS1, или VTvaf17-AQ1, или VTvaf17-AQ3, или VTvaf17-AQ5.
Таким образом, задача, поставленная в данном изобретении, а именно: конструирование генотерапевтических ДНК-векторов, несущих целевые гены человека на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов оптимально сочетающего в себе:
I) возможность безопасного использования для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности;
II) длину, обеспечивающую эффективное проникновение в клетку-мишень;
III) наличие регуляторных элементов, обеспечивающих эффективную экспрессию целевых генов и, в то же время, не представляющих собой нуклеотидные последовательности вирусных геномов;
IV) технологичность получения и возможность наработки в промышленных масштабах, а также задача по конструированию штаммов, несущих эти генотерапевтические ДНК-вектора для производства в промышленных масштабах этих генотерапевтических ДНК-векторов решена, что подтверждается примерами: для п. I - пример 1, 2, 3, 4, 5; 23 для п. II - пример 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, 20; 21, 22; для п. III - пример 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, 20; 21, 22; для п. IV - пример 23, 24.
Промышленная применимость:
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CFTR или NOS1 или AQ1 или AQ3 или AQ5 для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов, способа его получения и использования, штамма Escherichia coli SCS110-AF/VTvaf17-CFTR или Escherichia coli SCS110-AF/VTvaf17-NOS1 или Escherichia coli SCS110-AF/VTvaf17-AQ1 или Escherichia coli SCS110-AF/VTvaf17-AQ3, или Escherichia coli SCS110-AF/VTvaf17-AQ5, несущего генотерапевтический ДНК-вектор, способа его получения, способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
Перечень сокращений:
VTvaf17 - вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотикорезистентности (vector therapeutic virus-antibiotic-free)
ДНК - дезоксирибонуклеиновая кислота
кДНК - комплементарная дезоксирибонуклеиновая кислота
РНК - рибонуклеиновая кислота
мРНК - матричная рибонуклеиновая кислота
п.н. - пар нуклеотидов
ПЦР - полимеразная цепная реакция
мл - миллилитр, мкл - микролитр
куб. мм - кубический миллиметр
л - литр
мкг - микрограмм
мг - миллиграмм
г - грамм
мкМ - микромоль
мМ - миллимоль
мин - минута
сек - секунда
об/мин - обороты в минуту
нм - нанометр
см - сантиметр
мВт - милливатт
о.е. ф-относительная единица флуоресценции
PBS - фосфатно-солевой буфер
Реферат
Изобретение относится к генной инженерии, биотехнологии, медицине и представляет собой генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген CFTR, или NOS1, или AQ1, или AQ3, или AQ5, для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов, представляющий собой группу генотерапевтических ДНК-векторов, каждый из которых содержит кодирующую часть по крайней мере одного целевого гена, выбранного из CFTR, или NOS1, или AQ1, или AQ3, или AQ5, клонированную в генотерапевтический ДНК-вектор VTvaf17, при этом группу генотерапевтических ДНК-векторов составляют генотерапевтический ДНК-вектор VTvaf17-CFTR, размером 7606 п.н., или VTvaf17-NOS1, размером 7468 п.н., или VTvaf17-AQ1 размером 3982 п.н., или VTvaf17-AQ3, размером 4024 п.н., или VTvaf17-Q5, размером 3943 п.н., с нуклеотидной последовательностью SEQ ID №1, или SEQ ID №2, или SEQ ID №3, или SEQ ID №4, или SEQ ID №5 соответственно или их сочетание. Изобретение позволяет повысить экспрессию целевых генов. 14 н. и 2 з.п. ф-лы, 18 ил., 24 пр.
Формула
Документы, цитированные в отчёте о поиске
Плазмида без устойчивости к антибиотику

Комментарии