Рекомбинантный вектор на основе вируса оспы птиц, рекомбинантный вектор для вакцинации домашней птицы - RU2130971C1
Код документа: RU2130971C1
Чертежи
























Описание
Изобретение относится к рекомбинантным вирусам, производным от вируса Avipox и, в частности, от вируса, ответственного за оспу у птиц, обычно называемую Fowlpox. Изобретение относится также к способу получения этих вирусов в результате культивирования клеток, к применению этих вирусов для получения вакцин и к вакцинам, содержащим эти вирусы. Изобретение относится также к последовательностям переноса для включения в геном этого рекомбинантного вируса, а также к плазмидам, которые несут эти последовательности.
Вирус, ответственный за оспу у птиц, или Fowlpox вирус (FPV), принадлежит к роду Avipox семейства Poxviridae.
Вирус Fowlpox имеет характеристики, типичные для Pox. Эти вирусы большого размера, геном которых представляет собой ДНК в виде линейной двойной спирали величиной 300 ко, у которой концевые части простой цепи связаны ковалентным образом. Примерно 20 ко этого генома были собраны в виде последовательности, в частности последовательность обратных терминальных повторений (TIR для Terminal Inverted Repeats) (Campbell et al. 1989; Tomley et al. 1988). Обратные терминальные повторения представляют собой две длинные идентичные последовательности, находящиеся на каждом конце генома, с противоположной ориентацией.
Вирус коровьей оспы или Vaccinia был первым из Pox, который был выведен в качестве живущего рекомбинантного вируса, способного выражать чужеродные протеины. Перечень выраженных протеинов является очень длинным. В частности, экспрессия многочисленных чужеродных антигенов позволила получить иммунизацию против различных болезней.
В заявке на европейский патент 0 314 569 было предложено применение вируса Fowlpox в качестве вектора экспрессии гетерологичных протеинов с целью получения вакцины, т. е. применение рекомбинантного вируса, который интегрировал в некодирующую внутригенную область своего генома последовательность ДНК, кодирующую гетерологичный протеин; эта область представляет собой короткую последовательность из 32 нуклеотидов, расположенную между открытыми фазами для считывания (ORF для Open Reading Frame) ORF 7 и ORF 9, причем эта область была преобразована генетическим путем в неосновной сайт включения. В таких коротких внутригенных областях велик риск того, что включение отделит сигнал транскрипции от гена и тем самым введет мутацию, которая инактивирует этот ген. Это подтверждается: действительно, эта последовательность из 32 нуклеотидов оказывается является существенной областью, потому что она должна была увеличиться на 55 нуклеотидов, чтобы избежать возможного перекрывания между промотором фазы ORF 9 и кодирующей последовательностью 3' фазы ORF 7. В случае области, которая отделяет ORF 7 от ORF 9, включение в природной последовательности является, кроме того, нестабильным (Spehner et al., 1990), и его преобразование является необходимым. Более того, предложенный способ преобразования короткой внутригенной области не является общим.
С другой стороны, в заявке на международный патент WO 88/02022 было также предложено конструирование вируса Fowlpox и других рекомбинантных Pox у птиц, отличающихся включением чужеродной ДНК в ген тимидинкиназы. Это включение создает мутацию в гене, которая могла бы уменьшить заражающую способность вируса. Это имеет риск слишком большого ослабления штамма и уменьшенной иммуногенной способности вакцины, выведенной из рекомбинантного вируса.
Кроме того, в заявке на европейский патент 0 353 851 было предложено применение рекомбинантного вируса Fowlpox в качестве вектора экспрессии гетерологичного протеина. Включение чужеродного гена в вирусный геном осуществляется в открытых фазах для считывания (ORF), расположенных в обратных терминальных повторениях (TIR). Включение одного или нескольких чужеродных генов во внутреннюю часть открытых фаз для считывания имеет риск произвести мутацию гена, функция которого не известна.
Настоящее изобретение предоставляет другие области для включения одного или нескольких чужеродных генов в вирусный геном, которые больше не имеют недостатков, свойственных указанным выше областям включений.
В связи с этим настоящее изобретение относится к рекомбинантному вирусу Avipox, выведенному из ослабленного штамма вируса Avipox и содержащему в неосновной части своего генома по меньшей мере одну последовательность ДНК, кодирующую полностью или частично протеин, гетерологичный по отношению к вирусу Avipox, а также элементы, способные обеспечить экспрессию этого протеина в клетке, зараженной указанным рекомбинантным вирусом, причем неосновная часть генома образована внутригенной некодирующей областью вируса Avipox, т. е. областью, расположенной между двумя открытыми фазами для считывания, включая их сигналы экспрессии.
Под неосновной частью генома вируса Avipox понимают область, которая может быть модифицирована без ухудшения функций, задействованных в преобразовании вируса in vitro и in vivo. В качестве неосновной части выбирают некодирующую внутригенную область генома, т.е. расположенную между двух ORF, включая их сигналы экспрессии.
Внутригенные области по изобретению являются широкими, так чтобы риск того, что включение отделит сигналы транскрипции от их соответствующих генов, был минимален, а также чтобы их преобразование было бы не нужно. С другой стороны, последовательности этих внутригенных областей являются некодирующими, и, следовательно, риск мутации в ORF является нулевым. Под широкой областью понимают область, имеющую последовательность из более чем 60 нуклеотидов. Обычно выбирают область, имеющую последовательность из более чем 100 нуклеотидов. Предпочтительно выбирают область, имеющую последовательность из более чем 200 нуклеотидов. По особенно предпочтительному способу выбирают область, имеющую последовательность из более чем 400 нуклеотидов.
С другой стороны, обычно выбирают внутригенную
область, в которой клонируется по меньшей мере одна последовательность ДНК, расположенную в одной из двух областей TIR вируса Avipox. Обычно по меньшей мере одна последовательность ДНК клонируется в
по меньшей мере одной из двух областей TIR вируса Avipox. Предпочтительно по меньшей мере одна последовательность ДНК клонируется в обеих областях TIR вируса. По еще более предпочтительному способу
выбирают внутригенную область, называемую область β1, и/или внутригенную область, называемую область β2, причем внутригенная область, называемая область β1, располагается между нуклеотидами 1675 и 2165, а внутригенная область, называемая область β2, располагается между нуклеотидами 2672 и 3605, принимая в качестве исходного
нуклеотида сайт рестрикции BamHI, находящийся в TIR. Этот сайт рестрикции BamHI, выбираемый здесь для отсчета внутригенных областей, представляет собой первый нуклеотид последовательности,
опубликованной в работе Tomley et al. 1988. Можно также определить эти области по изобретению следующим образом: внутригенная область, называемая область β1, располагается между
открытыми фазами для считывания ORF 1 и ORF 2, причем открытая фаза для считывания OFR 1 находится между нуклеотидами 419 (нуклеотид A из ATG) и 1674 (3-й нуклеотид стоп-кодона), а открытая фаза для
считывания ORF 2 находится между нуклеотидами 2166 (нуклеотид A из ATG) и 2671 (3-й нуклеотид стоп-кодона), принимая в качестве исходного нуклеотида сайт рестрикции BamHI и TIR, а внутригенная область,
называемая область β2, располагается между открытыми фазами для считывания ORF 2 и ORF 3, причем открытая фаза для считывания ORF 2 находится между нуклеотидами 2166 (нуклеотид A из
ATG) и 2671 (3-й нуклеотид стоп-кодона), а открытая фаза для считывания ORF 3 находится между нуклеотидами 3606 (3-й нуклеотид стоп-кодона) и 4055 (нуклеотид A из ATG), принимая в качестве исходного
нуклеотида сайт рестрикции BamHI в TIR. По более предпочтительному способу в области β1 выбирают часть, расположенную между нуклеотидами 1775 и 2065, а в области β2
- часть, расположенную между нуклеотидами 2772 и 3505. Хорошие результаты были получены при клонировании на уровне нуклеотида 1842, называемого сайтом включения B1, который расположен в области
β1, и/или на уровне нуклеотида 3062, называемого сайтом включения B2, который расположен в области β2.
Хорошие результаты были получены, когда по меньшей
мере одна последовательность ДНК клонируется в области β2 в одной из двух областей TIR вируса Avipox. Хорошие результаты также были получены, когда одна последовательность ДНК
клонируется в области β1 в каждой из двух областей TIR. Это является другим преимуществом изобретения, потому что можно получить две копии гетерологичной последовательности ДНК на
один геном.
Под рекомбинантным вирусом Avipox, выведенным из ослабленного штамма вируса Avipox, понимают ослабленный вирус, принадлежащий к роду Avipox, геном которого содержит гетерологичную последовательность в сопровождении сигналов экспрессии. Обычно в качестве вируса используют вирус рода Avipox, такой как Fowlpox, Pigeonpox или Canarypox. Обычно в качестве вируса используют Fowlpox. Предпочтительно в качестве вируса Fowlpox используют вакцинальный штамм вируса оспы кур или Fowlpox такого как вакцина, производимая и поставляемая в торговлю фирмой СОЛЬВЕЙ под маркой POXINE или вакцина, производимая и поставляемая в торговлю фирмой СОЛЬВЕЙ под марками CHICK-N-POX, POULVAC CHICK-N-POX, CHICK-N-POX TC, POULVAC CHICK-N-POX TC, POULVAC POXINE, POULVAC P. По более предпочтительному способу в качестве вируса Fowlpox используют вакцину, поставляемую в торговлю фирмой СОЛЬВЕЙ под марками CHICK-N-POX, POULVAC CHICK-N-POX, CHICK-N-POX TC, POULVAC CHICK-N-POX Tc, POULVAC POXINE, POULVAC P, сокращенно CNP.
Ослабление получается в результате последовательных прохождений через эмбрион или, если вирус был адаптирован к культивируемым клеткам, в результате прохождений через культуру клеток.
Под элементами, способными обеспечить экспрессию гена, который кодирует гетерологичный протеин в клетке, зараженной указанным рекомбинантным вирусом, понимают сигналы генетической экспрессии, узнаваемые вирусом, в частности промотор и терминатор, т.е. элементы, известные специалисту, такие как, в частности, описанные, например, у Moss, 1990. В общем случае используют промотор для Pox. Обычно используют промотор для Vaccinia или для Fowlpox. Предпочтительно используют промотор P11 и промотор P7.5 для Vaccinia, такие как описанные у Venkatesan et al., 1981; Cochran et al., 1985 и Bertholet et al, 1985.
Под по меньшей мере одной последовательностью ДНК, кодирующей полностью или частично протеин, гетерологичный по отношению к вирусу Avipox, понимают любой фрагмент ДНК, извлеченный из генома, или копию ДНКк или еще синтезированную ДНК в сопровождении сигналов экспрессии, последовательность которой кодирует полностью или частично протеин, чужеродный для Avipox.
Фиг. 1-11 были подготовлены, чтобы позволить лучше понять изобретение.
Фиг. 1 изображает конструирование рекомбинантного вируса Avipox, модифицированного согласно Mackett et al. 1984. Клетки, зараженные (I : инфекция) вирусом Fowplpox (FPV), трансфектируются (T : "трансфекция") плазмидой переноса. Эта плазмида (P) несет ориентированный промотор (Pr), чтобы обеспечить экспрессию смежного гетерологичного гена (q), с той и с другой стороны которого располагаются последовательности вирусной ДНК. Гомологичная рекомбинация (R) имеет место в цитоплазме клетки (C) между последовательностями, которые окаймляют ген, и последовательностями, находящимися на вирусном геноме. Это приводит к включению гетерологичного гена в вирусный геном. Этот геном может упаковываться и производить рекомбинантные вирусные частицы (VP). N означает ядро клетки (C).
Фиг. 2 схематично изображает концевые части генома Fowlpox с TIR справа (TIR-R) и слева (TIR-L), обозначаемыми прямоугольниками, и с единственной последовательностью, обозначаемой чертой. Пунктир обозначает центральную область генома. Фрагмент рестрикции EcoRI из TIR-L имеет величину 6,2 ко, тогда как аналогичный фрагмент из TIR-R имеет величину 9,0 ко. Эта схема показывает, что эти два фрагмента имеют общую последовательность, причем единственную последовательность. Показан сайт BamHI, расположенный ниже EcoRI в TIR.
Фиг. 3 изображает карту рестрикции плазмиды pTIRBI (PTIRBI) для некоторых единичных сайтов и положение ORF. Единичный сайт BamHI используется для клонирований гетерологичных генов.
ori (ORI): начало репликации плазмиды в Escherichia coli (E.coli); Ap: ген устойчивости к ампициллину; ORF 1 - ORF 6; открытые фазы для считывания в Fowlpox.
Фиг. 4 представляет собой рисунок, подобный фиг. 3, но для плазмиды pTIRB2 (RTIRB2).
Фиг. 5 изображает карту рестрикции плазмиды pIILac (PIILAC). Эта плазмида несет ген LacZ микроорганизма E.coli под контролем промотора PII для Vaccinia. PII : промотор PII для Vaccinia; LACZ: ген, кодирующий β-галактозидазу; ori: начало репликации в E.coli; Brin + : цепь, упакованная в фаге M13 : AP : ген устойчивости к ампициллину.
Фиг. 6 изображает пример вектора переноса для гена LacZ в TIP. Этот вектор представляет собой плазмиду pTIRBIP75Lac (PTIRBIP75LAC). Кассета P7.5-LacZ клонируется в сайте BamHI плазмиды pTIRBI (в направлении по часовой стрелке). P7.5 : промотор P7.5 для Vaccinia.
Фиг. 7 является схематическим изображением включений гена LacZ (представленного заштрихованным прямоугольником) в геноме CNP. Кассеты P7.5 LacZ и PII-LacZ включаются в терминальные области (TIR) в том или ином направлении. Область TIR справа не представлена. Стрелки указывают направление транскрипции генов, изображенных в виде прямоугольников. Масштаб не соблюдается.
Фиг. 8 изображает сегмент A для IBDV, положение праймеров и различные фрагменты, полученные в результате обратной транскрипции и амплификации ARN сегмента A из штамма Edgar.
A : строение ORF
p : "праймеры", используемые для осуществления амплификации сегмента A.
>, < : ориентация праймеров по отношению к кодирующей последовательности сегмента A.
fgt PCR : фрагменты, генерируемые в результате амплификации ARN сегмента A.
pb : пар оснований.
Фиг. 9 (от 9a до 9e) изображает нуклеотидную последовательность увеличенной ДНК, соответствующей ARN сегмента A штамма Edgar и трансляцию аминокислот фаз ORF 1, 2 и 3.
Primers 0,1, 1b, 2, 3, 4, 5, и 6 : праймеры, используемые для генерирования (путем обратной транскрипции и амплификации) фрагментов ДНК, соответствующих сегменту A штамма Edgar.
Фиг. 10 изображает схему реконструирования сегмента ДНК, соответствующего сегменту A штамма Edgar, исходя из фрагментов, полученных в результате обратной транскрипции и амплификации.
* : направленный мутагенез.
Фиг. 11 изображает карту рестрикции плазмиды pTIR75EI LAC (PTIR75EILAC).
Часть плазмиды, обозначенная жирной чертой, соответствует гомологичным последовательностям генома FPV. ori (ORI) : начало репликации плазмиды в E. coli; Ar : ген устойчивости к ампициллину; P7.5 : промотор P7.5 для vaccinia; ORF 1 - IBDV : ORF I сегмента A штамма Edgar; P11 : промотор P11 для vaccinia; LACZ : ген, кодирующий β-галактозидазу; pb : пар оснований; OFR 1 - ORF 6 : открытые фазы для считывания в Fowlpox.
Фиг. 12 изображает описание при помощи теста ELISA протеинов IBDV, выраженных в рекомбинантах FPV (IBDV). Описание было осуществлено следующим образом: по 50 мкл клеточных суспензий и последовательных разбавлений вдвое этих суспензий были помещены в чашечки. После инкубации второго антитела анти-IBDV (моноклональный анти-VP3 или анти-VP2) была осуществлена имплификация сигнала при помощи системы анти-IgG мыши, меченной посредством биотин + стрептавидин совместно со щелочной фосфатазой.
Фиг. 12a соответствует детектированию при помощи моноклонального антитела анти-VP3. Фиг. 12B соответствует детектированию по помощи моноклонального антитела анти-VP2.
На этих фигурах абцисса изображает последовательные разбавления в 2 раза клеточных экстрактов в логарифмических единицах, а ордината изображает отношение поглощений, измеренных при 690 мм и 405 мм.
Фиг. 13 изображает описание при помощи Western blot протеинов IBDV, выраженных в рекомбинантах FPV (IBDV). Это исследование было осуществлено следующим образом: клеточные суспензии центрифугируются с ускорением 3000 g, а полученные всплывшие продукты подвергаются ультрацентрифугированию с ускорением 185 000 g; остатки, полученные после двух процессов центрифугирования, объединяются и снова переводятся в суспензию при помощи буферного раствора PBS (Phosphate Buffered Saline, Gibco).
Отстой протеинов в количестве от 20 до 40 мкг для рекомбинант FPV/IBDV и 5 мкг для клеток, зараженных при помощи IBDV (положительный контроль) наносится в расчете на одну лунку на гель типа акриламид-SDS. После переноса на мембрану протеины IBDV детектируются при помощи поликлональной сыворотки, распознающей все протеины IBDV, для фиг. 13A, или при помощи моноклонального антитела анти-VP3 для фиг. 13B. Амплификация сигнала реализуется при помощи системы анти-IgG, меченной биотином и сопряженной системой стрептавидин-щелочная фосфатаза. PM (mW): протеины с известными молекулярными массами.
Способ, используемый для осуществления изобретения, схематично показан на фиг. 1 (модифицированный согласно Mackett et al., 1984). Клетки, зараженные при помощи Avipox или Fowlpox, трансфектируются плазмидой переноса. Эта плазмида несет промотор, ориентированный так, чтобы разрешить экспрессию смежного гетерологичного гена, окаймленного с обеих сторон последовательностями вирусной ДНК. Гомологичная рекомбинация происходит в цитоплазме клетки между последовательностями, которые окаймляют ген, и последовательностями, находящимися на вирусном геноме. Таким образом, происходит включение гетерологичного гена в вирусный геном. Этот геном может упаковаться и производить рекомбинантные вирусные частицы. Этот способ включения путем заражения клеток при помощи Pox с последующим переносом плазмидой был разработан для Vaccinia и обычно используется во многих лабораториях для конструирования рекомбинантных Pox (Mackett et al., 1985).
Способ по
изобретению включает обычно следующие стадии:
- первая стадия заключается в конструировании плазмид переноса, разрешающих просеивание,
- вторая стадия заключается в клонировании
генов, кодирующих гетерологичные антигены в плазмидах переноса,
- третья стадия заключается в конструировании рекомбинантных вирусов Avipox, и
- четвертая стадия заключается в
проведении тестов по вакцинации с рекомбинантными вирусами.
Предпочтительно способ включает следующие стадии:
a. Конструирование плазмид переноса, разрешающих просеивание:
- клонирование фрагментов, несущих TIR,
- включение сайта клонирования в TIR,
- клонирование промоторов P11 и P7.5 из Vaccinia;
- конструирование кассеты, несущей ген
LacZ, и ее клонирование ниже P11 или P7.5,
- клонирование элементов P11 LacZ или P.7.5 LacZ в плазмидах переноса TIR.
b. Конструирование рекомбинантных вирусов CNP (ген LacZ
для осуществления предварительного теста):
- перенос клеток QT35 вирусом CNP и плазмидой переноса,
- просеивание с последующей очисткой рекомбинант благодаря экспрессии гена LacZ,
- анализ геномов рекомбинант и экспрессии гена LacZ
c. Тест вакцинации:
- вакцинация цыплят рекомбинантными вирусами и защита от птичьей оспы, внесенной при помощи
рекомбинантного вируса LacZ.
d. Клонирование генов, кодирующих гетерологичные антигены (гетерологичный протеин) в плазмидах переноса:
- клонирование генов, кодирующих
гетерологичные антигены ниже P11 или P7.5,
- клонирование кассет P11-антиген и P7.5 - LacZ или P7.5-Антиген и P11-LacZ в плазмидах TIR.
e. Конструирование рекомбинантных
вирусов CNP:
- перенос клеток QT35 вирусом CNT и плазмидой переноса,
- просеивание с последующей очисткой рекомбинантных вирусов благодаря экспрессии гена LacZ,
- анализ
экспрессии антигена на культуре клеток и анализ генома рекомбинантных вирусов.
f. Вакцинация:
- вакцинация рекомбинантными вирусами CNP,
- оценка степени защиты,
обусловленной экспрессией антигена, гетерологичного по отношению к CNP.
Изобретение относится также к последовательностям переноса, которые позволяют включать гетерологичную ДНК в геном вируса Avipox, как определено выше, и, в частности, на сайтах B1 или B2. Изобретение относится к также к плазмидам, которые несут эти последовательности. Под плазмидой переноса понимают плазмиду, которая содержит гетерологичный ген под контролем промотора, распознаваемого вирусом Avipox, который окаймлен с обеих сторон последовательностями, расположенными с одной и с другой стороны от сайта B1 или от сайта B2. Длина этих последовательностей, гомологичных для FPV, которые окаймляют гетерологичный ген, должна быть достаточно велика, чтобы разрешить рекомбинацию слева и справа от гетерологичного гена. Обычно выбирают последовательности величиной не менее 1 ко. Хорошие результаты получаются для B1, окаймленного последовательностью величиной примерно 1850 нуклеотидов сверху и 4321 нуклеотидов снизу, а для B2 - примерно 3070 нуклеотидов сверху и 3100 нуклеотидов снизу. Плазмиды переноса принимают участие в процессе для изолирования рекомбинантных Avipox, причем способ вводит в действие перенос клеток перепелки QT35, предварительно зараженных вирусом Avipox.
Изобретение относится также к культивированию эукариотных клеток, зараженных рекомбинантным вирусом Avipox, выведенным из ослабленного штамма вируса Avipox и содержащим в неосновной части своего генома по меньшей мере одну последовательность ДНК, кодирующую полностью или частично протеин, гетерологичный для вируса Avipox, а также элементы, способные обеспечить экспрессию этого протеина в клетке, зараженной указанным рекомбинантным вирусом, причем неосновная часть образована некодирующей внутригенной областью вируса Avipox, расположенной между двух OFR, включая их сигналы экспрессии.
Предпочтительно применяют культивирование клеток домашней птицы. Хорошие результаты были получены с культурой клеток перепелки. Превосходные результаты были получены с культурой клеток перепелки QT35 такой, которая описана Cho (1981).
Рекомбинантный вирус Avipox по изобретению развивается в качестве векторов, способных выражать полностью или частично гетерологичный протеин. Следовательно, настоящее изобретение относится также к применению вируса по изобретению в качестве вектора, способного выражать полностью или частично гетерологичный протеин, такой как, в частности, антиген.
Изобретение относится также к вакцине, содержащей рекомбинантные вирус Avipox, выведенный из ослабленного штамма вируса Avipox и содержащий в неосновной части своего генома по меньшей мере одну последовательность ДНК, кодирующую полностью или частично протеин, гетерологичный для вируса Avipox, а также элементы, способные обеспечить экспрессию этого протеина в клетке, зараженной указанным рекомбинантным вирусом, причем неосновная часть генома образована некодирующей внутригенной областью вируса Avipox, расположенной между двумя ORF, включая их сигналы экспрессии.
Под гетерологичным протеином понимают любой протеин или часть протеина, которые чужеродны по отношению к вирусу Avipox, причем протеин может быть естественным или модифицированным. В общем случае этот протеин может быть антигеном, позволяющим разработать вакцину против патогенного организма. Обычно антигенами являются, в частности, протеины агентов, заражающих птиц: вирусов, бактерий, хламид, микоплазм, простейших одноклеточных организмов, грибов и червей.
Это, в частности, Adenoviridae, такие как вирус, ответственный за апластичную анемию (AA) или за синдром снижения кладки яиц (EDS), Birnaviridae, такие как вирус болезни Гумборо (IBDV), Coronaviridae, такие как вирус инфекционного бронхита (IBY), Herpesviridae, такие как вирус болезни Макера (MDV) и вирус, ответственный за инфекционный ларинготрахеит (ILTV), Orthomyxoviridae, такие как вирус, ответственный за грипп (Influeusa), Paramyxoviridae, такие как вирус болезни Ньюкасла (NDV), Picornaviridae, такие как вирус, ответственный за энцефаломиелит (AE), Roeviridae, ответственный за тенозиновит, Retrovirus, такие как вирус, ответственный за лимфоидный лейкоз (LL), вирус, ответственный за анемию у кур (CAV).
Это, в частности, хламиды, такие как Chlamydia psittaci.
Это, в частности, микоплазмы, такие как Mycoplasma gallisepticum и M. synoviae.
Это, в частности, бактерии, такие как Escherichia coli, Haemophilus, в том числе H. paragallinarum, которая является ответственной за насморк, Pasteurella, в том числе P. multocida, которая является ответственной за холеру, Salmonella, в том числе S.gallinarium, ответственная за тиф, и S. pullorum, Clostridium, в том числе C.botulinum, которая вырабатывает токсин, ответственный за ботулизм, C. perfringens и C.septicum ответственные за дерматозы, C.colinum, Campilobacter jejuni, Streptococcus aures.
Это, в частности, простейшие одноклеточные организмы, такие как Eimeria, ответственный за кокцидиоз, и Cryptosporidiosis baileyi, ответственный за криптоспородиоз.
Это, в частности, черви, такие как ленточные черви и круглые черви, в том числе Ascaridia galli.
Это, в частности, грибы, такие как Aspergillus fumigatis.
Предпочтительными антигенами являются антигены вируса болезни Гумборо (IBDV), вируса инфекционного бронхита (IBV), вируса, ответственного за анемию у кур (CAV), простейшего одноклеточного организма Eimeria, ответственного за кокцидиоз, вируса болезни Ньюкасла (NDY) и вируса болезни Марека (MDV).
Особенно предпочтительными антигенами являются
антигены вируса болезни Гумборо (IBDV), вируса инфекционного бронхита (IBV), вируса, ответственного за анемию у кус (CAV) и простейшего одноклеточного организма Eimeria, ответственного за кокцидиод.
Хорошие результаты были получены в следующих условиях:
- для IBDV : полностью или частично открытые фазы для считывания, в том числе полипротеин и части полипротеина. Такими протеинами
являются, в частности, VP2, VP3, VP4. Сюда входят также все их комбинации или модификации. Эти модификации представляют собой, например, включение сайта расщепления,
- для IBV : антигена E2,
- для Eimeria : естественный поверхностный антиген TA4 и поверхностный антиген, у которого последовательность сайта протеолитического расщепления была модифицирована,
- для CAV :
протеин P50.
Превосходные результаты были получены с IBDV, причем гетерологичным протеином является часть полипротеина, содержащая аминокислоты с 1 по 493, за которыми следуют аминокислоты с 1010 по 1012, причем в эту часть включен протеин VP2, как изображено на фиг. 9.
Последовательности ДНК могут кодировать протеин полностью или же фрагменты протеина и могут вызывать у животных соответствующую ответную реакцию иммунитета. Другие молекулы, отличные от антигенов, также могут приниматься во внимание, в том числе факторы роста и иммуномодуляторы, такие как интерлейкины. Целью настоящего изобретения является также производство in vivo (в домашней птице) фактора, участвующего в метаболизме животного, такого как, например, гормон роста или фактор, индуцирующий последний. Настоящее изобретение относится также к получению протеинов или пептидов путем культивирования клеток in vitro или in vivo у животных. В зависимости от введенного гетерологичного протеина он может выступать, в частности, в качестве фермента, в качестве компонента пищи или в области здоровья людей или животных в качестве фармацевтического продукта для медицинского или ветеринарного применения.
С другой стороны, могут генерироваться мультиплетные рекомбинантные вирусы, несущие несколько гетерологичных генов, т.е. путем клонирования нескольких генов в одном и том же геноме, в одном и том же сайте или в различных областях или сайтах. Полифункциональный продукт также может быть создан в результате комбинации различных рекомбинантных вирусов.
Мишенью животного происхождения для вируса Avipox по изобретению являются птицы, в частности домашние птицы. Рекомбинантный вирус может также применяться для объектов, отличных от птиц.
Вакцина по изобретению может вводится в виде различных форм, известных специалисту. Обычно вакцина вводится оральным путем с пищей или с водой для питья, интраназальным путем, в результате подкожной инъекции, в виде аэрозоля, в результате внутримышечной инъекции или путем прокалывания крыла в соответствии с методом, называемым "wing web". Предпочтительно вакцина вводится путем прокалывания перепонки крыла в соответствии с методом, называемым "wing web", в результате внутримышечной инъекции или в результате подкожной инъекции.
Рецептура вакцины по изобретению составляется известным специалисту способом. Обычно вакцинальная композиция содержит стабилизаторы, соответствующие способу введения вакцины. Вакцина может храниться в лиофилизированной форме.
Настоящее изобретение иллюстрируется последующими примерами.
Пример 1. Очистка вируса CNP и его ДНК.
В качестве вируса Fowlpox используют вакцинальный штамм, поставляемый в торговлю фирмой Сольвей под маркой POULVAC CHICK-N-POX, CHICK-N-POX, CHICK-N-POX TC, POULVAC CHICK-N-POX TC (CNP) в виде живущей ослабленной вакцины. Первоначальная колония происходит из почвенного штамма, пропущенного несколько раз через яйца и адаптированного к клеткам in vitro в результате 2 прохождений через CEF (фибробласты куриного эмбриона) и 5 прохождений через клеточное потомство перепелки QT35, описанное Chno (1981). Клеточное потомство перепелки QT35 получено у Dr.Moscovici (6816, Нортвест, 18-я авеню, Гайнесвиль, Флорида 32605, Соединенные штаты), который его выделил и распределяет его.
CNR культивируется на клеточном потомстве QT35, среда для роста которого состоит из E199 (Gibco 500 мл), F12 (Gibco 500 мл), LAH (Gibco, гидролизат лактальбумина, 25 мл), FCS (Gibco, Foetal Calf Serum 25 мл) и фруктозы (5 мл раствора с концентрацией 200 г/л), инкубация при температуре 38oC, 3% CO2. Обычная мультиплетность заражения (MOI) составляет 0,01 вируса на одну клетку, причем клетки на 80% находятся в слиянии.
Вирусная колония очищалась следующим образом: клетки, зараженные вирусом Fowlpox CNP и извлеченные из фосфатного буферного раствора PBS (Phosphate Buffered Saline, Gibco) центрифугируются с ускорением 6000 g (15 минут). Осадок после центрифугирования снова переводится в суспензию в буферном растворе Трис (pH 9,1 мМ), обрабатывается трипсином (конечная концентрация трипсина 0,25 мг/мл; Gibco) и ультразвуком. Этот продукт помещается в среду с 36% сахарозы (вес/объем) и центрифугируется в течение 45 минут с ускорением 30000 g. Остаток после центрифугирования извлекается в буферном растворе Трис с концентрацией 1 мМ, pH = 9,0. Вирусы центрифугируются последний раз в течение 30 минут с ускорением 40000 g. Осадок после центрифугирования извлекается в буферном растворе для разложения лизинами : 10 мМ Трис-HCl, pH = 8,0, 10 мМ ЭДТА, 1% SDS (додецилсульфат натрия), 500 мкг/мл протеиназы K (Boehringer) 0,1 мг/мл RN-азы (Boehringer), и инкубируется в течение 2 часов при температуре 37oC. Экстрагированная в феноле ДНК осаждается в этаноле. Было очищено порядка 20 мкг ДНК, исходя из 40 зараженных чашек с площадью 150 см2.
Пример 2. Конструирование геномного банка EcoRI и
геномного банка BamHI для CNP
Используемые генетические методы описания у Maniatis et al., 1982. Ферменты рестрикции, полимеразы, лигазы и фосфатазы были поставлены фирмами Pharmacia,
Boehringer et Biolabs. Синтетические ДНК были поставлены фирмой Eurogentec.
Фрагменты рестрикции вирусной ДНК посредством EcoRI или BamHI были связаны в векторе PUC18, описанном у Messing (1983), и введены в бактерию E. coli MC1061 (araD139, (ara, Leu) 7697, LacX74, galU, galK, hsdR, strA, продаваемые фирмой Фармация). Оба геномных банка хранятся при температуре -70o C в глицерине в виде двух трансформированных клеточных суспензий. Восемьдесят % плазмид содержат одно включение. Семнадцать фрагментов BamHI и 45 фрагментов EcoRI были дифференцированы на основе их размера и их модели рестрикции посредством Bg12 или HinFI. Включения имеют размеры от 0,5 до 15 ко; сумма охарактеризованных таким образом включений BamHI составляет 82 ко и 210 ко для фрагментов EcoRI. Размер генома Pox у птиц близок к 300 ко (Coupar et al. , 1990). Выделенные фрагменты составляют тем самым 25% для BamHI и 70% для EcoRI от всего генома.
Пример 3. Клонирование
фрагментов, несущих TIR
Обратные терминальные повторения (TIR) представляют собой две идентичные последовательности, находящиеся на концах генома вирусов Pox и имеющие противоположное
направление. Последовательность величиной более 17 ко одного конца генома штамма HP вируса Fowlpox была опубликована (Campbell et al., 1989 и Tomley et al., 1988). Она содержит примерно 10 ко
повторяемой последовательности и 7,0 ко ее смежной последовательности.
Осуществляют клонирование фрагментов EcoRI для TIR. Повторяемая последовательность содержит сайт EcoRI. Как это показывает фиг. 2, клонируются два фрагмента EcoRI: каждый несет одну часть TIR и одну единичную смежную последовательность. Единичная последовательность ограничена наиболее близким сайтом EcoRI из TIR. Эти два фрагмента были выделены благодаря олигонуклеотиду, комплементарному по отношению к последовательности, расположенной в повторяемой части. Первый фрагмент имеет размер 6,2 ко и будет называться (по договоренности) TIR-L. Второй имеет размер 9,0 ко и будет называться (по договоренности) TIR-R. Последовательность фрагмента EcoRI TIR- для CNP является идентичной с опубликованной последовательностью.
Место соединения между TIR и единичной последовательностью, идентифицированной при сравнении последовательностей TIR-L и TIR-R, находится на нуклеотиде 4007, причем сайт BamHI последовательности, опубликованной у Tomley et al., (1988), принимается за нуклеотид номер 1. Место соединения находится в открытой фазе для считывания, называемой ORF 3 указанными авторами.
Пример 4. Создание в результате направленного мутагенеза сайтов BamHI в TIR
Открытые фазы для считывания (ORF) были идентифицированы в результате анализа
нуклеотидных последовательностей TIR. В частности, OFR 1 находится между нуклеотидами 416 и 1674, OFR 2 находится между нуклеотидами 2166 и 2671 и, наконец, ORF 3 находится между нуклеотидами 3606 и
4055 и кодируется на комплементарной цепи. Мы принимаем в качестве нуклеотида N 1 первый нуклеотид G сайта BamHI из TIR. Эти ORF ограничивают две больших некодирующих внутригенных последовательности,
называемых область β1, между ORF 1 и ORF 2, с одной стороны, и область β2, между ORF 2 и ORF 3, с другой стороны. Именно эти две внутригенные области выбираются в
качестве областей для включения.
Единичный сайт клонирования был введен в результате направленного мутагенеза (оборудование для мутагенеза фирмы БиоРад) в области β1
и β2. Сайт BamHI был выбран в качестве сайта клонирования, потому что он совместим с другими сайтами рестрикции, в том числе Bg11 и Bg12. Положение сайта клонирования выбиралось
примерно в середине каждой внутригенной области, чтобы избежать всякого риска отделить сигналы транскрипции от их соответствующих генов, т.е.:
- в области β1 : сайт B1
представляет собой последовательность 5' GATC 3' на нуклеотиде 1842, трансформированную в BamHI GGATCC путем включения G в 5' и C в 3';
- в области β2 : сайт B2 представляет
собой последовательность 5' GGATT 3' на нуклеотиде 3062, трансформированную в BamHI путем мутации второго T в CC.
Два сайта BamHI находятся в плазмиде, которая несет фрагмент TIR-L (пример 3). Один сайт происходит из вектора pUC18. Второй сайт происходит из TIR и находится на 71 нуклеотид ниже сайта EcoRI, выбранного для клонирования (Campbell et al., 1989, фиг. 2). Эти два сайта BamHI были подвергнуты делеции из плазмиды, несущей TIR-L, путем рестрикции BamHI с последующим заполнением на полимеразе Klenow и связыванием. Плазмида, которая при этом получается, представляет собой pTIRI.
Для генерирования сайта BamHI в B1 фрагмент Hind П величиной 0,9 ко плазмиды pTIRI был клонирован в векторе pBSPIus, поставляемом в торговлю фирмой Стратаген.
Праймер мутагенеза представлял собой:
5' TTTCGAAAGACTTTGGAT
CCGTAGTATAATATTATA 3'
Подчеркнутые нуклеотиды, т. е. GGATCC, представляют собой последовательность, указываемую
сайтом BamHI.
Для генерирования сайта BamHI в B2 фрагмент Xbal величиной 1,7 ко плазмиды pTIRI был клонирован в PBSRI us. Прамер представлял собой:
5' TATATCACGGGATCCA
AAAGGTTATTAGTAGTC 3'
Подчеркнутые нуклеотиды, т. е. GGATCC, представляют собой последовательность, узнаваемую сайтом BamHI.
Повторное включение каждого мутированного
фрагмента в pTIRI является результатом связываний:
- для B1: Hind 3 - Scal плазмиды pTIRI (1491 по) + Scal-Aat 2 из pBSPIus после мутагенеза (485 по) + Aat 2 - EcoRI из pTIRI (4220 по) +
EcoRI-Hind 3 из плазмиды pTIRI (2635 по),
- для B2: Xhol-SpII из плазмиды pTIRI (8512 по) + SpII-Xhol из pBSPIus после мутагенеза (318 по).
Эти два связывания генерировали векторы pTIRBI и PTIRB2. Их карты рестрикции приведены на фиг. 3 и 4.
Исходя из плазмиды pTIRI, была генерирована плазмида pTIRBID в результате делеции своего фрагмента EcoRI-Hpal величиной 2657 по.
Пример 5. Клонирование промоторов P11 и P7.5 из Vaccinia.
P11 и P7.5 являются известными промоторами для Vaccinia. P11 представляет собой промотор гена, кодирующего протеин P11, который подвергается транскрипции в ходе поздней фазы вирусного заражения. P7.5 представляет собой промотор гена, кодирующего протеин P7.5, который подвергается транскрипции одновременно в ходе ближайшей и поздней фаз.
Конструирование векторов с единичными сайтами Bg12 и Bc11.
Два вектора клонирования, содержащие единичные
сайты Bg12, Bc11 и BamHI, были сконструированы, чтобы обеспечить последовательные клонирования кассет, совместимых с BamHI. Последовательности сайтов Bg12 и Bc11 были введены в сайт BamHI из pBSPIus
путем клонирования следующей синтезированной ДНК:

Векторами являются pBSLK1 и pBSLK2. Линкерами являются в направлении:
pBSLK1... Ava/Smal-BamHI-Bc11-Bg12-Xbal...
pBSLK2... Ava/Smal-Bg12-Bc11-BamHI-Xbal...
Клонирование промотора P7.5
Фрагмент Bc11-BamHI длиной 143 по плазмиды pGS20 содержит промотирующую последовательность p7.5 (Mackett et al. , 1984). Эта последовательность приводится ниже (Venkatesan et al., 1981, Cochran et al.,
1985). Запаздывающий и ближайший промоторы подчеркнуты. Последнее основание у BamHI отстоит на 10 по от ATG, инициирующего ген.

Фрагмент Bc11-BamHI был клонирован в сайтах Bc11 и BamHI плазмид pBSLK1 и pBSLK2, генерирующих соответственно плазмиды p1P65 и p2P75. Чтобы разрешить переваривание Bc11, плазмиды pBSLK1 и pBSLK2 экстрагируются из штамма JM110, который доступен в АТСС (American Type Culture Collection) под шифром АТСС 47013.
Клонирование
промотора P11
Последовательность промотора P11 была клонирована в виде синтезированной ДНК, исходя из данных о последовательностях Bertholet et al., (1985), Hanggi et al. , (1986) показали,
что фрагмент из 30 нуклеотидов выше первого нуклеотида ATNm содержит промотор.
Синтезированная ДНК представляет собой 40-мер, несущий сайт Bg12 и сайт BamHI на своих концах. Эта ДНК была клонирована в pBSLK1, чтобы генерировать p1P11, и в pBSLK2, чтобы генерировать p2P11. Фрагмент Bg12-BamHI из p2P11 был затем клонирован в сайтах Xho2-BamHI из pACYC184. pACYC184 представляет собой вектор, описанный у Chang et Cohen (1978). Связывание между Xho2 (GGATCT) и Bg12 (AGATCT) восстанавливает Bg12.
Последовательность синтетической ДНК, несущей p11, представляет
собой:

Пример 6. Конструирование кассеты, несущей ген LacZ, совместимый с сайтом рестрикции BamHI.
Экспрессия гена LacZ даст возможность для просеивания рекомбинантных вирусов.
Кассета Bg12-BamHI, несущая ген LacZ, была преобразована в результате направленного мутагенеза. Эта кассета была клонирована в плазмиде pBSPIus (стратаген), подвергнутой делеции фрагмента LacZα, причем последнее для того, чтобы избежать рекомбинации между двумя гомологичными последовательностями: одной из LacZ, а другой на LacZα. Эта плазмида представляет собой pASMut LacZ1. Последовательность на концах гена LacZ после мутагенеза приводится ниже. Номера соответствуют номерам аминокислот природного протеина.
На конце 5':
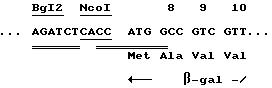
На коне 3':

Пример 7. Клонирование гена LacZ позади промоторов P7.5 или P11.
Кассета LacZ, Bg12-BamHI, из pBSMut LacZ 1 была клонирована в сайтах Bg12-BamHI из p2P75 и из p2P11 для генерирования соответственно p75 Lac и P11 Lac. Получают экспрессию гена LacZ в E.coli, когда он находится позади промоторов P7.5 или P11. Трансформированные колонии имеют голубой цвет на среде, содержащей X-Gal (хромогенный субстрат: 5-бром-4-хлор-3-индолил-β-D-галактопиранозид), который вызывает голубое окрашивание под действием β-галактозидазы. Этот тест доказывает, что ген является функциональным. Кассета P11 Lac в виде фрагмента Bg12-Hind 3 плазмиды P11 Lac также была клонирована в сайтах Xho2 и Hind3 плазмиды pACYC184, генерирующей pACP11 Lac. Карта p11 Lac приведена на фиг. 5.
Пример 8. Клонирование кассет p75 Lac и P11 Lac в плазмидах pTIRB1 и
pTIRB2
Фрагмент Bg12-BamHI из p11 Lac (или pACP11 Lac) и фрагмент Bg12-BamHI из p75 Lac несут кассету "промотор P7.5 или P11, за которым следует ген LacZ" (пример 7). Эти фрагменты были
клонированы в сайтах BamHI плазмиды pTIRB1 и плазмиды pTIRB2 (пример 4) в двух возможных направлениях при помощи фетотипа LacZ для просеивания. Были выделены шесть плазмид из восьми возможных
рекомбинант. Их нумерация приводится ниже. Примем, что ориентация "+" - это та, которая размещает транскрипцию гена LacZ в направлении от ORF 1 к ORF 2 или от ORF 2 к ORF 3, а ориентация "-" - это та,
которая соответствует противоположной ориентации. Названия плазмид "P75 Lac" и "P11 Lac" означают, что эти кассеты имеют ориентацию "+", тогда как "LacP75" и "LacP11" означают, что эти кассеты имеют
ориентацию "-". В качестве примера на фиг. 6 приводится карта плазмиды pTIRBIP75 Lac (табл. 1).
Примечание к табл. 1.
N - номер, данный плазмиде
Пром
- промотор.
Сайт B1 или B2 - сайт клонирования BamHI, выделенный в TIR.
Ор - ориентация. Ориентация является "+", когда направление транскрипции LacZ совпадает с направлением от ORF 1 к ORF 2 или от ORF 2 к ORF 3. Ориентация "-" является противоположной.
Название - название плазмиды переноса.
Пример 9. Выяснение условий
переноса и просеивания и выделения рекомбинантных вирусов CNP/LacZ
Принцип конструирования рекомбинантного вируса CNP представлен на фиг. 1. Протокол опыта переноса является следующим:
В день Д = 1 : в пересчете на чашку с площадью 25 см2 инокулируют 2,5 • 106 клеток QT35 в среде роста (состав описан в примере 1).
В день Д = 2 осуществляют перенос.
Вирусы: 1 мл лиофилизированной вакцины CNP в пробирке регидратируется при помощи 3 мл стерильной воды Милли-Q и хранится при температуре -70oC. Эта колония вирусов размораживается и подвергается мягкой ультразвуковой обработке в течение 1 минуты. Затем разбавляют в среде культивирования, обозначаемой E119-F12, которая соответствует среде E119, описанной в примере 1, но без LAH, сыворотки и фруктозы, чтобы достигнуть мультиплетности заражения величиной 0,05 вирусов на одну клетку в 2 мл среды. Затем заменяют среду для культивирования на вирусную суспензию и инкубируют культуру 2 часа при температуре 38oC.
Плазмиды: смешивают 20 мкг плазмид с 400 мкл воды и 100 мкл 1,25 М CaCl2, прибавляют по капле 500 мкл буферного раствора BBS /BES Buffer Saline/ с удвоенной концентрацией /50 мМ BES (Sigma), 280 мМ NaCl, 1,5 мМ Na2HPO4, pH = 7,0/ и инкубируют в интервале от 15 до 30 минут при температуре 25oC. Затем 1 мл препарата плазмид наносится на клетки после удаления среды. Потом инкубируют в течение 30 минут при температуре 38oC. Затем прибавляют 4 мл среды без LAH, но с добавкой 5% FCS и 15 мМ раствора Гепеса (Sigma) при значении pH = 7,2. Снова инкубируют в течение 4 часов при температуре 38oC. Затем заменяют среду на 5 мл среды роста, обозначаемой E199 (состав описан в примере 1).
В день Д = 0: собирают выращенные вирусы, как описано в примере 1.
Просеивание основывается на получении β -галактозидазы, выявляемом в результате опыта на чашке Петри "plaque assay". Протокол опыта для одной чашки Петри размером 6 см является следующим.
В день Д = 1 : инокулируют 2,5 • 106 клеток в 5 мл среды для роста.
В день Д = 2 : заражают эту культуру при помощи 1 мл вирусов с разбавлениями 1: 10 и 1:100, инкубируют в течение 4 часов при температуре 38oC, потом прибавляют 4 мл среды для роста (состав описан в примере 1).
В день Д = 3 : заменяют среду на 5 мл слоя агарозы, образованного 1 объемом 2%-й агарозы (Sea Plaque Agarose (FMC), растворенной в воде) и 1 объемом следующей смеси: 9 мл среды 199 2X (Gibco), 0,5 мл LAH (Gibco) и 0,1 мл раствора Гепеса (pH = 7,2, конечная концентрация 15 мМ) и 1, 0 мл FCS. Растаявшая агароза и смесь выдерживаются при температуре 38oC перед смешением. Дают агарозе образовать студень в течение 30 минут при температуре окружающей среды, потом инкубируют при температуре 38oC.
В день Д = 6 : покрывают культуру посредством 2 мл 1%-й агарозы в PBS (Gibco), содержащей 0,3 мл/мл X-Gal (5-бром-4-хлор-3-индолил-β -D-галактопиранозид, Boehringer). X-Gal растворен с концентрацией 30 мг/мл в ДМСО (диметилсульфоксид, Флука).
В день Д = 7 : подсчитывают число и долю голубых областей по отношению к числу неокрашенных областей. Потом отбирают индивидуально 5 областей при помощи пипетки Пастера. Хранят вирусы в 500 мкл среды для роста при температуре -70oC.
Частота рекомбинации для каждой плазмиды представлена в приведенной табл. 2. Рекомбинантные вирусы обозначают символом "V" с последующим номером плазмиды переноса (таким, который определен в примере 8). Процентная доля рекомбинант варьируется от 0,1% до 0,5%, что соответствует литературным данным для Pox. Изображение рекомбинантных геномов схематично дается на фиг. 7.
Примечание к табл. 2.
Голубое/общее - число голубых областей/общее число областей.
% - процентная доля голубых областей.
Пример 10. Очистка рекомбинантных вирусов
CNP/LacZ
Клон получается в результате последовательной очистки одной голубой области на чашке Петри (как описано в примере 9). В принципе, когда все области являются голубыми, то все вирусы
выражают ген LacZ и больше не загрязнены диким вирусом. От трех до четырех переходов необходимо для достижения такой однородности. Так, например, эволюция доли голубых областей в ходе переходов была
следующей (табл. 3).
Примечание к табл. 3.
Голубое/общее - число голубых областей/общее число областей.
% - процентная доля голубых областей.
На фотографии, полученной методом электронной микроскопии, среза клеток QT35, зараженных рекомбинантным вирусом V8, отчетливо видны типичные структуры вирусов Pox, в частности внутренняя структура, которая имеет форму собачьей кости.
Пример 11. Получение большого количества каждой рекомбинанты
Шесть рекомбинант были увеличены в результате трех
последовательных переходов на чашках. Титр второго перехода варьируется от 4•105 до 1,1•107 TCID50 (Tissue Culture Infections Dose) на мл. Только вирус V10 имеет
титр, меньший чем 104. Другие рекомбинанты размножаются фактически так же хорошо, как и дикий вирус, для которого титры обычно находятся в интервале от 105 до 107.
Пример 12. Анализ на "plaque assay" стабильности гена LacZ, внедренного в TIR
Ген LacZ, внедренный в вирусный геном, может быть стабильным или нестабильным в зависимости от типа
рекомбинации, которая имела место (это объясняется у Shuman et al., (1989). Так, если имеют место две рекомбинации с двух сторон от включения, то внедренный ген LacZ является стабильным. Например,
простая рекомбинация приводит к включению всей плазмиды переноса и, следовательно, гена LacZ. Этот вирус дает голубые области. Однако вирусный геном несет гомологичные последовательности прямого
направления, рекомбинация которых может привести к потере включения и к появлению неокрашенных областей.
С другой стороны, у вирусов Pox изменение в последовательности одного TIR может быть перенесено к другому TIR в ходе циклов заражения и репликации вируса. Двойная рекомбинация может внедрить LacZ в TIR-L, тогда область этого вируса становится голубой. В ходе последующих заражений рекомбинация между этим рекомбинантным TIR-L и диким TIR-R генерирует смешанную вирусную популяцию TIR-L/LacZ, TIR-L/LacZ-TIR-R/LacZ и WT /дикий/. Другие рекомбинации могут, кроме того, генерировать последний возможный тип, который представляет собой TIR-R/LacZ. Следовательно, голубая область может содержать три типа вирусов: вирусы, которые потеряли ген LacZ, вирусы, которые несут только одну копию гена LacZ, и вирусы, которые несут две копии гена LacZ.
Проверяют однородность вирусного препарата на "plaque assay" после нескольких последовательных заражений в жидкой среде (пример 9). На "plague assay" 3-го перехода вирусов V3, V4, V5, V8, V9 и V10 появились следующие доли голубых областей (табл. 4).
Примечание к табл. 4.
П3 и П6 - 3-й и 6-й переход вируса.
Голубое/общее - число голубых областей/общее число областей.
% - процентная доля голубых областей.
- - не
проводился
Таким образом, препараты рекомбинантных вирусов V8 и V9 являются однородными. Рекомбинанта V8 является стабильной до 6-го перехода. Например, препараты вирусов V3, V4 и V5 не
являются однородными. Они содержат долю от 5 до 20% вируса дикого типа. Эта доля имеет еще большее значение для вируса V10.
Пример 13. Анализ геномов CNP/LacZ методом Southern blot.
Проверяют однородность вирусного препарата методом Southern blot (Maniatis et al., 1982). Фрагменты рестрикции геномов рекомбинантных вирусов и нерекомбинантных вирусов различаются по их размеру.
Протокол опыта для получения вирусной ДНК является следующим:
В день Д = 1: в чашке площадью 25 см2, содержащей 5 мл питательной среды,
инокулируют 2 • 106 клеток QT35.
В день Д = 2: заражают с мультиплетностью инфекции величиной 0,01.
В день Д = 5: отделяют клетки при помощи скребка (Костар). Центрифугируют в течение 10 минут с ускорением 6000 g. К остатку после центрифугирования прибавляют 500 мкл буферного раствора для разложения лизинами, который состоит из 10 мМ Трис-HCl, pH = 8,0, 10 мМ ЭДТА, 0,1% SDS, 0,1 мг/мл RN-азы, 0,1 мг/мл протеиназы К. Переносят клетки в пробирку Эппендорфа. Затем перемешивают полученную суспензию и инкубируют в течение 1 часа при температуре 50oC. Потом экстрагируют водную фазу 3 раза в феноле с хлороформом. Осаждают ДНК при помощи 0,3 М ацетата натрия и 2 объемов этанола при температуре -20oC в течение 15 минут. Центрифугируют в течение 10 минут с ускорением 18300 g. Осадок после центрифугирования переводят в суспензию посредством 500 мкл воды. Порядка 5 мкл этой суспензии полной ДНК достаточно для метода.
Для сайта B1
Геномы перевариваются EcoRI. Зонд представляет собой плазмиду pTIRB1 LacP75, переваренную посредством EcoRI. Этот зонд различает рекомбинантные и родственные
фрагменты TIR-L и TIR-R. Фрагменты имеют размеры 9,3 и 6,2 ко для дикого вируса, 7,4, 5,1 (дублет) и 4,4 для вируса V3, 7,4, 4,9 и 4,4 ко для вируса V8 и, наконец, для вируса V9 - 10,4, 7,7 и 2,0
(дублет) ко. Вирусы V8 и V9 приобрели две копии гена LacZ (по одной в каждом TIR) и не содержат фрагмент TIR родственного типа. Напротив, в случае вируса V3 последнее имеет место.
Поскольку в каждом TIR можно клонировать одну копию гена LacZ, то можно сделать вывод, что сайт включения B1 является несущественным для развития вируса и для его роста на клетках при культивировании. С другой стороны, поскольку ген LacZ имеет размер 3 ко приблизительно, то выделение этих двойных рекомбинант доказывает, что можно внедрять 6 ко на геном вируса CNP.
Для сайта B2
Результаты по методу Southern показывают присутствие рекомбинантных фрагментов TIR-L и TIR-R, но также и родственных фрагментов в препаратах вирусов V4, V5 и V10. Эти три препарата,
следовательно, не являются однородными.
Пример 14. Альтернатива для выделения двойной рекомбинанты в сайте включения B1
Эволюция рекомбинаций в TIR предсказывает появление
стабильной двойной рекомбинанты в потомстве вируса, несущего дикое TIR и рекомбинантное TIR. Вирусные области повторно выделяются из голубой области в чашке Петри "plaque assay" либо в результате
нового опыта на "plaque assay", либо на пластинках для титрования с 96 лунками. Можно анализировать геном из каждой новой области либо методом Southern либо методом ПЦР. Эти различные возможности были
проработаны.
Метод Southern, осуществленный на геномах вирусов из 10 различных голубых областей, полученных на "plaque assay" для 3-го перехода вируса V3, показал, что в 10 областях препарат является однородным и содержит включение гена LacZ в каждом из TIR.
В случае пластинки для титрования разбавление является таким, что ноль или одна вирусная область приходится на одну лунку. Это оптимальное разбавление оценивается методом предварительного титрования. Хорошие результаты получаются при заражении пластики для титрования (200 мкл на лунку, 20 мл на пластинку) при помощи 50 мкл вирусной суспензии, взятой из чашки Петри "plaque assay" после извлечения в 1 мл. Когда области хорошо видны, то отмечаются лунки, которые содержат одну область. После замораживания с последующим размораживанием отбирают пробы по 100 мкл среды на одну лунку.
В случае метода ПЦР полная ДНК быстро экстрагируется в следующих условиях: центрифугируют в течение 10 минут с ускорением 1000 g, извлекают остаток после центрифугирования в 200 мкл буферного раствора для разложения лизинами (10 мМ Трис-HCl, pH = 8,0, 10 мМ ЭДТА, 0,1%, SDS) с добавлением RN-азы (0,1 мг/мл) и протеиназы K (0,1 мг/мл) и инкубируют полученную таким образом смесь в течение 1 часа при температуре 50oC. Потом экстрагируют водную фазу три раза в смеси фенол/хлороформ. Из этой водной фазы осаждают ДНК этанолом. Извлекают полученный осадок в 50 мкл воды. Используют 10 мкл этой суспензии для метода ПЦР. Условия, используемые для метода ПЦР, являются такими, которые рекомендуются фирмой Перкин Эльмер (Gene Amp DNA Amplification Reagent kit). Увеличенные фрагменты анализируются на геле агарозы.
Праймеры 5168 и 5169 гибридизируются
с двух сторон от сайта включения B1, соответственно ниже и выше этого сайта. Их последовательность является следующей:

Фрагмент величиной 220 по увеличивается на диких TIR, а фрагмент величиной более 3 ко - для рекомбинантного TIR, содержащего ген LacZ. Для выявления гена LacZ вторая амплификация использует праймер 5168, расположенный ниже сайта B1, и праймер 3254, расположенный в гене LacZ. Увеличивается фрагмент величиной 674 по. Этот разумный выбор праймеров позволяет, следовательно, различать рекомбинантные TIR и нерекомбинантные TIR. Вирусная суспензия считается однородной, двойной рекомбинантной, если фрагмент WT (дикий) не увеличивается. Контрольными являются геном вируса WT и плазмиды pTIRB1 и pTIRB1 Lac (табл. 5).
Примечание к табл. 5.
- - отсутствие увеличенного фрагмента.
Пример 15. Экспрессия гена
LacZ при культивировании ткани рекомбинантными вирусами CNR/LacZ
Активность β-галактозидазы (β- gal) измеряют, используя о-нитофенил-β-галактопиранозид (ОНФГ) в качестве
субстрата. Фермент превращает ОНФГ в галактозу и о-нитрофенол (ОНФ) желтого цвета, количество которого измеряется в результате поглощения при 420 нм. Это поглощение переводится в единицы β-gal
при помощи калибровочной кривой в соответствии с правилом: "1 единица β-gal = 1 мкмоль полученного ОНФ (3 • 106 клеток) 60 минут инкубации экстрактов при 28oC".
Этот опыт "β-Gal" проводится, как будет видно, в чашке с поверхностью 25 см2. Для вирусов Pox различают ближайшую и запаздывающую фазы заражения. Ближайшая фаза является наиболее короткой; она длится примерно 6 часов. Она заканчивается в момент репликации генома. Запаздывающая фаза начинается с репликации и завершается по окончании цикла заражения высвобождением вирусных частиц, т.е. три дня спустя. Чтобы иметь достаточную экспрессию гена LacZ в ходе ближайшей фазы, предлевают искусственно ближайшую фазу при помощи цитозин-β -D-арабинофуранозида (АгаС), который является ингибитором репликации.
a. Клетки.
В день Д = 1: на чашке инокулируют 3 • 106 клеток QT35 в 5 мл питательной среды.
В день Д = X2: проводят заражение с мультиплетностью инфекции 3 вируса на клетку. Инкубируют в течение 1 часа при температуре 38oC. Затем удаляют вирусный инокулят при помощи пипетки. Потом прибавляют (на одну чашку) 5 мл среды для сохранения с добавкой или без добавки АгаС (Сигма) с концентрацией 40 мкг/мл. Инкубируют культуры в течение 16 часов при температуре 38oC.
b. Собирание в день Д = 3
Соскребают клетки с чашки.
Центрифугируют культуру в течение 10 минут с ускорением 6000 g. Снова переводят остаток после центрифугирования в суспензию посредством 500 мкл PBS, перемешивают эту суспензию и переносят ее в пробирку Эппендорфа с объемом 1,4 мл.
Затем лизируют клетки путем прибавления 50 мкл CHCl3 и 5 мкл 10% SDS. Перемешивают суспензию клеток в течение короткого времени. Потом центрифугируют эту суспензию в течение 5 минут с ускорением 9000 g.
с. Ферментативная реакция
Субстрат ОНФГ для 25 образцов приготавливается следующим образом: смешивают 27,7 мг ОНФГ (Сигма) и 50 мл разбавителя, состоящего из 1 мл 0,1 М
MgSO4 и 1 мл 2-меркаптоэтанола (Мерк) в конечном объеме 100 мл буферного раствора (90 мл 0,1 М NaHPO4 с pH = 7,0, 0,1 М MgSO4, 1 мл меркаптоэтанола.
Смешивают 1,95 мл раствора ОНФГ и 50 мкл суспензии клеток, которую инкубируют в течение 1 часа при температуре 28oC. Потом прибавляют к этой суспензии 2 мл 1 М Na2CO3 и измеряют поглощение этой суспензии при 420 нм.
Сравнение активности β-gal для рекомбинантных вирусов приводится ниже в единицах β-gal (табл. 6).
Примечание к табл. 6.
WT - дикий тип, нерекомбинантный.
Ближайшая (АгаС) - ближайшая фаза роста, искусственно продленная на 16 часов за счет АгаС.
Ближайшая + Запаздывающая (-АгаС) - естественные ближайшая и запаздывающая фазы без АгаС.
Погл - поглощение.
ед β-gal - единица измерения β -галактозидазы.
1:5 и 1:10 - предварительные разбавления экстрактов в 5 и 10 раз.
Промотор P7.5 для Vaccinia действует в ходе ближайшей и запаздывающей фаз заражения (V3, V4 и V5), промотор P11 имеет исключительно запаздывающую активность (V8 и V9), промотор P11 является более сильным, чем промотор P7.5, как и для Vaccinia. Временное регулирование, а также относительная сила обоих промоторов, следовательно, сохраняются в вирусе CNP, будь то включение в B1 или B2 и какова бы ни была ориентация LacZ.
Пример 16. Вакцинация цыплят рекомбинантным вирусом CNP/LacZ. Защита от птичьей оспы.
Иммунная ответная реакция против β-gal.
Испытывают вакцинирующую способность рекомбинант CNP/LacZ. Двумя заказываемыми критериями являются защита против птичьей оспы и иммунная ответная реакция против β-галактозидазы.
a. Введение путем прокалывания крыла
Суспензия
рекомбинантных вирусов V4, V8 или суспензия вакцинального штамма CNP вводились путем инъекции цыплятам в возрасте одного дня, освидетельствованным в том, что они свободны от патогенных
микроорганизмов (SPF), в результате прокалывания перепонки крыла (способ, называемый "wing web" (WW).
Тесты распространяются на три группы от 28 до 30 цыплят, вакцинированных вирусами V4 или V8 или CNP, и на группу из 15 невакцинированых цыплят, рассматриваемую в качестве отрицательного контроля.
Каждый вакцинированный цыпленок получил 10 мкл суспензии с содержанием вирусов 5 • 105 ТСIД50 (Tissue Culture Infections Dose)/мл, что эквивалентно 5 • 103 TCID50 на одну птицу. На 29 день цыплята были приведены в контакт с вирулентным вирусом (штамм Fowlpox Challenge Virus, полученный из Афиса, США).
Отсутствие нарушений здоровья, оцениваемое десять дней спустя, свидетельствует о защите всех вакцинированных цыплят от птичьей оспы. Напротив, половина невакцинированных цыплят имела нарушения здоровья. Анализ титров антител против β-галактозидазы прямым методом ELISA показал, что 21 из 29 (72%) цыплят, вакцинированных вирусами V4, и 20 из 38 /71%/ цыплят, вакцинированных вирусом V8, имеют серологическую реакцию, т.е. являются сероположительными.
Поскольку титр ELISA является последним разбавлением, которое дает оптическую плотность, превышающую 100, то средний титр ELISA анти-β-галактозидазы в сыворотке этих цыплят составляет 1:800.
b. Введение внутримышечным и подкожным путем
Однодневные цыплята вакцинируются в первый день посредством 104,4 ТСIД50 вируса V8 внутримышечным путем (ВМ, 27 цыплят) или подкожным
путем (ПК, 34 цыпленка). Они подвергаются испытанию здоровья спустя 27 дней. Они защищены от птичьей оспы (100%). Серологическая реакция против β-галактозидазы наблюдается у 24 из 27 (88%)
цыплят, вакцинированных ВМ путем, и у 27 из 34 (79%) цыплят, вакцинированных ПК путем.
Таким образом, результаты иммунизации показывают,
- что рекомбинантные вирусы, которые
содержат ген LacZ в областях TIR их генома в сайте B1 или B2, сохранили свою иммуногенную способность,
- что промоторы P7.5 и P11 действуют в животных,
- что ответная реакция антител
направлена против β-галактозидазы, рассматриваемой здесь в качестве гетерологичного протеина, выраженного рекомбинантной CNP,
- что внутримышечный (ВМ) путь, подкожный (ПК) путь и
способ путем прокалывания перепонки крыла (WW) являются эквивалентными одновременно по отношению к защите от птичьей оспы и к доле серологической реакции против β-галактозидазы.
Пример 17. Включение генов, которые кодируют гликопротеин E2 вируса птичьего бронхита, в векторы переноса
Вирусом, ответственным за инфекционный птичий бронхит (IBV), является коронавирус.
Наиболее важным поверхностным антигеном этого вируса является протеин E2, образованный двумя субъединицами S1 и S2 (Cavanagh, 1983, Cavanagh et al., 1988). Существуют многочисленные серотипы, в том
числе массачусеттский, называемый M41, и галландские серотипы, в частности Д1466 и Д274 (Kusters et al., 1987).
Разрабатывают рекомбинантную вакцину CNP, которая выражает протеин E2 для IBV, чтобы получить эффективную вакцину против вируса, ответственного за инфекционный птичий бронхит (IBV).
Ген протеина E2 серотипа M41 был получен доктором Кустерсом из Утрехтского Университета (Голландия), также как и большие фрагменты генов E2 серотипов D1466, D207 и D274.
Кассета BamHI гена E2 для M41 была сконструирована в результате направленного мутагенеза. Полный ген штамма D1466 и полный гибридный ген D207/D274 были сконструированы, исходя из фрагментов, а также на кассетах, совместимых с BamHI. Эти три кассеты были клонированы ниже промотора P7.5, генерирующего три плазмиды p75M41, p75D1466 и p75D207.
Кассеты P7.5-E2 клонируются в сайте BamHI вектора переноса pTIRBI, потом кассета P11Lac клонируется ниже E2 в сайте BamHI. Эти плазмиды переноса представляют собой pTIRBIP75M41Lac, pTIRBIP75D1446Lac и pTIRBIP75D207Lac. Рекомбинантные вирусы конструируются путем переноса и очищаются, как описано в примерах 9, 10 и 11. Геномы анализируются методом Southern blot, как описано в примере 13. Экспрессия антигена E2 выявляется иммунологическими методами: ELISA, Western blot или иммунофлуоресценция при помощи специфических антител. Получают колонию рекомбинантных вирусов. Домашняя птица вакцинируется дозой этих рекомбинант. Эффективность вакцины оценивается после заражения патогенными вирусами в соответствии с классическими методами для инфекционного бронхита и в результате оценки содержания антител против вируса.
Пример 18. Включение гена Eimeria в
плазмиды переноса - конструирование рекомбинант CNP/TA4
Род Eimeria включает паразитов домашней птицы, ответственных за кокцидиоз. Были описаны поверхностные антигены, в частности, для
микроорганизмов E. tenella, E. necatrix, E.maxima (заявки на европейский патент 0 164 176 и 0 231 537).
Разрабатывают эффективную рекомбинантную вакцину против кокцидиоза.
Антиген для E.tenella, обозначаемый TA4 или A4, представляет собой протеин с молекулярным весом 25 кДа, состоящий из двух субъединиц с 17 кДа и 8 кДа, соединенных дисульфидным мостиком. Ген был выделен из геномного банка, а также исходя из mARN. Полное описание гена было опубликовано в вышеуказанных заявках на патент.
Кассета BamHI гена TA4 была сконструирована в результате субклонирования. Плазмида pTA406 содержит кодирующую последовательность из TA4. Плазмида pTA410 несет ген TA4 с модификацией в протеолитической последовательности, которая разделяет две субъединицы. В результате направленного мутагенеза природная последовательность Arg-Arg-Leu была заменена на последовательность Arg-Glu-Lys-Arg (описана Kieny et al., 1988). Эти две кассеты BamHI были клонированы ниже промотора P7.5 плазмиды pIP7.5 в направлении, которое размещает ген TA4 под контроль P7.5.
Кассеты P7.5-TA406 и P7.5-TA410 клонируются в сайте BamHI вектора переноса pTIRBID. Потом кассета P11-Lac клонируется в сайте BamHI ниже гена TA4. Плазмидами переноса являются pTIRTA406Lac и pTIRA410Lac.
Рекомбинантные вирусы были получены путем переноса, как описано в примерах 9, 10, 11. Получаются голубые области. Рекомбинанта, несущая ген TA406, представляет собой вирус V20, рекомбинанта, несущая ген TA410, представляет собой вирус V21.
Двойной рекомбинантный вирус V21, т. е. носитель одной копии TA410 и одной копии LacZ в каждой области TIR, очищается на пластинке для титрования, а его геном анализируется методом ПЦР, как описано в примере 14. Используемые праймеры и размер увеличенных фрагментов даются в приведенной ниже таблице. Праймер 1871 является комплементарным для гена LacZ (табл. 7).
Экспрессия антигена TA4 выявляется иммунологическими методами: ELISA, Western blot или иммунофлуоресценция при помощи специфических антител.
Получают колонию рекомбинантных вирусов. Домашняя птица вакцинируется дозой этих рекомбинант. Эффективность вакцины оценивается после испытания ("Challenge") вирулентными микроорганизмами Eimeria в соответствии с классическими методами для кокцидиоза, такими как анализ сывороток, скорость приращения веса и клинические признаки.
Пример 19. Включение гена полипротеина Гумборо в векторы переноса
Агентом,
ответственным за болезнь Гумборо, является вирус из семейства Birnaviridae. Вирус, называемый IBDV (Infections Bursal Disease Virus), вызывает очень заразную болезнь (болезнь Гумборо), которая
поражает молодых кур и характеризуется разрушением лимфоидных клеток сумки Фабрициуса. Вирус имеет геном, состоящий из двух сегментов двойной цепи РНК, называемых сегмент A (примерно 3400 пар
оснований; по) и сегмент B (примерно 2900 по). Вирусные частицы являются незакрученными и имеют форму икосаэдра с диаметром примерно 60 нанометров. Четыре вирусных протеина были четко
идентифицированы: VP1 с молекулярным весом (МВ) 90 кДа (кДа: кило-Дальтон), VP2 с МВ от 37 кДа до 40 кДа; VP3 с МВ от 32 кДа до 35 кДа и VP4 с МВ от 24 кДа до 29 кДа (Dobos, 1979, Fahey et al., 1985).
Протеин VP2 является производным предшественника VPX с МВ от 41 кДа до 54 кДа.
Сегмент B кодирует VP1, который в действительности является вирусной полимеразой. Сегмент A кодирует 3 других протеина. Последние генерируются в результате протеолитического расщепления, исходя из предшественника с МВ примерно 110 кДа, который соответствует большой открытой фазе для считывания сегмента A. В этом протеолитическом расщеплении задействован протеин VP4 (Jagadish et al., 1988). Протеины VP2 и VP3 образуют вирусный капсид. Протеин VP2 содержит антигенные детерминанты, способные вызывать синтез антител, нейтрализующих вирус (Becht et al., 1988, Fahey et al., 1988).
Разрабатывается рекомбинантная вакцина Fowlpox против болезни Гумборо.
Стадии этой
разработки являются следующими:
1. Выделение генетического материала из выбранного штамма IBDV, а именно из штамма EDGAR. Штамм вируса EDGAR можно достать в сельскохозяйственном департаменте
Соединенных Штатов (USDA, APHIS 6505 Belcrest Road, Hyattsville, МД 20782, Соединенные Штаты).
2. Синтез, клонирование и определение нуклеотидной последовательности ДНК, соответствующей сегменту A.
3. Внедрение ДНКк, а также последовательностей, необходимых для экспрессии этого генетического материала в клетках животного происхождения, зараженных вирусом Fowlpox, и последовательностей, позволяющих просеивать рекомбинантные вирусы Fowlpox, в плазмиду переноса pTIRBI, описанную в примере 4.
4. Выделение, очистка рекомбинантных вирусов.
5. Генетический анализ рекомбинантных вирусов.
6. Анализ экспрессии in vitro (при культивировании клеток) генов из IBDV, носимых этими рекомбинантными вирусами.
7. Вакцинация цыплят рекомбинантными вирусами и анализ защиты из болезни Гумборо.
Стадия 1.
Вирусная РНК штамма EDGAR была выделена, исходя из сумок цыплят, зараженных вирусом.
Примерно 40 г сумок, собранных спустя 7 дней после заражения вирусом, измельчаются в 40 мл буферного раствора TNE (TNE: 10 мМ Трис-HCl, 100 мМ NaCl, 1 мМ ЭДТА, pH = 8). Измельченная масса центрифугируется с ускорением 17000 g, и полученная водная фаза наносится на предварительно сформированный сахарозный градиент, состоящий из 2 слоев с содержанием сахарозы 40% и 60% (% как отношение вес/объем, в буферном растворе TNE). Градиент центрифугируется с ускорением 134000 g в течение 2 часов 30 минут. Собирают фазу поверхности раздела 40 - 60% сахарозного градиента, которая содержит частично очищенный вирус. Прибавляют 5 мл этой фазы к 5 мл буферного раствора, содержащего 10 мМ Трис-HCl, 100 мМ NaCl, 0,5% SDS, 10 мМ ЭДТА, 2 мг/мл Протеиназы K при значении pH = 7,5. Смесь инкубируется в течение 1 часа при температуре 37oC. Затем водная фаза экстрагируется в смеси фенол/хлороформ. Нуклеиновые кислоты водной фазы осаждаются в этаноле в присутствии 0,8 М LiCl и извлекаются в 500 мкл воды.
Стадия 2.
Синтез и амплификация ДНКк, соответствующей сегменту A, были осуществлены по методу, описанному в "GENEAMP RNA PCR KIT, PERKIN ELMER CETUS", при помощи синтетических олигонуклеотидов или "праймеров", комплементарных для последовательности сегмента A, в качестве затравки для синтеза первой цепи ДНК под действием обратной транскриптазы. Выбор этих синтетических нуклеотидов был определен в результате анализа опубликованных последовательностей сегментов A других штаммов IBDV: австралийского штамма 002-73 (Hudson et al. , 1986), немецкого штамма CU-1 (Spies et al., 1989) и британского штамма 52/70 (Bayliss et al., 1990). Последовательность праймеров и их положение относительно сегмента A штамма EDGAR приведены на фиг. 8 и 9.
Анализ опубликованных последовательностей штаммов IBDV показывает, что помимо большой открытой фазы для считывания (ORF 1), кодирующей протеины VP2, VP4, VP3, существуют две другие открытые фазы для считывания на той же самой цепи, кодирующей сегмент A. Одна, ORF 2, начинающаяся на 34 по выше ATG фазы ORF 1, находится выше последней и имеет длину 435 по. Другая, ORF 3, начинается на 32 по выше ORF 2 и имеет длину 31 по. Возможная роль этих ORF в биологии вируса в настоящее время не определена.
Были генерированы четыре фрагмента двойной цепи ДНКк, ограниченные соответственно парами "праймеров": 0-1b/585 по/ 1-2 (1129 по), 3-4 (670 по), 5-6 (1301 по), и покрывающие фазы ORF 1 и ORF 2 сегмента A (смотри фиг. 8).
Эти фрагменты были клонированы в плазмидах pBSPIus или pBSLKI, шесть плазмид были сконструированы указанным образом (смотри фиг. 8 и 10) (табл. 8).
Нуклеотидные последовательности фрагментов IBDV этих плазмид были определены и выровнены так, чтобы восстановить последовательность увеличенного сегмента A штамма EDGAR методом ПЦР (смотри фиг. 9). Первоначальные последовательности штамма EDGAR, которые были заменены в результате использования "праймеров", определенных на основе опубликованных последовательностей других штаммов IBDV, также были определены, исходя из продуктов увеличения этих областей при помощи "праймеров", расположенных снаружи последних.
Реконструирование сегмента A, исходя из полученных клонов, схематично изображено на фиг. 10.
Стадии являются следующими:
1. Конструирование pEDGAR12:
pBSIA2 (EcoRI + T4 ДНК-полимераза, SacI) + pBSIB (SphI) + T4 ДНК-полимераза, SacI)
2. Конструирование плазмиды pEADGARM12 в результате направленного мутагенеза на pEDGAR12:
a) делеция сайта SphI из pEDGAR12, распложенного выше последовательности IBDV:
- первоначальная последовательность:

5' GTCTGATCTCTACGG
TTCCCTTTAGTGAGGG 3'
b) делеция сайта EcoRI из плазмиды pEDGAR12 и введение сайта SphI ниже последовательности IBDV:
- первоначальная последовательность:
3. Конструирование pACEDGARM12:
Включение фрагмента Bc11-SphI плазмиды pEDGARM12 в сайты Bc11-SphI плазмиды pACYC184.
4. Конструирование pEDGARM34i путем направленного мутагенеза на pEDGAR34i
Замена сайта SphI на сайт NsiI:
- первоначальная последовательность:

5. Конструирование pEDGAR45:
pBS3A (Hinc2 + Pst1) + фрагмент Hinc2-Pst1 плазмиды pEDGAR34i
6. Конструирование pACEDGAR14:
pACEDGARM12 (SphI + T4 ДНК-полимераза, BamHI) + pEDGARM34i (NsiI + T4 ДНК-полимераза, BamHI)
7. Конструирование pACEDGAR15:
pACEDGAR14 (BamHI + T4 ДНК-полимераза, SaII) + pEDGAR45 (PVu2-SaII)
8. Конструирование pACEDGAR1:
pACEDGAR15 (SphI + EcoRI) + pBS3B (SphI + PVu2).
Эта плазмида содержит полную последовательность фазы ORF 1 сегмента A на фрагменте BcII-BamHI.
9. Конструирование плазмиды pBSIBDVOb в результате направленного мутагенеза pBSIBDV0:
Введение фазы ORF 3 в
плазмиду pBSIBDV0, которая несет начало фаз ORF 1 и ORF 2:
- первоначальная последовательность:
10. Конструирование pACEDGAR2 и pACEDGAR3:
Плазмиды pACEDGAR2 и pACEDGAR3 были получены в результате замены области BcI-I-Rsr2 плазмиды pACEDGAR1 на фрагмент BcII-Rsr2 плазмид pBSIBDVO и pBSIBDVOb соответственно.
3 плазмиды pACEDGAR1, pACEDGAR2 и pACEDGAR3 позволяют, таким образом, выделить на фрагменте BcII-BamHI соответственно ORF 1, ORF 1 - ORF 2 и ORF 1 - ORF 2 - ORF 3 сегмента A штамма EDGAR.
Последовательности этих 3 плазмид со стороны ATG фаз ORF приведены ниже:
Стадия 3.
Затем эти фрагменты BcII-BamHI были клонированы в сайте BamHI плазмиды p2P75, которая генерирует плазмиду p75EDGAR1, p75EDGAR2 и p75EDGAR3 и помещает одну или несколько кодирующих последовательностей сегмента A под контроль промотора P7.5.
Эти кодирующие последовательности помещались также под контроль промотора P11. Фрагмент BcII-BamHI плазмиды pACP11, несущий промотор p11, был включен в сайт BamHI плазмид pACEDGAR1, pACEDGAR2 и pACEDGAR3, чтобы генерировать соответственно плазмиды pIIEDGAR1, pIIEDGAR2 и pIIEDGAR3.
Кассеты BcII-BamHI P75-EDGAR или P11-EDGAR были выделены из этих различных плазмид и включены в сайт BamHI плазмиды pTIRBI, которая производит плазмиды pTIR75EDGAR1, pTIR75EDGAR2, pTIR75EDGAR3, pTIR11EDGAR1, pTIR11EDGAR2 и pTIR11EDGAR3. Ориентация кассет BcII-BamHI в плазмиде pTIRBI, которая была сохранена, является такой, чтобы направление транскрипции, инициируемой, начиная с промоторов P7.5 и P11, совпадало бы с направлением фаз ORF 1 и ORF 2, находящихся в плазмиде pTIRBI.
Фрагмент Bg12-BamHI плазмиды pACP11LAC, несущий кассету P11-LacZ, был включен в сайт BamHI плазмид pTIR75EDGAR1 и pTIR75EDGAR2, чтобы генерировать соответственно плазмиды pTIR75E1LAC и pTIR75E2LAC. Ориентация P11 - LacZ в этих плазмидах является такой, чтобы направление транскрипции гена LacZ совпадало бы с направлением открытых фаз ORF 1 и ORF 2.
Аналогичным образом плазмиды pTIR11E1LAC, pTIR11E2LAC и pTIR11E3LAC были генерированы путем включения в сайт BamHI соответственно плазмид pTIR11EDGAR1, pTIR11EDGAR2 и pTIR11EDGAR3 из кассеты P75-LacZ, выделенной в виде фрагмента Bg12-BamHI плазмиды p75LAC.
Наконец, плазмида pTIR11VP2LAC была генерирована путем включения в сайты PpuMI (обработанный ДНК-полимеразой T4) и Bg12 плазмиды pTIR11E1LAC фрагмента XhoI (обработанного ДНК-полимеразой T4) - Bg12 плазмиды p11EDGAR1. Плазмида переноса pTIR11VP2LAC содержит под контролем промотора P11 полную последовательность протеина VP2, а также амино-терминальную часть протеина VP4; для конструирования объединяются в фазу три последних аминокислоты (Asp, Leu, Glu; карбокси-терминальная часть протеина VP3) и кодон окончания трансляции (TGA) полипротеина. В соответствии с фиг. 9 этот гетерологичный протеин соответствует, следовательно, одной части полипротеина, содержащей аминокислоты с 1 по 493, за которыми следуют аминокислоты с 1010 по 1012, в которую включен протеин VP2.
В качестве примера на фиг. 11 изображена плазмида pTIR75E1LAC.
Стадия 4 и Стадия 5.
Рекомбинантные вирусы из Fowlpox, в которых были интегрированы открытые фазы ORF штамма Edgar, были выделены, очищены и охарактеризованы в соответствии с методами, описанными в примерах 9, 10, 11, 12, 13 и 14.
Обозначение рекомбинантных вирусов является
следующим:
V11 = P7.5E1; V12 = P7.5E2;
V14 = P11E1; V15 = P11E2;
V17 = P11VP2; V16 = P11E3.
Праймеры, используемые для селекции двойных рекомбинантных TIR в методе ПЦР, различают TIR WT, TIR, содержащие LacZ, E1, E2, E3 или VP2. Комбинации праймеров и размер увеличенных фрагментов даются в табл. 9.
Праймеры IBDV16, 3, 1b и 22 гибридизируются с IBDV. Праймеры IBDV16, 1b и 3 гибридизируются с кодирующей частью протеина VP2. Праймер IBDV22 гибридизируется c кодирующей частью протеина VP3 и, следовательно, не гибридизируется с геномом V17. Праймеры 5168 и 5169 гибридизируются с FPV. Праймер 1871 гибридизируется с геном β-галактозидазы. Последовательность этих праймеров определена в таблие "Список и последовательности праймеров".
Стадия 6.
Сравнивалась экспрессия антигенов IBDV рекомбинантных вирусов в клетках QT35.
Используемые антитела, настроенные против штамма IBDV Си-1, были любезно предоставлены профессором Г.Мюллером, Институт вирусологии, Юстус-Либих-Университет, Гессен, Германия.
А именно:
1 - поликлональная сыворотка (N B22)
гипериммунизированного кролика против штамма Си-1,
2 - моноклональное антитело мыши анти-VP3 (N 1/A10), распознавающее протеин VP3 в природной и денатурированной форме,
3
- моноклональное антитело мыши анти-VP2 (N B1), распознающее конформационный эпитоп протеина VP2; антитело, B1 является антителом, способным нейтрализовать вирусный штамм Си-1.
a.
Экспериментальные условия заражения
В день Д = 1: в расчете на одну чашку площадью 25 см2 инокулируют 2,5 • 106 клеток QT35 в 5 мл питательной среды (состав
описан в примере 1). Приготавливают восемь чашек.
В день Д = 2 : заражают клетки с мультиплетностью заражения 0,01 вирусов на одну клетку при помощи каждого рекомбинантного вируса, V11, V12, V14, V15, V16, V17, V8 (отрицательный контроль) и IBDV (штамм Bursine 2, положительный контроль).
В день Д = 5 : собирают зараженные клетки и среду после замораживания с последующим размораживанием.
b. Анализ продуктов экспрессии методом ELISA типа сэндвич-метода.
тест ELISA проводят, используя в качестве первого антитела поликлональное антитело B22, а в качестве второго антитела - либо моноклональное антитело анти-VP3 (N 1/A10), либо моноклональное антитело, нейтрализующее анти-VP2 (N B1). Кривые методы ELISA представлены на фиг. 12A для анти-VP3 и 12B для анти-VP2.
Результаты этих анализов показывают, что:
1 - фиг. 12A: протеин VP3 выражен во всех рекомбинантах (V11, V12, V14,
V15 и V16), которые содержат по крайней мере последовательность, кодирующую полипротеин (ORF 1, протеины VP2-VP4-VP3), но не выражен в рекомбинанте V17, потому что она содержит только область,
кодирующую VP2, и амино-терминальную часть протеина VP4, и не выражен в рекомбинанте V8, потому что она не содержит никакой последовательности IBDV.
Уровень экспрессии протеина VP3 является более слабым в рекомбинантах V11 и V12, чем в рекомбинантах V14, V15 и V16, что в действительности коррелируется с силой промоторов, присутствующих в различных рекомбинантах : активность промотора p7.5 (рекомбинанты V11 и V12) является менее сильной, чем активность промотора p11 (рекомбинанты V14, V15, V16) (смотри пример 15).
Не наблюдают различия уровня экспрессии протеина VP3 в зависимости от фаз считывания сегмента A, введенных в различные рекомбинанты: ORF 1 для рекомбинант V11 и V14, ORF 1 + ORF2 для рекомбинант V12 и V15 и ORF 1 + ORF 2 + ORF 3 для рекомбинанты V16.
2 - фиг. 12B : протеин VP2 выражен во всех рекомбинантах, за исключением V8, которая не содержит последовательностей IBDV.
Уровень экспрессии является наиболее высоким для рекомбинанты V17; в этом случае он близок к уровню экспрессии протеина VP2, выраженного в клетках, зараженных вирусом IBDV.
Снова наблюдают корреляцию между силой промоторов, присутствующих в различных рекомбинантах, и уровнем экспрессии протеина VP2.
Эти результаты показывают, с одной стороны, что эпитоп протеина VP2, распознаваемый антителом, нейтрализующим B1, которое настроено против штамма Си-1, также присутствует в протеине VP2 американского штамма Edgar, и, с другой стороны, что первоначальная конформация протеина VP2 сохраняется во всех рекомбинантах по крайней мере в этой области.
c. Анализ продуктов экспрессии методом Western blot.
Анализ при помощи метода Western blot протеинов, произведенных различными рекомбинантами, был осуществлен, с одной стороны, при помощи поликлональной сыворотки (B22), распознавающей совокупность протеинов IBDV, и, с другой стороны, при помощи моноклонального антитела анти-VP3 (1/A10).
Результаты, иллюстрируемые фиг. 13A, показывают, что поликлональная сыворотка распознает в экстрактах клеток, зараженных при помощи IBDV, в основном 3 протеина, соответствующих VP2 (≈ 40 кДа), VP3 (≈ 32 кДа) и VP4 (≈ 28 кДа). Протеин с молекулярным весом примерно 46 кДа также является наблюдаемым и мог бы представлять собой предшественника (VPX, ≈ 48-49 кДа) протеина VP2.
Для всех рекомбинант (V11, V12, V14, V15 и V16), которые содержат по крайней мере последовательность, кодирующую полипротеин (ORF1, VP2-VP3-VP4), выявлены при помощи поликлональной сыворотки анти-IBDV (рисунок 13A) протеины с молекулярным весом (МВ), совпадающим соответственно с МВ для VP3, VP4 и, вероятно, VPX. Для рекомбинанты V17 детектирован только один протеин, молекулярный вес которого близок к молекулярному весу протеина слияния VP2 + аминотерминальная область протеина VP4 (≈ 52 кДа).
Моноклональное антитело анти-VP3 (фиг. 13B) распознает в основном два протеина: VP3 и, вероятно, продукт разложения VP3 в клетках, зараженных при помощи IBDV, и все рекомбинанты, выражающие полипроетин. Никакой протеин из IBDV не распознается в рекомбинанте V17, выражающей протеин слияния VP2-VP4.
Совокупность этих результатов указывает, что фаза для считывания, кодирующая полипротеин (ORF 1), транслируется во всех рекомбинантах независимо от присутствия дополнительных фаз для считывания ORF 2 (рекомбинанты V12, V15) или ORF 2 и ORF 3 (рекомбинанта V16). Расщепление предшественника полипротеина осуществляется корректно, но оказывается неполным в том, что касается VP2, было предложено, что полное созревание предшественника VPX будет осуществляться в ходе или после переноса вирусных частиц IBDV к поверхности клеток (Muller et al., 1982).
Стадия 7.
Испытывают вакцинирующую способность рекомбинант FPV/IBDV.
a. Серологическая реакция под действием VII
Первая компания по вакцинации рекомбинантной FPV/IBDV сравнивала серологическую реакцию против β-галактозидазы и
против вируса IBDV для трех различных путей введения: внутримышечным путем (ВМ), подкожным путем (ПК) и путем прокалывания крыла (WW или wing web).
Однодневные цыплята вакцинируются при помощи 104,4 рекомбинантных вирусов V11 в соответствии с тремя путями введения ВМ, ПК или WW. Они умерщвляются 11 дней спустя.
Анализ сывороток прямым методом ELISA показал, что 2/14 (14%) цыплят, вакцинированных внутримышечным путем, 3/6 (50%) цыплят, вакцинированных подкожным путем, и 8/15 (53%) цыплят, вакцинированных путем прокалывания крыла, имеют антитела против β-галактозидазы, тогда как 5/14 (36%) цыплят, вакцинированных внутримышечным путем, 1/6 (17%) цыплят, вакцинированных подкожным путем и 1/15 (7%) цыплят, вакцинированных путем прокалывания крыла, имеют антитела против вируса IBDV.
Таким образом, протеины IBDV выражаются рекомбинантной FPV/IBDV11 у вакцинированного животного и вызывают ответную реакцию антител у некоторых цыплят. Из трех путей введения внутримышечный путь вызывает ответную реакцию, большую, чем для всех других.
b. Ранняя защита под действием вирусов V11, V15 и V16.
Однодневные цыплята получили дозу величиной 104,4 вирусов V8 (отрицательный контроль) V11, V15 или V16 внутримышечным путем и были подвергнуты вливанию. 10 дней спустя под действием 100 LD50 (стократная летальная доза) вируса 849 VB, введенного через глаз. Штамм 849 VB описан Van Den Berg et al., 1991.
Цыплята умерщвляются 210 дней спустя.
Умноженное на 100 отношение между весом сумки и общим весом является коэффициентом защиты.
Для контрольной группы, вакцинированной вирусом V8 и не подвергавшейся испытанию IBDV, это отношение составляет 0,57 (среднее для 10 цыплят).
Для группы V8, подвергнутой испытанию, это отношение доходит до 0,11 (9 цыплят).
Для цыплят, вакцинированных вирусами V11, V15 и V16, это отношение составляет соответственно 0,1 (20 цыплят), 0,12 (18 цыплят) и 0,12 (18 цыплят).
Применение этого критерия показывает, что отсутствует ранняя защита против вируса IBDV под действием рекомбинант V11, V15 и V16.
c. Поздняя защита под действием V11, V15 и V16.
Цыплята, вакцинированные вирусами V8, V11, V15 и V16, как описано в предыдущем пункте, были подвергнуты испытанию вирусом IBDV спустя 42 дня после инъекции.
Отобранные для анализа сыворотки перед испытанием анализируются методом ILISA, чтобы оценить ответную реакцию антител против β-галактозидазы и вируса IBDV.
Ответная реакция против β-галактозидазы показывает, что 100%-ная серологическая реакция получается у всех вакцинированных цыплят, т.к. всего у 70 цыплят. Титры варьируются от 1:200 до 1:51200. Нет существенной разницы между титрами, полученными для V11, у которого ген LacZ находится под контролем P7.5, и V8, V15 и V16, у которых гены LacZ находятся под контролем промотора P11.
Ответная реакция против IBDV у 10 цыплят, вакцинированных вирусом V8, является нулевой, она является положительной у всех цыплят, вакцинированных вирусами V11, V15 и V16. Подробности следующие: титры ответных реакций у 20 цыплят, вакцинированных вирусом V11, варьируются от 1:800 до 1:51200 при среднем 1:6400. Они составляют от 1:6400 до 1:102400 при среднем 1:25600 для 20 цыплят, вакцинированных вирусом V15. Они находятся между 1:6400 и 1: 204800 при среднем 1: 25600 у 20 цыплят, вакцинированных вирусом V16. Содержание антител является явно более высоким для групп, вакцинированных вирусами V15 или V16, чем в случае V11.
Титры серонейтрализации вакцинального штамма PBG68, адаптированного к культивируемым клеткам, составляет 1:10 для V11, в качестве отрицательного контроля, 4 сыворотки из 20 для V15 и 1 сыворотка из 20 для V16 имеют титры серонейтрализации величиной 1:20. Следовательно, этот титр является слабым и наблюдается только у некоторых животных.
Отношение (вес сумок/общий вес) • 100 составляет в среднем 0,66 в контрольной группе V8, не подвергавшейся вливанию (10 цыплят). Оно доходит до 0,1 в группе V8, подвергнутой испытанию "Challenge" (1 выживший). Оно составляет 0,1, 0,11 0, 11 для трех групп V11 (3 цыпленка), V15 (11 цыплят) и V16 (8 цыплят) соответственно. Отсутствует защита против атрофии сумок.
Смертность через четыре дня, которые следуют за испытанием "Challenge", была практически полной для контрольной группы (9 цыплят из 10). В группе V11 выжили 3 цыпленка из 20, тогда как выжили 11 цыплят из 20, вакцинированных вирусом V15, и 8 цыплят из 20, вакцинированных вирусом V16. Таким образом, наблюдают защиту порядка 50% животных, вакцинированных вирусами V15 или V16.
d. Защита под действием вирусов V14, V15 и V17.
Четыре группы домашней птицы с возрастом три недели получили 0,2 мл рекомбинантных вирусов V8 (отрицательный контроль), V14, V15 или V17. Количество вирусов на одного цыпленка составило 106,4 ТСIД50. Путь введения является внутримышечным.
Спустя двадцать один день отбирается для анализа сыворотка от каждого животного, чтобы оценить титр по антителам типа анти-IBDV. Пятикратная летальная доза IBDV вводится животным из групп V14, V15 или V17 и части животным из группы V8 (т.е. из группы домашней птицы, получившей рекомбинантный вирус V8).
Спустя 11 дней, т. е. 32 дня после вакцинации, животные-свидетели из группы V8 и те, которые выжили при испытании, умерщвляются, и определяется отношение (вес сумок/вес домашних птиц) • 100.
Результаты следующие:
- Смертность: число домашних птиц, не выдержавших вливания, распределяются следующим образом:
для V8: 12 птиц из 14 (85%), для
V14: 21/24 (87%),
для V15 : 17/25 (68%) и для V17 : 0/25 (0%).
Другими словами, все домашние птицы, вакцинированные рекомбинантой V17, устойчивы к вливанию. В этой группе защита является полной. Кроме того, ни одна из домашних птиц не показала ни малейшего клинического признака болезни. Защита величиной 32%, полученная для рекомбинанты V15, близка к защите величиной 50%, полученной в предыдущем эксперименте.
- Метод ELISA: средние оцененные титры против вируса составляют: для V8 титры меньше 1: 100 и рассматриваются как отрицательные, для V14 титры величиной 1: 12800 (от 1:6400 до 1:51200), для V15 титры величиной 1:6400 (от 1: 800 до 1: 25600), для V17 титры меньше 1:100, за исключением 3 домашних птиц (1:800, 1:6400 и 1:51200).
Следовательно, ответная реакция антител против IBDV, вызванная экспрессией полипротеина рекомбинантного FPV/IBDV, является очень высокой. Ответная реакция против полного вируса, вызванная посредством V17, является, напротив, слабой.
- Серонейтрализация: титры серонейтрализации против штамма PBG68 составляют в среднем: для V8, V14 и V15 титры меньше 1:10 и рассматриваются как отрицательные; для V17 5 домашних птиц из 20 имеют титр, превышающий 1:20, т.е, в частности, 1:20 (два раза), 1:40, 1:80 и 1:320.
Следовательно, серонейтрализация наблюдается исключительно в сыворотке домашних птиц, вакцинированных вирусом V17.
- Сумки: среднее отношение (вес сумок/общий вес) • 100 является следующим: для V8, не подвергавшихся вливанию, отношение составляет 0,68 (± 0,13), для V8, подвергнутых испытанию "Challenge", отношение составляет 0,09 (± 0,01), для V14 отношение составляет 0,10 (± 0, 02), V15 отношение составляет 0,13 (± 0,04) и для V17 отношение составляет 0,34 ± 0,23).
Следовательно, частичная защита сумок Фабрициуса наблюдается исключительно в группе V17. Действительно, 8 домашних птиц из 24 имеют отношение, подобное тому, которое имеют свидетели, не подвергавшиеся вливанию. Шестнадцать других имеют отношение, более высокие, чем у свидетелей, подвергнутых испытанию "Challenge".
Выводы.
Основные выводы из этих компаний по вакцинации являются следующими
- Рекомбинанты, которые выражают
полипротеин из IBDV, вызывают у домашних птиц сильную ответную реакцию ELISA с высокими титрами против вируса.
- Рекомбинанта, которая выражает часть VP2 полипротеина, полностью защищает домашних птиц от гибели и частично от атрофии сумки.
Список плазмид, список микроорганизмов, список и последовательности праймеров приведены после формулы изобретения.
Реферат
Изобретение относится к биотехнологии и может быть использовано для получения вакцин. Рекомбинантный вектор конструируют на основе аттенуированного вируса оспы птиц путем интеграции нуклеотидной последовательности, определяющей синтез гетерологичного белка микроорганизма, патогенного для домашней птицы, в некодирующую межгенную область, расположенную в концевых инвертированных поворотах (TIR). Межгенная область β1 и β2 расположена между нуклеотидами 1675 и 2165 TIR и 2672 и 3605 TIR соответственно. Клетки, трансформированные конструированным вектором, способны экспрессировать гетерологический протеин. Протеин может быть антигеном патогенных для птиц агентов: вирус болезни Гумборо, вирус инфекционного бронхита, вирус болезни Марека, паразитического простейшего, вызывающего кокцидиоз. Изобретение позволяет создать новые рекомбинантные вакцины против болезней птиц. 2 с. и 6 з.п. ф-лы, 13 ил., 9 табл.
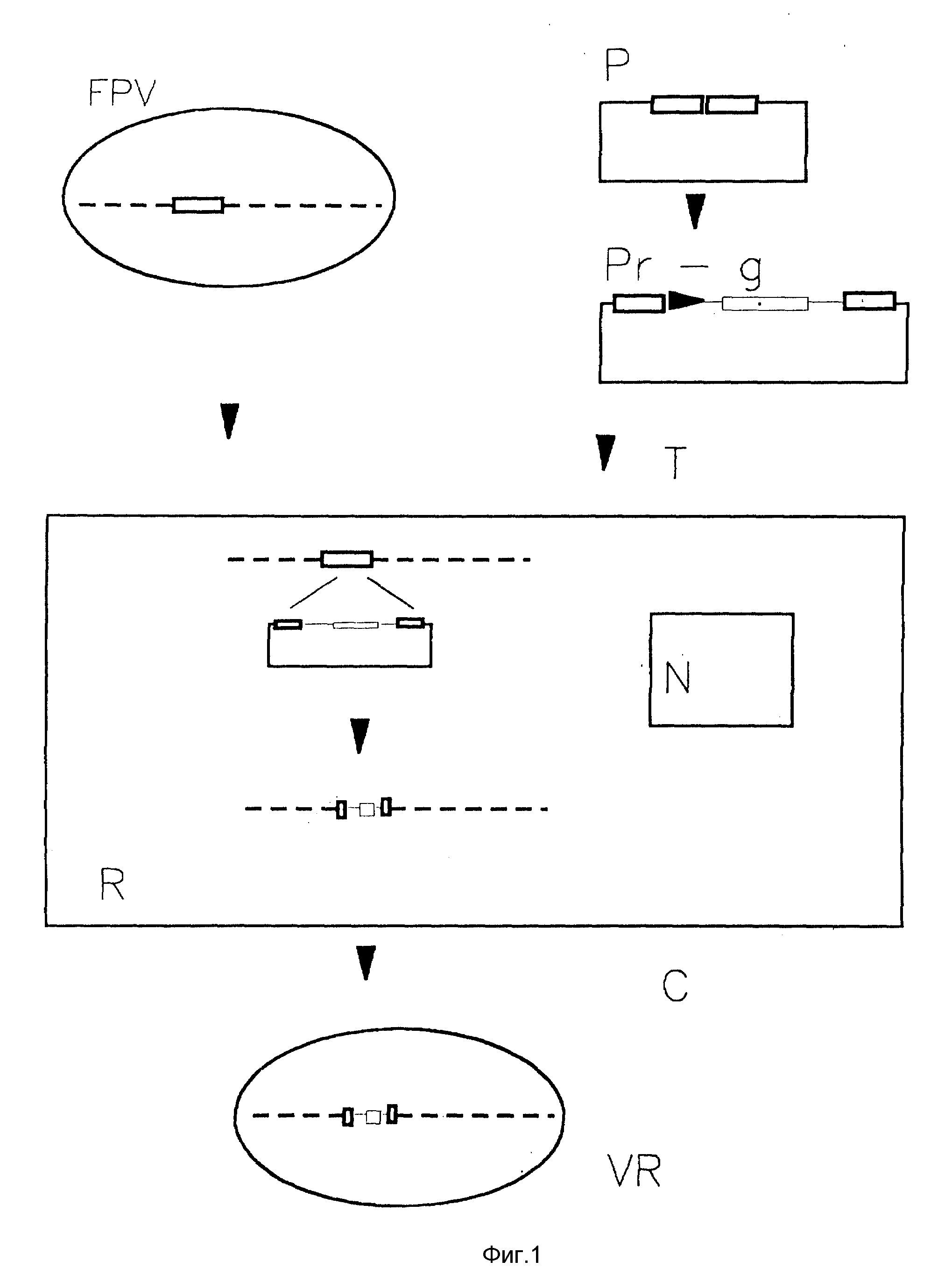

Комментарии