Сопряженные с g-белком рецепторы drosophila, нуклеиновые кислоты и способы, имеющие к ним отношение - RU2326385C2
Код документа: RU2326385C2
Описание
Данное изобретение частично относится к молекулам нуклеиновых кислот, кодирующим новые сопряженные с G-белком рецепторы Drosophila melanogaster (DmGPCR), новым полипептидам, анализам для скрининга соединений, которые связываются с DmGPCR и/или модулируют активность DmGPCR, способам связывания DmGPCR, реагентам, таким как антитела к DmGPCR, праймеры и зонды для выявления нуклеотидных последовательностей, кодирующих DmGPCR, наборам, содержащим антитела, праймеры и зонды согласно изобретению, композициям, содержащим DmGPCR, партнерам, связывающим DmGPCR, и модуляторам DmGPCR, и к способам контролирования популяции насекомых с использованием связывающего партнера или модулятора DmGPCR.
УРОВЕНЬ ТЕХНИКИ
Люди и другие живые формы состоят из живых клеток. Один из механизмов, посредством которых клетки организма обмениваются информацией друг с другом и получают информацию и стимулы из окружающей среды, основан на молекулах рецепторов клеточных мембран, экспрессированных на поверхности клеток. Многие из таких рецепторов идентифицированы, охарактеризованы и иногда их классифицировали в основные надсемейства рецепторов на основании структурных мотивов и характеристик сигнальной трансдукции. Такие семейства включают в себя (но не ограничены указанным) рецепторы управляемых лигандом ионных каналов, рецепторы зависимых от потенциала ионных каналов, рецепторные тирозинкиназы, рецепторные тирозиновые протеинфосфатазы и сопряженные с G-белком рецепторы. Рецепторы являются первым необходимым связующим звеном для преобразования внеклеточного сигнала в физиологический ответ клетки.
Сопряженные с G-белком рецепторы (т.е. GPCR) образуют многочисленное надсемейство поверхностных рецепторов клетки, которые характеризуются аминоконцевым внеклеточным доменом, карбоксиконцевым внутриклеточным доменом и змеевидной структурой, которая проходит через мембрану семь раз. Поэтому также рецепторы иногда также называют рецепторами с семью трансмембранными доменами (7TM). Указанные семь трансмембранных доменов определяют границы трех внеклеточных петель и трех внутриклеточных петель кроме амино- и карбоксиконцевых доменов. Внеклеточные части рецептора играют роль в узнавании и связывании одного или нескольких внеклеточных партнеров в связывании (например, лигандов), тогда как внутриклеточные части играют роль в узнавании и взаимодействии с расположенными ниже в каскаде эффекторными молекулами.
GPCR связывают множество лигандов, включая ионы кальция, гормоны, хемокины, нейропептиды, нейромедиаторы, нуклеотиды, липиды, одоранты и даже фотоны. Не удивительно, что GPCR имеют важное значение в нормальном (и иногда аномальном) функционировании многих типов клеток. В общем смысле см. Strosberg, Eur. J. Biochem., 1991, 196, 1-10; Bohm et al., Biochem J., 1997, 322, 1-18. Когда специфичный лиганд связывается со своим соответствующим рецептором, лиганд обычно стимулирует рецептор, активируя специфичный гетеротримерный связывающий гуаниновый нуклеотид регуляторный белок G (G-белок), который сопряжен с внутриклеточной частью или областью рецептора. G-белок, в свою очередь, передает сигнал к эффекторной молекуле в клетке, либо стимулируя, либо ингибируя активность данной эффекторной молекулы. К указанным эффекторным молекулам относятся аденилатциклаза, фосфолипазы и ионные каналы. Аденилатциклаза и фосфолипазы являются ферментами, которые вовлечены в продукцию молекул вторичных мессенджеров цАМФ, инозитолтрифосфата и диацилглицерина. Именно через такую последовательность событий стимул внеклеточного лиганда вызывает внутриклеточные изменения посредством сопряженного с G-белком рецептора. Каждый такой рецептор имеет свою собственную характерную первичную структуру, характер экспрессии, профиль связывания лиганда и внутриклеточную эффекторную систему.
Вследствие важной роли сопряженных с G-белком рецепторов в осуществлении коммуникаций между клетками и их окружением, такие рецепторы являются привлекательными мишенями для регуляции, например, посредством активации или антагонистического воздействия на такие рецепторы. В случае рецепторов, имеющих известные лиганды, можно попытаться специально идентифицировать агонисты или антагонисты, чтобы усилить или ингибировать действие лиганда. Например, некоторые сопряженные с G-белком рецепторы играют роль в патогенезе заболеваний (например, некоторые рецепторы хемокинов, которые действуют как корецепторы ВИЧ, могут играть роль в патогенезе СПИДа) и являются привлекательными мишенями для терапевтического вмешательства даже при отсутствии сведений о природном лиганде рецептора. Другие рецепторы являются привлекательными мишенями для терапевтического вмешательства в силу характера их экспрессии в тканях или типах клеток, которые сами по себе являются привлекательными мишенями для терапевтического воздействия. Примеры указанной последней категории рецепторов включают в себя рецепторы, экспрессируемые в иммунных клетках, которые могут быть нацелены на то, чтобы либо ингибировать аутоиммунные ответы, либо усилить иммунные ответы для борьбы с патогенами или злокачественной опухолью; и рецепторы, экспрессируемые в головном мозге и других органах и тканях нервной системы, которые, вероятно, являются мишенями при лечении шизофрении, депрессии, биполярного расстройства или других неврологических расстройств. Указанная последняя категория рецепторов также применима в качестве маркера для идентификации и/или очистки (например, посредством флуоресцентно активируемой сортировки клеток) подтипов клеток, которые экспрессируют рецептор.
Насекомые считаются основными вредителями в сельском хозяйстве и в домашней среде человека. Насекомые также являются паразитами животных и человека, именуемыми в таких случаях эктопаразитами, вызывающими заболевания и смертность. Насекомые также служат переносчиками вирусных и паразитарных заболеваний растениям, животным и человеку. Таким образом, продолжает существовать настоятельная необходимость в открытии новых способов контролирования популяций насекомых и отпугивания и/или уничтожения патогенных и вредных видов. Один из путей контролирования популяций насекомых путем уничтожения или парализации насекомых заключается в применении химических агентов, называемых инсектицидами, которые являются избирательно токсичными по отношению к насекомым и, вероятно, по отношению к другим беспозвоночным. В настоящее время инсектициды имеют огромное значение для контроля насекомых, которые повреждают сельскохозяйственные продукты, включая зерновые и домашний скот. Инсектициды также используют в домашней обстановке человека для борьбы с вредителями газонов и садов, а также насекомыми, которые вредят или раздражают человека, включая жалящих или кусающих насекомых, мух и тараканов. Инсектициды также имеют важное значение для лечения или профилактики патологических состояний, вызванных эктопаразитами, включая блох, вшей, иксодовых клещей, клещей и кусающих двукрылых, у домашнего скота и домашних животных. Однако современные химические средства, используемые в качестве инсектицидов, не оптимальны. Некоторые обладают очевидной токсичностью для млекопитающих, в то время как у некоторых видов-мишеней к некоторым из них возникает резистентность. Поэтому существует необходимость в новых избирательных инсектицидах, которые имеют новые механизмы действия.
Известны примеры GPCR насекомых, которые имеют нейропептидные лиганды (см., например, Li, et al., EMBO Journal, 1991, 10, 3221-3229; Li, et al., J. Biol. Chem., 1992, 267, 9-12; Monnier, et al., J. Biol. Chem., 1992, 267, 1298-1302; Vanden Broeck, et al., Int. Rev. Cytology, 1996, 164, 189-268; Guerrero, Peptides, 1997, 18, 1-5; Hauser, et al., J. Biol. Chem., 1997, 272, 1002-1010; Birgul et al., EMBO J., 1999, 18, 5892-5900; Torfs et al., J. Neurochem., 2000, 74, 2182-2189; and Hauser et al., Biochem. Biophys. Res. Comm., 1998, 249, 822-828; Larsen, et al., Biochem. Biophys. Res. Comm., 2001, 286, 895-901; Lenz, et al., Biochem. Biophys. Res. Comm., 2001, 286, 1117-1122; Kubiak et al., Biochem. Biophys. Res. Comm., 2002, 291, 313-320; Staubli et al., Proc. Natl. Acad. Sci. USA, 2002, 99, 3446-3451; Garczynski et al., Peptides, 2002, 23, 773-780), Holmes et al. Insect Molecular Biology, 2000, (5), 457-465; Cazzamali et al. Proc. Natl. Acad. Sci. USA, 2002, 99, 12073-12078; Cazzamali et al., Biochem. Biophys. Res. Comm., 2002, 298, 31-36; Radford et al., J. Biol. Chem. 2002, 277, 38810-38817; Park et al., Proc. Natl. Acad. Sci. USA, 2002, 99, 11423-11428; Kreienkamp et al., J. Biol. Chem, 10.1074/jbc.M206931200 (published online 6 August 2002) and Mertens, et al., Biochem. Biophys. Res. Comm., 2002, 297, 1140-1148. Новые родственные заявки на выдачу патента: Ebens, Allen James, Jr.; Torpey, Justin; Keegan, Kevin Patrick. Nucleic acids and polypeptides of Drosophila melanogaster G protein-coupled receptor and their use as pesticidal and pharmaceutical targets. PCT Int. Appl. (2001), 43 pp.CODEN: PIXXD2 WO 0170981 A2 20010927 CAN 135:268323 AN 2001:713564 CAPLUS. Kravchik, Anibal. Drosophila G protein-coupled receptors, genomic DNA and cDNA molecules encoding GPCR proteins, and their uses as insecticidal targets. PCT Int. Appl. (2001), 392 pp.CODEN: PIXXD2 WO 0170980 A2 20010927 CAN 135:269068 AN 2001:713563 CAPLUS.
Большим семейством пептидов, как правило, длиной 4-12 аминокислот, обычно обнаруживаемых у беспозвоночных животных (например, насекомых), является класс нейропептидов, известных как FMRFамид-родственные пептиды (т.е. FaRP). Прототипные пептиды FMRFамид (FMRFa) называются так из-за консенсусной аминокислотной последовательности «FMRF» на их C-концах, как правило, состоящих из (F,Y)(M,V,I,L)R(F,Y)NH2. В качестве нейропептидов указанные молекулы вовлечены в жизненно важные биологические процессы, требующие контролируемой нейромышечной активности. Хотя показано, что некоторые нейромедиаторы и нейромодуляторы (включая нейропептиды) функционируют в качестве лигандов для рецепторов, до настоящего времени не идентифицирован нейропептид FaRP в качестве лиганда GPCR.
Пептиды Drosophila, содержащие консервативный мотив FXGXR-амид, структурно родственны тахикининам млекопитающих и поэтому названы новым термином дротахикининов (Siviter et al., J. Biol. Chem., 2000, 275 (30), 23273-23280). Дротахикинины оказывают мощное стимулирующее действие на сокращение кишечника насекомых (там же).
Лейкокинины представляют собой группу широко распространенных гормонов насекомых, которые стимулируют моторику кишечника и скорости секреции жидкости канальцами. В канальцах их главное действие заключается в повышении проницаемости для хлоридов посредством связывания с рецептором на базолатеральной мембране. Лейкокинин действует, повышая внутриклеточное содержание кальция только в звездчатых клетках (O'Donnell et al., J. Physiol., 1998, 43, R1039-R1049).
Аллатостатины представляют собой важную группу нейрогормонов насекомых, контролирующих разнообразные функции, включая синтез ювенильных гормонов, которые, как известно, играют центральную роль в метаморфозе и репродукции у различных видов насекомых. Самый первый аллатостатин Drosophila, Ser-Arg-Pro-Tyr-Ser-Phe-Gly-Leu-NH2 (т.е. дростатин-3) (SEQ ID NO: 165) выделяли из экстрактов голов Drosophila (Birgul et al., EMBO J., 1999, 18, 5892-5900). Недавно клонирован ген препрогормона аллатостатина Drosophila, который кодирует четыре аллатостатина Drosophila: Val-Glu-Arg-Tyr-Ala-Phe-Gly-Leu-NH2 (дростатин-1) (SEQ ID NO: 163), Leu-Pro-Val-Tyr-Asn-Phe-Gly-Leu-NH2 (дростатин-2) (SEQ ID NO: 164), Ser-Arg-Pro-Tyr-Ser-Phe-Gly-Leu-NH2 (дростатин-3) (SEQ ID NO: 165) и Thr-Thr-Arg-Pro-Gln-Pro-Phe-Asn-Phe-Gly-Leu-NH2 (дростатин-4) (SEQ ID NO: 166) (Lenz et al., Biochem. Biophys. Res. Comm., 2000, 273, 1126-1131). Первый рецептор аллатостатина Drosophila клонирован Birgul et al. и было показано, что он функционально активируется дростатином-3 посредством Gi/Go-путей (Birgul et al., EMBO J. 1999, 18, 5892-5900). Недавно клонирован второй предполагаемый рецептор аллатостатина Drosophila (т.е. DARII) (Lenz et al., Biochem. Biophys. Res. Comm., 2000, 273, 571-577). кДНК рецептора DARII (номер доступа AF253526) кодирует белок, который является близкородственным первому рецептору аллатостатина Drosophila. Недавно показана функциональная активация DARII аллатостатинами авторами данного изобретения (Larsen et al., Biochem. Biophys. Res. Comm., 2001, 286, 895-901) и другими авторами (Lenz et al., Biochem. Biophys. Res. Comm., 2001, 286, 1117-1122). Недавно клонирован ген препрогормона аллатостатина типа C Drosophila, который кодирует аллатостатин-С Drosophila: Gln-Val-Arg-Tyr-Gln-Cys-Tyr-Phe-Asn-Pro-Ile-Ser-Cys-Phe-OH (Williamson et al., Biochem. Biophys. Res. Comm., 2001, 282, 124-130). Зрелый пептид должен иметь pGlu на N-конце, образованный в результате циклизации N-концевого Gln, чтобы получить pGlu-Val-Arg-Tyr-Gln-Cys-Tyr-Phe-Asn-Pro-Ile-Ser-Cys-Phe-OH (SEQ ID NO: 183), и дисульфидный мостик между Cys6 и Cys13, подобно аллатостатину типа C Manduca sexta, pGlu-Val-Arg-Phe-Gln-Cys-Tyr-Phe-Asn-Pro-Ile-Ser-Cys-Phe-OH (SEQ ID NO: 182), который отличается только по положению 4 (Phe4 вместо Tyr4) (Kramer et al., Proc. Natl. Acad. Sci. USA, 1991, 88, 9458-9462). Nichols at al. показали сильное и продолжительное ингибирование мышечного сокращения аллатостатином-C Drosophila, который назвали пептидом «ровной линии» (FLT) (Nichols et al. Peptides, 2002, 23, 787-794). Насколько известно авторам, до настоящего времени не идентифицированы рецепторы аллатостатина типа C насекомых.
Сульфакинины представляют собой семейство Tyr-сульфатированных нейропептидов насекомых. Они проявляют сходство последовательностей и функциональное сходство (миотропные эффекты, стимуляция высвобождения ферментов пищеварения) с пептидами позвоночных гастрином и холецистокинином. У Drosophila melanogaster идентифицирован ген, кодирующий два сульфакинина (также называемых дросульфакининами), DSKI [Phe-Asp-Asp-Tyr(SO3H)-Gly-His-Met-Arg-Phe-амид] (SEQ ID NO: 160) и DSKII [Gly-Gly-Asp-Asp-Gln-Phe-Asp-Asp-Tyr(SO3H)-Gly-His-Met-Arg-Phe-амид] (SEQ ID NO: 161) (Nichols, Mol. Cell Neuroscience, 1992, 3, 342-347; Nichols et al., J. Biol. Chem., 1988, 263, 12167-12170). C-концевая гептапептидная последовательность, Asp-Tyr(SO3H)-Gly-His-Met-Arg-Phe-амид (SEQ ID NO: 162), идентична во всех сульфакининах, идентифицированных до настоящего времени у насекомых, которые значительно удалены друг от друга в эволюционном смысле. Консервативность гептапептидной последовательности, включая наличие сульфатированного остатка Tyr в значительной степени дивергентном таксоне насекомых, вероятно, отражает функциональное значение данного миотропного «активного кора» (Nachman and Holman, in Insect Neuropeptides: Chemistry, Biology and Action, Menu, Kelly and Massler, Eds., American Chemical Society, Washington, D. C., 1991, pp.194-214). Недавно авторы изобретения идентифицировали сиротский рецептор Drosophila (DmGPCR9) в качестве рецептора дросульфакинина (названного DSK-R1) и подобрали соответствующий ему активирующий пептид, Met5→Leu-модифицированный дросульфакинин-1, Asp-Tyr(SO3H)-Gly-His-Leu-Arg-Phe-амид (SEQ ID NO: 157) (Kubiak et al., Biochem. Biophys. Res. Comm., 2002, 291, 313-320). Новые GPCR Drosophila, которые уже переведены из разряда сиротских, включают рецепторы для пептидов PRXамид, CCAP, коразонина и AKH (Park et al., Proc. Natl. Acad. Sci. USA, 2002, 99, 11423-11428; Cazzamali et al., Biochem. Biophys. Res. Comm., 2002, 298, 31-36); лейкокинина (Radford et. al., J. Biol. Chem. 2002, 277, 38810-38817); дростатина-C (Kreienkamp et al., J. Biol. Chem, 10.1074/jbc. M206931200 (опубликовано в оперативном режиме 6 августа 2002)); FMRFамид (Cazzamali et al. Proc. Natl. Acad. Sci. USA, 2002, 99, 12073-12078) и нейропептида F (Mertens, et al., Biochem. Biophys. Res. Comm., 2002, 297, 1140-1148).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение заключается в неожиданном открытии новых полипептидов у Drosophila melanogaster, называемых в данном описании DmGPCR (сопряженные с G-белком рецепторы Drosophila melanogaster), которые проявляют различные степени гомологии с другими GPCR нейропептидов. Данное изобретение относится к генам, кодирующим указанные неизвестные ранее сопряженные с G-белком рецепторы, полипептидам DmGPCR, кодируемым данными генами; антителам к полипептидам; наборам, в которых используют полинуклеотиды и полипептиды, и способам получения и применения указанного выше. DmGPCR могут играть роль в качестве ключевого компонента, например, в регуляции связывания нейропептидов и/или передачи сигнала. Таким образом, DmGPCR применимы при поиске новых агентов, которые могут модифицировать и/или регулировать связывание и/или передачу сигнала нейропептидами или другими агентами. Указанные и другие аспекты изобретения описаны ниже.
В некоторых вариантах в изобретении предлагаются очищенные и изолированные полипептиды DmGPCR, содержащие аминокислотную последовательность, указанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24, или ее фрагмент, содержащий эпитоп, характерный для DmGPCR. Под «эпитопом, характерным для» подразумевается часть рецептора DmGPCR, которая узнается антителом, специфичным в отношении DmGPCR, что подробно определено ниже. Один вариант изобретения включает в себя очищенные и изолированные полипептиды, содержащие полные аминокислотные последовательности, указанные в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24, приведенных в таблице 4 ниже. Указанные аминокислотные последовательности рассчитаны на основе полинуклеотидных последовательностей, кодирующих DmGPCR (SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, приведенных в таблице 4 ниже). Подразумевается, что термин «DmGPCR», используемый в данном описании в единственной форме охватывает любую из десяти аминокислотных последовательностей, приведенных в качестве примера ниже, кодируемых соответствующими полинуклеотидными последовательностями.
Хотя представленные последовательности являются конкретными последовательностями Drosophila, подразумевается, что в объем изобретения включены аллельные варианты, формы DmGPCR позвоночных и беспозвоночных.
В некоторых вариантах в изобретении предлагаются очищенные и изолированные полинуклеотиды (например, кДНК, геномная ДНК, синтетическая ДНК, РНК или их комбинации, либо однонитевые, либо двунитевые), которые содержат нуклеотидную последовательность, кодирующую аминокислотную последовательность полипептидов согласно изобретению. Такие полинуклеотиды применимы для рекомбинантной экспрессии рецептора, а также для регистрации экспрессии рецептора в клетках (например, с использованием анализов Нозерн-гибридизации и гибридизации in situ). Такие полинуклеотиды также применимы для конструирования антисмысловых и других молекул для супрессии или регуляции экспрессии DmGPCR в культивируемой клетке, ткани или животном. Из определения полинуклеотидов согласно изобретению, в частности, исключены полные изолированные нерекомбинантные нативные хромосомы клеток-хозяев. Полинуклеотиды согласно изобретению могут иметь последовательность любой из последовательностей, указанных SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, которые соответствуют встречающимся в природе последовательностям DmGPCR. Будет понятно, что существует множество других полинуклеотидных последовательностей, которые также кодируют DmGPCR, имеющих последовательность, указанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24, вследствие хорошо известной вырожденности универсального генетического кода.
Изобретение также относится к очищенному и изолированному полинуклеотиду, содержащему нуклеотидную последовательность, которая кодирует полипептид млекопитающих, при этом полинуклеотид гибридизуется с полинуклеотидом, имеющим последовательность, указанную в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, или с некодирующей нитью, комплементарной данной, в следующих условиях гибридизации:
a) гибридизация в течение 16 часов при 42°C в растворе для гибридизации, содержащем 50% формамид, 1% SDS, 1 М NaCl, 10% сульфат декстрана; и
b) промывка 2 раза по 30 минут, каждая при 60°C в растворе для промывки, содержащем 0,1% SSC, 1% SDS.
Условия гибридизации должны быть такими, чтобы гибридизация в присутствии других молекул нуклеиновых кислот происходила только с генами. В жестких условиях гибридизации гибридизуются только высококомплементарные последовательности нуклеиновых кислот. Такие условия могут препятствовать гибридизации нуклеиновых кислот, имеющих 1 или 2 ошибочных спаривания из 20 непрерывно следующих друг за другом нуклеотидов.
В некоторых вариантах в изобретении предлагаются векторы, содержащие полинуклеотид согласно изобретению. Такие векторы применимы, например, для амплификации полинуклеотидов в клетках-хозяевах для образования достаточных для применения количеств полинуклеотидов. В некоторых вариантах вектор является экспрессирующим вектором, в котором полинуклеотид согласно изобретению оперативно связан с полинуклеотидом, содержащим последовательность регуляции экспрессии. Такие векторы применимы для рекомбинантного получения полипептидов согласно изобретению.
В некоторых вариантах изобретение относится к клеткам-хозяевам, которые трансформируют или трансфицируют (стабильно или временно) полинуклеотидами согласно изобретению или векторами согласно изобретению. Как указано выше, такие клетки-хозяева применимы для амплификации полинуклеотидов, а также для экспрессии полинуклеотида DmGPCR или его фрагмента, кодируемого полинуклеотидом.
В еще одном варианте изобретение относится к способам получения полипептида DmGPCR (или его фрагмента), включающим в себя стадии выращивания клетки-хозяина согласно изобретению в питательной среде и выделения полипептида или его варианта из клетки или среды. Так как DmGPCR является рецептором с семью трансмембранными доменами, будет понятно, что для некоторых применений, таких как некоторые анализы активности, выделение может заключаться в выделении клеточным мембран, содержащих заключенный в них полипептид, тогда как для других применений может требоваться более полное выделение.
Будет понятно, что внеклеточные эпитопы, в частности, применимы для создания и скрининга антител или других связывающих соединений, которые связываются с рецепторами, такими как DmGPCR. Таким образом, в другом варианте изобретение относится к очищенному и изолированному полипептиду, содержащему по меньшей мере один внеклеточный домен (например, N-концевой внеклеточный домен или одну из трех внеклеточных петель) DmGPCR, такой как N-концевой внеклеточный домен DmGPCR. Также в изобретение включены очищенные полипептиды, содержащие трансмембранные домены DmGPCR, внеклеточную петлю, связывающую трансмембранные домены DmGPCR, внутриклеточную петлю, связывающую трансмембранные домены DmGPCR, C-концевую цитоплазматическую область DmGPCR и их слияния. Такие фрагменты могут представлять собой непрерывные части нативного рецептора. Однако также будет понятно, что сведения о последовательностях гена и белка DmGPCR, которые приведены в данном описании, позволяют осуществлять рекомбинацию различных доменов, которые не следуют друг за другом в нативном белке.
В еще одном варианте изобретение относится к антителам, специфичным в отношении DmGPCR согласно изобретению. Специфичность антител более подробно описана ниже. Однако следует подчеркнуть, что антитела, которые могут быть созданы на основе полипептидов, которые были описаны ранее в литературе и которые способны случайно перекрестно реагировать с DmGPCR (например, вследствие случайного существования сходного эпитопа в обоих полипептидах), считаются «перекрестно-реагирующими» антителами. Такие перекрестно-реагирующие антитела не являются антителами, «специфичными» в отношении DmGPCR. Определение того, является ли антитело специфичным в отношении DmGPCR или перекрестно-реагирующим с другим известным рецептором, осуществляют с использованием любого из нескольких анализов, таких как Вестерн-блоттинг-анализ, который хорошо известен в данной области. Для идентификации клеток, которые экспрессируют DmGPCR, а также для модулирования активности связывания DmGPCR-лиганд можно использовать антитела, которые специфически связываются с внеклеточным эпитопом DmGPCR.
В одном варианте изобретение относится к моноклональным антителам. Гибридомы, которые продуцируют такие антитела, также считаются аспектами изобретения.
В другом варианте изобретение относится к бесклеточной композиции, содержащей поликлональные антитела, в которой по меньшей мере одно из антител является антителом согласно изобретению, специфичным в отношении DmGPCR. Примером композиции являются антисыворотки, выделенные из животного, также как композиция, содержащая фракцию антител антисыворотки, которая была ресуспендирована в воде или в другом разбавителе, эксципиенте или носителе.
В еще одном связанном варианте изобретение относится к антиидиотипическим антителам, специфичным к антителу, которое специфично в отношении DmGPCR.
Также хорошо известно, что антитела содержат относительно небольшие антигенсвязывающие домены, которые можно выделить химически или рекомбинантными способами. Такие домены сами по себе являются применимыми молекулами, связывающими DmGPCR, а также могут быть слиты с токсинами или другими полипептидами. Таким образом, в еще одном варианте изобретение относится к полипептиду, содержащему фрагмент DmGPCR-специфичного антитела, при этом фрагмент и полипептид связываются с DmGPCR. В качестве неограничивающего примера изобретение относится к полипептидам, которые являются одноцепочечными антителами, CDR-привитыми антителами и гуманизированными антителами.
Также в объем изобретения входят композиции, содержащие полипептиды, полинуклеотиды или антитела согласно изобретению, которые были приготовлены, например, с фармацевтически приемлемым носителем.
Изобретение также относится к способам применения антител согласно изобретению. Например, изобретение относится к способам модулирования связывания лиганда DmGPCR, включающим в себя стадию осуществления контакта DmGPCR с антителом, специфичным в отношении DmGPCR, в условиях, при которых антитело связывается с рецептором.
Изобретение относится к способам индуцирования иммунного ответа у субъекта против полипептида, содержащего последовательность из группы SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 и 24, или его гомолога или фрагмента. Способы включают в себя введение субъекту количества полипептида, достаточного для индуцирования иммунного ответа.
Изобретение также относится к анализам для идентификации соединений, которые связывают DmGPCR. Один из таких анализов включает в себя стадии (a) осуществления контакта композиции, содержащей DmGPCR, с соединением, которое предположительно связывается с DmGPCR; и (b) измерения связывания между соединением и DmGPCR. В одном варианте композиция содержит клетку, экспрессирующую DmGPCR на своей поверхности. В другом варианте используют изолированный DmGPCR или клеточные мембраны, содержащие DmGPCR. Связывание можно измерять непосредственно, например, используя меченое соединение, или можно измерять опосредованно несколькими способами, включая измерение внутриклеточной передачи сигнала DmGPCR, индуцированной соединением (или измерение изменений уровня передачи сигнала DmGPCR).
Изобретение также относится к способам связывания DmGPCR со связывающим партнером. Способы включают в себя стадии (a) осуществление контакта композиции, содержащей DmGPCR, со связывающим партнером и (b) обеспечение возможности для связывания связывающего партнера с DmGPCR. Например, DmGPCR может представлять собой DmGPCR1 (SEQ ID NO: 1), DmGPCR5 (SEQ ID NO: 9), DmGPCR7 (SEQ ID NO: 17) или DmGPCR8 (SEQ ID NO: 19). Связывающим партнером может быть, например, дротахикинин, лейкокинин или аллатостатин-C. Дротахикинин (DTK) может представлять собой, например, DTK-1 (SEQ ID NO: 169), Met8-DTK-2 (SEQ ID NO: 170), DTK-2 (SEQ ID NO: 171), DTK-3 (SEQ ID NO: 172), DTK-4 (SEQ ID NO: 173) и DTK-5 (SEQ ID NO: 174). Лейкокинин (LK) может представлять собой, например, LK-I (SEQ ID NO: 175), LK-V (SEQ ID NO: 176), LK-VI (SEQ ID NO: 177) и LK-VIII (SEQ ID NO: 178), кулекинин (SEQ ID NO: 179), пептид подобный лейкокинину моллюсков, лимнокинин (PSFHSWSa) (SEQ ID NO: 180) и лейкокининподобные пептиды Drosophila DLK-1(NSVVLGKKQRFHSWGa) (SEQ ID NO: 181), DLK-2 (pGlu-RFHSWGa) (SEQ ID NO: 182) и DLK-2A (QRFHSWGa) (SEQ ID NO: 183). Аллатостатин (AST) может представлять собой, например, AST-C (SEQ ID NO: 184) или DST-C (SEQ ID NO: 185). Другие связывающие партнеры включают без ограничения SEQ ID NO: 186 и SEQ ID NO: 187.
Изобретение также относится к способам идентификации модулятора связывания DmGPCR с партнером, связывающим DmGPCR, включающим в себя стадии (a) осуществления контакта партнера, связывающего DmGPCR, и композиции, содержащей DmGPCR, в присутствии и в отсутствие предполагаемого соединения модулятора; (b) регистрации связывания между связывающим партнером и DmGPCR; и (c) идентификации предполагаемого соединения модулятора или соединения модулятора, принимая во внимание уменьшенное или увеличенное связывание между связывающим партнером и DmGPCR в присутствии предполагаемого модулятора по сравнению со связыванием в отсутствие предполагаемого модулятора. Например, DmGPCR может представлять собой DmGPCR5 (SEQ ID NO: 9), DmGPCR7 (SEQ ID NO: 17) или DmGPCR8 (SEQ ID NO: 19). Связывающим партнером может быть, например, дротахикинин, лейкокинин или аллатостатин. Дротахикинин (DTK) может представлять собой, например, DTK-1 (SEQ ID NO: 169), Met8-DTK-2 (SEQ ID NO: 170), DTK-2 (SEQ ID NO: 171), DTK-3 (SEQ ID NO: 172), DTK-4 (SEQ ID NO: 173) и DTK-5 (SEQ ID NO: 174). Лейкокинин (LK) может представлять собой, например, LK-I (SEQ ID NO: 175), LK-V (SEQ ID NO: 176), LK-VI (SEQ ID NO: 177) и LK-VIII (SEQ ID NO: 178), кулекинин (SEQ ID NO: 179), лейкокининподобный пептид моллюсков, лимнокинин (PSFHSWSa) (SEQ ID NO: 180) и лейкокининподобные пептиды Drosophila DLK-1 (NSVVLGKKQRFHSWGa) (SEQ ID NO: 181), DLK-2 (pGlu-RFHSWGa) (SEQ ID NO: 182) и DLK-2A (QRFHSWGa) (SEQ ID NO: 183). Аллатостатин (AST) может представлять собой, например, AST-C (SEQ ID NO: 184) или DST-C (SEQ ID NO: 185). В одном варианте композиция содержит клетку, экспрессирующую DmGPCR на своей поверхности. В другом варианте используют изолированный DmGPCR или клеточные мембраны, содержащие DmGPCR. Связывание можно измерять непосредственно, например, используя меченое соединение, или можно измерять опосредованно несколькими способами, включая измерение внутриклеточной передачи сигнала DmGPCR, индуцированной соединением (или измерение изменений уровня передачи сигнала DmGPCR). Например, функцию можно измерить анализом индуцированного агонистом связывания [35S]GTPγS, анализом цАМФ (индукция или ингибирование продукции цАМФ) или измерением внутриклеточных уровней кальция с использованием анализа с помощью считывающего устройства для флуориметрической визуализации планшетов (FLIPR).
Партнеры, связывающие DmGPCR, которые стимулируют активность DmGPCR, применимы в качестве агонистов для усиления или пролонгирования передачи сигнала DmGPCR и, таким образом, для вмешательства в нормально активируемые пути передачи сигнала рецептора. Партнеры, связывающие DmGPCR, которые блокируют опосредованную лигандом передачу сигнала DmGPCR, применимы в качестве антагонистов DmGPCR для того, чтобы вмешаться в нормальную передачу сигнала DmGPCR и ослабить опосредованные рецептором эффекты. Кроме того, модуляторы DmGPCR, а также полинуклеотиды и полипептиды DmGPCR применимы в диагностических анализах статуса или состояний, при которых активность DmGPCR повышена или ослаблена.
В другом аспекте изобретение относится к способам лечения заболевания или патологического состояния, вызванного эктопаразитом, посредством введения субъекту, нуждающемуся в таком лечении, вещества, которое модулирует активность или экспрессию полипептида эктопаразита, выбранного из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24.
Вещества, применимые для лечения расстройств или заболеваний, вызванных эктопаразитом, могут давать положительные результаты в одном или нескольких анализах in vitro в отношении активности, соответствующей лечению рассматриваемого заболевания или расстройства. Вещества, которые модулируют активность полипептидов, включают, но не ограничены указанным, антисмысловые олигонуклеотиды, агонисты и антагонисты и антитела.
В другом аспекте отличительным признаком изобретения являются способы выявления полипептида в образце в качестве диагностического средства в случае заболеваний или расстройств, вызванных эктопаразитом, при этом способы включают в себя стадии: (a) осуществления контакта образца с зондом нуклеиновой кислоты, который гибридизуется в условиях анализа гибридизации с областью нуклеиновой кислоты-мишени, кодирующей полипептиды, выбранные из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24, при этом указанный зонд содержит последовательность нуклеиновой кислоты, кодирующей полипептид, ее фрагменты и/или комплементы последовательностей или фрагментов; и (b) выявления присутствия или количества гибрида зонд:область-мишень в качестве показателя состояния.
Тестируемые образцы, подходящие для способов зондирования нуклеиновых кислот согласно данному изобретению, включают, например, клетки или экстракты нуклеиновых кислот клеток или биологические жидкости. Образцы, используемые в описанных выше способах, будут варьироваться в зависимости от формы анализа, способа регистрации и природы анализируемых тканей, клеток или экстрактов. Способы получения экстрактов нуклеиновых кислот из клеток хорошо известны в данной области и могут быть легко адаптированы для получения образца, который совместим с применяемым способом.
В некоторых вариантах данное изобретение относится к гомологам DmGCPR, таким как гомологи млекопитающих. Гомологи DmGPCR млекопитающих могут экспрессироваться в тканях, включая, но не ограничивая указанным, ткани нервной системы, поджелудочной железы (и особенно ткани островков поджелудочной железы), гипофиза, скелетной мышцы, жировой ткани, печени, желудочно-кишечного (ЖК) тракта и щитовидной железы.
В некоторых вариантах данное изобретение относится к способам идентификации гомолога DmGPCR млекопитающего, включающим в себя стадии скрининга базы данных нуклеиновых кислот или библиотеки нуклеиновых кислот млекопитающего, используя молекулу нуклеиновой кислоты, выбранную из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 и 23, или ее часть, и определения того, гомологична ли часть базы данных или библиотеки данной последовательности.
Другой аспект изобретения относится к способам контролирования популяции насекомых посредством введения связывающего партнера или модулятора полинуклеотида или полипептида DmGPCR насекомому, чтобы модифицировать экспрессию или активность DmGPCR. Например, насекомое может быть выбрано из группы, состоящей из мухи, плодовой мушки, иксодового клеща, блохи, вши, клеща и таракана.
Партнером, связывающим DmGPCR, может быть дротахикинин (например, DTK-1 (SEQ ID NO: 169), Met8-DTK-2 (SEQ ID NO: 170), DTK-2 (SEQ ID NO: 171), DTK-3 (SEQ ID NO: 172), DTK-4 (SEQ ID NO: 173) и DTK-5 (SEQ ID NO: 174)), лейкокинин (например, LK-I (SEQ ID NO: 175), LK-V (SEQ ID NO: 176), LK-VI (SEQ ID NO: 177) и LK-VIII (SEQ ID NO: 178), кулекинин (SEQ ID NO: 179), подобный лейкокинину пептид моллюсков, лимнокинин (PSFHSWSa) (SEQ ID NO: 180), DLK-1 (SEQ ID NO: 181), DLK-2 (SEQ ID NO: 182) и DLK-2A (QRFHSWGa) (SEQ ID NO: 183)) или аллатостатин (AST-C (SEQ ID NO: 184) или DST-C (SEQ ID NO: 185)). Другие связывающие партнеры включают без ограничения SEQ ID NO: 186 и SEQ ID NO: 187. Модулятором DmGPCR может быть анти-DmGPCR-антитело или антисмысловой полинуклеотид DmGPCR.
Другие варианты изобретения относятся к способам профилактики или лечения заболевания или состояния, вызванного эктопаразитом у субъекта-хозяина, посредством введения субъекту связывающего партнера или модулятора полинуклеотида или полипептида DmGPCR, чтобы модифицировать экспрессию или активность DmGPCR.
Дополнительные отличительные признаки или варианты изобретения будут очевидны для специалистов в данной области на основании данной заявки в целом, включающей подробное описание, и все такие отличительные признаки считаются аспектами изобретения. Подобным образом, отличительные признаки изобретения, указанные в данном описании, можно перекомбинировать в дополнительных вариантах, которые также рассматриваются как аспекты изобретения, независимо от того упоминается ли указанная выше комбинация отличительных признаков специально в качестве аспекта или варианта осуществления изобретения. Также только те ограничения, которые указаны в данном описании в качестве критически важных ограничений для данного изобретения, следует считать таковыми; подразумевается, что изменения изобретения, лишенные ограничений, которые не приведены в данном описании в качестве критически важных, являются аспектами изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Данное изобретение наряду с прочим относится к изолированным и очищенным полинуклеотидам, которые кодируют сопряженный с G-белком рецептор D. melanogaster (DmGPCR) или его часть, векторам, содержащим указанные полинуклеотиды, клеткам-хозяевам, трансформированным указанными векторами, способам получения DmGPCR, способам применения указанным выше полинуклеотидов и векторов, к изолированному и очищенному DmGPCR, способам скрининга соединений, которые модулируют активность DmGPCR, и способам идентификации гомологов DmGPCR млекопитающих, позвоночных или беспозвоночных.
На протяжении данного документа приводятся различные определения. Большинство слов имеют значение, которое приписывает данным словам специалист в данной области. Слова, специально определенные либо ниже, либо в другом месте данного документа, имеют значение, которое предусмотрено в контексте данного изобретения в целом, и которое обычно понимается специалистами в данной области.
Необходимо понимать, что когда указаны группы последовательностей, то также специально предполагаются их комбинации и субкомбинации. Например, в случае описания «SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23» следует понимать, что данное изобретение включает комбинации и субкомбинации, включая, но не ограничивая указанным, SEQ ID NO: 1 и 3; 1 и 5; 1, 3 и 5 и т.д.
«Синтезированный» в используемом в данном описании и понимаемом в данной области смысле относится к полинуклеотидам, полученным исключительно химическими способами, в противоположность ферментативным способам. Следовательно, «целиком» синтезированные последовательности ДНК получают полностью химическими способами, а «частично» синтезированные ДНК охватывают такие ДНК, в которых только части полученной в результате ДНК получены химическими способами.
Под термином «область» подразумевают физически непрерывную часть первичной структуры биомолекулы. В случае белков область определяют как непрерывную часть аминокислотной последовательности данного белка.
Термин «домен» в данном описании определяют как относящийся к структурной части биомолекулы, которая вносит вклад в известную или предполагаемую функцию биомолекулы. Домены могут иметь протяженность, совпадающую с областями или их частями; кроме всей области или части данной области домены также могут включать в себя часть биомолекулы, которая отличается от конкретной области. Примеры доменов белка GPCR включают без ограничения внеклеточные (т.е. N-концевые), трансмембранные или цитоплазматические (т.е. C-концевые) домены, которые имеют протяженность, совпадающую с называемыми сходным образом областями GPCR; каждый из семи трансмембранных участков GPCR и каждый из участков петель (как внеклеточных, так и внутриклеточных петель), соединяющих близлежащие трансмембранные участки.
В используемом в данном описании смысле термин «активность» относится к множеству измеряемых признаков, прямо или косвенно свидетельствующих или выявляющих связывание; влияющих на ответ, т.е. оказывающих измеряемое действие в ответ на какое-либо воздействие или стимул, включая, например, аффинность соединения в отношении прямого связывания полипептида или полинуклеотида согласно изобретению, или, например, измерение количеств белков, расположенных выше или ниже в каскаде, или другие сходные функции после какого-либо стимула или явления.
В используемом в данном описании смысле подразумевается, что термин «антитело» относится к полным интактным антителам и Fab, Fab', F(ab')2, Fv и другим их фрагментам. Полные интактные антитела включают моноклональные антитела, такие как мышиные моноклональные антитела, химерные антитела, человеческие антитела и гуманизированные антитела.
В использованном в данном описании смысле термин «связывание» означает физическое или химическое взаимодействие между двумя белками или соединениями или ассоциированными белками или соединениями или их комбинациями. Связывание включает ионные, неионные, водородные связи, взаимодействия Ван дер Ваальса, гидрофобные взаимодействия и т.д. Физическое взаимодействие, связывание, может быть прямым или непрямым, при этом непрямое осуществляется посредством или благодаря влиянию другого белка или соединения. Прямое связывание относится к взаимодействиям, которые не происходят посредством или благодаря другому белку или соединению, а вместо этого происходит без других реальных химических промежуточных продуктов.
В используемом в данном описании смысле термин «соединение» означает любое идентифицируемое химическое соединение или молекулу, включая, но не ограничивая указанным, малую молекулу, пептид, белок, сахар, нуклеотид или нуклеиновую кислоту, и такое соединение может быть природным или синтетическим.
В используемом в данном описании смысле термин «комплементарный» относится к спариванию оснований Уотсона-Крика между нуклеотидными единицами молекулы нуклеиновой кислоты.
В используемом в данном описании смысле термин «осуществление контакта» означает сведение вместе либо прямо, либо опосредованно, соединения с полипептидом или полинуклеотидом согласно изобретению до состояния физической близости. Полипептид или полинуклеотид может быть в любом из множества буферов, солей, растворов и т.д. Осуществление контакта включает, например, помещение соединения в химический стакан, планшет для микротитрования, колбу для культуры ткани или микроматрицу, такую как генный чип или тому подобное, которые содержат молекулу нуклеиновой кислоты или полипептид, кодирующий GPCR или его фрагмент.
В используемом в данном описании смысле фраза «гомологичная нуклеотидная последовательность» или «гомологичная аминокислотная последовательность» или их вариации, относятся к последовательностям, характеризуемым гомологией на уровне нуклеотидов или на уровне аминокислот, составляющей по меньшей мере заданный процент.
Гомологичные нуклеотидные последовательности включают те последовательности, которые кодируют изоформы белков. Такие изоформы могут экспрессироваться в различных тканях одного и того же организма, например, в результате альтернативного сплайсинга РНК. Альтернативно, изоформы могут кодироваться разными генами. Гомологичные нуклеотидные последовательности включают нуклеотидные последовательности, кодирующие белок другого вида, отличного от насекомых, включая, без ограничения, млекопитающих. Гомологичные нуклеотидные последовательности также включают, но не ограничены указанным, встречающиеся в природе аллельные варианты и мутации нуклеотидных последовательностей, указанных в данном описании. Однако гомологичная нуклеотидная последовательность не включает нуклеотидную последовательность, кодирующую другие известные GPCR. Гомологичные аминокислотные последовательности включают такие аминокислотные последовательности, которые кодируют консервативные аминокислотные замены, а также полипептиды, обладающие активностью в связывании нейропептидов и/или передаче сигнала. Однако гомологичная аминокислотная последовательность не включает аминокислотную последовательность, кодирующую другие известные GPCR. Гомологию в процентах можно определить, например, с помощью программы Gap (пакет для анализа последовательностей Wisconsin, версия 8 для Unix, Genetics Computer Group, University Research Park, Madison, WI), используя установки по умолчанию, в которой используется алгоритм Smith и Waterman (Adv. Appl. Math., 1981, 2, 482-489, которая включена в данное описание в виде ссылки в полном объеме).
В используемом в данном описании смысле термин «изолированная» молекула нуклеиновой кислоты относится к молекуле нуклеиновой кислоты (ДНК или РНК), которая была извлечена из ее природного окружения. Примеры изолированных молекул нуклеиновых кислот включают, но ограничены указанным, молекулы рекомбинантной ДНК, находящейся в векторе, молекулы рекомбинантной ДНК, сохраняемые в гетерологичной клетке-хозяине, частично или в значительной степени очищенные молекулы нуклеиновых кислот и синтетические молекулы ДНК или РНК.
В используемом в данном описании смысле термины «регулирует», «модулирует» или «модифицирует» означают увеличение или уменьшение количества, качества или эффекта конкретной активности или белка.
В используемом в данном описании смысле термин «повышенная активность» означает увеличенную активность. Термин «ослабленная активность» означает уменьшенную активность.
В используемом в данном описании смысле термин «олигонуклеотид» относится к последовательному ряду связанных нуклеотидных остатков, который имеет достаточное количество оснований для использования в полимеразной цепной реакции (ПЦР). Данная короткая последовательность основана на (или сконструирована из) последовательности геномной или кДНК и используется для амплификации, подтверждения или выявления наличия идентичной, сходной или комплементарной ДНК или РНК в конкретной клетке или ткани. Олигонуклеотиды содержат части последовательности ДНК, имеющие по меньшей мере примерно 10 нуклеотидов и примерно до 50 нуклеотидов, предпочтительно примерно от 15 до 30 нуклеотидов. Они могут быть синтезированы химическим способом и могут быть использованы в качестве зондов.
В используемом в данном описании смысле термин «зонд» относится к последовательностям нуклеиновых кислот переменной длины, предпочтительно примерно по меньшей мере от 10 и примерно до 6000 нуклеотидов в зависимости от применения. Их используют для выявления идентичных, сходных или комплементарных последовательностей нуклеиновых кислот. Более длинные зонды получают из природного или рекомбинантного источника, и они являются высокоспецифичными и гибридизуются намного медленнее, чем олигомеры. Они могут быть одно- или двунитевыми, и их тщательно конструируют, чтобы они обладали специфичностью в способах ПЦР, способах, основанных на мембранах для гибридизации, или способах, подобных ELISA.
«Часть» или «фрагмент» в том случае, если относится к полинуклеотиду, включает в себя полинуклеотидную последовательность, имеющую по меньшей мере 14, 16, 18, 20, 25, 50 или 75 последовательных нуклеотидов эталонного полинуклеотида, из которого получен фрагмент или часть. «Часть» или «фрагмент» в том случае, если имеет отношение к полипептиду, относится к полипептиду, имеющему по меньшей мере 5, 10, 15, 20, 25, 30, 35 или 40 последовательных аминокислот эталонного полипептида, из которого получен фрагмент.
Термин «профилактика» относится к снижению вероятности того, что организм заразится или в организме будет развиваться аномальное состояние.
Фраза «контролирование популяции насекомых» или ее вариации относятся к увеличению или уменьшению количества насекомых в популяции. Например, способы контролирования популяции насекомых включают способы увеличения количества полезных насекомых в данной популяции насекомых и способы уменьшения количества вредных насекомых в данной популяции насекомых.
Термин «лечение» относится к наличию терапевтического эффекта и по меньшей мере частичного ослабления или аннулирования аномального состояния в организме.
Термин «субъект» в используемом в данном описании смысле относится к насекомым, позвоночным, беспозвоночным и млекопитающим.
Термин «терапевтический эффект» относится к ингибированию или активации факторов, вызывающих или вносящих вклад в аномальное или нормальное состояние. Терапевтический эффект в какой-либо степени ослабляет один или несколько симптомов аномального или нормального состояния. Терапевтический эффект может относиться к одному или нескольким из следующих эффектов: (a) увеличение пролиферации, роста и/или дифференцировки клеток; (b) ингибирование (т.е. замедление или остановка) гибели клеток; (c) ингибирование дегенерации; (d) ослабление в какой-либо степени одного или нескольких симптомов, связанных с состоянием; и (e) усиление функции пораженной популяции клеток. Соединения, проявляющие эффективность по отношению к аномальным или нормальным состояниям, можно идентифицировать, как указано в данном описании.
Состояние организма, подвергаемого лечению, может быть аномальным или нормальным. Термин «аномальное состояние» относится к функции клеток или тканей организма, которая отклоняется от нормальных функций в данном организме. Например, аномальное состояние может относиться к пролиферации клеток, дифференцировке клеток, передаче сигналов в клетке или выживаемости клеток.
Фраза «нормальное состояние» относится к нормальной функции клеток или ткани организма. Например, нормальное состояние может относиться к пролиферации клеток, дифференцировке клеток, передаче сигналов в клетке или выживаемости клеток.
Термин «введение» относится к способу включения соединения в клетки или ткани организма. Состояние может быть предотвращено, подвергнуто лечению или индуцировано, когда клетки или ткани организма находятся в организме или вне организма. Клетки, находящиеся вне организма, можно поддерживать или выращивать в чашках для культуры тканей. Для клеток, находящихся в организме, в данной области существует много способов введения соединений, включая (без ограничения) пероральное, парентеральное, дермальное, инъекционное и аэрозольное применения. Для клеток вне организма в данной области существует множество способов введения соединений, включая (без ограничения) способы микроинъекции клеток, способы трансформации и способы на основе носителей.
Состояние также может быть предотвращено, подвергнуто лечению или индуцировано введением соединения в группу клеток, которые должны модифицировать путь сигнальной трансдукции данного организма. Затем можно следить за влиянием введения соединения на функцию организма. Субъектом, например, может быть млекопитающее, такое как мышь, крыса, кролик, морская свинка, домашнее животное (такое как собака или кошка), домашний скот (такой как куры, свинья или корова), коза, лошадь, обезьяна, человекообразная обезьяна или человек; червь или насекомое.
Под «амплификацией» подразумеваются повышенные количества ДНК или РНК в клетке по сравнению с нормальными клетками. «Амплификация» по отношению к РНК может представлять собой регистрируемое присутствие РНК в клетках, хотя в некоторых нормальных клетках нет базовой экспрессии РНК. В других нормальных клетках базовый уровень экспрессии существует, следовательно, в указанных случаях амплификация означает регистрацию по меньшей мере 1-2-кратную и предпочтительно более высокую по сравнению с базовым уровнем.
В используемом в данном описании смысле фраза «жесткие условия гибридизации» или «жесткие условия» относится к условиям, при которых зонд, праймер или олигонуклеотид будет гибридизоваться со своей последовательностью-мишенью, но не с другими последовательностями. Условия жесткости зависят от последовательности и будут различными в разных обстоятельствах. Более длинные последовательности специфично гибридизуются при более высоких температурах. Как правило, условия жесткости выбирают так, чтобы они были примерно на 5°C ниже, чем температурная точка плавления (Tm) для конкретной последовательности при определенной ионной силе и pH. Tm является температурой (при определенной ионной силе, pH и концентрации нуклеиновой кислоты), при которой 50% зондов, комплементарных последовательности-мишени, гибридизуются с последовательностью-мишенью в равновесии. Хотя последовательности-мишени обычно присутствуют в избытке, при Tm 50% зондов в равновесии занято. Обычно условия жесткости будут такими, при которых концентрация соли составляет примерно менее 1,0 М иона натрия, обычно примерно от 0,01 до 1,0 М иона натрия (или других солей) при pH от 7,0 до 8,3, и температура составляет по меньшей мере примерно 30°C для коротких зондов, праймеров или олигонуклеотидов (например, от 10 до 50 нуклеотидов) и по меньшей мере примерно 60°C для более длинных зондов, праймеров или олигонуклеотидов. Условия жесткости также могут быть достигнуты с помощью добавления дестабилизирующих агентов, таких как формамид.
Аминокислотные последовательности представлены в направлении от аминоконца к карбоксиконцу слева направо. Аминогруппы и карбоксигруппы не представлены в последовательности. Нуклеотидные последовательности представлены только одной нитью в направлении от 5' к 3'-концу слева направо. Нуклеотиды и аминокислоты представлены таким способом, который рекомендован комиссией по биохимической номенклатуре ИЮПАК-ИЮБ, или (для аминокислот) трехбуквенным кодом.
Полинуклеотиды
Геномная ДНК согласно изобретению содержит кодирующую белок область для полипептида согласно изобретению и также имеется в виду, что она включает аллельные варианты. Общеизвестно, что в случае многих генов геномная ДНК транскрибируется в РНК-транскрипты, которые подвергаются одному или нескольким событиям сплайсинга, при котором интроны (т.е. некодирующие области) транскриптов удаляются или «сплайсируются». РНК-транскрипты, которые могут подвергаться сплайсингу посредством альтернативных механизмов и, следовательно, подвергаются удалению различных последовательностей РНК, но тем не менее кодируют полипептид DmGPCR, в данной области называют «вариантами сплайсинга», которые входят в объем изобретения. Следовательно, варианты сплайсинга, охватываемые изобретением, кодируются одними и теми же исходными последовательностями геномной ДНК, но возникают из различных транскриптов мРНК. Аллельные варианты являются модифицированными формами последовательности гена дикого типа, при этом модификация является результатом рекомбинации во время сегрегации хромосом или воздействии условий, которые вызывают генетическую мутацию. Аллельные варианты подобно генам дикого типа являются встречающимися в природе последовательностями (в противоположность не встречающимся в природе вариантам, которые возникают в результате манипуляции in vitro).
Изобретение также охватывает кДНК, которую получают посредством обратной транскрипции полинуклеотида РНК, кодирующего DmGPCR (обычно с последующим синтезом второй комплементарной нити, чтобы получить двунитевую ДНК).
Последовательность ДНК, кодирующая полипептид DmGPCR, указана в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23. ДНК согласно изобретению может содержать двунитевую молекулу вместе с комплементарной молекулой («некодирующей нитью» или «комплементом»), имеющей последовательность однозначно рассчитываемую на основании кодирующей нити согласно правилам спаривания оснований для ДНК Уотсона-Крика. Также в изобретение включены другие полинуклеотиды, кодирующие какой-либо конкретный полипептид DmGPCR согласно изобретению, которые отличаются по последовательности от конкретных полинуклеотидов, приведенных в данном описании, в силу хорошо известной вырожденности универсального ядерного генетического кода.
Изобретение, кроме того, охватывает гомологи ДНК DmGPCR видов, таких как млекопитающие. Видовые гомологи, иногда называемые «ортологами», в общем имеют гомологию с ДНК согласно изобретению, составляющую по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99%. Обычно процент «гомологии» последовательностей по отношению к полинуклеотидам согласно изобретению может быть рассчитан в виде процентного содержания оснований нуклеотидов в выбранной для исследования последовательности, которые идентичны нуклеотидам в последовательности DmGPCR, указанной в конкретной полинуклеотидной последовательности, после выравнивания последовательностей и введения, при необходимости, пробелов, чтобы достичь максимальной идентичности последовательностей в процентах.
Другим аспектом данного изобретения является применение нуклеотидных последовательностей DmGPCR, раскрытых в данном описании, для идентификации гомологов DmGPCR у других животных, включая млекопитающих, позвоночных и беспозвоночных. Любые нуклеотидные последовательности, приведенные в данном описании, или любую их часть можно, например, использовать в качестве зондов для скрининга базы данных или библиотек нуклеиновых кислот, таких как, например, библиотеки геномной и кДНК, чтобы идентифицировать гомологи, используя способы скрининга, хорошо известные специалистам в данной области.
Информация о полинуклеотидных последовательностях, представленная изобретением, делает возможной крупномасштабную экспрессию кодируемого полипептида способами, хорошо известными и используемыми в повседневной практике в данной области. Полинуклеотиды согласно изобретению также позволяют идентифицировать и выделять полинуклеотиды, кодирующие родственные полипептиды DmGPCR, такие как аллельные варианты и видовые гомологи, хорошо известными способами, включая Саузерн- и/или Нозерн-гибридизацию и полимеразную цепную реакцию (ПЦР). Примеры родственных полинуклеотидов включают геномные последовательности, включая аллельные варианты, а также полинуклеотиды, кодирующие полипептиды, гомологичные DmGPCR, и структурно родственные полипептиды, имеющие одно или несколько биологических, иммунологических и/или физических свойств, общих с DmGPCR. Гены, кодирующие белки, гомологичные DmGPCR, также могут быть идентифицированы Саузерн-анализом и/или ПЦР-анализом и применимы в животных моделях GPCR-нарушений. Знание последовательности ДНК DmGPCR также делает возможным при использовании Саузерн-гибридизации или полимеразной цепной реакции (ПЦР) идентифицировать последовательности геномной ДНК, кодирующие регуляторные последовательности, контролирующие экспрессию DmGPCR, такие как промоторы, операторы, энхансеры, репрессоры и тому подобное. Полинуклеотиды согласно изобретению также применимы в анализах гибридизации для выявления способности клеток экспрессировать DmGPCR. Полинуклеотиды согласно изобретению также обеспечивают основу диагностических способов, применимых для идентификации присутствия эктопаразита, экспрессирующего DmGPCR, которое лежит в основе патологического состояния или состояний, и данная информация применима как для диагностики, так и для выбора методики лечения.
Раскрытие в данном описании полноразмерного полинуклеотида, кодирующего полипептид DmGPCR, делает любой возможный фрагмент полноразмерного полинуклеотида легко доступным для специалиста в данной области. Поэтому изобретение относится к фрагментам полинуклеотидов, кодирующих DmGPCR, содержащим по меньшей мере 14 и предпочтительно по меньшей мере 16, 18, 20, 25, 50 или 75 последовательных нуклеотидов полинуклеотида, кодирующего DmGPCR. Полинуклеотидные фрагменты согласно изобретению могут содержать последовательности, уникальные для последовательности полинуклеотида, кодирующего DmGPCR, и поэтому могут гибридизоваться в условиях высокой жесткости или умеренной жесткости только (т.е. «специфично») с полинуклеотидами, кодирующими DmGPCR (или их фрагментами). Полинуклеотидные фрагменты геномных последовательностей согласно изобретению содержат не только последовательности, уникальные для кодирующей области, но также включают в себя фрагменты полноразмерной последовательности, полученные из интронов, регуляторных областей и/или других нетранслируемых последовательностей. Последовательности, уникальные для полинуклеотидов согласно изобретению, можно распознать посредством сравнения последовательностей с другими известными полинуклеотидами и можно идентифицировать, используя программы выравнивания, используемые в повседневной практике в данной области, например такие, которые доступны в опубликованных базах данных о последовательностях. Такие последовательности также можно распознать на основе анализа Саузерн-гибридизации, определяя количество фрагментов геномной ДНК, с которыми будет гибридизоваться полинуклеотид. Полинуклеотиды согласно изобретению можно метить таким образом, который позволяет их регистрацию, включая радиоактивное, флуоресцентное и ферментативное мечение.
Полинуклеотидные фрагменты особенно применимы в качестве зондов для регистрации полинуклеотидов DmGPCR полной длины или фрагментов. Один или несколько полинуклеотидов могут быть включены в наборы, которые используются для выявления присутствия полинуклеотида, кодирующего DmGPCR, или используются для выявления изменений в полинуклеотидной последовательности, кодирующей DmGPCR.
Изобретение также охватывает ДНК, кодирующие полипептиды DmGPCR, которые гибридизуются в условиях умеренной жесткости или условиях высокой жесткости с некодирующей нитью или комплементом полинуклеотидов в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23.
Примерами условий гибридизации высокой жесткости являются следующие условия: гибридизация при 42°C в растворе для гибридизации, содержащем 50% формамид, 1% SDS, 1 М NaCl, 10% сульфат декстрана, и промывка два раза в течение 30 минут при 60°C в растворе для промывки, содержащем 0,1 X SSC и 1% SDS. В данной области понятно, что условия эквивалентной жесткости можно достичь, варьируя температуру и буфер или концентрацию соли, как описано Ausubel et al. (Eds.), Protocols in Molecular Biology, John Wiley and Sons, 1994, pp.6.0.3-6.4.10. Модификации условий гибридизации можно определить эмпирически или точно рассчитать на основе длины и процентного содержания пар оснований гуанозин/цитозин (GC) зонда. Условия гибридизации можно рассчитать как описано в Sambrook et al. (Eds.), Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York, 1989, pp.9.47-9.51.
Владея информацией о нуклеотидных последовательностях, раскрытой в данном изобретении, специалист в данной области может идентифицировать и получить нуклеотидные последовательности, которые кодируют DmGPCR из разных источников (т.е. различных тканей или различных организмов), посредством множества способов, хорошо известных специалисту в данной области, и которые описаны, например, Sambrook et al., Molecular cloning: a laboratory manual, Second Edition, Cold Spring Harbor Press, Cold Spring Harbor, NY, 1989, и данная публикация включена в данное описание в виде ссылки в полном объеме.
Например, ДНК, которая кодирует DmGPCR, можно получить путем скрининга мРНК, кДНК или геномной ДНК с использованием олигонуклеотидных зондов, созданных на основе информации о последовательности гена DmGPCR, представленной в данном описании. Зонды можно метить регистрируемой группой, такой как флуоресцирующая группа, радиоактивный атом или хемилюминесцентная группа, согласно способам, известным специалисту в данной области и используемым в обычных анализах гибридизации, которые описаны, например, Sambrook et al.
Молекулу нуклеиновой кислоты, содержащую любую из нуклеотидных последовательностей DmGPCR, описанных выше, альтернативно можно синтезировать, используя способ полимеразной цепной реакции (ПЦР) с олигонуклеотидными праймерами ПЦР, полученными на основе нуклеотидных последовательностей, представленных выше. См. патенты США №№4683195, Mullis et al., и 4683202, Mullis. Реакция ПЦР обеспечивает способ избирательного повышения концентрации конкретной последовательности нуклеиновой кислоты даже в том случае, когда последовательность предварительно не очищена и присутствует только в единственной копии в конкретном образце. Способ можно использовать для амплификации либо однонитевой, либо двунитевой ДНК. Сущность способа заключается в применении двух олигонуклеотидных зондов, служащих в качестве праймеров для зависимой от матрицы опосредованной полимеразой репликации требуемой молекулы нуклеиновой кислоты.
Широкое множество альтернативных методик клонирования и амплификации in vitro хорошо известны специалистам в данной области. Примеры таких методик имеются, например, в Berger et al., Guide to Molecular Cloning Techniques, Methods in Enzymology 152 Academic Press, Inc., San Diego, CA (Berger), и эта публикация включена в данное описание в виде ссылки в полном объеме.
Молекулы нуклеиновой кислоты согласно данному изобретению и полученные из них фрагменты применимы для скрининга полиморфизма длин рестрикционных фрагментов (RFLP) и генетического картирования.
Для получения или подтверждения нуклеотидной последовательности DmGPCR можно использовать автоматизированные способы секвенирования. Предполагается, что нуклеотидные последовательности DmGPCR согласно данному изобретению являются точными на 100%. Однако, как известно в данной области, нуклеотидные последовательности, полученные автоматизированными способами, могут содержать некоторые ошибки. Нуклеотидные последовательности, определенные при автоматизации, обычно по меньшей мере примерно на 90%, более обычно по меньшей мере примерно на 95% - по меньшей мере примерно на 99,9% идентичны реальной нуклеотидной последовательности данной молекулы нуклеиновой кислоты. Реальную последовательность можно более точно определить, используя способы ручного секвенирования, которые хорошо известны в данной области. Ошибка в последовательности, которая приводит к инсерции или делеции одного или нескольких нуклеотидов, может приводить к сдвигу рамки при трансляции, так что рассчитанная аминокислотная последовательность будет отличаться от последовательности, которая могла бы быть рассчитана на основе реальной нуклеотидной последовательности молекулы нуклеиновой кислоты, начиная с точки мутации.
Экспрессирующие конструкции и векторы
Также предлагаются автономно реплицирующиеся рекомбинантные экспрессирующие конструкции, такие как плазмидные векторы или векторы на основе вирусной ДНК, содержащие полинуклеотиды согласно изобретению. Векторы используют в данном изобретении для того, чтобы амплифицировать ДНК или РНК, кодирующую DmGPCR, и/или чтобы экспрессировать ДНК, которая кодирует DmGPCR. Векторы согласно изобретению включают, но не ограничены указанным, плазмиды, фаги, космиды, эписомы, вирусные частицы, вирусы и интегрируемые фрагменты ДНК (т.е. фрагменты, интегрируемые в геном хозяина посредством гомологичной рекомбинации). Вирусные частицы могут включать, но не ограничены указанным, аденовирусы, бакуловирусы, парвовирусы, вирусы герпеса, поксвирусы, аденоассоциированные вирусы, вирусы леса Семлики, вирусы вакцинии и ретровирусы. Примеры экспрессирующих векторов включают, но не ограничены указанным, pcDNA3 (Invitrogen) и pSVL (Pharmacia Biotech). Другие экспрессирующие векторы включают, но не ограничены указанным, векторы pSPORT, векторы pGEM (Promega), векторы pPROEX (LTI, Bethesda, MD), векторы Bluescript (Stratagene), векторы pQE (Qiagen), pSE420 (Invitrogen) и pYES2 (Invitrogen).
Также предлагаются экспрессирующие конструкции, в которых кодирующие DmGPCR полинуклеотиды оперативно связаны с эндогенной или экзогенной последовательностью ДНК, регулирующей экспрессию, и терминатором транскрипции. Последовательности ДНК, регулирующие экспрессию, обычно включают в себя промоторы, энхансеры, операторы и сайты, связывающие регуляторные элементы, и обычно выбраны на основе систем экспрессии, в которых используется экспрессирующая конструкция. Последовательности промотора и энхансера обычно выбирают на основании способности увеличивать экспрессию гена, в то время как последовательности оператора обычно выбирают на основании способности регулировать экспрессию гена. Экспрессирующие конструкции согласно изобретению также могут содержать последовательности, кодирующие один или несколько селектируемых маркеров, которые позволяют идентифицировать клетки-хозяева, несущие конструкцию. Экспрессирующие конструкции также могут содержать последовательности, которые способствуют и/или стимулируют гомологичную рекомбинацию в клетке-хозяине. Конструкции согласно изобретению также могут содержать последовательности, необходимые для репликации в клетке-хозяине.
Экспрессирующие конструкции можно использовать для получения кодируемого белка, но также можно использовать просто для того, чтобы амплифицировать полинуклеотидную последовательность, кодирующую DmGPCR. В некоторых вариантах осуществления изобретения вектор представляет собой экспрессирующий вектор, в котором полинуклеотид согласно изобретению оперативно связан с полинуклеотидом, содержащим последовательность регуляции экспрессии. Некоторые экспрессирующие векторы являются реплицируемыми конструкциями ДНК, в которых последовательность ДНК, кодирующая DmGPCR, оперативно связана или соединена с подходящими регуляторными последовательностями, способными осуществлять экспрессию DmGPCR в подходящем хозяине. Области ДНК оперативно связаны или соединены в том случае, когда они функционально связаны друг с другом. Например, промотор оперативно связан или соединен с кодирующей последовательностью, если он регулирует транскрипцию последовательности. Векторы для амплификации не требуют доменов регуляции экспрессии, а скорее требуют только способности реплицироваться в хозяине, обычно придаваемой началом репликации, и селектируемого гена, чтобы облегчить распознавание трансформантов. Необходимость регуляторных последовательностей в экспрессирующем векторе будет варьироваться в зависимости от выбранного хозяина и выбранного способа трансформации. Обычно регуляторные последовательности включают в себя промотор транскрипции, необязательную последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания мРНК с рибосомой, и последовательности, которые регулируют терминацию транскрипции и трансляции.
Векторы могут содержать промотор, который узнается организмом хозяина. Последовательности промотора согласно данному изобретению могут быть прокариотическими, эукариотическими или вирусными. Примеры подходящих прокариотических последовательностей включают промоторы PR и PL бактериофага лямбда (The bacteriophage Lambda, Hershey, A. D., Ed., Cold Spring Harbor Press, Cold Spring Harbor, NY, 1973, публикация включена в данное описание в виде ссылки в полном объеме; Lambda II, Hendrix, R. W., Ed., Cold Spring Harbor Press, Cold Spring Harbor, NY, 1980, публикация включена в данное описание в виде ссылки в полном объеме); промоторы trp, recA, теплового шока и lacZ E.coli и ранний промотор SV40 (Benoist et al., Nature, 1981, 290, 304-310, публикация включена в данное описание в виде ссылки в полном объеме). Дополнительные промоторы включают, но не ограничены указанным, промотор вируса опухоли молочной железы мышей, длинного концевого повтора вируса иммунодефицита человека (ВИЧ), вируса Малони, немедленный ранний промотор цитомегаловируса, промотор вируса Эпштейн-Барра, вируса саркомы Рауса, актина человека, миозина человека, гемоглобина человека, креатина мышц человека и металлотионеина человека.
В векторы согласно изобретению также могут быть включены дополнительные регуляторные последовательности. Примеры подходящих регуляторных последовательностей включают, например, последовательность Шайне-Далгарно гена репликазы фага MS-2 и гена cII бактериофага лямбда. За последовательностью Шайне-Далгарно может непосредственно следовать ДНК, кодирующая DmGPCR, что приводит к экспрессии зрелого белка DmGPCR.
Кроме того, подходящие экспрессирующие векторы могут содержать соответствующий маркер, который позволяет осуществлять скрининг трансформированных клеток-хозяев. Трансформацию выбранного хозяина осуществляют с использованием любого из различных способов, хорошо известных специалисту в данной области и описанных, например, в Sambrook et al., выше.
Начало репликации также может обеспечиваться либо конструкцией вектора, чтобы включить экзогенное начало репликации, либо механизмом репликации хромосом клетки-хозяина. Если вектор интегрируется в хромосому клетки-хозяина, то последний может быть достаточным. Альтернативно, вместо того чтобы использовать векторы, которые содержат вирусные начала репликации, специалист в данной области может трансформировать клетки млекопитающих способом котрансформации ДНК селектируемого маркера и DmGPCR. Примером подходящего маркера является дигидрофолатредуктаза (DHFR) или тимидинкиназа (например, патент США №4399216).
Нуклеотидные последовательности, кодирующие DmGPCR, можно подвергать рекомбинации с векторной ДНК согласно обычным способам, включая тупые и липкие концы для лигирования, расщепление ферментами рестрикции для получения соответствующих концов, заполнение липких концов в соответствии с обстоятельствами, обработку щелочной фосфатазой, чтобы избежать нежелательного связывания и лигирование соответствующими лигазами. Способы для такого манипулирования описаны Sambrook et al., выше, и хорошо известны в данной области. Способы конструирования экспрессирующих векторов млекопитающих описаны, например, в Okayama et al., Mol. Cell. Biol., 1983, 3, 280; Cosman et al., Mol. Immunol. 1986, 23, 935; Cosman et al., Nature, 1984, 312, 768; EP-A-0367566 и WO 91/18982, каждая из публикаций включена в данное описание в виде ссылки в полном объеме.
Клетки-хозяева
Согласно другому аспекту изобретения предлагаются клетки-хозяева, включая прокариотические и эукариотические клетки, содержащие полинуклеотид согласно изобретению (или вектор согласно изобретению) таким образом, который позволяет экспрессировать кодируемый полипептид DmGPCR. Полинуклеотиды согласно изобретению можно ввести в клетку-хозяина в виде части кольцевой плазмиды или в виде линейной ДНК, содержащей изолированную кодирующую белок область, или в виде вирусного вектора. Способы введения ДНК в клетку-хозяина, которые хорошо известны и используются в повседневной практике в данной области, включают трансформацию, трансфекцию, электропорацию, ядерную инъекцию или слияние с носителями, такими как липосомы, мицеллы, клеточные тени и протопласты. Системы экспрессии согласно изобретению включают системы клеток бактерий, дрожжей, грибов, растений, насекомых, беспозвоночных, позвоночных и млекопитающих.
В изобретении предлагаются клетки-хозяева, которые трансформируют или трансфицируют (стабильно или временно) полинуклеотидами согласно изобретению или векторами согласно изобретению. Как указано выше, такие клетки-хозяева применимы для амплификации полинуклеотидов, а также для экспрессии полипептида DmGPCR или его фрагмента, кодируемого полинуклеотидом.
Согласно некоторым аспектам данного изобретения предлагаются трансформированные клетки-хозяева, имеющие экспрессирующий вектор, содержащий какую-либо из молекул нуклеиновых кислот, описанных выше. Экспрессия нуклеотидной последовательности происходит в том случае, когда экспрессирующий вектор вводят в соответствующую клетку-хозяина. Подходящие клетки-хозяева для экспрессии полипептидов согласно изобретению включают, но не ограничены указанным, прокариоты, дрожжи и эукариоты. Если используют прокариотический экспрессирующий вектор, то соответствующей клеткой-хозяином может быть любая прокариотическая клетка, способная экспрессировать клонированные последовательности. Подходящие прокариотические клетки включают, но не ограничены указанным, бактерии родов Escherichia, Bacillus, Salmonella, Pseudomonas, Streptomyces и Staphylococcus.
Если используют эукариотический вектор, то соответствующей клеткой-хозяином может быть любая эукариотическая клетка, способная экспрессировать клонированную последовательность. Эукариотическими клетками могут быть клетки высших эукариот. Подходящие эукариотические клетки включают, но не ограничены указанным, клетки культуры ткани млекопитающих, отличных от человека, и клетки культуры ткани человека. Клетки-хозяева могут включать, но не ограничены указанным, клетки насекомых, клетки HeLa, клетки яичника китайского хомячка (клетки CHO), клетки почки зеленой африканской мартышки (клетки COS), клетки человека 293 и фибробласты 3T3 мышей. Размножение таких клеток в культуре клеток стало обычным способом (см., например, Tissue Culture, Academic Press, Kruse and Patterson, eds., 1973, публикация включена в данное описание в виде ссылки в полном объеме).
Кроме этого, в качестве клетки-хозяина можно использовать дрожжевого хозяина. Примеры дрожжевых клеток включают, но не ограничены указанным, роды Saccharomyces, Pichia и Kluveromyces. Примерами дрожжей-хозяев являются S. cerevisiae и P. pastoris. Дрожжевые векторы могут содержать последовательность начала репликации из дрожжевой плазмиды 2T, автономно реплицирующуюся последовательность (ARS), область промотора, последовательности для полиаденилирования, последовательности для терминации транскрипции и ген селектируемого маркера. Также в данное изобретение включены челночные векторы для репликации как в дрожжах, так и в E.coli.
Альтернативно, в качестве клеток-хозяев можно использовать клетки насекомых. В одном варианте полипептиды согласно изобретению экспрессируют с использованием бакуловирусной системы экспрессии (см. Luckow et al., Bio/Technology, 1988, 6, 47, Baculovirus Expression Vectors: A Laboratory Manual, O'Rielly et al. (Eds.), W. H. Freeman and Company, New York, 1992, и патент США №4879236, каждый из которых включен в данное описание в виде ссылке в полном объеме). Кроме того, для продукции в клетках насекомых можно, например, использовать полную бакуловирусную систему экспрессии MAXBACTM (Invitrogen).
В еще одном родственном варианте изобретение относится к способам получения полипептида DmGPCR (или его фрагмента), включающим в себя стадии выращивания клетки-хозяина согласно изобретению в питательной среде и выделения полипептида или его варианта из клетки или среды. Так как DmGPCR является рецептором с семью трансмембранными доменами, будет понятно, что для некоторых применений, таких как определенные анализы активности, выделение может заключаться в выделении клеточных мембран, содержащих заключенный в них полипептид, тогда как для других применений может требоваться более полное выделение.
Клетки-хозяева согласно изобретению являются полезным источником иммуногена для выработки антител, специфично иммунологически реагирующих с DmGPCR. Клетки-хозяева согласно изобретению также применимы в способах крупномасштабного получения полипептидов DmGPCR, при этом клетки выращивают в подходящей культуральной среде и требуемые полипептидные продукты выделяют из клеток или из среды, в которой клетки выращивают, способами очистки, известными в данной области, например, обычными хроматографическими способами, включая иммунно-аффинную хроматографию, рецепторно-аффинную хроматографию, хроматографию на основе гидрофобных взаимодействий, аффинную хроматографию на основе лектина, эксклюзионную гель-фильтрацию, катионо- или анионообменную хроматографию, высокоэффективную жидкостную хроматографию (ВЭЖХ), обращенно-фазовую ВЭЖХ и тому подобное. Другие способы очистки включают такие способы, в которых требуемый белок экспрессируют и очищают в виде слитого белка, имеющего специфичную концевую метку, метку или хелатирующий остаток, который узнается специфично связывающим партнером или агентом. Очищенный белок можно расщепить, чтобы получить требуемый белок, или можно оставить в виде интактного слитого белка. Отщепление слитого компонента может давать форму требуемого белка, имеющую дополнительные аминокислотные остатки как следствие процесса расщепления.
Знание последовательностей ДНК DmGPCR дает возможность модифицировать клетки, чтобы сделать возможной или увеличить экспрессию эндогенного DmGPCR. Клетки можно модифицировать (например, гомологичной рекомбинацией), чтобы обеспечить повышенную экспрессию, заменяя в целом или часть встречающегося в природе промотора DmGPCR полным или частью гетерологичного промотора, для того чтобы клетки экспрессировали DmGPCR на более высоких уровнях. Гетерологичный промотор встраивают таким образом, чтобы он был оперативно связан с последовательностями, кодирующими эндогенный DmGPCR. (См., например, публикацию международной заявки на выдачу патента PCT №WO 94/12650, публикацию международной заявки на выдачу патента PCT №WO 92/20808 и публикацию международной заявки на выдачу патента PCT №WO 91/09955). Также предполагается, что кроме ДНК гетерологичного промотора могут быть встроены ДНК амплифицируемого маркера (например, ada, dhfr и многофункциональный ген CAD, который кодирует карбамоилфосфатсинтазу, аспрататтранскарбамилазу и дигидрооротазу) и/или ДНК интрона вместе с ДНК гетерологичного промотора. В случае связывания с кодирующей последовательностью DmGPCR амплификация ДНК маркера стандартными способами селекции дает коамплификацию кодирующих последовательностей DmGPCR в клетках.
Нокауты
Информация о последовательностях ДНК, представленная данным изобретением, также делает возможным создание (например, посредством гомологичной рекомбинации или методик «нокаута»; см. Capecchi, Science, 1989, 244, 1288-1292) субъектов, которые не могут экспрессировать функциональный DmGPCR или которые экспрессируют вариант DmGPCR. Такие субъекты (особенно включая насекомых и червей) применимы в качестве моделей для исследования активностей DmGPCR in vivo и модуляторов DmGPCR, а также применимы для дальнейшего выяснения роли DmGPCR у насекомых и червей.
Антисмысловые полинуклеотиды
Также доступными благодаря изобретению являются антисмысловые полинуклеотиды, которые узнают и гибридизуются с полинуклеотидами, кодирующими DmGPCR. Предлагаются полноразмерные и фрагментарные антисмысловые полинуклеотиды. Фрагментарные антисмысловые молекулы согласно изобретению включают молекулы, которые специфично узнают и гибридизуются с последовательностями регуляции экспрессии DmGPCR или РНК DmGPCR (что определяют при сравнении последовательностей ДНК, кодирующих DmGPCR, с ДНК, кодирующей другие известные молекулы). Идентификацию последовательностей, уникальных для полинуклеотидов, кодирующих DmGPCR, можно осуществить, используя любую имеющуюся в открытом доступе базу данных о последовательностях и/или используя коммерчески доступные программы сравнения последовательностей. После идентификации требуемых последовательностей можно осуществить выделение посредством рестрикционного расщепления или амплификации, используя любой из различных способов полимеразной цепной реакции, хорошо известных в данной области. Антисмысловые полинуклеотиды в частности подходят для регуляции экспрессии DmGPCR клетками, которые экспрессируют мРНК DmGPCR.
Антисмысловые нуклеиновые кислоты (предпочтительно олигонуклеотиды длиной от 10 до 20 пар оснований), способные специфично связываться с последовательностями регуляции экспрессии DmGPCR или РНК DmGPCR, вводят в клетки (например, с помощью вирусного вектора или коллоидной дисперсной системы, такой как липосома). Антисмысловая нуклеиновая кислота связывается с нуклеотидной последовательностью-мишенью DmGPCR в клетке и предотвращает транскрипцию и/или трансляцию последовательности-мишени. Фосфоротиоатные и метилфосфонатные антисмысловые олигонуклеотиды специально рассматриваются в изобретении для терапевтического применения. Антисмысловые олигонуклеотиды можно дополнительно модифицировать остатками поли-L-лизина, трансферрина-полилизина или холестерина на 5'-конце. Супрессия экспрессии DmGPCR либо на транскрипционном, либо на трансляционном уровне применима для создания клеточных или животных моделей для изучения биологической роли DmGPCR.
Антисмысловые олигонуклеотиды или фрагменты нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, или комплементарных или гомологичных им последовательностей, полученные из нуклеотидных последовательностей согласно данному изобретению, кодирующих DmGPCR, применимы для исследования экспрессии генов в различных тканях. Например, ткань можно исследовать in situ с использованием олигонуклеотидных зондов, несущих регистрируемые группы, обычными способами авторадиографии. Антисмысловые олигонуклеотиды, направленные к регуляторным областям нуклеотидной последовательности, можно выбрать из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, или соответствующем им мРНК, включая, но не ограничивая указанным, кодон инициации, TATA-бокс, энхансерные последовательности и тому подобное.
Факторы транскрипции
Последовательности DmGPCR, раскрытые в данном изобретении, облегчают конструирование новых факторов транскрипции для модулирования экспрессии DmGPCR в нативных клетках и субъектах и клетках, трансформированных или трансфицированных полинуклеотидами DmGPCR. Например, показано, что белки Cys2-His2-цинковых пальцев, которые связывают ДНК посредством своих доменов цинковых пальцев, можно подвергать структурным изменениям, которые приводят к распознаванию различных последовательностей-мишеней. Указанные искусственные белки цинковых пальцев распознают специфичные сайты-мишени с высокой аффинностью и низкими константами диссоциации и способны действовать в качестве переключателей генов, модулируя экспрессию генов. Знание конкретной последовательности-мишени DmGPCR согласно данному изобретению облегчает конструирование белков цинковых пальцев, специфичных для последовательности-мишени, с использованием известных способов, таких как комбинирование основанного на структуре моделирования и скрининга библиотек на основе фагового дисплея (Segal et al., Proc. Natl. Acad. Sci. USA, 1999, 96, 2758-2763; Liu et al., Proc. Natl. Acad. Sci. USA, 1997, 94, 5525-5530 (1997); Greisman et al., Science, 1997, 275, 657-661; Choo et al., J. Mol. Biol., 1997, 273, 525-532). Каждый домен цинковых пальцев обычно узнает три или более пар оснований. Так как в любом известном геноме последовательность узнавания из 18 пар оснований обычно достаточна по длине, чтобы придать ей уникальность, то можно ожидать, что белок цинковых пальцев, состоящий из 6 тандемных повторов цинковых пальцев, обеспечивает специфичность по отношению к конкретной последовательности (Segal et al.). Искусственные повторы цинковых пальцев, сконструированные на основе последовательностей DmGPCR, сливают с доменами активации или репрессии, чтобы стимулировать или супрессировать экспрессию DmGPCR (Liu et al.). Альтернативно, домены цинковых пальцев можно слить с фактором, связывающим TATA-бокс (TBP), с помощью линкерной области различной длины между пептидом цинкового пальца и TBP, чтобы создать либо активаторы, либо репрессоры транскрипции (Kim et al., Proc. Natl. Acad. Sci. USA, 1997, 94, 3616-3620). Такие белки и полинуклеотиды, которые их кодируют, применимы для модулирования экспрессии DmGPCR in vivo. Новый фактор транскрипции может быть доставлен к клеткам-мишеням трансфицирующими конструкциями, которые экспрессируют фактор транскрипции (генная терапия), или введением белка. Конструируемые белки цинковых пальцев также можно разработать так, чтобы они связывали последовательности РНК для применения в терапевтических целях в качестве альтернативы способам на основе антисмысловых или каталитических РНК (McColl et al., Proc. Natl. Acad. Sci. USA, 1997, 96, 9521-9526; Wu et al., Proc. Natl. Acad. Sci. USA, 1995, 92, 344-348). В данном изобретении предлагаются способы разработки таких факторов транскрипции на основе последовательности гена согласно изобретению, а также создаваемых согласно техническим требованиям белков цинковых пальцев, которые применимы для модулирования экспрессии DmGPCR в клетках (нативных или трансформированных), генетический комплект которых содержит данные последовательности.
Полипептиды
Изобретение также относится к очищенным и изолированным полипептидам DmGPCR, кодируемым полинуклеотидом согласно изобретению, включая полипептид DmGPCR, содержащий аминокислотную последовательность, указанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24.
Будет понятно, что внеклеточные эпитопы в частности применимы для создания и скрининга антител и других связывающий соединений, которые связываются с рецепторами, такими как DmGPCR. Таким образом, в другом варианте изобретение относится к очищенным и изолированным полипептидам, содержащим по меньшей мере один внеклеточный домен (например, N-концевой внеклеточный домен или одну из трех внеклеточных петель) DmGPCR, такой как N-концевой внеклеточный домен DmGPCR. Также в объем изобретения включены очищенные и изолированные полипептиды, содержащие фрагмент DmGPCR, выбранный из группы, состоящей из трансмембранных доменов DmGPCR, внеклеточной петли, связывающей трансмембранные домены DmGPCR, внутриклеточной петли, связывающей трансмембранные домены DmGPCR, C-концевой цитоплазматической области DmGPCR и их слияний. Такие фрагменты могут быть непрерывными частями нативного рецептора. Однако также будет понятно, что сведения о последовательностях гена и белка DmGPCR, которые представлены в данном описании, позволяют рекомбинировать различные домены, которые не являются близлежащими в нативном белке. С использованием компьютерной программы FORTRAN, называемой «tmtrest.all» (Parodi et al., Comput. Appl. Biosci., 1994, 5, 527-535), показано, что DmGPCR содержит домены, пронизывающие мембрану.
Изобретение также охватывает полипептиды, которые имеют по меньшей мере 99%, по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 85%, по меньшей мере 80%, по меньшей мере 75%, по меньшей мере 70%, по меньшей мере 65%, по меньшей мере 60%, по меньшей мере 55%, по меньшей мере 50% идентичность и/или гомологию с эталонным полипептидом согласно изобретению. «Идентичность» аминокислотной последовательности в процентах по отношению к эталонному полипептиду согласно изобретению в данном случае определяют в виде процентного содержания аминокислотных остатков в выбранной для исследования последовательности, которые идентичны остаткам в последовательности DmGPCR после выравнивания обеих последовательностей, и введения при необходимости пробелов, чтобы достичь максимальной идентичности последовательностей в процентах, и не считая при этом какие-либо консервативные замены как часть идентичности последовательностей. «Гомология» последовательности в процентах по отношению к эталонному полипептиду согласно изобретению в данном случае определяют в виде процентного содержания аминокислотных остатков в выбранной для исследования последовательности, которые идентичны остаткам в последовательности DmGPCR после выравнивания последовательностей и введения при необходимости пробелов, чтобы достичь максимальной идентичности последовательностей в процентах, и при этом также рассматривая любые консервативные замены как часть идентичности последовательностей.
В одном аспекте гомологию в процентах рассчитывают в виде процентного содержания аминокислотных остатков в наименьшей из двух последовательностей, которые встают вровень с идентичным аминокислотным остатком в сравниваемой последовательности в том случае, когда можно ввести четыре пробела в участок длиной 100 аминокислот, чтобы максимизировать выравнивание (Dayhoff, in Atlas of Protein Sequence and Structure, vol. 5, National Biochemical Research Foundation, Washington, D.C., 1972, p.124, включенная в данное описание в виде ссылки).
Полипептиды согласно изобретению можно выделить из природных клеточных источников или можно синтезировать химически и можно получить рекомбинантными способами с привлечением клеток-хозяев согласно изобретению. Предполагается, что применение клеток-хозяев млекопитающих обеспечивает такие посттрансляционные модификации (например, гликозилирование, укорочение, липидизация и фосфорилирование), которые могут быть необходимы для придания оптимальной биологической активности рекомбинантным экспрессируемым продуктам согласно изобретению. Гликозилированные и негликозилированные формы полипептидов DmGPCR входят в объем изобретения.
Изобретение также охватывает вариант (или аналог) полипептидов DmGPCR. В одном примере предлагаются инсерционные варианты, в которых один или несколько аминокислотных остатков добавлены в аминокислотную последовательность DmGPCR. Инсерции могут быть расположены на любом или на обоих концах белка или могут быть расположены во внутренних областях аминокислотной последовательности DmGPCR. Инсерционные варианты с дополнительными остатками на любом или на обоих концах могут включать, например, слитые белки и белки, содержащие аминокислотные концевые метки и метки.
Инсерционные варианты включают полипептиды DmGPCR, в которых один или несколько аминокислотных остатков добавлены к аминокислотной последовательности DmGPCR или к его биологически активному фрагменту.
Варианты продуктов согласно изобретению также включают зрелые продукты DmGPCR, т.е. продукты DmGPCR, в которых удалены лидерные или сигнальные последовательности, с дополнительными аминоконцевыми остатками. Дополнительные аминоконцевые остатки могут быть получены из другого белка или могут содержать один или несколько остатков, которые не идентифицируются как полученные из конкретных белков. Рассматриваются продукты DmGPCR с дополнительным остатком метионина в положении -1 (Met-1-DmGPCR), так же как варианты с дополнительными остатками метионина и лизина в положениях -2 и -1 (Met-2-Lys-1-DmGPCR). Варианты DmGPCR с дополнительными остатками Met, Met-Lys, Lys (или в общем одним или несколькими основными остатками) особенно применимы для усиленной продукции рекомбинантного белка в бактериальных клетках-хозяевах.
Изобретение также охватывает варианты DmGPCR, имеющие дополнительные аминокислотные остатки, которые возникают в результате применения конкретных систем экспрессии. Например, применение коммерчески доступных векторов, которые экспрессируют требуемый полипептид в виде части слитого продукта с глутатион-S-трансферазой (GST), обеспечивает требуемый полипептид, имеющий дополнительный остаток глицина в положении -1 после отщепления GST-компонента от требуемого полипептида. Также рассматриваются варианты, которые возникают в результате экспрессии в других векторных системах.
Инсерционные варианты также включают слитые белки, в которых аминоконец и/или карбоксильный конец DmGPCR слит/слиты с другим полипептидом.
В другом аспекте изобретение относится к делеционным вариантам, в которых один или несколько аминокислотных остатков в полипептиде DmGPCR удалены. Делеции можно осуществить на одном или на обоих концах полипептида DmGPCR или путем удаления одного или нескольких неконцевых аминокислотных остатков DmGPCR. Следовательно, делеционные варианты включают все фрагменты полипептида DmGPCR.
В объем изобретения также входят полипептидные фрагменты последовательности, указанной в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 или 24, где фрагменты сохраняют биологические (например, связывание лиганда и/или внутриклеточная передача сигнала) и иммунологические свойства полипептида DmGPCR. Фрагменты, содержащие по меньшей мере 5, 10, 15, 20, 25, 30, 35 или 40 следующих друг за другом аминокислот любого из полипептидов, приведенных в данном описании, включены в изобретение. Полипептидные фрагменты могут проявлять антигенные свойства, уникальные или специфичные для DmGPCR и его аллельных и видовых гомологов. Фрагменты согласно изобретению, обладающие требуемыми биологическими и иммунологическими свойствами, можно получить любым из способов, хорошо известных и используемых в повседневной практике в данной области.
В еще одном аспекте изобретение относится к вариантам полипептидов DmGPCR с заменами. Варианты с заменами включают такие полипептиды, в которых один или несколько аминокислотных остатков полипептида DmGPCR удалены и заменены альтернативными остатками. В одном аспекте замены являются консервативными по природе; однако изобретение охватывает замены, которые также являются неконсервативными. Консервативные замены для данной цели можно определить как указано в таблицах 1, 2 или 3 ниже.
Варианты полипептидов включают такие полипептиды, в которых консервативные замены были введены посредством модификации полинуклеотидов, кодирующих полипептиды согласно изобретению. Аминокислоты можно классифицировать согласно физическим свойствам и вкладу во вторичную и третичную структуру белка. Консервативная замена понимается в данной области как замена одной аминокислоты другой аминокислотой, которая имеет сходные свойства. Примерные консервативные замены указаны в таблице 1 (из WO 97/09433, страница 10, опубликованной 13 марта 1997 (PCT/GB96/02197, поданной 9/6/96)) непосредственно далее.
Альтернативно консервативные аминокислоты могут быть сгруппированы как описано в Lehninger, (BIOCHEMISTRY, Second Edition; Worth Publishers, Inc. NY, NY, 1975, pp.71-77), как указано в таблице 2, непосредственно ниже.
В качестве другой альтернативы примеры консервативных замен указаны в таблице 3 ниже.
Следует понимать, что предполагается, что определение полипептидов согласно изобретению включает в себя полипептиды, несущие другие модификации, отличные от инсерции, делеции или замены аминокислотных остатков. В качестве примера, модификации могут быть ковалентными по природе и включать химическое связывание с полимерами, липидами, другими органическими и неорганическими остатками. Такие производные могут быть получены для того, чтобы увеличить время полужизни циркулирующего полипептида, или могут быть разработаны для повышения способности полипептида направляться к мишени - требуемым клеткам, тканям или органам. Подобным образом изобретение, кроме того, включает в себя полипептиды DmGPCR, которые были ковалентно модифицированы так, чтобы они содержали одно или несколько связываний с водорастворимыми полимерами, такими как полиэтиленгликоль, полиоксиэтиленгликоль или полипропиленгликоль.
Варианты, которые проявляют связывающие свойства нативного DmGPCR по отношению к лиганду и экспрессируются на более высоких уровнях, а также варианты, которые обеспечивают конститутивно активные рецепторы, в частности, применимы в анализах согласно изобретению; варианты также применимы в анализах согласно изобретению и для обеспечения клеточных, тканевых и животных моделей для исследования аномальной активности DmGPCR.
Антитела
Также в объем данного изобретения входят антитела (например, моноклональные и поликлональные антитела, одноцепочечные антитела, химерные антитела, бифункциональные/биспецифичные антитела, гуманизированные антитела, человеческие антитела и антитела с привитыми областями, определяющими комплементарность (CDR), включая соединения, которые содержат последовательности CDR, которые специфично узнают полипептид согласно изобретению), специфичные по отношению к DmGPCR или его фрагментам. Также в изобретении предлагаются фрагменты антител, включая Fab, Fab', F(ab')2 и Fv. Термин «специфичные по отношению к» при использовании для описания антител согласно изобретению указывает, что вариабельные области антител согласно изобретению узнают и связывают исключительно полипептиды DmGPCR (т.е. способны отличать полипептиды DmGPCR от других известных полипептидов GPCR на основании измеряемых различий в аффинности связывания, несмотря на возможное существование локализованной идентичности, гомологии или сходства последовательностей между DmGPCR и такими полипептидами). Будет понятно, что специфичные антитела также могут взаимодействовать с другими белками (например, белком A S. aureus или другими антителами в способах ELISA) посредством взаимодействий с последовательностями вне вариабельной области антител и, в частности, в константной области молекулы. Скрининговые анализы для определения специфичности связывания антитела согласно изобретению хорошо известны и используются в повседневной практике в данной области. Для всестороннего обсуждения таких анализов см. Harlow et al. (Eds.), Antibodies A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1988, Chapter 6. Также рассматриваются антитела, которые узнают и связывают фрагменты полипептидов DmGPCR согласно изобретению, при условии, что антитела специфичны по отношению к полипептидам DmGPCR. Антитела согласно изобретению можно получить, используя любой способ, хорошо известный и используемый в повседневной практике в данной области.
Изобретение относится к антителам, которые специфичны по отношению к DmGPCR согласно изобретению. Специфичность антител более подробно описана ниже. Однако следует подчеркнуть, что антитела, которые могут быть созданы на основе полипептидов, которые были описаны ранее в литературе и которые случайно способны перекрестно реагировать с DmGPCR (например, вследствие случайного существования сходного эпитопа в обоих полипептидах), считаются «перекрестно реагирующими» антителами. Такие перекрестно реагирующие антитела не являются антителами, которые «специфичны» по отношению к DmGPCR. Определение того, является ли антитело специфичным по отношению к DmGPCR или перекрестно реагирующим с другим известным рецептором, осуществляют, используя любой из нескольких анализов, таких как Вестерн-блоттинг-анализы, которые хорошо известны в данной области. Для идентификации клеток, которые экспрессируют DmGPCR, а также для модулирования связывающей активности DmGPCR-лиганд применимы антитела, которые специфично связываются с внеклеточным эпитопом DmGPCR.
В одном варианте изобретение относится к моноклональным антителам. Гибридомы, которые продуцируют такие антитела, также рассматриваются в качестве аспектов изобретения. В еще одном варианте изобретение относится к гуманизированному антителу. Гуманизированные антитела применимы в случае терапевтических показаний для лечения заболеваний или состояний, вызванных эктопаразитами.
В другом варианте изобретение относится к бесклеточной композиции, содержащей поликлональные антитела, в которой по меньшей мере одно из антител является антителом согласно изобретению, специфичным по отношению к DmGPCR. Антисыворотки, выделенные из животного, являются примером композиции, так же как композиция, содержащая фракцию антител антисыворотки, которая была ресуспендирована в воде или другом разбавителе, эксципиенте или носителе.
В еще одном родственном варианте изобретение относится к антиидиотипическим антителам, специфичным по отношению к антителу, которое специфично для DmGPCR.
Хорошо известно, что антитела содержат относительно небольшие антигенсвязывающие домены, которые могут быть выделены химически или рекомбинантными способами. Такие домены сами по себе являются полезными DmGPCR-связывающими молекулами, а также могут быть слиты с токсинами или другими полипептидами. Таким образом, в еще одном варианте изобретение относится к полипептиду, содержащему фрагмент DmGPCR-специфичного антитела, при этом фрагмент и полипептид связываются с DmGPCR. В качестве неограничивающего примера, изобретение относится к полипептидам, которые являются одноцепочечными антителами, CDR-привитыми антителами и гуманизированными антителами.
Антитела других организмов, отличных от человека, можно гуманизировать любыми способами, известными в данной области. В одном способе CDR других организмов, отличных от человека, встраивают в антитело человека или консенсусную каркасную последовательность антитела. Затем можно ввести дополнительные изменения в каркас антитела, чтобы модулировать аффинность или иммуногенность.
Антитела согласно изобретению применимы, например, для терапевтических целей (посредством модулирования активности DmGPCR эктопаразита), диагностических целей, чтобы выявить или количественно определить DmGPCR эктопаразита, и очистки DmGPCR. Также в объем изобретения включены наборы, содержащие антитело согласно изобретению, для любых указанных в данном описании целей. В общем, набор согласно изобретению также содержит контрольный антиген, по отношению к которому антитело является иммуноспецифичным.
Изобретение также относится к способам использования антител согласно изобретению. Например, изобретение относится к способам модулирования связывания лиганда DmGPCR, включающим в себя стадию контактирования DmGPCR с антителом, специфичным по отношению к DmGPCR, в условиях, при которых антитело связывается с рецептором. Антитела согласно изобретению можно использовать для контроля популяции насекомых введением анти-DmGPCR-антитела насекомому, чтобы модулировать связывание лиганда DmGPCR. Например, насекомые могут быть выбраны из мух, плодовых мушек, иксодовых клещей, вшей, блох, тараканов и клещей.
Генная обработка
Генная обработка с использованием DmGPCR также применима на таких субъектах, как насекомые. Генная обработка включает восстановление активности DmGPCR, сверхэкспрессию DmGPCR и негативную регуляцию DmGPCR. В объем данного изобретения также включена генная обработка для восстановления активности DmGPCR, утраченной вследствие нарушения функциональной мутации. Доставку функционального гена DmGPCR в соответствующие клетки осуществляют ex vivo, in situ или in vivo с использованием векторов и более конкретно вирусных векторов (например, аденовируса, аденоассоциированного вируса или ретровируса) или ex vivo с использованием способов физического переноса ДНК (например, липосом или химических обработок). См., например, Anderson, Nature, 1998, suppl. 392 (6679), 25-20. Для дополнительного обзора методики генной терапии см. Friedmann, Science, 1989, 244, 1275-1281; Verma, Scientific American, 1990, 68-84; и Miller, Nature, 1992, 357, 455-460. Также предполагается, что генная обработка, например, антисмысловая обработка, может применяться для негативной регуляции экспрессии DmGPCR. В качестве неограничивающего примера генная обработка может быть применима для контролирования популяции насекомых нокаутированием или понижающей регуляцией одного или нескольких генов DmGPCR или их фрагментов (см. выше и ниже).
Композиции
Другой аспект данного изобретения связан с композициями, включая инсектицидные и фармацевтические композиции, содержащие любую из молекул нуклеиновых кислот или рекомбинантных экспрессирующих векторов, описанных выше, и приемлемый носитель или разбавитель. Носитель или разбавитель может быть фармацевтически приемлемым. Подходящие носители описаны в самой последней редакции Remington's Pharmaceutical Sciences, A. Osol, стандартном справочном руководстве в данной области, которое включено в данное описание в виде ссылки в полном объеме. Примеры таких носителей или разбавителей включают, но не ограничены указанным, воду, физиологический раствор, раствор Рингера, раствор декстрозы и 5% сывороточный альбумин человека. Также можно использовать липосомы и неводные носители, такие как жирные масла. Препараты стерилизуют обычно используемыми способами.
Также в объем изобретения включены композиции, содержащие полипептиды, полинуклеотиды или антитела согласно изобретению, которые приготовлены, например, с фармацевтически приемлемым носителем.
Изобретение относится к инсектицидным композициям, содержащим полинуклеотид DmGPCR, полипептид DmGPCR, анти-DmGPCR-антитело, его фрагменты или части, обладающие DmGPCR-связывающей активностью, партнер, связывающий DmGPCR или модулятор DmGPCR.
Наборы и способы
Данное изобретение также относится к наборам, включая фармацевтические и инсектицидные наборы. Наборы могут содержать любую из молекул нуклеиновых кислот, описанных выше, любой из полипептидов, описанных выше, или любое антитело, которое связывается с полипептидом согласно изобретению, которое описано выше, а также негативный контроль. Набор может содержать дополнительные компоненты, такие как, например, инструкции, твердую подложку, реагенты, полезные для количественного анализа, и тому подобное.
Наборы могут быть предназначены для того, чтобы управлять либо экспрессией полинуклеотидов, либо кодируемыми белками. Например, могут быть предложены наборы для гибридизации олигонуклеотидов, которые содержат емкость, содержащую олигонуклеотидный зонд, специфичный для DmGPCR-специфичной ДНК, и необязательно емкости с позитивными и негативными контролями и/или инструкции. Подобным образом могут быть предложены наборы для ПЦР, которые включают в себя емкость, содержащую праймеры, специфичные для DmGPCR-специфичных последовательностей, ДНК и необязательно емкости с маркерами размера, позитивными и негативными контролями и/или инструкции.
Условия гибридизации должны быть такими, чтобы гибридизация в присутствии других молекул нуклеиновых кислот происходила только с генами. В жестких условиях гибридизации гибридизуются только высоко комплементарные последовательности нуклеиновых кислот. Такие условия могут предотвращать гибридизацию нуклеиновых кислот, имеющих 1 или 2 ошибочных спаривания из 20 следующих друг за другом нуклеотидов. Такие условия определены выше.
Тестируемые образцы, подходящие для способов исследования нуклеиновых кислот с помощью зондов согласно данному изобретению, включают, например, клетки или экстракты нуклеиновых кислот из клеток или биологические жидкости. Образцы, используемые в описанных выше способах, будут варьироваться в зависимости от формы анализа, способа регистрации и природы исследуемых тканей, клеток или экстрактов. Способы приготовления экстрактов нуклеиновых кислот из клеток хорошо известны в данной области и могут быть легко адаптированы для того, чтобы получить образец, который совместим с используемым способом.
В другом аспекте изобретение относится к способам регистрации полинуклеотида в образце в качестве средства для диагностики заболеваний или расстройств, вызванных эктопаразитом, при этом способы включают в себя стадии: (a) контактирования образца с зондом нуклеиновой кислоты, который гибридизуется в условиях анализа гибридизации с областью-мишенью нуклеиновой кислоты, кодирующей полипептид, имеющий последовательность, выбранную из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 и 24, при этом указанный зонд содержит последовательность нуклеиновой кислоты, кодирующий полипептид, ее фрагменты и комплементы последовательностей или фрагментов; и (b) регистрации присутствия или количества гибрида зонд:область-мишень в качестве показателя заболевания.
Альтернативно могут быть предложены наборы для иммуноанализа, которые содержат емкости, содержащие антитела, специфичные для белка DmGPCR, и необязательно емкости с позитивными и негативными контролями и/или инструкции.
Также предлагаются наборы, которые применимы для идентификации партнеров, связывающих DmGPCR, таких как природные лиганды или модуляторы (агонисты или антагонисты). Вещества, применимые для лечения расстройств или заболеваний, могут давать положительные результаты в одном или нескольких анализах in vitro в отношении активности, соответствующей лечению рассматриваемого заболевания или расстройства. Вещества, которые модулируют активность полипептидов, включают, но не ограничены указанным, антисмысловые олигонуклеотиды, агонисты и антагонисты и антитела.
Изобретение также относится к способам модулирования связывания лиганда DmGPCR, включающим в себя стадию контактирования DmGPCR с антителом, специфичным по отношению к DmGPCR, в условиях, при которых антитело связывается с рецептором.
Способы индуцирования иммунного ответа
Другой аспект данного изобретения направлен на способы индуцирования иммунного ответа у субъекта против полипептида согласно изобретению посредством введения субъекту количества полипептида, достаточного для того, чтобы индуцировать иммунный ответ. Количество будет зависеть от вида субъекта, размера субъекта и тому подобного, но может быть определено специалистами в данной области.
Способы идентификации лигандов
Другой аспект данного изобретения направлен на способы идентификации соединений, которые связываются либо с DmGPCR, либо с молекулами нуклеиновых кислот, кодирующими DmGPCR, включающие в себя контактирование DmGPCR или кодирующей его молекулы нуклеиновой кислоты с соединением и определение того, связывает ли соединение DmGPCR или кодирующую его молекулу нуклеиновой кислоты. Связывание можно определить анализами связывания, которые хорошо известны специалисту в данной области, включая, но не ограничивая указанным, анализы сдвигов в геле, Вестерн-блоты, конкурентные анализы с радиоактивным мечением, клонирование с экспрессией на основе фагов, совместное фракционирование хроматографией, копреципитацию, перекрестное связывание, ловушку взаимодействия/двугибридный анализ, саузвестерн-анализ, ELISA и тому подобное, которые описаны, например, в Current Protocols in Molecular Biology, John Wiley and Sons, NY, 1999, публикация включена в данное описание в виде ссылки в полном объеме. Соединения, подвергаемые скринингу, включают (и они могут включать соединения, которые предположительно связывают DmGPCR или кодирующую его молекулу нуклеиновой кислоты), но не ограничены указанным, соединения внеклеточного, внутриклеточного, биологического или химического происхождения.
Изобретение также относится к анализам для идентификации соединений, которые связывают DmGPCR. Один из таких анализов заключается в контактировании композиции, содержащей DmGPCR, с соединением, предположительно связывающим DmGPCR, и измерении связывания между соединением и DmGPCR. В некоторых вариантах композиция содержит клетку, экспрессирующую DmGPCR на своей поверхности. В другом варианте используют изолированный DmGPCR или клеточные мембраны, содержащие DmGPCR. Связывание можно измерить непосредственно, например, используя меченое соединение, или можно измерить косвенно несколькими способами, включая измерение внутриклеточной передачи сигнала DmGPCR, индуцированной соединением (или измеряя изменения в уровне передачи сигнала DmGPCR).
Специфичные связывающие молекулы, включая природные лиганды и синтетические соединения, можно идентифицировать или разработать, используя выделенные или рекомбинантные DmGPCR-продукты, варианты DmGPCR или клетки, экспрессирующие такие продукты. Партнеры в связывании применимы для очистки продуктов DmGPCR и выявления или количественного определения DmGPCR-продуктов в образцах жидкости или ткани с использованием известных иммунологических способов. Связывающие молекулы также очевидно применимы для модулирования (т.е. блокирования, ингибирования или стимулирования) биологических активностей DmGPCR, особенно тех активностей, которые вовлечены в сигнальную трансдукцию.
Информация о последовательности ДНК и аминокислотной последовательности, представленная данным изобретением, также делает возможной идентификацию соединений-партнеров при связывании, с которыми будет взаимодействовать полипептид или полинуклеотид DmGPCR. Способы идентификации соединений-партнеров при связывании включают анализы в растворах, анализы in vitro, в которых полипептиды DmGPCR иммобилизованы, и основанные на клетках анализы. Идентификация связывающих соединений-партнеров полипептидов DmGPCR предоставляет кандидатов для терапевтического или профилактического вмешательства в патологии, связанные с эктопаразитами, экспрессирующими DmGPCR, и кандидатов в инсектициды.
Изобретение относится к нескольким системам анализа для идентификации связывающих партнеров DmGPCR. В случае анализов в растворах способы согласно изобретению включают в себя стадии (a) контактирования полипептида DmGPCR с одним или несколькими соединениями, являющимися кандидатами в партнеры при связывании, и (b) идентификации соединений, которые связываются с полипептидом DmGPCR. Идентификацию соединений, которые связывают полипептид DmGPCR, можно осуществить, выделяя комплекс полипептид DmGPCR/связывающий партнер и отделяя соединение связывающего партнера от полипептида DmGPCR. В другой вариант осуществления изобретения также включена дополнительная стадия характеризации физических, биологических и/или биохимических свойств соединения связывающего партнера. В одном аспекте комплекс полипептид DmGPCR/связывающий партнер выделяют с использованием антитела, иммуноспецифичного по отношению либо к полипептиду DmGPCR, либо к соединению кандидата в партнеры при связывании.
В следующих вариантах либо полипептид DmGPCR, либо соединения кандидата в партнеры при связывании содержит метку или концевую метку, которая облегчает его выделение, и способы согласно изобретению для идентификации соединений связывающих партнеров включают стадию выделения комплекса полипептид DmGPCR/связывающий партнер посредством взаимодействия с меткой или концевой меткой. Примером концевой метки данного типа является полигистидиновая последовательность обычно примерно из шести остатков гистидина, которая позволяет выделять меченное таким образом соединение с использованием хелатирования никеля. Другие метки и концевые метки, такие как концевая метка FLAG® (Eastman Kodak, Rochester, NY), хорошо известные и используемые в повседневной практике в данной области, входят в объем изобретения. Метки согласно изобретению также включают, но не ограничены указанным, радиоактивную метку (например,125I,35S,32P,33P,3 H), флуоресцентную метку, хемилюминесцентную метку, ферментативную метку и иммуногенную метку.
В некоторых вариантах анализов in vitro в изобретении предлагаются способы, включающие в себя стадии (a) контактирования иммобилизованного полипептида DmGPCR с соединением-кандидатом в партнеры при связывании и (b) регистрации связывания соединения-кандидата с полипептидом DmGPCR. В альтернативном варианте иммобилизуют соединение-кандидат в партнеры при связывании и регистрируют связывание DmGPCR. Иммобилизацию осуществляют с использованием любого из способов, хорошо известных в данной области, включая ковалентное связывание с подложкой, шариком или смолой для хроматографии, а также нековалентные высокоаффинные взаимодействия, такие как связывание антителами, или использование связывания стрептавидин/биотин, при котором иммобилизованное соединение содержит биотиновую метку. Регистрацию связывания можно осуществить (i) используя радиоактивную метку на соединении, которое не иммобилизовано, (ii) используя флуоресцентную метку на неиммобилизованном соединении, (iii) используя антитело, иммуноспецифичное по отношению к неиммобилизованному соединению, (iv) используя метку на неиммобилизованном соединении, которая возбуждает флуоресцирующую подложку, с которой связано иммобилизованное соединение, а также другие способы, хорошо известные и используемые в повседневной практике в данной области.
Изобретение также относится к основанным на клетках анализах для идентификации соединений связывающих партнеров для полипептида DmGPCR. В одном варианте изобретение относится к способам, включающим в себя стадии контактирования полипептида DmGPCR, экспрессируемого на поверхности клетки с соединением-кандидатом в партнеры при связывании и регистрации связывания соединения-кандидата в партнеры при связывании с полипептидом DmGPCR. В другом варианте регистрация заключается в регистрации потока кальция или других физиологических событий в клетке, вызванных связыванием молекулы.
В другом варианте осуществления изобретения используют высокопроизводительный скрининг соединений, обладающих подходящей аффинностью связывания с DmGPCR. Коротко, большие количества различных небольших тестируемых пептидных соединений синтезируют на твердой подложке или в виде свободных соединений, растворенных в соответствующих буферах. Осуществляют контакт тестируемых пептидных соединений с DmGPCR и промывают. Затем связанный DmGPCR регистрируют способами, хорошо известными в данной области. Очищенные полипептиды согласно изобретению также можно нанести в виде покрытия на планшеты для применения в указанных выше анализах связывания. Кроме того, можно использовать не нейтрализующие антитела для захвата белка и иммобилизации его на твердой подложке.
Обычно, экспрессированный DmGPCR можно использовать для HTS-анализов связывания вместе с его определенным лигандом. Идентифицированный пептид метят подходящим радиоизотопом, включая без ограничения125I,3H,35S или32P, способами, которые хорошо известны специалистам в данной области. Альтернативно, пептиды можно метить хорошо известными способами подходящим флуоресцирующим производным (Baindur et al., Drug Dev. Res., 1994, 33, 373-398; Rogers, Drug Discovery Today, 1997, 2, 156-160). Радиоактивный лиганд, специфично связанный с рецептором в препаратах мембран, полученных из линии клеток, экспрессирующих рекомбинантный белок, можно регистрировать в HTS-анализах одним из нескольких стандартных способов, включая фильтрование комплекса рецептор-лиганд, чтобы отделить связанный лиганд от несвязанного лиганда (Williams, Med. Res. Rev., 1991, 11, 147-184; Sweetnam et al., J. Natural Products, 1993, 56, 441-455). Альтернативные способы включают анализ сцинтилляционного сходства (SPA) или формат FlashPlate, в котором такое разделение необязательно (Nakayama, Curr. Opinion Drug Disc. Dev., 1998, 1, 85-91; Bosse et al., J. Biomolecular Screening, 1998, 3, 285-292). Связывание флуоресцирующих лигандов можно регистрировать различными способами, включая перенос энергии флуоресценции (FRET), прямой спектрофотофлуорометрический анализ связанного лиганда или поляризацию флуоресценции (Rogers, Drug Discovery Today, 1997, 2, 156-160; Hill, Curr. Opinion Drug Disc. Dev., 1998, 1, 92-97).
Можно использовать другие анализы для идентификации специфичных лигандов DmGPCR, включая анализы, в которых идентифицируют лиганды белка-мишени посредством измерения прямого связывания тестируемых лигандов с белком-мишенью, а также анализы, в которых идентифицируют лиганды белков-мишеней посредством аффинной ультрафильтрации и способов масс-спектроскопии с ионным распылением/ВЭЖХ или других физических и аналитических способов. Альтернативно, такие взаимодействия при связывании оценивают опосредованно, используя двугибридную дрожжевую систему, описанную в Fields et al. (Nature, 1989, 340, 245-246) и Fields et al. (Trends in Genetics, 1994, 10, 286-292), обе публикации включены в данное описание в виде ссылки. Двугибридная система представляет собой генетический анализ для регистрации взаимодействий между двумя белками или полипептидами. Ее можно использовать для идентификации белков, которые связываются с известным представляющим интерес белком или чтобы определить домены или остатки, важные для взаимодействия. Разработаны варианты данной методики для того, чтобы клонировать гены, которые кодируют ДНК-связывающие белки, идентифицировать пептиды, которые связываются с белком, и проводить скрининг лекарственных средств. В двугибридной системе используют способность пары взаимодействующих белков приводить домен активации транскрипции в близкое соседство с ДНК-связывающим доменом, который связывается с вышерасположенной последовательностью активации (UAS) репортерного гена, и обычно осуществляют на дрожжах. Анализ требует конструирования двух гибридных генов, кодирующих (1) ДНК-связывающий домен, который слит с первым белком, и (2) домен активации, слитый со вторым белком. ДНК-связывающий домен направляет первый гибридный белок к UAS репортерного гена; однако поскольку у большинства белков отсутствует домен активации, данный ДНК-связывающий гибридный белок не активирует транскрипцию репортерного гена. Второй гибридный белок, который содержит домен активации, не может сам по себе активировать экспрессию репортерного гена, так как он не связывает UAS. Однако, когда присутствуют оба гибридных белка нековалентное взаимодействие первого и второго белков связывает домен активации с UAS, активируя транскрипцию репортерного гена. Например, в том случае, когда первым белком является продукт гена DmGPCR или его фрагмент, который как известно взаимодействует с другим белком или нуклеиновой кислотой, то данный анализ можно использовать для того, чтобы выявить агенты, которые препятствуют связывающему взаимодействию. Контролируют экспрессию репортерного гена по мере добавления различных тестируемых агентов к системе. Результатом присутствия ингибирующего агента является отсутствие сигнала репортера.
В том случае, когда функция продукта гена DmGPCR не известна и не известны лиганды, связывающие генный продукт, дрожжевой двугибридный анализ также можно использовать для того, чтобы идентифицировать белки, которые связываются с продуктом гена. В анализе для идентификации белков, которые связываются с рецептором DmGPCR или его фрагментом, можно использовать слитый полинуклеотид, кодирующий как рецептор DmGPCR (или фрагмент), так и UAS-связывающий домен (т.е. первый белок). Кроме того, в анализе получают и проводят скрининг большого количества гибридных генов, кодирующих разные вторые белки, слитые с доменом активации. Обычно второй белок кодируется одним или несколькими представителями библиотеки слияний суммарной кДНК или геномной ДНК, при этом каждая область, кодирующая второй белок, слита с доменом активации. Данная система применима для широкого множества белков и при этом даже не требуется идентифицировать или знать функцию второго связывающего белка. Система является высокочувствительной и может регистрировать взаимодействия, не выявляемые другими способами; даже временные взаимодействия могут запускать транскрипцию, продуцируя стабильную мРНК, которую можно неоднократно транслировать, получая репортерный белок.
Можно использовать другие анализы для поиска агентов, которые связываются с белком-мишенью. Один из таких способов скрининга для идентификации прямого связывания тестируемых лигандов с белком-мишенью описан в патенте США №5585277, включенном в данное описание в виде ссылки. Данный способ основан на том принципе, что белки обычно существуют в виде смеси белков в состоянии укладки или в развернутом состоянии и два состояния непрерывно сменяют друг друга. В том случае, когда лиганд связывается с подвергнутой укладке формой белка-мишени (т.е. когда тестируемый лиганд является лигандом белка-мишени), молекула белка-мишени, связанная лигандом, остается в своем подвергнутом укладке состоянии. Таким образом, подвергнутый укладке белок-мишень в большем количестве имеется в присутствии тестируемого лиганда, который связывает белок-мишень, чем в отсутствие лиганда. Связывание лиганда с белком-мишенью можно определить любым способом, который различает подвергнутое укладке и развернутое состояния белка-мишени. Функцию белка-мишени не обязательно знать, чтобы осуществить данный анализ. Фактически любой агент можно анализировать данным способом в качестве тестируемого лиганда, включая без ограничения металлы, полипептиды, белки, липиды, полисахариды, полинуклеотиды и малые органические молекулы.
Другой способ идентификации лигандов белка-мишени описан в Wieboldt et al. (Anal. Chem., 1997, 69, 1683-1691), включенной в данное описание в виде ссылки. В случае данного способа проводят скрининг комбинаторных библиотек 20-30 агентов одновременно в растворенной фазе в отношении связывания с белком-мишенью. Агенты, которые связываются с белком-мишенью, отделяют от других компонентов библиотеки простой промывкой мембран. Специфично отобранные молекулы, которые остаются на фильтре, затем освобождают от белка-мишени и анализируют ВЭЖХ и масс-спектроскопией с ионизацией в пневматически усиленном электроспрее (ионное распыление). Данный способ отбирает компоненты библиотеки с самой высокой аффинностью по отношению к белку-мишени и особенно применим для библиотек малых молекул.
Другие варианты осуществления изобретения заключаются в использовании конкурентных скрининговых анализов, в которых нейтрализующие антитела, способные связывать полипептид согласно изобретению, специфично конкурируют с тестируемым соединением за связывание с полипептидом. Таким образом, антитела можно использовать для выявления присутствия любого пептида, который имеет одну или несколько общих антигенных детерминант с DmGPCR. Исследования конкурентного связывания с использованием радиоактивной метки описаны в A. H. Lin et al. (Antimicrobial Agents and Chemotherapy, 1997, 41 (10), 2127-2131), описание которой включено в данное описание в виде ссылки в полном объеме.
Способы идентификации модулирующих агентов
Изобретение также относится к способам идентификации модулятора связывания между DmGPCR и связывающим партнером DmGPCR, включающим в себя стадии: (a) осуществления контакта связывающего партнера DmGPCR и композиции, содержащей DmGPCR, в присутствии и в отсутствие соединения предполагаемого модулятора; (b) регистрации связывания между связывающим партнером и DmGPCR; и (c) идентификации соединения предполагаемого модулятора с точки зрения пониженного или повышенного связывания между связывающим партнером и DmGPCR в присутствии предполагаемого модулятора по сравнению со связыванием в отсутствие предполагаемого модулятора.
Связывающие партнеры DmGPCR, которые стимулируют активность DmGPCR, применимы в качестве агонистов в условиях, характеризуемых недостаточной передачей сигнала DmGPCR (например, в результате недостаточной активности лиганда DmGPCR). Связывающие партнеры DmGPCR, которые блокируют опосредованную лигандом передачу сигнала DmGPCR, применимы в качестве антагонистов DmGPCR в условиях, характеризуемых избыточной передачей сигнала DmGPCR. Кроме того, модуляторы DmGPCR в общем, а также полинуклеотиды и полипептиды DmGPCR применимы в диагностических анализах в отношении заболеваний, вызванных эктопаразитами, или состояний, при которых активность DmGPCR повышена или ослаблена.
В другом аспекте изобретение относится к способам лечения заболевания или состояния путем введения субъекту, нуждающемуся в таком лечении, вещества, которое модулирует активность или экспрессию полипептида, имеющего последовательность, выбранную из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 и 24.
В другом аспекте изобретение относится к способам контролирования популяции насекомых путем введения насекомым в популяции связывающего партнера или модулятора, который модифицирует экспрессию или активность DmGPCR.
Агенты, которые модулируют (т.е. увеличивают, уменьшают или блокируют) активность или экспрессию DmGPCR, можно идентифицировать посредством инкубации предполагаемого модулятора с клеткой, содержащей полипептид или полинуклеотид DmGPCR, и определения влияния предполагаемого модулятора на активность или экспрессию DmGPCR. Избирательность соединения, которое модулирует активность DmGPCR, можно оценить, сравнивая его влияние на DmGPCR с его влиянием на другие соединения GPCR. Избирательные модуляторы могут включать, например, антитела и другие белки, пептиды или органические молекулы, которые специфично связываются с полипептидом DmGPCR или нуклеиновой кислотой, кодирующей DmGPCR. Модуляторы активности DmGPCR будут терапевтически применимы для лечения заболеваний и физиологических состояний, в которые вовлечена нормальная или аномальная активность DmGPCR.
Полинуклеотиды и полипептиды DmGPCR, а также модуляторы DmGPCR, также можно использовать в диагностических анализах заболеваний, вызванных эктопаразитами, или состояний, характеризуемых повышенной или ослабленной активностью DmGPCR.
Способы согласно изобретению для идентификации модуляторов включают варианты любого из описанных выше способов идентификации соединений связывающих партнеров, варианты, включающие способы, в которых соединение связывающего партнера идентифицировано и анализ связывания осуществляют в присутствии и отсутствие выбранного для исследования модулятора. Модулятор идентифицируют в тех случаях, когда связывание между полипептидом DmGPCR и соединением связывающего партнера изменяется в присутствии кандидата в модуляторы по сравнению со связыванием в отсутствие соединения-кандидата в модуляторы. Модулятор, который увеличивает связывание между полипептидом DmGPCR и соединением связывающего партнера, описывают как усилитель или активатор, а модулятор, который снижает связывание между полипептидом DmGPCR и соединением связывающего партнера, описывают как ингибитор.
Изобретение также охватывает высокопроизводительные скрининговые анализы (HTS) для идентификации соединений, которые взаимодействуют с полипептидом DmGPCR или ингибируют биологическую активность (т.е. влияют на ферментативную активность, связывающую активность и т.д.) полипептида DmGPCR. HTS-анализ позволяет эффективно проводить скрининг большого количества соединений. Рассматриваются основанные на клетках HTS-системы для исследования взаимодействия рецептор DmGPCR-лиганд. HTS-анализы предназначены для идентификации «хитов» или «соединений-лидеров», обладающих требуемым свойством, на основании которых можно разработать модификации, чтобы улучшить требуемое свойство. Химическая модификация «хита» или «соединения-лидера» часто основана на идентифицируемой взаимосвязи структуры/активности между «хитом» и полипептидом DmGPCR.
Модуляторы, входящие в объем изобретения, включают, но не ограничены указанным, непептидные молекулы, такие как непептидные миметики, непептидные аллостерические эффекторы, и пептиды. Полипептид или полинуклеотид DmGPCR, используемый в таком тесте, может быть свободным в растворе, связанным с твердой подложкой, находиться на поверхности клеток или может быть локализован внутриклеточно или связан с частью клетки. Специалист в данной области, например, может измерить образование комплексов между DmGPCR и тестируемым соединением. Альтернативно, специалист в данной области может определить снижение образования комплекса между DmGPCR и его субстратом, вызванное тестируемым соединением.
Другой аспект данного изобретения направлен на способы идентификации соединений, которые модулируют (т.е. увеличивают или уменьшают) активность DmGPCR, включающие в себя контактирование DmGPCR с соединением и определение того, модифицирует ли соединение активность DmGPCR. Активность в присутствии тестируемого соединения сравнивают с активностью в отсутствие тестируемого соединения. В том случае, когда активность образца, содержащего тестируемое соединение, выше, чем активность образца, не содержащего тестируемое соединение, соединение будет обладать повышенной активностью. Подобным образом, в том случае, когда активность образца, содержащего тестируемое соединение, ниже, чем активность образца, не содержащего тестируемого соединения, соединение будет обладать ингибированной активностью.
Данное изобретение в частности применимо для скрининга соединений с использованием DmGPCR в любом из множества анализов активности. Соединения, подвергаемые скринингу, включают (и они могут включать соединения, которые предположительно модулируют активность DmGPCR), но не ограничены указанным, соединения внеклеточного, внутриклеточного, биологического или химического происхождения. Полипептид DmGPCR, используемый в таком тесте, может быть в любой форме, такой как свободно в растворе, связанным с твердой подложкой, находящимся на поверхности клеток или может быть локализован внутриклеточно. Специалист в данной области, например, может измерить образование комплексов между DmGPCR и тестируемым соединением. Альтернативно, специалист в данной области может определить снижение образования комплекса между DmGPCR и его субстратом, вызванное тестируемым соединением.
Активность полипептидов DmGPCR согласно изобретению можно определить, например, исследуя способность связываться или активироваться химически синтезированными пептидными лигандами. Альтернативно, активность DmGPCR можно анализировать, исследуя их способность связывать ионы кальция, гормоны, хемокины, нейропептиды, нейромедиаторы, нуклеотиды, липиды, одоранты и фотоны. Альтернативно, активность DmGPCR можно определить, исследуя активность эффекторных молекул, включая, без ограничения, аденилатциклазу, фосфолипазы и ионные каналы. Таким образом, модуляторы активности DmGPCR могут изменять функцию рецептора DmGPCR, такую как связывающее свойство рецептора, или активность, такую как опосредованная G-белком трансдукция сигнала, или мембранную локализацию. В различных вариантах способов, анализ может принимать форму анализа потока ионов, анализа роста дрожжей, анализа негидролизуемого GTP, такой как анализ [35S]GTPγS, анализа цАМФ, анализа инозитолтрифосфата, анализа диацилглицерина, анализа экворина, анализа люциферазы, анализа FLIPR в отношении внутриклеточной концентрации Ca2+, анализа митогенеза, анализа MAP-киназной активности, анализа высвобождения арахидоновой кислоты (например, с использованием [3 H]-арахидоновой кислоты) и анализа в отношении степени подкисления внеклеточной среды, а также других анализов активности DmGPCR, основанных на связывании или функции, которые как правило известны в данной области. В некоторых из указанных вариантов изобретение охватывает включение любого из G-белков, известных в данной области, таких как G16, G15 или химерные Gqi5 , Gqs5, Gqo5, Gqz5 и тому подобные. Активность DmGPCR можно определить способом, который используется для анализа активности FaRP, который хорошо известен специалистам в данной области. Биологические активности рецепторов DmGPCR согласно изобретению включают, но не ограничены указанным, связывание природного или неприродного лиганда, а также любую из функциональных активностей GPCR, известных в данной области. Неограничивающие примеры активностей GPCR включают трансмембранную передачу сигнала различных форм, в которую может быть вовлечена ассоциация G-белка и/или проявление влияния на связывание G-белком различных гуанидилатных нуклеотидов; другой приведенной в качестве примера активностью GPCR является связывание вспомогательных белков или полипептидов, которые отличаются от известных G-белков.
Модуляторы согласно изобретению имеют множество химических структур, которые можно как правило отнести к группам непептидных миметиков природных лигандов рецептора DmGPCR, пептидных и непептидных аллостерических эффекторов рецепторов DmGPCR и пептидов, которые функционируют в качестве активаторов или ингибиторов (конкурентных, внеконкурентных и неконкурентных) (например, продукты антител) рецепторов DmGPCR. Изобретение не ограничено источниками подходящих модуляторов, которые могут быть получены из природных источников, таких как растительные, животные или минеральные экстракты, или неприродных источников, таких как библиотеки малых молекул, содержащие продукты комбинаторных химических способов конструирования библиотек, и библиотеки пептидов. Примеры пептидных модуляторов рецепторов DmGPCR имеют следующие первичные структуры: GLGPRPLRFамид (SEQ ID NO: 49), GNSFLRFамид (SEQ ID NO: 136), GGPQGPLRFамид (SEQ ID NO: 102), GPSGPLRFамид (SEQ ID NO: 103), PDVDHVFLRFамид (SEQ ID NO: 150) и пиро-EDVDHVFLRFамид (SEQ ID NO: 167).
Можно использовать другие анализы для исследования ферментативной активности, включая, без ограничения, фотометрические, радиометрические анализы, ВЭЖХ, электрохимические анализы и тому подобные, которые описаны, например, в Enzyme Assays: A Practical Approach, eds. R. Eisenthal and M. J. Danson, 1992, Oxford University Press, публикация включена в данное описание в виде ссылки в полном объеме.
Применение кДНК, кодирующих GPCR, в анализах активности хорошо известно; анализы, способные тестировать тысячи неизвестных соединений в день в высокопроизводительных скринингах (HTS), всесторонне документированы. Литература насыщена примерами использования радиоактивно меченных лигандов в HTS-анализах связывания для обнаружения лекарственных средств (см. Williams, Medicinal Research Reviews, 1991, 11, 147-184; Sweetnam, et al., J. Natural Products, 1993, 56, 441-455 для обзора). Рекомбинантные рецепторы являются предпочтительными для анализа связывания в HTS, так как они обеспечивают лучшую специфичность (более высокая относительная чистота), дают возможность создавать большие количества вещества рецептора и могут быть использованы в широком множестве форм (см. Hodgson, Bio/Technology, 1992, 10, 973-980, включенная в данное описание в виде ссылки в полном объеме).
Множество гетерологичных систем доступно для функциональной экспрессии рекомбинантных рецепторов, которые хорошо известны специалистам в данной области. Такие системы включают бактерии (Strosberg, et al., Trends in Pharmacological Sciences, 1992, 13, 95-98), дрожжи (Pausch, Trends in Biotechnology, 1997, 15, 487-494), несколько видов клеток насекомых (Vanden Broeck, Int. Rev. Cytology, 1996, 164, 189-268), клетки амфибий (Jayawickreme et al., Curr. Opin. Biotechnol., 1997, 8, 629-634) и несколько линий клеток млекопитающих (CHO, HEK293, COS и т.д.; см. Gerhardt, et al., Eur. J. Pharmacology, 1997, 334, 1-23). Указанные примеры не исключают использование других возможных клеточных систем экспрессии, включая линии клеток, полученные от нематод (заявка PCT WO 98/37177).
В некоторых вариантах осуществления изобретения способы скрининга соединений, которые модулируют активность DmGPCR, включают в себя контактирование тестируемых соединений с DmGPCR и анализ наличия комплекса между соединением и DmGPCR. В таких анализах лиганд обычно метят. После соответствующей инкубации лиганд отделяют от лиганда, присутствующего в связанной форме, и количество свободной или не входящей в комплекс метки является мерой способности конкретного соединения связываться с DmGPCR.
Хорошо известно, что активация гетерологичных рецепторов, экспрессированных в рекомбинантных системах, приводит к ряду биологических ответов, которые опосредуются G-белками, экспрессируемыми в клетках-хозяевах. Если GPCR занят агонистом, то это приводит к замене связанного GDP на GTP в сайте связывания на субъединице Gα; можно использовать радиоактивное негидролизуемое производное GTP, [35S]GTPγS, чтобы измерить связывание агониста с рецептором (Sim et al., Neuroreport, 1996, 7, 729-733). Также можно использовать данное связывание для измерения способности антагонистов связываться с рецептором, уменьшая связывание [35S]GTPγS в присутствии известного агониста. Поэтому можно конструировать HTS-анализ на основе связывания [35S]GTPγS.
G-белки, необходимые для функциональной экспрессии гетерологичных GPCR, могут быть нативными компонентами клетки-хозяина или могут быть введены посредством хорошо известной методики получения рекомбинантов. G-белки могут быть интактными или химерными. Часто используют почти универсально подходящий G-белок (например, Gα16), чтобы связать любой данный рецептор с регистрируемым путем ответа. Активация G-белка приводит к стимуляции или ингибированию других нативных белков, событиям, которые могут быть связаны с измеряемым ответом.
Примеры таких биологических ответов включают, без ограничения, следующие ответы: способность выживать в отсутствие ограничивающего питательного вещества у специально сконструированных дрожжевых клеток (Pausch, Trends in Biotechnology, 1997, 15, 487-494); изменения внутриклеточной концентрации Ca2+, которую измеряют с использованием флуоресцирующих красителей (Murphy, et al., Curr. Opin. Drug Disc. Dev., 1998, 1, 192-199). Изменения флуоресценции также можно использовать для того, чтобы контролировать индуцированные лигандом изменения мембранного потенциала или внутриклеточного pH; для данных целей описана автоматизированная система, подходящая для HTS (Schroeder, et al., J. Biomolecular Screening, 1996, 1, 75-80). Меланофоры, полученные из Xenopus laevis, демонстрируют зависимое от лиганда изменение организации пигмента в ответ на активацию гетерологичного GPCR; данный ответ можно адаптировать для HTS-форматов (Jayawickreme, et al., Curr. Opin. Biotechnol., 1997, 8, 629-634). Также имеются анализы для измерения обычных вторичных мессенджеров, включая цАМФ, фосфоинозитиды и арахидоновую кислоту.
Способы HTS, в которых используются данные рецепторы, включают постоянно трансфицированные клетки CHO, в которых можно идентифицировать агонисты и антагонисты по способности специфично изменять связывание [35S]GTPγS в мембранах, полученных из данных клеток. В другом варианте осуществления изобретения постоянно трансфицированные клетки CHO можно использовать для получения мембран, которые содержат значительные количества рекомбинантных белков рецептора; затем указанные мембранные препараты могут быть использованы в анализах связывания с рецептором с применением радиоактивно меченного лиганда, специфичного по отношению к конкретному рецептору. Альтернативно для HTS может быть применим функциональный анализ, такой как флуоресцентный мониторинг индуцированных лигандов изменений внутренней концентрации Ca2+или мембранного потенциала в постоянно трансфицированных клетках CHO, содержащих какой-либо из данных рецепторов отдельно или в комбинации. В равной мере в сходных форматах применимым может быть альтернативный тип клетки млекопитающего, такой как клетки HEK293 или COS. Постоянно трансфицированные линии клеток насекомых, такие как клетки S2 Drosophila, и рекомбинантные дрожжевые клетки, экспрессирующие рецепторы Drosophila melanogaster в HTS-форматах, хорошо известные специалистам в данной области (например, Pausch, Trends in Biotechnology, 1997, 15, 487-494), также могут быть применимы в изобретении.
В объем изобретения входит множество анализов для скрининга и идентификации ингибиторов лиганда, связывающегося с рецепторами DmGPCR. В одном примере рецептор DmGPCR иммобилизуют и оценивают взаимодействие со связывающим партнером в присутствии и отсутствие кандидата в модуляторы, такого как соединение ингибитора. В другом примере взаимодействие между рецептором DmGPCR и его связывающим партнером оценивают в анализе, проводимом в растворе, как в присутствии, так и в отсутствие соединения-кандидата в ингибиторы. В любом анализе ингибитор идентифицируют как соединение, которое снижает связывание между рецептором DmGPCR и его связывающим партнером. Другой предполагаемый анализ включает в себя вариант дигибридного анализа, в котором ингибитор белок-белковых взаимодействий идентифицируют, регистрируя позитивный сигнал в трансформированной или трансфицированной клетке-хозяине, как описано в публикации PCT №WO 95/20652, опубликованной 3 августа 1995 г.
Кандидаты в модуляторы, рассматриваемые в данном изобретении, включают соединения, выбранные из библиотек потенциальных активаторов или потенциальных ингибиторов. Существует ряд различных библиотек, используемых для идентификации модуляторов, являющихся малыми молекулами, включая: (1) химические библиотеки, (2) библиотеки природных продуктов и (3) комбинаторные библиотеки, содержащие случайные пептиды, олигонуклеотиды или органические молекулы. Химические библиотеки состоят из случайных химических структур, некоторые из которых являются аналогами известных соединений или аналогами соединений, которые были идентифицированы как «хиты» или «лидеры» в других скринингах для обнаружения лекарственных средств, некоторые из которых получены из природных продуктов, а некоторые из которых являются результатом непрямого органического химического синтеза. Библиотеки природных продуктов представляют собой коллекции микроорганизмов, животных, растений или морских организмов, которые используются для создания смесей для скрининга посредством: (1) ферментации и экстракции бульонов почвенных, растительных или морских микроорганизмов или (2) экстракции растений или морских организмов. Библиотеки природных продуктов включают поликетиды, нерибосомные пептиды и их варианты (не встречающиеся в природе). Для обзора см. Science, 1998, 282, 63-68. Комбинаторные библиотеки состоят из большого количества пептидов, олигонуклеотидов или органических соединений в виде смеси. Указанные библиотеки относительно легко получить традиционными автоматизированными способами синтеза, ПЦР, клонирования или запатентованными способами синтеза. Особый интерес представляют непептидные комбинаторные библиотеки. Другие представляющие интерес библиотеки включают библиотеки пептидов, белков, пептидомиметиков, многопараллельные синтетические коллекции, перекомбинированные библиотеки и библиотеки полипептидов. Для обзора комбинаторной химии и созданных на ее основе библиотек см. Myers, Curr. Opin. Biotechnol., 1997, 8, 701-707. Идентификация модуляторов посредством применения различных библиотек, указанных в данном описании, позволяет модифицировать кандидат-«хит» (или «лидер») для оптимизации способности «хита» модулировать активность.
Могут быть сконструированы еще и другие кандидаты в ингибиторы, рассматриваемые в изобретении, и они включают растворимые формы связывающих партнеров, а также такие связывающие партнеры как химерные или слитые белки. «Связывающий партнер» в используемом в данном описании смысле охватывает широкий круг непептидных модуляторов, а также такие пептидные модуляторы, как нейропептиды, отличные от природных лигандов, антитела, фрагменты антител и модифицированные соединения, содержащие домены антител, которые являются иммуноспецифичными в отношении продукта экспрессии идентифицированного гена DmGPCR.
В других вариантах осуществления изобретения полипептиды согласно изобретению используют в качестве средства исследования для идентификации, характеристики и очистки взаимодействующих регуляторных белков. Подходящие метки включают в полипептиды согласно изобретению различными способами, известными в данной области, и полипептиды используют для захвата взаимодействующих молекул. Например, молекулы инкубируют с мечеными полипептидами, промывают, чтобы удалить несвязанные полипептиды, и определяют количество полипептидного комплекса. Данные, полученные с использованием различных концентраций полипептида, используют для расчета значений количества, аффинности и ассоциации полипептида с белковым комплексом.
Меченые полипептиды также используют в качестве реагентов для очистки молекул, с которыми полипептид взаимодействует, включая, но не ограничивая указанным, ингибиторы. В одном варианте осуществления аффинной очистки полипептид ковалентно связывают с хроматографической колонкой. Экстрагируют клетки и их мембраны и различные клеточные субкомпоненты пропускают через колонку. Молекулы связываются с колонкой в силу своей аффинности к полипептиду. Комплекс с полипептидом извлекают из колонки, диссоциируют и извлеченную молекулу подвергают секвенированию белка. Затем данную аминокислотную последовательность используют для идентификации захваченной молекулы или для разработки вырожденных олигонуклеотидов для клонирования соответствующего гена из соответствующей библиотеки кДНК.
Альтернативно, могут быть идентифицированы соединения, которые проявляют сходные свойства с лигандом для DmGPCR согласно изобретению, но которые меньше по размеру и имеют более длительное время полужизни, чем эндогенный лиганд в организме человека или животного. В том случае, когда конструируют органическое соединение, молекулу согласно изобретению используют в качестве соединения-«лидера». Разработка миметиков до известных фармацевтически активных соединений является хорошо известным способом разработки фармацевтических препаратов на основе соединений-«лидеров». Разработку, синтез и тестирование миметиков обычно используют для того, чтобы избежать скрининга по принципу случайности большого количества молекул в отношении целевого свойства. Кроме того, структурные данные, получаемые на основе анализа рассчитанных аминокислотных последовательностей, кодируемых ДНК согласно данному изобретению, применимы для разработки новых лекарственных средств, которые являются более специфичными и поэтому обладают более высокой фармакологической эффективностью.
Сравнение последовательностей белков согласно данному изобретению с последовательностями, присутствующими во всех доступных базах данных, показало значительную гомологию с трансмембранной частью сопряженных с G-белком рецепторов. Следовательно, можно использовать компьютерное моделирование, чтобы сконструировать предполагаемую третичную структуру белков согласно изобретению на основе имеющейся информации о трансмембранном домене других белков. Таким образом можно разработать новые лиганды на основе предсказанной структуры DmGPCR.
В конкретном варианте осуществления изобретения новые молекулы, идентифицированные способами скрининга согласно изобретению, являются низкомолекулярными органическими молекулами, и в данном случае может быть приготовлена их композиция или фармацевтическая композиция для перорального приема, такая как таблетки. Композиции или фармацевтические композиции, содержащие молекулы нуклеиновых кислот, векторы, полипептиды, антитела и соединения, идентифицированные способами скрининга, приведенными в данном описании, могут быть приготовлены для любого пути введения, включая без ограничения пероральный, внутривенный, кожный, подкожный, назальный, внутримышечный или внутрибрюшинный. Природа носителя или других ингредиентов будет зависеть от конкретного пути введения и конкретного варианта осуществления изобретения, необходимого для введения. Примеры способов и протоколов, которые применимы в данном контексте наряду с прочим, имеются в Remington's Pharmaceutical Sciences, Osol, A (ed.), 1980, включенном в данное описании в виде ссылки в полном объеме.
Доза указанных соединений с низкой молекулярной массой будет зависеть от статуса или состояния болезни, подвергаемой лечению, и других клинических факторов, таких как масса и состояние субъекта, подвергаемого лечению, и путь введения соединения. В случае лечения животных соединение можно вводить примерно от 0,5 мг/кг массы тела до 500 мг/кг массы тела. Терапию обычно проводят при более низких дозах и продолжают вплоть до наблюдения требуемого терапевтического результата.
Способы определения доз соединений, вводимых субъекту, и способы введения соединений в организм раскрыты в заявке на выдачу патента США с регистрационным №08/702282, поданной 23 августа 1996, и в международной публикации патента №WO 96/22976, опубликованной 1 августа 1996, которые обе включены в данное описание в виде ссылки в полном объеме, включая любые чертежи, фигуры или таблицы. Специалистам в данной области будет понятно, что такие описания применимы к данному изобретению и могут быть легко адаптированы для него.
Точная доза зависит от различных факторов, таких как тип заболевания, подвергаемого лечению, конкретная используемая композиция и размер и физиологическое состояние субъекта. Терапевтически эффективные дозы для приведенных в данном описании соединений можно оценить сначала на культуре клеток и в моделях на животных. Например, в моделях на животных может быть приготовлена доза для достижения пределов циркулирующих концентраций, при расчете которой вначале во внимание принимается IC50, определенная в анализах на культуре клеток.
Также можно определить время полужизни в плазме и биораспределение лекарственного средства и метаболитов в плазме, опухолях и основных органах, чтобы облегчить подбор лекарственных средств, наиболее подходящих для подавления расстройства. Такие измерения можно провести. Например, можно осуществить ВЭЖХ-анализ плазмы животных, которых лечили лекарственным средством, и можно определить положение радиоактивно меченных соединений, используя такие способы регистрации, как рентгеновский анализ, компьютерная томография и магнитно-резонансная томография. Соединения, которые проявляют сильную ингибирующую активность в скрининговых анализах, но имеют плохие фармакокинетические характеристики, можно оптимизировать посредством изменения химической структуры и повторного тестирования. В этом отношении соединения, проявляющие хорошие фармакокинетические характеристики, можно использовать в качестве модели.
Исследования токсичности также можно осуществить, измеряя состав клеток крови. Например, исследования токсичности можно проводить в подходящей модели на животном следующим образом: 1) соединение вводят мышам (необходимо также использовать необработанных контрольных мышей); 2) образцы крови получают периодически из хвостовой вены от одной мыши в каждой группе обработки; и 3) образцы анализируют в отношении количества красных и белых кровяных клеток, состава клеток крови и процента лимфоцитов по сравнению с полиморфно-ядерными клетками. Сравнение результатов для каждой схемы дозирования с контролями показывает, имеется ли токсичность.
В конце каждого исследования токсичности могут быть проведены дальнейшие исследования путем забивания животных (предпочтительно в соответствии с руководством Медицинской ассоциации американских ветеринаров, Report of the American Veterinary Medical Assoc. Panel on Euthanasia, J. Amer. Vet. Med. Assoc., 1993, 202, 229-249). Представителей животных из каждой группы обработки затем можно исследовать при полном вскрытии для прямого доказательства метастазов, необычного заболевания или токсичности. Отмечают крупные аномалии в ткани и ткани исследуют гистологически.
Данные соединения и способы, включая молекулы нуклеиновых кислот, полипептиды, антитела, соединения, идентифицированные способами скрининга, приведенными в данном описании, имеют множество фармацевтических и сельскохозяйственных (например, в качестве инсектицидов) применений и могут быть использованы, например, для лечения или профилактики состояний, вызванных эктопаразитами, или для контроля популяции насекомых.
Данное изобретение также охватывает способы агонистического (стимулирующего) или антагонистического воздействия на активность, связанную с природным связывающим партнером DmGPCR, у субъекта, включающие в себя введение указанному субъекту агониста или антагониста одного из описанных выше полипептидов в количестве, достаточном для получения указанного агонизма или антагонизма. В таком случае одним из вариантов осуществления указанного изобретения является способ лечения заболеваний или состояний у субъекта, вызванных эктопаразитом, с использованием агониста или антагониста белка согласно данному изобретению, включающий в себя введение агониста или антагониста субъекту в количестве, достаточном для агонистического или антагонистического воздействия на функции эктопаразита, связанные с DmGPCR.
Следующая таблица 4 содержит последовательности полинуклеотидов и полипептидов согласно изобретению.
В соответствии с Будапештским договором клоны согласно данному изобретению депонированы в коллекции культур для сельскохозяйственных исследований (NRRL), Международный депозитарный орган, 1815 N. University Street, Peoria, Illinois 61604, U.S.A. Номера доступа и даты депозитов приведены ниже в таблице 5.
Изобретение далее иллюстрируется посредством следующих примеров, которые предназначены для разъяснения изобретения. Указанные примеры не предназначены и не должны рассматриваться как ограничивающие объем изобретения. Будет понятно, что изобретение может быть осуществлено на практике иначе, чем конкретно описано в данной публикации. Возможны многочисленные модификации и варианты данного изобретения, принимая во внимание приведенные в данном описании инструкции, и, следовательно, они входят в объем изобретения.
Подразумевается, что каждый из патентов, заявок и печатных публикаций, указанных в данном патентном документе, тем самым включен в виде ссылки в полном объеме.
ПРИМЕРЫ
Пример 1: Идентификация DmGPCR
Базу данных генома D. melanogaster Celera преобразовывали в базу данных рассчитанных белков и базу данных мРНК, используя ряд компьютерных способов обнаружения генов, чтобы предсказать мРНК, которые могут быть образованы (база данных «PnuFlyPep»). Способы анализа геномных баз данных с использованием компьютерных средств обнаружения генов известны специалистам в данной области.
Нуклеотидные последовательности нескольких GPCR FaRP C. elegans использовали в качестве запрашиваемых последовательностей в базе данных мРНК, описанной выше. В указанной базе данных искали области сходства, используя ряд способов, включая FASTA и BLAST с созданием пробелов (Altschul et al., Nuc. Acids Res., 1997, 25, 3389, публикация включена в данное описание в виде ссылки в полном объеме).
Коротко, алгоритм BLAST, что означает основная программа поиска локального выравнивания, подходит для определения сходства последовательностей (Altschul et al., J. Mol. Biol., 1990, 215, 403-410, публикация включена в данное описание в виде ссылки в полном объеме). Компьютерная программа для осуществления BLAST-анализа имеется в широком доступе из National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/). Данный алгоритм заключается сначала в идентификации пар последовательностей с высоким количеством баллов (HSP) посредством идентификации коротких слов длиной W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому позитивно оцениваемому пороговому количеству баллов T при выравнивании со словом такой же длины в последовательности базы данных. T означает порог количества баллов для слов в окрестности (Altschul et al., выше). Указанные исходные совпадения слов в окрестности действуют как затравки для начала поисков, чтобы найти содержащие их HSP. Совпадения слов расширяют в обоих направлениях вдоль каждой последовательности до тех пор, пока совокупное количество баллов выравнивания может быть увеличено. Расширение для совпадения слов в каждом направлении прекращают, когда: 1) совокупное количество баллов выравнивания уменьшается на количество X от своего максимального достигнутого значения; 2) совокупное количество баллов снижается до нуля или ниже вследствие накопления одного или нескольких отрицательно оцениваемых выравниваний остатков; или 3) достигается конец какой-либо последовательности. Параметры алгоритма Blast W, T и X определяют чувствительность и скорость выравнивания. В программе Blast используются по умолчанию длина слов (W), равная 11, матрица подсчета баллов BLOSUM62 (см. Henikoff et al., Proc. Natl. Acad. Sci. USA, 1992, 89, 10915-10919, публикация включена в данное описание в виде ссылки в полном объеме), выравнивания (B) - 50, ожидание (E) - 10, M=5, N=4 и сравнение обеих нитей.
Алгоритм BLAST (Karlin et al., Proc. Natl. Acad. Sci. USA, 1993, 90, 5873-5787, публикация включена в данное описание в виде ссылки в полном объеме) и BLAST с созданием пробелов осуществляют статистический анализ сходства между двумя последовательностями. Одной из мер сходства, обеспечиваемых алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), которая служит показателем вероятности, с которой случайно может происходить совпадение между двумя нуклеотидными или аминокислотными последовательностями. Например, нуклеиновая кислота считается сходной с геном или кДНК DmGPCR, если наименьшая суммарная вероятность при сравнении тестируемой нуклеиновой кислоты с нуклеиновой кислотой DmGPCR составляет примерно менее 1, предпочтительно примерно менее 0,1, более предпочтительно примерно менее 0,01 и наиболее предпочтительно примерно менее 0,001.
мРНК, соответствующие рассчитанным белкам, были найдены в базе данных рассчитанных мРНК, используемой для получения базы данных PnuFlyPep. Указанные мРНК идентифицированы в виде следующих нуклеотидных последовательностей: SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 и 23, каждая из которых обладает статистически значимой перекрывающейся гомологией с запрашиваемой последовательностью. Нуклеотидные последовательности SEQ ID NO: 3, 5, 9, 11, 13 и 15 (соответствующие DmGPCR 2a, 2b, 5a, 5b, 6a и 6b) получали на основе ПЦР-клонирования и секвенирования другой идентифицированной последовательности (не показано). Каждая из указанных последовательностей представляет собой вариант сплайсинга гена DmGPCR.
Пример 2: Клонирование DmGPCR
Получение кДНК
кДНК получали либо из поли A+-РНК взрослых особей Drosophila melanogaster (Clontech Laboratories, Palo Alto, CA), либо суммарной РНК взрослых особей Drosophila melanogaster (ниже). Чтобы получить суммарную РНК, родительские линии Drosophila melanogaster (Biological Supply Company, Burlington, NC) анестезировали охлаждением и 5-6 взрослых особей добавляли в культуральный сосуд, содержащий 10 мл H2O, 10 мл готовой среды для Drosophila состава 4-24 и 6-10 гранул активных сухих дрожжей (Biological Supply Company). На конце каждого сосуда помещали пенополиуретановую пробку и мух инкубировали при комнатной температуре (КТ) в течение от 4 до 6 недель. В нужное время сосуды охлаждали и анестезированных мух переносили в полипропиленовую пробирку объемом 50 мл, которую держали в жидком N2. Замороженных мух хранили при -70°C до их размельчения с помощью ступки и пестика в присутствии жидкого N2. Размолотую в порошок ткань вместе некоторым количеством жидкого N2 сливали в полипропиленовые пробирки объемом 50 мл на сухом льду. После испарения жидкого N2 порошкообразную ткань хранили при -70°C.
Чтобы получить РНК 300 мг порошкообразной ткани помещали в полипропиленовые пробирки на сухом льду и добавляли 5 мл 6 М гидрохлорида гуанидина в 0,1 М NaOAc, pH 5,2. Все растворы либо обрабатывали DEPC, либо готовили с dH2O, обработанной DEPC, и всю стеклянную посуду прокаливали или использовали новое пластмассовое лабораторное оборудование, чтобы уменьшить проблемы, связанные с загрязнением РНКазой. Пробирки встряхивали, затем помещали на лед. Порошкообразную ткань гомогенизировали последовательным пропусканием через иглы калибра 20, 21 и 22. Пробирки центрифугировали (1000×g в течение 10 мин), затем 2,5-3 мл надосадка наносили сверху 8 мл 5,7 М хлорида цезия в 0,1 М NaOAc, находящегося в центрифужных пробирках Ultra-Clear 14×95 мм (Beckman Instruments, Inc., Palo Alto, CA). Образцы центрифугировали при 25000 об/мин в течение 18 ч при 18°C в ультрацентрифуге L8-70 (Beckman Instruments, Inc.). Надосадок сливали и пробирку переворачивали и давали возможность высохнуть. Осадок РНК суспендировали в 200 мкл не содержащей РНКазы dH2O (Qiagen Inc., Valencia, CA), затем дважды промывали 100 мкл не содержащей РНКазы dH2O (всего 400 мкл). РНК осаждали добавлением 44 мкл 3 М NaOAc, pH 5,2, и 1 мл 100% этанола. После хранения в течение ночи при -70°C пробирку центрифугировали при 14000 об/мин в течение 1 ч (микроцентрифуга Eppendorf 5402), промывали 75% этанолом (приготовленным с dH2O, обработанной DEPC), затем осадок растворяли в не содержащей РНКазы dH2O. Оптические плотности при 260 или 280 нм, определенные в 10 мМ трис-HCl, pH 7,5%, использовали для оценки концентрации и чистоты РНК.
Первую нить кДНК получали согласно способу, предлагаемому для фермента Superscript II (GIBCO BRL, Rockville, MD). Либо 500 нг (2 мкл) поли A+-РНК, либо 3 мкг (4 мкл) суммарной РНК добавляли в микроцентрифужные пробирки, содержащие dH2O без РНКазы и 250 нг (2,5 мкл) случайных праймеров. Пробирки (12 мкл) инкубировали при 70°C в течение 10 мин, охлаждали на льду, затем добавляли 4 мкл 5×буфера для первой нити, 2 мкл 0,1 М DTT и 1 мкл 10 мМ смеси dNTP. После инкубации при 25°C в течение 10 мин, затем при 42°C в течение 2 мин добавляли 1 мкл (200 единиц) Superscript II и инкубацию продолжали при 42°C в течение 50 мин. Фермент инактивировали инкубацией при 70°C в течение 15 мин. Чтобы удалить РНК, комплементарную кДНК, добавляли 2 мкл (2 единицы) РНКазы H (Boehringer Mannheim, Indianapolis, IN) с последующей инкубацией при 37°C в течение 20 мин. кДНК хранили при -20°C.
Реакции ПЦР
Либо стандартную реакцию ПЦР 50/100 мкл, либо реакцию ПЦР с горячим стартом с использованием шариков Ampliwax (Perkin Elmer Cetus, Norwalk, CT) применяли для амплификации сопряженных с G-белком рецепторов Drosophila melanogaster (DmGPCR). Использовали дистиллированную H2O для растворения праймеров (Genosys Biotechnologies, Inc., The Woodlands, TX): 5'- и 3'-праймеры в концентрации 10 мкМ, внутренние праймеры в концентрации 1 мкМ. Каждая реакционная смесь для ПЦР содержала 2-4 единицы ДНК-полимеразы rTth XL, 1,2-1,5 мМ Mg(OAc)2, 200 мкМ каждого dNTP и 200 или 400 нМ каждого праймера. Для ПЦР с горячим стартом 32 или 36 мкл «нижней смеси» (dH2O, 3,3×XL-буфер, dNTP и Mg(OAc)2) добавляли к 2 или 4 мкл каждого праймера (общий объем 40 мкл). Добавляли шарик Ampliwax (Perkin Elmer Cetus), пробирки инкубировали при 75°C в течение 5 мин, охлаждали при комнатной температуре (КТ), затем добавляли 60 мкл «верхней» смеси (dH2O, 3,3×XL-буфер, rTth и матрица). ПЦР-амплификации осуществляли в термоциклере Perkin Elmer серии 9600. Обычная программа для термоциклера включала в себя: 1 мин при 94°C с последующими 30 циклами амплификации (0,5 мин при 94°C, 0,5 мин при 60°C, 2 мин при 72°С), затем 6 мин при 60°C. Чтобы создать 3'-A-выступающие концы на ПЦР-продукте («хвосты») 1 мкл полимеразы Taq (Invitrogen, Carlsbad, CA) добавляли в конце ПЦР-амплификации и пробирки инкубировали при 72°C в течение 10 мин. Реакционные смеси анализировали в 1% агарозном геле, приготовленном в буфере TAE (5). ПЦР-продукты обычно очищали с использованием центрифужных колонок QIAquick (QIAGEN).
Лигирование и трансформация
Лигирование всех ПЦР-продуктов в вектор PCR 3.1 (Invitrogen) и трансформацию лигированных продуктов в компетентные клетки One ShotTM TOP10F' (Invitrogen) осуществляли согласно инструкциям производителя. Трансформанты, подлежащие скринингу в отношении вставок, размножали в бульоне LB, содержащем 50 мкг ампициллина/мл. Колонии со вставками идентифицировали либо используя способ mini-prep выделения плазмид лизисом с помощью кипячения (5), либо способом «ПЦР колоний», в котором непосредственно амплифицировали плазмидную ДНК из трансформированных бактерий (6).
Секвенирование ДНК
ДНК для секвенирования получали, используя наборы для выделения плазмид анионообменной хроматографией Qiagen (QIAGEN-tip 20), выделяя ДНК из 5 мл LB-культур, выращенных при 37°C в течение ночи согласно инструкциям производителя. Для секвенирования каждой ДНК обычно использовали четыре праймера (T7, обратный M13, «смысловой» и «антисмысловой») (таблица 6). Использовали химическое секвенирование с меченными красителем терминаторами, либо реагентами-терминаторами BigDyeTM (Applied Biosystems, Foster City, CA), либо набором терминаторов DYEnamicTM ET (Amersham Pharmacia Biotech, Inc., Piscataway, NJ). Для подготовки реакций секвенирования следовали рекомендациям производителя. Праймеры и невключенные нуклеотиды удаляли, используя центрифужные колонки Centri-Sep (Princeton Separations, Adelphia, NJ). Реакции секвенирования анализировали на автоматизированном секвенаторе ДНК Applied Biosystems 377. Последовательности ДНК компоновали и анализировали, используя Sequencher (Gene Codes, Ann Arbor, MI), программы для анализа последовательностей группы GCG (Wisconsin Package, версия 10.1, Genetics Computer Group (GCG), Madison, WI) и функции, доступные при помощи набора программ Vector NTI 5.5 (Informax, Bethesda, MD).
Получены следующие результаты клонирования и секвенирования DmGPCR согласно данному изобретению:
DmGPCR1
ПЦР-праймеры, сконструированные к кДНК, соответствующей PnuFlyPep34651, использовали для успешной амплификации продукта ПЦР из препарата кДНК, полученного на основе поли A+-мРНК Drosophila. Полученный в результате продукт клонировали и секвенировали. Экспериментально полученная последовательность была идентична предсказанной последовательности. Получили интактный клон и назвали «DmGPCR1».
DmGPCR2
Исходные попытки амплифицировать продукт ПЦР с использованием праймеров, сконструированных к кДНК, соответствующей PnuFlyPep67585, были безуспешными. Выравнивание рассчитанной последовательности с существующими рецепторами C. elegans и с другими рецепторами нейропептидов показало, что 5'-конец рассчитанной последовательности является необычно длинным, и свидетельствовало о том, что с этой стороны могла быть ошибка при расчете гена. Используя геномную последовательность в качестве направляющей, сконструировали и тестировали ряд альтернативных 5'-праймеров ПЦР. Одна из таких комбинаций праймеров с использованием кДНК, полученной на основе суммарной РНК, была удачной для получения продукта правильного размера. Секвенирование клонов, полученных исходя из ПЦР-реакции, показало, что амплифицированный продукт содержал ожидаемые 5'- и 3'-концы и был идентичен рассчитанной последовательности за исключением того, что в рассчитанной последовательности отсутствовал небольшой участок из 6 аминокислот. Сравнение клонов также выявило, что присутствовали две изоформы сплайсинга, одна сходная с рассчитанной последовательностью (названная «DmGPCR2a»), а другая с отсутствующим участком из 23 аминокислот, расположенным сразу после TM VII на внутриклеточном C-конце молекулы (названная «DmGPCR2b»).
DmGPCR3
Ген, соответствующий рассчитанному белку DmGPCR3, уже описан в литературе. Данный ген (GenBank, доступ M77168) описан как NKD, «регулируемый при развитии рецептор тахикинина», Monnier D, et al., J Biol. Chem. 1992, 267 (2), 1298-302. Сравнение последовательностей M77168 и PnuFlyPep68505 показало, что рассчитанные последовательности значительно отличаются от кДНК. кДНК имела более длинный 5'-конец и не имела экзона, кодирующего 51 аминокислоту, и была значительно короче на 3'-конце. Сконструировали праймеры ПЦР к опубликованной последовательности и получили ПЦР-продукт, используя кДНК, полученную на основе суммарной РНК. Данный продукт был идентичен по структуре сообщенной последовательности NKD.
DmGPCR4
кДНК, соответствующую PnuFlyPep 67393, использовали для конструирования праймеров ПЦР для амплификации DmGPCR4. Используя библиотеку кДНК, полученную на основе мРНК Drosophila, получили и клонировании продукт ПЦР. Сравнение клонов с последовательностью, рассчитанной в PnuFlyPep, показало, что последовательности идентичны, за исключением того, что один экзон, рассчитанный в HMMGene не присутствовал ни в одном из клонированных ПЦР-продуктов. DmGPCR4 недавно клонирован Lenz et al., Biochem. Biophys. Res. Comm., 2000, 273, 571-577 и классифицирован как второй предполагаемый рецептор аллатостатина.
DmGPCR5
DmGPCR5 (FlyPepCG7887) неправильно содержит мутацию сдвига рамки. Вариант PnuFlyPep, PnuFlyPep67522, который описан в литературе как «рецептор Drosophila для родственных тахикинину пептидов» (M77168) (Li XJ, et al., EMBO Journal, 1991, 10 (11), 3221-3229) устраняет данную ошибку, но неправильно предсказывает некоторые внутренние последовательности и C-конец. На первый взгляд, рассчитанная кДНК, соответствующая белку PnuFlyPep, была идентична опубликованной последовательности. Праймеры ПЦР использовали для успешной амплификации ПЦР-продукта соответствующего размера из смеси кДНК, полученной на основе поли A+-мРНК Drosophila melanogaster. Секвенирование клонированных продуктов ПЦР показало, что хотя картина сплайсинга в целом была такой же, в последовательности PnuFlyPep присутствовали две ошибки секвенирования. Результатом указанных ошибок была мутация сдвига рамки, за которой следовала компенсирующая мутация сдвига рамки, что приводило к различию в 13 аминокислотах между экспериментально определенной и опубликованной последовательностями, начиная с положения аминокислоты 46. Данный клонированный ген назван «DmGPCR5a».
Кроме того, обнаружена изоформа сплайсинга для DmGPCR5. Данный вариант кодировал дополнительные три аминокислоты в N-концевом внеклеточном домене. Указанный вариант назван «DmGPCR5b».
DmGPCR6
GPCR, соответствующий PnuFlyPep 15731, уже описан в литературе как «рецептор нейропептида Y» (M81490. Li XJ, et al., J. Biol. Chem., 1992, 267 (1), 9-12). Рассчитанная в PnuFlyPep последовательность отличалась от M81490 на обоих концах молекулы. PnuFlyPep15731 содержала дополнительные 15 аминокислот на N-конце по сравнению с M81490. 3'-конец PnuFlyPep 15731 также отличался от M81490, будучи укороченным и не содержащим консервативных остатков TM VI и TM VII.
Исходные праймеры ПЦР конструировали с использованием последовательности M81490. Используя указанные праймеры и матрицу, полученную на основе суммарной мРНК, получили ПЦР-продукт. Исследование клонированного ПЦР-продукта выявило, что в нем использована форма процессинга, идентичная M81490. Данный клон назван «DmGPCR6a».
Во время клонирования DmGPCR6a обнаружена дополнительная изоформа сплайсинга. Данная изоформа образовывалась при использовании альтернативного акцепторного сайта сплайсинга с образованием альтернативного 3'-конца молекулы и с использованием почти такой же последовательности, как и в изоформе «6a», но в другой рамке считывания. Кроме того, открытая рамка считывания для данного клона простирается после начального 3'-праймера ПЦР. Исследование геномной последовательности на 3'-конце выявило ряд вероятных вариантов экзонов. Тестировали праймеры ПЦР, соответствующие ряду указанных возможных экзонов, до тех пор, пока не обнаружили, что один может амплифицировать ПЦР-продукт. Данный продукт назвали «6b». При исследовании геномной последовательности также рассчитано, что инициирующий ATG, рассчитанный на основе PnuFlyPep15731, был в рамке с инициирующим кодоном M81490, содержащим дополнительные 15 аминокислот, и что вероятно, что стартовый кодон PnuFlyPep15731 представлял собой подлинный стартовый кодон. Сконструировали новый 5'-праймер ПЦР, который включал в себя стартовый кодон PnuFlyPep15731, и использовали вместе с двумя 3'-праймерами ПЦР, чтобы амплифицировать и клонировать «DmGPCR6aL» и «DmGPCR6bL» («длинный»).
DmGPCR7
Исходные попытки амплифицировать продукт гена DmGPCR7 были безуспешными. Выравнивание рассчитанной последовательности (PnuFlyPep67863) с другими GPCR свидетельствовало о том, что возможно была ошибка в расчете 3'-конца молекулы. Рассчитанная последовательность имела 3'-конец, который был длиннее, чем конец большинства других GPCR. Исследование геномных последовательностей свидетельствовало о том, что вероятно была ошибка в расчете события сплайсинга, при котором удаляется стоп-кодон в рамке, результатом которого могла бы быть молекула соответствующего размера. Сконструирован 3'-праймер ПЦР в пределах данного интрона. Кроме того, сконструирован новый 5'-праймер ПЦР, чтобы использовать ATG в рамке, расположенный непосредственно выше рассчитанного стартового кодона. ПЦР-амлификация кДНК, полученной на основе суммарной мРНК давала продукт ожидаемого размера.
В обоих вариантах DmGPCR7, PnuFlyPep и WO 01/70980, отсутствуют две аминокислоты на N-конце. Как указано ранее, варианты PnuFlyPep и FlyPep CG10626 также неверны на C-конце. Неверные варианты продукта гена DmGPCR7 рассчитывались как предполагаемые рецепторы лейкокинина Drosophila (например, Hewes and Taghert, Genome Res., 2001, 11, 1126-1142; Holmes et al., Insect Mol. Biol., 2000, 9, 457-465); однако до настоящего изобретения данное предположение не было подтверждено ни одним экспериментальным доказательством.
DmGPCR8
DmGPCR8 успешно амплифицировали, используя праймеры ПЦР, сконструированные к рассчитанной последовательности PnuFlyPep. кДНК, полученную на основе поли A+-РНК, использовали в качестве матрицы для реакции ПЦР. Все шесть секвенированных клонов были идентичны по структуре с последовательностью, рассчитанной в PnuFlyPep. Отмечен полиморфизм в положении №68 (последовательность ДНК), при этом половина клонов имели «C» в данном положении, а половина - «A». Указанная замена приводит к замене аминокислоты, Asp или Glu, соответственно. В последовательности Celera указан «A», таким образом клон «A» (Glu) был случайно выбран для дальнейшего исследования. Не получили клонов «A» в правильной ориентации, следовательно, чтобы изменить ориентацию на противоположную, использовали стадию субклонирования с применением Pme I, чтобы удалить вставку из исходного клона pCR3.1, и вектор pCR3.1, расщепленный Pme I.
Вариант PnuFlyPep является правильным. Однако в варианте WO 01/70980 отсутствуют примерно 17 N-концевых аминокислот и примерно 15 внутренних аминокислот. Данный рецептор был классифицирован как предполагаемый рецептор, подобный соматостатиновому (например, Hewes and Taghert, Genome Res., 2001, 11, 1126-1142). До настоящего изобретения данный расчет не был подтвержден никаким экспериментальным доказательством.
DmGPCR9
DmGPCR9 клонировали, используя праймеры ПЦР, сконструированные к рассчитанной последовательности PnuFlyPep, и матрицу кДНК, полученную на основе поли A+-РНК. Геномная структура была правильно рассчитана в PnuFlyPep.
DmGPCR10
Исходные попытки создать продукт ПЦР с помощью праймеров, сконструированных для DmGPCR10 (PnuFlyPep70325), были безуспешными. Исследование рассчитанной кДНК показало, что рассчитанная последовательность была необычной в том, что она не содержала ни высококонсервативного мотива «WXP» в TM VI, ни мотива «NPXXF» в TM VII, хотя присутствовали несколько других консервативных остатков. Исследование геномных последовательностей до 80 т.п.о. ниже последнего экзона не выявило никаких других вероятных экзонов. Попытки получить интактный клон DmGPCR10 не предпринимались.
DmGPCR11 (рецептор подобного аллатостатину пептида)
Праймеры ПЦР для рецептора подобного аллатостатину пептида конструировали, используя опубликованную последовательность. Birgul et al., EMBO Journal, 1999, 18 (21), 5892-5900. ПЦР-продукт получали, используя кДНК, полученную на основе суммарного препарата мРНК, и клонировали и секвенировали. Конечная кДНК кодировала белок, идентичный белку, описанному в публикации.
Пример 3: Нозерн-блот-анализ
Могут быть выполнены Нозерн-блоты для исследования экспрессии мРНК. Олигонуклеотид в смысловой ориентации и олигонуклеотид в антисмысловой ориентации, описанные выше, использовали в качестве праймеров, чтобы амплифицировать часть последовательности кДНК GPCR с нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 и 23.
Множественный Нозерн-блот тканей человека из Clontech (Human II №7767-1) гибридизуют с зондом. Предгибридизацию осуществляют при 42°C в течение 4 часов в 5×SSC, 1×реагенте Денхардта, 0,1% SDS, 50% формамиде, 250 мг/мл ДНК спермы лосося. Гибридизацию осуществляют в течение ночи при 42°C в такой же смеси с добавлением меченого зонда примерно 1,5×106 имп/мин/мл.
Зонд метят α-32P-dCTP с помощью системы мечения ДНК Rediprime (Amersham Pharmacia), очищают на колонке Nick (Amersham Pharmacia) и добавляют в раствор для гибридизации. Фильтры несколько раз промывают при 42°C в 0,2×SSC, 0,1% SDS. Фильтры экспонируют с пленкой Kodak XAR (Eastman Kodak Company, Rochester, N. Y., USA) с усиливающим экраном при -80°C.
Пример 4: Рекомбинантная экспрессия DmGPCR в эукариотических клетках
Экспрессия DmGPCR в клетках млекопитающих
Чтобы получить белок DmGPCR, полинуклеотид, кодирующий DmGPCR, экспрессируют в подходящей клетке-хозяине, используя подходящий экспрессирующий вектор и стандартный способ генетической инженерии. Например, последовательность, кодирующую DmGPCR, описанную в примере 1, субклонируют в коммерческом экспрессирующем векторе pzeoSV2 (Invitrogen, San Diego, CA) и трансфицируют в клетки яичника китайского хомячка (CHO), используя реагент для трансфекции FuGENE 6 (Boehringer-Mannheim) и протокол трансфекции, предложенный во вкладыше к продукту. Также подходящими являются другие линии эукариотических клеток, включая, например, клетки эмбриональной почки человека (HEK 293) и клетки COS. Клетки, стабильно экспрессирующие DmGPCR, отбирают по росту в присутствии 100 мкг/мл зеоцина (Stratagene, LaJolla, CA). Необязательно, DmGPCR можно очистить из клеток, используя стандартные способы хроматографии. Чтобы облегчить очистку, получают антисыворотку против одной или нескольких последовательностей синтетических пептидов, которые соответствуют частям аминокислотной последовательности DmGPCR, и антисыворотку используют для аффинной очистки DmGPCR. DmGPCR также можно экспрессировать в рамке с последовательностью метки (например, полигистидина, гемагглютинина, FLAG), чтобы облегчить очистку. Кроме того, будет понятно, что многие применения полипептидов DmGPCR, такие как анализы, описанные ниже, не требуют очистки DmGPCR из клетки-хозяина.
Экспрессия DmGPCR в клетках 293
Для экспрессии DmGPCR в клетках 293, получают плазмиду, несущую соответствующую кодирующую последовательность DmGPCR, используя вектор pSecTag2A (Invitrogen). Вектор pSecTag2A содержит лидерную последовательность цепи IgK мышей для секреции, эпитоп c-myc для выявления рекомбинантного белка с помощью анти-myc-антитела, C-концевой полигистидин для очистки с помощью никель-хелатной хроматографии и ген резистентности к зеоцину для селекции стабильных трансфектантов. Прямой праймер для амплификации данной кДНК GPCR определяют используемыми в повседневной практике способами, и он предпочтительно содержит 5'-удлинение нуклеотидов, чтобы ввести сайт клонирования HindIII и нуклеотиды, соответствующие последовательности GPCR. Обратный праймер также определяют используемыми в повседневной практике способами, и он предпочтительно содержит 5'-удлинение нуклеотидов, чтобы ввести сайт рестрикции XhoI для клонирования и нуклеотиды, соответствующие обратному комплементу последовательности DmGPCR. Условия ПЦР представляют собой 55°C в качестве температуры отжига. Продукт ПЦР очищают из геля и клонируют в сайтах HindIII-XhoI вектора.
ДНК очищают, используя хроматографические колонки Qiagen, и трансфицируют в клетки 293, используя среды для трансфекции DOTAP (Boehringer Mannheim, Indianapolis, IN). Временно трансфицированные клетки тестируют в отношении экспрессии через 24 часа после трансфекции, используя Вестерн-блоты, анализируемые с помощью антител против His и против пептида DmGPCR. Постоянно трансфицированные клетки отбирают с помощью зеоцина и размножают. Продукцию рекомбинантного белка регистрируют как в клетках, так и в средах с помощью Вестерн-блотов, анализируемых с использованием анти-His, анти-Myc или антител против пептида GPCR.
Экспрессия DmGPCR в клетках COS
Для экспрессии DmGPCR в клетках COS7 молекулу полинуклеотида, имеющего нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, можно клонировать в векторе p3-CI. Данный вектор является полученной из pUC 18 плазмидой, которая содержит промотор-интрон HCMV (цитомегаловируса человека), расположенный выше последовательности полиаденилирования bGH (гормона роста быка), и сайт множественного клонирования. Кроме того, плазмида содержит ген dhfr (дигидрофолатредуктазы), который обеспечивает селекцию в присутствии лекарственного средства метотрексана (MTX) для отбора стабильных трансформантов.
Прямой праймер определяют используемыми в повседневной практике способами, и он предпочтительно содержит 5'-удлинение, которое вводит сайт рестрикции XbaI для клонирования, после которого следуют нуклеотиды, которые соответствуют нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23. Обратный праймер также определяют используемыми в повседневной практике способами, и он предпочтительно содержит 5'-удлинение нуклеотидов, которое вводит сайт клонирования SalI, за которым следуют нуклеотиды, которые соответствуют обратному комплементу нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23.
ПЦР состоит из начальной стадии денатурации в течение 5 мин при 95°C, 30 циклов 30 с денатурации при 95°C, 30 с отжига при 58°C и 30 с элонгации при 72°C, с последующей 5 мин элонгацией при 72°C. ПЦР-продукт очищают из геля и лигируют в сайты XbaI и SalI вектора p3-CI. Данной конструкцией трансформируют клетки E.coli для амплификации и очистки ДНК. ДНК очищают с помощью хроматографических колонок Qiagen и трансфицируют в клетки COS7, используя реагент липофектамин из BRL, следуя протоколам производителя. Через сорок восемь и 72 часа после трансфекции среду и клетки тестируют в отношении экспрессии рекомбинантного белка.
DmGPCR, экспрессированный из культуры клеток COS, можно очистить концентрированием среды роста клеток примерно до 10 мг белка/мл и очищая белок, например, посредством хроматографии. Очищенный DmGPCR концентрируют до 0,5 мг/мл в концентраторе Amicon, оснащенном мембраной YM-10, и хранят при -80°C.
Экспрессия DmGPCR в клетках насекомых
Для экспрессии DmGPCR в бакуловирусной системе молекулу полинуклеотида, имеющего нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, можно амплифицировать с помощью ПЦР. Прямой праймер определяют используемыми в повседневной практике способами, и он предпочтительно содержит 5'-удлинение, которое добавляет сайт клонирования NdeI, за которым следуют нуклеотиды, которые соответствуют нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23. Обратный праймер также определяют используемыми в повседневной практике способами, и он предпочтительно содержит 5'-удлинение, который вводит сайт клонирования KpnI, за которым следуют нуклеотиды, которые соответствуют обратному комплементу нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23.
ПЦР-продукт очищают из геля, расщепляют NdeI и KpnI и клонируют в соответствующих сайтах вектора pAcHTL-A (Pharmingen, San Diego, CA). Экспрессирующий вектор pAcHTL содержит сильный промотор полиэдрина вируса ядерного полиэдроза Autographa californica (AcMNPV) и 6XHis-метку выше сайта множественного клонирования. Также присутствует сайт протеинкиназы для фосфорилирования и сайт тромбина для вырезания рекомбинантного белка, предшествующий сайту множественного клонирования. Конечно можно использовать многие другие бакуловирусные векторы вместо pAcHTL-A, такие как pAc373, pVL941 и pAcIM1. Можно использовать другие подходящие векторы для экспрессии полипептидов GPCR при условии, что векторная конструкция содержит соответствующим образом расположенные сигналы транскрипции, трансляции и миграции, такие как AUG в рамке и сигнальный пептид при необходимости. Такие векторы наряду с другими публикациями описаны в Luckow et al., Virology 170: 31-39.
Вирус выращивают и выделяют, используя стандартные способы бакуловирусной экспрессии, такие как способы, описанные в Summers et al. (A Manual of Methods for Baculovirus Vectors and Insect Cell Culture Procedures, Texas Agricultural Experimental Station Bulletin №1555 (1987)).
В одном варианте pAcHLT-A, содержащий ген DmGPCR, вводят в бакуловирус, используя набор для трансфекции «BaculoGold» (Pharmingen, San Diego, CA), используя способы, разработанные производителем. Отдельные вирусные изоляты анализируют в отношении продукции белка с использованием радиоактивного мечения инфицированных клеток35S-метионином через 24 часа после инфекции. Инфицированные клетки собирают через 48 часов после инфекции, и меченые белки визуализируют в SDS-ПААГ. Вирусы, демонстрирующие высокие уровни экспрессии, могут быть выделены и использованы для экспрессии в большем масштабе.
Для экспрессии полипептида DmGPCR в клетках Sf9, молекулу полинуклеотида, имеющего нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или 23, можно амплифицировать в ПЦР, используя праймеры и способы, описанные выше для бакуловирусной экспрессии. кДНК DmGPCR клонируют в векторе pAcHLT-A (Pharmingen) для экспрессии в клетках насекомых Sf9. Вставку клонируют в сайтах NdeI и KpnI после удаления внутреннего сайта NdeI (используя такие же праймеры, которые описаны выше для экспрессии в бакуловирусе). ДНК очищают с использованием хроматографических колонок Qiagen и экспрессируют в клетках Sf9. Предварительные эксперименты на основе Вестерн-блотов неочищенных бляшек тестируют в отношении присутствия рекомбинантного белка ожидаемого размера, которые взаимодействует с GPCR-специфичным антителом. Данные результаты подтверждают после дальнейшей очистки и оптимизации экспрессии в клетках HiG5.
Пример 5: Ловушка взаимодействия/двугибридная система
Чтобы исследовать белки, взаимодействующие с DmGPCR, можно использовать способ скрининга ловушки взаимодействия/двугибридной библиотеки. Данный анализ впервые описан в публикации Fields, et al., Nature, 1989, 340, 245, которая включена в данное описание в виде ссылки в полном объеме. Протокол опубликован в Current Protocols in Molecular Biology, John Wiley and Sons, NY, 1999, и Ausubel et al., Short Protocols in Molecular Biology, fourth edition, Greene and Wiley-interscience, NY, 1992, которые включены в данное описание в виде ссылки в полном объеме. Наборы доступны из Clontech, Palo Alto, CA (Matchmaker Two-Hybrid System 3).
Слияние нуклеотидных последовательностей, кодирующих весь или часть DmGPCR и ДНК-связывающий домен дрожжевого фактора транскрипции GAL4 (DNA-BD) конструируют в соответствующей плазмиде (т.е. pGBKT7), используя стандартные способы субклонирования. Подобным образом конструируют библиотеку слияний активного домена GAL4 (AD) во второй плазмиде (т.е. pGADT7) на основе кДНК потенциальных GPCR-связывающих белков (в отношении протоколов создания библиотек кДНК, см. публикацию Sambrook et al., Molecular Cloning: A Laboratory Manual, second edition, Cold Spring Harbor Press, Cold Spring Harbor, NY, 1989, которая включена в данное описание в виде ссылки в полном объеме). Слитую конструкцию ДНК-BD/GPCR проверяют секвенированием и тестируют в отношении автономной активации репортерного гена и клеточной токсичности, оба указанных явления могут мешать успешному двугибридному анализу. Сходные контроли выполняют с конструкцией слияния AD/библиотека, чтобы гарантировать экспрессию в клетке-хозяине и отсутствие транскрипционной активности. Дрожжевые клетки трансформируют (примерно 105 трансформантов/мг ДНК) обеими плазмидами с GPCR и слиянием из библиотеки согласно стандартному способу (Ausubel et al., Short Protocols in Molecular Biology, fourth edition, Greene and Wiley-interscience, NY, 1992, публикация включена в данное описание в виде ссылки в полном объеме). Связывание in vivo ДНК-BD/GPCR с AD/белки библиотеки приводило к транскрипции специфичных репортерных генов дрожжевой плазмиды (т.е. lacZ, HIS3, ADE2, LEU2). Дрожжевые клетки высевали на дефицитные по питательным веществам среды, чтобы провести скрининг в отношении экспрессии репортерных генов. Колонии в двух повторах анализировали в отношении активности β-галактозидазы при выращивании в средах с добавлением Xgal (5-бром-4-хлор-3-индолил-β-D-галактозида) (анализ фильтров в отношении активности β-галактозидазы описан в публикации Breeden et al., Cold Spring Harb. Symp.Quant. Biol., 1985, 50, 643, которая включена в данное описание в виде ссылки в полном объеме). Позитивные плазмиды AD-библиотеки спасали из трансформантов и повторно вводили в исходный дрожжевой штамм, а также другие штаммы, содержащие неродственные слитые белки ДНК-BD, чтобы подтвердить специфичные взаимодействия DmGPCR/белок библиотеки. ДНК вставки секвенировали, чтобы подтвердить наличие открытой рамки считывания, слитой с AD GAL4, и чтобы идентифицировать DmGPCR-связывающий белок.
Пример 6: Анализ связывания ДНК по сдвигу подвижности с использованием гель-электрофореза.
Анализ сдвига подвижности при гель-электрофорезе легко может выявить специфичные взаимодействия белок-ДНК. Протоколы широко доступны из таких руководств как Sambrook et al., Molecular Cloning: A Laboratory Manual, second edition, Cold Spring Harbor Press, Cold Spring Harbor, NY, 1989 и Ausubel et al., Short Protocols in Molecular Biology, fourth edition, Green and Wiley-interscience, NY, 1992, каждое из которых включено в данное описание в виде ссылки в полном объеме.
ДНК зонда (<300 п.о.) получают из синтетических олигонуклеотидов, фрагментов рестрикции эндонуклеазами или ПЦР-фрагментов и их концы метят32P. Аликвоту очищенного DmGPCR (примерно 15 мкг) или неочищенного экстракта DmGPCR (примерно 15 нг) инкубируют при постоянной температуре (в пределах 22-37°C) в течение по меньшей мере 30 минут в 10-15 мкл буфера (например, TAE или TBE, pH 8,0-8,5), содержащего радиоактивно меченую ДНК зонда, неспецифичный ДНК-носитель (примерно 1 мкг), БСА (300 мкг/мл) и 10% (об./об.) глицерина. Затем реакционную смесь наносят на полиакриламидный гель и разгоняют при 30-35 мА вплоть до того, как происходит хорошее разделение свободной ДНК зонда и комплекса белок-ДНК. Затем гель сушат и полосы, соответствующие свободной ДНК и комплексам белок-ДНК регистрируют с помощью авторадиографии.
Пример 7: Антитела к DmGPCR
Используют стандартные способы для создания поликлональных или моноклональных антител к DmGPCR и создания их применимых антигенсвязывающих фрагментов или вариантов, включая «гуманизированные» варианты. Такие протоколы, например, можно найти в Sambrook et al. (1989), выше, и Harlow et al. (Eds.), Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1988. В одном варианте осуществления изобретения рекомбинантные полипептиды DmGPCR (или клетки или клеточные мембраны, содержащие такие полипептиды) используют в качестве антигена для создания антител. В другом варианте осуществления изобретения в качестве антигена используют один или несколько пептидов, имеющих аминокислотные последовательности, соответствующие иммуногенной части DmGPCR (например, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислот). Пептиды, соответствующие внеклеточным частям DmGPCR, особенно гидрофильным внеклеточным частям, включены в данное изобретение. Антиген может быть смешан с адъювантом или связан с гаптеном, чтобы увеличить продукцию антител.
Поликлональные и моноклональные антитела
В качестве одного из типичных протоколов, рекомбинантный DmGPCR или его синтетический фрагмент используют для иммунизации мыши, чтобы получить моноклональные антитела (или более крупного млекопитающего, такого как кролик, для поликлональных антител). Чтобы повысить антигенность, пептиды конъюгируют с гемоцианином моллюска блюдечко «замочная скважина» (Pierce) согласно рекомендациям производителя. Для первичной инъекции антиген эмульгируют с полным адъювантом Фрейнда и инъецируют подкожно. С интервалами от двух до трех недель дополнительные аликвоты антигена DmGPCR эмульгируют с неполным адъювантом Фрейнда и инъецируют подкожно. Перед конечной бустер-инъекцией от иммунизированных мышей берут образец сыворотки и анализируют с помощью Вестерн-блота, чтобы подтвердить наличие антител, которые иммунореактивны по отношению к DmGPCR. Сыворотку от иммунизированных животных можно использовать в качестве поликлональных антисывороток или использовать для выделения поликлональных антител, которые узнают DmGPCR. Альтернативно, мышей забивают и извлекают их селезенки для создания моноклональных антител.
Чтобы создать моноклональные антитела селезенки помещают в 10 мл бессывороточной среды RPMI 1640 и получают суспензии отдельных клеток измельчением селезенок в бессывороточной среде RPMI 1640 с добавлением 2 мМ L-глутамина, 1 мМ пирувата натрия, 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина (RPMI) (Gibco, Canada). Суспензии клеток фильтруют и промывают центрифугированием и ресуспендируют в бессывороточной RPMI. Тимоциты, взятые от трех необработанных мышей Balb/c, готовят сходным образом и используют в качестве питающего слоя. Клетки миеломы NS-1, поддерживаемые в log-фазе в RPMI с 10% фетальной сыворотки теленка (FBS) (Hyclone Laboratories, Inc., Logan, Utah) в течение трех дней перед слиянием, также центрифугируют и промывают.
Чтобы получить гибридомные слияния, клетки селезенки от иммунизированных мышей объединяют с клетками NS-1 и центрифугируют, и надосадок отсасывают. Осадок клеток встряхивают, постукивая пробиркой, и к осадку примешивают 2 мл ПЭГ 1500, нагретого до 37°C (50% в 75 мМ HEPES, pH 8,0) (Boehringer-Mannheim) с последующим добавлением бессывороточной среды RPMI. После этого клетки центрифугируют, ресуспендируют в RPMI, содержащей 15% FBS, 100 мкл натрий-гипоксантина, 0,4 мкМ аминоптерина, 16 мкМ тимидина (HAT) (Gibco), 25 единиц/мл IL-6 (Boehringer-Mannheim) и 1,5×106 тимоцитов/мл, и высевают в 10 96-луночных планшетов для культур ткани с плоским дном Corning (Corning, Corning New York).
На 2, 4 и 6 день после слияния 100 мкл среды извлекают из лунок планшетов для слияния и помещают в свежую среду. На 8 день проводят скрининг слияний посредством ELISA, тестируя наличие мышиного IgG, который связывается с DmGPCR. Выбранные лунки со слияниями далее клонируют разведением вплоть до получения моноклональных культур, продуцирующих анти-DmGPCR-антитела.
Гуманизация моноклональных антител против DmGPCR
Характер экспрессии DmGPCR, о котором сообщается в данном описании, и подтвержденные достижения при использовании GPCR в качестве мишеней для терапевтического вмешательства, свидетельствуют о терапевтических показаниях для применения ингибиторов (антагонистов) DmGPCR. DmGPCR-нейтрализующие антитела составляют один класс терапевтических средств, применимых в качестве антагонистов DmGPCR. Ниже следуют протоколы для гуманизации моноклональных антител согласно изобретению.
Принципы гуманизации описаны в литературе и облегчаются модульной классификацией белков антител. Чтобы минимизировать возможность связывания комплемента можно использовать гуманизированное антитело изотипа IgG4.
Например, уровень гуманизации достигается созданием химерных антител, содержащих вариабельные домены представляющих интерес белков антител других организмов, отличных от человека, с константными доменами молекул антител человека. (См., например, Morrison et al., Adv. Immunol., 1989, 44, 65-92). Вариабельные домены DmGPCR-нейтрализующих анти-DmGPCR-антител клонируют из геномной ДНК B-клеточной гибридомы или из кДНК, созданной на основе мРНК, выделенной из представляющей интерес гибридомы. Фрагменты гена V-области связывают с экзонами, кодирующими константные домены антитела человека, и полученную в результате конструкцию экспрессируют в подходящих клетках-хозяевах млекопитающих (например, клетках миеломы или CHO).
Чтобы достичь еще более высокого уровня гуманизации в последовательностях антитела человека, клонируют только такие части генных фрагментов вариабельной области, которые кодируют антигенсвязывающие области, определяющие комплементарность («CDR»), генов моноклонального антитела организма, отличного от человека. (См., например, Jones et al., Nature, 1986, 321, 522-525; Riechmann et al., Nature, 1988, 332, 323-327; Verhoeyen et al., Science, 1988, 239, 1534-36; и Tempest et al., Bio/Technology, 1991, 9, 266-71). При необходимости, β -складчатый каркас антитела человека, окружающий области CDR3, также модифицируют для более близкого отображения трехмерной структуры антигенсвязывающего домена исходного моноклонального антитела. (См. Kettleborough et al., Protein Engin., 1991, 4, 773-783; и Foote et al., J. Mol. Biol., 1992, 224, 487-499).
При альтернативном подходе поверхность представляющего интерес моноклонального антитела организма, отличного от человека, гуманизируют изменением выбранных поверхностных остатков антитела организма, отличного от человека, например сайт-направленным мутагенезом, при этом сохраняя все внутренние и контактирующие остатки антитела организма, отличного от человека. См. Padlan, Molecular Immunol, 1991, 28 (4/5), 489-98.
Вышеупомянутые подходы применяют с использованием DmGPCR-нейтрализующих моноклональных анти-DmGPCR-антител и гибридом, которые их продуцируют, чтобы создать гуманизированные DmGPCR-нейтрализующие антитела, применимые в качестве терапевтических средств для лечения или облегчения состояний, при которых экспрессия DmGPCR или опосредованная лигандом передача сигнала являются вредными.
Пример 8: Анализ для идентификации модуляторов активности DmGPCR
Ниже изложено несколько неограничивающих анализов для идентификации модуляторов (агонистов и антагонистов) активности DmGPCR. Среди модуляторов, которые можно идентифицировать данными анализами, имеются природные соединения лигандов рецепторов; синтетические аналоги и производные природных лигандов; антитела, фрагменты антител и/или подобные антителам соединения, полученные из природных антител, или из комбинаторных библиотек соединений, подобных антителам; и/или синтетические соединения, идентифицированные высокопроизводительным скринингом библиотек; и тому подобное. Все модуляторы, которые связывают DmGPCR, применимы для идентификации DmGPCR в образцах тканей (например, для диагностических целей, для целей исследования патологии и тому подобного). Модуляторы, являющиеся агонистами и антагонистами, применимы для повышающей регуляции и понижающей регуляции активности DmGPCR, соответственно, чтобы лечить состояния болезни, характеризуемые аномальными уровнями активности DmGPCR. Анализы можно выполнить с использованием предполагаемых модуляторов отдельно и/или можно выполнить с использованием известного агониста в комбинации с антагонистами-кандидатами (или наоборот).
Анализы цАМФ
В анализе одного типа измеряют уровни циклического аденозинмонофосфата (цАМФ) в DmGPCR-трансфицированных клетках, на которые воздействовали соединениями-кандидатами в модуляторы. Протоколы анализов цАМФ описаны в литературе. (См., например, Sutherland et al., Circulation, 1968, 37, 279; Frandsen et al., Life Sciences, 1976, 18, 529-541; Dooley et al., J. Pharm. and Exper. Ther., 1997, 283 (2), 735-41; и George et al., J. Biomolecular Screening, 1997, 2 (4), 235-40). Типичный протокол для такого анализа с использованием анализа FlashPlate® активации аденилилциклазы из NENTM Life Science Products, приведен ниже.
Коротко, кодирующую последовательность DmGPCR (например, кДНК или не содержащую интронов геномную ДНК) субклонируют в коммерческом экспрессирующем векторе, таком как pzeoSV2 (Invitrogen), и временно трансфицируют в клетки яичника китайского хомячка (CHO), используя известные способы, такие как протокол трансфекции, предлагаемый Boehringer-Mannheim, при поставке реагента для трансфекции FuGENE 6. Трансфицированные клетки CHO высевают в 96-луночные микропланшеты из набора для анализа FlashPlate®, которые покрыты твердым сцинтиллятором, с которым была связана антисыворотка к цАМФ. Для контроля некоторые лунки засевают клетками CHO дикого типа (нетрансфицированными). В другие лунки в планшете вносят разные количества стандартного раствора цАМФ, используемые для создания стандартной кривой.
Одно или несколько тестируемых соединений (т.е. кандидатов в модуляторы) добавляют к клеткам в каждую лунку, при этом вода и/или не содержащая соединения среда/разбавитель служат в качестве контроля или контролей. После обработки дают возможность накопиться цАМФ в клетках точно в течение 15 минут при комнатной температуре. Анализ останавливают добавлением лизирующего буфера, содержащего [125I]-меченый цАМФ, и планшет просчитывают, используя сцинтилляционный счетчик Packard TopcountTM для 96-луночных микропланшетов. Немеченый цАМФ из лизированных клеток (или из стандартов) и фиксированные количества [125I]-цАМФ конкурируют за антитело, связанное с планшетом. Строят стандартную кривую и значения цАМФ для неизвестных получают интерполяцией. Изменения внутриклеточных уровней цАМФ в клетках в ответ на воздействие тестируемого соединения являются показателем DmGPCR-модулирующей активности. Модуляторы, которые действуют как агонисты рецепторов, которые сопряжены с Gs-подтипом G-белков, будут стимулировать продукцию цАМФ, приводя к измеряемому 3-10-кратному увеличению уровней цАМФ. Агонисты рецепторов, которые сопряжены с Gi/o-подтипом G-белков, будут ингибировать стимулированную форсколином продукцию цАМФ, приводя к измеряемому снижению уровней цАМФ на 50-100%. Модуляторы, которые действуют как обратные агонисты, будут реверсировать данные воздействия на рецепторы, которые либо являются конститутивно активными, либо активированными известными агонистами.
Анализы экворина
В другом анализе, клетки (например, клетки CHO) временно котрансфицируют конструкцией, экспрессирующей DmGPCR, и конструкцией, которая кодирует фотобелок апоакворин. В присутствии кофактора коэлентеразина апоакворин будет испускать измеряемую люминесценцию, которая пропорциональная количеству внутриклеточного (цитоплазматического) свободного кальция. (В общем см. Cobbold, et al., «Aequorin measurements of cytoplasmic free calcium», in Cellular Calcium: A Practical Approach, McCormack J. G. and Cobbold P. H., eds., Oxford: IRL Press, 1991; Stables et al., Anal. Biochem., 1997, 252, 115-26; и Haugland, Handbook of Fluorescent Probes and Research Chemicals, sixth edition, Eugene, OR, Molecular Probes, 1996).
В одном типичном анализе DmGPCR субклонируют в коммерческом экспрессирующем векторе pzeoSV2 (Invitrogen) и временно котрансфицируют вместе с конструкцией, которая кодирует фотобелок апоакворин (Molecular Probes, Eugene), в клетки CHO, используя реагент для трансфекции FuGENE 6 (Boehringer-Mannheim) и протокол трансфекции, предлагаемый во вкладыше к продукту.
Клетки культивируют в течение 24 часов при 37°C в MEM (Gibco/BRL, Gaithersburg, MD) с добавлением 10% фетальной сыворотки теленка, 2 нМ глутамина, 10 ед./мл пенициллина и 10 мкг/мл стрептомицина, и в данное время среду заменяют на бессывороточную MEM, содержащую 5 мкм коэлентеразина (Molecular Probes, Eugene, OR). Затем культивирование продолжают еще в течение двух часов при 37°C. Затем клетки открепляют от планшета, используя версен (Gibco/BRL), промывают и ресуспендируют в концентрации 200000 клеток/мл в бессывороточной MEM.
Разведения соединений кандидатов в модуляторы DmGPCR готовят в бессывороточной среде MEM и распределяют в лунки непрозрачного 96-луночного планшета для анализа по 50 мкл/лунку. Затем планшеты загружают на люминометр для планшетов для микротитрования MLX (Dynex Technologies, Inc., Chantilly, VA). Прибор программируют на распределение по 50 мкл суспензии клеток в каждую лунку, одну лунку за один раз, и сразу же считывают люминесценцию в течение 15 секунд. Кривые доза-ответ для кандидатов в модуляторы создают, используя площадь под кривой для каждого пика светового сигнала. Данные анализируют с применением SlideWrite, используя уравнение для односайтового лиганда, и получают значения EC50. Изменения люминесценции, вызванные соединениями, считают показателем модулирующей активности. Модуляторы, которые действуют как агонисты рецепторов, которые сопряжены с Gq-подтипом G-белков, дают увеличение люминесценции до 100-кратного. Модуляторы, которые действуют как обратные агонисты, будут реверсировать данное воздействие на рецепторы, которые либо являются конститутивно активными, либо активированы известными агонистами.
Анализ репортерного гена люциферазы
Фотобелок люцифераза обеспечивает другое средство, применимое для анализа модуляторов активности DmGPCR. Клетки (например, клетки CHO или клетки COS7) временно котрансфицируют конструкцией, экспрессирующей DmGPCR (например, DmGPCR в pzeoSV2), и репортерной конструкцией, которая содержит ген белка люциферазы ниже сайта связывания фактора транскрипции, такого как элемент цАМФ-ответа (CRE), AP-1 или NF-kappa B. Агонист, связывающийся с рецепторами, сопряженными с G-белками Gs-подтипа, приводит к увеличению цАМФ, тем самым активируя фактор транскрипции CRE и в результате приводя к экспрессии гена люциферазы. Агонист, связывающийся с G-белком Gq-подтипа, приводит к продукции диацилглицерина, который активирует протеинкиназу C, которая активирует факторы транскрипции AP-1 или NF-kappa B, в свою очередь приводящие к экспрессии гена люциферазы. Уровни экспрессии люциферазы отражают состояние активации событий передачи сигнала. В общем, см., George et al., J. Biomolecular Screening, 1997, 2(4), 235-240; и Stratowa et al., Curr. Opin. Biotechnol., 1995, 6, 574-581. Активность люциферазы можно количественно измерить, используя, например, реагенты для анализа люциферазы, которые коммерчески доступны из Promega (Madison, WI).
В одном типичном анализе клетки CHO высевают в 24-луночные чашки для культивирования при плотности 100000 клеток/лунку за один день до трансфекции и культивируют при 37°C в MEM (Gibco/BRL) с добавлением 10% фетальной сыворотки теленка, 2 мМ глутамина, 10 ед./мл пенициллина и 10 мкг/мл стрептомицина. Клетки временно котрансфицируют конструкцией, экспрессирующей DmGPCR, и репортерной конструкцией, содержащей ген люциферазы. Репортерные плазмиды CRE-люцифераза, AP-1-люцифераза и NF-kappaB-люцифераза можно приобрести из Stratagene (LaJolla, CA). Трансфекции осуществляют с использованием реагента для трансфекции FuGENE 6 (Boehringer-Mannheim) согласно инструкциям поставщика. Клетки, трансфицированные только репортерной конструкцией, используют в качестве контроля. Через двадцать четыре часа после трансфекции клетки один раз промывают PBS, предварительно нагретым до 37°C. Затем к клеткам добавляют бессывороточную среду MEM либо отдельно (контроль), либо с одним или несколькими кандидатами в модуляторы, и клетки инкубируют при 37°С в течение пяти часов. После этого клетки один раз промывают ледяным PBS и лизируют добавлением 100 мкл лизирующего буфера на лунку из набора для анализа люциферазы, поставляемого Promega. После инкубации в течение 15 минут при комнатной температуре 15 мкл лизата смешивают с 50 мкл раствора субстрата (Promega) в непрозрачном белом 96-луночном планшете и немедленно считывают флуоресценцию на сцинтилляционном и люминесцентном счетчике MicroBeta Wallace, модель 1450 (Wallace Instruments, Gaithersburg, MD).
Различия в люминесценции в присутствии по сравнению с отсутствием соединения-кандидата в модуляторы, являются показателем модулирующей активности. Рецепторы, которые либо являются конститутивно активными, либо активированы агонистами, обычно дают 3-20-кратную стимуляцию люминесценции по сравнению с клетками, трансфицированными только одним репортерным геном. Модуляторы, которые действуют в качестве обратных агонистов, будут отменять данный эффект.
Измерение внутриклеточного кальция с использованием FLIPR
Изменения уровней внутриклеточного кальция являются другим общепризнанным показателем активности сопряженного с G-белком рецептора, и такие анализы можно использовать для скрининга модуляторов активности DmGPCR. Например, клетки CHO, стабильно трансфицированные вектором, экспрессирующим DmGPCR, высевают при плотности 4×104 клеток/лунку в 96-луночные планшеты с черными стенками Packard, специально разработанные для того, чтобы отличить сигналы флуоресценции, исходящие из разных лунок планшета. Клетки инкубируют в течение 60 минут при 37°C в модифицированном Дульбекко PBS (D-PBS), содержащем 36 мг/л пирувата и 1 г/л глюкозы и один из четырех красителей, являющихся индикаторами кальция (Fluo-3TM AM, Fluo-4TM AM, Calcium GreenTM-1 AM или Oregon GreenTM 488 BAPTA-1 AM), каждый в концентрации 4 мкМ. Планшеты один раз промывают модифицированным D-PBS и инкубируют в течение 10 минут при 37°C, чтобы удалить остаточный краситель из клеточной мембраны. Кроме того, непосредственно перед активацией кальциевого ответа проводят серию промывок модифицированным D-PBS.
Кальциевый ответ инициируют добавлением одного или нескольких соединений-кандидатов в агонисты рецепторов, ионофора кальция A23187 (10 мкМ; позитивный контроль) или ATP (4 мкм; позитивный контроль). Флуоресценцию измеряют посредством FLIPR Molecular Device с аргоновым лазером (возбуждение при 488 нм). (См., например, Kuntzweiler et al., Drug Dev. Res., 1998, 44(1), 14-20). F-стоп для камеры детектора устанавливали при 2,5, и продолжительность экспозиции составляла 0,4 миллисекунды. Базовый уровень флуоресценции клеток измеряли в течение 20 секунд перед добавлением кандидата в агонисты, ATP или A23187, и базовый уровень флуоресценции вычитали из сигнала ответа. Кальциевый сигнал измеряют примерно в течение 200 секунд, делая замеры каждые две секунды. Ионофор кальция A23187 и ATP увеличивают кальциевый сигнал на 200% выше базовых уровней. В общем активированные GPCR увеличивают кальциевый сигнал примерно на 10-15% выше базовой линии сигнала.
Анализ митогенеза
В анализе митогенеза определяют способность кандидатов в модуляторы индуцировать или ингибировать опосредованное DmGPCR деление клеток. (См., например, Lajiness et al., J. Pharm. and Exper. Ther., 1993, 267 (3), 1573-1581). Например, клетки CHO, стабильно экспрессирующие DmGPCR, высевают в 96-луночные планшеты при плотности 5000 клеток/лунку и выращивают при 37°C в MEM с 10% фетальной сыворотки теленка в течение 48 часов, и в это время клетки два раза промывают бессывороточной MEM. После промывки добавляют 80 мкл свежей MEM или MEM, содержащей известный митоген, вместе с 20 мкл MEM, содержащей различные концентрации одного или нескольких кандидатов в модуляторы или тестируемых соединений, разведенных в бессывороточной среде. В качестве контролей в некоторые лунки на каждом планшете добавляют только бессывороточную среду, а в некоторые добавляют среду, содержащую 10% фетальную сыворотку теленка. Нетрансфицированные клетки или клетки, трансфицированные только одним вектором, также могут служить в качестве контролей.
После культивирования в течение 16-18 часов в лунки добавляют 1 мкКи [3H]-тимидина (2 Ки/ммоль) и клетки инкубируют еще в течение 2 часов при 37° C. Клетки обрабатывают трипсином и собирают на фильтровальные листы с помощью сборщика клеток (Tomtec); затем фильтры считают в счетчике Betaplate. Включение [3H]-тимидина в не содержащих сыворотку тестируемых лунках сравнивают с результатами, полученными в клетках, стимулированных сывороткой (позитивный контроль). Использование множества концентраций тестируемых соединений позволяет создать и провести анализ кривых доза-ответ, используя нелинейное уравнение подгонки методом наименьших квадратов: A=B×[C/(D+C)]+G, где A означает процент стимуляции сывороткой; B означает максимальный эффект минус эффект базового уровня; C означает EC50; D означает концентрацию соединения и G означает максимальный эффект. Параметры B, C и G определяют Simplex-оптимизацией.
Предполагается, что агонисты, которые связываются с рецептором, увеличивают включение [3H]-тимидина в клетки, достигая ответа, составляющего до 80% ответа на сыворотку. Антагонисты, которые связываются с рецептором, будут ингибировать стимуляцию, наблюдаемую с известным агонистом, вплоть до 100%.
Анализ связывания [35S]GTPγS
Так как сопряженные с G-белком рецепторы передают сигнал через внутриклеточные G-белки, в активность которых вовлечено связывание GTP и гидролиз с получением связанного GDP, то измерение связывания негидролизуемого аналога GTP, [35S]GTPγS в присутствии и отсутствии кандидатов в модуляторы обеспечивает другой анализ активности модулятора. См., например, Kowal et al., Neuropharmacology, 1998, 37, 179-187.
В одном типичном анализе клетки, стабильно трансфицированные вектором, экспрессирующим DmGPCR, выращивают в 10-см чашках для культуры ткани почти до слияния, один раз промывают 5 мл ледяного фосфатно-солевого буфера, не содержащего Ca2+/Mg2+, и соскабливают в 5 мл такого же буфера. Клетки осаждают центрифугированием (500×g), 5 минут, ресуспендируют в буфере TEE (25 мМ трис, pH 7,5, 5 мМ EDTA, 5 мМ EGTA) и замораживают в жидком азоте. После размораживания клетки гомогенизируют с использованием гомогенизатора Даунса (один мл TEE на чашку клеток) и центрифугируют при 1000×g в течение 5 минут, чтобы удалить ядра и неразрушенные клетки.
Надосадок гомогената центрифугируют при 20000×g в течение 20 минут, чтобы выделить фракцию мембран, и осадок мембран промывают один раз TEE и ресуспендируют в буфере для связывания (20 мМ HEPES, pH 7,5, 150 мМ NaCl, 10 мМ MgCl2, 1 мМ EDTA). Ресупендированные мембраны можно заморозить в жидком азоте и хранить при -70°C до использования.
Аликвоты клеточных мембран, полученных как описано выше и хранившихся при -70°C, размораживают, гомогенизируют и разбавляют в буфере, содержащем 20 мМ HEPES, 10 мМ MgCl2, 1 мМ EDTA, 120 мМ NaCl, 10 мкМ GDP и 0,2 мМ аскорбат, при концентрации 10-50 мкг/мл. В конечном объеме 90 мкл гомогенаты инкубируют с различными концентрациями соединений кандидатов в модуляторы или 100 мкМ GTP в течение 30 минут при 30°C и затем помещают на лед. К каждому образцу добавляют 10 мкл гуанозин-5'-O-(3[35S]тио)трифосфата (NEN, 1200 кюри/ммоль; [35S]-GTPγS) до конечной концентрации 100-200 пМ. Образцы инкубируют при 30°C еще в течение 30 минут, добавляют 1 мл 10 мМ HEPES, pH 7,4, 10 мМ MgCl2 при 4°C и реакцию останавливают фильтрованием.
Образцы фильтруют через фильтры Whatman GF/B и фильтры промывают 20 мл ледяного 10 мМ HEPES, pH 7,4, 10 мМ MgCl2. Фильтры считают посредством жидкостной сцинтилляционной спектроскопии. Неспецифичное связывание [35S]-GTPγS измеряют в присутствии 100 мкМ GTP и вычитают из суммарного. Отбирают соединения, которые модулируют количество [35S]GTPγS, связывающегося в клетках, по сравнению с нетрансфицированными контрольными клетками. Активация рецепторов агонистами дает увеличение связывания [35S]GTPγS до пятикратного. Данный ответ блокируется антагонистами.
Анализ активности MAP-киназы
Оценка активности MAP-киназы в клетках, экспрессирующих GPCR, обеспечивает другой анализ для идентификации модуляторов активности DmGPCR. См., например, Lajiness et al., J. Pharm. and Exper. Ther., 1993, 267 (3), 1573-1581 и Boulton et al., Cell, 1991, 65, 663-675.
В одном варианте клетки CHO, стабильно трансфицированные DmGPCR, высевают в 6-луночные чашки при плотности 70000 клеток/лунку за 48 часов до анализа. В течение данного 48-часового периода клетки культивируют при 37°C в среде MEM с добавлением 10% фетальной сыворотки теленка, 2 мМ глутамина, 10 ед./мл пенициллина и 10 мкг/мл стрептомицина. Клетки подвергают голоданию без сыворотки за 1-2 часа до добавления стимуляторов.
Для анализа клетки обрабатывают только средой или средой, содержащей либо кандидат в агонисты, либо 200 нМ сложного форболового эфира меристоилацетата (т.е. PMA, позитивный контроль), и клетки инкубируют при 37°C в течение различных периодов времени. Чтобы остановить реакцию, чашки помещают на лед, среду отсасывают и клетки промывают 1 мл ледяного PBS, содержащего 1 мМ EDTA. После этого к клеткам добавляют 200 мкл буфера дли лизирования клеток (12,5 мМ MOPS, pH 7, 3, 12,5 мМ глицерофосфат, 7,5 мМ MgCl2, 0,5 мМ EGTA, 0,5 мМ ванадат натрия, 1 мМ бензамидин, 1 мМ дитиотреитол, 10 мкг/мл лейпептина, 10 мкг/мл апротинина, 2 мкг/мл пепстатина A и 1 мкМ окадаевой кислоты). Клетки соскребают с чашек и гомогенизируют 10 пропусканиями через иглу 23 3/4 G, и получают фракцию цитозоля центрифугированием при 20000×g в течение 15 минут.
Аликвоты (5-10 мкл, содержащих 1-5 мкг белка) цитозоля смешивают с 1 мМ пептидным субстратом MAPK (APRTPGGRR (SEQ ID NO: 168), Upstate Biotechnology, Inc., N.Y.) и 50 мкМ [γ-32P]ATP (NEN, 3000 кюри/ммоль), разбавляют до конечной удельной активности ˜2000 имп./мин/пмоль в общем объеме 25 мкл. Образцы инкубируют в течение 5 минут при 30°C и реакции останавливают нанесением в виде пятен по 20 мкл на квадраты фосфоцеллюлозной бумаги Whatman P81 площадью 2 см2. Квадраты фильтров промывают 4 сменами 1% H3PO4и квадраты подвергают жидкостной сцинтилляционной спектроскопии, чтобы количественно измерить связанную метку. Эквивалентные цитозольные экстракты инкубируют без пептидного субстрата MAPK и количество связанной метки из данных образцов вычитают из соответствующих образцов с пептидным субстратом. Цитозольный экстракт из каждой лунки используют в качестве отдельной точки. Концентрации белка определяют в анализе белка, связывающего краситель (Bio-Rad Laboratories). Предполагается, что активация рецептора агонистом приводит к увеличению активности фермента MAPK до пятикратного. Указанное увеличение блокируется антагонистами.
Высвобождение [3H]-арахидоновой кислоты
Также обнаружено, что активация GPCR стимулирует высвобождение арахидоновой кислоты из клеток, обеспечивая еще один анализ, применимый для анализа модуляторов активности GPCR. См., например, Kanterman et al., Molecular Pharmacology, 1991, 39, 364-369. Например, клетки CHO, которые стабильно трансфицированы вектором, экспрессирующим DmGPCR, высевают в 24-луночные чашки при плотности 15000 клеток/лунку и выращивают в среде MEM с добавлением 10% фетальной сыворотки теленка, 2 мМ глутамина, 10 ед./мл пенициллина и 10 мкг/мл стрептомицина в течение 48 часов при 37°C перед использованием. Клетки каждой лунки метят, инкубируя с [3H]-арахидоновой кислотой (Amersham Corp., 210 кюри/ммоль) в концентрации 0,5 мкКи/мл в 1 мл MEM с добавлением 10 мМ HEPES, pH 7,5, и 0,5% бычьего сывороточного альбумина, не содержащего жирных кислот, в течение 2 часов при 37°C. Затем клетки дважды промывают 1 мл такого же буфера.
Соединения-кандидаты в модуляторы добавляют в 1 мл такого же буфера либо отдельно, либо с 10 мкМ ATP, и клетки инкубируют при 37°C в течение 30 минут. В качестве контролей используют только один буфер и ложно трансфицированные клетки. Образцы (0,5 мл) из каждой лунки считают посредством жидкостной сцинтилляционной спектроскопии. Агонисты, которые активируют рецептор, будут приводить к усилению ATP-стимулированного высвобождения [3H]-арахидоновой кислоты. Данное усиление блокируется антагонистами.
Уровень подкисления внеклеточной среды
В еще одном анализе влияние кандидатов в модуляторы активности DmGPCR анализируют, контролируя внеклеточные изменения pH, индуцированные тестируемыми соединениями. См., например, Dunlop et al., J. Pharmacological and Toxicological Methods, 1998, 40 (1), 47-55. В одном варианте клетки CHO, трансфицированные вектором, экспрессирующим DmGPCR, высевают в 12-мм капсульные колпачки (Molecular Devices Corp.) при плотности 4×105 клеток/колпачок в MEM с добавлением 10% фетальной сыворотки теленка, 2 мМ L-глутамина, 10 ед./мл пенициллина и 10 мкг/мл стрептомицина. Клетки инкубируют в данной среде при 37°C в атмосфере с 5% CO2 в течение 24 часов.
Уровни подкисления внеклеточной среды измеряют, используя микрофизиометр Cytosensor (Molecular Devices Corp.). Капсульные колпачки загружают в сенсорные камеры микрофизиометра и камеры перфузируют рабочим буфером (не содержащая карбоната MEM с добавлением 4 мМ L-глутамина, 10 единиц/мл пенициллина, 10 мкг/мл стрептомицина, 26 мМ NaCl) со скоростью потока 100 мкл/минуту. Кандидаты в агонисты или другие агенты разбавляют в рабочем буфере и перфузируют через второй путь жидкости. В течение каждого 60-секундного цикла насоса насос работает в течение 38 секунд и отключается на остальные 22 секунды. pH рабочего буфера в сенсорной камере регистрируют во время цикла 43-58 секунд и насос снова запускают во временной точке 60 секунд, чтобы начать следующий цикл. Уровень подкисления рабочего буфера в течение периода времени регистрации рассчитывают с помощью программы Cytosoft. Изменения в уровне подкисления рассчитывают вычитанием значения исходного уровня (среднее из четырех измерений уровня непосредственно перед добавлением кандидата в модуляторы) из самой высокого измерения уровня, полученного после добавления кандидата в модуляторы. Выбранный прибор регистрирует 61 мВ/единицу pH. Модуляторы, которые действуют как агонисты рецептора, приводят к увеличению уровня подкисления внеклеточной среды по сравнению с уровнем в отсутствие агониста. Данный ответ блокируется модуляторами, которые действуют как антагонисты рецептора.
Пример 9: Сочетание DmGPCR с пептидными лигандами
Культуры клеток и трансфекции
Клетки яичника китайского хомячка дикого типа (CHO-K1) (из Американской коллекции типов культур, Rockville, MD) или клетки CHO-10001A культивировали при 37°C во влажной атмосфере 5% CO2 в воздухе в среде DMEM с добавлением 10% инактивированной нагреванием FBS, 10 мкг/мл гентамицина, 0,1 мМ заменимых аминокислот, чтобы получить полную среду DMEM. Клетки трансфицировали сиротскими ДНК GPCR в векторе pCR3.1, используя LipofectAMINE PLUSTM, по существу согласно инструкциям производителя. Коротко, клетки CHO высевали на 10-см стерильные чашки для культуры ткани (Corning Glass Works, Corning, NY) и они сливались в слой примерно на 50-60% в день трансфекции. В пластиковой пробирке PLUS (20 мкл/чашку) добавляли к плазмиде с кДНК (5 мкг/чашку), которую предварительно разбавляли в 0,75 мл OptiMEM, смешивали и инкубировали при комнатной температуре в течение 15 мин. Отдельно LipofectAMINE (30 мкл/чашку) смешивали с 0,75 мл OptiMEM и добавляли к предварительно составленной смеси ДНК/PLUS и инкубировали при комнатной температуре в течение 15 минут. Среду, покрывающую клетки, заменяли бессывороточной средой для трансфекции (простая DMEM, 5 мл/чашку) и добавляли комплекс ДНК-PLUS-LipofectAMINE (1,5 мл на чашку) и осторожно смешивали со средой, после чего инкубировали в течение 3 ч при 37°C/5% CO2. Затем среду дополняли полной средой DMEM, содержащей 20% FBS (6,5 мл/чашку) и инкубацию продолжали при 37°C/5% CO2 в течение от 24 до 48 ч. Плазмиду для белка с зеленой флуоресценцией (GFP, 4 мкг/чашку) использовали для временной экспрессии GFP в клетках CHO, чтобы оценить выходы трансфекции при таких же условиях, которые использовали для GPCR.
Приготовление мембран
Трансфицированные клетки промывали один раз ледяным фосфатно-солевым буфером Дульбекко (PBS), 5 мл на 10-см чашку и соскребали в 5 мл такого же буфера. Суспензии клеток с множества планшетов объединяли и центрифугировали при 500×g в течение 10 мин при 4°C. Осадок клеток вновь суспендировали в ледяном TEE (25 мМ трис, 5 мМ EGTA, 5 мМ EDTA). Подходящие аликвоты мгновенно замораживали в жидком азоте и хранили при -70°C. После размораживания клетки гомогенизировали и центрифугировали при 4°C, 500×g в течение 5 минут, чтобы осадить ядра и неразрушенные клетки. Надосадок центрифугировали при 47000×g в течение 30 минут при 4°C. Осадок мембран один раз промывали TEE, ресуспендировали в 20 мМ HEPES, pH 7,4, 100 мМ NaCl, 10 мМ MgCl2, 1 мМ EDTA (буфер для анализа), делили на аликвоты и замораживали в жидком азоте. Аликвоты мембран хранили при -70°C. Концентрацию мембранного белка определяли, используя реагент для анализа белка BCA из Pierce (Rockford, Illinois) и БСА в качестве стандарта.
Анализ связывания [35S]GTPγS
Аликвоты клеточных мембран размораживали, гомогенизировали и разбавляли в буфере, содержащем 20 мМ HEPES, pH 7,4, 100 мМ NaCl, 10 мМ MgCl2, 1 мМ EDTA (буфер для анализа). Сначала готовили реакционные смеси в 96-луночных полипропиленовых планшетах (Nunc). В каждой лунке смешивали водный раствор пептида (20 мкл, 10 X) или водные контроли (20 мкл), 18,2 мкМ GDP в буфере для анализа (0,11 мл, конечная концентрация 10 мкМ) и мембраны, суспендированные в буфере для анализа (50 мкл, 10 мкг мембранного белка) и помещали на лед. Смеси лиганд-GDP-мембраны инкубировали в течение 20 мин при комнатной температуре на встряхивающей платформе и затем помещали на лед. К каждому образцу добавляли 20 мкл гуанозин-5'-O-(3-[35S]тио)трифосфата ([35S]GTPγS) (600-1200 кюри/ммоль из New England Nuclear, Boston, MA) до ˜ 40000 имп./мин/0,2 мл или конечной концентрации 0,1 нМ. Планшеты со смесями для инкубации (всего 0,2 мл/лунку) инкубировали при комнатной температуре в течение 45 минут. Затем аликвоты реакционной смеси по 0,175 мл каждая переносили в предварительно обработанные буфером для промывки (100 мкл/лунку) 96-луночные планшеты с фильтрами FB MultiScreen (Millipore) и подвергали вакуумной фильтрации с использованием вакуумного коллектора MultiScreen (Millipore). Затем мембраны 3 раза промывали 0,25 мл ледяного буфера для промывки/лунку (10 мМ HEPES, 10 мМ MgCl2, pH 7,4) и подвергали вакуумной фильтрации. После последней промывки добавляли сцинтилляционную жидкость Supermix Opti-phase (25 мкл/лунку, Wallac) и планшеты герметично закрывали и считали в счетчике Trilux 1450 Microbeta (Wallac) по 1 минуте/лунку. В качестве позитивных контролей мембраны из клеток CHO, стабильно экспрессирующих рецептор допамина типа 2 (rD2), обрабатывали 1 мМ допамином в 0,025% аскорбиновой кислоте (конечная концентрация допамина 100 мкМ) или наполнителем (аскорбиновой кислотой в конечной концентрации 0,0025%). Неспецифичное связывание измеряли в присутствии 100 мкМ немеченого GTPγS и вычитали из суммарного. Каждую обработку проводили в трех повторах.
Анализ данных
Индуцированное лигандом стимулирование связывания [35S]GTPγS выражали в виде кратного увеличения по сравнению с базовой активностью без добавления лиганда. Каждую обработку проводили либо в трех повторах, либо иногда в двух повторах и связывание (имп./мин) рассчитывали в виде средних+/- стандартные отклонения. Кривые доза-ответ для систем рецептор/лиганд анализировали, используя нелинейную модель SAS наименьших квадратов, y=BmaxX/(Kd+X). Другие кривые доза-ответ анализировали, используя Prism (GraphPad Software, Inc. San Diego, CA) и следующее уравнение y=Нижний уровень+(Верхний уровень-нижний уровень)/(1+10LogEC50-X).
Результаты
Исходно авторы выбрали анализ GTPγS в качестве функционального анализа, так как управляемая агонистом стимуляция GTPγS отражает ранние события в каскаде активации DmGPCR, безотносительно к дальнейшим путям активации различных событий передачи сигнала в каскаде ниже. Анализ, по-видимому, особенно применим для оценки возможной активации сиротских DmGPCR с неизвестными функциями и неизвестными путями передачи сигнала. Анализ GTPγS выполняют, используя мембраны, полученные из клеток CHO, временно трансфицированных ДНК, кодирующей GPCR Drosophila, используя 96-луночные планшеты с фильтрами MultiScreen G/FB и вакуумный коллектор MultiScreen (Millipore) для фильтрации. Так как известно, что анализ GTPγS плохо распознает GPCR, сопряженные с Gq-классом G-белков, то также использовали анализ мобилизации Ca+2, основанный на снятии показаний FLIPR, чтобы оценить сопряженные с Gq сиротские GPCR в клетках CHO, временно трансфицированных ДНК, кодирующей GPCR Drosophila.
Используя анализ GTPγS, обнаружили, что DmGPCR1 (PnuFlyPep34651) активируется двумя NPF-подобными пептидами Drosophila, AQRSPSLRLRF-NH2 (SEQ ID NO: 186) и PIRSPSLRLRF-NH2 (SEQ ID NO: 187), что отражается в определенных значениях EC50 , составляющих примерно 2,5 нМ. Активация DPKQDFMRF-NH2 (SEQ ID NO: 26) и PDNFMRF-NH2 (SEQ ID NO: 27) приводила к GTPγS-ответам с EC50 в диапазоне от 370 нМ до 500 нМ. Как сообщалось Nambu et al. (Neuron, 1988, 1, 55-61), указанные два пептида кодируются в одном и том же гене предшественника вместе с девятью другими FaRP. Дополнительные FaRP и другие нейропептиды, которые также стимулировали связывание GTPγS, хотя и менее эффективно (EC50 в диапазоне от 5 до 10 мкМ), включали следующие пептиды: TDVDHVFLRF-NH2 (SEQ ID NO: 25), TPAEDFMRF-NH2 (SEQ ID NO: 28), SLKQDFMHF-NH2 (SEQ ID NO: 29), SVKQDFMHF-NH2 (SEQ ID NO: 30), AAMDRY-NH2 (SEQ ID NO: 31) и SVQDNFMHF-NH2 (SEQ ID NO: 32).
Кроме того, в анализе FLIPR идентифицировали пептид колорадского жука картофеля, ARGPQLRLRF-NH2 (SEQ ID NO: 33), подходящий для рецептора DmGPCR1 с EC50 100-200 нМ. Полученные авторами данные свидетельствуют, что DmGPCR1 должен быть классифицирован как рецептор короткого нейропептида F, так как он сильно активируется двумя короткими пептидами NPF, SEQ ID NO:186 и SEQ ID NO:187.
Как показано на основании GTPγS-ответов, DmGPCR4 (PnuFlyPep 67393) активировался аллатостатином Drosophila melanogaster, дростатином-3 (SRPYSFGL-NH2 (SEQ ID NO: 165)) с EC50 в низком наномолярном диапазоне, а также различными аллатостатинами Diplotera punctata (таракан), а именно: GDGRLYAFGL-NH2 (SEQ ID NO: 34), DRLYSFGL-NH2 (SEQ ID NO: 35), APSGAQRLYGFGL-NH2 (SEQ ID NO: 36) и GGSLYSFGL-NH2 (SEQ ID NO: 37) (EC50 в диапазоне примерно 20-280 нМ). Такие же пептиды вызывали очень сильный кальциевый сигнал при тестировании в концентрации 10 мкМ с помощью FLIPR. Недавно DmGPCR4 был клонирован Lenz et al., выше, и классифицирован как второй предполагаемый рецептор аллатостатина (DARII). Однако до настоящего времени не сообщалось фармакологических данных об активации рецептора. Насколько известно авторам, это самое первое экспериментальное доказательство того, что различные аллатостатины действительно активируют данный рецептор.
Как показано на основании GTPγS-ответов, DmGPCR5 (GenBank, №доступа AX128628) при временной экспрессии в клетках CHO-10001A активировался дротахикининами (DTK), а именно DTK-1 (APTSSFIGMR-NH2) (SEQ ID NO: 169), Met8-DTK-2 (APLAFYGMR-NH2) (SEQ ID NO: 170), DTK-2 (APLAFYGLR-NH2) (SEQ ID NO: 171), DTK-3 (APTGFTGMR-NH2) (SEQ ID NO: 172), DTK-4 (APVNSFVGMR-NH2) (SEQ ID NO: 173), и DTK-5 (APNGFLGMR-NH2) (SEQ ID NO: 174). В эксперименте доза-ответ DTK-1, Met8-DTK-2, DTK-3 и DTK-5 стимулировали связывание GTPγS с EC50 в диапазоне 250-500 нМ и максимальной стимуляцией примерно в 1,5 раза выше базового уровня. DTK-2 и DTK-4 были менее эффективными, судя по их EC50 в низком микромолярном диапазоне. В анализе мобилизации кальция (FLIPR) DmGPCR5 демонстрировал Ca+2-ответы на такие же DTK с EC50 в диапазоне 1-20 нМ. Кроме того, DTK-5, DTK-2 и Met8-DTK-2 тестировали в анализе цАМФ (основанном на репортерном гене), и они стимулировали высвобождение цАМФ дозо-зависимым образом с EC50 197 нМ, 1,06 мкМ и 583 нМ, соответственно. Полученные данные свидетельствуют, что DmGPCR5 сопряжен с путями передачи сигналов, опосредованных как с Gs (цАМФ), так и Gq (Ca+2), которые аналогичны путям передачи сигнала, сообщенным для рецепторов тахикинина позвоночных.
Сообщалось о DmGPCR6a как рецепторе PYY Li et al. (J. Biol. Chem., 1992, 267, 9-12). При использовании анализа GTPγS пептиды, перечисленные в таблице 7, тестированные в концентрации 5 мкМ, стимулировали связывание GTPγS (увеличение в 1,7-4 раза выше базового уровня) с мембранами из клеток CHO, трансфицированных ДНК, кодирующей DmGPCR6a. Заслуживает внимания, что кроме группы пептидов насекомых и C. elegans, которые активировали данный рецептор, также обнаружено, что NPFF человека (FLFQPQRF-NH2 (SEQ ID№: 59)) является лигандом для DmGPCR6 (4-кратное увеличение связывания GTPγS при 5 мкМ NPFF).
DmGPCR6aL и DmGPCR6bL являются двумя вариантами сплайсинга DmGPCR6a (M811490). Последний согласно сообщению Li et al. (J Biol. Chem., 1992, 267, 9-12) является рецептором PYY. Авторы назвали оба рецептора DmGPCR6aL и DmGPCR6bL RF-амидными рецепторами, так как они узнают только пептиды, которые имеют последовательность Arg-Phe-NH2 (RFa) на C-конце. Пептиды, которые данные DmGPCR не «видели», имеют другие, отличные от Rfa, последовательности на C-конце (например, SFa, QFa, YFa, RLa, DWa, RPa, HFa, LQa, SNa и т.д.). В анализе мобилизации кальция (FLIPR) Dmgpcr6aL и Dmgpcr6bL демонстрировали очень сильные Ca+2-ответы на группу FaRP, тестированных в концентрации 10 мкМ. Последовательности, показанные ниже в таблице 7, представляют собой все идентифицированные активные FaRP, относящиеся к разным видам, включая Drosophila, C. elegans, A. suum, Mollusca, P. redivivus, Trematoda, омара, человека и пиявку. Единственным исключением из «RF-амидного правила» в отношении C-конца был пептид pGluDRDYRPLQF-NH2 (SEQ ID NO: 120), C-конец которого заканчивался последовательностью Gln-Phe-NH2 (QFa). Интересно, что и Dmgpcr6aL и Dmgpcr6bL также узнавали NPFF (FLFQPQRF-NH2 (SEQ ID NO: 152)), пептид млекопитающих с RF-амидной последовательностью на C-конце. (В указанных выше результатах обратите внимание, что p-Glu или pQ относится к пироглутаминовой кислоте).
Как показано при анализе FLIPR, DmGPCR7 (GenBank, №доступа AX128636), временно экспрессированный в клетках CHO-10001A, активировался лейкокининами (LK) и родственными пептидами, а именно LK-I (DPAFNSWGa) (SEQ ID NO: 175), LK-V (GSGFSSWGa) (SEQ ID NO: 176), LK-VI (pGlu-SSFHSWGa) (SEQ ID NO: 177), LK-VIII (GSAFYSWGa) (SEQ ID NO: 178), кулекинином (NPFHSWga) (SEQ ID NO: 179), лимнокинином моллюска (PSFHSWSa) (SEQ ID NO: 180) и лейкокининподобными пептидами Drosophila DLK-1 (NSVVLGKKQRFHSWGa) (SEQ ID NO: 181), DLK-2 (pGlu-RFHSWGa) (SEQ ID NO: 182) и DLK-2A (QRFHSWGa) (SEQ ID NO: 183). DmGPCR7 лучше всего активировался LK-пептидами, имеющими общую C-концевую тетрапептидную последовательность HSWGa. Обработки данной группой пептидов, которая включала DLK-1, DLK-2, DLK-2a, LK-VI и кулекинин, приводили к очень эффективному высвобождению внутриклеточного кальция (EC50 от пикомолярного до субнаномолярного диапазона). В отличие от этого, другие LK саранчи с C-концевой S/NSWGa (LK-I, LK-V), а также LK Lymnaea (SEQ ID NO: 180) демонстрировали низкую эффективность (EC50 15-30 нМ), и LK-VIII со своей C-концевой последовательностью YSWGa был наименее эффективным в серии (EC50 в диапазоне 100-200 нМ). Невозможно было выявить GTPγS-ответов на указанные пептиды в мембранах, полученных из клеток DmGPCR7/CHO, что является показателем Gq/11 -сопряженного рецептора. Таким образом, DmGPCR7 идентифицировали как рецептор лейкокинина, передающий кальциевый сигнал (наиболее вероятно Gq/11-сопряженный), и ему соответствовали дролейкокинины в качестве родственных ему лигандов.
Как показано на основании GTPγS-ответов, DmGPCR8 (GenBank, №доступа AX128638), временно экспрессированный в клетках CHO-10001A, активировался аллатостатином-C Manduca sexta (AST-C или Manse-AC), (pGlu-VRFRQCYFNPISCF-OH) (SEQ ID NO: 184) или дростатином-C (DST-C), также называемым пептидом «ровной линии» (FLT) (pGlu-VRYRQCYFNPISCF-OH) (SEQ ID NO: 185). В эксперименте по исследованию зависимости доза-ответ на основе GTPγS-связывания регистрировали высокоэффективные ответы на AST-C и DST-C (EC50 в низком наномолярном диапазоне). Указанные активности полностью отменялись предварительной обработкой клеток коклюшным токсином, что свидетельствует об участии Gi/Go в активации рецептора. В прямом анализе мобилизации кальция (FLIPR) DmGPCR8 не проявлял никакой активности в том случае, когда ее вызывали AST-C или DST-C. Однако высокую активность в высвобождении кальция в ответ на DST-C регистрировали в клетках CHO-10001A, котрансфицированных DmGPCR8 и химерными G-белками Gqi5 или Gqo5 (EC50 примерно 30 нМ). С другой стороны, сопряжение с Gqz5 было менее эффективным (EC50 244 нМ), и не наблюдалось мобилизации кальция в клетках, котрансфицированных DmGPCR8 и Gqs5. Полученные результаты свидетельствуют, что DmGPCR8 является ингибирующим рецептором в клетках CHO, который предпочтительно сопряжен с G-белками Gi/Go-типа. Представленные результаты определенно идентифицируют DmGPCR8 как рецептор DST-C/FLT.
Для DmGPCR9 был подобран FDDY(SO3H)GHLRF-NH2 (SEQ ID NO: 157) на основании очень сильного сигнала в анализе мобилизации кальция (EC50 в низком наномолярном диапазоне). Тот факт, что не выявлено GTPγS-ответов на данный пептид при использовании мембран, полученных из клеток CHO, трансфицированных ДНК, кодирующей DmGPCR9, свидетельствует, что DmGPCR9 наиболее вероятно сопряжен с Gq-путями передачи сигнала. FDDY(SO3H)GHLRF-NH2 (SEQ ID NO: 157) представляет собой Met7→ Leu7-аналог встречающегося в природе дросульфакинина-1 (DSK-1), FDDY(SO3H)GHMRF-NH2 (SEQ ID NO: 159). Таким образом, авторы определили рецептор DmGPCR9 как рецептор сульфакинина. Данное соответствие очень специфично, так как даже FDDYGHLRF-NH2 (SEQ ID NO: 158), который является несульфатированным аналогом FDDY(SO3H)GHLRF-NH2 (SEQ ID NO: 157), демонстрировал только очень слабый кальциевый сигнал при тестировании в концентрации 10 мкМ, и ни один из других 117 тестированных FaRP и родственных пептидов не проявлял никакой активности ни в анализе FLIPR, ни в анализе GTPγS по отношению к рецептору DmGPCR9.
Таблица сопоставления лигандов с взаимодействующими с ними рецепторами показана ниже в таблице 7.
Пример 10: Конкурентный анализ
Получение монойодированного пептида
Пептид йодировали с помощью обычного способа с хлорамином T. В стеклянный флакон объемом 2 мл добавляют 10 мкл 1 мМ водного раствора пептида, 10 мкл 0,1 М (pH 7,99) буфера на основе фосфата натрия, 1,0 мкюри [125I]-йодида натрия и 5 мкл раствора хлорамина T с концентрацией 2 мг/мл (в фосфатном буфере). Смесь встряхивают в течение 60 секунд и реакцию останавливают добавлением 25 мкл раствора метабисульфита натрия в фосфатном буфере в концентрации 5 мг/мл. Затем смесь подвергают ВЭЖХ, инъецируя ее на колонку Vydac C18 (0,45×15 см) и подвергая ее градиентному разделению. Используемый градиент представляет собой от 70% A и 30% B в нулевое время до 20% A и 80% B во временной точке 25 минут (A=0,1 М ацетат NH4 в воде. B=0,1 М ацетат NH4 в воде 40%:CH3CN 60%, об.:об.). Расход составляет 1,0 мл/минуту. Образцы собирают в 0,25 мл буфера для захвата (0,1 М натрий-фосфатный буфер с 0,5% бычьего сывороточного альбумина, 0,1% тритон X100 и 0,05% твин 20) с интервалами в 30 секунд от t=8 до t=20 минутам. Монойодпептид обычно элюируется при t=11 минутам, и выход составляет примерно 100 мкКи в 0,75 мл.
Анализ связывания
Используемые 96-луночные планшеты являются планшетами для фильтрации Millipore Multiscreen® (FB непрозрачные из стекловолокна 1,0 мкМ типа B, № в каталоге MAFBNOB50). Для фильтрования в конце анализа вместе с планшетами используют устойчивый к растворителям коллектор Millipore Multiscreen® (№ в каталоге MAVMO960R). Каждый повтор представлен одной лункой и имеет объем 100 мкл, содержащий 5 мкг белка (приготовление описано выше). Каждая тестируемая группа имеет два повтора. Для каждого тестируемого соединения одну группу испытывают только с [125I]-пептидом (для общего связывания), а одну с 1 мкМ (или указанной) концентрацией тестируемого соединения и [125I]-пептидом (для неспецифичного связывания). Порядок добавления реагентов для каждого повтора: буфер для анализа (20 мМ HEPES, 10 мМ MgCl2, 1% бычий сывороточный альбумин, pH 7,4), тестируемое соединение (приготовленное в буфере для анализа), [125I]-пептид (в буфере для анализа) и суспензия мембран (в буфере для анализа). Добавление суспензии мембран инициирует реакцию связывания, которую проводят в течение 30 минут при комнатной температуре (22°C). После 30 минутной инкубации каждый планшет помещают на коллектор для фильтрации и прилагают вакуум, прокачивая жидкость через фильтр (отбрасываемую) и улавливая белок на фильтрах в каждой лунке. Для промывки вакуум отключают и в каждую лунку добавляют 200 мкл буфера для анализа, после чего снова подключают вакуум. Указанную промывку повторяют еще два раза (всего 3X промывки для каждого повтора). После промывки пластиковое покрытие на нижней стороне каждого планшета удаляют, и планшет помещают в кассету для сцинтилляционного счета с герметично закрытым дном Microbeta® (№ в каталоге 1450-105). В каждую лунку добавляют 25 мкл сцинтиллятора и планшет помещают на ротационный встряхиватель при 80 об/мин на один час и затем дают возможность стоять в течение ночи. На следующий день планшет считают в сцинтилляционном счетчике Microbeta®. Среднее неспецифичное связывание вычитают из общего связывания, получая специфичное связывание как для стандарта (пептидамид), так и неизвестных соединений.
Как будет понятно специалистам в данной области, могут быть осуществлены многочисленные изменения и модификации вариантов изобретения, описанных выше, не отходя от сути изобретения. Предполагается, что все такие изменения входят в объем изобретения.
Полное описание каждой публикации, цитированной в данном описании, тем самым включено в виде ссылки.
Реферат
Изобретение относится к генной инженерии, а именно к полипептидам GPCR Drosophila melanogaster (DmGPCR) и полинуклеотидам, которые определяют и кодируют такие полипептиды. Конструирование экспрессирующих векторов на основе упомянутых полинуклеотидов и получение содержащих их клеток-хозяев позволяет применять DmGPCR в качестве инсектицидов. Изобретение, кроме того, относится к способам связывания DmGPCR, способ идентификации модуляторов экспрессии и активности DmGPCR, способам контроля популяции насекомых с использованием антитела к DmGPCR, антисмыслового полинуклеотида DmGPCR, связывающего партнера или модулятора DmGPCR. 7 н. и 28 з.п. ф-лы, 7 табл.
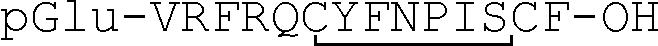


Комментарии