Олигопептид, обладающий активностью в прикреплении, распластывании и откреплении клеток, и фармацевтическая композиция - RU2241005C2
Код документа: RU2241005C2
Чертежи








Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к пептидам и их производным, проявляющим активность в прикреплении, распластывании и откреплении клеток. В частности, данное изобретение относится к пептиду NKDIL и EPDIM и их производным, которые стимулируют активность в прикреплении клеток посредством взаимодействия с интегрином α3β1 в качестве функционального клеточного рецептора, и содержат аспарагиновую кислоту и изолейцин, необходимые для активности в прикреплении и откреплении клеток.
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
βig-h3 является белком внеклеточного матрикса, экспрессия которого индуцируется в разных линиях клеток, включая клетки меланомы человека, эпителиальные клетки млекопитающих, кератиноциты и фибробласты легкого, после передачи сигнала активным TGF-β. Сначала ген βig-h3 выделили в результате основанного на дифференциальной гибридизации скрининга библиотеки кДНК, полученной из линии клеток аденокарциномы легкого человека, которые были обработаны TGF-β. Ген βig-h3 кодирует белок из 683 аминокислот, который высоко консервативен среди разных видов. Он содержит N-концевой сигнальный пептид секреции и мотив Arg-Gly-Asp (RGD) на С-конце. Мотив RGD, который модулирует адгезию клеток, обнаружен во многих белках внеклеточного матрикса и служит в качестве последовательности узнавания лигандов для нескольких интегринов.
Так как TGF-β увеличивает экспрессию гена βig-h3 в разных линиях клеток и ген индуцируется в разных линиях клеток, скорость пролиферации которых контролируется TGF-β, предполагается, что βig-h3 вовлечен в опосредование некоторых путей передачи сигнала TGF-β. Напротив, сообщалось, что экспрессия βig-h3 снижается в фибробластах, культивирируемых из участков повреждения кожи, пораженных локальным гиперостозом при мелореостозе, в некоторых опухолевых клетках и стволовых клетках, обработанных дексаметазоном. Следовательно, βig-h3 играет важную роль в морфогенезе и взаимодействиях с клетками и другими белками внеклеточного матрикса в разных тканях.
Кроме того, известно, что βig-h3 опосредует прикрепление и открепление клеток, выполняя роль молекулы клеточной адгезии. Обнаружено, что очищенный белок βig-h3 стимулирует прикрепление и распластывание фибробластов кожи наряду с ингибированием адгезии клеток А549, HeLa и Wi-38 в бессывороточных средах. В частности, известно, что βig-h3 обладает ингибирующей активностью, направленной против роста клеток опухоли и образования колоний. Действительно, сообщалось, что βig-h3 в высокой степени подавлял рост клеток СНО (яичника китайского хомячка) у мышей nude. Кроме того, разработан способ заживления ран на основе наблюдения того, что нанесение на раны фармацевтически эффективного количества βig-h3 заставляет клетки, особенно фибробласты, распластываться над местом раны и слипаться с ним. Поэтому βig-h3, молекула клеточной адгезии, индуцируемая TGF-β в разных линиях клеток, играет очень важную роль в росте клеток, дифференцировке клеток, заживлении ран, морфогенезе и адгезии клеток.
βig-h3 содержит четыре повтора из 140 аминокислот с внутренней гомологией. Повторяющиеся внутри домены имеют высоко консервативные последовательности, обнаруженные в секретируемых белках или мембранных белках разных видов, включая млекопитающих, насекомых, морского ежа, растения, дрожжи и бактерии. Такие белки, как периостин, фасциклин I, HLC-2 морского ежа, САМ водорослей и МРВ70 микобактерии, являются примерами, содержащими консервативные последовательности. Гомологичный домен, консервативный у указанных белков (в дальнейшем называемый “fas-1”), состоит примерно из 110-140 аминокислот с двумя высоко консервативными ветвями Н1 и Н2, каждая из которых содержит примерно 10 аминокислот. Четыре домена fas-1 обнаружены в βig-h3, периостине и фасциклине I, два домена fas-1 в HLC-2 и только один домен fas-1 в МРВ70. Хотя функции белков точно не выяснены, известно, что некоторые из них действуют как молекулы клеточной адгезии. Например, сообщается, что βig-h3, периостин и фасциклин I соответственно опосредуют адгезию фибробластов, остеобластов и нервных клеток. Также сообщается, что САМ водорослей является молекулой клеточной адгезии, присутствующей в зародышах водоросли Volvox.
Сначала активность βig-h3 в прикреплении клеток обнаружили в фибробластах кожи человека, а затем - в хондроцитах, перитонеальных фибробластах и фибробластах MRC5 человека. Сначала считали, что активность βig-h3 в прикреплении клеток, вероятно, опосредуется С-концевым мотивом RGD. Однако в результате некоторых исследований выявлено, что мотив RGD не является необходимым для стимулирования распластывания хондроцитов и что зрелый растворимый βig-h3, у которого делетирован мотив RGD в результате процессинга карбоксильного конца, способен ингибировать адгезию клеток, что приводит к заключению о том, что мотив RGD βig-h3 несущественен для опосредования активности βig-h3 в прикреплении клеток. Кроме того, недавно сообщалось, что βig-h3 стимулирует распластывание фибробластов посредством интегрина α1β1, тогда как мотив RGD βig-h3 не является необходимым для опосредованного βig-h3 распластывания клеток. Кроме того, консервативные пептиды Н1 и Н2 βig-h3 не ингибируют опосредованную βig-h3 адгезию клеток, таким образом, консервативные пептиды не влияют на прикрепление клеток, опосредованное βig-h3. Полученные результаты, вместе взятые, свидетельствуют о том, что аминокислоты, необходимые для активности βig-h3 в прикреплении клеток, существуют в других районах, отличных от Н1 и Н2. Компьютерный анализ гомологии доменов fas-1 в других белках, а также повторяющихся доменов fas-1 βig-h3 показывает наличие нескольких высоко консервативных аминокислотных последовательностей, кроме пептидов Н1 и Н2, что свидетельствует о возможности участия консервативных аминокислотных последовательностей в активности в прикреплении клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Результатом проведенного авторами данного изобретения интенсивного и всестороннего исследования консервативных мотивов, ответственных за активность в прикреплении и откреплении клеток, которое привело к данному изобретению, было обнаружение того, что аспарагиновая кислота и изолейцин в положениях вблизи района Н2 в каждом 2-м и 4-м fas-1-доменах βig-h3 очень высоко консервативны и идентифицированы как функционально необходимая единица для опосредования адгезии клеток посредством интегрина α3β1.
Поэтому данное изобретение относится к пептидам и их производным, которые содержат консервативные аминокислотные последовательности, необходимые для активности в прикреплении, распластывании и откреплении клеток.
Другим объектом данного изобретения являются фармацевтические композиции для применения при заживлении ран, регенерации тканей и придании устойчивости к метастазам злокачественных опухолей.
Согласно одному аспекту данное изобретение относится к пептиду, обладающему активностью в прикреплении, распластывании и откреплении клеток, содержащему аминокислотную последовательность, представленную следующими однобуквенными символами: XXDIX, где X представляет собой любую из двадцати обычных аминокислот, D - аспарагиновую кислоту и I - изолейцин и их производные.
Согласно другому аспекту данное изобретение относится к фармацевтической композиции, содержащей указанный выше пептид или его производное в качестве фармацевтически активного ингредиента.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
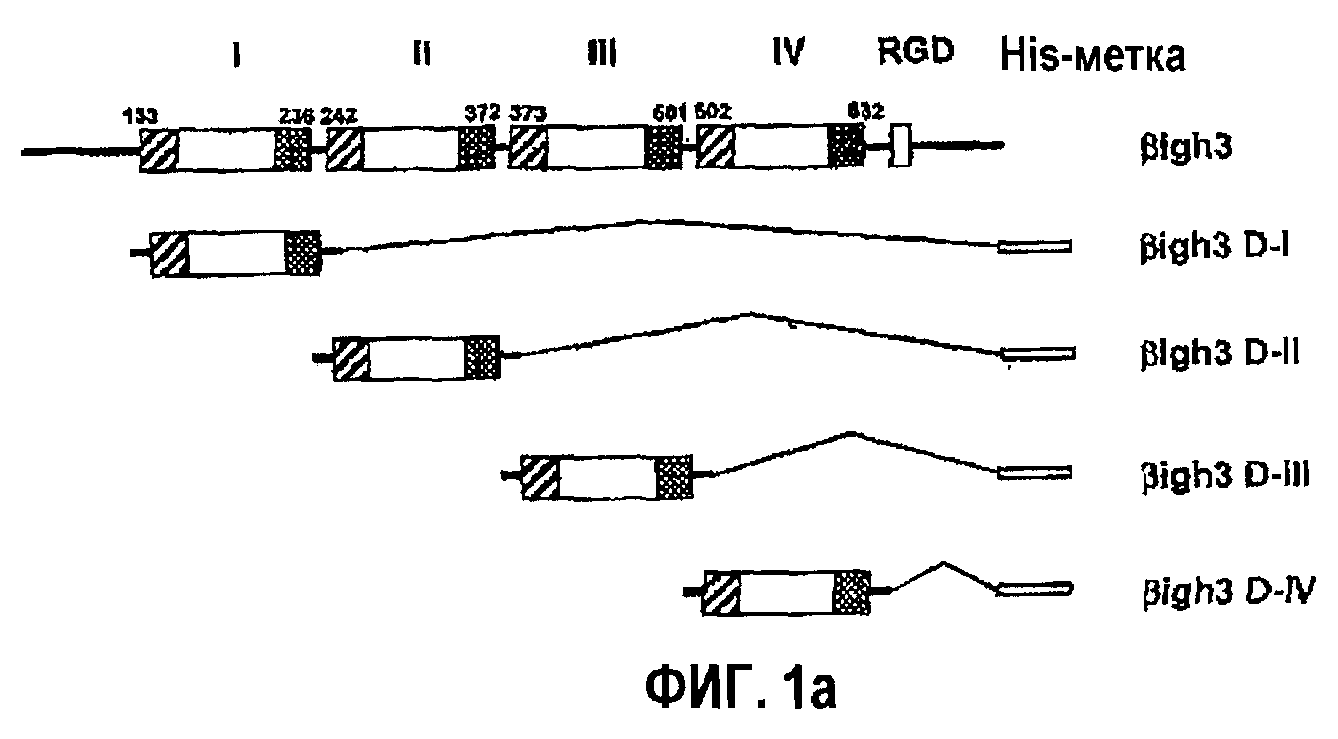
Фиг.1а является схематической диаграммой, на которой показаны рекомбинантные белки, полученные из доменов fas-1 βig-h3.
Фиг.1b является фотографией, на которой показаны результаты SDS-ПААГ рекомбинантных белков, полученных из доменов fas-1 βig-h3.
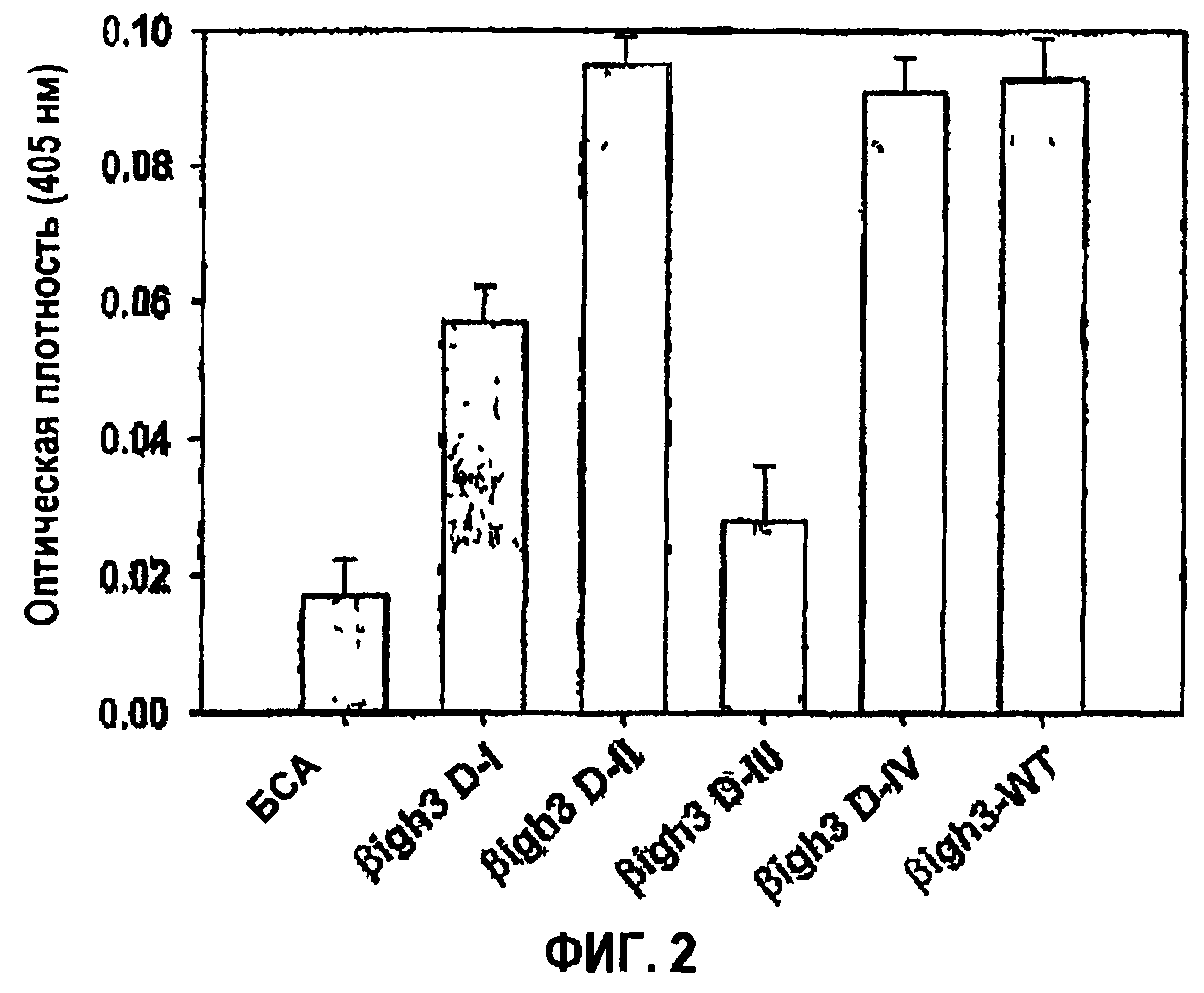
Фиг.2 является гистограммой, на которой показана активность рекомбинантных белков, полученных из доменов fas-1 βig-h3, в прикреплении клеток.
Фиг.3 является гистограммой, на которой показана ингибирующая активность антиинтегринового антитела, направленная против активности рекомбинантных белков, полученных из доменов fas-1 βig-h3, в прикреплении клеток.
На фиг.4 показаны аминокислотные последовательности различных белков матрикса, содержащих домены fas-1.
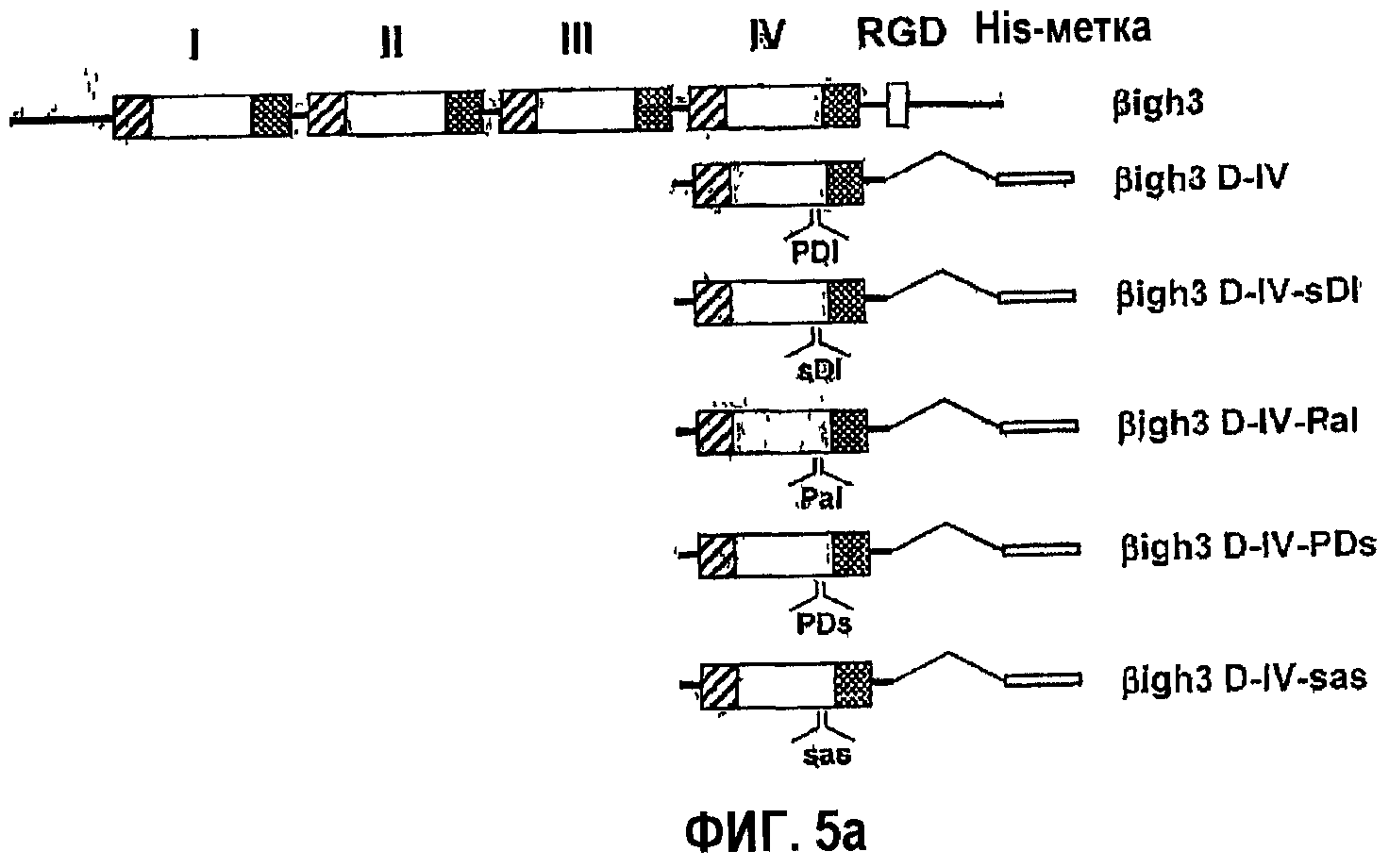
Фиг.5а является схематичной диаграммой, на которой показаны мутанты с заменами, полученные из 4-го fas-1-домена βig-h3.
Фиг.5b является фотографией, на которой показаны результаты электрофореза в 15% полиакриламидном геле мутантов с заменами, полученных из 4-го fas-1-домена β ig-h3.
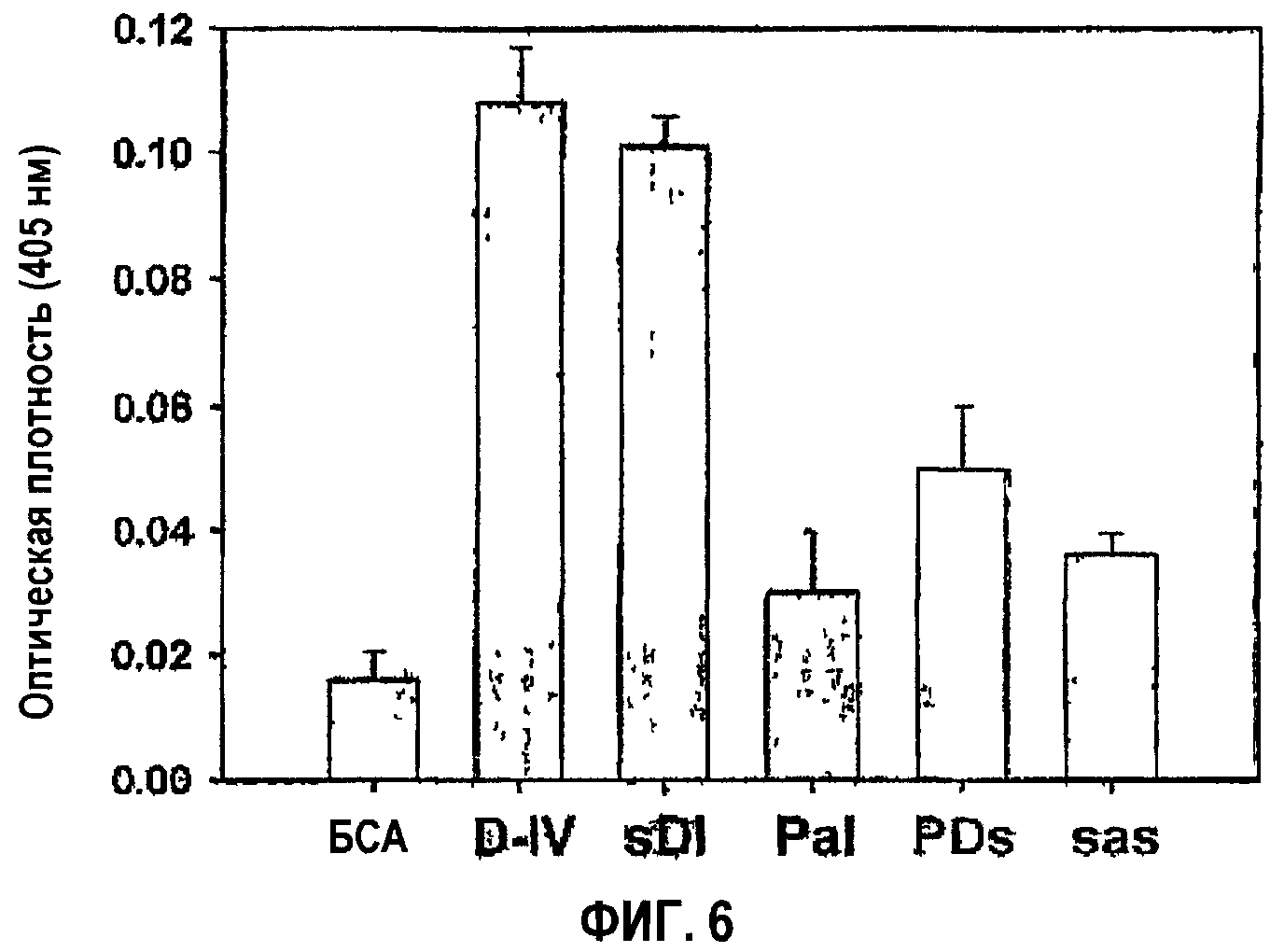
Фиг.6 представляет собой гистограмму, на которой показана активность в прикреплении клеток мутантов с заменами, полученных из 4-го fas-1-домена βig-h3.
На фиг.7 показаны аминокислотные последовательности синтетических пептидов согласно данному изобретению.
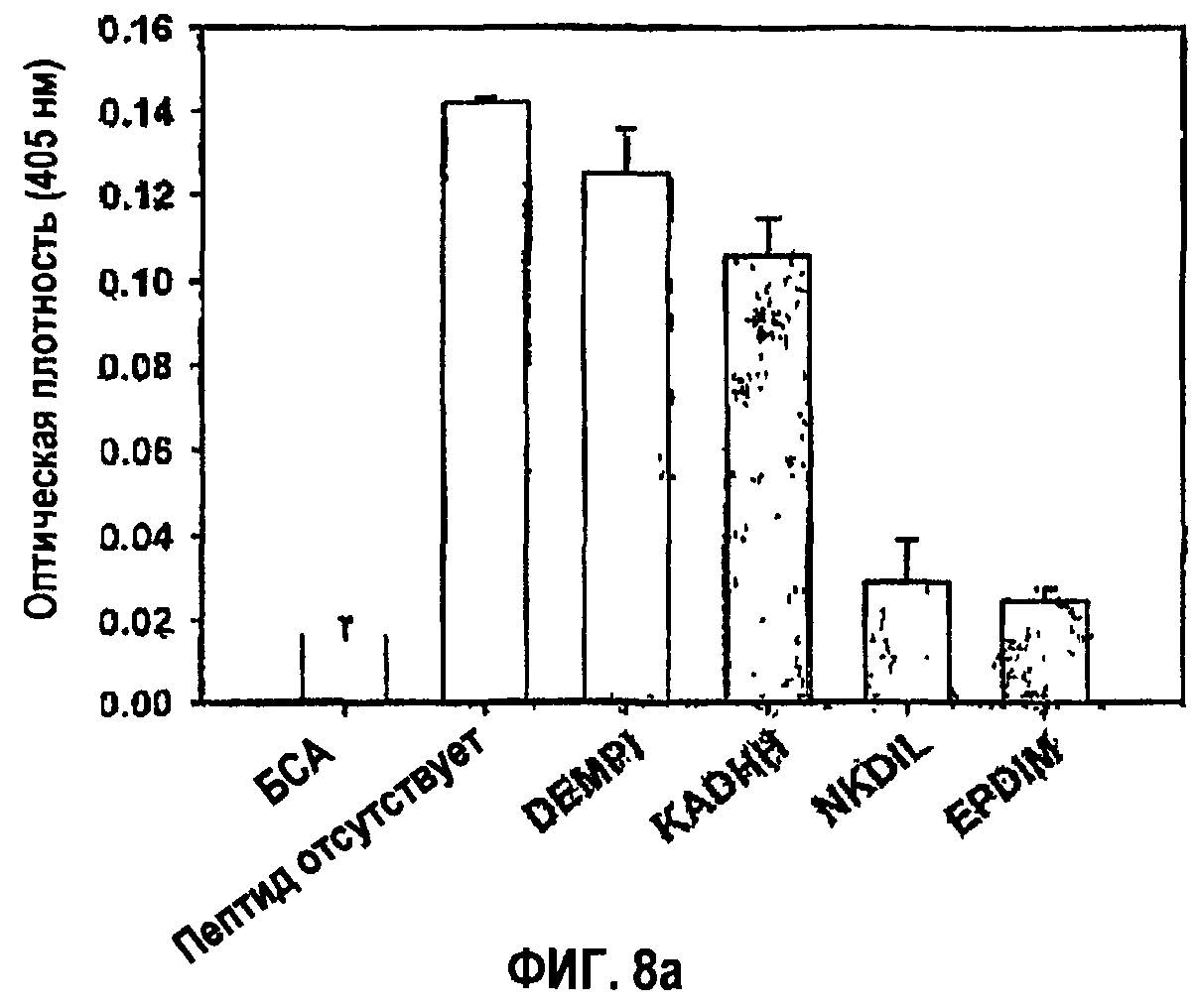
Фиг.8а является гистограммой, показывающей ингибирующую активность синтетических пептидов, направленную против адгезии клеток НСЕ.
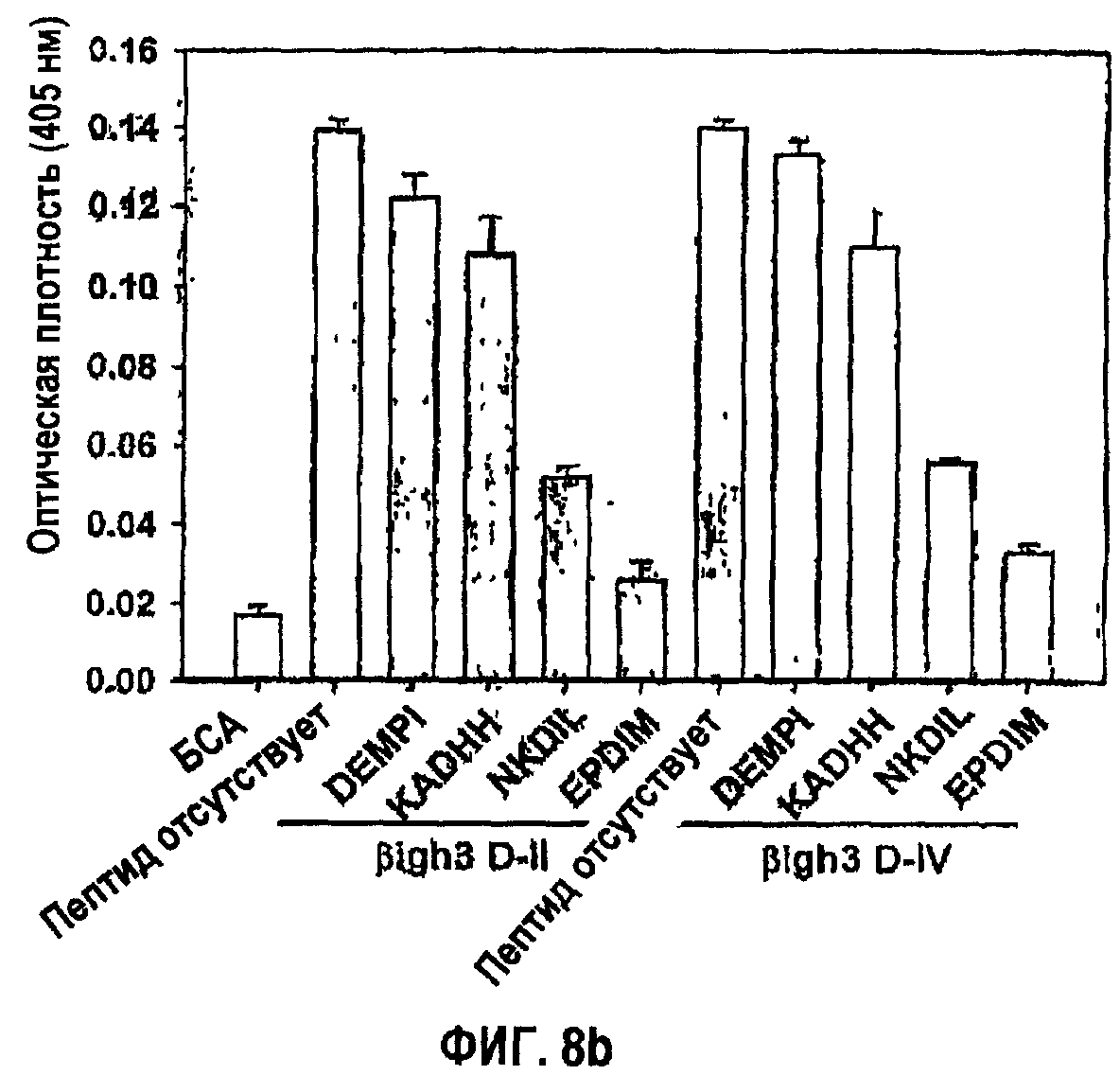
Фиг.8b является гистограммой, показывающей ингибирование адгезии клеток НСЕ с белками βig-h3 D-II или βig-h3 D-IV синтетическими пептидами βig-h3.
Фиг.9а представляет собой кривую, показывающую активность синтетических пептидов согласно данному изобретению в прикреплении клеток НСЕ.
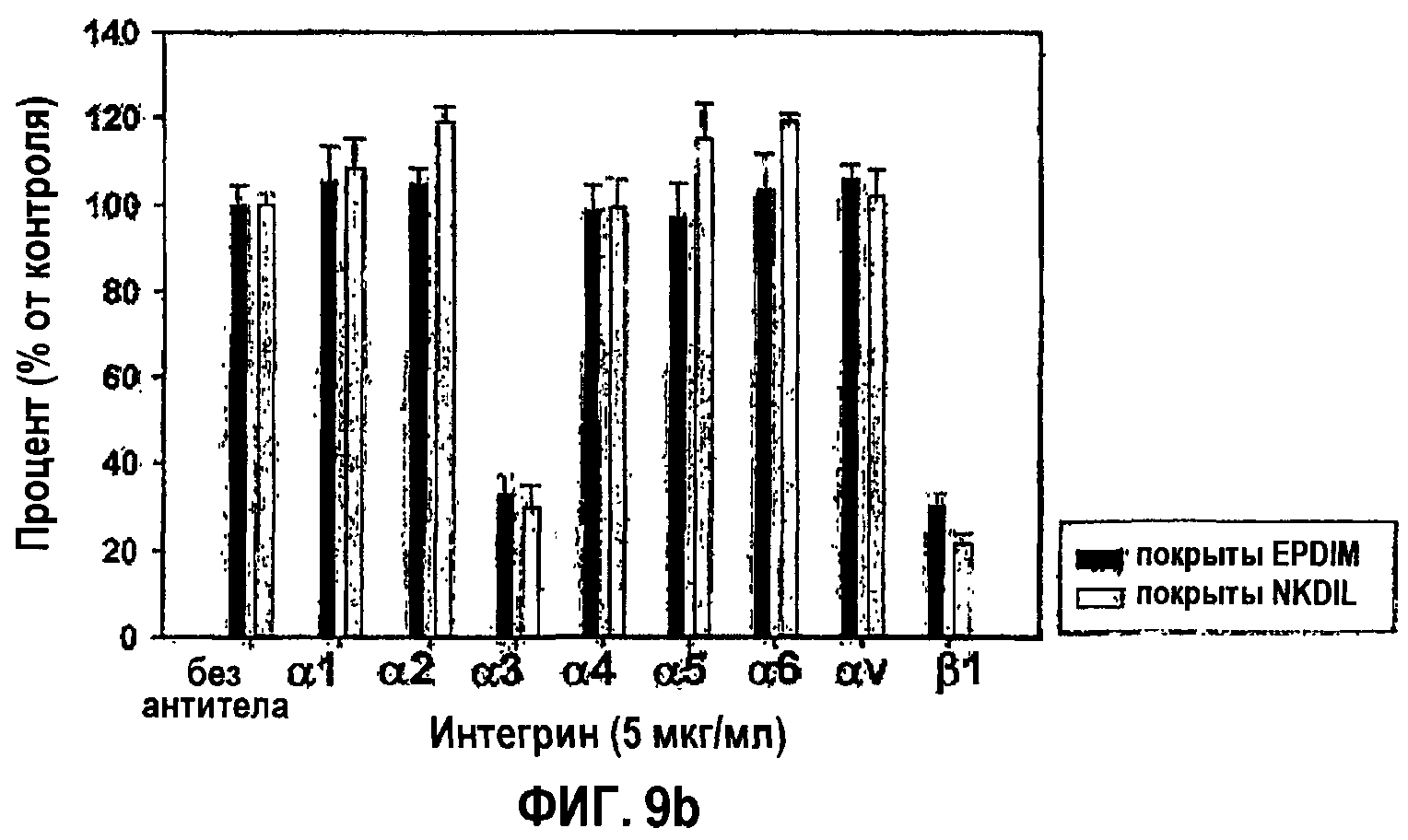
Фиг.9b является гистограммой, на которой показано ингибирование антиинтегриновыми антителами адгезии клеток НСЕ к синтетическим пептидам EPDIM и NKDIL.
Фиг.10а является гистограммой, показывающей влияние синтетических пептидов согласно данному изобретению на адгезию клеток НСЕ к нескольким белкам внеклеточного матрикса.
Фиг.10b представляет собой кривую, показывающую дозозависимое ингибирование адгезии клеток НСЕ к нанесенным на поверхность белкам внеклеточного матрикса, в присутствии разных концентраций EPDIM.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном изобретении используют аминокислотную последовательность βig-h3, которая, как известно, опосредует активность в прикреплении клеток, для получения пептидов, содержащих консервативные последовательности, необходимые для активности в прикреплении и распластывании клеток, на основании полученных данных о том, что только βig-h3, содержащий 4 домена fas-1, а также отдельно либо 2-й, либо 4-й домен, может опосредовать активность в прикреплении клеток.
Более подробно, синтезировали четыре укороченных фрагмента ДНК гена β ig-h3, а именно βig-h3 D-I, βig-h3 D-II, βig-h3 D-III и βig-h3 IV, которые соответственно кодируют с 1-го по 4-й внутренние повторяющие домены, как показано на фиг.1а. Количественное измерение, которое показывает активность в прикреплении и распластывании клеток четырех полученных в результате рекомбинантных белков, демонстрирует, что только либо 2-й, либо 4-й домен из четырех fas-1-доменов может опосредовать активность βig-h3 в прикреплении и распластывании клеток, как показано на фиг.2, что свидетельствует о наличии в двух доменах аминокислот, необходимых для опосредования прикрепления и распластывания клеток. Напротив, 1-й домен βig-h3 проявляет промежуточную активность в прикреплении и распластывании клеток, тогда как в случае 3-го домена не выявляется активность в прикреплении клеток.
Также согласно данному изобретению идентифицирован интегрин α3β1 как функциональный рецептор для 2-го и 4-го доменов βig-h3.
Используя укороченные белки, содержащие 2-й и 4-й домены βig-h3, каждый из которых проявляет активность в прикреплении, распластывании и откреплении клеток, авторы данного изобретения исследовали рецепторы βig-h3. Активность в прикреплении клеток, опосредованная 2-м или 4-м доменами fas-1, почти полностью подавляли антителами против субъединиц α3 и β1 интегрина, как показано на фиг.3. Полученные результаты означают, что оба домена, 2-й и 4-й, связываются с функциональным рецептором интегрином α3β1, опосредуя активность в прикреплении клеток, и имеют аминокислоты, необходимые для того, чтобы опосредовать активность в адгезии клеток.
Данное изобретение также относится к пептидам, которые содержат характерную консервативную аминокислотную последовательность Asp-Ile, необходимую для активности βig-h3 в прикреплении, распластывании и откреплении клеток, и, следовательно, проявляют такую же активность, как и 2-й и 4-й домены.
Чтобы обнаружить аминокислотную последовательность, ответственную за адгезию клеток, во 2-м и 4-м fas-1-доменах βig-h3, которая независимо проявляет активность в прикреплении, распластывании и откреплении клеток, выполнили выравнивание аминокислотных последовательностей не только между внутренними повторяющимися fas-1-доменами β ig-h3, но также между другими белками, содержащими домены fas-1. После этого авторы данного изобретения обнаружили, что две аминокислоты, аспарагиновая кислота и изолейцин вблизи района Н2 являются высоко консервативными среди разных белков, как показано на фиг.4.
Далее остается подтвердить необходимость аминокислотной последовательности аспарагиновой кислоты и изолейцина для активности в прикреплении клеток. Для этого осуществили мутацию укороченного белка, содержащего 4-й fas-1-домен βig-h3, заменой пролина, аспарагиновой кислоты и изолейцина серином аланином и серином соответственно, как показано на фиг.5а. Наблюдали почти полное подавление опосредованной 4-м fas-1-доменом активности в прикреплении клеток мутантных белков, в которых были заменены аспарагиновая кислота и изолейцин, что подтверждает, что аминокислотная последовательность аспарагиновой кислоты и изолейцина имеет очень важное значение в опосредовании активности βig-h3 в прикреплении клеток.
Кроме того, обе аминокислоты – аспарагиновая кислота и изолейцин, являются консервативными во 2-м и 4-м fas-1-доменах βig-h3, которые обладают высокой активностью в прикреплении клеток, тогда как в 1-м fas-1-домене 1, который проявляет промежуточную активность в прикреплении клеток, консервативна только аспарагиновая кислота. Что касается 3-го fas-1-домена, который не проявляет активности в прикреплении клеток, в нем отсутствуют обе аминокислоты. Полученные факты являются дальнейшим доказательством, свидетельствующим, что аспарагиновая кислота и изолейцин необходимы для того, чтобы опосредовать активность в прикреплении и распластывании клеток.
Подтверждая необходимость аспарагиновой кислоты и изолейцина для активности в прикреплении клеток, синтезировали три пептида, содержащих две аминокислоты из fas-1-доменов I, II и IV βig-h3 соответственно. Указанные пептиды имеют консервативные последовательности fas-1-доменов I, II и IV βig-h3. То есть пептиды сконструированы так, чтобы они имели KADHH (а/к 219-223) SEQ ID NO. 1, NKDIL (а/к 354-358) SEQ ID NO. 2 и EPDIM (а/к 615-619) SEQ ID NO. 3, которые показаны на фиг.7.
Что само собой разумеется, указанные синтетические пептиды, полученные из fas-1-доменов βig-h3, исследовали в отношении активности в прикреплении и распластывании клеток. Оценивали синтетический пептид NKDIL, полученный из 2-го fas-1-домена, и синтетический пептид EPDIM, полученный из 4-го fas-1-домена, чтобы показать превосходное действие в откреплении клеток при значительном подавлении активности в прикреплении клеток, как видно на фиг.8а. С другой стороны, относительно очень низкое влияние на открепление клеток наблюдали в случае синтетического пептида KADHH, полученного из 1-го fas-1-домена, вследствие слабого подавления адгезии клеток, а также контрольного пептида DEMPI, не проявляющего влияния вследствие отсутствия активности в адгезии клеток. Результаты подавления, направленного против активности в прикреплении клеток, полученные в случае использования 2-го и 4-го fas-1-доменов в качестве субстратов, были почти такими же, как результаты, полученные при использовании в качестве субстрата βig-h3, как показано на фиг.8b.
Как показано на фиг.9а, синтетические пептиды NKDIL и EPDIM способны опосредовать адгезию клеток дозозависимым образом. Более того, выявлено, что интегрин α3β1, известный как поверхностный рецептор βig-h3, действует как рецептор в опосредованной синтетическими пептидами EPDIM и NKDIL адгезии клеток, что видно на фиг.9b. По этим причинам NKDIL и EPDIM, по-видимому, специфично конкурируют с молекулами, взаимодействующими с α3β1, как показано на фиг.10а.
Как описано выше, в данном изобретении представлены пептиды, NKDIL и EPDIM, которые содержат аспарагиновую кислоту и изолейцин, необходимые для активности в прикреплении и откреплении клеток, и которые являются достаточными для того, чтобы индуцировать адгезию клеток посредством интегрина α3β1, который является функциональным рецептором для βig-h3. Указанные пептидные последовательности получены из консервативной последовательности fas-1-доменов II и IV, которая независимо индуцирует адгезию клеток. Пептиды согласно данному изобретению можно успешно использовать для изучения активности в прикреплении клеток, опосредованной различными белками внеклеточного матрикса, включая βig-h3, и разработке пептидов, стимулирующих прикрепление, распластывание и открепление клеток.
Согласно следующему аспекту данного изобретения представлены фармацевтические композиции, содержащие пептиды, проявляющие активность в прикреплении и откреплении клеток, или их производные в качестве эффективных ингредиентов, придающих способность заживлять раны и осуществлять регенерацию тканей и резистентность к метастазам злокачественных опухолей.
Пептиды или их производные, вводимые посредством перорального или парентерального путей, можно применять в обычных лекарственных формах. То есть пептиды или их производные можно приготовить в виде различных дозированных форм для парентерального введения. Для приготовления композиции можно использовать фармацевтически приемлемые разбавители, наполнители и/или носители, включая наполнители, загустители, связывающие вещества, увлажняющие агенты, дезинтеграторы, поверхностно-активные вещества и т.д. Дозированные формы для парентерального введения включают стерильные водные растворы, неводные растворители, суспензии, эмульсии, лиофильно высушенные средства, суппозитории и т.д. Для приготовления растворов в неводных растворителях и суспензий можно использовать растительные масла, такие как пропиленгликоль и полиэтиленгликоль, или инъецируемые сложные эфиры, такие как этилолеат. В качестве основы для суппозиториев пригодны витепсол, макрогол, твин 61, масло какао, лауриновая кислота и глицерожелатин.
Кроме того, пептиды и их производные можно использовать в комбинации с фармацевтически приемлемыми носителями, такими как биологически активные солевые или органические растворители. Также для повышения стабильности или абсорбции пептидов можно применять углеводы, такие как глюкоза, сахароза и декстран, антиоксиданты, такие как аскорбиновая кислота и глутатион, хелатирующие агенты, белки с низкой молекулярной массой или другие стабилизаторы.
Суммарное эффективное количество пептидов можно вводить в виде дозированной болюсной формы или можно вводить посредством инфузии в одной дозе в том случае, когда желателен относительно короткий период введения. Альтернативно, при введении пептидов можно придерживаться способа многократных доз согласно протоколу фракционного лечения. В зависимости от возраста, состояний организма и массы тела пациентов, а также путей введения и количества лечений фармацевтически эффективная доза пептидов согласно данному изобретению может варьировать, и ее легко могут определить специалисты в данной области.
Поскольку фармацевтические композиции, содержащие в качестве эффективных ингредиентов пептиды или их производные, вводят парентерально, их не тестировали на токсичность.
ПРИМЕРЫ
Лучше понять данное изобретение можно в свете следующих примеров, которые представлены для иллюстрации и не предназначены для ограничения данного изобретения.
ПРИМЕР 1: Создание рекомбинантных белков fas-1-доменов βig-h3 и анализ активности в прикреплении клеток
Чтобы выявить аминокислоты βig-h3, необходимые для адгезии клеток, определяли способность каждого из четырех повторяющихся fas-1-доменов опосредовать адгезию клеток к βig-h3. C этой целью для анализа активности в прикреплении клеток были созданы четыре рекомбинантных белка, которые содержали четыре повторяющихся домена fas-1.
1-1: Получение рекомбинантных белков fas-1 βig-h3, кодирующих каждый из четырех повторяющихся доменов
Посредством ПЦР создали четыре фрагмента ДНК, кодирующие с 1-го по 4-й домены, соответствующие основаниям с 133 по 236, с 242 по 372, с 373 по 501 и с 502 по 632 гена β ig-h3 соответственно, и клонировали в pET-29β (Novagen), чтобы сконструировать экспрессирующие векторы для доменов fas-1, названные βig-h3 D-1, βig-h3 D-II, βig-h3 D-III и βig-h3 D-IV, которые показаны на фиг.1а. С-конец фрагментов ДНК снабжали 6 тандемно повторяющимися остатками гистидина, чтобы получить His-метку, которая пригодна для очистки экспрессированных белков с использованием смолы Ni-NTA (Quiagen). Штамм BS21(DE3) E. coli трансформировали каждым рекомбинантным экспрессирующим вектором и культивировали в средах LB, содержащих 50 мкг/мл канамицина. Рекомбинантные белки βig-h3 индуцировали культивированием трансформантов в присутствии 1 мМ IPTG с последующим центрифугированием. Осадок суспендировали в лизирующем буфере, состоящем из 50 мМ трис-HCl (рН 8,0), 100 мМ EDTA, 1% тритона Х-100, 1 мМ PMSF и 0,5 мМ ДТТ, и затем озвучивали, чтобы лизировать клетки. После пяти повторений процедуры проводили центрифугирование, чтобы отделить надосадок, из которого представляющие интерес белки очищали на колонке, наполненной смолой Ni-NTA.
В SDS-ПААГ рекомбинантный белок βig-h3 D-I выявляли в области 14,4 кД, тогда как все другие рекомбинантные белки, βig-h3 D-II, βig-h3 D-III и βig-h3 D-IV, выявляли в области 21,5 кД, что показано на фиг.1b.
1-2: Анализ активности рекомбинантных белков fas-1-доменов βig-h3 в прикреплении клеток
Рекомбинантные белки fas-1-доменов βig-h3, полученные, как описано выше, анализировали в отношении активности в прикреплении клеток. Сначала рекомбинантным белкам βig-h3 давали возможность прилипнуть ко дну 96-луночных планшетов для микротитрования (Falcon) посредством инкубации при 37°С в течение 1 часа и блокировали PBS, содержащим 0,2% БСА. Клетки НСЕ суспендировали в среде для культивирования при плотности 2×105 клеток/мл. В каждую лунку планшетов, покрытых рекомбинантными белками, добавляли 0,1 мл суспензии клеток. После инкубации при 37°С в течение 1 часа неприкрепленные клетки удаляли промывкой PBS. Прикрепленные клетки инкубировали в течение 1 часа при 37°С в 50 мМ цитратном буфере, рН 5,0, содержащем 3,75 мМ пара-нитрофенол-N-ацетил-1-β-D-глюкозаминид в качестве субстрата гексозаминидазы, и 0,25% тритона Х-100, после чего добавляли 50 мМ глициновый буфер, рН 10,4, содержащий 5 мМ EDTA, чтобы блокировать ферментативную активность. Измерение оптической плотности проводили при 405 нм в считывающем устройстве для микропланшетов Multiscan MCC/340. Данные оптической плотности показаны на фиг.2.
Как видно на гистограмме фиг.2, клетки НСЕ проявляли активность в прикреплении и распластывании клеток, сравнимую с активностью βig-h3 дикого типа (βig-h3-WT), в обоих планшетах, покрытых рекомбинантным белком 2-го fas-1-домена (βigh3-D-II) и рекомбинантным белком 4-го fas-1-домена (βigh3-D-IV), при этом слабая активность проявлялась в планшете, покрытом рекомбинантным белком 1-го fas-1-домена (βigh3-D-I). С другой стороны, почти не выявлена активность в планшете, покрытом рекомбинантным белком fas-1-домена III (βigh3-D-III).
Либо 2-й, либо 4-й домен fas-1 достаточны для того, чтобы опосредовать адгезию и распластывание клеток, что свидетельствует о том, что аминокислоты, необходимые для адгезии и распластывания клеток, присутствуют в каждом из двух доменов.
1-3: Идентификация рецепторов для белков fas-1-доменов βig-h3
Используя рекомбинантные белки 2-го и 4-го доменов βig-h3, каждый из которых проявлял активность в прикреплении и распластывании клеток, исследовали рецепторы βig-h3. С этой точки зрения исследовали влияние блокирующих функционирование моноклональных антител против разных субъединиц интегрина на адгезию клеток НСЕ к поверхности, покрытой βig-h3.
Подробно, НСЕ предварительно инкубировали в растворе для инкубации (3×105клеток/мл) в присутствии каждого из моноклональных антител (5 мкг/мл) против разных типов интегринов при 37°С в течение 30 мин. Предварительно инкубированные клетки переносили в планшеты, предварительно покрытые белками βig-h3, и затем инкубировали при 37° С еще в течение 1 часа, после чего проводили количественный анализ с субстратом гексозаминидазы, как описано в примере 1-2. Данные количественного анализа приведены на фиг.3, на которой значения выражены в процентах от количества клеток, прилипающих в отсутствии моноклональных антител.
Как видно на фиг.3, адгезия клеток, опосредованная 2-м или 4-м fas-1-доменами, почти полностью ингибировалась обоими антителами против субъединиц интегрина α3 и β1. Полученные результаты свидетельствуют о том, что оба fas-1-домена, 2-й и 4-й, связываются с интегрином α3β1, опосредуя активность в прикреплении клеток, и имеют аминокислоты, необходимые для опосредования.
ПРИМЕР 2: Аминокислоты, аспарагиновая кислота и изолейцин, необходимые для активности βig-h3 в прикреплении и распластывании клеток
2-1: Выравнивание аминокислотных последовательностей разных белков, содержащих домены fas-1
Чтобы идентифицировать аминокислоты, ответственные за адгезию клеток, во 2-м и 4-м fas-1-доменах βig-h3, выравниванию аминокислотных последовательностей подвергали не только внутренние повторяющиеся fas-1-домены βig-h3, но также другие белки, содержащие fas-1-домены, каждый из которых обладает активностью в прикреплении и распластывании клеток. В результате обнаружено, что две аминокислоты, а именно аспарагиновая кислота и изолейцин, являются высоко консервативными в сайте вблизи района Н2 каждого домена fas-1 среди разных субстратных белков, как показано на фиг.4. В целом, и аспарагиновая кислота и изолейцин являются консервативными в разных доменах fas-1, включая 2-й и 4-й домены βig-h3, тогда как в 1-м домене fas-1 консервативна только аспарагиновая кислота. Что касается 3-го домена fas-1, он не содержит ни одной из двух аминокислот.
2-2: Создание рекомбинантных белков, содержащих мутационные замены в 4-м fas-1-домене β ig-h3
Для того чтобы исследовать необходимость аспарагиновой кислоты и изолейцина для активности βig-h3 в адгезии клеток, создали мутанты рекомбинантного белка βig-h3 D-IV, полученного из 4-го домена βig-h3, в которых пролин в положении 616, аспарагиновую кислоту в положении 617 и изолейцин в положении 618 заменяли серином, аланином и серином соответственно. Полученные в результате рекомбинантные белки названы βigh3 D-IV-sDI, βigh3 D-IV-PaI, βigh3 D-IV-PDs и βigh3 D-IV-sas (фиг.5а). В SDS-ПААГ все мутантные рекомбинантные белки выявлялись в том же положении, что и βigh3 D-IV (фиг.5b).
2-3: Анализ активности в прикреплении клеток рекомбинантных белков, содержащих мутационные замены в 4-м fas-1-домене βig-h3
Проведено исследование активности в прикреплении клеток мутантных белков, в которых Pro616, Asp617 и Ile618 βigh3 D-IV в комбинации заменяли соответственно Ser, Ala и Ser, то есть βigh3 D-IV-sDI, βigh3 D-IV-PaI, βigh3 D-IV-PDs и βigh3 D-IV-sas. С этой целью клетки НСЕ инкубировали при 37°С в течение 1 часа в лунках планшетов, покрытых мутантными белками, после чего прикрепленные клетки подвергали воздействию субстрата гексозаминидазы, как описано в примере 1-2. Результаты представлены на фиг.6.
Как видно на фиг.6, мутантный белок, содержащий Ala вместо Asp617, названный D617A (βigh3 D-IV-PaI), и мутантный белок, содержащий Ser вместо Ile618, названный I618S (βigh3 D-IV-PDs), в значительной степени блокировали адгезию клеток, тогда как выявлено, что мутантный белок, содержащий Ser вместо Pro616, названный P616S (βigh3 D-IV-sDI), проявляет активность в прикреплении клеток, сравнимую с активностью контроля дикого типа. Что касается мутантного белка, в котором мутантными были три аминокислоты, названного P616S/D617A/I618S (βigh3 D-IV-sas), его активность в прикреплении клеток также была гораздо ниже, чем в контроле.
Потеря активности в прикреплении клеток, опосредованной 1-м доменом fas-1, в 1-м домене fas-1, мутантном в положении Asp617 или Ile618, свидетельствует о том, что аспарагиновая кислота в положении 617 и изолейцин в положении 618 имеют очень важное значение в опосредовании активности βig-h3 в прикреплении клеток.
Полученные результаты согласуются с результатами примера 1. Анализируя результаты примера 1, можно сказать, что аспарагиновая кислота и изолейцин, которые идентифицированы как необходимые для опосредования активности в прикреплении клеток, консервативны как во 2-м, так и в 4-м доменах fas-1, проявляющих активность в прикреплении клеток, тогда как в 1-м домене fas-1, который проявляет слабую активность в прикреплении клеток, консервативна только аспарагиновая кислота. С другой стороны, 3-й домен, не обладающий активностью в прикреплении клеток, не содержит ни одной из двух аминокислот. Следовательно, вместе взятые результаты свидетельствуют о том, что Asp617 и Ile618 очень важны для опосредования активности βig-h3 в прикреплении и распластывании клеток.
ПРИМЕР 3: Синтетические пептиды на основе βig-h3, обладающие активностью в прикреплении, распластывании и откреплении клеток
Подтверждая необходимость аспарагиновой кислоты и изолейцина для активности в прикреплении клеток, синтезировали пептиды, содержащие две аминокислоты, и анализировали активность в прикреплении и откреплении клеток.
3-1: Синтез белков, полученных на основе fas-1-домена βig-h3
Синтезировали пептиды, являющиеся производными 1-го, 2-го и 4-го fas-1-доменов βig-h3, и контрольный пептид с помощью автоматического синтезатора разнообразных пептидов (PE/ABD 433) стандартными способами твердофазного синтеза, и пептиды выделяли и очищали обращенно-фазовой высокоэффективной жидкостной хроматографией. Синтезированные пептиды конструировали так, чтобы они имели KADHH (а/к 219-223) SEQ ID NO. 1, NKDIL (а/к 354-358) SEQ ID NO. 2 и EPDIM (а/к 615-619) SEQ ID NO. 3, соответствующие консервативным последовательностям 1-го, 2-го и 4-го fas-1-доменов βig-h3 соответственно, и контрольный пептид DEMPI имел такой же аминокислотный состав, как пептид EPDIM, но измененную последовательность аминокислот, как показано на фиг.7.
3-2: Анализ активности синтетических пептидов в прикреплении и откреплении клеток
Влияние пептидов, содержащих консервативные последовательности fas-1-доменов βig-h3, на опосредованную βig-h3 адгезию клеток исследовали с использованием клеток НСЕ.
Клетки предварительно инкубировали в течение 30 минут в средах, содержащих 100 мкМ каждого из четырех синтетических пептидов, или без пептидов и переносили в пластиковые чашки для культивирования, покрытые 10 мкг/мл БСА или 10 мкг/мл βig-h3. Прикрепленные клетки подвергали количественному анализу на гексозаминидазу, как в примере 1-2. Результаты представлены на фиг.8а.
Как показано на фиг.8а, синтетические пептиды NKDIL и EPDIM, каждый из которых содержит консервативные остатки аспарагиновой кислоты-изолейцина, в значительной степени блокировали адгезию клеток НСЕ к βig-h3, проявляя прекрасную активность в откреплении клеток, тогда как синтетический пептид KADHH, содержащий только консервативную аспарагиновую кислоту, слабо ингибировал адгезию клеток. С другой стороны, контрольный пептид DEMPI, не содержащий ни одного из консервативных аминокислотных остатков, не влиял на адгезию клеток и соответственно обладал низкой активностью в откреплении клеток.
Адгезию клеток НСЕ к рекомбинантным белкам βigh3 D-II и βigh3 D-IV также исследовали в присутствии или отсутствие синтетических пептидов. С этой целью клетки НСЕ предварительно инкубировали в течение 30 минут в средах, содержащих 100 мкМ каждого из четырех синтетических пептидов, или без пептидов и затем переносили в пластиковые чашки для культивирования, покрытые 10 мкг/мл βig-h3 D-II или D-IV. После инкубации прикрепленные клетки количественно анализировали в отношении гексозаминидазы, как в примере 1-2. Результаты представлены на фиг.8b.
Как показано на фиг.8b, блокирующее действие синтетических пептидов, полученное в том случае, когда в качестве субстратов использовали 2-й и 4-й домены fas-1, было сходно с действием, полученным в том случае, когда в качестве субстрата использовали βig-h3.
3-3: Клеточная адгезия клеток НСЕ к поверхностям, покрытым синтетическими пептидами
Эксперимент проводили для того, чтобы определить, способен ли каждый из синтетических пептидов опосредовать адгезию клеток. Луночные планшеты покрывали каждым пептидом в концентрации 0, 20, 40, 60, 80, 100 и 120 мкМ и затем инкубировали с клетками НСЕ при 37°С в течение 1 часа. Прикрепленные клетки количественно анализировали в отношении гексозаминидазы, как в примере 1-2. Результаты показаны на фиг.9а.
Обнаружено, что синтетические пептиды NKDIL и EPDIM, каждый из которых содержит как аспарагиновую кислоту, так и изолейцин, опосредуют адгезию клеток дозозависимым образом. Синтетический пептид KADHH также обладал способностью опосредовать адгезию клеток дозозависимым образом, но его активность была ниже по сравнению с NKDIL и EPDIM. Как и ожидалось, контрольный пептид, не содержащий ни одной из двух аминокислот, был неактивным в адгезии клеток.
3-4: Идентификация рецепторов для опосредования активности синтетических пептидов в прикреплении, распластывании и откреплении клеток
Проводили эксперименты по блокированию функционирования, используя моноклональные антитела против разных субъединиц интегрина, чтобы исследовать, вовлечен ли интегрин α3β1, известный как поверхностный рецептор βig-h3, в адгезию клеток, опосредованную синтетическими пептидами EPDIM и NKDIL. НСЕ предварительно инкубировали при 37°С в течение 30 мин в присутствии каждого из моноклональных антител (5 мкг/мл) против разных типов интегринов. Предварительно инкубированные клетки переносили в планшеты, предварительно покрытые 100 мкМ EPDIM или 100 мкМ NKDIL, и затем инкубировали при 37°С еще в течение 1 часа, после чего количественно анализировали с помощью субстрата гексозаминидазы, как в примере 1-2. Количественные результаты приведены на фиг.9b.
Как видно на фиг.3, адгезия клеток, опосредованная 2-м или 4-м fas-1-доменами, почти полностью ингибировалась обоими антителами против субъединиц интегрина α3 и β 1. Полученные результаты свидетельствуют о том, что оба fas-1-домена, 2-й и 4-й, связаны с интегрином α3β1, опосредуя адгезию клеток.
3-5: Влияние синтетических пептидов на адгезию клеток к разным пептидам внеклеточного матрикса
Чтобы определить, является ли ингибирующая активность синтетических пептидов EPDIM и NKDIL, направленная против адгезии клеток, специфичной для βig-h3, исследовали влияние синтетических пептидов на адгезию клеток к разным белкам внеклеточного матрикса. Клетки НСЕ предварительно инкубировали в средах с добавлением 100 мкМ каждого из синтетических пептидов EPDIM или NKDIL, или без них, и затем наносили на планшеты, покрытые разными белками внеклеточного матрикса, включая βig-h3, фибронектин, ламинин, витронектин, коллаген типа I и типа II. После 1 часа инкубации прикрепленные клетки количественно анализировали в отношении гексозаминидазы, как в примере 1-2. Результаты показаны на фиг.10а.
Как показано на фиг.10а, синтетические пептиды NKDIL и EPDIM эффективно блокировали адгезию клеток не только к βig-h3, но также к ламинину, проявляя прекрасную активность в откреплении клеток. Однако они слабо ингибировали адгезию клеток к фибронектину и вообще не влияли на адгезию клеток к коллагену типа I и типа II и витронектину. Таким образом, взятые вместе результаты свидетельствуют о том, что синтетические пептиды NKDIL и EPDIM специфично конкурируют с молекулами, взаимодействующими с интегрином α3β1.
Адгезию клеток к βig-h3, ламинину и фибронектину, которая, как обнаружено, блокируется синтетическими пептидами NKDIL и EPDIM, исследовали при разных концентрациях EPDIM. Клетки НСЕ инкубировали в средах, содержащих синтетический пептид EPDIM в концентрациях 0, 200, 400, 600, 800, 1000 и 1200 мкМ, и наносили на планшеты, покрытые βig-h3, фибронектином и ламинином. После инкубации в течение 1 часа прикрепленные клетки количественно анализировали в отношении гексозаминидазы, как в примере 1-2. Результаты показаны на фиг.10b.
Как видно на кривых, адгезия клеток к βig-h3, фибронектину и ламинину становится слабой по мере увеличения концентрации синтетического пептида EPDIM. То есть ингибирующее действие EPDIM на адгезию клеток к βig-h3, фибронектину и ламинину зависит от дозы.
В данном изобретении, как описано выше, получены синтетические пептиды NKDIL и EPDIM, которые оба содержат аспарагиновую кислоту и изолейцин, необходимые в консервативных мотивах для активности в прикреплении и распластывании клеток. Пептиды содержат консервативные последовательности 2-го и 4-го fas-1 доменов βig-h3, при этом обнаружено, что каждый домен проявляет активность в прикреплении клеток, и они индуцируют адгезию клеток посредством интегрина α3β1, известного как функциональный клеточный рецептор. В случае разных белков внеклеточного матрикса, которые, как известно, связываются с интегрином α3β1, таких как тромбоспондин, ламинин, коллаген типа IV и т.д., до сих пор не было выявлено ни характерных последовательностей в их активных сайтах, обладающих гомологией, ни характерных консервативных связывающих мотивов для интегрина α3β1. Однако, получив данные о том, что синтетические пептиды NKDIL и EPDIM, каждый из которых содержит обе консервативные аминокислоты, аспарагиновую кислоту-изолейцин, специфично связываются с интегрином α3β1, с тем чтобы опосредовать активность в прикреплении клеток, согласно данному изобретению консервативные аминокислоты аспарагиновую кислоту-изолейцин идентифицируют как характерный консервативный связывающий мотив для интегрина α3β1. Следовательно, пептиды согласно данному изобретению можно успешно использовать для изучения активности в прикреплении клеток, опосредованной разными белками внеклеточного матрикса, включая βig-h3, и для разработки пептидов, стимулирующих прикрепление, распластывание и открепление клеток.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Согласно данному изобретению обнаружено, что из четырех fas-1-доменов βig-h3, который представляет собой молекулу клеточной адгезии, 2-й и 4-й домены проявляют активность в прикреплении и откреплении клеток, и каждый из них содержит консервативную последовательность аспарагиновая кислота-изолейцин, необходимую для активности в прикреплении и откреплении клеток. Получив указанные результаты, создали пептиды NKDIL и EPDIM, которые содержат функциональные аминокислотные остатки и индуцируют адгезию клеток посредством интегрина α3β1. Пептиды согласно данному изобретению можно успешно применять для изучения активности в прикреплении клеток, опосредованной различными белками внеклеточного матрикса, включая βig-h3, и для разработки пептидов, стимулирующих прикрепление, распластывание и открепление клеток.
Данное изобретение описано иллюстративным образом, и следует понимать, что имеется в виду, что используемая терминология имеет скорее характер описания, а не ограничения. Возможны многочисленные модификации и вариации данного изобретения в свете приведенных выше инструкций. Поэтому следует понимать, что в рамках прилагаемой формулы изобретения практическое использование изобретения может осуществляться иным образом, отличным от конкретно описанного способа.
Реферат
Изобретение относится к области биотехнологии, конкретно к пептидам, проявляющим активность в прикреплении, распластывании и откреплении клеток, и может быть использовано для изучения активности в прикреплении клеток, опосредованной разными белками внеклеточного матрикса, для разработки пептидов, адгезии, а также в лечебных целях. Олигопептиды стимулируют активность в прикреплении клеток посредством взаимодействия с интегрином α3β1 как функциональным клеточным рецептором, и содержат аспарагиновую кислоту и изолейцин, необходимые для активности в прикреплении и откреплении клеток. Фармацевтическую композицию, содержащую эффективное количество олигопептида, используют для заживления ран, регенерации тканей и ингибирования метастазов. Изобретение позволяет получить олигопептид, содержащий консервативную аминокислотную последовательность DI, необходимую для регуляции клеточной адгезии. 2 н. и 6 з.п. ф-лы, 15 ил.
Формула
Документы, цитированные в отчёте о поиске
Препарат для открепления контактзависимых клеток от субстрата и дезагрегации их в культуре

Комментарии