Среда, не содержащая белков и сыворотки, и способ культивирования клеток млекопитающих в такой среде - RU2380412C2
Код документа: RU2380412C2
Чертежи
Описание
Изобретение связано со средой для культивирования клеток без белка и без сыворотки.
Культивирование клеток, особенно эукариотических клеток или клеток млекопитающих, постоянно нуждается в применении специальных культуральных сред, которые обеспечивают клетки питательными веществами и ростовыми веществами, которые необходимы для эффективного роста и для продукции требуемых белков. В этом отношении, как правило, в качестве компонента среды используют сыворотку или соединения, которые получают из сыворотки (например, бычью сыворотку).
Однако в случае применения в культурах клеток добавок сыворотки или белков, которые получают от человека или из животных источников, существуют многочисленные проблемы, особенно если с помощью культуры клеток получают исходный материал для приготовления лекарственного средства, который необходимо вводить людям.
Поэтому в случае таких препаратов сыворотки состав и качество варьируют от партии к партии уже только вследствие отличия организмов доноров для таких препаратов. Это представляет значительную проблему особенно для стандартизации продукции клеток и при установлении стандартных условий роста для таких клеток. Несмотря на это в каждом случае требуется тщательный и постоянный контроль качества материала используемой сыворотки. Однако это чрезвычайно трудоемкий и дорогостоящий процесс, особенно в случае таких сложных композиций, как сыворотка.
Кроме того, такие сложные препараты содержат множество белков, которые могут действовать разрушающим образом, особенно в связи с процессом очистки рекомбинантного белка, который необходимо выделить из культуры клеток. Особенно это относится к белкам, которые гомологичны или сходны с белком, который необходимо выделить. Естественно, указанные проблемы являются особенно острыми в связи с очисткой, поскольку используемую биогенную добавку к среде (например, бычий белок) надежно можно удалить только посредством довольно специфичной дифференциальной очистки (например, с помощью антител, которые специфично направлены только против рекомбинантного белка, но не против бычьего белка (Björck, L., J. Immunol., 1988, Vol. 140, pp. 1194-1197; Nilson et al., J. Immunol Meth., 1993, 164, pp. 33-40).
С другой стороны, определенная проблема при применении сыворотки или соединений, которые получают из сыворотки, в среде для культивирования также состоит в риске загрязнения микоплазмой, вирусами или агентами КГЭ (BSE). Что касается препаратов, которые получают из крови человека, в этой связи особенно необходимо подчеркнуть риск загрязнения вирусами, такими как вирусы гепатита или ВИЧ. В случае сыворотки или компонентов сыворотки, которые получают из материала коров, в частности, существует опасность загрязнения КГЭ. При этом все полученные из сыворотки материалы, кроме того, могут быть загрязнены возбудителями заболеваний, которые еще не известны.
За немногими исключениями, для культивирования клеток на твердых поверхностях ранее считали совершенно необходимым добавление компонентов сыворотки для того, чтобы гарантировать адекватную адгезию клеток с их поверхностями и чтобы гарантировать адекватную продукцию требуемых веществ из клеток. Так, например, с помощью способа, который описан в WO 91/09935, можно было добиться процесса культивирования вируса FSME/антигена вируса посредством культивирования поверхностно-зависимых постоянных культур клеток, предпочтительно клеток Vero без сыворотки и без белков (смотри WO 96/15231). Однако указанные клетки не являются рекомбинантными клетками, а скорее клетками-хозяевами, которые используют для получения вирусного антигена в процессе лизиса.
В отличие от этого клетки, которые преимущественно используют для получения рекомбинантов, например клетки СНО, способны к адгезии только в ограниченной степени. Таким образом, клетки СНО, которые размножали традиционными способами, связываются как с гладкими, так и с пористыми микроносителями только в условиях наличия сыворотки (смотри патент США 4973616; Cytotechnology 9 (1992), 247-253). Однако если такие клетки выращивают в условиях без сыворотки, они теряют свои свойства и не прилипают к гладким носителям, или становятся легко отделяемыми от носителей, если в среду не внесены другие стимулирующие адгезию добавки, такие, например, как фибронектин, инсулин или трансферрин. Однако указанные добавки также являются белками, которые получают из сыворотки.
Альтернативно клетки можно размножать, используя технологию суспензионной культуры, а также, например, используя периодический способ или используя технологию непрерывного культивирования. Предпочтительно имеет место культивирование с использованием способа культивирования в хемостате. (Ozturk S.S. et al., 1996, Abstr. Pap. Am. Chem. Soc., BIOT 164, Payne G.F. et al., в “Large Scale Cell Culture Technology,” 1987, ed. Lydersen B.K., Hauser publishers; pp. 206-212). Kattinger H. et al. (Advance Mol. Cell. Biology, 1996, 15A, 193-207) описывают долговременное культивирование клеток в среде, не содержащей белка, но указанные клетки необходимо обязательно культивировать на носителях и не допускаются альтернативы в виде способов непрерывного культивирования. Это говорит о том, что указанные клетки проявляют долговременную стабильность только в том случае, когда они адгезированы на поверхности носителей, вследствие пониженного роста и, как следствие, сниженных требований по отношению к факторам роста.
Кроме того, в нескольких случаях на предшествующем уровне техники были предприняты попытки адаптировать клетки в среде, не содержащей белков, начиная с условий в присутствии сыворотки. Однако в случае такой адаптации неоднократно обнаруживали, что по сравнению с условиями в присутствии сыворотки выход экспрессированного белка и продуктивность рекомбинантных клеток заметно снижена после адаптации в среде, не содержащей белков (Appl. Microbiol. Biotechnol. 40 (1994), 691-658).
Также обнаружено, что при высокой плотности клеток продукция рекомбинантных белков иногда значительно ограничена. В ходе попыток адаптировать клетки к средам, не содержащим белков или сыворотки, наряду с пониженным ростом используемых клеток, также часто выявляют нестабильность, вследствие чего получают клетки с пониженной экспрессией, или даже получают не продуцирующие клетки, при этом они обладают преимуществами в росте относительно продуцирующих клеток в среде без белков и без сыворотки, и это приводит к тому факту, что данные клетки перерастают продуцирующие клетки и затем, наконец, вся культура продуцирует теперь продукт с очень низким выходом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью данного изобретения поэтому является расширение возможностей для культивирования рекомбинантных клеток без белка и без сыворотки и предоставление средств и способов, с помощью которых можно эффективно культивировать рекомбинантные клетки способом в отсутствие сыворотки и в отсутствие белков. Кроме того, к тому же должно быть возможным не только культивирование поверхностно-зависимых клеток, но также использование способа суспензионного культивирования, в силу чего требуется подавить нестабильность в продуктивности клеток насколько это возможно.
Следующей целью данного изобретения, кроме того, является эффективное увеличение продукции рекомбинантных клеток.
Наконец, согласно изобретению, требуется усовершенствование и более эффективное формирование адаптации рекомбинантных клеток к средам, не содержащим сыворотки и не содержащим белков.
Согласно изобретению указанные задачи выполняют с помощью среды для культивирования клеток, особенно клеток млекопитающих, в отсутствие белков и в отсутствие сыворотки, характерной особенностью которой является то, что среда содержит часть гидролизата сои.
Неожиданно оказалось возможным показать, что цели, которые были определены выше, могут быть достигнуты культивированием клеток в среде, которая содержит гидролизат сои, без необходимости претерпевать недостатки культивирования без сыворотки, которые описаны в предшествующем уровне техники. Было обнаружено, что в отличие от других гидролизатов, которые известны из предшествующего уровня техники, таких, например, как гидролизаты пшеницы, гидролизаты риса или дрожжевые гидролизаты, только гидролизат сои опосредует свойства в соответствии с изобретением, и приводит, например, к значительно увеличенному выходу рекомбинантного белка-мишени. При обсуждении указанных терминов может быть использован либо термин «гидролизат сои», либо термин «соевый пептон», которые при этом не имеют разных значений.
Среда согласно изобретению предпочтительно содержит гидролизат сои в количестве более 10%, исходя из общей массы сухой среды. Как правило, в среде предусмотрено количество гидролизата сои 4-40%.
Выбор конкретного гидролизата сои не является критическим согласно изобретению. Согласно изобретению можно использовать множество препаратов сои, которые можно обнаружить на рынке, например пептоны из соевой муки, расщепленные ферментативно (например, папаином), со значением рН от 6,5 до 7,5 и общим содержанием азота от 9% до 9,7% и содержанием золы от 8 до 15%. Указанные пептоны представляют собой пептоны соевых бобов в форме, в которой их обычно использует специалист в данной области для культивирования клеток.
В соответствии с предпочтительным вариантом для среды согласно изобретению используют очищенный препарат гидролизата сои или его неочищенную фракцию. Примеси, которые могут мешать эффективному культивированию, предпочтительно удаляют в ходе указанной очистки, или повышают определенность гидролизата, например, в отношении молекулярной массы.
Согласно изобретению подтверждено, что на практике в ходе указанной очистки особенно полезно предусмотреть стадию ультрафильтрации; вследствие этого особенно предпочтительно использование в среде согласно изобретению гидролизата сои, подвергнутого ультрафильтрации.
Ультрафильтрацию можно осуществлять согласно способу, полно описанному в предшествующем уровне техники, например, с применением мембранных фильтров с определенным пределом отсечения.
Очистку подвергнутого ультрафильтрации соевого пептона можно осуществлять гель-хроматографией, например, посредством хроматографии на сефадексе, например сефадексе G25 или сефадексе G10, или эквивалентных материалах, ионообменной хроматографией, аффинной хроматографией, эксклюзионной хроматографией по размеру или «обращенно-фазовой» хроматографией. Указанные способы являются способами предшествующего уровня техники, с которым специалист в данной области знаком. С использованием указанного способа можно отобрать те фракции, которые содержат гидролизат сои определенной молекулярной массы, т.е. ≤1000 дальтон, предпочтительно ≤500 дальтон, более предпочтительно ≤350 дальтон. Поэтому изобретение также включает в себя способ получения среды для культуры клеток, не содержащей сыворотки и белков, который заключается в получении гидролизата сои, ультрафильтрации указанного гидролизата сои с использованием способа ультрафильтрации, очистке фракции указанного гидролизата сои эксклюзионной хроматографией по размеру и отборе фракции гидролизата сои, состоящих из гидролизата сои, имеющего молекулярную массу ≤1000 дальтон, предпочтительно ≤500 дальтон, более предпочтительно ≤350 дальтон.
Характерным признаком особенно предпочтительного гидролизата сои является то, что содержание свободных аминокислот в нем составляет от 10,3 до 15,6 или предпочтительно от 12 до 13,5%, общее содержание азота составляет от 7,6 до 11,4% или предпочтительно в пределах от 8,7 до 9,5%, и содержание эндотоксина <500 ед./г, и при этом, по меньшей мере, 40% или предпочтительно, по меньшей мере, 50%, или особенно предпочтительно по меньшей мере, 55% гидролизата имеет молекулярную массу 200-500 дальтон, и, по меньшей мере, 10% или предпочтительно 15% гидролизата имеет молекулярную массу 500-1000 дальтон. Наиболее предпочтительно, по меньшей мере, 90% гидролизата сои имеет молекулярную массу ≤500 дальтон. Такой гидролизат сои особенно хорошо подходит для промышленного получения рекомбинантных белков, так как вследствие его особых свойств его можно особенно легко стандартизовать, и он удобен для стандартных способов.
Кроме гидролизата сои, среда согласно изобретению также может содержать синтетические среды, которые в определенной степени известны, такие, например, как DMEM/HAM F12, среда 199 или RPMI, которые в достаточной мере известны из литературы.
Кроме того, среда согласно изобретению также предпочтительно содержит аминокислоты, предпочтительно аминокислоты, выбранные из группы, состоящей из L-аспарагина, L-цистеина, L-цистина, L-пролина, L-триптофана, L-глутамина или их смесей.
Также в среду согласно изобретению предпочтительно добавляют следующие аминокислоты: L-аспарагин (в количестве 0,001-1 г/л среды, предпочтительно 0,1-0,05 г/л, особенно предпочтительно 0,015-0,03 г/л); L-цистеин (0,001-1 г/л, предпочтительно 0,005-0,05 г/л, особенно предпочтительно 0,01-0,03 г/л); L-цистин (0,001-1 г/л, предпочтительно 0,015-0,05 г/л, особенно предпочтительно 0,015-0,03 г/л); L-пролин (0,001-1,5 г/л, предпочтительно 0,01-0,07 г/л, особенно предпочтительно 0,02-0,05 г/л); L-триптофан (0,001-1 г/л, предпочтительно 0,01-0,05 г/л, особенно предпочтительно 0,015-0,03 г/л) и L-глутамин (0,05-1 г/л, предпочтительно 0,1-1 г/л).
Указанные выше аминокислоты можно добавлять в среду согласно изобретению либо отдельно, либо в комбинации. Особенно предпочтительно комбинированное добавление смеси аминокислот, которая состоит из всех указанных выше аминокислот.
В особом варианте используют среду, не содержащую сыворотки и не содержащую белков, при этом указанная среда дополнительно содержит комбинацию указанной выше смеси аминокислот и очищенный подвергнутый ультрафильтрации соевый пептон.
Неожиданно было обнаружено, например, что для того, чтобы инактивировать вирусы или другие патогены, среду можно нагревать без отрицательных последствий в течение примерно 5-20 мин или предпочтительно 15 мин при 70-95°С, или предпочтительно 85-98°С.
Согласно изобретению, в комбинации с гидролизатом сои можно использовать любую известную синтетическую среду. Обычные синтетические среды могут содержать неорганические соли, аминокислоты, витамины, источник углеводов и воду. Например, можно использовать среду DMEM/HAM F12. Концентрация экстракта сои в среде предпочтительно может быть в пределах от 0,1 до 100 г/л, особенно предпочтительно от 1 до 5 г/л. Согласно особенно предпочтительному варианту, можно использовать соевый пептон, который был стандартизован в отношении его молекулярной массы. Молекулярная масса соевого пептона предпочтительно меньше 50 кД, особенно предпочтительно меньше 10 кД, наиболее предпочтительно меньше 1 кД.
Оказалось, что добавление подвергнутого ультрафильтрации соевого пептона особенно полезно для продуктивности рекомбинантных линий клеток, при этом средняя молекулярная масса соевого пептона составляет 350 дальтон (Quest Company). Это вещество, выделенное из сои, с общим содержанием азота примерно 9,5% и содержанием свободных аминокислот примерно 13%.
Особенно предпочтительно применение очищенного, ультрафильтрованного соевого пептона с молекулярной массой ≤1000 дальтон, предпочтительно ≤500 дальтон, особенно предпочтительно ≤350 дальтон.
Среда согласно изобретению предпочтительно также содержит дополнительные вещества, такие, например, как буферные вещества, стабилизаторы окисления, стабилизаторы для нейтрализации механического воздействия или ингибиторы протеаз.
Главным образом используют среду следующего состава: синтетическая минимальная среда (1-25 г/л), соевый пептон (0,5-50 г/л), L-глутамин (0,05-1 г/л), NaHCO3 (0,1-10 г/л), аскорбиновая кислота (0,0005-0,05 г/л), этаноламин (0,0005-0,05 г/л) и селенит Na (1-15 мкг/л).
При необходимости, в качестве противопенного средства согласно изобретению в среду можно добавить неионное поверхностно-активное вещество, такое, например, как полипропиленгликоль (PLURONIC F-61, PLURONIC F-68, SYNPERONIC F-68, PLURONIC F-71 или PLURONIC F-108).
Указанное средство обычно используют для того, чтобы защитить клетки от негативного воздействия аэрации, так как без добавления поверхностно-активного вещества поднимающиеся и лопающиеся пузырьки воздуха могут привести к повреждению тех клеток, которые располагаются на поверхности этих пузырьков воздуха («барботаж») (Murhammer and Goochee, 1990, Biotechnol. Prog. 6: 142-148).
При этом количество неионного поверхностно-активного вещества может в пределах от 0,05 до 10 г/л, хотя особенно предпочтительно наименьшее возможное количество от 0,1 до 5 г/л.
Кроме того, среда согласно изобретению также может содержать циклодекстрин или его производное.
Среда без сыворотки и без белков предпочтительно содержит ингибитор протеазы, такой, например, как ингибиторы сериновых протеаз, которые подходят для культуры клеток и имеют синтетическое или растительное происхождение.
В качестве клеток для культивирования в среде согласно изобретению предпочтительно используют клетки, которые уже были адаптированы, т.е. клетки, которые уже были адаптированы к росту в среде, не содержащей белков и не содержащей сыворотки. Было обнаружено, что с помощью таких предварительно адаптированных клеток можно не только достичь увеличенного выхода, но и стабильность их культивирования в отсутствие сыворотки и белков также явно повышена при использовании среды согласно изобретению.
Однако показано, что рекомбинантные клоны клеток особенно полезны согласно изобретению, при этом клетки стабильны от начала в течение по меньшей мере 40 генераций и предпочтительно по меньшей мере 50 генераций в бессывороточной среде в отсутствие белков, и экспрессируют рекомбинантные продукты.
Такие клоны клеток можно получить из культуры клеток, которую получают после культивирования исходного рекомбинантного клона клеток в среде, содержащей сыворотку, и повторной адаптации клеток к среде без сыворотки и без белков.
Термин «исходный клон клеток» можно понимать в значении рекомбинантного трансфицированного клона клеток, который после трансфекции клеток-хозяев рекомбинантной нуклеотидной последовательностью стабильно экспрессирует рекомбинантный продукт в лабораторных условиях. Исходный клон размножают в среде, содержащей сыворотку, для того, чтобы оптимизировать его рост. Для того чтобы увеличить его продуктивность, исходный клон размножают необязательно в присутствии селектирующего агента с отбором в отношении селектируемого маркера и/или маркера амплификации. Для крупномасштабного промышленного производства исходный клон клеток размножают в условиях культивирования в присутствии сыворотки до высокой плотности клеток, и затем его повторно адаптируют к среде без сыворотки и без белков непосредственно перед фазой продуцирования. В этом случае культивирование предпочтительно осуществляют в отсутствие давления отбора.
Культивирование рекомбинантного исходного клона можно с самого начала осуществлять в среде без сыворотки и без белков; в результате уже не требуется реадаптация. При необходимости в данном случае можно использовать селектирующий агент, и может иметь место селекция в отношении селектируемого маркера и/или маркера амплификации. Способ для этого, например, описан в EP 0 711 835.
Культуру клеток, которую получают после реадаптации в среде, не содержащей сыворотки и не содержащей белков, анализируют в отношении таких клеточных клонов популяции клеток, которые стабильно продуцируют продукты в условиях отсутствия сыворотки и отсутствия белков, необязательно в отсутствие давления отбора. Это можно осуществить, например, посредством иммунофлуоресценции с помощью меченых специфичных антител, которые направлены против рекомбинантного полипептида или белка. Клетки, которые идентифицируют как продуценты продуктов, выделяют из культуры клеток и повторно размножают в условиях отсутствия сыворотки и отсутствия белка, которые предпочтительно эквивалентны условиям продуцирования. При этом выделение клеток можно осуществлять выделением клеток и их тестированием в отношении продуцентов продуктов.
Культуру клеток, содержащую стабильные клетки, можно снова тестировать в отношении стабильных рекомбинантных клонов, и указанные клоны выделяют из культуры клеток и субклонируют. Стабильные клоны рекомбинантных клеток, которые получают в условиях отсутствия сыворотки и отсутствия белков, затем можно далее размножать в условиях отсутствия сыворотки и отсутствия белков.
Рекомбинантные клоны клеток или популяции клеток, которые получают таким образом в среде согласно изобретению, в частности, отличаются той особенностью, что они стабильны в течение по меньшей мере 40 генераций, предпочтительно по меньшей мере в течение 50 генераций, и особенно предпочтительно - в течение более чем 60 генераций, и экспрессируют рекомбинантный продукт.
Пример такого стабильного рекомбинантного клона клеток или популяции клеток зарегистрирован согласно Будапештскому договору под номером 98012206 в ECACC (Великобритания).
Культуру клеток, которую необходимо культивировать согласно изобретению, предпочтительно получают из рекомбинантной клетки млекопитающего. При этом рекомбинантными клетками млекопитающих могут быть все клетки, которые содержат последовательности, которые кодируют рекомбинантный полипептид или белок. В рассмотрение включены все непрерывно растущие клетки, которые растут либо адгезивно, либо не адгезивно. Особенно предпочтительны рекомбинантные клетки СНО или клетки ВНК. Рекомбинантными полипептидами или белками могут быть факторы крови, факторы роста или другие продукты, имеющие отношение к биомедицине.
Согласно данному изобретению, предпочтительны клоны клеток, которые содержат кодирующую последовательность для рекомбинантного фактора крови, такого как фактор II, фактор V, фактор VII, фактор VIII, фактор IX, фактор X, фактор XI, белок S, белок C, активированная форма одного из этих факторов или vWF, и которые способны стабильно их экспрессировать в течение нескольких генераций. Особенно предпочтительны в этом отношении рекомбинантные клетки СНО, которые экспрессируют vWF или полипептид с активностью vWF, фактор VIII или полипептид с активностью VIII, vWF и фактор VIII, фактор IX или фактор II.
Для того чтобы создать банк исходных клеток, необходимо 30 генераций. По меньшей мере примерно 40 генераций необходимо для того, чтобы получить среднюю партию культуры в масштабе 1000 л. В случае среды согласно данному изобретению, начиная с отдельного клона клеток, можно получить «исходный банк клеток» (MCB) и «рабочий банк клеток» (WCB) примерно через 8-10 генераций, и следовательно, культуру клеток в масштабе продуцирования (продуцирующая биомасса) в условиях отсутствия белков и отсутствия сыворотки при прохождении до 20-25 генераций, тогда как, в противоположность этому, в случае предыдущих клонов клеток и сред некоторые генерации становились нестабильными после роста в среде без сыворотки и без белков, и в результате а) не возможна однородная культура клеток с продуцентами продукта и b) не возможна стабильная продуктивность в течение длительного периода времени.
Однако согласно изобретению, напротив, можно было выявить даже повышенную продуктивность по сравнению с исходным клоном клеток, который культивировали в среде, содержащей сыворотку.
Согласно следующему аспекту данное изобретение также имеет отношение к способу культивирования клеток, особенно клеток млекопитающих, характерной особенностью которого является то, что указанные клетки вводят в среду согласно изобретению и затем культивируют в указанной среде.
Таким образом, данное изобретение также относится к применению среды согласно изобретению для культивирования рекомбинантных клеток, предпочтительно эукариотических клеток, и особенно клеток млекопитающих.
Соответственно, целью данного изобретения также является культура клеток, которая содержит среду согласно изобретению и клетки, предпочтительно эукариотические клетки, и особенно клетки млекопитающих.
Изобретение будет освещено более подробно посредством следующих приведенных ниже примеров, а также чертежей, но этим изобретение не ограничено.
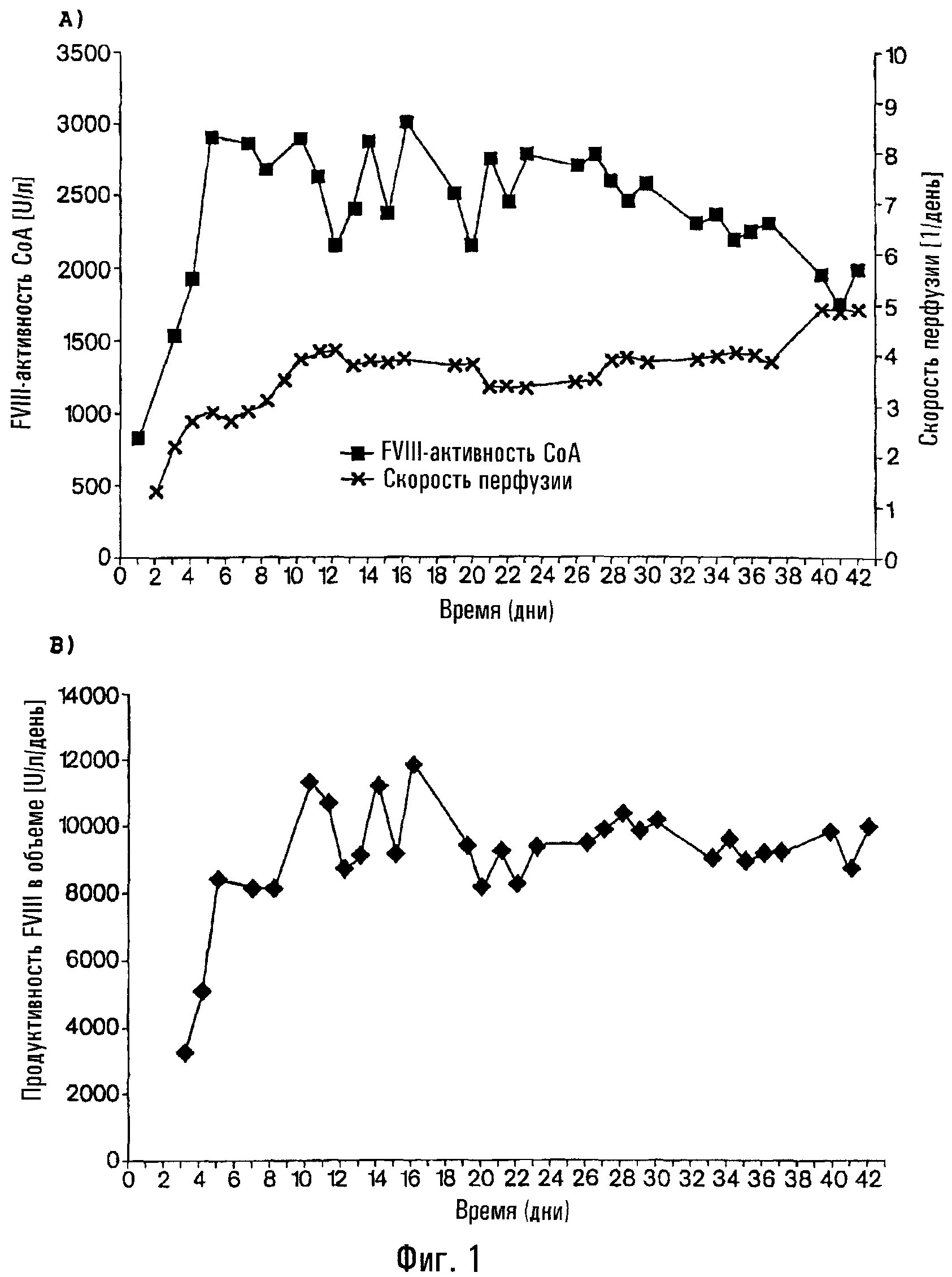
На фиг.1 показаны результаты культивирования клона клеток rFVIII-CHO в проточном биореакторе объемом 10 л:
а) активность фактора VIII (миллиединиц/мл) и скорость перфузии (1-5/сутки) в течение 42-дневного периода;
b) продуктивность, приведенная к объему (единицы фактора VIII/л/сутки в проточном биореакторе.
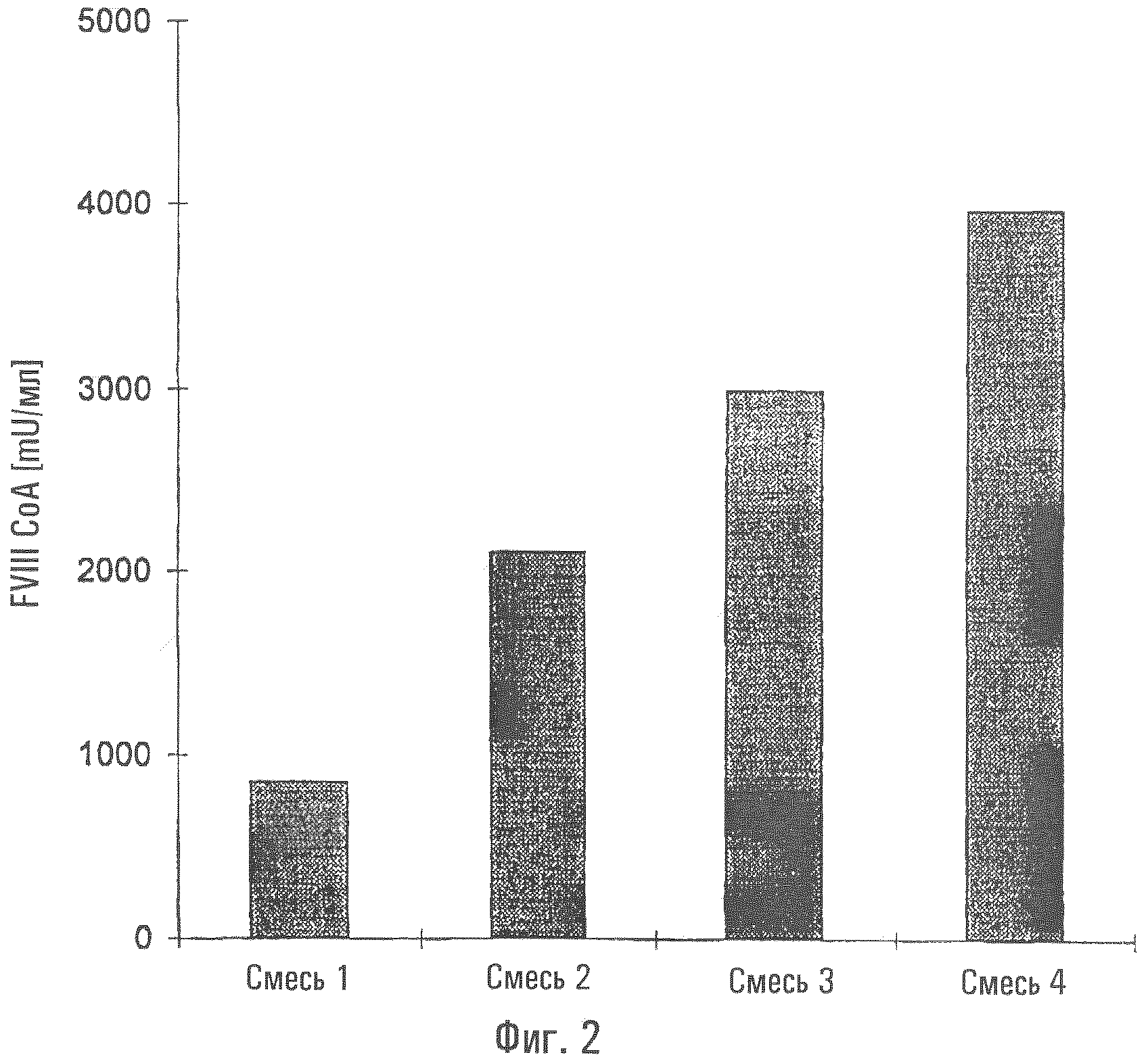
На фиг.2 показано сравнение продуктивности по фактору VIII (мU/мл) в случае культивирования периодическим способом клеток СНО, которые экспрессируют r-фактор VIII, в разных средах. Смесь 1 состоит из среды, не содержащей сыворотки и не содержащей белков, без гидролизата сои, но содержащей смесь аминокислот, перечисленных в таблице 4; смесь 2 состоит из среды, не содержащей сыворотки и не содержащей белков, но содержащей гидролизат сои; смесь 3 состоит из среды, не содержащей сыворотки и не содержащей белков, но содержащей гидролизат сои и смесь аминокислот, перечисленных в таблице 4, и смесь 4 состоит из среды, не содержащей сыворотки и не содержащей белков, но содержащей 2,5 г/л очищенного ультрафильтрованного гидролизата сои и смесь аминокислот, перечисленных в таблице 4. Для очистки ультрафильтрованного гидролизата сои использовали колонку Sephadex®.
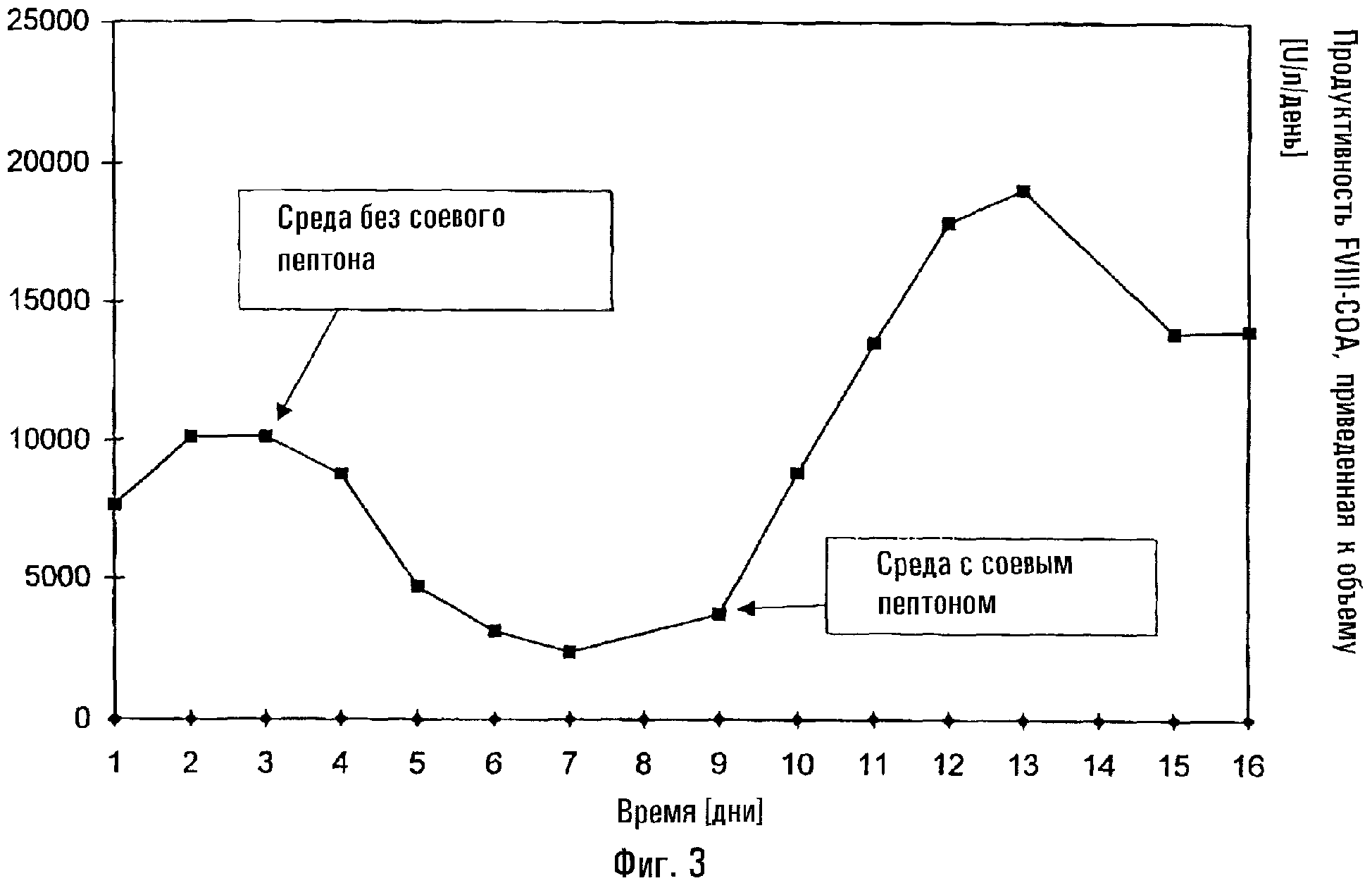
На фиг.3 показана продуктивность по фактору VIII (U/л) [т.е. ед/л] в случае непрерывного роста клеток СНО, которые экспрессируют r-фактор VIII, в среде, не содержащей сыворотки и не содержащей белков, после начала добавления очищенного ультрафильтрованного соевого пептона, а именно на 6-й день культивирования.
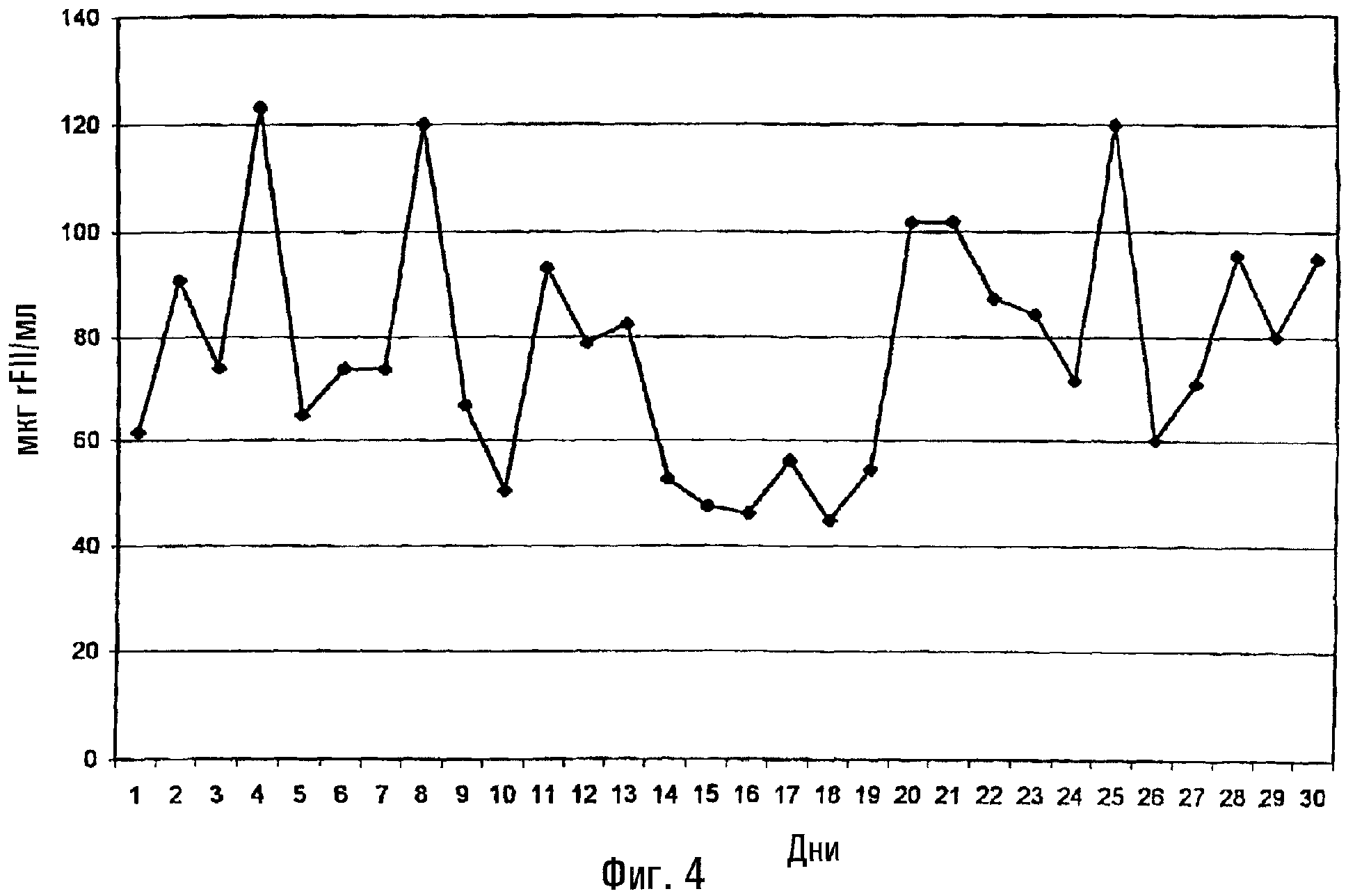
На фиг.4 показаны клетки ВНК, экспрессирующие рекомбинантный фактор II, которые размножали в среде, не содержащей белков и не содержащей сыворотки, но которая содержит гидролизат сои.
ПРИМЕРЫ
Пример 1:
Стабильность клеток rvWF-CHO после перевода из среды, содержащей сыворотку, в среду, не содержащую сыворотки и не содержащую белков
Клетки CHO-dhfr совместно трансфицировали плазмидами phAct-rvWF и pSV-dhfr, и клоны, экспрессирующие vWF, субклонировали, как описано Fischer et al. (1994, FEBS Letters 351: 345-348). Рабочий банк клеток (WCB) начинали c субклонов, которые стабильно экспрессировали rvWF, в условиях присутствия сыворотки, но в отсутствие MTX, и клетки иммобилизовали на пористом микроносителе (Cytopore®) в условиях наличия сыворотки. Перевод клеток в среду, не содержащую сыворотки и не содержащую белков, происходил после того, как плотность клеток достигала 2×107 клеток/мл матрикса. Затем клетки культивировали в течение нескольких генераций в условиях отсутствия сыворотки и отсутствия белков. Клетки анализировали в среде, не содержащей сыворотки и не содержащей белков в разных временных точках посредством иммунофлуоресценции с использованием меченых антител против vWF. Оценку стабильности клеток проводили, используя рабочий банк клеток до перевода в новую среду, после 10 генераций и после 60 генераций в среде, не содержащей сыворотку и не содержащей белков. В то время как в рабочем банке клеток еще выявляют 100% продуцентов rvWF, доля продуцентов rvWF снижается примерно до 50% после 10 генераций в среде, не содержащей сыворотки и белков. После 60 генераций более 95% клеток идентифицировали как не являющиеся продуцентами.
Пример 2:
Клонирование стабильных рекомбинантных клонов СНО
Готовили серийные разведения культуры клеток, содержащей клетки rvWF-CHO согласно примеру 1 (указанный стабильный клон клеток, который назвали r-vWF-CHO F7, зарегистрирован согласно Будапештскому договору в ЕСАСС (Европейская коллекция культур клеток), Salisbury, Wiltshire SP4 OJG, UK 22 января 1998 г., и при депонировании получил номер 98012206), которые культивировали в течение 60 генераций в среде, не содержащей сыворотки и белков, и 0,1 клеток высевали в каждую лунку планшета для микротитрования. Клетки культивировали примерно в течение 3 недель в DMEM/HAM F12 без добавления сыворотки или добавок белка и без давления отбора, и клетки анализировали посредством иммунофлуоресценции с использованием меченых антител против vWF. Клон клеток, который идентифицировали как позитивный, использовали в качестве исходного клона для получения банка посевных клеток. Исходный банк клеток (MCB) получали, исходя из банка посевных клеток в среде, не содержащей сыворотки и не содержащей белков, и отбирали отдельные ампулы и замораживали для дальнейшего приготовления рабочего банка клеток. Рабочий банк клеток готовили в среде, не содержащей сыворотки и не содержащей белков, из отдельной ампулы. Клетки иммобилизовали на пористых микроносителях и затем культивировали в течение нескольких генераций в условиях отсутствия сыворотки и отсутствия белков. Клетки анализировали в отношении продуктивности в разных временных точках в среде, не содержащей сыворотки и не содержащей белков, посредством иммунофлуоресценции с использованием меченых антител против vWF. Оценку стабильности клеток осуществляли в стадии рабочего банка клеток и после 10 и 60 генераций в среде, не содержащей сыворотки и не содержащей белков. Примерно 100% клеток идентифицировали как позитивные стабильные клоны, которые экспрессируют rvWF, в стадии рабочего банка клеток, после 10 генераций и 60 генераций.
Пример 3:
Удельная клеточная продуктивность рекомбинантных клонов клеток
В ходе культивирования рекомбинантных клеток на определенных стадиях отбирали определенное количество клеток и инкубировали их в течение 24 часов в свежей среде. В надосадочной жидкости культур клеток определяли активность rvWF: Risto-CoF. В таблице 1 показано, что в случае стабильных рекомбинантных клонов клеток согласно изобретению удельная продуктивность клеток была стабильной даже после 60 генераций в среде, не содержащей сыворотки и не содержащей белков, и даже увеличивалась по сравнению с исходным клоном, который культивировали в среде, содержащей сыворотку.
Пример 4:
Состав синтетической среды, не содержащей сыворотки и не содержащей белков
Пример 5:
Культивирование клеток rFVIII-CHO в минимальной среде, не содержащей белков и не содержащей сыворотки
Культуру клеток, содержащую клетки rFVIII-CHO, культивировали в проточном сосуде с мешалкой объемом 10 л. В данном случае использовали среду согласно примеру 4. При этом клетки иммобилизовали на пористом микроносителе (Cytopore®, Pharmacia), и затем культивировали, по меньшей мере, в течение 6 недель. Скорость перфузии составляла 4 смены объема в сутки; рН был равен 6,9-7,2; концентрация О2 примерно составляла 20-50% и температура составляла 37°С.
На фиг.1 показаны результаты культивирования клона клеток rFVIII-CHO в проточном биореакторе объемом 10 л.
а) Активность фактора VIII (миллиединиц/мл) и скорость перфузии (1-5/сутки) в течение периода, равного 42 дням.
b) Продуктивность в пересчете на объем (единиц фактора VIII/л/день) в проточном реакторе.
В таблице 3 показана стабильность и удельная продуктивность клеток, экспрессирующих rFVIII. Для того чтобы получить указанные результаты, отбирали образцы через 15, 21, 28, 35 и 42 дня, и затем центрифугировали при 300 g и ресуспендировали в свежей среде, не содержащей сыворотки и не содержащей белков. Концентрацию фактора VIII в надосадочной жидкости культур клеток и количество клеток определяли спустя следующие 24 часа. На основе этих данных рассчитывали удельную FVIII-продуктивность.
Была достигнута стабильная средняя продуктивность 888 миллиединиц/106 клеток/день. Указанную стабильную продуктивность также подтвердили иммунофлуоресценцией с использованием меченых антител против FVIII через 15, 21, 28, 35 и 42 дня в среде, не содержащей сыворотки и не содержащей белков.
Пример 6:
Сравнение продуктивности рекомбинантных клеток FVIII-CHO в среде, не содержащей белков и не содержащей сыворотки, но содержащей дополнительные компоненты среды.
Культуру клеток, содержащую клетки rFVIII-CHO, культивировали периодическим способом. В данном случае использовали среду согласно примеру 4, в которую добавили следующие аминокислоты:
Клетки размножали при 37°С и рН 6,9-7,2. Клетки размножали, используя периодический способ в течение периодов 24-72 ч.
Продуктивность рекомбинантных клеток FVIII-CHO измеряли при следующих составах среды:
Смесь 1: содержащая среду без сыворотки и без белков, без соевого пептона, но дополнительно содержащая смесь аминокислот в соответствии с приведенной выше таблицей.
Смесь 2: содержащая среду без сыворотки и без белка, но содержащая соевый пептон.
Смесь 3: содержащая среду без сыворотки и без белков, но содержащая соевый пептон и дополнительно содержащая смесь аминокислот в соответствии с приведенной выше таблицей.
Смесь 4: содержащая среду без сыворотки и без белков, но дополнительно содержащая смесь аминокислот в соответствии с приведенной выше таблицей и 2,5 г/л очищенного ультрафильтрованного соевого пептона. Очистку ультрафильтрованного соевого пептона осуществляли хроматографически через колонку Sephadex®.
Пример 7:
Культивирование рекомбинантных клеток FVIII-CHO в среде, не содержащей белков и не содержащей сыворотки, с использованием способа культивирования в хемостате
Культуру клеток, содержащую клетки rFVIII-CHO, культивировали в сосуде биореактора с мешалкой объемом 10 л. В данном случае использовали среду в соответствии с примером 4 без соевого пептона, содержащую смесь аминокислот согласно примеру 6. Клетки размножали при 37°С и рН 6,9-7,2; концентрация кислорода составляла 20-50% насыщения воздуха. Образцы отбирали каждые 24 часа, для того чтобы определить титр фактора VIII и концентрацию клеток в жидком надосадке культуры. Общая концентрация клеток была постоянной со 2-го по 14-й день. Ультрафильтрованный соевый пептон добавляли в среду, начиная с 6-го дня. Продуктивность в отношении фактора VIII показана в 3; измерения проводили с помощью системы CHROMOGENIX CoA FVIII:C/4. Иммунофлуоресценцию выполняли с использованием меченых антител против FVIII. На основании данных можно видеть, что в результате добавления соевого пептона происходило явное увеличение продуктивности в отношении фактора VIII и, следовательно, увеличение в продуктивности, пересчитанной на объем системы биореактора, причем это не приводило к заметному увеличению роста клеток. Отсутствие соевого пептона в непрерывной культуре приводит к явному снижению продуктивности по фактору VIII через несколько дней, тогда как добавление соевого пептона приводит в результате к почти 10-кратному увеличению продуктивности. Однако, поскольку указанное добавление не увеличивает количество клеток, следовательно, это четко показывает, что ультрафильтрованный соевый пептон в результате приводит к явному увеличению продуктивности, которое не зависит от роста клеток.
Пример 8:
Сравнение скорости роста и продуктивности рекомбинантных клеток FVIII-CHO в среде, не содержащей белков и не содержащей сыворотки, но содержащей различные гидролизаты
Культуру клеток rFVIII-CHO культивировали периодическим способом. В данном случае использовали среду, не содержащую сыворотки и не содержащую белков, которая описана в примере 4, к которой добавляли различные гидролизаты (из сои, дрожжей, риса и пшеницы). В качестве контроля использовали среду, не содержащую сыворотки и не содержащую белков, в которую гидролизат не добавляли.
Исходная плотность клеток составляла 0,6×105 и 0,4×106, соответственно. Клетки культивировали при 37°С, используя периодический способ при рН 6,9-7,2.
Таблица 5: показаны результаты экспериментов по культивированию клеток rFVIII-CHO в среде, не содержащей сыворотки и не содержащей белков, в которую добавляли соевый гидролизат (нефильтрованный) и дрожжевой гидролизат. Исходная плотность клеток составляла 0,6×105 клеток. В качестве контроля использовали среду, не содержащую сыворотки и не содержащую белков без добавок гидролизата.
Таблица 6: показаны результаты экспериментов по культивированию клеток rFVIII-CHO в среде, не содержащей сыворотки и не содержащей белков, в которую добавляли соевый гидролизат (нефильтрованный), гидролизат риса и гидролизат пшеницы. Исходная плотность клеток составляла 0,6×105 клеток. В качестве контроля использовали среду, не содержащую сыворотки и не содержащую белков без добавок гидролизата.
Таблица 7: показаны результаты экспериментов по культивированию клеток rFVIII-CHO в среде, не содержащей сыворотки и не содержащей белков, в которую добавляли соевый гидролизат (нефильтрованный) и гидролизат пшеницы. Исходная плотность клеток составляла 0,4×106 клеток.
Пример 9:
Культивирование клеток ВНК в среде без белков и без сыворотки, содержащей соевый гидролизат.
Клетки ВНК-21 (АТСС CCL 10) совместно трансфицировали способом на основе CaPO4 три раза следующими плазмидами: 25 мкг плазмиды pSV-FII (Fischer, B. et al., J. Biol. Chem., 1996, Vol. 271, pp. 23737-23742), которая содержит кДНК фактора II (протромбина) человека под контролем промотора SV40 (промотор раннего гена SV40); 4 мкг плазмиды pSV-DHFR для устойчивости к метотрексату и 1 мкг плазмиды pUCSV-neo (Schlokat, U. et al., Biotech. Appl. Biochem., 1996, Vol. 24, pp. 257-267), которая опосредует устойчивость к G418/неомицину. Стабильные клоны клеток отбирали посредством культивирования в среде, которая содержала 500 мкг/мл G418, при ступенчатом возрастании концентрации метотрексата до концентрации 3 мкМ.
Полученные таким образом клоны субклонировали и адаптировали к среде, не содержащей белков и не содержащей сыворотки. Культивирование проводили, используя технологию суспензионной культуры.
Результаты можно видеть в таблице 6; клетки ВНК, которые размножали в среде без белков и без сыворотки, содержащей гидролизат сои, проявляли высокую и стабильную степень продуцирования рекомбинантного фактора II.
Реферат
Изобретение относится к биотехнологии. Среда для культивирования клеток млекопитающего содержит синтетическую среду от 0,1 до 100 г/л гидролизата сои. Причем молекулярная масса гидролизата сои составляет ≤1000 дальтон или ≤500 дальтон, или ≤350 дальтон. Способ культивирования клеток млекопитающего включает введение указанных клеток млекопитающего в среду, не содержащую белков и сыворотки, где указанная среда содержит синтетическую среду от 0,1 до 100 г/л гидролизата сои, имеющего молекулярную массу ≤1000 дальтон. Способ получения белка из культуры клеток млекопитающего включает введение клеток в указанную выше среду, причем указанные клетки экспрессируют требуемый белок; выращивание указанных клеток в указанной среде и экспрессию указанного белка, тем самым получение смеси указанных клеток и указанного белка в среде; очистку указанного белка из указанной смеси. Изобретение позволяет повысить выход клеток млекопитающего. 5 н. и 9 з.п. ф-лы, 7 табл., 4 ил.

Комментарии