Рекомбинантный вирус, экспрессирующий чужеродную днк, кодирующую кошачий cd80, кошачий ctla-4 или кошачий cd86, и его использование - RU2244006C2
Код документа: RU2244006C2
Чертежи













Описание
Интерферон-γ и его использование
В этой заявке испрашивается приоритет заявки США рег. №09/071711, поданной 1 мая, 1998, содержание которой вводится в настоящее описание посредством ссылки. В настоящей заявке ссылки на различные публикации даны в скобках. Все ссылки на эти публикации можно найти в конце описания непосредственно перед списком последовательностей. Для более полного описания предшествующего уровня техники в области, к которой относится настоящее изобретение, указанные публикации во всей своей полноте вводятся в настоящее описание посредством ссылки.
Предшествующий уровень техники
Предполагается, что стимуляция активации и пролиферации Т-клеток в ответ на заболевание хозяина зависит от двух типов взаимодействия: распознавания Т-клеточного рецептора (TCR) иммуногенными пептидами в присутствии молекул МНС класса I, и вторичного взаимодействия дополнительных лигандов, таких как CD80 и CD86 с их корецепторами CD-28 и/или CTLA-4 на Т-клетках. Эффективное взаимодействие по этим двум путям каскадов реакций приводит к активации и пролиферации как CD4+-T-, так и СD8+-T-клеток и к повышенному продуцированию регулирующих иммунный ответ цитокинов типа Th1 и Th2. В отсутствие адекватной ко-стимуляции Т-клеток может развиваться анергическое состояние, в результате чего будет отсутствовать пролиферация Т-клеток и секреция цитокинов. За последние несколько лет было выявлено, что главными регуляторами Т-клеточного ответа являются две молекулы, CD28 и его лиганды, CD80 и CD86. CD28 представляет собой главный ко-стимулирующий Т-клеточный рецептор, и после взаимодействия с CD80 и CD86 он усиливает пролиферацию Т-клеток и синтез цитокинов, предупреждая гибель Т-клеток. CTLA-4 (также называемый CD152), гомолог CD-28, также играет важную роль в ко-стимуляции. Очевидно, хотя это точно не известно, он ингибирует Т-клеточные ко-стимулирующие ответы. Взаимодействие и взаимосвязь между CD28, CTLA-4 и их лигандами CD80 и CD86 в процессах ко-стимуляции играют ключевую роль в общем индуцировании и супрессии иммунных реакций в ответ на заболевание хозяина. (Linsley et al., 1991 a; 1993 a).
В настоящее время не существует эффективных вакцин для предупреждения состояния иммунодефицита у кошек и инфекционного перитонита у кошек. В настоящее время имеются вакцины против вируса кошачьего лейкоза, но уровень их эффективности остается проблематичным, а в некоторых случаях они могут даже вызывать данное заболевание. Было показано, что экспериментальные вакцины против инфекционного перитонита у кошек не обладают протективным действием или даже вызывают преждевременную гибель животного вследствие антитело-опосредованного обострения заболевания. Поэтому необходимо получить лекарственные средства и композиции, которые обеспечивали бы защиту от этих и других заболеваний, против которых еще не существует вакцин, либо которые повышали бы эффективность существующих и широко применяемых вакцин. Кроме того, необходимо получить вакцины и лекарственные средства, которые индуцировали бы клеточно-опосредованный ответ в отсутствие антител, способствующих обострению заболевания. И наконец, вакцинация котят представляет определенные трудности вследствие невозможности подавлять у них продуцирование материнских антител. Следовательно, необходимо получить безопасные и эффективные средства, которые позволяли бы решить эти проблемы.
В настоящем изобретении, для продуцирования нужного иммунного ответа на конкретный кошачий патоген или патологическое состояние у кошек можно регулировать Т-клеточные ответы посредством модификации экспрессии кошачьего CD28, кошачьего CTLA-4 и их лигандов, и к о-стимулирующих молекул кошачьего CD80 и кошачьего CD86 путем усиления, супрессии или переориентации этой экспрессии. В частности, указанные ко-стимулирующие молекулы могут быть использованы для вакцинации против инфекционных болезней, лечения инфекционных болезней и лечения опухолевых, дегенеративных, аутоиммунных и иммунодефицитных состояний у кошек. Настоящее изобретение позволяет решить проблемы, связанные с отсутствием эффективности и действенности современных кошачьих вакцин, описанных выше.
Краткое описание изобретения
Настоящее изобретение относится к рекомбинантному вирусу, который содержит, по крайней мере, одну чужеродную нуклеиновую кислоту, встроенную в не-основную область вирусного генома, где каждая такая чужеродная нуклеиновая кислота, кодирует белок.
Этот кодируемый белок выбирают из группы, состоящей из белка кошачьего CD28 или его иммуногенной части, белка кошачьего CD80 или его иммуногенной части, белка кошачьего CD86 или его иммуногенной части или белка кошачьего CTLA-4 или его иммуногенной части. Эта часть может быть экспрессирована при введении указанного рекомбинантного вируса в соответствующего хозяина.
Настоящее изобретение также относится к рекомбинантному вирусу, который, кроме того, содержит чужеродную нуклеиновую кислоту, кодирующую иммуноген, происходящий от патогена. Настоящее изобретение также относится к рекомбинантным вирусам, которые способны усиливать иммунный ответ у кошек.
Настоящее изобретение также относится к рекомбинантным вирусам, способным подавлять иммунный ответ у.кошек. Краткое описания чертежей
Фигура 1А: ДНК и аминокислотная последовательность кошачьего CD80 (В7-1) (TAMU)(SEQ ID NO. 1 и 2).
Фигура 1В: Кривая гидрофобности аминокислотной последовательности кошачьего CD80 (В7-1) (TAMU).
Фигура 2А: ДНК и аминокислотная последовательность кошачьего CD80 (b7-1) (SYNTRO) (SEQ ID NO. 3 и 4).
Фигура 2В: Кривая гидрофобности аминокислотной последовательности кошачьего CD80 (B7-1) (SYNTRO).
Фигура 3А: ДНК и аминокислотная последовательность кошачьего CD86 (В7-2)(SEQ ID NO. 5 и 6).
Фигура 3В: Кривая гидрофобности аминокислотной последовательности кошачьего CD86 (В7-2).
Фигура 4А: ДНК и аминокислотная последовательность кошачьего CD28 (SEQ ID NO. 7 и 8).
Фигура 4В: Кривая гидрофобности аминокислотной последовательности кошачьего CD28.
Фигура 5А: ДНК и аминокислотная последовательность кошачьего CTLA-4 (CD152)(SEQ ID NO. 9 и 10).
Фигура 5В: Кривая гидрофобности аминокислотной последовательности кошачьего CTLA-4 (CD152). Подробное описание изобретения
Настоящее изобретение относится к рекомбинантному вирусу, который содержит, по крайней мере, одну чужеродную нуклеиновую кислоту, встроенную в не-основную область вирусного генома, где каждая такая чужеродная нуклеиновая кислота (а) кодирует белок, выбранный из группы, состоящей из белка кошачьего CD28 или его иммуногенной части, белка кошачьего CD80 или его иммуногенной части, белка кошачьего CD86 или его иммуногенной части; белка кошачьего CTLA-4 или его иммуногенной части; и (Ь) способна экспрессироваться при введении указанного рекомбинантного вируса в соответствующего хозяина.
В одном из вариантов осуществления вышеописанного изобретения указанный рекомбинантный вирус содержит, по крайней мере, две чужеродные нуклеиновые кислоты, каждая из которых встроена в не-основную область вирусного генома.
В другом варианте осуществления изобретения указанный рекомбинантный вирус содержит, по крайней мере, три чужеродные нуклеиновые кислоты, каждая из которых встроена в не-основную область вирусного генома.
В другом варианте осуществления изобретения указанный рекомбинантный вирус содержит четыре чужеродные нуклеиновые кислоты, каждая из которых встроена в не-основную область вирусного генома.
В другом варианте осуществления изобретения, указанным рекомбинантным вирусом является, но не ограничивается ими, вирус оспы енотов, вирус оспы свиней или вирус герпеса кошек.
В другом варианте осуществления вышеописанного изобретения указанный рекомбинантный вирус содержит более чем одну чужеродную нуклеиновую кислоту, и каждая из этих чужеродных нуклеиновых кислот встроена в одну и ту же не-основную область. В другом варианте осуществления настоящего изобретения любой из указанных рекомбинантных вирусов содержит более чем одну чужеродную нуклеиновую кислоту, где все указанные чужеродные нуклеиновые кислоты не являются встроенными в одну и ту же неосновную область.
В одном из вариантов осуществления изобретения любой из указанных рекомбинантных вирусов содержит чужеродную нуклеиновую кислоту, кодирующую иммуноген, происходящий от патогена. В еще одном варианте осуществления изобретения рекомбинантный вирус кодирует кошачий патоген, рабивирусный патоген, патоген, происходящий от хламидий, патоген Toxoplasmosis gondii, патоген Dirofilaria immitis, патоген, происходящий от блох, или бактериальный патоген. В другом варианте осуществления изобретения рекомбинантный вирус содержит кодирующую последовательность вируса иммунодефицита кошек (FIV), вируса лейкоза кошек (FeLV), вируса инфекционного перитонита кошек (FIP), вируса панлейкопении кошек, кошачьего калицивируса, кошачьего реовируса типа 3, кошачьего ротавируса, кошачьего коронавируса, синцитиального вируса кошек, вируса саркомы кошек, вируса герпеса кошек, вируса болезни Борна кошек или кошачьих паразитов.
В другом варианте осуществления изобретения указанный рекомбинантный вирус содержит, по крайней мере, одну чужеродную нуклеиновую кислоту, которая включает промотор для экспрессии чужеродной нуклеиновой кислоты. В другом варианте осуществления изобретения указанный рекомбинантный вирус экспрессирует, по крайней мере, одну чужеродную нуклеиновую кислоту, которая находится под контролем промотора, который является эндогенным для этого вируса.
В одном из вариантов осуществления изобретения любой из указанных рекомбинантных вирусов содержит чужеродную нуклеиновую кислоту, кодирующую детектируемый маркер. В другом варианте осуществления изобретения указанным детектируемым маркером является бета-галактозидаза E.coli.
Настоящее изобретение также относится к рекомбинантному вирусу, кодирующему иммуногены, происходящие от gаg-протеазы FIV, белка оболочки FIV, gаg-протеазы FeLV или белка оболочки FeLV.
Настоящее изобретение относится к рекомбинантному вирусу, который, кроме того, содержит нуклеиновую кислоту, включающую геном вируса иммунодефицита кошек или его часть. Настоящее изобретение относится к рекомбинантному вирусу, который, кроме того, содержит нуклеиновую кислоту, включающую геном вируса лейкоза кошек или его часть. Настоящее изобретение относится к рекомбинантному вирусу, который, кроме того, содержит нуклеиновую кислоту, кодирующую кошачий IL12, GM-CSF, р35 или р40. Настоящее изобретение также относится к вакцине, включающей эффективное иммунизирующее количество такого рекомбинантного вируса и соответствующий носитель.
Настоящее изобретение относится к рекомбинантному вирусу герпеса кошек, содержащему не-основную область, которой является ген гликопротеина G вируса герпеса кошек.
Настоящее изобретение относится к рекомбинантному вирусу герпеса кошек по п.12 формулы изобретения, обозначенному S-FHV-031 (АТСС, номер доступа VR-2604). Этот вирус был депонирован 1 мая 1998 в Американской коллекции типовых культур (АТСС), 10801 University Boulevard, Manassas, VA 20108-0971, U.S.A. в рамках Будапештского договора в соответствии Международным соглашением по депонированию микроорганизмов для проведения патентной экспертизы.
Настоящее изобретение относится к рекомбинантному вирусу оспы свиней, имеющему не-основную область в более крупном HindIII-BglII-субфрагменте HindIII-фрагмента М вируса оспы свиней. Настоящее изобретение относится к рекомбинантному вирусу оспы свиней по п.14 формулы изобретения, обозначенному S-SPV-246 (АТСС, номер доступа VR-2603). Этот вирус был депонирован 1 мая 1998 в Американской коллекции типовых культур (АТСС), 10801 University Boulevard, Manassas, VA 20108, U.S.A. в рамках Будапештского договора в соответствии Международным соглашением по депонированию микроорганизмов для проведения патентной экспертизы.
В одном из вариантов своего осуществления вышеописанное изобретение относится к рекомбинантному вирусу, где часть белка CD28, CD80 или CD86 является растворимой частью белка. В другом варианте своего осуществления настоящее изобретение относится к рекомбинантному вирусу, который содержит чужеродную нуклеиновую кислоту, кодирующую белок CTLA-4 кошек.
Вышеописанное изобретение относится к вакцине, которая содержит эффективное иммунизирующее количество рекомбинантного вируса и подходящий носитель. В одном из вариантов осуществления настоящего изобретения вакцина содержит эффективное иммунизирующее количество рекомбинантного вируса, составляющее от около 1×105 б.о.е./мл до около 1×108 б.о.е./мл. В другом варианте настоящего изобретения вакцина, кроме того, включает смесь, содержащую рекомбинантный вирус и эффективное иммунизирующее количество второго иммуногена.
Настоящее изобретение относится к способу усиления иммунного ответа у кошек, предусматривающему введение этим кошкам эффективного иммунизирующего количества любого из вышеиндентифицированных рекомбинантных вирусов. Настоящее изобретение, кроме того, относится к способу иммунизации кошек, предусматривающему введение этим кошкам эффективного иммунизирующего количества любого из вышеиндентифицированных рекомбинантных вирусов.
Настоящее изобретение относится к способу супрессии (подавления) иммунного ответа у кошек, предусматривающему введение этим кошкам эффективного супрессирующего количества рекомбинантного вируса, содержащего растворимый CD28, CD80 или CD86. Настоящее изобретение относится к способу супрессии иммунного ответа у кошек путем введения этим кошкам любого эффективного супрессирующего количества рекомбинантного вируса, содержащего белок кошачьего CTLA-4.
Настоящее изобретение относится к внутривенному, подкожному, внутримышечному, чрезмышечному, местному, пероральному или внутрибрюшинному введению вышеописанного рекомбинантного вируса.
В одном из вариантов своего осуществления настоящее изобретение относится к способу супрессии иммунного ответа у кошки, где эта кошка является реципиентом трансплантированного органа или ткани или подвержена иммунной реакции.
В другом варианте своего осуществления настоящее изобретение относится к способу супрессии иммунного ответа у кошек, предусматривающему введение этим кошкам антисмысловой нуклеиновой кислоты, способной гибридизоваться: (а) с мРНК-транскриптом кошачьего CD28, (b) с транскриптом кошачьего CD80 или (с) с мРНК-транскриптом кошачьего CD86, или ингибировать их трансляцию, где указанная антисмысловая нуклеиновая кислота присутствует в количестве, эффективном для ингибирования трансляции, и тем самым подавляет иммунный ответ у кошек.
В одном из вариантов своего осуществления вышеописанное изобретение относится к способу уменьшения или уничтожения опухоли у кошки, предусматривающему введение в опухоль этой кошки рекомбинантного вируса, содержащего нуклеиновую кислоту, которая кодирует белок кошачьего CD80, белок кошачьего CD86 или их комбинацию в количестве, эффективном для уменьшения и уничтожения этой опухоли.
В одном из вариантов своего осуществления настоящее изобретение относится к способу уменьшения или уничтожения опухоли у кошек, где указанный рекомбинантный вирус, кроме того, содержит и способен экспрессировать опухолеассоциированный антиген кошек, и где указанный способ осуществляют путем системного введения этого рекомбинантного вируса.
Настоящее изобретение относится к выделенной и очищенной ДНК, кодирующей лиганд кошачьего CD80 (В7-1) или лиганд кошачьего CD86 (В7-2), либо рецептор CD28 кошек или рецептор CTLA-4 кошек (CD152), а также к клонирующим и экспрессирующим векторам, содержащим CD80 или CD86, либо CD28 или CTLA-4, или РНК, частично или целиком, и к клеткам, трансформированным CD80-кодирующими векторами или CD86-кодирующими векторами, либо CD28-кодирующими векторами или CTLA-4-кодирующими векторами. Животных семейства кошачьих, от которых происходит CD80, CD86, CD28 или CTLA-4, выбирают из группы, включающей, но не ограничивающейся ими: домашние кошки, львы, пумы, рыси и гепарды.
Настоящее изобретение относится к выделенной и очищенной кДНК кошачьего CD80 (В7-1), содержащей приблизительно 941 нуклеотид. Настоящее изобретение также относится к выделенному и очищенному полипептиду кошачьего CD80, содержащему приблизительно 292 аминокислоты, в нативной мембраноассоциированной или зрелой форме, и имеющему молекулярную массу около 33485 кДа, изоэлектрическую точку около 9,1, и общий заряд при рН 7,0, равный 10. Ко-экспрессия CD80, вместе с костимулирующей молекулой CD28 и опухолевым антигеном или антигеном от патогенного организма, способствует активации или усилению активации Т-лимфоцитов, что приводит к продуцированию цитокина, стимулирующего иммунный ответ, а также способствует регуляции роста клеток других типов. Ко-экспрессия CD80, вместе с ко-стимулирующей молекулой CTLA-4, способствует регуляции активации Т-лимфоцитов.
Настоящее изобретение относится к выделенной и очищенной кДНК кошачьего CD86 (В7-2), содержащей приблизительно 1176 нуклеотидов. Настоящее изобретение также относится к выделенному и очищенному полипептиду кошачьего CD86, содержащему приблизительно 320 аминокислот, в нативной мембраноассоциированной или зрелой форме, и имеющему молекулярную массу приблизительно 36394 кДа, изоэлектрическую точку около 9,19, и общий заряд при рН 7,0, равный 11,27. Ко-экспрессия CD86, вместе с ко-стимулирующей молекулой CD28 и опухолевым антигеном или антигеном от патогенного микроорганизма, способствует активации или усилению активации Т-лимфоцитов, что приводит к продуцированию цитокинов, стимулирующих иммунный ответ, а также способствует регуляции роста клеток других типов. Ко-экспрессия CD86, вместе с ко-стимулирующе и молекулой CTLA-4, способствует регуляции активации Т-лимфоцитов.
В соответствии с настоящим изобретением кошачий CD80 или кошачий CD86 получают из природных или рекомбинантных источников. В соответствии с настоящим изобретением кошачьи CD80 или CD86 имеют нативную или мембраносвязанную форму либо секретированную форму, в которой отсутствует трансмембранный домен.
Настоящее изобретение относится к выделенной и очищенной кДНК кошачьего CD28, содержащей около 689 нуклеотидов. Настоящее изобретение также относится к выделенному и очищенному полипептиду кошачьего CD28, содержащему приблизительно 221 аминокислоту, в нативной мембрано-связанной или зрелой форме, и имеющему молекулярную массу около 25319 кДа, изоэлектрическую точку около 9,17 и общий заряд при рН 7,0, равный 9,58.
Настоящее изобретение относится к выделенной и очищенной кДНК кошачьего CTLA-4, содержащей около 749 нуклеотидов. Настоящее изобретение также относится к выделенным и очищенным полипептидам кошачьего CTLA-4, содержащим приблизительно 223 аминокислоты, в нативной мембраноассоциированной или зрелой форме, и имеющим молекулярную массу около 24381 кДа, изоэлектрическую точку около 6,34, и общий заряд при рН 7,0, равный -0,99.
Настоящее изобретение относится к рекомбинантному вирусу оспы свиней, экспрессирующему чужеродную ДНК, где указанная чужеродная ДНК кодирует кДНК и полипептиды кошачьего CD80, кошачьего CD86, кошачьего CD28 и кошачьего CTLA-4.
Настоящее изобретение относится к рекомбинантному вирусу оспы енотов, экспрессирующему чужеродную ДНК, где указанная чужеродная ДНК кодирует кДНК и полипептиды кошачьего CD80, кошачьего CD86, кошачьего CD28 и кошачьего CTLA-4.
Настоящее изобретение относится к рекомбинантному вирусу герпеса кошек, экспрессирующему чужеродную ДНК, где указанная чужеродная ДНК кодирует кДНК и полипептиды кошачьего CD80, кошачьего CD86, кошачьего CD28 и кошачьего CTLA-4.
В другом своем аспекте настоящее изобретение относится к способу усиления иммунного ответа у кошек на иммуноген, который достигается введением этого иммуногена до, после или, в основном, одновременно с введением кошачьего CD80 или кошачьего CD86 вместе с кошачьим CD28 или кошачьим CTLA-4 или без них в рекомбинантном векторе на основе вируса оспы свиней, в рекомбинантном векторе на основе вируса оспы енотов, или в рекомбинантном векторе на основе вируса герпеса кошек, в количестве, эффективном для усиления иммунного ответа.
В другом своем аспекте настоящее изобретение относится к способу подавления иммунного ответа у кошек на иммуноген, который достигается введением этого иммуногена до, после или, в основном, одновременно с введением кошачьего CD80 или кошачьего CD86 вместе с кошачьим CD28 или кошачьим CTLA-4 или без них, либо вместе с антисмысловой РНК или ДНК, частично или целиком кодирующей кошачий CD80, кошачий CD86, кошачий CD28 или кошачий CTLA-4, в рекомбинантном векторе на основе вируса оспы свиней, в рекомбинантном векторе на основе вируса оспы енотов или в рекомбинантном векторе на основе вируса герпеса кошек, в количестве, эффективном для подавления иммунного ответа.
В другом своем аспекте настоящее изобретение относится к вакцине для индуцирования иммунного ответа у кошек на иммуноген, содержащей иммуноген и эффективное количество кошачьего CD80 в рекомбинантном векторе на основе вируса оспы свиней, в рекомбинантном векторе на основе вируса оспы енотов или в рекомбинантном векторе на основе вируса герпеса кошек, для усиления иммунного ответа. Этот иммуноген происходит, например, от кошачьих патогенов, таких как вирус иммунодефицита кошек, вирус лейкоза кошек, парвовирус кошек, коронавирус кошек, лептовирус кошек и т.п.
В другом своем аспекте настоящее изобретение относится к вакцине для индуцирования иммунного ответа у кошек на иммуноген, которое достигается путем введения рекомбинантного вектора на основе вируса оспы свиней, рекомбинантного вектора на основе вируса оспы енотов или рекомбинантного вектора на основе вируса герпеса кошек, экспрессирующего ДНК или РНК иммуногена и ДНК или РНК дополнительных молекул кошачьих CD80, CD86, CD28 в любой комбинации, кодирующих белки или фрагмент белков в количестве, эффективном для модуляции иммунного ответа.
Белок кошачьего CD80 имеет аминокислотную последовательность, которая на 59% и 46% идентична последовательностям белков человека и мыши, соответственно. Белок кошачьего CD86 имеет аминокислотную последовательность, которая на 68% и 64% идентична последовательностям белков человека и кролика, соответственно. Белок кошачьего CD28 имеет аминокислотную последовательность, которая на 82% и 74% идентична последовательностям белков человека и мыши, соответственно. Белки кошачьего CTLA-4 имеют аминокислотную последовательность, которая на 88% и 78% идентична последовательностям белков человека и мыши, соответственно. Человеческие или мышиные белки CD80 или CD86 не могут функционально заменять белки кошачьего CD80 или CD86. Поэтому кошачий CD80, кошачий CD86, кошачий CD28 и кошачий CTLA-4 представляют собой новые реагенты, необходимые для регуляции иммунитета у кошек.
Настоящее изобретение относится к дополнительным Т-клеточным регуляторным молекулам, CD80 (В7-1) или CD86 (В7-2) или CD28 или CTLA-4 (CD152), происходящим от животных семейства кошачьих. Настоящее изобретение относится к выделенным и очищенным нуклеиновым кислотам, кодирующим, частично или полностью, кошачий CD80, кошачий CD86, кошачий CD28 или кошачий CTLA-4, а также к полипептидам CD80, CD86, CD28 или CTLA-4, выделенным либо из нативных, либо из рекомбинантных источников. Кошачий CD80, CD86, CD28 или CTLA-4, продуцируемый в соответствии с настоящим изобретением, может быть использован для усиления эффективности кошачьих вакцин против опухолей и патогенных микроорганизмов, а также в качестве терапевтического средства для лечения вирусных и бактериальных болезней кошек. Кошачий CD80, CD86, CD28 или CTLA-4, продуцируемый в соответствии с настоящим изобретением, может быть также использован для ослабления заболевания, обусловленного высокоактивным, сверхактивным или неправильно направленным иммунным ответом.
Нуклеиновые кислоты, векторы, трансформанты
Последовательности кДНК, кодирующие кошачий CD80 (SEQ ID NO: 1, 3) кошачий CD86 (SEQ ID NO: 5), кошачий CD28 (SEQ ID NO: 7) или кошачий CTLA-4 (SEQ ID NO: 9) показаны на фиг.1-5, а предсказанные аминокислотные последовательности кошачьего CD80 (SEQ ID NO: 2, 4) кошачьего CD86 (SEQ ID NO: 6), кошачьего CD28 (SEQ ID NO: 8) или кошачьего CTLA-4 (SEQ ID NO: 10) показаны на фиг.1-5. Конструирование этих кошачьих полипептидов, таких как CD80, CD86, CD28 или CTLA-4 основано на частичной гомологии аминокислотных последовательностей с человеческим, мышиным или кроличьим гомологом этих полипептидов, и способности полипептидов CD80 или CD86 связываться с рецептором кошачьего CD28 (см. ниже) или CTLA-4 и активировать или стимулировать либо регулировать активацию Т-лимфоцитов каким-либо другим образом. Кроме того, не претендуя на какую-либо конкретную теорию, можно предположить, что полипептиды кошачьего CD80 или кошачьего CD86 также обладают одной или более биологическими активностями: активацией клеток-киллеров (природных киллеров), стимуляцией созревания В-клеток, активацией МНС-рестриктированных цитотоксических Т-лимфоцитов, пролиферацией тучных клеток, взаимодействием с рецепторами цитокинов и индуцированном цитокинов, регулирующих иммунный ответ.
Вследствие вырожденности генетического кода (то есть, когда множество кодонов кодируют определенные аминокислоты), ДНК-последовательности, отличающиеся от последовательностей, показанных на фиг.1-5, могут также кодировать аминокислотные последовательности кошачьего CD80, CD86, CD28 или CTLA-4, показанные на фиг.1-5. Такими другими ДНК являются последовательности, содержащие "консервативные в отношении последовательности" варианты, в которых модификация в одном или нескольких нуклеотидах в данном кодоне не приводит к изменению аминокислоты, кодируемой в этом положении. Кроме того, данный аминокислотный остаток в полипептиде часто может быть заменен без изменения всей конформации и функции нативного полипептида. Такими "функционально консервативными" вариантами являются, но не ограничиваются ими, замена аминокислоты другой аминокислотой, имеющей аналогичные физико-химические свойства, такие как например, кислотные, основные, гидрофобные, гидрофильные, ароматические свойства и т.п.(например, замена лизина на аргинин, аспартата на глутамат или глицина на аланин). Кроме того, аминокислотные последовательности могут быть добавлены или делетированы без нарушения биологической активности молекулы. Так, например, к амино- или к карбокси-концам могут быть добавлены дополнительные аминокислотные последовательности, которые служат в качестве меток для очистки, таких как гистидиновые метки (то есть, для обеспечения одностадийной очистки белка, после которой их удаляют химическим или ферментативным методом). Альтернативно, эти дополнительные последовательности вносят дополнительные сайты связывания на клеточной поверхности, или каким-либо другим способом изменяют специфичность кошачьих CD80, CD86, CD28 или CTLA-4 по отношению к клетке-мишени, так, чтобы в результате добавлялся антигенсвязывающий сайт для антител.
кДНК кошачьего CD80, кошачьего CD86, кошачьего CD28 или кошачьего CTLA-4, входящие в объем настоящего изобретения, представляют собой последовательности, показанные на фиг.1-5; консервативные в отношении последовательности вариантные ДНК; ДНК-последовательности, кодирующие функционально консервативные вариантные полипептиды; и их комбинации. Настоящее изобретение относится к фрагментами кошачьих CD80, CD86, CD28 и CTLA-4, которые, взятые отдельно или в комбинации с другими последовательностями или компонентами, обладают нужной степенью биологической активности. Как будет объяснено ниже, каждый специалист может самостоятельно осуществлять прогнозируемые манипуляции с последовательностями CD80, CD86, CD28 или CTLA-4 и установить, обладает ли данный вариант кошачьего CD80, CD86, CD28 или CTLA-4 соответствующей стабильностью и биологической активностью для данного применения, либо установить, приводят ли изменения, которые влияют на активности связывания этих молекул, к повышенной эффективности. Каждый из кошачьих CD80 и CD86 связывается с ко-рецептором CD28 или с ко-рецептором CTLA-4. Это может быть достигнуто путем экспрессии и очистки вариантных полипептидов CD80, CD86, CD28 или CTLA-4 в рекомбинантной системе путем анализа их Т-клеточной стимулирующей активности и/или стимулирующей рост активности в клеточной культуре и в организме животных с последующим тестированием на пригодность для данного применения. Вариант CD80 тестируют на биологическую активность по функциональному связыванию с рецепторами CD28 или CTLA-4. Вариант CD86 тестируют на биологическую активность по функциональному связыванию с рецепторами CD28 или CTLA-4. Аналогичным образом вариант CD28 или CTLA-4 тестируют на биологическую активность.
Настоящее изобретение также относится к ДНК кошачьих CD80, CD86, CD28 или CTLA-4 (и к полипептидам), происходящим от животных семейства кошек, таких как, но не ограничиваюясь ими, домашние кошки, львы, тигры, гепарды, рыси и т.п. Гомологи последовательностей кошачьих CD80, CD86, CD28 или CTLA-4, показанные на фиг.1-5, были легко индентифицированы путем скрининга кДНК или геномных библиотек для идентификации клонов, которые гибридизуются с зондами, содержащими всю или часть последовательности, показанной на фиг.1-5. Альтернативно, библиотеки экспрессируемых последовательностей скринируют с использованием антител, которые распознают кошачьи CD80, CD86, CD28 или CTLA-4. Не претендуя на конкретную теорию, можно предположить, что гены CD80 или CD86 от других кошачьих имеют гомологию с генами кошачьих CD80, CD86, CD28 или CTLA-4, по крайней мере, приблизительно на 70%. В объем настоящего изобретения также входят ДНК, которые кодируют гомолог CD80, CD86, CD28 или CTLA-4, определенный как ДНК, кодирующая полипептиды, имеющие идентичность аминокислот с кошачьими CD80, CD86, CD28 или CTLA-4, по крайней мере, приблизительно на 25%.
В основном для манипуляций с нуклеиновыми кислотами в соответствии с настоящим изобретением используются методы, хорошо известные специалистам, такие, которые были описаны, например, в Molecular Cloning: A Laboratory manual, (2nd Ed., Sambrook Fritsch & Maniatis, Cold Spring Harbor Laboratory, Cold Spring Harbor), или Current Protocols in Molecular Biology, (Eds. Ausubel, Brent, Kingston, More, Feidman, Smith & Stuhl, Greene Publ. Assoc. Wiley Interscience, NY, NY, 1992).
Настоящее изобретение относится к кДНК- и РНК-последовательностям и к смысловым и антисмысловым последовательностям.
Настоящее изобретение также относится к геномным ДНК-последовательностям кошачьих CD80, CD86, CD28 или CTLA-4 и к фланкирующим последовательностям, включая регуляторные последовательности, но не ограничиваясь ими. Последовательности нуклеиновых кислот, кодирующие полипептид(ы) кошачьих CD80, CD86, CD28 или CTLA-4, также ассоциируются с гетерологичными последовательностями, включая промоторы, энхансеры, элементы иммунного ответа, сигнальные последовательности, последовательности полиаденилирования, интроны, 5’- и 3’-некодирующие области и т.п. Элементами регуляции транскрипции, которые функционально присоединены к кДНК-последовательности(ям) кошачьих CD80, CD86, CD28 или CTLA-4, являются, но не ограничиваются ими, последовательности, которые способны регулировать экспрессию генов, происходящих от прокариотических клеток, эукариотических клеток, вирусов прокариотических клеток, вирусов эукариотических клеток и любых их комбинаций. Специалистам известны и другие подходящие гетерологичные регуляторные последовательности.
Нуклеиновые кислоты настоящего изобретения были модифицированы методами, известными специалистам, в целях изменения их стабильности, растворимости, аффинности связывания и специфичности. Так, например, эти последовательности были селективно метилированы. Последовательности нуклеиновых кислот настоящего изобретения были также модифицированы меткой, способной прямо или опосредованно продуцировать детектируемый сигнал. Примерами меток являются радиоизотопы, флуоресцентные молекулы, биотин и т.п.
Настоящее изобретение также относится к векторам, которые включают нуклеиновые кислоты, которые, частично или полностью, кодируют полипептиды CD80, CD86, CD28 или CTLA-4. Такими векторами являются, например, плазмидные векторы для экспрессии в различных эукариотических и прокариотических хозяевах. Эти векторы, предпочтительно, также содержат промотор, функционально присоединенный к части, кодирующей полипептид кошачьего CD80, CD86, CD28 или CTLA-4. Кодированные полипептиды кошачьего CD80, CD86, CD28 или CTLA-4 были экспрессированы с использованием любых подходящих векторов и клеток-хозяев, описанных в настоящей заявке или известных специалистам из других источников.
Настоящее изобретение также относится к векторам, которые включают нуклеиновые кислоты, кодирующие полипетиды кошачьих CD80, CD86, CD28 или CTLA-4 частично или полностью. Такими векторами являются, например, векторы на основе "живого" вируса для экспрессии в различных эукариотических хозяевах или для экспрессии ДНК- или РНК-вакцин. В одном из вариантов осуществления изобретения этот вектор на основе живого вируса является аттенуированным (ослабленным). В другом варианте настоящего изобретения этот вектор на основе живого вируса был аттенуирован посредством делеции генов. В другом варианте настоящего изобретения этот вирусный вектор был инактивирован путем химической обработки или термообработки. Этот вектор получают на основе живого вируса, выбранного из группы, включающей, но не ограничивающейся ими, вирус герпеса, поксвирус, аденовирус, адено-ассоциированный вирус, ретровирус, бакуловирус, альфавирус, рабдовирус, пикорнавирус. Этот вектор получают на основе живого вируса, выбранного из группы, включающей, но не ограничивающейся ими, кошачий вирус герпеса, собачий вирус герпеса, птичий вирус герпеса, бычий вирус герпеса, лошадиный вирус герпеса, псевдорабивирус, вирус оспы свиней, вирус оспы птиц, вирус оспы домашней птицы, вирус оспы енотов, вирус оспы канареек, вирус коровьей оспы, вирус мышиного лейкоза Молони, вирус Синдбис и вирус Семлики-Форест.
Вектор на основе живого вируса представляет собой рекомбинантный вирусный вектор, экспрессирующий чужеродную ДНК, которой является часть или вся кДНК кошачьего CD80, CD86, CD28 или CTLA-4. Чужеродной ДНК является также кДНК для антигена от патогенного организма. Рекомбинантный вирусный вектор конструируют методами гомологичного рекомбинантного или космидного реконструирования, известными специалистам. Предпочтительно, чтобы эти векторы также включали промотор, функционально присоединенный к части, кодирующей полипептид кошачьего CD80, CD86, CD28 или CTLA-4. Этот промотор выбирают из группы, включающей, но не ограничивающейся ими, промотор вируса герпеса gЕ кошек, синтетическтй ранний/поздний промотор поксвируса, предранний промотор цитомегаловируса человека, промотор псевдорабивируса gХ. Стимуляция экспрессии генов также предусматривает экспрессию кДНК CD80, CD86, CD28 или CTLA-4, происходящую от элемента внутреннего сайта связывания с рибосомой (IRES), присутствующего в кластере (вектор pCITE, Novagen, Madison, WI). Клеточными линиями для культивирования вирусных векторов являются, но не ограничиваются ими, клетки кошачьей почки Crandell (CRFK), фибробласты куриного эмбриона, клетки почки свиного эмбриона (ESK-4), клетки свиной почки (РК). Кодируемый(е) полипептид(ы) кошачьего CD80, CD86, CD28 или CTLA-4 экспрессировали с использованием подходящих векторов и клеток-хозяев, описанных в настоящей заявке или известных специалистам из других источников.
В предпочтительном варианте осуществления изобретения, гены, кодирующие кошачьи CD80 и CD28, CD80 и CTLA-4, CD86 и CD28 или CD86 и CTLA-4 в комбинации с генами для иммуногена, происходящего от кошачьего патогена, вводят в один рекомбинантный вирусный вектор, а затем на основе этого вектора получают живую вакцину. Гены кошачьих CD80, CD86, CD28 или CTLA-4, отдельно или в комбинации с генами кошек, происходящими от кошачьих патогенов, вводят в рекомбинантный вирус, так, чтобы экспрессия этих генов регулировалась соответствующим промотором. В другом варианте осуществления изобретения гены, кодирующие кошачьи CD80, CD86, CD28 или CTLA-4, отдельно, или в комбинации, встраивают в рекомбинантный вирусный вектор и вводят в вакцину вместе со вторым рекомбинантным вирусным вектором, который кодирует гены для иммуногена(ов), происходящего(щие) от кошачьих патогенов. Эти два варианта осуществления изобретения позволяют продуцировать нужные иммунные ответы в тех же клетках или в клетках, находящихся в непосредственной близости от этих клеток, в результате чего достигается усиление, супрессия или переориентация нужного иммунного ответа.
Иммуноген выбирают из группы, включающей, но не ограничивающейся ими, кошачьи патогены, такие как вирус иммунодефицита кошек, вирус лейкоза кошек, вирус инфекционного перитонита кошек, вирус панлейкопении кошек (парвовирус), кошачий калицивирус, кошачий реовирус типа 3, кошачий ротавирус, кошачий коронавирус (вирус инфекционного перитонита), рабивирус, синцитиальный вирус кошек, вирус саркомы кошек, вирус герпеса кошек (вирус ринотрахеита), вирус болезни Борна кошек, хламидии, Toxoplasmosis gondii, кошачьи паразиты, Dirofilaria iimnitis, блохи, бактериальные патогены, и т.п.
Векторы или векторы на основе "живых" вирусов часто включают одну или несколько систем репликации для клонирования или экспрессии, один или несколько маркеров для отбора в хозяине, таких как, например, маркер резистентности к антибиотику, или калориметрические маркеры, такие как β-галактозидаза (lacZ) или β-глюкуронидаза (uidA), или флуоресцентные маркеры, такие как белок, флуоресцирующий в зеленом диапазоне спектра, и один или несколько экспрессионных кластеров. Встроенные кодирующие последовательности синтезируют, выделяют из природных источников и получают в виде гибридов или т.п. Лигирование кодирующих последовательностей с последовательностями регуляции транскрипции осуществляют методами, известными специалистам. Подходящие клетки-хозяева трансформируют/трансфецируют/инфицируют любым подходящим методом, включая электропорацию, поглощение ДНК, опосредованное СаСl2 или липосомой, инфицирование грибками, микроинъекцию, доставку микрочастиц путем бомбардировки или т.п.
Подходящими векторами, предназначенными для использования в настоящем изобретении, являются, но не ограничиваются ими, YEp352, pcDNAI (Invitrogen, Carlsbad, CA), pRc/CMV (Invitrogen) и pSFVl (GIBCO/BRL, Gaitheersburg, MD). Одним из предпочтительных векторов, предназначенных для использования в настоящем изобретении, является pSFVl. Подходящими клетками-хозяевами являются E.coli, дрожжи, клетки COS, клетки РС12, клетки СНО, клетки GH4C1, клетки ВНК-21 и клетки меланофоров амфибий. Для использования в настоящем изобретении предпочтительной клеточной линией-хозяином являются клетки ВНК-21. Векторами, подходящими для конструирования "оголенной" ДНК или для вакцинации генными вакцинами, являются, но не ограничиваются ими, pTarget (Promega, Madison, WI), pSI (Promega, Madison, WI) и pcDNA (Invitrogen, Carlsbad, CA).
Нуклеиновые кислоты, кодирующие полипептид(ы) кошачьих CD80, CD86, CD28 или CTLA-4, были также введены в клетки с помощью рекомбинантный методик. Так, например, такая последовательность может быть введена путем микроинъекции в клетку с осуществлением гомологичной рекомбинации в сайте эндогенного гена, кодирующего полипептид, его аналог или псевдоген, или последовательность со значительной идентичностью гену, кодирующему полипептид кошачьего CD80, CD86, CD28 или CTLA-4. Могут быть также использованы и другие методы, основанные на рекомбинации, такой как негомологичная рекомбинация и делеция эндогенного гена путем гомологичной рекомбинации, а в частности, в полипотентных клетках.
Настоящее изобретение относится к способу усиления иммунного ответа у кошек на иммуноген, который достигается введением этого иммуногена до введения, после введения или, в основном, одновременно с введением кошачьего CD80 или CD86 вместе с кошачьим CD28 или кошачьим CTLA-4 или без них в количестве, эффективном для усиления иммунного ответа.
Настоящее изобретение относится к способу усиления иммунного ответа у кошачьих на иммуноген, который достигается введением экспрессирующего вектора, содержащего иммуноген, происходящий от кошачьего патогена, и дополнительные молекулы кошачьего CD80 или CD86 вместе с кошачьим CD28 или кошачьим CTLA-4 или без них в количестве, эффективном для усиления иммунного ответа.
Настоящее изобретение относится к способу переориентации иммунного ответа у кошек на иммуноген, который достигается введением экспрессирующего вектора, содержащего иммуноген, происходящий от кошачьего патогена, и дополнительные молекулы кошачьего CD80 или CD86 вместе с кошачьим CD28 или кошачьим CTLA-4 или без них в количестве, эффективном для усиления иммунного ответа.
Настоящее изобретение относится к способу супрессии иммунного ответа у кошачьих на иммуноген, который достигается введением этого иммуногена до введения, после введения или, в основном, одновременно с введением кошачьего CD80 или CD86, вместе с кошачьим CD28 или кошачьим CTLA-4 или без них, либо вместе с антисмысловой РНК или ДНК, кодирующей кошачий CD80, кошачий CD86, кошачий CD28 или кошачий CTLA-4, в количестве, эффективном для супрессии иммунного ответа.
Настоящее изобретение относится к вакцине для индуцирования иммунного ответа у кошек на иммуноген, содержащей иммуноген и эффективное количество кошачьего CD80 или кошачьего CD86 вместе с кошачьим CD28 или кошачьим CTLA-4 или без них для усиления иммунного ответа, либо эффективное количество кошачьего CD80 или кошачьего CD86 вместе с кошачьим CTLA-4 для супрессии иммунного ответа. В другом варианте своего осуществления настоящее изобретение относится к вакцине, включающей экспрессирующий вектор, содержащий гены, кодирующие иммуноген(ы) для кошачьих патогенов, и гены, кодирующие CD80, CD86 вместе с кошачьим CD28 или кошачьим CTLA-4 или без них для усиления или супрессии иммунного ответа.
Полипептиды кошачьего CD80, CD86, CD28 или CTLA-4
Ген кошачьего CD80 (ДНК и аминокислотная последовательность которого показаны на фиг.1 и 2) кодирует полипептид приблизительно в 292 аминокислоты. Ген кошачьего CD86 (ДНК и аминокислотная последовательность которого показаны на фиг.3) кодирует полипептид приблизительно в 320 аминокислот. Ген кошачьего CD28 (ДНК и аминокислотная последовательность которого показаны на фиг.4) кодирует полипептид приблизительно в 221 аминокислоту. Ген кошачьего CTLA-4 (ДНК и аминокислотная последовательность которого показаны на фиг.3) кодирует полипептид приблизительно в 223 аминокислоты.
Очистку кошачьих CD80, CD86, CD28 или CTLA-4 из природных или рекомбинантных источников осуществляют хорошо известными методами, такими как, но не ограничиваясь ими, ионообменная хроматография, обращенно-фазовая хроматография на колонках с С4, гель-фильтрация, изоэлектрическое фокусирование, аффинная хроматография и т.п. В предпочтительном варианте осуществления изобретения, большие количества биологически активного кошачьего CD80, CD86, CD28 или CTLA-4 получают путем конструирования рекомбинантной ДНК-последовательности, содержащей область, кодирующую кошачий CD80, CD86, CD28 или CTLA-4, лигированный с сохранением рамки считывания с последовательностью, кодирующей 6 С-концевых гистидиновых остатков в репликоне pSFVl (GIBCO/BRL). мРНК, кодируемую этой плазмидой, синтезируют с использованием техники, хорошо известной специалистам, и вводят в клетки ВНК-21 путем электропорации. Эти клетки синтезируют и секретируют зрелые гликозилированные полипептиды кошачьего CD80, CD86, CD28 или CTLA-4, содержащие 6 С-концевых гистидиновых остатков. Модифицированные полипептиды кошачьего CD80, CD86, CD28 или CTLA-4 очищают из клеточного супернатанта с помощью аффинной хроматографии с использованием гистидин-связывающего полимера (His-bind, Novagen, Madison, WI).
Полипептиды кошачьего CD80 или кошачьего CD86, выделенные из любого источника, модифицируют известными методами. Так, например, кошачьи CD80, CD86, CD28 или CTLA-4 могут быть фосфорилированы или дефосфорилированы, гликозилированы или дегликозилированы и т.п. Особенно эффективными являются такие модификации, которые приводят к изменению растворимости, стабильности и специфичности и аффинности связывания кошачьего CD80, CD86, CD28 или CTLA-4.
Химерные молекулы кошачьих CD80, CD86, CD28, CTLA-4
Настоящее изобретение относится к продуцированию химерных молекул, полученных из фрагментов кошачьих CD80, CD86, CD28 и CTLA-4 в любой комбинации. Так, например, для повышения аффиности связывания с CD28 при поддержании усиленного иммунного ответа вместо сайта связывания CD28 вводят сайт связывания CTLA-4.
В одном из вариантов осуществления изобретения связывающие сайты для CD80 или CD86 на CTLA-4 и CD28 заменяют так, чтобы область связывания на CD28 была заменена областью связывания CTLA-4. Действие химерной молекулы CD28 с областью связывания с CTLA-4 должно способствовать увеличению аффинности CD28 по отношению к CD80 или CD86 и увеличению степени усиления иммунного ответа.
В альтернативном варианте осуществления изобретения химерные молекулы CD80 и CD28 или CD86 и CD28 или их фрагменты являются мембраносвязанными и повышают способность этих молекул к усилению иммунитета. В альтернативном варианте осуществления изобретения химерные молекулы CD80 и CTLA-4 или CD86 и CTLA-4 или их фрагменты являются мембраносвязанными и повышают способность этих молекул к подавлению иммунитета. В альтернативном варианте осуществления изобретения химерные молекулы CD80 и CTLA-4 или CD86 и CTLA-4 или их фрагменты являются мембраносвязанными и способствуют переориентации иммунного ответа для достижения нужного эффекта.
В альтернативном варианте осуществления изобретения кошачий CD80, CD86, CD28 или CTLA-4 представляет собой гибридный белок с другим полипептидом. Таким полипептидом является, но не ограничивается ими, иммуноглобулин, антиген, опухолевый антиген, рецептор клеточной поверхности или лиганд клеточной поверхности.
Антитела против кошачьего CD80, CD86, CD28 или CTLA-4
Настоящее изобретение относится к антителам, которые являются специфичными для полипептидов кошачьего CD80, CD86, CD28 или CTLA-4, идентифицированных как описано выше. Эти антитела являются поликлональными или моноклональными и распознают кошачий CD80, CD86, CD28 или CTLA-4 различных видов, идентифицируют функциональные домены и т.п. Такие антитела обычно продуцируют с использованием методов и композиций, описанных Harlow & Lane, Antibodies. A Laboratory Manual, Cold Spring Harbor Laboratory, 1988, а также с помощью иммунологической и гибридомной технологии, известной специалистам. Если для индуцирования иммунного ответа, специфичного для кошачьего CD80, CD86, CD28 или CTLA-4, используются пептиды, происходящие от природного и синтетического кошачьего CD80, CD86, CD28 или CTLA-4, то эти пептиды, обычно, присоединяют к подходящему носителю, такому как KLH, и вводят в подходящий адъювант, такой как адъювант Фрейнда. Выбранные пептиды, предпочтительно, присоединяют к носителю с лизиновой сердцевиной методами, в основном, описанными Tan (1988) Proc.Natl. Acad. Sci., USA, 85: 5409-5413. Полученные антитела, а в частности антиидиотипические антитела, несущие "внутреннний образ", могут быть также получены известными методами.
В одном из вариантов осуществления изобретения очищенные кошачьи CD80, CD86, CD28 или CTLA-4 используются для иммунизации мышей, после чего селезенку этих мышей удаляют, а спленоциты используют для генерирования клеточных гибридов с миеломными клетками с получением клонов антитело-секретирующих клеток методами, обычно используемыми специалистами. Полученные моноклональные антитела, секретированные указанными клетками, скринируют с использованием in vitro-анализов на следующие активности: связывания с кошачьим CD80, CD86, CD28 или CTLA-4, ингибирования рецепторсвязывающей активности CD80, CD86, CD28 или CTLA-4, и ингибирования Т-клеточно-стимулирующей активности CD80, CD86, CD28 или CTLA-4.
Антитела против кошачьего CD80, кошачьего CD86, кошачьего CD28 или кошачьего CTLA-4 используют для идентификации и количественной оценки кошачьего CD80, CD86, CD28 или CTLA-4 с использованием иммуноанализов, таких как ELISA, РИА и т.п. Антитела против кошачьего CD80, кошачьего CD86, кошачьего CD28 или кошачьего CTLA-4 также используют для иммунологического истощения экстрактов кошачьего CD80, кошачьего CD86, кошачьего CD28 или кошачьего CTLA-4. Кроме того, эти антитела могут быть использованы для идентификации, выделения и очистки кошачьего CD80, CD86, CD28 или CTLA-4 из различных источников и для проведения исследований по их субклеточной и гистохимической локализации.
Применения
Лиганд кошачьего CD80 (В7-1), лиганд кошачьего CD86 (В7-2), рецептор кошачьего CD28 или рецептор кошачьего CTLA-4 (CD152), продуцируемые в соответствии с настоящим изобретением, могут быть использованы преимущественно в качестве вакцины для предупреждения инфекционного заболевания или для стимуляции роста у гомологичных или гетерологичных видов кошачьих. Так, например, может быть осуществлена коэкспрессия CD80 или CD86 с ко-стимулирующими молекулами CD28 или CTLA-4 в любой комбинации, и опухолевого антигена или антигенов от патогенного микроорганизма. Ко-экспрессия кошачьего CD80 или CD86 с рецептором кошачьего CTLA-4 способствует ингибированию активации Т-лимфоцитов и супрессии иммунного ответа. Конкретным примером может служить ко-экспрессия CD80 или CD86 с иммуногенами, происходящими от FIV, FeLV или FIP, в вирусном векторе или в ДНК-экспрессирующем векторе, которые, при введении их в качестве вакцины, должны активировать, усиливать или регулировать пролиферацию CD4+- и CD8+-T-лимфoцитoв и индуцировать цитокины, регулирующие иммунный ответ, такие как IL-2, IFN-g, IL-12, TNFa, IL-6 и т.п. Другим конкретным примером может служить коэкспрессия CD80, CD86, CD28 или CTLA-4 в вирусном векторе или в ДНК-экспрессирующем векторе, которые, при введении их в качестве терапевтического средства, должны регулировать или переориентировать иммунный ответ.
Усиление иммунитета посредством взаимодействия кошачьего CD80 или CD86 с CD28 или CTLA-4 или ингибирование иммунного ответа посредством взаимодействия кошачьего CD80 или CD86 с CTLA-4 дает то преимущество, что при этом используется природный способ регуляции, а не добавление чужеродных веществ, которые даже могут оказывать множественное негативное действие на здоровье животного в течение всей его жизни или в течение продолжительного времени. Молекулы CD80, CD86, CD28 или CTLA-4 вводят вместе с другими рекомбинантными молекулами, такими, которые кодируют антигены, необходимые для индуцирования иммунитета. Ген кошачьего CD80, CD86, CD28 и/или CTLA-4 встраивают в экспрессирующий вектор или инфицируют или трансфецируют в клетку-мишень, и в этой клетке-мишени экспрессируется генный продукт так, что он является заякоренным в плазматической мембране этой клетки-мишени или антиген-презентирующей клетки, либо он секретируется из этой клетки-мишени или из антиген-презентирующей клетки. Экспрессирующий вектор, такой как плазмида, вирус Семлики-Форест, поксвирус или вирус герпеса, переносит данный ген в антиген-презентирующую клетку. Ген кошачьего CD80, CD86, CD28 и/или CTLA-4 или фрагменты генов в любой комбинации встраивают в ДНК- или РНК-экспрессирующий вектор и инъекцируют кошкам, в результате чего у этих кошек экспрессируется генный продукт в виде "оголенной" ДНК/РНК или в виде генной вакцины. Такая ко-экспрессия иммуногена и CD80, CD86, CD28 и/или CTLA-4 в клетке-мишени или в организме кошачьих способствует активации, усилению активации или регуляции Т-лимфоцитов, В-лимфоцитов и других клеток. Альтернативно, экспрессированный белок может быть введен после экспрессии в прокариотической или эукариотической системе, такой как плазмида, вирус Семлики-Форест, поксвирус или вирус герпеса или другой вирусный или бактериальный вектор. Белки кошачьего CD80, CD86, CD28 или CTLA-4 обычно функционируют в заякоренном виде в клеточной мембране, в качестве дополнительных молекул плазматической мембраны, но они могут быть представлены и в других формах, а в частности, без мембранных якорей.
В одном из вариантов осуществления изобретения кошачий CD80 и кошачий CD86 являются растворимыми, не содержат трансмембранного домена или гидрофобную область и взаимодействуют с ко-стимулирующими молекулами CD28 или CTLA-4 либо в мембрано-ассоциированной, либо в растворимой форме. В альтернативном варианте осуществления изобретения кошачий CD80 и кошачий CD86 являются мембраносвязанными, а костимулирующие молекулы CD28 или CTLA-4 присутствуют в растворимой форме и не содержат трансмембранного домена или гидрофобной области. Растворимые CD28 и CTLA-4, предпочтительно, в димерной форме, могут быть использованы для лечения болезней, связанных с Т-клеточно-опосредованной иммуносупрессией у кошек. Растворимый CD28 или CTLA-4 предупреждает отторжение трансплантированной ткани и может быть использован для лечения аутоиммунных заболеваний. В частности, растворимый CD28 или CTLA-4 может быть использован для предупреждения реакции "трансплантат против хозяина" при трансплантации костного мозга. Растворимый CD28 или CTLA-4 предупреждает связывание клетки, содержащей мембраноассоциированный кошачий CD80 или CD86.
В другом варианте настоящего изобретения кошачий CTLA-4 гибридизируют с иммуноглобулином (Ig). Гибрид "CTLA-4-IgG" может быть использован для подавления иммунного ответа или для лечения аутоиммуного заболевания. Такими аутоиммунными заболеваниями являются, но не ограничиваются ими, артрит, псориаз, отторжение трансплантированного органа, реакция "трансплантат против хозяина".
В одном из вариантов осуществления изобретения белки кошачьего CD80 и/или CD86, экспресссированные либо в связанной, либо в растворимой форме, могут быть использованы для лечения, т.е., уменьшения или уничтожения опухолей у кошек. В частности, белки кошачьего CD80 и/или CD86 могут быть экспресссированы из вирусного вектора или "оголенной" ДНК путем их прямой инъекции в опухоль или системного введения в комбинации с (или без них) кошачьими опухолеассоциированными антигенами, присутствующими в этом же векторе.
Консервативные в отношении последовательности и функционально консервативные варианты ДНК и полипептиды кошачьего CD80, CD86, CD28 или CTLA-4 или биологически активный фрагмент или субфрагмент кошачьего CD80, CD86, CD28 или CTLA-4 лигируют с сохранением рамки считывания с другой последовательностью, такой как последовательность цитокина, интерлейкина, интерферона, колониестимулирующего фактора, антигена от патогенного микроорганизма, антитела, или с последовательностью для очистки, такой как гистидиновая метка или репортерный ген, такой как lacZ E.coli, uidA E.coli, или белок, флуоресцирующий в зеленой области спектра.
Вакцины
Настоящее изобретение относится к способам и к композициям для усиления эффективности иммунного ответа у кошачьих. В этом варианте осуществления изобретения кошачий CD80, CD86, CD28 или CTLA-4 используют в сочетании с иммуногеном, против которого необходимо продуцировать иммунный ответ. Так, например, для регуляции интенсивности и качества иммунного ответа, желательно, чтобы в вакцине, содержащей иммуногены от патогенов, таких как вирус иммунодефицита кошек и вирус лейкоза кошек, и других патогенов, таких как кошачий парвовирус, кошачий лептовирус и кошачий коронавирус, присутствовал кошачий CD80, CD86, CD28 или CTLA-4. Для этого кошачьи CD80, CD86, CD28 или CTLA-4, очищенные из нативных или рекомбинантных источников, описанных выше, включают в вакцинный препарат в концентрации, составляющей в пределах от около 0,01 до 100,0 мг/вакцину на кошку. Альтернативно, рекомбинантный вектор, экспрессирующий кошачьи CD80, CD86, CD28 и/или CTLA-4, и иммуноген от кошачьего патогена вводят в указанный вакцинный препарат в концентрации, составляющей в пределах от около 0,01 до 100,0 мг/вакцину на кошку, а предпочтительно в концентрации, составляющей от около 0,25 до около 25 мг/кг/день.
Кошачий CD80, CD86, CD28 или CTLA-4 вводят в сочетании с вакциной на основе "живого" (т.е., реплицирующегося) вируса или с не-реплицирующейся вакциной. Неограничивающими примерами реплицирующихся вакцин являются вакцины, содержащие нативные или рекомбинантные вирусы или бактерии, такие как модифицированный вирус герпеса кошек или модифицированный вирус оспы енотов. Неограничиващими примерами "живых" вирусных вакцин, которые ограниченно реплицируются или вообще не реплицируются в организме-хозяине кошки, но которые экспрессируют чужеродную ДНК (такую, как ДНК кошачьего CD80, CD86, CD28 или CTLA-4 или иммуноген от кошачьего патогена) в клетке-хозяине, являются модифицированный вирус оспы домашней птицы, модифицированный вирус оспы свиней или вирус Семлики-Форест. Неограничивающими примерами нереплицирующихся вакцин являются вакцины, содержащие "убитые" или инактивированные вирусы или другие микроорганизмы, либо неочищенные или очищенные антигены, происходящие от нативных, рекомбинантных или синтетических источников, таких как, например, вакцины на основе вируса лейкоза кошек.
Коммерческие источники кошачьих вакцин известны каждому специалисту (Compendium of Veterinary Pharmaceuticals, 1997), и для получения более эффективной вакцины они могут быть использованы в комбинации с вакцинами настоящего изобретения.
Вакцина для индуцирования и регуляции иммунного ответа у кошачьих в ответ на иммуноген состоит из иммуногена и эффективного количества кошачьего CD80 и кошачьего CD86 вместе с кошачьм CD28 или кошачьим CTLA-4, или без них, для усиления иммунного ответа, или кошачьего CD80 и кошачьего CD86 вместе с кошачьим CTLA-4, для подавления иммунного ответа.
Этот иммуноген выбирают из группы, включающей, но не ограничивающейся ими, кошачьи патогены, такие как вирус иммунодефицита кошек, вирус лейкоза кошек, вирус инфекционного перитонита кошек, вирус панлейкопении кошек (парвовирус), кошачий калицивирус, кошачий реовирус типа 3, кошачий ротавирус, кошачий коронавирус (вирус инфекционного перитонита), рабивирус, синцитиальный вирус кошек, вирус саркомы кошек, вирус герпеса кошек (вирус ринотрахеита), вирус болезни Борна кошек, хламидии, Toxoplasmosis gondii, кошачьи паразиты, Dirofilaria immitis, блохи, бактериальные патогены и т.п.
Регуляция роста или регуляция активации клетки определенного типа, такой как Т-лимфоцит, свидетельствует о том, что регуляторный ответ либо стимулирует, либо подавляет рост клетки. Регуляция иммунного ответа у кошек указывает на то, что этот иммунный ответ либо стимулируется, либо подавляется с излечением данной болезни или устранением инфекционного агента у кошек.
В предпочтительном варианте осуществления изобретения гены, кодирующие кошачьи CD80 и CD28, CD80 и CTLA-4, CD86 и CD28, или CD86 и CTLA-4 в комбинации с генами, кодирующими иммуноген от кошачьего патогена, вводят в один рекомбинантный вирусный вектор, а затем получают "живую" вакцину. Гены кошачьего CD80, CD86, CD28 или CTLA-4, взятые отдельно или в комбинации с генами кошачьего иммуногена, вводят в рекомбинантный вирус так, чтобы экспрессия этих генов находилась под контролем соответствующего промотора. Введение вакцины приводит к экспрессии биологически активных кошачьих лигандов CD80 или CD86, и рецепторов CD28 или CTLA-4, и к экспрессии кошачьего иммуногена(нов) в той же самой клетке, и тем самым способствует продуцированию первичных и вторичных костимулирующих сигналов, необходимых для усиления нужного иммунного ответа. В этом варианте своего осуществления настоящее изобретение относится к раннему локализованному иммунному ответу на кошачий иммуноген и к вакцине с повышенной эффективностью, направленной против болезней у кошек.
В другом варианте настоящего изобретения гены, кодирующие кошачьи CD80, CD86, CD28 или CTLA-4, взятые отдельно или в комбинации, вводят в рекомбинантный вирусный вектор, и вводят в вакцину вместе со вторым рекомбинантным вирусным вектором, который включает гены кошачьего иммуногена(ов), и тем самым способствует продуцированию нужного ответа в тех же самых клетках или в клетках, находящихся в непосредственной близости от этих клеток, в результате чего достигается усиление нужного иммунного ответа с получением вакцины с повышенной эффективностью, направленной против болезней у кошек.
Ниже приводятся примеры рекомбинантных вирусных векторов, используемых для экспрессии кошачьих CD80, CD86, CD28 или CTLA-4 и для получения вакцины в целях продуцирования повышенной протективной иммунной реакции в ответ на заражение патогенным микроорганизмом, а именно векторов, используемых для:
1. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней (встроенном в любой не-основной сайт инсерции). Для вакцинации кошек, но не только кошек, нереплицирующимися вакцинами, используемыми отдельно или в любой комбинации с другой вакциной или с терапевтическим агентом (рекомбинантным, живым или "убитым").
2. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе герпеса кошек (встроенном в сайт gЕ FHV или в любой не-основной сайт инсерции). Для вакцинации кошек, но не только кошек, реплицирующимися вакцинами, используемыми отдельно или в комбинации с другой вакциной или с терапевтическим агентом (рекомбинантным, живым или "убитым").
3. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов (встроенном в любой не-основной сайт инсерции). Для вакцинации кошек, но не только кошек, реплицирующимися вакцинами, используемыми отдельно или в комбинации с другой вакциной или с терапевтическим агентом (рекомбинантным, живым или "убитым").
4. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней, содержащем гены для gаg-протеазы и/или оболочки FIV.
5. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе герпеса кошек, содержащем гены для gаg-протеазы и/или оболочки FIV.
6. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов, содержащем гены для gаg-протеазы и/или оболочки FIV.
7. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней, содержащем гены для gаg-протеазы и/или оболочки FeLV.
8. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном кошачьем вирусе герпеса, содержащем гены для gаg-протеазы и/или оболочки FeLV.
9. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов, содержащем гены для gаg-протеазы и/или оболочки FeLV.
10. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней, содержащем гены для gаg-протеазы и/или оболочки FeLV и гены gаg-протеазы и/или оболочки FIV или любую их комбинацию.
11. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном кошачьем вирусе герпеса, содержащем гены для gаg-протеазы и/или оболочки FeLV и гены gаg-протеазы и/или оболочки FIV или любую их комбинацию.
12. Экспрессии частичных или полных, кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов, содержащем гены для gаg-протеазы и/или оболочки FeLV и гены gаg-протеазы и/или оболочки FIV или любую их комбинацию.
13. Экспрессии, частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в вирусе оспы свиней, или в вирусе оспы енотов, или в любой другой экспрессирующей системе, включая, но не ограничиваясь ими, E.coli, вирус Семлики-Форест или бакуловирус, в целях генерирования неочищенного или очищенного полипептида. Для использования в нужных целях, включая, но не ограничиваясь ими, продуцирование поликлональных и моноклональных антител, и продуцирование реагентов для разработки функциональных анализов.
14. Экспрессии частичных или полных кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в векторе на основе аттенуированного вируса FIV или FeLV. В одном из вариантов осуществления изобретения, вектор на основе вирусов FIV или FeLV аттенуирован посредством делеции гена.
15. Экспрессии, частичных или полных, кошачьих CD80, CD86, CD28 или CTLA-4, взятых отдельно или в любой комбинации, в экспрессирующем векторе, содержащем ген(ы) кошачьих иммуногенов, в целях его введения в качестве генной вакцины или вакцины на основе "оголенной" ДНК. Такими векторами являются, но не ограничиваются ими, pTarget (Promega Corp., Madison, WI), pcDNA (Invitrogen, Carlsbad, CA). (Donnelly J.J., et al., 1997; Hassett & Whitton, 1996).
16. Гены или фрагменты генов CD80, CD86, CD28 или CTLA-4, взятые отдельно или в любой комбинации, частично или полностью, могут быть введены или трансфецированы в хромосомы кошек или другого млекопитающего. Такая интеграция этих генов или фрагментов этих генов может быть достигнута с использованием ретровирусного вектора и может быть использована в генной терапии.
Настоящее изобретение относится к способам и композициям, предназначенным для повышения у кошачьих резистентности к болезням и используемым в медицинских и/или в коммерческих целях. В этом варианте осуществления настоящего изобретения кошачьи CD80, CD86, CD28 или CTLA-4, экспрессированные отдельно или в любой комбинации, частично или полностью, и в комбинации с генами, кодирующими кошачьи иммуногены, или без них, вводят кошкам любым подходящим способом введения. Для стимуляции роста или для вырабатывания резистентности к болезням, кошачьи CD80, CD86, CD28 или CTLA-4, экспрессированные отдельно, или в любой комбинации, вводят в композицию в концентрации, составляющей от около 0,01 до 100,0 мг на вакцину для одной кошки, а предпочтительно, в концентрации, составляющей от около 0,25 до около 25 мг/кг/день. Для стимуляции роста или для вырабатывания резистентности к болезням рекомбинантный вирусный вектор, экспрессирующий кошачьи CD80, CD86, CD28 или CTLA-4, отдельно или в любой комбинации, вводят в композицию в концентрации, составляющей от около 0,01 до 100,0 мг на вакцину для одной кошки, а предпочтительно, в концентрации, составляющей от около 0,25 до около 25 мг/кг/день. При этом следует отметить, что необходимое количество кошачьего CD80, CD86, CD28 или CTLA-4 может быть определено методом рутинного экспериментирования, хорошо известного специалистам, например, путем установления матрицы доз и частоты введения и сравнения группы экспериментальных единиц или субъектов с каждой точкой в матрице.
Согласно настоящему изобретению нативный или рекомбинантный кошачий CD80, CD86, CD28 и CTLA-4 вводят в композицию вместе с физиологически приемлемым носителем, таким как, например, забуференный фосфатом физиологический раствор или деионизованная вода. Эта композиция может также содержать наполнители, включая замасливатель(и), пластификатор(ы), усилилель(и) абсорбции, бактерицид(ы) и т.п., хорошо известные специалистам. Полипептид кошачьего CD80, CD86, CD28 и CTLA-4 настоящего изобретения вводят любым эффективным способом, включая, но не ограничиваясь ими, внутривенное, подкожное, внутримышечное, чрезмышечное, местное или пероральное введение. Например, для подкожного введения лекарственная форма состоит из кошачьего CD80, CD86, CD28 или CTLA-4 в стерильном физиологическом растворе. Для перорального введения или введения путем ингаляции, кошачий CD80, CD86, CD28 или CTLA-4 вместе с наполнителем или без него, заключают в микро- или макрокапсулы, например, в липосомы и микросферы. Могут быть также использованы кожные пластыри (или другие лекарственные формы пролонгированного высвобождения).
Материалы и методы
Получение исходных образцов вируса оспы енотов
Для получения исходных образцов вируса оспы енотов и геномной ДНК вируса оспы енотов использовали изолят вируса оспы енотов (RPV) АТСС VR-838. Другим доступным изолятом RPV является V71-I-85A, имеющийся в Центре по контролю заболеваемости (CDC; Atlanta, GA). Образцы вируса оспы енотов (RPV) получали путем инфицирования клеток VERO, клеток CRFK или клеток MDCK при множественности заражения 0,01 б.о.е./клетку в модифицированной по способу Дульбеккко среде Игла, содержащей 2 мМ глутамина, 100 ед./мл пенициллина, 100 ед./мл стрептомицина (эти компоненты были получены от Sigma или аналогичного поставщика) и называемой далее дефицитной средой DMEM. Перед инфицированием клеточные монослои один раз промывали дефицитной средой DMEM для удаления следовых количеств фетальной бычьей сыворотки. Затем эти монослои оставляли на два часа, перераспределяя их каждые полчаса, для абсорбции в них RPV, содержащегося в исходном инокуляте (0,5 мл на 10 см-пластинку, 10 мл на 225 см2-Т-колбу). По истечение этого периода времени исходный инокулят доводили до рекомендуемого объема путем добавления полной среды DMEM (дефицитная среда DMEM + 5% фетальная бычья сыворотка). Эти планшеты инкубировали при 37°С в 5% СO2 до тех пор, пока не было завершено цитопатическое действие. Эту среду и клетки собирали и замораживали в конических 50 мл-пробирках с завинчивающейся крышкой при -70°С. После оттаивания при 37°С аликвоты исходного вирусного материала распределяли по 1,0 мл-сосудам и снова замораживали при -70°С. Титры составляли, в основном, примерно 106 б.о.е./мл. Получение исходных образцов вируса оспы свиней
Образцы вируса оспы свиней (SPV) получали путем инфицирования клеток почки свиного эмбриона (EMSK), клеток ESK-4, клеток РК-15 или клеток Vero при множественности заражения 0,01 б.о.е./клетку в 1:1-смеси в модифицированной по способу Дульбеккко среде Исков (IMDM) и среде RPMI 1640, содержащей 2 мМ глутамина, 100 ед./мл пенициллина, 100 ед./мл стрептомицина (эти компоненты были получены от Sigma или аналогичного поставщика, и далее они будут называться дефицитной средой EMSK). Перед инфицированием, клеточные монослои один раз промывали дефицитной средой EMSK для удаления следовых количеств фетальной бычьей сыворотки. Затем эти монослои оставляли на два часа, перераспределяя их каждые полчаса, для абсорбции в них SPV, содержащегося в исходном инокуляте (0,5 мл на 10 см-пластинку, 10 мл на 175 см-колбу Т). По истечении этого периода времени исходный инокулят доводили до рекомендуемого объема путем добавления полной среды EMSK (дефицитная среда EMSK + 5% фетальная бычья сыворотка). Эти планшеты инкубировали при 37°С в 5% СО2до тех пор, пока не было завершено цитопатическое действие. Эту среду и клетки собирали и замораживали при -70°С в конических 50 мл-пробирках с завинчивающейся крышкой. После оттаивания при 37°С аликвоты исходной вирусной культуры распределяли по 1,0 мл-сосудам и снова замораживали при -70°С. Титры составляли, в основном, примерно 106 б.о.е./мл.
Получение ДНК RPV или SPV
Для выделения ДНК вируса оспы енотов или вируса оспы свиней, конфлюэнтный монослой клеток VERO (для RPV) или клеток EMSK (для SPV) в 225 см2-колбе Т инфицировали вирусом оспы енотов (АТСС VR-838) при множественном заражении 0,1 и инкубировали в течение 3-5 дней до тех пор, пока клетки не обнаруживали 100% цитопатический эффект. Затем инфицированные клетки собирали путем соскабливания клеток в среду и центрифугировали в течение 5 минут при 3000 об/мин в лабораторной клинической центрифуге. Затем среду декантировали, и клеточный осадок мягко ресуспендировали в 1, 0 мл забуференного фосфатом физиологического раствора (PBS: 1,5 г Na2HPO4, 0,2 г KH2PO4, 0,8 г NaCl и 0,2 г КСl на литр Н2О) (на Т175) и подвергали двум последовательным циклам замораживания-оттаивания (от -70 до 37°С). После последнего оттаивания эти клетки (на льду) два раза обрабатывали ультразвуком, каждый раз в течение 30 секунд с интервалами в 45 секунд для охлаждения. Затем клеточный дебрис удаляли путем центрифугирования (на сверхскоростной центрифуге Sorvall RC-5B) при 3000 об/мин в течение 5 минут на роторе НВ4 при 4°С. Затем вирионы RPV, присутствующие в супернатанте, осаждали путем центрифугирования при 15000 об/мин в течение 20 минут при 4°С на роторе SS34 (Sorvall) и ресуспендировали в 10 мМ Трисе (рН 7,5). Затем эту фракцию наносили на 36% градиент сахарозы (масс./об. в 10 мМ Трис, рН 7,5) и центрифугировали (ультрацентрифуга Beckman LB-70M) при 18000 об/мин в течение 60 минут на роторе SW41 (Beckman) при 4°С. Осадок вириона ресуспендировали в 1,0 мл 10 мМ Трис, рН 7,5, и обрабатывали ультразвуком в течение 30 секунд на льду. Эту фракцию наносили на 20-50% непрерывный градиент сахарозы и центрифугировали при 16000 об/мин в течение 60 минут на роторе SW41 при 4°С. Полосу вириона RPV, локализованную примерно на три четверти ниже градиента, собирали, разводили 20% сахарозой и осаждали центрифугированием при 18000 об./мин в течение 60 минут на роторе SW41 при 4°С. Затем полученный осадок один раз промывали 10 мМ Трисом, рН 7,5, для удаления следовых количеств сахарозы и, наконец, ресуспендировали в 10 мМ Трисе, рН 7,5. После этого ДНК RPV экстрагировали из очищенных вирионов путем лизиса (4 часа при 60°С), индуцированного путем добавления EDTA, ДСН и протеиназы К до получения конечных концентраций 20 мМ, 0,5% и 0,5 мг/мл, соответственно. После гидролиза проводили три экстракции смесью фенола-хлороформа (1:1), и образец осаждали путем добавления двух объемов абсолютного этанола и инкубировали при -20°С в течение 30 минут. Затем образец центрифугировали в мини-центрифуге Эппендорфа в течение 5 минут на полной скорости. Супернатант декантировали, и полученный осадок сушили на воздухе и повторно гидратировали в 0,01М Трисе, рН 7,5, 1 мМ EDTA при 4°С.
Получение образцов исходного вирусного материала FHV
S-FHV-000 получали из АТСС (АТСС №636), a S-FHV-001 получали из NVSL (NVSL - испытуемый штамм вируса SGE, Lot KS). Образцы исходной вирусной культуры FHV получали путем инфицирования клеток кошачьей почки Crandel (CRFK) при множественности заражения 1,0 б.о.е./клетку в модифицированной по способу Дуль-беккко среде Игла, содержащей 2 мМ глутамина, 100 ед./мл пенициллина, 100 ед./мл стрептомицина (эти компоненты были получены от Irvine Scientific или эквивалентного поставщика, и далее они будут называться полной средой DME) + 5% фетальная бычья сыворотка. После завершения цитопатического действия эту среду и клетки собирали, расслаивали и замораживали при -70°С. Титры составляли, в основном, примерно от 1×107 до 1×108б.о.е./мл.
Получение ДНК вируса герпеса
Конфлюентный монослой клеток CRFK в 25 см2-колбе или в 60 мм-чашке Петри инфицировали 100 мл образца вируса. После инкубирования в течение ночи или после обнаружения клетками 100% цитопатического действия эти клетки соскребали в среду. Эти клетки и среду центрифугировали при 3000 об./мин в течение 5 минут в лабораторной клинической центрифуге. Эту среду декантировали, и клеточный осадок слегка ресуспендировали в 0,5 мл раствора, содержащего 0,5% NONIDET Р-40 (конденсат октилфенолэтиленоксида, содержащий в среднем 9 моль этиленоксида на молекулу) (NP-40 был закуплен у Sigma Chemical Co., St. Louis, МО). Этот образец инкубировали при комнатной температуре в течение 10 минут. Затем добавляли 10 мл маточного раствора РНКазы А (Sigma Chemical Co., St. Louis, МО.)(маточный раствор имел концентрацию 10 мг/мл, и был прокипячен в течение 10 минут для инактивации ДНКазы). Этот образец центрифугировали для осаждения ядер. ДНК-осадок удаляли пастеровской пипеткой или деревянной палочкой и отбрасывали. Жидкий супернатант декантировали в 1,5-мл пробирку Эппендорфа, содержащую 25 мл 20% додецилсульфата натрия (Sigma) и 25 мл протеиназы К (10 мг/мл; Boehringer Mannhiem Biochemicals, Indianopolis, IN). Этот образец смешивали и инкубировали при 37°С в течение 30-60 минут. Затем добавляли равный объем насыщенного водой фенола и образец быстро размешивали. Затем образец центрифугировали в мини-центрифуге Эппендорфа на полной скорости в течение 5 минут. Верхнюю водную фазу собирали и помещали в новую пробирку Эппендорфа, затем добавляли два объема абсолютного этанола, и эту пробирку помещали на 30 минут при -20°С для осаждения нуклеинцвой кислоты. Затем образец центрифугировали в мини-центрифуге Эппендорфа в течение 5 минут. Супернатант декантировали, и осадок сушили на воздухе и повторно гидратировали в ~16 мл Н2O. Для получения больших количеств ДНК эту процедуру проводили в увеличенном масштабе, начиная с роллер-флаконов или 175 cм2-кoлб с клетками CRFK. ДНК хранили в 0,01 М Трис, рН 7,5, 1 мМ EDTA при 4°С.
ДНК-трасфекция для генерирования рекомбинантного вируса:
Этот метод основан на процедуре с использованием фосфата кальция Graham и Van der eb [25] с нижеследующими модификациями. Вирус и/или плазмидную ДНК разводили до 298 мл в 0,01 М Трис, рН 7,5, 1 мМ EDTA. Затем добавляли 40 мл 2М CaCl2 с последующим добавлением равного объема 2-забуференного HEPES солевого раствора (10 г N-2-гидроксиэтилпиперазин-N’-2-этансульфоновой кислоты (HEPES), 16 г Nad, 0,74 КСl, 0,25 г Na2HPO4, 2Н2О, 2 г декстрозы на 1 литр Н2O и забуференный NaOH до рН 7,4). После этого, смесь инкубировали на льду в течение 10 минут, а затем по каплям добавляли к 80% конфлюэнтному монослою клеток CRFK, культивированных в 60 мм-чашке Петри в 5 мл среды (DME + 5% фетальная бычья сыворотка). Эти клетки инкубировали в течение 4 часов при 37°С в инкубаторе с повышенной влажностью, содержащем 5% CO2. Среды на планшетах отсасывали и клетки обрабатывали 20% глицерином в 1x PBS (1,15 г Na2HPO4, 0,2 КН2РO4, 0,8 г NaCl, 0,2 г КСl на 1 литр Н2О) в течение одной минуты. Клетки три раза промывали 5 мл 1x PBS, а затем добавляли 5 мл среды (DME + 5% фетальная бычья сыворотка). Клетки инкубировали при 37°С, как описано выше, в течение 3-7 дней, до тех пор, пока цитопатический эффект вируса не составлял 50-100%. Вирус собирали, как описано выше, для получения исходного вирусного материала. Этот исходный вирусный материал называли трансфекционным исходным вирусным материалом, а затем скринировали на рекомбинантный вирус, как описано в главе "Скрининг, на рекомбинантный вирус герпеса, экспрессирующий ферментные маркерные гены".
Получение инфицированных клеточных лизатов. Для получения клеточных лизатов использовали бессывороточную среду. Конфлюэнтный монослой клеток (VERO, CRFK или MDCK) в 25 см2-колбе или 60 мм-чашке Петри инфицировали 100 мкл образца вируса. После обеспечения цитопатического эффекта среду и клетки собирали, и эти клетки осаждали при 3000 об/мин в течение 5 минут в лабораторной клинической центрифуге. Клеточный осадок ресуспендировали в 250 мкл буфера для лизиса (2% додецилсульфат натрия, 2% β-меркаптоэтанол). Образцы обрабатывали ультразвуком в течение 30 секунд на льду и хранили при -20°С.
Процедура Вестерн-блоттинга. Образцы стандартных лизатов и белков подвергали электрофорезу в полиакриламидном геле в соответствии с методом Лаемнли (Laemnli). После гель-электрофореза белки переносили и процессировали, как описано Sambrook и др. (1989). "Первое" антитело разводили 1:100 5% обезжиренным сухим молоком в смеси Триса-хлорида натрия и азида натрия (TSA: 6,61 г Трис-НСl, 0,97 г Трис-основания, 9,0 г NaCl и 2,0 г азида натрия на 1 литр Н2О). "Второе" антитело конъюгировали со щелочной фосфатазой и разводили 1:1000 TSA.
Техника молекулярной биологии. Техника манипуляций с бактериями и ДНК, включая такие процедуры, как гидролиз рестриктирующими эндонуклеазами, гель-электрофорез, гель-экстракция ДНК, лигирование, фосфорилирование киназой, обработка фосфатазой, культивирование бактериальных культур, трансформация бактерий с использованием ДНК и другие методы, применяемые в молекулярной биологии, описана Sambrook et al.(1989) & Current Protocols in Molecular Biology (1992). В особо оговариваемых случаях, они могут быть использованы с незначительными изменениями.Секвенирование ДНК.
Секвенирование ДНК осуществляли путем проведения реакций дидезокси-секвенирования посредством флуоресцентной метки с использованием готового набора для циклической реакции секвенирования, содержащего краситель для терминации цепи ABI PRISM (Dye Terminator Cycle Sequencing Ready Reaction) с использованием ДНК-полимеразы Amplitaq, FS (Perkin-Elmer; в соответствии с инструкциями производителей) и подвергали электрофорезу на автоматическом ДНК-секвенаторе модели 373А Perkin Elmer/Applied Biosystems в соответствии с инструкциями производителей. Реакции с использованием как смесей dGTP, так и смесей dITP, осуществляли для осветления участков уплотнения. Альтернативно, уплотненные участки разделяли в формамидных гелях. Матрицы представляли собой субклоны двухцепочечных плазмид или субклоны одноцепочечного М13, а праймеры либо встраивали в вектор непосредственно за секвенируемой вставкой, либо встраивали в предварительно полученную последовательность. Полученную последовательность собирали и сравнивали с использованием программного обеспечения DNAStar.
Клонирование с использованием полимеразной цепной реакции. Для введения рестрикционных сайтов, подходящих для проведения манипуляции с различными ДНК, использовали полимеразную цепную реакцию (ПЦР). Используемые процедуры описаны Innis и др. (1990). В основном амплифицированные фрагменты имели менее чем 500 пар оснований, и основные области амплифицированных фрагментов были подтверждены путем ДНК-секвенирования. Праймеры, используемые в каждом случае, подробно описаны ниже в описании конструирования гомологичных векторов.
Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV. Этот метод основан на гомологичной рекомбинации между ДНК вируса оспы енотов и ДНК плазмидного гомологичного вектора, которая происходит в клетках культуры ткани, содержащих как ДНК вируса оспы енотов, так и трансфецированный плазмидный гомологичный вектор. Для осуществления гомологичной рекомбинации монослои клеток (CRFK, MDCK, или VERO) инфицировали S-RPV-000 (ATCC VR-838) или S-SPV-001 или S-FHV-001 при множественности заражения 0,01 б.о.е./клетку для введения реплицирующегося RPV (т.е. для синтеза ДНК) в эти клетки. Затем ДНК плазмидного гомологичного вектора трансфецировали в эти клетки в соответствии с процедурой инфицирования-трансфекции. Конструирование гомологичных векторов, используемых в этой процедуре, описано ниже.
Процедура инфицирования-трансфекции. 6 см-чашки с клетками (CRFK, MDCK или VERO) с конфлюэнтностью около 80% инфицировали S-RPV-000 или S-SPV-001 или S-FHV-001 при множественности заражения 0,01 б.о.е./клетку в дефицитной среде DMEM и инкубировали при 37°С в атмосфере 5% CO2 с повышенной влажностью в течение 2-3 часов. В основном использовали процедуру трансфекции, которая рекомендована для реагента липофектина™ (BRL). Вкратце, для каждой 6 см-чашки, 15 мкг плазмидной ДНК разводили Н2O до объема 100 мкл. Отдельно 50 микрограммов липофектинового реагента разводили H2O до объема 100 мкл. Затем 100 мкл разведенного липофектинового реагента по каплям добавляли к разведенной плазмидной ДНК, содержащейся в полистироловой 5 мл-пробирке с защелкивающейся крышкой, и слегка размешивали. Затем эту смесь инкубировали в течение 15-20 минут при комнатной температуре. В течение этого периода времени вирусный инокулят удаляли из 6-см чашек и клеточные монослои один раз промывали дефицитной средой DMEM. Затем 3 мл дефицитной среды DMEM добавляли к смеси плазмидной ДНК/липофектина, и содержимое наносили пипеткой на клеточный монослой. Эти клетки инкубировали в течение ночи (около 16 часов) при 37°С в атмосфере 5% CO2 с повышенной влажностью. На следующий день 3 мл дефицитной среды DMEM удаляли и заменяли 5 мл полной среды DMEM. Эти клетки инкубировали при 37°С в атмосфере 5% CO2 с повышенной влажностью в течение 3-5 дней до тех пор, пока цитопатическое действие вируса не составляло 80-100%. Вирус собирали, как описано выше, для получения исходной вирусной культуры. Эту культуру называли трансфекционной исходной культурой, а затем скринировали на рекомбинантный вирус, как описано в разделе "Скрининг, методом BLUOGAL на рекомбинантный вирус оспы енотов или скрининг методом CPRG на рекомбинантный вирсус оспы енотов".
Скрининг на рекомендантный вирус RPV или FHV, экспрессирующий β-галактозидаэу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)
При введениии маркерного гена β-галактозидазы (lacZ) E.coli в рекомбинантный вирус бляшки, содержащие рекомбинанты, визуализировали одним из двух простых методов. В первом методе химический Bluogal™ (Life Sciences Technology, Bethesda, MD) наносили (200 мкг/мл) поверх агарозного слоя во время анализа на бляшкообразование, и бляшки, экспрессирующие активную β-галактозидазу, приобретали синюю окраску. Затем синие бляшки высевали на свежие клетки (MDCK, CRFK или VERO) и очищали путем дополнительного выделения синих бляшек. Во втором методе CPRG (Boehringer Mannhiem) наносили (400 мкг/мл) поверх агарозного слоя во время анализа на образование бляшек, и бляшки, экспрессирующие активную β-галактозидазу, приобретали красную окраску. Затем красные бляшки высевали на свежие клетки (MDCK, CRFK или VERO) и очищали путем дополнительного выделения красных бляшек. В обоих случаях вирусы обычно очищали с использованием трех или четырех циклов очистки бляшек.
При введении маркерного гена β-глюкуронидазы (uidA) E.coli в рекомбинантный вирус бляшки, содержащие рекомбинанты, визуализировали с использованием хромогенного субстрата, Х-бета-D-gluUA CHX (X-GLUC; циклогексиламмониевая соль 5-бром-4-хлор-3-индоксил-бета-D-глюкуроновой кислоты; Biosynth AG; Switzerland) наносили (200 мкг/мл) поверх агарозного слоя во время анализа на образование бляшек, и бляшки, экспрессирующие активную β-глюкуронидазу, приобретали синюю окраску. Затем синие бляшки высевали на свежие клетки (MDCK, CRFK или VERO) и очищали путем дополнительного выделения синих бляшек.
Скрининг на экспрессию чужеродного гена в рекомбинантном RPV с использованием анализов на образование черных бляшек
Для анализа экспрессии чужеродных антигенов, экспрессированных рекомбинантными вирусами оспы енотов, монослои клеток (MDCK, CRFK или VERO) инфицировали рекомбинантными RPV, SPV или FHV, наносили на них питательные агарозные среды и инкубировали в течение 3-5 дней при 37°С для образования бляшек. Верхний агарозный слой удаляли из чашки, клетки фиксировали 100% метанолом в течение 10 минут при комнатной температуре, а затем сушили на воздухе. Фиксация клеток позволяет детектировать цитоплазматический антиген, а также поверхностный антиген, тогда как экспрессия специфического поверхностного антигена может быть детектирована с использованием нефиксированных клеток. Затем "первое" антитело разводили до соответствующей концентрации 1х реагентом "блотто" (5% обезжиренное сухое молоко в Трис-хлориде натрия и азиде натрия (TSA: 6,61 г Трис-HCl, 0,97 г Трис-основания, 9,0 г NaCl и 2,0 г азида натрия на 1 л Н2O) и инкубировали на клеточном монослое в течение 2 часов при комнатной температуре. Несвязанное антитело удаляли путем трехкратного промывания клеток буфером TS при комнатной температуре. "Второе" антитело, конъюгированное со щелочной фосфатазой, разводили 1:1000 1х реагентом "блотто" и инкубировали к клетками в течение 2 часов при комнатной температуре. Затем несвязанное "второе" антитело удаляли путем трехкратного промывания клеток буфером TS (6,61 г Трис-HCl, 0,97 г Трис-основания, 9,0 г NaCl на 1 л H2O) при комнатной температуре. После этого клетки инкубировали 15-30 минут при комнатной температуре со свежеприготовленным раствором субстрата (100 мМ Трис-HCl, рН 9,5, 100 мМ NaCl, 5 мМ MgCl2, 0,3 мг/мл нитротетразолиевого синего и 0,15 мг/мл 5-бром-4-хлор-3-индоилфосфатазы). Бляшки, экспрессирующие нужный антиген, окрашивались в черный цвет. Для прекращения развития цветовой реакции использовали раствор-фиксатор (20 мМ Трис-HCl, рН 2,9 и 1 мМ EDTA).
Скрининг на экспрессию кошачьих CD80 (В7-1) и CD86 (В7-2) в рекомбинантных SPV, RPV или FHV с использованием анализа на образование черных бляшек
Для анализа экспрессии костимулирующих молекул CD80 или CD86, экспрессированных рекомбинантными вирусами оспы свиней, вирусами оспы енотов или вирусами герпеса кошек на монослоях клеток (MDCK, CRFK, VERO или ESK-4), эти клетки инфицировали рекомбинантными вирусами RPV, SPV или FHV, экспрессирующими CD80 или CD86, затем на них наносили питательные агарозные среды и инкубировали в течение 3-5 дней при 37°С для образования бляшек. Верхний агарозный слой удаляли из чашки, клетки либо фиксировали 100% метанолом в течение 10 минут при комнатной температуре, а затем клетки сушили на воздухе, либо оставляли нефиксированными или оставляли нефиксированными и сразу обрабатывали 1х PBS. Фиксация клеток позволяет детектировать цитоплазматический антиген, а также поверхностный антиген, тогда как экспрессия специфического поверхностного антигена может быть детектирована с использованием нефиксированных клеток. Затем химеру huCTLA-4/Fc (R&D Systems, Minn. MN, cat. # 325-CT) разводили до соответствующего разведения 1х реагентом "блотто" (5% обезжиренного сухого молока в Трис-хлориде натрия (TS: 6,61 г Трис-HCl, 0,97 г Трис-основания, 9,0 г Nad и 2,0 г азида натрия на 1 л H2 O) и инкубировали на клеточном монослое в течение 2 часов при комнатной температуре. Несвязанную химеру удаляли путем трехкратного промывания клеток буфером TS при комнатной температуре. Антитело для детекции, моноклональное антитело против hulgGI fc, конъюгированное с щелочной фосфатазой (Zymed, cat.05-3322), разводили до соответствующей концентрации 1х реагентом "блотто" и инкубировали к клетками в течение 2 часов при комнатной температуре. Несвязанное антитело для детекции удаляли путем трехкратного промывания клеток буфером TS (6,61 г Трис-HCl, 0,97 г Трис-основания, 9,0 г NaCl на 1 л Н2О) при комнатной температуре. Затем клетки инкубировали 15-30 минут при комнатной температуре со свежеприготовленным раствором субстрата (100 мМ Трис-HCl, рН 9,5, 100 мМ NaCl, 5 мМ MgCl2, 0,3 мг/мл нитротетразолиевого синего и 0,15 мг/мл 5-бром-4-хлор-3-индоилфосфатазы). Бляшки, экспрессирующие CD80 или CD86, окрашивались в черный цвет. Для прекращения развития цветовой реакции использовали раствор-фиксатор (20 мМ Трис-HCl, рН 2,9 и 1 мМ EDTA).
Скрининг на биоактивность кошачьего гамма-интерферона, экспрессированного рекомбинантными SPV, RPV или FHV, с использованием анализа на снижение числа бляшек, образуемых под действием VSV
CRFKS или подходящую кошачью клеточную линию в 96-луночных планшетах обрабатывали супернатантом от клеток, инфицированных рекомбинантными вирусами, экспрессирующими кошачий IFN-гамма и инкубировали в течение 6-12 часов при 37°С. Затем в соответствующие лунки добавляли вирус VSV (100-1000 частиц/лунку) и инкубировали в течение 24 часов или до тех пор, пока контрольные лунки, содержащие только одни клетки, не были полностью лизированы. Эти лунки три раза промывали 1х PBS, и монослои фиксировали 100% метанолом и сушили на воздухе. В каждую лунку добавляли 0,05% раствор кристаллического фиолетового в течение 10 минут при комнатной температуре, а затем сушили на воздухе. Эти лунки оценивали на наличие пурпурной окраски. Монослой здоровых интактных клеток будет поглощать кристаллический фиолетовый краситель. Супернатанты с активностью IFN-гамма будут обеспечивать защиту CRFK от VSV-индуцированного клеточного лизиса и окрашиваться пурпурным цветом.
Процедура очистки вирусных гдикопротеинов для использования в целях диагностики
Вирусные гликопротеины очищали с использованием аффинных колонок с антителами. Для продуцирования моноклональных антител 8-10 недельных самок мышей BALB/c внутрибрюшинно вакцинировали семь раз с интервалами в 2-4 недели 107 б.о.е. рекомбинантов вируса оспы енотов. Через три недели после последнего вакцинирования мышам внутрибрюшинно вводили 40 мг соответствующего вирусного гликопротеина. Через три дня после введения последней дозы антигена селезенки мышей удаляли.
Спленоциты сливали с клетками мышиной плазмацитомы NSl/Ag4 усовершенствованным методом Oi и Herzenberg. Спленоциты и клетки плазмацитомы осаждали вместе путем центрифугирования при 300х г в течение 10 минут. 1 мл 50% раствора полиэтиленгликоля (мол.масса 1300-1600) добавляли к клеточному осадку при перемешивании в течение одной минуты. К этим клеткам в течение трех минут добавляли модифицированную по способу Дульбеккко среду Игла (5 мл). Клетки осаждали путем центрифугирования при 300х г в течение 10 минут и ресуспендировали в среде, содержащей 10% фетальную бычью сыворотку, а также содержащей 100 мМ гипоксантин, 0,4 мМ аминоптерин и 16 мМ тимидин (HAT). Клетки (100 мл) добавляли в лунки 8-10 96-луночных планшетов для культивирования тканей, содержащих 100 мл-слой нормальных клеток-фидеров селезенки и инкубировали при 37°С. Эти клетки подпитывали свежей средой HAT через каждые три или четыре дня.
Супернатанты гибридомных культур тестировали с помощью анализа ELISA в 96-луночных микротитрационных планшетах, покрытых 100 нг вирусного гликопротеина. Затем супернатанты от реактивных гибридом анализировали с помощью анализа на образование черных бляшек и с помощью Вестерн-блоттинга. Отобранные гибридомы два раза клонировали путем лимитирующего разведения. Асцитическую жидкость продуцировали путем внутрибрюшинной инъекции мышам BALB/c 5×106 гибридомных клеток, обработанным пристаном.
Клеточные лизаты от рекомбинантов вирусов оспы енотов получали как описано выше в разделе "Получение инфицированных клеточных лизатов". Гликопротеинсодержащие клеточные лизаты (100 мл) пропускали через 2-мл агарозную аффинную смолу, на которой было иммобилизовано 20 мг моноклонального антитела против гликопротеина в соответствии с инструкциями производителей (AFC Medium, New Brunswick Scientific, Edison, N.J.). Колонку промывали 100 мл 0,1% Nonidet P-40 в забуференном фосфатом физиологическом растворе (PBS) для удаления неспецифически связанного материала. Связанный гликопротеин элюировали 100 мМ карбонатным буфером, рН 10,6 (40). Мониторинг на чистоту пре- и постэлюированных фракций проводили путем анализа на реактивность с моноклональными антителами против RPV в системе ELISA.
Анализ ELISA
Для определения иммунного статуса животного после вакцинации и контрольного заражения использовали протокол стандартного твердофазного иммуноферментного анализа (ELISA). Раствор гликопротеинового антигена (100 мл при нг/мл в PBS) оставляли на 18 часов при 4°С для абсорбции на лунках микротитрационных планшетов. Покрытые лунки один раз промывали PBS. Эти лунки блокировали путем добавления 250 мл PBS, содержащего 1% BSA (Sigma) и инкубировали в течение 1 часа при 37°С. Блокированные лунки один раз промывали PBS, содержащим 0,02% Твин-20. В эти лунки добавляли 50 мл тестируемой сыворотки (предварительно разведенной 1:2 в PBS, содержащем 1% BSA) и инкубировали в течение 1 часа при 37°С. Антисыворотку удаляли и лунки три раза промывали PBS, содержащим 0,02% Твин-20. 50 мл раствора, содержащего антитела против бычьих IgG, конъюгированные с пероксидазой хрена (разведенной 1:500 в PBS, содержащим 1% BSA, Kirkegaard and Perry Laboratories, Inc.), добавляли для визуализации лунок, содержащих антитело против специфического антигена. Раствор инкубировали в течение 1 часа при 37°С, а затем удаляли, и лунки три раза промывали PBS, содержащим 0,02% Твин-20. В каждую лунку добавляли 100 мл раствора субстрата (ATBS, Kirkegaard and Perry Laboratories, Inc.) и оставляли на 15 минут для проявления окраски. Реакцию прекращали путем добавления 0,1 М щавелевой кислоты. Окраску регистрировали при оптической плотности 410 нм на автоматическом планшет-ридере.
Стратегия конструирования синтетических поксвирусных промоторов. Для векторов на основе рекомбинантных вирусов оспы свиней, синтетические поксвирусные промоторы имеют некоторые преимущества, включая их способность регулировать уровень и стадию экспрессии чужеродного гена. Были сконструированы три промоторных кластера LP1, ЕР1 и LP2 на основе промоторов, которые были охарактеризованы в вирусе коровьей оспы. Каждый кластер был сконструирован так, чтобы он содержал ДНК-последовательности, определенные для вируса коровьей оспы и фланкированные рестрикционными сайгами, которые могут быть использованы для объединения этих кластеров в любом порядке или комбинации. В каждый кластер были также введены инициирующие метионины так, чтобы лигирование с сохранением рамки считывания можно было проводить либо в EcoRI-сайте, либо в BamHI-сайте. Ниже от сайта лигирования с сохранением рамки считывания была также сконструирована серия трансляционных стоп-кодонов во всех трех рамках считывания и сигнал ранней терминации транскрипции. ДНК, кодирующую каждый кластер, синтезировали стандартными методами и клонировали в соответствующие гомологичные векторы.
Выделение исходного фрагмента CD80
мРНК экстрагировали из мононуклеарных клеток периферической крови (МКПК), стимулированных в течение 16 часов Con А с использованием реагента для экстракции РНК RNAzolB (Biotexc, Houston, TX). Сначала из этой РНК получали кДНК посредством реакции с обратной транскриптазой (RT) с использованием oligo dT в качестве 3’-праймера. Вкратце, РНК и oligo dT нагревали до 75°С в течение 3 минут для удаления вторичной структуры. Затем добавляли RT, dNTP, буфер и дистиллированную воду, и смесь инкубировали в течение 1 часа при 42°С. После этого инкубирования образец нагревали до 95°С в течение 5 минут для инактивации RT. Затем вырожденные праймеры, полученные от консенсусных областей опубликованных последовательностей CD80 человека и мыши (GenBank, Gaithersburg, MA), использовали для первоначальной амплификации 344-нуклеотидного (нкл.) фрагмента, кодирующего центральную область константного домена этого гена:
5’-праймер В7-2: GGC CCG AGT A(CT)A AGA ACC GGA С (SEQ ID NO 56)
3’-праймер В7-3 CAG (AT)TT CAG GAT C(CT)T GGG AAA (CT)TG (SEQ ID NO 57).
Амплификацию этого продукта осуществляли по протоколу полимеразной цепной реакции (ПЦР) с "горячим стартом" с использованием полимеразы Taq. Для предотвращения образования димеров праймеров реакционную смесь, не содержащую фермента Taq, сначала нагревали до 95°С в течение 5 минут в стадии "горячего старта". Перед инициацией проведения температурного цикла добавляли фермент. Затем ПЦР-смесь нагревали до 95°С в течение 30 секунд для расплавления двухцепочечной ДНК. После этого реакционную смесь охлаждали до 42°С в течение 30 секунд для облегчения отжига вырожденных праймеров. Для облегчения связывания праймеров, которые не являются гомологичными на 100%, использовали низкую температуру отжига. Затем для удлинения праймера и создания копии противоположной цепи ДНК реакционную смесь нагревали в течение 45 секунд до 72°С, оптимальной температуры для полимеразы Taq. Температурный цикл повторяли 30 раз. После проведения 30 циклов проводили конечную стадию удлинения при 72°С в течение 7 минут для облегчения удлинения любых неполных продуктов. После визуализации на 1% агарозном геле, этот продукт для его секвенирования лигировали в вектор для клонирования ТА (InVitrogen, San Diego, СА) в течение ночи при 16°С. 2 мл этой реакционной смеси для лигирования использовали для трансформации InvaF-компетентных клеток. Трансформированные бактерии наносили штрихами на LB-планшеты (50 мг/мл ампициллин), покрытые 40 мл 50 мг/мл раствора x-gal. На следующий день белые колонии собирали и инокулировали в 5 мл LB-среды, содержащей 100 мг/мл ампициллина, и культивировали в течение ночи при 37°С со встряхиванием при 225 об/мин.
Для определения клонов, содержащих плазмиду с правильной вставкой, были получены мини-препараты на ночных культурах. Плазмиду экстрагировали из этих культур с использованием стандартной процедуры щелочного лизиса, после чего ДНК очищали путем экстракции смесью фенола:хлороформа (Maniatis et al., 1982). Эту ДНК осаждали в 2 объемах этанола, а затем гидролизовали EcoRI. Гидролизаты визуализировали на 1% агарозном геле для определения колоний с плазмидой, содержащей правильную вставку. Затем плазмиду очищали из положительных клонов и секвенировали либо путем дидезоксисеквенирования с использованием S35-радиоактивно меченного дидезокситерминатора цепи на основе секвеназы (USB, Cleveland, ОН), либо путем циклического секвенирования методом обрыва цепи с использованием флуоресцентного красителя (Perkin-Elmer, Norwalk CT). Из последовательности кДНК, конструировали специфические 3’- и 5’-праймеры для использования в реакции быстрой амплификации 5’-концов кДНК (RACE) и для дериватизации 3’-последовательности в комбинации с вырожденными праймерами из 3’-нетранслируемой области (UTR).
Выделение 5’-области CD80
Для дериватизации 5’-последовательности гена использовали протокол Marathon для амплификации кДНК (Clonetech, Palo Alto, СА). мРНК продуцировали из МКПК, стимулированных Con А в течение 12 часов и одновременно стимулированных ЛПС в течение 4 часов. Эту мРНК экстрагировали с использованием реагента для экстракции РНК ULTRASPEC (Biotexc, Houston, TX). Для облегчения связывания праймера с самой крайней частью 5’-конца поли-А-хвоста продуцировали кДНК с использованием якорного праймера oligo dT с вырожденными нуклеотидами у 5’-конца. Затем кДНК транскрибировали, как описано выше. Специфические линкеры лигировали с кДНК с помощью ДНК-лигазы Т4. Затем на этой кДНК осуществляли кратковременную ПЦР с использованием внутреннего 3’-праймера, специфического в отношении области, амплифицированной ранее:
В7-284: ТТА ТАС TAG GGA CAG GGA AG (SEQ ID NO: 58)
В7-190: AGG CTT TGG AAA ACC TCC AG (SEQ ID NO: 59)
и якорного праймера, комплементарного лигированной линкерной последовательности. Кратковременную ПЦР с использованием полимеразной смеси KlenTaq (Clontech, Palo Alto, CA) проводили при следующих условиях: 1 цикл при 95°С в течение 5 мин; 5 циклов при 95°С в течение 30 сек, при 72°С в течение 30 сек и при 68°С в течение 45 сек; 5 циклов при 95°С в течение 30 сек, при 65°С в течение 30 сек и при 68°С в течение 45 сек; и 25 циклов при 95°С в течение 30 сек, при 60°С в течение 30 сек и при 68°С в течение 45 сек. 1 мл этой реакционной смеси разводили в 50 мл воды и 5 мл этого разведения затем использовали в "гнездовой" ПЦР-реакции (1 цикл при 95°С в течение 5 мин; 30 циклов при 95°С в течение 30 сек, при 65°С в течение 30 сек и при 68°С в течение 45 сек; с использованием полимеразной смеси KlenTaq) и с использованием специфического якорного праймера и ген-специфического 3’-праймера, локализованного со стороны 5’-конца исходного праймера (фиг.6).
В7-20: TTG TTA TCG GTG ACG ТСА GTG (SEQ ID NO: 60)
В7-135: САА ТАА CAT CAC CGA AGT CAG G(SEQ ID NO: 61)
20 мл каждой реакционной смеси визуализировали на 1,5% агарозном геле и нужный фрагмент вырезали из геля. кДНК экстрагировали и очищали из агарозного геля путем центрифугирования гелевых срезов с помощью гелевого распылителя и 0,22 мм-фильтра для микроочистки (Amicon, Beverly, MA). Затем очищенную ДНК секвенировали прямым методом терминации цепи с использованием красителя (Perkin-Elmer, Norwalk, CN).
Выделение 3’-области CD80
3’-область гена дериватизировали путем отбора 5 ген-специфических праймеров из 344-нуклеотидного фрагмента и предварительно секвенированной 5’-области:
B7-S220 GTC ATG TCT GGC ААА СТА САА G (SEQ ID NO: 62)
В7-50 CAC TGA CGT CAC CGA ТАА ССА С (SEQ ID NO: 63)
B7-140 CTG ACT TCG GTG ATG TTA TTG G (SEQ ID NO: 64)
B7-550 GCC ATC AAC АСА АСА GTT TCC (SEQ ID NO: 65)
В7-620 TAT GAC AAA САА ССА TAG CTT С (SEQ ID NO: 66)
Вырожденные 3’-праймеры выбирали из консенсусных областей 3’-UTR человеческого и мышиного CD80.
В7-1281 G(A/G)A AGA (A/T)TG CCT CAT GA(G/T) CC (SEQ ID NO: 67)
B7-1260 CA(C/T)(A/G)AT ССА АСА TAG GG (SEQ ID NO: 68)
кДНК продуцировали из РНК, экстрагированной с использованием ULTRASPEC (Biotexc, Houston, ТХ) из МКПК, стимулированных Con А и ЛПС, как описано ранее.
Заякоренный олиго-dT использовали в качестве исходного 3’-праймера для транскрипции РНК с образованием кДНК. С этой кДНК осуществляли ПЦР-реакции на основе полимеразы Taq с использованием специфических 5’-праймеров и вырожденных 3’-праймеров (1 цикл при 95°С в течение 5 минут; 30 циклов при 95°С в течение 30 секунд, при 42°С в течение 30 секунд и при 72°С в течение 45 секунд; и, наконец, при 72°С в течение 7 минут).
Перед продуцированном одного фрагмента нужного размера необходимо проведение двух раундов "гнездовых" реакций. Этот продукт вырезали из 1,5% агарозного геля, очищали, как описано ранее, и подвергали циклическому секвенированию с использованием красителя в качестве терминатора цепи(Perkin-Elmer,Norwalk, CN).
На основе данных о последовательности 5’- и 3’-областей были сконструированы праймеры, с помощью которых необходимо амплифицировать область, кодирующую всю открытую рамку считывания гена кошачьего CD80:
B7-START: ATG GGT САС GCA GCA AAG TGG (SEQ ID NO:69)
B7-960: CCT AGT AGA GAA GAG СТА AAG AGG С (SEQ ID NO:70)
Была использована кДНК МКПК, которая была продуцирована ранее и о которой известно, что она содержит ДНК, кодирующую указанный ген. В целях минимизации случайных ошибок, часто ассоциированных с полимеразой Taq, в этой ПНР-реакции (1 цикл при 95°С в течение 5 минут; 30 циклов при 95°С в течение 30 секунд, при 42°С в течение 30 секунд и 72°С в течение 45 секунд; и при 72°С в течение 7 минут) использовали ДНК-полимеразу KlenTaq, ферментную смесь, которая сохраняет определенную 5'-экзонуклеазную активность. В этой реакции амплифицировали фрагмент из 960 пар оснований (п.о.), который клонировали в вектор для клонирования ТА (InVitrogen, San Diego, СА) и секвенировали, как описано ранее. Конечная последовательность этого гена включала кДНК от двух отдельно взятых животных. Для снижения вероятности погрешностей, возникающих в результате ПЦР-индуцированных ошибок, каждую пару оснований этого гена независимо проверяли, по крайней мере, в трех отдельных последовательностях, полученных от отдельных ПЦР-реакций.
Выделение первоначального фрагмента CD28: мРНК экстрагировали из лимфоцитов периферической крови НК5, стимулированных в течение 16 часов Con А с использованием реагента для экстракции РНК RNAzolB (Biotexc, Houston, TX). Сначала из этой РНК получали кДНК посредством реакции с участием обратной транскриптазы (RT) с использованием oligo dT в качестве 3’-праймера. Для этого РНК и oligo dT нагревали до 75°С в течение 3 минут для удаления вторичной структуры. Затем добавляли RT, dNTP, буфер и дистиллированную воду и смесь инкубировали в течение 1 часа при 42°С.
После этого инкубирования образец нагревали до 95°С в течение 5 минут для инактивации RT. Вырожденные праймеры, полученные от консенсусных областей, обнаруженных в опубликованных последовательностях нуклеиновых кислот человеческого, мышиного и кроличьего CD28 (GenBank, Bethesda, MD), затем использовали для первоначальной амплификации 673-нуклеотидного фрагмента, кодирующего большую часть открытой рамки считывания:
CD28-113: САА ССТ TAG CTG CAA GTA САС (SEQ ID NO 71):
CD28-768: GGC TTC TGG ATA GGG ATA GG (SEQ ID NO 72).
Для амплификации этого продукта использовали протокол полимеразной цепной реакции (ПЦР) с "горячим стартом" (1 цикл при 95°С в течение 5 минут; 30 циклов при 95°С в течение 30 секунд, при 48°С в течение 30 секунд и 72°С в течение 45 секунд; и 1 цикл при 72°С в течение 7 минут). Этот фрагмент визуализировали на 1% агарозном геле, лигировали в вектор для клонирования ТА (InVitrogen, San Diego, CA) и секвенировали, как описано ранее. Исходя из этой последовательности кДНК, были выведены и синтезированы специфические 3’-праймеры для использования в 5’-РАСЕ-реакциях.
CD28 190: CGG AGG TAG AAT TGC ACT GTC С (SEQ ID NO 73):
CD28 239: ATT TTG CAG AAG TAA ATA TCC (SEQ ID NO 74).
Выделение 5’-области CD28
Для получения остальной 5’-последовательности молекулы кошачьего CD28 был использован модифицированный протокол 5’-RACE GIBCO (Gibco BRL, Gaithersburg, MD). РНК экстрагировали из 16 часовой культуры Con А-стимулированных МКПК. Для синтеза первой цепи кДНК использовали ген-специфический 3’-праймер. РНК и этот праймер нагревали до 75°С в течение 5 минут, а затем добавляли другие реагенты RT. После денатурации смесь охлаждали до 4°С и добавляли реакционный буфер, хлорид магния, dNTP, DTT и RT Superscript (Gibco BRL, Gaithersburg, MD). RT-смесь инкубировали при 42°С в течение 30 минут, а затем нагревали до 70°С в течение 15 минут для денатурации RT. Затем добавляли смесь РНКаз, и реакционную смесь инкубировали при 55°С в течение 10 минут для удаления остаточной РНК и предотвращения неправильного концевого трансферазного (TdT) удлинения. Затем кДНК очищали на вращающейся колонке GlassMax (Gibco BRL, Gaithersburg, MD) для удаления невключенного dNTP и праймера. Очищенную кДНК, элюированную с колонки, удлиняли с помощью TdT. TdT использовали для добавления 20-30-нуклеотидного хвоста dC к кДНК. После денатурации кДНК при 95°С в течение 3 минут к смеси очищенной кДНК, хлорида магния, реакционного буфера и dCTP добавляли фермент. Реакционную смесь инкубировали при 37°С в течение 10 минут, после чего фермент подвергали термоинактивации при 70°С еще 10 минут. Удлиненную кДНК амплифицировали с помощью ПЦР с "горячим стартом" на основе полимеразы Taq (95°C в течение 5 мин; 35 циклов при 95°C в течение 30 сек, при 55°С в течение 30 сек и 72°С в течение 45 секунд; и при 72°С в течение 7 мин). В качестве праймеров для этой реакции использовали 3’-праймер, локализованный со стороны 5’-конца праймера для синтеза кДНК, и якорный праймер, специфичный для линкера dC и состоящий, главным образом, из dG с несколькими остатками dI. 1 мл этой реакционной смеси разводили в 50 мл воды, и 5 мл этого разведения использовали в гнездовой ПЦР (1 цикл при 95°С в течение 5 мин; 30 циклов при 95°С в течение 30 сек, при 55°С в течение 30 сек и при 72°С в течение 45 сек со смесью полимераз KlenTaq) с использованием якорного 5’-праймера с dG/dI и дополнительного 3’-праймера, специфичного к вышерасположенному гену. Затем 30 мл смеси для гнездовой реакции визуализировали на 1,5% агарозном геле и из этого геля экстрагировали нужный фрагмент (фиг.19). кДНК очищали, как описано ранее, с помощью гелевого распылителя Amicon и фильтра для микроочистки (Amicon, Beverly, МА). Затем образец очищенной кДНК секвенировали путем циклического секвенирования методом терминации цепи с использованием красителя (Perkin-Elmer, Norwalk, CN). Из всех этих фрагментов была получена консенсусная последовательность. Исходя из этой последовательности, была синтезирована пара праймеров, которая охватывает всю открытую рамку считывания гена кошачьего CD28:
fe CD28 5’: CGC GGA TCC ACC GGT AGC АСА ATG ATC CTC AGG (SEQ ID NO: 75)
fe CD28 3’: CGC GGA TCC TCT GGA TAG GGG TCC ATG TCA G (SEQ ID NO: 76)
С использованием этих праймеров кДНК-молекулу, включающую всю кодирующую область, амплифицировали из кДНК, происходящей из ConА-стимулированных МКПК ЕК6 и ED3. Эта кДНК МКПК была продуцирована ранее и было показано, что она содержит РНК, кодирующую ген. В этой ПЦР (1 цикл при 95°С в течение 5 мин; 30 циклов при 95°С в течение 30 сек, при 42°С в течение 30 сек и при 72°С в течение 45 сек; и 1 цикл при 72°С в течение 7 мин), проводимой с использованием ДНК-полимеразы KlenTaq для минимизации числа случайных ошибок, часто ассоциированных с полимеразой Taq, продуцировали 754 п.о.-фрагмент, который клонировали в клонирующий вектор ТА и секвенировали, как описано ранее. Как и в случае молекулы CD80, каждый нуклеотидный сайт подтверждали с использованием, по крайней мере, трех независимо полученных последовательностей.
Гомологичный вектор 902-49.46. Плазмиду 902-49.46 конструировали в целях встраивания чужеродной ДНК в RPV. Она включала маркерный ген β-галактозидазы (lacZ) E.coli, фланкированный ДНК RPV. Выше от этого чужеродного гена находился фрагмент ДНК RPV, состоящий приблизительно из 906 пар оснований. Ниже от этого чужеродного гена находился фрагмент ДНК RPV, состоящий приблизительно из 895 пар оснований. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что маркерный ген β-галактозидазы (lacZ) находится под контролем позднего промотора (LP1), а вторую чужеродную ДНК встраивают в EcoRI- или BamHI-сайт, где эта вторая чужеродная ДНК находится под контролем позднего/раннего промотора (LP2EP2). Эта плазмида была сконструирована с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источников к синтетическим ДНК-последовательностям. Этот плазмидный вектор был получен из рестрикционного HindIII-фрагмента плазмиды pSP64, имеющего приблизительно 2999 пар оснований (Promega). Фрагмент 1 представляет собой рестрикционный HindIII-XbaI-субфрагмент рестрикционного HindIII-фрагмента U RPV, имеющий приблизительно 906 пар оснований (Knight et al.). Фрагмент 2 представляет собой рестрикционный BamHI-PvuII-фрагмент плазмиды pJF751 (Ferrari et al.), имеющий приблизительно 3010 пар оснований. Фрагмент 3 представляет собой рестрикционный XbaI-HindIII-субфрагмент HindIII-фрагмента U RPV, имеющий приблизительно 895 пар оснований. XbaI-сайты фрагментов 1 и 3 превращали в уникальные NotI-сайты с использованием NotI-линкеров.
Гомологичный вектор 904-63.В7. Гомологичный вектор 904.63.В7 использовали для встраивания чужеродной ДНК в SPV. Он включает маркерный ген β-галактозидазы (lacZ) E.coli и гены gag/протеазы и оболочки вируса иммунодефицита кошек (FIV), фланкированные ДНК SPV. С использованием этого гомологичного вектора в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены.
Следует отметить, что маркерный ген β -галактозидазы (IacZ) находится под контролем синтетического позднего промотора поксвируса (LP1), а гены FIV gag/протеазы и оболочки находятся под контролем отдельных, но идентичных синтетических поздних/ранних промоторов поксвируса (LP2EP2). Кластеры промотора/гена FIVgag/протеазы и оболочки FIV ориентированы в противоположных направлениях так, что транскрипция генов gag/протеазы и оболочки проходит по направлению друг к другу для того, чтобы исключить возможность гомологической рекомбинации между идентичными промоторами. Гомологичный вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеследующих источников к соответствующим синтетическим ДНК-последовательностям. Этот плазмидный вектор был получен из рестрикционного HindIII-BamHI-фрагмента плазмиды рSР64, имеющего приблизительно 2972 пар оснований (Promega). Фрагмент 1 представляет собой рестрикционный BglII-AccI-субфрагмент рестрикционного HindIII-фрагмента М(23) SPV, имеющий приблизительно 1484 пар оснований. Фрагмент 2 представляет собой EcoRI-BglII-фрагмент гена оболочки FIV, имеющий приблизительно 2580 пар оснований и синтезированный посредством обратной транскрипции (RT) и полимеразной цепной реакции (ПЦР) (15,42) с использованием кДНК от штамма PPR FIV. Обратный праймер (5’-GCCCGGATCCTATGGCAGAAGGGTTTGCAGC-3’ 10/93.21) (SEQ ID NO: 77) синтезируется с 5’-конца гена оболочки FIV и вводит BamHI-сайт у 5’-конца этого гена. Прямой праймер (5’-CCGTGGATCCGGCACTCCATCATTCCTCCTC-3’ 10/93.20) (SEQ ID NO: 78) синтезируется с 3’-конца гена оболочки FIV и вводит BamHI-сайт у 3’-конца этого гена и используется для обратной транскрипции и полимеразной цепной реакции. ПЦР-продукт рестриктировали ферментом BamHI с получением фрагмента длиной 2580 пар оснований, соответствующего гену оболочки FIV. Фрагмент 3 представляет собой рестрикционный EcoRI-BglII-фрагмент гена gag/протеазы FIV, имеющий приблизительно 1839 пар оснований и синтезированный посредством обратной транскрипции (RT) и полимеразной цепной реакции (ПЦР) (15, 42) с использованием кДНК от штамма PPR FIV. Обратный праймер (5’-GCGTGAATTCGGGGAATGGACAGGGGCGAGAT-3’ 11/94.9) (SEQ ID NO: 79) синтезируется с 5’-конца гена gаg/протеазы FIV и вводит EcoRI-сайт у 5’-конца этого гена. Прямой праймер (5’-GAGCCAGATCTGCTCTTTTTACTTTCCC-3’ 11/94. 10) (SEQ ID NO: 80) синтезируется с 3’-конца гена gаg/протеазы FIV, вводит Вg1II-сайт у 3’-конца этого гена и используется для обратной транскрипции и полимеразной цепной реакции. ПЦР-продукт рестриктировали ферментами EcoRI и ВglII с получением фрагмента длиной приблизительно 1839 пар оснований, соответствующего гену gаg/протеазы FIV. Фрагмент 4 представляет собой рестрикционный BamHI-PvuII-фрагмент плазмиды pJF751, имеющий приблизительно 3010 пар оснований(Ferrari et al.). Фрагмент 5 представляет собой рестрикционный AccI-HindIII-субфрагмент рестрикционного HindIII-фрагмента М SPV, имеющий приблизительно 2149 пар оснований. ACCI-сайт гомологичного вектора SPV превращали в уникальный NotI-сайт с использованием синтетических линкеров.
Гомологичный вектор 917-60.В9. Плазмиду 917-60.В9 конструировали в целях встраивания чужеродной ДНК в SPV. Она включала маркерный ген β-галактозидазы (lacZ) E.coli и ген кошачьего IFN-γ (Onions, et al.,(1996); Argyle et al.,(1995), фланкированный ДНК SPV. Выше от этих чужеродных генов находился фрагмент ДНК SPV, состоящий приблизительно из 1484 пар оснований. Ниже от этих чужеродных генов находился фрагмент ДНК SPV, состоящий приблизительно из 2149 пар оснований. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что маркерный ген β-галактозидазы (lacZ) находится под контролем промотора OIL вируса оспы свиней, а ген кошачьего CD28 находится под контролем синтетического позднего/раннего промотора поксвируса (LP2EP2). Эта плазмида может быть сконструирована с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источников. Этот плазмидный вектор был получен из рестрикционного HindIII-BamHI фрагмента плазмиды pSP64, имеющего приблизительно 2972 пар оснований (Promega). Фрагмент 1 представляет собой рестрикционный BglII-Accl-субфрагмент рестрикционного HindIII-фрагмента М SPV, имеющий приблизительно 1484 пар оснований. Фрагмент 2 представляет собой рестрикционный EcoRI-BamHI-фрагмент, синтезированный посредством обратной транскрипции и полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы РНК от СоnА-стимулированных клеток селезенки кошек. Для синтеза кошачьего IFN-γ, праймер 5’-TCGAGAATTCGATGAATTACACAAGTTTTATTTTCG-3’; 1/97.4) (SEQ ID NO:81) синтезировался от 5’-конца гена кошачьего IFN-γ и вводил EcoRI-сайт у 5’-конца этого гена. Праймер (5’-TCGAGGATCCTTATTTCGATGCTCTACGGCCTC-3’; 1/97.3) (SEQ ID NO:82) был использован для обратной транскрипции и ПЦР, синтезировался от 3’-конца гена кошачьего IFN-γ, и вводил BamHI-сайт у 3’-конца этого гена. ПЦР-продукт рестриктировали ферментами EcoRI и BamHI с получением фрагмента длиной приблизительно 504 пары оснований, соответствующего гену кошачьего IFN-γ. Фрагмент 3 представляет собой рестрикционный BamHI-PvuII-фрагмент плазмиды pJFV751, имеющий приблизительно 3010 пар оснований (Ferrari et al.). Фрагмент 4 представляет собой AccI-HindIII-субфрагмент HindIII-фрагмента М SPV, имеющий приблизительно 2149 пар оснований. Accl-сайты фрагментов 1 и 4 превращали в уникальные Notl-сайты с использованием NotI-линкеров. Гомологичный вектор 926-76.D7.
Гомологичный вектор 926-76.D7 конструировали для делетирования части кодирующей области gЕ от вируса герпеса кошек и для встраивания чужеродной ДНК. Он включает ген кошачьего CD80, фланкированный ДНК FHV. Ген кошачьего CD80 находится под контролем промотора gЕ FHV. Он был сконструирован из указанных ДНК-источников с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.). Плазмидный вектор получали из рестрикционного эндонуклеазного Asp718I-Аsр7181-фрагмента плазмиды pSP18/19, имеющего приблизительно 2958 пар оснований. Фрагмент 1 представляет собой Asp7181-SmaI-субфрагмент SalI-фрагмента В FHV, имеющий приблизительно 1415 пар оснований. Фрагмент 2 представляет собой EcoRI-BamHI-фрагмент гена кошачьего CD80, имеющий приблизительно 879 пар оснований и синтезированный в соответствии с процедурой, описанной в разделе "Клонирование посредством полимеразной цепной реакции". Матрица для ПЦР-реакции представляла собой РНК от СоnА-стимулированных клеток селезенки кошек. Обратный праймер


Гомологичный вектор 930-23.А1. Плазмиду 930-23.А1 конструировали для встраивания чужеродной ДНК в SPV. Она включает маркерный ген β-галактозидазы (lacZ) E.coli и ген кошачьего CD80, фланкированный ДНК SPV. Выше от этих чужеродных генов находится фрагмент ДНК SPV, имеющий приблизительно 1484 пары оснований. Ниже от этих чужеродных генов находится фрагмент ДНК SPV, имеющий приблизительно 2149 пар оснований. С использованием этой плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что маркерный ген β-галактозидазы (lacZ) находится под контролем синтетического позднего промотора поксвируса (LP1), а ген кошачьего CD80 находится под контролем синтетического позднего/раннего промотора поксвируса (LP2EP2). Этот вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источников. Этот плазмидный вектор был получен из рестрикционного HindIII-BamHI-фрагмента плазмиды pSP64, имеющего приблизительно 2972 пар оснований (Promega). Фрагмент 1 представляет собой рестрикционный BglII-AccI-субфрагмент рестрикционного HindIII-фрагмента М SPV, имеющий приблизительно 1484 пар оснований.
Фрагмент 2 представляет собой рестрикционный EcoRI-BamHI-фрагмент, синтезированный посредством обратной транскрипции (RT) и полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы РНК от ConA-стимулированных клеток селезенки кошек. Для синтеза кошачьего CD80, праймер


Гомологичный вектор 930-26. A1. Плазмиду 930-26. A1 конструировали в целях встраивания чужеродной ДНК в SPV. Она включала маркерный ген β-галактозидазы (lacZ) E.coli и ген кошачьего CD28, фланкированный ДНК SPV. Выше от этих чужеродных генов находился фрагмент ДНК SPV, состоящий приблизительно из 1484 пар оснований. Ниже от этих чужеродных генов находился фрагмент ДНК SPV, состоящий приблизительно из 2149 пар оснований. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что маркерный ген β-галактозидазы (lacZ) находится под контролем синтетического позднего промотора поксвируса (LP1), а ген кошачьего CD28 находится под контролем синтетического позднего/раннего промотора поксвируса (LP2EP2). Этот вектор может быть сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источников. Этот плазмидный вектор был получен из рестрикционного HindIII-BamHI-фрагмента плазмиды рSР64, имеющего приблизительно 2972 пар оснований (Promega). Фрагмент 1 представляет собой рестрикционный BglII-AccI-субфрагмент рестрикционного HindIII-фрагмента М SPV, имеющий приблизительно 1484 пар оснований. Фрагмент 2 представляет собой рестрикционный EcoRI-BamHI-фрагмент, синтезированный посредством обратной транскрипции и полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы РНК от Con А-стимулированных клеток селезенки кошек. Для синтеза кошачьего CD28, от 5’-конца гена кошачьего CD28 синтезировался праймер 5’-GATGAATTCCATG-ATCCTCAGGCTGGGCTTCT-3’; 7/97.1) (SEQ ID NO 54), который вводил EcoRI-сайт у 5’-конца этого гена. Для обратной транскрипции и ПЦР использовался праймер (5’-GATCAGATCTCAGGAACGGTATGCCGCAA-3’; 7/97.2) (SEQ ID NO 55), который синтезировался от 3’-конца гена кошачьего CD28 и вводил BamHI-сайт у 3’-конца гена. ПЦР-продукт рестриктировали ферментами EcoRI и BamHI с получением фрагмента длиной, приблизительно, 666 пар оснований, соответствующего гену кошачьего CD28. Фрагмент 3 представляет собой рестрикционный BamHI-PvuII-фрагмент плазмиды pJF751, имеющий приблизительно 3010 пар оснований (Ferrari et al). Фрагмент 4 представляет собой AccI-HindIII-субфрагмент HindIII-фрагмента М SPV, имеющий приблизительно 2149 пар оснований. AccI-сайты фрагментов 1 и 4 были превращены в уникальные NotI-сайты с использованием NotI-линкеров.
Гомологичный вектор 931-21.Al. Гомологичный вектор 931-21.Al использовали в целях встраивания чужеродной ДНК в SPV. Он включает маркерный ген β-глюкуронидазы (uidA) E.coli и ген кошачьего CD80, фланкированный ДНК SPV. С помощью этого гомологичного вектора в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что маркерный ген β-глюкуронидазы (uidA) находится под контролем синтетического раннего промотора поксвируса (ЕР2), а ген кошачьего CD80 находится под контролем отдельного и уникального синтетического позднего/раннего промотора поксвируса (LP2EP2). Гомологичный вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источнков к соответствующим синтетическим ДНК-последовательностям. Этот плазмидный вектор был получен из рестрикционного DraI-фрагмента плазмиды pNEB193 (New England Biolabs), имеющего приблизительно 2700 пар оснований. Фрагмент 1 представляет собой рестрикционный Dral-EcoRI-субфрагмент HindIII-фрагмента К SPV, имеющий приблизительно 881 пару оснований. Фрагмент 2 представляет собой рестрикционный EcoRI-BamHI-фрагмент гена кошачьего CD80, имеющий, приблизительно 879 пар оснований и синтезированный в соответствии с процедурой, описанной в разделе "Клонирование посредством полимеразной цепной реакции". Матрица для ПЦР-реакции представляла собой РНК от ConА-стимулированных клеток селезенки кошек. Обратный праймер


Гомологичный вектор 931-22.А1. Плазмиду 931-22. А1 конструировали в целях встраивания чужеродной ДНК в RPV. Эта плазмида вводила ген кошачьего CD80, фланкированный ДНК RPV. Выше от этих чужеородных генов находился фрагмент ДНК RPV, состоящий приблизительно из 906 пар оснований. Ниже от этих чужеородных генов находился фрагмент ДНК RPV, состоящий приблизительно из 895 пар оснований. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что ген кошачьего CD80 находится под контролем позднего/раннего промотора (LP2EP2). Этот вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источников к синтетическим ДНК-последовательностям. Этот плазмидный вектор был получен из рестрикционного HindIII-фрагмента плазмиды pSP64 (Promega), имеющего приблизительно 2999 пар оснований. Фрагмент 1 представляет собой рестрикционный HindIII-XbaI-субфрагмент рестрикционного HindIII-фрагмента U RPV (Knight et al.), имеющий приблизительно 906 пар оснований. Фрагмент 2 представляет собой EcoRI-BamHI-фрагмент гена кошачьего CD80, имеющий приблизительно 879 пар оснований и синтезированный в соответствии с процедурой, описанной в разделе "Клонирование посредством полимеразной цепной реакции". Матрица для ПЦР-реакции представляла собой РНК от ConА-стимулированных клеток селезенки кошек. Обратный праймер


Гомологичный вектор 931-32.А5. Плазмиду 931-32.А5 конструировали в целях встраивания чужеродной ДНК в RPV. Она включала ген кошачьего CD80 и маркерный ген β-галактозидазы (lacZ) E.coli, фланкированный ДНК RPV. Выше от этих чужеродных генов находился фрагмент ДНК RPV, состоящий приблизительно из 906 пар оснований. Ниже от этих чужеродных генов находился фрагмент ДНК RPV, состоящий приблизительно из 895 пар оснований. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Вектор конструировали с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источников к синтетическим ДНК-последовательностям. Этот плазмидный вектор был получен из рестрикционного HindIII-фрагмента плазмиды pSP64 (Promega), имеющего приблизительно 2999 пар оснований. Фрагмент 1 представляет собой рестрикционный HindIII-XbaI-субфрагмент рестрикционного HindIII-фрагмента U RPV (Knight et al.), имеющий приблизительно 906 пар оснований. Фрагмент 2 представляет собой EcoRI-BamHI-фрагмент гена кошачьего CD80, имеющий приблизительно 879 пар оснований и синтезированный в соответствии с процедурой, описанной в разделе "Клонирование посредством полимеразной цепной реакции". Матрица для ПЦР-реакции представляла собой РНК от ConА-стимулированных клеток селезенки кошек. Обратный праймер

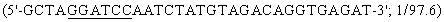
Гомологичный вектор 931-55.В12 использовали в целях встраивания чужеродной ДНК в SPV. Он включает маркерный ген β-глюкуронидазы (uidA) E.coli и ген кошачьего IFN-γ (Onions, et al., (1996); Argyle et al., (1995), фланкированный ДНК SPV. С использованием этого гомологичного вектора в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что маркерный ген β-глюкуронидазы (uidA) находится под контролем синтетического раннего промотора поксвируса (ЕР2), а ген кошачьего IFN-γ находится под контролем отдельного и уникального синтетического позднего/раннего промотора поксвируса (LP2EP2). Гомологичный вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеуказанных источников к соответствующим синтетическим ДНК-последовательностям. Этот плазмидный вектор был получен из рестрикционного DraI-фрагмента плазмиды pNEB193 (New England Biolabs), имеющего приблизительно 2700 пар оснований. Фрагмент 1 представляет собой рестрикционный DraI-EcoRI-субфрагмент HindIII-фрагмента К SPV, имеющий приблизительно 881 пару оснований. Фрагмент 2 представляет собой рестрикционный EcoRI-BamHI-фрагмент, синтезированный посредством обратной транскрипции и полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы РНК от СоnА-стимулированных клеток селезенки кошек. Для синтеза кошачьего IFN-γ, от 5’-конца гена кошачьего IFN-γ синтезировали праймер 5’-TCGAGAATTCGATGAATTACACAAGTTTTATTTTCG-3’; 1/97.4) (SEQ ID NO:81), который вводил EcoRI-сайт у 5’-конца этого гена. Для использования в реакции обратной транскрипции и ПЦР от 3’-конца гена кошачьего IFN-γ синтезировали праймер (5’-TCGAGGATCCTTATTTCGATGCTCTACGGCCTC-3’; 1/97.3) (SEQ ID NO:82), который вводил BamHI-сайт у 3’-конца этого гена. ПЦР-продукт рестриктировали ферментами EcoRI и BamHI с получением фрагмента длиной приблизительно 504 пары оснований, соответствующего гену кошачьего IFN-γ. Фрагмент 3 представляет собой рестрикционный EcoRI-SmaI-фрагмент плазмиды pRAJ260 (Clonetech), имеющий приблизительно 1823 п.о. Фрагмент 4 представляет собой рестрикционный EcoRI-DraI-субфрагмент рестрикционного HindIII-фрагмента К SPV, имеющий приблизительно 994 пары оснований. EcoRI-сайт в этом гомологичном векторе SPV превращали в уникальный NotI-сайт с использованием синтетических линкеров.
Гомологичный вектор 846-88.В17. Плазмиду 846-88.В17 конструировали для делетирования всей кодирующей области gЕ из вируса герпеса кошек и для встраивания чужеродной ДНК. Она включала маркерный ген β-галактозидазы (lacZ) E.coli, встроенный в сайт делетированной области gЕ FHV, фланкированный ДНК HV. Плазмида 846-88.В17 содержит делецию в 1638 пар оснований гена gЕ от SmaI-сайта в SalI-фрагменте В FHV до SalI-сайта в EcoRI-фрагменте Е FHV. SmaI-сайт в SalI-фрагменте В FHV и SalI-сайт в EcoRI-фрагменте Е FHV определяет концевые точки делеции гена gЕ. Выше от этих чужеродных генов находился Asp718-Smal-субфрагмент SalI-фрагмента В FHV, состоящий примерно из 1415 пар оснований и содержащий полную кодирующую последовательность гена gI (370 аминокислот). Ниже от этих чужеродных генов находился Sаll-Аsр718-субфрагмент EcoRI-фрагмента Е ДНК FHV, состоящий примерно из 2205 пар оснований и содержащий уникальные короткие концевые повторяющиеся последовательности. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV", получали вирус, содержащий ДНК, кодирующую этот чужеродный ген. Следует отметить, что ген lacZ E.coli находится под контролем конститутивного промотора gЕ FHV. Эта плазмида была сконструирована с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.).
Гомологичный вектор 921-65.В5. Гомологичный вектор 921-65.В5 конструировали для делетирования гена 15L SPV (приблизительно 237 п.о.) и для встраивания чужеродной ДНК в SPV. Он включает маркерный ген β -галактозидазы (lacZ) E.coli и гены gаg/протеазы и оболочки вируса лейкоза кошек (FeLV), фланкированные ДНК SPV. С использованием этого гомологичного вектора в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV", получали различные вирусы, содержащие ДНК, кодирующие эти чужеродные гены. Этот вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.). Следует отметить, что маркерный ген β-галактозидазы (lacZ) находится под контролем конститутивного позднего промотора поксвируса (15L), а гены gаg/протеазы FeLV и оболочки FeLV находятся под контролем отдельных синтетических ранних промоторов поксвируса ЕР2 и ЕР1, соответственно. Последовательность SPV, фланкирующая инсертированные чужеродные гены, происходила от геномного 3,2 т.п.о. HindIII-фрагмента N. Выше от последовательности чужеродных генов находится 903 п.о.-фрагмент, содержащий часть гена 14L SPV, а ниже от последовательности чужеродных генов находится 966 п.о.-фрагмент, содержащий часть гена 16L SPV. Ген lacZ E.coli, и открытые рамки считывания оболочки FeLV и gag/протеазы FeLV находятся в той же самой ориентации по отношению к генам 16L SPV и 14L SPV.
Гомологичный вектор 942-03.С6. Плазмиду 942-03.С6 конструировали для делетирования части кодирующей области gЕ из вируса герпеса кошек и для встраивания трех чужеродных генов в сайт делетированного gЕ. Она включает ген кошачьего CD80 (~879 п.о.), ген gаg/протеазы FIV (~1800 п.о.) и ген оболочки FIV (~2600 п.о.), фланкированные ДНК FHV. Ген кошачьего CD80 находится под контролем промотора gЕ FHV, ген gаg/протеазы FIV находится под контролем промотора gХ псевдорабивируса, а ген оболочки FIV находится под контролем предраннего промотора гена цитомегаловируса. Выше от этих чужеродных генов находится Asp718-SmaI-субфрагмент SalI-фрагмента В FHV, состоящий приблизительно из 1415 пар оснований. Ниже от этих чужеродных генов находится SalI-Asp718 субфрагмент EcoRI-фрагмента Е FHV, состоящий приблизительно из 2205 пар оснований и содержащий уникальные короткие концевые повторяющиеся последовательности. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV", получали вирус, содержащий ДНК, кодирующую этот чужеродный ген. Эта плазмида с гомологичной последовательностью, 942-03.С6, была сконструирована с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.).
Примеры
Пример 1А
Клонирование кДНК кошачьих CD80 (B7-1)-TMAU, CD80 (В7-1)-SPAH, CD86 (В7-2), CD28 и CTLA-4:
кДНК кошачьих CD80 (В7-1), CD86 (В7-2), CD28 и CTLA-4 клонировали посредством первой реакции RT-ПЦР (полимеразной цепной реакции с обратной транскриптазой), амплифицирующей область между двумя последовательностями, которые были достаточно консервативными для того, чтобы можно было сконструировать вырожденные праймеры, взаимодействующие с кошачьей мРНК. Источником мРНК были мононуклеарные клетки периферической крови (МКПК) или спленоциты, стимулированные Con А, по крайней мере, в течение 16 часов. Этот ПЦР-продукт секвенировали. Данная последовательность была использована для конструирования праймеров для RACE (быстрая амплификация кДНК-концов)-ПЦР. 5’-конец амплифицировали сначала путем получения кДНК с нижерасположенным праймером, комплементарным только что секвенированной консервативной области. Олигонуклеотид лигировали с 3’-концом кДНК (комплементарный 5’-концу мРНК). Эта последовательность служила в качестве сайта связывания для обратного праймера, который является ПЦР-совместимым с прямым ПЦР-праймером, соответствующим другой области в только что секвенированной области. Вырожденные праймеры были использованы во множестве циклов "гнездовых" реакций с получением 3’-конца. Этот обратный праймер для ПЦР конструировали таким образом, что он реагировал с последовательностью в только что секвенированной области. Продукты секвенировали либо прямым методом, либо они были клонированы в клонирующий вектор ТА и секвенированы из плазмиды. Всю открытую рамку считывания во всей своей полноте клонировали путем амплификации посредством ПЦР с использованием праймеров, сконструированных из известных последовательностей. Эти ОРС были клонированы и секвенированы три раза. ОРС В7-1 субклонировали в плазмиду pSI с использованием промотора SV40 и в плазмиду SFV. Плазмиду pSI использовали для установления функционального взаимодейстия В7-1 с кошачьим CD28.
Для RT/ПЦР кДНК кошачьего CD80 (В7-1) использовали ДНК-праймеры:
5’-праймер: 5’-CGCGGATCCGCACCATGGGTCACGCAGCAAAGTGGAAAAC-3’; (SEQ ID NO. 11)
3’-праймер: 5’-CCTAGTAGAGAAGAGCTAAAGAGGC-3’ (SEQ ID NO. 12) (см. выше полный список праймеров для кДНК кошачьего CD80).
Для RT/ПЦР кДНК кошачьего CD28 использовали ДНК-праймеры:
5’-праймер: 5’-CGCGGATCCACCGGTAGCACAATGATCCTCAGG-3’; (SEQ ID NO. 13)
3’-праймер: 5’-CGCGGATCCTCTGGATAGGGGTCCATGTCAG-3’ (SEQ ID NO.14) (см. выше полный список праймеров для кДНК кошачьего CD28). Для RT/ПЦР кДНК кошачьего CTLA-4 использовали ДНК-праймеры:
1. Вырожденные праймеры для первого ПЦР-продукта (672 п.о.)
Выр.5’-праймер: 5’-ATGGCTT (С) GCCTTGGATTT (С) CAGC (A) GG-3’; (SEQ ID NO. 15)
Выр.3’-праймер: 5’-TCAATTG (A) ATG (A) GGAATAAAATAAGGCTG-3’ (SEQ ID NO.16).
2. 5’-конец CTLA-4 (455 п.о.): Вырожденные ген-специфические (GSP) и "гнездовые" ген-специфические (NGSP) праймеры:
Первый раунд ПЦР:
Выр.5’-праймер: 5’-TGTTGGGTTTC (Т) G (A) CTCTG (А) СТТ (С) CCTG-3’; (SEQ ID NO. 17)
3’-СSР-праймер: 5’-GCATAGTAGGGTGGTGGGTACATG-3’ (SEQ ID NO.18). "Гнездовая" ПЦР с использованием ПЦР-продукта первого раунда:
Выр.5’-праймер: 5’-TGTTGGGTTTC (T) G (A) CTCTG (А) СТТ (С) CCTG 3'; (SEQ ID NO. 19)
3’-NGSР-праймер: 5’-ACATGAGCTCCACCTTGCAG-3’ (SEQ ID NO.20).
3. 3’-конец CTLA-4: адапторный праймер 1 (API, Clontech, Lab. Inc., Palo Alto, CA); "гнездовой" адапторный праймер (АР2, Clontech, Lab.), ген-специфический праймер (GSP) и "гнездовой" ген-специфический праймер (NGSP):
3’- RACE-ПЦР:
AP1: 5’-CCATCCTAATACGACTCACTATAGGGC-3’ (SEQ ID NO 21)
5’-GSP: 5’-GTGAATATGGGTCTTCAGGCAATG-3’ (SEQ ID NO 22)
3’ гнездовая RACE-ПЦР с использованием продукта 3’- RACE-ПЦР: АР2: 5’-ACTCACTATAGGGCTCGAGCGGC-3’ (SEQ ID NO 23)
5’-NGSP: 5’-GAAATCCGAGTGACTGTGCTGAG-3’ (SEQ ID NO 24)
4. Праймеры для целого гена CTLA-4
кош.CTLA-4 5’-праймер: 5’-AACCTGAACACTGCTCCCATAAAG-3’ (SEQ ID NO 25)
кош.CTLA-4 3’-праймер: 5’-GCCTCAGCTCTTAGAAATTGGACAG-3’ (SEQ ID NO 26).
Для RT/ПЦР кДНК кошачьего CD86 (В7-2) использовали ДНК-праймеры:
1. Вырожденные праймеры для первого ПЦР-продукта (423 п.о.)
Выр. 5’-праймер: 5’-TAGTATTTTGGCAGGACCAGG-3’; (SEQ ID NO. 27)
Выр. 3’-праймер: 5’-CTGTGACATTATCTTGAGATTTC-3’ (SEQ ID NO.28).
2. Вырожденные праймеры для второго ПЦР-продукта (574 п.о.)
Выр. 5’-праймер: 5’-GA (G) CA (Т) GCACT (A) ATGGGACTGAG-3’; (SEQ ID NO. 29)
Выр. 3’-праймер: 5’-CTGTGACATTATCTTGAGATTTC-3’ (SEQ ID NO. 30).
3. 5’-конец CD86: API, AP2 (Clontech, Lab.) вырожденные 3’-ген-специфический (GSP) и 3’-гнездовой ген-специфический (NGSP) праймеры:
5’- RACE-ПЦР:
API: 5’-CCATCCTAATACGACTCACTATAGGGC-3’ (SEQ ID NO 31)
3’-GSP: 5’-TGGGTAACCTTGTATAGATGAGCAGGTC-3’ (SEQ ID NO 32)
"Гнездовая" 5’-RАСЕ-ПЦР с использованием ПЦР-продукта 5’-RACE:
AP2: 5’-ACTCACTATAGGGCTCGAGCGGC-3’ (SEQ ID NO 33)
3’-NGSP: 5’-CAGGTTGACTGAAGTTAGCAAGCAC-3’ (SEQ ID NO 34).
4. 3’-конец В7-2: API, AP2, 5’-GSP и 5’-NGSP:
3’-RACE-ПЦР:
API: 5’-CCATCCTAATACGACTCACTATAGGGC-3’ (SEQ ID NO 35)
5’-GSP: 5’-GGACAAGGGCACATATCACTGTTTC-3’ (SEQ ID NO 36)
Гнездовая 3’-RACE-ПЦР с использованием ПЦР-продукта 3’-RACE:
AP2: 5’-ACTCACTATAGGGCTCGAGCGGC-3’ (SEQ ID NO 37)
5’-NGSP: 5’-CAGTGCTTGCTAACTTCAGTCAACC-3’ (SEQ ID NO 38).
Весь ген CD86:
кош. В7 2(1) 5’-праймер: 5’-CGGGAATGTCACTGAGCTTATAG-3’ (SEQ ID NO 39)
кош.В72(1176) 3’-праймер: 5’-GATCTTTTTCAGGTTAGCAGGGG-3’ (SEQ ID NO 40).
Пример 1В
Клонирование CD80 (В7-1)-Syntro/SPAH; Плазмида 917-19-8/16
У кошек выделяли клетки селезенки и культивировали с кон-канавалином А в течение 5 часов. Клетки осаждали, промывали PBS и использовали для выделения полноразмерной РНК (Qiagen RNeasy Total RNA System). Всю РНК обрабатывали ДНКазой 1 (Boehringer Mannhiem) для удаления ДНК-примесей из РНК-препаратов. Затем из этих препаратов экстрагировали информационную РНК с использованием сфер из олиготекса Qiagen (Santa Clara, CA) и быстрых колонок. Из мРНК продуцировали копию ДНК в присутствии рандомизированных гексамеров, dNTP, РНКазина, обратной транскриптазы (Promega) и буфера для обратной транскриптазы (Promega) и инкубировали в течение 30 минут при 42°С. Затем проводили ПЦР для генерирования двухцепочечного полноразмерного кДНК-клона открытой рамки считывания (ОРС) кошачьего В7-1 с использованием смыслового праймера 5/97.50 (5’-ATGGGTCACGCAGCAAAGTG-3’ (SEQ ID NO 41) и антисмыслового праймера 5/97.51 (5’-CTATGTAGACAGGTGAGATC-3’) (SEQ ID NO 42), dNTP, кДНК В7-1 (1-ая цепь), MgSO4, полимеразы Vent (BRL) и буфера для полимеразы Vent (BRL). ПЦР проводили при следующих условиях: 1 цикл при 94°С, 15 сек, 35 циклов при 94°С, 30 сек, при 48°С, 2 мин, при 72°С, 2 мин; 1 цикл при 72°С, 10 мин. ПЦР-смесь подвергали электрофорезу на 1% низкоплавком агарозном геле, и ДНК-фрагменты, соответствующие ожидаемому размеру ОРС В7-1, выделяли, подвергали гель-очистке с использованием набора для гель-очистки (Qiagen’s Gel Purification kit, Santa Clara, CA) и клонировали в плазмидный вектор pCR-BLUNT с использованием реагентов из набора для ПЦР-клонирования (Invitrogen’s Zero Blunt PCR Cloning kit, San Diego, CA). ДНК, экстрагированную из бактериальных колоний, резистентных к канамицину, предварительно скринировали на присутствие уникального Nhel-сайта (содержащегося в кошачьем CD80 (В7-1)-TAMU). Вставки, которые имели размер 800-900 п.о. и содержали Nhel-сайт, секвенировали с использованием протоколов и оборудования для автоматического флуоресцентного секвенирования ABI (Perkin-Elmer-Cetus; Applied Biosyntems, Inc.). Для генерирования ДНК-последовательности праймеров pCR-Blunt были использованы ген-специфические праймеры для плазмидного вектора и В7-1, происходящие от предварительно клонированного гена В7-1, а именно: 1/97.36 (5’-CAGGAAACAGCTATGAC-3’); (SEQ ID NO: 43) и 1/97.37 (5’-AATACGACTCACTATAGG-3’); (SEQ ID NO: 44). Праймерами, специфичными для гена В7-1, являются:
12/96.22 5’-ААСАССАТТТСАТСАТССТТТ-3’ (SEQ ID NO: 45);
1/97.33 5’-ATACAAGTGTATTTGCCATTGTC-3’ (SEQ ID NO: 46);
12/96.20 5’-AGCTCTGACCAATAACATCA-3’ (SEQ ID NO: 47);
12/96.21 5’-ATTAGAAATCCAGTTCACTGCT-3’ (SEQ ID NO: 48);
1/97.32 5’-TCATGTCTGGCAAAGTACAAG-3’ (SEQ ID NO: 49);
11/96.32 5’-ATTCACTGACGTCACCGA-3’ (SEQ ID NO: 50);
11/96.31 5’-AAGGCTGTGGCTCTGA-3’ (SEQ ID NO: 51).
Было определено, что два клона содержат полноразмерную последовательность CD80, соответствующую исходной последовательности CD80, за исключением 2 точковых мутаций ДНК. Одна такая точковая мутация не влияла на аминокислотную последовательность. Вторая мутация приводила к замене аминокислоты лейцина на изолейцин. Полученный клон кошачьего CD80 обозначали 917-19.8/16. (CD80-Syntro/SPAH).
Пример 2
S-SPV-229
S-SPV-229 представляет обой вирус оспы свиней, который экспркссирует, по крайней мере, два чужеродных гена. Ген β-галактозидазы E.coli (LacZ) и ген кошачьего CD80 встраивали в АссI сайт SPV в более крупный BglII-HindIII-субфрагмент геномного HindIII-фрагмента М SPV (уникальный рестрикционный NotI-сайт был заменен на уникальный рестрикционный AccI-сайт). Ген LacZ находится под контролем синтетического позднего промотора (LP1), а ген кошачьего CD80 находится под контролем синтетического позднего/раннего промотора (LP2EP2).
S-SPV-229 получали из S-SPV-001 (штамм Kasza). Эту процедуру осуществляли с использованием гомологичного вектора 930-23.А1 (см. "Материалы и методы") и вируса S-SPV-001, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG)". В результате очистки красных бляшек получали рекомбинантный вирус, обозначенный S-SPV-229. Этот вирус анализировали на экспрессию β-галактозидазы, чистоту и стабильность вставки путем множественных пересевов, прослеживаемых посредством анализа на образование синих бляшек и анализа на образование черных бляшек, как описано в разделе "Материалы и методы". После первоначальных трех циклов очистки все наблюдаемые бляшки имели синюю окраску, что указывало на то, что этот вирус был чистым, стабильным и экспрессировал β-галактозидазу (патент США 5382425, который вводится в настоящее описание посредством ссылки).
S-SPV-229 анализировали на экспрессию антигенов, специфичных для β-галактозидазы с использованием процедуры, описанной в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном SPV". Было показано, что моноклональное антитело против β-галактозидазы специфически реагируют с бляшками S-SPV-229 и не реагирует с негативными контрольными бляшками S-SPV-001. Все наблюдаемые бляшки S-SPV-229 реагировали с моноклональным антителом против β-галактозидазы, что указывает на то, что этот вирус стабильно экспрессирует чужеродный ген β-галактозидазы. Описанные здесь анализы осуществляли на клетках ESK-4, что указывает на то, что клетки ESK-4 должны быть подходящим субстратом для продуцирования рекомбинантных SPV-вакцин.
S-SPV-229 анализировали на экспрессию антигенов, специфичных для кошачьего CD80 с использованием процедуры, описанной в разделе "Скрининг на экспрессию кошачьего CD80 (B7-1) и CD86 (B7-2) в рекомбинантных SPV, PRV или FHV с использованием анализов на образование черных бляшек". Было показано, что химерное антитело против CTLA-4/Fc человека специфически реагирует с бляшками S-SPV-229 (экспрессирующими кошачий CD80) и не реагирует с негативными контрольными бляшками S-SPV-001. Было показано, что все наблюдаемые бляшки S-SPV-229 регаировали с химерным антителом против CTLA-4/Fc человека, что указывает на то, что этот вирус стабильно экспрессирует чужеродный ген кошачьего CD80.
Для подверждения экспрессии продукта гена кошачьего CD80 клетки инфицировали S-SPV-229, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали как описано в разделе "Процедура Вестерн-блоттинга".
S-SPV-229 использовали в качестве вакцин против болезней у кошек.
S-SPV-229, при его использовании отдельно или в комбинации с FIV-, FeLV-, FIP-вакцинами или с другими кошачьими вакцинами, способствует повышению эффективности вакцин против FIV, FeLV, FIP или других болезней кошек. S-SPV-229 может быть также использован для экспрессии полипептида кошачьего CD80. Клеточный лизат S-SPV-229-инифицированных клеток вводили путем инъекции мышам или кроликам для вырабатывания у них поликлональных моноспецифических антител против кошачьего CD80.
Пример 3
S-SPV-230
S-SPV-230 представляет собой вирус оспы свиней, который экспрессирует, по крайней мере, два чужеродных гена. Ген β-галактозидазы E.coli (LacZ) и ген кошачьего CD28 встраивали в AccI-сайт -SPV в более крупном Bg1II-HindIII-субфрагменте геномного HindIII-фрагмента М SPV (уникальный рестрикционный NotI-сайт был заменен на уникальный рестрикционный AccI-сайт). Ген LacZ находится под контролем синтетического позднего промотора (LP1), а ген кошачьего CD28 находится под контролем синтетического позднего/раннего промотора (LP2EP2).
S-SPV-230 получали из S-SPV-001 (штамм Kasza). Эту процедуру осуществляли с использованием гомологичного вектора 930-26.А1 (см. "Материалы и методы") и вируса S-SPV-001, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV". Исходный материал для трансфекции скринировали как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG)". В результате очистки красных бляшек получали рекомбинантный вирус, обозначенный S-SPV-230. Этот вирус анализировали на экспрессию β -галактозидазы, чистоту и стабильность вставки путем множественных пересевов, прослеживаемых посредством анализа на образование синих бляшек, как описано в разделе "Материалы и методы". После первоначальных трех циклов очистки все наблюдаемые бляшки имели синюю окраску, что указывало на то, что этот вирус был чистым, стабильным и экспрессировал чужеродный ген.
S-SPV-230 анализировали на экспрессию антигенов, специфичных для кошачьего CD28, с использованием процедуры, описанной в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном SPV". Описанные здесь анализы осуществляли на клетках ESK-4, что указывало на то, что клетки ESK-4 должны быть подходящим субстратом для продуцирования рекомбинантных SPV-вакцин.
Для подтверждения экспрессии продукта гена кошачьего CD28 клетки инфицировали S-SPV-230, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали, как описано в разделе "Процедура Вестерн-блоттинга".
S-SPV-230 использовали в качестве вакцин против болезней у кошек. S-SPV-230, при его использовании отдельно или в комбинации с FIV-, FeLV-, FIP-вакцинами или с другими кошачьими вакцинами, способствует повышению эффективности вакцин против FIV, FeLV, FIP или других болезней кошек. S-SPV-230 может быть также использован для экспрессии полипептида кошачьего CD28. Клеточный лизат S-SPV-229-инфицированных клеток вводили путем инъекции мышам или кроликам для вырабатывания у них поликлональных, моноспецифических антител против кошачьего CD28.
Пример 4
S-SPV-225
S-SPV-225 представляет собой вирус оспы свиней, который экспрессирует, по крайней мере, два чужеродных гена. Ген β-галактозидазы E.coli (LacZ) и ген кошачьего интерферона-γ (кошачьего IFN-γ) встраивали в AccI-сайт SPV в более крупном BglII-HindIII-субфрагменте геномного HindIII-фрагмента М SPV (уникальный рестрикционный NotI-сайт был заменен на уникальный рестрикционный AccI-сайт). Ген LacZ находится под контролем промотора вируса оспы свиней (O1L), а ген кошачьего IFN-γ находится под контролем синтетического позднего/раннего промотора (LP2EP2).
S-SPV-225 получали из S-SPV-001 (штамм Kasza). Эту процедуру осуществляли с использованием гомологичного вектора 917-60.В9 (см. "Материалы и методы") и вируса S-SPV-001, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV". Исходный материал для трансфекции скринировали как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG)". В результате очистки красных бляшек получали рекомбинантный вирус, обозначенный S-SPV-225. Этот вирус анализировали на экспрессию β-галактозидазы, чистоту и стабильность вставки путем множественных пересевов, прослеживаемых посредством анализа на образование синих бляшек, как описано в разделе "Материалы и методы". После первоначальных трех циклов очистки все наблюдаемые бляшки имели синюю окраску, что указывало на то, что этот вирус был чистым, стабильным и экспрессировал чужеродный ген.
S-SPV-225 анализировали на экспрессию антигенов, специфичных для кошачьего IFN-γ, с использованием процедуры, описанной в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном SPV". Описанные здесь анализы осуществляли на клетках ESK-4, что указывало на то, что клетки ESK-4 должны быть подходящим субстратом для продуцирования рекомбинантных SPV-вакцин.
Для подтверждения экспрессии продукта гена кошачьего IFN-γ клетки инфицировали S-SPV-225, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали, как описано в разделе "Процедура Вестерн-блоттинга".
S-SPV-225 анализировали на экспрессию биологически активного кошачьего IFN-γ с использованием процедуры, описанной в разделе "Скрининг на биологическую активность кошачьего интерферона-гамма, экспрессированного из рекомбинантных SPV, RPV или FHV с использованием анализов на снижение числа бляшек, образуемых под действием VSV".
S-SPV-225 использовали в качестве вакцин против болезней у кошек. S-SPV-225, при его использовании отдельно или в комбинации с FIV-, FeLV-, FIP-вакцинами или с другими кошачьими вакцинами, способствует повышению эффективности вакцин против FIV, FeLV, FIP или других болезней кошек.
Пример 5
S-SPV-200
S-SPV-200 представляет собой вирус оспы свиней, который экспрессирует три чужеродных гена. Ген gаg/протеазы вируса иммунодефицита кошек (FIV), ген оболочки FIV (полноразмерный) и ген β-галактозидазы E.coli (lacZ) встраивали в уникальный рестрикционный NotI-сайт (NotI-линкеры, встроенные в уникальный рестрикционный AccI-сайт SPV в OPC 01L HindIII-фрагмента М SPV). Гены gаg/протеазы и оболочки FIV находятся под контролем отдельного, но идентичного синтетического позднего/раннего промотора (LP2EP2). Ген LacZ находится под контролем синтетического позднего промотора (LP1).
S-SPV-200 получали из S-SPV-001 (штамм Kasza). Эту процедуру осуществляли с использованием гомологичного вектора 9.04-63.В7 и вируса S-SPV-001, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG и скрининг на рекомбинантный вирус герпеса, экспрессирующий ферментные маркерные гены)". В результате очистки красных бляшек получали рекомбинантный вирус, обозначенный S-SPV-157. Этот вирус анализировали на экспрессию β-галактозидазы с помощью анализа, описанного в разделе "Материалы и методы". Анализ на чистоту и на стабильнось вставки после 5 пересевов осуществляли путем детекции gag FIV и β-галактозидазы в анализе на образование черных бляшек и детекции gag и оболочки FIV в Вестерн-блот-анализе.
S-SPV-200 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий белки gag/протеазы FIV и оболочки FIV, может быть использован в качестве вакцины против FIV-инфекций у кошек. S-SPV-200 может быть также использован для экспрессии белков gag/протеазы и оболочки FIV.
Пример 6
S-SPV-233
S-SPV-233 представляет собой вирус оспы свиней, который экспрессирует пять чужеродных генов: gag FIV, env FIV, кошачьего CD80, lacZ E.coli и uidA E.coli. Полноразмерный ген кошачьего CD80 и ген β-глюкурунидазы E.coli (uidA) встраивали в уникальный рестрикционный NotI-сайт (Notl-линкеры, встроенные в уникальный рестрикционный EcoRI-сайт приблизительно в 3,2 т.п.о.-области (SEQ ID NO) 6,7-т.п.о.-HindIII-фрагмента К SPV). Гены gag/протеазы вируса иммунодифицита кошек (FIV) и оболочки FIV (полноразмерный) и ген β-галактозидазы E.coli встраивали в уникальный рестрикционный NotI-сайт (NotI-линкеры, встроенные в уникальный рестрикционный AccI-сайт SPV в OPC 01L HindIII-фрагмента М SPV). Ген CD80 находится под контролем синтетического позднего/раннего промотора (LP2EP2), а ген uidA находится под котролем отдельного уникального синтетического раннего промотора (ЕР2). Гены gag/протеазы и оболочки FIV находятся под контролем отдельного, но идентичного синтетического позднего/раннего промотора (LP2EP2). Ген lacZ находится под контролем синтетического позднего промотора (LP1). (Международная заявка РСТ WO 96/22363, которая вводится в настоящее описание посредством ссылки).
S-SPV-233 получали из S-SPV-200 (содержащего gag FIV, оболочки FIV и lacZ E.coli). Эту процедуру осуществляли с использованием гомологичного вектора 931-21.А1 и вируса S-SPV-200, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-глюкурунидазу (X-gLUC и скрининг на рекомбинантный вирус герпеса, экспрессирующий ферментное маркерные гены)". В результате конечной очистки синих/зеленых бляшек получали рекомбинантный вирус, обозначенный S-SPV-233.
S-SPV-233 анализировали на экспрессию антигенов, специфичных для gag FIV, env FIV и кошачьего CD80, с использованием процедуры, описанной в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном SPV". Описанные здесь анализы осуществляли на клетках ESK-4, что указывает на то, что клетки ESK-4 должны быть подходящим субстратом для продуцирования рекомбинантных SPV-вакцин.
S-SPV-233 анализировали на экспрессию антигенов, специфичных для кошачьего CD80 с использованием процедуры, описанной в разделе "Скрининг на экспрессию кошачьего CD80 (В7-1) и кошачьего CD86 (В7-2) в рекомбинантных SPV, RPV или FHV с использованием анализов на образование черных бляшек". Было показано, что химерное антитело против CTLA-4/Fc человека специфически реагирует с бляшками S-SPV-233 (экспрессирующими кошачий CD80) и не реагирует с негативными контрольными бляшками S-SPV-001. Было показано, что все наблюдаемые бляшки S-SPV-233 реагировали с химерным антителом против CTLA-4/Fc человека, что указывает на то, что этот вирус стабильно экспрессирует чужеродный ген кошачьего CD80.
Для подтверждения экспрессии продукта генов gag FIV, env FIV и кошачьего CD80, клетки инфицировали S-SPV-233, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали, как описано в разделе "Процедура Вестерн-блоттинга".
S-SPV-233 представляет собой вирус оспы свиней, экспрессирующий белки gag/протеазы FIV и оболочки FIV, и может быть использован в качестве вакцины против FIV-инфекций у кошек. S-SPV-233 может быть также использован для экспрессии белков gag/протеазы и оболочки FIV.
Пример 7
S-SPV-235
S-SPV-235 представляет собой вирус оспы свиней, который экспрессирует пять чужеродных генов: gag FIV, env FIV, кошачьего IFN-γ, lacZ E.coli и uidA E.coli. Полноразмерный ген кошачьего ifn-γ и ген β-глюкурунидазы E.coli (uidA) встраивали в уникальный рестрикционный NotI-сайт (NotI-линкеры, встроенные в уникальный рестрикционный EcoRI-сайт приблизительно в 3,2 т.п.о.-области (SEQ ID NO) 6,7-т.п.о.-HindIII-фрагмента К SPV). Гены gag/протеазы вируса иммунодифицита кошек (FIV) и оболочки FIV (полноразмерный) и ген β-галактозидазы E.coli (lacZ) встраивали в уникальный рестрикционный NotI-сайт (NotI-линкеры, встроенные в уникальный рестрикционный AccI-сайт SPV в OPC 01L HindIII-фрагмента М SPV). Ген IFN-γ находится под контролем синтетического позднего/раннего промотора (LP2EP2), а ген uidA находится под котролем отдельного уникального синтетического раннего промотора (ЕР2). Гены gаg/протеазы и оболочки FIV находятся под контролем отдельного, но идентичного синтетического позднего/раннего промотора (LP2EP2). Ген lacZ находится под контролем синтетического позднего промотора (LP1).
S-SPV-235 получали из S-SPV-200 (содержащего гены gag FIV, оболочки FIV и lacZ E.coli). Эту процедуру осуществляли с использованием гомологичного вектора 931-55.В12 и вируса S-SPV-200, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV". Исходный материал для трансфекции скринировали как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β -глюкуронидазу (X-GLUC и скрининг на рекомбинантный вирус герпеса, экспрессирующий ферментные маркерные гены)". В результате очистки синих/зеленых бляшек получали рекомбинантный вирус, обозначенный S-SPV-235.
S-SPV-235 анализировали на экспрессию антигенов, специфичных для gag FIV, env FIV и кошачьего IFN-γ с использованием процедуры, описанной в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном SPV". Описанные здесь анализы осуществляли на клетках ESK-4, что указывает на то, что клетки ESK-4 должны быть подходящим субстратом для продуцирования рекомбинантных SPV-вакцин.
S-SPV-235 анализировали на экспрессию биологически активного кошачьего IFN-γ с использованием процедуры, описанной в разделе "Скрининг на экспрессию биологической активности кошачьего интерферона-гамма, экспрессированного из рекомбинантных SPV, RPV или FHV с использованием анализов на снижение числа бляшек, образуемых под действием VSV".
Для подтверждения экспрессии продукта генов gag FIV, env FIV и кошачьего IFN-γ клетки инфицировали S-SPV-235, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали, как описано в разделе "Процедура Вестерн-блоттинга".
S-SPV-235 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий белки gag/протеазы FIV и белки оболочки FIV, и может быть использован в качестве вакцины против FIV-инфекций у кошек. S-SPV-235 может быть также использован для экспрессии белков gag/протеазы и оболочки FIV.
Пример 8:
S-SPV-224
S-SPV-224 представляет собой вирус оспы свиней, который экспрессирует три чужеродных гена. Ген gag/протеазы вируса лейкоза кошек (FeLV), ген оболочки FeLV (полноразмерный) и ген lacZ E.coli встраивали в сайт делетированного 15L SPV, происходящий от неполного геномного 1869 п.о.-HindIII-фрагмента N. Ген gag/протеазы FeLV находится под контролем синтетического раннего промотора поксвируса (ЕР2). Ген оболочки FeLV находится под контролем синтетического раннего промотора поксвируса (ЕР1). Ген lacZ находится под контролем конститутивного позднего промотора 15LP SPV.
S-SPV-224 получали из S-SPV-001 (штамм Kasza). Эту процедуру осуществляли с использованием гомологичного вектора 921-65.В5 и вируса S-SPV-001, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантных RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате очистки красных бляшек получали рекомбинантный вирус, обозначенный S-SPV-224. Этот вирус анализировали на экспрессию β-галактозидазы путем анализа синих бляшек, как описано в разделе "Материалы и методы".
S-SPV-224 анализировали на экспрессию белков gаg/протеазы FeLV, env FeLV и β-галактозидазы с использованием процедуры, описанной в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном RPV, SPV или FHV с использованием анализа на образование черных бляшек". Описанные здесь анализы осуществляли на клетках ESK-4, что указывает на то, что клетки ESK-4 должны быть подходящим субстратом для продуцирования рекомбинантных SPV-вакцин. 14 августа 1998.
Для подтверждения экспрессии продукта генов gаg/протеазы FeLV и env FeLV клетки инфицировали S-SPV-224, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали, как описано в разделе "Процедура Вестерн-блоттинга".
S-SPV-224 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий белки gаg/протеазы FeLV и оболочки FeLV, и может быть использован в качестве вакцины против FeLV-инфекций у кошек. S-SPV-224 может быть также использован для экспрессии белков gag/протеазы и оболочки FeLV.
Пример 9:
S-SPV-246
S-SPV-246 представляет собой вирус оспы свиней, который экспрессирует пять чужеродных генов: gag/протеазы FeLV, env FeLV, кошачьего CD80, lacZ E.coli и uidA E.coli. Полноразмерный ген кошачьего CD80 и ген β-глюкурунидазы E.coli (uidA) встраивали в уникальный рестрикционный NotI-сайт (NotI-линкер, встроенный в уникальный рестрикционный EcoRI-сайт приблизительно в 3,2 т.п.о.-области 6,7-т.п.о.-HindIII-фрагмента К SPV). Ген CD80 находится под контролем синтетического позднего/раннего промотора (LP2EP2), а ген uidA находится под контролем синтетического раннего промотора поксвируса, ЕР2. Ген gag/протеазы FeLV, ген оболочки FeLV (полноразмерный) и ген β-галактозидазы E.coli (lacZ) встраивали в сайт делетированного 15L SPV, происходящий от неполного геномного 1869 п.о.HindIII-фрагмента N. Ген gag/протеазы находится под контролем синтетического раннего промотора поксвируса, ЕР2. Ген оболочки FeLV находится под контролем синтетического раннего промотора поксвируса ЕР1. Ген lacZ находится под контролем конститутивного позднего промотора поксвируса 15L.(Международная заявка РСТ WO 96/22263, которая вводится в данное описание посредством ссылки).
S-SPV-246 получали из S-SPV-224 (содержащего гены gag/протеазы FeLV, оболочки FeLV и lacZ E.coli в сайте делетированного 15L геномного неполного 1869 т.п.о.-HindIII-фрагмента N). Это осуществляли с использованием гомологичного вектора 931-21.А1 и вируса S-SPV-224, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантные вирусы RPV, SPV или FHV, экспрессирующие β-галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате очистки синих/зеленых бляшек получали рекомбинантный вирус, обозначенный S-SPV-246.
S-SPV-246 анализировали на экспрессию белков gag/протеазы FeLV и оболочки FeLV с использованием процедуры, описанной в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном RPV, SPV или FHV с использованием анализа на образование черных бляшек". Описанные здесь анализы осуществляли на клетках ESK-4, что указывает на то, что клетки ESK-4 должны быть подходящим субстратом для продуцирования рекомбинантных SPV-вакцин.
S-SPV-246 анализировали на экспрессию антигена, специфичного для кошачьего CD80 с использованием процедуры, описанной в разделе "Скрининг на экспрессию кошачьего CD80 (В7-1) и CD86 (В7-2) в рекомбинантных SPV, RPV или FHV с использованием анализов на образование черных бляшек". Было показано, что химерное антитело против CTLA-4/Fc человека специфически реагирует с бляшками S-SPV-246 (экспрессирующими кошачий CD80) и не реагирует с негативными контрольными бляшками S-SPV-001. Было показано, что все наблюдаемые бляшки S-SPV-246 реагируют с химерным антителом против против CTLA-4/Fc человека, что указывает на то, что этот вирус стабильно экспрессирует чужеродный ген кошачьего CD80.
Для подтверждения экспрессии продукта генов gag/протеазы FeLV, оболочки FeLV и кошачьего CD80, клетки инфицировали S-SPV-246, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали, как описано в разделе "Процедура Вестерн-блоттинга".
S-SPV-246 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий белки gag/протеазы FeLV и оболочки FeLV, и может быть использован в качестве вакцины против FeLV-инфекций у кошек. S-SPV-246 может быть также использован для экспрессии белков gag/протеазы и оболочки FeLV.
Пример 10
Дополнительными примерами рекомбинантного вируса оспы свиней, который может быть использован в качестве вакцины против инфицирования вирусом иммунодефицита кошек (FIV), вирусом лейкоза кошек (FeLV) или вирусом кошачьего инфекционного перитонита (FIP), являются:
Рекомбинантный вирус оспы свиней, который экспрессирует пять чужеродных генов. Ген env FIV находится под контролем синтетического раннего промотора поксвируса, ЕР1, ген gag/протеазы FIV находится под контролем синтетического раннего промотора поксвируса ЕР2, ген lacZ E.coli находится под контролем промотора вируса оспы свиней 15L, ген кошачьего CD80 находится под контролем синтетического позднего/раннего промотора LP2EP2, ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса ЕР2. Гены оболочки FIV, gag/протеазы FIV и lacZ E.coli локализованы в другом неосновном инсерционном сайте SPV, отличающемся от сайтов инсерции гена кошачьего CD80 и гена uidA E.coli.
Рекомбинантный вирус оспы свиней, который экспрессирует пять чужеродных генов. Ген env FIV находится под контролем раннего промотора поксвируса, ЕР1, ген gag/протеазы FIV находится под контролем синтетического раннего промотора поксвируса, ЕР2, ген lacZ E.coli находится под контролем промотора вируса оспы свиней 15L, ген кошачьего CD86 находится под контролем синтетического позднего/раннего промотора LP2EP2, ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса ЕР2. Гены оболочки FIV, gag/протеазы FIV и lacZ E.coli локализованы в другом не-основном инсерционном сайте SPV, отличающемся от сайтов инсерции гена кошачьего CD86 и гена uidA Е. coli.
Рекомбинантный вирус оспы свиней экспрессирует два чужеродных гена. Ген кошачьего CD86 находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2; ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса ЕР2. Этот вирус используется отдельно или в комбинации с другими рекомбинантными белками или вакциной.
Другими примерами рекомбинантных свиных поксвирусов, используемых для продуцирования вакцин против заболевания, вызванного FeLV, могут служить вирусы, аналогичные описанным выше, за исключением того, что в них ген FIV был заменен на соответствующие FeLV-специфические гены.
Другими примерами рекомбинантных вирусов оспы свиней, используемых для получения белков для использования в качестве вакцины для продуцирования и очистки поликлональных антител, являются:
Рекомбинантный вирус оспы свиней, который экспрессирует один чужеродный ген. Ген кошачьего CD80, в котором отсутствует трансмембранный домен, находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2. Альтернативно, ген кошачьего CD80, в котором отсутствует трансмембранный домен, имеет гибридную гистидиновую метку у карбокси-конца для обеспечения очистки на никелевой аффинной колонке.
Рекомбинантный вирус оспы свиней, который экспрессирует один чужеродный ген. Ген кошачьего CD28, в котором отсутствует трансмембранный домен, находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2. Альтернативно, ген кошачьего CD28, в котором отсутствует трансмембранный домен, имеет гибридную гистидиновую метку у карбокси-конца для обеспечения очистки на никелевой аффинной колонке.
Рекомбинантный вирус оспы свиней, который экспрессирует один чужеродный ген. Ген кошачьего CD86, в котором осутствует трансмембранный домен, находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2. Альтернативно, ген кошачьего CD86, в котором отсутствует трансмембранный домен, имеет гибридную гистидиновую метку у карбокси-конца для обеспечения очистки на никелевой аффинной колонке.
Другими примерами рекомбинантных вирусов оспы свиней, в которых используются как CD80, так и CD86, и которые могут быть использованы в целях получения вакцины для лечения болезней, вызванных вирусами FIV и FeLV, являются:
Рекомбинантный вирус оспы свиней, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем синтетического позднего/раннего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания; ген uidA E.coli находится под контролем синтетического раннего промотора ЕР2. Ген gag/протеазы FIV находится под контролем промотора вируса оспы свиней OIL, а ген lacZ E.coli находится под контролем синтетического позднего промотора поксвируса LP1. Гены CD80/CD86 и uidA E.coli находятся в другом и не-основном инсерционном сайте SPV, отличающемся от сайтов инсерции гена gag/протеазы FIV и гена lacZ E.coli.
Рекомбинантный вирус оспы свиней, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем синтетического позднего/раннего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания; а ген lacZ E.coli находится под контролем синтетического позднего промотора поксвируса LP1. Ген оболочки FIV находится под контролем синтетического раннего промотора поксвируса ЕР1. Ген uidA E.coli находится под контролем синтетического позднего промотора LP1. Гены CD80/CD86 и uidA E.coli локализованы в другом и не-основном инсерционном сайте SPV, отличающемся от сайтов инсерции гена gag/протеазы FIV и гена lacZ E.coli.
Рекомбинантный вирус оспы свиней, который экспрессирует шесть чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем синтетического позднего/раннего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания; ген uidA E.coli находится под контролем синтетического раннего промотора ЕР2. Ген gag/протеазы FIV находится под контролем раннего промотора поксвируса ЕР2. Ген оболочки FIV находится под контролем синтетического раннего промотора поксвируса ЕР1, а ген lacZ E.coli находится под контролем конститутивного промотора поксвируса 15L. Гены CD80/CD86 и uidA E.coli встраивают в сайт SPV, отличающийся от сайтов инсерции гена оболочки FIV, gag/протеазы FIV и lacZ E.coli.
Другие вирусы оспы свиней, используемые в качестве FeLV-вакцин для кошек, могут быть сконструированы, как описано выше, с заменой генов FIV на совместимые FeLV-генные конструкции.
Пример 11
Дополнительными примерами рекомбинантного вируса оспы енотов, который может быть использован в качестве вакцины против болезней кошек, вызываемых вирусом иммунодефицита кошек (FIV), вирусом лейкоза кошек (FeLV) или вирусом кошачьего инфекционного перитонита (FIP), являются:
Рекомбинантный вирус оспы енотов, который экспрессирует два чужеродных антигена. Ген кошачьего CD86 находится под контролем синтетического позднего/раннего промотора поксвируса (LP2EP2), а ген LacZ E.coli находится под контролем промотора вируса оспы енотов L1.
Дополнительными примерами рекомбинантного вируса оспы енотов, который может быть использован в целях получения белков, используемых в качестве вакцины или для продуцирования и очистки поликлональных антител, являются:
Рекомбинантный вирус оспы енотов, который экспрессирует один чужеродный ген. Ген кошачьего CD80, не имеющий трансмембранного домена, находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2. Альтернативно, ген кошачьего CD80, не имеющий трансмембранного домена, имеет гибридную гистидиновую метку у карбокси-конца для очистки на никелевой аффинной колонке.
Рекомбинантный вирус оспы енотов, который экспрессирует один чужеродный ген. Ген кошачьего CD28, не имеющий трансмембранного домена, находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2. Альтернативно, ген кошачьего CD28, не имеющий трансмембранного домена, имеет гибридную гистидиновую метку у карбокси-конца для очистки на никелевой аффинной колонке.
Рекомбинантный вирус оспы енотов, который экспрессирует один чужеродный ген. Ген кошачьего CD86, не имеющий трансмембранного домена, находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2. Альтернативно, ген кошачьего CD86, не имеющий трансмембранного домена, имеет гибридную гистидиновую метку у карбокси-конца для очистки на никелевой аффинной колонке.
Рекомбинантный вирус оспы енотов, который экспрессирует четыре чужеродных гена. Ген кошачьего CD86 и ген кошачьего CD80, экспрессируемые в бицистронном кластере, находятся под контролем синтетического позднего/раннего промотора поксвируса LP2EP2, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания, инициирующими трансляцию 2-го, нижерасположенного гена CD80; ген gag FIV находится под контролем промотора вируса оспы свиней OIL; ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса ЕР2.
Рекомбинантный вирус оспы енотов, который экспрессирует четыре чужеродных гена. Ген кошачьего CD86 и ген кошачьего CD80, экспрессируемые в бицистронном кластере, находятся под контролем синтетического позднего/раннего промотора поксвируса LP2EP2, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания и инициирующий трансляцию 2-го нижерасположенного гена CD80; ген оболочки FIV находится под контролем синтетического раннего промотора поксвируса Е1; ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса Е2.
Рекомбинантный вирус оспы енотов, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем синтетического позднего/раннего промотора поксвируса LP2EP2, инициирующего транскрипцию CD80 и CD86, и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания и иницирующий трансляцию 2-го нижерасположенного гена CD80; ген gag FIV находится под контролем промотора вируса оспы свиней OIL; ген оболочки FIV находится под контролем синтетического раннего промотора поксвируса Е1; ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса Е2.
Дополнительными примерами рекомбинантного вируса оспы енотов, который может быть использован в качестве вакцины против болезней кошек, вызываемых вирусом иммунодефицита кошек (FIV), вирусом лейкоза кошек (FeLV) или вирусом кошачьего инфекционного перитонита (FIP), являются:
Рекомбинантный вирус оспы енотов, который экспрессирует два чужеродных гена. Ген кошачьего CD86 находится под контролем синтетического позднего/раннего промотора LP2EP2, ген lacZ E.coli находится под контролем синтетического позднего промотора поксвируса LP1.
Другими примерами рекомбинантных вирусов оспы енотов, в которых используются как CD80, так и CD86, и которые могут быть использованы в целях получения вакцины для лечения болезней, вызываемых вирусами FIV и FeLV, являются:
Рекомбинантный вирус оспы енотов, который экспрессирует четыре чужеродных гена. Ген кошачьего CD86 и ген кошачьего CD80, экспрессируемые в бицистронном кластере, находятся под контролем синтетического позднего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания. Ген gag/протеазы FIV находится под контролем синтетического позднего/раннего промотора поксвируса LP2EP2; ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса ЕР2. Гены CD80/CD86, gag/протеазы FIV и uidA встраивали в единственный не-основной сайт RPV.
Рекомбинантный вирус оспы енотов, который экспрессирует 4 чужеродных гена. Ген кошачьего CD86 и ген кошачьего CD80, экспрессируемые в бицистронном кластере, находятся под контролем синтетического позднего/раннего промотора поксвируса LP2, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания; ген lacZ E.coli находится под контролем синтетического раннего промотора поксвируса Е1; ген uidA E.coli находится под контролем синтетического раннего промотора поксвируса Е2. Гены CD80/CD86, оболочки FIV и uidA встраивали в единственный не-основной RPV-сайт.
Рекомбинантный вирус оспы енотов, который экспрессирует шесть чужеродных генов. Гены кошачьего CD86 и гены кошачьего CD80 экспрессируются в бицистронном кластере под контролем синтетического позднего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCVIRIS, находящийся между двумя открытыми рамками считывания; ген lacZ E.coli находится под контролем позднего промотора поксвируса. Ген gag/протеазы FIV находится под контролем синтетического раннего промотора ЕР2; ген оболочки FIV находится под контролем синтетического раннего промотора поксвируса ЕР2; ген оболочки FIV находится под контролем синтетического раннего промотора поксвируса ЕР1; ген uidA E.coli находится под контролем. Гены lacZ E.coli встраивали в сайт, отличающийся от сайтов инсерции гена оболочки FIV, gag/протеазы FIV и uidA E.coli.
Другие рекомбинантные вирусы оспы енотов для использования в качестве FeLV-вакцин для кошек могут быть сконструированы, как описано выше, с заменой генов FIV на совместимые гены FeLV.
Пример 12 S-FHV-020
S-FHV-020 представляет собой рекомбинантный вирус герпеса кошек, который имеет делецию целого гена gЕ FHV (1638 п.о.) и вставку гена lacZ E.coli в сайте делетированного gЕ. Ген lacZ E.coli находится под транскрипционным контролем конститутивного промотора gЕ FHV.
S-FHV-020 получали из S-FHV-001 (штамм NVSL). Это было осуществлено с использованием гомологичного вектора 486-88.В17 и вируса S-FHV-001, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус RPV, SPV или FHV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG) или β -глюкуронидазу (анализ X-GLUC)". В результате очистки синих бляшек получали рекомбинантный вирус, обозначенный S-FJV-020. После 5 пересевов проводили анализ на чистоту и стабильность вставки посредством детекции β-галактозидазы, как описано в разделе "Скрининг на экспрессию чужеродного гена в рекомбинантном RPV, SPV или FHV с использованием анализов на образование черных бляшек".
Пример 13 S-FHV-031
S-FHV-031 представляет собой рекомбинантный вирус герпеса кошек, который имеет делецию целого гена gЕ FHV в 1638 пар оснований и вставку трех чужеродных генов в сайте делетированного gЕ. Ген CD80 находится под транскрипционным контролем конститутивного промотора gЕ FHV и ориентирован в том же направлении, что и делетированный ген gЕ. Ген gag/протеазы FIV находится под контролем промотора псевдорабивируса gХ, а ген оболочки FIV находится под контролем предраннего промотора цитомегаловируса. Гены gag/протеазы и оболочки ориентированы в одном и том же направлении, но имеют противоположную ориентацию по отношению к гену CD80.
S-FHV-031 получали из S-FHV-020 (содержащего ген lacZ E.coli, находящийся за промотором gЕ). Это было осуществлено с использованием гомологичного вектора 942-03.С6 (см. "Материалы и методы") и вируса S-FHV-020, как описано в разделе "Гомологичная рекомбинация RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантные вирусы RPV, SPV или FHV, экспрессирующие β-галактозидазу (анализы BLUOGALAND и CPRG) или β-глюкурунидазу (анализ X-GLUC)". Рекомбинантные бляшки отбирали и очищали путем отбора белых бляшек. Этот вирус характеризовали путем картирования рестриктирующей эндонуклеазой и проведения процедуры Саузерн-блоттинга ДНК. Этот анализ подтвердил вставку генов кошачьего CD80, gag/протеазы FIV и оболочки FIV и делецию в 1638 пар оснований гена gЕ FIV. (Международная заявка РСТ WO 96/13575, которая вводится в настоящее описание посредством ссылки).
В настоящем примере S-FHV-031 анализировали на экспрессию антигенов, специфичных к кошачьему CD80, gag/протеазе FIV и к оболочке FIV, с использованием процедуры Вестерн-блоттинга. Описанные здесь анализы осуществляли на клетках CRFK, что указывало на то, что клетки CRFK могут служить подходящим субстратом для продуцирования рекомбинантных FHV-вакцин. Лизат клеток, инфицированных рекомбинантным кошачьим вирусом герпеса, обнаруживал полосу ожидаемого размера белка кошачьего CD80, gag/протеазы FIV и оболочки FIV.
В настоящем примере S-FHV-031 анализировали на экспрессию антигенов, специфичных для кошачьего CD80 с использованием процедуры, описанной в разделе "Скрининг на экспрессию кошачьего CD80 (В7-1) и CD86 (В7-2) в рекомбинантных SPV, RPV или FHV с использованием анализов на образование черных бляшек". Было показано, что химерное антитело против CTLA-4/Fc человека специфически реагирует с бляшками рекомбинантного вируса герпеса кошек (экспрессирующего кошачий CD80) и не реагирует с негативными контрольными бляшками S-FHV-001. Было показано, что все наблюдаемые бляшки рекомбинантного вируса герпеса кошек реагировали с химерным антителом против CTLA-4/Fc человека, что указывает на то, что этот вирус стабильно экспрессирует чужеродный ген кошачьего CD80.
S-FHV-031 представляет собой рекомбинантный вирус герпеса кошек, экспрессирующий белки gag/протеазы FIV, оболочки FIV и кошачьего CD80, и может быть использован в качестве вакцины против FIV-инфекций у кошек.
Пример 14
Рекомбинантный вирус герпеса кошек имеет делецию гена gЕ и вставку, по крайней мере, одного чужеродного гена в сайте делтированного gЕ. Чужеродный ген представляет собой ген кошачьего CD86 и находится под транскрипционным контролем промотора gЕ FHV.
Рекомбинантный вирус герпеса кошек, экспрессирующий кошачий CD86, может быть использован в качестве вакцин против болезней у кошек. Этот рекомбинантный вирус герпеса кошек, при его использовании отдельно или в комбинации с FIV-, FeLV-, FIP-вакцинами или с другими кошачьими вакцинами, способствует повышению эффективности вакцин против болезней, вызываемых FIV, FeLV, FIP, или других болезней кошек.
Пример 15
Дополнительными примерами рекомбинантного вируса герпеса кошек, который может быть использован в качестве вакцины против вируса иммунодефицита кошек (FIV), вируса лейкоза кошек (FeLV) или инфекционного перитонита у кошек (FIP), являются:
Рекомбинантный вирус герпеса кошек, который экспрессирует три чужеродных гена в сайтах делетированного гена gЕ FHV. Ген оболочки FeLV находится под контролем промотора псевдорабивируса gХ, ген gаg FIV находится под контролем предраннего промотора цитомегаловируса; ген кошачьего CD80 находится под контролем промотора вируса герпеса кошек gЕ. Рекомбинантный вирус герпеса кошек экспрессирует три чужеродных гена в сайте делетированного гена gЕ FHV. Ген env FeLV находится под контролем промотора псевдорабивируса gХ, ген gаg FIV находигся под контролем предраннего промотора цитомегаловируса; ген кошачьего CD86 находится под контролем промотора вируса герпеса кошек gЕ. Рекомбинантный вирус герпеса кошек экспрессирует три чужеродных гена в сайте делетированного гена gЕ FHV. Ген env FeLV находится под контролем промотора псевдорабивируса gХ, ген gаg FeLV находится под контролем предраннего промотора цитомегаловируса; ген кошачьего CD86 находится под контролем промотора вируса герпеса кошек gЕ.
Рекомбинантный вирус герпеса кошек, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и ген кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80/CD86 и uidA E.coli встроены в уникальную длинную область генома FHV в сайте, определенном как не-основной. Ген gag протеазы FIV, находящийсяся под контролем предраннего промотора цитомегаловируса; и ген lacZ E.coli, находящийся под контролем промотора псевдорабивируса gХ, встроены в сайт делетированного gЕ FHV.
Рекомбинантный вирус герпеса кошек, который экспрессирует пять чужеродных антигенов. Гены кошачьего CD86 и ген кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и трансляцию 2-й нижерасположенной открытой рамки считывания CD80, находящуюся под контролем элемента EMCV IRES. Ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и uidA E.coli встроены в уникальную длинную область генома FHV в сайте, определенном как не-основной. Ген оболочки FIV, находящийся под контролем предраннего промотора цитомегаловируса; и ген lacZ E.coli, находящийся под контролем промотора псевдорабивируса gХ, встроены в сайт делетированного gЕ FHV.
Рекомбинантный вирус герпеса кошек, который экспрессирует шесть чужеродных генов. Ген кошачьего CD86 и ген кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания. Ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита g1. Гены CD80, CD86 и uidA E.coli встроены в уникальную длинную область генома FHV в не-основном сайте. Ген оболочки FIV, находящийсяся под контролем предраннего промотора цитомегаловируса, ген gag/протеазы FIV, находящийся под контролем промотора псевдорабивируса gХ, и ген lacZ E.coli, находящийся под контролем промотора gе FHV, встроены в сайт делетированного gЕ FHV.
Рекомбинантный вирус герпеса кошек, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и uidA E.coli встроены в уникальную длинную область генома FHV в не-основном сайте. Ген gag/протеазы FeLV, находящийсяся под контролем предраннего промотора цитомегаловируса, и ген lacZ E.coli, находящийся под контролем промотора псевдорабивируса gХ, встроены в сайт делетированного дЕ FHV.
Рекомбинантный вирус герпеса кошек, когорый экспрессируег пягь чужеродных генов. Ген кошачьего CD86 и ген кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и трансляцию 2-й нижерасположенной открытой рамки считывания CD80, находящуюся под контролем элемента EMCV IRES. Ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и uidA E.coli встроены в уникальную область генома FHV в не-основном сайте. Ген оболочки FeLV, находящийсяся под контролем предраннего промотора цитомегаловируса, и ген lacZ E.coli, находящийся под контролем промотора псевдорабивируса gХ, встроены в сайт делетированного gE FHV.
Рекомбинантный вирус герпеса кошек, который экспрессирует шесть чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания. Ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и uidA E.coli встроены в уникальную длинную область генома FHV в не-основном сайте. Ген оболочки FeLV, находящийся под контролем предраннего промотора цитомегаловируса, ген gag/протеазы FeLV, находящийся под контролем промотора псевдорабивируса gХ, и ген lacZ E.coli, находящийся под контролем промотора gE FHV, встроены в сайт делетированного gE FHV.
Пример 17
Рекомбинантный вирус герпеса кошек имеет делецию гена gE и вставку, по крайней мере, одного чужеродного гена, в сайте делеции gE. Чужеродный ген представляет собой ген кошачьего CD80 и находится под транскрипционным контролем промотора gE FHV.
Этот рекомбинантный вирус герпеса кошек получали из S-FHV-001 (штамм NVSL). Это было осуществлено с использованием гомологичного вектора 926-76.D7 (см. "Материалы и методы") и вируса S-FHV-001, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного вируса герпеса". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус герпеса, экспрессирующий ферментные маркерные гены". Этот вирус характеризовали путем картирования рестриктирующей эндонуклеазой и проведения процедуры Саузерн-блоттинга ДНК. Этот анализ подтвердил вставку гена кошачьего CD80 и делецию в 1638 пар оснований гена gЕ FHV. (Международная заявка РСТ WO 96/13575, которая вводится в настоящее описание посредством ссылки).
В настоящем примере рекомбинантный вирус герпеса кошек анализировали на экспрессию антигенов, специфичных к кошачьему CD80, как описано в разделе "Скрининг черных бляшек на экспрессию чужеродного гена в рекомбинантном FHV". Описанные здесь анализы осуществляли на клетках CRFK, что указывало на то, что клетки CRFK могут служить подходящим субстратом для продуцирования рекомбинантных RPV-вакцин.
В настоящем примере рекомбинантный вирус герпеса кошек анализировали на экспрессию антигенов, специфичных к кошачьему CD80, с использованием процедуры, описанной в разделе "Скрининг на экспрессию кошачьего CD80 (В7-1) и CD86 (В7-2) в рекомбинантных SPV, RPV или FHV с использованием анализов на образование черных бляшек". Было показано, что химерное антитело против CTLA-4/Fc человека специфически реагирует с бляшками рекомбинантного вируса герпеса кошек (экспрессирующего кошачий CD80) и не реагирует с негативными контрольными бляшками S-FHV-001. Было показано, что все наблюдаемые бляшки рекомбинантного вируса герпеса кошек реагировали с химерным антителом против CTLA-4/Fc человека, что указывает на то, что этот вирус стабильно экспрессирует чужеродный ген кошачьего CD80.
Для подтверждения экспрессии продукта гена кошачьего CD80, клетки инфицировали рекомбинантным кошачим вирусом герпеса настоящего примера, и образцы инфицированных клеточных лизатов подвергали электрофорезу в полиакриламидном геле с ДСН. Этот гель блотировали и анализировали, как описано в разделе "Процедура Вестерн-блоттинга". Лизат клеток, инфицированных рекомбинантным кошачьим вирусом герпеса, обнаруживал полосу ожидаемого размера белка кошачьего CD80.
Пример 18
Рекомбинантный вирус герпеса кошек имеет делецию gЕ-гена FHV и вставку, по крайней мере, одного чужеродного гена в сайте делении gЕ. Этот чужеродный ген представляет собой ген кошачьего CD86 и находится под транскрипционным контролем промотора gЕ FHV.
Данный рекомбинантный вирус герпеса кошек, экспрессирующий кошачий CD86, может быть использован в качестве вакцин против болезней у кошек. Этот рекомбинантный вирус герпеса кошек при его использовании отдельно или в комбинации с FIV-, FeLV-, FIP-вакцинами или с другими кошачьими вакцинами способствует повышению эффективности вакцин против болезней, вызываемых FIV, FeLV, FIP или других болезней кошек.
Пример 19
Дополнительными примерами рекомбинантного вируса герпеса кошек, который может быть использован в качестве вакцины против вируса иммунодефицита кошек (FIV), вируса лейкоза кошек (FeLV) или инфекционного перитонита у кошек (FIP), являются:
Рекомбинантный вирус герпеса кошек, который экспрессирует три чужеродных гена. Ген env FIV находится под контролем промотора псевдорабивируса gХ, ген gag FIV находится под контролем предраннего промотора цитомегаловируса; а ген кошачьего CD80 находится под контролем промотора вируса герпеса кошек gE.
Рекомбинантный вирус герпеса кошек, который экспрессирует три чужеродных гена. Ген env FeLV находится под контролем промотора псевдорабивируса gХ, ген gag FeLV находится под контролем предраннего промотора цитомегаловируса, а ген кошачьего CD80 находится под контролем промотора вируса герпеса кошек gE.
Рекомбинантный вирус герпеса кошек, который экспрессирует три чужеродных гена. Ген env FIV находится под контролем промотора псевдорабивируса gХ, ген gag FIV находится под контролем предраннего промотора цитомегаловируса; а ген кошачьего CD86 находится под контролем промотора вируса герпеса кошек gE.
Рекомбинантный вирус герпеса кошек, который экспрессирует три чужеродных гена. Ген env FeLV находится под контролем промотора псевдорабивируса gХ, ген gag FeLV находится под контролем предраннего промотора цитомегаловируса; а ген кошачьего CD86 находится под контролем промотора вируса герпеса кошек gE.
Рекомбинантный вирус герпеса кошек, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания, инициирующий трансляцию 2-го нижерасположенного гена CD80; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl; ген gag FIV находится под контролем предраннего промотора цитомегаловируса; а ген lacZ E.coli находится под контролем промотора псевдорабивируса gХ. Эти пять чужеродных генов присутствуют в двух разных сайтах инсерции вируса герпеса кошек.
Рекомбинантный вирус герпеса кошек, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и трансляцию 2-й нижерасположенной открытой рамки считывания CD80, находящуюся под контролем элемента EMCV IRES; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl; ген оболочки FIV находится под контролем предраннего промотора цитомегаловируса; ген lacZ E.coli, находится под контролем промотора псевдорабивируса дХ. Рекомбинантный вирус герпеса кошек экспрессирует шесть чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания, инициирующий трансляцию 2-го нижерасположенного гена CD80; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl; ген gag FIV находится под контролем предраннего промотора цитомегаловируса; ген оболочки FIV находится под контролем предраннего промотора цитомегаловируса; а ген lacZ E.coli находится под контролем промотора псевдорабивируса gХ.
Рекомбинантный вирус герпеса кошек, который экспрессирует пять чужеродных генов. Гены кошачьего CD86 и кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания, инициирующий трансляцию 2-го нижерасположенного гена CD80; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl; ген gаg FeLV находится под контролем предраннего промотора цитомегаловируса; а ген lacZ E.coli находится под контролем промотора псевдорабивируса gХ. Эти пять чужеродных генов присутствуют в двух разных сайтах инсерции вируса герпеса кошек.
Рекомбинантный вирус герпеса кошек, который экспрессирует пять чужеродных генов. Ген кошачьего CD86 и ген кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и трансляцию 2-й нижерасположенной открытой рамки считывания CD80, находящуюся под контролем элемента EMCV IRES; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl; ген оболочки FeLV находится под контролем предраннего промотора цитомегаловируса; а ген lacZ E.coli находится под контролем промотора псевдорабивируса gХ.
Рекомбинантный вирус герпеса кошек, который экспрессирует шесть чужеродных генов. Ген кошачьего CD86 и ген кошачьего CD80 экспрессируются в бицистронном кластере под контролем предраннего промотора цитомегаловируса, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания, инициирующий трансляцию 2-го нижерасположенного гена CD80; ген uidA E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl; ген дад FeLV находится под контролем предраннего промотора цитомегаловируса; ген оболочки FeLV находится под контролем предраннего промотора цитомегаловируса; а ген lacZ E.coli находится под контролем промотора псевдорабивируса gХ.
Пример 20
Характеризация кДНК и полипептидов кошачьих CD80 (B7-1)-TAMU, CD86 (В7-2), CD28, CTLA-4 и CD80 (В7-1)-Syntro/SPAH:
Выделенная и очищенная кДНК кошачьего CD80 (В7-1), содержащая приблизительно 941 нуклеотид, кодирует открытую рамку считывания полипептида кошачьего CD80, состоящего, приблизительно, из 292 аминокислот, в нативной мембрано-ассоциированной или зрелой форме, и имеющего молекулярную массу около 33485 кДа, изоэлектрическую точку около 9,1, и общий заряд при рН 7,0, равный 10,24. Трансмембранный домен белка представляет собой область приблизительно в положениях аминокислот 241-271.
Кошачьи CD80-TAMU и CD80-Syntro/SPAH представляют собой кДНК и полипептиды, независимо выделенные из двух различных источников, и их ДНК- и аминокислотная последовательность слегка отличаются. Источником мРНК CD80-TAMU служили кошачьи мононуклеарные клетки периферической крови, стимулированные ConA, a источником РНК CD80-Syntro/SPAH служили клетки селезенки кошек, стимулированные ConA. Различие в кДНК-последовательности между CD80-TAMU и CD80-Syntro/SPAH заключается в замене Т на С в нуклеотиде 351 и в замене С на А в нуклеотиде 670. В аминокислотной последовательности замена в нуклеотиде 351 является "молчащей", а замена к нуклеотиде 670 приводит к консервативной замене нейтральных аминокислот, лейцина на изолейцин, в положении аминокислотного остатка 224.
Выделенная и очищенная кДНК кошачьего CD86 (В7-2), содержащая приблизительно 1176 нуклеотидов, кодирует открытую рамку считывания полипептида кошачьего CD86, состоящего, приблизительно, из 320 аминокислот, в нативной мембрано-связанной или зрелой форме, и имеющего молекулярную массу около 36394 кДа, изоэлектрическую точку около 9,19, и общий заряд при рН 7,0, равный 11,27.
Выделенная и очищенная кДНК кошачьего CD28, содержащая приблизительно 689 нуклеотидов, кодирует открытую рамку считывания полипептида кошачьего CD28, состоящего приблизительно из 221 аминокислоты, в нативной мембрано-связанной или зрелой форме, и имеющего молекулярную массу около 25319 кДа, изоэлектрическую точку около 9,17 и общий заряд при рН 7,0, равный 9,58.
Выделенная и очищенная кДНК кошачьего CTLA-4, содержащая приблизительно 749 нуклеотидов, кодирует открытую рамку считывания полипептида кошачьего CTLA-4, состоящего, приблизительно, из 223 аминокислот, в нативной мембрано-связанной или зрелой форме, и имеющего молекулярную массу около 24381 кДа, изоэлектрическую точку около 6,34 и общий заряд при рН 7, 0, равный -0,99.
Коэкспрессия CD80 с костимулирующими молекулами CD28 или CTLA-4 и с опухолевым антигеном или с антигеном от патогенного микроорганизма способствует активации или усилению активации Т-лимфоцитов, а более конкретно, лимфоцитов The-1, и стимулирует рост клеток других типов. Коэкспрессия CD80 с костимулирующей молекулой CTLA-4 способствует супрессии активации Т-лимфоцитов, а более конкретно, лимфоцитов The-1. Коэкспрессия CD86 с костимулирующими молекулами CD28 или CTLA-4 и с опухолевым антигеном или с антигеном от патогенного микроорганизма способствует активации или усилению активации Т-лимфоцитов, а более конкретно, лимфоцитов The-1, и стимулирует рост клеток других типов. Коэкспрессия CD86 с костимулирующей молекулой CTLA-4 способствует супрессии активации Т-лимфоцитов, а более конкретно, лимфоцитов The-1.

Пример 21
Использование кошачьих CD80(B7-1), CD86(B7-2), CD28 и CTLA-4 в вакцинах
Для оценки иммуностимулирующей активности кошачьих CD80, CD86, CD28 и CTLA-4 в вакцинах против болезней кошек были проведены следующие эксперименты.
Кошачьи CD80, CD86, CD28 или CTLA-4 встраивали в векторы на основе рекомбинантного вируса (происходящего от вируса герпеса кошек, вируса оспы свиней или вируса оспы енотов), используемые для экспрессии рекомбинантных белков у кошек (см. Международную заявку WO 96/22363 или WO 96/13575). Векторы на основе рекомбинантного вируса, экспрессирующие все четыре иммуностимулирующие молекулы, или, альтернативно, экспрессирующие попарные комбинации CD80 и CD28, или CD80 и CTLA-4, или CD86 и CD28, или CD86 и CTLA-4, вводили перорально или внутримышечно кошкам в возрасте 8 недель в дозе от 0,1 до 10,0 мг на кг веса тела, или в дозе, составляющей, приблизительно, 104-109 бляшкообразующих единиц (б.о.е.) или, предпочтительно, в дозе, составляющей приблизительно 106 б.о.е. Субединичную вакцину для FIV или FeLV или вакцину на основе вирусного вектора для FIV или FeLV (см. выше) вводили в минимальной протективной дозе одновременно с иммуностимулирующей вакциной, содержащей вектор на основе CD-80, CD86, CD28- или CTLA-4. Через 3-4 недели кошкам давали вторую дозу этой вакцины. Этих кошек подвергали заражению вирулентным штаммом FIV (PPR или Petaluma) или штаммом Rickard FeLV (вводимым с метилпреднизолоном для супрессии иммунитета у кошек) при уровне заражения, соответствующем стандартной дозе USDA, и регулярно наблюдали в течение 12 недель за развитеием виремии. Группу вакцинированных кошек наблюдали вплоть до 12 месяцев в отношении развития опухолей, вызываемых FeLV. Частоту заболеваемости у этих кошек сравнивали с контрольной группой кошек, которым не была введена вакцина, или с группой кошек, которым была введена FIV- или FeLV-вакцина без иммуностимулирующих молекул. Результаты этого контрольного заражения показали, что у более 60% кошек, которым не была введена вакцина и которые были затем заражены FeLV или FIV, наблюдалась персистентная виремия; 75% кошек, вакцинированных суъединичной FIV- или FeLV-вакциной, а затем подвергнутых контрольному заражению, оказались защищенными от виремии; а кошки, вакцинированные суъединичной FIV- или FeLV-вакциной и вакциной, содержащей комбинацию иммуностимулирующих вакцин на основе CD80-, CD86-, CD28- или CTLA-4-векторов, а затем подвергнутые контрольному заражению, были на 100% защищены от виремии. Другие преимущественные аспекты добавления вакцины, содержащей векторы на основе кошачьих CD80, CD86, CD28 и CTLA-4, давали 100% защиту от виремии и/или от образования опухолей; способствовали более продолжительному иммунитету (более 1 года) и раннему вырабатыванию иммунитета; или давали возможность проводить первичную вакцинацию кошек с использованием лишь одной дозы вместо двух доз, рекомендуемых в настоящее время всеми изготовителями. Кошки, вакцинированные вакцинами, содержащими векторы на основе вирусов FIV или FeLV, были значительно больше защищены от заражения, чем кошки, вакцинированные суъединичной FIV- или FeLV-вакциной. Кошки, которым вводили вакцину, содержащую векторы на основе FIV или FeLV, и вакцину, содержащую комбинацию векторов на основе иммуностимулирующих кошачьих CD80,CD86-, CD28- или CTLA-4 и которых затем подвергали контрольному заражению, были на 100% защищены от виремии. Вакцинирование кошек вакциной на основе FIV- или FeLV-содержащего вектора и вакциной, содержащей комбинацию иммуностимулирующих CD80-, CD86-, CD28- или CTLA-4-векторов, также давало дополнительные преимущественные результаты, описанные выше.
В альтернативной процедуре кошкам в возрасте 8 недель внутримышечно инъецировали 100 мкг плазмиды, содержащей кДНК для молекул кошачьих CD80, CD86, CD28 или CTLA-4 в смеси с плазмидой, содержащей кДНК для env и gag FIV, или env и gag FeLV, или, альтернативно, кошкам внутримышечно инъецировали 100 мкг плазмиды, содержащей кДНК, экспрессирующей попарные комбинации CD80 и CD28, или CD80 и CTLA-4, или CD86 и CD28, или CD86 и CTLA-4 в паре с CD28, или CTLA-4 в смеси с плазмидой, содержащей кДНК для env и gag FIV, или env и gag FeLV. Контрольной группе кошек не инъецировали CD80, CD86, CD28 или CTLA-4. Кошек подвергали заражению вирулентными FeLV или FIV и наблюдали признаки заболеваний, описанных выше. Результаты этого эксперимента по контрольному заражению показали, что кошки, которым вводили кДНК-вектор, содержащий кошачьи CD80, CD86, CD28 и CTLA-4, и кДНК-вектор, содержащий гены FIV или FeLV, обнаруживали 100% защиту от болезни по сравнению с кошками, которым был введен лишь кДНК-вектор, содержащий гены FIV или гены FeLV, и которые обнаруживали 75% защиту от болезни.
В альтернативной процедуре кошкам в возрасте 8 недель внутримышечно инъецировали 0,1-100 мкг очищенных молекул белка кошачьих CD80, CD86, CD28 или CTLA-4, или, альтернативно, кошкам инъецировали попарные комбинации CD80 и CD86 в паре с белками CD28 или CTLA-4 из рекомбинантных кДНК-векторов, описанных выше, и внутримышечно инъецировали 0,1-100 мкг субъединичной вакцины, содержащей env и gag FIV или env и gag FeLV. Контрольной группе кошек не инъецировали CD80, CD86, CD28 или CTLA-4. Кошек подвергали заражению вирулентным штаммом FIV или штаммом FeLV, и регулярно наблюдали за развитием болезни. Результаты этого эксперимента по контрольному заражению показали, что кошки, которым вводили очищенные молекулы белка кошачьих CD80, CD86, CD28 или CTLA-4, и субъединичную вакцину, содержащую FIV или FeLV, обнаруживали значительное снижение заболеваемости по сравнению с кошками, которым была введена лишь субъединичная вакцина, содержащая белки FIV или FeLV.
Пример 22
Использование кошачих CD80, CD86, CD28 или CTLA-4 в качестве профилактической вакцины для защиты от болезней.
Кошачьи CD80, CD86, CD28 и CTLA-4 в рекомбинантных векторах на основе вируса оспы свиней, рекомбинантных векторах на основе вируса оспы енотов, или рекомбинантных векторах на основе вируса герпеса кошек, при их введении как описано в Примере 17, но без введения антигенов, содержащихся в субъединичных или вирусных векторах и происходящих от патогенных микроорганизмов, могут быть использованы для стимуляции иммунитета и The-1-ответа, благодаря которому вырабатывается протективный иммунный ответ при заражении вирусными, паразитарными или бактериальными патогенами. В альтернативной процедуре кошачий CD80 или CD86 в комбинации с кошачьим CTLA-4 в вирусных векторах, при их введении как описано в Примере 3, может быть использован для подавления иммунного ответа и для защиты от аутоиммунных болезней у кошек.
Пример 23:
Использование кошачьих CD80, CD86, CD28 и CTLA-4 для ингибирования и подавления роста опухолевых клеток.
Опухолевые клетки кошек трансфецировали рекомбинантным вектором на основе вируса оспы свиней, рекомбинантным вектором на основе вируса оспы енотов или рекомбинантным вектором на основе вируса герпеса кошек, экспрессирующими кошачий CD80 или CD86 в комбинации с CD28 или CTLA-4. Затем кошке повторно вводили трансфецированные опухолевые клетки, и присутствие CD80, CD86, CD28 и CTLA-4 на поверхности опухолевой клетки вызывало продуцирование значительного иммунного ответа на трансфецированные и нетрансфецированные опухолевые клетки, что приводило, тем самым, к цитолизу локализованных и метастатических опухолевых клеток. В альтернативной процедуре векторы, экспрессирующие кошачий CD80 или CD86 в комбинации с CD28 или CTLA-4, инъецировали непосредственно в опухоль кошки, что приводило, тем самым, к вырабатыванию значительного иммунного ответа на опухолевые клетки и к цитолизу локализованных и метастатических опухолевых клеток.
Пример 24
Использование кошачьих CD80, CD86, CD28 и CTLA-4 в качестве терапевтических средств для лечения болезней кошек.
Кошачьи CD80, CD86, CD28 и CTLA-4 в рекомбинантном векторе на основе вируса оспы свиней, рекомбинантном векторе на основе вируса оспы енотов или в рекомбинантном векторе на основе вируса герпеса кошек при их введении, как описано в Примере 17, но без введения антигенов, содержащихся в субъединичных или вирусных векторах и происходящих от патогенных микроорганизмов, могут быть использованы для стимуляции иммунитета в целях иммунного клиренса или снижения уровня патологии заболевания.
Подтверждение экспериментальных данных: SPV 246
Безопасность и эффективность вакцины на основе рекомбинантного вирусного вектора SPV, содержащего ген gag и оболочки FeLV и ген кошачьего CD80.
Конструирование рекомбинантного вируса SPV, SPV 246 описано выше (в основной части описания настоящей первичной заявки). SPV 246 содержит пять чужеродных генов, включая гены, кодирующие белки gag и оболочки FeLV и кошачьего CD80, а также два маркерных гена, β-глюкорунидазу и β-галактозидазу. Экспрессию гена gag и оболочки FeLV и CD80 в клетках, инфицированных SPV 246, подтверждали с помощью Вестерн-блот-анализа. Полосы, представляющие специфические белки gag и оболочки FeLV, детектировали с помощью козьего поликлонального антитела против FeLV Р27 (Biodesign, ME) и моноклонального антитела против gр70 FeLV (Biodesign, ME), соответственно. Очевидно, что белки gag и оболочки FeLV посттрансляционно процессируются аналогично нативным вирусным белкам. Анализ на чистоту, экспрессию и стабильность проводили посредством анализа на образование черных бляшек с использованием антител, описанных выше. SPV 246 стабильно пересевался, по крайней мере, 5 раз. 100% бляшек, генерированных из клеток, инфицированных SPV 246, были положительными на белки gag и оболочки FeLV, β-галактозидазы и β-глюкуронидазу.
Экспрессию кошачьего CD80 подтверждали в Вестерн-блот-анализе с использованием поликлонального антитела против CD80 человека. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80. Эти полосы представляли картину чередующегося и множественного гликозилирования CD80, экспрессированного и модифицированного в "контексте" SPV в клетах ESK-4.
SPV 246 и контрольный вирус, SPV 003, а также другие рекомбинантные вирусы FHV и SPV FeLV, являющиеся кандидатами на вакцину, были протестированы на их способность обеспечивать защиту кошек от персистентной инфекции FeLV. Для этого 8-недельных котят, 10 котят на группу, подкожно вакцинировали 1 мл SPV 246, контрольного вируса или других рекомбинантных вирусов (в дозах, составляющих от 7×105 б.о.е. на кошку до 7×107 б.о.е. на кошку). Кошек вакцинировали три раза через интервалы в 3 недели. После вакцинации кошек подвергали контрольному ороназальному заражению стандартным лабораторным штаммом FeLV Rickard (106,2 TCID50/мл/кошку), после предварительной обработки ацетатом метилпреднизолона (Depo-Medrol).
Сыворотку, взятую у этих кошек, еженедельно анализировали на персистентную виремию в течение 15 недель после заражения. При тестировании на персистентную виремию считалось, что кошки имеют персистентную виремию, если у них непрерывно в течение 3 недель обнаруживалось присутствие р27 FeLV.
Результаты:
Исследовании методом заражения FeLV показали, что кошки, вакцинированные SPV 246, были частично защищены от FeLV-виремии. Предсказанное значение превентивной фракции (PF) для кошек, обработанных SPV 246, составляло 50% (Таблица 1).
Таблица 1: Число и процент кошек с персистентной виремией через 15 недель после контрольного заражения. Для каждой группы была вычислена превентивная фракция (PF).

Примеры дополнительных рекомбинантных вирусов, содержащих CD80 и CD86
SPV 280
SPV 280 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий шесть чужеродных генов. Гомологичный вектор, обозначенный 992-23.6 конструировали следующим образом: гены кошачьего CD86 и кошачьего CD80 экспрессировали в бицистронном ДНК-кластере под контролем синтетического позднего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания; ген β-глюкуронидазы E.coli находится под контролем синтетического раннего промотора ЕР2. SPV 280 получали из SPV 258, содержего гены gag и оболочки FeLV и β-галактозидазы. SPV 258 был предварительно сконструирован так, что он содержал ген gag/протеазы FeLV и усеченный ген оболочки FeLV (gp70) под контролем синтетических ранних/поздних промоторов поксвируса, LP2EP2; ген β-галактозидазы E.coli находится под контролем конститутивного промотора поксвируса 15L и встроен в делетированный неполный 1869 п.о.-HindIII-фрагмент N. Гены CD80/CD86 и β-глюкуронидазы E.coli клонировали в гомологичный вектор 992-23.6 в отдельном и не-основном неполном HindIII-фрагменте К SPV.
SPV 280 получали из SPV 258. Это было осуществлено с использованием гомологичного вектора 992-23.6 и вируса S-SPV-258, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, эрепрессирующий β-галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус SPV 280.
SPV 280 анализировали на экспрессию генов gag FeLV, оболочки FeLV и маркерных генов, генов β-галактозидазы и β-глюкуронидазы с помощью анализа на образование черных бляшек. С использованием козьего поликлонального антитела против gag FeLV (Biodesign, ME) и мышиного моноклонального антитела против белка оболочки gp70 FeLV (Biodesign, ME) было определено, что 100% бляшек, генерированных из клеток ESK-4, инфицированных очищенным SPV 280, экспрессируют ген gag и оболочки FeLV.
Экспрессию кошачьего CD80 и CD86 подтверждали в Вестерн-блот-анализе, используя козьи поликлональные антитела против CD80 и CD86 человека (R&D Systems,MN), соответственно. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы давали картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" SPV в клетках ESK-4.
SPV 281
SPV 281 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий шесть чужеродных генов. Гомологичный вектор, обозначенный 992-23.6, конструировали, как описано выше для SPV 280. SPV 281 был получен из SPV 228, содержего гены gag/протеазы и оболочки FIV и β-галактозидазы E.coli. Ген gag/протеазы FIV находится под контролем синтетического раннего промотора поксвируса ЕР2; ген оболочки FIV находится под контролем синтетического раннего промотора поксвируса ЕР1, ген β -галактозидазы E.coli находится под контролем конститутивного промотора поксвируса 15L. Гены gag/протеазы FIV, оболочки FIV и β-галактозидазы E.coli были встроены в делетированный неполный 1869 n.o.-HindIII-фрагмент N SPV. Гены CD80/CD86 и β-глюкуронидазы E.coli были встроены в отдельный и не-основной неполный HindIII-фрагмент К SPV.
SPV 281 получали из SPV 228. Это было осуществлено с использованием гомологичного вектора 992-23.6 и вируса S-SPV-228, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус SPV 281.
SPV 281 анализировали на экспрессию генов gag FIV, оболочки FIV, маркерных генов, генов β-галактозидазы и β-глюкуронидазы с помощью анализа на образование черных бляшек. С использованием мышиных моноклональных антител против gag FIV (р27) и оболочки FIV (gp100) (Custom Monoclonals, CA; Biodesign International, ME, соответственно), мышиного моноклонального антитела против β-галактозидазы и кроличьего поликлонального антитела против β -глюкуронидазы (Biodesign, ME & Molecular Probes, OR, соответственно) было определено, что 100% бляшек, генерированных из клеток ESK-4, инфицированных очищенным SPV 280, экспрессируют ген gag FIV, оболочки FIV, β-галактозидазы и β-глюкуронидазы.
Экспрессию кошачьего CD80 и CD86 подтверждали с помощью Вестерн-блот-анализа с использованием поликлонального антитела против CD80 и CD86 человека (R&D Systems, MN). Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы представляли картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" SPV и клетках ESK-4. Экспрессию gag FIV и оболочки FIV также подтверждали с использованием Вестерн-блот-анализа с использованием антител, описанных выше. Белки gag FIV и оболочки FIV, очевидно, процессируются в Р24 и gp100, соответственно.
FHV 043
FHV 043 представляет собой рекомбинантный вирус герпеса кошек, экспрессирующий пять чужеродных генов. Гомологичный вектор, обозначенный 987-57.А1, конструировали следующим образом:
гены кошачьего CD86 и кошачьего CD80 клонировали в бицистронный кластер под контролем предраннего промотора цитомегаловируса (CMV IE), инициирующего транскрипцию CD80 и CD86. Трансляция второй открытой рамки считывания нижерасположенного CD80 находится под контролем элемента EMCV IRES. Ген β-глюкуронидазы E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и β-глюкуронидазы E.coli встраивали в уникальную длинную область FHV в уникальном EcoRI-сайте, происходящем от неполного SalI-фрагмента Н FHV. Инсерция была введена между геном gL и смежным геном активатора транскрипции.
FHV 043 был получен из FHV 017, содержащего гены оболочки FIV и β-галактозидазы E.coli. Ген оболочки FIV находится под контролем промотора IE CMV, а ген β-галактозидазы E.coli находится под контролем промоторного элемента псевдорадивируса gХ. Ген оболочки FIV и β-галактозидазы E.coli были встроены в сайтделетированного gE US FHV.
FHV 043 получали из FHV 017. Это было осуществлено с использованием гомологичного вектора 987-51.А1 и вируса FHV 017, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 043.
FHV 043 анализировали на экспрессию маркерных генов, гена β-галактозидазы и гена β-глюкуронидазы с помощью анализа на образование черных бляшек. С использованием мышиного моноклонального антитела против β-галактозидазы (Biodesign, ME) и кроличьего поликлонального антитела против β-глюкуронидазы (Molecular Probes, OR) было определено, что 100% бляшек, генерированных из клеток CRFK, инфицированных FHV 043, очищенным методом бляшек, экспрессируют β-галактозидазу и β-глюкуронидазу. Было определено, что этот вирус является стабильным после, по крайней мере, 5 пересевов.
Экспрессию кошачьего CD80 и CD86 подтверждали с помощью Вестерн-блот-анализа с использованием поликлональных антител против CD80 и CD86 человека (R&D Systems, MN). Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Экспрессию гена оболочки FIV (др130) подтверждали с помощью Вестерн-блот-анализа с использованием сыворотки выздоравливающих кошек, взятой от FIV-инфицированных кошек.
Гомологичный вектор 1015-18.8А (LP1-CD8 6 / IRES-CD80):
Этот гомологичный вектор 1015-18.8А использовали для создания рекомбинантных вирусов RPV, экспрессирующих CD80 и CD86. Для этого конструировали плазмиду, содержащую промотор поксвируса LP1, элемент IRES EMCV и терминатор транскрипции Poly A поксвируса. Ген кошачьего CD80 подвергали ПЦР-амплификации с использованием праймеров 1/97.6 (5’-GCTAGGATCCAATCTATGTAGACAGGTGAGAT-3’) и 3/98.4 (5’-TCGAGGATCCGGGTCACGCAGCAAAGTGG-3’), каждый из которых содержал клонирующие BamHI-сайты. CD80 клонировали за промотором LP1. Ген кошачьего CD86 подвергали ПЦР-амплификации с использованием праймера 1/98.18 (5’-TCGACAATTGGATGGGCATTTGTGACAG-3’) с MfeI-сайтом клонирования и с использованием затупленного по концам праймера 8/97.31 (5’-GTGGATCCAGGATCCGGAGCGG-3’). CD86 клонировали за элементом IRES EMCV. Затем кластер рестриктировали ферментом NotI и клонировали в HindIII-фрагмент N RPV вектора, содержащего ген (3-галактозидазы E.coli под контролем синтетического позднего промотора 15L. Конечный гомологичный вектор 1015-18.8А использовали для создания вирусов, содержащих гены FIV или FeLV и гены CD80 и CD86 в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV".
S-RPV-045:
S-RPV-045 представляет собой рекомбинантный вирус оспы енотов, экспрессирующий три чужеродных гена. S-RPV-045 был получен из вируса оспы енотов RPV-000 (ATCC VR-838). Это было осуществлено с использованием гомологичного вектора 1015-18.8A и родительского вируса S-RPV-000, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV". Исходный материал для трансфекции скринировали на рекомбинант, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и скрининг на рекомбинантный RPV, экспрессирующий ферментные маркерные гены)". Вирус очищали методом бляшек и пересевали 5 раз.
RPV-045 анализировали на экспрессию β-галактозидазы путем анализа на образование черных бляшек. С использованием кроличьего поликлонального антитела (ICN, ОН) было определено, что 100% бляшек, генерированных из клеток VERO, инфицированных очищенным RPV-045, экспрессировали β-галактозидазу.
Экспрессию кошачьего CD80 и CD86 подтверждали в Вестерн-блот-анализе, описанном в соответствующем разделе, используя козьи поликлональные антитела против CD80 и CD86 человека (R&D Systems, MN), соответственно. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы давали картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" RPV и в клетках VERO.
S-RPV-046:
RPV-046 представляет собой вирус оспы енотов, экспрессирующий пять чужеродных генов. RPV-046 был получен от вируса оспы енотов RPV-036. Эту процедуру осуществляли с использованием гомологичного вектора 1015-18.8А и родительского вируса RPV-036, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV". Исходные материалы для трансфекции скринировали на рекомбинантный вирус, как описано в разделе "Скрининг на рекомбинантный вирус RPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и Скрининг на рекомбинантный RPV, экспрессирующий ферментные маркерные гены)". Вирус очищали методом бляшек и пересевали 5 раз. В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 046. RPV 046 содержит ген gag FIV под контролем синтетического раннего/позднего промотора поксвируса LP2EP2; и ген β-глюкуронидазы под контролем синтетического раннего промотора поксвируса ЕР2. Эти гены находятся в отдельном и не-основном неполном HindIII-сайте U RPV. Гены CD80 и CD86 и ген β-галактозидазы находятся в уникальном и отдельном не-основном неполном HindIII-сайте N RPV.
RPV-046 анализировали на экспрессию β-галактозидазы и β-глюкуронидазы путем анализа на образование черных бляшек. Было определено, что 100% бляшек, генерированных из клеток VERO, инфицированных очищенным RPV-046, экспрессировали β-галактозидазу и β-глюкуронидазу.
Экспрессию CD80 и CD86 подтверждали с помощью Вестерн-блот-анализа, описанном в соответствующем разделе, с использованием козьих поликлональных антител против CD80 и CD86 человека (R&D Systems, MN), соответственно. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы представляли картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" RPV в клетках VERO. Экспрессию gag/протеазы FIV также подтверждали с помощью Вестерн-блот-анализа с использованием мышиных моноклональных антител против gag FIV (p27) (Custom Monoclonals, CA).
S-RPV-047:
RPV-047 представляет собой вирус оспы енотов, экспрессирующий пять чужеродных генов. Был сконструирован, как описано выше, гомологичный вектор 1015-18.8А, который содержит кластер LP1-CD86/IRES-CD80 и ген β-галактозидазы E.coli под контролем синтетического позднего промотора (15L) в HindIII-фрагменте N. RPV-047 был получен от RPV-044, содержащего гены env FIV и β-глюкуронидазы E.coli (β-glucuronidase} в HindIII-фрагменте U RPV. Ген env FIV находится под контролем синтетического раннего промотора (ЕР1). Ген β -глюкуронидазы находится под контролем синтетического позднего промотора (LP1).
RPV-047 получали из вируса оспы енотов RPV 044. Это было осуществлено с использованием гомологичного вектора 1015-18.18А и родительского вируса RPV-044, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV". Исходные материалы для трансфекции скринировали на рекомбинант, как описано в разделе "Скрининг на рекомбинантный вирус RPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и Скрининг на рекомбинантный RPV, экспрессирующий ферментные маркерные гены). Вирус очищали методом бляшек и пересевали 5 раз. В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 047.
RPV-047 анализировали на экспрессию β-галактозидазы путем анализа на образование черных бляшек. С использованием поликлонального кроличьего антитела (ICN, ОН) было определено, что 100% бляшек, генерированных из клеток VERO, инфицированных очищенным RPV-047, экспрессируют β-галактозидазу.
Вестерн-анализ, описанный в соответствующем разделе, с использованием козьих поликлональных антител против CD80 и CD86 человека (R&D Systems, MN), проводимый, как описано в разделе "Процедура Вестерн-блоттинга", подтвердил экспрессию CD80 и CD86, соответственно. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы представляли картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" RPV в клетках VERO. Экспрессию env FIV также подтверждали с помощью Вестерн-блот-анализа с использованием мышиных моноклональных антител против env FIV (gp100) (BioDesign International, ME).
S-RPV-048:
RPV-048 представляет собой вирус оспы енотов, экспрессирующий пять чужеродных генов. Был сконструирован, как описано выше, гомологичный вектор 1015-18.8А, который содержит кластер LP1-CD86/IRES-CD80 и ген β-галактозидазы E.coli под контролем синтетического позднего промотора (15L) во HindIII-фрагменте N. RPV-048 был получен из RPV-038, содержащего гены gag/протеазы FeLV и β-глюкуронидазы E.coli в HindIII-фрагменте U RPV. Ген gag/протеазы FeLV находится под контролем синтетических позднего/раннего промоторов (LP2EP2). Ген β-глюкуронидазы находится под контролем синтетического позднего промотора (LP1).
RPV 048 получали из рекомбинантного вируса оспы енотов RPV 038. Это было осуществлено с использованием гомологичного вектора 1015-18.18А и родительского вируса RPV-038, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV". Исходные материалы для трансфекции скринировали на рекомбинантный вирус, как описано в разделе "Скрининг на рекомбинантный вирус RPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и Скрининг на рекомбинантный RPV, экспрессирующий ферментные маркерные гены)". Вирус очищали методом бляшек и пересевали 5 раз. В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 048.
RPV-048 анализировали на экспрессию β-галактозидазы путем анализа на образование черных бляшек. С использованием поликлонального кроличьего антитела (ICN, ОН) было определено, что 100% бляшек, генерированных из клеток VERO, инфицированных очищенным RPV-046, экспрессировали β -галактозидазу.
Экспрессию CD80 и CD86 подтверждали с помощью Вестерн-блот-анализа, проводимого, как описано в разделе "Процедура Вестерн-блоттинга", с использованием козьих поликлональных антител против CD80 и CD86 человека (R&D Systems, MN), соответственно. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы представляли картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" RPV в клетках VERO. Экспрессию gag/протеазы FeLV также подтверждали путем Вестерн-блоттинга с использованием кроличьих поликлональных антител против gag FeLV (р27)(BioDesign International, ME).
S-RPV-052:
RPV-052 представляет собой вирус оспы енотов, экспрессирующий шесть чужеродных генов. Был сконструирован, как описано выше, гомологичный вектор 1015-18.8А, который содержит кластер LP1-CD86/IRES-CD80 и ген β-галактозидазы E.coli под контролем синтетического позднего промотора (15L) в HindIII-фрагменте N. RPV-052 был получен из RPV-030, содержащего гены gag/протеазы FeLV, env FeLV и β-глюкуронидазы E.coli в HindIII-фрагменте U RPV. Ген gag/протеазы FeLV находится под контролем синтетического раннего промотора (ЕР2). Ген env FeLV находится под контролем синтетического раннего промотора (ЕР1). Ген β-глюкуронидазы находится под контролем синтетического позднего промотора (LP1).
RPV 052 получали из вируса оспы енотов RPV 030. Это было осуществлено с использованием гомологичного вектора 1015-18.8А и родительского вируса RPV-030, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV". Исходные материалы для трансфекции скринировали на рекомбинантный вирус, как описано в разделе "Скрининг на рекомбинантный вирус RPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и Скрининг на рекомбинантный RPV, экспрессирующий ферментные маркерные гены)". Вирус очищали методом бляшек и пересевали 5 раз. В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 052.
RPV-052 анализировали на экспрессию β-галактозидазы, β-глюкуронидазы, gag FeLV и оболочки FeLV путем анализа на образование черных бляшек. Экспрессию CD80 и CD86 подтверждали с помощью Вестерн-блот-анализа, проводимого, как описано в разделе "Процедура Вестерн-блоттинга", с использованием козьих поликлональных антител против CD80 и CD86 человека (R&D Systems, MN), соответственно. Экспрессию gag/протеазы FeLV и оболочки FeLV также подтверждали с помощью Вестерн-блот-анализа с использованием кроличьих поликлональных антител против gag FeLV (p27) (BioDesign International, ME) и мышиных моноклональных антител против env FeLV (gp100) (BioDesign, ME).
S-RPV-053:
RPV-053 представляет собой вирус оспы енотов, экспрессирующий шесть чужеродных генов. Был сконструирован, как описано выше, гомологичный вектор 1015-18.8А, который содержит кластер LP1-CD86/IRES-CD80 и ген β-галактозидазы E.coli под контролем синтетического позднего промотора (15L) в HindIII-фрагменте N. RPV-053 был получен из.RPV-034, который содержит гены gag/протеазы FIV, env FIV и β -глюкуронидазы E.coli в HindIII-фрагменте U RPV. Ген gag/протеазы FIV находится под контролем синтетического раннего промотора (ЕР2). Ген env FIV находится под контролем синтетического раннего промотора (ЕР1). Ген β-глюкуронидазы находится под контролем синтетического позднего промотора (LP1).
RPV-053 получали из вируса оспы енотов RPV-034. Это было осуществлено с использованием гомологичного вектора 1015-18.8А и родительского вируса RPV-034, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV". Исходные материалы для трансфекции скринировали на рекомбинантный вирус, как описано в разделе "Скрининг на рекомбинантный вирус RPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и Скрининг на рекомбинантный RPV, экспрессирующий ферментные маркерные гены)". Вирус очищали методом бляшек и пересевали 5 раз. В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 053.
S-SPV 275
S-SPV-275 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий пять чужеродных генов. Гомологичный вектор, обозначенный 992-23.6, конструировали следующим образом: гены кошачьих CD86 и CD80 были экспрессированы в бицистронном ДНК-кластере под контролем синтетического позднего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания. Ген β-глюкуронидазы E.coli находится под контролем синтетического раннего промотора поксвируса ЕР2. В качестве родительского вируса использовали S-SPV 046, который содержит ген gag/протеазы FIV, стимулируемый синтетическим поздним/ранним промотором поксвируса LP2EP2, и ген β-галактозидазы, находящийся под контролем конститутивного промотора поксвируса OIL. Генgag/протеазы FIV и ген β-галактозидазы встраивали в неполный HindIII-фрагмент М SPV, а гены CD86/CD80 и β -глюкуронидазы встраивали в неполный HindIII-фрагмент К SPV.
S-SPV 275 получали из S-SPV 046. Это было осуществлено с использованием гомологичного вектора 992-23.6 и вируса S-SPV-046, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки зеленых/синих бляшек получали рекомбинантный вирус SPV 275.
S-SPV 275 анализировали на экспрессию генов gag FIV, маркерных генов и генов β-глюкуронидазы с помощью анализа на образование черных бляшек. С использованием мышиного моноклонального антитела против gag FIV (Custom Monoclonals, CA) было определено, что 100% бляшек, генерированных в клетках ESK-4, инфицированных очищенным S-SPV 275, экспрессируют ген gag FIV и остаются стабильным после 5 пересевов.
Экспрессию gag FIV, CD86 и CD80 подтверждали с помощью Вестерн-блот-анализа с использованием мышиного моноклонального антитела против gag FIV, и с использованием козьих поликлональных антител против CD86 и CD80 человека (R&D Systems, MN) для кошачьих CD86 и CD80. Были обнаружены две отдельные полосы размером 50 и 27 кДа, специфичные для gag FIV. Было обнаружено множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86, а также полосы размером от 30 до 60 кДа, специфичные для кошачьего CD80.
S-FHV 040
S-FHV 040 представляет собой рекомбинантный вирус герпеса кошек, экспрессирующий пять чужеродных генов. Гомологичный вектор, обозначенный 957-87.А1, конструировали следующим образом: гены кошачьих CD86 и CD80 экспрессировали в бицистронном ДНК-кластере под контролем предраннего промотора цитомегаловируса (CMV IE), инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания. Ген β-глюкуронидазы E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и β-глюкуронидазы E.coli встраивали в уникальную длинную область FHV в уникальном EcoRI-сайте, происходящем от неполного Sail-фрагмента Н FHV, между геном gL и смежным геном активатора транскрипции. В качестве родительского вируса использовали S-FHV-019, который содержит ген gag FeLV, стимулированный IE CMV, и ген β-галактозидазы E.coli, находящийся под контролем промоторного элемента псевдорадивируса gХ; оба этих гена локализованы в уникальном коротком сайте (US) делеции gЕ FHV.
S-FHV 040 получали из S-FHV 019. Это было осуществлено с использованием гомологичного вектора 987-57.А1 и вируса S-FHV 019, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус FHV, экспрессирующий β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки зеленых/синих бляшек получали рекомбинантный вирус S-FHV 040.
S-FHV 040 анализировали на экспрессию gag FeLV, маркерных генов β-глюкуронидазы и β-галактозидазы с помощью анализа на образование черных бляшек. Было определено, что 100% бляшек, генерированных в клетках CRFK, экспрессировали β-глюкуронидазу и β-галактозидазу. Экспрессия gag FeLV была также подтверждена с помощью анализа на образование черных бляшек с использованием козьего поликлонального антитела против gp27 FeLV (Biodesign, ME). Этот вирус обнаруживал стабильность после пяти пересевов.
Экспрессию кошачьих CD80 и CDS 6 и gag FeLV подтверждали с помощью Вестерн-блот-анализа. Для кошачьих CD80 и CD86 использовали козьи поликлональные антитела против CD80 и CD86 человека (R&D Systems, MN). Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и полосы размером от 40 до 70 кДа, специфичные для кошачьего CD86. Экспрессию FeLV подтверждали с использованием козьего поликлонального антитела против gp27 FeLV (Biodesign, ME).
S-FHV 042
S-FHV 042 представляет собой рекомбинантный вирус герпеса кошек, экспрессирующий пять чужеродных генов. Гомологичный вектор, обозначенный 957-87.А1, конструировали следующим образом: гены кошачьих CD80 и CD86 экспрессировали в бицистронном ДНК-кластере под контролем предраннего промотора цитомегаловируса (CMV IE), инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания. Ген β-глюкуронидазы E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и β-глюкуронидазы встраивали в уникальную длинную область FHV в уникальном EcoRI-сайте, происходящем от неполного SalI-фрагмента Н FHV, между генами gL и смежными генами активатора транскрипции. В качестве родительского вируса использовали S-FHV-018, который содержит ген оболочки FeLV, стимулированный IE CMV, и ген β-галактозидазы E.coli, находищийся под контролем промоторного элемента псевдорадивируса дХ; оба этих гена локализованы в уникальном коротком сайте (US) делеции gЕ FHV.
S-FHV 042 был получен из S-FHV 018. Это было осуществлено с использованием гомологичного вектора 987-57.А1 и вируса S-FHV 018, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки зеленых/синих бляшек получали рекомбинантный вирус S-FHV 042. S-FHV 042 анализировали на экспрессию env FeLV, маркерных генов β-глюкуронидазы и β-галактозидазы с помощью анализа на образование черных бляшек. Было определено, что 100% бляшек, генерированных в клетках CRFK, экспрессировали β-глюкуронидазу и β -галактозидазу. Экспрессия env FeLV была также подтверждена с помощью анализа на образование черных бляшек с использованием мышиного моноклонального антитела против gр70 FeLV (Biodesign, ME). Этот вирус был стабильным после пяти пересевов.
Экспрессию кошачьих CD80 и CD86 и env FeLV подтверждали с помощью Вестерн-блот-аналиэа. Для кошачьих CD80 и CD86 использовали козьи поликлональные антитела против CD80 и CD86 человека (R&D Systems, MN). Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. С использованием мышиного моноклонального антитела против gр70 (Biodesign, ME) была обнаружена полоса 100 кДа env FeLV.
S-FHV 044
S-FHV 044 представляет собой рекомбинантный вирус герпеса кошек, экспрессирующий пять чужеродных генов. Гомологичный вектор, обозначенный 957-87.А1, конструировали следующим образом: гены кошачьего CD80 и кошачьего CD86 экспрессировали в бицистронном ДНК-кластере под контролем предраннего промотора цитомегаловируса (CMV IE), инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES, находящийся между двумя открытыми рамками считывания. Ген β-глюкуронидазы E.coli находится под контролем промотора вируса инфекционного ларинготрахеита gl. Гены CD80, CD86 и β -глюкуронидазы встраивали в уникальную длинную область FHV в уникальном EcoRI-сайте, происходящем от неполного SalI-фрагмента Н FHV, между геном gL и смежным геном активатора транскрипции. В качестве родительского вируса использовали S-FHV-016, который содержит ген gag/протеазы FIV, стимулированный IE CMV (с делецией в девять аминокислот в 5’-конце гена протеазы), и ген β-галактозидазы E.coli, который находится под контролем промотора псевдорадивируса дХ; где оба эти гена локализованы в уникальном коротком сайте (US) делеции gЕ FHV.
S-FHV 044 был получен из S-FHV 016. Это было осуществлено с использованием гомологичного вектора 987-57.А1 и вируса S-FHV 016, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус FHV, экспрессирующий β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки зеленых/синих бляшек получали рекомбинантный вирус S-FHV 044.
S-FHV 044 анализировали на экспрессию gag FIV и маркерных генов β-глюкуронидазы и β-галактозидазы с помощью анализа на образование черных бляшек. С использованием мышиных моноклональных антител (Biodesign, ME) было определено, что 100% бляшек, генерированных в клетках CRFK, экспрессировали оба маркерных гена. Экспрессия gag FIV была также подтверждена с помощью анализа на образование черных бляшек с использованием мышиного моноклонального антитела против gag FIV (Custom Monoclonals, CA). Этот вирус был стабильным после пяти пересевов.
Экспрессию кошачьих CD80 и CD86 и env FeLV подтверждали с помощью Вестерн-блот-анализа. Для кошачьих CD80 и CD86 использовали козьи поликлональные антитела против CD80 и CD86 человека (R&D Systems, MN). Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. С использованием мышиного моноклонального антитела против gag FIV были обнаружены две отдельные полосы размером 50 и 27 кДа, специфичные для gag FIV.
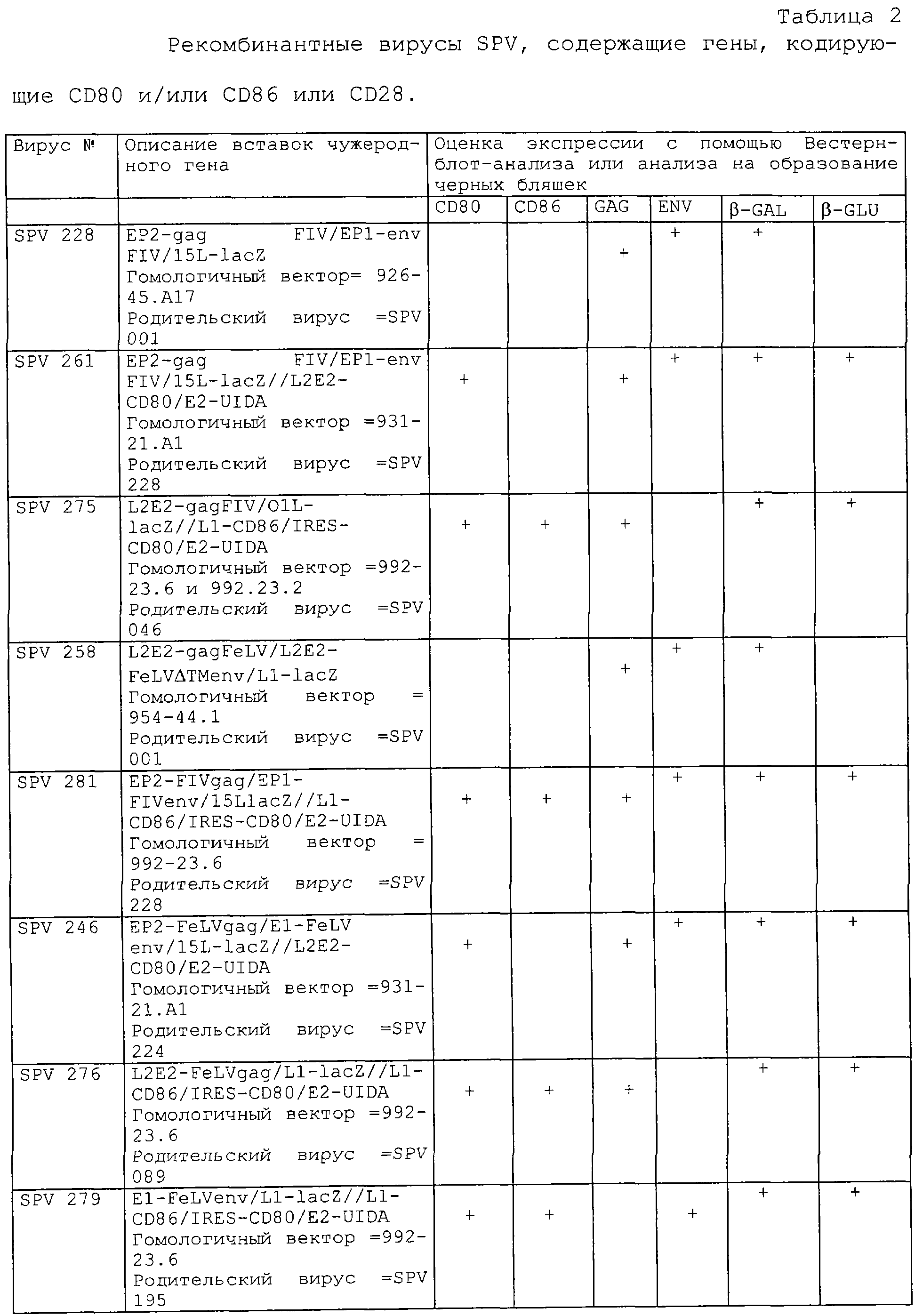




Дополнительные примеры создания ко-векторов, включающих кошачьи CD80 и CD86, и т.п.с неполными или полноразмерными геномами FIV или FeLV
Примечание: Рекомбинантные вирусные векторы, содержащие CD80, CD86, CTLA-4 или CD28 в рекомбинантном вирусе с неполным или полноразмерным геномным полипептидом FIV и/или FeLV, и с генами кошачьих IL-12 р35 и р40 или без них. Эти рекомбинантные вирусы могут быть использованы в качестве вакцин против болезней, вызываемых FIV и FeLV у кошек.
1. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней, содержащем полный или неполный геном FIV.
2. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном кошачьем вирусе герпеса, содержащем полный или неполный геном FIV.
3. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов, содержащем полный или неполный геном FIV.
4. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней, содержащем полный или неполный геном FeLV.
5. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном кошачьем вирусе герпеса, содержащем полный или неполный геном FeLV.
6. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов, содержащем полный или неполный геном FeLV.
7. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней, содержащем полный или неполный геном FIV и гены кошачьих IL-12, GM-CSF, р35 и р40.
8. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном кошачьем вирусе герпеса, содержащем полный или неполный геном FIV и гены кошачьих IL-12, GM-CSF, р35 и р40.
9. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов, содержащем полный или неполный геном FIV и гены кошачьих IL-12, GM-CSF, р35 и р40.
10. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы свиней, содержащем полный или неполный геном FeLV и гены кошачьих IL-12, GM-CSF, p35 и р40.
11. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном кошачьем вирусе герпеса, содержащем полный или неполный геном FeLV и гены кошачьих IL-12, GM-CSF, p35 и р40.
12. Экспрессия кошачьих CD80, CD86, CD28 и CTLA-4, взятых отдельно или в любой комбинации, в рекомбинантном вирусе оспы енотов, содержащем полный или неполный геном FeLV и гены кошачьих IL-12, GM-CSF, p35 и р40.

Примеры
Гомологичный вектор 1007-70.A2 (SPV N/CMV-геном FIV(ΔLTR)/15L-lacZ). Гомологичный вектор 1007.70.А2 использовали для встраивания чужеродной ДНК в инсерционный HindIII-сайт N SPV. Он включает маркерный ген β-галактозидазы E.coli и полноразмерный геном FIV (8,5 т.п.о.) без фланкирующих элементов длинных концевых повторов (LTR). Этот кластер был фланкирован ДНК SPV, гомологичной не-основному сайту в HindIII-фрагменте N SPV. С использованием этого гомологичного вектора в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного SPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что маркерный ген (3-галактозидазы находится под контролем конститутивного промотора поксвируса 15L, а геном FIV (ΔLTR) находится под контролем предраннего промотора цитомегаловируса (IE CMV). Этот гомологичный вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.). Геном FIV (ΔLTR) синтезировали путем клонирования с использованием полимеразной цепной реакции. В качестве матрицы для ПЦР служила провирусная ДНК от плазмиды, содержащей полноразмерный вирус PPR FIV. Обратный праймер (5’-ACGCGTCGACCAGCTAACAAGGTAGGAGAGACTCT-3’ 11/23.98BW/3) синтезировался с 5’-конца генома FIV выше от Gag-кодирующей области и вводил уникальный SalI-сайт. Прямой праймер (5’-TCGAGTCGACTTGTGACAGTTCTTAGTCCATAAGC-3’ 11/11/98BW.1) синтезировался с 3’-конца генома FIV ниже 2-го Rev-экзона и вводил уникальный Sall-сайт. Конечный гомологичный вектор, 1007.70.А2, использовали для создания рекомбинантных вирусов, содержащих геном FIV (без LTR) и кошачьи CD80 и CD86, или содержащих геном FIV (минус LTR) и гены кошачьих CD80 и CD86 и кошачьего IL-12, р35 и р40, в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантных SPV, RPV и FHV".
Гомологичный вектор 1005-95.1 (RPV U/CMV-геном FIV(ΔLTR)/15L-lacZ). Плазмиду 1005-95.1 конструировали в целях встраивания чужеродной ДНК в RPV. Эта плазмида вводит геном-ALTR FIV и ген β-глюкуронидазы E.coli, фланкированный ДНК RPV. Выше от этих чужеородных генов находился фрагмент ДНК RPV, состоящий приблизительно из 906 пар оснований. Ниже от этих чужеородных генов находился фрагмент ДНК RPV, состоящий приблизительно из 895 пар оснований. С использованием плазмиды в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV", получали вирус, содержащий ДНК, кодирующую эти чужеродные гены. Следует отметить, что геном-ΔLTR FIV находится под контролем предраннего промотора цитомегаловируса, а ген β-глюкуронизидазы находится под контролем синтетического раннего промотора поксвируса ЕР2. Этот гомологичный вектор был сконструирован с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.) путем присоединения рестрикционных фрагментов из нижеследующих источников к синтетическим ДНК-последовательностям. Этот плазмидный вектор был получен из рестрикционного HindIII-фрагмента плазмиды pSP64 (Promega), имеющего приблизительно 2999 пар оснований. Фрагмент 1 представляет собой рестрикционный HindIII-XbaI-суб-фрагмент рестрикционного HindIII-фрагмента U RPV, имеющий приблизительно 906 пар оснований (Knight et al.). Фрагмент 2 представляет собой 8,5 т.п.о.-SalI-фрагмент генома FIV без элементов LTR, и был синтезирован путем клонирования с помощью полимеразной цепной реакции (ПЦР). В качестве матрицы для ПЦР служила провирусная ДНК от плазмиды, содержащей полноразмерный вирус PPR FIV. Обратный праймер (5’-ACGCGTCGACCAGCTAACAAGGTAGGAGAGACTCT-3’ 11/23.98BW/3) синтезировался с 5’-конца генома FIV выше от Gag-кодирующей области и вводил уникальный SalI-сайт. Прямой праймер (5’-TCGAGTCGACTTGTGACAGTTCTTAGTCCATAAGC-3’ 11/11/ 98BW.1) синтезировался с 3’-конца генома FIV ниже 2-го Rev-экзона и вводил уникальный SalI-сайт. Фрагмент 3 представляет собой фрагмент размером приблизительно 2,0 т. п.о., содержащий ген β-глюкуронидазы E.coli. Фрагмент 4 представляет собой рестрикционный HindIII-XbaI-субфрагмент рестрикционного HindIII-фрагмента U RPV, имеющий приблизительно 895 пар оснований. Конечный гомологичный вектор 1005.95.1 использовали для создания рекомбинантных вирусов, содержащих геном FIV (ΔLТР) и гены кошачьих CD80 и CD86, или для создания рекомбинантных вирусов, содержащих геном (ΔLTR) FIV и гены кошачьих CD80 и CD86 и кошачьего IL-12, р35 и р40, в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантных SPV, RPV и FHV".
Гомологичный вектор 1016-74.А6 (FHVΔgE/CMV-геном FIV-ΔLTR/gX-lacZ). Гомологичный вектор 1016-74.А6 конструировали для делетирования части gЕ-кодирующей области вируса герпеса кошек и встраивания чужеродной ДНК. Он включает геном FIV (минус LTR) и ген β -галактозидазы Е.соli, фланкированный ДНК FHV. Геном-ΔLТР FIV находится под контролем промотора цитомегаловируса IE, a ген β-галактозидазы находится под контролем промотора псевдорабивируса gХ. Он был сконструирован из указанных ДНК-источников с использованием стандартной техники рекомбинантных ДНК (Sambrook et al.). Плазмидный вектор был получен из рестрикционного эндонуклеазного Аsр7181-Аsр7181-фрагмента плазмиды pSP18/19, имеющего приблизительно 2958 пар оснований. Фрагмент 1 представляет собой Аsр7181-SmаI-субфрагмент SalI-фрагмента В FHV, имеющий приблизительно 1415 пар оснований. Фрагмент 2 представляет собой SalI-фрагмент (размером приблизительно 8,5 т.п.о.) генома FIV без элементов LTR и был синтезирован путем клонирования с помощью полимеразной цепной реакции. В качестве матрицы для ПЦР служила провирусная ДНК от плазмиды, содержащей полноразмерный вирус PPR FIV. Обратный праймер (5’-ACGCGTCGACCAGCTAACAAGGTAGGAGAGACTCT-3’ 11/23.98BW.3) синтезировался с 5’-конца генома FIV выше от Gag-кодирующей области и вводил уникальный SalI-сайт. Прямой праймер (5’-TCGAGTCGACTTGTGACAGTTCTTAGTCCATAAGC-3’ 11/11/98BW.1) синтезировался с 3’-конца генома FIV ниже 2-го Rev-экзона и вводил уникальный SalI-сайт. Фрагмент 3 представляет собой фрагмент гена β-галактозидазы размером приблизительно 3,5 т.п.о. Фрагмент 4 представляет собой SalI-Asp718I-cyбфpaгмeнт EcoRI-фрагмента Е FHV, имеющий приблизительно 2205 пар оснований. Конечный гомологичный вектор 1016.74.А6 использовали для создания рекомбинантных вирусов, содержащих геном (ΔLTP) FIV и гены кошачьих CD80 и CD86, или для создания рекомбинантных вирусов, содержащих геном (ALTR) FIV и гены кошачьих CD80 и CD86 и кошачьего IL-12, р35 и р40 в соответствии с процедурой, описанной в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантных SPV, RPV и FHV".
SPV 288
SPV 288 представляет собой рекомбинантный вирус оспы свиней, экспрессирующий полноразмерный комплемент ОРС, содержащихся в геноме FIV, и четыре дополнительных чужеродных гена. SPV 288 был получен из SPV 282. SPV 282 содержит ген кошачьего CD86 и кошачьего CD80, экспрессированные в бицистронном ДНК-кластере под контролем синтетического позднего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания; и ген β-глюкуронидазы E.coli, находящийся под контролем синтетического раннего промотора ЕР2 в геномном HindIII-фрагменте К SPV. Гомологичный вектор 992-23.6 использовали для конструирования SPV 282, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантных SPV, RPV и FHV". Гены CD80 и CD86 и ген β -глюкуронидазы E.coli встраивали в отдельный и неосновной неполный HindIII-фрагмент К SPV. Геном CMV-FIV и гены β-галактозидазы встраивали в отдельный и не-основной неполный HindIII-фрагмент N SPV.
SPV 288 получали из SPV 282. Это было осуществлено с использованием гомологичного вектора 1007-70.А2 (см.выше) и вируса SPV-282, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β -галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус SPV 288.
SPV 288 анализировали на экспрессию гена gag FeLV, гена оболочки FeLV из генома FIV и маркерных генов β-галактозидазы и β-глюкуронидазы с помощью анализа на образование черных бляшек. С использованием козьего поликлонального антитела против gag FeLV (BioDesign, ME) и мышиного моноклонального антитела против оболочки FeLV, gp70 (BioDesign, ME), было определено, что 100% бляшек, генерированных в клетках ESK-4, инфицированных очищенным SPV 280, экспрессировали ген gag FeLV и ген оболочки FeLV.
Экспрессию кошачьих CD80 и CD86 подтверждали с помощью Вестерн-блот-анализа с использованием козьих поликлональных антител против CD80 и CD86 человека (R&D Systems, MN), соответственно. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы представляли картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" SPV в клетках ESK-4. Экспрессию белков, кодированных в геноме FIV, подтверждали посредством Вестерн-блот-анализа с использованием кошачьей сыворотки от FIV-инфицированных кошек.
FHV 054
FHV 054 представляет собой рекомбинантный вирус герпеса кошек, экспрессирующий полноразмерный комплемент ОРС, содержащихся в геноме FIV, и 2 дополнительных чужеродных гена. Гомологичный вектор, обозначенный 1016-75.B1 конструировали в целях встраивания генома (ΔLTR) FIV и гена β-галактозидазы в уникальный длинный неполный SalI-фрагмент Н FHV. Вставку встраивали между геном gL и смежным геном активатора транскрипции. Геном FIV находится под контролем промотора IE CMV, а ген β-галактозидазы E.coli находится под контролем промоторного элемента псевдорабивируса gХ.
FHV 054 был получен из FHV 30, содержащего ген кошачьего CD80 в сайте делетированного gЕ FHV. Это было осуществлено с использованием гомологичного вектора 1016-75.B1 и вируса FHV 030, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Методы скрининга на рекомбинантный вирус FHV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 054.
FHV 054 анализировали на экспрессию гена β-галактозидазы с помощью анализа на образование черных бляшек. С использованием мышиного моноклонального антитела (Biodesign, ME) было определено, что 100% бляшек, генерированных в клетках CRFK, инфицированных вирусом FHV 054, очищенным методом бляшек, экспрессировали ген β-галактозидазу. Было определено, что этот вирус является стабильным, по крайней мере, после 5 пересевов.
Экспрессию кошачьих CD80, gag FIV и оболочки FIV подтверждали с помощью Вестерн-блот-анализа с использованием поликлональных антител против CD80 человека (R&D Systems, MN), мышиных моноклональных антител против gag FIV (Custom Monoclonals, CA), мышиных моноклональных антител против оболочки FIV (Biodesign). Экспрессию полноразмерных комплементов генов FIV, присутствующим в геноме, подтверждали с помощью Вестерн-блот-анализа с использованием сыворотки от выздоравливающих FIV-инфицированных кошек.
FHV 055
FHV 055 представляет собой рекомбинантный вирус герпеса кошек, экспрессирующий полноразмерный комплемент ОРС, содержащихся в геноме FIV, и 3 дополнительных чужеродных гена. Гомологичный вектор, обозначенный 1016-75.B1, конструировали в целях встраивания генома (ALTR) FIV и гена β-галактозидазы в уникальный длинный неполный SalI-фрагмент Н FIV. Вставку встраивали между геном gL и смежным геном активатора транскрипции. Геном FIV находится под контролем промотора IE CMV, а ген β-галактозидазы E.coli находится под контролем промоторного элемента псевдорабивируса gХ.
FHV 055 был получен из FHV 041, содержащего ген кошачьего CD86 и ген β-глюкуронидазы в сайте делетированного gЕ FHV. Ген кошачьего CD86 находится под контролем промотора gЕ FHV, а ген β-глюкуронидазы находится под контролем промотора псевдорабивируса gХ. Это было осуществлено с использованием гомологичного вектора 1016-75.B1 и вируса FHV 041, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходные материалы для трансфекции скринировали, как описано в разделе "Методы скрининга на рекомбинантный вирус FHV, экспрессирующий β-галактозидазу (анализы X-BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус FHV 055.
FHV 055 анализировали на экспрессию β-галактозидазы и β-глюкуронидазы с помощью анализа на образование черных бляшек. С использованием мышиного моноклонального антитела (BioDesign, ME) и кроличьего поликлонального антитела (Molecular Probes, OR) было определено, что 100% бляшек от клеткок CRFK, инфицированных вирусом FHV 055, очищенным методом бляшек, экспрессировали β -галактозидазу и β-глюкуронидазу, соответственно. Было определено, что этот вирус является стабильным, по крайней мере, после 5 пересевов.
Экспрессию кошачьих CD80, gag FIV и оболочки FIV подтверждали с помощью Вестерн-блот-анализа с использованием поликлональных антител против CD86 человека (R&D Systems, MN), мышиных моноклональных антител против gag FIV (Custom Monoclonals, CA) и мышиного моноклонального антитела против оболочки FIV (BioDesign). Экспрессию полноразмерного комплемента генов FIV, присутствующим в геноме, подтверждали с помощью Вестерн-блот-анализа с использованием сыворотки от выздоравливающих FIV-инфицированных кошек.
RPV-055
RPV-055 представляет собой рекомбинантный вирус оспы енотов, экспрессирующий полнораэмерный комплемент ОРС, содержащихся в геноме FIV, и 4 дополнительных чужеродных гена. RPV 055 был получен из RPV-045, содержащего ген кошачьего CD86 и ген кошачьего CD80, экспрессированные в бицистронном ДНК-кластере под контролем синтетического позднего промотора поксвируса LP1, инициирующего транскрипцию CD80 и CD86 и включающего элемент EMCV IRES между двумя открытыми рамками считывания; и ген β-глюкуронидазы E.coli, находящийся под контролем синтетического раннего промотора ЕР2 в геномном неполном HindIII-фрагменте N RPV. Гомологичный вектор 1005-95.1 использовали для конструирования RPV 055, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантных SPV, RPV и FHV".
Гены CD80 и CD86 и ген β-галактозидазы E.coli встраивали в отдельный и не-основной неполный HindIII-фрагмент N RPV. Геном CMV-FIV и ген β-глюкуронидазы встраивали в отдельный и неосновной неполный HindIII-фрагмент U RPV.
RPV 055 был получен из RPV 045. Это было осуществлено с использованием гомологичного вектора 1005-95.1 и вируса RPV 045, как описано в разделе "Процедура гомологичной рекомбинации для генерирования рекомбинантного RPV, SPV или FHV". Исходный материал для трансфекции скринировали, как описано в разделе "Скрининг на рекомбинантный вирус SPV, экспрессирующий β-галактозидазу (анализы BLUOGAL и CPRG) или β-глюкуронидазу (анализ X-GLUC)". В результате многократных циклов очистки синих/зеленых бляшек получали рекомбинантный вирус RPV 055.
RPV 055 анализировали на экспрессию генов gag FeLV, оболочки FeLV из генома FIV и маркерных генов β-галактозидазы и β-глюкуронидазы с помощью анализа на образование черных бляшек. С использованием козьего поликлонального антитела против gag FeLV (BioDesign, ME) и мышиного моноклонального антитела против оболочки FeLV, gp70, (BioDesign, ME) было определено, что 100% бляшек, генерированных из клеток VERO, инфицированных очищенным вирусом RPV 055, экспрессировали ген gag FeLV и оболочки FeLV (BioDesign, ME).
Экспрессию кошачьего CD80 и кошачьего CD86 подтверждали с помощью Вестерн-блот-анализа с использованием козьих поликлональных антител против CD80 и CD86 человека (R&D Systems, MN), соответственно. Было обнаружено множество полос размером от 30 до 60 кДа, специфичных для кошачьего CD80, и множество полос размером от 40 до 70 кДа, специфичных для кошачьего CD86. Эти полосы представляли картину чередующегося и множественного гликозилирования CD80 и CD86, экспрессированных в "контексте" RPV в клетках VERO. Экспрессия белков, кодируемых в геноме FIV, была подтверждена с помощью Вестерн-блот-анализа с использованием кошачьей сыворотки от FIV-инфицированных кошек.
БИБЛИОГРАФИЯ
1. Argyle, et al., DNA Seg. 5, 169-171 (1995).
2. Azuma, M., et al., J. Immunology 149, 1115-1123 (1992).
3. Azuma, M., et al., Nature 366, 76-79 (1993).
4. Chambers, et al., Current Opinion in Immunology 9, 396-404. (1997).
5. Chen, et al., J. Immunology 148, 2617-2621 (1992).
6. Chen, et al.. Cell 71, 1093-1102 (1992).
7. Donnelly JJ, et al., Annu Rev Immunol 1997; 15: 617-648.
8. Freeman, et al., J. Immunology 143, 2714-2722 (1989).
9. Freeman, et al., J. Exp. Med. 174, 625-631 (1991).
10. Gimmi, et al., Proc. Natl. Acad. Sci. USA 88, 6575-6579 (1991).
11. Hathcock. et al., J. of Exp. Med. 180, 631-640 (1994).
12. Hassett and Whitton, Trends Microbiol 1996; 4: 307-312.)
13. Linsley, et al., Proc. Natl. Acad. Sci. USA 87, 5031-5035 (1990).
14. Jenkins, et al., J. Immunology 147, 2461-2466 (1991).
15. Onions et al., PCT Inti. Application WO 96/03435, Q-One Biotech, 8 February 1996.
16. Riley, et al., J. Immunology 158, 5545-5553 (1997).
17. Tsuji, et al., Eur J Immunology 27(3), 782-787 (1997).
18. PCT International Application WO 92/00092, Bristol Myers Squibb.
19. PCT International Application WO 92/15671, Cytomed, Inc. 17 September 1992.
20. PCT International Application WO 93/00431, Bristol Myers Squibb, 7 January 1993.
21. Akeson, A.L. and Woods, C.W. (1993). A fluorometric assay for the quantitation of cell adherence to endothelial cells. J. Immunol. Meth. 163, 181-185.
22. Allison, J.P. and Lanier L. (1987). The structure, serology, and function of the T-cell antigen receptor. Annu. Rev. Immunol. 5, 503-540.
23. Allison, J.P. (1994). CD28-B7 interaction in T-cell activation, Current Opinion Immunol. 6, 414-419.
24. Anderson, P., Morimoto, С., Breitmeyer, J.B., Schlossman, S.F. (1988). Regulatory interactions between members of the immunoglobulin superfamily. Immunol Today 9, 199-203.
25. Antonia, S.J., Munoz,-Antonia, Т., Soldevila, G., Miller, J., Flavell, R.A. (1995). B7-1 expression by a non-antigen presenting cell- derived tumor. Can. Res. 55, 2253-2256.
26. Arima, T., Rehman, A., Hickey, W., Flye, M. (1996).
Inhibition by CTLA-4Ig of experimental allergic encephalomyelitis. J. Immunol. 156, 4917-4924.
27. Arruffo, A. and Seed, В. (1987). Molecular cloning of a CD28 cDNA by a COS cell expression system. Proc. Nat. Acad. Sci. USA 84, 8573-8577.
28. Asjo, В., Cefai, D., Debre, P., Dudoit, Y., Autran, B. (1993). A novel mode of human immunodeficiency virus type 1 (HIV-1) activation: ligation of CD28 alone induces HIV-1 replication in naturally infected lymphocytes. J. Virol. 67, 4395-4398.
29. Azuma, M., Cayabyab, M., Buck, M., Phillips, J.H., Lanier, L.L. (1992). Involvement of CD28 in MHC unrestricted cytotoxicity mediated by a human killer leukaemic cell line. J. Immunol. 149, 1115-1123.
30. Azuma, M., Yssel, H., Phillips, J.H., Spits, H., Lanier, L.L., (1993b) Functional expression of B7/BB1 on activated T-lymphocytes. J. Exp. Med. 177, 845-850.
31. Azuma, M., Cayabyab, M., Phillips, J.H., Lanier, L.L. (1993с). Requirements for CD28-dependant Т cell-mediated cytotoxicity. J. Immunol. 150, 2091-2101.
32. Bajorath, J., Stenkamp, R., Aruffo, A. (1993). Knowledge based protein modeling: concepts and examples. Prot. Sci. 2.1798-1810.
33. Bajorath, J.. Peach, R., Linsley, P.S. (1994). Immunoglobulin fold characteristics of B7-1 (CD80) and B7-2 (CD86). Prot. Sci. 3, 2148-2150.
34. Balazano, С., Buonavista, N.. Rouvier, E., Goistein, Р. (1992) CTLA-4 and CD28: similar proteins, neighboring genes. Int. J. Can. Suppi. 7, 28-32.
35. Barcy, S., Wettendorf, M., Leo, 0., Urbain, J., Kruger, M., Ceuppens, J.L., de Boers, M. (1995). FcR crosslinking on monocytes results in impaired Т cell stimulatory capacity. Int. Immunol. 7, 179-189.
36. Beale, D. (1985). A comparison of the amino acid sequences of the extracellular domains of the immunoglobulin superfamily. Possible correlations between conservancy and conformation. Comp Biochem Phvsiol. 80, 181-194.
37. Bellone, M., lezzi, G., Manfredi, A.A., Protti, M.P., Dellabona, P., Casorati, G., Rugarii, C. (1994). In vitro priming of cytotoxic Т lymphocytes against poorly immunogenic epitopes by engineered antigen presenting cells. Eur. J. Immun. 24, 2691-2698.
38. Berke, G. (1993). The functions and mechanisms of action of cytolytic lymphocytes. In "Fundamental Immunology," (W. Paul), pp. 965-1014. New York: Raven Publ. 3rd ed.
39. Berke, G. (1994). The binding and lysis of targeT-cells by cytotoxic lymphocytes. Annu. Rev. of Immunol. 12, 735-773.
40. Boise, L.H., Minn, A.J., Noel, P.J., June, C.H., Accavitti, M., Lindstein, Т., Thompson, C.B. (1993). CD28 costimulation can promote Т cell survival by enhancing the expression of Bcl-xL. Immunity 3, 87-89.
41. Brinchmann, J.E., Doblung, J.H., Heger, B.H., Haaheim, L.L., Sannes, M., Egeland, T. (1994). Expression of costimulatory molecule CD28 on T-cells in human immunodeficiency virus type l infection: functional and clinical coorelations. J. Inf Pis. 169, 730-738.
42. Brown, W.C., Bissey, L., Logan, K.S., Pedersen, N.C., Elders, J.H., Collisson, E.W. (1991). Feline immunodeficiency virus infects both CD4+ and CD8+ T-Ivmphocvtes. -J. of Virol. 62, 3359- 3364.
43. Buck, С.А. (1992). Immunoglobulin Superfamily: structure function and relationship to other receptor molecules. Semin. Cell Biol. 3, 179-188.
44. Buelens, С., Willems, P.. Delvaux, A., Pierard, G., Delville, J.P., Velu, Т., Goldman, M. (1995). Interleukin 10 differentially regulates B7-1 (CD80) and В 7-2 (CD86) expression on human peripheral blood dendritic cells. Eur. J. Immunol. 25, 2668-2675.
45. Caruso, A., Cantalamessa, A., Licenziati, S., Peroni, L., Prati, E., Martinelli, F., Canaris, A.D., Folghera, S., Goria, R., Balsari, A. (1994). Expression of CD28 on CD8+ and CD4+ lymphocytes during HIV infection. Scan. J. Immunol. 40, 485-490.
46. Cerdan, С., Martin, Y., Brailly, H., Courcoul, M., Flavetta, S., Costello, R., Mawas, C., Birg, P., Olive, D. (1991). IL-1 is produced by T lymphocytes activated via the CD2 plus CD28 pathways. J. Immunol. 146, 560-564.
47. Chen, L., Linsley, P.S., Hellstrom, K.E. (1993). Costimulation of T cells for tumor immunity. Immunol. Today 14, 483-486.
48. Chesnut, R.W. and Grey, H.M. (1986). Antigen presentation by В cells and its significance in T-B interactions. Adv. Immunol. 39, 51-59.
49. Clark, S.J., Saag M.S., Decker, W.D., Campbell, H.S., Roberson, J.L., Veldkamp, P.J. (1991). High titers of cytopathic virus in plasma of patients with symptoms of primary HIV-l infection. N. Eng. J. Med. 324, 954-960.
50. Clayberger, С., Lyu, S.C., DeKruyff, R., Parham, P., Krensky, A.M. (1994). Peptides corresponding to the CDS and CD4 binding domains of HLA molecules block T-lymphocyte immune responses in vitro. J. Immunol. 153, 946-951.
51. Clevers, H., Alarcon, В., Wileman, Т., Terhorst, С. (1988). The T-cell receptor-CDB complex: A dynamic protein ensemble. Annu. Rev. Immunol. 6, 629-662.
52. Connor, R.I., Mohri, H., Cao, Y., Ho, D.D. (1993). Increased viral burden and cyfcopathicity correlate temporally with CD4+T- lymphocyte decline and clinical progression in human immunodeficiency virus type l-infected individuals. J Virol. 67, 1772-1777.
53. Cooper, D.A., Tindall, В., Wilson, E.J., Imreie, A.A., Penny, R. (1988). Characterization of T-lymphocyte responses during primary infection with human immunodeficiency virus. J, Inf. Pis. 157, 889-896.
54. Damie, N.K., Doyle, L.V., Grossmaire, L.S., Ledbetter, J.A. (1988). Differential regulatory signals delivered by antibody binding to the CD28 molecule during the activation of human Т lymphocytes. J. Immunol. 140, 1753-1761.
55. Damie, N.K., Klussman, K., Leytze, G., Martial, S., Arruffo, A., Ledbetter, J.A., Linsiey, P.S. (1994). Costimulation of lymphocytes with integrin ligands ICAM-1 or VCAM-1 induces fuctional expression of CTLA-4 a second receptor for B7. J. Immunol. 152, 2686-2697.
56. Davis, M.M. and Bjorkman, P.К. (1988). T-cell antigen receptor genes and T-cell recognition. Nature 334, 395-402.
57. de Boer, M., Kasran, A., Kwekkeboom, J., Walter, H., Vandenberghe, P., Ceuppens, J.L. (1993). Ligation of B7 with CD28/CTLA-4 on T-cells results in CD40 ligand expression, interleukin-4 secretion and efficient help for antibody production by В cells. Eur. J. Immunol. 23, 3120-3125.
58. deWaal Malefyt, R., Yssel, H., de Vries, J.E. (1993). Direct effects of IL-10 on subsets of human CD4+ Т cell clones and resting Т cells. Specific inhibition of 11-2 production and proliferation. J. Immunol. 150, 4754-4765.
59. Ding, L., Linsiey, P.S., Huang, L.Y., Germain, R.N., Shevach, E.M. (1993). IL-10 inhibits macrophage costimulatory activity by selectively inhibiting up regulation of B7 expression. J. Immunol. 151, 1224-1234.
60. Driscoll, P.C., Cyster, J., Campbell, I., Williams, A. (1991). Structure of domain 1 of rat T-lymphocyte CD2 antigen. Nature 353, 762-765.
61. Ellis, J.H., Burden, M., Vinogradov, D., Linge, C., Crowe, J. (1996). Interactions of CD80 and CD86 with CD28 and CTLA-4. J. Immunol. 155, 2700-2709.
62. Englehard, V.H. (1994). Structure of peptides associated with MHC class I molecules. Curr. Qp. Immunol. 6, 13-21.
63. English, R.V., Nelson, P., Johnson, C.M., Nasisse, M., Tompkins, W.A., Tompkins, M.B. (1994). Development of clinical disease in cats experimentally infected with feline immunodeficiency virus. J. Inf. Pis. 170, 543-552.
64. Fauci, A.S. and Dale, D.C. (1975). The effect of hydrocortisone on the kinetics of normal human lymphocytes. Blood 46, 235-243.
65. Fauci, A., Macher, A., Longo, D., Lane, H., Rook, A., Masur, H., Gelmann, E. (1984). Aquired immunodeficiency syndrome: epidemiological, clinical, immunological and therapeutic considerations. Ann. Int. Med. 100, 92-106.
66. F.A. Ferrari, et al., Journal of Bacteriology (1985) 161, 556-562.
67. Fong, T.A. and Mosmann, T.R. (1990). Alloreactive murine CD8+ T cell clones secrete the Thi pattern of cytokines. J Immunol. 144, 1744-1752.
68. Fouchier, R.A., Meyaard, L., Brouwer, M., Hovenkamp, E., Schuitemaker, H. (1996). Broader tropism and higher cytopathicity for CD4+ T-cells of asyncytium-inducing compared to a non-syncytium-indue ing HIV-1 isolate as a mechanism for accelerated CD4+ T cell decline in vivo. Virology 219, 87-95.
69. Freedman, A.S., Freeman, G., Horowitz, J.C., Daley, J., Nadler, L.M. (1987). A B-cell restricted antigen that identifies preactivated В cells. J. Immunol. 139, 3260-3267.
70. Freeman G.J., Borriello, F., Hodes, R.J., Reiser, H., Hathcock, K.S., Laszlo, G., McKnight, A.J., Kim. J., Du, L., Lombard, D.B., Gray, G.S., Nadler, L.M., Sharpe, A.H. (1993). Uncovering a functional alternative CTLA-4 counter receptor in B7-1 deficient mice. Science 262, 907-909.
71. Gajewski, Т. F.. Schell, S.R., Nau, G., Fitch, F. W. (1989). Regulation of T-cell activation: Differences among T-cell subsets. Immunol Rev. Ill, 79-110.
72. Germain, R.N. (1993). The Biochemistry and cell biology of antigen processing and presentation. Annu. Rev. Immunol. 11, 403-450.
73. Haffar, O.K., Smithgall, M.D., Bradshaw, J., Brady, W., Damie, N.K., Linsley, P.S. (1993). Costimulation of T-cell activation and virus production by B7 antigen on activated CD4+ T-cells from human immunodeficiency virus type 1-infected donors. Immunolocr у 90, 11094-11098.
74. Harlan, D.M., Abe, R., Lee, K.P., June, C.H. (1995). Potential roles of the B7 and CD28 receptor families in autoimmunity and immune evasion. Clin. Immunol. Immunopath. 75, 99-111.
75. Hodge, J.W., Abrami, S., Schlom, J., Kantor, J.A. (1994). Induction of antitumor immunity by recombinant vaccinia viruses expressing B7-1 or B7-2 costimulatory molecules. Can. Res. 54, 5552-5555.
76. Hutchcroft, J.E. and Bierer, B.E. (1996). Signaling through CD28/CTLA-4 family receptors. J. Immunol. 155, 4071-4074.
77. M.A. Innis, et al., PCR Protocols: A Guide to Methods and Applications. Academic Press, Inc., San Diego (1990).
78. Jenkins, M.K., Pardoll, D.M., Mizuguchi, J., Quill, H., Schwartz, R.H. (1987). Т cell responsiveness in vivo and in vitro: Fine specificity of induction and molecular characterisation of the unresponsive state. Immunol. Rev. 95, 113-135.
79. June, C.H., Ledbetter, J.H., Linsley, P.S., Thompson, C.B. (1990). Role of the CD28 molecule in T-cell activation. Immunol. Today 11, 211-216.
80. June, C.H., Bluestone, J.A., Nadler, L.M., Thompson, C.B. (1994). The B7 and CD28 receptor families. Immunol. Today 12, 321-333.
81. Knight, J.C., et al., (1992), Virology 190, 423-433.
82. Kozber, D., Moretta, A., Messner, H.A., Moretta, L., Croce, C.M. (1987). Tp44 molecules involved in antigen-independant Т cell activation are expressed on human plasma cells. J. Immunol. 138, 4128-4132.
83. Kupfer, A. and Singer, S.J. (1989). Cell biology of cytotoxic and helper T-cell functions. Annu. Rev. Immunol. 7, 309-337.
84. Landay, A.L., Mackewicz, C.E., Levy, J.A. (1993). An activated CD8+ Т cell phenotype coorelates with an anti-HIV activity and as symptomatic clinical status. Clin Immun. Immunopath. 69, 106-116.
85. Lane, P., Burdet, С., Hubele, S., Scheidegger, D., Muller, U., McConnell, P., Kosco-Vilbois, M. (1994). В cell function in mice transgenic for mCTLA4-H gamma 1: lack of germinal centers correlated with poor affinity maturation and class switching despite normal priming of CD4+ T-cells. J Exp Med. 179, 819-830.
86. Lanier, L.L., O’Fallon, S., Somoza, C., Phillips, J.H., Linsley, P.S., Okumura, K., Ito, D., Azuma, M. (1995). CD80 (B7) and CD86 (B70) provide similar costimulatory signals for Т cell proliferation, cytokine production, and generation of CTL. J. Immunol. 154, 97-105.
87. Larsen, С.P., Ritchie, S.C., Pearson, Т.C., Linsley, P.S., Lowry, R.P. (1992). Functional expression of the costimulatory molecule B7/BB1 in murine dendritic cell populations. J. exp. Med. 176, 1215-1220.
88. Leahy, D., Axel, R., Hendrickson, W. (1992). Crystal structure of a soluble form of human Т cell counter receptor CD8 at 2.8 resolution. Cell 68, 1145-1162.
89. Lechler, R.I., Lombardi, G., Batchelor J.R., Reinsmoen N., Bach, F.H. (1990). The molecular basis of alloreactivity. Annu. Rev. Immunol. 10, 83-88.
90. Lenschow, D.J., Su, G.H-T., Zuckermann, L.A., Nabavi, N., Jellis, C.L., Gray, G.S., Miller, J., Bluestone, J.A. (1993). Expression and functional significance of an additional ligand for CTLA-4. Proc. Nat. Acad. Sci. USA. 90, 11054-11058.
91. Lenschow, D.J., Walunas, T.L., Bluestone, j.a. (1996). CD28/B7 system of Т cell costimulation. Annu. Rev. Immunol. 14 233- 258.
92. Leung, H.T. and Linsley, P.S. (1994). The CD28 costimulatory pathway. The rap. Immunol 1, 217-228.
93. Lewis, D.E., Ng Tang, D.S., Adu-Oppong, A., Schober, W., Rodgers, J. (1994). Anergy and apoptosois in CD8+ T-cells from HIV infected persons. J. Immunol. 153, 412-420.
94. Li, Y., McGowan, P., Hellstrom, I., Hellstrom, K.E., Chen, L.(1994). Costimulation of tumor reactive CD4 and CDS T-lymphocytes by B7 a natural ligand for CD28 can be used to treat established mouse melanoma. J. Immunol. 153, 421-428.
95. Lindsten, Т., Lee, К.Р., Harris, E.S., Petryniak, В., Craighead, N., Reynolds, P.J., Lombard, D.B., Freeman, G.J., Nadler, L.M-, Gray, G.S. (1993). Characterization of CTLA-4 structure and expression on human T-cells. J. Immunol. 151, 3489-3499.
96. Linsley, P.S., Brady, W., Urnes, M., Grosmaire, L.S., Damie, N.K., Ledbetter, J.A. (1991a). Binding of the B-cell activation antigen B7 to CD28 eostimulates T-cell proliferation and Interleukin-2 mRNA accumulation. J. Exp. Med. 173, 721-730.
97. Linsley, P.S., Brady, W., Urnes, M., Grosmaire, L. S., Damie, N. K., Ledbetter, J. A. (1991b). CTLA-4 is a second receptor for the B-cell activation antigen B7. J. exp. Med. 174, 561-569.
98. Linsley, P. S., Wallace, P.M., Johnson, J., Gibson, M.G., Greene, J.L., Ledbetter, J. A., Singh, C., Tepper, M.A. (1992a). Immunosuppression in vivo by a soluble form of the CTLA-4 Т cell activation molecule. Science 257, 792-795.
99. Linsley, P.S., Greene, J.L., Tan, P., Bradshaw, J.. Ledbetter, J.A., Anasetti, C., Damie, N.K. (1992b). Coexpression and functional cooperation of CTLA-4 and CD28 on activated T-lymphocytes. J. Exp. Med. 176, 1595-1604.
100. Linsley, Р. S. and Ledbetter, J. A. (1993a). The role of CD28 receptor during Т cell responses to antigen. Ann. Rev. Immunol. 11, 191-212.
101. Linsley, P.S., Bradshaw, J., Urnes, M., Grosmaire, L., Thompson, C.B. (1993b). CD28 engagement by B7/BB-1 induces transient down-regulation of CD28 synthesis and prolonged unresponsiveness to CD28 signaling. J. Immunol. 150, 3161- 3169.
102. Linsley, P.S., Greene, J.L., Brady, W., Bajorath, J., Ledbetter, J.A., Peach, R. (1994a). Human B7-1 (CD80) and B7-2 (CD86) bind with similar avidities but distinct kinetics to CD28 and CTLA- 4 receptors. Immunity 1, 793-801.
103. Linsley, P.S., Peach, R., Gladstone, P., Bajorath, J. (1994b). Extending the B7(CD80) gene family. Prot. Sci. 3, 1341-1343.
104. Linsley, P.S., Ledbetter, J., Peach, R., Bajorath, J. (1995a). CD28/CTLA-4 receptor structure, binding stoichiometry and aggregation during Т cell activation. Res. Immunol. 146, 130-140.
105. Linsley, P.S., Nadler, S.G., Bajorath, J., Peach, R., Leung, H.T., Rogers, J., Bradshaw, J., Stebbins, M., Leytze, G., Brady, W., Malacko, A.R., Marquardt, H., Shaw, S. (1995b). Binding stoichiometry of the cytotoxic T-lymphocyte-associated molecule-4 (CTLA- 4). J. Biol. Chem. 270, 15417-15424.
106. Littman, D.R. (1987). The structure of the CD4 and CDS genes. Annu. Rev. Immunol. 5, 561-584.
107. Liu, С.С., Welsh, C.M., Young, J. D-E. (1995). Perforin: Structure and function. Immunol. Today 16, 194-201.
108. Liu, Y., Jones, В., Brady, W., Janeway, C.A., Linsley, P. (1992). Murine CD4 Т cell growth: B7 and heat stable antigen both participate in costimulation. Eur. J. Immunol. 115, 1905-1912.
109. Lombardi, S., Garzelli, С., Pistello, M., Massi, С., Matteucci, D., Baldinotti, F., Cammarota, G., Da Prato, L., Bandecchi, P., Tozzini, F., Bendinelli, M. (1994). A neutralizing antibody-inducing peptide of the V3 domain of feline immunodeficiency virus envelope glycoprotein does not induce protective immunity. J. Virol. 68, 8374-8379.
110. Lu, Y., Granelli-Piperno, A., Bjorndahl, J.M., Phillips, C.A., Trevillyan J.M. (1992). CD28-induced Т cell activation. Evidence for a protein-tyrosine kinase signal transduction pathway. J Immunol. 149, 24-29.
111. Luria, S.E. and Darnell, J.E. (1968). "General Virology." New York: John Willey and Sons, Inc.
112. Lwoff, A. (1957). The concept of virus. J. Gen Microbiol. 17, 239- 253.
113. Maniatis, Т., Fritsch, E.F., and Sambrook, J. (1982). "Molecular Cloning: A Laboratory Manual." New York: Cold Spring Harbor Press.
114. Martin, P.J., Ledbetter, J.A., Morishita, Y., June, C.H., Beatty, P.J., Hansen, J.A. (1986). A 44 kilodalton cell surface homodimer regulates interleukin 2 production by activated human Т lymphocytes. J. Immunol. 136, 3282-3287.
115. Matasumura, M., Fremont, D.H., Peterson, P. A., Wilson, I.A. (1992). Emerging principles for the recognition of peptide antigens by MHC class I molecules. Science 257, 927-934.
116. Mescher, M.F. (1992). Surface contact requirements for activation of cytotoxic T-lymphocytes. J. Immunol. 49, 2402-2405.
117. Minty, A., Chalon, P., Derocq, J.M., Dumont, X., Guillemot, J.C., Kaghad, M., Labit, C., Leplatois, P., Liauzun, P., Miloux, В., Minty, C., Casellas, P., Loison, G., Lupker, J., Shire, D., Ferrara, P., Caput, D., (1993). Interleukin 13 is a new human lymphokine regulating inflammatory and immune responses. Nature 362, 248-250.
118. Moffett, C.W. and Paden, C.M. (1994). Microglia in the rat neurohypophysis increase expression of class I major histocompatibilicy antigens following central nervous system injury. J Neuroimmunol. 50, 139-51.
119. Mosmann, T. and Coffman, R.L. (1989). TH1 and TH2 cells: Different patterns of lymphokine secretion lead to different functional properties. Annu. Rev. Immunol. 7, 145-173.
120. Nabavi, N., Freeman, G.J., Gault, D., Godfrey, G.N., Nadler, L.M., Glimcher. L.M. (1992). Signaling through the MHC CII cytoplasmic domain is required for antigen presentation and induces B7 expression. Nature 360, 266-268.
121. Nagata, S. and Golstein, P. (1995). The Fas death factor. Science 267, 1449-1465.
122. Nickoloff, B.J., Mitra, R.S., Lee, K., Turka, L.A., Greem, J., Thompson, C., Shimizu, Y. (1993). Discordant expression of CD28 ligands BB-1 and B7 on keratinocytes in vitro and psoriatic cells in vivo. Am J. Path. 142, 1029-1040.
123. Novotney, С., English, R., Housman, J., Davidson, M., Nasisse, M., Jeng, C.R. (1990). Lymphocyte population changes in cats naturally infected with feline immunodeficiency virus. AIDS 4, 1213-1218.
124. O’Doherty, U., Steinman, R.M., Peng, M., Cameron, P.U., Gezelter, S., Kopeloff, I., Swiggard, W.J., Pope, M., Bhardwaj, N. (1993). Dendritic cells freshly isolated from human blood express CD4 and mature into typical immunostimulatory dendritic cells after culture in monocyte-conditioned media. J. exp. Med. 178, 1067-1076.
125. Ozawa, H., Aiba, S., Nakagawa, S., Tagami, H. (1995). Interferon gamma and interleukin 10 inhibit antigen presentation by Langerhan’s cells for T helper type 1 cells by suppressing their CD80 (B7-1) expression. Eur. J. Immunol. 26 648-652.
126. Page, С., Thompson, С., Yacoub, M., Rose, M. (1994). Human endothelial stimulation of allogenic T-cells via a CTLA-4 independant pathway. Trans. Immunol. 2, 342-347.
127. Peach, R., Bajorath, J., Brady, W., Leytze, G., Greene, J., Naemura, J., Linsley, P.S. (1994). CDR1 and CDR3-analogous regions in CTLA-4 and CD28 determine the binding to B7-1. J. Exp. Med. 180, 2049-2058.
128. Peach, R., Bajorath, J., Naemura, J., Leytze, G., Greene, J., Aruffo, A., Linsley, P.S. (1995). Both extracellular immunoglobulin-like domains of CD80 contain residues critical for binding T-cell surface receptors CTLA-4 and CD28. J. Biol. Chem. 270, 21181-21187.
129. Pedersen, N.C., Но, Е., Brown, M.L., Yamamoto, J.K. (1987). Isolation of a T lymphotrophic virus from domestic cats with an immunodeficiency like syndrome. Science 235, 790-793.
130. Prasad, K.V., Cai Y.C., Raab, M.,, Duckworth, E., Cantley, L., Shoelson, S.E., Rudd, C.E. (1994). T-cell antigen CD28 interacts with the lipid kinase phosphatidylinositol3-kinase by a cytoplasmic Tyr (P)-Met-Xaa-Met motif. Proc Nati Acad Sci USA. 91, 2834-2838.
131. Radvanyi, L.G.. Shi, Y., Vaziri, H., Sharma, A., Dhala, R., Mills, G.B., Miller, R.G. (1996). CD28 costimulation inhibits TCR-induced apoptosis during a primary T cell response. J. Immunol. 158, 1788-1798.
132. Ranheim, E.A. and Kipps, T.J. (1995). Tumor necrosis factor-alpha facilitates induction of CD80 (B7-1) on human B cells by activated T-cells: complex regulation by IL-4, IL-10, and CD40L. Cell. Immunol. 161, 226-235.
133. Razi-Wolf, Z., Freeman, G., Galvin, P., Benacerraf, В., Nadler, L., Reiser, H. (1992). Expression and function of the murine B7 antigen and the major costimulatory molecule expressed by peritoneal exudate cells. Proc. Nat. Acad. Sci. USA. 89, 4210-4214.
134. Ronchese, F., Hausmann, В., Hubele, S., Lane, P. (1994). Mice transgenic for a soluble form of murine CTLA-4 show enhanced expansion of antigen-specific CD4+ T-cells and defective antibody production in vivo. J. Exp Med. 179, 809- 817.
135. Rotzschke, 0. and Falk, К. (1994). Origin structure and motifs of naturally processed MHC class II ligands. Curr. Op Immunol. 6, 45-51.
136. Russel, J.H. (1983). Internal disintegration model of cytotoxic lymphocyte induced target damage. Immunol. Rev. 72, 97- 118.
137. Sambrook, et al., Molecular Cloning: A Laboratory Manual. Second Edition, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1989).
138. Current Protocols in Molecular Biology (Eds. Aufubel, Brent, Kingston, More, Feidman, Smith and Stuhl, Greene Publ. Assoc., Wiley-Interscience, NY, NY, 1992).
139. Saukkonen, J.J., Kornfield, H., Berman, J.S. (1993). Expansion of a CD8+CD28+ cell population in the blood and lung of HIV- positive patients. JAIDS 11, 1194-1199.
140. Schattner, E. and Laurence, J. (1994). HIV induced T-lymphocyte depletion. Clin. Lab. Med. 14, 221-227.
141. Schmittel, A., Scheibenbogen, С., Keilnolz, U. (1995). Lipopolysaccharide effectively up-regulates B7-1 (CD80) expression and costimulatory function of human monocytes. Scan. J. Immunol. 42, 701-704.
142. Schwartz, R.H. (1992). Costimulation of T-lymphocytes: the role of CD28, CTLA-4 and B7/BB1 in interleukin-2 production and immunotherapy. Cell 71, 1065-1068.
143. Seder, R.A., Germain, R.N., Linsley, P.3., Paul, W.E. (1994). CD28 mediated co-stimulation of IL-2 production plays a critical role in Т cell priming for IL-4 and IFNg production, J. Exn Med. 179, 299-304.
144. Shahinian, A., Pfeffer, К., Lee, К.Р., Kundig, T.M., Kishihara, К., Wakeham, A., Kawai, К., Ohashi, P.S., Thompson, C.B., Mak, T.B. (1993). Differential Т cell costimulatory requirements in CD28 deficient mice. Science 261, 609-612.
145. Sher, A., Gazzinelli, R.T., Oswald, I.P., Clerici, M., Kullberg, M., Pearce, E.J., Berzofsky, J.A., Mosmann, T.R., James, S.L., Morse, H.C. (1992). Role of T-cell derived cytokines in the down regulation of immune responses inparasitic and retroviral infection. Immunol Rev. 127, 183-204.
146. Siebelink, K.H., Chu, I.H., Rimmelzwaan, G.F., Weijer, К., van Herwijnen, H.R., Knell, P. (1990). Feline Immunodeficiency virus (FIV) infection in the cat as a model for HIV infection in man: FIV induced impairment of immune function. AIDS Res. Hum. Retroviruses 6, 1373-1378.
147. Siebelink, K.H., Tijhaar, E., Huisman, R.C., Huisman, W., deRonde, A., Darby, I.H., Francis, M.J., Rimmelzwaan, G.F., Osterhaus, A.D. (1995). Enhancement of feline immunodeficiency virus infection after immunization with envelope glycoprotein subunit vaccines. J Virol. 69, 3704-3711.
148. Singer, S.J. (1992). Intracellular communication and cell:cell adhesion. Science 255, 1671-1674.
149. Smithgall, M.D., Wong, J.G., Linsley, P.S., Haffar, O.K. (1995). Costimulation of CD4+ T-cells via CD28 modulates human immunodeficiency type 1 infection and replication in vitro. AIDS Res. Hu. Retro. 11, 885-892.
150. Springer, Т.А., Dustin, M.L., Kishimoto, Т.К., Marlin, S.D. (1987). The lymphocyte function associated LFA-1, CD2 and LFA-3 molecules: cell adhesion receptors of the immune system. Annu. Rev. Immunol. 5, 223-252.
151. Springer, Т.А. (1990). Adhesion receptors of the immune system. Nature 346, 425-434.
152. Stack, R.M., Lenschow, D.J., Gray, G.S., Bluestone, J.A., Fitch, F.W. (1994). IL-4 treatment of small splenic В cells induces со- stimulatory molecules B7-1 and B7-2. J. Immunol. 152, 5723-5733.
153. Symington, F.W., Brady, W., Linsley, P.S. (1993). Expression and function of B7 on human epidermal Langerhan’s cells. J. Immunol. 150, 1286-1295.
154. Taylor, M.K. and Cohen, J.J. (1992). Cell mediated cytotoxicity. Curr. Opin. Immunol. 4, 338-343.
155. Thomas, R., Davi, L.S., Lipsky, P.E. (1994). Rheumatoid synovium is enriched in mature antigen presenting dendritic cells. J. Immunol. 152, 2613-2623.
156. Townsend, S.E., and Allison, J.P. (1993). Tumor rejection after direct costimulation of CD8+ T-cells by B7 transfected melanoma cells. Science 259, 368-370.
157. Turka L.A., Ledbetter, J.A., Lee, K., June, C.H., Thompson, C.B. (1990). CD28 is an inducible Т cell surface antigen that transduces a proliferative signal in CD3+ mature thymocytes. Tmmunol. 144, 1646-1653.
158. Turka, L.A., Linsley, P.S., Paine, R., Schieven, G.L., Thompson, C.B., Ledbetter, J.A.(1991). Signal transduction via CD4, CD8 and CD28 in mature and immature thymocytes. J. Immunol. 146, 1428-1436.
159. Unanue, E.R. (1984). Antigen presenting function of the macrophage. Annu. Rev. Immunol. 2, 395-428.
160. van Kooten, С., Rensink, I., Pascual, -Salcedo, D., van Oers, R., Aarden, L. (1991). Monokine production by human T-cells: IL-1 alpha production is limited to memory T-cells. J. Immunol. 146, 2654-2658.
161. van Seventer, G.A., Shimizu, Y., Shaw, S. (1991). Roles of multiple accessory molecules in Т cell activation. Curr. Opin Immunol. 3, 294-303.
162. Wang, R., Murphy, K.M., Loh, D.Y., Weaver, C., Russell, J.H. (1993). Differential activation of antigen-stimulated suicide and cytokine production pathways in CD4+ T-cells is regulated by the antigen-presenting cell. J Immunol. 150, 3832-42.
163. Weiss, A. and Littman, D.R. (1994). Signal transduction by lymphocyte antigen receptors. Cell 76, 263-274.
164. Williams, A. and Barclay, A. (1988). The immunoglobulin superfamily-domains for cell surface recognition. Ann. Rev. Immunol. 6, 381-405.
165. Windhagen, A., Newcombe, J., Dangond, P., Strand, C., Woodroofe, M.N., Cuzner, M.L., Hafler, D.A. (1995). Expression of costimulatory molecules B7-1 (CD80), B7-2 (CD86) and interleukin 12 in multiple schlerosis lesions. J. Exp. Med. 182, 1985-1996.
166. Yamamoto, J.K., Hansen, H., Ho, W.E., Morishita, T.Y., Okuda, Т., Sawa, T.R. (1989). Epidemiological and clinical aspects of feline immunodeficiency virus infection in cats from the continental United States and Canada and possible mode of transmission. J.A.V.M.A. 194, 213-220.
167. Yasukawa, M., Inatsuki, A., Kobayashi. Y. (1989). Differential in vitro activation of CD4+CD8- and CD8+CD4- herpes simplex virus-specific human cytotoxic T-cells. J. Immunol. 143, 2051-2057.
168. Yssel, H., Schneider, P.V., Lanier, L.L. (1993). Interleukin 7 specifically induces B7/BB1 antigen on human cord blood and peripheral blood T-cells and Т cell clones. Int. Immunol. 5, 753-759.
169. Zanussi, S., Simonelli, C., D’Andrea, M., Caffau, C., Clerici, M., Tirelli, U., DePaoli, P. (1996). CD8+lymphocyte phenotype and cytokine production in long-term non-progressor and in progressor patients with HIV-1 infection. Clin. Exp. Immunol. 105, 220-224.
170. Zhou, Т., Weaver, С., Linsley, P.S., Mountz, J.D. (1994). T-cells of stapphylococcal enterotoxin B-tolerized autoimmune MRL-Ipr/lpr mice require costimulation through the B7-CD28/CTLA-4 pathway for activation and can be reanergized in vivo by stimulation of the Т cell receptor in the absence of costimulatory signal. Eur. J. Immunol. 24, 1019-1025.


































Реферат
Изобретение относится к биотехнологии. Терапевтический вектор, используемый в терапии инфекционных заболеваний кошек, содержит, по крайней мере, одну чужеродную нуклеиновую кислоту, каждая из которых а) кодирует белок, выбранный из группы, состоящей из белка кошачьего CD28, представленного в SEQ ID NO:8, или его иммуногенной части; из белка кошачьего CD80, представленного в SEQ ID NO:2 или 4, или его иммуногенной части; из белка кошачьего CD86, представленного в SEQ ID NO:6, или его иммуногенной части, или из белка кошачьего CTLA-4, представленного в SEQ ID NO:10, или его иммуногенной части; и в) способна экспрессироваться при введении вектора в соответствующего хозяина. Указанный терапевтический вектор в эффективном количестве используется в составе вакцины против инфекционных болезней кошек для их иммунизации, а также в способах усиления или подавления иммунного ответа у кошек и уменьшения или уничтожения опухоли у кошек. Изобретение позволяет стимулировать активацию и пролиферацию Т-клеток и повысить эффективность борьбы с инфекционными заболеваниями кошек, 8 с. и 33 з.п. ф-лы, 13 ил.

Комментарии