Соматостатиновые пептиды, радиофармацевтическое средство, способ лечения опухолей, фармацевтический состав - RU2156774C2
Код документа: RU2156774C2
Описание
Предметом настоящего изобретения являются соматостатиновые пептиды, способ их получения, содержащие их фармацевтические препараты и их применение в качестве радиофармацевтического средства, например, для радиотерапии опухолей, положительных по соматостатиновым рецепторам.
Радиотерапия опухолей с применением радиоактивных соединений обладает преимуществом, заключающимся в избирательной нацеленности на опухоли и их метастазы, что ограничивает дозу радиации, получаемую нормальной тканью. Радиотерапевтический агент должен быстро накапливаться и хорошо удерживаться в органах-мишенях, например опухолях, и быстро выводиться из кровообращения, с тем чтобы ограничить дозу радиации, получаемую всем организмом. Радиотерапевтический агент, основой которого является радиоактивный металл, способный образовывать хелатные комплексы, должен быть также термодинамически и/или кинетически устойчивым против потери радиоактивного металла. Радиотерапевтический агент, предназначенный для повторного введения, не должен быть иммуногенным.
Описаны [1] соматостатиновые пептиды, несущие, по меньшей мере, одну хелатирующую группу, которая может быть мечена радиоактивным изотопом для in vivo диагностического и терапевтического применения. Эти соединения способны связываться с соматостатиновыми рецепторами, например экспрессируемыми или сверхэкспрессируемыми опухолями или метастазами. Описаны [2] соматостатиновые пептиды, содержащие бифункциональную полиаминополикарбоксильную кислотную хелатирующую группу, пришитую к их концевой аминогруппе посредством спейсерной группы. Однако, даже если присутствие бифункциональной хелатирующей группы (октадентата) и спейсерной группы приводит к улучшению некоторых свойств получаемого конъюгата, еще остается необходимость в радиофармацевтическом средстве с улучшенными свойствами, в частности с высоким соотношением мишень/почка, что позволит свести к минимуму дозу радиации в почках.
Было обнаружено, что соматостатиновые пептиды, содержащие, как описано ниже, монофункциональную ДОТК (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота), сконъюгированную непосредственно, то есть при отсутствии спейсерной группы, с концевой аминогруппой соматостатиновых пептидов, обладают улучшенными свойствами. В частности, они имеют лучшее соотношение опухоль/почка и обеспечивают поэтому более низкую дозу радиации, приходящуюся на почки.
Согласно изобретению предложено соединение формулы I

где M является катионом и
A является Phe или Tyr,
в свободной форме, в виде соли или в виде комплекса с радионуклидом.
Как будет определено далее, каждая связь

Если A является Рhе, то пептидная часть соединения формулы I соответствует октреотиду. Если A является Tyr, то пептидная часть соединения формулы I соответствует [Tyr3]-октреотиду.
A предпочтительно является Tyr.
M может быть H+ или любым солеобразующим катионом для карбоксильной группы, например одновалентным катионом или одним эквивалентом поливалентного катиона, например ионом щелочного металла, такого как натрий, калий или замещенный либо незамещенный ион аммония.
Соединения формулы I могут также существовать, например, в форме внутримолекулярной соли, в которой M является H+, или в форме кислых аддитивных солей. Кислые аддитивные соли включают в себя, например, соли, полученные при добавлении органической, полимерной или неорганической кислоты, например хлоргидрат, ацетат, трифторацетат или лактат.
Под радионуклеотидом подразумевают α- или β- излучающий нуклид с Auger-

Настоящее изобретение включает также способ получения соединений формулы I. Они могут быть
получены по аналогии с известными способами. Соединения формулы I могут быть получены, например, следующим образом:
а) удаляют по меньшей мере одну защитную группу, присутствующую в
защищенной форме соединения формулы I, или
б) соединяют амидной связью две пептидные единицы, одна из которых содержит по меньшей мере один аминоспирт в защищенной или незащищенной форме, а
другая содержит ДОТК группу, причем амидную связь располагают таким образом, что получают желаемую аминокислотную последовательность формулы I, а затем возможно осуществляют стадию а) данного способа
или
в) соединяют ДОТК и желаемый соматостатиновый пептид в замещенной и незамещенной форме таким образом, что группу, полученную из ДОТК, фиксируют на концевой аминогруппе пептида, а затем
возможно осуществляют стадию а), или
г) окисляют ДОТК-пептид, имеющий аминокислотную последовательность, указанную в формуле I, в которой меркапто группы Cys радикалов существуют в
несвязанной форме, что приводит к получению соединения формулы I, в котором 2 Cys радикала соединены S-S-cвязью,
и выделяют полученные таким образом соединения формулы I в несвязанной форме,
в форме соли или в форме комплекса с радионуклидом.
Указанные выше реакции могут быть осуществлены по аналогии с известными способами, например, как описано в следующих примерах. В случае необходимости в этих реакциях могут быть использованы защитные группы для функциональных групп, которые не участвуют в реакции, пригодные для применения в пептидах или для ДОТК хелатирующих групп. Термин защитная группа может также включать полимерную смолу, имеющую функциональные группы. ДОТК может быть применена на стадии способа (в) в несвязанной кислой форме, в виде ангидрида или в виде активированного, например, N-гидроксисукцинимидом сложного эфира.
Образование комплекса с радионуклидом может быть осуществлено при комнатной температуре согласно известным способам, например путем взаимодействия некомплексного соединения формулы I с солью, с получением желаемого радионуклида.
Предпочтительно осуществлять образование комплекса некомплексного соединения формулы I с образующей радионуклид солью при температуре от 60 до 120oC, более предпочтительно от 80 до 100oC. В случае, когда образование комплекса осуществляют при температуре ≥ 100oC, процесс может проходить в автоклаве. Образование комплекса при нагревании удобно проводить в течение короткого промежутка времени, например от 10 до 20 минут. В том случае, когда радионуклидом является90Y, предпочтительно, чтобы90Y-обоазующей солью являлся90YCl3.
Вышеуказанные реакции удобно проводить в условиях, позволяющих избежать загрязнения следовыми количествами металлов. Предпочтительно для снижения воздействия следовых количеств металла использовать дистиллированную деионизированную воду, ультрачистые реагенты, радиоактивность без добавления носителя и т.д.
Соединения формулы I в виде комплекса с радионуклидом проявляют фармацевтическую активность и являются поэтому перспективными в качестве радиофармацевтических средств для лечения in vivo опухолей и метастазов, положительных по соматостатиновым рецепторам, о чем свидетельствуют результаты стандартных тестов.
В частности, соединения формулы I обладают сродством к соматостатиновым рецепторам, которое может быть оценено in vitro в анализах связывания, проводимых, как описано [3,4].
Отмечено, что соединения формулы I, например соединение формулы I в виде комплекса с90Y или161Tb, связываются с высоким сродством и специфичностью с соматостатиновыми рецепторами со значением pKD приблизительно от 8,0 до 10,0.
Соединение из Примера 1 связывается с высоким сродством с соматостатиновыми
рецепторами, экспрессированными в клетках коры головного мозга или AR42J панкреатических опухолевых клетках: оно имеет pKi, равную 8,9±0,1 при использовании [125I][Tyr3]-октреотида в качестве специфического лиганда. Соединение из Примера 2 является специфическим в отношении соматостатиновых рецепторов лигандом, который может быть замешен в соматостатиновых
рецепторах октреотидом: μИK50 = 9,0 ± 0,3.
Сродство комплексных соединений формулы I к соматостатиновым рецепторам может быть продемонстрировано также при
тестировании in vivo согласно стандартным методам тестирования, например, как описано [1]. Например, в одном из тестов соединение из Примера 2 обнаруживает значительную опухолевую аккумуляцию спустя 2
часа после внутрибрюшинной инъекции дозы 5 мкKw мышам, имеющим экзокринную панкреатическую опухоль: 9,53±0,70% ИД/г наличия в опухоли, положительной по соматостатиновым рецепторам, в то время
как значительно меньшее количество радиоактивности аккумулируется в нормальных тканях, положительных по соматостатиновым рецепторам, например в поджелудочной железе оно составляет 1,52±0,08%
ИД/г. Под % ИД/г понимают процентное содержание инъецированной дозы радиоактивности на 1 г ткани. Соединение из Примера 2 спустя 24 часа после инъецирования дает не только высокое соотношение
опухоль/почка, но также и высокое соотношение опухоль/печень и опухоль/бедро. Костный мозг считают наиболее радиочувствительным органом, поэтому низкий уровень радиоактивности, аккумулируемый в костях,
является особенным преимуществом.
Соединение формулы I в виде комплекса с радионуклидом обладает антипролиферативным действием на опухолевые клетки, несущие соматостатиновые рецепторы, как показано, например, в тестах с безволосыми мышами.
AR42J клетки панкреатической опухоли крысы трипсинизируют и 1•107 опухолевых клеток (в 0,2 мл) инъецируют подкожно в оба бока безволосых мышей. Когда опухоли достигают значительного объема порядка 0,1-2 мл, животных случайным образом распределяют на контрольные и опытные группы. Контрольные животные получают либо некомплексное соединение формулы I, либо соответствующее комплексное (образование комплекса осуществлено на холоду) соединение формулы I путем внутрибрюшинных инъекций в дозах, соответствующих наивысшей дозе обработанных групп. Мышам вводят дозы от 0,8 мКи до 40 мКи/кг/100 мкл на мышь. Размер опухолей определяют с помощью штангенциркуля. Для вычисления объема опухоли в мл используют равенство "объем (эллипсоид) = длина • глубина • высота • 0,52". Для статистической обработки используют t-тест Стьюдента. При проведении этого теста отмечают временное опухолевое сжатие через одну неделю и задержку опухолевого роста на две недели после одноразового введения соединения из Примера 2. Контрольные группы, напротив, показали непрерывный опухолевый рост, при котором время удвоения объема составляло около семи дней. Доля выживания в обработанных группах значительно увеличена.
Сходные результаты получают при обработке мышей или крыс, имеющих другие типы опухолей, например карциномы молочной железы или рака мелких клеток легких, соединением из Примера 2.
Соответственно этому в ряде специфических или возможных
реализаций настоящее изобретение также предлагает:
1. Применение соединения формулы I в виде комплекса с радионуклидом или его фармацевтически приемлемой соли в качестве
радиофармацевтического средства для in vivo лечения опухолей и метастазов, положительных по соматостатиновым рецепторам.
2. Способ in vivo лечения опухолей и метастазов, положительных по соматостатиновым рецепторам, например для лечения инвазивности таких опухолей или симптомов, ассоциированных с ростом таких опухолей у пациента, нуждающегося в таком лечении, который включает введение указанному пациенту терапевтически эффективного количества соединения формулы I в виде комплекса с радионуклидом или его фармацевтически приемлемой соли.
3. Применение соединения формулы I или его фармацевтически приемлемой соли при производстве радиофармацевтического состава.
Дозы, используемые при реализации радиотерапевтического применения настоящего изобретения, будут, конечно, различаться, в частности, в зависимости от конкретного состояния, подлежащего лечению, например известной радиочувствительности опухолевого типа, объема опухоли и желаемой терапии. Обычно дозу высчитывают на основании распределения радиоактивности в каждом органе и наблюдаемого целевого поглощения. β-излучающий комплекс формулы I может быть введен в различные моменты времени, например спустя период, равный 1-3 неделям или более. Номинальный разброс доз составляет от 5 до 100 мкг соединения формулы I в виде комплекса с, например, 10-100 мКи радионуклида, например,90Y или161Tb, более высокий диапазон радиоактивности предпочтителен для161Tb.
Соединения формулы I в виде комплекса с радионуклидом могут быть введены любым стандартным способом, в частности внутривенно, например, в форме растворов или суспензий для инъекций. Также они могут быть успешно введены путем вливания, например вливанием в течение 30-60 минут. В зависимости от локализации опухоли они могут быть введены настолько близко к месту локализации опухоли, насколько это возможно, например, посредством катетера. Они могут быть введены несколькими раздельными дозами.
Опухолями, которые могут подвергаться лечению соединениями формулы I в виде комплекса с радионуклидами являются, например, гипофизарные, гастро-энтеропанкреатические, карциноидные опухоли, опухоли центральной нервной системы, молочной железы, простатические, овариальные опухоли или опухоли толстой кишки, рак мелких клеток легких, параганглиомы, рак почки, рак кожи, нейробластомы, феохромоцитомы, медуллярные карциномы щитовидной железы, миеломы, лимфомы, болезнь Hodgking'a и non-Hodgkins'a, опухоли костей и метастазы.
Выведение радиоактивных соединений происходит главным образом через почки. Дополнительная защита почек от накопления радиоактивности может быть реализована путем введения лизина или аргинина либо аминокислотного раствора, имеющего высокое содержание лизина и/или аргинина, например такой коммерчески доступный аминокислотный раствор, как VaminaR 18EF или SynthaminR-14 или -10, перед инъекцией комплексного соединения формулы I или вместе с ним.
Соединение формулы I в виде комплекса с радионуклидом может существовать в свободной кислотной форме или в виде фармацевтически приемлемых солей, имеющих тот же порядок активности, что и комплексы в свободной кислотной форме.
Предпочтительным является соединение из Примера 1 в виде комплекса с90Y.
Согласно следующему аспекту изобретения предлагается фармацевтический состав, содержащий соединение формулы I или соединения формулы I в виде комплекса с радионуклидом, или их фармацевтически приемлемую соль совместно с одним или более фармацевтически приемлемым носителем или растворителем. Такие составы могут быть приготовлены стандартным способом.
Согласно предпочтительной реализации изобретения фармацевтические составы на основе соединения формулы I в виде комплекса с радионуклидом включают, кроме того, стабилизатор, например утилизатор свободных радикалов, который ингибирует авторадиолиз пептидной части. К числу допустимых стабилизаторов относятся, например, сывороточный альбумин, аскорбиновая кислота, ретинол, гентизиновая кислота или их производные, либо аминокислотный раствор для вливания, например, используемый для парентерального белкового питания, предпочтительно свободные от электролита и глюкозы, например коммерчески доступное аминокислотное вливание, такое как ProteinsterilR KE Nephro. Предпочтительной является аскорбиновая кислота. Может быть использован стабилизатор в весовом соотношении 1'000-10'000 : 1 для незакомплексованного соединения формулы I, предпочтительно 4000-7000 : 1. Фармацевтические составы могут содержать дополнительные добавки, например агент для поддержания pH между 7,2 и 7,4, например ацетат Na или аммония или Na2HPO4. Предпочтительно добавить стабилизатор к некомплексному соединению формулы I, а комплексообразование с радионуклидом осуществлять в присутствии стабилизатора либо при комнатной температуре, либо, что предпочтительно, при температуре от 60 до 120oC. Комплексообразование удобно проводить в безвоздушных условиях, например под N2 или Ar. После комплексообразования к составу может быть добавлен дополнительный стабилизатор.
Соединения формулы I в виде комплекса с радионуклидом могут применяться также для лечения аутоиммунных или воспалительных расстройств, связанных с соматостатиновыми рецепторами, например ревматидного артрита.
Согласно следующей реализации изобретения соединения формулы I в виде комплекса с радионуклидом могут применяться в качестве адъювантов при цитостатической терапии, например, в сочетании с цитостатическим агентом, предпочтительно с цитостатическим агентом, усиливающим радиотерапевтический эффект путем действия в качестве радиосенсибилизатора. Примеры природных цитостатических или радиосенсибилизирующих агентов включают в себя, например, цисплатин, 5-фторурацил, циклофосфамид и доксорубицин.
Согласно вышеизложенному настоящее изобретение предусматривает еще один аспект.
4. Способ лечения инвазивности опухолей, положительных по соматостатиновым рецепторам, или симптомов, ассоциированных с подобным опухолевым ростом, у пациента, нуждающегося в таком лечении, причем этот способ включает введение указанному пациенту эффективного количества а) соединения формулы I в виде комплекса с радионуклидом либо его фармацевтически приемлемой соли и б) второго лекарственного вещества, причем указанное лекарственное вещество является цитостатическим агентом.
5. Терапевтический набор, например Кит, для применения при лечении опухолевой инвазивности или симптомов, ассоциированных с опухолевым ростом, причем указанный набор включает фармацевтический состав, содержащий соединение формулы I в виде комплекса с радионуклидом или его фармацевтически приемлемую соль, и, кроме того, включающий по меньшей мере один фармацевтический состав, содержащий цитостатический агент.
Цитостатический агент может быть применен в любом количестве, о котором известно, что оно оказывает эффективное цитостатическое или радиосенсибилизирующее действие. Цитостатический агент может вводиться параллельно или в последовательном режиме с радиофармацевтическим средством формулы I.
Изобретение иллюстрируют следующие примеры. Все температуры даны вoC.
Используют следующие сокращения:
Фмок = 9-флуоренилметоксикарбонил
Бок = трет-битоксикарбонил
ДОТК = 1,4,7,10-тетра-азациклододекан-1,4,7,10-тетрауксусная кислота
ДМФА = диметилформамид

ПРИМЕР 1:
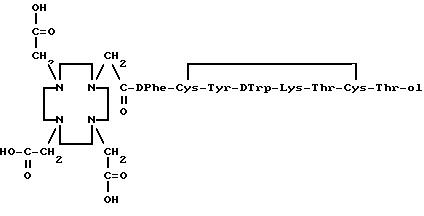
6 г ДОТК • H2O (свободная кислота) растворяют в 50 мл воды (pH 3,7). После разбавления 60 мл ДМФА незамедлительно добавляют 1 г N-гидроксисукцинимида, 2,7 г N,N-дициклогексилкарбодиимида (ДЦКИ) и 3 г [Tyr3, ε-Boc-Lys5] -октреотида. Реакцию поддерживают при комнатной температуре в течение 72 часов в условиях перемешивания. ε-Lys5-защищенное соединение выделяют посредством очистки на колонке с силикагелем 60 (подвижная фаза: 50%-смесь метиленхлорид/метанол/уксусная кислота (9/1/0,125).
После отщепления Lys5-защитной группы с помощью трифторуксусной кислоты (ТФУ, 100%) в течение 10 минут при комнатной температуре и очистки на колонке с силикагелем 60 (подвижная фаза: 50%-смесь метиленхлорид/метанол/уксусная кислота (7/3/1 до 7/5/2) и на RP18-ЖХВР колонке с использованием в качестве буферной системы 1%-ной смеси вода/ацетонитрил/уксусная кислота получают чистое и гомогенное соединение, указанное в заголовке, в форме его ацетатной соли.
FAB-MH+:1421 [α= -14,75o (95% AcOH; с = 0,52)
(FAB - облучение быстрыми анионами)
ПРИМЕР 2:90
Y-меченное соединение из Примера 1.
90Y-меченный ХЕЛАТ получают путем добавления 20 мкл90Y (1,2 мКи, 0,04 М HCl) к 20 мкл 50 мкМ соединения из Примера 1 (0,15 М NH4OAc, 0,3% БСА, pH 4,5). Этот раствор инкубируют в течение 15 минут при 100oC. Отбирают аликвоту и разводят ее 4мМ DTPA (pH 4,5) перед анализом посредством ЖХВР с реверсивной фазой C18, что позволяет установить количество свободного нехелатированного90Y в реакционной смеси (что определяют по присутствию [90YDTPA]2-). Радиохимическая чистота составляет обычно > 99,5%, а получаемый хелат является кинетически стабильным в 4 мМ DTPA (4 нМ соединения из Примера 1, pH 4,5) в течение семи дней.
ПРИМЕР 3:90Y-меченное соединение из Примера 1.
120 мкл 0,23 М аскорбиновой кислоты, 0,15 М ацетата аммония (pH 4,8), 6 мкл 1 мМ соединения из Примера 1 и 120 мкл90Y (85 мКи/мл, 0,04 М HCl) прогревают в ампуле в течение 15 минут на кипящей водяной бане. Полученный раствор разбавляют до 1 мл либо 0,23 М аскорбиновой кислотой и 0,15 М NH4OAc либо ProteinsterilR KE Nephro аминокислотным раствором для вливаний и хранят при температуре окружающей среды в течение длительного промежутка времени.
ProteinsterilR KE Nephro
аминокислотный раствор содержит:
11,4 г/л Leu, 9,63 г/л Lys, 9,53 г/л Val, 7,76 г/л Phe, 7,52 г/л Ile, 6,78 Thr, 6,59 г/л Met, 4,9 г/л His, 2,91 r/л Trp.
ПРИМЕР 4:

Соединение, указанное в заголовке, получают посредством повторения способа из Примера 1, но с использованием ε-Boc-Lys5- -октреотида.
MC (ионное облучение): 1403 (M - H).
ПРИМЕР 5:90Y-меченное соединение из Примера 4.
Повторяют процесс введения метки из Примера 2, что позволяет получать90Y хелат.
ПРИМЕР 6:161Tb-меченное соединение из Примеров 1 или 4.
Повторяют процесс введения метки из Примера 2 с использованием161Tb-образующей соли вместо90Y-образующей соли, что приводит к получению161Tb хелата.
Литература
1. GB-A-2, 225, 579, C 07 K 7/26.
2. EP-A2-607, 103.
3. J.C. Reubi, Life Sc. 36, 1829 (1985).
4. C. Bruns et al., Biochem. J., 265, 39 (1990).
Реферат
Описываются новые соматостатиновые пептиды общей формулы I, где М - Н или катион, образующий кислотно-аддитивные соли; А - Phe или Tyr, в свободной форме или в форме кислотно-аддитивной соли, или комплекса с радионуклидом. Они могут быть применены в качестве радиофармацевтических средств при условии, что они представляют собой комплексы с α- или β- излучающими радионуклидами или нуклидом с Аu-ger-е-каскадами. 4 c. и 8 з.п. ф-лы.

Формула

где M является катионом;
A является Phe или Tyr;
в свободной форме, или в форме кислотно-аддитивной соли, или комплекса с радионуклидом.

Комментарии