Получение биологически активных белков - RU2441911C2
Код документа: RU2441911C2
Чертежи






























































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка заявляет преимущество предварительной заявки с порядковым номером 60/776391, которая была подана 23 февраля 2006 года.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение рассматривает получение биологически активных рекомбинантных пептидов и белков, совокупно называемых полипептидами, в эукариотических клетках и организмах в качестве систем-хозяев. Более конкретно, биологически активный полипептид сливают с индуцирующей образование белковых телец последовательностью (PBIS), которая опосредует индукцию рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA) с образованием слитого белка, который стабильно экспрессируется и накапливается в системе-хозяине в виде RPBLA после трансформации клеток-хозяев подходящим вектором.
УРОВЕНЬ ТЕХНИКИ
Получение рекомбинантных белков для терапевтического, нутрицевтического или промышленного применения успешно развивалось на протяжении последнего десятилетия. Введение гетерологичных генов, имеющих желаемую нуклеотидную последовательность, приводит к экспрессии полипептида или белка, имеющего соответствующую желаемую последовательность аминокислотных остатков или первичную структуру. Однако во многих случаях этот экспрессируемый белок или полипептид имел последовательность аминокислотных остатков природно продуцируемого материала, но не имел биологической активности этого материала.
Биологической активностью при условии правильной первичной структуры экспрессированного продукта может быть функция этого продукта, имеющего правильную укладку и образование внутренних водородных, ван-дер-ваальсовых, ионных и дисульфидных связей, а также имеющего правильную посттрансляционную модификацию, например гликозилирование. Например, образование дисульфидных связей происходит самопроизвольно в просвете эндоплазматического ретикулума (ER), но не в цитозоле прокариотов, что делает бактериальные клетки, такие как E. coli, плохими хозяевами для синтеза правильно уложенных белков млекопитающих, которые обычно стабилизированы дисульфидными связями. Образование дисульфидных связей может происходить в периплазматическом пространстве E. coli, где PDI-подобные белки являются функциональными (Fernandez, et al., 2001. Mol. Microbiol. Apr 40(2): 332-346), однако эта окислительно-восстановительная система является не очень эффективной.
Конкретный рассматриваемый случай относится к эритропоэтину (ЕРО), белку, который стимулирует образование эритроцитов. Рекомбинантный ЕРО описан в Патенте США № 4703008, Lin. Этот патент описывает активности для белка ЕРО, экспрессируемого в E. coli, S. cerevisiae и млекопитающих: в клетках яичника китайского хомячка (СНО) и почки африканской зеленой мартышки (COS-1). Хотя антисыворотки против ЕРО иммунореагировали с ЕРО, экспрессированным каждым типом клеток, только белки, экспрессированные клетками млекопитающих, проявляли существенную биологическую активность в качестве ЕРО in vivo и сходные концентрации в анализе антител, анализах in vitro и in vivo. Именно экспрессируемый млекопитающими белок используется для лечения людей.
Считается, что эти различия в биологической активности зависели от гликозилирования, так как E. coli, прокариот, не может гликозилировать экспрессируемые ею белки. Клетки дрожжей являются эукариотами, но их картина гликозилирования для секретируемых белков отличается от картины гликозилирования млекопитающих. С другой стороны, клетки СНО и COS-1, используемые для обеспечения белка с существенной активностью, были клетками млекопитающих и экспрессируемый ими белок был применимым. Опубликованные исследования гликозилированного и негликозилированного ЕРО показывают, что гликозилирование играет решающую роль в стабилизации эритропоэтина против денатурирующих условий. Narhi et al., (1991) J. Biol. Chem., 266(34):23022-23026. Кроме того, сообщалось, что период полувыведения in vivo и активность ЕРО могут быть связаны с гликозилированием этой молекулы.
Таким образом, эукариотические клетки являются в значительной степени предпочтительными для рекомбинантного получения терапевтических, промышленных и других применимых белков эукариотического происхождения. Было показано, что различные эукариотические клетки и организмы способны продуцировать активные терапевтические средства на основе белков. К сожалению, высокие стоимости, часто вызываемые низкими уровнями получения рекомбинантных белков и/или процедурами выделения и очистки белков, могут свести на нет возможность их промышленного применения. Проводится активное исследование для улучшения как уровней получения, так и процедур очистки с использованием различных подходов.
Одним путем улучшения эффективности выделения рекомбинантных белков является путь внутриклеточного концентрирования. Одним из этих подходов является рандомизированная агрегация рекомбинантных белков в несекретируемые внутриклеточные тельца (включения), которые могут быть выделены из лизированных клеток способами очистки на основе плотности. Тельца включений являются отложениями аморфного белка, обнаруживаемыми в бактериях. Исследования структурных свойств показали, что нерастворимый характер этих телец включений может быть обусловлен гидрофобными межмолекулярными взаимодействиями неприродно уложенных белков (Seshadri et al., 1999, Methods Enzymol. 309: 559-576). Общая стратегия, используемая для извлечения активных белков из телец включений, требует солюбилизации этого белка для разрушения этих случайных агрегатов с последующими одной или несколькими химическими стадиями рефолдинга. Это является важной проблемой, которая должна быть решена, так как эффективность ренатурации денатурированных белков может быть ограниченной, обычно, если этот белок содержит дисульфидные связи (Clark, Ed., Apr. 2001 Curr. Opin. Biotechnol. 12(2):202-207).
Более конкретно, используют сильные денатурирующие агенты, например высокую концентрацию хаотропных агентов (т.е. мочевины и гидрохлорида гуанидиния), для солюбилизации неуложенных белков, которые накапливаются в агрегатах. После этого эти денатурирующие агенты диализуют из агрегатов в попытке рефолдинга белка в природной конформации. Биологическая активность таких повторно уложенных белков обычно является гораздо меньшей, чем биологическая активность нативно-образованного белка.
Белковые тельца (РВ) являются природно-встречающимися структурами в семенах некоторых растений, которые эволюционировали для концентрирования запасных белков внутриклеточно в эукариотических клетках при сохранении правильного фолдинга и биологической активности. Белковые тельца (РВ) имеют некоторые общие свойства с тельцами включений из бактерий. Они являются плотными и содержат большое количество агрегированных белков, которые плотно упакованы гидрофобными взаимодействиями [Momany et al., 2006 J Agric. Food Chem. Jan 25; 54(2):543-547 и Garrat et al., 1993 Proteins et al., 1993 Proteins Jan; 15(1):88-99]. Кроме того, присутствие большого количества дисульфидных связей в некоторых из этих PBIS, например RX3, [Ludevid et al., 1984 Plant Mol Biol. 3: 227-234 и Kawagoe et al., 2005 Plant Cell Apr 17(4): 1141-1153], которые, возможно, участвуют в образовании и стабилизации РВ, могли бы представлять дополнительную трудность в получении биологически активного, нативно-уложенного белка, в частности белка, который содержит остатки цистеина.
Таким образом, наблюдение биологической активности без необходимости рефолдинга и ренатурации большого разнообразия белков, получаемых в синтетических РВ в недрожжевых эукариотических клетках, было неожиданным.
Новая технология, основанная на слиянии домена запасного белка семени растения с представляющим интерес белком (WO 2004/003207), была разработана для увеличения стабильности и накапливания рекомбинантных белков в высших растениях. Эти запасные белки являются специфическими для семян растений, где они стабильно накапливаются в белковых тельцах (Galili et al., 1993, Trends Cell Biol 3:437-442).
Эти запасные белки встраиваются в просвет эндоплазматического ретикулума (ER) через сигнальный пептид и собираются либо в развивающих эндоплазматический ретикулум специфических органеллах, называемых ER-происходящими белковыми тельцами (ER-PB), или в запасающих белки вакуолях (PSV) (Okita et al., 1996 Annu. Rev. Plant Physiol Mol. Biol. 47:327-350; Herman et al., 1999 Plant Cell 11:601-613; Sanderfoot et al., 1999 Plant Cell 11:629-642). Полноразмерные рекомбинантные запасные белки были также описаны для сборки в РВ-подобные органеллы в системах-хозяевах, не являющихся растениями, таких как ооциты Xenopus.
Экспрессия проламинов зерновых культур (наиболее обильных зерновых запасных белков) была описана в ооцитах Xenopus после инъекции соответствующих мРНК. Эта система была использована в качестве модели для исследования нацеливающих свойств этих запасных белков (Simon et al., 1990, Plant Cell 2:941-950; Altschuler et al., 1993, Plant Cell 5:443-450; Torrent et al., 1994, Planta 192:512-518) и для испытания возможности модификации α-зеина 19 кДа, проламина кукурузы, введением незаменимых аминокислот лизина и триптофана в его последовательность без изменения его стабильности (Wallace et al., 1988, Science 240:662-664).
Зеины, комплексную группу проламинов кукурузы, получали в дрожжах с различными целями. Corragio et al., 1988, Eur J Cell Biol 47:165-172, экспрессировали нативные и модифицированные α-зеины в дрожжах для исследования нацеливающих детерминант этого белка. Kim et al., 2002, Plant Cell 14: 655-672, исследовали возможные взаимодействия α-, β-, γ- и δ-зеинов, которые приводят к образованию белковых телец. Для решения этого вопроса они трансформировали дрожжевые клетки кДНК, кодирующей эти белки. Кроме того, эти авторы сконструировали слитые белки зеин-GFP для определения субклеточной локализации зеиновых белков в клетках дрожжей, но не наблюдали образования плотных концентрированных структур, характерных для bona fide РВ. Следует отметить, что Kim et al., 2002, Plant Cell 14:655-672, сделали вывод, что дрожжи не являются хорошей моделью для исследования взаимодействий зеинов, так как зеины сами по себе слабо накапливались в трансформированных дрожжах. Клетки дрожжей также использовали в качестве модели для исследования механизмов, которые контролируют транспорт и отложение белковых телец запасных белков пшеницы, называемых глиадинами (Rosenberg et al., 1993, Plant Phesiol 102:61-69).
Биологическая активность является особенно важной для вакцин, которые должны индуцировать корректную иммунную реакцию в иммунизированном человеке или другом животном. Несколько новых вакцин состоят из синтетических, рекомбинантных или высокоочищенных субъединичных иммуногенов (антигенов), которые, как считается, являются более безопасными, чем полностью инактивированные или живые аттенуированные вакцины. Однако отсутствие вспомогательных (адъювантных) иммуномодуляторных компонентов, ассоциированных с аттенуированными или убитыми вакцинами, часто приводит к более слабой иммуногенности таких вакцин.
Иммунологическими адъювантами являются агенты, которые усиливают специфические иммунные реакции на вакцины. Иммунологический адъювант может быть определен как любое вещество или любая композиция, которая при включении в вакцину, действует обычно, ускоряя, пролонгируя или усиливая качество специфических иммунных реакций на антигены вакцины. Слово «адъювант» произведено от латинского глагола adjuvare, который означает помогать или способствовать. Механизмы действия адъювантов включают в себя следующее: (1) увеличение биологического или иммунологического полупериода существования в организме иммуногенов вакцины; (2) улучшение доставки антигена к антигенпрезентирующим клеткам (АРС), а также процессирования и презентации антигена этими АРС; и (3) индукцию продуцирования иммуномодуляторных цитокинов.
Фагоцитоз включает в себя внедрение больших частиц, таких как апоптотические клетки или целые микробы. Способность клеток поглощать большие частицы, по-видимому, является функцией питания в одноклеточных организмах; однако сложные организмы используют преимущество фагоцитарного аппарата для выполнения дополнительных функций. Например, фагоцитоз антигенов, предпринимаемый макрофагами, В-клетками или дендритными клетками, представляет ключевой процесс в адоптивном и врожденном иммунитете. Действительно, фагоцитоз и последующее убивание микробов в фагосомах образует основу врожденной защиты организма против внутриклеточных патогенов. Кроме того, деградация патогенов в полости фагосомы и продуцирование антигенных пептидов, которые презентируются фагоцитарными клетками для активации специфических лимфоцитов, также связывает фагоцитоз с адоптивным иммунитетом (Jutras et al., 2005 Annual Review in Cell Development Biology. 21:511-27).
Белки, присутствующие на поглощенных частицах, сталкиваются с рядом деградирующих протеаз в фагосомах. Однако эта деструктивная среда генерирует пептиды, которые способны связывать молекулы МНС класса II. Новообразованные комплексы антиген-МНС класса II доставляются к клеточной поверхности для презентации CD4+ Т-клеткам (Boes et al., 2002. Naturе 418:983-988). Активация этих клеток индуцирует ТН2-субпопуляцию цитокинов, таких как IL-4 и IL-5, которая способствует пролиферации и дифференцировке В-клеток и связана с иммунными реакциями гуморального типа.
Большое количество доказательств указывает на то, что кроме явного участия пути МНС класса II в иммунной реакции против фагоцитированных патогенов антигены против патогенов, в том числе микобактерий, Salmonella, Brucella и Leishmania, могут индуцировать перекрестную презентацию антигенов. То есть можно сказать, что презентация поглощенного антигена фагоцитозом посредством зависимой от МНС класса I реакции стимулирует пролиферацию цитотоксических CD8+ Т-клеток (Ackerman et al., 2004 Nature Immunology 5(7):678-684 Kaufmann et al., 2005 Current Opinions in Immunology 17(1):79-87).
Дендритные клетки играют центральную роль презентации антигенов для индукции иммунной системы (Blander et al., Nature Immunology 2006 10:1029-1035). Хотя и редкие, дендритные клетки являются наиболее высокоспециализированными АРС, способными как провоцировать, так и регулировать иммунную реактивность (Lau et al., 2003 Gut 52:307-314). Хотя дендритные клетки являются важными в презентации антигенов, в частности для инициирования первичных иммунных реакций, макрофаги являются типом АРС, наиболее важным в участках воспаления и специализированным для клиренса некротического и апоптотического материала. Макрофаги могут не только действовать в качестве АРС, но могут также выполнять про- или антивоспалительную роль в зависимости от способа, посредством которого они активированы.
С учетом того, что АРС играет центральную роль в индукции и регуляции адоптивного иммунитета (гуморального или клеточного), узнавание и фагоцитоз антигена этими клетками может рассматриваться как ключевая стадия в процессе иммунизации. Большое разнообразие способов на основе поглощения флуоресцентных частиц были разработаны для исследования фагоцитоза макрофагами (Vergne et al., 1998 Analytical Biochemistry 255:127-132).
Важным аспектом в ветеринарных вакцинах является генетическое разнообразие рассматриваемых видов и необходимость общих систем, которые работают в различных видах. До значительной степени, это разнообразие ограничивает применение молекулярных способов нацеливания на маркеры клеточной поверхности и иммуномодуляторы, такие как цитокины, так как для многих видов, в том числе диких животных, доступны лишь минимальные данные в отношении этих молекул. Таким образом, предпочтительными являются адъюванты, которые основаны на универсальных сигналах активации врожденной иммунной реакции (т.е. которые являются идентичными в различных видах). С учетом этих требований состоящие из частиц системы доставки вакцин являются вполне подходящими для стратегий вакцин для ветеринарии и диких животных (Scheerlinck et al., 2004 Methods 40: 118-124).
Как обсуждается более подробно далее, данное изобретение показывает, что экспрессия слитого белка, состоящего из (i) последовательности белка, которая опосредует индукцию рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA), связанной с (ii) биологически активным полипептидом (представляющим интерес белком или мишенью), индуцирует накапливание этих RPBLA в клетках эукариотических организмов, таких как растения, грибы, водоросли и животные, с получением биологически активной мишени (белка).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает систему и способ для получения слитого белка, содержащего индуцирующую белковые тельца последовательность (PBIS) и представляющий интерес биологически активный пептид или белок (часто в совокупности называемый здесь полипептидом или мишенью), в эукариотических клетках. Эти слитые белки, содержащие представляющий интерес полипептид, накапливаются в виде рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA) в эукариотических клетках, которыми могут быть клетки растения, животного, грибов или водорослей.
Клетки высших растений являются предпочтительными эукариотическими клетками-хозяевами в некоторых вариантах осуществления, в то время как клетки низших растений, таких как водоросли, являются предпочтительными в других вариантах осуществления, клетки животных, таких как млекопитающие и насекомые, являются предпочтительными эукариотическими клетками-хозяевами в других вариантах осуществления, и грибы являются предпочтительными эукариотическими клетками-хозяевами в других вариантах осуществления. Этот слитый белок может экспрессироваться конститутивно или преимущественно в конкретных клетках в многоклеточных эукариотах. Эти PBIS способны опосредовать индукцию образования RPBLA и вхождение и/или накапливание слитого белка в этих органеллах с подходящим фолдингом и/или подходящими посттрансляционными модификациями, такими как базальное гликозилирование и образование дисульфидных связей, для обеспечения биологической активности представляющему интерес экспрессируемому пептиду или белку (мишеням).
Таким образом, эукариотическая клетка-хозяин, которая содержит биологически активный рекомбинантный слитый белок в рекомбинантных подобных белковым тельцам упорядоченных структурах (RPBLA), рассматривается в качестве одного аспекта данного изобретения. Слитый белок содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является последовательностью из по меньшей мере 20 аминокислотных остатков биологически активного полипептида. Биологически активный полипептид, как обнаруженный в природе, может быть гетерологичным относительно указанных эукариотических клеток-хозяев и, следовательно, экспрессируется во втором типе клеток, которые отличаются от первой упомянутой выше эукариотической клетки-хозяина, или его получают синтетически. Кроме того, эта эукариотическая клетка-хозяин не продуцирует РВ в отсутствие этого слитого белка. Таким образом, именно экспрессия слитого белка и PBIS заставляет клетку-хозяина образовывать подобные белковым тельцам упорядоченные структуры или RPBLA.
В конкретном варианте осуществления, последовательность нуклеиновой кислоты, используемая для трансформации, содержит (i) последовательность нуклеиновой кислоты, кодирующую PBIS, и (ii) последовательность нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую представляющий интерес продукт. В одном варианте осуществления, 3'-конец последовательности нуклеиновой кислоты (i) связан с 5'-концом указанной последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, 5'-конец последовательности нуклеиновой кислоты (i) связан с 3'-концом указанной последовательности нуклеиновой кислоты (ii). Таким образом, последовательность PBIS может находиться на N-конце или С-конце этого слитого белка. Должно быть понятно, что все из ДНК-связей, обсуждаемые здесь для экспрессии слитого белка, являются такими, что эти два компонента слитого белка экспрессируются в рамке считывания.
Биологически активный полипептид этого слитого белка обнаруживает по меньшей мере 25 процентов, предпочтительно по меньшей мере 50 процентов, более предпочтительно 75 процентов и наиболее предпочтительно по меньшей мере 90 процентов биологической активности одного и того же полипептида, выделенного из вышеуказанного второго типа клеток, в анализе активности этого полипептида.
В другом конкретном варианте осуществления, последовательность нуклеиновой кислоты, используемая для трансформации, содержит, кроме вышеупомянутых последовательностей нуклеиновых кислот (i) и (ii), последовательность нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую линкерную или спейсерную аминокислотную последовательность. Эта спейсерная аминокислотная последовательность может быть аминокислотной последовательностью, расщепляемой или не расщепляемой, ферментативными или аутопротеолитическими или химическими средствами. В конкретном варианте осуществления, эта последовательность нуклеиновой кислоты (iii) помещена между последовательностями нуклеиновых кислот (i) и (ii), например, 3'-конец последовательности нуклеиновой кислоты (iii) связан с 5'-концом указанной последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, 5'-конец указанной последовательности нуклеиновой кислоты (iii) связан с 3'-концом последовательности нуклеиновой кислоты (ii).
Кроме того, в конкретном варианте осуществления, последовательность нуклеиновой кислоты, используемая для целей трансформации, кодирует последовательность в соответствии с заявкой на патент WO 2004/003207, где эта последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность, которая является специфически расщепляемой ферментативными или химическими средствами, присутствует или отсутствует. В следующем варианте осуществления, эти слитые белки могут быть прямым слиянием между PBIS и представляющим интерес пептидом или белком.
В следующем варианте осуществления, способ этого изобретения дополнительно предусматривает выделение и очистку биологически активного слитого белка.
В другом варианте осуществления, способ этого изобретения дополнительно предусматривает выделение и очистку этого слитого белка и получение биологически активного слитого белка. Таким образом, когда этот слитый белок плотно собран и заключен в мембране, трудно показать, что этот полипептид является биологически активным. Вследствие этого, биологическая активность может анализироваться после удаления этой мембраны и, если требуется, солюбилизации слитого белка. Таким образом, обсуждается способ получения биологически активного полипептида.
В этом способе, обеспечивают рекомбинантные подобные белковым тельцам упорядоченные структуры (RPBLA), которые содержат заключенный в мембрану слитый белок. Эти RPBLA обычно присутствуют в основном в сферической форме, имеющей диаметр приблизительно 0,5 - приблизительно 3 мкм, но в некоторых случаях являются аморфными по форме и могут широко варьироваться в размерах, но все еще происходят из ER. Этот слитый белок содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является биологически активным полипептидом. Эти RPBLA контактируют в водном буфере, содержащем разрушающее упорядоченную структуру мембраны количество детергента (поверхностно-активного вещества). Этот контакт поддерживают в течение периода времени, достаточного для разрушения упорядоченной структуры мембраны, и температуре, которая не денатурирует биологически активный полипептид, для разделения мембраны и слитого белка. После этого отделенный слитый белок собирают обычным способом, или он может действовать в дальнейшем без его сбора.
В некоторых вариантах осуществления, отделенный слитый белок обнаруживает биологическую активность биологически активного полипептида. В других вариантах осуществления, биологическая активность этого полипептида проявляется, после того как этот слитый белок растворяют или диспергируют в подходящем буфере. В других вариантах осуществления, этот слитый белок должен быть расщеплен на составляющие его части перед проявлением биологической активности этого полипептида. Таким образом, биологически активный полипептид может быть связан с PBIS спейсерной аминокислотной последовательностью, которая является расщепляемой ферментативными или химическими средствами. Затем, после расщепления, этот биологически активный полипептид проявляет биологическую активность при отщеплении от PBIS этого слитого белка. В некоторых вариантах осуществления этот слитый белок сохраняет его активность даже тогда, когда он еще включен в интактные RPBLA.
В другом варианте осуществления, биологически активный полипептид содержит по меньшей мере две N-связанные последовательности гликозилирования.
Еще в одном варианте осуществления, представляющий интерес полипептид слит с природным или модифицированным запасным белком, например с природными или модифицированными проламинами или доменами проламинов.
В другом варианте осуществления, RPBLA, содержащие биологически активный полипептид, используют в качестве системы доставки биологически активного полипептида. Эти преимущества этого изобретения могли бы применяться в доставке лекарственных средств, вакцин и питания.
Еще в одном варианте осуществления, RPBLA, содержащие полипептидный антиген, могут быть использованы в качестве системы доставки для обеспечения адъювантности (увеличения иммунной реакции). Введение этих RPBLA может представлять улучшение в параметрах иммунизации, таких как скорость, количество, качество и длительность иммунизации. Предпочтительное действие введения антигенов в RPBLA может достигаться, так как (i) антиген является инкапсулированным и остается дольше в крови или в желудочно-кишечном тракте (эффект медленного высвобождения), и/или (ii) антиген лучше экспонирован иммунной системе (RPBLA в качестве носителя презентации антигена), и/или (iii) в препаратах RPBLA присутствуют молекулы адъюванта, и/или (iv) RPBLA являются носителями, способными пересекать мембраны, которые сами обеспечивают адъювантность, и т.д.
Таким образом, другим аспектом этого изобретения является вакцина или инокулят (иммуногенная композиция), которые содержат иммуногенное эффективное количество RPBLA, которые содержат в качестве биологически активного вещества рекомбинантный слитый белок, растворенный или диспергированный в фармацевтически приемлемом разбавителе. Этот рекомбинантный слитый белок содержит две последовательности, связанные вместе, где одна последовательность является PBIS, а другая является биологически активным полипептидом, к которому должна быть индуцирована иммунологическая реакция указанной вакциной или инокулятом. Фармацевтически приемлемая композиция разбавителя содержит также воду. В другом варианте осуществления RPBLA, не включающую в себя антиген, но имеющую активные адъювантные свойства, доставляют совместно с выделенным антигеном для индукции иммунологической реакции.
В другом варианте осуществления, последовательность PBIS может быть использована в качестве носителя для пересечения мембран. В конкретном варианте осуществления, PBIS является ZERA (RX3) или его фрагментом.
Данное изобретение имеет несколько выгодных эффектов действий и преимуществ.
Одним выгодным эффектом является то, что применение этого изобретения делает возможной относительно простую и быструю экспрессию желаемого рекомбинантного биологически активного белка в выбранной эукариотической клетке.
Преимущество этого изобретения заключается в том, что оно обеспечивает источник легко получаемого и очищаемого рекомбинантного биологически активного белка вследствие уникальных свойств экспрессии в RPBLA.
Другим выгодным эффектом этого изобретения является то, что содержащие слитый белок RPBLA могут быть использованы для доставки вакцин, в том числе вакцин для пероральной доставки.
Другим преимуществом данного изобретения является то, что содержащие слитый белок RPBLA могут быть использованы в иммуногене в инъецируемой вакцине.
Другим преимуществом данного изобретения является то, что RPBLA могут быть использованы в качестве изолирующих агентов, мембраносвязанных структур, которые изолируют экспрессируемый полипептид от остальных компонентов клетки. Эти изолирующие агенты защищают клетку от активности этого полипептида и полипептид от этой клетки, увеличивая скорость накапливания. Таким образом, могут быть успешно экспрессированы создающие трудности биологически активные полипептиды, которые являются токсичными и/или лабильными.
Дополнительные выгодные эффекты и преимущества будут очевидными для квалифицированного в данной области специалиста из следующего ниже обсуждения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На чертежах, образующих часть этого описания:
Фиг. 1, панель А является схематическим представлением конструкций, используемых для исследований трансфекций клеток СНО. Конструкция pECFP-N1 соответствует контролю, экспрессирующему ECFP в цитозоле. pRX3-ECFP и pRX3-Gx5-ECFP являются конструкциями, экспрессирующими слитый белок RX3-ECFP, в отсутствие или в присутствии спейсера, образованного пятью аминокислотными остатками глицина (Gx5), соответственно. Р22аZ-ECFP является конструкцией, кодирующей альфа-зеин кукурузы (22 кДа), слитый с ECFP. В нижней части представлены векторы на основе рсDNA3.1 (-) (Invitrogen) вместе с несколькими конструкциями, обсуждаемыми здесь далее. Панель В показывает схематическое представление бинарных векторов для трансформации растений (верхняя часть) и бакуловирусных векторов для инфицирования насекомых (нижняя часть). “RX3” = N-концевая богатая пролином последовательность гамма-зеина; “(Gly)x5” = спейсер, образованный пятью глицинами; “ECFP” = ген усиленного сине-зеленого флуоресцентного белка; “PCMV” = промотор цитомегаловируса человека; “PPH” = промотор полиэдрина; “PSV40” = ранний промотор SV40; “CaMV35S x2” = двойной промотор вируса мозаичной болезни цветной капусты; “Pcbh1” = промотор целлюлазы 1; “t35S” = терминатор вируса мозаичной болезни цветной капусты; “TEV” = трансляционный энхансер вируса табачной гравировки; “SV40 ter” = терминатор SV40; “HSV ter” = сигнал полиаденилирования тимидинкиназы вируса простого герпеса; “cbh1 ter” = сигнал полиаденилирования целлюлазы 1; “Kana/Neo” = ген устойчивости к канамицину/неомицину; “Amp R” = ген устойчивости к ампициллину; “гентамицин” = ген устойчивости к гентамицину; “SPcbh1” = сигнальный пептид целлюлазы 1; “Ori f1” = сайт инициации репликации одноцепочечной ДНК f1; “Ori pUC” = сайт инициации репликации плазмиды; “BGH ter” = терминатор бычьего гормона роста; “PBLA” = промотор гена бета-лактамазы; “GFP” = зеленый флуоресцентный белок; “hGH” = гормон роста человека; “EGF” = эпидермальный фактор роста человека; “EK” = бычья энтерокиназа; “GUS” = глюкуронидаза; “RTB” = лектиновая субъединица рицина (Ricinus communis); “Casp2” = каспаза 2 человека; “Casp3” = каспаза 3 человека; “Int” = интеин Ssp DNAb из New England Biolabs; “mInt” = мутированная версия интеина Ssp DNAb (замена Asp154 → Ala).
Фиг. 2 показывает иммуноблоты из исследований субклеточного фракционирования клеток СНО, трансфицированных рRX3-ECFP, рRX3-G-ECFP и рECFP-N1 в качестве контроля (Панель А); плазмиды р3.1-RX3-hGH, р3.1-RX3, р3.1-RX3-ЕК, р3.1-RX3-С3, р3.1-RX3-С2, р3.1-RX3-GUS и р3.1-RX3-I-hGH (Панель В). В панели В показан также иммуноблот из исследований субклеточного фракционирования растений табака, агроинфильтрированных рВ-RX3-RTB. Панель С соответствует исследованиям субклеточного фракционирования личинок насекомых, инфицированных pF-RX3-DsRED и pF-DsRED, в качестве контроля. Трансфицированные гомогенаты клеток наносили на ступенчатые градиенты сахарозы и после центрифугирования накапливание соответствующих слитых белков анализировали при помощи иммуноблота во фракциях супернатанта, границы раздела и осадка. Молекулярные массы и антитело, используемое в иммуноблоте, указаны справа. Н, гомогенат, нанесенный в градиенте плотности; S, супернатант; FX, нижняя граница раздела Х% м/м подушки сахарозы; Р, осадок под 56% сахарозной подушкой.
Фиг. 3 является фотографией конфокальной микроскопии в шести панелях, показывающей локализацию слитых белков RX3-ECFP (панель А), RX3-Gx5-ECFP (панель В), 22aZ-ECFP (панель D), RX3-GFP (панель Е) и RX3-DsRED (панель F) в RPBLA в трансфицированных клетках СНО. Некоторые из RPBLA-структур, содержащих активные (флуоресцентные) слитые белки, указаны стрелками. Локализация ECFP в цитозоле и ядре (панель С) в клетках СНО, трансфицированных рECFP-N1, показана в качестве контроля. “N” = ядро.
Фиг. 4 является фотографией конфокальной микроскопии в четырех панелях, показывающей локализацию флуоресцентных RX3-слитых белков в различных хозяевах. В панели А показаны конфокальные оптические срезы эпидермальной ткани листа из растений табака, ко-агроинфильтрированных рВ-RX3-GFP и бинарным вектором, кодирующим HсPRO, супрессором сайленсинга генов. Можно наблюдать множество флуоресцентных RPBLA, содержащих активный слитый белок RX3-GFP. Справа, в панели В, слияние флуоресценции RX3-GFP и контрастная фаза показывают высокий процент транзиторно трансфицированных клеток. Проекция оптических срезов клеток SF9 насекомых, инфицированных pF-RX3-DsRED, показана в панели С. Оптические срезы 1 мкм жировой ткани из личинки насекомого, инфицированного pF-RX3-DsRED, показаны в панели D. Некоторые из этих структур RPBLA, содержащие активные (флуоресцентные) слитые белки, указаны стрелками.
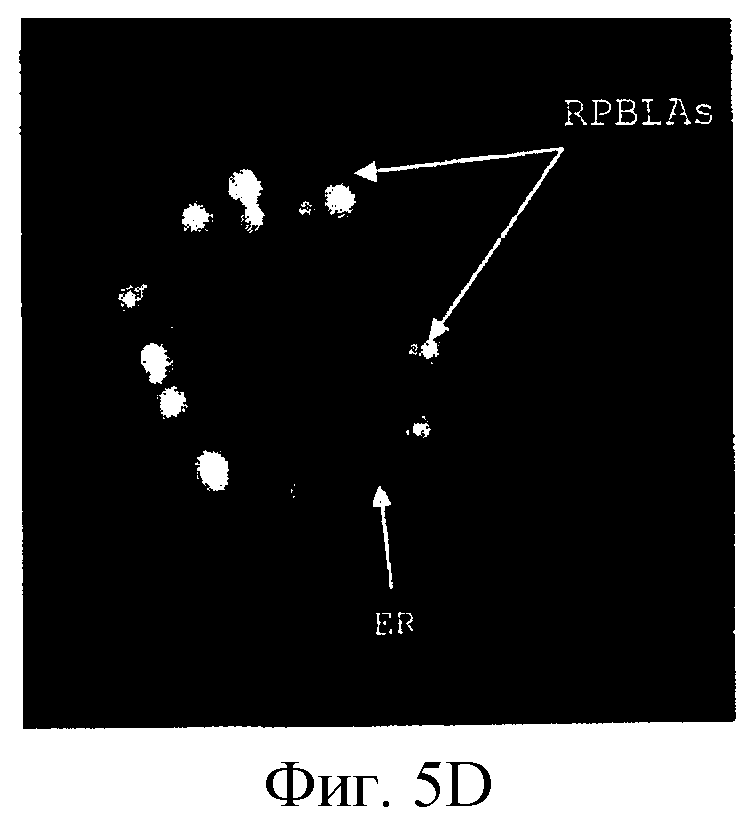
Фиг. 5 является фотографией в шести панелях (A-F), показывающей локализацию слитых белков RX3 в RPBLA в клетках СНО, спустя четыре дня после их трансфекции. Оптическую микроскопию использовали для демонстрации клеток СНО, экспрессирующих RX3-hGH (панели А и В), иммунолокализованных с использованием анти-RX3- и анти-hGH-сыворотки, соответственно. Панель С показывает иммунолокализацию с RX3-антисывороткой. Анти-hGH-сыворотку использовали в панели D для иммунолокализации слитого белка RX3-I-hGH. Инкубация клеток СНО, экспрессирующих слитый белок RX3-GUS, с RX3-антисывороткой показана в панели Е. Меньшие RPBLA наблюдали в клетках СНО, экспрессирующих RX3-ЕК, инкубированных с анти-RX3-сывороткой (панель F). Эндоплазматический ретикулум (ER) и RPBLA указаны.
Фиг. 6 показывает вестерн-блоты, которые иллюстрируют индукцию саморасщепления интеина Ssp DNAb после солюбилизации слитого белка RX3-I-hGH из препарата RPBLA низкоскоростным центрифугированием. Панели А и В иллюстрируют саморасщепление слитого белка RX3-I-hGH (интеина Ssp DNAb дикого типа), после солюбилизации. Слитый белок RX3-Im-hGH (мутированный интеин Ssp DNAb) был включен в качестве отрицательного контроля. Эквивалентные объемы этих проб наносили на дорожку и вестерн-блоты получали с анти-RX3-сывороткой (панель А) или анти-hGH-сывороткой (панель В). Полноразмерные слитые белки указаны белыми остриями стрелок, а продукты саморасщепления интеина Ssp DNAb (RX3-I в панели А и hGH в панели В) указаны черными остриями стрелок. Панель С иллюстрирует сравнение эффективности саморасщепления слитого белка RX3-I-hHG после солюбилизации 0,1% ДСН (S1) и двухфазной (S2) солюбилизации. Инкубация с анти-hGH-сывороткой показывает полноразмерный слитый белок RX3-I-hGH (белое острие стрелки) и высвобожденный hGH (черное острие стрелки). “S” = растворимая фракция; “U” = нерастворимая фракция; “T0” = проба перед индукцией саморасщепления интеина.
Фиг. 7 содержит микрофотографии, которые показывают поглощение и процессирование RPBLA RX3-DsRED из личинок насекомых макрофагами. В панели А показан анализ с использованием конфокальной микроскопии макрофагов спустя 1 час после инкубации с RPBLA RX3-DsRED. Слева, 2 макрофага можно наблюдать с использованием фазово-контрастной микроскопии. Справа, показаны возникшее изображение флуоресценции DsRED (черные острия стрелок) и самофлуоресценция макрофагов (белые острия стрелок) из оптического среза 1 мкм тех же самых клеток. Наблюдение ядра (N) в этом оптическом срезе указывает на то, что эти RPBLA были поглощены и являются теперь внутриклеточными. Панель В показывает исследование временного хода (1 час и 10 часов) флуоресценции DsRED, испускаемой этими макрофагами, после инкубации в течение 1 часа с RPBLA, содержащими RX3-DsRED. Слева, фазово-контрастная микроскопия показывает присутствие макрофагов. Справа, флуоресценция DsRED оптических срезов 1 мкм показывает присутствие нерасщепленных RPBLA при 1 часе (белое острие стрелки) и более гомогенную картину флуоресценции DsRED при 10 часах, свидетельствующую о расщепленных и диспергированных RPBLA. Вставленное изображение соответствует более высокому увеличению нерасщепленных RPBLA, наблюдаемых при 1 часе.
Фиг. 8 содержит микрофотографии, которые показывают поглощение RPBLA RX3-DsRED из личинок насекомых дендритными клетками. Эти фотографии соответствуют дендритным клеткам, инкубированным с RPBLA (панель А) и не содержащим мембраны RPBLA (панель В) на протяжении времени (2, 5 и 10 часов). В верхней части каждой панели фазовый контраст показывает присутствие дендритных клеток. В нижней части, флуоресценция DsRED из тех же самых клеток показывает присутствие RPBLA, абсорбированных на плазматической мембране (2 часа) или фагоцитированных внутри клетки (5 и 10 часов). “N” = ядро.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Рассматриваемый рекомбинантный биологически активный полипептид является частью слитого белка, который образует рекомбинантные подобные белковым тельцам упорядоченные структуры (RPBLA), часто включенные в мембрану, в клетках-хозяевах, в которых они экспрессируются. Образование RPBLA индуцируется индуцирующей белковые тельца последовательностью (PBIS), состоящей из сигнального пепетида и домена запасного белка, которая образует отложения высокой плотности в этих клетках. Эти плотные отложения могут накапливаться в цитозоле, органелле эндомембранной системы, митохондриях, пластиде или могут секретироваться. За исключением семян некоторых зерновых растений, сама эукариотическая клетка-хозяин не продуцирует белковые тельца (РВ) в отсутствие этого слитого белка. Таким образом, именно экспрессия этого слитого белка и его PBIS-части заставляют клетку-хозяина образовывать подобные белковым тельцам упорядоченные структуры или RPBLA.
Рассматриваемый слитый белок содержит две полипептидные последовательности, связанные вместе непосредственно или опосредованно пептидной связью, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), связанной со второй последовательностью, которая является представляющим интерес биологически активным полипептидным продуктом (например, пептидом или белком) (мишенью). Этот биологически активный полипептид, обнаруживаемый в природе, является гетерологичным относительно указанных эукариотических клеток-хозяев и, следовательно, экспрессируется во втором типе клеток, которые отличаются от вышеупомянутой эукариотической клетки-хозяина, или его получают синтетически. То есть, биологически активный полипептид является гетерологичным относительно вышеуказанных эукариотических клеток-хозяев. PBIS являются аминокислотными последовательностями белков или полипептидов, которые опосредуют индукцию образования RPBLA и вхождение этого белка в органеллы и/или накапливание этого белка в органеллах, таких как ER. Этот слитый белок при его освобождении и отделении от PBIS проявляет биологическую активность, сходную с биологической активностью этого полипептида.
Биологически активный полипептид этого слитого белка проявляет по меньшей мере 25 процентов, предпочтительно по меньшей мере 50 процентов, более предпочтительно по меньшей мере 75 процентов и наиболее предпочтительно по меньшей мере 90 процентов биологической активности того же самого полипептида, выделенного из вышеуказанного второго типа клеток или синтезированного in vitro. Материал считается «биологически активным» или «биоактивным», если он взаимодействует с любым метаболитом, белком, рецептором, органеллой, клеткой или тканью в организме или влияет на любой метаболит, белок, рецептор, органеллу, клетку или ткань в организме.
Эти биологические активности могут быть легко определены качественно и количественно с использованием стандартных способов для определения активности этого полипептида. Например, могут сравниваться результаты анализа на биологическую активность между полипептидом, выделенным из второго типа клеток или синтезированным in vitro, и экспрессированным полипептидом. При сравнении активности слитого белка в этом анализе учитывают долю этого материала, обеспечиваемую PBIS и любой линкерной последовательностью. Биологическая активность может проявляться экспрессируемыми RPBLA, слитым белком в виде белка, не содержащего окружающей мембраны, или в виде полипептида-мишени, который не содержит его PBIS.
В конкретном варианте осуществления, последовательность нуклеиновой кислоты, используемая для трансформации, содержит (i) последовательность нуклеиновой кислоты, кодирующую PBIS, и (ii) последовательность нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую представляющий интерес продукт. В одном варианте осуществления, 3'-конец последовательности нуклеиновой кислоты (i) связан с 5'-концом указанной последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, 5'-конец последовательности нуклеиновой кислоты (i) связан с 3'-концом указанной последовательности нуклеиновой кислоты (ii). Таким образом, последовательность PBIS может находиться на N-конце или С-конце этого слитого белка. Должно быть понятно, что все из ДНК-связей, обсуждаемые здесь для экспрессии слитого белка, являются такими, что эти два компонента слитого белка экспрессируются в рамке считывания.
Большинство белковых телец имеют округлые (обычно сферические) структуры, с диаметрами приблизительно 0,5 - приблизительно 3,0 мкм. При экспрессии в клетках животных, RPBLA являются обычно сферическими по форме, имеют диаметры приблизительно 0,5 - приблизительно 3 мкм и имеют окружающую их мембрану. RPBLA, экспрессируемые в растениях, являются обычно также сферическими, имеют диаметры приблизительно 0,5 - приблизительно 2 мкм и окружены мембраной. RPBLA, экспрессируемые в растениях, животных или грибах, получают из ER, если они нацелены туда ER-специфическим сигналом секреции, и накапливаются наружно на оболочке ER клетки-хозяина после сборки. Следует отметить, что EGF-содержащие RPBLA, экспрессируемые в ER клеток растений, обычно не были сферическими и были более аморфными по форме и имели неоднородный размер.
Рекомбинантные подобные белковым тельцам упорядоченные структуры имеют предопределенную плотность, которая может различаться среди различных слитых белков, но является известной для получаемого конкретного слитого белка. Эта предопределенная плотность RPBLA является обычно большей, чем плотность по существу всех эндогенных белков клетки-хозяина, присутствующих в гомогенате, и обычно равна приблизительно 1,1 - приблизительно 1,35 г/мл. Эта высокая плотность новых RPBLA обусловлена общей способностью рекомбинантных слитых белков собираться в виде мультимеров и накапливаться в виде упорядоченных агрегатов, связанных с мембранами. Рассматриваемые RPBLA экспрессируются в эукариотах и могут быть охарактеризованы по их плотностям, как отмечалось выше, и по их размеру и форме.
Считается, что полипептидная часть слитого белка получает ее биологическую активность из укладки внутри ER и в некоторых случаях из гликозилирования в ER. Интересно, что большинство растений, животных, таких как млекопитающие, и одноклеточные эукариоты, такие как грибы, N-гликозилируют белки в одной и той же схеме гликозилирования, основанной на трипептидной последовательности гликозилирования Asn-X-Ser или Asn-X-Thr, где “X” является любым аминокислотным остатком, кроме пролина. Таким образом, сначала образуется N-связанный полипептид Glc3Man9(GlcNAc)2 и подрезается обратно после образования N-связанного полипептида Man7-9(GlcNAc)2, который может экскретироваться в аппарат Гольджи или сохраняться в ER. Это базальное гликозилирование является удивительно сходным во всех родах эукариот. Дополнительная посттрансляционная модификация, такая как специфическое для хозяина терминальное гликозилирование, может встречаться в аппарате Гольджи для белков, не сохраненных в RPBLA, таких как рассматриваемые здесь слитые белки.
В этом способе обеспечены рекомбинантные подобные белковым тельцам упорядоченные структуры (RPBLA), которые часто содержат заключенную в мембрану упорядоченную структуру слитого белка, предпочтительно присутствуют в основном в сферической форме, имеющей диаметр приблизительно 0,5 - приблизительно 3 мкм. Этот слитый белок содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является биологически активным полипептидом. Эти RPBLA контактируют с водным буфером, содержащим разрушающее упорядоченную структуру мембраны количество детергента (поверхностно-активного вещества). Этот контакт поддерживают в течение периода времени, достаточного для разрушения упорядоченной структуры мембраны, и при температуре, которая не денатурирует биологически активный полипептид (например, выше замерзания до приблизительно 40оС) для разделения мембраны и слитого белка. После этого отделенный слитый белок собирают обычным образом или он может действовать далее без сбора. Иллюстративные применимые поверхностно-активные вещества включают в себя Тритон-Х 100, CHAPS и т.п., известные в биохимии для солюбилизации липидов.
Отделенный слитый белок находится обычно в нерастворимой форме вследствие взаимодействий среди PBIS-частей слитого белка, опосредованных по меньшей мере частично присутствием остатков цистеина. Однако представляющий интерес полипептид образует комплекс с эукариотическими шаперонами и фолдазами, происходящими из ER, и, следовательно, удерживается в правильно уложенной конформации, несмотря на то, что он связан с упорядоченным (и, следовательно, нерастворимым) доменом PBIS. Взаимодействия PBIS-PBIS могут быть разрушены и слитый белок может быть солюбилизирован контактированием слитого белка с водным буфером, который содержит восстанавливающий агент, такой как дитиотреитол или 2-меркаптоэтанол (β-МЕ). Условия выбирают таким образом, чтобы не разрушить и не нарушить укладку присоединенного представляющего интерес биологически активного белка. Затем этот отделенный солюбилизированный слитый белок, который содержит биологически активный полипептид, собирают или используют иным образом. Кроме того, две части этого слияния могут быть отщеплены одна от другой после солюбилизации. Должно быть понятно, что расщепление не должно обязательно происходить при точных границах между этими двумя белками.
В некоторых вариантах осуществления, отделенный слитый белок обнаруживает биологическую активность этого биологически активного полипептида. В других вариантах осуществления, слитый белок растворяют или диспергируют в подходящем буфере для проявления биологической активности этого полипептида. Например, как обсуждается подробно далее, гормон роста человека (hGH), экспрессированный в RPBLA в клетках млекопитающих и солюбилизированный в виде слитого белка, проявлял значительную активность и так же, как отщепленный полипептид, проявлял активности, по существу сходные с активностью нативного полипептида.
В других вариантах осуществления, этот слитый белок должен был быть расщеплен на составляющие его части перед проявлением биологической активности этого полипептида. Таким образом, биологически активный полипептид может быть связан с PBIS спейсерной аминокислотной последовательностью, которая является расщепляемой ферментативными или химическими средствами. Затем, после отщепления PBIS этого слитого белка и анализа полипептид-мишень (биологически активный полипептид) проявляет биологическую активность. Исследования, обсуждаемые здесь далее, иллюстрируют биологическую активность полипептида Т-20, отщепленного от его партнера слияния и продуцируемого в растениях.
Индуцирующие белковые тельца последовательности
Рассматриваемые индуцирующие белковые тельца последовательности (PBIS) и клетка-хозяин относятся предпочтительно к различным биологическим типам. Так, PBIS предпочтительно происходит из высшего растения, семенного растения, в то время как клетка-хозяин является эукариотом, который является другим, чем семенное растение, и может быть клеткой животного, например клетками млекопитающих или насекомых, грибом или клеткой водоросли, все из которых относятся к другим типам, чем семенные растения. PBIS и клетка-хозяин могут также относиться к одному и тому же типу, например оба могут происходить из высшего растения. Иллюстративные, неограничивающие примеры PBIS включают в себя запасные белки или модифицированные запасные белки, такие как, например, проламины или модифицированные проламины, домены проламинов или модифицированные домены проламинов. Проламины обсуждаются в обзоре Shewry et al., 2002 J. Exp. Bot. 53 (370):947-958. Предпочтительными PBIS являются PBIS производных проламинов, такие как гамма-зеин, альфа-зеин, дельта-зеин, бета-зеин, проламин риса и гамма-глиадин, которые обсуждаются здесь далее.
PBIS включает в себя также последовательность, которая направляет белок в направлении эндоплазматического ретикулума (ER) клетки растения. Эта последовательность, часто называемая лидерной последовательностью или сигнальным пептидом, может происходить из того же самого растения или из животного или гриба. Иллюстративными сигнальными пептидами являются состоящая из 19 остатков последовательность сигнального пептида альфа-зеина, показанная в WO 2004003207 (US 20040005660), состоящая из 19 остатков последовательность сигнального пептида альфа-глиадина или состоящая из 21 остатка последовательность сигнального пептида гамма-глиадина (см. Altschuler et al., 1993 Plant Cell 5:443-450; Sugiyama et al., 1986 Plant Sci. 44:205-209; и Rafalski et al., 1984 EMBO J 3(6):1409-11415 и ссылки в них). Связанный с патогенезом белок класса PR10 включает в себя состоящую из 25 остатков последовательность сигнального пептида, которая также применима здесь. Подобным образом функционирующие сигнальные пептиды из других растений и животных также сообщаются в литературе.
Характеристики сигнальных пептидов, ответственных за направление белка в ER, основательно исследовались (von Heijne et al., 2001 Biochim. Biophys. Acta Dec 12 1541 (1-2):114-119). Эти сигнальные пептиды не имеют гомологии в первичной структуре, но имеют обычную состоящую из трех частей структуру: центральный гидрофобный h-район и гидрофильные N- и С-концевые фланкирующие районы. Эти сходства и тот факт, что белки перемещаются через мембрану ER с использованием, по-видимому, общих путей, позволяют взаимообмен этих сигнальных пептидов между различными белками или даже из различных организмов, принадлежащих к разным типам (см. примеры 1 и 2 далее и Martoglio et al., 1998 Trends Cell Biol. Oct; 8(10):410-415). Таким образом, PBIS может включать в себя пептид из белка из типа, отличающегося от высших растений.
Гамма-зеин, запасной белок кукурузы, последовательности ДНК и аминокислотных остатков которого показаны здесь далее, является одним из четырех проламинов кукурузы и составляет 10-15 процентов общего белка в эндосперме кукурузы. Как и другие проламины зерновых культур, альфа- и гамма-зеины биосинтезируются в мембраносвязанных полисомах на цитоплазматической стороне неровного (шероховатого) ER, собираются в просвете (полости) и затем секвестрируются в происходящие из ER белковые тельца (Herman et al., 1999 Plant Cell 11:601-613; Ludevid et al., 1984 Plant Mol. Biol. 3:277-234; Torrent et al., 1986 Plant Mol. Biol. 7:93-403).
Гамма-зеин состоит из четырех характерных доменов i) сигнального пептида из 19 аминокислот, ii) домена повторов, содержащего восемь единиц гексапептида PPPVHL (SEQ ID NO:1) [(53 аминокислотных остатка (aa)], iii) домена ProX, где остатки пролина перемежаются с другими аминокислотами (29 аминокислот, aa) и iv) гидрофобного богатого цистеином С-концевого домена (111 аминокислот, aa).
Способность гамма-зеина собираться в ER-происходящие RPBLA не ограничивается семенами. Действительно, при конститутивной экспрессии гена гамма-зеина в трансгенных растениях Arabidopsis этот запасной белок накапливается в происходящих из ER PBLS клетках мезофилла листьев (Geli et al., 1994 Plant Cell 6: 1911-1922). При поиске сигнала, ответственного за отложение гамма-зеина в происходящие из ER белковые тельца (проламины не имеют сигнала KDEL), было продемонстрировано, что для ER-удерживания был необходим богатый пролином N-концевой домен, включающий в себя тандемный домен повторов. В этой работе было высказано предположение, что С-концевой домен мог бы участвовать в образовании белкового тельца, однако недавние данные (WO 2004003207 A1) демонстрируют, что богатый пролином N-концевой домен является необходимым и достаточным для удерживания в ER и для индукции образования белковых телец. Однако механизмы, при помощи которых эти домены стимулируют сборку белковых телец, являются все еще неизвестными, но результаты из исследований in vitro предполагают, что N-концевая часть гамма-зеина способна к самосборке в упорядоченные структуры.
Предпочтительно, PBIS на основе гамма-зеина включают в себя по меньшей мере один повтор и девять аминоконцевых остатков домена ProX, и более предпочтительно весь домен Pro-X. С-концевая часть гамма-зеина не является необходимой, но может присутствовать. Эти последовательности показаны в US 20040005660 и обозначены как RX3 и PA, соответственно, и показаны здесь далее.
Поскольку белковые тельца называют таким образом только в семенах, аналогичные структуры, продуцируемые в других органах растений и не в высших растениях, называют в общем синтетическими РВ или рекомбинантными подобными белковым тельцам упорядоченными структурами (RPBLA).
Зеины составляют четыре различающихся типа: альфа, бета, дельта и гамма. Они накапливаются последовательным образом в происходящих из ER белковых тельцах во время развития эндосперма. Бета-зеин и дельта-зеин не накапливаются в большом количестве в РВ кукурузы, но они были стабильными в вегетативных тканях и откладывались в происходящих из ER подобных белковым тельцам структурах при экспрессии в растениях табака (Bagga et al., 1997 Plant Cell Sep 9(9): 1683-1696). Этот результат указывает на то, что бета-зеин, а также дельта-зеин могут индуцировать удерживание в ER и образование белковых телец.
Запасные белки типа проламинов пшеницы, глиадины, являются группой не содержащих K/HDEL белков, транспорт которых через ER, по-видимому, является сложным. Эти белки секвестрируются в ER, где они либо удерживаются, либо упаковываются в плотные белковые тельца или транспортируются из ER через аппарат Гольджи в вакуоли. (Altschuler et al., 1993 Plant Cell 5: 443-450). Глиадины, по-видимому, являются природными химерами, содержащими два отдельно уложенных автономных района. N-конец состоит из приблизительно 7 - приблизительно 16 тандемных повторов, богатых глутамином и пролином. Последовательность этих тандемных повторов варьируется среди различных глиадинов, но они основаны на одной или на других консенсусных последовательностях PQQPFPQ (SEQ ID NO:47), PQQQPPFS (SEQ ID NO:48) и PQQPQ (SEQ ID NO:49). C-концевой район этого белка содержит шесть - восемь цистеинов, которые образуют внутримолекулярные дисульфидные связи. Работа группы Altschuler et al. показывает, что N-концевой район и консенсусные последовательности являются ответственными за образование РВ в ER из гамма-глиадина (Altschuler et al., 1993 Plant Cell 5: 443-450).
Другие иллюстративные применимые последовательности типа проламинов показаны ниже в таблице вместе с их идентификаторами GenBank.
Дополнительные применимые последовательности получают проведением поиска BLAST в базе данных всех неизбыточных CDS GenBank translations+PDB+SwissProt+PIR+PRF (за исключением средовых проб), как описано в Altschul et al., 1997 Nucleic Acids Res. 25: 3389-3402, с использованием запрашиваемой последовательности, такой как указанные ниже:
Запрос RX3 (SEQ ID NO:2)
Aльфа-зеин (SEQ ID NO:3)
Запрос проламина риса (SEQ ID NO:4)
Иллюстративный модифицированный проламин включает в себя (a) последовательность сигнального пептида, (b) последовательность одной или нескольких копий домена повторов гексапептида PPPVHL (SEQ ID NO:1) белка гамма-зеина, полного домена, содержащего восемь гексапептидных единиц; и (c) последовательность всего или части домена ProX гамма-зеина. Иллюстративные конкретные модифицированные проламины включают в себя полипептиды, идентифицированные ниже как R3, RX3 и P4, последовательности ДНК и аминокислотные последовательности которых также показаны ниже.
Особенно предпочтительные проламины включают в себя гамма-зеин и части его компонентов, описанные в опубликованной заявке WO2004003207, белок rP13 риса и альфа-зеин 22 кД кукурузы и его N-концевой фрагмент. Последовательности ДНК и последовательности аминокислотных остатков гамма-зеина, белков риса и альфа-зеина показаны ниже.
Гамма-зеин 27 кД
ДНК-последовательность (SEQ ID NO:5)
Последовательность белка (SEQ ID NO:6)
RX3
ДНК-последовательность (SEQ ID NO:7)
Последовательность белка (SEQ ID NO:8)
R3
ДНК-последовательность (SEQ ID NO:9)
Последовательность белка (SEQ ID NO:10)
P4
ДНК-последовательность (SEQ ID NO:11)
Последовательность белка (SEQ ID NO:12)
X10
ДНК-последовательность (SEQ ID NO:13)
Последовательность белка (SEQ ID NO:14)
rP13 - проламин риса 13 кД, гомологичный клону - AB016504 Sha et al., 1996 Biosci. Biotеcnol. Biochem. 60(2):335-337; Wen et al., 1993 Plant Physiol. 101(3):1115-1116; Kawagoe et al., 2005 Plant Cell 17(4):1141-1153; Mullins et al., 2004 J. Agric. Food Chem. 52(8):2242-2246; Mitsukawa et al., 1999 Biosci. Biotechnol. Biochem. 63(11):1851-1858
Последовательность белка (SEQ ID NO:15)
ДНК-последовательность (SEQ ID NO:16)
22aZt N-концевой фрагмент альфа-зеина 22 кД кукурузы - V01475 - Kim et al., 2002 Plant Cell 14 (3):655-672; Woo et al., 2001 Plant Cell 13(10):2297-2317; Matsushima et al., 1997 Biochim. Biophys. Acta 1339(1):14-22; Thompson et al., 1992 Plant Mol. Biol. 18(4):827-833.
Последовательность белка (полноразмерная) (SEQ ID NO:17)
ДНК-последовательность (SEQ ID NO:18)
Предшественник гамма-глиадина - AAA34272- Scheets et al., 1988 Plant Sci. 57:141-150.
Последовательность белка (SEQ ID NO:19)
ДНК-последовательность (SEQ ID NO:20)
Бета-зеин - AF371264 - Woo et al., (2001) Plant Cell 13(10), 2297-2317.
ДНК (SEQ ID NO: 21)
Белок (SEQ ID NO:22)
Дельта-зеин 10 кД - AF371266- Woo et al., (2001) Plant Cell 13(10), 2297-2317 и Kirihara et al., (1988) Gene. Nov 30; 71(2):359-70.
ДНК (SEQ ID NO:23)
Белок (SEQ ID NO:24)
Сигнальные пептиды
Гамма-зеин (SEQ ID NO:25)
Aльфа-глиадин (SEQ ID NO:26)
Гамма-глиадин (SEQ ID NO:27)
PR10 (SEQ ID NO:28)
Представляющие интерес белки
Примеры представляющих интерес полипептидов или белков (мишеней) включают в себя любой белок, имеющий терапевтические, нутрацевтические, сельскохозяйственные, биоконтрольные или промышленные применения. Иллюстративные активности таких белков включают в себя (а) захват и излучение света, такие как обеспечиваемые зеленым флуоресцентным белком (GFP), усиленным сине-зеленым флуоресцентным белком (ECFP), красным флуоресцентным белком (DsRED) и т.п.; (b) ферментативную активность, которая ассоциирована с первичной и вторичной трансдукцией внутриклеточного сигнала и метаболическими путями и может быть иллюстрирована энтерокиназой, бета-глюкуронидазой (GUS), фитазой, карбангидразой и промышленными ферментами (гидролазами, гликозидазами, целлюлазами, оксидоредуктазами, и т.п.); (c) взаимодействие белок-белок, белок-рецептор и белок-лиганд, такие как, например, антитела (mAb, такие как IgG, IgM, IgA и т.д.) и их фрагменты, гормоны [кальцитонин, гормон роста человека (hGH), эпидермальный фактор роста (EGF) и т.п.], ингибиторы протеазы, антибиотики, антимикробные агенты, ингибиторы внедрения ВИЧ [Ryser et al., 2005 Drug Discov Today. Aug. 15/10(16): 1085-1094], коллаген, лактоферрин человека и цитокины; (d) белковые и пептидные антигены для вакцин (вирус иммунодефицита человека, ВИЧ; пре-поверхностные, поверхностные и коровые антигены гепатита В, ген Р1 структурного полипротеина ящура (FMDV) [Dus Santos et al., 2005 Vaccine. Mar 7;23(15): 1838-1843], T-клетки стимулирующие пептиды Патента США № 4882145, коронавирус гастроэнтерита, папилломавирус человека и т.п.); (e) взаимодействия белок-не-белок, например фитогемагглютинин (PHA), субъединица В рицинового токсина (токсина семян клещевины) (RTB) и другие лектины.
Анализы на биоактивность таких экспрессируемых полипептидов хорошо известны в данной области и доступны в одной или нескольких публикациях. Например, активность ECFP (усиленного сине-зеленого флуоресцентного белка) может быть измерена количественным измерением флуоресценции, испускаемой при длине волны 470-530 нм при возбуждении этого белка при 458 нм (см. Richards et al., 2003 Plant Cell Rep. 22:117-121). Ферментативная активность энтерокиназы (ЕК) может быть, например, измерена с использованием двух различных подходов. Эта активность может быть определена анализом расщепления слитого белка, содержащего сайт специфического расщепления энтерокиназы, при помощи вестерн-блота, как обсуждается в каталоге Invitrogen Life Technologies (E180-01 и E180-2), а также количественным определением активности ЕК с использованием флуорогенного пептидного субстрата для EK (Sigma G-5261, CAS® RN 70023-02-8); активность фермента измеряют по увеличению флуоресценции (возбуждение при 337 нм, испускание при 420 нм), вызываемому высвобождением β-нафтиламина из этого пептида, на протяжении времени (см. LaVallie et al., 1993 J. Biol. Chem. 268 (31): 23311-23317). Активность фермента бета-глюкуронидазы (GUS) может быть измерена превращением субстрата MUG (4-метилумбеллиферилглюкуронида) в продукт MU. Этот продукт может быть определен количественно измерением флуоресценции с возбуждением при 365 нм, испусканием при 455 нм на спектрофлуориметре (см. Pai-Hsiang et al., 2001 J. Plant Physiol. 158(2):247-254; и Jefferson et al., 1987 EMBO J 6:3901-3907). Анализы фитазы проводят количественным определением неорганических ортофосфатов, высвобождаемых из реагента ААМ, состоящего из ацетона, 5,0 н. серной кислоты и 10 мМ молибдата аммония (см. Ullah et al., 1999 Biochem. Biophys. Res. Commun. 264(1):201-206). Аналогичные анализы доступны для других биологических белков. Анализы активности RTB могут выполняться измерением связывания RTB с асиалофетуином, лактозой и галактозой, как описано в Reed et al., 2005 Plant Cell Rep. Apr,24(1):15-24.
EGF является фактором роста, участвующим в пролиферации фибробластов. Активность EGF может быть анализирована количественным определением индукции синтеза ДНК, измеренного по включению аналога пиримидина 5-бром-2'-дезоксиуридина (BrdU) вместо тимидина в ДНК пролиферирующих клеток с использованием набора ELISA для пролиферации клеток [Oliver, et al., 2004 Am. J. Physiol. Cell Physiol. 286:1118-1129; Catalog no. 1647229, Roche Diagnostics, Mannheim, Germany].
Отмечается, что улавливание и излучение света составляет отдельный и особый тип «биологической активности», отличающийся тем, что такая активность не обеспечивает терапевтического, нутрацевтического, сельскохозяйственного, биоконтрольного или промышленного применения, как это делают другие типы активности, отмеченные выше. Полипептиды этого класса мишеней включены здесь в качестве биологически активных, так как они имеют некоторые из требуемых вторичных, третичных и четвертичных структурных признаков, общие с признаками молекул-мишеней, которые обеспечивают терапевтическое, нутрицевтическое, биоконтрольное или промышленное применения. Однако эти белки применимы в качестве репортерных молекул во многих типах анализов или скринингов, используемых в анализе или обнаружении биологически важных молекул, и их люминесцентная активность требует присутствия правильной вторичной и третичной структуры белка. Можно более точно назвать группу мишеней, таких как полипептиды, которые являются биологически активными, и/или таких, которые являются люминесцентно активными.
Ниже приведены последовательности ДНК и последовательности аминокислотных остатков для иллюстративных представляющих интерес белков.
ECFP
ДНК (SEQ ID NO:29)
белок (SEQ ID NO:30)
GUS1381
ДНК (SEQ ID NO:31)
белок (SEQ ID NO:32)
GUS1391Z
ДНК (SEQ ID NO:33)
белок (SEQ ID NO:34)
Кальцитонин лосося BAC57417
Последовательность белка (SEQ ID NO:35)
Последовательность ДНК (SEQ ID NO:36)
hEGF - Конструкция на основе AAF85790 без сигнального пептида
Последовательность белка (SEQ ID NO:37)
Последовательность ДНК (SEQ ID NO:38)
hGH - Конструкция на основе P01241 без сигнального пептида
Последовательность белка (SEQ ID NO:39)
Последовательность ДНК (SEQ ID NO:40)
В другом варианте осуществления, рекомбинантный слитый белок дополнительно содержит, кроме последовательностей PBIS и представляющего интерес продукта, спейсерную аминокислотную последовательность. Этой спейсерной аминокислотной последовательностью может быть аминокислотная последовательность, расщепляемая ферментативными или химическими средствами или нерасщепляемая. Под выражением «нерасщепляемая» имеют в виду, что расщепление этого спейсера не происходит без деструкции некоторой части или всего биологически активного полипептида.
В конкретном варианте осуществления, спейсерная аминокислотная последовательность помещена между PBIS и биологически активным полипептидом. Иллюстративная аминокислотная последовательность может расщепляться протеазой, такой как энтерокиназа, Arg--C эндопротеаза, Glu--C эндопротеаза, Lys--C эндопротеаза, Фактор Xa, протеазы SUMO [Tauseef et al., 2005 Protein Expr. Puπf. 2005 Sep 43(1): 1-9] и т.п. Альтернативно, эта спейсерная аминокислотная последовательность соответствует саморасщепляемой последовательности, такой как аутопроцессирующая 2А последовательность вируса FMDV, интеины, такие как интеин Ssp DNAb и т.п., которые коммерчески доступны из New England Biolabs и из других фирм-поставщиков. Применение линкерной последовательности интеина является предпочтительным, так как такие последовательности могут быть селективно индуцированы для вызывания сплайсинга белка и посредством этого элиминации их из экспрессированного, извлеченного белка. Интеины являются особенно интересными, так как они не требуют больших ферментов-белков для достижения их сайта-мишени для отщепления PBIS от представляющего интерес белка. Это свойство может быть особенно полезным для прямого выделения представляющих интерес белков из интактных RPBLA. Альтернативно, кодируется аминокислотная последовательность, которая является специфически расщепляемой химическим реагентом, таким как, например, цианогенбромид, который расщепляет при остатках метионина.
В следующем варианте осуществления, последовательность нуклеиновой кислоты, используемая для целей трансформации, является последовательностью, описанной в соответствии с совместно переуступленной заявкой на патент WO 2004003207, с последовательностью нуклеиновой кислоты или без последовательности нуклеиновой кислоты, кодирующей расщепляемую аминокислотную последовательность
Способы получения
В предпочтительном варианте осуществления, слитые белки получают в соответствии со способом, который предусматривает трансформацию системы эукариотических клеток-хозяев, такую как животное, культура клеток животных, растение или культура клеток растений, культура гриба, культура клеток насекомых или культура водорослей, последовательностью нуклеиновой кислоты (ДНК или РНК), содержащей (i) первую нуклеиновую кислоту, кодирующую PBIS, которая функционально связана в рамке считывания с (ii) последовательностью второй нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую представляющий интерес полипептидный продукт, который является биологически активным; то есть последовательность нуклеиновой кислоты, которая кодирует PBIS, химически связана (связана пептидной связью) с последовательностью, которая кодирует представляющий интерес полипептид, так что оба полипептида экспрессируются из их правильных рамок считывания и представляющий интерес белок является биологически активным. Предполагается также, что подходящие регуляторные последовательности присутствуют на любой стороне последовательностей нуклеиновых кислот, которые кодируют PBIS и представляющий интерес белок, как обсуждается далее. Такие регуляторные последовательности хорошо известны и присутствуют в коммерчески доступных векторах. Применение непрямых средств введения ДНК, таких как введение через вирусную трансдукцию или инфекцию, также обсуждается и будет использоваться взаимозаменяемо с прямыми способами доставки ДНК, такими как трансфекция.
Трансформированные клетка-хозяин или организм-хозяин поддерживаются в течение периода времени и при условиях культивирования, подходящих для экспрессии слитого белка и сборки этого экспрессированного слитого белка в рекомбинантные подобные белковым тельцам упорядоченные структуры (RPBLA). После экспрессии полученный слитый белок накапливается в трансформированной системе-хозяине в виде рекомбинантных подобных белковым тельцам упорядоченных структур высокой плотности. Затем этот слитый белок может быть выделен из этих клеток-хозяев, или клетки-хозяева, содержащие этот слитый белок, могут быть использованы, как будет желательно, например, для корма животного, содержащего добавленный нутриент или добавку. Слитый белок может быть выделен в виде части RPBLA или в виде не содержащего RPBLA белка.
Условия культивирования, подходящие для экспрессии этого слитого белка, обычно являются различными для каждого типа организма-хозяина или клетки-хозяина. Однако эти условия известны квалифицированным в данной области работникам и могут быть легко определены. Подобным образом продолжительность поддержания может быть разной в зависимости от клеток-хозяев и количества слитого белка, которое желательно получить. И в этом случае, эти условия хорошо известны и могут быть легко определены в конкретных ситуациях. Кроме того, конкретные условия культивирования могут быть получены из приведенных здесь ссылок.
В одном варианте осуществления, 3'-конец первой последовательности нуклеиновой кислоты (i) связан с 5'-концом второй последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, 5'-конец первой последовательности нуклеиновой кислоты (i) связан с 3'-концом второй последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, PBIS содержит запасной белок или модифицированный запасной белок, его фрагмент или модифицированный фрагмент.
В другом конкретном варианте осуществления, слитый белок получают в соответствии со способом, который предусматривает трансформацию системы клеток-хозяев, такую как животное, культура клеток животных, растение, культура клеток растений, культура гриба или водорослей, последовательностью нуклеиновой кислоты, содержащей, кроме последовательностей нуклеиновых кислот (i) и (ii), упомянутых ранее, последовательность нуклеиновой кислоты (iii) в рамке считывания, которая кодирует спейсерную аминокислотную последовательность. Эта спейсерная аминокислотная последовательность может быть аминокислотной последовательностью, расщепляемой ферментативными или химическими средствами или нерасщепляемой, как отмечалось ранее. В одном конкретном варианте осуществления, последовательность нуклеиновой кислоты (iii) помещена между указанными последовательностями нуклеиновых кислот (i) и (ii), например, 3'-конец третьей последовательности нуклеиновой кислоты (iii) связан с 5'-концом второй последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, 5'-конец третьей последовательности нуклеиновой кислоты (iii) связан с 3'-концом второй последовательности нуклеиновой кислоты (ii).
Последовательность (сегмент) нуклеиновой кислоты, которая кодирует описанную ранее молекулу слитого белка, или комплемент этой кодирующей последовательности также обсуждается здесь. Такой сегмент нуклеиновой кислоты в некоторых предпочтительных вариантах осуществления присутствует в выделенной или очищенной форме.
В живых организмах, последовательность аминокислотных остатков белка или полипептида прямо связана через генетический код с последовательностью дезоксирибонуклеиновой кислоты (ДНК) гена, который кодирует этот белок. Таким образом, посредством хорошо известной вырожденности генетического кода могут быть получены дополнительные последовательности ДНК и соответствующие последовательности РНК (нуклеиновые кислоты), если желательно, которые кодируют последовательности аминокислотных остатков того же самого слитого белка, но являются достаточно отличающимися от обсуждаемой выше последовательности гена, чтобы не гибридизоваться при условиях высокой строгости, но гибридизоваться при условиях умеренной строгости.
Условия высокой строгости могут быть определены как условия, предусматривающие гибридизацию при температуре приблизительно 50-55°C в 6XSSC и конечную промывку при температуре 68°C в 1-3XSSC. Условия умеренной строгости предусматривают гибридизацию при температуре приблизительно 50°C - приблизительно 65°C в 0,2 - 0,3 M NaCl, с последующим промыванием при приблизительно 50оC - приблизительно 55°C в 0,2XSSC, 0,1% ДСН (додецилсульфате натрия).
Последовательность нуклеиновой кислоты (последовательность ДНК или последовательность РНК), которая (1) сама кодирует или ее комплемент кодирует слитый белок, содержащий индуцирующую белковые тельца последовательность (PBIS) и представляющий интерес полипептид, также обсуждается здесь. Как хорошо известно, последовательность нуклеиновой кислоты, такая как рассматриваемая последовательность нуклеиновой кислоты, экспрессируется, когда она функционально связана с подходящим промотором в подходящей экспрессионной системе, как обсуждается в другом месте здесь. Эта последовательность нуклеиновой кислоты может доставляться прямо или опосредованно (через подходящий векторный организм, такой как вирус или бактерия) в эукариотическую клетку-хозяина и может стабильно интегрироваться в ядерный геном или геном органеллы хозяина или экспрессироваться транзиторно без интеграции в геном.
Различные хозяева часто имеют предпочтения в отношении конкретного кодона, который должен быть использован для кодирования конкретного аминокислотного остатка. Такие предпочтения кодонов хорошо известны, и последовательность ДНК, кодирующая желаемую последовательность слитого белка, может быть изменена с использованием, например, мутагенеза in vitro, так что предпочитаемые хозяином кодоны используются для конкретного хозяина, в котором должен экспрессироваться этот слитый белок.
Рекомбинантная молекула нуклеиновой кислоты, например молекула ДНК, содержащая вектор, содержащий одну или несколько регуляторных последовательностей (регуляторных элементов), таких как промотор, подходящий для запуска экспрессии этого гена в совместимой эукариотической клетке-хозяине (совместимом организме-хозяине), функционально связанный с сегментом (например, сегментом или последовательностью ДНК) экзогенной нуклеиновой кислоты, который определяет ген, кодирующий рассматриваемый слитый белок, как обсуждалось выше, также рассматривается в этом изобретении. Более конкретно, также рассматривается рекомбинантная молекула ДНК, которая содержит вектор, содержащий промотор, который запускает экспрессию этого слитого белка в клетках организма-хозяина, функционально связанный с ДНК-сегментом, который определяет ген, кодирующий индуцирующую белковые тельца последовательность (PBIS), связанную с представляющим интерес полипептидом. Эта рекомбинантная молекула ДНК после подходящей трансфекции и экспрессии в эукариотической клетке-хозяине обеспечивает рассматриваемый слитый белок в виде RPBLA.
Как хорошо известно в данной области, пока присутствует требуемая нуклеиновая кислота, например последовательность ДНК (в том числе стартовые сигналы и стоп-сигналы), обычно могут присутствовать дополнительные пары оснований на любом конце этого ДНК-сегмента, и этот сегмент все еще может быть использован для экспрессии этого белка. Это, конечно, предполагает отсутствие в этом сегменте функционально связанной последовательности ДНК, которая подавляет экспрессию, экспрессирует дополнительный продукт, который потребляет слитый белок, который желательно экспрессировать, экспрессирует продукт, который потребляет желаемый продукт реакции, продуцируемый этим желаемым слитым белком, или иным образом препятствует экспрессии гена этого ДНК-сегмента.
Таким образом, пока этот ДНК-сегмент не содержит таких мешающих ДНК-последовательностей, ДНК-сегмент этого изобретения может иметь длину приблизительно 500 - приблизительно 15000 пар оснований. Максимальный размер рекомбинантной молекулы ДНК, в частности экспрессирующего вектора, определяется в основном пригодностью и размером этого вектора, который может быть помещен в клетку-хозяина, при наличии всех минимальных последовательностей ДНК, необходимых для репликации и экспрессии, когда это желательно. Минимальные размеры векторов хорошо известны. ДНК-сегменты такой длины не являются предпочтительными, но могут быть использованы.
ДНК-сегмент, который кодирует описанный выше слитый белок, может быть синтезирован химическими способами, например фосфотриэфирным способом Matteucci et al., 1981 J. Am. Chem. Soc., 103:3185. Конечно посредством химического синтеза кодирующей последовательности любые желаемые модификации могут быть сделаны просто заменой подходящими основаниями оснований, кодирующих нативную последовательность аминокислотных остатков. Однако ДНК-сегменты, включающие в себя последовательности, специально обсуждаемые здесь, являются предпочтительными.
ДНК-сегменты, содержащие ген, кодирующий слитый белок, предпочтительно получают из рекомбинантных молекул ДНК (плазмидных векторов), содержащих этот ген. Вектор, который управляет экспрессией гена слитого белка в клетке-хозяине, называют здесь «экспрессирующим вектором».
Экспрессирующий вектор содержит элементы регуляции экспрессии, в том числе промотор. Кодирующий этот слитый белок ген функционально связан с экспрессирующим вектором для создания возможности этой промоторной последовательности управлять связыванием РНК-полимеразы и экспрессией кодирующего полипептид гена. Применимыми в экспрессии кодирующего полипептид гена являются промоторы, которые являются индуцибельными, вирусными, синтетическими, конститутивными, как описано Paszkowski et al., 1989 EMBO J., 3:2719 и Odell et al., 1985 Nature, 313:810, а также регулируемыми во времени, пространственно регулируемыми и регулируемыми пространственно и во времени, как описано в Chua et al., 1989 Science, 244:174-181.
Здесь обсуждаются экспрессирующие векторы, совместимые с клетками млекопитающих, водорослей или насекомых и т.п. Такие экспрессирующие векторы могут быть также использованы для образования рекомбинантных молекул ДНК данного изобретения. Экспрессирующие векторы эукариотических клеток хорошо известны в данной области и доступны из нескольких коммерческих источников. Обычно такие векторы содержат один или несколько подходящих сайтов рестрикции для встраивания желаемого ДНК-сегмента и промоторных последовательностей. Необязательно такие векторы содержат селектируемый маркер, специфический для применения в эукариотических клетках.
Получение слитого белка экспрессией рекомбинантных ДНК в клетках млекопитающих иллюстрируется далее с использованием рекомбинантного вектора ДНК, который экспрессирует ген слитого белка, в клетках-хозяевах яичника китайского хомячка (СНО), клетках-хозяевах обезьяны Cos1 и клетках-хозяевах человека 293Т. Это получение выполняют с использованием процедур, которые хорошо известны в данной области и описаны более подробно в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratories (1989).
Система клеток насекомых также может быть использована для экспрессии рассматриваемого слитого белка. Например, в одной такой системе вирус ядерного полиэдроза Autographa californica (AcNPV) или бакуловирус используют в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или в личинках Trichoplusia. Последовательности, кодирующие слитый белок, могут быть клонированы в не-эссенциальный район этого вируса, такой как ген полиэдрина, и помещены под контроль промотора полиэдрина. Успешное встраивание последовательности слитого белка делает ген полиэдрина неактивным и производит рекомбинантный вирус, не имеющий белка оболочки. Затем эти рекомбинантные вирусы могут быть использованы для инфицирования, например, клеток S. frugiperda или личинок Trichoplusia, в которых может экспрессироваться этот слитый белок E. Engelhard et al. (1994) Proc. Natl. Acad. Sci., USA, 91:3224-3227; и V. Luckow, "Insect Cell Expression Technology", pages 183-218, in Protein Engineering: Principles and Practice, J.L. Cleland et al. eds., Wiley-Liss, Inc, 1996). Гетерологичные гены, помещенные под контроль промотора полиэдрина вируса ядерного полиэдроза Autographa californica (AcNPV), часто экспрессируются при высоких уровнях во время поздних стадий инфекции.
Рекомбинантные бакуловирусы, содержащие ген слитого белка, конструируют с использованием системы бакуловирусного челночного вектора (Luckow et al., 1993 J. Virol., 67:4566-4579], продаваемого коммерчески в виде системы бакуловирусной экспрессии Bac-To-Bac™ (Life Technologies). Готовят исходные растворы рекомбинантных вирусов и экспрессию этого рекомбинантного белка подвергают мониторингу при помощи стандартных протоколов (O'Reilly et al., Baculovirus Expression Vectors: A Laboratory Manual, W.H. Freeman and Company, New York, 1992; и King et al., The Baculovirus Expression System: A Laboratory Guide, Chapman & Hall, London, 1992). Применение бакуловируса или других векторов доставки в клетках млекопитающих, таких как система 'BacMam', описанная T. Kost et al. (см., например, Merrihew et al., 2004 Methods Mol Biol. 246:355-365), или других таких систем, которые известны квалифицированным в данной области специалистам, также обсуждаются в данном изобретении.
Выбор, какой экспрессирующий вектор должен быть использован и, в конечном счете, с каким промотором должен быть функционально связан кодирующий слитый белок ген, зависит непосредственно от желаемых функциональных свойств, например от местоположения и тайминга экспрессии белка и подлежащей трансформации клетки-хозяина. Эти свойства являются хорошо известными ограничениями, имеющимися в области конструирования рекомбинантных молекул ДНК. Однако вектор, применимый в использовании на практике данного изобретения, может управлять репликацией и, предпочтительно, также экспрессией (для экспрессирующего вектора) гена слитого белка, включенного в сегмент ДНК, с которым он функционально связан.
Типичные векторы, применимые для экспрессии генов в клетках из высших растений и млекопитающих, хорошо известны в данной области и включают в себя векторы растений, произведенные из индуцирующей опухоли (Ti) плазмиды Agrobacterium tumefaciens, описанные Rogers et al. (1987) Meth. in Enzymol., 153:253-277, и экспрессирующие векторы млекопитающих pKSV-10, описанный выше, и pCI-neo (Promega Corp., #E1841, Madison, WI). Однако известно, что несколько других систем экспрессирующих векторов функционируют в растениях, в том числе вектор контроля переноса pCaMVCN, описанный Fromm et al. (1985) Proc. Natl. Acad. Sci. USA, 82:58-24. Плазмида pCaMVCN (доступная из Pharmacia, Piscataway, NJ) включает в себя промотор 35S CaMV (вируса мозаики цветной капусты).
Приведенные выше экспрессионные системы растений обычно обеспечивают системную или конститутивную экспрессию встроенного трансгена. Системная экспрессия может быть полезной, когда большую часть растения или все растение используют в качестве источника RPBLA и их слитых белков. Однако может быть более эффективной экспрессия RPBLA и содержащегося в них слитого белка в запасающем органе, таком как корень, семена или плоды, из которых эти частицы могут быть более легко выделены или приняты внутрь.
Одним способом достижения экспрессии в запасающем органе является применение промотора, который экспрессирует контролируемый им ген в одном или нескольких заранее выбранных или заранее заданных нефотосинтезирующих органах растения. Экспрессию в одном или нескольких заранее выбранных запасающих органах с малой экспрессией или с отсутствием экспрессии в других органах, таких как корни, семена или плод (а не листья или стебли), называют здесь усиленной или предпочтительной экспрессией. Примерный промотор, который управляет экспрессией в одном или нескольких заранее выбранных органах в сравнении с другим органом при соотношении по меньшей мере 5:1, определен здесь как усиливаемый органом промотор. Экспрессию по существу только в одном запасающем органе и по существу отсутствие экспрессии в других запасающих органах называют здесь органоспецифической экспрессией: т.е. отношение продуктов экспрессии в одном запасающем органе относительно другого приблизительно 100:1 или более свидетельствует об органоспецифичности. Таким образом, специфические в отношении запасающих органов промоторы являются членами класса усиливаемых запасающим органом промоторов.
Примеры запасающих органов растений включают в себя корни моркови, таро или маниока, клубни картофеля и мякоть плодов, таких как красная гуайява, плод страстоцвета (маракуйи), манго, папайи, томата, авокадо, вишни, тангерина, мандарина, пальмы, дыни, например канталупы (мускусной дыни), и арбузов и других сочных плодов, таких как тыква, огурцы, манго, абрикосы, персики, а также семена маиса (кукурузы), сои, риса, масличные семена рапса и т.п.
Обычно предполагается, что промотор CaMV 35S является конститутивным промотором. Однако исследование показало, что район 21 п.н. промотора CaMV 35S при функциональном связывании с другим, гетерологичным обычным промотором зеленой ткани, промотором rbcS-3A, может делать полученный химерный промотор усиливаемым корнем промотором. Эта последовательность 21 п.н. описана в патенте США №5023179. Этот химерный промотор rbcS-3A, содержащий инсерт 21 п.н. Патента США №5023179, является полезным усиливаемым корнем промотором.
Сходным усиливаемым корнем промотором, который включает в себя описанный выше сегмент 21 п.н., является район -90 - +8 самого промотора CаMV 35S. Патент США № 5110732 показывает, что этот укороченный промотор CaMV 35S обеспечивает усиленную экспрессию в корнях и зародышевом корне семени, ткани, которая должна стать корнем. Этот промотор является также применимым здесь.
Другим применимым усиливаемым корнем промотором является промотор -1616 - -1 гена семян масличного рапса (Brassica napus L.), описанный в PCT/GB92/00416 (WO 91/13922, опубликованном 19 сентября 1991 года). E. coli DH5 альфа, несущая плазмиду pRlambdaS4, и бактериофаг лямбда бета 1, которые содержат этот промотор, были депонированы в National Collection of Industrial and Marine Bacteria, Aberdeen, GB 8 марта 1990 года и имеют номера доступа NCIMB40265 и NCIMB40266. Применимая часть этого промотора может быть получена в виде фрагмента 1,0 т.п.н. расщеплением этой плазмиды с использованием HaeIII.
Предпочтительным усиливаемым в корне промотором является промотор маннопинсинтазы (mas), присутствующий в плазмиде pKan2, описанной DiRita and Gelvin (1987) Mol. Gen. Genet, 207:233-241. Этот промотор может быть удален из плазмиды pKan2 в виде XbaI-Xba1I-фрагмента.
Этот предпочтительный усиливаемый корнем промотор маннопинсинтазы состоит из центрального (корового) района промотора маннопинсинтазы (mas) до положения -138 и активатора маннопинсинтазы от -318 до -213, и в целом называется AmasPmas. Было обнаружено, что этот промотор увеличивает продуцирование в корнях табака приблизительно в 10 - приблизительно в 100 раз в сравнении с уровнями экспрессии в листьях.
Другой специфический для корней промотор является 5'-фланкирующей последовательностью 500 п.н., сопровождающей ген богатого гидроксипролином гликопротеина, HRGPnt3, экспрессируемого во время инициации латеральных корней, и сообщенного Keller et al. (1989) Genes Dev., 3:1639-1646. Другой предпочтительный специфический для корней промотор присутствует в 5'-фланкирующем районе приблизительно -636 - -1 специфического для корня табака гена ToRBF, сообщенного Yamamoto et al. (1991) Plant Cell, 3: 371-381. Эти цис-действующие элементы, регулирующие экспрессию, более конкретно, расположены, согласно этим авторам, в районе от приблизительно -636 до приблизительно -299 5' (слева) от сайта инициации транскрипции. Yamamoto et al. сообщали стационарное продуцирование мРНК из гена ToRBF в корнях, но не в листьях, меристемах побегов или стеблях.
Еще одним применимым специфическим для запасающего органа промотором являются 5'- и 3'-фланкирующие районы гена Е8 дозревания плодов E8, Lycopersicon esculentum. Эти районы и их кДНК-последовательности иллюстрированы и обсуждены в Deikman et al. (1988) EMBO J., 7(11):3315-3320 и Plant Physiol., 100:2013-2017 (1992).
Три района расположены в 2181 п.н. 5'-фланкирующей последовательности этого гена и последовательности 522 п.н. 3' (слева) от сайта присоединения поли (А), по-видимому, для регуляции экспрессии гена Е8. Один район от -2181 до -1088 необходим для активации транскрипции гена Е8 в незрелом плоде этиленом, а также способствует транскрипции во время дозревания. Два дополнительных района, -1088 - -863 и -409 - -263, не способны сообщать отвечаемость на этилен в незрелом плоде, но являются достаточными для экспрессии гена Е8 во время созревания.
Сообщалось, что промотор сахарозосинатазы-1 кукурузы (Sh), который в кукурузе экспрессирует регулируемый им фермент при высоких уровнях в эндосперме, при гораздо меньших уровнях в корнях и не экспрессирует в зеленых тканях или пыльце, экспрессирует химерный репортерный ген, β-глюкуронидазу (GUS), специфически в клетках флоэмы табака, которые являются обильными в стеблях и корнях (Yang et al. (1990) Proc. Natl. Acad. Sci., U.S.A., 87: 4144-4148). Таким образом, этот промотор применим для таких органов растений, как сочные плоды, например дыни, например канталупы, или семян, которые содержат эндосперм, и для корней, которые имеют высокие уровни клеток флоэмы.
Другим примером тканеспецифического промотора является промотор лектина, который является специфическим для ткани семени. Белок лектин в семенах сои кодируется единственным геном (Le1), который экспрессируется только во время созревания семян и составляет приблизительно 2 - приблизительно 5 процентов общей мРНК семени. Ген лектина и семеноспецифический промотор были полностью охарактеризованы и использованы для управления семеноспецифической экспрессией в трансгенных растениях табака. См., например, Vodkin et al. (1983) Cell, 34:1023 и Lindstrom et al. (1990) Developmental Genetics, 11:160.
Особенно предпочтительным клубнеспецифическим промотором экспрессии является 5'-фланкирующий район промотора гена пататина. Применение этого промотора описано в Twell et al. (1987) Plant Mol. Biol., 9:365-375. Этот промотор присутствует во фрагменте приблизительно 406 п.н. бактериофага LPOTI. Промотор LPOTI имеет районы с более чем 90-процентной гомологией с четырьмя другими промоторами пататина и приблизительно с более чем приблизительно 95-процентной гомологией на протяжении всех 400 оснований с промотором пататина PGT5. Каждый из этих промоторов применим здесь. См. также Wenzler et al. (1989) Plant Mol. Biol.,12:41-50.
Дополнительные усиливаемые органами растений и органоспецифические промоторы описаны в Benfey et al. (1988) Science, 244:174-181.
На каждую из используемых здесь промоторных последовательностей по существу не влияет количество RPBLA в клетке. В данном контексте, термин «по существу не влияет» означает, что этот промотор не отвечает на прямое регулирование по типу обратной связи (ингибирование) структурами RPBLA, накапливаемыми в трансформированных клетках или трансгенном растении.
Трансфекцию клеток растений с использованием Agrobacterium tumefaciens обычно наилучшим образом проводят на двудольных растениях. Однодольные растения обычно наиболее легко трансформируются так называемым прямым переносом генов с использованием протопластов. Прямой перенос генов обычно проводят электропорацией, опосредованным полиэтиленгликолем переносом или бомбардировкой клеток микроснарядами, несущими требуемую ДНК. Эти способы трансфекции хорошо известны в данной области и не требуют дополнительного объяснения здесь. Способы регенерации целых растений из трансфицированных клеток и протопластов также хорошо известны, как и способы получения желаемого белка из тканей растений. См. также Патенты США с номерами 5618988 и 5679880 и ссылки в них.
Трансгенное растение, образованное с использованием трансформации Agrobacterium, электропорации или других способов, обычно содержит единственный ген на одной хромосоме. Такие трансгенные растения могут называться гетерозиготными в отношении добавленного гена. Однако, поскольку слово «гетерозиготный» обычно подразумевает присутствие комплементарного гена в том же самом локусе второй хромосомы из пары хромосом и такого гена нет в растении, содержащем один добавленный ген, считается, что более точным названием для такого растения является название независимый сегрегант, так как добавленный, экзогенный кодирующий химерную молекулу ген расщепляется независимо во время митоза и мейоза. Трансгенное растение, содержащее усиливаемый органом промотор, запускающий единый структурный ген, который кодирует рассматриваемую химерную молекулу НВс; т.е. независимый сегрегант, является предпочтительным трансгенным растением.
Более предпочтительным является трансгенное растение, которое является гомозиготным в отношении добавленного структурного гена; т.е. трансгенное растение, которое содержит два добавленных гена, по одному гену в одном и том же локусе на каждой хромосоме пары хромосом. Гомозиготное трансгенное растение может быть получено половым скрещиванием (самоопылением) трансгенного растения, являющегося независимым сегрегантом, которое содержит единственный добавленный ген, проращиванием некоторой части полученных семян и анализом полученных растений, на увеличенное накапливание химерных частиц в сравнении с контролем (нативным, не-трансгенным) или трансгенным растением, являющимся независимым сегрегантом. Гомозиготное трансгенное растение обнаруживает увеличенное накапливание химерных частиц в сравнении как с нативным, нетрансгенным растением, так и с трансгенным растением, являющимся независимым сегрегантом.
Должно быть понятно, что два различных трансгенных растения могут быть также скрещены с получением потомства, которое содержит два независимо расщепляющихся добавленных, экзогенных (гетерологичных) гена. Самоопыление подходящего потомства может продуцировать растения, которые являются гомозиготными для обоих добавленных экзогенных генов, которые кодируют химерную молекулу НВс и могут передавать этот ген их потомству. Более предпочтительное трансгенное растение является гомозиготным в отношении гетерологичного гена и передает этот ген всему его потомству при половом скрещивании.
Экспрессируемые RPBLA и их слитые продукты могут быть получены из экспрессии клеток-хозяев обычными способами, используемыми в биохимическом и биологическом получении. Поскольку RPBLA являются плотными относительно других белков, присутствующих в клетках-хозяевах, эти RPBLA особенно удобны для сбора центрифугированием клеточного гомогената.
Таким образом, районы различной плотности образуются в гомогенате для обеспечения района, который содержит относительно увеличенную концентрацию RPBLA, и района, который содержит относительно истощенную концентрацию RPBLA. RPBLA-истощенный район отделяют от района относительно увеличенной концентрации RPBLA, очищая посредством этого указанный слитый белок. После этого район относительно увеличенной концентрации RPBLA может быть собран или может быть обработан одним или несколькими реагентами или подвергнут одной или нескольким процедурам перед выделением RPBLA или слитого белка, находящегося в них. В некоторых вариантах осуществления, собранные RPBLA используют в том виде, в каком они находятся, без необходимости выделения слитого белка, например при использовании этих RPBLA в качестве пероральной вакцины. Слитый белок, содержащий биологически активный полипептид, может быть получен из собранных RPBLA растворением окружающей мембраны в водном буфере, содержащем детергент и восстанавливающий агент, как обсуждалось ранее. Иллюстративные восстанавливающие агенты включают в себя 2-меркаптоэтанол, тиогликолевую кислоту и соли тиогликолевой кислоты, дитиотреитол (ДТТ), ионы сульфита или бисульфита с последующими обычными способами выделения белков. Предпочтительным детергентом является додецилсульфат натрия (ДСН), хотя могут быть также использованы другие ионогенные (деоксихолат,1N-лауроилсаркозин и т.п.), неионогенные (Tвин® 20, Nonidet® P-40, октилглюкозид и т.п.) и цвиттерионные (CHAPS, Zwittergent™ 3-X serie и т.п.) поверхностно-активные вещества. Используют минимальное количество поверхностно-активного вещества, которое растворяет или диспергирует этот слитый белок.
ВАКЦИНЫ И ИНОКУЛЯТЫ
Еще в одном варианте осуществления, RPBLA используют в качестве иммуногена инокулята или вакцины в пациенте-человеке или подходящем животном-хозяине, таком как шимпанзе, мышь, крыса, лошадь, овца, корова, собака, кошка или т.п. Инокулят может индуцировать В-клеточную или Т-клеточную реакцию (стимуляцию), такую как продуцирование антител, которые иммунореагируют с иммуногенным эпитопом или антигенной детерминантой, или Т-клеточную активацию в отношении такого эпитопа, в то время как вакцина обеспечивает защиту против организма, из которого был получен этот иммуноген, посредством одной или обеих из реакций В-клеток или Т-клеток. По-видимому, RPBLA рассматриваемой вакцины или инокулята действуют на антигенпрезентирующие клетки (АРС), такие как дендритные клетки и моноциты/макрофаги, которые поглощают эти RPBLA и процессируют их содержимое. В действии на эти типы клеток, RPBLA улучшают доставку антигена к антигенпрезентирующим клеткам. Эти RPBLA улучшают также процессирование и презентацию антигенов антигенпрезентирующим клеткам.
Таким образом это изобретение рассматривает также вакцину или инокулят, которые содержат иммуногенно эффективное количество рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA), которые растворены или диспергированы в фармацевтически приемлемом разбавителе. Эти RPBLA содержат рекомбинантный слитый белок, который сам содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является биологически активным полипептидом, на который должна быть индуцирована иммунологическая реакция указанной вакциной или инокулятом.
Активация T-клеток может быть измерена различными способами. В обычной практике, животное-хозяина инокулируют рассматриваемой вакциной или инокулятом RPBLA и после этого собирают мононуклеарные клетки периферической крови. Затем эти PBMC культивируют in vitro в присутствии биологически активного полипептида (иммуногена Т-клеток) в течение периода приблизительно трех - пяти дней. Затем культивируемые PBMC анализируют на пролиферацию или секрецию цитокина, такого как IL-2, GM-CSF или IFN-γ. Анализы на активацию Т-клеток хорошо известны в данной области. См., например, Патент США № 5478726 и цитируемые в нем ссылки.
С использованием образования антител в качестве примера, рассматриваемые инокулят или вакцина содержат иммуногенно эффективное количество RPBLA, которые растворены или диспергированы в фармацевтически приемлемой композиции разбавителя, который обычно содержит также воду. При введении животному-хозяину, в котором должна быть индуцирована иммунологическая реакция на биологически активный полипептид этой вакциной или инокулятом, например животному-хозяину, которое нуждается в иммунизации или в котором желательно индуцировать антитела, такому как млекопитающее (например, мышь, собака, коза, овца, лошадь, корова, мартышка, обезьяна или человек) или птица (например, курица, индейка, утка или гусь), инокулят индуцирует антитела, которые иммунореагируют с одной или несколькими антигенными детерминантами биологически активного полипептида-мишени.
Количество иммуногена RPBLA, используемое в каждой иммунизации, называют иммуногенно эффективным количеством, и оно может широко варьироваться в зависимости inter alia от иммуногена RPBLA, иммунизируемого пациента и от присутствия адъюванта в этой вакцине, как описано ниже. Иммуногенно эффективное количество для (i) вакцины и (ii) инокулята обеспечивают (i) защиту или (ii) антитело или Т-клеточную активность, соответственно, как обсуждалось выше.
Вакцины или инокуляты обычно содержат концентрацию иммуногена RPBLA приблизительно 1 мкг - приблизительно 1 мг на инокуляцию [унифицированная (стандартная) доза] и предпочтительно приблизительно 10 мкг - приблизительно 50 мкг на унифицированную дозу. Термин «унифицированная доза», в применении к вакцине или инокуляту данного изобретения, относится к физически дискретным единицам, подходящим в качестве единичных доз для животных, причем каждая единица содержит заданное количество активного материала, рассчитанное для индивидуального или коллективного получения желаемого иммуногенного эффекта, в ассоциации с требуемым разбавителем; т.е. носителем или наполнителем.
Вакцины или инокуляты обычно готовят из извлеченного иммуногена RPBLA диспергированием этого иммуногена, в форме частиц, в физиологически переносимом (приемлемом) разбавителе-носителе, таком как вода, солевой раствор, забуференный фосфатом солевой раствор (PBS, ЗФР), забуференный ацетатом солевой раствор (АВS), раствор Рингера или т.п., для образования водной композиции. Этот разбавитель-носитель может также включать в себя маслянистые материалы, такие как арахисовое масло, сквалан или сквален, как обсуждается далее.
Приготовление инокулятов и вакцин, которые содержат белковые материалы в качестве активных ингредиентов, также хорошо известно в данной области. Обычно такие инокуляты или вакцины готовят в виде парентеральных средств, либо в виде жидких растворов, либо в виде суспензий; могут быть также приготовлены твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией. Этот препарат может быть также эмульгирован, что является особенно предпочтительным.
Иммуногенно активные RPBLA часто смешивают с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Подходящими эксципиентами являются, например, вода, солевой раствор, декстроза, глицерин, этанол или т.п. и их комбинации. Кроме того, если желательно, инокулят или вакцина может содержать минорные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, рН-буферящие агенты, которые усиливают иммуногенную эффективность этой композиции.
Термин «антиген» использовали исторически для обозначения объекта, который связывается антителом или рецептором, а также для обозначения объекта, который индуцирует продуцирование этого антитела. Более современное применение ограничивает это значение антигена значением объекта, связываемого антителом или рецептором, в то время как термин «иммуноген» используют для объекта, который индуцирует продуцирование антител или связывается с рецептором. При обсуждении здесь объекта, который является как иммуногенным, так и антигенным, обычно его называют либо иммуногеном, либо антигеном в соответствии с его предполагаемым применением.
«Антигенной детерминантой» называют фактическую структурную часть антигена, которая иммунологически связывается антигенсвязывающим (активным) сайтом антитела или Т-клеточного рецептора. Этот термин используют также взаимозаменяемо с термином «эпитоп».
В данном контексте, термин «слитый белок» обозначает полипептид, который содержит по меньшей мере две последовательности аминокислотных остатков, обычно не обнаруживаемых связанными вместе в природе, которые функционально связаны вместе непрерывно («голова к хвосту») пептидной связью между соответствующими карбокси- и аминоконцевыми аминокислотными остатками. Слитые белки данного изобретения являются химерами индуцирующей белковые тельца последовательности (PBIS), связанной со второй последовательностью, которая является представляющим интерес биологически активным полипептидным продуктом (например, пептидом или белком) (мишенью).
Без дополнительного уточнения авторы считают, что квалифицированный в данной области специалист с использованием предыдущего описания и подробных примеров ниже может использовать данное изобретение в его самой полной степени. Таким образом, следующие предпочтительные конкретные примеры должны пониматься только как иллюстративные и не ограничивающие остальное описание каким бы то ни было образом.
Пример 1: Накапливание произведенных из RX3-ECFP слитых белков в плотных фракциях трансфицированных клеток млекопитающих
Полинуклеотидную последовательность, кодирующую N-концевую кодирующую гамма-зеин последовательность RX3 (WO2004003207), сливали прямо или через линкер, состоящий из пяти глицинов, с 5'-концом последовательности, кодирующей ECFP, сине-зеленый флуоресцентный вариант GFP. Эти конструкции (фиг. 1А), которые кодируют слитые белки RX3-ECFP или RX3-Gx5-ECFP, вводили в культивируемые клетки млекопитающих СНО способом трансфекции на основе липофектамина (Invitrogen). Клетки CHO, трансфицированные плазмидой pECFP-N1 (Clontech), содержащей последовательность гена цитозольного ECFP, использовали в качестве контролей.
Экстракты трансфицированных клеток млекопитающих наносили в ступенчатые градиенты плотности и центрифугировали. Накапливание рекомбинантных белков в различных фракциях анализировали при помощи иммуноблота (фиг. 2А). Результаты, показанные на этом чертеже, указывают на то, что RX3-ECFP и RX3-Gx5-ECFP появлялись во фракциях F42, F56 и P, соответствующих плотным RPBLA (фиг. 2А, дорожки 3-5). Этот результат демонстрирует, что эти слитые белки способны собираться в упорядоченные структуры и индуцировать образование RPBLA. Некоторое количество слитых белков детектировали также во фракции супернатанта (фиг. 2А, дорожка 1), возможно, они представляли слитые белки из RPBLA, частично солюбилизированные во время процесса экстракции, или слитые белки, только что синтезированные, которые еще не образовали упорядоченных структур.
В противоположность этому, при нанесении на такие же ступенчатые градиенты плотности экстракта клеток млекопитающих, трансфицированных контрольной плазмидой pECFP-N1, белок ECFP наблюдали исключительно в супернатанте. Никакие следы ECFP не детектировались в плотных фракциях, что указывает на то, что сам ECFP не был способен агрегироваться и образовывать РВ-подобные структуры.
Пример 2: Накапливание активного ECFP, слитого с доменами PBIS, в RPBLA трансфицированных клеток млекопитающего
Для определения, являются ли слитые белки RX3-ECFP, RX3-Gx5-ECFP и 22aZ-ECFP активными в RPBLA, конфокальные микроскопические анализы выполняли в клетках СНО, трансфицированных конструкциями, которые их кодируют (фиг. 1A). Сине-зеленые изображения собирали при возбуждении светом 458 нм с использованием лазера на основе ионов аргона с использованием окна излучения, установленного при 470-530 нм. Как показано на фиг. 3, соответствующие слитые белки, RX3-ECFP (фиг. 3A) и RX3-Gx5-ECFP (фиг. 3B) и 22aZ-ECFP (фиг. 3D), детектировали в эндоплазматическом ретикулуме, что указывает на то, что гамма-зеин и сигнальный пептид альфа-зеина являются функциональными в клетках млекопитающего, где они опосредуют перемещение этого слитого белка в ER.
Важно отметить, что эти слитые белки неожиданным образом накапливали, по-видимому, предпочтительно большие и плотные сферические структуры, которые в сильной степени сходны как с природными РВ семян зерновых культур, так и с RPBLA в гетерологичных системах, визуализированные иммунодетектированием. Интенсивная флуоресценция, наблюдаемая в этих структурах, свидетельствует о том, что этот слитый белок остается правильно уложенным и, следовательно, активным, несмотря на то, что он является высокоупакованным внутри RPBLA. Важно также отметить, что домены RX3, а также другие индуцирующие белковые тельца последовательности (PBIS), ответственные за образование РВ и РВ-подобных структур, содержат множественные остатки цистеина. Хотя можно предсказать, что такие цистеины могли бы образовывать дисульфидные связи с цистеинами белка-мишени и, следовательно, мешать правильному фолдингу белков-мишеней, в этом случае не наблюдали этого. Наблюдали как активный белок-мишень (флуоресценция ECFP), так и функциональный PBIS (образование RPBLA).
В качестве контроля для трансфекции клеток СНО использовали конструкцию pECFP-N1. Экспрессия цитозольного ECFP показала гомогенное распределение флуоресценции на всем протяжении клетки, в том числе ядра (фиг. 3C).
Пример 3: Субклеточная локализация других флуоресцентных белков, слитых с RX3, в клетках СНО
Субклеточную локализацию слитых белков RX3-DsRED и RX3-GFP в транзиторно трансфицированных клетках СНО анализировали конфокальной микроскопией для анализа, являются ли другие флуоресцентные белки, чем ECFP, слитые с RX3, правильно уложенными внутри RPBLA и биоактивными. Важно отметить, что DsRED не имеет гомологии с ECFP, что предполагает полностью отличающийся механизм фолдинга. Микрофотографии трансфицированных клеток получали с использованием конфокального лазерного сканирующего микроскопа (Leica TCS SP, Heidelberg, Germany), оборудованного спектрофотометрами для выбора длины волны полосы излучения. Зеленые флуоресцентные изображения собирали при возбуждении при 488 нм лазером на основе иона аргона с использованием окна излучения, установленного при 495-535 нм. Красные флуоресцентные изображения собирали после возбуждения при 543 нм лазером HeNe с использованием окна излучения 550-600 нм. Оптические срезы имели толщину 0,5 мкм.
Экспрессия слитых белков RX3-GFP (фиг. 3E) и RX3-DsRED (фиг. 3F) в клетках СНО производила большое количество высокофлуоресцентных округлых RPBLA. Эти результаты подтверждают, что оба слитых белка являются правильно уложенными и активными внутри RPBLA.
Пример 4: Субклеточная локализация флуоресцентных слитых белков RX3 в растениях и насекомых
Для анализа, могут ли клетки-хозяева, другие, чем клетки СНО, продуцировать RPBLA, содержащие флуоресцентные белки, слитые с доменами RX3, растения табака транзиторно трансформировали RX3-GFP агроинфильтрацией при помощи шприца. Анализ конфокальной микроскопией эпидермальных клеток (фиг. 4А и 4В) показал присутствие большого количества флуоресцентных RPBLA. Сходные результаты получали при анализе трансформированных клеток мезофилла табака.
Сходные результаты получали при инфицировании клеток насекомых Spodoptera SF9 или личинок насекомого (Trichoplusia ni) бакуловирусом, кодирующим слитый белок RX3-DsRED. Как показано на фиг. 4С, проекция оптических срезов инфицированных клеток насекомого накапливала большое количество флуоресцентных RPBLA с диаметром приблизительно 0,5 мкм, содержащих активный слитый белок RX3-DsRED. Конфокальный анализ инфицированных личинок также показал впечатляющее количество флуоресцентных RPBLA в любой анализируемой ткани. На фиг. 4D, жировые клетки из инфицированных личинок обнаруживают RPBLA, содержащие активный RX3-DsRED. Интересно, что флуоресценцию DsRED не наблюдали в гемолимфе насекомого, что позволяет предположить, что этот экспрессированный белок оставался заключенным полностью внутри RPBLA.
Пример 5: Активность RX3-hGH, собранного в RPBLA, в клетках СНО
Были предприняты исследования для определения активности гормона роста человека (hGH), продуцируемого в RPBLA. hGH был выбран, поскольку эта молекула содержит 2 дисульфидные связи, которые важны для правильного фолдинга этого белка. Домен RX3 также содержит остатки цистеина, включенные в дисульфидные связи, которые являются существенными для сборки и стабилизации RPBLA, которые могли бы препятствовать правильному фолдингу hGH.
Эту конструкцию p3.1-RX3-hGH вводили в клетки СНО транзиторной трансфекцией с использованием протокола с липофектамином (Invitrogen). Спустя четыре дня после трансфекции эти клетки фиксировали, увеличивали их проницаемость и инкубировали с анти-RX3- или анти-hGH-антисывороткой (фиг. 5А и 5В, соответственно) и вторичным антителом, конъюгированным с Aleхa Fluor 488 (Invitrogen). Присутствие больших RPBLA (1-3 мкм), содержащих слитый белок RX3-hGH, наблюдали анализом с использованием оптической микроскопии независимо от использованного первичного антитела.
Для подтверждения, что RPBLA были плотными органеллами, как было описано выше, клетки СНО, экспрессирующие RX3-hGH, гомогенизировали и гомогенаты наносили на ступенчатый градиент плотности и центрифугировали, как описано в другом месте. Накапливание RX3-hGH в различных фракциях анализировали при помощи иммуноблота. Как можно видеть, часть этого слитого белка присутствовала в супернатанте, представляя несобранный RX3-hGH, но большая часть этого слитого белка детектировалась во фракции F56, соответствующей плотным RPBLA (фиг. 2B, дорожки 2 и 5, соответственно).
Эту фракцию F56 разбавляли в 3 раза в буфере PBP4 (100 мМ Трис pH 7,5, 50 мМ KCl, 5 мМ MgCl2, 5 мМ ЭДТА) и центрифугировали при 80000g в бакетном роторе (с качающимися гнездами пробирок) для извлечения RPBLA в осадке. Присутствие hGH определяли количественно с использованием анализа ELISA (Active® Human Growth Hormone ELISA - DSL-10-1900; Diagnostic Systems Laboratories, Inc), который был способен детектировать hGH даже в присутствии интактной мембраны RPBLA.
Ту же самую пробу использовали в анализе биоактивности (Active® Bioactive Human Growth Hormone ELISA - DSL-10-11100; Diagnostic Systems Laboratories, Inc). Этот анализ биоактивности основан на способности правильно уложенного hGH взаимодействовать с hGH-связывающим белком, обеспечиваемым этим набором, причем это взаимодействие зависит от функциональной конформации hGH. Эта проба давала положительный результат при 24 нг/мл биоактивного белка. Очевидно, что белки hGH были правильно уложены и представлены на наружной поверхности плотных RPBLA. Удаление мембраны, окружающей RPBLA, промыванием этого препарата 50 мМ Трис рН 8 и 1% Тритоном Х-100 с обработкой ультразвуком при 50% амплитуде и 50% цикле в течение 1 минуты, повторяемом 5 раз (Ikasonic U200S-IKA Labortechnik), приводило к более высокой удельной активности (45 нг/мл) вследствие экспонирования дополнительных молекул hGH на поверхности этих агрегатов.
В определении активности hGH, слитого с RX3, этот слитый белок солюбилизировали из RPBLA, выделенных при помощи градиента плотности (F56, разбавленная в 3 раза в буфере PBP4 и центрифугированная при 80000g в бакетном роторе с качающимися гнездами для пробирок в течение 2 часов). Этот слитый белок солюбилизировали в буфере S (Трис 50 мМ, pH 8 и 2% β-ME) и обрабатывали ультразвуком (цикл 5, амплитуда 50%, 1 минута, повторяемые пять раз; Ikasonic U200S-IKA Labortechnik). После инкубирования при 37оС в течение 2 часов пробу центрифугировали при 5000g в течение 10 минут и супернатант, содержащий растворимый слитый белок RX3-hGH, анализировали количественно и оценивали биоактивный компонент этой фракции. Количество слитого белка в этом супернатанте было равно 250 нг/мл согласно ELISA (Active® Human Growth Hormone ELISA-DSL-10-1900; Diagnostic Systems Laboratories, Inc). Белок, анализированный в анализе биоактивности ELISA (Active® Bioactive Human Growth Hormone ELISA-DSL-10-11100; Diagnostic Systems Laboratories, Inc), давал результат 70 нг/мл, что указывает на то, что приблизительно 30% слитого белка RX3-hGH является активным. Эта потеря активности hGH могла быть следствием высокой концентрации восстанавливающего агента, использованного в солюбилизации, или следствием некоторого эффекта нарушения домена RX3 через hGH или hGH-связывающий белок.
Наконец, слитый белок RX3-hGH расщепляли сайт-специфической протеазой для высвобождения hGH из этого слитого белка. Солюбилизированный слитый белок RX3-hGH разбавляли в 2 раза и расщепление выполняли с использованием EKmax, как описано изготовителем (Invitrogen). После этого свободный hGH отделяли от нерасщепленного слитого белка (нерастворимого) центрифугированием при 16000g при 4°C в течение 1 часа. Растворимый hGH извлекали из супернатанта и использовали для определения количества и анализов биоактивности из Diagnostic Systems Laboratories. Неожиданно результаты, полученные с использованием обоих этих наборов, давали одну и ту же величну 90 нг/мл для анализов количества и биоактивности ELISA (Active® Human Growth Hormone ELISA-DSL-10-1900; Diagnostic Systems Laboratories, Inc и Active® Bioactive Human Growth Hormone ELISA-DSL-10-11100; Diagnostic Systems Laboratories, Inc), что свидетельствует о том, что весь присутствующий белок, определенный с использованием этого набора для количественного определения, является биоактивным согласно этому определению.
Ниже представлена таблица, суммирующая результаты по определению количества и биоактивности белка hGH во всех этих композициях.
Важно отметить, что клетки СНО, стабильно трансфицированные вектором p3.1-RX3, использовали в качестве отрицательного контроля. Как показано на фиг. 2В, экспрессия RX3 в клетках СНО также накапливает плотные структуры, которые могут быть выделены при помощи ступенчатого градиента плотности в F56 (фиг. 2В, дорожка 5). Кроме того, оптический анализ клеток СНО, трансфицированных p3.1-RX3, показал, что белок RX3 накапливается в RPBLA (фиг. 5C). Эти контрольные препараты RPBLA RX3 и выделенный белок RX3 не обнаруживали активности hGH в анализе биоактивности ELISA.
Пример 6: Активность интеина DNAb после солюбилизации RX3-Int-hGH из RPBLA из клеток СНО
Полинуклеотидную последовательность, кодирующую интеин Ssp DNAb (New England Biolabs), сливали в рамке считывания с 3'-концом последовательности RX3 (WO2004003207) и с 5'-концом кДНК hGH. Полученную конструкцию клонировали в вектор pcDNA3.1(-) (фиг. 1A) с образованием вектора p3.1-RX3-I-hGH. В качестве отрицательного контроля неактивную версию того же самого интеина получали при помощи ПЦР, где аминокислотный остаток Aspl54 был мутирован в Ala (фиг. 1А), с образованием вектора p3.1-RX3-Im-hGH. Сообщалось, что аминокислотный остаток Asp154 является важным для активности саморасщепления Ssp DNAb (Mathys et al, GENE (1999) 231:1-13).
Иммунохимический анализ клеток СНО, трансфицированных p3.1-RX3-I-hGH, с использованием анти-hGH-антисыворотки, выявил, что слитый белок RX3-Int-hGH накапливался в больших округлых RPBLA, сходных с RPBLA, наблюдаемыми в клетках СНО, экспрессирующих RX3-hGH (сравните фиг. 5В и 5D). Этот результат показывает, что слитый белок, содержащий интеин Ssp DNAb, самособирается и накапливается в структурах высокой плотности.
Клетки СНО, трансфицированные p3.l-RX3-I-hGH, гомогенизировали, гомогенаты наносили на ступенчатые градиенты плотности и фракции, соответствующие различным плотностям, анализировали при помощи иммуноблота. Наибольшую часть RX3-I-hGH дететировали во фракции F56, соответствующей плотным RPBLA (фиг. 2B). Как и для других слитых белков RX3, присутствие слитого белка RX3-I-hGH в супернатанте, возможно, представляет несобранный слитый белок, содержащийся в ER и солюбилизированный во время процесса гомогенизации.
После демонстрации, что RX3-I-hGH накапливался в RPBLA, эти происходящие из ER органеллы выделяли низкоскоростным центрифугированием, как описано здесь в другом месте. Центрифугирование гомогената клеток СНО, трансфицированных p3.l-RX3-I-hGH, при 1500×g в течение 10 минут позволяло отделить несобранные слитые белки RX3-Int-hGH в супернатанте от собранных в RPBLA в осадке. Эквивалентные исследования выполняли с клетками СНО, экспрессирующими неактивный слитый белок RX3-mInt-hGH.
Осадки, содержащие собранные слитые белки RX3-Int-hGH и RX3-mInt-hGH, солюбилизировали в буфере S1 (20 мМ Трис pH 7, 200 мМ NaCl, 1 мМ ЭДТА, 0,1% ДСН и 0,1 мМ TCEP) при 37°C в течение 2 часов и ферментативную активность интеина индуцировали инкубацией при 25°C в течение 48 часов после диализа против буфера для индукции расщепления: 20 мМ Трис pH 7, 200 мМ NaCl, 1 мМ ЭДТА. После индукции саморасщепления интеина эту композицию центрифугировали при 16000×g в течение 10 минут и супернатант и осадок анализировали при помощи иммуноблота с использованием антисыворотки против RX3 и против hGH.
Оба слитых белка солюбилизировали, но только слитый белок, содержащий активный интеин (RX3-Int-hGH), был способен к саморасщеплению (фиг. 6А и 6В, черные острия стрелок). Отсутствие саморасщепления мутированного слитого белка RX3-mInt-hGH демонстрирует, что саморасщепление, наблюдаемое с RX3-Int-hGH, обусловлено специфической активностью этого интеина, а не некоторой эндогенной протеазной активностью, соочищаемой во время процесса выделения RPBLA.
Для оптимизации эффективности саморасщепления интеина испытывали альтернативные протоколы солюбилизации. Саморасщепление интеина RX3-Int-hGH можно сравнивать после солюбилизации буфером S1 и двухфазного протокола экстракции (S2), описанного в другом месте (фиг. 6C). Из отношения между оставшимся полноразмерным слитым белком и появлением полосы, соответствующей выделившемуся hGH, даже хотя двухфазный протокол экстракции был более эффективным, позволяющим более чем 50%-ное расщепление, можно сделать вывод, что в обоих случаях большая доля интеина Ssp DNAb была активной и способной к саморасщеплению.
Пример 7: Активность RX3-EGF, собранного в RPBLA, в растениях табака
RPBLA из трансгенных растений табака, экспрессирующих слитый белок RX3-EGF, выделяли низкоскоростным центрифугированием в основном, как описано в US11/289264. Слитый белок солюбилизировали обработкой ультразвуком (Цикл 5, амплитуда 50%, 1 минута, повторяемый пять раз; Ikasonic U200S - IKA Labortechnik) в 50 мМ Трис pH 8 и 2% β-ME и инкубацией при 37°C в течение 2 часов. После этого солюбилизированный материал центрифугировали при 16000×g при 4°C в течение 30 минут с выбрасыванием несолюбилизированного слитого белка в осадке. Супернатант диализовали против 50 мМ Триса pH 8 для удаления β-ME, центрифугировали один раз опять при 16000×g при 4°C в течение 30 минут и супернатант подвергали количественному определению с использованием набора hEGF из Biosource International Inc. (KHG0062).
Биоактивность EGF анализировали определением скорости пролиферации (по включению радиоактивного тимидина в ДНК) клеток МDA-MB231 (клеток рака молочной железы, которые сверхэкспрессируют рецептор EGF), инкубированных с 1,2 нг/мл слитого белка RX3-EGF. В качестве положительного контроля, клетки MDA-MB231 инкубировали с 10 нг/мл коммерческого EGF (Promega) или фетальной телячьей сыворотки (ФТС). Результаты, суммированные в следующей таблице, представлены в виде процента (%) пролиферации относительно базовой скорости пролиферации клеток MB231 (100%), определенной как скорость пролиферации этих клеток, культивируемых в отсутствие EGF (лишенных EGF).
Как и ожидалось, дополнение культуры клеток MB231 коммерческим EGF (Promega) или ФТС давало значимое увеличение скорости пролиферации (158% и 145%, соответственно). Неожиданно, добавление 1,2 нг/мл RX3-EGF также дало увеличение 146% скорости пролиферации. Важно отметить, что почти такую же пролиферацию наблюдали с большей в 10 раз концентрацией коммерческого EGF, чем с RX3-EGF. Этот неожиданный результат может объясняться более ранними результатами, показывающими, что насыщение скорости пролиферации клетки MB231 наблюдалось при 5 нг/мл коммерческого EGF. Другим возможным объяснением могла бы быть более активная конформация EGF при слиянии с RX3. В любом случае, этот результат показывает, что RX3-EGF является по меньшей мере таким же активным, как и коммерческий EGF (Promega).
Пример 8: Активность RX3-GUS, собранного в RPBLA, в клетках СНО
Фермент β-глюкуронидаза (GUS) является широко применяемым репортерным белком (Gilisen et al., Transgenic Res.(1998) 7(3): 157-163). Экспрессия активного слитого белка RX3-GUS в RPBLA была проблемой в основном из-за присутствия 9 остатков аминокислоты цистеина, а также вследствие того, что он является большим белком (приблизительно 70 кДа).
Полинуклеотидную последовательность, кодирующую RX3 (WO2004003207), сливали в рамке считывания с 5'-концом последовательности, кодирующей GUS (фиг. 1A. RX3-GUS) и полученную конструкцию использовали для трансфекции клеток СНО, как описано в примере 7.
Иммунохимический анализ клеток СНО, трансфицированных p3.1-RX3-GUS, инкубированных с антисывороткой против RX3, выявил присутствие больших RPBLA (фиг. 5E). Для подтверждения плотности этих RPBLA клетки СНО, трансфицированные той же самой плазмидой, гомогенизировали и после этого наносили на ступенчатые градиенты плотности. Анализ этих различных фракций при помощи иммуноблота показал, что слитые белки локализовались во фракциях более высокой плотности (фиг. 2В, F56), что указывало на то, что они способны собираться в упорядоченные структуры и накапливаться в плотных RPBLA. Важно отметить, что слитый белок не детектировался в супернатанте, что означает, что почти весь RX3-GUS собирается в плотные структуры (RPBLA).
После того как было показано, что RX3-GUS накапливался в RPBLA, этот слитый белок выделяли из фракции F56 (как описано в примере 5 для RX3-hGH) и солюбилизировали в 50 мМ Трисе, pH 8, 2% β-ME и 0,1% ДСН при 37оC в течение 2 часов. После этого солюбилизированный материал центрифугировали при 16000×g при комнатной температуре в течение 10 минут и супернатант, содержащий растворимый, извлеченный из упорядоченной структуры слитый белок RX3-GUS диализовали при 4°C против 50 мМ раствора Триса pH 8 на протяжении ночи (приблизительно 18 часов).
Тест на активность GUS основан на катализе метилумбеллиферил-β-глюкуронида (MUG) во флуоресцентный продукт 4-метилумбеллиферон (4-MU) посредством фермента GUS (Jefferson et al. 1987 EMBO J. 6(13): 3901-3907). Пятьдесят мкл солюбилизированного слитого белка RX3-GUS (около 0,25 нг RX3-GUS/мкл) инкубировали в присутствии MUG при комнатной температуре и появление 4-MU определяли во флуориметре (длина волны возбуждения 355 нм; длина волны испускания 420 нм). Для исключения возможности измерения эндогенной GUS-подобной активности, присутствующей в препарате RPBLA из клеток СНО, трансфицированных p3.1-RX3, выделяли и после солюбилизации белка RX3 эту пробу включали в тест на активность в качестве контроля. Приведенная ниже таблица суммирует полученные результаты.
Из результатов, показанных в этой таблице, ясно, что слитый белок RX3-GUS остается активным после солюбилизации из RPBLA. Удельная активность этого RX3-GUS, рассчитанная из этих экспериментов, была равна 0,2 пмоль 4-MU/мин-1 * 12,5 нг-1 RX3-GUS. Не наблюдали значимой эндогенной GUS-подобной активности при анализе препарата RX3.
Пример 9: Активность RX3-EK, собранного в RPBLA, в клетках СНО
Энтерокиназа (энтеропептидаза) Bos taurus является мембраносвязанной сериновой протеазой слизистой оболочки двенадцатиперстной кишки, участвующей в процессировании трипсиногена в трипсин (DDDK↓) химотрипсин-подобным доменом сериновой протеазы. Эта энтеропептидаза является связанным дисульфидными связями двухцепочечным пептидом, образованным тяжелой цепью (EKHC-120 кД) и каталитической легкой цепью (EKLC - 47 кД). Каталитическая субъединица (здесь называемая ЕК) является почти такой же активной и специфической сама по себе, что и полный голофермент (LaVallie et al. 1993 J. Biol. Chem. 268(31):23311-23317). Важно указать на то, что бычья ЕК имеет 4 дисульфидные связи. Кроме того, N-концевая сторона этого белка является уложенной в этом белке, и это является необходимым для правильного фолдинга функциональной ЕК. Эти два требования делают белок ЕК проблемным белком для экспрессии в качестве активного белка в RPBLA.
Полинуклеотидную последовательность, кодирующую RX3 (WO 2004003207), сливали через линкер, содержащий сайт расщепления FXa (IEGR), с 5'-концом последовательности ЕК и клонировали в pcDNA3.1(-) (фиг. 1A, p3.1-RX3-EK).
Эту конструкцию использовали в трансфекции клеток СНО с использованием способа с липофектамином (Invitrogen). Иммунохимический анализ этих трансфицированных клеток с антисывороткой против RX3 выявил присутствие большого количества малых RPBLA. Эти органеллы можно было видеть по всей цитоплазме трансфицированных клеток, но размер обычно не превышал 0,5 мкм (фиг. 5F).
Для подтверждения плотности этих малых RPBLA клетки СНО, трансфицированные той же самой плазмидой, гомогенизировали и наносили на ступенчатые градиенты плотности. Слитый белок RX3-EK локализовался во фракции F56 (фиг. 2B). Высокая плотность упорядоченных структур слитого белка RX3-EK предполагает, что этот слитый белок накапливается в плотных RPBLA. Важно отметить, что слитый белок не детектировался в супернатанте, что означает, что почти весь RX3-EK собран в плотных структурах (RPBLA). Интересно, что молекулярная масса слитого белка RX3-EK была равна 58 кД, приблизительно на 15 кД выше, чем теоретическая молекулярная масса. Этот результат предполагает, что EK в этих RPBLA является высокогликозилированной, как было описано для природного белкка (LaVallie et al., 1993 J. Biol. Chem. 268(31): 23311-23317).
Этот слитый белок извлекали из фракции F56 (как описано в примере 5 для RX3-hGH) и солюбилизировали в 50 мМ Трисе, pH 8, 2% β-ME и 0,1% ДСН при 37°C в течение 2 часов. Для увеличения солюбилизации пробу обрабатывали ультразвуком при 50% амплитуде и 50% цикле в течение 1 минуты, повторяемым 5 раз (Ikasonic U200S-IKA Labortechnik), перед добавлением ДСН. После этого эту пробу центрифугировали при 5000g при комнатной температуре в течение 10 минут и супернатант, содержащий растворимый, извлеченный из упорядоченной структуры слитый белок RX3-EK диализовали при 4°C против 50 мМ раствора Триса pH 8 на протяжении ночи (приблизительно 18 часов). Затем этот слитый белок расщепляли с использованием FXa, как описано изготовителем (Quiagen), и активность ЕК измеряли флуориметрическим анализом (Grant, et al., 1979 Biochim. Biophys. Acta 567:207-215). Высвобожденная EK из RX3-EK имела энтеропептидазную активность.
Пример 10: Активность RX3-Casp2 и RX3-Casp3, собранных в RPBLA, в клетках СНО
Были предприняты исследования для определения активности каспаз, продуцируемых в RPBLA.
Каспазы являются семейством цистеиновых протеаз, которые расщепляют с высокой специфичностью после аспарагиновой кислоты консенсусной последовательности. Они являются основными исполнителями («палачами») высокорегулируемого процесса апоптоза.
Каспазы существуют в виде неактивных прокаспаз с продоменом вариабельной длины, за которым следуют большая субъединица (р20) и малая субъединица (р10). Они активируются протеолизом и зрелая активная каспаза состоит из гетеротетрамера p202-pl02 (Lavrik et al., 2005 J. Clin. Invest. 115:2665-2671). Каспазы подразделяются на каспазы-инициаторы и каспазы-исполнители, которые различаются по механизму их действия. Касапаза 2 (каспаза-инициатор) и каспаза 3 (каспаза-исполнитель) были выбраны в качестве примера белков, которые являются активными в RPBLA (Baliga et al., 2004 Cell Death and Differentiation 11:1234-1241; Feeney et al., 2006 Protein Expression and Purification 47(1):311-318). Эти белки являются особенно проблемными, так как они синтезируются в виде зимогенов, которые, чтобы стать активными, нуждаются в саморасщеплении и в образовании гетеротетрамера.
Конструкции p3.1-RX3-C2 и p3.1-RX3-C3 (фиг. 1) вводили в клетки СНО транзиторной трансфекцией по протоколу с липофектамином (Invitrogen). Спустя четыре дня после трансфекции для определения, накапливаются ли каспазы в плотных органеллах RPBLA, клетки СНО, экспрессирующие RX3-Casp2 или RX3-Casp3, гомогенизировали, наносили на ступенчатый градиент плотности и центрифугировали, как обсуждалось в другом месте.
Накапливание слитых белков обеих RX3-каспаз в различных фракциях анализировали при помощи иммуноблота (фиг. 2В). Как можно видеть, большая часть слитых белков RX3-Casp2 или RX3-Casp3 осаждалась во фракциях F56 и F42, соответствующих плотным RPBLA. Этот результат указывает на то, что эти два слитых белка способны прочно собираться в плотные структуры.
В иммуноблоте, представленном на фиг. 2В, показан только слитый белок полной длины, но полосы разной молекулярной массы присутствуют в этой фракции. Эти полосы являются реактивными либо с анти-RX3-антителом, либо с анти-CASP-антителом (SA-320 и SA-325, Biomol International, соответствующими разным субъединицам каспазы), что указывает на то, что аутокаталитическая активация имела место внутри RPBLA. Эти наблюдения показывают, что каспаза 2 и каспаза 3 являются активными in vivo.
Фракции F56 и F42 разбавляли в 4 раза в буфере РВР4 и центрифугировали при 80000×g в бакетном роторе с качающимися гнездами для выделения RPBLA в осадке. Мембрану ER, окружающую эту органеллу, удаляли промыванием препарата RPBLA 50 мМ Трисом pH 8 и 1% Тритоном Х-100. После удаления мембраны ER активность каспазы тестируют с использованием системы анализа BIOMOL QυantiZyme™, набора для анализа активности клеточной каспазы 3 PLUS-AK703 (каспаза 3) и системы анализа BIOMOL QuantiZyme™, набора для анализа активности клеточной каспазы 2 PLUS-AK702 (каспаза 2). Этот набор измеряет активность каспазы колориметрически со специфическим субстратом. RPBLA RX3-Casp2 и RX3-Casp3 обнаруживают каспазную активность.
В определении активности каспаз, слитых с RX3, слитый белок солюбилизируют из RPBLA, выделенных при помощи градиента плотности (F56 и F42 разбавляют в 4 раза в буфере РВР4 и центрифугируют при 80000g в бакетном роторе). Этот слитый белок солюбилизируют в буфере СА (50 мМ Hepes, pH 7.4, 100 мМ NaCl, 1 мМ ЭДТА, 100 мМ ДТТ, 1% CHAPS, 10% глицерин) после обработки ультразвуком (50% амплитуда и 50% цикл в течение 30 секунд, 5 раз). Солюбилизацию выполняют 2-часовой инкубацией при 37°C и нерастворимый материал выбрасывают центрифугированием при 16000g в течение 10 минут. Супернатант, содержащий растворимый слитый белок RX3-casp, диализуют против буфера для анализа из набора каспазы (50 мМ Hepes, pH 7.4, 100 мМ NaCl, 1 мМ EDTA, 10 мМ ДТТ, 0,1% CHAPS, 10% глицерин). Активность диализованной пробы, содержащей RX3-Casp2 и RX3-Casp3, оценивают с использованием системы анализа BIOMOL QuantiZyme™, набора для анализа активности клеточной каспазы 3 PLUS-AK703 (каспаза 3) и системы анализа BIOMOL QuantiZyme™, набора для анализа активности клеточной каспазы 2 PLUS-AK702 (каспаза 2). Каспаза 2 и каспаза 3 являются активными.
Пример 11: Активность RX3-RTB, собранных в RPBLA, в агроинфильтрированных растениях табака
Полинуклеотидную последовательность, кодирующую RTB (Reed et al., 2005 Plant Cell Report 24:15-24), сливали в рамке считывания с 3'-концом домена RX3 и клонировали в бинарном векторе (pB-RX3-RTB).
Эту конструкцию использовали в растениях табака, трансформированных агроинфильтрацией с использованием шприца, как описано в другом месте. Агроинфильтрированные листья табака гомогенизировали и наносили на ступенчатые градиенты плотности. Слитый белок RX3-RTB был локализован во фракциях F42 и F56 (фиг. 2B), что позволяет предполагать, что этот слитый белок собирается и накапливается в плотных RPBLA. Как описано для RX3-EK, слитый белок RX3-RTB, выделенный из RPBLA, имеет более низкую электрофоретическую подвижность в сравнении с теоретической молекулярной массой. Этот результат подтверждает, что RTB может быть гликозилирован в RPBLA.
Этот слитый белок выделяли из этих плотных фракций (как описано в примере 5 для RX3-hGH) и солюбилизировали в 50 мМ Трисе, рН 8, 0,8% β-ME при 37оC в течение 2 часов. Для увеличения солюбилизации пробу обрабатывали ультразвуком при 50% амплитуде и 50% цикле в течение 1 минуты, повторяемом 5 раз (Ikasonic U200S-IKA Labortechnik). После этого эту пробу центрифугировали при 5000×g при комнатной температуре в течение 10 минут и супернатант, содержащий растворимый не содержащий упорядоченной структуры RX3-RTB, анализировали при помощи ELISA на связывание с гликопротеином фетуином, обработанным сиалидазой для обнажения заканчивающихся галактозой гликанов. RX3-RTB связывается с ним.
Пример 12: Плазмидная конструкция для трансформации растений
Кодирующие последовательности эпидермального фактора роста человека (hEGF) получали синтетически и модифицировали для оптимизации его использования кодонов для экспрессии в растениях.
Белок hEGF (SEQ ID NO:41)
ДНК hEGF (SEQ ID NO:42)
Синтетический ген, кодирующий 53 аминокислоты активного hEGF, получали с использованием ПЦР-способа праймерного перекрывающегося удлинения с использованием 4 олигонуклеотидов из приблизительно 60 нуклеотидов, с 20 перекрывающимися основаниями. Эта синтетическая кДНК hEGF включала в себя 5'-линкерную последовательность, соответствующую сайту специфического расщепления Фактора Ха. Эти олигонуклеотиды очищали с использованием полиакриламидного денатурирующего геля.
Синтетическую кДНК hEGF очищали из агарозного геля (Amersham) и клонировали в вектор pGEM (Promega). кДНК-фрагмент (кодирующий N-концевой домен гамма-зеина), содержащий липкие концы BspHI и NcoI, инсертировали в вектор pCKGFPS65C (Reichel et al., 1996 Proc. Natl. Acad. Sci. USA 93:5888-5893), предварительно расщепленный NcoI (как описано в заявке на патент WO 2004003207). Последовательность, кодирующую EGF, сливали в рамке считывания с последовательностью RX3. Конструкцию RX3-EGF получали заменой GFP-кодирующей последовательностью синтетического гена EGF.
Полученная конструкция, названная pCRX3EGF, содержала последовательность нуклеиновой кислоты, которая управляет транскрипцией белка, такую как усиленный промотор 35S, энхансер трансляции, такой как вирус гравировки табака (TEV), кодирующую EGF последовательность и последовательности 3'-полиаденилирования из вируса мозаичной болезни цветной капусты (CaMV). Эффективный вектор трансформации растений pl9RX3EGF был получен в конечном счете встраиванием экспрессионных кассет HindIII/HindIII в бинарный вектор pBinl9 (Bevan, 1984 Nucleic Acids Research 12:8711-8721).
кДНК, кодирующую альфа-зеин 22 кД (22aZ) и проламин риса 13 кД (rP13), амплифицировали при помощи ОТ-ПЦР из кДНК-библиотеки из сорта W64A кукурузы и сорта Senia риса, соответственно. Олигонуклеотидами, использованными в этой ПЦР-реакции, были:
22aZ-5' (SEQ ID NO:43)
22aZ-3' (SEQ ID NO:44)
Rice13Prol-5' (SEQ ID NO:45)
Rice13Prol-3' (SEQ ID NO:46)
Соответствующие ПЦР-фрагменты клонировали в вектор pCRII (Invitrogen), секвенировали и клонировали в векторы pUC18, содержащие усиленный промотор CaMV 35S, последовательность TEV и 3'-терминатор ocs. Эту плазмиду рCRII-rP13 расщепляли SalI и NcoI и клонировали в плазмиды pUC18RX3Ct, pUC18RX3hGH и pUC18RX3EGF, расщепленные теми же самыми ферментами, с получением плазмиды pUC18rP13EGF. The pCRII-22aZ расщепляли SalI/NcoI и клонировали в плазмиду pUC18RX3EGF, расщепленную теми же самыми ферментами, с получением плазмиды pUC1822aZtEGF. Наконец, этот произведенный из pUC18 вектор клонировали в pCambia 5300 с использованием HindIII/EcoRI.
Конструкция pBIN m-gfp4-ER содержит оптимизированный GFP для экспрессии в растениях (Haseloff et al., 1997 Proc. Natl. Acad. Sci. USA 94:2122-2127). Эту конструкцию использовали в качестве матрицы для ПЦР-амплификации GFP. Были сконструированы олигонуклеотиды для элиминации сигнального пептида и мотива HDEL, присутствующих в исходной последовательности, а также для введения сайтов рестрикции для дополнительного клонирования.
Праймеры:
5' GFP (SEQ ID NO:50)
3' GFP (SEQ ID NO:51)
Продукт ПЦР клонировали в ПЦР-клонирующем векторе (PCR®II Vector, Invitrogen) и эту последовательность подтверждали. GFP-фрагмент, содержащий липкие концы RcaI/BamHI, клонировали в pUC18RX3hGH (US2006123509 (A1)) для добавления кассеты RX3-GFP в вектор pUC18. Эту кассету высвобождали расщеплением HindIII/BamHI и затем встраивали в вектор pCAMBIA 2300 (pB-RX3-GFP).
Этот клон RTB (номер доступа GenBank X03179) амплифицировали при помощи ПЦР (RTB5 и RTB3) и расщепляли RcaI/SmaI. Этот расщепленный ПЦР-фрагмент клонировали в pUC18RX3hGH (US2006123509 (Al)), расщепленный NcoI/SmaI, с получением pUC18RX3RTB. Затем, этот вектор расщепляли HindIII/EcoRI и высвобожденный фрагмент клонировали в векторе pCAMBIA 2300, расщепленном теми же самыми рестрикционными ферментами (pB-RX3-RTB).
Праймеры:
RTB5 (SEQ ID NO:52)
RTB3 (SEQ ID NO:53 )
Растительный материал
Растения табака (Nicotiana tabacum var. Wisconsin) выращивали в камере для выращивания in vitro при 24-26°C со световым периодом 16 часов. Зрелые растения выращивали в оранжерее при температуре 18-28°C, влажность поддерживали при 55-65% со средним световым периодом 16 часов.
Проростки для способа агроинфильтрации (Vaquero et al., 1999 Proc. Natl. Acad. Sci., USA 96(20):11128-11133; Kapila et al., 1997 Plant Sci. 122:101-108) выращивали из семян в течение 4-6 недель в условиях in vitro, описанных выше.
Стабильная трансформация табака
Бинарные векторы переносили в штамм LBA4404 A. tumefaciens. Диски листьев табака (Nicotiana tobaccum, W38) трансформировали, как описано Draper and Hamil 1988, In: Plant Genetic Transformation and Gene Expression. A Laboratory Manual (Eds. Draper, J., Scott, R., Armitage, P. and Walden, R.), Blackwell Scientific Publications. Регенерированные растения отбирали на среде, содержащей 200 мг/л канамицина, и переносили в оранжерею. Трансгенные растения табака, имеющие наивысшие уровни трансгенного продукта, культивировали для получения генераций Т1 и Т2.
Уровни рекомбинантного белка детектировали при помощи иммуноблота. Экстракты общего белка из листьев табака определяли количественно по способу Бредфорда, разделяли электрофорезом на ДМН-ПААГ и переносили на нитроцеллюлозные мембраны с использованием устройства для электрофоретического переноса Mini Trans-Blot Electrophoretic Transfer Cell (Bio Rad). Мембраны инкубировали с антисывороткой против гамма-зеина (разведением 1/7000) (Ludevid et al. 1985, Plant Science 41:41-48) и затем инкубировали с конъюгированными с пероксидазой хрена антителами (разведением 1/10000, Amersham Pharmacia). Иммунореактивные полосы детектировали с использованием услиленной хемилюминесценции (системы Вестерн-блоттинга ECL, Amersham Pharmacia).
Агроинфильтрация табака
Вакуумная агроинфильтрация
Проростки для способа агроинфильтрации выращивали из семян в течение 4-6 недель в камере для выращивания in vitro при 24-26°C с фотопериодом 16 часов.
Штамм A. tumefaciens LB4404, содержащий желаемую конструкцию, выращивали на среде LB (Триптон 10 г/л, дрожжевой экстракт 5 г/л, NaCl 10 г/л), дополненной канамицином (50 мг/л) и рифампицином (100 мг/л) при 28°C со встряхиванием (250 об/мин) на протяжении ночи (приблизительно 18 часов). Затем агробактерии инокулировали в 30 мл LB, также дополненной канамицином (50 мг/л) и рифампицином (100 мг/л). После ночного культивирования при 28°C (приблизительно 18 часов) клетки агробактерий собирали центрифугированием в течение 10 минут при 3000g и ресуспендировали в 10 мл жидкой среды MS с MES (Sigma Chemical) 4,9 г/л и сахарозой 30 г/л при pH 5,8. Бактериальную культуру доводили до конечного OD600 0,1 для агроинфильтрации. Затем культуру клеток дополняли ацетосирингоном 0,2 мМ и инкубировали в течение 90 минут при 28°C.
Для агроинфильтрации проростки полностью покрывали этой суспензией и применяли вакуум (100 КПа) в течение 5-6 секунд. Эту суспензию удаляли и проростки выдерживали в камере для выращивания при 24-26°C с фотопериодом 16 часов в течение 4 дней. Растительный материал извлекали и экстракцию общего белка анализировали при помощи иммуноблота с использованием анти-гамма-зеин-антитела.
Агроинфильтрация при помощи шприца
Штамм Agrobacterium tumefaciens EHA 105 выращивали при 28°C в L-бульоне, дополненном 50 мкг/мл канамицина и 50 мкг/мл рифамицина, до стационарной фазы. Бактерии осаждали центрифугированием при 5000 g в течение 15 минут при комнатной температуре и ресуспендировали в 10 мМ буфере MES pH 5,6, 10 мМ MgCl и 200 мкМ ацетосирингоне до конечной концентрации OD600 0,2. Клетки оставляли в этой среде на 3 часа при комнатной температуре. Отдельные культуры Agrobacterium, несущие конструкции RX3, и конструкции супрессора сайленсинга HC-Pro (Goytia et al., 2006) смешивали вместе и инфильтрировали в абаксиальную поверхность (нижнюю поверхность) листьев 24-недельных растений Nicotiana benthamiana (Voinnet et al, 2003).
Пример 13: Выделение (очистка) RPBLA при помощи градиента плотности из вегетативных тканей трансгенного растения
Ген, кодирующий полученные из гамма-зеина RX3-EGF слитые белки, вводили в растения табака через Agrobacterium tumefaciens. Трансформированные растения анализировали при помощи иммуноблота для определения растений с более высокой экспрессией рекомбинантного белка. Преобладающие нижние полосы иммуноблотов соответствуют мономерной форме слитых белков, а верхние полосы соответствуют димерам. Слитые белки обычно накапливаются в виде мультимеров и количество мономеров и олигомеров, детектируемых в этих иммуноблотах, зависит от уровня восстановления дисульфидных связей.
Экстракты листьев табака наносили на ступенчатые градиенты плотности и накапливание рекомбинантных белков в различных фракциях анализировали при помощи иммуноблота. Эти результаты указывают на то, что RX3-EGF появлялся во фракциях, соответствующих плотным RPBLAs. Большинство из этих органелл обнаруживало плотности, более высокие чем 1,2632 g/см3, и значительная часть их обнаруживала плотность, более высокую чем 1,3163 г/см3.
Эти новые RPBLA, образованные в листьях табака, обнаруживают плотности в диапазоне природных белковых телец кукурузы (Ludevid et al., 1984 Plant Mol. Biol. 3:227-234; Lending et al., 1989 Plant Cell 1:1011-1023) или даже более высокие плотности.
Было приближенно определено, что более 90% рекомбинантного белка извлекалось во фракциях плотных RPBLA и осадке. Таким образом, выделение RPBLA по плотности является, по-видимому, применимой системой для очистки (концентрирования) этих слитых белков.
Для оценки очистки рекомбинантного белка RX3-EGF по выделению RPBLA, фракции разной плотности анализировали с использованием содержащего серебро красителя. Более 90 процентов эндогенных белков табака локализовались в растворимой фракции и во фракциях поверхности раздела этого градиента, фракциях, в которых белок RX3-EGF отсутствовал или был едва детектируемым. Таким образом, растворимые белки и основная масса белков, присутствующих в менее плотных органеллах, могли быть выброшены отбором одной или двух фракций этого градиента.
В отношении степени очистки слитых белков во фракциях RPBLA было определено, что белок RX3-EGF составляет приблизительно 80 процентов белков, детектированных в PBLS-содержащих фракциях. Этот результат указывает на то, что, с использованием процедуры выделения RPBLA можно достичь важного обогащения слитых белков в единственной стадии очистки.
Пример 14: Извлечение рекомбинантных белков в RPBLA, выделенных из тканей сухих растений
Важным моментом в молекулярном выращивании является наличие простых средств для хранения растительной биомассы. В этой связи, высушивание может обеспечивать удобный способ уменьшения объема хранения и консервирования продукта. Тем не менее, высушивание часто стимулирует деградацию представляющих интерес белков. Применение высушенных растений для выделения RPBLA, содержащих рекомбинантные белки, могло бы представлять большой интерес для промышленных целей.
Листья трансформированного табака, накапливающие слитый белок RX3-EGF, как описано здесь, сушили, как также обсуждалось здесь. После 5 месяцев хранения в сухом виде анализировали стабильность рекомбинантных белков. Экстракты белка из эквивалентных количеств сырого (свежего) материала и ткани сухих листьев анализировали при помощи иммуноблота. Белок RX3-EGF был стабильным в высушенных трансформированных растениях, причем количество белка, извлеченного из сырых и сухих растений, является одинаковым.
Распределение в ступенчатых градиентах плотности слитого белка RX3-EGF из гомогенатов высушенных листьев анализировали при помощи иммуноблота. Этот слитый белок в основном извлекался в плотных структурах, обнаруживающих плотности, более высокие чем 1,1868 г/см3 и 1,2632 г/см3.
Таким образом, рекомбинантные белки могут быть очищены из высушенных тканей посредством выделения RPBLA, что иллюстрирует то, что сбор трансгенных растений и экстракция и очистка рекомбинантных белков могут быть независимыми во времени. В соответствии с этими результатами слитые белки гамма-зеина накапливались также в RPBLA в семенах риса.
Пример 15: Извлечение рекомбинантных белков выделением RPBLA из транзиторно трансформированных проростков табака
Транзиторные системы экспрессии могут быть удобным инструментом для тестирования поведения накапливания рекомбинантных белков в коротком периоде времени. Так, рекомбинантный белок RX3-EGF также экспрессировался и накапливался в транзиторно трансформированных проростках табака посредством агроинфильтрации. Экстракты белка из трансформированных проростков, анализированные при помощи иммуноблота, показывают характерную комплексную электрофоретическую картину, наблюдаемую в случае стабильно трансформированных растений, что свидетельствует о том, что слитые белки собираются правильно в упорядоченные структуры с использованием этого способа трансформации.
Пример 16: Извлечение рекомбинантных белков при помощи низкоскоростного и среднескоростного центрифугирования
Для упрощения процедуры, используемой для очистки рекомбинантных белков через плотные рекомбинантные подобные белковым тельцам упорядоченные структуры, выполняли два дополнительных альтернативных способа: i) осветленные гомогенаты центрифугировали только через одну плотную подушку сахарозы и ii) осветленные гомогенаты просто центрифугировали при низкоскоростном центрифугировании (т.е. 1000-2500g в течение 10 минут).
В соответствии с описанными ранее результатами белок RX3-EGF извлекался с высокими выходами (большими чем 90%) в осадках, полученных после центрифугирования через подушки 1,1868 г/см3. Кроме того, очистка белка RX3-EGF была очень высокой, так как примесные эндогенные белки табака едва детектировались в соответствующем осадке.
Главное преимущество этого способа в сравнении со ступенчатыми градиентами плотности заключается в его легкой масштабируемости для промышленного получения рекомбинантных белков. Следует отметить, что плотность подушки, а также другие свойства, такие как вязкость и осмолярность подушки, могут корректироваться в каждом случае для оптимизации извлечения и очистки рекомбинантных белков.
Кроме того, низкоскоростное центрифугирование (LSC) также анализировали на концентрирование и очистку содержащих слитый белок подобных белковым тельцам структур. Эти результаты показали, что после 1000g в течение 10 минут практически весь слитый белок RX3-EGF извлекался в осадке. Но окрашивание белков, содержащихся в этом осадке, показало, что этот слитый белок не был высокоочищенным в сравнении с белком, полученным после центрифугирования через подушку 1,1868 г/см3 сахарозы.
После этого первый осадок, полученный низкоскоростным центрифугированием, промывали с использованием буфера, содержащего 5% Тритон® X-100. После промывания пробу центрифугировали при 12000g в течение 5 минут и, что интересно, масса загрязняющих белков, присутствующих в этом осадке Р1, элиминировалась после промывания и центрифугирования, и новый осадок содержал высокообогащенный белок RX3-EGF. Отмечается, что количество, а также распределение белков, отмеченное в этом исследовании, является сходным с количеством и распределением, полученными после промывания осадка, полученного после центрифугирования через сахарозную подушку в содержащем Тритон Х-100 буфере. Альтернатива низкоскоростного центрифугирования основывается на высокой плотности структур, содержащих слитые белки, и условия центрифугирования могут быть оптимизированы для любой мишени перед масштабированием.
Трансгенные растения табака, экспрессирующие слитые белки, которые включают в себя EGF, слитый с проламином риса или альфа-зеином, а не с RX3, rP13-EGF и 22aZ-EGF, получали трансформацией с использованием Agrobacterium tumefasciens. Наилучшие экспрессирующие клеточные линии определяли иммуноблоттингом с использованием антитела против EGF, и эти клеточные линии использовали в сравнительном анализе с проростками табака, агроинфильтрированными теми же самыми конструкциями. Во всех случаях, эти RPBLA извлекали в уникальной поверхности раздела, что предполагает, что эти RPBLA являются очень плотными и гомогенными.
При суммировании всех этих результатов ясно, что проламины способны индуцировать RPBLA высокой плотности даже в том случае, когда они слиты с другими белками. Это является неожиданным результатом в основном тогда, когда между ними почти не наблюдается гомологии. Кроме того, имеются некоторые данные, позволяющие предположить, что проламины взаимодействуют, стабилизируя эти белковые тельца, и что некоторые из них не являются стабильными при экспрессии в вегетативной ткани по отдельности, например альфа-зеин (Coleman et al., 1996 Plant Cell 8:2335-2345).
Пример 17: Экстракция рекомбинантных белков из выделенных RPBLA
Было продемонстрировано, что выделение плотных рекомбинантых РВ-подобных упорядоченных структур является выгодным способом для извлечения рекомбинантных белков с высоким выходом и высоким уровнем очистки из трансгенных организмов. Здесь показано, что эти рекомбинантные белки могут быть экстрагированы из запасающих органелл.
После инкубации на протяжении ночи (приблизительно 18 часов) фракций RPBLA при 37оС в буфере, содержащем детергент и восстанавливающие агенты (обработка буфером SB, который содержал 12,5 мМ борат натрия pH 8, 0,1% ДСН и 2% β-меркаптоэтанол), белок RX3-EGF был солюбилизирован. Этот экстрагированный слитый белок извлекали в его растворимой форме. После этого, в зависимости от их применения, эти экстрагированные белки могут быть подвергнуты дополнительной очистке или использованы в виде частично очищенных экстрактов.
Пример 18: Конструирование плазмид для трансформации клеток животных
Последовательность RX3 амплифицировали при помощи ПЦР с получением кДНК-фрагментов, соответствующих RX3 и RX3-(Gly)x5. Эти фрагменты расщепляли SalI/BamHI, клонировали в плазмиде pECFP-Nl (Clontech), открытой (расщепленной) теми же самыми ферментами, с получением плазмид pRX3-ECFP и pRX3-G-ECFP, соответственно.
Праймеры:
SPfor (SEQ ID NO:54)
RX3ECFP3' (SEQ ID NO:55)
RX3G5ECFP3' (SEQ ID NO:56)
Вектор p22aZ-ECFP соответствует следующему ДНК-фрагменту HindIII/XbaI в плазмиде pEGFP-N1 (Clontech) (SEQ ID NO:57).
GFP получали ПЦР-амплификацией плазмиды pEGFP-N1 (Clontech) со специфическими олигонуклеотидами, содержащими сайты рестрикции ферментов, для дальнейшего клонирования:
ECFP NcoI 5' (SEQ ID NO:58)
ECFPN1 BamNotSac 3'(SEQ ID NO:59)
Этот ПЦР-продукт (GFP) клонировали в ПЦР-клонирующем векторе (PCR®II Vector, Invitrogen) и эту последовательность подтверждали. Фрагмент GFP вырезали расщеплением при помощи NcoI/BamHI и клонировали в pUC18RX3hGH (US2006123509 (Al)) с получением кассеты RX3-GFP в векторе pUC18. Эту кассету высвобождали расщеплением при помощи SalI/BamHI и затем клонировали в pCDNA3.1(-) (Invitrogen), предварительно расщепленный XhoI/BamHI (p3.1-RX3-GFP).
Конструкция, содержащая кодирующую последовательность улучшенного мономерного белка DS Red (mCherry; Shaner et al., 2004 Nat. Biotechnol. 22:1567-1572), была матрицей в реакции ПЦР (mCherry RсaI 5'/ECFPN1 BamNotSac 3').
mCherry RсaI 5' (SEQ ID NO:60)
Продукт ПЦР (DsRed) клонировали в ПЦР-клонирующем векторе (PCR®II Vector, Invitrogen)) и последовательность подтверждали. DsRed-фрагмент вырезали расщеплением при помощи RcaI/BamHI и клонировали в pUC18RX3hGH (US2006123509 (Al)) с получением кассеты RX3-DsRed в векторе pUC18. Эту кассету высвобождали расщеплением при помощи SalI/BamHI и затем клонировали в pCDNA3.1(-) (Invitrogen), предварительно расщепленный XhoI/BamHI (p3.1-RX3-DsRED).
Для получения кДНК RX3 со стоп-кодоном на 3'-конце RX3-фрагмент амплифицировали при помощи ПЦР (SPFOR/RX3STOP) и расщепляли SalI/BamHI. Этот фрагмент клонировали в pcDNA3.1(-), расщепленный теми же самыми рестрикционными ферментами с получением p3.1-RX3.
RX3STOP3' (SEQ ID N0:61)
кДНК, кодирующую hGH, сливали с N-концевой кодирующей последовательностью гамма-зеина RX3 (патент WO2004003207) и вводили в вектор pcDNA3.1(-) (Invitrogen), как описано в другом месте. В полученной конструкции, названной p3.lRX3hGH, эти последовательности слитого белка находились под контролем промотора CMV и терминатора pA BGH.
Интеин Ssp DNAb из плазмиды pTWIN1 (New England Biolabs) и кДНК hGH амплифицировали при помощи ПЦР. Оба фрагмента ПЦР сливали в рамке считывания также при помощи ПЦР, расщепляли при помощи NcoI/BamHI и клонировали в векторе pUC18RX3hGH (US 2006121573 (Al)), также расщепленном NcoI/BamHI. Инсерт RX3-Int-hGH получали расщеплением с использованием Sall/BamHI этого промежуточного вектора и клонировали в pcDNA3.1(-) (Invitrogen), расщепленной XhoI/BamHI. Полученная конструкция была названа р3.l-RX3-I-hGH. Этот продукт ПЦР расщепляли с использованием BsRGI/BamHI и клонировали в плазмиде p3.1-RX3-I-hGH, расщепленной теми же самыми рестрикционными ферментами.
Праймеры:
5' DNAb (SEQ ID NO:62)
3' DNAb (SEQ ID NO:63)
DNAb-hGH: (SEQ ID NO:64)
3'hGH (SEQ ID NO:65)
В качестве отрицательного контроля индукции расщепления конструировали нерасщепляемый Ssp DnaB. Мутированный (Asp154 → Ala154) интеин Ssp DnaB, слитый в рамке считывания с hGH, получали при помощи ПЦР из p3.1-RX3-I-hGH.
Праймеры:
IM-for (прямой) (SEQ ID NO:66)
IM-rev (обратный) (SEQ ID NO:67)
Полноразмерные кДНК каспазы-2 (IRAUp969A0210D6) и каспазы-3 (IRATp970B0521D6) человека получали из RZPD GmbH (Berlin), из исходной ссылки на основе библиотеки Nacional Lawrence Livermore Library.
При помощи ПЦР сайт специфического расщепления каспазы-3 и каспазы-2 (DEVD и DEHD, соответственно) добавляли на 5'-концах соответствующей последовательности каспазы. Важно отметить, что амплифицированный фрагмент, соответствующий каспазе-2, не содержал продомена.
Casp3 forward (прямой) (SEQ ID NO:68)
Casp3 reverse (обратный) (SEQ ID NO:69)
Casp2 forward (прямой) (SEQ ID NO:70)
Casp2 reverse (обратный)(SEQ ID N0:71)
Амплифицированные последовательности клонировали в pUC18RX3hGH (US 2006123509 (Al)) расщеплением с использованием NcoI и KpnI. Затем полученную конструкцию расщепляли с использованием SalI/KpnI и клонировали в вектор pCDNA3.1 (Invitrogen), расщепленный с использованием XhoI/KpnI. Соответствующие векторы были названы p3.1-RX3-C2 и p3.1-RX3-C3.
Вектор pUC18RX3hGH (US2006123509 (Al)) расщепляли HindIII/EcoRI и высвобожденный инсерт клонировали в pCambia2300, также расщепленный этими ферментами. Соответствующий вектор расщепляли HindIII/NcoI и инсерт клонировали в pCambia1381, открытый HindIII/NcoI (p4-17). ДНК, содержащую фрагмент RX3-(gly)x5-GUS, получали расщеплением p4-17 с использованием BstEII, достраиванием в выступе ДНК-полимеразой Кленова и наконец расщеплением SalI. Этот фрагмент клонировали в pcDNA3.1(-), расщепленный XhoI/EcoRV, с получением клона p3.1-RX3-GUS.
p3.1-RX3-EK соответствует следующему NheI/HindIII-фрагменту ДНК в pcDNA3.1(-) (Invitrogen) (SEQ ID NO:72).
Пример 19: Конструирование плазмиды для инфицирования насекомых
Фрагмент RX3-DsRED из p3.1-RX3-DsRED расщепляли XbaI/HindIII и клонировали в pFastBac1 (Invitrogen), расщепленный также этими двумя ферментами, с получением вектора pF-RX3-DsRED.
кДНК DsRED амплифицировали при помощи ПЦР из pF-RX3-DsRED с использованием следующих праймеров:
bGH rev (обратный) (SEQ ID NO:73)
bGH rev2 (обратный 2) (SEQ ID NO:74)
Для получения вектора pF-DsRED, ПЦР-амплифицированный ДНК-фрагмент расщепляли XbaI/HindIII и клонировали в pFastBac1 (Invitrogen), также расщепленный XbaI/HindIII.
Пример 20: Инфицирование клеток и личинок насекомых
Бакуловирус и личинки
Систему бакуловирусного экспрессирующего вектора (pFastBac, Invitrogen) использовали в качестве базового вектора для этого исследования. Рекомбинантный вирус получали и амплифицировали, как описано изготовителем. Яйца совки ни, Trichoplusia ni, получали из Entopath, Inc. (Easton, PA). Личинки из этих яиц вылуплялись в соответствии с инструкциями изготовителя; личинки четвертой возрастной стадии использовали для инфицирования.
Инфицирование личинок
Разные количества исходного раствора бакуловируса, состоящего из «вкрапленного» рекомбинантного вируса, намазывали на корм для личинок, которые заказывали в виде предварительно приготовленного корма в чашках Styrofoam из Entopath, Inc. (Easton, PA). Эти чашки закрывали и давали им стоять в течение часа, так что вирус полностью абсорбировался этой средой. Затем личинок четвертой возрастной стадии помещали на эти чашки (приблизительно 10-15 личинок на чашку) и чашки перевертывали. Личинки поедали корм сверху (со дна чашки), так что фекалии падали на крышку, откуда их ежедневно выбрасывали. Количество корма было достаточным по меньшей мере для 5 дней роста. Трех из пяти личинок собирали один раз в день для анализов RX3-DsRED и DsRED.
Инфицирование SF9
Spodoptera
Клетки Sf9 получали из Invitrogen (San Diego, CA, U.S.A.) и культивировали, как описано ранее (O'Reilly et al., 1992) с использованием среды Грейса для насекомых, дополненной гидролизатом лактальбумина, дрожжевым экстрактом (yeastolate), L-глутамином, 10% инактивированной нагреванием фетальной телячьей сывороткой и 1% раствором пенициллина/стрептомицина (Gibco). Клетки выращивали либо во вращающихся колбах (Bellco Glass, Vineland, NJ, U.S.A.), либо в пластиковых чашках 100 мм для культуры ткани (Falcon). Рекомбинантные вирусы получали с использованием набора для трансфекции BaculoGold (PharMmgen, San Diego, CA, U.S.A.). Отдельные бляшки выделяли и амплифицировали два - четыре раза с получением вирусного исходного раствора с высоким титром, который хранили при 4°C до использования. Для рутинного заражения, клеткам Sf9 в среде Грейса давали прикрепляться ко дну пластиковой чашки для культивирования 100 мм (107 клеток на чашку). После инкубации в течение 15 минут - 1 часа добавляли часть вирусного исходного раствора и эти культуры поддерживали при 27оC в атмосфере увлажненного воздуха. Обычно клетки использовали при 30-36 часах после инфицирования.
Пример 21: Получение RPBLA из клеток млекопитающего и личинок насекомых
Гомогенизация
Клетки млекопитающего
Трансфицированные клетки извлекали из культуральных чашек выскребанием и суспендировали в среде В для гомогенизации (10 мМ Трис-HCl рН 8,0, 0,9% NaCl, 5 мМ ЭДТА с ингибиторами протеаз). Эту суспензию клеток набирали в шприц на 5 мл, снабженный иглой 23-го калибра (23 G), и набирали и выпускали приблизительно 30 раз. Разрушение клеток подвергали мониторингу с использованием фазово-контрастного микроскопа.
Личинки насекомых
Замороженные личинки Trichoplusia ni, экспрессирующие белки RX3-DsRED и DsRED, гомогенизировали в буфере РВР5 (20 мМ Hepes pH 7,5, 5 мМ ЭДТА) с использованием политрона в течение 2 минут при 135000 об/мин и при помощи гомогензатора Поттера в течение 5 минут на льду при 2000 об/мин. Этот гомогенат центрифугировали при 200g 10 минут для удаления остатков кутикулы и ткани и супернатант наносили на ступенчатый градиент плотности.
Выделение RPBLA на основе плотности
RPBLA из клеток млекопитающих и замороженных личинок выделяли по существу, как описано для растений (с использованием ступенчатого градиента плотности или низкоскоростного центрифугирования).
Пример 22: Солюбилизация Тритоном Х-114, основанная на двухфазном разделении
Гомогенаты клеток разбавляли ЗФР и центрифугировали при 16000g в течение 15 минут. Супернатант удаляли и осадок сушили. К осадку добавляли 3 мл охлажденного на льду буфера для солюбилизации (50 мМ Трис рН 7, 5% Тритон Х-114, 20 мМ ТСЕР, 20 мМ NDSB195 и 100 мМ MgCl2) и после этого 1 мл ЗФР, содержащий 1 М мочевину, 10% глицерин и 100 мМ MgCl2.
Эту композицию инкубировали на льду в течение 15 минут с периодическим перемешиванием на вортексе. Затем эту суспензию обрабатывали ультразвуком в течение 20 секунд × 4 при 50% потенциале для поддержания ее на льду между включениями ультразвука в течение 1 минуты для поддержания холодной температуры. Затем эту суспензию инкубировали при 37оС в течение 15 минут с образованием 2 фаз. К нижнему гидрофобному слою (обогащенному Тритоном Х-114) добавляли три миллилитра ПЭГ, и эту композицию инкубировали на льду в течение 20 минут. Затем этот раствор инкубировали при 37оС в течение 15 минут с образованием опять двух фаз. Верхнюю фазу (4 мл) извлекали и хранили для анализа.
Пример 23: Иммунолокализация
Иммунохимия с использованием флуоресцентного микроскопа (Immunocytochemistry using a fluorescent microscope (Vertical Eclipse Microscope Nikon E600A)). Между 2 - 4 днями после трансфекции клетки фиксировали в течение 30 минут в 1% растворе параформальдегида и после промывания забуференным фосфатом буфером инкубировали в течение 45 минут с антителом против: (i) hGH (разведение 1/150), (ii) EK (разведение 1/500), (iii) RX3 (разведение 1/700). Для детектирования реакции антиген-антитело после инкубации в течение 45 минут с антителом против кроличьего иммуноглобулина, конъюгированным с Alexa Fluor 488 (Invitrogen), выполняли конфокальный анализ в конфокальном лазерном сканирующем микроскопе (Leica TCS SP, Heidelberg, Germany), оборудованном спектрофотометрами для выбора длины волны полосы испускания. Зеленые флуоресцентные изображения собирали после возбуждения 488 нм лазером на основе ионов аргона с использованием окна излучения, установленного при 495-535 нм. Красные флуоресцентные изображения собирали после возбуждения 543 нм с использованием HeNe-лазера и окна излучения 550-600 нм. Оптические срезы имели толщину 0,5-1 мкм.
Пример 24: Анализы активности
Анализ активности EGF
Клетки MDA-MB231 (клетки рака молочной железы, которые сверхэкспрессируют рецептор EGF) высевают в 96-луночные планшеты при 5500 клетках/мл. Клеткам давали прикрепляться в течение 8 часов в среде для выращивания с 10% ФТС (фетальной телячьей сывороткой) и затем оставляли голодать в среде, дополненной 0,1% ФТС. После этого среду удаляют и добавляют EGF (положительный контроль) из Promega или соответствующую пробу (солюбилизированный RX3-EGF) в различных концентрациях. Затем добавляют радиоактивный тимидин до конечной концентрации 0,5 мкКи. Пролиферацию исследуют при 48 часах после стимуляции при 37оС. Затем эти клетки промывают дважды холодным ЗФР и клетки выдерживают на льду для остановки метаболизма клеток. Добавляют 10% раствор трихлоруксусной кислоты (ТХУ) и эти клетки инкубируют в течение 20 минут при 4°C. После удаления раствора ТХУ планшеты промывают дважды этанолом при 70% и клетки инкубируют в течение 20 минут при 37оС в 0,5 мл лизисного раствора (2% Na2СО3, 0,1 н. NaOH и 10% ДСН). Планшеты перемешивают на вортексе и пробу не измеряют, пока не пройдет период 12 часов во избежание нежелательных явлений хемолюминесценции.
Анализ активности EK
Эту ферментативную активность измеряли флуорометрическим анализом (Grantet al. (1979) Biochim. Biophys. Acta 567:207-215). Реакцию инициировали добавлением фермента к 0,3-1,0 мМ флуорогенному субстрату Gly-(Asp)4-Lys-β-нафтиламиду (Sigma) в 25 мМ Трис-HCl (pH 8,4), 10 мМ CaCl2, 10% ДМСО (диметилсульфоксид) при 37оС. Концентрацию свободного β-нафтиламина определяли из приращения флуоресценции (λex=337 нм и λem=420 нм) при непрерывном мониторинге в течение 1 минуты. Активность рассчитывали как изменение во флуоресценции на протяжении времени.
Анализ активности GUS
Анализ активности GUS основан на катализе метилумбеллиферил-β-глюкуронида (MUG) до флуоресцентного продукта 4-метилумбеллиферона (4-MU) ферментом GUS (Jefferson RA, et al. (1987) EMBO J. 6(13):3901-3907). 50 мкл солюбилизированного RX3-GUS (или солюбилизированного RX3 в качестве контроля) добавляли к 200 мкл реакционного буфера (50 мМ фосфатный буфер pH 7, 10 мМ ЭДТА, 0,1% ДСН и 0,1% Тритон Х-100) плюс 66 мкл метанола. Субстрат (MUG) добавляли до конечной концентрации 10 мМ. Стандарт готовили добавлением 0, 50, 100, 200, 300 или 500 пмоль 4-MU (продукта реакции) к 200 мкл реакционного буфера этой реакции (4-MU).
Эти пробы и стандарт перемешивали и их измеряли во флуориметре (Victor, Perkin-Elmer) при λeх = 355 нм и λem = 460 нм. Пробы измеряли каждые 30 минут в течение 3 часов. Удельную активность рассчитывали по формуле: активность GUS (пмоль 4-MU/мин-1*mg-1=(λem(T1) - (λem(T0))/(k*(T1-T0)). “K”=отношение (Единицы флуоресценции)/(пмоль 4-MU).
Анализ активности RTB
(ELISA связывания асиалофетуина)
Функциональность RX3-RTB в белковых экстрактах из RPBLA определяли через связывание асиалофетуина, гликопротеина фетуина, обработанного сиалидазой для выставления заканчивающихся галактозой гликанов. Двести микролитров асиалофетуина (Sigma) в концентрации 300 мг/мл в модифицированном буфере ЗФР (мЗФР) (100 мМ Na-фосфат, 150 мМ NaCl, pH 7,0) связывали с лунками микротитрационного планшета Immulon 4HBX (Fisher, Pittsburg, Pa.) в течение 1 часа при комнатной температуре (RT). Покрывающий раствор выбрасывали и лунки блокировали 200 мл 3% БСА, 0,1% Твином 20 в мЗФР в течение 1 часа при комнатной температуре. После выбрасывания блокирующего раствора наносили 100 мл стандартов RTB и белковых экстрактов (см. ниже) и инкубировали в течение 1 часа при комнатной температуре. Затем лунки промывали три раза 200 мл мЗФР, 0,1% Твина 20. Кроличьи поликлональные антитела (Ab) против лектина R. сommunis (RCA60) при разведении 1:4000 в блокирующем буфере (описанном выше) наносили и инкубировали в течение 1 часа при комнатной температуре. Затем эти лунки промывали, как описано выше. АР-конъюгированное козье антитело против кроличьего IgG (Bio-Rad) наносили при разведении 1:3000 в блокирующем буфере и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали три раза, как описано выше, и наносили 100 мл субстрата pNPP (динатриевой соли п-нитрофенилфосфата) (Pierce, Rockford, 111.). Реакцию останавливали после 15 минут добавлением 50 мкл 2 н. NaOH. Поглощение (A405) считывали в микропланшет-ридере Bio-Tek EL808 Ultra. Экстракты белка готовили при соотношении 1 г сырой массы листа к 3 мл Трис-аскорбатного буфера (см. выше) и пробы сравнивали со стандартной кривой, состоящей из серийно разведенного полученного из клещевины обыкновенной RTB (Vector Labs, Burlingame, Calif.), в Трис-аскорбатном буфере, с концентрациями в диапазоне от 5 нг до 500 нг на лунку.
Пример 25: Усиленное поглощение RX3-DsRED, собранного в RPBLA, из личинок насекомого макрофагами
кДНК, кодирующие RX3-DsRED и DsRED, клонировали в бакуловирусный вектор FastBac (Invitrogen) с получением pFB-RX3-DsRED и pFB-DsRED. Эти конструкции использовали для инфицирования личинок Trichoplusia ni. Замороженных личинок, экспрессирующих белки RX3-DsRED и DsRED, гомогенизировали и наносили на ступенчатый градиент плотности. После центрифугирования при 80000g в качающемся бакетном роторе в течение 2 часов выполняли анализ с использованием иммуноблота слитого белка RX3-DsRED и контроля, соответствующего DsRED, экспрессируемому в цитозоле (фиг. 2C). Как и ожидалось, при экспрессии в цитозоле клеток личинок белок не собирался в структуры высокой плотности и был локализован в супернатанте и фракции F35 (фиг. 2C, дорожки 2 и 3). С другой стороны, слитый белок RX3-DsRED был способен собираться и накапливаться в плотных структурах, которые могут быть выделены из F56 (фиг. 2C, дорожка 5). Как показано анализом конфокальной микроскопии в примере 4 (фиг. 4), RX3-DsRED накапливались в округлых RPBLA.
RPBLA RX3-DsRED из F56 разводили 3 раза в РВР5 (10 мМ HEPES pH 7,4, 2 мМ ЭДТА) и собирали в осадке центрифугированием при 80000g при 4°C в качающемся бакет-роторе в течение 2 часов. Осадок ресуспендировали в буфере ЗФР и количество RPBLA определяли при помощи FACS. Из 1 личинки, инфицированной вектором pFB-RX3-DsRED, получали приблизительно 1×109 частиц RPBLA при концентрации 500000 RPBLA на микролитр (мкл).
Сообщалось, что презентация антигена антигенпредставляющими клетками (APC), такими как макрофаги и дендритные клетки, является ключевым процессом, необходимым для индукции иммунной реакции (Greenberg et al, Current Op. Immunology (2002), 14:136-145). В этом процессе APC фагоцитируют антиген, который затем расщепляется на малые пептиды в фаголизосоме. Эти пептиды взаимодействуют с МНСII и сортируются к плазматической мембране для презентации опосредованным клетками и антителами реакциям иммунитета (Villandagos et al., Immunological Reviews (2005) 207:101-205).
Для определения антигенности слитых белков RX3, присутствующих в RPBLA, культуру клеток-макрофагов инкубировали с этими органеллами при различных соотношениях RPBLA/клетка (100:1 и 1000:1). Культуры клеток-макрофагов выращивали в условиях голодания или в присутствии M-CSF. Эти культуры клеток инкубировали с RPBLA в течение 1 часа и спустя 1, 2, 5 и 10 часов после удаления RPBLA макрофаги экстенсивно промывали ЗФР и фиксировали 2% параформальдегидом. После этого эти фиксированные макрофаги анализировали при помощи FACS для определения количества флуоресцентных RPBLA, поглощенных макрофагами, а также процента макрофагов, которые фагоцитировали флуоресцентные содержащие RX3-DsRED RPBLA.
Из этих результатов ясно, что макрофаги фагоцитировали RPBLA RX3-DsRED с неожиданной авидностью. Даже при более низком отношении RPBLA/клетка (1:100) и в присутствии M-CSF, при 1 часе после добавления RPBLA, 65% макрофагов являются флуоресцентными. Даже присутствие митогенного цитокина, такого как M-CSF, который отрицательно действует на фагоцитоз, осуществляемый макрофагами, не может значимо нарушить поглощение RPBLA. При 5 часах почти все (более 80%) макрофаги были флуоресцентными, что означает, что большинство этих клеток поглотили некоторое количество RPBLA из среды.
При анализе флуоресценции, ассоциированной с макрофагами, на протяжении времени инкубирования результат был даже более удивительным. Ни в одном из анализируемых условий (отношение RPBLA/клетка или присутствие или отсутствие М-CSF) не наблюдали насыщающего действия на способность макрофагов поглощать RPBLA. Если результаты приведенной выше таблицы и приведенной ниже таблицы сравнить при 5 и 10 часах инкубирования, видно, что почти все макрофаги являются флуоресцентными, но имеется непрерывное увеличение общей флуоресценции, ассоциированной с макрофагами. Этот результат показывает, что макрофаги фагоцитируют большое количество флуоресцентных частиц RPBLA.
Для демонстрации, что RPBLA, содержащие слитый белок RX3-DsRED, находились внутри макрофагов, а не просто адсорбировались на плазматической мембране, выполняли анализ с использованием конфокальной микроскопии. Фиг. 7А (левая панель) показывает некоторые из этих клеток-макрофагов, инкубированных с частицами RX3-DsRED (при 100:1) в течение 1 часа. На левой панели той же самой фигуры срез 1 мкм тех же самых клеток показывает типичную зеленую автофлуоресценцию макрофагов, наблюдаемую с зеленым фильтром (фиг. 7А, белые острия стрелок). Присутствие ядра и имеющих красную флуоресценцию частиц RPBLA (фиг. 7А, черное острие стрелки) в том же самом оптическом срезе указывает на то, что эти RPBLA были поглощены внутрь этих клеток фагоцитозом.
Другим важным фактором, который должен быть анализирован, является деградация иммуногена, как только он был фагоцитирован макрофагом. Деградация антигена необходима для продуцирования антигенных пептидов, которые презентируются на рецепторе МНСII. Анализ флуоресцентного распределения DsRED макрофагов на протяжении времени показал, что эти частицы RPBLA активно расщеплялись.
Другая серия микрофотографий показывает, что после 1 часа инкубирования частицы RPBLA не были полностью деградированы и могли все еще наблюдаться внутри этих клеток (фиг. 7В, верхние панели). После 10 часов, распределение красной флуоресценции было более гомогенным по всем клеткам, что указывает на то, что макрофаги начинали деградировать частицы RPBLA (фиг. 7В, нижние панели).
Пример 26: Усиленное поглощение RX3-DsRED в RPBLA из личинок насекомых дендритными клетками
Дендритные клетки играют центральную роль презентации антигена для индукции иммунной системы (Blander et al., Nature Immunology (2006) 10:1029-1035). Хотя редкие, дендритные клетки являются наиболее высоко специализированными АРС, способными как провоцировать, так и регулировать иммунореактивность (Lau AH et al Gut 2003 52:307-314). Для оценки способности этих клеток фагоцитировать слитые белки RX3-DsRED в RPBLA из личинок насекомых культуру дендритных клеток инкубировали с этими органеллами при соотношении 100 RPBLA на клетку. Готовили два типа RPBLA: (i) RPBLA, выделенные, как описано выше, и (ii) те же самые RPBLA, тщательно промытые в 50 мМ Трисе рН 8, 1% Тритоне Х-100, для удаления мембраны ER. Культуры дендритных клеток выращивали в условиях голодания в присутствии RPBLA и пробы анализировали при 0, 1, 2, 5 и 10 часах.
Как можно заключить на основании приведенных выше таблиц, дендритные клетки обнаруживают удивительную авидность в отношении RPBLA. Как и ожидалось, они имеют более медленную скорость фагоцитоза в сравнении с макрофагами (сравните предыдущие таблицы), как описано в другом месте. Процент флуоресцентных дендритных клеток увеличивается на протяжении всего анализированного временного хода и эффект отсутствия насыщения наблюдали даже при 10 часах после инкубирования RPBLA. Аналогичные выводы могут быть сделаны при анализе величины флуоресценции, ассоциированной с макрофагами, на протяжении времени.
Способность дендритных клеток поглощать RPBLA не обнаруживала эффект насыщения. Это отсутствие эффекта может быть объяснено тем фактом, что все более и более дендритных клеток индуцируются для фагоцитоза (и становятся флуоресцентными) на протяжении времени. Тем не менее, возможно также, что способность фагоцитоза этих клеток не насыщается, как это наблюдали с макрофагами.
Неожиданно, анализ FACS дендритных клеток, инкубированных с не содержащими мембран RPBLA, показал значимо более высокий процент флуоресцентных дендритных клеток, чем тех же самых клеток, инкубированных с содержащими мембраны RPBLA. Кроме того, флуоресценция этих дендритных клеток была также более высокой. Сходные результаты получали с использованием макрофагов с не содержащими мембран RPBLA. Это было несколько удивительным, так как ожидалось, что присутствие происходящих из насекомого мембранных белков в содержащих мембрану RPBLA могло бы узнаваться в качестве чужеродных белков мышиными дендритными клетками и, следовательно, усиливать фагоцитоз. Таким образом, очевидно, что происходящие из насекомого RPBLA в присутствии или в отсутствие окружающей мембраны являются очень эффективными антигенпрезентирующими носителями.
Для демонстрации, что RPBLA и не содержащие мембраны RPBLA, содержащие слитый белок RX3-DsRED, поглощались дендритными клетками, выполняли анализ оптической микроскопии. Фиг. 8А (верхняя часть) показывает дендритные клетки, инкубированные в течение 2, 5 и 10 часов с RX3-DsRED RPBLA (в соотношении 100:1). В нижней части фиг. 8В красная флуоресценция белка DsRED иллюстрирует поглощение RPBLA этими клетками. При 2 часах инкубирования можно наблюдать некоторый фагоцитоз, но большинство RPBLA адсорбируются только на плазматической мембране. При 5 часах и даже более при 10 часах наблюдали многочисленные фагоцитированные красные флуоресцентные RPBLA. Сходные результаты получали при инкубировании дендритных клеток с не содержащими мембраны RPBLA (фиг. 8В).
Важно отметить, что даже при 10 часах инкубирования с RPBLA или не содержащими мембраны RPBLA большинство фагоцитированных частиц остаются видимыми в виде частиц, что означает, что имеет место небольшой протеолиз. Это наблюдение согласуется с прежним наблюдением, показывающим, что кинетика приобретения протеаз и, следовательно, протеолиза является более медленной в дендритных клетках, чем в макрофагах (Lennon-Dum'enil et al. (2002) J. Exp. Med. 196:529-540). Эти условия могут ограничивать протеолиз белков в дендритных клетках и благоприятствовать генерированию пептидных антигенов подходящей длины для загрузки на молекулы МНС класса II.
Пример 27: Фагоцитоз макрофагов и дендритных клеток
Макрофаги
Макрофаги получали из костного мозга мышей Balb/c. Мышей умерщвляли смещением шейных позвонков и извлекали бедренную и большеберцовую кость. Кости нарезали и костный мозг экстрагировали средой DMEM с использованием шприца. Костный мозг культивировали на чашке Петри 150 мм с полной средой DMEM (дополненной 20% ФТС и 30% L-клетками). Культуру макрофагов с чистотой 99% получали после 7 дней инкубирования при 37°С.
Дифференцированные макрофаги культивировали в полной среде с получением 350000 клеток на лунку. После прикрепления клеток среду удаляли и клетки инкубировали с новой средой, которая содержала RPBLA RX3-DsRED из личинок. Этот эксперимент выполняли с 100 или 1000 частиц: 1 клетка. Количество частиц (RPBLA) считали при помощи Coulter Epics XL FACS с использованием аргонового лазера при 488 нм для возбуждения и FL2 при 575 нм ±30 для испускания. Flow-count (количество протекающих частиц) из стандарта Beckman Coulter ref. 7547053 (lot 754896F) использовали для контроля протекания.
После различных периодов времени (0, 1, 2, 5 и 10 часов) среду удаляли и выполняли два промывания ЗФР. Клеткам давали вторично индуцировать их компетентность и затем фиксировали ЗФР с 2% параформальдегида. Обработанные макрофаги хранили при 4°С и флуоресценцию анализировали при помощи FACS (с той же самой программой, которую использовали для счета).
Для подтверждения, что частицы RX3-DsRED были фагоцитированы внутри клеток, выполняли эксперимент с использованием иммуноцитохимии. Дифференцированные макрофаги (50000 клеток на лунку) инкубировали с частицами 100:1 RX3-DsRED в течение 1 часа. После инкубирования, клетки промывали дважды ЗФР и фиксировали ЗФР с 2% формальдегидом в течение 15 минут. Обработанные клетки анализировали конфокальной микроскопией.
Дендритные клетки
Костный мозг из мышей Balb/c культивировали с полной средой (DMEM, 10% ФТС, 5 нг/мл GM-CSF) в течение одного дня. Для удаления гранулоцитов чашки встряхивали и среду заменяли дважды. Затем среду заменяли дважды без встряхивания и инкубировали в течение 2 дней с получением незрелых дендритных клеток. Дендритные клетки инкубировали с 100:1 частицами RX3-DsRED в течение 1, 5 и 10 часов. После обработок клетки фиксировали 2% параформальдегидом, хранили при 4°С и флуоресценцию анализировали при помощи FACS.
Каждая из заявок на патент, каждый из патентов и каждая из статей, цитируемых здесь, включены в качестве ссылки.
Предыдущее описание и примеры должны пониматься как иллюстративные, а не как ограничивающие. Возможны и другие вариации в идее и объеме этого изобретения, и они будут легко обнаруживаться квалифицированными в данной области специалистами.
Реферат
Изобретение относится к биотехнологии. Описана эукариотическая клетка-хозяин для экспрессирования слитого белка, которая содержит рекомбинантный слитый белок в рекомбинантных подобных белковым тельцам упорядоченных структурах (RPBLA). Указанный слитый белок содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является биологически активным полипептидом, где индуцирующая белковые тельца последовательность содержит последовательность проламина. Указанный биологически активный полипептид природно обнаруживается во втором типе клеток, который отличается от указанной эукариотической клетки-хозяина. Представлены рекомбинантные подобные белковым тельцам упорядоченные структуры (RPBLA) для сборки слитого белка, которые содержат заключенный в мембрану слитый белок. Также предложен способ получения биологически активного полипептида и вакцина или инокулят, содержащие иммуногенно эффективное количество рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA), которые содержат рекомбинантный слитый белок, растворенный или диспергированный в фармацевтически приемлемом разбавителе. 5 н. и 33 з.п. ф-лы, 8 ил.
Формула
причем указанная эукариотическая клетка-хозяин не продуцирует белковые тельца в отсутствие указанного слитого белка.
a) обеспечения рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA), которые содержат заключенный в мембрану слитый белок, причем указанный белок содержит две последовательности, соединенные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является биологически активным полипептидом, где индуцирующая белковые тельца последовательность содержит последовательность проламина;
b) приведения RPBLA в контакт с водным буфером, содержащим разрушающее структуру мембраны количество поверхностно-активного вещества;
c) поддержания указанного контакта в течение периода времени, достаточного для разрушения структуры мембраны, и при температуре, которая не денатурирует биологически активный полипептид, для отделения мембраны от слитого белка;
d) сбора отделенного слитого белка, который содержит биологически активный полипептид;
e) обработки слитого белка с выделением биологически активного полипептида.

Комментарии