Клонирование, экспрессия в дрожжах, очистка и биологическая активность области удлинения альфа'-субъединицы 7s-глобулина сои, вовлеченной в гомеостаз холестерина в клетках hep g2 - RU2558259C2
Код документа: RU2558259C2
Чертежи

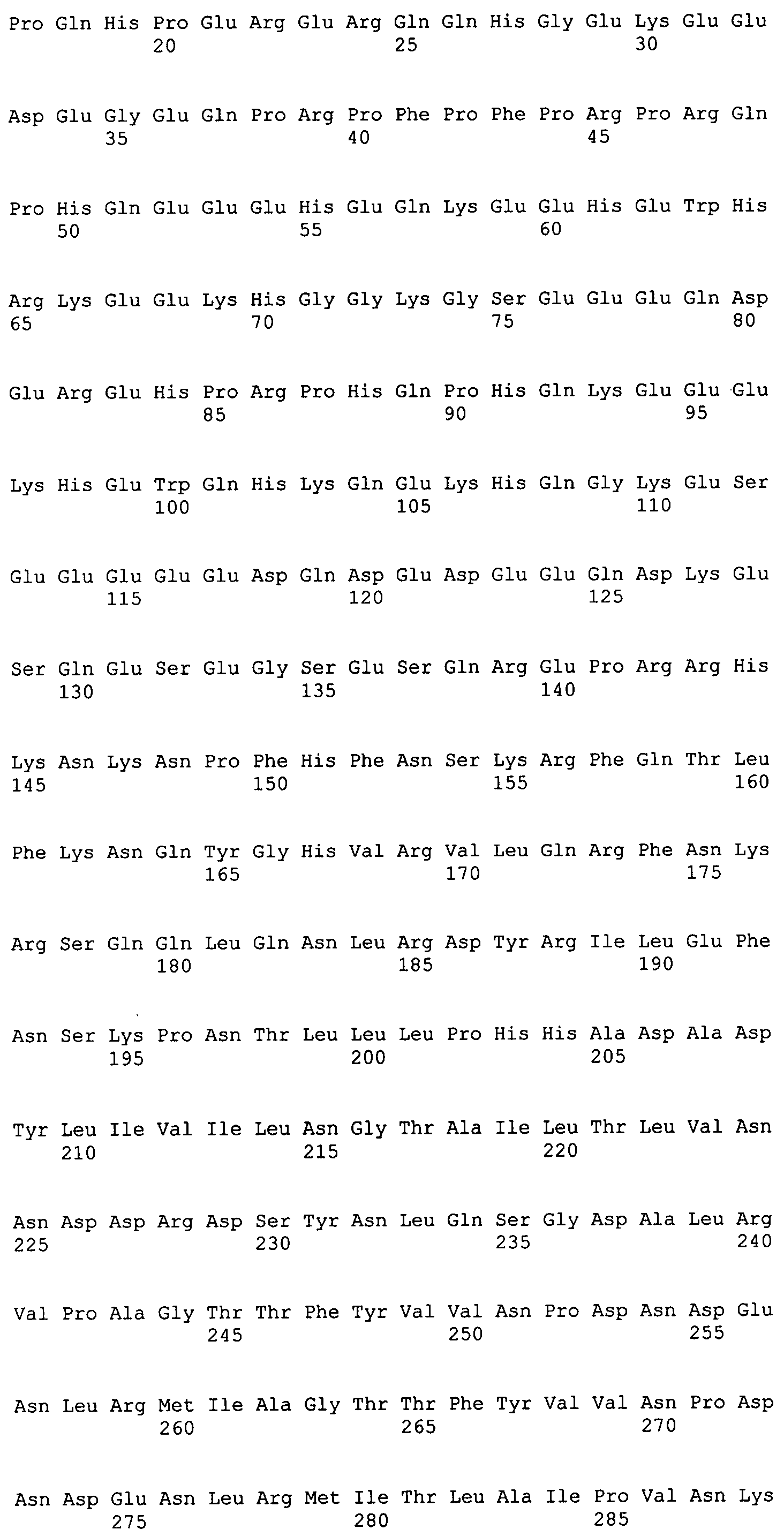
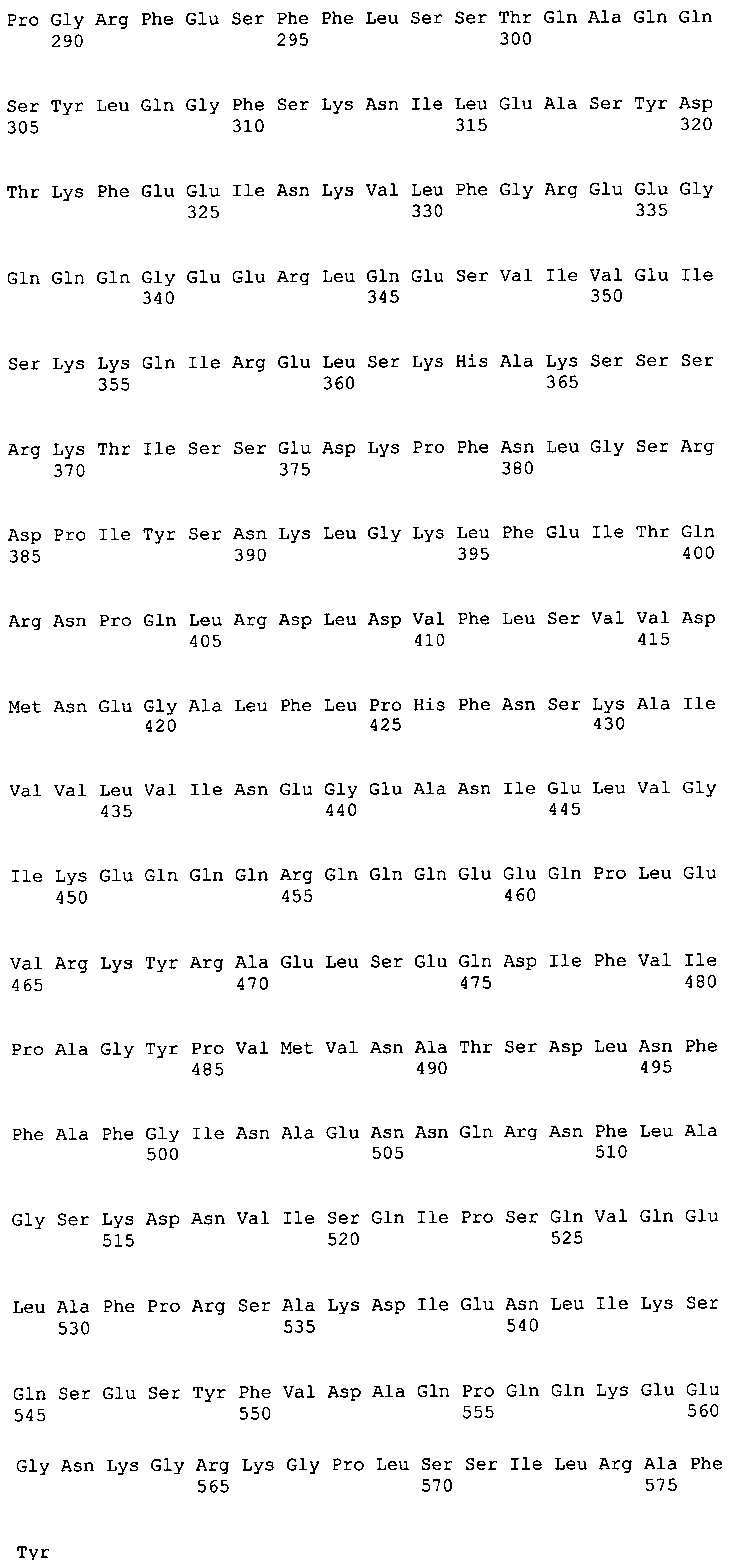

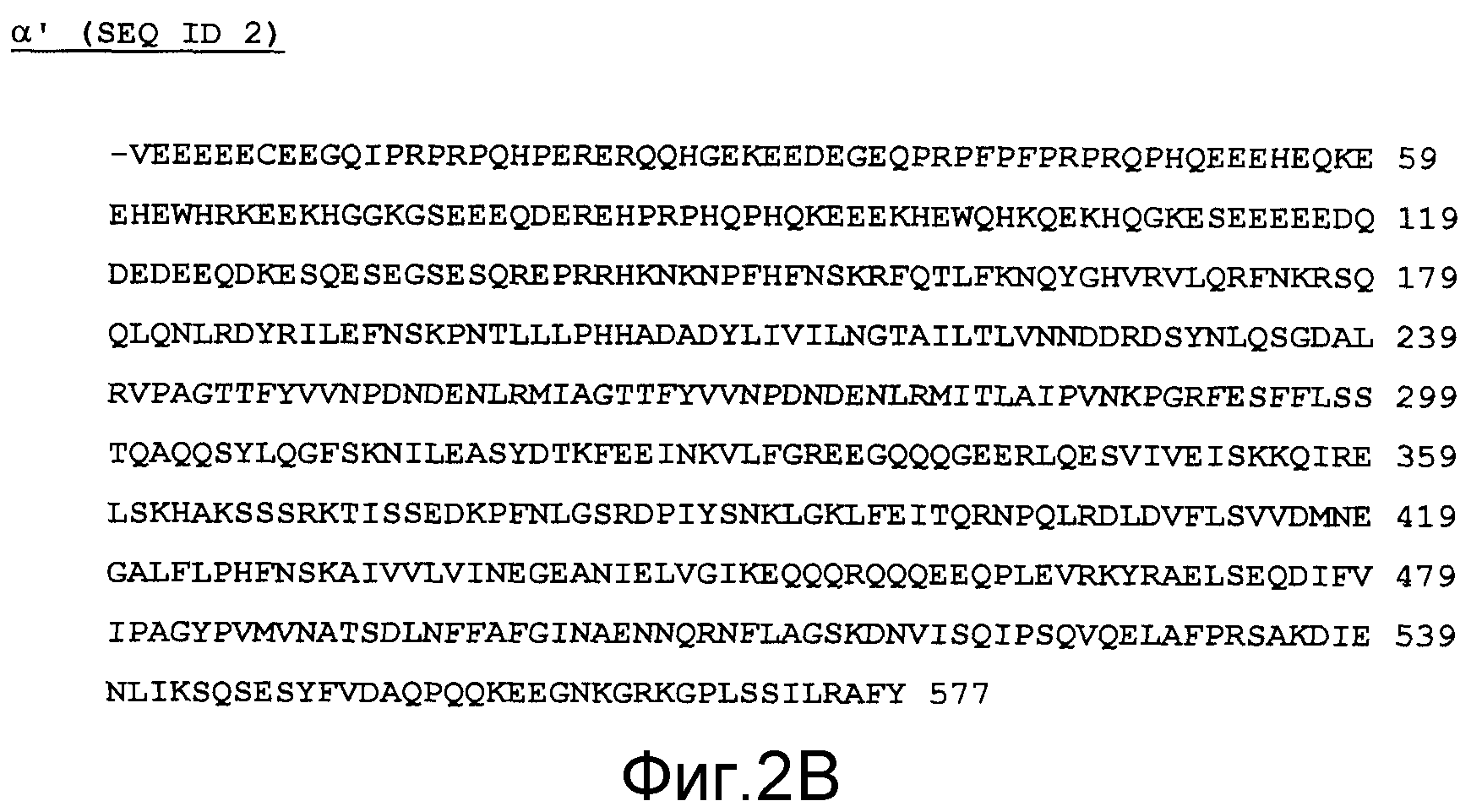

Описание
Настоящее изобретение относится к рекомбинантному α'-фрагменту 7S-глобулина сои, соответствующему N-концевому гидрофильному фрагменту природной α'-субъединицы, к способу его получения и к композициям, содержащим его в качестве активного ингредиента, пригодным для контроля гомеостаза холестерина и триглицеридов.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Роль пищевых соевых белков в контроле уровня липидов в крови у пациентов с гиперхолестеринемией является общепринятым положением [1]. В предыдущих исследованиях [2-4] показано прямое участие одной из субъединиц 7S-глобулина сои, α'-субъединицы, в положительной регуляции рецептора ЛПНП в системах in vitro и in vivo, что позволяет предположить, что вероятно вследствие процессинга клеточными ферментами продуцируются биологически активные (поли)пептиды, способные регулировать гомеостаз холестерина.
Природный 7S-глобулин состоит из трех случайным образом сгруппированных полипептидных цепей, субъединиц α', α и β [5], кодируемых различными генами. Зрелые цепи α' (номер доступа базы данных UniProtKB/Swiss-Prot P11827) и α (номер доступа базы данных UniProtKB/Swiss-Prot P13916) содержат одинаковую N-концевую область удлинения, состоящую приблизительно из 145 аминокислотных остатков, которые отсутствуют в субъединице β (номер доступа базы данных UniProtKB/Swiss-Prot P25974). На основе характерной аминокислотной последовательности области удлинения α' эту субъединицу очищали посредством металло-аффинной хроматографии и перорально вводили крысам с гиперхолестеринемией, таким образом демонстрируя ее способность снижать уровень липидов в плазме и положительную регуляцию β-ЛПОНП-рецепторов печени [4]. С другой стороны, так как молекулярная масса α'-субъединицы составляет приблизительно 71 кДа [6], представляется маловероятным, что она может преодолеть кишечный барьер in vivo без модификации.
По этой причине исследование авторов изобретения было направлено на поиск аминокислотной/ых последовательности/ей субъединицы α', отвечающей за фармакологический эффект. Так как основные области этих трех субъединиц содержат более сходные аминокислотные последовательности, понятно, что биологическая активность должна быть свойственна одному или нескольким (поли)пептидам области удлинения. Количество пептидов, отвечающих за биологическую активность, по существу могут ограничивать локализованные, но значимые различия аминокислот между областями удлинения цепей α' и α.
На основе предыдущих утверждений первой используемой стратегией являлось тестирование влияния полипептидов, полученных посредством расщепления in vitro (пепсин/трипсин) CroksoyR70, соевого концентрата, не содержащего изофлавонов, как правило, применяемого в диетотерапии пациентов с гиперхолестеринемией [7-8], и синтетических пептидов, соответствующих конкретным аминокислотным последовательностям, которые различаются у субъединиц 7S-глобулина сои, на модуляцию рецепторов ЛПНП (ЛПНП-Р) в клетках Hep G2. Результаты, полученные в этих исследованиях, указывали на то, что в клетках Hep G2 можно индуцировать значительную положительную регуляцию ЛПНП-Р под воздействием продуктов ферментативного расщепления CroksoyR70 с MW в диапазоне от 3000 до 20000 Да, а также низкомолекулярного синтетического пептида (2271 Да) 7S-глобулина сои, добавляемого к клеткам в концентрации 10-4M [9]. Исследование малых пептидов продолжается и к настоящему времени еще не окончено [10].
Способность соевых белков снижать уровень холестерина и триглицеридов является общепризнанным положением. Питание на основе соевого белка в настоящее время является наиболее действенным диетическим средством лечения пациентов с гиперхолестеринемией, таким образом предоставляя уникальную возможность лечения как взрослых, так и детей. Кроме того, точно установлено, что снижение уровня холестерина в крови происходит в большей степени у пациентов с более высоким исходным уровнем холестеринемии [14].
Гипотеза о том, что белки самостоятельно снижают уровень холестерина в крови, возникла в результате экспериментальных исследований, указывающих на то, что переход от животных к растительным белкам в пище активизирует работу рецепторной системы ЛПНП в печени лабораторных животных [15], а также циркуляцию лимфомоноцитов у пациентов с гиперхолистеринемией [16]. Для идентификации компонентов соевого белка, отвечающих за снижение уровня холестерина в крови, проведены исследования in vitro на основе клеточной линии гепатомы человека, которая является крайне чувствительной к факторам, регулирующим экспрессию рецепторов ЛПНП и биосинтез/распад холестерина. Обнаружено, что очищенная α'-субъединица 7S-глобулина сои активирует рецепторы ЛПНП в клетках Hep G2 [3], и это подтверждено на крысах, которым вводился холестерин [4]. Хотя эти данные подтверждают гипотезу о том, что за наблюдаемый биологический эффект отвечает белковая молекула, можно выдвинуть различные аргументы относительно биологической судьбы α'-цепи in vivo, вследствие того, что пептиды и аминокислоты в норме образуются в результате действия желудочных и/или кишечных протеолитических ферментов. Однако выявляют все увеличивающееся число животных и растительных (поли)пептидов, выполняющих важные регуляторные функции, часто приписываемые антиоксидантному, антипролиферативному и противовоспалительному действию [17]. Что касается сои, экспериментальные данные четко указывают на возможность того, что может происходить всасывание пептидов и даже низкомолекулярных компактных белков, таких как ингибитор Баумана-Бирк [18], таким образом вызывая ряд эффектов, включая противораковый, противовоспалительный, радиопротективный [19]. Кроме того, показано, что генетически модифицированные (поли)пептиды сои запускают механизм биологического ответа, такого как гипотензивные эффекты [20]. Недавно в гидролизате сои, полученном с использованием протеаз Bacillus amyloliquefaciens, а затем путем химического синтеза выявлен пептид, стимулирующий транскрипцию ЛПНП-Р (FVVNATSN), происходящий из β-цепи 7S-глобулина [21]. В этом случае в клетках Hep G2, подвергавшихся воздействию пептида в концентрации 100 мкМ, выявлена повышенная транскрипция ЛПНП-Р (+148%). Показано, что другие пептиды, происходящие из 11S-глобулина, проявляют сходную, но более низкую активность [21].
Желательно получить более короткие полипептиды с сохранением или даже с улучшением биологических свойств полноразмерного белка.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящее время обнаружено, что так называемая область удлинения α' 7S-глобулина сои, соответствующая его N-концевому участку, обладает преимущественной биологической активностью, и доказано, что она является даже более эффективной при захвате и разрушении ЛПНП, чем полноразмерная α'-цепь.
Таким образом, изобретение относится к указанной области удлинения α', которая далее в настоящем описании обозначена как eα', а также к способу ее получения посредством клонирования, экспрессии в дрожжах и очистки рекомбинантного полипептида, содержащего N-концевую область удлинения α-субъединицы сои.
С этой целью проводили гетерологическую экспрессию N-концевого фрагмента α'-цепи. Задачу решали посредством компетентных по секреции дрожжевых клеток дрожжей Pichia pastoris. Рекомбинантный полипептид очищали и его биологическую активность оценивали в клетках Hep G2. Посредством этого биотехнологического подхода можно получать достаточное количество рекомбинантного полипептида для тестирования в испытаниях in vitro, а также в экспериментах in vivo.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
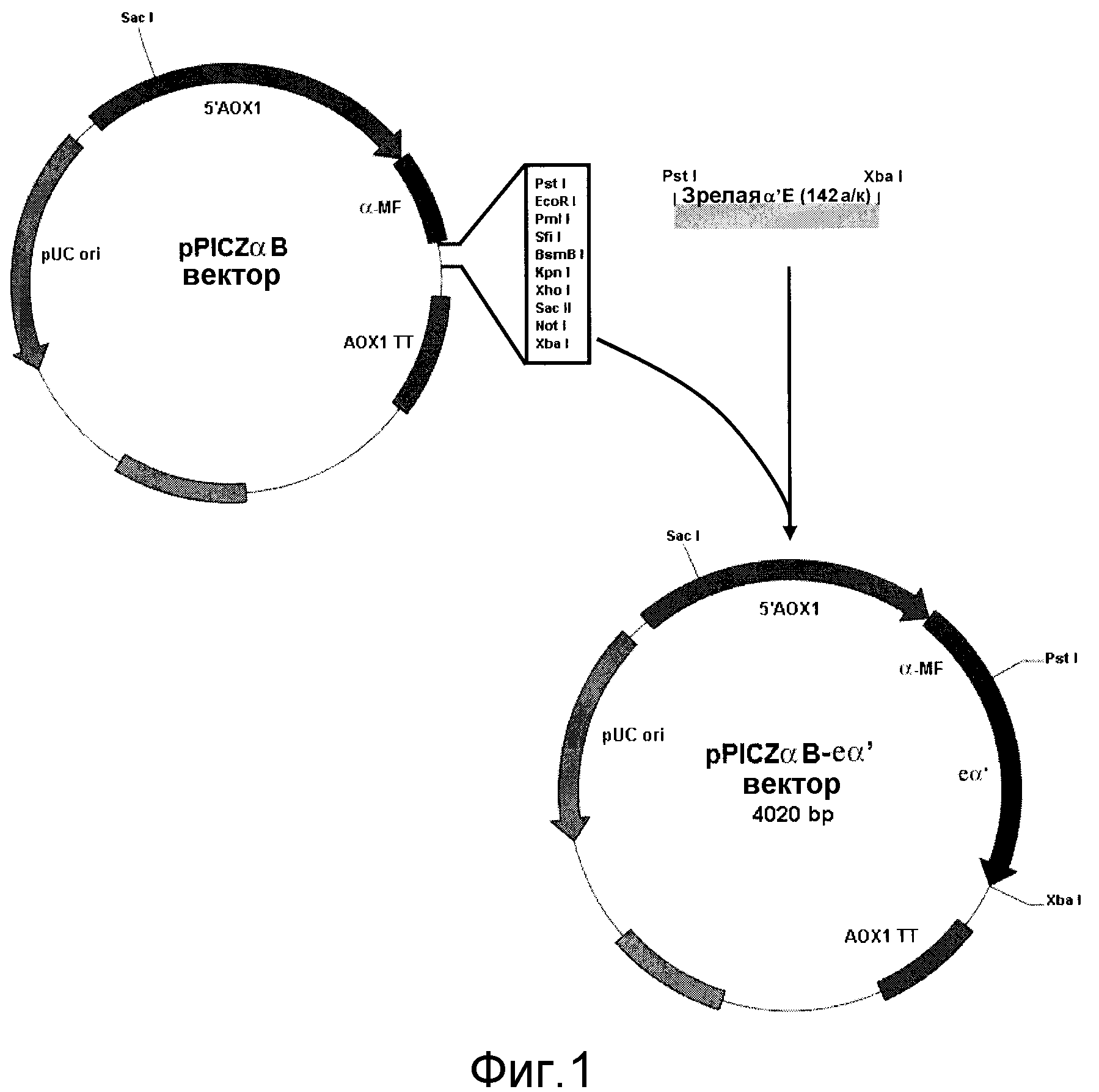
Фиг.1 - общий вид конструкции pPICZαB-eα'. Экспрессия eα' находится под контролем индуцируемого метанолом промотора AOX (алкогольоксидазы) (5'AOX1); фактор спаривания α (α-MF) обеспечивает секрецию рекомбинантного белка в среду; AOX1 TT: область терминации транскрипции AOX. Ген Sh ble придает устойчивость к зеоцину; pUC Ori: точка начала репликации для высокого числа копий плазмиды у E. coli. Другие аббревиатуры относятся к положениям расщепления рестрикционными ферментами; п.о.: пары оснований.
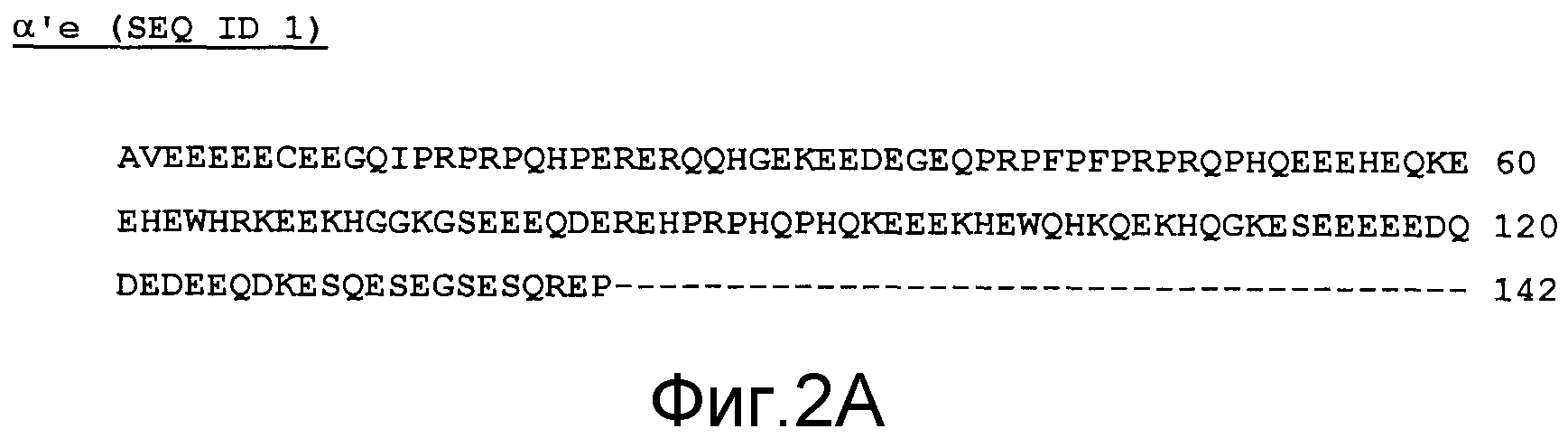
Фиг.2 - выравнивание последовательностей рекомбинантного полипептида (eα') и α'-субъединицы сои дикого типа. Звездочки указывают идентичные в двух последовательностях аминокислотные остатки.
Фиг.2A - последовательность рекомбинантного полипептида (eα)' (SEQ ID1).
Фиг.2B - последовательность дикого типа α'-субъединицы сои (SEQ ID2).
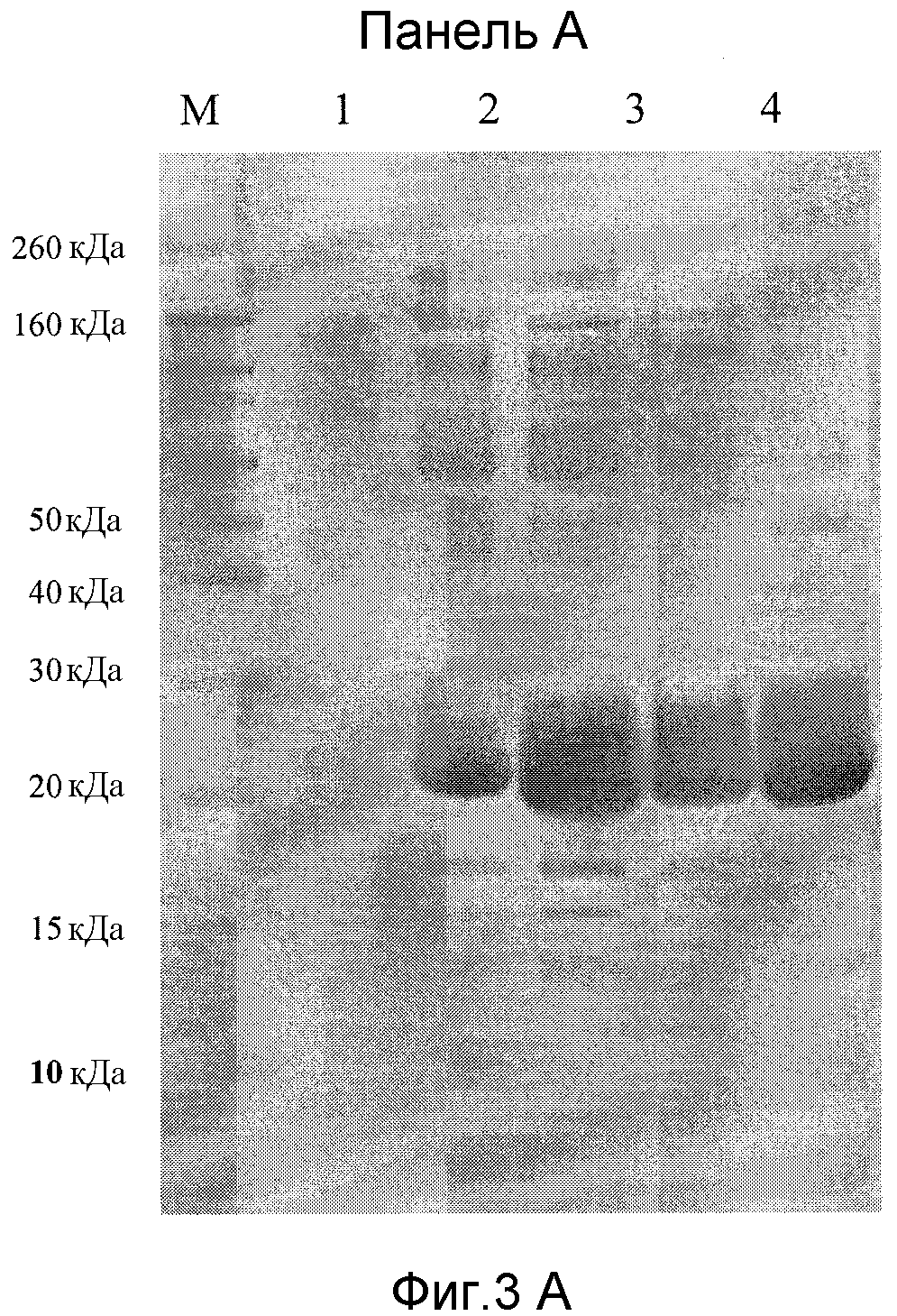
Фиг.3A - SDS-PAGE рекомбинантной культуры Pichia pastoris в восстановительных условиях:
Дорожка M: маркер молекулярной массы,
Дорожка 1: супернатант осажденной TCA культуры (без клеток) перед индукцией метанолом,
Дорожка 2: супернатант осажденной TCA культуры (без клеток) через 1 час после индукции метанолом,
Дорожка 3: супернатант осажденной TCA культуры (без клеток) после 8 часов индукции с метанолом,
Дорожка 4: супернатант осажденной TCA культуры (без клеток) после 19 часов индукции с метанолом,
Дорожка 5: супернатант осажденной TCA культуры (без клеток) после 25 часов индукции с метанолом.
Фиг.3B - SDS-PAGE этапов очистки eα' в восстановительных условиях:
Дорожка M: маркер молекулярной массы,
Дорожка 1: лиофилизированный порошок ферментативного бульона,
Дорожка 2: эллюированная фракция DEAE-целлюлозы 150 мМ NaCl,
Дорожка 3: эллюированная фракция DEAE-целлюлозы 250 мМ NaCl.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение подробно описано в приведенном ниже экспериментальном разделе.
Материалы и способы
Дрожжи, бактериальные штаммы и химические реактивы. Для экспрессии в дрожжах использовали штамм Pichia pastoris X33 (WT) (Invitrogen, San Diego, CA). Бактериальным штаммом, используемым для генетических процедур, являлся XL 1-Blue E. coli (Invitrogen, San Diego, CA). Ферменты рестрикции PstI и XbaI приобретали в Roche (Indianapolis, IN), SacI в Fermentas (Ontario, Canada), ДНК-полимеразу Taq приобретали в Invitrogen (San Diego, CA). Зеоцин приобретали в Invivogen (San Diego, CA). Олигонуклеотиды для ПЦР получали в Primm (Milano, Italy). Пептон, триптон, дрожжевой экстракт и агар приобретали в Becton Dickinson and Company (Sparks, MD). Глюкозу и сорбит приобретали в Sigma (St. Louis MO). Мембраны для диализа приобретали в Spectrum Laboratories (Rancho Dominguez, CA). Смолу DEAE приобретали в Whatman (Maidstone, England). Смолу NiNTA приобретали в Qiagen (Hilden, Germany). Колонку Symmetry C4 HPLC Column приобретали в Waters (Milford, MA).
Другие химические реактивы, являвшиеся химически чистыми, получали в Sigma (St. Luis, MO) или в Merck (Darmstadt, Germany).
Среды и условия среды. Штамм P. pastoris X33 культивировали в полной среде YPD (дрожжи, пептон, декстроза) (2% пептона, 1% дрожжевого экстракта, 2% глюкозы). Селекцию трансформантов Mut+ производили в планшетах, содержащих YPD, агар 1,5%, 100 мг/мл зеоцина. Все дрожжевые культуры поддерживали при 30°C. Для детекции гетерологичного белка трансформанты Zeor-Mut+ культивировали до оптической плотности от 5 до 600 нм в среде YPS (дрожжи, пептон, сорбит) (2% пептона, 1% дрожжевого экстракта, 2% сорбита). Затем добавляли метанол до конечной концентрации 1%. Селекцию всех бактериальных трансформантов производили в планшетах с низкосолевой средой LB (Луриа-Бертани), содержащей зеоцин (1% триптона, 0,5% дрожжевого экстракта, 0,5% хлорида натрия, 1,5% агара, 25 мг/мл зеоцина). Все бактериальные культуры поддерживали при 37°C.
Конструкция экспрессирующего вектора для гена eα'. Ген eα' амплифицировали посредством ПЦР на экспрессионной матрице плазмидной ДНК Pichia pastoris (pPICZαB), содержащей вставку (tα'), включающую интересующую последовательность (eα'). Олигонуклеотид 5'-GAAAAGATAGATTAAAGCTGCAGTGGAGGAAG-3' конструировали так, чтобы получить участок рестрикции PstI на 5'-конце гена eα'. Мутация приводила к вставке остатка аланина в N-концевом положении eα'. Второй олигонуклеотид 5'-CCCTTCTTATTCTTTCTAGATCATGGTTCTCTTTGAGACTC-3' конструировали так, чтобы получить участок рестрикции XbaI на 3'-конце гена eα'. Оба олигонуклеотида растворяли в стерильной воде качества mQ. Реакционная смесь ПЦР состояла из 0,5 мМ праймеров, 0,8 мМ dNTP (Eppendorf, Hamburg, Germany), 30 нг матрицы (pPICZαB/tα'), 2,5 Ед ДНК-полимеразы Taq, буфера для ПЦР (конечный состав: 50 мМ KCl, 1,5 мМ MgCl2, 20 мМ Tris-Cl, pH 8,4 и стерильной воды качества mQ до окончательного объема 25 мл). Амплификацию ПЦР проводили на термоциклере Perkin Elmer Geneamp PCR System 2400 (Perkin Elmer Corp., Wellesley, MA) с использованием следующих условий: старт при 94°C в течение 10 мин; 30 циклов при 94°C в течение 40 сек, 60°C в течение 40 сек, 72°C в течение 20 сек; конечная элонгация 72°C в течение 10 мин и хранение при 4°C. Продукт ПЦР 465 п.н. ферментативно расщепляли до полноразмерной конструкции длиной 423 п.н. и клонировали в вектор pPICZαB, получая конструкцию pPICZαB-eα', и трансформировали в клетки XL1-Blue E. coli. Отбор позитивных клонов проводили на полутвердой среде LB, содержащей тетрациклин и зеоцин. Один из этих клонов секвенировали в Primm (Milano, Italy), чтобы удостовериться, что в последовательности конструкции pPICZαB-eα' не произошло никакой мутации. Двадцать мкг конструкции pPICZαB-eα' и 30 мкг экспрессирующего вектора pPICZαB (отрицательный контроль) линеаризировали посредством расщепления ферментом рестрикции SacI, а затем очищали.
Трансформация pPICZαB-eα' в геном P. pastoris.Дрожжевые клетки дикого типа (wt) трансформировали посредством электропорации 20 мкг линеаризованной конструкции pPICZαB-eα' и 30 мкг линеаризованного pPICZαB на электропорирующем устройстве Eppendorf 2510 (Hamburg, Germany), установленном на 1,5 кВ. Трансформанты сначала отбирали, высевая их в планшеты с YPD, содержащие 100 мг/мл зеоцина. Для подтверждения интеграции конструкции авторов изобретения в трансформированный геном P. pastoris, для выделения геномной ДНК применяли набор Dneasy Plant Mini Kit (QIAGEN, Hilden, Germany). Геномную ДНК применяли в качестве матрицы для подтверждении вставки конструкции в участок промотора алкогольоксидазы (AOX1) посредством ПЦР, применяя праймеры 5'AOX1 (5'-GACTGGTTCCAATTGACAAGC-3') и 3'AOX1 (5'-GCAAATGGCATTCTGACATCC-3'). Реакционная смесь ПЦР состояла из 0,5 мМ праймеров, 0,25 мМ dNTP, 100 нг геномной матрицы, 2,5 Ед ДНК-полимеразы Taq, буфера для ПЦР (конечный состав, как указано выше). Реакцию ПЦР проводили при следующих условиях: старт при 94°C в течение 10 мин; 30 циклов при 94°C в течение 40 сек, 60°C в течение 40 сек, 72°C в течение 20 сек; финальная элонгация при 72°C в течение 10 мин и хранение при 4°C.
Отбор трансформированных клонов. Восемнадцать трансформантов Zeo+ и один трансформант, содержащий экспрессирующий вектор pPICZαB (отрицательный контроль), выращивали в 50 мл среды YPS при 30°C в инкубаторе с перемешиванием (180 об/мин) до OD600=5. Фазу индукции запускали посредством добавления метанола до конечной концентрации 1%, и она продолжалась в течение 24 часов. Аликвоты супернатантов проверяли на экспрессию eα' посредством SDS-PAGE. Трансформированный клон с наивысшей экспрессией eα' отбирали для получения рекомбинантного белка в масштабе ферментера.
Экспрессия eα': в масштабе ферментера. Для массового получения выбранный клон выращивали в 14 л ферментере (Chemap, Switzerland), в соответствии с "Pichia Fermentation Process Guidelines" Invitrogen (Version B, 053002). Инокулируемую культуру получают на среде YNB (KH2PO4 2,0 г; (NH4)2SO4 10,0 г; MgSO4·7H2O 1,0 г; NaCl 0,2 г; CaCl2 0,2 г; глицерин 100% 10,0 г; KOH до pH 5,2; дистиллированная вода до 1,0 л) во встряхиваемых колбах без перегородок. После инкубации в течение приблизительно 24 часов при 30°C при 250 об/мин 1,0 л посевной культуры используют для инокуляции ферментера с подготовленными 8,5 л основной солевой среды (H3PO4 85% 227 мл; CaSO4·2H2O 7,9 г; K2SO4 155 г; MgSO4·7H2O 127 г; KOH 35 г; глицерин 100% 340 г; дистиллированная вода до 8,5 л; pH, скорректированный до 5,0 посредством добавления NH4OH после стерилизации). Обе указанные выше среды для культивирования дополнены биотином и инозитолом (по 1 мг/л каждая). Основная солевая среда также дополнена модифицированным PTM1 Trace Salt Solution (H2SO4 96% 2,5 мл; CoC2O4·2H2O 243 мг; CuSO4·5H2O 3,0 г; KI 44,5 мг; MnSO4·H2O 1,5 г; Na2MoO4·2H2O 100 мг; H3BO3 10 мг; FeSO4·7H2O 32,5 г; ZnCl2 10 г; дистиллированная вода до 500 мл).
Рост микроорганизма и экспрессию гетерологичного белка обеспечивают посредством трехэтапного процесса. После фазы роста первой партии (глицерин в качестве источника C) в течение приблизительно 24 часов следует фаза подкормки (глицерин в качестве лимитирующего источника C) в течение приблизительно 4 часов. В течение этих первых двух фаз pH поддерживают при 5,0 посредством добавления NH4OH 20%. После того как потребляется весь глицерин, начинается подкормка метанолом для запуска экспрессии белка eα', и pH сдвигают до 6,0 посредством добавления NH4OH 20%. Фаза подкормки метанолом длится приблизительно 24 часа. В течение этих двух фаз подкормки растворенный кислород (DO%) сохраняется стабильным на уровне 30% посредством точной электронной регуляции скорости перемешивания (об/мин), в то время как скорость аэрации (vvm) постепенно увеличивается вручную. Каждые несколько часов условие, лимитирующее источник C, проверяется посредством уровня DO%: его значение должно резко возрастать после внезапной остановки подачи метанола и, vice versa, быстро снижаться после ее восстановления. Каждые несколько часов из ферментера берутся образцы в стерильных условиях для следующих анализов: оптическая плотность (лямбда 600 нм), % клеточной биомассы (влажной массы), стерильность, микроскопическое наблюдение, SDS-PAGE.
Очистка eα': переработка ферментативного бульона. Приблизительно 9,2 л культуры выливают из ферментера и охлаждают на льду. Все последующие операции проводят при +4°C. Полную культуру разделяют посредством центрифугирования (Centrikon T-124, Kontron Instruments) при 3000×g в течение 30 мин; биомассу (осадок) удаляют; приблизительно 7,5 л супернатанта очищают посредством глубокой фильтрации на Zetaplus 30SP (Cuno) и затем проводят микрофильтрацию через 0,22 мкм фильтр (Millipak 100, Millipore). Чистый фильтрат концентрируют посредством ультрафильтрации через полиэфирсульфоновую мембрану, MWCO 10 кДа (Omega filter, Pall). Проводят диафильтрацию концентрата, приблизительно 300 мл, против 3,0 л Tris-HCl 10 мМ pH 7,2 и в заключение лиофилизируют. Посредством этой процедуры получили 34,5 г лиофилизированного порошка, характеризующегося довольно низкой степенью содержания контаминирующих белков на SDS-PAGE и общее содержание белка в котором составило приблизительно 25% p/p (Bradford Protein Assay, бычий сывороточный альбумин как калибровочный стандарт).
Очистка eα': хроматографическая очистка.
Для проведения электрофореза в геле с более высоким разрешением применяли NuPAGE® Pre-Cast Gel System (Invitrogen) в соответствии с указаниями поставщиков. Два грамма лиофилизированного порошка растворяли в 150 мл 50 мМ Tris-HCl, pH 7,50 и загружали на DEAE-целлюлозную колонку (6×10 см, Whatman, Maidstone, UK), уравновешенную тем же буфером. Элюцию оставшегося белка проводили с тем же буфером, содержащим 150 и 250 мМ NaCl, соответственно. Фракция, элюированная с 0,25 M NaCl (300 мл), показала наибольшее содержание eα'. Раствор концентрировали до 100 мл посредством лиофильной сушки, а затем проводили диализ на 6000-8000 Да мембране при 4°C в течение 24 часов с применением ультрафильтрованной воды качества миллиQ, а затем лиофилизировали. Получили приблизительно 370 мг белка.
Для верификации гомогенности белка приблизительно 1 мг белка наносили на колонку с обращенной фазой Symmetry C4 (4,6×250 мм). Применяли буфер A (ультрафильтрованная вода и трифторуксусная кислота 0,1%) и буфер B (ацетонитрил 100% + трифторуксусная кислота 0,1%).
Электрофоретические способы. SDS-PAGE в восстановительных условиях (2% β-меркаптоэтанол) проводили в 12% полиакриламидном геле, в соответствии с ссылкой 11, с применением mini-Protean II (Bio-Rad) cell. Гели окрашивали Кумасси синим.
Клеточные культуры. Стабильную клеточную линию гепатомы человека (Hep G2) получали из American Type Culture Collection (Rockville, MD). Минимальную поддерживающую среду Игла (MEM), эмбриональную телячью сыворотку, трипсин-ЭДТА (1x), пенициллин (105 Ед/л), стрептомицин (100 г/л), трицин буфер (1 ммоль/л, pH 7,4) и растворы заменимых аминокислот (100x) приобретали в GIBCO (Madison, WI). Чашки Петри приобретали в COSTAR (Cambridge, MA). Фильтры приобретали в Millipore (Bedford, MA). Набор The Protein Coomassie Plus Protein Assay приобретали в Pierce (Rockford, IL, USA).125Иод без носителя в 100 ммоль/л NaOH приобретали в Perkin Elmer Life Sciences (Boston, MA). Колонки Sephadex G25 (PD10) приобретали в Pharmacia Biotech (Uppsala, Sweden). LDH и набор MTT приобретали в Sigma Diagnostics (Milano-Italy). Все другие химические реактивы аналитической степени чистоты приобретали в Merck (Darmstadt, Germany). Клетки выращивали в монослоях в чашках Петри диаметром 90 мм и поддерживали при 37°C в увлажненной атмосфере из 95% воздуха, 5% CO2 в MEM, дополненной 10% эмбриональной телячьей сывороткой (ЭТС), раствором заменимых аминокислот (1%, об/об), пенициллином (105 Ед/л), стрептомицином (0,1 г/л), трицин буфером (20 ммоль/л, pH 7,4), NaHCO3 (24 ммоль/л) и пируватом натрия (0,11 г/л). Для экспериментов, спланированных для оценки модуляции рецептора ЛПНП, клетки высевали в 35 мм пластиковые чашки (3-5×105 клеток) и применяли непосредственно перед достижением конфлюэнтности. Во всех экспериментах с клеточными культурами среду меняли каждые 2-3 дня. Для оценки жизнеспособности клеток культуральные среды от клеток, к которым добавляли eα' в различных концентрациях, тестировали посредством анализа на основе метилтетразолиевых солей (MTT), принцип которого изложен в ссылке 9. Утечку фермента из клетки определяли посредством измерения активности лактатдегидрогеназы (LDH), используя диагностический набор (LDH/LD) (Sigma Diagnostics). ЛПНП (1,019≤d≤1,063 г/л) выделяли посредством последующего препаративного ультрацентрифугирования [12] из плазмы клинически здоровых волонтеров с нормальным содержанием липидов в крови. Липопротеины были помечены в соответствии со способом McFarlane, модифицированным Bilheimer et al. [13] и описанным ранее [3].125I-ЛПНП стерилизовали посредством фильтрации (Millipore filters, размер пор 0,45 мкм) и хранили при 4°C до применения. Сыворотку человека, лишенную липопротеина (LPDS), получали, как описано ранее [9].
Захват и деградация 125I-ЛПНП. Монослои клеток преинкубировали при 37°C в течение 24 часов в MEM, дополненной 5 г/100 г LPDS для позитивной регуляции рецепторов ЛПНП [2], в присутствии/отсутствие eα' в различной концентрации, указанной в таблице, или 3,5 мкмоль/л очищенной α'-субъединицы или 1,0 мкмоль/л симвастатина. Затем в среду добавляли125I-ЛПНП в фиксированной концентрации (7,5 мг/л) и продолжали инкубацию в течение дополнительного 5 часа при 37°C. Специфический захват (связывание + интернализация) и деградацию125I-ЛПНП оценивали, как сообщалось ранее [2].
Статистические анализы. Различия в клеточном захвате и деградации ЛПНП после инкубации клеток с eα' в различных концентрациях определяли посредством ANOVA, а затем с применением критерия Даннета. Значения выражались как средние значения ± СО; P значения <0,05 рассматривались как статистически значимые.
Результаты
Экспрессия eα' в Pichia pastoris. Структура плазмиды, применяемой для трансформации клеток Pichia pastoris, показана на фиг.1. Последовательность вставки и ее выравнивание внутри α'-субъединицы показаны на фиг.2. Как указано в разделе Материалы и способы, единственное различие между рекомбинантными полипептидами и полипептидами дикого типа состоит в первом N-концевом аминокислотном остатке, который по техническим причинам в рекомбинантной цепи являлся аланином. Клон, демонстрирующий наибольшую продукцию рекомбинантного полипептида по результатам анализа среды для культивирования посредством SDS-PAGE (не показаны), отбирали для массивного получения. На фиг.3A показан электрофоретический анализ супернатанта культуры дрожжей до (дорожка н.1) и после индукции с метанолом в течение 1-8-19 и 25 часов (дорожки н.2, н.3, н.4, н.5). Как показано, выраженная полоса при наблюдаемой молекулярной массе приблизительно 20 кДа поднимается как следствие индукции.
Очистка eα'. Очистку eα' проводили с применением хроматографических способов. Образцы с каждого этапа собирали и анализировали посредством SDS-PAGE. Влияние этапов очистки на гомогенность идентифицированного полипептида показано на фиг.3B. Очень низкую степень контаминации дрожжевым белком достигали уже в среде для культивирования, но основные контаминантные белки устранили на дальнейших стадиях хроматографической очистки, что позволило восстановить рекомбинантный полипептид почти в гомогенной форме. Анализ N-концевой последовательности этой полосы подтвердил, что этот 20 кДа полипептид соответствовал цепи eα'. Чистоту этого образца сочли подходящей для клеточных анализов.
Биологическая активность eα'. Как сообщается в следующей таблице, добавление очищенной α'-субъединицы в качестве положительного контроля и ее укороченной формы α' к клеткам Hep G2 вызвало значительное возрастание опосредованных рецептором ЛПНП захвата и деградации по сравнению с необработанными клетками.
Результаты показали, что модуляция ЛПНП зависела от дозы eα' и что наивысшая концентрация сходна с концентрацией положительного контроля, симвастатина. При отсутствии концентрации eα' не проявлялось признаков токсичности для клеток, что определено анализами MTT и LDH (не показано).
Таким образом, установлено по изобретению, что аминокислотная последовательность, способная индуцировать биологический ответ, располагается в N-концевом домене удлинения α'-цепи. Кроме того, мы обнаружили, что N-концевой гидрофильный фрагмент оказывает влияние при концентрациях того же порядка величины, что и симвастатин, сильнодействующее лекарственное средство, снижающее уровень липидов в крови. Этот эффект мог по меньшей мере частично быть следствием взаимодействия in vitro между вышеназванным фрагментом и тиоредоксином, малым мультифункциональным белком с редокс-активным дисульфидным дитиолом в консервативном активном центре последовательности Cys-Gly-Pro-Cys, как сообщали авторы настоящего изобретения [3]. Эти данные могли бы объяснить более длительную задержку фазы окисления ЛПНП, индуцированного оксидом меди, которое наблюдали у кроликов, получавших богатое холестерином питание, содержащее белок сои, по сравнению с той задержкой, которую обнаруживали у кроликов, получавших то же самое питание, но содержащее казеин в качестве источника белка [22].
Полученные данные представляют особый интерес, так как они впервые демонстрируют, что N-концевой гидрофильный фрагмент α'-цепи 7S-глобулина сои действует в модели in vitro в концентрациях менее чем 10 мкМ, которые являются сходными с теми, о которых сообщалось в связи с симвастатином. Кроме того, применение рекомбинантного белка исключает любое вовлечение другого белка и небелковых компонентов сои, в том числе изофлавонов, для которых сообщалось отсутствие явных преимуществ и потенциальная токсичность [23].
Изобретение относится к функциональным продуктам питания и композициям с положительным воздействием на различные заболевания, включая гиперлипидемию и сердечно-сосудистые заболевания, для применения как самостоятельного средства или в комбинации с лекарственными препаратами в лечении, направленном на снижение содержания липидов в крови, т.е. статинами, такими как симвастатин, правастатин, флувастатин, аторвастатин, ловастатин.
Композиции по изобретению получают с применением общепринятых эксципиентов и способов. Дозировка рекомбинантного полипептида по изобретению зависит от нескольких факторов, таких как масса пациента, возраст и пол, и легко определяется терапевтом на основе фармакодинамики, фармакокинетики и токсикологических характеристик полипептида. Однако, как правило, указанная дозировка находится в пределах от приблизительно 50 до приблизительно 500 мг, от одного до трех раз в сутки.
СПИСОК ССЫЛОК
1. Sirtori CR. et al., Curr Atheroscler Rep. 2001; 3: 47-53.
2. Lovati MR. et al., J Nutr. 1992; 122: 1971-8.
3. Manzoni C. et al., J Nutr. 2003; 133: 2149-55.
4. Duranti M. et al., J Nutr. 2004; 134: 1334-39.
5. Thanh, VH. et al., Biochim Biophys Acta. 1976; 439: 326-38.
6. Maruyama N. et al., J Agric Food Chem. 1999; 47: 5278-84.
7. Sirtori CR. et al., Nutr Metab Cardiovasc Dis. 1998; 8: 334-40.
8. Lovati MR. et al., J Agric Food Chem. 1998; 46: 2474-80.
9. Lovati MR. et al., J Nutr. 2000; 130: 2543-2549.
10. Lovati MR. et al., Faseb J. 2006; LB 391: 86.
11. Laemmli UK. Nature. 1970; 227: 660-5.
12. Havel RY. et al., J Clin Invest. 1955; 34: 1345-53.
13. Bilheimer DW. et al., Biochim. Biophys. Acta 1972; 260: 212-21.
14. Sirtori CR. et al., Brit J Nutr. 2007; 97: 816-22.
15. Lovati MR. et al., Nutr Metab Cardiovasc Dis. 1991; 1: 18-24.
16. Lovati MR. et al., J Clin Invest. 1987; 80: 1498-502.
17. Kitts DD. et al., Curr Pharm Des. 2003; 9: 1309-23.
18. Wan XS. et al., Nutrition and Cancer. 2002; 43: 167-73.
19. Clemente A. et al., Recent Progress in Medicinal Plants. 2008; 20: 397-417.
20. Matoba N. et al., FEBS Lett. 2001; 497: 50-4.
21. Cho SJ. et al., J Agric Food Chem. 2008; 56: 4372-6.
22. Castiglioni S. et al., Atherosclerosis. 2003; 171: 163-70.
23. Sirtori CR. et al., Drug Safety 2001; 24: 665-82.
Реферат
Изобретение относится к области генетической инженерии и молекулярной биологии. Предложен N-концевой гидрофильный фрагмент α′-субъединицы 7S-глобулина сои, состоящий из 142 аминокислотных остатков с указанного N-конца, для контроля гомеостаза холестерина и триглицеридов, а также способ его получения и соответствующая композиция. 3 н. и 1 з.п. ф-лы, 1 табл., 3 ил.

Комментарии