Способ получения растительного лектина ml1 из омелы белой и фармацевтическая композиция на его основе (варианты). - RU2644332C1
Код документа: RU2644332C1
Чертежи
Описание
Область техники
Изобретение относится к фармацевтике и касается способа выделения (получения) растительного лектина вискумин (mestletoe lectin I, MLI) из омелы белой (VISCUM ALBUM), а также фармацевтической композиции на его основе, обладающей противоопухолевым и иммуномодулирующим действием.
Уровень техники
Злокачественные опухоли относятся к одним из наиболее тяжелых заболеваний, являются одной из основных причин смерти человека. Ежегодно регистрируется не менее 10 миллионов случаев заболеваний такого рода, значительная часть которых приводит к смерти. Учитывая высокий уровень смертности от онкологических заболеваний (по данным ВОЗ, свыше 7,5 млн. человек в год, что составляет более 13% всех случаев смерти), а также ежегодный прирост заболеваемости, увеличивается потребность в разработке эффективных противораковых препаратов и диагностических средств нового поколения. Накопленные к настоящему времени знания о механизмах злокачественной трансформации, функционировании и молекулярном составе клеток, претерпевших такую трансформацию, а также определенные успехи в исследовании онкомаркеров - молекул, позволяющих различить нормальные и опухолевые клетки, - формируют прочную теоретическую базу для создания агентов, способных к селективному воздействию на раковые клетки.
Экстракты омелы белой на протяжении многих столетий используются в терапевтических целях. С начала этого столетия препараты омелы белой, с тем или иным успехом применяющиеся в терапии рака (
В качестве активного начала экстракта омелы белой в настоящее время рассматривают протеин лектина омелы белой (ML) массой 63 кДа, который может быть получен биохимическим путем из экстрактов (Franz Н. Viscaceae lectins. // Advances in lectin research (Franz H., ed.), Berlin, VEB, Verlag volk und Gesundheit, 2, 28-59.). Белок ML состоит из двух ковалентно соединенных дисульфидным мостиком субъединиц, чья А-цепь ответственна за ферментативную инактивацию рибосом, а В-цепь ответственна за связывание углеводов. Биологическая активность согласно известным к настоящему времени данным сводится в основном к лектиновой активности В-цепи.
Гетерогенность растительных препаратов лектина омелы белой является среди прочего результатом посттрансляционной обработки MLI в изоформы MLII и MLIII, так что в препаратах ML в зависимости от методики выделения или продолжительности ферментации обнаруживают разное содержание MLI, MLII и MLIII, которые отличаются по специфичности углеводо связывающего фрагмента (Schumacher U., Pfuller U. From Berlin and Witten to Southampton and Hamburg: 25 Years of Mistletoe Research Cooperation // Mistletoe: From Mythology to Evidence-Based Medicine. - Karger Publishers. 2015. Vol. 4. P. 39-47.).
Доля MLI в составе экстракта омелы белой, как правило, наиболее высока, кроме того этот лектин имеет наибольшую биологическую активность, которая приписывается его способности связывать и активировать лимфоциты, а потому считается наиболее ценным компонентом экстракта и представляет наибольший терапевтический интерес [Urech K., Baumgartner S. Chemical Constituents of Viscum album L.: Implications for the Pharmaceutical Preparation of Mistletoe. //
Также в экстракте находятся MLII и MLIII - другие изоформы токсических лектинов. MLI, MLII и MLIII различаются между собой по молекулярной массе, а также углеводной специфичности. MLI специфичен по отношению к галактозе, MLIII - к N-ацетилгалактозамину, а MLII имеет одинаковую аффинность к обоим сахарам. Применение экстрактов омелы в качестве дополнительных препаратов при лечении рака существенно снижает побочное действие химиотерапии.
В настоящее время экстракты омелы белой довольно широко применяются в таких странах Западной Европы, как Швейцария, Германия, Франция, Австрия. Большинство проводимых клинических исследований эффективности экстрактов омелы белой проводятся на фоне текущего лечения пациентов, т.е. в качестве средства дополнительной лекарственной терапии. Это осложняет получение выводов об противоопухолевой эффективности именно экстрактов омелы белой. Тем не менее в качестве показателей эффективности экстрактов омелы белой отмечаются увеличение продолжительности и качества жизни онкологических больных, улучшение переносимости стандартного конвенциального лечения (
В последние годы основное внимание уделялось исследованию препарата на основе рекомбинантного аналога MLI (препарат Авискумин), благодаря которому могла быть решена проблема стандартизации лекарственных препаратов. Было показано, что рекомбинантный MLI обладает теми же биологическими свойствами, что и природный MLI, содержащийся в экстрактах омелы белой. Это позволило начать клинические испытания Авискумина (Bergmann L., Aamdal S., Marreand S. et al. Phase I trial of rviscumin (INN:aviscumine) given subcutaneously in patients with advanced cancer: a study of the European organisation for Research and Treatment of cancer (EORTC protocol number 13001) // Europ. J. Cancer. - 2009. - Vol. 44. - P. 1657-1662). Однако, у рекомбинантного MLI отсутствуют пострансляционные модификации, характерные для природного белка, что влияет на стабильность белковой молекулы. Отсутствие гликозилированных фрагментов также может негативно сказываться на иммуномодулирующих свойствах MLI. При этом препараты, полученные на основе рекомбинантного вискумина, обладают сроком хранения порядка 1,5 года, что свидетельствует о недостаточной стабильности используемого активного компонента.
Препараты омелы ранее использовались для внутреннего или парентерального применения в различных формах (в виде чая, порошка, капель, инъекций), в основном водных или спиртовых экстрактов, или соков. Однако применение таких форм вызывало множество проблем. Известно, что парентеральное использование препаратов, даже если они имеют существенные иммуностимулирующее и противоопухолевые эффекты, вызывало много нежелательных побочных эффектов и общих аллергических реакции, таких как озноб, высокая температура, головная боль, одышка и др. Кроме того, оральное использование препаратов вызывало скачки давления, головокружение, сужение коронарных сосудов, сердечных аритмий.
При выделении из растительного источника при существующем уровне техники, как правило, получают гетерогенную смесь веществ. Гетерогенность растительных препаратов лектина омелы белой является среди прочего результатом посттрансляционной обработки MLI в изоформы MLII и MLIII, так что в препаратах ML в зависимости от методики выделения или продолжительности ферментации обнаруживают разное содержание MLI, MLII и MLIII.
Из уровня техники известен способ получения вискумина раскрытый в охранном документе DE 4221836. Для выделения галактозил-специфичного лектина (MLI), сушеные листья омелы замачивают на ночь в фосфатном буфере, далее полученную взвесь перемешивают и центрифугируют. После центрифугирования из надосадочной жидкости выделяют лектин путем аффинной хроматографии на лактозил-Sepharose. После прохождения полученный лектин промывают несколько раз. После хроматографии раствор концентрируют с помощью ультрафильтрации. В результате такого способа выделения получают смесь лектинов MLI, MLII и MLIII с преимущественным содержанием MLI (85-90%). Недостатком данного способа является то, что получают лектин MLI из омелы белой с чистотой не более 90%.
Из охранного документа DE 4229876 известно выделение лектинов омелы из растительного сырья путем гомогенизации свежих или высушенных измельченных частей омелы с дистиллированной водой, перемешивании, фильтрации и подкислении полученного экстракта уксусной кислотой. После центрифугирования надосадочную жидкость помещают на подходящую катионообменную колонку, предпочтительно SP-Sephadex. Недостатком данного способа является то, что для экстрагирования лектинов используют агрессивные растворы.
В охранном документе WO 9600239 раскрыто выделение лектина MLI из омелы путем измельчения свежесобранных растений омелы и перемешивании с дистиллированной водой. Водную суспензию фильтруют и доводят pH раствора до <7 добавлением уксусной кислоты. Полученную суспензию центрифугируют, надосадочную жидкость пропускают через катионообменную колонку SP-Sephadex. Собранные фракции промывают буферным раствором. Недостатком данного способа является то, что использование свежесобранного сырья ограничивает применение способа во времени, а также ограничен доступ сырья.
Наиболее близким по совокупности существенных признаков к разработанному способу является способ, раскрытый в документе WO 9711967, который заключается в получении водного экстракта омелы белой, содержащего лектины омелы в соотношении MLI:MLII:MLIII от 0,1-90:90-0.1:0-3, согласно которому все части растения вымачиваются в холодном водном растворе, предпочтительно изотоническом солевом растворе или фосфатном буферном растворе, затем смесь фильтруют, белки из фильтрата высаливают сульфатом аммония, фильтрацию повторяют до удаления низкомолекулярных компонентов, имеющих молекулярную массу менее чем на 1 кД, и экстракт дополнительно разбавляют водой. С целью стандартизации соотношения содержания изомеров лектина в составе, их содержание дополнительно корректируют путем добавления чистых веществ. Недостатком указанного способа является то, что получаемый состав экстракта не однороден по составу и требует корректировки за счет добавления чистых веществ. Полученный состав включает изоформы лектинов омелы, имеющие разную специфичность, а также различный механизм присоединения к клеткам опухоли. Кроме того, содержание полученного лектина MLI из омелы белой составляет не более 90%.
Таким образом, остается актуальным разработка способа производства такого препарата омелы, который оказывал бы значительное иммуностимулирующее и противоопухолевое действие и не вызывал нежелательных побочных эффектов.
С целью подробного исследования терапевтического действия лектина омелы белой MLI представляется необходимым получить его в чистом виде для его использования в качестве активной составной части лекарственных средств при промышленном получении последних.
Раскрытие изобретения
Задачей настоящего изобретения является разработка способа получения лектина MLI из омелы белой с чистотой не менее 95% и фармацевтической композиции на его основе.
Поставленная задача решается заявляемым способом выделения белка MLI (mistletoe lectin I) из омелы белой (Viscum album), включающим:
- получение мелкодисперсной суспензии из сухих листьев омелы белой в 0,25 М растворе NaCl, взятом в количестве, достаточном для экстрагирования,
- проведение первого этапа очистки суспензии от примесей, не относящихся к группе белков ML, посредством введения в суспензию сульфата аммония из расчета 60-80 г на 100 мл экстракта, выдерживание полученной суспензии для осаждения растительных белков, включая группу белков ML (с содержанием не менее 95% MLI по белку), с последующим отделением образовавшегося осадка;
- растворение полученного осадка в растворе NaCl, который берут в количестве, достаточном для полного растворения осадка;
- проведение второго этапа очистки для выделения белков группы ML из полученного раствора растительных белков, посредством аффинной хроматографии с использованием в качестве буфера 0,25 М раствора NaCl;
- проведение третьего этапа очистки для выделения белка MLI из раствора смеси белков группы ML с использованием ионно-обменной хроматографии, при этом в качестве сорбента используют катионообменную смолу типа monoS с размером частиц сорбента не более 10 мкм;
- перевод полученной фракции очищенного MLI в фосфатно-солевой буфер с физиологическим значением pH и изотоническим составом с помощью диализа, используя диализные мембраны Slide-A-Lyzer™ Dialysis Cassettes (Thermo Fisher) с отсечкой по молекулярной массе 10-20 кДа или аналоги, или гель-фильтрацией, используя колонку HiTrap Desalting Column (GE Helthcare).
Предпочтительно, проводить выдерживание (инкубацию) суспензии на первом этапе очистки не менее 16 ч.
Поставленная задача также решается способом получения концентрата белка MLI, включающим концентрирование раствора белка MLI, полученного вышеописанным способом до величины 2 мг/мл с допустимой величиной отклонения до 20%. Для этой цели используют концентрирующие системы, включая такие, как Amicon® Ultra производства Millipore с мембраной с низкой сорбирующей способностью (размер пор фильтрующей мембраны от 10 до 30 кДа).
Также поставленная задача решается фармацевтической композицией для инъекционного введения, включающей активный компонент и буфер, где в качестве активного компонента использован лектин MLI, полученный вышеуказанным способом, в качестве буфера - водный изотонический солевой раствор с физиологическим pH, при этом содержание растительного лектина вискумин (MLI) в 1 мл раствора составляет 0,04-0,15 мг.
Предпочтительно, когда фармацевтическая композиция дополнительно содержит вспомогательные вещества (добавки), например, для стабилизации белка, уменьшения сорбции белка, такие как гидрохлорида пиридоксин, и борной кислоты (1-2% вес.), сахара, полиольные спирты, аминокислоты и их производные, поверхностно-активных веществ, например Твин-80 и др., в общепринятом количестве (предпочтительно, чтобы общее количество добавок по массе составляло не более 10% от массы раствора с активным компонентом). При этом для получения водного изотонического солевого раствора используют кристаллогидраты натрия гидрофосфат, натрия дигидрофосфат, калия гидрофосфат, калия дигидрофосфат, а также натрия хлорид.
Поставленная задача также решается фармацевтической композицией для инъекционного введения, включающей буфер и активный компонент, где в качестве активного компонента использован концентрат лектин MLI, полученный описанным ранее способом, конъюгированный с ферромагнитными наночастицами (ФНЧ), в качестве буфера - водный изотонический солевой раствор с физиологическим pH, при этом содержание растительного лектина вискумин (MLI) в 1 мл раствора составляет 0,1-10 мкг, ферромагнитных наночастиц - 0,1-1 мг.
Техническим результатом заявленной группы изобретений является то, что разработанный способ выделения позволяет получить лектин MLI с чистотой не менее 95% (примесь изоформ MLII и MLIII - не более 5%), при этом полученная фармацевтическая композиция обладает стабильностью по меньшей мере в течение 2,5 года. Кроме того, применение фармацевтической композиции, содержащей конъюгат растительного лектина и ферромагнитных частиц, позволяет увеличить время нахождения вискумина в ткани без увеличения дозы вводимого препарата, что приводит к снижению побочных эффектов.
Краткое описание чертежей
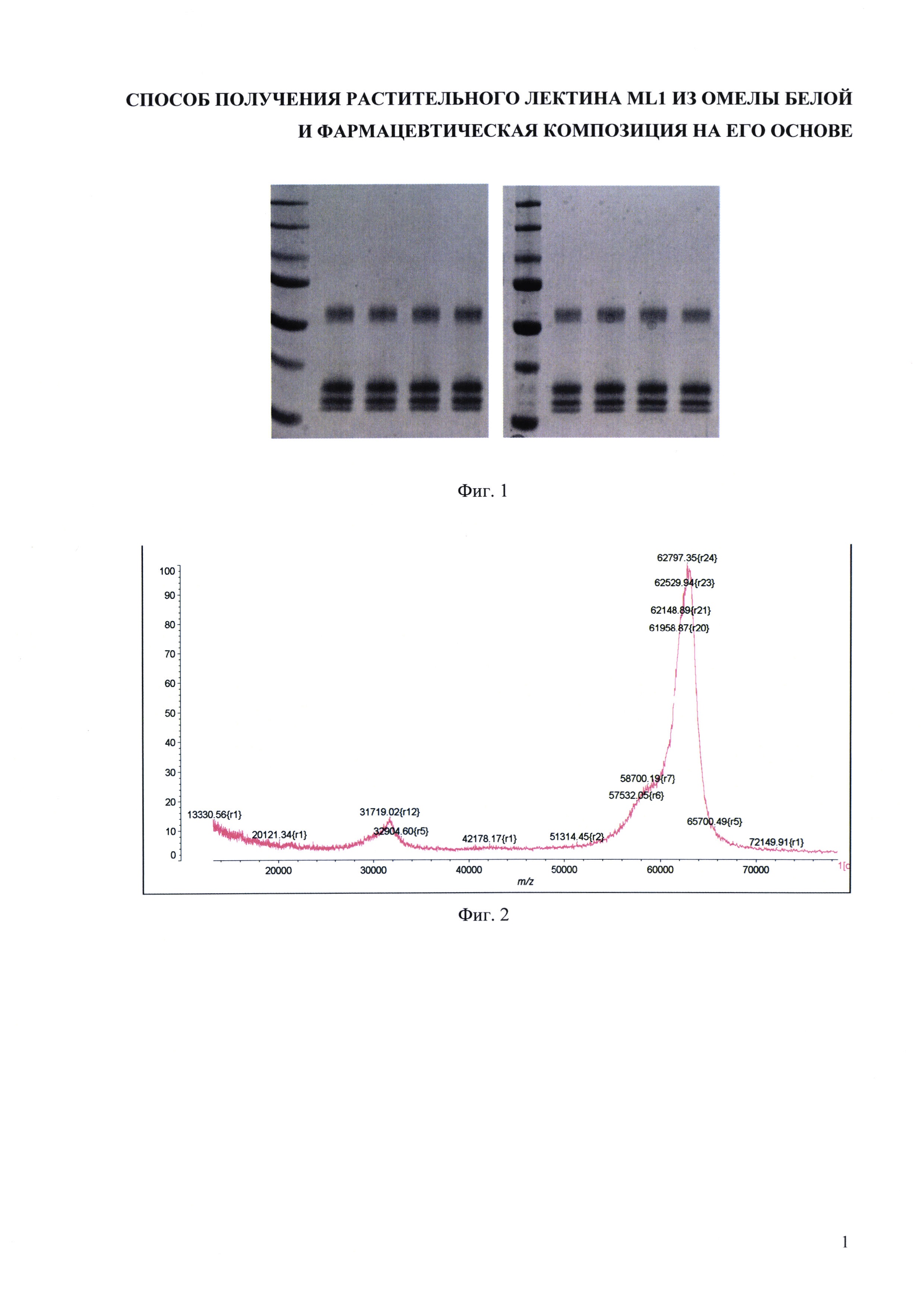
На фиг. 1 представлены примеры типичных электрофореграмм, полученных при подтверждении заявленного технического результата, касательно чистоты препарата лектина ML, полученного заявленным способом, не менее 95%.
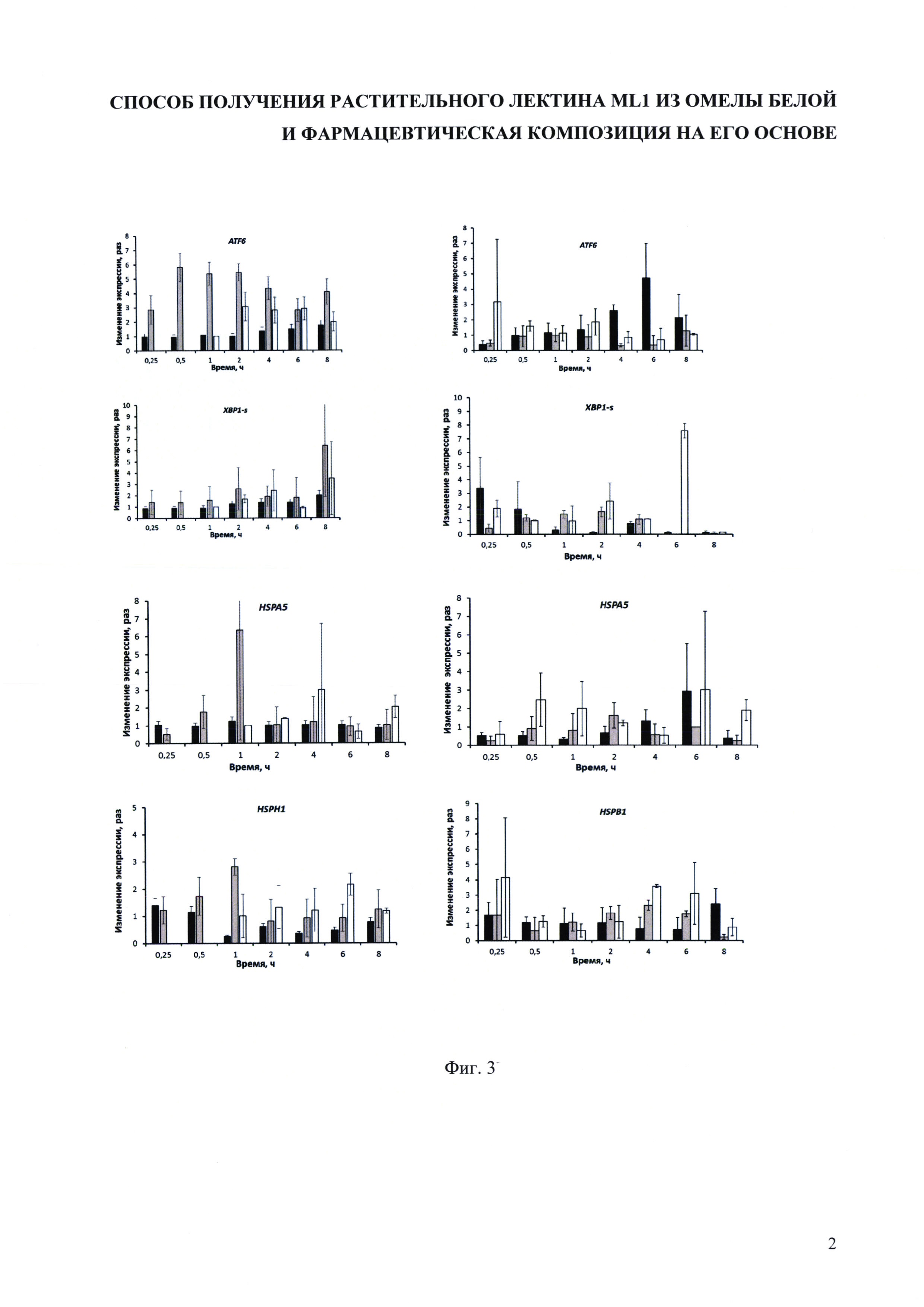
На фиг. 2 представлены результаты анализ препарата лектина MLI, полученного заявленным способом, масс-спектрометрическим методом (MALDI).
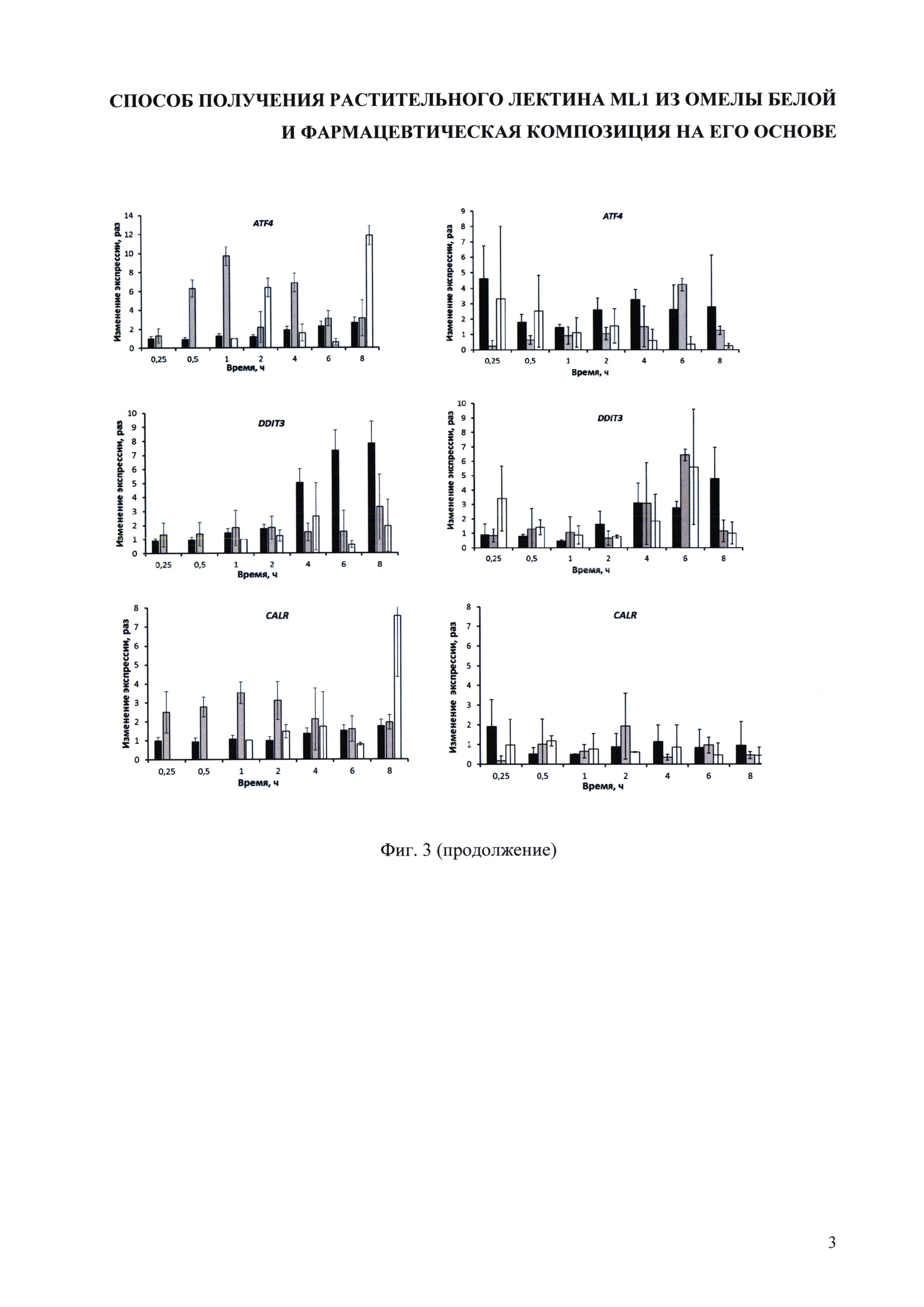
На фиг. 3 приведены гистограммы, демонстрирующие изменение экспрессии генов, вовлеченные в реакцию клетки на увеличение количества несвернутых белков в ER, в результате воздействия MLI в концентрациях 1⋅10-7 М (черный), 1⋅10-9 М (серый), 1⋅10-11 M (белый) на клетки CaCo2 и Molt4.
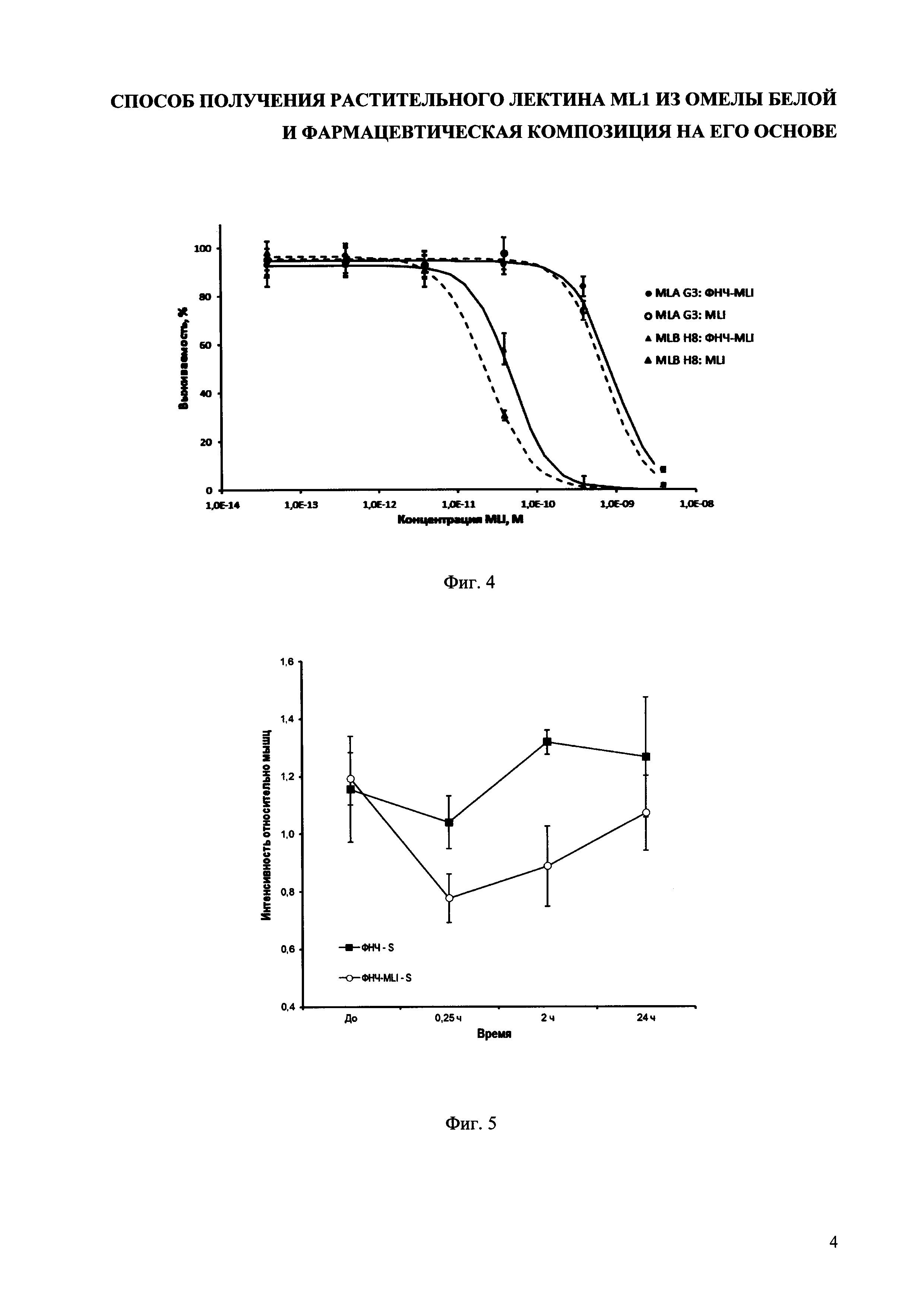
На фиг. 4 представлен график выживаемости B-клеточных лимфом мыши MLA G3 и MLB Н8 при различных концентрациях MLI и конъюгата ФНЧ-MLI. Результаты обработки клеток эквивалентными количествами контрольного препарата ФНЧ свидетельствовали об отсутствии влияния ФНЧ на жизнеспособность клеток в исследуемых количествах конъюгата ФНЧ-MLI.
На фиг. 5 показана динамика изменения отношения интенсивности МРТ сигнала в опухолях к сигналу в мышце при внутриопухолевом введении препаратов, содержащих контрольный препарат ферромагнитных наночастиц (ФНЧ) и ферромагнитных наночастиц, конъюгированных с MLI (ФНЧ- MLI).
Осуществление изобретения
Противоопухолевое действие вискумина обусловлено как его цитотоксическими свойствами, так и способностью неспецифически активировать иммунную систему. Предполагаемый механизм включает непосредственное взаимодействие вискумина с NK-клетками и макрофагами, локализованными в верхних слоях кожи в области введения препарата, приводя к их активации. Активация проявляется в виде индукции цитокинов, а также в изменении профиля экспрессии поверхностных рецепторов клеток. Активированные клетки иммунной системы характеризуются более высоким лизирующим потенциалом и способны преодолевать барьеры, экранирующие опухолевые клетки от иммунной системы.
В отличие от ранее полученных экстрактов омелы белой, разработанный способ позволяет получить высокоочищенный растительный лектин вискумин, содержащий все естественные природные модификации.
Выделение белка ML1 (mistletoe lectin I) из омелы белой (Viscum album), осуществляют в следующей последовательности.
Сначала высушенные листья омелы белой измельчают до пудрообразного состояния, после чего заливают 0,25 М раствором NaCl, взятом в количестве, достаточном для эффективного экстрагирования. При этом, как правило, это количество может варьироваться в пределах от 400 мл до 1 л на 50 г измельченных листьев омелы белой.
Затем полученную мелкодисперсную суспензию из сухих листьев омелы очищают в несколько этапов с получением концентрата лектина ML1 с содержанием не менее 95%.
На первом этапе проводят очистку суспензии от примесей, не относящихся к группе белков ML, посредством введения в суспензию сульфата аммония из расчета 60-80 г на 100 мл экстракта, выдерживание полученной суспензии для осаждения растительных белков, включающих группу белков ML, с последующим отделением образовавшегося осадка. При этом суспензию, как правило, выдерживают не менее 16 ч. А отделение образовавшегося осадка осуществляют известными методами, например, центрифугированием в течение 20-30 мин при 4500-5500 g.
Полученный осадок затем растворяют в растворе 0,5 М NaCl, который берут в количестве, достаточном для полного растворения осадка, например 30-40 мл на 50 г исходных сухих измельченных листьев.
На втором этапе очистки производят выделение белков группы ML из полученного раствора растительных белков, посредством аффинной хроматографии с использованием в качестве буфера 0,25 М раствора NaCl. При этом аффинная хроматография может проводиться может проводиться с использованием лактозил-содержащего сорбента, например лактозил-Sepharose 4 В или α-Lactose-Agarose (Sigma).
На третьем этапе очистки осуществляют выделение белка MLI из раствора смеси белков группы ML с использованием ионно-обменной хроматографии, при этом в качестве сорбента используют катионообменную смолу типа monoS с размером частицсорбента не более 10 мкм. Ионнообменную хроматографию проводят в 15 мМ нитратном буфере при pH 4,0-5,0, целевой белок элюируют в градиенте концентрации от 250 до 500 мМ NaCl. Катионообменная смола типа monoS может быть использована, например, марки Mono S 5/50 GL (GE Healthcare). После проведения третьего этапа очистки концентрация полученного белка (активного компонента) составляет 0,5-2 мг/мл.
Полученную на третьем этапе фракцию очищенного белка MLI переводят в фосфатно-солевой буфер с физиологическим значением pH и изотоническим составом с помощью диализа, используя, например, диализные мембраны типа Slide-A-Lyzer™ Dialysis Cassettes (Thermo Fisher) с отсечкой по молекулярной массе 10-20 кДа. Возможен также вариант применения гель-фильтрации с использованием колонки, например, типа HiTrap Desalting Column (GE Helthcare). Концентрация полученного белка (активного компонента) после введения фосфатно-солевого буфера составляет 0,25-1,5 мг/мл.
Таким образом, полученный заявляемым способом продукт с данной концентрацией (0,25-1,5 мг/мл) может быть использован для терапевтических целей (в качестве противоопухолевого и иммуномодулирующего средства), при этом для инъекционного введения средства пациенту рекомендуется его разведение фосфатно-солевым буфером с физиологическим значением pH и изотоническим составом до значений концентрации активного компонента - 200-800 нг/мл.
При этом фармацевтическим компаниям рекомендуется производство фармацевтической композиции с содержанием активного компонента MLI 0,04-0,15 мг на 1 мл раствора. Для получения водного изотонического солевого раствора могут быть использованы кристаллогидраты натрия гидрофосфат, натрия дигидрофосфат, калия гидрофосфат, калия дигидрофосфат, а также натрия хлорид.
Кроме того, фармацевтическая композиция может дополнительно содержать вспомогательные вещества для стабилизации белка, уменьшения сорбции белка и т.д.
Кроме того, для обеспечения пролонгированного действия активного компонента в опухоли фармацевтическая композиция для инъекционного введения может содержать лектин MLI, конъюгированный с ферромагнитными наночастицами с содержанием в 1 мл раствора растительного лектина MLI от 0,1 до 10 мкг, ферромагнитных наночастиц - от 0,1 до 1,0 мг. Способ конъюгирования MLI с ферромагнитными наночастицами представлен в работе (Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека A172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12/ P. 797-801). В процессе получения конъюгата MLI-ФНЧ используют белок MLI с концентрацией 1,6 - 2,4 мг/мл. Для этой цели раствор белка концентрируют с использованием концентрирующей системы с мембраной с низкой сорбирующей способностью, характеризующейся размером пор от 10 до 30 кДа.
Лекарственное средство на основе вискумина может быть использовано для терапии пациентов с метастазирующим или местно распространенным колоректальным раком в качестве самостоятельного средства при невозможности проведения химиотерапии.
Добавление стабилизирующих веществ в растворы белков является наиболее простым способом сохранения их активности. В качестве стабилизирующих добавок могут быть использованы растворы гидрохлорида пиридоксина (5-10% вес.) и борной кислоты (1-2% вес.) (RU 2020154, 1991), сахара, полиольные спирты, аминокислоты и их производные (EP 0821058, 2002), поверхностно-активные вещества, например Твин-80. При этом для получения водного изотонического солевого раствора используют кристаллогидраты натрия гидрофосфат, натрия дигидрофосфат, калия гидрофосфат, калия дигидрофосфат, а также натрия хлорид.
Ниже приведены примеры конкретной реализации изобретения, подробно описывающие каждый этап заявляемого способа, которые иллюстрируют, но не ограничивают объем притязаний.
Выделение вискумина - растительного лектина MLI из сухих листьев омелы белой (Viscum album)
Из 100 г сухих листьев было получено ~14 мг смеси лектинов (MLI, MLII, MLIII) при этом были осуществлены следующие шаги:
1) Для получения 100 г высушенных листьев листья были отделены от веток, которые затем измельчили до порошкообразного состояния. Полученный порошок из листьев омелы белой заливали 800 мл 0,5 М раствора NaCl и перемешивали в течение 1 часа при комнатной температуре, затем в течение 48 часов при 4°C.
2) Полученную суспензию профильтровали через марлю (удобнее под вакуумом). Объем суспензии после фильтрации составил 650-700 мл.
3) Фильтрат центрифугировали при 10000 g в течение 20 мин. Супернатант перенесли в отдельную пробирку, осадок выбросили. Повторили процедуру еще два раза. Суммарный объем супернатанта после трех раундов центрифугирования составил 550-600 мл.
4) Полученную суспензию профильтровали через 0,45 мкм. Объем фильтрата составил примерно 550 мл.
5) Проводили первую стадию очистки целевого белка. К фильтрату (примерно 550 мл) по порциям при перемешивании добавляли твердый сульфат аммония (60 г на 100 мл экстракта). Перемешивали смесь в течение 16 часов при комнатной температуре, затем инкубировали 1 час при комнатной температуре без перемешивания.
6) Суспензию центрифугировали в течение 20 мин при 5000 g. Осторожно сливали надосадочную жидкость (примерно 420 мл). Осадок растворяли в минимальном объеме 0,5 М раствора NaCl (примерно ~60-70 мл). Дважды центрифугировали смесь при 5000 rpm в течение 20 мин для удаления не растворившегося осадка. Объем супернатанта после центрифугирования составлял примерно 60 мл.
7) Профильтровали супернатант через фильтр 0,45 мкм с мембраной, не связывающей вискумин (тип мембраны PVDF или PES). Объем фильтрата составил примерно 60 мл.
8) Для проведения второй стадии очистки целевого белка была подготовлена аффинная колонка (лактозил-Sepharose 4B, связывающая способность не менее 6 мг/мл) объемом на 50 мл (объем смолы 10 мл), которую набивали сорбентом, и промывали 15 объемами раствора 0,5 М NaCl.
9) Весь объем прозрачного супернатанта (около 60 мл) наносили на подготовленную аффинную колонку, после чего собирали проскок, содержащий не связавшиеся белки.
10) Промывали колонку 10 объемами раствора 0,25 М NaCl, сохраняли аликвоту образца для анализа.
11) Промывали колонку 10 объемами раствора 0,25 М NaCl с 20 мМ D-галактозой.
12) Элюировали целевой белок с использованием элюирующего буфера (0,25 М NaCl, 200 мМ D-галактоза). Первый объем, соответствующий объему колонки (~10 мл), не содержал целевой белок. Собирали первый объем в отдельную пробирку. После этого собирали 8 фракций по 2 мл. Измеряли оптическую плотность в каждой из фракции. Объединяли все фракции, содержащие белок (обычно 0,2-0,6 о.е./мл). Суммарный объем элюата, содержащего белок, составил около 12 мл.
13) Промывали колонку 5 объемами 0,25 М NaCl, 400 мМ D-галактозы для удаления всех связавшихся белков. Промывали колонку 5 объемами 50% спирта, хранили под спиртом на 4°C.
14) Проанализировали элюат на SDS-ПААГ по Лэммли на содержание целевого белка.
15) Сконцентрировали элюат после аффинной хроматографии примерно в 3-4 раза, так, чтобы концентрация раствора не превышала 4 о.е./мл при 280 нм (объем около 4 мл).
16) Профильтровали элюат после концентрирования через фильтр 0,45 мкм. Объем фильтрата составил около 4 мл.
17) Для проведения третьего этапа очистки подготовили колонку HiTrap Desalting Column (GE Helthcare) объемом 20 мл (4 последовательно соединенных колонки объемом по 5 мл) для перевода фильтрата в цитратный буфер, уравновесив ее 5 объемами 15 мМ цитратного буфера pH 4,2.
18) Используя уравновешенную цитратным буфером колонку HiTrap Desalting Column (GE Helthcare) объемом 20 мл (4 последовательно соединенных колонки объемом по 5 мл), переводили весь полученный объем фильтрата (около 4 мл) в 15 мМ цитратный буфер pH 4,2 для последующей ион-обменной хроматографии.
19) Собирали белок в цитратном буфере, объем около 6 мл (разбавляли в 1,5-2 раза). Допустимое концентрирование раствора - в 1,5-2 раза.
20) После перевода белка в цитратный буфер профильтровали раствор через фильтр 0,45 мкм. Объем фильтрата составил 3-6 мл.
21) Промывали колонку HiTrap Desalting Column (GE Helthcare) 5 объемами 15 мМ цитратного буфера pH 4,2, затем 5 объемами 20% этанола, хранили при 4°C.
22) Подготовили катион-обменную колонку monoS 5/50 GL (объем сорбента 1 мл, связывающая способность 50 мг/мл) для завершающей очистки целевого белка. Для этого уравновешивали колонку, промыв ее 5 объемами 15 мМ цитратного буфера pH 4,2.
23) Наносили весь профильтрованный раствор белка в цитратном буфере на колонку monoS 5/50 GL.
24) Промывали колонку 8 объемами 15 мМ цитратного буфера pH 4,2.
25) Промывали колонку 12 объемами 15 мМ цитратного буфера pH 4,2 с 300 мМ NaCl.
26) Элюировали связавшиеся белки градиентом концентрации NaCl от 300 до 800 мМ в течение 8 объемов колонки. Собирали фракции по 1,5 мл.
27) Отмывали колонку 5 объемами 15 мМ цитратного буфера pH 4,2 с 1 М NaCl.
28) Промывали колонку 5 объемами 15 мМ цитратного буфера pH 4,2, затем 5 объемами 20% этанола, хранили при 4°C.
29) После ионо-обменной хроматографии в SDS-ПААГ по Лэммли проанализировали фракции, в которых содержался целевой белок и которые соответствовали второй части пика на хроматограмме (фракции 3-4 от начала пика при элюции белка). После объединения фракций суммарный объем раствора очищенного белка составил около 4,5 мл.
30) Готовили фосфатно-солевой буфер для хранения pH 8.0 для разведения полученного белка и последующего хранения раствора.
Состав буфера:
NaCl - 7,5 г/л;
Na2HPO4×2 H2O - 3,4 г/л;
NaH2PO4×2 H2O - 0,16 г/л.
В апирогенную стеклянную мерную емкость вместимостью 2 л наливали 1 л деионизованной воды, вносили взвешенные компоненты: 15 г NaCl, 6,8 г Na2HPO4×2 H2O, 0,32 г NaH2PO4×2 H2O и перемешивали на магнитной мешалке до их полного растворения. Устанавливали в растворе величину pH 8,0±0,02 по pH-метру добавлением 2М раствора NaOH в объеме ~10 мл. Доводили общий объем водой до 2 л.
31) Переводили раствор очищенного белка в фосфатно-солевой буфер для хранения pH 8.0, используя колонку HiTrap Desalting Column (GE Helthcare) или с помощью диализа. Измеряли концентрацию белка спектрофотометрически в полученном растворе при длине волны 280 нм.
Подтверждение получения лектина MLI с чистотой не менее 95%
Подтверждение чистоты и молекулярной массы белка MLI проводили методом электрофоретического разделения в 10%-ом SDS-полиакриламидном геле в невосстанавливающих условиях (без меркаптоэтанола).
Провели определений %-ого содержания и молекулярной массы белка для трех серий препарата MLI, полученных заявленным способом. Для каждой серии препарата MLI заливали по 2 геля; наносили на каждый гель по 4 испытуемых образца двумя разными аналитиками. Примеры полученных электрофореграмм представлены на фиг. 1 Для определения молекулярной массы использовались маркеры молекулярных масс Precision Plus Protein Unstained Standards (Bio-Rad). Электрофореграммы сканировали, определяли содержание и молекулярную массу целевого белка с помощью программы ImageLab Software (Bio-Rad). С использованием программы Microsoft Excel рассчитали стандартное отклонение и относительное стандартное отклонение. Результаты представлены в таблице 1.
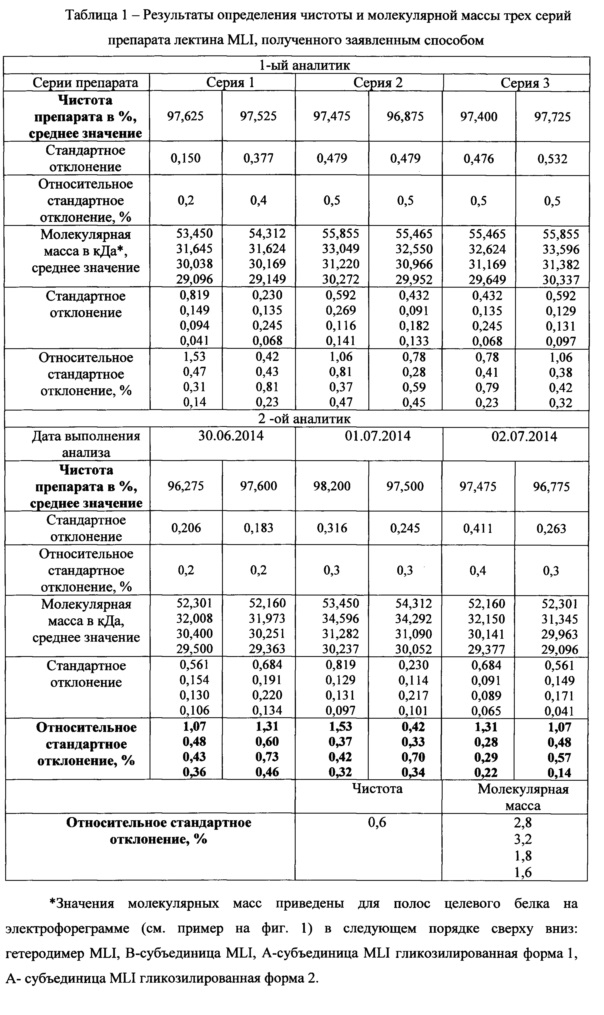
Заключение: Относительное стандартное отклонение, определенное для испытаний, выполненных разными аналитиками, не превышает 3% при определении молекулярной массы, и составляет 0,6% при определении чистоты препарата. Чистота препаратов MLI, полученных заявленным способом, составляет 96,2% и выше.
Сравнение результатов определения молекулярной массы белка MLI, полученных электрофоретическим и масс-спектрометрическими методами.
Анализ препарата масс-спектрометрическим методом (MALDI) показал наличие основного соединения с молекулярной массой около 63 кДа (см. фиг. 2). Масса целевого белка составляет 63-65 кДа.
Среднее значение молекулярной массы, определенной электрофоретическим методом, составляет около 54 кДа для полноразмерного гликозилированного белка. При этом сложение молекулярных масс, полученных для A- и B-субъединиц белка, дает значение около 63 кДа. Аномальная подвижность полноразмерного белка в полиакриламидном геле по отношению к стандартным белкам (маркерам) может объясняться наличием гликозилированных фрагментов.
Пример 1, демонстрирующий возможность использования в качестве активного компонента лектина MLI.
Из полученного указанным выше способом лектина готовили концентрат препарата следующего состава:
Для этого, используя приготовленный фосфатно-солевой буфер для хранения pH 8.0, разводили полученный раствор очищенного белка до концентрации 0,1 мг/мл.
Концентрат для приготовления раствора для подкожных инъекций представляет собой бесцветный, прозрачный раствор. Для подкожных введений концентрат предварительно разводят.
Раствор для разведения - бесцветный, прозрачный раствор следующего состава (1 мл):
Пример 2, демонстрирующий возможность использования в качестве активного компонента лектина MLI, конъюгированного с ферромагнитными наночастицами магнетита.
Ферромагнитные наночастицы (ФНЧ), модифицированные ПЭГ, с ковалентно иммобилизованным лектином MLI получали следующим образом. К 3 мл раствора ФНЧ, модифицированных ПЭГ-кислотой (1.67 мг/мл) в буфере MES (pH 6.0), добавляли раствора 1,53 мг EDC и 4,34 мг сульфо-NHS в 1 мл буфере MES (pH 6.0). Активацию карбоксильных групп проводили в течение 15 мин, после чего ФНЧ осаждали центрифугированием и ресуспензировали в буфере MES (pH 6.0) три раза, последний раз ФНЧ ресуспендировали в фосфатно-солевом буфере (pH 8.0) и концентрировали до 250 мкл. Затем к ФНЧ с активированными карбоксильными группами добавляли 3 мл раствора MLI с концентрацией 2 мг/мл и 400 мкл 100 мМ лактозы в 1x PBS, pH 8.0. Инкубировали 2 часа. После этого НЧ осаждали центрифугированием в режиме 18000 g и ресуспендировали в фосфатно-солевом буфере (pH 8.0). Осаждение и ресуспендирование в фосфатно-солевом буфере (pH 8.0) повторили пять раз для элиминирования непровзаимодействовавшего лектина с ФНЧ. (Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека А172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12/ P. 797-801).
Исследования иммуномодулирующего и противоопухолевого действия разработанного препарата было проведено на клеточных культурах (исследование in vitro) и на ксенографтных моделях животных.
Исследование цитотоксических свойств исследуемого препарата MLI in vitro
В результате in vitro экспериментов было показано, что цитотоксические свойства разработанного препарата MLI различаются для разных типов клеток. 70%-ное ингибирование роста опухолевых клеток достигается в среднем на концентрациях 0,2 нг/мл по активно действующему веществу (растительному лектину вискумин). Установлено, что образование модифицированной 28S рибосомной РНК в опухолевых клетках - проявление специфической N-гликозидной активности вискумина - детектируется при воздействии препарата уже через 15 мин, что свидетельствует о высокой активности тестируемого препарата.
Для четырех клеточных линий MV3, ТНР-1, Caco2 и MOLT4 методом МТТ была проведена оценка жизнеспособности клеток после взаимодействия с заявляемым препаратом на широком диапазоне доз. Показано, что в случае линии MV3 препарат проявляет токсические свойства уже при концентрации 100-24 M. Так, инкубация тестируемого вещества в данной концентрации с клетками MV3 в течение 72 ч приводит к снижению жизнеспособности до 65%. Для клеточных линий дифференцированных моноцитов ТНР-1 и колоректального рака Caco2 показатели IC50 отличаются, указывая на меньшую чувствительность этих клеток к препарату. Расчетные значения IC50 для клеточных линий MV3, ТНР-1, Caco2 и MOLT4 составили 5×10-12 нМ, 3×10-9 нМ, 1,0×10-6 М и 4,6⋅10-10 М соответственно.
Специфической реакцией заявляемого препарата является гидролиз N-гликозидной связи в 4324 положении сарциновой петли 28S рибосомальной РНК (в случае клеток человек в положении 4605). Метод оценки данной активности вискумина основан на определении доли разрушенных рибосом в клетке с помощью ПЦР в режиме реального времени.
Результаты определения N-гликозидазной активности препарата коррелируют с данными MTT-теста - при большей концентрации падает жизнеспособность клеток ТНР-1 и Caco2 и увеличивается доля модифицированных рибосом, достигая 52,0% и 9,5% соответственно.
При изучении кинетики образования модифицированных 28S рибосомных РНК детектирование ферментативной активности обнаруживается уже через 15 мин для исследованных концентраций 10-7 M, 10-9 M и 10-11 M. На начальных временах воздействия отмечена более высокая скорость накопления модифицированного продукта в клетках линии MOLT4, что согласуется с данными об их большей чувствительности к препарату согласно MTT-тесту.
Результаты оценки развития реакции несвернутых белков под воздействием разработанного препарата MLI
В качестве основного механизма противоопухолевого действия MLI рассматривается активация иммунной системы. Показано, что элиминация иммунокомпетентных клеток в результате цитотоксического действия MLI при их непосредственном взаимодействии, сопровождается высвобождением сигналов, способствующих активации других иммунных клеток и увеличению их противоопухолевой активности [Schumacher U., Pfuller U. From Berlin and Witten to Southampton and Hamburg: 25 Years of Mistletoe Research Cooperation // Mistletoe: From Mythology to Evidence-Based Medicine. - Karger Publishers. 2015. Vol. 4. P. 39-47.]. Активации иммунной системы может способствовать запуск иммуногенного апоптоза и стресса эндоплазматического ретикулума (ER-стресса) [Aaes Т. L., Kaczmarek A., Delvaeye Т., et al. Vaccination with Necroptotic Cancer Cells Induces Efficient Anti-tumor Immunity // Cell reports. 2016. Vol. 15. №. 2. P. 274-287; Grootjans J., Kaser A., Kaufman,R. J., Blumberg R. S. The unfolded protein response in immunity and inflammation // Nature Reviews Immunology. 2016. Vol. 16. P. 469-484]. MLI является рибосом-инактивирующим белком II типа и способен блокировать белковый синтез в клетке [Sweeney Е.С. Tonevitsky, A.G., Palmer, R.A., Niwa, Н., Pfuller, U., Eck, J., Lentz H., Agapov I.I., Kirpichnikov, M.P. Mistletoe lectin I forms a double trefoil structure // FEBS letters. 1998. Vol. 431. №. 3. P. 367-370], подобный механизм активации иммунной системы возможен и для данного лектина.
Для проверки гипотезы о роли ER-стресса и запуска ответа клетки на увеличение количества несвернутых белков (the unfolded protein response, UPR) в механизме противоопухолевой и иммуномодулирующей активности MLI, было исследовано изменение экспрессии генов, вовлеченные в указанные процессы в клетках линий Molt4 и CaCo2, обладающих различной чувствительностью к MLI (IC50 составляет 4,6⋅10-10 М и 1,0⋅10-6 M, соответственно). Из данных, представленных на фиг. 3 видно, что профиль изменения экспрессии генов, вовлеченных в UPR зависит от типа клеток, концентрации MLI и продолжительности воздействия. Однако для обоих типов клеток прослеживается общая тенденция: более низкие концентрации MLI (1⋅10-9 M, 1⋅10-11 M) способствуют запуску скорее адаптационных процессов в клетке, чем к запуску апоптоза. Так, увеличение уровня сплайсированной форма мРНК гена XBP1 (XBPls), мРНК генов белков талеров (HSPH1, HSPB1, HSPA5) и транскрипционного фактора ATF6, по-видимому, обусловлено активацией IRE1α- и ATF6-зависимых сигнальных путей [Grootjans J., Kaser A., Kaufman, R.J., Blumberg R.S. The unfolded protein response in immunity and inflammation // Nature Reviews Immunology. 2016. Vol. 16. P. 469-484], направленных на уменьшение общего количества белков, с одной стороны, и росту количества белков, необходимых для выведения из ER неправильно свернутых белков, увеличения его размеров и емкости, а также повышению эффективности сворачивания белков, с другой стороны. Изменения количества транскриптов генов транскрипционного фактора ATF4 и его мишени CHOP (гена DDIT3) проявляют дозозависимый характер. Для обоих генов прослеживается волнообразных характер изменения экспрессии. При этом увеличение экспрессии DDIT3, медиатора ER-стресс зависимого апоптоза, в случае СаСо2 наблюдается практически только для концентрации MLI 1⋅10-7 М, а в случае Molt4 - для всех исследуемых концентраций. Это согласуется с различной чувствительность данных типов клеток к MLI. Отметим, что мРНК гена EIF2AK3, кодирующего трансмембранный белок эндоплазматического ретикулума PERK, ответственный за запуск PERK-зависимого сигнального каскада - третьего каскада, связанного с UPR, достаточно хорошо представлен в клетках CaCo2 и очень мало или практически отсутствует в клетках Molt4.
Важнейшим маркером иммуногенности процесса является высвобождение калретикулина, кодируемого геном CALR. Калретикулин принадлежит к так называемым молекулярным паттернам, ассоциированных с повреждением клеток (DAMPs). В случае клеток CaCo2, увеличение экспрессии гена CALR наблюдается для концентрации MLI 1⋅10-9 и 1⋅10-11 М, а в случае MOLT4 - даже некоторое падение экспрессии (фиг. 3).
Полученные данные позволяют сделать вывод, что воздействие MLI действительно приводит к ER-стрессу и запуску UPR. При этом высвобождение важного иммуногенного компонента калретикулина проявляет зависимость от типа клеток, дозы и продолжительности воздействия MLI. Меньшие концентрации MLI (1⋅10-9 и 1⋅10-11 M) ассоциированы с большим содержанием транскрипта CALR и активацией адаптационных процессов в клетке. Таким образом, для проявления иммуномодулирующих свойств MLI, по-видимому, важным является время присутствия лектина в ткани, тогда как увеличение локальной концентрации MLI может нивелировать этот эффект.
Исследование иммунологической активности препарата MLI in vitro
В рамках данного исследования была проведена оценка эффективности разработанного препарата индуцировать высвобождение TNFα, IL-6 и тотальной формы IL-12 на фракции мононуклеаров, полученных из крови здоровых людей. При концентрации 10 нг/мл происходило значительное увеличение TNFα (p<0,05), а при 1 нг/мл - IL-6 (p<0,05). Экспрессия IL-12, продуцируемого, в основном активированными моноцитами, также была исследована. Значительное увеличение тотального IL-12 было детектировано в культуре мононуклеаров после 24 ч инкубации с 10 нг/мл препарата (в 2,1 раза; p<0,05).
Предполагается, что механизмами активации клеток крови в составе иммунной системы включается не только увеличение цитокинов, но также увеличение фагоцитарной активности, уровня поверхностных молекул, участвующих в адгезии и распознавании, в результате которых регулируются различные макрофаг-опосредованные нативные и адаптивные формы иммунного ответа. Результаты, полученные в рамках проведенных исследований, позволяют предположить, что одним из возможных медиаторов изменения фенотипа клеток при действии на них разработанного препарата, может быть активация реакции несвернутых белков (см. выше).
Исследование in vivo противоопухолевого и антиметастатического действия разработанного препарата MLI на ксенографтных моделях мышей
Исследования противоопухолевого и антиметастатического действия разработанного препарата проводилось с использованием ксенографтных моделей на основе иммунодефицитных мышей SCID с трансплантированными опухолевыми клетками человека нескольких видов рака: рака яичников, меланомы, колоректального рака. Препарат вводили животным подкожно в трех дозах 30, 150 и 500 нг/кг. Рост опухоли и введение животным разработанного препарата во всех трех исследуемых дозах 30, 150 и 500 нг/кг не оказывали отрицательного влияния на жизнеспособность, поведение и физиологические реакции, внешний вид, потребление пищи и воды животными. В некоторых случаях при введении максимальной дозы 500 нг/кг наблюдалось местное раздражающее действие, шелушение в местах введения препарата, у двух животных наблюдалось изменение пигментации кожи,
У животных в группе рака яичников, получавших тестируемый препарат в дозах 30 и 500 нг/кг, наблюдалось статистически значимое увеличение продолжительности жизни по сравнению с контрольной группой (p<0,0002).
У животных в группе меланомы, получавших дозу 150 нг/кг, средний вес первичных опухолей, был в 1,5 раза больше, чем в группе с дозой 30 нг/кг (p<0,04). В группе мышей, получавших 30 нг/кг заявляемого препарата, наблюдалось снижение количества метастазов в 2,3 по сравнению с контрольной группой (p<0,0001). Для всех экспериментальных групп детектировалось статистически значимое увеличение количества дендритных клеток, инфильтрированных в первичную опухоль (для всех групп p<0,05).
У животных в группе колоректального рака, получавших препарат в дозе 30 нг/кг, выживаемость была значительно лучше (p<0,01). При этом среднее значение массы первичной опухоли у животных в группе «30 нг/кг» было статистически значимо ниже, чем в контрольной группе (p=0,04). Также в этой группе наблюдалось значительное уменьшение количества метастазов (в 3,7 раза) по сравнению с контрольной группой (p<0,0001). Количество дендриных клеток для животных данной группы было больше в 1,8 раза.
Иммуномодулирующее действие препарата MLI
Иммуномодулирующие свойства разработанного препарата были изучены с использованием в качестве in vivo модели крыс линии Wistar. Показано увеличение абсолютного количества мононуклеарных клеток в периферической крови (РВМС) крыс после подкожного введения препарата на 15-22% в зависимости от вводимой дозы препарата (вводили от 1 до 30 нг/кг). Также было показано увеличение абсолютного количества больших гранулярных лимфоцитов (LGLs) в 2-3,5 раза через 24 и 48 ч в группах «0,5 нг/кг» и «1 нг/кг», соответственно. Более высокие дозы препарата (10 и 30 нг/кг) приводили к статистически значимому снижению общего числа LGLs в 1,5 и 2 раза через 24 ч и 48 ч, соответственно. Детектировалось повышенное содержание активированных моноцитов, а также NK-клеток.
Кроме того, было показано, что низкие дозы (30 нг/кг или ниже) увеличивают количество дендритных клеток, инфильтрирующих в первичную опухоль мышей. Кроме того, эксперименты на крысах показали, что даже более низкие дозы препарата (1 нг/кг) приводят к увеличению количество больших гранулярных лимфоцитов, а также содержание активированных клеток иммунной системы.
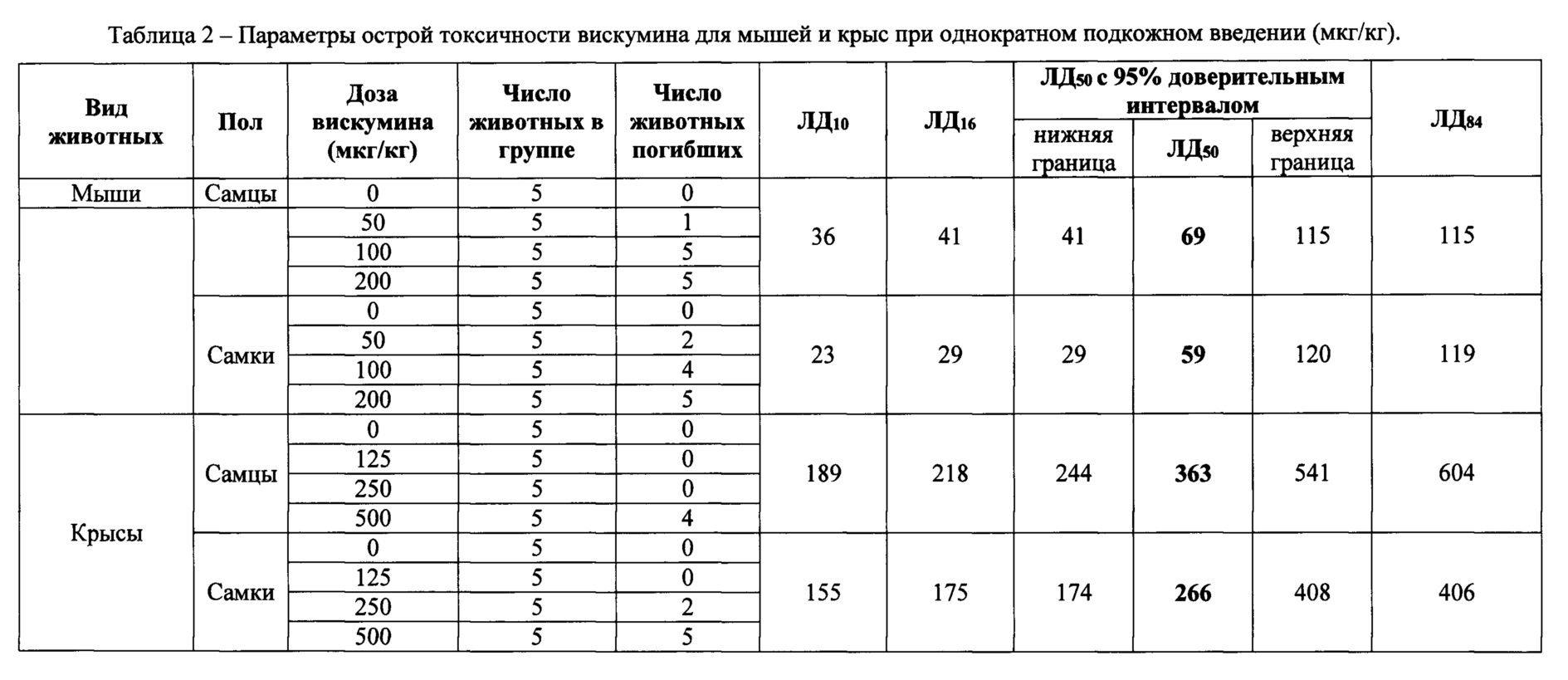
Изучение острой токсичности препарата MLI
Изучение острой токсичности растительного лектина MLI из Viscum album (далее по тексту - вискумин) на мышах и крысах при подкожном введении с определением переносимых, токсических и летальных доз выполнено на белых беспородных мышах крысах. Препарат вводили мышам и крысам подкожно однократно в заданных по условиям эксперимента дозах по вискумину. В предварительном исследовании каждая доза испытана на одном самце и одной самке, а в основном исследовании - 5 самцах и 5 самках. Животным контрольных групп вводили носитель - фосфатный буфер с pH 8,0 (раствор для разведения) - в таком же объеме, как и субстанцию в максимальной дозе. Вводимые объемы корректировали с учетом индивидуальной массы тела животного.
В период наблюдения (в течение 14 дней после введения) оценивали общее состояние животных по их двигательной активности, потреблению корма и воды, состоянию шерсти и слизистых оболочек, массе тела.
После окончания периода наблюдения проводили патологоанатомическое вскрытие у всех животных, получивших растворитель и максимальную дозу препарата, не вызвавшую гибель. Умерщвление животных производили ингаляцией углекислого газа. Патологоанатомическое исследование осуществляли в течение 1 часа после эвтаназии животных. Морфологическое состояние внутренних органов животных определяли визуально при вскрытии.
Расчет параметров острой токсичности препаратов (ЛД10, ЛД16, ЛД50, 95% доверительный интервал ЛД50, ЛД84) проводили пробит-методом.
Оценку острой токсичности субстанции при подкожном введении проводили на белых беспородных мышах и крысах в два этапа.
На первом этапе в предварительном исследовании определяли ориентировочный диапазон переносимых, токсических и летальных доз тестируемого вещества на двух животных на дозу (1 самец и 1 самка). На мышах были испытаны дозы 0,5, 5, 50, 100, 200 и 300 мкг/кг. Все животные на дозах: 100, 200 и 300 мкг/кг погибли. На крысах сначала были испытаны дозы 0,5, 5, 50, 100, 200 и 300 мкг/кг. Гибели животных в течение 14 дней опыта не было. Поэтому дополнительно были испытаны дозы 400 и 800 мкг/кг. Все животные на обоих дозах погибли на 3-4 день опыта.
По результатам предварительного исследования на мышах и крысах были установлены диапазоны доз для основного исследования.
В основном исследовании субстанцию вводили мышам в дозах 50, 100 и 200 мкг/кг, а крысам - в дозах 125, 250 и 500 мкг/кг (по 5 самцов и 5 самок на дозу).
В первые сутки после введения субстанции клинические симптомы отравления у мышей и крыс обоего пола и всех подопытных групп отсутствовали. На 2-е сутки после введения на максимальной и средней дозах у животных обоих видов отмечали дозозависимые неспецифические симптомы интоксикации (угнетенное состояние, учащенное дыхание, снижение потребления корма и воды) и местно-раздражающее действие.
Местно-раздражающее действие проявлялось следующим образом. У всех животных на максимальной дозе отмечали со второго дня опыта отек и покраснение кожи в месте введения, и некротические изменения подкожной клетчатки в области введения. У животных, получивших минимальную и среднюю дозы, наблюдали покраснение кожи в области введения. И начиная с 2-3 дня опыта и до окончания срока наблюдения (14 дней) отмечали нарастающие дозозависимые некротические изменения в подкожной клетчатке с образованием открытых незаживающих язв у части подопытных животных, получавших тестируемое вещество в дозах ≥50 мкг/кг (мыши) и ≥125 мкг/кг (крысы).
Гибель мышей и крыс наблюдалась, начиная с 3-го дня опыта. Гибель основной массы животных происходила в ночные часы на фоне угнетенного состояния в 3-6 дни.
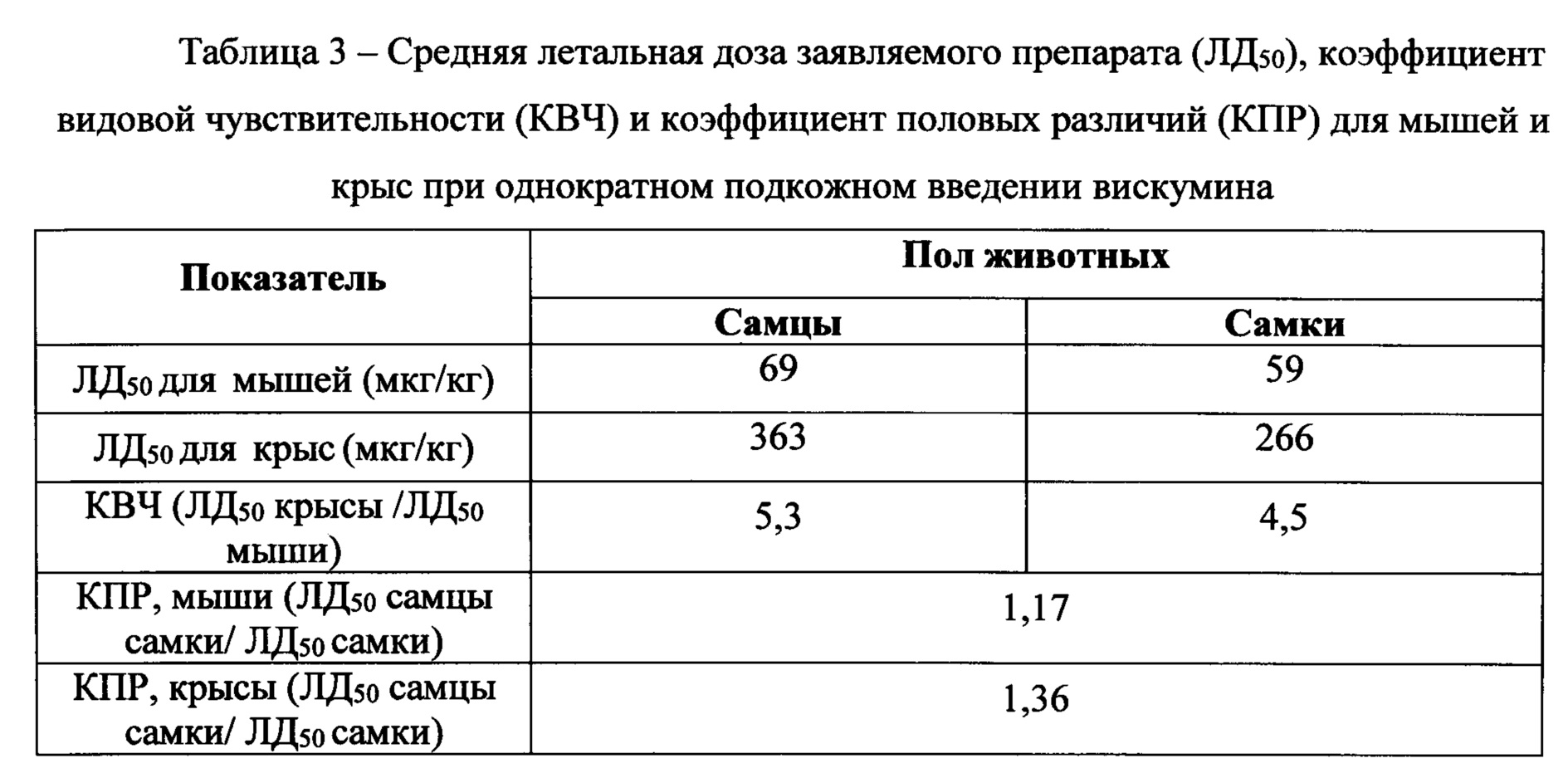
Параметры острой токсичности субстанции для мышей и крыс представлены в таблицах 2 и 3. Из полученных результатов следует, что мыши более чем крысы чувствительны к вискумину. В то же время, у мышей и крыс половые различия чувствительности к вискумину не выражены.
У всех животных, получивших исследуемое вещество, в первую неделю наблюдения отмечали потерю веса. У выживших животных на 2-й неделе опыта общее состояние несколько улучшилось: стали больше потреблять корма, и частично восполнили потерю массы тела.
Патоморфологическое исследование мышей и крыс проводили в случаях падежа животных в течение периода наблюдения, а также на 15-й день после введения вискумина (Субстанция заявляемого препарата, раствор для инъекций, 0,1 мг/мл) (животные из групп, в которых не было падежа и животные, получавшие носитель).
При патологоанатомическом вскрытии павших мышей и крыс, получивших подкожно препарат вискумина, в месте введения были обнаружены выраженные некротические изменения в коже и подкожной клетчатке, а в отдельных случаях дополнительно - петехиальные кровоизлияния в прилежащей мышечной ткани.
Кроме того, у павших мышей, ранее получивших вискумин в дозе 200 мкг/кг, в желудочно-кишечном тракте обнаруживали содержимое темно-красного цвета, предположительно кровь. При этом повреждений слизистых оболочек или сосудов желудка и кишечника выявлено не было.
При плановом патологоанатомическом вскрытии мышей, получивших тестируемое вещество в дозе 50 мкг/кг, при внешнем осмотре и исследовании трупов были установлены изменения в коже и подкожной клетчатке. В участках кожи в месте введения вискумина у животных определяли небольшие уплотнения, иногда с изъязвлением на поверхности кожи, а также петехии в подлежащей подкожной клетчатке и мышечной ткани. У мышей, которым инъецировали носитель, изменений в коже и прилежащих тканях не обнаруживали. Других различий между подопытными и контрольными мышами не установлено. При некропсии органы грудной и брюшной полостей мышей подопытных и контрольных групп имели анатомически правильное расположение и нормальную макроструктуру, каких-либо макроскопически различимых патологических изменений не установлено.
При плановом патологоанатомическом вскрытии крыс, получивших вискумин в дозе 250 мкг/кг, при внешнем осмотре и исследовании трупов были установлены значительные по размеру и выраженности признаков изменения в коже и подкожной клетчатке. Так, в участках кожи в месте введения тестируемого вещества у животных определяли обширные постнекротические очаги, покрытые сухими корками цвета от темно-серого до черного и размером от 4,5×1,5 см до 7,0×3,5 см. У одного самца и двух самок под описываемыми корками были обнаружены очаги со сметанообразным содержимым, имевшим ихорозный запах, что, по всей видимости, явилось следствием инфицирования некротических тканей гноеродными бактериями. У крыс, которым инъецировали носитель, изменений в коже и прилежащих тканях не обнаруживали. Других различий между подопытными и контрольными крысами не установлено. При некропсии органы грудной и брюшной полостей крыс подопытных и контрольных групп имели анатомически правильное расположение и нормальную макроструктуру, каких-либо макроскопически различимых патологических изменений не установлено.
Таким образом, проведенным патоморфологическим исследованием установлено выраженное местное раздражающее действие вискумина при подкожном введении в испытанных концентрациях и дозах мышам и крысам, приводящее к глубокому некрозу кожи и прилежащих тканей. Повреждения макроструктуры внутренних органов животных установлено не было.
На белых беспородных мышах и крысах изучена острая токсичность вискумина (субстанции нового лекарственного препарата) при однократном подкожном введении.
По результатам клинических наблюдений выявлены дозозависимые неспецифические симптомы интоксикации (угнетенное состояние, учащенное дыхание, снижение потребления корма и воды) и местно-раздражающее действие. Гибель мышей и крыс наблюдалась, начиная с 3-го дня опыта. Гибель основной массы животных происходила в ночные часы на фоне угнетенного состояния в 3-6 дни.
По данным гибели животных в экспериментах установлены параметры острой токсичности субстанции (ЛД10, ЛД16, ЛД50, 95% доверительный интервал ЛД50, ЛД84) для мышей и крыс.
Установлено, что мыши более чувствительны к вискумину чем крысы. У мышей и крыс половые различия чувствительности к вискумину не выражены. Минимальные значения ЛД50 вискумина для самок мышей (59 мкг/кг) и самок крыс (266 мкг/кг) превышают предполагаемую разовую терапевтическую для человека дозу при подкожном введении (5 нг/кг) более чем в 11800 раз и 53200 раз соответственно.
Патоморфологическим исследованием установлено выраженное местное раздражающее действие вискумина при подкожном введении в испытанных концентрациях и дозах мышам и крысам, приводящее к глубокому некрозу кожи и прилежащих тканей. Повреждения макроструктуры внутренних органов животных установлено не было.
Несмотря на наличие местного раздражающего действия в чрезмерных дозах (≥50 мкг/кг у мышей и ≥125 мкг/кг у крыс), субстанция имеет высокий терапевтический индекс и не имеет противопоказаний для проведения клинических испытаний.
Во второй части исследования острой токсичности препарата MLI белым беспородным мышам и крысам однократно подкожно вводили препарат в дозах 50, 500 и 5000 нг/кг по вискумину. Животным контрольных групп вводили носитель - фосфатный буфер с pH 8,0 (раствор для разведения) - в таком же объеме, как и препарат в максимальной дозе.
Патоморфологическое исследование проводили на 15-й день после введения препарата. Некропсии подвергали мышей и крыс, получивших исследуемый препарат в максимальной дозе, не вызвавшей гибели животных - 5000 нг/кг, а также всех животных, получавших носитель.
Проведенным патоморфологическим исследованием не установлено морфологических признаков какого-либо повреждающего действия препарата на органы и ткани подопытных крыс и мышей. Также в месте введения препарата ни в одном из случаев не было обнаружено признаков местного раздражающего действия.
Разработанный препарат имеет высокий терапевтический индекс и не имеет противопоказаний для проведения клинических испытаний.
Изучение хронической токсичности разработанного препарата MLI на крысах при подкожном введении в течение одного месяца
Опыты проводили на белых беспородных крысах по оценке характера и выраженности возможного повреждающего действия препарата на организм крыс при многократном подкожном введении.
Тестируемый препарат вводили крысам в течение одного месяца подкожно по 2 раза в неделю через 2-3 дня в дозах 0, 5, 50 и 500 нг/кг по вискумину. Каждая доза препарата испытана на 10 самцах и 10 самках.
В течение курса введения и 14 дней восстановительного периода оценивали общее состояние животных по их двигательной активности, потреблению корма и воды, состоянию шерсти и слизистых оболочек, массе тела. Через 24 ч после окончания курса введения и после 14 дней восстановительного периода проводили отбор биологических образцов согласно схеме эксперимента в каждый срок для проведения гематологических, биохимических и патоморфологических исследований.
В течение месячного курса введения и 14 дней восстановительного периода клинических симптомов интоксикации и гибели животных не было. Общее состояние животных подопытных и контрольных групп не различалось. Во всех группах животные были активны, охотно поедали корм. Динамика изменения массы тела у животных всех групп была положительная. Статистически значимых различий среднегрупповых значений массы тела животных подопытных групп относительно контрольных не выявлено.
Анализ данных гематологического исследования, биохимического исследования сыворотки крови крыс, патоморфологического исследования, массовых коэффициентов органов, сравнительного микроскопическом изучении гистологических препаратов органов и тканей животных показывает, что препарат при подкожном введении в течение одного месяца в изученных дозах не вызывает признаков общетоксического и местного раздражающего действия как после месячного курса подкожного введения крысам, так и по окончании восстановительного периода.
Изучение влияния разработанного препарата MLI на жизненно важные системы (нервную, дыхательную, сердечно-сосудистую) при его подкожном введении
В исследовании оценивалось влияние субстанции препарата «ВискулаН»-«Вискумин, растительный лектин MLI из Viscum album» на функции нервной, кровеносной и дыхательной систем при многократном подкожном введении самцам и самкам мышей CD-I.
Тестируемое вещество вводили в трех дозах (10 нг/кг, 100 нг/кг и 1000 нг/кг). Доза 10 нг/кг (условно-терапевтическая) близка к предполагаемой терапевтической дозе человека и к минимальным дозам, при которых наблюдается терапевтический эффект (с учетом перерасчета на единицу площади поверхности тела мыши (мг/м2)), доза 1000 нг/кг (условно-токсическая) взята как субтоксическая. Доза 100 нг/кг взята как промежуточная. Препарат сравнения не был предусмотрен, поскольку препарат «Вискулан» является инновационным и не имеет аналогов, позволяющих провести сравнение.
В качестве контрольного вещества вводили растворитель - специальный буфер, предназначенный для разведения оригинального препарата.
Препарат и контрольное вещество вводились один раз в двое суток, в течение 30 дней, то есть каждое животное получило всего 15 доз.
В течение периода введения у животных регистрировали прирост массы тела, потребление корма, смертность, локомоторную активность, мышечную силу передних лап (тест Grip strength), параметры ЦНС (оценка нейротоксичности), параметры дыхания. На 31-й день после первого введения была произведена оценка состояния кровеносной системы, после чего животные были подвергнуты эвтаназии и некропсии; органы осмотрены и взвешены, взяты образцы кожи в месте введения.
В ходе исследования не обнаружено никаких признаков нейротоксичности, в том числе никаких признаков отклонений в локомоторной активности, мышечной силе и других параметрах нейротоксичности. Не обнаружено отклонений в динамике массы тела, потреблении корма, параметрах дыхательной системы.
При оценке состояния сердечно-сосудистой системы не выявлено признаков влияния на артериальное давление. Не выявлено статистически достоверных признаков влияния препарата на частоту сердечных сокращений у самок во всех группах и у самцов, получавших препарат в условно-терапевтической дозе (10 нг/кг). Имеющиеся данные частоты сердечных сокращений обнаруживают тенденцию к увеличению для животных, получавших препарат в дозах 100 нг/кг и 1000 нг/кг, однако не выходят за рамки допустимых значений и не могут однозначно интерпретироваться как проявление патологии и, в то же время, не могут исключить возможность влияния препарата на сердечно-сосудистую систему.
В ходе эксперимента у отдельных животных, получавших препарат в дозе 1000 нг/кг наблюдались выраженные признаки местно-раздражающего действия в месте введения (кожа между лопаток). Эффект наблюдался и к моменту некропсии, у животных взяты образцы кожи. В группах, получавших препарат в дозах 10 нг/кг и 100 нг/кг, признаков местно-раздражающего действия не наблюдалось. Гибели животных, связанной с действием препарата, не установлено.
Таким образом, исследование препарата «Вискумин» не выявило признаков влияния на нервную и дыхательную системы. Выявлена возможность формирования у отдельных животных выраженного местно-раздражающего действия при введении препарата в дозе 1000 нг/кг. Имеющиеся данные параметров сердечно-сосудистой системы не исключают влияния препарата на это звено физиологии, но не могут однозначно интерпретироваться как проявление патологического влияния.
Специфическая токсичность препарата MLI
Изучение влияния разработанного препарата на гуморальный иммунитет
Воздействие исследуемого препарата на гуморальный иммунитет изучали на модели иммунного ответа на ЭБ. Использовали два пути введения препарата:
- однократное внутрибрюшинное введение в дозе 10 ТД;
- курсовое введение: подкожно по 2 раза в неделю в течение 30 дней в дозах 10 ТД и 100 ТД.
Гуморальный иммунитет оценивали после завершения курса введения препарата и после восстановительного периода, по уровню гемагглютининов в сыворотке крови животных, выделенной на 7 сутки после иммунизации ЭБ.
Было показано супрессивное действие препарата в дозе 100 ТД на гуморальный иммунитет, однако оно имело обратимый эффект с восстановлением к 21 суткам после завершения курса введения.
Изучение влияния разработанного препарата MLI на клеточный иммунитет
Воздействие препарата на клеточный иммунитет изучали на модели иммунного ответа на тринитробензолсульфоновую кислоту (ТНБС). Исследуемый препарат вводили подкожно в дозах 10 ТД и 100 ТД по 2 раза в неделю в течение 30 дней. Гаптен ТНБС вводили в день завершения курса введения препарата и после восстановительного периода (через 14 суток после последнего введения). Клеточный иммунитет оценивали в тесте отека лапки мыши на 6 сутки после введения ТНБС, по показателю ИР, рассчитанному по формуле. Установлено, что заявляемый препарат не оказывает влияния на клеточный иммунитет.
Изучение влияния разработанного препарата MLI на функциональную активность перитонеальных макрофагов
Воздействие исследуемого препарата на функциональную активность перитонеальных макрофагов (ПМФ) изучали при подкожном введении в дозах 10 ТД и 100 ТД по 2 раза в неделю в течение 30 дней. ПМФ выделяли на следующие сутки после завершения курса введения препарата. Оценивали показатель активности фагоцитоза (АФ - процентный показатель количества макрофагов, поглотивших бактерии) и показатель интенсивности фагоцитоза (ИФ - показатель среднего количества бактерий в одном фагоците).
Статистически значимых отличий в значениях показателей АФ и ИФ между группами, получавшими исследуемый препарат, и группой отрицательного контроля выявлено не было. Так как после завершения курса введения изученные показатели в группах опыта не отличались от показателей в группе контроля, необходимости в их оценке после восстановительного периода не было.
Таким образом, препарат MLI не оказывает влияния на фагоцитарную активность макрофагов.
Изучение мутагенного действия разработанного препарата MLI при однократном подкожном введении
При однократном подкожном введении изучали мутагенное действие двух доз препарата (по содержанию активного вещества): 1,2 нг/особь (1 ТД) и 20 нг/особь (1/5 LD50). Животным из группы отрицательного контроля вводили однократно подкожно фосфатный буфер с pH 8,0 (раствор для разведения). Животным из группы положительного контроля вводили однократно внутрибрюшинно циклофосфамид в дозе 20 мг/кг. Исследование проведено на самцах.
Показано, что при однократном подкожном введении мышам в дозах до 20 нг/особь (1000 нг/кг) по содержанию активного вещества мутагенное действие заявляемого препарата в тесте учета хромосомных аберраций костного мозга не установлено.
Изучение мутагенного действия разработанного препарата MLI при четырехкратном подкожном введении
При четырехкратном подкожном введении изучали мутагенное действие одной дозы препарата: 1,2 нг/особь по содержанию активного вещества (1 ТД). Препарат вводили с интервалом 24 часа. Животным из группы отрицательного контроля вводили четырехкратно подкожно фосфатный буфер с pH 8,0 (раствор для разведения). Исследование проведено на самцах и самках.
При анализе цитогенетических препаратов костного мозга мышей после четырехкратного подкожного введения исследуемого препарата не отмечено статистически значимого увеличения количества клеток со структурными нарушениями хромосом по сравнению с группами отрицательного контроля. Клетки с множественными аберрациями не обнаружены. Выявленные хромосомные аберрации - одиночные или парные фрагменты хромосом. Доля поврежденных клеток у мышей не достигала 4%: в подопытных группах было выявлено 2,00±0,71% (самки) и 1,40±0,55% (самцы) клеток с хромосомными аберрациями, в соответствующих группах отрицательного контроля - 1,60±0,89% и 1,80±0,45% клеток с хромосомными аберрациями.
Таким образом, при четырехкратном подкожном введении мышам в дозе, эквивалентной терапевтической, рассчитанной по соотношению площади поверхности тела человека и мыши, мутагенное действие препарата в тесте учета хромосомных аберраций костного мозга не установлено.
Изучение аллергизирующего действия разработанного препарата MLI на мышах
Препарат вводили мышам подкожно по 2 раза в неделю в течение 30 дней, оценку ГЗТ проводили через 5 после завершения курса введения, оценку ГНТ - через 14 дней после завершения курса введения.
Для выявления у мышей ГЗТ использовали тест отека лапки. Индекс реакции (ИР) ГЗТ определяли по разнице в весе опытной и контрольной лапок через 24 часа после введения разрешающей дозы (РД).
В результате проведенного исследования аллергизирующее действие заявляемого препарата на мышах не выявлено.
Изучение аллергизирующего действия разработанного препарата MLI на морских свинках
Для сенсибилизации морских свинок использовали две схемы введения: 1) подкожное введение по 2 раза в неделю в течение 30 дней; 2) трехкратное введение: первое - подкожно, второе и третье - через сутки - внутримышечно.
Для выявления гиперчувствительности у морских свинок использовали метод конъюнктивальной пробы и реакцию общей анафилаксии.
Методом конъюнктивальной пробы тестировали морских свинок-альбиносов, получавших препарат подкожно в течение 30 дней. При проведении конъюнктивальной пробы не было отмечено признаков беспокойства животных и изменений в состоянии слезного протока и конъюнктивы в течение первых 30 минут, а также через 24 и 48 часов после введения разрешающей дозы. Методом конъюнктивальной пробы аллергическая реакция на заявляемый препарат не выявлена ни у одного животного, получившего курс подкожного введения препарата в дозах до 10 ТД.
Реакцию общей анафилаксии проводили на морских свинках, сенсибилизированных по схеме: первое введение - подкожно, второе и третье - через сутки - внутримышечно. При проведении реакции общей анафилаксии состояние животных регистрировали в течение часа после внутрисердечного введения разрешающей дозы, превышающей суммарную сенсибилизирующую. Реакция общей анафилаксии была отрицательной у всех животных: 0 баллов по таблице индексов по Weigle.
Таким образом, аллергизирующее действие заявляемого препарата на морских свинках не выявлено.
Определение токсичности исследуемого препарата MLI на тест-штаммах сальмонелл методом разведений
При постановке теста Эймса в пробирки с селективным полуобогащенным агаром (0,6%) вносили по 0,1 см3 суспензии исследуемого препарата в необходимых концентрациях, затем - по 0,1 см3 суспензий исследуемых штаммов бактерий в 2,5% растворе DMSO, растворенном в физиологическом растворе. После этого в пробы вносили по 0,5 см3 микросомной активирующей смеси. В контрольных вариантах суспензии исследуемого вещества заменяли равным объемом 2,5%-ного раствора DMSO. Содержимое пробирок быстро перемешивали и выливали на поверхность нижнего минимального агара. Интервал времени между внесением в пробы микросомной активирующей смеси и разливом полужидкого агара на чашки не превышал 5-10 секунд.
Чашки оставляли при комнатной температуре на 30-40 минут и после полного застывания агара переносили в термостат (37°C). Учет результатов проводили через 48-72 часа инкубации. В качестве позитивных контролей использовали вещества, индуцирующие мутации у соответствующих тест-штаммов при наличии или отсутствии условий активации.
Результаты исследований продемонстрировали, что коллекционные штаммы Salmonella typhimurium соответствуют своим паспортным характеристикам, соответствующим требуемым для работы по оценке мутагенности лекарственного препарата в форме таблеток, покрытых пленочной оболочкой, содержащего в качестве активных субстанций метформин и сибутрамин.
Цитотоксичность
На первом этапе исследования оценивали цитотоксичность тестируемого образца. Результаты исследований показали, что в диапазоне всех исследованных концентраций 0,1-1000,0 мкг/чашку исследуемый препарат не оказывал цитотоксического действия на штаммы Salmonella typhimurium TA97, TA98, TA100.
Оценка мутагенности препарата MLI
При проведении теста Эймса в каждом контрольном и опытном вариантах использовали по три чашки. В качестве положительных контролей использовали вещества, индуцирующие мутации у соответствующих тест-штаммов. При постановке негативных контролей вместо исследуемого вещества в чашки вносили равные объемы 2,5% раствора DMSO.
Положительные контроли сработали как на штаммы, так и на работоспособность микросомальной смеси. Опытные варианты, содержащие препарат достоверно (p=0.95) не отличались от вариантов без препарата (отрицательные контроли).
Таким образом, в результате проведенных экспериментальных исследований по оценке потенциальной мутагенной активности заявляемого препарата установлено, что изучаемый препарат и его метаболиты не вызывают индукции к прототрофности по гистидину у his- - ревертантов Salmonella typhimurium (штаммы TA97, TA98, TA100) как в условиях с метаболической активацией фракцией S9 гомогената печени крыс, так и без нее.
Контроль биологической активности препарата MLI в концентрации 0,1 мг/мл N-гликозидазная активность
Специфической активностью A-цепи вискумина является гидролиз N-гликозидной связи в 4324 положении сарциновой петли 28S рибосомальной РНК. Метод оценки данной активности вискумина основан на определении разрушенных рибосом в клетке с помощью ПЦР в режиме реального времени. Для этого клетки линии Caco2 культивировали с интактной питательной средой, и содержащей MLI в концентрации 1,04⋅10-8 M в течение 6 часов в CO2-инкубаторе (37°C, 5% CO2). Затем отбирали среду с препаратом MLI из каждой лунки с клетками практически досуха. Клетки лизировали добавлением Qiazol Lysis реагента (Qiagen, Германия), инкубировали в течение 5 мин при комнатной температуре. Далее проводили выделение РНК из полученных лизатов. На обратную транскрипцию и последующий анализ брали РНК только высокого качества (RIN ≥7).
Проведение обратной транскрипции проводили с использованием коммерческого набора SuperScriptVILO™ cDNASynthesisKit (Invitrogen, США). Количественное определение содержания модифицированных фрагментов рибосом в образцах проводили с помощью ПЦР-РВ. Действовали по следующему протоколу:
1) Разбавляли кДНК каждого образца в 1000 раз.
2) В качестве праймеров использовали две пары к различным частям 28S субъединицы РНК:
CLR_L: 5'-AGGTGGGGAGTTTGACTGGG-3'
CLR_R: 5'- TCCACGGGAGGTTTCTGTCC-3'
RIP_L: 5'-TGCCATGGTAATCCTGCTCAGTA-3'
RIP_m_R: 5'-TCTGAACCTGCGGTTCCACA-3'
CLR - праймеры, которые отжигаются рядом с модифицированным нуклеотидом, но не затрагивают его - контрольные праймеры дистального фрагмента.
RIP_m - праймеры к модифицированной последовательности, позволяют нарабатывать ПЦР-продукт с модифицированной 28S рибосомной РНК. Количество праймера RIP_m_R в реакционной смеси должно быть в 3 раза больше по отношению к RIP_L.
3) Для приготовления реакционных смесей использовали набор для ПЦР-РВ «2,5x Реакционная смесь для проведения ПЦР-РВ» (Синтол, Россия). Готовили 2 реакционные смеси на 24 лунки (с запасом) для каждой из пары праймеров.
4) Проводили анализ выходных данных ПЦР-РВ (значений пороговых циклов Ct).
Для этого:
А. Рассчитывали средние значения
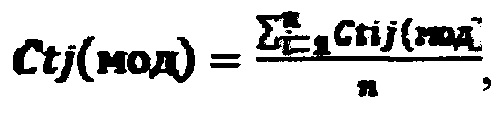
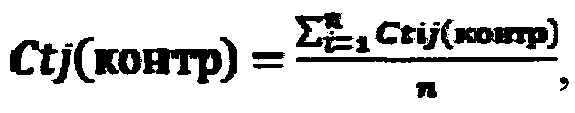
где i - повторности реакций (i=1…n), j - номер биологического повтора (j=1…k), Ct(контр) - пороговый цикл для контрольной пары праймеров, Ct(мод) - пороговый цикл для пары праймеров к модифицированному участку.
Б. Рассчитывали среднее значение по трем биологическим повторам для каждой пары праймеров:
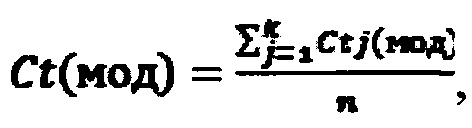
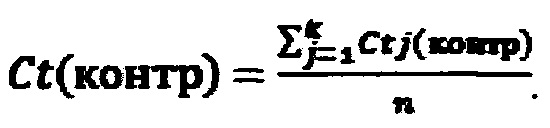
Действующее вещество в составе исследуемого раствора считается активным, если пороговый цикл для контрольной пары праймеров (для дистального фрагмента) лежит в диапазоне Ct(контр)=12±2. Пороговый цикл для пары праймеров к модифицированному участку рибосомной РНК Ct(мод)≤22.
Разработанный препарат представляет собой раствор для подкожного введения, содержащий растительный лектин вискумин (MLI) и буфер. Белок MLI, выделенный из листьев омелы белой, принадлежит к рибосоминактивирующим белкам, а именно удаляет аденин в сарциновой петле рибосомной РНК, и, таким образом, блокирует белковый синтез в клетке и вызывает апоптоз. Противоопухолевое действие препарата обусловлено не только прямым действием на опухолевые клетки, но и воздействием на цитотоксические звенья иммунной системы.
Проведенные исследования позволяют сделать вывод, что препарат обладает противоопухолевой активностью (ингибирование роста опухоли) и иммуномодулирующим действием.
Установлено, что все испытанные дозы препарата не вызывали гибели подопытных животных. Значения ЛД50 препарата для мышей и крыс обоего пола превышают максимальную испытанную дозу - 5000 нг/кг и, таким образом, превышают разовую терапевтическую для человека дозу при подкожном введении (5 нг/кг) более чем в 1000 раз. Различий половой чувствительности к препарату в испытанных дозах не установлено. Препарат не обладает местным раздражающим действием при однократном подкожном введении.
Исследование препарата не выявило признаков влияния на нервную и дыхательную системы. Выявлена возможность формирования у отдельных животных выраженного местно-раздражающего действия при введении препарата в дозе 1000 нг/кг. Имеющиеся данные параметров сердечно-сосудистой системы не исключают прямого или косвенного влияния препарата на это звено физиологии, но не могут однозначно интерпретироваться как проявление патологического влияния.
Для подтверждения стабильности полученного растительного лектина были проведены исследования стабильности концентрата для приготовления раствора для подкожных инъекций при долгосрочном испытании хранения +2 - +8°C в течение 2,5 года на трех сериях препарата. Результаты представлены в таблице 4.
На протяжении 2,5 лет хранения препарата - концентрат для приготовления раствора для подкожных инъекций, исследованные показатели соответствуют требованиям спецификации.
Многочисленные данные свидетельствуют о том, что в основе противоопухолевого действия MLI лежит запуск иммуногенного апоптоза и стресса эндоплазматического ретикулума (ER-стресса) - стимуляторов, так называемой, иммунизация in vivo (Aaes Т.L., Kaczmarek A., Delvaeye Т., et al. Vaccination with Necroptotic Cancer Cells Induces Efficient Anti-tumor Immunity // Cell reports. 2016. Vol. 15. №. 2. P. 274-287). При этом, как было показано выше, по-видимому, важным является время присутствия лектина в ткани, тогда как увеличение локальной концентрации MLI может нивелировать иммуномодулирующий эффект. С целью возможного увеличения времени удержания тканью белка MLI после введения, был получен и охарактеризован конъюгат ферромагнитных наночастиц магнетита и MLI (ФНЧ-MLI). В рамках изучения фармакологических свойств ФНЧ-MLI, исследовалось элиминирование конъюгата у мышей при внутриопухолевом введении.
Методика исследования препарата ФНЧ-MLI
Реактивы и материалы, питательная среда для культивирования клеток L-15 (Invitrogen, США), FBS (PAA, Австрия), амниотик (смесь антибиотиков-пенициллин, стрептомицин и амфотерацин B; Invitrogen, США), матригель Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-Free (Coining, США).
Получение растительного лектина MLI и конъюгата MLI с ферромагнитными наночастицами магнетита. Нативный растительный лектин MLI получали из зеленных частей омелы белой (Viscum album) заявляемым способом. Ферромагнитные наночастицы и их конъюгат с MLI с получали также, как описано в работе (Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека А172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12/ P. 797-801). Количество молекул MLI, конъюгированных с одной наночастицей и сохранивших активность, определяли методом конкурентного связывания с иммобилизованным лигандом белком фетуин в присутствии различных концентраций лактозы (Manevich Е.М., Tonevitsky А.G., Bergelson L.D. The binding of the B-chain of ricin to Burkitt lymphoma cells // FEBS letters. 1986. Vol. 194. №. 2. P. 313-316.).
Культивирование клеточной культуры MDA-MB231 модель. Клетки аденокарциномы молочной железы человека MDA-MB231 культивировали в течение 5-7 пассажей на среде L-15 с добавлением 10% FBS и амниотика. Перед инъекцией животным клетки опухоли снимали с подложки раствором трипсин/версен и после 5 мин центрифугирования при 1000 об/мин осадок тщательно ресуспендировали в среде без сыворотки, доводя до концентрации 4-5×106 клеток в 100 мкл.
Оценку выживаемости клеток гибридом, а также линии MDA-MB231 при различных концентрациях MLI проводили методом МТТ в течение 24 ч, как описано в [Moisenovich, 2004].
Ксенографтная модель. Использовалась модель ортотопической ксенотрансплантации клеток карциномы молочной железы человека MDA-MB231 иммунодефицитным мышам линии SCID (Severe combined immunodeficient mouse). Самкам мышей подкожно ортотопически вводили клетки линии MDA-MB231 в смеси с матригелем в соотношении 1:1 в количестве 100 мкл (5×106 клеток). После введения в течении 42 суток наблюдали за ростом опухолевого узла. В исследовании принимали участие животные с размерами опухолевого узла меньше 500 мм3 (маленькая опухоль).
Исследование биораспределения конъюгата ферромагнитных наночастиц магнетита и MLI. Животным однократно внутриопухолево вводили по 10 мкл препарата ФНЧ-MLI (концентрация по MLI составляла 6×10-9 М) или контрольного препарата наночастиц в эквивалентном количестве по содержанию железа. В качестве контрольного препарата наночастиц использовали ферромагнитные наночастицы магнетита, обшитые полиэтеленгликолем (ФНЧ). За распределение препаратов следили с помощью магнитно-резонансной томографии (МРТ) по изменению сигнала магниторезонасного вещества (ФНЧ) через 0,15 мин, 2 и 24 часа после введения препарата.
Часть животных через 3 суток после однократной внутриопухолевой инъекции ФНЧ-MLI была подвергнута эфтаназии, осуществлены забор ткани опухоли и фиксация ее в 4% растворе формалина. Затем проводилась стандартная проводка тканей с последующей заливкой в парафиновые блоки для гистологического анализа.
Гистологический анализ. Срезы толщиной 4 мкм монтировались на позитивно заряженные стекла (SuperFrost Plus, ThermoFisher Scientific). Окраска гематоксилином и эозином производилась по стандартной методике.
Результаты исследования
Для оценки влияния конъюгирования MLI с ферромагнитными наночастицами на свойства вискумина, была изучена цитотоксичность конъюгата для клеток гибридом. Результаты, представленные на фиг. 4, указывают на сохранение цитотоксической активности MLI в составе конъюгата.
В качестве модели опухолевых клеток была выбрана линия MDA-MB-231. Данная линия является трижды негативной аденокарциномой молочной железы человека (без рецепторов эстрогена, прогестерона и со сниженной экспрессией рецепторов Her2) и обладает повышенной устойчивостью к различным противоопухолевым препаратам. Известно, что чувствительность разных клеток к MLI сильно различается. Поэтому сначала была проведена оценка цитотоксических свойств MLI для клеток линии MDA-MB-231. Показано, что IC50 составляет 3,4×10-8 М.
Самкам иммунодефицитных мышей линии SCID с ортотопически привитой подкожной опухолью MDA-MB231 однократно внутриопухолево вводилось 10 мкл контрольного препарата ферромагнитных наночастиц, не содержащих вектор-лиганд MLI, или препарата ФНЧ-MLI, содержащего эквивалентное количество железа. Концентрация MLI во вводимом образце ФНЧ-MLI составляла 6×10-9 M. Полученные предварительные данные свидетельствую о том, что иммуномодулирующие свойства MLI проявляются в концентрациях ниже цитотоксических. Используемая для внутриопухолевого введения доза препарата ФНЧ-MLI удовлетворяет этому условию.
За изменением содержания ФНЧ-MLI и контрольного препарата в опухоли следили с помощью магнитно-резонансной томографии (МРТ). Динамика изменения МРТ сигнала в опухоли по отношению к сигналу в мышце, как наиболее стабильной магнитоконтрастной ткани, представлена на фиг. 5. Наибольшее снижение относительной интенсивности МРТ сигнала в опухоли, которое свидетельствует о накоплении магнитоконтрастного вещества, наблюдалось и для контрольных ФНЧ, и для ФНЧ-MLI через 15 мин. Однако во временной точке 2 ч уже проявлялись различия в скорости выведения контрольного препарата наночастиц и препарата, содержащего MLI, когда можно отметить большую степень накопления для ФНЧ-MLI (p<0.08).
Ранее было исследовано биораспределение нативного растительного MLI у мышей при подкожном введении, было показано, что через 2 ч в месте введения остается не более 8% от введенной дозы, а через 24 ч - менее 1%. В случае ФНЧ-MLI, в опухолевом узле содержание конъюгата через 2 ч уменьшается в 1,4 раза, а через 24 часа в 3,5 раза, по сравнению со значением через 15 мин. При этом относительная интенсивность ткани опухоли на 10% остается ниже, чем до введения препарата. Таким образом, по-видимому, скорость элиминирования конъюгата ФНЧ-MLI значительно ниже, чем нативного растительного MLI. Гистологический анализ через трое суток после введения препарата не выявил существенных различий в состоянии ткани опухолевых узлов в случае инъекции контрольного препарата и конъюгата ФНЧ-MLI.
Таким образом, полученные данные свидетельствую о том, что конъюгирование MLI с ферромагнитными наночастицами магнетита приводит к уменьшению скорости элиминирования лектина из опухолевого узла. Кроме того, присутствие конъюгата в дозах, использованных в исследовании, не приводит к нежелательным изменениям состояния опухолевой ткани. Это позволяет предполагать возможность тонкой регуляции противоопухолевого иммунного посредством запуска иммуногенного апоптоза, индукция которого была нами продемонстрирована на клеточных линиях.
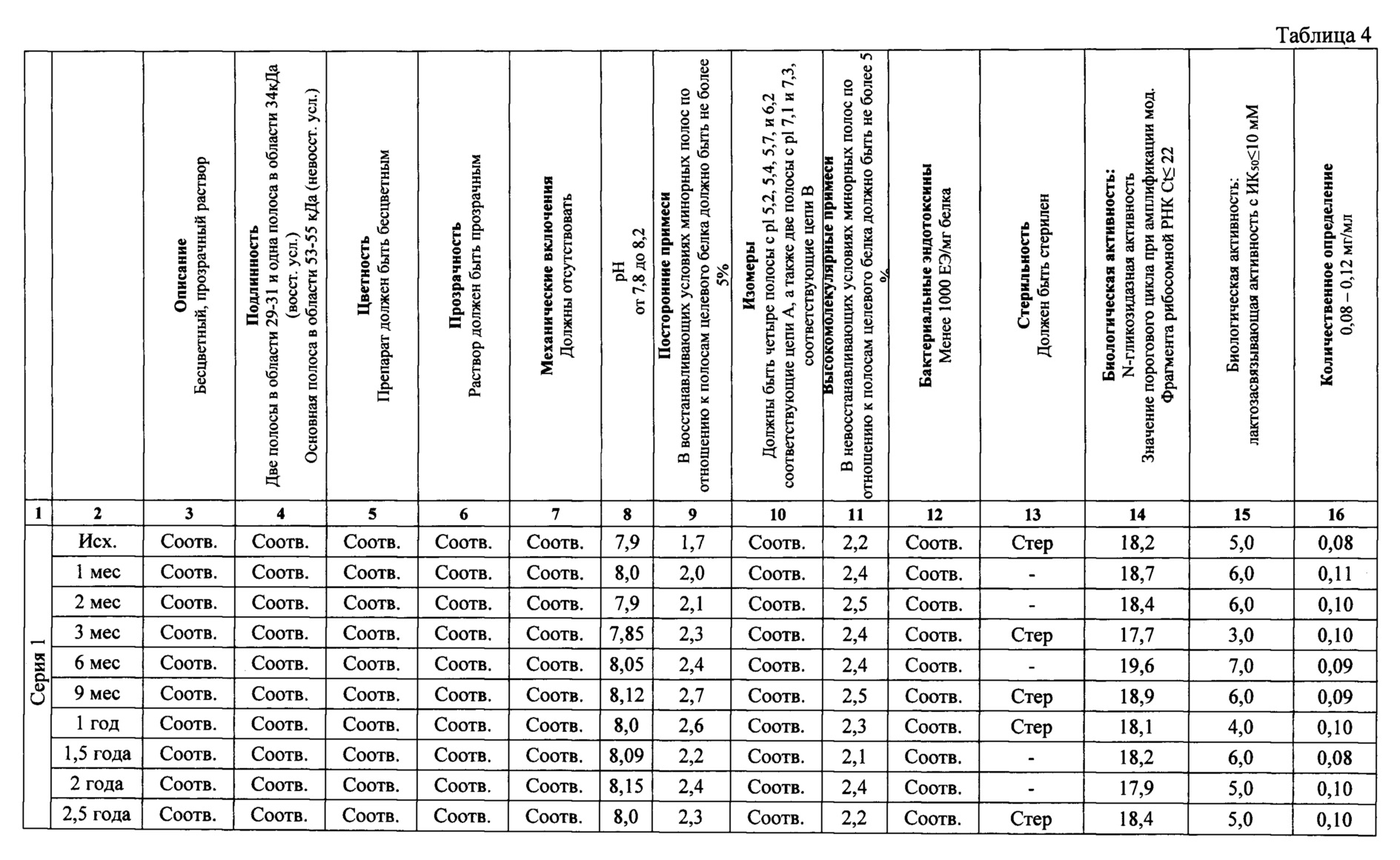
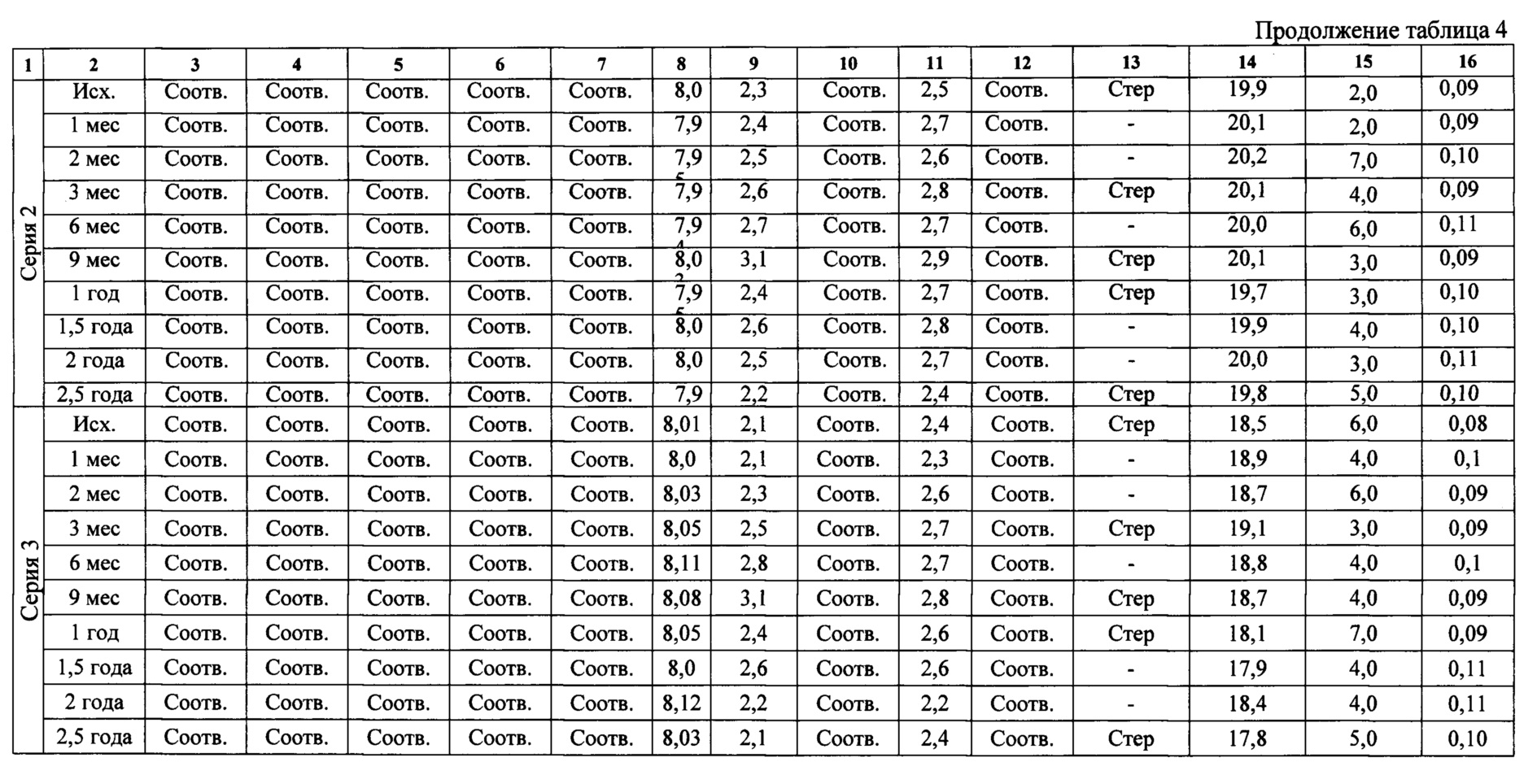
Реферат
Изобретения относятся к получению биологически активных препаратов. Предложены способ выделения белка ML1 из омелы белой и фармацевтическая композиция (варианты). Способ предусматривает экстракцию белка из сухих листьев омелы белой в 0,25М растворе NaCl, проведение трех этапов очистки, включая аффинную хроматографию с лактозил-содержащим сорбентом и ионно-обменную хроматографию с катионообменной смолой типа monoS, и концентрирование до 2 мг/мл на мембране с размерами пор от 10 до 30 кДА. Композиция содержит 0,04-0,15 мг/мл белка ML1 и водный изотонический солевой раствор или 0,1-10 мкг/мл белка ML1, 0,1-1 мг/мл ферромагнитных наночастиц и водный изотонический солевой раствор. Изобретения обеспечивают получение лектина ML1 из омелы белой с чистотой не менее 95% и фармацевтической композиции на его основе, обладающей иммуностимулирующим, противоопухолевым действием и стабильностью в течение 2,5 года. 3 н. и 5 з.п. ф-лы, 5 ил., 4 табл., 2 пр.

Комментарии