Генетически модифицированный бактериальный штамм wsj-ia, продуцирующий изовалерилспирамицин i с высоким содержанием и высоким выходом - RU2553564C2
Код документа: RU2553564C2
Чертежи



Описание
Область техники
Настоящее изобретение включает получение бактериального штамма, продуцирующего однокомпонентный антибиотик с высоким содержанием и с высоким выходом, путем конструирования с использованием технологии регулирования генов.
Уровень техники
Байтспирамицин (Bitespiramycin), примитивное название: Шенджимицин (Shengjimycin)) [патент № ZL 97104440.6] представляет собой производное спирамицина, полученное путем присоединения изовалерила по гидроксильной группе в положении 4'' фрагмента микарозы молекулы спирамицина. Байтспирамицин получают с применением генетически модифицированной технологии, благодаря которой получают комбинацию бактериальных генов: гена ist изовалерилспирамицина термоустойчивых Streptomyces и спирамицина. Байтспирамицин обладает относительно высокой активностью в отношении грамположительных бактерий, особенно в отношении Streptococcus pneumonia, Mycoplasma pneumonia и хламидий, проявляет антибактериальную активность в отношении бактерий, устойчивых к эритромицину и β-лактамным антибиотикам, таких как influenza bacillus, Legionella, Clostridium perfringens, и не демонстрирует полной перекрестной устойчивости с аналогичными лекарственными средствами. Байтспирамицин обладает относительно высокой липофильностью, при этом быстро всасывается при пероральном введении, высокой способностью к проникновению в ткани, широким распределением в организме и большим временем удерживания. Следовательно, он демонстрирует хороший постантибиотический эффект. Для байтспирамицина, полученного посредством генетически модифицированной технологии, была закончена III фаза клинических испытаний, и ее результаты показали хороший терапевтический эффект и безопасность. Для данного лекарственного средства была подана заявка на получение сертификата лекарственного средства класса I.
Клинические исследования показывают, что байтспирамицин является безопасным и эффективным антибиотиком. Его терапевтический эффект сравним с антибиотиком азитромицином, который в настоящее время считается лучшим макролидом. Тем не менее, вследствие того, что байтспирамицин является многокомпонентным лекарственным средством, организация процесса производства таблеток, позволяющего получать продукты с контролируемым соотношением компонентов и стабильным качеством, в любом случае требует относительно жесткого контроля экстракции, а также процессов очистки, при этом процесс контроля качества является сложным. В тоже время, чтобы усилить его терапевтические эффекты, необходимо разработать лекарственные формы для инъекций. Хорошо известно, что инъекции обеспечивают очень быстрые терапевтические эффекты, что особенно важно для тяжелобольных пациентов или для тех, кому не подходит пероральный прием лекарственных средств. Очевидно, что к инъекционным формам предъявляются более высокие требования в отношении контроля качества.
Продукция многокомпонентного байтспирамицина соответствующими бактериями обусловлена многокомпонентными характеристиками спирамицина. Байтспирамицин, который имеет общее происхождение с платеномицином (Platenomycin), представляет собой макролидный антибиотик, основное ядро которого представляет собой 16-членное лактонное кольцо. Он содержит три молекулы сахара: форозамин, микаминозу и микарозу, и основным компонентом байтспирамицина является производное, изовалерилированное по гироксильной группе в 4'' положении микарозного фрагмента молекулы спиромицина. Вследствие присутствия гена ацетилтрансферазы в бактериях, продуцирующих спирамицин, положение 3 лактонного кольца в молекуле спирамицина может быть ацетилировано с образованием компонента спирамицин II; пропионилировано с образованием компонента спирамицин III; и если положение 3 лактонного кольца деацетилированно, образуется компонент спирамицин I. Вследствие этого байтспирамицин также представляет собой смесь по меньшей мере трех компонентов: изовалерилспирамицинов I, II, III. Указанные три основные компоненты байтспирамицина имеют следующие структуры:

где:
Исследования показали, что все отдельные компоненты изовалерилспирамицина I, II и III обладают антибиотической активностью, причем между их активностями нет значительных различий [заявка на патент №201010119745.1]. Согласно действующему стандарту качества, установленному для байтспирамицина, компонентов изовалерилспирамицина (I+II+III) должно быть не менее 60%. Следовательно, отдельный компонент (содержащий более 60%) может быть использован для замены многокомпонентной смеси. Для уменьшения продуцирования многочисленных компонентов, данная лаборатория создала бактериальный штамм WSJ-2 путем блокирования гена 3-О-ацилтрансферазы путем применения технологии рекомбинации генов для бактерии WSJ-1, продуцирующей байтспирамицин. WSJ-2 продуцировал только изовалерилспирамицин I [Chunyan Ma et al. Current Microbiology, 2011, 62: 16-20]. Однако этот штамм проявил очень низкую ферментативную активность и поэтому не подходит для крупномасштабного производства. Задачей настоящего изобретения является регулирование гена acyB2 с получением модифицированного штамма WSJ-2, обеспечивающего повышенный выход отдельного компонента изовалерилспирамицина I и его содержание в смеси. Это будет основой для разработки нового лекарственного средства - однокомпонентного гомолога байтспиромицина, изовалерилспирамицина I, для клинического применения.
Известно, что ген ist изовалерилтрансферазы термоустойчивых стрептомицетов связан с регуляторным геном acyB2, и присутствие этого регуляторного гена может активировать экспрессию гена ist. Модельный штамм стрептомицета Streptomyces Variable Lead Green Streptomyces, содержащий полный ген ist и регуляторный ген acyB2, способен превращать 67-79% добавленного извне тилозина в 4''-изовалерилтилозин, тогда как аналогичный штамм Streptomyces, содержащий только ген ist, или ген ist и неполный acyB2 ген, превращал только 0-2,4% добавленного тилозина [Arisawa A et al: Biosci Biotechnol Biochem 1993, 57 (12): 2020-2025]. При переносе рекомбинантной плазмиды автономной репликативной формы (векторы pIJ702 или pIJ943), содержащей гены ist и acyB2, в бактерию Streptomyces fradiae, продуцирующую тилозин, в условиях внешнего добавления лекарственного средства (тиопептина), трансформант при культивировании в основном продуцировал тилозин, а также обнаруживалось незначительное количество 4''-изовалерилтилозина (примерно 56 г/мл) [Arisawa A. et al: J Antibiotics 1996, 49(4): 349-354]. Однако до настоящего времени не было сообщений об увеличении выхода 4''-изовалерилтилозина или о более высоком содержании отдельного компонента в смеси за счет переноса генов ist и асуВ в бактерию, продуцирующую тилозин.
В бактерии (Streptomyces ambofaciens), продуцирующей спирамицин, регуляторный ген acyB2 и регуляторный белок Srm28c гомологичны [Fatma Karray et al Microbiology 2007, 153, 4111-4122], степень их идентичности составляет 69%, степень идентичности гена acyB2 и регуляторного белка tylR в бактерии (Streptomyces fradiae), продуцирующей тилозин, составляет 41%, tylR представляет собой белок положительной регуляции биосинтеза в бактериях, продуцирующих тилозин, он регулирует экспрессию модуля поликетидсинтазы (tylGI) в бактериях, продуцирующих тилозин, и играет регуляторную роль в синтезе тилозингликозила, а так же в окислении кольца поликетона. Высокий уровень экспрессии гена tylR в бактериях, продуцирующих тилозин, может увеличивать выход тилозина [George S. et al., Mol. Microbiology 2004, 54 (5): 1326-1334]. Однако способ интеграции гена ist в бактерию, продуцирующую спирамицин, который гомологичен acyB2, посредством плазмидной хромосомно-рекомбинантной технологии гомологичной рекомбинации ДНК, приводит только к продуцированию смеси изовалерилспирамициновс выходом выше, чем 800 мг/мл [Shang Guangdong et al. Chinese Journal of Biotechnology, 1999, 15 (2): 171]. Это показывает, что только перенос гена ist в штамм, содержащий регуляторный ген, схожий с acyB2, не способен значительно увеличить выход и целевого продукта и содержащие в нем какого-либо компонента.
В данной лаборатории было показано, что в результате соединение генов ist с применением генетически модифицированной технологии, что обеспечивает увеличение количества копий гена ist в бактериях, продуцирующих спирамицин, и увеличение дозы гена ist, также возрастает способность бактерии к продуцированию изовалератов; также было показано, что путем замены исходной последовательности промотора гена ist на промотор с высокой активностью, такой как последовательность промотора гена ermE устойчивости к эритромицину, может быть увеличена экспрессия гена ist. Это увеличивает продукцию изовалерилспирамицина генетически модифицированной бактерией на 62% [заявка на патент No. 200910148767.8].
Задача настоящего изобретения состоит в получении бактериальных штаммов, продуцирующих отдельный компонент байтспирамицина - изовалерилсирамин I с высоким содержанием и имеющих высокую продуктивность, посредством экспрессии гена ist, связанного с регуляторным геном acyB2, в полученном ранее штамме, способном к продуцированию только компонента изовалерилспирамицин I, с применением высокоэффективной и стабильной системы экспрессии. Для решения данной задачи необходимо преодолеть затруднения, связанные с ограничениями генетической модификации экзогенными генами бактерияй, продуцирующих антибиотик и имеющих практическую ценность, что позволило бы улучшить показатель конверсии экзогенной ДНК. В то же время необходимо выбрать векторные системы для стабильной экспрессии, так чтобы генетически модифицированные бактерии могли быть использованы для крупномасштабного промышленного производства. Согласно настоящему изобретению предложено применять вектор интеграции для неавтономной репликации в стрептомицетах, такой как вектор, содержащий фермент интегразу фага стрептомицетов, а также сайты прикрепления, и содержащий только репликон Е.coli для облегчения подготовки в Е.coli; у данного вектора отсутствует репликон стрептомицета. При попадании в клетки стрептомицета, интеграция обуславливается сайтами прикрепления (attP) на носителе и специфичными сайтами прикрепления бактериальной клетки-хозяина. В результате, экзогенный ген может стабильно экспрессироваться в условиях крупномасштабного производства. Опубликованных результатов исследований по совместной экспрессии указанного гена изовалерилацилазы ist и регуляторного гена acyB2 в бактериях, продуцирующих изовалерилспирамицин I, с увеличением выхода и содержания изовалерилспирамицина I, а также работ по полупромышленному производству на сегодняшний день в Китае и за его пределами не было обнаружено.
Краткое описание изобретения
1. Согласно настоящему изобретению предложен генетически модифицированный бактериальный штамм, продуцирующий с высоким выходом и высоким содержанием компонент изовалерилспирамицин I, причем указанная модифицированная бактерия представляет собой клональный штамм с геном изовалерилтрансферазы ist, слепленного с регуляторным геном acyB2, совместно экспрессирующимися в бактерии WSJ-2, продуцирующей изовалерилспирамицин I.
2. Согласно настоящему изобретению предложено конструирование генетически модифицированного бактериального штамма, продуцирующего с высоким выходом и высоким содержанием компонент изовалерилспирамицин I, причем в указанном конструировании в качестве матрицы применяют тотальную ДНК термоустойчивого стрептомицета (Streptomyces thermotolarences CGMCC4.1501), праймеры создают в соответствии с последовательностями acyB2, опубликованным в NCBI, связанный генный фрагмент ist-acyB2 получают посредством ПЦР, встраивают подходящие сайты рестрикции; также предложено лигировать фрагменты генов ist и acyB2 соответственно, с помощью вектора интеграции, переносимого в подходящие сайты рестрикции в штамме бактерии, продуцирующем изовалерилспирамицин I, с образованием рекомбинатной плазмиды, несущей ген ist-acyB2. Рекомбинантную плазмиду с геном ist-acyB2 затем встраивают в бактерию WSJ-2, продуцирующую изовалерилспирамицин I, после этого проводят ПЦР, чтобы подтвердить, что ген ist-acyB2 встроился в геном трансформанта с получением штмма WSJ-IA.
3. Согласно настоящему изобретению предложено определение характеристик штамма стрептомицетов WSJ-IA в соответствии со стандартами классификации и идентификации стрептомицетов.
4. Используя бактерию WSJ-2, продуцирующую изовалерилспирамицин I, содержащую моноген ist в качестве контроля, в настоящем изобретении исследовали производительность процесса культивирования штамма WSJ-IA, измеряя титр ферментации штамма WSJ-IA микробиологическими методами и измеряя содержание изовалерилспирамицина I в культуральной жидкости посредством количественного анализа методом ВЭЖХ. Результаты исследования показали, что введение регуляторного гена acyB2 может значительно улучшить содержание и выход компонента изовалерилспирамицин I для данного штама.
Результат настоящего изобретения: положительный эффект изобретения показывает, что введение регуляторного гена acyB2 в штамм бактерии WSJ-2, продуцирующий изовалерилспирамицин I, позволяет увеличить титр ферментации на 414%, а содержание компонента изовалерилспирамицина I на 170,2%. Штамм с высоким уровнем продукции изовалерилспирамицина I, сконструированный согласно настоящему изобретению, был тщательно испытан в 2-тонном ферментере и наработанный изовалерилспирамицин был использован для исследований фармакодинамики. Применение настоящего штамма в промышленном производстве может не только упростить контроль качества и испытания стандарта продукта, но также обеспечить условия для изготовления инъекционной лекарственной формы изовалерилспирамицина.
Описание чертежей
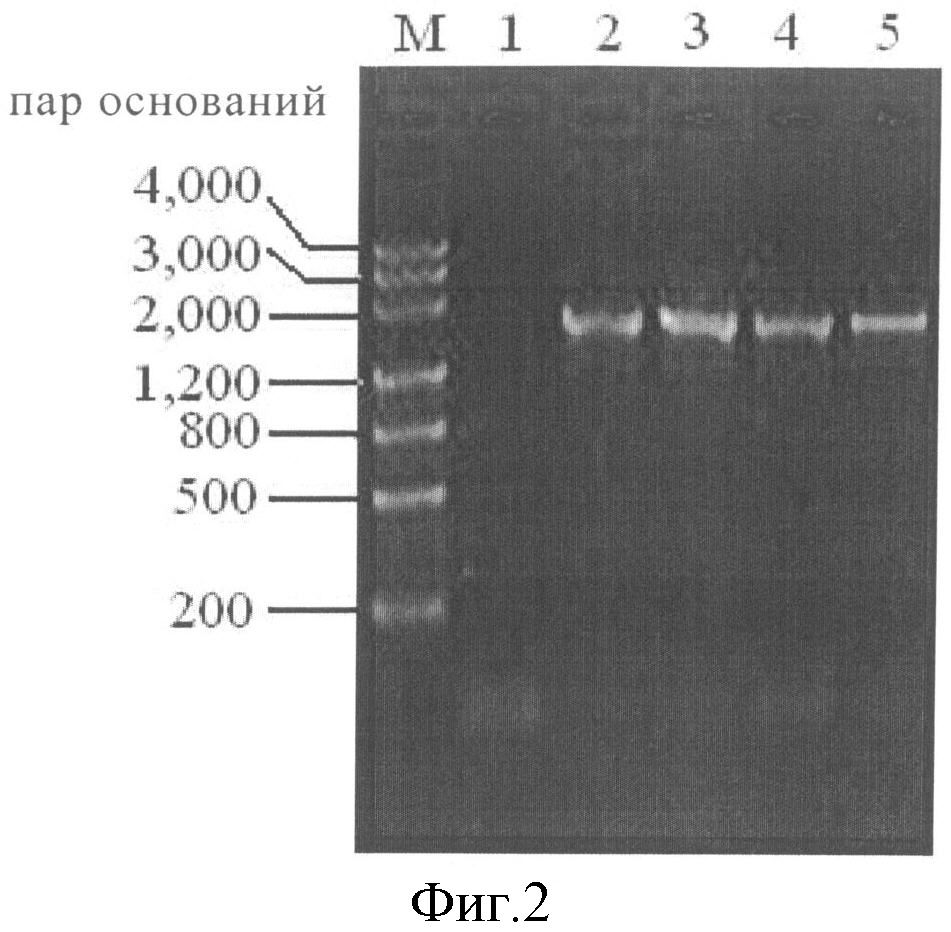
На Фигуре 1 представлена конструкция гена ist-acyB2 в рекомбинантной плазмиде pSET52-ia;
Фигура 2 представляет собой результат ПЦР хромосомы бактериального штамма, продуцирующего изовалерилспирамицин и содержащего ген ist-acyB2; где М: ДНК-маркер MarkerIII; 1 - контрольная бактерия WSJ-2; 2-5: трансформанты WSJ-IA 1-4;
Фигура 3 представляет собой результат ВЭЖХ компонента изовалерилспирамицина I в продуктах культивирования бактериального штамма WSJ-IA, содержащей ген ist-acyB2 в рекомбанантной плазимиде pSET52-ia; где A: контрольная бактерия WSJ-2; B: генетически модифицированная бактерия WSJ-IA, содержащая ген ist и регуляторный ген acyB2; SP-спирамицин; ISO-SP-изовалерилспирамицин I.
Варианты реализации изобретения
Нижеследующие примеры служат только для облегчения понимания настоящего изобретения специалистами в данной области, и никоем образом не накладывают никаких ограничений на настоящее изобретение.
Пример 1: Конструирование рекомбинантной плазмиды pSET52-ia, содержащей спаренный ген ist-acyB2.
Рекомбинантную плазмиду pSW4, ранее сконструированная в лаборатории [Shang Guangdong et al., Chinese Journal of Biotechnology, 1999, 15 (2): 171], расщепили ферментом SmaI-BamHI, в результате чего получили полный ген ist и 1820 п.н. сегмент, содержащий вышележащую часть гена acyB2, применяя в качестве матрицы тотальную ДНК термоустойчивого стрептомицета, предоставленного Главным Китайским Центром Коллекций Микробиологических Культур (China General Microbiological Culture Collection Center) (Streptomyces thermotolarences CGMCC4.1501), разработали праймеры в соответствии с последовательностью гена acyB2, опубликованной в NCBI
p1: CGCTCAGGGACGCAAGACC и Р2: CCGGAATTCGCCCCGTGACCTCACCGTC, температура ПЦР: предварительная денатурация при 94°C в течение 2 мин; 94°C в течение 30 сек, 60°C в течение 30 сек, 72°C в течение 1 мин, 28 циклов; финальная элонгация при 72°C в течение 5 мин, с получением 1013 п.н. сегмента нижележащей части гена acyB2. Фермент BamHI-EcoRI применяли для расщепления продуктов ПЦР с получением 934 п.н. сегментов. Эти сегменты расщепляли с помощью SmaI-BamHI (1820 п.н.) и BamHI-EcoRI (934 п.н.) и встраивали в вектор pBluesript II KS (+) (Е-Merck) по сайтам рестрикции SmaI-EcoRI с получением рекомбинантной плазмиды pBKS-ia, содержащей ген ist и полный ген acyB2. Плазмиду pSET152 лигировали в плазмиду интеграции E.coli/Streptomyces для конъюгативного переноса через сайты рестрикции с использованием фермента XbaI-EcoRI [Bierman М. et al Gene 1992, 116, 43-49, из общедоступного банка генов, http://www.genecool.com] с получением рекомбинантной плазмиды pSET52-ia с геном ist-acyB2 (Экспериментальный способ в соответствии с операционными процедурами TAKARA Biotechnology (Dalian) Co., Ltd.). Процесс конструирования показан на фигуре 1.
Пример 2: Конверсия рекомбинантной плазмиды pSET52-ia бактериального штамма WSJ-2, продуцирующей изовалерилспирамицин I
Штамм бактерии WSJ-2, продуцирующий изовалерилспирамицин I, был сконструирован данной лабораторией [Chunyan Ma et al. Current Microbiology, 2011, 62: 16-20]. Указанный штамм культивировали на скошенной питательной среде [мука из соевого жмыха 2,0%, глюкоза 1,0%, крахмал 3,0%, CaCO3, 0,5%, NaCl, 0,4%, агар 2,0%] при температуре 28°C в течение 7-10 дней, протопласт получали в соответствии с методиками, описанными в литературе [D.A. Hopwood et al. Genetic manipulation of Streptomyces, A Laboratory Manual, Norwich; John Innes Foundation UK, 1985]. В частности, кусочек культуры штамма брали высевали на питательную среду R2YE, содержащей сахарозу, и культивировали при 28°C в течение 2-4 дней, затем такую же среду засевали путем переноса 10% вышеуказанной культуры с добавлением 0,5% глицина и культивировали в течение 20 часов. Мицелий собирали путем центрифугирования, промывали 2-3 раза 10,3% раствором глюкозы, мицелий лизировали при 37°C в течение 15-60 мин в растворе Р, содержащем 2 мг/мл лизоцима, фильтровали через вату с получением протопластов. Для преодоления ограничения модификации бактерии WSJ-2, продуцирующей изовалерилспирамицин I, экзогенным геном, сначала рекомбинантные плазмиды pSET52-ia перенесли в клетки Е.coli 12567 [Mac Neil et al Gene 1992, 111, 61-68, from shared gene bank, www.genecool.com], лишенные способности к метилированию. Из трансформанта экстрагировали плазмидную ДНК, затем в присутствии ПЭГ перенесли в протопласт, нанесенный на твердую питательную среду R2YE. После культивирования при 28°C в течение 24 часов, культуру покрывали раствором с апрамицином с получением конечной концентрации апрамицина в среде 50 мкг/мл, и культивировали в течение 7-10 дней для отбора устойчивых трансформантов. Трансформанты последовательно субклонировали без антибиотика, и затем тестировали после обработки антибиотиком, в получали бактериальный штамм WSJ-IA, продуцирующий изовалерилспирамицин I, со стабильной экспрессией устойчивой рекомбинантной плазмиды pSET52-ia.
Были разработаны праймеры для вышележащей части гена ist и нижележащей части гена acyB2 Р3: GAGGTAGAAGGCGAAGGT и Р4: CGTCAGATGCCAGTTCAC, провели ПЦР с использованием тотальной ДНК контрольной бактерии WSJ-2 и трансформанта (4) WSJ-IA согласно настоящему изобретению в качестве матриц, процедура ПЦР включала: предварительную денатурацию при 94°C в течение 2 мин; 94°C в течение 30 с, 60°C в течение 30 с, 72°C в течение 1 мин, 28 циклов; финальную элонгацию при 72°C в течение 5 мин (фигура 2).
Полученные результаты показывают, что из генома WSJ-IA можно получить продукты ПЦР длиной 1733 п.н., тогда как в контрольном штамме не было получено продуктов ПЦР, это означает, что ген ist-acyB2 был успешно интегрирован в геном целевого штамма. Указанный штамм был отправлен в Главный китайский центр коллекций микробиологических культур, №1, строение 3, Западная дорога Бакен, район Чаоянг, Пекин, и зарегистрирован 25 июня 2010 года. Учетный номер: No. CGMCC 3942, название категории: Streptomyces spiramyceticus.
Пример 3: Идентификация и подтверждение характеристик штамма WSJ-IA
Ссылаясь на "классификацию и идентификацию актиномицетов" [Yan Xunchu ed., 1992] авторы настоящего изобретения идентифицировали и подтвердили характеристики штамма WSJ-IA.
1. Морфология культуры, физиологические и биохимические характеристики штамма WSJ-IA
(1) Культуральные характеристики
Был рассмотрен воздушный мицелий, субстратный мицелий и цвет растворимых пигментов штамма, культивируемого на разных питательных средах, результаты представлены в таблице 1.
(2) Микроскопические характеристики
Фибриллы спор гибкие и извилистые, крючкоподобные и спиральные; споры цилиндрические и овальные.
Глюкозо-аспарагиновая среда: глюкоза 10 г, аспарагин 0,5 г, K2HPO4 0,5 г, агар 15,0 г, дистиллированная вода 1,0 л, pH 7,2-7,4.
Глицерин-аспарагиновая среда: глицерин 10 г, аспарагин 0,5 г, K2HPO4 0,5 г, агар 15,0 г, дистиллированная вода 1,0 л, pH7,2-7,4.
Среда с крахмалом и неорганическими солями: растворимый крахмал 10,0 г, MgSO4·7H2O 1,0 г, NaCl 1,0 г, (NH4)2SO4 2,0 г, CaCO3 2,0 г, K2HPO4 1,0 г, MnCl2·4H2O 10 мг, FeSO4 10 мг, ZnSO4·7H2O 10 мг, агар 15,0 г, дистиллированная вода 1,0 л, pH7,2.
Среда ISP-2: дрожжевой экстракт 4,0 г, солодовый экстракт 10,0 г, глюкоза 4,0 г, агар 20,0 г, дистиллированная вода 1,0 л, pH7,2-7,4.
Среда с овсяной мукой: овсяная мука 20,0 г, слабый соляной раствор 1 мл, агар 15 г, дистиллированная вода 1,0 л, рН7,2, где: слабый соляной раствор: FeSO4·7H2O 0,1 г, MnCl2·4H2O 0,1 г, ZnSO4·7H2O 0,1 г, дистиллированная вода 100 мл.
Среда Гауса №1: растворимый крахмал 20,0 г, KNO3 1,0 г, K2HPO4 0,5 г, MgSO4·7H2O 0,5 г, NaCl 0,5 г, FeSO4·7H2O 0,01 г, агар 15,0 г, дистиллированная вода 1,0 л, pH7,2-7,4.
Среда Санты: KH2PO4 0,5 г, MgSO4·7H2O 0,5 г, лимонная кислота 2,0 г, железо-аммонийный цитрат 0,05 г, глицерин 60 мл, аспарагин 4,0 г, агар 15,0 г, дистиллированная вода 1,0 л, pH7,4.
(3) Физиологические и биохимические характеристики
A. Определение потребления источников углерода штаммом WSJ-IA в выбранной основной питательной среде.
Основная питательная среда: (NH4)2SO4 2,0 г, MgSO4·7H2O 0,2 г, NaH2PO4·H2O 0,5 г, CaCl2·2H2O 0,1 г, K2HPO4 0,5 г, дистиллированная вода 1,0 л. Добавляли 0,1%-0,5% источника углерода для измерения в основной питательной среде. После стерилизации питательную среду засевали бактериальной суспензией, культивировали при 28°C, пересаживали последовательно три раза. Определяли потребление источников углерода штаммом WSJ-IA в соответствии с состоянием роста клеток.
B. Определение потребления малоновой кислоты в основной питательной среде: Основная питательная среда: дрожжевой экстракт 1,0 г, (NH4)2SO4 2,0 г, K2HPO4 0,6 г, KH2PO4 0,4 г, NaCl 2,0 г, малонат натрия 3,0 г, бромтимоловый синий 0,025 г, дистиллированная вода 1,0 л, pH7,0-7,4. После стерилизации питательную среду засевали бактериальной суспензией, культивировали при 28°C в течение 1-2 дней, потребление малоновой кислоты бактериями определяли по изменению цвета питательной среды изменялся с зеленого на синий.
C. Определение потребления винной кислоты в основной питательной среде: Основная питательная среда: пептон 10,0 г, NaCl 5,0 г, тартрат натрия 10,0 г, бромтимоловый синий (0,2%) 12,5 мл, дистиллированная вода 1,0 л, пред употреблением среду стерилизовали. Одновременно готовили насыщенный раствор ацетата свинца. Питательную среду засеивали бактериальной суспензией, культивировали при 28°C в течение 14 дней, Добавляли равновесный раствор ацетата свинца, потребление винной кислоты бактериями определяли по изменению цвета питательной среды изменялся на желто-зеленый с небольшим количеством осадка ацетата свинца.
D. Разжижение желатина: основная питательная среда: пептон 5,0 г, желатин 100-150 г, дистиллированная вода 1,0 л, pH7,2-7,4, стерилизована. После культивирования бактерий в течение 18-24 часов, путем прокола засевали суспензию бактерий в желатиновую питательную среду, в это же время ставили не засеянный контроль. Образцы культивировали при 20°C в инкубаторе в течение 2, 7, 10, 14 и 30 дней, наблюдали рост клеток и разжижение желатина при комнатной температуре ниже 20°C. Если результаты показывали рост бактерий, и что нет углублений на желатиновой поверхности и желатиновый сгусток устойчив, то это означало, что разжижение желатина отсутствует.
E. Реакция молока: Свежее молоко кипятили и помещали в холодильник на ночь. Брали нижний слой обезжиренного молока, добавляли 4 мл 2,5% водного раствора лакмуса (2,5 лакмуса погружают в 100 мл дистиллированной воды на ночь, затем фильтруют) в 100 мл обезжиренного молока, добавляли смесь в пробирки до высоты примерно 4 см. Пробирки стерилизовали и засевали штаммом, культивировали при 28°C в течение 1, 3, 5, 7, 14 и 30 дней. Результаты показывают, что молоко пептонизируется с образованием сгустков.
F. Восстановление нитратов: питательная среда с агаром 1,0 л, KNO3 1,0 г, pH7,0-7,6. Разливали по 4-5 мл указанной среды в пробирки, затем стерилизовали. Реактивы Грисса: а) растворить 0,5 г сульфаниловой кислоты в в 150 мл разбавленной уксусной кислоты (10%); b) растворить 0,1 г g-нафтиламина в 20 мл дистиллированной воды ив 150 мл разбавленной уксусной кислоты (10%). Дифениламиновый реактив: растворить 0,5 г дифениламина в 100 мл концентрированной серной кислоты разбавляли 20 миллилитрами дистиллированной воды. Высевали штамм в нитратную питательную среду, культивировали при 28°C в течение 1, 3, 5 дней, в чистые пробирки добавляли небольшое количество культуры на 1, 3, 5 дни культивирования и добавляли по капле реактивов а) и b) соответственно, цвет раствора изменялся на красный, показывая реакцию восстановления нитратов до нитритов; при добавлении капли дифениламинового реактива посинение не наблюдалось.
G. Тест на тирозиназу: Высевали штамм в жидкую питательную среду Гауса №1, культивировали при 28°C в течение 1, 9, 12 дней соответственно, образцы культуральной жидкости объемом 2 мл центрифугировали и удаляли супернатант, добавляли 2 мл фосфатного буфера (pH5,9) и 1 мл 0,04% раствора тирозина, выдерживали при температуре 37°C в течение 5 мин, покраснение не наблюдалось.
H. Тест на амилазу: Высевали штамм в питательную среду ВРА, содержащую 0,2% растворимого крахмала, агар и культивировали при 28°C в течение 2-5 дней. После появления видимых колоний на чашках с агаром капали на чашку раствор иода (йод 1,0 г, KI 2,0 г, 300 мл дистиллированной воды). Образование прозрачных кругов вокруг колоний без изменения цвета свидетельствует о гидролизе крахмала.
Физиологические и биохимические характеристики штамма WSJ-IA приведены в таблице 2.
2. Анализ характеристик штамма WSJ-IA с точки зрения молекулярной систематики
(1) Последовательность гена 16S рДНК:
16S рДНК представляет собой часть бактериальной рибосомы и является последовательностью ДНК в хромосоме бактерии, отвечающей за кодирование рРНК. В связи с тем, что в генетике эта последовательность является высоко консервативной, данная последовательность широко признанна как одна из характеристик молекулярной таксономии бактерий.
Применяли следующие праймеры рДНК 16S: 5'-AGAGTTTGATCMTGGCTCAG-3', 5'-GGTTACCTTGTTACGACTT-3'.
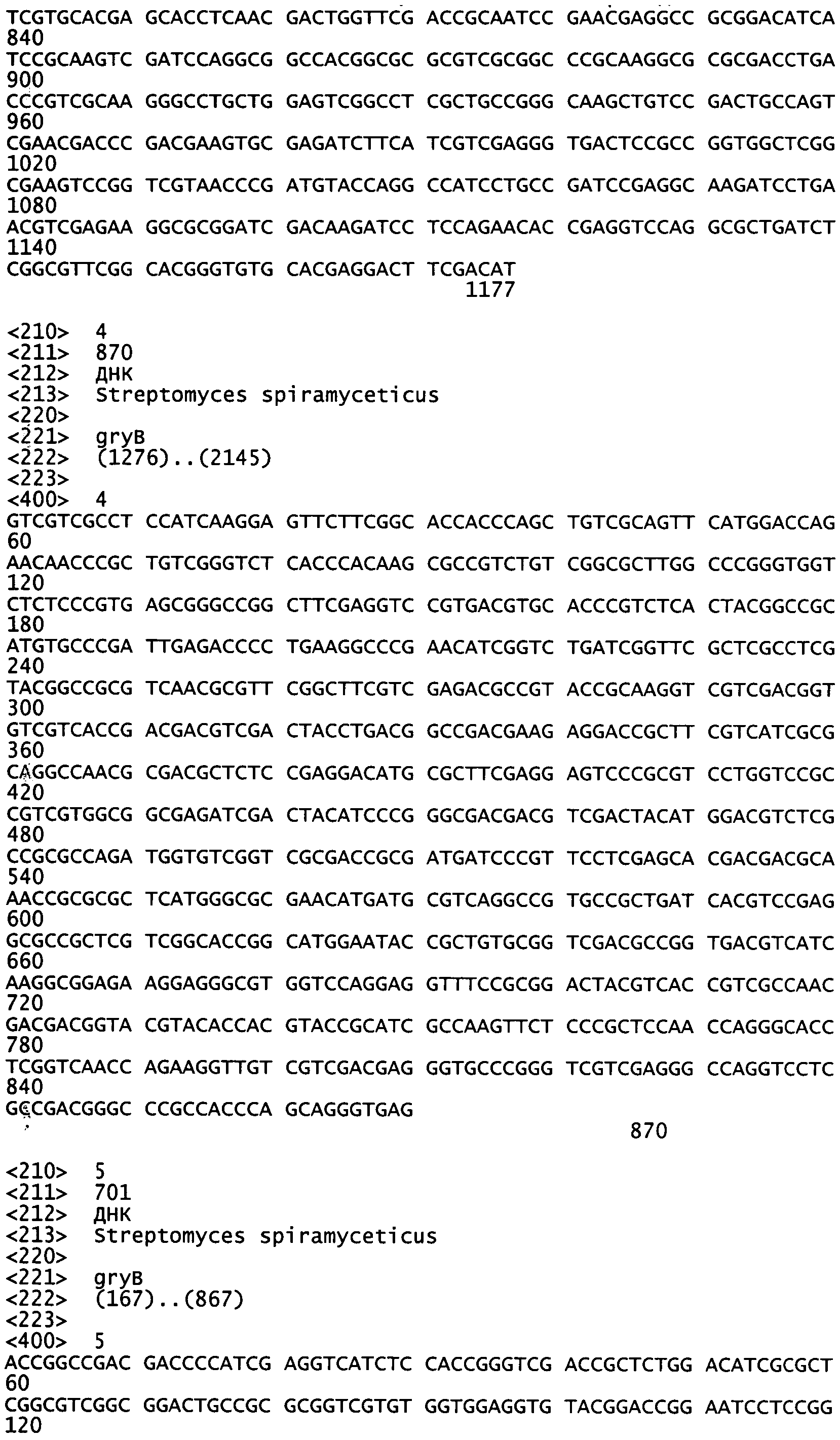
Применяя тотальную ДНК бактериального штамма WSJ-IA в качестве матрицы, проводили ПЦР в соответствии со следующей процедурой: предварительная денатурация при 96°C в течение 1 мин; в каждом из 25 циклов: денатурация при 96°C в течение 30 с, отжиг при 50°C в течение 30 с, элонгация при 72°C в течение 1,5 мин; затем, финальная элонгация при 72°C в течение 10 мин с получением 1393 п.н. последовательности, смотри таблицу 1.
Далее согласно настоящему изобретению определили последовательности следующих пяти конститутивных генов, широко используемых в молекулярной таксономии Streptomyces, а именно гены atpD gyrB, rpoB, recA и trpB в штамме WSJ-I. Они представляют однокопийные гены, кодирующие белки. Гены имеют устойчивую структуру и не содержат пробелов и стекинга. Следовательно, результаты секвенирования можно напрямую использовать для осуществления межвидового сравнения штамма как по уровню нуклеотидов, так и по уровню аминокислот с последующим определением таксономической принадлежности штамма WSJ-IA.
(2) Конститутивные (housekeeping) гены
A. Последовательность гена atpD
Ген atpD представляет собой субъединицу АТФ-синтетазы. Ген обладает высокой устойчивостью и широким распространением среди видов микроорганизмов, поэтому он подходит в качестве молекулярного маркера для генеративной категоризации. Для целей настоящего изобретения применяли следующие праймеры
5'-GTCGGCGACTTCACCAAGGGCAAGGTGTTCAACACC-3'
5'-GTGAACTGCTTGGCGACGTGGGTGTTCTGGGACAGGAA-3'
Применяя тотальную ДНК бактериального штамма WSJ-IA в качестве матрицы, проводили ПЦР согласно следующей процедуре: предварительная денатурация при 96°C в течение 1 мин; в каждом из 28 циклов: денатурация при 96°C в течение 30 с, отжиг при 63°C в течение 30 с, элонгация при 72°C в течение 1,0 мин; затем, финальная элонгация при 72°C в течение 10 мин с получением 680 п.н. последовательности, смотри таблицу 2.
B. Последовательность гена gyrB
Ген gyrB представляет собой субъединицу тетрамера ДНК-гиразы, ДНК-гираза принадлежит к ДНК-топоизомеразам II прокариот. Она регулирует топологию ДНК посредством разрезания и сшивания ДНК, она имеет некоторую связь с устойчивостью некоторых штаммов бактерий, продуцирующих антибиотики, и имеет высокую степень устойчивости и универсальности среди видов микроорганизмов, вследствие этого подходит в качестве молекулярного маркера для филогенетической классификации. Поэтому последовательность этого гена широко признанна как одна из характеристик молекулярной таксономии бактерий.
Для целей настоящего изобретения применяли следующие праймеры:
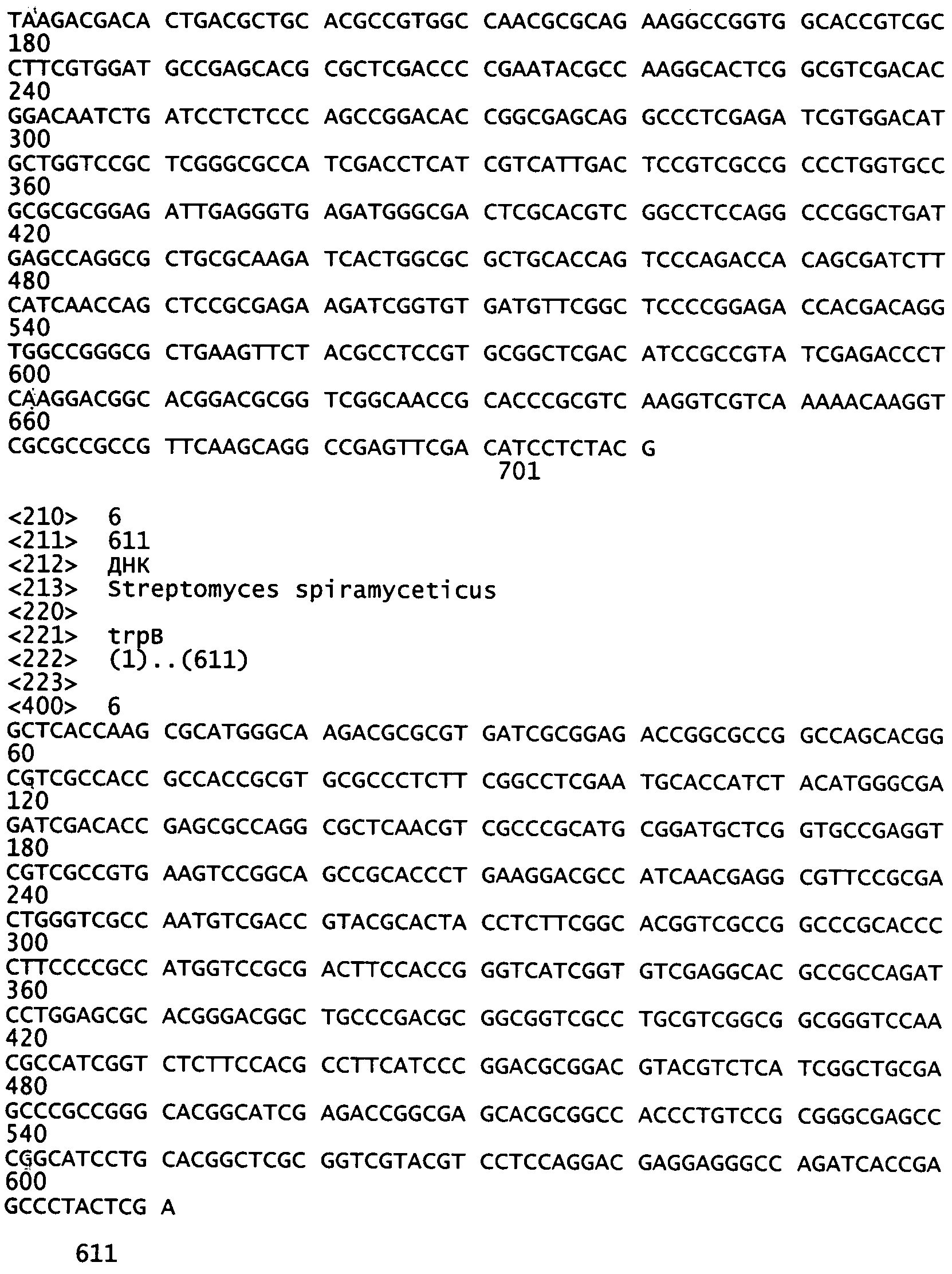
Применяя тотальную ДНК бактериального штамма WSJ-IA в качестве матрицы, проводили ПЦР в соответствии со следующей процедурой: преварительная денатурация при 96°C в течение 1 мин; в каждом из 28 циклов: денатурация при 96°C в течение 30 с, отжиг при 65°C в течение 30 с, элонгация при 72°C в течение 1,5 мин; затем, финальная элонгация при 72°C в течение 10 мин с получением 1177 п.н. последовательности, смотри таблицу 3.
C. Последовательность гена rpoB
Ген rpoB представляет собой b-субъединицу РНК-полимеразы, этот ген широко распространен в Streptomyces.
Для целей настоящего изобретения применяли следующие праймеры:
5'-GAGCGCATGACCACCCAGGACGTCGAGGC-3'
5'-CCTCGTAGTTGTGACCCTCCCACGGCATGA-3'
Применяя тотальную ДНК бактериального штамма WSJ-IA в качестве матрицы, проводили ПЦР в соответствии со следующей процедурой: преварительная денатурация при 96°C в течение 1 мин; в каждом из 28 циклов: денатурация при 96°C в течение 30 с, отжиг при 65°C в течение 30 с, элонгация при 72°C в течение 1,3 мин; затем, финальная элонгация при 72°C в течение 10 мин с получением 870 п.н. последовательности, смотри таблицу 4.
D. Последовательность гена recA
Ген recA представляет собой рекомбиназу, она играет важную роль в процессах гомологичной рекомбинации ДНК и репарации поврежденной ДНК. Присутствие гена recA является очень важным фактором в обеспечении стабильности геномной ДНК штамма, поэтому последовательность этого гена широко признана как одна из характеристик молекулярной таксономии бактерий.
Для целей настоящего изобретения применяли следующие праймеры:
5'-CCGCRCTCGCACAGATTGAACGSCAATTC-3'
5'-GCSAGGTCGGGGTTGTCCTTSAGGAAGTTGCG-3'
Применяя тотальную ДНК бактериального штамма WSJ-IA в качестве матрицы; проводили ПЦР в соответствии со следующей процедурой: преварительная денатурация при 96°C в течение 1 мин; в каждом из 28 циклов: денатурация при 96°C в течение 30 с, отжиг при 60°C в течение 30 с, элонгация при 72°C в течение 1,0 мин; затем, финальная элонгация при 72°C в течение 10 мин с получением 701 п.н. последовательности, смотри таблицу 5.
Е. Последовательность гена trpB
Ген trpB кодирует триптофансинтетазу, которая участвует в первичном метаболизме Streptomyces, этот ген рассматривается как штамм-специфичный, последовательность этого гена широко признана как одна из характеристик молекулярной таксономии бактерий.
Для целей настоящего изобретения применяли следующие праймеры:
5'-GCGCGAGGACCTGAACCACACCGGCTCACACAAGATCAACA-3'
5'-TCGATGGCCGGGATGATGCCCTCGGTGCGCGACAGCAGGC-3'
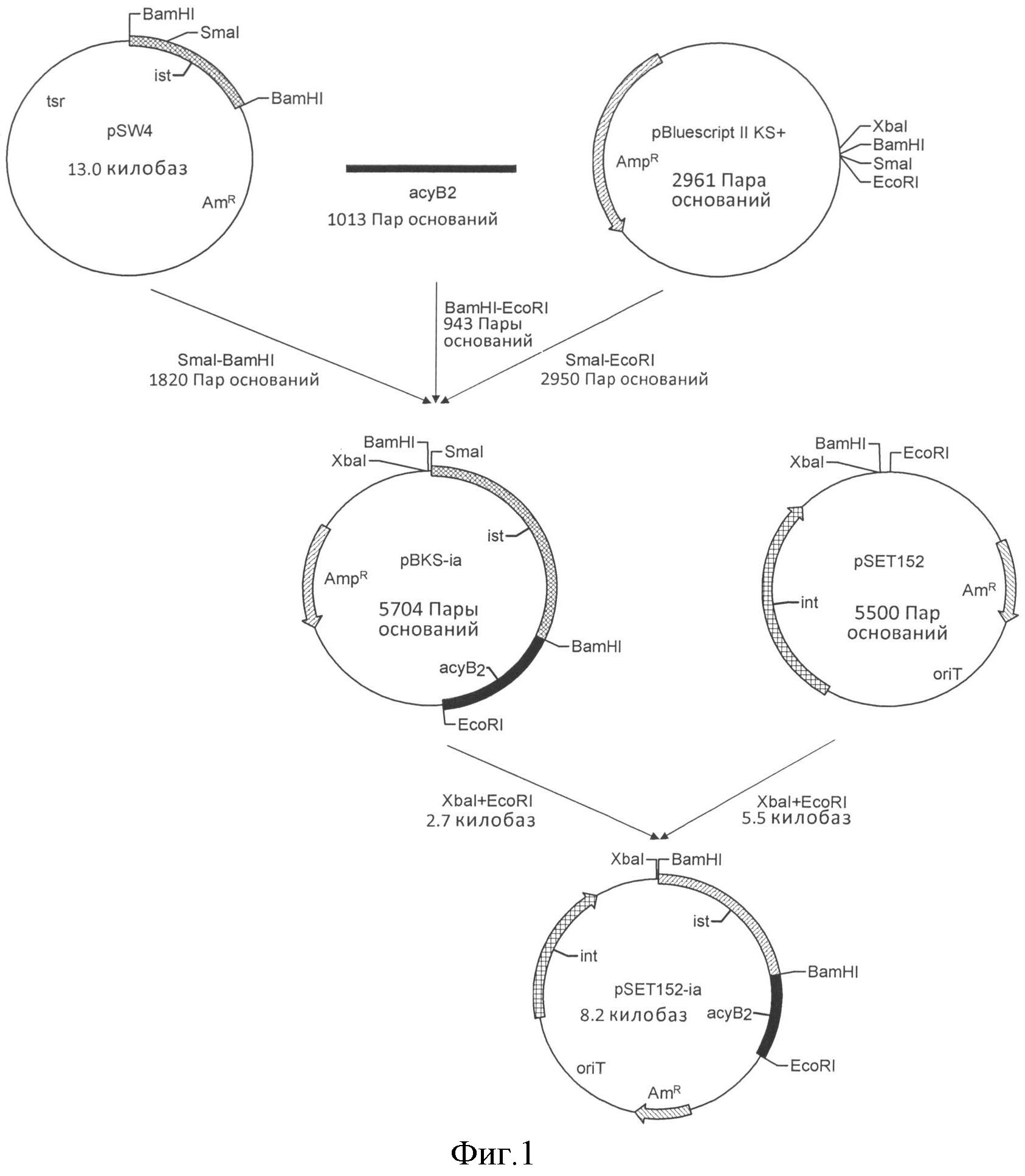
Применяя тотальную ДНК бактериального штамма WSJ-IA в качестве матрицы, проводили ПЦР в соответствии со следующей процедурой: преварительная денатурация при 96°C в течение 1 мин; в каждом из 28 циклов: денатурация при 96°C в течение 30 с, отжиг при 66°C в течение 30 с, элонгация при 72°C в течение 1,0 мин; затем, финальная элонгация при 72°C в течение 10 мин с получением 611 п.н. последовательности, смотри таблицу 6.
Результаты, приведенные в таблицах 3 и 4, показывают, что нет полного соответствия между 16S рДНК и последовательностями пяти конститутивных генов бактериального штамма WSJ-IA и последовательностями генов известных штаммов, поэтому можно предположить, что WSJ-IA возможно является новым видом Streptomyces.
Пример 3: Определение титра ферментации в условиях полупромышленного культивирования бактериального штамма WSJ-IA
Штамм WSJ-IA выращивали на скошенной питательной среде, описанной в примере 2, при температуре 28°C в течение 7-10 дней, часть указанной культуры брали для засева посевной среды (мука из соевого жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, CaCO3 0,5%, рыбный пептон 0,3%, KH2PO4 0,05%) и культивировали при температуре 28°C в течение 48 часов на этапе A, затем пересеяли на этапе В и культивировали при температуре 28°C в течение 24 часов, затем пересеяли в инокулятор объемом 50 л и культивировали в течение 36 часов, и затем пересеяли в 2 т бродильный чан для культивирования в посевной среде (культуральная среда: глюкоза 0,5%, крахмал 6,0%, дрожжевой экстракт 0,5%, рыбная мука 2,0%, NH4NO3 0,6%, NaCl 1,0%, CaCO3 0,5%, KH2PO4 0,05%, MgSO4 0,1%) и культивировали при температуре 28°C в течение 96 часов. Отбирали пробы супернатананта культуральной жидкости, разводили фосфатным буфером pH7,8~8,0, содержащим 3% NaCl. Bacillus [CGMCC(B)63501] использовали как тестовую бактерию для определения ферментационного тира, применяя метод калибровочных кривых в соответствии с Китайской Фармакопеей 2010 вып.II, Приложение XI, на следующей питательной среде: полипетон 0,6%, порошок мясного экстракта 0,15%, паста дрожжевого экстракта 0,6%, глюкоза 0,2%, агар 1,5-2,0%), с ацетилспирамицином в качестве контроля. Эксперимент повторяли три раза с получением среднего значения ферментационного титра 1160 мкг/мл для штамма WSJ-IA, для сравнения, культивирование штамма WSJ-2, содержащего одиночный ген ist, давало возрастание среднего титра до 280 мкг/мл (таблица 5).
Пример 4: Определение выхода продукта компонента изовалерилспирамицина I, продуцируемого штаммом WSJ-IA.
Отбирали пробы культуральной жидкости, полученной в примере 3, доводили рН жидкости до 8,5, экстрагировали равным объемом этилацетата, этилацетатный экстракт концентрировали досуха, растворяли в метаноле. Раствор разделяли с применением колонки Kromasil С18 (4,5 мм × 150 мм, 5 мкм); подвижная фаза: метанол: раствор дигидрофосфата натрия (53:47 объемное соотношение); длина волны измерения: 231 нм; скорость потока: 1,0 мл/мин; температура колонки: 25°C; объем пробы: 10-20 мкл. Содержание компонента изовалерилспирамицина I в жидкой среде рассчитывали по данным анализа методом ВЭЖХ (Фигура 3). Результаты трех экспериментов показали, что при культивировании штамма WSJ-IA и штамма WSJ-2, содержащего моноген ist, среднее общее содержание компонента изовалерилспирамицина I было 12,061%) и 7,088% соответственно. После культивирования в соответствии с примером 3, ферментационные титры двух штаммов измерили с применением микробиологического анализа, а продукты исследовали методом ВЭЖХ (фигура 3). В соответствии с полученными площадями пиков при ВЭЖХ анализе, сравнивали содержание компонента изовалерилспирамицина I продуцированного двумя штаммами, рассчитывали отношение изовалерилспирамицина I к спирамицину, продуцированного двумя штаммами соответственно. Результаты показали, что введение гена ist-acyB2 увеличило титр ферментации штамма WSJ-IA на 414%, содержание продуцированного изовалерилспирамицина I увеличилось на 170,2%, в тоже время содержание спиромицина соответственно уменьшилось. Это увеличило отношение между содержанием изовалерилспирамицина I и содержанием спирамицина на 218% (таблица 5).
Согласно настоящему изобретению предложен штамм, содержащий ген ist-acyB2, способный к продуцированию изовалерилспирамицина I при определенных условиях культивирования. Настоящий штамм увеличивает содержание изовалерилспирамицина I на коэффициент равный 1,7, и увеличивает титр ферментации на коэффициент равный 4,14 по сравнению со штаммом, содержащим только ген ist.
Реферат
Настоящее изобретение относится к биотехнологии и представляет собой генетически модифицированный штамм бактерии Streptomyces thermotolarences WSJ-IA, продуцирующий изовалерилспирамицин I. Настоящее изобретение также раскрывает способ получения указанного штамма. Способ включает этапы конструирования рекомбинантной плазмиды, содержащей двойной ген ist-acyB2, и трансформации указанной плазмиды в штамм WSJ-2, продуцирующий изовалерилспирамицин I. Изобретение также раскрывает способ получения изовалерилспирамицина I культивированием штамма Streptomyces thermotolarences WSJ-IA в питательной среде. Настоящее изобретение позволяет повысить выход получаемого изовалерилспирамицина I. 3 н.п. ф-лы, 3 ил., 5 табл., 4 пр.
Формула
A) рекомбинантную плазмиду pSW4 расщепляют с помощью фермента SmaI-BamHI, в результате чего получают полный ген ist и 1820 п.н. сегмент, содержащий вышележащую часть гена асуВ2;
B) применяя тотальную ДНК термоустойчивых Streptomyces thermotolarences CGMCC4.1501 в качестве матрицы, разрабатывают следующие праймеры:
p1: CGCTCAGGGACGCAAGACC
Р2: CCGGAATTCGCCCCGTGACCTCACCGTC,
температура ПЦР: предварительная денатурация при 94°C в течение 2 мин; 94°C в течение 30 сек, 60°C в течение 30 сек, 72°C в течение 1 мин, 28 циклов; финальная элонгация при 72°С в течение 5 мин, с получением 1013 п.н. сегмента нижележащей части гена асуВ2;
C) фермент BamHI-EcoRI применяют для расщепления продуктов ПЦР с получением 934 п.н. сегментов, указанные сегменты расщепляют с помощью SmaI-BamHI и BamHI-EcoRI и встраивают в вектор pBluesript II KS(+) по сайтам рестрикции SmaI-EcoRI с получением рекомбинантной плазмиды pBKS-ia, содержащей ген ist и полный ген асуВ2;
D) фермент XbaI-EcoRI применяют для расщепления плазмиды pSET152 и pBKS-ia, с получением рекомбинантной плазмиды pSET52-ia с геном ist-acyB2;
E) рекомбинантные плазмиды pSET52-ia переносят в клетки Е. coli 12567, лишенные способности к метилированию; из трансформанта экстрагируют плазмидную ДНК, затем в присутствии ПЭГ переносят в Streptomyces thermotolarences WSJ-2A на твердой питательной среде R2YE; после культивирования при 28°C в течение 24 часов культуру покрывают раствором с апрамицином с получением конечной концентрации апрамицина в среде 50 мкг/мл и культивируют в течение 7-10 дней для отбора устойчивых трансформантов; трансформанты последовательно субклонируют без антибиотика и затем тестируют после обработки антибиотиком с получением бактериального штамма WSJ-IA, продуцирующего изовалерилспирамицин I, со стабильной экспрессией устойчивой рекомбинантной плазмиды pSET52-ia.

Комментарии