Стабилизированная стрептокиназа,обладающая тромболитической активностью - SU822551A1
Код документа: SU822551A1
Описание
(Л
с









Реферат
Стабилизированная стрептокинаэаобщей формулы-"^^^0..,ан но'НгСcHa->&iH-cii;)U^'CHjOH -сн^рн /^^CHjOHгде - Щ - Стр - нативная стрепто~ киназа, обладающая тромболитической активностью. , .

Формула
00 ю
O1
СП
Изобретение относится к химикофармацевтической промышленности, а
именно к синтезу биологически-активных химических соединений, проявляющих
т.ромболитическую активность. Описываемые соединения ьредставляют собой
полисахаридные производные стрептокиназы .
Стрептокиназу достаточно широко
применяют в медицине в качестве тромболитического препарата при терапии
таких заболеваний, как инфаркта миокарда , тромбозы, тромбоэмболии легочных
артерий. Препарат вводят внутривенно в течение нескольких дней. Однако терапия стрептокиназой осложняется
двумя обстоятельствами.Во-первых , как и все ферментные препараты, стрептокиназа быстро инактивируется
физиологических условиях под действием рН, тe шepaтypы, эндогенных протеаз и природных ингибиторов и
быстро выводится из кровотока, что приводит к необходимости введения
больших доз фермента в течение продолжительного времени. Во-вторых,
стрептокиназа представляет собой чужеродный белок, который вызывает
сильную иммунологическую реакцию организма . Кроме того, частое или повторное
применение стрептокиназы может вызывать нежелательные реакции вплоть до анафилактического шока даже
при первом ее применении.
В настоящее время известно, что во
многих случаях связывание ферментов с растворимыми биосовместимыми полимерами
позволяет получать препараты, обладающие по сравнению с нативными ферментами значительно повышенной
стабильностью по отношению к различным инактивирующим воздействиям,
замедленным выведением из организма и пониженной антигенностью. Наиболее
удобными и хорошо зарекомендовавшими себя с точки зрения биосовместимостн
носителями ферментов являются полисахариды , например декстраны.
Известны полисахаридные производные стрептокиназы, в частности иммобилизованная
стрептокиназа, представляющая собой Стрептокиназу, связанную с активированным бромцианом
растворимым декстраном. Эти соединения представляют, преимущественно,
теоретический интерес, поскольку способ их получения включает активацию
декстр.ана высокотоксичным соединением - бромцианом.
Биосовместимость такого носителя проблематична, поскольку содержащиеся в нем активные группы циклических
иминокарбонатов отличаются высокой
реакционноспособностью и могут вступать
в непредсказуемые реакции с другими белками организма.
Цель изобретения состоит в получении нового препарата, обладающего
ценными свойствами, обуславливающими его применение в медицине, в расширении
ассортимента иммобилизованных и стабилизированных ферментов медицинского назначения и в получении
полисахаридных производных стрептокиназы , обладающих тромболитической
активностью, повышенной стабильностью, пониженной антигенностью и увеличенным
временем циркуляции в кровотоке с использованием носителя, отвечающего медицинским требованиям,
полученного без использования токсичных реагентов и не содержащего
после иммобилизации свободных реакционноспособных групп.
Цель изобретения достигается свойствами стабилизированной стрептокиназы , получаемой связыванием
стрептокиназы при iS-SO C и рН 6,010 ,5 с предварительно окисленным
водораствори я 1М декстраном общей формулы (, где х - 100-1000,
и восстановлением полученного продукта боргидридом натрия.
Схематическое строение целевого продукта может быть представлено ч виде
где NH - Стр - нативная стрептокиназа . Мол.м. полученного продукта 100000 ± 300000, содержание белка
10-20%, содержание декстрана 60-80%. Полисахаридное производное стрептокиназы
обладает тромболитической активностью, повышенной стабильностью , пониженной антигенностью,
увеличенным временем циркуляции в организме.
. -.г. ....
Продукт полностью сохраняет биологическую активность, согласно
данным испытаний in vivo и in vitro, и обладает целым рядом преимуществ зировали однократно внутривенно пре паратом нативной стрептокиназы в до зе 0,77 мг/белка/кг. Через три неде
ли этим животным вводили модифицированньш фермент в трех предполагае мых терапевтических дозах (см.табл,
Как видно из представленных данных предварительная иммунизация нативным ферментом не изменяла иммунный
ответ к модифицированному ферменту . Титры антител в обеих группа практически не отличаются.Более
того, превышение титров антител над титрами антител нормальных животных практически отсутствует. Аналогичны
результаты, показывающие, что предварительная иммунизация не изменяет а главное не усиливает иммунньй от
.вет к модифицированной форме были получены в опытах на мышах. Важно отметить, что у кроликов или мьш1ей
мы не наблюдали минимальных признаков анафилактической реакции. В экспериментах на морских свинках
влияние предшествующей иммуниза ции оценивали методом активной системной анафилаксии. Установлено, чт
введение разрешающих доз препарата модифицированной стрептокиназы животным , получавшим ранее препарат
нативной стрептокиназы, не приводило к заметной шоковой реакции. Установлено, что предварительное
введение нативного фермента у экспе риментальньпс животных не усиливает
иммунной ответ к модифицированному ферменту. . . Отсутствие вьфаженного гуморального
ответа к модифицированному ферменту, полное отсутствие или сла бое проявление анафилактогенной и
кожносенсибилизируннцей активности в испытанных нами дозировках свидетельствуют , что аллергизирующий
потенциал препарата не высок. Антигенные свойства стабилизированной стрептокиназы изучали в опытах
по истощению плазмы. Для этого в пробирки вносили такое количество препарата нативной стрептокиназы,
которое полностью связывает антистрептокиназные антитела и поэтому лизиса искусственного тромба не
происходит. Далее добавляются различные количества модифицированного фермента и тромбин. Оказалось,что
для получения лизиса сгустка необхо димо такое же (а не меньшее) количе ство модифицированного препатата, как в пробах, где нативный фермент предварительно не добавлялся. Если
же вначале добавляется модифицированный Фермент, то для проявления каталитической активности необходимо
добавить такое же количество нативного фермента, как в опытах без истощения. Таким образом, полученные
результаты показывают, что модифицированный фермент не взаимодействует с антителами человека.
Исследование влияния плазмы крови .кроликов на активность нативного и
модифицированного фермента также не выявило вьфаженного взаимодействия
антител с энзимами. Образцы плазмы . в этих опытах получали от животных
иммунизированных различными дозами препаратов нативной и модифицированной
стрептокиназы. Результаты определений представлены в табл. 8. Изложенные выше результаты испытаний
показывают, что: 1. Лечение экспериментального тромбоза методом однократной внутривенноструйной
инфузии эффективно при минимальной дозе препарата 50000 ед/кг веса. Лизис тромба начинается в первые
полтора часа после инфузии и спустя сутки проходимость кровеносных сосудов оказьшается полностью
восстановленной. 2. Нормализация изменений системы свертывания крови, вызванных введением
иммобилизованной стрептокиназы, наступает у подопытных животных на
вторые-третьи сутки, что свидетельствует о продлении фибринолитической
активности препарата в 2-3 раза по сравнению с нативной стрептокиназой.
Пролонгахщя эффекта фибринолиза у стабилизированной стрептокиназы увеличивается
с увеличением дозы препа- , рата. 3.Стабилизированная стрептокиназа
обладает малой токсичностью. Внутривенное введение препарата в дозах,
превышакнцих максимальные терапевтические в 50-100 раз хорошо переносятся животными.
4.Аллергизирующий потенциал стабилизированной стрептокиназы не высок,
поскольку при испытании на морских свинках анафилактогенная и кожносенсибилизирующая
активность практически отсутствовала.
5. Антигенная активность модифицированного препарата снижена. В опытах по истощению плазмы модифицированная
стрептокиназа не взаимодействовала с антителами человека.
Создание иммобилизованньпс препаратов-фибринолитиков , обладанмдих пролонгированным
действием, позволит заменить многодневный внутривенно-капельный способ введения препарата
одноразовым внутривенно-струйным, сократить курсовую дозу и тем самым снизить число осложнений и повысить
а.Исследование на модели тр Контроль Опыт 1
Стрептокиназа нативная3 Опыт II
Стрептокиназа стабилизированная из примеров 1 и 2 10
б.Исследования, на модели тр Контроль Опыт 1
Стрептокиназа яативная1 Опыт II
Стрептокиназа стабилизированная из . примеров 1 и 2 2
в.Исследование на модели тр Контроль Опыт 1
Стрептокиназа нативная Опыт II
Стрептокиназа стабилизированная из примеров 1 и 2
эффективность тромболитической терапии .
4,
Стабилизированная стрептокиназа
5может применяться для лечения острых
тромбозмболий и тромбозов легочных артерий, мозговых сосудов, периферических артерий (до того, как
развилась гангрена), при тромбофлебите, тромбозе периферических вен, остром инфаркте миокардаj тромбозе
центральной вены или артерии сетчат ки глаз.
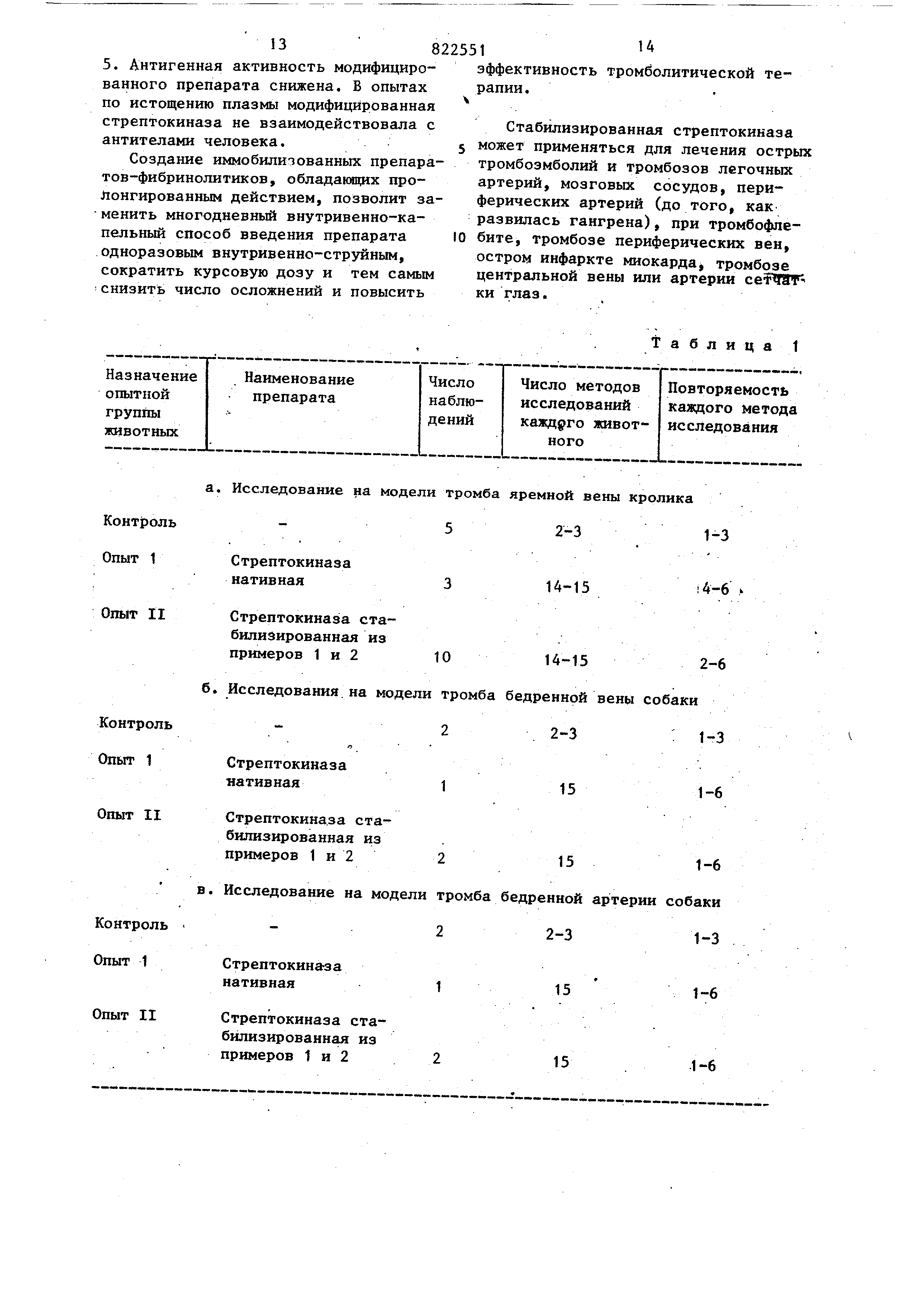
Таблица 1
5 2 2 ой вены кролика
2-31-3 4-15 :4-6 i 4-152-6 нной вены собаки
2-3 -1-3 151-6 151-6 нной артерии собаки
2-31-3 по сравнению с нативной стрептокина
зой. Получаемый целевой продукт представляет собой стрептокиназу, связанную
с окисленным декстраном. Сте пень окисления декстрана 5-35%. Свя зывание фермента с окисленным декст
раном идет по механизму образования Шиффовых оснований между альдегидны
ми группами декстрана и аминогруппами фермента. Реакция связывания протекает в растворе 30-120 мин.
После связывания с ферментом непрореагировавшие альдегидные группы но сителя легко переводятся в инертные
оксигруппы под действием мягкого восстановителя - боргидрида натрия. Целевой продукт вьзделяют лиофильной
сушкой после восстановления боргидри ;дом натрия и после диализа против воды в течение 18-40 ч при для
дополнительной очистки препарата. Пример 1. 2г декстрана полиглюкина растворяют в 40 мл дистиллированной
воды и добавляют 1,226 периодата калия. Окисление проводят при температуре 22 i 3 С и постоянном
перемешивании в течение 1 ч. Полученный раствор окисленного полиглюкина пропускают через хромато
графическую колонку, заполненную 10 анионита АРА в ацетатной форме, отбрасьшают
объем элюата, равный мертвому объему колонки - 6 мл, и собирают оставшиеся 40 мл в мерный цилиндр
. : 40 мл .очищенного и окисленного полиглюкина смешивают с 10 мл 0,5М
содового буферного раствора рН 9,25 (до концентрации ДАПГ 40 мг/мл) и добавляют при легком перемешивании
10QO мг стрептокиназы фирмы Берингверк , Реакционную смесь в объеме 50 мл
выдерживают при рН 9,9 при комнатной температуре 1 ч, затем ее охлаждают
до 4 Си добавляют мелкими порциями 450 мг боргидрида натрия. Реакция восстановления проходит в течение
1 ч при рН 9,25. Раствор стабилизированной стрептокиназы разбавляют апирогенной во
дои до. 400 МП и заливают в ячейку установки для диафильтрации ТСГ-10
фирмы АМИКОН . Собирают диафильтрат (1000 мл) и отбрасывают, а раствор в ячейке концентрируют до 25 мл.,
Концентрированный раствор стабилизированной стрептокиназы пропускают
через стерильный фильтр Миллипор ;(диаметр пор 0,45 мк) и высушивают ЛИОФИЛЬНО.
Выход препарата составляет 1500мг с удельной фибринолитической активностью 4300 ед/мг препарата и общей
активностью 6500000 ФЕ, что составляет 50% от исходного. Полученный продукт имеет мол.м.
100000. Представляет собой пористую массу белого цвета, без запаха, без
вкуса. Гигроскопичен, легко растворим в воде, в изотоническом 0,9% растворе натрияхлорида, практически
не растворим в 95% спирте, эфире и хлороформе. Пример2. 1г декстрана-по
лиглюкина растворяют в 20 мл дистиллированной воды и добавляют 613 Мг.
периодата калия. Окисление проводят при температуре 22 t 2 С и постоянном перемешивании в течение 1ч.
Полученный раствор окисленного полиглюкина со степенью окисления .
22 + 2% пропускают через стеклянную колонку, заполненную 5 г анионита
АРА в ацетатной форме для полного отделения ДАПГ от анионов НСОО
10, Юз . На выходе из колонки отбрасывают объем элюата, равный мертвому объему колонки -4 мл, а 20 кл
содержащие ДАПГ в концентрации 50 мг/мл, собирают в мерный цилиндр.
20 мл очищенного полиглюкина смешивают с 5 мл 0,5М содового буферного
раствора рН 9,35 (до концентрации ДАПГ.40 мг/мл) и добавляют при легком
перемешивании 500 мг стрептокиназы фирмы Берингверк. Реакционную смесь в объеме 25 мл
вьщерживают при рН 9,1 пр1И температуре 20 ± 2 С 40 мин, охлаждают на
бане со льдом до 4°С и добавляют небольшими порциями 224 мг боргидрида
натрия. Реакция восстановления проходит за 30 мин. Затем раствор стабилизированной
стрептокиназы ставят на диализ против дистиллированной воды на 18 ч при 4-7 С и высушивают лиофильно.
Выход препарата составляет 1100мг с удельной активностью 1700 ед/мг препарата и общей активностью
1875000 ФЕ, что составляет 30% от исходного.
Полученный продукт имеет мол.м
100000. Представляет собой пористую
ассу белого цвета, без запаха, без куса. Гигроскопичен, легко раствоим в воде, в изотоническом 0,9%-ном
астворе натрия хлорида, практически е растворим в 95%-ном спирте, эфие и хлороформе.
Полученный продукт ковалентного
вязывания стрептокиназы с окисленными
декстранами удовлетворяет как клиническим, так и технологическим
требованиям получения лекарственных препаратов: матрица не содержит
токсичных групп, избыточные реакционноспособные альдегидные группы во избежание их связывания с белками
, содержащимися в организме, вое- . становлены до гидрокс.ильных, при
реакции не используются высокотоксичные вещества.
Диальдегиддекстран не оказывает, нежелательного побочного воздействия на организм, поскольку токсичность
ферментов иммобилизованных на нем не вьппе, а подчас ниже, чем у нативных
, а иммуногенность и антигенность ферментов в результате их модификации
окисленными декстранами существенно снижается.
Биологическая активность полученных препаратов была проверена на
экспериментальных животных. Исследование проведено на кроликах-самцах породы шиншилла, весом 2,2-2,5 кг
и на беспородных собаках весом 1213 кг.
Исходя из предполагаемого пролонгированного фибринолитического эффекта действия стабилизированной
стрептокиназы, изучаемую дозу препа7 рата - 30000 - 240000 ед/кг веса растворяли
в физиологическом растворе для кроликов в 20-30 мл, а для собак в 50- 100 мл и вводили шприцом
на протяжении 20 мин внутривенно струйно, а не по инструкции к стрептазе (внутривенно-капельным методом
на протяжении 16-18 ч).
Введение испытуемого (и контрольного
) препарата начинали через 1 ч после образования тромба. Препарат вводили кроликам в вену на стороне
образования тромба в яремной вене, собаке - в вену задней лапы.
Анализ крови проводили перед началом эксперимента, через 2,3 ч 1, 2, 3 суток после образования тромба
. Для каждой серии анализов крови животного брали 10-12 мл крови из
неповрежденных вен. Кровопотерю восполняли введением равного коли5 честна стерильного физиологического
раствора; Динамику образования и лизиса тромба наблюдали визуально и
мунуально на протяжении первых шести часов опыта, через одни, двое и
0 трое суток. Ангиографию и флюометрию проводили до начала опыта, через
одни, двое и трое суток. По завершении эксперимента животных забивали, после чего для гистологического
исследования брали кусочки кровеносных сосудов в местах фиксации тромбов.
Изучение тромболитической активности стабилизированной стрептокиназы проводили на моделях тромбов
0 бедренных артерий и вен собак и яремной вены кролика (см.табл. 1).
Результаты, полученные на собаках , подтвердили закономерности тром5
болитической терапии, установленные на кроликах.
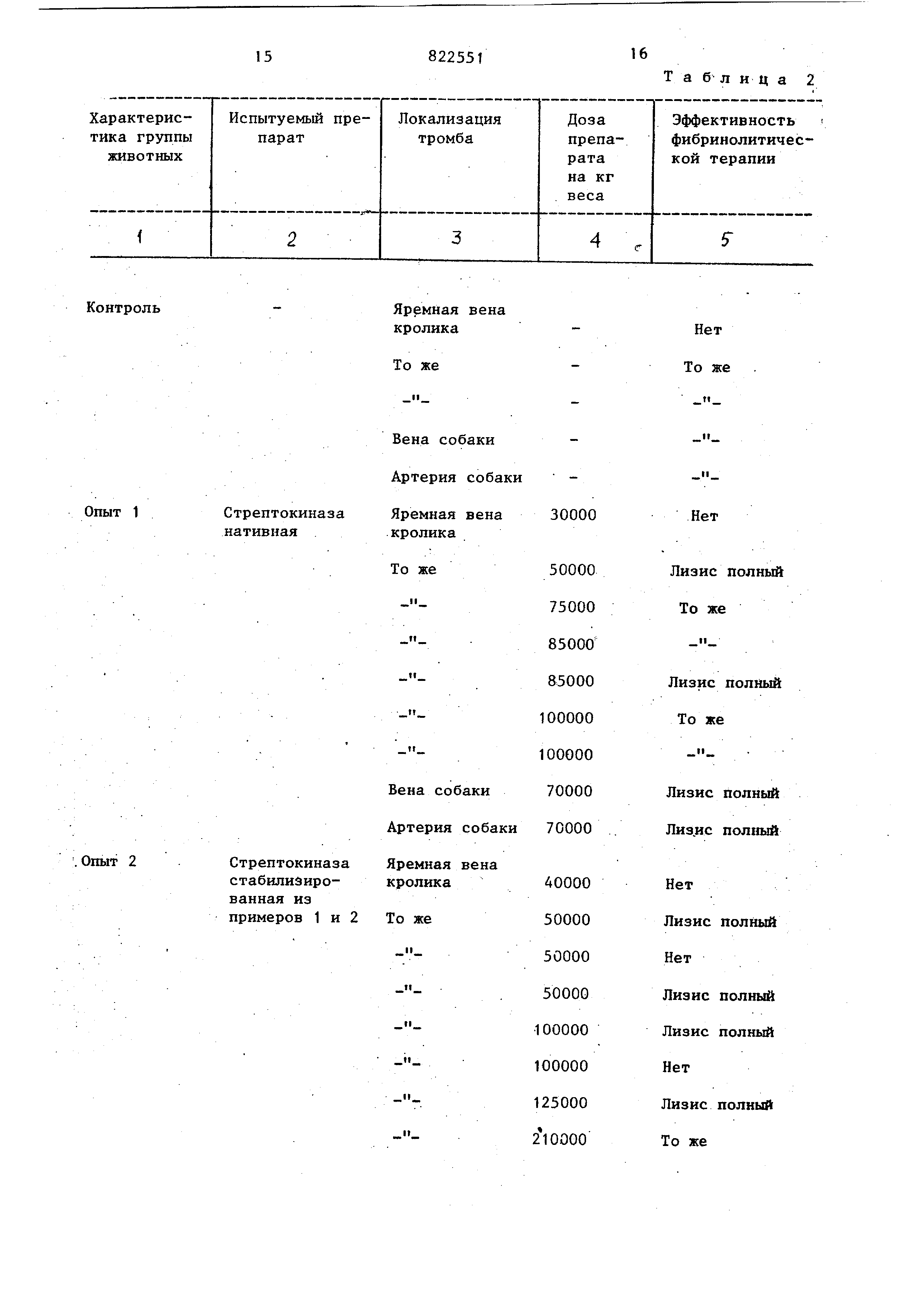
Для испытания тромболитической активности нативной и стабилизированной
стрептокиназы препараты вводили
0 методом однократной внутривенно-струйной
инфузии в течение 20 мин. Результаты приведены в табл. 2.
Таким o6pa30ft}, из полученных данных следует, что минимальная терапевтическая доза стабилизированной
стрептокиназы составляет 50000ФЕ/кг, оптимальная - свЬше 100000 ФЕ/кг, а
тромболитическая активность нативной и стабилизированной стрептокиназы
равнозначны.
Изучение изменений свертывающей
и фибрииолитической систем крови.
Проводили измерение времени рекальцификации
плазмы после введения подопытньм животным стабилизированной или нативной стрептокиназы (в сек.).
Установлено, что при введении стабилизированной стрептокиназы время
рекальцификации плазмы значительно удлинилось.
Кроме того, проводили определение концентрации фибриногена у подопытных животных в мг% по Г.А.Рутберг
.у взвешиванием роздушно-сухого сгустка-фибрина , образованного при рекальцификации цитратной плазмы.
Установлено, что концентрация фибриногена в плазме крови кроликов .
резко снижается в первые часы после введения препаратов- стрептокиназы.
Через сутки концентрация фибриногена возвращается к исходной или возрастает
по сравнению с ней. У тех животных , у которых тромбы лизкровалиеь после введения иммобилизованной
стрептокиназы, концентрация фибриногена возрастала через сутки в меньшей степени, чем у животных, у которых
тромбы не лизировались. У собак . концентрация фибриногена резко падала через 2 ч после введения испытуемых
препаратов и нормализовалась через сутки, после чего нарастала. Наряду с удлинением времени рекальцификации
плазмы и снижением концентрации фибриногена через 2-3 ч после введения препаратов наблюдалос
также укорочение времени лизиса эугло-20 булиновой фракции плазмы, определяемое по Коваржику.
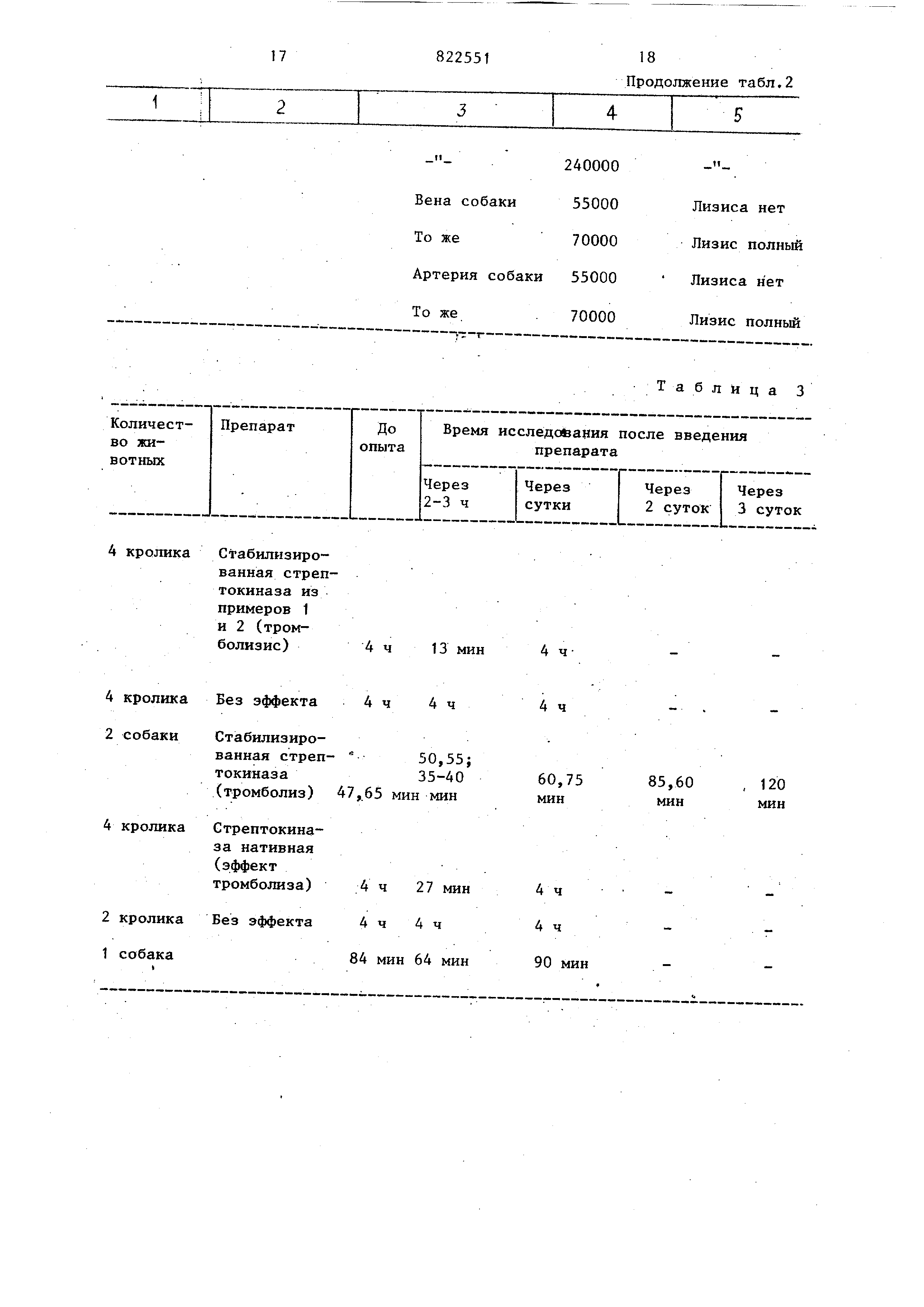
Результаты приведены в табл.3. Полученные результаты свидетельствуют об усилении фибринолитической
активности крови. Изменение лизиса эуглобулиновой «(фракции плазмы у кроликов после вве дения
опытного и контрольного образ . цов стрептокиназы было столь выраженным , что сгусток из эуглрбулиновой
фракции плазмы лизировался мгновенно. Восстановление тромболитической активности крови до исход-
ного уровня происходило через сутки после введения препарата. До опыта
лизис тромба эуглобулинового сгустка происходил более, чем за 4ч. Иногда
лизиса не бьшо даже через 24 ч. Одна ко, в плазме крови, .взятой через
2 ч после введения препарата, лизис происходил очень быстро, причем у
кроликов наблюдалась четкая закономерность - если лизис сгустка не ускорялся
, то лизиса тромба, как прави ло, не происходило. Изменение лизиса эуглобулииовой фракции крови у собак
не столь значительно, как у кроликов и нормализуется за одни сутки. Для вьщвления изменений свертываю
щей и фибринвлитической систем крови у кроликов в зависимости от введения
нативной я стабилизированной стрепто киназы были проведены тромбоэластографические исследования (ТЭГ) на
тромбоэластографе Тромб-2. Результаты приведены в табл. 4.
Приведенные данные показывают, что у тех кроликов, у которых произошел лизис тромбов после введения
стабилизированной стрептокиназы, существенные изменения показателей
ТЭГ наблюдались лишь черед одни сутки (удлинение 1 , соответствующие
невидимой свертываемости и удлинение k,, характеризующее начало образования
, сгустка фибрина). Удлинение времени этих двух величин свидетельствует о гипокоагуляции. Уменьшена
и амплитуда та, свидетельствующая об уменьшении вязкости свернувшейся крови. Коагуляционный индекс
(с.т) также снижается значительно лишь через сутки (на 70% от исходного ) .
При введении нативной стрептоки- назы наибольшие изменения показателей ТЭГ наблюдались уже через 2 ч
после введения препарата. Индекс коагуляции снижался на 75% и через 2 суток показатели ТЭГ полностью
нормализовались. В случае же введения стабилизированной стрептокиназы
показатели ТЭГ были резко изменены до пяти суток .после введения препарата
, т.е. наблюдалась пролонгация действия иммобилизованной стрептокиназы по сравнению с нативной. У
животных, у которых лизис тромба после введения стабилизированной
стрептокиназы не произошёл, показатели ТЭГ, измененные через 2 ч пос
ле введения препарата, через сутки {практически нормализовались. По данным записи на коагулографе
Н-33 обнаружено резкое замедление времени свертывания через 2 ч и
1 сутки после введения стабилизированной стрептокиназы. Через двое суток
время свертывания возвращается к норме. В случае введения подопытным животным той же дозы нативной
стрептокиназы время свертывания ускоряется до исходного уже к концу первых суток.
В тех опытах, где кроликам была введена большая доза стабилизированной
стрептокиназы (свьш1е 100000 ед/кг веса) почти всеми тестами отмечалась
пролонгация действия препарата до трех суток. При этом на тромбозластограмме
определяли резкое удлинение времени свертывания, уменьшение площади ветвей ТЭГ, снижение индекса
свертывания. Пролангация действия фибринолизина на протяжении двух-тре
суток подтверждалась и данными коагу лограммы - удлинение времени рекальцификации
плазмы, снижение активност ФСФ (фибриносвертывакмцего фактора), толерантности плазмы к гепарину.
При проведении подобных испытаний на собаках тромботест также нормализовался через сутки (изменение
показателей ТЭГ, удлинение г и уменьшение амплитуды та, снижение
на 70% коагуляционного индекса с от исходного).
Токсичность стабилизированной строптокиназы в острых опытах изучена на белых мьпиах и кроликах. В
опытах на мышах CWP массой 18-20 г нативную, стабилизированную стрептокиназу
и окисленный декстран, являющийся матрицей иммобилизованного препарата , вводили внутривенно в виде
водных растворов в объеме 0,5 мл. За животными наблюдали в течёние 7 дней.
Установлено, что однократное введение нативной стрептокиназы в дозах
до 1 г/кг и стабилизированной стрептокиназы и модифицированного де.кстра
на в дозах до 2 г/кг не вызывает гибели мьшей и не отражается на их поведении и внешней виде (см.табл.5)
Полученные результаты позволяют утверждать, что оба препарата при однократном внутривенном введении
мышам в ,дозах, превьш1аннцих макси-. мальные терапевтические дозы в 50100
раз, хорошо переносятся животными и что стабилизированная стрепто
киназа не обладает большей токсичностью , чем нативная. Хорошо переносили стабилизированную
стрёптокиназу и кролики. .Внутривенное введение им препарата в дозах
.t/iiO и 100 тыс. ЕД/кг не сопровождаось никакими проявлениями токсического
действия за.- исключением незначительного увеличения фибринолитичес кой активности крови. После введения
модифицированной стрептокиназы в дозе 200 тыс. ЕД/кг имел место несколько более выраженный фибринолиз,
однако, и эта. доза препарата никак не сказывалась на состоянии животных
Аллергенные свойства стабилизированной стрептокиназы изучали на морских свинках.:
Для определения анафилактогенной активности стабилизированной стрептокиназ .ы морских свинок иммунизировали однократно дозами 1,0, 0,5, 0,13 и 0,05 и 0,005 мг белка/мг, что
в пересчете на активность составляет 31000, 15500, 4200, 1700 и 155 МЕ/кг.
Результаты этих исследований, а также сравнение их с данными по нативной
стрептокиназе и другим ферментам , обладающим тромболитической активностью, приведены в табл. 6.
Как показали испытания, стрептокиназа в стабилизированной форме практически не обладает анафилактоген-
ной активностью, особенно при сравнении с такими ферментами, как террилитин и гигролитин.
Кожносенсибилизирующую активность стабилизированной стрептокиназы изучали
на морских свинках и кроликах. 20|Каждый опыт включал три группы животных
по 5-6 штук, которые получали препараты однократно в дозах 31000, 4200 и 1700 МЕ/кг. Кожные
реакции учитывали через 3 и 24 ч. Во всех опытах были получены отрицательные результаты.
Полученные результаты свидетельствуют , что в испытанном диапазоне
дозировок модифицированная стрептокиназа практически лишена кожносенсибиЛизирующей
активности, что согла- суется с данными системой анафилаксии t
(АА) и результатами проведения пассивной кожной анафилаксии (ПКА).
Таким образом, на основании изучения анафилактогенных и кожносенсибилизирующих
свойств иммобилизованной стрептокиназы, можно сделать вывод, что фермент обладает незначительным
аллергизирующим потенциалом для лабораторных животных. Моделирование условий применения
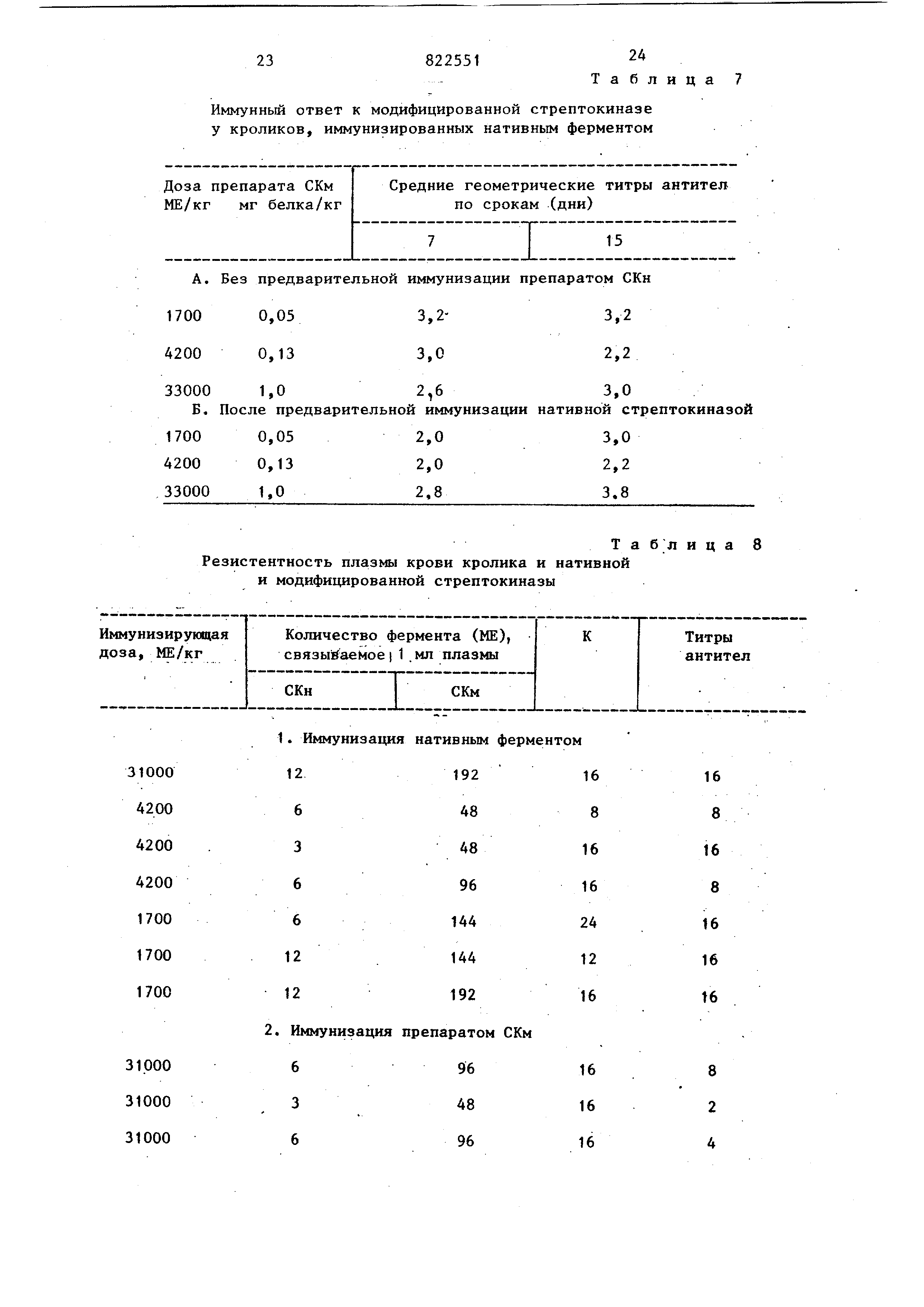
модифицированной стрептокиназы в сенсибилизированном организме. Хорошо известно, что на протяжении
жизни человек неоднократно стал- ; кивается в возбудителем стрептококковых
инфекций. В результате такого контакта у многих людей наблюдается
повьш1енное содержание антистрептокиназных антител. В связи с этим представлялось
необходимьв выяснить влия:-. ние предшествующей сенсибилизации к нативному ферменту на иммунный от
вет к модифицированной форме. Опыты проводили на мьшгах, морских свинках
и кроликах. Для создания антистрептокиназного -фона животных иммуниЯремная вена
Контроль кролика
То же
Вена собаки
Артерия собаки
1
Стрептокиназа
Яремная вена кролика
нативная
То же
Вена собаки Артерия собаки
2
Стрептокиназа
Яремная вена стабилизирокролика ванная из
примеров 1 и 2 То же
«
11
Нет То же
Нет
Лизис полный
То же
11
Лизис полный
То же
Лизис полный Лиз.ис полный
Нет
Лизис полный
Нет
Лизис полный
Лизис полный
Нет
Лизис полный
То же
Стабилизированная стрептокиназа из примеров 1
и 2 (тромболизис )
4 ч
4ч 4ч
Без эффекта
Стабилизированная стреп- 50,55; токиназа35-40
(тромболиз) 47,65 мин мин
Стрептокиназа нативная
(эффект
тромболиза) 4ч 27 мин
Без эффекта 4ч 4ч
84 мин 64 мин
240000
55000
Лизиса нет 70000
Лизис полный
55000 Лизиса нет
70000
Лизис полный
Таблица 3
13 мин
4 ч4 ч
85,60
120 мин мин
4ч 4 ч 90 мин
2182255122
Число погибших (числитель) и выживших (знаменатель) мышей
при внутривенном введении исследованных препаратов
Анафилактогенные свойства стрептокиназы и микробных
тромболитических протеиназ Примечание:
Таблица 5
Таблица 6 - - не определяли; О - анафилактическая реакция отсутствует . Подчеркнуты дозы соответствующие:
максимальной, терапевтической (суммарно) 1,85 млн ME 250 тыс. ME и минимальная йсходнал..терапевтическая
по рекомендациям фирмы-изготовителя нативной стрептокиназы .
Иммунный ответ к модифицированной стрептокиназе у кроликов, иммунизированных нативным ферментом
А. Без предварительной иммунизации препаратом СКн 1700 0,053,2-3,2
4200 0,133,02,2
33000 1,02,6 Б, После предварительной иммунизации
Резистентность плазмы крови кролика и нативной и модифицированной стрептокиназы
Т а б л и ц а 8 3,0 нативной стрептокиназой
25 Примечание: 26
822551 Продолжение табл.8 отношение количеств СКм и СКн, связываемых
1 мл плазмы. Титры антител определяли в РИГА. Соответствуют максимальным разведениям
сывороток крови реагирующим с гомоголичным тестантителом.

Комментарии