Композиция, способ и набор для получения плазмина - RU2497948C2
Код документа: RU2497948C2
Чертежи

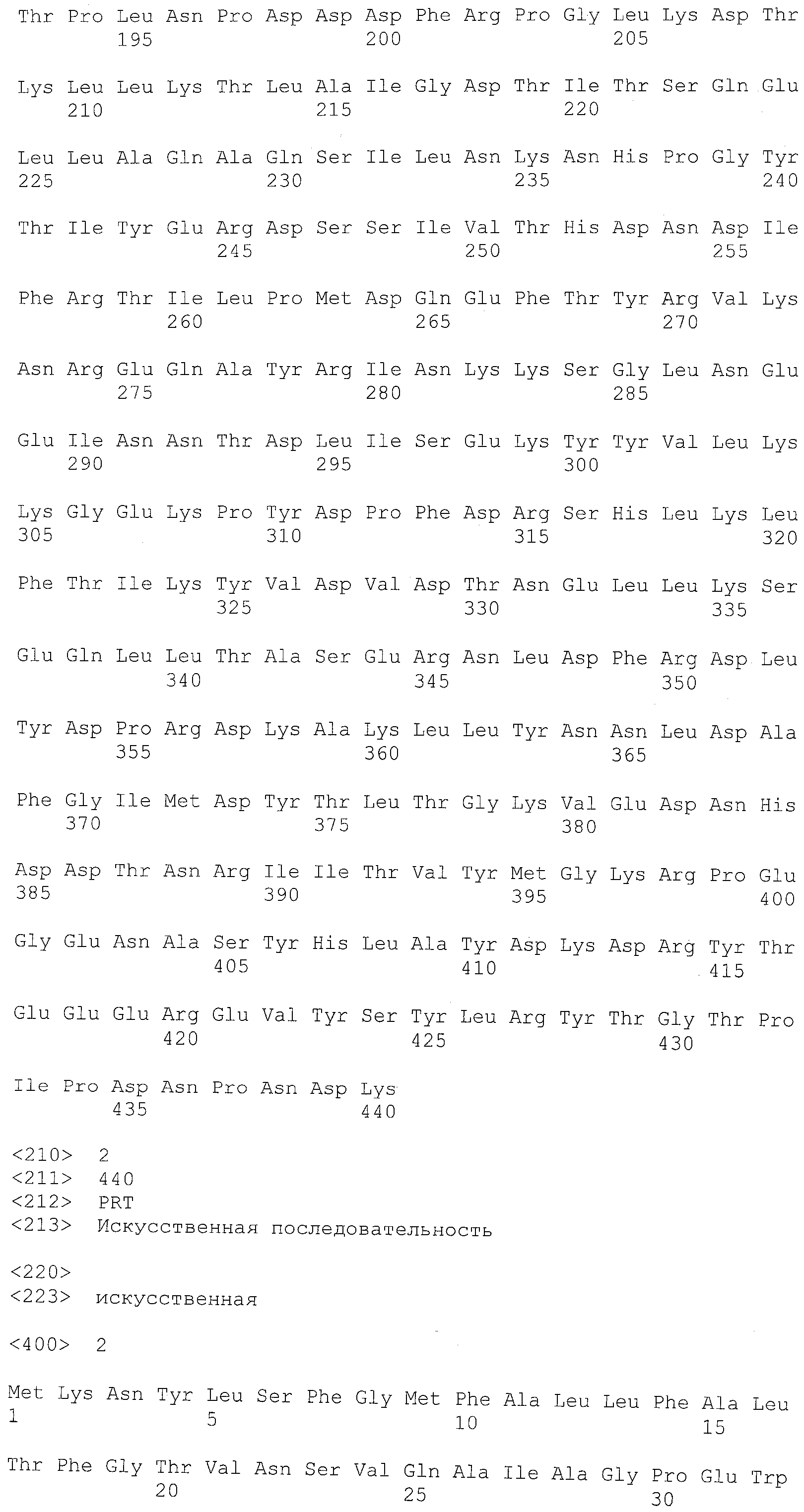
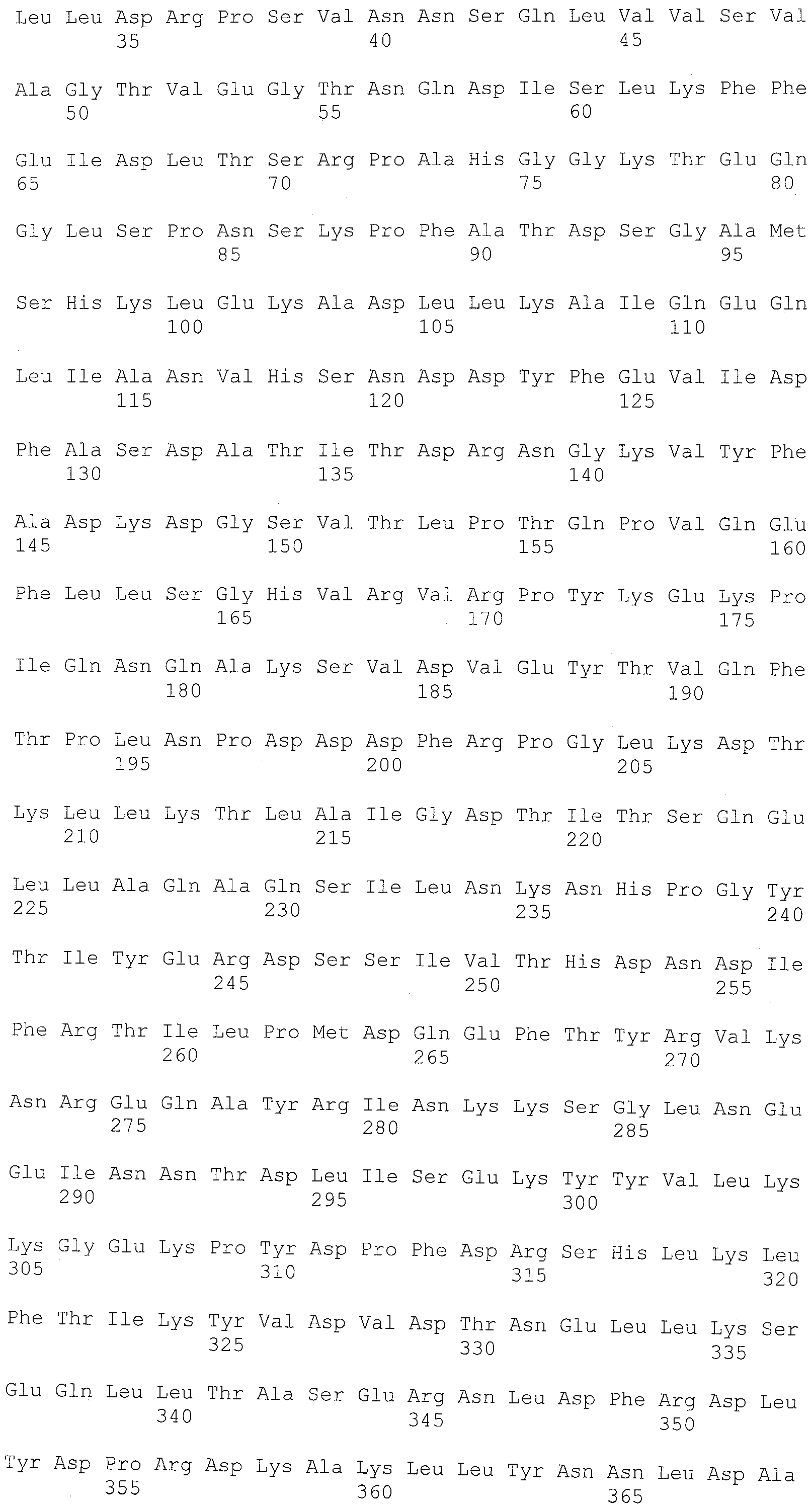


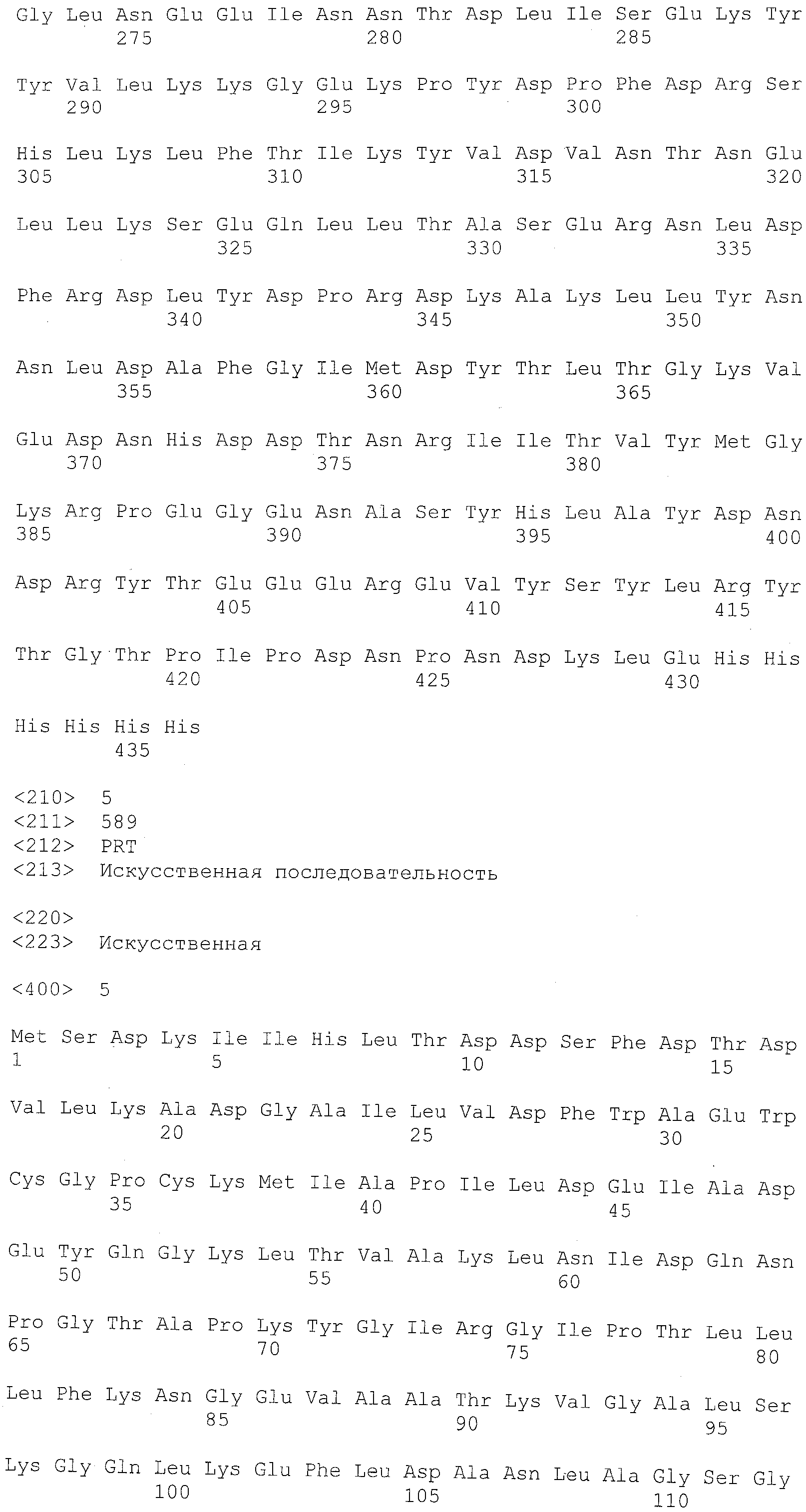
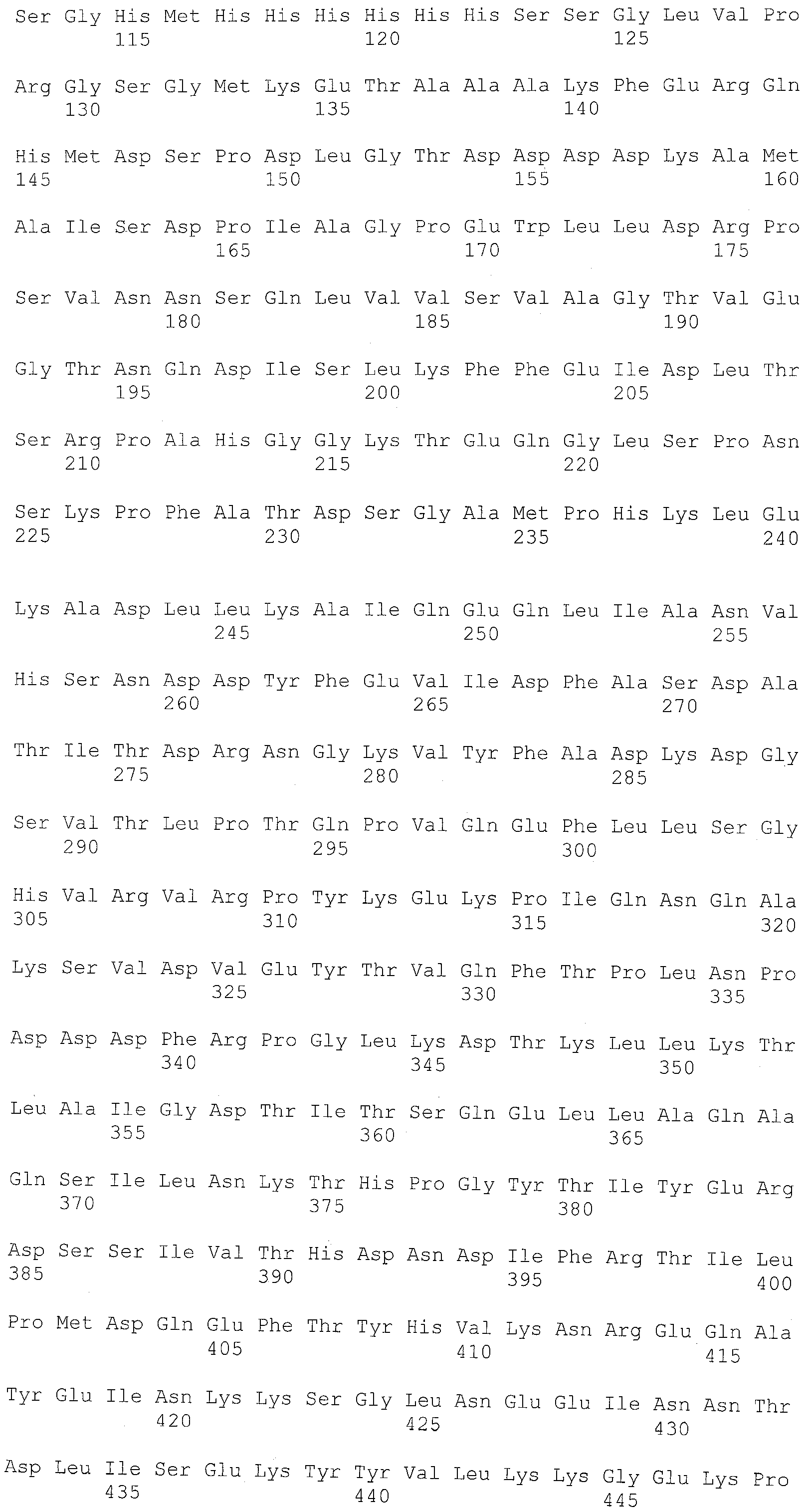

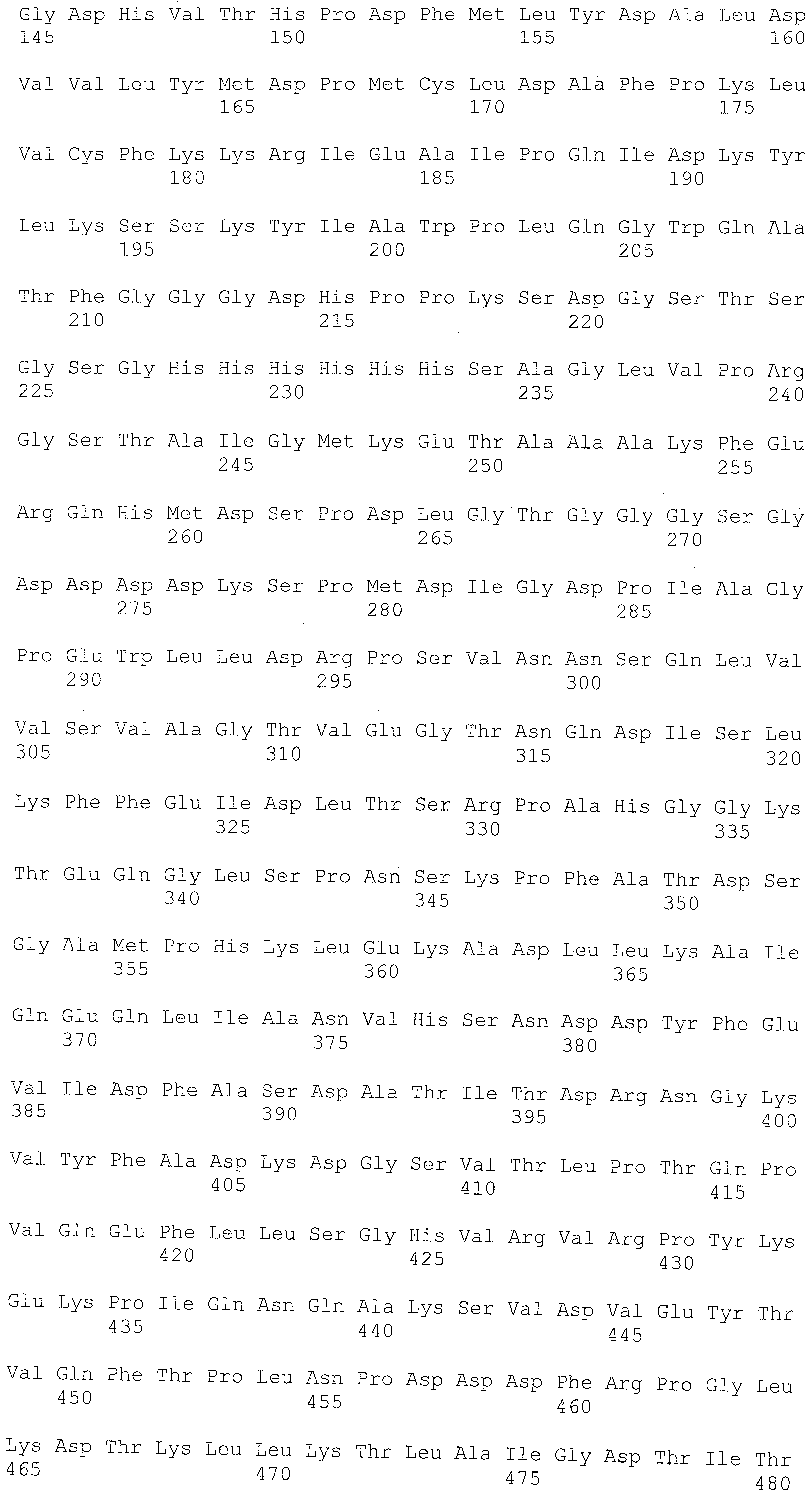
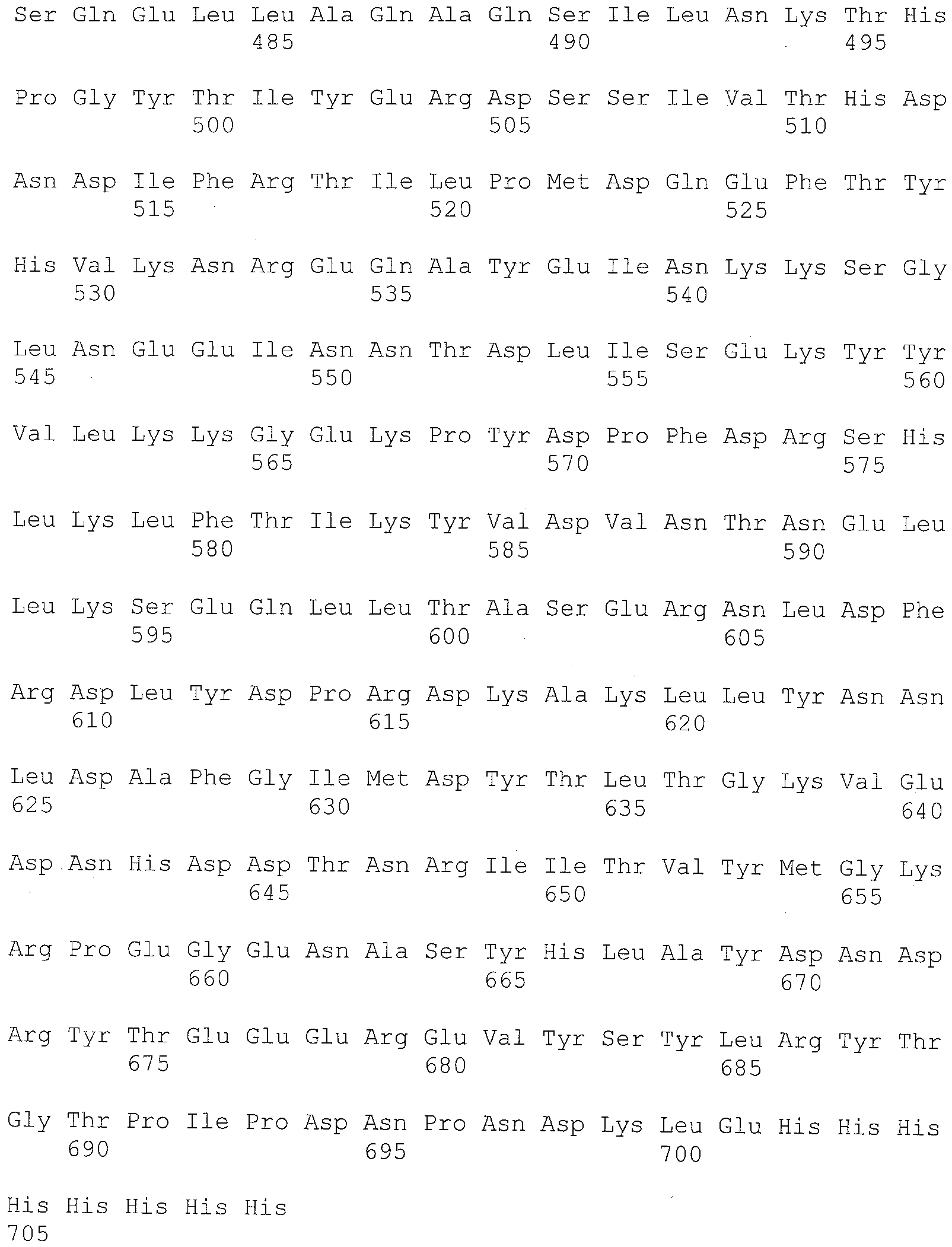
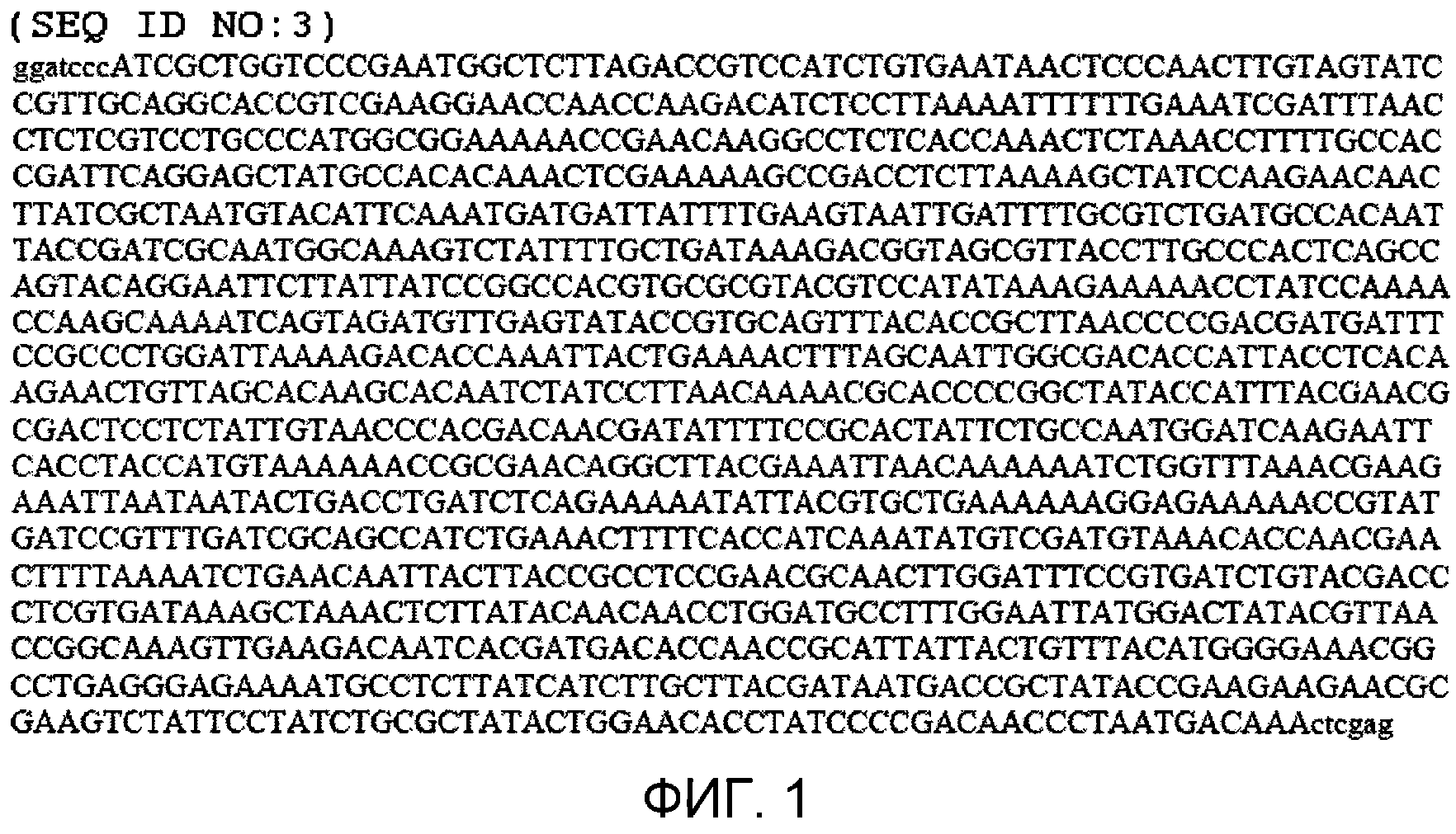



Описание
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке, согласно 35 USC §119, испрашивается приоритет предварительной заявки США № 61/058677, поданной 4 июня 2008 года, содержание которой полностью включено со ссылкой в настоящее описании.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам получения плазмина, в частности, к композициям и способам получения плазмина с использованием иммобилизованной стрептокиназы.
УРОВЕНЬ ИЗОБРЕТЕНИЯ
Сгустки крови (тромбы) состоят из волокнистой сети, растворять которую способен протеолитический фермент плазмин. Фермент образуется из неактивного профермента плазминогена, который является компонентом плазмы крови, под действием активатора плазминогена. Существуют два иммунологически отличающихся активатора плазминогена млекопитающих. Эндогенный активатор плазминогена, также называемый урокиназой, представляет собой фермент, вырабатываемой почкой, и его можно выделять из мочи. Также источником его получения может быть ряд тканевых культур. Экзогенный активатор плазминогена, также называемый сосудистым активатором плазминогена и тканевым активатором плазминогена (t-PA), можно выделять из многих тканевых гомогенатов (в частности, из человеческой матки), клеточной стенки сосудов и из некоторых клеточных культур. В дополнение к указанным двум видам активатора плазминогена также существует бактериальный продукт стрептокиназа (стрептокиназа), получаемый из стрептококков.
С расширением применения в клинической практике артериальных и венозных катетеров локальная доставка активного плазмина предоставляет привлекательные терапевтические возможности для тромболитической терапии или восстановления проходимости затромбированных катетеров. Для этого существует ряд причин: 1) Будучи активной протеазой серина, плазмин представляет собой прямой растворитель тромба в отличие от активаторов плазминогена, для которых необходим субстрат (плазминоген) вблизи тромба; 2) Направленную локальным катетером тромболитическую терапию с активным плазмином можно интенсифицировать до любого уровня, необходимого для достижения полного растворения тромба; 3) Теоретически плазмин также может быть более безопасным тромболитиком, поскольку более низкая дозировка, необходимая для локальной доставки, может уменьшать или даже устранять осложнения в виде кровотечения, связанные с высокими дозами тромболитической терапии, и любое потенциальное остаточное действие плазмина в непосредственной близости к тромбированному участку будет быстро нейтрализовано посредством циркулирующего α2-антиплазмина.
Существует несколько технических проблем, связанных с очисткой плазмина, в особенности при его терапевтическом применении и доставке. Плазмин является активной протеазой серина, которая имеет тенденцию к аутолизу и инактивации при физиологическом уровне pH. К сожалению, расщепление плазмина наиболее выражено в диапазоне уровня pH, который необходим для проявления его функции, то есть, для растворения тромба.
В настоящее время в способах коммерческого применения активации полученного из плазмы плазминогена в плазмин задействована растворимая стрептокиназа в реакции, осуществляемой в жидкой фазе. Продуцируемый в этой реакции активации плазмин не является полностью стабилизированным против аутопротеолиза, пока продолжается этап активации до желательной степени превращения плазминогена в плазмин. Во время указанной активации стрептокиназа расщепляется плазмином, что требует удаления из конечного продукта множества молекулярных соединений стрептокиназы. Дополнительно, вновь образованные молекулы плазмина могут также начать расщеплять другие молекулы плазмина/плазминогена, что приводит к потере ценного продукта, то есть, плазмина.
Таким образом, в настоящее время существует потребность в простых и эффективных способах или методиках получения плазмина. Дополнительно желательно, чтобы такой способ приводил к получению растворов плазмина, по существу не содержащих стрептокиназу, таким образом, чтобы при желании можно было применять плазмин для введения (например, парентерального) в качестве фармацевтического средства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к композиции, содержащей стрептокиназу, иммобилизованную на матрице. Стрептокиназа представляет собой мутантную стрептокиназу, отличающуюся способностью к активации плазминогена в плазмин, при этом устойчивую к расщеплению плазмином по сравнению с соответствующей ей стрептокиназой дикого типа.
В другом аспекте настоящее изобретение относится к изделию, содержащему матрицу с иммобилизованной на ней стрептокиназой, при этом стрептокиназа представляет собой мутантную стрептокиназу, отличающуюся способностью к активации плазминогена в плазмин, при этом устойчивую к расщеплению плазмином по сравнению с соответствующей ей стрептокиназой дикого типа.
В некоторых аспектах настоящее изобретение относится к способу получения плазмина. Способ включает:
a) контактирование композиции, содержащей плазминоген, со стрептокиназой, иммобилизованной на матрице с превращением таким образом плазминогена в плазмин; и
b) очистку плазмина.
В других аспектах настоящее изобретение относится к набору для получения плазмина. Набор содержит:
a) стрептокиназу, иммобилизованную на матрице, при этом стрептокиназа является мутантной стрептокиназой, отличающейся способностью к активации плазминогена в плазмин, при этом устойчивую к расщеплению плазмином по сравнению с соответствующей ей стрептокиназой дикого типа; и
b) связывающую плазмин матрицу с расположенной на ней молекулой, которая обладает аффинностью к плазмину.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 показывает нуклеотидную последовательность (а именно, SEQ ID NO:3), содержащую открытую рамку считывания (обозначенную прописными буквами), кодирующую двойной полипептид мутантной стрептокиназы. Показана открытая рамка считывания, фланкированная участками рестрикционного фермента (которые обозначены строчными буквами), предназначенными для клонирования.
Фиг.2 показывает аминокислотную последовательность (SEQ ID NO:4) полипептидного продукта вектора экспрессии pET21 (pET System, Novagen, Madison, WI), содержащего открытую рамку считывания (обозначенную прописными буквами), показанную в SEQ ID NO:3. Мутации от лизина (K) до аргинина (N) в полипептиде стрептокиназы подчеркнуты одной линией. Аминокислотный остаток изолейцина (I), соответствующий N-концу последовательности стрептокиназы, выделен двойным подчеркиванием.
Фиг.3 показывает аминокислотную последовательность (SEQ ID NO:5) полипептидного продукта вектора экспрессии pET32 (pET System, Novagen, Madison, WI), содержащего открытую рамку считывания (обозначенную прописными буквами), показанную в SEQ ID NO:3. Мутации от лизина (K) до аргинина (N) в полипептиде стрептокиназы подчеркнуты одной линией. Аминокислотный остаток изолейцина (I), соответствующий N-концу последовательности стрептокиназы, выделен двойным подчеркиванием.
Фиг.4 показывает аминокислотную (последовательность SEQ ID NO: 6) полипептидного продукта вектора экспрессии pET41 (pET System, Novagen, Madison, WI), содержащего открытую рамку считывания (обозначенную прописными буквами), показанную в SEQ ID NO:3. Мутации от лизина (K) до аргинина (N) в полипептиде стрептокиназы подчеркнуты одной линией. Аминокислотный остаток изолейцина (I), соответствующий N-концу последовательности стрептокиназы, выделен двойным подчеркиванием.
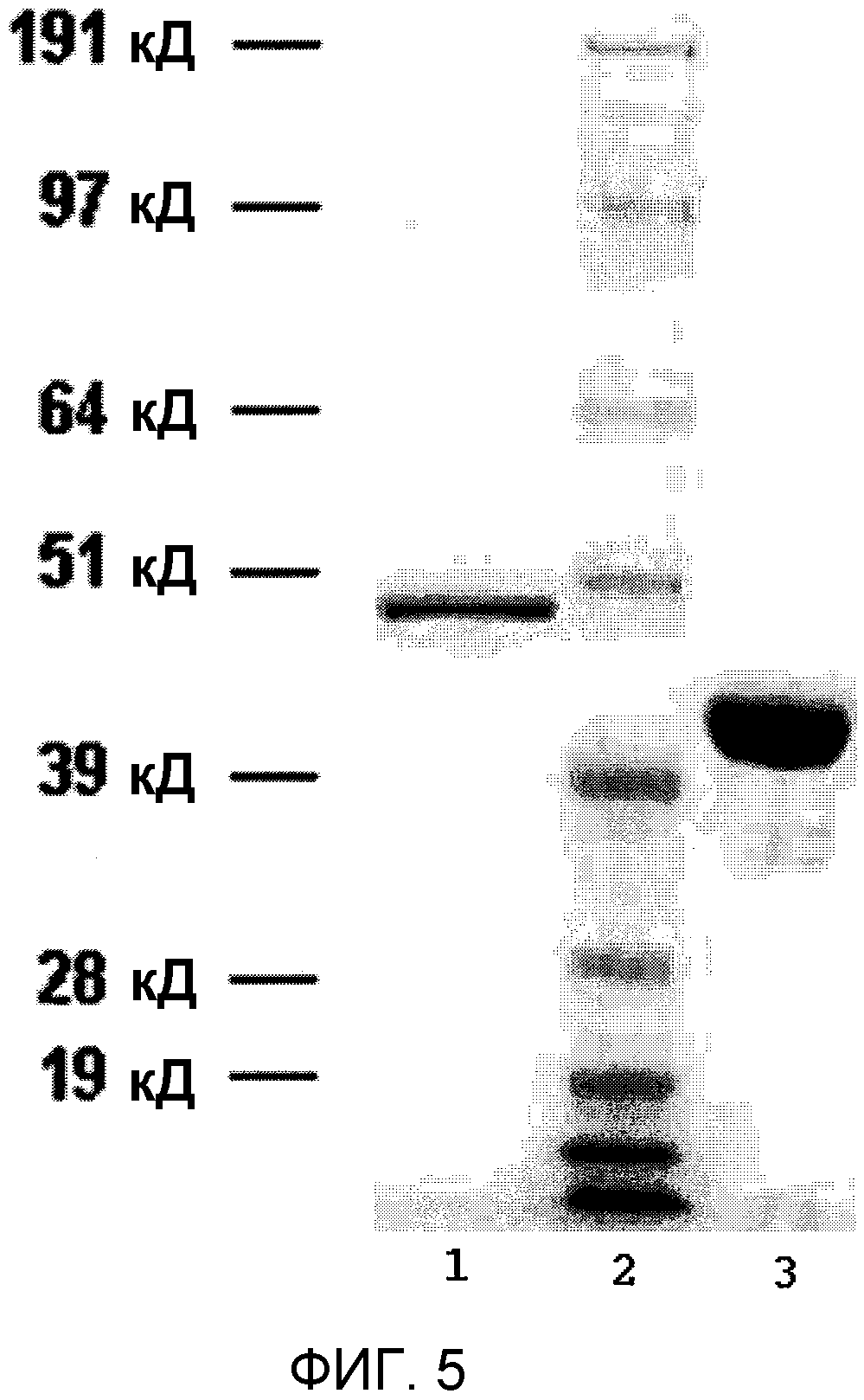
Фиг.5 показывает электрофорез в полиакриламидном геле с додецилсульфатом натрия SDS-PAGE при окрашивании Кумаси синим очищенной рекомбинантной стрептокиназы (полоса 1); маркера молекулярной массы (ММ) SeeBlue® Plus 2 (Invitrogen, Carlsbad, CA) (полоса 2); и рекомбинантного плазминогена (полоса 3).
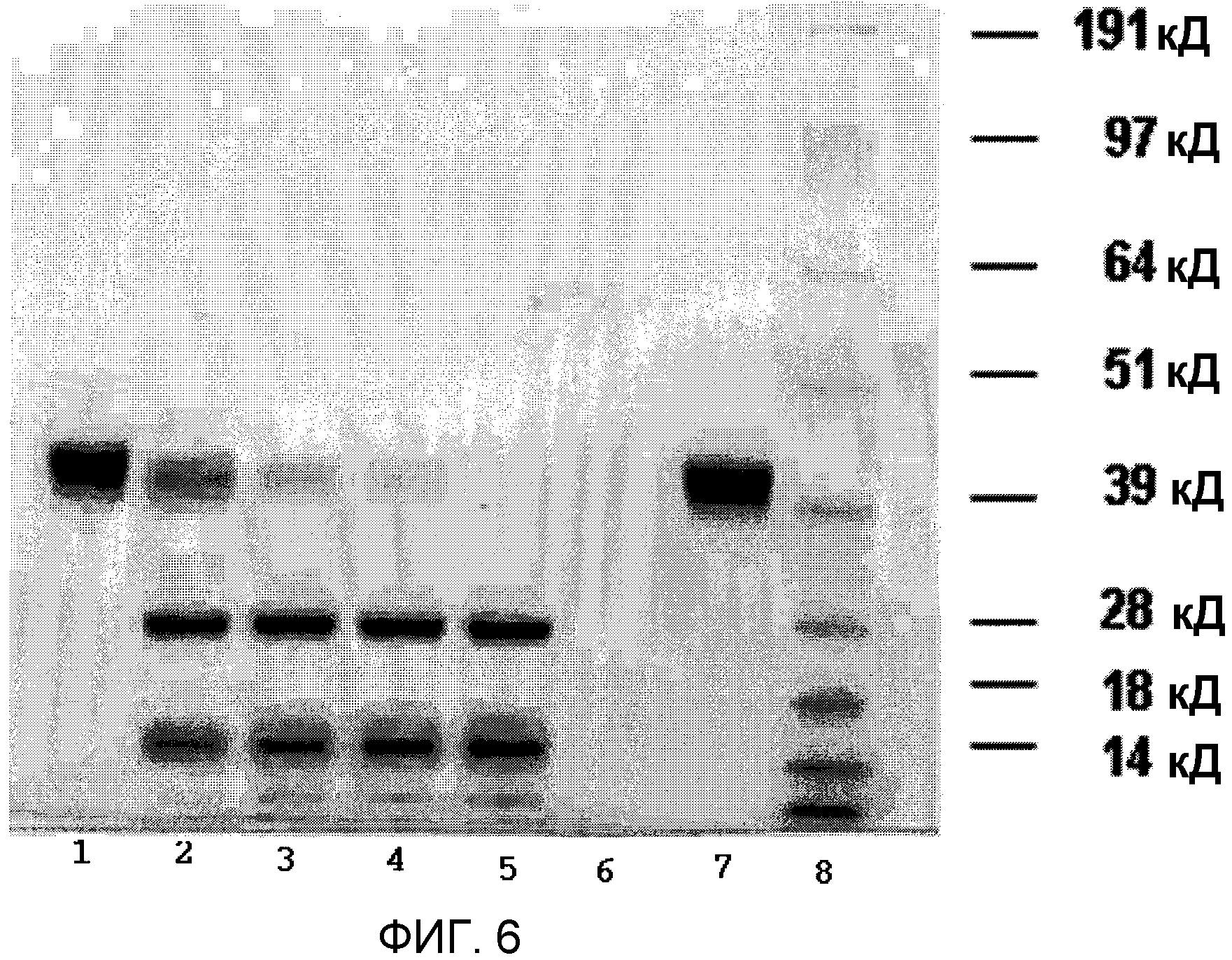
Фиг.6 представляет SDS-PAGE и показывает зависимость от времени для превращения рекомбинантного плазминогена в рекомбинантный плазмин, катализируемого рекомбинантной стрептокиназой. Показатели времени = 0 часов (полоса 1); 2 часа (полоса 2); 4 часа (полоса 3); 6 часов (полоса 4); и 18 часов (полоса 5). Полосы 6, 7, и 8 соответствуют контрольной рекомбинантной стрептокиназе, контрольному рекомбинантному плазминогену и маркеру ММ (SeeBlue® Плюс 2), соответственно.
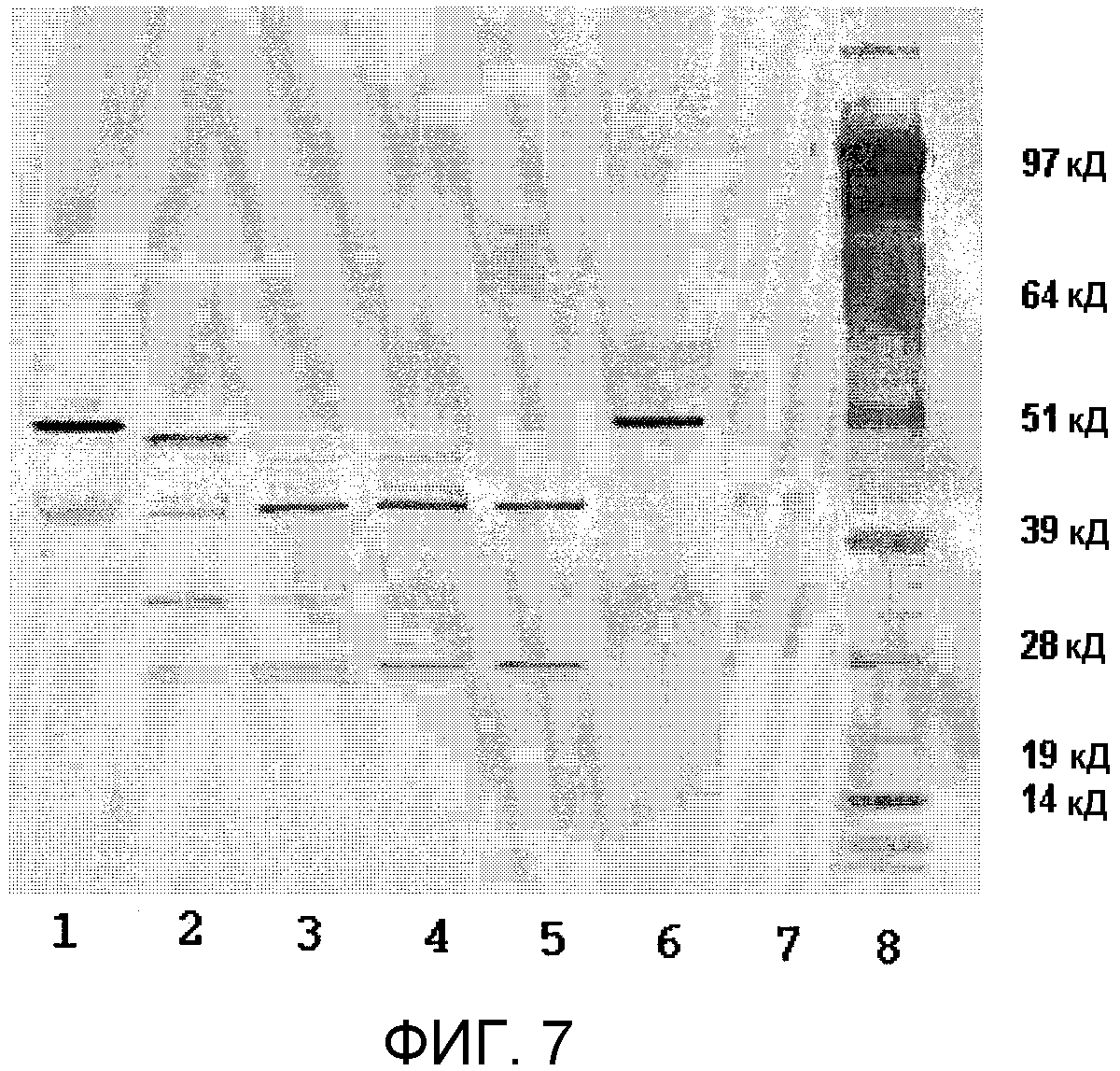
Фиг.7 представляет вестерн-блоттинг эксперимента определения зависимости от времени, показанного в фигуре 6, с использованием поликлональных анти-стрептокиназных антител. Показатели времени = 0 часов (полоса 1); 2 часа (полоса 2); 4 часа (полоса 3); 6 часов (полоса 4); и 18 часов (полоса 5). Полосы 6, 7 и 8 относятся к контрольной рекомбинантной стрептокиназе, контрольному рекомбинантному плазминогену и маркеру ММ (SeeBlue® Плюс 2), соответственно.
ПОДРОБНОЕ ОПИСАНИЕ
Способ очистки плазмина, раскрытый в настоящем изобретении, является простым, эффективным, воспроизводимым и надежным. Указанным способом можно получать достаточное количество высоко очищенного плазмина, обладающего активностью, сопоставимой с потенциальной активностью очищенных препаратов плазминогена. Очистка может по меньшей мере сохранять активность плазмина, или даже увеличивать ее. В конечном плазмине содержится минимальное количество стрептокиназа или она отсутствует, поскольку ее наличие нежелательно для терапевтического применения. В одном варианте осуществления способ очистки плазмина включает следующие основные этапы: этап a: активация плазминогена в плазмин с использованием иммобилизованной стрептокиназы, где указанная стрептокиназа представляет собой мутантную стрептокиназу, отличающуюся способностью к активации плазминогена в плазмин, при этом устойчивую к расщеплению плазмином по сравнению с соответствующей ей стрептокиназой дикого типа; и этап b: захват активного плазмина на плазмин-захватывающей матрице, такой как, например, бензамидин-сефароза. Необязательно, способ дополнительно включает элюирование связанного плазмина с буфером с низким уровнем pH; и, дополнительно необязательно, приготовление конечного плазмина в подкисленной до уровня pH 3,7 воде.
1. Стрептокиназа
В настоящем изобретении рассмотрена стрептокиназа природного происхождения, а также рекомбинантная стрептокиназа. Без связи с конкретной теорией предполагается, что механизм активации стрептокиназы подразумевает образование стехиометрического комплекса с плазминогеном.
Понятие "природного происхождения", используемое в настоящем изобретении применительно к стрептокиназе, относится к тому факту, что такую стрептокиназу можно выделять из природного источника, и человек не подвергал ее преднамеренной модификации в лаборатории. Подразумевается, что стрептокиназы природного происхождения включают стрептокиназу "мутантных" форм природного происхождения, которые являются стойкими к плазмину по сравнению со стрептокиназой "дикого типа" природного происхождения.
"Рекомбинантная" стрептокиназа относится к стрептокиназам, получаемым технологией рекомбинантной ДНК, то есть, продуцируемым из клеток, трансформированных экзогенной конструкцией ДНК, кодирующей желательную стрептокиназу, которая может быть стрептокиназой дикого типа или плазмин-резистентным мутантом.
"Синтетические" стрептокиназы представляют собой стрептокиназы, полученные путем химического синтеза.
Стрептокиназа природного происхождения продуцируется определенными Streptococci и определенными бактериями, которые несут соответствующий генетический материал, полученный из Streptococci групп Lancefield A, C или G. Например, стрептокиназу можно получать из культур штамма H46A S. equisimilis.
Описаны многочисленные способы очистки стрептокиназы, включающие, например, патенты США №№ 2701227, 2702781, 2677642, 2677643, 2691620, 2784145, 3226304, 3255094, 3419472, 3444045, 3980772, 4381346, RE32271 и 5334384, которые включены со ссылкой в настоящее описание.
В стрептокиназе не содержатся аминокислоты цистеин или цистин, в отличие от стрептолизина или стрептодорназы, которые являются обычными примесными белками, представляющими собой примеси в препаратах стрептокиназы природного происхождения (Einarsson et al., Biochim, Biophys. Acta 568:19-29 (1979); De Renzo et al, J. Biol. Chem. 242, 533-542 (1967)). Было предложено использовать указанное структурное различие для получения способа очистки стрептокиназы из ферментационного бульона. Например, патент США № 5334384 описывает способ отделения стрептокиназы от примесных белков в смеси, содержащей стрептокиназу, и указанный способ включает обработку смеси восстановителем для восстановления дисульфидных мостиков в примесных белках, чтобы освободить тиоловые группы, контактирование смеси с реактивом, способным к реакции со свободной тиоловой группой и с тиол-содержащей матрицей, и после этого сепарацию химически модифицированных примесных белков, получаемых из смеси, чтобы получить форму стрептокиназы, по существу не содержащую примесных белков.
Ген, кодирующий стрептокиназу, был выделен из его природного источника (виды Streptococcus), и клонирован в несколько гетерологичных микроорганизмов, таких как дрожжи (Hagenson et al., Enzyme. Microb. Technol. 11:650 (1989)), бактерии, а именно, E. coli (Malke et al., Proc. Nat'l Acad. Sci. 81:3557 (1984)), другие виды Streptococcus (Malke et al., MoI. Gen. Genet. 196:360 (1984)), и Bacillus (Wong et al., Applied and Env. Microbiol 1:517 (1994)), все из которых включены в настоящее изобретение со ссылкой на их теории, относящиеся к выделению и клонированию стрептокиназы. Дополнительно, в настоящее изобретение включены ссылки на Caballero et al., Infection and Immunity, 67:6478-6486 (1999) в части их теории, отноящейся к клонированию и характеристикам стрептокиназ, которые продуцируют выделенные свиные и лошадиные Streptococcus equisimilis, и к использованию матрицы для иммобилизации рекомбинантного белка.
Таблица 1 показывает аминокислотную последовательность стрептокиназы, кодируемую геном стрептокиназы из штамма H46A Streptococcus equisimilis, что опубликовано Malke et al, Gene 34:357- 362 (1985) (см. также GenBan, номер доступа 1106184A), и включено в настоящее изобретение со ссылкой.
Дополнительно, стрептокиназа является коммерчески доступной, как например, стрептокиназа из β-гемолитического стрептококка (группа C Lancefield) (Sigma-Aldrich Corp., St-Louis, MO) и рекомбинантная стрептокиназа, продуцируемая E.Coli путем хроматографических технологий (ABR-Affinity BioReagents Inc, Golden, CO). Дополнительно, были описаны (ЕС 0397366 А1) генетически модифицированные производные стрептокиназы, содержащие крингл-домены связывания фибрина, происходящие из плазминогена, и способы их получения способами рекомбинантной ДНК.
В некоторых вариантах осуществления стрептокиназа, которая должна быть иммобилизована, является рекомбинантной стрептокиназой (например, рекомбинантом дикого типа или мутантом, устойчивым к плазмину), получаемой путем экспрессии из рекомбинантной ДНК или в условиях in vivo или in vitro. Рекомбинантная технология является общепринятой и известной в данной области техники. Аффинной метки аминокислоты можно вставлять с помощью полимеразной цепной реакции. Экспрессии можно осуществлять in vivo, используя как бактерии (например, E. coli), низшие эукариоты (например, Saccharomyces cerevisiae, Saccharomyces pombe, Pichia pastoris) или высшие эукариоты (например, бакуло-инфицированные клетки насекомых, клетки насекомых, клетки млекопитающих), так и in vitro (лизаты E. coli, экстракты зародышей пшеницы, лизаты ретикулоцитов). Стрептокиназу можно очищать аффинной хроматографией с использованием коммерчески доступных смол.
Последовательности ДНК, кодирующие аминокислотные аффинной метки и адапторные белки, можно конструировать в векторы экспрессии таким образом, что рассматриваемые гены можно клонировать в рамке или 5' или 3' последовательности ДНК, кодирующей аффинную метку и адапторный белок. Вектор может нести начало репликации и ген, способный придавать клетке - хозяину устойчивость к антибиотикам. Вставка этого вектора может содержать промоторную последовательность, ген, кодирующий рассматриваемую стрептокиназу, необязательно, последовательность, кодирующую полипептидную аффинную метку, и сигнальную последовательность терминации. Необязательно, вектор может также содержать последовательность, которая кодирует молекулу полипептидного адаптора, предпочтительно расположенную между областями, кодирующими белок и аффинную метку.
Для экспрессии in vivo белков можно клонировать кДНК в коммерчески доступные векторы экспрессии (например, поставляемые компаниями Qiagen, Novagen, Clontech) и вводить в подходящий организм для экспрессии. Для экспрессии in vitro ПЦР-амплифицированные последовательности ДНК можно использовать непосредственно спаренными in vitro в системах транскрипции/трансляции (например, лизаты E. coli S30, полученные экспрессией РНК полимеразы T7, предпочтительно протеазо-дефицитные штаммы, лизаты пшеничных зародышей, лизаты ретикулоцитов с микросомами и без микросом (например, поставляемые компаниями Promega, Pharmacia, Panvera)).
Полимеразные цепные реакции (ПЦР) можно проводить в стандартных условиях или оптимизировать без неоправданного экспериментирования. Олигонуклеотидные праймеры могут нести уникальные сайты рестрикции для облегчения клонирования в векторы экспрессии. Альтернативно, можно использовать клонирующую систему TA (Clontech Laboratories, Inc, Mountain View, CA). Векторы экспрессии содержат последовательности для аффинных меток и белковых адапторов. Продукты ПЦР лигируют в векторы экспрессии (с помощью индуцибельных промоторов), и вводят в подходящий компетентный штамм E. coli путем кальций-зависимой трансформации (штаммы включают в себя: XL-1 Blue, BL21, SG13009 (lon-)). Культуры можно выращивать до середины логарифмического роста, индуцированной для экспрессии, и собирать клетки путем центрифугирования. Клетки, содержащие лизозим, можно ресуспендировать и разрушать мембраны быстрыми циклами замораживания/оттаивания или с помощью ультразвука. Клеточный дебрис можно удалять путем центрифугирования, и можно добавлять к супернатантам подходящую матрицу аффинности. Рассматриваемая стрептокиназа является связанной, неспецифично связанные белки удаляют повторными этапами промывания. Альтернативно, можно использовать магнитные шарики для аффинности и устройства для фильтрации (QIAGEN, Inc, Valencia, CA).
Для Saccharomyces cerevisiae возможно гликозилирование кора и липидная модификация белков. Подход, описанный выше для E. coli, можно применять с небольшими модификациями для трансформации и лизиса клеток. Трансформацию Saccharomyces cerevisiae можно осуществлять ацетатом лития, и лизировать клетки можно или путем литиказного расщепления клеточной стенки с последующим замораживанием - оттаиванием, обработкой ультразвуком или экстракцией стеклянными бусами. Если желательно, варианты посттрансляционных модификаций можно получать с разными штаммами дрожжей (а именно, Saccharomyces pombe, Pichia pastoris).
Преимущество бакуловирусной системы или клеток млекопитающих состоит в изобилии возможных посттрансляционных модификаций. Для бакуло-системы необходимо клонирование вирусов, получение исходных высоких титров и инфицирование жидких суспензий клеток насекомых (клетки - SF9, SF21). Для экспрессии на основе клеток млекопитающих необходимы трансфекции и клонирование клеточных линий. Отбор растворимых белов осуществляют из среды, тогда как внутриклеточные или связанные с мембраной белки требуют лизиса клетки (или солюбилизацию детергентом, оттаивание-замораживание). Затем белки можно очищать аналогично процедуре, описанной для E. coli.
Для трансляции in vitro системой выбора являются лизаты E. coli, полученные из протеазо-дефицитных штаммов и штаммов со сверхэкспрессией РНК-полимеразы T7. Лизаты E. coli обеспечивают эффективную экспрессию белка (30-50 мкг/мл лизатов). Весь процесс осуществляют в 96-луночных матрицах. Рассматриваемые гены амплифицируют с помощью ПЦР с использованием олигонуклеотидов, которые содержат ген-специфичные последовательности, содержащие промотор РНК-полимеразы T7 и связывающий участок, и последовательность, кодирующую аффинную метку. Альтернативно, адапторный белок можно сливать с рассматриваемым геном с помощью ПЦР. Для быстрого анализа амплифицированные ДНК можно напрямую подвергать транксрипции и трансляции в лизаты E. coli без предварительного клонирования. Затем белки выделяют путем связывания с матрицей аффинности и процессируют, как описано выше.
Возможные для использования альтернативные системы включают экстракты пшеничных зародышей и экстракты ретикулоцитов. Для синтеза мембранных белков in vitro и/или посттрансляционно модифицированных белков будут нужны лизаты ретикулоцитов в комбинации с микросомами.
a) Плазмин-резистентная стрептокиназа
Стрептокиназа является лабильным белком, восприимчивым к расщеплению в реакции с плазмином. Обнаружено, что фрагменты расщепленной плазмином стрептокиназы проявляют более слабое действие в качестве активатора плазминогена по сравнению с нативной стрептокиназой (Shi et al., Biochem. J. 304: 235-241 (1994)). Были заранее определены пептидные связи молекулы стрептокиназ, которые гидролизируются плазмином (Shi et al, см. выше). Плазмин специфично катализирует гидролиз пептидных связей, имеющих на амино-конце Lys и Arg. Более конкретно, пептидная связь стрептокиназы Lys59-Ser60 принадлежит к немногочисленным пептидным связям, которые расщепляются в начале реакции с плазмином, тогда как NH2-концевой пептид Ile1-Lys59 необходим для стабилизации структуры стрептокиназы (Shi et al., выше). Таким образом, можно сконструировать более устойчивую мутантную стрептокиназу путем сайт-направленного мутагенеза или другими подходящими способами генетического клонирования, в которых можно предотвратить ранний гидролиз плазмином пептидной связи Lys59-Ser60.
Мутантные формы стрептокиназы описаны, например, в патентах США № 587699, 5854049, 6413759, 6309873 и авторами Wu et al., Applied and Environmental Microbiology, 64:824-829 (1998), все из которых полностью включены в настоящее описание.
В одном варианте осуществления стрептокиназа представляет собой мутантную стрептокиназу, отличающуюся способностью к активации плазминогена в плазмин и сохраняющую устойчивость к расщеплению плазмина относительно соответствующей ей стрептокиназы дикого типа. В другом варианте осуществления стрептокиназа содержит аминокислотную последовательность, имеющую аминокислоту, отличную от лизина в положении, соответствующем положению 85, 412, или в обоих положениях в SEQ ID NO:1. В некоторых вариантах осуществления аминокислотой, отличной от лизина в положении, соответствующем положению 85, 412, или обоим положениям в SEQ ID NO:1, является аспарагин или глутамин. В одном варианте осуществления полипептид стрептокиназы содержит аминокислотную последовательность, показанную в SEQ ID NO:2 (таблица 2). В другом варианте осуществления полипептид стрептокиназы содержит аминокислотные остатки 27-440, показанные в SEQ ID NO:2 (таблица 2).
В других вариантах осуществления последовательность стрептокиназы необязательно, дополнительно содержит полярные или заряженные остатки в одном или нескольких положениях, соответствующих положениям 406-410 в SEQ ID NO:1.
2. Иммобилизованная стрептокиназа
Иммобилизованную стрептокиназу можно использовать для активации плазминогена в плазмин. Такой подход обеспечивает небольшое количество примесей в конечном препарате непосредственно со стрептокиназой, или их отсутствие. Существуют множество методик иммобилизации стрептокиназы.
Стрептокиназу можно адсорбировать на подходящую матрицу. Например, по публикациям известно, что стрептокиназа сохраняет способность к активации плазминогена в плазмин, если стрептокиназа плотно связана с нитроцеллюлозой (Kulisek et al., Analytical Biochemistry 177:78-84 (1989)). Также адсорбция стрептокиназы на подходящей ионнообменной смоле может приводить к ее иммобилизации с сохранением способности к активации плазминогена.
Иммобилизованная стрептокиназа была описана авторами Rimon et al., Biochem. Biophy. Acta 73:301 (1963), использовавшими диазотизированный сополимер p-аминофенилаланина и лейцина. Эти авторы использовали иммобилизованную стрептокиназу для изучения механизма активации плазминогена. Исследователи Sugitachi et al., Thrombos. Haemostas (Stuttg). 39:426 (1978) описали иммобилизацию активатора плазминогена урокиназы на нейлоне. В патенте США № 4305926, включенном в изобретение со ссылкой, предлагается иммобилизация стрептокиназы на биосовместимый полимер, такой как нейлон, дакрон, коллаген, поливинилпиролидин или сополимер p-аминофенилаланина и лейцина.
В одном варианте осуществления стрептокиназу иммобилизуют на поверхности, используя аффинную метку, как описано в патенте США № 6406921, который полностью включен в настоящее описание посредством ссылки. Поверхность может быть или органической или неорганической, биологической или небиологической, или представлять собой любую комбинацию указанных материалов. В одном варианте осуществления поверхность является прозрачной или просвечивающей. Для использования в качестве поверхностей подходит множество материалов. Например, поверхность может содержать материал, выбранный из группы, состоящей из силикона, кремния, кварца, стекла, стекла с регулируемыми порами, углерода, оксида алюминия, диоксида титана, германия, нитрида кремния, цеолитов и арсенида галлия. Ряд металлов, таких как золото, платина, алюминий, медь, титан и их сплавы также являются вариантами для поверхностей. Дополнительно, также можно использовать многие керамические и полимерные материалы. Полимеры, которые можно использовать в качестве поверхности, включают без ограничения следующее: полистирол; поли(тетра)фторэтилен; (поли)винилидендифторид; поликарбонат; полиметилметакрилат; поливинилэтилен; полиэтиленимин; поли(эфирэфир)кетон; полиоксиметилен (ПОМ); поливинилфенол; полилактиды; полиметакрилимид (ПМИ); полиалкенсульфон (ПАС); полигидроксиэтилметакрилат; полидиметилсилоксан; полиакриламид; полиимид; блок-сополимеры; и Eupergit™ Photoresists, полимеризированные пленки Ленгмюра-Блоджетта (Langmuir-Blodgett), и структуры LIGA, которые могут также служить в качестве поверхностей в настоящем изобретении.
Термин "аффинная метка", используемый в настоящем изобретении, относится к функциональной группе, способной к иммобилизации белка на функциональные группы, выступающие на поверхности. В некоторых случаях аффинной меткой может быть простая химическая функциональная группа. Другие варианты включают аминокислоты, полипептиды, белки, двухслойные липиды или гидрогель. Аффинная метка может быть соединена с белком или ковалентно, или нековалентно (например, посредством химического соединения или как слитый белок). Аналогично, аффинная метка может как ковалентно, так и нековалентно связываться с поверхностным слоем.
Термин "адапторная молекула" в настоящем изобретении означает любую структуру, которая связывает аффинную метку с белком. Адапторная молекула не должна быть обязательно дискретной молекулой, которая нековалентно присоединена как к аффинной метке, так и к белку. Адапторная молекула может ковалентно присоединяться к аффинной метке или к белку или к ним обоим (например, посредством химического соединения или как слитый белок). В некоторых случаях аффинная метка может также быть внутренней частью белка, например, аминокислотой. Примеры адапторных молекул включают полипептиды, белки, мембранные якоря и биотин.
Термин "слитый белок" относится к белку, состоящему из двух или больше полипептидов, которые в нативном состоянии обычно не являются соединенными, и которые соединяются пептидной связью посредством своих соответствующих амино- и карбокси-концов с образованием монолитного непрерывного полипептида. Подразумевается, что два или больше полипептидных компонента могут соединяться или прямым или опосредованным образом с помощью пептидного линкера/спейсера.
Поверхность может быть покрыта слоем органических молекул. Одна сторона слоя может состоять из химических функциональных групп на концах органических молекул, которые химически или физически сорбированы на материале поверхности (головные группы). Другая сторона слоя может выступать на поверхности и может иметь любое число химических функциональных групп (концевые группы). В некоторых вариантах осуществления молекулы слоя высоко упорядочены и плотно упакованы, в значительной степени благодаря ван-дер-ваальсовым и гидрофобным взаимодействиям между молекулами.
Аффинная метка может увеличивать иммобилизацию стрептокиназы на поверхности. Аффинная метка может увеличивать связывание или усиливать реакции стрептокиназы с функциональной группой. Пара аффинная метка/функциональная группа могут допускать иммобилизацию стрептокиназы на поверхности так, что не требуется жестких условий реакции, которые неблагоприятны для стабильности или функции стрептокиназы. Аффинная метка также может предусматривать иммобилизацию, которая является специфичной для обозначенного сайта или участка на стрептокиназе. Для ее осуществления присоединение аффинной метки к белку стрептокиназы должно быть сайт-специфичным. Такая сайт-специфичная иммобилизация может способствовать гарантии, что активный участок белка останется доступным для лигандов в растворе. Другое преимущество иммобилизации посредством аффинных меток состоит в том, что она позволяет применять общую стратегию иммобилизации с множеством различных белков.
В некоторых вариантах осуществления аффинная метка содержит по меньшей мере одну аминокислоту. Аффинная метка может быть полипептидом, содержащим по меньшей мере одну активную аминокислоту. Альтернативно, аффинная метка может быть одиночной аминокислотой активного слоя органической молекулы, такой как, например, цистеин, лизин, гистидин, аргинин, тирозин и глутамин. Полипептидная или аминокислотная аффинная метка предпочтительно экспрессируется как белок, слитый с белком. Аминокислотные метки несут или моноаминокислоту или ряд аминокислот, которые могут взаимодействовать с функциональной группой молекулярного слоя. Аминокислотные аффинной метки можно легко вставлять в рекомбинантные белки для облегчения ориентируемой иммобилизации с помощью ковалентного соединения с биореактивной Y-функциональной группой монослоя.
Аффинная метка может содержать поли(аминокислотную) метку. Поли(аминокислотная) метка представляет собой полипептид, который содержит от около 2 до около 100 остатков моноаминокислоты, необязательно прерываемых остатками других аминокислот. Например, аффинная метка может содержать полицистеин, полилизин, полиаргинин или полигистидин. Аминокислотные метки предпочтительно состоят из остатков моноаминокислоты в количестве от двух до двадцати, например, таких как гистидины, лизины, аргинины, цистеины, глутамины, тирозины или их любые комбинации.
В одном варианте осуществления аминокислотные метки из одной - двадцати аминокислот содержат по меньшей мере от одного до десяти цистеинов для тиоэфирной связи; или от одного до десяти лизинов для амидной связи; или от одного до десяти аргининов для присоединения к окружающим дикарбонильным группам. Рядовой специалист в данной области техники может легко соединять подходящие аффинной метки с заданными Y-функциональными группами.
Аминокислотная метка может располагаться на амино- или карбокси-конце белка стрептокиназы или где-либо между ними. При соответствии с функцией белка введенные для очистки белка аффинной метки предпочтительно расположены на C-конце рекомбинантного белка, для гарантии того, что в ходе очистки белка выделяют только полноразмерные белки.
Аффинной метки могут также содержать одну или несколько неприродных аминокислот. Неприродные аминокислоты можно вводить с помощью супрессорных тРНК, которые распознают терминирующие кодоны (то есть, амбер-кодоны) (Noren et al, Science, 1989, 244:182-188; Ellman et al., Methods Enzym., 1991, 202:301-336; Cload et al., Chem. Biol., 1996, 3:1033-1038). Осуществляют химическое аминоацилирование тРНК, чтобы они содержали химически измененные ("неприродные") аминокислоты для использования со специфичными химическими агентами присоединения (а именно, с кетонными модификациями, фотореактивными группами).
В некоторых вариантах осуществления аффинная метка содержит без оганичения целый белок, такой как глутатион- S-трансфераза, антитело, авидин или стрептапдивин.
Другие способы конъюгации и иммобилизации белка, известные в данной области техники, можно адаптировать с целью иммоблизации стрептокиназы на поверхности. Например, аффинная метка может представлять собой органический биоконъюгат, который химически присоединен к стрептокиназе. Биотин или антигены могут быть химически сшиты со стрептокиназой. Альтернативно, можно применять химический кросс-линкер, который присоединяет на поверхность стрептокиназы простую функциональную группу, такую как тиол или амин.
В других вариантах осуществления аффинная метка представляет собой компонент слоя аффинной метки, иммобилизованной на слое органических молекул на поверхности. Например, гидрогель, состоящий из такого материала, как декстран, может служить подходящим слоем аффинной метки. Использование таких гидрогелей для иммобилизации белка описаны в патенте США № 5242828. Другим вариантом материала, пригодного для образования слоя аффинной метки, является полилизин (как пример, см. патент США № 5629213). Слой аффинной метки также может состоять из фосфолипидного бислоя или фосфолипидного монослоя, как описано в публикации РСТ WO 96/38726.
Также в дополнительных вариантах осуществления адапторная молекула может связывать аффинную метку с иммобилизованной стрептокиназой. Может давать преимущество дополнительное пространство между белком и поверхностью, которое создается при помощи адапторной молекулы, поскольку белки могут иметь тенденцию к поверхностной инактивации. Рядовой специалист в данной области техники сможет выбрать адапторную молекулу, которая подходит для заданной аффинной метки. Например, если аффинной меткой является стрептапдивин, то адаптор может представлять собой молекулу биотина, химически конъюгированную со стрептокиназой, которую нужно иммобилизировать. Альтернативно, если аффинной меткой является фосфолипидный бислой или монослой, тогда в качестве подходящей адапторной молекулы можно выбирать мембранный якорь.
В одном варианте осуществления адапторная молекула является полипептидом, например, белком G или белком A. В другом варианте осуществления аффинная метка, адапторная молекула и белок вместе составляют слитый белок. Такой слитый белок можно легко экспрессировать с помощью стандартной технологии рекомбинантной ДНК. Адапторные белки являются особенно полезными для повышения растворимости рассматриваемого белка и увеличения расстояния между поверхностью и рассматриваемым белком. Примеры возможных адапторных белков включают глутатион-S-трансферазу (GST), мальтозо-связывающий белок, хитин-связывающий белок, тиоредоксин, зеленый флуоресцентный белок (GFP). GFP также можно применять для количественного анализа поверхностного связывания.
В другом варианте осуществления рекомбинантную стрептокиназу можно иммобилизировать с помощью аффинной хроматографии с использованием иммобилизованных металлов (IMAC). Этот хроматографический способ, который представляет собой особо чувствительную технологию разделения, также применим к большинству типов белков, является обычно применяемой технологией в схемах очистки вместе с другим этапом хроматографии, например, с ионнообменной хроматографией (ИОХ) и/или хроматографией гидрофобного взаимодействия (ХГВ).
Для IMAC применяют матрицы, которые содержат группу, способную к образованию хелата с ионом переходного металла, и указанный хелат в свою очередь используется в хроматографии в качестве лиганда для адсорбции соединения из жидкости. На силу связывания в IMAC преимущественно влияет вид иона металлов, уровень pH буферов и природа применяемого лиганда. Поскольку ионы металлов тесно связаны с матрицей, адсорбированный белок необязательно можно элюировать или путем снижения уровня pH или конкурентным элюированием.
В общем, IMAC пригодна для разделения белков или других молекул, которые представляют аффинность к иону переходного металла в матрице. Например, белки будут связываться с матрицей в присутствии доступных остатков гистидина, цистеина и триптофана, все из которых проявляют аффинность к хелатирующему металлу.
В одном варианте осуществления стрептокиназу можно метить одним или больше остатками гистидина для повышения их аффинности к металло-хелатирующим лигандам.
В качестве лигандов для IMAC были предложены простые хелаторы, такие как иминодиуксусная кислота (IDA). IDA, соединенную с агарозными основами и заряженную затем ионами разных металлов, таких как Cu2+, Zn2+ и Ni2+, использовали для захвата белков и пептидов, также она коммерчески доступна в виде смол. Более конкретно, патент США № 4551271 (Hochuli, переуступленный Hoffmann-La Roche Inc), который включен в настоящее изобретение со ссылкой, раскрывает смолу металло-хелатов, которая содержит ИДК-лиганды. Смолу согласно описанию можно изготовлять известным способом путем обработки агарозы эпихлоргидрином или эпибромгидрином, проведением реакции получаемого эпоксида с динатриевой солью иминоуксусной кислоты и превращения продукта в соль меди или цинка посредством промывания раствором меди (II) или цинка.
Оба патента - EP 87109892.7 (F. Hoffmann-La Roche AG) и эквивалентный патент США №4877830 (Döbeli et al., переуступленный Hoffmann-La Roche Inc), включены в настоящее изобретение со ссылкой на изложенную в них теорию иммобилизации белка с использованием смол металло-хелатов.
Патент WO 01/81365 (Sigma-Aldrich Co.), который включен в изобретение со ссылкой на изложенную в нем теорию композиций металло-хелатов, которые согласно описанию способны к образованию относительно устойчивых хелатов с ионами металлов и показывают улучшенную селективность для меченых полигистидином белков. Согласно приведенным примерам, раскрытые композиции соединяют с нерастворимым носителем, такому как СЕФАРОЗА™.
Ссылка на данные Lizano et al., J. Microbiol. Methods, 23:261-280 по использованию матрицы для иммобилизации рекомбинантного белка включена в настоящее изобретение.
Композиции по настоящему изобретению также могут доставляться в виде набора. Соответственно, в других аспектах настоящее изобретение относится к набору для получения плазмина. Набор содержит стрептокиназу, иммобилизованную на матрице, и эта стрептокиназа является мутантной стрептокиназой, отличающейся способностью к активации плазминогена в плазмин, при этом сохраняет устойчивость к расщеплению плазмином относительно соответствующей ей стрептокиназе дикого типа. Описание стрептокиназы приведено выше.
В одном варианте осуществления набор дополнительно содержит плазмин-связывающую матрицу с расположенной на ней молекулой, обладающей аффинностью к плазмину.
Наборы могут содержать различные компоненты в отдельных контейнерах. Например, контейнеры могут отдельно содержать стрептокиназу, матрицу и т.д. таким образом, что при объединении с другими компонентами набора создаются композиции и способы получения плазмина. Упакованные композиции и наборы настоящего изобретения также могут включать в себя инструкции для хранения, изготовления и тому подобное.
Настоящее изобретение будет более подробно описано посредством примеров, при этом необходимо отметить, что примеры не ограничивают объем изобретения.
ПРИМЕРЫ
Пример 1
Получение меченой рекомбинантной стрептокиназы
Синтезировали молекулу ДНК, показанную в фигуре 1 (а именно, SEQ ID NO:3), которая содержит последовательность нуклеиновой кислоты, кодирующей белок стрептокиназы с двойной мутацией (Blue Heron Biotech, Bothell, WA) и клонировали (для облегчения клонирования вставляли участки 5' BamHI и 3' Xhol) в коммерчески доступные векторы pET21b, pET32b и pET41b (EMD Chemicals, Inc (Novagen®), Gibbstown, NJ) для получения нескольких рекомбинантных полипептидов (фиг.2-4, соответственно), содержащих аминокислотные последовательности, соответствующие плазмин-резистентной стрептокиназе, которые присоединяются на C- и/или N-конце с разными метками, включающими в себя полигистидин, тиоредоксин и GST. Указанные метки способствуют аффинной очистке трех молекул рекомбинантной стрептокиназы с использованием соответствующих наборов смол и буферов согласно протоколам изготовителя и согласно описанию в руководстве Novagen® pET System Manual, 11-ый выпуск, которое включено в изобретение с его указаниями по направленному генному клонированию, экспрессии и аффинной очистки белков-мишеней.
Все три конструкции ДНК рекомбинантных стрептокиназ были трансформированы в E. coli - компетентные клетки BL21 (DE3) Gold (Stratagene, La Jolla, CA) и выращены с использованием среды Лурия-Бертани (LB). Обычно в течение ночи при 37°C выращивали около 0,5 мл культуры и использовали для инокуляции примерно 200 мл свежей среды LB. Для конструкций pET21b и pET32b к среде LB добавляли 50 мкг/мл ампициллина, тогда как конструкцию pET41b выращивали в присутствии 30 мкг/мл канамицина. Каждую культуру выращивали до значения OD595нм примерно 0,7 и затем индуцировали добавлением 1,0 мМ изопропил β-D-1-тиогалактопиранозида (IPTG). Через четыре часа выращивания при 37°C из культур путем центрифугирования собирали клетки и замораживали их до -20°C до использования.
Начальные этапы очистки рекомбинантной стрептокиназы для всех трех конструкций были сходными и включали в себя лизис клетки и осветление. Оттаявшую клеточную массу ресуспендировали в 20 мл реагента для экстракции бактериального белка (BPER) (Pierce, Rockford, IL), и затем культивировали при комнатной температуре в течение 10 минут. Лизированные культуры осветлялись центрифугированием в течение 20 минут при 15 К (ротор Sorvall SS34 в центрифуге RC5C) и фильтровались через фильтр 0,22 мкм.
Использовали кобальтовую заряженную хелатирующую колонку 5 мл HiTrap Chelating HP (GE Healthcare Bio-Sciences Corp, Piscataway, NJ) для очистки рекомбинантной стрептокиназы от культур, полученных от pET21b и pET32b (варианты, меченые полигистидином). Осветленный клеточный лизат вносили в заряженную HiTrap Chelating кобальтовую колонку со скоростью 5 мл/минуту после уравновешивания 20 мМ фосфатом натрия, 500 мМ NaCl и 10 мМ имидазола, с уровнем pH 7,4. После загрузки колонку интенсивно промывали вышеупомянутым буфером. Элюирование белка начинали с введения 20 мМ фосфата натрия, 500 мМ NaCl и 500 мМ имидазола с уровнем pH элюирующего буфера 7,4. Для контроля проведения очистки применяли измерение спектральной поглощательной способности при длине волны 280 нм, с использованием хроматографическего инструмента GE Healthcare AKTA Explorer. В процессе элюирования объединяли фракции, содержащие белок-мишень рекомбинантной стрептокиназы, что определяли электрофорезом SDS-PAGE, и заменяли буфер для дополнительной очистки с помощью анионобменной хроматографии.
Для дополнительной очистки элюированной фракции, полученной из иммобилизованной кобальтовой колонки использовали Q-сефарозную колонку 5 мл HiTrap (GE Healthcare Bio-Sciences Corp, Piscataway, NJ) с уравновешиваем 25 мМ Трис-HCl, и 1 мМ ЭДТА, уровень pH 8,0. После диализа в течение ночи против Q-сефарозного равновесного буфера объединенные фракции вносили в Q-сефарозную колонку со скоростью 5 мл/минуту. После загрузки колонку интенсивно промывали равновесным буфером. Белок элюировали из Q-сефарозной колонки путем применения элюирующего буфера NaCl (25 мМ Трис-HCl, 1,0 мМ NaCl и 1 мМ ЭДТА, уровень pH 8,0). Для элюирования белка-мишени использовали градиент элюирующего буфера 0-100 %, который создавали в течение 20 минут.
Слитый белок pET41 GST очищали из осветленного клеточного лизата, используя колонку 5 мл GSTrap FF (GE Healthcare Bio-Sciences Corp, Piscataway, NJ). Осветленный клеточный лизат вносили в колонку с уравновешиванием фосфатно-буферным раствором (ФБР). После загрузки осуществляли обильное промыванием ФБР, и элюировали белок с 50 мМ Трис-HCl и 10 мМ глутатиона, уровень pH 8,0. Идентификацию всех трех очищенных белков подтверждали с помощью SDS-PAGE, анти-стрептокиназного вестерн-блоттинга и анализов активации.
Фиг.5 показывает пример очищенной рекомбинантной стрептокиназы с окрашиванием Кумаси синим с гелем SDS-PAGE, а также очищенного рекомбинантного плазминогена.
Пример 2
Получение иммобилизованной меченой полигистидином плазмин-резистентной мутантной стрептокиназы
Меченую гистидином (устойчивую к плазмину) стрептокиназу (100 мкг) в 10 мМ Трис-HCl (уровень pH 8,0) и 100 мМ NaCl добавляли к 100 мкл металло-хелатирующей матрице аффинности IMAC. После инкубации при 22°C в течение 5 минут кашицу переносили в микроцентрифужную колонку Spin-X (Costar, Cambridge, MA), снабженную целлюлозно-ацетатным фильтром 0,45 мкм. Матрицу пеллетировали центрифугированием при 2000 г в течение 3 минут и затем несколько раз промывали 20 мМ Трис-HCl с уровнем pH 7,4. Матрицу удаляли из устройства Spin-X, помещали в микроцентрифужную пробирку и ресуспендировали в 200 мл 50 мМ буфера Трис-HCl с уровнем pH 7,4.
Пример 3
Получение плазминогена
Полученный из плазмы плазминоген можно получать, например, согласно описанию патентов США № 6964764 и 6969515, которые включены в настоящее изобретении со ссылкой во всей полноте. Например, плазминоген очищали из пасты Cohn Fraction II+III афинной хроматографией на Lys-сефарозе, как описано авторами Deutsch et al., Science, 170:1095 (1970). А именно, 200 г пасты ресуспендировали в 2 литрах 0,15M буфера цитрата натрия с уровнем pH 7,8. Суспензию инкубировали в течение ночи при 37°C, центрифугировали при 14000 оборотах в минуту, фильтровали через стекловолокно и смешивали с 500 мл Lys-сефарозы 4B (Pharmacia). Связывание плазминогена происходило при комнатной температуре в течение 2 часов. Затем Lys-сефарозу переносили на стеклянный фильтр объемом 2 литра и несколько раз промывали 0,15 M цитрата натрия, содержащей 0,3M NaCl, пока спектральная поглощательная способность при 280 нм не уменьшалась ниже 0,05. Связанный плазминоген элюировали тремя порциями по 200 мл 0,2 M ε-аминокапроновой кислоты. Элюированный плазминоген осаждали 0,4 г твердого сульфата аммония /на мл раствора плазминогена. Осадок из неочищенного плазминогена (с чистотой 80-85%) можно сохранять при 4°C.
Пример 4
Активация плазминогена в плазмин с использованием иммобилизованной меченой полигистидином плазмин-резистентной мутантной стрептокиназы
Эквимолярное количество плазминогена добавляли к иммобилизованной стрептокиназе в 50 мМ буфера Триса-HCl с уровнем pH 7,4. Образцы культивировали при 22°C и помещали на вращающуюся платформу, для поддержания матрицы в виде суспензии. После завершения активации раствор плазмина фильтровали от стрептокиназы-СЕФАРОЗЫ на стеклянном фильтре и немедленно переносили на бензамидин-СЕФАРОЗУ.
Для контроля процесса активации плазминогена с разными интервалами собирали образцы, и завершали реакцию добавлением 0,1 объема 10X останавливающего буфера (1,0 М NaHCO3, 1,0 М ε-аминокапроновой кислоты [уровень pH 9,4]). Образец переносили в микроцентрифужную пробирку Spin-X и пеллетировали центрифугированием при 2000 г в течение 3 минут. Иммобилизованные реагенты элюировали добавлением 25 мл 100 мМ ЭДТА, с последующим центрифугированием при 5000 г в течение 10 мин. Образцы подготавливали для анализа SDS-PAGE добавлением 25 мл SDS буфера 23, содержащего β-меркаптоэтанол, кипятили в течение 5 минут и переносили в SDS-10% полиакриламидный гель.
Пример 5
Активация рекомбинантного плазминогена меченой плазмин-резистентной стрептокиназой в растворе
Очищенную рекомбинантную стрептокиназу, полученную с экспрессией конструкции pET21b, подвергали диализу против 25 мм Трис-HCl, уровень pH 7,0, 100 мМ ε-аминокапроновой кислоты, 1 мМ ЭДТА и 25% глицерина (объем:объем). Аффинно-очищенный рекомбинантный плазминоген смешивали в том же буфере с рекомбинантной стрептокиназой в молярных соотношениях 100:1, 10:1 и 1:1. Количество стрептокиназы в каждой из этих трех реакций считалось постоянным, тогда как количество рекомбинантного плазминогена варьировали, чтобы получить разные молярные отношения рекомбинантного плазминогена к стрептокиназе. Эти два компонента смешивали и культивировали при комнатной температуре в течение 18 часов. В точки времени 0, 1, 2, 3, 4 и 18 часов в реакцию активации переносили аликвотное количество смеси и подготавливали ее для электрофореза SDS-PAGE. Образцы SDS-PAGE обрабатывали согласно протоколу подготовки образцов NuPAGE Novex BisTris (Invitrogen, Carlsbad, CA) c применением восстанавливающих условий. Для экспериментов SDS-PAGE использовали 4-12% гели BisTris в буфере MOPS.
Как показано в фиг.6 для молярного соотношения 100:1 рекомбинантного плазминогена к рекомбинантной стрептокиназе, SDS-PAGE выявил очевидную активацию рекомбинантного плазминогена в рекомбинантный плазмин с помощью рекомбинантной стрептокиназы. Динамика активации выявила превращение рекомбинантного плазминогена в рекомбинантный плазмин в начале реакции, что подтвержает образование двух полос при восстанавливающих условиях PAGE. Наблюдаемая полоса, мигрирующая около маркера 28 кД, представляет собой область протеазы серина рекомбинантного плазминогена, тогда как меньшая полоса, мигрирующая непосредственно выше маркера 14 кД, является крингл-доменом. Появлению этих двух полос сопутствует исчезновение исходного материала рекомбинантного плазминогена в 39 кД. В точке времени реакции t=18 часов почти весь рекомбинантный плазминоген был превращен в рекомбинантный плазмин.
Для молярного соотношения реакции 10:1 применение SDS-PAGE было возможно только для отслеживания эксперимента, тогда как общее количество белка, присутствующего в эксперименте при молярном соотношении 1:1 было слишком малым для контроля SDS-PAGE (данные не показаны).
По данным SDS-PAGE геля, показанным в фиг.6, очевидно, что очищенная рекомбинантная стрептокиназа (конструкция pET 21b) обладает способностью превращать рекомбинантный плазминоген в рекомбинантный плазмин.
Для контроля пути рекомбинантной стрептокиназы в реакциях активации было необходимо следить за ходом реакии с помощью вестерн-блоттинга. Во всех трех случаях реакций наблюдали динамику гелей SDS-PAGE, как указано выше, и затем переносили их на мембраны PVDF соответственно протоколу модуля окрашивания Novex X Cell II (Invitrogen, Carlsbad, CA). Блокирование мембраны PVDF осуществляли 1% раствором бычьего сывороточного альбумина (БСА) в фосфатно-буферном растворе (Sigma-P3688, St-Louis, MO), при этом для всех растворов для промывания и разведения антител применяли Трис-буферный раствор (Sigma-T9039, St-Louis, MO). После электрофоретического переноса и блокирования мембраны PVDF исследовали пятно с поликлональным кроличьим анти-стрептокиназным антителом (AbD Serotec (0100-0173), Raleigh, NC) с использованием стокового 1° антитела в разведении 1:4000. Для визуализации фрагментов стрептокиназа использовали козьи антикроличьи IgG антитела (Sigma-A3937, St-Louis, MO), меченые щелочной фосфатазой, в разведении 1:5000, в соединении с субстратом Sigma Fast BCIP/NBT (Sigma-B5655, St-Louis, MO).
Как показано в фиг.7, в условиях реакции при культивировании рекомбинантного плазминогена с рекомбинантной стрептокиназой (молярное соотношение 100:1), молекулы стрептокиназы подвергались протеолизу к некоторым видам время-зависимым образом. Начальное протеолитическое отсечение удаляло небольшую часть полипептидного скелета, что подтверждалось вестерн-блоттингом по образованию полосы ниже маркера 51 кД. С течением времени реакции этот фрагмент дополнительно расщеплялся и проходил через некоторые транзиторные виды, до образования устойчивого вида, который перемещался выше маркеров ММ 39 и 51 кД. Начальное появление нечеткой полосы в той же локализации на пятне было обусловлено кросс-реактивностью 1° антитела к полноразмерному рекомбинантному плазминогену. Оба из контрольного рекомбинантного плазминогена (полоса 7) и образца реакции в точке времени t=0 (полоса 1) продемонстрировали такую кросс-реактивность. При более продолжительном времени реакции с поглощением рекомбинантного плазминогена происходило уменьшение нечеткой полосы, и появлялась новая отчетливая полоса, отображающая коровый фрагмент стрептокиназы. Кросс-реактивность также была очевидной с доменом рекомбинантного плазмина протеазы серина (SP) (данные не показаны).
В эксперименте с молярным соотношением 1:1 скорость активации была значительно снижена (данные не показаны). Первые признаки протеолиза стрептокиназы были заметными в точке времени реакции t=4 часа. В этих условиях реакции создавался очень устойчивый стрептокиназный фрагмент, даже на момент реакции t=18 часов. Вероятно, это было результатом связывания всей присутствующей стрептокиназы в комплекс с рекомбинантным плазмином, при очень небольшом количестве свободного рекомбинантного плазмина, доступного для расщепления молекул рекомбинантной стрептокиназы.
Результаты показывают, что в начале реакции активации рекомбинантная стрептокиназа разрушается на ряд транзиторных видов, но позже с течением времени образует стабильный полипептид с ММ заметно выше 39 кД.
Пример 6
Захват плазмина на бензамидин-СЕФАРОЗУ
Афинная хроматография представляет собой полезную технологию очистки белка. Поскольку рассматриваемый белок является активной протеазой серина (то есть, плазмином) с трипсино- подобной специфичностью, в качестве аффинного сорбента была выбрана бензамидин-СЕФАРОЗА, которая будет допускать захват только активного плазмина и игнорировать различные примеси и продукты расщепления плазминогена. Захват плазмина, элюирование и создание рецептуры описаны, например, в патенте США № 6355243, который полностью включен в изобретение со ссылкой.
Полностью активированный раствор плазминогена в 50% глицерине вносили в колонку 50 мл с бензамидин-СЕФАРОЗОЙ, уравновешивали 0,05 М Трис с уровнем pH 8,0, 0,5 М NaCl при скорости потока 3 мл/в минуту. Поддерживали колонку при 3 мл/в минуту при 4°C.
Пример 7
Элюирование связанного плазмина с буфером с низким уровнем pH
Для предохранения плазмина от инактивации при нейтральном уровне pH выбирали кислые условия элюирования. Плазмин, связанный с бензамидин-СЕФАРОЗОЙ, элюировали 0,2 М глициновым буфером, уровень pH 3,0, содержащем 0,5 М NaCl. Пик связывания обычно делится на три пула: две небольших передних части пика, В1 и B2, и основная часть элюированного материала, B3.
Пример 8
Получение элюированного материала в окисленной воде
Элюированный плазмин подвергали диализу водой, которая была окислена, например, до уровня pH от около 3,3 до около 3,7 ледяной уксусной кислотой. Первоначально, такие условия растворения были выбраны просто для сохранения активного плазмина в ходе его получения для будущих процедур получения препарата, таких как лиофилизация, замораживание, изменение условий растворения и так далее. Все эти перечисленные процедуры легче осуществлять с небуферным раствором с низкой ионной силой. Вместе с тем, авторы настоящего изобретения обнаружили, что плазмин чрезвычайно устойчив в окисленной воде и может эффективно применяться в этой форме в исследованиях in vitro и in vivo.
Реферат
Изобретение относится к биотехнологии и представляет собой иммобилизованную на матрице стрептокиназу, активирующую плазминоген в плазмин. Такая стрептокиназа устойчива к расщеплению плазмином по сравнению с соответствующей ей стрептокиназой дикого типа и содержит аминокислотную последовательность, имеющую аспарагин в положениях, соответствующих положениям 85 и 412 в SEQ ID NO:1. Изобретение относится также к иммобилизованной указанной стрептокиназой матрице, способу получения плазмина и набору для получения плазмина. Изобретение позволяет сохранить функциональные характеристики стрептокиназы с одновременным повышением устойчивости к расщеплению плазмином при иммобилизации ее на матрицу. 4 н. 3 з.п. ф-лы, 7 ил, 8 пр., 2 табл.
Формула
a) контактирование иммобилизованной на матрице стрептокиназы по п.1 или иммобилизованной стрептокиназой матрицы по п.2 с плазминогеном, с превращением таким образом плазминогена в плазмин; и
b) очистку плазмина.
a) иммобилизованную на матрице стрептокиназу по п.1; и
b) плазмин-связывающую матрицу с расположенной на ней молекулой, обладающей аффинностью к плазмину.

Комментарии