Способ продукции пуриновых нуклеозидов и нуклеотидов методом ферментации с использованием бактерий, принадлежащих к роду escherichia или bacillus - RU2365622C2
Код документа: RU2365622C2
Чертежи

Описание
Область техники
Настоящее изобретение относится к способу получения пуриновых нуклеозидов, являющихся важным исходным реагентом для синтеза 5'-инозиновой кислоты или 5'-гуаниловой кислоты, и к новому микроорганизму, используемому для их продукции.
Предшествующий уровень техники
Обычно пуриновые нуклеозиды, такие как инозин, гуанозин и ксантозин, получают в промышленном масштабе методом ферментации с использованием штаммов микроорганизмов, ауксотрофных по аденину. С другой стороны, таким штаммам может быть дополнительно придана устойчивость к различным соединениям, таким как аналоги пуринов и сульфагуанидин. Указанные штаммы принадлежат к роду Bacillus (патентные заявки Японии 38-23039 (1963), 54-17033 (1979), 55-2956 (1980) и 55-45199 (1980), выложенная патентная заявка Японии 56-162998 (1981), патентные заявки Японии 57-14160 (1982) и 57-41915 (1982), выложенная патентная заявка Японии 59-42895 (1984)), к роду Brevibacterium (Corynebacterium) (патентные заявки Японии 51-5075 (1976) и 58-17592 (1972), и Agric. Biol. Chem., 42, 399 (1978)), к роду Escherichia (заявка РСТ WO 9903988) и подобные им.
Получение указанных мутантных штаммов обычно состоит из обработки микроорганизмов с целью получения мутаций, такой как облучение УФ-излучением или обработка нитрозогуанидином (N-метил-N'-нитро-N-нитрозогуанидин), с последующей селекцией нужного штамма на подходящей селективной питательной среде. С другой стороны, также практикуется выращивание мутантных штаммов, принадлежащих к роду Bacillus (выложенные патентные заявки Японии 58-158197 (1983), 58-175493 (1983), 59-28470 (1984), 60-156388 (1985), 1-27477 (1989), 1-174385 (1989), 3-58787 (1991), 3-164185 (1991), 5-84067 (1993) и 5-192164(1993)), к роду Brevibacterium (Corynebacterium) (выложенная патентная заявка Японии 63-248394 (1988)) и к роду Escherichia (заявка РСТ WO9903988), полученных с использованием методов генной инженерии.
Продуктивность штаммов - продуцентов пуринового нуклеозида далее может быть улучшена путем увеличения способности к экскреции пуринового нуклеозида. В настоящее время общепризнано, что проникновение метаболитов через цитоплазматическую мембрану обычно происходит с участием более или менее специфических транспортных белков, осуществляющих их выброс (Рао, S.S. et al, Microbiol. Mol. Biol. Rev., 62 (1), 1-34, (1998); Paulsen I.T. et al, J. Mol. Biol., 277, 573-592, (1998); Saier M.H. et al, J. Mol. Microbiol. Biotechnol., 1, 257-279, (1999)). Ранее авторы настоящего изобретения показали, что штаммы - продуценты инозина или ксантозина, принадлежащие к роду Escherichia и к роду Bacillus и обладающие повышенной активностью белка RhtA, кодируемого геном rhtA (ybiF), продуцировали больше инозина или ксантозина, чем родительские штаммы (патент РФ 2239656). Кроме того, штаммы-продуценты инозина, принадлежащие к роду Escherichia, обладающие повышенной активностью белков YijE, YdeD, или YicM, кодируемых генами yijE, ydeD или yicM соответственно, продуцировали больше инозина, чем родительские штаммы (патенты РФ 2244003, 2244004, 2271391 соответственно).
Ранее авторы настоящего изобретения обнаружили, что ген yeaS (leuE) из Е.coli кодирует мембранный белок, который принадлежит к семейству транспортных белков RhtB, осуществляющих выброс аминокислот (Aleshin V.V., et al., TIBS, 24:133-135 (1999)). В частности, этот ген кодирует экспортер лейцина, гистидина и метионина (Kutukova E.A., et al., FEBS Letters, 579, 4629-4534, 2005).
Подробное описание наилучшего способа осуществления изобретения
Целью настоящего изобретения является увеличение продуктивности пуриновых нуклеозидов штаммами-продуцентами пуриновых нуклеозидов и предоставление способа получения пуриновых нуклеозидов с использованием указанных штаммов.
Данная цель была достигнута путем установления того факта, что ген yeaS, предположительно кодирующий экспортер аминокислот, придает устойчивость к аналогам пуриновых оснований, 8-азааденину, 2,6-диаминопурину, 6-меркаптопурину и 6-тиогуанину, в случае, когда природный аллель указанного гена введен в клетки штамма бактерий на многокопийной плазмиде. Более того, ген yeaS может увеличивать продукцию нуклеозидов в случае, когда указанный ген под контролем конститутивного промотора введен в клетки соответствующих продуцентов пуриновых нуклеозидов, принадлежащих к роду Escherichia или к роду Bacillus. Так было совершено настоящее изобретение.
Таким образом, настоящее изобретение предоставляет микроорганизм, принадлежащий к роду Escherichia или к роду Bacillus, обладающий способностью к продукции пуриновых нуклеозидов.
В частности, настоящее изобретение предоставляет микроорганизм с повышенной способностью к продукции пуринового нуклеозида, основанной на повышении активности белка, вовлеченного, как предполагается, в транспорт пуриновых нуклеозидов из клетки указанного микроорганизма. Более конкретно, настоящее изобретение предоставляет микроорганизм с повышенной способностью к продукции пуринового нуклеозида, основанной на повышении экспрессии гена, кодирующего белок, вовлеченный в процесс экскреции пуриновых нуклеозидов.
Далее настоящее изобретение предоставляет способ получения пуринового нуклеозида методом ферментации, включающим стадии выращивания указанного выше микроорганизма в питательной среде с целью продукции и накопления пуринового нуклеозида в питательной среде, и выделения пуринового нуклеозида из культуральной жидкости.
Далее настоящее изобретение предоставляет способ получения 5'-инозиновой кислоты или 5'-гуаниловой кислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного инозина или гуанозина и выделения полученной и накопленной 5'-инозиновой кислоты или 5'-гуаниловой кислоты.
Целью настоящего изобретения является предоставление бактерии, принадлежащей к роду Escherichia или к роду Bacillus, обладающей способностью к продукции пуринового нуклеозида, при этом в бактерии повышена активность белка, выбранного из группы, состоящей из:
(А) белка, включающего аминокислотную последовательность, показанную на SEQ ID NO: 2; и
(Б) белка, включающего аминокислотную последовательность, показанную на SEQ ID NO: 2, при этом один или несколько аминокислотных остатков в указанной последовательности заменены, делетированы, вставлены, добавлены или инвертированы, и обладающего активностью, которая придает бактерии устойчивость к 8-азааденину, 6-меркаптопурину или 6-тиогуанину.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом активность белка, описанного выше, повышена путем трансформации бактерии с помощью фрагмента ДНК, кодирующего белок, как описано выше, или путем изменения регуляции экспрессии указанного фрагмента ДНК в хромосоме упомянутой бактерии таким образом, что экспрессия этого фрагмента ДНК усиливается.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом трансформация осуществляется с использованием многокопийного вектора.
Также целью настоящего изобретения является предоставление способа получения пуринового нуклеозида, включающего стадии выращивания бактерии, описанной выше, в питательной среде и выделения из культуральной жидкости накопленного в ней пуринового нуклеозида.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом бактерия модифицирована таким образом, чтобы усилить в ней экспрессию гена, вовлеченного в биосинтез пуринового нуклеозида.
Также целью настоящего изобретения является предоставление способа получения 5'-пуринового нуклеотида, который включает стадии выращивания бактерии, описанной выше, в питательной среде, фосфорилирования пуринового нуклеозида и выделения 5'-пуринового нуклеотида.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом бактерия модифицирована таким образом, чтобы усилить в ней экспрессию гена, вовлеченного в биосинтез пуринового нуклеозида.
Более детально настоящее изобретение описано ниже.
1. Бактерия согласно настоящему изобретению.
Бактерией согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia или к роду Bacillus, обладающая способностью к продукции пуринового нуклеозида, в которой повышена активность некоего белка. В качестве белка, чья активность в указанной бактерии повышена, может выступать белок с аминокислотной последовательностью, показанной на SEQ ID NO: 2, или белок, включающий аминокислотную последовательность, показанную на SEQ ID NO: 2, при этом один или несколько аминокислотных остатков заменены, делетированы, вставлены, добавлены или инвертированы и обладающий активностью, которая придает бактерии устойчивость к 8-азааденину, 6-меркаптопурину или 6-тиогуанину. Термин «бактерия, принадлежащая к роду Escherichia или к роду Bacillus» или «бактерия рода Escherichia или рода Bacillus)) означает, что бактерия относится к роду Escherichia или к роду Bacillus в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (E.coli). Примеры микроорганизмов, принадлежащих к роду Bacillus, включают Bacillus subtilis. Bacillus amyloliquefaciens, and Bacillus pumilus. Примеры штаммов Bacillus subtilis включают штамм Bacillus subtilis 168 Marburg (ATCC6051) и штамм Bacillus subtilis PY79 (Plasmid, 1984, 12, 1-9). Примеры штаммов Bacillus amyloliquefaciens включают штамм Bacillus amyloliquefaciens Т (АТСС 23842) и штамм Bacillus amyloliquefaciens N (АТСС 23845).
Использованный здесь термин «способность к продукции пуринового нуклеозида» означает способность к продукции и накоплению инозина, гуанозина, ксантозина или аденозина в питательной среде. Термин «бактерия, обладающая способностью к продукции пуринового нуклеозида» означает то, что бактерия, принадлежащая к роду Escherichia или к роду Bacillus, обладает способностью к продукции и накоплению в питательной среде инозина, гуанозина, ксантозина или аденозина в количестве, большем, чем природный штамм E.coli, такой как штаммы E.coli W3110 и MG1655, или природный штамм В. Amyloliquefaciens, такой как штамм В. amyloliquefaciens К. Предпочтительно это означает, что микроорганизм способен к продукции и накоплению в питательной среде инозина, гуанозина, ксантозина или аденозина в количестве не менее чем 10 мг/л, более предпочтительно не менее чем 50 мг/л.
Термин «активность белка повышена» означает, что количество молекул указанного белка в клетке повышено, или сама активность в пересчете на белок повышена. Термин «активность» означает активность, придающую бактерии устойчивость к 8-азааденину, 2,6-диаминопурину или 6-тиогуанину.
К белкам согласно настоящему изобретению относятся белки, описанные в следующих пунктах (А) или (Б):
(А) белок, который представлен аминокислотной последовательностью, показанной на SEQ ID NO: 2;
(Б) белок, который представлен аминокислотной последовательностью, показанной на SEQ ID NO: 2, в которой один или несколько аминокислотных остатков заменены, делетированы, вставлены, добавлены или инвертированы и который при этом обладает активностью, придающей бактерии устойчивость к 8-азааденину, 2,6-диаминопурину или 6-тиогуанину. Белок согласно настоящему изобретению может быть назван белком YeaS. Белок YeaS является высокогидрофобным белком, состоящим из 212 аминокислотных остатков и содержащим 6 предполагаемых трансмембранных сегментов, однако функция этого белка остается неизвестной (http://ecocyc.org, http://www.tcdb.org).
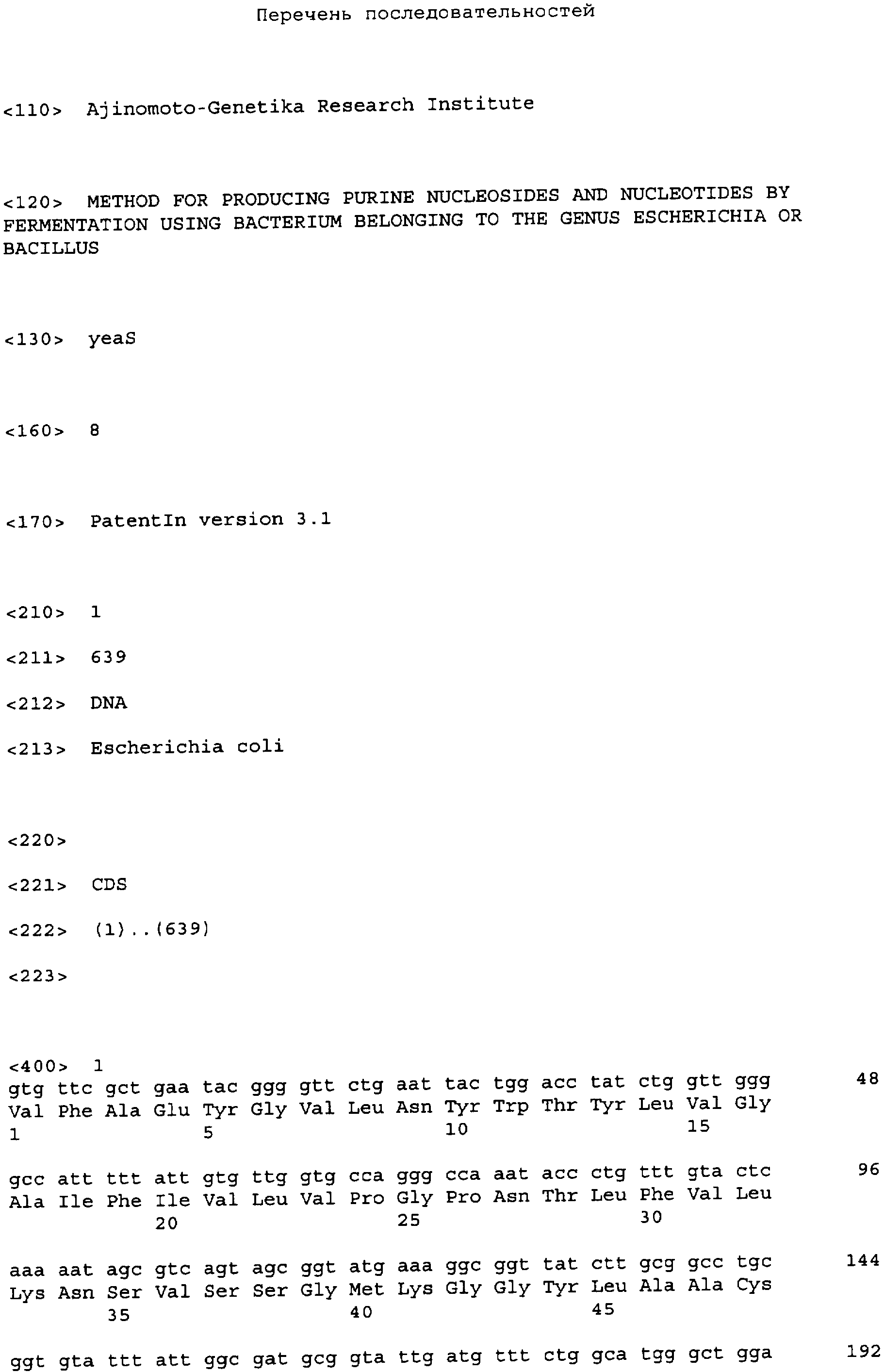
Белок YeaS кодируется геном yeaS. Ген yeaS (нуклеотиды с 1,878,145 по 1,878,783 в последовательности с инвентарным номером NC_000913 в базе данных GenBank) расположен на хромосоме Е. coli между генами yeaR и уеаТ. Ген yeaS (в настоящее время переименованный в leuE) может кодировать белок, который участвует в экспорте аминокислоты из клетки (патент РФ 2175351; Aleshin V.V., et al., TIBS, 24:133-135 (1999); Kutukova E.A., et al., FEBS Letters, 579: 4629-4534 (2005)).
Количество «нескольких» аминокислотных остатков, которые могут быть делетированы, заменены, вставлены или добавлены, различается в зависимости от положения и типа аминокислотного остатка в трехмерной структуре белка. Оно может быть от 1 до 27, предпочтительно от 1 до 15 и более предпочтительно от 1 до 5 для белка, показанного на SEQ ID NO: 2.
Термин «повышенная устойчивость к 8-азааденину, 2,6-диаминопурину или 6-тиогуанину» означает способность бактерии к росту на минимальной питательной среде, содержащей 8-азааденин, 2,6-диаминопурин, или 6-тиогуанин в концентрации, при которой природный или родительский штамм не может расти, или способность бактерии расти на питательной среде, содержащей 8-азааденин, 2,6-диаминопурин или 6-тиогуанин, с большей скоростью, чем природный или родительский штамм. Упомянутая выше концентрация аналогов пуринового основания составляет обычно от 10 до 5000 мкг/мл, предпочтительно от 50 до 1000 мкг/мл.
Методы увеличения активности белка согласно настоящему изобретению, в особенности методы увеличения количества молекул указанного белка в клетке, включают методы изменения последовательности, регулирующей экспрессию фрагмента ДНК, кодирующего белок согласно настоящему изобретению, и методы увеличения числа копий гена, но не ограничиваются только ими.
Изменение последовательности, регулирующей экспрессию фрагмента ДНК, кодирующего белок согласно настоящему изобретению, может быть достигнуто путем помещения фрагмента ДНК, кодирующего белок согласно настоящему изобретению, под контроль сильного промотора. В качестве сильных промоторов известны, например, lac промотор, trp промотор, промотор гена nlpD, trc промотор, PL промотор фага лямбда, промотор гена repA на плазмиде pLF22. С другой стороны, промотор может быть усилен, например, путем введения мутации в указанный промотор с целью увеличения уровня транскрипции гена, расположенного после промотора. Далее, известно, что замена нескольких нуклеотидов в участке между местом связывания рибосомы (RBS) и старт-кодоном, а в особенности в последовательности непосредственно перед старт-кодоном, в значительной степени влияет на уровень трансляции мРНК. Например, было обнаружено 20-кратное изменение уровня экспрессии в зависимости от природы трех нуклеотидов, предшествующих старт-кодону (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984). Помимо этого экспрессия фрагмента ДНК, кодирующего белок согласно настоящему изобретению, в клетках бактерий рода Bacillus может быть достигнута путем размещения фрагмента ДНК после RBS, специфичного для бактерий рода Bacillus, например RBS гена purE из В. subtilis (см. Пример 4).
Более того, некий «энхансер» может быть дополнительно введен с целью увеличения уровня транскрипции указанного гена. Введение фрагмента ДНК, содержащего либо ген, либо промотор, в хромосомную ДНК описано, например, в выложенной патентной заявке Японии 1-215280 (1989).
В качестве альтернативы число копий гена может быть увеличено путем введения гена в многокопийный вектор с образованием рекомбинантной ДНК, с последующим введением такой рекомбинантной ДНК в микроорганизм. Примерами векторов, использующихся для введения рекомбинантной ДНК, являются плазмидные векторы, такие как pMW118, pBR322, pUC19, pBluescript KS+ pACYC177, pACYC184, pOK12, pAYC32, pMW119, pET22b, вектора-переносчики из E.coli - B.subfilis, такие как pHY300PLK, pGK12, pLF14, pLF22 и подобные им, фаговые вектора, такие как 11059, 1BF101, M13mp9, фаг Mu (выложенная патентная заявка Японии 2-109985) и подобные им, и транспозоны (Berg, D.E. and Berg, C.M., Bio/Technol., 1, 417 (1983)), такие как Mu, Tn10, Tn5 и подобные им. Кроме того, усиление экспрессии гена может быть достигнуто путем интеграции гена в бактериальную хромосому методом гомологичной рекомбинации или подобным ему методом.
Методы использования сильного промотора или «энхансера» могут быть скомбинированы с методами увеличения числа копий гена.
Методами получения хромосомной ДНК, гибридизации, полимеразной цепной реакции (ПЦР), получения плазмидной ДНК, расщепления и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве затравок и подобными методами могут являться традиционные методы, хорошо известные специалисту в данной области. Эти методы описаны в книге Sambrook, J., and Russell D., "Molecular Cloning A Laboratory Manual, Third Edition", Cold Spring Harbor Laboratory Press (2001) и других подобных изданиях.
Для выведения микроорганизма, принадлежащего к роду Escherichia и обладающего повышенной экспрессией гена, кодирующего белок согласно настоящему изобретению, необходимые участки генов могут быть получены с помощью ПЦР на основе уже доступной информации о генах E.coli. Например, ген yeaS, который, как предполагается, кодирует транспортер, может быть клонирован из хромосомной ДНК штаммов E.coli К12 W3110 и E.coli MG1655 с использованием метода ПЦР. Хромосомная ДНК, используемая для этих целей, также может быть получена из любого другого штамма E.coli.
К белкам согласно настоящему изобретению относятся мутанты и варианты белка YeaS, которые могут существовать вследствие природного разнообразия, при условии, что указанные мутанты и варианты демонстрируют функциональные свойства белка YeaS, по крайней мере, устойчивость к 8-азааденину, 2,6-диаминопурину, 6-меркаптопурину или 6-тиогуанину. Фрагмент ДНК, кодирующий указанные мутанты и варианты, может быть получен путем выделения молекулы ДНК, которая гибридизуется с геном yeaS М (SEQ ID NO: 1) или частью указанного гена в жестких условиях, и которая кодирует белок, увеличивающий продукцию инозина. Термин «жесткие условия», упомянутый здесь, означает условия, при которых образуются так называемые специфические гибриды, а неспецифические - не образуются. Например, к жестким условиям относятся условия, при которых гибридизуются фрагменты ДНК, обладающие высокой степенью гомологии, к примеру, фрагменты ДНК, обладающие гомологией не менее 70%, 80%, 90% или 95%, друг относительно друга. В качестве варианта примером жестких условий являются условия, соответствующие условиям отмывки при гибридизации по Саузерну, например 60°С, 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS. В качестве зонда для фрагмента ДНК, кодирующего варианты и гибридизующегося с геном yeaS, также может быть использована часть нуклеотидной последовательности, показанная на SEQ ID NO:1. Зонд подобного рода может быть получен в результате ПЦР с использованием в качестве затравок олигонуклеотидов, полученных на основе нуклеотидной последовательности, показанной на SEQ ID NO: 1, и фрагмента ДНК, содержащего нуклеотидную последовательность, показанную на SEQ ID NO: 1, в качестве матрицы. В случае, когда в качестве зонда используется фрагмент ДНК длиной около 300 пар оснований, условия отмывки при гибридизации соответствуют, например, 50°С, 2×SSC и 0.1% SDS.
До тех пор, пока ферментативная активность белка YeaS сохраняется, ген, кодирующий белок YeaS, может кодировать белок, имеющий аминокислотную последовательность, показанную на SEQ ID NO: 2, при этом один или несколько аминокислотных остатков в указанной последовательности могут быть заменены, делетированы, вставлены или добавлены в одном или в нескольких положениях. При этом, хотя количество «несколько» зависит от типа аминокислотного остатка и его положения в трехмерной структуре белка, оно означает от 1 до 30, предпочтительно от 1 до 20 и более предпочтительно от 1 до 10.
Описанная выше мутация в аминокислотной последовательности белка, показанной на SEQ ID NO: 2, предпочтительно является консервативной мутацией, которая не снижает ферментативную активность белка. Замена означает мутацию, в результате которой, по крайней мере, один аминокислотный остаток в аминокислотной последовательности удаляют, а один или более остатков вставляют на его место. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Туr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr or Ala, замену Thr на Ser или Ala, замену Trp на Phe или Туr, замену Туr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Бактерия согласно настоящему изобретению может быть получена путем введения вышеуказанных фрагментов ДНК в бактерию, уже обладающую способностью к продукции пуринового нуклеозида. С другой стороны, бактерия согласно настоящему изобретению может быть получена путем придания бактерии, уже содержащей указанные фрагменты ДНК, способности к продукции пуринового нуклеозида.
В качестве родительского штамма - продуцента пуриновых нуклеозидов, в котором активности белков согласно настоящему изобретению необходимо повысить, может быть использован штамм Е.coli FADRaddedd (pMWKQAp). Указанный штамм является производным от известного штамма W3110, содержащего мутации, введенные в ген purF, кодирующий PRPP амидотрансферазу, ген purR, кодирующий репрессор биосинтеза пуринов, ген deoD, кодирующий фосфорилазу пуриновых нуклеозидов, ген purA, кодирующий сукцинил-АМР-синтазу, ген add, кодирующий аденозиндеаминазу, ген edd, кодирующий 6-фосфоглюконатдегидразу (WO9903988), а также содержащего плазмиду pMWKQAp - производную от вектора pMWKQ, в которой находятся гены purFKQ, кодирующие PRPP амидотрансферазу, нечувствительную к гуанозин монофосфату (GMP) (заявка РСТ WO9903988).
В качестве примера родительского штамма, принадлежащего к роду Bacillus, который может быть использован в настоящем изобретении, можно привести штамм В.subtilis strain KMBS16-1. Этот штамм является производным от штамма-продуцента инозина В.subtilis KMBS16 (US2004-0166575), в котором мутация purA::erm была заменена на мутацию purA::cat. В свою очередь, штамм В. subtilis KMBS16 является производным от известного штамма В. subtilis trpC2, содержащего мутации, введенные в ген purA, кодирующий сукцинил-АМР-синтазу (purA::erm), в ген purR, кодирующий репрессор биосинтеза пуринов (purR::spc), и в ген deoD, кодирующий фосфорилазу пуриновых нуклеозидов (deoD::kan) (патент РФ 2239656).
Другие родительские штаммы, принадлежащие к роду Bacillus, которые могут быть использованы в настоящем изобретении, включают штамм бактерии-продуцента инозина, принадлежащий к роду Bacillus, такой как штамм Bacillus subtilis AJ12707 (FERM P-12951) (патентная заявка Японии JP6113876), штамм Bacillus subtilis AJ3772 (FERM-P 2555) (патентная заявка Японии JP 62014794), штамм Bacillus pumilus NA-1102 (FERM BP-289), Bacillus subtilis NA-6011 (FERM BP-291), "Bacillus subtilis" G1136A (ATCC No. 19222) (патент США 3,575,809), реидентифицированные и депонированные во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как штаммы Bacillus amyloliquefaciens AJ1991 (VKPM B-8994) 10 марта, 2006, Bacillus subtilis NA-6012 (FERM BP-292) (патент США 4,701,413), В.pumilis Gottheil No. 3218 (ATCC No. 21005) (патент США 3,616,206), В. amyloliquefaciens strain AS 115-7 (VKPM B-6134) (патент РФ 2003678) или подобные им могут быть использованы or the like may be used.
Чтобы увеличить саму активность в пересчете на белок согласно настоящему изобретению, также возможно ввести мутацию в структурную часть гена, кодирующего белок, чтобы увеличить активность белка. Для того, чтобы ввести мутацию в ген, могут быть использованы сайт-специфический мутагенез (Kramer, W. and Frits, H.J., Methods in Enzymology, 154, 350 (1987)), методы рекомбинантной ПЦР (PCR Technology, Stockton Press (1989)), химический синтез специфических участков ДНК, обработка нужного гена с помощью гидроксиламина, обработка микробных штаммов, содержащих нужный ген, с помощью УФ излучения или химического реагента, такого как нитрозогуанидин или азотистая кислота, или подобным методом. Микроорганизм, в котором активность указанного белка повышена, может быть отобран как штамм, растущий на минимальной среде, содержащей 8-азааденин, 2,6-диаминопурин, 6-меркаптопурин или 6-тиогуанин.
Бактерия согласно настоящему изобретению может быть в дальнейшем улучшена за счет увеличения экспрессии одного или нескольких генов, вовлеченных в биосинтез пуринов. Примерами таких генов являются гены риг регулона из Е.coli (Escherichia coli and Salmonella, Second Edition, Editor in Chief: F.C.Neidhardt, ASM Press, Washington D.C., 1996) или pur-оперон из В. subtilis (Bacillus subtilis and other Gram-positive bacteria. Editor in Chief: A.L. Sonenshein. ASM Press, Washington D.C., 1993). Описан штамм Е.coli - продуцент инозина, содержащий мутантный ген purF, кодирующий PRPP амидотрансферазу, нечувствительную к ингибированию GMP и AMP по типу обратной связи, инактивированный ген purR, кодирующий репрессор биосинтеза пуринов (заявка РСТ WO 9903988).
Механизмом, увеличивающим продукцию пуриновых нуклеозидов бактерией путем увеличения активности белков, согласно настоящему изобретению является, как можно предположить, повышенная экскреция целевого пуринового нуклеозида из клетки бактерии.
2. Способ получения нуклеозидов, таких как инозин и/или гуанозин.
К способу согласно настоящему изобретению относится способ получения нуклеозида, такого как инозин и/или гуанозин, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления инозина в питательной среде, и выделения инозина из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка пуринового нуклеозида из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых пуриновый нуклеозид продуцируется с использованием микроорганизма. Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, неорганические ионы и другие необходимые органические компоненты. К источникам углерода относятся различные углеводы, такие как глюкоза, лактоза, сахароза, галактоза, фруктоза, арабиноза, мальтоза, ксилоза, трегалоза, рибоза и гидролизат крахмала; спирты, такие как глицерин, маннитол и сорбитол; различные органические кислоты, такие как глюконовая кислота, фумаровая кислота, лимонная кислота и янтарная кислота и подобные им. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как сульфат аммония, хлорид аммония и фосфат аммония, органические источники азота, такие как гидролизат соевых бобов; газообразный аммиак, раствор аммония и подобные соединения. Желательно, чтобы подходящие небольшие количества витаминов, таких как витамин B1, и других необходимых веществ, например нуклеиновых кислот, таких как аденин и РНК, или дрожжевой экстракт и подобные соединения присутствовали в питательной среде в качестве органических питательных компонент. Кроме того, небольшие количества фосфата кальция, сульфата магния, ионов железа, ионов марганца и подобных соединений могут быть добавлены, если необходимо.
Выращивание осуществляется предпочтительно в аэробных условиях в течение 16-72 часов, температура при выращивании поддерживается в пределах от 30 до 45°С и рН в пределах от 5 до 8, рН среды может регулироваться неорганическими или органическими кислотными или щелочными веществами, а также газообразным аммиаком.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем целевой пуриновый нуклеозид может быть выделен из культуральной жидкости любым из традиционных методов или любой комбинацией этих методов, таким как ионообменная хроматография и осаждение.
3. Способ получения пуриновых нуклеотидов, таких как 5'-инозиновая кислота и/или 5'-гуаниловая кислота.
Способ согласно настоящему изобретению включает способ получения пуриновых нуклеотидов, таких как 5'-инозиновая кислота и/или 5'-гуаниловая кислота, и включает стадию выращивания бактерии согласно настоящему изобретению в питательной среде, стадию фосфорилирования полученных и накопленных пуриновых нуклеозидов, таких как инозин и/или гуанозин, и стадию выделения полученных и накопленных 5'-пуриновых нуклеотидов.
Согласно настоящему изобретению выращивание, выделение и очистка пуриновых нуклеозидов, таких как инозин и/или гуанозин, из культуральной или подобной ей жидкости могут быть осуществлены способом, подобным традиционным способам ферментации, в которых инозин и/или гуанозин продуцируется с использованием микроорганизма. Далее, согласно настоящему изобретению фосфорилирование полученных и накопленных пуриновых нуклеозидов, таких как инозин и/или гуанозин, а также выделение полученных и накопленных 5'-пуриновых нуклеотидов инозиновой кислоты и/или 5'-гуаниловой кислоты может быть осуществлено методом, подобным традиционным методам, в которых пуриновые нуклеотиды, такие как 5'-инозиновая кислота и/или 5'-гуаниловая кислота, получаются из пуриновых нуклеозидов, таких как инозин и/или гуанозин.
Фосфорилирование пуринового нуклеозида может быть осуществлено ферментативно с использованием различных фосфатаз, нуклеозидкиназ и нуклеозидфосфотрансфераз или химически с использованием фосфорилирующих агентов, таких как РОСl3 или подобных им. Могут быть использованы фосфатаза, способная к катализу селективного переноса фосфорильной группы пирофосфата в 5'-положение нуклеозида (Mihara et. al, Phosphorylation of nucleosides by the mutated acid phosphatase from Morganella morganii. Appl. Environ. Microbiol. 2000, 66:2811-2816), или кислая фосфатаза, использующая полифосфорные кислоты (их соли), фенилфосфорную кислоту (ее соли) или карбамилфосфорную кислоту (ее соли) в качестве донора фосфорной кислоты (заявка РСТ WO 9637603 A1), или подобные им. Также в качестве примера фосфатазы может быть приведена фосфатаза, способная к каталитическому переносу фосфорильной группы в 2', 3', 5'-положение нуклеозида с использованием в качестве субстрата п-нитрофенилфосфата (Mitsugi, K., et al, Agric. Biol. Chem. 1964, 28, 586-600), неорганического фосфата (JP42-1186) или ацетил фосфата (JP61-41555), или подобная ей. В качестве примера нуклеозидкиназы может быть приведена гуанозин-инозинкиназа из Е.coli (Mori et. al. Cloning of a guanosine-inosine kinase gene of Escherichia coli and characterization of the purified gene product. J. Bacteriol. 1995. 177:4921-4926; WO 9108286) или подобная ей. В качестве примера нуклеозидфосфотрансферазы может быть приведена нуклеозидфосфотрансфераза, описанная Hammer-Jespersen, K.. (Nucleoside catabolism, p.203-258. In A Munch-Petesen (ed.), Metabolism of nucleotides, nucleosides, and nucleobases in microorganism. 1980, Academic Press, New York), или подобная ей. Химическое фосфорилирование нуклеозидов может быть осуществлено с использованием фосфорилирующего агента, такого как РОСl3 (Yoshikawa et. al. Studies of phosphorylation. III. Selective phosphorylation of unprotected nucleosides. Bull. Chem. Soc. Jpn. 1969, 42:3505-3508), или подобного ему.
Способом согласно настоящему изобретению бактерия может быть модифицирована таким образом, что экспрессия гена, вовлеченного в биосинтез пуринового нуклеозида, усиливается.
Краткое описание фигур
На Фиг.1 показана структура рекомбинантной конструкции PnlpD-yeaS.
На Фиг.2 показана структура рекомбинантной плазмиды pLF-YeaS.
Наилучший способ осуществления изобретения
Пример 1. Клонирование гена yeaS под сильный конститутивный промотор PnlpD и встраивание клонированной конструкции в хромосому.
Нуклеотидная последовательность генома штамма Е.coli K-12 к настоящему времени описана полностью (Science, 277, 1453-1474, 1997). Результаты поиска в программе PSI-BLAST выявили присутствие в геноме штамма Е.coli K-12 по крайней мере четырех паралогов гена rhtB, включая ген yeaS. Ген yeaS кодирует трансмембранный белок с неустановленной функцией.
На основе уже известной нуклеотидной последоательности были синтезированы праймеры, изображенные на SEQ ID NO:3 (праймер 1) и на SEQ ID NO: 4 (праймер 2). Препарат ДНК из хромосомы штамма Е.coli MG1655 был приготовлен обычным способом. ПЦР проводили в амплификаторе "Perkin Elmer GeneAmp PCR System 2400" при соблюдении следующего температурного профиля для 30-ти циклов: 40 сек при 95°С, 40 сек при 47°С, 40 сек при 72°С, с использованием Так-полимеразы фирмы Fermentas. Полученный фрагмент ПЦР обрабатывали рестриктазами SalI и XbaI и клонировали в предварительно обработанную теми же рестриктазами плазмиду pMIV-PnlpD под контроль промотора гена nlpD из Е.Coli.
Плазмиду pMIV-PnlpD получали путем последовательного клонирования гена cat, промотора и RBS-участка гена nlpD между АТТ-сайтами фага Мu в плазмиде рМ1 (патент РФ 2212447, Kutukova E.A., et al., FEBS Letters, 579: 4629-4534 (2005)). Интеграция полученной кассеты cat-PnlpD-yeaS (Фиг.1) в хромосому штамма Е.coli TG1 проводилась с помощью Mu-интегративной системы с использованием хелперной плазмиды рМН10, как описано в патенте РФ 2212447.
Так был получен штамм TG1::PnlpD-yeaS.
Пример 2. Влияние усиленной экспрессии гена veaS на устойчивость штамма Е.coli TG1 к аналогам пуринового основания.
Минимальные ингибирующие концентрации (MIC-minimal inhibitory concentrations) аналогов пуриновых оснований для рекомбинантного штамма TG1::PnlpD-yeaS и для родительского штамма TG1 устанавливали на чашках с минимальной агаризованной средой М9 с глюкозой, содержащей ступенчатые концентрации ингибиторов. Чашки были засеяны клетками (от 105 до 106) ночной культуры, выращенной на минимальной среде. Степень роста была оценена после инкубации в течение 44 часов при 37°С. Результаты представлены в Таблице 1.
Как видно из Таблицы 1, усиление экспрессии гена yeaS в значительной степени увеличивает устойчивость клеток к 8-азааденину, 2,6-диаминопурину, 6-меркаптопурину и 6-тиогуанину. Известно, что ген yeaS (leuE) кодирует мембранный белок, вовлеченный в выброс аминокислот из клетки (патент РФ 2175351; Aleshin V.V., et al., TIBS, 24:133-135(1999); Kutukova E.A., et al., FEBS Letters, 579: 4629-4534 (2005)). Таким образом, белок YeaS обладает широкой специфичностью и также включен в экскрецию производных пурина.
Пример 3. Влияние усиленной экспрессии гена yeas на продукцию инозина штаммом-продуцентом инозина Е.coli
Штамм-продуцент инозина Е.coli FADRaddedd(pMWKQ)(заявка PCT WO 99/03988) трансдуцировали фагом Р1, выросшим на штамме TGl::PnlpD-yeaS. Трансдуктанты отбирали на LB-агаре, содержащем 10 мкг/мл хлорамфеникола и 75 мкг/мл канамицина. Так был получен штамм Е.coli FADRaddedd::_PnlpD-yeaS (pMWKQ). Этот штамм и родительский штамм Е. coli FADRaddedd(pMWKQ) каждый выращивали при температуре 37°С в течение 18-ти часов в L-бульоне, содержащем 75 мкг/мл канамицина, и 0.3 мл выросшей культуры инокулировали в 3 мл ферментационной среды, содержащей 75 мг/л канамицина, в пробирки объемом 20×200 мм, и выращивали при 37°С в течение 72 часов на роторной качалке.
Состав среды для ферментации, г/л:
Глюкоза и сульфат магния стерилизуются раздельно. СаСО3 стерилизуется сухим жаром при температуре 180°С в течение 2 часов. рН раствора доводится до 7.0. Антибиотики добавляются в среду после стерилизации.
После выращивания количество инозина, которое накопилось в питательной среде, определяли с помощью ВЭЖХ. Образец культуральной жидкости (500 мкл) центрифугировали при 15,000 об/мин, 5 минут и надосадок разводили в 4 раза водой, и анализировали с помощью ВЭЖХ. Условия для анализа с помощью ВЭЖХ были следующие: колонка: Luna С18(2) 250×3 мм, 5 u (Phenomenex, USA); буфер: 2% v/v C2H5OH; 0.8% v/v триэтиламин, 0.5% v/v уксусная кислота (ледяная), рН 4.5. Температура: 30°С. Скорость потока: 0.3 мл/мин. Объем пробы: 5 мкл. УФ-детектор: 250 нм.
Время удерживания, мин:
Результаты представлены в Таблице 2.
Как видно из Таблицы 2, усиление экспрессии гена yeaS улучшало продукцию инозина штаммом FADRaddedd (pMWKQ).
Пример 4. Клонирование гена yeaS в вектор-переносчик с единичным репликоном pLF22.
Для того, чтобы ген yeaS экспрессировался в штаммах бактерий рода Bacillus, он был клонирован в вектор-переносчик с единичным репликоном pLF22 (Tarakanov et al., Expression vector pLF22 for the lactic acid bacteria. Mikrobiologiia (Rus). 73(2): 211-217, (2004)) под контролем промотора генов repAB плазмиды и сайта связывания рибосомы гена pure из Bacillus subtilis. Для этой цели использовали праймер 3 (SEQ ID NO:5) и праймер 4 (SEQ ID NO:6), а также ДНК из хромосомы MG1655 в качестве матрицы. Праймер 3 содержит нуклеотидную последовательность сайта связывания рибосомы гена рurE из B. subtilis. Полученный в результате ПEР фрагмент ДНК обрабатывали рестриктазами SmaI и HindIII и клонировали в плазмиду pLF22, предварительно обработанную теми же рестриктазами, под контроль плазмидного промотора генов repAB.
Так была получена плазмида pLF-YeaS.
Пример 5. Влияние усиления экспрессии гена yeaS на продукцию инозина и гуанозина штаммом-продуцентом инозина и гуанозина Bacillus amyloliquefaciens.
Плазмиды pLF22 и pLF-YeaS вводили в штамм В.subtilis168 путем трансформации и результирующие штаммы обозначили как В.subtilis (pLF22) и В.subtilis (pLF-YeaS) соответственно. Затем фаг Е40, выросший на этих штаммах, использовали для трансдукции штамма В. amyloliquefaciens AJ1991 (АТСС No. 19222, VKPM В-8994) (патент США 3,575,809). Трансдуктанты отбирали на LB-среде, содержащей 10 мкг/мл хлорамфеникола.
Так были получены штаммы В. amyloliquefaciens AJ1991 (pLF22) и В.amyloliquefaciens АJ1991 (pLF-YeaS)
Штамм В. amyloliquefaciens AJ1991(pLF-YeaS) и контрольный штамм B.amyloliquefaciens АJ1991 (pLF22) выращивали каждый при температуре 34°С в течение 18-ти часов в L-бульоне. Затем 0.3 мл выросшей культуры инокулировали в 3 мл среды для ферментации в пробирки объемом 20×200 мм и выращивали при температуре 34°С в течение 72 часов на роторной качалке.
Состав среды для ферментации,г/л:
Глюкоза и сульфат магния стерилизуются раздельно. СаСО3 стерилизуется сухим жаром при температуре 180°C в течение 2 часов. рН раствора доводится до 7.0.
После выращивания количество инозина и гуанозина, которое накопилось в питательной среде, определяли с помощью ВЭЖХ, как описано выше. Результаты измерения представлены в Таблице 3.
Как следует из Таблицы 3, усиление экспрессии гена yeaS приводило к увеличению продукции инозина и гуанозина штаммом В. amyloliquefaciens AJ1991(pLF-YeaS).
Хотя указанное изобретение описано в деталях со ссылкой на наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.



Реферат
Изобретение относится к биотехнологии и предоставляет собой способ получения пуриновых нуклеозидов, таких как инозин и гуанозин, а также способ получения 5'-инозиновой кислоты или 5'-гуаниловой кислоты, с использованием бактерий, принадлежащих как к роду Escherichia, так и к роду Bacillus, в котором продукция пуриновых нуклеозидов указанными бактериями увеличена за счет увеличения активности белка, кодируемого геном yeaS (leuE). Изобретение позволяет получать пуриновые нуклеозиды и нуклеотиды с высокой степенью эффективности. 3 н. и 4 з.п. ф-лы, 2 ил., 3 табл.
Формула
(А) белка, включающего аминокислотную последовательность, показанную на SEQ ID NO: 2; и
(Б) белка, включающего аминокислотную последовательность,
показанную на SEQ ID NO: 2, при этом один или несколько
аминокислотных остатков в указанной последовательности заменены, делетированы, вставлены, добавлены или инвертированы, и обладающего активностью, которая придает бактерии устойчивость к 8-азааденину, 6-меркаптопурину, или 6-тиогуанину; в этой бактерии увеличена.

Комментарии