Антигенные пептиды neisseria - RU2284332C2
Код документа: RU2284332C2
Чертежи


















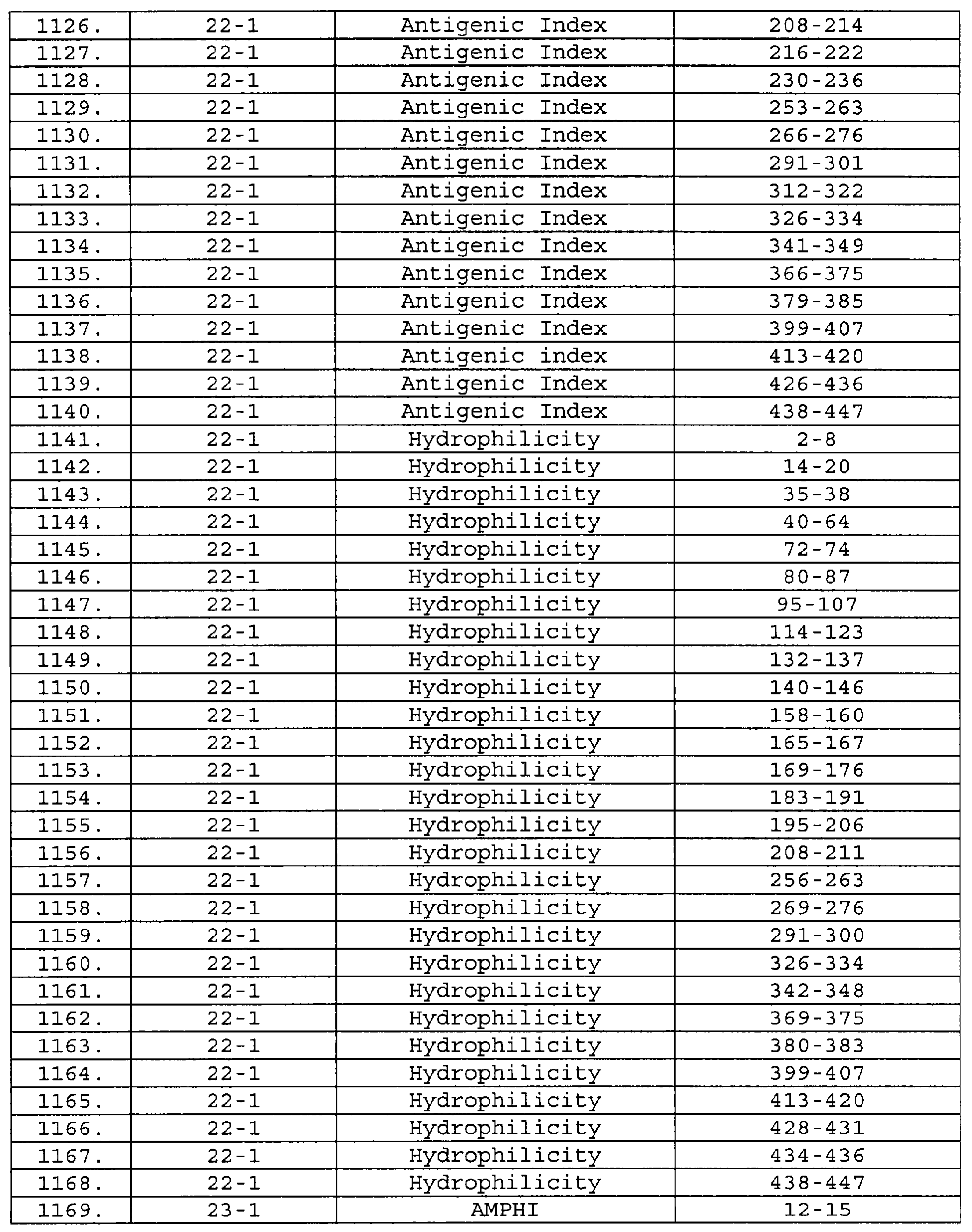
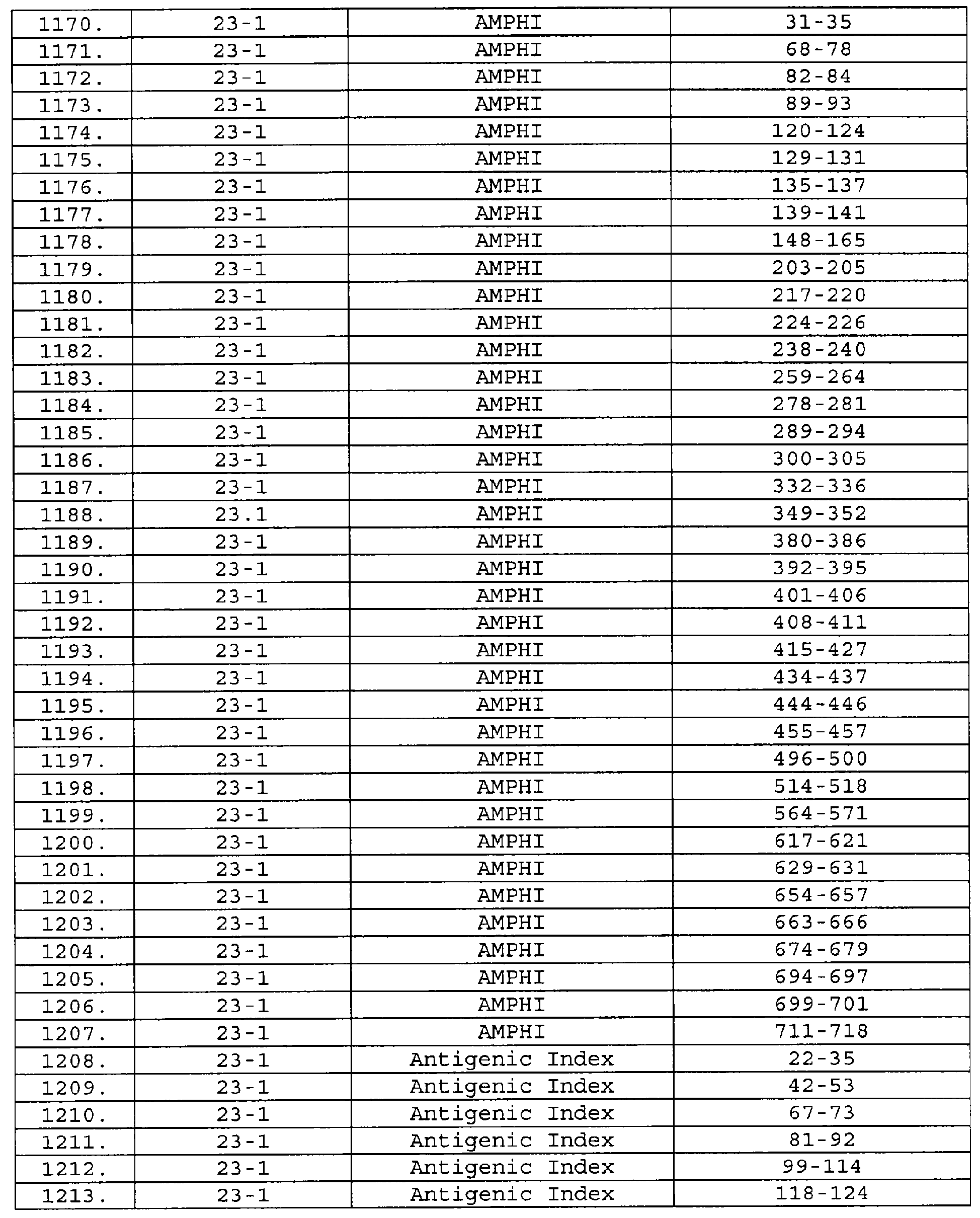

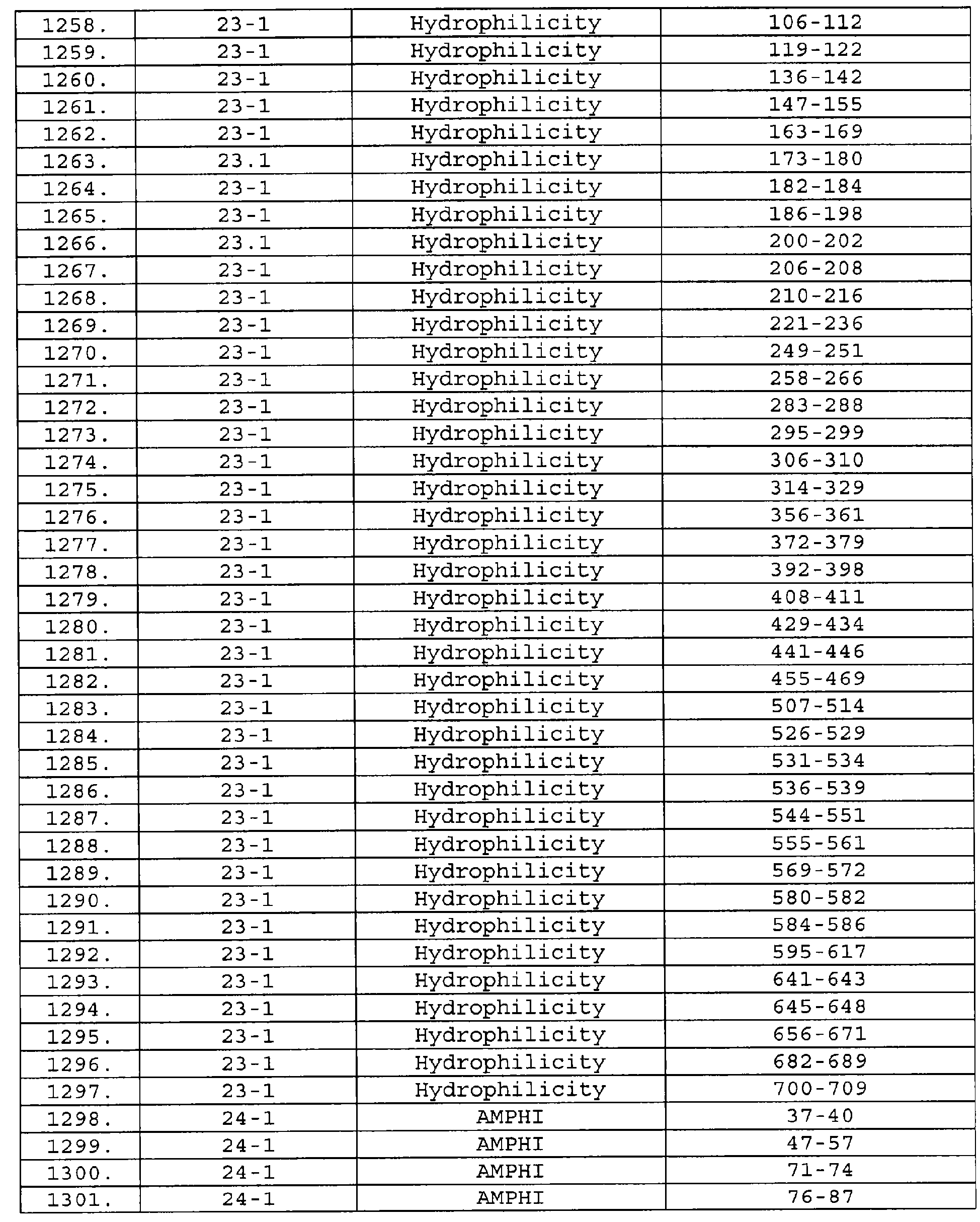


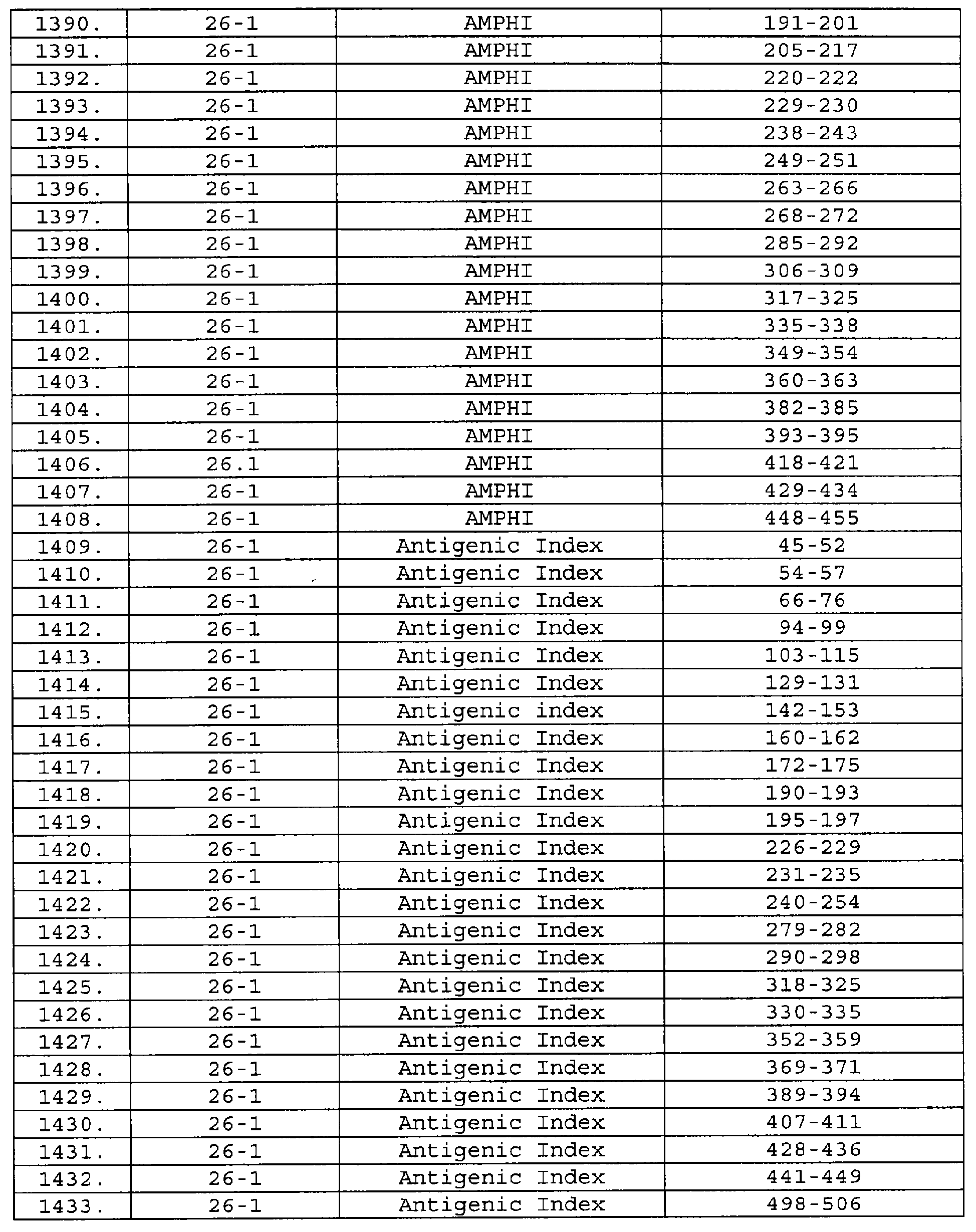
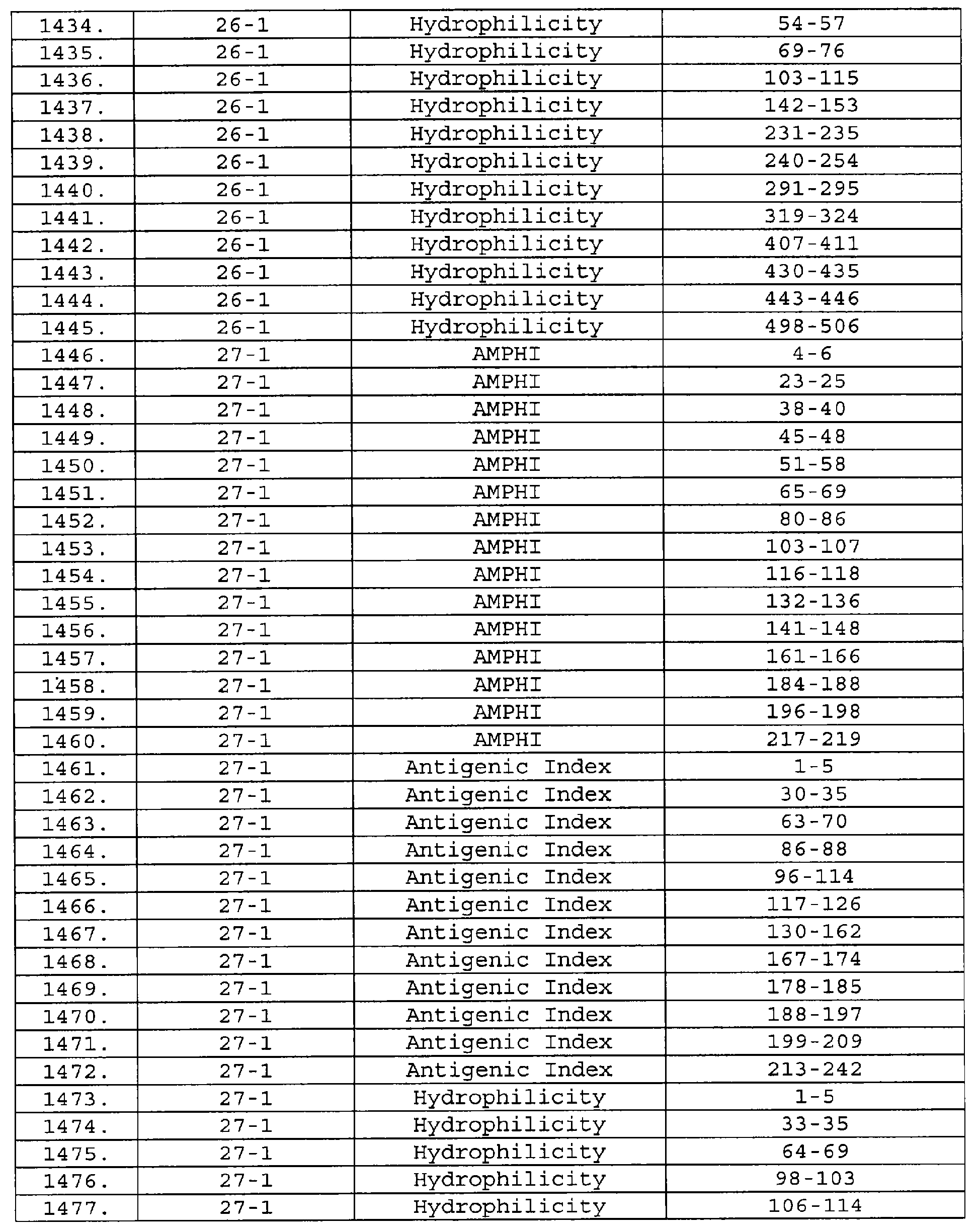
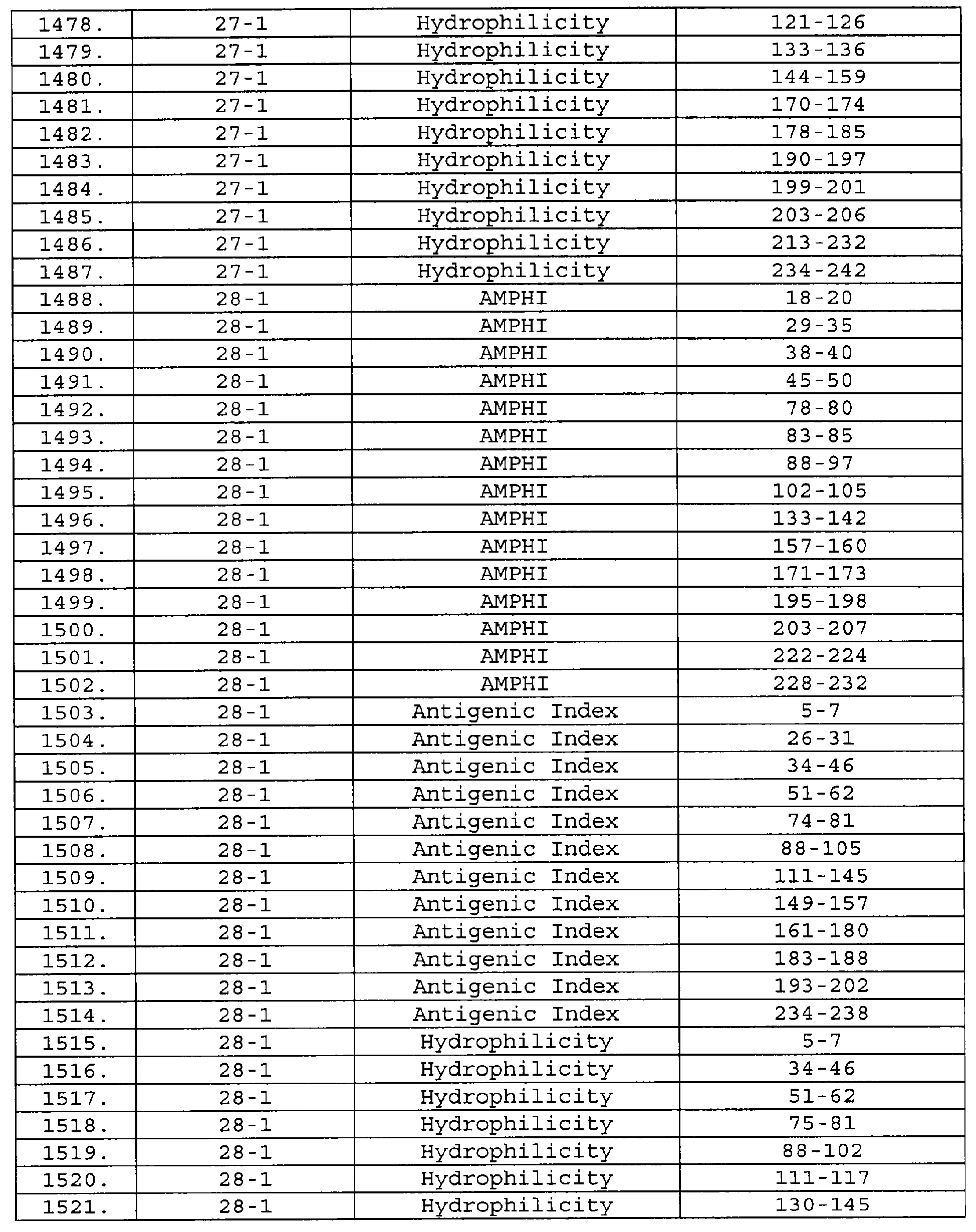
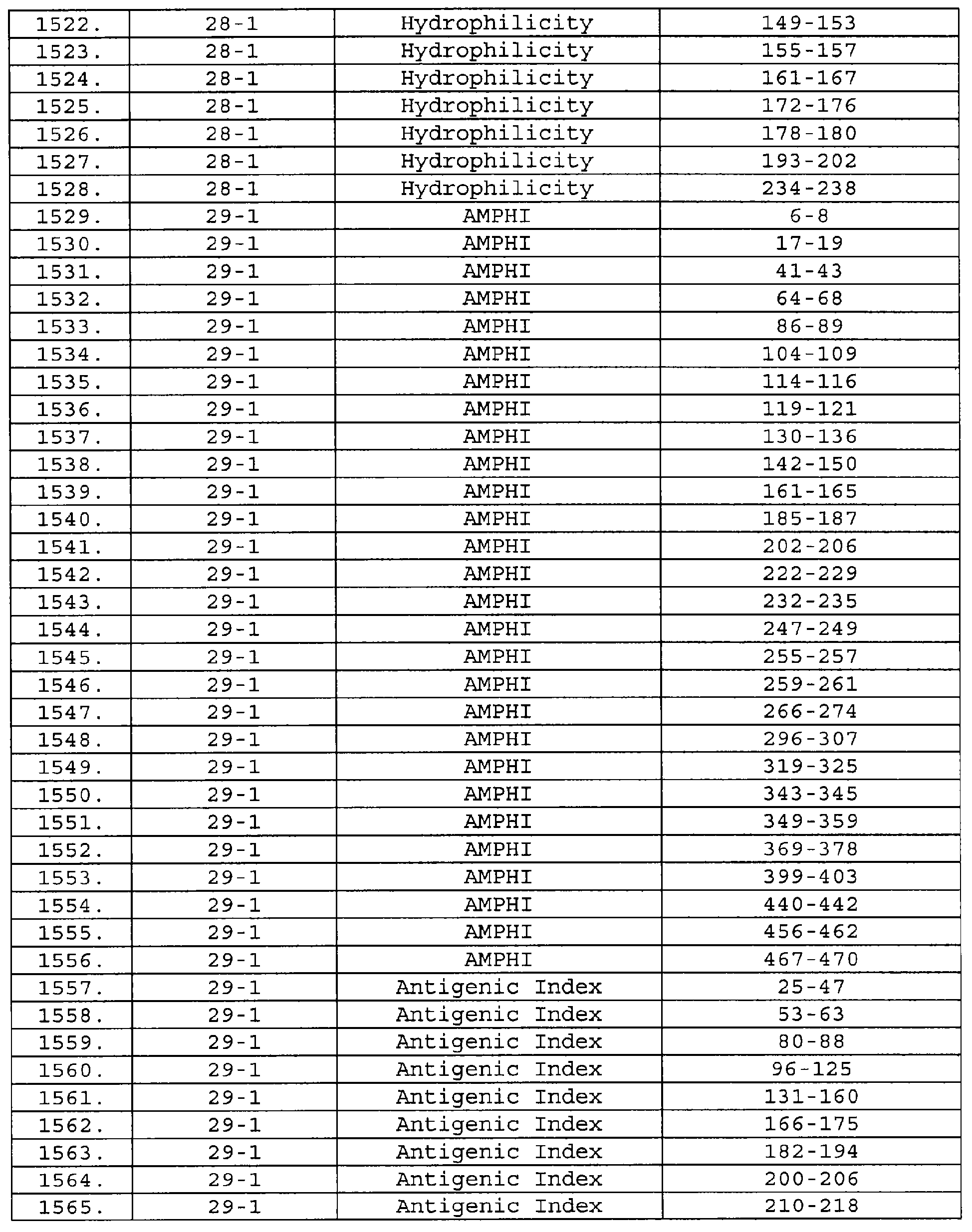


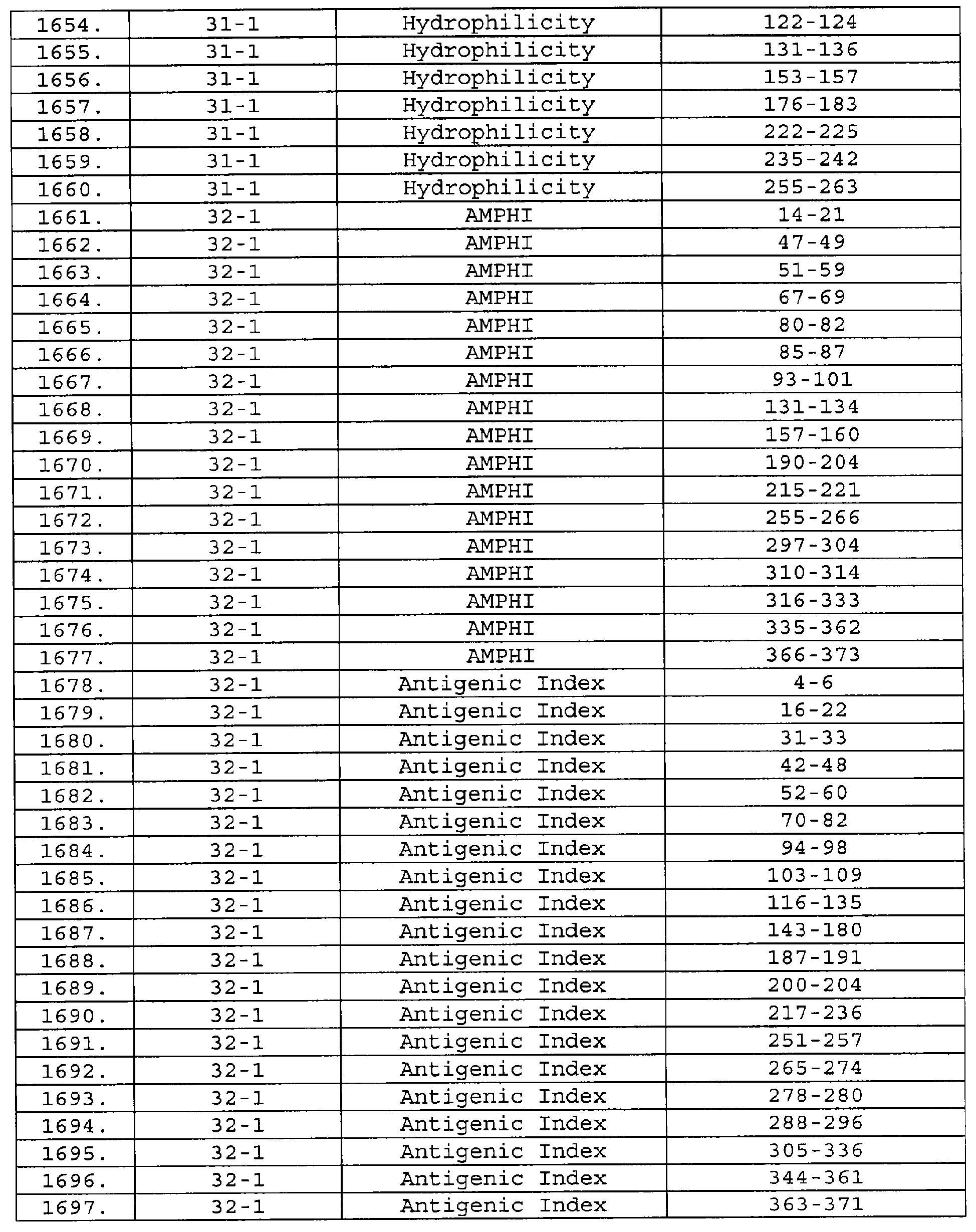














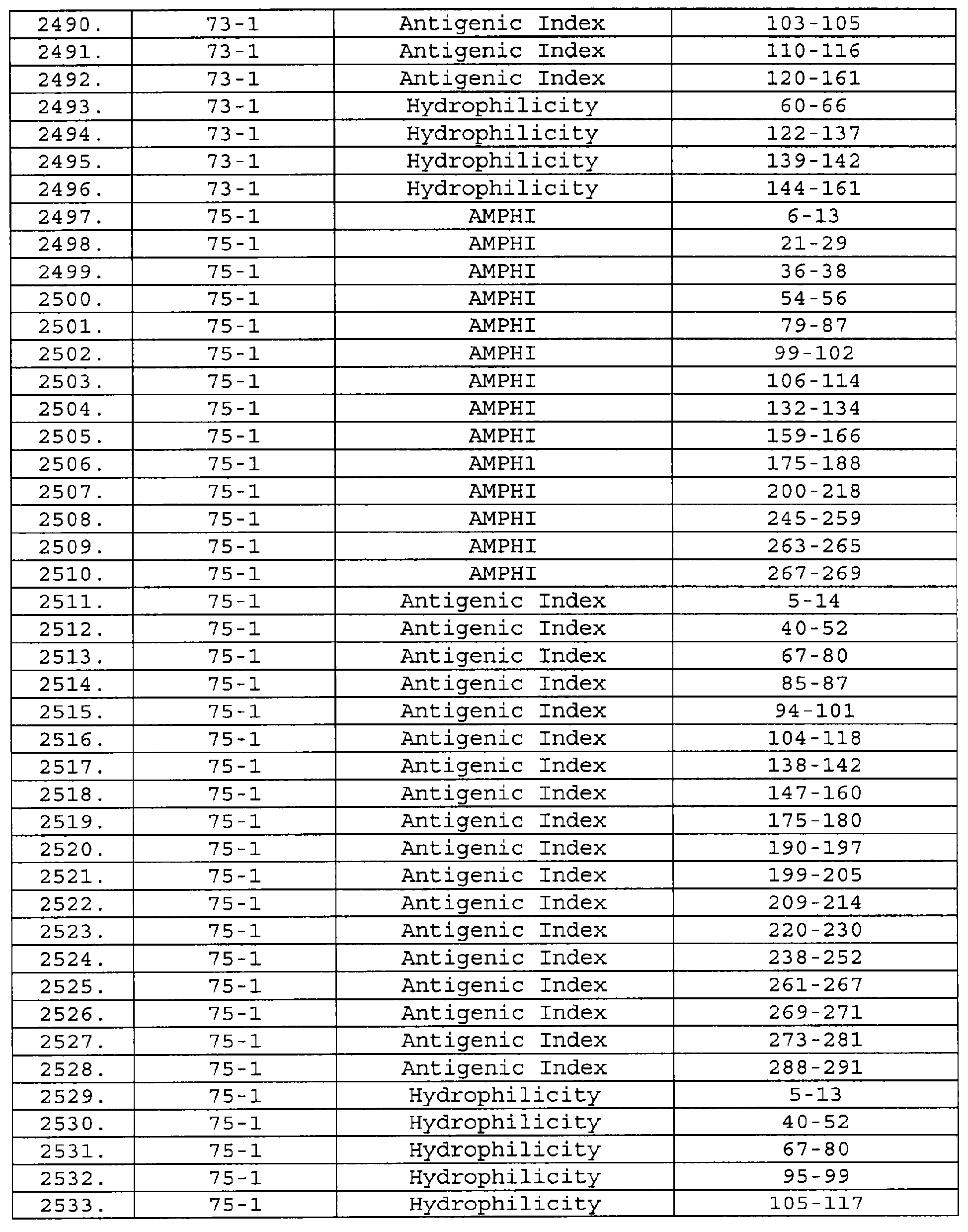



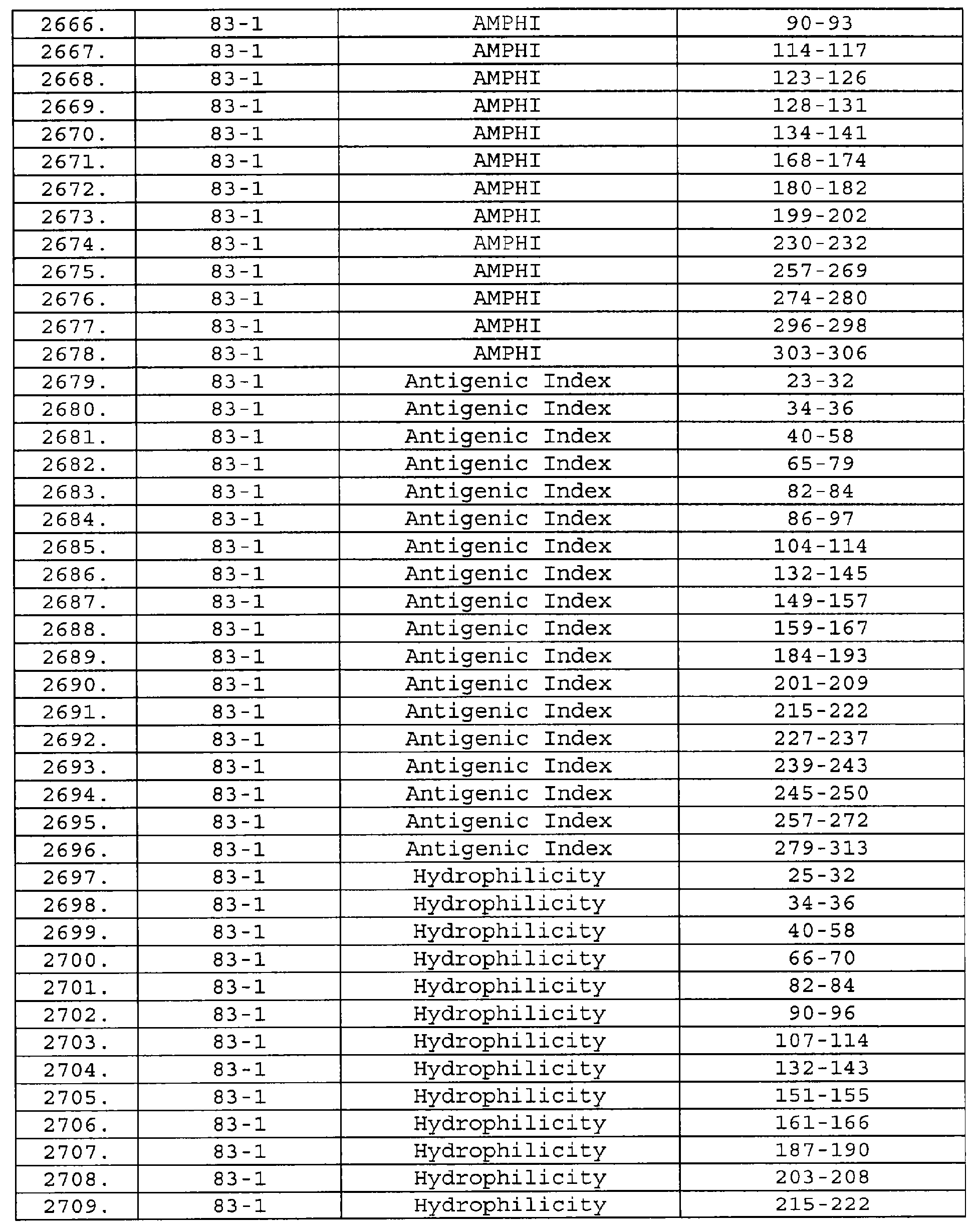




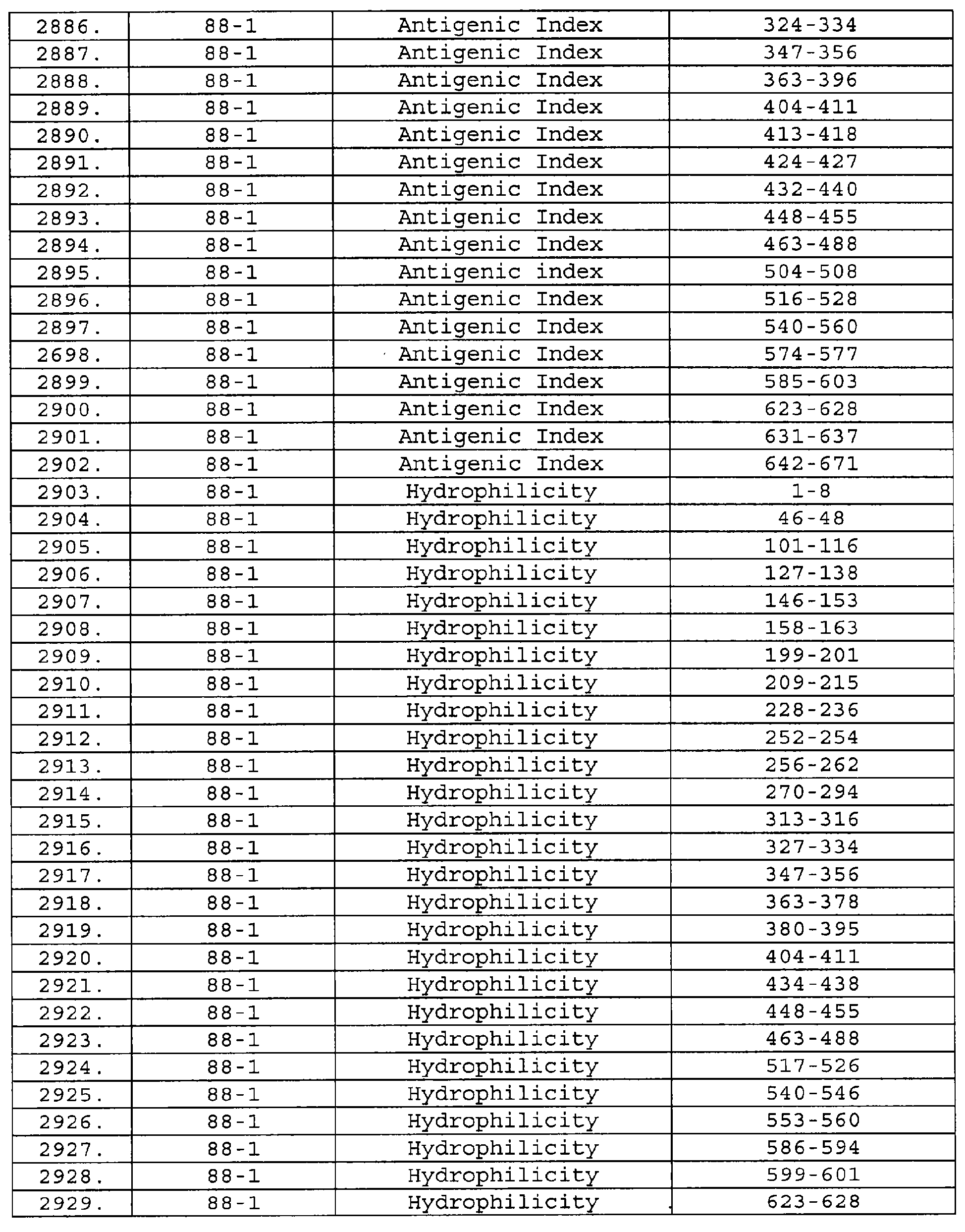



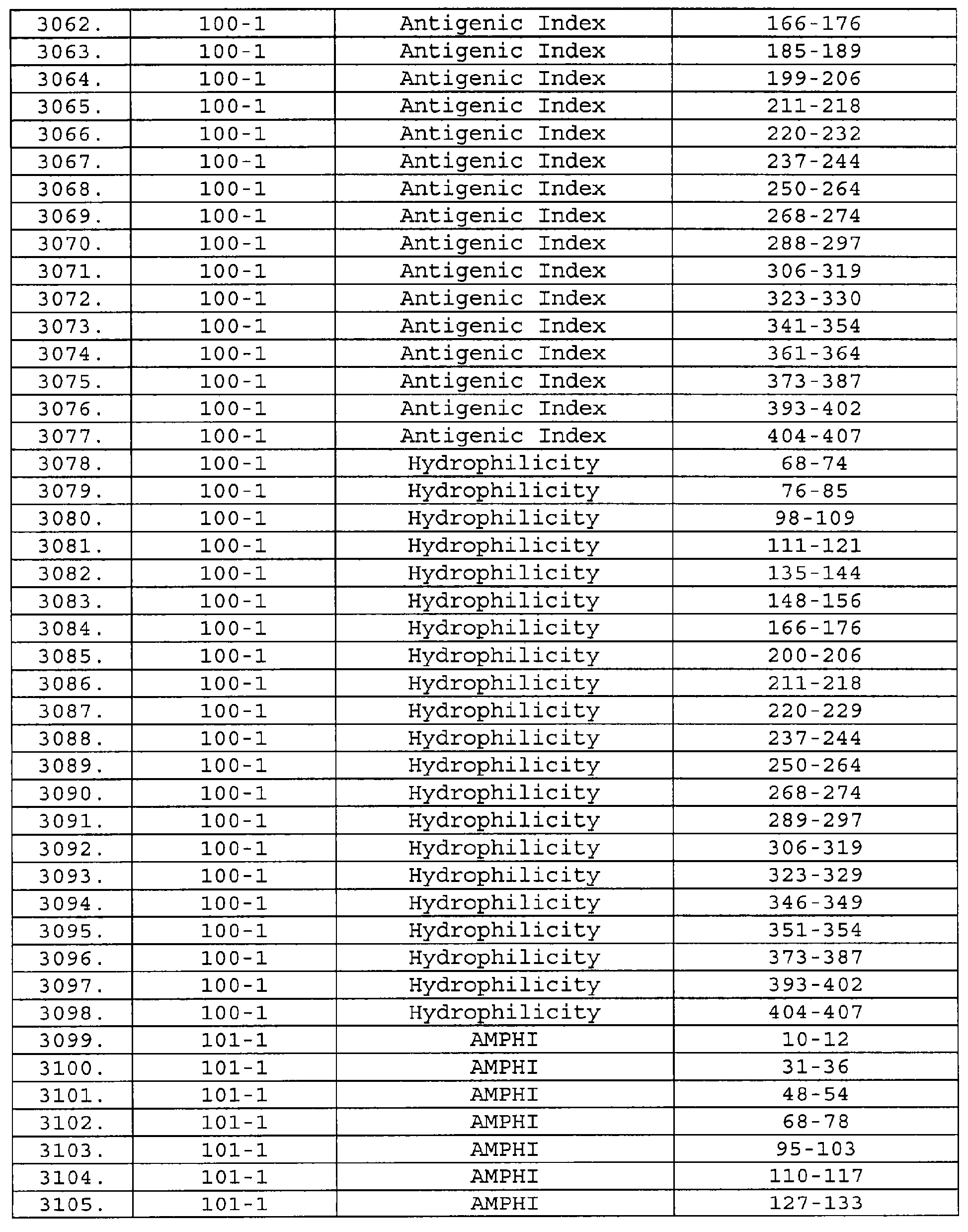
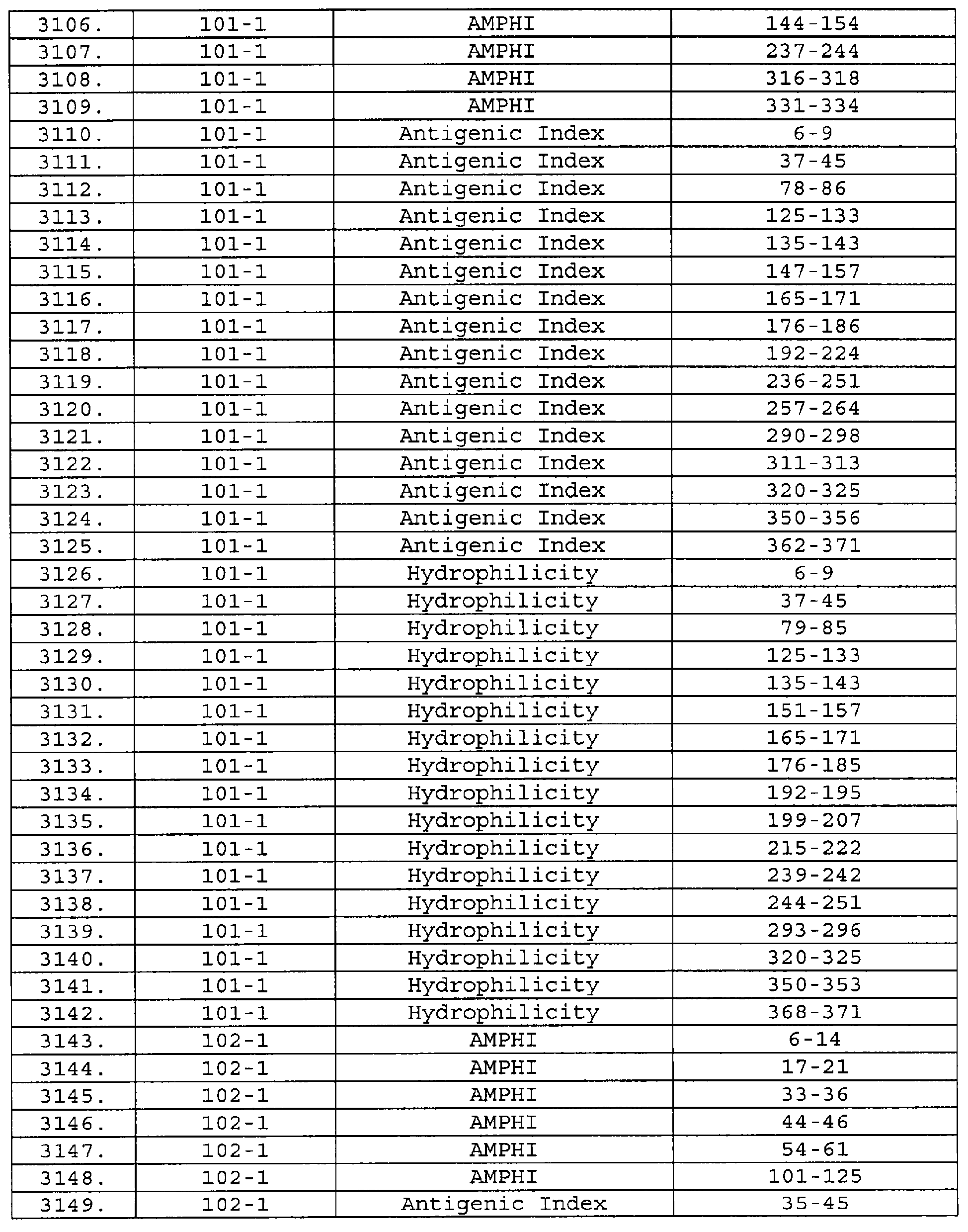





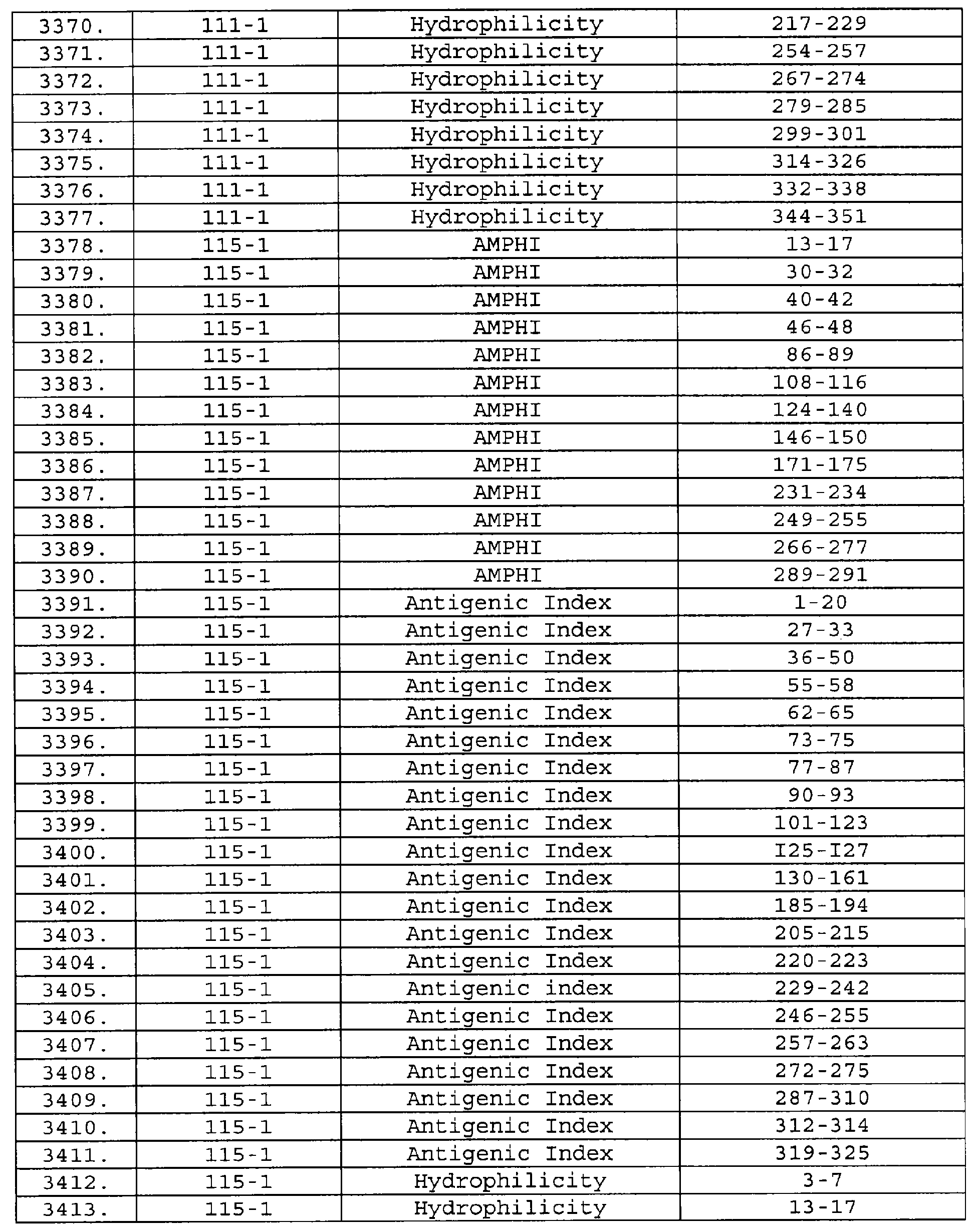
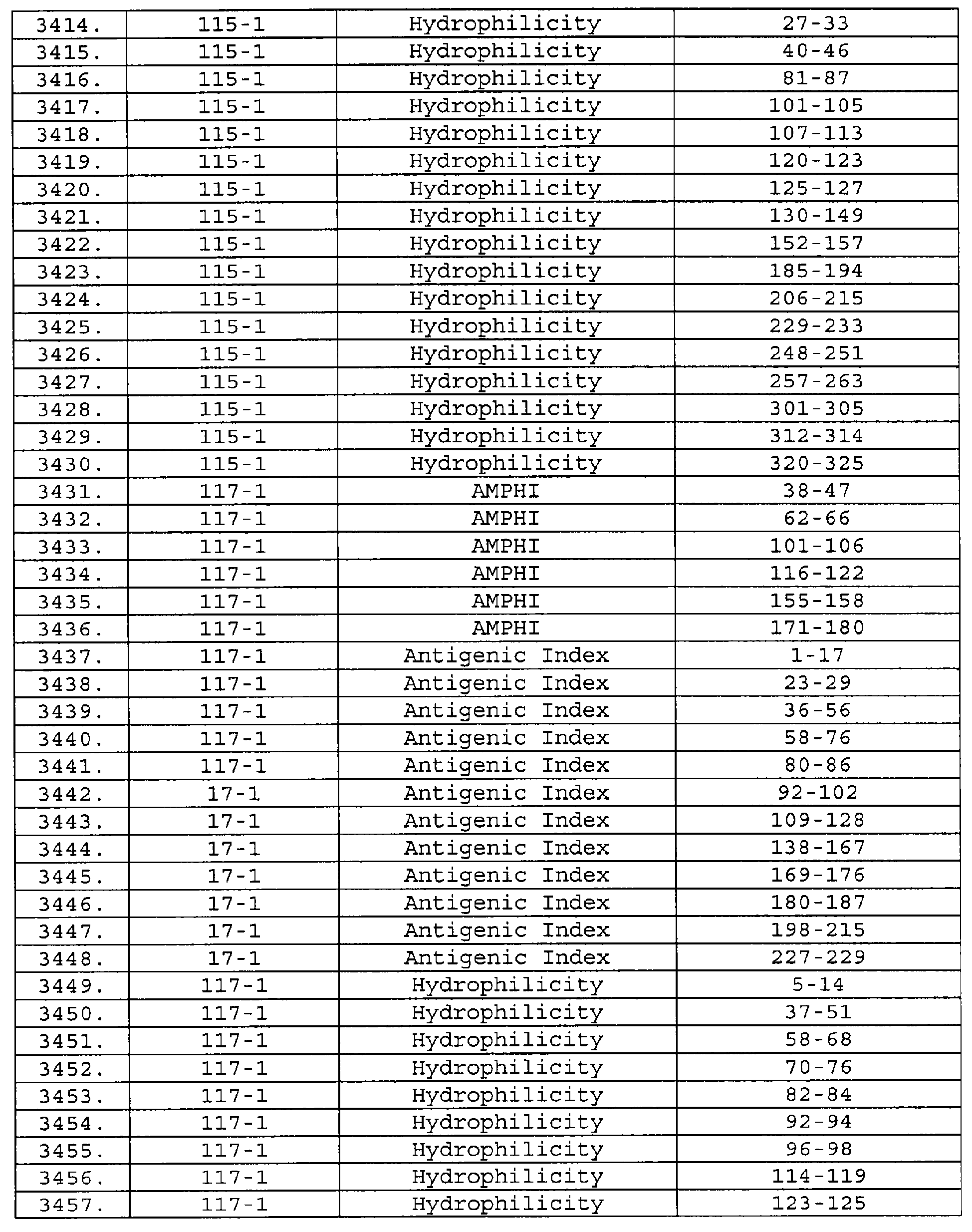


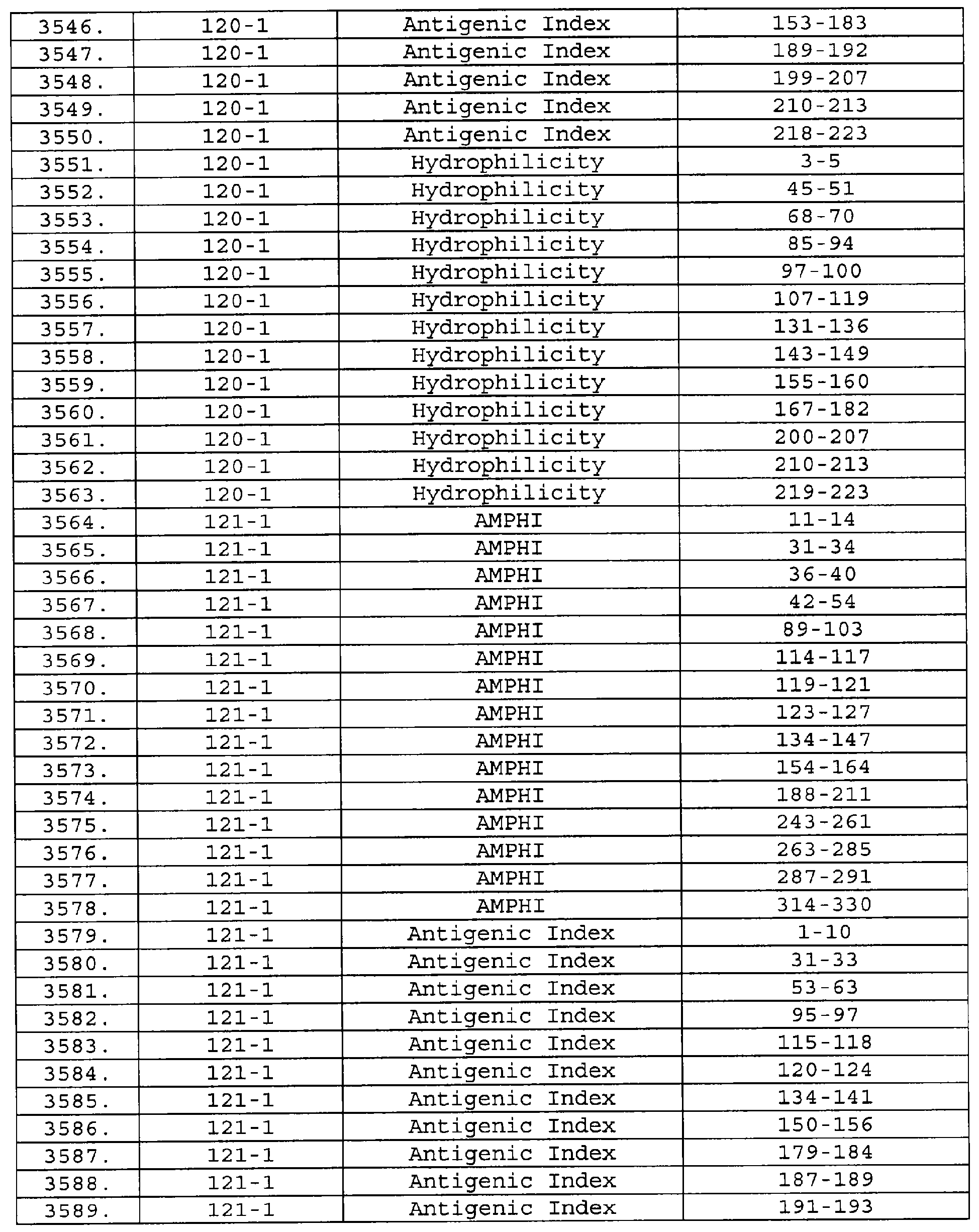
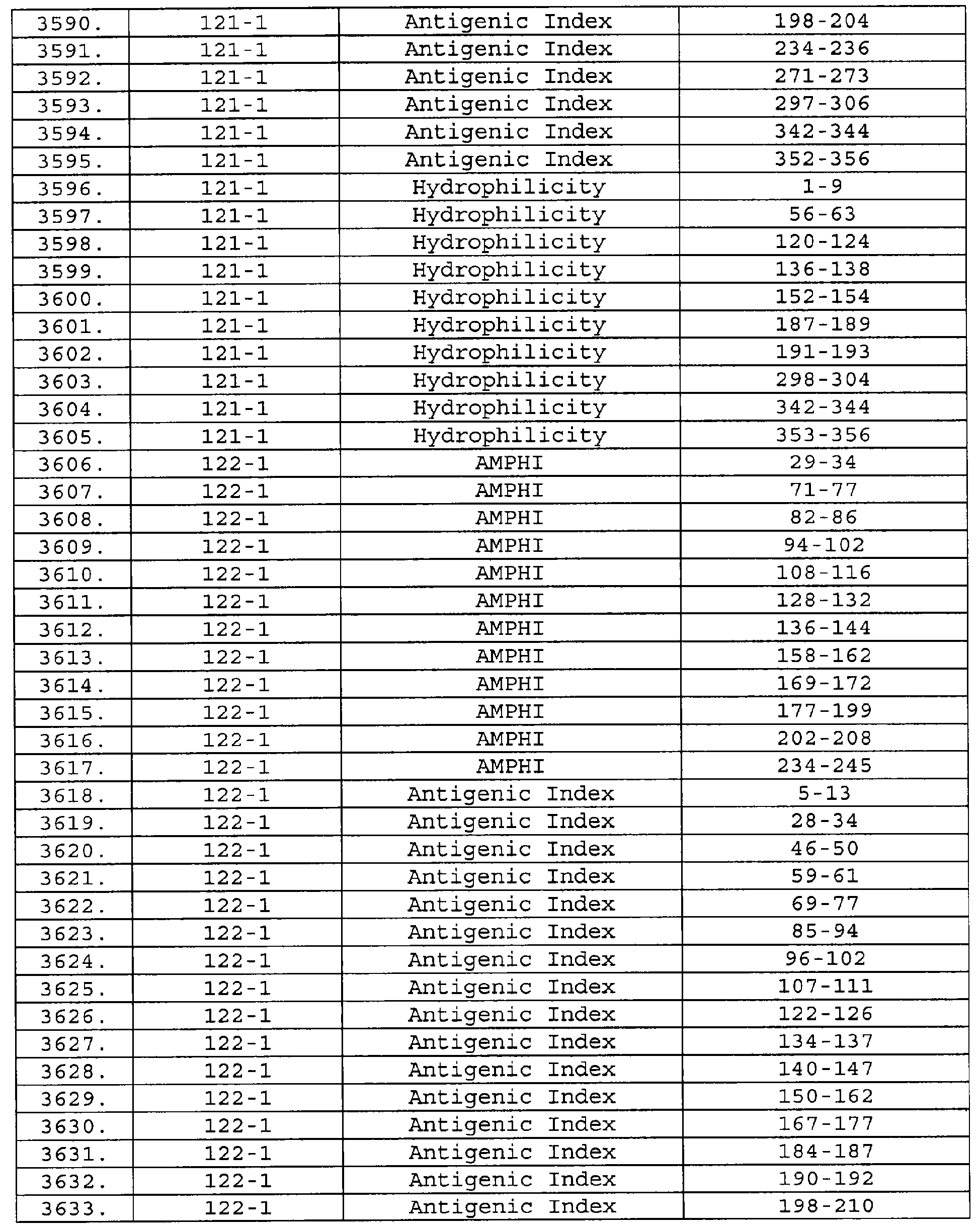





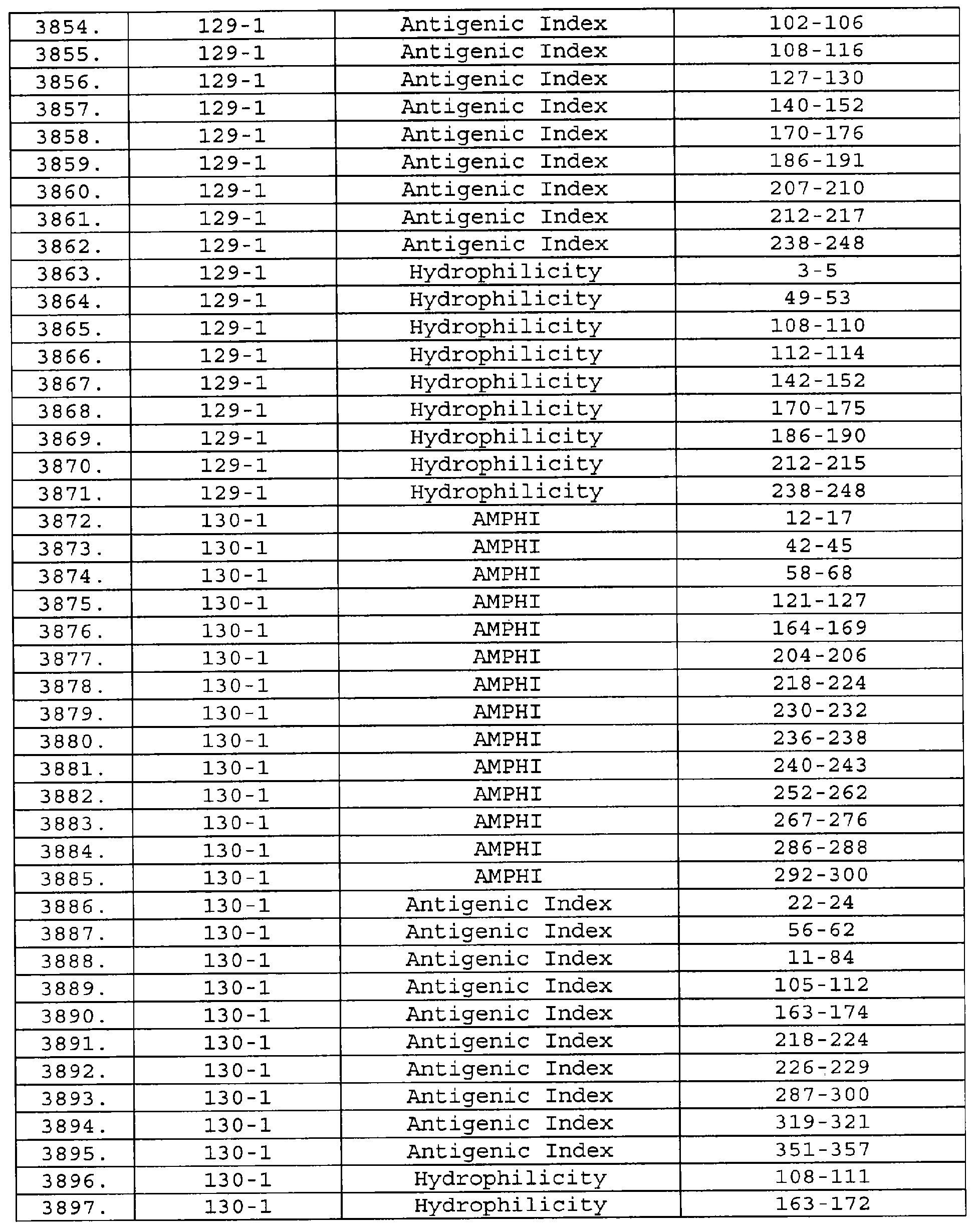


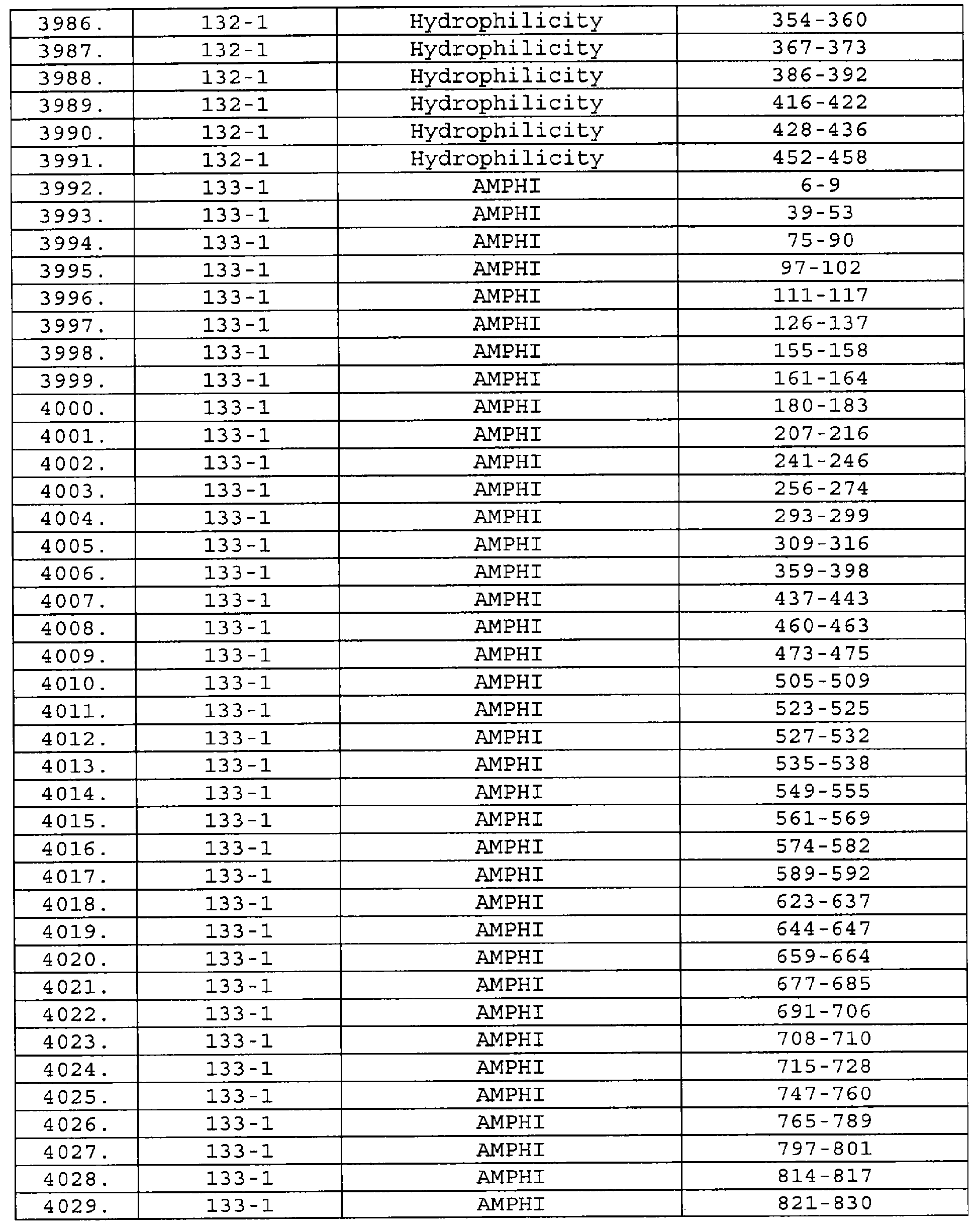


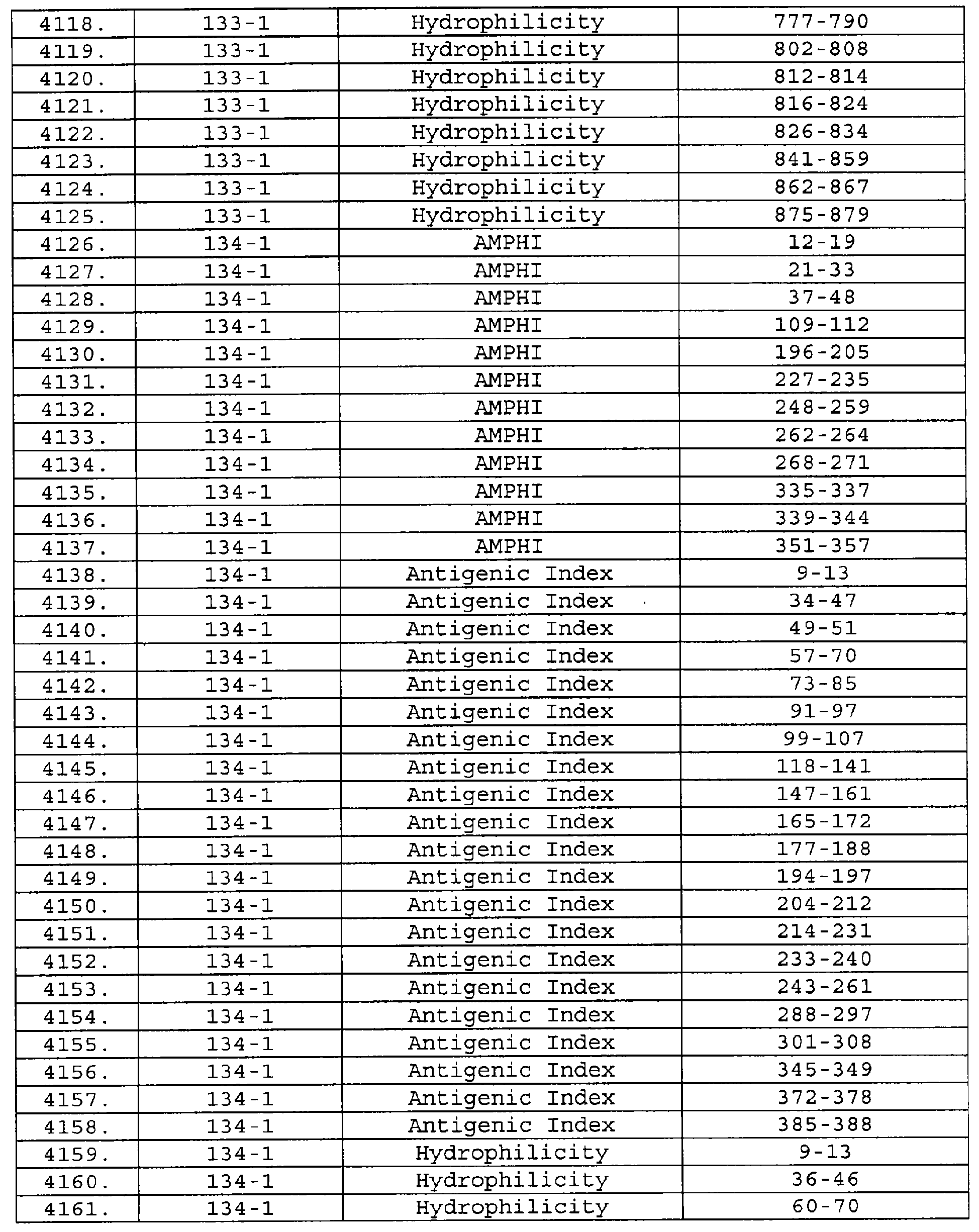

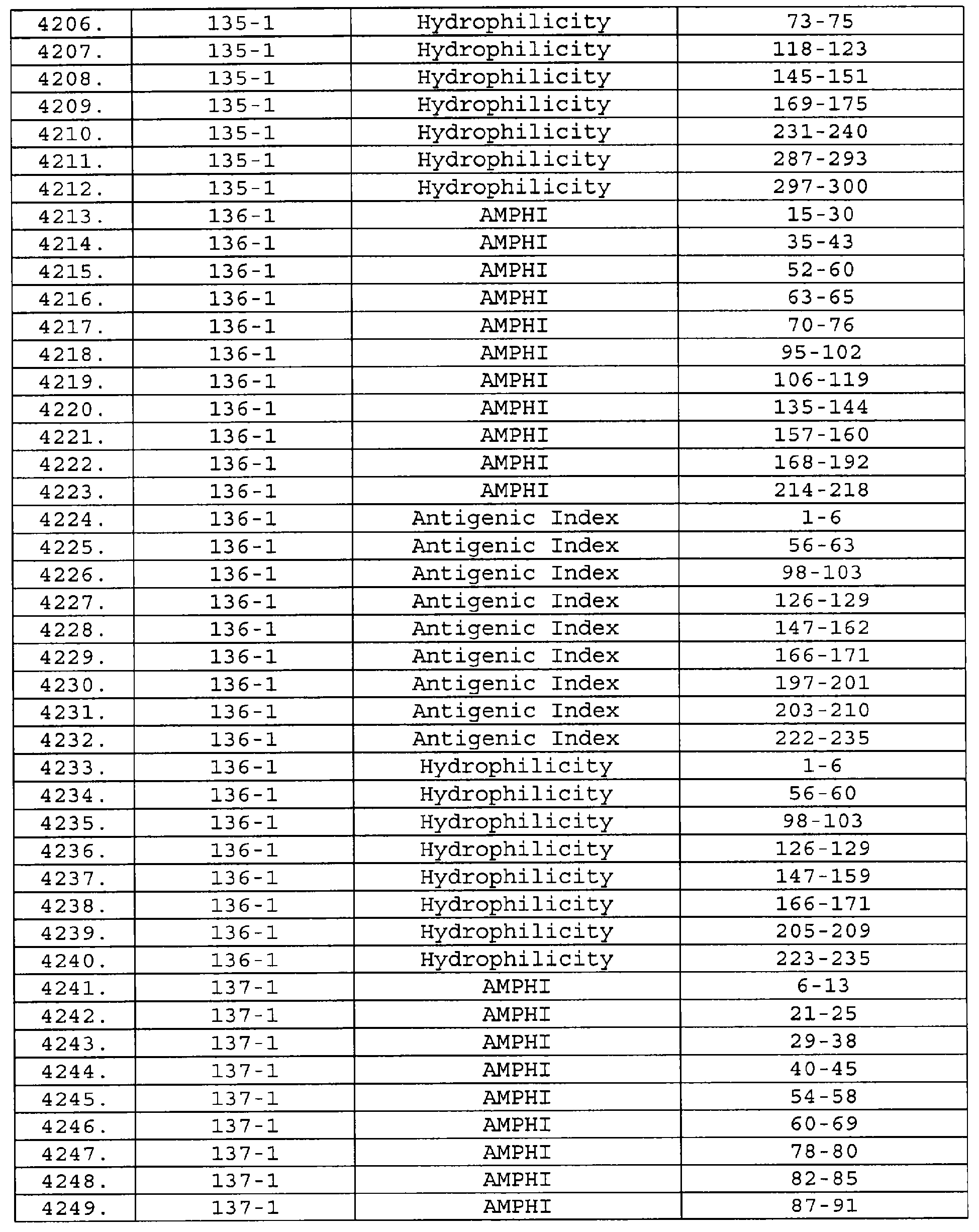
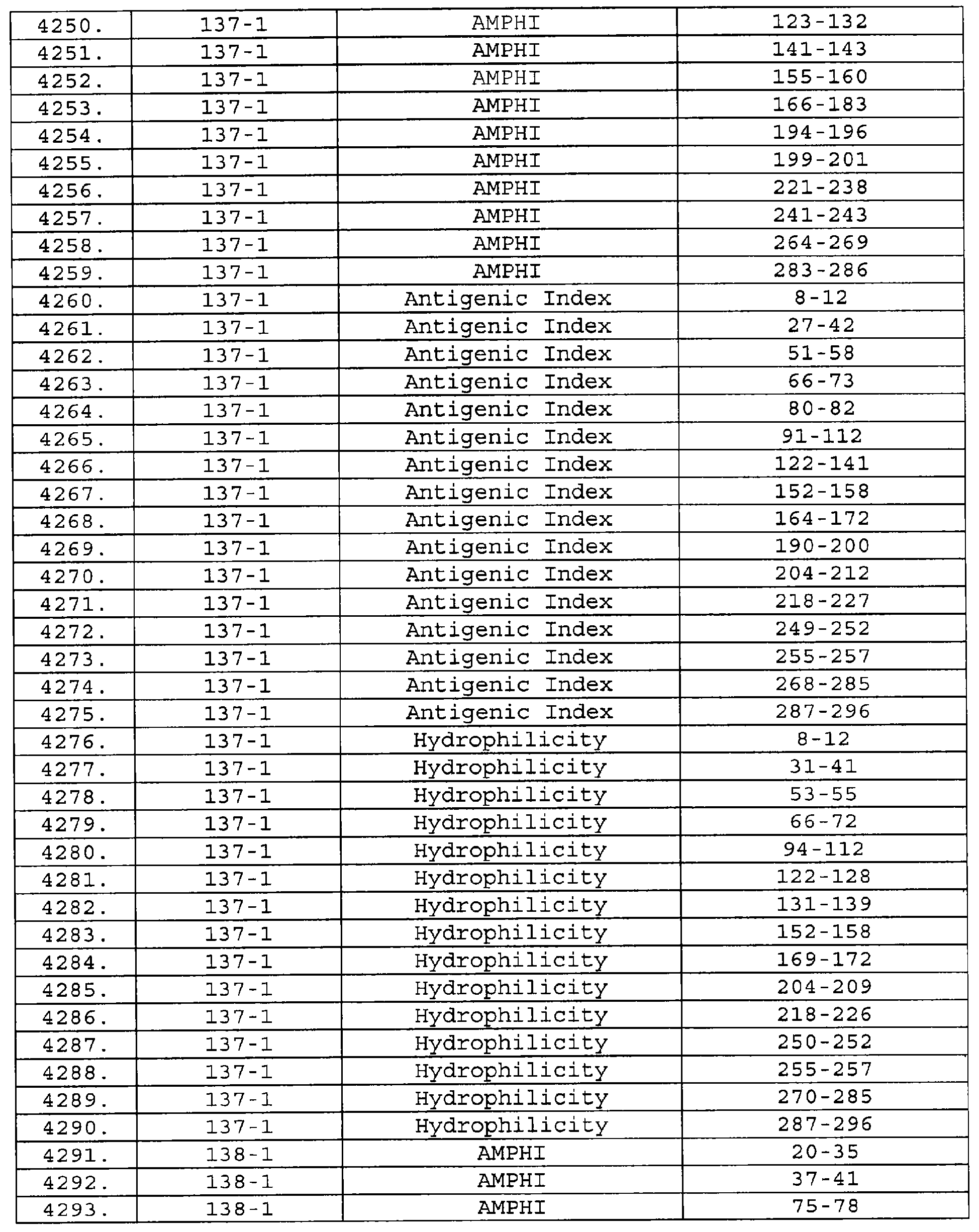

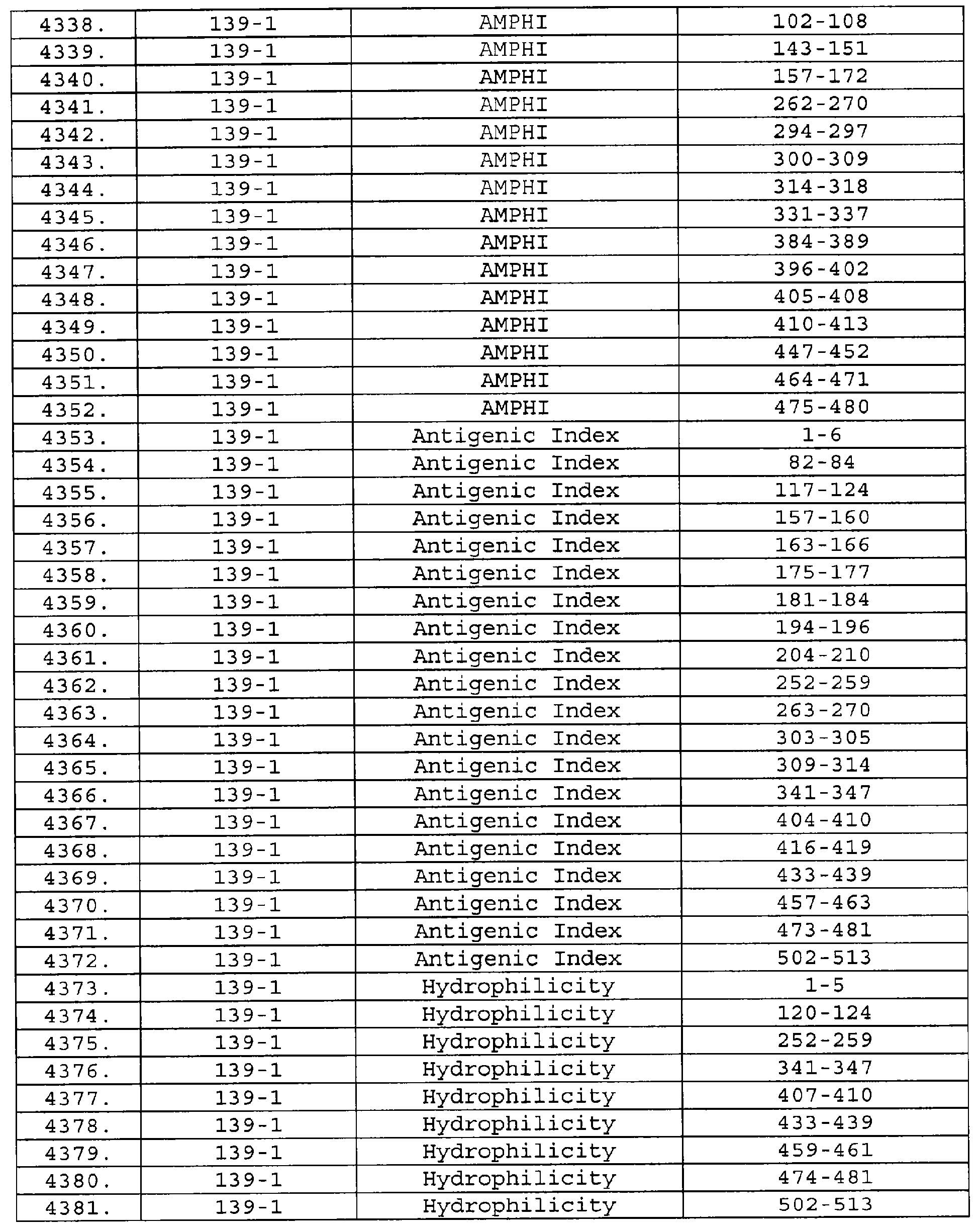






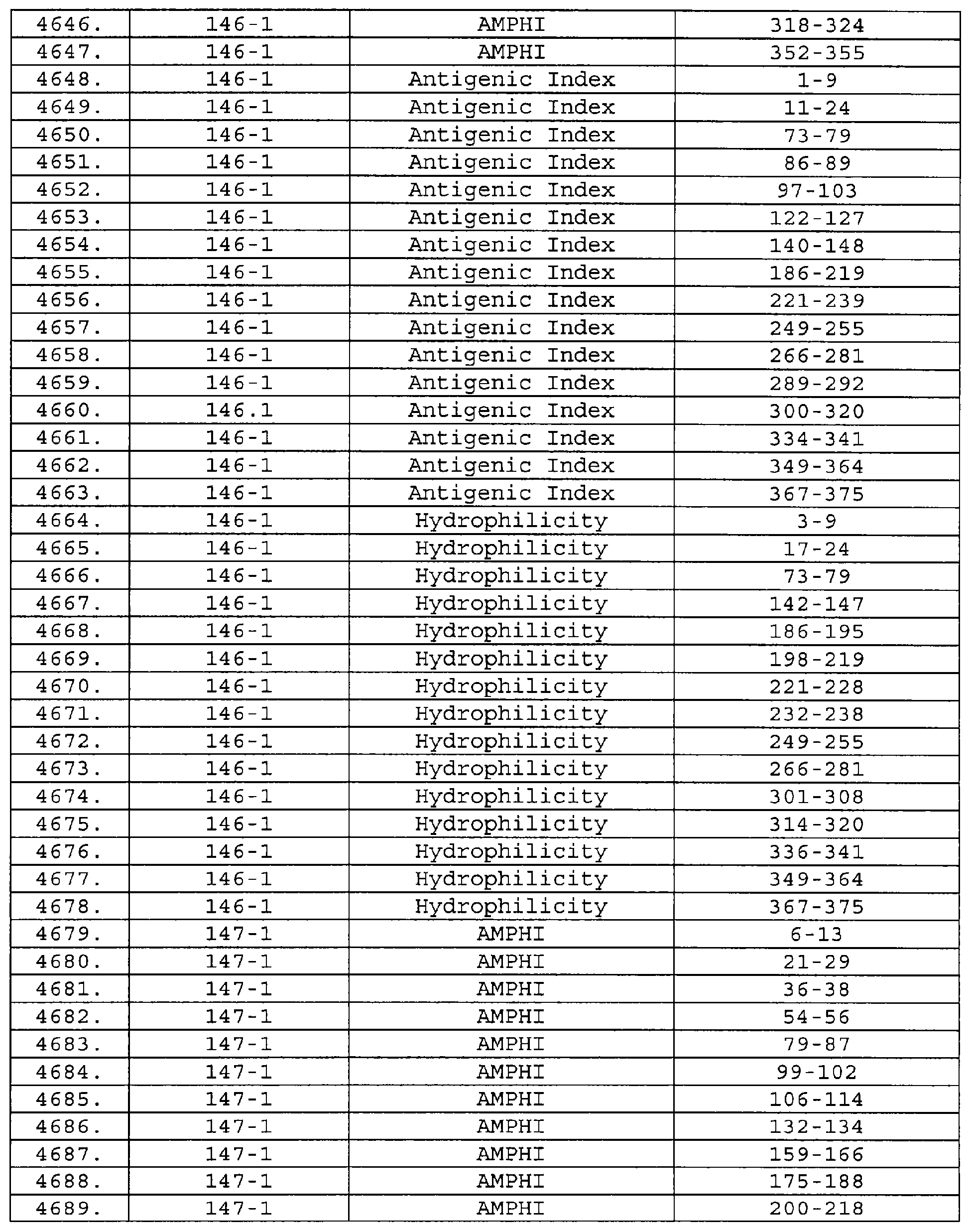
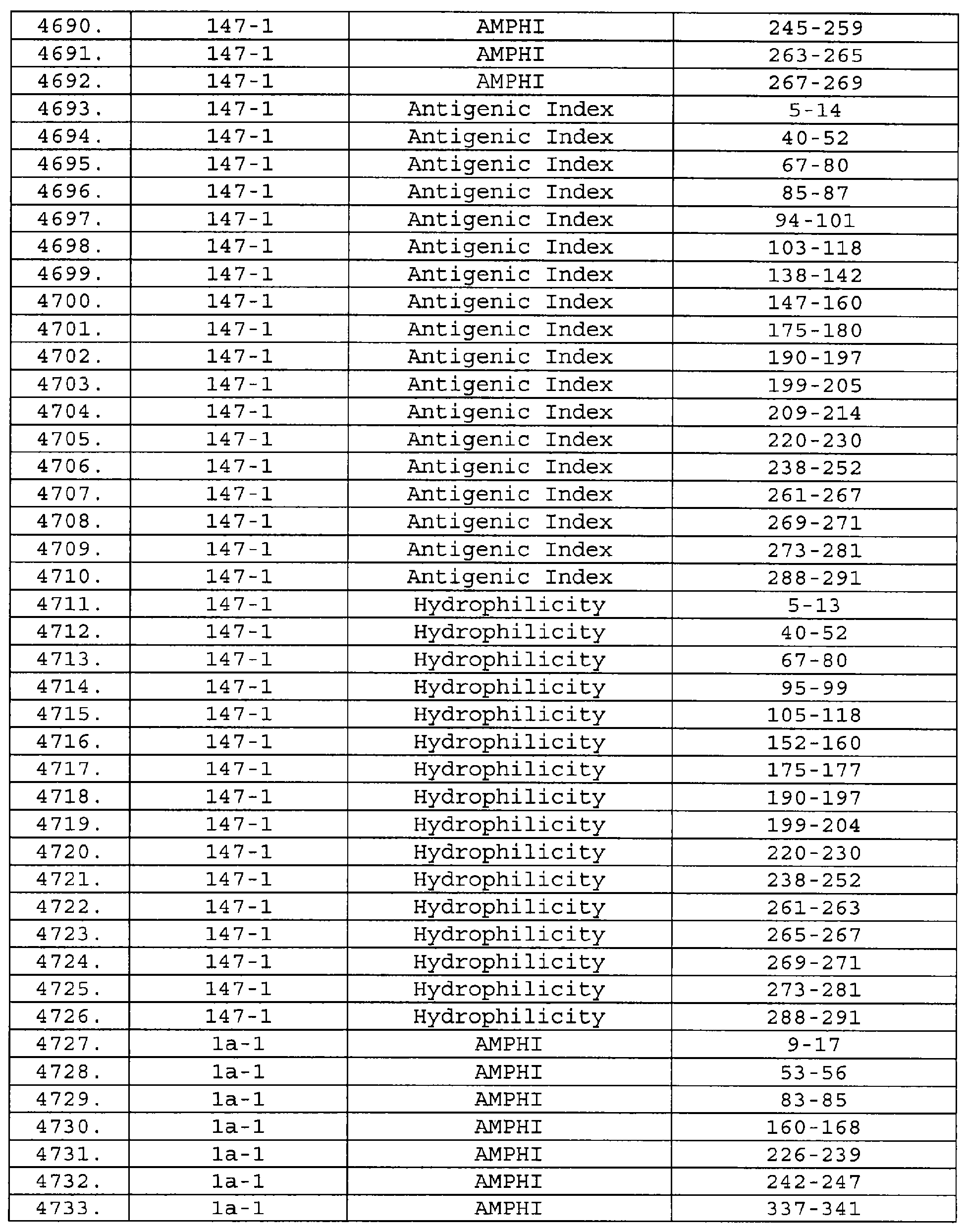

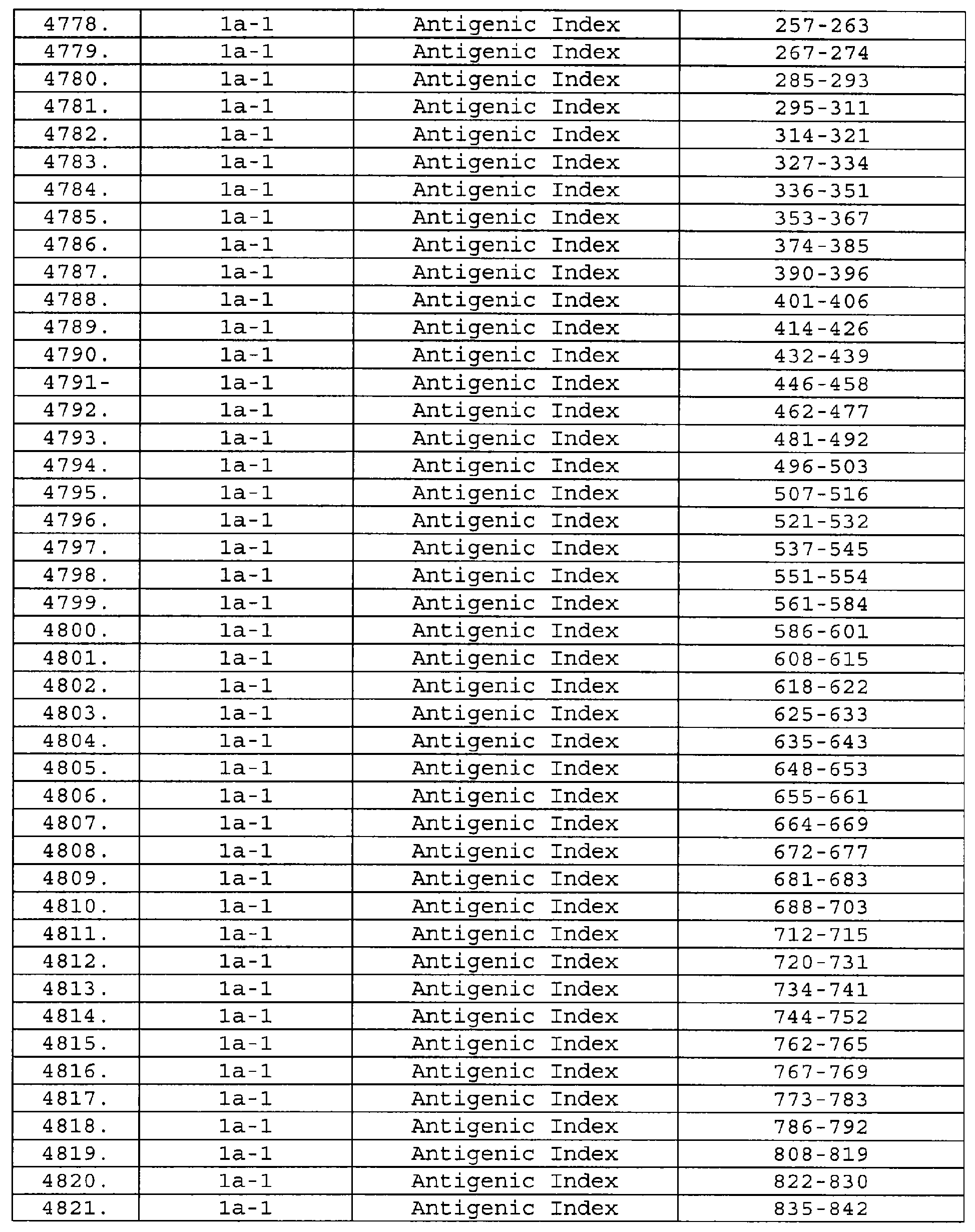


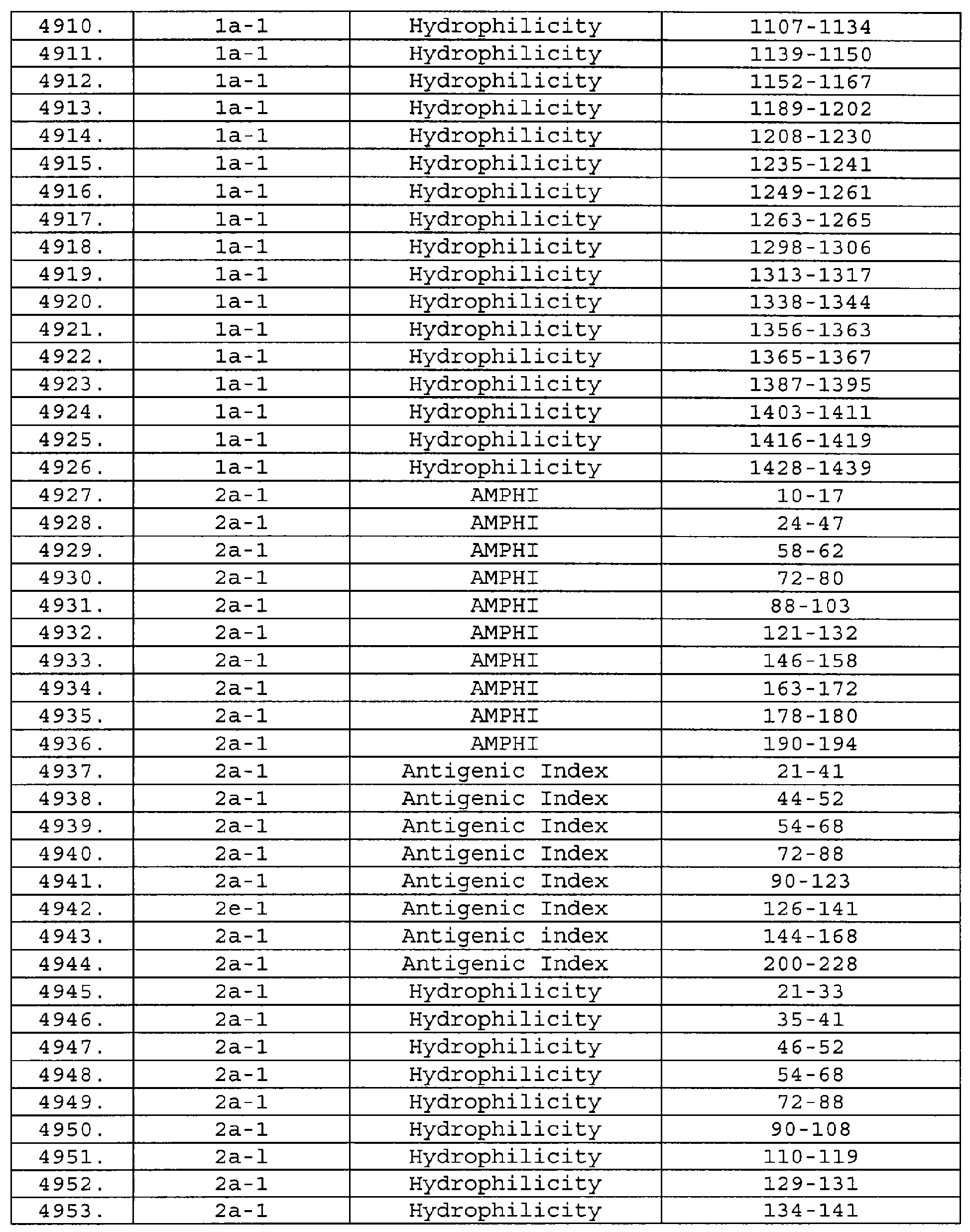

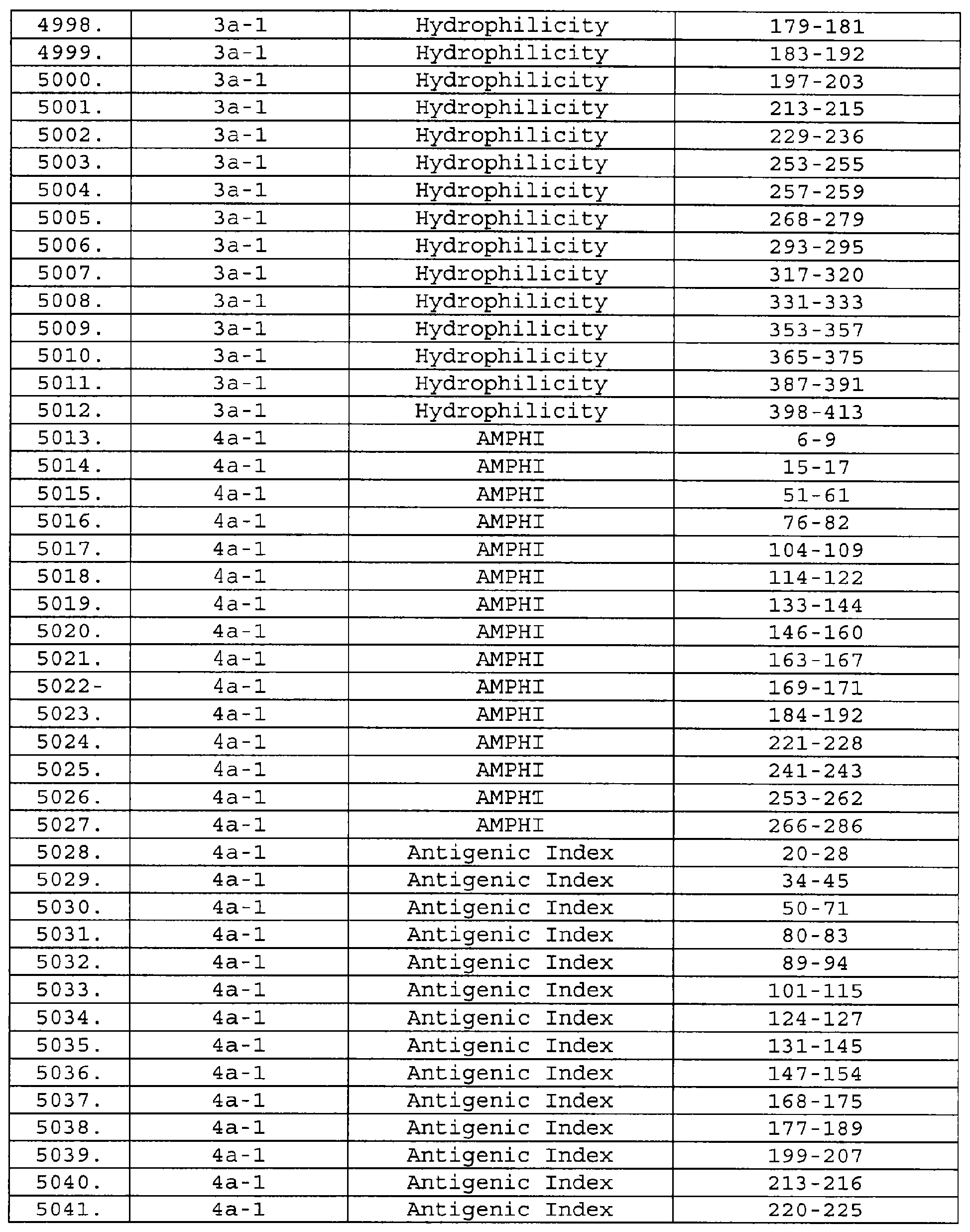
















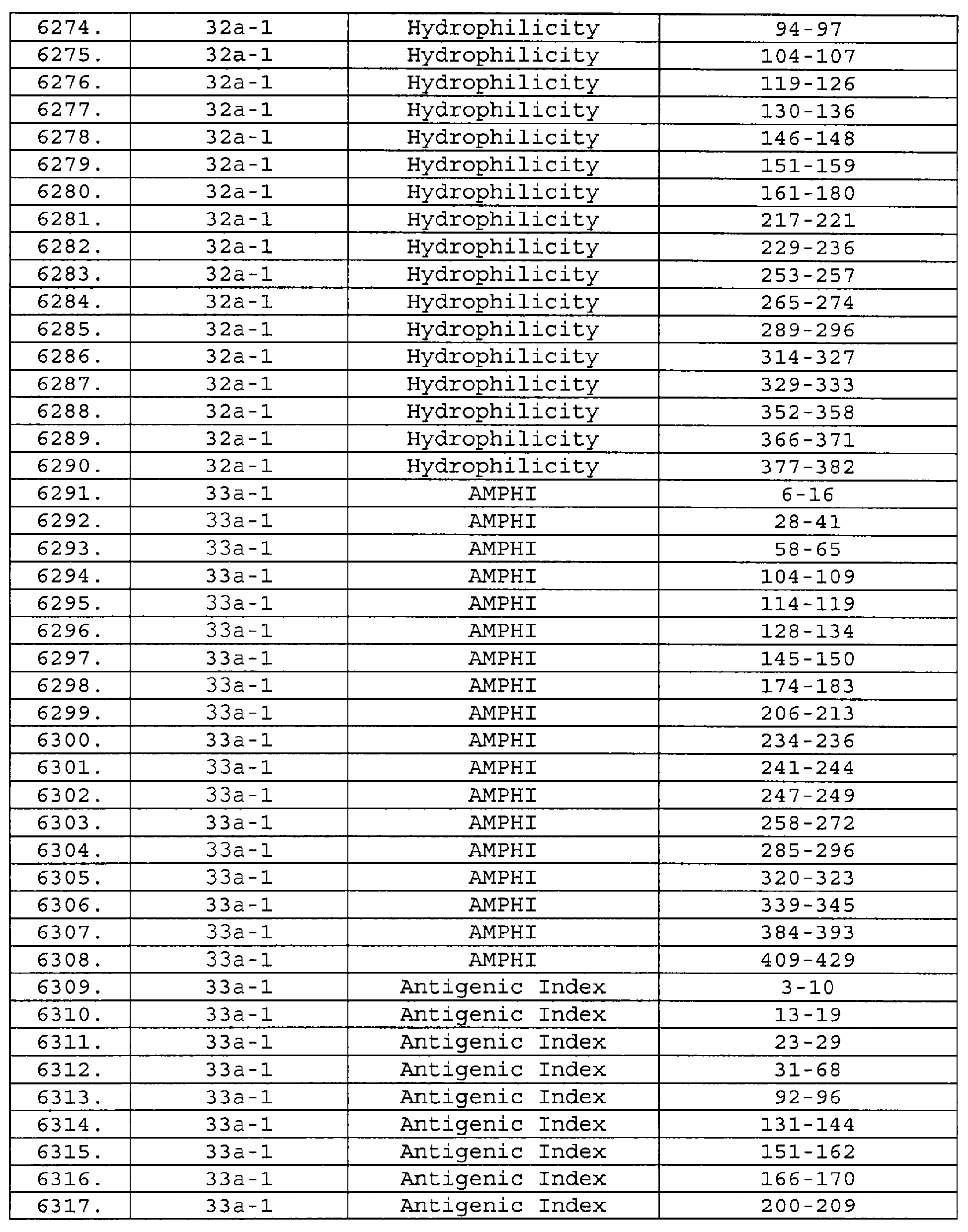




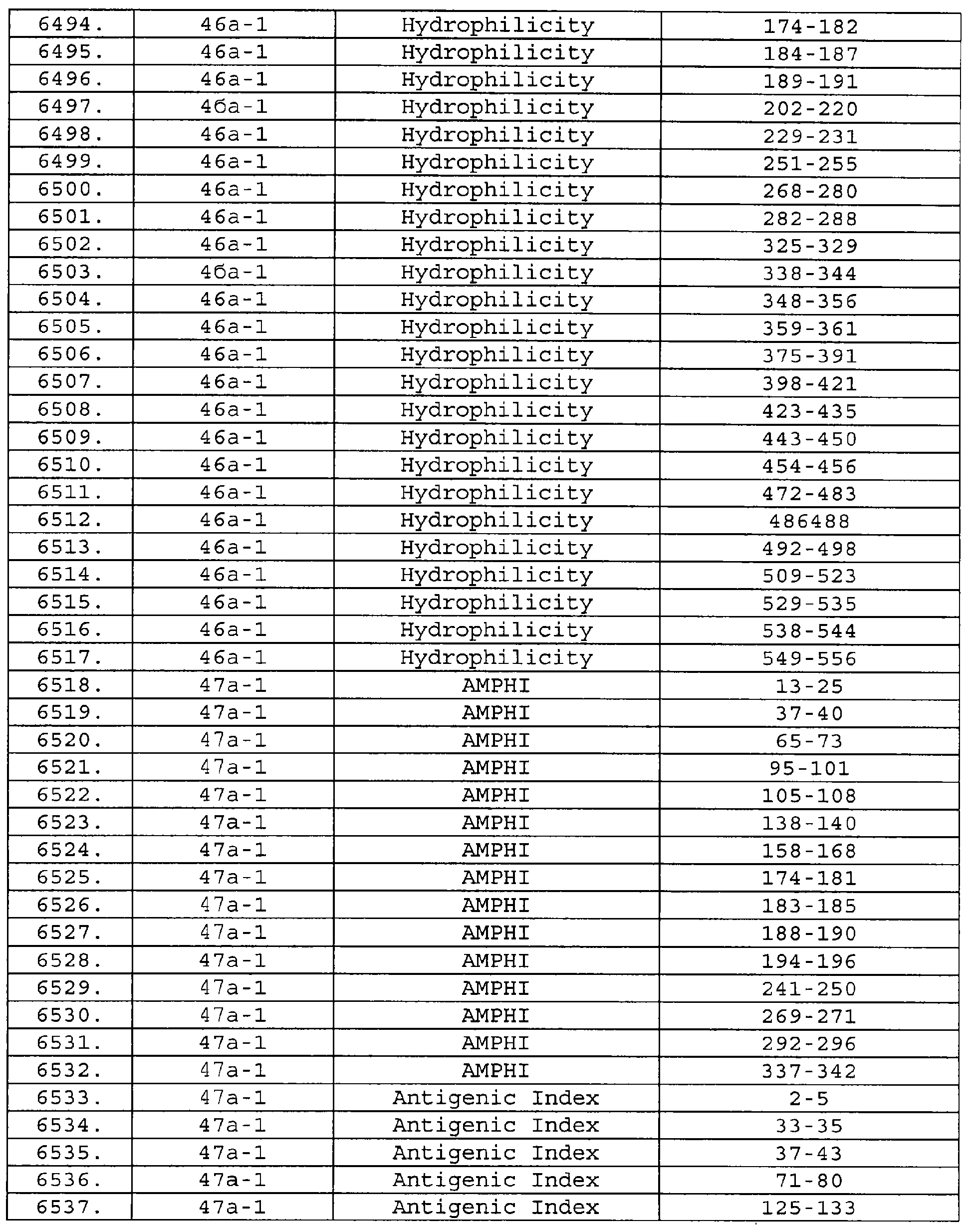
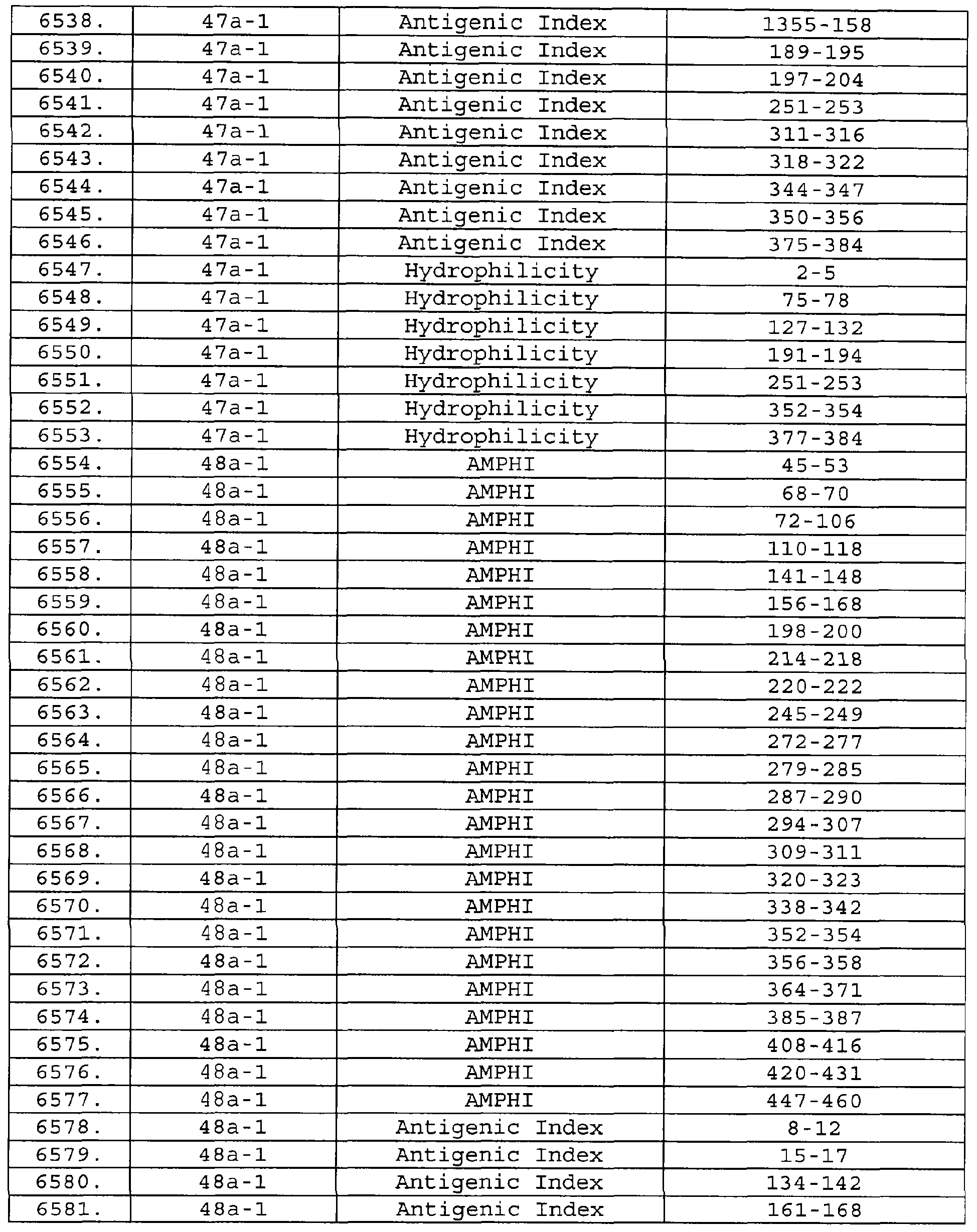
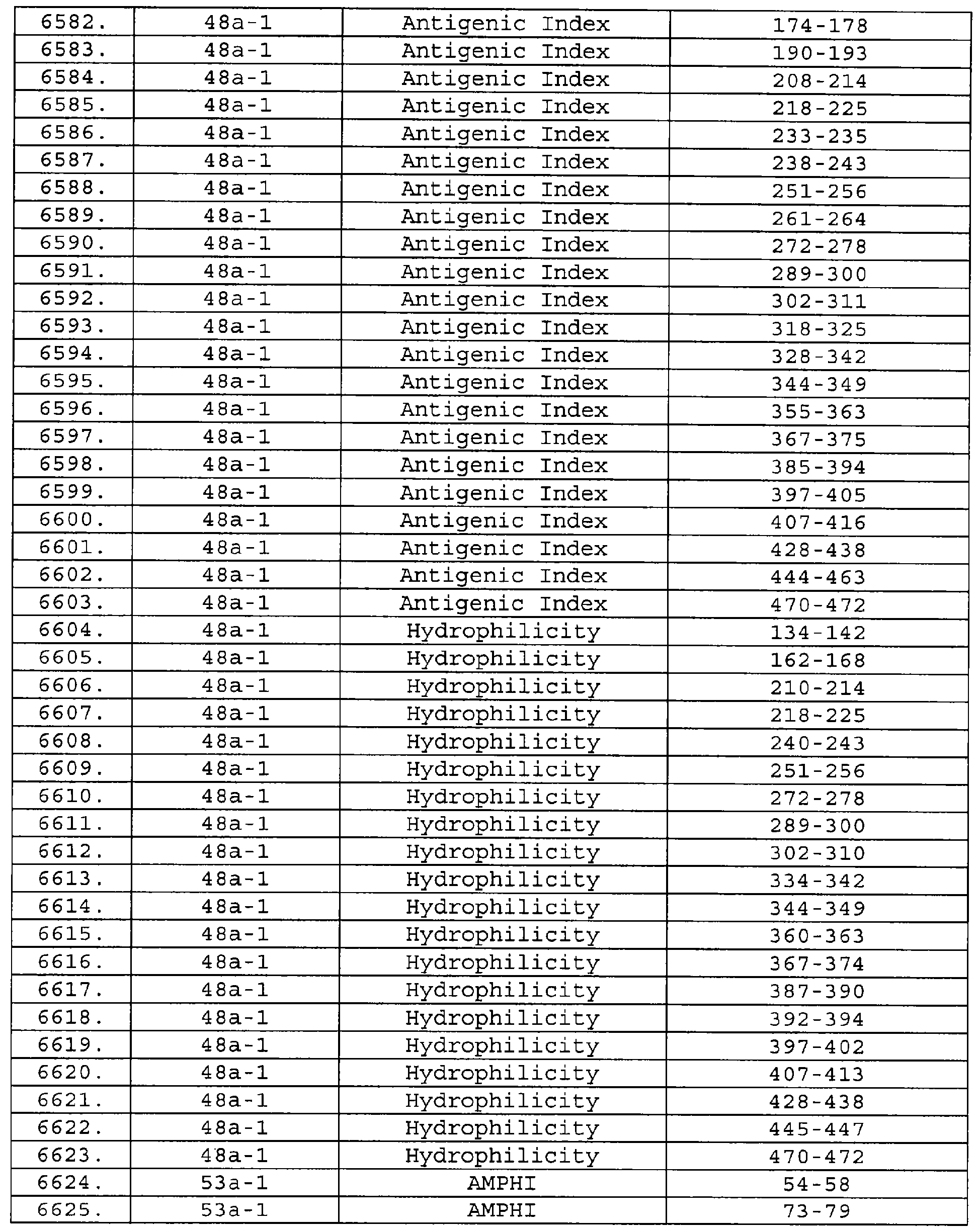



















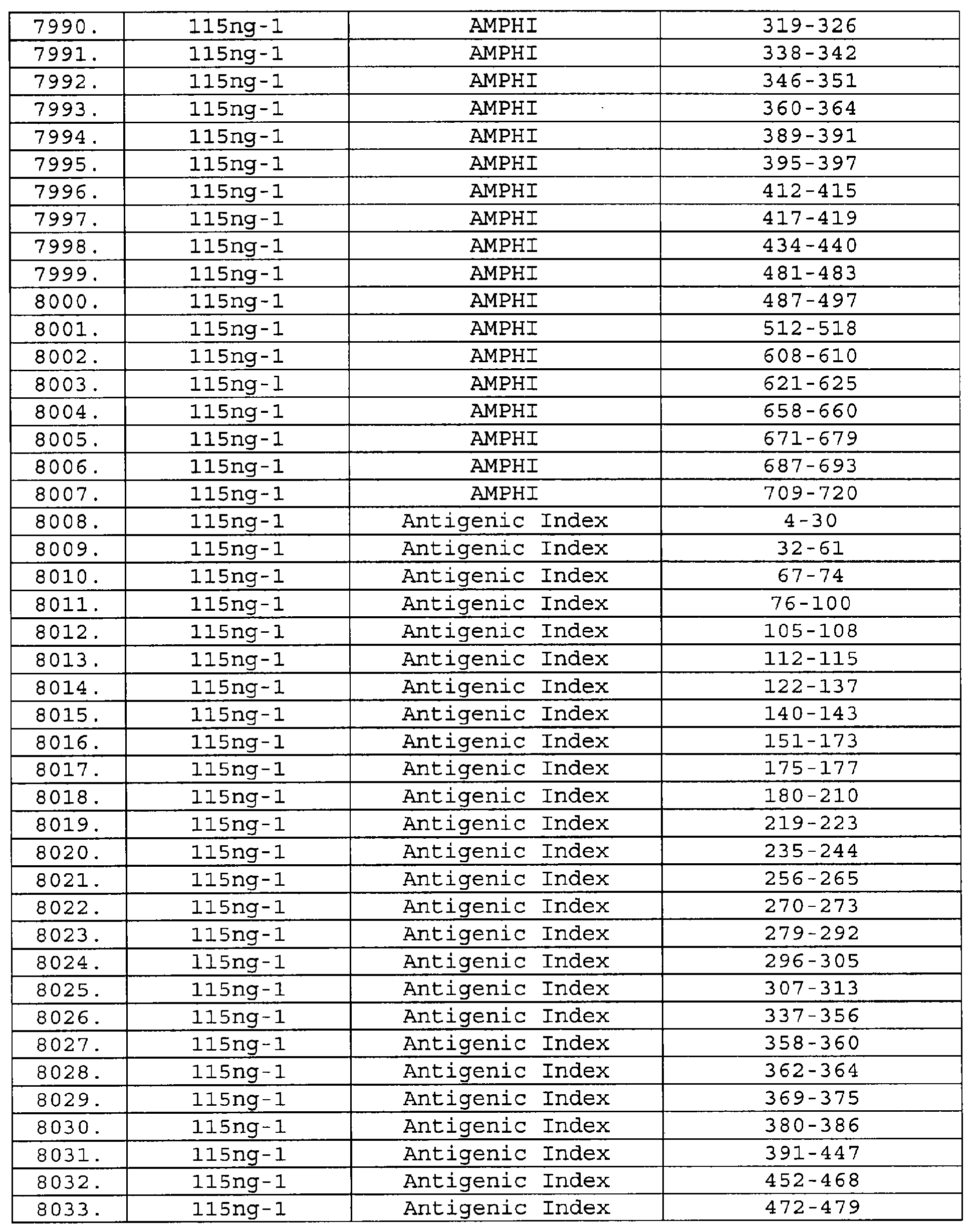

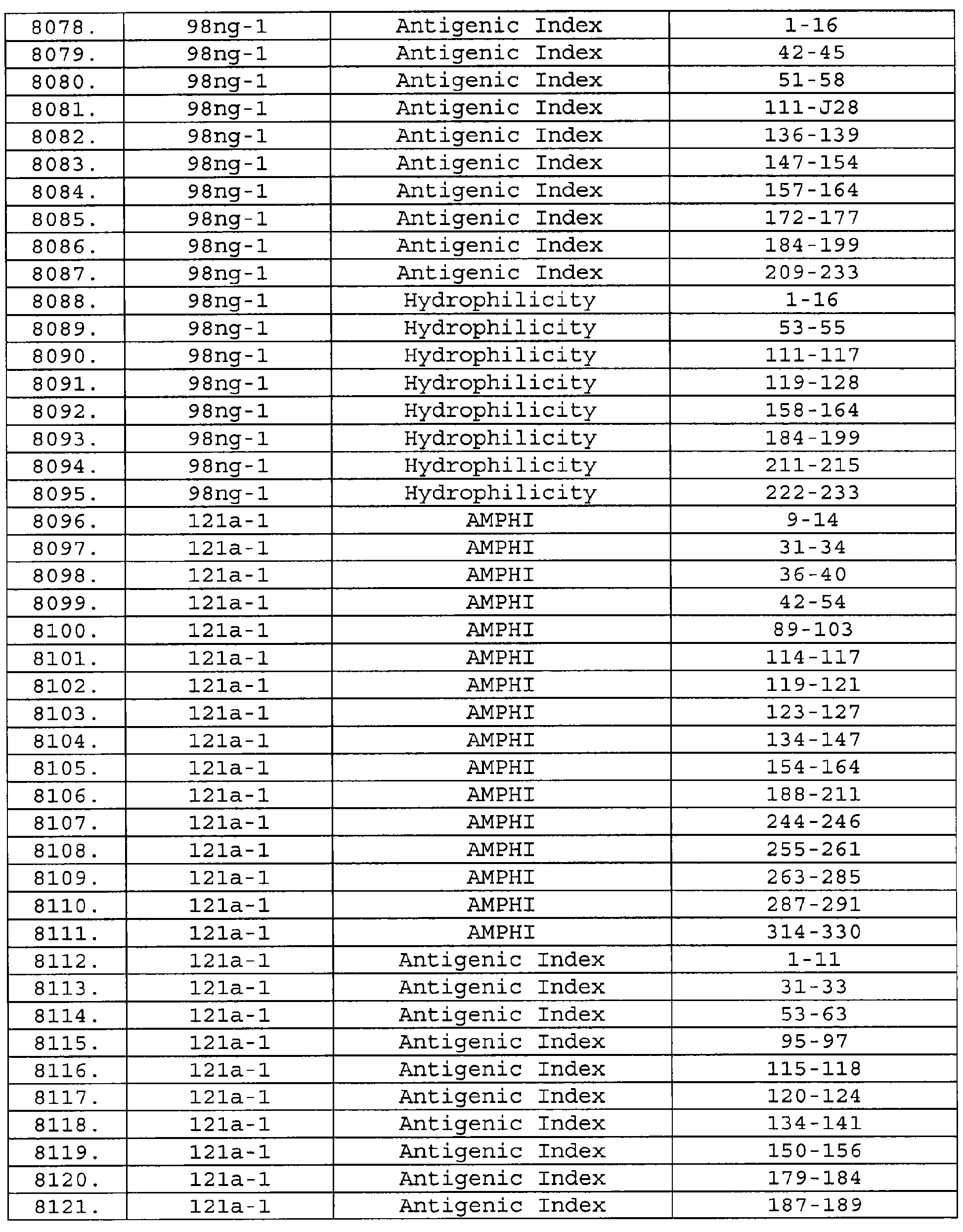


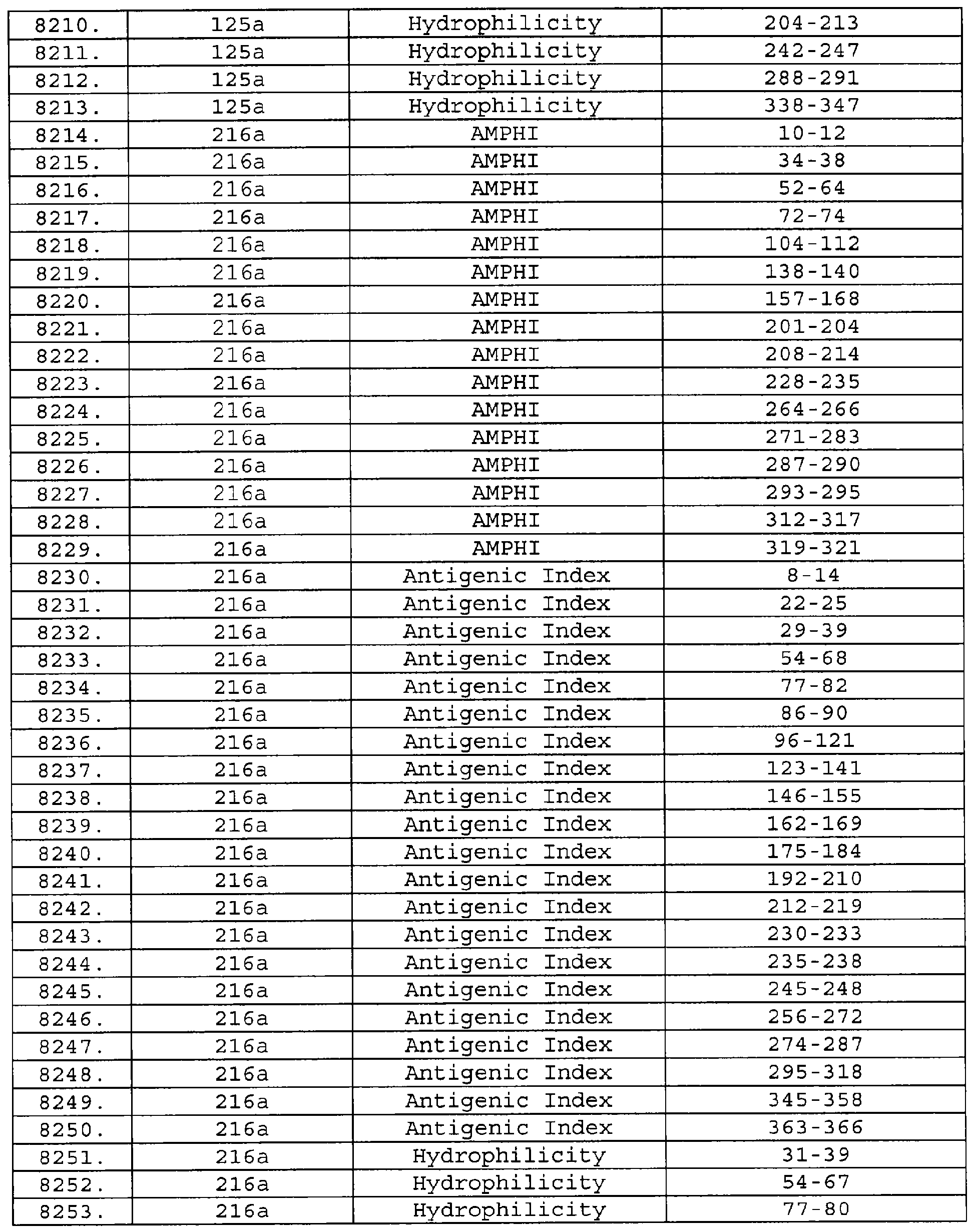


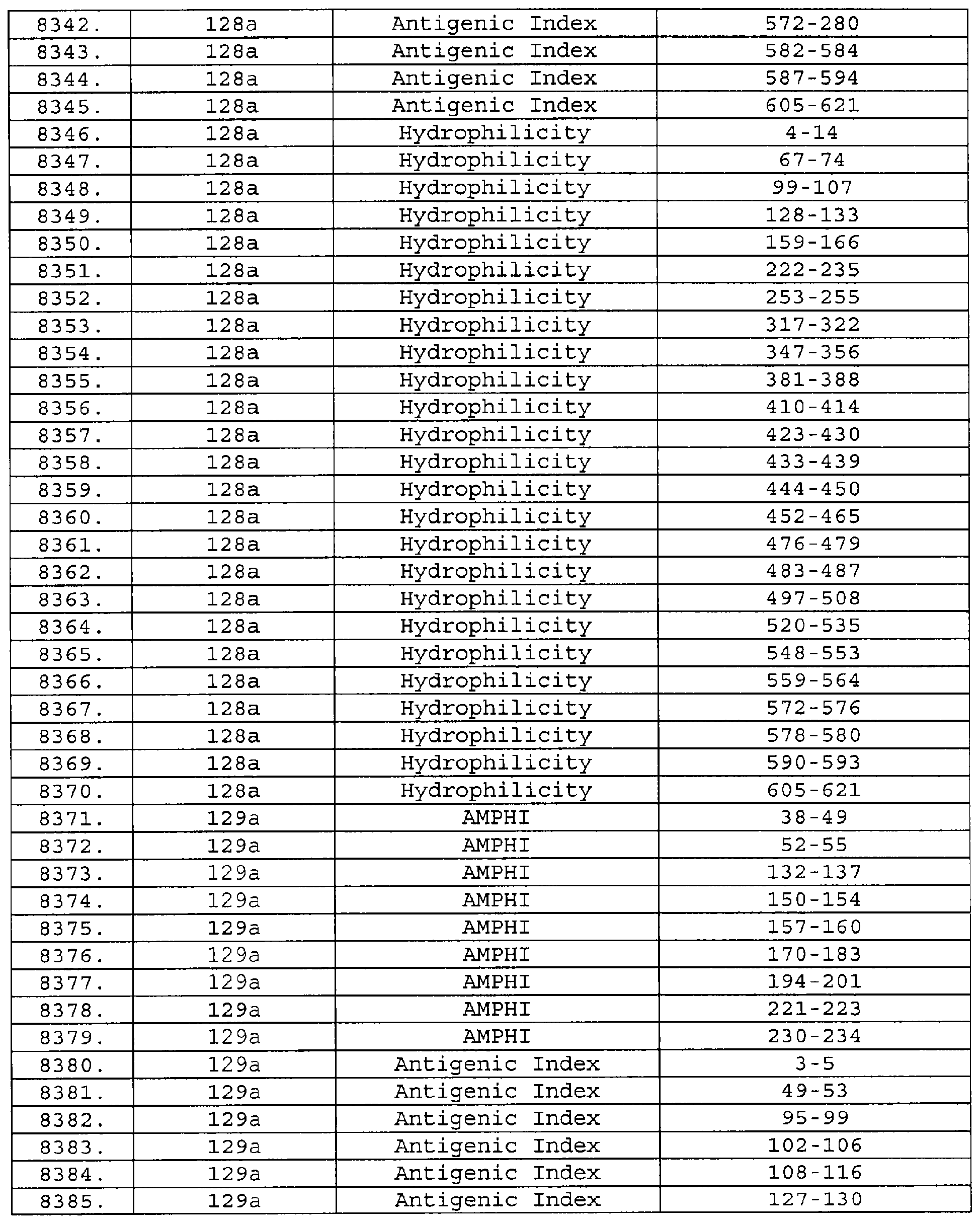




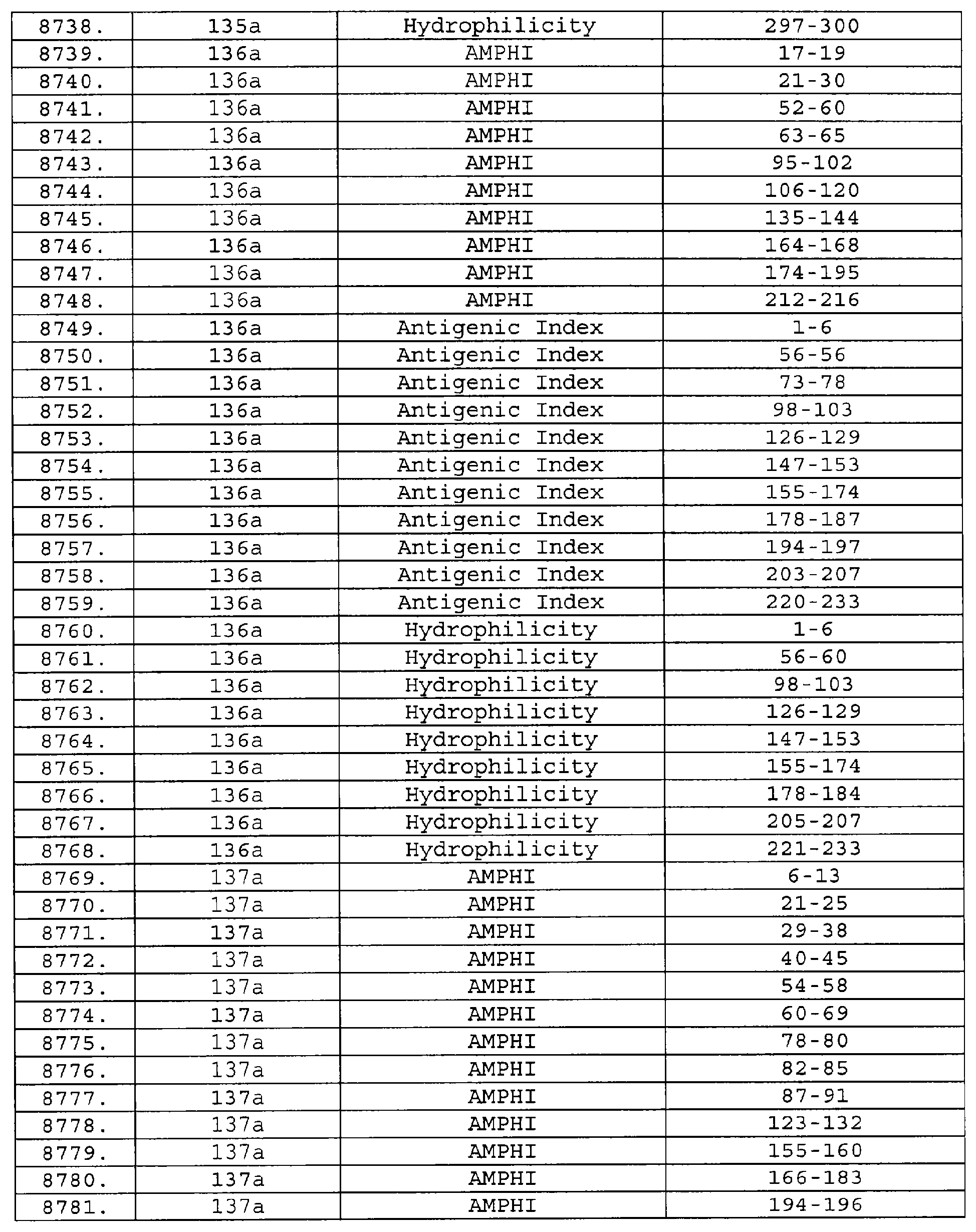





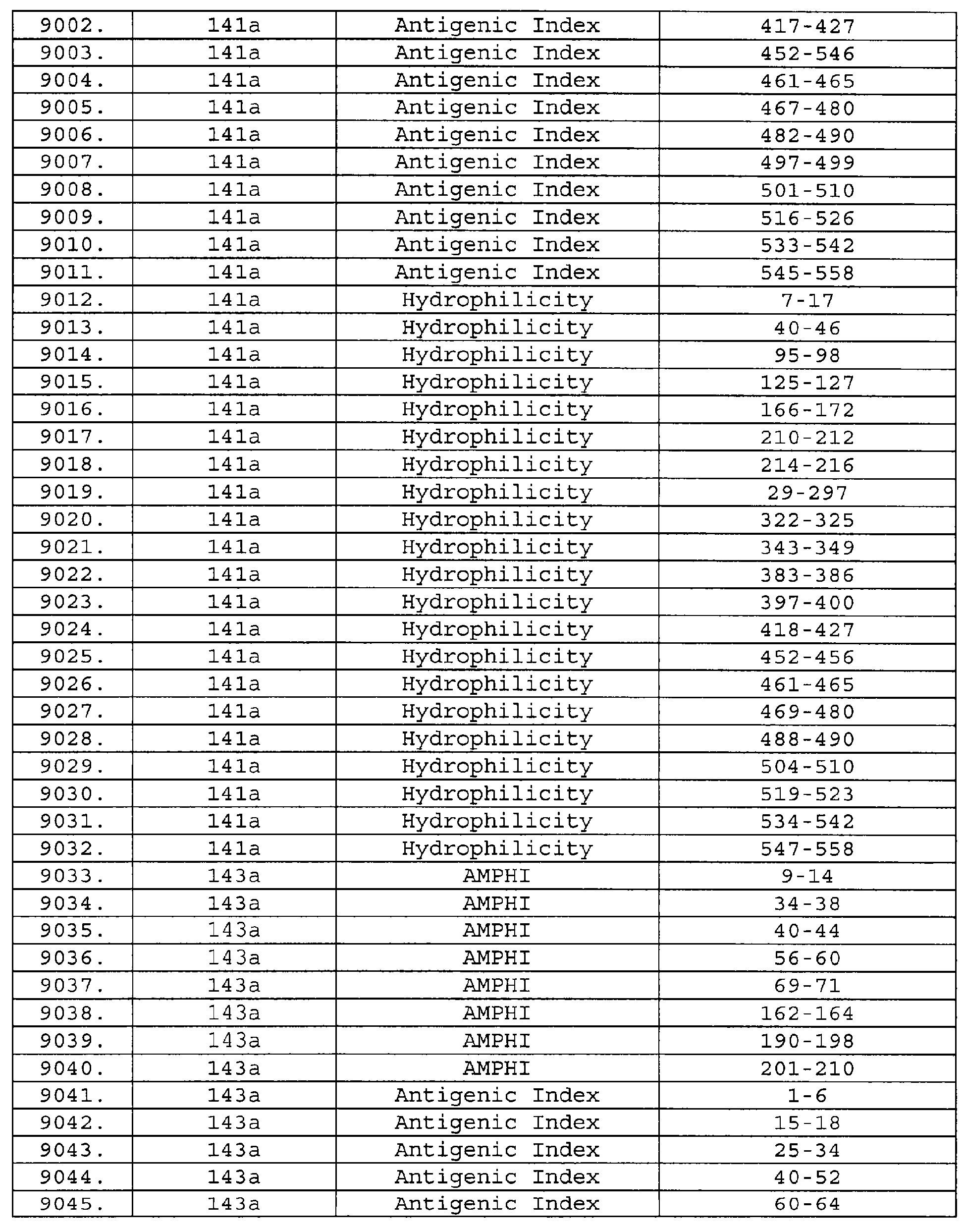

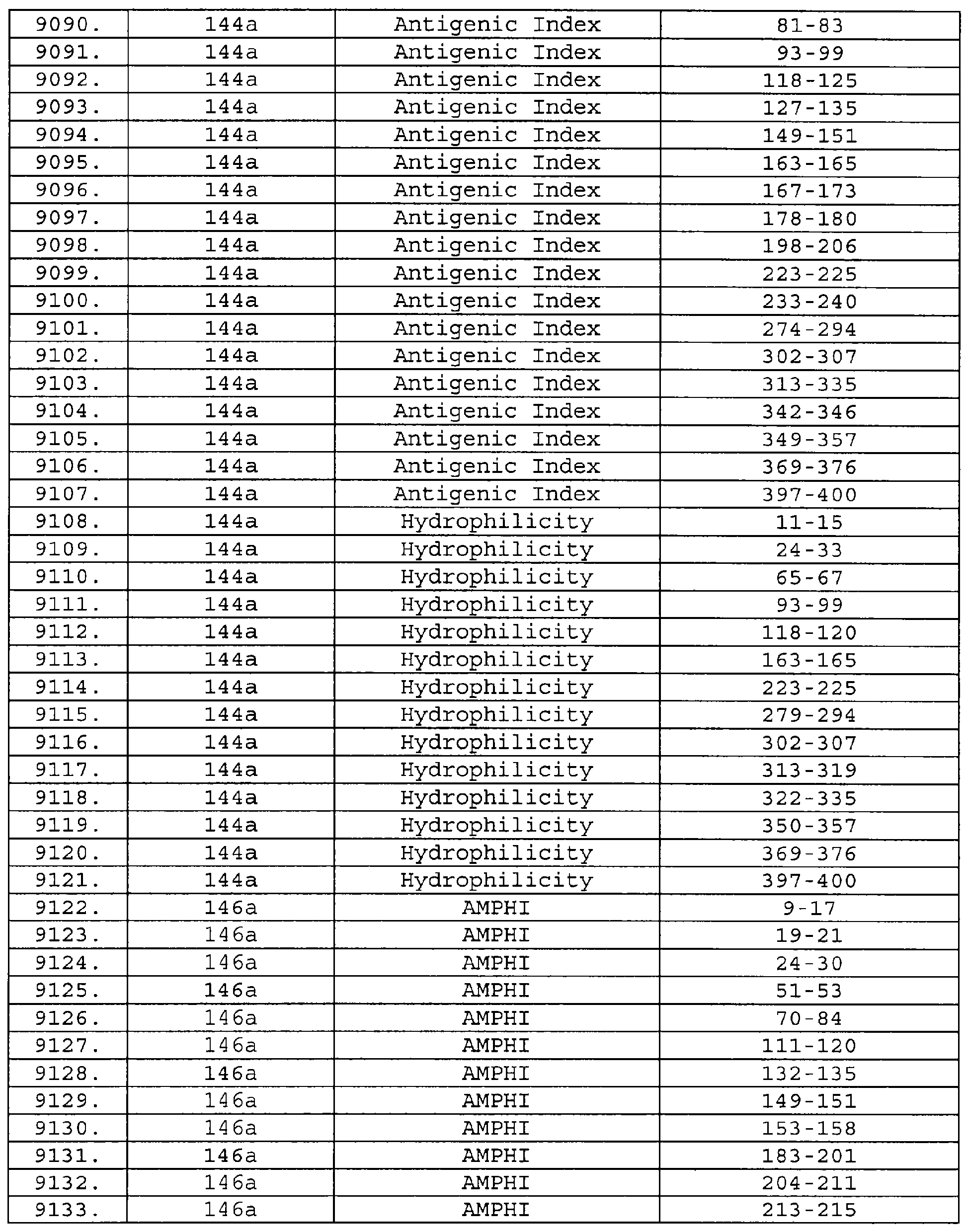





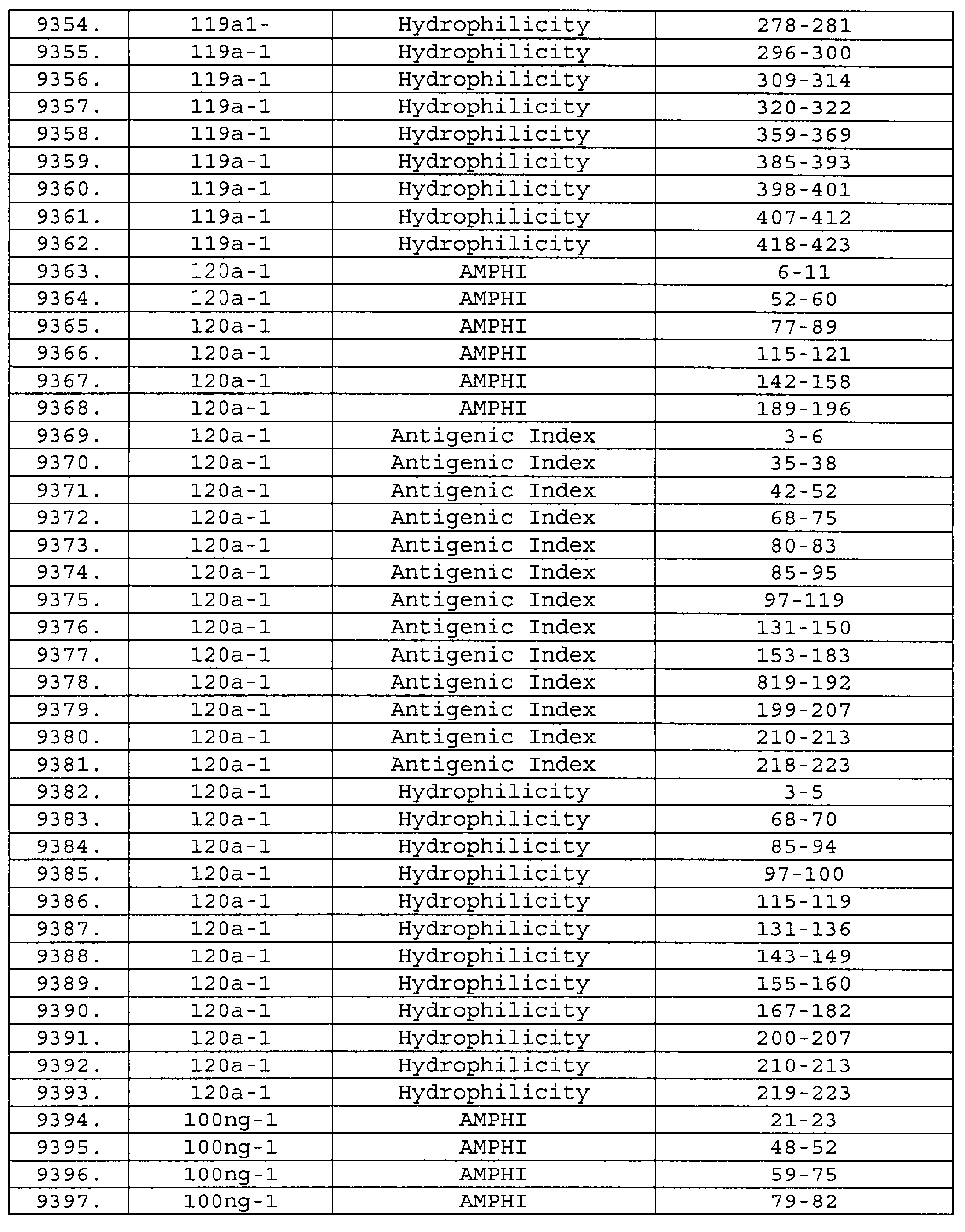



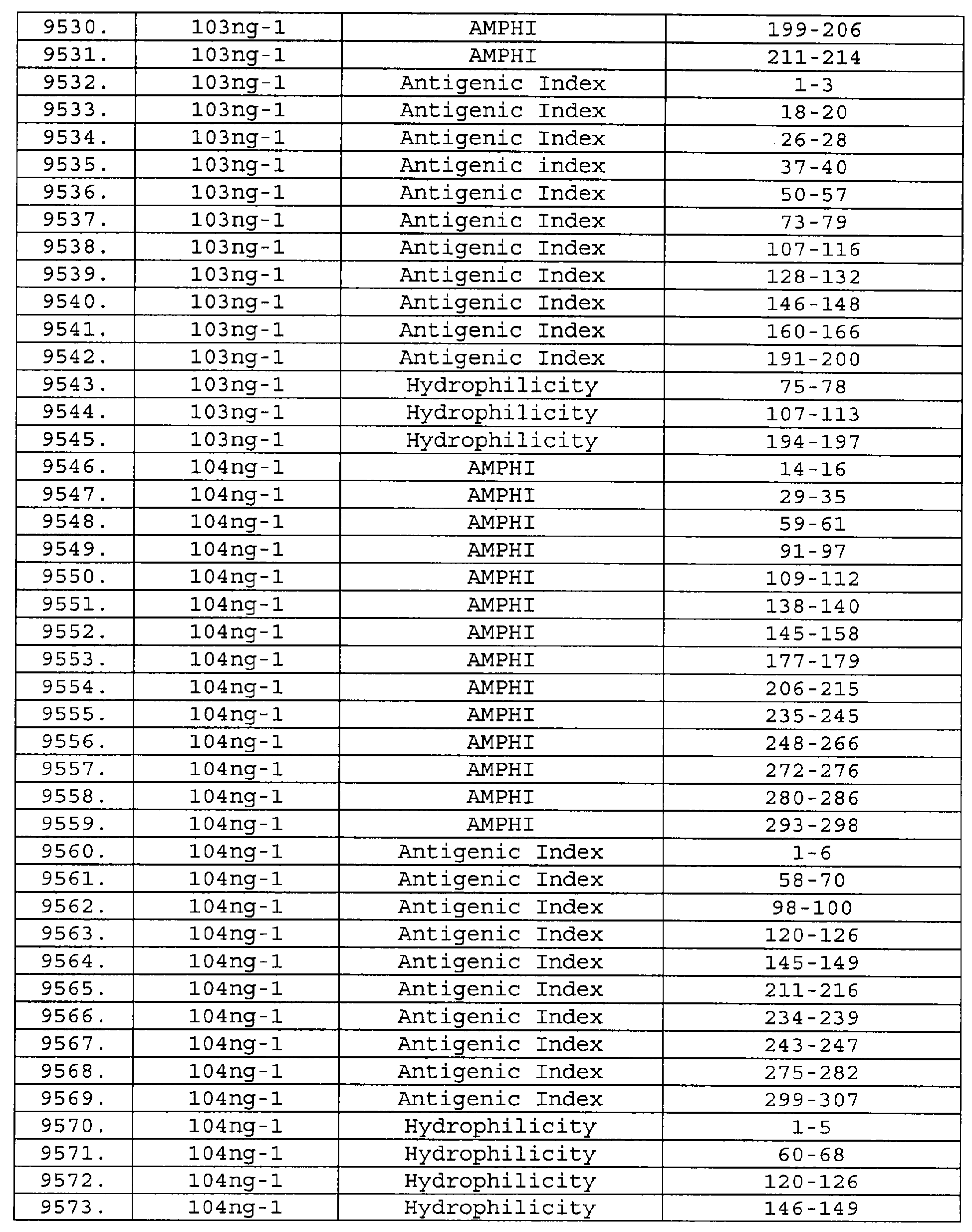


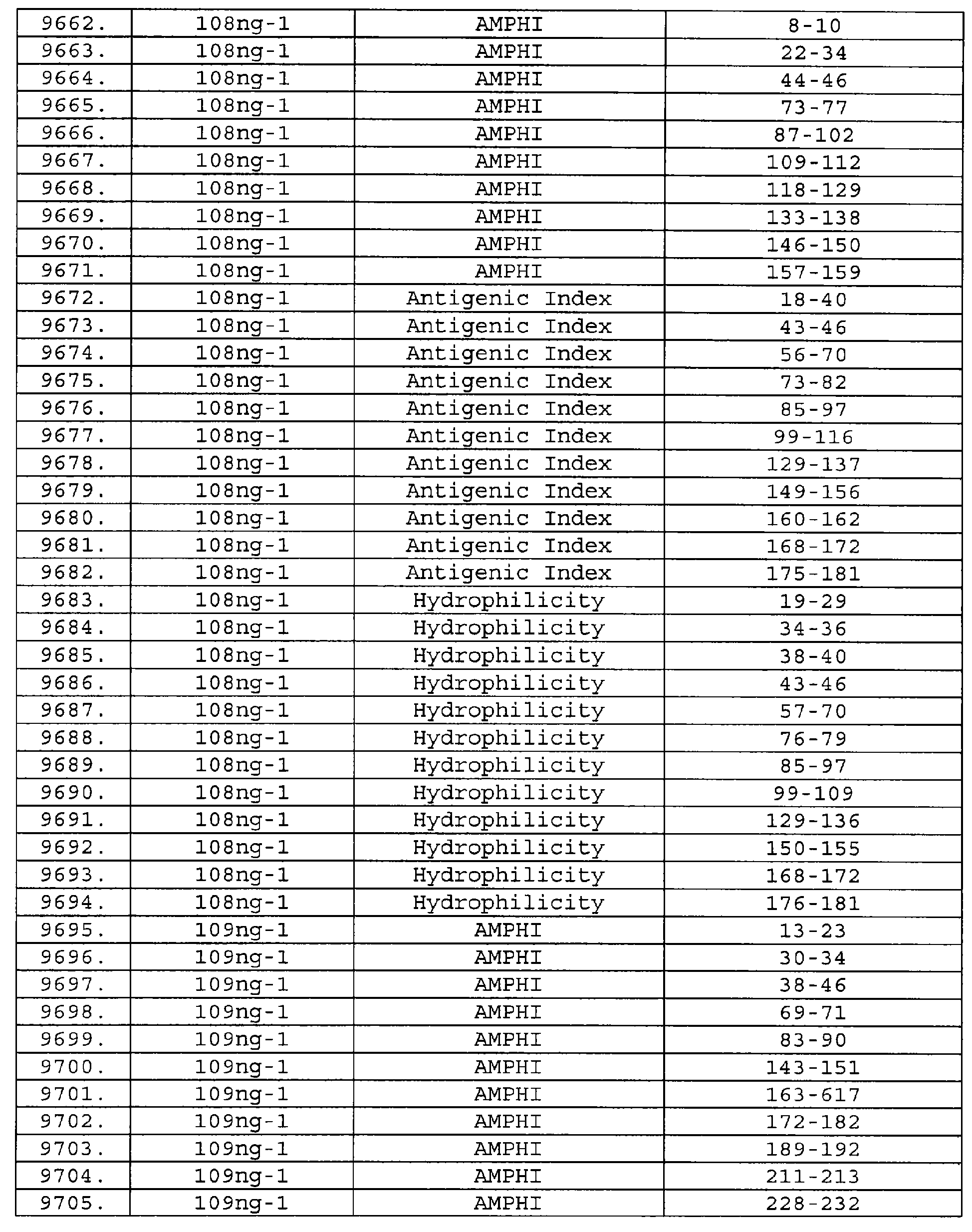

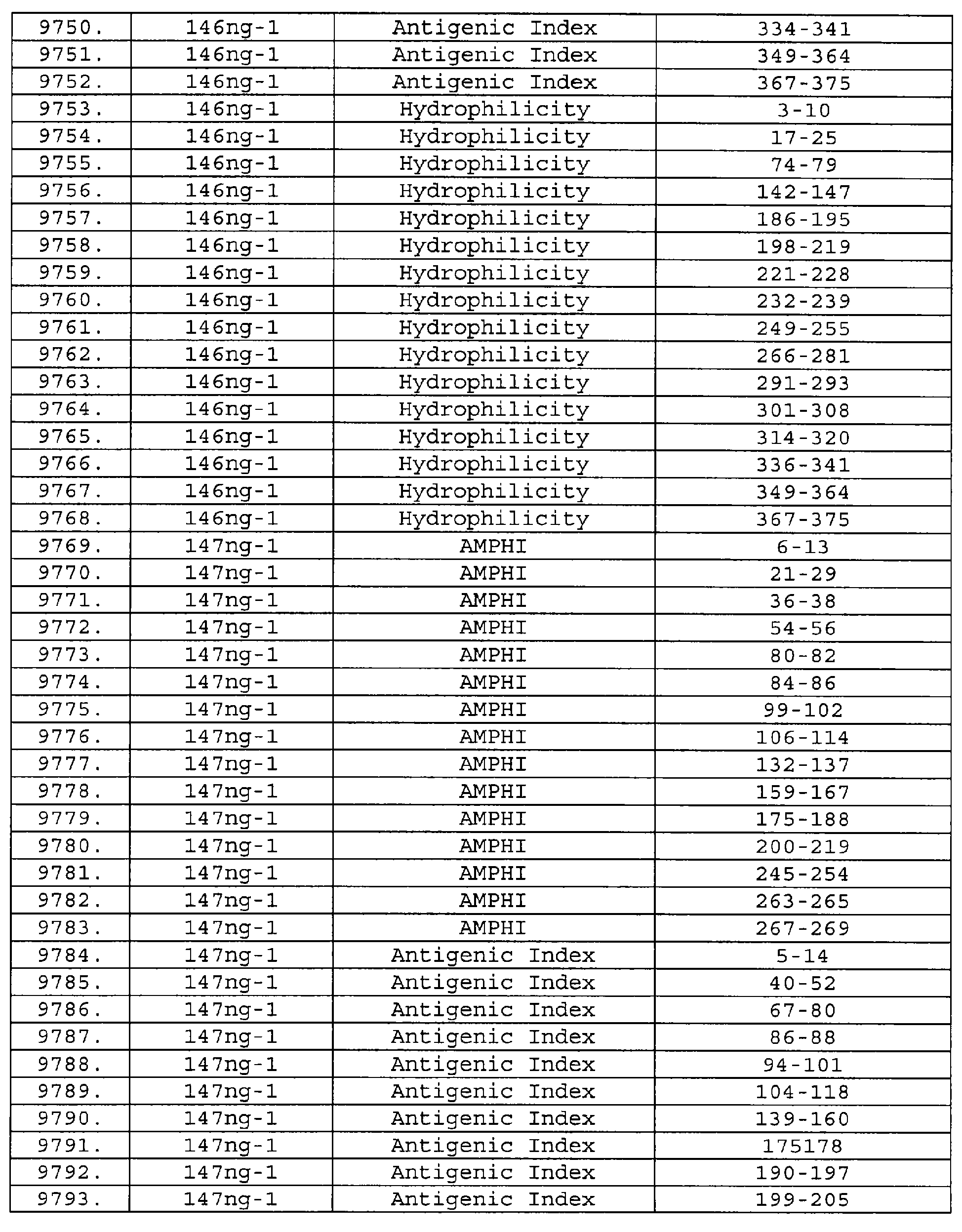











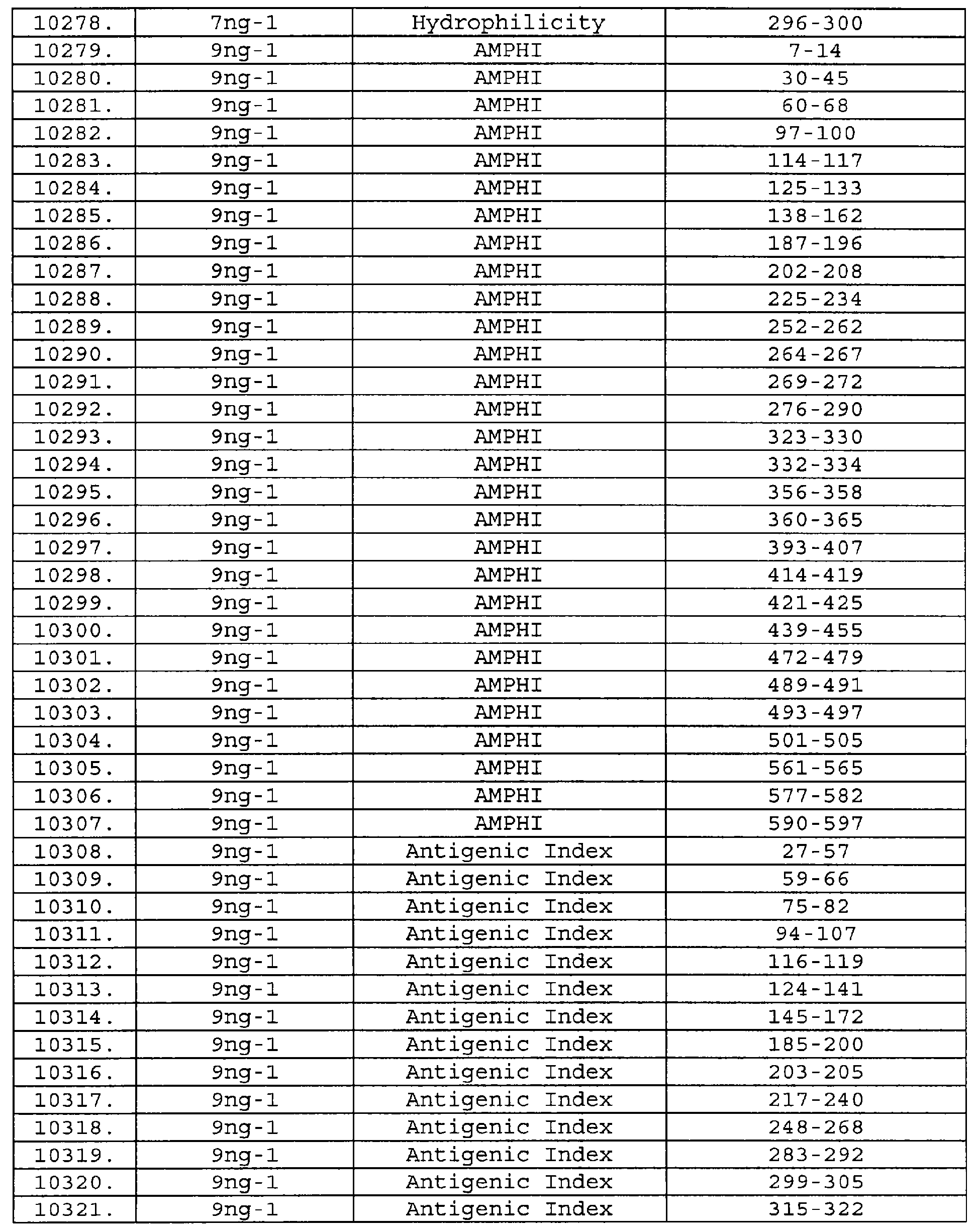
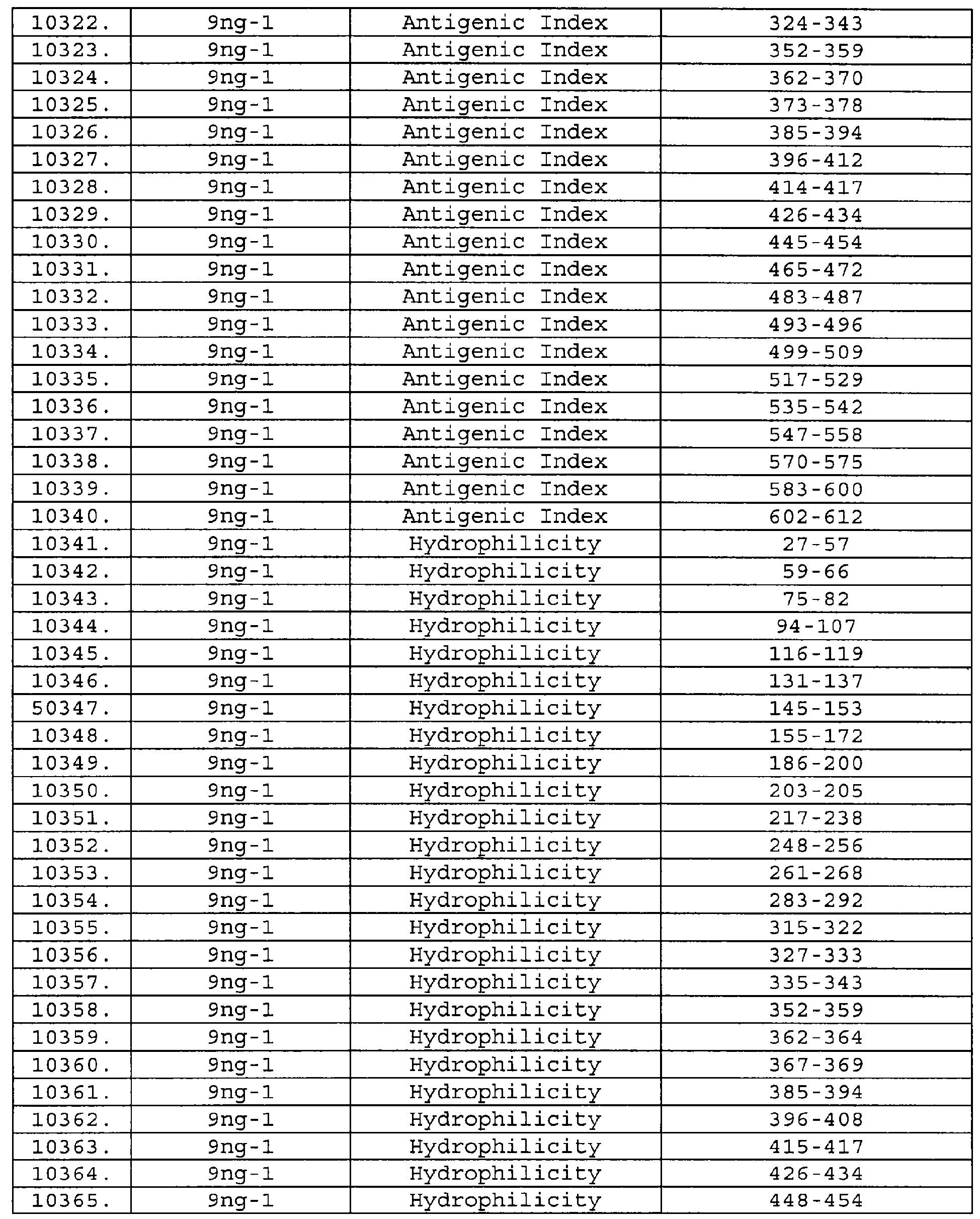


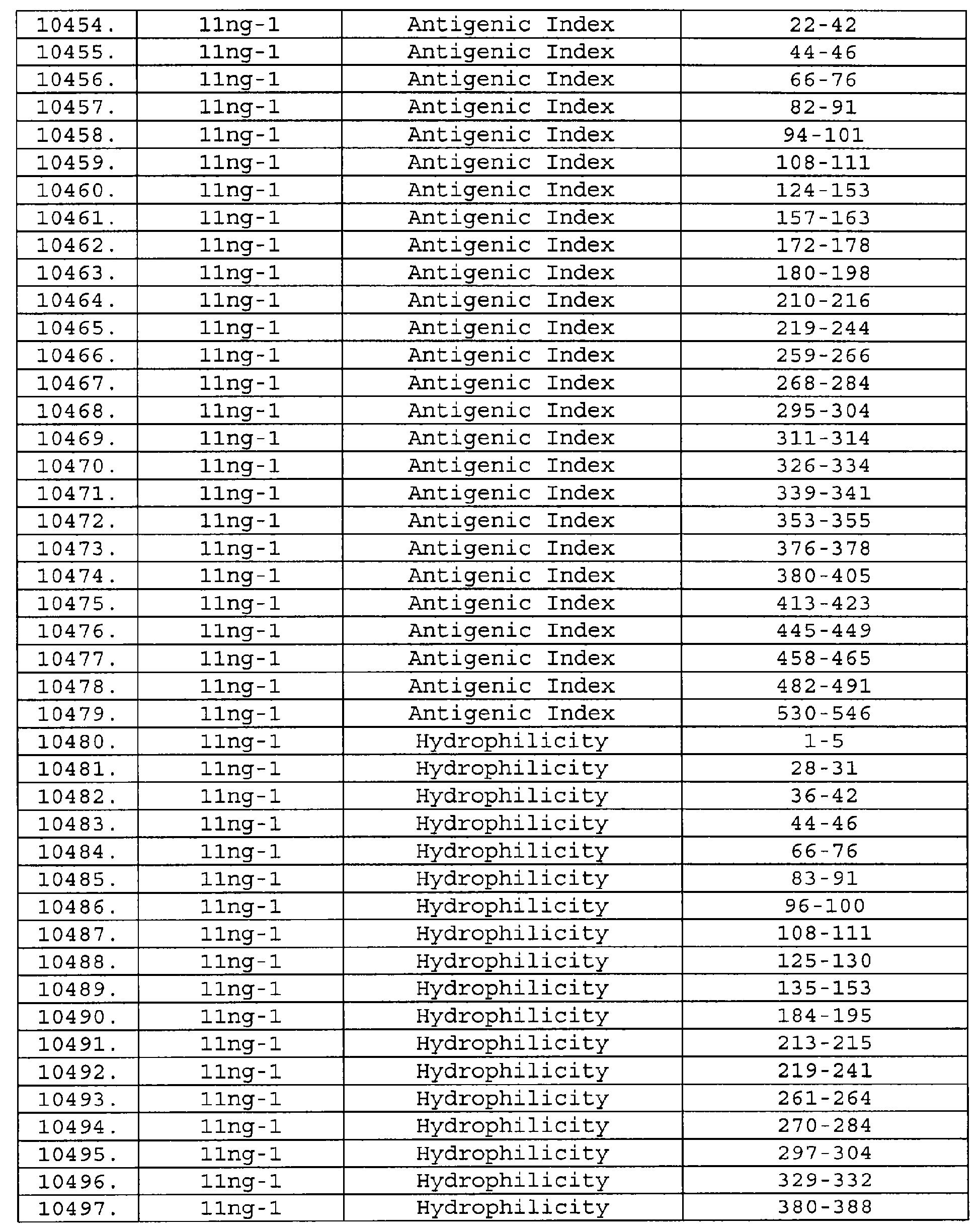

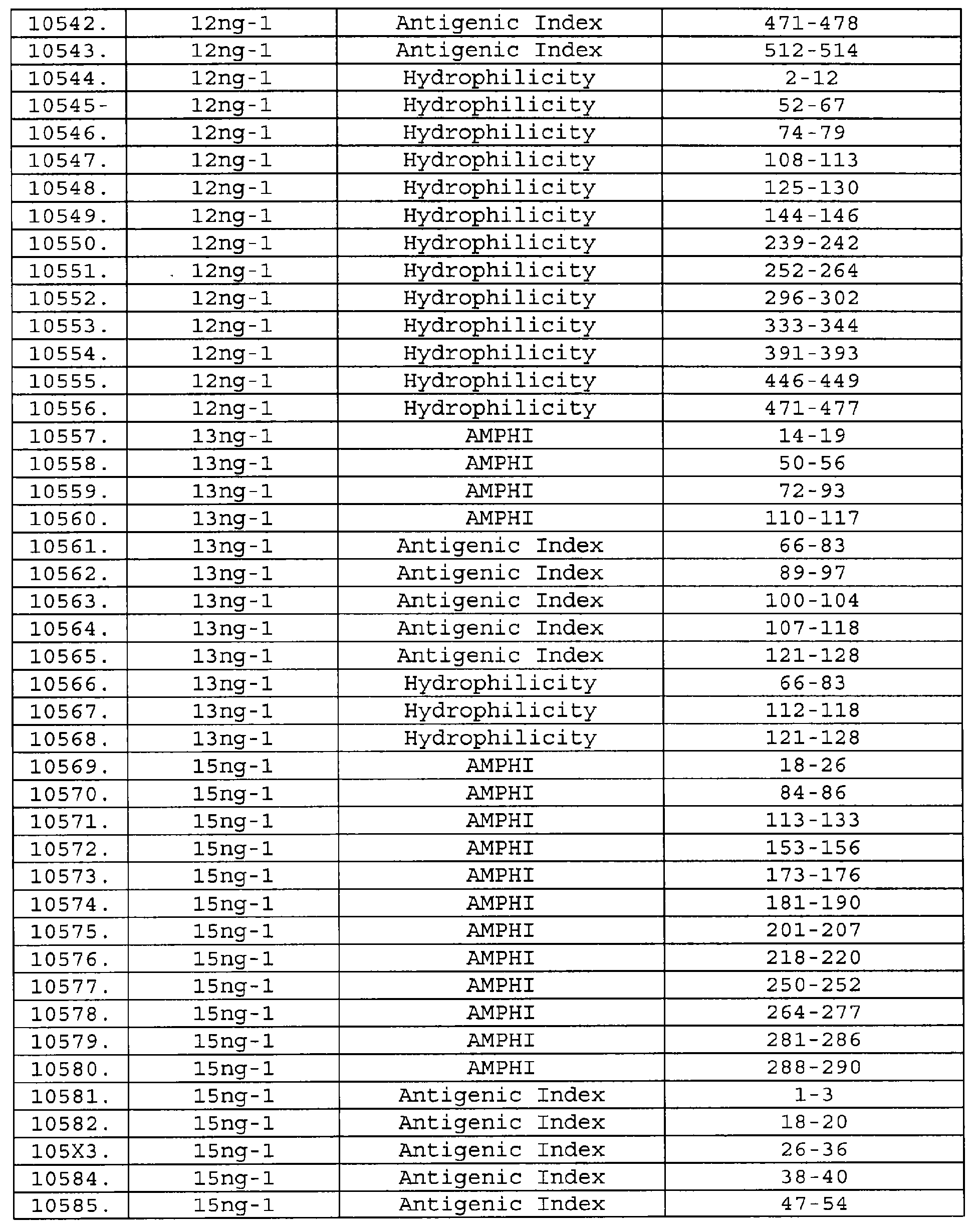
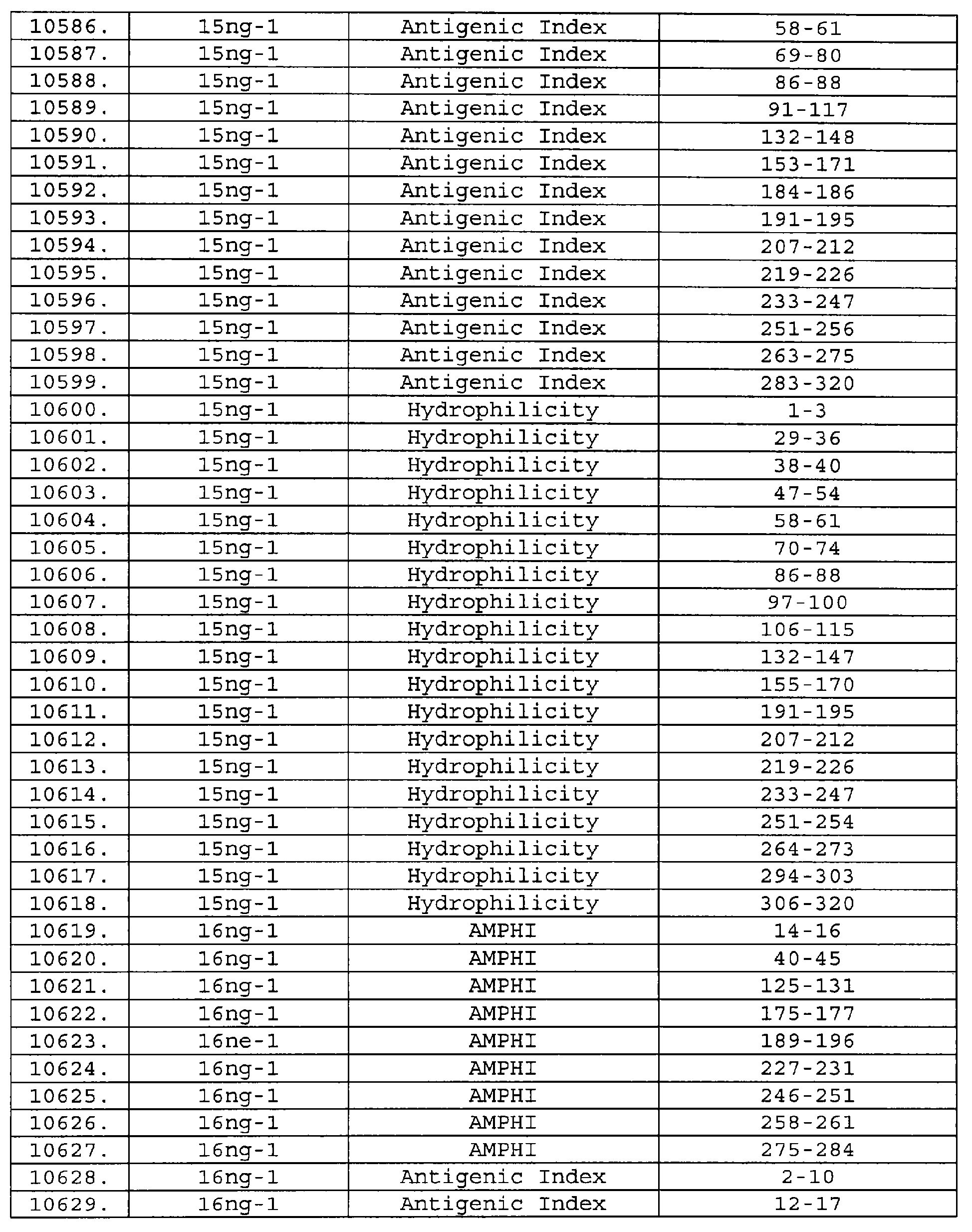
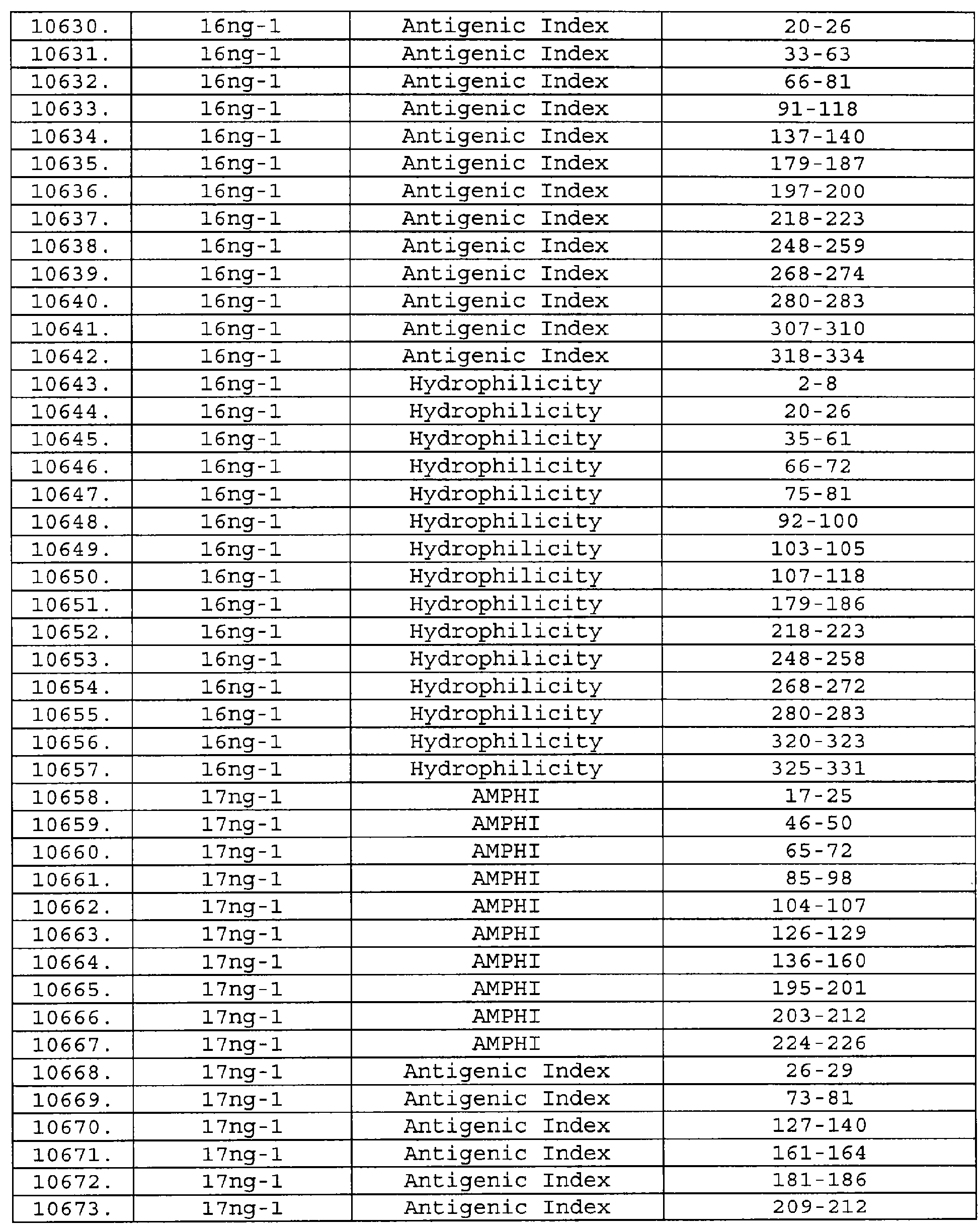


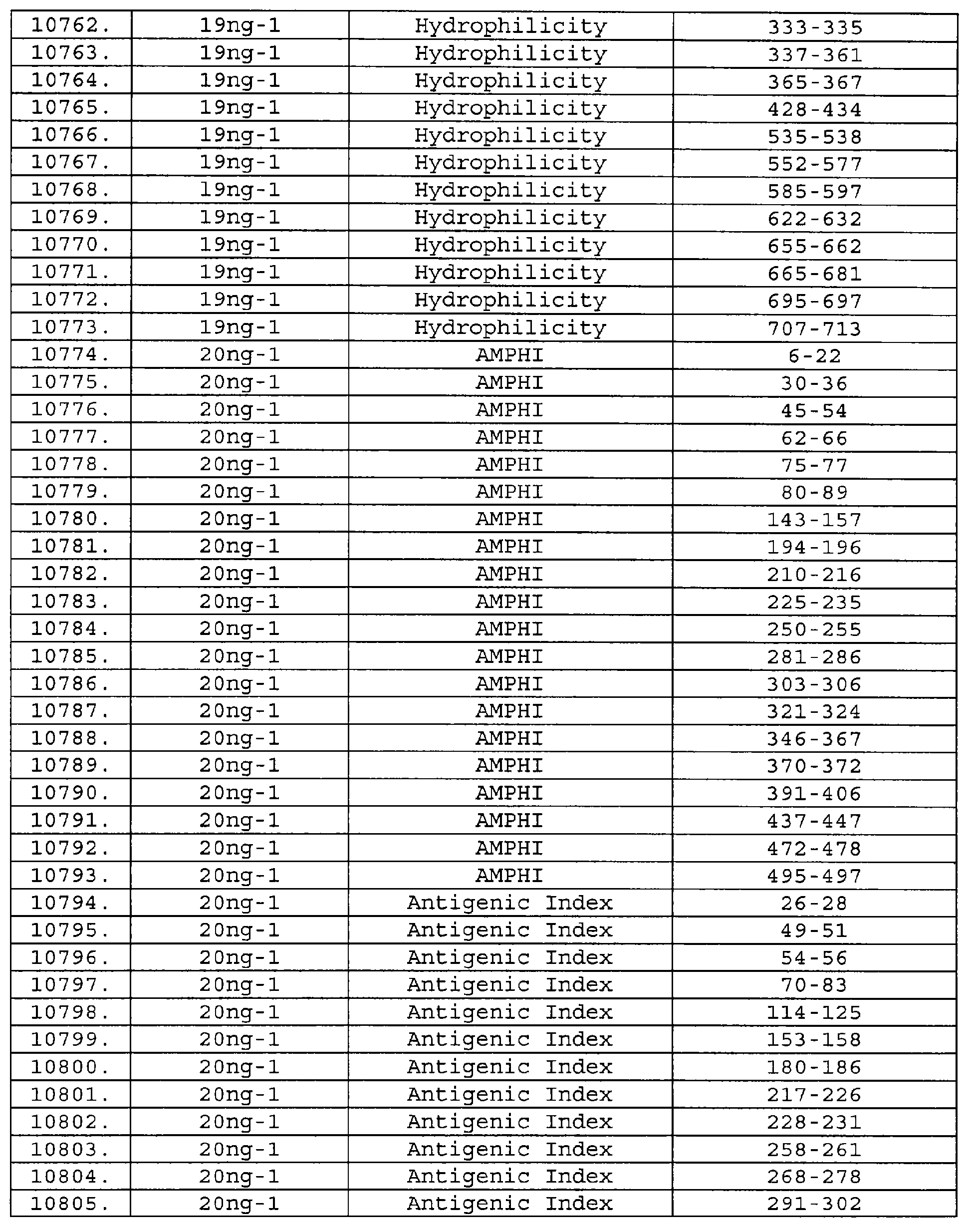
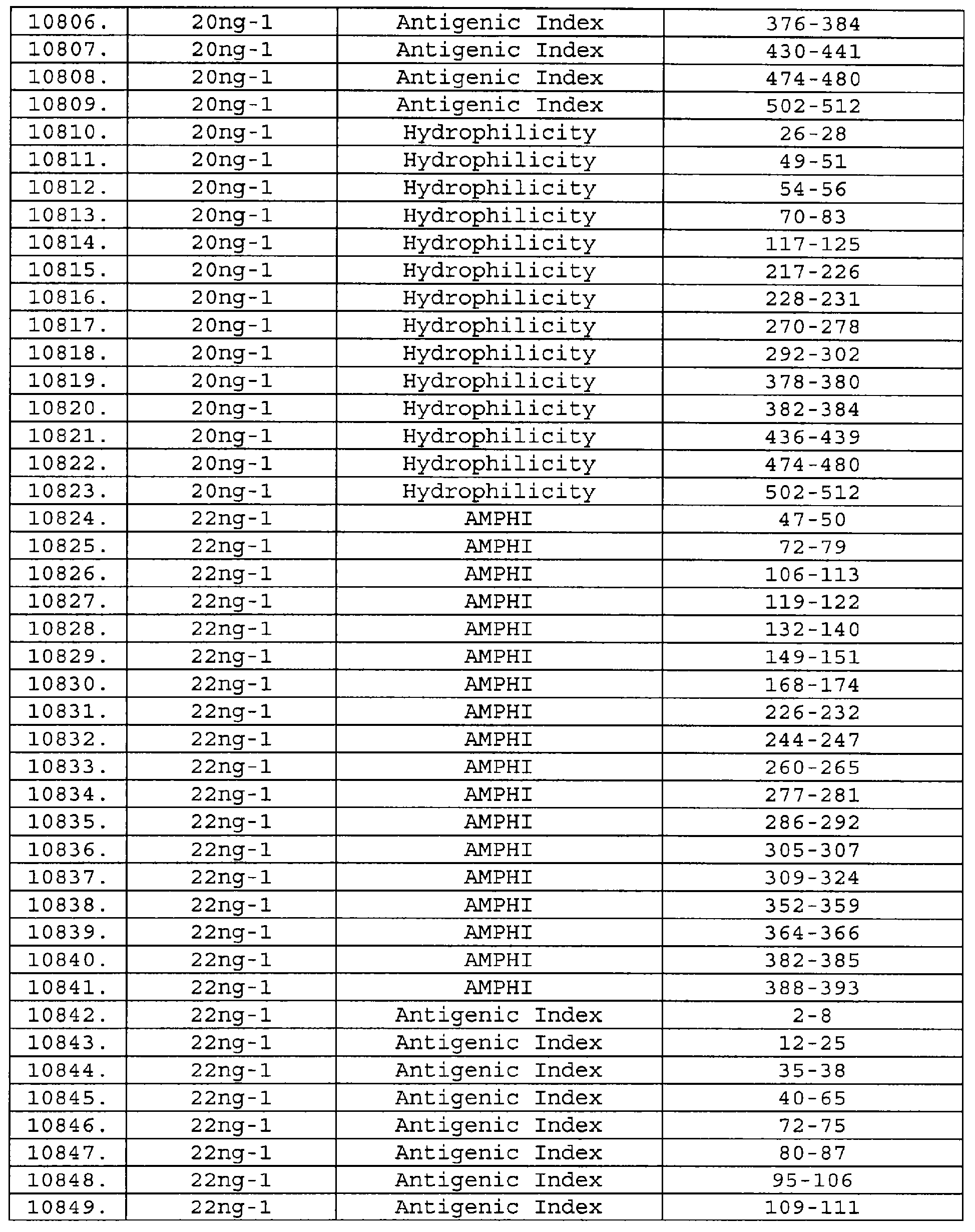




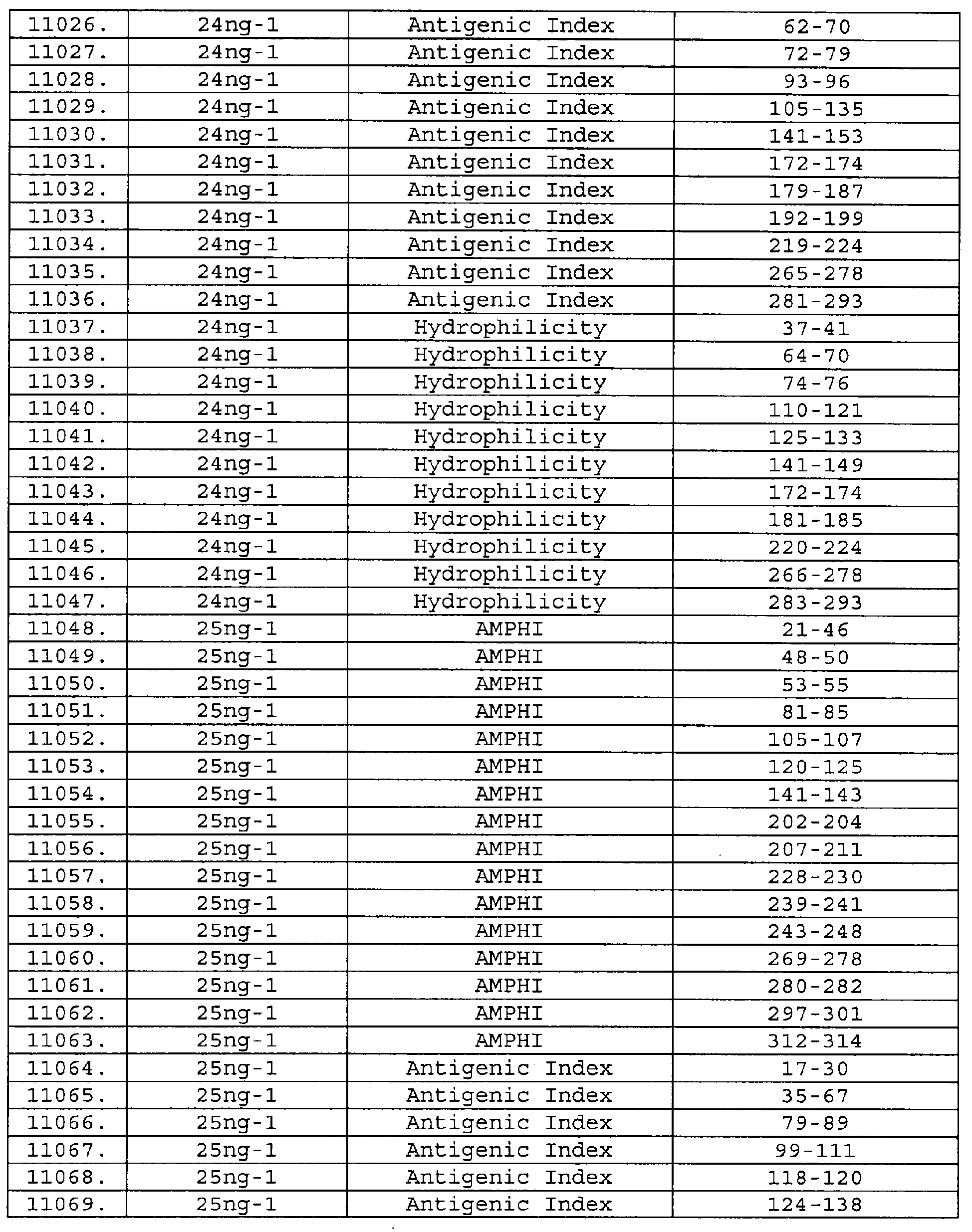









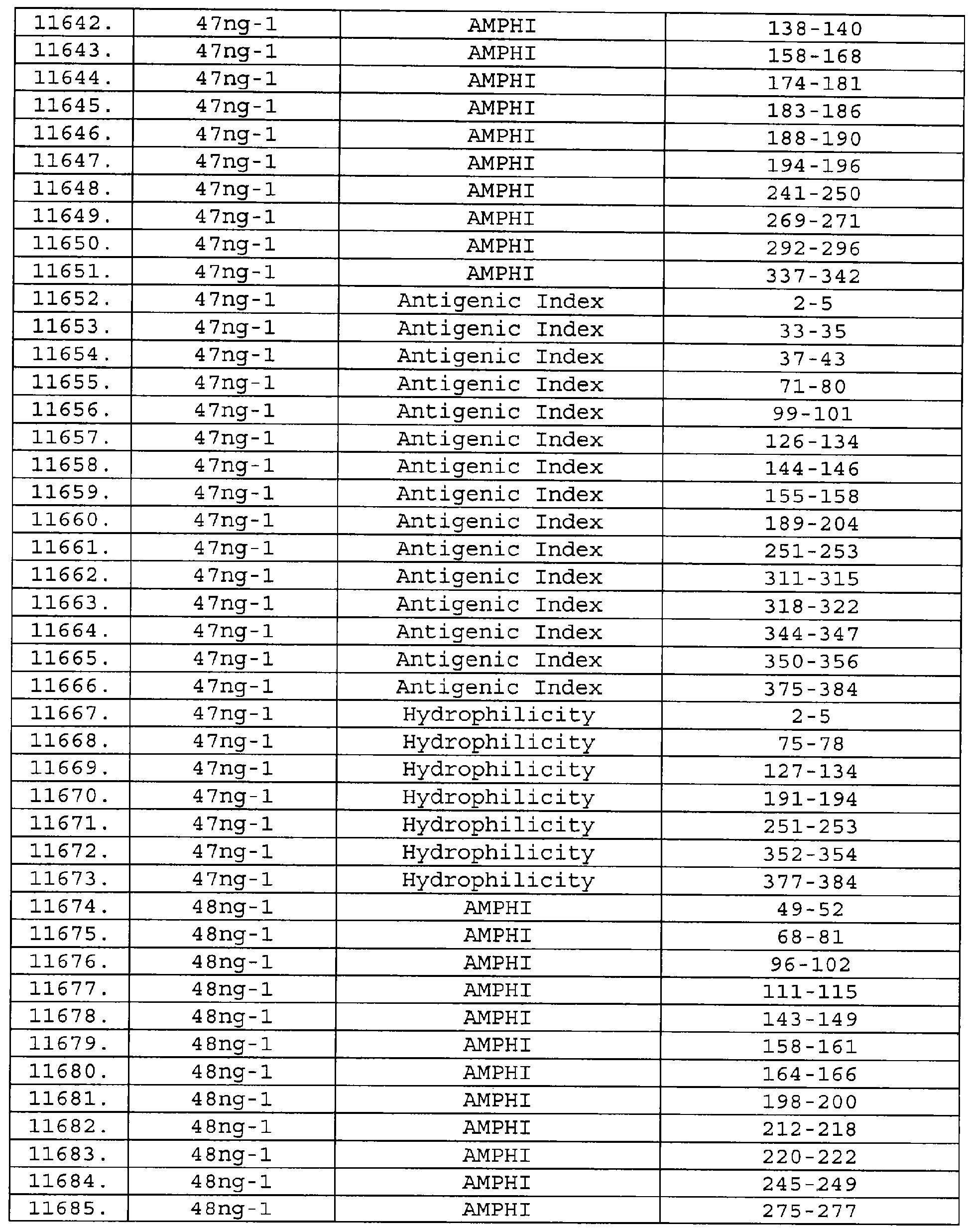

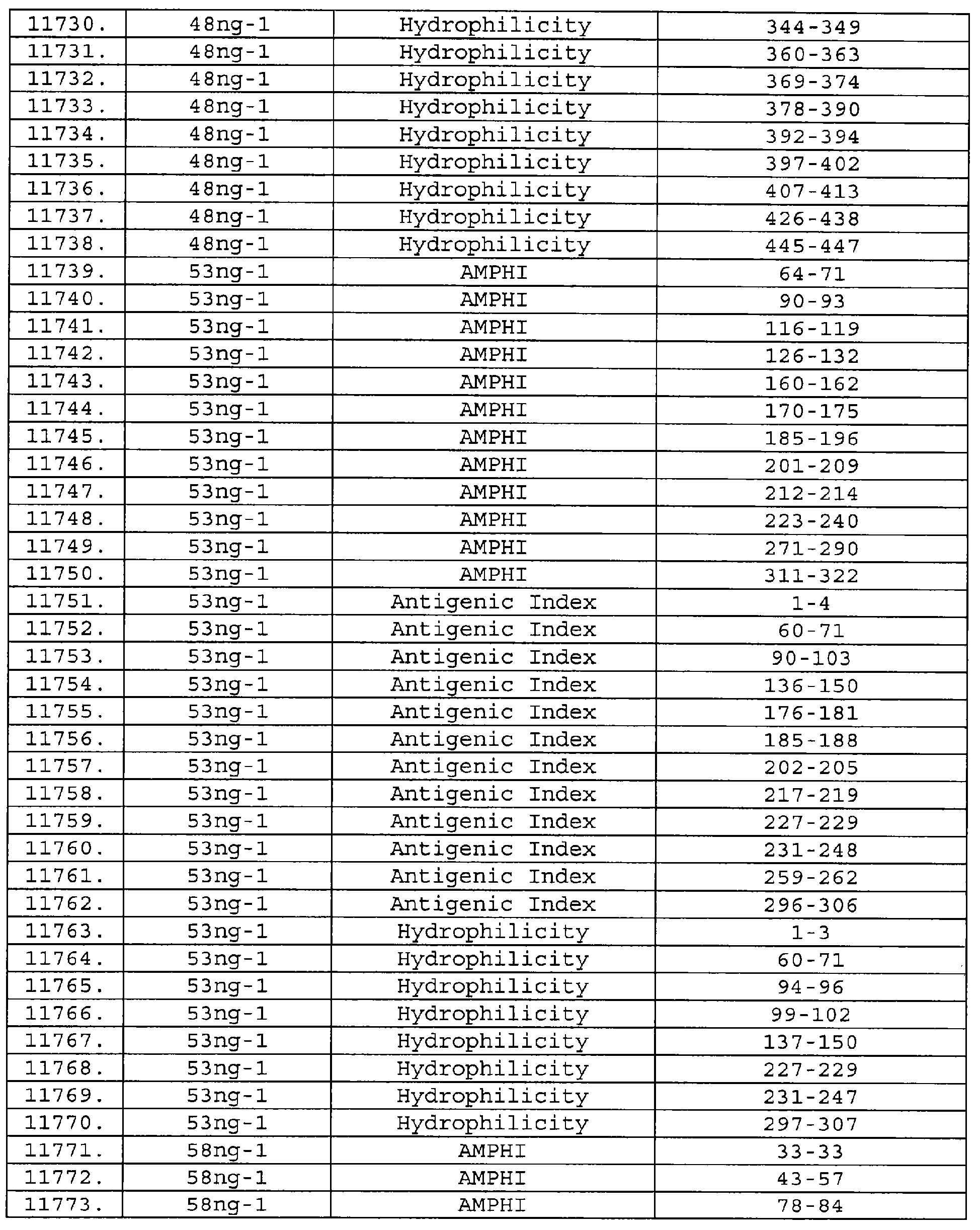

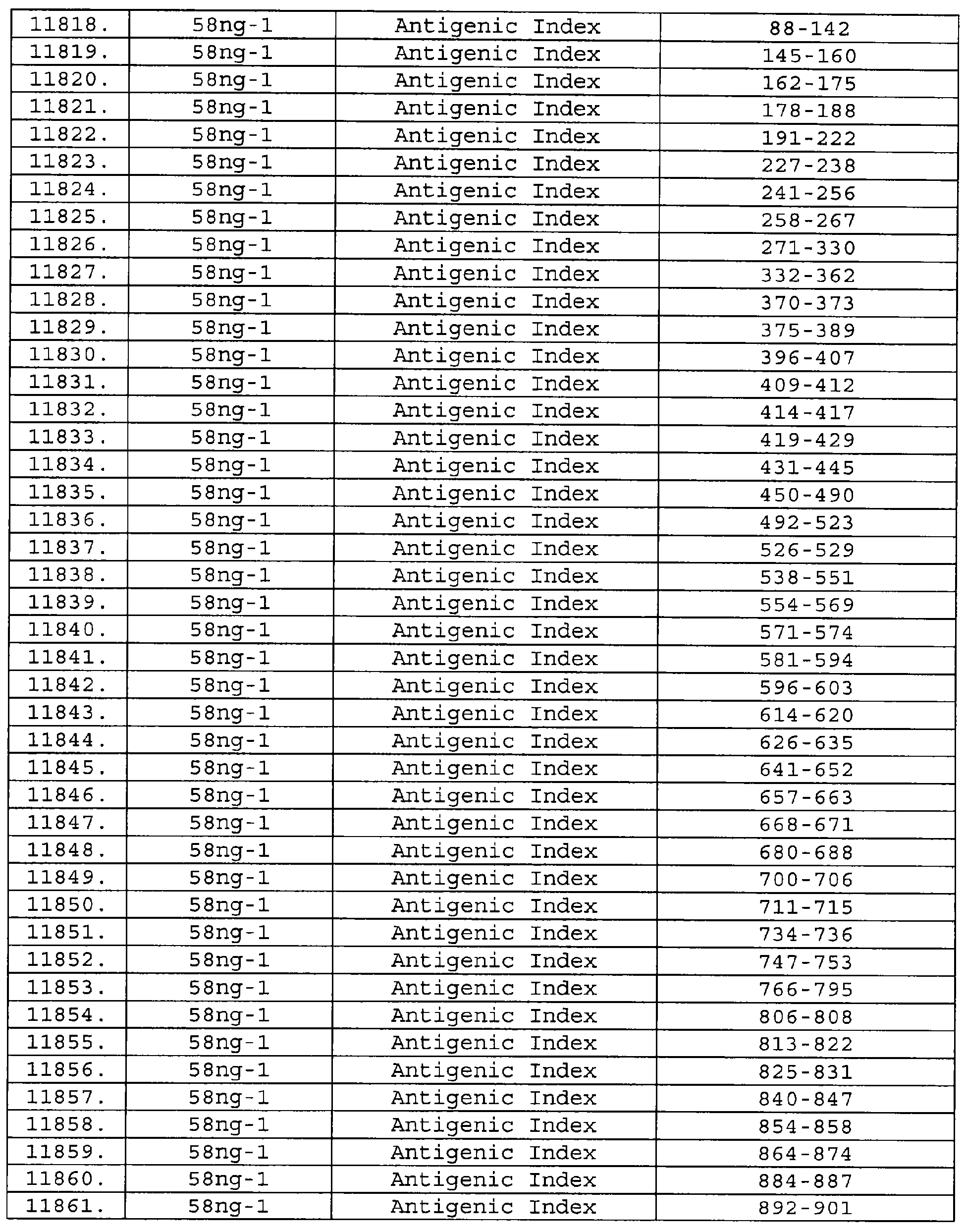
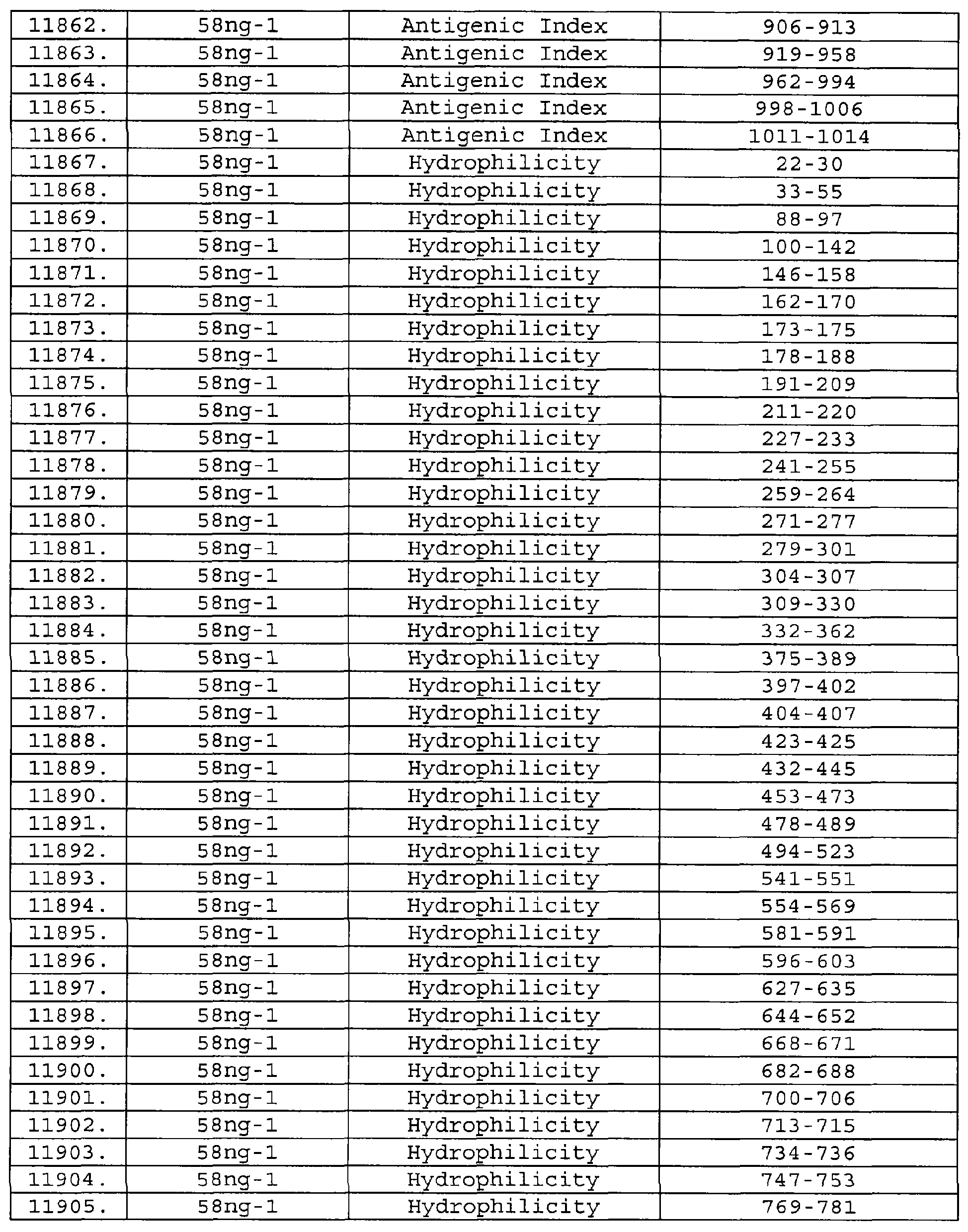













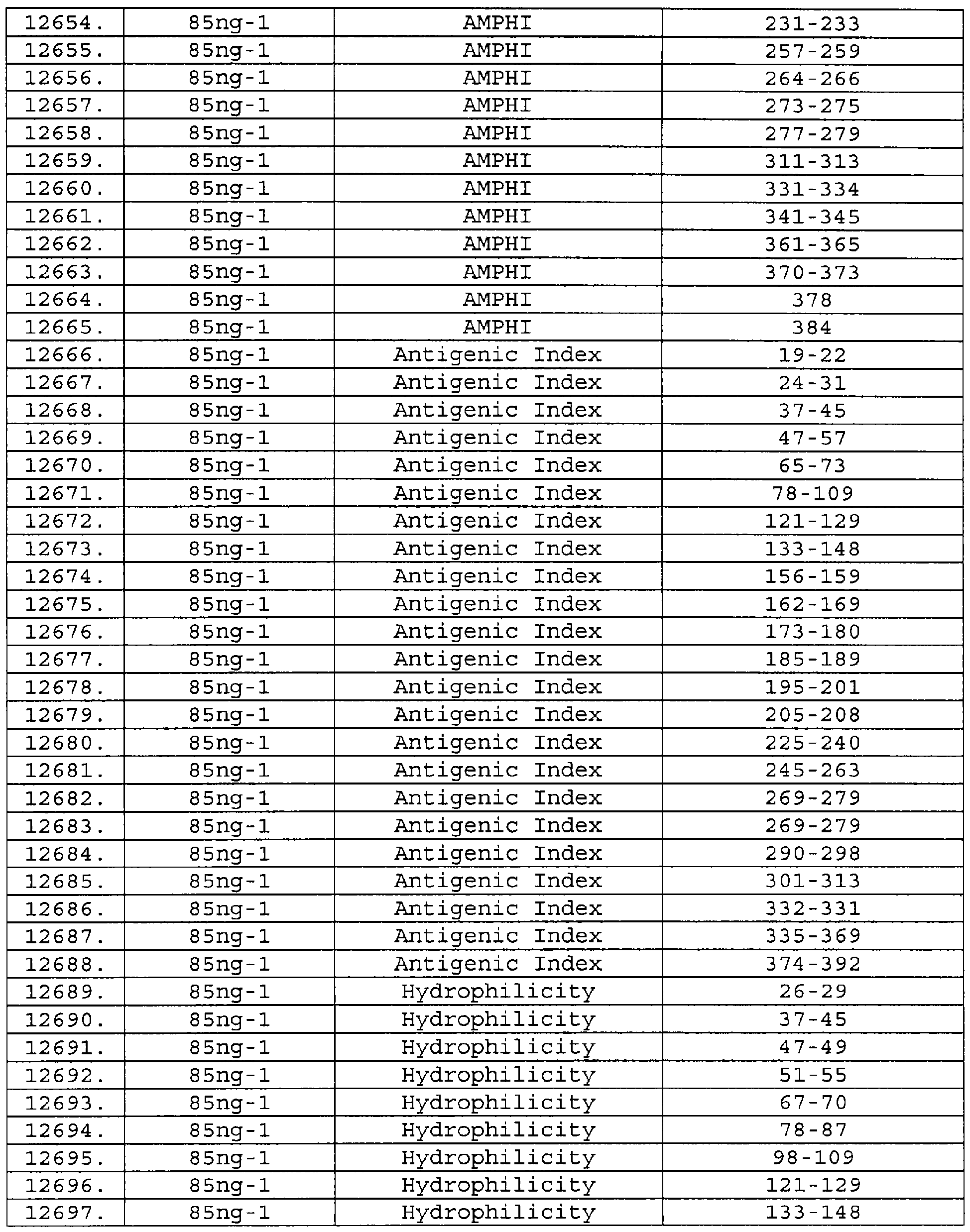



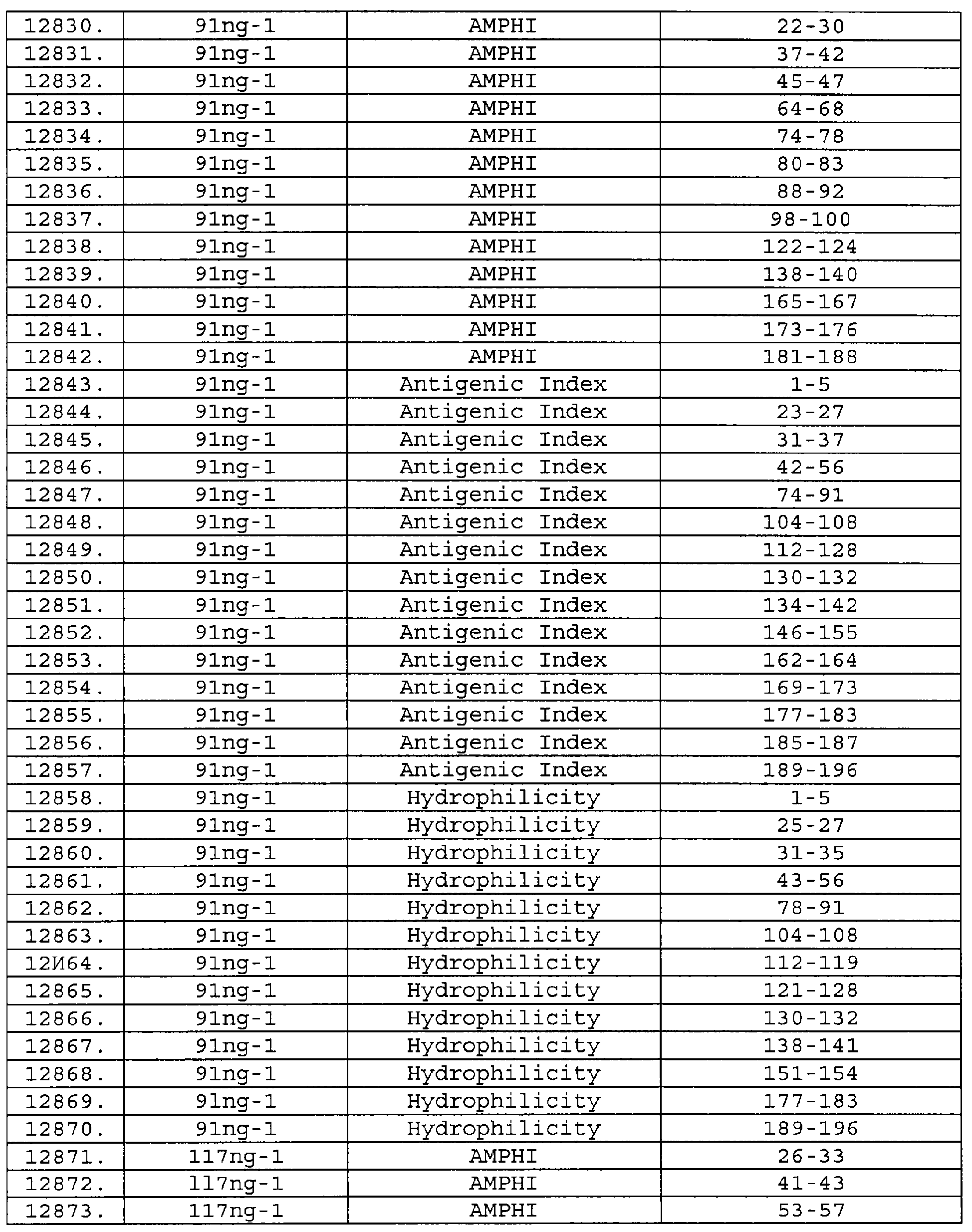




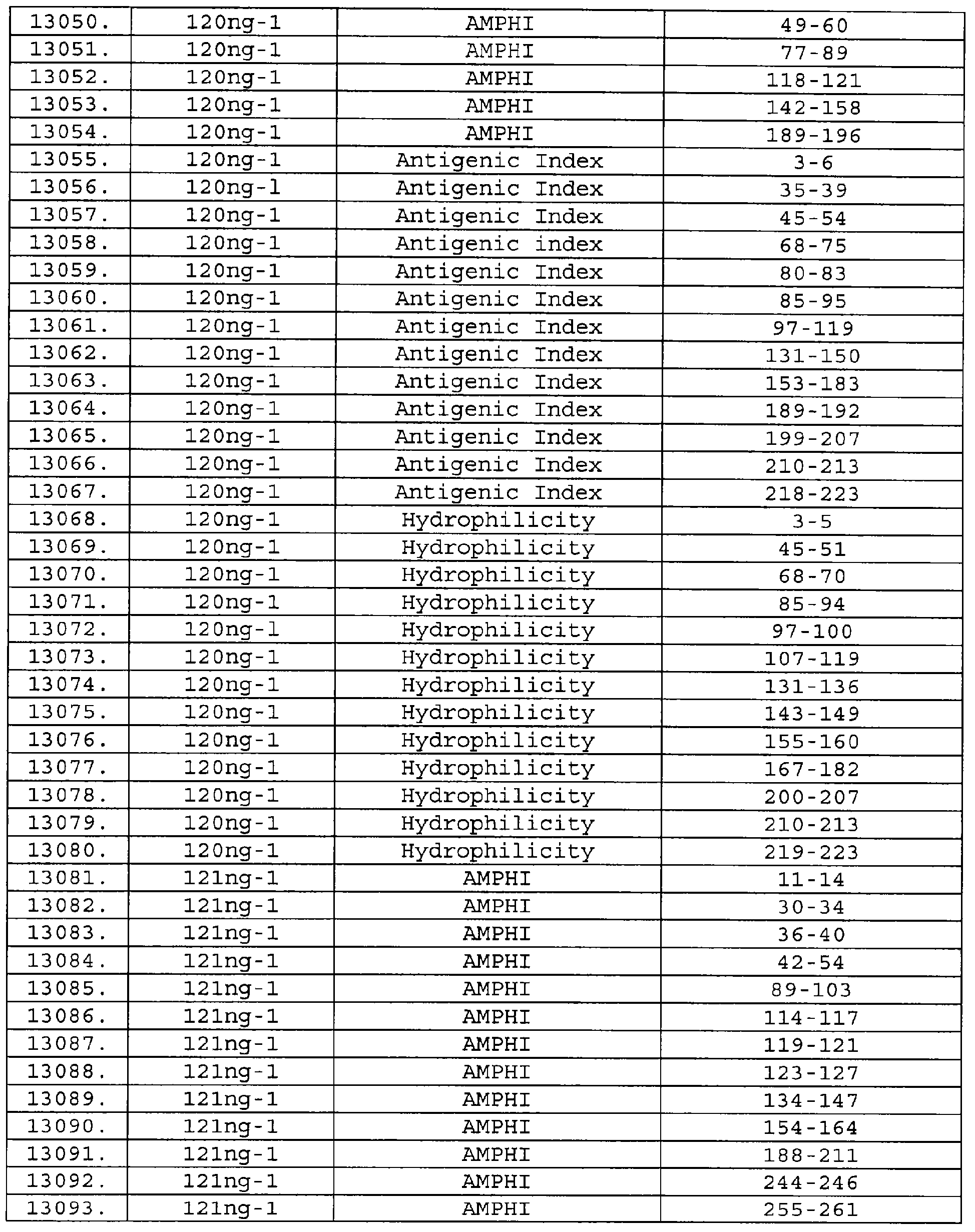

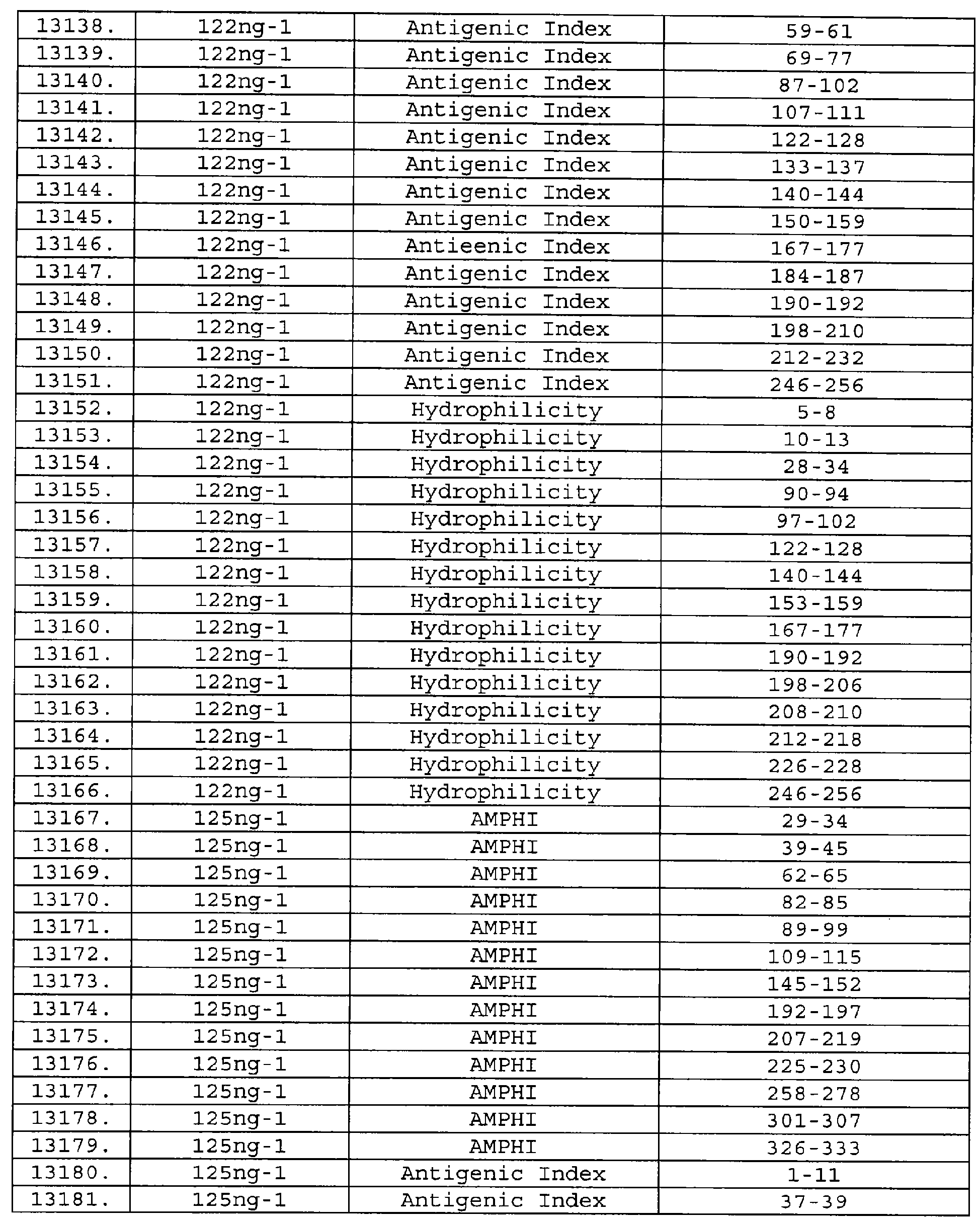

















Описание
Все цитируемые документы во всей своей полноте вводятся в настоящее описание посредством ссылки. В частности, настоящее описание полностью включает содержание Международной патентной заявки WO 99/24578.
Область, к которой относится изобретение
Настоящее изобретение относится к антигенным пептидным последовательностям, происходящим от бактерий Neisseria meningitidis и Neisseria gonorrhoeae.
Предпосылки создания изобретения
Neisseria meningitidis и Neisseria gonorrhoeae представляют собой неподвижные грамотрицательные диплоккоки, которые являются патогенными для человека.
Исходя из наличия инкапсулированного полисахарида у данного микроорганизма, были идентифицированы 12 серологических групп N.meningitidis. Микроорганизм группы А является патогеном, наиболее часто вызывающим эпидемические заболевания в регионах Африки, простирающихся ниже Сахары. Серологические группы В и С ответственны за подавляющее большинство случаев возникновения данных заболеваний в Соединенных Штатах и в большинстве развитых стран. В остальных случаях возникновения этого заболевания в Соединенных Штатах и в развитых странах ответственны серологические группы W135 и Y.
Используемая в настоящее время менингококковая вакцина представляет собой тетравалентную полисахаридную вакцину, представленную серологическими группами А, С, Y и W135, однако использование MenB связано с определенными проблемами. Метод на основе данного полисахарида не может быть использован, поскольку капсулярный полисахарид MenB является полимером α(2-8)-связанной N-ацетилнейраминовой кислоты, которая также присутствует в тканях млекопитающих. В одном из методов получения вакцин на основе menB были использованы смеси внешних мембранных белков (OMPs). Для преодоления антигенной изменчивости были сконструированы мультивалентные вакцины, содержащие вплоть до девяти различных поринов (см., например, Poolman J.T. (1992) Development of a meningococcal vaccine. Infect. Agents Dis.4: 13-28). Другими белками, используемыми в вакцинах на основе внешних мембран, были белки ора и орс, но ни один из этих вариантов не позволял преодолеть антигенную изменчивость (см., например, Ala'Aldeen & Borriello (1996) The meningococcal transferrin-binding proteins 1 and 2 are both surface exposed and generate bactericidal antibodies capable of killing homologous and heterologous strains. Vaccine 14(1):49-53).
Описание изобретения
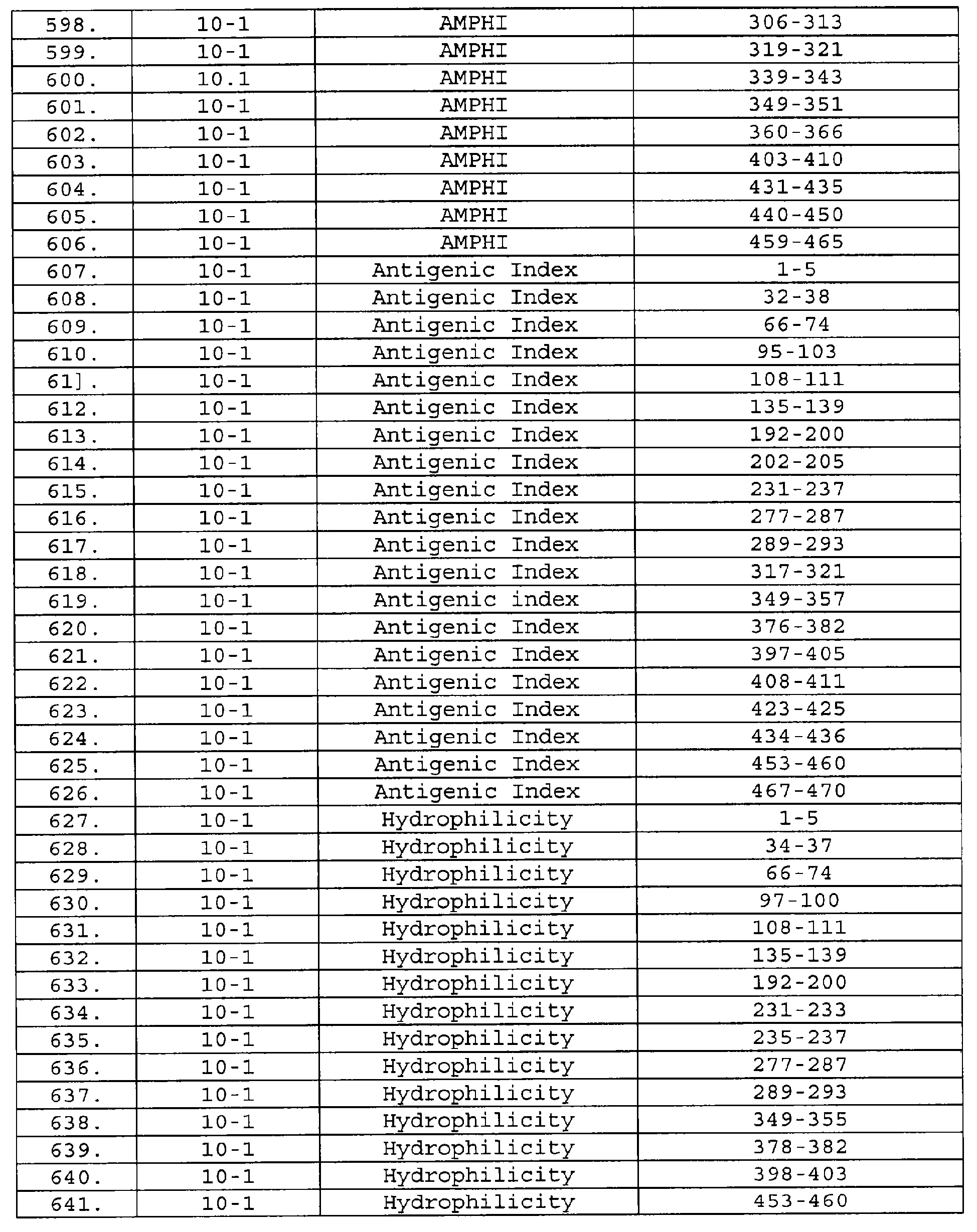
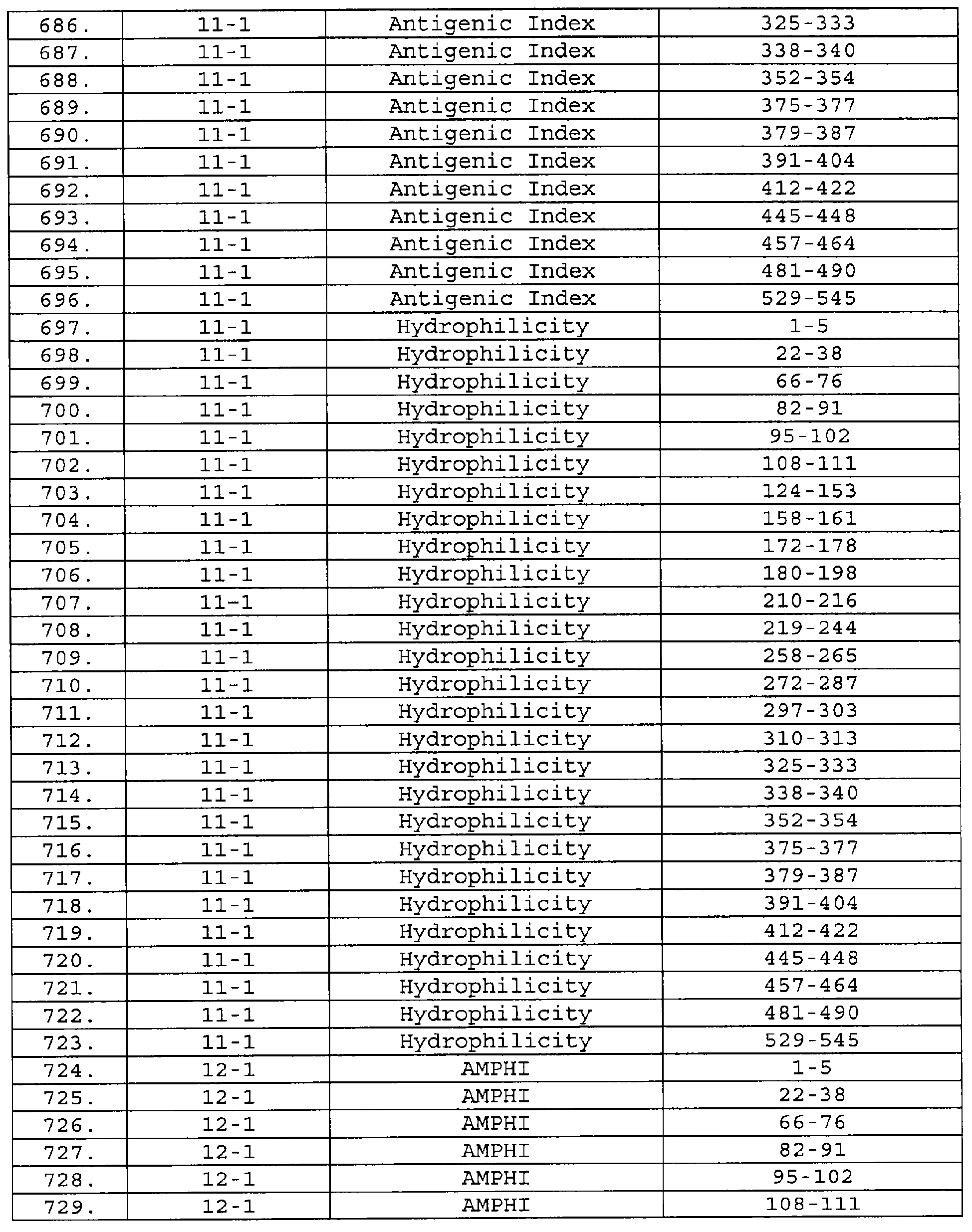
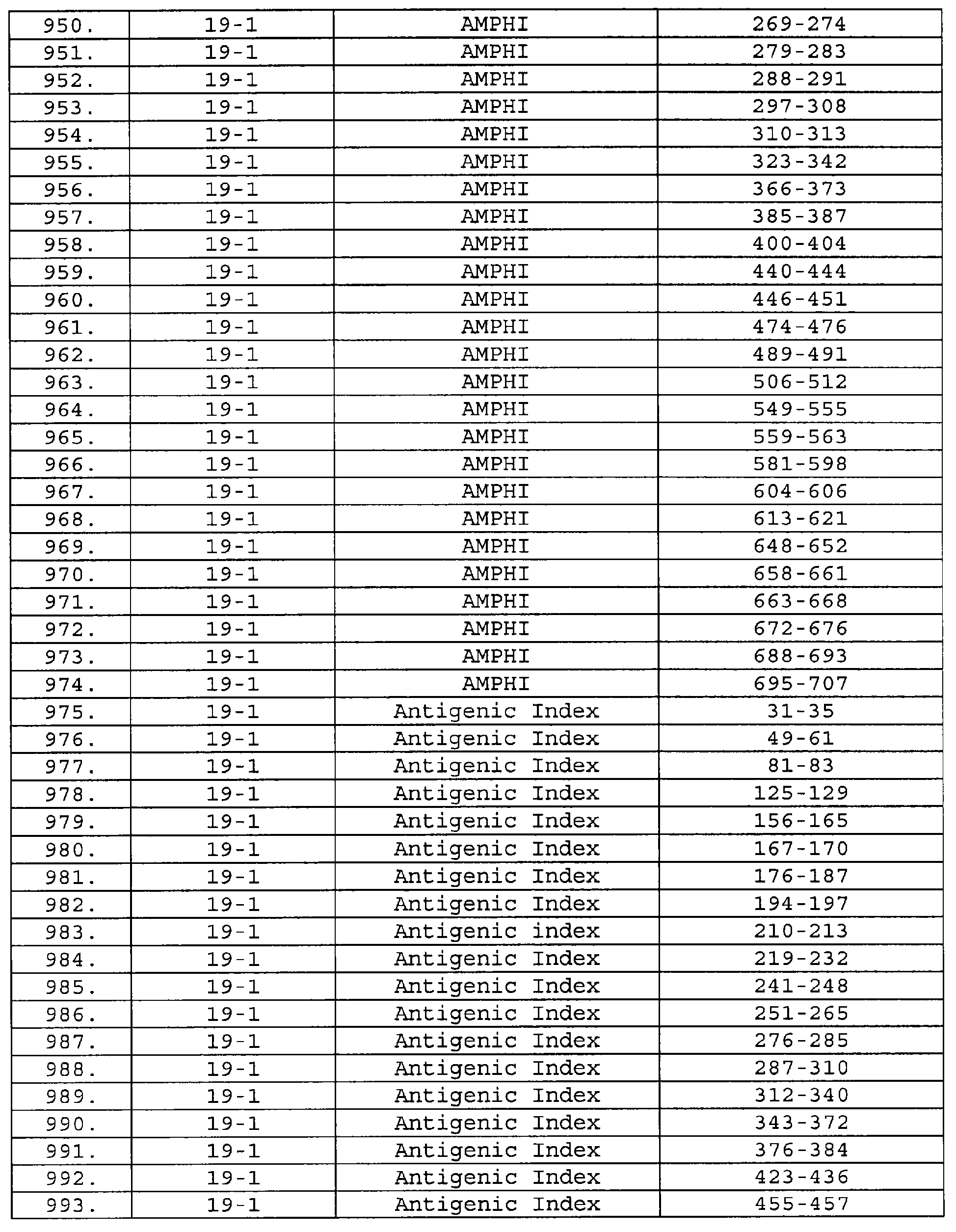
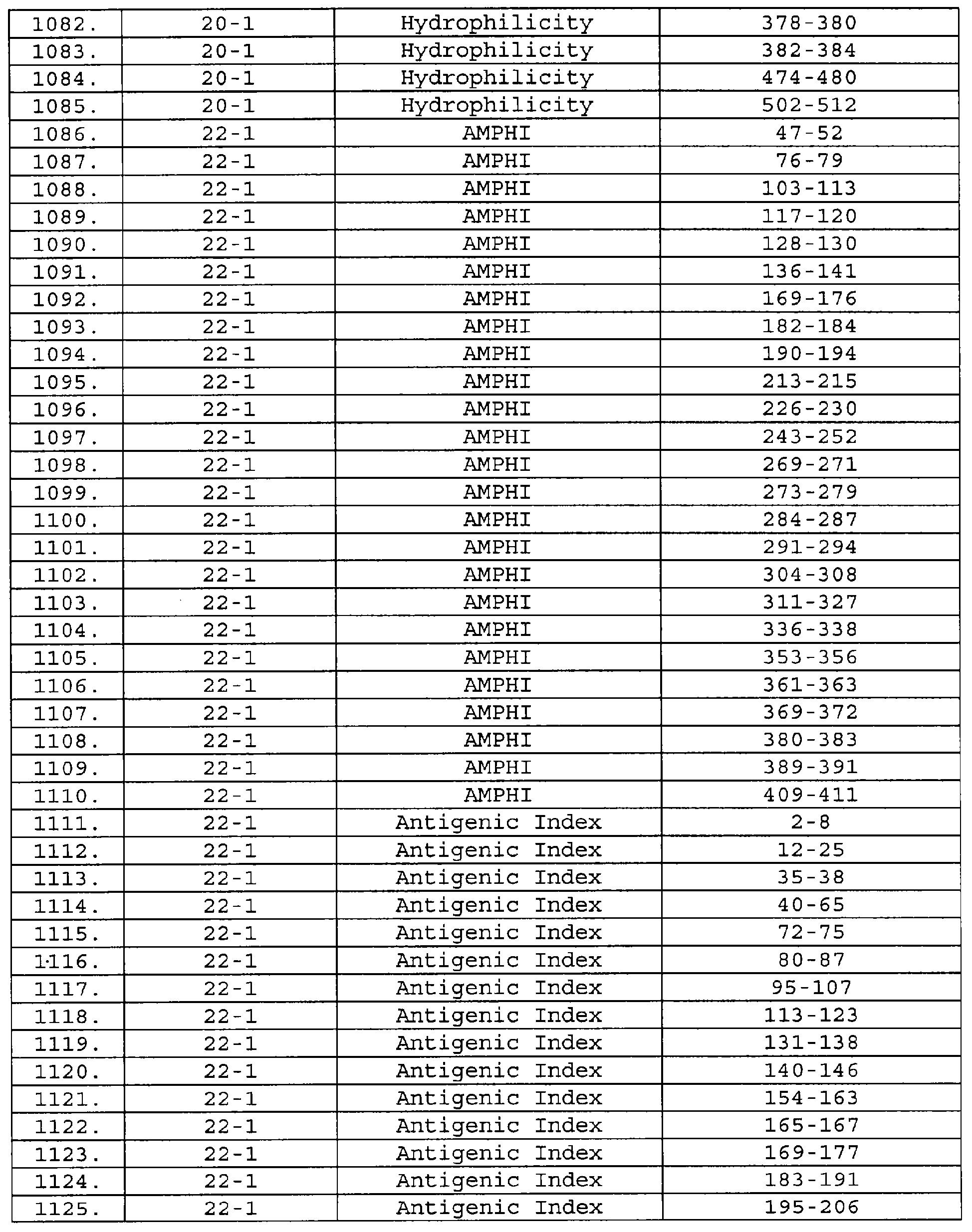
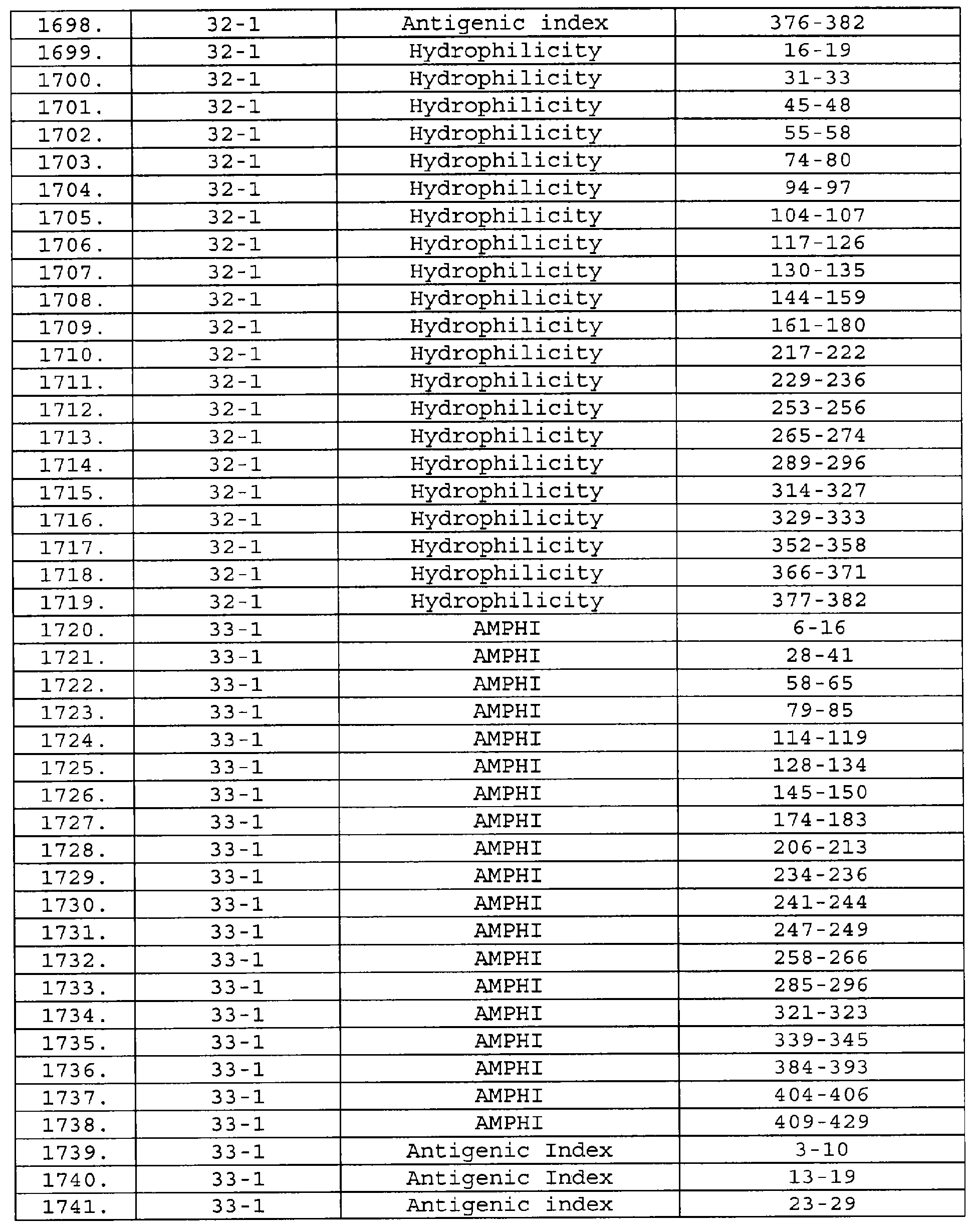
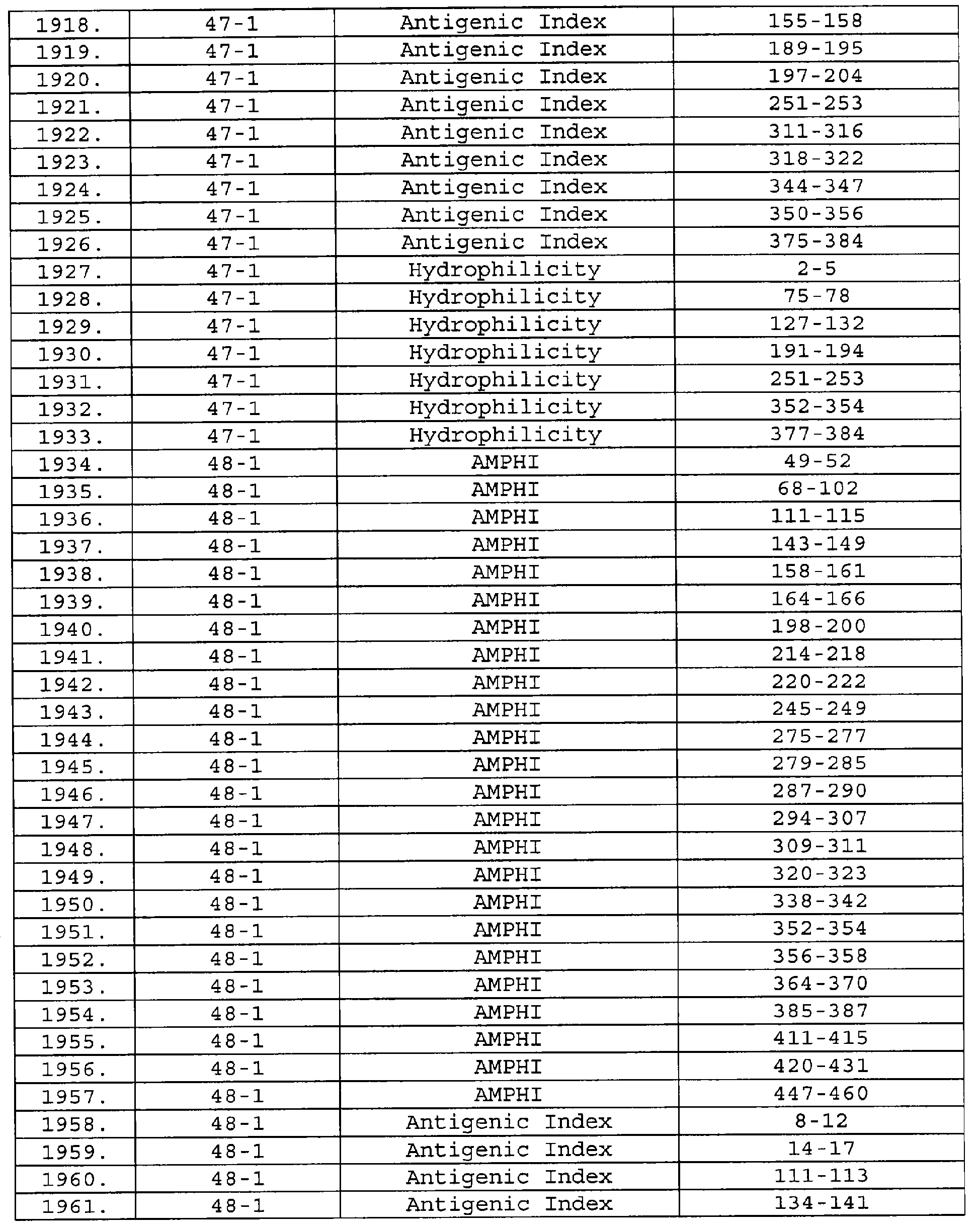
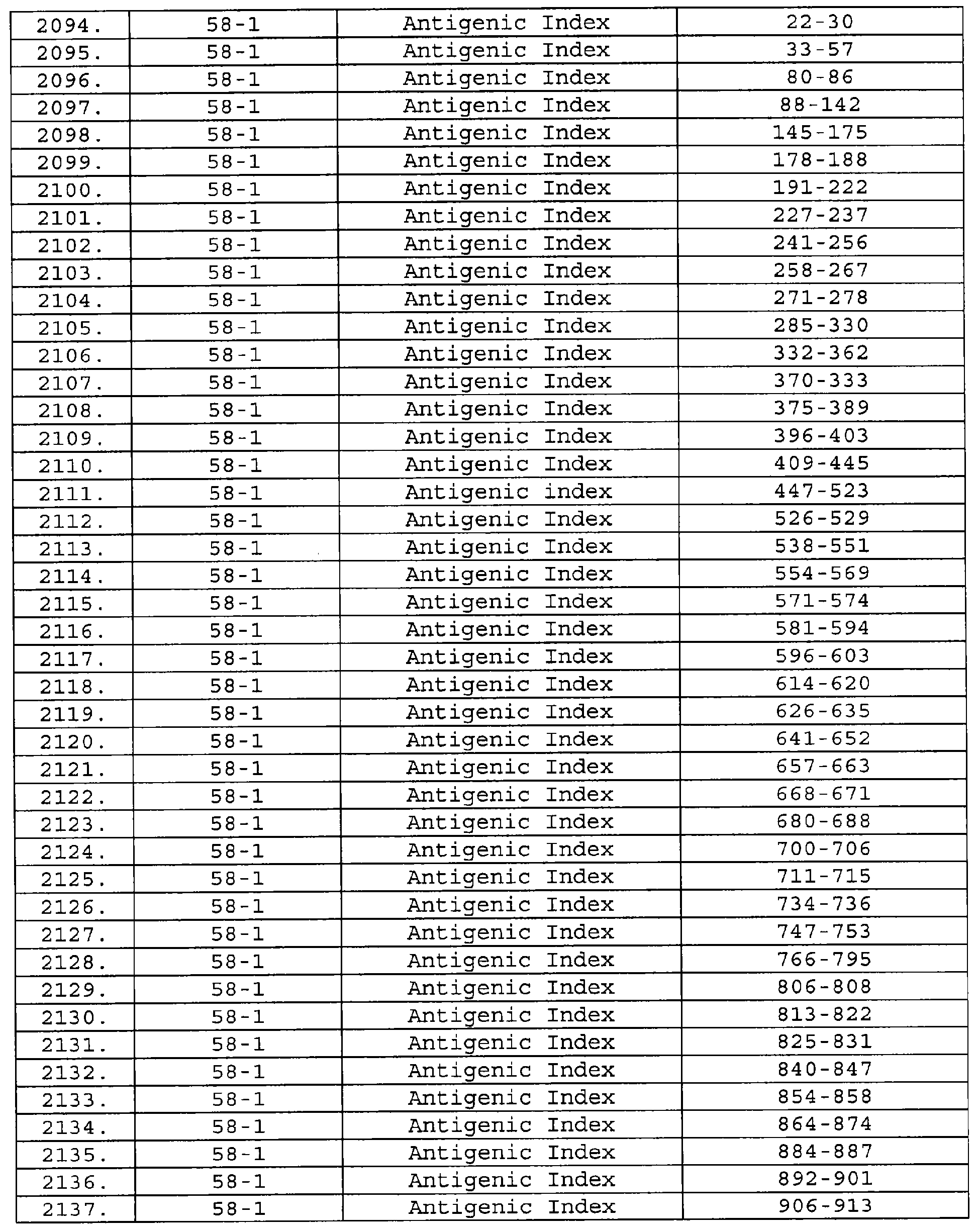
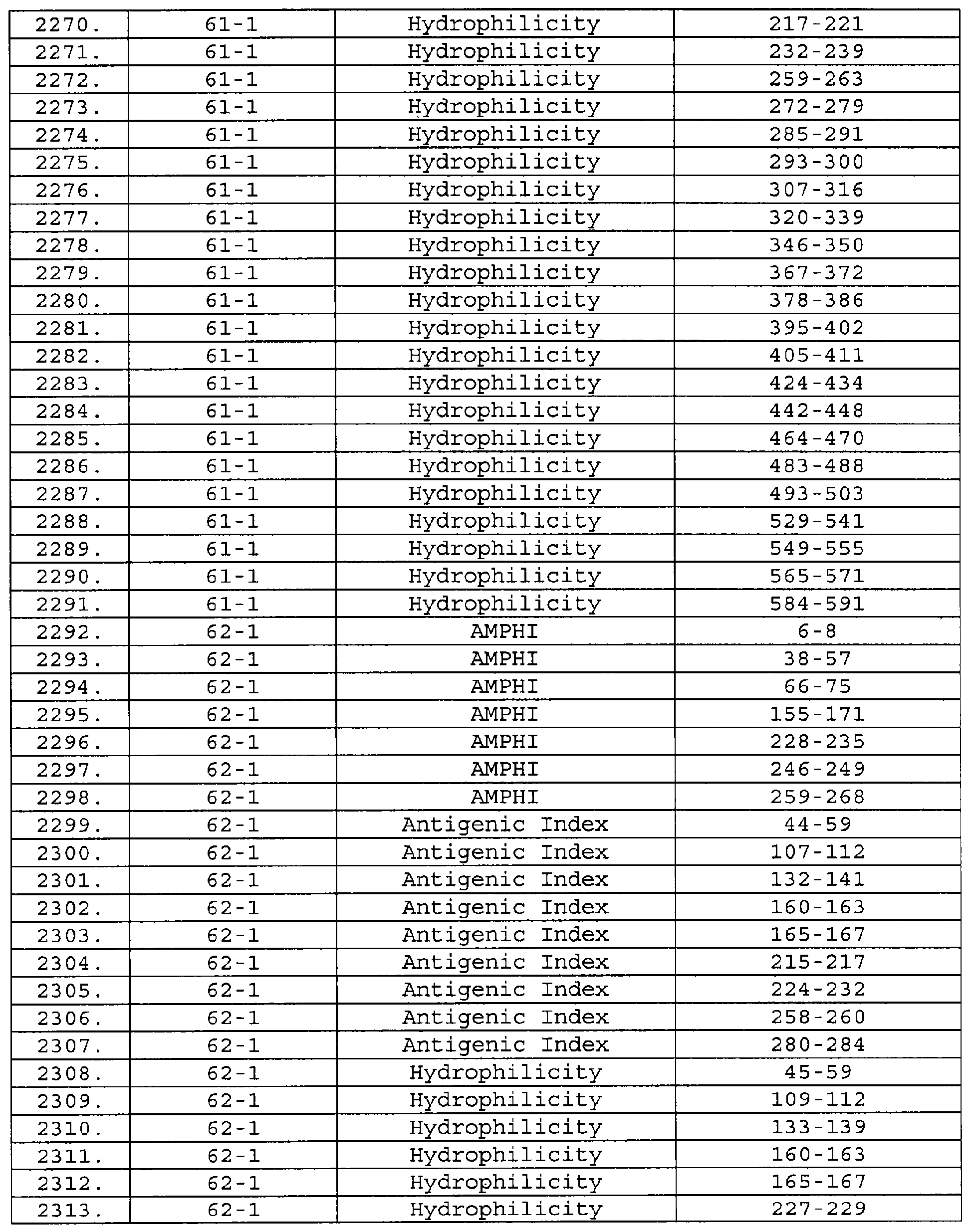
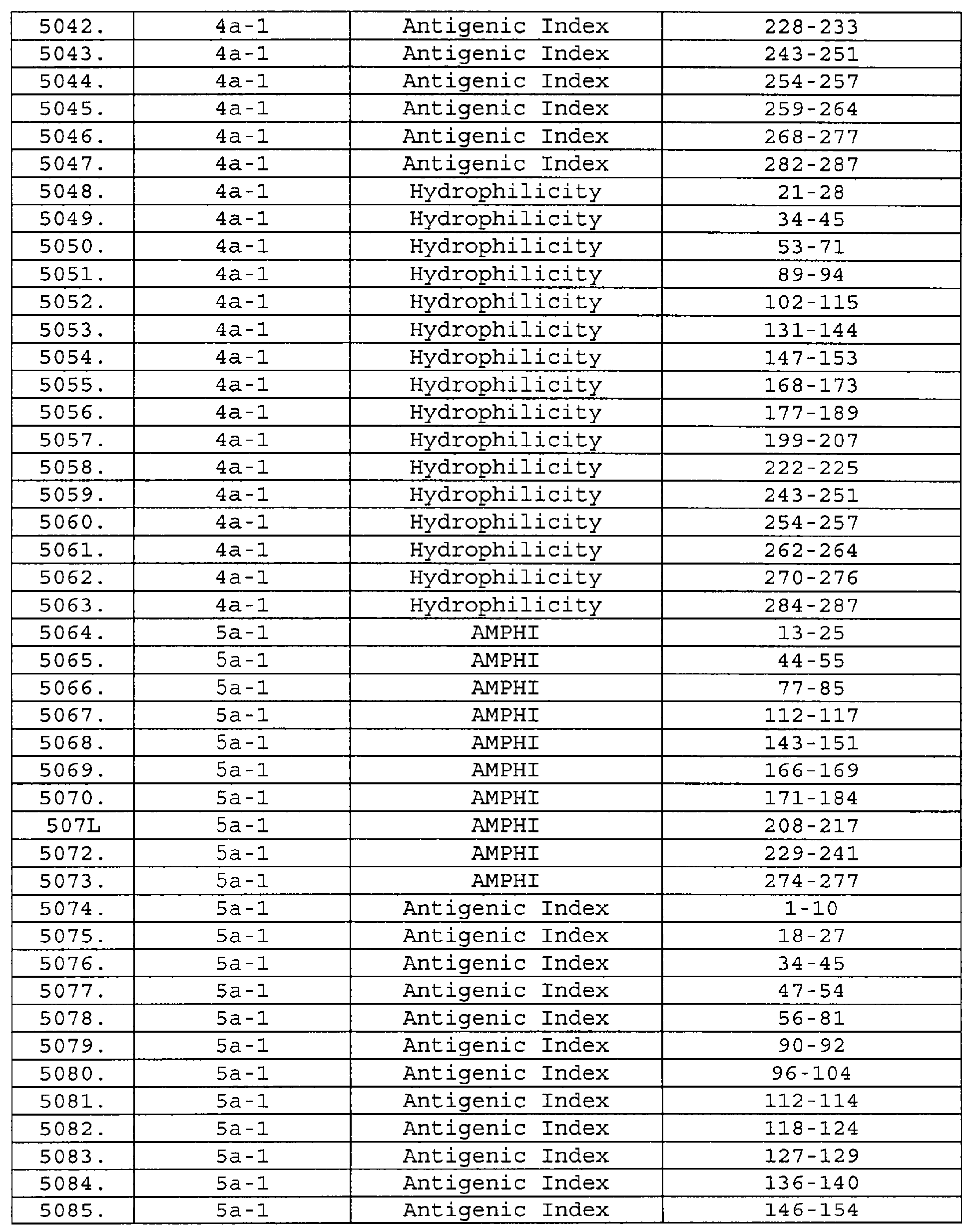
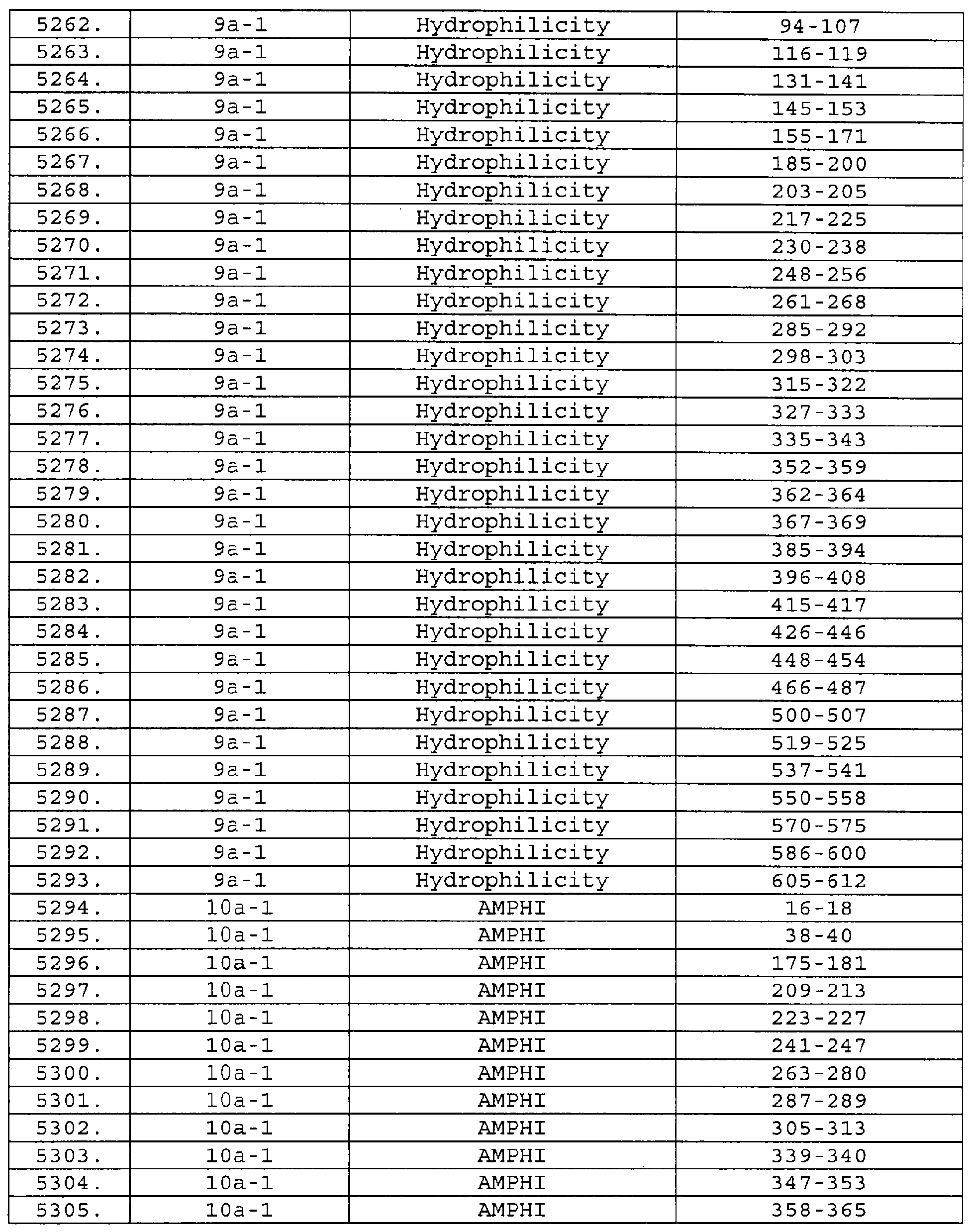
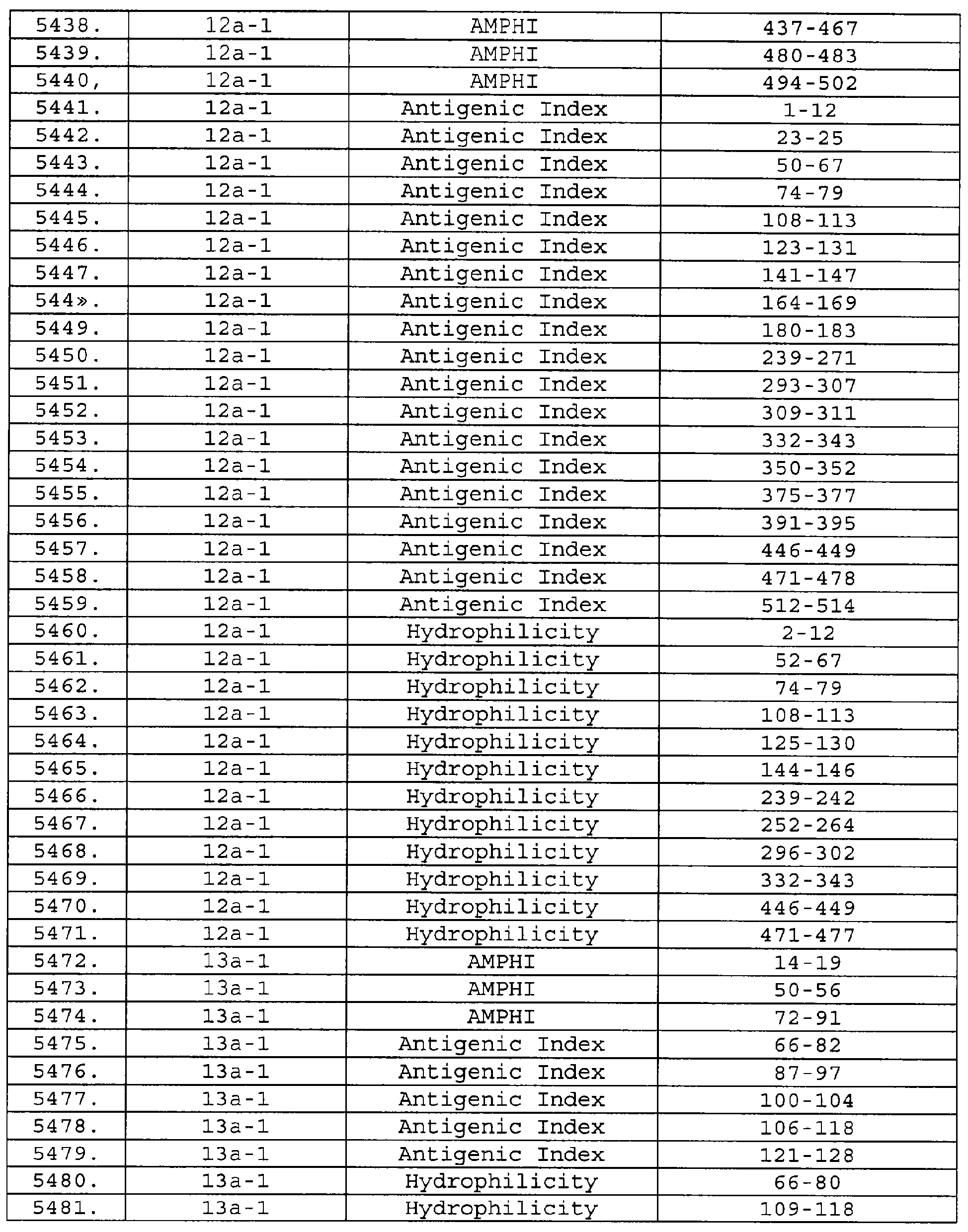
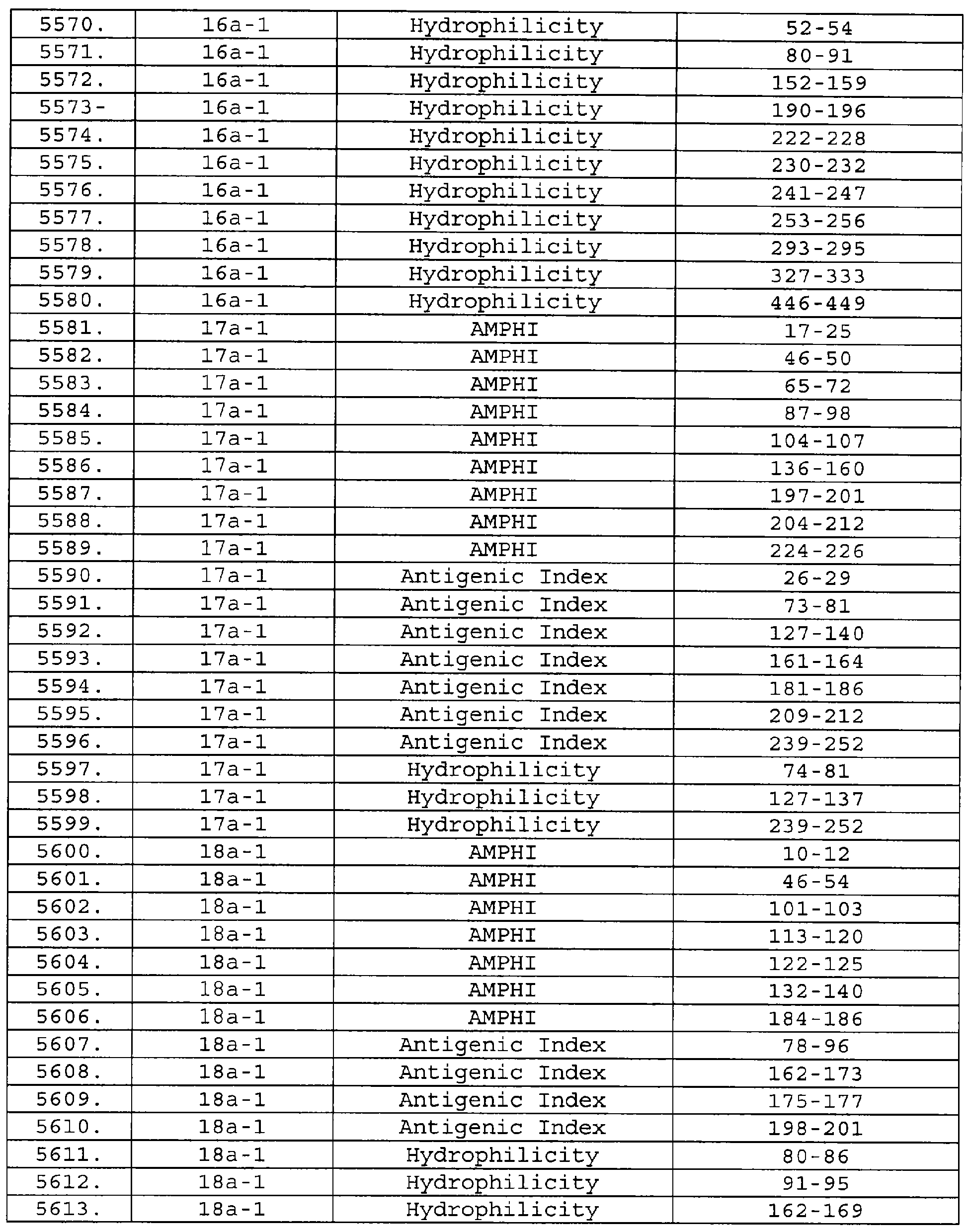
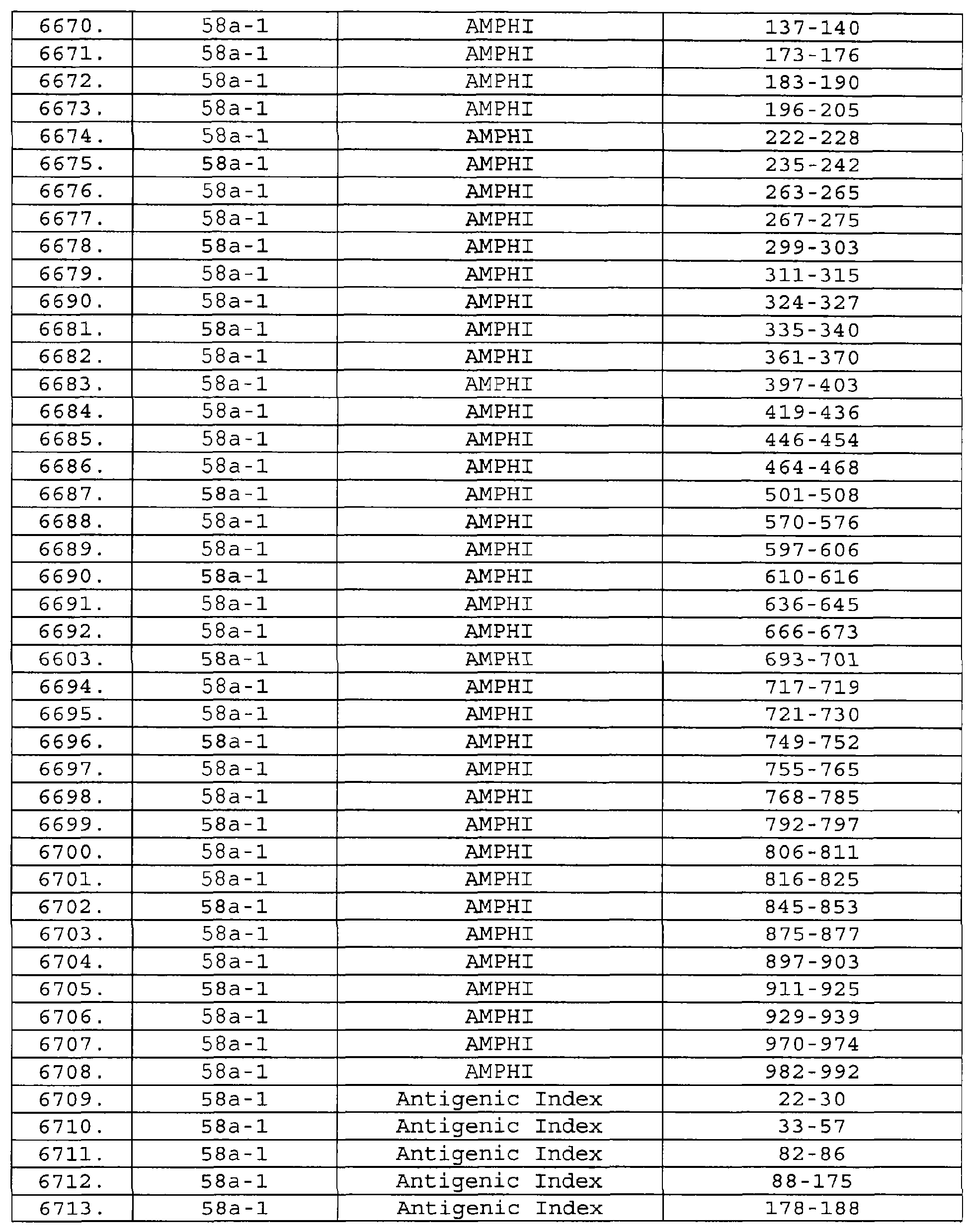
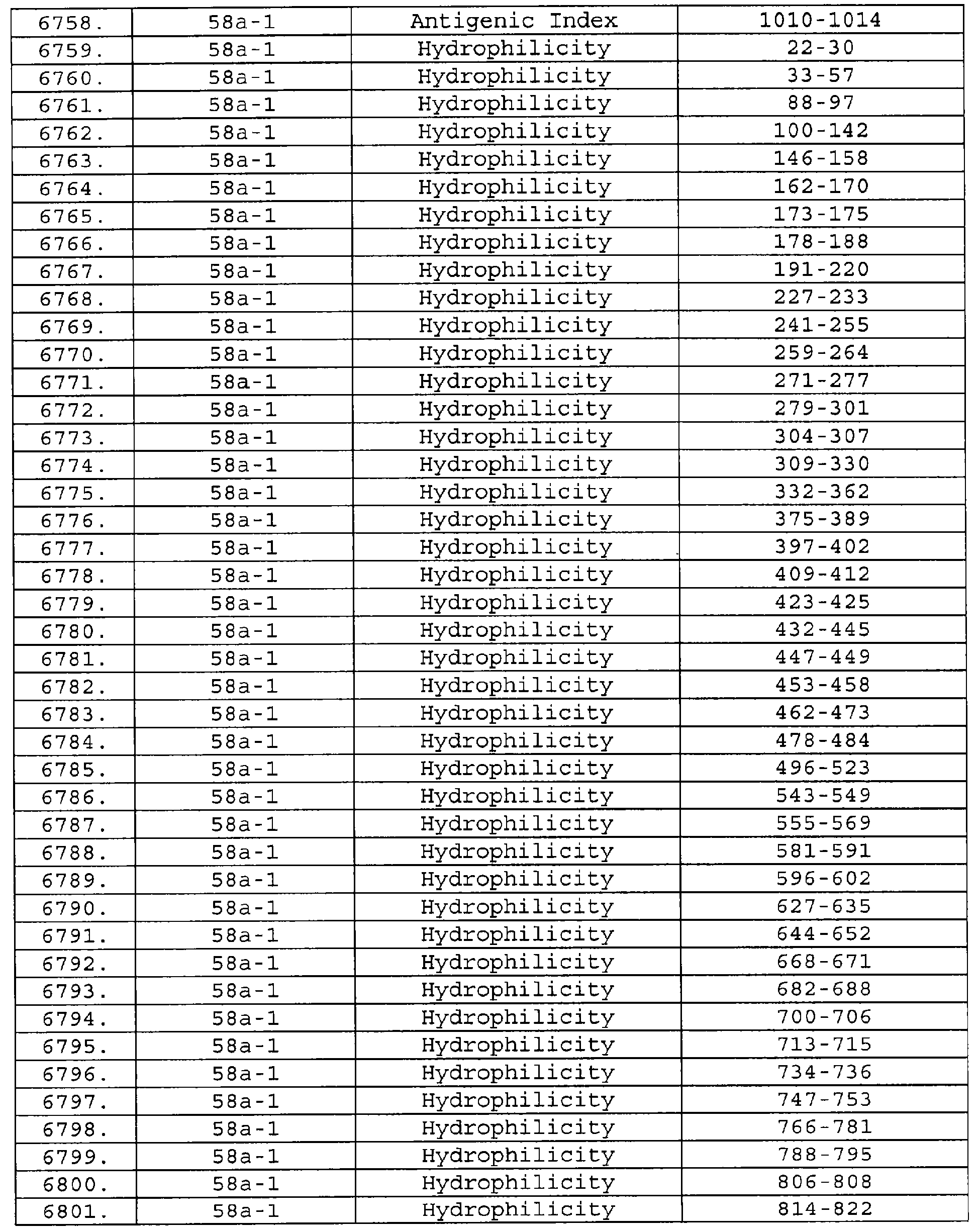
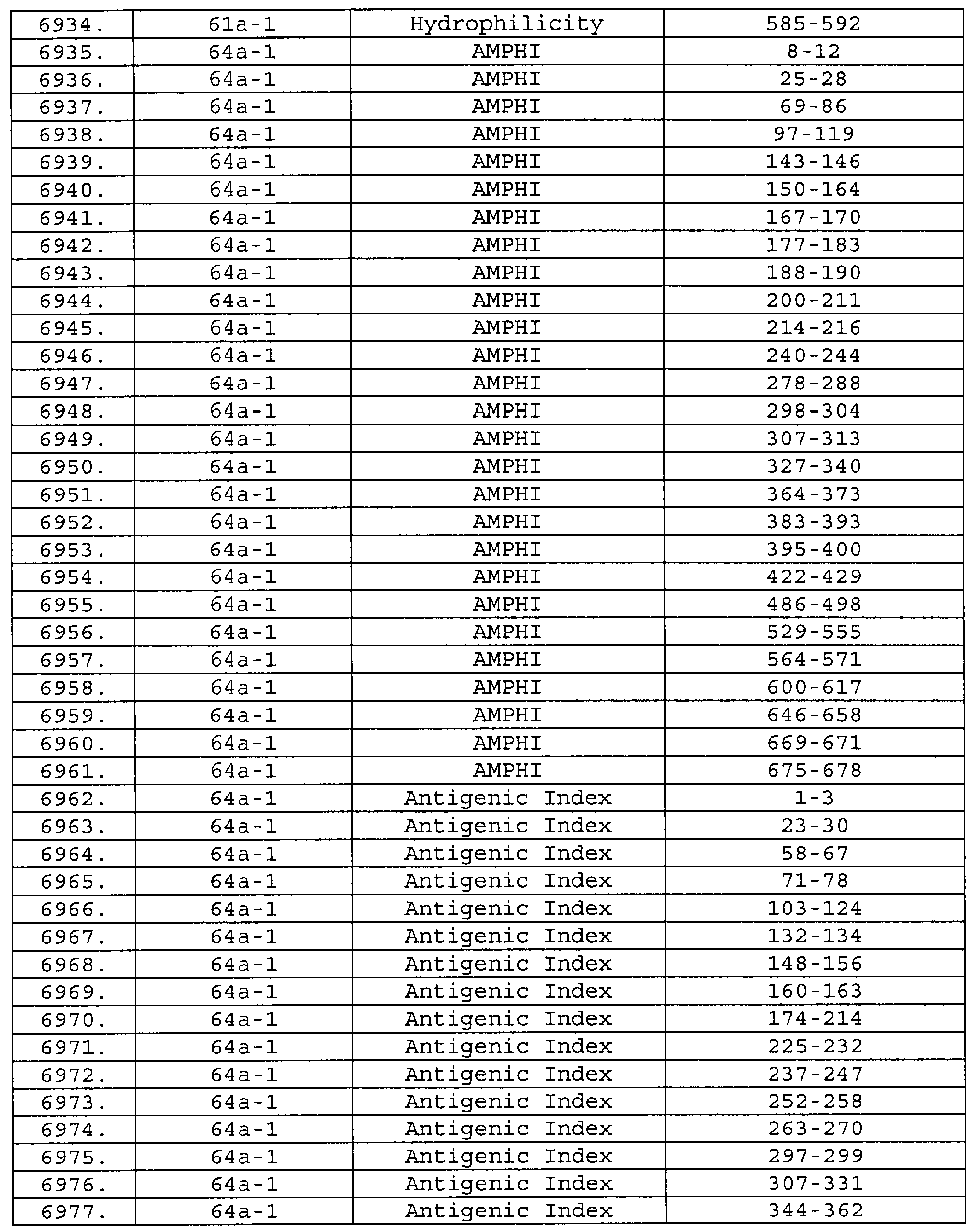
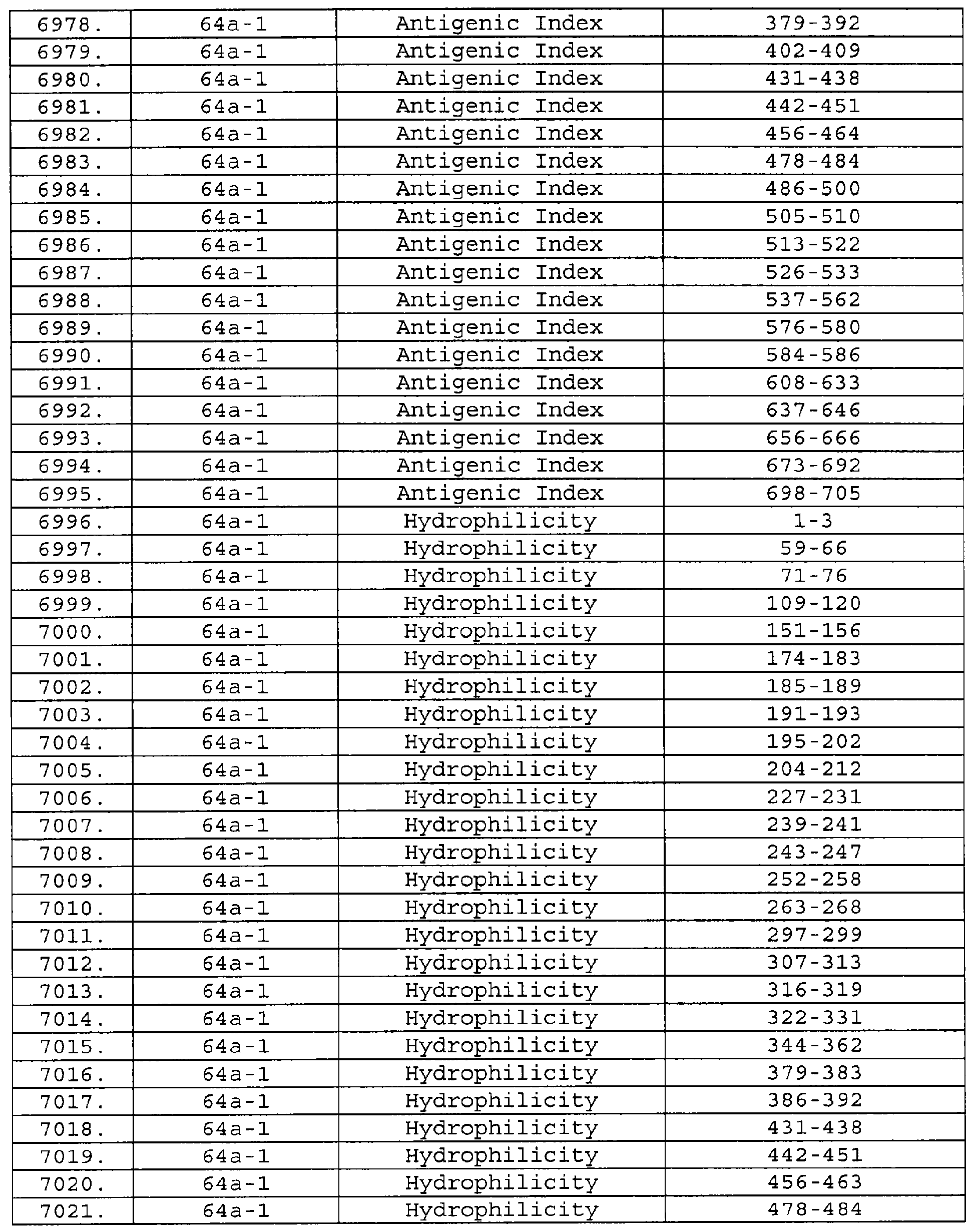
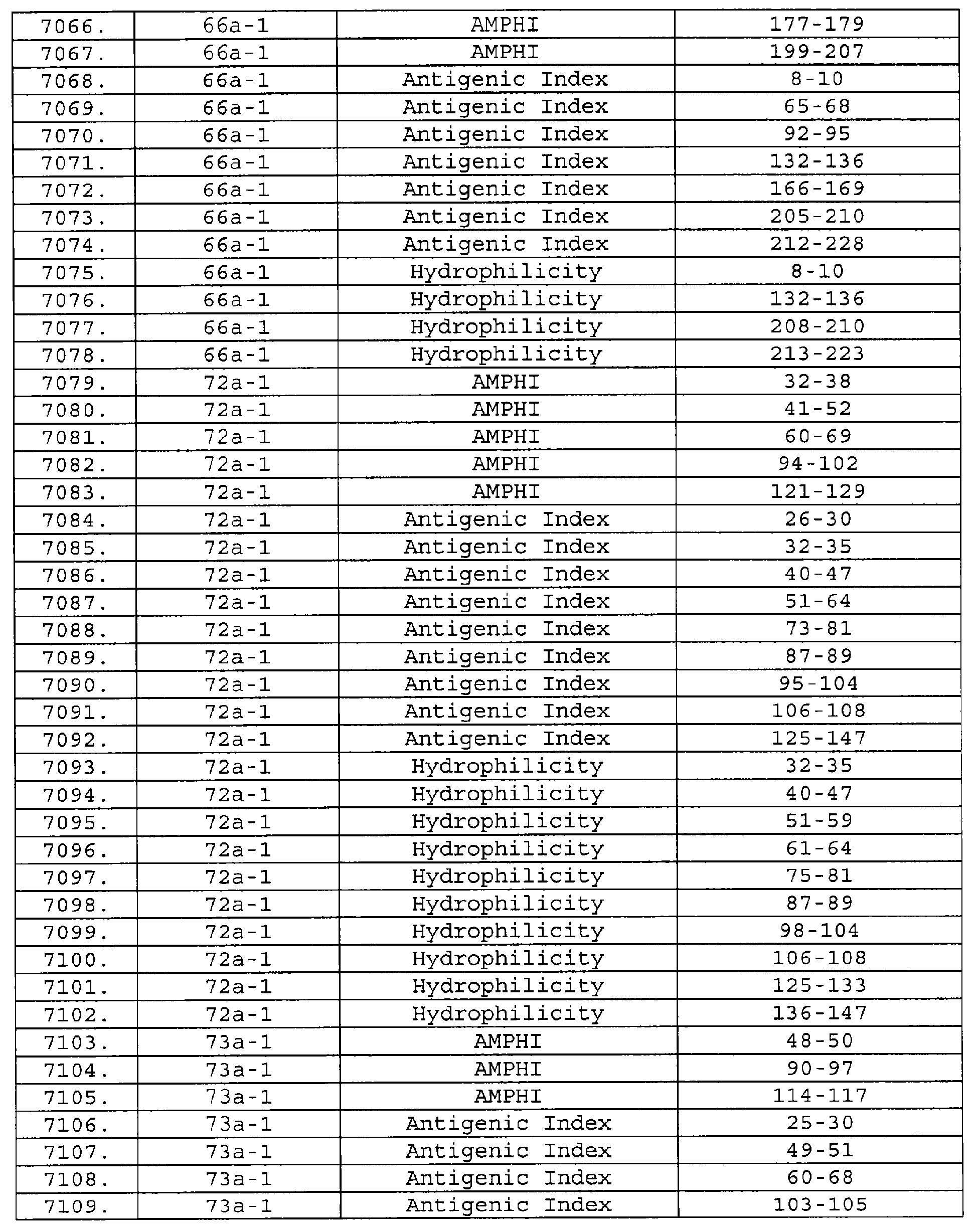
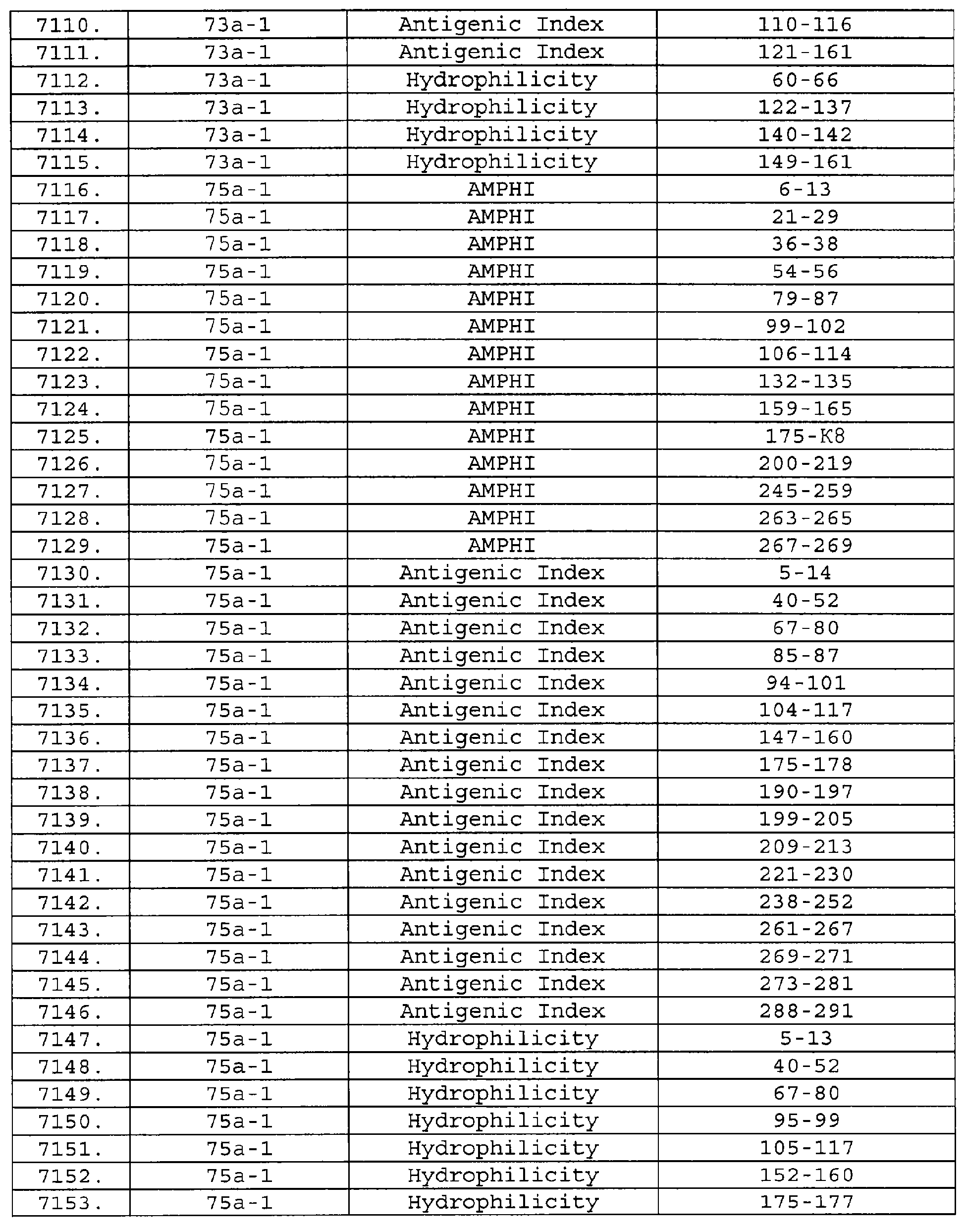
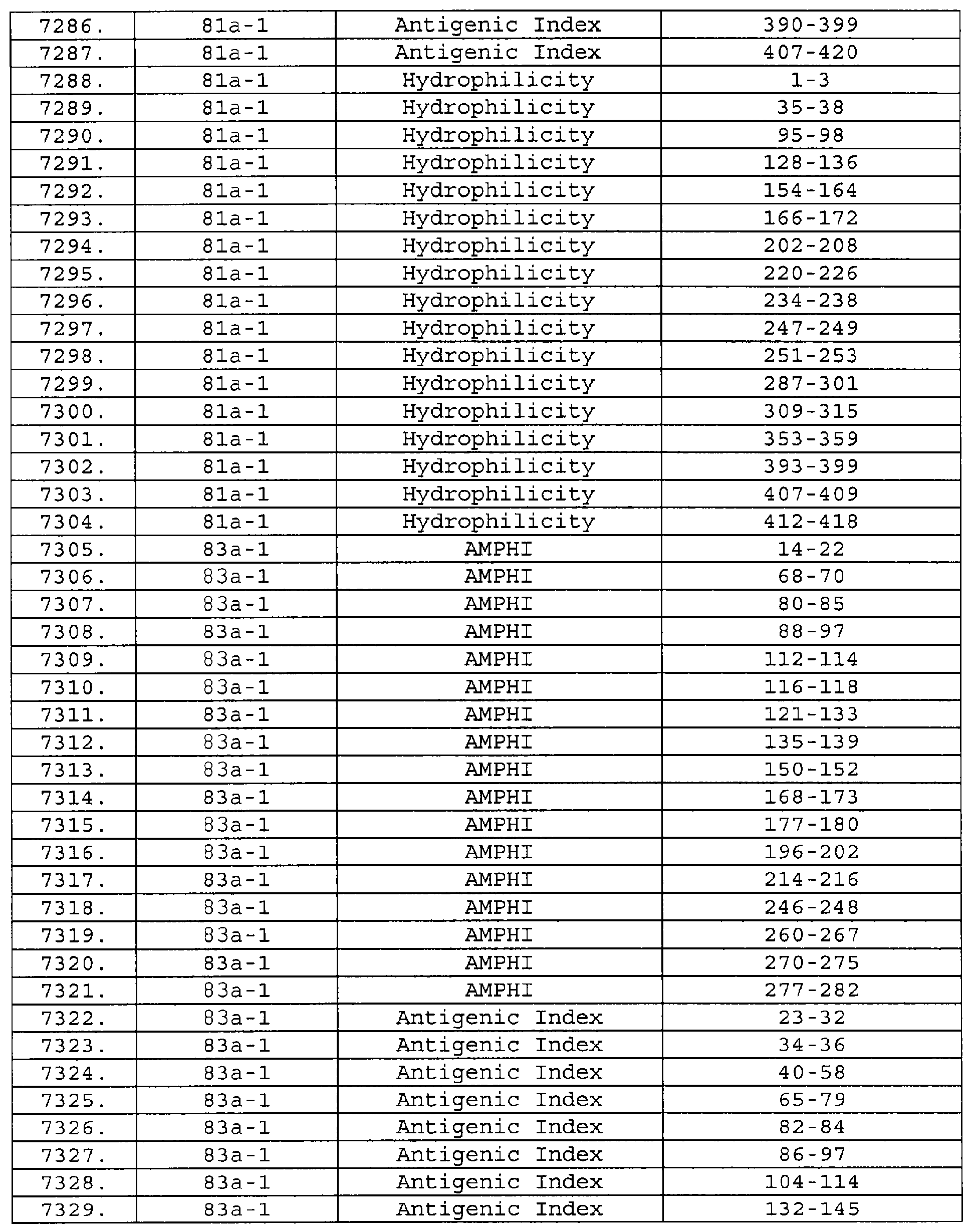
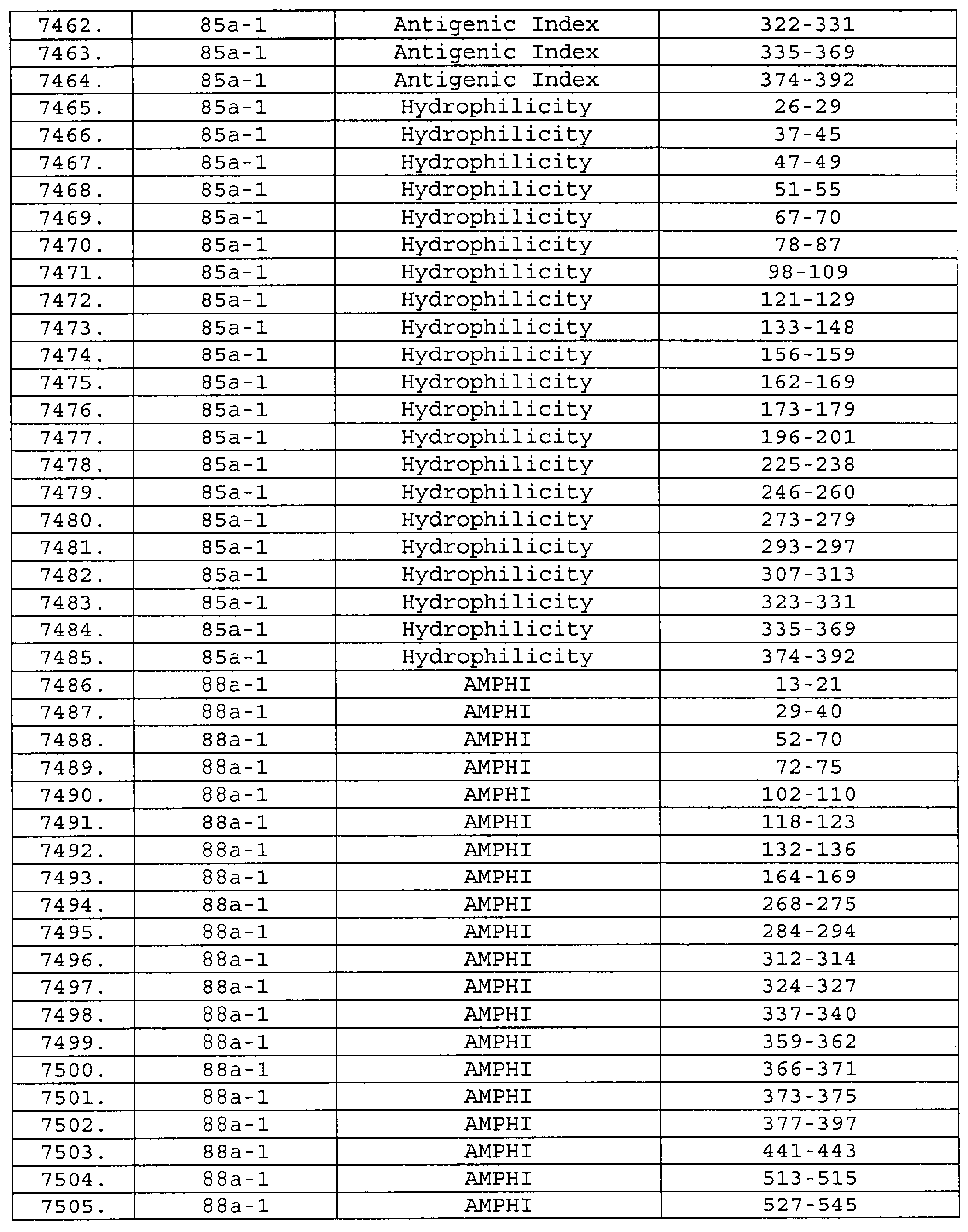
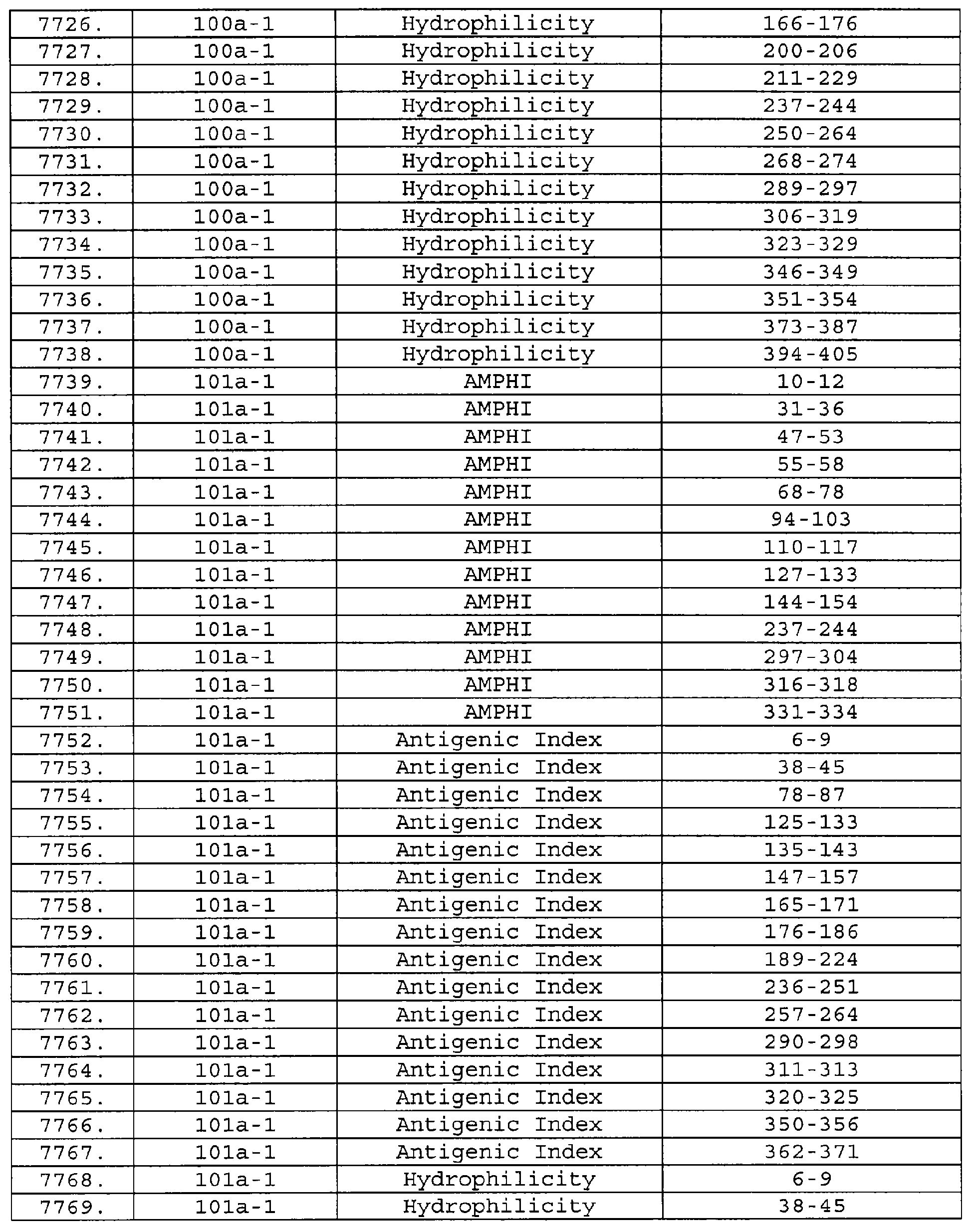
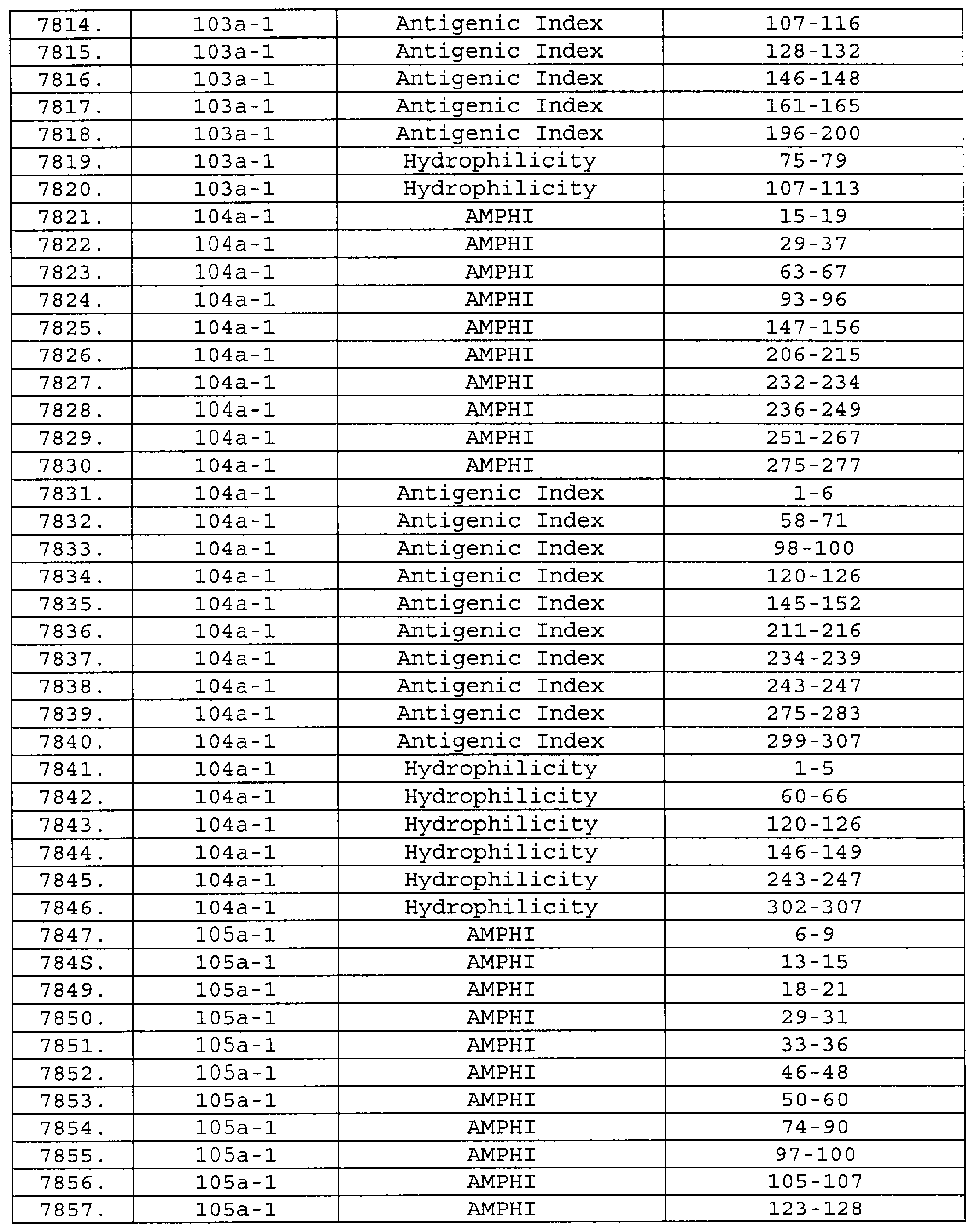
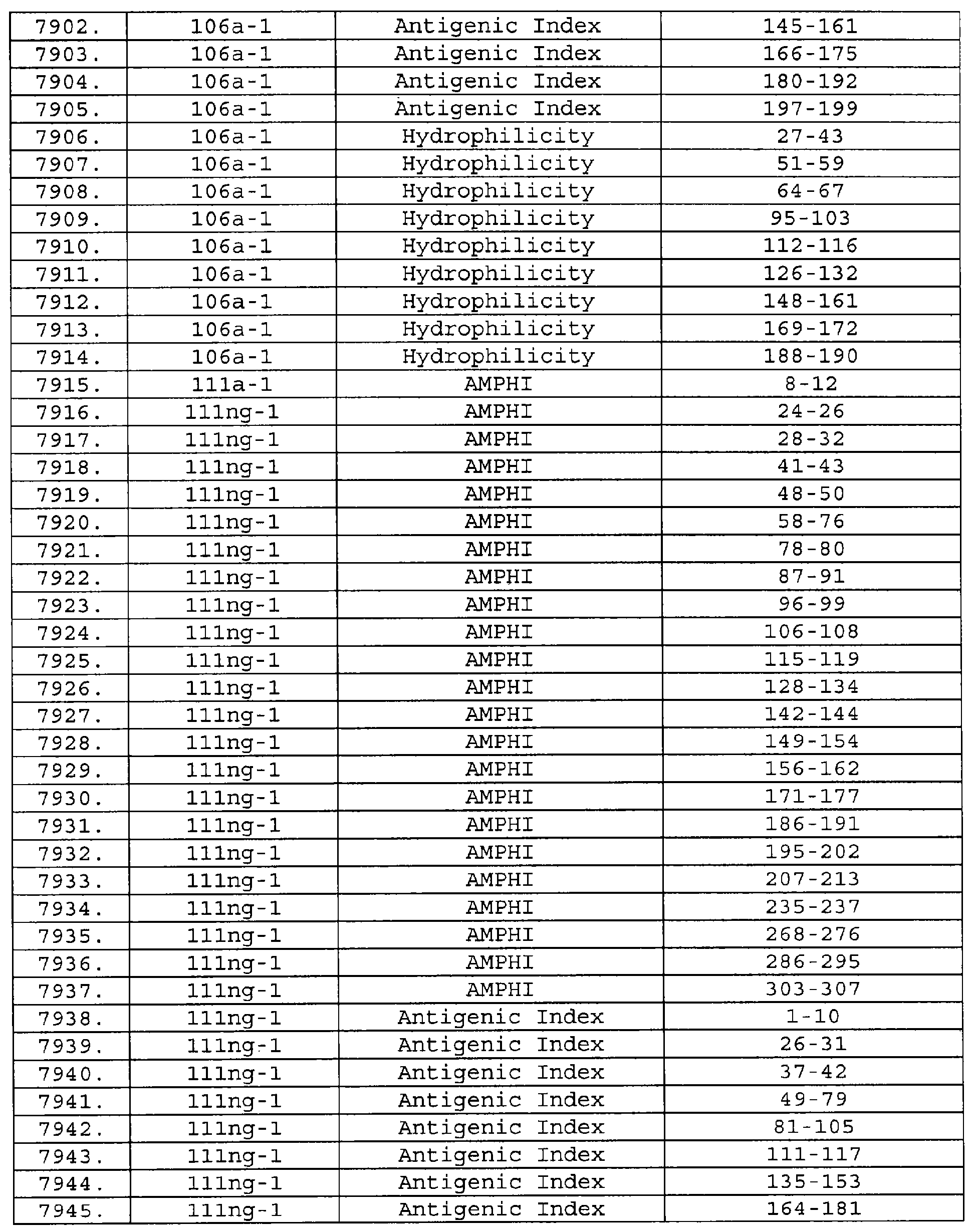
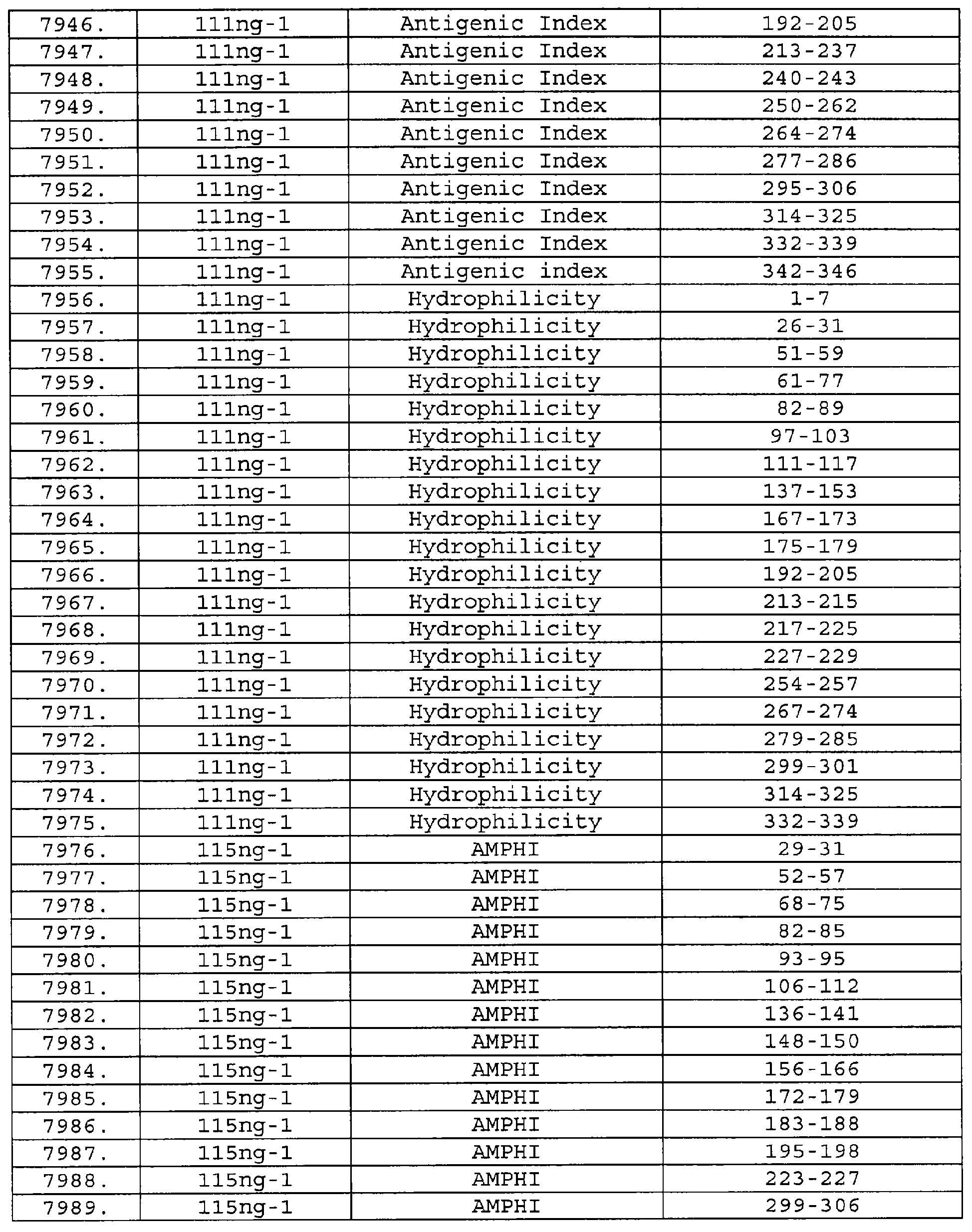
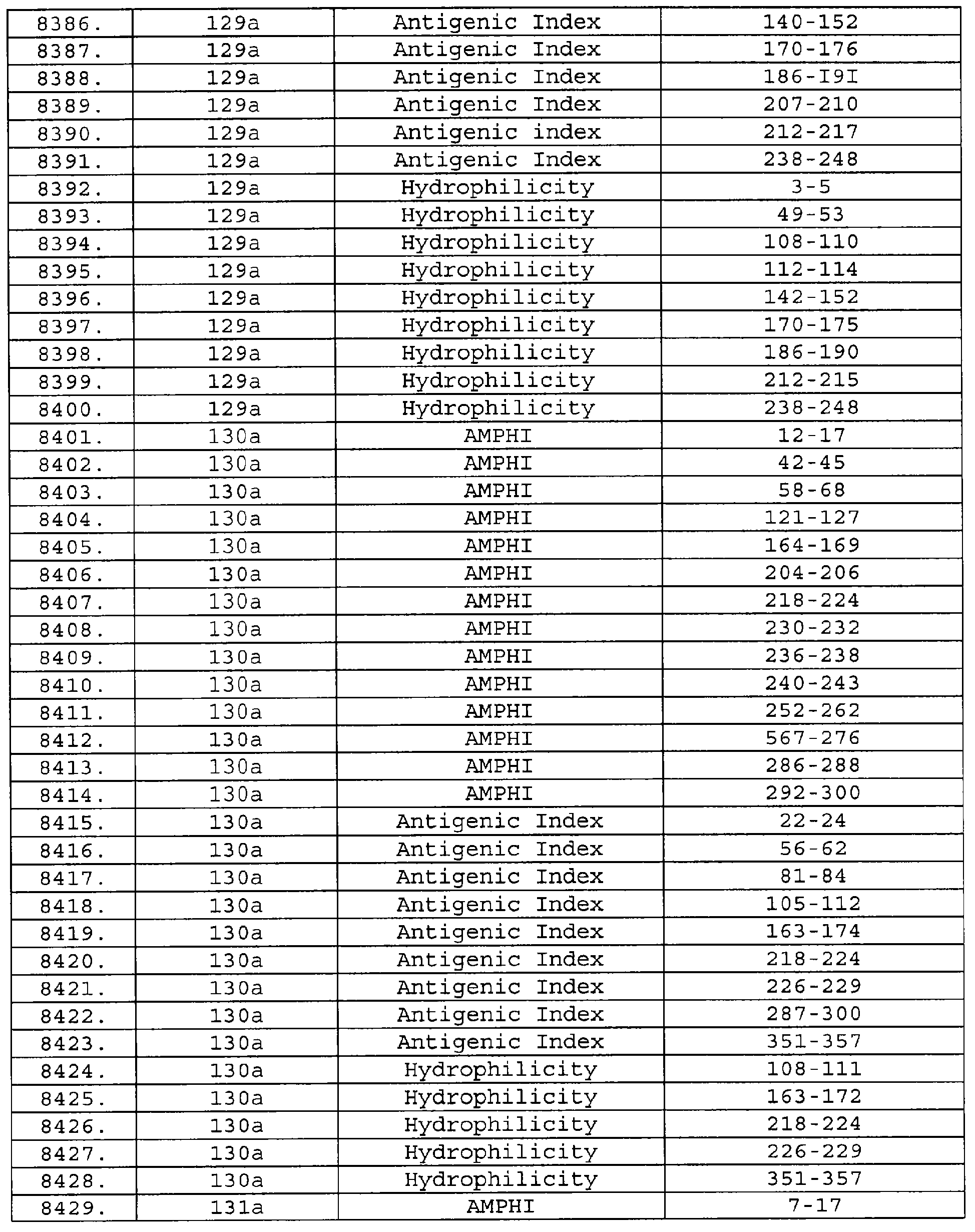
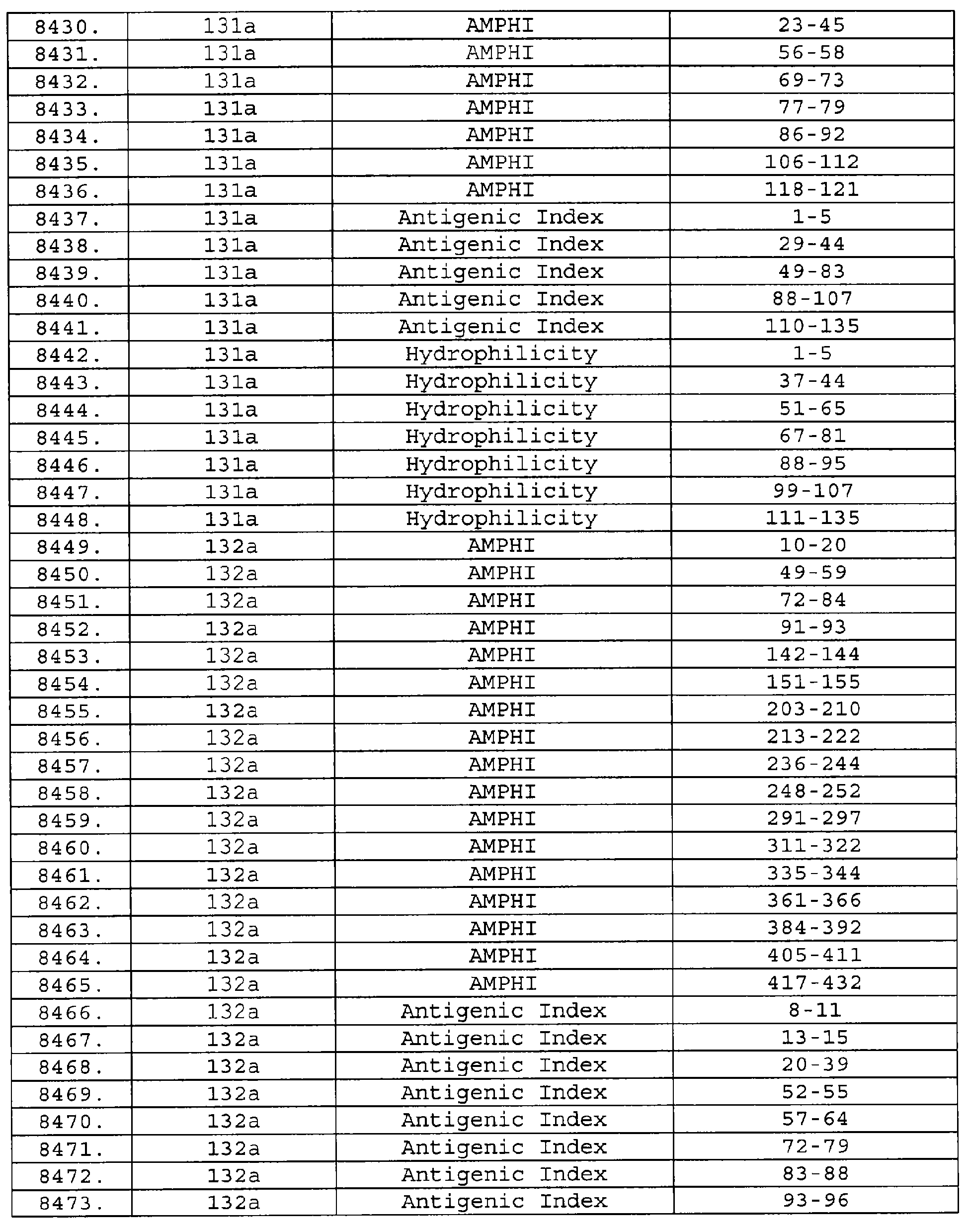
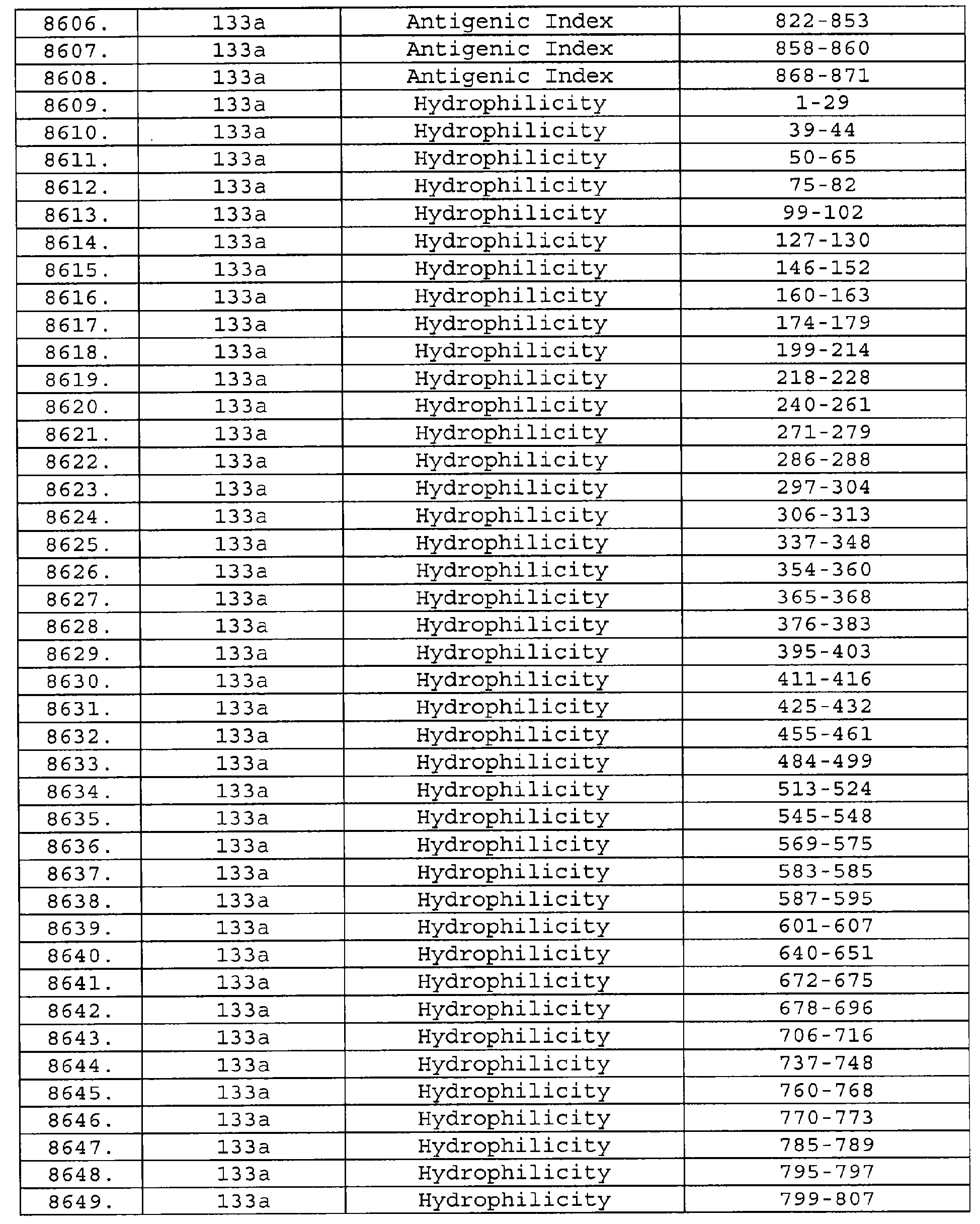
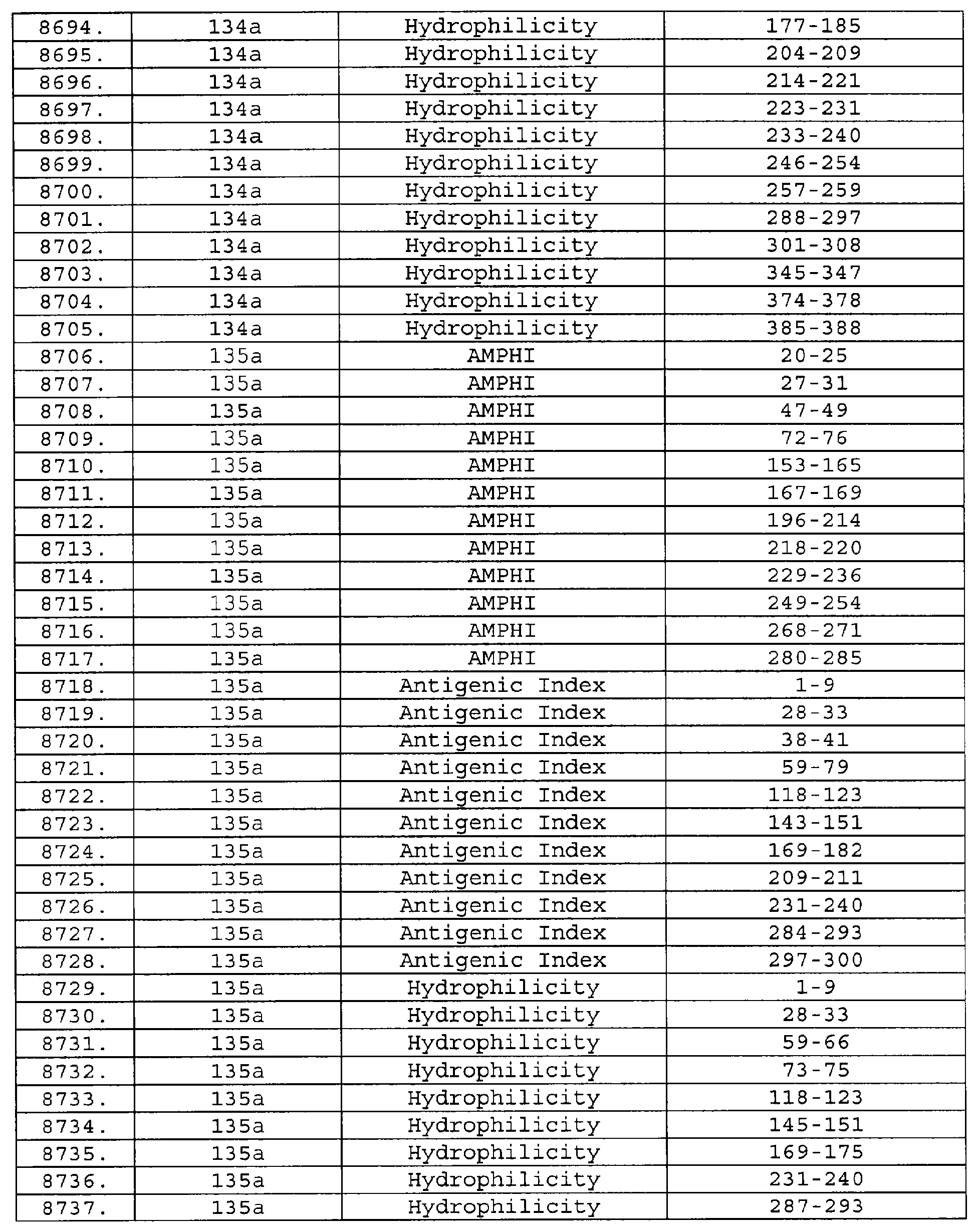
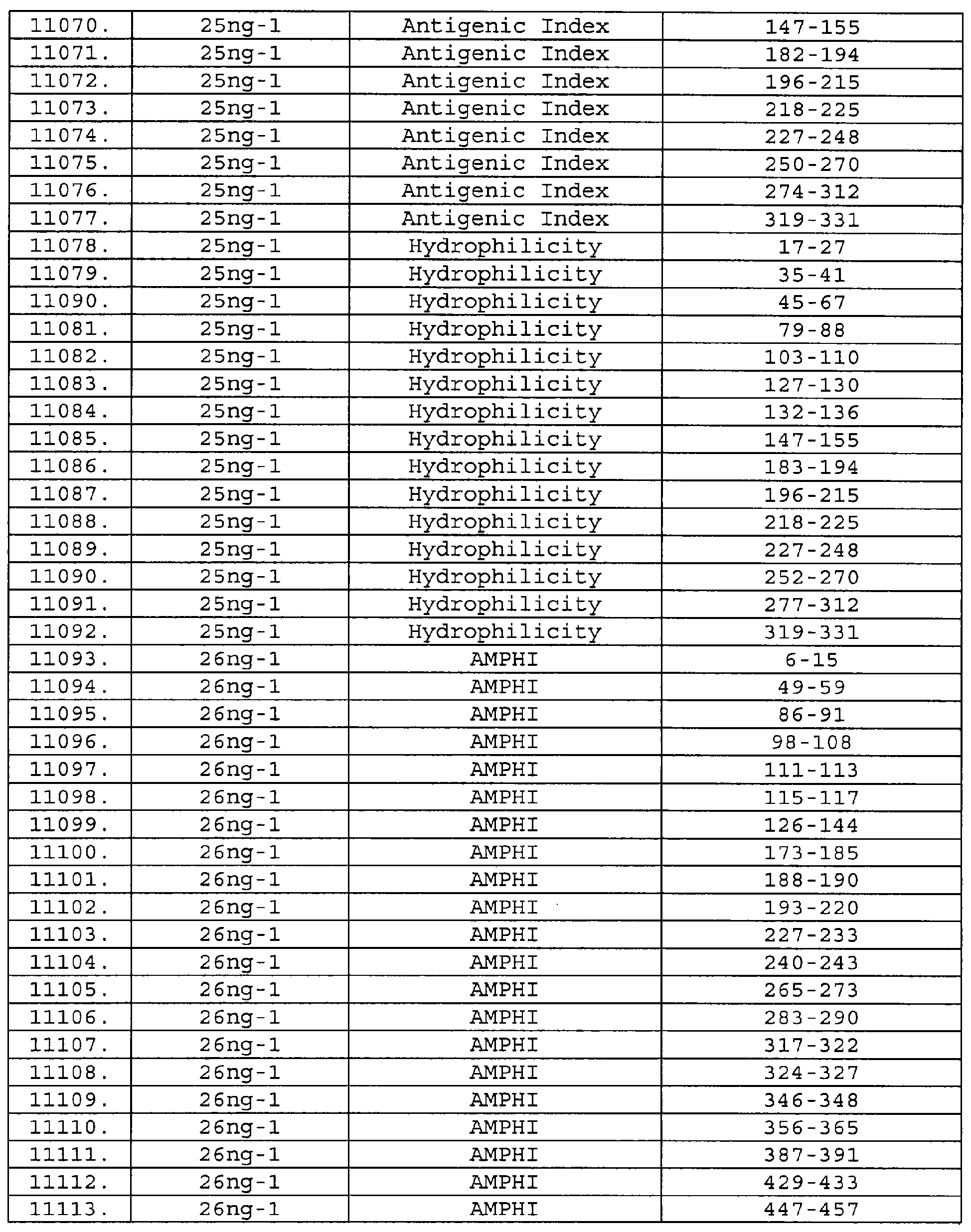
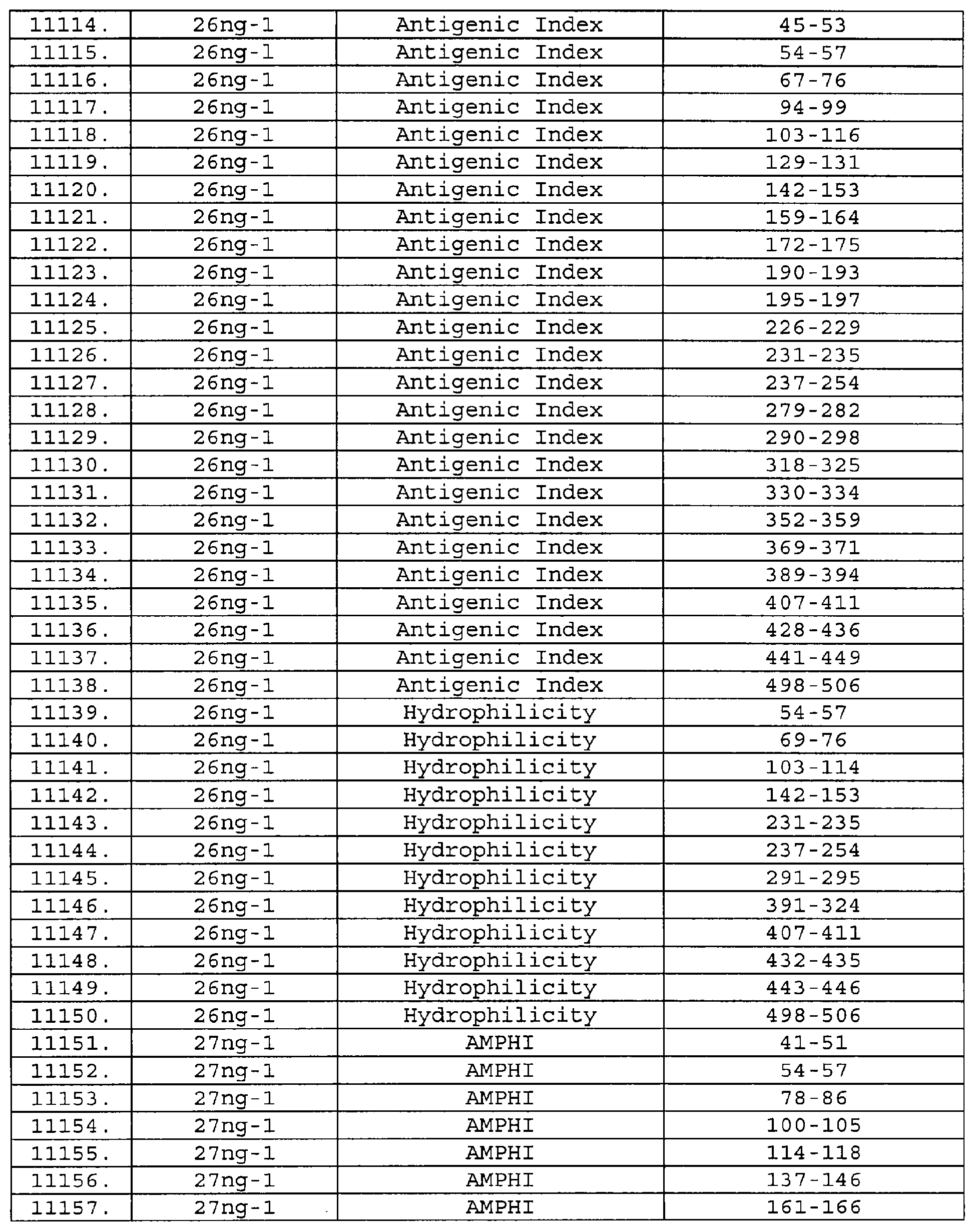
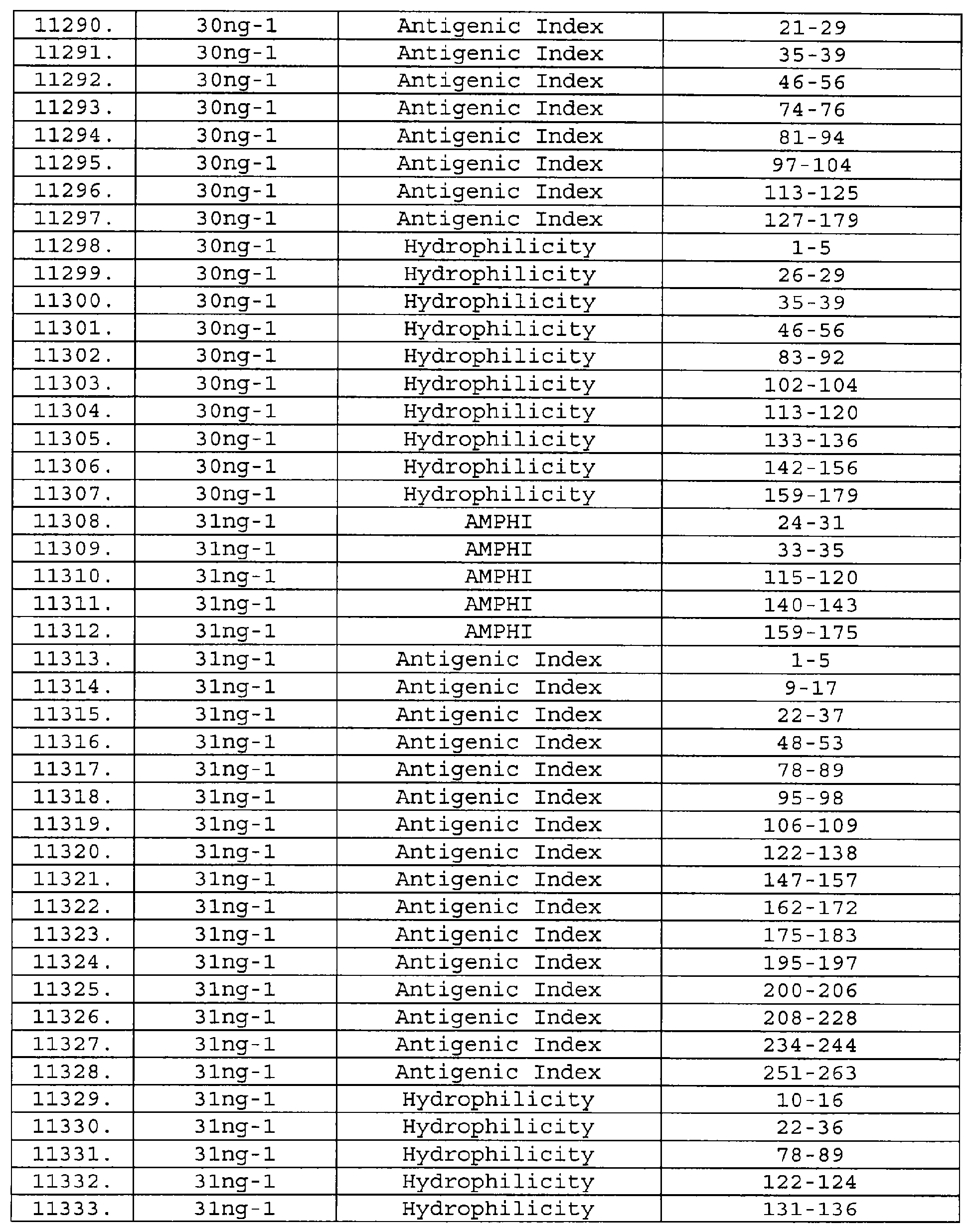
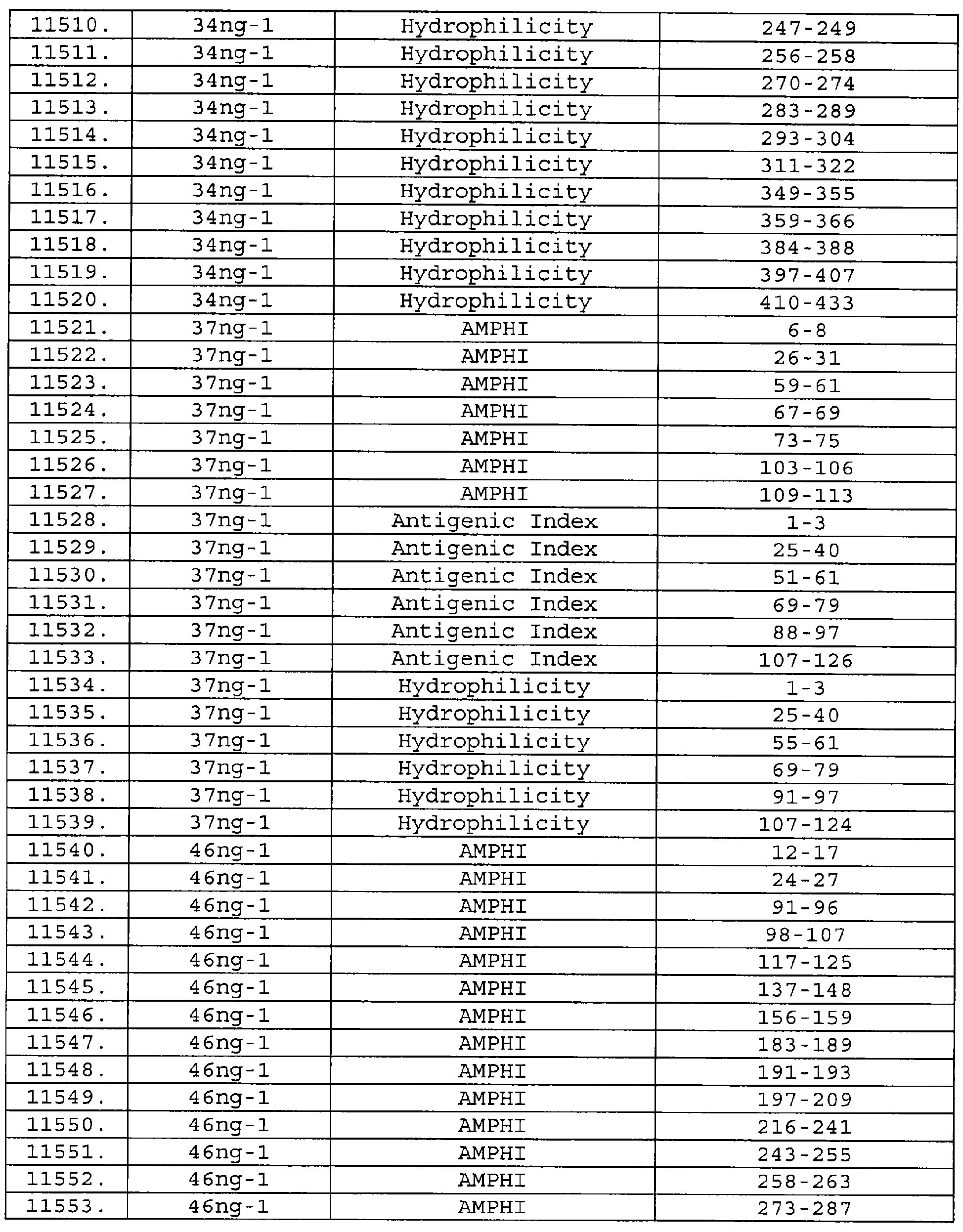
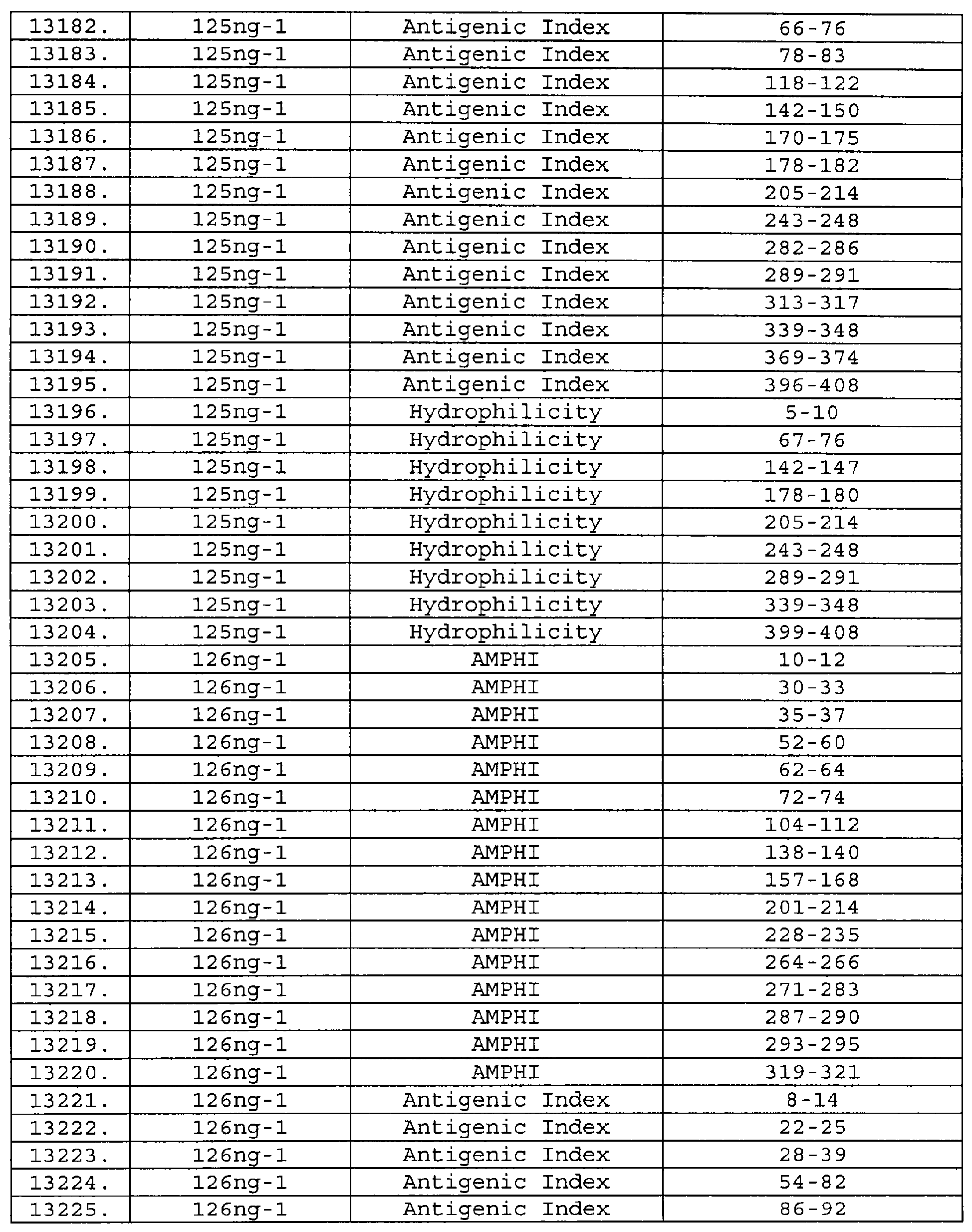
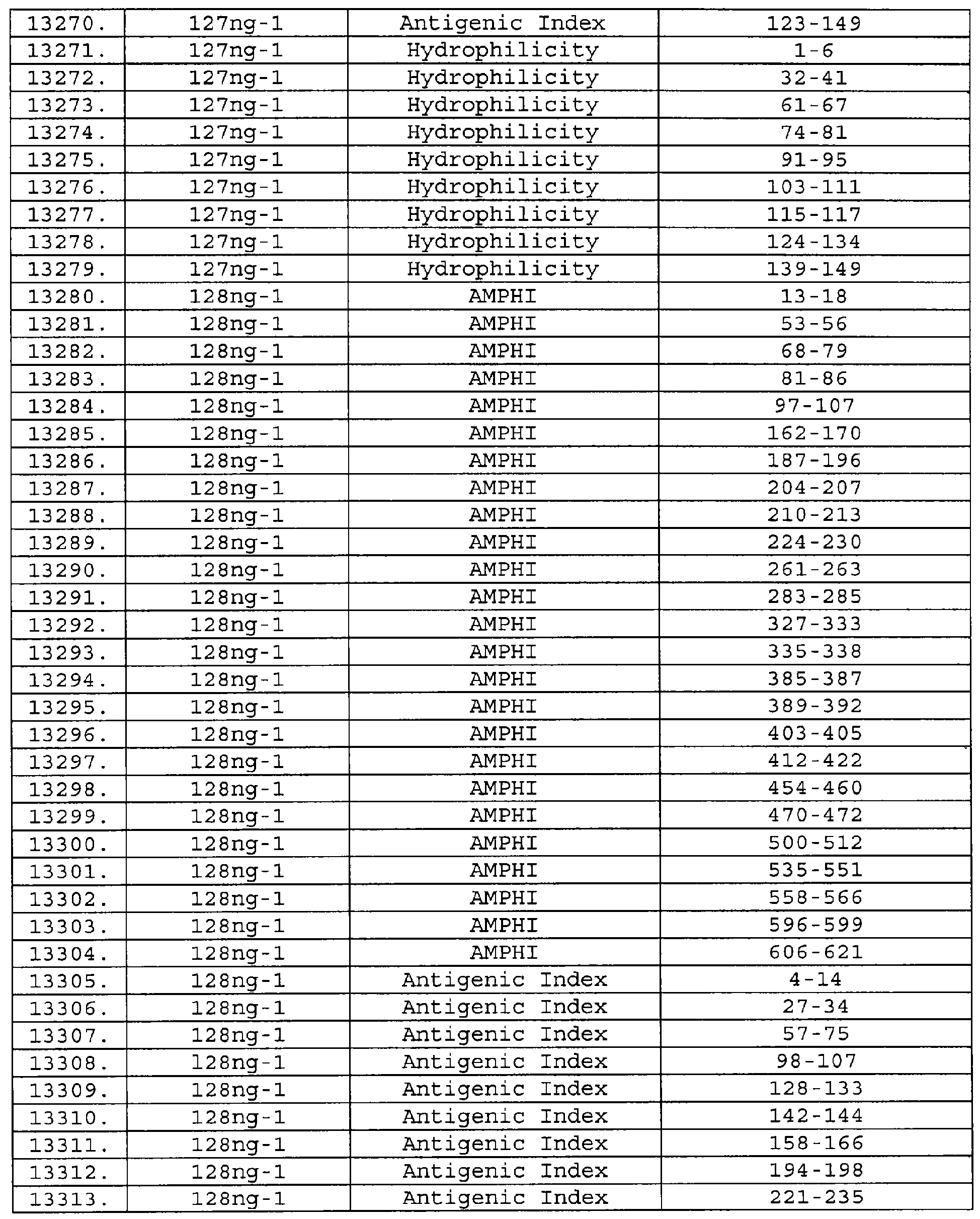
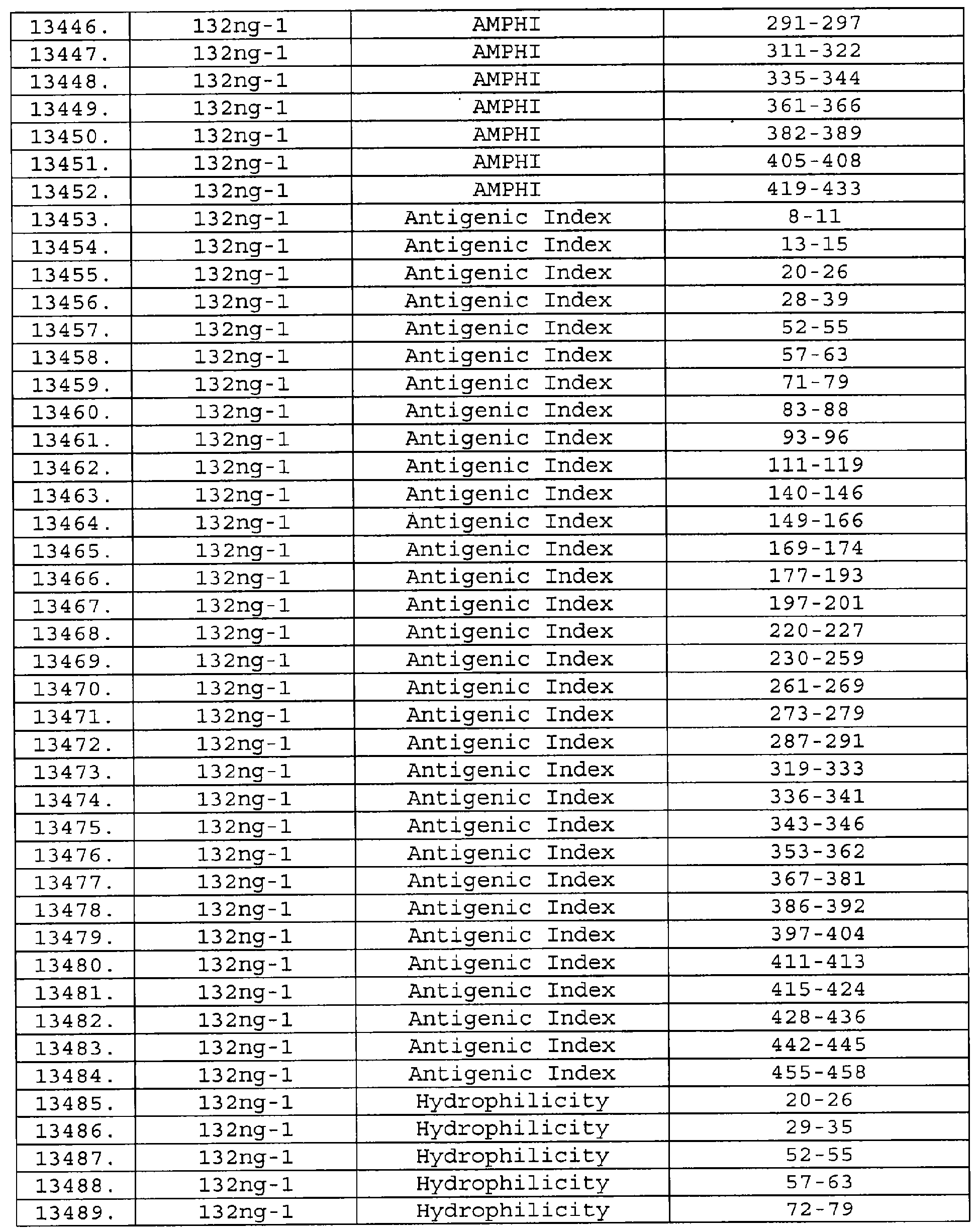
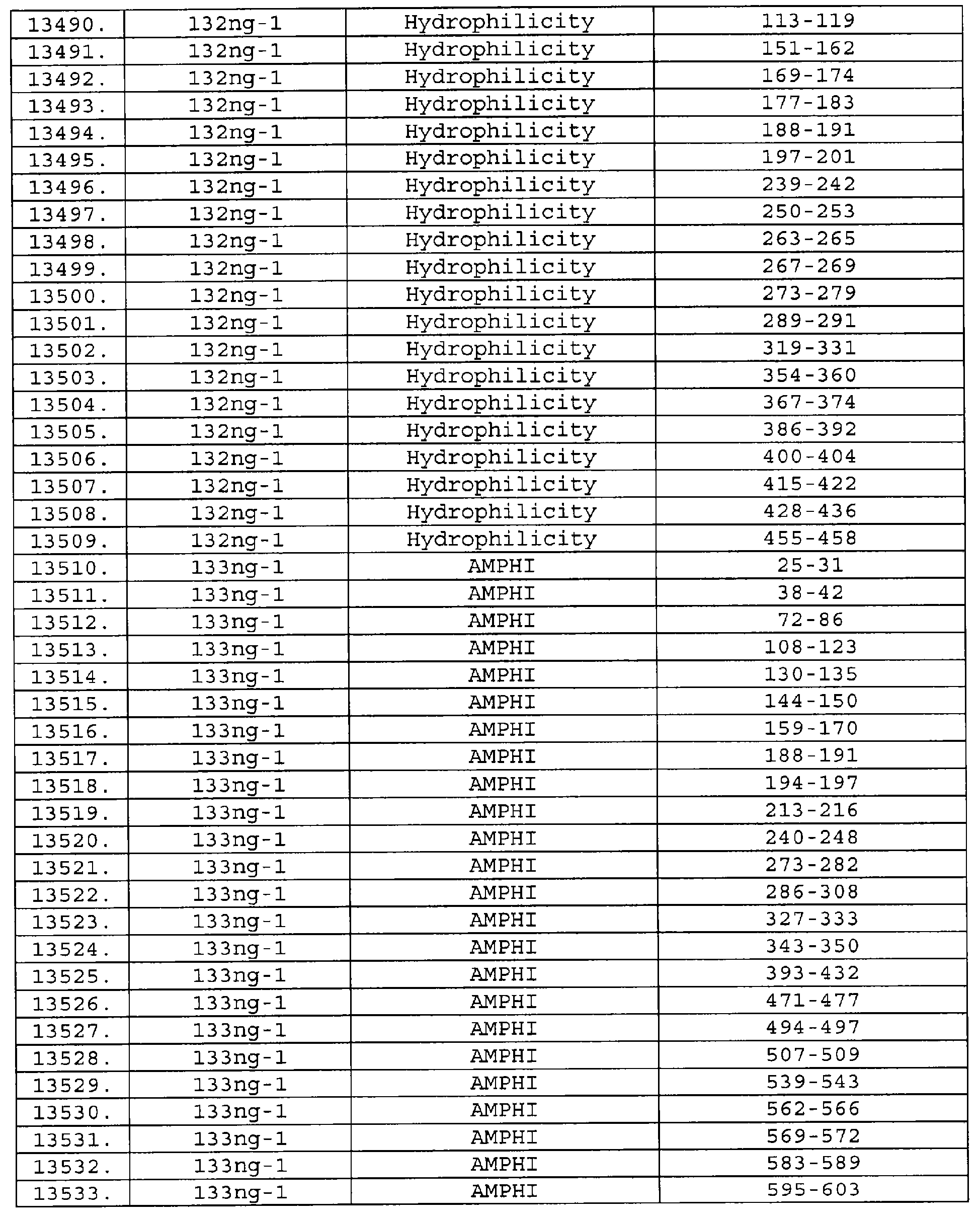
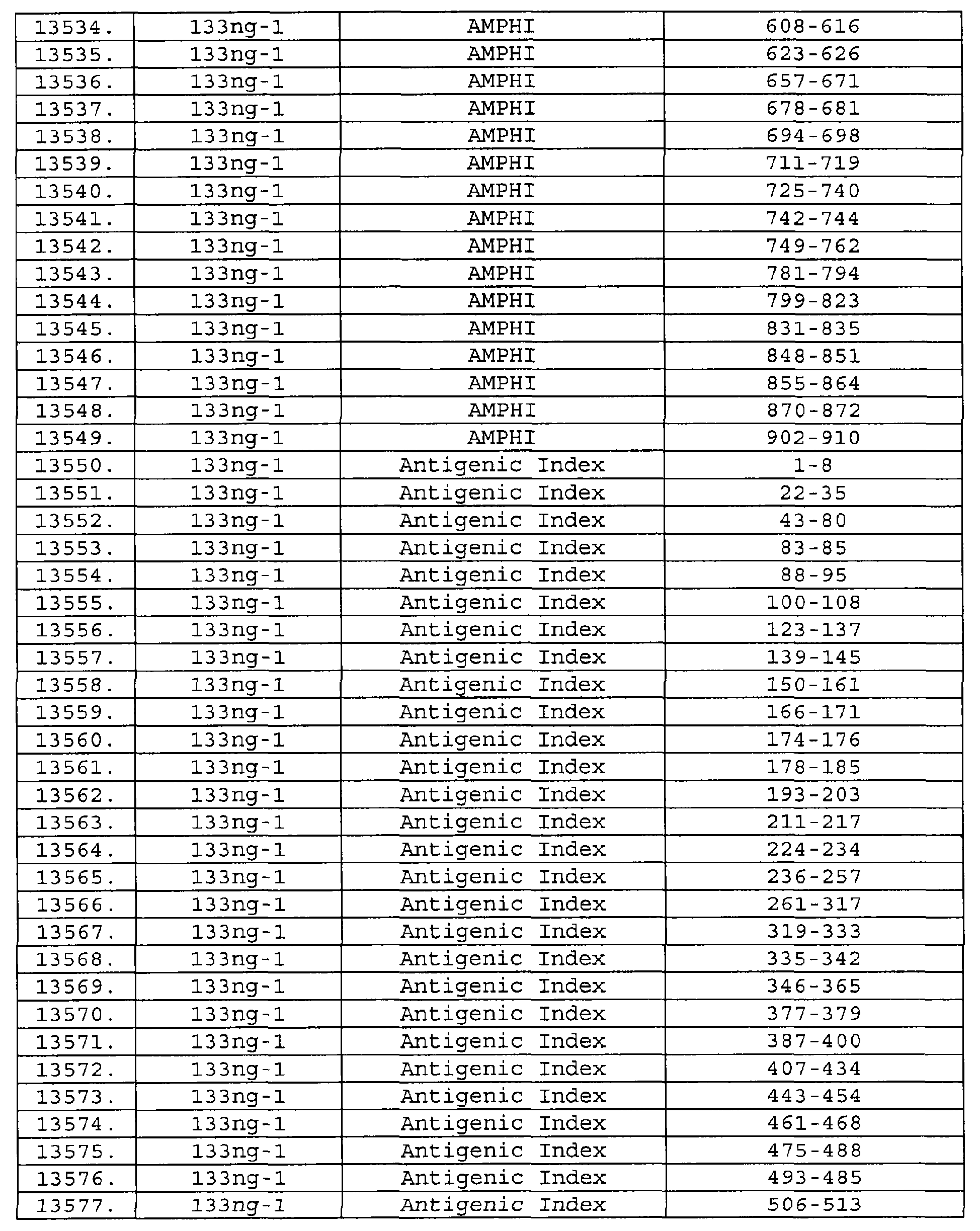
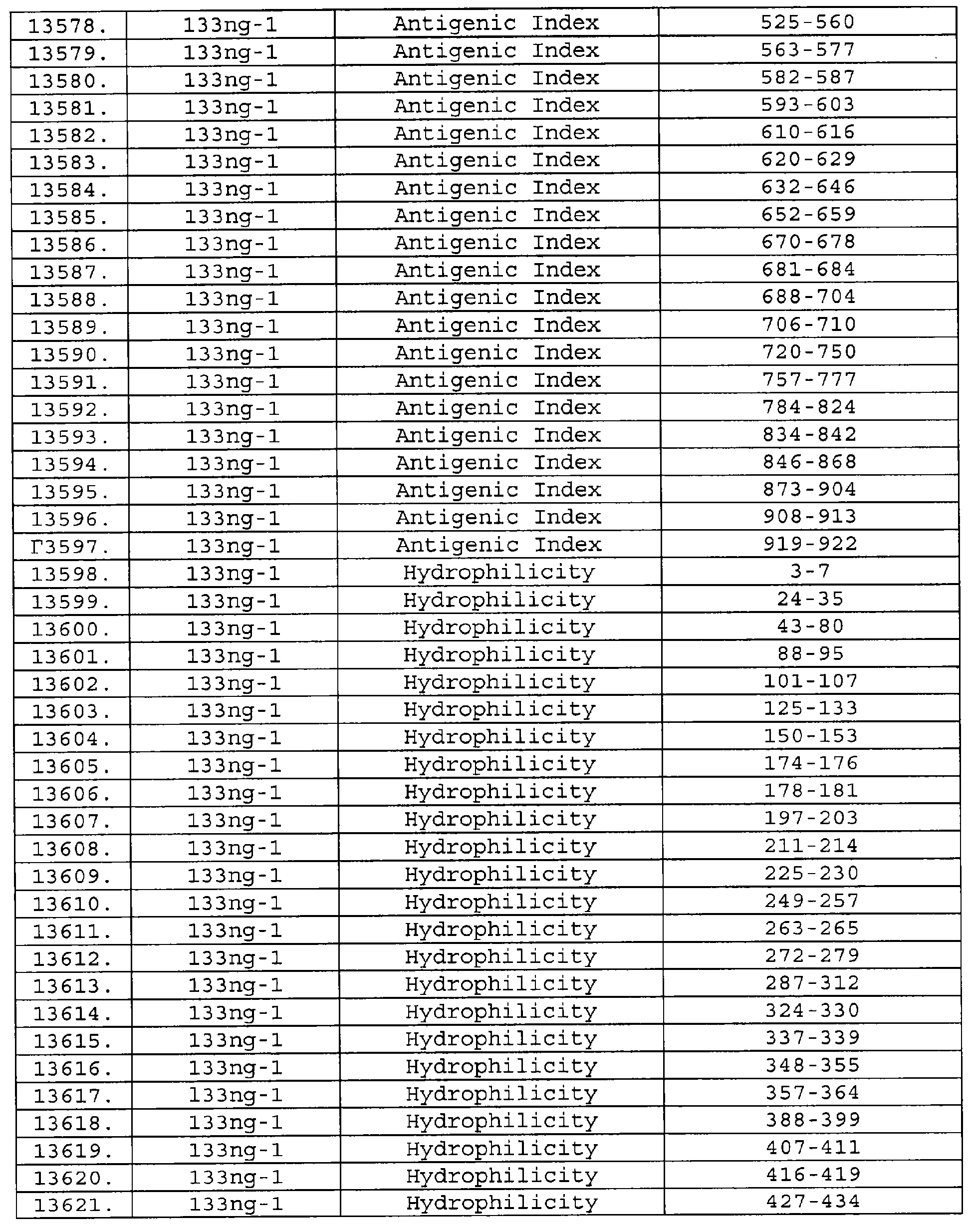
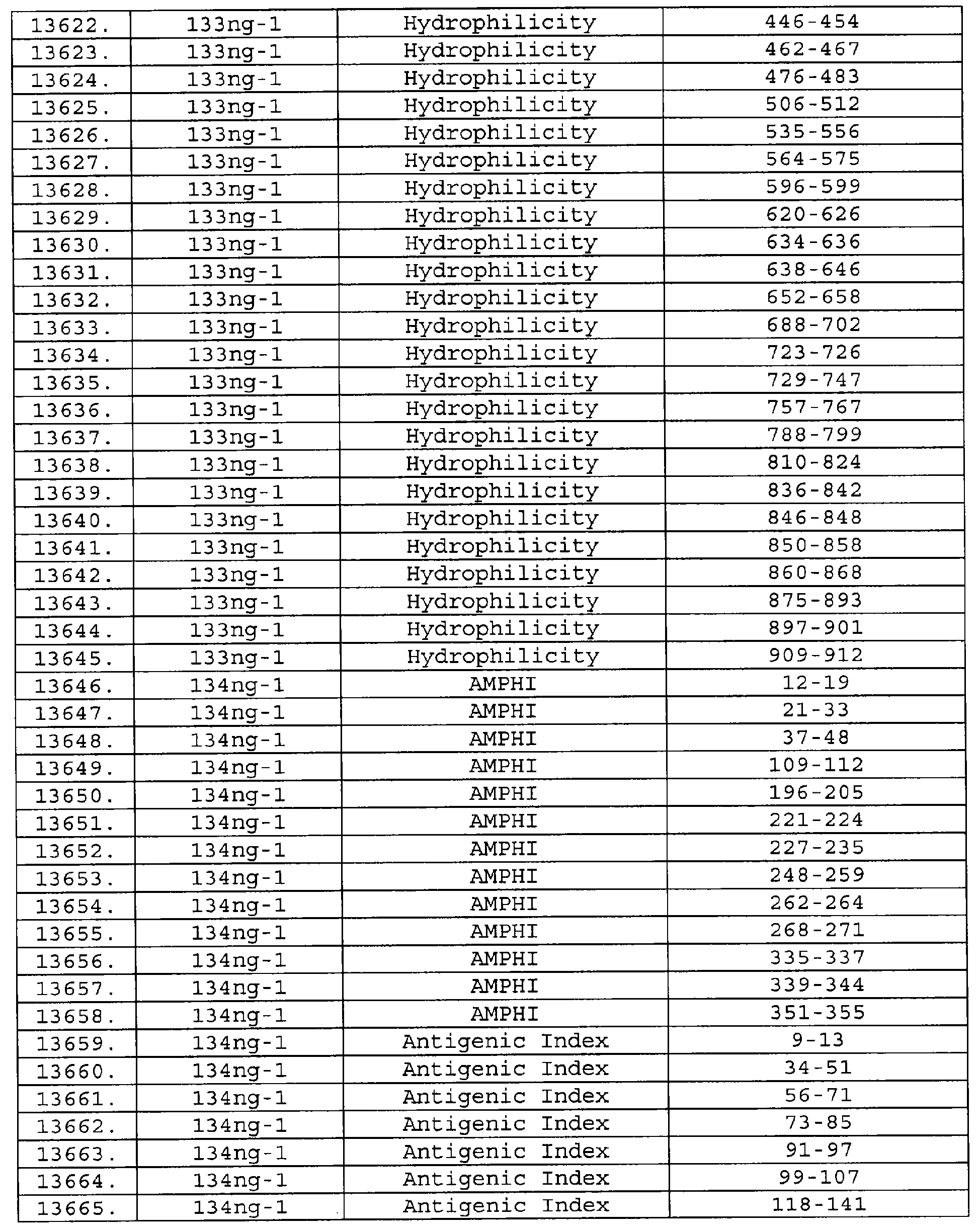
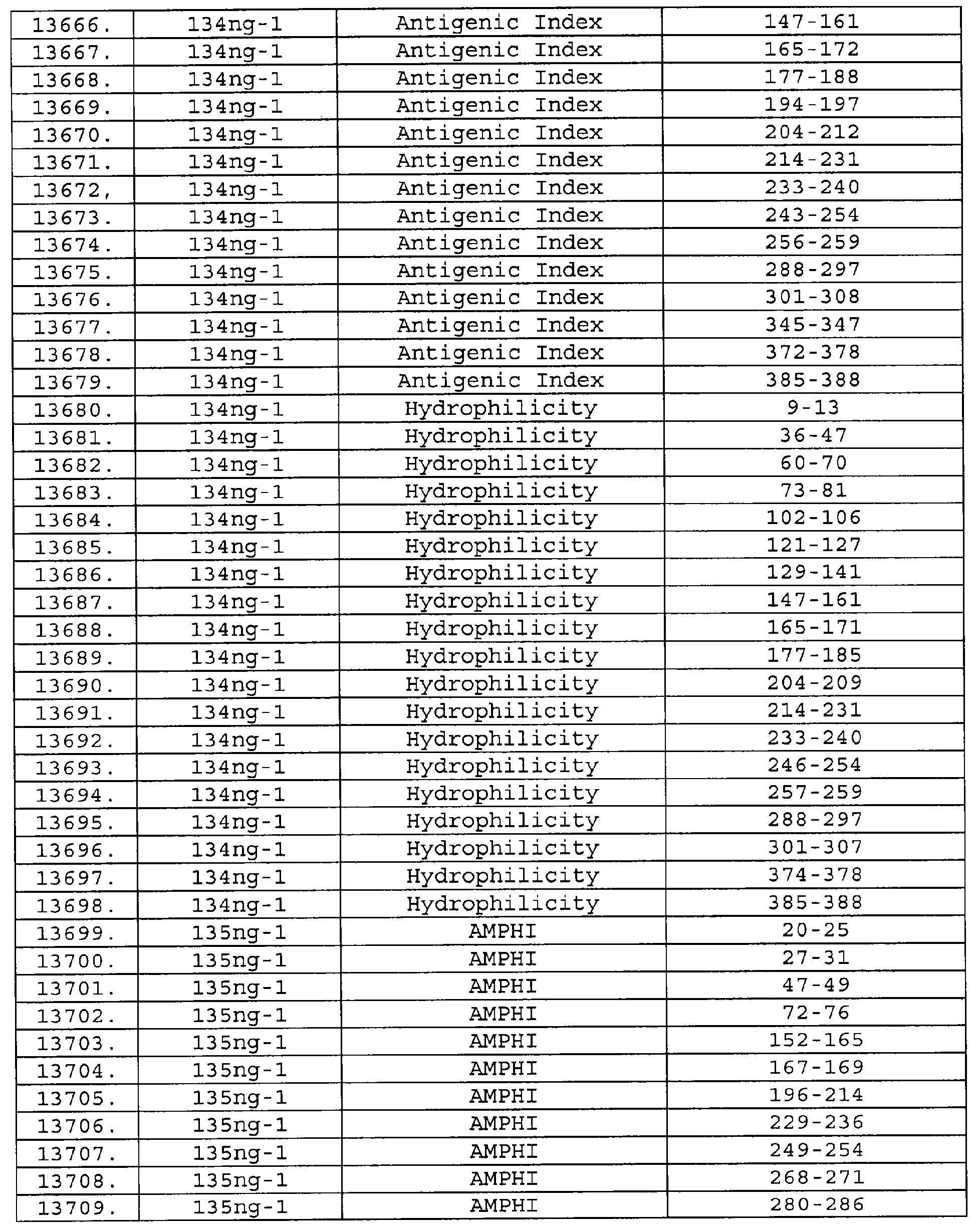
Настоящее изобретение относится к фрагментам белков, описанных в Международной патентной заявке WO 99/24578, где указанные фрагменты содержат, по крайней мере, одну антигенную детерминанту. Таким образом, если длина любой конкретной белковой последовательности, описанной в WO 99/24578, составляет х аминокислот (см. таблицу II), то настоящее изобретение относится к фрагментам, состоящим, максимум, из х-1 аминокислот данного белка. Конкретный фрагмент может быть короче, чем указанный фрагмент (например, х-2, х-3, х-4, ...), а предпочтительно его длина составляет 100 аминокислот или менее (например, 90 аминокислот или менее, 80 аминокислот и т.п.). Данный фрагмент может иметь длину минимум 3 аминокислоты, но предпочтительно он является более длинным (например, имеет длину вплоть до 6, 7, 8, 9, 10, 12, 15, 20, 25, 30, 35, 40, 50, 75 или 100 аминокислот).
Предпочтительные фрагменты содержат пептидные последовательности Neisseria, описанные в таблице I, или их субпоследовательности. Эти фрагменты могут быть длиннее, чем фрагменты, указанные в таблице I, например, если фрагмент в таблице I начинается от аминокислотного остатка p до остатка q белка, то настоящее изобретение также относится к фрагментам, начинающимся от остатка (р-1), (р-2) или (р-3) до остатка (q+1), (q+2) или (q+3).
Настоящее изобретение также относится к полипептидам, которые являются гомологичными (т.е. имеющими идентичные последовательности) этим фрагментам. В зависимости от конкретного фрагмента степень идентичности последовательности предпочтительно превышает 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Этими гомологичными полипептидами являются мутанты и аллельные варианты данных фрагментов. Идентичность двух последовательностей предпочтительно определяют с помощью алгоритма поиска гомологии Smith-Waterman, выполняемого в программе MPSRCH (Oxford Molecular) и проводимого с использованием аффинных брешей с параметрами: ″штраф на брешь-пропуск″=12 и ″штраф на брешь-удлинение″=1.
Настоящее изобретение также относится к белкам, содержащим один или несколько фрагментов, определенных выше.
Настоящее изобретение ограничивается условием, что в его объем не входят белки, содержащие любую из 446 последовательностей белка, описанных в WO 99/24578 (то есть четные номера SEQ ID NO: 2, 4, 6, 8, 10, ..., 888, 890, 892 WO 99/24578).
Само собой разумеется, что белки настоящего изобретения могут быть получены различными способами (например, путем экспрессии рекомбинантных последовательностей, очистки из клеточных культур, химического синтеза и т.п.) и в различных формах (например, в нативной форме, в форме С-концевых и/или N-концевых гибридов и т.п.). Эти белки предпочтительно получают, в основном, в чистом виде (т.е. в форме, в основном, не содержащей других белков Neisseria или белков клеток хозяина). Белки с короткой цепью предпочтительно продуцируют методами химического пептидного синтеза.
В другом своем аспекте настоящее изобретение относится к антителам, которые распознают фрагменты настоящего изобретения, при условии, что в объем настоящего изобретения не входят антитела, распознающие одну из 446 полноразмерных последовательностей белка, описанных в WO 99/24578. Этими антителами могут быть поликлональные или предпочтительно моноклональные антитела, которые могут быть получены любыми подходящими способами.
Настоящее изобретение также относится к белкам, содержащим пептидные последовательности, распознаваемые этими антителами. Самом собой разумеется, что указанные пептидные последовательности будут включать фрагменты белков Neisseria, описанных в WO 99/24578, а также пептиды, имитирующие антигенную структуру пептидов Neisseria при связывании с иммуноглобулином.
В еще одном своем аспекте настоящее изобретение относится к нуклеиновой кислоте, кодирующей фрагменты и белки настоящего изобретения, при условии, что в объем настоящего изобретения не входит нуклеиновая кислота, кодирующая одну из 446 полноразмерных последовательностей белка, описанных в WO 99/24578.
Кроме того, настоящее изобретение относится к нуклеиновой кислоте, содержащей последовательности, гомологичные (т.е. имеющие идентичность) указанным последовательностям. Кроме того, настоящее изобретение относится к нуклеиновой кислоте, которая может гибридизоваться с указанными последовательностями предпочтительно в условиях "высокой жесткости" (например, при 65°С в растворе 0,1×SSC, 0,5% ДСН).
Следует также отметить, что настоящее изобретение относится к нуклеиновой кислоте, содержащей последовательности, комплементарные последовательностям, описанным выше (например, для получения антисмысловой последовательности или для зондирования).
Само собой разумеется, что нуклеиновая кислота настоящего изобретения может быть получена многими способами (например, методом химического синтеза, из геномной или кДНК-библиотек, из самого микроорганизма и т.п.) и может иметь различные формы (например, одноцепочечную, двухцепочечную, векторы, зонды и т.п.). Кроме того, термин "нуклеиновая кислота" означает ДНК и РНК, а также их аналоги, такие как аналоги, содержащие модифицированные остовы, а также связанные с пептидами нуклеиновые кислоты (ПНК) и т.п.
В другом своем аспекте настоящее изобретение относится к векторам, содержащим нуклеотидные последовательности настоящего изобретения (например, экспрессирующие векторы) и клетки-хозяева, трансформированные такими векторами.
В другом своем аспекте настоящее изобретение относится к композициям, содержащим белок, антитело, и/или нуклеиновую кислоту настоящего изобретения. Эти композиции могут быть получены, например, в виде вакцин или в виде диагностических реагентов, либо в виде иммуногенных композиций.
Настоящее изобретение также относится к нуклеиновой кислоте, белку или антителу настоящего изобретения для использования в качестве лекарственных препаратов (например, в качестве вакцин или их иммуногенных композиций) или в качестве диагностических реагентов. Настоящее изобретение также относится к использованию нуклеиновой кислоты, белка или антитела настоящего изобретения в целях изготовления (i) лекарственного средства для лечения или профилактики инфекции, вызываемой бактериями Neisseria; (ii) диагностического реагента для обнаружения присутствия бактерии Neisseria или антител, вырабатываемых против бактерии Neisseria; и/или (iii) реагента, который может способствовать продуцированию антител против бактерии Neisseria. Указанными бактериями Neisseria могут быть бактерии любого вида или штамма (такие как N.gonorrhoeae), но предпочтительно N.meningitidis, а в частности, штамм А или штамм В.
Настоящее изобретение также относится к способу лечения пациента, предусматривающему введение этому пациенту терапевтически эффективного количества нуклеиновой кислоты, белка и/или антитела настоящего изобретения.
В соответствии с другими своими аспектами, настоящее изобретение относится к различными способам.
Настоящее изобретение относится к способу продуцирования белков, предусматривающему проведение стадии культивирования клетки-хозяина настоящего изобретения в условиях, благоприятствующих индуцированию экспрессии белка.
Настоящее изобретение относится к способу продуцирования белка или нуклеиновой кислоты настоящего изобретения, где этот белок или нуклеиновая кислота синтезируются частично или целиком с использованием химических методов.
Настоящее изобретение относится к способу обнаружения полинуклеотидов настоящего изобретения, предусматривающему проведение стадий: (а) контактирования нуклеотидного зонда настоящего изобретения с биологическим образцом в условиях гибридизации с образованием дуплексов и (b) обнаружения указанных дуплексов.
Настоящее изобретение относится к способу обнаружения белков настоящего изобретения, предусматривающему проведение стадий: (а) контактирования антитела настоящего изобретения с биологическим образцом в условиях, благоприятствующих образованию комплексов антитело-антиген и (b) обнаружения указанных комплексов.
Ниже приводится краткое описание стандартных методов и процедур, которые могут быть использованы для осуществления настоящего изобретения (например, для использования описанных последовательностей в целях вакцинации или диагностики). Это краткое описание не должно рассматриваться как ограничение изобретения и приводится лишь в качестве примеров, которые могут быть использованы, но которые не являются обязательными.
Общее описание
Для осуществления настоящего изобретения, если это не оговорено особо, могут быть использованы стандартные методы молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, известные специалистам. Такие методы полностью описаны в литературе, например, Sambrook Molecular Cloning, A Laboratory Manual, Second Edition, (1989); DNA Cloning, Volumes I and II (D.N.Glover ed. 1985); Oligonucleotide Synthesis (M.J.Gait ed, 1984); Nucleic Acid Hybridization (B.D.Hames & S.J.Higgins eds. 1984); Transcription and Translation (B.D.Hames & S.J.Higgins eds. 1984); Animal Cell Culture (R.I.Freshney ed. 1986); Immobilized Cells and Enzymes (IRL Press, 1986); B.Perbal, A Practical Guide to Molecular Cloning (1984); the Methods in Enzymology series (Academic Press, Inc.), especially volumes 154&155; Gene Transfer Vectors for Mammalian Cells (J.H.Miller & M.P.Calos eds. 1987, Cold Spring Harbor Laboratory); Mayer & Walker, eds. (1987), Immunochemical Methods in Cell and Molecular Biology (Academic Press, London); Scopes, (1987) Protein Purification: Principles and Practice, Second Edition (Springer-Verlag, N.Y.), и Handbook of Experimental Immunology, Volumes I-IV (D.M.Weir and C.C.Blackwell eds. 1986).
В этом описании используются сокращения, обычно принятые для нуклеотидов и аминокислот.
Все цитированные публикации, патенты и патентные заявки во всей своей полноте вводятся в настоящее описание посредством ссылки.
Определения терминов
Термин "композиция, содержащая X" означает "композицию, по существу, не содержащую Y", если в этой композиции содержание Х составляет, по крайней мере, 85% по общей массе Х+Y. Предпочтительно, чтобы в данной композиции Х составлял, по крайней мере, около 90% по общей массе X+Y, а более предпочтительно, по крайней мере, 95% или даже 99% масс.
Термин "содержащий" означает "включающий", а также "состоящий", например, композиция, "содержащая" X, может состоять исключительно из X, либо она, помимо X, может содержать еще какой-либо компонент, такой как X+Y.
Термин "антигенная детерминанта" означает В-клеточные эпитопы и Т-клеточные эпитопы.
Термин "гетерологичный" относится к двум биологическим компонентам, которые вместе в природе не обнаружены. Этими компонентами могут быть клетки-хозяева, гены или регуляторные области, такие как промоторы. Хотя эти гетерологичные компоненты в сочетании друг с другом в природе не обнаруживаются, однако, они могут функционировать вместе в случае, когда к этому гену функционально присоединен промотор, гетерологичный данному гену. В другом примере последовательность Neisseriae является гетерологичной последовательности мышиных клеток-хозяев. Другими примерами могут служить два эпитопа от одинаковых или различных белков, которые были ассоциированы в один белок с образованием структуры, не обнаруживаемой в природе.
Термин "сайт инициации репликации" означает полинуклеотидную последовательность, которая инициирует и регулирует репликацию полинуклеотидов, такую как экспрессирующий вектор. Сайт инициации репликации ведет себя как автономная единица репликации полинуклеотидов в клетке, способной реплицироваться под своим собственным контролем. Сайт инициации репликации может быть необходим вектору для его репликации в конкретной клетке-хозяине. С помощью некоторых сайтов инициации репликации экспрессирующий вектор может быть репродуцирован с большим числом копий в присутствии соответствующих белков в этой клетке. Примерами сайтов инициации репликации могут служить автономно реплицирующиеся последовательности, которые являются эффективными в дрожжах; и вирусный Т-антиген, эффективный в клетках COS-7.
Экспрессирующие системы
Нуклеотидные последовательности Neisseriae могут быть экспрессированы в ряде различных экспрессирующих систем; например, такими экспрессирующими системами являются клетки млекопитающих, бакуловирусы, растения, бактерии и дрожжи.
i. Системы млекопитающих
Экспрессирующие системы млекопитающих хорошо известны специалистам. Промотором млекопитающих является любая ДНК-последовательность, способная связываться с РНК-полимеразой млекопитающих и инициировать прямую транскрипцию (в направлении 5'→3') кодирующей последовательности (например, структурного гена) с образованием мРНК. Промотор может иметь сайт инициации транскрипции, который обычно расположен с 5'-конца от кодирующей последовательности, и ТАТА-бокс, который обычно расположен на 25-30 пар оснований (п.о.), выше (в направлении 5'→3') от сайта инициации транскрипции. ТАТА-бокс, очевидно, ориентирует РНК-полимеразу II для инициации синтеза РНК в нужном сайте. Промотор млекопитающих может также содержать расположенный выше промоторный элемент, обычно локализованный в области 100-200 п.н., расположенной выше ТАТА-бокса. Локализованный выше промоторный элемент определяет степень инициации транскрипции и может действовать в любой ориентации [Sambrook et al. (1989), "Expression of Cloned Genes in Mammalian Cells." In Molecular Cloning: A laboratory Manual, 2 nd ed.].
Вирусные гены млекопитающих часто являются высокоэкспрессируемыми и имеют широкий круг хозяев; поэтому последовательности, содержащие вирусные гены млекопитающих, имеют особенно ценные промоторные последовательности. Примерами таких последовательностей являются: ранний промотор SV40, промотор LTR вируса опухоли молочной железы мыши, главный поздний промотор аденовируса (Ad MLP) и промотор вируса простого герпеса. Кроме того, последовательности, происходящие от невирусных генов, таких как ген металлотеионеина мыши, также имеют ценные промоторные последовательности. Экспрессия может быть конститутивной или регулируемой (индуцибельной) в зависимости от промотора, который может быть индуцирован глюкокортикоидом в восприимчивых к гормону клетках.
Присутствие энхансерного элемента (энхансера), объединенного с промоторными элементами, описанными выше, обычно способствует увеличению уровней экспрессии. Энхансер представляет собой регуляторную ДНК-последовательность, которая при присоединении к гомологичным или гетерологичным промоторам может стимулировать транскрипцию вплоть до в 1000 раз, при этом синтез инициируется в нормальном старт-сайте РНК. Энхансеры также являются активными в том случае, если они расположены выше или ниже от сайта инициации транскрипции, либо в нормальной или во флип-ориентации, либо на расстоянии более чем 1000 нуклеотидов от промотора [Maniatis et al. (1987) Science 236:1237; Alberts et al. (1989) Molecular Biology of the Cell, 2nd ed.]. Энхансерные элементы, происходящие от вирусов, могут быть особенно ценными, поскольку они обычно имеют более широкий круг хозяев. Примерами таких энхансерных элементов являются энхансер раннего гена SV40 [Dijkema et al. (1985) EMBO J. 4:761] и энхансеры/промоторы, происходящие от длинного концевого повтора (LTR) вируса саркомы Рауса [German et al., (1982b) Proc. Natl. Acad. Sci. 79:6777] и от цитомегаловируса человека [Boshart et ai., (1985) Cell 41:521]. Помимо этого, некоторые энхансеры являются регулируемыми и становятся активными только в присутствии индуктора, такого как гормон или ион металла [Sassone-Corsi and Borelli (1986) Trends Genet. 2:215; Maniatis et al., (1987) Science 236:12371].
ДНК-молекула может быть экспрессирована в клетках млекопитающих. Промоторная последовательность может быть непосредственно присоединена к ДНК-молекуле; причем в этом случае, первая аминокислота у N-конца рекомбинантного белка всегда является метионином, который кодируется старт-кодоном ATG. Если это необходимо, то N-конец может быть отщеплен от белка путем in vitro-инкубирования с бромистым цианом.
Альтернативно, чужеродные белки могут быть также секретированы из клетки в культуральную среду путем создания химерных ДНК-молекул, кодирующих гибридный белок, который состоит из фрагмента лидерной последовательности, обеспечивающий секрецию чужеродного белка в клетках млекопитающих. При этом предпочтительно, чтобы присутствовали сайты процессинга, локализованные между фрагментом лидерной последовательности и чужеродным геном, которые могут быть расщеплены либо in vivo, либо in vitro. Фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые обеспечивают направленную секрецию белка из клетки. Примером лидерной последовательности, которая обеспечивает секрецию чужеродного белка в клетках млекопитающих, является трехкомпонентная лидерная последовательность аденовируса.
Обычно, последовательностями терминации транскрипции и последовательностями полиаденилирования, распознаваемыми клетками млекопитающих, являются регуляторные области, расположенные с 3'-конца от кодона терминации трансляции, и, таким образом, эти области, взятые вместе с промоторными элементами, фланкируют кодирующую последовательность. 3'-Конец зрелой мРНК образуется благодаря сайт-специфическому посттранскрипционному расщеплению и полиаденилированию [Birnstiel et al., (1985) Cell, 41:349; Proudfoot & Whitelaw (1988) "Termination and 3' end processing of eukaryotic RNA" в Transcription and. splicing (ed. B.D.Hames & D.M.Glover); Proudfoot (1989) Trends Biochem. Sci. 14:105). Эти последовательности обеспечивают направленную транскрипцию мРНК, которая может транслироваться с образованием полипептида, кодируемого ДНК. Примерами сигналов терминации транскрипции/полиаденилирования являются сигналы, происходящие от SV40 [Sambrook et al. (1989), "Expression of cloned genes in cultured mammalian cells." In Molecular Cloning: A Laboratory Manual].
Обычно, вышеуказанные компоненты, содержащие промотор, сигнал полиаденилирования и последовательность терминации транскрипции, помещают вместе в экспрессирующие конструкции. Если необходимо, то в экспрессирующую конструкцию могут быть также введены энхансеры, интроны с донорными и акцепторными сайтами функционального сплайсинга и лидерные последовательности. Экспрессирующие конструкции часто встраивают в репликон, такой как внехромосомный элемент (например, плазмида), который может стабильно поддерживаться в хозяине, таком как клетки млекопитающих или бактерии. Системами репликации млекопитающих являются системы, происходящие от вирусов животных, для репликации которых требуются трансдействующие факторы. Так, например, плазмиды, содержащие системы репликации паповавирусов, таких как SV40 [Gluzman (1981) Cell, 23:175] или полиомавирусов, реплицируются с чрезвычайно высоким числом копий в присутствии соответствующего вирусного Т-антигена. Другими примерами репликонов млекопитающих являются репликоны, происходящие от коровьих папиломавирусов и вируса Эпштейна-Барра. Кроме того, этот репликон может иметь две системы репликации, что позволяет его использовать, например, для экспрессии в клетках млекопитающих и для клонирования и амплификации в прокариотическом хозяине. Примерами таких челночных векторов, происходящих от млекопитающего и от бактерии, являются рМТ2 [Kaufman et al. (1989) Mol. Cell. Biol. 9:946] и рНЕВО [Shimizu et al. (1986) Mol. Cell. Biol. 6:1074].
Используемый способ трансформации зависит от трансформируемого хозяина. Методы введения гетерологичных полинуклеотидов в клетки млекопитающих известны специалистам, и такими методами являются декстран-опосредованная трансфекция, преципитация фосфатом кальция, полибрен-опосредованная трансфекция, слияние протопластов, электропорация, инкапсулирование полинуклеотида(ов) в липосомы и непосредственное микроинъецирование ДНК в ядра клеток.
Клетки млекопитающих, пригодных для их использования в качестве хозяев, известны специалистам, и такими клетками являются многие иммортализованные линии клеток, депонированные в Американской коллекции типовых культур (АТСС), включая, но не ограничиваясь ими, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки детеныша хомяка (ВНК), клетки почек обезьян (COS), клетки гепатоцеллюлярной карциномы человека (например, Нер G2) и ряд других клеточных линий.
(ii) Бакуловирусные системы
Полинуклеотид, кодирующий белок, может быть также встроен в подходящий экспрессирующий вектор насекомого и функционально присоединен к регуляторному элементу, присутствующему в этом векторе. При конструировании вектора используют известные методы. В основном, компонентами экспрессирующей системы являются вектор переноса, обычно, бактериальная плазмида, которая содержит как фрагмент бакуловирусного генома, так и стандартный сайт рестрикции для встраивания гетерологичного гена или генов, предназначенных для экспрессии; бакуловирус дикого типа, имеющий последовательность, гомологичную бакуловирус-специфическому фрагменту в векторе переноса (что позволяет осуществлять гомологичную рекомбинацию гетерологичного гена в бакуловирусном геноме); а также подходящие клетки-хозяева насекомых и среда для культивирования.
После встраивания ДНК-последовательности, кодирующей белок, в вектор переноса этот вектор и вирусный геном дикого типа трансфецируют в клетки-хозяева насекомых, где указанный вектор и вирусный геном подвергаются рекомбинации. Упакованный рекомбинантный вирус экспрессируется, после чего рекомбинантные бляшки идентифицируют и очищают. Материалы и методы для экспрессирующих систем "бакуловирус/клетка насекомого" являются коммерчески доступными в виде набора, поставляемого, среди прочих, фирмой Invitrogen, San Diego CA (набор "МахВас"). Эти методы известны специалистам и подробно описаны в работе Summers & Smith, Texas Agricultural Experiment Station Bulletin No 1555 (1987) (цитируемой далее как "Summers & Smith").
Перед встраиванием ДНК-последовательности, кодирующей белок, в бакуловирусный геном вышеописанные компоненты, включающие промотор, лидерную последовательность (если это необходимо), нужную кодирующую последовательность и последовательность терминации транскрипции, обычно объединяют с получением промежуточной конструкции для замены генов (вектор переноса). Эта конструкция может содержать один ген и функционально присоединенные регуляторные элементы; множество генов, каждый из которых имеет свой собственный набор функционально присоединенных регуляторных элементов; или множество генов, регулируемых тем же самым набором регуляторных элементов. Промежуточные конструкции для замены генов часто встраиваются в репликон, такой как внехромосомный элемент (например, плазмиды), способный стабильно поддерживаться в хозяине, таком как бактерия. Этот репликон имеет систему репликации, которая позволяет его использовать для клонирования и амплификации в подходящем хозяине.
В настоящее время, вектором переноса, наиболее часто используемым для введения чужеродных генов в AcNPV, является рАс373. Может быть также использовано множество других векторов, известных специалистам. Такими векторами, являются например, pVL985 (который заменяет полиэдриновый старт-кодон ATG на АТТ, и который вводит BamHI-сайт клонирования в положение, находящееся на 32 пары оснований ниже кодона АТТ; см., Luckow & Summers, Virology (1989) 17:31.
Эта плазмида, обычно, также содержит полиэдриновый сигнал полиаденилирования (Miller et al. (1988) Ann. Rev. Microbiol. 42:177), и прокариотический ген резистентности к ампициллину (amp) и сайт инициации репликации для осуществления отбора и размножения в E.coli.
Бакуловирусные векторы переноса обычно содержат бакуловирусный промотор. Бакуловирусный промотор представляет собой любую ДНК-последовательность, способную связываться с бакуловирусной РНК-полимеразой и инициировать транскрипцию кодирующей последовательности (например, структурного гена) в прямом направлении (5'→3') с образованием мРНК. Промотор может иметь область инициации транскрипции, которая обычно находится с 5'-конца от кодирующей последовательности. Эта область инициации транскрипции обычно включает сайт связывания с РНК-полимеразой и сайт инициации транскрипции. Бакуловирусный вектор переноса может также иметь второй домен, называемый энхансером, который, если он присутствует, обычно расположен далеко от структурного гена. Экспрессия может быть либо регулируемой, либо конститутивной.
Структурные гены, которые в избытке транскрибируются в заключительных стадиях инфекционного цикла вируса, имеют особенно ценные промоторные последовательности. Примерами таких последовательностей являются последовательности, происходящие от гена, кодирующего вирусный белок полиэдрон, Friesen et al. (1986) "The Regulation of Baculovirus Gene Expression", в "The Molecular Biology of Baculoviruses" (ed. Walter Doerfler); EPO Publ. Nos. 127839 and 155476; и гена, кодирующего белок р10, Vlak et al. (1988), J. Gen. Virol. 69:765.
ДНК, кодирующая подходящие сигнальные последовательности, может происходить из генов, кодирующих секретируемые белки насекомых или бакуловирусов, таких как бакуловирусный ген полиэдрина (Carbonell et al. (1988) Gene, 73:409). Альтернативно, поскольку сигналы для посттрансляционной модификации в клетках млекопитающих (таких как отщепление сигнального пептида, протеолитическое отщепление и фосфорилирование), очевидно, распознаются клетками насекомых, а сигналы, необходимые для секреции и аккумуляции в ядрах, очевидно, также являются консервативными для клеток беспозвоночных и позвоночных, то для обеспечения секреции в клетках насекомых могут быть также использованы лидерные последовательности, не происходящие от насекомых, такие как последовательности, происходящие от генов, кодирующих α-интерферон человека, Maeda et al. (1985), Nature 315:592; гастрин-высвобождающий пептид человека, Lebacq-Verheyden et al. (1988), Molec. Cell. Biol. 8:3129; IL-2 человека. Smith et al. (1985) Proc. Natl. Acad. Sci. USA, 82:8404; IL-3 мыши (Miyajima et al. (1987) Gene 58:273;и глюкоцереброзидазу человека, Martin et al. (1988) DNA, 7:99.
Рекомбинантный полипептид или полипротеин могут экспрессироваться внутриклеточно, либо, если они экспрессируются с подходящими регуляторными последовательностями, они могут быть секретированы. Для хорошей внутриклеточной экспрессии негибридных чужеродных белков, обычно, требуется присутствие гетерологичных генов, которые, в идеальном случае, имеют короткую лидерную последовательность, содержащую подходящие сигналы инициации трансляции перед старт-сигналом ATG. Если это необходимо, то метионин у N-конца может быть отщеплен от зрелого белка путем in vifcro-инкубирования с бромцианом.
Альтернативно, рекомбинантные полипротеины или белки, которые не секретируются в природных условиях, могут быть секретированы из клеток насекомых путем создания химерных ДНК-молекул, кодирующих гибридный белок, состоящий из фрагмента лидерной последовательности, которая обеспечивает секрецию чужеродного белка у насекомых. Фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые способствуют транспорту белка в эндоплазматический ретикулум.
После введения ДНК-последовательности и/или гена, кодирующего предшественник продукта экспрессии белка, клетка-хозяин насекомого ко-трансформируется гетерологичной ДНК вектора переноса и геномной ДНК бакуловируса дикого типа, обычно, посредством ко-трансфекции. Промоторная последовательность и последовательность терминации транскрипции этой конструкции обычно содержит 2-5 т.п.н.-область генома бакуловируса. Методы встраивания гетерологичной ДНК в нужный сайт бакуловируса известны специалистам (см. Summers & Smith, см. выше; Ju et al. (1987); Smith et al., Mol. Cell. Biol. (1983) 3:2156; и Luckow & Summers (1989)). Например, такая инсерция может быть введена в ген, такой как ген полиэдрина, путем гомологичной рекомбинации посредством двойного кроссинговера; эта инсерция может быть также введена в рестрикционный сайт, сконструированный в нужном бакуловирусном гене. Miller et al. (1989), Bioassays 4:91. ДНК-последовательность, при ее клонировании в экспрессирующий вектор вместо гена полиэдрина, фланкирована по обоим 5'- и 3'-концам полиэдрин-специфическими последовательностями и расположена ниже промотора полиэдрина.
Затем, вновь сконструированный бакуловирусный экспрессирующий вектор упаковывают в инфекционный рекомбинантный бакуловирус. Гомологичная рекомбинация происходит при низкой частоте (в пределах от около 1% до около 5%), а поэтому большинство вирусов, продуцированных после ко-трансфекции, все еще являются вирусами дикого типа. Следовательно, необходимо разработать метод для идентификации рекомбинантных вирусов. Преимущество данной экспрессирующей системы заключается в том, что она позволяет идентифицировать рекомбинантные вирусы методом визуального скрининга. Белок полиэдрина, продуцируемый нативным вирусом, продуцируется в ядрах инфецированных клеток в очень больших количествах на последних стадиях после инфекционного цикла вируса. Аккумулированный белок полиэдрина образует тельца включения, которые также содержат встроенные частицы. Эти тельца включения размером вплоть до 15 мкм, обладают в высокой степени преломляющими свойствами, что придает им блестящий яркий цвет, который легко визуализируется с помощью оптического микроскопа. Клетки, инфецированные рекомбинантными вирусами, не обнаруживают телец включения. Для дифференциации рекомбинантного вируса от вируса дикого типа, трансфекционный супернатант наносят пятнами на монослой клеток насекомых с помощью техники, известной специалистам. А именно, бляшки скринируют с помощью оптического микроскопа на присутствие (указывающее на вирус дикого типа) или отсутствие (указывающее на рекомбинантный вирус) телец включения. "Current Protocols in Microbiology" Vol.2 (Ausubel et al., eds) at 16,8 (Supp.10, 1990); Summers and Smith, см. выше; Miller et al. (1989).
Рекомбинантные бакуловирусные экспрессирующие векторы были сконструированы для инфицирования некоторых клеток насекомых. Например, рекомбинантные бакуловирусы были сконструированы, помимо прочего, для: Aedes aegypti, Autographa californica, Bombyx mori, Drosophila melanogaster, Spodoptera frugiperda и Trichoplusia ni (WO 89/046699; Carbonell et al. (1985) J. Virol. 56:153; Wright (1986) Nature 321:718; Smith et al. (1983) Mol. Cell. Biol. 3:2156; и, в общих чертах, см. Fraser et al. (1989) In Vitro Cell. Dev. Biol. 25:225).
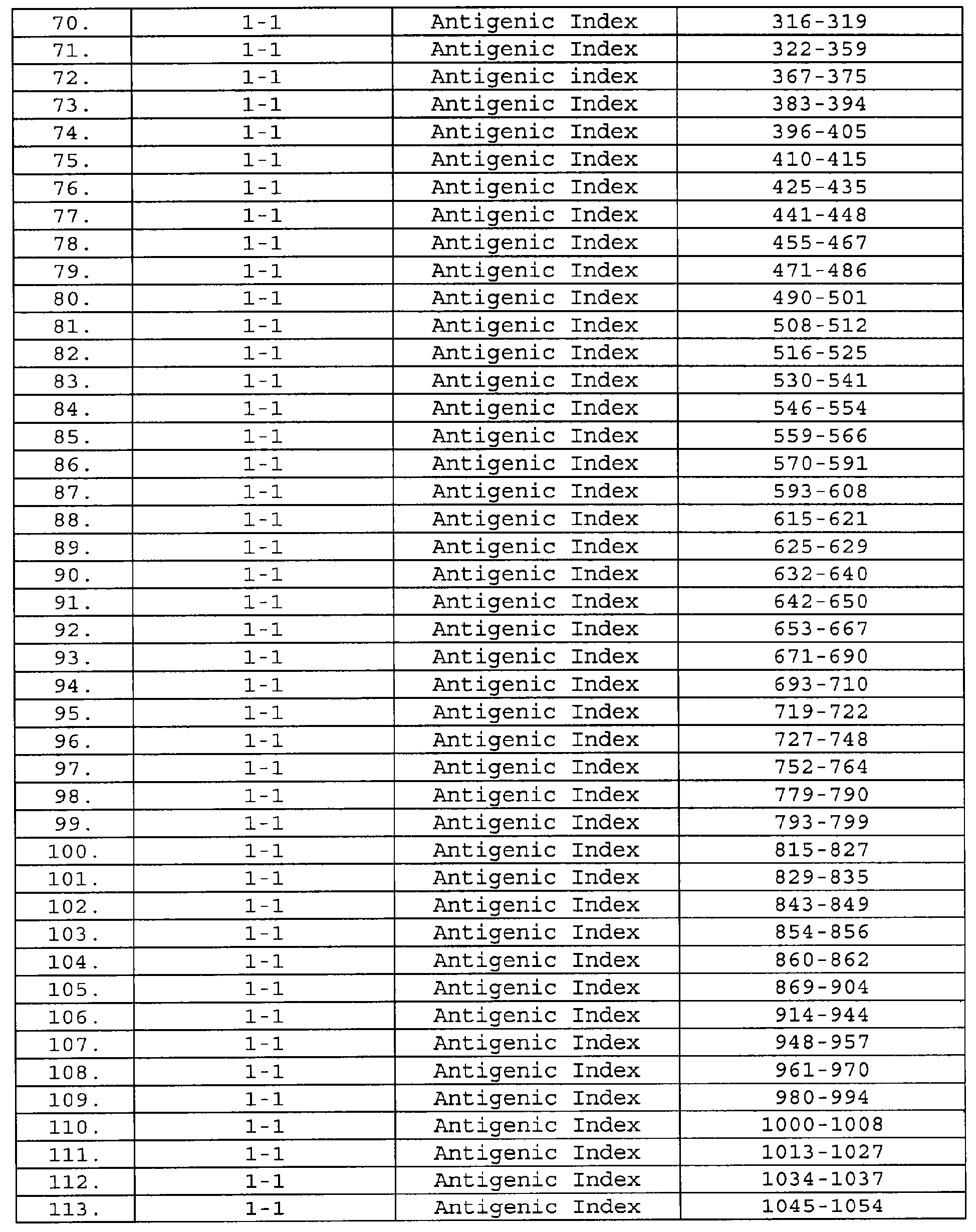
Клетки и среды для культивирования клеток являются коммерчески доступными материалами, используемыми для прямой экспрессии и экспрессии гетерологичных полипептидов в виде гибридов в бакуловирусных/экспрессионных системах; метод культивирования клеток, в основном, известен специалистам. См., например, Summers & Smith, см. выше.
Затем, модифицированные клетки насекомых могут быть культивированы в соответствующей питательной среде, которая обеспечивает стабильность плазмиды (плазмид), присутствующей в модифицированном насекомом-хозяине. Если ген экспрессируемого продукта находится под индуцибельным контролем, то клетки-хозяева могут быть культивированы до высокой плотности и экспрессия является индуцируемой. Альтернативно, если экспрессия является конститутивной, то данный продукт будет непрерывно экспрессироваться в среду, а поэтому питательная среда должна непрерывно циркулировать с удалением нужного продукта и с истощением питательных веществ. Этот продукт может быть очищен с помощью такой техники, как хроматография, например, ВЭЖХ, аффинная хроматография, ионообменная хроматография и т.п.; электрофорез; центрифугирование в градиенте плотности; экстракция растворителем или т.п. При необходимости, этот продукт может быть дополнительно очищен, например, для удаления, по существу, любых белков насекомых, которые также секретируются в этой среде или высвобождаются в нее в результате лизиса клеток насекомых, с получением, в итоге, продукта, который не содержит, по крайней мере, значительного количества клеточного дебриса хозяина, например белков, липидов и полисахаридов.
Для получения экспрессии белка рекомбинантные клетки-хозяева, происходящие от трансформантов, инкубируют в условиях, которые позволяют осуществлять экспрессию последовательности, кодирующей рекомбинантный белок. Эти условия могут варьироваться в зависимости от выбранной клетки-хозяина. Однако эти условия легко могут быть установлены каждым специалистом на основе имеющегося опыта.
iii. Растительные системы
Существует множество растительных клеточных культур и цельных систем для экспрессии генов в растениях. Примерами систем для экспрессии генов в клетках растений являются системы, описанные в патентах, таких как патенты США №5693506; 5659122 и 5608143. Другие примеры экспрессии генов в клеточных культурах растений описаны Zenk, Phytochemistry 30: 3861-3863 (1991). Описания сигнальных пептидов растительных белков можно найти, кроме того, в работах, указанных выше, Vaulcombe et al., Mol. Gen. Genet. 209:33-40 (1987); Chandler et al., Plant Molecular Biology 3:407-418 (1984); Rogers, J. Biol. Chem. 260:3731-3738 (1985); Rothstein et al., Gene 55:353-356 (1987); Whittier et al., Nucleic Acids Research 15:2515-2535 (1987); Wirsel et al., Molecular Microbiology 3:3-14 (1989); Yu et al., Gene 122:247-253 (1992). Описание регуляции экспрессии генов растений под действием фитогормона, гибберелловой кислоты и секретированных ферментов, индуцированных гибберелловой кислотой, можно найти в работах R.L.Jones and J.MacMillin, Gibberellins, в Advanced Plant Physiology, Malcolm B.Wilkins, ed., 1984 Pitman Publishing Limited, London, pp.21-52. Описание других метаболически регулируемых генов можно найти в работах: Sheen, Plant Cell, 2:1027-1038 (1990); Maas et al., EMBO J. 9:3447-3452 (1990); Benkel & Hickey, Proc. Natl. Acad. Sci. 84:1337-1339 (1987).
Обычно, с использованием техники, известной специалистам, нужную полинуклеотидную последовательность встраивают в экспрессирующий кластер, содержащий генные регуляторные элементы, сконструированные для проведения манипуляций в растениях. Этот экспрессирующий кластер встраивают в нужный экспрессирующий вектор вместе с сопровождающими последовательностями, расположенными выше и ниже от экспрессирующего кластера, подходящего для экспрессии в растительной клетке-хозяине. Эти сопровождающие последовательности происходят от плазмиды или вируса и наделяют вектор необходимыми свойствами, позволяющими переносить ДНК из первоначального клонирующего хозяина, такого как бактерия, в нужную растительную клетку-хозяина. Предпочтительно, чтобы основная конструкция бактериального/растительного вектора имела сайт инициации репликации для широкого круга хозяев-прокариотов; селектиуемый маркер прокариота; а для трансформации Agrobacterium, Т-ДНК-последовательности для Agrobacterium-опосредованного переноса в хромосомы растения. Если гетерологичный ген трудно поддается обнаружению, то предпочтительно, чтобы эта конструкция также содержала селектируемый маркерный ген, который позволил бы определить, является ли растительная клетка трансформированной. Общий обзор подходящих маркеров, например, для членов семейства злаковых, можно найти у Wilmink & Dons, 1993, Plant Mol. Blol. Reptr, 11(2):165-185.
Рекомендуется также использовать последовательности, позволяющие интегрировать гетерологичную последовательность в геном растения. Такими последовательностями могут быть последовательности транспозона и т.п. для гомологичной рекомбинации, а также Ti-последовательности, которые позволяют осуществлять случайное встраивание экспрессирующего кластера гетерологичных последовательностей в геном растения. Подходящими прокариотическими селективными маркерами являются последовательности резистентности к антибиотикам, таким как ампициллин или тетрациклин. В векторе могут также присутствовать другие ДНК-последовательности, кодирующие дополнительные функциональные элементы и хорошо известные специалистам.
Молекулы нуклеиновых кислот настоящего изобретения могут быть включены в экспрессирующий кластер для экспрессии нужного(ных) белка(ов). В основном, используют лишь один экспрессирующий кластер, хотя, в некоторых случаях, могут быть использованы два или более кластеров. Помимо последовательности, кодирующей гетерологичный белок, рекомбинантный экспрессирующий кластер содержит следующие элементы: промоторную область; 5'-нетранслируемые последовательности растения; старт-кодон, в зависимости от того, имеет ли структурный ген этот кодон или нет; и последовательность терминации транскрипции и трансляции. Присутствие уникальных сайтов рестрикции на 5'- и 3'-концах этого кластера позволяют легко осуществлять встраивание в уже имеющийся вектор.
Гетерологичная кодирующая последовательность может быть получена для любого белка, имеющего отношение к настоящему изобретению. Последовательность, кодирующая нужный белок, будет кодировать сигнальный пептид, который обеспечивает процессинг и транслокацию белка, если это необходимо, и, как правило, не будет содержать какой-либо последовательности, которая может приводить к связыванию нужного белка настоящего изобретения с мембраной. Поскольку, по большей части, область инициации транскрипции предназначена для гена, который экспрессируется и транслоцируется во время прорастания семян, то благодаря использованию сигнального пептида, который обеспечивает транслокацию, можно также индуцировать транслокацию нужного белка. Таким образом, нужный белок (или белки) будет транспортирован из клеток, в которых он был экспрессирован, и может быть с успехом выделен. Обычно, секреция в семенах растения происходит через алейроновый слой или эпителиальный слой щитка в эндосперм семени. Хотя секреция белка из клеток, в которых этот белок был продуцирован, не является необходимой, однако она облегчает выделение и очистку рекомбинантного белка.
Поскольку окончательная экспрессия нужного генного продукта будет происходить в эукариотической клетке, то желательно определить, содержит ли какая-либо часть клонированного гена последовательности, которые будут вырезаться как интроны под действием сплайсингосомного аппарата клетки. Если это так, то для предупреждения потери части генетической информации в виде ложного интронного кода может быть проведен сайт-направленный мутагенез "интронной" области. Reed & Maniatis, Cell, 41:95-105, 1985.
Для механического переноса рекомбинантной ДНК данный вектор может быть непосредственно введен в растительные клетки путем микроинъецирования с использованием микропипеток. Crossway, Mol. Gen. Genet. 202:179-185, 1985. Генетический материал может быть также перенесен в растительную клетку с использованием полиэтиленгликоля; Krens et al., Nature, 296, 72-74, 1982. Другим методом введения сегментов нуклеиновых кислот является высокоскоростной баллистический метод с использованием мелких частиц с нуклеиновой кислотой, находящейся либо в матрице мелких гранул или частиц, либо на их поверхности; см. Klein et al., Nature, 327, 70-73, 1987 и Knudsen & Muller, 1991, Planta, 185:330-336, где описана бомбардировка эндосперма ячменя этими частицами для получения трансгенного ячменя. Другим методом введения генов является слияние протопластов с другими частицами, либо миниклетками, клетками, липосомами, либо другими поддающимися слиянию тельцами с липидами на поверхности, Fraley et al., Proc. Natl. Acad. Sci., USA, 79, 1859-1863, 1982.
Этот вектор может быть также введен в клетки растений путем электропорации (Fromm et al., Proc. Natl. Acad. Sci., USA, 82:5824, 1985). В этом методе, протопласты растения подвергают электропорации в присутствии плазмид, содержащих генную конструкцию. Электрические импульсы поля высокого напряжения делают мембраны обратимо проницаемыми, что позволяет вводить через них плазмиды. Протопласты растений, подвергнутые электропорации, снова создают клеточную стенку, делятся и образуют растительные каллюсы.
Все растения, из которых протопласты могут быть выделены и культивированы с получением целых регенерированных растений, могут быть трансформированы методами настоящего изобретения с получением целых растений, содержащих перенесенный ген. Известно, что практически все растения могут быть регенерированы из культивированных клеток или тканей, включая, но не ограничиваясь ими: все основные виды сахарного тростника, сахарную свеклу, хлопчатник, плодовые и другие деревья, бобовые и овощные культуры. Некоторыми подходящими растениями являются, например, виды растений рода Fragaria, Lotus, Medicago, Onobrychis, Trifolium, Trigonella, Vigna, Citrus, Linum, Geranium, Manihot, Daucus, Arabidopsis, Brassica, Raphanus, Sinapis, Atropa, Capsicum, Datura, Hyoscyamus, Lycopersion, Nicotiana, Solanum, Petunia, Digitalis, Majorana, Cichorium, Helianthus, Lactuca, Bromus, Asparagus, Antirrhinum, Hererocallis, Nemesia, Pelargonium, Panicum, Pennisetum, Ranunculus, Senecio, Salpiglossis, Cucumis, Browaalia, Glycine, Lolium, Zea, Trikicum, Sorghum и Datura.
Способы регенерации варьируются в зависимости от вида растения, но, обычно, сначала получают суспензию трансформированных протопластов, содержащих копии гетерологичных генов. Сначала формируется ткань каллюса, и из этого каллюса может быть индуцирован рост побегов, которые затем укореняются. Альтернативно, образование зародышей может быть индуцировано из суспензии протопластов. Эти зародыши прорастают как природные зародыши и из них образуются растения. Культуральные среды, в основном, содержат различные аминокислоты и гормоны, такие как ауксин и цитокины. В эту среду также предпочтительно добавить глутаминовую кислоту и пролин, особенно для таких видов растений, как кукуруза и люцерна. Побеги и корни обычно развиваются одновременно. Эффективная регенерация зависит от среды, генотипа и от развития культуры. При регулировании этих трех параметров, процесс регенерации может быть полностью воспроизводимым и повторяемым.
В некоторых системах культур растительных клеток, нужный белок настоящего изобретения может быть секретирован, или, альтернативно, этот белок может быть экстрагирован из целого растения. В случае, когда нужный белок настоящего изобретения секретируется в среду, он может быть собран. Альтернативно, половина семян с зародышами и половина семян без зародышей, или другие ткани растений могут быть механически разрушены с высвобождением любого белка, секретированного в межклеточную и межтканевую области. Эта смесь может быть суспендирована в буферном растворе с получением растворимых белков. Для очистки рекомбинантного белка могут быть затем использованы стандартные методы выделения и очистки белков. Для оптимизации экспрессии и выделения гетерологичного белка, такие параметры, как время, температура, рН, содержание кислорода и объем могут быть скорректированы рутинными методами.
iv. Бактериальные системы
Техника экспрессии в бактериях известна специалистам. Бактериальным промотором является любая ДНК-последовательность, способная связываться с бактериальной РНК-полимеразой и инициировать транскрипцию кодирующей последовательности (например, структурного гена) в направлении 5'→3' с образованием мРНК. Промотор имеет область инициации транскрипции, которая обычно локализована с 5'-конца по отношению к кодирующей последовательности. Эта область инициации транскрипции обычно включает сайт связывания с РНК-полимеразой и сайт инициации транскрипции. Бактериальный промотор может также иметь второй домен, называемый оператором, который может перекрываться со смежным сайтом связывания с РНК-полимеразой, в котором инициируется синтез РНК. Этот оператор позволяет осуществлять негативно регулируемую (индуцибельную) транскрипцию, поскольку белок-репрессор гена может связываться с оператором и, тем самым, подавлять транскрипцию специфического гена. Конститутивная экспрессия может происходить в отсутствие элементов негативной регуляции, таких как, оператор. Кроме того, позитивная регуляция может быть достигнута с помощью последовательности, связывающейся с белком-активатором гена, которая, если она присутствует, обычно расположена непосредственно с 5'-конца от последовательности связывания с РНК-полимеразой. Примером белка-активатора гена является белок-активатор катаболического гена (CAP), который способствует инициации транскрипции lac-оперона в Escherichia coli (E.coli) [Raibaud et al., (1984) Annu. Rev. Genet. 18:173]. Таким образом, регулируемая экспрессия может быть либо положительной, либо отрицательной, а следовательно, либо усиливающей, либо ослабляющей транскрипцию.
Последовательности, кодирующие ферменты пути метаболизма, имеют особенно ценные промоторные последовательности. В качестве примеров могут служить промоторные последовательности, происходящие от генов ферментов метаболизма сахаров, таких как галактоза, лактоза (lac) [Chang et al. (1977) Nature 198:1056] и мальтоза. В качестве других примеров могут служить промоторные последовательности, происходящие от генов ферментов биосинтеза, таких как триптофан (trp) [Goeddel et al. (1980) Nucl. Acids Res. 8:4047; Yelverton et al. (1981) Nucl. Acids Res. 9:731; патент США 4738921; EP-A-0036776 и ЕР-А-0121775]. Промоторные системы g-лактамазы (bla) [Weissmann (1981) "The clonning of interferon and other mistakes" в Interferon 3 (ed. I.Gresser)], бактериофага лямбда PL [Shimatake et al. (1981) Nature 292:128] и Т5 [патент США 4689406] также имеют пригодные промоторные последовательности.
Кроме того, не встречающиеся в природе синтетические промоторы также являются функциональными, как и бактериальные промоторы. Так, например, последовательности активации транскрипции одного бактериального или бактериофагового промотора могут быть присоединены к последовательностям оперона другого бактериального или бактериофагового промотора с образованием синтетического гибридного промотора [патент США 4551433]. Например, tac-промотор представляет собой гибридный trp-lac-промотор, который состоит из последовательностей trp-промотора и lac-оперона и регулируется lac-репрессором [Amann et al. (1983) Gene 25:167; de Boer et al. (1983) Proc. Natl. Acad. Sci. 80:21]. Кроме того, бактериальным промотором могут быть природные промоторы, не происходящие от бактерий и обладающие способностью связываться с бактериальной РНК-полимеразой и инициировать транскрипцию. Такой природный не происходящий от бактерии промотор может также связываться с совместимой РНК-полимеразой с продуцированием высоких уровней экспрессии некоторых генов в прокариотах. Примером сопряженной промоторной системы является система "РНК-полимераза/промотор бактериофага Т7" [Studier et al. (1986) J. Mol. Biol. 189:113; Tabor et al. (1985) Proc. Natl. Acad. Sci. 82:1074]. Кроме того, гибридный промотор может также состоять из бактериофагового промотора и области оператора Е.coli (ЕРО-А-0267851).
Помимо функционирующей промоторной последовательности, для экспрессии чужеродных генов в прокариотах может быть также использован эффективный сайт связывания с рибосомой. В Е.coli такой сайт связывания с рибосомой называют последовательностью Шайна-Дальгарно (SD), и этот сайт включает инициирующий кодон (ATG) и последовательность длиной в 3-9 нуклеотидов, расположенную на 3-11 нуклеотидов выше от инициирующего кодона [Shine et al. (1975) Nature 254:34]. Очевидно, последовательность SD стимулирует связывание мРНК с рибосомой путем спаривания оснований между последовательностью SD и 3'-концом и рРНК Е.coli 16S [Steitz et al. (1979) "Genetic signals and nucleotide sequences in messenger RNA" в Biologocal Regulation and Development: Gene Expression (ed. R.F.Goldberger)]. Экспрессия эукариотических генов и прокариотических генов со слабым сайтом связывания с рибосомой описана Sambrook et al. (1989) в "Expression of Cloned Genes in Escherichia coli", Molecular Cloning: A Laboratory Manual].
ДНК-молекула может быть экспрессирована внутриклеточно. Промоторная последовательность может быть непосредственно присоединена к ДНК-молекуле, где первой аминокислотой у N-конца всегда является метионин, который кодируется старт-кодоном ATG. Если это необходимо, то метионин у N-конца может быть отщеплен от белка путем in vitro-инкубирования с бромцианом, либо путем in vivo- или in vitro-инкубирования с бактериальной пептидазой, отщепляющий N-концевой метионин (ЕРО-А-0219237).
Гибридные белки представляют собой альтернативу прямой экспрессии. Обычно, ДНК-последовательность, кодирующую N-концевую часть эндогенного бактериального белка или другого стабильного белка, гибридизуют с 5'-концом гетерологичных кодирующих последовательностей. После экспрессии получают конструкцию гибридов двух слитых аминокислотных последовательностей. Так, например, ген клетки бактериофага лямбда может быть присоединен у 5'-конца чужеродного гена и экспрессирован в бактерии. Полученный гибридный белок предпочтительно сохраняет сайт для процессирующего фермента (фактора Ха) для отщепления бактериофагового белка от чужеродного гена [Nagai et al. (1984) Nature 309:810]. Могут быть также получены гибридные белки с использованием последовательностей генов lacZ [Jia et al. (1987) Gene 60:197], trpE [Allen et al. (1987) J. Biotechnol. 5:93; Makoff et al. (1989) J. Gen. Microbiol., 135:11] и Chey [EP-A-0324647]. ДНК-последовательность на стыке двух аминокислотных последовательностей может кодировать, а может и не кодировать сайт отщепления. Другим примером может служить гибридный белок убихитина. Этот гибридный белок получают с использованием убихитиновой области, которая предпочтительно сохраняет сайт для процессирующего фермента (например, убихитин-специфической процессирующей протеазы) для отщепления убихитина от чужеродного белка. С использованием этого метода может быть выделен нативный чужерожный белок [Miller et al. (1989) Bio/Technology 7:698].
Альтернативно, чужеродные белки могут быть также секретированы из клетки путем создания химерных ДНК-молекул, которые кодируют гибридный белок, состоящий из фрагмента сигнальной пептидной последовательности, способствующей секреции чужеродного белка в бактерии [патент США 4336336]. Этот фрагмент сигнальной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые направляют секрецию белка из клетки. Этот белок либо секретируется в культуральную среду (грамположительных бактерий), либо в периплазматическое пространство, расположенное между внутренней и внешней мембраной клетки (грамотрицательных бактерий). При этом предпочтительно, если имеются сайты процессинга, которые могут быть расщеплены либо in vivo, либо in vitro, и которые расположены между фрагментом сигнального пептида и чужеродным геном.
ДНК, кодирующая подходящие сигнальные последовательности, может быть получена от генов, ответственных за секрецию бактериальных белков, таких как ген белка внешней мембраны E.coli (ompA) [Masui et al. (1983), в Experimental Manipulation of Gene Expression; Ghrayeb et al. (1984) EMBO J., 3:2437] и сигнальной последовательности щелочной фосфатазы Е.coli (phoA) [Oka et al. (1985) Proc. Natl. Acad. Sci., 82:7212]. В качестве дополнительного примера можно упомянуть, что для секреции гетерологичных белков от B.subtilis может быть использована сигнальная последовательность гена альфа-амилазы от различных штаммов Bacillus [Palva et al. (1982) Proc. Natl. Acad. Sci., USA, 79:5582; EP-A-0244042].
Обычно, последовательности терминации транскрипции, распознаваемые бактериями, представляют собой регуляторные области, локализованные с 3'-конца по отношению к стоп-кодону трансляции, и таким образом, вместе с промотором, они фланкируют кодирующую последовательность. Эти последовательности направляют транскрипцию мРНК, которая может быть транслирована в полипептид, кодированный данной ДНК. Последовательности терминации транскрипции часто включают ДНК-последовательности, состоящие приблизительно из 50 нуклеотидов, способные образовывать структуры ″петли на стебле″, которые способствуют терминации транскрипции. Примерами таких последовательностей являются последовательности терминации транскрипции, происходящие от генов с сильными промоторами, таких как ген trp в E.coli, a также других биосинтетических генов.
Обычно, вышеописанные компоненты, содержащие промотор, сигнальную последовательность (если это необходимо), нужную кодирующую последовательность и последовательность терминации транскрипции, взятые вместе, образуют экспрессионные конструкции. Эти экспрессионные конструкции часто вводят в репликон, такой как внехромосомный элемент (например, плазмиды), способный стабильно поддерживаться в хозяине, таком как бактерии. Этот репликон имеет систему репликации, которая позволяет ему присутствовать в прокариотическом хозяине либо для экспрессии, либо для клонирования и амплификации. Кроме того, репликон может быть либо высококопийной, либо низкокопийной плазмидой. Высококопийная плазмида обычно имеет число копий в пределах от около 5 до около 200, а, обычно, от около 10 до около 150. Хозяин, содержащий высококопийную плазмиду, предпочтительно содержит, по крайней мере, около 10, а более предпочтительно, по крайней мере, около 20 плазмид. В зависимости от влияния вектора и чужеродного белка на хозяина, могут быть выбраны либо высококопийный, либо низкокопийный вектор.
Альтернативно, экспрессирующие конструкции могут быть интегрированы в бактериальный геном при помощи интегрирующегося вектора. Интегрирующиеся векторы обычно содержат, по крайней мере, одну последовательность, гомологичную бактериальной хромосоме, что позволяет этому вектору интегрироваться. Интеграция, очевидно, происходит вследствие рекомбинаций между гомологичной ДНК в векторе и бактериальной хромосомой. Так, например, интегрирующиеся векторы, сконструированные с использованием ДНК от различных штаммов Bacillus, интегрируются в хромосому Bacillus (ЕР-А-0127328). Интегрирующиеся векторы также могут состоять из последовательностей бактериофага или транспозона.
Обычно, внехромосомные и интегрирующиеся экспрессионные конструкции могут содержать селективные маркеры, позволяющие проводить отбор трансформированных бактериальных штаммов. Селективные маркеры могут экспрессироваться в бактериальном хозяине и могут иметь гены, которые наделяют бактерии резистентностью к лекарственным средствам, таким как ампициллин, хлорамфеникол, эритромицин, канамицин (неомицин) и тетрациклин [Davies et al. (1978) Annu. Rev. Microbiol. 32:469]. Селективные маркеры могут также иметь гены биосинтеза, такие как гены, участвующие в пути биосинтеза гистидина, триптофана и лейцина.
Альтернативно, некоторые из вышеописанных компонентов вместе могут образовывать трансформирующие векторы. Трансформирующие векторы обычно состоят из селективного маркера, который либо присутствует в репликоне, либо формируется в интегрирующийся вектор, описанный выше.
Экспрессирующие и трансформирующие векторы, либо внехромосомные репликоны, либо интегрирующиеся векторы были сконструированы для трансформации в множество бактерий. Так например, экспрессирующие векторы были сконструированы, помимо прочего, для следующих бактерий: Bacillus subtilis [Palva et al. (1982) Proc. Natl. Acad. Sci. USA 79:5582; EP-A-0036259 и EP-A-0063953; WO 84/04541], Escherichia coli [Shimatake et al. (1981) Nature 292:128; Amann et al. (1985) Gene 40:183; Studier et al. (1986) J. Mol. Biol. 189:113; EP-A-0036776, EP-A-0136829 и ЕР-А-0136907], Streptococcus cremoris [Powell et al. (1988) Appl. Environ. Microbiol. 54:655]; Streptococcus lividans [Powell et al. (1988) Appl. Environ. Microbiol. 54:655], Streptomyces lividans [патент США №4745056].
Способы введения экзогенной ДНК в бактериального хозяина хорошо известны специалистам, и такими способами обычно является трансформация бактерий, обработанных либо CaCl2, либо другими агентами, такими как двухвалентные катионы и ДМСО. ДНК также может быть введена в бактериальные клетки путем электропорации. Способы трансформации обычно варьируются в зависимости от трансформируемых видов бактерий. См., например, [Masson et al. (1989) FEMS Microbiol. Lett. 60:273; Palva et al. (1982) Proc. Natl. Acad. Sci. USA 79:5582; EP-A-0036259 и ЕР-А-0063953; WO 84/04541, Bacillus], [Miller et al. (1988) Proc. Natl. Acad. Sci. 85:856; Wang et al. (1990) J. Bacteriol. 172:949, Campylobacter], [Cohen et al. (1973) Proc. Natl. Acad. Sci. 69:2110; Dower et al. (1988) Nucleic Acids Res. 16:6127; Kushner (1978) "An improved method for transformation of Escherichia coli with ColE1-derived plasmids. In Genetic Engineering: Proceedings of the International Symposium on Genetic Engineering (eds, H.W.Boyer and S.Nicosia); Mandel et al. (1970) J. Mol. Biol. 53:159; Taketo (1988) Biochem. Biophys, Acta 949:318; Escherichia], [Chassy et al. (1987) FEMS Microbiol. Lett. 44:173 Lactobacillus]; [Fiedler et al. (1988) Anal. Biochem 170:38, Pseudomonas]; [Augustin et al. (1990) FEMS Microbiol. Lett. 66:203, Staphylococcus], [Barany et al. (1980) J. Bacteriol. 144:698; Harlander (1987) "Transformation of Streptococcus lactis by electroporation, in: Streptococcal Genetics (ed. J.Ferretti & R.Curtiss III); Perry et al. (1981) Infect. Immun. 32:1295; Powell et al. (1988) Appl. Environ. Microbiol. 54:655; Somkuti et al. (1987) Proc. 4th Evr. Cong. Biotechnology 1:412, Streptococcus].
v. Экспрессия в дрожжах
Дрожжевые экспрессирующие системы также известны каждому специалисту. Дрожжевой промотор представляет собой любую ДНК-последовательность, способную связываться с дрожжевой РНК-полимеразой и инициировать транскрипцию кодирующей последовательности (например, структурного гена) в направлении 5'→3' с образованием мРНК. Промотор имеет область инициации транскрипции, которая обычно находится с 5'-конца от кодирующей последовательности. Эта область инициации транскрипции обычно включает сайт связывания с РНК-полимеразой ("ТАТА-бокс") и сайт инициации транскрипции. Дрожжевой промотор может также иметь второй домен, называемый вышерасположенной последовательностью-активатором (UAS), которая, если она присутствует, обычно находится на значительном расстоянии от структурного гена. UAS обеспечивает регулируемую (индуцибельную) экспрессию. Конститутивная экспрессия может происходить в отсутствие UAS. Регуляция экспрессии может быть либо позитивной, либо негативной, то есть она либо усиливает, либо ослабляет транскрипцию.
Дрожжи представляют собой ферментирующий микроорганизм с активным путем метаболизма, а поэтому последовательности, кодирующие ферменты пути метаболизма, представляют собой особенно ценные промоторные последовательности. Примерами таких ферментов являются алкоголь-дегидрогеназа (ADH) (ЕР-А-0284044), энолаза, глюкокиназа, глюкозо-6-фосфатизомераза, глицеральдегид-3-фосфат-дегидрогеназа (GAP или GAPDH), гексокиназа, фосфофруктокиназа, 3-фосфоглицератмутаза и пируваткиназа (РуК) (ЕРО-А-0329203). Дрожжевой ген РН05, кодирующий кислотную фосфатазу, также имеет ценные промоторные последовательности [Myanohara et al. (1983) Proc. Natl. Acad. Sci., USA, 80:1].
Кроме того, не встречающиеся в природе синтетические промоторы функционируют так же, как и дрожжевые промоторы. Так, например, последовательности UAS одного дрожжевого промотора могут быть присоединены к области активации транскрипции другого дрожжевого промотора, в результате чего образуется синтетический гибридный промотор. Примерами таких гибридных промоторов являются регуляторная последовательность ADH, присоединенная к области активации транскрипции GAP (патенты США №№4876197 и 4880734). Другими примерами гибридных промоторов являются промоторы, которые состоят из регуляторных последовательностей генов ADH2, GAL4, GAL10 или РН05, объединенных с областью активации транскрипции гена гликолитического фермента, такого как GAP или РуК (ЕР-А-0164556). Кроме того, дрожжевым промотором может быть природный промотор, не происходящий от дрожжей и обладающий способностью связываться с бактериальной РНК-полимеразой и инициировать транскрипцию. Примеры таких промоторов можно найти, помимо прочего, в работах Cohen et al. (1980) Proc. Natl. Acad. Sci. USA 77:1078; Henikoff et al., Nature 283:835; Hollenberg et al. (1981) Curr. Topics Microbiol. Immunol. 96:119; Hollenberg et al. (1979) "The Expression of Bacterial Antibiotic Resistance Genes in the Yeast Saccharomyces cerevisiae" в Plasmids of Medical, Environmental and Commercial Importance (eds. K.N.Timmis & A.Puhler); Mercerau-Puigalon et al. (1980) Gene 11:163; Panthier et al. (1980) Curr. Genet. 2:109].
ДНК-молекула может быть экспрессирована в дрожжевых клетках. Промоторная последовательность может быть непосредственно просоединена к ДНК-молекуле, где первой аминокислотой у N-конца является всегда метионин, который кодируется старт-кодоном ATG. Если это необходимо, то метионин у N-конца может быть отщеплен от белка путем in vitro-инкубирования с бромцианом.
Альтернативой дрожжевым экспрессирующим системам являются гибридные белки, а также экспрессирующие системы на основе клеток млекопитающих, бакуловирусные экспрессирующие системы и бактериальные экспрессирующие системы. Обычно, ДНК-последовательность, кодирующую N-концевую часть эндогенного дрожжевого белка или другого стабильного белка, гибридизуют с 5'-концом гетерологичных кодирующих последовательностей. После экспрессии получают конструкцию из двух гибридных аминокислотных последовательностей. Например, ген супероксид-дисмутазы (SOD) дрожжей или человека может быть присоединен у 5'-конца чужеродного гена и экспрессирован в дрожжах. ДНК-последовательность на стыке двух аминокислотных последовательностей может кодировать, а может и не кодировать сайт расщепления. См., например, ЕР-А-0196056. Другим примером может служить гибридный белок убихитина. Этот гибридный белок получают с использованием убихитиновой области, которая предпочтительно сохраняет сайт для процессирующего фермента (например, убихитин-специфической процессирующей протеазы) для отщепления убихитина от чужеродного гена. А следовательно, с использованием этого метода, нативный чужеродный белок может быть выделен (например, WO 88/024066).
Альтернативно, чужеродные белки могут быть также секретированы из клетки в культуральную среду путем создания химерных ДНК-молекул, которые кодируют гибридный белок, состоящий из фрагмента лидерной последовательности, которая способствует секреции чужеродного белка в дрожжах. При этом предпочтительно, если имеются сайты процессинга, которые кодируются между лидерным фрагментом и чужеродным геном и которые могут быть расщеплены либо in vivo, либо in vitro. Этот фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые направляют секрецию данного белка из клетки.
ДНК, кодирующая подходящие сигнальные последовательности, может быть получена от генов для секретируемых дрожжевых белков, таких как ген дрожжевой инвертазы (ЕР-А-0012873; JPO 62096086) и ген А-фактора (патент США 4588684). Альтернативно, для секреции в дрожжах могут также присутствовать недрожжевые лидерные последовательности, такие как лидерная последовательность интерферона (ЕР-А-0060057).
Предпочтительным классом лидерных последовательностей, обеспечивающих секрецию, являются такие последовательности, которые содержат фрагмент гена альфа-фактора дрожжей, содержащий как "пре"-сигнальную последовательность, так и "про"-область. Типами фрагментов альфа-фактора, которые могут быть использованы, являются полноразмерные лидерные пре-про-последовательности альфа-фактора (около 83 аминокислотных остатка), а также усеченные лидерные последовательности альфа-фактора (обычно от около 25 до около 50 аминокислотных остатков) (патенты США №№4546083 и 4870008; ЕР-А-0324274). Другими лидерными последовательностями, содержащими фрагмент лидерной последовательности альфа-фактора, обеспечивающий секрецию, являются гибридные лидерные последовательности альфа-фактора, сконструированные с использованием пре-последовательности от первого альфа-фактора дрожжей и прообласти от второго альфа-фактора дрожжей (см., например, WO 89/02463).
Обычно, последовательности терминации транскрипции, распознаваемые дрожжами, представляют собой регуляторные области, локализованные с 3'-конца по отношению к стоп-кодону трансляции, и таким образом, вместе с промотором, они фланкируют кодирующую последовательность. Эти последовательности направляют транскрипцию мРНК, которая может быть транслирована в полипептид, кодируемый ДНК. Примерами последовательностей терминации транскрипции и других распознаваемых дрожжами последовательностей терминации являются те, которые кодируют гликолитические ферменты.
Обычно, вышеописанные компоненты, содержащие промотор, лидерную последовательность (если это необходимо), нужную кодирующую последовательность и последовательность терминации транскрипции, взятые вместе, образуют экспрессионные конструкции. Экспрессионные конструкции часто вводят в репликон, такой как внехромосомный элемент (например, плазмиды), способный стабильно поддерживаться в хозяине, таком как дрожжи или бактерии. Этот репликон может иметь две системы репликации, что позволяет его использовать, например, в дрожжах для экспрессии, и в прокариотическом хозяине для клонирования и амплификации. Примерами таких челночных векторов типа "дрожжи-бактерии" являются YEp24 [Botstein et al. (1979) Gene 8:17-24], pCI/1 [Brake et al. (1984) Proc. Natl. Acad. Sci., USA, 81:4642-4646], и YRp17 [Stinchcomb et al. (1982) J. Mol. Biol. 158:157]. Кроме того, репликон может быть либо высококопийной, либо низкокопийной плазмидой. Высококопийная плазмида обычно имеет число копий в пределах от около 5 до около 200, а обычно от около 10 до около 150. Хозяин, содержащий высококопийную плазмиду, предпочтительно содержит, по крайней мере, около 10, а более предпочтительно, по крайней мере, около 20 плазмид. В зависимости от действия вектора и чужеродного белка на хозяина, могут быть выбраны либо высококопийный, либо низкокопийный вектор. См. выше, например, Brake et al.
Альтернативно, экспрессирующие конструкции могут быть интегрированы в дрожжевой геном при помощи интегрирующегося вектора. Интегрирующиеся векторы обычно содержат, по крайней мере, одну последовательность, гомологичную последовательности дрожжевой хромосомы, что позволяет этому вектору интегрироваться, а предпочтительно содержат две гомологичные последовательности, фланкирующие экспрессирующую конструкцию. Интеграция, очевидно, происходит вследствие рекомбинаций между гомологичной ДНК в векторе и дрожжевой хромосомой [Orr-Weaver et al. (1983) Methods in Enzymol. 101:228-245]. Интегрирующийся вектор может быть направлен в специфический локус в дрожжах путем отбора подходящей гомологичной последовательности для ее включения в вектор. Orr-Weaver et al., см. выше. Одна или несколько экспрессионных конструкций могут интегрироваться, оказывая, возможно, воздействие на уровни продуцируемых рекомбинантных белков [Rine et al. (1983) Proc. Natl. Acad. Sci. USA, 80:6750]. Хромосомные последовательности, включенные в вектор, могут присутствовать либо в виде одного сегмента в векторе, который способствует интеграции целого вектора, либо в виде двух сегментов, гомологичных смежным сегментам в хромосоме и фланкирующих экспрессионную конструкцию в векторе, что может приводить к стабильной интеграции лишь экспрессионной конструкции.
Обычно, внехромосомные и интегрирующиеся экспрессионные конструкции могут содержать селективные маркеры, позволяющие проводить отбор трансформированных бактериальных штаммов. Селективными маркерами могут быть биосинтетические гены, которые могут экспрессироваться в дрожжевом хозяине, такие как ADE2, HIS4, LEU2, TRP1 и ALG7 и ген резистентности к G418, которые придают дрожжевым клеткам резистентность к туникамицину и G418 соответственно. Кроме того, подходящий селективный маркер может также обеспечивать способность дрожжей расти в присутствии токсичных соединений, таких как металл. Так, например, присутствие СUР1 позволяет дрожжам расти в присутствии ионов меди [Butt et al. (1987) Microbiol. Rev. 51:351].
Альтернативно, некоторые из вышеописанных компонентов, вместе могут образовывать трансформирующие векторы. Трансформирующие векторы обычно состоят из селективного маркера, который либо присутствует в репликоне, либо формируется в интегрирующийся вектор, описанный выше.
Экспрессирующие и трансформирующие векторы, или внехромосомные репликоны, или интегрирующие векторы, были сконструированы для трансформации многих дрожжей. Так например, экспрессирующие векторы были сконструированы помимо прочего, для следующих дрожжей: Candida albicans [Kurtz et al. (1986) Mol. Cell. Biol. 6:142], Candida maltosa [Kunze et al. (1985) J. Basic Microbiol. 25:141], Hansenula polymorpha [Gleeson et al. (1986) J. Gen. Microbiol. 132:3459; Roggenkamp et al. (1986) Mol. Gen. Genet. 202:302], Kluyveromyces fragilis [Das, et al. (1984) J. Bacteriol. 158:1165], Kluyveromyces lactis [De Louvencourt et al. (1983) J. Bacteriol. 154:737; Van den Berg et al. (1990) Bio/Technology 8:135], Pichia guillerimondii [Kunze et al. (1985) J. Basic Microbiol. 25:141], Pichia pastoris [Cregg et al. (1985) Mol. Cell. Biol. 5:3376; патенты США №№4837148 и 4929555], Saccharomyces cerevisiae [Hinnen et al. (1978) Proc. Natl. Acad. Sci. USA 75:1929; Ito et al. (1983) J. Bacteriol. 153:163], Schizosaccharomyces pombe [Beach and Nurse (1981) Nature 300:706] и Yarrowia lipolytica [Davidow, et al. (1985) Curr. Genet. 10:380471, Gaillardin et al. (1985) Curr. Genet. 10:49].
Методы введения экзогенной ДНК в дрожжевые клетки-хозяева хорошо известны специалистам и такими методами обычно является трансформация сферопластов или интактных дрожжевых клеток, обработанных щелочными катионами. Способы трансформации обычно варьируются в зависимости от вида трансформируемых дрожжей. См., например, [Kurtz et al. (1986) Mol. Cell. Biol. 6:142; Kunze et al. (1985) J. Basic Microbiol. 25:141; Candida]; [Gleeson et al. (1986) J. Gen. Microbiol. 132:3459; Roggenkamp et al. (1986) Mol. Gen. Genet. 202:302, Hansenula]; [Das, et al. (1984) J. Bacteriol. 158:1165; De Louvencourt et al. (1983) J. Bacteriol. 154:737; Van den Berg et al. (1990) Bio/Technology 8:135 Kluyveromyces], [Cregg et al. (1985) Mol. Cell. Biol. 5:3376; Kunze et al. (1985) J. Basic Microbiol. 25:141; патенты США №№4837148 и 4929555; Pichia]; [Hinnen et al. (1978) Proc. Natl. Acad. Sci. USA 75:1929; Ito et al. (1983) J. Bacteriol. 153:163 Saccharomyces]; [Beach & Nurse (1981) Nature 300:706 Schizosaccharomyces]; [Davidow, et al. (1985) Curr. Genet. 10:39; Gaillardin et al. (1985) Curr. Genet. 10:49; Yarrowia].
Антитела
Используемый в настоящем описании термин "антитело" относится к полипептиду или к группе полипептидов, содержащих, по крайней мере, один связывающий центр антитела. Термин "связывающий центр антитела" представляет собой трехмерный связывающий участок, имеющий форму внутренней поверхности и распределение заряда, которые комплементарны структурным особенностям эпитопа антигена, что позволяет этому антителу связываться с данным антигеном. Таким "антителом" являются, например, антитела позвоночных, гибридные антитела, химерные антитела, "очеловеченные" антитела, модифицированные антитела, одновалентные антитела, Fab-белки и антитела с одним доменом.
Антитела против белков настоящего изобретения могут быть использованы для аффинной хроматографии, иммуноанализов и обнаружения/идентификации белков Neisseria.
Антитела против белков настоящего изобретения, как поликлональные, так и моноклональные, могут быть получены стандартными методами. В основном, этот белок используют, главным образом, для иммунизации подходящих животных, предпочтительно мышей, крыс, кроликов и коз. Для получения поликлональной сыворотки предпочтительными являются кролики и козы из-за объема получаемой сыворотки и доступности меченых антикроличьих и антикозьих антител. Иммунизацию, в основном, осуществляют путем смешивания или эмульгирования белка в физиологическом растворе, а предпочтительно в адъюванте, таком как полный адъювант Фрейнда, и инъецирования этой смеси или эмульсии парентерально (в основном, подкожно или внутримышечно). В основном, достаточной является доза 50-200 мкг на инъекцию. Повторную иммунизацию, обычно, проводят через 2-6 недель путем введения одной или более инъекций белка в физиологическом растворе предпочтительно с использованием неполного адъюванта Фрейнда. Альтернативно, антитела могут быть продуцированы путем in vitro-иммунизации известными методами, которые с точки зрения настоящего изобретения являются эквивалентными in vivo-иммунизации. Поликлональную антисыворотку получают путем взятия крови у иммунизованного животного с помещением ее в стеклянный или пластиковый контейнер, и инкубирования этой крови в течение одного часа при 25°С, а затем в течение 2-18 часов при 4°С. Сыворотку выделяют путем центрифугирования (например, при 1000 g в течение 10 минут). От кроликов может быть получено примерно 20-50 мл сыворотки на объем крови.
Моноклональные антитела получают с использованием стандартных методов Kohler & Milstein [Nature (1975) 256:495-96] или их модификаций. Обычно, мышей или крыс иммунизируют как описано выше. Однако вместо того, чтобы брать кровь у животного для экстракции сыворотки, удаляют селезенку (и необязательно, несколько крупных лимфоузлов) и эту селезенку разлагают на отдельные клетки. Если это необходимо, то клетки селезенки могут быть скринированы (после удаления неспецифически прилипших клеток) путем нанесения клеточной суспензии на планшет или лунку, покрытую белком-антигеном. В-клетки, экспрессирующие мембрано-ассоциированный иммуноглобулин, который является специфичным для данного антигена, связываются с планшетом и не смываются с остальной суспензией. Полученные В-клетки или все диссоциированные клетки селезенки затем индуцируют для их гибридизации с клетками миеломы с образованием гибридом, и культивируют в селективной среде (например, среде с гипоксантином, в среде с аминоптерином, в среде с тимидином, "HAT"). Полученные гибридомы засевают путем ограниченного разведения и оценивают на продуцирование антител, которые специфически связываются с иммунизирующим антигеном (и которые не связываются с неродственными антигенами). Затем, отобранные MAb-секретирующие гибридомы культивируют in vitro (например, в сосудах с тканевой культурой или в реакторах для полого волокна), или in vivo (в качестве асцита у мышей).
Если это необходимо, то антитела (поликлональные или моноклональные) могут быть помечены стандартными методами. Подходящими метками являются флуорофоры, хромофоры, радиоактивные атомы (в частности,32P и125I), электронно-плотные реагенты, ферменты и лиганды, имеющие партнеров по специфическому связыванию. Ферменты обычно обнаруживаются по их активности. Так, например, пероксидазу хрена (ПХ) обнаруживают по ее способности превращать 3,3',5, 5'-тетраметилбензидин (ТМВ) в синий пигмент, который может быть количественно оценен с помощью спектрофотометра. Термин "партнер по специфическому связыванию" означает белок, способный связываться с молекулой лиганда с высокой специфичностью, как, например, в случае антигена и специфичного к нему моноклонального антитела. Другими партнерами по специфическому связыванию являются биотин и авидин или стрептавидин, IgG и белок А, а также множество пар "рецептор - лиганд", известных специалистам. При этом следует отметить, что в вышеуказанном описании не предусматривается разделение различных меток на отдельные классы, поскольку одна и та же метка может служить для различных целей. Так, например,125I может служить в качестве радиоактивной метки или в качестве электронно-плотного реагента. Пероксидаза хрена (ПХ) может служить в качестве фермента или в качестве антигена для MAb. Кроме того, для достижения нужного эффекта можно объединять различные метки. Так, например, в соответствии с настоящим изобретением, для MAb и авидина также требуется использование меток: а именно MAb может быть помечено биотином, и его присутствие обнаруживают с помощью авидина, помеченного125I, или с помощью ПХ-меченого MAb против биотина. Другие модификации и возможности настоящего изобретения будут очевидны для каждого специалиста, и они могут рассматриваться как эквиваленты настоящего изобретения, а поэтому они также входят в объем изобретения.
Фармацевтические композиции
Фармацевтические композиции могут содержать либо полипептиды, либо антитела, либо нуклеиновую кислоту настоящего изобретения. Фармацевтические композиции содержат терапевтически эффективное количество полипептидов, антител или полинуклеотидов настоящего изобретения.
Термин "терапевтически эффективное количество", используемый в настоящем описании, означает количество терапевтического агента, предназначенное для лечения, ослабления симптомов заболевания или профилактики данного заболевания или состояния, либо для выявления детектируемого терапевтического или профилактического эффекта. Этот эффект может быть обнаружен, например, по уровню химических маркеров или антигена. Терапевтическими эффектами также является ослабление физических симптомов, такое как снижение температуры тела. Точное эффективное количество, вводимое индивидууму, зависит от веса и состояния здоровья индивидуума, от природы и тяжести этого состояния и от терапевтических средств или их комбинаций, выбранных для введения индивидууму. Таким образом, нецелесообразно заранее определять точное эффективное количество лекарственного средства. Однако эффективное количество для каждого данного случая может быть определено путем рутинного экспериментирования и в соответствии с клинической оценкой лечащего врача.
В целях настоящего изобретения эффективная доза составляет от около 0, 01 мг/кг до 50 мг/кг или от 0,05 мг/кг до около 10 мг/кг ДНК-конструкций, предназначенных для введения индивидууму.
Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" означает носитель для введения терапевтического агента, такого как антитела или полипептид, гены и другие терапевтические агенты. Этот термин относится ко всем фармацевтическим носителям, которые при введении этой композиции сами не индуцируют вырабатывания нежелательных для индивидуума антител и которые не оказывают чрезмерного токсического действия. Подходящими носителями могут быть крупные макромолекулы с замедленным метаболизмом, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. Такие носители хорошо известны каждому специалисту.
В настоящем изобретении могут быть использованы фармацевтически приемлемые соли, например соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п.; и соли органических кислот, такие как, ацетаты, пропионаты, малонаты, бензоаты и т.п. Подробное обсуждение фармацевтически приемлемых наполнителей приведено в Remington's Pharmaceutical Sciences (Mack Pub. Co, N.J. 1991).
Фармацевтически приемлемые носители в терапевтических композициях могут содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Кроме того, в таких носителях могут присутствовать и другие добавки, такие как смачивающие или эмульгирующие агенты, забуферивающие вещества для коррекции рН, и т.п. Обычно, терапевтические композиции получают в виде инъекций, в форме либо жидких растворов, либо суспензий; или они могут быть также получены в виде твердых форм, подходящих для изготовления растворов или суспензий в жидких наполнителях и приготавливаемых перед инъецированием. В определение фармацевтически приемлемого носителя также входят липосомы.
Методы доставки
После приготовления нужного состава, композиции настоящего изобретения могут быть непосредственно введены индивидууму. Такими индивидуумами, подвергаемыми лечению, могут быть животные, а в частности, человек.
Прямую доставку композиций обычно осуществляют путем подкожной, внутрибрюшинной, внутривенной или внутримышечной инъекции, либо путем введения в интерстициальное пространство ткани. Эти композиции могут быть также введены в область поражения. Другие способы введения предусматривают пероральное и внутрилегочное введение, введение с помощью суппозиториев и трансдермальное или чрескожное введение (см., например, WO 98/20734), с использованием игл, "генного ружья", или безыгольных шприцов. Схема лечения может предусматривать введение лишь однократной дозы или множества доз.
Вакцины
Вакцины настоящего изобретения могут быть либо профилактическими (т.е. для предупреждения инфекции), либо терапевтическими (т.е. для лечения заболевания после инфицирования).
Указанные вакцины содержат иммунизирующий(е) антиген(ы), иммуноген(ы), полипептид(ы), белок(и) или нуклеиновую кислоту, обычно в сочетании с "фармацевтически приемлемыми носителями", которыми могут быть любые носители, сами по себе не способствующие продуцированию нежелательных антител у индивидуума при введении ему данной композиции. Подходящими носителями обычно являются крупные макромолекулы с замедленным метаболизмом, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, липидные агрегаты (такие как масляные капельки или липосомы) и неактивные вирусные частицы. Указанные носители хорошо известны каждому специалисту. Кроме того, эти носители могут функционировать как иммуностимулирующие агенты ("адъюванты"). Кроме того, антиген или иммуноген может быть конъюгирован с бактериальным токсоидом, таким как токсоид дифтерии, столбняка, холеры, Н.pylori, и другим патогеном.
Предпочтительными адъювантами для увеличения эффективности композиции являются, но не ограничиваются ими: (1) соли алюминия (алюмы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.п; (2) эмульсионные композиции типа "масло в воде" (в присутствии или в отсутствие других специфических иммуностимулирующих агентов, таких как мурамиловые пептиды (см. ниже), или компонентов стенок бактериальных клеток), такие как, например, (a) MF59™ (WO 90/14837; Глава 10 в "Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995), содержащий 5% сквален, 0,5% Твин-80 и 0,5% Span 85 (необязательно содержащий различные количества МТР-РЕ (см. ниже), хотя это и не обязательно) и полученный в виде субмикронных частиц с использованием микрофлюидизатора, такого как микрофлюидизатор модели 110Y (Microfluidics, Newton, MA), (b) SAF, содержащий 10% сквален, 0,4% Твин-80, блокированный 5% плюроником полимер L121, и thr-MDP (см. ниже) либо микроожиженный на микрофлюидизаторе с образованием субмикронной эмульсии, либо интенсивно перемешанный с образованием эмульсии с более крупным размером частиц, и (с) адъювантная система Ribi™ (RAS) (Ribi Immunochem., Hamilton, MT), содержащая 2% сквален, 0,2% Твин-80 и один или несколько компонентов стенки бактериальной клетки, выбранных из группы, включающей монофосфориллипид A (MPL), трегалозодимиколат (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™); (3) сапониновые адъюванты, такие как Стимулон™ (Cambridg Bioscience, Worcester, MA), или продуцированные из них частицы, такие как ISCOM (иммуностимулирующие комплексы); (4) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (5) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.п.), интерфероны (например, гамма-интерферон), колониестимулирующий фактор макрофагов (M-CSF), фактор некроза опухолей (TNF) и т.п. и (6) другие вещества, действующие как иммуностимулирующие агенты и повышающие эффективность композиции. Предпочтительными являются алюм и MF59™.
Упомянутыми выше мурамиловыми пептидами являются, но не ограничиваются ими, N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (МТР-РЕ) и т.п.
Иммуногенные композиции (например, иммунизирующий антиген/иммуноген/полипептид/белок/нуклеиновая кислота, фармацевтически приемлемый носитель и адъювант) обычно содержат разбавители, такие как вода, физиологический раствор, глицерин, этанол и т.п. Кроме того, в этих наполнителях могут присутствовать и другие добавки, такие как смачивающие или эмульгирующие агенты, забуферивающие вещества для коррекции рН, и т.п.
Обычно, иммуногенные композиции получают в виде инъекций в форме либо жидких растворов, либо суспензий; однако могут быть также получены и твердые формы, подходящие для изготовления растворов или суспензий в жидких наполнителях и приготавливаемые перед инъецированием. Этот препарат может быть также эмульгирован или инкапсулирован в липосомы для усиления действия адъюванта, как указывалось выше при обсуждении фармацевтически приемлемых носителей.
Иммуногенные композиции, используемые в качестве вакцин, включают иммунологически эффективное количество антигенных или иммуногенных полипептидов, а также любых других вышеупомянутых компонентов, если это необходимо. Термин "иммунологически эффективное количество" означает, что введение этого количества индивидууму либо в виде однократной дозы, либо в виде множества доз, является эффективным для лечения или профилактики заболевания. Это количество варьируется в зависимости от состояния здоровья и физического состояния индивидуума, подвергаемого лечению, от таксономической группы индивидуума, подвергаемого лечению (например, примата, не относящегося к человеку, примата и т.п.), от способности иммунной системы индивидуума к синтезу антител, степени вырабатывания нужного иммунитета, состава вакцины, оценки клинического состояния лечащим врачом, и от других важных факторов. Предполагается, что это количество будет варьироваться в относительно широких пределах, которые могут быть определены методами рутинного экспериментирования.
Иммуногенные композиции обычно вводят путем подкожной, внутримышечной или трансдермальной/чрескожной инъекции (см., например, WO 98/20734). Другими препаратами, подходящими для других способов введения, являются препараты для перорального и внутрилегочного введения, суппозитории и препараты для чрескожного введения. Схема лечения может предусматривать введение лишь однократной дозы или множества доз. Эта вакцина может быть введена в сочетании с другими иммунорегуляторными агентами.
В качестве альтернативы вакцинам, изготавливаемым на основе белка, может быть проведена ДНК-вакцинация [например, Robinson & Torres (1997) Seminars in Immunology, 9:271-283; Donnelly et al. (1997) Annu. Rev. Immunol., 15:617-648; см. также ниже].
Носители для доставки генов
Носители для генной терапии, используемые для доставки конструкций, включая кодирующую последовательность терапевтического гена настоящего изобретения, необходимые для доставки в ткани млекопитающих в целях их экспрессии у этих млекопитающих, могут быть введены либо местно, либо системно. В этих конструкциях может быть использован вирусный или невирусный вектор для in vivo или ex vivo-введения. Экспрессия таких кодирующих последовательностей может быть индуцирована с использованием эндогенных промоторов млекопитающих или гетерологичных промоторов. Эспрессия кодирующей последовательности in vivo может быть конститутивной или регулируемой.
Настоящее изобретение включает носители для доставки генов, способные обеспечивать экспрессию рассматриваемых последовательностей нуклеиновых кислот. Носителем для доставки генов является предпочтительно вирусный вектор, а более предпочтительно вирус на основе ретровируса, аденовируса, аденоассоциированного вируса (AAV), вируса герпеса или альфа-вируса. Вирусным вектором может быть также вектор на основе астровируса, коронавируса, ортомиксовируса, паповавируса, парамиксовируса, парвовируса, пикорнавируса, поксвируса или тогавируса. См, в основном, Jolly (1994) Cancer Gene Therapy 1:51-64; Kimura (1994) Human Gene Therapy 5:845-852; Connelly (1995) Human Gene Therapy 6:185-193; и Kaplitt (1994) Nature Genetics 6:148-153.
Ретровирусные векторы хорошо известны специалистам, и авторы настоящей заявки считают, что в настоящем изобретении может быть использован любой вектор, который обычно применяется в ретровирусной генной терапии, включая ретровирусы типа В, С и D, ксенотропные ретровирусы (например, NZB-X1, NZB-X2 и NZB9-1 (см. O'Neill (1985) J. Virol. 53:160), политропные ретровирусы, например MCF и MCF-MLV (см. Kelly (1983) J. Virol. 45:291), спумавирусы и лентивирусы. См. RNA Tumor Viruses, Second Edition, Cold Spring Harbor Laboratory, 1985.
Части векторов, используемых для ретровирусной генной терапии, могут быть получены от различных ретровирусов. Например, LTR (длинные концевые повторы) ретровектора могут происходить от вируса саркомы мыши; сайт связывания с тРНК может происходить от вируса саркомы Рауса; сигнал упаковки может происходить от вируса мышиного лейкоза; а сайт инициации синтеза второй цепи может происходить от вируса птичьего лейкоза.
Эти рекомбинантные ретровирусные векторы могут быть использованы для генерирования компетентных по трансдукции частиц ретровирусного вектора путем их введения в соответствующие линии клеток с дефектом упаковки (см. патент США 5591624). Ретровирусные векторы могут быть сконструированы для сайт-специфической интеграции ДНК в клетки-хозяева путем введения химерного фермента интегразы в ретровирусную частицу (см. WO 96/37626). Предпочтительно, чтобы рекомбинантный вирусный вектор представлял собой рекомбинантный вирус, дефектный по репликации.
Упаковывающие клеточные линии, подходящие для использования с вышеописанными ретровирусными векторами и хорошо известные специалистам, могут быть легко получены (см. WO 95/30763 и WO 92/05266), и могут быть использованы для создания клеточных линий-продуцентов (также называемых векторными клеточными линиями или "VCL") в целях продуцирования частиц рекомбинантного вектора. Предпочтительно, чтобы клеточные линии с дефектом упаковки были получены от человеческих родительских клеток (например, клеток НТ1080) или родительских клеточных линий норки, которые устраняют инактивацию в сыворотке человека.
Предпочтительными ретровирусами для конструирования векторов, используемых для ретровирусной генной терапии, являются вирус птичьего лейкоза, вирус коровьего лейкоза, вирус мышиного лейкоза, фокус-индуцирующий вирус клеток норки, вирус саркомы мыши, вирус ретикулоэндотелиоза и вирус саркомы Рауса. Особенно предпочтительными вирусами мышиного лейкоза являются штаммы 4070А и 1504А (Hartley & Rowe (1976) J. Virol. 19:19-25), вирусы Абельсона (АТСС №VR-999), Френда (АТСС №VR-245), Граффи, Гросса (АТСС №VR-590) и Кирстена, вирус саркомы Харви и Раушера (АТСС №VR-998) и вирус мышиного лейкоза Молони (АТСС №VR-190). Такие ретровирусы могут быть взяты из депозитариев или коллекций, таких как Американская коллекция типовых культур ("АТСС") в Rockville, Maryland, или они могут быть выделены из известных источников известными методами.
Примерами используемых в настоящем изобретении векторов для ретровирусной генной терапии являются векторы, описанные в патентных заявках: GB 2200651, ЕР 0415731, ЕР 0345242, ЕР 0334301, WO 89/02468, WO 89/05349, WO 89/09271, WO 90/02806, WO 90/07936, WO 94/03622, WO 93/25698, WO 93/25234, WO 93/11230, WO 93/10218, WO 91/02805, WO 91/02825, WO 95/07994, в патентах США 5219740, 4405712, 4861719, 4980289, 4777127, 5591624. См. также Vile (1993) Cancer Res. 53:3860-3864; Vile (1993) Cancer Res. 53:962-967; Ram (1993) Cancer Res. 53 (1993) 83-88; Takamiya (1992) J. Neurosci. Res 33:493-503; Baba (1993) J. Neurosurg. 79:729-735; Mann (1983) Cell, 33:153; Cane (1984) Proc. Natl. Acad. Sci. 81:6349; и Miller (1990) Human Gene Therapy 1.
Векторы, применяемые для аденовирусной генной терапии человека, также известны специалистам и могут быть использованы в настоящем изобретении. См., например, Berkner (1988) Biotechnologues 6:616 и Rosenfeld (1991) Science 252:431, и WO 93/07283, WO 93/06223 и WO 93/07282. Примерами векторов для аденовирусной генной терапии человека, которые могут быть использованы в настоящем изобретении, являются векторы, описанные в вышеуказанных работах, а также в WO 94/12649, WO 93/03769, WO 93/19191, WO 94/28938, WO 95/11984, WO 95/00655, WO 95/27071, WO 95/29993, WO 95/34671, WO 96/05320, WO 94/08026, WO 94/11506, WO 93/06223, WO 94/24299, WO 95/14102, WO 95/24297, WO 95/02697, WO 94/28152, WO 94/24299, WO 95/09241, WO 95/25807, WO 95/05835, WO 94/18922 и WO 95/09654. Альтернативно, может быть осуществлено введение ДНК, связанной с "убитым" аденовирусом, как описано Curiel (1992) в Hum. Gene Ther. 3:147-154. Носителями для доставки генов настоящего изобретения также являются векторы на основе аденоассоциированного вируса (AAV). Основными и предпочтительными примерами таких векторов, которые могут быть использованы в настоящем изобретении, являются векторы на основе AAV-2, описанные Srivastaya в WO 93/09239. Наиболее предпочтительные векторы содержат два инвертированных концевых повтора AAV, где нативные D-последовательности были модифицированы путем замены нуклеотидов, так что, по крайней мере, от 5 до 18 нативных нуклеотидов предпочтительно, по крайней мере, от 10 до 18 нативных нуклеотидов, а наиболее предпочтительно 10 нативных нуклеотидов были сохранены, а остальные нуклеотиды этой D-последовательности были делегированы или заменены на ненативные нуклеотиды. Нативными D-последовательностями инвертированных концевых повторов AAV являются последовательности из 20 непрерывно следующих друг за другом нуклеотидов в каждом из инвертированных концевых повторов AAV (то есть у каждого конца имеется одна последовательность), которые не участвуют в образовании HP. Ненативным нуклеотидом для замены может быть любой нуклеотид, кроме нуклеотида, присутствующего в нативной D-последовательности в том же самом положении. Другими примерами AAV-векторов, которые могут быть использованы, являются pWP-19, pWN-1, оба из которых описаны Nahreini (1993) Gene 124:257-262. Другим примером такого AAV-вектора является psub201 (см., Samulski (1987) J. Virol. 61:3096). Другим примером AAV-вектора является вектор Double D-ITR. Конструирование вектора Double D-ITR описано в патенте США 5478745. Другими векторами являются векторы, описанные Carter в патенте США 4797368, Muzyczka в патенте США 5139941, Chartejee в патенте США 5474935 и Kotin в WO 94/288157. Другим примером AAV-вектора, который может быть использован в настоящем изобретении, является вектор SSV9AFABTKneo, содержащий энхансер AFP и альбуминовый промотор и обеспечивающий направленную экспрессию преимущественно в печени. Структура и конструирование этого вектора описаны Su (1996) в Human Gene Therapy 7:463-470. Другими примерами AAV-векторов для генной терапии являются векторы, описанные в патентах США 5354678, 5173414, 5139941 и 5252479.
В качестве векторов для осуществления генной терапии настоящего изобретения могут быть также использованы векторы на основе вируса герпеса. Основными и предпочтительными примерами таких векторов являются векторы на основе вируса простого герпеса, содержащие последовательность, кодирующую полипептид тимидинкиназы, такие как векторы, описанные в патенте США 5288641 и в ЕР 0176170 (Roizman). Другими примерами векторов на основе вируса простого герпеса являются вектор HFEM/ICP6-LacZ, описанный в WO 95/04139 (Wistar Institute), вектор pHSVlac, описанный Geller (1988), Science 241:1667-1669, и в WO 90/09441 и WO 92/07945, вектор HSV Us3::pgC-lacZ, описанный Fink (1992) в Human Gene Therapy 3:11-19, и векторы HSV 7134, 2 RH 105 и GAL4, описанные в ЕР 0453242 (Breakefield), и векторы, депонированные в АТСС под номерами доступа АТСС VR-977 и АТСС VR-260.
Рассматриваются также альфа-вирусные векторы для генной терапии, которые могут быть использованы в настоящем изобретении. Предпочтительными альфа-вирусными векторами являются векторы на основе вируса Синдбис. Могут быть использованы тогавирусы, вирус лесов Семлики (АТСС VR-67; АТСС VR-1247), вирус Миддлберга (АТСС VR-370), вирус реки Росс (АТСС VR-373; АТСС VR-1246), вирус венесуэльского лошадиного энцефалита (АТСС VR923; АТСС VR-1250; АТСС VR-1249; АТСС VR-532) и вирусы, описанные в патентах США №5091309, 5217879 и WO 92/10578. Более конкретно, векторами, которые могут быть использованы в настоящем изобретении, являются альфа-вирусные векторы, описанные в патентной заявке США рег. №08/405627, поданной 15 марта 1995, WO 94/21792, WO 92/10578, WO 95/07994, и в патентах США 5091309 и 5217879. Такие альфа-вирусы могут быть взяты из депозитариев или коллекций, таких как АТСС в Rockville, Maryland, или они могут быть выделены из известных источников с помощью стандартной техники. Предпочтительно использовать альфа-вирусные векторы с ослабленной цитотоксичностью (см. заявку на патент США рег. №08/679640).
Для экспрессии нуклеиновых кислот настоящего изобретения могут быть также использованы системы ДНК-векторов, такие как системы экспрессии в эукариотических клетках. Подробное описание эукариотических экспрессирующих систем представлено в WO 95/07994. Предпочтительными эукариотическими экспрессирующими системами настоящего изобретения являются системы, полученные с использованием векторов на основе альфа-вирусов, а наиболее предпочтительно векторов вируса Синдбис.
Другими вирусными векторами, подходящими для использования в настоящем изобретении, являются векторы, полученные на основе полиовирусов, например АТСС VR-58, и вирусов, описанных Evans, Nature 339 (1989) 385, и Sabin (1973) J. Biol. Standardization 1:115; риновирусов, например АТСС VR-1110, и вирусов, описанных Arnold (1990) в J. Cell. Biochem L401; поксвирусов, таких как вирус оспы канареек или вирус коровьей оспы, например АТСС VR-111 и АТСС VR-2010, и вирусов, описанных Fisher-Hoch (1989) Proc. Natl. Acad. Sci. 86:317; Flexner (1989) в Ann. NY Acad. Sci 569:86, Flexner (1990) Vaccine 8:17; в патенте США №4603112 и 4769330 и WO 89/01973; вируса SV40, например АТСС VR-305, и вирусов, описанных Mulligan (1979) Nature 277:108 и Madzak (1992) в J. Gen. Virol 73:1533; вируса гриппа, например АТСС VR-797, и рекомбинантных вирусов гриппа, сконструированных с использованием техники "обратной генетики", как описано в патенте США №5166057 и Enami (1990) в Proc. Natl. Acad. Sci 87:3802-3805; Enami & Palese (1991) в J. Virol 65:2711-2713 и Luytjes (1989) Cell 59:110 (см. также McMichael (1983) NEJ Med. 309:13 и Yap (1978) Nature 273:238 и Nature (1979) 277:108); вируса иммунодефицита человека, описанного в ЕР-0386882 и Buchschacher (1992) J. Virol. 66:2731; вируса кори, например АТСС VR-67 и VR-1247, и вирусов, описанных в ЕР-0440219; вируса Аура, например АТСС VR-368; вируса Бебару, например АТСС VR-600 и АТСС VR-1240; вируса Кабассу, например АТСС VR-922; вируса Чикунгунья, например АТСС VR-64 и АТСС VR-1241; вируса Форт-Моргана, например АТСС VR-924; вируса Гета, например АТСС VR-369 и АТСС VR-1243; вируса Кузулагач, например АТСС VR-927; вируса Майяро, например АТСС VR-66; вируса Мукамбо, например АТСС VR-580 и АТСС VR-1244; вируса Ндуму, например АТСС VR-371; вируса Пиксуна, например АТСС VR-372 и АТСС VR-1245; вируса Тонате, например АТСС VR-925; вируса Тринити, например АТСС VR-469; вируса Уна, например АТСС VR-374; вируса Ватароа, например АТСС VR-926; вируса Y-62-33, например АТСС VR-375; вируса О'ньонг-ньонг, вируса восточного энцефалита, например АТСС VR-65 и АТСС VR-1242; вируса западного энцефалита, например АТСС VR-70, АТСС VR-1251, АТСС VR-622 и АТСС VR-1252; и коронавирусов, например АТСС VR-740, и вирусов, описанных Hamre (1966) в Proc. Soc. Exp. Biol. Med. 121:190.
Доставка композиций настоящего изобретения в клетки не ограничивается использованием вышеупомянутых векторов. Могут быть использованы и другие методы доставки и среды, например, такие как векторы экспрессии нуклеиновых кислот; поликатионная конденсированная ДНК, связанная или не связанная лишь с одним инактивированным аденовирусом, см., например, заявку США №08/366787, поданную 30 декабря 1994, и Curiel (1992) Hum. Gene Ther 3:147-154; связанная с лигандом ДНК, см., например, Wu (1989) J. Biol. Chem 264:16985-16987, носители для доставки в эукариотические клетки, см., например, заявку на патент США рег. №08/240030, поданную 9 мая 1994, и заявку на патент США 08/404796; осаждение на фотополимеризованные гидрогелевые материалы, лабораторный аппарат для переноса генов типа "генного ружья", как описано в патенте США 5149655; ионизирующее облучение, как описано в патенте США 5206152 и в WO 92/11033; нейтрализация заряда нуклеиновой кислоты или слияние с клеточными мембранами. Другие методы описаны в работах Philip (1994) Mol. Cell Biol. 14:2411-2418 и Woffendin (1994) Proc. Natl. Acad. Sci., 91:1581-1585.
Перенос генов может быть осуществлен с помощью частиц, см., например, заявку США рег. №60/023867. Вкратце, последовательность может быть встроена в соответствующие векторы, которые содержат соответствующие регуляторные последовательности для обеспечения высокого уровня экспрессии и которые затем инкубируют с синтетическими молекулами для переноса генов, такими как полимерные ДНК-связывающие катионы, например полилизин, протамин и альбумин, связанные с лигандами, обеспечивающими доставку в клетки-мишени, такими как асиалооросомукоид, как описано в работе Wu & Wu (1989) J. Biol. Chem. 262:4429-4432, инсулин, как описано в работе Hucked (1990) Biochem. Pharmacol. 40:253-263, галактоза, как описано в работе Plank (1992) Bioconjugate Chem. 3:533-539, лактоза или трансферрин.
Может быть также использована "голая" (свободная) ДНК. Примеры методов введения свободной ДНК описаны в WO 90/11092 и в патенте США 5580859. Эффективность введения может быть увеличена с использованием биологически разлагаемых латексных сфер. Покрытые ДНК латексные сферы эффективно транспортируются в клетки после инициации эндоцитоза этими сферами. Этот метод может быть еще более усовершенствован путем обработки этих сфер в целях повышения гидрофобности и, тем самым, облегчения разрушения эндосомы и высвобождения ДНК в цитоплазму.
Липосомы, которые могут действовать как носители для доставки генов, описаны в патенте США 5422120, WO 95/13796, WO 94/23697, WO 91/14445 и ЕР-524968. Как описано в заявке США рег. №60/023867, для невирусной доставки последовательности нуклеиновых кислот, кодирующие полипептид, могут быть встроены в соответствующие векторы, которые содержат соответствующие регуляторные последовательности для обеспечения высокого уровня экспрессии и которые затем инкубируют с синтетическими молекулами для переноса генов, такими как полимерные ДНК-связывающие катионы, такие как полилизин, протамин и альбумин, связанные с лигандами, обеспечивающими доставку в клетки-мишени, такими как асиалоорозомукоид, инсулин, галактоза, лактоза или трансферрин. Другими системами доставки являются липосомы для инкапсулирования ДНК, содержащей ген под контролем различных тканеспецифических или активных во всех тканях промоторов. Другими невирусными системами доставки, подходящими для использования, являются системы механической доставки, такие как системы, описанные Woffendin et al., (1994) Proc. Natl. Acad. Sci., USA, 91(24):11581-11585. Кроме того, кодирующая последовательность и продукт экспрессии этой последовательности могут быть доставлены посредством осаждения фотополимеризованных гидрогелевых материалов. Другими стандартными методами доставки генов, с помощью которых может быть осуществлена доставка кодирующей последовательности, являются, например, использование лабораторного аппарата для переноса генов типа "генного ружья", как описано в патенте США 5149655, и использования ионизирующего облучения для активации перенесенного гена, как описано в патенте США 5206152 и в WO 92/11033.
Примеры липосом и поликатионных носителей для доставки генов описаны в патентах США №5422120 и 4762915; в WO 95/13796, WO 94/23697 и WO 91/14445; в ЕР-0524968; и в работе Stryer, Biochemistry, pp.236-240 (1975) W.H.Freeman, San Francisco; Szoka (1980) Biochem Biophys Acta 600:1; Bayer (1979) Biochem Biophys Acta 550:464; Rivnay (1987) Meth Enzymol 149:119; Wang (1987) Proc. Natl. Acad. Sci. 84:7851; Plant (1989) Anal. Biochem 176:420.
Полинуклеотидная композиция может содержать терапевтически эффективное количество генно-терапевтического носителя, определенного выше. В целях настоящего изобретения, эффективная доза составляет от около 0,01 мг/кг до 50 мг/кг или от 0,05 мг/кг до около 10 мг/кг ДНК-конструкций, предназначенных для введения индивидууму.
Методы доставки
После приготовления нужного состава полинуклеотидные композиции настоящего изобретения могут быть (1) непосредственно введены индивидууму, (2) введены ex vivo в клетки, выделенные от этого индивидуума, или (3) введены in vitro для экспрессии рекомбинантных белков. Такими индивидуумами, подвергаемыми лечению, могут быть млекопитающие или птицы. Человек также может быть подвергнут лечению этими методами.
Прямую доставку композиций обычно осуществляют путем подкожной, внутрибрюшинной, внутривенной или внутримышечной инъекции, либо путем введения в интерстициальное пространство ткани. Эти композиции могут быть также введены в область поражения. Другие способы введения предусматривают пероральное и внутрилегочное введение, введение с помощью суппозиториев, и трансдермальное или чрескожное введение (см., например, WO 98/20734), с использованием игл, "генных ружей" или безыгольных шприцов. Схема лечения может предусматривать введение лишь однократной дозы или дробных доз.
Методы для ex vivo-доставки и реимплантации трансформированных клеток индивидууму известны специалистам и описаны, например, в WO 93/14778. Примерами клеток, подходящих для ех vivo-введения являются, например, стволовые клетки, а в частности, гемопоэтические клетки, лимфоидные клетки, макрофаги, дендритные клетки или опухолевые клетки.
Доставка нуклеиновых кислот как ех vivo, так и in vitro может быть осуществлена, в основном, следующими методами, например декстран-опосредованной трансфекцией, преципитацией фосфатом кальция, полибрен-опосредованной трансфекцией, слиянием протопластов, электропорацией, инкапсуляцией полинуклеотида(ов) в липосомы и прямым микроинъецированием ДНК в ядра клеток, причем все эти методы хорошо известны специалистам.
Полинуклеотидные и полипептидные фармацевтические композиции
Помимо фармацевтически приемлемых носителей и солей, описанных выше, в полинуклеотидных и/или полипептидных композициях могут быть использованы следующие дополнительные агенты.
А. Полипептиды
Одним примером являются полипептиды, которые включают, но не ограничиваются ими, асиолоорозомукоид (ASOR); трансферрин; асиалогликопротеины; антитела; фрагменты антител; ферритин; интерлейкины; интерфероны; колиниестимулирующий фактор гранулоцитов-макрофагов (GM-CSF), колониестимулирующий фактор гранулоцитов (G-CSF), колониестимулирующий фактор макрофагов (M-CSF), фактор стволовых клеток и эритропоэтин. Могут быть также использованы вирусные антигены, такие как белки оболочки. Кроме того, могут быть использованы белки от других инвазивных микроорганизмов, такие как, пептид, состоящий из 17 аминокислот и происходящий от белка круглого спорозоида серповидной пары плазмодия, известный как RII.
B. Гормоны, витамины, и т.п.
Другие группы, которые могут быть использованы, включают, например, гормоны, стероиды, андрогены, эстрогены, тиреоидный гормон или витамины, например фолиевую кислоту.
С. Полиалкилены, полисахариды и т.п.
Может быть также введен полиалкиленгликоль вместе с нужными полинуклеотидами/полипептидами. В предпочтительном варианте, таким полиалкиленгликолем является полиэтиленгликоль. Кроме того, для этих целей могут быть использованы моно-, ди- или полисахариды. В предпочтительном варианте этого аспекта таким полисахаридом является декстран или DEAE-декстран. Также могут быть использованы хитозан и поли(лактид-ко-гликолид).
D. Липиды и липосомы
Нужный полинуклеотид/полипептид может быть также инкапсулирован в липиды или упакован в липосомы перед его доставкой индивидууму или в клетки, выделенные от этого индивидуума.
Инкапсулирование липидов осуществляют, в основном, с использованием липосом, которые способны стабильно связать или захватить и удержать нуклеиновую кислоту. Отношение конденсированного полинуклеотида к липидному препарату может варьироваться, но, обычно, оно составляет приблизительно 1:1 (мг ДНК:микромоль липида) или более в пользу липида. Для обзора использования липосом в качестве носителей в целях доставки нуклеиновых кислот, см. Hug & Sleight (1991) Biochim. Biophys. Acta. 1097-17; Straubinger (1983) Meth. Enzymol. 101:512-527.
Липосомными препаратами для использования в настоящем изобретении являются катионные (положительно заряженные), анионные (отрицательно заряженные) и нейтральные препараты. Было показано, что катионные липосомы опосредуют внутриклеточную доставку плазмидной ДНК (Felgner (1987) Natl. Acad. Sci. USA 84:7413-7416); мРНК (Malone (1989) Proc. Natl. Acad. Sci. USA 86:6077-6081); и очищенных факторов транскрипции (Debs (1990) J. Biol. Chem. 265:10189-10192) в функциональной форме.
Катионные липосомы являются легкодоступными. Так, например, N-[1-2, 3-диолеилокси)пропил]-N,N, N-триэтиламмониевые (DOTMA) липосомы выпускаются под торговым знаком Липофектин от GIBCO BRL, Grand Island, NY (см. также Felgner, выше). Другими коммерчески доступными липосомами являются трансфектак (DDAB/DOPE) и DOTAP/DOPE (Boerhinger). Другие катионные липосомы могут быть получены из легкодоступных материалов с помощью техники, хорошо известной специалистам. См. например, Szoka (1978) Proc. Natl. Acad. Sci. USA 75:4194-4198; WO 90/11092, где описан синтез липосом DOTAP (на основе 1,2-бис(олеилокси)-3-(триметиламмонио)-пропана).
Аналогично, анионные и нейтральные липосомы являются легкодоступными, так, например, они поставляются Avanti Polar Lipids (Birmingham, AL), либо они могут быть элементарно получены с использованием легкодоступных материалов. Такими материалами, среди прочих, являются фосфатидилхолин, холестерин, фосфатидилэтаноламин, диолеоилфосфатидилхолин (DOPC), диолеоилфосфатидилглицерин (DOPG), диолеоилфосфатидилэтаноламин (DOPE). Эти материалы могут быть также смешаны с исходными материалами DOTMA и DOTAP в подходящем соотношении. Методы изготовления липосом с использованием этих материалов хорошо известны специалистам.
Указанные липосомы могут содержать многослойные везикулы (MLV), небольшие однослойные везикулы (SUV), или большие однослойные везикулы (LUV). Различные комплексы "липосома-нуклеиновая кислота" получают способами, известными специалистам. См. например, Straubinger (1983) Meth. Immunol. 101:512-527; Szoka (1978) Proc. Natl. Acad. Sci. USA 75:4194-4198; Papahadjopoulos (1975) Biochim. Biophys. Acta 394:483; Wilson (1979) Cell 17:77); Deamer & Bangham (1976) Biochim. Biophys. Acta 443:629; Ostro (1977) Biochem. Biophys. Res. Commun. 76:836; Fraley (1979) Proc. Natl. Acad. Sci. USA 76:3348); Enoch & Strittmatter (1979) Proc. Natl. Acad. Sci. USA 76:145; Fraley (1980) J. Biol. Chem. (1980) 255:10431; Szoka & Papahadjopoulos (1978) Proc. Natl. Acad. Sci., USA, 75:145; и Schaefer-Ridder (1982) Science 215:166.
E. Липопротеины
К полинуклеотидам/полипептидам, предназначенным для доставки, могут быть добавлены липопротеины. Примерами липопротеинов, которые могут быть использованы, являются: хиломикроны, ЛПВП, ЛПСП, ЛПНП и ЛПОНП. Могут быть также использованы мутанты, фрагменты или гибриды этих белков. Кроме того, могут быть использованы модификации природных липопротеинов, такие как ацетилированные ЛПНП. Эти липопротеины могут обеспечивать целевую доставку полинуклеотидов в клетки, экспрессирующие липопротеиновые рецепторы. Предпочтительно, чтобы в данную композицию, вместо другого лиганда для доставки, были включены липопротеины, обеспечивающие доставку нужного полинуклеотида.
Природные липопротеины содержат липидную и белковую часть. Белковая часть известна как апопротеины. В настоящее время были выделены и идентифицированы апоротеины А, В, С, D и Е. По крайней мере, два из этих апопротеинов содержат несколько белков, обозначенных римскими цифрами AI, AII, AIV; CI, CII, CIII.
Липопротеин может содержать более одного апопротеина. Так, например, природные хиломикроны включают А, В, С и Е, со временем эти липопротеины теряют А, и приобретают апопротеины С и Е. ЛПОНП содержит апоротеины А, В, С и Е, ЛПНП содержат апопротеин В; а ЛПВП содержит апопротеины А, С и Е.
Аминокислоты этих апопротеинов известны и описаны, например, Breslow (1985), Annu. Rev. Biochem. 54:699; Law (1986), Adv. Exp. Med. Biol. 151:162; Chen (1986), J. Biol. Chem 261:12918; Kane (1980), Proc. Natl. Acad. Sci. USA, 77:2465; и Ultermann (1984) Hum. Genet. 65:232.
Липопротеины содержат ряд липидов, включая, триглицериды, холестерин (свободный и в виде сложных эфиров) и фосфолипиды. Состав липидов варьируется в зависимости от природы липопротеинов. Так, например, хиломикроны содержат, главным образом, триглицериды. Более подробное описание липидного состава природных липопротеинов можно найти, например, в Meth. Enzymol. 128 (1986). Липидный состав выбирают так, чтобы конформация апопротеина благоприятствовала активности связывания с рецептором. Липидный состав может быть также выбран так, чтобы он способствовал облегчению гидрофобного взаимодействия и ассоциации с молекулой, связывающейся с полинуклеотидом.
Природные липоротеины могут быть выделены из сыворотки, например, путем ультрацентрифугирования. Эти методы описаны в Meth. Enzymol. (см. выше); Pitas (1980) J. Biochem. 255:5454-5460 и Mahey (1979) J. Clin. Invest. 64:743-750. Липоротеины могут быть также продуцированы in vitro или методами рекомбинантных ДНК путем экспрессии генов апопротеинов в нужной клетке-хозяине. См., например, Atkinson (1986) Annu. Rev. Biophys. Chem. 15:403 и Radding (1958) Biochim. Biophys. Acta 30:443. Липопротеины могут быть также закуплены у фирм-поставщиков, таких как Biomedical Technologies, Inc., Stoughton, Massachusetts, USA. Более подробное описание липопротеинов можно найти у Zuckermann et al. WO 98/06437.
F. Поликатионные агенты
В композицию, вместе с нужным полинуклеотидом/полипептидом, предназначенным для доставки, могут быть включены поликатионные агенты с липопротеином или без него.
Обычно, поликатионные агенты, при соответствующем физиологическом рН, имеют суммарный положительный заряд и способны нейтрализовать электрический заряд нуклеиновых кислот, что способствует облегчению доставки в нужный участок. Эти агенты могут быть использованы in vitro, ex vivo и in vivo. Поликатионные агенты могут быть использованы для доставки нуклеиновых кислот в живой организм либо внутримышечно, либо подкожно и т.п.
Примерами полипептидов, которые могут быть использованы в качестве поликатионных агентов, являются: полилизин, полиаргинин, полиорнитин и протамин. Другими примерами являются гистоны, протамины, сывороточный альбумин человека, ДНК-связывающие белки, негистоновые хромосомные белки, оболочечные белки ДНК-вирусов, такие как Х174 (транскрипционные факторы также содержат домены, которые связываются с ДНК, а поэтому они могут быть использованы в качестве агентов, способствующих конденсации нуклеиновой кислоты). Вкратце, транскрипционные факторы, такие как, С/СЕВР, c-jun, c-fos, АР-1, АР-2, АР-3, CPF, Prot-1, Sp-1, Oct-1, Oct-2, CREP и TFIID содержат основные домены, которые связываются с ДНК-последовательностями.
Органическими поликатионными агентами являются спермин, спермидин и пуртресцин.
Исходя из вышеуказанного списка, размеры и физические свойства поликатионного агента могут быть проэкстраполированы для конструирования других полипептидных поликатионных агентов или для продуцирования синтетических поликатионных агентов.
Синтетическими поликатионными агентами, которые могут быть использованы, являются например, DEAE-декстран, полибрен. Липофектин™ и липофектамин™ (lipofectAMINE™) представляют собой мономеры, которые образуют комплексы при их комбинации с полинуклеотидами/полипептидами.
Иммунологические анализы
Антигены Neisseria настоящего изобретения могут быть использованы в иммуноанализах для детекции уровней антител (либо, наоборот, антитела против Neisseria могут быть использованы для обнаружения уровней антигена). Вместо инвазивных методов диагностики могут быть разработаны иммуноанализы, основанные на подробно описанных рекомбинантных антигенах. С помощью этих анализов могут быть обнаружены антитела против белков Neisseria, присутствующих в биологических образцах, включая, например, пробы крови или сыворотки. Протоколы для иммуноанализов подвергались множеству модификаций, и некоторые из них известны специалистам. Протоколы иммуноанализов могут быть основаны, например, на конкурентном связывании, прямых реакциях или на "сэндвич"-анализах. В этих протоколах могут быть, например, использованы твердые подложки, либо они могут быть основаны на иммунопреципитации. Большинство анализов предусматривает использование меченого антитела или полипептида; причем в качестве меток могут служить, например, флуоресцентные, хемилюминесцентные, радиоактивные молекулы или молекулы-красители. Известны также анализы, которые основаны на амплификации сигнала от зонда, и примерами которых являются анализы, проводимые с использованием биотина и авидина, иммуноферментные анализы с использованием меченных ферментом антител и непрямые иммуноанализы, такие как анализы ELISA.
Наборы, подходящие для иммунодиагностики и содержащие соответствующие меченные реагенты, были изготовлены путем упаковки соответствующих материалов, включая композиции настоящего изобретения, в подходящие контейнеры вместе с остальными реагентами и материалами (например, подходящими буферами, солевыми растворами и т.п.), необходимыми для проведения анализа, а также с соответствующими инструкциями по проведению анализа.
Гибридизация нуклеиновых кислот
Термин "гибридизация" означает связывание двух последовательностей нуклеиновых кислот друг с другом посредством водородной связи. Обычно, одну последовательность фиксируют на твердом носителе, а другая присутствует в растворе в свободном виде. Затем, эти две последовательности подвергают контакту друг с другом в условиях, благоприятствующих образованию водородной связи. Факторами, которые влияют на образование этой связи, являются типы и объем растворителя; реакционная температура, время гибридизации, перемешивание, агенты, блокирующие неспецифическое связывание последовательности в жидкой фазе с твердым носителем (реагент Денхардта или BLOTTO); концентрация этих последовательностей; использование соединений для повышения скорости ассоциации последовательностей (сульфат декстрана или полиэтиленгликоль); и жесткость условий промывки после гибридизации. Sambrook и др. [см. выше], т.2, гл.9, стр.9.47-9.57.
Термин "жесткость" условий относится к условиям реакции гибридизации, которые благоприятствуют присоединению последовательностей с очень высокой степенью гомологии, к отличным последовательностям. Так, например, комбинация таких параметров, как температура и концентрация соли должна быть выбрана так, чтобы температура плавления (Tm), вычисленная для гибрида в этом исследовании, составляла приблизительно ниже 120-200°С. Температура и концентрация соли могут быть, в большинстве случаев, определены эмпирически в предварительных экспериментах, в которых образцы геномной ДНК, иммобилизованной на фильтрах, подвергают гибридизации с нужной последовательностью, а затем промывают в условиях различной жесткости. См. Sambrook и др. на стр.9.50.
Параметрами, рассматриваемыми при осуществлении, например, Саузерн-блот-анализа, являются (1) сложность блотируемой ДНК и (2) гомология между зондом и детектируемыми последовательностями. Общее количество исследуемого(ых) фрагмента(ов) может отличаться на порядок (10), от 0,1-1 мкг для гидролизата плазмиды или фага до 10-9-10-8 г для одной копии гена в эукариотическом геноме с высокой степенью комплексности. Для полинуклеотидов с низкой комплексностью могут быть использованы более короткое время блоттинга, гибридизации и экспонирования, меньшее количество исходных полинуклеотидов и более низкая специфическая активность зондов. Так, например, однокопийный дрожжевой ген может быть обнаружен при экспонировании в течение лишь 1 часа, исходя из 1 мкг дрожжевой ДНК, при блоттинге в течение двух часов и при гибридизации в течение 4-8 часов с использованием зонда 108им/мкг. Для однокопийного гена млекопитающего обычная процедура предусматривает использование 10 мкг ДНК, проведение блоттинга в течение ночи и гибридизацию в течение ночи в присутствии 10% сульфата декстрана с использованием зонда с более чем 108 им/мкг, что требует времени экспонирования ˜24 часа.
На температуру плавления (Tm) ДНК-ДНК-гибрида, образованного между зондом и нужным фрагментом, а следовательно, на соответствующие условия гибридизации и промывки могут влиять несколько факторов. Во многих случаях, этот зонд не имеет 100%-ную гомологию с данным фрагментом. Другими обычно рассматриваемыми параметрами являются длины гибридизующихся последовательностей и общее содержание в них G+C, а также ионная сила и содержание формамида в буфере для гибридизации. Влияние всех этих факторов может быть приблизительно представлено одним уравнением:
Tm=81+16,6(log10Ci)+0,4[%(G+C)]-0,6(% формамид)-600/n-1,5(% несоответствий).
где Ci означает концентрацию соли (одновалентных ионов), а n означает длину гибрида, выраженную в парах оснований (слегка модифицированное уравнение, взятое из Meinkoth & Wahl (1984) Anal. Biochem. 138:267-284).
При разработке эксперимента по гибридизации, некоторые факторы, влияющие на гибридиразцию нуклеиновых кислот могут быть соответствующим образом изменены. Легче всего поддаются коррекции такие параметры, как температура гибридизации и промывка, а также концентрация соли во время промывки. По мере возрастания температуры гибридизации (то есть жесткости условий), становится менее вероятным, что гибридизация будет происходить между негомологичными цепями, и в результате этого фон снижается. Если радиоактивно меченный зонд не является полностью гомологичным иммобилизованному фрагменту (как это часто бывает в случае экспериментов по гибридизации семейства генов и межвидовой гибридизации), то температура гибридизации должна быть уменьшена, но при этом фон будет возрастать. Температура промывки одинаково влияет на интенсивность полос гибридизации и на уровень фона. Жесткость промывки также повышается с увеличением концентраций соли.
В основном, обычная температура гибридизации в присутствии 50% формамида составляет 42°С для зонда, имеющего 95%-100%-ную гомологию с фрагментом-мишенью, 37°С для 90%-95%-ной гомологии и 32°С 85%-90%-ной гомологии. Для более низкой степени гомологии содержание формамида должно быть снижено, а температура надлежащим образом скорректирована в соответствии с вышеприведенным уравнением. Если неизвестно, имеется ли гомология между зондом и целевым фрагментом, то проще всего начать с нежестких условий гибридизации и промывки. Если после авторадиографии наблюдаются неспецифические полосы или высокий фон, то фильтр может быть промыт в условиях высокой жесткости и повторно экспонирован. Если время, требуемое для экспонирования, делает этот метод непрактичным, то могут быть параллельно протестированы несколько условий жесткости гибридизации и/или промывки.
Анализы с использованием зондов нуклеиновых кислот
Такие методы, как ПЦР, анализ с использованием разветвленных ДНК-зондов или техника блоттинга с применением зондов нуклеиновых кислот в соответствии с настоящим изобретением позволяют обнаруживать присутствие кДНК или мРНК. Считается, что зонд "гибридизуется" с последовательностью настоящего изобретения, в том случае, если он может образовывать дуплекс или двухцепочечный комплекс, который является достаточно стабильным для его обнаружения.
Зонды нуклеиновых кислот будут гибридизоваться с нуклеотидными последовательностями Neisseria настоящего изобретения (включая как смысловую, так и антисмысловую цепь). Хотя многие различные нуклеотидные последовательности кодируют аминокислотную последовательность, однако предпочтительной является нативная последовательность Neisseria, поскольку она является реальной последовательностью, присутствующей в клетках. мРНК представляет собой кодирующую последовательность, а поэтому зонд должен быть комплементарен этой кодирующей последовательности; одноцепочечная кДНК должна быть комплементарна мРНК, а следовательно кДНК-зонд должен быть комплементарен некодирующей последовательности.
Последовательность зонда не должна быть обязательно идентичной последовательности Neisseria (или ее комплементу), при этом некоторые изменения в этой последовательности и в ее длине могут приводить к увеличению чувствительности анализа в том случае, если зонд нуклеиновых кислот может образовывать дуплекс с нуклеотидами-мишенями, которые могут быть обнаружены. Кроме того, зонд нуклеиновых кислот может включать дополнительные нуклеотиды для стабилизации образованного дуплекса. Другая последовательность Neisseria может также служить меткой для обнаружения образованного дуплекса. Так, например, некомплементарная нуклеотидная последовательность может быть присоединена к 5'-концу зонда при условии, что остальная часть последовательности зонда должна быть комплементарна последовательности Neisseria. Альтернативно, некомплементарное основание или более длинные последовательности могут быть встроены в зонд, при условии, что последовательность зонда достаточно комплементарна последовательности Neisseria для того, чтобы он мог гибридизоваться с ней с образованием дуплекса, который может быть обнаружен.
Точная длина и последовательность зонда зависят от условий гибридизации, таких как температура, концентрация соли и т.п. Так, например, для диагностических целей, в зависимости от комплектности последовательности аналита, зонд нуклеиновых кислот обычно содержит, по крайней мере, 10-20 нуклеотидов, предпочтительно 15-25, а более предпочтительно, по крайней мере, 30 нуклеотидов, хотя может быть использован и более короткий зонд. Короткие праймеры обычно требуют более низких температур для образования достаточно стабильных гибридных комплексов с матрицей.
Зонды могут быть получены методом синтеза, таким как метод с использованием сложного триэфира, описанный Matteucci et al. [J. Am. Chem. Soc. (1981) 103:3185], или описанный Urdea et al. [Proc. Natl. Acad. Sci., USA, (1983) 80:7461], или с использованием коммерчески доступных автоматических синтезаторов олигонуклеотидов.
Химическая природа этого зонда может быть выбрана в соответствии с его специфичностью. Для некоторых целей подходящими являются ДНК или РНК. Для других целей могут быть введены модификации, например модификации в остове, такие как фосфоротиоаты или метилфосфонаты, могут быть использованы для увеличения времени полужизни in vivo, для изменения аффинности РНК и для увеличения резистентности к нуклеазе и т.п. [см., например, Agrawal & Iyer (1995) Curr Opin Biotechnol 6:12-19; Agrawal (1996) TIBTECH 14:376-387]; а также могут быть использованы аналоги, такие как связанные с пептидом нуклеиновые кислоты [см., например, Corey (1997) TIBTECH 15:224-229; Buchardt et al. (1993) TIBTECH 11:384-386].
Альтернативно, другим хорошо известным способом детекции небольших количеств нуклеиновых кислот-мишеней является полимеразная цепная реакция (ПЦР). Этот анализ описан в работе Mullis et al. [Meth. Enzymol. (1987) 155:335-350]; в патентах США №4683195 и 4683202. Два нуклеотида-"праймера" гибридизуются с нуклеиновыми кислотами-мишенями и используются для инициации реакции. Для обеспечения стабильности дуплекса или, например, для введения подходящего рестрикционного сайта, эти праймеры могут содержать последовательность, которая не гибридизуется с последовательностью амплифицируемой мишени (или ее комплементом). Обычно, такая последовательность будет фланкировать нужную последовательность Neisserial.
Термоустойчивая полимераза образует копии нуклеиновых кислот-мишеней из праймеров при использовании исходных нуклеиновых кислот-мишеней в качестве матриц. После того как под действием полимеразы генерируется пороговое количество нуклеиновых кислот-мишеней, они могут быть обнаружены более традиционными методами, такими как Саузерн-блот-анализы. При использовании Саузерн-блот-анализа меченые зонды будут гибридизоваться с последовательностью Neisserial (или ее комплементом).
Кроме того, мРНК или кДНК могут быть обнаружены стандартными методами блоттинга, описанными Sambrook et al. [см. выше]. мРНК или кДНК, генерированные из мРНК с использованием фермента полимеразы, могут быть очищены и разделены с помощью гель-электрофореза. Затем, эти нуклеиновые кислоты на геле переносят методом блоттинга на твердый носитель, такой как нитроцеллюлоза. Этот твердый носитель экспонируют меченым зондом, а затем промывают для удаления всех негибридизовавшихся зондов. Затем обнаруживают дуплексы, содержащие меченый зонд. Обычно, этот зонд метят радиоактивной меткой.
Примеры и предпочтительные фрагменты
Последовательности белка, описанные в WO 99/24578, были подвергнуты компьютерному анализу для предсказания антигенных пептидных фрагментов в указанных полноразмерных белках. В этом анализе были использованы три алгоритма:
- AMPHI. Эта программа была использована для предсказания Т-клеточных эпитопов [Gao et al. (1989) J. Immunol. 143:3007; Roberts et al. (1996) AIDS Res Hum Retrovir 12:593; Quakyi et al. (1992) Scand J. Immunol suppl. 11:9), и имеется в пакете Protean программ DNASTAR, Inc. (1228 South Park Street, Madison, Wisconsin 53715 USA).
- Antigenic index ("Антигенный индекс"), описанный Jameson & Wolf (1988). Антигенный индекс: новый алгоритм для предсказания антигенных детерминант. CABIOS, 4:181-186.
- Hydrophilicity ("Гидрофильность"), описанный Норр & Woods (1981). Предсказание белковых антигенных детерминант из аминокислотных последовательностей. PNAS, 78:3824-3828.
В таблице I (см. графические материалы)указаны предпочтительные фрагменты белков, описанных в WO 99/24578. Эти три алгоритма, в большинстве случаев, идентифицируют те же самые фрагменты (например, ORF100 - фрагмент от остатка 98 до остатка 109, и фрагменты от остатка 111 до остатка 121). Особенно предпочтительными являются фрагменты, идентифицированные много раз. Эти алгоритмы, в большинстве случаев, идентифицируют перекрывающиеся фрагменты (например, ORF100 - AMPHI идентифицирует остатки 143-152, а алгоритм "Антигенный индекс" идентифицирует остатки 148-157). Настоящее изобретение в качестве примера включает фрагменты, полученные в результате комбинирования этих перекрывающихся фрагментов (например, фрагменты от остатка 143 до остатка 157, в случае ORF100). Также часто идентифицируются фрагменты, разделенные одной аминокислотой (например, ORF 48-1 в алгоритме "гидрофильность" - 334-342 и 344-349). Настоящее изобретение также относится к фрагментам, простирающимся между двумя концами таких "смежных" фрагментов (например, 334-349 для ORF 48-1).
Следует отметить, что вышеприведенное описание настоящего изобретения представлено лишь в иллюстративных целях, и в него могут быть внесены модификации, не выходящие за рамки объема и существа изобретения.
В объем настоящего изобретения не входят белки, содержащие любую из 446 последовательностей белка, описанных в WO 99/24578. Как указывалось выше, если длина любой из конкретных последовательностей белка, описанных в WO 99/24578, составляет х аминокислот, то антигенный фрагмент настоящего изобретения имеет, по большей мере, х-1 аминокислот данного белка. В таблице II (см. графические материалы) приводится величина х для каждой из 446 последовательностей белка, приведенных в WO 99/24578.
Реферат
Изобретение относится к иммунологии и биотехнологии. Приведены варианты белков, полученных из Neisseria meningitides, которые имеют свойства антигена и обладают общими антигенными детерминантами. Аминокислотная последовательность представлена в описании. Раскрыты варианты нуклеиновых кислот, кодирующих указанные белки. Описаны варианты фармацевтической композиции, содержащие эффективное количество любого из указанных белков или эффективное количество любой из раскрытых нуклеиновых кислот, кодирующих указанные белки. Фармацевтические композиции применяют в качестве вакцины или иммуногенной композиции для лечения и профилактики инфекции, вызываемой бактерией Neisseria. Фармацевтические композиции применяют как диагностический реагент для обнаружения бактерий Neisseria. Предложен способ лечения инфекции, вызываемой бактерией Neisseria. Использование изобретения позволяет проводить диагностику и профилактику заболевания, опосредованного Neisseria meningitides. 7 н. и 14 з.п. ф-лы, 2 табл.

Комментарии