Множественные варианты менингококкового белка nmb1870 - RU2336091C2
Код документа: RU2336091C2
Чертежи
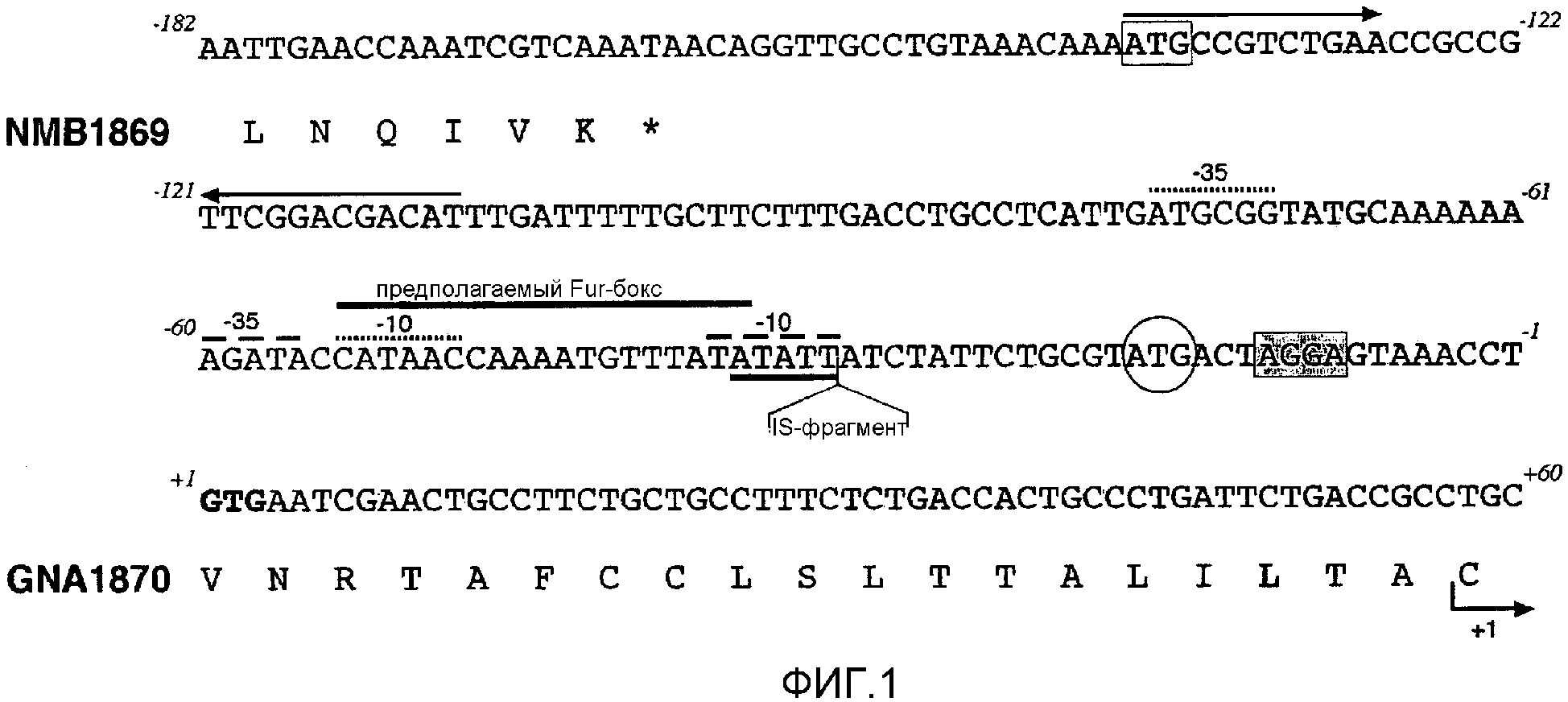

Описание
Все цитируемые здесь документы включены сюда в качестве ссылок во всем своем объеме.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области вакцинации и, в особенности, вакцинации против заболевания, вызываемого патогенными бактериями рода Neisseria, такими как N. meningitidis (менингококк).
УРОВЕНЬ ТЕХНИКИ
Neisseria meningitidis является грамотрицательной инкапсулированной бактерией, которая образует колонии в верхних дыхательных путях приблизительно у 10% популяции человека. Приблизительно в одном случае на каждые 10000 колонизированных человек (или в одном случае на 100000 населения) бактерия выходит в кровоток, где она размножается и вызывает сепсис. Из кровотока бактерия может проникать через гематоэнцефалический барьер и вызывать менингит. Оба заболевания являются очень опасными и могут приводить к смерти 5-15% зараженных детей и молодых взрослых людей в течение нескольких часов, несмотря на наличие эффективных антибиотиков. Вплоть до 25% у тех, кто выживает, остаются долговременные осложнения.
Предупреждение заболевания частично достигается вакцинацией. Иммунизация стала возможной с 1969, когда было обнаружено, что защита от заболевания коррелирует с наличием сывороточных антител, способных вызвать комплементзависимую гибель бактерий, и что очищенный капсульный полисахарид способен вызывать образование данных антител. Несмотря на то, что существуют полисахаридные или конъюгированные вакцины против серогрупп A, C, W135 и Y, данный подход не может применяться против серогруппы B, поскольку капсульный полисахарид представляет собой полимер полисиаловой кислоты, которая является аутоантигеном у людей. Для разработки вакцины против серогруппы B были использованы экспонированные на поверхностность белки, содержащиеся в везикулах наружной мембраны (OMV). Данные вакцины вызывают сывороточные бактерицидные ответы антител и защищают от заболевания, но они не индуцируют перекрестную штаммовую защиту [1].
Полная геномная последовательность N. meningitidis серогруппы B была опубликована [2] и подвергалась анализу для идентификации антигенов для вакцин [3]. Также известна полная геномная последовательность N. meningitidis серогруппы А [4] и доступна полная геномная последовательность штамма FA1090 Neisseria gonorrhoeae [5]. В ссылках с 6 по 9 описаны белки Neisseria meningitidis и Neisseria gonorrhoeae и способы экспрессии данных белков описаны в ссылках с 10 по 12.
Цель данного изобретения заключается в предоставлении дополнительных и улучшенных композиций для получения иммунитета против менингококкового заболевания и/или инфекции, в особенности, против серогруппы B.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
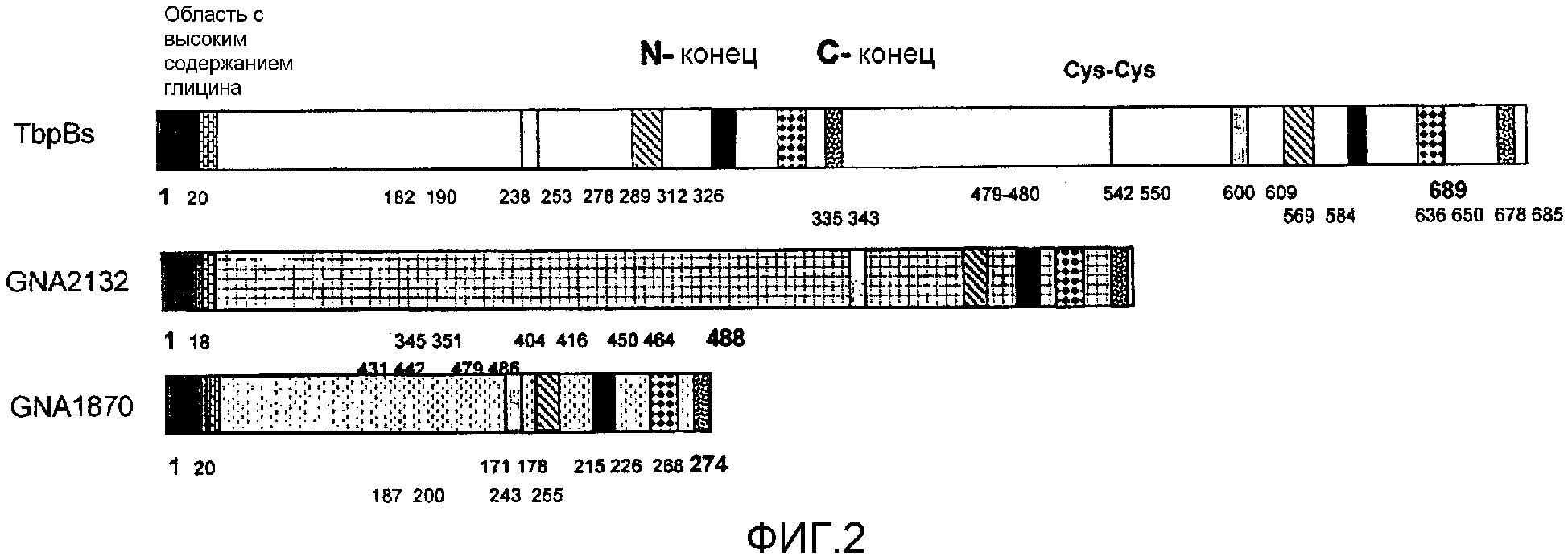
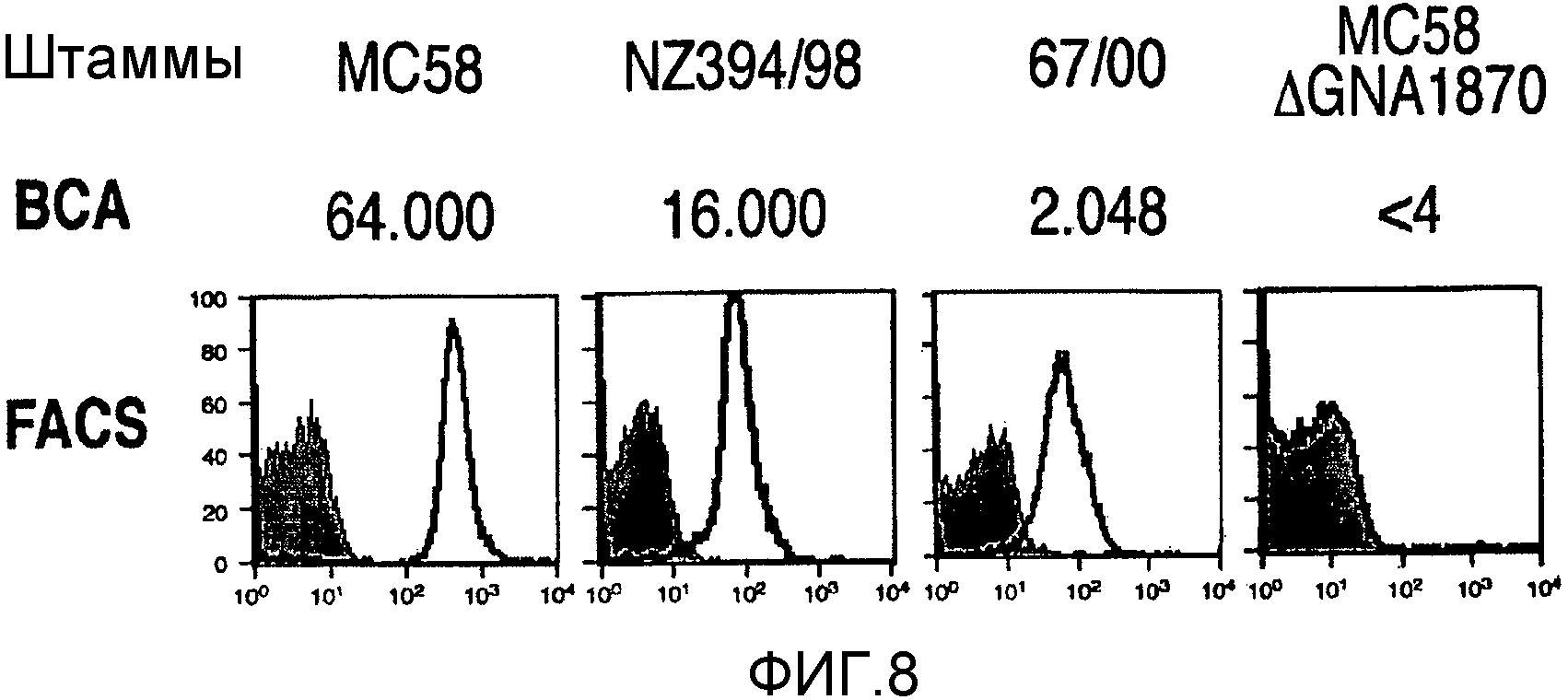
Один из ˜ 2200 белков, описанных в ссылке 2, является «NMB1870». Первоначально белок был описан как белок «741» из штамма MC58 [SEQ ID 2535 и 2536 в ссылке 8; здесь - SEQ ID 1], и также он обозначался как «GNA1870» [следующая ссылка 3] или как «ORF2086» [13].
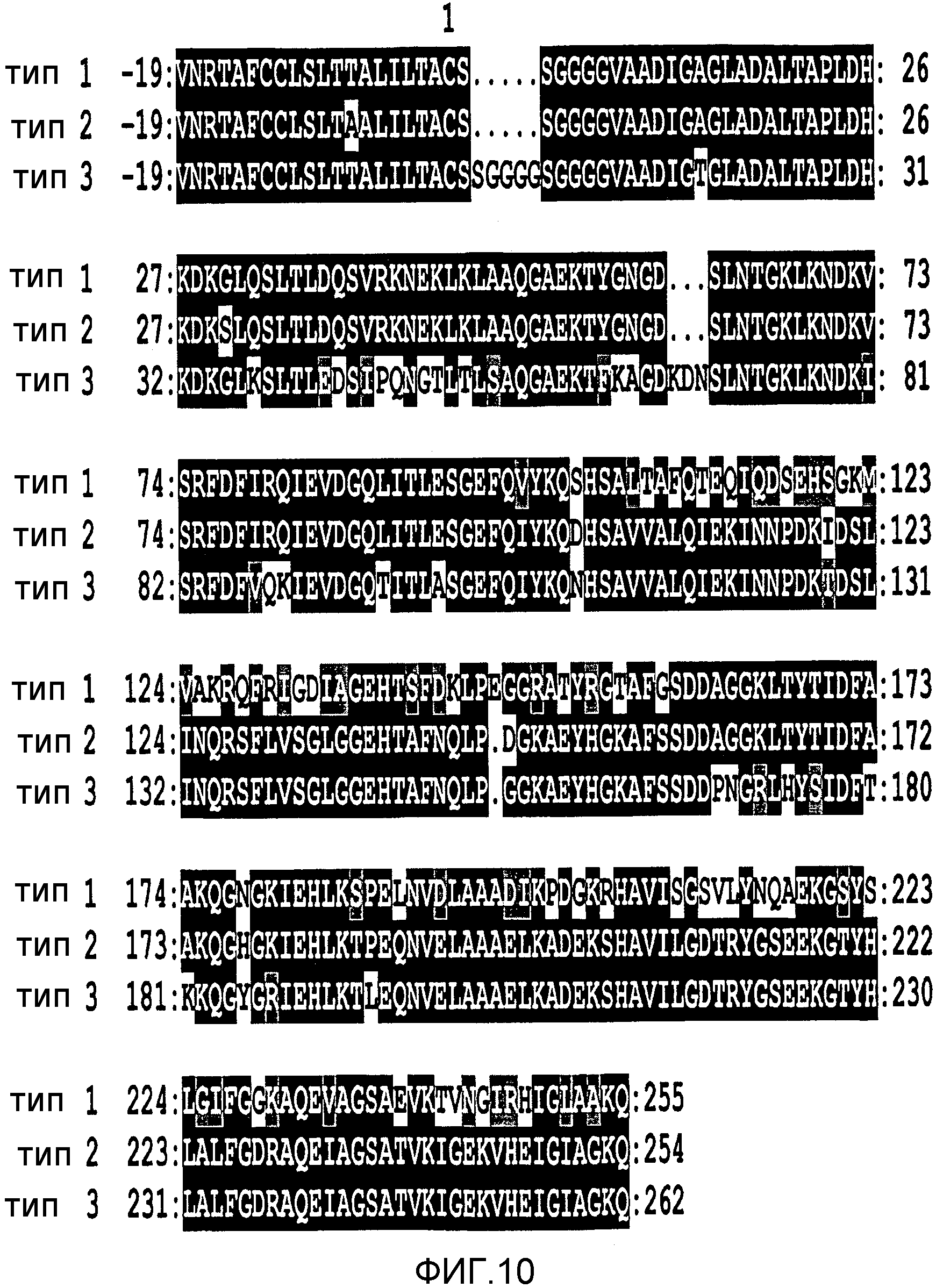
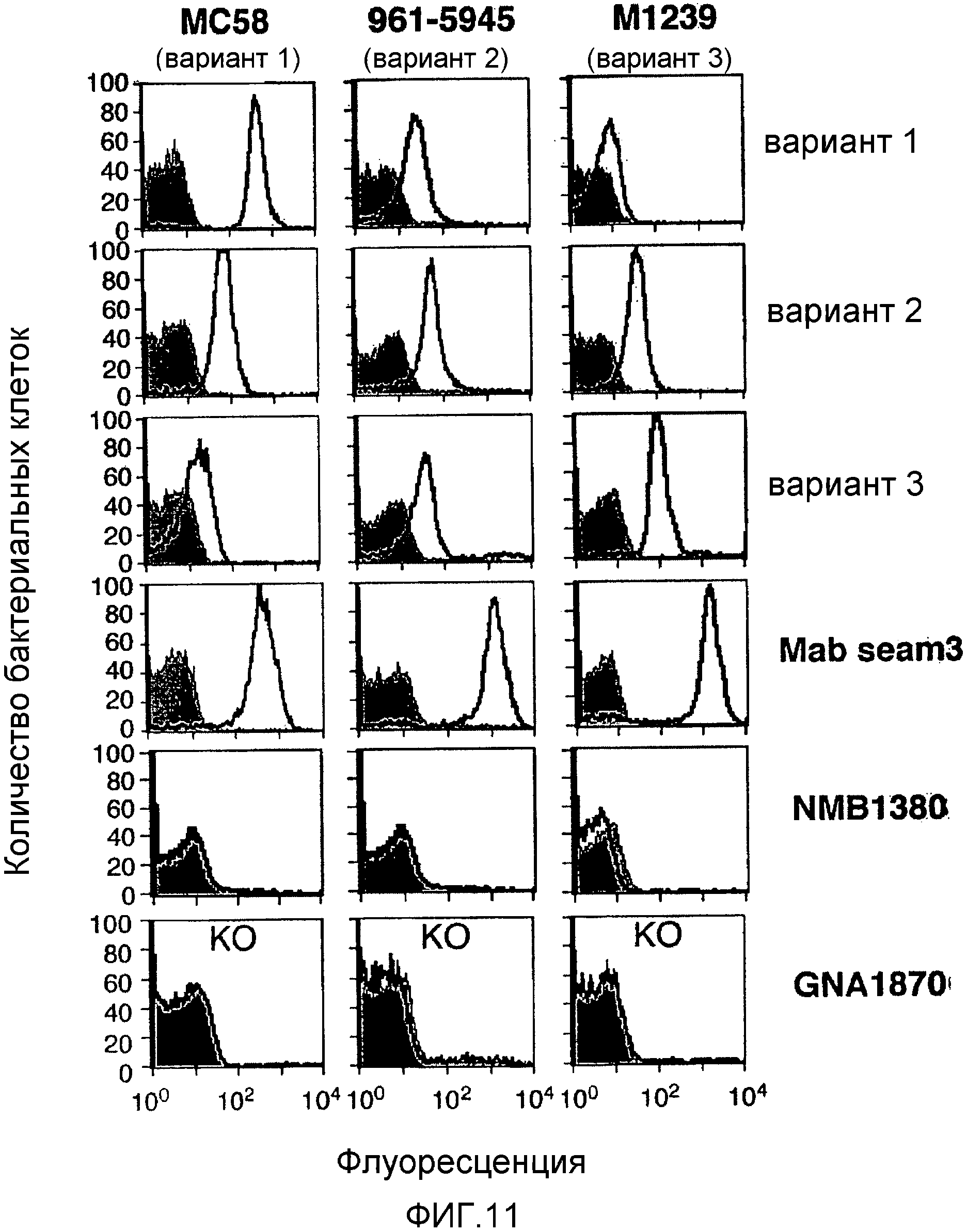
В наши дни было обнаружено, что NMB1870 является чрезвычайно эффективным антигеном, вызывающим противоменингококковые ответы антител, и что он экспрессируется во всех менингококковых серогруппах. NMB1870 был обнаружен во всех менингококковых штаммах, исследованных до настоящего времени. Были определены сорок две различные менингококковые последовательности NMB1870 и было обнаружено, что данные последовательности группируются в три варианта. Кроме того, было обнаружено, что сыворотка, полученная против конкретного варианта, является бактерицидной в пределах той же самой группы варианта, но не является активной против штаммов, которые экспрессируют один из двух других вариантов, то есть существует внутривариантная перекрестная защита, но не межвариантная перекрестная защита.
Поэтому для максимальной перекрестной межштаммовой эффективности следует использовать более одного варианта для иммунизации пациента.
Следовательно, изобретение относится к композиции, содержащей, по крайней мере, два из следующих антигенов:
(а) первый белок, содержащий аминокислотную последовательность, имеющую, по крайней мере, a% идентичности последовательности с SEQ ID 24 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, x следующих одна за другой аминокислот из SEQ ID 24;
(b) второй белок, содержащий аминокислотную последовательность, имеющую, по крайней мере, b% идентичности последовательности с SEQ ID 33 и/или содержащей аминокислотную последовательность, состоящую из фрагмента, по крайней мере, y следующих одна за другой аминокислот из SEQ ID 33; и
(c) третий белок, содержащий аминокислотную последовательность, имеющую, по крайней мере, c% идентичности последовательности с SEQ ID 41 и/или содержащей аминокислотную последовательность, состоящую из фрагмента, по крайней мере, z следующих одна за другой аминокислот из SEQ ID 41.
Изобретение также относится к использованию NMB1870 для получения иммунитета против множества (например, 2, 3, 4, 5 или более) штаммов и/или серогрупп N. meningitidis.
Вариабельность внутри и между (a), (b) и (c)
Величина а составляет, по крайней мере, 85, например 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина b составляет, по крайней мере, 85, например 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина с составляет, по крайней мере, 85, например 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величины a, b и c по сути своей не связаны друг с другом.
Величина x составляет, по крайней мере, 7, например 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250. Величина y составляет, по крайней мере, 7, например 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250. Величина z составляет, по крайней мере, 7, например 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250. Величины x, y и z по сути своей не связаны друг с другом.
Предпочтительно, чтобы любая данная аминокислотная последовательность не попадала в более чем одну из категорий (a), (b) и (c). Любая данная последовательность NMB1870, таким образом, попадет только в одну из категорий (a), (b) и (c). Таким образом, предпочтительно, чтобы: у белка (a) было менее чем i% идентичности последовательности с белком (b); у белка (a) было менее чем j% идентичности последовательности с белком (c); и у белка (b) было менее чем k% идентичности последовательности с белком (c). Величина i составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и представляет собой по большей части a. Величина j составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и представляет собой по большей части b. Величина k составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и представляет собой по большей части c. Величины i, j и k по сути своей не связаны друг с другом.
Следовательно, как пример осуществления изобретения с двумя белками, белок (a) может иметь >85% идентичности последовательности с SEQ ID 24, белок (b) может иметь >85% идентичности последовательности с SEQ ID 33, но белок (a) и (b) имеет менее чем 75% идентичности последовательности относительно друг друга. Следовательно, каждый белок (a) и (b) близко родственны их «прототипным» последовательностям, но они не являются настолько близко родственными друг другу.
Следовательно, как пример осуществления изобретения с тремя белками, белок (a) может иметь >85% идентичности последовательности с SEQ ID 24, белок (b) может иметь >85% идентичности последовательности с SEQ ID 33, белок (c) может иметь >85% идентичности последовательности с SEQ ID 41, но белок (a) и (b) имеют менее чем 75% идентичности последовательности относительно друг друга, белок (a) и (c) имеют менее чем 75% идентичности последовательности относительно друг друга, белок (b) и (c) имеют менее чем 75% идентичности последовательности относительно друг друга.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против, по крайней мере, одного штамма N. meningitidis для каждого из, по крайней мере, двух из нижеследующих трех групп штаммов:
(a) MC58, gb185 (=M01-240185), m4030, m2197, m2937, iss1001, NZ394/98, 67/00, 93/114, bz198, ml390, nge28, lnp17592, 00-241341, f6124, 205900, m198/172, bz133, gb149 (=M01-240149), nm008, nm092, 30/00, 39/99, 72/00, 95330, bz169, bz83, cu385, h44/76, m1590, m2934, m2969, m3370, m4215, m4318, n44/89, 14847.
(b) 961-5945, 2996, 96217, 312294, 11327, a22, gb013(=M01-240013), e32, m1090, m4287, 860800, 599, 95N477, 90-18311, c11, m986, m2671, 1000, m1096, m3279, bz232, dk353, m3697, ngh38, L93/4286.
(c) M1239, 16889, gb355 (=M01-240355), m3369, m3813, ngp165.
Например, смесь может вызывать бактерицидный ответ, эффективный против каждого из штаммов MC58, 961-5945 и M1239 N. meningitidis серогруппы B.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным, по крайней мере, для 50% клинически значимых менингококковых штаммов серогруппы В (например, по крайней мере, 60%, 70%, 80%, 90%, 95% или более).
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.meningitidis серогруппы B и штаммов из, по крайней мере, одной (например, 1, 2, 3, 4) из серогрупп A, C, W135 и Y.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.gonococcus и/или N.cinerea.
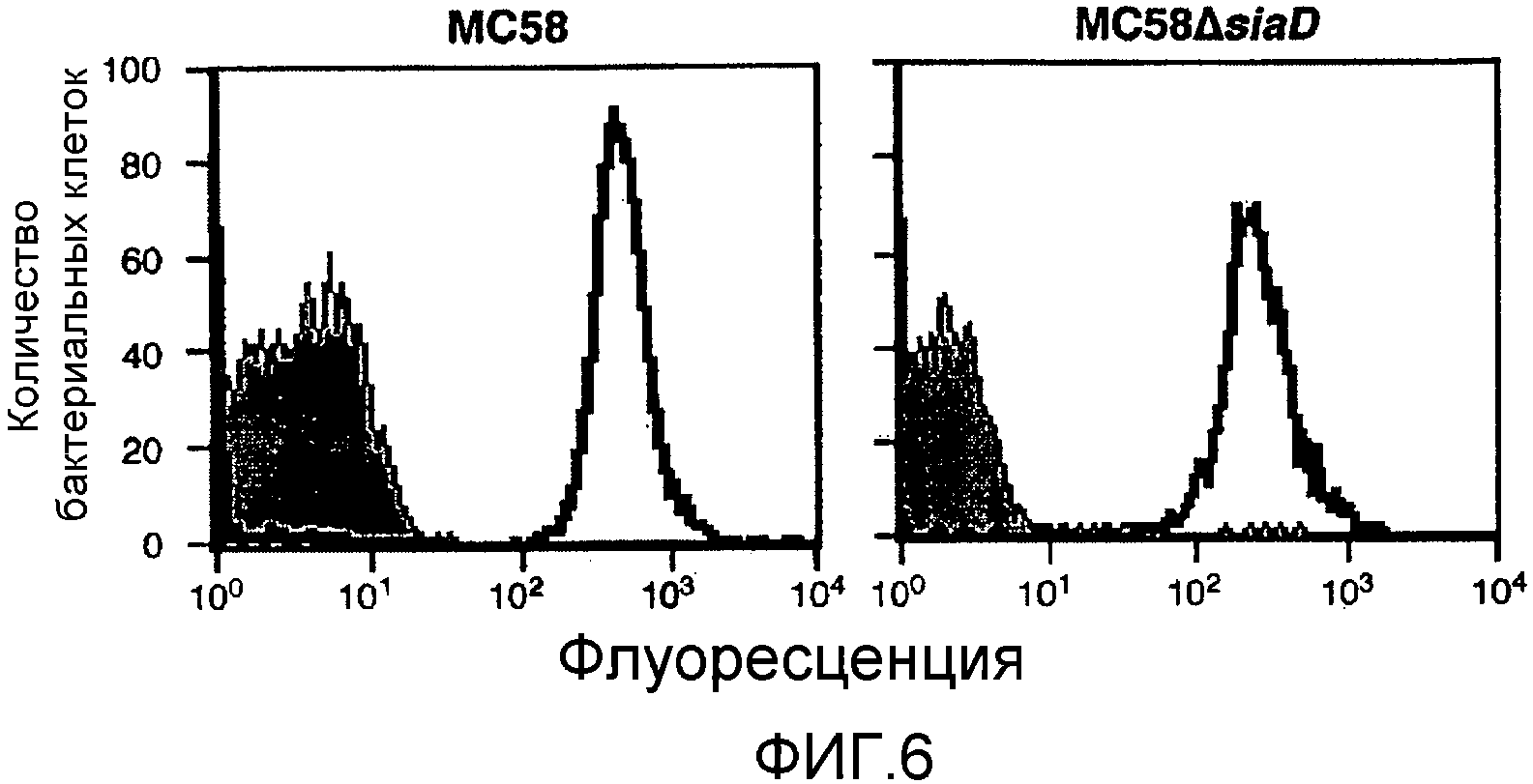
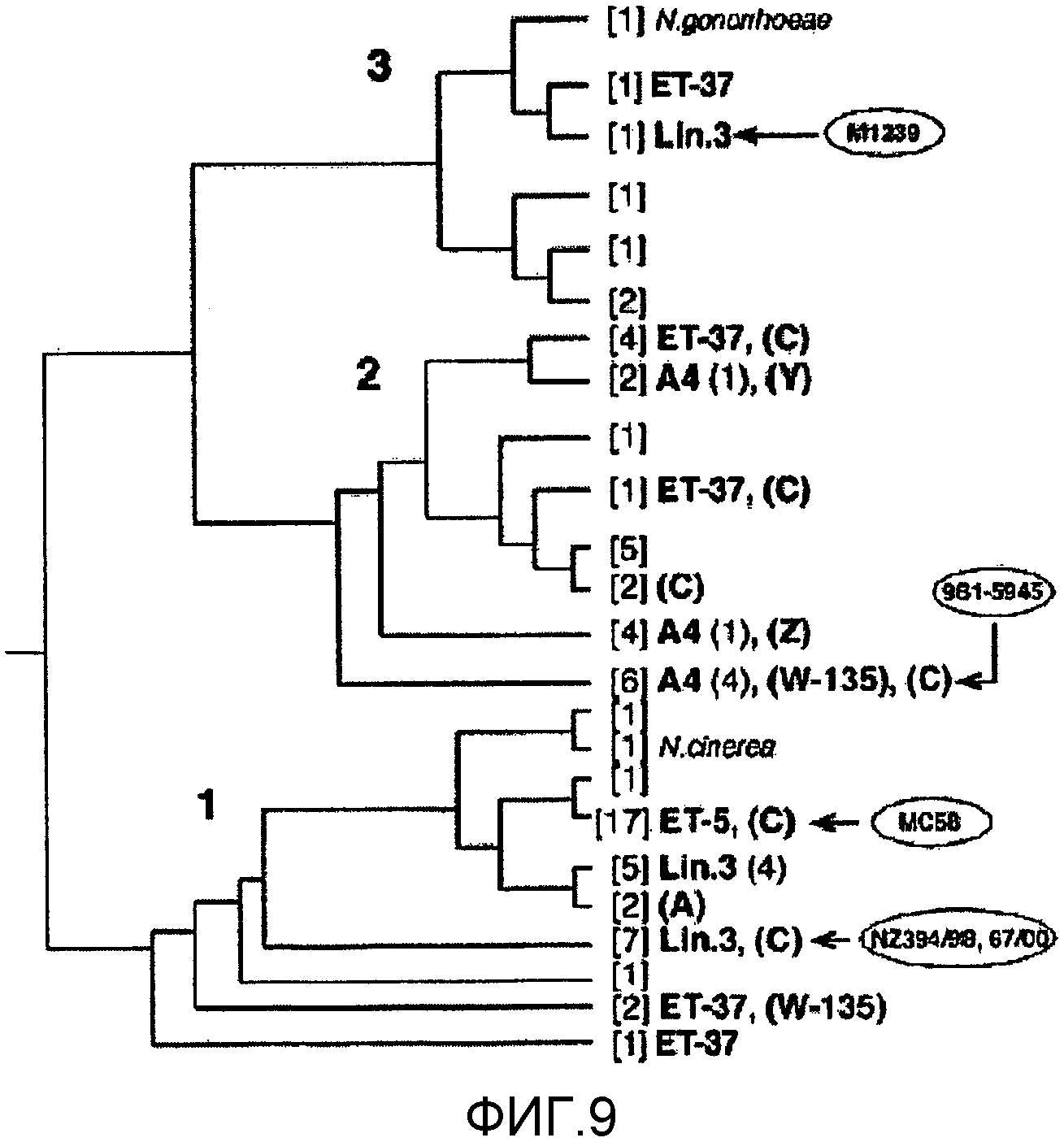
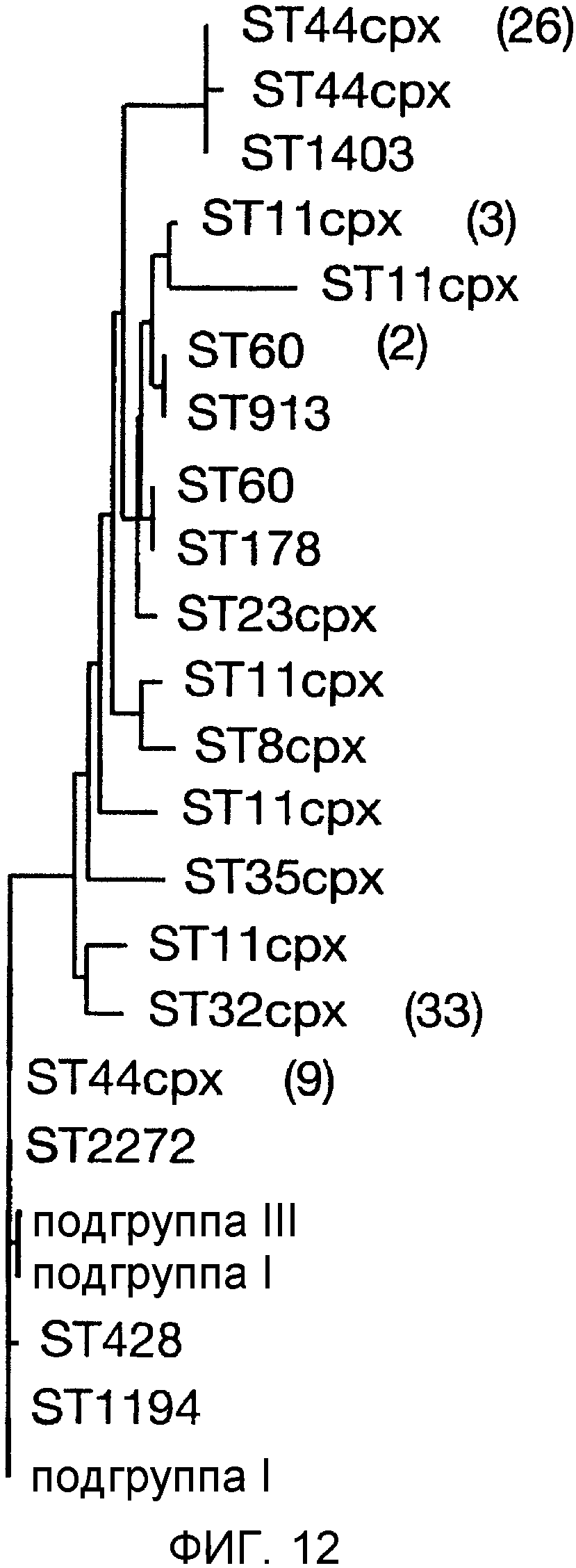
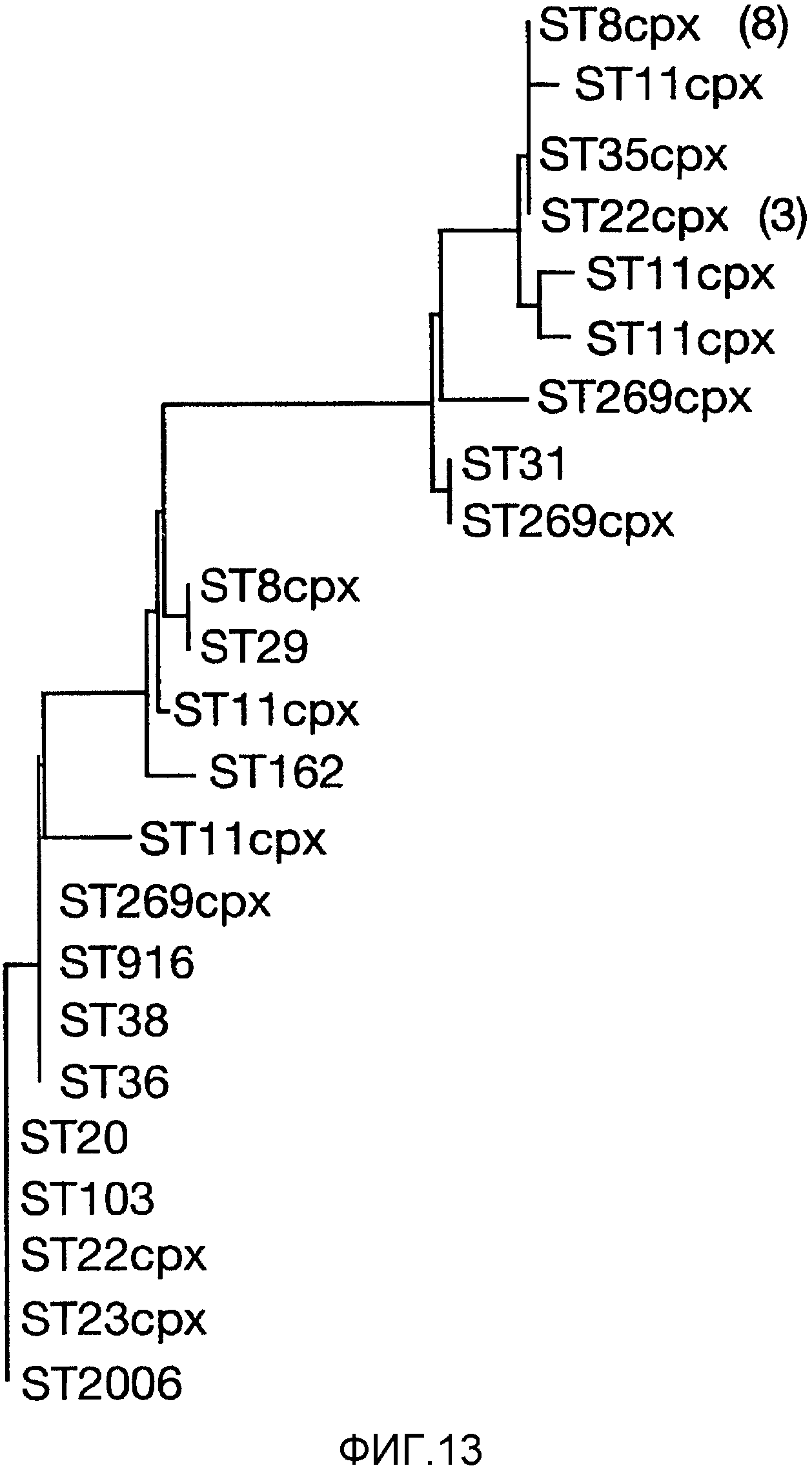
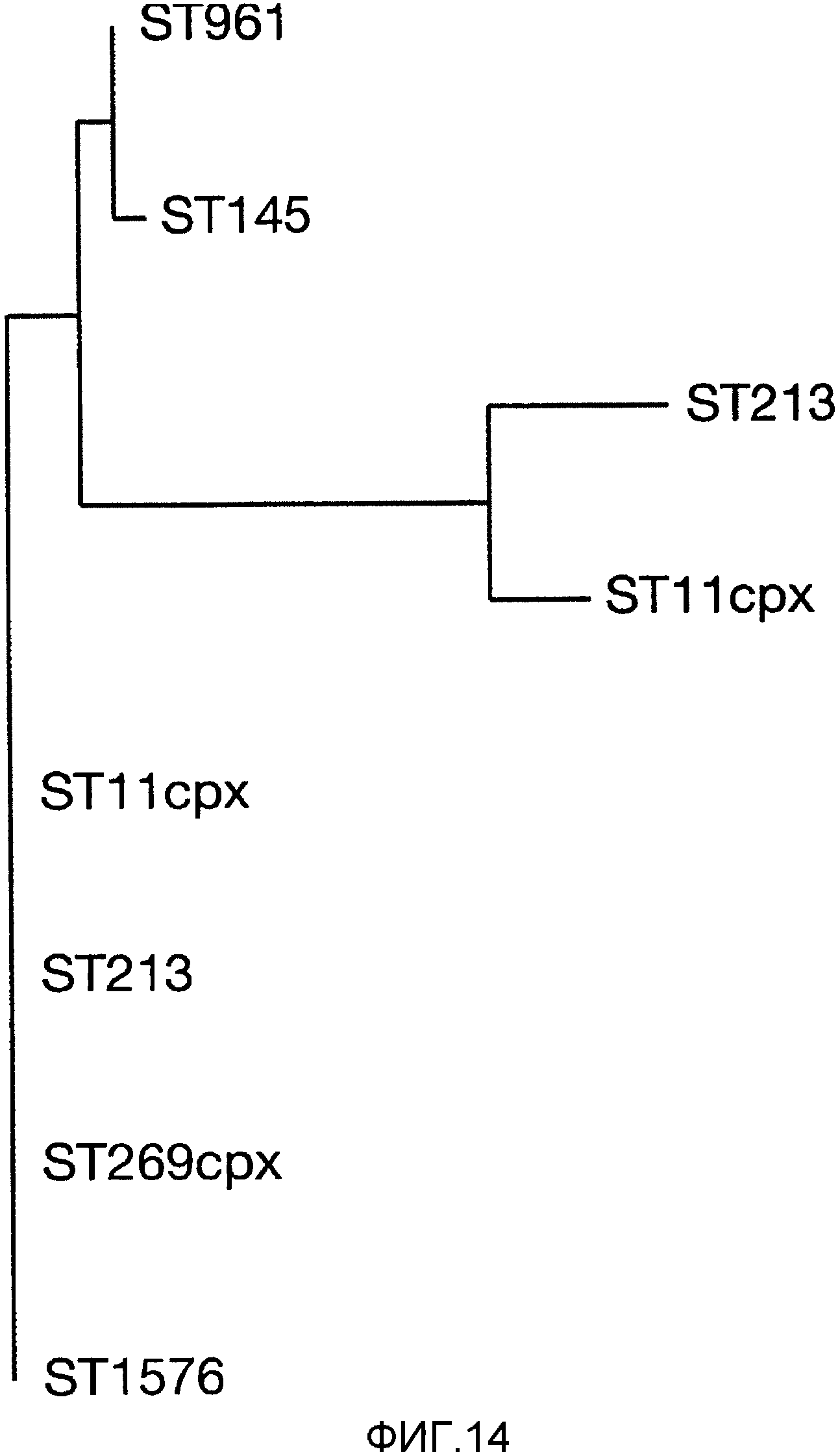
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов, по крайней мере, в двух из трех основных ветвей древовидной схемы, показанной на фигуре 9 (то есть древовидной схемы, полученной при анализе SEQ ID с 1 по 23 при помощи алгоритма Кимуры и Джукса-Кантора).
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.meningitidis, по крайней мере, у 2 (например, 2, 3, 4, 5, 6, 7) гипервирулентных линий ET-37, ET-5, кластера A4, линии 3, подгруппы I, подгруппы III и подгруппы IV-1 [14, 15].
Композиции по изобретению могут дополнительно вызывать бактерицидные иммунные ответы против одной или более гиперинвазивных линий.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.meningitidis, по крайней мере, в 2 (например, 2, 3, 4, 5, 6, 7) из следующих типов мультилокусных последовательностей: ST1, ST4, ST5, ST8, ST11, ST32 и ST41 [16]. Смесь может также вызывать иммунный ответ, который является бактерицидным против штаммов ST44.
Бактерицидные иммунные ответы без труда измеряют у мышей, и они являются стандартными показателями эффективности вакцины [например, смотри заключительное примечание 14 в ссылке 3]. Композиция не обязательно вызывает образование бактерицидных антител против каждого штамма MenB внутри определенных линий или MLST; скорее для любой конкретной группы из четырех или более штаммов менингококка серогруппы В внутри определенной гипервирулентной линии или MLST; антитела, индуцируемые за счет композиции, являются противобактерицидными против по крайней мере 50% (например 60%, 70%, 80%, 90% или более) группы. Предпочтительные группы штаммов будут включать в себя штаммы, выделенные, по крайней мере, в четырех из нижеследующих стран: GB, AU, CA, NO, IT, US, NZ, NL, BR и CU. Предпочтительно сыворотка имеет бактерицидный титр, равный, по крайней мере, 1024 (например, 210, 211, 212, 213, 214, 215, 216, 217, 218или выше, предпочтительно, по крайней мере, 214), то есть сыворотка способна уничтожить, по крайней мере, 50% тестовых бактерий определенного штамма, если она разведена в соотношении 1/1024, например, как описано в заключительном примечании 14 ссылки 3.
Липопротеины
NMB1870 в N.meningitidis по своей природе представляет липопротеин. Также было обнаружено, что он липидизирован при экспрессии в E.coli.
Предпочтительно, чтобы один или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10) белков NMB1870, входящих в композиции по изобретению, являлись липопротеинами.
Изобретение относится к белку, содержащему аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID с 24 по 45 и/или содержащей аминокислотную последовательность, состоящую, по крайней мере, из 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID с 24 по 45 (предпочтительно SEQ ID с 25 по 45), отличающихся тем, что белок является липопротеином.
Предпочтительно липопротеин имеет N-концевой остаток цистеина, к которому липид присоединен ковалентно. Для того чтобы получить липопротеин посредством бактериальной экспрессии, как правило, необходим подходящий N-концевой сигнальный пептид для непосредственной липидизации диацилглицирилтрансферазой, за которой следует расщепление специфичной для липопротеина SPазы (тип II). Наряду с тем, что липопротеин по изобретению может содержать N-концевой цистеин (например, SEQ ID с 24 по 45), он, следовательно, будет являться продуктом посттрансляционной модификации образующегося белка, который обычно содержит N-концевой метионин (например, SEQ ID с 1 по 22).
Липопротеин может быть связан с липидным бислоем и может быть солюбилизирован детергентом.
Последовательности
Белки NMB1870, применимые по изобретению, содержат аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO с 1 по 23 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO с 1 по 23.
Предпочтительные фрагменты включают в себя: (a) фрагменты, которые содержат эпитоп и предпочтительно бактерицидный эпитоп; (b) фрагменты, общие для двух или более SEQ ID с 1 по 23; (c) SEQ ID с 1 по 23 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 110, 120 или более и т.д.) удаленными N-концевыми остатками; (d) SEQ ID с 1 по 23 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) удаленными C-концевыми остатками; и (e) SEQ ID с 1 по 23 без их сигнальных пептидов (например, SEQ ID с 24 по 45). Данные фрагменты не являются взаимно исключающими, например, фрагмент может попадать в категорию (a) и (b) или категорию (c) и (d) и т.д.
Далее белки NMB1870, применимые по изобретению, содержат аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO с 123 по 141, и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO с 123 по 141.
Далее белки NMB1870, применимые по изобретению, содержат аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO с 1 по 252 по ссылке 13 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO с 1 по 252 по ссылке 13. SEQ ID NO 300-302 по ссылке 13 относятся к консенсусным последовательностям, и SEQ ID NO 254-299 являются фрагментами. Предпочтительные фрагменты включают в себя: (a) фрагменты, которые содержат эпитоп и предпочтительно бактерицидный эпитоп; (b) фрагменты, общие для двух или более SEQ ID с 123 по 141; (c) SEQ ID с 123 по 141 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 110, 120 или более и т.д.) удаленными N-концевыми остатками; (d) SEQ ID с 123 по 141 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) удаленными C-концевыми остатками; и (e) SEQ ID с 123 по 141 без их сигнальных пептидов. Данные предпочтительные фрагменты не являются взаимно исключающими, например, фрагмент может попадать в категорию (a) и (b), или категорию (c) и (d) и т.д.
Предпочтительные аминокислотные последовательности с идентичностью <100% с SEQ ID NO с 1 по 23 и с 123 по 141 являются их аллельными вариантами, гомологами, ортологами, паралогами, мутантами и т.д. Предпочтительно, чтобы одно или более отличий в аллельных вариантах, гомологах, ортологах, паралогах или мутантах, по сравнению с SEQ ID NO с 1 по 23 и с 123 по 141, содержали консервативные аминокислотные замены, то есть замены одной аминокислоты на другую, которая имеет похожую боковую цепь. Генетически кодируемые аминокислоты обычно подразделяют на четыре семейства: (1) кислые, то есть аспартат, глутамат; (2) основные, то есть лизин, аргинин, гистидин; (3) неполярные, то есть аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные, то есть глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют вместе в качестве ароматических аминокислот. В основном, замещение единичных аминокислот в пределах данных семейств не имеет большого влияния на биологическую активность.
Предпочтительная подгруппа белков не содержит аминокислотную последовательность TRSKP (SEQ ID NO: 70) или TRSKPV (SEQ ID NO: 71) среди 10 аминокислот N-конца белка. Другая предпочтительная подгруппа белков не содержит аминокислотную последовательность PSEPPFG (SEQ ID NO: 72) среди 10 аминокислот N-конца белка.
Другая предпочтительная подгруппа белков для применения по изобретению содержит аминокислотную последовательность (Gly)n, где n составляет 1, 2, 3, 4 или более, например SEQ ID NO: 73.
Особенность предпочтительных белков по изобретению заключается в их способности вызывать образование бактерицидных противоменингококковых антител после введения животному-хозяину.
Белки можно получить различными способами, например, при помощи химического синтеза (по крайней мере, частично), расщепляя более длинные полипептиды с использованием протеаз, транслируя с РНК, очищая из клеточной культуры (например, при рекомбинантной экспрессии или из культуры N.meningitidis) и т.д. Гетерологичная экспрессия в клетки хозяина E.coli является предпочтительным путем экспрессии (например, штаммы DH5α, BL21с(DE3), BLR и т.д.).
Белки по изобретению можно прикрепить или иммобилизировать на твердой подложке.
Белки по изобретению могут содержать обнаруживаемую метку, например, радиоактивную метку, флуоресцентную метку или биотиновую метку. Это особенно применимо в методиках иммунологического анализа.
Белки могут находиться в различных формах (например, нативной, слитой, гликозилированной, негликозилированной, липидизированной, с дисульфидными мостиками и т.д.). Белки предпочтительно являются менингококковыми белками.
Белки предпочтительно получают в значительной степени очищенными или в значительной степени в выделенном виде (то есть в значительной степени свободными от других белков клеток Neisseria или хозяина). В основном белки получают в неприродном окружении, например, они отделяются от их природного окружения. В некоторых осуществлениях исследуемые белки присутствуют в композициях, которые обогащены белками по сравнению с контролем. По существу, получают очищенные белки, в соответствии с чем, очищенные означает, что белки присутствуют в композиции, которая в значительной степени свободна от других экспрессированных белков, в соответствии с чем, в значительной степени свободные означает, что менее чем 90%, обычно менее чем 60% и наиболее обычно, менее чем 50% композиции дополняют другие экспрессированные белки.
Термин "белок" обозначает аминокислотные полимеры любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может прерываться неаминокислотными элементами. Термины также охватывают аминокислотный полимер, который был модифицирован природно или посредством вмешательства; например, образование дисульфидных связей, гликозилирование, липидизация, ацетилирование, фосфорилирование или любая другая манипуляция или модификация, такая как конъюгация с компонентом мечения. Также попадающими под определение являются, например, белки, содержащие один или более аналогов аминокислот (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области. Белки могут встречаться в качестве единичных цепей или связанных цепей.
Изобретение также относится к белкам, содержащим аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO 77, 79, 82,83, 85, 87, 88, 89, 90, 91, 92, 93 и 94, и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO 77, 79, 82, 83, 85, 87, 88, 89, 90, 91, 92, 93 и 94.
В тех случаях, когда изобретение относится к одному белку NMB1870, изобретение не охватывает белок, содержащий аминокислотную последовательность, как описано в любой из SEQ ID NO: с 1 по 302 ссылки 13. Тем не менее, такие белки могут по выбору использоваться в тех случаях, когда изобретение относится к смесям NMB1870.
Гибридные и тандемные белки
Как упоминалось выше, NMB1870 можно использовать в виде слитого белка, хотя белки также могут экспрессироваться и иначе как слитые белки (например, без GST, MBP, гистидиновой метки или тому подобного).
У слитых белков может быть C-концевой и/или N-концевой партнер слияния. В тех случаях, когда N-концевой партнер слияния используется с SEQ ID с 1 по 23, специалисты поймут, что стартовый кодон (если он содержится) будет экспрессироваться как валин, поскольку GTG транслируется как валин, за исключением тех случаев, когда он используется в качестве стартового кодона, и в этом случае он транслируется как N-формил-метионин.
Подходящие N-концевые партнеры слияния включают в себя лидерные пептиды из других белков (особенно, других липопротеинов), которые можно заменить на природные лидерные пептиды NMB1870 (то есть, последовательность перед N-концевым цистеином можно заменить на другой интересующий лидерный пептид). Примерами являются последовательности, содержащие SEQ ID 46, и лидерная последовательность липопротеина Р4 H.influenzae [например, 17].
Предпочтительный тип слитого белка описан в ссылках 10, 11 и 12, в которых два или более (например, 3, 4, 5, 6 или более) белков Neisseria объединены таким образом, что они транслируются в качестве единой полипептидной цепи. В основном, такие гибридные белки можно представить формулой:
NH2-A-[-X-L-]n-B-COOH,
где X представляет собой аминокислотную последовательность, содержащую последовательность Neisseria, L представляет собой необязательную линкерную аминокислотную последовательность, A представляет собой необязательную N-концевую аминокислотную последовательность, B представляет собой необязательную C-концевую аминокислотную последовательность и n является целым числом, большим, чем 1. Значение n находится между 2 и x, и значение x типично представляет собой 3, 4, 5, 6, 7, 8, 9 или 10. Предпочтительно n равно 2, 3 или 4; более предпочтительно 2 или 3; наиболее предпочтительно n=2.
По настоящему изобретению, по крайней мере, одна из частей -X- представляет собой последовательность NMB1870, как описано выше. В некоторых гибридных белках, обозначаемых как «тандемные» белки, по крайней мере, одна из частей -X- имеет идентичность последовательности, по крайней мере, с одной из других X частей, например, X1 представляет собой SEQ ID NO: 24 и X2 представляет собой SEQ ID NO: 25. Белки, в которых объединены два или три из трех вариантов NMB1870, являются предпочтительными.
Для частей X, отличных от X1, предпочтительно, чтобы нативный лидерный пептид был бы удален, особенно когда X не является последовательностью NMB1870. В одном осуществлении удаляют лидерный пептид за исключением части -X-, расположенной в N-конце гибридного белка, то есть лидерный пептид X1 оставляют, но лидерные пептиды X2...Xn удаляют. Это равнозначно удалению всех лидерных пептидов и использованию лидерного пептида X1 в качестве части -A-.
Предпочтительные последовательности NMB1870 для использования в качестве частей -X- укорочены вплоть до полиглициновой последовательности и включают в себя эту последовательность полиглицинов, обнаруженную около зрелого N-конца, например, последовательность NMB1870 будет начинаться с VAA... (или IAA... для штамма m3813). Такие последовательности NMB1870 включают в себя SEQ ID NO: 80, 81 и 84.
Для каждых n случаев [-X-L-], может присутствовать или отсутствовать линкерная аминокислотная последовательность -L-. Например, если n=2, гибрид может быть NH2-X1-L1-X2-L2-COOH, NH2-X1- -X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH и т.д. Линкерная аминокислотная последовательность (последовательности) -L- типично будут короткими (например, 20 или менее аминокислот, то есть 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя короткие последовательности пептидов, которые облегчают клонирование, полиглициновые линкеры (то есть, Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (то есть Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности будут очевидны специалистам в данной области. Применимым линкером является GSGGGG (SEQ ID NO: 144) с дипептидом Gly-Ser, образованным из сайта рестрикции BamHI, таким образом, облегчающим клонирование и манипуляцию, и тетрапептид Gly4 (SEQ ID NO: 73) представляет собой другой типичный полиглициновый линкер. Другой применимый линкер представляет собой SEQ ID NO: 78.
-A- представляет собой необязательную N-концевую аминокислотную последовательность. Данная последовательность типично является короткой (например, 40 или менее аминокислот, то есть 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя лидерные последовательности для непосредственной миграции белков или короткие последовательности пептидов, которые облегчают клонирование или очистку (например, гистидиновые метки, то есть Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности будут очевидны специалистам в данной области. Если Xl теряет свой N-концевой метионин, то -A- может предоставить такой остаток метионина в транслируемом белке (например, -A- представляет собой один остаток Met). Применимая для экспрессии NMB1870 часть -A- представляет собой SEQ ID NO: 86. В сформировавшихся липопротеинах -A- предпочтительно относится к N-концевому цистеину (например, -A- представляет собой один остаток Cys).
-B- представляет собой необязательную С-концевую аминокислотную последовательность. Данная последовательность типично является короткой (например, 40 или менее аминокислот, то есть 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя последовательности для непосредственной миграции белков, короткие последовательности пептидов, которые облегчают клонирование или очистку (например, содержащие гистидиновые метки, то есть Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более), или последовательности, которые увеличивают стабильность белка. Другие подходящие С-концевые аминокислотные последовательности будут очевидны специалистам в данной области.
У предпочтительного гибридного белка по изобретению одна из X частей представляет собой последовательность «белка 936». Например, где n=2, A=Met, X1 представляет собой последовательность 936 (например, SEQ ID NO: 76, которая является процессированным белком MC58), L1= полиглициновый линкер (например, SEQ ID NO: 144), X2= последовательность NMB1870, в которой N-конец удален вплоть до собственной полиглициновой последовательности и включающему ее в себя, и L2 и B могут отсутствовать. Примером такого гибридного белка является SEQ ID NO: 77, в которой укороченный NMB1870 из штамма m1239 расположен ниже процессированного 936 из штамма MC58. Дальнейшими примерами гибридных белков 936 (штамм 2996) и укороченного NMB1870 (штамм 2996 или M1239) являются SEQ ID NO: 91, 92, 93 и 94.
Предпочтительные тандемные белки, где n=3, могут иметь все три варианта NMB1870 в любом порядке:
Предпочтительные тандемные белки, где n=2, могут иметь два различных варианта NMB1870:
Примерами тандемных белков, где n=2 (два различных варианта NMB1870), являются SEQ ID NO: 79, 82, 83, 85, 87, 88, 89 и 90, которые используют штаммы MC58 (вариант 1), 2996 (вариант 2) и M1239 (вариант 3).
Пример тандемного белка, где n=3, приведен в качестве SEQ ID NO: 142.
NadA
Белок NadA описан в ссылках 191 и 192. В данных ссылках описаны три различные аллели NadA, хотя были обнаружены некоторые минорные варианты, например, штамм ISS1024 серогруппы C имеет вариант аллели 2 с одной делецией семивалентного повтора, оба штамма ISS759 и 973-1720 серогруппы C содержат вариант аллели 3 с одной мутацией аминокислоты в лидерном пептиде и штамм 95330 серогруппы B содержит рекомбинацию аллелей 1 и 2.
При секвинировании NadA из штаммов менингококка Haji была определена SEQ ID NO: 143. Данный белок является рекомбинантом известных аллелей 2 и 3.
Изобретение относится к белку, содержащему аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более, например, 100%) идентичности последовательности с SEQ ID NO: 143 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из SEQ ID NO: 143.
Предпочтительные фрагменты включают в себя: (a) фрагменты, которые содержат эпитоп и предпочтительно бактерицидный эпитоп; (b) фрагменты, общие для SEQ ID NO: 143 и, по крайней мере, одной из последовательностей NadA, описанных в ссылках 191 и 192; (c) SEQ ID NO: 143 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 110, 120 или более и т.д.) удаленными N-концевыми остатками; (d) SEQ ID NO: 143 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) удаленными С-концевыми остатками; и (e) SEQ ID NO: 143 без ее сигнального пептида. Данные фрагменты не являются взаимно исключающими, например, фрагмент может попадать в категорию (a) и (b) или категорию (c) и (d) и т.д.
Предпочтительные аминокислотные последовательности с идентичностью <100% с SEQ ID NO: 143 являются ее аллельными вариантами, гомологами, ортологами, паралогами, мутантами и т.д. Предпочтительно, чтобы одно или более различий в аллельных вариантах, гомологах, ортологах, паралогах или мутантах по сравнению с SEQ ID NO: 143, заключало в себе консервативную аминокислотную замену.
Нуклеиновые кислоты
Изобретение относится к нуклеиновой кислоте, кодирующей белок по изобретению, как описано выше. Изобретение также относится к нуклеиновой кислоте, содержащей: (a) фрагмент, по крайней мере, из n следующих один за другим нуклеотидов из указанной нуклеиновой кислоты, где n составляет 10 или более (например, 12, 14, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500 или более); и/или (b) последовательность, имеющая, по крайней мере, 50% (например, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более) идентичности последовательности с указанной нуклеиновой кислотой.
Более того, изобретение относится к нуклеиновой кислоте, которую можно гибридизовать до нуклеиновой кислоты, кодирующей белок по изобретению, предпочтительно при "строгих" условиях (например, 65°C в 0,1×SSC, 0,5% раствор SDS).
Нуклеиновые кислоты по изобретению можно использовать в реакциях гибридизации (например, нозерн- или саузерн-блотах, или микроматрицах с нуклеиновыми кислотами или «генных чипах») и реакциях амплификации (например PCR, SDA, SSSR, LCR, TMA, NASBA и т.д.) и других методиках с нуклеиновыми кислотами.
Нуклеиновые кислоты по изобретению можно получить множеством способов, например, полностью или частично при помощи химического синтеза, расщепляя более длинные полинуклеотиды с использованием нуклеаз (например, рестрикционные ферменты), из геномных библиотек или библиотек кДНК, из самих бактерий и т.д.
Нуклеиновые кислоты по изобретению могут принимать различные формы, например, одноцепочечные, двуцепочечные, векторы, праймеры, зонды, меченные, не меченные и т.д.
Нуклеиновые кислоты по изобретению предпочтительно представляют собой выделенные или в значительной степени выделенные формы.
Изобретение охватывает нуклеиновую кислоту, содержащую последовательности, комплементарные последовательностям, описанным выше, например, для антисмысловых последовательностей или зондов или для использования в качестве праймеров.
Термин «нуклеиновая кислота» охватывает ДНК и РНК, и также их аналоги, такие как аналоги, содержащие модифицированные основные цепи и также пептидные нуклеиновые кислоты (PNA) и т.д.
Нуклеиновая кислота по изобретению может быть меченной, например, радиоактивной или флуоресцентной меткой. Это особенно применимо, когда нуклеиновая кислота должна использоваться в методиках определения нуклеиновых кислот, например, где нуклеиновая кислота представляет собой праймер или зонд при использовании в таких методах, как PCR, LCR, TMA, NASBA и т.д.
Изобретение также относится к векторам, содержащим нуклеотидные последовательности по изобретению (например, клонирующие или экспрессирующие вектора, такие как вектора, подходящие для иммунизации нуклеиновыми кислотами), и к клеткам хозяина, трансформированным такими векторами.
Дополнительные антигенные компоненты
Композиции по изобретению включают в себя небольшое количество (например, меньше чем t антигенов, где t составляет 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4 или 3) очищенных антигенов серогруппы B. Особенно предпочтительно, чтобы композиция не включала в себя сложные или неопределенные смеси антигенов, например, предпочтительно не включать в композицию везикулы наружной мембраны. Антигены предпочтительно экспрессируют в гетерологичном хозяине и затем очищают.
Композиция по изобретению включает в себя, по крайней мере, два различных белка NMB1870. Она может также включать в себя другой антиген Neisseria, так как вакцина, которая нацелена на более чем один антиген на бактерию уменьшает возможность селекции ускользающих мутантов. Антигены Neisseria для добавления в композиции включают в себя белки, содержащие:
(a) 446 четных SEQ ID (то есть 2, 4, 6,..., 890, 892), описанных в ссылке 6;
(b) 45 четных SEQ ID (то есть 2, 4, 6,..., 88, 90), описанных в ссылке 7;
(c) 1674 четных SEQ ID 2-3020, четных SEQ ID 3040-3114, и всех SEQ ID 3115-3241, описанных в ссылке 8;
(d) 2160 аминокислотных последовательностей с NMB0001 по NMB2160 из ссылки 2;
(e) аминокислотную последовательность, описанную в ссылке 10, 11 или 12;
(f) вариант, гомолог, ортолог, паралог, мутант и т.д. от (a) до (e), или
(g) везикулы наружной мембраны, полученные из N.meningitidis [например, смотри ссылку 139].
Дополнительно к антигенам из Neisseria композиция может включать в себя антигены для иммунизации против других заболеваний или инфекций. Например, композиция может включать в себя один или более из следующих далее антигенов:
- антигены из Helicobacter pylori, такие как CagA [с 18 по 21], VacA [22, 23], NAP [24, 25, 26], HopX [например 27], HopY [например 27] и/или уреаза.
- сахаридный антиген из N. meningitidis серогруппы А, C, W135 и/или Y, такой как олигосахарид, описанный в ссылке 28 из серогруппы C [смотри также ссылку 29] или олигосахарид ссылки 30
- сахаридный антиген из Streptococcus pneumoniae [например, 31, 32, 33].
- антиген из вируса гепатита A, такой как инактивированный вирус [например, 34, 35].
- антиген из вируса гепатита В, такой как поверхностный и/или центральный антигены [например, 35, 36].
- дифтерийный антиген, такой как дифтерийный анатоксин [например, глава 3 ссылки 37], например, мутант CRM197 [например, 38].
- столбнячный антиген, такой как столбнячный анатоксин [например, глава 4 ссылки 37].
- антиген из Bordetella pertussis, такой как коклюшный голотоксин (PT) и фимбриальный гемагглютинин (FHA) из B.pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 39 и 40].
- сахаридный антиген из Haemophilus influenzae B [например, 29].
- антиген из вируса гепатита С [например, 41].
- антиген из N.gonorrhoeae [например, 6, 7, 8, 42].
- антиген из Chlamydia pneumoniae [например, ссылки с 43 по 49].
- антиген из Chlamydia trachomatis [например, 50].
- антиген из Porphyromonas gingivalis [например, 51].
- антиген (антигены) полиомиелита [например, 52,53], такой как IPV.
- антиген (антигены) бешенства [например, 54], такой как лиофилизированный инактивированный вирус [например, 55, RabAvertTM].
- антигены кори, свинки и/или краснухи [например, главы 9, 10 и 11 ссылки 37].
- антиген (антигены) гриппа [например, глава 19 ссылки 37], такие как поверхностные белки гемагглютинин и/или нейраминидаза.
- антиген из Moraxella catarrhalis [например, 56].
- белковый антиген из Streptococcus agalactiae (стрептококк группы B) [например, 57, 58].
- сахаридный антиген из Streptococcus agalactiae (стрептококк группы B).
- антиген из Streptococcus pyogenes (стрептококк группы А) [например, 58, 59, 60].
- антиген из Staphylococcus aureus [например, 61].
- антиген из Bacillus anthracis [например, 62, 63, 64].
- антиген из вируса семейства flaviviridae (род flavivirus), такой как из вируса желтой лихорадки, вируса японского энцефалита, четырех серотипов вируса денге, вируса клещевого энцефалита, вируса энцефалита Западного Нила.
- антиген пестивируса, такой как из классического вируса свиной лихорадки, вируса бычьей вирусной диареи и/или вируса пограничной болезни овец.
- антиген парвовируса, например, из парвовируса B 19.
- прионовый белок (например, прионовый белок CJD)
- амилоидный белок, такой как пептид бета [65]
- раковый антиген, такой как антигены, перечисленные в таблице 1 ссылки 66 или в таблицах 3 и 4 ссылки 67.
Композиция может содержать один или более из данных дополнительных антигенов.
Токсичные белковые антигены, когда необходимо, можно подвергнуть детоксикации, (например, детоксикация коклюшного токсина химическими и/или генетическими способами [40]).
Когда в композицию включен дифтерийный антиген, предпочтительно также включать в нее столбнячный антиген и антиген коклюша. Схожим образом, когда включен столбнячный антиген, предпочтительно также включать дифтерийный антиген и антиген коклюша. Схожим образом, когда включен антиген коклюша, предпочтительно также включать дифтерийный и столбнячный антигены. Таким образом, комбинации DTP являются предпочтительными.
Антигены сахаридов предпочтительно находятся в виде конъюгатов. Белки-носители для конъюгатов включают в себя белки наружной мембраны N.meningitidis [68], синтетические пептиды [69, 70], белки теплового шока [71, 72], коклюшные белки [73, 74], белок D из H.influenzae [75], цитокины [76], лимфокины [76], стрептококковые белки, гормоны [76], факторы роста [76], токсин A или B из C.difficile [77], белки, захватывающие железо [78], и т.д. Предпочтительным белком-носителем является дифтерийный анатоксин CRM197 [79].
Антигены в композиции типично будут присутствовать в концентрации, по крайней мере, 1мкг/мл каждый. В основном, концентрации любого данного антигена будет достаточно для того, чтобы вызвать иммунный ответ против антигена.
Иммуногенные композиции по изобретению можно использовать терапевтически (то есть для лечения существующей инфекции) или профилактически (то есть для предупреждения развития инфекции в будущем).
В качестве альтернативы использования антигенов белков в иммуногенных композициях по изобретению можно использовать нуклеиновую кислоту (предпочтительно ДНК, например, в виде плазмиды), кодирующую антиген.
Особенно предпочтительные композиции по изобретению включают в себя один, два или три из: (a) сахаридных антигенов из менингококков серогрупп Y, W135, C и (необязательно) A; (b) сахаридного антигена из Haemophilus influenzae типа B; и/или (c) антигена из Streptococcus pneumoniae.
Менингококк серогрупп Y, W135, C и (необязательно) A
Полисахаридные вакцины против серогрупп A, C, W135 и Y были известны много лет. Данные вакцины (MENCEVAX ACWYTM и MENOMUNETM) основаны на капсульном полисахариде организма и, хотя они эффективны для подростков и взрослых людей, они дают слабый иммунный ответ и кратковременную защиту у детей, и их невозможно использовать у детей.
В отличие от неконъюгированных полисахаридных антигенов в таких вакцинах, недавно одобренные вакцины серогруппы С (MenjugateTM [80, 28], MeningitecТМ и NeisVac-CTM) содержат конъюгированные сахариды. В MenjugateTM и MeningitecТМолигосахаридные антигены конъюгированы с носителем CRM197, в то время как в NeisVac-CTM используется полный полисахарид (де-O-ацетилированный), конъюгированный с носителем столбнячным анатоксином. Предложенная вакцина MenActraTM содержит конъюгированные капсульные сахаридные антигены из каждой серогуппы Y, W135, C и A.
Композиции по настоящему изобретению предпочтительно включают в себя капсульные сахаридные антигены из одной или более менингококковых серогрупп Y, W135, C и (необязательно) A, где антигены конъюгированны с белком(белками)-носителем и/или представляют собой олигосахариды. Например, композиция может включать в себя капсульный сахаридный антиген из: серогруппы C; серогрупп A и C; серогрупп A, C и W135; серогрупп A, C и Y; серогрупп C, W135 и Y; или из всех четырех серогрупп A, C, W135 и Y.
Типичное количество каждого менингококкового сахаридного антигена на дозу находится в диапазоне между 1 мкг и 20 мкг, например, приблизительно 1 мкг, приблизительно 2,5 мкг, приблизительно 4 мкг, приблизительно 5 мкг или приблизительно 10 мкг (выраженного как сахарид).
В тех случаях, когда смесь содержит капсульные сахариды из обеих серогрупп A и C, соотношение (мас./мас.) сахарид MenA:сахарид MenC может быть больше, чем 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). В тех случаях, когда смесь содержит капсульные сахариды из серогруппы Y и одной или обеих серогрупп C и W135, соотношение (мас./мас.) сахарид MenY:сахарид MenW135 может быть больше, чем 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше), и/или чтобы соотношение (мас./мас.) сахарид MenY:сахарид MenC могло быть меньше, чем 1 (например, 1:2, 1:3, 1:4, 1:5 или ниже). Предпочтительными соотношениями (мас./мас.) для сахаридов из серогрупп A:C:W135:Y являются: 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2 и 2:2:2:1. Предпочтительными соотношениями (мас./мас.) для сахаридов из серогрупп C:W135:Y являются: 1:1:1; 1:1:2; 1:1:1; 2:1:1; 4:2:1; 2:1:2; 4:1:2; 2:2:1 и 2:1:1. Использование в значительной степени равных масс каждого сахарида является предпочтительным.
Капсульные сахариды в основном будут использоваться в виде олигосахаридов. Их без труда получают при фрагментации очищенного капсульного полисахарида (например, при гидролизе), которая обычно будет сопровождаться очищением фрагментов необходимого размера.
Фрагментацию полисахаридов предпочтительно проводят для того, чтобы конечная средняя степень полимеризации (DP) олигосахаридов была менее чем 30 (например, между 10 и 20, предпочтительно около 10 для серогруппы A; между 15 и 25 для серогрупп W135 и Y, предпочтительно приблизительно 15-20; между 12 и 22 для серогруппы C; и т.д.). DP можно без труда измерить с помощью ионобменной хроматографии или колориметрического анализа [81].
Если проводят гидролиз, то гидролизаты, в основном, сортируют по размеру для того, чтобы удалить короткие олигосахариды [29]. Этого можно добиться различными способами, такими как ультрафильтрация, сопровождаемая ионообменной хроматографией. Для серогруппы A предпочтительно удаляют олигосахариды со степенью полимеризации меньше чем или равной приблизительно 6, для серогрупп W135 и Y удаляют олигосахариды со степенью полимеризации меньше, чем приблизительно 4.
Предпочтительные сахаридные антигены MenC описаны в ссылке 80 в качестве используемых в MenjugateТМ.
Сахаридный антиген можно химически модифицировать. Данный способ особенно применим для уменьшения гидролиза в серогруппе A [82; смотри ниже]. Можно провести де-О-ацетилирование менингококковых сахаридов. Для олигосахаридов модификации могут иметь место до или после деполимеризации.
В тех случаях, когда композиция по изобретению включает в себя сахаридный антиген MenA, антиген предпочтительно представляет собой модифицированный сахарид, в котором одна или более гидроксильных групп на природном сахариде заменена/заменены на блокирующую группу [82]. Данная модификация улучшает устойчивость к гидролизу.
Количество моносахаридных единиц, содержащих блокирующие группы, может меняться. Например, все или почти все моносахаридные единицы могут содержать блокирующие группы. Альтернативно, по крайней мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% моносахаридных единиц могут содержать блокирующие группы. По крайней мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 моносахаридных единиц могут содержать блокирующие группы.
Подобным образом может изменяться количество блокирующих групп на моносахаридной единице. Например, количество блокирующих групп на моносахаридной единице может составлять 1 или 2. Блокирующие группы, в основном, будут находиться в 4 положении и/или в 3 положении моносахаридных единиц.
Концевая моносахаридная единица может содержать или может не содержать блокирующую группу вместо ее природного гидроксила. Предпочтительно сохранить свободную аномерную гидроксильную группу на концевой моносахаридной единице, для того чтобы обеспечить проведение дальнейших реакций (например, конъюгации). Восстановительным аминированием (используя, например, NaBH3CN/NH4Cl) можно превратить аномерные гидроксильные группы в аминогруппы (-NH2 или -NH-E, где E представляет собой защитную группу азота), и затем можно их обратно восстановить, после того, как гидроксильные группы будут превращены в блокирующие.
Блокирующие группы для замены гидроксильных групп могут быть доступны непосредственно посредством реакции дериватизации гидроксильных групп, то есть при замене атома водорода гидроксильной группы на другую группу.
Подходящими производными гидроксильных групп, которые действуют в качестве блокирующих групп, являются, например, карбаматы, сульфонаты, карбонаты, сложные эфиры, простые эфиры (например, силиловые эфиры или алкиловые эфиры) и ацетали. Некоторые определенные примеры таких блокирующих групп представляют собой аллил, Aloc, бензил, BOM, t-бутил, тритил, TBS, TBDPS, TES, TMS, TIPS, PMB, MEM, MOM, MTM, THP и т.д. Другие блокирующие группы, которые непосредственно недоступны и которые полностью замещают гидроксильную группу, представляют собой C1-12-алкил, C3-12-алкил, C5-12-арил, C5-12-арил-C1-6-алкил, NR1R2 (R1 и R2 определены в следующем абзаце), H, F, Cl, Br, CO2H, CO2(C1-6-алкил), CN, CF3, CCl3 и т.д. Предпочтительными блокирующими группами являются электроноакцепторные группы.
Предпочтительные блокирующие группы представлены формулой: -O-X-Y или -OR3, где: X представляет собой C(O), S(O) или SO2; Y представляет собой C1-12-алкил, C1-12-алкокси, C3-12-циклоалкил, C5-12-арил или C5-12-арил-C1-6-алкил, каждый из которых необязательно может быть замещен 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2H, CO2(C1-6-алкила), CN, CF3 или CCl3; или Y представляет собой NR1R2; R1 и R2 независимо выбраны из H, C1-12-алкила, C3-12-циклоалкила, C5-12-арила, C5-12-арил-C1-6-алкила; или R1 и R2 можно объединить для образования C3-12-насыщенных гетероциклических групп; R3 представляет собой C1-12-алкил или C3-12-циклоалкил, каждый из которых необязательно может быть замещен 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2(C1-6-алкила), CN, CF3 или CCl3 или R3 представляет собой C5-12-арил или C5-12-арил-C1-6-алкил, каждый из которых необязательно может быть замещен 1, 2, 3, 4 или 5 группами, независимо выбранными из F, Cl, Br, CO2H, CO2(C1-6-алкила), CN, CF3 или CCl3. Если R3 представляет собой C1-12-алкил или C3-12-циклоалкил, он обычно замещен 1, 2 или 3 группами, как определено выше. Если R1 и R2объединяют для образования C3-12-насыщенных гетероциклических групп, то это значит, что R1 и R2вместе с атомом азота образуют насыщенную гетероциклическую группу, содержащую любое количество атомов углерода в диапазоне между 3 и 12 (например, C3, C4, C5, C6, C7, C8, C9, C10, C11, C12). Гетероциклическая группа может содержать 1 или 2 гетероатома (таких, как N, O или S), кроме атома азота. Примерами C3-12-насыщенных гетероциклических групп являются пирролидинил, пиперидинил, морфолинил, пиперазинил, имидазолидинил, азетидинил и азиридинил.
Блокирующие группы -O-X-Y или -OR3можно получить из -OH-групп стандартным способом получения производных соединений, такой как реакция гидроксильной группы с ацилгалогенидом, алкилгалогенидом, сульфонилгалогенидом и т.д. Однако атом кислорода в -O-X-Y предпочтительно представляет собой атом кислорода гидроксильной группы, в то время как группа -X-Y в -O-X-Y предпочтительно заменяет атом водорода гидроксильной группы.
Альтернативно, блокирующие группы могут быть доступны посредством реакции замещения, такой как Mitsonobu-тип замещения. Данные и другие способы получения блокирующих групп из гидроксильных групп хорошо известны.
Более предпочтительно, блокирующая группа представляет собой -OC(О)CF3 [83], или карбаматную группу -OC(O)NR1R2, где R1 и R2 независимо выбраны из C1-6-алкила. Более предпочтительно, группы R1 и R2 обе представляют собой метил, то есть блокирующей группой является -OC(O)NMe2. Карбаматные блокирующие группы имеют стабилизирующее влияние на гликозидную связь и ее можно получить в мягких условиях.
Предпочтительные модифицированные сахариды MenA содержат n моносахаридных единиц, где, по крайней мере, h% моносахаридных единиц не имеют -OH групп ни в положении 3, ни в положении 4. Величина h составляет 24 или более (например, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 98, 99 или 100) и предпочтительно составляет 50 или более. Отсутствующие -OH группы являются предпочтительными для блокирующих групп, как определено выше.
Другие предпочтительные модифицированные сахариды MenA содержат моносахаридные единицы, в которых, по крайней мере, s моносахаридных единиц не имеют -OH групп в положении 3 и не имеют -OH групп в положении 4. Величина s составляет, по крайней мере, 1 (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90). Отсутствующие -OH группы являются предпочтительными для блокирующих групп, как определено выше.
Подходящие модифицированные сахариды MenA для использования по изобретению имеют формулу:
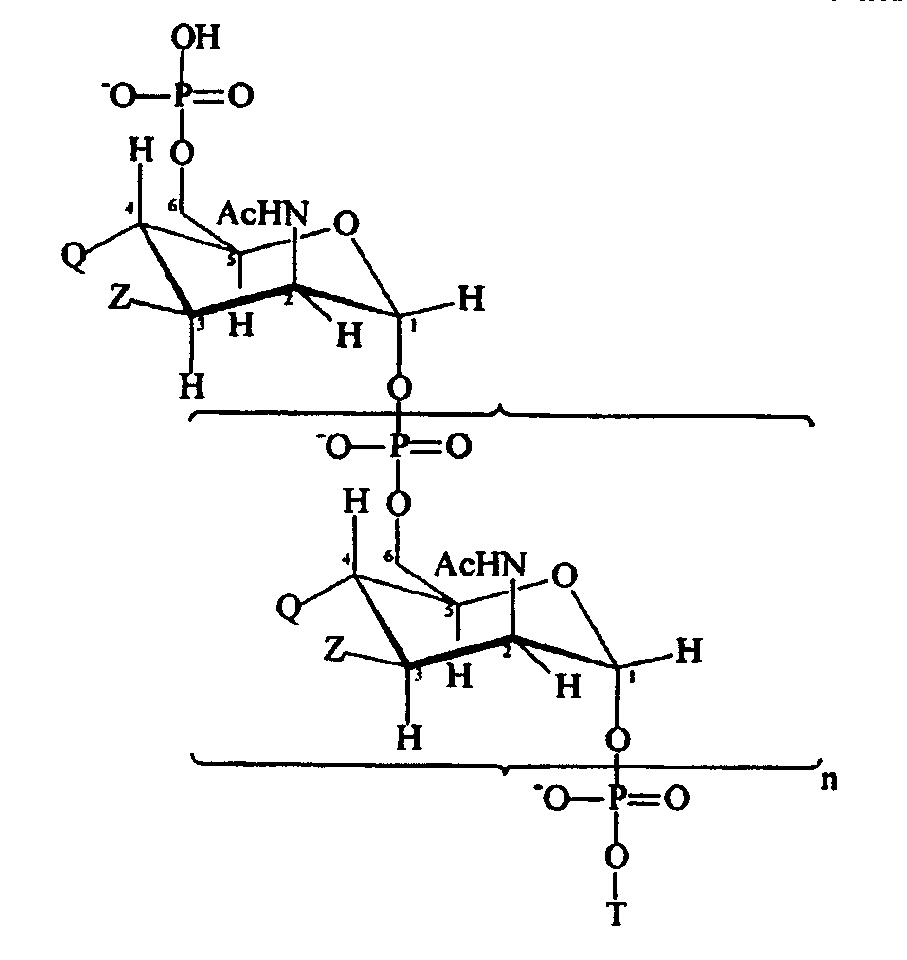
где n является целым числом от 1 до 100 (предпочтительно целым числом от 15 до 25);
T представлен формулой (A) или (B):
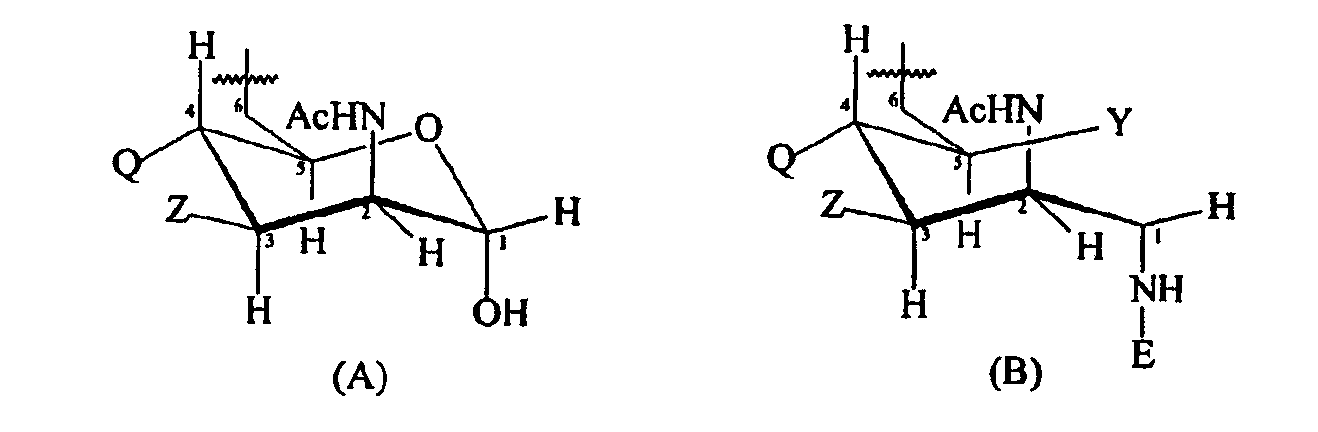
каждая группа Z независимо выбрана из OH или блокирующей группы, как определено выше; и каждая группа Q независимо выбрана из OH или блокирующей группы, как определено выше;
Y выбран из OH или блокирующей группы, как определено выше;
E представляет собой H или защитную группу азота;
и где более, чем приблизительно 7% (например, 8%, 9%, 10% или более) групп Q являются блокирующими группами.
Каждые из n+2 групп Z могут быть теми же самыми или отличаться друг от друга. Аналогично каждые из n+2 групп Q могут быть теми же самыми или отличаться друг от друга. Все группы Z могут представлять собой OH. Альтернативно, по крайней мере, 10%, 20%, 30%, 40%, 50% или 60% групп Z могут представлять собой OAc. Предпочтительно приблизительно 70% групп Z представляют собой OAc, причем оставшиеся группы Z представляют собой OH или блокирующие группы, как определено выше. По крайней мере, приблизительно 7% групп Q являются блокирующими группами. Предпочтительно, по крайней мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или даже 100% групп Q являются блокирующими группами.
Менингококковые капсульные полисахариды типично получают способом, охватывающим стадии осаждения полисахарида (например, используя катионный детергент), фракционирования этанолом, низкотемпературной экстракции фенолом (для того, чтобы удалить белки) и ультрацентрифугирования (для того, чтобы удалить LPS) [например, ссылка 84]. Более предпочтительный способ [30], однако, включает в себя осаждение полисахарида, сопровождающееся солюбилизацией осажденного полисахарида с использованием низших спиртов. Осаждение можно осуществить с использованием катионного детергента, такого как соли тетрабутиламмония и цетилтриметиламмония (например, бромидные соли), или бромид гексадиметрина и соли миристилтриметиламмония. Бромид цетилтриметиламмония («CTAB») особенно предпочтителен [85]. Солюбилизацию осажденного материала можно осуществить, используя низшие спирты, такие как метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метил-пропан-1-ол, 2-метил-пропан-2-ол, диолы и т.д., но этанол особенно подходит для солюбилизации комплексов CTAB и полисахарида. Этанол предпочтительно добавляют к осажденному полисахариду, чтобы получить конечную концентрацию (основанную на общей доле этанола и воды) в пределах от 50% до 95%.
После повторной солюбилизации полисахарид можно затем обработать для того, чтобы удалить загрязняющие примеси. Это особенно важно в ситуациях, когда даже минорные загрязняющие примеси недопустимы (например, для получения человеческих вакцин). Обработка будет типично включать в себя одну или более стадий фильтрации, например глубокую фильтрацию, можно использовать фильтрацию через активированный уголь, гель фильтрацию и/или ультрафильтрацию. Однократно отфильтрованный для удаления загрязняющих примесей полисахарид можно осадить для будущей обработки и/или преобразований. Осаждение можно легко осуществить при обмене катионов (например, добавляя соли кальция или натрия).
В качестве альтернативы очистке, капсульный полисахарид по настоящему изобретению модно получить при полном или частичном синтезе, например, синтез Hib описан в ссылке 86, и синтез MenA описан в ссылке 87.
Композиции по изобретению содержат капсульные сахариды из, по крайней мере, двух серогрупп N.meningitidis. Сахариды предпочтительно получают отдельно (включая сюда любую фрагментацию, конъюгацию, модификацию и т.д.) и затем их добавляют в смесь, чтобы получить композицию по изобретению.
Однако в тех случаях, когда композиция содержит капсульный сахарид из серогруппы A, предпочтительно, чтобы сахарид серогруппы A не объединяли с другим сахаридом (сахаридами) до непосредственного использования, для того чтобы минимизировать возможный гидролиз. Это можно без труда осуществить при наличии компонента серогруппы A (типично, вместе с подходящими наполнителями) в лиофилизированном виде и компонента (компонентов) другой серогруппы в жидкой форме (также с подходящими наполнителями), причем жидкие компоненты будут использоваться для восстановления лиофилизированного компонента MenA, когда они будут готовиться к употреблению. В тех случаях, когда используют адъювант на основе соли алюминия, предпочтительно включая адъювант во флакон, содержащий жидкую вакцину, и к лиофилизированному компоненту MenA без адъюванта.
Композицию по изобретению можно таким образом приготовить из набора, состоящего из: (a) капсульного сахарида из N.meningitidis серогруппы A в лиофилизированном виде; и (b) дополнительных антигенов из композиции в жидкой форме. Изобретение также относится к способу приготовления композиции по изобретению, включающего смешивание лиофилизированного капсульного сахарида из N.meningitidis серогруппы A с дополнительными антигенами, где указанные дополнительные антигены находятся в жидкой форме.
Изобретение также относится к набору, состоящему из: (a) первой емкости, содержащей капсульный сахарид из двух или более серогрупп C, W135 и Y N.meningitidis, все в лиофилизированном виде; и (b) второй емкости, содержащей в жидкой форме (i) композицию, которая после введения индивидууму, способна вызывать образование антител у этого индивидуума, у которого иммунный ответ является бактерицидным против двух или более (например, 2 или 3) гипервирулентных линий A4, ET-5 и линии 3 серогруппы B N.meningitidis, (ii) капсульные сахариды из ни одной или из одной серогруппы С, W135 и Y N.meningitidis, и необязательно (iii) дополнительные антигены (смотри ниже), которые не содержат менингококковых капсульных сахаридов, где восстановление содержимого емкости (a) содержимым емкости (b) позволяет получить композицию по изобретению.
В пределах каждой дозы, количество индивидуальных сахаридных антигенов, в основном, находится между 1-50 мкг (измеренных как масса сахарида), причем приблизительно 2,5 мкг, 5 мкг или 10 мкг каждого будет предпочтительным. Следовательно, при соотношении масс A:C:W135:Y 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2 и 2:2:2:1 количество, представленное числом 1, предпочтительно составляет приблизительно 2,5 мкг, 5 мкг или 10 мкг. Поэтому для соотношения 1:1:1:1 композиции A:C:W:Y и 10 мкг на сахарид, 40 мкг сахарида вводится за дозу. Предпочтительные композиции содержат приблизительно следующее количество мкг сахарида на дозу:
Предпочтительные композиции по изобретению содержат менее чем 50 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат ≤40 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат ≤30 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат ≤25 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат ≤20 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат ≤10 мкг менингококкового сахарида на дозу, но в идеале, композиции по изобретению содержат, по крайней мере, 10 мкг менингококкового сахарида на дозу.
В конъюгатах MenC MenjugateТМ и NeisVacТМ используется гидроксидный адъювант, тогда как в MeningitecТМ используется фосфатный. В композициях по изобретению можно адсорбировать несколько антигенов на гидроксид алюминия, но содержать другие антигены в соединении с фосфатом алюминия. Для тетравалентных комбинаций серогрупп, например, возможны следующие перестановки:
Для тривалентных комбинаций серогрупп N.meningitidis возможны следующие перестановки:
Haemophilus influenzae типа B
В тех случаях, когда композиция включает в себя антиген H.influenzae типа B, он типично представляет собой капсульный сахаридный антиген Hib. Сахаридные антигены из H.influenzae типа B хорошо известны.
Преимущественно, сахарид Hib ковалентно конъюгирован с белком-носителем, для того чтобы увеличить его иммуногенность, особенно у детей. Приготовление полисахаридных конъюгатов в целом и капсульного полисахарида Hib в частности хорошо документировано [например, ссылки с 88 по 96 и т.д.]. По изобретению можно использовать любой подходящий конъюгат Hib. Подходящие белки-носители описаны ниже, и предпочтительными носителями для сахаридов Hib являются CRMI97 («HbOC»), столбнячный анатоксин («PRP-T») и комплекс наружной мембраны N.meningitidis («PRP-OMP»).
Сахаридная часть конъюгата может представлять собой полисахарид (например, полноразмерный полирибозилрибитолфосфат (PRP)), но предпочтительно для гидролиза полисахаридов получить олигосахариды (например, МВ от ˜1 до ˜5 кДа).
Предпочтительный конъюгат содержит олигосахарид Hib, ковалентно связанный с CRM197 посредством линкера адипиновой кислоты [97,98]. Столбнячный анатоксин также является предпочтительным носителем.
Композиции по изобретению могут содержать более чем один антиген Hib.
В тех случаях, когда композиция включает в себя сахаридный антиген Hib, предпочтительно, чтобы она также не включала в себя адъювант гидроксид алюминия. Если композиция включает в себя адъювант фосфат алюминия, то антиген Hib можно адсорбировать с адъювантом [99] или его можно не адсорбировать [100].
Антигены Hib можно лиофилизировать, например, вместе с менингококковыми антигенами
Streptococcus pneumoniae
В тех случаях, когда композиция включает в себя антиген S.pneumoniae, он типично представляет собой капсульный сахаридный антиген, который предпочтительно конъюгирован с белком-носителем [например, ссылки 31-33]. Предпочтительно включать в композицию сахариды из более чем одного серотипа S.pneumoniae. Например, широко используются смеси полисахаридов из 23 различных серотипов, то есть они представляют собой конъюгированные вакцины с полисахаридами из от 5 до 11 различных серотипов [101]. Например, PrevNarTM [102] содержит антигены из семи серотипов (4, 6В, 9V, 14, 18C, 19F и 23F), причем каждый сахарид индивидуально конъюгирован с CRM197 восстановительным аминированием, с 2 мкг каждого сахарида на 0,5 мл дозы (4 мкг серотипа 6В) и с конъюгатами, адсорбированными на адъюванте фосфат алюминия. Композиции по изобретению предпочтительно включают в себя, по крайней мере, серотипы 6B, 14, 19F и 23F. Конъюгаты можно адсорбировать на фосфате алюминия.
В качестве альтернативы для использования сахаридных антигенов из пневмококка композиция может включать в себя один или более полипептидных антигенов. Для некоторых штаммов доступны геномные последовательности [103, 104] и их можно подвергнуть обратной вакцинологии [105-108] для определения подходящих полипептидных антигенов [109, 110]. Например, композиция может включать в себя один или более из следующих антигенов: PhtA, PhtD, PhtB, PhtE, SpsA, LytB, LytC, LytA, Sp125, Sp101, Sp128 и Sp130, как определено в ссылке 111.
В нескольких осуществлениях, композиция может включать как сахаридные, так и полипептидные антигены из пневмококка. Данные антигены можно использовать в простой смеси или пневмококковый сахаридный антиген можно конъюгировать с пневмококковым белком. Подходящие белки-носители для таких осуществлений включают в себя антигены, перечисленные в предыдущем абзаце [111].
Пневмококковые антигены можно лиофилизировать, например, вместе с менингококковыми и/или антигенами Hib.
Ковалентная конъюгация
Капсульные сахариды в композиции по изобретению обычно конъюгируют с белком(белками)-носителем. В основном, конъюгация увеличивает иммуногенность сахаридов, поскольку она превращает их из T-независимых антигенов в T-зависимые антигены, делая возможным, таким образом, примирование иммунологической памяти. Конъюгация является особенно полезной для педиатрических вакцин и представляет собой хорошо известную методику [например, рассмотренную в ссылках 112 и 88-96].
Предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийный анатоксин или столбнячный анатоксин. Мутантный дифтерийный токсин CRM197 [79, 113, 114] является особенно предпочтительным. Другие подходящие белки-носители включают в себя белок наружной мембраны N.meningitidis [68], синтетические пептиды [69, 70], белки теплового шока [71,72], коклюшные белки [73,74], цитокины [76], лимфокины [76], гормоны [76], факторы роста [76], искусственные белки, содержащие множественные эпитопы человеческих CD4+ T-клеток из различных патогенных антигенов [115], белок D из H.influenzae [75,116], пневмококковый поверхностный белок PspA [117], белки, захватывающие железо [78], токсин A или B из C.difficile [77] и т.д. Предпочтительными носителями являются дифтерийный анатоксин, столбнячный анатоксин, белок D H.influenzae и CRM197.
В композиции по изобретению возможно использование более чем одного белка-носителя, например, чтобы уменьшить риск супрессии носителя. Таким образом, различные белки-носители можно использовать для различных серогрупп, например, сахариды серогруппы A можно конъюгировать с CRM197, в то время как сахариды серогруппы C можно конъюгировать со столбнячным анатоксином. Также возможно использование более чем одного белка-носителя для определенного сахаридного антигена, например сахариды серогруппы A могут находиться в двух группах, некоторые, конъюгированные с CRM197, и другие, конъюгированные со столбнячным анатоксином. Тем не менее, в основном предпочтительно использовать один и тот же белок-носитель для всех сахаридов.
Один белок-носитель может нести более чем один сахаридный антиген [118]. Например, один белок-носитель можно было бы конъюгировать с сахаридами из серогрупп A и C. Для достижения этой цели сахариды можно смешивать перед реакцией конъюгации. Тем не менее, в основном предпочтительно иметь отдельные конъюгаты для каждой серогруппы.
Конъюгаты сахарид:белок с соотношением (мас./мас.) в диапазоне между 1:5 (то есть с избытком белка) и 5:1 (то есть с избытком сахарида) являются предпочтительными. Соотношения в диапазоне 1:2 и 5:1 являются предпочтительными, а соотношения между 1:1,5 и 1:2,5 являются более предпочтительными. Избыток белка-носителя предпочтителен для MenA и MenC.
Конъюгаты можно использовать совместно со свободным белком-носителем [119]. Когда в композиции по изобретению данный белок-носитель представлен как в свободной, так и конъюгированной форме, неконъюгированная форма составляет предпочтительно не более чем 5% от общего количества белка-носителя в композиции в целом, и более предпочтительно представляет, по крайней мере, менее чем 2 мас.%.
Можно использовать любую реакцию конъюгации, с любым подходящим линкером, когда необходимо.
Перед конъюгацией сахариды типично активируют или функционализируют. Активация может включать, например, использование цианилирующих реагентов, таких как CDAP (например, тетрафлуороборат 1-циано-4-диметиламинопиридиния [120, 121 и т.д.]). В других подходящих методиках используют карбодиимиды, гидразиды, активные сложные эфиры, норборан, п-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS, EDC, TSTU; смотри также введение к ссылке 94.
Присоединения при помощи линкерной группы можно провести, используя любой известный способ, например способ, описанный в ссылках 122 и 123. Один тип присоединения включает в себя восстановительное аминирование полисахаридов, соединяя полученную в результате аминогруппу с одним концом линкерной группы адипиновой кислоты и затем соединяя белок с другим концом линкерной группы адипиновой кислоты [92, 124, 125]. Другие линкеры включают в себя B-пропионамидный линкер [126], нитрофенил-этиламин [127], галоацилгалогениды [128], гликозидные связи [129], 6-аминокапроновую кислоту [130], ADH [131], компоненты с C4 по C12 [132] и т.д. В качестве альтернативы для использования линкера можно использовать непосредственное присоединение. Непосредственное присоединение к белку может охватывать окисление полисахарида с последующим восстановительным аминированием, как описано, например, в ссылках 133 и 134.
Способ, включающий в себя введение аминогруппы в сахарид (например, замещая концевые =О группы на -NH2), сопровождающееся дериватизацией при помощи адипинового сложного диэфира (например, сложный диэфир N-гидроксисукцинимида адипиновой кислоты) и реакцией с белком-носителем, является предпочтительным. В другой предпочтительной реакции используется активация CDAP с белком-носителем D, например для MenA или MenC.
После конъюгации свободные и конъюгированные сахариды можно разделить. Существует множество подходящих способов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [смотри также ссылки 135 и 136 и т.д.].
В тех случаях, когда композиция по изобретению включает в себя конъюгированный олигосахарид, предпочтительно, чтобы получение олигосахарида предшествовало конъюгации.
Везикулы наружной мембраны
Предпочтительно, чтобы композиции по изобретению не включали бы в себя сложные или неопределенные смеси антигенов, которые обычно характерны OMV. Тем не менее, одним способом, в котором по изобретению можно применить OMV, является способ, в котором OMV должны вводится по схеме многократной дозы.
В тех случаях, когда необходимо ввести более чем одну дозу OMV, каждую дозу можно дополнить (либо добавляя очищенные белки, либо экспрессируя белок в бактериях, из которых получают OMV) одним из первого, второго или третьего белка, как описано выше. Предпочтительно различные дозы дополняют различными вариантами NMB1870. По схеме трех доз OMV, например, каждая доза может содержать один различный белок из первого, второго белка и третьего белка при условии, что после получения третьей дозы OMV, были получены все три варианта. По схеме двух доз OMV, один вариант может использоваться на дозу OMV (таким образом, исключая один вариант), или одна или обе дозы OMV можно дополнить более чем одним вариантом, для того чтобы получить перекрывание по всем трем вариантам. В предпочтительных осуществлениях, существует три дозы OMV, и каждая из трех доз OMV содержит три различные генетически сконструированные популяции везикул, каждая из которых представляет три подтипа, тем самым, давая всего 9 различных подтипов.
Данный подход можно использовать, в основном, для улучшения получения микровезикул N.meningitidis серогруппы B [137], «нативных OMV» [138], пузырьков или везикул наружной мембраны [например, ссылки с 139 по 144 и т.д.]. Их можно получить из бактерий, которые подверглись генетическим воздействиям [145-148], например, для увеличения иммуногенности (например, гиперэкспрессируемые иммуногены), для уменьшения токсичности, для ингибирования синтеза капсульного полисахарида, для понижающей регуляции экспрессии PorA и т.д. Их можно получить из штаммов с увеличенным содержанием пузырьков [149-152]. Можно включить сюда везикулы из непатогенных Neisseria [153]. OMV можно получить без использования детергентов [154, 155]. Они могут экспрессировать на своей поверхности белки не из Neisseria [156]. Они могут быть обеднены LPS. Их можно смешать с рекомбинантными антигенами [139, 157]. Можно использовать везикулы из бактерий с различными подтипами белков наружной мембраны класса I, например, шесть различных подтипов, используя две различные генетически сконструированные популяции везикул, каждая из которых представляет три подтипа 158, 159], или девять различных подтипов, используя три различные генетически сконструированные популяции везикул, каждая из которых представляет три подтипа, и т.д. Применимые подтипы включают в себя: P1.7,16; P1.5-1,2-2; P1.19,15-1; P1.5-2,10; P1.12-1,13; P1.7-2,4; P1.22,14 ; P1.7-1,1; P1.18-1,3,6.
Также возможно, конечно, дополнять препараты везикул двумя или тремя различными вариантами.
Иммунизация
Композиция по изобретению предпочтительно представляет собой иммуногенную композицию, и изобретение относится к иммуногенной композиции по изобретению для использования в качестве лекарственного средства.
Изобретение также относится к способу увеличения иммунного ответа у млекопитающих, охватывающему введение млекопитающим иммуногенной композиции по изобретению. Иммунный ответ является предпочтительно защитным и/или бактерицидным иммунным ответом.
Изобретение также относится к способу защиты млекопитающих от инфекции Neisseria (например, менингококковой), охватывающему введение млекопитающим иммуногенной композиции по изобретению.
Изобретение также относится к использованию, по крайней мере, двух антигенов (a), (b) и (c), как определено выше в промышленном производстве лекарственного средства для предупреждения инфекции Neisseria (например, менингококковой) у млекопитающих.
Млекопитающие предпочтительно представляют собой человека. Человек может быть взрослым или ребенком.
Иммуногенные композиции по изобретению можно использовать терапевтически (то есть для лечения существующей инфекции) или профилактически (то есть для предупреждения будущей инфекции).
Применения и способы особенно применимы для предупреждения/лечения заболеваний, включающих в себя в качестве неограничивающих примеров менингит (особенно бактериальные менингиты) и бактериемии.
Эффективность терапевтического лечения можно проверить при помощи мониторинга инфекции Neisseria после введения композиции по изобретению. Эффективность профилактического лечения можно проверить при помощи мониторинга иммунного ответа против NMB1870 после введения композиции. Иммуногенность композиций по изобретению можно определить при введении их исследуемым пациентам (например, детям в возрасте 12-16 месяцев, или модельным животным [160]) и затем, определяя стандартные параметры, включающие в себя сывороточные бактериальные антитела (SBA) и титры ELISA (GMT) тотальных и высокоавидных IgG. Данный иммунный ответ, в основном, определяют через приблизительно 4 недели после введения композиции и сравнивают со значениями, определенными перед введением композиции. Увеличение SBA, по крайней мере, 4-кратное или 8-кратное является предпочтительным. В тех случаях, когда вводится более чем одна доза композиции, можно провести более чем одно определение.
Предпочтительные композиции по изобретению могут поддерживать у пациентов титр антител, которые превышают критерии серозащиты для каждого антигенного компонента для приемлемого процента человеческих индивидуумов. Антигены с ассоциированным титром антител, выше которого организм-хозяина, как полагают, сероконвертирован против антигена, хорошо известны, и такие титры публикуются организациями, такими как WHO. Предпочтительно более чем 80% статистически значимых примеров индивидуумов сероконвертированы, более предпочтительно более чем 90%, еще более предпочтительно более чем 93% и наиболее предпочтительно 96-100%.
Композиции по изобретению, в основном, вводят непосредственно пациенту. Непосредственную доставку можно осуществить парентеральным введением (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно или в интерстициальное пространство тканей) или ректальным, оральным вагинальным, местным, чрескожным, интраназальным, глазным, ушным, легочным или другим введением через слизистую оболочку. Внутримышечное введение в бедро или плечо предпочтительно. Сделать инъекцию можно при помощи иглы (например, подкожной иглы), но можно альтернативно использовать безыгольные инъекции. Типичная внутримышечная доза составляет 0,5 мл.
Изобретение можно использовать для того, чтобы вызвать системный иммунитет и/или иммунитет слизистой оболочки.
Дозирование можно осуществлять по однодозовой схеме или по многодозовой схеме. Многократные дозы можно использовать по схеме первичной вакцинации и/или по схеме повторной иммунизации. Однодозовая схема для первичной дозы может сопровождаться схемой для повторной дозы. Подходящее распределение по времени между первичными дозами (например, между 4-16 неделями) и между первичными и повторными можно определить обычным образом.
Иммуногенные композиции по изобретению, в основном, включают в себя фармацевтически приемлемый носитель, которым может быть любое вещество, которое само по себе не вызывает продукцию антител вредных для пациента, получающего композицию, и которые можно вводить без чрезмерной токсичности. Подходящие носители могут быть большими, медленно метаболизирующимися молекулами, такими как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные кополимеры и инактивированные вирусные частицы. Такие носители хорошо известны специалистам в данной области. Фармацевтически приемлемые носители могут включать в себя жидкости, такие как воду, соляной раствор, глицерин и этанол. Вспомогательные вещества, такие как смачивающие и эмульгирующие агенты, вещества буферного действия на pH и тому подобные, могут тоже презентоваться такими везикулами. Липосомы являются подходящими носителями. Полное обсуждение фармацевтических носителей доступно в ссылке 161.
Инфекции Neisseria воздействуют на различные области тела, и поэтому композиции по изобретению можно приготовить в различных формах. Например, композиции можно приготовить в виде, пригодном для инъекций, либо жидких растворов, либо суспензий. Также можно приготовить твердые формы, подходящие для растворения или суспендирования в жидких разбавителях перед инъекцией. Композицию можно приготовить для местного ведения, например, как мазь, крем или порошок. Композицию можно приготовить для орального введения, например, как таблетку или капсулу, или в качестве сиропа (необязательно ароматизированный). Композицию можно приготовить для легочного введения, например, как ингалируемую, используя мельчайший порошок или спрей. Композицию можно приготовить как суппозиторию или пессарий. Композицию можно приготовить для назального, ушного или глазного введения, например, как капли.
Композиция предпочтительно является стерильной. Она предпочтительно апирогенна. Она предпочтительно буферизована, например рН в диапазоне между 6 и 8, в основном около 7. В тех случаях, когда композиция содержит соль гидроксида алюминия, предпочтительно использовать гистидиновый буфер [162]. Композиции по изобретению могут быть изотоническими в отношении людей.
Иммуногенные композиции содержат иммунологически эффективное количество иммуногена, а также при необходимости любые другие из других определенных компонентов. «Иммунологически эффективное количество» означает, что введение такого количества индивидууму либо в одной дозе, либо частями, либо сериями, эффективно для лечения или предупреждения заболевания. Это количество изменяется в зависимости от состояния здоровья и физического состояния индивидуума, которого необходимо лечить, возраста, таксономической группы индивидуума, которого необходимо лечить (например, не относящиеся к человеческому роду приматы, приматы и т.д.), способности иммунной системы индивидуума синтезировать антитела, степени необходимой защиты, рецептуры вакцины, заключения лечащего врача о медицинском состоянии и других важных факторов. Ожидается, что количество попадет в относительно широкий диапазон, который можно определить посредством общепринятых испытаний. Дозирование лекарств может проходить по однодозовой схеме или по многодозовой схеме (например, включая в себя повторные дозы). Композицию можно вводить совместно с другими иммуногенными агентами.
Иммуногенная композиция, в основном, включает в себя адъювант. Предпочтительные адъюванты для увеличения эффективности композиции включают в себя в качестве неограничивающих примеров: (A) MF59 (5% сквален, 0,5% Tween 80, и 0,5% Span 85, приготовленный в субмикронных частицах, используя микрофлюидизатор) [смотри главу 10 ссылки 163; смотри также ссылку 164]; (B) микрочастицы (то есть, частицы с диаметром от ˜100 нм до ˜150 мкм, более предпочтительно с диаметром от ˜200 нм до ˜30 мкм и наиболее предпочтительно с диаметром от ˜500 нм до ˜10 мкм), полученные из материалов, которые подвержены биологическому разложению и нетоксичны (например, поли( α-оксикислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т.д.), причем поли(лактид-ко-гликолид) является предпочтительным («PLG»), необязательно содержащим заряженную поверхность (например, добавляя катионный, анионный или неионный детергент, такой как SDS (отрицательный) или CTAB (положительный) [например, ссылки 165 и 166]); (C) липосомы [смотри главы 13 и 14 ссылки 163]; (D) ISCOM [смотри главу 23 ссылки 163], который может быть свободен от дополнительного детергента [167]; (E) SAF, содержащий 10% сквалена, 0,4% Tween 80,5% блок-сополимера полиоксиэтилена и полиоксипропилена L121 и thr-MDP, либо микрофлюидизированный в субмикронную эмульсию, либо подвергавшийся встряхиванию до образования эмульсии частиц большего размера [смотри главу 12 ссылки 163]; (F) адъювантная система RibiТМ(RAS) (Ribi Immunochem), содержащая 2% сквалена, 0,2% Tween 80 и один или более компонентов бактериальной клеточной стенки из группы, состоящей из монофосфорил-липида A (MPL), димиколат трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (DetoxTM); (G) сапониновые адъюванты, такие как QuilA или QS21 [смотри главу 22 ссылки 163], также известный как StimulonTM; (H) хитозан [например, 168]; (I) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (J) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.д.), интерфероны (например, интерферон-γ), макрофагальный колониестимулирующий фактор, фактор некроза опухоли и т.д. [смотри главы 27 и 28 ссылки 163], RC529; (K) сапонин (например, QS21) +3dMPL + IL-12 (необязательно + стерин) [169]; (L) монофосфорил-липид A (MPL) или 3-О-деацетилированный MPL (3dMPL) [например, глава 21 ссылки 163]; (M) комбинации 3dMPL, например, с QS21 и/или эмульсий типа масло в воде [170]; (N) олигонуклеотиды, содержащие мотив CpG [171], то есть состоящие, по крайней мере, из одного динуклеотида CG, с 5-метилцитозином, необязательно используемым вместо цитозина; (O) эфиры полиоксиэтилена или сложные эфиры полиоксиэтилена [172]; (P) поверхностно-активное вещество сложный эфир полиоксиэтиленсорбитана в комбинации с октоксинолом [173] или поверхностно-активное вещество сложный эфир полиоксиэтиленалкила или простой эфир полиоксиэтиленалкила в комбинации, по крайней мере, с одним дополнительным неионогенным поверхностно-активным веществом, таким как октоксинол [174]; (Q) иммуностимулирующий олигонуклеотид (например, олигонуклеотид CpG) и сапонин [175]; (R) иммуностимуляторы и частица соли метала [176]; (S) сапонин и эмульсия типа масло в воде [177]; (T) термолабильный энтеротоксин E.coli («LT»), или его нейтрализованные мутанты, такие как мутанты K63 или R72 [например, глава 5 ссылки 38]; (U) холерный токсин («CT»), или его нейтрализованные мутанты [например, глава 5 ссылки 38]; (V) двухцепочечная РНК; (W) соли алюминия, такие как гидроксиды алюминия (включая сюда оксигидроксиды), фосфаты алюминия (включая сюда гидроксифосфаты), сульфат алюминия и т.д. [главы 8 и 9 в ссылке 163] или соли кальция, такие как фосфат кальция; и (X) другие вещества, которые действуют в качестве иммуностимулирующих агентов для увеличения эффективности композиции [например, смотри главу 7 ссылки 163]. Соли алюминия (фосфаты алюминия и особенно гидроксифосфаты и/или гидроксиды и особенно оксигидроксиды) и MF59 представляют собой предпочтительные адъюванты для парентеральной иммунизации. Мутанты токсинов являются предпочтительными адъювантами для слизистой оболочки. QS21 представляет собой другой приемлемый адъювант для NMB1870, который можно использовать в чистом виде или в комбинации с любым из с (A) до (X), например, с солью алюминия.
Мурамил-пептиды включают в себя N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетил-мурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин MTP-PE) и т.д.
Экспрессия белка
Методики бактериальной экспрессии известны в данной области. Бактериальный промотор представляет собой любую последовательность ДНК, способную связывать бактериальную РНК-полимеразу и инициировать даунстрим транскрипцию (т.е. ниже) (3') кодирующей последовательности (например, структурный ген) в мРНК. Промотор содержит область инициации транскрипции, которая обычно расположена проксимально от 5'-конца кодирующей последовательности. Данная область инициации транскрипции обычно включает в себя участок связывания РНК-полимеразы и участок инициации транскрипции. Бактериальный промотор может также содержать второй домен, называемый оператор, который может частично перекрывать расположенный рядом участок связывания РНК-полимеразы, с которой начинается синтез РНК. Оператор позволяет осуществлять отрицательную регулируемую (индуцибельную) транскрипцию, таким образом, что белок генной репрессии может связать оператор и тем самым ингибировать транскрипцию определенного гена. При отсутствии отрицательных регуляторных элементов, таких как оператор, может иметь место нерегулируемая экспрессия. Кроме того, положительную регуляцию можно осуществить посредством последовательности, связывающей генный белок-активатор, которая, если имеется, расположена обычно проксимально от (5') последовательности, связывающей РНК-полимеразу. Примером генного белка-активатора является белок-активатор катаболитных оперонов (CAP), который способствует инициации транскрипции lac-оперона у Escherichia coli (E.coli) [Raibaud et al. (1984) Annu.Rev.Genet. 18: 173]. Регулируемая экспрессия, следовательно, может быть либо положительной, либо отрицательной, тем самым увеличивая или уменьшая транскрипцию.
Последовательности, кодирующие ферменты метаболических путей, позволяют получить особенно применимые промоторные последовательности. Примеры включают в себя промоторные последовательности, полученные из ферментов, метаболизирующих сахара, такие как галактоза, лактоза (lac) [Chang et al. (1977) Nature 198: 1056] и мальтоза. Дополнительные примеры включают в себя последовательности, полученные из биосинтетических ферментов, такие как триптофан (trp) [Goeddel et al. (1980) Nuc. Acids Res. 8: 4057; Yelverton et al. (1981) Nucl. Acids Res. 9: 731; патент США 4738921; EP-A-0036776 и EP-A-0121775]. β-лактамазная (bla) промоторная система [Weissmann (1981) "The cloning of interferon and other mistakes." In Interferon 3 (ed. I.Gresser)], промоторные системы бактериофага лямбда PL [Shimatake et al. (1981) Nature 292:128] и Т5 [патент США 4689406] также позволяют получить применимые промоторные последовательности. Другим промтором, представляющим интерес, является индуцируемый арабинозный промотор (pBAD).
Кроме того, синтетические промоторы, которые не встречаются в природе, также функционируют в качестве бактериальных промоторов. Например, последовательности активации транскрипции одного бактериального или бактериофагового промотора можно объединить с последовательностями оперона другого бактериального или бактериофагового промотора, создавая гибридный промотор [патент США 4551433]. Например, tac-промотор представляет собой гибридный trp-lac-промотор, содержащий последовательности как trp-промотора, так и lac-оперона, которые регулируются lac-репрессером [Amann et al. (1983) Gene 25: 167; de Boer et al. (1983) Proc. Natl. Acad. Sci 80: 21]. Более того, бактериальный промотор может включать в себя встречающиеся в природе промоторы небактериального происхождения, которые имеют способность связывать бактериальную РНК-полимеразу и инициировать транскрипцию. Встречающиеся в природе промоторы небактериального происхождения можно также объединять с совместимой РНК-полимеразой для получения высокого уровня экспрессии некоторых генов у прокариотов. Система РНК-полимераза/промотор бактериофага Т7 является примером объединенной промоторной системы [Studier et al. (1986) J. Mol. Biol. 189:113; Tabor et al. (1985) Proc. Natl. Acad. Sci 82:1074]. Дополнительно, гибридный промотор может также содержаться в промоторе бактериофага и области оператора E.coli (EPO-А-0267851).
Дополнительно к функционирующей промоторной последовательности эффективный участок связывания рибосомы также применим для экспрессии чужеродных генов у прокариот. В E.coli участок связывания рибосомы называется последовательностью Шайна-Дальгарно (Shine-Dalgarno) (SD) и включает в себя инициирующий кодон (ATG) и последовательность длиной в 3-9 нуклеотида, расположенную на 3-11 нуклеотидов выше инициирующего кодона [Shine et al. (1975) Nature 254:34]. Последовательность SD, как полагают, является промотором, связывающим мРНК с рибосомой, спаривая основания между последовательностью SD и 3' и 16S рРНК E.coli [Steitz et al. (1979) "Genetic signals and nucleotide sequences in messenger RNA." In Biological Regulation and Development: Gene Expression (ed. R.F. Goldberger)]. Для экспрессии эукариотических генов и прокариотических генов со слабым участком связывания рибосомы смотри [Sambrook et al. (1989) "Expression of cloned genes in Escherichia coli. " In Molecular Cloning: A Laboratory Manual].
Промоторную последовательность можно непосредственно связывать с молекулой ДНК, и в этом случае первой аминокислотой на N-конце всегда будет метионин, который кодируется стартовым кодоном ATG. Если необходимо, метионин на N-конце можно отщепить от белка при инкубации in vitro с бромцианом или инкубации либо in vivo, либо in vitro с бактериальной метиониновой N-концевой пептидазой (EP-A-0219237).
Обычно последовательности терминации транскрипции, распознаваемые бактерией, представляют собой регуляторные области, расположенные на 3' конце от терминирующего трансляцию кодона, и таким образом вместе с промотором фланкируют кодирующую последовательность. Данные последовательности управляют транскрипцией мРНК, которая может транслироваться в полипептид, кодируемый ДНК. Последовательности терминации транскрипции часто включают в себя последовательности ДНК приблизительно в 50 нуклеотидов, способных образовать структуры типа «стебель-петля», которые способствуют терминации транскрипции. Примеры включают в себя последовательности терминации транскрипции, полученные из генов с сильными промоторами, такими как ген trp в E.coli, а также и другие биосинтетические гены.
Обычно описанные выше компоненты, содержащие промотор, сигнальную последовательность (если необходимо), интересующую кодирующую последовательность и последовательность терминации транскрипции помещают вместе в экспрессирующие конструкции. Экспрессирующие конструкции часто поддерживают в репликонах, таких как внехромосомный элемент (например, плазмиды), способных стабильно сохраняться в организме хозяина, таком как бактерия. Репликон содержит систему репликации, таким образом позволяя сохраняться в прокариотическом организме хозяина либо для экспрессии, либо для клонирования и амплификации. Дополнительно, репликон может нести либо высоко-, либо низкокопийную плазмиду. Высококопийная плазмида, в основном, имеет число копий в диапазоне от приблизительно 5 до приблизительно 200 и обычно от приблизительно 10 до приблизительно 150. Организм хозяина, содержащий высококопийную плазмиду, предпочтительно содержит, по крайней мере, приблизительно 10 и более предпочтительно, по крайней мере, приблизительно 20 плазмид. В зависимости от влияния вектора и чужеродного белка на организм хозяина можно выбрать либо высоко-, либо низкокопийный вектор.
Альтернативно, экспрессирующие конструкции можно интегрировать в бактериальный геном при помощи интегрирующего вектора. Интегрирующие вектора обычно состоят, по крайней мере, из одной последовательности, гомологичной бактериальной хромосоме, которая позволяет вектору интегрироваться. Интеграция, по-видимому, происходит в результате рекомбинаций между гомологичной ДНК в векторе и бактериальной хромосомой. Например, интегрирующие вектора, сконструированные с ДНК из различных штаммов Bacillus, интегрируются в хромосому Bacillus (EP-A-0127328). Интегрирующие вектора можно также заключать в последовательности бактериофагов и транспозонов.
Обычно внехромосомные и интегрирующие экспрессирующие конструкции могут содержать селектируемые маркеры для того, чтобы позволить провести отбор бактериальных штаммов, которые были трансформированы. Селектируемые маркеры можно экспрессировать в бактериальной клетке хозяина, и они могут включать в себя гены, которые визуализируют бактерии, устойчивые к лекарственным препаратам, таким как ампициллин, хлорамфеникол, эритромицин, канамицин (неомицин) и тетрациклин [Davies et al. (1978) Annu. Rev. Microbiol. 32:469]. Селектируемые маркеры могут также включать в себя биосинтетические гены, такие как гены в биосинтетических путях метаболизма гистидина, триптофана и лейцина.
Альтернативно, некоторые из описанных выше компонентов можно поместить вместе в трансформирующие вектора. Трансформирующие вектора обычно содержат селектируемый маркер, который либо содержится в репликоне, либо введен в интегрирующий вектор, как описано.
Экспрессирующие и трансформирующие вектора, либо внехромосомные репликоны, либо интегрирующие вектора, были разработаны для трансформации во множество бактерий. Например, были разработаны экспрессирующие векторы, в частности, для следующих бактерий: Bacillus subtilis [Palva et al. (1982) Proc. Natl. Acad. Sci USA 79:5582; EP-A-0 036 259 и EP- A-0 063 953; WO 84/04541], Escherichia coli [Shimatake et al. (1981) Nature 292: 128; Amann et al. (1985) Gene 40:183; Studier et al. (1986) J. Mol. Biol. 189:113; EP-A-0036776, EP-A-0136829 и EP-A-0136907], Streptococcus cremoris [Powell et al. (1988) Appl. Environ. Microbiol. 54:655]; Streptococcus lividans [Powell et al. (1988) Appl. Environ. Microbiol. 54:655], Streptomyces lividans [патент США 4745056].
Способы введения экзогенной ДНК бактериальным клеткам хозяина хорошо известны в данной области и обычно включают в себя трансформацию бактерий, обработанных либо CaCl2, либо другими агентами, такими как двухзарядные катионы и DMSO. ДНК можно вводить в бактериальные клетки электропорацией. Процесс трансформации обычно меняется в зависимости от бактериального вида, который необходимо трансформировать. Смотри, например [Masson et al. (1989) FEMS Microbiol. Lett. (60:273; Palva et al. (1982) Proc. Natl. Acad. Sci. USA 79:5582; EP-A-0 036 259 and EP-A-0 063 953; WO 84/04541, Bacillus], [Miller et al. (1988) Proc. Natl. Acad. Sci. 85:856; Wang et al. (1990) J. Bacteriol. 172:949, Campylobacter], [Cohen et al. (1973) Proc. Natl. Acad. Sci. 69:2110; Dower et al. (1988) Nucleic Acids Res. 16:6127, Kushner (1978) "An improved method for transformation of Escherichia coli with ColE1-derived plasmids. In Genetic Engineering: Proceedings of the International Symposium on Genetic Engineering (eds. H.W. Boyer and S. Nicosia); Mandel et al. (1970) J. Mol. Biol. 53:159; Taketo (1988) Biochim. Biophys. Acta 949:318; Escherichia], [Chassy et al. (1987) FEMS Microbiol. Lett. 44:173 Lactobacillus]; [Fiedler et al. (1988) Anal. Biochem 170:38, Pseudomonas]; [Augustin et al. (1990) FEMS Microbiol. Lett. 66:203, Staphylococcus], [Barany et al. (1980) J. Bacteriol. 144:698; Harlander (1987) "Transformation of Streptococcus lactis by electroporation, in: Streptococcal Genetics (ed. J. Ferretti and R. Curtiss III); Perry et al. (1981) Infect. Immun. 32:1295; Powell et al. (1988) Appl. Environ. Microbiol. 54:655; Somkuti et al. (1987) Proc. 4th Evr. Cong. Biotechnology 1:412, Streptococcus].
Отказ от прав
Изобретение предпочтительно не охватывает: (а) аминокислотные последовательности и последовательности нуклеиновых кислот, доступные в открытых базах данных последовательностей (например, GenBank или GENESEQ) до 22 ноября 2002 года; (b) аминокислотные последовательности и последовательности нуклеиновых кислот, описанные в заявках на патент, имеющих дату регистрации заявки или, в тех случаях, когда имеется, дату приоритета до 22 ноября 2002 года. В частности, входные данные SEQ ID в каких-либо ссылках, цитируемых здесь, можно исключить, например, ссылка 13.
Общее
Термин «содержащий» означает «включающий в себя», а также и «состоящий из», например, композиция «содержащая» Х может состоять исключительно из Х или может включать в себя что-то дополнительное, например, X+Y.
Термин «приблизительно» в отношении к численному значению х означает, например, х±10%.
Слова «в значительной степени» не исключают «полностью», например, композиция, которая «в значительной степени не содержит» Y, может быть полностью без Y. В тех случаях, когда это необходимо, слова «в значительной степени» можно опустить в формуле изобретения.
«Идентичность последовательности» предпочтительно определяют при помощи алгоритма поиска гомологии Смита-Уотермана, реализованного в программе MPSRCH (Oxford Molecular), использующего поиск сходных разрывов с параметрами штрафа за начало разрыва = 12 и штраф за удлинение разрыва = 1.
После серогруппы, менингококковая классификация включает в себя серотип, сероподтип и затем иммунотип, и в стандартной системе условных обозначений перечисляются серогруппа, серотип, сероподтип и иммунотип, каждая разделенная двоеточием, например B:4:P1.15:L3,7,9. Внутри серогруппы В некоторые линии часто вызывают заболевания (гиперинвазивные), некоторые линии вызывают более серьезные формы заболевания, чем другие (гипервирулентные) и другие вообще редко вызывают заболевание. Признают семь гипервирулентных линий, а именно подгруппы I, III и IV-1, комплекс ET-5, комплекс ET-37, кластер A4 и линию 3. Данные линии определили при помощи мультилокусного ферментативного электрофореза (MLEE), но мультилокусное типирование последовательности (MLST) также использовали для классификации менингококков [ссылка 16]. Четыре основных гипервирулентных кластера представляют собой комплексы ST32, ST44, ST8 и ST11.
Термин «алкил» обозначает алкильную группу как в линейном, так и в разветвленном виде. Алкильная группа может прерываться 1, 2 или 3 гетероатомами, выбранными из -O-, -NH- или -S-. Алкильная группа может также прерываться 1, 2 или 3 двойными и/или тройными связями. Однако термин «алкил» обычно обозначает алкильные группы, не содержащие гетероатомные вставки или вставки двойных или тройных связей. В тех случаях, когда упоминают алкил C1-12, это означает, что алкильная группа может содержать любое количество атомов углерода в диапазоне между 1 и 12 (например, C1, C2, C3, C4, C5, C6, C7, C8, C9, C10, C11, C12). Подобным образом в тех случаях, когда упоминают алкил C1-6, это означает, что алкильная группа может содержать любое количество атомов углерода в диапазоне между 1 и 6 (например, C1, C2, C3, C4, C5, C6).
Термин «циклоалкил» включает в себя циклоалкильные, полициклоалкильные и циклоалкенильные группы, а также их комбинации с алкильными группами, такими как циклоалкилалкильные группы. Циклоалкильная группа может прерываться 1, 2 или 3 гетероатомами, выбранными из -O-, -NH- или -S-. Однако термин «циклоалкил» обычно обозначает циклоалкильные группы, не содержащие гетероатомные вставки. Примеры циклоалкильных групп включают в себя циклопентильные, циклогексильные, циклогексенильные, циклогексилметильные и адамантильные группы. В тех случаях, когда упоминают циклоалкил C3-12, это означает, что циклоалкильная группа может содержать любое количество атомов углерода в диапазоне между 3 и 12 (например, C3, C4, C5, C6, C7, C8, C9, C10, C11, C12).
Термин «арил» обозначает ароматическую группу, такую как фенил или нафтил. В тех случаях, когда упоминают арил C5-12, это означает, что арильная группа может содержать любое количество атомов углерода в диапазоне между 5 и 12 (например, C5, C6, C7, C8, C9, C10, C11, C12).
Термин «C5-12-арил-C1-6-алкил» обозначает группы, такие как бензил, фенилэтил и нафтилметил.
Защитные группы азота включают в себя силильные группы (такие как TMS, TES, TBS, TIPS), ацилпроизводные (такие как, фталимиды, трифтороацетамиды, метоксикарбонил, этоксикарбонил, t-бутоксикарбонил (Boc), бензилоксикарбонил (Z или Cbz), 9-флоуренилметоксикарбонил (Fmoc), 2-(триметилсилил)этоксикарбонил, 2,2,2-трихлорэтоксикарбонил (Troc)), производные сульфонила (такие как β-триметилсилилэтансульфонил (SES)), производные сульфенила, C1-12-алкил, бензил, бензгидрил, тритил, 9-фенилфлуоренил и т.д. Предпочтительной защитной группой азота является Fmoc.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показана нуклеотидная последовательность области выше NMB1870.
Фигура 2 является схематическим представлением структуры белков TbpB и антигенов NMB2132 и NMB1870. Указаны лидерные пептиды и проксимальные области с повышенным содержанием глицина. Пять консервативных боксов показаны различными повторяющимися мотивами и расположены на последовательности белка.
На фигуре 3 показано увеличение уровней NMB1870 в N.meningitidis MC58 на кривой роста.
На фигуре 4 показано увеличение уровней NMB1870 в супернатанте за тот же самый период. Уровни PorA и NMB1380 не увеличиваются. Цифры над дорожками обозначают OD620нм культуры. KO обозначает NMB1870-нокуатный мутант MC58, и Wcl обозначает контроль лизата целой клетки
На фигуре 5 показаны OMV, исследованные с антителом против NMB1870.
На фигуре 6 показаны результаты FACS-анализа инкапсулированного MC58 или неинкапсулированного мутантного MC58 с использованием антитела против NMB1870.
На фигуре 7 представлен вестерн-блот градиентного SDS-PAGE геля с нанесенными целыми клеточными лизатами сильных (ряд 1 и 2), средних (3 и 4) и слабых (5 и 6) экспрессоров NMB1870. Дорожка 7 содержит NMB1870-нокаут MC58. Дорожки представляют собой: (1) MC58; (2) H44/76; (3) NZ394/98; (4) 961-5945; (5) 67/00; (6) M1239; (7) MC58Δnmb1870.
На фигуре 8 показаны титры FACS и бактерицидные титры для каждого сильного, среднего и слабого экспрессора и также для NMB1870-нокаута. Средний и слабый экспрессор содержит идентичную NMB1870 аминокислотную последовательность, с совпадением 91,6% с MC58.
На фигуре 9 представлена древовидная схема, показывающая кластеризацию штаммов по расстояниям для белка NMB1870. Пометки «1», «2» и «3» обозначают три варианта. Цифры в квадратных скобках обозначают количество штаммов с идентичной последовательностью, представленных в каждом ответвлении древовидной схемы. Обозначены гипервирулентные линии, за ними следует количество штаммов в тех случаях, когда оно отличается от общего количества. Также указаны серогруппы за исключением серогруппы B. Три типовых штамма (MC58, 961-5965 и M1239) и другие штаммы, используемые в серологическом анализе, находятся в овалах.
На фигуре 10 представлено выравнивание последовательностей варианта 1 (MC58), варианта 2 (961-5945) и варианта 3 (M1239). Нумерацию аминокислот начинают с цистеина, который, как предсказано, является первой аминокислотой зрелого белка. Серый и черный фон обозначает консервативные и идентичные остатки, соответственно.
На фигуре 11 показан FACS-анализ сывороток против варианта 1 (первый ряд), варианта 2 (второй ряд) и варианта 3 (третий ряд) с использованием штамма варианта 1 (MC58), варианта 2 (961-5945) и варианта 3 (M1239). Контрольные сыворотки против капсульного полисахарида показаны в ряду 4 (моноклональное антитело Seam3). Контрольные сыворотки против цитоплазматических белков показаны в ряду 5 (антитело против NMB1380). Ряд 6 содержит нокаут-мутанты (KO) каждого типа штаммов, исследуемых с гомологичной антисывороткой.
На фигурах 12 (вариант 1), 13 (вариант 2) и 14 (вариант 3) показаны древовидные схемы для трех отдельных вариантов NMB1870, классифицированных при помощи мультилокусных типов последовательностей (ST).
СПОСОБЫ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
NMB1870 в штамме MC58 серогруппы B - идентификация стартового кодона
Ген NMB1870 определили в геномных последовательностях MenB и MenA, опубликованных The Institute for Genomic Research (TIGR) и Sanger Center, соответственно [2, 4; NMB1870 и NMA0586]. Однако существует несоответствие по расположению стартового кодона ATG, поскольку стартовый кодон MenB находится на 120 н.п. выше (в положении апстрим) стартового кодона MenA. В отличие от обеих известных аннотаций, по настоящему изобретению стартовый кодон расположен как и кодон GTG, который расположен ниже (в положении даунстрим) известных стартовых кодонов (18 н.п. ниже для MenA, 138 н.п. для MenB), и это согласуется со ссылкой 8.
Как показано на фигуре 1, начало GTG (+1) согласуется с наличием правильно расположенного в пространстве участка связывания рибосомы и с предсказанием характеристики липопротеина. Известный в TIGR стартовый кодон MenB указан в прямоугольнике, и стартовый кодон MenA из Sanger находится в круге. Инвертированные повторы показаны горизонтальными стрелками.
NMB1870 представляет собой моноцистронный ген, расположенный на 157 пар ниже терминирующего кодона гена фруктозобифосфатальдолазы nmbl869. В Z2491 MenA общая организация похожа, но на 31 нуклеотидную пару выше стартового кодона GTG, существует вставка из 186 нуклеотидов, которые гомологичны внутренней области повторов IS1106 и фланкируются двумя инвертированными повторами в 16 нуклеотидных пар. Предполагаемый участок связывания рибосомы (заштрихованный) представлен на 8 н.п. выше стартового кодона GTG. Fur-бокс (11/19 совпадений с консенсусной последовательностью fur-бокса E.coli [178]; SEQ ID NO: 74 и 75) расположен на 35 н.п. выше стартового кодона, как предсказано GCG FindPatterns, начинающегося от SEQ ID NO: 75 и допускающий максимум девять несовпадений. Также была определена предполагаемая промоторная последовательность.
Набор программ GCG Wisconsin Package (версия 10.0) использовали для компьютерного анализа последовательности гена и белковых последовательностей. Программу PSORT [179] использовали для предсказания местоположения. NMB1870 содержал типичный характерный экспонированный на поверхность липопротеин, характеризующийся сигнальным пептидом с мотивом липо-бокс типа -Leu-X-X-Cys-, где за цистеином следовал серин, аминокислота, в основном, ассоциированная с локализацией липопротеинов в наружной мембране [180]. Липо-бокс потерян в гонококках из-за встраивания одного основания (G) со сдвигом рамки после нуклеотида 36 в MC58, причем правильная рамка считывания восстановлена за счет вставки из 8 н.п. после положения 73.
Зрелый белок MC58, как предсказывают, является липопротеином с молекулярной массой в 26964 Да и с pI 7,96 и характеризуется наличием четырех глицинов ниже мотива липо-бокс.
Анализ предсказания вторичной структуры с использованием программы PredictProtein [181] показал, что NMB1870 представляет собой глобулярный белок, в основном состоящий из бета-листов.
Анализ последовательности
Алгоритм PSI-BLAST применяли для поиска гомологии [182] с использованием базы данных белков без повторов. Никаких гомологичных белков не было обнаружено при поиске в базах данных без повторов прокариотических и эукариотических белков, хранящихся на сайте NCBI, включая сюда человеческий геном, предполагая, что NMB1870 является специфичным для Neisseria. Однако домен с некоторой гомологией (28% идентичности свыше 146 аминокислот) был обнаружен в C-концевой части трансферрин связывающего белка TfbA Actinobacillus pleuropneumoniae [183] (фигура 2). Подробное рассмотрение данного домена выявило также гомологию с трансферрин связывающим белком из N.meningitidis [184], H.influenzae [185], Moraxella catarrhalis [186] и с поверхностным антигеном NMB2132 N.meningitidis, ранее аннотированным как гомолог TbpB [3].
Для того чтобы посмотреть, влияет ли данная гомология последовательности на функциональную гомологию, рекомбинантный NMB1870 (смотри ниже), трансферрин человека hTF (Sigma T-4132) и смесь их двоих (конечная концентрация 7 мкМ) диализировали в течение ночи в PBS при температуре 4°C. После диализа 20 мкл каждого белка и их смеси загружали на гель-фильтрационную колонку Superdex 200 PC 3,2/30 (Amersham) для ВЭЖХ, используя PBS в качестве рабочего буфера [187]. Blue Dextran 2000 и стандарты молекулярных масс рибонуклеазу A, химотрипсин A, овальбумин A, бычий сывороточный альбумин (Amersham) использовали для калибровки колонки. Гель-фильтрацию проводили с использованием системы Smart со скоростью потока 0,04 мл/мин и элюированное вещество регистрировали при 214 нм и 280 нм. (Объем удерживания NMB1870 составлял 1,68 мл и 1,47 мл для htf). Фракции по 40 мкл собирали и анализировали при помощи SDS-PAGE. Рекомбинантный трансферрин связывающий белок 2 (Tbp2) MC58 использовали в качестве положительного контроля.
Рекомбинантный белок не мог связывать трансферрин человека in vitro.
Fur-бокс в промоторе наводит на мысль, что экспрессия NMB1870 может регулироваться железом. Однако экспрессия белка, по-видимому, не уменьшалась в условиях низкого содержания железа.
Интересной особенностью белка является наличие участка из четырех глицинов ниже липидизированного цистеина. Три или более последовательно расположенных глицина ниже липидизированного цистеина присутствуют также в других пяти липопротеинах в N.meningitidis, а именно, в трансферрин связывающем белке B (TbpB), в компоненте наружной мембраны транспортера ABC NMB0623, в гипотетическом белке NMB1047, в гомологе TbpB NMB2132 и в липопротеине AspA [188]. Ни в одном из этих белков полиглициновый участок не кодируется участком поли-G, наводя на мысль, что данная особенность не используется для того, чтобы вызвать антигенную модуляцию.
Поиск липопротеинов с участком с повышенным содержанием глицина проводили с 22 полными геномными последовательностями, извлеченными из сайта NCBI [189] с использованием FindPatterns. При поиске нашли 29 липопротеинов в некоторых, но не всех, бактериальных видах. Организмы с данным типом липопротеинов включали в себя как грамотрицательные, так и грамположительные бактерии, включая сюда Haemophilus influenzae, Enterococcus fecalis, Mycobacterium tuberculosis, Lysteria monocytogenes и Staphylococcus aureus, в то время как другие, такие как E.coli, Bacillus subtilis, Helicobacter pylori, Streptococcus pneumoniae, S.pyogenes и Vibrio cholerae не имели такого липопротеина. Большинство липопротеинов с данной особенностью принадлежит к транспортерам ABC, за которыми следуют белки с неизвестной функцией. Хотя данная общая особенность в первичной структуре предполагает общую роль для глициновых повторов, до сих пор их функция неизвестна. Тем не менее, они могут служить для того, чтобы направлять липопротеины по определенному пути секреции и поверхностной локализации [190].
Секвенирование для других штаммов
70 штаммов, представляющих генетическое и географическое разнообразие популяции N.meningitidis, выбрали для дальнейшего исследования NMB1870. Штаммы получали из 19 различных стран, 73% принадлежат к серогруппе B и 32 были выделены за последние пять лет. Список штаммов в основном включает в себя штаммы серогруппы В, несколько штаммов серогрупп A, C, Y, W-135 и Z и по одному штамму каждого из N.gonorrhoeae и N.cinerea. Более подробно штаммы описаны в ссылках 191 и 192. Некоторые штаммы доступны в ATCC (например, штамм MC58 доступен под обозначением BAA-335).
Ген NMB1870 амплифицировали, используя праймеры, находящиеся вне кодирующей последовательности (A1, SEQ ID 55; и B2, SEQ ID 56). Приблизительно 10 нг хромосомной ДНК использовали в качестве матрицы для амплификации. Условия для PCR представляли собой: 30 циклов, 94°C в течение 40 мин, 58°C в течение 40 мин, 68°C в течение 40 мин. Фрагмент PCR очищали при помощи набора для очистки Qiagen QIAquick после PCR и предоставляли для анализа последовательности, который проводили с использованием автоматического секвенатора ABI 377. Секвенирование проводили с использованием праймеров Al, B2, 22 (SEQ ID 57) и 32 (SEQ ID 58).
Ген определяли при помощи PCR во всех 70 штаммах Neisseria. В N.lactamica полосу можно было определить вестерн-блоттингом, но ген невозможно было амплифицировать.
Нуклеотидную последовательность гена определяли во всех 70 штаммах. Всего 23 различных белковых последовательностей было кодировано (SEQ ID NO с 1 по 23). Компьютерный анализ данных 23 последовательностей с использованием алгоритма Кимуры и Джукса-Кантора подразделил их на три варианта (фигура 9). Была получена древовидная схема, начиная с множественного выравнивания белковых последовательностей NMB1870 (PileUP) с использованием Protein Sequence Parsimony Method (ProtPars), программы доступной в Phylogeny Inference Package (Phylip), и она была подтверждена программой Distances GCG, использующей алгоритмы Кимуры и Джукса-Кантора.
Последовательности NMB1870 из 100 дополнительных штаммов были определены. Многие из них были идентичны одной из SEQ ID NO с 1 по 23, но 19 дополнительных уникальных последовательностей приведены в качестве SEQ ID NO с 140 по 158.
На фигурах 12-14 показаны древовидные схемы различных последовательностей, классифицированных при помощи мультилокусных типов последовательностей ST. Внутри варианта 1 (фигура 12) штаммом сравнения является MC58, причем наименьшая идентичность последовательности к штамму сравнения составляет 89,4% против среднего значения 93,7%. Внутри варианта 2 (фигура 13) штаммом сравнения является 2996, и последовательности располагаются ниже с идентичностью 93,4% (среднее значение 96,3%). Внутри варианта 3 (фигура 14) самая низкая идентичность к последовательности сравнения M1239 составляет 94,7% (среднее значение 95,8%). ST32cpx является самой гомогенной гипервирулентной группой, заключая в себе только одну последовательность NMB8170 из варианта 1 (также только одну форму NMB1343 и NadA). Большинство штаммов ST44cpx заключает в себе вариант 1 (несколько различных последовательностей) NMB1870, но некоторые содержат вариант 3 (одна последовательность). Такие данные наводят на мысль, что ST32cpx более близок ST44cpx по сравнению с другими кластерами, которые соответствуют данным на основе генотипа porA (класс III). Комплексы ST11 и ST8 в основном представлены различными последовательностями внутри варианта 2 NMB1870, предполагая, что данные комплексы ближе друг к другу по сравнению с другими кластерами, и соответствуют генотипу porA (класс II). ST11cpx заключает в себе все три варианта, указывая на то, что он представляет собой самый разнообразный гипервирулентный кластер из четырех.
Штаммы MC58, 961-5945 и M1239 были произвольно отобраны в качестве типов штаммов для вариантов 1, 2 и 3, соответственно. Разнообразие последовательности между тремя типами штаммов показано на фигуре 10. Аминокислотная идентичность составляла 74,1% между вариантом 1 и вариантом 2, 62,8% между вариантом 1 и вариантом 3 и 84,7% между вариантом 2 и вариантом 3. Последовательности внутри каждого варианта были высоко консервативны, самая отдаленная последовательность демонстрирует 91,6%, 93,2% и 93,4% идентичности со штаммами их типов, соответственно. N.cinerea принадлежит к варианту 1 и имеет 96,7% идентичности с MC58. Как показано на фигуре 9, вариант 1 заключает в себе все штаммы из гипервирулентных линий ЕТ-5, большинство линий штамма 3, штаммы серогруппы А, два недавно выделенных изолята W-135 и один ЕТ-37. Вариант 2 заключает в себе все штаммы из гипервирулентного комплекса A4, из серогрупп Y и Z, один старый изолят W-135 и пять штаммов ЕТ-37. Вариант 3 заключает в себе четыре уникальных штамма ST, один штамм ЕТ-37, один штамм линии 3 и гонококк.
Штаммы в каждой группе варианта и их последовательности NMB1870 являются следующими:
SEQ ID NO 139 (штамм 220173i), 140 (штаммы gb101 и ISS908) и 141 (штамм nge31) отдаленны от этих трех вариантов (как и, в меньшей степени, штамм m3813).
Внутри варианта 1 последовательность штамма lnp17592 (также обнаруженная в штаммах 00-241341, 00-241357, 2ND80, 2ND221 и ISS1142) обнаружена в Haji серогруппы W-135. Внутри штаммов Haji последовательность NadA (SEQ ID NO: 143) представляет собой рекомбинацию между аллелями 2 и 3 [191, 192].
Клонирование, экспрессия и очистка в E.coli
Гены NMB1870 амплифицировали при помощи PCR из генома N.meningitidis штаммов MC58, 961-5945 и M1239. Прямые и обратные праймеры сконструировали для того, чтобы амплифицировать кодирующую последовательность nmb1870, лишенную кодирующей последовательности для предполагаемого лидерного пептида. Было обнаружено, что варианты M1239 и 961-5945 не были экспрессированы в E.coli. Поэтому они были экспрессированы с добавлением к N-концу последовательности SEQ ID NO: 46, которая присутствует в белке гонококка, но отсутствует в аналоге менингококка. Олигонуклеотиды, используемые для амплификации, были следующими:
Участки рестрикции, соответствующие NdeI для прямых праймеров, и XhoI (HindIII для M1239) для обратных праймеров подчеркнуты. Для прямых праймеров 961-5945 и M1239, часть последовательности гонококка показана курсивом, и совпадающие последовательности менингококкового NMB1870 показаны полужирным шрифтом.
Условия PCR в случае комбинации праймеров Forl/Revl представляли собой: денатурацию при 94°C в течение 30 мин, отжиг при 57°C в течение 30 мин, элонгацию при 68°C в течение 1 мин (5 циклов), денатурацию при 94°C в течение 30 мин, отжиг при 68°C в течение 30 мин, элонгацию при 68°C в течение 1 мин (30 циклов). В случае комбинации праймеров: For2/Rev2 и For3/Rev2 и For3/Rev3: 94°C в течение 30 мин, 56°C в течение 30 мин, 68°C в течение 1 мин (5 циклов), 94°C в течение 30 мин, 71°C в течение 30 мин, 68°C в течение 1 мин (30 циклов).
Полноразмерный ген nmbl870 амплифицировали из генома MC58 с использованием следующих праймеров: f-lFor (CGCGGATCCCATATGAATCGAACTGCCTTCTGCTGCC; SEQ ID 53) и f-lRev (CCCGCTCGAGTTATTGCTTGGCGGCAAGGC; SEQ ID 54) и при следующих условиях: 94°C в течение 30 мин, 58°C в течение 30 мин, 72°C в течение 1 мин (30 циклов).
PCR проводили приблизительно с 10 нг хромосомной ДНК, с использованием High Fidelity Taq DNA Polymerase (Invitrogen). Продукты PCR расщепляли при помощи NdeI и XhoI и клонировали в участки NdeI/XhoI экспрессирующего вектора pET-21b+ (Novagen).
Рекомбинантные белки экспрессировали в E.coli в качестве слитых с гистидиновой меткой и очищали при помощи MCAC (металлаффинной хелатирующей хроматографии), как описано ранее [3], и использовали их для иммунизации мышей для получения антисывороток. DH5α E.coli использовали для клонирования и BL21 (DE3) использовали для экспрессии.
Изогенные мутанты nmb1870 и siaD
Изогенные нокаут-мутанты, в которых ген nmb1870 был укорочен и замещен на кассету антибиотика эритромицина, получали трансформируя штаммы MC58, 961-5945 и M1239 плазмидой pBSΔnmb1870ERM. Данная плазмида содержит ген устойчивости к эритромицину внутри nmb1870 выше и ниже (в положениях апстрим и даунстрим, соответственно) фланкирующих областей в 500 н.п. Данные области амплифицировали из генома MC58 с использованием следующих олигонуклеотидов Ufor GCTCTAGACCAGCCAGGCGCATAC (SEQ ID 59, подчеркнут участок XbaI); URev TCCCCCGGGGACGGCATTTTGTTTACAGG (SEQ ID 60, подчеркнут участок SmaI); DFor TCCCCCGGGCGCCAAGCAATAACCATTG (SEQ ID 61, подчеркнут участок SmaI) и Drev CCCGCTCGAGCAGCGTATCGAACCATGC (SEQ ID 62, подчеркнут участок XhoI). Мутант с дефектами оболочки был создан, используя тот же самый подход. Ген siaD удалили и заменили на ermC, используя плазмиду pBSΔCapERM. 1000 н.п. и 1056 н.п. выше и ниже фланкирующих областей, соответственно, амплифицировали из генома MC58 с использованием следующих праймеров: UCapFor GCTCTAGATTCTTTCCCAAGAACTCTC (SEQ ID 63, подчеркнут Xba1); UcapRev TCCCCCGGGCCCGTATCATCCACCAC (SEQ ID 64, подчеркнут Sma1); DCapFor TCCCCCGGGATCCACGCAAATACCCC (SEQ ID 65, подчеркнут Sma1) и DCapRev CCCGCTCGAGATATAAGTGGAAGACGGA (SEQ ID 66, подчеркнут Xho1). Амплифицированные фрагменты клонировали в pBluescript и трансформировали в компетентный в природе штамм MC58 N.meningitidis. Смесь помещали на планшет с GC-агаром, инкубировали в течение 6 часов при 37°C, затем 5% CO2 растворяли в PBS и распределяли по планшетам с GC-агаром, содержащим эритромицин в концентрации 5 мкг/мл. Делецию гена nmbl870 в штаммах MC58 Δnmbl870, 961-5945Δnmbl870 и M1239Δnmbl870 подтверждали PCR; отсутствие экспрессии NMB1870 подтверждали анализом вестерн-блотт. Делецию гена siaD и отсутствие экспрессии капсулы в штамме MC58 ΔsiaD подтверждали PCR и FACS, соответственно.
Липопротеины
Для исследования липидизации NMB1870 введение пальмитата рекомбинантного штамма E.coli BL21(DE3), несущего полноразмерный ген nmbl870, проверяли, как описано в ссылке 193.
Менингококковые штаммы MC58 и MC58Δnmbl870 растили на GC-среде и метили [9, 10-3H]-пальмитиновой кислотой (Amersham). Клетки из 5 мл культуры лизировали кипячением в течение 10 мин и центрифугировали при 13000 об./мин. Супернатанты осаждали при помощи TCA и дважды отмывали в охлажденном ацетоне. Белки суспендировали в 50 мкл 1,0% SDS, и 15 мкл анализировали при помощи SDS-PAGE, окрашенного кумасси бриллиантовым голубым, фиксировали и выдерживали в течение 15 мин в растворе Amplify (Amersham). Гели облучали в Hyperfilm MP (Amersham) при -80°C в течение трех дней.
Радиоактивную полосу соответствующей молекулярной массы определяли в MC58, но не в нокуат-мутанте Δnmb1870.
Рекомбинантные E.coli, выросшие в присутствии [9, 10-3H]-пальмитиновой кислоты, также имели радиоактивную полосу ожидаемой молекулярной массы, подтверждая, что E.coli распознает липопротеиновый мотив и добавляет липидный хвост к рекомбинантному белку.
Определение белка
Штамм MC58 растили при 37°C с 5% CO2 в GC-среде в стационарной фазе. Образцы собирали во время роста (OD620nm 0,05-0,9). MC58Δnmbl870 растили до OD620nm 0,5. Бактериальные клетки накапливали центрифугированием, один раз отмывали в PBS, ресуспендировали в различных объемах PBS для того, чтобы стандартизировать значения OD. Супернатант культуры фильтровали с использованием фильтра с диаметром отверстий 0,2 мкм и 1 мл осаждали, добавляя 250 мкл 50% трихлоруксусной кислоты (TCA). Образцы инкубировали на льду в течение 2 часов, центрифугировали в течение 40 мин при 4°C и осадок отмывали 70% охлажденным до 0°C этанолом и ресуспендировали с PBS. 3 мкл каждого образца (соответствующей OD620 0,03) затем загружали на 12% полиакриламидный гель и переносили электроблоттингом на нитроцеллюлозные мембраны.
Анализ вестрн-блотт проводили согласно стандартным способам с использованием поликлональных антител, полученных против белка, экспрессированного в Е.coli, при разведении 1:1000, сопровождающимся разведением 1/2000 меченных HPR против IgG человека (Sigma). Сканирование проводили, используя LabScan (Pharmacia) и программу Imagemaster (Pharmacia).
Как показано на фиг.3, белок массой ˜ 29,5 кДа определяли в общих клеточных экстрактах N.meningitidis. Количество белка в общем клеточном лизате приблизительной удваивалось во время кривой роста, в то время как оптическая плотность культуры увеличивалась с 0,05 до 0,9 OD620nm. Полосу такого же размера также определяли в супернатанте культуры. Белок не определялся в супернатанте только что инокулированной культуры (OD620nm 0,05) и увеличивался приблизительно в четыре раза во время роста с 0,1 до 0,9 OD620nm (фигура 4, снимок слева). Истинную природу экспрессии в супернатанте подтверждали, проверяя те же самые образцы на наличие мембранных пузырьков и цитоплазматических белков. Как показано на среднем снимке на фигуре 4, отсутствие PorA в препаратах супернатанта PorA исключает возможное загрязнение мембранными пузырьками, в то время как отсутствие в супернатанте цитоплазматического белка NMB1380 подтверждает, что образцы супернатантов не являются результатом лизиса клетки (снимок справа).
В нокаут-штамме MC58Δnmb1870 не показано никакого белка ни в общем клеточном лизате, ни в культуре супернатанта (полоса «KO» на фигурах 3 и 4).
NMB1870 определяли вестерн-блоттингом в везикулах наружной мембраны, подтверждая, что белок разделяется с мембранными фракциями N.meningitidis (фигура 5). Однако сыворотки из мышей, иммунизированных OMV, не распознали рекомбинантный NMB1870 в вестерн-блоттинге, наводя на мысль, что белок не является иммуногенным в препаратах OMV.
FACS-анализ с использованием антител против NMB1870 подтвердил, что белок экспонирован на поверхность и доступен для антител как в инкапсулированных, так и неинкапсулированных штаммах N.meningitidis (фигура 6).
При FACS-анализе использовали проточный цитометр FACS-Scan, причем связывание антитела обнаруживали с использованием вторичного антитела против мыши (целой молекулы), конъюгированного с FITC (Sigma). В положительном FACS-контроле использовали SEAM3, mAb, специфичное для менингококкового капсульного полисахарида B [194]; отрицательный контроль состоял из мышиной поликлональной антисыворотки против цитоплазматического белка NMB 1380 [195].
Анализ вестерн-блоттинг 43 штаммов показал, что NMB1870 экспрессируется во всех исследуемых штаммах. Однако, как показано на фигуре 7, уровни экспрессии значительно изменялись от штамма к штамму. Исследуемые штаммы можно грубо классифицировать на сильные, средние и слабые экспрессоры:
Большинство штаммов гипервирулентных линий (ET-5, линия 3, ET-37) экспрессировали высокие уровни белка, за исключением A4, где два штамма экспрессировали средние уровни и два штамма экспрессировали низкие уровни белка. Интересно, что белок экспрессировался на высоком уровне штаммами, которые классически использовались в качестве штаммов для OMV-вакцин. Не было обнаружено никаких очевидных генетических структур для предсказания количества белка, экспрессируемого каждым штаммом. Даже наличие IS-элемента в области промотора, который был обнаружен в 8/70 штаммов (один из серогруппы A, три из линии 3 и четыре из штаммов, классифицированных как другие), не показывал никакой корреляции с экспрессией белка.
Сканирование вестерн-блоттов показало, что различия в экспрессии между высокой и средней, средней и низкой или высокой и низкой могли быть двух-, пяти- и девятикратными, соответственно. Не существует никакого непосредственно очевидного основания для различных уровней экспрессии, и анализ последовательностей ДНК выше гена не показал никакой особенности, которая коррелировала бы с экспрессией.
Иммунный ответ
Сыворотки здоровых и выздоравливающих индивидуумов анализировали вестерн-блоттом на наличие антител против NMB1870. Очищенный NMB1870 (1 мкг/полоса) загружали на 12,5% SDS-полиакриламидные гели и переносили на нитроцеллюлозную мембрану. Связывание белка обнаружили при разведении сывороток 1/200, сопровождаемых разведением 1/2000 меченного HPR IgG против человека (Sigma). В то время как только 2/10 сывороток здоровых людей распознавали NMB1870, 21/40 сыворотки выздоравливающих распознали белок, что приводит к заключению, что NMB1870 иммуногенен в течение инфекции in vivo. Поэтому антисыворотки мышей, иммунизированных с рекомбинантным NMB1870, исследовали далее.
Для того чтобы получить антисыворотки, 20 мкг рекомбинантных белков NMB1870 варианта 1, варианта 2 и варианта 3 использовали для иммунизации мышей CD1 женского пола в возрасте шести недель (Charles River). Использовали от четырех до шести мышей на группу. Рекомбинантные белки вводили внутрибрюшинно, совместно с полным адъювантом Фрейнда (CFA) в первой дозе и неполным адъювантом Фрейнда (CFA) во второй (21 день) и третьей (35 день) повторных дозах. Такую же схему иммунизации проводили с использованием в качестве адъюванта гидроокиси алюминия (3 мг/мл) вместо адъюванта Фрейнда. Образцы крови для анализа были взяты на 49 день.
Антисыворотки анализировали на их способность вызывать комплементзависимую гибель капсулированных штаммов N.meningitidis, как описано ранее [3, 196] с использованием объединенной сыворотки крольчат (CedarLane), используемой в качестве источника комплемента. Сыворотки здоровых взрослых людей (без свойственной бактерицидной активности во время анализа при конечной концентрации 25 или 50%), также использовали в качестве источника комплемента. Сывороточные бактерицидные титры определяли как разведение сыворотки, приводящее к уменьшению на 50% колониеобразующих единиц (КОЕ) на мл через 60 мин инкубации бактерий с реакционной смесью, по сравнению с контрольными КОЕ на мл во время 0. Типично, бактерии, инкубируемые с антителом для отрицательного контроля в присутствии комплемента, показывали от 150 до 200% увеличение КОЕ/мл во время инкубации в течение 60 мин.
Репрезентативные штаммы из сильных, средних и слабых экспрессоров выбирали для анализа. Различную экспрессию белка на поверхности выбранных штаммов подтверждали FACS-анализом (фигура 8). MC58, представитель штаммов сильных экспрессоров погибал с высокой эффективностью от сыворотки, разбавленной вплоть до 1/64000; NZ394/98 (исходно NZ98/254), представитель средних экспрессоров также погибал с высокой эффективностью от сыворотки, разбавленной вплоть до 1/16000 и даже штамм 67/00, представитель штаммов слабых экспрессоров погибал от антисыворотки, разбавленной вплоть до 1/2048. Контрольные штаммы, где нокаутировали ген nmbl870, не погибали от той же самой антисыворотки.
Для того чтобы подтвердить, были ли сыворотки также способны поддерживать защиту in vivo, их проверили на способность вызывать пассивную защиту на модели новорожденных крысы. Пятидневным крысятам предварительно внутрибрюшинно вводили антисыворотки против NMB1870 или моноклональное антитело против PorA во время 0 и их оценивали через два часа после внутрибрюшинной инъекции 5×103 КОЕ/крысу 4243 MenC (OAc-положительный) или NZ394/98 MenB. Количественные культуры крови получали через 24 часа. Определение количества бактерий в культурах крови (КОЕ/мл, геометрические средние) получали, помещая кровь на планшеты с шоколадным агаром. Сыворотка для положительного контроля представляла собой сыворотку против PorA (P1.2) для MenC и SEAM3 для MenB. Результаты экспериментов были следующие:
Следовательно, никаких бактериальных колоний не извлекали из крови крыс, пассивно иммунизированных сывороткой против NMB1870, в то время как у большинства животных отрицательного контроля наблюдалась бактериемия.
Бактерицидная активность специфична для варианта
Каждый тип варианта экспрессировали в E.coli в качестве меченного гистидином белка и использовали для иммунизации мышей. Сыворотки использовали для анализа перекрестной реакционноспособности между штаммами трех вариантов при помощи FACS и бактерицидного анализа. Как показано на фигуре 11 при FACS-анализе, все штаммы распознавались каждой сывороткой, хотя степень распознавания значительно варьировала, обычно отражая аминокислотную гомологию среди белков.
При более тщательном анализе, сыворотка против варианта 1 (фигура 11, первый ряд) очень хорошо распознавала штамм MC58 (как и ожидалось), в более низкой степени штамм 961-5945 (74,1% идентичности) и самой малой степени штамм M1239 (62,8% идентичности). Похожую тенденцию обнаружили для антисывороток против вариантов 2 и 3 (ряд 2 и 3 на фигуре 11), хотя с сывороткой против варианта 2 различия не были столь поразительны.
Моноклональное антитело против капсулы распознавало все три штамма в равной степени хорошо (ряд 4), хотя сыворотка против цитоплазматического белка NMB1380, использованного в качестве отрицательного контроля, не распознавала ни один штамм (ряд 5). Схожим образом, нокаут-мутанты nmb1870 не распознавались никакими сыворотками (ряд 6).
Различия в иммунораспознавании между вариантами были более доказательны при бактерицидном анализе:
Данные показывают, что сыворотка против каждого варианта способна вызывать эффективную комплементзависимую гибель гомологичного штамма (титры находятся в диапазоне между 16000 и 64000), в то время как активность против штаммов других вариантов была ниже (128-2048) или отсутствовала (<4). Как предсказано по близкой аминокислотной гомологии, перекрестные бактерицидные титры среди вариантов 2 и 3 были выше, чем другие. Когда использовали человеческий комплемент, используя штаммы гомологичных типов, получили бактерицидные титры 4096, 256 и 512 для вариантов 1, 2 и 3, соответственно. Против гетерологичных штаммов не было обнаружено никаких титров.
Гибридные и тандемные белки
Гибридные и тандемные белки можно представить формулой: NH2-A-[-X-L-]n-B-COOH. Были сконструированы гены, кодирующие белки такого типа, где n=2, N-конец X1 и X2 удаляли до конца их полиглициновых областей и -L2- и -B- отсутствовали (или же B представлял собой полигистидиновую метку, используемую для очистки). В следующей таблице представлены компоненты таких белков в их зрелых формах и приведены SEQ ID NO полного полипептида и SEQ ID NO и штаммы для последовательностей компонентов A, X1, L1 и X2:
Следовательно, восемь из данных двенадцати белков представляют собой тандемные белки NMB1870 (MB ˜ 55 кДа) и четыре являются гибридными белками с «9362996» на N-конце (MB ˜ 49 кДа). Использовали два линкера: (a) SEQ ID NO: 78, который получен из гонококкового гомолога NMB1870 (SEQ ID NO: 46) и (b) линкер с повышенным содержанием глицина (SEQ ID NO: 144). SEQ ID NO: 78 также использовали на N-концах зрелых белков, без его двух N-концевых остатков BamHl (Gly-Ser), то есть SEQ ID NO: 86.
Все двенадцать белков солюбилизировали при экспрессии в E.coli и после очистки их использовали для иммунизации мышей. Ответы сывороточных бактерицидных антител (SBA) оценивали против четырех менингококковых штаммов, обеспечивая один из каждого из трех вариантов NMB1870 с 1 по 3 (показаны как верхний индекс). Адъювант представлял собой либо CFA (сверху) или гидроксид алюминия (снизу):
Данные результаты ясно показывают специфичную для варианта природу иммунных реакций. Например, белки (1) и (2) содержат последовательности NMB1870 из вариантов 1 и 2, и лучшие результаты SBA обнаружены против данных двух вариантов. Подобным образом лучшие результаты обнаружены против вариантов 1 и 3, если используют белки (3) и (4). Высокая активность замечена при использовании NMB1870 из вариантов 2 и 3, в любом порядке от N-конца до C-конца с использованием белков с (5) по (8), с небольшой активностью против варианта 1. Специфичная для варианта природа ответа NMB1870 также очевидна при использовании гибридных белков, причем некоторая активность против 2996 обеспечивается частью «936».
Следующие олигонуклеотидные праймеры использовали для получения 12 белков:
Тройной тандемный белок
«Тройной тандемный» белок, где n=3, конструировали на основе штаммов (1) MC58, (2) 2996 и (3) m1239. 757-мерный тройной тандемный белок NH2-A-X1-L1-X2-L2-X3-L3-B-COOH содержит аминокислотную последовательность SEQ ID NO: 142:
Обе части X2 и X3 не содержат N-концов вплоть до их полиглициновых областей (то есть они представляют собой последовательности ΔG).
Бактерицидные титры SBA
Мышей иммунизировали девятью различными белками и бактерицидную активность получившихся в результате сывороток проверяли против различных штаммов менингококка, включающих в себя как штаммы, которые соответствуют штаммам, из которых получали белки для иммунизации, так и штаммы, которые отличаются от белков для иммунизации. Девять белков представляли собой:
Гибридные белки 936 и NMB1870 (A), (B) и (C)
(A) NMB1870MC58 = вариант 1 [12]
(B) NMB18702996 = вариант 2, например, SEQ ID NO: 91 и 92
(C) NMB1870M1239 = вариант 3, например, SEQ ID NO: 91 и 92
Белки NMB1870 из единичных штаммов (D), (E) и (F)
(D) NMB1870MC58 = вариант 1, например, SEQ ID NO: 80
(E) NMB18702996 = вариант 2, например, SEQ ID NO: 81
(F) NMB1870M1239 = вариант 3, например, SEQ ID NO: 84
Тандемные белки NMB1870 (G), (H) и (I)
(G) NMB1870MC58-NMB18702996 = варианты 1 и 2, например SEQ ID NO: 79 и 82
(H) NMB18702996-NMB1870M1239 = варианты 2 и 3, например SEQ ID NO: 87 и 88
(I) NMB1870MC58-NMB1870M1239 = варианты 1 и 3, например SEQ ID NO: 83 и 85
Бактерицидные ответы измеряли против вплоть до 20 штаммов, которые имели вариант 1 NMB1870, против вплоть до 22 штаммов с вариантом 2 NMB1870 и против вплоть до 5 штаммов с вариантом 3.
Бактерицидная эффективность сывороток, полученных против белков с (A) по (C), соответствовала генотипу исследуемых штаммов, например, используя CFA в качестве адъюванта для иммунизации, титры SBA против штамма MC58 (вариант 1) составляли: (A) 262144; (B) <4; (C) <4. Подобным образом, если сыворотки исследовались против штамма 961-5945 (вариант 2), SBA составляли: (A) 256; (B) 32768; (C) 4096. Наконец, против штамма M1239 (вариант 3) титры составляли: (A) <4; (B) 512; (C) 32768.
Белок (A) с использованием в качестве адъюванта CFA или гидроксида алюминия вызвал титры SBA ≥512 против следующих штаммов: M01-240185, M2197, LPN17592, M6190 (все ET37); MC58, BZ83, CU385, N44/89, 44/76, M2934, M4215 (все ET5); BZ133; M1390, ISS1026, ISS1106, ISS1102 (линия 3); F6124 (sIII); и M2937 (другие). Данные штаммы охватывают серогруппы A, B, C и W135; никакие штаммы серогруппы Y не исследовались.
Белок (B) с использованием в качестве адъюванта CFA или гидроксида алюминия вызвал титры SBA ≥512 против штаммов: 2996, 961-5945, 96217 (кластер A4); M01-240013, C11, NGH38, M3279, M4287, BZ232 (другие). Данные штаммы охватывают серогруппы B и C; никакие штаммы серогруппы A, W135 или Y не исследовались.
Белок (C) с использованием в качестве адъюванта CFA или гидроксида алюминия вызвал титры SBA ≥512 против штаммов: M01-0240364, NGP165 (ET37); M1239 (линия 3); M01-240355, M3369 (другие). Данные штаммы находятся в серогруппе B, и никакие штаммы серогруппы A, C, W135 или Y не исследовались.
Характер SBA, наблюдаемый с белками с (A) по (C), также наблюдали с белками с (D) по (F). Против штамма MC58 сыворотка, полученная с использованием белка (D) и адъюванта гидроксид алюминия, показывала титр SBA 16384, тогда как сыворотки, полученные с использованием белка (E) или (F) и того же самого адъюванта, показывали титры SBA<4. Против штамма 961-5945 белок (D) и (F) вызывал более низкие титры, чем титры, полученные при использовании (E). Против штамма M1239 титры SBA составляли: (D) <4; (E) 128; (F) 16384.
Эффективность SBA с использованием тандемных белков была улучшена. Сыворотки, полученные с использованием белка (G), являлись бактерицидными против штамма MC58 и 961-5945, а также и других штаммов, которые имели вариант 1 или вариант 2 NMB1870. Сыворотки, полученные против белка (H), показывали низкие титры против штаммов, которые имели вариант 1 NMB1870, но высокие титры против других штаммов, например, 16384 против штамма 961-5945 (вариант 2) и 32768 против штамма M3369 (вариант 3).
Сыворотки, полученные при иммунизации белком (H) с адъювантом CFA, показывали титры SBA ≥512 против штаммов: LNP17094, 96217, 961-5945, 2996, 5/99 (кластер A4); C4678, M01-0240364, NGP165 (ET37); M1239 (линия 3); M2552, BZ232, M3279, M4287, 1000, NGH38, C11, M01-240013, M01-240355, M3369 (другие). Данные штаммы охватывают серогруппы B и C; активность против штаммов серогрупп A, W135 или Y не проверялась с белком (H).
Сыворотки, полученные при иммунизации белком (I) с адъювантом CFA, показывали титры SBA ≥512 против штаммов: M01-0240364, 14784, M6190, MC58, LPN17592, M2197 (ET37); 44/76 (ET5); M1239, ISS1102, ISS1106, ISS1026, 394/98 (линия 3); M2937 (другие). Данные штаммы охватывают серогруппы B, C и W135; активность против штаммов серогрупп A или Y не исследовалась с белком (I).
После иммунизации белками, охватывающими вариант 1 NMB1870, сыворотки, исследованные против вплоть до 20 штаммов, которые имели NMB1870 варианта 1, показывали следующие титры SBA:
После иммунизации белками, охватывающими вариант 2 NMB1870, сыворотки, исследованные против вплоть до 22 штаммов, которые имели NMB1870 варианта 2, показывали следующие титры:
После иммунизации белками, охватывающими вариант 3 NMB1870, сыворотки, исследованные против вплоть до 5 штаммов, которые имели NMB1870 варианта 3, показывали следующие титры:
Заключение
Во-первых, NMB1870, по-видимому, не является антигеном, применимым для полиспецифичной иммунизации - уровни его экспрессии изменяются между штаммами, существует значительная вариабельность последовательности и не существует перекрестной защиты между различными вариантами. Тем не менее, было показано, что даже те штаммы, которые экспрессируют очень низкие уровни данного антигена, чувствительны к сывороткам против NMB1870. Более того, разнообразие последовательности ограничено тремя видами вариантов, таким образом, полиспецифичный иммунитет можно обеспечить без необходимости в большом количестве антигенов. Дополнительно, считается, что данные три белка могут вызывать иммунитет против более чем только менингококки серогруппы В.
Различные варианты NMB1870 можно экспрессировать совместно в качестве слитых белков, для того чтобы получить единичные полипептидные цепи, которые активны против более чем одного варианта.
NMB1870 иммуногенен во время инфекции способен вызывать образование бактерицидных антител и защищать крысят бактериального контрольного заражения.
Дополнительную экспериментальную информацию о NMB1870 можно обнаружить в ссылке 197.
Понятно, что изобретение описано выше посредством только одного примера и можно разработать модификации, оставаясь в пределах объема и сущности изобретения.
КРАТКОЕ ОПИСАНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
ССЫЛКИ
(содержание которых включено сюда в полном объеме)
[I] Jodar et al. (2002) Lancet 359(9316):1499-1508.
[2] Tettelin etal. (2000) Science 287:1809-1815.
[3] Pizza et al. (2000) Science 287:1816-1820.
[4] Parkhill et al. (2000) Nature 404:502-506.
[5] http://dnal.chem.ou.edu/gono.html
[6] WO99/24578.
[7] WO99/36544.
[8] WO99/57280.
[9] WO00/22430.
[10] WO01/64920.
[11] WO01/64922.
[12] WO03/020756.
[13] WO03/063766.
[14] Achtman (1995) Global epidemiology of meningococcal disease. Pages 159-175 of Meningococcal disease (ed. Cartwight). ISBN: 0-471-95259-1.
[15] Caugant (1998) APMIS 106:505-525.
[16] Maiden et al. (1998) Proc. Natl. Acad. Sci. USA 95:3140-3145.
[17] Reilly & Smith (1999) Protein Expr Purif 17:401-409.
[18] Covacci & Rappuoli (2000) J. Exp. Med. 19:587-592.
[19] WO93/18150.
[20] Covacci et al. (1993) Proc. Natl. Acad. Sci. USA 90: 5791-5795.
[21] Tummuru et al. (1994) Infect. Immun. 61:1799-1809.
[22] Marchetti et al. (1998) Vaccine 16:33-37.
[23] Telford et al. (1994) J. Exp. Med. 179:1653-1658.
[24] Evanse et al. (1995) Gene 153:123-127.
[25] WO96/01272 & WO96/01273, especially SEQID NO:6.
[26] WO97/25429.
[27] WO98/04702.
[28] Costantino et al. (1992) Vaccine 10:691-698.
[29] Costantino et al. (1999) Vaccine 17:1251-1263.
[30] International patent application WO03/007985.
[31] Watson (2000) Pediatr Infect Dis J 19:331-332.
[32] Rubin (2000) Pediatr Clin North Am 47:269-285, v.
[33] Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207.
[34] Bell (2000) Pediatr Infect Dis J 19:1187-1188.
[35] Iwarson (1995) APMIS 103:321-326.
[36] Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
[37] Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0.
[38] Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70.
[39] Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355.
[40] Rappuoli et al. (1991) TIBTECH 9:232-238.
[41] Hsu et al. (1999) Clin Liver Dis 3:901-915.
[42] WO02/079243.
[43] International patent application WO02/02606.
[44] Kalman et al. (1999) Nature Genetics 21:385-389.
[45] Read et al. (2000) Nucleic Acids Res 28:1397-406.
[46] Shirai et al. (2000) J. Infect. Dis. 181 (Suppl 3):S524-S527.
[47] International patent application WO99/27105.
[48] International patent application WO00/27994.
[49] International patent application WO00/37494.
[50] International patent application WO99/28475.
[51] Ross et al. (2001) Vaccine 19:4135-4142.
[52] Sutter et al. (2000) Pediatr Clin North Am 47:287-308.
[53] Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126.
[54] Dreesen (1997) Vaccine 15 Suppl:S2-6.
[55] MMWR Morb Mortal Wkly Rep 1998 Jan 16;47(1):12,19.
[56] McMichael (2000) Vaccine 19 Suppl 1:S101-107.
[57] Schuchat (1999) Lancet 353(9146):51-6.
[58] International patent application WO02/34771.
[59] Dale (1999) Infect Dis Clin North Am 13:227-43, viii.
[60] Ferretti et at. (2001) PNAS USA 98: 4658-4663.
[61] Kuroda et al. (2001) Lancet 357(9264):1225-1240; see also pages 1218-1219.
[62] J Toxicol Clin Toxicol (2001) 39:85-100.
[63] Demicheli et al. (1998) Vaccine 16:880-884.
[64] Stepanov el al. (1996) J Biotechnol 44:155-160.
[65] Ingram (2001) Trends Neurosci 24:305-307.
[66] Rosenberg (2001) Nature 411:380-384.
[67] Moingeon (2001) Vaccine 19:1305-1326.
[68] EP-A-0372501.
[69] EP-A-0378881.
[70] EP-A-0427347.
[71] WO93/17712.
[72] WO94/03208.
[73] WO98/58668.
[74] EP-A-0471177.
[75] WO00/56360.
[76] WO91/01146.
[77] WO00/61761.
[78] WO01/72337.
[79] Research Disclosure, 453077 (Jan 2002).
[80] Jones (2001) Curr Opin Investig Drugs 2:47-49.
[81] Ravenscroft et al. (1999) Vaccine 17:2802-2816.
[82] International patent application WO03/080678.
[83] Nilsson & Svensson (1979) Carbohydrate Research 69:292-296).
[84] Frash (1990) p. 123-145 of Advances in Biotechnological Processes vol. 13 (eds. Mizrahi & Van Wezel).
[85] Inzana (1987) Infect. Immun. 55:1573-1579.
[86] Kandil et al. (1997) Glycoconj J 14:13-17.
[87] Berkin et al. (2002) Chemistry 8:4424-4433.
[88] Lindberg (1999) Vaccine 17 Suppl 2:S28-36.
[89] Buttery & Moxon (2000) J.R Coll Physicians Lond 4:163-168.
[90] Ahmad & Chapnick (1999) Infect Dis Clin North Am 13:113-33, vii.
[91] Goldblatt (1998) J. Med Microbiol. 47:563-567.
[92] European patent 0477508.
[93] US patent 5,306,492.
[94] WO98/42721.
[95] Dick et al. in Conjugate Vaccines (eds. Cruse et al.) Karger, Basel, 1989, 10:48-114.
[96] Hermanson Bioconjugate Techniques, Academic Press, San Diego (1996) ISBN: 0123423368.
[97] Kanra et al. (1999) The Turkish Journal of Paediatrics 42:421-427.
[98] Ravenscroft et al. (2000) Dev Biol (Basel) 103: 35-47.
[99] WO97/00697.
[100] WO02/00249.
[101] Zielen et al. (2000) Infect. Immun. 68:1435-1440.
[102] Darkes & Plosker (2002) Paediatr Drugs 4:609-630.
[103] Tettelin el al. (2001) Science 293:498-506.
[104] Hoskins et al (2001) J Bacteriol 183:5709-5717.
[105] Rappuoli (2000) Curr Opin Microbiol 3:445-450.
[106] Rappuoli (2001) Vaccine 19:2688-2691.
[107] Masignani et al. (2002) Expert Opin Biol Ther 2:895-905.
[108] Mora et al. (2003) Drug Discov Today 8:459-464.
[109] Wizemann et al. (2001) Infect Immun 69:1593-1598.
[110] Rigden et al. (2003) Crit Rev Biochem Mol Biol 38:143-168.
[111] WO02/22167.
[112] Ramsay et al. (2001) Lancet 357(9251):195-196.
[113] Anderson (1983) Infect Immun 39(1):233-238.
[114] Anderson et al. (1985) J Clin Invest 76(1):52-59.
[115] Falugi et al. (2001) Eur J Immunol 31:3816-3824.
[116] EP-A-0594610.
[117] WO02/091998.
[118] WO99/42130.
[119] WO96/40242.
[120]Lees et al. (1996) Vaccine 14:190-198.
[121] WO95/08348.
[122] US patent 4,882,317.
[123] US patent 4,695,624.
[124] Porro et al. (1985) Mol Immunol 22:907-919.s
[125] EP-A-0208375.
[126] WO00/10599.
[127] Gever et al. Med. Microbiol. Immunol, 165:171-288 (1979).
[128] US patent 4,057,685.
[129] US patents 4,673,574; 4,761,283; 4,808,700.
[130] US patent 4,459,286.
[131] US patent 4,965,338.
[132] US patent 4,663,160.
[133] US patent 4,761,283.
[134] US patent 4,356,170.
[135]Lei et al. (2000) Dev Biol (Basel) 103:259-264.
[136] WO00/38711; US patent 6,146,902.
[137] WO02/09643.
[138] Katial et al. (2002) Infect Immun 70:702-707.
[139] WO01/52885.
[140] European patent 0301992.
[141] Bjune et al. (1991) Lancet (338(8775):1093-1096.
[142] Fukasawa et al. (1999) Vaccine 17:2951-2958.
[143] WO02/09746.
[144] Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333.
[145] WO01/09350.
[146] European patent 0449958.
[147] EP-A-0996712.
[148] EP-A-0680512.
[149] WO02/062378.
[150] WO99/59625.
[151] US patent 6,180,111.
[152] WO01/34642.
[153] WO03/051379.
[154] US patent 6,558,677.
[155] PCT/IB03/04293.
[156] WO02/062380.
[157] WO00/25811.
[158] Peeters et al. (1996) Vaccine 14:1008-1015.
[159] Vermont et al. (2003) Infect Immun 71:1650-1655.
[160] WO01/30390.
[161] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition, ISBN: 0683306472.
[162] WO03/009869.
[163] Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995 (ISBN 0-306-44867-X).
[164] WO90/14837.
[165] WO02/26212.
[166] WO98/33487.
[167] WO00/07621.
[168] WO99/27960.
[169] WO98/57659.
[170] European patent applications 0835318, 0735898 and 0761231.
[171] Krieg (2000) Vaccine 19:618-622; Krieg (2001) Curr opin Mol Ther 2001 3:15-24; WO96/02555, WO98/16247, WO98/18810, WO98/40100, WO98/55495, WO98/37919 and WO98/52581 etc.
[172] WO99/52549.
[173] WO01/21207.
[174] WO01/21152.
[175] WO00/62800.
[176] WO00/23105.
[177] WO99/11241.
[178] de Lorenzo et al. (1987) J. Bacteriol. 169:2624-2630.
[179] Nakai & Kanehisa (1991) Proteins 11:95-110.
[180] Yamaguchi el al. (1988) Cell 53:423-432.
[181] http://cubic.bioc.columbia.edu/predictprotein/
[182]
[183] Strutzberg et al. (1995) Infect. Immun. 63:3846-3850.
[184] Legrain et al. (1993) Gene 130:73-80.
[185] Loosmore et al. (1996) Mol Microbiol 19:575-586.
[186] Myers et al. (1998) Infect. Immun. 66:4183-4192.
[187] Schlegel et al. (2992) J. Bacteriol. 184:3069-3077.
[188] Turner et al. (2002) Infect. Immun. 70:4447-4461.
[189]
[190] Voulhoux et al. Thirteeth International Pathogenic Neisseria Conference. NIPH, Oslo, page 31.
[191] Comanducci et al. (2002) J. Exp. Med. 195: 1445-1454.
[192] WO03/010194.
[193] Jennings et al. (2002) Eur. J. Biochem. 269:3722-3731.
[194] Granoff et al. (1998).J. Immunol. 160:5028-5036.
[195] Grifantini et al. (2002) Nat. Biotechnol. 20:914-921.
[196] Peeters et al. (1999) Vaccine 17:2702-2712.
[197] Masignani el al. (2003) J Exp Med 197:789-799.











Реферат
Изобретение касается композиции для лечения заболевания, вызываемого Neisseria meningitides. Согласно изобретению белок NMB 1870 представляет собой эффективный антиген для получения иммунного ответа против менингококка, и он экспрессируется среди всех менингококковых серогрупп. Идентифицированы сорок две различные последовательности NMB 1870, и они образуют группы трех вариантов. Сыворотка, полученная против данного варианта, бактерицидна внутри той же самой группы варианта, но неактивна против штаммов, которые экспрессируют один из двух других вариантов, т.е. существует внутривариантная, но не межвариантная перекрестная защита. Поэтому в данном изобретении для максимальной перекрестной штаммовой эффективности используют смеси, содержащие различные варианты NMB 1870. В изобретении раскрывается способ индуцирования иммунного ответа млекопитающего, предусматривающий использование композиций на основе различных вариантов NMB 1870, а также представлены нуклеиновые кислоты, кодирующие указанные варианты белка NMB 1870 (соответствующие последовательности представлены в перечне последовательностей). Композиции на основе белка NMB 1870 обладают иммуногенными двойствами во время инфекции, способны вызывать образование бактерицидных антител, вызывают иммунитет против менингококков, причем не только против менингококков серогруппы В. 5 н. и 27 з.п. ф-лы, 14 ил., 19 табл.
Формула
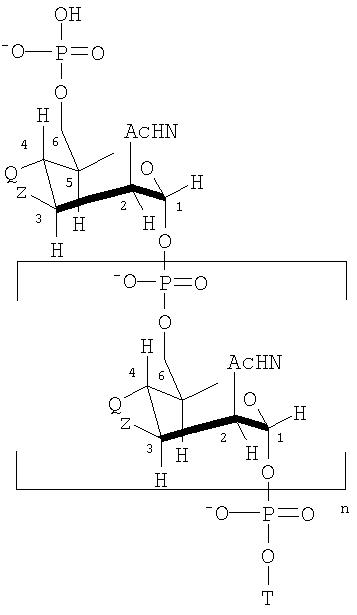
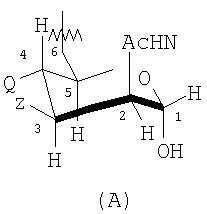

Комментарии