Способ выделения и очистки белка внешней мембраны moraxella catarrhalis, штамм м.catarrhalis для получения белка cd, изолированный и очищенный неденатурированный белок cd внешней мембраны м.catarrhalis и иммуногенная композиция, содержащая белок cd внешн - RU2186582C2
Код документа: RU2186582C2
Чертежи









Описание
Область изобретения
Настоящее изобретение относится к области иммунологии, в частности касается главных белков внешней мембраны Moraxella, способов их получения и применения.
Предпосылки к созданию
изобретения
Отит средний (воспаление среднего уха) является наиболее распространенным заболеванием раннего детства, приблизительно 70% всех детей по меньшей мере один раз болеют отитом
средним в возрасте до семи лет. Хронический отит средний может привести к нарушению слуха, речи и познавательной способности у детей. Он является следствием бактериальной инфекции Streptococcus
pneumoniae (приблизительно 50%), нетипируемой Haemophilus influenzae (приблизительно 30%) и Mofaxella (Branhamella) catarrhalis (приблизительно 20%). Только в Соединенных Штатах затраты на лечение
отита среднего составляют между одним и двумя миллиардами долларов в год на антибиотики и хирургические операции, такие как удаление миндалин, аденоидов и прокол барабанной перепонки. Из-за того, что
отит средний случается в том возрасте, когда быстро развиваются языковые навыки, у подростков с часто повторяющимся отитом средним документально зафиксированы случаи инвалидности вследствие порока
развития, конкретно относящиеся к познавательной способности и слуховому восприятию.
М. catarrhalis колонизирует, главным образом, дыхательные пути и является преимущественно слизистым патогеном. Исследования с использованием культур жидкости среднего уха, полученных при проколе барабанной перепонки, показали, что М. catarrhalis вызывает приблизительно 20% случаев отита среднего (ссылка 1 - На протяжении этой заявки ссылки на различные источники для более полного описания состояния в области знания, к которой относится это изобретение, приведены в круглых скобках. Полная библиографическая информация о каждом цитируемом источнике находится в конце описания. Сообщения об этих источниках включаются в виде ссылок в настоящем описании.
Заболеваемость отитом средним, вызываемым М.catarrhalis, растет. Так как пути предотвращения отита среднего, вызываемого пневмококками и нетипируемой Н. influenzae, разработаны, относительная важность М.catarrhalis как причины отита среднего, как можно предположить, еще увеличивается.
М. catarrhalis является также серьезной причиной инфекций нижних отделов дыхательных путей у взрослых, особенно при установлении хронического бронхита и эмфиземы (ссылки 2, 3, 4, 5, 6, 7 и 8). M.catarrhalis также вызывает синусит у детей и взрослых (ссылки 9, 10, 11, 12 и 13) и время от времени вызывает инвазивное заболевание (ссылки 14, 15, 16, 17, 18 и 19).
Как и у других грамотрицательных бактерий внешняя мембрана М. catarrhalis состоит из фосфолипидов, липополисахарида (LPS) и белков внешней мембраны (ОМР). Восемь из ОМР М. catarrhalis идентифицированы как главные компоненты. Они обозначены буквами от А до Н, начиная с ОМР А, который имеет молекулярную массу 98 кД, до ОМР Н, который имеет молекулярную массу 21 кД (ссылка 20).
Из главных ОМР, идентифицированных в М. catarrhalis, очевидный дублет, названный СD, является термомодифицируемым белком. Он имеет молекулярную массу 55 кД при комнатной температуре и массу 60 кД, когда нагрет в восстановительных условиях. Этот белок находится на поверхности и сохраняется у многих штаммов М.catarrhalis, как продемонстрировано исследованием с использованием CD-специфичных моноклональных антител (ссылка 21). Ген, кодирующий CD, недавно был клонирован и экспрессирован в Е. coli Мерфи и др. (ссылка 22). Рестрикционное картирование 30 изолятов М. catarrhalis с олигонуклеотидными зондами, соответствующими последовательностям в гене CD, давшее идентичные картины при саузерн-блоттинге, подтверждает, что последовательность гена CD сохраняется.
Таким образом, термомодифицируемый белок CD из М. catarrhalis является поверхностным сохраняемым белком, который содержит по меньшей мере два эпитопа, которые присутствуют во всех изученных штаммах М.catarrhalis (ссылка 21). Свойства белка CD показывают, что белок применим при диагностике болезни, вызываемой М.catarrhalis или другими бактериальными патогенами, которые продуцируют белок CD или продуцируют белок, способствующий появлению антител, специфически реакционноспособных с белком CD, а также для вакцинации против такой болезни.
Существует необходимость в получении очищенного белка CD (и в обеспечении способов его очистки) для применения в качестве антигенов, иммуногенных препаратов, включая вакцины, носителейрля других антигенов и иммуногенов и генерации диагностических реагентов.
Краткое описание изобретения
Настоящее изобретение относится к обеспечению очищенного
главного белка CD внешней мембраны Moraxella catarrhalis и способам его очистки.
В соответствии с одним воплощением изобретения обеспечивают изолированный и очищенный неденатурированный белок CD внешней мембраны, выделяемый из штамма Moraxella. Белок CD может быть, по существу, в своей природной конформации (так, чтобы иметь характерную иммуногенность белка CD в штамме Moraxella ) и может быть изолирован из штамма M.catarrhalis из такого, как М.catarrhalis 4223 или RH408. Такой изолированный и очищенный белок CD практически не содержит CD белок внешней мембраны, фосфолипиды и липополисахариды Moxarella.
Настоящее изобретение также относится к иммуногенной композиции, содержащей иммуноэффективное количество белка внешней мембраны настоящего изобретения. Иммуногенная композиция может быть в виде вакцины для введения in vivo хозаину для придания иммунитета против заболеваний, вызываемых бактериальным патогеном, который продуцирует белок CD или продуцирует белок, способный индуцировать антитела у хозяина, специфически реакционноспособные по отношению к белку CD. В частности, бактериальным патогеном является M.catarrhalis.
Иммуногенные композиции изобретения могут быть получены как препараты в виде микрочастиц, капсул, ISCOM или липосом. Иммуногенная композиция может быть использована в комбинации с молекулой-мишенью для доставки к специфическим клеткам иммунной системы или к слизистым поверхностям. Некоторые молекулы-мишени включают штамм В12 и фрагменты бактериальных токсинов, как описано в WO 92/17167 (Biotech Australia Pty. Ltd.), и моноклональные антитела, как описано в патенте США 5194254 (Barber et al.).Иммуногенные композиции изобретения (включая вакцины) могут также содержать по меньшей мере один другой иммуногенный или иммуностимулирующий материал, и иммуностимулирующий материал может быть по меньшей мере одним адъювантом.
Подходящие адъюванты для использования в настоящем изобретении включают (но не ограничиваются только этим) фосфат алюминия, гидроксид алюминия, QS21, Quil А, их производные и компоненты, матрикс ISCOM, фосфат кальция, гидроксид кальция, гидроксид цинка, аналог гликолипида и октадециловый эфир аминокислоты, мурамиловый дипептид, полифосфазен, ISCOPRP, DC-chol, DDBA и липопротеин или другие адъюванты для индуцирования ответа Th 1. Наиболее предпочтительные комбинации адъювантов описаны в находящейся на рассмотрении патентного ведомства патентной заявке США N 261194, переданной правоприемнику, сообщение о которой приводится здесь ссылкой.
В следующем аспекте изобретения предложен способ генерирования иммунного ответа в организме хозяина, заключающийся во введении в него иммуноэффективного количества иммуногенной композиции настоящего изобретения. Иммунный ответ может быть гуморальным или опосредованным клеткой иммунным ответом. Иммунный ответ может обеспечивать защиту хозяина от заболеваний, вызываемых бактериальным патогеном, который продуцирует белок CD или продуцирует белок, способный индуцировать антитела в организме хозяина, специфически реакционноспособные по отношению к белку CD. Хозяева, которым может быть обеспечена защита от заболеваний, включают приматов, включая людей.
Другим аспектом изобретения является антитело, специфичное для белка CD внешней мембраны и продуцируемое иммунизацией хозяина иммуногенной композицией настоящего изобретения.
В еще одном воплощении изобретения обеспечен
способ определения наличия в пробе антител, специфически реакционноспособных в отношении белка CD внешней мембраны из белка Moraxella catarrhalis, содержащий стадии:
(а) контактирования пробы
с белком CD настоящего изобретения в условиях, подходящих для получения комплексов, содержащих белок CD и указанные антитела, присутствующие в пробе и специфически реакционноспособные с ним, и
(б) определения образования этих комплексов.
В следующем аспекте изобретения предложен также способ определения наличия белка CD в пробе, содержащий стадии:
(а) иммунизации
субъекта иммуногенной композицией настоящего изобретения для продуцирования антител, специфичных для белка CD;
(б) контактирования пробы с антителами для образования комплексов, содержащих
белок CD, присутствующий в пробе, и указанные антитела, специфичные для белка CD, и
(в) определения образования комплексов.
Белок CD может быть частью штамма Moraxella catarrhalis или бактерии, которая продуцирует белок CD или продуцирует белок, способный генерировать антитела, специфически реакционноспособные с белком CD.
И в еще одном воплощении
изобретения обеспечен диагностический набор для определения в пробе наличия антител, специфически реакционноспособных с белком CD, содержащий
(а) белок CD, как представлено здесь;
(б) приспособления для контактирования белка CD с пробой для получения комплексов, содержащих белок CD и антитела, присутствующие в пробе; и
(в) средства для определения образования
комплексов.
Изобретение также обеспечивает диагностический набор для определения наличия белка CD в пробе, содержащий:
(а) антитело, специфичное для белка CD настоящего
изобретения;
(б) приспособления для контактирования антитела с пробой для получения комплексов, содержащих белок CD и CD-специфичное антитело; и
(в) средства для определения
образования комплексов.
Настоящее изобретение обеспечивает, в дополнительном его аспекте, способ получения вакцины для защиты от заболевания, вызываемого бактериальным патогеном, который продуцирует белок СD или продуцирует белок, способный индуцировать антитела в организме хозяина, специфически реакционноспособные с белком СD, содержащий введение иммуногенной композиции хозяину для определения относительных количеств ее компонентов и частоты введения ее для создания защиты от болезни, вызываемой бактериальным патогеном, который продуцирует белок CD или продуцирует белок, способный индуцировать антитела в организме хозяина, специфически реакционно-способные с белком CD; и получение иммуногенной композиции в форме, пригодной для введения хозяину, подвергаемому лечению, в соответствии с указанным определенным количеством и частотой введения. Подвергаемым лечению хозяином может быть человек.
В дополнительном аспекте изобретения представлен
способ продуцирования моноклональных антител, специфичных для белка CD внешней мембраны из штамма Moraxella, содержащий:
(а) введение иммуногенной композиции, как представлено здесь, по
меньшей мере одной мыши для получения по меньшей мере одной иммунизированной мыши,
(б) удаление В-лимфоцитов из по меньшей мере одной иммунизированной мыши;
(в) слияние В-лимфоцитов
из по меньшей мере одной иммунизированной мыши с миеломными клетками с получением таким образом гибридом;
(г) клонирование гибридом, которые продуцируют выбранное антитело против белка CD;
(д) культивирование клонов, продуцирующих антитело против белка CD; и
(е) изолирование антител против белка CD из культур.
В дополнительном аспекте изобретения
представлен способ получения изолированного и очищенного белка CD внешней мембраны бактериального штамма, который продуцирует белок CD, содержащий стадии:
(а) получения клеточной массы
бактериального штамма;
(б) разрушения клеточной массы для получения клеточного лизата;
(в) фракционирования клеточного лизата для получения первого супернатанта и первого осадка,
причем первый супернатант содержит существенно большую часть растворимых бактериальных белков;
(г) отделения первого супернатанта от указанного первого осадка,
(д) экстрагирования
первого осадка для удаления из него, в основном, всех растворимых белков и мембранных белков иных, чем белок CD, для получения второго супернатанта и экстрагированного осадка, содержащего белок CD;
(е) отделения указанного второго супернатанта от указанного экстрагированного осадка;
(ж) солюбилизации экстрагированного осадка для получения солюбилизированного экстракта;
(з) фракционирования солюбилизированного экстракта для получения содержащего белок CD супернатанта и отбрасываемого осадка; и
(и) отделения содержащего белок CD супернатанта от отбрасываемого
осадка.
Бактериальным штаммом, продуцирующим белок CD, может быть Moraxella catarrhalis. Клеточный лизат фракционируют его центрифугированием, и солюбилизированный экстракт фракционируют центрифугированием его. Стадия избирательного фракционирования первого осадка содержит по меньшей мере одно (включая многократное) экстрагирование детергентом. Экстрагированный осадок распределяют и солюбилизируют забуференным раствором, содержащим детергент и солюбилизирующее вещество, при температуре и в течение времени, достаточных для осуществления солюбилизации экстрагированного осадка для получения солюбилизированного экстракта. Забуференный раствор имеет рН от около 7 до около 8,5 и содержит около 0,1 до около 2 мас.% детергента, например Triton X-100, и от около 3 до около 8-молярную мочевину, такую как около 4-молярную, как солюбилизирующее вещество. Солюбилизацию осуществляют при температуре от приблизительно 40o-70oС в течение около 10-120 минут.
Содержащий CD супернатант обычно впоследствии подвергают диализу для удаления детергента и солюбилизирующего вещества для получения более очищенного раствора белка CD в неденатурированной форме.
В дальнейшем аспекте изобретения представлен не образующий колоний штамм Moraxella catarrhalis, имеющий идентифицирующие признаки
Moraxella catarrhalis RH408 (АТСС Designation No 55637). Такой не образующий колоний штамм наиболее предпочтителен для выращивания в промышленных ферментерах, где затруднено их образование. Этот не
образующий колоний штамм используют в способе определения антибактериальной активности против Moraxella антисыворотки, в следующем аспекте изобретения, который содержит:
осуществление
опосредуемого комплементом умерщвления антисывороткой выбранного числа клеток штамма, не образующего скоплений, и
определение доли убитых антисывороткой клеток от выбранного числа клеток как
меры указанной антибактериальной активности против Moraxella.
Преимуществом настоящего изобретения является:
- простой способ изоляции очищенного белка CD внешней мембраны
бактериального штамма, который продуцирует белок CD, включая Moraxella catarrhalis;
- изолированный и очищенный неденатурированный белок CD внешней мембраны, выделяемой из штамма Moraxella,
и
- диагностические наборы и иммунологические реагенты для специфической идентификации Moraxella и инфицированных им хозяев.
Краткое описание фигур
Настоящее
изобретение станет более понятным из последующего описания со ссылкой на фигуры, на которых:
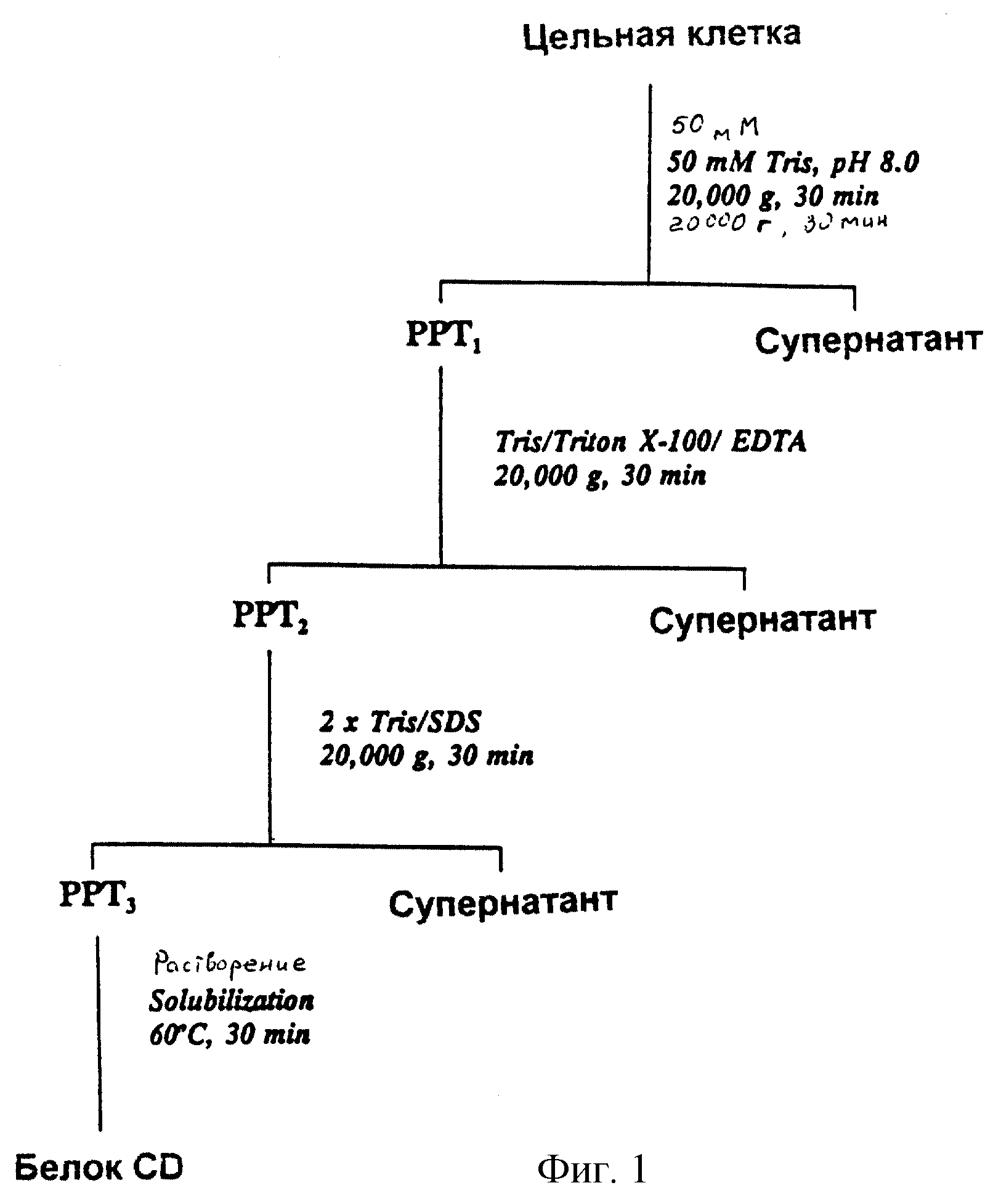
фигура 1 является маршрутной схемой способа очистки белка CD из Moraxella catarrhalis в
соответствии с одним воплощением изобретения;
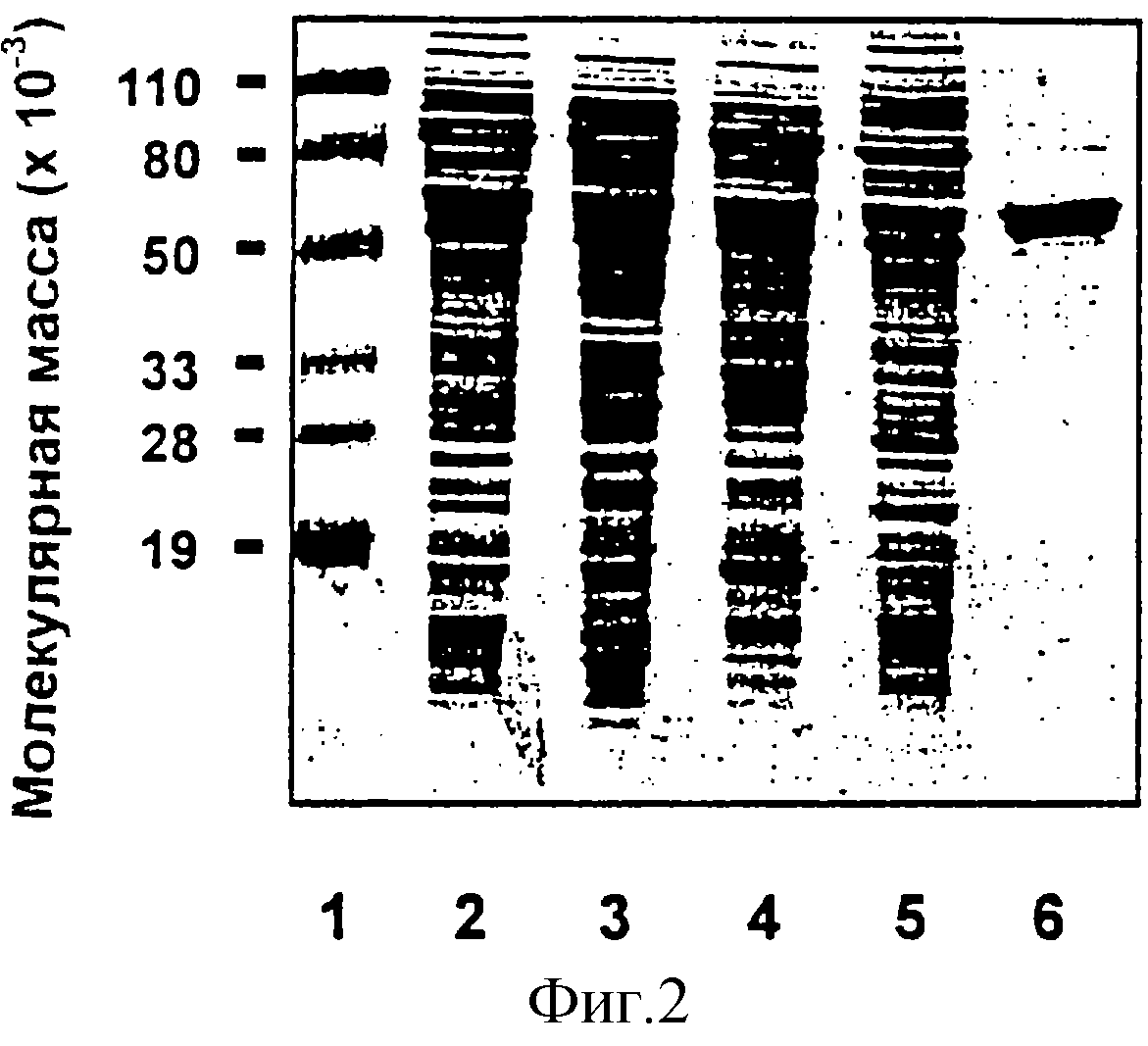
фигура 2 показывает анализ изолированного и очищенного белка CD методом ПААГ-ДСН (гель-электрофорез в полиакриламидном геле с додецилсульфатом
Na),
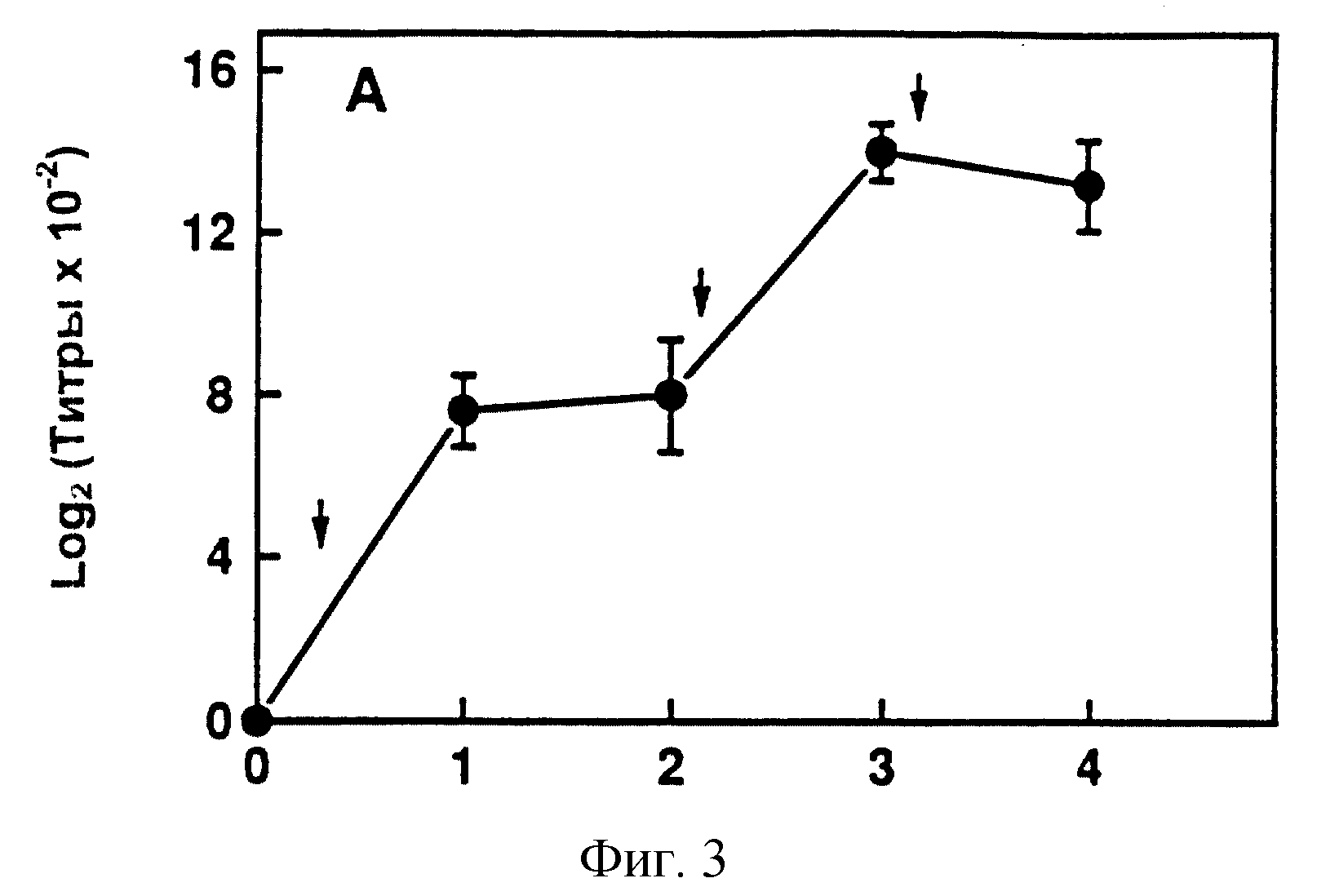
фигура 3 иллюстрирует генерирование СD-специфичных антител в мышах иммунизацией цельным М.catarrhalis;
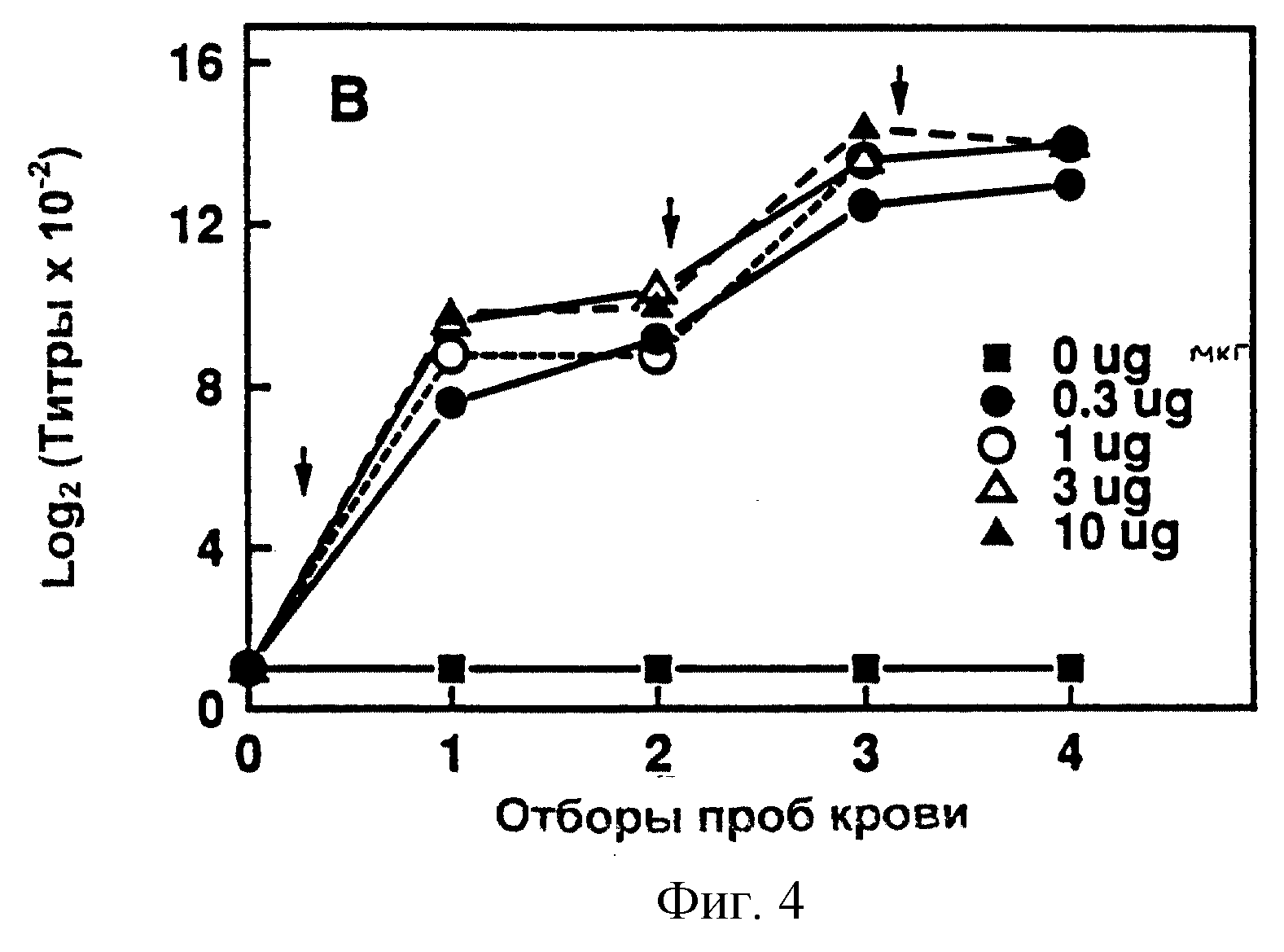
фигура 4 иллюстрирует генерирование CD-специфичных антител в мыши
иммунизацией изолированным и очищенным белком CD;
фигура 5 представляет иммуноблот, показывающий сохранение антигенности СD в ряде штаммов M.catarrhalis;
фигура 6 показывает
сравнительный график подкласса IgG, продуцированного в мышах иммунизацией либо цельным М. catarrhalis, либо изолированным и очищенным белком CD;
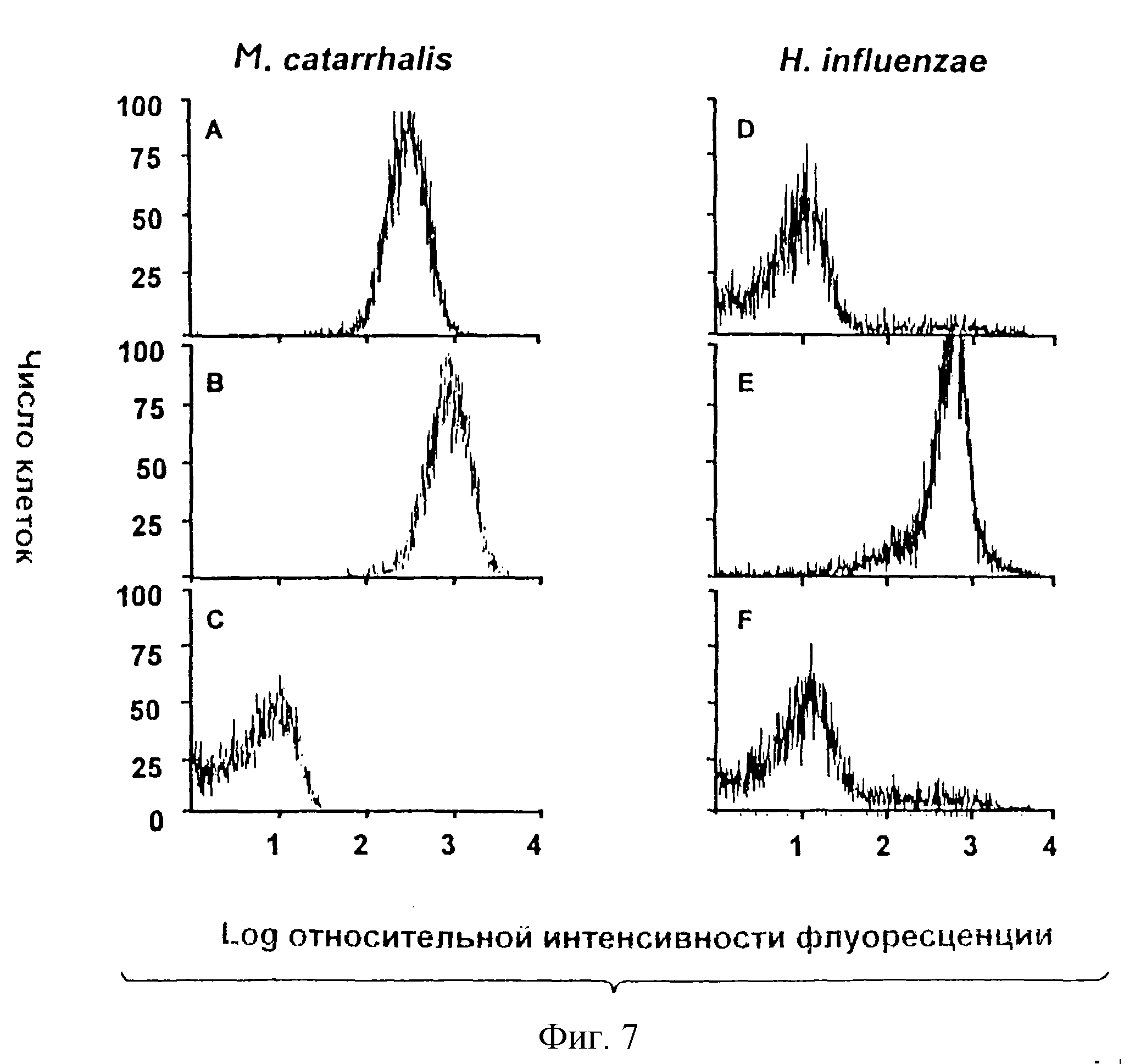
фигура 7 показывает посредством проточной
цитометрии способность мышиной антисыворотки, полученной иммунизацией либо цельным М. catarrhalis, либо изолированным и очищенным белком CD, связываться с белком CD, экспрессированным на поверхности
M.catarrhalis,
фигура 8 представляет иммуноблот для демонстрации способности мышиной антисыворотки к CD, полученной иммунизацией изолированным и очищенным белком CD, для выявления
специфического различия между М. catarrhalis и другими бактериальными патогенами, которые вызывают отит средний.
Подробное описание изобретения
В этой заявке термин "белок CD
внешней мембраны штамма Moraxella" используют для обозначения семейства белков CD внешней мембраны, имеющихся в M. catarrhalis, и включает белки, имеющие вариации в их аминокислотных
последовательностях, включая те, которые встречаются в природе в различных штаммах Moraxella. В этой заявке первый белок является "функциональным аналогом" второго белка, если первый белок
иммунологически родственен ему и/или имеет такую же функцию, как и второй белок. Функциональным аналогом может быть, например, фрагмент белка или его мутант, полученный замещением, присоединением или
делецией.
Настоящее изобретение предоставляет новые технологии, которые могут быть использованы для получения практически чистого белка CD внешней мембраны. Любая бактерия, которая продуцирует белок CD или продуцирует белок, способный генерировать антитела, которые специфически распознают белок CD, фрагмент или аналог его, может быть подходящим образом использована для получения изолированного и очищенного белка CD внешней мембраны настоящего изобретения. Изобретение включает белок CD, полученный рекомбинантными методами, и его аналоги, которые сохраняют иммуногенные свойства белка CD. Бактерия является, в основном, бактериальным патогеном и обычно является штаммом Moraxella, таким как M.catarrhalis. Такие штаммы являются, в основном, доступными из клинических источников и из коллекций бактериальных культур. К подходящим штаммам M.catarrhalis относятся М. catarrhalis 4223 и M.catarrhalis RH408.
Очистку белка СD из М. catarrhalis в соответствии с одним воплощением изобретения осуществляют по схеме фигуры 1. Целые клетки подвергают лизису в обычных буферных условиях для получения клеточного лизата. Клеточный лизат центрифугируют для получения супернатанта, содержащего около 95% растворимого белка, который в дальнейшем не использую, и осадка (РРТ1). Этот осадок избирательно экстрагируют детергентом для удаления остаточных растворимых белков и других мембранных белков, не являющихся белком CD, из осадка (РРТ1), а также других загрязняющих примесей, включая фосфолипиды и липополисахариды. Такое избирательное экстрагирование осуществляют обычным способом. Одна такая процедура включает многократные экстрагирования осадка детергентом. В частности, первое экстрагирование детергентом осуществляют, используя Triton X-100 для удаления остаточных растворимых белков с последующим центрифугированием до образования осадка (РРТ2) и супернанта, который не используют. Такое экстрагирование Triton X-100 осуществляют, используя раствор с концентрацией около 0,2 до около 1 мас.% Triton X-100 в буферных условиях, таких как рН около 7 до около 8,5, обычно используя Трис при рН 8,0.
Далее экстрагирование РРТ2 детергентом осуществляют, используя додецилсульфат натрия (SDS) или другой обычный детергент, такой как дезоксихлорат натрия, наносимый в один или несколько приемов для удаления, в основном, белков внешней мембраны иных, чем белок CD, и для обеспечения удаления других загрязняющих примесей с последующим центрифугированием до образования осадка (РРТ3) и супернатанта, который удаляют. Такое экстрагирование детергентом осуществляют, используя раствор с концентрацией около 0,1 до около 1 мас.% детергента. Более высокие концентрации имеют тенденцию вызывать некоторую солюбилизацию белка CD и, следовательно, потери продукта, поэтому их, в основном, избегают. Такой раствор детергента используют, в основном, в буферных условиях, таких как около 7 до около 8,5, обычно используя Трис при рН 8,0.
Экстрагирование детергентом, осуществляемое на РРТ1 до продукта РРТ3, проводят в подходящем диапазоне температур от около 4o до около 30oС. Хотя вышеописанная процедура экстрагирования детергентом включает экстрагирование различными детергентами, избирательное экстрагирование может быть осуществлено единственным детергентом с подходящей избирательной экстракционной способностью.
Твердая фаза (РРТ3), полученная в результате избирательного экстрагирования детергентом осадка клеточного лизата, содержит белок CD и клеточный остаток и, в основном, не содержит других бактериальных белков и загрязняющих примесей. Белок CD затем солюбилизируют из твердой фазы и отделяют от клеточного остатка, например, центрифугированием полученного раствора. Такую солюбилизацию вначале осуществляют диспергированием твердой фазы с использованием раствора детергента, а затем с использованием вещества, солюбилизирующего белок, такого как мочевина, до солюбилизации суспендированного белка CD с последующим центрифугированием для удаления суспендированного клеточного остатка.
Раствор детергента, используемый для диспергирования твердой фазы (РРТ3), может быть любым подходящим детергентом, таким как Triton X-100, в буферных условиях, таких как около рН 7 до около 8,5. Количество используемого солюбилизирующего вещества должно быть по меньшей мере достаточным для солюбилизации, в основном, всего суспендированного белка CD. Например, когда используют мочевину, концентрация ее может быть от около 3 до около 8 М. Процедуру солюбилизации облегчают использованием повышенной температуры, такой как около 40 до около 70oС, и осущестляют в течение времени, по меньшей мере достаточного для осуществления практически полной солюбилизации белка CD, например от около 10 до около 120 минут.
После отделения раствора белка CD от осадка, содержащего клеточный остаток, удаляют солюбилизирующее вещество любым приемлемым способом, например диализом, в условиях, необходимых для получения раствора белка CD. Водный раствор белка CD может быть получен в любой подходящей концентрации, согласующейся с предназначением материала, в основном около 100 до около 200 мкг/мл. Дальнейшее концентрирование раствора может быть осуществлено обычным способом.
Со ссылкой на фигуру 2 показан анализ методом ПААГ-ДСН чистоты белка CD, очищенного способом, описанным здесь и схематически показанным как типичный пример на фигуре 1. На фигуре 2 полоса 2 показывает клеточный лизат M.catarrhalis. Полоса 3 показывает супернатант, содержащий около 95% растворимого белка, полученного обработкой клеточного лизата 50 мМ Трис рН 8,0 и центрифугированием. Полосы 4 и 5, соответственно, показывают супернатанты, полученные после одного и двух экстрагировании детергентом осадка, полученного обработкой клеточного лизата 50 мМ Трис рН 8,0 и центрифугированием. Полоса 6 показывает очищенный белок CD, который имеет известную молекулярную массу белка (55650кД). Способ очистки белка CD внешней мембраны настоящего изобретения дает препарат белка CD чистотой по меньшей мере 70%. Иллюстрированный полосой 6 на фигуре 2 препарат имеет чистоту по меньшей мере 95%, как определено денситометрическим сканированием.
Со ссылкой на фигуры 3 и 4 иллюстрируют на мышах иммуногенность изолированного и очищенного белка CD внешней мембраны настоящего изобретения. Фигура 3 поясняет продуцирование CD-специфичных антител у мышей после иммунизации цельными клетками М. catarrhalis. Фигура 4 демонстрирует образование специфических антител после иммунизации очищенным белком CD этого изобретения. Как можно видеть из этих данных, очищенный белок CD имеет более высокую иммуногенность по сравнению с иммуногенностью белка CD, когда он присутствует в иммунной системе как часть бактерии.
Для того, чтобы белок CD был пригодным в качестве компонента иммуногенных композиций (включая вакцины) и в качестве антигена в диагностических целях, этот белок, очищенный, как здесь описано, должен быть преимущественно способным генерировать антитела, которые распознают или нейтрализуют множество штаммов Moraxella catarrhalis. Фигуpa 5 (Панель А) иллюстрирует иммуноблот, показывающий способность мышиной антисыворотки к CD, полученной иммунизацией мышей очищенным белком CD, как представлено здесь, распознавать белок CD из Moraxella catarrhalis, выделенный из разных источников. Подопытными штаммами М. catarrhalis являются представленные в таблице 1.
Фигура 5 (Панель В) также показывает, что иммунная сыворотка, полученная иммунизацией мышей целыми инактивированными клетками M.catarrhalis, обнаруживает высокую реакционную способность с очищенным белком CD (полоса 2) или штаммами М. catarrhalis (полосы с 3 по 10). Это показывает, что белок CD является высокоиммуногенным в случае М. catarrhalis.
Со ссылкой на фигуру 6 показывают сравнение профиля подкласса IgG против CD, продуцированного в мышах путем иммунизации либо целыми инактивированными клетками М. catarrhalis, либо изолированным и очищенным белком CD настоящего изобретения. Наиболее ярко выраженные ответы дают изотипы IgG1 и IgG2. Кроме того, профили подкласса IgG, полученные иммунизацией целыми инактивированными клетками M.catarrhalis или очищенным белком CD, являются очень похожими, что свидетельствует о том, что изолированный и очищенный белок CD, описанный здесь, находится, в основном, в его природной конформации.
Ссылаясь на фигуру 7, иллюстрируют проточный цитометрический анализ связывания антисыворотки к CD с М. catarrhaiis. Смешанная мышиная антисыворотка к CD, полученная иммунизацией изолированным и очищенным белком CD настоящего изобретения, имеет почти такую же способность связываться с интактным М. catarrhaiis (Панель А), что и анти- М.catarrhaiis, полученная иммунизацией целыми клетками М. catarrhaiis (Панель В). Связывание является специфическим по отношению к М. catarrhaiis, так как такая же антисыворотка к CD не обнаруживает значительного связывания с бактерией, Н. influenzae, которая не продуцирует белок CD (Панель D). Напротив, смешанная мышиная антисыворотка к Н. influenzae сильно реагирует с Н. influenzae (Панель Е).
Панели С и F иллюстрируют существенный недостаток связывания неиммунной сыворотки с М. catarrhalis и Н.influenzae соответственно. Анализ проточной цитометрией показывает, что антитела против CD, полученные иммунизацией изолированным и очищенным белком CD, как представлено здесь, распознают белок CD на поверхности интактного М. catarrhaiis, и, кроме того, является доказательством того, что белок CD, представленный здесь, находится, в основном, в его природной конформации.
В одном воплощении настоящего изобретения изолированный и очищенный белок CD, представленный здесь, является полезным для генерирования антител, которые могут быть использованы для специфического различения М. catarrhalis от других бактериальных патогенов, которые вызывают отит средний. Так, со ссылкой на фигуру 8 иллюстрируют иммуноблот, показывающий специфическую реакционную способность мышиной антисыворотки к CD, полученной иммунизацией мышей белком CD, как представлено здесь. Анализируемые бактерии представлены в таблице 2.
Результаты, показанные на фигуре 8, демонстрируют значимость CD-специфичной антисыворотки настоящего изобретения для идентификации и выявления различия между бактериальными патогенами, которые вызывают заболевания со сходными клиническими симптомами.
Результаты, показанные в Таблице 1, иллюстрируют способность антисыворотки к CD, полученной иммунизацией мышей или морских свинок белком CD настоящего изобретения, лизировать два различных штамма M.catarrhalis. Результаты показывают, что обе антисыворотки, полученные иммунизацией белком CD, выделенным из штамма 4223, являются бактерицидными в отношении гомологичного не образующего колоний штамма М. catarrhalis RН408, полученного из штамма M. catarrhalis 4223 и гетерологичного не образующего колоний штамма Q8 (дар от Dr. M. G. Bergeron, Centre Hospitalier de I'Universite Laval, St. Foy, Quebec). Титры бактерицидности в иммунной сыворотке морских свинок являются очень высокими (1:1,024). Бактерицидные активности в мышиной антисыворотке к CD - около 1:128 против обоих штаммов, что является сравнимым с титром, полученным с использованием антисыворотки к М. catarrhalis, полученной иммунизацией целыми инактивированными клетками M.catarrhalis. Способность изолированного и очищенного белка CD, представленного здесь, генерировать бактерицидные антитела in vivo является доказательством полезности белка CD как вакцины для защиты против болезни, вызываемой M.catarrhalis или другой бактерией, которая продуцирует белок CD или продуцирует белок, способный генерировать антитела, которые специфически распознают белок CD.
Так, в соответствии с другим аспектом настоящего изобретения, предложена вакцина против Moraxella или других бактериальных патогенов, которые продуцируют белок CD или продуцируют белок, способный индуцировать антитела, которые специфически распознают белок CD, содержащая иммуногенно эффективное количество белка CD, как представлено здесь, и физиологически приемлемый носитель для него. Белок CD, предложенный здесь, также может быть использован как несущий белок для гаптена, полисахаридов или пептидов для получения конъюгатной вакцины против антигенных детерминант неродственных CD.
Белок CD настоящего изобретения нашел свое применение как диагностический реагент, как антиген и для генерирования антител против CD или для вакцинации против заболеваний, вызываемых видами Moraxella и другими бактериальными патогенами, которые продуцируют белок, способный продуцировать антитела, которые специфически распознают CD, и для определения заражения Moraxella и другими такими бактериями.
В дополнительных воплощениях настоящего изобретения белок CD, как представлено здесь, может быть использован как молекула-носитель для получения химерных молекул и вакцин на основе конъюгатов (включая гликоконъюгаты) против патогенных бактерий, включая инкапсулированные бактерии. Так, например, гликоконъюгаты настоящего изобретения могут быть использованы для создания иммунитета против болезни и инфекции, вызываемых какими-либо бактериями, имеющими полисахаридные антигены, включая липоолигосахариды (LOS) и PRP. К таким бактериальным патогенам относятся, например Наетоphilus influenzae, Steptococcus pneumoniae, Escherichia coli, Neisseria meningitides, Salmonella typhi, Steptococcus mutants, Cryptococcus neoformans, Klebsiella, Staphy-lococcus aureus и Pseudomonas aeruginosa. Конкретные антигены, которые могут быть конъюгированы с белком СD, и способы осуществления конъюгации описаны в опубликованной заявке РСТ WO 94/12641, переданной ее правоприемнику, содержание которой приводится здесь ссылкой.
В другом воплощении функцию белка-носителя CD используют, например, для индуцирования иммунного ответа против аномальных полисахаридов опухолевых клеток или для продуцирования антител против опухоли, которые могут быть конъюгированы с хемотерапевтическими или биоактивными агентами.
Изобретение относится к изолированному и очищенному неденатурированному белку CD внешней мембраны, выделяемому из штамма Moraxella, для применения в качестве активного фармацевтического вещества, особенно в качестве активного ингредиента в вакцине против болезни, вызываемой инфекцией Moraxella.
Для специалиста очевидно, что различные воплощения настоящего изобретения находят свое применение в области вакцинации, диагностики, лечения, например, инфекций Moraxella и инфекций другими бактериальными патогенами, которые продуцируют белки, способные продуцировать антитела, которые специфически распознают белок CD, и как поколение иммунологических реагентов. Дальнейшее обсуждение, не ограничивающее таких применений, представлено ниже.
1. Получение и применение вакцины
Иммуногенные композиции, применение которых возможно в качестве вакцины, получают из белка CD настоящего изобретения. Предпочтительно, антигенный материал подвергают экстенсивному диализу для
удаления нежелательных молекул с небольшой молекулярной массой и/или лиофилизируют для более быстрого введения в желательный носитель. Иммуногенная композиция вызывает иммунный ответ у субъекта,
который продуцирует антитела, включая антитела против CD и антитела, которые являются опсоническими или бактерицидными. Если вакцинированный субъект заражается Moraxella или другой бактерией, которая
продуцирует белки, способные продуцировать антитела, которые специфически распознают белок CD, антитела связываются с бактерией и инактивируют ее. Более того, опсонические или бактерицидные антитела
против CD могут также обеспечивать защиту альтернативными механизмами.
Вакцины, включающие иммуногенные композиции, могут быть приготовлены как жидкие растворы и эмульсии для инъекций. Белок CD может быть смешан с фармацевтически приемлемыми разбавителями, которые совместимы с белком CD. К таким разбавителям относятся вода, физиологический раствор, декстроза, глицерин, этанол и их комбинации. Иммуногенные композиции и вакцины могут также содержать вспомогательные вещества, такие как смачивающие или эмульгирующие вещества, забуферивающие рН вещества или адъюванты для повышения их эффективности. Иммуногенные композиции и вакцины можно вводить парентерально путем подкожного или внутримышечного впрыскивания. Альтернативно, иммуногенные композиции, составленные в соответствии с настоящим изобретением, могут быть получены и доставлены таким способом, чтобы вызывать иммунный ответ на слизистых поверхностях. Так, иммуногенная композиция может быть введена на слизистые поверхности, например, назальным или пероральным (внутрижелудочным) путем. Альтернативно, возможны и другие формы для введения, включая суппозитории и препараты для перорального приема. Суппозитории могут содержать в качестве связующих и носителей, например, полиалкиленгликоли или триглицериды. Такие суппозитории формуют из смесей, содержащих активный ингредиент (ингредиенты) в пределах от около 0,5 до около 10%, предпочтительно около 1-2%. Пероральные препараты могут включать обычно используемые наполнители, такие как, например, пригодные для фармацевтического применения сахарин, целлюлозу и карбонат магния. Такие композиции могут быть в форме растворов, суспензий, таблеток, драже, капсул, препаратов с замедленным выделением активного вещества или порошков и могут содержать около 1-95% белка CD, предпочтительно около 20 до около 75%.
Иммуногенные препараты и вакцины вводят способом, совместимым с лекарственной формой, и в таком количестве, которое было бы терапевтически эффективным, защитным и иммуногенным. Количество, которое должно быть введено, зависит от субъекта, подвергаемого лечению, включая, например, способность индивидуальной иммунной системы синтезировать антитела и, если необходимо, давать опосредуемый клеткой иммунный ответ. Точные количества активного ингредиента, требующиеся для введения, зависят от оценки врача-практика. Однако подходящие пределы дозировок легко определяются специалистом и могут быть порядка микрограммов белка CD на вакцинацию. Подходящие схемы первоначального введения и бустер-доз также варьируются, но могут включать начальное введение, сопровождаемое последующими введениями. Дозирование может зависеть от пути введения и может изменяться в соответствии с размерами реципиента.
Концентрация антигена СD в иммуногенной композиции согласно изобретению составляет, в основном, около 1-95%. Вакцина, которая содержит антигенный материал только одного патогена, является моновалентной вакциной. Вакцины, которые содержат антигенный материал нескольких патогенов, являются комбинированными вакцинами и также принадлежат настоящему изобретению. Такие комбинированные вакцины содержат, например, материал от различных патогенов или от различных штаммов одного и того же патогена или от комбинаций различных патогенов.
Иммуногенность может быть значительно улучшена, если антигены вводят совместно с адъювантами, обычно используемыми в виде 0,05-0,1-процентного раствора в забуференном фосфатом физиологическом растворе. Адъюванты улучшают иммуногенность антигена, но сами по себе не являются обязательно иммуногенными. Адъюванты могут действовать путем локального удерживания антигена вблизи места введения для создания эффекта депо, облегчающего медленное задержанное поступление антигена к клеткам иммунной системы. Адъюванты также могут привлекать клетки иммунной системы к депо антигена и побуждать такие клетки к иммунным ответам.
Иммуностимулирующие вещества или адъюванты используются в течение многих лет для улучшения иммунных ответов реципиента на, например, вакцины. Внутренние адъюванты, такие как липополисахариды, обычно являются компонентами убитых или ослабленных бактерий, используемых как вакцины. Внешние адъюванты являются иммуномодуляторами, которые обычно нековалентно связаны с антигенами и введены в состав для улучшения иммунных ответов реципиента. Таким образом, адъюванты идентифицированы как вещества, которые улучшают иммунный ответ на парентерально вводимые антигены. Некоторые из таких адъювантов являются, однако, токсичными и могут вызывать нежелательные побочные эффекты, которые делают их непригодными для применения на людях и животных. Действительно, только гидроксид алюминия и фосфат алюминия (общераспространенное название - алюм) обычно используют как адъюванты в вакцинах для людей и животных. Хорошо установлена эффективность алюма в повышении гуморального иммунного ответа (антителогенеза) на токсоиды дифтерии и столбняка, и в вакцину HBsAg в качестве адъюванта введен алюм. Хотя полезность алюма хорошо установлена для некоторых применений, она имеет ограничения. Например, алюм не эффективен для вакцинации против гриппа и неустойчиво вызывает опосредуемый клеткой иммунный ответ. Антитела, вызываемые у мыши антигенами с алюмом в качестве адъюванта, относятся, главным образом, к изотипу IgG1, что не может быть оптимальным для защиты некоторыми вакцинными агентами.
Широкий диапазон внешних адъювантов может провоцировать сильные иммунные ответы на антигены. К ним относятся сапонины, комплексованные с мембранными белковыми антигенами (иммуностимулирующие комплексы), блоксополимеры полиоксиэтилена и полиоксипропилена с минеральным маслом, убитые микобактерии в минеральном масле, полный адъювант Фрейнда, бактериальные продукты, такие как мурамил-дипептид (MDP) и липополисахарид (LPS), а также липид А и липосомы.
Для эффективного индуцирования гуморальных иммунных ответов (HIR) и опосредуемого клетками иммунитета (CMI) иммуногены эмульгируют в адъювантах. Многие адъюванты являются токсичными, вызывающими гранулематоз, острые и хронические воспаления (полный адъювант Фрейнда, FCA), цитолиз (сапонины и блоксополимеры полиоксиэтилена и полиоксипропилена), повышение температуры тела, артрит и фронтальный увеит (LPS и MDP). Хотя FCA является превосходным адъювантом и широко используется при исследованиях, он не лицензирован для применения в вакцинах для людей и животных из-за его токсичности.
Желательные характеристики идеальных адъювантов включают:
(1) отсутствие токсичности;
(2) способность стимулировать продолжительный
иммунный ответ;
(3) простота получения и устойчивость при продолжительном хранении;
(4) способность вызывать как CM1, так и H1R на антигены, вводимые различными путями, если
необходимо;
(5) синергизм с другими адъювантами;
(6) способность к избирательному взаимодействию с популяциями антигенпрезентирующих клеток (АРС);
(7) способность
специфически вызывать соответствующие Тн1 или Тн2 клеточно-специфические иммунные ответы, и
(8) способность избирательно повышать уровни антитела соответствующего
изотипа (например IqA) против антигенов.
Патент США 4855283, выданный Lockhoff и др. 8 августа 1989 г., который приводится здесь ссылкой, преподносит в качестве иммуномодуляторов или адъювантов аналоги гликолипида, включающие N-гликозиламиды, N-гликозилкарбамиды и N-гликозилкарбаматы, каждый из которых замещен в остатке сахара аминокислотой. Так, Lockhoff et al. (патент США 4855283 и ссылка 27) сообщает, что аналоги N-гликолипида, обнаруживающие структурные сходства с встречающимися в природе гликолипидами, такие как гликосфинголипиды и гликоглицеролипиды, способны вызывать сильные иммунные ответы и на вакцину вируса простого герпеса и на вакцину вируса псевдобешенства. Такие гликолипиды синтезированы из длинноцепочечных алкиламинов и жирных кислот, которые связаны непосредственно с сахарами через аномерный атом углерода для имитации функций встречающихся в природе липидных остатков.
Патент США 4258029, выданный Moloney, переуступленный его правоприемнику и приведенный здесь ссылкой, сообщает, что гидрохлорид октадецилтирозина (ОТН) функционирует как адъювант, когда находится в комплексе со столбнячным токсоидом и вакциной вируса полиомиелита типа I, II и III, инактивированного формалином. Также, Nixon-George et al. (ссылка 24) сообщает, что сложные октадециловые эфиры ароматических аминокислот в комплексе с поверхностным антигеном гепатита В улучшают иммунные ответы реципиента на вирус гепатита В.
Связывание с липидами синтетических пептидов также используют для повышения их иммуногенности. Так, Weismuller (ссылка 25) описывает пептид с последовательностью, гомологичной белку вируса ящура, связанный с адъювантом трипальмитил -S-глицерил-цистеинил-серил-серином, являющимся синтетическим аналогом N-концевой части липопротеина их грам-отрицательной бактерии. Кроме того, Deres et al. (ссылка 26) сообщает о подвергании вирус-специфических цитотоксичных Т-лимфоцитов in vivo первичному воздействию синтетической липопептидной вакцины, содержащей модифицированные синтетические пептиды, полученные из нуклеопротеида вируса гриппа путем связывания с липопептидом, N-пальмитил-S-(2, 3-бис(пальмитилокси)-(2RS)-пропил-[R]-цистеином (ТРС).
2. Иммуноанализы
Белок CD настоящего изобретения полезен как иммуноген для генерирования антител против CD, как антиген
в иммуноанализах, включая твердофазный иммуноферментный анализ (ELISA), радиоиммунные анализы (RIA's) и другие неферментативные реакции связывания антител или процедуры, известные в этой области, для
определения антибактериальных, анти-Moraxella и анти-CD антител. В анализах ELISA белок CD иммобилизируют на выбранной поверхности, например на поверхности, способной к связыванию белков, такой как
лунки полистиролового титрационного микропланшета. После промывания для удаления неполностью адсорбированного белка CD с выбранной поверхностью связывают неспецифический белок, такой как раствор
бычьего сывороточного альбумина (BSA), который, как известно, является антигенно нейтральным по отношению к исследуемому образцу. Это позволит блокировать неспецифические сайты адсорбции на
иммобилизирующей поверхности и тем самым уменьшить фон, появляющийся из-за неспецифических связывании антисыворотки на поверхности.
Иммобилизирующую поверхность затем приводят в контакт с образцом, таким как клинические или биологические материалы, для проведения испытания подходящим способом на образование иммунного комплекса (антиген/антитело). Это может включать разбавление образца разбавителями, такими как растворы BSA, бычьего гамма-глобулина (BGG) и/или забуференный фосфатом физиологический раствор (PBS)/Tween. Образец затем инкубируют в течение 2-4 часов при температуре порядка около 25-37oС. После инкубации поверхность, находящуюся в контакте с образцом, промывают для удаления материала, не связанного в иммунный комплекс. Процедура промывания может включать промывание раствором, таким как PBS/Tween или обратный буфер. После образования специфических иммунокомплексов между исследуемым образцом и связанным белком CD и последующего промывания качественно и даже количественно определяют образование иммунокомплекса, подвергая иммунокомп-лекс воздействию второго антитела, имеющего специфичность в отношении первого антитела. Если исследуемый образец человеческого происхождения, второе антитело является антителом, имеющим специфичность в отношении иммуноглобулинов человека и, главным образом, IgG. Чтобы обеспечить средства детектирования, второе антитело может иметь ассоциированную активность, такую как ферментативная активность, которая могла бы вызывать, например, появление окрашивания при инкубировании с подходящим хромогенным субстратом. Количественное определение возможно путем измерения степени окрашивания с использованием, например, спектрофотометра.
Биологические депозиты
Штамм
Branhamella catarrhalis, RH408, о котором здесь говорится, депонирован до подачи настоящей заявки в Американской коллекции типовых культур (АТСС), находящейся по адресу 12301 Parklawn Drive, Rockville,
Maryland USA, в соответствии с Будапештским соглашением. Штамму Branhamella catarrhalis RH408 присвоено обозначение 55637 и дата подачи 13 декабря 1994 г. Образцы депонированного штамма становятся
доступными для публики по праву патента на основании этой патентной заявки США. Изобретение, описанное и заявленное здесь, не ограничивается в объеме депонированными штаммами, так как то, что
депонировано, предназначено только для иллюстрирования изобретения. Любые эквивалентные или подобные штаммы, которые не образуют скоплений и имеют те же идентификационные характеристики, как описано в
этой заявке, находятся в сфере действия настоящего изобретения.
ПРИМЕРЫ
Сообщенное выше, в основном, описывает настоящее изобретение. Более полное понимание может быть
достигнуто путем рассмотрения следующих специфических примеров. Эти примеры описаны единственно для целей иллюстрации и не означают ограничения объема изобретения. Изменения в форме и замена
эквивалентов рассматриваются как обстоятельства, которые могут быть рекомендуемым или воспроизводимым приемом. Хотя здесь используются специфические термины, такие термины рассматриваются в
описательном смысле, а не для целей ограничений.
Способы молекулярной генетики, биохимии белка и иммунологии использованы, но подробно не описаны в этом сообщении, и эти примеры полно описаны в научной литературе и соответствуют возможностям специалистов в этой области.
Пример 1
Этот пример иллюстрирует рост М. catarrhalis. Штамм М. catarrhalis 4223
инокулируют в 20 мл бульона с сердечномозговым экстрактом (BHI). Культуру инкубируют в течение ночи с аэрацией при 37oС. Для выращивания в условиях с ограничением по железу один мл
полученной в течение ночи культуры инокулируют в 20 мл бульона BHI, содержащего 25 мкМ EDDA, и культуру выращивают при 37oС приблизительно 3-4 ч. Клетки, выращенные до мид-лог-фазы (А578>0,5), собирают центрифугированием при 10000•q в течение 20 мин. Осадок используют для экстрагирования белка CD, как описано в примере 3.
Пример 2
Этот
пример иллюстрирует генерацию не образующего колоний штамма (RH408) М. catarrhalis.
Штамм М. catarrhalis 4223 инокулируют в несколько колб, содержащих 20 мл бульона ВНГ, и культуры инкубируют при встряхивании (170 об/мин) в течение ночи при 37oС. Пять мл каждой полученной в течение ночи культуры переносят в отдельные 1-мл пробирки и оставляют при комнатной температуре на 3-8 часов, чтобы позволить бактерии выпасть в осадок. Сто мкл осветленной верхней фазы каждой культуральной среды используют для инокулирования 25 мл бульона BHI, и культуры инкубируют в течение ночи при 37oС, как описано выше. Это пассивирование повторяют шесть раз, используя 25 мкл осветленной среды для инокулирования 25 мл BHI для каждой ночной культуры. Не образующие колоний бактериальные культуры идентифицируют измерением А578 с интервалами более 3-часового периода времени, чтобы сравнить скорости седиментации пассивированных штаммов с таковой для культуры оригинального штамма М. catarrhalis 4223. Не образующие колоний мутанты, включая М. catarrhalis RH408, не агрегируются в течение трехчасового периода времени. На ВНI агаровых пластинах штамм RH408 имеет морфологию поселения, типичную для всех не образующих колоний штаммов.
Пример 3
Этот пример иллюстрирует экстрагирование и очистку белка CD.
Белок CD выделяют из М. catarrhalis способом, в основном, проиллюстрированным на фигуре 1. Осадок клеток М. catarrhalis из 250 мл культуры, полученной, как описано в примере 1, повторно суспендируют в 40 мл 50 мМ Трис-НСl, рН 8,0 и разрушают обработкой ультразвуком (3•10 мин, цикл 70%-ного режима). Экстракт центрифугируют при 20000•q, и полученный супернатант, который содержит более чем 95% растворимых белков из М. catarrhalis, удаляют.
Остаточный осадок (РРТ1) экстрагируют вначале в 40 мл 50 мМ Трис, рН 8,0, содержащем 0,5% Triton X-100 и 10 мМ EDTA, а затем дважды в 40 мл 50 мМ Трис, рН 8,0, содержащем 0,5% SDS. Эти два экстрагирования удаляют остаточные растворимые белки, а также основную часть мембранных белков, за исключением белка CD.
Осадок, полученный после указанного выше экстрагирования, (РРТ3), используют как исходный материал для очистки CD. Осадок повторно суспендируют в 50 мМ Трис, рН 8,0, содержащем 0,5% Triton X-100, 10 мМ EDTA. К полученной суспензии добавляют мочевину до концентрации 6 М, а затем суспензию нагревают при 60oС в течение 30 мин для солюбилизации белка CD. После центрифугирования при 20000 q в течение 30 мин полученный супернатант, содержащий гомогенный очищенный белок CD, отделяют от осадка. Раствор очищенного белка CD подвергают диализу против 50 мМ Трис, рН 8,0 в течение ночи для удаления мочевины и затем снова центрифугируют при 20000•q в течение 30 мин для удаления любых осажденных материалов, которые могут выпадать из раствора. Белок CD в этих условиях остается растворимым. Количество CD в конечном препарате, которое составляет около 100 мкг/мл, определяют ВСА белковым анализом, а чистоту белка CD оценивают анализом ПААГ-ДСН (см. фиг.2) и денситометрией. Чистота белка CD, как показано на фигуре 2, составляет около 95%. Анализ ПААГ-ДСН подтверждает, что полученный белок CD имеет известную для такого белка молекулярную массу от 55 до 60 кД (ссылка 21). Подлинность очищенного белка CD подтверждают анализом аминокислотной последовательности фрагментов, полученных расщеплением бромидом цианогена, в сравнении с опубликованной последовательностью (ссылка 22). Очищенный белок CD хранят при -20oС.
Пример 4
Этот пример иллюстрирует иммунизацию мышей и морских свинок очищенным белком CD.
Группы из пяти мышей Balb/c инъецируют три раза подкожно (s.c.) в дни 1, 29 и 43 либо неактивированным M.catarrhalis (около 10 клеток), либо очищенным белком CD, полученным, как описано в примере 3 (0,3 мкг до 10 мкг) в присутствии АlРО4 (1,5 мг на дозу). Образцы крови отбирают в дни 14, 28, 42 и 56 для анализа титров антитела против CD методом ElAs.
Группы из двух морских свинок (Charles River, Quebec) иммунизируют внутримышечно (i. m.) в день 1 дозой 10 мкг очищенного белка СD, эмульгированного в полном адъюванте Фрейнда (CFA). Образцы крови отбирают в день 42 для анализа бактерицидной активности антисыворотки.
Пример 5
Этот пример иллюстрирует EIAS для определения антител против CD в мышиной антисыворотке.
ElAs проводят, в основном, как описано Panezutti et al. (ссылка 23). Микротитрационные лунки покрывают 1 мкг белка CD на 16 часов при комнатной температуре. Планшеты затем блокируют 0,1% (мас./об.) бычьим сывороточным альбумином в PBS. Мышиную сыворотку последовательно разбавляют, добавляют в лунки, затем инкубируют в течение 1 часа при комнатной температуре. В качестве второго антитела используют подобные очищенные фрагменты F(ab')2 козьего антитела IgG (Fc специфичного) против мыши, конъюгированного с пероксидазой хрена. Реакции осуществляют с использованием тетраметилбензидина (ТМВ/Н2O2), и оптическую плотность измеряют при 450 нм (используя 540 нм как сравнительную длину волны) в проточном многоканальном спектрофотометре МСС для прочтения планшетов. Реактивный титр антисыворотки определяют как величину, обратную разбавлению, устойчиво показывающую двухкратное повышение оптической плотности по сравнению с той, которая получена с образцом неиммунной сыворотки.
Пример 6
Этот пример иллюстрирует EIAs для определения подклассов IgG против CD в мышиной сыворотке.
Микротитрационные лунки покрывают 1 мкг очищенного CD. Конечные взятия образцов мышиной сыворотки при исследовании иммуногенности (как описано в примере 4) группируют и анализируют в ЕIАз. В качестве реагентов в EIAs используют крысиные антитела IgG1, IgG2a, IgG2b против мыши, конъюгированные с пероксидазой хрена. Рабочее разбавление каждого конъюгата определяют, используя подклассы очищенного антитела, чтобы избежать перекрестной реактивности. Реактивные титры определяют, как описано в примере 5.
Пример 7
Этот пример иллюстрирует анализ проточной цитометрией.
Штамм М. catarrhalis RH408 выращивают приблизительно до 2•108 КОЕ/мл, как описано в примере 1, и затем 100 мкл аликвотную пробу смешивают с 200 мкл антисыворотки, разбавленной 1/500 в PBS (4 мМ Na2HPO4•7Н20, 1,5 мМ КН2РО4, 140 мМ NaCl, 7 мМ КСl, рН 7,3), содержащем 1% BSA. Образцы затем инкубируют при 4oС в течение 30 мин. Штамм H.influenzae 12 также выращивают до 2•108 КОЕ/мл, инкубируют с такой же антисывороткой и используют как отрицательный контроль. Дополнительные контроли включают инкубирование только с конъюгатами без какой-либо первичной антисыворотки. После первичного инкубирования бактерии дважды промывают РВS, содержащим 1% ВSА, и затем смешивают с 200 мкл разбавленного полностью очищенного козьего иммуноглобулина против мыши - DTAF(Jackson Immunoresearch Labs, Inc., Mississaga, Ontario). Бактерии инкубируют с конъюгатами в течение 30 мин при 4oС, дважды промывают в PBS/BSA и повторно суспендируют в 1% параформальдегиде.
Флуоресценцию помеченных бактерий оценивают с помощью проточного цитомера Coulter Elite. Десять тысяч бактерий определяют в каждом анализе. Аргоновый лазер используют, и испускаемые сигналы при 525 нм суммируют. Уровень связывания антитела выражают как средний канал флуоресценции на основе логарифмической шкалы.
Пример 8
Этот пример иллюстрирует анализ бактерицидности против М. catarrhalis.
Образцы (25 мкл) антисыворотки нагревают до 56oС в течение 30 мин для удаления активности комплемента и разбавляют 1:8 в буфере веронал (NaCl 8,0 г/л, NaHCO3 0,25 г/л, барбитурат натрия 0,30 г/л, барбитуровая кислота 0,45 г/л, MqCl2• 6Н2О 0,1 г/л, СаСl2•2Н2О 0,05 г/л), содержащем 0,1% BSA (VBS), и затем добавляют в первую лунку 96-луночного планшета для микротитрования Nunc. Двухкратные последовательные разбавления антисыворотки в VBS помещают в остальные лунки. Бактериальные клетки, выращенные до А578>0,5, разбавляют 1: 200000 в VBS, и порции по 25 мкл бактериальной суспензии добавляют в каждую лунку. Комплемент морской свинки (Biowhittaker, Walkersville, MD) разбавляют 1: 10 в VBS, и 25 мкл раствора добавляют в каждую лунку для инициации реакций. Планшеты инкубируют при 37oС в течение 60 мин, и 50 мкл каждой реакционной смеси помещают затем на агаровую пластину Mueller-Hinton, содержащую 2,2% бульона Mueller-Hinton и 1,5% агара. После инкубирования при 37oС в течение 48 ч подсчитывают колонии для определения бактерицидного титра (обратная величина наибольшего разбавления антисыворотки, при котором она способна убивать более чем 50% бактерий по сравнению с контролями, содержащими предиммунную сыворотку).
В табл.3 приведена бактериальная активность антисыворотки.
РЕЗЮМЕ
Суммируя изложенное, настоящее изобретение обеспечивает изолированный и очищенный неденатурированный белок CD внешней мембраны, который является белком, выделенным из штамма Moraxella или
соответствует ему, и способы выделения его из бактериальных штаммов.
В пределах объема изобретения возможны модификации.
Реферат
Изобретение относится к области иммунологии. Выделяют белок из бактериального штамма Moraxella catarrhalis. Фракционируют клеточный лизат, полученный разрушением клеточной массы бактериального штамма, центрифугированием до получения осадка и супернатанта. Осадок избирательно экстрагируют для удаления остаточных растворимых белков, мембранных белков иных, чем CD, и других загрязняющих примесей. Оставшийся CD-содержащий осадок диспергируют и солюбилизируют и затем фракционируют центрифугированием для удаления клеточного остатка. Штамм Moraxella catarrhalis RH 408 используют для получения белка CD внешней мембраны. Белок CD используют в иммуногенных композициях, в частности для введения in vivo реципиенту. Изобретение позволяет создать защиту против заболевания, вызываемого бактериальным патогеном, который продуцирует белок CD или продуцирует белок, способный индуцировать антитела у реципиента, специфически реакционноспособные с белком CD. 4 с. и 11 з.п. ф-лы, 8 ил., 3 табл.

Комментарии