Рекомбинантные векторы hvt, экспрессирующие антигены патогенов птиц и их применение - RU2620936C2
Код документа: RU2620936C2
Чертежи














































































































































Описание
Перекрестные ссылки на родственные заявки
Настоящая заявка претендует на приоритет по предварительной заявке U.S. 61/564,877, поданной 30 ноября 2011 г., и предварительной заявке U.S. 61/694,957, поданной 30 августа 2012 г.
Область техники, к которой относится изобретение
Настоящее изобретение касается рекомбинантных вирусных векторов для инсерции (вставки) и экспрессии чужеродных генов для применения в качестве безопасных носителей для иммунизации для защиты от различных патогенов. Оно также касается поливалентной композиции или вакцины, содержащей один или несколько рекомбинантных вирусных векторов для защиты от различных патогенов. Настоящее изобретение касается способов получения и применения рекомбинантных вирусных векторов.
Уровень техники
Вакцинация домашней птицы широко применяется для защиты поголовья птиц от разрушительных заболеваний, в том числе болезни Ньюкасла (ND), инфекционного бурсита (IBD), болезни Марека (MD), инфекционного бронхита (IB), инфекционного ларинготрахеита (ILT) и птичьего гриппа (AI). ND вызывается птичьим парамиксовирусом-1 (APMV-1), который также называют вирусом ND (NDV), принадлежащим к семейству Paramyxoviridae. MD вызывается герпесвирусом-2 куриных (семейство Herpesviridae), который также называют вирусом MD серотипа 1 (MDV1). IB вызывается вирусом IB (IBV), принадлежащим к семейству Coronaviridae, ILT вызывается герпесвирусом-1 куриных (семейство Herpesviridae), который также называют вирусом ILT (ILTV), a AI вызывается вирусом AI (AIV), принадлежащим к семейству Orthomyxoviridae.
Был предложен целый ряд рекомбинантных птичьих вирусных векторов с целью вакцинации птиц против этих птичьих патогенов. Используются такие вирусные векторы, как авипоксвирусы, особенно вируса птичьей оспы (EP-A-0,517,292), вируса болезни Марека, к примеру, серотипов 2 и 3 (HVT) (WO-A-87/04463), или же ITLV, NDV и птичьи аденовирусы. При использовании некоторых из этих рекомбинантных птичьих вирусных векторов для вакцинации они проявляли различные уровни защиты.
Было разработано и лицензировано несколько рекомбинантных векторов на основе герпесвируса индейки (HVT, который также называют герпесвирусом-1 индейковых или MDV серотипа 3), экспрессирующих антигены из различных патогенов (US Patent Nos. 5,980,906, 5,853,733, 6,183,753, 5,187,087), включая IBDV, NDV, ILTV и ATV. Особый интерес представляет вектор HVT, экспрессирующий ген VP2, защищающий от IBDV, который проявлял явное преимущество перед классическими вакцинами от IBD (Bublot et al., J. Comp. Path. 2007, 137, S81-S84; US 5,980,906). Другие представляющие интерес векторы HVT экспрессируют гены, защищающие либо от NDV (Morgan et al., 1992, Avian Dis. 36, 858-70; US 6,866,852; US 5,650,153), либо от ILTV (Johnson et al., 2010, Avian Dis. 54, 1251-1259; US 6,299,882; US 5,853,733). Одна из практических проблем при совместном применении нескольких рекомбинантных вакцин на основе HVT заключается в их интерференции. При смешивании двух рекомбинантных HVT, экспрессирующих различные антигены, снижается защита по меньшей мере от одного из заболеваний (Rudolf Heine 2011; Issues of the poultry recombinant viral vector vaccines which may cause an effect on the economic benefits of those vaccines; paper presented at the XVII World Veterinary Poultry Association (WVPA) Congress in Cancún, Mexico, August 14-18, 2011; Slacum G, Hein R. and Lynch P., 2009, The compatibility of HVT recombinants with other Marek's disease vaccines, 58th Western Poultry Disease Conference, Sacramento, CA, USA, March 23-25, p 84).
Комбинация из HVT и SB-1, вакцинного штамма герпесвируса-3 куриных (MDV серотипа 2 или MDV-2), проявляла синергический эффект на защиту от MD (Witter and Lee, 1984, Avian Pathology 13, 75-92). Для решения проблемы интерференции представляет интерес оценка вируса HVT в качестве вакцинного вектора для экспрессии одного или нескольких защитных антигенов от различных птичьих патогенов.
Геном SB-1 был клонирован и охарактеризован в бактериальной искусственной хромосоме (ВАС) (Petherbridge et al., J. Virol. Methods 158, 11-17, 2009; Singh et al., Research in Veterinary Science 89, 140-145, 2010). Недавно была получена и проанализирована последовательность SB-1 MDV2 (Spatz and Schat, Virus Gene 42, 331-338, 2011). В работе Petherbridge et al. описана делеция гликопротеина E у вируса SB-1 (J. Virol. Methods 158, 11-17, 2009). Однако не было сообщений об исследованиях с использованием SB-1 в качестве вирусного вектора, экспрессирующего чужеродные защитные гены.
Учитывая потенциальное воздействие таких патогенов животных, как NDV и IBDV, на ветеринарное здравоохранение и экономику, необходимы эффективные методы предотвращения инфекции и защиты животных. Существует потребность в решении проблемы эффективных комбинированных векторных вакцин и подходящего способа получения вакцин, которое могло бы ослабить интерференцию, наблюдаемую между вакцинами с двумя векторами на основе HVT.
Сущность изобретения
Настоящее изобретение проявляло неожиданный результат, когда поливалентные композиции или вакцины, содержащие одинарные или двойные векторы HVT, оказались эффективными при защите животных от различных патогенов птиц без интерференции. Неожиданные результаты наблюдались и при различных комбинациях промоторов, оптимизированных по кодонам генов, хвостов поли-A и сайтов вставки, которые придавали различные уровни эффективности и стабильности при экспрессии одного или нескольких гетерологичных генов in vivo.
Настоящее изобретение касается рекомбинантных векторов HVT, содержащих один или несколько гетерологичных полинуклеотидов, кодирующих и экспрессирующих по меньшей мере один антиген птичьего патогена.
Настоящим изобретением предусмотрены композиции или вакцины, содержащие один или несколько рекомбинантных векторов HVT, содержащих один или несколько гетерологичных полинуклеотидов, кодирующих и экспрессирующих по меньшей мере один антиген птичьего патогена.
Настоящим изобретением предусмотрены поливалентные композиции или вакцины, содержащие один или несколько рекомбинантных векторов HVT, содержащих гетерологичные полинуклеотиды, кодирующие и экспрессирующие по меньшей мере один антиген птичьего патогена, и один или несколько рекомбинантных векторов SB1, содержащих гетерологичные полинуклеотиды, кодирующие и экспрессирующие по меньшей мере один антиген птичьего патогена.
Настоящее изобретение касается способа вакцинации животных или вырабатывания иммуногенного или защитного ответа у животных, который включает по меньшей мере одно введение композиции или вектора настоящего изобретения.
Краткое описание фигур
Нижеследующее подробное описание, которое приводится в качестве примера и не предназначено для ограничения изобретения описанными конкретными воплощениями, станет понятным в сочетании с прилагаемыми фигурами, включенными сюда в виде ссылки.
На фиг. 1 представлена таблица, в которой приведены SEQ ID NOs присвоенные каждой из последовательностей ДНК и белков.
На фиг. 2 представлена структура генома HVT и его сайты инсерции.
На фиг. 3 представлена карта плазмиды pHM103.
На фиг. 4 представлены результаты анализа vHVT114 методом ПЦР.
На фиг. 5 представлены результаты анализа методом двойной иммунофлуоресценции.
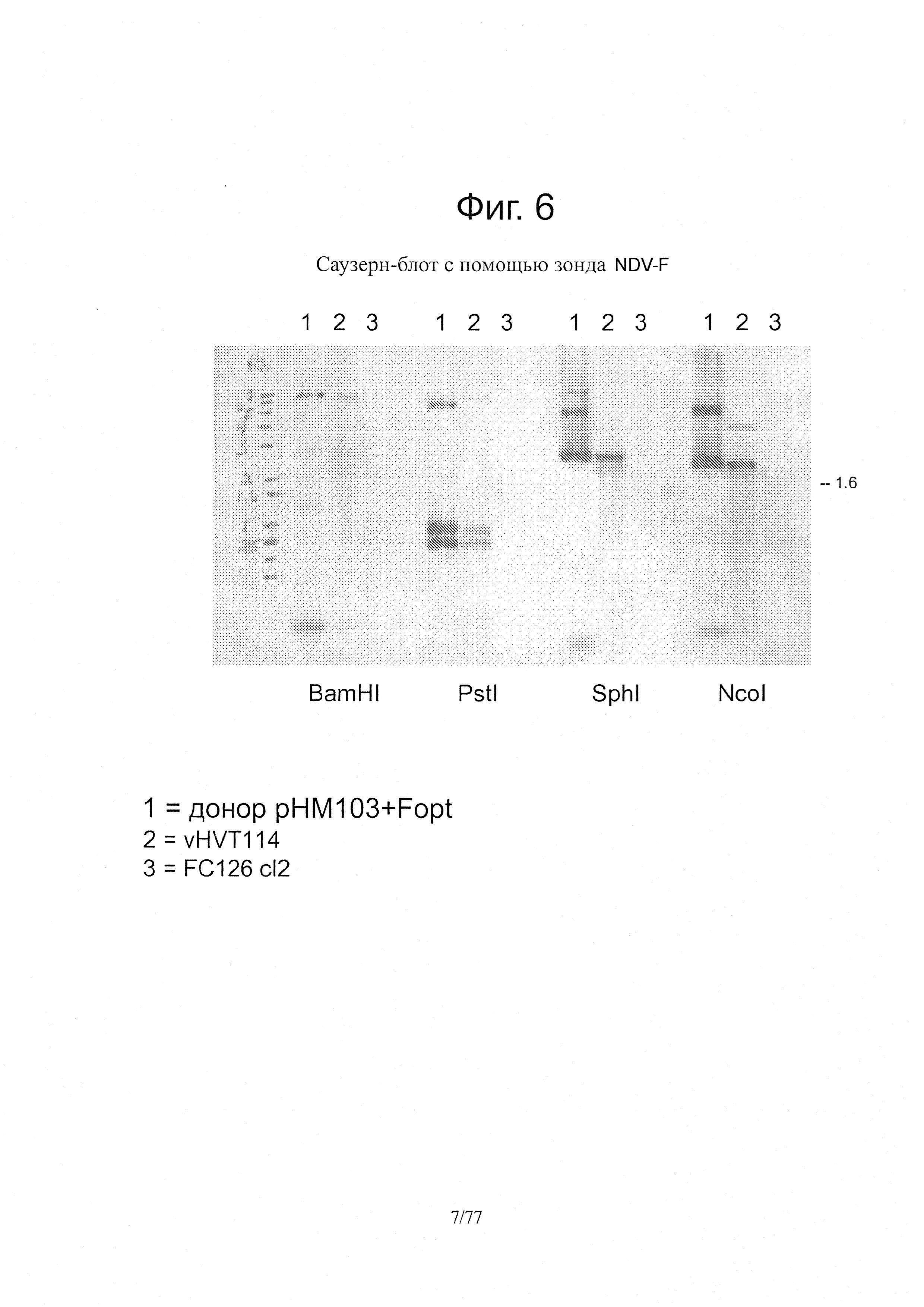
На фиг. 6 представлены результаты Саузерн-блота vHVT114.
На фиг. 7 представлены результаты анализа vHVT114 методом иммунопреципитации и Вестерн-блота.
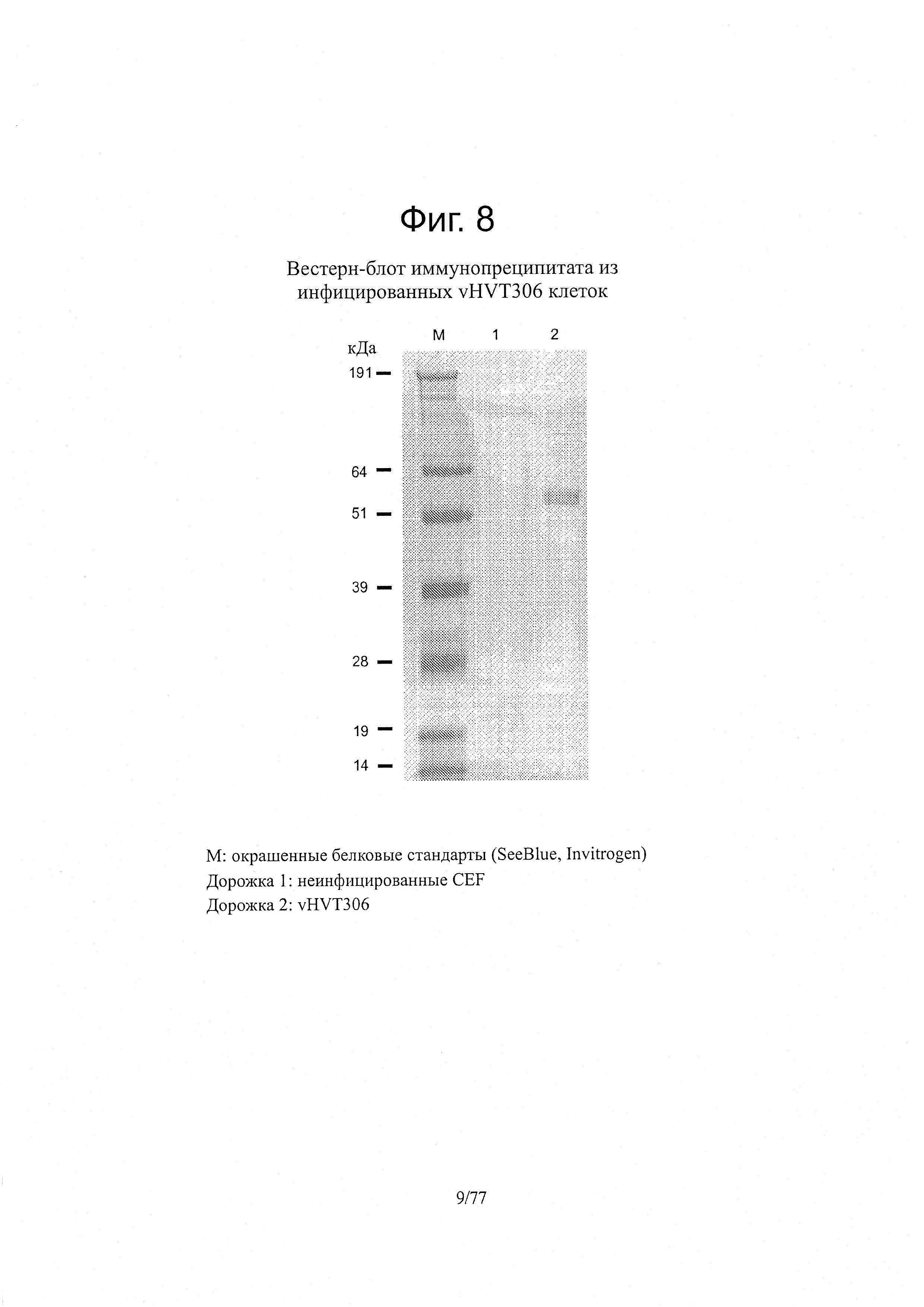
На фиг. 8 представлен анализ методом Вестерн-блота подвергнутого иммунопреципитации образца из инфицированных vHVT306 клеток.
На фиг. 9 представлен анализ методом Вестерн-блота подвергнутого иммунопреципитации образца из инфицированных vSB1-009 клеток.
На фиг. 10 представлены результаты исследования VHVT304 и vHVT114 против заражения NDV ZJ1 и СА02.
На фиг. 11 представлены результаты по выделению вируса после заражения NDV СА02 и ZJ1.
На фиг. 12 представлены результаты по выделению вируса после заражения NDV Chimalhuacan.
На фиг. 13 представлено выравнивание последовательностей и степень их идентичности.
На фиг. 14 представлены последовательности ДНК и белков.
Раскрытие сущности изобретения
Следует отметить, что в настоящем описании и особенно в формуле изобретения такие термины, как "содержит", "состоящий", "содержащий" и т.п. могут иметь смысл, придаваемый им в патентном законодательстве США, т.е. они могут означать "включает", "включающий", "включая" и т.п.; а такие термины, как "состоящий в основном из" и "состоит в основном из" имеют значение, придаваемое им в патентном законодательстве США, т.е. они допускают элементы, не приведенные в явном виде, но исключают элементы, которые встречаются на предшествующем уровне техники либо затрагивают основные или новые характеристики изобретения.
Если не указано иначе, технические термины применяются в соответствии с обычной практикой. Определения распространенных в молекулярной биологии терминов приведены в Benjamin Lewin, Genes V, published by Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
Термины в единственном числе включают значения множественного числа, если из контекста не следует четко иное. Аналогичным образом слово "или" также охватывает "и", если из контекста не следует четко иное. Слово "или" подразумевает любых членов определенного списка, а также включает любые комбинации членов этого списка.
Термин "животное" в настоящем изобретении включает всех млекопитающих, птиц и рыб. При этом животное может быть выбрано из группы, состоящей из лошадиных (например, лошадь), собачьих (например, собаки, волки, лисы, койоты, шакалы), кошачьих (например, львы, тигры, домашние кошки, дикие кошки, другие большие кошки и другие кошачьи, в том числе гепарды и рыси), бычьих (например, крупный рогатый скот), свиней (например, свиньи), овечьих (например, овцы, козы, ламы, бизоны), птиц (например, куры, утки, гуси, индейки, перепела, фазаны, попугаи, зяблики, ястребы, вороны, страусы, эму и казуары), приматов (например, полуобезьяны, долгопяты, мартышки, гиббоны, человекообразные обезьяны), человека и рыб. Термин "животное" также включает индивидуальных животных на всех стадиях развития, включая стадию эмбриона и плода.
Термины "полипептид" и "белок" применяются здесь взаимозаменяемо для обозначения полимера из последовательных аминокислотных остатков.
Термины "нуклеиновая кислота", "нуклеотид" и "полинуклеотид" применяются взаимозаменяемо и обозначают РНК, ДНК, кДНК или кРНК и их производные типа тех, что содержат модифицированные остовы. Следует иметь в виду, что изобретением предусмотрены полинуклеотиды, содержащие последовательности, комплементарные тем, что описаны здесь. "Полинуклеотид", предусмотренный в настоящем изобретении, включает как прямую нить (от 5' к 3'), так и обратную комплементарную нить (от 3' к 5'). Полинуклеотиды по изобретению могут быть получены различными способами (например, путем химического синтеза, клонирования гена и т.д.) и могут принимать различные формы (например, линейную или разветвленную, одноцепочечную или двухцепочечную либо их гибриды, праймеры, зонды и др.).
Термины "геномная ДНК" или "геном" используются взаимозаменяемо и относятся к наследуемой генетической информации организма-хозяина. Геномная ДНК включает ДНК из ядра (также называется хромосомной ДНК), а также ДНК из плазмид (например, хлоропластов) и других клеточных органелл (например, митохондрий). Геномная ДНК или геном в настоящем изобретении также относятся к РНК вирусов. РНК может представлять собой положительную нить или отрицательную нить РНК. Термин "геномная ДНК" в настоящем изобретении включает геномную ДНК, содержащую последовательности, комплементарные тем, что описаны здесь. Термин "геномная ДНК" также относится к матричной РНК (мРНК), комплементарной ДНК (кДНК) и комплементарной РНК (кРНК).
Термин "ген" применяется в широком смысле для обозначения любых сегментов полинуклеотидов, связанных с биологической функцией. Так, гены или полинуклеотиды включают нитроны и экзоны, как в геномной последовательности, или только кодирующие последовательности, как в кДНК, типа открытой рамки считывания (ORF), начиная со стартового кодона (кодона метионина) и заканчивая сигналом терминации (стоп-кодоном). Гены и полинуклеотиды также могут включать участки, регулирующие их экспрессию, как-то инициацию транскрипции, трансляцию и терминацию транскрипции. Так, к ним также относятся промоторы и участки связывания рибосом (в общем, эти регуляторные элементы располагаются примерно на 60-250 нуклеотидов выше от стартового кодона кодирующей последовательности или гена; Doree SM et al.; Pandher K et al.; Chung J Y et al.), терминаторы транскрипции (в общем, терминатор располагается примерно на 50 нуклеотидов ниже от стоп-кодона кодирующей последовательности или гена; Ward C K et al.). Ген или полинуклеотид также относится к таким фрагментам нуклеиновой кислоты, которые экспрессируют мРНК или функциональную РНК, либо кодируют определенный белок, а также содержат регуляторные последовательности.
Термин "гетерологичная ДНК" в настоящем изобретении означает ДНК, происходящую из другого организма, как-то из другого типа клеток или другого вида, чем реципиент. Этот термин также относится к ДНК или ее фрагментам в геноме одного и того же организма, но при этом гетерологичная ДНК встроена в участок генома, который отличается от исходного положения.
В настоящем изобретении термин "антиген" или "иммуноген" означает вещество, которое вызывает специфический иммунный ответ у животного-хозяина. Антиген может включать целый организм, убитый, ослабленный или живой; субъединицу или часть организма; рекомбинантный вектор, содержащий вставку с иммуногенными свойствами; кусок или фрагмент ДНК, способный вызывать иммунный ответ при презентировании животному-хозяину; полипептид, эпитоп, гаптен или любые их комбинации. С другой стороны, иммуноген или антиген может включать токсин или антитоксин.
Термин "иммуногенный белок или пептид" в настоящем изобретении включает полипептиды, которые являются иммунологически активными в том смысле, что при введении в организм они способны вызывать иммунный ответ гуморального и/или клеточного типа, направленный против белка. Предпочтительно фрагмент белка должен обладать практически такой же иммунологической активностью, что и целый белок. Таким образом, фрагмент белка по изобретению содержит или состоит в основном или состоит из по меньшей мере одного эпитопа или антигенной детерминанты. "Иммуногенный" белок или полипептид в настоящем изобретении включает полную последовательность белка, его аналоги или иммуногенные фрагменты. Под "иммуногенным фрагментом" понимается такой фрагмент белка, который включает один или несколько эпитопов и тем самым вызывает иммунный ответ, как описано выше. Такие фрагменты могут быть идентифицированы любыми методами картирования эпитопов, хорошо известными в данной области. Например, линейные эпитопы можно определить, например, путем одновременного синтеза большого числа пептидов на твердой подложке, причем пептиды соответствуют частям молекулы белка, и пептидам, проведения реакции пептидов с антителами в то время, когда пептиды все еще прикреплены к подложке. Точно так же легко идентифицируются конформационные эпитопы путем определения пространственной конформации аминокислот, например, при помощи рентгеновской кристаллографии и 2-мерного ядерного магнитного резонанса.
Термин "иммуногенный белок или пептид" также охватывает делеции, вставки и замены в последовательности при условии, что полипептид будет функционировать при выработке иммунного ответа, как определено здесь. Термин "консервативная замена" означает такую замену аминокислотного остатка другим биологически сходным остатком или замену нуклеотида в последовательности нуклеиновой кислоты, при которой кодируемый аминокислотный остаток не изменяется или представлен другим биологически сходным остатком. В этом отношении особенно предпочтительные замены являются консервативными по природе, т.е. это такие замены, которые происходят в пределах одного семейства аминокислот. Например, аминокислоты обычно подразделяют на 4 семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда причисляют к ароматическим аминокислотам. Примеры консервативных замен включают замену одного гидрофобного остатка типа изолейцина, валина, лейцин или метионина на другой гидрофобный остаток либо замену одного полярного остатка на другой полярный остаток типа замены аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин и т.п. либо аналогичную консервативную замену одной аминокислоты на близкую по структуре аминокислоту, которая не будет оказывать большого эффекта на биологическую активность. Таким образом, белки, имеющие практически такую же аминокислотную последовательность, что и контрольная молекула, но с небольшими аминокислотными заменами, практически не влияющими на иммуногенность белка, попадают под определение контрольного полипептида. Сюда же входят все полипептиды, полученные при таких модификациях. Термин "консервативная замена" также включает использование замещенной аминокислоты вместо незамещенной исходной аминокислоты при условии, что антитела к замещенному полипептиду тоже дают иммунную реакцию с незамещенным полипептидом.
Термином "эпитоп" обозначается тот сайт на антигене или гаптене, на который реагируют специфичные B-клетки и/или T-клетки. Термин также применяется взаимозависимо с "антигенной детерминантой" или "участком антигенной детерминанты". Антитела, распознающие один и тот же эпитоп, можно идентифицировать методом простого иммуноанализа по способности одного антитела блокировать связывание другого антитела с антигеном мишени.
"Иммунологический ответ" на композицию или вакцину означает возникновение у хозяина клеточного и/или антитело-опосредованного иммунного ответа на данную композицию или вакцину. Обычно "иммунологический ответ" включает, без ограничения, один или несколько из следующих эффектов: выработку антител, B-клеток, хелперных T-клеток и/или цитотоксических T-клеток, направленных специфически на антиген или антигены, входящие в состав данной композиции или вакцины. Предпочтительно у хозяина будет проявляться такой терапевтический либо защитный иммунологический ответ, что у него усилится устойчивость к новой инфекции и/или уменьшится клиническая тяжесть заболевания. Такая защита будет проявляться ослаблением или отсутствием симптомов, которые в норме отмечаются у инфицированного организма, ускорением выздоровления и/или снижением титра вируса у инфицированного организма.
Термины "рекомбинантный" и "генетически модифицированный" применяются взаимозаменяемо и относятся к любым модификациям, изменениям или перестройкам полинуклеотидов или белков в их естественной форме или структуре или же к любым модификациям, изменениям или перестройкам полинуклеотидов или белков в их естественном окружении. Модификации, изменения или перестройки полинуклеотидов или белков могут включать, без ограничения, делецию одного или нескольких нуклеотидов или аминокислот, делецию целого гена, оптимизацию гена по кодонам, консервативную замену аминокислот, вставку одного или нескольких гетерологичных полинуклеотидов.
Термины "двойная конструкция HVT" или "двойной вектор HVT" относятся к вирусным векторам HVT, содержащим два гетерологичных полинуклеотида.
Термины "поливалентная вакцина или композиция", "комбинированная вакцина или композиция" и "мультивалентная вакцина или композиция" применяются взаимозаменяемо для обозначения композиций или вакцин, содержащих более одной композиции или вакцины. Поливалентная вакцина или композиция может содержать две, три, четыре или больше композиций или вакцин. Поливалентная вакцина или композиция может содержать рекомбинантные вирусные векторы, активные или ослабленные или убитые вирусы дикого типа либо смеси из рекомбинантных вирусных векторов и вирусов дикого типа в активном, ослабленном или убитом виде.
В одном воплощении изобретения предусмотрен рекомбинантный вирусный вектор HVT, содержащий один или несколько гетерологичных полинуклеотидов, кодирующих и экспрессирующих по меньшей мере один антиген или полипептид патогена птиц. Штаммы HVT, используемые для рекомбинантного вирусного вектора, могут быть любые штаммы HVT, включая, без ограничения, штамм FC126 HVT (Igarashi T. et al., J. Gen. Virol. 70, 1789-1804, 1989).
В другом воплощении изобретения предусмотрен рекомбинантный вирусный вектор SB-1, содержащий один или несколько гетерологичных полинуклеотидов, кодирующих и экспрессирующих по меньшей мере один антиген или полипептид патогена птиц. Штаммы SB-1 могут быть любые штаммы SB-1, включая, без ограничения, штамм SB-1 из коммерческой вакцины против болезни Марека (вакцины SB-1) (Merial Select Inc., Gainesville, GA 30503, USA), последовательность генома которого находится в GenBank под номером доступа HQ840738.1.
Гены, кодирующие антиген или полипептид, могут представлять собой гены, кодирующие белок слияния (F) вируса болезни Ньюкасл (NDV-F), нейраминидазу гемагглютинина вируса болезни Ньюкасл (NDV-HN), гликопротеин С вируса болезни Марека (gC), гликопротеин В вируса болезни Марека (gB), гликопротеин Е вируса болезни Марека (gE), гликопротеин I вируса болезни Марека I (gI), гликопротеин Н вируса болезни Марека (gH) или гликопротеин L вируса болезни Марека (gL), VP2 вируса инфекционного бурсита (IBDV), VPX IBDV, VP3 IBDV, VP4 IBDV, гликопротеин В ILTV, гликопротеин I ILTV, UL32 ILTV, гликопротеин D ILTV, гликопротеин Е ILTV, гликопротеин С ILTV, гемагглютинин вируса гриппа (НА), нейраминидазу вируса гриппа (NA), защитные гены из Mycoplasma gallisepticum (MG) или Mycoplasma synoviae (MS) либо их комбинации. Антиген или полипептид может быть представлен любым антигеном из патогена птиц, выбранного из группы, состоящей из вируса птичьего энцефаломиелита, птичьего реовируса, птичьего парамиксовируса, птичьего метапневмовируса, вируса птичьего гриппа, птичьего аденовируса, птичьего поксвируса, птичьего коронавируса, птичьего ротавируса, вируса анемии кур, птичьего астровируса, птичьего парвовируса, возбудителей кокцидиоза (Eimeria sp.), Campylobacter sp., Salmonella sp., Pasteurella sp., Avibacterium sp., Mycoplasma gallisepticum, Mycoplasma synoviae, Clostridium sp. и E.coli.
Кроме того, в объем настоящего изобретения входят гомологи вышеприведенных антигенов или полинуклеотидов. В настоящем изобретении термин "гомологи" включает ортологи, аналоги и паралоги. Термин "аналоги" относится к таким двум полинуклеотидам или полипептидам, которые имеют одинаковые или близкие функции, но эволюционировали по отдельности у неродственных организмов. Термин "ортологи" относится к таким двум полинуклеотидам или полипептидам из разных видов, которые произошли из общего предкового гена в процессе видообразования. В норме ортологи кодируют полипептиды, имеющие одинаковые или близкие функции. Термин "паралоги" относится к таким двум полинуклеотидам или полипептидам, которые образовались путем дупликации в пределах одного генома. Паралоги обычно имеют разные функции, но эти функции могут быть близкими. Аналоги, ортологи и паралоги полипептида дикого типа могут отличаться от полипептида дикого типа посттрансляционными модификациями, отличиями по аминокислотной последовательности или теми и другими. В частности, гомологи по изобретению обычно проявляют идентичность последовательности по меньшей мере на 80-85%, 85-90%, 90-95% или на 95%, 96%, 97%, 98%, 99% по всей или по части последовательности полинуклеотидов или полипептидов описанных выше антигенов и должны проявлять близкие функции.
В одном воплощении настоящего изобретения предусмотрен рекомбинантный вирусный вектор HVT или SB-1, содержащий один или несколько гетерологичных полинуклеотидов, кодирующих и экспрессирующих антиген или полипептид NDV-F. В одном аспекте этого воплощения антиген или полипептид NDV-F по последовательности по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичен полипептиду, имеющему последовательность, приведенную в SEQ ID NO: 2, 4, 6, 33, 35 или 37, либо консервативному варианту, аллельному варианту, гомологу или иммуногенному фрагменту, содержащему по меньшей мере 8 или по меньшей мере 10 последовательных аминокислот одного из этих полипептидов, либо комбинации этих полипептидов. В другом аспекте этого воплощения гетерологичный полинуклеотид кодирует антиген или полипептид NDV-F, который по последовательности по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичен полипептиду, имеющему последовательность, приведенную в SEQ ID NO: 2, 4, 6, 33, 35 или 37. В еще одном аспекте этого воплощения гетерологичный полинуклеотид по последовательности по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичен полинуклеотиду, имеющему последовательность, приведенную в SEQ ID NO: 1, 3, 5, 32, 34 или 36.
Варианты включают в себя аллельные варианты. Термин "аллельный вариант" относится к полинуклеотидам или полипептидам, содержащим полиморфизмы, которые приводят к изменению аминокислотной последовательности белка и которые существуют в естественной популяции (например, у вида или разновидности вируса). Такие природные аллельные варианты обычно составляют 1-5% изменчивости полинуклеотида или полипептида. Аллельные варианты можно идентифицировать путем секвенирования данной последовательности нуклеиновой кислоты у целого ряда различных видов, что легко осуществляется с помощью гибридизационных зондов для идентификации генетического локуса одного и того же гена у этих видов. Всевозможные такие вариации нуклеиновой кислоты и возникающие при этом аминокислотные полиморфизмы и варианты, которые являются результатом естественной аллельной изменчивости и не изменяют функциональную активность данного гена, входят в объем настоящего изобретения.
Термин "идентичность" в отношении последовательностей может означать, к примеру, число положений с одинаковыми нуклеотидами или аминокислотами, деленное на общее число нуклеотидов или аминокислот в более короткой из двух последовательностей, при этом выравнивание двух последовательностей может быть определено по алгоритму Уилбура и Липмана (Wilbur and Lipman). Идентичность или сходство по последовательности у двух аминокислотных последовательностей либо идентичность между двумя нуклеотидными последовательностями можно определить с помощью пакета программ Vector NTI (Invitrogen, 1600 Faraday Ave., Carlsbad, CA). Когда последовательности РНК считаются сходными или имеют некоторую степень идентичности или гомологичности по последовательности с последовательностями ДНК, то тимидин (T) в последовательности ДНК принимается равным урацилу (U) в последовательности РНК. Таким образом, в объем настоящего изобретения также входят последовательности РНК, которые могут быть определены, основываясь на последовательности молекулы ДНК, где тимидин (T) в последовательности ДНК принимается равным урацилу (U) в последовательности РНК.
Полинуклеотиды по изобретению включают последовательности, которые являются вырожденными вследствие вырожденности генетического кода, например, оптимизированные по употребительности кодонов для определенного организма. При этом "оптимизированные" это такие полинуклеотиды, которые подвергались генетической инженерии для усиления экспрессии у данного вида. Для получения оптимизированных полинуклеотидов, кодирующих полипептиды NDV-F, можно модифицировать последовательность ДНК у гена белка NDV-F так, чтобы она 1) содержала кодоны, которые предпочтительны у генов с очень высоким уровнем экспрессии у данного вида; 2) имела практически такое же содержание A+T или G+C в нуклеотидном составе, которое встречается у данного вида; 3) имела последовательность инициации данного вида; или 4) были устранены последовательности, вызывающие дестабилизацию, неправильное полиаденилирование, деградацию и терминацию РНК, либо образующие шпильки во вторичной структуре или сайты сплайсинга РНК. Усиление экспрессии белка NDV-F у данного вида достигается при помощи оптимизации последовательности с учетом частоты использования кодонов у эукариот и прокариот или у данного вида. Термин "частота использования предпочтительных кодонов" относится к той предпочтительности, которую проявляют клетки определенного организма при употреблении нуклеотидных кодонов для кодирования определенной аминокислоты. Существует 20 природных аминокислот, большинство которых кодируется более чем одним кодоном. Поэтому в изобретение включены все вырожденные нуклеотидные последовательности, если только аминокислотная последовательность белка NDV-F, кодируемого данной нуклеотидной последовательностью, не будет иметь функциональных изменений.
Успешная экспрессия гетерологичных полинуклеотидов рекомбинантным/модифицированным инфекционным вирусом требует двух условий. Во-первых, гетерологичные полинуклеотиды должны быть вставлены или встроены в некий участок генома вируса таким образом, чтобы модифицированный вирус оставался жизнеспособным. Второе условие для экспрессии встроенных гетерологичных полинуклеотидов заключается в наличии регуляторных последовательностей, обеспечивающих экспрессию гена в вирусном генетическом окружении (к примеру: промотор, энхансер, донорный и акцепторный сайты сплайсинга и интрон, консенсусная последовательность инициации трансляции Козака, сигналы полиаденилирования, нетранслируемые элементы последовательности).
Местом инсерции может быть любой несущественный участок генома HVT, включая, без ограничения, участок между ATG из ORF UL55 и соединение UL с соседним участком повтора (US 5,980,906), локус IG1, локус IG2, локус IG3, локус UL43, локус US10, локус SORF3/US2 (см. фиг. 2).
В общем, целесообразно использовать сильный промотор, функционирующий в эукариотических клетках. Промоторы включают, без ограничения, немедленно ранний промотор цитомегаловируса (CMV), промотор CMV морской свинки, промотор SV40, промоторы вируса псевдобешенства типа промотора гликопротеина X, промоторы вируса Herpes simplex-1 типа промотора альфа-4, промоторы вирусов болезни Марека (включая MDV-1, MDV-2 и HVT) типа управляющих экспрессией гликопротеинов gC, gB, gE или gI, промоторы вируса инфекционного ларинготрахеита типа промоторов генов гликопротеинов gB, gE, gI, gD или промоторы других герпесвирусов.
В одном воплощении изобретения предусмотрен рекомбинантный вектор HVT, содержащий гетерологичный полинуклеотид, кодирующий и экспрессирующий антиген или полипептид NDV-F. В одном аспекте этого воплощения полинуклеотид, кодирующий полипептид NDV-F, функционально связан с промотором SV40, последовательность которого приведена в SEQ ID NO: 9, поэтому экспрессия антигена или полипептида NDV-F регулируется промотором SV40. В другом аспекте этого воплощения экспрессия антигена или полипептида NDV-F регулируется сигналом поли-A SV40, последовательность которого приведена в SEQ ID NO: 11. В еще одном аспекте этого воплощения полинуклеотид, кодирующий полипептид NDV-F, функционально связан с промотором gB MDV, последовательность которого приведена в SEQ ID NO: 38, поэтому экспрессия антигена или полипептида NDV-F регулируется промотором gB MDV.
В другом воплощении изобретения предусмотрен рекомбинантный двойной вектор HVT, содержащий первый гетерологичный полинуклеотид, кодирующий и экспрессирующий антиген или полипептид NDV-F, и второй полинуклеотид, кодирующий и экспрессирующий антиген или полипептид VP2 IBDV. В одном аспекте этого воплощения последовательность антигена или полипептида NDV-F по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности полипептида, приведенной в SEQ ID NO: 2, 4, 6, 33, 35 или 37. В другом аспекте этого воплощения последовательность антигена или полипептида VP2 IBDV по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности полипептида, которая приведена в SEQ ID NO: 8 или 42. В другом аспекте полинуклеотид, кодирующий полипептид NDV-F, функционально связан с промотором SV40, последовательность которого приведена в SEQ ID NO: 9, и экспрессия антигена или полипептида NDV-F регулируется промотором SV40. В еще одном аспекте экспрессия антигена или полипептида NDV-F регулируется сигналом поли-А SV40, последовательность которого приведена в SEQ ID NO: 11, либо синтетическим сигналом поли-A, последовательность которого приведена в SEQ ID NO: 12. В другом аспекте экспрессия антигена или полипептида VP2 IBDV регулируется промотором CMV-IE, последовательность которого приведена в SEQ ID NO: 10, и сигналом поли-А SV40, последовательность которого приведена в SEQ ID NO: 11.
В следующем воплощении изобретения предусмотрен рекомбинантный двойной вектор HVT, содержащий два полинуклеотида, кодирующие и экспрессирующие антигены или полипептиды VP2 IBDV. В одном аспекте этого воплощения последовательность антигена или полипептида VP2 IBDV по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности полипептида, приведенной в SEQ ID NO: 8 или 42. В одном аспекте полинуклеотид, кодирующий первый антиген или полипептид VP2 IBDV, функционально связан с промотором CMV-IE, последовательность которого приведена в SEQ ID NO: 10, а полинуклеотид. кодирующий второй антиген или полипептид VP2 IBDV, функционально связан с промотором CMV морской свинки, последовательность которого приведена в SEQ ID NO: 43. В другом аспекте экспрессия первого антигена или полипептида VP2 IBDV регулируется промотором CMV-IE, последовательность которого приведена в SEQ ID NO: 10, и сигналом поли-A SV40, последовательность которого приведена в SEQ ID NO: 11, а экспрессия второго антигена или полипептида VP2 IBDV регулируется промотором CMV морской свинки, последовательность которого приведена в SEQ ID NO: 43, и синтетическим сигналом поли-A, последовательность которого приведена в SEQ ID NO: 12. В следующем аспекте этого воплощения полинуклеотиды, кодирующие антиген или полипептид VP2 IBDV, могут быть вставлены в один или несколько участков локуса, выбранного из группы, состоящей из IG1, IG2, US10, SORF3-US2 и gD в геноме HVT. В одном воплощении настоящее изобретение касается фармацевтической композиции или вакцины, содержащей один или несколько рекомбинантных вирусных векторов HVT или SB-1 настоящего изобретения и фармацевтически или ветеринарно-приемлемый носитель, наполнитель, растворитель или адьювант.
В другом воплощении настоящего изобретения предусмотрена композиция или вакцина, включающая вирусный вектор HVT, содержащий полинуклеотид, кодирующий антиген NDV-F, промотор SV40 и необязательно фармацевтически или ветеринарно-приемлемый носитель, наполнитель, растворитель или адьювант. В другом воплощении настоящего изобретения предусмотрена фармацевтическая композиция или вакцина, включающая первый вектор HVT, содержащий полинуклеотид, кодирующий антиген NDV-F, второй вектор HVT, содержащий полинуклеотид, кодирующий антиген VP2 IBDV, и необязательно фармацевтически или ветеринарно-приемлемый носитель, наполнитель, растворитель или адьювант. В другом воплощении настоящего изобретения предусмотрена фармацевтическая композиция или вакцина, включающая вектор HVT, содержащий полинуклеотид, кодирующий антиген NDV-F, вектор SB-1, содержащий полинуклеотид, кодирующий антиген NDV-F, и необязательно фармацевтически или ветеринарно-приемлемый носитель, наполнитель, растворитель или адъювант. Фармацевтическая композиция или вакцина настоящего изобретения может содержать первый вектор HVT, содержащий полинуклеотид, кодирующий антиген NDV-F, второй вектор HVT, содержащий полинуклеотид, кодирующий антиген VP2 IBDV, вектор SB-1, содержащий полинуклеотид, кодирующий антиген NDV-F, и необязательно фармацевтически или ветеринарно-приемлемый носитель, наполнитель, растворитель или адъювант.
В следующем воплощении настоящего изобретения предусмотрена композиция или вакцина, включающая двойной вирусный вектор HVT, содержащий: i) первый гетерологичный полинуклеотид, кодирующий и экспрессирующий антиген или полипептид NDV-F; ii) второй полинуклеотид, кодирующий и экспрессирующий антиген или полипептид VP2 IBDV; и iii) необязательно фармацевтически или ветеринарно-приемлемый носитель, наполнитель, растворитель или адъювант. В другом воплощении настоящего изобретения предусмотрена композиция или вакцина, включающая двойной вирусный вектор HVT, содержащий два полинуклеотида, кодирующих и экспрессирующих антигены или полипептиды VP2 IBDV, и необязательно фармацевтически или ветеринарно-приемлемый носитель, наполнитель, растворитель или адъювант. В следующем воплощении композиция, содержащая двойной вирусный вектор HVT, дополнительно содержит вектор HVT, содержащий полинуклеотид, кодирующий антиген VP2 IBDV, или вектор SB-1, содержащий полинуклеотид, кодирующий антиген NDV-F, либо их комбинацию. Фармацевтически или ветеринарно-приемлемые носители или адъюванты или растворители или наполнители хорошо известны специалистам в данной области. Например, фармацевтически или ветеринарно-приемлемым носителем или адъювантом или растворителем или наполнителем может быть разбавитель для вакцины от болезни Марека, используемый для вакцин MD. Другие фармацевтически или ветеринарно-приемлемые носители или адъюванты или растворители или наполнители, которые могут использоваться в способах по изобретению, включают, без ограничения, 0,9% раствор NaCl (например, физраствор) или фосфатный буфер, поли-(L-глутамат) или поливинилпирролидон. Фармацевтически или ветеринарно-приемлемым носителем или растворителем или наполнителем может быть любое соединение или комбинация соединений, способствующих введению вектора (или белка, экспрессируемого из вектора по изобретению in vitro) или способствующих транфекции или инфицированию и/или улучшающие сохранность вектора (или белка). Дозы и объемы доз обсуждаются здесь в общем описании, а также могут быть определены специалистами по данному описанию в сочетании с познаниями в данной области, без излишнего экспериментирования.
Необязательно в качестве фармацевтически или ветеринарно-приемлемых носителей или адъювантов или растворителей или наполнителей могут добавляться и другие соединения, включая, без ограничения, квасцы; олигонуклеотиды CpG (ODN), в частности ODN 2006, 2007, 2059 или 2135 (Pontarollo R.A. et al., Vet. Immunol. Immunopath. 2002, 84: 43-59; Wernette CM. et al., Vet. Immunol. Immunopath. 2002, 84: 223-236; Mutwiri G. et al., Vet. Immunol. Immunopath. 2003, 91: 89-103); поли-А-поли-U, диметилдиоктадециламмония бромид (DDA) ("Vaccine Design: The Subunit and Adjuvant Approach", edited by Michael F. Powell and Mark J. Newman, Pharmaceutical Biotechnology, 6: p.03, p.157); N,N-диоктадецил-N',N'-бис(2-гидроксиэтил)пропандиамин (типа Avridine®) (ibid, p. 148); карбомер, хитозан (например, см. US Patent Serial No. 5,980,912).
Фармацевтические композиции и вакцины по изобретению могут содержать или состоять в основном из одного или нескольких адъювантов. Подходящими адъювантами в применении к настоящему изобретению являются (1) полимеры акриловой или метакриловой кислоты, малеинового ангидрида и полимеры производных алкенилов, (2) иммуностимулирующие последовательности (ISS) типа последовательностей олигодезоксирибонуклеотидов, содержащих одно или несколько неметилированных звеньев CpG (Klinman et al., 1996; WO 98/16247), (3) эмульсии типа масло-в-воде типа эмульсии SPT, описанной на стр. 147 в "Vaccine Design: The Subunit and Adjuvant Approach" published by M. Powell, M. Newman, Plenum Press 1995, и эмульсии MF59, описанной на стр. 183 той же работы, (4) катионные липиды, содержащие четвертичные соли аммония, например, DDA, (5) цитокины, (6) гидроксид алюминия или фосфат алюминия, (7) сапонин или (8) другие адъюванты, приведенные в любом документе, цитированном и включенном путем ссылки в настоящую заявку, или (9) любые их комбинации или смеси.
Другой аспект изобретения касается способа индуцирования иммунологического ответа у животных против одного или нескольких антигенов или защитного ответа у животных против одного или нескольких патогенов птиц, который включает прививку животного по меньшей мере один раз вакциной или фармацевтической композицией настоящего изобретения. Следующий аспект изобретения касается способа индуцирования иммунологического ответа у животных на один или несколько антигенов или защитного ответа у животных против одного или нескольких патогенов птиц по схеме прайм-буст, которая включает по меньшей мере одно прайм введение и по меньшей мере одно буст введение с использованием по меньшей мере одного общего полипептида антигена, эпитопа или иммуногена. Иммунологическая композиция или вакцина, используемая при прайм-вакцинации, может быть такой же или другой по природе, чем используемая при буст-вакцинации.
Патогенами птиц могут быть вирус болезни Ньюкасл (NDV), вирус инфекционного бурсита (IBDV, он же вирус болезни Gumboro), вирус болезни Марека (MDV), вирус инфекционного ларинготрахеита (ILTV), вирус птичьего энцефаломиелита, птичьи реовирусы, птичьи парамиксовирусы, птичьи метапневмовирусы, вирус птичьего гриппа, птичьи аденовирусы, птичьи поксвирусы, птичьи коронавирусы, птичьи ротавирусы, птичьи парвовирусы, птичьи астровирусы, вирус анемии кур, возбудители кокцидиоза (Eimeria sp.), Campylobacter sp., Salmonella sp., Mycoplasma gallisepticum, Mycoplasma synoviae, Pasteurella sp., Avibacterium sp., E.coli или Clostridium sp.
Обычно проводится одно введение вакцины в 1-дневном возрасте подкожно или внутримышечно либо in ovo у 17-19-дневных эмбрионов. Второе введение проводится в возрасте первых 10 дней. Во время первого введения это предпочтительно 17-дневные эмбрионы или животные в 1-дневном возрасте.
При введении 1-дневным цыплятам можно использовать различные способы введения, как-то подкожно или внутримышечно, интрадермально, трансдермально. Вакцинация in ovo может проводиться в амниотический мешок и/или в эмбрион. Для вакцинации можно использовать коммерчески доступные приспособления для введения in ovo или для подкожного введения.
Далее изобретение будет более подробно описано на следующих неограничивающих примерах.
Примеры
Конструирование вставок ДНК, плазмид и рекомбинантных вирусных векторов проводили по стандартным методикам молекулярной биологии, описанным в J. Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989).
Пример 1. Конструирование рекомбинантного vHVT114, экспрессирующего NDV-F
Получение донорской плазмиды pHM103+Fopt
Плазмиду pHM103 (Merial Limited), содержащую плечи межгенной области I из HVT FC126 (см. фиг. 2), промотор SV40 и поли-A SV40, расщепляли с помощью NotI, дефосфорилировали и экстрагировали из геля фрагмент в 5,6 т.п.о. Также расщепляли с помощью NotI фланкированный NotI фрагмент синтезированного химически оптимизированного по ко донам гена NDV-F с генотипом VIId (SEQ ID NO: 1, кодирует SEQ ID NO: 2) и экстрагировали из геля фрагмент в 1,7 т.п.о. Фрагменты в 5,6 и 1,7 т.п.о. лигировали, получая pHM103+Fopt (фиг. 3).
Получение рекомбинантного вирусного вектора HVT
Проводили рекомбинацию in vitro (IVR) методом совместной электропорации вторичных эмбриональных клеток фибробластов кур (клеток 2° CEF), используя в качестве донорской плазмиды pHM103+Fopt и вирусную ДНК, выделенную из HVT штамма FC126. Совместную электропорацию проводили при 1×107 клеток 2° CEF в 300 мкл Opti-MEM, которые подвергали электрошоку в 150 вольт при емкости 950 в кювете на 2 мм для электропорации. Трансфецированные клетки высеивали в 96-луночный планшет и инкубировали в течение 5 дней. Клетки, выращенные в 96-луночном планшете, затем дублировали в двух 96-луночных планшетах. Один набор 96-луночных планшетов использовали для ИФА с помощью поликлональной куриной сыворотки против NDV-F, чтобы идентифицировать положительные лунки, содержащие рекомбинанты, а другой -для выделения инфицированных клеток из положительных лунок.
Очистку рекомбинантных вирусов проводили сначала путем дублирования 96-луночного планшета и отбора методом ИФА лунок, содержащих большинство положительных по ИФА бляшек с наименьшим числом отрицательных по ИФА бляшек. Затем собирали лунки, удовлетворяющие этим критериям, и доводили до 1 мл в DMEM+2% FBS. Из исходного 1 мл отбирали 5-20 мкл и смешивали с 1×107 клеток CEF в 10 мл DMEM+2% FBS и раскапывали на новый 96-луночный планшет так, чтобы иметь по одной бляшке HVT на лунку. Супернатант из лунок, содержащих одиночные бляшки, тестировали на отсутствие родительского вируса методом ПЦР. После пяти циклов очистки методом бляшек был выделен рекомбинантный вирус, обозначенный как vHVT114, чистоту которого проверяли методами ИФА и ПЦР для подтверждения экспрессии NDV-F и отсутствия родительского вируса.
Анализ рекомбинантного vHVT114 методом ПЦР
Экстрагировали ДНК из vHVT114 смесью фенол/хлороформ, осаждали этанолом и ресуспендировали в 20 мМ HEPES. Составляли праймеры для ПЦР (приведенные в таблице 1) специально для определения присутствия оптимизированного по кодонам NDV-F, промотора SV40, а также чистоты рекомбинантного вируса от исходного вируса FC126 CL2. Проводили ПЦР при 200 нг ДНК матрицы вместе с указанными парами праймеров, приведенными в таблице 1. ПЦР проводили при следующих условиях: 2 мин при 94°C; 30 циклов по 30 сек при 94°C, 30 сек при 55°C, 3 мин при 68°C; и еще 5 мин при 68°C. Ожидаемые продукты ПЦР приведены в таблице 2. Результаты ПЦР представлены на фиг. 4. Как видно из фиг. 4, размеры продуктов ПЦР после гель-электрофореза хорошо соответствуют ожидаемым размерам и профилям полос.

Анализ экспрессии рекомбинантного vHVT114
Проводили иммунофлуоресцентный анализ с использованием такого VHVT114, который прошел свыше 10 пассажей после стадии экспериментального превакцинного вируса (pre-MSV). Материалы pre-MSV и pre-MSV+12 разводили средой 1:100. По 50 мкл разведенного вируса добавляли к 10 мл DMEM+2% FBS с 1×107 клеток CEF, а затем раскапывали в 96-луночный планшет (100 мкл на лунку). Планшеты инкубировали 3 дня при 37°C + 5% CO2 до тех пор, пока не появятся вирусные бляшки. Планшеты фиксировали 95% ледяным ацетоном в течение 3 минут и промывали три раза PBS. Добавляли куриную антисыворотку против вируса болезни Ньюкасл (лот №С0139, Charles River Laboratories) в разведении 1:1000 вместе с моноклональным антителом L-78 (Merial Limited) в разведении 1:3000 и инкубировали планшеты при 37°C в течение 1 ч. После инкубации планшеты три раза промывали PBS и добавляли антитело против курицы с FITC (кат. №F8888, Sigma) вместе с ослиным антителом против IgG мыши с Alexa Fluor 568 (кат. № A10037, Molecular Probes) в разведении 1:500. Планшеты снова инкубировали при 37°C в течение 1 ч. После инкубации клетки промывали три раза PBS. Добавляли небольшое количество PBS, чтобы предотвратить высыхание монослоя и возникновения автофлуоресценции. Затем визуализировали клетки с помощью флуоресцентного микроскопа, используя комбинацию фильтров для изотиоцианата тетраметилродамина (TRITC) и изотиоцианата флуоресцеина (FITC).
Вирусные бляшки vHVT114 визуализировали с помощью фильтров для TRITC и FITC для двойного окрашивания. Тест на FITC показывает экспрессию NDV-F, а тест на TRITC показывает экспрессию HVT. Вследствие небольшого размера лунок 96-луночных планшетов каждую лунку регистрировали так, что сначала подсчитывали бляшки с помощью фильтра для TRITC, а затем еще раз подсчитывали с помощью фильтра для FITC. Просчитывали более 500 бляшек по пассажам pre-MSV и MSV+12. Все бляшки оказались положительными и на FITC, и на TRITC на обоих планшетах (фиг. 5). Анализ рекомбинантного vHVT114 методом Саузерн-блот
Экстрагировали тотальную геномную ДНК из HVT FC126 и vHVT114 по стандартной методике экстракции геномной ДНК. Для каждого рестрикционного расщепления использовали 3 мкг геномной ДНК (1 нг для донорской плазмиды) при общем объеме реакции в 20 мкл для каждого образца. Геномную ДНК HVT FC126 (отрицательный контроль), донорскую плазмиду pHM103+Fopt и vHVT114 расщепляли по отдельности в течение ночи при 37°C с помощью рестрикционных эндонуклеаз BamHI, Pstl, Sphl и Ncol. Рестрикционные фрагменты HVT FC126 (отрицательный контроль), донорской плазмиды pHM103+Fopt и геномной ДНК vHVT114 разделяли в 1% агарозном геле и переносили на положительно заряженную нейлоновую мембрану. Следуя инструкциям производителей набора North2South Chemiluminescent Hybridization and Detection Kit (Thermo Scientific), мембрану предгибридизовали в течение 1 ч, а затем гибридизовали с биотинилированным зондом для NDV-F в течение ночи при 55°C. После ночной гибридизации проводили несколько отмывок при жестких условиях, после чего мембрану помещали в блокирующий буфер с добавлением стрептавидин-HRP. После отмывки мембраны от несвязавшегося стрептавидин-HRP добавляли раствор субстрата Luminal и пероксида. Затем мембрану экспонировали на рентгеновской пленке и проявляли пленку. Зоны, в которых биотинилированный зонд связывался с ДНК, были хемилюминесцентными и проявлялись на рентгеновской пленке. В таблице 3 представлены ожидаемые полосы при Саузерн-блоте с использованием зонда на NDV-F. Результаты Саузерн-блота проявляли те профили расщепления, которые ожидались (фиг. 6).

Анализ последовательности области вставки в рекомбинантном vHVT114
Проводили анализ области геномной ДНК vHVT114 методом ПЦР-амплификации. Для амплификации всей кассеты, а также за фланкирующими плечами BamHI-I в донорской плазмиде использовали в общей сложности 10 праймеров. Продукт ПЦР в 4,727 т.п.о. очищали из геля и весь фрагмент секвенировали с помощью секвенирующих праймеров. Результат секвенирования подтвердил, что vHVT114 содержит правильные последовательности промотора SV40, оптимизированного по кодонам NDV-F и поли-A SV40, которые точно соответствуют последовательности, приведенной для донорской плазмиды pHM103+Fopt в SEQ ID NO: 18.
Анализ рекомбинантного vHVT114 методом Вестерн-блот
Примерно 2×106 клеток фибробластов курицы инфицировали vHVT114 pre-MSV при множественности заражения в ~0,1 MOI. После двух дней инкубации при 37°C собирали как инфицированные, так и не инфицированные клетки с помощью клеточного скребка после удаления среды и промывки PBS. Клетки собирали в 1 мл PBS и центрифугировали. Клеточные осадки подвергали лизису с помощью набора Pierce Classic IP Kit (кат. №26146, Thermo Scientific). Для образования иммунного комплекса использовали 100 мкл моноклонального антитела 001C3 против NDV-F (Merial Limited). Образец антитело/лизат добавляли к агарозе с белком A/G (Protein A/G Plus Agarose) для захвата иммунного комплекса. Иммунный комплекс промывали три раза для удаления несвязавшегося материала, а затем элюировали в объеме 50 мкл буфером для элюирования образца в невосстанавливающих условиях. После кипячения в течение 5 мин наносили 10 мкл образца на 10% акриламидный гель (Invitrogen). Проводили PAGE в буфере MOPS (Invitrogen) в течение 1 ч при 200 В. Затем переносили гель на мембрану из PVDF.
Для блоттинга мембраны из PVDF использовали набор Protein Detector Western Blot Kit TMB System (KPL, кат. №54-11-50), используя реагенты и следуя инструкциям производителя. После блокирования мембраны в течение 1 ч при комнатной температуре мембрану отмывали три раза по 5 мин в отмывочном буфере 1X Wash Buffer, а затем выдерживали в блокирующем буфере, содержащем разведенную 1:1000 куриную антисыворотку против вируса NDV (серия C0139, Charles River Laboratories). После отмывки три раза в отмывочном буфере мембрану инкубировали с меченным пероксидазой хрена козьим антителом против IgG курицы (KPL, кат. №14-24-06) при разбавлении 1:2000 в течение 1 ч при комнатной температуре. Мембрану отмывали три раза по 5 мин в буфере 1X Wash Buffer. К мембране добавляли 5 мл субстрата пероксидазы ТМВ и осторожно покачивали примерно 1 мин. Проявление мембраны останавливали, помещая ее в воду.
При иммунопреципитации и Вестерн-блоттинге в образце vHVT114 выявлялся белок примерно в 55 кД, что соответствует ожидаемому размеру компонента F1 белка NDV-F (фиг. 7).
Пример 2. Конструирование рекомбинантных vHVT110, vHVT111, vHVT112, VHVT113 и vHVT116, экспрессирующих NDV-F
Конструирование и характеристика рекомбинантов HVT: vHVT110, vHVT111, vHVT112, vHVT113 и VHVT116 в основном проводились так же, как и для vHVT114, описанного в примере 1. В таблице 4 представлены характеристики, присущие каждой из конструкций вокруг экспрессионных кассет, в том числе соответствующие последовательности.

vHVT110
Плазмиду pCD046 (фирмы Merial), содержащую плечи межгенной области I из HVT FC126, промотор мышиного CMV и поли-A SV40, расщепляли с помощью NotI, дефосфорилировали и экстрагировали из геля фрагмент в 6,6 т.п.о. Также расщепляли с помощью NotI фланкированный NotI фрагмент синтезированного химически гена NDV-F, содержащий последовательность F дикого типа (SEQ ID NO: 3, кодирует SEQ ID NO: 4), и экстрагировали из геля фрагмент в 1,7 т.п.о. Фрагменты в 6,6 и 1,7 т.п.о. лигировали, получая донорскую плазмиду pCD046+NDV-F wt (SEQ ID NO: 21 для vHVT110), которую использовали при трансфекции для получения рекомбинантного vHVT110. Секвенирование области вставки подтвердило, что vHVT110 содержит правильные последовательности промотора mCMV, гена NDV-F дикого типа и поли-A SV40. Последовательность также в точности соответствует последовательности, приведенной для донорской плазмиды pCD046+NDV-F wt в SEQ ID NO: 21.
vHVT111
Плазмиду pHM103 (фирмы Merial), содержащую части (плечи) межгенной области I из HVT FC126, промотор SV40 и поли-A SV40, расщепляли с помощью NotI, дефосфорилировали и экстрагировали из геля фрагмент в 5,6 т.п.о. Также расщепляли с помощью NotI фланкированный NotI фрагмент синтезированного химически гена NDV-F в 1,7 т.п.о., содержащий последовательность F дикого типа (SEQ ID NO: 3, кодирует SEQ ID NO: 4), и экстрагировали из геля фрагмент в 1,7 т.п.о. Фрагменты в 5,6 и 1,7 т.п.о. лигировали, получая донорскую плазмиду (SEQ ID NO: 22 для vHVT111), которую использовали при трансфекции для получения рекомбинантного vHVT111. Секвенирование области вставки подтвердило, что vHVT111 содержит правильные последовательности промотора SV40, гена NDV-F дикого типа и поли-A SV40, как видно из последовательности донорской плазмиды pHM103+NDV-F wt (SEQ ID NO: 22).
vHVT112
Из плазмиды pUC57 NDV-F YZCQ (синтезированной на фирме GeneScript) с помощью NotI вырезали фрагмент, охватывающий синтетический ген NDV-F YZCQ дикого типа (SEQ ID NO: 34, кодирует SEQ ID NO: 35), и вставляли в тот же самый сайт плазмиды pCD046, содержащей промотор mCMV и хвост поли-A SV40. Лигированный материал трансформировали с помощью набора Тор 10 Oneshot kit (кат. № С404002, Invitrogen). Выращивали бактериальные колонии в бульоне LBamp, экстрагировали плазмиды с помощью набора Qiagen MiniSpin Prep kit и проводили скрининг на ориентацию вставки. Правильную донорскую плазмиду обозначили pCD046+NDV-F VII YZCQ. Выращивали крупномасштабные культуры и проводили экстракцию плазмиды с помощью набора Qiagen Maxi Prep. Временную экспрессию плазмиды из Maxi Prep проверяли на клетках эмбриональных фибробластов курицы (CEFs) с помощью реагента Fugene Transfection Reagent и куриной поликлональной антисыворотки против NDV.
Плазмиду pCD046+NDV-F VII YZCQ (SEQ ID NO: 29) использовали при трансфекции для получения рекомбинантного vHVT112. Секвенирование области вставки подтвердило, что vHVT112 содержит правильные последовательности промотора mCMV, гена NDV-F YZCQ дикого типа и поли-A SV40. Последовательность также в точности соответствовала последовательности, описанной для донорской плазмиды pCD046+NDV-F VII YZCQ в SEQ ID NO: 29.
vHVT1113
Из плазмиды pUC57 NDV Texas F (синтезированной на фирме GeneScript) с помощью NotI вырезали фрагмент, охватывающий синтетический ген F NDV Texas (SEQ ID NO: 36, кодирует SEQ ID NO: 37), и вставляли в тот же самый сайт плазмиды pCD046, содержащей промотор mCMV и хвост поли-A SV40. Лигированный материал трансформировали с помощью набора Тор 10 Oneshot kit (кат. № C404002, Invitrogen). Выращивали бактериальные колонии в бульоне LBamp, экстрагировали плазмиды с помощью набора Qiagen MiniSpin Prep kit и проводили скрининг на ориентацию вставки. Правильную донорскую плазмиду обозначили pCD046+Texas NDV-F. Выращивали крупномасштабные культуры и проводили экстракцию плазмиды с помощью набора Qiagen Maxi Prep. Временную экспрессию плазмиды из Maxi Prep проверяли на клетках эмбриональных фибробластов курицы (CEFs) с помощью реагента Fugene Transfection Reagent и куриной поликлональной антисыворотки против NDV.
Плазмиду pCD046+Texas NDV-F (SEQ ID NO: 30) использовали при трансфекции для получения рекомбинантного vHVT113. Секвенирование области вставки подтвердило, что vHVT113 содержит правильные последовательности промотора mCMV, гена F NDV Texas дикого типа и поли-A SV40. Последовательность также в точности соответствовала последовательности, описанной для донорской плазмиды pCD046+Texas NDV-F в SEQ ID NO: 30.
vHVT039
Из экстрагированной ДНК MDV1 штамма RB1B методом ПЦР амплифицировали промотор gB MDV (SEQ ID NO: 38) с помощью праймеров НМ101 (5'-CCG-GAA-TTC-CGA-TGT-TTA-GTC-ACG-ATA-GAC-3') (SEQ ID NO: 44) и НМ102 (5'-ATA-AGA-GCG-GCC-GCA-GTG-AGA-TGA-TCT-TAA-TGA-TG-3') (SEQ ID NO: 45). Первый содержит сайт EcoRI, а второй содержит сайт NotI для лигирования расщепленного EcoRI/NotI продукта ПЦР в 630 п.о. в расщепленную EcoRI/NotI плазмиду pCD046. Продукт лигирования использовали для трансформации компетентных клеток DH5α. Собирали колонии и проводили скрининг на присутствие вставленного ПЦР-фрагмента путем рестрикционного анализа с помощью EcoRI и NotI. Полученную плазмиду обозначили pHM102.
Выращивали велогенный штамм NDV Texas (генотип IV) на 11-дневных беспатогенных яйцах с эмбрионами и подвергали частичной очистке. Экстрагировали тотальную РНК и проводили ОТ-ПЦР с помощью двух праймеров: F-ATG (5'-TAT-AGC-GGC-CGC-AAG-ATG-GGC-TCC-AGA-TCT-TCT-ACC-AG-3') (SEQ ID NO: 46) и F-STOP (5'-CGA-GGC-GGC-CGC-TCA-TAT-TTT-TGT-AGT-GGC-TCT-C-3') (SEQ ID NO: 47). Они позволяют полностью амплифицировать ген NDV-F с добавлением сайтов NotI перед ATG и после стоп-кодона. ПЦР-фрагмент в 1,7 т.п.о. расщепляли NotI и дотировали в расщепленную NotI плазмиду pHM102. Полученную плазмиду обозначили pHM119 и использовали в качестве донорской плазмиды при рекомбинации in vitro путем совместной трансфекции клеток CEF с ДНК исходного HVT для получения vHVT039, как описано выше. Секвенирование области вставки подтвердило, что vHVT039 содержит правильные последовательности промотора gB MDV, немодифицированного гена NDV-F дикого типа из штамма Texas (SEQ ID NO: 32, кодирует SEQ ID NO: 33) и поли-А SV40, как видно из частичной последовательности донорской плазмиды pHM119 (SEQ ID NO: 31).
vHVT116
Плазмиду pHM103 (фирмы Merial), содержащую плечи межгенной области I из HVT FC126, промотор SV40 и поли-A SV40, расщепляли с помощью NotI, дефосфорилировали и экстрагировали из геля фрагмент в 5,6 т.п.о. Также расщепляли с помощью NotI фланкированный NotI фрагмент синтезированного химически, оптимизированного по ко донам гена NDV-F СА02 генотипа V (SEQ ID NO: 5, кодирует SEQ ID NO: 6) в 1,7 т.п.о. и экстрагировали из геля фрагмент в 1,7 т.п.о. Фрагменты в 5,6 и 1,7 т.п.о. лигировали, получая плазмиду pHM103+NDV-F CA02 (SEQ ID NO: 23 для vHVT116), которую использовали при трансфекции для получения рекомбинантного vHVT116. Секвенирование области вставки подтвердило, что vHVT116 содержит правильные последовательности промотора SV40, оптимизированного по кодонам гена NDV-F CA02 и поли-A SV40, как видно из последовательности донорской плазмиды pHM103+NDV-F CA02 (SEQ ID NO: 23).
Обсуждение
Вставляли различные кассеты под контролем промотора mCMV или не CMV в различные локусы генома HVT (таблица 4). Несмотря на неоднократные попытки, создание конструкции с комбинацией mCMV и оптимизированной по кодонам последовательности F не было успешным после пассажа 2. Однако когда последовательность дикого типа была под контролем mCMV, получалась стабильная конструкция vHVT110. Кроме того, рекомбинантный vHVT111 с последовательностью F дикого типа под контролем промотора SV40 также оказался стабильным на протяжении более 10 пассажей in vitro. Вне ожидания, оптимизированная по кодонам последовательность F под контролем промотора SV40 также оказалась стабильной на протяжении более 10 пассажей in vitro (например, vHVT114 и vHVT116). Эти результаты указывают на тонкий баланс между силой промотора и природой контролируемого им гена (оптимизированного по кодонам или нет) при получении генетически стабильной конструкции HVT.
Пример 3. Конструирование vHVT306, двойного вектора HVT, экспрессирующего NDV-F и VP2 IBDV
Конструировали донорскую плазмиду pHVT US2 SV-Fopt-synPA, содержащую промотор SV40, синтетический оптимизированный по кодонам ген F NDV VII, синтетический хвост поли-A, фланкированные последовательностями плечей SORF3 и US2 из HVT FC126.
Получение рекомбинантного вируса
По стандартной методике гомологической рекомбинации проводили совместную электропорацию вторичных клеток CEF с помощью донорской плазмиды pHVT US2 SV-Fopt-synPA и вирусной ДНК, выделенной из vHVT13 (вектор HVT, экспрессирующий ген VP2 IBDV, Merial Limited). В основном следовали методике, описанной в примере 1 для vHVT114, для получения, очистки методом бляшек и характеристики рекомбинантов по иммунофлоресценции.
После пяти циклов очистки бляшек был выделен чистый рекомбинантный вирус (vHVT306), чистоту которого проверяли и подтвердили по ИФА и ПЦР.
Анализ методом ПЦР
Экстрагировали вирусную ДНК из vHVT306 на стадии превакцинного вируса (pre-MSV) с помощью набора QIA DNeasy Blood & Tissue Kit (Qiagen, кат. №69506). Составляли праймеры для ПЦР для определения присутствия оптимизированного NDV-F, NDV-F дикого типа, промотора SV40, промотора mCMV, фланкирующих плечей US2 вируса HVT и вируса SB-1.
ПЦР-амплификация с различными праймерами подтвердила, что vHVT306 имеет ожидаемый профиль амплификации и ожидаемые ампликоны.
Анализ экспрессии
Проводили непрямой иммунофлуоресцентный анализ (ИФА) на vHVT114 из стадии превакцинного вируса (pre-MSV). Клетки CEF, которые были инокулированы vHVT306, фиксировали ледяным 95% ацетоном в течение 3 мин при комнатной температуре и высушивали на воздухе в течение 10 мин. После трех промывок PBS добавляли два первичных антитела: куриную антисыворотку против вируса болезни Ньюкасл (Charles River Laboratories, кат. №10100641, серия С0117А) в разведении 1:500 и моноклональное антитело L78 против HVT (Merial Select, Gainesville, GA) в разведении 1:3000 и инкубировали 45 мин при 37°C. После трех отмывок PBS добавляли два вторичных антитела: козье против IgG курицы с флуоресцеином (KPL, кат. №02-24-06, серия 110020) в разведении 1:500 и ослиное против IgG мыши с Alexa Fluor 568 (Molecular Probes, кат. № A10037, серия 989784) в разведении 1:300. Планшеты инкубировали при 37°C в течение 45 мин, а затем три раза отмывали PBS. Для идентификации ИФА-положительных бляшек клетки просматривали с помощью флуоресцентного микроскопа, используя фильтры для изотиоцианата флуоресцеина (FITC) и изотиоцианата тетраметилродамина (TRITC) у инвертированного микроскопа Nikon Eclipse Ti.
Точно так же изучали экспрессию белка VP2 IBDV (SEQ ID NO: 8, кодируемого SEQ ID NO: 7) у vHVT306 методом ИФА, используя в качестве первичных антител куриную антисыворотку против IBDV (Charles River Laboratories, кат. №10100610, серия G0117) (разведение 1:500) и моноклональное антитело 001С3 против NDV-F (асцитическая жидкость, партия 10/09/044, 02/11/2010) (разведение 1:300); а затем в качестве вторичных антител козье против IgG курицы с флуоресцеином (KPL, кат. №02-24-06, серия 110020) (разведение 1:500) и ослиное против IgG мыши с Alexa Fluor 568 (Molecular Probes, кат. № A10037, серия 989784) (разведение 1:300).
Результаты ИФА показали, что vHVT306 экспрессирует гены NDV-F в инфицированных вирусом клетках CEF.
Было подсчитано более 400 бляшек vHVT306 с помощью микроскопа с фильтрами для FITC и TRITC. В целом экспрессия гена NDV-F и VP2 IBDV соответствует бляшкам HVT (таблица 5).

Анализ методом Саузерн-блот
Экстрагировали тотальную геномную ДНК из клеток CEF, инфицированных vHVT306 из стадии pre-MSV. Проводили анализ методом Саузерн-блот по стандартной методике.
В целом использовали 3 зонда для проверки кассеты NDV-F (промотор SV40, оптимизированный по ко донам ген NDV-F, синтетический хвост поли-А) между SORF3 и US2 у vHVT306, а также сохранности кассеты VP2 IBDV (промотор mCMV, ген VP2 IBDV, хвост поли-A SV40).
Результаты Саузерн-блота показали, что профили расщепления были такими, как и ожидалось на основе картирования вектора NTI (Invitrogen, 1600 Faraday Ave., Carlsbad, CA). Кассета NDV-F (промотор SV40, оптимизированный по кодонам ген NDV-F, синтетический хвост поли-А) располагается между SORF3 и US2, а кассета VP2 IBDV (промотор mCMV, ген VP2 IBDV, хвост поли-A SV40) цела, как у исходного вируса (vHVT13).
Геномный анализ
Секвенировали геномную ДНК vHVT306 из стадии pre-MSV, чтобы проверить последовательность рекомбинационных участков, а также вставленной генной кассеты.
Составляли праймеры для амплификации всей вставленной генной кассеты, включая рекомбинационные плечи, в донорской плазмиде. Проводили анализ геномной ДНК vHVT306 методом ПЦР-амплификации с последующим определением нуклеотидной последовательности.
Подтвердили, что vHVT306 (донорская плазмида pHVT US2 SV-Fopt-synPA) содержит правильные рекомбинационные плечи, промотор SV40 и оптимизированный по кодонам ген NDV-F, как показано в SEQ ID NO: 20.
Анализ методом Вестерн-блот
Монослой CEF инфицировали vHVT306 pre-MSV при множественности заражения в ~0,1 MOI. После 4-дневной инкубации клетки CEF осаждали и промывали PBS, а затем подвергали лизису с помощью буфера IP Lysis/Wash buffer из набора Pierce Classic IP (Thermo Scientific, кат. №26146) в соответствии с методикой производителя. Лизат предварительно очищали и инкубировали с 100 мкл моноклонального антитела 001C3 против NDV-F для получения иммунного комплекса. Иммунный комплекс захватывали на агарозу с белком A/G (Protein A/G Plus Agarose) и, после удаления несвязавшегося иммунного комплекса путем нескольких отмывок, использовали 50 мкл буфера для образца для элюирования в невосстанавливающих условиях. В качестве контроля включали неинфицированные клетки CEF. По 20 мкл элюированных образцов разделяли электрофорезом в 10% гелях с Bis-Tris. После электрофореза разделенные белки переносили на мембрану из PVDF. Для выявления антигенов NDV на мембране PVDF использовали набор Protein Detection ТМВ Western Blot Kit (KPL, кат. №54-11-50) с куриной антисывороткой против NDV (Charles River Laboratories, кат. №10100641, серия C0117A) и конъюгатом козьего антитела против IgG курицы с пероксидазой (KPL, кат. №14-24-06), следуя методике производителя.
Экспрессию белка NDV-F из vHVT306 проверяли методом иммунодетекции в две стадии. Сначала белки NDV-F, экспрессированные в инфицированных VHVT306 клетках CEF, захватывали методом иммунопреципитации с помощью моноклонального антитела 001C3 против NDV-F. Затем для выявления белка NDV-F в захваченных образцах (комплекса белок NDV-F-моноклональное антитело) применяли метод Вестерн-блот с использованием поликлональной антисьгворотки против NDV (Charles River Laboratories, кат. №10100641, серия C0117A) (фиг. 8). В лизатах с vHVT306 pre-MSV с помощью антисыворотки к NDV выявлялся белок в 55 кДа, который соответствовал ожидаемому размеру белка слияния F1 NDV (фиг. 8).
Пример 4. Конструирование двойных HVT-векторов vHVT301, vHVT302, vHVT303, vHVT304 и vHVT307, экспрессирующих NDV-F и VP2 IBDV, и двойного HVT-вектора vHVT202, экспрессирующего варианты VP2 IBDV
Пример 4.1. Конструирование vHVT301, vHVT302, vHVT303, vHVT304 и vHVT307
Получение и характеристика двойных HVT-рекомбинантов vHVT301, vHVT302, vHVT303, vHVT304 и vHVT307 в основном проводились таким же образом, как и для vHVT306, описанного в примере 3. В таблице 6.1 представлены уникальные характеристики, присущие каждой из конструкций вокруг экспрессионных кассет, в том числе соответствующие последовательности.

vHVT301
Плазмиду pHVT IG2 SbfI (фирмы Merial), содержащую последовательности плечей межгенной области 2 из vHVT13, расщепляли с помощью SmaI, дефосфорилировали и экстрагировали из геля фрагмент в 4,3 т.п.о. Донорскую плазмиду pHM103+NDV-F wt, содержащую промотор SV40, NDV-F генотипа VIId дикого типа, хвост поли-A SV40, расщепляли с помощью EcoRI и SalI, обрабатывали ферментом Klenow и экстрагировали из геля фрагмент в 2,3 т.п.о. Два фрагмента лигировали, получая донорскую плазмиду pHVT IG2 SV Fwt SbfI (SEQ ID NO: 24), которую использовали при трансфекции для получения рекомбинантного vHVT301.
vHVT302
Синтезированную химически плазмиду pHVT US10 cds, содержащую последовательности плечей US10 из vHVT13, расщепляли с помощью NotI, дефосфорилировали и экстрагировали из геля фрагмент в 4,7 т.п.о. Отщепляли с помощью NotI фланкированный NotI фрагмент в 1,7 т.п.о. из синтезированного химически оптимизированного по кодонам NDV-F генотипа VIId и экстрагировали его из геля. Два фрагмента лигировали, получая донорскую плазмиду pHVT US10 cds F opt, которую использовали при трансфекции для получения рекомбинантного vHVT302. Транскрипция вставленного гена F должна управляться нативным промотором US10 и останавливаться нативным сигналом поли-A US10. Для экспрессии этой вставки не добавляли никакого экзогенного промотора или поли-A. Секвенирование области вставки подтвердило, что vHVT302 содержит правильную последовательность оптимизированного по ко донам гена NDV-F VIId, как это видно из последовательности донорской плазмиды pHVT US10 cds F opt (SEQ ID NO: 25).
vHVT303
Синтезированную химически плазмиду pHVT US10 cds, содержащую последовательности плечей US10 из vHVT13, расщепляли с помощью NotI, дефосфорилировали и экстрагировали из геля фрагмент в 4,7 т.п.о. Отщепляли с помощью NotI фланкированный NotI фрагмент в 1,7 т.п.о. из синтезированного химически оптимизированного по кодонам NDV-F генотипа V и экстрагировали его из геля. Два фрагмента лигировали, получая донорскую плазмиду pHVT US10 cds F CA02 opt, которую использовали при трансфекции для получения рекомбинантного vHVT303. Как и у vHVT302, транскрипция вставленного гена F также должна управляться нативным промотором US10 и останавливаться нативным сигналом поли-A US10. Для экспрессии этой вставки не добавляли никакого экзогенного промотора или поли-A. Секвенирование области вставки подтвердило, что VHVT303 содержит правильную последовательность оптимизированного по кодонам гена NDV-F генотипа V, как это видно из последовательности донорской плазмиды pHVT US10 cds F CA02 (SEQ ID NO: 26).
vHVT304
Донорскую плазмиду pHVT IG2 SbfI, содержащую последовательности плечей межгенной области 2 из vHVT13, расщепляли с помощью SbfI, дефосфорилировали и экстрагировали из геля фрагмент в 4,3 т.п.о. Синтезированную химически плазмиду, содержащую промотор SV40 + оптимизированный по кодонам NDV-F генотипа VIId+синтетический хвост поли-A, фланкированный SbfI, расщепляли с помощью SbfI и экстрагировали из геля фрагмент в 2,3 т.п.о. Два фрагмента лигировали, получая донорскую плазмиду pHVT IG2 SV Fopt syn tail, которую использовали при трансфекции для получения рекомбинантного vHVT304. Секвенирование области вставки подтвердило, что vHVT304 содержит правильные последовательности промотора SV40, оптимизированного по кодонам гена NDV-F VIId и синтетического хвоста поли-A, как это видно из последовательности донорской плазмиды pHVT IG2 SV Fopt syn tail (SEQ ID NO: 27).
vHVT307
Донорскую плазмиду pHVT US2-SORF3, содержащую последовательности плечей US2 и SORF3 из vHVT13, расщепляли с помощью SbfI, дефосфорилировали и экстрагировали из геля фрагмент в 5,1 т.п.о. Плазмиду SB-I UL55 SV CaF syn tail SbfI, содержащую промотор SV40 + оптимизированный по кодонам NDV-F генотипа V + синтетический хвост поли-A, фланкированный SbfI, расщепляли с помощью SbfI и экстрагировали из геля фрагмент в 2,3 т.п.о. Два фрагмента лигировали, получая донорскую плазмиду pHVT US2 SV-FCA02 opt-synPA, которую использовали при трансфекции для получения рекомбинантного vHVT307. Секвенирование области вставки подтвердило, что vHVT307 содержит правильные последовательности промотора SV40, оптимизированного по кодонам гена NDV-F генотипа V и синтетического хвоста поли-А, как это видно из последовательности донорской плазмиды pHVT US2 SV-FCA02 opt-synPA (SEQ ID NO: 28).
Обсуждение
Одной из главных целей этой работы была разработка мультивалентного вектора на основе птичьего герпесвируса путем включения нескольких представляющих интерес защитных генов в остов птичьего герпесвируса (например, HVT). Предпосылкой такого подхода является определение экспрессионных кассет, содержащих соответствующие комбинации промотор-ген-поли-A, и оценка их генетической стабильности и способности защищать от определенного заболевания.
С целью создания эффективной трехвалентной векторной вакцины MD-IBD-ND клонировали оптимизированные по кодонам или не оптимизированные последовательности гена F вируса болезни Ньюкасл (NDV) в остов vHVT13 (HVT-IBD, лицензированная вакцина для одновременной защиты кур от MD и IBD) под контролем промотора CMV человека (в vHVT13 используется CMV мыши). Все конструкции vHVT-IBD-F под контролем промотора CMV человека теряли экспрессию F-белка через шесть пассажей независимо от того, была ли последовательность NDV-F оптимизированной по кодонам и независимо от места вставки. Потеря экспрессии F-белка была быстрой (за два пассажа) при комбинировании hCMV с оптимизированным по кодонам F-белком по сравнению с комбинацией hCMV с последовательностью F дикого типа (потеря экспрессии F-белка за 6 пассажей). В целом эти данные показывают, что промотор CMV человека не является идеальным для получения стабильных рекомбинантов HVT, эспрессирующих белок NDV-F. Вне ожидания, этот пример показывает, что промотор SV40 и эндогенный промотор HVT (промотор US10) образуют стабильные рекомбинанты HVT, экспрессирующие белок NDV-F.
Пример 4.2. Конструирование vHVT202
Конструирование донорской плазмиды HVT SORF3-US2 gpVar-Ewtsyn
Фрагмент, охватывающий синтетический вариант Е гена VP2 IBDV дикого типа (SEQ ID NO: 41, кодирует SEQ ID NO: 42), вырезали из плазмиды pUC57 Varient Е wt (синтезирована на фирме GeneScript) с помощью NotI и вставляли в тот же самый сайт SORF3 и US2 плазмиды, содержащей промотор gp CMV и синтетический хвост поли-A. Лигированный материал трансформировали с помощью набора Тор10 Oneshot (кат. № C404002, Invitrogen). Выращивали бактериальные колонии в бульоне LBamp, экстрагировали плазмиды с помощью набора Qiagen MiniSpin Prep kit и проводили скрининг на ориентацию вставки по расщеплению SacI+HindIII. Правильную донорскую плазмиду обозначили pHVT SORF3-US2 gpVar-EwtSyn. В таблице 6.2 приведены характеристики, присущие конструкции вокруг экспрессионной кассеты, включая соответствующие последовательности. Выращивали крупномасштабные культуры и проводили экстракцию плазмид с помощью набора Qiagen Maxi Prep. Временную экспрессию плазмид из Maxi Prep проверяли на клетках эмбриональных фибробластов курицы (CEFs) с помощью куриной поликлональной антисыворотки против IBDV.

Получение рекомбинанта
По стандартной методике гомологической рекомбинации проводили совместную электропорацию вторичных клеток CEF с помощью донорской плазмиды pHVT SORF3-US2 gpVar-EwtSyn и вирусной ДНК, выделенной из vHVT306 и расщепленной SbfI. Для упрощения процесса отбора в качестве исходного выбрали vHVT306, экспрессирующий классический VP2 IBDV и NDV-F, как описано ниже. Для замены гена F разработали донорскую плазмиду варианта Е VP2, а рекомбинанты отбирали сначала по отсутствию экспрессии гена F, а затем методом ПЦР на наличие варианта E VP2. Совместную электропорацию проводили при 1×107 клеток 2° CEF в 300 мкл Opti-MEM, которые подвергали электрошоку в 150 вольт при емкости 950 в кювете для электропорации на 2 мм. Трансфецированные клетки высеивали в 96-луночный планшет и инкубировали в течение 5-7 дней. Клетки, выращенные в 96-луночном планшете, затем дублировали в двух 96-луночных планшетах и инкубировали еще в течение 5 дней. Один набор 96-луночных планшетов использовали для ИФА с поликлональной куриной сывороткой против NDV-F, чтобы идентифицировать положительные лунки, содержащие исходный vHVT306, а другой - для выделения инфицированных клеток из отрицательных по ИФА лунок.
Очистку рекомбинантного вируса проводили сначала путем дублирования 96-луночного планшета и отбора методом ИФА лунок, содержащих большинство отрицательных по ИФА бляшек (против NDV-F) с наименьшим числом положительных по ИФА бляшек. Затем собирали лунки, удовлетворяющие этим критериям, и доводили до 1 мл в DMEM+2% FBS. Из исходного 1 мл отбирали 5-20 мкл (в зависимости от числа видимых бляшек) и смешивали с 1×107 клеток CEF в 10 мл DMEM+2% FBS и раскапывали на новый 96-луночный планшет так, чтобы иметь по одной бляшке HVT на лунку. После 4 дней инкубации 96-луночные планшеты дублировали и лунки, содержащие бляшки, тестировали на наличие рекомбинантного HVT и отсутствие исходного вируса по ИФА и ПЦР. Опять собирали лунки, содержащие больше рекомбинантного вируса и меньше исходного вируса при сравнении полученных при ПЦР полос, доводили до 1 мл и раскапывали в новые 96-луночные планшеты (такие же, как и прежде). После пяти циклов очистки инфицированных вирусом клеток был выделен рекомбинантный HVT, несущий два белка VP2 IBDV, а чистоту рекомбинантного вируса проверяли методом ПЦР, чтобы подтвердить отсутствие исходного вируса.
Секвенирование области вставки подтвердило, что vHVT202 содержит правильные последовательности промотора CMV морской свинки, варианта E гена VP2 IBDV дикого типа и синтетического хвоста поли-A, как это видно из последовательности донорской плазмиды pHVT SORF3-US2 gpVar-EwtSyn (SEQ ID NO: 39).
Анализ рекомбинанта методом ПЦР
Экстрагировали ДНК из препарата вируса смесью фенол/хлороформ, осаждали этанолом и ресуспендировали в 20 мМ HEPES. Разрабатывали праймеры для ПЦР специально для идентификации варианта Е гена дикого типа, промотора, поли-A, а также чистоты рекомбинантного вируса от исходного вируса HVT. Проводили ПЦР при 200 нг ДНК матрицы вместе с указанными парами праймеров, приведенными в таблице 1. Циклы ПЦР при следующих условиях (если не указано иначе): 2 мин при 94°C; 30 циклов по 30 сек при 94°C, 30 сек при 55°C, 3 мин при 68°C; и еще 5 мин при 68°C.
Чистоту рекомбинантного вируса проверяли методом ПЦР с помощью пар праймеров, специфичных к фланкирующим плечам HVT, промотору gpCMV, гену варианта E и синтетическому хвосту. При анализе также включали праймеры, специфичные к SB1, MDV серотипа 2 (SB1US1.FP+SB1 Sorf4.RP). Результаты ПЦР показали, что рекомбинантный вирус vHVT202 несет искомую экспрессионную кассету, а препарат вируса свободен от заметного количества исходного вируса HVT.
Иммунофлуоресцентное окрашивание рекомбинантного вируса vHVT202, экспрессирующего два белка VP2 IBDV
Для иммунофлуоресцентного анализа материал P3 разводили средой 1:100. Примерно 50 мкл разведенного вируса добавляли к 10 мл DMEM+2% FBS с 1×107 клеток CEF, а затем раскапывали в 96-луночный планшет (по 100 мкл на лунку). Планшеты инкубировали 4 дня при 37°C + 5% CO2 до тех пор, пока не появятся вирусные бляшки. Планшеты фиксировали 95% ледяным ацетоном в течение 3 минут и промывали три раза PBS. Одну лунку использовали для куриной антисыворотки против вируса болезни Ньюкасл (серия C0139, Charles River Laboratories), которую добавляли в разведении 1:1000. Другую лунку использовали для куриной антисыворотки против IBDV (серия G0117) и инкубировали планшеты при 37°C в течение 1 ч. После инкубации планшеты трижды отмывали PBS и добавляли антитело против курицы с FITC (кат. № F8888, Sigma) в разведении 1:500. Планшеты снова инкубировали при 37°C в течение 1 ч. После инкубации клетки трижды промывали PBS и визуализировали их с помощью флуоресцентного микроскопа, используя фильтр для изотиоцианата флуоресцеина (FITC).
Результаты иммунофлуоресцентного окрашивания указывают на то, что vHVT202 проявляет очень сильную экспрессию белка VP2 при использовании поликлональных антисывороток и против классического, и против варианта E белка VP2.
Заключение
Исходя из ПЦР и иммунофлуоресцентного анализа, vHVT202 представляет собой рекомбинантный HVT, в который был успешно вставлен вариант Е гена VP2 IBDV под контролем промотора gpCMV на фоне такого рекомбинантного HVT, который уже экспрессирует классический ген VP2 IBDV. Следовательно, VHVT202 несет гены и варианта Е VP2, и классического VP2 IBDV и свободен от заметного количества исходного вируса vHVT306.
Пример 5. Конструирование рекомбинантных vSB1-009, vSB1-004, vSB1-006, vSB1-007, vSB1-008 и vSB1-010, экспрессирующих NDV-F
Пример 5.1. Конструирование vSB1-009, vSB1-004, vSB1-006, vSB1-007 и vSB1-008
Целью данного исследования является конструирование рекомбинантного вектора vSB1-009 из вируса SB-1, в который вставлена экспрессионная кассета, содержащая промотор SV40 и слитый белок вируса болезни Ньюкасл (NDV-F) взамен кодирующей последовательности UL44 (gC) SB-1.
Была сконструирована донорская плазмида pSB1 44 cds SV FCAopt, содержащая фланкирующие плечи UL44 вируса SB1, промотор SV40 и последовательность оптимизированного по кодонам reHaNDV-F (SEQ ID NO: 5, кодирует SEQ ID NO: 6).
Получение рекомбинантного вируса
По стандартной методике гомологической рекомбинации проводили совместную электропорацию вторичных клеток CEF с помощью донорской плазмиды pSB1 44 cds SV FCAopt и вирусной ДНК, выделенной из инфицированных вирусом SB-1 клеток CEF. В основном следовали методике, описанной в примере 1 для vHVT114, для получения, очистки методом бляшек и характеристики рекомбинантов по иммунофлоресценции.
После пяти циклов очистки бляшек был выделен чистый рекомбинантный вирус (vSB1-009), чистоту которого проверяли по ИФА и ПЦР для подтверждения правильности вставки, а также отсутствия остатков исходного вируса.
Анализ методом ПЦР
Экстрагировали вирусную ДНК из vSB1-009 на стадии превакцинного вируса (pre-MSV) с помощью набора QIA DNeasy Blood & Tissue Kit (Qiagen, кат. №69506). Разрабатывали праймеры для ПЦР для определения присутствия оптимизированного NDV-F, NDV-F дикого типа, промотора SV40, промотора mCMV, фланкирующих плечей UL44 вируса SB-1 и вируса HVT. ПЦР-амплификация проводилась с использованием примерно 200 нг ДНК матрицы вместе с парами праймеров.
ПЦР-амплификация с различными праймерами подтвердила, что vSB1-009 имеет ожидаемый профиль амплификации и ожидаемые ампликоны.
Анализ экспрессии
Проводили непрямой иммунофлуоресцентный анализ (ИФА) на vSB1-009 из стадии pre-MSV для проверки экспрессии гена NDV-F и антигена вируса SB-1. Клетки CEF, которые были инокулированы vSB1-009, фиксировали ледяным 95% ацетоном в течение 3 мин при комнатной температуре и высушивали на воздухе в течение 10 мин. Планшеты промывали PBS, а затем добавляли два первичных антитела: куриную антисыворотку против вируса болезни Ньюкасл (Charles River Laboratories, кат. №10100641, серия C0117A) в разведении 1:500 и моноклональное антитело Y5.9 против вируса SB-1 (Merial Select, Gainesville, GA) в разведении 1:3000 и инкубировали 45 мин при 37°C. После трех отмывок PBS добавляли два вторичных антитела: козье против IgG курицы с флуоресцеином (KPL, кат. №02-24-06, серия 110020) в разведении 1:500 и ослиное против IgG мыши с Alexa Fluor 568 (Molecular Probes, кат. № A10037, серия 989784) в разведении 1:250. Планшеты инкубировали при 37°C в течение 45 мин, а затем трижды отмывали PBS. Лунки подвергали скринингу на ИФА-положительные бляшки с помощью флуоресцентного микроскопа, используя фильтры для изотиоцианата флуоресцеина (FITC) и изотиоцианата тетраметилродамина (TRITC) у инвертированного микроскопа Nikon Eclipse Ti. Таким же образом проверяли реактивность vSB1-009 с mAb к NDV-F методом двойного ИФА, используя в качестве первичных антител куриную антисыворотку против MDV (Charles River Laboratories, кат. №10100628, серия D0111) (разведение 1:300) и моноклональное антитело против NDV-F (разведение 1:300). В качестве вторичных антител использовали козье антитело против IgG курицы с флуоресцеином (KPL, кат. №02-24-06, серия 110020) (разведение 1:500) и ослиное против IgG мыши с Alexa Fluor 568 (Molecular Probes, кат. № A10037, серия 989784) (разведение 1:250). Для идентификации ИФА-положительных бляшек лунки просматривали с помощью флуоресцентного микроскопа, используя фильтры для FITC и TRITC у инвертированного микроскопа Nikon Eclipse Ti.
Результаты ИФА показали, что vSB1-009 экспрессирует белок NDV-F в инфицированных вирусом клетках CEF. Было подсчитано более 500 бляшек vSB1-009 на экспрессию белка NDV-F, а также на экспрессию специфичного для вируса SB-1 белка методом двойного ИФА. Экспрессия белка NDV-F полностью соответствовала экспрессии антигена вируса SB-1 в каждой вирусной бляшке (таблица 7).

Методом двойного ИФА была подтверждена реактивность с mAb к NDV-F. Было проверено свыше 200 бляшек vSB1-009 на реакцию с mAb к NDV-F, а также на реакцию с антисывороткой против MDV. Реакция с mAb к NDV-F полностью соответствовала реакции с антисывороткой против MDV в каждой вирусной бляшке (таблица 8).

Анализ методом Саузерн-блот
Экстрагировали тотальную геномную ДНК из клеток CEF, инфицированных vSB1-009 из стадии pre-MSV. Геномную ДНК vSB1-009, вируса SB-1 (отрицательный контроль), донорской плазмиды pSB1 44 cds SV FCA opt расщепляли по отдельности при 37°C рестрикционными эндонуклеазами EcoRI, NcoI и KpnI. Рестрикционные фрагменты разделяли электрофорезом в 0,8% агарозном геле и переносили на положительно заряженную нейлоновую мембрану. После переноса мембрану обрабатывали 0,4 М NaOH, а затем нейтрализировали буфером 2×SSC-HCl. После этого мембрану сушили на воздухе и подвергали перекрестному сшиванию с помощью УФ.
Следуя инструкциям производителей набора North2South Chemiluminescent Hybridization and Detection Kit (Thermo Scientific, кат.№89880), мембрану предгибридизовали в течение 1 ч, а затем гибридизовали с зондом в течение ночи при 55°C. Для гибридизации использовали два зонда: 1) SbfI-фрагмент pSB1 44 cds SV FCA opt в качестве зонда для кассеты NDV-F, 2) SmaI-EcoRI-фрагмент плеча pUC57 SB1 44 (GenScript) в качестве зонда для рекомбинантного плеча. После гибридизации несколько раз проводили отмывку при жестких условиях, после чего мембрану помещали в блокирующий буфер с добавлением стрептавидин-HRP. После отмывки мембраны от несвязавшегося стрептавидин-HRP добавляли раствор субстрата Luminal и пероксида. Затем мембрану накладывали на рентгеновскую пленку и экспонировали, после чего проявляли пленку.
Результаты Саузерн-блота соответствовали ожиданиям на основании анализа карты вектора NTI. Кассета NDV-F (промотор SV40, оптимизированный по кодонам ген NDV-F CA02) замещала последовательности, кодирующие UL44 вируса SB-1.
Геномный анализ
Проводили анализ геномной ДНК vSB1-009 из стадии pre-MSV путем определения нуклеотидной последовательности рекомбинационных плеч, а также вставленной генной кассеты. Разрабатывали праймеры, которые использовали для амплификации всей кассеты гена NDV-F, включая рекомбинационные плечи.
Подтвердили, что последовательность vSB1-009 (донорская плазмида pSB1 44 cds SV FCAopt) содержит правильные рекомбинационные плечи, промотор SV40 и оптимизированный по кодонам ген NDV-F, как показано в SEQ ID NO: 19.
Анализ методом Вестерн-блот
Монослой CEF инфицировали vSB1-009 pre-MSV при множественности заражения в ~01 MOI. После 5-дневной инкубации клетки CEF осаждали и промывали PBS, а затем подвергали лизису с помощью буфера IP Lysis/Wash buffer из набора Pierce Classic IP (Thermo Scientific, кат. №26146) в соответствии с методикой производителя. Лизат предварительно очищали и инкубировали со 100 мкл моноклонального антитела против NDV-F для получения иммунного комплекса. Иммунный комплекс захватывали на агарозу с белком A/G (Protein A/G Plus Agarose) и, после удаления несвязавшегося иммунного комплекса путем нескольких отмывок, использовали 50 мкл буфера для образца для элюирования в невосстанавливающих условиях. В качестве контроля включали неинфицированные клетки CEF. По 20 мкл элюированных образцов разделяли электрофорезом в 10% гелях с Bis-Tris. После электрофореза разделенные белки переносили на мембрану из PVDF. Для выявления антигенов NDV на мембране PVDF использовали набор Protein Detection ТМВ Western Blot Kit (KPL, кат. №54-11-50) с куриной антисывороткой против NDV (Charles River Laboratories, кат. №10100641, серия C0117A) и конъюгатом козьего антитела против IgG курицы с пероксидазой (KPL, кат. №14-24-06), следуя методике производителя.
Экспрессию белка NDV-F из vSB1-009 проверяли методом иммунодетекции в две стадии. Сначала белки NDV-F, экспрессированные в инфицированных vSB1-009 клетках CEF, захватывали методом иммунопреципитации с помощью моноклонального антитела 001С3 против NDV-F. Затем для выявления белка NDV-F в захваченных образцах (комплекса белок NDV-F-моноклональное антитело) применяли метод Вестерн-блот с использованием поликлональной антисыворотки против NDV (Charles River Laboratories, кат. №10100641, серия C0117A) (фиг. 9). В лизатах с vSB1-009 pre-MSV с помощью антисыворотки к NDV выявлялся белок в 55 кДа, который соответствовал ожидаемому размеру белка слияния F1 NDV (фиг. 9).
Получение и характеристика HVT-рекомбинанов vSB1-004, vSB1-006, vSB1-007 и vSB1-008 в основном проводились таким же образом, как и для vSB1-009, описанного в этом примере. В таблице 9.1 представлены уникальные характеристики, присущие каждой из конструкций вокруг экспрессионной кассеты, включая соответствующие последовательности. Получение и характеристика рекомбинантных векторов из вируса SB1 также описаны в патентной заявке США за номером USSN 13/689,572, поданной 29.11.2012 (Merial Limited), которая включена сюда путем ссылки во всей полноте.
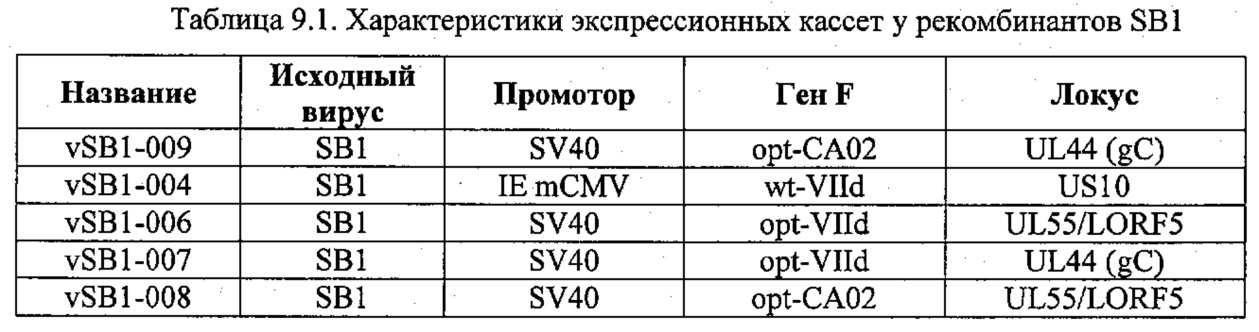
Пример 5.2. Конструирование двойной конструкции vSB1-010
Конструирование донорской плазмиды SB1US2 gpVIIdwtsyn
Используя плазмиду HVT SOrf3-US2 gpVar-Ewt Syn, извлекали gpCMV, вариант E и хвост Syn путем расщепления SbfI. Этот фрагмент лигировали в донорскую плазмиду SB1 US2. Ген варианта Е вырезали с помощью NotI и заменяли на NDV-F VIId дикого типа. Синтетический ген NDV-F VIId дикого типа (SEQ ID NO: 3, кодирует SEQ ID NO: 4) вырезали из плазмиды pUC57 NDV-F VIId wt (синтезирована на фирме GeneScript) путем расщепления с NotI. Лигированный материал трансформировали с помощью набора Тор 10 Oneshot (кат. № C404002, Invitrogen). Выращивали бактериальные колонии в бульоне LBamp, экстрагировали плазмиды с помощью набора Qiagen MiniSpin Prep и проводили скрининг на ориентацию вставки по расщеплению NcoI+SalI. Правильную донорскую плазмиду обозначили pSB1 US2 gpVIIdwt Syn. В таблице 9.2 приведены характеристики, присущие конструкции вокруг экспрессионной кассеты, включая соответствующие последовательности. Выращивали крупномасштабные культуры и проводили экстракцию плазмид с помощью набора Qiagen Maxi Prep. Временную экспрессию плазмид из Maxi Prep проверяли на клетках эмбриональных фибробластов курицы (CEFs) с помощью куриной поликлональной антисыворотки против NDV-F.
Получение рекомбинанта
По стандартной методике гомологической рекомбинации проводили совместную электропорацию вторичных клеток CEF с помощью донорской плазмиды pSB1 US2 gpVIIdWt Syn и вирусной ДНК, выделенной из vSB1-009 (этот рекомбинантный вектор экспрессирует ген F из NDV CA02). В основном следовали методике, описанной в примере 1 для vHVT114, для получения, очистки бляшек и характеристики рекомбинантов путем иммунофлоресценции.
После пяти циклов очистки бляшек был выделен чистый рекомбинантный вирус (vSB1-010), чистоту которого проверяли по ИФА и ПЦР для подтверждения правильности вставки, а также отсутствия остатков исходного вируса.

Секвенирование области вставки подтвердило, что vSB1-010 содержит правильные последовательности промотора CMV морской свинки и гена NDV-F VIId дикого типа, как это видно из последовательности донорской плазмиды SB1US2 gpVIIdwtsyn (SEQ ID NO: 40).
Анализ рекомбинанта методом ПЦР
Экстрагировали ДНК из препарата вируса смесью фенол/хлороформ, осаждали этанолом и ресуспендировали в 20 мМ HEPES. Составляли праймеры для ПЦР специально для идентификации гена NDV-F VIId дикого типа, промотора, поли-A, а также чистоты рекомбинантного вируса от исходного вируса SB1. Проводили ПЦР при 200 нг ДНК матрицы вместе с указанными парами праймеров, приведенными в таблице 1. Циклы ПЦР при следующих условиях (если не указано иначе): 2 мин при 94°C; 30 циклов по 30 сек при 94°C, 30 сек при 55°C, 3 мин при 68°C; и еще 5 мин при 68°C.
Чистоту рекомбинантного вируса проверяли методом ПЦР с помощью пар праймеров, специфичных к фланкирующим плечам SB1, промотору gpCMV, гену NDV-F VIId дикого типа и синтетическому хвосту. При анализе также включали праймеры, специфичные к HVT, MDV серотипа 3 (MB080+MB081). Результаты ПЦР показали, что рекомбинантный вирус vSB1-010 несет искомую экспрессионную кассету, а препарат вируса свободен от заметного количества исходного вируса SB1-009.
Иммунофлуоресцентное окрашивание рекомбинантного вируса vSB1-010, экспрессирующего два белка NDV-F
Для иммунофлуоресцентного анализа материал Р3 разводили средой 1:100. Примерно 50 мкл разведенного вируса добавляли к 10 мл DMEM+2% FBS с 1×107 клеток CEF, а затем раскапывали в 96-луночный планшет (по 100 мкл на лунку). Планшеты инкубировали 5 дней при 37°C + 5% CO2 до тех пор, пока не появятся вирусные бляшки. Планшеты фиксировали 95% ледяным ацетоном в течение 3 минут и промывали три раза PBS. Добавляли куриную антисыворотку против вируса болезни Ньюкасл (серия C0139, Charles River Laboratories) в разведении 1:1000 и инкубировали планшеты при 37°C в течение 1 ч. После инкубации планшеты трижды отмывали PBS и добавляли антитело против курицы с FITC (кат. №F8888, Sigma) в разведении 1:500. Планшеты снова инкубировали при 37°C в течение 1 ч. После инкубации клетки трижды промывали PBS и визуализировали их с помощью флуоресцентного микроскопа, используя фильтр для изотиоцианата флуоресцеина (FITC).
Результаты иммунофлуоресцентного окрашивания указывают на то, что vSB1-010 проявляет очень сильную экспрессию белка NDV-F при использовании поликлональных антисывороток и против белка NDV-F CA02, и против белка NDV-F VIId.
Заключение
Исходя из ПЦР и иммунофлуоресцентного анализа, vSB1-010 представляет собой рекомбинантный SB-1, у которого в vSB1-009, который уже экспрессирует ген NDV-F CA02, был успешно вставлен ген NDV-F VIId под контролем промотора gpCMV. Следовательно, vSBT-010 несет гены NDV-F и генотипа VIId, и СА02, и свободен от заметного количества исходного vSB1-009.
Пример 6. Эффективность vHVT110, vHVT111, vHVT114 и vSB1-004, экспрессирующих ген NDV-F, против заражения штаммами NDV Chimalhuacan и Malaysia (MAL04-01) у 14-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности трех рекомбинантных конструкций из HVT (vHVT110, vHVT111 и vHVT114) и одной рекомбинантной конструкции из SB1 (vSB1-004), экспрессирующих ген F NDV, против заражения вирусом болезни Ньюкасл (штаммы Chimalhuacan и Malaysia), которое проводилось на 14-дневных беспатогенных цыплятах.
Характеристики этих 5 вакцин-кандидатов представлены ниже в таблице 10.

В день D0 100 однодневных беспатогенных цыплят случайным образом разбивали на 10 групп по 10 птиц. Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 2000 кое, как описано ниже в таблице 11. Следует отметить, что титр vSB1-004 (31600 кое) при введении птицам из групп 6 был намного выше намеченного. В день D14 птиц внутримышечно заражали велогенным штаммом NDV Malaysia (генотип VIId) (подгруппы "a") либо вирулентным штаммом NDV Chimalhuacan (генотип V) (подгруппы "b").


Каждую группу наблюдали до и после заражения. Ежедневно оценивали клинические признаки после заражения следующим образом: здоровые / со специфическими симптомами (взъерошенные перья, прострация, кривошея, тремор) / мертвые. В день D14 в каждой группе брали образцы сыворотки на серологическое исследование (тест на ингибирование гемагглютинации (HI) вирусом болезни Ньюкасл (NDV).
Как и ожидалось, непривитые животные (G1a и G1b) не проявляли антител к NDV в день D14. В каждой из вакцинированных групп (подгруппы "a" и "b" от G2 до G5) отмечалась сероконверсия с низким титром (средний титр HI<0,6 log10), подтверждая получение вакцины. Количество положительных птиц от общего числа протестированных зависело от группы и было наибольшим (90%) у птиц, вакцинированных vHVT114 (см. приведенную выше таблицу).
Степень защиты от смертности и заболеваемости представлена в приведенной выше таблице. В контрольных группах G1a и G1b наблюдалась полная восприимчивость, что подтверждает большую тяжесть заболевания при обоих заражениях. Самые низкие уровни защиты наблюдались в группах, вакцинированных vHVT111 или vSB1-004. Самая высокая степень защиты от заболеваемости и смертности отмечалась в группах, вакцинированных vHVT110 или vHVT114, независимо от того, какой штамм использовался для заражения (гомологичный штамм, т.е. Malaysia генотипа VIId, или гетерологичный штамм, т.е. Chimalhuacan генотипа V). Наблюдалась корреляция между % птиц, положительных по тесту HI до заражения, и степенью защиты в %.
Отличия по степени защиты между vHVT110 и vHVT111 наглядно показывают важное значение промотора, причем промотор IE mCMV оказался более сильным, чем промотор SV40 для транскрипции гена F дикого типа (wt) генотипа VIId. Отличия по степени защиты между vHVT111 и vHVT114 иллюстрируют важное значение нуклеотидной последовательности гена F, причем оптимизированная последовательность оказалась более сильной, чем последовательность дикого типа (или природная).
В заключение, результаты данного исследования показали важное значение промотора и нуклеотидной последовательности гена F при защите от ND, которую индуцировали векторы-вакцины из вируса болезни Марека. Для наилучших показателей эффективности необходимо оптимальное сочетание этих факторов, как у vHVT114.
Пример 7. Эффективность vHVT114, vHVT116, vHVT301, vHVT302 и vHVT303, экспрессирующих ген NDV-F, против заражения штаммом NDV Texas GB у 14-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности 2 одинарных рекомбинантных конструкций из HVT (vHVT114 и vHVT116), экспрессирующих ген F NDV, и 3 двойных рекомбинантных конструкций из HVT (vHVT-301, vHVT302 и vHVT303), экспрессирующих и ген F NDV, и ген VP2 IBDV, против заражения вирусом болезни Ньюкасл (штамм Texas GB, генотип II), которое проводилось на 14-дневных беспатогенных цыплятах.
Характеристики этих 4 вакцин-кандидатов представлены ниже в таблице 12.

В день D0120 однодневных беспатогенных цыплят случайным образом разбивали на 6 групп по 20 птиц. Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 1000 кое, как описано ниже в таблице 13. В день D14 птиц внутримышечно заражали велогенным штаммом NDV Texas GB (генотип II) в дозе 4,5 log10 EID50.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки и смертность после заражения NDV.
Степень клинической защиты представлена в приведенной выше таблице. В невакцинированной зараженной контрольной группе G1 наблюдалась полная восприимчивость, что подтверждает большую тяжесть заболевания при заражении. Частичная защита наблюдалась у 5 вакцин-кандидатов, а наилучшие результаты отмечались у vHVT114 и vHVT116. Среди двойных HVT-рекомбинантов наибольшую защиту давал vHVT302. Он проявил себя лучше, чем vHVT303, свидетельствуя о том, что оптимизированный ген F NDV генотипа VIId может давать лучшую перекрестную защиту от заражения генотипом II, чем оптимизированный ген F NDV генотипа V. Такая же тенденция наблюдалась и с одинарным HVT, vHVT114 (ген VIId), который проявил себя слегка лучше, чем vHVT116 (ген V), но разница была менее выражена. Эти результаты показывают, что гены F NDV обоих генотипов VIId и V, вставленные в HVT-вектор, дают перекрестную защиту от заражения гетерологичным NDV генотипа II; причем ген VIId может потенциально давать лучшую перекрестную защиту. vHVT302 индуцировал лучшую защиту от ND, чем VHVT301, что подтверждает важное значение промотора, поли-A и локуса вставки. В заключение, результаты данного исследования показали, что исследованные векторы-вакцины из вируса болезни Марека дают очень хорошую раннюю защиту от ND, особенно для исследованного одинарного HVT-ND.
Пример 8. Эффективность vHVT114, vHVT116, vSB1-007, vSB1-008 (одного или вместе с vHVT13) и vHVT304 против заражения штаммами NDV ZJ1 (генотип VIId) и California/02 (генотип V) у 21-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности 2 одинарных рекомбинантных конструкций из HVT (vHVT114 и vHVT116), 2 рекомбинантных конструкций из SB1 (vSB1-007 и vSB1-008), экспрессирующих ген F NDV, и двойного рекомбинанта из HVT (vHVT304) против заражения вирусом болезни Ньюкасл штаммов NDV ZJ1 (генотип VIId) и California/02 (генотип V), которое проводилось на 21-дневных беспатогенных цыплятах.
Характеристики этих 5 вакцин-кандидатов представлены ниже в таблице 14.
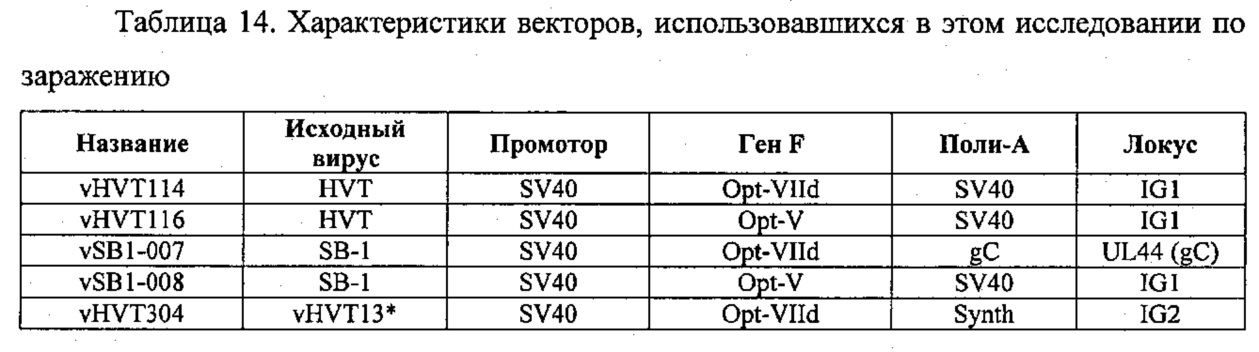

В день D0 158 однодневных беспатогенных цыплят случайным образом разбивали на 6 групп по 24 птицы (вакцинированные) и 1 группу из 12 птиц (невакцинированные контроли). Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 1000 кое, как описано ниже в таблице 15. Затем птиц разделяли на две подгруппы, которых в день D21 внутримышечно заражали велогенным штаммом NDV ZJ1 (генотип VIId) либо California/02 (генотип V) в дозе 5 log10 EID50.

Каждую группу наблюдали до и после заражения. Технические проблемы с изоляторами сократили число птиц в группе 2 (vHVT114: с 24 до 14) и в группе 3 (vHVT116: с 24 до 20). Отмечали клинические признаки после заражения NDV. Брали сыворотку из образцов крови от птиц из групп 2 и 7 перед заражением (D21) для серологии на NDV по тесту HI, используя каждый из заражающих штаммов в качестве антигена.
Средние серологические титры HI в группах G2 и G7 до заражения представлены на фиг. 10. В обеих группах титры HI были выше с антигеном ZJ1. Титры HI, индуцированные vHVT114, были выше, чем индуцированные vHVT304.
Степень защиты от смертности и заболеваемости представлена в приведенной выше таблице. В невакцинированной зараженной контрольной группе G1 наблюдалась полная восприимчивость, что подтверждает большую тяжесть заболевания при заражении. Все вакцины давали высокую степень защиты от заражения. Полную клиническую защиту от заражения обоими штаммами давали vHVT114 и vSB1-008. Следуя той же тенденции, что и титры, vHVT304 обеспечивал слегка большую защиту от ND, чем vHVT114.
Выделение вируса оценивали после заражения методом ОТ-ПЦР в реальном времени в мазках из ротовой полости и клоаки, взятых через 2 и 4 дня после заражения.
На фиг. 11A и 11B представлены проценты положительных (Ct<40) птиц. Следует отметить, что в контрольной группе, зараженной изолятом CA/02, через 4 дня после заражения умерли все 6 птиц, а в контрольной группе, зараженной ZJ1, только одна птица оставалась живой через 4 дня после заражения. У всех контрольных птиц отмечалось выделение вируса. Во всех вакцинированных группах наблюдалось снижение процента птиц, положительных по выделению вируса.
В заключение, результаты данного исследования показали, что исследованные векторы-вакцины из вируса болезни Марека дают очень хорошую защиту от ND в 3-недельном возрасте.
Пример 9. Эффективность vHVT114, vSB1-007, vSB1-009, vHVT306 и vHVT307 как вакцин против заражения штаммом NDV Texas GB у 28-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности различных комбинаций векторов-вакцин из вируса болезни Марека, экспрессирующих ген F NDV и/или ген VP2 IBDV, против заражения вирусом болезни Ньюкасл (штамм Texas GB, генотип II), которое проводилось на 28-дневных беспатогенных цыплятах.
Характеристики 5 рекомбинантных вакцин-кандидатов, протестированных в этом исследовании, представлены ниже в таблице 16.

В некоторых группах в комбинации с рекомбинантными вирусами также использовали вакцины из вируса болезни Марека серотипа 1 (штамм CVI988 или Rispens; герпесвирус куриных 2) и серотипа 2 (штамм SB-1; герпесвирус куриных 3).
В день D0 135 однодневных беспатогенных цыплят случайным образом разбивали на 9 групп по 15 птиц. Птицам в день D0 вводили подкожно в шею по 0,2 мл вакцин, содержащих заданную дозу в 2000 кое для рекомбинантных вакцин (vSB1-007, vSB1-009, vHVT13, vHVT306, vHVT307, vHVT114) и 1000 кое для исходных вакцинных штаммов болезни Марека (SB-1 и CVI988). Состав этих 9 групп представлен ниже в таблице 17. В день D28 птиц внутримышечно заражали велогенным штаммом NDV Texas GB (генотип II) в дозе 4,0 log10 EID50.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки после заражения NDV.
Степень защиты от смертности и заболеваемости представлена в приведенной выше таблице. В невакцинированной зараженной контрольной группе G1 наблюдалась полная восприимчивость, что подтверждает большую серьезность заражения. Во всех вакцинированных группах наблюдалась превосходная степень защиты. Полная защита отмечалась у птиц из групп G3, G6, G7 и G9. Данное исследование показывает, что кандидаты vSB1-ND могут вводиться вместе с vHVT13 и CVI988 и по-прежнему обеспечивать очень хорошую защиту от ND. Точно так же двойные HVT-IBD+ND совместимы с SB-1, a vHVT-ND (vHVT114) совместим с vHVT13 и SB-1.
В заключение, результаты данного исследования показывают отсутствие интерференции при защите от ND, индуцированной исследованными исходными и векторными вакцинами из вируса болезни Марека.
Пример 10. Эффективность vHVT114, vHVT307, vSB1-007 и vSB1-009 в комбинации с vHVT13 против заражения штаммом NDV Chimalhuacan (генотип V) у 28-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности 1 рекомбинантной конструкции из HVT (vHVT114) и 2 рекомбинантных конструкций из SB1 (vSB1-007 и vSB1-009), экспрессирующих ген F NDV, в комбинации с vHVT-IBD (vHVT13), а также двойного HVT (vHVT307), экспрессирующего и F NDV, и VP2 IBDV, против заражения вирусом болезни Ньюкасл (Chimalhuacan, генотип V), которое проводилось на 28-дневных беспатогенных цыплятах.
Характеристики этих 4 вакцин-кандидатов представлены ниже в таблице 18.
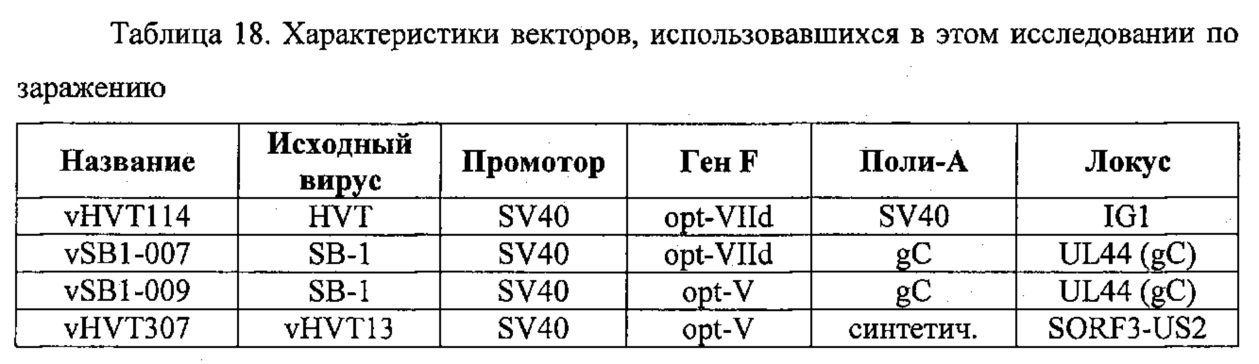
В день D0 45 однодневных беспатогенных цыплят случайным образом разбивали на 4 группы по 10 птиц и 1 группу из 5 птиц (невакцинированная контрольная группа). Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 2000 кое, как описано ниже в таблице 19. В день D28 птиц внутримышечно заражали велогенным штаммом NDV Chimalhuacan (генотип V) в дозе 5,0 log10 EID50.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки после заражения NDV. В вакцинированных группах брали мазки из ротоглотки через 5 и 7 дней после заражения, чтобы оценить вирусную нагрузку методом ОТ-ПЦР.
Степень защиты от смертности и заболеваемости представлена в приведенной выше таблице. В невакцинированной зараженной контрольной группе G1 наблюдалась полная восприимчивость, что подтверждает большую серьезность заражения. Во всех 4 вакцинированных группах наблюдалась очень хорошая защита, а полную клиническую защиту давали vHVT114+vHVT13.
Процент положительных птиц и средний титр выделяющегося вируса (в виде log10 EID50 эквивалента на мл) представлены на фиг. 12A и 12В. Вне ожидания, выделение вируса не обнаруживалось в группе G2, что означает полную защиту (и от клинических признаков, и от выброса вируса) от ND, которую дает vHVT114 даже при введении вместе с vHVT13, в условиях тестирования. В других вакцинированных группах выявлялся очень низкий уровень выброса, а в группе G3 (vHVT307) проявлялся несколько более высокий уровень только через 5 дней после заражения.
В заключение, этот пример еще больше иллюстрирует превосходную защиту от ND, которую дает двойной рекомбинант HVT-IBD+ND или комбинация из рекомбинантных вирусов SB1-ND или HVT-ND и HVT-IBD (vHVT13). В противоположность общему мнению в данной области, что вторая вакцина из HVT (обычная вакцина из HVT или рекомбинантная вакцина из HVT) мешает проявлению иммунитета к чужеродным генам, встроенным в первую рекомбинантную вакцину из HVT, настоящее изобретение дало неожиданный результат, что vHVT114 в комбинации с vHVT13 дает превосходную защиту от NDV и не наблюдается эффект интерференции.
Пример 11. Эффективность vHVT306 и vSB1-008 в комбинации с vHVT13 при подкожном введении или in ovo против заражения штаммом NDV Chimalhuacan (генотип V) у 28-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности vHVT306 - двойного HVT, экспрессирующего и ген F NDV, и ген VP2 IBDV, и vSB1-008 - рекомбинанта SB1, экспрессирующего ген F NDV, в комбинации с vHVT-IBD (vHVT13), при введении in ovo или подкожно, против заражения вирусом болезни Ньюкасл (Chimalhuacan, генотип V), которое проводилось на 28-дневных беспатогенных цыплятах.
Характеристики этих 2 вакцин-кандидатов против ND представлены в таблице 14 (vSB1-008) и в таблице 16 (vHVT306).
Состав групп представлен в таблице 20. Для введения in ovo использовали 60 беспатогенных яиц с эмбрионами (примерно после 18 дней и 18 часов инкубации; D-3) (по 20 на группу для G1, G2 и G3). При введении in ovo вводили 50 мкл вакцины, содержащей 2000 кое, при помощи устройства IntelliLab System фирмы AviTech LLC (Salisbury, MD, USA). После введения in ovo отмечали выводимость птенцов и выживаемость. В день D0 20 однодневных беспатогенных цыплят случайным образом разбивали на 2 группы по 10 птиц (G4 и G5). Птицам в день D0 вводили подкожно (п/к) в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 2000 кое, как описано ниже в таблице 20. В день D28 по 10 птиц на группу заражали внутримышечно велогенным штаммом NDV Chimalhuacan (генотип V) в дозе 5,0 log10 EID50.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки после заражения NDV. В вакцинированных группах брали мазки из ротоглотки через 5 и 7 дней после заражения, чтобы оценить вирусную нагрузку методом ОТ-ПЦР в реальном времени.
У птиц в группах G1 и G2 отмечалась полная выводимость птенцов и выживаемость вплоть до D28 (дня заражения). В группе G3 выводимость составила 85% и еще одна птица в этой группе умерла после появления из яйца. Меньшая выводимость в этой группе может быть вызвана проблемами с инкубатором. Вес тела у самцов и самок в группах G1, G2 и G3 был одинаковым и в день D1, и в день D28.
Степень защиты от смертности и заболеваемости представлена в таблице 20. В невакцинированной зараженной контрольной группе G1 наблюдалась полная восприимчивость, что подтверждает большую серьезность заражения. Во всех 4 вакцинированных группах наблюдалась очень хорошая защита, а полную клиническую защиту давал vHVT306 при обоих способах введения.
Процент положительных птиц и средний титр вьщеляющегося вируса (в эквивалентах log10 EID50 на мл) представлены в таблице 21. В группах G2 и G4, вакцинированных vHVT306, наблюдалось явное отсутствие или очень слабое выделение вируса. В группах, вакцинированных vSB1-008+vHVT13, уровень выброса был выше, особенно через 5 дней после заражения (pi).

В заключение, этот пример показывает, что двойной рекомбинант HVT - vHVT306 дает превосходную защиту от ND при введении как in ovo, так и подкожно. vSB1-008+vHVT13 проявил себя несколько хуже, особенно при введении in ovo, но это может объясняться, по крайней мере частично, проблемами с инкубатором. Действительно, при тестировании безопасности in ovo другого рекомбинанта SB1-ND (vSB1-009) при 1000 или 4000 кое вместе с 6000 кое vHVT13 не проявлялось никаких отличий по выводимости и раннем выживании от группы, получавшей только 6000 кое vHVT13.
Пример 12. Эффективность vHVT304, vHVT306, vSB1-007 и vSB1-008 в комбинации с vHVT13 против заражения штаммом NDV Chimalhuacan (генотип V) у 42-дневных коммерческих бройлерных цыплят
Целью данного исследования была оценка эффективности двух двойных HVT (vHVT304 и vHVT306), экспрессирующих и ген F NDV, и ген VP2 IBDV, и двух рекомбинантов SB1 (vSB1-007 и vSB1-008), экспрессирующих ген F NDV, в комбинации с vHVT-IBD (vHVT13), против заражения вирусом болезни Ньюкасл (Chimalhuacan, генотип V), которое проводилось на 42-дневных коммерческих бройлерных цыплятах.
Характеристики этих 4 вакцин-кандидатов против ND представлены в таблице 14 и 16. Состав групп представлен в таблице 22. В день D0 55 однодневных коммерческих бройлерных цыплят случайным образом разбивали на 5 групп по 11 птиц. Птицам в день D0 вводили подкожно (п/к) в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 2000 кое, как описано ниже в таблице 22. В день D42 по 10 птиц на группу заражали внутримышечно велогенным штаммом NDV Chimalhuacan (генотип V) в дозе 5,0 log10 EID50.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки в течение 14 дней после заражения NDV. В вакцинированных группах брали мазки из ротоглотки через 5 и 7 дней после заражения, чтобы оценить вирусную нагрузку методом ОТ-ПЦР в реальном времени.
Степень защиты от смертности и заболеваемости представлена в таблице 22. В невакцинированной зараженной контрольной группе G1 наблюдалась полная восприимчивость, что подтверждает большую серьезность заражения. Во всех 4 вакцинированных группах наблюдалась очень хорошая защита, а полную клиническую защиту давали vHVT306 и vSB1-007+vHVT13.
Процент положительных птиц и средний титр выделяющегося вируса (в эквивалентах log10 EID50 на мл) представлены в таблице 23. Наибольшее снижение выброса да- вали vHVT306 и vSB1-007+vHVT13, которые также были наилучшими кандидатами для клинической защиты.

Как оказалось, vHVT306 давал лучшую защиту от ND, чем vHVT304. Эти два двойных HVT содержат одну и ту же экспрессионную кассету NDV F, но она вставлена в два различных локуса, а кассета VP2 IBDV вставлена в одном и том же положении. Так что этот пример иллюстрирует важное значение локуса вставки при разработке рекомбинантов HVT. vSB1-007+vHVT13 проявил себя лучше, чем vSB1-008+vHVT13. Геномная структура vSB1-007 отличается от таковой у vSB1-008 в различных аспектах: по локусу вставки, промотору, сигналу поли-аденилирования и происхождению гена F. Сочетание этих чужеродных последовательностей и локуса вставки в vSB1-007 скорее всего ответственны за его лучшие показатели защиты от ND.
В заключение, этот пример показывает важное значение локуса вставки и других регуляторных последовательностей в экспрессионной кассете NDV при защите от ND, индуцированной векторами из HVT и MDV серотипа 2.
Пример 13. Эффективность рекомбинантных вакцин HVT-ND+IBD (vHVT304 и VHVT306) или SB1-ND (vSB1-008) в комбинации с vHVT13 против заражения классическим изолятом IBDV у 14-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности на ранней стадии IBD у двойных рекомбинантов HVT - vHVT304 и vHVT306, а также vHVT13 при совместном введении с рекомбинантной конструкцией SB1-ND (vSB1-008) против заражения вирулентным штаммом (Faragher 52/70) вируса инфекционного бурсита (vIBDV), которое проводилось на 14-дневных беспатогенных цыплятах.
Характеристики двойных рекомбинантов HVT и SB1, использовавшихся в данном исследовании, представлены в таблице 14 и 16.
В день D0 95 однодневных беспатогенных цыплят случайным образом разбивали на 9 групп по 10 птиц и 1 группу из 5 птиц (невакцинированная незараженная контрольная группа). Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 300 или 1000 кое, как описано ниже в таблице 24. В день D1 брали пробы крови у 5 птиц на группу для серологического исследования с помощью набора ProFLOK® Plus IBD (Synbiotics Corp). В день D14 птиц (по 10 птиц на группу, за исключением группы 7, в которой 1 птица умерла еще до заражения) заражали при помощи глазных капель (0,05 мл на птицу) в дозе 2,5 log10 EID50.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки в течение 11 дней после заражения IBDV (от D15 по D25). По окончании периода наблюдения после заражения (D33) всех выживших птиц подвергали эвтаназии и вскрывали. Отмечали вес тела и фабрициевой сумки. Каждую фабрициеву сумку (BF) взвешивали, а затем хранили в индивидуальных сосудах, содержащих 4% формальдегида для гистологии. Гистологические поражения фабрициевой сумки оценивали по шкале, представленной в таблице 25.

Птица считалась пораженной, если она погибала и/или проявляла заметные признаки заболевания и/или тяжелые поражения фабрициевой сумки (т.е. гистологический показатель ≥3).
Средние титры антител по ELISA IBD+, выраженные в log10 перед заражением, представлены в таблице 24. Во всех вакцинированных группах выявлялись существенные титры, которые были значительно выше, чем в контрольной группе G1. Серологический титр не зависел от дозы.
У всех птиц контрольной группы G1 наблюдались тяжелые клинические признаки после заражения. В этой группе за период наблюдения в 11 дней умерло 7 из 10 птиц, что указывает на большую серьезность заражения. Ни одна из вакцинированных птиц не проявляла тяжелых клинических признаков после заражения, за исключением 1 птицы из G4, которая умерла. Степень защиты от тяжелого поражения фабрициевой сумки представлена в приведенной выше таблице. Во всех группах наблюдалась существенная защита от IBD, а наилучшая защита наблюдалась в группах G2 и G3 (только один vHVT13). Совместное введение vSB1-008+vHVT13 и двойных конструкций vHVT304 и vHVT306 давало близкие уровни защиты от IBD. Защита не зависела от дозы при исследованных дозах. В таблице 24 также представлено среднее соотношение фабрициева сумка/вес тела. Это соотношение во всех вакцинированных группах было выше, чем в зараженной контрольной группе.
В заключение, эти данные показывают, что комбинации вектора SB1-ND как с одинарным HVT-IBD, так и с двойным HVT, экспрессирующим и NDV-F, и IBDV-VP2, индуцируют антитела и раннюю защиту от IBD на модели тяжелого заражения IBDV.
Пример 14. Эффективность одинарных рекомбинантных вакцин HVT-ND (VHVT114) или SB1-ND (vSB1-007 и vSB1-009) в комбинации с vHVT13 против заражения очень вирулентным изолятом IBDV у 23-дневных коммерческих бройлерных цыплят
Целью данного исследования была оценка эффективности от IBD при введении vHVT13 вместе с рекомбинантными конструкциями HVT-ND (vHVT114) или SB1-ND (vSB1-007 и vSB1-009) против заражения очень вирулентным вирусом инфекционного бурсита (vvIBDV) (91-168/980702), которое проводилось на 23-дневных коммерческих бройлерных цыплятах.
Характеристики этих 4 вакцин-кандидатов представлены в таблице 14 и 16. В день D0 90 однодневных бройлерных цыплят случайным образом разбивали на 7 групп по 12 птиц и 1 группу из 6 птиц (невакцинированная незараженная контрольная группа). Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 3000 кое, как описано в таблице 26. В день D14 брали пробы крови у 5 птиц на группу для серологического исследования с помощью набора ProFLOK® Plus IBD (Synbiotics Corp). Сыворотки еще 10 однодневных бройлерных цыплят в D0 тестировали с тем же самым набором, чтобы оценить уровень материнских антител к IBDV. В день D23 птиц (по 10 птиц на группу) заражали при помощи глазных капель (0,05 мл на птицу) в дозе 4,3 log10 EID50 изолята wIBDV 91-168.
Каждую группу наблюдали до и после заражения. Отмечали клинические признаки в течение 11 дней после заражения IBDV (от D23 по D33). По окончании периода наблюдения после заражения (D33) всех выживших птиц подвергали эвтаназии и вскрывали. Отмечали вес тела и фабрициевой сумки. Каждую фабрициеву сумку (BF) взвешивали, а затем хранили в индивидуальных сосудах, содержащих 4% формальдегида для гистологии. Гистологические поражения фабрициевой сумки оценивали по шкале, представленной в таблице 25.
Птица считалась пораженной, если она погибала и/или проявляла заметные признаки заболевания и/или тяжелые поражения фабрициевой сумки (т.е. гистологический показатель ≥3).

Средний серологический титр по ELISA IBD+ в день D0 составил 4,36±0,01 log10, что указывает на очень высокий уровень материнских антител к IBD на момент появления из яйца. В день D23 средний титр по ELISA IBD+ был все еще высоким (3,9) в контрольной группе G1. Средние титры ELISA в вакцинированных группах не отличались существенно от таковых в контрольной группе.
Ни в одной из групп после заражения не наблюдалось ни заболеваемости, ни смертности. Степень защиты от тяжелого поражения сумки представлена выше в таблице 26. Результаты показывают, что совместное введение vHVT114, vSB1-007 или vSB1-009 не мешало vHVT13 вызывать защиту от IBD, что указывает на отсутствие интерференции. Аналогичным образом, средние соотношения фабрициева сумка/вес тела в вакцинированных группах были близкими и явно выше, чем в контрольной группе, указывая на защиту от IBD и отсутствие отличий между схемами вакцинации.
В заключение, эти данные свидетельствуют о совместимости между vHVT114, vSB1-007 или vSB1-009 и vHVT13 при защите от IBD. Отсутствие интерференции между двумя векторами из HVT при защите от IBD было опять неожиданным и подтверждает результаты, полученные в отношении защиты от ND (см. пример 10).
Пример 15. Эффективность двойных рекомбинантных вакцин HVT-ND+IBD (VHVT304 и VHVT306) вместе с SB-1 или без него и SB1-ND (vSBl-007 и vSB1-008) в комбинации с vHVT13 против заражения изолятом варианта E IBDV у 28-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности двух двойных вакцин с векторами из HVT (HVT-ND+IBD: vHVT304 и vHVT306) или двух vSB-1-NDV в комбинации с vHVT13 (vSB1-007+vHVT13, vSB1-008+vHVT13) при подкожном введении 1-дневным беспатогенным цыплятам и заражении вариантом E IBDV (VAR-E) через 28 дней после вакцинации.
В день D0 105 однодневных беспатогенных цыплят случайным образом разбивали на 7 групп по 15 птиц, включая группу зараженного контроля (G6) и группу незараженного контроля (G7). Птицам из групп G1-G5 в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин и/или вакцин SB-1, содержащих заданную дозу в 2000 кое. Схема исследования представлена ниже в таблице 27. В день D28 всех птиц из групп G1-G6 заражали при помощи глазных капель (0,03 мл на птицу) в дозе 3 log10 EID50 изолятом варианта Е IBDV из University of Delaware (USA). Каждую группу наблюдали до и после заражения. Через 11 дней после заражения птиц взвешивали и вскрывали. Извлекали фабрициеву сумку и взвешивали. Рассчитывали соотношения фабрициева сумка/вес тела (вес фабрициевой сумки/вес тела × 100).

Средние соотношения фабрициева сумка/вес тела представлены в таблице 27. У зараженных контрольных птиц была сильная атрофия фабрициевой сумки по сравнению с незараженными. Вакцины vSB1-007 и vSB1-008 не мешали vHVT13 вызывать защиту (G4 и G5). Соотношения фабрициева сумка/вес тела у птиц, вакцинированных двойным HVT (HVT-ND+IBD), были слегка ниже, чем у незараженной контрольной группы, но явно выше, чем у зараженной контрольной группы. Кроме того, вакцина от болезни Марека из SB-1 серотипа 2 не мешала VHVT304 вызывать защиту от IBD.
В заключение, эти данные показывают, что обе комбинации вектора SB1-ND с одинарным HVT-IBD или двойным HVT, экспрессирующим и NDV-F, и IBDV-VP2, дают защиту от IBD на модели заражения вариантом Е IBDV.
Пример 16. Отсутствие интерференции у vHVT114, vSB1-009 и/или SB-1 на индуцированную vHVT13 защиту от варианта E IBD у беспатогенных цыплят
Целью данного исследования была оценка эффективности vHVT13 от IBD при подкожном введении или in ovo одновременно с vHVT114, vSB1-009 и/или SB-1 у беспатогенных цыплят на модели заражения вариантом E IBDV (VAR-E) в день D28.
75 однодневных беспатогенных цыплят и 75 18-19-дневных эмбрионов беспатогенных цыплят случайным образом разбивали на 5 групп (G1-G5 и G6-G10, соответственно), включая группы зараженного контроля (G4 и G9, соответственно) и незараженного контроля (G5 и G10, соответственно). Птицам из групп G1-G3 в день D0 вводили подкожно в шею по 0,2 мл вакцин, содержащих заданную дозу в 3000 кое, за исключением SB-1, для которой доза заданная составляла 1000 кое. Птицы из групп G6-G8 получали такие же дозы вакцин, но в объеме 0,05 мл in ovo за 2-3 дня перед появлением из яйца. Схема исследования представлена ниже в таблице 28. В день D28 всех птиц из групп G1-G4 и G6-G9 заражали при помощи глазных капель (0,03 мл на птицу) в дозе 3 log10 EID50 изолятом варианта Е IBDV из University of Delaware (USA). Каждую группу наблюдали до и после заражения. Через 11 дней после заражения птиц взвешивали и вскрывали. Извлекали фабрициеву сумки и взвешивали. Рассчитывали соотношения фабрициева сумка/вес тела (вес фабрициевой сумки/вес тела × 100).

Средние соотношения фабрициева сумка/вес тела представлены в таблице 28. У зараженных контрольных птиц (G4 и G9) была сильная фабрициевой атрофия сумки по сравнению с незараженными. Соотношения фабрициева сумка/вес тела у вакцинированных групп (G1-G3 и G6-G8) были близки таковым у незараженных контрольных групп (G5 и G10) и явно выше, чем у зараженных контрольных групп (G4 и G9). Отсутствие интерференции vHVT114 на индуцированную vHVT13 защиту от IBD при подкожном введении или in ovo было неожиданным и подтверждает данные, полученные в примерах 10 и 14.
В заключение, эти данные четко показывают совместимость vHVT114+vSB1-009 или +SB-1 и vSB1-009 с vHVT13 при подкожном введении или in ovo на модели заражения вариантом Е IBDV.
Пример 17. Эффективность векторов vHVT114 и vHVT13 и SB1 или vSB1-009 против заражения очень вирулентным вирусом болезни Марека
Целью данного исследования была оценка эффективности против болезни Марека у различных комбинаций вакцин, включающих vHVT114, vHVT13, SB-1 и/или vSB1-009, при подкожном введении однодневным беспатогенным цыплятам и заражении 4 днями позже сверхвирулентным вирусом болезни Марека (vv+MDV)-изолят T-King.
В день D0 100 однодневных беспатогенных цыплят случайным образом разбивали на 5 групп по 20 птиц. Птицам из групп G1-G3 в день D0 вводили подкожно в шею по 0,2 мл вакцин, содержащих заданную дозу в 2000 кое для каждой вакцины, за исключением SB-1, для которой заданная доза составляли 1000 кое. Птиц из групп G4 и G5 не вакцинировали и использовали в качестве контроля - зараженных (группа G4) или незараженных (группа G5). Схема исследования представлена в таблице 29. В день D4 всех птиц из групп G1-G4 заражали с помощью 0,2 мл изолята T-King vv+MDV путем внутрибрюшинного введения.

Каждую группу ежедневно наблюдали до и после заражения на предмет любых нежелательных реакций. В день D49 всех выживших птиц забивали и вскрывали для исследования на макроскопические поражения, связанные с болезнью Марека. Цыплят классифицировали как положительных на заражение болезнью Марека, если наблюдались такие нервные признаки, как паралич, локомоторные признаки, присущие заболеванию, и сильное истощение и подавленное состояние, если отмечалась смертность, свойственная для болезни Марека, или если при вскрытии наблюдались макроскопические поражения. Поражения могли включать, без ограничения, поражения печени, сердца, селезенки, гонад, почек и мышц.
Результаты по защите представлены выше в таблице 29. Все вакцинированные группы (G1-G3) проявили себя одинаково, вызывая частичную (65%) защиту от MD, как и ожидалось на этой модели очень тяжелого и раннего заражения. Эти результаты показывают, что векторы вакцин-кандидатов сохраняют способность защищать от болезни Марека.
Пример 18. Эффективность рекомбинантных векторов из HVT и SB1 против болезни Марека
Эффективность против болезни Марека также засвидетельствована у рекомбинантных векторов из HVT и рекомбинантных векторов из SB1 как по отдельности, так и в комбинации. Для заражения использовали штаммы вирулентного вируса болезни Марека (vMD) типа GA22, высоковирулентного вируса болезни Марека (vvMD) типа RB1B и/или сверхвирулентного вируса болезни Марека (vv+MD) типа вируса T-King. Однодневным цыплятам вводили подкожно либо в 18-19-дневные яйца с эмбрионами вводили дозы в 0,2 или в 0,05 мл, соответственно, исследуемых вирусов. В возрасте пяти дней вакцинированных цыплят и необработанных контролей заражали соответствующим вирусом болезни Марека (v, vv или vv+MDV). Зараженных птиц наблюдали до 7-недельного возраста. Всех птиц забивали и вскрывали для исследования на макроскопические поражения, связанные с болезнью Марека, как описано в примере 17.
Пример 19. Интерференция HVT на индуцированные vHVT13 антитела к IBDV у коммерческих цыплят
Целью данного исследования было установить, будет ли совместное введение HVT вместе с vHVT13 оказывать влияние на индуцированный vHVT13 антительный ответ к IBDV у коммерческих цыплят.
Использовали 80 однодневных коммерческих цыплят коричневой породы в трех изолированных помещениях. У 15 из них брали пробы крови в суточном возрасте для проверки на полученные от матери антитела к IBD (MDA). Остальных птиц разбивали на три группы, как показано в таблице 30. Птиц из групп 2 и 3 вакцинировали подкожно в загривок коммерческими дозами vHVT13 (Vaxxitek HVT+IBD; Merial SAS, Lyon, Франция) и/или связанного с клетками HVT - BioHVT (Merial S.p.A., Noventa, Италия). Пробы крови брали в возрасте 25, 35 и 45 дней. Для оценки серологического ответа на IBDV методом ELISA использовали набор ProFLOK Plus IBD (IBD+) Ab ELISA фирмы Synbiotics (Synbiotics Corp., Kansas City, MO, USA).
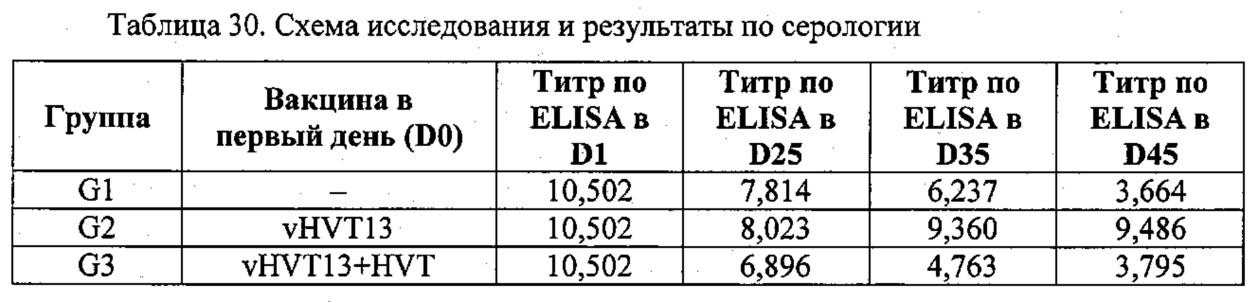
Средние титры по ELISA представлены в таблице 30. Титры в невакцинированной группе G1 снижались от D1 до D45, что соответствовало снижению материнских антител к IBDV. Как и ожидалось; титры по ELISA в группе vHVT13 - G2 оставались высокими вплоть до D45, указывая на то, что материнские антитела постепенно заменялись на антитела, индуцированные vHVT13. Добавление HVT к vHVT13 оказывало явно отрицательное влияние, так как титры антител в группе G3 были близки к G1. Эти результаты противоречат результатам, полученным с vHVT114+vHVT13, поскольку vHVT114 не снижал индуцированные vHVT13 титры IBD+ELISA (см. пример 14, таблица 26). Они подтверждают неожиданное свойство vHVT114 не мешать иммуногенности VHVT13.
В заключение, в отличие от того, что наблюдалось с vHVT114, добавление HVT к vHVT13 оказывало явно негативное влияние на индуцированный vHVT13 гуморальный иммунитет к IBDV.
Пример 20. Интерференция коммерческих вакцин HVT-ND на индуцированную vHVT13 защиту от IBD
Целью данного исследования было установить, будет ли совместное введение коммерческих векторных вакцин HVT-ND вместе с vHVT13 оказывать влияние на индуцированную vHVT13 защиту от IBD у беспатогенных цыплят.
В день D0 75 беспатогенных цыплят (3 группы: G2, G3 и G4 по 25) вакцинировали подкожно коммерческой дозой vHVT13 (вакцина HVT+IBD Vaxxitek) вместе или без коммерческой дозы лицензированной HVT-векторной вакцины против ND (vHVT-ND1 и vHVT-ND2), как показано в таблице 31. Пятнадцать птиц держали в качестве невакцинированного контроля (G1). Через три недели после вакцинации птиц (по 20 цыплят в группах G2, G3 и G4 и 10 цыплят в группе G1) заражали вирусом IBD штамма Ph/B1 (выделен на Филиппинах) в дозе по меньшей мере 2,0 log10 EID50 в 0,05 мл при введении через глаза. Всех цыплят наблюдали в течение 5 дней на клинические признаки или смерть от причин, связанных с заражением вирусом IBD, и по окончании периода наблюдения подвергали гуманной эвтаназии для вскрытия и исследования на поражения при IBD, особенно фабрициевой сумки. Птицы считались защищенными, если фабрициева сумка не имела типичных для IBD повреждений сумки: атрофии фабрициевой сумки, отечности вокруг фабрициевой сумки и/или кровоизлияний в тканях фабрициевой сумки.

Результаты представлены в таблице 31. Все 10 зараженных контрольных птиц проявляли клинические признаки, а 8 из 10 умерли через 4 или 5 дней после заражения, указывая на то, то заражение IBDV было очень тяжелым. Все они имели сильные поражения фабрициевой сумки, включая сильную атрофию сумки и геморрагические пятна. Сам vHVT13 давал полную защиту, тогда как обе комбинации с vHVT-ND давали лишь частичную клиническую защиту и защиту фабрициевой сумки.
В заключение, эти результаты четко показывают, что эти 2 коммерческие HVT-векторные вакцины против ND мешают индуцированной vHVT13 защите от IBD.
Пример 21. Эффективность SB1-векторных вакцин против ND - vSB1-004, vSB1-006, vSB1-007, vSB1-008, одних или вместе с vHVT13 - HVT-векторной вакциной против IBD, а также вакцин vHVT302 и vHVT304 против заражения штаммом NDV Texas GB у 14- и/или 28-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности различных комбинаций векторов-вакцин из вируса болезни Марека, экспрессирующих ген F NDV и/или ген VP2 IBDV, против заражения вирусом болезни Ньюкасл (штамм Texas GB, генотип II), которое проводилось на 14- и/или 28-дневных беспатогенных цыплятах.
Характеристики 6 рекомбинантных вакцин-кандидатов от NDV, протестированных в этом исследовании, представлены ниже в таблице 32.

В день D0 225 однодневных беспатогенных цыплят случайным образом разбивали на 9 групп по 15 птиц (G1a-G9a, заражение в день D14) и 6 групп по 15 птиц (G1b, G3b, G4b, G5b, G8b, G9b, заражение в день D28). Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 2000 кое. Схема исследования представлена ниже в таблице 33. В день D14 или D28 птиц заражали внутримышечно велогенным штаммом NDV Texas GB (генотип II) в дозе 4,3 и 4,2 log10 EID50 (0,1 мл), соответственно.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки после заражения NDV. В группах G6 и G7 по одной птице умерли перед заражением, так что число птиц в этих группах уменьшилось с 15 до 14.
Степень клинической защиты (включая защиту от смертности и заболеваемости) представлена выше в таблице 33. В невакцинированных зараженных контрольных группах G1 и G1b наблюдалась полная восприимчивость, что подтверждает большую тяжесть заболевания при заражении. Частичная защита в пределах от 1363 до 4666% наблюдалась после заражения в D14, а наибольшую степень защиты давали vSB1-008, vSB1-007 и vHVT304. Степень защиты после заражения ND в день D28 была гораздо выше у всех вакцинированных групп и опять же была немного выше в группах, вакцинированных vSB1-008, vSB1-007 или vHVT304. Эти результаты показывают, что степень защиты от ND зависит от срока заражения и от конструкции. Конструкции vSB1-008 и vSB1-007 проявили себе слегка лучше, чем vSB1-004 и vSB1-006, a vHVT304 слегка лучше, чем vHVT302, указывая на то, что различия в характеристиках конструкций играют роль в показателях векторных вакцин на основе MDV.
В заключение, результаты данного исследования показывают, что степень защиты от ND, которую дают векторы из вируса болезни Марека, экспрессирующие ген F NDV, могут зависеть от различных параметров, включая вектор, локус вставки, ген F, промотор, сайт полиаденилирования и условия заражения.
Пример 22. Эффективность двойных вакцин типа HVT-ND+IBD - vHVT304 и vHVT306 против заражения штаммом NDV Texas GB у 14- и/или 28-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности HVT-векторных вакцин, экспрессирующих и ген F NDV, и ген VP2 IBDV, против заражения вирусом болезни Ньюкасл (штамм Texas GB, генотип II), которое проводилось на 14- и/или 28-дневных беспатогенных цыплятах.
Характеристики 2 рекомбинантных вакцин-кандидатов, протестированных в этом исследовании, представлены ниже в таблице 34.

В день D0 90 однодневных беспатогенных цыплят случайным образом разбивали на 3 группы по 15 птиц (G1a-G3a, заражение в день D14) и 3 группы по 15 птиц (G1b-G3b, заражение в день D28). Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 2000 кое. Схема исследования представлена ниже в таблице 35. В день D14 или D28 птиц заражали внутримышечно велогенным штаммом NDV Texas GB (генотип II) в дозе 4,0 log10 EID50 (0,1 мл).

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки после заражения NDV. В группе G2b одна птица умерла перед заражением, так что число птиц в этой группе уменьшилось с 15 до 14.
Степень клинической защиты (включая защиту от смертности и заболеваемости) представлена выше в таблице 35. В невакцинированных зараженных контрольных группах G1 и G1b наблюдалась полная восприимчивость, что подтверждает большую тяжесть заболевания при заражении. Степень защиты после заражения в день D14 была гораздо ниже, чем после заражения в день D28. Эти вакцины-кандидаты содержали одну и ту же экспрессионную кассету NDV-F, вставленную в 2 разных локуса генома vHVT13. Они проявили себя одинаково в смысле защиты от ND в условиях тестирования, указывая на то, что оба локуса вставки (IG2 и SORF3-US2) одинаково подходят для вставки кассеты NDV-F.
В заключение, результаты данного исследования показывают, что степень защиты от ND, которую дают векторы из вируса болезни Марека, экспрессирующие ген F NDV, зависят от различных параметров, включая вектор, локус вставки, ген F, промотор, сайт полиаденилирования и условия заражения.
Пример 23. Ранняя эффективность двойных вакцин HVT-ND+IBD (vHVT302, vHVT303 и vHVT304) или SB1-векторов (vSB1-006 и vSB1-007) у однодневных беспатогенных цыплят против заражения велогенным NDV генотипа V
Целью данного исследования была оценка эффективности трех двойных вакцин HVT-ND+IBD (vHVT302, vHVT303 и vHVT304) и двух SB1-ND векторов (vSB1-006 и vSB1-007) у однодневных беспатогенных цыплят против заражения велогенным NDV генотипа V (Chimalhuacan) в день D14.
Характеристики 5 рекомбинантных вакцин-кандидатов, протестированных в этом исследовании, представлены ниже в таблице 36.

Составляли случайным образом 6 групп по 10 однодневных беспатогенных белых цыплят Леггорн. Птиц из групп 2-6 вакцинировали подкожно (в загривок) заданной дозой в 2000 кое, как показано ниже в таблице 37. Цыплят из группы 1 не вакцинировали, а держали в качестве контрольных. В возрасте 2 недель всех птиц заражали велогенным штаммом NDV генотипа V Mexican Chimalhuacan (Mex V). Заражение проводили внутримышечно (IM), используя 105 яичных инфекционных доз-50 (EID50), разведенных в 0,2 мл физиологически стерильной воды. Всех птиц наблюдали вплоть до 14 дней после заражения. Ежедневно после заражения оценивали состояние здоровья каждой птицы следующим образом: здоровые / со специфическими симптомами (взъерошенные перья, прострация, кривошея, тремор) / мертвые. При расчетах заболеваемости учитывали всех птиц, проявлявших специфические симптомы в течение более 2 дней или отмеченных как больные в день D28.

Результаты по защите приведены в таблице 37. Все контрольные птицы умерли после заражения ND. Различные протестированные вакцины давали разные степени защиты от ND в пределах от 10% до 80% и от 0% до 60% в смысле защиты против смертности и заболеваемости, соответственно. Вакцина-кандидат vHVT304 давала лучшую защиту, чем кандидаты vHVT303 и vHVT302; это может быть связано с экзогенным промотором SV40, размещенным перед геном F NDV. vSB1-007 проявил себя немного лучше, чем vSB1-006. Кроме того, показатели у vHVT304 были сопоставимы с показателями у vSB1-007, указывая на то, что различные векторы из вируса болезни Марека могут давать такую же степень защиты от ND.
В заключение, данное исследование показывает, что и двойные вакцины HVT-ND+IBD, и SB1-векторные вакцины против ND могут давать существенную защиту от ND на модели очень тяжелого и раннего заражения NDV.
Пример 24. Эффективность против ND у двойной вакцины HVT-ND+IBD-vHVT306 при введении in ovo или подкожно однодневным беспатогенным цыплятам против заражения велогенным NDV генотипа V в день D28
Целью данного исследования была оценка эффективности двойной вакцины HVT-ND+IBD (vHVT306) при введении in ovo или подкожно однодневным беспатогенным цыплятам против заражения велогенным NDV генотипа V (Chimalhuacan) в возрасте 28 дней.
Характеристики рекомбинантной вакцины-кандидата vHVT306, протестированной в этом исследовании, представлены ниже в таблице 38. В качестве контроля использовали одинарную вакцину HVT-IBD из вектора vHVT13.

В день - 340 куриных беспатогенных яиц с эмбрионами в возрасте около 18 дней и 18 часов инкубации случайным образом разбивали на 2 группы по 20 яиц. В день D0 добавляли одну группу из 12 однодневных беспатогенных цыплят. Определения групп представлены ниже в таблице 39. Вакцинацию проводили в день D-3 (in ovo) или в день D0 (подкожно, в загривок), а заданная доза vHVT306 и vHVT13 составляла 2000 кое на птицу. При введении in ovo отмечали выводимость, жизнеспособность (до дня D28) и рост птиц (между появлением из яйца и D28).
В день D28 по 10 птиц на группу заражали вирулентным штаммом NDV Chimalhuacan. Заражение проводили внутримышечно (IM), используя 105 яичных инфекционных доз-50 (EID50), разведенных в 0,2 мл физиологически стерильной воды. Птиц наблюдали вплоть до 14 дней после заражения. Отмечали специфические клинические признаки и смертность. При расчетах заболеваемости учитывали всех птиц, проявлявших специфические симптомы в течение более 2 дней или отмеченных как больные в день D42. Через 5 и 7 дней после заражения (i.e. в D33 и D35) у всех выживших птиц брали мазки из ротоглотки. Все мазки анализировали специфичным к NDV методом qOT-ПЦР.

Отмечалась полная выводимость после вакцинации in ovo в группах 1 и 2 и все вылупившиеся птицы выжили вплоть до D28. Не обнаружено никакой разницы в массе тела между двумя группами и в день D0, и в день D28, что подтверждает отличную безопасность vHVT306 при введении in ovo. Результаты по защите представлены в таблице 39. Все вакцинированные vHVT13 контрольные птицы умерли к 4 дню после заражения ND. vHVT306 давал полную клиническую защиту от ND при введении обоими способами. Кроме того, не отмечалось выделения вируса при введении in ovo, а при подкожном введении лишь немногие птицы давали заметный выброс заражающего вируса.
В заключение, данное исследование показывает, что двойная вакцина HVT-ND+IBD-VHVT306 дает превосходную степень защиты от ND при подкожном введении либо in ovo на модели очень серьезного заражения гетерологичным NDV.
Пример 25. Эффективность двойных рекомбинантных вакцин HVT-ND+IBD (VHVT302, VHVT303 и vHVT304) против заражения классическим изолятом IBDV в день D15 у беспатогенных цыплят
Целью данного исследования была оценка ранней эффективности против IBD у двойных рекомбинантов HVT - рекомбинантных конструкций vHVT302, vHVT303 и vHVT304 против заражения вирулентным вирусом инфекционного бурсита (vIBDV) (штамм Faragher 52/70) на 15-дневных беспатогенных цыплятах.
Характеристики 3 двойных рекомбинантных вакцин-кандидатов HVT-ND+IBD, протестированных в этом исследовании, представлены ниже в таблице 40.

В день D0 40 однодневных беспатогенных цыплят случайным образом разбивали на 4 группы по 10 птиц, включая одну контрольную группу (G1), которую вакцинировали вектором vSB1-004 из SB-1, экспрессирующим ген F NDV. Пять других беспатогенных птиц держали невакцинированными и незараженными для оценки веса фабрициевой сумки/тела. Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 2000 кое, как описано ниже в таблице 41. В день D15 брали пробы крови у всех птиц из каждой группы (10 птиц на группу, за исключением групп 1 и 3, в которых по 1 птице умерло перед взятием крови) для серологического исследования с помощью набора ProFLOK® Plus IBD (Synbiotics Corp). В день D15 птиц из всех 4 групп заражали при помощи глазных капель (0,05 мл на птицу) в дозе 2,5 log10 EID50.
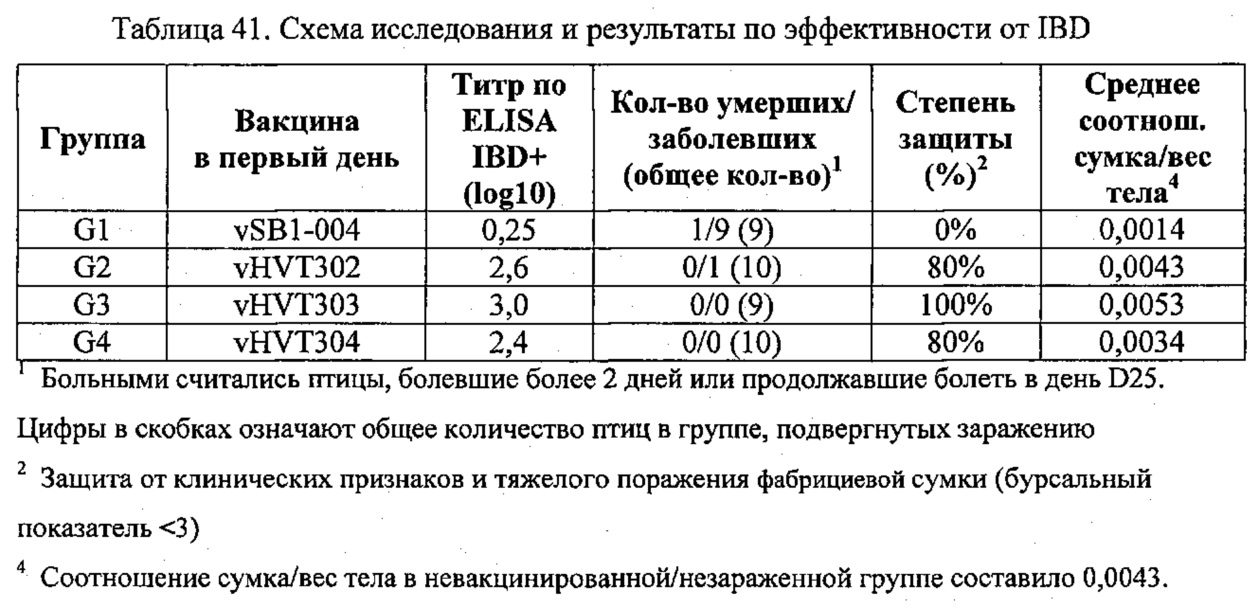
Каждую группу наблюдали до и после заражения. Отмечали клинические признаки в течение 11 дней после заражения IBDV (от D15 по D25). По окончании периода наблюдения после заражения (D25) всех выживших птиц подвергали эвтаназии и вскрывали. Отмечали вес тела и фабрициевой сумки. Каждую фабрициеву сумку (BF) взвешивали, а затем хранили в индивидуальных сосудах, содержащих 4% формальдегида для гистологии. Гистологические поражения фабрициевой сумки оценивали по шкале, представленной в таблице 42.


Птица считалась пораженной, если она погибала и/или проявляла заметные признаки заболевания и/или тяжелые поражения фабрициевой сумки (т.е. гистологический показатель ≥3).
Средние титры антител по ELISA IBD+, выраженные в log10 перед заражением, представлены в таблице 41. Во всех вакцинированных группах выявлялись существенные титры, которые были значительно выше, чем в контрольной группе G1. Серологический титр был немного выше в группе G3 (vHVT303).
У всех 9 птиц из контрольной группы G1 наблюдались тяжелые клинические признаки после заражения, которые привели к смерти 1 птицы. В группе G2 (vHVT302) только одна вакцинированная птица проявляла клинические признаки после заражения. Степень защиты от тяжелых поражений сумки представлена выше в таблице 41. Во всех вакцинированных группах наблюдалась существенная защита от IBD, а полная защита наблюдалась в группе G3 (vHVT303). В таблице 41 также представлено среднее соотношение фабрициева сумка/вес тела. Это соотношение во всех вакцинированных группах было выше, чем в зараженной контрольной группе G1, и не отличалось значительно от невакцинированной и незараженной контрольной группы.
В заключение, эти данные показывают, что три двойные вакцины HVT-IBD+ND, протестированные в данном исследовании, индуцируют антитела и раннюю защиту от IBD на модели тяжелого заражения IBDV.
Пример 26. Эффективность пяти различных вакцин-кандидатов HVT-ND против заражения велогенным изолятом NDV ZJ1 (генотип VIId) у 14-дневных беспатогенных цыплят
Целью данного исследования была оценка эффективности 5 одинарных рекомбинантных конструкций из HVT (vHVT39, vHVT110, vHVT111, vHVT112 и vHVT113), экспрессирующих ген F NDV, против заражения болезнью Ньюкасл с помощью велогенного изолята NDV ZJ1 (генотип VIId), которое проводилось на 14-дневных беспатогенных цыплятах.
Характеристики этих 5 вакцин-кандидатов представлены ниже в таблице 43.

В день D0 72 однодневных беспатогенных цыпленка случайным образом разбивали на 5 групп по 12 птиц и 1 группу из 12 птиц (невакцинированный контроль). Птицам в день D0 вводили подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 6000 кое, как описано ниже в таблице 44. В день D14 птиц внутримышечно заражали велогенным штаммом NDV ZJ1/2000 (генотип VIId) в дозе 5,0 log10 EID50.

Каждую группу наблюдали до и после заражения. Отмечали клинические признаки и смертность после заражения NDV. Через 2 и 4 дня после заражения (pi) брали мазки из ротоглотки, чтобы оценить вирусную нагрузку методом ОТ-ПЦР в реальном времени по методике, описанной Wise et al. (2004; Development of a real-time reverse-transcription PCR for detection of Newcastle disease virus RNA in clinical samples. J Clin Microbiol 42, 329-338).
Степень защиты от смертности и заболеваемости представлена выше в таблице 44. В невакцинированной зараженной контрольной группе G1 наблюдалась полная восприимчивость, что подтверждает большую серьезность заражения. Вакцины давали различную степень защиты от смертности (25-100%) или от заболеваемости (8%-83%). Наибольшую степень защиты давала vHVT110, а наименьшую - vHVT039, тогда как другие кандидаты давали промежуточные результаты. В таблице 44 выше также представлены результаты по выделению вируса из ротоглотки через 2 и 4 дня pi, которые соответствуют результатам по клинической защите. Эти вакцины-кандидаты отличаются по своим промоторам и последовательности гена F. Результаты свидетельствуют, что оба эти параметра важны для разработки оптимальной вакцины-кандидата HVT-ND.
В заключение, результаты данного исследования показывают важное значение промотора и последовательности гена F для эффективности от ND, которую дают HVT-векторные вакцины-кандидаты против ND.
Пример 27. Оценка эффективности против болезни Ньюкасл у двойных конструкций SB1, экспрессирующих VP2 IBDV и F NDV
Целью данного исследования является оценка эффективности двойных конструкций из SB1, экспрессирующих VP2 IBDV и F NDV, против заражения болезнью Ньюкасл.
В день D0 однодневных беспатогенных цыплят случайным образом разбивают на несколько групп по 10-20 птиц, включая вакцинированные и невакцинированные группы. Птицам из вакцинированных групп в день D0 вводят подкожно в шею по 0,2 мл рекомбинантных вакцин, содержащих заданную дозу в 1000-5000 кое. В качестве альтернативы такие же дозы в 0,05 мл можно вводить in ovo за 2 или 3 дня до появления из яйца. В различное время после вакцинации, к примеру, в день D14, D28 или D42 птиц (по меньшей мере одну вакцинированную и одну невакцинированную группу) заражают внутримышечно велогенным штаммом NDV типа Texas GB (генотип II), ZJ1 (генотип VIId), Chimalhuacan (генотип V) в дозе примерно 4,0 log10 EID50 (0,1 мл).
Каждая группа подвергается клиническому наблюдению до и после заражения. Отмечают клинические признаки (заболеваемость) и смертность после заражения NDV. Во всех группах рассчитывают степень клинической защиты. По меньшей мере 90% невакцинированных зараженных беспатогенных птиц должны погибнуть или серьезно заболеть после заражения, чтобы подтвердить серьезность заражения. В различное время после заражения, как-то через 3, 5, 7 и 9 дней после заражения можно брать мазки из ротоглотки и клоаки и оценивать вирусную нагрузку методом ОТ-ПЦР в реальном времени. Наилучшими кандидатами будут те, что индуцируют самые высокие уровни клинической защиты и самые низкие уровни вирусной нагрузки в мазках. Аналогичное исследование можно провести на бройлерах, содержащих материнские антитела к NDV; однако эти материнские антитела могут потенциально защитить невакцинированных птиц, если заражение будет проведено в раннем возрасте. Также можно протестировать двойные конструкции из SB1 в комбинации с другой вакциной или вектором из вируса болезни Марека.
Пример 28. Оценка эффективности против инфекционного бурсита у двойных конструкций SB1, экспрессирующих VP2 IBDV и F NDV
Целью данного исследования является оценка эффективности против IBD у двойных конструкций из SB1, экспрессирующих и VP2 IBDV, и F NDV.
Однодневных беспатогенных цыплят случайным образом разбивают на несколько групп по 10-20 птиц, включая вакцинированные и невакцинированные контроли. Невакцинированные контроли разделяют на 2 подгруппы, включающие зараженных и незараженных птиц. Птицам из вакцинированных групп в день D0 вводят подкожно в шею по 0,2 мл вакцин, содержащих заданную дозу в 1000-5000 кое. В качестве альтернативы такие же дозы в 0,05 мл можно вводить in ovo за 2 или 3 дня до появления из яйца. В различное время после вакцинации, как-то через 14, 21, 28 или 42 дней после вакцинации, всех птиц из вакцинированных групп и подвергаемых заражению контролей заражают при помощи глазных капель (по 0,03 мл, содержащих от 2 до 4 log10 EID50 на птицу) вирулентным IBDV (типа штамма Faragher или стандартного штамма US), очень вирулентным IBDV типа изолята 91-168 или вариантом изолята IBDV типа варианта Е изолята US Delaware.
Каждая группа подвергается клиническому наблюдению до и после заражения. Можно провести вскрытие птиц через 4 или 5 дней после заражения для макроскопической оценки поражений фабрициевой сумки. Вскрытие можно проводить и через 10-11 дней после заражения. Определяют макроскопические и/или гистологические поражения. Кроме того, взвешивают птиц и фабрициевой сумки, рассчитывают соотношения фабрициева сумка/вес тела (вес фабрициевой сумки/вес тела × 100) и сравнивают с таковыми у невакцинированной незараженной группы. Контрольные зараженные беспатогенные птицы должны проявлять клинические признаки и/или иметь значительные макроскопические и/или гистологические поражения и/или должны иметь соотношение фабрициева сумка/вес тела существенно ниже, чем у невакцинированных незараженных контрольных птиц, чтобы подтвердить серьезность заражения. Эффективность вакцины оценивают путем сравнения этих параметров у невакцинированных/зараженных и невакцинированных/незараженных групп. Такое исследование может проводиться на цыплятах-бройлерах, содержащих материнские антитела к IBDV; однако эти материнские антитела могут потенциально защитить невакцинированных птиц, если заражение будет проведено в раннем возрасте. Также можно протестировать двойные конструкции из SB1 в комбинации с другой вакциной или вектором из вируса болезни Марека.
Пример 29. Оценка эффективности против болезни Марека у двойных конструкций SB1, экспрессирующих VP2 IBDV и F NDV
Целью данного исследования является оценка эффективности против болезни Марека у двойных конструкций из SB1, экспрессирующих VP2 IBDV и F NDV.
Однодневных беспатогенных цыплят случайным образом разбивают на несколько групп по 20-50 птиц, включая вакцинированные и невакцинированные контроли. Невакцинированные контроли разделяют на 2 подгруппы, включающие зараженных и незараженных птиц. Птицам из вакцинированных групп в день D0 вводят подкожно в шею по 0,2 мл вакцин, содержащих заданную дозу в 1000-5000 кое. В качестве альтернативы такие же дозы в 0,05 мл можно вводить in ovo за 2 или 3 дня до появления из яйца. В различное время после вакцинации, как-то от 3 до 10 дней после вакцинации, всех птиц из вакцинированных групп и подвергаемых заражению контролей заражают внутрибрюшинно 0,2 мл какого-либо штамма вируса болезни Марека (MDV). Штамм MDV может относиться к нескольким патотипам, таким как вирулентный MDV (vMDV), включая изолят JM или GA22, высоковирулентный MDV (vvMDV) типа изолята RB-1B или Md5, сверхвирулентный (vv+MDV) типа изолята T-King или 648A. Инокулят из штамма MDV для заражения получают путем инфицирования цыплят, выделения клеток крови и замораживания их в жидком азоте в присутствии криопротектора типа DMSO. Перед проведением опытов по вакцинации/заражению устанавливается инфекционная доза-50 для цыплят (CID50) для каждой партии инокулята.
Каждая группа подвергается клиническому наблюдению до и после заражения. Проводится вскрытие птиц по меньшей мере через 7 недель после вакцинации и у каждой птицы проверяется наличие макроскопических поражений болезни Марека. Поражения могут включать, без ограничения, поражения печени, сердца, селезенки, гонад, почек, нервов и мышц. Такое исследование может проводиться на цыплятах-бройлерах, содержащих материнские антитела к MDV. Также можно протестировать двойные конструкции из SB1 в комбинации с другой вакциной против болезни Марека (к примеру, из штамма HVT и/или CVI988 Rispens) или вектором из MDV. Заражение MD может проводиться и посредством контакта между вакцинированными птицами и инфицированными MDV невакцинированными беспатогенными цыплятами.
***
После подробного описания предпочтительных воплощений настоящего изобретения следует иметь в виду, что изобретение, определяемое вышеприведенными примерами, не должно ограничиваться конкретными деталями, изложенными в вышеприведенном описании, так как возможны многие очевидные их вариации, не отходящие от сути или не выходящие за рамки настоящего изобретения.
Все документы, процитированные или приведенные здесь ("приведенные здесь документы"), и все документы, процицитированные или приведенные здесь в виде ссылки, вместе с любыми инструкциями производителей, описаниями, спецификациями продуктов и буклетами для любых продуктов, упомянутых здесь или в любом документе, включенном сюда в виде ссылки, тем самым включаются сюда в виде ссылки и могут использоваться при применении на практике настоящего изобретения.
Реферат
Настоящая группа изобретений относится к биотехнологии и иммунологии. Предложены рекомбинантный вирусный вектор из герпесвируса индейки (HVT), содержащий гетерологичный кодон-оптимизированный полинуклеотид, кодирующий полипептид F вируса болезни Ньюкасл (NDV-F), функционально связанный с промотором SV40, а также иммунологические композиции, для индукции иммунного ответа в животном, и способы индуцирования иммуногенной реакции и вакцинации животных против птичьих патогенов. Иммунологические композиции являются поливалентными и содержат один или несколько рекомбинантных векторов из герпесвируса индейки (HVT), содержащих гетерологичные полинуклеотиды, кодирующие NDV-F, VP2 IBDV, а также один или несколько рекомбинантных векторов SB1, содержащих гетерологичный полинуклеотид, кодирующий NDV-F. Предложенные поливалентные иммуногенные композиции являются эффективными при защите животных от различных патогенов птиц без интерференции и могут быть использованы в вакцинации против птичьих патогенов. 8 н. и 24 з.п. ф-лы, 14 ил., 45 табл., 29 пр.

Комментарии