Нуклеинокислотные и аминокислотные последовательности аденовируса обезьян, векторы, содержащие указанные последовательности, и их применение - RU2604815C2
Код документа: RU2604815C2
Чертежи

































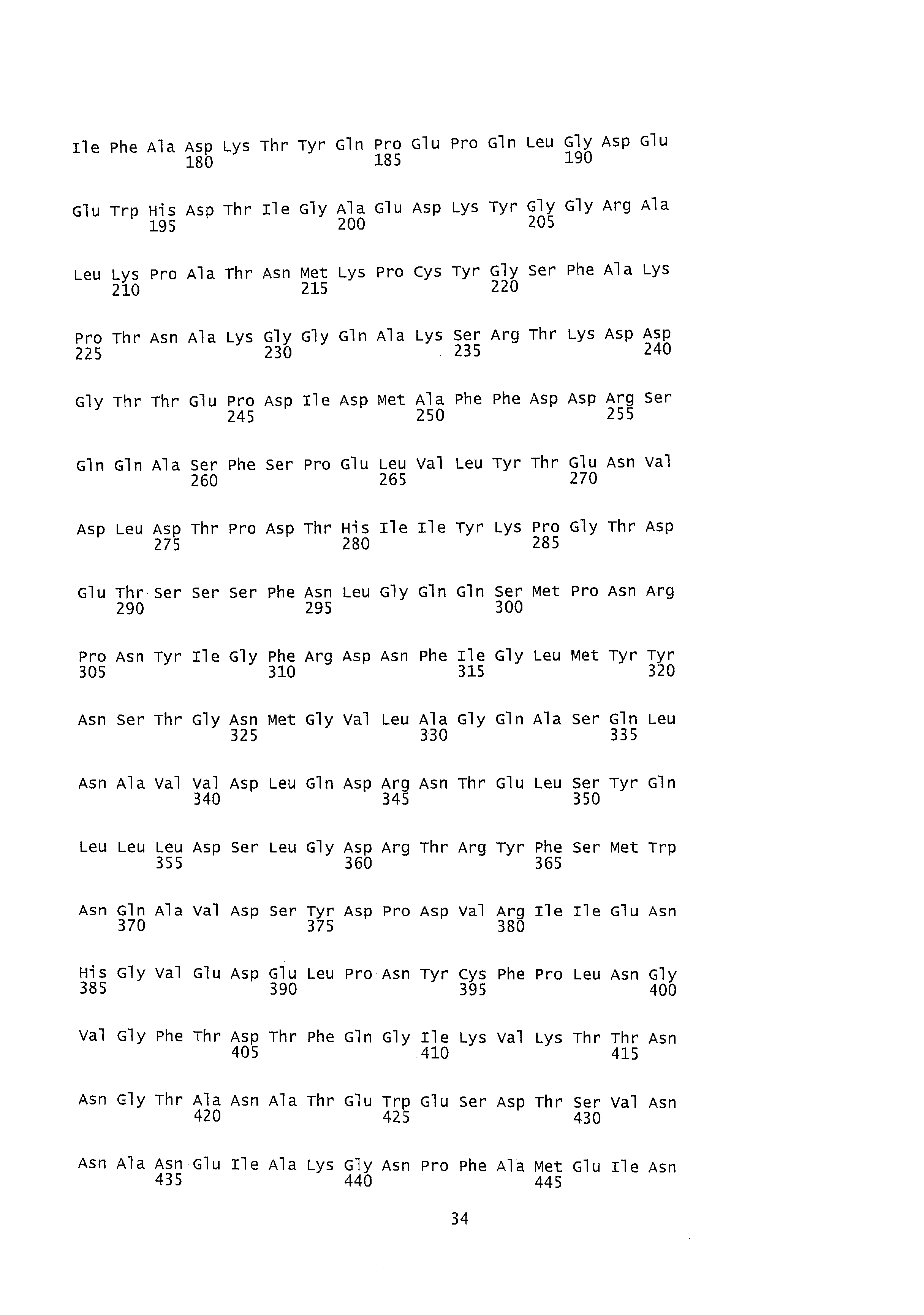




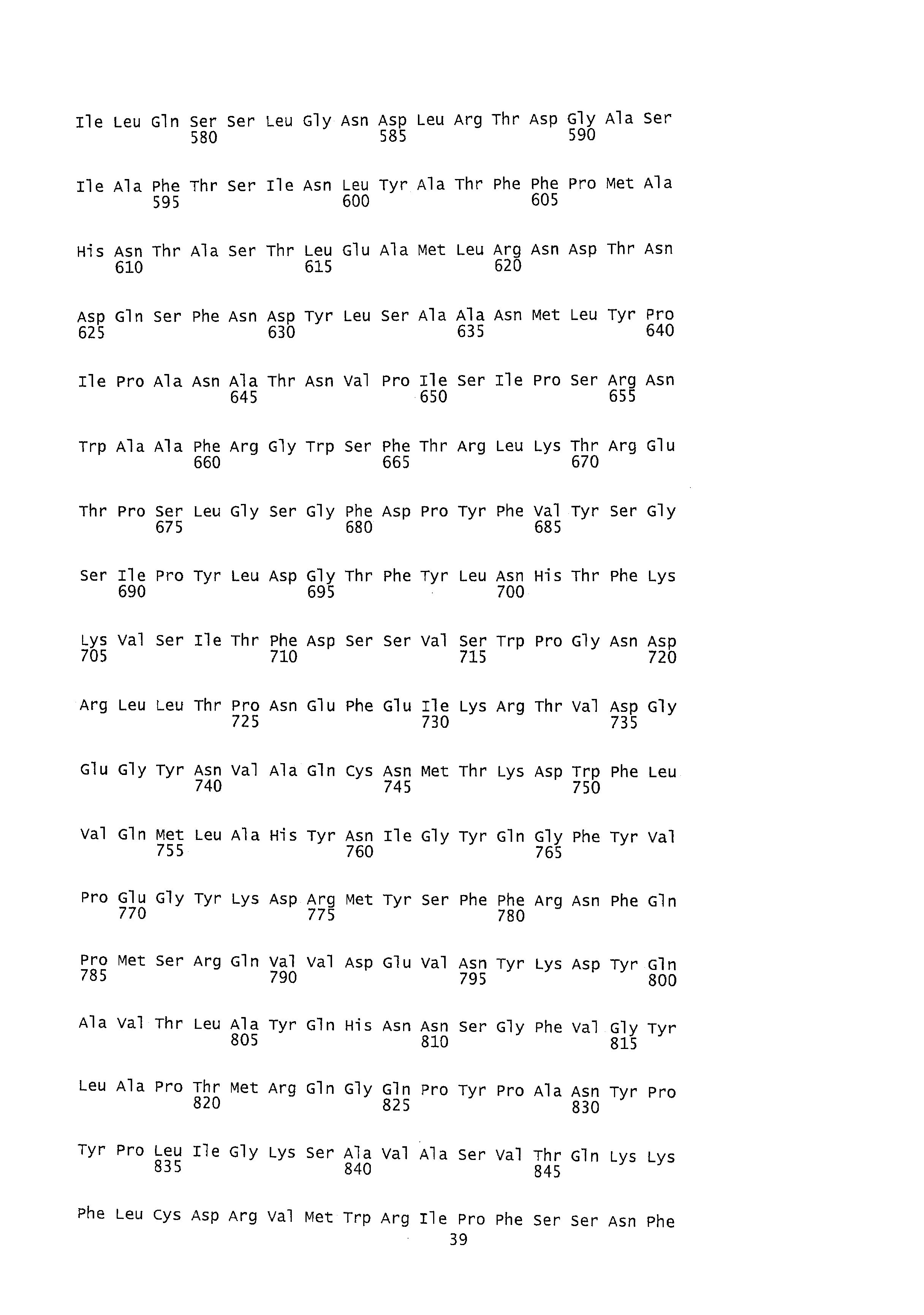























































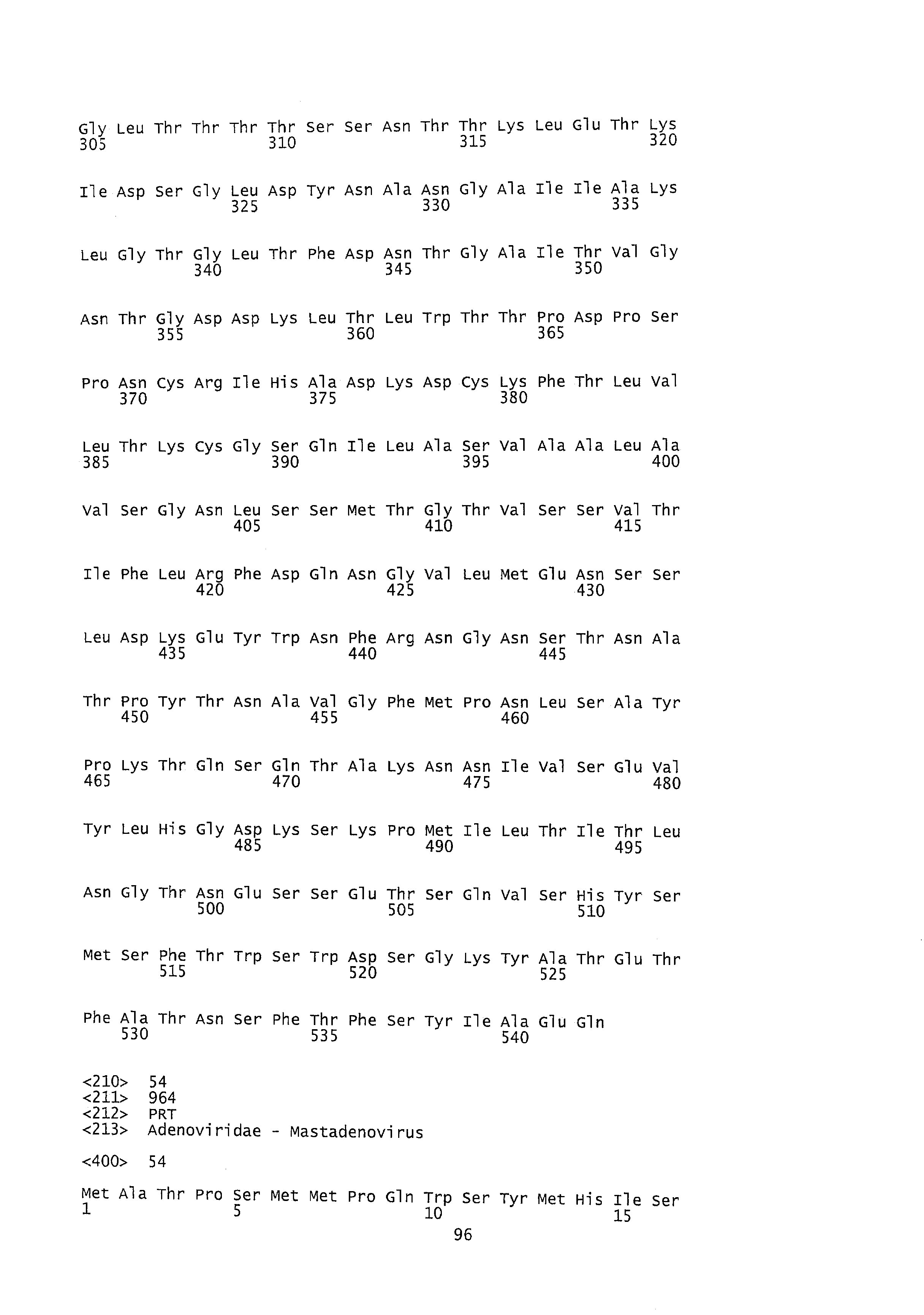



















































































Описание
Настоящее изобретение относится к новым аденовирусным штаммам с улучшенной серопревалентностью. В одном аспекте настоящее изобретение относится к выделенным полипептидам аденовирусных капсидных белков, таких как гексон, пентон и фибер ("fiber") и их фрагменты, и к полинуклеотидам, кодирующим эти полипептиды. Предлагаются также вектор, содержащий выделенный полинуклеотид изобретения, аденовирусы, содержащие выделенные полинуклеотиды или полипептиды изобретения, и фармацевтическая композиция, содержащая указанные вектор, аденовирус, полипептид и/или полинуклеотид. Изобретение относится также к применению выделенных полинуклеотидов, выделенных полипептидов, вектора, аденовирусов и/или фармацевтической композиции для терапии или профилактики заболевания.
Предшествующий уровень техники
Аденовирусы (Ads) составляют большое семейство вирусов с двунитевой ДНК, обнаруженных у земноводных, птиц и млекопитающих; они имеют лишенную оболочки икосаэдрическую капсидную структуру (Straus, Adenovirus infections in humans; The Adenoviruses, 451-498, 1984; Hierholzer et al., J. Infect. Dis., 158: 804-813, 1988; Schnurr and Dondero, Intervirology., 36: 79-83,1993; Jong et al., J. din. Microbiol., 37: 3940-3945: 1999). В отличие от ретровирусов, аденовирусы способны трансдуцировать многочисленные типы клеток некоторых видов млекопитающих, включая как делящиеся, так неделящиеся клетки, не встраиваясь при этом в геном клетки хозяина.
Вообще говоря, аденовирусная ДНК в типичных случаях очень стабильна и остается эписомальной (например, внехромосомной) за исключением тех случаев, когда произошла трансформация или опухолегенез. К тому же аденовирусные векторы могут размножаться с высокими выходами в строго определенных производственных системах, которые легко приспособить к крупномасштабному фармацевтическому производству композиций клинического назначения. Эти характеристики и их хорошо изученная молекулярная генетика делают рекомбинантные аденовирусные векторы подходящими кандидатами для применения в качестве носителей вакцин. Создание рекомбинантных аденовирусных векторов может базироваться на использовании пакующей клеточной линии, способной комплементировать функции аденовирусных генных продуктов, которые были либо делегированы, либо рекомбинированы для подавления генетической функции.
В настоящее время два хорошо изученных серотипа аденовируса человека подгруппы С (т.е. hAd2 и hAd5) широко используются в качестве источников вирусного каркаса для большинства аденовирусных векторов, применяемых для генной терапии. Дефектные по репликации векторы аденовируса человека тестировались также на пригодность в качестве носителей вакцин для доставки множества иммуногенов, полученных от множества возбудителей инфекции. Исследования, проведенные на подопытных животных (например, на грызунах, собаках и приматах, кроме человека), показывают, что рекомбинантные репликационно-дефектные векторы аденовируса человека, несущие трансгены, кодирующие иммуногены, а также другие антигены, вызывают как гуморальный, так и клеточно-опосредованный иммунный ответ на трансгенный продукт. Исследователи сообщают об успешном применении векторов аденовируса человека в качестве носителей вакцин в экспериментальных системах, не предназначенных для человека, либо в соответствии с протоколами иммунизации, использующими высокие дозы рекомбинантных аденовирусных векторов, которые, как прогнозируется, вызывают иммунные ответы, либо в соответствии с протоколами иммунизации, которые предусматривают последовательное введение аденовирусных векторов, полученных от различных серотипов, но несущих такой же трансгенный продукт, в качестве буст иммунизации (Mastrangeli et al., Human Gene Therapy, 7: 79-87 (1996)).
Были сконструированы вирусные векторы на основе человеческого аденовируса 5-го типа (Ad5) для различного применения в генной терапии и в качестве вакцин. Хотя векторы на основе Ad5 показывают очень высокую эффективность на животных моделях, в ходе их клинических испытаний было выявлено, что наличие у человека предсуществующего иммунитета против вируса Ad5 "дикого типа" снижает эффективность трансдукции генов. В частности, четкое снижение эффективности иммунизации было отмечено у субъектов с титрами нейтрализующих антител более 200, которые участвовали в клиническом испытании вакцины на основе векторов Ad5. Наиболее экстенсивная характеристика вакцины на основе векторов Ad5 была получена в ходе STEP-испытания вакцины против ВИЧ, проведенного фирмой Merck (Moore JP et al. Science. 2008 May 9; 320 (5877):753-5). Испытание вакцины базировалось на совместной инъекции 3-х векторов Ad5, экспрессирующих различные антигены ВИЧ, субъектам с высоким риском ВИЧ-инфекции для доказательства обоснованности концепции. Поразительно, но данные показали скорее повышение уровня инфицированности ВИЧ у вакцинированных субъектов с предсуществующим анти-Ad5 иммунитетом, чем защитный эффект. Хотя механизм этого парадоксального наблюдения еще не ясен, его результаты вызвали дополнительные вопросы о безопасности и эффективности векторов на основе аденовируса человеческого происхождения для применения в качестве вакцины для здоровых субъектов. Если суммировать все полученные на сегодняшний день результаты различных клинических испытаний вакцин и генной терапии, таких как испытания векторов Ad5, то все они свидетельствуют о возрастающей необходимости получения аденовируса, характеризующегося очень низким или полным отсутствием предсуществующего иммунитета у человека.
Краткое изложение сущности изобретения
В первом аспекте настоящего изобретения предложен выделенный полинуклеотид, который кодирует аденовирусный белок фибер или его функциональное производное и который выбирается из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно любой из SEQ ID NO:14-19, 50 и 53;
(b) полинуклеотида, кодирующего функциональное производное полипептида согласно любой из SEQ ID NO:14-19, 50 и 53, в котором указанное функциональное производное содержит делецию, инсерцию и/или замену одного или более аминокислотных остатков, и
(c) полинуклеотида, кодирующего функциональное производное имеющее аминокислотную последовательность, которая, по меньшей мере, на 85% идентична по всей своей длине любой аминокислотной последовательности из SEQ ID NO:14-19, 50 и 53.
В следующем аспекте настоящее изобретение относится к выделенному полинуклеотиду, который кодирует аденовирусный белок гексон или его функциональное производное и который выбирается из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно любой из SEQ ID NO:20-25, 51 и 54;
(b) полинуклеотида, кодирующего функциональное производное полипептида согласно любой из SEQ ID NO:20-25, 51 и 54, в котором указанное функциональное производное содержит делецию, инсерцию и/или замену одного или более аминокислотных остатков, и
(c) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 95% идентична по всей своей длине любой аминокислотной последовательности из SEQ ID NO:20-25, 51 и 54.
Предлагается также выделенный полинуклеотид, который кодирует аденовирусный белок пентон или его функциональное производное и который выбирается из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно любой из SEQ ID NO: 26-31, 52 и 55;
(b) полинуклеотида, кодирующего функциональное производное полипептида согласно любой из SEQ ID NO: 26-31, 52 и 55, в котором указанное функциональное производное содержит инсерцию, вставку и/или замену одного или более аминокислотных остатков, и
(c) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 85% идентична по всей своей длине любой аминокислотной последовательности из SEQ ID NO: 26-31, 52 и 55.
Изобретение относится также к полинуклеотиду, содержащему, по меньшей мере, один из выделенных полинуклеотидов согласно изобретению, как описано выше. Кроме того, изобретение предлагает выделенный аденовирусный капсидный полипептид, кодируемый выделенным полинуклеотидом согласно изобретению, или его функциональное производное.
В следующем аспекте изобретения предложен вектор, содержащий выделенный полинуклеотид согласно изобретению.
Предлагается также рекомбинантный аденовирус, предпочтительно репликационно-некомпетентный аденовирус, содержащий выделенный полинуклеотид согласно изобретению и/или, по меньшей мере, один выделенный аденовирусный капсидный полипептид согласно изобретению.
Следующим аспектом изобретения является композиция, содержащая адьювант и, по меньшей мере, один из следующих компонентов (i)-(iv):
(i) один или более выделенных аденовирусных капсидных полипептидов изобретения;
(ii) выделенный полинуклеотид по изобретению;
(iii) вектор по изобретению;
(iv) рекомбинантный вирус по изобретению
и, необязательно, фармацевтически приемлемое вспомогательное вещество.
Кроме того, изобретение относится к клетке, содержащей, по меньшей мере, один из следующих компонентов:
(i) один или более выделенных аденовирусных капсидных полипептидов изобретения;
(ii) выделенный полинуклеотид по изобретению;
(iii) вектор по изобретению;
(iv) рекомбинантный вирус по изобретению.
Следующий аспект изобретения касается применения выделенного аденовирусного капсидного полипептида изобретения; выделенного полинуклеотида изобретения; вектора изобретения; рекомбинантного аденовируса изобретения и/или композиции изобретения для терапии или профилактики заболевания.
Подробное описание изобретения
Прежде чем перейти к подробному описанию изобретения, необходимо подчеркнуть, что настоящее изобретение не ограничивается описанными здесь конкретными методиками, протоколами и реагентами, поскольку все они могут варьировать. Следует также иметь в виду, что употребляемая в описании терминология служит только цели описания частных вариантов осуществления изобретения и не имеет целью ограничить объем настоящего изобретения, который ограничивается только приложенной формулой изобретения. Если нет указания на что-либо иное, то все употребляемые здесь технические и научные термины имеют значения, общеизвестные специалисту в данной области техники.
Употребляемые в описании термины предпочтительно трактуются так же, как они описаны в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)" [Многоязычный словарь биотехнологических терминов: рекомендации IUPAC (Международного Союза теоретической и прикладной химии)], Leuenberger, H.G.W, Nagel, В. и Kibl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland) и как они описаны в "Pharmaceutical Substances: Syntheses, Patents, Applications" [Фармацевтические вещества: синтез, патенты, применение], Axel Kleemann & Jurgen Engel, изд. Thieme Medical Publishing, 1999; the "Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals" [Merck-Индекс: Энциклопедия химических веществ, лекарственных препаратов и биологических веществ], изд. Susan Budavari et al., CRC Press, 1996, и the United States Pharmacopeia-25/National Formulary-20, опубл. the United States Pharmcopeial Convention, Inc., Rockville Md., 2001.
В нижеследующем подробном описании и формуле изобретения, если контекст не требует другого, слова включать, содержать ("comprise") и производные от них, такие как включает, содержит ("comprises") и включающий, содержащий ("comprising"), следует понимать как включение определенного признака, целого или стадии либо группы признаков, целого или стадий, а не исключение любого другого признака, целого или стадии либо группы признаков, целого или стадий. В нижеследующих параграфах различные аспекты изобретения раскрываются более подробно. Каждый раскрываемый аспект может комбинироваться с любым другим аспектом или аспектами, если четко не указано обратное. В частности, любой признак, описанный как предпочтительный или выгодный, может комбинироваться с любым другим признаком или признаками, описываемыми как предпочтительные или выгодные.
В тексте описания цитируется ряд документов. Каждый из документов (включая все патенты, патентные заявки, научные публикации, спецификации производителя, инструкции и др.), независимо от того, упоминается он выше или ниже, включен в полном объеме в настоящую заявку в виде ссылки. Ничто здесь не должно быть истолковано как признание того, что изобретатели не вправе датировать такое раскрытие задним числом на основании изобретения предшествующего уровня техники.
Ниже дается толкование терминов, часто употребляемых в настоящем описании. Каждый из этих терминов в каждом случае его употребления в остальной части описания имеет значение, соответствующее его толкованию, и предпочтительные значения.
Вообще говоря, аденовирусный геном хорошо изучен. В общей организации аденовирусного генома отмечена определенная консервативность, заключающаяся в сходном позиционировании специфических открытых рамок считывания, например, в местах локализации Е1А, Е1В, Е2А, Е2В, Е3, Е4, LI, L2, L3, L4 и L5 генов каждого вируса. Каждый конец аденовирусного генома содержит последовательность, известную как обращенный концевой повтор (ITR), который необходимы для репликации вируса. Вирус содержит также вирус-кодируемую протеазу, которая необходима для процессинга некоторых из структурных белков, требующихся для продукции инфекционных вирионов. В основе описания структуры аденовирусного генома лежит порядок экспрессии вирусных генов после трансдукции клетки хозяина. Если говорить более конкретно, то вирусные гены относятся к ранним (Е) или поздним (L) генам в зависимости от того, когда происходит транскрипция - до или после начала репликации ДНК. В ранней фазе трансдукции Е1А, Е1В, Е2А, Е2В, Е3 и Е4 гены аденовируса экспрессируются для подготовки клетки хозяина к вирусной репликации. В поздней фазе инфекции экспрессия поздних генов L1-L5, которые кодируют структурные компоненты вирусных частиц, активируется.
В нижеследующей таблице 1 приводится перечень последовательностей, упомянутых в настоящем изобретении.
В контексте описания термин "выделенный" относится к молекуле, не содержащей, в основном, других молекул, с которыми она может связываться естественным образом. Таким образом, выделенная молекула - это молекула, которая не содержит других молекул, способных естественным образом взаимодействовать или контактировать с ней в организме живого животного, т.е. вне экспериментальных условий.
В контексте описания термины "белок", "пептид", "полипептид", "пептиды" и "полипептиды" употребляются взаимозаменяемо. Эти термины относятся как к встречающимся в природе пептидам, например, к встречающимся в природе белкам, так и к синтезированным пептидам, которые могут включать встречающиеся в природе или не встречающиеся в природе аминокислоты. Пептиды могут быть химически модифицированными путем модификации боковой цепи или свободного амино- или карбоксильного конца встречающейся или не встречающейся в природе аминокислоты. Такая химическая модификация включает введение дополнительных химических веществ, а также модификацию функциональных групп в боковых цепях аминокислоты, например, гликозилирование. Пептид является полимером, предпочтительно содержащим, по меньшей мере, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или, по меньшей мере, 100 аминокислот, наиболее предпочтительно, по меньшей мере, 8 или, по меньшей мере, 30 аминокислот. Поскольку раскрываемые в описании полипептиды и белки имеют аденовирусное происхождение, предпочтительно, чтобы молекулярная масса выделенного полипептида или белка, используемого в изобретении, не превышала 200 кДа.
Термин "вектор" в контексте описания включает любые векторы, известные специалисту в данной области техники, такие как плазмидные векторы, космидные векторы, фаговые векторы, такие как фаг лямбда, вирусные векторы, такие как аденовирусные (Ad) векторы (например, не реплицирующиеся векторы Ad5, Ad11, Ad26, Ad35, Ad49, ChAd3, ChAd4, ChAd5, ChAd7, ChAd8, ChAd9, ChAd10, ChAd11, ChAd16, ChAd17, ChAd19, ChAd20, ChAd22, ChAd24, ChAd26, ChAd30, ChAd31, ChAd37, ChAd38, ChAd44, ChAd63 и ChAd82 или репликационно-компетентные векторы Ad4 и Ad7, известные из предшествующего уровня техники (например, из WO 2005/071093 А2)), векторы аденоассоциированных вирусов (AAV) (например, AAV 5-го типа), векторы альфавирусов (например, вируса Венесуэльского лошадиного энцефалита (VEE), вируса Синдбис (SIN), вируса леса Семлики (SFV) и VEE-SIN химеры), векторы герпес-вируса, векторы вируса кори, векторы вируса оспы (например, вируса осповакцины), модифицированного вируса осповакцины Ankara (MVA), NYVAC (выделенного из штамма Copenhagen осповакцины) и векторы вируса оспы птиц (avipox): векторы вируса оспы канареек (ALVAC) и вируса оспы пернатой дичи (FPV)); векторы вируса везикулярного стоматита, вирусоподобные частицы или споры бактерий. Термин "вектор" включает также векторы экспрессии, векторы для клонирования и векторы, пригодные для генерации рекомбинантных вирусов в клетках хозяина.
Термин "экспрессионная кассета" относится к молекуле нуклеиновой кислоты, которая содержит, по меньшей мере, одну нуклеинокислотную последовательность, которая должна быть экспрессирована, а также последовательности, контролирующие ее транскрипцию и трансляцию. Замена экспрессионной кассеты заставляет вектор, в который она встроена, направлять экспрессию другой последовательности или комбинации последовательностей. Благодаря тому, что сайты рестрикции предпочтительно конструируются так, чтобы они располагались на концах 5′ и 3′, кассета может легко встраиваться, удаляться или заменяться другой кассетой. Предпочтительно экспрессионная кассета включает цис-регулирующие элементы для эффективной экспрессии данного гена, такие как промотор, сайт инициации и/или сайт полиаденилирования, что подробно описывается ниже.
Термин "антитело" относится как к моноклональным, так и к поликлональным антителам, т.е. к любому белку-иммуноглобулину или его части, способной связывать антиген или гаптен. Антигенсвязывающие части могут быть получены методом рекомбинантных ДНК или ферментативным либо химическим расщеплением интактных антител. В некоторых вариантах осуществления изобретения антигенсвязывающие части включают: Fab, Fab′, F(ab′)2, Fd, Fv, dAb и варианты участка, определяющего комплементарность (CDR), одноцепочечные антитела (scFv), химерные антитела, гуманизированные антитела, димерные антитела и полипептиды, которые содержат, по меньшей мере, часть антитела, достаточную для придания полипептиду специфических антигенсвязывающих свойств.
Введение иммуногена/антигена для индуцирования/генерирования иммунного ответа у млекопитающего в контексте настоящего изобретения обозначается термином "прайминг", а введение иммуногена/антигена для усиления иммунного ответа на указанный иммуноген/антиген, например, конкретный патоген (такой как вирион или вирусный патоген, антиген патогенной бактерии или опухолевый антиген) у млекопитающего обозначается термином "бустинг". Выражение "гетерологичный прайм-буст" означает, что вектор для индуцирования/генерирования иммунного ответа (прайминг) у млекопитающего и вектор для усиления иммунного ответа (бустинг) у млекопитающего различны. "Гетерологичный прайм-буст" целесообразен в том случае, если организм субъекта, например, пациента, наработал антитела против первого вектора и требуется бустинг.Поэтому в предпочтительном варианте осуществления гетерологичного прайм-буста могут использоваться два разных аденовируса, например, для вакцинации и/или для генной терапии. В этом контексте первый и второй аденовирусы будут достаточно разными, если образование антител, индуцируемое в ходе прайминга первым аденовирусом, не препятствует прониканию более 70% или предпочтительно более 80% частиц второго аденовируса, введенного для бустинга, в ядро клеток животного, которое подверглось праймингу и бустингу.
Термин "репликационно-компетентный" рекомбинантный аденовирус (AdV) относится к аденовирусу, который способен реплицироваться в клетке хозяина в отсутствие любых рекомбинантных хелперных белков, содержащихся в клетке. Предпочтительно "репликационно-компетентный" аденовирус содержит следующие интактные или функционально существенные ранние гены: Е1А, Е1В, Е2А, Е2В, Е3 и Е4. Аденовирусы дикого типа, выделенные от конкретного животного, будут репликационно-компетентны в этом животном.
Термин "репликационно-дефектный" рекомбинантный AdV относится к аденовирусу, который не способен к репликации, поскольку он сконструирован таким образом, что содержит, по меньшей мере, одну функциональную делецию, т.е. делецию, которая нарушает функцию гена без его полного удаления, например, за счет введения искусственных стоп-кодонов, делеции или мутации активных сайтов или доменов взаимодействия, мутации или делеции регуляторной последовательности гена и др., либо с полным удалением гена, кодирующего генный продукт, являющийся существенным для вирусной репликации, например, один или более аденовирусных генов, выбранных из Е1, Е2, Е3 и Е4. Векторы рекомбинантного аденовируса шимпанзе по изобретению предпочтительно являются дефектными по репликации.
Термин "идентичность" или "идентичный" в контексте полинуклеотида, полипептида или последовательностей белков относится к количеству остатков в двух последовательностях, которые, будучи выровненными для максимального соответствия, являются идентичными. Если говорить более конкретно, то процент идентичности двух последовательностей (нуклеинокислотных или аминокислотных последовательностей) - это число точных соответствий между двумя выровненными последовательностями, деленное на длину более короткой последовательности и умноженное на 100. Инструменты выравнивания, которые могут использоваться для выравнивания двух последовательностей, хорошо известны специалисту в данной области техники и доступны, например, в Интернете, к примеру, ClustalW (www.ebi.ac.uk/clustalw) или Align (http://www.ebi.ac.uk/emboss/align/index.html). Выравнивание между двумя последовательностями может проводиться с использованием стандартных настроек: для Align EMBOSS::needle - предпочтительно: Matrix: Blosum62, Gap Open 10.0, Gap Extend 0.5. Специалистам в данной области техники должно быть понятно, что может возникнуть необходимость введения пробелов в ту или другую последовательность для достижения удовлетворительного выравнивания. "Наилучшее выравнивание последовательностей" между двумя полипептидами определяется как такое выравнивание, которое дает наибольшее количество выровненных идентичных остатков.
Аденовирусы
Аденовирус (Ad) - это не имеющий оболочки, икосаэдрический вирус, который был идентифицирован у некоторых птиц- и млекопитающих-вирусоносителей. Аденовирусы человека (hAds) относятся к роду Mastadenovirus, который включает все известные вирусы человека и многие Ads животного (например, крупного рогатого скота, свиней, собак, грызунов, лошадей, обезьян и овец) происхождения. Аденовирусы человека в большинстве случаев подразделяются на шесть подгрупп (A-F) по ряду биологических, химических, иммунологических и структурных критериев, которые включают гемагглютинирующие свойства эритроцитов крыс и макак-резусов, гомологию ДНК, паттерн расщепления ферментами рестриктазами, процентное содержание G+C и онкогенность (Straus, 1984: в: The Adenoviruses, ed. H. Ginsberg, pp.451-498, New York: Plenus Press, and Horwitz, 1990; в: Virology, ed. B.N. Fields and D.M. Knipe, pp.1679-1721).
Аденовирусный вирион имеет икосаэдрическую симметрию и, в зависимости от серотипа, диаметр от 60 до 90 нм. Икосаэдрический капсид содержит три основных белка - гексон (II), основание пентона (III) и узловатый фибер (IV) (W.С. Russel, J. Gen. Virol., 81: 2573-2604 (2000)). Одним аспектом предсуществующего иммунитета, который наблюдается у человека, является гуморальный иммунитет, который может приводить к продукции и персистенции антител, специфичных к аденовирусным белкам. Гуморальный иммунный ответ, вызываемый аденовирусом, направлен главным образом против трех основных структурных белков - гексона, пентона и фибера.
Количество выявленных на сегодняшний день различных серотипов аденовируса человека составляет 51; все они сгруппированы в подгруппы на основе их гемагглютинирующих свойств и биофизических и биохимических критериев. Из опубликованных отчетов следует, что титры антител против множества серотипов являются общими (Dambrosio, Е. (1982) J. Hyg. (London) 89: 209-219) и что значительная часть титров показывает нейтрализующую активность.
Как уже упоминалось выше, рекомбинантные аденовирусы находят применение в генной терапии и в качестве вакцин. Вирусные векторы на основе аденовируса шимпанзе являются альтернативой использованию векторов аденовируса (Ad) человека для создания генетических вакцин (Farina SF, J Virol. 2001 Dec; 75(23): 11603-13.; Fattori Е, Gene Ther. 2006 July; 13(14): 1088-96). Аденовирусы, выделенные от шимпанзе, являются близкородственными с аденовирусами, выделенными от человека, о чем свидетельствует их эффективная репродукция в клетках человеческого происхождения. Однако коль скоро аденовирусы человека и шимпанзе являются "ближайшими родственниками", можно предположить, что между этими двумя видами вирусов существует серологическая перекрестная реактивность.
Это предположение подтвердилось, когда были выделены и охарактеризованы аденовирусы шимпанзе. Тем не менее, изоляты аденовируса шимпанзе показали пониженную перекрестную реактивность с общераспространенными серотипами эпитопов человеческого аденовируса. Поэтому аденовирус шимпанзе (также обозначенный в настоящем описании аббревиатурой "ChAd" [аденовирус обычного шимпанзе] и "PanAd" [аденовирус бонобо]) обеспечивает основу для снижения побочных эффектов, связанных с предсуществующим иммунитетом у человека к общераспространенным серотипам человеческих аденовирусов. Однако имеющий значение от низкого до среднего нейтрализующий титр антител против выделенных к настоящему времени аденовирусов шимпанзе обнаруживается в подгруппах человеческих сывороток, и, следовательно, все известные серотипы аденовирусов шимпанзе до некоторой степени все же нейтрализуются сыворотками крови человека.
В рамках настоящего изобретения сделано неожиданное открытие о возможности выделения новых штаммов аденовирусов шимпанзе, а именно ChAd55, ChAd73, ChAd83, ChAdl46, ChAd147, выделенных от шимпанзе обыкновенного (Pan troglodytes), и PanAd1, PanAd2 и PanAd3, выделенных от бонобо (Pan paniscus). Все эти новые штаммы не показывают определяемой серопревалентности у человека, т.е. эти аденовирусные штаммы составляют исключение из описанных к настоящему времени аденовирусов шимпанзе в силу того, что все протестированные человеческие сыворотки дали полностью негативные результаты на присутствие нейтрализующих антител. В этом контексте термин "нейтрализующее антитело" относится к антителу, которое связывается с эпитопом аденовируса и предотвращает возникновение продуктивной инфекции в клетке хозяина или предупреждает трансдукцию целевой клетки репликационно-некомпетентным вектором, экспрессирующим трансген, например, аденовирусная ДНК способна проникать в клетку хозяина. В то время как нейтрализующие антитела были выявлены ко всем аденовирусам шимпанзе, описанным в предшествующем уровне техники, новые типы аденовирусов ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 PanAd1, PanAd2 и PanAd3 характеризуются полным отсутствием у человека предсуществующего нейтрализующего антитела, направленного против указанных типов аденовирусов. Таким образом, эти аденовирусы являются ценным медицинским инструментом, который может использоваться, например, для иммунизации и/или генной терапии.
Как подробно рассматривается ниже, изобретение в одном аспекте предлагает новые последовательности аденовирусных капсидных белков, которые представляют большинство экспонированных на поверхности аденовирусных эпитопов, а именно гексона, пентона и фибера. Как уже упоминалось выше, в сыворотках крови человека не содержится нейтрализующих антител, специфичных к вирусам согласно изобретению. Таким образом, одним преимуществом вышеупомянутых новых последовательностей белков аденовируса шимпанзе - гексона, пентона и фибера - является то, что последовательности этих белков могут использоваться для усиления аденовирусов предшествующего уровня техники, сконструированных, например, для медицинских целей. Например, капсидные белки или их функциональные фрагменты согласно настоящему изобретению могут использоваться, например, для замены соответственно одного или более основных структурных капсидных белков или их функциональных фрагментов различных аденовирусов, например, аденовируса предшествующего уровня техники, для получения улучшенных рекомбинантных аденовирусов с пониженной серопревалентностью у человека. Поскольку новые аденовирусы изобретения, а также аденовирусы, переконструированные, как описано, при введении их человеку не будут сталкиваться со значительным ингибиторным иммунным ответом, их общая трансдукционная эффективность и инфективность усилятся. Это позволяет предположить, что такие улучшенные аденовирусы могут служить, например, более эффективными вакцинами, поскольку их проникновению в клетки хозяина и экспрессии антигенной кассеты не будет препятствовать любой значительный титр нейтрализующих антител. К тому же, как показано в примерах, активный иммунный ответ против HIV(BH4)-gag индуцировался даже у незараженных мышей, вакцинированных рекомбинантным HIV-gag-кодирующим аденовирусом, который содержит гексон, пентон и фибер ChAd55, ChAd73, ChAd83, ChAd146, ChAd147, PanAd1, PanAd2 или PanAd3 изолята. Иммунный ответ, индуцированный аденовирусами ChAd55-gag, ChAd73-gag, ChAd83-gag, ChAd146-gag, ChAd147-gag, PanAd1-gag, PanAd2-gag и PanAd3-gag, сравним с иммунным ответом, наблюдавшимся в случае наиболее активных векторов, сконструированных до настоящего времени на основе рекомбинантного человеческого Ad5 вектора предшествующего уровня техники, экспрессирующего HIV-gag белок [см. данные иммуноферментного спот-анализа (ELIspot assay) на фиг.5A, 5B, 5C].
Как упоминалось ранее, гуморальный иммунный ответ, индуцируемый аденовирусом, направлен главным образом против трех основных аденовирусных структурных белков - гексона, пентона и фибера; все эти белки имеют полипептидные последовательности, которые являются частью аденовирусного капсида и которые экспонируются на наружной поверхности вирусной частицы (см. также: Madisch I. et al., J. Virol. 2005 Dec; 79(24): 15265-76; а также: Madisch I. et al., J Virol. 2007 Aug; 81(15):8270-81; и Pichla-Gollon SL et al., J. Virol. 2007 Feb; 81(4): 1680-9).
Как видно из множественного выравнивания последовательностей, показанного на фиг.1, изоляты новых аденовирусов группы PanAd1, PanAd2, PanAd3, ChAd55, ChAd73, ChAd83, ChAd146 и ChAd147 согласно настоящему изобретению совместно используют очень схожие последовательности белка гексона. При выравнивании отмечены и гипервариабельные области (HVR), которые локализуются в петлях на верхней части молекулы гексона, лежащих на наружной поверхности вириона и занимающих большую часть его поверхности (см. Jophn J. Rux et al., J. of Virology, Sept. 2003, Vol.77, No.17). Взаимное сходство последовательностей других капсидных белков (фибера и пентона) новых аденовирусов шимпанзе показано соответственно на фиг.2 и 3. Предполагается, что все три структурных капсидных белка участвуют в снижении серопревалентности, и поэтому могут использоваться независимо друг от друга или в комбинации друг с другом для подавления аффиности аденовируса к предсуществующим нейтрализующим антителам, например, для создания рекомбинантного химерного аденовируса с пониженной серопревалентностью.
Таким образом, в первом аспекте изобретение предлагает выделенный полинуклеотид, который кодирует аденовирусный белок фибер или его функциональное производное и который выбирается из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно любой из SEQ ID NO:14-19, 50 и 53, т.е. SEQ ID NO:14, 15, 16, 17, 18, 19, 50 или 53;
(b) полинуклеотида, кодирующего функциональное производное полипептида согласно любой из SEQ ID NO:14-19, 50 и 53, т.е. SEQ ID NO:14, 15, 16, 17, 18, 19, 50 или 53, в котором указанное функциональное производное содержит делецию, инсерцию и/или замену одного или более аминокислотных остатков, и
(c) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85% и наиболее предпочтительно, по меньшей мере, на 99% идентична по всей своей длине любой аминокислотной последовательности из SEQ ID NO:14-19, 50 и 53, т.е. SEQ ID NO:14, 15, 16, 17, 18, 19, 50 или 53.
Под "аденовирусным белком фибер" имеется в виду белок, имеющий форму нити с узловым утолщением «Knobbed fiber» (IV), который содержится в аденовирусе. В предпочтительном варианте выделенный полинуклеотид, описанный в первом аспекте изобретения и в предпочтительных вариантах его осуществления, раскрываемых ниже, кодирует белок фибер или его функциональное производное, которое выполняет ту же функцию, что и фибер или его фрагмент в инфекционном аденовирусном вирионе. Таким образом, рекомбинантный аденовирус, содержащий указанный белок фибер или функциональное производное фибера предпочтительно в качестве капсидного белка, способен к проникновению в клетку хозяина. Его можно легко определить, если рекомбинантный аденовирус может проникать в клетку хозяина. Например, после контактирования клетки хозяина с аденовирусом рекомбинантную клетку хозяина можно промыть и подвергнуть лизису, а затем с помощью, например, соответствующего гибридизационного зонда, специфичного к аденовирусной РНК и/или ДНК, можно определить, находится ли аденовирусная РНК и/или ДНК в клетке хозяина. Альтернативно или в дополнение к этому, клетку хозяина после приведения ее в контакт с рекомбинантным аденовирусом можно промыть, подвергнуть лизису и протестировать на специфичные к аденовирусу антитела, например, с помощью вестерн блот-анализа. В еще одной альтернативе можно провести наблюдение, например, in vivo, за тем, экспрессирует ли клетка хозяина генный продукт, например, флуоресцентный белок при инфицировании рекомбинантным аденовирусом, содержащим соответствующую экспрессионную кассету для экспрессии генного продукта в клетке хозяина.
Предпочтительно также, чтобы белок фибер и его функциональное производное показывали сродство к аденовирусному белку пентону, например, к SEQ ID NO:26-31, 52 и/или 55. Средний специалист хорошо знает, как протестировать белок-белковое сродство. Чтобы определить, способен ли первый белок к связыванию второго белка, такого как пентон аденовируса шимпанзе, можно применить, например, генетический метод дрожжевой двугибридный анализ или биохимический метод, такой как метод pull-down (аналогичен методу иммуноосаждения, но вместо антитела использует меченый иммобилизованный белок-приманку), метод твердофазного иммуноферментного анализа (ELISA), метод, основанный на флуоресцентно-активированной сортировке клеток (FACS), или метод плазменного резонанса. В случае применения методов pull-down или плазменного резонанса может быть целесообразным слияние, по меньшей мере, одного из белков с аффинной меткой, такой HIS-tag, GST-tag или др., что хорошо известно в биохимии. Кроме того, аденовирусный белок фибер в гликозилированной форме способен к тримеризации. Поэтому предпочтительно также, чтобы белок фибер или его фрагмент, кодируемый полинуклеотидом согласно первому аспекту изобретения, был способен к гликозилированию и/или к образованию тримера.
В контексте настоящего описания выражение "функциональное производное" белка или полипептида в общем смысле относится к модифицированной версии белка или полипептида, в которой, например, одна или более аминокислот белка могут быть делегированы, вставлены, модифицированы и/или заменены. Производное является функциональным, если, как упоминалось выше, химерный аденовирус, содержащий функциональное производное в своем капсиде, способен инфицировать клетку хозяина. Кроме того, в контексте "функционального производного" встраивание относится к инсерции одной или более аминокислот в исходный полипептид или белок.
Предпочтительно, чтобы функциональное производное не содержало более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100 аминокислотных замен (т.е. делегированных, встроенных, модифицированных и/или замещенных аминокислот). В другом варианте предпочтительно, чтобы было изменено (т.е. делегировано, встроено, модифицировано и/или заменено) не более 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15% или не более 20% (наиболее предпочтительно - не более 5%) всех аминокислот белка или полипептида. Аминокислоты белка или полипептида могут быть также модифицированы, например, химически модифицированы. Например, боковая цепь либо свободный аминоконец (N-конец) или карбоксильный конец (С-конец) аминокислоты белка или полипептида могут быть модифицированы, например, гликозилированием, амидированием, фосфорилированием, убиквитинированием и др. Химическая модификация может также иметь место in vivo, например, в клетке-хозяине, что хорошо известно в уровне техники. Например, соответствующий мотив химической модификации, например, мотив гликозилирования последовательности, присутствующий в аминокислотной последовательности белка, может вызвать гликозилирование белка. Замена в производном может быть консервативной или неконсервативной, предпочтительно консервативной заменой. В некоторых вариантах осуществления изобретения замена включает также обмен встречающейся в природе аминокислоты на аминокислоту, не встречающуюся в природе. Консервативная замена предусматривает замену одной аминокислоты другой аминокислотой, обладающей химическим свойством, аналогичным такому же свойству заменяемой аминокислоты. Предпочтительно консервативная замена является заменой, выбираемой из группы, состоящей из:
(i) замены одной основной аминокислоты другой, отличающейся от нее, основной аминокислотой;
(ii) замены одной кислой аминокислоты другой, отличающейся от нее, кислой аминокислотой;
(iii) замены одной ароматической аминокислоты другой, отличающейся от нее, ароматической аминокислотой;
(iv) замены одной неполярной алифатической аминокислоты другой, отличающейся от нее, неполярной алифатической аминокислотой, и
(v) замены одной полярной, не несущей заряда аминокислоты другой, отличающейся от нее, полярной, не несущей заряда аминокислотой.
Основная аминокислота предпочтительно выбирается из группы, состоящей из аргинина, гистидина и лизина. Кислой аминокислотой предпочтительно является аспартат или глутамат. Ароматическая аминокислота предпочтительно выбирается из группы, состоящей из фенилаланина, тирозина и триптофана. Неполярная алифатическая аминокислота предпочтительно выбирается из группы, состоящей из глицина, аланина, валина, лейцина, метионина и изолейцина. Полярная, не несущая заряда аминокислота предпочтительно выбирается из группы, состоящей из серина, треонина, цистеина, пролина, аспарагина и глутамина. В отличие от консервативной аминокислотной замены, неконсервативная аминокислотная замена предусматривает обмен одной аминокислоты на другую аминокислоту, которая не подпадает под вышеприведенное определение консервативных замен (i)-(v).
Если функциональное производное содержит делецию, то это означает, что из этого производного удалены одна или несколько аминокислот, которые присутствуют в референсном полипептиде или последовательности белка. Однако делеция не должна быть слишком "масштабной", и производное должно содержать в целом не менее 200 аминокислот.
Методы определения идентичности последовательностей уже описаны выше. В дополнение к ним, определение процента идентичности между двумя последовательностями может проводиться также с использованием математического алгоритма Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90: 5873-5877. Такой алгоритм введен также в программы BLASTN и BLASTP (Altschul et al. (1990) J. Mol. Biol. 215: 403-410). При пользовании программами BLASTN и BLASTP предпочтительно, чтобы использовались стандартные настройки этих программ.
Как упоминалось выше, гипервариабельные домены аденовирусного белка гексона экспонированы на наружной поверхности аденовируса. Поэтому эти области могут узнаваться и связываться нейтрализующими антителами. То есть аденовирус с капсидом, содержащим белок гексон, происходящий из одного из новых аденовирусных изолятов настоящего изобретения, показывает улучшенную, т.е. более низкую, серопревалентность в организме человека. Таким образом, во втором аспекте изобретение предлагает выделенный полинуклеотид, который кодирует аденовирусный белок гексон или его функциональное производное и который выбирается из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно любой из SEQ ID NO: 20-25, 51 и 54, т.е. SEQ ID NO: 20, 21, 22, 23, 24, 25, 51 или 54;
(b) полинуклеотида, кодирующего функциональное производное полипептида согласно любой из SEQ ID NO: 20-25, 51 и 54, т.е. SEQ ID NO: 20. 21, 22, 23, 24, 25, 51 или 54, в котором указанное функциональное производное содержит делецию, инсерцию и/или замену одного или более аминокислотных остатков, и
(c) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно - по меньшей мере на 98% и наиболее предпочтительно - по меньшей мере на 99,95% идентична по всей своей длине любой аминокислотной последовательности из SEQ ID NO:20-25, 51 и 54, т.е. SEQ ID NO:20, 21, 22, 23, 24, 25, 51 или 54.
В предпочтительном варианте выделенный полинуклеотид, описанный во втором аспекте изобретения и в предпочтительных вариантах его осуществления, раскрываемых ниже, кодирует белок гексон или его функциональное производное, которое выполняет ту же функцию, что и белок гексон, в инфекционном аденовирусном вирионе. Таким образом, рекомбинантный аденовирус, содержащий указанный белок гексон или его функциональное производное предпочтительно в качестве капсидного белка, способен проникать в клетку хозяина. Один из методов, пригодных для получения функциональных производных белка гексона, описан в патенте США №5 922 315, который включен в настоящую заявку в виде ссылки. В этом методе, по меньшей мере, одна область петли аденовирусного гексона заменяется, по меньшей мере, одной областью петли аденовируса другого серотипа. Например, для замены соответствующей петли гексона аденовируса предшествующего уровня техники может использоваться область петли белка гексона изобретения с целью создания гибридного аденовируса. Аналогичным образом могут быть получены также производные белка пентона и белка фибера изобретения.
В третьем аспекте изобретение предлагает выделенный полинуклеотид, который кодирует аденовирусный белок пентон или его функциональное производное и который выбирается из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно любой из SEQ ID NO:26-31, 52 и 55, т.е. SEQ ID NO:26, 27, 28, 29, 30, 31, 52 или 55;
(b) полинуклеотида, кодирующего функциональное производное полипептида согласно любой из SEQ ID NO:26-31, 52 и 55, т.е. SEQ ID NO:26, 27, 28, 29, 30, 31, 52 или 55, в котором указанное функциональное производное содержит делецию, инсерцию и/или замену одного или более аминокислотных остатков, и
(c) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно - по меньшей мере на 85%, наиболее предпочтительно - по меньшей мере на 99%, идентична по всей своей длине любой аминокислотной последовательности из SEQ ID NO:26-31, 52 и 55, т.е. SEQ ID NO:26, 27, 28, 29, 30, 31, 52 или 55.
Предпочтительно, чтобы белок пентон и его функциональное производное обладали сродством к аденовирусному белку фиберу, например, к SEQ ID NO:14-19, 50 и/или 53. Среднему специалисту хорошо известно, как проводить тест на белок-белковое сродство. Под "аденовирусным белком пентоном" подразумевается основной белок пентон (III), содержащийся в аденовирусе. Аденовирусный белок пентон характеризуется тем, что он локализуется в углах икосаэдрической симметрии капсида. Как упоминалось выше, в предпочтительном варианте полинуклеотида первого, второго и/или третьего аспектов изобретения и в предпочтительных вариантах осуществления изобретения, раскрываемых ниже, полинуклеотид кодирует один или более полипептидов, в котором рекомбинантный аденовирус, содержащий указанный один или более полипептидов предпочтительно в качестве капсидного(ых) белка(ков), способен инфицировать, т.е. проникать в клетку хозяина.
Ниже дается описание предпочтительных вариантов осуществления первого, второго и третьего аспектов изобретения по каждому из раскрываемых в заявке новых изолятов аденовируса шимпанзе.
Аденовирус ChAd55
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:14 или его функциональное производное, в котором функциональное производное (1) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 99% идентична по всей своей длине аминокислотной последовательности SEQ ID NO:14.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:20 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо(ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:20.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:26 или его функциональное производное, в котором функциональное производное (1) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99,9%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:26.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид(ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием Ad5 генома в качестве стандарта. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
Аденовирус ChAd73
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:15 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 98%, 99% или, по меньшей мере, на 99,9%, более предпочтительно, по меньшей мере, на 99%, наиболее предпочтительно, по меньшей мере, на 99,9%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:15.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:21 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:21.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:27 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:27.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид(ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием генома Ad5 в качестве стандарта. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
Аденовирус ChAd83
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:16 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность SEQ ID NO:16.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:22 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:22.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:28 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:28.
В наиболее предпочтительном варианте полинуклеотид изобретения состоит из или содержит полинуклеотид, который, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% идентичен, наиболее предпочтительно, по меньшей мере, на 99% или 100% идентичен по всей своей длине последовательности, которая состоит из SEQ ID NO:65, или последовательности, которая состоит из SEQ ID NO:65, но в которой отсутствует какая-либо одна из областей генома E1A, E1B, E2A, E2B, E3 и/или E4 последовательности SEQ ID NO:65, наиболее предпочтительно, в которой отсутствуют области генома E1, E3 и E4 последовательности SEQ ID NO:65.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид(ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием генома ChAd83, приведенного в SEQ ID NO:65. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
Аденовирус ChAd146
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:17 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность SEQ ID NO:17.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:23 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:23.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:29 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:29.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид(ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием генома Ad5 в качестве стандарта. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
Аденовирус ChAd147
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:18 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 90%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:18.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:24 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:24.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:30 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:30.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид(ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием генома Ad5 в качестве стандарта. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
Аденовирус PanAd1
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:19 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:19.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:25 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:25.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:31 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 90%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:31.
В наиболее предпочтительном варианте полинуклеотид изобретения состоит из или включает полинуклеотид, который, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% идентичен, наиболее предпочтительно, по меньшей мере, на 99% или 100% идентичен по всей своей длине последовательности, которая состоит из SEQ ID NO:13, или последовательности, которая состоит из SEQ ID NO:13, но в которой отсутствует какая-либо одна из областей генома E1A, E1B, E2A, E2B, E3 и/или E4 последовательности SEQ ID NO:13, наиболее предпочтительно - в которой отсутствуют области генома E1, E3 и E4 последовательности SEQ ID NO:13.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид(ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием генома PanAd1, как описано в SEQ ID NO:13. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
Аденовирус PanAd2
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:50 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:50.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:51 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:51.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:52 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 90%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:52.
В наиболее предпочтительном варианте полинуклеотид изобретения состоит из или включает полинуклеотид, который, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% идентичен, наиболее предпочтительно, по меньшей мере, на 99% или 100% идентичен по всей своей длине последовательности, которая состоит из SEQ ID NO:62, или последовательности, которая состоит из SEQ ID NO:62, но в которой отсутствует какая-либо одна из областей генома E1A, E1B, E2A, E2B, E3 и/или E4 последовательности SEQ ID NO:62, наиболее предпочтительно - в которой отсутствуют области генома E1, E3 и E4 последовательности SEQ ID NO:62.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид (ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием генома PanAd1, как описано в SEQ ID NO:62. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
Аденовирус PanAd3
В предпочтительном варианте осуществления первого аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок фибер с аминокислотной последовательностью согласно SEQ ID NO:53 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:53.
В предпочтительном варианте осуществления второго аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок гексон с аминокислотной последовательностью согласно SEQ ID NO:54 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 95%, 98%, 99%, 99,5%, 99,9% или, по меньшей мере, на 99,95%, более предпочтительно, по меньшей мере, на 98%, наиболее предпочтительно, по меньшей мере, на 99%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:54.
В предпочтительном варианте осуществления третьего аспекта изобретения выделенный полинуклеотид кодирует аденовирусный белок пентон с аминокислотной последовательностью согласно SEQ ID NO:55 или его функциональное производное, в котором функциональное производное (i) не содержит более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 10, делегированных, встроенных, модифицированных и/или замененных аминокислот либо (ii) имеет аминокислотную последовательность, которая, по меньшей мере, на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, на 99%, более предпочтительно, по меньшей мере, на 85%, наиболее предпочтительно, по меньшей мере, на 90%, идентична по всей своей длине аминокислотной последовательности SEQ ID NO:55.
В наиболее предпочтительном варианте полинуклеотид изобретения состоит из или включает полинуклеотид, который, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% идентичен, наиболее предпочтительно, по меньшей мере, на 99% или 100% идентичен по всей своей длине последовательности, которая состоит из SEQ ID NO:63, или последовательности, которая состоит из SEQ ID NO:63, но в которой отсутствует какая-либо одна из областей генома E1A, E1B, E2A, E2B, E3 и/или E4 последовательности SEQ ID NO:63, наиболее предпочтительно - в которой отсутствуют области генома E1, E3 и E4 последовательности SEQ ID NO:63.
В следующем аспекте изобретение относится к полинуклеотиду, включающему первый, второй, третий, первый и второй, первый и третий, второй и третий или первый, второй и третий аспекты. Предпочтительно, чтобы полинуклеотид, включающий этот или эти полинуклеотид(ы), содержал другие аденовирусные гены и нуклеотидные сегменты, примыкающие к гену гексона, пентона и/или фибера в геноме аденовируса, например, с использованием генома PanAd1, как описано в SEQ ID NO:63. Предпочтительно, чтобы полинуклеотид содержал также последовательности, необходимые для упаковки полинуклеотида в аденовирусную частицу.
В рекомбинантном аденовирусе каждый из белков, т.е. фибер, гексон и пентон, согласно первому, второму и третьему аспектам изобретения и в соответствии с описанными предпочтительными вариантами его осуществления играет свою роль в ослаблении взаимодействия между указанным рекомбинантным аденовирусом и нейтрализующими антителами человека и/или грызунов. Соответственно этому, полинуклеотиды, которые кодируют указанные белки (фибер, гексон и/или пентон) настоящего изобретения, пригодны для конструирования улучшенных рекомбинантных аденовирусов. Поэтому в следующем, четвертом, аспекте изобретение предлагает полинуклеотид, включающий, по меньшей мере, один, предпочтительно, по меньшей мере, два и наиболее предпочтительно, по меньшей мере, три выделенных полинуклеотида, выбираемых из группы полинуклеотидов, состоящей из полинуклеотида согласно первому аспекту изобретения, второму аспекту изобретения и третьему аспекту изобретения. Следовательно, четвертый аспект наиболее предпочтительно относится к выделенному полинуклеотиду, включающему первый, второй и третий аспекты изобретения. В предпочтительном варианте полинуклеотид согласно четвертому аспекту изобретения является полинуклеотидом, выбираемым из группы, состоящей из:
(i) полинуклеотида, включающего один полинуклеотид согласно первому, второму или третьему аспекту изобретения;
(ii) полинуклеотида, включающего полинуклеотид согласно первому аспекту изобретения и полинуклеотид согласно второму аспекту изобретения;
(iii) полинуклеотида, включающего полинуклеотид согласно первому аспекту изобретения и полинуклеотид согласно третьему аспекту изобретения;
(iv) полинуклеотида, включающего полинуклеотид согласно второму аспекту изобретения и полинуклеотид согласно третьему аспекту изобретения, и
(v) полинуклеотида, включающего полинуклеотид согласно первому, второму и третьему аспектам изобретения;
в котором предпочтительным является то, что указанные полинуклеотиды, входящие в группы полинуклеотидов (i)-(v), выбираются из одного и того же аденовирусного изолята, например, все три полинуклеотида, кодирующие фибер, гексон и пентон или соответственно их функциональные производные, выделены только из одного из следующих аденовирусов: ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 PanAd1, PanAd2 или PanAd3. Кроме того, предпочтительно, чтобы в четвертом аспекте изобретения или в предпочтительном варианте его осуществления, например, как подчеркивается выше, каждое "функциональное производное" не содержало более 10, более 5 или более 3 аминокислотных альтераций (т.е. делегированных, встроенных, модифицированных и/или замененных аминокислот).
В таблице 2 (ниже) перечислен ряд особенно предпочтительных вариантов полинуклеотида четвертого аспекта изобретения, изложенного выше. Предпочтение отдается полинуклеотиду, выбираемому из полинуклеотидов A1-AF1, показанных в таблице 2, в котором полинуклеотид включает три полинуклеотида согласно альтернативе (с) первого, второго и третьего аспектов изобретения, каждый из которых соответственно кодирует аденовирусный белок, фибер, гексон и пентон или их функциональные производные. Таблица 2 (ниже) показывает минимальную идентичность последовательности (т.е., по меньшей мере, указанную идентичность последовательности), которую каждый из вышеуказанных трех кодируемых белков должен иметь по всей своей длине с аминокислотной последовательностью SEQ ID NO, также показанной в таблице 2.
Например, предпочтительный полинуклеотид А1, как показано в таблице 1 (выше), включает:
(i) полинуклеотид, кодирующий полипептид, который имеет аминокислотную последовательность, которая, по меньшей мере, на 85% идентична по всей своей длине последовательности SEQ ID NO: 14;
(ii) полинуклеотид, кодирующий полипептид, который имеет аминокислотную последовательность, которая, по меньшей мере, на 95% идентична по всей своей длине последовательности SEQ ID NO: 20, и
(iii) полинуклеотид, кодирующий полипептид, который имеет аминокислотную последовательность, которая, по меньшей мере, на 98% идентична по всей своей длине последовательности SEQ ID NO: 26.
Как упоминалось выше, наиболее предпочтительно, чтобы указанные "функциональные производные" полинуклеотида, перечисленные в таблице 2, не содержали более 10 аминокислотных альтераций (т.е. делегированных, встроенных, модифицированных и/или замененных аминокислот).
В таблице 3 (ниже) перечисляются другие предпочтительные варианты полинуклеотида четвертого аспекта изобретения. Предпочтительным является полинуклеотид, выбранный из полинуклеотидов А2-J2 таблицы 3, в котором полинуклеотид включает три полинуклеотида, обозначенных как "Полинуклеотид 1", "Полинуклеотид 2" и "Полинуклеотид 3", в котором каждый соответствующий полинуклеотид имеет, по меньшей мере, указанную идентичность последовательности по всей своей длине с соответствующим полинуклеотидом с SEQ ID NO, показанной в таблице 3.
Так, например, предпочтительный вариант A2 ("A2-ChAd55") таблица 3 (выше) представляет собой полинуклеотид, включающий:
(i) полинуклеотид, который, по меньшей мере, на 98% идентичен SEQ ID NO:32 по всей своей длине;
(ii) полинуклеотид, который, по меньшей мере, на 98% идентичен SEQ ID NO:38 по всей своей длине, и
(iii) полинуклеотид, который, по меньшей мере, на 98% идентичен SEQ ID NO:44 по всей своей длине.
В таблице 4 (ниже) перечислен ряд других особенно предпочтительных вариантов полинуклеотида четвертого аспекта изобретения, изложенного выше. Предпочтительным является полинуклеотид, выбранный из полинуклеотидов A3-H3, показанных в таблице 4, в котором полинуклеотид кодирует аденовирусные белки (фибер, гексон и пентон) согласно указанной SEQ ID NO или их функциональные производные, в котором все три белка и/или кодируемых функциональных производных в целом содержат ≤ 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или более 100, предпочтительно - не более 20, делегированных, встроенных, модифицированных и/или замененных аминокислот.
В другом варианте полинуклеотида четвертого аспекта изобретения полинуклеотид кодирует аденовирусный белок фибер и белок гексон одного и того же штамма согласно соответствующим SEQ ID NO, как показано в таблице 4, или их функциональные производные. В еще одном варианте полинуклеотида четвертого аспекта изобретения полинуклеотид кодирует аденовирусный белок фибер и белок пентон одного и того же штамма согласно соответствующим SEQ ID NO, как показано в таблице 4, или их функциональные производные. В следующем варианте полинуклеотида четвертого аспекта изобретения полинуклеотид кодирует аденовирусные белки гексон и пентон одного и того же штамма согласно соответствующим SEQ ID NO, как показано в таблице 4, или их функциональные производные. В этом контексте указанные функциональные производные содержат в каждом случае менее 1, 2, 3, 4, 5, 6, 7, 8, 9 или менее 10, наиболее предпочтительно - менее 3, делегированных, встроенных, модифицированных и/или замененных аминокислот.
В еще одном предпочтительном варианте четвертого аспекта изобретения полинуклеотид состоит из или включает полинуклеотид, который, по меньшей мере, на 90%, 91%, 92%, 94%, 95%, 96%, 97%, 98%, 99%, 99,9% или 100%, предпочтительно - на 98%, идентичен по всей своей длине последовательности, которая (i) состоит из любой одной из SEQ ID NO:13, 62, 63 или 65, либо (ii) последовательности, которая состоит из любой одной из SEQ ID NO:13, 62 63 или 65, но в которой отсутствует одна или более областей генома E1A, E1B, E2A, E2B, E3 ORF1, E3 ORF2, E3 ORF3, E3 ORF4, E3 ORF5, E3 ORF6, E3 ORF7, E3 ORF8, E3 ORF9, E4 ORF7, E4 ORF6, E4 ORF5, E4 ORF4, Е4 ORF3, E4 ORF2 и/или E4 ORF1. Таким образом, вышеупомянутые одна или более областей генома предпочтительно не учитываются в выравнивании при определении процента идентичности. В другом предпочтительном варианте выделенного полинуклеотида изобретения полинуклеотид включает или состоит из SEQ ID NO:13, 62, 63 или 65, в которой одна или более областей генома E1A, E1B, E2A, E2B, E3 ORF1, E3 ORF2, E3 ORF3, E3 ORF4, E3 ORF5, E3 ORF6, E3 ORF7, E3 ORF8, E3 ORF9, E4 ORF7, E4 ORF6, E4 ORF5, Е4 ORF4, Е4 ORF3, Е4 ORF2 и Е4 ORF1 делегируются соответственно из SEQ ID NO: 13, 62, 63 или 65 либо заменяются трансгеном или экспрессионной кассетой, кодирующей гетерологичный белок, как описано в заявке. В наиболее предпочтительном варианте аденовирусные области Е1, Е3 и/или Е4 делегируются, как показано в примере 2. Вышеупомянутые предпочтительные полинуклеотиды, в которых отсутствует одна или более вышеуказанных областей генома, могут включать также полинуклеотидную последовательность, кодирующую гетерологичный белок, или экспрессионную кассету, содержащую такую полинуклеотидную последовательность, кодирующую гетерологичный белок. Указанная полинуклеотидная последовательность, кодирующая гетерологичный белок, и указанная экспрессионная кассета, содержащая такую полинуклеотидную последовательность, кодирующую гетерологичный белок, могут встраиваться, например, на место делегированных областей полинуклеотида изобретения, что хорошо известно в данной области техники, а также описано в нижеприведенных примерах. Указанный гетерологичный белок может представлять собой молекулу для доставки в целевую клетку, такую как описанная в заявке, например, полинуклеотид, кодирующий антигенный белок или его фрагмент, предпочтительно - антигенный белок или фрагмент патогена, такой как белок HIV(ВИЧ)-gag, опухолевый антиген или белок вируса простого герпеса, как описано в примерах. Таким образом, в предпочтительном варианте выделенный полинуклеотид изобретения включает также полинуклеотид, кодирующий антиген, выбранный из группы, состоящей из вирусного антигена, антигена патогенной бактерии и опухолевого антигена. Поэтому в одном варианте осуществления изобретения указанный гетерологичный белок может быть антигеном, выбранным из группы, состоящей из антигена РНК-содержащего вируса, антигена патогенной бактерии и опухолевого антигена. Термин "антиген" относится к любому белку или пептиду, способному индуцировать иммунный ответ у млекопитающего. Антиген предпочтительно содержит, по меньшей мере, 8 аминокислот, наиболее предпочтительно - от 8 до 12 аминокислот. Следовательно, при определении идентичности последовательностей области генома Е1А, Е1В, Е2А, Е2В, Е3 и/или Е4 предпочтительно не учитываются при выравнивании, т.е. выравнивание производится с использованием последовательности, которая состоит из полной последовательности SEQ ID NO: 13, 62, 63 или 65, за исключением областей генома Е1А, Е1B, Е2А, Е2В, Е3, Е4, и/или любого полинуклеотида, кодирующего гетерологичный полипептид, либо экспрессионной кассеты, включающей такой полинуклеотид. Как также упоминалось выше, предпочтительно, чтобы полинуклеотид четвертого аспекта изобретения и все его предпочтительные варианты кодировал функциональные капсидные белки - гексон, пентон и/или фибер - или их функциональные производные, например, чтобы кодируемые белки выполняли ту же функцию, что и соответствующие капсидные белки или их фрагменты, в инфекционном аденовирусном вирионе. Таким образом, рекомбинантный аденовирус, содержащий в своем капсиде указанные кодируемые рекомбинантные белки пентон, гексон и/или фибер или их функциональные производные, способен проникать в клетку хозяина. Предпочтительно также, чтобы капсидные белки или их функциональные производные согласно изобретению или кодируемые полинуклеотидами изобретения не имели серопревалентности у человека.
Изобретение обеспечивает также выделенный белок, кодируемый выделенным полинуклеотидом изобретения, т.е. выделенный аденовирусный капсидный полипептид, кодируемый выделенным полинуклеотидом согласно первому, второму и/или третьему аспекту изобретения, либо его функциональное производное. В данном контексте термин "функциональное производное" в одном варианте осуществления изобретения не содержит более 5, 10 или содержит не более 25 аминокислотных альтераций (т.е. делегированных, встроенных, модифицированных и/или замененных аминокислот),
Помимо этого, изобретение относится к вектору, содержащему выделенный полинуклеотид изобретения.
Предпочтительно вектор не содержит ген в области генома, выбранной из группы областей генома, состоящей из E1A, E1B, E2A, E2B, E3 и E4, и/или содержит, по меньшей мере, один ген области генома, выбранной из группы E1A, E1B, E2A, E2B, E3 и E4, в котором указанный, по меньшей мере, один ген включает делецию и/или мутацию, которая делает, по меньшей мере, этот один ген нефункциональным. Одной из возможностей перевода одного из этих генных продуктов в нефункциональное состояние является введение одного или более искусственных стоп-кодонов (например, TAA) в открытую рамку считывания указанных генов. Методы перевода вируса в дефектное по репликации состояние хорошо известны в уровне техники (см., например, Brody et al., 1994 Ann NY Acad. Sci., 716: 90-101).
В некоторых вариантах осуществления изобретения полинуклеотид изобретения включает полинуклеотид, кодирующий белок гексон; белок пентон; белок фибер; белок гексон и белок пентон; белок гексон и белок фибер; белок пентон и белок фибер; или белок гексон, белок пентон и белок фибер изобретения, а также включает дополнительные аденовирусные полинуклеотиды. Таким образом, в одном предпочтительном варианте осуществления изобретения выделенный полинуклеотид изобретения включает, по меньшей мере, одно из следующего:
(a) аденовирусный 5'-обращенный концевой повтор (ITR);
(b) аденовирусную область E1a или ее фрагмент, выбранный из областей 13S, 12S и 9S;
(c) аденовирусную область E1b или ее фрагмент, выбранный из группы, состоящей из областей малого T, большого T и IX;
(d) аденовирусную область E2b или ее фрагмент, выбранный из группы, состоящей из областей малого pTP, полимеразы и областей IVa2;
(e) аденовирусную область L1 или ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка 28,1 кДа, полимеразы, агнопротеина, белка 52/55 кДа и белка IIIa;
(f) аденовирусную область L2 или область L2, включающую полинуклеотид, кодирующий белок пентон изобретения, либо ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка пентона или белка пентона изобретения, белков VII, V и Mu;
(g) аденовирусную область L3 или область L3, включающую полинуклеотид, кодирующий белок гексон изобретения, либо ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка VI, белка гексона или белка гексона изобретения и эндопротеазы;
(h) аденовирусную область E2a;
(i) аденовирусную область L4 или ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка 100 кДа, гомолога 33 кДа и белка VIII;
(j) аденовирусную область E3 или ее фрагмент, выбранный из группы, состоящей из E3 ORF1, E3 ORF2, E3 ORF3, E3 ORF4, E3 ORF5, E3 ORF6, E3 ORF7, E3 ORF8 и E3 ORF9;
(k) аденовирусную область L5 или область L5, включающую полинуклеотид, кодирующий белок фибер изобретения, либо ее фрагмент, причем указанный фрагмент кодирует белок фибер или белок фибер изобретения;
(l) аденовирусную область Е4 или ее фрагмент, выбранный из группы, состоящей из Е4 ORF7, Е4 ORF6, Е4 ORF5, Е4 ORF4, Е4 ORF3, Е4 ORF2 и Е4 ORF1, в частности, ORF6 указанной области Е4, и/или
(m) аденовирусный 3'-ITR.
В некоторых вариантах вышеупомянутого полинуклеотида может быть желательным, как также описано выше, чтобы полинуклеотид предпочтительно не содержал ORF (открытой рамки считывания) геномной области, описанной выше (такой как, например, область Е3 и/или Е4, определенной в примере 2), и/или содержал аденовирусный ген, включающий делецию и/или мутацию, которые делают, по меньшей мере, один ген нефункциональным. В этих предпочтительных вариантах подходящие области аденовируса модифицируются таким образом, что они не содержат вышеупомянутого(ых) гена(ов) или что в них выбранный(ые) гены находятся в нефункциональном состоянии. Любые делеции аденовирусных генов обеспечивают место для инсерции трансгенов, таких как мини-генная кассета, описанная в заявке. Кроме того, делеции генов могут использоваться для создания аденовирусных векторов, неспособных к репликации без использования пакующей линии клеток или хелперного вируса, что хорошо известно в уровне техники. Таким образом, готовый рекомбинантный аденовирус, содержащий описанный выше полинуклеотид, который включает одну или более оговоренных выше делеции генов/областей или мутаций, вызывающих утрату функции, может стать более безопасным рекомбинантным аденовирусом, например, для генной терапии или вакцинации.
В особенно предпочтительном варианте осуществления изобретения полинуклеотид изобретения включает, по меньшей мере, одно из следующего:
(a) область 5′-обращенного концевого повтора (ITR) любой одной из SEQ ID NO: 13, 62, 63 или 65;
(b) аденовирусную область Ela любой одной из SEQ ID NO: 13, 62, 63 или 65 либо ее фрагмент, выбранный из областей 13S, 12S и 9S;
(c) аденовирусную область Elb любой одной из SEQ ID NO: 13, 62, 63 или 65 либо ее фрагмент, выбранный из группы, состоящей из областей малого Т, большого Т и IX;
(d) аденовирусную область Е2b любой одной из SEQ ID NO: 13, 62, 63 или 65 либо ее фрагмент, выбранный из группы, состоящей из областей малого рТР, полимеразы и IVa2;
(e) аденовирусную область L1 любой одной из SEQ ID NO: 13, 62, 63 или 65 либо ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка 28,1 кДа, полимеразы, агнопротеина, белка 52/55 кДа и белка IIIа;
(f) аденовирусную область L2 любой одной из SEQ ID NO: 13, 62, 63 или 65 либо ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка пентона с аминокислотной последовательностью SEQ ID NO: 31, 52 или 55, белков VII, V и Mu;
(g) аденовирусную область L3 любой одной из SEQ ID NO: 13, 62, 63 или 65 либо ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка VI, белка гексона с аминокислотной последовательностью SEQ ID NO:25, 51 или 54 и эндопротеазы;
(h) аденовирусную область E2a любой одной из SEQ ID NO:13, 62, 63 или 65;
(i) аденовирусную область L4 любой одной из SEQ ID NO:13, 62, 63 или 65 либо ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка 100 кДа, гомолога 33 кДа и белка VIII;
(j) аденовирусную область E3 любой одной из SEQ ID NO:13, 62, 63 или 65 либо ее фрагмент, выбранный из группы, состоящей из E3 ORF1, E3 ORF2, E3 ORF3, E3 ORF4, E3 ORF5, E3 ORF6, E3 ORF7, E3 ORF8 и E3 ORF9;
(k) аденовирусную область L5 любой одной из SEQ ID NO:13, 62, 63 или 65 либо ее фрагмент, причем указанный фрагмент кодирует белок фибер с аминокислотной последовательностью SEQ ID NO:19, 50 или 53;
(l) аденовирусную область E4 любой одной из SEQ ID NO:13, 62, 63 или 65 либо ее фрагмент, выбранный из группы, состоящей из E4 ORF7, E4 ORF6, E4 ORF5, E4 ORF4, E4 ORF3, E4 ORF2 и E4 ORF1, или ORF6 Ad5-области E4 (SEQ ID NO:64), и
(m) 3'-ITR любой одной из SEQ ID NO:13, 62, 63 или 65.
В одном варианте осуществления изобретения выделенный полинуклеотид изобретения кодирует также один или более, предпочтительно - все, из следующих аденовирусных белков: белок VI, белок VIII, белок IX, белок IIIa и белок IVa2. Предпочтительно эти белки кодируются соответствующими открытыми рамками считывания геномной последовательности PanAd1, PanAd2 или PanAd3, описанной в заявке. Специалисту средней квалификации в области рекомбинантных аденовирусов хорошо известно, как определить открытые рамки считывания, кодирующие вышеназванные аденовирусные белки. Ему известна также структура аденовирусных геномов, и он может без особого труда картировать отдельные аденовирусные области и указанные в описании ORF, например, к любому из новых аденовирусных геномов PanAd1, PanAd2 или PanAd3 изобретения.
Для экспрессии полинуклеотида, предпочтительно - кДНК, кодирующего один или более аденовирусных белков изобретения, можно субклонировать указанный полинуклеотид в векторе экспрессии, который содержит сильный промотор для направления транскрипции, терминатор транскрипции/трансляции и сайт связывания рибосомы для инициации трансляции. Подходящие бактериальные промоторы хорошо известны в уровне техники, например, Е.coli. Bacillus sp. и Salmonella, и готовые наборы для таких экспрессионных систем имеются в продаже. Равным образом, хорошо известны и также имеются в продаже эукариотические экспрессионные системы для клеток млекопитающих, дрожжей и насекомых.
В дополнение к промотору, вектор экспрессии содержит в типичных случаях транскрипционную единицу или экспрессионную кассету, которая содержит все дополнительные элементы, необходимые для экспрессии в клетках хозяина нуклеиновой кислоты, кодирующей аденовирусный белок. То есть типичная экспрессионная кассета содержит промотор, оперативно связанный с нуклеинокислотной последовательностью, кодирующей аденовирусный белок/полипептид, и сигналы, необходимые для эффективного полиаденилирования транскрипта, сайты связывания рибосомы и терминатор трансляции. Дополнительные элементы кассеты могут включать, например, энхансеры. Экспрессионная кассета должна также содержать область терминации транскрипции справа (по ходу транскрипции) от структурного гена для достижения эффективной терминации. Область терминации может быть получена из того же гена, что и промоторная последовательность или может быть получена из других генов.
Каждый отдельный вектор экспрессии, используемый для переноса генетической информации в клетку, не является особенно критическим. Можно использовать любой из векторов, обычно применяемых для экспрессии в клетках-эукариотах или клетках-прокариотах. Стандартные бактериальные векторы экспрессии включают плазмиды, такие как плазмиды на основе pBR322, pSKF, pET23D, и слитые экспрессионные системы, такие как GST и LacZ, но существует много других, более известных специалисту, которые могут эффективно использоваться.
Векторы экспрессии, содержащие регуляторные элементы эукариотических вирусов, обычно используются в эукариотических векторах экспрессии, например, в SV40-векторах, векторах на основе вируса папилломы и векторах на основе вируса Эпштейна-Барра. Примеры других эукариотических векторов включают векторы pMSG, pA V009/A.sup.+, pMTO10/A.sup.+, pMAMneo-5, бакуловирусные pDSVE, pcDNA3.1, pIRES и любой другой вектор, обеспечивающий экспрессию белков под контролем, например, HCMV немедленно-раннего промотора, SV40 раннего промотора, SV40 позднего промотора, металлотионеинового промотора, промотора вируса рака молочных желез мышей, промотора Рауса саркомы вируса, полигедринового промотора или других промоторов, показавших себя эффективными для экспрессии в клетках-эукариотах.
Некоторые экспрессионные системы имеют маркеры, которые обеспечивают амплификацию генов, такие как тимидинкиназа, гигромицин-В-фосфотрансфераза и дигидрофолат-редуктаза. Альтернативно, могут использоваться также экспрессионные системы с высоким выходом, для которых не требуется амплификация генов.
К элементам, которые могут также вводиться в векторы экспрессии, относятся репликон, функционирующий в Е. coli; ген, кодирующий лекарственную устойчивость, что дает возможность селекции бактерий, несущих рекомбинантные плазмиды, и уникальные сайты рестрикции в несущественных областях плазмиды, позволяющие проводить инсерцию эукариотических последовательностей. Выбранный конкретный ген лекарственной устойчивости не является критическим - пригодными для указанной цели могут быть любые из множества генов лекарственной устойчивости, известных в уровне техники. Прокариотические последовательности при необходимости выбираются таким образом, чтобы они не вмешивались в репликацию ДНК в клетках-эукариотах.
Для получения линий бактериальных клеток, клеток млекопитающих, дрожжей или насекомых могут применяться стандартные методы трансфекции. Может использоваться любая из хорошо известных процедур введения чужеродных полинуклеотидных последовательностей в клетки хозяина. Например, могут применяться имеющиеся в продаже готовые наборы для трансфекции на липосомной основе, такие как Lipofectamine™ (Invitrogen); имеющиеся в продаже наборы для трансфекции на липидной основе, такие как Fugene (Roche Diagnostics); трансфекция, основанная на полиэтиленгликоле; кальций-фосфатная преципитация; генная пушка (биологическая баллистика = биолистика); электропорация или вирусная инфекция и любые другие хорошо известные методы введения клонированной геномной ДНК, кДНК, синтетической ДНК либо другого чужеродного генетического материала в клетку хозяина. Необходимо только, чтобы каждая применяемая генно-инженерная процедура была способна обеспечить успешное введение, по меньшей мере, одного гена в клетку хозяина, способную экспрессировать рецептор.
Экспрессированный аденовирусный белок может необязательно подвергаться очистке с помощью стандартных методов. Например, клетки могут быть подвергнуты лизису либо механическим путем, либо осмотическим шоком перед стадиями преципитации и хроматографии, природа и последовательность которых будет зависеть от конкретного извлекаемого рекомбинантного материала. Альтернативно, рекомбинантный белок может быть секретирован и извлечен из культуральной среды, в которой культивировались рекомбинантные клетки, что хорошо известно из области экспрессии белков.
В одном предпочтительном варианте осуществления изобретения вектор изобретения является плазмидным вектором, например, вектором экспрессии. Плазмидный вектор согласно изобретению может использоваться также для создания рекомбинантного аденовируса.
Таким образом, следующим аспектом настоящего изобретения является рекомбинантный аденовирус, предпочтительно - репликационно-некомпетентный аденовирус, содержащий выделенный полинуклеотид изобретения и/или, по меньшей мере, один выделенный аденовирусный капсидный полипептид согласно изобретению. Предпочтительно рекомбинантный аденовирус изобретения содержит белки гексон, фибер и пентон настоящего изобретения, например, комбинацию, приведенную в таблице 2 (выше). В предпочтительном варианте осуществления изобретения рекомбинантный аденовирус характеризуется тем, что он способен инфицировать человеческую клетку - предпочтительно способен инфицировать человеческую клетку после инкубации указанного аденовируса в течение одного часа в сыворотке крови человека, не подвергавшегося ранее воздействию аденовируса шимпанзе.
Поскольку изобретение раскрывает информацию о последовательности новых белков - гексона, пентона и фибера, указанный рекомбинантный аденовирус может быть получен, например, путем конструирования рекомбинантного аденовируса, состоящего из обычных аденовирусных белков, но имеющего капсид, который содержит, по меньшей мере, один выделенный аденовирусный капсидный полипептид изобретения или его функциональное производное. В рамках этого предпочтительно, чтобы рекомбинантный аденовирус включал область L2, которая содержит полинуклеотидную последовательность, кодирующую белок пентон изобретения; область L3, которая содержит полинуклеотидную последовательность, кодирующую белок гексон изобретения, и/или область L5, которая содержит полинуклеотидную последовательность, кодирующую белок фибер изобретения. Наиболее предпочтительно, чтобы указанный рекомбинантный аденовирус содержал область L2, область L3 и область L5, которые соответственно кодируют, по меньшей мере, пентон, гексон и фибер изобретения.
Методы конструирования рекомбинантных аденовирусов хорошо известны. Подходящие методики создания рекомбинантных аденовирусов рассматриваются, например, в: Graham & Prevec, 1991. Methods in Molecular Biology: Gene Transfer and Expression Protocols, (Ed. Murray, EJ.), p.109; и Hitt et al., 1997. "Human Adenovirus Vectors for Gene Transfer into Mammalian Cells" Advances in Pharmacology 40:137-206. Другие методы описаны в WO 2006/086284. Для создания дефектных по репликации аденовирусов один или несколько генных продуктов E1A, E1B, E2A, E2B, E3 и E4 могут экспрессироваться в комплементирующей линии клеток, которая может использоваться для размножения и спасения рекомбинантных аденовирусов, являющихся репликационно-некомпетентными, поскольку в них отсутствует, например, один из вышеупомянутых генных продуктов. Использование таких линий клеток описано также в приведенных выше ссылках.
В одном варианте осуществления изобретения полинуклеотиды изобретения (или векторы, содержащие указанные полинуклеотиды изобретения, как описано выше) используются для продукции рекомбинантных аденовирусных частиц. Рекомбинантные аденовирусы предпочтительно являются функционально делегированными, как упоминалось выше, в одной или более аденовирусных областей, таких как, например, области Е1а или E1b, и необязательно несут другие мутации, например, температурозависимые мутации или делеции в других аденовирусных генах. В других вариантах осуществления изобретения может быть желательным сохранение в рекомбинантных аденовирусах интактной области Е1а и/или E1b. Такая интактная область Е1 может локализоваться в своем нативном местоположении в аденовирусном геноме или располагаться в месте делеции в нативном аденовирусном геноме (например, в области Е3).
При конструировании аденовирусных векторов для доставки гена в клетку хозяина, например, человека (или другого млекопитающего) может использоваться большой спектр нуклеинокислотных последовательностей аденовируса в векторах изобретения. Например, из аденовирусной последовательности, являющейся частью рекомбинантного вируса, может элиминироваться весь или только часть аденовирусного задержанно-раннего гена Е3. Предполагается, что функция гена Е3 обезьян иррелевантна функции и продукции рекомбинантной вирусной частицы. В некоторых вариантах осуществления изобретения могут также конструироваться аденовирусные векторы с делецией, по меньшей мере, области ORF6 гена Е4, более предпочтительно, в силу избыточности функции этой области, - с делецией всей области Е4. Еще один вектор настоящего изобретения содержит делецию в задержанно-раннем гене Е2а. Делеции могут также иметь место в любом из поздних генов L1-L5 генома аденовируса обезьян. Равным образом, для некоторых целей могут быть полезны делеции в промежуточных генах IX и IVa2. Другие делеции могут иметь место в других структурных или неструктурных генах аденовируса. Вышеназванные делеции могут использоваться по отдельности, т.е. аденовирусная последовательность для использования в настоящем изобретении может содержать делеции только в одной-единственной области. Альтернативно, делеции целых генов или их частей, эффективных в плане подавления их биологической активности, могут использоваться в любой комбинации. Например, в одном показательном векторе согласно изобретению последовательность аденовируса может иметь делеции областей Е1 и Е4 или Е1, Е2а и Е3, или Е1 и Е3, или Е1, Е2а и Е4, с делецией или без делеции Е3, и т.д. Как обсуждалось выше, указанные делеции могут использоваться в комбинации с другими мутациями аденовирусных генов, такими как температурозависимые мутации, для достижения желаемого результата.
Аденовирусный вектор, в котором отсутствуют любые необходимые аденовирусные последовательности (например, область, выбранная из E1a, E1b, E2a, E2b, Е4 ORF6, L1 или L4), может культивироваться в присутствии недостающих аденовирусных генных продуктов, необходимых для вирусной инфективности и размножения аденовирусной частицы. Эти хелперные функции могут обеспечиваться за счет культивирования аденовирусного вектора в присутствии одного или более хелперных конструктов (например, плазмиды или вируса) или пакующей линии клеток хозяина упаковки (комплементирующей линии клеток, также описанной выше). См., например, нижеприведенные примеры и методы создания "минимального" человеческого аденовирусного вектора, описанные в Международной патентной заявке WO 96/13597, опубликованной 9 мая 1996 г. и включенной в настоящую заявку в виде ссылки.
Полезные хелперные вирусы содержат выбранные последовательности аденовирусных генов, которые комплементируют соответствующие гены, делегируемые в предпочтительных вариантах воплощения аденовирусного вектора изобретения, и/или которые не экспрессируются пакующей линией клеток, в которую вектор трансфектируется. В одном варианте хелперный вирус является дефектным по репликации и содержит множество аденовирусных генов в дополнение к вышеописанным последовательностям.
Хелперные вирусы могут также формироваться в поликатионные конъюгаты, как описано в: Wu et al., J. Biol. Chem., 264: 16985-16987 (1989); К.J.Fisher and J.M.Wilson, Biochem. J., 299: 49 (April 1, 1994). Хелперный вирус может необязательно содержать второй мини-ген-репортер. В уровне техники известно множество таких генов-репортеров. Присутствие гена-репортера в хелперном вирусе, который отличается от трансгена на аденовирусном векторе, делает возможным независимый контроль и Ad вектора, и хелперного вируса. Указанный второй репортер может использоваться для облегчения разделения полученного рекомбинантного вируса и хелперного вируса при в процессе очистки.
Для создания рекомбинантных аденовирусов (Ad), с делецией в любом из генов, описанных в контексте предпочтительных вариантов осуществления изобретения, функция делегированной области гена, если она существенна для репликации и инфективности вируса, предпочтительно передается рекомбинантному вирусу с помощью хелперного вируса или линии клеток, т.е. комплементирующей или пакующей линии клеток. Во многих обстоятельствах линия клеток, экспрессирующая человеческий Е1, может использоваться для транскомплементации вектора, используемого для создания рекомбинантных аденовирусов. Это особенно предпочтительно, потому что из-за несхожести полинуклеотидных последовательностей изобретения и последовательностей человеческого аденовирусного Е1, обнаруженной в доступных на сегодняшний день пакующих клетках, использование имеющихся в настоящее время клеток, содержащих человеческий Е1, может препятствовать генерации репликационно-компетентных аденовирусов в ходе репликации и продуцирования. Однако в определенных обстоятельствах для создания Е1-делегированного рекомбинантного аденовируса может быть желательным использовать линию клеток, которая экспрессирует E1-генные продукты.
При необходимости можно использовать описанные здесь последовательности для получения пакующей клетки или клеточной линии, экспрессирующей, как минимум, ген Е1 из аденовируса ChAd55, ChAd73, ChAd83, ChAd146, ChAd147, PanAd1, PanAd2 или PanAd3 под транскрипционным контролем промотора для экспрессии в выбранной родительской клеточной линии, такой как, например, клетка HeLa. Для этой цели можно использовать индуцируемые или конститутивные промоторы. Примеры промоторов даются в описанных в заявке примерах. Такие E1-экспрессирующие клеточные линии целесообразно использовать при создании рекомбинантных аденовирусных векторов с делегированным Е1. В дополнение к этому или альтернативно, изобретение предлагает линии клеток, которые экспрессируют один или более аденовирусных генных продуктов, например, E1a, E1b, Е2а и/или Е4 ORF6, предпочтительно - Ad5 E4 ORF6 (см. также примеры ниже), которые могут конструироваться по тем же, в основном, методикам для последующего использования в создании рекомбинантных аденовирусных векторов. Такие клеточные линии могут использоваться для транскомплементации аденовирусных векторов, делегированных в существенных генах, кодирующих указанные продукты, или для обеспечения хелперных функций, необходимы для упаковки хелпер-зависимого вируса (например, аденоассоциированного вируса).
В большинстве случаев при доставке вектора изобретения, содержащего, например, мини-ген, трансфекцией вектор доставляется в количестве примерно от 0,1 мкг - 100 мкг ДНК, предпочтительно - примерно от 10-50 мкг ДНК, в примерно 1×104 клеток - 1×103 клеток, предпочтительно - примерно около 105 клеток. Однако относительные количества вводимой векторной ДНК в клетки хозяина могут варьировать в зависимости от таких факторов, как выбранный вектор, метод доставки и выбранные клетки хозяина. Введение вектора в клетку хозяина может достигаться любым известным методом или раскрываемым в настоящей заявке методом, включающим трансфекцию и инфекцию, например, с применением СаРO4-трансфекции или электропорации.
Для конструирования и сборки желательного содержащего мини-ген рекомбинантного аденовируса вектор можно трансфецировать in vitro в присутствии хелперного вируса в пакующую линию клеток, что делает возможной гомологичную рекомбинацию между хелпером и векторными последовательностями, которая создает возможности для репликации аденовирус-трансгенных последовательностей в векторе и упаковку их в капсиды вирионов, что приводит к получению рекомбинантных вирусных векторных частиц, как хорошо известно в уровне техники. Рекомбинантные аденовирусы изобретения пригодны, например, для переноса выбранного трансгена в выбранную клетку хозяина.
В предпочтительном варианте аденовируса изобретения аденовирус показывает серопревалентность менее 5% у человеческих субъектов, предпочтительно - вообще не показывает серопревалентности у человеческих субъектов, наиболее предпочтительно не показывает серопревалентности у человеческих субъектов, которые ранее не были в контакте с аденовирусом шимпанзе. В данном контексте человеческие субъекты предпочтительно относятся к этнической группе, выбранной из европейцев, коренных народов Африки, азиатов, коренных народов Америки и коренных народов Океании. Методы идентификации этнического происхождения человеческого субъекта известны (см., например, WO 2003/102236).
В следующем предпочтительном варианте рекомбинантного аденовируса изобретения аденовирусная ДНК способна проникать в целевую клетку млекопитающего, т.е. он является инфекционным. Инфекционные рекомбинантные аденовирусы изобретения могут использоваться в качестве вакцины и для генной терапии, что также описывается ниже. Поэтому в другом варианте рекомбинантный аденовирус предпочтительно содержит молекулу для доставки в целевую клетку. Предпочтительно целевая клетка является клеткой млекопитающего, например, клеткой шимпанзе, клеткой грызуна или клеткой человека. Например, молекула для доставки в целевую клетку может быть экспрессионной кассетой в том определении, которое дается в описании. Методы введения экспрессионной кассеты в геном аденовируса хорошо известны (см., например, цитируемую выше литературу). В одном примере рекомбинантный аденовирус настоящего изобретения, который содержит экспрессионную кассету, кодирующую, например, мини-ген или антиген, может быть получен путем замены области аденовирусного генома, выбранной из Е1А, Е1В, Е2А, Е2В, Е3 и Е4, указанной экспрессионной кассетой. Геномные области Е1А, Е1В, Е2А, Е2В, Е3 и Е4 аденовирусов изобретения можно легко идентифицировать путем выравнивания с известными и аннотированными в описании аденовирусными геномами, такими как геном Ad5 человека (см.: Birgitt Täuber and Thomas Dobner, Oncogene (2001) 20, p.7847-7854; а также: Andrew J. Davison, et al., "Genetic content and evolution of adenoviruses". Journal of General Virology (2003), 84, p.2895-2908). He ограничивающие объема изобретения примеры того, как получить модифицированные аденовирусы, содержащие молекулу для доставки в целевую клетку, приводятся также в примерах 1 и 2 и на фиг.4 (ниже).
Молекула для доставки в целевую клетку предпочтительно является полинуклеотидом, но она может быть также полипептидом или малым химическим соединением, предпочтительно обладающим терапевтической или диагностической активностью. В одном особенно предпочтительном варианте осуществления изобретения молекула для доставки в целевую клетку является полинуклеотидом, который содержит аденовирусную последовательность с 5′-обращенным концевым повтором (ITR), ген, например, SEQ ID NO: 1 и 3′ ITR. Специалисту должно быть очевидно, что молекулярный размер молекулы должен подбираться таким образом, чтобы смог сформироваться капсид вокруг молекулы и упаковать молекулу в ходе получения рекомбинантного аденовируса, например, в пакующей клеточной линии. Таким образом, ген предпочтительно является мини-геном, который может иметь, например, до 7000, максимум - до 8000 пар оснований.
В предпочтительном варианте осуществления изобретения молекула для доставки в целевую клетку, содержащаяся в рекомбинантном аденовирусе согласно изобретению, является полинуклеотидом, кодирующим антигенный белок или его фрагмент. Антигенный белок или его фрагмент способен индуцировать иммунный ответ у млекопитающего и в особенно предпочтительном варианте может быть gag-белком ВИЧ (HIV), как показано в примерах, и кодироваться полинуклеотидом согласно SEQ ID NO: 1.
В особенно предпочтительном варианте рекомбинантный аденовирус изобретения является аденовирусом, который был депонирован в ЕСАСС (Европейская коллекция клеточных культур, Porton Down, Salisbury, SP4 OJG, UK) и имеет депозитарный номер, выбранный из группы, состоящей из 08110601 (ChAd83), 08110602 (ChAd73), 08110603 (ChAd55), 08110604 (ChAd147) и 08110605 (ChAd146). Депонирование вышеупомянутых аденовирусных штаммов (латинское название: Mastadenovirus, Adenoviridae) выполнено 6 ноября 2008 г. фирмой Okairos AG, Elisabethenstr. 3,4051 Basel, Switzerland.
Сохранение и поддержание депонированных штаммов осуществляются в рамках Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры. Депонирование было предпринято только для удобства специалистов в данной области техники; оно не является признанием того, что этого требует 35 U.S.С. 112. Все ограничения на доступность депонированного материала для общественности будут беспрекословно пресекаться, за исключением требований, оговоренных в 37 С.F.R. 1. 808 (b), при выдаче патента.
Другим предпочтительным вариантом рекомбинантного аденовируса изобретения является аденовирус, происходящий из аденовируса, выбранного из группы, состоящей из 08110601 (ChAd83), 08110602 (ChAd73), 08110603 (ChAd55), 08110604 (ChAd147) и 08110605 (ChAd146). Предпочтительно аденовирус, происходящий из одного из вышеупомянутых депонированных аденовирусов, был изменен путем введения функциональной делеции, делеции или модификации в его геном, например, для получения репликационно-некомпетентного аденовируса и/или аденовируса, способного экспрессировать трансген в клетке хозяина. Например, один или более генов, выбранных из группы, состоящей из генов Е1А, Е1В, Е2А, Е2В, Е3 и Е4, могут делетироваться, переводиться в нефункциональное состояние и/или могут заменяться экспрессионной кассетой, как описано выше. В дополнение к этому, могут вводиться один или более генов другого аденовируса, предпочтительно взамен делетированного гена. Специалисту известно, как вводить эти геномные альтерации в депонированные штаммы. Методы получения модифицированных аденовирусов, содержащих молекулу для доставки в целевую клетку, которая является предпочтительной модификацией депонированных штаммов, описаны выше.
В следующем аспекте предлагается композиция, которая содержит иммунологический адъювант и, по меньшей мере, один из следующих компонентов (i)-(iv):
(i) выделенный белок согласно изобретению;
(ii) выделенный полинуклеотид согласно изобретению;
(iii) вектор согласно изобретению;
(iv) рекомбинантный аденовирус согласно изобретению,
и необязательно фармацевтически приемлемое вспомогательное вещество.
Композиция изобретения, которая содержит адъювант, может применяться в качестве вакцины, например, для человеческих субъектов. Иммунологический адъювант, входящий в композицию (далее по тексту - коротко "адъювант"), ускоряет, пролонгирует и/или усиливает качество и/или интенсивность иммунного ответа на антиген/иммуноген в сравнении с введением только одного антигена, снижая, тем самым, количество антигена/иммуногена, необходимое в данной вакцине, и/или частоту инъекций, необходимую для индуцирования адекватного иммунного ответа на интересующий антиген/иммуноген.
Примерами адъювантов, которые могут использоваться в контексте композиции настоящего изобретения, являются гелеобразные преципитаты гидроксида алюминия (alum); AlPO4; алгидрогель; бактериальные продукты из наружной мембраны грамотрицательных бактерий, в частности, монофосфорил-липид A (MPLA), липополисахариды (LPS), мурамилдипептиды и их производные; неполный адъювант Фрейнда; липосомы, в частности, нейтральные липосомы, липосомы, содержащие композицию и необязательно цитокины; неионные блок-сополимеры; адъювант ISCOMATRIX (Drane et al., 2007); CpG динуклеотиды, содержащие неметилированную ДНК (CpG мотив), в частности, CpG ODN с фосфотиоатным (РТО) каркасом (CpG PTO ODN) или с фосфодиэфирным (РО) каркасом (CpG РО ODN); синтетические производные липопептидов, в частности, Pam3Cys; липоарабиноманнан; пептидогликан; зимозан; белки теплового шока (HSP), в частности, HSP 70; дцРНК и ее синтетические производные, в частности, Поли I: поли С; поликатионные пептиды, в частности, поли-L-аргинин; таксол; фибронектин; флагеллин; имидазохинолин; цитокины с адъювантной активностью, в частности, GM-CSF, интерлейкин-(1b-)2, IL-6, IL-7, IL-18, интерфероны I и II типов, в частности, интерферон-гамма, TNF-альфа; 2,5-дигидроксивитамин D3 (кальцитриол); и синтетические олигопептиды, в частности, МНСII-презентирующие пептиды. В качестве адъювантов могут использоваться неионные блок-сополимеры, содержащие полиоксиэтилен (РОЕ) и полиоксипропилен (POP), такие как блок-сополимеры РОЕ-РОР-РОЕ (Newman et al., 1998). Этот тип адъюванта особенно пригоден для композиций, содержащих нуклеиновые кислоты в качестве активного ингредиента.
Необязательно могут использоваться различные фармацевтически приемлемые вспомогательные вещества. Предпочтительные фармацевтически приемлемые вспомогательные вещества упоминаются ниже при обсуждении применения согласно изобретению.
Активация специфических рецепторов способна стимулировать иммунный ответ. Такие рецепторы известны специалисту и включают, например, цитокиновые рецепторы, в частности, цитокиновые рецепторы I типа, цитокиновые рецепторы II типа, TNF-рецепторы; рецептор витамина D, действующий как фактор транскрипции; Толл-подобные рецепторы 1 (TLR1), TLR-2, TLR3, TLR4, TLR5, TLR-6, TLR7 и TLR9. Агонисты таких рецепторов обладают адъювантной активностью, т.е. являются иммуностимуляторами. В предпочтительном варианте в качестве адъюванта композиции настоящего изобретения может использоваться один или более агонистов Толл-подобных рецепторов. В более предпочтительном варианте адъювант является агонистом Толл-подобного рецептора 4. В особенно предпочтительном варианте адъювант является агонистом Толл-подобного рецептора 9, предпочтительно кодируемый нуклеотидом tccatgacgttcctgacgtt (SEQ ID NO: 2).
В следующем аспекте изобретение предлагает клетку, предпочтительно - не обезьянью клетку, содержащую, по меньшей мере, один из следующих компонентов:
(i) выделенный белок согласно изобретению;
(ii) выделенный полинуклеотид согласно изобретению;
(hi) вектор согласно изобретению;
(iv) рекомбинантный аденовирус согласно изобретению.
Клетка может выбираться из бактериальной клетки, такой как клетка Е. coli, клетки дрожжей, таких как Saccharomyces cerevisiae или Pichia pastoris; растительной клетки; клетки насекомого, такой как клетка SF9 или Hi5, либо клетки млекопитающего. Предпочтительными примерами клеток млекопитающих являются клетки яичников китайского хомячка (СНО), клетки эмбриональной почки человека (НЕК 293), клетки HELA, клетки гепатомы человека (например, Huh7.5), клетки гепатомы человека Нер G2, клетки гепатомы человека Нер 3В и др.
Если клетка содержит выделенный полинуклеотид согласно (ii), то этот полинуклеотид может присутствовать в клетке либо (i) как таковой в свободно диспергированном виде, либо (ii) встроенным в геном или митохондриальную ДНК клетки хозяина.
В другом предпочтительном варианте клетка является клеткой-хозяином, предпочтительно - клеткой 293 или клеткой PER.C6™, которая экспрессирует, по меньшей мере, один аденовирусный ген, выбранный из группы, состоящей из генов Е1а, E1b, Е2а, Е2b, Е4, L1, L2, L3, L4 и L5.
Изобретение относится также к применению выделенного полинуклеотида изобретения, выделенного белка изобретения, вектора изобретения, рекомбинантного аденовируса изобретения и/или фармацевтической композиции согласно изобретению для терапии или профилактики заболевания.
Аденовирусные векторы показали большой потенциал как вакцинные векторы. В доклинических и клинических исследованиях с помощью описанной системы была продемонстрирована осуществимость дизайна векторов, усиленной экспрессии антигена и защитного иммунитета. Таким образом, предпочтительным вариантом является применение согласно изобретению, в котором под терапией или профилактикой понимается вакцинация, например, человеческих субъектов. Подробные инструкции по использованию и подготовке аденовирусов для вакцинации содержатся в обширной литературе и известны специалисту.
Если применение является вакцинацией, то рекомбинантный аденовирус изобретения может вводиться в иммунологически и/или профилактически эффективной дозе, которая предпочтительно составляет от 1×108 до 1×1011 вирусных частиц (вч) (т.е. 1×108; 5×108; 1×109; 5×109; 1×1010; 2,5×1010 или 5×1010 вирусных частиц). Кроме того, в случае вакцинации, требующей бустинга, предпочтительнее применять методику "гетерологичного прайм-буста", описанную выше. Кроме того, при использовании в вакцине выделенного полинуклеотида изобретения, выделенного белка изобретения, вектора изобретения, рекомбинантного аденовируса изобретения и/или фармацевтической композиции изобретения предпочтительно, чтобы вакцина содержала адъювант. Предпочтительные иммунологические адъюванты упоминались выше и могут использоваться в такой вакцине.
Рекомбинантный аденовирус, полученный с применением полинуклеотида или рекомбинантного аденовирусного белка либо его фрагмента согласно изобретению, может использоваться для трансдукции клетки хозяина полинуклеотидом, например, ДНК. Таким образом, предпочтительно дефектный по репликации, но тем не менее инфекционный, т.е. способный проникать в клетку хозяина, аденовирус может быть получен для экспрессии любого обычного белка или полипептида в клетке хозяина. Поэтому в предпочтительном варианте под терапией в рамках применения согласно изобретению понимается генная терапия. Если выделенный полинуклеотид, выделенный белок, вектор, рекомбинантный аденовирус и/или фармацевтическая композиция согласно изобретению используется для генной терапии и вводится лечащемуся субъекту, то предпочтительно, чтобы вводимая доза была достаточно большой с тем, чтобы результатом такого лечения была трансфекция, т.е. трансдукция, одной или более клеток пациента. Если рекомбинантный аденовирус и/или фармацевтическая композиция согласно изобретению вводятся любым из описанных в заявке предпочтительных способов введения, то предпочтительным является введение эффективной дозы, которая предпочтительно составляет от 1×108 до 5×1011 вирусных частиц (т.е. 1×108; 5×108; 1×109; 5×109; 1×1010; 2,5×1010; 5×1010; 1×1011 или, наиболее предпочтительно, 5×1011 вирусных частиц). В предпочтительных вариантах осуществления изобретения предпочтительно гетерологичный полинуклеотид, который содержится в рекомбинантном аденовирусе изобретения, способен экспрессировать белок или полипептид в клетке-хозяине субъекта, в которой белок или полипептид содержит сигнальный пептид, оказывающий влияние на секрецию белка или полипептида из указанной клетки-хозяина. Например, пациента, нуждающегося в определенном белке, можно лечить с применением аденовируса настоящего изобретения, который содержит кДНК, кодирующую секретируемую форму указанного белка.
В следующем варианте применения настоящего изобретения выделенный полинуклеотид, выделенный белок, вектор, аденовирус и/или фармацевтическая композиция согласно изобретению (далее по тексту - "фармацевтик согласно изобретению") имеет состав, который включает также один или более фармацевтически приемлемых разбавителей; носителей; вспомогательных веществ, включающих наполнители, связующие вещества, смазывающие вещества, вещества, обеспечивающие сыпучесть, разрыхлители, адсорбенты и/или консерванты.
Прием фармацевтика согласно изобретению может осуществляться различными хорошо известными способами, включающими пероральный прием, ректальное, внутрижелудочное и парентеральное введение, например, внутривенное, внутримышечное, внутриназальное, внутрикожное, подкожное и аналогичные способы введения. Предпочтительными способами введения являются парентеральное, внутримышечное и внутривенное. Предпочтительно фармацевтик изобретения изготовляется в виде сиропа, инфузионного или инъекционного раствора, таблетки, капсулы, каплетки или каплеты (капсула + таблетка), пастилки, липосомы, суппозитория, пластыря, бактерицидного лейкопластыря, капсулы пролонгированного действия, порошка или композиции замедленного действия. Предпочтительно в качестве разбавителя используется вода, буфер, буферный солевой раствор или солевой раствор, а носитель предпочтительно выбирается из группы, состоящей из какао-масла и vitebesole.
Особенно предпочтительными фармацевтическими формами для приема фармацевтика согласно изобретению при применении настоящего изобретения являются формы, пригодные для введения в виде инъекций и включающие стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсий непосредственно перед инъекцией. В типичных случаях такой раствор или дисперсия включает растворитель или дисперсионную среду, содержащую, например, водно-буферные водные растворы, например, биосовместимые буферы, этанол, полиол, такой как глицерин, пропиленгликоль, полиэтиленгликоль, их приемлемые смеси, поверхностно-активные вещества или растительные масла.
Инфузионные или инъекционные растворы могут готовиться любыми известными способами, включающими (но весь перечень не ограничивается только названными здесь) добавление консервантов, таких как антибактериальные или противогрибковые агенты, например, парабен, хлорбутанол, фенол, сорбиновая кислота или тиомерсал. Помимо этого, в инфузионные или инъекционные растворы могут вводиться изотонические агенты, такие как сахара или соли, в частности, хлорид натрия.
Предпочтительными разбавителями настоящего изобретения являются вода, физиологически приемлемые буферы, физиологически приемлемые буферные солевые растворы или солевые растворы. Предпочтительными носителями являются какао-масло и vitebesole. Вспомогательные вещества, которые могут использоваться с различными фармацевтическими формами фармацевтика согласно изобретению, могут выбираться из нижеприведенного (не ограничивающего весь перечень) списка:
a) связующие вещества, такие как лактоза, маннитол, кристаллический сорбитол, диосновные фосфаты, фосфаты кальция, сахара, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза, поливинилпирролидон и т.п.;
b) смазывающие вещества, такие как стеарат магния, тальк, стеарат кальция, стеарат цинка, стеариновая кислота, гидрогенизированное растительное масло, лейцин, глицериды и стеарилфумараты натрия;
c) разрыхлители, такие как крахмалы, кроскармеллоза, натрийметилцеллюлоза, агар, бентонит, альгиновая кислота, карбоксиметилцеллюлоза, поливинилпирролидон и т.п.
Другие подходящие вспомогательные вещества можно найти в Справочнике фармацевтических вспомогательных веществ, опубликованном Американской Фармацевтической Ассоциацией, который включен в настоящую заявку в виде ссылки.
Для терапии или профилактики заболевания предпочтительными являются определенные количества фармацевтика согласно изобретению. Однако должно быть понятно, что для достижения терапевтического или профилактического эффекта требуются различные дозы фармацевтика согласно изобретению в зависимости от тяжести заболевания, типа заболевания, а также от соответствующего лечащегося пациента, например, от общего статуса здоровья пациента и др. Определение соответствующей дозы относится к компетенции врача-консультанта.
Если фармацевтик согласно изобретению предполагается использовать в профилактических целях, то он может иметь форму вакцины. В этом случае фармацевтик согласно изобретению предпочтительно вводится в вышеуказанных предпочтительных и индивидуальных предпочтительных дозах. Предпочтительно введение вакцины повторяется, по меньшей мере, два, три, четыре, пять, шесть, семь, восемь, девять или, по меньшей мере, 10 раз в течение определенного периода времени, пока организм субъекта не наработает достаточно антител против фармацевтика согласно изобретению так, чтобы риск развития соответствующего заболевания снизился. Период времени в этом случае обычно варьирует в зависимости от антигенности вакцины. Предпочтительно период времени составляет не более четырех недель, трех месяцев, шести месяцев или трех лет. В одном варианте осуществления изобретения при применении аденовируса изобретения для целей вакцинации, по меньшей мере, один из гипервариабельных доменов белка гексона может быть заменен иммуногенным эпитопом возбудителя соответствующего заболевания, против которого направлена вакцинация. Вакцины в типичных случаях содержат один или более адъювантов, как описано выше. Подробную информацию о применении аденовирусов для вакцинации и методах, связанных с этим, см. Bangari DS and Mittal SK (2006) Vaccine, 24(7), p.849-862; см. также Zhou D, et al., Expert Opin Biol Ther. 2006 Jan; 6(1): 63-72; и Folgori A, et al., Nat Med. 2006 Feb; 12(2): 190-7.; см. также Draper SJ, et al., Nat Med. 2008 Aug; 14(8): 819-21. Publ. 2008, July 27.
Специалистам в данной области техники будут очевидны различные модификации и изменения изобретения в пределах объема изобретения. Хотя изобретение описано на примере конкретных предпочтительных вариантов его осуществления, само собой разумеется, что изобретение, как оно заявлено в формуле, ни в коей мере не следует ограничивать лишь этими конкретными вариантами осуществления. Различные модификации описанных вариантов осуществления изобретения, которые очевидны специалистам в релевантных областях, должны быть охвачены настоящим изобретением.
Следующие фигуры представлены только для иллюстрации настоящего изобретения и ни в коей мере не должны рассматриваться как лимитирующие объем изобретения, определяемый прилагаемой формулой изобретения.
Краткое описание фигур
Фиг.1. Множественное выравнивание последовательностей между белками гексонами различных аденовирусных изолятов изобретения с использованием Clustal-W с стандартными настройками. Показаны белки гексоны указанных новых изолятов аденовируса шимпанзе (обозначенные как PanAd1, PanAd2, PanAd3, ChAd55, ChAd73, ChAd83, ChAd146 и ChAd147). Гипервариабельные домены 1-7 обозначены соответственно "HVR 1-6" и "HVR 7".
Фиг.2. Множественное выравнивание последовательностей между белками фиберами аденовируса ChAd55 и указанных новых изолятов аденовируса шимпанзе (обозначенных как PanAd1, PanAd2, PanAd3, ChAd73, ChAd83, ChAd146 и ChAd147) с использованием Clustal-W со стандартными настройками.
Фиг.3. Множественное выравнивание последовательностей между белками пентонами аденовируса ChAd55 и указанных новых изолятов аденовируса шимпанзе (обозначенных как PanAd1, PanAd2, PanAd3, ChAd73, ChAd83, ChAd146 и ChAd147) с использованием Clustal-W со стандартными настройками.
Фиг.4. Схема конструирования репликационно-дефектного аденовирусного вектора гомологичной рекомбинацией с геномом вируса дикого типа и соответствующей челночной плазмидой. См. также пример 2.
Фиг.5. Клеточно-опосредованный иммунный ответ у мышей, вакцинированных рекомбинантными аденовирусами, содержащими экспрессионную кассету для экспрессии белка HIV(ВИЧ) gag (SEQ ID NO: 1). Сравнительная оценка эффективности вакцинации рекомбинантными аденовирусами человека Ad5 и шимпанзе ChAd55 (фиг.5А), рекомбинантными аденовирусами человека Ad5 и бонобо PanAd1, PanAd2 и PanAd3 (фиг.5В) и рекомбинантными аденовирусами ChAd55, ChAd73, ChAd83, ChAd146 и ChAd147 (фиг.5С). Иммунный ответ измерялся методом интерферон-γ ELIspot путем инкубации клеток с эпитопом CD8 HIV gag, картированным у мышей Balb/C. Результаты представлены числом spot-образующих клеток/106 спленоцитов.
Фиг.6. Серопревалентность новых аденовирусных векторов оценивалась на панели сывороток крови человека европейского происхождения. Параллельно на той же панели оценивалась серопревалентность человеческого аденовируса 5-го типа (Ad5) и аденовирусов шимпанзе ChAd55, ChAd73, ChAd83, ChAd146, ChAd147, PanAd1, PanAd2, PanAd3 и CV-68. Данные выражены в % субъектов, показавших иммунопревалентность. Нейтрализующие антитела обнаружены только против аденовирусов Ad5 и CV-68, но не против новых аденовирусов настоящего изобретения.
Фиг.7. Иммунизация мышей BALB/c аденовирусом PanAd HSV (вирус простого герпеса) показана на фиг.7А; иммунизация мышей BALB/c аденовирусом PanAd раковый Ag показана на фиг.7В.
Фиг.8. Иммунизация Macaca fascicularis аденовирусом PanAd HIV (ВИЧ) gag показана в эксперименте с прайм/буст вакцинацией.
Примеры
Пример 1. Выделение аденовирусов и их характеристика
ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 составляют группу аденовирусов шимпанзе, полученных от здоровых животных, содержащихся в разных условиях в европейских странах и США. ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 показывают свойство недетектируемой реактивности с сыворотками крови человека. PanAd1, PanAd2 и PanAd3 являются новым аденовирусом, выделенным от здоровых бонобо (Pan Paniscus), содержащихся в разных условиях в европейских странах и США. PanAd1, PanAd2 и PanAd3 показывают свойство недетектируемой реактивности с сыворотками крови человека.
Разновидности аденовирусов шимпанзе обыкновенного и бонобо клонировались путем инфицирования ими клеток 293, высеянных в 96-луночные планшеты, после первого пассажа амплификации. Клонирование вирусов проводилось при ограниченном разбавлении клеточного лизата, полученного в первом пассаже амплификации вируса. Было собрано и серийно размножено 5 выделенных клонов. После 3-4-серийных пассажей амплификации проводилось крупномасштабное получение аденовируса на клетках, высеянных на 5 двухслойных клеточных фабриках (NUNC) (200 миллионов клеток/клеточную фабрику). Очищенные вирусные частицы получали из клеточного лизата двухступенчатым ультрацентрифугированием в градиентах плотности хлорида цезия.
Геномную ДНК выделяли из 3×1012 рр очищенного вирусного препарата путем переваривания протеиназой К (0,5 мг/мл) в 1% SDS-TEN (2 часа при 55°С). После экстракции смесью фенол-хлороформ и осаждения этанолом геномную ДНК ресуспендировали в воде и подвергали секвенированию.
Начальная классификация новых изолятов была получена секвенированием гипервариабельной области 7 (HVR7) гена гексона. С этой целью были сконструированы два праймера на высококонсервативные участки, фланкирующие HVR7: TGTCCTACCARCTCTTGCTTGA (SEQ ID NO. 3) и GTGGAARGGCACGTAGCG (SEQ ID NO. 4). HVR7 амплифицировали посредством ПЦР с использованием в качестве матрицы очищенной вирусной ДНК или суммарного лизата 293, а затем секвенировали. Более подробная информация об изоляте была получена секвенированием гипервариабельных областей 1-6. Область ДНК, содержащую HVR1-6, амплифицировали посредством ПЦР с использованием олигонуклеотидов HVR1-6fd, CAYGATGTGACCACCGACCG (SEQ ID NO. 5) и HVR1-6rev, GTGTTYCTGTCYTGCAAGTC (SEQ ID NO. 6). На основе результатов секвенирования HVR новые выделенные вирусы были классифицированы как подгруппа Е (ChAd55, ChAd73, ChAd83, ChAd146, ChAd147) и подгруппа С (PanAd1, PanAd2 и PanAd3) общей классификации аденовирусов (Ad) человека (Horowitz, MS (1990), Adenoviridae and their replication. B: Virology B.N.Fields and D.M.Knipe, eds (raven Press, New York) pp.1679-1740).
Филогенетическое древо было получено путем выравнивания аминокислотных последовательностей белков гексонов аденовирусов человека и шимпанзе. Результаты коррелировали с начальной классификацией, основанной на выравнивании нуклеотидных последовательностей, ограниченном гексоновыми HVR1-6 и -7, с помощью программы Align X (Informax, Inc), которая выявила тесную филогенетическую связь изолятов ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 с человеческим Ad4 (подгруппа Е), тогда как изоляты аденовируса бонобо PanAd1, PanAd2 и PanAd3 филогенетически связаны с человеческим Ad1, 2, 5, 6 (подгруппа С).
Пример 2. Конструирование вектора
Геномы вирусов PanAd1, PanAd2 и PanAd3 и ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 клонировались в плазмидном векторе согласно стратегии, подробно описанной ниже. Все манипуляции с векторным геномом выполнялись в E.coli в соответствии со стандартными методами. Векторные системы создавались путем делегирования областей Е1 и Е3 из каркасов ChAd и PanAd. Область Е1 заменялась экспрессионными кассетами на основе человеческого CMV IE промотора и BGHpA сигнала, содержащего неструктурные гены HCV области (HCV NS) и HIV gag (SEQ ID NO: 1), для оценки иммунологической активности на животных моделях. В дополнение к этому, были сконструированы векторы ChAd и PanAd, экспрессирующие ген секретируемой щелочной фосфатазы (SEAP), для тестов на нейтрализацию. Векторы размножали в клетках 293 и очищали CsC1 градиентами согласно стандартным протоколам.
Конструирование векторов PanAd1, PanAd2 и PanAd3 ΔЕ1 выполнялось в несколько стадий, описанных ниже.
I. Конструирование челночного вектора PanAd
Геном PanAd1 использовался для конструирования челночного вектора для клонирования путем гомологичной рекомбинации полного генома PanAd1, PanAd2 и PanAd3. Если говорить коротко, то челночный вектор, используемый для клонирования аденовируса 1 бонобо и обозначенный здесь как pBAd1RLD_EGFP, был сконструирован следующим образом.
Левый конец (nt 1-450) PanAd1 был амплифицирован посредством ПЦР с использованием олигонуклеотидов:
5′- ATCTGGAATTCGTTTAAACCATCATCAATAATATACCTTATTTTG-3′ (SEQ ID NO: 7) и 5′- TCAGGAACTAGTTCCGTATACCTATAATAATAAAACGGAGACTTTG-3′ (SEQ ID NO: 8), рестрицирован с помощью SpeI и EcoRI, а затем лигирован в плазмидный вектор, уже содержащий HCMV-EGFP-bgh полиА кассету, с получением pBAd1-L.
Затем был амплифицирован правый конец (nt 37362-37772) PanAd1 посредством ПЦР с использованием олигонуклеотидов:
5′- TCCAGCGGCGCGCCAGACCCGAGTCTTACCAGGA-3′ (SEQ ID NO: 9) и
5′- ATTCAGGATCCGAATTCGTTTAAACCATCATCAATAATATACCTTATTTTG-3′ (SEQ ID NO: 10) и клонирован в pBAd1-L, с получением плазмиды pBAd1-RL.
Впоследствии был амплифицирован фрагмент ДНК (nt 3498-4039) PanAd1, содержащий рIХ кодирующую область, посредством ПЦР с использованием олигонуклеотидов:
5′-TATTCTGCGATCGCTGAGGTGGGTGAGTGGGCG-3′ (SEQ ID NO: 11) и
5′-TTACTGGCGCGCCTGCCTCGAGTAAACGGCATTTGCAGGAGAAG-3′ (SEQ ID NO: 12) и затем клонирован в pBAd1-RL с получением челночной плазмиды pBAd1RLD EGFP. Челночные плазмиды, содержащие экспрессионные кассеты для экспрессии гена секретируемой щелочной фосфатазы (SEAP), HIV gag, HCV области неструктурных (NS) генов, также конструировались путем замены гена EGFP в челноке pBAd1RLD EGFP.
Экспрессионная кассета для экспрессии HIV gag, HCV NS области, SEAP и EGFP на основе промотора человеческого цитомегаловируса (HCMV) и сигнала полиаденилирования гена бычьего гормона роста (Bgh polyA) была сконструирована, как описано в: Emini et al., International Publication Number WO 03/031588. Была сконструирована также кассета вирусной ДНК, содержащая сайты рестрикции ферментов (PmeI), которые присутствуют только на концах обоих ITR (обращенных концевых повторов), что обеспечило высвобождение вирусной ДНК из плазмидной ДНК.
II. Конструирование векторов ΔЕ1 PanAd1, PanAd2 и PanAd3
Векторы PanAd1, PanAd2 и PanAd3 конструировались путем гомологичной рекомбинации в in E. coli, штамм BJ5183. Клетки BJ5183 котрансформировались с очищенными ДНК вирусов PanAd1, 2 и 3 и pBAd1RLD-EGFP или pBAd1RLD-Gag. Гомологичная рекомбинация между генами р1Х, ДНК-последовательностями правого ITR, присутствующими на концах линеаризованных pBAd1RLD-EGFP или pBAd1RLD-Gag, и вирусной геномной ДНК обеспечила возможность ее инсерции в плазмидный вектор при одновременном делетировании области Е1, которая была заменена экспрессионной кассетой. Такая стратегия позволила сконструировать преадено-плазмиды pPanAd1, pPanAd2 и pPanAd3, экспрессирующие трансгены EGFP или HIV gag. Экспрессионные кассеты для экспрессии SEAP или HCV-NS клонировались затем в векторах pPanAd 1, 2 and 3 путем замены экспрессионных кассет для экспрессии либо EGFP, либо Gag.
III. Деления области Е3
Делеция области Е3 вводилась в каркасы векторов PanAd1, PanAd2 и PanAd3 согласно стратегии, включающей несколько стадий клонирования и гомологичной рекомбинации в E. coli. Делеция PanAd1 Е3 простирается от нуклеотида 28636 до нуклеотида 32596 геномной PanAd1 последовательности (SEQ ID NO: 13); делеция PanAd2 Е3 простирается от нуклеотида 28653 до нуклеотида 32599 геномной PanAd2 последовательности (SEQ ID NO: 62); делеция PanAd3 Е3 простирается от нуклеотида 28684 до нуклеотида 32640 геномной PanAd3 последовательности (SEQ ID NO: 63).
IV. Деления области Е4
Нативная область Е4 векторов PanAd1, PanAd2 и PanAd3 делетировалась и заменялась последовательностью, кодирующей Ad5 Е4 ORF6 (SEQ ID NO: 64). Координаты делеции Е4, введенной в каркасы PanAd 1, 2 и 3, следующие:
PanAd1 Е4 деления простирается от нуклеотида 34690 до 37369 (SEQ ID NO: 13);
PanAd2 Е4 делеция простирается от нуклеотида 34696 до 37400. (SEQ ID NO: 62);
PanAd3 Е4 делеция простирается от нуклеотида 34690 до 37369 (SEQ ID NO: 63). Делетированная область содержит все PanAd E4 orfs (открытые рамки считывания), тогда как Е4 нативный промотор и сигнал полиаденилирования не делегировались.
Экспрессионная кассета для экспрессии HIV gag и HCV NS-области на основе промотора человеческого цитомегаловируса (HCMV) и сигнала полиаденилирования гена бычьего гормона роста (Bgh polyA) была сконструирована, как описано в: Emini et al., International Publication Number WO 03/031588, и вставлена в векторы PanAd1, 2 и 3 ΔЕ1 EGFP путем гомологичной рекомбинации в Е. coli, штамм BJ5183, использующей гомологии между HCMV и Bgh polyA ДНК последовательностями.
V. Конструирование вектора экспрессии ChAd55 DEI и метод спасения вируса
Конструирование челночного вектора для клонирования ChAd55
Челночный вектор ChAd55 был сконструирован в соответствии с той же стратегией, какая описана выше для векторов PanAd, а затем использовался для клонирования ChAd55-вирусных геномов. С этой целью челночный вектор pARS ChAd55, содержащий правый конец, а также левый конец вирусного генома (левый конец - от ITR до гена рIХ с делетированной областью Е1, замененной экспрессионной кассетой), был линеаризован рестрикционным ферментом AscI и котрансформирован в E. coli, штамм BJ5183, с очищенной ChAd55-вирусной ДНК. Гомологичная рекомбинация между ДНК последовательностями от генов рIХ до правых ITR, присутствующих на концах линеаризованных pARS ChAd55, и очищенными ChAd55, ChAd73, ChAd83, ChAd146 и ChAd147-вирусными геномными ДНК обеспечила возможность их встраивания в плазмидный вектор с одновременным делегированием области Е1. Схема стратегии клонирования генома аденовируса шимпанзе 55 (ChAd55) представлена на фиг.4.
Были сконструированы экспрессионные кассеты на основе промотора цитомегаловируса человека (HCMV) и сигнала полиаденилирования гена бычьего гормона роста (Bgh polyA) для экспрессии генов секретируемой щелочной фосфатазы (SEAP), EGFP, HIV gag, HCV NS. Все экспрессионные кассеты встраивались в единственный SnaBI сайт вектора pARS ChAd55 с последующим переносом его путем гомологичной рекомбинации в ΔЕ1 аденовирусные пре-плазмиды.
Пример 3. Эксперименты по иммунизации
Эффективность векторов ChAd55, ChAd73, ChAd83, ChAd146, ChAd147, PanAd1, PanAd2 и PanAd3 как потенциальной рекомбинантной вакцины оценивалась на мышах с использованием векторов, экспрессирующих трансген HIV(ВИЧ) gag. Эффективность вектора ChAd55 gag сравнивалась с эффективностью человеческого Ad5 gag в проводившихся параллельно экспериментах по иммунизации. Группам из 10 животных инъецировалась в четырехглавую мышцу доза вектора (Ad5gag или ChAd55gag) 108 vp (вирусных частиц/мышь (фиг.5А). В отдельно проводившемся эксперименте группе из 5 животных инъецировалась доза вектора (Ad5gag или PanAd1 gag, PanAd2gag и PanAd3gag) 108 vp/мышь (фиг.5В). Эффективность ChAd73 gag, ChAd83 gag, ChAd146 gag и Chad147gag определялась также путем иммунизации групп из 5 мышей дозой вектора 108vp/мышь параллельно с ChAd55 gag (фиг.5С). Иммунный ответ, индуцируемый против HIV gag, измерялся методом интерферон-γ ELIspot на спленоцитах. Результаты экспериментов по иммунизации векторами ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 и PanAd1, PanAd2, PanAd3 в сравнении с вектором человеческого Ad5 gag показывают, что новые аденовирусы изобретения являются, по меньшей мере, такими же эффективными в индуцировании специфического иммунного ответа, что и рекомбинантный аденовирус Ad5 предшествующего уровня техники.
Пример 4. Тесты на нейтрализацию
Тесты на нейтрализацию проводились с тем, чтобы оценить превалентность в человеческих сыворотках нейтрализующих антител против аденовируса шимпанзе обыкновенного 55, 73, 83, 146, 147 и аденовируса 1-, 2- и 3-го типов бонобо. Тесты оценивали влияние предварительной инкубации сыворотки на способность ChAd55, ChAd73, ChAd83, ChAd146, ChAd147, PanAd1, PanAd2 и PanAd3, несущих ген секретируемой щелочной фосфатазы (SEAP), трансдуцировать человеческие клетки 293. Титр нейтрализации определяется как разведение сыворотки, дающее 50%-ное снижение активности SEAP, наблюдаемое в положительном контроле с вирусом в отсутствие сыворотки. Образец каждой сыворотки тестировался при разных разведениях (пять 4-кратных инкрементов, начиная с разведения 1/18 и кончая разведением 1:4608). Образцы предварительно инкубировались в течение одного часа при 37°С, а затем добавлялись к клеткам 293, посеянным на 96-луночные планшеты (3×104 клеток/лунку). Панель человеческих сывороток тестировалась на нейтрализующую активность. Параллельно та же панель тестировалась на векторы Ad5 и векторы Ad SEAP шимпанзе и бонобо. Результаты представлены на фиг.6. Результаты указывают на то, что серопревалентность на аденовирусы шимпанзе ниже, чем на аденовирус Ad5 человека. Однако в большинстве случаев наличие нейтрализующих антител против уже описанных ChAds (CV-68) можно было обнаружить и у подвидов субъектов. В противоположность этому, все тестируемые до настоящего времени человеческие сыворотки оказались неспособными нейтрализовать ChAd55 и PanAd1, PanAd2 и PanAd3 даже при очень низком титре. То же самое наблюдалось и в случае ChAd73, ChAd83, ChAd146 и ChAd147. Таким образом, новые аденовирусные изоляты ChAd55, ChAd73, ChAd83, ChAd146, ChAd147 и PanAd1, PanAd2 и PanAd3 представляют идеальное решение проблемы предсуществующего иммунитета против Ad человека, который ограничивает возможность введения вирусных векторов на основе обычных серотипов аденовируса Ad человека, таких как Ad5.
Пример 5. Эффективность иммунизации векторами PanAd1 и 3 в сравнении с векторами Ad5
Эффективность векторов PanAd1 и PanAd3 в качестве потенциальных рекомбинантных вакцин оценивалась на мышах BALB/c с использованием векторов, экспрессирующих антиген (Ag) вируса простого герпеса (HSV), и векторов, экспрессирующих раковый антиген. Эффективность векторов PanAd1 и 3, экспрессирующих HSV Ag и раковый Ag, сравнивалась с соответствующими векторами на основе Ad5 человека.
Для оценки противовирусной активности 9 группам мышей BALB/c инъецировались в четырехглавую мышцу увеличивающиеся дозы векторов, начиная с 107 vp/мышь и кончая 109 vp/мышь, параллельно с PanAd1-HSV, PanAd3-HSV и Ad5-HSV (см. фиг.7А). Иммунный ответ на антиген HSV измерялся методом интерферон-γ Elispot на мышиных спленоцитах, инкубированных с пептидным пулом, охватывающим полную аминокислотную последовательность антигена. Результаты экспериментов по иммунизации векторами PanAd1, PanAd2 и PanAd3 в сравнении с вектором человеческого Ad5, представленные на фиг.7, показывают, что новые аденовирусы изобретения являются более эффективными в индуцировании специфического иммунного ответа, чем рекомбинантный аденовирус Ad5 предшествующего уровня техники, в каждой изучаемой концентрации. Это четко подтверждается большей частотой встречаемости антиген-специфической Т-клетки, наблюдавшейся у мышей, иммунизированных векторами PanAd1 и PanAd3.
Эффективность в индуцировании противоопухолевого Т-клеточного ответа векторами PanAd оценивалась по результатам иммунизации групп мышей BALB/c путем введения им в четырехглавую мышцу увеличивающихся доз векторов, начиная с дозы 107 vp/мышь и кончая дозой 109 vp/мышь. Двум группам мышей BALB/C инъецировался вектор Ad5, экспрессирующий опухолевый антиген, соответственно в дозе 107 vp/мышь и 109 vp/мышь. Параллельно с этим, 3 группы мышей BALB/c иммунизировали 107, 108, 109 vp вектора PanAd1 или PanAd3, несущего такой же опухолевый антиген. Т-клеточный иммунный ответ измерялся методом интерферон-γ ELISspot на спленоцитах с использованием единичного пептида, представляющего собой картированный CD8 эпитоп.Результаты, представленные на фиг.7В, показали более высокую частоту встречаемости животных-респондеров (т.е. реагирующих на антиген) при самой низкой дозе вакцины, а также более высокую частоту встречаемости антиген-специфических Т-клеток в группах животных, иммунизированных векторами PanAd, по сравнению с животными, иммунизированными вектором Ad5.
Пример 6. Иммунизация Масаса fascicularis векторами PanAd
Две группы из 3 макак иммунизировали путем внутримышечного введения CsCl-очищенных PanAd1 и PanAd3 в режиме гетерологичного прайм/буста. Каждое животное в группе 1 получило дозу 108 vp (вирусных частиц), тогда как животные в группе 2 получили дозу 1010 vp вектора PanAd3 Gag в дельтовидную мышцу на 0 неделе. Затем все животные обеих групп были повторно иммунизированы единичной дозой 1010 vp вектора PanAd1 Gag на 13 неделе.
CMI (клеточный иммунитет) измерялся в разные моменты времени методом интерферон-γ (IFNγ)-ELISpot. Эти методы измеряют опосредованные ВИЧ антиген-специфическими CD8+ и CD4+ Т-лимфоцитами ответы. Для использования в указанных методах были приготовлены пептиды на основе аминокислотной последовательности белка HIV Gag с целью измерения иммунных ответов у обезьян, вакцинированных аденовирусным вектором. Индивидуальные пептиды являются перекрывающимися 20-мерами со смещением на 10 аминокислот.
Метод IFNγ-ELISpot позволяет количественно определить опосредованные антиген-специфическими Т-лимфоцитами ответы. РВМС (мононуклеарные клетки (лимфоциты) периферической крови) серийно разводили и помещали в лунки микропланшета с покрытием из антирезусного IFN-γ антитела (MD-1 U-Cytech). Их культивировали с пулом пептидов HIV Gag в течение 20 часов, что привело к рестимуляции клеток-предшественниц и секреции IFN-γ. Клетки отмывали, оставляя секретированный IFN, связавшийся с покрытыми антителом лунками, на тех концентрированных участках, где локализуются клетки. Обнаружение поглощенного IFN проводили с помощью биотинилированното антирезусного IFN антитела (детектор Ab U-Cytech), а затем конъюгированного со щелочной фосфатазой стрептавидина (Pharmingen 13043Е). Добавление нерастворимого субстрата со щелочной фосфатазой приводило к появлению темных пятен (спотов) в лунках в местах локализации клеток - по одному еноту на каждую Т клетку, секретировавшую IFN-γ.
Количество енотов на лунку напрямую связано с частотой встречаемости предшественниц антиген-специфических T клеток. Гамма-интерферон был выбран как цитокин, визуализируемый в этом методе (использующем специфические анти-гамма-интерферон-моноклональные антитела), поскольку он является наиболее распространенным и одним из самых обильно синтезируемых и секретируемых активированными Т лимфоцитами цитокинов. Согласно указанному методу, количество спот образующих клеток (SFC) на миллион РВМС определяется в образцах в присутствии и отсутствие (контроль сред) пептидных антигенов. Данные, полученные от макак на РВМС в разные моменты времени после введения дозы 1 и после введения дозы 2, представлены на фиг.8. Все животные, праймированные вектором PanAd3 в обеих дозах, показали T-клеточный ответ против HIV Gag, эффективно бустированный второй инъекцией PanAd1, подтверждая, что, как уже предполагалось в случае выравнивания последовательностей гексона, пентона и фибера, PanAd1 и PanAd3 являются разными серотипами, которые могут комбинироваться в режиме гетерологичной прайм-буст иммунизации. Таким образом, в другом аспекте изобретение предлагает применение двух рекомбинантных аденовирусов изобретения для гетерологичной прайм-буст иммунизации, в котором два рекомбинантных аденовируса изобретения являются разными аденовирусными серотипами, наиболее предпочтительно - PanAd1 и PanAd3, описанных в заявке.
Реферат
Изобретение относится к области биотехнологии, вирусологии и иммунологии. Описаны новые аденовирусные штаммы с улучшенной серопревалентностью. В одном аспекте настоящее изобретение относится к выделенным полипептидам аденовирусных капсидных белков, таких как гексон, пентон и фибер и их фрагменты, и к полинуклеотидам, кодирующим указанные полипептиды и их фрагменты. Предлагаются также вектор, содержащий выделенный полинуклеотид изобретения; аденовирусы, содержащие выделенные полинуклеотиды или полипептиды согласно изобретению, и фармацевтическая композиция, содержащая указанные вектор, аденовирус, полипептид и/или полинуклеотид. Изобретение относится также к применению выделенных полинуклеотидов, выделенных полипептидов, вектора, аденовирусов и/или фармацевтической композиции для терапии или профилактики заболевания. Предложенная группа изобретений может быть использована в медицине. 7 н. и 10 з.п. ф-лы, 11 ил., 4 табл., 6 пр.
Формула
(i) выделенный полинуклеотид, который кодирует аденовирусный белок фибер, который выбирается из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно SEQ ID NO: 53; и
(b) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 85% идентична по всей своей длине аминокислотной последовательности SEQ ID NO: 53;
(ii) выделенный полинуклеотид, который кодирует аденовирусный белок гексон и который выбирается из группы, состоящей из:
(c) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно SEQ ID NO: 54; и
(d) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 95% идентична по всей своей длине аминокислотной последовательности SEQ ID NO: 54; и
(iii) выделенный полинуклеотид, который кодирует аденовирусный белок пентон, который выбирается из группы, состоящей из:
(e) полинуклеотида, кодирующего полипептид, который имеет аминокислотную последовательность согласно SEQ ID NO: 55; и
(f) полинуклеотида, кодирующего функциональное производное, имеющее аминокислотную последовательность, которая, по меньшей мере, на 85% идентична по всей своей длине аминокислотной последовательности SEQ ID NO: 55.
(a) аденовирусный 5′-конец, предпочтительно аденовирусный 5′ обращенный концевой повтор;
(b) аденовирусную область Ela или ее фрагмент, выбранный из областей 13S, 12S и 9S;
(c) аденовирусную область Elb или ее фрагмент, выбранный из группы, состоящей из областей малого Т, большого Т и IX;
(d) аденовирусную область E2b или ее фрагмент, выбранный из группы, состоящей из областей малого рТР, полимеразы и IVa2;
(e) аденовирусную область L1 или ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка 28,1 кДа, полимеразы, агнопротеина, белка 52/55 кДа и белка IIIa;
(f) аденовирусную область L2 или ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белков VII, V и Mu;
(g) аденовирусную область L3 или ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка VI и эндопротеазы;
(h) аденовирусную область Е2а;
(i) аденовирусную область L4 или ее фрагмент, причем указанный фрагмент кодирует аденовирусный белок, выбранный из группы, состоящей из белка 100 кДа, гомолога 33 кДа и белка VIII;
(j) аденовирусную область Е3 или ее фрагмент, выбранный из группы, состоящей из Е3 ORF1, Е3 ORF2, Е3 ORF3, Е3 ORF4, Е3 ORF5, Е3 ORF6, Е3 ORF7, Е3 ORF8 и Е3 ORF9;
(k) аденовирусную область L5;
(l) аденовирусную область Е4 или ее фрагмент, выбранный из группы, состоящей из Е4 ORF7, Е4 ORF6, Е4 ORF5, Е4 ORF4, Е4 ORF3, Е4 ORF2 и Е4 ORF1,
и/или
(m) аденовирусный 3′-конец, предпочтительно аденовирусный 3′ обращенный концевой повтор.
(i) один или более выделенных аденовирусных капсидных полипептидов по п. 4;
(ii) выделенный полинуклеотид по любому из пп. 1-3;
(iii) вектор по любому из пп. 5-6;
(iv) рекомбинантный аденовирус по любому из пп. 7-9, и фармацевтически приемлемое вспомогательное вещество.
(i) один или более выделенных аденовирусных капсидных полипептидов по п. 4;
(ii) выделенный полинуклеотид по любому из пп. 1-3;
(iii) вектор по любому из пп. 5-6;
(iv) рекомбинантный аденовирус по любому из пп. 7-9.
Документы, цитированные в отчёте о поиске
Способы и композиции для диагностики и лечения рака

Комментарии